Хиральные трифторметилированные монотерпеновые тиоацетаты и тиолы пинанового ряда - RU2733369C1
Код документа: RU2733369C1
Описание
Изобретение относится к синтезу новых терпеновых тиоацетатов и тиолов пинановой структуры, содержащих трифторметильную группу, которые могут быть использованы в органическом синтезе энантиомерно-чистых биологически активных веществ в качестве промежуточных продуктов и индукторов хиральности.
Согласно литературным данным, такие монотерпеновые аналоги, как трифторметилированные производные иминоспиртов, кетонов и (S-аминоспиртов, полученных из камфоры - важные интермедиаты в синтезе хиральных индукторов и органокатализаторов [Е. Obijalska, G. Mloston, A. Linden, Н. Heimgartner.Trifluoromethylation of camphorquinone and its monoimine derivatives. Tetrahedron: Asymmetry 2008, 19, 1676-1683].
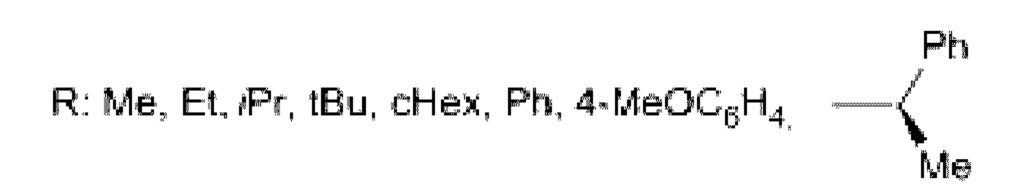
В литературе встречаются такие аналоги как (-)-2-трифтор-1-фурил этанол, проявляющий антибактериальную активность против грамположительных и грамотрицательных бактерий, и противогрибковую активность против мицелиальных грибков и грибков брожения [S. Tflatanabe, Т. Fujita, М. Sakamoto, Y. Mino, Т. Kitazume. Trifluoromethylation and pentafluoroethylation of terpenoid carbonyl compounds used in perfumery. Journal of Fluorine Chemistry 1995, 73, 21-26].
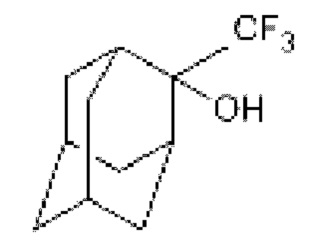
Другой структурный аналог полученных соединений 2-трифторметил-2-адамантол обладает активностью против вируса гриппа А [W. DeGrado, J. Wang. Adamantane Analogs. - Патент US 0270917 (A1) - 2012].
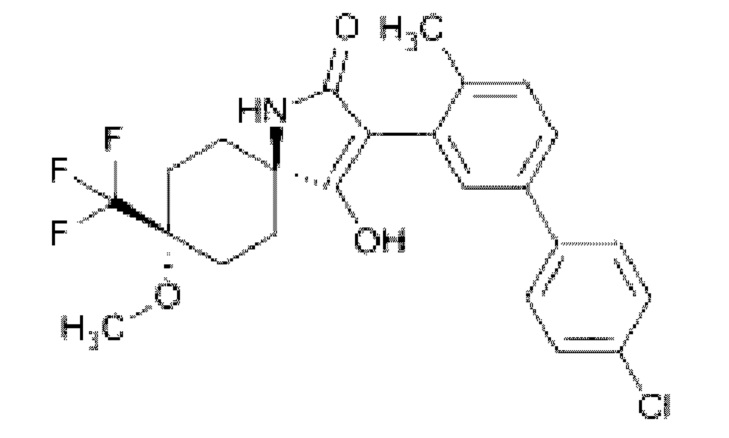
Трифторметилированное соединение со схожей структурой (5r,8r)-3-(4-хлоро-4-метилбифенил-3-ил)-4-гидрокси-8-метокси-8-(трифторметил)-1-азаспиро[4.5]декан-3-ен-2-он проявляет противоопухолевую активность [N. Liu, K. Thede, U. Monning, А. Scholz, C.-S. Hilger, U. Bomer, R. Fischer. Substituted 3-(biphenyl-3-yl)-4-hydroxy-8-methoxy-1-azaspiro[4.5]dec-3-en-2-one. - Патент US 9278925 (B2) - 2016].
Изобретение направлено на расширение арсенала средств и получение новым трифторметил-производных монотерпеноидов, которые могут быть использованы в органическом синтезе энантиомерно-чистых биологически активных веществ в качестве промежуточных продуктов и индукторов хиральности. Представленные соединения одни из первых серасодержащих веществ среди соединений подобной структуры. В этом заключается технический результат.
Структурные аналоги полученных соединений проявляют антибактериальную активность против грамположительных, грамотрицательных бактерий, в частности штамма Acinetobacter baumannii, противогрибковую - против мицелиальных грибков, грибков брожения, в том числе штамма Candida albicans, противовирусную - против вируса гриппа А, противоопухолевую, антиоксидантную и мембранопротекторную активности. Технический результат заключается в расширении арсенала средств, в том, что представленные соединения одни из первых серасодержащих веществ среди соединений подобной структуры.
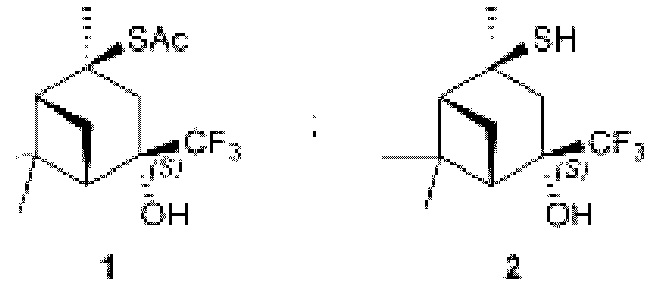
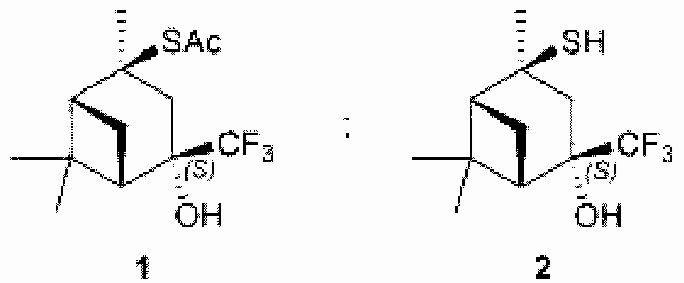
Технический результат достигается тем, что новые хиральные CF3-содержащие монотерпеновые тиоацетат и тиол получены в виде индивидуальных диастереомеров, которые определены как:
Способ получения трифторметил-производных монотерпеноидов осуществляется следующим образом.
В двугорлую колбу, снабженную мешалкой и обратным холодильником, охлажденную до -30° - 0°С в атмосфере аргона поместили 1.34 ммоль тиоацетата. После охлаждения вещества прилили 6.72 ммоль TMSCF3 в 0.5 мл THF, по истечении 5 мин перемешивания, добавили 0.37 ммоль CsF. Ход реакции контролировали методом ТСХ (элюент - петролейный эфир : этилацетат 10:1). Полученную смесь перемешивали в течение 3 суток, при температуре от -30° до tкомн. Полученный триметилсилиловый эфир подвергли кислотному гидролизу раствором HCl. Затем реакционную смесь экстрагировали этилацетатом, органический слой промывали насыщенным раствором NaCl и сушили над Na2SO4. Растворитель отгоняли при пониженном давлении.
Продукты реакции выделяли методом колоночной хроматографии на силикателе.
Для подбора оптимальных условий реакции варьировали такие параметры, как температура охлаждающей бани, время перемешивания, и соотношение тиол - трифторметилтриметилсилан - фторид цезия. Было отмечено, что наилучшие результаты в синтезе 1 достигаются при соотношении субстрат : реагент : активатор, равному 1 - 5 - 0.3 соответственно. При более высокий температурах идет большее образование побочных продуктов.
Синтез трифторметилированного монотерпеновопо тиоацетата 1 проводили с использованием тиоацета 3, полученного по известной методике [F. Martinez-Ramos, М.Е. Vargas-Diaz, L. Chacon-Garcia, J. Tamariz. Highly diastereoselective nucleophilic additions using a novel myrtenal-derived oxathiane as a chiral auxiliary. Tetrahedron: Asymmetry 2001, 12, 3095-3103].
ИК-спектры регистрировали на ИК-Фурье спектрометре Shimadzu IR Prestige 21 в ок. KBr. Температуры плавления определяли на приборе Gall encamp- Sanyo. Спектры ЯМР1Н и13С регистрировали на спектрометре Bruker Avance-300 (300.17 МГц для1H и 75.48 МГц для13С) в CDCl3 в качестве растворителя и внутреннего стандарта. Спектры ЯМР13С регистрировали в режиме J-модуляции. Полное отнесение сигналов1Н и13С выполняли с помощью двумерных гомо- (1H-1H COSY,1Н-1Н NOESY) и гетероядерных экспериментов (1Н-13С HSQC,1H-13С НМВС). Угол оптического вращения измеряли на автоматизированном цифровом поляриметре PolAAr3001 фирмы Optical Activity. Для тонкослойной хроматографии использовали пластины Sorbfil, элюенты - петролейный эфир: этилацетат - 10:1, CH2Cl2, в качестве проявителей - растворы KMnO4, ванилина. Растворители использовали без дополнительной очистки. Для колоночной хроматографии применяли силикагель Alfa Aesar (0.06-0.2 мм), элюент - петролейный эфир: этилацетат - 10:1.
Новые соединения демонстрируются следующими примерами.
Пример 1.
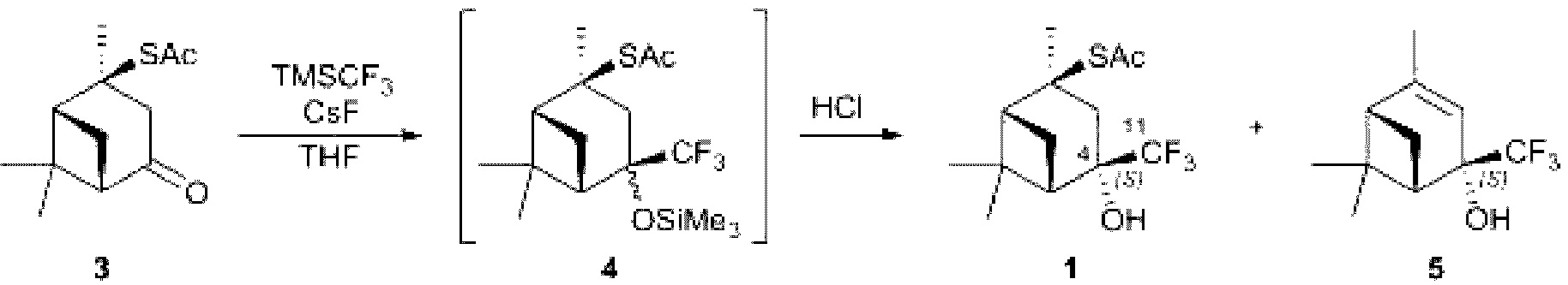
В двугорлую колбу, снабженную мешалкой и обратным холодильником, охлажденную до 0°С в атмосфере аргона поместили 1.34 ммоль 2-тиоацетата вербанона 3, 6.72 ммоль тифторметилтриметилсилана TMSCF3 в 0.5 мл THF. После охлаждения смеси, при перемешивании добавили 0.37 ммоль CsF. Полученную смесь перемешивали в течение 10 мин, затем убрали охлаждение. Реакционная смесь перемешивалась в течение 3 суток при комнатной температуре. После этого порциями добавили 6 мл HCl и 10 мл этанола перемешивали при комнатной температуре в течение ночи до полного исчезновения силилового эфира. Затем добавили 7 мл этилацетата и экстрагировали водный слой этилацетатом. После этого обработали раствор насыщенным раствором NaCl. Объединенные органические фазы сушили над Na2SO4. Растворитель отгоняли в вакууме. Продукты реакции выделили методом колоночной хроматографии. Выход 1 составил 37%, de >99%, выход побочного продукта 5 составил 31%.
S-((1R,2S,4S,5S)-4-гидрокси-2,6,6-триметил-4-(трифторметил)бицикло[3.1.1]гептан-2-ил)этантиоат (1). Выход: 37%, de >99%; бесцветн. кристаллы; т.пл. 89-90°С;
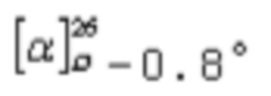
(1S,2S,5S)-4,6,6-триметил-2-(трифторметил)бицикло[3.1.1]гепт-3-ен-2-ол (5). Выход: 31%; коричнево-оранжев. кристаллы; т.пл. 61,5-62,5°С;
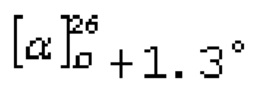
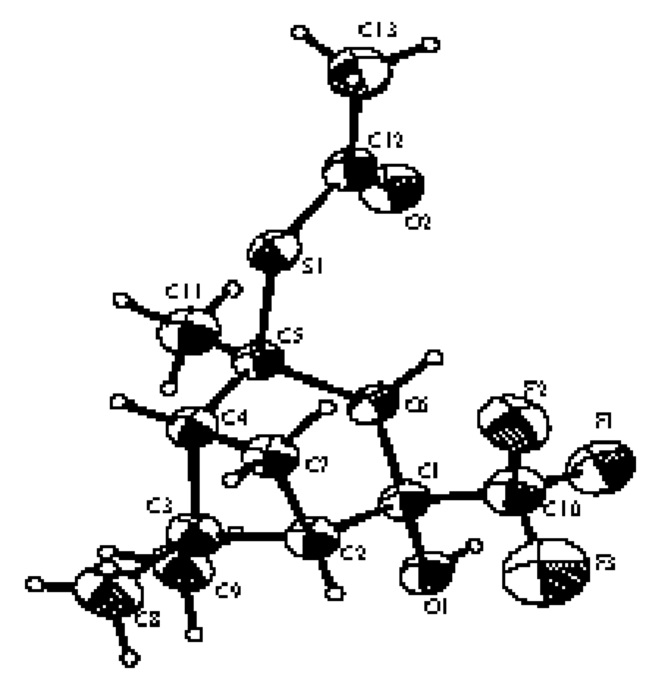
Структура S-((1R,2S,4S,5S)-4-гидрокси-2,6,6-триметил-4-(трифторметил)бицикло[3.1.1]гептан-2-ил)этантиоата 1 по данным РСА
Пример 2.
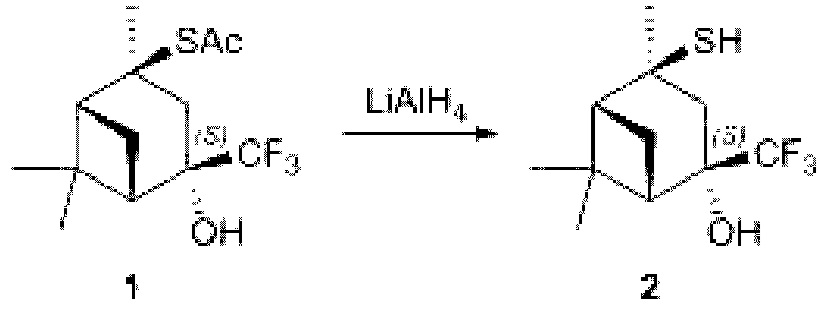
В двугорлуюколбу, снабженную мешалкой и обратным холодильником, при охлаждении на льду с NaCl в атмосфере аргона, поместили 0.30 ммоль трифторметилированного 2-тиоацетата вербанона 1 и 2 мл сухого диэтилового эфира. К раствору порциями прикапывали 0.30 ммоль LiAlH4. Полученную смесь перемешивали в течение 10 минут, за ходом реакции следили по ТСХ. По окончанию реакции в смесь добавили 10 мл диэтилового эфира, 0,5 мл этанола, перемешивали в течение 10 мин. Затем в реакционную смесь добавили 1 мл 10%-го раствора HCl и 5 мл Н2О и перемешивали до расслоения. Далее водный слой экстрагировали диэтиловым эфиром. Объединенные органические фазы промывали насыщенным раствором NaCl и сушили над Na2SO4. Из полученной смеси тиол 2 выделили методом колоночной хроматографии. Выход 6 составил 73%.
(1S,2S,4S,5R)-4-меркапто-4,6,6-триметил-2-(трифторметил)бицикло[3.1.1]гептан-2-ол (2). Выход: 73%; светло-желт, масл. жидк.;
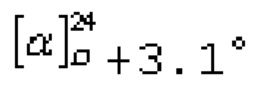
Таким образом, получены новые индивидуальные хиральные трифторметилированные монотерпеновые тиоацетаты и тиолы, которые могут быть использованы в органическом синтезе для получения биологически активных веществ.
Синтез и использование трифторметилированных монотерпеновых тиолов не зафиксированы в литературных источниках, однако трифторметилированные тиолы, как и их нефторированные монотерпеновые аналоги, могут быть использованы в синтезе N-замещенных фторсодержащих сульфинамидов, сульфиниминов, дисульфидов и сульфидов, проявляющих биологическую активность.
Примером использования монотерпеновых тиолов в качестве интермедиатов в синтезе N-замещенных фторсодержащих сульфинамидов, является получение этил (R)-2,2-дифтор-3-(2-гидроксифенил)-3-(((S)-((1R,3S,4R,6S)-4,7,7-триметилбицикло[4.1.0]гептан-3-ил)сульфинил)амино)пропаноата, проявляющего противогрибковую активность против штамма Candida albicans [Д. Судариков, Ю. Крымская, Н. Ильченко, П. Слепухин, С. Рубцова, А. Кучин. Синтез и биологическая активность фторсодержащих аминопроизводных на основе 4-карантиола. Известия Академии наук. Серия химическая. 2018, 4, 731-742].
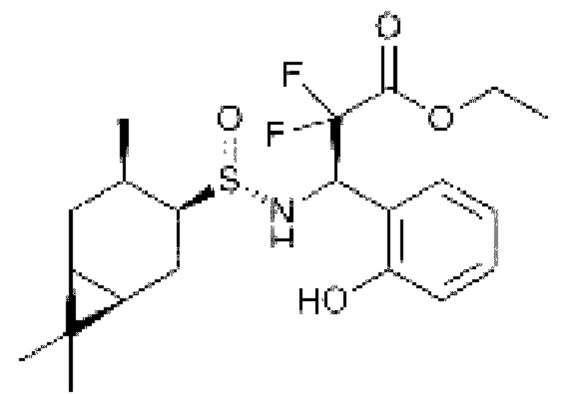
В этой работе также описан (R,1R,3S,4R,6S)-4,7,7-триметил-N-((S)-2,2,2-трифтор-1-(2-гидроксифенил)этил)бицикло[4.1.0]гептан-3-сульфинамид, полученный на основе 4-каранола, который проявляет противомикробную активность против штамма Acinetobacter baumannii.
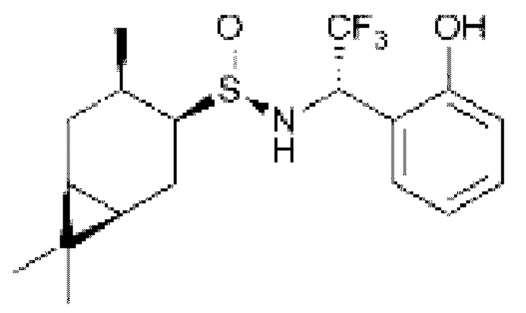
Другим примером использования монотерпеновых тиолов является синтез (S,1S,2R,3S,5R)-2-(гидроксиметил)-6,6-диметил-N-(4-нитробензил)бицикло[3.1.1]гептан-3-сульфинамида, обладающего антиоксидантной и мембранопротекторной активностью [D. Sudarikov, Y. Krymskaya, О. Shevchenko, P. Slepukhin, S. Rubtsova, A. Kutchin. Synthesis and Antioxidant Activity of Carane and Pinane Based Sulfenimines and Sulfinimines. Chem. Biodiversity. 2019, 16, e1900413].
Реферат
Настоящее изобретение относится к области органической химии, а именно к хиральному трифторметилированному монотерпенову тиоацетату структурной формулы (1) и тиолу структурной формулы (2) на основе вербенона, полученные в виде индивидуальных диастереомеров:Технический результат: предложены новые органические соединения, которые могут быть использованы в органическом синтезе энантиомерно-чистых биологически активных веществ в качестве индукторов хиральности и в фармацевтической промышленности в качестве интермедиатов в синтезе лекарственных препаратов. 2 пр.
Формула
Документы, цитированные в отчёте о поиске
Сульфопроизводные на основе бета-пинена и способ их получения

Комментарии