Способ получения аминофеноксипроизводных - RU2032669C1
Код документа: RU2032669C1
Чертежи






Описание
Изобретение относится к способам
получения новых аминофеноксипроизводных общей формулы I
Cy-B



R3 представляет алкил, содержащий 1-4 атома углерода или радикал формулы
Alk-Ar,
где Alk представляет простую связь или алкилен нормального или изо-строения с 1-4 атомами углерода и Ar представляет пиридил, фенил, 2,3-метилендиоксифенил или 3,4-метилендиоксифенил, или 3, 4-дихлорфенил, R4 представляет атом водорода или алкил С1-С4; Су означает группу, выбранную из фенила, нафтила, фурила, дигидрофурила, пиразолила, N-R11 -имидазолила, изоксазолила, тиазолила, бензофурила, бензотиенила, N-R11-индолила, N-R11 -бензимидазолила, хинолина, циннолинила, индолизин-3-ила, тетрагидротиенопиридила, пиразол(1,5-а)пиримидил, пиррол[1,2-b]пиридазинила, причем каждый может быть замещен в α-положении, С1-С4 алкилом, С3-С4 циклоалкилом бензилом и фенилом, R11-атом водорода, низший алкил, фенил, дифенилметил, бензил или галогенбензилрадикал, причем когда Су-бензо(а)фурил или бензо(b)тиенил и В-SO2-группа, то R3 радикал-Alk-Ar, или их солей.
Было обнаружено, что аминофеноксипроизводные согласно изобретению обладают исключительными фармакологическими свойствами, в особенности ингибирующими свойствами по транспортировке кальция, а также брадикардическими, гипотензивными и противоадренергическими свойствами.
Указанные свойства делают рассматриваемые соединения полезными при лечении определенных патологических синдромов сердечно-сосудистой системы, в особенности при лечении стенокардии, повышенного давления, аритмии и кровеносной церебральной недостаточности.
В противоопухолевой области соединения изобретения могут быть полезными в качестве усилителей
противораковых лекарств. Способ согласно изобретению заключается в том, что цепь общей формулы
II


Cy-B

Гал-А-Гал
где А имеет указанное значение; Гал представляет атом галогена, в присутствии щелочного агента, с последующей обработкой полученного соединения амином общей формулы V
H

где R3 и R4 имеют указанные значения, которую осуществляют в присутствии акцептора кислоты, чтобы получить целевое аминофеноксипроизводное в форме свободного основания, которое при желании переводят в соль взаимодействием с минеральной или органической кислотой.
Реакцию
взаимодействия соединения формулы III с дигалоидалканом формулы IV с целью получения соединения общей формулы VI
Cy-B



где Cy, B', A имеют указанные значения, Гал предпочтительно бром, проводят кипячением в растворителе, таком как метилэтилкетон или N, N-диметилформамид в присутствии агента основного характера, такого как карбоната щелочного металла, например карбоната калия, гидрида щелочного металла, например гидрида натрия, гидроксида щелочного металла, например гидроксида натрия или калия, или алкоголята щелочного металла, например метилата или этилата натрия. Реакцию соединения VI с амином формулы V осуществляют при температуре от комнатной до температуры кипения реакционной среды в присутствии акцептора кислоты, такого как карбонат или гидроксид щелочного металла или избыток амина V.
Соединения формулы III являются известными соединениями, например, те
соединения, в которых Су представляет бензофурил или бензотиенил, В' представляет группу -SO2-. Эти
соединения описаны в патенте США N 4 117 128 [1]
Другие соединения формулы III
могут быть получены использованием способа, описанного в упомянутом патенте, а также нижеописываемыми
способами.
В большинстве случаев соединения формулы III могут быть получены присоединением 4-0-защищенного бензолсульфонила или фенилтиогруппы к целевому карбоциклу или гетероциклу применением реакции Фриделя-Крафтса с последующим удалением защитной группы кислорода в 4-положении бензолсульфонила или фенилтиегруппы с помощью классических методов регенерация ОН-групп.
Соединения формулы I, полученные в виде свободного основания, могут быть затем превращены в фармацевтически приемлемые соли в реакции с приемлемыми органическими кислотами, например, щавелевой, малеиновой, фумаровой, метансульфоновой, бензойной, аскорбиновой, памоевой, янтарной, гексамовой, бисметиленоалициловой, этансульфоновой, уксусной, пропионовой, винной, салициловой, лимонной, глюконовой, молочной, яблочной, коричной, миндальной, цитраконовой, аспаратиновой, пальмитиновой, стеариновой, итаконовой, гликолевой, п-аминобензойной, глутаминовой, бензолсульфоновой или теофилинуксусной кислоты, или с лизином или гистидином.
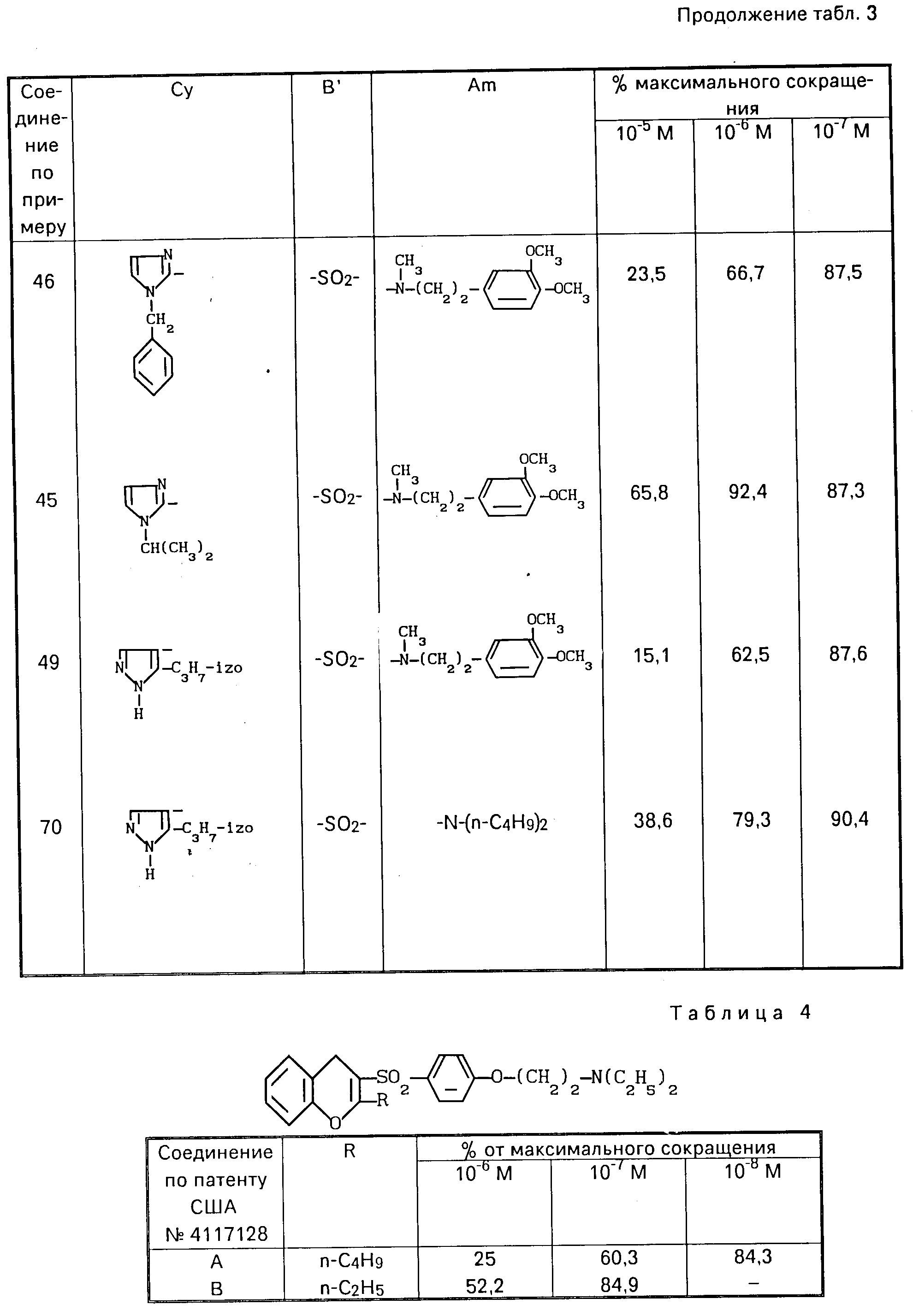
Проведены испытания с соединениями, указанными в патенте США N 4 117 128, кл. С 07 D 307/82, а именно с 2-этил- и 2-н-бутил-3[4-(2-диэтиламиноэтокси)бензолсуль- фонил]бензфураном.
Из результатов проведенных испытаний можно сделать вывод о том, что на собаках в дозировке 10 мг/кг внутривенно эти известные соединения проявляют слабую α-противоадренергическую активность и полное отсутствие или практически полное отсутствие β-противоадренергического действия.
Неожиданно было обнаружено, что заменой моно- или диалкиламиноалкоксицепи известных бензолсульфонил- бензфуранов или бензтиофенов аралкиламино-алкоксицепью получают соединения с гораздо более высокой α и β-противоадренергической активностью по сравнения с рассматриваемыми известными соединениями.
Например, указанные аралкиламиноалкоксибензолсульфонилбензфураны или бензтиофены даже в таких низких дозировках как 0,1-1,5 мг/кг показывают субполное ингибирование α-адренергического действия вместе с важным β-противоадренергическим действием.
Такие ценные противоадренергические свойства, как было найдено, присущи соединениям, аналогичным по своему строению указанным аралкиламиноалкоксибензолсульфонилбензфуранам или бензтиофенам, но в которых бензфурановая или бензтиофеновая часть замещена другой карбоциклической или гетероциклической группой. Также известны производные индолизина, замещенные в 1-положении алкоксибензоильной цепью, которая в свою очередь замещена моно- или диалкиламиногруппой, и как указывается, обладающие фармакологическим действием в сердечно-сосудистой области.
В этой связи можно упомянуть патент Франции N 2 341 578 [2] в которых особо указаны 2-этил, 2-н-пропил или 2-н-бутил-1-[4-(3-ди-н-пропил или 3-ди-н-бутиламинопропокси)бензоил]индолизин, возможно диметилированной в бензоильной части.
Эти известные соединения не показали или показали низкую противоадренергическую активность, которая во всех случаях была слишком низкой, чтобы представлять какую-то ценность для лечения.
Известны также и другие моноалкил- или диалкиламиноалкоксибензоилпроизводные.
Например в литературе имеются сведения о моноалкил- или
диалкиламиноалкоксибензоильных производных
Тиофена (J.Med. Chem. V. 13(3), стр.
359-366 (1970)(3)
Нафталина или дигидронафталина (Chim. Ther. Y, 7 (5) стр. 369-377) (4)
Пиридина (Ing. Chem. Y. 59 (283) стр. 3-13 (1977) (5)
Тиено (3,2-с) пиридина
(Heterocycles, Y, 22 (5) стр, 1235-1247 (1984) (6)
Индола (Eur. J.Med. Chem.Chim.Ther. Y, 12 (5) стр.
483-487) (7)
Фурана (патент Франции N 2400515) (8)
Хромона (патент США
N 4220645) (9).
Испытания, проведенные с этими соединениями, показали, что некоторые из них проявляют противоадренергическую активность, но на таком низком уровне, который делает их малоценными для лечения.
Кроме того было найдено, что моно- или диалкиламиноалкоксибензолсульфонильные производные, отражающие соединения, описанные в патенте США N 4 117 128, но в которых бензфурановая или бензтиофеновая часть заменена другим карбоциклическим или гетероциклическим кольцом проявляют более ценные противоадренегические свойства по сравнению с сульфонильными производными указанного патента США или известными бензоилпроизводными.
Например, α- или β-противоадренергические свойства были отмечены на собаках при внутривенном введении в таких низких дозировках как 0,1-1,5 мг/кг в случае моно- или диалкиламиноалкоксибензолсульфонильных производных формулы (1), в которых Су представляет отличную от бензфурила или бензтиенила группу, например хинолинил или пирроло (1,2-b) пиридазинил.
И еще один ценный класс соединений изобретения включает соединения, в которых R1, R2, R4 и A принимают значения, указанные для формулы (I), В представляет группу -SO2- и R3 представляет алкил при условии, что Су отличен от бенз(b)фурила или бенз(b)тиенила.
Особенно ценный класс соединений изобретения включает
соединения, в которых R1, R2, R4 и А принимают указанные для формулы I значения, В представляет группу
-SO2-, R3 представляет алкил и Су
представляет группу, выбранную из
Хинолинила, в частности, 2-R-хинолин-3-ила
Пирроло (1,2-b)пиридазинила, в частности,
6-R-пирроло(1,2-b)-пиридазинила
Пиразоло (1,
5-а)пиридила, в частности, 2-R-пиразоло-(1,5-а)-пирид-3-ила
Имидазо (1,2-а)пиридила, в частности, 2-R-имидазо (1,2-а)пирид-3-ила
4,5-Дигидрофуранила, в частности, 2-R-4,
5-дигидрофуран-3-ила
Индолила, в частности, 2-R-индол-3-ила и 1-R11-2-R-индол-3-ила
Индолизин-3-ила
Более того было
найдено, что ингибирующая активность по
кальцию соединений изобретения по меньшей мере равна, если не выше, активности, наблюдаемой в испытаниях с известными соединениями. В противоположность
известным соединениям оказалось возможным
показать для соединений изобретения фармакологический спектр действия, включающий противокальциевое действие, а также α- и β
-противоадренергическое действие со сбалансированной
интенсивностью, представляющий терапевтическую ценность, например, при лечении стенокардии.
Как подробно сообщалось Charlier R. Bruxelles Medical N 9, стр. 543-560, сентябрь 1969, [10] принято считать, что лечение стенокардии лекарствами оказывается возможным, в частности, путем подавления сердечно-сосудистых реакций противоадренергического типа. В связи с этим были предложены средства, способные блокировать α-рецепторы.
Однако клиническое использование подобных соединений для лечения стенокардии оставалось неэффективным скорее всего вследствие того факта, что антагонисты α-рецепторов вызывают лишь незначительную частичную нейтрализацию адренергической системы, при этом активность β-рецепторов не затрагивается.
Большинство нежелательных гаемодинамических проявлений, возникающих у больных стенокардией во время болезненных приступов, в большинстве случаев носит сердечный характер и соответственно включает участие β-рецепторов.
Параллельно было предложено лечение лекарствами, являющимися антагонистами β -адренергических рецепторов. Такие соединения, представляющие непревзойденную клиническую ценность, уменьшают приступы стенокардии уменьшением работы сердца, замедлением сердцебиения. Однако при этом не наблюдается падения в периферийном артериальном сопротивлении, которое напротив возрастает путем реализации α-тонуса.
Тем не менее лечение такими лекарствами меняет некоторые газмодинамические параметры, в связи с чем ценность этих лекарств для лечения больных стенокардией, в частности, и сердечных больных в целом на фундаментальном уровне снижается.
При рассмотрении противоадренергического аспекта β-блокирующих средств становится ясным, что только тахикардия и рост силы и скорости сокращения сердца поддаются нейтрализации, а артериальное повышенное давление, включающее стимуляцию α-рецепторов, на действие β-антагонистов не реагирует.
Сердечно-сосудистые отклонения, возникающие при стимуляции β -рецепторов, наиболее вредны для больных стенокардией, и тем не менее справедливо, что повышенное артериальное давление также играет не такую уже незначительную роль.
Кроме того, в блокировании β-рецепторов имеется риск лишения больных, страдающих от сердечной недостаточности, компенсирующего механизма, который обычно включается для ограничения сосудистой недостаточности.
Такой рефлекторный механизм, основной компонент которого использует пути β-адренергической системы, приводит, в частности, к увеличению силы и скорости сжатия сердца. Соответственно, в случае блокировки этой системы пациенты, страдающие от сердечной недостаточности, чувствуют ухудшение в своем функциональном состоянии. Следовательно, естественно предположить, что применение β-блокирующих средств, действие которых является частым и полным, всегда включает риск для сердца.
Соответственно, видимо оказывается желательным поиск средств, не обладающих полностью α- или β -антагонистическими свойствами и оказывающих побочное клиническое действие, сопутствующее их применению. Видимо, более логично поставить целью ослабление, а не ликвидацию сердечно-сосудистых отклонений, характеризующих гиперстимуляцию адренергической системы в целом.
Соединение изобретения отвечают такой цели, поскольку проявляют α- и β -противоадренергические свойства неполного типа. Соответственно их можно рассматривать не как β-блокирующие средства, а как адрено-децелераторы, т.е. частично антагонисты α- и β -адренергических реакций, потенциально не обладающих недостатками, перечисленными для β-блокирующих средств.
Кроме того, ингибирующее по отношению к кальцию действие, обнаруженное у соединений изобретения, является исключительным качеством в фармакологическом спектре их действия на сердечно-сосудистую систему.
Достоверно установлено, что транспорт ионов кальция является одним из основных компонентов потенциала действия в сердечных клетках и, следовательно, такой транспорт играет фундаментальную роль в электрической проводимости, а также нарушениях, которые могут с нею происходить (аритмия). Кроме того, известно, что ионы кальция участвуют в сочетании возбуждение-сжатие, регулирующем степень вазоконструкции в гладкой мускулатуре и в некоторых обстоятельствах играют критическую роль в приступах стенокардии.
Соединения, являющиеся антагонистами к кальцию, действуют на уровне клеточных мембран, селективно не допускающих участия кальция в процессе сокращения в пределах артериальных клеток.
В самом деле, в настоящее время становится все более ясным, что
клинические результаты, достигаемые
использованием комбинации ингибиторов кальция и β-адренергических ингибиторов лучше по сравнению с использованием каждого ингибитора по отдельности (J,
А.М.А. 1982, 247, стр. 1911-1917),
[11]
Кроме того, ни одно из существующих в настоящее время β-блокирующих средств не обладает дополнительно значительным ингибирующим действием по
отношению к транспорту кальция.
С этой точки зрения соединения изобретения, обладая как противокальциевым действием, так и α и β-противоадренер- гическим действием, приобретают фундаментальное значение, поскольку позволяют их более интенсивно применять в терапии по сравнению с β-блокирующими средствами или ингибиторами кальция по отдельности.
Соединения изобретения обладают α и β-противоадренергическим действием, усиленным кислородсберегающим действием, что делает их способными оказывать лечебное действие на человека в случае синдрома стенокардии усилия, при котором кроме того может быть использовано традиционное β-блокирующее средство. Однако главное преимущество этих соединений заключается в том, что они вследствие их противокальциевого действия могут быть использованы при лечении стенокардии покоя синдрома, вызываемого появлением спазма в коронарных артериях, с которым в настоящее время борются с помощью таких соединений как дильтиазем, верапамиль или нифедипин.
Кроме того, соединения изобретения способны вызывать значительное увеличение коронарного потока.
Результаты фармакологических испытаний, проведенных с целью выявления действия соединений изобретения на сердечно-сосудистую систему, изложены ниже.
1. Ингибирующие по отношению к кальцию свойства.
Свойство ингибировать транспорт кальция на мембранном уровне, показанное соединениями изобретения, продемонст- рировано их антагонистическим действием по отношению к изменению сокращения от вызываемой калием деполяризации на вырезанной аорте крысы. Точно установлено, что деполяризация мембран гладкой мускулатуры калием делает последние проницаемыми для внеклеточного кальция и вызывает мышечное сокращение.
Соответственно измерение изменения сокращения от деполяризации калием или измерение расслабления тонического сокращения от деполяризации калием может явиться показателем силы соединения в качестве ингибитора проницаемости мембран ионам Са++.
Использована следующая методика.
У мужских особей крыс линии Wistar массой примерно 300 г удаляют аорту, которую нарезают на полоски примерно 40 мм длиной и 3 мм шириной.
Полученные кусочки помещают в ванночку для изолированных органов на 25 мл, содержащую модифицированный бикарбонатный раствор Крабса (112 ммолей NaCl, 5 ммолей KCl, 25 ммолей NaHCO3, 1 ммоль КН2РО, 1,2 ммолей MgSO4, 2,5 ммоля CaCl2, 11,5 ммолей глюкозы и дистиллированной воды до 1000 мл), через которую пропускают поток 5-7% двуокиси углерода в кислороде при 37оС. Препарат соединяют с микродатчиком силы и измеряют после усиления на самописце изменение сокращения.
К препарату прилагают усилие в 2 г, которое поддерживают 60 мин в модифицированном бикарбонатном растворе Кребса, после чего вызывают сокращение заменой бикарбонатного раствора Кребса калиевым раствором Кребса (17 ммолей NaCl, 100 ммолей KCl, 25 ммолей NaHCO3, 1 ммоль КН2 РО4, 1,2 ммолей MgSO4, 2,5 ммолей CaCl2, 11,5 ммоля глюкозы и дистиллированной воды до 1000 мл). После того, как изменение сокращения становится воспроизводимым, в ванночку вводят заданное количество соединения изобретения и через 60 мин с помощью калиевой деполяризации вызывают новый спазм.
Полученные в экспериментах на аорте результаты затем выражают в виде процента от максимального эффекта сокращения перед инкубированием с испытуемым соединением.
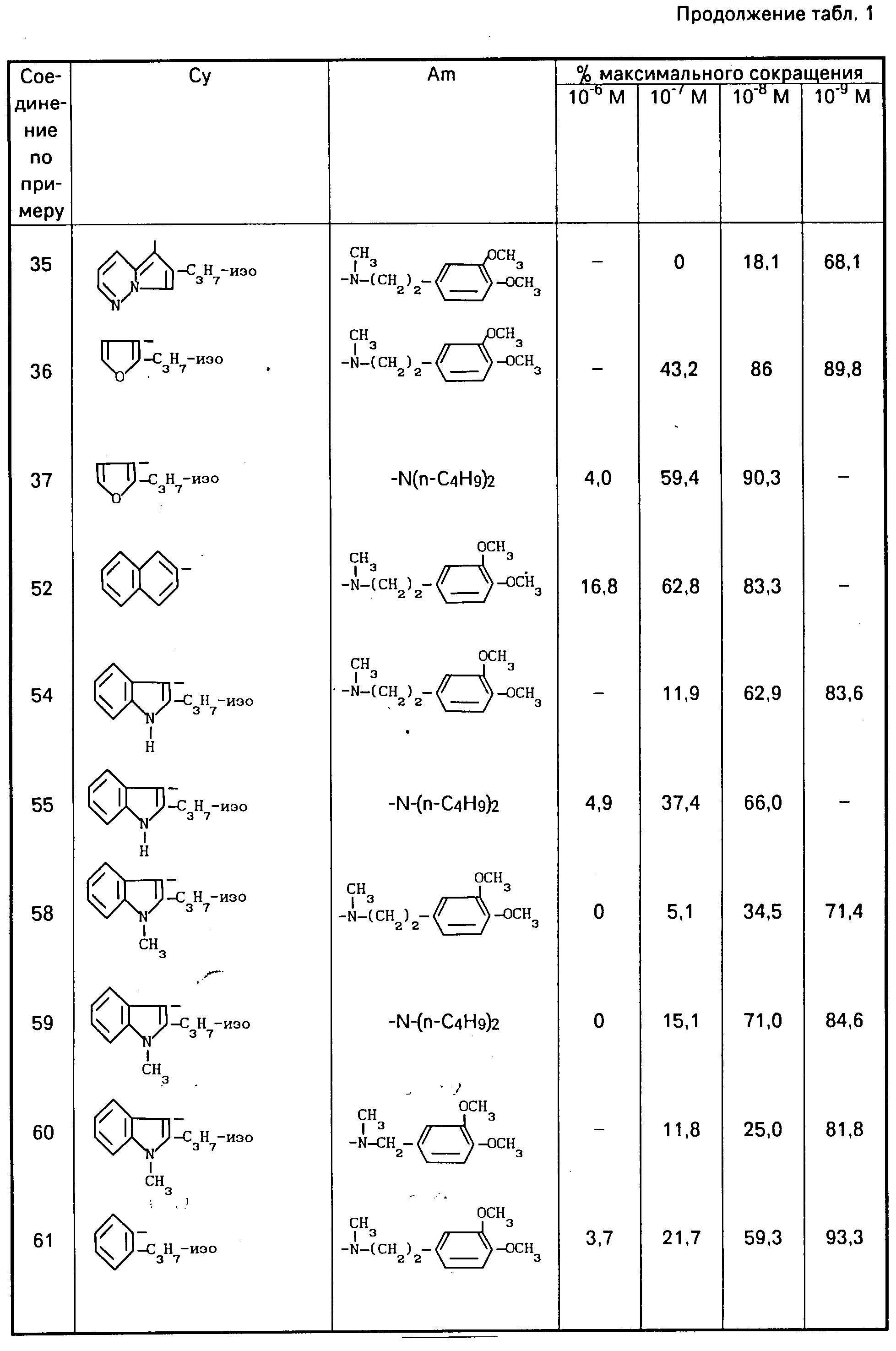
В виде примеров получены результаты для соединений формулы (1) в виде свободных оснований, хлоргидратов или оксалатов, приведенные в табл. 1. Для сравнения с известными соединениями получены результаты, приведенные в табл. 4 и 5.
II. Противоадренергические свойства.
Цель испытания заключается в определении способности соединений изобретения снижать вызываемый эпинефрином рост кровяного давления (анти-α эффект) и вызываемого изопреналином усиления сердцебиения (анти-β эффект) на собаках, предварительно анестезированных пентабар- биталом и антропинизированных.
Для каждой собаки предварительно определяют дозировку эпинефрина (между 3 и 10 мкг/кг), вызывающую воспроизводимое повышение кровяного давления в 133х102 Па, и дозировку изопропелина (1-2 мкг/кг), вызывающую усиление сердцебиения примерно до 70 ударов/мин. Определенные таким образом дозировки эпинефрина и изопреналина инъекцируют попеременно каждые 10 мин и после получения двух последовательных контрольных сигналов внутривенно вводят заданное количество испытуемого соединения.
Анти-α эффект.
Регистрируют процент снижения гипертензии, вызванного испытуемым соединением по сравнению с контрольной ранее полученной гипертензией (примерно 100 мм Н).
Анти-β эффект.
Регистрируют процент снижения сердцебиения, вызванного испытуемым соединением по сравнению с ранее измеренной тахикардией (примерно 70 ударов).
В обоих случаях результаты снижения кровяного давления или уменьшения сердцебиения
выражают следующим образом:
+ для снижения
50%
++ для снижения 50%
+++ для субполного снижения (почти полное снижение).
Для сравнения, известные соединения показали следующее противоадренергическое действие, приведенное в табл. 6.
Полученные результаты показывают, что соединения изобретения проявляют гораздо более высокую α- и β-противоадренергическую активность по сравнению с известными соединениями.
Терапевтические композиции согласно изобретению могут быть представлены в любой форме, приемлемой для лечения человека или животных. Что касается дозировочных единиц, то они могут иметь вид, например, таблеток с покрытием или без покрытия, твердых или мягких желатиновых капсул, упакованных порошков, суспензий или сиропов для перорального введения, свеч для ректального введения, растворов или суспензий для парентерального введения.
Терапевтические композиции изобретения могут содержать в дозировочной единице, например, 50-500 мг активного компонента для перорального введения, 50-200 мг активного компонента для ректального введения и 50-150 мг для парентерального введения.
В зависимости от выбранного пути введения терапевтические ветеринарные композиции изобретения готовят смешиванием по меньшей мере одного соединения формулы (1) или его неядовитой соли с приемлемым наполнителем, последний включает по меньшей мере один компонент, выбранный, например, из лактозы, крахмалов, талька, стеарата магния, поливинилпирролидона, альгининовой кислоты, коллоидной окиси кремния, дистиллированной воды, бензилового спирта и подслащивающих веществ.
П р и м е р 1. Получение кислого оксалата 2-н-бутил-1-{4-[3-(ди-н-бутиламино)пропилокси]бензолсульфонил} бензимидазола (SR 33631А).
2-н-бутил-1-(4-бромпропоксибензолсульфонил)-бензимидазол.
Раствор 0,0035 моля 4-бромпропоксибензолсульфонила, 0,0035 моля 2 н-бутилбензимидазола и 0,0035 моля триэтиламина в 15 мл диоксана перемешивают 7-8 ч при комнатной температуре. После удаления растворителя в вакууме получают остаток, который очищают хроматографией на колонке с окисью кремния (элюент: дихлорметан этилацетат 9:1).
В результате с выходом 50% получают 2-н-бутил-1-(4-бромпропоксибензолсульфо- нил)бензимидазол, который используют как таковой.
Кислый оксалат 2-н-бутил-1-{4-[3-(ди-н-бутиламино)-пропилокси]бензолсульфо- нил}бензимидазола.
К раствору 0,0017 моля 2-н-бутил-1-(4-бромпропоксибензолсульфонил) бензимидазола в 15 мл диметилсульфоксида прибавляют 0,0034 моля н-бутиламина, реакционную смесь оставляют на 17 ч при комнатной температуре и затем переносят в 50 мл воды. После экстрагирования эфирную фазу сушат и испаряют досуха. Полученный остаток очищают хроматографией на колонке с окисью кремния (элюент: дихлорметан этилацетат) с получением масла, представляющего собой целевой продукт в виде свободного основания (выход 50%). Оксалат полученного основания образуют добавлением к эфирному раствору основания эфирного раствора щавелевой кислоты.
В результате после перекристаллизации из этанола получают кислый оксалат 2-н-бутил-1-{ 4-[3-(ди-н-бутиламино)-про- пилокси]бензолсульфонил}бензимидазола.
П р и м е р 2. Получение 2-н-бутил-3-[4-{3-[N-метил-N-(3, 4-диметокси-β-фенэтил)- амино] пропилокси} бензолсульфонил] бенз- фуранхлоргидрата (SR 33646 A).
а) 2-н-бутил-3-[4-(3-бромпропилокси)бензолсульфонил]-бензфуран.
К раствору 0,02 моля 2-н-бутил-3-(4-гидроксибензолсульфонил) бензфурана в 150 мл диметилсульфоксида добавляют 0,06 моля мелкоизмельченного безводного карбоната калия и смесь перемешивают 1 ч. После этого добавляют 0,1 моля 1,3-дибромпропана и реакционную смесь нагревают 6 ч при 50оС. После прекращения реакции смесь отфильтровывают и испаряют в вакууме досуха. Полученный в результате остаток переносят в дихлорэтан, промывают водой, затем разбавленным раствором гидроксида натрия и наконец водой. После испарения органической фазе в вакууме в остатке получают масло, которое очищают хроматографией на колонке с окисью кремния (элюент: гексан этилацетат 9:1).
В результате с выходом 43% получают 2-н-бутил-3-[4-(3-бромпропилокси) бензолсульфонил]бензфуран.
Хлоргидрат 2-н-бутил-3-[4-{3-(N-метил-N-(3,4-диметокси-β-фенэтил)амино] пропил- окси}-бензолсульфонил]бензфурана.
Смесь 0,0086 моля 2-н-бутил-3-[4-(3-бромпропилокси) бензолсульфонил]бензфурана, 4 г безводного карбоната калия и 0,015 моль N-метил-3,4-диметокси-β-фенэтиламина в 50 мл диметилсульфоксида перемешивают 24 ч. Затем реакционную смесь переносят в воду и экстрагируют этиловым эфиром. Органический раствор промывают водой, сушат над сульфатом натрия, фильтруют и испаряют в вакууме досуха. Маслянистый остаток очищают хроматогра- фированием на колонке с окисью кремния использованием в качестве элюента смеси дихлорэтан метанол (9: 1). Хлоргидрат основания получают добавлением эфирного раствора хлористого водорода.
В результате с выходом 38 получают хлоргидрат 2-н-бутил-3-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)амино] пропилок- си}бензолсульфонил]бензфурана, т.пл. 60о (диизопропиловый эфир).
П р и м е р 3. Получение 2-изопропил-3-{4-[3-(трет-бутиламино)пропилокси] бензол- сульфонил} пиразоло(1,5-а)пиридин-окса- лата (SR 33686А).
а) 2-Изопропил-3-[4-(3-бромпропилокси)бензолсульфонил] пиразоло(1,5-а)пири-дин.
Смесь 0,003 моля 2-изопропил-3-(4-гидроксибензолсульфонил)-пиразоло(1,5-а)пи- ридина, 0,064 моль 1, 3-дибромпропана и 0,004 моль карбоната калия в 6 мл N,N-диметилформамида перемешивают 1 ч при 100оС, после чего смесь переносят в воду и отгоняют в присутствии этилацетата. После высушивания над сульфатом натрия смесь фильтруют и после концентрирования получают остаток, который очищают на колонке с окисью кремния с элюированием смесью этилацетат гексан (1:1).
В результате получают 0,0021 моля (выход 69%) 2-изопропил-3-[4-(3-бромпропилокси)бензолсульфонил]пиразоло(1,5-а)пи- ридина в виде вязкого масла.
Оксалат 2-изопропил-3-{4-[3-(трет-бутиламино)пропилокси]бензолсульфонил} пи-разоло (1,5-а)пиридина.
В колбе перемешивают 24 ч при комнатной температуре раствоp 0,002 моля 2-изопропил-3-[4-(бромпропилокси) бензолсуль- фонил]пиразоло(1,5-а)пиридина и 0,008 моля трет-бутиламина в 4 мл N,N-диметилсульфоксида, после чего смесь переносят в воду и отгоняют в присутствии этилацетата. После высушивания над сульфатом натрия смесь фильтруют и концентрируют с получением основания в виде масла. Раствор основания в смеси этилацетат гексан затем обрабатывают одним эквивалентом щавелевой кислоты, образовавшийся белый осадок перекристаллизовывают из смеси этиловый эфир изопропанол.
В результате получают 0,002 моля (выход 99%) оксалата 2-изопропил-3-{ 4-[3-(трет-бутиламино)пропилокси] -бензолсуль- фонил} -пиразоло (1,5-а)пиридина, т.пл. 208оС.
П р и м е р 4. Получение оксалата 2-изопропил-3-{4-[3-(трет-бутиламино)пропил- окси]бензолсульфонил}фурана (SR 33702).
2-Изопропил-3-[4-(3-бромпропилокси)бензолсульфонил]фуран.
Смесь 0,003 моля 2-изопропил-3-(4-гидроксибензолсульфонил) фурана, 0,06 моля 1,3-дибромпропана и 0,005 моля размолотого карбоната калия в 8 мл N, N-диметилформамида нагревают 1 ч при 100оС, после чего смесь переносят в воду и отгоняют в присутствии этилацетата. После высушивания над сульфатом натрия смесь фильтруют и концентрируют. Полученный остаток очищают хроматографией на колонке с окисью кремния использованием смеси этилацетат гексан (2:8).
В результате получают 0,00282 моля (выход 94%) 2-изопропил-3-[4-(3-бромпропилокси)бензолсульфонил]фурана в виде масла.
2-Изопропил-3-{4-[3-(трет-бутилами- но)пропилокси]бензолсульфонил}фуран- оксалат.
Смесь 0,00282 моля 2-изопропил-3-[4-(3-бромпропилокси)-бензолсульфонил] фурана и 0,013 моля трет-бутиламина в 7 мл диметилсульфоксида перемешивают 24 ч при комнатной температуре. После этого смесь переносят в воду, отгоняют в присутствии этилацетата, сушат над сульфатом натрия, фильтруют и концентрируют. Полученный остаток очищают на колонке с окисью кремния с использованием в качестве элюента смеси метанол этилацетат (2:8). Полученное в виде масла основание затем обрабатывают эфирным раствором щавелевой кислоты и образовавшийся осадок перекристаллизовывают из этанола.
В результате получают 0,0023 моля (выход 82%) оксалата 2-изопропил-3-{ 4-[3-(трет-бутиламино)пропилокси]бензолсуль-фонил}-фурана, т.пл. 143,6оС.
П р и м е р 5. Получение кислого оксалата 2-изопропил-3-[4-{3-(N-метил-N-(3, 4-диметоксибензил)амино] пропилокси} бензолсульфонил]бензфурана (SR 33747 А).
2-Изопропил-3-[4-(3-бромпропилокси)бензолсульфонил]-бензфуран.
Соединение синтезировано способом, описанным в примере 15, т.пл. 111-112оС.
Использованием той же методики получены следующие соединения:
2-изопропил-3-[4-(2-бромэтокси)
бензолсульфонил]-бензфуран, т.пл. 109-110оС;
2-изопропил-3-[4-(4-бромбутилокси)бе- нзолсульфонил]бензфуран.
в) Кислый оксалат 2-изопропил-3-[4-{ 3-[N-метил-N-(3, 4-диметоксибензил)амино] пропилокси}-бензолсульфонил]бензофура- на.
Смесь 0,0103 моля 2-изопропил-3-[4-(3-бромпропилокси)-бензолсульфонил] -бенз-фурана и 0,0206 моль N-метил-3, 4-диметокси-β-фенэтиламина в 75 мл толуола кипятят 4 дня в присутствии 0,03 моля безводного и мелкоразмельченного карбоната калия. После охлаждения реакционной смеси минеральные соли отфильтровывают и фильтрат испаряют досуха. После этого непрореагировавший амин отделяют вытеснительной хроматографией на нейтральной окиси алюминия с использованием в качестве элюента хлороформа. Целевое соединение очищают вытеснительной хроматографией на окиси кремния с использованием в качестве элюента ацетона. Выделенное в результате масло (выход примерно 96%) затем превращают в этилацетате в кислый оксалат использованием эфирного раствора щавелевой кислоты.
В результате с выходами 40-60% получают кислый оксалат 2-изопропил-3-[4-{ 3-[N-метил-N-(3, 4-диметоксибензил)-амино] пропилокси}бензолсульфонил] бензфурана, т.пл. 167оС (этанол).
С использованием приведенной методики получены следующие соединения:
Полуоксалат
2-изопропил-3-[4-{2-[N-метил-N-(3,4-диметоксибензил) амино] этилокси} бензолсульфонил] бензфурана (SR 33752 А) (пример 6), т.пл. 197оС (метанол)
Кислый оксалат
2-изопропил-3-[4-{3-[N-(3,4-диметокси-β-фенэтил)амино] пропилок- си}бензолсульфонил]бензфурана (SR 33753 А) (пример 7), т.пл. 196оС (метанол)
Полуоксалат
2-изопропил-3-[4-{2-(N-метил-N-(3,4-диметокси-β-фенэтил)амино] эти- локси}бензолсульфонил]бензфурана (33754 А), Пример 8), т.пл. 180о С (метанол)
Полуоксалат
2-изопропил-3-[4-{4-[N-метил-N-(3,4-диметоксибензил) амино] бутилокси} бензолсульфонил] бензофурана (SR 33755 А) (пример 9), т.пл. 154оС (этанол)
Кислый оксалат
2-изопропил-3-[4-{4-[N-метил-N-(3,4-диметокси-β-фенэтил)амино] бутилокси}бензолсульфонил]-бензофурана (SR 33756А) (пример 10) 2-Изопропил-3-[4-{ 3-(N-метил-N-[(2-пи-ридил)-β
-этил]амино]-пропилокси} бензолсульфонил]бензфуран (SR 33783) (Пример 11), желтое масло;
Кислый оксалат 2-изопропил-3-[4-{3-[N-[3-(1,3-бензодиоксолил)-β-этил] амино] про- пилокси}
бензолсульфонил]бензфурана (SR 33790 А) (Пример 12), т. пл. 194оС (метанол)
П р и м е р 13. Получение 1-метил-2-изопропил-3-[4-{3-(третбутиламино)пропилок-си} бензолсульфонил]
индола (SR 33770).
К раствору 2,8 г (0,0085 моля) 1-метил-2-изопропил-3-(4-гидроксибензолсульфонил) индола в 100 мл N,N-диметилформамида добавляют 14 г безводного размолотого карбоната калия, после чего добавляют 6,8 г (0,037 моля) 1,3-дибромпропана и смесь кипятят 0,5 ч при 100оС. Затем смесь переносят в воду, экстрагируют этиловым эфиром, эфирный раствор промывают водой, сушат над безводным сульфатом натрия, фильтруют и после испарения получают 2,7 г 1-метил-3-[4-(3-бромпропокси) бензолсуль- фонил]-2-изопропилиндола (выход 69%). Полученное сырое бромпропоксипроизводное растворяют в 60 мл диметилсульфоксида и к раствору добавляют 2,2 г (0,03 моля) трет-бутиламина. Смесь перемешивают 48 ч при комнатной температуре, переносят в воду и экстрагируют этиловым эфиром. Эфирный раствор промывают водой, сушат над безводным сульфатом натрия и испаряют. Полученный сырой продукт (2,3 г) очищают хроматографией на колонке с окисью кремния (растворитель-метанол).
В результате после перекристаллизации из смеси гептан изопропанол (1:1) с выходом 42,3% (1,4 г) получают 1-метил-2-изопропил-3-[4-{3-(трет-бутиламино)пропи- локси} бензолсульфонил]-индол, т.пл. 145оС.
С использованием вышеприведенной методики с выходом 60,8% получают кислый оксалат 1-метил-3-изопропил-2-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)амино] про- пилокси}бензолсульфонил]-индола (SR 33805 А) (пример 14), т.пл. около 94оС (этилацетат-изопропанол-диизопропиловый эфир).
П р и м е р 15. Получение кислого оксалата 2-изопропил-1-[4-{3-(трет-бутиламино) пропилокси}бензолсульфонил]бензола (SR 33728А)
а) 2-Изопропил-1-[4-(3-бромпропилокси) бензолсульфонил] бензол.
К 2 г (0,0072 моль) 2-изопропил-1-(4-гидроксибензолсульфонил)бензола в 100 мл N,N-диметилформамида при перемешивании прибавляют 11,6 г безводного размельченного карбоната калия, после чего добавляют 5,8 г (0,0288 моль) 1,3-дибромпропана и смесь нагревают 0,5 ч при 100оС. Затем охлаждают, переносят в воду и экстрагируют этиловым эфиром. Эфирный слой промывают водой, сушат над безводным сульфатом натрия и фильтруют. Эфир удаляют, остаток очищают хроматографией на колонке с окисью кремния с использованием смеси дихлорэтан гексан (6:4).
В результате с выходом 84% (2,5 г) получают 2-изопропил-1-[4-(3-бромпропилокси)бензолсульфонил] бензол; nD25 1, 558.
С использованием приведенной методики с количественным выходом получают 2-этил-1-[4-(3-бромпропилокси)бензолсульфонил] бензол.
Кислый оксалат 2-изопропил-1-[4-{3-(трет-бутиламино)-пропилокси}бензолсуль- фонил]бензола.
Смесь 2,5 г (0,00629 моля) 2-изопропил-1-[4-(3-бромпропилокси)бензолсульфонил]бензола, 2,26 г (0,031 моля) трет-бутиламина и 25 мл диметилсульфоксида перемешивают 48 ч при комнатной температуре, после чего смесь переносят в воду и экстрагируют этиловым эфиром. Эфирную часть промывают водой, сушат над безводным сульфатом натрия и фильтруют. После удаления эфира получают 2,4 г основания, которое в эфирной среде переводят в кислый оксалат.
В результате после перекристаллизации из смеси этилацетат изопропанол (7: 3) с выходом 60% (1,8 г) получают кислый оксалат 2-изопропил-1-[4-{3-(трет-бутиламино) пропилокси}бензолсульфонил]бензола, т.пл. 116оС.
С использованием той же методики с выходом 43,1% получают кислый оксалат 2-этил-1-[4-{ 3-(трет-бутиламино)пропилокси} -бензолсульфонил] бензола (SR 33763 А) (пример 16), т.пл. 203,7оС (изопропанол).
Работая аналогичным образом, получают следующие продукты:
N 17 оксалат 2-изопропил-3-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)амино] пропилокси}
бензолсульфонил] индолизина, SR 33700 А, т.пл. 135-137оС
N 18 диоксалат 4-{4-[3-(ди-н-бутиламино)-пропилокси]фенилтио} -пиридина, т.пл. 153оС. (этанол), выход80% (SR
33683)
N 19 оксалат 4-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтиламино]пропилокси} фенилтио]-пиридина (SR 33682А), т.пл. 150о (этанол)
N 20 оксалат
2-{4-[3-(ди-н-бутиламино)пропил-окси]бензолсульфонил} пиридина (SR 33692А), выход 50% т.пл. 70оС (этилацетат)
N 21 оксалат 2-[4-{3-[N-метил-N-(3,4-диметокси-β
-фенэтил)амино]пропилокси} бензолсульфонил]пиридина, (SR 33691А) Т.пл. 161,9оС (этанол)
N 22 диоксалат 4-{4-[3-(ди-н-бутиламино]-пропилокси] бензолсульфонил}-пиридина, (SR 33685
А),
т.пл. 122оС (этилацетат этанол 1/1)
N 23 оксалат 4-[4-{3-[N-метил-N-3,4-диметокси-β-фенэтил)амино] пропилокси}бензолсульфонил]-пиридина (SR 33680А). т.пл. 160оС
(этанол)
N 24 оксалат 2-{4-[3-(трет.бутиламино)пропилокси] бензолсульфонил} пиридина, выход 23% т.пл. 147оС (SR 33693А)
N 25 гидрохлорид 4-{3-[метил-N-3,
4-диметокси-β-фенэтил)амино]пропилокси} бензолсульфонилбензола (SR 33652А), выход 30% т.пл. 114оС (этанол)
N 26 оксалат
4-[3-(ди-н-бутиламино)пропилокси]бензолсульфонилбензола (SR 31810А), выход: 48% т.пл. 78,8оС (изопропанол)
N 27 оксалат 2-изопропил-3-[4-{3-N-метил-N-(3,4-диметокси-β
-фенэтил)амино] пропокси}бензолсульфонил]бензофурана, (SR 33670 A), т.пл. 151-158оС (метанол/этилацетат)
N 28 оксалат 2-н-пропил-3-[4-{3-[N-метил-N-3,4-диметокси-β
-фенэтил)амино] пропоксил} бензолсульфонил]бензофурана, (SR 33689 А), Т.пл. 143-144оС (метанол/этилацетат)
N 29 полуоксалат 2-н-пропил-3-[4-{ 3-[N-метил-N-(3,4-диметокси-β
-фенэтил)ам- ино]пропилокси} бензолсульфонил]бензотиофена (SR 33688 А), т. пл. 148-149оС (метанол/этилацетат)
N 30 оксалат 2-изопропил-3-{4-[3-(ди-н-бутиламино)пропилокси
бензолсульфонил} пиразоло[1,5-a] пиридина (SR 33684А), т.пл. 72оС
N 31 оксалат 2-изопропил-3-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)амино]
пропилокси}бензолсульфонил]пиразоло- [1,5-b]пиридина, (SR 33679 А), т.пл. 144-147оС
N 32 оксалат 2-изопропил-3-[4-{3-[N-метил-N-3,4-диметокси-β-фенэтил)амино] пропилокси}
бензолсульфонил]4,5-дигидро- фурана (SR 33681 А), т.пл. 147,2оС (метанол)
N 33 оксалат 2-изопропил-3-[4-{3-(ди-н-бутиламино)пропилокси бензолсульфонил хинолина, (Р 33695 А), т.пл.
130оС
N 34 оксалат 2-изопропил-3-[4-{3-[N-метил-N-3,4-диметокси-β-фенэтил)амино] пропилокси} бензолсульфонил] хинолина, (SR 33694А), т.пл. 162оС (этанол)
N 35 оксалат 5-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)амино]пропилокси} бензолсульфонил]-6-изопропилпирроло 1,2-в пиридазина (SR 33687 А), т. пл. 88оС
(этилацетат/изопропанол)
N 36 оксалат 2-изопропил-3-[4-[3-[N-метил-N-(3,4-диметокси-β-фенэтил)амино] пропилокси} бензолсульфонил] фурана, (SR 33697А), т.пл. 102оС
(хлороформ/этилацетат)
N 37
оксалат 2-изопропил-3-{4-[3-(ди-н-бутиламино пропилокси]бензолсульфонил} фурана, (SR 33701А) т.пл. 98оС (этанол/этиловый эфир)
N 38 оксалат
4-[4-{3-(N-метил-N-(3,
4-диметокси-β-фенэтил)амино]пропилокси} фенилтио]циннолина, (SR 33699 А), т.пл. 138 и 160оС
N 39 оксалат 3-[4-{3-[N-метил-N-(3,4-диметокси-β
-фенэтил)амино]пропилокси}-β- фенилтио]циннолина, (SR 33704А). т.пл. 166oC
N 40 оксалат 3-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)амино]пропилокси}
бензолсульфонил]циннолина (SR 33703А), т.пл. 158оС
N 41 1-бензил-1-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил] амино] пропилокси}бензолсульфонил]имидазол (SR 33776)
N 42 оксалат 1-изопропил-2-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)амино] пропилокси}бензолсульфонил]бензимид- азола
N 43 оксалат 2-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)
амино]пропилокси}бензолсульфонил]пиримидина
N 44 оксалат 2-[4-{3-{N-метил-N-(3,4-диметокси-β-фенэтил)амино]пропилокси} бензолсульфонил]индена, (SR 33705А) т.пл. 176оС
(этанол/изопропанол)
N 45 дигидрохлорид 1-изопропил-2-[4-{ 3-[N-метил-N-(3,4-диметокси-β-фенэтил) амино] пропилокси} бензолсульфонил] имидазола, т. пл. 130,5оС
(этилацетат/метанол)
N 46 кислый оксалат 1-бензил-2-[4-{ 3-[N-метил-N-3,4-диметокси-β-фенэтил)ами- но] пропилокси}бензолсульфонил]имидазола, (SR 33776А), т.пл. 130,5оС
(этилацетат/метанол)
N 47 кислый оксалат 4-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)амино] -про- пилокси} бензолсульфонил]-1,5-дифенилимидазола, т.пл. 162оС
(изопропанол/этанол/метанол)
N 48 кислый оксалат 4-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)амино] пропил- окси}бензолсульфонил]-5-фенил-тиазола, (SR 33791А), т.пл. 161,8о
С
N 49 кислый оксалат 4-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)амино] пропил- окси}бензолсульфонил]-5-изопропил-пира- зола, (SR 33801А)
N 50 4-[4-{ 3-[N-метил-N-(3,
4-диметокси-β-фенэтил)амино) пропилокси бензолсульфонил-5-изопропил-изоксазол
N 51 4-[4-{ 3-[N-метил-N-(3,4-диметокси-β-фенэтил)амино] пропилокси}
бензолсульфонил]-5-изопропил-3-фенил-изокса-зол, т.пл. 158,3оС (метанол)
N 52 кислый оксалат 2-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)амино] пропилокси} бензолсульфонил]
нафталина, (SR 33732 А), т.пл. 146оС (этанол)
N 53 кислый оксалат 1-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)амино] пропилокси}бензолсульфонил]циклогексена, (SR 33767А),
т.пл. 174оС
N 54 полуоксалат 2-изопропил-3-[4-{ 3-[N-метил-N-(3,4-диметокси-β-фенэтил)ам- ино] -пропилокси} бензолсульфонил] индола, (SR 33738А), т.пл. около 115о
С (изопропанол/этиловый эфир)
N 55 кислый оксалат 2-изопропил-3-{4-[3-(ди-н-бутиламино)пропилокси] бензол- сульфонил}индола, (SR 33743 А), т.пл. около 85оС (этилацетат/изопропанол
8/2)
N 56 полуоксалат 2-изопропил-3-[4-{ 3-[N-метил-N-(3,4-диметокси-β-фенэтил)- амино] пропилокси}фенилтио]индола (SR 33737А), (2-изопропил-3-4-гидрокси-фенилтио/индола), т.пл.
134оС (изопропанол/этиловый эфир)
N 57 кислый оксалат 3-изопропил-2-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)- амино] пропилокси} бензолсульфонил]индола, (SR 33807А),
т.пл.
около 105оС
N 58 1-метил-2-изопропил-3-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)амино] пропилокси} бензолсульфонил] индол, (SR 33741, т.пл. 96oC
(изопропанол/диизопропилэфир)
N 59 кислый оксалат 1-метил-2-изопропил-3-{ 4-[3-(ди-н-бутиламино)пропилок- си] бензолсульфонил} индола, (SR 33744А), т.пл. около 90оС
(изопропанол)
N 60 кислый оксалат 1-метил-2-изопропил-3-[4-{3-[N-метил-N-(3,4-диметокси-бензил)амино] пропилокси} бензолсульфонил] индола, (SR 33768 А), т.пл. 105оС
(изопропанол)
N 61 кислый оксалат 2-изопропил-1-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)- амино] пропилокси}бензолсульфонил]бензола, (SR 33718А), т.пл. 120оС
N
62
2-изопропил-1-{4-[3-(ди-н-бутиламинопропилокси] бензолсульфонил} бензола, (SR 33722А), т.пл. 88оС (этилацетат)
N 63 кислый оксалат-2-этил-1-[4-[N-метил-N-(3,4-диметокси-β
-фенэтил)амино] пропилокси-бензолсульфонил] бензола, (SR 33735 А), т.пл. 175оС (изопропанол)
N 64 кислый оксалат 2-этил-1-{4-[3-(ди-н-бутиламино) пропилокси]бензолcульфонил}
бензола (SR 33740А), т.пл. около 80оС (изопропанол/этиловый эфир)
N 65 5-(2-хлорбензил)-2-этил-3-[4-{ 3-[N-метил-N-(3,4-диметокси-β-фенэтил)ами- но] пропилокси}
бензолсульфонил] -4,5, 6,7-тетрагидротиено[3.2-с]пиридин, оксалат (SR 33785А), т.пл. 110оС
N 66 диоксалат 5-(2-хлорбензил)2-этил-3-{4-[3-(ди-н-бутиламино)пропилокси]
бензолсульфонил}-4,5,6,6-тетрагидротиенo[3,2-c]пиридина, (SR 33787А), т.пл. 105оС (изопропанол/диизопропилэфир)
N 67 гидрохлорид 2-изопропил-3-{4-[3-трет-бутиламино)
пропилокси]бензолсульфонил]индолизина, (SR 33712А), т.пл. 198-200оС (этилацетат/метанол)
N 68 кислый оксалат 2-этил-3-{4-[3-(ди-н-бутиламино пропилокси]бензолсульфонил}индолизина,
(SR 33711А), т.пл. 71-73оС (этилацетат)
N 69 кислый оксалат 4-{4-[3-(ди-н-бутиламино)пропилокси]бензолсульфонил} -5-фенилтиазола, (SR 33786А), т.пл. 110,4оС
(этилацетат)
N 70 кислый оксалат -{4-[3-(ди-н-бутиламино)пропилокси] бензолсульфонил} 5-изопропилпиразола, (SR 33789А), т.пл. около 53оС (метанол)
N 71 4-{
4-[3-(ди-н-бутиламино)пропилокси] бензолсульфонил}-5-изопропил-3-фенил-изоксазол (SR 33758А), т.пл. 53,5оС (толуол)
N 72 кислый оксалат 2-{4-[3-(ди-н-бутиламино)пропилокси]
бензолсульфонил}нафталина (SR 33727А), т.пл. 90оС (гептан)
N 73 кислый оксалат 2-изопропил-3-[4-{3-[N-(3,4-дихлорбензил)амино]пропилок- си} бензолсульфонил]бензфурана, т.пл.
198-199оС (метанол)
N 74 кислый оксалат 2-изопропил-3-[4-{3-[N-(3,4-дихлор-β-фенэтил)амино] пропилокси}бензолсульфонил бензфурана, т.пл. 203-204оС (метанол)
N 75 кислый оксалат 2-изопропил-1-[4-{3-[N-(1,3-бензодиоксоланил]-β-этил)ами- но] пропилокси}бензолсульфонил]бензола, т.пл. 164оС (абсолютный этанол)
N 76 кислый
оксалат 2-изопропил 1 -[4-{3-[N-метил-N-(3,4-диметокси)-бензил)-амино] пропилокси} бензолсульфонил]бензола, т.пл. 168оС (абсолютный этанол)
N 77 кислый оксалат
2-изопропил-3-[4-{3-[N-метил-N-(3,4-диметокси-β-фенэтил)- амино] пропилокси}бензолсульфонил]-1-метил-4,5-дигидропиррола, т.пл. 100-102оС (этилацетат/метанол)
Реферат
Использование: в медицине в качестве средства, проявляющего ингибигующую активность в отношении транспортировки кальция, а также гипотензивную активность. Сущность изобретения: продукт - аминофеноксипроизводные ф-лы I, где В, Су, А, R3 и R4 имеют соответствующие значения, или их солей. Соединения ф-лы I в дозе 5,89 - 0,12 проявляют анти - Альфа и Бэта эффекты 50% и более. Реагент 1: 4 - алкоксифенильное производные ф-лы II, где В, Су, А и Х - указано выше. Реагент 2: амин ф-лы III HNR3R4, где R3, R4 имеют соответствующие значения. Целевой продукт выделяют в свободном виде или в виде соли, при желании соль переводят в основание, и при желании основание переводят в соль. Структура соединения ф-лы I и II

Формула
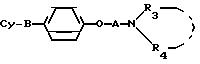
где B S или -SO2 группа;
A линейный C2 C4-алкиленовый радикал;
A C1 C4-алкильный радикал или радикал формулы Alk Ar, где Alk линейный или разветвленный C1 C4-алкиленовый радикал, Ar 3,4-диметоксифенил или 3,4-метилендиоксифенил, 3,4-дихлорфенил или пиридил;
R4 водород или C1 C4 алкильный радикал;
Cy группа, выбранная из фенила, нафтила, фурила, дигидрофурила, пиразолила, N R11-имидазолила, изоксазолила, тиазолила, бензофурила, бензотиенила, N R11-индолила, N - R11-бензимидазолила, хинолила, циннолинила, индолизин-3-ила, тетрагидротиенепиридила, пиразол (1,5 a)пиримидил, пиррол(1,2 - b)пиридазинила, причем каждый может быть замещен в альфа-положении C1 - C4-алкилом, C3 C4 -циклоалкилом, бензилом или фенилом, где R11 водород, низший алкил, фенил, бензил или галогенбензилрадикал, причем когда Cy бензо(b)фурил или бензо(b)тиенил и B SO2-группа, то R3 радикал Alk Ar,
или их солей, отличающийся тем, что 4-алкоксифенильное производное общей формулы
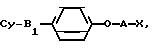
где A S или SO2-группа;
Cy и A имеют указанные значения;
X галоген, C1 C4 -алкилсульфонилокси группа, C6 - C10-арилсульфонилокси группа,
подвергают конденсации в присутствии акцептора кислоты и в неполярном растворителе с амином общей формулы

где R3 и R4 имеют указанные значения,
и выделяют целевой продукт в свободном виде или, при желании, обработкой органической или минеральной кислотой переводят его в соль.

Комментарии