Nα -2-(4-нитрофенилсульфонил)этоксикарбонил-аминокислоты в качестве nα -защищенных аминокислот для твердофазного синтеза пептидов - RU2079491C1
Код документа: RU2079491C1
Чертежи

Описание
Предлагаемое изобретение относится к новым производным
аминокислот, имеющим применение в химии пептидов, а именно к Nα -2- (4-ниртрофенилсульфонил)этоксикарбонил-аминокислотам общей формулы I:

где
R1 есть атом водорода, а R2 принимает значения: водород, метил, изопропил, 1-метипроаил, 2-метилпропил, трет бутоксиметил, 1-трет-бутоксиэтил, 2-метилтиоэтил, бензил, карбоксамидометил, 2 - карбоксамидоэтил, трет-бутоксикарбонилметил, 2-(трет-бутоксикарбонил)этил, 4-(трет бутоксикарбамидо)бутил, 4-трет-бутоксибензил, индолил-3-метил, S-(трифенилметил)тиометил, 1 (трифенилметил)имидазолил -4-метил, 3-NG мезитиленсульфанилгуанидино)пропил, N -ксантилкарбоксамидометил, 2-(N-ксантилкарбоксамидо)этил, S -(ацетамидометил)тиометил;
либо R1 и R2 вместе составляют пропиленовый радикал, применяется в качестве Nα защищенных аминокислот для твердофазного синтеза пептидов.
Твердофазный синтез широко применяется для получения биологически активных пептидов, используемых в медицине, ветеринарии, биотехнологии и научных исследованиях.
Сущность твердофазного синтеза пептидов состоит в ступенчатом наращивании пептидной цепи посредством повторяющихся циклов химических реакций, начиная с C-концевой аминокислоты, закрепленной на нерастворимом носителе. При этом целевые продукты всех реакций в процессе синтеза остаются связанными с носителем, а избыточные реагенты и побочные продукты удаляются фильтрованием и промыванием носителя.
Для проведения твердофазного синтеза пептида C-концевую аминокислоту целевой аминокислотной последовательности, защищенную по a -аминогруппе, через a -карбоксильную группу ковалентно связывают с нерастворимым полимерным носителем путем образования амидной или эфирной связи. Затем с полученного Nα -защищенного аминоацил-полимера отщепляют Nα -защитную группу и получают аминоацил-полимер cо свободной a -аминогруппой. Далее этот полимер ацилируют следующей аминокислотой, защищенной по a -аминогруппе, и получают Nα -защищенный дипептидил-полимер. Синтетические циклы, состоящие из стадий отщепления Nα -защитной группы и ацилирования свободной аминогруппы пептидил-полимера последующей аминокислотой, защищенной по a -аминогруппе, повторяют до тех пор, пока не будет собрана полная аминокислотная последовательность целевого пептида.
Так как в процессе твердофазного синтеза применяются большие молярные избытки ацилирующих реагентов (2-10-кратные по отношению к свободным аминогруппам), все реакционноспособные группы в боковых радикалах аминокислот, в частности амино-, карбокси-, гидрокси-, меркапто-, гуанидино-группы, должны быть блокированы защитными группами. Защитные группы для этой цели подбирают таким образом, чтобы, с одной стороны, обеспечить полную и постоянную защиту боковых радикалов аминокислот в условиях реакций ацилирования пептидил-полимера и отщепления временной Nα -защитной группы и, с другой стороны, иметь возможность количественно и без повреждения структуры синтезированного пептида отщепить эти защитные группы в одну или две стадии. Как правило, при этом необходимо обеспечить расщепление связи пептид-полимер. Очевидно, что структура и химические свойства постоянных защитных групп боковых радикалов аминокислот в значительной мере определяются структурой и свойствами используемой временной Nα -защитной группы.
Известны и широко применяются в твердофазном синтезе пептидов Nα -трет-бутил-оксикарбонил-амонокислоты (Вос-аминокислоты) [1] Трет-бутилоксикарбонильная (Вос) группа расщепляется под действием кислотных реагентов средней силы, например, трифторуксусной кислоты и ее растворов в хлористом метилене, растворов хлористого водорода в органических растворителях, эфирата трехфтористого бора и ряда других кислот (схема 1).

Наиболее часто в твердофазном синтезе пептидов для удаления Вос-защиты применяют обработку пептидио-полимера 50% раствором трифторуксусной кислотой в хлористом метилене в течение 10 30 мин.
В сочетании с временной Nα -Boc-группой для постоянной защиты боковых радикалов аминокислот используют защитные группы, устойчивые в условиях отщепления Boc-группы и расщепляемые более сильными кислотными реагентами одновременно с расщеплением пептидил-полимерной связи. В качестве таких реагентов применяют жидкий фтористый водород, трифторметансульфокислоту и их смеси с анизолом, тиоанизолом, диметилсульфидом. Основным недостатком стратегии твердофазного синтеза с Nα -Boc-защитойявляется использование ацидолиза для отщепления и временных и постоянных защитных групп, что не может обеспечить полной стабильности постоянной защиты. С увеличением длины синтезируемого пептида постоянные защитные группы подвергаются все более длительному воздействию кислот, что приводит к частичному их отщеплению. Кроме того, обработка сверхсильными кислотами при полном деблокировании синтезированного пептида вызывает ряд побочных реакций и приводит к частичной деструкции целевого продукта. Необходимо также отметить, что работа с жидким фтористым водородом требует специального оборудования и особых мер безопасности.
Применение в твердофазном синтезе пептидов Nα -дитиасукцинил-аминокислот (Dts-аминокислот) [2] позволяет преодолеть ряд недостатков, свойственных описанным выше Boc-аминокислотам. Nα -Дитиасукцинильная (Dts) защитная группировка расщепляется под действием тиольных реагентов, например, 2-меркаптоэтанола, этандитиола-1,2, -2-тиопиридона, в нейтральной среде с освобождением аминогруппы и образованием сероокиси углерода (схема 2).

Условия расщепления Nα -Dts-группы позволяют применять ее в сочетании с постоянными защитными группами так называемого трет-бутильного типа, отщепляемыми мягкими кислотными реагентами в условиях, близких к отщеплению Boc-группы, например, трифторуксусной кислотой и ее растворами. В данном случае временные и постоянные защитные группы отщепляются по принципиально различным механизмам. Такая схема, называемая "ортогональной" [3] дает возможность полностью селективного отщепления временных Nα -защитных групп в присутствии постоянных (а также наоборот) и, таким образом, обеспечивает полную стабильность постоянной защиты в процессе твердофазного синтеза.
Следует однако, что способы получения Nα -Dts-аминокислот многостадийны и трудоемки, поэтому они труднодоступны, дороги и почти не используются в практическом твердофазном синтезе пептидов.
Из известных Nα -производных аминокислот, применяемых для твердофазного синтеза пептидов, наиболее близкими к предлагаемым соединениям по химическим свойствам и способу применения являются Nα -9-флуоренилметоксикарбонил-аминокислоты (Fmoc-аминокислоты) [4] Nα -9-Флуоренилметоксикарбонильная (Fmoc) группа устойчива к действию кислотных реагентов и расщепляется по механизму b -элиминирования органическими основаниями в апротонных растворителях, например, морфолином, диэтиламином, пиперазином, пиперидином в диметилформамиде или хлористом метилене, с освобождением аминогруппы и образованием дибензофульфена и CO2 (Схема 3).

В твердофазном пептидном синтезе для расщепления Fmoc-группы преимущественно используют обработку защищенного пептидил-полимера смесями пиперидина с диметилформамидом, содержащими от 20 до 50% пиперидина по объему, в течение 10 30 мин. Условия отщепления Fmoc-группы также позволяют применять ее в сочетании с постоянными защитными группами трет-бутильного типа, отщепляемыми мягкими кислотными реагентами, что обеспечивает "ортогональность" всей схемы твердофазного синтеза. Мягкие условия отщепления временной Nα -Fmoc-группы и постоянных защит трет-бутильного типа обеспечивают, как правило, высокие выходы и чистоту синтезируемых пептидом.
Nα -Fmoc-аминокислоты широко применяются как в ручном твердофазном синтезе пептидом, так и в автоматических и полуавтоматических синтезаторах с реакторами шейкерного и колоночного типов. Однако, ввиду относительно высокой стоимости Nα -Fmoc-аминокислот, их используют только в синтезах малого масштаба (обычно не более 2 3 ммолей по C-концевой аминокислоте). Кроме того, из-за высокой лабильности Nα -Fmoc-аминокислот в присутствии даже слабых оснований, они редко применяются для синтеза пептидов длиной более 30 аминокислотных остатков.
Целью предполагаемого изобретения является изыскание новых Nα -защищенных производных аминокислот, расщепляемых органическими основаниями в неводных средах и пригодных для твердофазного синтеза пептидов.
Поставленная цель достигается тем, что предлагается тем, что предлагаются новые соединения, а именно Nα
-2-(4-нитрофенилсульфонил)этоксикарбонил-аминокислоты Nα -Nsc-амнокислоты) общей формулы I:

где
R1 есть атом водорода, а R2 принимает значения: водород, метил, изопропил, 1-метилпропил, 2-метилпропил, трет-бутоксиметил, 1-трет - бутоксиэтил, -метилтиоэтил, бензил, карбоксамидометил, 2-карбоксамидоэтил, трет-бутоксикарбонилметил, 2 (трет-бутоксикарбонил)этил, 4-(трет-бутоксикарбамидо)бутил, 4-трет-бутоксибензил, индолил -3- метил, S-(трифенилметил)тиометил, 1-(трифенилметил)имидазолил -4- метил, 3-(NG -мезитиленсульфонилгуанидино)пропил, N-ксантилкарбоксамидометил, 2 - (N-ксантилкарбоксамидо)этил, S-(ацетамидометил)тиометил;
либо R1 и R2 вместе составляют пропиленовый радикал,
в качестве Nα -защищенных аминокислот для твердофазного синтеза пептидов.
Указанные соединения могут быть получены путем обработки аминокислот общей формулы II, где R1 и R2 принимают указанные выше значения, 2-(4-нитрофенилсульфонил)этилхлорформиатом III в среде водно-органического растворителя в присутствии основания при температуре от 0 до 40oC (схема 4).

Хлорформиат III вводят в реакцию в количестве от 0.5 до 1.5 г-экв. предпочтительно 0.7 0.9 г-экв. по отношению к аминокислоте. В качестве органического компонента растворителя берут апротонный органический растворитель, растворяющий ацилирующий агент и смешивающийся с водой, например, ацетонитрил, диметилформамид, тетрагидрофуран, диоксан. В качестве основания используют неорганическое или органическое основание, например, карбонат калия или натрия, оксид магния или кальция, триэтиламин, N-метилморфолин.
По другому способу, аминокислоты формулы II известным способом превращаются в N, O-бис-триметилсилил производные формулы IV, которые затем без выделения в чистом виде обрабатывают хлорформиатом III в среде безводного органического растворителя, например хлористого метилена. После водного гидролиза промежуточных триметилсилиловых эфиров получают свободные Nα -Nsc-аминокислоты формулы I (схема 5).

Соединения формулы I, где R1 атом водорода, а R2 - N-ксантилкарбоксамидометил либо 2(N-ксантилкарбоксамидо)этил, получают взаимодействием соединений формулы I, где R1 карбоксамидометил или 2-(карбоксамидо)этил, соответственно, с ксантгидролом в среде апротонного органического растворителя в присутствии кислоты. Как растворитель может быть использован диметилформамид, в качестве кислоты предпочтительно органическая кислота, например, трифторуксусная кислота, n толуолсульфокислота или метансульфокислота.
Из структурной формулы видно, что соединения формулы I имеют асимметрический α -атом углерода (кроме соединения с R1=R2=H). Поскольку в реакциях, используемых для их получения, не участвует a -атом углерода, то конфигурация этого атома, имеющаяся в исходных аминокислотах формулы II, сохраняется в Nα -Nsc-аминокислотах формулы I. Таким образом, очевидно, что, в зависимости от конфигурации исходных аминокислот формулы II, описанными методами могут быть получены Nα -Nsc-аминокислоты D- или L-конфигурации, а также рацемические соединения.
Значения заместителей R1 и R2 в заявляемых соединениях формулы I соответствуют структурам боковых радикалов аминокислот природного происхождения, содержащих либо не содержащих защитные группы известного строения, преимущественно требутильного типа или близкие к ним по условиям отщепления (таблица 1).
Из таблицы 1 видно, что соединения формулы I составляют полный набор защищенных производных аминокислот, необходимых для синтеза пептидов любого аминокислотного состава.
Nα Nsc-аминокислоты I представляют собой кристаллические вещества, нерастворимые или малорасторимые в воде и растворимые в полярных органических растворителях, устойчивые при длительном хранении при температурах от -10 до 25oC.
Nα -Nsc-аминокислоты I применяются для твердеющего синтеза пептидов. С этой целью первую Nα -Nsc-аминокислоту, соответствующую C-концевой аминокислоте аминокислотной последовательности целевого пептида, через a - карбоксильную группу ковалентно связывают с нерастворимым полимерным носителем путем образования амидной или эфирной связи. При этом происходит образование Nα -Nsc-аминоацил-полимера. В качестве полимерного носителя используют сетчатый или макропористый полистирол, сшитый дивинилбензолом, поли-N,N- диметилакриламид в виде гранул или в виде композита с кизельгуром, сшитые декстраны, целлюлозы, бумагу и иные полимерные носители, известные для твердого синтеза пептидов. Полимерный носитель должен содержать якорные группы, необходимые для присоединения первой аминокислоты. Предпочтительными якорными группами являются группы, обеспечивающие отщепление синтезированного пептида от полимерного носителя с освобождением C-концевой карбоксильной или карбоксамидной группы при обработке кислотными реагентами, например, трифторуксусной кислотой, растворами хлористого водорода в уксусной кислоте. Такими якорными группами могут быть: для образования эфирной связи - 4-гидроксиметилфеноксиалкильная, 4-хлор- или 4-бромметилфеноксиалкильная, a -гидроксидифенилметильная и другие известные якорные группы; для образования амидной связи известные ди- и триалкоксибензгидраминные группы с различным расположением алкокси-заместителей, 4-аминометил-3,5-диметоксифеноксиалкильная, а также другие известные группа, применяющиеся для указанной цели.
Присоединение C-концевой Nsc-аминокислоты к якорным группам полимерного носителя осуществляется способами, известными в химии пептидов.
Для получения аминоацил-полимера со свободной a -аминогруппой с полученного Nα Nsc-аминоацил-полимера отщепляют Nsc-группу. С этой целью полимер обрабатывают основным реагентом. Предпочтительными основными реагентами для этого являются азотистые основания, например, аммиак, морфолин, пиперидин, пиперазин, диэтиламин, 1,8-диазабицикло[5,4,0]унден-7-ен, 1,1,3,3-тетраметилгуанидин и их растворы в апротонных органических растворителях. Наиболее предпочтительным основным реагентом является раствор от 20 до 50% по объему пиперидина в диметилформамиде. Продуктами расщепления Nsc-группы в данном случае являются N-[2-(4-нитрофенилсульфонил) этил]пиперидин и CO2, при этом происходит освобождение a -аминогруппы.
Далее полученный аминоацил-полимер со свободной a -аминогруппой ацилируют следующей Nα -Nsc-аминокислотой и получают Nα -Nsc-дипептидил-полимер. С этой целью применяют приемы и методы, известные в химии пептидов. В качестве ацилирующих реагентов могут быть использованы 4-нитрофениловые, пентахлорфениловые, пентафторфениловые, 1-оксибензотриазолиловые эфиры Nα -Nsc-аминокислот, а также другие типы активированных эфиров, применяемые в твердофазном синтезе пептидов; симметричные ангидриды Nα -Nsc-аминокислот. Ацилирование можно осуществлять Nα -Nsc-аминокислотами в присутствии известных конденсирующих реагентов, например, дициклогексилкарбодиимида, диизопропилкарбодиимида, гексафторфосфата, бензотриазолил-1-окси-трис(диметиламино)фосфония.
Синтетические циклы, состоящие из стадий отщепления Nα -Nsc-группы и ацилирования свободной аминогруппы пептидил-полимера последующей Nα -Nsc-аминокислотой до тех пор, пока не будет собрана аминокислотная последовательность целевого пептида.
По окончании сборки с полученного Nα -Nsc-пептидил-полимера удаляют Nα -Nsc-группу, после чего целевой пептид отщепляют от якорной группы полимера с одновременным удалением постоянных защитных групп с боковых радикалов аминокислот. Для этой цели используют кислотные реагенты, известные для отщепления защитных групп трет-бутильного типа, например трифторуксусную кислоту, растворы метансульфокислоты или п-толуолсульфокислоты в органических растворителях, с добавлением или без добавления известных реагентов для связывания образующихся карбониевых ионов, например, анизола, тиоанизола, диметилсульфида, этандитиола-1,2.
Деблокированный целевой пептид выделяют и очищают известными способами.
Nα -Nsc-группа медленнее, чем Nα -Fmoc-группа, расщепляется основаниями, однако в течение реального времени, которое обычно отводится пор протоколу твердофазного синтеза для стадии удаления Nα -защитной группы (15 - 20 мин), происходит, тем не менее, количественное отщепление Nsc-группы с пептидил-полимера. Вместе с тем, большая устойчивость Nα -Nsc-аминокислот к действию оснований по сравнению с Fmoc-аминокислотами обеспечивает их более высокую стабильность в нейтральных и слабоосновных средах, используемых для проведения стадий ацилирования.
Как указано выше, Nsc-группа может быть количественно отщеплена основными реагентами в присутствии защитных групп трет-бутильного типа, которые устойчивы к действию органических оснований. С другой стороны, Nsc-группа полностью устойчива к действию кислотных реагентов, применяемых для расщепления защитных групп третбутильного типа. Таким образом, использование для твердофазного синтеза пептидов Nα -Nsc-аминокислот формулы I, содержащих в боковых радикалах постоянные защитные группы преимущественно трет-бутильного типа или близкие к ним по условиям отщепления, позволяет обеспечить условия "ортогональности", которые являются основой эффективности схем твердофазного синтеза пептидов.
Сущность предполагаемого изобретения иллюстрируется примерами. При
описании примеров используются следующие сокращения и условные обозначения:
ДМФА диметилформамид,
ВЭЖХ высокоэффективная жидкостная хроматография.
Оптически активные аминокислоты, приведенные в описаниях примеров, по умолчанию имеют L-конфигурацию.
Пример 1. Получение Nα -Nsc-L-аспарагина (I 10).
Растворили 3,96 г (30 ммол) L-аспарагина и 7,7 г (55 ммол) карбоната калия в 100 мл смеси вода-диоксан (3:1) и при охлаждении в ледяной бане в течение 15 мин прибавили при перемешивании раствор 7,5 г (25 ммол (2-(4-нитрофенилсульфонил)этилхлорформиата III в 70 мл диоксана. Смесь перемешивали еще 20 мин без охлаждения, упарили при пониженном давлении до 100 мл и перенесли в делительную воронку. К смеси прибавили 100 ил воды и экстрагировали этилацетатом (2 х 50 мл). Водный слой отделили, подкислили 40% серной кислотой до pH 2 и охладили в ледяной бане. Через 30 мин выпавший осадок отфильтровали, промыли ледяной водой до нейтральной реакции, сушили на воздухе до постоянного веса. Получили соединение 1 10 в виде белого кристаллического порошка, выход 71% Характеристики полученного продукта приведены в таблице 2 (Пример 5).
Пример 2. Получение Nα -Nsc-L-лейцина (1 5).
4,92 г (37,5 ммол) L-лейцина и 90 мл сухого хлористого метилена поместили в круглодонную колбу вместимостью 250 мл, снабженную обратным холодильником и капельной воронкой. К суспензии при сильном перемешивании прилили 9,5 мл (75 ммол) триметилхлорсилана, смесь нагрели до кипения и кипятили 1 ч. Затем смесь охладили на деляной бане и добавили при перемешивании 9,1 мл (65 ммол) триэтиламина и 9,0 г (30 ммол) хлорформиата III. Смесь перемешивали 20 мин при охлаждении, затем 1,5 ч при комнатной температуре. Растворитель отогнали на ротационном испарителе, остаток распределили между 200 мл этилацетата и 250 мл 2,5% раствора бикарбоната натрия. Водный слой отделили, промыли 50 мл эфира, подкислили 1 н.соляной кислотой до pH 2 и экстрагировали этилацетатом (200 мл). Этилацетатные вытяжки сушили сульфатом натрия, удалили растворитель, остаток перекристаллизовали из смеси гексан-этилацетат. Получили соединение 1 5 в виде белого кристаллического порошка, выход 80% Характеристики полученного продукта приведены в табл. 2 (Пример 5).
Пример 3. Получение b тpет-бутилового эфира Nα -Nsc-L-аспарагиновой кислоты (1 12).
7,09 г (37,5 ммол) b -трет-бутилового эфира L-аспарагиновой кислоты и 90 мл сухого хлористого метилена поместили в круглодонную колбу вместимостью 250 мл, снабженную обратным холодильником и капельной воронкой. К смеси при сильном перемешивании добавили 12,7 мл (73 ммол) диизопропилэтиламина, затем 9,5 мл( 75 ммол) триметилхлорсилана и кипятили реакционнцю смесь 1,5 ч. Смесь охладили на ледяной бане, добавили в один прием 7,9 г (30 ммол) хлорформиата III и перемешивали 1,5 ч при комнатной температуре. Растворитель отогнали на ротационном испарителе, остаток распределили между 200 мл этилацетата и 250 мл 2,5% раствора бикарбоната натрия. Водный слой промыли 50 мл эфира, подкислили 1 н.соляной кислотой до pH 2 и экстрагировали этилацетатом (200 мл). Этилацетатные вытяжки сушили сульфатом натрия, удалили растворитель, остаток перекристаллизовывали из смеси гексан-этилацетата. Получили соединение 1 12 в виде белого кристаллического порошка, выход 86% Характеристики полученного продукта приведены в табл. 2 (Пример 5).
Пример 4. Получение Nα -Nsc-N-ксантил-L-аспарагина (1-20).
Растворили 3,89 г (10 ммол) Nα -Nsc-L-аспарагина (1 10) и 2,6 г (13 ммол) ксантгидрола в 20 мл ДМФА. К раствору добавили 0,4 мл метансульфокислоты, перемешали и оставили стоять при комнатной температуре. Через двое суток реакционную смесь вылили в 100 мл ледяной воды, выпавший осадок отфильтровали, промыли водой, этилацетатом, этанолом, эфиром. Осадок растворили при нагревании в 10 мл ДМФА, профильтровали, осадили эфиром, промыли эфиром и сушили в вакуум-эксиакоторе над хлористым кальцием. Получили соединение 1 20 в виде кристаллического порошка, выход 74% Характеристики полученного продукта приведены в табл. 2 (пример 5).
Пример 5. Физико-химические свойства Nα -Nsc-аминокислот I.
С использованием способов, описанных в примерах 1 4, получены соединения формулы I, приведенные в табл. 2. Номер в колонке "Способ" соответствует номеру примера, в котором изложен способ получения. Величины удельного оптического вращения [α] измерены на поляриметре DIP-320 JASCO (Япония) в кювете длиной 10 см. Температуры плавления измерены в капиллярах и не корректированы. Значения хроматографических подвижностей Rf приведены для пластинок для тонкостенной хроматографии Alufolien Kieselgel 60 F254 (Merck, ФРГ) в системах хлороформ-метанол-уксусуная кислота, 95:5:3 (А) и бензол-ацетон-уксусуная кислота, 100:50:3 (Б). Обнаружение пятен на пластинках проводили в УФ-свете и нингидриновым реактивом после прогревания. Массы молекулярных ионов (M+H+) измерены на времяпролетном масс-спектре МСБХ-1 (НПО "Электрон", Украина). Элементный состав (C, H, N) полученных соединений формулы I соответствует вычислительному в пределах погрешности метода определения (CHN-анализатор Perkin-Elmer, данные в таблице не приводятся). Все оптически активные соединения I, приведенные в таблице 2, имеют L-конфигурацию.
Пример 6. Синтез додекапептида Ala-Ser-Ser-Thr-Ile-Ile-Lys-Phe-Gly-Ile-Asp-Lys.
а) Введение якорной группы в полимерный носитель.
К 250 мг аминометилированного сополимера стирола с 1% дивинилбензола (1,0 мэкв NH2/г) прибавили 0,75 ммол 2,4,5-трихлорфенилового эфира 4-гидроксиметилфеноксипропионовой кислоты, 0,75 ммол 1-гидроксибензотриазола и 3 мл ДМФА. Реакционную смесь перемешивали 24 ч при комнатной температуре. Полимер отфильтровали, промыли ДМФА, этанолом, эфиром, гексаном, сушили 24 ч в вакуум-эксикаторе над пятиокисью фосфора.
б) Присоединение Nsc-Lys(Boc)-OH к якорной группе.
К полученному полимеру прибавили 0,75 ммолд Nsc-Lys(Boc)-OH (1 14), 0,75 ммол дициклогексилкарбодиимида, 0,1 ммол 4-диметиламинопиридина и 4 мл смеси дихлорэтан-N-метилпирролидон (3:1). Реакционную смесь перемешивали 24 ч при комнатной температуре. Полимер отфильтровали, промывали тщательно на фильтре хлороформом, смесью хлороформ-метанол (1:1), этанолом, эфиром, гексаном. Получено 400 мл Nsc-Lys(Bos)-полимера.
в) Сборка аминокислотной последовательности додекапептида.
200 мг полученного Nsc-Lys(Boc)-полимера
поместили в полипропиленовый шприц вместимостью 10 мл, снабженный полипропиленовым фильтром. Полимер в шприце тщательно промыли ДМФА и далее осуществляли синтетические циклы согласно следующему
протоколу:
1. Промывание 33% пиперидин/ ДМФА, 4 мл; 0,5 мин.
2. Деблокирование: 33% пиперидин/ДМФА, 4 мл; 15 мин.
3. Промывание: ДМФА, 6 х (4 мл; 1 мин).
4. Ацилирование: Nα -Nsc-аминокислота I, 0,5 ммол; гексафторфосфат бензотриазолил-1-окси-трис(диметиламино)фосфония (ВОР), 0,5 ммол; 1-гидроксибензотриазол, 0,5 ммол; N-метилморфолидин 0,75 ммол; ДМФА, 2 мл; 60 мин (для Nsc-Ile-OH 90 мин).
5. Промывание: ДМФА, 5х(4мл; 1 мин).
Nα Nsc-Аминокислоты вводили в
синтетические циклы в следующей последовательности: Nsc-Asp(OtBu)-OH, Nsc-Ile-OH, Nsc-Gly-OH, Nsc-Phe-OH, Nsc-Lys(Boc(-OH, Nsc-Ile-OH, Nsc-Ile-OH,Nsc-Thr(tBu)-OH, Nsc-Ser(tBu)-OH, Nsc-Ser(tBu)-OH,
Nsc-Ala-OH,
После сборки целевой аминокислотной последовательности пептидил-полимер обработали 33% пиперидином в ДМФА (4 мл) в течение 20 мин, затем промыли ДМФА, хлористым метиленом,
этанолом, эфиром, гексаном.
г) Деблокирование и очистка додекапептида.
Пептидил-полимер обработали 5 мл 50% трифторуксусной кислоты в дихлорэтане при перемешивании в течение 60 мин при комнатной температуре. Полимер отфильтровали, промыли на фильтре 5 мл 50% трифторуксусной кислоты в дихлорэтане, объединенные фильтраты разбавили 100 мл сухого охлажденного эфира. Выпавший осадок отфильтровали, промыли эфиром и сушили в вакууме. Получено 170 мг сырого додекапептида 70% чистоты по данным аналитической обращенно-фазовой ВЭЖХ.
Сырой додекапептид растворили в 3 мл 1 М водного раствора уксусной кислоты и хроматографировали на колонке 1,5х70 см с TSK HW-40F(Merck, ФPГ ), уравновешенной 1 М водным раствором уксусной кислоты. Элюцию проводили этим же буфером, фракции, содержащие чистый пептид, объединили и лиофилизовали. Получили 104 мг (41%) целевого додекапептида с чистотой более 95% по данным аналитической обращенно-фазовой ВЭЖХ. Анализ аминокислотного состава (после гидролиза 6 н. HCl, 110oC 24 и 48 ч, относительно Ala): Asp 1.02 (1); Ser 1,84 (2); Thr 0,93 (1); Glu 0,94(1); Gly 1.03(1); Ala 1.00 (1); Ile 2.78(3); Lys 2.04 (2).
Приведенные примеры свидетельствуют, что заявляемые соединения Nα -2-4(нитрофенилсульфонил)этоксикарбонил-аминокислоты общей формулы 1 могут применяться в качестве Nα -защищенных производных аминокислот в твердофазном синтезе пептидов.
Реферат
Использование: в качестве Nα - защищенных аминокислот для твердофазного синтеза пептидов, Сущность изобретение: продукт: Nα -2- /4 -нитрофенилсульфонил/этоксикарбониламинокислоты: 4-NO2 -C6H4-S/O/2-CH2-CH2 -O-C /O/ - NR1-CHR2-COOH, где: R1 - водород; R2 - водород, метил, изопропил, метилпропил, трет.-бутоксиметил, 1 -трет-бутоксиэтил/ 2-метилтиоэтил, бензил, карбоксаамидоалкил, трет-бутоксикарбонилалкил, или вместе составляют пропиленовый радикал. Выходы до 86%. Реагент 1: соответствующая аминокислота, Реагент 2: 2-/4 - нитрофенилсульфонил/этилхлорформиат. Условия реакции: водно-органический растворитель, в присутствии основания при температуре 0 - 40oC. 2 табл.
Формула
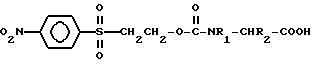
где R1 водород;
R2 водород, метил, изопропил, 1-метилпропил, 2-метилпропил, трет-бутоксиметил, 1-трет-бутоксиэтил, 2-метилтиоэтил, бензил, карбоксамидоматил, 2-карбоксамидоэтил, трет-бутоксикарбонилметил, 2-(трет-бутоксикарбонил)-этил, 4-(трет-бутоксикарбамидо)бутил, 4-трет-бутоксибензил, индолил-3-метил, S-(трифенилметил)тиометил, 1-(трифенилметил)имидазолил-4- метил, 3-(NG-мезитиленсульфонилгуанидино) пропил, N-ксантилкарбоксамидометил, 2-(N-ксантилкарбоксамидо)этил или S-(ацетамидометил)тиометил
или R1 и R2 вместе составляют пропиленовый радикал,
в качестве Nα защищенных аминокислот для твердофазного синтеза пептидов.

Комментарии