Бифенилсульфонилцианамиды, способ их получения и их применение в качестве лекарственных средств - RU2247111C2
Код документа: RU2247111C2
Описание
Данное изобретение относится к соединениям формулы
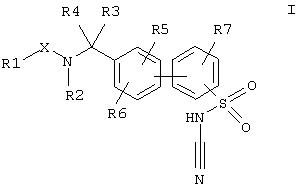
где заместители имеют следующие значения:
R(1) 1. алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами;
2. алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами, в котором от одного до всех атомов водорода заменены фтором;
3. алкенил с 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 С-атомами или
4. -CnH2n-nn-Y,
nn - нуль или 2 и
n - нуль, 1, 2, 3 или 4; причем n не равно нулю или 1, если nn равно 2;
5. -CnH2n-nn-Y,
nn - нуль или 2 и
n - 1, 2, 3 или 4; причем n не равно 1, если nn
равно 2;
причем 1, 2 или 3 атома водорода в двухвалентном остатке -CnH2n-nn- независимо друг от друга заменены остатком из ряда
1. арил с 6, 7, 8, 9, 10, 11, 12, 13 или 14 С-атомами, предпочтительно фенил, 1-нафтил или 2-нафтил;
2. аминогруппа;
3. NR(22)R(23);
4. алкоксикарбонил;
5. COOR(16);
6. алкил с 1, 2, 3 или 4 С-атомами;
7. (C6-C14)-арил -(C1-C4)-алкил-карбонил, предпочтительно фенилацетил;
R(2)
1. водород;
2. алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами;
3. алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами, в котором от одного до всех атомов водорода заменены фтором;
4. алкенил с 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 С-атомами;
5. алкинил с 2, 3, 4, 5, 6, 7 или 8 С-атомами;
6. -CnH2n-nn-Z
nn - нуль или 2 и
n - нуль, 1, 2, 3 или 4; причем n не равно нулю или 1, если nn равно 2;
7. -CnH2n-nn-Z
nn - нуль или 2 и
n - 1, 2, 3 или 4; причем n не равно 1, если nn
равно 2;
причем 1, 2 или 3 атома водорода в двухвалентном остатке -CnH2n-nn- независимо друг от друга заменены остатком из ряда
1. арил с 6, 1, 8, 9, 10, 11, 12, 13 или 14 С-атомами, предпочтительно фенил, 1-нафтил или 2-нафтил;
2. аминогруппа;
3. NR(22)R(23);
4. (C1-C4)-алкоксикарбонил;
5. COOR(16);
6. алкил с 1, 2, 3 или 4 С-атомами;
R(3) и R(4) независимо друг от друга водород или алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами;
R(5), R(6) и R(7) независимо друг от друга водород, алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами, F, Cl, Br, I, CF3, -CN, -NO2, SOq-R(8), CO-R(21) или O-R(10);
R(8) алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами, NR(11)R(12) или фенил, который незамещен или замещен 1, 2 или 3 одинаковыми или различными остатками из ряда F, Cl, Вr, I, СF3, метил, метокси-, гидроксигруппы или NR(11)R(12);
R(9) и R(21) независимо друг от друга водород, алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами или OR(13);
R(10) водород, алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами, в случае необходимости замещенный (C1-C4)-алкоксигруппой; или фенил, который незамещен или замещен 1, 2 или 3 одинаковыми или различными остатками из ряда F, Cl, Вr, I, СF3, метил, метокси-, гидроксигруппы или NR(11)R(12);
R(11), R(12), R(19) и R(20) независимо друг от друга
водород, алкил с 1, 2, 3 или 4 С-атомами или (C1-C4)-алканоил, предпочтительно ацетил;
R(13) водород или алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами;
X карбонил, -CO-NH-, -СО-СО- или сульфонил;
Y и Z независимо друг от друга
1. арил с 6, 7, 8, 9, 10, 11, 12, 13 или 14 С-атомами, предпочтительно фенил, 1-нафтил или 2-нафтил;
2. один из остатков, определенных в п.1, замещенный 1, 2, 3, 4 или 5 одинаковыми или различными остатками из ряда алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами, арил с 6, 7, 8, 9, 10, 11, 12, 13 или 14 С-атомами, предпочтительно фенила, 1-нафтил или 2-нафтил, F, Сl, Вr, I, СF3 , SOqR(18), OR(16), NR(19)R(20), -CN, NO2 или СО-R(9); или два остатка вместе образуют один конденсированный гетероциклический остаток, предпочтительно метилендиоксигруппу.
3. гетероарил с 1, 2, 3, 4, 5, 6, 7, 8 или 9 С-атомами;
4. один из остатков, определенных в п.3, замещенный 1, 2 или 3 одинаковыми или различными остатками из ряда F, Cl, Вr, I, СF3, СН3, метокси-, гидроксигруппы или NR(11)R(12);
5. циклоалкил с 3, 4, 5, 6, 7, 8, 9 или 10 С-атомами, предпочтительно циклопропил, циклопентил, циклогексил, 1, 2,3,4-тетрагидронафтил или инданил;
6. один из остатков, определенных в п.5, замещенный арилом с 6, 7, 8, 9, 10, 11, 12, 13 или 14 С-атомами, предпочтительно фенилом, 1-нафтилом или 2-нафтилом;
7. O-R(14);
8. O-R(17);
9. -SO2-R(14);
10. арилалкилкарбонил, предпочтительно фенил-СН2-СО-;
или
11. гетероциклил;
R(14) и R(17) независимо друг от друга
1. водород;
2. алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами;
3. алкенил с 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 С-атомами;
4. -СnН2n-nn-фенил,
nn - нуль или 2 и
n - нуль, 1, 2, 3, или 4; причем n не равно нулю или 1, если nn равно 2;
5. один из остатков, определенных в п.4, причем фенильная часть замещена 1, 2 или 3 одинаковыми или различными остатками из ряда алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами, F, Cl, Br, I, СF3, SOqR(15), OR (16), NR(11)R(12), -CN, -NO2 или CO-R(9) или R(15) и R(18) независимо друг от друга алкил с 1, 2, 3 или 4 С-атомами, алкил с 1, 2, 3 или 4 С-атомами, в котором от одного до всех атомов водорода заменены фтором, предпочтительно СF3, или NR(11)R(12);
R(16) 1. водород,
2. алкил с 1, 2, 3 или 4 С-атомами,
3. алкил с 1, 2, 3 или 4 С-атомами, замещенный (C1-C4 )-алкоксигруппой,
4. алкил с 1, 2, 3 или 4 С-атомами, в котором от одного до всех атомов водорода заменены фтором, предпочтительно СF3;
5. арил с 6, 7, 8, 9, 10, 11, 12, 13 или 14 С-атомами, предпочтительно фенил, 1-нафтил или 2-нафтил;
6. один из остатков, определенных в п.5, который замещен 1, 2 или 3 одинаковыми или различными остатками из ряда F, Cl, Br, I, CF3, NR(19)R(20), -CN, NO2;
R(22) и R(23) независимо друг от друга водород или CO-OR(24);
R(24) водород, алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами или -СnН2n -фенил с n, равным 1, 2, 3 или 4;
q независимо друг от друга нуль, 1 или 2;
а также их физиологически приемлемые соли.
Предпочтительными являются соединения формулы (I) с R(1)
1. алкил с 1, 2, 3, 4 или 5 С-атомами;
2. алкил с 1, 2, 3, 4 или 5 С-атомами, в котором от одного до всех атомов водорода заменены фтором;
3. алкенил с 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12
С-атомами или
4. -CnH2n-nn-Y,
nn - нуль или 2 и
n - нуль, 1, 2, 3 или 4; причем n не равно нулю
или 1, если nn равно 2;
5. -CnH2n-nn-Y,
nn - нуль или 2 и
n - 1, 2, 3 или 4; причем n не равно 1, если nn равно 2;
причем 1, 2 или 3 атома водорода в двухвалентном остатке -CnH2n-nn - независимо друг от друга заменены на остаток из ряда
1. арил с 6, 7, 8, 9, 10, 11, 12, 13 или 14 С-атомами, предпочтительно фенил, 1-нафтил или 2-нафтил;
2. аминогруппа;
3. NR(22)R(23);
4. алкоксикарбонил;
5. COOR(16);
6. алкил с 1, 2, 3 или 4 С-атомами;
7. (C6-C14)-арил -(C1-C4)-алкил-карбонил, предпочтительно фенилацетил;
R(2) 1. водород;
2. алкил с 1, 2, 3, 4, 5 или 6 С-атомами;
3. алкил с 1, 2, 3, 4, 5 или 6 С-атомами, в котором от одного до всех атомов водорода заменены фтором;
4. алкенил с 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 С-атомами;
5. алкинил с 2, 3, 4 или 5 С-атомами;
6. -CnH2n-nn-Z,
nn - нуль или 2 и n - нуль, 1, 2, 3, или 4; причем n не равно нулю
или 1, если nn равно 2;
7. -CnH2n-nn -Z,
nn - нуль или 2 и
n - 1, 2, 3 или 4; причем n не равно 1, если nn
равно 2;
причем 1, 2 или 3 атома водорода в двухвалентном остатке -CnH2n-nn- независимо друг от друга заменены на остаток из ряда
1. арил с 6, 7, 8, 9, 10, 11, 12, 13 или 14 С-атомами, предпочтительно фенил, 1-нафтил или 2-нафтил;
2. аминогруппа;
3. NR(22)R(23);
4. (C1-C4)-алкоксикарбонил;
5. COOR(16);
6. алкил с 1, 2, 3 или 4 С-атомами;
R(3) и R(4) независимо друг от друга водород или алкил с 1, 2, 3 или 4 С-атомами;
R(5), R(6) и R(7) независимо друг от друга водород, алкил с 1, 2, 3 или 4 С-атомами, F, Cl, Br, СF3, -CN, SOq-R(8), CO-R(21) или O-R(10);
R(8) алкил с 1, 2, 3 или 4 С-атомами, NR(11)R(12) или фенил, который незамещен или замещен 1 или 2 одинаковыми или различными остатками из ряда F, Cl, Br, СF3, метил, метокси-, гидроксигруппы или NR(11)R(12);
R(9) и R(21) независимо друг от друга водород, алкил с 1, 2, 3 или 4 С-атомами или OR(13);
R(10) водород, алкил с 1, 2, 3 или 4 С-атомами, в случае небходимости замещенный (C1-C4)-алкоксигруппой; или фенил, который незамещен или замещен 1 или 2 одинаковыми или различными остатками из ряда F, Cl, Вr, СF3, метил, метокси-, гидроксигруппы или NR(11)R(12);
R(11), R(12), R(19) и R(20) независимо друг от друга водород, алкил с 1, 2, 3 или 4 С-атомами или (C1-C4)-алканоил, предпочтительно ацетил;
R(13) водород или алкил с 1, 2, 3 или 4 С-атомами;
X карбонил, -CO-NH-, -СО-СО- или сульфонил;
Y и Z независимо друг от друга
1. фенил, 1-нафтил или 2-нафтил;
2. один из остатков, определенных в п.1, замещенный 1, 2, 3, 4 или 5 одинаковыми или различными остатками из ряда алкил с 1, 2, 3 или 4 С-атомами, фенил, 1-нафтил или 2-нафтил, F, Cl, Вr, СF3, SOq R(18), OR(16), NR(19)R(20), -CN или CO-R(9);
или два остатка вместе образуют один конденсированный гетероциклический остаток, предпочтительно метилендиоксигруппу;
3. гетероарил с 1, 2, 3, 4, 5, 6, 7, 8 или 9 С-атомами;
4. один из остатков, определенных в п.3, замещенный 1 или 2 одинаковыми или различными остатками из ряда F, Cl, Вr, CF3, СН3, метокси-, гидроксигруппы или NR(11)R(12);
5. циклоалкил с 3, 4, 5, 6, 7, 8, 9 или 10 С-атомами, предпочтительно циклопропил, циклопентил, циклогексил, 1,2,3, 4-тетрагидронафтил или инданил;
6. один из остатков, определенных в п.5, замещенный фенилом, 1-нафтилом или 2-нафтилом;
7. O-R(14);
8. O-R(17);
9. -SO2-R(14);
10. арилалкилкарбонил, предпочтительно фенил-СН2-СО- или
11. гетероциклил;
R(14) и R(17) независимо друг от друга
1. водород;
2. алкил с 1, 2, 3 или 4 С-атомами;
3. алкенил с 2, 3, 4, 5 или 6 С-атомами;
4. -CnH2n-nn -фенил,
nn - нуль или 2 и
n - нуль, 1, 2, 3 или 4; причем n не равно нулю
или 1, если nn равно 2;
5. один из остатков, определенных в п.4, причем фенильная часть замещена 1, 2 или 3 одинаковыми или различными радикалами из ряда алкил с 1, 2, 3 или 4 С-атомами, F, Cl, Br, CF3, SOqR(15), OR(16), NR(11)R(12), -CN или CO-R(9) или R(15) и R(18) независимо друг от друга
алкил с 1, 2, 3 или 4 С-атомами, алкил с 1, 2, 3 или 4 С-атомами, в котором от одного до всех атомов водорода заменены фтором, предпочтительно CF3, или NR(11)R(12);
R(16) 1. водород;
2. алкил с 1, 2, 3 или 4 С-атомами;
3. алкил с 1, 2, 3 или 4 С-атомами, замещенный (C1-C4)-алкоксигруппой,
4. алкил с 1, 2, 3 или 4 С-атомами, в котором от одного до всех атомов водорода заменены фтором, предпочтительно CF3;
5. фенил, 1-нафтил или 2-нафтил;
6. один из остатков, определенных в п.5, который замещен 1, 2 или 3 одинаковыми или различными остатками из ряда F, Cl, Br, CF3, NR(19)R(20), -CN;
R(22) и R(23) независимо друг от друга водород или CO-OR(24);
R(24) водород, алкил с 1, 2, 3 или 4 С-атомами или -CnH2n-nn-фенил с n, равным 1, 2 или 3;
q независимо друг от друга нуль, 1 или 2;
а также их физиологически приемлемые соли.
Особенно предпочтительными являются соединения формулы (I) с
R(1) 1. алкил с 1, 2, 3, 4 или 5 С-атомами;
2. алкенил с 2, 3 или 4 С-атомами;
3. -CnH2n-nn-Y,
Y 1. фенил;
2. один из остатков, определенных в п.1, который замещен 1, 2, 3, 4 или 5 одинаковыми или различными остатками из ряда алкил с 1, 2, 3 или 4 С-атомами, F, Cl, Br, цианогруппа, CF3, гидроксигруппа, NO2, SO2R(18), OR(16), SCF3, NR(19)R(20), CO-R(9);
3. OR(14) или
4. SO2-R(14);
5. 1-нафтил или 2-нафтил;
6. один из остатков, определенных в п.5, который замещен остатком из ряда алкил с 1, 2, 3 или 4 С-атомами, F, Cl, CF3, SO2R(18), OR(16), NR(19)R(20) или CO-R(9);
7. гетероарил с 1, 2, 3, 4, 5, 6, 7, 8 или 9 С-атомами, предпочтительно тиенил, бензотиофенил, индолил или фурил;
8. один из определенных в п.3 остатков, который замещен остатком из ряда F, Cl, CF3, СН3, метоксигруппа или N(СН3)2;
9. циклоалкил с 3, 4, 5, 6 или 7 С-атомами;
nn - нуль или 2 и
n - нуль, 1, 2, 3 или 4; причем n не равно нулю или 1, если nn равно 2;
4. -CnH2n-nn-Y,
Y 1. фенил;
2. OR(14) или
3. гетероарил, предпочтительно тиенил;
nn - нуль или 2 и
n - 1, 2 или 3, причем n не равно 1, если nn равно 2;
причем 1, 2 или 3 атома водорода в двухвалентном остатке -CnH2n-nn- независимо друг от друга заменены на остаток из ряда
1. арил с 6, 7, 8, 9, 10, 11, 12, 13 или 14 С-атомами, предпочтительно фенил, 1-нафтил или 2-нафтил или фенилацетил;
2. аминогруппа;
3. NR(22)R(23) или
4. алкил с 1, 2, 3 или 4 С-атомами;
R(2)
1. водород;
2. алкил с 1, 2, 3, 4 или 5 С-атомами;
3. алкил с 1, 2, 3, 4 или 5 С-атомами, в котором от одного до всех атомов водорода заменены фтором;
4. алкенил с 2, 3, 4, 5, 6, 7, 8, 9 или 10 С-атомами;
5. алкинил с 2, 3, 4 или 5 С-атомами;
6. -Cn H2n-nn-Z,
Z 1. фенил;
2. один из остатков, определенных в п.1, который замещен 1, 2 или 3 одинаковыми или различными остатками из ряда алкил с 1, 2, 3 или 4 С-атомами, фенил, F, Сl, Вr, CF3, SO2R(18), OR(16), нитро-, цианогруппа, NR(19)R(20), CO-R(9) или при этом два остатка вместе образуют метилендиоксигруппу;
3. 1-нафтил или 2-нафтил;
4. один из остатков, определенных в п.3, который замещен остатком из ряда алкил с 1, 2, 3 или 4 С-атомами, F, Cl, CF3, SO2R(18), OR(16), нитро-, цианогруппы, NR(19)R(20) или CO-R(9);
5. гетероарил с 1, 2, 3, 4, 5, 6, 7, 8 или 9 С-атомами, предпочтительно бензимидазолил, пиридил, тиенил, фурил, тетрагидрофурил, пирролидинил, пирролидин-1-карбонил-4,5-дигидроизоксазолил, бензофуранил, например, 1,3-дигидро-1-оксо-бензо[с]фуранил, хиназолинил; например 3,4-дигидрохиназолинил;
6. один из определенных в п.5 остатков, который замещен остатком из ряда F, Cl, CF3, СН3, метокси-, гидроксигруппы или N(СН3)2;
7. циклоалкил с 3, 4, 5, 6, 7, 8, 9- или 10 С-атомами, предпочтительно циклопропил, циклопентил, циклогексил, 1,2,3,4-тетрагидронафтил или инданил;
8. один из определенных в п.7 остатков, который замещен фенилом; предпочтительно фенилциклопентил;
nn - нуль или 2 и
n - нуль, 1, 2 или 3; причем n не равно нулю или
1, если nn равно 2;
7. -CnH2n-nn-Z,
Z 1. фенил;
2. один из остатков, определенных в п.1, который замещен 1, 2 или 3 одинаковыми или различными остатками из ряда алкил с 1, 2, 3 или 4 С-атомами, фенил, F, Cl, CF3, SO2R(18), -OR(16), нитро-, цианогруппы, NR(19)R(20) или CO-R(9);
nn - нуль или 2 и
n - 1, 2 или 3; причем n не равно 1, если nn равно 2;
причем 1, 2 или 3 атома водорода в двухвалентном
остатке -CnH2n-nn- независимо друг от друга заменены
на остаток из ряда
1. (C1 -C4)-алкоксикарбонил;
2. COOR(16) или
3. алкил с 1, 2, 3 или 4 С-атомами;
8. -CnH2n-OR(17);
n - нуль, 1, 2 или 3;
R(3) и R(4)
водород или метил;
R(5), R(6) и R(7) независимо друг от друга
водород, алкил с 1, 2, 3 или 4 С-атомами, F, Cl, CF3,
CN, SO2-R(18), CO-R(21) или О-R(10);
R(8) алкил с 1, 2, 3 или 4 С-атомами, N(СН3)2 или фенил, который незамещен или замещен остатком из ряда F, Cl, СF3, метил, метокси-, гидроксигруппы или N(СН3)2;
R(9) и R(21) независимо друг от друга водород, метил или OR(13);
R(10) водород, алкил с 1, 2, 3 или 4 С-атомами, в случае необходимости замещенный (C1-C4)-алкоксигруппой; или фенил, который незамещен или замещен остатком из ряда F, Cl, CF3, метил, метоксигруппа или N(СН3)2;
R(11) и R(12) независимо друг от друга водород, алкил с 1, 2, 3 или 4 С-атомами или (C1-C4)-алканоил, предпочтительно ацетил;
R(13) водород или алкил с 1, 2, 3 или 4 С-атомами;
X карбонил, -СО-СО- -NH-CO- или сульфонил;
R(14) 1. водород;
2. алкил с 1, 2, 3 или 4 С-атомами;
3. алкенил с 2, 3, 4, 5 или 6 С-атомами;
4. -CnH2n-nn-фенил,
nn - нуль или 2 и
n - нуль, 1, 2, 3, или 4; причем n не равно нулю
или 1, если nn равно 2;
5. один из остатков, определенных в п.4, причем фенильная часть замещена 1, 2 или 3 одинаковыми или различными остатками из ряда алкил с 1, 2, 3 или 4 С-атомами, F, Cl, Br, CF3, SOqR(15), OR(16), NR(11)R(12), -CN или CO-R(9);
R(15) алкил с 1, 2, 3 или 4 С-атомами или N(CH3)2;
R(16) 1. водород,
2. алкил с 1, 2, 3 или 4 С-атомами,
3. алкил с 1, 2, 3 или 4 С-атомами, замещенный (C1-C4)-алкоксигруппой,
4. алкил с 1, 2, 3 или 4 С-атомами, в котором от одного до всех атомов водорода заменены фтором, предпочтительно CF3;
5. фенил, 1-нафтил или 2-нафтил;
6. один из остатков, определенных в п.5, который замещен 1, 2 или 3 одинаковыми или различными остатками из ряда F, Cl, Br, CF3, NR(19)R(20), -CN;
R(17) 1. водород;
2. алкил с 1, 2, 3 или 4 С-атомами;
3. алкенил с 2, 3 или 4 С-атомами;
4. -CnH2n-nn-фенил,
nn - нуль или 2 и
n - нуль, 1, 2, 3, или 4; причем n не равно нулю или 1, если nn равно 2;
5. один из остатков, определенных в п.4, причем фенильная часть замещена остатком из ряда алкил с 1, 2, 3 или 4 С-атомами, F, Cl, Br, CF3, SOqR(15), OR(16), NR(11)R(12), -CN или CO-R(9) или
R(18) алкил с 1, 2, 3 или 4 С-атомами, алкил с 1, 2, 3 или 4 С-атомами, в котором от одного до всех атомов водорода заменены фтором, предпочтительно CF3, или NR(11)R(12);
R(19) и R(20) независимо друг от друга водород, алкил с 1, 2, 3 или 4 С-атомами или (C1-C4)-алканоил, предпочтительно ацетил;
R(22) и R(23) независимо друг от друга водород или CO-OR(24);
R(24) водород, алкил с 1, 2, 3 или 4 С-атомами или -CnH2nn -фенил с n, равным 1 или 2;
q независимо друг от друга нуль, 1 или 2;
а также их физиологически приемлемые соли.
Наиболее особенно предпочтительны соединения формулы (I) с
R(1) 1. алкил с 1, 2, 3, 4 или 5 С-атомами;
2. алкенил с 2, 3 или 4 С-атомами;
3. -CnH2n-nn-Y,
Y 1. фенил;
2. один из остатков, определенных в п.1, который замещен 1, 2, 3, 4 или 5 одинаковыми или различными остатками из ряда алкил с 1, 2, 3 или 4 С-атомами, F, Cl, Br, цианогруппа, CF3, гидроксигруппа, NO2, SO2R(18), ОСН3, OCF3, SCF3, N(CH3)2, NH-CO-СН3, CO-R(9), феноксигруппа или феноксигруппа, однократно или многократно замещенная галогеном, предпочтительно Cl или F:
3. OR(14) или
4. SO2-R(14);
nn - нуль или 2 и
n - нуль, 1, 2, 3 или 4; причем n не равно нулю
или 1, если nn равно 2;
4. -CnH2n-nn-Y,
Y 1. фенил;
2. OR(14) или
3. гетероарил, предпочтительно тиенил;
nn - нуль или 2 и
n - 1, 2 или 3, причем n не равно 1, если nn равно 2;
причем 1, 2 или 3 атома водорода в двухвалентном остатке -CnH2n-nn- независимо друг от друга заменены на остаток из ряда
1. арил с 6, 7, 8, 9, 10, 11, 12, 13 или 14
С-атомами, предпочтительно фенил, 1-нафтил или 2-нафтил или фенилацетил;
2. аминогруппа;
3. NR(22)R(23) или
4. алкил с 1, 2, 3 или 4 С-атомами;
5. -CnH2n-Y,
Y 1. 1-нафтил или 2-нафтил;
2. один из остатков, определенных в п.1, который замещен остатком из ряда алкил с 1, 2, 3 или 4 С-атомами, F, Cl, CF3 , SO2R(18), ОСН3, N(CH3)2 или CO-R(9);
3. гетероарил с 1, 2, 3, 4, 5, 6, 7, 8 или 9 С-атомами, предпочтительно тиенил, бензотиофенил, индолил или фурил;
4. один из остатков, определенных в п.3, который замещен остатком из группы F, Cl, CF3, СН3, метоксигруппа или N(СН3)2;
5. циклоалкил с 3, 4, 5, 6 или 7 С-атомами;
n - нуль, 1, 2, 3 или 4;
6. -CnH2n-OR(14);
n - нуль, 1 или 2;
R(2) 1. алкил с 1, 2, 3, 4 или 5 С-атомами;
2. алкил с 1, 2, 3, 4 или 5 С-атомами, в котором от одного до всех атомов водорода заменены фтором;
3. алкенил с 2, 3, 4, 5, 6, 7, 8, 9 или 10 С-атомами;
4. алкинил с 2, 3, 4 или 5 С-атомами;
5. -CnH2n-nn-Z
Z 1. фенил;
2. один из остатков, определенных в п.1, который замещен 1, 2 или 3 одинаковыми или различными остатками из ряда алкил с 1, 2, 3 или 4 С-атомами, фенил, F, Сl, Вr, CF3, SO2R(18), -ОСН3, -О(С2H4)ОСН3, этокси-, гидрокси-, нитро-, цианогруппа, N(СН3)2 , -NH-CO-СН3, CO-R(9), феноксигруппа или феноксигруппа, однократно или многократно замещенная галогенами, предпочтительно Сl или F, или где два остатка вместе образуют метилендиоксигруппу;
nn - нуль или 2 и
n - нуль, 1, 2 или 3; причем n не равно нулю или 1, если nn равно 2;
6. -CnH2n-nn-Z,
Z 1. фенил;
2. один из остатков, определенных в п.1, который замещен 1, 2 или 3 одинаковыми или различными остатками из ряда алкил с 1, 2, 3 или 4 С-атомами, фенил, F, Сl, CF3, SO2R(18), -ОСН3, -О(С2 Н4)ОСН3, этокси-, гидрокси-, нитро-, цианогруппы, N(СН3)2 или CO-R(9);
nn - нуль или 2 и
n - 1, 2 или 3; причем n не равно 1, если nn равно 2;
причем 1, 2 или 3 атома водорода в двухвалентном остатке -CnH2n-nn- независимо друг от друга заменены на остаток из ряда
1. (C1-C4) -алкоксикарбонил;
2. COOR(16) или
3. алкил с 1, 2, 3 или 4 С-атомами;
7. -CnH2n-Z;
Z 1. 1-нафтил или 2-нафтил;
2. один из остатков, определенных в п.1, который замещен остатком из ряда алкил с 1, 2, 3 или 4 С-атомами, F, Cl, CF3, SO2R(18), ОСН3, -O(С2Н4)ОСН3, этокси-, гидрокси-, нитро-, цианогруппы, N(СН3)2, -NНСОСН3 или CO-R(9);
3. гетероарил с 1, 2, 3, 4, 5, 6, 7, 8 или 9 С-атомами, предпочтительно бензимидазолил, пиридил, тиенил, фурил, тетрагидрофурил, пирролидинил, пирролидин-1-карбонил-4, 5-дигидроизоксазолил, бензофуранил, например, 1,3-дигидро-1-оксо-бензо[с]фуранил, хиназолинил; например, 3,4-дигидрохиназолинил;
4. один из остатков, определенных в п.3, который замещен остатком из ряда F, Cl,
CF3, СН3, метокси-, гидроксигруппы или N(СН3)2;
5. циклоалкил с 3, 4, 5, 6, 7, 8, 9 или 10 С-атомами; предпочтительно циклопропил, циклопентил, циклогексил, 1,2,3,4-тетрагидронафтил или инданил;
6. один из остатков, определенных в п.5, который замещен фенилом; предпочтительно фенилциклопентил;
n - нуль, 1, 2 или 3;
8. -CnH2n-OR(17);
n - 2 или 3;
R(3) и R(4)
водород;
R(5), R(6) и R(7) независимо друг от друга
водород, алкил с 1, 2, 3 или 4 С-атомами, F, Cl, CF3, SO2-R(8), CO-R(21) или O-R(10);
R(8) метил или N(СН3 )2;
R(9) и R(21) независимо друг от друга водород, метил или OR(13);
R(10) водород, метил или этил, в случае необходимости замещенный метоксигруппой; или фенил, который незамещен или замещен остатком из ряда F, Cl, CF3, метил, метоксигруппа или N(СН3)2;
R(13) водород или алкил с 1, 2, 3 или 4 С-атомами;
X - карбонил, -СО-СО-, -NH-CO- или сульфонил;
R(14) 1. водород;
2. метил или этил;
3. алкенил с 2, 3, 4, 5 или 6 С-атомами, предпочтительно аллил;
4. -CnH2n-фенил с n, равным нулю или 1;
5. один из остатков, определенных в п.4, причем фенильная часть замещена остатком из ряда алкил с 1, 2, 3 или 4 С-атомами, F, Cl, CF3, SO2R(15), ОСН3, N(СН3)2 или CO-R(9) или
6. алкенил с 2, 3, или 4 С-атомами;
R(15) метил или N(СН3)2;
R(16) водород или алкил с 1, 2, 3 или 4 С-атомами, предпочтительно метил или трет-бутил;
R(17) 1. водород;
2. метил;
3. -CnH2n-фенил с n, равным нулю или 1;
4. один из остатков, определенных в п.3, причем фенильная часть замещена остатком из ряда алкил с 1, 2, 3 или 4 С-атомами, F, Cl, CF3, SO2R(15), ОСН3, N(СН3)2 или CO-R(9) или
5. алкенил с 2, 3 или 4 С-атомами;
R(18) метил, CF3, аминогруппа или N(CH3)2;
R(22) и R(23) независимо друг от друга водород или CO-OR(24);
R(24) водород, алкил с 1, 2, 3 или 4 С-атомами или -CnH2n- фенил с n, равным 1 или 2;
а также их физиологически приемлемые соли.
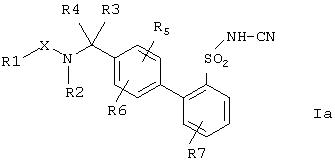
Предпочтительными также являются соединения формулы Ia,
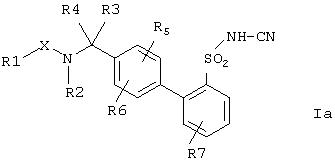
где остатки Х и с R(1) no R(7) имеют указанные выше значения, а также их физиологически приемлемые соли.
Далее предпочтительными являются соединения формулы I и/или Iа, где остатки X, R(1), R(2), R(3), R(4), R(5), R(6) и R(7) имеют значения, указанные в Примерах 1-568.
Если группы или заместители могут встречаться в соединениях формулы I многократно, то все они могут принимать независимые друг от друга значения и могут быть одинаковыми или различными.
Как алкил, алкенил, так и алкинил могут независимо друг от друга быть линейными или разветвленными. Это относится также к тем случаям, когда они содержатся в других группах, например, в алкоксигруппах, алкоксикарбонильных группах или в аминогруппах, или когда они замещены.
Примерами алкильных остатков с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами являются: метил, этил, пропил, бутил, пентил, гексил, гептил, октил, изопропил, изобутил, изопентил, неопентил, изогексил, 3-метилпентил, втор-бутил, трет-бутил, трет-пентил.
Примерами алкенильных остатков являются винил, 1-пропенил, 2-пропенил (аллил), бутенил, 3-метил-2-бутенил, 2-бутенил, 2-метил-2-пропенил. Алкенильные остатки могут также содержать две или более двойных связей, как например, бутадиенил или (СН3)2С=СН-СН2-СН2-С(СН3 )=СН-СН2 -.
Примерами алкинильных остатков являются этинил, 2-пропинил (пропаргил) или 3-бутинил. Алкинильные остатки могут также содержать две или более тройных связей.
Циклоалкил охватывает насыщенные и частично ненасыщенные циклоалкильные остатки, которые могут быть моно-, би- или также трициклическими. Примерами таких циклоалкильных остатков являются циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, 1,2,3,4-тетрагидронафталин и инданил, которые могут быть также замещены, например, одним или более одинаковыми или различными (C1-C4)-алкильными остатками, в частности, метилом. Примерами таких замещенных циклоалкильных остатков являются 4-метилциклогексил, 4-трет-бутилциклогексил или 2, 3-диметилциклопентил.
Арильными группами с 6, 7, 8, 9, 10, 11, 12, 13 или 14 С-атомами являются, например, фенил, нафтил, бифенил, антрил или флуоренил, причем 1-нафтил, 2-нафтил и особенно фенил являются предпочтительными.
Гетероарильные остатки и гетероциклические остатки предпочтительно являются производными гетероциклов, которые содержат один, два, три или четыре одинаковых или различных гетероатомов в цикле; особенно предпочтительно гетероциклы, которые содержат один или два или три, в частности, один или два одинаковых или различных гетероатома. Если не указано иначе, гетероциклы могут быть моноциклическими или полициклическими, например, моноциклическими, бициклическими или трициклическими. Предпочтительно они являются моноциклическими или бициклическими. Циклы предпочтительно являются 5-членными, 6-членными или 7-членными. Примерами моноциклических и бициклических гетероциклических систем, остатки которых могут быть пригодными для соединений формулы I, являются пиррол, фуран, тиофен, имидазол, пиразол, 1,2,3-триазол, 1,2,4-триазол, 1,3-диоксол, 1,3-оксазол, 1,2-оксазол, 1,3-тиазол, 1,2-тиазол, тетразол, пиридин, пиридазин, пиримидин, пиразин, пиран, тиопиран, 1,4-диоксин, 1,2-оксазин, 1,3-оксазин, 1,4-оксазин, 1,2-тиазин, 1,3-тиазин, 1,4-тиазин, 1,2,3-триазин, 1,2,4-триазин, 1,3,5-триазин, 1, 2,4,5-тетразин, азепин, 1, 2-диазепин, 1,3-диазепин, 1,4-диазепин, 1,3-оксазепин, 1,3-тиазепин, индол, бензотиофен, бензофуран, бензотиазол, бензимидазол, хинолин, изохинолин, циннолин, хиназолин, хиноксалин, фталазин, тиенотиофен, 1,8-нафтиридин и другие нафтиридины, птеридин, или фенотиазин, все в насыщенной форме (пергидро-форме) или в частично ненасыщенной форме (например, дигидро-форме или тетрагидро-форме) или в максимально ненасыщенной форме, если соответствующая форма является известной и стабильной. К подходящим гетероциклам относятся также, например, насыщенные гетероциклы пирролидин, пиперидин, пиперазин, морфолин и тиоморфолин. Ненасыщенные гетероциклы могут, например, содержать одну, две или три двойные связи в цикле. 5-Членные и 6-членные циклы в моноциклических и полициклических гетероциклах могут, в частности, быть также ароматическими.
Остатки этих гетероциклов могут быть всякий раз связаны через каждый пригодный атом углерода. Азотистые гетероциклы, которые содержат у циклического атома азота атом водорода или заместитель, например, пиррол, имидазол, пирролидин, морфолин, пиперазин и т.д., могут также быть связаны через кольцевой атом азота, в особенности, если соответствующий азот в гетероцикле связан с атомом углерода. Примерами могут быть тиенил в виде 2-тиенильного остатка или 3-тиенильного остатка, остаток фурана в виде 2-фурильного остатка или 3-фурильного остатка, остаток пиридил в виде 2-пиридила, 3-пиридила или 4-пиридила, остаток пиперидина в виде 1-пиперидильного остатка, 2-пиперидильного остатка, 3-пиперидильного остатка или 4-пиперидильного остатка, тиоморфолиновый остаток в виде 2-тиоморфолинильного остатка, 3-тиоморфолинильного остатка или 4-тиоморфолинильного остатка (= тиоформолиновому остатку). Связанный через атом углерода остаток 1,3-тиазола или имидазола может быть связан во 2-положении, 4-положении или 5-положении.
Если не указано иное, гетероциклические группы могут быть незамещены или содержать один или более, например, один, два, три или четыре одинаковых или различных заместителей. Заместители в гетероциклах могут находиться в любых положениях, например, в 2-тиенильном остатке или 2-фурильном остатке в 3-положении и/или в 4-положении и/или в 5-положении, в 3-тиенильном остатке или 3-фурильном остатке во 2-положении и/или в 4-положении и/или в 5-положении, в 2-пиридильном остатке в 3-положении и/или в 4-положении и/или в 5-положении и/или в 6-положении, в 3-пиридильном остатке во 2-положении и/или в 4-положении и/или в 5-положении и/или в 6-положении, в 4-пиридильном остатке во 2-положении и/или в 3-положении и/или в 5-положении и/или в 6-положении. Если не указано иное, в качестве заместителей могут быть, например, заместители, указанные при определении арильной группы, в случае насыщенных или частично ненасыщенных гетероциклов в качестве дополнительных заместителей также оксогруппы и тиоксогруппы. Заместители гетероциклов, так же как и заместители карбоциклов, могут также образовывать кольцо, могут также быть сконденсированы в циклическую систему дополнительного цикла, так что, например, могут образоваться циклопента-конденсированные, циклогекса-конденсированные или бензоконденсированные циклы. В качестве заместителей у способного замещаться атома азота в гетероцикле речь идет, например, о незамещенных (C1-C5 )-алкильных остатках и арилзамещенных алкильных остатках, арильных остатках, ацильных остатках, как СО-(C1-C5)-алкил или сульфонильных остатках, как SO2-(C1 -C5)-алкил. Подходящие азот-содержащие гетероциклы могут также быть представлены в виде N-оксидов или четвертичных солей с анионом одной из физиологически приемлемых кислот, в качестве противоиона. Пиридильный остаток может быть, например, представлен в виде пиридин-N-оксида.
В качестве гетероарила пригодны, в частности, фуранил, тиенил, пирролил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, индазолил, хинолил, изохинолил, фталазинил, хиноксалинил, хиназолинил, циннолинил.
Гетероарильные остатки могут также быть полностью или частично гидрированными. Например, следует назвать пирролидин-1-карбонил-4,5-дигидроизоксазолил, 1, 3-дигидро-1-оксо-бензо[с]фуранил или 3,4-дигидрохиназолинил.
Фенильные, нафтильные и гетероциклические остатки, например, гетероарильные остатки, могут, если не указано иное, быть незамещенными или содержать один или более, например, один, два, три или четыре одинаковых или различных заместителей, которые могут находиться в любом положении. Если не указано иное, в этих остатках в качестве заместителей могут выступать, например, заместители, указанные при определении арильной группы. Например, в арильных, как например фенильных и/или в гетероциклических остатках, в качестве заместителей могут выступать фенильные остатки, феноксигруппы, бензильные остатки или бензилоксигруппы, причем бензольные кольца в них также могут быть незамещенными или могут быть замещены одним или более, например, двумя, тремя или четырьмя одинаковыми или различными остатками из ряда (C1-C4)-алкил, галоген, гидрокси-, (C1-C4)-алкокси-группы, трифторметил, циан, гидроксикарбонил, ((C1-C4)-алкокси)карбонил, аминокарбонил, нитро-, амино-, (C1-C4)-алкиламино-, ди-((C1-C4 )алкил) амино- и ((C1-C4)-алкил) карбонил аминогруппы.
В монозамещенных фенильных остатках заместители могут находиться во 2-положении, 3-положении или 4-положении, в дизамещенных фенильных остатках заместители могут находиться в 2,3-положениях, 2,4-положениях, 2,5-положениях, 2,6-положениях, 3,4-положениях или 3,5-положениях. В тризамещенных фенильных остатках заместители могут находиться в 2,3,4-положениях, 2,3,5-положениях, 2,3,6-положениях, 2,4,5-положениях, 2,4,6-положениях или 3,4,5-положениях. Толил (= метилфенил) является 2-толилом, 3-толилом или 4-толилом. Нафтил может быть 1-нафтилом или 2-нафтилом. В монозамещенных 1-нафтильных остатках заместители могут находиться во 2-положении, 3-положении, 4-положении, 5-положении, 6-положении, 7-положении или 8-положении, в монозамещенных 2-нафтильных остатках в 1-положении, 3-положении, 4-положении, 5-положении, 6-положении, 7-положении или 8-положении.
Галоген означает фтор, хлор, бром или йод, предпочтительно фтор или хлор.
Данное изобретение охватывает все стереоизомерные формы соединений формулы I. Содержащиеся в соединениях формулы I асимметричные центры независимо друг от друга могут иметь S-конфигурацию или R-конфигурацию. К изобретению относятся все возможные энантиомеры и диастереомеры, а также смеси двух или более стереоизомерных форм, например, смеси энантиомеров и/или диастереомеров, во всех соотношениях. Энантиомеры в энантиомерно чистых формах, как в форме левовращающих, так и правовращающих антиподах, в форме рацематов и в форме смесей обоих энантиомеров во всех соотношениях также являются предметом изобретения. При наличии цис/трансизомерии предметом изобретения являются как цис-форма, так и транс-форма и смеси этих форм во всех соотношениях. Получение отдельных стереоизомеров может, в случае необходимости, производиться путем разделения смеси обычными способами, например, путем хроматографии или кристаллизации, путем использования стереохимически однородных исходных веществ при синтезе или путем стереоселективного синтеза. В случае необходимости перед разделением стереоизомеров может производиться образование производных. Разделение смеси стереоизомеров может производиться на стадии соединений формулы I или на стадии промежуточного продукта при проведении синтеза. При наличии подвижных атомов водорода данное изобретение охватывает также все таутомерные формы соединений формулы I.
Если соединения формулы I содержат одну или более кислотных или основных групп, то предметом изобретения являются также соответствующие физиологически или токсикологически приемлемые соли, в частности, фармацевтически применимые соли. Так соединения формулы I, которые содержат кислотные группы, могут быть представлены и, в случае необходимости, использованы в виде солей щелочных металлов, солей щелочноземельных металлов или солей аммония. Примерами таких солей являются соли натрия, соли калия, соли кальция, соли магния или соли с аммиаком или органическими аминами, как, например, этиламин, этаноламин, триэтаноламин или аминокислоты. Соединения формулы I, которые содержат одну или более основных, так называемых протонируемых групп, могут быть представлены и, в случае необходимости, использованы в виде их аддитивных солей с физиологически приемлемыми неорганическими или органическими кислотами, например, в виде солей с хлористым водородом, бромистым водородом, фосфорной кислотой, серной кислотой, азотной кислотой, метансульфокислотой, пара-толуолсульфокислотой, нафталиндисульфокислотами, щавелевой кислотой, уксусной кислотой, винной кислотой, молочной кислотой, салициловой кислотой, бензойной кислотой, муравьиной кислотой, пропионовой кислотой, пивалиновой кислотой, диэтилуксусной кислотой, малоновой кислотой, янтарной кислотой, пимелиновой кислотой, фумаровой кислотой, малеиновой кислотой, яблочной кислотой, сульфаминовой кислотой, фенилпропионовой кислотой, глюконовой кислотой, аскорбиновой кислотой, изоникотиновой кислотой, лимонной кислотой, адипиновой кислотой и т.д. Если соединения формулы I содержат в молекуле одновременно кислотные и основные группы, то к изобретению наряду с описанными солевыми формами относятся также внутренние соли или бетаины (цвиттерионы). Соли могут быть получены из соединений формулы I обычными известными специалистам способами, например, путем соединения с органической или неорганической кислотой или основанием в растворителе или диспергаторе, или путем анионообмена или катионообмена из других солей. Данное изобретение охватывает все соли соединений формулы I, которые благодаря их незначительной физиологической переносимости не применимы непосредственно для использования в лекарственных препаратах, но применимы, например, в качестве промежуточных продуктов для химических реакций или для получения физиологически приемлемых солей. Под физиологически приемлемыми солями соединений формулы (I) понимают, например, их органические, а также неорганические соли, как описано в Remington's Pharmaceutical Sciences (17. издание, стр.1418 (1985)). Благодаря физической и химической стабильности и растворимости кислотных групп предпочтительны среди прочих соли натрия, калия, кальция и аммония; для основных групп предпочтительны среди прочих соли соляной кислоты, серной кислоты, фосфорной кислоты или карбоновых кислот или сульфокислот, как например, уксусной кислоты, лимонной кислоты, бензойной кислоты, малеиновой кислоты, фумаровой кислоты, винной кислоты и пара-толуолсульфокислоты.
Данное изобретение дополнительно охватывает все сольваты соединений формулы I, например, гидраты или аддукты со спиртами, а также производные соединений формулы I, как, например, сложные эфиры, и пролекарственные формы и активные метаболиты.
Изобретение относится также к получению новых соединений формулы (I), а также их физиологически приемлемых солей.
Так соединения формулы I могут быть получены, например, путем твердофазного синтеза.
Синтез осуществляют путем подходящего связывания бензолсульфонильной структуры общей формулы (II) через химически связывающее звено (линкер) с полимерной матрицей по известному специалистам способу синтеза сульфонамида из хлорангидрида сульфокислоты и амина. В качестве полимерной матрицы применимы, например, полистирол, политетрафторэтилен, полиакриламид и т.д., которые, в случае необходимости, для улучшения набухаемости могут быть удлинены полиоксиэтиленовой цепью (спейсер). В качестве линкерного структурного звена пригодны структуры, которые высвобождают синтезированное соединение под действием кислоты, основания, восстановителя, окислителя, света или ионов фтора; причем линкерное структурное звено остается на полимерной матрице (обзор линкерных групп и полимеров в твердофазном синтезе смотри
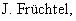
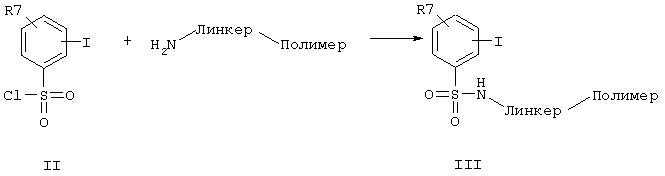
Полученное таким образом основное соединение общей формулы (III), связанное с полимером через сульфонамидную группу, можно подвергать взаимодействию с производным арилборной кислоты общей формулы (IV) до получения бифенилового производного формулы (V). Для этого использовались известные из литературы условия реакции, катализируемой палладием, как описано, например, в Organometallics 1984, 3, 1261 или в Synth. Commun. 11 (7), 513 (1981).
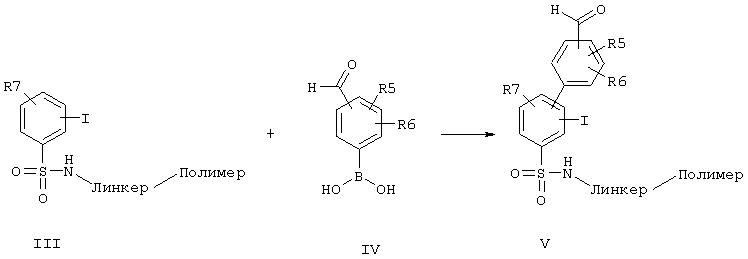
Синтез бензолборной кислоты общей формулы (IV) проводят, например, аналогично синтезу 4-формил-бензолборной кислоты, как описано в Liebigs Ann. 1995, 1253.
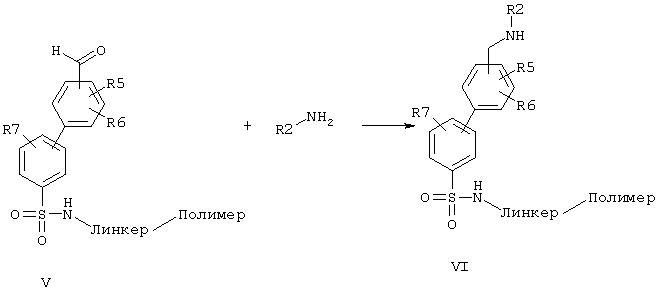
Восстановительное аминирование с помощью NaBH3CN (обзор о NaBH3CN в Synthesis 1975, 135) дает структурный элемент (VI), который под действием хлорангидрида кислоты R1-X-Cl может быть превращен в структурный элемент общей формулы (VII). Синтез в твердой фазе имеет при этом преимущество, заключающееся в том, что реактивы и реагенты могут применяться в большом избытке, растворители могут широко варьироваться, и очистка осуществляется путем простого промывания твердых частиц.
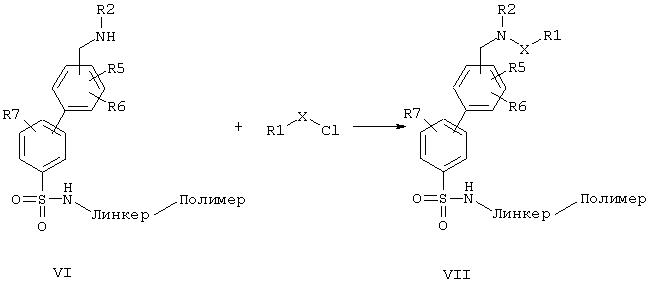
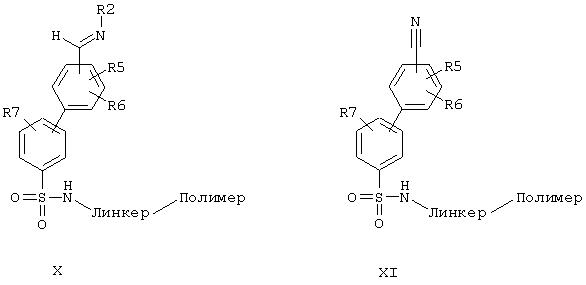
В случае, когда остатки R(3), R(4) не являются атомами водорода, необходимо вводить соответствующие остатки. Это происходит либо в результате синтеза имина общей формулы (X) путем восстановительного аминирования в отсутствие восстановителя из альдегида (V) и соответствующего амина и взаимодействия с металлоорганическим соединением, содержащим остаток R(3) или R(4), например, с реактивом Гриньяра или с алкиллитиевым соединением известным специалисту способом. Или альдегидную функцию соединения общей формулы (V) окисляют до нитрила общей формулы (XI), как, например, описано в Synthesis 1982, 190, и затем последовательно один за другим вводят остатки R(3) и R(4) с помощью литий- или магнийорганических соединений известным специалисту способом. В последнем случае кроме того необходимо провести еще известным специалисту способом аминоарилирование или аминоалкилирование остатка R(2).
После последовательного проведения стадий синтеза проводят отщепление вновь синтезированных соединений с помощью специальных реагентов, соответствующих выбору линкера (для описания твердофазного синтеза смотри:
(G. Breipohl, J. Knolle, W. Stьber, Int. J. Peptide Protein Res. 34, 1989, 262f). В этом случае отщепление от смолы проводят в кислых условиях. Соединения общей формулы (VII) для этого обрабатывают в инертном растворителе, предпочтительно CH2Cl2, кислотой с рКа<5, предпочтительно кислотой с рКа<2, особенно предпочтительно трифторуксусной кислотой и получают сульфонамид общей формулы (IX). Обычно время реакции составляет от 5 минут до 10 часов при температуре между -30°С и точкой кипения растворителя, предпочтительно время реакции составляет от 20 минут до одного часа при комнатной температуре.
Последняя стадия синтеза отличается тем, что соединения формулы (IX),
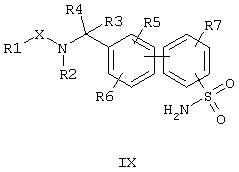
где остатки имеют указанные выше значения, подвергают взаимодействию с бромцианом с образованием целевых соединений общей формулы (I). Реакцию ведут в диполярном апротонном растворителе, устойчивом по отношению к бромциану, например, ацетонитриле, диметилацетамиде, N,N,N’,N’-тетраметилмочевине или N-метилпирролидоне с сильным вспомогательным основанием, которое является слабо нуклеофильным, как, например, К2СО3 или Сs2СО3. В качестве температуры реакции пригодна температура между 0°С и точкой кипения используемого растворителя, предпочтительно речь идет о температуре между 40°С и 100°С.
Соединения формулы I могут также быть синтезированы классическим синтезом, то есть в растворе, по известным специалисту способам.
Предложенные соединения формулы I пригодны в качестве ингибиторов натрийзависимого бикарбонат/хлоридного обмена (NCBE) или натрий/бикарбонатных симпортеров.
В заявке ЕР-А 855392 описаны производные имидазола с бифенилсульфонилцианамидной боковой цепью в качестве ингибиторов NCBE.
В европейской патентной заявке 98117529.2 в качестве NCBE-ингибиторов предложены бифенилсульфонилцианамиды, которые отличаются от соединений формулы I заместителями в бифенильной циклической системе.
Дополнительно изобретение касается соединений формулы I, пригодных для получения лекарственного средства для лечения или профилактики заболеваний, вызываемых ишемическим состоянием;
так же как соединений формулы I, используемых для получения лекарственного средства для лечения или профилактики инфаркта миокарда;
так же как соединений формулы I, используемых для получения лекарственного средства для лечения или профилактики стенокардии;
так же как соединений формулы I, используемых для получения лекарственного средства для лечения или профилактики ишемических состояний сердца;
так же как соединений формулы I, пригодных для получения лекарственного средства для лечения или профилактики ишемических состояний периферической и центральной нервной системы и острых приступов;
так же как соединений формулы I, пригодных для получения лекарственного средства для лечения или профилактики ишемических состояний периферических органов и конечностей;
так же как соединений формулы I, пригодных для получения лекарственного средства для лечения или профилактики шоковых состояний;
так же как соединений формулы I, пригодных для получения лекарственного средства для введения при хирургических операциях и трансплантациях органов;
так же как соединений формулы I, применяемых для получения лекарственного средства для консервации и хранения трансплантатов для хирургических мероприятий;
так же как соединений формулы I, применяемых для получения лекарственного средства для лечения заболеваний, при которых первичной или вторичной причиной является разрастание клеток; и таким образом для получения антиатеросклеротического средства, средства против диабетических поздних осложнений, раковых заболеваний, фиброзных заболеваний, как фиброз легких, фиброз печени или фиброз почек, гиперплазии простаты;
так же как соединений формулы I, применяемых для получения лекарственного средства для лечения затрудненного дыхания;
так же как и лекарственного средства, отличающегося эффективным содержанием соединения формулы I.
Предложенные соединения формулы I проявляют очень хорошие антиаритмические свойства, что, например, важно для лечения заболеваний, вызываемых кислородной недостаточностью.
Соединения формулы I благодаря их фармакологическим свойствам в качестве антиаритмических лекарственных средств широко применимы с кардиозащитными компонентами для профилактики инфаркта и лечения инфаркта, так же как и для лечения стенокардии, причем они также превентивно ингибируют или сильно замедляют патофизиологические процессы при возникновении ишемически индуцируемых нарушений, в частности, при проявлении индуцируемой ишемией сердечной аритмии.
Благодаря их защитному действию против патологических гипоксических и ишемических состояний предложенные соединения формулы I вследствие ингибирования клеточного Nа+ -зависимого механизма Сl-/НСО-обмена или натрий/бикарбонатных симпортеров могут применяться в качестве лекарственного средства для лечения всех острых или хронических, вызванных ишемией нарушений или индуцируемых ими первичных или вторичных заболеваний. Они защищают органы, страдающие от острой или хронической кислородной недостаточности, путем уменьшения или затруднения ишемически индуцированных нарушений и, таким образом, применимы в качестве лекарственного средства, например, при тромбозах, сосудистых спазмах, атеросклерозе или при оперативных вмешательствах (например, при трансплантации органов почек или печени, причем соединения применимы как для защиты органа у донора перед или во время взятия, для защиты отделенного органа, например, при обработке или хранении в физиологическом растворе, так и при перенесении в организм реципиента) или хронической или острой почечной недостаточности.
Соединения формулы I равным образом являются ценными протективно активными лекарственными средствами при проведении ангиопластических оперативных вмешательств, например, на сердце, так же как и на периферических сосудах. В соответствии с их протективной активностью по отношению к ишемически индуцированным нарушениям эти соединения применимы также в качестве лекарственных средств для лечения ишемий нервной системы, в частности, центральной нервной системы, причем они применимы, например, для лечения острых приступов или отеков головного мозга. Благодаря этому предложенные соединения формулы I равным образом применимы для лечения различных форм шоков, как, например, аллергические, кардиогенные, гиповолемические и бактериальные шоки.
Сверх того предложенные соединения формулы I проявляют сильную ингибирующую активность в отношении разрастания клеток, например, разрастание клеток фибробласта и разрастание клеток гладких мышц. Поэтому речь идет о соединениях формулы I как ценных терапевтических средствах при заболеваниях, в которых разрастание клеток является первичной или вторичной причиной, и поэтому они могут применяться в качестве антиатеросклеротических средств, средств против диабетических поздних осложнений, раковых заболеваний, фиброзных заболеваний, как фиброз легких, фиброз печени или фиброз почек, гипертрофии и гиперплазии органов, в частности, при гиперплазии простаты или гипертрофии простаты.
Обнаружено, что ингибиторы Na+-зависимого Сl-
/НСО
Улучшение дыхательных импульсов путем стимуляции хеморецепторов веществами, которые замедляют
Na+-зависимый Сl-/НСО
Предложенные соединения формулы I и их физиологически приемлемые соли могут быть использованы для животных, предпочтительно для млекопитающих и, в частности, для людей в качестве лекарственных препаратов, индивидуально, в виде смесей друг с другом или в виде фармацевтических готовых препаративных форм. Предметом данного изобретения являются также соединения формулы I и их физиологически приемлемые соли для применения в качестве лекарственных средств, их применение в терапии и профилактике названных заболеваний и приготовление из них лекарственных препаратов. Дополнительно предметом данного изобретения являются фармацевтические готовые препаративные формы, которые в качестве активной составной части содержат активную дозу по меньшей мере одного соединения формулы I и/или его физиологически приемлемой соли наряду с обычными фармацевтическими, не встречающими возражений, носителями и вспомогательными веществами. Фармацевтические композиции содержат обычно от 0,1 до 99 весовых процентов, предпочтительно от 0,5 до 95 весовых процентов соединений формулы I и/или их физиологически приемлемых солей. Приготовление фармацевтических композиций может осуществляться известным образом. Для этого соединения формулы I и/или их физиологически приемлемые соли с одним или более твердыми или жидкими галеновыми носителями и/или вспомогательными веществами и, при желании, в комбинации с другими активными лекарственными веществами, доводят до пригодной готовой формы или дозированной формы, которые затем могут быть использованы в качестве лекарственных средств в медицине или ветеринарии.
Лекарственные средства, которые содержат соединение формулы (I) и/или его физиологически приемлемую соль, могут при этом вводиться перорально, парентерально, внутривенно, ректально или путем ингаляции, причем предпочтительное введение зависит от каждого проявления заболевания. Соединения формулы I при этом могут применяться индивидуально или вместе с галеновыми вспомогательными веществами, как в ветеринарии, так и в медицине.
Какие вспомогательные вещества применимы для желательной формы лекарственного средства, известно специалисту на основе его специальных знаний. Наряду с растворителями, гелеобразователями, основами суппозиториев, вспомогательными веществами для таблеток и другими носителями активных веществ могут быть использованы, например, антиоксиданты, диспергаторы, эмульгаторы, вспениватели, корректоры вкуса, консерванты, солюбилизаторы или красители.
Для пероральной формы применения активные соединения смешивают с подходящими для этого добавками, такими как носители, стабилизаторы или инертные разбавители, и обычными способами переводят в пригодные формы применения, такие как таблетки, драже, капсулы, водные, спиртовые или масляные растворы. В качестве инертных носителей могут применяться, например, гуммиарабик, магнезия, карбонат магния, фосфат калия, молочный сахар, глюкоза или крахмал, в частности, кукурузный крахмал. Причем готовые препаративные формы могут изготавливаться как в виде сухих, так и в виде влажных гранул. В качестве масляного носителя или в качестве растворителя пригодны, например, растительные или животные масла, такие как подсолнечное масло или рыбий жир.
Для подкожного или внутривенного применения активные соединения переводят в раствор, суспензию или эмульсию, при желании с обычными для этого веществами, такими как сорастворители, эмульгаторы или другие вспомогательные вещества. В качестве растворителя речь идет, например, о воде, физиологическом растворе поваренной соли или спирте, например, этаноле, пропаноле, глицерине, а также растворах сахаров, таких как растворы глюкозы или маннита, или о смесях различных перечисленных растворителей.
В качестве фармацевтических готовых препаративных форм для использования в форме аэрозолей или спреев пригодны, например, растворы, суспензии или эмульсии активных веществ формулы I в фармацевтически приемлемом растворителе, в особенности, этанол или вода, или в смеси таких растворителей.
Готовая прапаративная форма по мере надобности может содержать еще другие фармацевтические вспомогательные вещества, такие как поверхностно-активные вещества, эмульгаторы и стабилизаторы, так же как и рабочий газ. Такой состав содержит активное вещество обычно в концентрации примерно от 0, 1 до 10, в частности примерно от 0,3 до 3 вес.%.
Дозировка применяемых активных веществ формулы I и частота введения зависят от активности и длительности действия применяемых соединений; кроме того также от вида и степени заболевания, так же как и от пола, возраста, веса и индивидуальных потребностей подвергающегося лечению млекопитающего.
В среднем ежедневные дозы соединения формулы I для пациента весом примерно 75 кг составляют по меньшей мере 0,001 мг/кг, предпочтительно 0,01 мг/кг до самое большее 10 мг/кг, предпочтительно 1 мг/кг веса тела. При острых случаях заболевания, возможно непосредственно после развития инфаркта миокарда, могут быть необходимы также еще более высокие и прежде всего более частые дозировки, например, до 4 отдельных доз в день. В особенности, при внутривенном введении, для пациентов с инфарктом в отделении интенсивной терапии, может быть необходимо до 200 мг в день.
Соединения формулы I могут использоваться как индивидуальные активные вещества или в сочетании с другими фармакологически активными соединениями.
Соединения формулы I и/или их физиологически приемлемые соли для достижения полезного терапевтического эффекта могут также вводиться вместе с другими фармакологически активными соединениями для лечения или профилактики названных выше заболеваний, в частности, для лечения сердечно-сосудистых заболеваний. Предпочтительной является комбинация с ингибиторами натрий/водородного обмена (NHE) и/или с другими классами веществ, активных в отношении сердечно-сосудистой системы.
Изобретение относится далее к комбинациям a) NCBE-ингибиторов формулы I и/или их физиологически приемлемых солей с NHE-ингибиторами и/или их физиологически приемлемыми солями; б) NCBE-ингибиторов формулы I и/или их физиологически приемлемых солей с другими классами активных в отношении сердечно-сосудистой системы веществ и/или их физиологически приемлемыми солями, так же как и в NCBE-ингибиторов формулы I и/или их физиологически приемлемых солей NHE-ингибиторами и/или их физиологически приемлемыми солями и с активными веществами из других классов активных в отношении сердечно-сосудистой системы веществ и/или их физиологически приемлемыми солями.
Среди известных и идентифицированных NHE-ингибиторов речь идет о производных гуанидина, предпочтительно об ацил-гуанидинах, среди других, как описано Edward J. Cragoe, Jr., "DIURETICS, Chemistry, Pharmacology and Medicine", J. WILEY & Sons (1983), 303-341 или о приведенных в заявке ЕР98115754.8 NHE-ингибиторах.
Пригодными NHE-ингибиторами являются, например, также бензоилгуанидины, как они описаны в патентах и заявках US 5292755, US 5373024, US 5364868, US 5591754, US 5516805, US 5559153, US 5571842, US 5641792, US 5631293, ЕР-А 577024, ЕР-А 602522, ЕР-А 602523, ЕР-А 603650, ЕР-А 604852, ЕР-А 612723, ЕР-А 627413, ЕР-А 628543, ЕР-А 640593, ЕР-А 640588, ЕР-А 702001, ЕР-А 713864, ЕР-А 723956, ЕР-А 754680, ЕР-А 765868, ЕР-А 774459, ЕР-А 794171, ЕР-А 814077, ЕР-А 869116; орто-замещенные бензоилгуанидины, как они описаны в заявках ЕР-А 556673, ЕР-А 791577, ЕР-А 794172; орто-аминозамещенные бензоилгуанидины, как они описаны в заявке ЕР-А 690048; изохинолины, как они описаны в заявке ЕР-А 590455; бензоконденсированные 5-членные гетероциклы, как они описаны в заявке ЕР-А 639573; диацилзамещенные гуанидины, как они описаны в заявке ЕР-А 640587; ацилгуанидины, как они описаны в патенте US 5547953; гуанидиновые производные содержащих перфторалкильные группы фенилзамещенных алкил- или алкенилкарбоновых кислот, как они описаны в патенте US 5567734 и заявке ЕР-А 688766; гетероароилгуанидины, как они описаны в заявке ЕР-А 676395; бициклические гетероароилгуанидины, как они описаны в заявке ЕР-А 682017; инденоилгуанидины, как они описаны в заявке ЕР-А 738712; бензоилоксикарбонилгуанидины, как они описаны в заявке ЕР-А 748795; гуанидиновые производные содержащих фторфенильные группы фенилзамещенных алкенилкарбоновых кислот, как они описаны в заявке ЕР-А 744397; гуанидиновые производные замещенных коричных кислот, как они описаны в заявке ЕР-А 755919; сульфонимидамиды, как они описаны в заявке ЕР-А 771788; дигуанидиновые производные бензолдикарбоновых кислот, как они описаны в заявках ЕР-А 774458, ЕР-А 774457; дигуанидиновые производные диарилкарбоновых кислот, как они описаны в заявке ЕР-А 787717; гуанидиновые производные замещенных тиофенил-алкенилкарбоновых кислот, как они описаны в заявке ЕР-А 790245; бис-орто-замещенные бензоилгуанидины, как они описаны в заявке ЕР-А 810207; замещенные 1- или 2-нафтилгуанидины, как они описаны в заявках ЕР-А 810205 и ЕР-А 810206; инданилидинацетилгуанидины, как они описаны в заявке ЕР-А 837055; гуанидиновые производные фенилзамещенных алкенилкарбоновых кислот, как они описаны в заявке ЕР-А 825178; аминопиперидил-бензоилгуанидины, как они описаны в заявке ЕР-А 667341; гетероциклилокси-бензоилгуанидины, как они описаны в заявке ЕР-А 694537; орто-замещенные бензоилгуанидины, как они описаны в патенте ЕР704431; орто-замещенные алкил-бензоилгуанидины, как они описаны в заявке ЕР-А 699660; орто-замещенные гетероциклил-бензоилгуанидины, как они описаны в заявке ЕР-А 699666; орто-замещенные 5-метилсульфонил-бензоилгуанидины, как они описаны в заявке ЕР-А 708088; орто-замещенные 5-алкилсульфонил-бензоилгуанидины с 4-амино-заместителями, как они описаны в заявке ЕР-А 723963; орто-замещенные 5-алкилсульфонил-бензоилгуанидины с 4-меркапто-заместителями, как они описаны в заявке ЕР-А 743301; 4-сульфонил- или 4-сульфинил-бензилгуанидины, как они описаны в заявке ЕР-А 758644; алкенилбензоилгуанидины, как они описаны в заявке ЕР-А 760365; бензоилгуанидины с конденсированными циклическими сульфонами, как они описаны в патенте DE 19548708; бензоил-, полициклические ароил- и гетероарилгуанидины, как они описаны в заявке WO 9426709; 3-арил-гетероароил-бензоилгуанидины, как они описаны в заявке WO 9604241; 3-фенил-бензоилгуанидины с основной амидогруппой в 5-положении, как они описаны в заявке WO 9725310; 3-дигалогентиенил- или 3-дигалогенфенил-бензоилгуанидины с основным заместителем в 5-положении, как они описаны в заявке WO 9727183; 3-метилсульфонилбензоилгуанидины с определенными аминозаместителями в 4-положении, как они описаны в заявке WO 9512584; производные амилорида, как они описаны в заявке WO 9512592; 3-метилсульфонил-бензоилгуанидины с определенными аминозаместителями в 4-положении, как они описаны в заявке WO 9726253; индолилгуанидины, как они описаны в заявках ЕР-А 622356 и ЕР-А 708091; индолилгуанидины с дополнительной конденсированной циклической системой, как они описаны в патенте ЕР 787728; производные метилгуанидина, как они описаны в WO 9504052; 1,4-бензоксазиноилгуанидины, как они описаны в заявке ЕР-А 719766; 5-бром-2-нафтоил-гуанидины, как они описаны в патенте JP 8225513; хинолин-4-карбонилгуанидины с фенильным остатком во 2-положении, как они описаны в заявке ЕР-А 726254; циннамоилгуанидины, как они описаны в патенте JP 09059245; пропеноилгуанидины с нафталиновым заместителем, как они описаны в патенте JP 9067332; пропеноилгуанидины с индольными заместителями, как они описаны в патенте JP 9067340; или гетероароилзамещенные акрилоилгуанидины, как они описаны в заявке WO 9711055, так же как и их физиологически приемлемые соли.
Пригодными NHE-ингибиторами являются соединения, отмеченные в названных публикациях в качестве предпочтительных.
Особенно предпочтительными являются соединения карипорид (НОЕ642), НОЕ 694, EMD 96785, FR 168888, FR 183998, SM-20550, KBR-9032, так же как и их физиологически приемлемые соли. Наиболее предпочтительным является карипорид или другая физиологически приемлемая соль N-(4-изопропил-3-метансульфонил-бензоил)-гуанидина.
Примерами классов активных в отношении сердечно-сосудистой системы веществ, которые терапевтически целесообразно комбинировать с NCBE-ингибиторами или дополнительно с комбинациями NCBE-ингибиторов и NHE-ингибиторов, являются блокаторы бета-рецепторов, кальциевые антагонисты, ингибиторы ангиотензинпревращающего фермента, блокаторы рецепторов ангиотензина, канальцевые диуретики, тиазиддиуретики, калийсберегающие диуретики, антагонисты альдостерона, которые, например, вводят для снижения кровяного давления, а также сердечные гликозиды или другие увеличивающие силу сокращения средства при лечении сердечной недостаточности и застойной сердечной недостаточности, так же как и антиаритмические средства классов I-IV, нитраты, КATP-открыватели, КАТР-блокаторы, ингибиторы вератридинактивируемых натриевых каналов и т. д. Примерами являются: бета-блокаторы пропанолол, атенолол, метопролол; кальциевые антагонисты дилтиазем-гидрохлорид, верапамил-гидрохлорид, нифедипин; АСЕ-ингибиторы каптоприл, еналаприл, рамиприл; трандолаприл, квинаприл, спираприл, предпочтительно рамиприл или трандолаприл; антагонисты рецептора-II ангиотензина лосартан, вальсартан, тельмисартан, эпросартан, тазосартан, кандесартан, ирбесартан; канальцевые диуретики фуросемид, пиретанид, торасемид; тиазидные диуретики гидрохлортиазид, метолазон, индапамид; калийсберегающие диуретики амилорид, триамтерен, спиронолактон; сердечные гликозиды дигоксин, дигитоксин, строфантин; антиаритмические вещества амиодарон, соталол, бретилий, флекаинид; нитрат глицеронитрат; K+(АТР)-открыватели кромакалим, лемакалим, нокорандил, пинацидил, миноксидил; ингибиторы вератридинактивируемых Na+-кaнaлoв.
Примером такого особенно предпочтительного сочетающегося с NCBE-ингибиторами формулы I вещества является блокатор неинактивированных натриевых каналов (вератридинактивируемых натриевых каналов). Комбинация NCBE-ингибитора с блокатором неинактивированного натриевого канала (вератридинактивируемого натриевого канала) применима для профилактики инфаркта и рецидивирующего инфаркта и для лечения инфаркта, так же как и для лечения стенокардии и ингибирования индуцированных ишемией сердечных аритмий, тахикардии и возникновения и продолжения мерцания желудочков; причем комбинации NCBE-ингибитора с блокатором неинактивированного натриевого канала также превентивно ингибируют или сильно уменьшают патофизиологические предвестники при возникновении ишемически индуцируемых нарушений. Благодаря усиленному защитному действию в отношении патологических гипоксических и ишемических ситуаций предложенные комбинации ингибитора NCBE-ингибитора формулы I с блокатором неинактивированного натриевого канала вследствие усиленного ингибирования входного потока Nа+ в клетку могут быть использованы в качестве лекарственных средств для лечения всех острых или хронических вызываемых ишемией нарушений или первично или вторично индуцируемых ими заболеваний. Это относится к их применению в качестве лекарственных средств при оперативных вмешательствах, например, при трансплантации органов; причем комбинации NCBE-ингибитора формулы I с блокатором неинактивированных натриевых каналов могут применяться как для защиты органа у донора перед или в процессе отделения, для защиты отделенного органа, например, при его хранении в физиологической жидкости, так и при внесении в организм реципиента. Комбинации NCBE-ингибитора формулы I с блокатором неинактивированных натриевых каналов равным образом являются ценными протективно действующими лекарственными средствами при проведении ангиопластических оперативных вмешательств, например, на сердце, также и на периферических сосудах. В соответствии с их протективным действием в отношении индуцируемых ишемией нарушений комбинации NCBE-ингибитора формулы I с блокатором неинактивированных натриевых каналов пригодны также в качестве лекарственных средств для лечения ишемий нервной системы, в частности, центральной нервной системы, причем они применимы для лечения острых приступов и отеков головного мозга. К тому же предложенные комбинации NCBE-ингибитора формулы I с блокатором неинактивированных натриевых каналов применимы для лечения различных форм шоков, как, например, аллергический, кардиогенный, гиповолемический и бактериальный шоки.
Наряду с применением в качестве фиксированных комбинаций изобретение относится также к одновременному, раздельному или постадийному применению NCBE-ингибиторов формулы I с ингибиторами натрий-водородного обмена и/или дополнительным активным веществом из другого класса активных в отношении сердечно-сосудистой системы веществ для лечения названных выше заболеваний.
Изобретение относится к фармацевтической композиции, содержащей а) NCBE-ингибитор формулы I и ингибитор натрий-водородного обмена и/или его физиологически приемлемую соль;
или б) NCBE-ингибитор формулы I и дополнительно активное вещество из другого класса активных в отношении сердечно-сосудистой системы веществ и/или их физиологически приемлемых солей; или в) NCBE-ингибитор формулы I', ингибитор натрий-водородного обмена и дополнительно активное вещество из другого класса активных в отношении сердечно-сосудистой системы веществ и/или их физиологически приемлемых солей.
Путем комбинированного применения эффект одного сочетающегося компонента может усиливаться другим соответствующим компонентом, то есть действие и/или продолжительность действия предложенной комбинации или композиции сильнее или продолжительнее, чем активность и/или продолжительность каждого отдельно взятого компонента (синергический эффект). Это приводит при комбинированном применении к уменьшению дозы каждого компонента комбинации по сравнению с раздельным применением. Предложенные комбинации и готовые препаративные формы обладают тем преимуществом, что используемое количество активных веществ значительно уменьшается, и нежелательные побочные действия могут быть устранены или сильно уменьшены.
Далее изобретение относится к упаковке для продажи, содержащей в качестве фармацевтически активного вещества
а) NCBE-ингибитор формулы I и ингибитор натрий-водородного обмена и/или их физиологически приемлемые соли; или
б) NCBE-ингибитор формулы I и дополнительно активное вещество из другого класса активных в отношении сердечно-сосудистой системы веществ и/или их физиологически приемлемые соли; или в) NCBE-ингибитор формулы I, ингибитор Na+/H+-обмена и дополнительно активное вещество из другого класса активных в отношении сердечно-сосудистой системы веществ и/или их физиологически приемлемые соли вместе с инструкциями по применению этих активных веществ в комбинации для одновременного, раздельного или постадийного применения при лечении или профилактике названных выше заболеваний, в частности, при лечении сердечно-сосудистых заболеваний.
Фармацевтические композиции согласно изобретению могут, например, быть получены либо путем интенсивного перемешивания отдельных компонент в виде порошков, либо путем растворения отдельных компонент в пригодном растворителе, как, например, низший спирт, и последующего удаления растворителя.
Весовое соотношение NCBE-ингибитора к ингибитору Nа+/H+ -обмена или активному в отношении сердечно-сосудистой системы веществу в комбинациях согласно изобретению и композициях составляет целесообразно от 1:0,01 до 1:100, предпочтительно от 1:0,1 до 1:10.
Предлагаемые комбинации и композиции содержат в общем предпочтительно 0,5-99,5 вес.%, особенно предпочтительно 4-99 вес.% таких активных веществ.
При применении согласно изобретению для млекопитающих, предпочтительно для человека, дозы различных компонент активных веществ колеблются, например, в интервале от 0,001 до 100 мг/кг в день.
Примеры:
Общая методика твердофазного синтеза:
Синтезы соединений формулы I в твердой фазе предусматривают подходящее присоединение сульфонамидных структур через химически связывающее звено (линкер) к полимерной матрице известными специалисту способами. Присоединенное через сульфонамидную группу к полимеру основное вещество далее подвергают обычным в органической химии органическим реакциям.
В частности были проведены следующие стадии (например, описанные для соединения формулы Iа,
где R(1) обозначает 2-хлорфенил, R(2) бензил, Х карбонил и R(3) до R(7) обозначают водород.
А. Синтез структурного звена линкер/полимер
В качестве имеющегося в продаже полимера был использован аминометилполистирол фирмы Fluca (1,1 ммоль амина/г смолы; 2% сшитого дивинилбензолом). В качестве линкера использовано известное из литературы соединение 1 (G, Breipohl, J. Knolle,
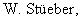

Для связывания полимера и линкера смешивали 14,4 г аминометилполистирола 2, 28,2 г 1, 3,2 г HOOBt, 11,5 г диизопропилкарбодиимида в 105 мл ДМФА и 45 мл метиленхлорида и встряхивали 48 ч. Затем подкисляли и тщательно промывали ДМФА и МТБ.
Б. Синтез связанного со смолой сульфонамида
5 г 3 обрабатывали смесью пиперидин/ДМФА (1:3) при комнатной температуре, раствор подкисляли и тщательно промывали ДМФА. К увлажненной ДМФА смоле прибавляли 3,1 г известного из литературы соединения 4 (Gilman, Marker, JACS 74, 1952, 5317) в 20 мл ДМФА. После прибавления 0,7 мл пиридина оставляли реагировать 18 ч при комнатной температуре. Подкисляли и промывали ДМФА и МТБ.
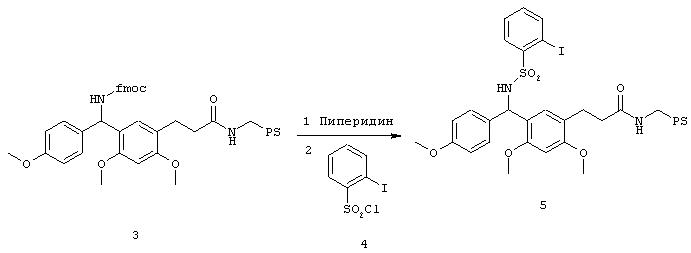
В. Синтез связанного со смолой биарилсульфонамида 7
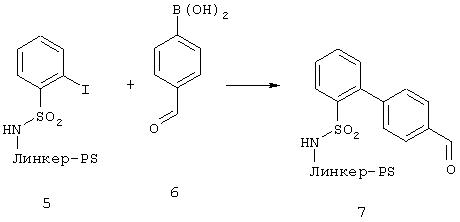
Проводили набухание 1 г 5 в 15 мл ДМФА и прибавляли 1,5 г борной кислоты 6,50 мг Рd(РРh3)4 и 3,5 мл 2 М раствора Nа2СО3. Оставляли реагировать 24 ч при 100°С в атмосфере аргона. Подкисляли и тщательно промывали водой, ДМФА и МТБ.
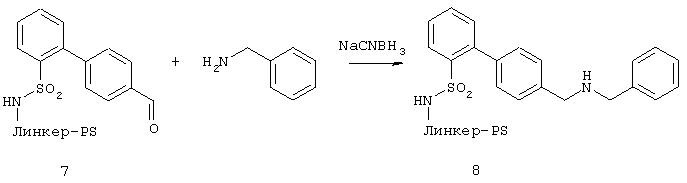
Г. Восстановительное аминирование в твердой фазе, например, бензиламине
200 мг связанного со смолой основного вещества 7 обрабатывали 1 ммолем амина, растворенного в 1 мл смеси диметоксиэтан/метанол (3:1) и прибавляли 0, 2 мл 1 М раствора уксусной кислоты в диметоксиэтане, а также 0,5 мл 1 М раствора NaBH3CN в диметоксиэтане. Оставляли реагировать 4 ч при комнатной температуре. Подкисляли и тщательно промывали ДМФА и МТБ.
После отщепления пробы (10 мг) от смолы путем обработки 1 мл смеси метиленхлорид/трифторуксусная кислота (3:1) свободный амин 8 был охарактеризован высокоэффективной жидкостной хроматографией и масс-спектрометрией.
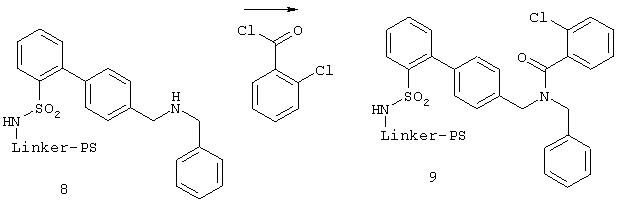
К 190 мг 8 прибавляли 2 мл 1 М раствора N-этилморфолина в метиленхлориде. Охлаждали до 0°С и добавляли при перемешивании 0,5 ммоля хлорангидрида кислоты, растворенного в 0,5 мл метиленхлорида. Оставляли реагировать 1 ч при 0°С. Подкисляли и промывали ДМФА и МТБ. Ход реакции контролировали путем отбора пробы 9 (смотри Г) методами высокоэффективной жидкостной хроматографии и масс-спектрометрии.
Е. Отщепление от смолы
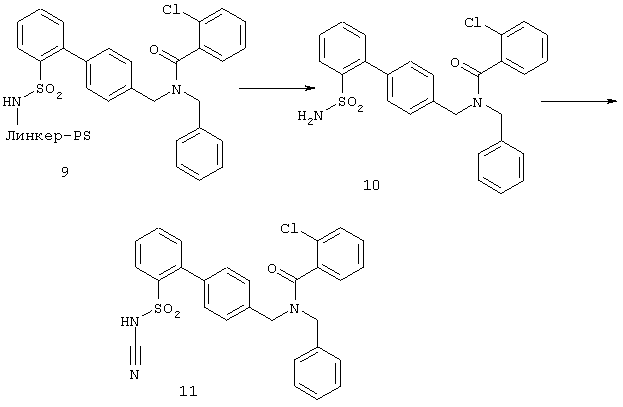
180 мг 9 обрабатывали 30 мин при комнатной температуре 3 мл раствора метиленхлорида/трифторуксусной кислоты (3:1).
После отделения раствора от полимера обрабатывали в роторном испарителе в вакууме. В качестве остатка получили 30 мг свободного амида 10, который непосредственно направляли на стадию цианилирования (Ж).
Ж. Синтез сульфонилцианамидов
30 мг 10 растворяли в 3 мл ацетонитрила и прибавляли 0,3 ммоля триэтиламина, а также 0,12 ммоля BrCN, растворенного в ацетонитриле. Оставляли реагировать 18 ч при комнатной температуре, прибавляли затем 3 мл МТБ и 2 мл водного буферного раствора (рН6). После хорошего перемешивания отделяли верхнюю фазу и наносили на силикагель. Сначала промывали 5 мл МТБ, а затем вымывали продукт 5 мл смеси ЭА/НОАс (5:1). После упаривания раствора в вакууме получили 12 мг сульфонилцианамида 60-90%-ной степени чистоты (например, 11, 90%). Полученный таким образом продукт может быть подвергнут дальнейшей очистке путем препаративной высокоэффективной жидкостной хроматографии с обращенными фазами. Продукт охарактеризован путем высокоэффективной жидкостной хроматографии и масс-спектрометрии, а также выборочно путем ЯМР-спектроскопии.
Аналогично были получены следующие соединения формулы Ia (R(3) до R(7) обозначают водород), см. таблицу 1.
Пример 554
4’-{[Бензил-(2-тиофен-2-ил-ацетил)амино]-метил}-3’-хлор-бифенил-2-сульфонилцианамид
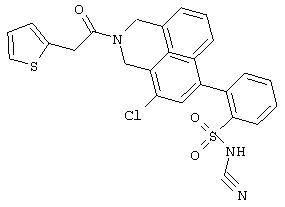
а) 4-Бром-1-бромметил-2-хлорбензол
7,1 мл 4-бром-2-хлортолуола растворяли в 20 мл хлорбензола и при 130°С порциями прибавляли смесь 9,4 г N-бром-сукцинимида и 200 мг дибензоилпероксида. Кипятили 30 минут с обратным холодильником, после охлаждения разбавляли 100 мл CH2Cl2 и промывали по 1 разу 50 мл насыщенного водного раствора Na2SO3 и 100 мл насыщенного водного раствора NаНСО3. Сушили над Na2SO4, и растворители удаляли в вакууме.
Получили 11,0 г бледно-желтого масла.
Rf (ЭА/ГП 1:8)=0,49. Масс-спектр (ДХИ): 283(M+H)+.
б) Бензил-(4-бром-2-хлорбензил)амин
765 мкл бензиламина растворяли в 10 мл ТГФ (безводного), и при 0°С прибавляли 1,0 г 4-бром-1-бромметил-2-хлорбензола и перемешивали 4 ч при комнатной температуре. После этого прибавляли 100 мл полунасыщенного водного раствора Nа2СО3 и три раза экстрагировали по 100 мл ЭА. Сушили над МgSO4 и хроматографировали на силикагеле с ДИП. Получили 590 мг бесцветного масла.
Rf (ДИП)=0,30. Масс-спектр (ДХИ): 310 (М+Н)+.
в) Бензил-(4-бром-2-хлорбензил)амид 2-тиофен-2-ил-уксусной кислоты
580 мг бензил-(4-бром-2-хлорбензил)амина растворяли в 10 мл CH2Cl2 (безводного) и прибавляли сначала 300 мкл пиридина, а затем 330 мг хлорангидрида 2-тиофен-2-ил-уксусной кислоты. Перемешивали 4 ч при комнатной температуре, затем разбавляли 100 мл CH2Cl2 и промывали 50 мл насыщенного водного раствора Na2СО3. Сушили над MgSO4, и растворители удаляли в вакууме. Хроматографировали на силикагеле с ДИП и получали 490 мг бесцветного масла.
Rf (ДИП)=0,56. Масс-спектр (ЭР): 434 (М+Н)+.
г) Трет-бутиламид 4’-{[бензил-(2-тиофен-2-ил-ацетил)амино]-метил}–3’-хлорбифенил-2-сульфоновой кислоты
480 мг бензил-(4-бром-2-хлорбензил)амида 2-тиофен-2-ил-уксусной кислоты, 426 мг N-трет-бутил-2-дигидроксиборан-2-ил-бензолсульфамида (J. Med. Chem. 1997, 40, 547), 26,2 мг трифенилфосфина, 11,2 мг ацетата Pd(II) и 133 мг Na2CO3 суспендировали в 1 мл воды, 0, 5 мл EtOH, а также 5 мл толуола и в течение 2 ч кипятили с обратным холодильником. Охлаждали, после чего удаляли летучие компоненты в вакууме.
Остаток вносили в 2 мл CH2 Cl2 и хроматографировали на силикагеле с ДИП. Получили 520 мг бесцветного аморфного твердого вещества.
Rf (ДИП)=0,20. Масс-спектр (ЭР): 567 (М+Н)+.
д) 4’-{[Бензил-(2-тиофен-2-ил-ацетил)амино]-метил}-3’-хлорбифенил-2-сульфонамид
510 мг трет-бутиламида 4'-{[бензил-(2-тиофен-2-ил-ацетил) амино]-метил)-3’-хлорбифенил-2-сульфоновой кислоты и 110 мкл анизола в 3 мл трифторуксусной кислоты оставляли стоять на 18 ч при комнатной температуре. После этого летучие компоненты удаляли в вакууме, вносили в 5 мл толуола и снова удаляли летучие компоненты в вакууме. Получили 586 мг бесцветного масла, которое далее использовали без очистки. Rf (ДИП)=0,12. Масс-спектр (ЭР): 511 (М+Н)+.
е) 4’-{[Бензил-(2-тиофен-2-ил-ацетил)амино]-метил}-3’-хлорбифенил-2-сульфонилцианамид
586 мг 4’-{[бензил-(2-тиофен-2-ил-ацетил)амино]-метил}-3’-хлорбифенил-2-сульфонамида, 372 мг К2СО3, а также 180 мкл 5 молярного раствора BrCN в ацетонитриле кипятили 1, 5 ч с обратным холодильником. После охлаждения всю реакционную смесь хроматографировали на силикагеле с ЭА/МеОН (10:1). Получили 181 мг бесцветного аморфного твердого вещества.
Rf (ЭА/МеОН 10:1)=0,22. ИК-спектр (CN): 2172,5 см-1.
Масс-спектр (ЭР): 536 (M+H)+. Остаточная активность NCBE при 10 мкМ: 15%.
Целевое соединение Примера 555 было синтезировано аналогично Примеру 554.
Пример 555
4’-{[Бензил-(2-тиофен-2-ил-ацетил)амино]-метил}-3’-метилсульфонилбифенил-2-сульфонилцианамид
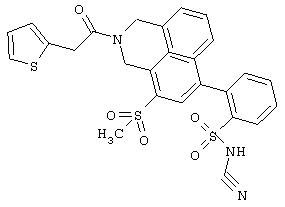
а) 2-Бром-5-метил-бензолсульфонилхлорид
40 г 4-бромтолуола при перемешивании медленно вносили при -10°С в 250 мл хлорсульфоновой кислоты. Перемешивали 30 минут при этой температуре, оставляли нагреваться до 0°С и выливали на избыток льда. Продукт отсасывали и промывали небольшим количеством воды. Сушили в вакууме над Р4O10 и получили 63 г бесцветного твердого вещества, которое сразу использовали далее.
б) 2-Бром-5-метилбензолсульфиновая кислота
37,6 г сульфита натрия растворяли в 500 мл воды и нагревали до 70°С. При этой температуре порциями прибавляли 62 г 2-бром-5-метилбензолсульфонилхлорида. При этом одновременно прибавляли по каплям 10 н. водный раствор NaOH, так чтобы значение рН раствора поддерживалось между рН=9 и рН=10. Перемешивали 1,5 ч при 70°С, раствор отфильтровывали и затем на ледяной бане насыщенным раствором НСl доводили до рН=0. Перемешивали 30 минут, затем продукт отфильтровывали, промывали небольшим количеством воды и сушили. Получили 49,6 г белых кристаллов, т.пл. 120-122°С. Масс-спектр (ЭР): 236 (М+Н)+.
в) 2-Бром-5-метилбензолсульфинат натрия
49,6 г 2-бром-5-метилбензолсульфиновой кислоты растворяли в 400 мл метанола и прибавляли эквимолярное количество NaOH в 50 мл воды. Перемешивали 3 часа при комнатной температуре, раствор отфильтровывали и затем растворители удаляли в вакууме. В конце остатки воды удаляли азеотропно с 50 мл толуола. Твердый остаток сушили над Р4О10 в вакууме и получили 54,0 г продукта, т.пл. 288-290°С (с разложением).
г) 1-Бром-2-метансульфонил-4-метилбензол
54,0 г 2-бром-5-метилбензолсульфината натрия суспендировали в 300 мл безводного ДМФА, и прибавляли 45,7 мл метилйодида. При этом температура раствора поднялась до 50°С. Перемешивали 3 часа при 50°С, и ДМФА удаляли в вакууме. Остаток перемешивали с 500 мл воды, перемешивали еще 1 час при 0°С и отфильтровывали. Продукт промывали водой, сушили и перекристаллизовывали из 400 мл ГП/250 мл ЭА с активным углем. Получили 27,0 г бесцветных кристаллов, т.пл. 110-114°С.
Rf (ЭА/ГП 1:4)=0,09. Масс-спектр (ДХИ): 250 (M+H)+.
д) 1-Бром-4-бромметил-2-метансульфонилбензол
9,9 г 1-бром-2-метансульфонил-4-метилбензола вносили в 100 мл хлорбензола, прибавляли 77 мг бензоилпероксида, а также 7,1 г бромсукцинимида и кипятили 1 час с обратным холодильником. После этого растворитель удаляли в вакууме, остаток вносили в 100 мл СН2Сl2 и промывали 2 раза насыщенным водным раствором Nа2 СО3 и 1 раз 50 мл воды. Сушили над Na2SO4 и растворитель удаляли в вакууме. Остаток перекристаллизовывали из 80 мл ГП/30 мл ЭА и получили 6,9 г бледно-желтого твердого вещества, т.пл. 120-124°С.
Rf (ЭА/ГП 1:2)=0,38. Масс-спектр (ДХИ): 329 (М+Н)+.
е) Бензил-(4-бром-2-метилсульфонилбензил)амин
652 мкл бензиламина растворяли в 10 мл ТГФ (безводного) и при 0°С медленно прибавляли 1,0 г 1-бром-4-бромметил-2-метилсульфонилбензола. Перемешивали 4 ч при комнатной температуре, затем прибавляли 100 мл насыщенного водного раствора Na2СО3 и 2 раза экстрагировали по 100 мл ЭА. Сушили над МgSO4 и растворитель удаляли в вакууме. Хроматографией на силикагеле с МТБ/ДИП 1:1 получили 510 мг бесцветного масла.
Rf (ДИП)=0,10. Масс-спектр (ЭР): 354 (М+Н)+.
ж) 4’-{[Бензил-(2-тиофен-2-ил-ацетил)амино]-метил}-3’-метилсульфонилбифенил-2-сульфонилцианамид
Rf (ЭА/МеОН 10:1)=0,21. ИК-спектр (CN): 2175.3 см-1.
Масс-спектр (ЭР): 580 (М+Н)+.
Остаточная реактивность NCBE при 10 мкМ: 31%.
Пример 556
4’-{[Бензил-(тиофен-2-сульфонил)амино]-метил}-3’-хлор-бифенил-2-сульфонилцианамид
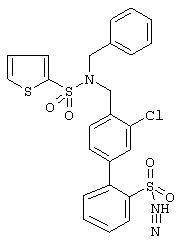
а) Бензил-(4-бром-2-хлорбензил)амид тиофен-2-сульфоновой кислоты
2,0 г бензил-(4-бром-2-хлорбензил)амина (Пример Хб) и 1,0 г пиридина растворяли в 20 мл CH2Cl2 и при комнатной температуре медленно прибавляли 1,4 г хлорангидрида тиофен-2-сульфоновой кислоты. Перемешивали 4 ч при комнатной температуре, затем разбавляли 200 мл ЭА и промывали 2 раза по 100 мл 5%-ного водного раствора гидросульфата натрия и также 2 раза по 50 мл насыщенного водного раствора карбоната натрия. Сушили над сульфатом магния, и растворитель удаляли в вакууме. Хроматографией на силикагеле с ДИП получено 1,5 г бесцветного масла.
Rf (ДИП)=0,21. Масс-спектр (ББА): 456 (М+Н)+.
Дальнейшие превращения с образованием целевого соединения проведены аналогично Примерам 554 г)-е).
б) 4’-{[Бензил-(тиофен-2-сульфонил)амино]-метил}-3’-хлорбифенил-2-сульфонилцианамид
Rf (ЭА/МеОН 10:1)=0,17. ИК-спектр (CN): 2178,5 см-1. Масс-спектр (ББА): 580 (M+Na)+. Остаточная реактивность NCBE при 10 мкМ: 0%.
Целевое соединение Примера 557 синтезировано аналогично Примеру 556 из целевого соединения Примера 555б).
Пример 557
4’-{[Бензил-(тиофен-2-сульфонил)амино]-метил}-3’-метилсульфонилбифенил-2-сульфонилцианамид

Rf (ЭА/МеОН 10:1)=0,28. ИК-спектр (CN): 2175,0 см-1. Масс-спектр (ЭР): 602 (М+Н)+.
Остаточная реактивность NCBE при 10 мкМ: 14%.
Пример 558
4’-{[Бензил-(тиофен-2-сульфонил)амино]-метил}-3’-(2-метокси)этоксибифенил-2-сульфонилцианамид
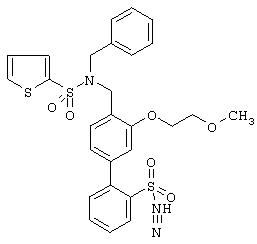
а) 4-Метил-3-(2-метокси)этоксианилин
22,0 г 3-гидрокси-4-метиланилина, 24,9 г простого 2-бромэтилметилового эфира и 233 г Сs2СО3 растворяли в 570 мл ДМФА и перемешивали 8 ч при 40°С. Добавляли 3 л 10%-ного водного раствора гидрокарбоната натрия, 6 раз экстрагировали по 750 мл ЭА и промывали 2 раза по 1 л 10%-ного водного раствора гидрокарбоната натрия. Сушили над сульфатом натрия, и растворитель удаляли в вакууме. Получили 32,9 г желтого масла, которое было использовано в далее.
Rf (ЭА/ГП 1:1)=0,33.
б) 4-Метил-3-(2-метокси)этоксибромбензол
32,8 г 4-метил-3-(2-метокси)этоксианилина суспендировали в 660 мл полунасыщенного водного раствора НВr и при 0°С медленно прибавляли по каплям 12,5 г NaNO3 в 25 мл воды.
Перемешивали 30 минут при 0°С, и затем полученный раствор медленно прибавляли к нагретому до 50°С раствору 51,9 г CuBr в 490 мл насыщенного водного раствора НВr. Реакционную смесь затем медленно, в течение 6 ч, нагревали от 50°С до 70° С. После последующего охлаждения экстрагировали 4 раза по 500 мл диэтилового эфира, промывали 500 мл водного раствора NaCl и сушили над сульфатом натрия. Хроматографией на силикагеле с ЭА/ГП 1:8 получено 15,4 г бесцветного масла.
rf (ЭА/ГП 1:1)=0,41. Масс-спектр (ДХИ): 245 (M+H)+.
в) 4-Бромметил-3-(2-метокси)этоксибромбензол
15,3 г 4-метил-3-(2-метокси)этоксибромбензола растворяли в 300 мл хлорбензола и добавляли порциями при перемешивании смесь 11,1 г N-бромсукцинимида и 125 мг бензоилпероксида. Кипятили 24 ч с обратным холодильником, растворитель удаляли в вакууме и затем соединяли с 500 мл CH2Cl2. Промывали сначала 200 мл насыщенного водного раствора Na2SO4 и затем 100 мл насыщенного водного раствора карбоната натрия. Сушили над сульфатом натрия, и растворитель удаляли в вакууме. Хроматографией на силикагеле с ЭА/ГП 1:15 получено 12,8 г бледно-желтого масла.
Rf (ЭА/ГП 1:4)=0,42. Масс-спектр (ДХИ): 323 (М+Н)+.
г) Бензил-[4-бром-2-(2-метокси)этоксибензил)амин
2,4 мл бензиламина растворяли в 20 мл ТГФ (безводного) и при 0°С медленно прибавляли 3,2 г 4-бромметил-3-(2-метокси)этоксибромбензола. Перемешивали 19 ч при комнатной температуре, затем разбавляли 200 мл ЭА и промывали 100 мл насыщенного водного раствора карбоната натрия. Сушили над сульфатом магния и удаляли в вакууме растворитель. Хроматографией на силикагеле с МТБ получено 1,3 г бесцветного масла.
Rf (МТБ)=0,20. Масс-спектр (ДХИ): 350 (М+Н)+.
д) Бензил-[4-бром-2-(2-метокси)этоксибензил]амид тиофен-2-сульфоновой кислоты
1,2 г бензил-[4-бром-2-(2-метокси)этоксибензил)амина, 713 мг хлорангидрида тиофен-2-сульфоновой кислоты и 430 мкл пиридина растворяли в 50 мл СН2Сl2 и перемешивали 17 ч при комнатной температуре. Затем разбавляли 100 мл CH2Cl2 и промывали сначала 2 раза по 50 мл 5%-ного водного раствора гидрокарбоната натрия и затем 50 мл насыщенного водного раствора карбоната натрия. Сушили сульфатом магния, и растворитель удаляли в вакууме. Хроматографией на силикагеле с ДИП получено 900 мг бесцветного масла.
Rf (ДИП)=0,2. Масс-спектр (ЭР): 496 (М+Н)+.
е) Дигидроксиборан-2-ил-бензолсульфонамид
50 г N-трет-бутил-2-дигидроксиборан-2-ил-бензолсульфонамида (J. Med. Chem. 1997, 40, 547) и 23,3 г анизола растворяли в 500 мл трифторуксусной кислоты и выдерживали 2 дня при комнатной температуре. Летучие компоненты удаляли в вакууме, выливали в 100 мл воды и снова удаляли летучие компоненты в вакууме. Наконец, вносили в 100 мл толуола и еще раз летучие компоненты удаляли в вакууме. Получили 56 г бесцветного масла, которое использовали далее без очистки.
Rf (МТБ)≈0,4.
ж) Диметиламинометиленамид дигидроксиборан-2-ил-бензолсульфоновой кислоты
20 г дигидроксиборан-2-ил-бензолсульфонамида и 66 мл диметилацеталя диметилформамида растворяли в 200 мл ДМФА (безводного) и выдерживали 18 ч при комнатной температуре. Реакционную смесь выливали на 1,5 л воды и 4 раза экстрагировали по 500 мл ЭА. Сушили над сульфатом магния, и растворитель удаляли в вакууме. Кристаллизацией из 100 мл ЭА получено 5,2 г бесцветных кристаллов, т.пл. 175°С (с разложением).
Rf (ЭА)=0, 25.
з) Диметиламинометиленамид {[бензил-(тиофен-2-сульфонил)амино]-метил}-3’-(метокси)этоксибифенил-2-сульфоновой кислоты
900 мг бензил-[4-бром-2-(2-метокси)этоксибензил]амида тиофен-2-сульфоновой кислоты, 1,4 г диметиламинометиленамида дигидроксиборан-2-ил-бензолсульфоновой кислоты, 47 мг трифенилфосфина, 20 мг ацетата Pd(II) и 575 мг Na2CO3 cycпендировали в 30 мл толуола, 5 мл воды, а также 5 мл EtOH.
Кипятили 6 ч с обратным холодильником, затем охлаждали и разбавили 100 мл ЭА. Промывали 2 раза по 50 мл насыщенного водного раствора NaCl. Сушили над сульфатом магния, и растворитель удаляли в вакууме. Хроматографией на силикагеле с МТБ получено 560 мг бесцветного вязкого масла.
Rf (МТБ)=0,13. Масс-спектр (ЭР): 628 (М+Н)+.
и) {[Бензил-(тиофен-2-сульфонил)амино]-метил}-3’-(2-метокси)этоксибифенил-2-сульфонамид
550 мг диметиламинометиленамида {[бензил-(тиофен-2-сульфонил)амино]-метил}-3’-(2-метокси) этоксибифенил-2-сульфоновой кислоты в 5 мл EtOH и 5 мл насыщенного водного раствора НСl кипятили 1 ч с обратным холодильником. Добавляли 100 мл 10%-ного водного раствора гидрокарбоната натрия и 3 раза экстрагировали по 100 мл ЭА. Сушили над сульфатом магния, и растворитель удаляли в вакууме. Хроматографией на силикагеле с МТБ/ДИП 1:1 получено 188 мг бесцветного масла.
Rf (МТБ/ДИП 1:1)=0,33. Масс-спектр (ЭР): 573 (М+Н)+.
к) 4’-{[Бензил-(тиофен-2-сульфонил)амино]-метил}-3’-(2-метокси)этоксибифенил-2-сульфонилцианамид
180 мг {[бензил-(тиофен-2-сульфонил)амино]-метил}-3’-(2-метокси)этоксибифенил-2-сульфонамида, 63 мкл 5 молярного раствора BrCN в ацетонитриле, а также 131 мг К2СО3 суспендировали в 3 мл ацетонитрила (безводного) и кипятили 2 ч с обратным холодильником. Оставляли охлаждаться и хроматографировали всю реакционную смесь на силикагеле с ЭА/МеОН 10:1 и получили 149 мг аморфного твердого вещества.
Rf (ЭА/МеОН 10:1)=0,13. ИК-спектр (CN): 2175,3 см-1.
Масс-спектр (ББА): 598 (М+Н)+.
Остаточная активность NCBE при 10 мкМ: 30%.
Пример 559
4’-{[Бензил-(тиофен-2-сульфонил)амино]-метил}-3’-(2-метокси)этоксибифенил-2-сульфонилцианамид

а) 4-Фтор-1-(2-метоксиэтокси)-2-метилбензол
10 г 4-фтор-2-метилфенола, 7,5 мл 1-бром-2-метоксиэтана, а также 22 г К2СО3 суспендировали в 200 мл ДМФА (безводного) и перемешивали 12 ч при 120°С. Оставляли охлаждаться, и удаляли растворитель в вакууме. Смешивали с 400 мл МТБ и промывали 3 раза по 200 мл 10%-ного водного раствора NaOH, а также 1 раз 100 мл насыщенного водного раствора NaCl. Сушили над сульфатом магния, и растворитель удаляли в вакууме. Получили 10,4 г бледно-желтого масла.
Rf (ЭА/ГП)=0,39. Масс-спектр (ДХИ): 185 (М+Н)+.
б) 2-Бромметил-4-фтор-1-(2-метоксиэтокси)-бензол
10,4 г 4-фтор-1-(2-метоксиэтокси)-2-метилбензола растворяли в 100 мл хлорбензола и при температуре кипения порциями прибавляли смесь 10,1 г N-бромсукцинимида и 200 мг бензоилпероксида. Кипятили 30 минут с обратным холодильником. Охлаждали и разбавляли 300 мл ЭА. Затем промывали сначала 1 раз 100 мл насыщенного водного раствора Nа2СО3, потом 2 раза по 100 мл насыщенного водного раствора карбоната натрия. Сушили над сульфатом магния, и растворитель удаляли в вакууме. Хроматографией на силикагеле с ЭА/ГП 1:4 получено 5,2 г бесцветного масла.
Rf (ЭА/ГП 1:4)=0,20. Масс-спектр (ДХИ): 262 (M+H)+.
б) 1-Бром-4-бромметил-2-метансульфонилбензол
9,9 г 1-бром-2-метансульфонил-4-метилбензола вносили в 100 мл хлорбензола, добавляли 77 мг бензоилпероксида, а также 7,1 г N-бромсукцинимида и кипятили 1 час с обратным холодильником. Затем растворитель удаляли в вакууме, остаток вносили в 100 мл СН2 Сl2 и промывали 2 раза 50 мл насыщенного водного раствора Na2CO3 и 1 раз 50 мл воды. Сушили над Na2SO4, и растворитель удаляли в вакууме. Остаток перекристаллизовывали из 80 мл ГП/30 мл ЭА и получили 6,9 г бледно-желтого твердого вещества, т.пл. 120-124°С.
Rf (ЭА/ГП 1:2)=0,38. Масс-спектр (ДХИ): 329 (М+Н)+.
в) 2-(4-Бром-2-метансульфонилбензил)-изоиндол-1,3-дион
3,0 г 4-бром-1-бромметил-2-метансульфонилбензола и 2,0 г фталимида калия перемешивали в 30 мл безводного ДМФА 1 ч при 100°С. Охлаждали, разбавляли 200 мл воды и перемешивали суспензию в течение 30 минут при комнатной температуре. Продукт отфильтровывали и получили 1,8 г бесцветного твердого вещества, т.пл. 188-190°С. Масс-спектр (ЭР): 393 (М+Н)+.
г) 4-Бром-2-метансульфонилбензиламин
1,8 г 2-(4-бром-2-метансульфонилбензил)-изоиндол-1, 3-диона и 1,5 мл гидразингидрата в 30 мл EtOH сначала перемешивали при 60°С 1 ч, а затем кипятили 4 ч с обратным холодильником. Охлаждали, отфильтровывали осадок, и летучие компоненты фильтрата удаляли в вакууме. Остаток помещали в 100 мл СН2Сl2 и снова отфильтровывали твердые компоненты. Растворитель удаляли из фильтрата в вакууме и получили 1,3 г бледно-желтого масла.
rf (ЭА/МеОН 10:1)=0,10. Масс-спектр (ДХИ): 264 (М+Н)+.
д) (4-Бром-2-метансульфонилбензил)-[5-фтор-2-(2-метоксиэтокси)-бензил]-амин
1,3 г 4-бром-2-метансульфонилбензиламина и 1,4 мл триэтиламина растворяли в 20 мл ТГФ (безводного) и при 0°С прибавляли по каплям раствор 1,3 г 2-бромметил-4-фтор-1-(2-метоксиэтокси)-бензола в 5 мл ТГФ (безводного). Перемешивали 60 ч при комнатной температуре, затем разбавляли 200 мл ЭА и 2 раза промывали по 100 мл насыщенного водного раствора Nа2СО3. Сушили над МgSO4 и растворитель удаляли в вакууме. Хроматографией на силикагеле с ЭА получено 910 мг бесцветного масла.
Rf (ЭА)=0,43. Масс-спектр (ЭР): 446 (М+Н)+.
Дальнейшие превращения производили аналогично Примерам 558 е)-к)
е) 4’-{[Бензил-(тиофен-2-сульфонил)амино]-метил}-3’-(2-метокси)этоксибифенил-2-сульфонилцианамид
Rf (ЭА/МеОН 10:1)=0,33. ИК-спектр (CN): 2174,3 см-1.
Масс-спектр (ЭР): 694 (М+Н)+.
Остаточная активность NCBE при 10 мкМ: 12%.
Целевое соединение Примера 560 синтезировано аналогично Примеру 558.
Пример 560
4’-{[Бензил-2-(тиофен-2-ил)ацетиламино]-метил}-3’-(2-метокси)этоксибифенил-2-сульфонилцианамид
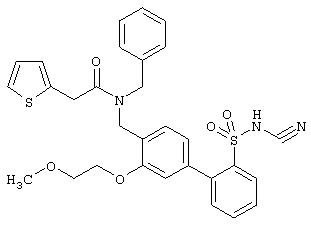
Rf (ЭА/МеОН 5:1)=0,36. ИК-спектр (CN): 2175,0 см-1.
Масс-спектр (ЭР): 579 (М+Н)+.
Т.пл. 95°С (с разложением). Остаточная активность NCBE при 10 мкМ: 8,0%.
Пример 561
4’-{[Бензил-2-(2-метилфенил)ацетиламино]-метил}-бифенил-2-сульфонилцианамид

а) (Диметиламино)метиленамид 4’-(бензиламинометил)-бифенил-2-сульфоновой кислоты
4,4 мл бензиламина растворяли в 90 мл ТГФ (безводного) и при 0°С порциями прибавляли 7,6 г 4’-(бромметил)-N-[(диметиламино)метилен]-(1,1'-бифенил)-2-сульфонамида (J. Med. Chem. 1995, 38, 2357). Перемешивали 24 ч при комнатной температуре, затем разбавляли 500 мл ЭА и 2 раза промывали по 200 мл насыщенного водного раствора Na2CO3. Сушили над Na2SO4, и растворитель удаляли в вакууме. Хроматографией на силикагеле с ЭА/МеОН 10:1 получено 3,8 г бесцветного масла.
Rf (ЭА/МеОН 10:1)=0,25. Масс-спектр (ББА): 408 (М+Н)+.
б) о-Толилацетилхлорид
4,8 г о-толил-уксусной кислоты растворяли в 36 мл SOCl2и кипятили 12 ч с обратным холодильником. Летучие компоненты затем удаляли в вакууме, и остаток после этого 3 раза вносили в 50 мл толуола и удаляли летучие компоненты в вакууме. Получили 6,6 г бледно-желтой жидкости, которую использовали далее без очистки.
в) (Диметиламино)метиленамид 4’-{[бензил-2-(2-метилфенил)ацетиламино]-метил}-бифенил-2-сульфоновой кислоты
408 мг (диметиламино)метиленамида 4’-(бензиламинометил)-бифенил-2-сульфоновой кислоты растворяли в 9 мл CH2Cl2 (безводного) и при комнатной температуре добавляли сначала 162 мкл пиридина, затем 220 мг о-толилацетилхлорида. Перемешивали 24 ч при комнатной температуре, разбавляли 100 мл CH2Cl2 и 3 раза промывали по 50 мл насыщенного водного раствора Nа2СО3. Сушили над Na2SO4, и растворитель удаляли в вакууме. Хроматографией на силикагеле с ЭА/ГП 2:1 получено 330 мг бесцветного масла.
Rf (ЭА/ГП 2:1)=0,52. Масс-спектр (ББА): 540 (М+Н)+.
г) 4’-{[Бензил-2-(2-метилфенил)ацетиламино]-метил}-бифенил-2-сульфонамид
320 мг (диметиламино)метиленамида 4’-{[бензил-2-(2-метилфенил)ацетиламино]-метил}-бифенил-2-сульфоновой кислоты растворяли в 6 мл МеОН и при комнатной температуре прибавляли 3 мл насыщенного водного раствора НСl. Кипятили 8 ч с обратным холодильником, и после охлаждения устанавливали при помощи 6 н. водного раствора NaOH pH=5-6. Разбавляли 70 мл воды и 3 раза экстрагировали по 70 мл ЭА. Сушили над Na2SO4, и растворитель удаляли в вакууме. Получили 300 мг бесцветного масла.
Rf (ЭА)=0,68. Масс-спектр (ЭР): 485 (М+Н)+.
д) 4’-{[Бензил-2-(2-метилфенил)ацетиламино]-метил}-бифенил-2-сульфонилцианамид
280 мг 4’-{[бензил-2-(2-метилфенил)ацетиламино]-метил}-бифенил-2-сульфонамида и 245 мг К2СО3 растворяли в 6 мл ацетонитрила (безводного) и при комнатной температуре вводили шприцем 116 мкл 5 н. раствора BrCN в ацетонитриле. Кипятили 2 ч с обратным холодильником и после охлаждения всю реакционную смесь хроматографировали на силикагеле с ЭА/МеОН 10:1. Получили 130 мг бесцветного твердого вещества, т.пл. 108°С (с разложением).
Rf (ЭА/МеОН 10:1)=0,27. ИК-спектр (CN): 2177,0 см-1.
Масс-спектр (ББА): 532 (M+Na)+.
Остаточная активность NCBE при 10 мкМ: 16%.
Целевые соединения Примеров с 562 по 568 синтезированы аналогично Примеру 561.
Пример 562
4’-{[Бензил-2-(2-трифторметилфенил)ацетиламино]-метил}-бифенил-2-сульфонилцианамид

Rf (ЭА/МеОН 10:1)=0,30. ИК-спектр (CN): 2178,0 см-1.
Масс-спектр (ББА): 586 (М+Nа)+.
Т.пл. 90°С (с разложением). Остаточная активность NCBE при 10 мкМ: 33%.
Пример 563
4’-{[Бензил-2-(2-трифторметоксифенил)ацетиламино]-метил}-бифенил-2-сульфонилцианамид

rf (ЭА/МеОН 10:1)=0,26. ИК-спектр (CN): 2177,0 см-1.
Масс-спектр (ЭР): 580 (М+Н)+.
Т.пл. 125°С (с разложением). Остаточная активность NCBE при 10 мкМ: 46%.
Пример 564
4’-{[Бензил-2-(2-трифторметилтиофенил)ацетиламино]метил}-бифенил-2-сульфонилцианамид
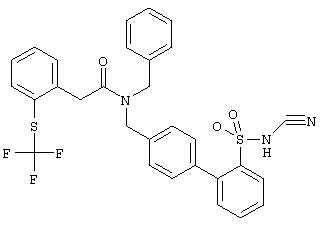
Rf (ЭА/МеОН 10:1)=0,27. ИК-спектр (CN): 2176,0 см-1.
Масс-спектр (ЭР): 596 (М+Н)+.
Т.пл. 122°С (с разложением). Остаточная активность NCBE при 10 мкМ: 23%.
Пример 565
4’-{[Бензил-2-метилбензоиламино]-метил}-бифенил-2-сульфонилцианамид

Rf (ЭА/МеОН 10:1)=0,22. ИК-спектр (CN): 2174,0 см-1
Масс-спектр (ЭР): 496 (М+Н)+.
Т.пл. 173°С (с разложением). Остаточная активность NCBE при 10 мкМ: 42%.
Пример 566
4’-{[Бензил-2-трифторметилбензоиламино]-метил}-бифенил-2-сульфонилцианамид
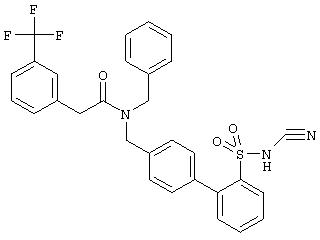
Rf (ЭА/МеОН 10:1)=0,20. ИК-спектр (CN): 2176,0 см-1.
Масс-спектр (ЭР): 550 (М+Н)+.
Т.пл. 165°С (с разложением). Остаточная активность NCBE при 10 мкМ: 72%.
Пример 567
4’-{[Бензил-2-трифторметоксибензоиламино]-метил}-бифенил-2-сульфонилцианамид

rf (ЭА/МеОН 10:1)=0,22. ИК-спектр (CN): 2176,0 см-1.
Масс-спектр (ЭР): 566 (M+H)+.
Т.пл. 160°С (с разложением). Остаточная активность NCBE при
10 мкМ: 69%.
Пример 568
4’-{[Бензил-(5-метилтиофен-2-ил)карбониламино]-метил}-бифенил-2-сульфонилцианамид
Rf (ЭА/МеОН 10:1)=0,16. ИК-спектр (CN): 2175,0 см-1.
Масс-спектр (ББА): 524 (M+Na)+.
Т.пл. 166°С (с разложением). Остаточная активность NCBE при 10 мкМ: 70%.
Фармакологические данные
Ингибирование Nа+-зависимого Сl-/НСО
Эндотелиальные клетки человека (ECV-304) из культурального сосуда растворяли с помощью буфера трипсин/этилендиаминтетрауксусная кислота (0,05/0,02% в фосфатном буфере) и после центрифугирования (100 г, 5 мин) помещали в буферный солевой раствор (ммоль/л: 115 NaCl, 20 NH4Cl, 5 КСl, 1 CaCl2, 1 MgSO4, 20 N- (2-гидроксиэтил) пиперазин-N'-2-этансульфоновой кислоты (HEPES), 5 глюкозы и 1 г/л альбумина сыворотки крови крупного рогатого скота; рН 7,4). Эту клеточную суспензию инкубировали 5 мкМ ацетоксиметилового эфира БКЭКФЦ 20 мин при 37°С. Затем клетки промывали и ресуспендировали в буферном растворе, не содержащем натрия и бикарбоната (ммоль/л: 5 HEPES, 133,8 хлорида холина, 4,7 КСl, 1,25 MgCl2, 0,97 K2HPO4, 0,23 KH2PO4, 5 глюкозы; рН 7,4).
Для последующего измерения флуоресценции в FLIPR (Fluorescent Imaging Plate Reader) в каждую лунку 96-луночного микропланшета помещали пипеткой по 100 мкл этой клеточной суспензии с 20000 клеток в каждой порции и центрифугировали этот микропланшет (100 г, 5 мин). В FLIPR отбирали из далее приготовленных микропланшетов по 100 мкл буферного раствора и вносили пипеткой в каждую из 96 лунок. При этом для 100%-ного контроля, то есть восстановления внутриклеточного рН (pHi) сверх NCBE, использовали буферный раствор, содержащий бикарбонат и натрий (ммоль/л: 5 HEPES, 93, 8 NaCl, 40 NаНСО3, 4,7 КСl, 1,25 CaCl2, 1,25 MgCl2, 0,97 Na2HPO4, 0,23 NaH2PO4, 5 глюкозы; рН 7,4), который содержал 50 мкМ НОЕ 642. Для 0%-ного контроля, то есть отсутствие восстановления pHi, прибавляли буферный раствор, не содержащий бикарбоната и содержащий натрий (ммоль/л: 5 HEPES, 133,8 NaCl, 4,7 КСl, 1,25 CaCl2, 1, 25 MgCl2, 0,97 Na2HPO4, 0,23 NaH2PO4, 5 глюкозы; рН 7,4), к которому также было прибавлено 50 мкМ НОЕ 642. Предлагаемые согласно изобретению соединения прибавляли в различных концентрациях к раствору, содержащему натрий и бикарбонат. После прибавления буферных растворов к находящимся в микропланшетах окрашенным подкисленным клеткам определяли возрастание интенсивности флуоресценции, которое соответствовало увеличению pHi, в каждом микропланшете. Измерения производились каждые 2 минуты при 35°С.
Увеличение интенсивности флуоресценции для различных концентраций соединений согласно изобретению было соотнесено с обоими контрольными опытами, и таким образом установлена ингибирующая активность веществ.
Реферат
Изобретение относится к новым бифенилсульфонилцианамидам формулы (I),
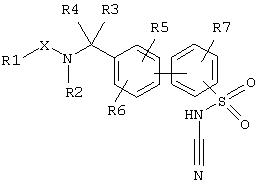
где:
R(1) означает
1) С1-С8алкил,
4) -CnH2n-nn-Y,
nn=0 или 2 и
n=0-4; примем n не равно 0 или 1, если nn равно 2;
5) CnH2n-nn-Y,
nn=0 или 2 и
n=1-4; причем n не равно 1, если nn равно 2;
причем 1 атом водорода в двухвалентном остатке CnH2n-nnзамещен аминогруппой или NR(22)R(23),
R(2)
2) С1-С8алкил,
4) С2-С12алкенил,
5) С2-С8алкинил,
6) -CnH2n-nn-Z,
nn=0 или 2 и
n=0-4; причем n не равно нулю
или 1, если nn равно 2;
7) -CnH2n-nn -Z,
nn=0 или 2 и
n=1-4; причем n не равно 1, если nn
равно 2;
причем 1 атом водорода в двухвалентном остатке CnH2n-nnзамещен остатком из ряда
1) фенил,
3) NR(22)R(23),
5) COOR(16);
R(3) и R(4) водород;
R(5), R(6) и R(7) независимо друг от друга означают H, C1-C8 алкил; SO2-C1-C4алкил, F, Cl, Br, J, OR(10),
где R(10) означает H, C1-C4 алкил при необходимости замещенный метокси или этоксигруппой;
R(9) - означает OR(13),
R(13) означает H, С1-С8,
Х означает карбонил, -CO-СО- или сульфонил;
Y и Z независимо друг от друга означают
1) фенил, 1-нафтил, 2-нафтил,
2) один из остатков, определенных в п.1, замещенный 1-5, одинаковыми или различными остатками из ряда фенила,
F, Cl, Br, J, CF3, SOqR(18), OR(16), NR(19)R(20), -CN, NO2, COR(9); или два остатка образуют метилендиоксигруппу,
3) фурил, тиенил, пиридил, бензимидазолил, индолил, бензотиофенил, дигидрохиназолинил,
5) С3-С10циклоалкил предпочтительно циклопропил, циклопентил, циклогексил, инданил,
6) один из остатков, определенных в п.5, замещенный фенилом;
R(16) означает 1, водород,
2) С1-С4алкил,
3) С1-С4алкил, замещенный С1-С4алкокси;
R(19) и R(20) независимо означают
Н, С1-С4алкил;
R(22) и R(23) означают независимо друг от друга
Н или CO-OR(24);
R(24) означает –CnH2n-фенил с n=1-4;
q означает 2,
а также их физиологически приемлемые соли.
Соединения 1 ингибируют натрий- зависимый хлорид/бикарбонатный обмен ″NCBE″. 3 з.п. ф-лы, 2 табл.
Формула
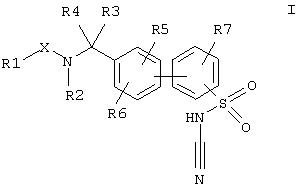
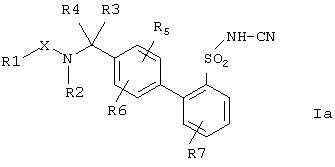

Комментарии