Замещенные основанием бензоилгуанидины, способ их получения, фармацевтический состав, способ его получения и способ ингибирования клеточного na+/h+-антипортера - RU2161604C2
Код документа: RU2161604C2
Чертежи



Описание
Изобретение
касается бензоилгуанидинов формулы I
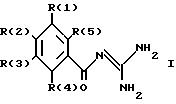
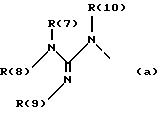
в которой обозначают:
один из трех заместителей R(1), R(2) и R(3) означает R(6)-A-B-D;
R(6) - основной протонируемый остаток, т.е. аминогруппу -NR(7)R(8), амидиногруппу R(7)R(8)N-C[=N-R(9)] или гуанидиногруппу
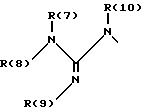
где R(7), R(8), R(9) и R(10) независимо друг от друга означают водород или алкил с 1, 2, 3 или 4 C-атомами;
или R(7) и R(8) вместе означают CaH2a;
"a" означает 4, 5, 6 или 7;
причем в случае если a = 5, 6 или 7, одна метиленовая группа группы Ca H2a может быть заменена гетероатомной группой O, или NR(11),
или R(8) и R(9) или R(9) и R(10) или R(7) и R(10) означают группу CaH2a;
"а" означает 2, 3, 4 или 5;
причем в случае если a = 3, 4 или 5, одна метиленовая группа группы CaH2a может быть заменена гетероатомной группой O или NR(11);
R(11) означает водород или метил;
или R(6) означает имидазолил, дигидроимидазолил, бензимидазолил, пиридил, хинолил, пирролидинил или фенил, в случае необходимости, замещенные (C1-C4 )-алкилом,
А означает CbH2b;
"b" означает 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10;
причем в группе CbH2b одна или две метиленовые группы могут быть заменены одной из группировок, выбранных из группы, состоящей из -SOm-, NR(20), -NR(20)-CO-,
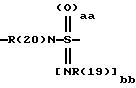
и -SOaa[NR(19)]bb;
"aa" означает 1 или 2;
"bb" означает 0 или 1;
aa + bb = 2;
R(19) означает водород или алкил с 1, 2, 3 или 4 C-атомами;
R(20) означает водород или метил;
В означает фениленовый остаток, в которой обозначают:
один из трех заместителей R(1), R(2) и R(3) означает R(6)-A-B-D;
R(6) - основной протонируемый остаток, т.е. аминогруппу -NR(7)R(8), амидиногруппу R(7)R(8)N-C[=N-R(9)] или гуанидиногруппу
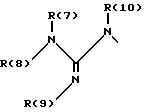
где R(7), R(8), R(9) и R(10) независимо друг от друга означают водород или алкил с 1, 2, 3 или 4 C-атомами;
или R(7) и R8) вместе означают CaH2a;
"a" означает 4, 5, 6 или 7;
причем в случае если a = 5, 6 или 7, одна метиленовая группа группы CaH2a может быть заменена гетероатомной группой O, или NR(11),
или R(8) и R(9) или R(9) и R(10) или R(7) и R(10) означают группу CaH2a;
"a" означает 2, 3, 4 или 5;
причем в случае если a = 3, 4 или 5, одна метиленовая группа группы CaH2a может быть заменена гетероатомной группой O или NR(11);
R(11) означает водород или метил;
или R(6) означает имидазолил, дигидроимидазолил, бензимидазолил, пиридил, хинолил, пирролидинил или фенил, в случае необходимости, замещенные (C1-C4)-алкилом,
A означает CbH2b;
"b" означает 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10;
причем в группе CbH2b одна или две метиленовые группы могут быть заменены одной из группировок, выбранных из группы, состоящей из -SOm-, -NR(20), -NR(20)-CO-,
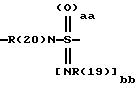
и -SOaa[NR(19)]bb]-;
"aa" означает 1 или 2;
"bb" означает 0 или 1;
aa + bb = 2;
R(19) означает водород или алкил с 1, 2, 3 или 4 C-атомами;
R(20) означает водород или метил;
B означает фениленовый остаток
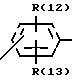
R(12) и R(13) независимо друг от друга означают водород,
D означает
-CdH2d-Xf-;
"d" означает нуль,
X означает -O-,
"f" означает 1;
и каждый другой заместитель R(1), R(2) и R(3) независимо один от другого означают водород, F, Cl, Br, I, -(C1-C8)-алкил, или R(17)-CgH2g -SO2-;
"g" означает нуль, 1, 2, 3 или 4;
R(17) означает водород или CkF2k+1-;
"k" означает 1, 2 или 3;
R(4) и R(5) означают водород,
а также их фармакологически переносимые соли.
Предпочтительно соединение, выбранное из группы, состоящей из следующих соединений:
4-[4-N-(диметиламиноэтил)-метилсульфамоил] фенокси-3- трифторметилбензоилгуанидин, дигидрохлорид;
4-[4-(метилпиперазиносульфонил)фенокси] -3- трифторметилбензоилгуанидин, дигидрохлорид;
4-[4-(2-пиролидинэтиламиносульфонил)фенокси] -3- трифторметилбензоилгуанидин, дималеинат;
4-[4-(2-пиперидинэтиламиносульфонил)фенокси] -3- трифторметилбензоилгуанидин, дималеат;
4-[4-(N-диметиламино-н-пропил)сульфамоил] фенокси-3- трифторметилбензоилгуанидин;
4-[4-(N-диметиламиноэтил)сульфамоил] фенокси-3- трифторметилбензоилгуанидин;
4-(4-имидамидосульфонил)фенокси-3-трифторметил-бензоилгуанидин;
3-трифторметил-4-(4-N-метилимидамидосульфонил)фенокси- бензоилгуанидин;
3-метил-4-(4-(1-метилпиперазин-4-илсульфонил)-бензоилгуанидин;
4-(4-гуанидиносульфонил)фенокси-3-трифторметил-бензоилгуанидин;
4-[4-(2-имидазолилтио-ацетил)фенокси]
-3- метилсульфонилбензоилгуанидин, дигидрохлорид;
4-[4-(N, N'-димeтил-S-изoтиуpoнил-aцeтил)фeнoкcи] 3- мeтилсульфонилбензоилгуанидин, дигидрохлорид;
4-[4-(2-бензамидазолилтио-ацетил)фенокси] -3- метилсульфонилбензоилгуанидин, дигидрохлорид;
4-[4-(2-N-имидазолил-1-гидроксиэтил)фенокси] -3- метилсульфонилбензоилгуанидин, дигидрохлорид;
4-[4-(N, N-диметилглициламино)фенокси]-3- метилсульфонилбензоилгуанидин, дигидрохлорид;
4-[4-(N, N -диэтиламиноэтил)аминосульфонилфенокси] -3- метилсульфонилбензоилгуанидин,
дигидрохлорид,
4-[4-(4-имидазолилэтил)аминосульфонил-фенокс] -3- метилсульфонилбензоилгуанидин, дигидрохлорид;
4-[4-(3-N-имидазолил-1-пропил)аминосульфонил]
-3- метилсульфонилбензоилгуанидин, дигидрохлорид;
4-[4-(1-метил-2-пирролидинилэтил)аминосульфонил-фенокси]-3- метилсульфонилбензоилгуанидин, дигидрохлорид;
4-[4-(N-пиперидиноэтил)аминосульфонил-фенокси] -3- метилсульфонилбензоилгуанидин, дигидрохлорид;
4-[4-(2-диметиламиноэтил)сульфонилметил-фенокси] -3- метилсульфонилбензоилгуанидин,
дигидрохлорид;
4-[4-(2-диметиламиноэтил)сульфонилметил-фенокси] -3- трифторметилбензоилгуанидин, дигидрохлорид.
Названные алкильные остатки могут быть как линейными, так и разветвленными.
Под основной гетероароматической кольцевой системой с 1-9 C-атомами понимаются, в частности, остатки, которые происходят от циклопентила, фенила или нафтила, в которых одна или несколько CH-групп замещены на N. В качестве гетероарила рассматриваются, в частности, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридил, хинолил, изохинолил. Галоген обозначает F, Cl, Br или I.
Если соединения формулы I содержат асимметрические центры, то формула I описывает как отдельные оптические антиподы, так и смеси их возможных энантиомеров.
Изобретение касается далее способа получения соединения 1, отличающегося тем, что соединение формулы II
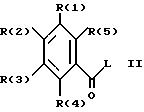
в которой R(1)-R(5) имеют указанное значение, а L обозначает легко нуклеофильно замещаемую отходящую группу, подвергают взаимодействию с гуанидином и что при желании полученное соединение переводят в фармакологически переносимую соль.
Активированные кислотные производные формулы II, в которой L, обозначает алкокси, преимущественно метоксигруппу, феноксигруппу, фенилтио, метилтио, 3-пиридилокси, 2-пиридилтиогруппу, азотный гетероцикл, преимущественно 1-имидазолил, целесообразно получают известным образом из лежащих в основе хлорангидридов карбоновых кислот (формула II, L = Cl), которые в свою очередь опять-таки известным образом можно получать из лежащих в основе карбоновых кислот (формула II, L = OH).
Наряду с хлорангидридами карбоновых кислот формулы II (L = Cl) исходные производные бензойной кислоты (формула II, L = OH) также могут быть использованы для непосредственного получения известным образом других активированных производных бензойной кислоты (формула II, L = OH), например метиловых эфиров формулы II с L = OCH3 обработкой газообразным HCl в метаноле, имидазолидов формулы II обработкой карбонилдиимидазолом (L = 1-имидазолил, staab, Angew. Chem. Int. Ed. Engl. 1, 351-367 (1962)), смешанных ангидридов обработкой ClCOOC2H5 или тозилхлоридом в присутствии триэтиламина в инертном растворителе, как и активирование бензойных кислот дициклогексилкарбодиимидом (DCC) или O /(циано(этоксикарбонил) метилен)амино/-1,1,3,3-тетраметилурония тетрафторборатом ("TOTU") /Proceedings of the 21 European Peptide Symposium Peptides 1990, Editors E. Yiralt and D. Andreu, Escom, Zeiden, 1991/.
Ряд подходящих методов получения активированных производных карбоновых кислот формулы II указан в списке литературных источников в J. March, Advanced Organis Chemistry, Third Edition (John Wiley & Sons, 1985), s. 350.
Взаимодействие активированного производного карбоновой кислоты формулы I с гуанидином осуществляют известным образом в протонном или апротонном полярном, но инертном органическом растворителе. При этом метанол, изопропанол или тетрагидрофуран при взаимодействии эфиров бензойной кислоты (II, L = OMe) с гуанидином оказались пригодными при температурах от 20oC до температуры кипения этих растворителей. Большей частью взаимодействие соединений II со свободным от соли гуанидином проводили целесообразно в апротонных инертных растворителях, как например тетрагидрофуран, диметоксиэтан, диоксан или изопропанол. Но и воду можно применять при использовании основания, например NaOH, в качестве растворителя при взаимодействии II и III.
Когда L = Cl, то целесообразно работать с добавкой кислотоуловителя, например в форме избыточного гуанидина для связывания галогенводородной кислоты.
Лежащие в основе производные
бензойной кислоты частично известны. По литературным данным их получают переводя готовый остаток R(6)-A-B-CdH2d-Xf- или предварительную его ступень обменом галогена в
производное бензойной кислоты формулы III
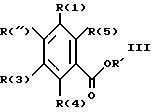
в которой заместитель R' имеет значение низшего алкильного остатка, как например метил или этил, а R'' обозначает галоген. Реакции описаны в литературе, например как нуклеофильные заместительные реакции, как радикально протекающая реакция Ульмана или реакции, катализируемые палладием.
Введение производных бензолсульфонамида, замещенных в фенильной части серным, кислородным или азотным нуклеофилами, удается согласно известным из литературы методам нуклеофильного замещения на ароматических соединениях. В качестве удаляемой группы у производного бензойной кислоты хорошо зарекомендовали себя при этом замещении галогениды и трифторметансульфонаты. Успешно применяют диполярно апротонный растворитель, как например диметилформамид (DMF) и тетраметилмочевину (TMU), при температуре от 0oC до точки кипения растворителя, предпочтительно от 80oC до точки кипения растворителя. В качестве кислотоуловителя очень полезной оказывается щелочная или щелочно-земельная соль с анионом высокой основности и незначительной неклеофильности, например K2CO3 или Cs2CO3.
Применяемые в качестве предварительных ступеней соединения R(6)-A-B-CdH2d-Xf - большей частью известны и отчасти также имеются в продаже в виде реагентов. Их получают методами, описанными в литературе, которые известны специалисту.
Введение некоторых заместителей в 4- и 5-положении удается известными из литературы методами опосредованного палладием перекрестного сопряжения арилгалогенидов, например с органостаннанами, борорганическими кислотами или органоборанами или медь- или цинкорганическими соединениями.
Бензоилгуанидины I в общем представляют собой слабые основания и могут связывать кислоты с образованием солей. В качестве кислотных солей присоединения годятся соли всех фармакологически переносимых кислот, например галогениды, в частности гидрохлориды, лактаты, сульфаты, цитраты, тартраты; аскорбаты, ацетаты, фосфаты, метилсульфонаты, п-толуолсульфонаты.
Соединения I являются замещенными ацилгуанидинами.
Наиболее важным представителем ацилгуанидинов является производное пиразина Амилорид, находящий применение в терапии в качестве калийсберегающего диуретика. В литературе описаны другие многочисленные соединения типа Амилорида, как например диметиламилорид или этилизопропиламилорид.
Амилорид: R', R''=H.
Диметиламилорид: R', R''=CH3.
Этилизопропиламилорид: R'=C2H5, R''=CH(CH3)2.
Кроме того, стали известны исследования, указывающие на антиаритмические свойства амилорида (Circulation 79, 1257-1263 (1989)). Широкому применению в качестве антиаритмического средства препятствует, однако, то, что этот эффект выражен лишь слабо и сопровождается понижающим кровяное давление и салюретическим действием, а эти побочные эффекты при лечении нарушений сердечного ритма нежелательны.
Указания на антиаритмические свойства амилорида были получены также в экспериментах на изолированных сердцах животных (bur. Heart J. 9 (suppl. 1): 167 (1988) (book of abstracts)). Так, было найдено, например, в экспериментах с крысиными сердцами, что искусственно вызванное мерцание желудочка полностью подавлялось амилоридом. Еще более сильнодействующим в этой модели было вышеупомянутое производное амилорида - этилизопропиламилорид.
В патенте США 5091394 (HOE 89/F 288) описаны бензоилгуанидины, которые в положении, соответствующем остатку R(1), несут лишь атом водорода и в которых ни один из заместителей не имеет значения R(5)-A-B-D-. В европейской выложенной заявке 0556674 A (HOE 92/F 034) предлагаются 3,5-замещенные бензоилгуанидины, в которых, однако, заместитель R(2) не имеет значения R(5)-A-B-D-, заявляемого согласно настоящему изобретению.
В патенте США 3780027 заявлены ацилгуанидины, структурно схожие с соединениями формулы I и происходящие от имеющихся в продаже петлевых диуретиков, как например буметанид. Соответственно сообщается о сильном салидиуретическом действии этих соединений.
Поэтому было неожиданно, что соединения согласно изобретению не имеют никаких нежелательных и неблагоприятных, салидиуретических свойств, но зато имеют очень хорошие антиаритмические свойства против таких аритмий, какие наблюдаются, например, при явлениях кислородной недостаточности. Соединения благодаря их фармакологическим свойствам прекрасно годятся в качестве антиаритмических средств с кардиопротективной компонентой для профилактики инфаркта и лечения инфаркта, а также для лечения грудной жабы, причем они также превентивно тормозят или сильно уменьшают патофизиологические процессы при возникновении вызванных ишемией поражений, в частности вызванных ишемией аритмий сердца. Благодаря их защитным действиям против патологических гипоксических и ишемических ситуаций соединения согласно изобретению формулы I вследствие торможения клеточного Na+/H+-обменного механизма могут применяться в качестве лекарственных средств для лечения всех острых или хронических вызываемых ишемией поражений или вызванных ими первичных или вторичных болезней. Это касается их применения в качестве лекарственных средств для оперативного вмешательства, например при трансплантациях органов, причем соединения могут применяться как для защиты органов у донора до и во время изъятия, для защиты изъятых органов, например при лечении физиологическими жидкими ваннами или при хранении органов в таких жидкостях, а также при пересадке в организм пациента. Соединения также представляют собой ценные, оказывающие защитное действие лекарственные средства при проведении ангиопластических оперативных вмешательств, например на сердце, как и на периферийных сосудах. Соответственно их защитному действию против вызываемых ишемией повреждений, соединения пригодны также и как лекарственные средства для лечения ишемий нервной системы, в частности центральной нервной системы, причем они пригодны, например для лечения апоплексического удара или отека мозга. Помимо этого, заявленные соединения формулы I также подходят для лечения форм шока, таких как например аллергический, кардиогенный, гиповолемический и бактериальный шок.
Кроме того, соединения формулы I согласно изобретению характеризуются сильным ингибирующим действием на пролиферацию клеток, например пролиферацию фибробластовых клеток и пролиферации клеток гладких мускулов сосудов. Поэтому соединения формулы I могут применяться как ценные терапевтические средства для болезней, при которых пролиферация клеток представляет собой первичную или вторичную причину, и поэтому они могут применяться в качестве антиатеросклеротического средства, средства против поздних осложнений при диабете, раковых заболеваний, фиброзных заболеваний, как например фиброз легких, фиброз печени или фиброз почек, гипертрофии и гиперплазии органов, в частности при гиперплазии или гипертрофии простаты.
Соединения согласно изобретению являются ценными ингибиторами клеточного натрий-протонного антипортера (Na+/H+ -обменника), который при многочисленных заболеваниях (эссенциальная гипертония, атеросклероз, диабет и т.д.) повышен также и в таких клетках, которые легко доступны для измерений, как например в эритроцитах, тромбоцитах или лейкоцитах. Соединения согласно изобретению поэтому пригодны в качестве прекрасных и простых научных инструментов, например в их применении в качестве диагностиков, для определения и различения определенных форм гипертонии, но также и атеросклероза, диабета, пролиферативных заболеваний и т.д. Кроме того, соединения формулы I являются подходящим средством для предупредительной терапии с целью предупреждения развития высокого кровяного давления, например эссенциальной гипертонии.
Наряду с очень сильным тормозящим действием Na+ /H+-обменник соединения согласно изобретению обладают значительно улучшенной водорастворимостью в сравнении с известными соединениями. Поэтому они существенно лучше годятся для внутривенных применений.
Лекарственные средства, содержащие соединение I, могут при этом применяться орально, парентерально, внутривенно, ректально или посредством ингаляции, причем предпочтительное применение зависит от соответствующей картины проявления заболевания. Соединения I могут при этом применяться как таковые или вместе с вспомогательными веществами, обычно применяемыми при приготовлении лекарств, а именно как в ветеринарии, так и в медицине.
Какие вспомогательные вещества годятся для желательной лекарственной композиции, известно специалисту на основе его специальных знаний. Наряду с растворителями, гелеобразователями, основами суппозиториев, вспомогательными средствами в таблетках и другими носителями активного начала, могут применяться, например, противоокислители, диспергаторы, эмульгаторы, противопенные средства, вкусовые корректирующие добавки, консерванты, агенты растворения или красители.
Для оральной формы применения активные соединения смешивают с подходящими для этого добавками, как например носителями, стабилизаторами или инертными разбавителями и с помощью обычных методов переводят в подходящие формы применения, как например в таблетки, драже, капсулы, водные, спиртовые или масляные растворы. В качестве инертных носителей могут применяться, например, гуммиарабик, магнезия, карбонат магния, фосфат калия, молочный сахар, глюкоза или крахмал, в частности кукурузный крахмал. При этом приготовление может происходить как в виде сухого, так и влажного гранулята. В качестве масляных носителей или растворителей возможны, например, растительные или животные масла, как например подсолнечное масло или рыбий жир.
Для подкожного или внутривенного применения активные соединения желательно применять в форме раствора, суспензии или эмульсии с обычными для этого веществами, как например агентами растворения, эмульгаторами или другими вспомогательными веществами. В качестве растворителей, например, могут быть приняты в расчет вода, физиологический раствор поваренной соли или спирты, например этанол, пропанол, глицерин, а также растворы сахара, как например глюкозы или растворы маннита, или же смесь из различных названных растворителей.
В качестве фармацевтического состава для дачи в форме аэрозолей и распыляемых растворов годятся, например, растворы, суспензии или эмульсии активного вещества формулы I в фармацевтически безупречном растворителе, в частности этанол или вода, или смеси таких растворителей.
Состав может содержать при необходимости еще и другие фармацевтические вспомогательные вещества, такие как поверхностно-активные вещества, эмульгаторы и стабилизаторы, а также газ-вытеснитель. Такой препарат содержит активное вещество, как правило, в концентрации от ~ 0,1 до 10, в частности от ~ 0,3 до 3 вес.%.
Дозировка и частота дачи активного вещества формулы I зависят от эффективности и времени действия применяемых соединений, кроме того, также от вида и тяжести заболевания, а также от пола, возраста, веса и индивидуальной восприимчивости млекопитающего, которое получает такое лечение.
В среднем ежедневная доза соединения формулы I для пациента весом около 75 кг составляет от по меньшей мере 0,001 мг/кг, предпочтительно 0,01 мг/кг, до максимально 10 мг/кг, предпочтительно 1 мг/кг веса тела. При острых вспышках болезни, примерно после перенесенного инфаркта миокарда, могут потребоваться еще большие и прежде всего более частые дозировки, например до 4 отдельных доз в день. В частности, при внутривенном применении для инфарктного больного в отделении интенсивной терапии возможно придется назначать в день до 200 мг.
Список сокращений:
AIBN - α
,α-азо-бис-изобутиронитрил,
Bn - бензил,
Брайн (Brine) - насыщенный водный раствор NaCl (=рассол),
CH2Cl2 - дихлорметан,
DCI
- десорбционно-химическая ионизация,
DIP - диизопропиловый эфир,
DMA - диметилацетамид,
DME - диметоксиэтан,
DMF - N,N-диметилформамид,
EE - этилацетат
(EtOAC),
EI - электронный удар,
eq - эквивалент,
ES - электроаэрозольная ионизация,
Et - этил,
FAB - бомбардировка быстрыми атомами,
HEP
- н-гептан,
HOAc - уксусная кислота,
Me - метил,
MeOH - метанол,
MTB - метилтрет-бутиловый эфир,
NBS - N-бромсукцинимид,
NMP - N-метилпирролидон,
THF - тетрагидрофуран,
TMU - N,N,N,N-тетраметилмочевина,
ZNS - центральная нервная система.
Экспериментальная часть
Общая методика получения
бензоил-гуанидинов (I)
Вариант A: из бензойных кислот (H, L = OH)
0,01 М производного бензойной кислоты формулы II растворяют или, соответственно, суспендируют в 60 мл безводного THF
и затем смешивают с 1,78 г (0,011 М) карбонилдиимидазола. После перемешивания в течение 2 часов при комнатной температуре вводят 2,95 г (0,05 М) гуанидина в реакционный раствор. После перемешивания в
течение ночи отгоняют THF под уменьшенным давлением (ротационный испаритель), смешивают с водой, pH устанавливают на величину 6-7 с помощью 2 н. HCl и отфильтровывают соответствующий бензоилгуанидин
(формула I).
Полученные таким образом бензоилгуанидины могут быть переведены обработкой водным, метанольным или эфирным раствором соляной кислоты или других фармакологически переносимых кислот в
соответствующие соли.
Общая методика получения бензоил-гуанидинов (I)
Вариант B: из алкильных эфиров бензойной кислоты (II, L = O-Алкил)
5 ммолей алкилового эфира
бензойной кислоты формулы II, а также 25 ммолей гуанидина (свободное основание) растворяют в 15 мл изопропанола или суспендируют в 15 мл THF и кипятят до полного превращения (тонкослойный контроль) с
обратным холодильником (типичное время реакции 2-5 часов). Растворитель отгоняют при уменьшенном давлении (ротационный испаритель), собирают в 300 мл ЕЕ (этилацетата) и промывают 3 раза в растворе
NaHCO3 (по 50 мл каждый раз). Сушат над Na2SO4, растворитель отгоняют в вакууме и хроматографируют на кизельгеле с подходящим растворителем, например EE/MeOH 5:1
(солеобразование, ср. вариант A).
Пример 1
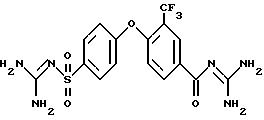
4-(4-Аминосульфонил) фенокси-3-трифторметил-бензоилгуанидин
a) Метиловый эфир 4-фтор-3-трифторметил-бензойной кислоты
5 г 4-фтор-3-фторметил-бензойной кислоты и 9 мл SOCl2 перемешивают в 50 мл MeOH 8 часов при 60oC. Затем удаляют летучие компоненты в вакууме и получают 5,1 г бесцветного
масла, которое без очистки применяют дальше.
Rf(EE/MeOH 10:1) = 0,74.
MS(DCI): 223 (M+H)+.
b) Метиловый эфир
4-(4-аминосульфонил)фенокси-3- трифторметил-бензойной кислоты
890 мг фторида a), 690 мг 4-гидроксибензолсульфонамида и 1,1 г K2CO3 перемешивают в 5 мл DMF 2 часа при
120oC. Дают остыть до комнатной температуры, добавляют 100 мл насыщенного раствора NaCl и экстрагируют три раза этилацетатом (EE) (по 50 мл каждый раз). Сушат над Na2SO4, растворитель удаляют в вакууме. Получают 1,2 г бесцветного масла.
Rf(MTB) = 0,45.
MS (DCI): 376 (M+H)+.
с)
4-(4-Аминосульфонил)фенокси-3-трифторметил-бензоилгуанидин
550 мг метилового эфира 1b) гуанилируют по варианту B. Получают 170 мг аморфного порошка.
Rf (EE/MeOH 10:1) = 0,50.
MS (ES): 403 (M+H)+.
Переводят в гидрохлорид.
T.пл. > 270oC.
Пример 2
4 -/4
-(N-Трет-бутилимидо-N'-трет-бутил)сульфамоил/-3- фторметил-бензоилгуанидин, дигидрохлорид
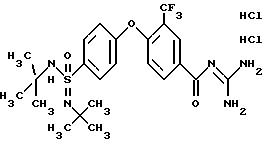
a) N-N'-Бис-трет-бутил-имидамид-4-фторбензолсульфоновой кислоты
900 мл трет-бутиламина смешивают при -30oC с 10,3 мл брома. Дают нагреться до -5oC и добавляют 6,6 мл 4-фтортиофенола. Смесь нагревают до комнатной температуры и затем 4 часа перемешивают при этой температуре. Затем выливают на 600 г льда, добавляют 500 мл этилацетата (EE) и три раза промывают 100 мл (каждый раз) насыщенного водного раствора Na2SO3. Органическую фазу концентрируют в вакууме, снова собирают в 500 мл этилацетата и 3 раза промывают каждый раз 200 мл 0,6 М водного раствора KH2PO4. Затем органическую фазу в течение одного часа перемешивают с 100 мл 2 н. водного раствора HCl и после этого отделяют этилацетатную фазу. pH водной фазы доводят до значения 9 с помощью Na2CO3 и три раза экстрагируют с помощью 200 мл (каждый раз) этилацетата. Сушат над Na2SO4 и удаляют растворитель в вакууме. Получают 6,4 г бесцветного масла.
Rf (DIP) = 0,46.
MS (DCI): 287 (M+H)+.
b) N-N'-Бис-трет-бутил-имидамид
4-гидрокси-бензол-сульфоновой кислоты
2,9 г N-N'-бис-трет-бутил-имидамида 4-фтор-бензолсульфоновой кислоты и 3,4 г CsOH (моногидрат) перемешивают 8 часов в 25 мл тетраметилмочевины (TMU) при
160-170oC. Затем дают остыть до комнатной температуры, смешивают с 100 мл воды и 50 мл насыщенного водного раствора NaHCO3 и экстрагируют три раза с помощью 100 мл (каждый раз)
этилацетата. Сушат над Na2SO4 и удаляют раствор в вакууме. Хроматографируют на кизельгеле с помощью EE/HEP 1:1, получая 700 мг бесцветного масла.
Rf (MTB/IP)1,1) = 0,27.
MS(E1): 285 (M+H)+.
c) Метиловый эфир 4-/4-(N-тpeт-бутилимидo-N'-тpeт-бутил) сульфамоил/фенокси-3-трифторметилбензойной кислоты
600 мг N-N'-бис-трет-бутил/имидамида 4-гидрокси- бензолсульфоновой кислоты, 468 мг метилового эфира 4-фтор-3- трифторметилбензойной кислоты и 2,1 г Cs2CO3 перемешивают в 10 мл
тетраметилмочевины (TMU) в течение 1,5 часа при 160oC. Дают остыть до комнатной температуры, добавляют 100 мл насыщенного водного раствора NaHCO3 и экстрагируют три раза 100 мл
(каждый раз) этилацетата. Сушат над Na2SO4 и удаляют растворитель в вакууме. Хроматографируют на кизельгеле диизопропиловым эфиром (DIP), получая 400 мг бесцветного масла.
Rf(DIP) = 0,28.
MS (ES): 487 (M+H)+.
d) 4-/4-(N-трет-Бутилимидо-N'-трет -бутил)сульфамоил/фенокси-3- трифторметил-бензоилгуанидин
300 мг метилового эфира 4-[4-(N-трет-бутилимидо-N'-трет- бутилсульфамоил]-3- трифторметил-бензойной кислоты и 182 мг гуанидина подвергают взаимодействию в 10 мл изопропанола по общей методике
получения бензоил-гуанидина, вариант B. Получают 120 мг бесцветного масла.
Rf(EE) = 0,24.
MS(FAB): 587 (M+H)+.
Т.пл. (дигидрохлорид)=165-168oC.
Пример 3
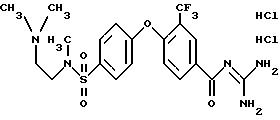
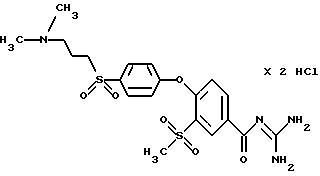
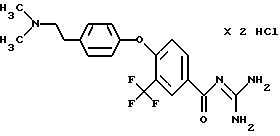
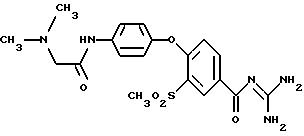
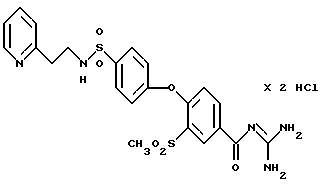
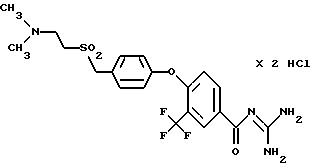
4-/4-N-(Диметиламиноэтил)-метилсульфамоил/фенокси-3- трифторметил-бензоилгуанидин, дигидрохлорид
a) Метиловый эфир 4-фенокси-3 -трифторметил-бензойной кислоты
15 г метилового эфира 4-хлор-3-трифторметил -бензойной кислоты, 5,9 г фенола и 17,4 г K2CO3 перемешивают в 100 мл диметилформамида в течение 14 часов при 110oC. Дают остыть до комнатной температуры, разбавляют одним литром этилацетата, промывают два раза 200 мл (каждый раз) воды, два раза 200 мл (каждый раз) 0,1 н. водного раствора NaOH и два раза 300 мл (каждый раз) насыщенного водного раствора NaCl. Сушат над Na2SO4 и удаляют растворитель в вакууме. Хроматографируют на кизельгеле с помощью EE/HEP 1:8, получая 11 г бесцветного масла.
Rf(EE/HEP 1:8) = 0,24.
MS (DCI): 297 (M+H)+.
b) 4-Фенокси-3-трифторметил-бензойная кислота
11 г метилового эфира
4-фенокси-3-трифторметил-бензойной кислоты растворяют в 200 мл MeOH и смешивают с 41 мл 1 н. водного раствора NaOH и перемешивают 24 часа при комнатной температуре. Затем MeOH удаляют в вакууме,
разбавляют 1 л воды, с помощью водного раствора HCl pH устанавливают на значение 2 и осадок отфильтровывают. Сушат 48 часов на воздухе и получают 9,2 г аморфного твердого вещества.
Rf(EE) = 0,10.
MS(DCI): 283 (M+H)+.
c) 4-(4-Хлорсульфонил)фенокси-3-трифторметил-бензойная кислота
1 г 4-фенокси-3-трифторметил-бензойной
кислоты растворяют в 15 мл CHCl3 и добавляют по каплям 710 мкл хлорсульфоновой кислоты. Перемешивают 3 часа при комнатной температуре и затем удаляют растворитель в вакууме. После этого
добавляют 50 г льда и 50 мл воды, перемешивают 10 минут и осадок отфильтровывают. Получают 0,96 г аморфного твердого вещества.
Rf(DIP 2% HOAc) = 0,38.
MS (EI): 381 (M+H)+.
d) 4-/4-N-(Диметиламиноэтил)-метилсульфамоил-фенокси- 3- трифторметил-бензойная кислота
475 мг 4-(4-хлорсульфонил)фенокси-3-трифторметил-бензойной
кислоты растворяют в 10 мл ацетона и смешивают с 160 мкл триметилэтилендиамина и 350 мкл триэтиламина. Смесь в течение 2 часов перемешивают при комнатной температуре, затем разбавляют 100 мл воды и
ацетон удаляют в вакууме. C помощью 0,1 н. водного раствора HCl устанавливают pH 6-7 и 6 раз экстрагируют 100 мл (каждый раз) этилацетата. Сушат над Na2SO4 и удаляют растворитель
в вакууме. Получают 330 мг аморфного твердого вещества.
Rf(CH2Cl2/MeOH/HOAc/H2O 8:4:1:1) = 0,42.
MS (EI): 447 (M+H)+.
e) Метиловый эфир 4-/4-N-(диметиламиноэтил)-метил- сульфамоил/ фенокси-3-трифторметилбензойной кислоты
330 мг
4-/4-N-(диметиламиноэтил)-метилсульфамоил/фенокси- 3-трифторметилбензойной кислоты и 1 мл SOCl2 нагревают с обратным холодильником в 10 мл MeOH в течение 8 часов. Летучие компоненты смеси
удаляют под вакуумом, собирают в 100 мл насыщенного водного раствора Na2CO3 и 100 мл этилацетата и трижды экстрагируют 100 мл (каждый раз) этилацетата. Сушат над Na2
SO4 и растворитель удаляют в вакууме. Хроматографируют на кизельгеле с помощью EE/MeOH 2:1, получая 150 мг бесцветной смолы.
Rf(EE/MeOH 1:1) = 0,03.
MS(EI): 461 (M+H)+.
f) 4-/4-N-(Диметиламиноэтил)-метилсульфамоил)фенокси- 3-трифторметил-бензоилгуанидин
140 мг метилового эфира
4-/4-N-(диметиламиноэтил)-метил- сульфамоил/ фенокси-3-трифторметил-бензойной кислоты и 90 мг гуанидина подвергают взаимодействию в 3 мл изопропанола по общей методике получения бензоил-гуанидина,
вариант В. Получают 130 мг аморфного твердого вещества.
Rf(EE/MeOH 1:1) = 0,12.
MS(EI): 488 (M+H)+.
Т.пл. (дигидрохлорид) = 203oC.
Соединения, указанные в заглавии примеров 4-8, получали аналогично примеру 3.
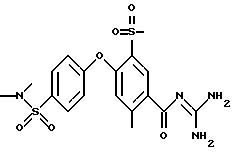
Пример 4
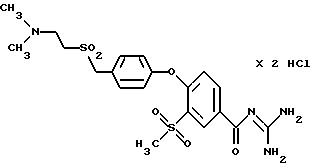
4-/4-(4-Метилпиперазиносульфонил)фенокси-3- трифторметилбензоилгуанидин, дигидрохлорид
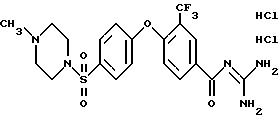
Rf (EE/MeOH 1:1) = 0,15.
MS (EI): 486 (M+H)+.
Т.пл. (дигидрохлорид) > 250oC.
Пример 5
4-/4-(2-Пиролидинэтиламиносульфонил)фенокси/-3- трифторметилбензоилгуанидин, дималеинат
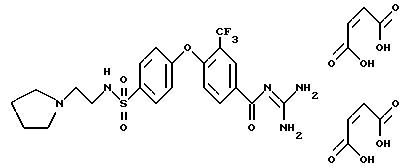
Rf (CH2Cl2/MeOH/HOAc/H2O 8:4:1:1) = 0,37.
MS (FAB): 500 (M+H)+.
Пример 6
4-/4-(2-Пиперидинэтиламиносульфонил)фенокси/-3- трифторметил-бензоилгуанидин, дималеинат
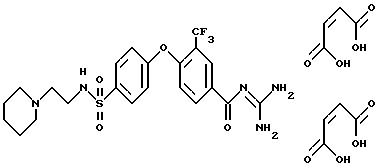
Rf (CH2Cl2/MeOH/HOAc/H2O 8:4:1:1) = 0,40.
MS (FAB): 514 (M+H)+.
Пример 7
4-/4-(N-Димeтилaминo-н-пpoпил)сульфамоил/фенокси-3- трифторметил-бензоилгуанидин
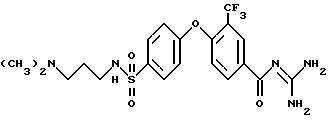
Rf (ЕЕ/MeOH 1:1) =0,06 MS (EI): 488 (M+H)+
Пример 8
4-/4-(N-Диметиламиноэтил)сульфамоил/фенокси-3- трифторметил-бензоилгуанидин.
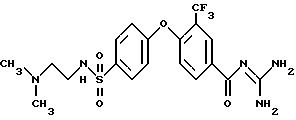
Rf (ЕЕ/MeOH 1:1) = 0,17.
MS (EI): 474 (M+H)+.
Пример 9
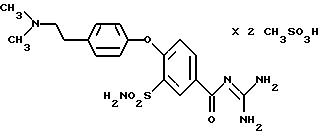
4-(4-Имидамидосульфонил)фенокси-3-трифторметил-бензоилгуанидин
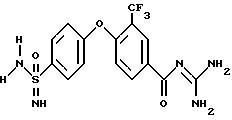
a) 4-/4-(N-трет-Бутилимидо-N'-трет-бутил)cульфaмoил/фeнокси-3- трифторметил-бензойная кислота
7,9 г метилового эфира 4-/4-(N-тpeт-бутилимидo-N'-тpeт-бутил) сульфамоил/фенокси-3-трифторметил-бензойной кислоты (пример 2c) растворяют в 100 мл MeOH и 40 мл 2 н. водного раствора NaOH. Кипятят 3 часа с обратным холодильником, MeOH удаляют в вакууме и остаток собирают смесью из 100 мл воды и 100 мл этилацетата (EE). Сушат над Na2SO4 и растворитель удаляют в вакууме. Получают 7,2 г белых кристаллов.
Rf(MTB) = 0,25.
MS (ES): 473 (M+H)+.
Т.пл. = 200oC.
b) 4-(4-Имидосульфамоил)фенокси-3-трифторметил-бензойная кислота
6,6 г
4-/4-(N-трет-бутилимидо-N'-трет-бутил)сульфамоил/-фенокси-3- трифторметил-бензойной кислоты растворяют в 140 мл безводного CH2Cl2, добавляют 3,7 мл трифторметаносульфоновой
кислоты и перемешивают 24 часа при комнатной температуре. Смесь примешивают в 1 л 0,66 М водного раствора KH2PO4 и трижды экстрагируют 300 мл (каждый раз) этилацетата. Очищенные
органические фазы сушат над Na2SO4 и растворители удаляют в вакууме. Получают 6,7 г вязкого масла, которое применяют без дальнейшей очистки.
Rf (ЕЕ/MeOH 5:1) = 0,21.
MS (ES): 361 (М+Н)+.
с) Метиловый эфир 4-(4-имидосульфамоил)фенокси-3- трифторметил-бензойной кислоты и
d) метиловый эфир
4-(4-N-метил-имидосульфамоил)фенокси-3- трифторметил-бензойной кислоты
6,7 г 4-(4-имидосульфамоил)фенокси-3-трифторметил-бензойной кислоты растворяют в 100 мл MeOH, по каплям прибавляют 20 мл
2 н. раствора триметилсилилдиазометана в HEP и перемешивают 6 часов при комнатной температуре. Затем добавляют 200 мл 20%-ного водного раствора уксусной кислоты и перемешивают еще 30 минут. После
этого добавляют 200 мл этилацетата и 9 раз экстрагируют каждый раз 100 мл 1 н. водного раствора HCl. Водную фазу затем доводят с помощью Na2CO3 до pH 9 и 3 раза экстрагируют
каждый раз 200 мл этилацетата (ЕЕ). Сушат над Na2SO4 и удаляют растворитель в вакууме. Остаток хроматографируют на кизельгеле с помощью ЕЕ/HEP 1:1, получая 1,2 г продукта с)
наряду с 890 мг продукта d), в обоих случаях в виде масла.
с) Rf (ЕЕ) = 0,32. MS (ES): 375 (М+Н)+.
d) Rf (ЕЕ) = 0,38. MS (ES): 389 (М+Н)+.
е) 4- (4-Имидамидосульфонил)фенокси-3 -трифторметил-бензоилгуанидин
220 мг метилового эфира 4-(4-имидосульфамоил)фенокси-3- трифторметил-бензойной кислоты
и 174 мг гуанидина подвергают взаимодействию в 10 мл THF по общей методике получения бензоилгуанидинов, вариант В. Получают после хроматографии на кизельгуре с помощью ЕЕ/MeOH 5:1 80 мг бесцветных
кристаллов.
Rf (ЕЕ/MeOH 5:1) =0,22.
MS (ES): 402 (М+Н)+.
Т.пл. = 156oC.
Пример 10
3-Трифторметил-4-(4-N-метилимидамидосульфонил)фенокси-бензоилгуанидин
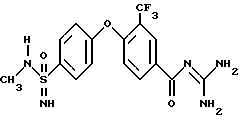
490 мг метилового эфира 4-(4-N-метил-имидосульфамоил)- фенокси-3-трифторметил-бензойной кислоты (пример 9d) и 373 мг гуанидина подвергают взаимодействию в 20 мл THP по общей методике получения бензоил-гуанидинов, вариант B. Получают после хроматографирования на кизельгеле с помощью ЕЕ/MeOH 5: 1 370 мг бесцветных кристаллов.
Rf (ЕЕ/MeOH 5:1) = 0,33.
MS (ES): 416 (М+Н)+.
Т.пл. (дигидрохлорид) = 233oC.
Соединение, указанное в заголовке примера 11, синтезируют аналогично примеру 3 из метилового эфира 3-метил-4-фенокси-бензойной кислоты.
Пример 11
3-Метил-4- (4-(1-метилпиперазин-4-илсульфонил)фенокси)- бензоил-гуанидин
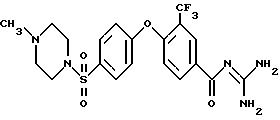
а) Метиловый эфир 3-метил-4-фенокси-бензойной кислоты
3,4 г метилового эфира 4-фтор-3-метил-бензойной кислоты, 2,4 г фенола и 19,5 г Cs2CO3 перемешивают в 100 мл N-метил- пирролидоне в течение 20 минут при 160oC. Смесь выливают в 400 мл насыщенного водного раствора NaHCO3, разбавляют 400 мл воды и трижды экстрагируют каждый раз 200 мл метил-трет-бутилового эфира. Сушат над Na2SO4 и растворитель удаляют в вакууме. Хроматографируют остаток на кизельгеле с EE/HEP 1:4, получая 2,0 г бесцветного масла.
Rf (ЕЕ/HEP 1:4) = 0,33.
MS (EI): 243 (H+Н)+.
Соединение, указанное в заголовке примера 12, синтезируют аналогично примеру 9.
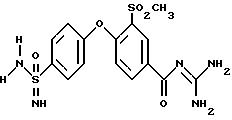
Пример 12
3-Метилсульфонил-4- (4-имидамидосульфонил)фенокси-бензоилгуанидин
Rf (EE/MeOH 5:1) = 0,24.
MS (ES): 412 (M+H)+.
Пример 13
4-(4-Гуанидиносульфонил)фенокси-3-трифторметил-бензоилгуанидин
а) 4-(4-Гидроксисульфонил)фенокси-3-трифторметил-бензойная кислота
13,5 г 4-фенокси-3-трифторметил-бензойной кислоты (пример 3b) растворяют в 150 мл CHCl3, по каплям прибавляют при комнатной температуре 3,3 мл хлорсульфоновой кислоты и 3 часа перемешивают. Растворитель удаляют в вакууме, добавляют 300 г льда и 100 мл воды и перемешивают 10 минут. Затем добавляют 400 мл охлажденного до 0oC насыщенного водного раствора NaCl перемешивают еще 15 минут при 0oC и осадок отсасывают. Сушат при 40oC в вакууме, получая 16,5 г белого твердого вещества, которое применяют дальше без очистки.
b) 4-(4-Хлорсульфонил) фенокси-3-трифторметил-бензоилхлорид
14,0 г 4-(4-гидроксисульфонил)фенокси-3-трифторметил-бензойной
кислоты и 1 мл диметилформамида растворяют в 250 мл SOCl2 и нагревают 8 часов с обратным холодильником. Затем удаляют под вакуумом приблизительно половину избыточного SOCl2 и
раствор по каплям выливают на 1 кг льда. Экстрагируют трижды метиленхлоридом (каждый раз по 500 мл CH2Cl2), сушат над MgSO4 и удаляют растворитель в вакууме. Получают
18,0 г масла, которое применяют без дальнейшей очистки.
Rf (DIP/2% HOAc) = 0,51.
с) 3-Гидроксипиридиловый эфир
4-/4-(3-пиридилокси)- сульфонил/ фенокси-3-трифторметил-бензойной кислоты
18,0 г 4-(4-хлорсульфонил)фенокси-3-трифторметил- бензоилхлорид растворяют в 150 мл ацетона, смешивают с 3,7 г
З-гидроксипиридина и 11,0 г K2CO3 и перемешивают 3 часа при комнатной температуре. Реакционную смесь выливают на 500 мл воды и трижды экстрагируют этилацетатом (каждый раз по 300
мл ЕЕ). Сушат над Na2SO4, растворитель удаляют под вакуумом и хроматографируют на кизельгеле с MTB/2% HOAc. Получают 8,0 г желтоватого масла.
Rf (MTB/2% HOAc) = 0,29.
MS (FAB): 517 (M+H)+.
d) 4-(4-Гуанидиносульфонил)фенокси-3-трифторметил-бензоилгуанидин
3,0 г 3-гидроксипиридилового эфира
4-/4-(3-пиридилокси)- сульфонил/ фенокси-3-трифторметил-бензойной кислоты и 3,4 г гуанидина растворяют в 10 мл изопропанола и 3 часа нагревают с обратным холодильником. Растворитель удаляют в вакууме,
собирают с помощью 400 мл воды, pH устанавливают на значение 8 с помощью водного раствора HCl и 2 часа перемешивают при комнатной температуре. Осадок отфильтровывают и хроматографируют на кизельгеле с
ЕЕ/MeOH 5:1. Получают 272 мг аморфного твердого вещества.
Rf (ЕЕ/MeOH 5:1) = 0,33.
MS (ES): 445 (M+H)+.
Пример 14
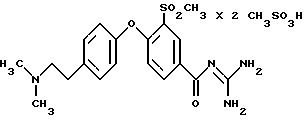
3-Метилсульфонил-4-/4-(2-диметиламиноэтил) фенокси/бензоилгуанидин, бис-метансульфонат
a) 5-Карбокси-2-фторбензолсульфиновая кислота
15,6 г (0,124 М) сульфита натрия растворяют при 70oC в 120 мл воды. Поддерживая данную температуру, добавляют одновременно и порциями 23, 8 г (0,1 М) 4-фтор-3-хлорсульфонилбензойной кислоты и 10 н. NaOH так, чтобы pH было между 9 и 10 (экзотермическая реакция). Перемешивают еще 3 часа при 70oC еще перемешивают 15 минут с активированным углем и затем фильтруют. Фильтрат устанавливают на pH 0-1 концентрированной соляной кислотой при наружном охлаждении и отфильтровывают кристаллическую 5-карбокси- 2-фторбензольсульфиновую кислоту. Бесцветные кристаллы.
Т.пл. 167-170oC.
b) 5-Карбокси-2-фторбензолсульфиновая кислота, динатровая соль
Получают путем введения 17,2 г (0,084 М) карбокси-2- фторбензолсульфиновой кислоты в перемешанный раствор 6,72 г (0,168 М) NaOH в смеси из 150 мл метанола и 30 мл воды: после отделения взвешенных
путем фильтрации отгоняют растворитель и кристаллизуют остаток под ацетоном.
Бесцветное кристаллическое вещество, т.пл. > 320oC.
c) Метиловый эфир
4-фтор-3-метилсульфонилбензойной кислоты
Суспензию 15 г (0,06 М) динатровой соли 5-карбокси-2- фторбензолсульфиновой кислоты в 80 мл сухого диметилформамида добавляют к 30 г (0,21 М)
метилйодида, перемешивают в течение 6 часов при 60oC, отгоняют растворитель и смешивают остаток с водой. Перемешивают 30 минут при охлаждении льдом, и осадок отфильтровывают.
Бесцветное кристаллическое вещество, т.пл. 102-105oC.
d) Метиловый эфир 3-метилсульфонил-4-/4-(2-диметиламиноэтил) фенокси/-бензойной кислоты
4,64 г (0,
02 М) метилового эфира 4-фтор-3-метилсульфонил- бензойной кислоты вводят в смесь из 60 мл диметилацетамида, 3,6 г (0,022 М) N,N-диметил-2-(4-гидроксифенил)этиламина и 9,08 г (0,066 М) измельченного в
порошок безводного K2CO3 и суспензию перемешивают в течение 4 часов при 90oC. После отгонки растворителя и смешения остатка с водой экстрагируют несколько раз этиловым
эфиром уксусной кислоты, очищенные органические фазы концентрируют под пониженным давлением и получают вещество в виде желтой маслянистой жидкости.
e) Получение
3-метилсульфонил-4-/4-(2-диметиламиноэтилфенокси/- бензойной кислоты, гидрохлорида
1,88 г (0,005 М) метилового эфира 3-метилсульфонил-4-/4-(2- диметиламиноэтил)фенокси/-бензойной кислоты
кипятят в 40 мл полуконцентрированной соляной кислоты в течение 5 часов с обратным холодильником, водную соляную кислоту отгоняют и остаток кристаллизуют под ацетоном.
Бесцветное кристаллическое вещество, т.пл. 246-248oC.
f) 3-Метилсульфонил-4-/4-(2-диметиламиноэтил)фенокси/- бензоилгуанидин
Это соединение получают по методике, аналогичной
указанной в варианте A, из 3-метилсульфонил-4-/4-(2-диметиламиноэтил)фенокси/- бензойной кислоты при pH между 7 и 8.
Бесцветные кристаллы, т.пл. 214-218oC.
3-Метилсульфонил-4-/4-(2-диметиламиноэтил)фенокси/- бензоилгуанидин, бис-метансульфонат
Это соединение получают по методике, аналогичной указанной в варианте А, из
метилсульфонил-4-/4-(2-диметиламиноэтил)фенокси/- бензоилгуанидина обработкой 2,5 эквивалентами метансульфоновой кислоты в этиноле.
Бесцветное твердое вещество, т.пл. 102o C.
Пример 15
4-/4- (2-Диметиламиноэтил) тиoмeтил-фeнoкcи/-3- мeтилcульфoнил-бензоил-гуанидин, дигидрохлорид
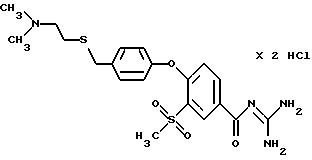
a) Получение 4-(2-димeтилaминoэтил)тиoметил-фенола
Смесь из 200 мг п-толуолсульфоновой кислоты, 14,1 г (0,1 М) 2-диметиламиноэтилмеркаптана гидрохлорида и 12,4 г (0,1 М) 4-гидроксибензилового спирта в 250 мл толуола кипятят в течение ~ 5 часов в водоотделителе по Кучеру и Штойделю с обратным холодильником, отгоняют растворитель и остаток после растворения в метаноле фильтруют. После повторного концентрирования кристаллизуют остаток под ацетоном, отфильтровывают кристаллический продукт и легко гигроскопическую массу сушат над NaOH без доступа воздуха.
T.пл. 134-140oC.
b) Метиловый эфир 4-/4-(2-диметиламиноэтил)тиометил- фенокси/-3-метилсульфонилбензойной кислоты
Смесь из 3,48 г
(0,015 М) 4-(2-диметиламиноэтил)тиометил- фенола, 40 мл безводной тетраметилмочевины, 6,8 г (0,049 М) безводного растертого в порошок K2CO3 и 3,48 г (0,015 М) метилового эфира
4-фтор-3-метилсульфонилбензойной кислоты перемешивают в течение 6 часов при 90-100oC растворитель отгоняют и остаток промывают водой. После экстракции уксусным эфиром, сушки и
концентрирования очищенных органических фаз получают целевой продукт в виде масла.
c) 4-/4-(2-Диметиламиноэтил)тиометил-фенокси/-3-метилсульфонил- бензойная кислота, гидрохлорид
Это соединение получают аналогично описанной в примере 14d методике путем гидролиза метилового эфира 4-фтор-3- метилсульфонилбензойной кислоты в 20%-ной HCl.
Кристаллическое вещество, от бесцветного до светло-желтого цвета. T.пл. 179-185oC.
d) 4-/4-(2-Диметиламиноэтил)тиометил-фенокси/-3- метилсульфонилбензоилгуанидин, дигидрохлорид
Это соединение получают аналогично описанной в примере 14e методике из гидрохлорида 4-/4-(2-диметиламиноэтил) тиометил- фенокси/-3-метилсульфонилбензойной кислоты.
Гигроскопическое вещество, т.пл. 230oC.
Пример 16
4-/4- (2-Диметиламиноэтилтио) фенокси/-3- метилсульфонилбензоилгуанидин, дигидрохлорид
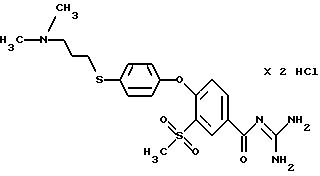
a) N,N-Диметил-2-(4-гидроксифенилтио)этиламин
К раствору из 12,6 г (0,1 М) 4-меркаптофенола в 100 мл безводного диметилформамида прибавляют в атмосфере защитного газа (аргон) 17,28 г (0,11 М) 2-диэтиламиноэтилхлорида гидрохлорида и затем 19,38 г (0,15 М) этилдизопропиламина и нагревают реакционную смесь в течение 12 часов при магнитном перемешивании до 110oC. После отгонки растворителя остаток смешивают с водой, доводят с помощью 2 н. NaOH до pH 8-9, экстрагируют аморфный осадок несколько раз этилацетатом и сушат объединенные органические фазы над сульфатом натрия. Растворитель отгоняют, и остаток элюируют на кизельгеле хроматографически смесью, состоящей из 8 частей этилацетата и 1 части метанола.
Бесцветные кристаллы.
T.пл. 108-110oC.
b) Метиловый эфир 4-/4-(2-диметиламиноэтилтио)фенокси/- 3-метилсульфонилбензойной
кислоты
Это соединение получают в виде желтого масла по методике, аналогичной описанной в примере 14d, взаимодействием N,N-диметил-2- (4-гидроксифенилтио) этиламина с метиловым эфиром
4-фтор-3- метилсульфонилбензойной кислотой, причем применяют диметилформамид вместо диметилацетамида в качестве реакционной среды.
Желтая маслянистая жидкость.
c)
4-/4-(2-Диметиламиноэтилтио)фенокси/-3- метилсульфонилбензойная кислота
6,8 г метилового эфира 4-/4- (2-диметиламиноэтилтио) фенокси/-3 -метилсульфонилбензойной кислоты кипятят в 10 мл
ледяной уксусной кислоты и 70 мл полуконцентрированной HCl 5 часов с обратным холодильником. После отгонки растворителя получают заданный продукт в виде аморфного твердого тела без определенной точки
плавления.
d) 4-/4-(2-Диметиламиноэтилтио)фенокси/-3- метилсульфонилбензоилгуанидин дигидрохлорид
Это соединение получают по методике, аналогичной указанной в качестве
варианта А.
Бесцветное твердое вещество.
Точка разложения: 160oC при вспенивании.
Пример 17
4-/4-(2-Диметиламиноэтилсульфонил)
фенокси/-3- метилсульфонилбензоилгуанидин дигидрохлорид
a) 4-/4- (2-Диметиламиноэтилсульфонил) фенокси/-3- метилсульфонилбензойная кислота
К раствору 3,8 г (0,0008 М) 4-/4-(2-диметиламиноэтилтио)- фенокси/-3-метилсульфонилбензойной кислоты в 50 мл ледяной уксусной кислоты прибавляют порциями при 5-10oC 6,9 г (0,028 М) 3-хлорпербензойной кислоты и перемешивают 12 часов при комнатной температуре. После добавки воды осадок 3-хлорбензойной кислоты отфильтровывают и из фильтрата экстрагируют другие примеси уксусным эфиром. Водную фазу концентрируют и аморфный остаток кристаллизуют под этилацетатом.
Бесцветные кристаллы, т.пл. 167-171oC.
b) 4-/4-(2-Диметиламиноэтилсульфонил)фенокси-3- метилсульфонилбензоилгуанидин, дигидрохлорид
Это соединение получают по
методике, аналогичной указанной в варианте А, из 4-/4-(2-диметиламиноэтилсульфонил)фенокси/-3- метилсульфонилбензойной кислоты в тетраметилмочевине в качестве реакционной среды. Дигидрохлорид
кристаллизуют под метанолом.
Бесцветные кристаллы, т.пл. 233-240oC (разложение).
Пример 18
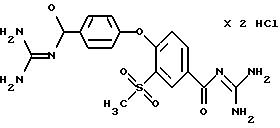
4-/(4-Гуанидинокарбонил)
фeнoкcи/-3- мeтилcульфoнилбeнзoил гуанидиндигидрохлорид
a) 4-(4-Карбоксифенокси)-3 -метилсульфонилбензойная кислота
Реакцией этилового эфира 4-гидроксибензойной кислоты с метиловым эфиром 4-фтор-3-метилсульфонилбензойной кислоты получают по методике, аналогичной указанной в примере 14d, метиловый эфир 4-(4- этоксикарбонилфенокси)бензойной кислоты в виде бесцветного до светло-желтого масла, которое без дальнейших мероприятий по очистке способом, аналогичным указанному в методике 16c, гидролизуют в 4-(4-карбоксифенокси)-3-метилсульфонилбензойную кислоту.
Бесцветные кристаллы, т.пл. 272-275oC.
b)
4-/(4-Гуанидинокарбонил)фенокси/-3- метилсульфонилбензоилгуанидин, дигидрохлорид
Это соединение получают по методике, аналогичной описанной в варианте А, путем взаимодействия 0,74 г (0,0022
М) (4-карбоксифенокси) -3-метилсульфонилбензойной кислоты с 0,78 г (0,0048 M) карбонилдиимидазолом и 1,55 г (0,026 M) гуанидина в диметилацетамиде.
Бесцветные кристаллы, т.пл. 252oC (разложение).
Пример 19
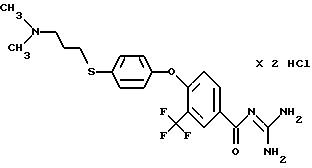
4-/4- (2-Диметиламиноэтил)тиометил-фенокси/-3- трифторметилбензоилгуанидин дигидрохлорид
a) Метиловый эфир 4-/4-(2-диметиламиноэтил) тиометил- фенокси/-3-трифторметилбензойной кислоты
Это соединение получают по методике, аналогичной описанной в примере 15b, из 4-(2-диметиламиноэтил)тиометил-фенола и метилового эфира 4-фтор-3-трифторметилбензойной кислоты в качестве реакционной среды в виде аморфного маслянистого продукта.
b) 4-/4-(2-Диметиламиноэтил)тиометил-фенокси/-3- трифторметилбензойная кислота
Это соединение получают по методике, аналогичной описанной в примере 14b, кислым
гидролизом метилового эфира 4-/4-(2-ди- метиламиноэтил)тиометил-фенокси/-3-трифторметил-бензойной кислоты.
Бесцветные гигроскопические кристаллы, т.пл. 158-168oC (разложение).
c) 4-/4-(2-Диметиламиноэтил) тиометил-фенокси/-3- трифторметилбензоилгуанидин дигидрохлорид
Это соединение получают по методике, аналогичной описанной в
варианте А, из 4-/4-(2-диметиламиноэтил)тиометил-фенокси/-3- трифторметилбензойной кислоты в тетраметилмочевине в качестве реакционной среды. Аморфное сильно гигроскопическое твердое вещество,
разложение при 80-85oC.
Пример 20
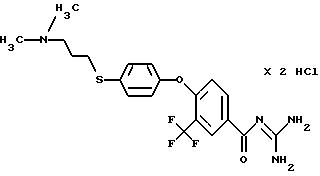
4-/4-(2-Диметиламиноэтилтио)фенокси/3 -трифторметил- бензоилгуанидин, дигидрохлорид
a) Метиловый эфир 4-/4-(2-диметиламиноэтилтио)фенокси) 3-трифторметил-бензойной кислоты
Это соединение получают по методике, аналогичной описанной в примере 15b, из 4-(2-диметиламиноэтилтио) фенола и метилового эфира 4-фтор-3-трифторметилбензойной кислоты в DMU в качестве реакционной среды в виде аморфного маслянистого продукта.
b) 4-/4-(2-Диметиламиноэтилтио)фенокси/-3- трифторметилбензойная кислота
Это соединение получают по методике, аналогичной описанной в примере 14d, кислым гидролизом
метилового эфира 4-/4-(2- диметиламиноэтилтио)фенокси/-3-трифторметилбензойной кислоты. Целевой продукт
4-/4-(2-диметиламиноэтилтио)фенокси/-3- трифторметилбензойную кислоту кристаллизуют под
ацетоном.
Бесцветные кристаллы, т.пл. 174-182oC (разложение).
c) 4-/4-(2-Димeтилaминoэтилтиo)фeнoкcи/-3- тpифтopмeтилбензоилгуанидин, дигидрохлорид
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(2-диметиламиноэтилтио) фенокси/3- трифторметилбензойной кислоты в тетрагидрофуране в качестве реакционной
среды.
Аморфное гигроскопическое кристаллическое твердое вещество, т.пл. 240oC.
Пример 21
3-Трифторметил-4-/4-(2-диметиламиноэтил)фенокси/бензоилгуанидин дигидрохлорид
a) 4-Хлор-3-трифторметил-бензойная кислота
Сначала из 100 г 5-бром-2-хлор-бензотрифторида и 10,2 г магния в 600 мл диэтилового эфира получают соединение Гриньяра. Затем в этот раствор при комнатной температуре вводят 60 г безводного CO2. Прибавляют по каплям 500 мл насыщенного водного раствора NaHSO4, разделяют фазы и еще дважды экстрагируют диэтиловым эфиром (по 100 мл). Органическую фазу трижды экстрагируют 300 мл (каждый раз) 1 н. NaOH, затем водную фазу трижды промывают 100 мл (каждый раз) диэтилового эфира. pH водной фазы устанавливают с помощью HCl на значение 2 и разбавляют водой до 4 л. Продукт отсасывают и сушат в вакууме.
75 г белого порошка.
Rf (MTB 2% HOAc) = 0,68.
b) Метиловый
эфир 4-хлор-3-трифторметил-бензойной кислоты
75 г 4-хлор-3-трифторметил-бензойной кислоты растворяют в 500 мл MeOH и прибавляют по каплям 75 мл SOCl2. Кипятят в течение 5 часов с
обратным холодильником, затем удаляют летучие компоненты в вакууме. Собирают одним литром этилацетата и промывают насыщенным водным раствором Na2CO3 (500 мл). Сушат над Na2SO4, растворитель удаляют под вакуумом и в вакууме дистиллируют.
T. кип. 94oC (2 Торр).
Rf (DIP) = 0,49.
MS (DCI): 239 (M+H)+.
c) Метиловый эфир 4-/4-(2-диметиламино)этил/фенокси-3- трифторметилбензойной кислоты
1,9 г метилового эфира 4-хлор-3-трифторметил-бензойной
кислоты, 1,3 г 4-(2-диметиламиио) этил-фенола, 7,8 г Cs2CO3 перемешивают в 50 мл тетраметилмочевине в течение 5 часов при 140oC. Дают остыть, затем добавляют 300 мл
насыщенного водного раствора NaHCO3 и 150 мл воды и экстрагируют трижды этилацетатом (по 100 мл). Сушат над Na2SO4, затем удаляют растворитель в вакууме.
Хроматографируют с применением смеси ацетон/вода 10:1, получая 2,0 г бесцветного масла.
Rf (ацетон/вода 10:1)= 0,15.
MS (DCI): 368 (М+Н)+.
d) 4-/4-(2-Диметиламино)этил/фенокси-3- трифторметилбензоилгуанидин
2,0 г метилового эфира 4-/4-(2-диметиламино) этил/фенокси- бензойной кислоты гуанилируют 1,6 г гуанидина в 60 мл
изопропанола по варианту В. Сырой продукт переводят в дигидрохлорид и перекристаллизовывают из 1,2-диметоксиэтан/вода 9:1.
T.пл. (свободное основание): 164oC.
T.пл. (дигидрохлорид): 236oC.
MS (DCI): 395 (М+Н)+.
Водорастворимость дигидрохлорида 49 мг/мл (pH 5,3).
Пример 22
4-(4-N, N-Диметиламиноэтилфенокси/-3- сульфамоилбензоилгуанидин, бисметансульфонат
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(2-диметиламиноэтил)фенокси/-3- сульфамоилбензойной кислоты в диметилацетамиде или N-метилпирролидоне в качестве реакционной среды. Аморфное гигроскопическое кристаллическое твердое вещество, т.пл.: 183oC.
a) Метиловый эфир 4-/4-(2-диметиламиноэтил)фенокси/-3-сульфамоилбензойной кислоты получают нагреванием 0,011 моль N,N-диметил-2-(4- гидроксифенил)этиламина, 0,033 моль карбоната калия (молотого) и 0,01 моль метилового эфира 4-фтор-3-сульфамоилбензойной кислоты в 40 мл диметилацетамида в течение 5 часов до 90-100oC. После отгонки растворителя остаток перемешивают с водой, обрабатывают коричневый аморфный продукт ледяной уксусной кислотой, отфильтровывают от кристаллического осадка и отгоняют из фильтрата растворитель. Аморфный маслянистый продукт.
b) 4-/4-(2-диметиламиноэтилфенокси/-3- сульфамоилбензойную кислоту получают гидролизом 0, 0066 моль соответствующего метилого эфира (a) в 60 мл кипящей полуконцентрированной соляной кислоты в течение 5 часов. После испарения водной соляной кислоты в вакууме остаток обрабатывают ацетоном и осадок отфильтровывают. Растворитель отгоняют и получают целевой продукт - бензойную кислоту. Точка размягчения - начиная с 60oC.
Пример 23
3-Хлор-4-/4-(2-диметиламиноэтил)фенокси/-5- метилсульфонилбензоилгуанидин бисметансульфонат
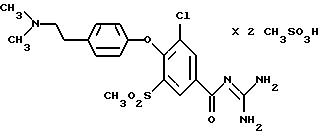
Это соединение получают по методике, аналогичной описанной в варианте А, из 3-хлор-4-/4-(2-диметиламиноэтил)фенокси/-5- метилсульфонилбензойной кислоты в диметилацетамиде или N-метилпирролидоне в качестве реакционной среды.
Гигроскопическое кристаллическое твердое вещество, т.пл.: 200oC.
а) Метиловый эфир
3-хлор-4-/4-(2-диметиламиноэтил)фенокси/- 5-метилсульфонилбензойной кислоты
Это соединение получают аналогично примеру 22а реакцией метилового эфира 3,4-дихлор-5-метилсульфонилбензойной
кислоты с N,N-диметил-2-(4-гидроксифенил)-этиламином. Аморфное, маслянистое вещество.
b) 3-Хлор-4-/4-(2-диметиламиноэтил)фенокси/-5-метилсульфонилбензойная кислота
Получают
аналогично примеру 22а. Кристаллическое твердое вещество.
Разложение: при 238-244oC.
Пример 24
4-/(4-Гуанидинокарбонил)
фенокси/-3-метилсульфонилбензоилгуанидин
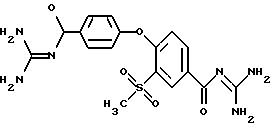
Получают в виде не содержащего соли основания примера 18 путем обработки 4-/(4-гуанидинокарбонил) фенокси/-3- метилсульфонилбензоилгуанидина дигидрохлорида триэтиламином в диметилформамиде.
Бесцветное кристаллическое твердое вещество, т.пл.: 237oC.
Пример 25
4-/4- (2-N-Имидазолил-1-оксо-этил) фенокси/-3- метилсульфонилбензоилгуанидин дигидрохлорид
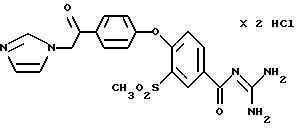
Получают по методике, аналогичной описанной в варианте А, из 4-/4-(2-N-имидазолил-1-оксо-этил) фенокси/-3- метилсульфонилбензойной кислоты в сухом диметилацетамиде или N-метилпирролидине в качестве реакционной среды.
Бесцветное кристаллическое твердое вещество, разлагается при 255oC.
а) 4-(4-хлорацетилфенокси)-3 -метилсульфонилбензойная кислота
0,02 моль 3-метилсульфонил- 4-феноксибензойной кислоты порциями вводят в смесь, состоящую из 0,
08 моль хлорацетилхлорида, 16 г безводного хлорида алюминия и 150 мл 1,2-дихлорэтана при 0-5oC, перемешивают 2 часа при комнатной температуре и затем перемешивают еще 2 часа при 40-45oC. После отстаивания в течение ночи реакционную смесь при перемешивании выливают в ледяную воду, кристаллический осадок отфильтровывают, промывают водой и сушат.
Желтые кристаллы, т.пл.: 184-187oC.
b) 4-/4-(2-N-Имидазолил- 1-оксо-этил)фенокси/-3- метилсульфонил- бензойная кислота
Раствор 0,005 моль
4-(4-хлорацетилфенокси)-3- метилсульфонилбензойной кислоты (25, а) в 25 мл безводного диметилформамида перемешивают с 0,0225 моль имидазола в течение 4 часов при 60oC и затем растворитель
отгоняют. После обработки аморфного остатка водой и доведения pH до значения 2-3 с помощью соляной кислоты перемешивают один час и кристаллический осадок отфильтровывают. Кристаллы, разл. 235-241oC.
Пример 26
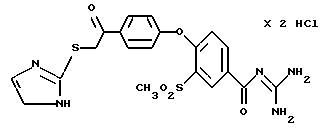
4-/4-(2-Имидазолилтио-ацетил) фенокси/-3-метилсульфонил- бензоилгуанидин, дигидрохлорид
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(2-имидазолилтио-ацетил)фенокси/-3- метилсульфонилбензойной кислоты в смеси из 50 мл тетрагидрофурана и 10 мл диметилацетамида в качестве реакционной среды. Бесцветное кристаллическое твердое вещество, т.пл.: 220oC.
а)
4-/4-(2-Имидазолилтио-ацетилфенокси/ -3- метилсульфонилбензойной кислоты
Это соединение получают взаимодействием 4-(4-хлорацетил- фенокси)-3 -метилсульфонилбензойной кислоты (пример 25а) и
молем 2-меркаптоимидазола в 20 мл ацетона и кратковременным нагреванием до кипения. Перемешивают около 5 дней при комнатной температуре и кристаллический осадок отфильтровывают.
Разложение: 202-205oC.
Пример 27
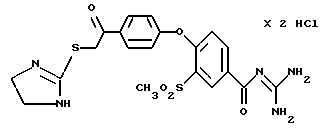
4-/4-(4,5-Дигидро-2 -имидазолтио-ацетил) фенокси/-3- метилсульфонил-бензоилгуанидин, дигидрохлорид
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(4, 5-дигидро-2-имидазолилтио-ацетил)- фенокси/-3-метилсульфонилбензойной кислоты в смеси, состоящей из 50 мл тетрагидрофурана и 10 мл диметилацетата, в качестве реакционной среды.
Бесцветное кристаллическое твердое вещество, т.пл. 210oC.
а) 4-/4- (4,5-Дигидро-2-имидазолилтио-ацетил) фенокси/-3- метилсульфонилбензойная кислота
Это соединение
получают аналогично методике примера 26a реакцией 4- (4-хлорацетилфенокси)-3 -метилсульфонилбензойной кислоты (пример 25а) с 2-меркапто-4,5-дигидроимидазолом. Разл.: 305-310oC.
Пример 28
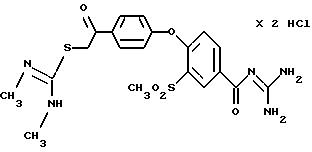
4-/4-(N, N'-Диметил-S -изотиуронил-ацетил) фенокси/-3- метилсульфонил-бензоилгуанидин, дигидрохлорид.
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(N, N-диметил-S-изотиуронил-ацетил)- фенокси/-3-метилсульфонилбензойной кислоты в смеси, состоящей из 50 мл тетрагидрофурана и 10 мл диметилацетамида в качестве реакционной среды.
Бесцветное кристаллическое твердое вещество, т.пл.: 150oC.
а) 4-/4-(N, N'-Диметил-S -изотиуронил-ацетил)фенокси/- 3-метилсульфонилбензойная кислота
Это соединение
получают аналогично методике примера 26a по реакции 4-(4-хлорацетилфенокси- 3-метилсульфонилбензойной кислоты (пример 25a) с N, N-диметилтиомочевиной при комнатной температуре. Бесцветные
кристаллы.
Разл.: 185-190oC.
Пример 29
4-/4-(2-Бензимидазолтио-ацетил) фенокси/-3- метилсульфонилбензоилгуанидин, дигидрохлорид
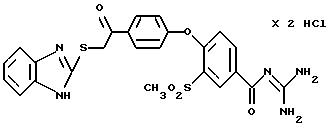
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(2-бензимидазолтио-ацетил)фенокси/-3- метилсульфонилбензойной кислоты в тетрагидрофуране в качестве реакционной среды. Бесцветное кристаллическое твердое вещество, т.пл.: 228oC.
а) 4-/4-(2-Бензимидазолтио-ацетил) фенокси/-3- метилсульфонилбензойная кислота
Это соединение получают согласно методике примера 26a по реакции
4-(4-хлорацетилфенокси)-3-метилсульфонилбензойной кислоты (пример 25а) с 2-меркаптобензимидазолом в диметилформамиде.
T.пл.: 182oC.
Пример 30
4-/4-(2-Пиридилтио-ацетил) фенокси/-3-метилсульфонил- бензоилгуанидин, дигидрохлорид.
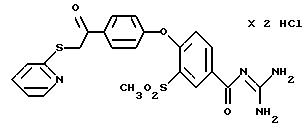
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(2-пиридилтио-ацетил)фенокси/-3- метилсульфонилбензойной кислоты в тетрагидрофуране в качестве реакционной среды. Бесцветное кристаллическое твердое вещество, т.пл.: 203oC.
а) 4-/4-(2-Пиридилтио-ацетил) фенокси/-3- метилсульфонилбензойная кислота
Это соединение получают
аналогично методике примера 26a по реакции 4-(4-хлорацетилфенокси)-3-метилсульфонилбензойной кислоты (пример 25a) с 2-меркаптопиридином.
T.пл.: 194-196oC.
Пример 31
4-/4-(2-Хинолилтио-ацетил) фенокси/-3-метилсульфонил- бензоилгуанидин дигидрохлорид.
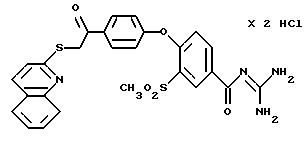
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(2-хинолилтио-ацетил)фенокси/-3- метилсульфонилбензойной кислоты в тетрагидрофуране в качестве реакционной среды. Бесцветное кристаллическое твердое вещество, т.пл.: 192oC.
а) 4-/4-(2-Хинолилтио-ацетил) фенокси/-3- метилсульфонилбензойная
кислота
Это соединение получают аналогично методике примера 26a по реакции 4-(4-хлорацетилфенокси)-3 -метилсульфонилбензойной кислоты (пример 25a) с 2-меркаптохинолином в диметилформамиде.
T.пл.: 210-214oC.
Пример 32
4-/4-(2-N-Имидазолил-1-гидроксиэтил) фенокси/-3- метилсульфонилбензоилгуанидин, дигидрохлорид
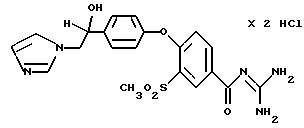
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(2-N-имидазолил-1-гидроксиэтил)фенокси/-3- метилсульфонилбензойной кислоты в диметилацетамиде или N-метилпирролидине в качестве реакционной среды. Бесцветное кристаллическое твердое вещество, точка разложения: 260oC.
a) 4-/4-(2-N-Имидазолил-1-гидроксиэтил) фенокси/-3- метилсульфонилбензойная кислота.
Это соединение получают восстановлением 0, 0034 моль 4-/4- (2-N-имидазолил-1 -оксо-этил) фенокси/-3 -метилсульфонил-бензойной кислоты с помощью 0,0068 моль натрийбораната в 40 мл этанола. После отгонки растворителя, смешения остатка с водой и доведения pH до значения 4 с помощью 2 н. HCl перемешивают несколько часов при комнатной температуре и кристаллы отфильтровывают.
T.пл.: 240-248oC.
Пример
33
3-Метилсульфонил-4-(4-сульфамоилфенокси)бензоилгуанидин гидрохлорид
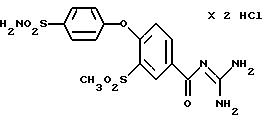
Это соединение получают по методике, аналогичной описанной в варианте А, из 3-метилсульфонил-4-(4-сульфамоилфенокси)бензойной кислоты в диметилацетамиде в качестве реакционной среды. Бесцветное кристаллическое твердое вещество, точка разложения: 267oC.
а) 3-Метилсульфонил-4-(4-хлорсульфонилфенокси)бензойная кислота
Это соединение получают взаимодействием
0,03 моль 4-фенокси-3-метилсульфонилбензойной кислоты с 0,15 моль хлорсульфоновой кислоты в 60 мл метиленхлорида при 0-5oC и дальнейшим перемешиванием в течение 4 часов при комнатной
температуре. После обработки ледяной водой метиленхлоридную фазу отделяют, промывают водой, сушат над сульфатом магния и отгоняют растворитель. Кристаллы, т.пл.: 167-170oC.
b) 3-Метилсульфонил-4-(4- сульфамоилфенокси)бензойная кислота
Это соединение получают по реакции 3-метилсульфонил-4-(4- хлорсульфонилфенокси) -бензойной кислоты с водным концентрированным
раствором аммиака в течение 24 часов при комнатной температуре, с отгонкой аммиака и подкислением водного раствора 2 н. HCl до pH 1-2. Отфильтровывают кристаллы, промывают водой и сушат. Бесцветное
кристаллическое вещество, т. пл. 240-245oC.
Пример 34
4-/4-(1-Гидрокси-2-(2- пиридилтио)этил) фенокси/-3- метилсульфонилбензоилгуанидин, дигидрохлорид
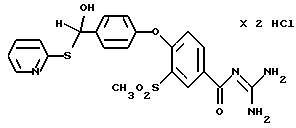
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(1-гидрокси-2- (2-пиридилтио)этил)фенокси/- 3-метилсульфонилбензойной кислоты в тетрагидрофуране в качестве реакционной среды. Бесцветное кристаллическое твердое вещество, т.пл.: 116o C.
а) 4-/4-(1-Гидрокси-2-(2 -пиридилтио)этил) фенокси/-3- метилсульфонилбензойная кислота
Это соединение получают аналогично примеру 32a. Бесцветное кристаллическое вещество.
Т.пл.: 169-174oC.
Пример 35
4-/4- (1-Гидрокси-2-(2-бензимидазолилтио)этил)фенокси/-3- метилсульфонилбензоилгуанидин дигидрохлорид
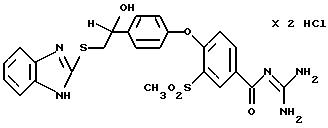
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(1-гидрокси-2-(2-бензимидазолилтио)этил)- фенокси/-3-метилсульфонилбензойной кислоты в диметилацетамиде в качестве реакционной среды. Бесцветное кристаллическое твердое вещество, т.пл.: 213oC.
а) 4-/4-(1-Гидрокси-2-(2 -бензимидазолилтио) этил)фенокси/-3 -метилсульфонилбензойная кислота
Это соединение получают аналогично примеру 32a. Бесцветное
кристаллическое вещество. Т.пл.: 186-188oC.
Пример 36
4-/4-(1-Гидрокси-2-(2-хинолилтио)этил)фенокси/-3- метилсульфонилбензоилгуанидин, дигидрохлорид
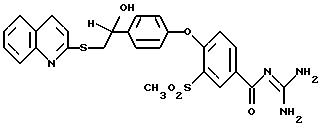
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(1-гидрокси-2-(2- хинолилтио)этил) фенокси/-3 -метилсульфонилбензойной кислоты в тетрагидрофуране в качестве реакционной среды. Бесцветное кристаллическое твердое вещество, т.пл.: 180o C.
а) 4-/4-(1-Гидрокси-2-(2- хинолилтио)этил) фенокси/-3- метилсульфонилбензойная кислота
Это соединение получают аналогично примеру 32a из 4-/4-(2- хинолилтио-ацетил)
фенокси/-3 -метилсульфонил-бензойной кислоты (пример 31а).
Бесцветное кристаллическое вещество.
Пример 37
4-/4-(N,N-Диметилглициламино)
фенокси/-3- метилсульфонилбензоилгуанидин, дигидрохлорид
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(N,N-диметилглициламино)фенокси/-3- метилсульфонилбензойной кислоты в тетрагидрофуране в качестве реакционной среды. Бесцветное кристаллическое вещество, т.пл.: 223oC.
а) 3-Метилсульфонил-4-(4 -нитрофенокси)бензойной кислоты
Это соединение получают взаимодействием 0,02 моль 3-метилсульфонил- 4-феноксибензойной
кислоты с 0,96 моль 100%-ной азотной кислоты в смеси из 8 мл ацетангидрида и 4 мл ледяной уксусной кислоты при -10oC. После 1,5-часового перемешивания при этой температуре перемешивают 24
часа при комнатной температуре и еще 8 часов при 40oC. Выливают на ледяную воду и, перемешивая под водой, доводят аморфный маслянистый продукт до кристаллизации. Желтое кристаллическое
вещество, т.пл.: 140-150oC.
b) 4-(4-Аминофенокси)-3-метилсульфонилбейзойная кислота
Это соединение получают каталитическим гидрированием
3- метилсульфонил-4-(4-нитрофенокси)бензойной кислоты (пример 37a) на никеле Ренея в метаноле под нормальным давлением до полного поглощения водорода. Получают после выпаривания растворителя
однообразное аморфное масло.
c) N,N-Диметилглицин-имидазолид, гидрохлорид
Это соединение получают взаимодействием N,N-диметилглицина гидрохлорида с карбонилдиимидазолом в
безводном диметилацетамиде, из которого выделяется продукт. Смесь без какой-либо дополнительной переработки подвергают дальнейшим взаимодействиям.
d) 4-/4-(N, N-Диметилглициламино)
фенокси/-3- метилсульфонилбензойная кислота
Это соединение получают взаимодействием N,N-диметилглицин-имидазолид гидрохлорида (пример 37с) с 4-(4-аминофенокси)-3- метилсульфонилбензойной
кислотой (пример 37c) путем перемешивания в течение 5 часов в диметилацетамиде при комнатной температуре. Растворитель отгоняют, pH доводят до значения 1-2 с помощью HCl и экстрагируют этилацетатом.
Водную фазу отгоняют, а остаток обрабатывают метанолом. После отделения на фильтре нерастворимых частиц получают целевое соединение в виде бесцветного масла.
Пример 38
4-/4-(N, N-Диэтиламиноэтил)аминосульфонилфенокси/-3- метилсульфонилбензоил-гуанидин, дигидрохлорид
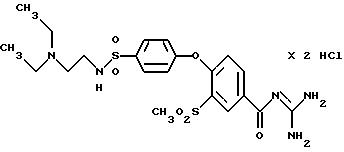
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(N, N-диэтиламиноэтил) аминосульфонилфенокси/-3- метилсульфонилбензойной кислоты в безводном диметилацетамиде в качестве реакционной среды. Бесцветное кристаллическое твердое вещество, т.пл.: 206oC.
а) 4-/4-(N,N-Диэтиламиноэтил) аминосульфонилфенокси/-3- метилсульфонилбензойная
кислота
Это соединение получают по реакции 0,05 моль 3-метилсульфонил-4- (4-хлорсульфонилфенокси)бензойной кислоты (пример 33а) с 0,06 моль N,N-диэтиламиноэтиламина в присутствии избытка
триэтиламина (~ 0,015 моль) в метаноле в качестве реакционной среды. После отгонки смеси растворителей смешивают с небольшим количеством воды и доводят pH до 4-5. Отфильтровывают кристаллический
осадок. Т.пл.: 263-268oC.
Пример 39
4-/4-(1-Метил-4-пиперазино) сульфонилфенокси/-3- метилсульфонилбензоил-гуанидин, дигидрохлорид
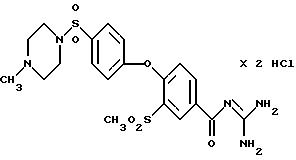
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(1-метил-4-пиперазино) сульфонилфенокси/-3- метилсульфонилбензойной кислоты в тетрагидрофуране в качестве реакционной среды. Бесцветное кристаллическое твердое вещество, т.разл.: 234-244oC.
а)
4-/4-(1-Метил-4-пиперазино) сульфонилфенокси/-3-метил- сульфонилбензойная кислота
Это соединение получают взаимодействием метилсульфонил-4-(4- хлорсульфонилфенокси)-бензойной кислоты (пример
33a) N-метилпиперазином аналогично примеру 38a. Бесцветные кристаллы, т.разл.: 287-292oC.
Пример 40
4-/4-(4-Имидазолилэтил)
аминосульфонил-фенокси/-3- метилсульфонилбензоил-гуанидин, дигидрохлорид
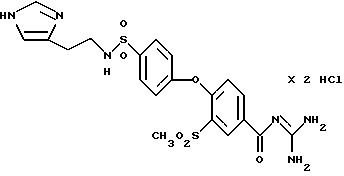
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(4-имидазолилэтил) аминосульфонилфенокси/-3- метилсульфонилбензойной кислоты в диметилацетамиде в качестве реакционной среды. Бесцветное кристаллическое твердое вещество, т.пл.: 264oC.
а) 4-/4-(4-Имидазолилэтил)аминосульфонилфенокси/-3- метилсульфонилбензойная кислота
Это соединение
получают аналогично примеру 38a путем взаимодействия метилсульфонил-4-(4-хлорсульфонилфенокси)бензойной кислоты (пример 33a) с гистамином. Бесцветное аморфное твердое вещество, т.разл.: 265o
C.
Пример 41
4-/4- (3-N-Имидазолил-1-пропил) аминосульфонил-фенокси/- 3-метилсульфонилбензоил-гуанидин, дигидрохлорид
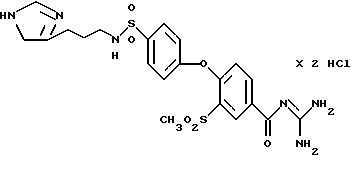
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(3-N-имидазолил-1-пропил)аминосульфонилфенокси/-3- метилсульфонилбензойной кислоты в тетрагидрофуране в качестве реакционной среды. Бесцветное кристаллическое твердое вещество, т.разл: 257oC.
а) 4-/4-(3-N-Имидазолил-1-пропил)аминосульфонилфенокси/- 3- метилсульфонилбензойная кислота
Это соединение получают аналогично примеру 38а путем взаимодействия
метилсульфонил-4-(4-хлорсульфонилфенокси)бензойной кислоты (пример 33a) с 1-(3-аминопропил)имидазолом. Бесцветное аморфное твердое вещество, т.пл.: 250oC.
Пример 42
4-/4- (1-Метил-2-пирролидинилэтил) аминосульфонил-фенокси/- 3-метилсульфонилбензоил-гуанидин, дигидрохлорид
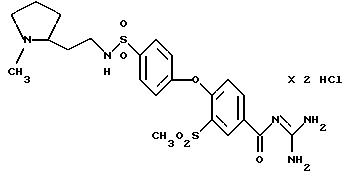
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(1-метил-2-пирролидинилэтил) аминосульфонилфенокси/-3 -метилсульфонилбензойной кислоты в диметилацетамиде в качестве реакционной среды. Бесцветное кристаллическое твердое вещество, т.пл.: 254oC.
а) 4-/4-(1-Метил-2-пирролидинилэтил)
аминосульфонилфенокси/-3- метилсульфонилбензойная кислота
Это соединение получают аналогично примеру 38a путем взаимодействия метилсульфонил-4-(4-хлорсульфонилфенокси)бензойной кислоты
(пример 33a) с 2-(2-аминоэтил)-1-метилпирролидином, т.пл.: 242-247oC.
Пример 43
4-/4-(N-Морфолиноэтил) аминосульфонил-фенокси/-3- метилсульфонилбензоил-гуанидин,
дигидрохлорид
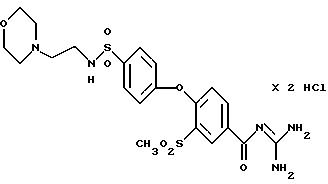
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(N-морфолиноэтил) аминосульфонилфенокси/-3- метилсульфонилбензойной кислоты в диметилацетамиде в качестве реакционной среды. Бесцветное кристаллическое вещество, т.пл.: 272oC.
а) 4-/4-(N-Морфолиноэтил) аминосульфонилфенокси/-3- метилсульфонилбензойная кислота
Это соединение получают аналогично примеру 38a путем взаимодействия
метилсульфонил-4-(4- хлорсульфонилфенокси)бензойной кислоты (пример 33a) с N-(2-аминоэтил)морфолином. Бесцветное кристаллическое твердое вещество.
T.пл.: 220-224oC.
Пример 44
4-/4-(N-Пиперидиноэтил) аминосульфонил-фенокси/-3- метилсульфонилбензоил-гуанидин, дигидрохлорид
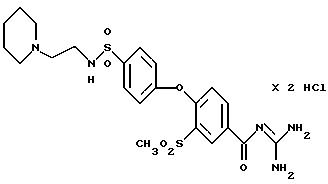
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(N-пиперидиноэтил) аминосульфонилфенокси/-3- метилсульфонилбензойной кислоты в безводном диметилацетамиде в качестве реакционной среды. Бесцветное кристаллическое твердое вещество, т.пл.: 266oC.
а) 4-/4-(N-Пиперидиноэтил)
аминосульфонилфенокси/-3- метилсульфонилбензойная кислота
Это соединение получают аналогично примеру 38a путем взаимодействия метилсульфонил-4-(4- хлорсульфонилфенокси)бензойной кислоты
(пример 33a) с N-(2-аминоэтил)пиперидином. Бесцветное кристаллическое вещество.
T.пл.: 271-273oC.
Пример 45
4-/4-(2-Пиридилэтил)аминосульфонил
-фенокси/-3- метилсульфонилбензоил-гуанидин, дигидрохлорид
Это соединение получают по методике, аналогичной описанной в варианте А, из 4-/4-(2-пиридилэтил) аминосульфонилфенокси/-3- метилсульфонилбензойной кислоты в безводном диметилацетамиде в качестве реакционной среды. Бесцветное кристаллическое твердое вещество, т.пл.: 257oC.
а) 4-/4-(2-Пиридилэтил) аминосульфонилфенокси/-3- метилсульфонилбензойная кислота
Это соединение получают
аналогично примеру 38a путем взаимодействия метилсульфонил-4-(4-хлорсульфонилфенокси)бензойной кислоты (пример 33a) с 2-(аминоэтил)пиридином. Бесцветные кристаллы. Т.пл.: 268-270oC.
Пример 46
4-/4-(2-Диметиламиноэтил) сульфонилметил-фенокси/-3- метилсульфонилбензоил-гуанидин, дигидрохлорид
Это соединение получают путем перкислотного окисления по методике, аналогичной описанной в примере 4, и 4-/4-(2-диметиламиноэтил) тиометил-фенокси/-3- метилсульфонилбензоил-гуанидина дигидрохлорида (пример 15). Бесцветные кристаллы.
T.пл.: 245oC.
Пример 47
4-/4-(2-Диметиламиноэтил)сульфонилметил-фенокси/-3- трифторметилбензоил-гуанидин, дигидрохлорид
Это соединение получают путем перкислотного окисления по методике, аналогичной описанной в примере 17, из 4-/4-(2- диметиламиноэтил)тиoмeтил-фeнoкcи/-3-тpифтopмeтилбeнзoилгуaнидинa дигидрохлорида (пример 19). Бесцветные кристаллы, Т.пл.: 140oC.
Пример 48
3-метилсульфонил-4-(4-(2-трет-бутоксикарбониламиноэтил)фенокси) бензоил-гуанидин,
дигидрохлорид
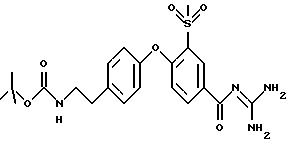
а) Метил 3-метилсульфонил- 4-(4-(2-трет-бутоксикарбониламиноэтил)- фенокси)бензоат
20,2 г метил 4-хлор-3-метилсульфонилбензоата, 19,3 трет-бутоксикарбонилтирамина и 33,8 г K2CO3 перемешивают при 100oC в течение 8 часов в 400 мл NMP. Растворитель удаляют под вакуумом, отбирают остаток с помощью 600 мл насыщенного водного раствора NaHCO3 и 600 мл воды, после чего раствор экстрагируют 3 раза, используя каждый раз по 400 мл этилацетата (ЕЕ). Органическую фазу высушивают над Na2SO4 и растворитель удаляют под вакуумом. Хроматография на силикагеле с использованием DIP приводит к получению 30,4 г бесцветного масла.
Rf (DIP) = 0,11.
MS (ES): 450 (M+H)+.
б) 3-метилсульфонил-4-(4-(2-трет- бутоксикарбониламиноэтил) фенокси)бензоил-гуанидин, гидрохлорид
Проводят реакцию с использованием 2,2 г метил
3-метилсульфонил-4-(4-(2-трет- бутоксикарбониламиноэтил) фенокси)бензоата в соответствии с основным способом получения бензоил-гуанидинов, вариант B, и получают в результате 1,1 г гидрохлорида в виде
бесцветных кристаллов, Т.пл.: 216oC (при разложении).
Rf (EE)= 0,19.
MS (ES): 477(M+H)+.
Пример 49
3-метилсульфонил-4-(4-(2 -аминоэтил)фенокси) бензоил-гуанидин, дигидрохлорид
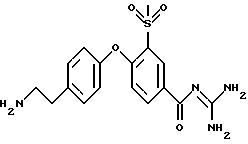
1,1 г 3-метилсульфонил-4-(4-(2-трет- бутоксикарбониламиноэтил) фенокси)бензоил-гуанидин, гидрохлорида растворяют в 5 мл трифтор метансульфокислоты при 0oC, и смесь перемешивают при указанной температуре в течение 2 часов, затем при комнатной температуре в течение 6 часов. Реакционную смесь осторожно добавляют к 150 мл насыщенного водного раствора NaHCO3 и экстрагируют 3 раза, используя каждый раз по 100 мл ЕЕ. Органическую фазу высушивают над Na2SO4 и растворитель упаривают под вакуумом. Хроматографией на силикагеле с использованием CH2 Cl2/MeOH/ацетон/вода (16:8:1:1) получают 150 мг бесцветного пенистого вещества, которое превращают в гигроскопичный дигидрохлорид с использованием 4 н. водного раствора HCl.
Rf (CH2Cl2/MeOH/ацетон/вода 16:8:1:1) = 0,27.
MS (ES): 377 (М+Н)+.
Пример 50
4-(4-Диметиламиносульфонил)
фенокси-5-метилсульфонил -2-метил бензоил-гуанидин
а) 4-Бром-5-хлорсульфонил -2-метилбензойная кислота
62 мл хлорсульфокислоты добавляют по каплям при комнатной температуре к 20 г 4-бром-2-метилбензойной кислоты.
Затем смесь перемешивают при 120oC в течение 5 часов и после охлаждения медленно по каплям добавляют к 1,5 кг льда. Продукт отсасывают и высушивают в вакууме. Получают 23 г белых кристаллов. Т.пл.: 214oC.
Rf (DIP, 2% HOAc) = 0,38.
MS (ES): 450 (М+Н)+.
б) Метил 4-бром-5-метилсульфонил-2-метилбензоат
Добавляют порциями 23 г
4-бром-5-хлорсульфонил -2-метилбензойной кислоты к теплому раствору при 70oC 14,7 г Na2CO3 в 300 мл воды. pH поддерживают при значении 9-10, добавляя соответствующее
количество 10 н. водного раствора NaOH. Смесь перемешивают при 70oC в течение 2 часов, охлаждают до комнатной температуры и доводят значение pH до 1 с использованием 6 н. водного раствора
HCl, осадок отсасывают. Твердое вещество подвергают кратковременному высушиванию, суспендируют в 100 мл воды и доводят значение pH до 10, используя 10 н. водный раствор NaOH. Воду удаляют под вакуумом,
остаток суспендируют в 100 мл толуола, и растворитель снова удаляют под вакуумом. После этого остаток суспендируют в 100 мл ацетона, отфильтровывают твердое вещество и высушивают под вакуумом при
комнатной температуре. Затем остаток смывают 200 мл безводного DMF, обрабатывают 16,4 мл метилиодида и перемешивают при 50oC в течение 6 часов. Реакционную смесь выливают в 2 л воды,
перемешивают в течение 30 минут, и осадок отсасывают и высушивают. Перекристаллизацией из смеси 300 мл DIP и 100 мл ЕЕ получают 18,2г бесцветного твердого вещества. Т.пл.: 150oC.
Rf (ЕЕ/HEP 1:4) = 0,12.
MS (DCI): 307 (M+H)+.
b) 4-Фенокси-5-метилсульфонил-2-метилбензойная кислота
2,5 г метил
4-бром-5-метилсульфонил-2-метилбензоата, 0,94 г фенола и 7,8 г Cs2CO3 растворяют в 40 мл N-метилпирролидона и перемешивают при 160oC в течение 4 часов. Реакционную
смесь вливают в 100 мл насыщенного водного раствора NaHCO3 и 100 мл воды и экстрагируют 5 раз с использованием каждый раз 100 мл ЕЕ. Водную фазу медленно доводят до значения pH 2-3 с
использованием 6 н. водного раствора HCl и снова экстрагируют 5 раз, используя каждый раз 100 мл ЭА. Органическую фазу высушивают над Na2SO4 и растворитель удаляют под вакуумом.
Хроматографией на силикагеле с использованием DIP/2% HOAc получают 1,85 г бесцветного твердого вещества. Т.пл.: 195oC.
Rf (DIP 2% HOAc) = 0,34.
MS (DCI): 307 (М+Н)+.
г) 4-(4-Хлорсульфонил)фенокси -5-метилсульфонил-2-метилбензоил хлорид
1,8 г 4-фенокси-5-метилсульфонил-2-метилбензойной кислоты растворяют в
30 мл CHCl3 и добавляют по каплям при комнатной температуре 4,0 мл хлорсульфоновой кислоты. Смесь перемешивают при комнатной температуре в течение 6 часов и растворитель и избыток
хлорсульфоновой кислоты удаляют затем под вакуумом при 40oC. Полученный продукт используют далее без дополнительной очистки.
д) 4-(4-Димeтилaминocульфoнил)
фeнoкcи-5-мeтилcульфoнил-2-мeтил бензоил-гуанидин
8,6 г гуанидин гидрохлорида растворяют в 90 мл DMF и добавляют по каплям при комнатной температуре раствор 9,5 г трет-бутоксида калия в 80 мл
DMF. Смесь перемешивают при комнатной температуре в течение 90 минут и затем добавляют раствор 3,4 г 4-(4-хлорсульфонил)фенокси-5-метилсульфонил-2-метилбензоилхлорида в 40 мл DMF. Реакционную смесь
перемешивают при комнатной температуре в течение 24 часов и затем выливают в 1 л насыщенного водного раствора NaHCO3. Полученный раствор экстрагируют 4 раза, используя каждый раз 250 мл
ЕЕ/MeOH, органическую фазу высушивают над Na2SO4 и растворитель удаляют под вакуумом. Хроматографией на силикагеле с использованием ЕЕ/MeOH, 10: 1 получат 49 мг
4-(4-диметиламиносульфонил)фенокси-5- метилсульфонил-2-метилбензоил-гуанидина в виде белой кристаллической массы. Т.пл.: 163-165oC.
Rf (EE/MeOH 5:1) = 0,31.
MS (ES): 455 (М+Н)+.
Кроме того, получают в виде белого вещества 120 мг 4-(4- анидиносульфонил) фенокси-5-метилсульфонил-2-метилбензойной кислоты.
Rf (EE/MeOH 5:1)= 0,06.
MS (ES): 428 (M+H)+.
Пример 51
4-(4-Гуанидинсульфонил)фенокси-5-метилсульфонил-2- метилбензоил-гуанидин
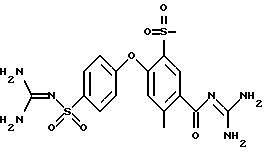
144 мг трет-бутоксида калия растворяют в 2 мл DMF добавляют при комнатной температуре раствор 135 мг гуанидин гидрохлорида в 2 мл DMF и смесь перемешивают в течение еще 45 минут. Кроме того, 110 мг 4-(4-гуанидинсульфонил)фенокси- 5-метилсульфонил-2- метилбензойной кислоты растворяют в 2 мл DMF, добавляют при комнатной температуре 46 мг карбонилдиимидазола и смесь перемешивают еще в течение 30 минут. Затем добавляют указанный выше раствор гуанидина и перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь вливают в 100 мл насыщенного водного раствора NaHCO3 и экстрагируют 3 раза, используя каждый раз 100 мл ЕЕ. Органическую фазу сушат над Na2SO4 и растворитель удаляют под вакуумом. Получают 70 мг белого пенистого вещества.
Rf (EE/MeOH 5:1) = 0,17.
MS (ES): 469(M+H)+.
Пример 52
4-(4-(2-диметиламиноэтил) фенокси)-2-метил-5-метилсульфонил
бензоил-гуанидин дигидрохлорид
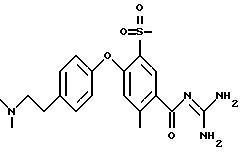
а) Метил 4-(4-(2-димeтилaминoэтил) фeнoкcи)-2-мeтил-5 -мeтилcульфонилбензоат
615 мг метил 4-бром-5-метилсульфонил -2-метилбензойной кислоты, 331 мг 4-(2-диметиламиноэтил)фенола и 2,0 г Cs2CO3 перемешивают при 100o C в течение 3 часов в 10 мл NMP. Затем смесь вливают в 75 мл насыщенного водного раствора NaHCO3, разбавляют 75 мл воды и экстрагируют 3 раза, используя каждый раз 100 мл ЕЕ. Органическую фазу высушивают над Na2SO4, растворитель удаляют под вакуумом и получают 680 мг бесцветного масла.
Rf (CH2Cl2/MeOH/AcOH/H2O 16:8:1:1) = 0,69.
MS (ES): 392 (M+H)+.
б) 4-(4-(2-Диметиламиноэтил) фенокси)-2-метил -5-метилсульфонилбензоил-гуанидин дигидрохлорид
873
мл гуанидингидрохлорида растворяют в 10 мл DMF и добавляют при комнатной температуре раствор 932 мг трет-бутоксида калия в 9 мл DMF. Смесь перемешивают при комнатной температуре в течение 3 часов,
затем добавляют 650 мг метил 4-(4-(2-диметиламиноэтил) фенокси)-2-метил-5-метил сульфонилбензоата в 10 мл DMF и смесь перемешивают при комнатной температуре в течение 12 часов. Реакционную смесь
вливают в 250 мл воды и 50 мл насыщенного водного раствора NaHCO3 и смесь экстрагируют 3 раза, используя каждый раз 100 мл ЕЕ. Органическую фазу высушивают над Na2SO4
и растворитель удаляют под вакуумом, получая 510 мг вязкого масла. Указанное масло растворяют в 15 мл ацетона, добавляют 4 мл 4 н. водного раствора HCl и удаляют под вакуумом летучие компоненты.
Получают 530 мг белых кристаллов. Т.пл.: 260oC (с разложением).
Rf (CH2Cl2/MeOH/AcOH/H2O 16:8:1:1) = 0,25.
MS (ES): 419 (M+H)+.
Пример 53
4-(4-Гуанидинсульфонил) фенокси-2-метил -5-трифторметилбензоил гуанидин
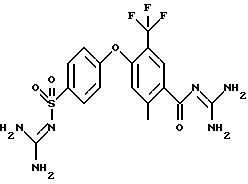
а) 4-Бром-2-метил-5-нитробензойная кислота
11 г 4-бром-2-метилбензойной кислоты растворяют в 70 мл 96% серной кислоты и добавляют по каплям при 0oC 70 мл 65% азотной кислоты, после чего смесь перемешивают при 0oC в течение 3 часов. Затем смесь выливают в 500 г льда, перемешивают в течение 1 часа, продукт отсасывают и высушивают под вакуумом. Получают 14,4 г белых кристаллов. T.пл. 162oC. Кроме желательных стереоизомеров, с помощью ЯМР-спектроскопии также обнаруживают примерно 20% 4-бром-2-метал-3-нитробензойной кислоты.
MS (DCI): 260 (M+H)+.
б) Метил 4-бром-2-метил-5-нитробензоат
14,3 г 4-бром-2-метил-5-нитробензойной
кислоты растворяют в 250 мл MeOH и медленно, по каплям добавляют 11,6 г SOCl2. Смесь выдерживают при комнатной температуре в течение 5 дней, летучие компоненты удаляют под вакуумом, и
остаток перекристаллизовывают из DIP. Получают 5,2 белых кристаллов. Т.пл.: 104oC.
Rf (ЕЕ/HEP 1:4) = 0,26.
MS (DCI): 274 (M+Н)+.
в) Метил 2-метил-5-нитро-4-фенилбензоат
22,6 г метил 4-бром-2-метил-5-нитробензоата, 23 г K2CO3 и 7,8 г фенола перемешивают при 120oC в течение
2 часов в 300 мл DMF. Растворитель удаляют под вакуумом, добавляют 2 л воды, подводят pH смеси до 7 с использованием водного раствора HCl и затем экстрагируют 3 раза с использованием каждый раз 500 мл
ЕЕ. Органическую фазу высушивают над Na2SO4, растворитель удаляют под вакуумом и получают с помощью хроматографии на силикагеле, используя ЕЕ/HEP, 1:4, 13 г бесцветного масла.
Rf (EE/HEP 1:4) = 0,18.
MS (DCI): 288 (M+H)+.
г) Метил 5-амино-2-метил-4-фенилбензоат
13 г метил
2-метил-5-нитро-4-фенилбензоата растворяют в 150 мл MeOH и обрабатывают с использованием 10 г порошка железа. Затем медленно добавляют по каплям насыщенный водный раствор HCl, и смесь перемешивают при
комнатной температуре в течение 2 часов. Летучие компоненты удаляют под вакуумом при максимальной температуре 30oC, добавляют 500 мл насыщенного водного раствора NaHCO3,
отфильтровывают соли железа и фильтрат экстрагируют 3 раза с использованием каждый раз 500 мл ЕЕ. Органическую фазу высушивают над Na2SO4 и растворитель удаляют под вакуумом.
Получают 10 г бесцветного масла.
Rf (DIP) = 0,50.
MS (DCI): 258 (M+H)+.
д) Метил 5-йод-2-метил-4-фенилбензоат
10 г
метил 5-амино-2-метил-4-фенилбензоата суспендируют при 0oC в 200 мл полуконцентрированного водного раствора серной кислоты и медленно по каплям при температуре 5oC добавляют 2,95
г NaNO2 в 50 мл воды. Смесь перемешивают при температуре от 0 до 5oC в течение 15 минут и затем суспензию выливают частями в теплый раствор при 50oC 65 г NaI в 300 мл
воды. Смесь экстрагируют 3 раза с использованием каждый раз 300 мл ЕЕ, органическую фазу высушивают над Na2SO4 и растворитель удаляют под вакуумом. Хроматографией на силикагеле с
использованием ЕЕ/HEP, 1:4 получают 5,8 г бледно-желтого масла.
Rf (ЕЕ/HEP 1:4) = 0,39.
MS (DCI): 369 (М+Н)+.
е) Метил
2-метил-4-фенил-5-трифторметилбензоат
5,8 г метил 5-йод-2-метил-4-фенилбензоата, 4,8 г трифторацетата калия и 6,6 г CuI добавляют к 300 мл толуола и 100 мл DMF и толуол отгоняют из смеси на
бане с температурой 160oC. Таким образом раствор DMF освобождают от следов воды и затем нагревают при температуре кипения с обратным холодильником в течение 8 часов. Снова добавляют 4,8 г
трифторацетата калия и 6,6 г CuI, а также 100 мл толуола, толуол отгоняют и смесь нагревают при температуре с обратным холодильником в течение 4 часов. Реакционную смесь добавляют к 500 мл воды и
экстрагируют 3 раза с использованием каждый раз 200 мл ЕЕ. Хроматографией на силикагеле с использованием ЕЕ/HEP, 1:8, получают 2,66 г бесцветного масла.
Rf (ЕЕ/HEP 1:8) = 0,25.
MS (DCI): 311 (М+Н)+.
ж) 2-Метил-4-фенил-5-трифторметилбензойная кислота
2,6 г метил 2-метил-4-фенил-5-трифторметилбензоата растворяют в 100 мл MeOH,
добавляют 20 мл 1 н. водного раствора NaOH и раствор перемешивают при комнатной температуре в течение 8 часов.
Реакционную смесь вливают в 100 мл насыщенного водного раствора NaHCO3 и экстрагируют 3 раза с использованием каждый раз 100 мл ЕЕ. Органическую фазу высушивают над Na2SO4 и растворитель удаляют под вакуумом. Получают 1,93 г вязкого масла.
Rf (EE) = 0,08.
MS (DCI): 297 (М+Н)+.
з) 4-(4-Хлорсульфонил)фенил -2-метил-5-трифторметилбензойная кислота
1,0 г
2-метил-4-фенил -5-трифторметилбензойной кислоты растворяют в 50 мл CH2Cl2 и медленно по каплям добавляют при комнатной температуре 1,1 мл хлорсульфокислоты. Смесь перемешивают
при комнатной температуре в течение 1 часа, добавляют к 100 г льда продукт отсасывают и высушивают под вакуумом. Получают 1,1 г бесцветного твердого вещества, которое используют далее в полученном
виде.
и) 4-(4-Хлорсульфонил)фенил- 2-метил-5-трифторметилбензоил-хлорид
1,1 г 4- (4-хлорсульфонил)фенил -2-метил-5-трифторметилбензойной кислоты растворяют в 15 мл SOCl2 и добавляют 0,4 мл DMF. Смесь нагревают при температуре кипения с обратным холодильником в течение 5 часов и удаляют под вакуумом летучие компоненты. Получают 1,1 г вязкого масла, которое
далее используют непосредственно в полученном виде.
к) 4-(4-Гуанидинсульфонил)фенокси-2 -метил-5- трифторметилбензоил-гуанидин
3,4 г гуанидин гидрохлорида растворяют в 100 мл
DMF добавляют 3,3 трет-бутоксида калия, и смесь перемешивают при комнатной температуре в течение 1 часа. К указанному раствору добавляют по каплям раствор 1,1 г
4-(4-хлорсульфонил)фенил-2- метил-5-трифторметилбензоилхлорида в 50 мл DMF. Смесь перемешивают при комнатной температуре в течение 90 минут и выдерживают в течение 18 часов. Растворитель удаляют под
вакуумом, остаток смывают 100 мл воды и раствор экстрагируют 3 раза, используя каждый раз 100 мл ЕЕ. Органическую фазу высушивают над Na2SO4 и растворитель удаляют под вакуумом.
Хроматографией на силикагеле с использованием ЕЕ/MeOH, 5:1, получают 354 мг бесцветных кристаллов. Т.пл.: 160-164oC (с разложением).
Rf (EE/MeOH 5:l) = 0,26.
MS (ES): 459 (M+H)+.
Пример 54
2-Хлор-4-(4-(2-диметиламиноэтил) фенокси)-5- метилсульфонил бензоил-гуанидин

а) 2-Хлор-5-хлорсульфонил -4-фторбензойная кислота
17,5 г 2-хлор-4-фторбензойной кислоты добавляют порциями к 67 мл хлорсульфоновой кислоты и смесь перемешивают при 95oC в течение 10 часов. Реакционную смесь медленно, по каплям добавляют к 600 г льда, и осадок отсасывают, промывают 3 раза с использованием каждый раз 200 мл воды и высушивают под вакуумом. Получают 20,3 г бесцветного твердого вещества. Т.пл.: 137oC.
Rf (DIP 2% HOAc) = 0,44.
MS (DCI): 273 (М+Н)+.
б) Метил 2-хлор-4-фтор-5- метилсульфонилбензоат
11,6 г Na2CO3 растворяют в 44 мл воды и добавляют порциями
при 70oC 20,1 г 2-хлор-5-хлорсульфонил-4-фторбензойной кислоты, поддерживая при этом значение pH в диапазоне от 9 до 10 при добавлении по каплям 10 н. водного раствора NaOH. Реакционную
смесь перемешивают при 70oC в течение 2,5 часа, вливают в 300 мл 6 н. водного раствора HCl и осадок отсасывают. Указанный осадок промывают 3 раза с использованием каждый раз 50 мл воды и
водную фазу экстрагируют 3 раза с использованием каждый раз 200 мл ЕЕ Органическую фазу высушивают над Na2SO4, растворитель удаляют под вакуумом и остаток соединяют с осадком,
получая в результате 14,6 г карбоксисульфиновой кислоты. Указанный продукт смывают с использованием 61 мл 2 н. водного раствора NaOH, и воду удаляют под вакуумом, получая 20,9 г двунатриевой соли.
Указанный продукт суспендируют в 150 мл DMF добавляют 16,2 мл метилиодида, и смесь перемешивают при 60oC в течение 3 часов. Реакционную смесь вливают в 800 мл 2 н. водного раствора HCl и
экстрагируют 6 раз с использованием каждый раз 200 мл ЕЕ. Органическую фазу промывают еще 2 раза с использованием каждый раз 400 мл насыщенного водного раствора NaHCO3, высушивают над
Na2SO4 и растворитель удаляют под вакуумом. Хроматографией на силикагеле с использованием ЕЕ/HEP, 1:4, получают 2,0 г бесцветного твердого вещества. Т.пл.: 139oC.
Rf (ЕЕ/HEP 1:1) = 0,40.
MS (DCI): 267 (M+H)+.
в) Метил 2- хлор-4-(4-(2-диметиламиноэтил) фенокси)-5- метилсульфонилбензоат
534 мг метил 2-хлор-4-фтор-5-метилсульфонилбензоата, 331 мг 4-(2-диметиламиноэтил)фенола и 2,0 г растворяют в 10 мл NMP, и смесь перемешивают при 100oC в течение 3 часов. Реакционную смесь
вливают в 150 мл насыщенного водного раствора NaHCO3 и экстрагируют 3 раза, используя каждый раз 100 мл ЕЕ. Органическую фазу высушивают над Na2SO4 и растворитель
удаляют под вакуумом. Хроматографией на силикагеле с использованием ЕЕ/MeOH, 3:1, получают 240 мг вязкого масла.
Rf (ЕЕ/MeOH 3:1) = 0,11.
MS (ESI): 412 (М+Н)+.
г) 2-Хлор-4-(4-(2- диметиламиноэтил)фенокси)-5- метилсульфонилбензоил-гуанидин
268 мг гуанидин гидрохлорида растворяют в 3 мл DMF и добавляют раствор 286
мг трет-бутоксида калия в 3 мл DMF. Смесь перемешивают при комнатной температуре в течение 3 часов и затем добавляют раствор 210 мл метил
2-хлор-4-(4-(2-диметаламиноэтил)фенокси)-5-метилсульфонилбензоата в 4 мл DMF. Смесь перемешивают при комнатной температуре в течение 3 часов и выдерживают при комнатной температуре в течение 18 часов.
Смесь выливают в 150 мл воды и экстрагируют 3 раза с использованием каждый раз по 100 мл ЕЕ. Органическую фазу высушивают над Na2SO4 и растворитель удаляют под вакуумом. Получают
230 мг стекловидного твердого вещества.
Rf (CH2Cl2/MeOH/H2O/AcOH 16:8:1:1) = 0,53.
MS (ESI): 439 (M+H)+.
Пример 55
2-Хлор-4-(4-(2- диметиламиноэтил)фенокси)-5- трифторметилбензоил-гуанидин
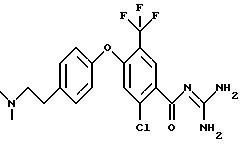
Пример 56
2-Хлор-4-(4-(2- диметиламиноэтил)фенокси) -5-йодбензоил-гуанидин
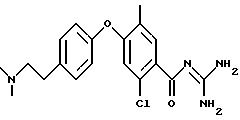
а) 2-Хлор-4-фтор-5-йодбензойная кислота
17,5 г 2-хлор-4-фторбензойной кислоты растворяют в 50 мл трифторметансульфокислоты и добавляют порциями при 0oC 22,5 г N-йодсукцинимида. Смесь перемешивают при 0oC в течение 1 часа и затем еще 1 час при комнатной температуре. Добавляют 4,5 г N-йодсукцинимида, и смесь перемешивают при комнатной температуре еще 2,5 часа. Реакционную смесь добавляют к 400 г льда, перемешивают в течение 30 минут и продукт отсасывают. Полученный продукт промывают 2 раза с использованием каждый раз 200 мл воды и высушивают под вакуумом. Получают 30,8 г бесцветного твердого вещества.
Rf (EE/MeOH 5:1) = 0,71.
MS (DCI): 301 (M+Н)+.
б) Метил
2- хлор-4-фтор-5-йодбензоат
30,8 г 2-хлор-4-фтор-5-йодбензоат кислоты растворяют в 300 мл MeOH и добавляют по каплям 36 мл тионилхлорида. Смесь нагревают при температуре кипения с обратным
холодильником в течение 4 часов и удаляют под вакуумом летучие компоненты. Остаток отбирают с использованием 600 мл ЕЕ и промывают 400 мл полуконцентрированного водного раствора Na2SO4. Органическую фазу высушивают над Na2CO3 и растворитель удаляют под вакуумом. Остаток перемешивают с 200 мл HEP, осадок отфильтровывают и промывают 100 мл HEP. Получают 5,
8 мг метил 2-хлор-4-фтор-3,5-дийодбензоата. Т.пл.: 155oC.
Rf (ЕЕ/HEP 1:4) = 0,41.
MS (DCI): 411 (M+H)+.
Растворитель удаляют под вакуумом от фильтрата, содержащего желательный продукт, получая при этом 23,5 г белых кристаллов. Т.пл.: 52oC.
Rf (ЕЕ/HEP 1:4) = 0,47.
MS (DCI): 315 (M+H)+.
в) Метил 2-хлор-4-фтор-5-трифторметилбензоат
12,5 г метил 2-хлор-4-фтор-5-йодбензоата, 11,2 г трифторацетата калия, 15,6 г CuI
суспендируют в 320 мл DMF и 240 мл толуола и отгоняют толуол для удаления следов воды. Реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 2 часов, затем вливают в 1
л полуконцентрированного водного раствора NaHCO3 и экстрагируют 4 раза с использованием каждый раз 350 мл ЕЕ. Органическую фазу высушивают над Na2SO4 и растворитель
удаляют под вакуумом. Хроматографией на силикагеле с использованием ЕЕ/HEP, 1:8, получают 860 мг вязкого масла.
Оно содержит неотделяемое количество метил 2-хлор-4-фтор-5-йодбензоата.
Rf (ЕЕ/HEP 1:8)= 0,35.
MS (DCI): 257 (М+Н)+.
г) Метил
2-хлор-4-(4-(2-диметиламиноэтил)фенокси)-5- трифторметилбензоат
860 мг метил 2-хлор-4-фтор-5-трифторметилбензоата, 554 мг 4-(2-диметиламиноэтил)фенола и 3,3 г Cs2CO3
растворяют в 15 мл NMP, и смесь перемешивают при 60oC в течение 90 минут. Реакционную смесь вливают в 250 мл полуконцентрированного водного раствора NaHCO3 и экстрагируют 3 раза
с использованием каждый раз 150 мл ЕЕ. Органическую фазу высушивают над Na2SO4 и растворитель удаляют под вакуумом. Хроматографией на силикагеле с использованием ЕЕ/MeOH, 3:1,
получают 880 мг вязкого масла. Оно содержит неотделяемое количество метил 2-хлор-4-(4-(2-диметиламиноэтил) фенокси)-5-йодбензоата.
Rf (ЕЕ/MeOH 3:1)= 0,14.
MS (ESI): 402 (М+Н)+.
д) 2-Хлор-4-(4-(2-диметиламиноэтил) фенокси)-5- трифторметилбензоил-гуанидин
1,1 гуанидин гидрохлорида растворяют в 10 мл DMF и добавляют
раствор 1,2 г трет-бутоксида калия в 10 мл DMF. Смесь перемешивают при комнатной температуре в течение 2 часов, затем добавляют раствор метил 2- хлор-4-(4-(2- диметиламиноэтил)фенокси)
-5-трифторметилбензоата в 10 мл DMF, и смесь перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь выливают в 250 мл воды и продукт отфильтровывают. Хроматографией осадка на
силикагеле с использованием ацетона/MeOH, 20:1 + 2% триэтиламина, получают 130 мг целевого соединения в виде белых кристаллов. Т.пл.: 141oC.
Rf (ацетон/MeOH, 15:1 + 2% триэтиламина) = 0,28.
MS (ESI): 429 (М+Н)+.
Кроме того, получают 390 мг соединения примера 55: 2-хлор-4-(4-(2-диметиламиноэтил) фенокси)-5-йодбензоил-гуанидина в виде белых кристаллов, т. пл.: 150oC.
Rf (ацетон/MeOH, 15:1+2%триэтиламина) = 0,23.
MS (ESI): 487 (М+Н)+.
Пример 57
2-Хлор-4-(4-гуанидинсульфонил)фенокси-5- метилсульфонилбензоил-гуанидин
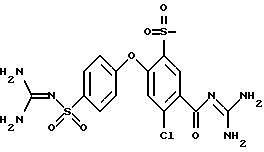
Пример 58
2-Диметиламино-4-(4-гуанидинсульфонил)-фенокси-5- метилсульфонилбензоил-гуанидин
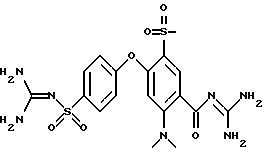
Пример 59
2-Диметиламино-4-(4-диметиламиносульфонил) -фенокси-5- метилсульфонилбензоил-гуанидин
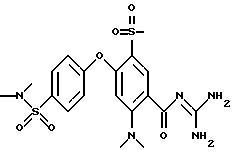
Пример 60
2-Хлор-4-(4-диметиламиносульфонил) фенокси-5- метилсульфонилбензоил-гуанидин
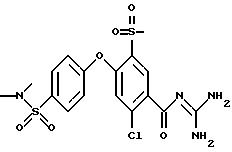
а) Метил 2-хлор-4-фенокси -5-метилсульфонилбензоат
2,7 г метил 2-хлор-4-фтор-5 -метилсульфонилбензоата (пример 53б), 1,2 г фенола и 4,1 г K2CO3 перемешивают при 60oC в течение 75 минут 30 мл NMP. Реакционную смесь вливают в 300 мл воды и экстрагируют 3 раза, с использованием каждый раз 200 мл ЕЕ. Органическую фазу промывают еще 2 раза с использованием каждый раз 150 мл воды, высушивают над Na2SO4 и растворитель упаривают под вакуумом. Получают 3,4 г бесцветного масла.
Rf (ЕЕ/толуол 1:2) = 0,71.
MS (DCI): 341 (М+Н)+.
б)
2-Хлор-4-фенокси-5 -метилсульфонилбензойная кислота
3,4 г метил 2-хлор-4-фенокс -5-метилсульфонилбензоата растворяют в 40 мл MeOH и добавляют 9,9 мл 2 н. водного раствора NaOH. Смесь
перемешивают при комнатной температуре в течение 4 часов, доводят значение pH до 1-2, с использованием 2 н. водного раствора HCl и экстрагируют 3 раза с использованием каждый раз 150 мл ЕЕ.
Органическую фазу высушивают над Na2SO4 и растворитель удаляют под вакуумом, получая 2,9 г белых кристаллов. Т.пл.: 200oC.
Rf(ЕЕ) = 0, 17.
MS (DCI): 327 (М+H)+.
в) 2-Хлор-4-(4-хлорсульфонил) фенокси-5-метилсульфонилбензойная кислота
2,9 г 2-хлор-4-фенокси-5
-метилсульфонилбензойной кислоты растворяют в 44 мл CHCl3, добавляют по каплям 5,9 мл хлорсульфокислоты, и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь
вливают в 300 г льда и экстрагируют 3 раза с использованием каждый раз 150 мл ЕЕ. Органическую фазу высушивают над CHCl3 и растворитель удаляют под вакуумом. Получают 3,1 г аморфного
твердого вещества.
Rf (DIP, 2%HOAc) = 0,06.
MS (ESI): 425 (M+H)+.
г) 2-Хлор-4- (4-хлорсульфонил)фенокси
-5-метилсульфонилбензоилхлорид
3,0 г 2-хлор-4-(4-хлорсульфонил) фенокси-5- метилсульфонилбензойной кислоты обрабатывают 36 мл SOCl2 и нагревают при температуре кипения с обратным
холодильником в течение 4 часов и 20 минут. Под вакуумом удаляют летучие составляющие и получают 3,2 г вязкого масла, которое непосредственно используют далее для реакции.
д)
2-Хлор-4-(4-гуанидинсульфонил) фенокси-5- метилсульфонилбензоил-гуанидин и 2-диметиламино-4-(4- гуанидинсульфонил)фенокси -5-метилсульфонилбензоил-гуанидин и
2-диметиламино-4-(4-диметиламиносульфонил) фенокси-5- метилсульфонилбензоил-гуанидин и
2-хлор-4-(4-диметиламиносульфонил)фенокси -5- метилсульфонилбензоил-гуанидин
7,5 г гуанидин
гидрохлорида растворяют в 80 мл DMF и добавляют при комнатной температуре раствор 8,0 г трет-бутоксида калия в 70 мл DMF. Смесь перемешивают при комнатной температуре в течение 1 часа, затем добавляют
по каплям раствор 3,2 г 2-хлор-4-(4-хлорсульфонил) фенокси-5-метилсульфонилбензоилхлорида в 40 мл DMF и смесь перемешивают при комнатной температуре в течение 12 часов и затем выдерживают в течение
ночи. Реакционную смесь вливают в 1 л воды и экстрагируют 6 раз с использованием каждый раз 200 мл ЕЕ. Органическую фазу высушивают над Na2SO4 и растворитель удаляют под вакуумом,
получая 1,8 г грубой смеси 4 целевых соединений. Хроматографией на силикагеле с использованием градиента от ЕЕ/MeOH, 10:1, до ЕЕ/MeOH, 1:1, получают 350 мг 2-хлор-4-(4-гуанидинсульфонил)фенокси
-5-метилсульфонилбензоил-гуанидина. Т.пл.: 95-97oC.
Rf (EE/MeOH 3:l) = 0,11.
MS (ESI): 489 (M+H)+.
90 мг 2-диметиламино-4-(4- гуадидинсульфонил)фенокси -5- метилсульфонилбензоил-гуанидина. Т.пл.: 127-128oC.
Rf (EE/MeOH 1:1) = 0,10.
MS (ESI): 498 (М+Н)+.
170 мг 2-диметиламино-4-(4-диметиламиносульфонил)фенокси-5- метилсульфонилбензоил-гуанидина. Т.пл.: 150-151oC.
Rf (EE/MeOH 3:1) = 0,06.
MS (ESI): 484 (М+Н)+.
40 мг 2-хлор-4-(4-диметиламиносульфонил)фенокси-5- метилсульфонилбензоил-гуанидина, аморфного.
Rf (EE/MeOH 3:1) = 0,36.
MS (ESI): 475 (М+Н)+.
Пример 61
4-(4-(2-Трет-бутоксикарбониламиноэтил)фенокси
-2-метил-5- метилсульфонилбензоил-гуанидин
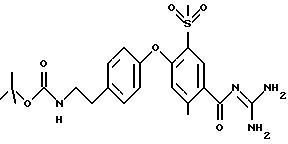
а) Метил 4-4-(2-трет-бутоксикарбониламиноэтил) фенокси-2- метил-5-метилсульфонилбензоат
2,4 г трет-бутоксикарбонилтирамина, 3,1 г 4-бром-5- метилсульфонил-2-метилбензоата (пример 49б) и 4,2 г K2CO3, перемешивают при 100oC в течение 26 часов в 45 мл в NMP. Реакционную смесь разбавляют 400 мл полуконцентрированного водного раствора NaHCO3 и экстрагируют 4 раза с использованием каждый раз 125 мл ЕЕ. Органическую фазу высушивают над Na2SO4 и растворитель удаляют под вакуумом. Хроматографией на силикагеле с использованием DIP получают 3,4 г белых кристаллов. Т.пл.: 130oC.
Rf (DIP) = 0,12.
MS (ESI): 464 (M+H)+.
б) 4-(4-(2-Трет-бутоксикарбониламиноэтил)фенокси
-2-метил-5- метилсульфонилбензоил-гуанидин
3,8 г гуанидин гидрохлорида растворяют в 40 мл DMF и добавляют при комнатной температуре раствор 4,1 г трет-бутоксида калия в 36 мл DMF. Раствор
перемешивают при комнатной температуре в течение 75 минут, затем указанный раствор добавляют по каплям к раствору 3,4 г метил 4-(4-(2-трет-бутоксикарбониламиноэтил)фенокси -2-метил-5- метилсульфонил
бензоата в 36 мл DMF. Смесь перемешивают при комнатной температуре в течение 6 часов и затем выдерживают в течение ночи. Реакционную смесь вливают в 500 мл полуконцентрированного водного раствора
NaHCO3 и экстрагируют 5 раз с использованием каждый раз 150 мл ЕЕ. Органическую фазу промывают затем еще 2 раза с использованием каждый раз 200 мл полуконцентрированного водного раствора
NaHCO3, высушивают над Na2SO4 и растворитель удаляют под вакуумом. Остаток перекристаллизовывают из ЕЕ и получают 530 мг белых кристаллов. Т.пл.: 205oC.
Растворитель удаляют под вакуумом от маточного раствора, остаток хроматографируют на силикагеле с использованием ЕЕ/MeOH, 10:1, и получают 2,31 г аморфного пенистого вещества, которое не отличается от
кристаллической фракции при хроматографии в тонком слое.
Rf (EE/MeOH 10:1) = 0,30.
MS (FAB): 491 (M+H)+.
Пример 62
4-(4-(2-Аминоэтил)фенокси-2- мегал-5-метилсульфонилбензоил-гуанидин
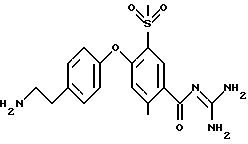
2,3 г 4-(4-(2-трет-бутоксикарбониламиноэтил) фенокси-2-метил- 5-метилсульфонилбензоил-гуанидина растворяют в 12 мл CF3SO3H при 0oC и смесь перемешивают при указанной температуре в течение 150 минут. Реакционную смесь добавляют по каплям к 400 мл охлажденного на льду насыщенного водного раствора Na2CO3 и экстрагируют 10 раз с использованием каждый раз 200 мл ЕЕ. Органическую фазу высушивают над Na2SO4 и растворитель удаляют под вакуумом. Хроматографией на силикагеле с использованием CH2Cl2 /MeOH/AcOH/H2O, 32:8:1: 1, получают 110 мг аморфного твердого вещества.
Rf (ацетон/MeOH/15:1,2% триэтиламина) = 0,37.
MS (ESI): 391 (M+H)+.
Пример 63
4-(4-(2-Ацетиламиноэтил)фенокси -3-метилсульфонилбензоил-гуанидин
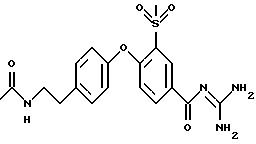
а) Метил 4-(4-(2-ацетиламиноэтил)фенокси-3- метилсульфонилбензоат
2,3 г метил 3-метилсульфонил-4-(4-(2-трет- бутоксикарбониламиноэтил)фенокси)бензоата растворяют в 30 мл CH2Cl2 и добавляют 35 мл фторуксусной кислоты. Смесь перемешивают при комнатной температуре в течение 90 минут и выдерживают в течение ночи. Реакционную смесь вливают затем в 150 мл насыщенного водного раствора полуконцентрированного водного раствора Na2CO3 и экстрагируют 3 раза с использованием каждый раз 100 мл ЕЕ. Органическую фазу высушивают над Na2SO4 и растворитель удаляют под вакуумом. Остаток отбирают с использованием 35 мл триэтиламина и добавляют по каплям при комнатной температуре 1,1 мл ацетилхлорида. Смесь перемешивают при комнатной температуре в течение 90 минут и выдерживают в течение ночи и затем кипятят с обратным холодильником в течение 45 минут. После этого реакционную смесь вливают в 150 мл насыщенного водного раствора NaHCO3 и экстрагируют 3 раза с использованием каждый раз 100 мл ЭА. Органическую фазу высушивают над Na2SO4, растворитель удаляют под вакуумом и остаток хроматографируют на силикагеле с использованием ЕЕ. Получают 770 мг бесцветного твердого вещества Т.пл.: 151oC.
Rf(ЕЕ) = 0,12.
MS (ESI): 392 (М+Н)+.
б) 4-(4-(2-Ацетиламиноэтил)фенокси -3-метилсульфонилбензоил-гуанидин
740 мг метил 4-(4-(2-ацетиламиноэтнл)фенокси
-3-
метилсульфонилбензоата гуанилируют с использованием синтеза бензоил-гуанидинов, вариант B и получают 540 мг аморфного твердого вещества. Т.пл.: (гидрохлорид) 215-216oC.
Rf (EE) = 0,025.
MS (ESI): 419 (M+H)+.
Целевые соединения примеров 64 и 65 синтезируют аналогично примеру 63.
Пример 64
4-(4-(2-Бензоиламиноэтил)фенокси -3-метилсульфонилбензоил-гуанидин
Т.пл.: (гидрохлорид) > 266oC.
Rf (ЕЕ) = 0,06.
MS (ESI): 481 (М+Н)+.
Пример 65
3
метилсульфонил-4-(4-(2-(3- фенилпропионил)аминоэтил) феноксибензоил-гуанидин
Т.пл.: (гидрохлорид) 266oC.
Rf (ЕЕ) = 0,036.
MS (ESI): 509 (M+H)+.
Пример 66
4-(4-(2-Ацетиламиноэтил)фенокси
-2-метил-5- метилсульфонилбензоил-гуанидин
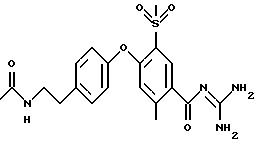
а) Метил 4-(4-(2-ацетиламиноэтил) фенокси-2-метил-5- метилсульфонилбензоат
1,5 г метил 4-бром-5-метилсульфонил -2- метилбензоата, 0,9 г Вос-тир амина и 2,1 г K2CO3, перемешивают при 100oC в течение 9 часов в 25 мл NMP. Реакционную смесь вливают в 300 мл полуконцентрированного водного раствора NaHCO3, экстрагируют 4 раза с использованием каждый раз 200 мл ЕЕ и промывают 3 раза с использованием каждый раз 150 мл воды. Органическую фазу высушивают над Na2SO4, растворитель удаляют под вакуумом, и остаток хроматографируют на силикагеле с использованием ЕЕ. Получают 1,5 г бесцветного твердого вещества. Т.пл.: 151oC.
Rf (ЕЕ) = 0,19.
MS (ESI): 406 (М+Н)+.
б)
4-(4-(2-Ацетиламиноэтил)фенокс-2 -метил-5- метилсульфонилбензоил-гуанидин
1,1 г гуанидин гидрохлорида растворяют в 11 мл DMF и добавляют при комнатной температуре раствор 1,1 г трет-бутоксида
калия в 10 мл DMF. Смесь перемешивают при комнатной температуре в течение 75 минут, затем добавляют раствор 0,8 г метил 4-(4-(2-ацетиламиноэтил)фенокси-2-метил-5-метилсульфонилбензоата в 10 мл DMF, и
смесь перемешивают при комнатной температуре в течение 10 часов и затем выдерживают в течение ночи. Реакционную смесь вливают в 200 мл воды, осадок отфильтровывают и высушивают. Получают 640 мг
бесцветного твердого вещества. Т.пл.: 150oC.
Rf (EE/MeOH 5:1) = 0,13.
MS (ESI): 433 (M+H)+.
Фармакологические
данные
Ингибирование Na+/H+-обменника кроличьих эритроцитов
Белые новозеландские кролики получали стандартное питание с 2% холестерина в течение шести недель
для того, чтобы активировать Na+/H+-обмен и таким образом иметь возможность пламенно-фотометрически определять приток Na+ в эритроциты через Na+/H+-обмен. Кровь брали из ушных артерий и с помощью 25 IE калий-гепарина делали несвертываемой. Часть каждой пробы использовали для двойного определения гематокрита путем центрифугирования.
Аликвоты соответственно по 100 мкл служили для измерения исходного содержания Na+ в эритроцитах.
Для определения чувствительного к амилориду притока натрия инкубировали 100 мкл каждой пробы крови каждая в 5 мл гиперосмолярной солесахарной среды (ммоль/л; 140 NaCl, 3 KCl, 150 сахароза, 0,1 уабаина, 20 трис-гидроксиметиламинометана) при pH 7,4 и 37oC. Эритроциты затем трижды промывали ледяным раствором MgCl2-уабаина (ммоль/л; 112 MgCl2, 0,1 уабаина) и гемолизировали в 2,0 мл дестиллированной воды. Определяли внутриклеточное содержание натрия пламенно-фотометрическим методом.
Нетто-приток Na+ подсчитывали по разности между исходными значениями натрия и содержанием натрия в эритроцитах после инкубации. Из разности между содержанием натрия в эритроцитах после инкубации с амилоридом и без него было определено, что ингибируемый амилоридом приток натрия составил 3 x 10-4 моль/л. Таким же образом проводили определения и с соединениями согласно изобретению (табл. 1 и 2).
Исследование цитотоксических свойств тестируемых соединений проводили с использованием нетрансфицированных LAP1-клеток. Накануне измерения 60 внутренних лунок 96-луночного микротитрационного планшета заполняли каждую 30000 LАР1-клеток. Внешние лунки (36) не содержали клеток. Для определения цитотоксичности сначала отбирали среду роста и клетки промывали физиологическим раствором с фосфатным буфером.
Затем к клеткам добавляли 100 мкл восстанавливающего раствора (133,8 ммоль NaCl, 4,7 ммоль KCl, 1,25 ммоль CaCl2, 1,25 ммоль MgCl2, 0,97 ммоль Na2HPO4, 0,23 ммоль NaH2PO4, 5 ммоль Hepes, 5 ммоль глюкозы и 1 моль NaOH) со значением pH 7,0, который содержал преимущественно 500 мкмоль/л тестируемого соединения. После инкубирования в течение часа при температуре 37oC отбирали восстанавливающий раствор, и выделяли клетки после промывания физиологическим раствором с фосфатным буфером и средой, которая по данным изготовителя содержала все компоненты клеточно-пролиферативного набора фирмы Boehringer Mannheim.
Абсорбцию каждой лунки микротитрационного планшета определяли на следующий день с помощью фотометра Spectra Мах (MWG Biotech) при длине 450 нм и 650 нм.
Разница в величине абсорбции (A450нм-A650нм) была определена для всех лунок. Среднее значение всех лунок, которые не содержали клеток (n=36), соответствует 0% выживших. Среднее значение (по измерению между n=6 и n=18) всех лунок, содержащих клетки, к которым не добавляли соединения, которые также могли беспрепятственно расти, было принято за 100% выживших. C помощью этих величин исходя из среднего значения абсорбции тестируемых соединений (n=3) могли рассчитать процент выживших.
Заявитель приводит данные для всех примеров, имеющихся в описании заявки (см. табл. 3).
В табл. 4 приведены данные по цитотоксичности соединений, полученных согласно примерам.
Реферат
Описываются новые замещенные основанием бензоилгуанидины формулы I, в которой один из трех заместителей R(1), R(2) и R(3) имеет значение R(6)-A-B-D-, где R(6) - основной протонируемый остаток, т. е. аминогруппа - NR(7)R(8), аминогруппа R(7)R(8)N-C/= N-R(9)/ или гуанидиногруппа (a), где R(7), R(8), R(9) и R(10) независимо один от другого означают водород или алкил с 1-4 C-атомами или R(7) и R(8) вместе означают CaH2a, где a = 4, 5, 6 или 7, причем в случае если a = 5, 6 или 7, одна метиленовая группа группы CaH2a может быть заменена гетероатомной группой O, или NR(11), или R(8) и R(9), или R(9) и R(10), или R(7) и R(10) означают группу CaH2a, где a = 2, 3, 4 или 5, причем в случае если a = 3, 4 или 5, одна метиленовая группа группы CaH2a может быть заменена гетероатомной группой O или NR(11), где R(11) - водород или метил; или R(6) - имидазолил, дигидроимидазолил, бензимидазолил, пиридил, хинолил, пирролидинил или фенил, которые в случае необходимости замещены (C1-C4)-алкилом, A - Cb H2b; b = 1 - 10, целое число; причем в группе CbH2b одна или две метиленовые группы могут быть заменены одной из группировок, выбранных из (d) или -SOaa /NR(19)/bb-, где aa = 1 или 2; bb = 0 или 1; aa + bb = 2; R(19) - водород или алкил с 1-4 C-атомами; R(20) - водород или метил; B - фениленовый остаток формулы II, где R(12) и R(13) - водород, D - CdH2d-Xf-, где d = 0, X - -O-, f = 1, и соответственно другие заместители R(1) и R(3) независимо один от другого означают водород, F, Cl, Br, I, (C1-C8)-алкил, или R(17)-CgHg-SO2, g = 0, 1, 2, 3 или 4, где R(17) - водород или CkF2k+1-, k = 1, 2 или 3; R(4) и R(5) - водород, а также их фармакологически переносимые соли. Описывается также способ их получения, фармацевтический состав, способ его получения и способ ингибирования клеточного Na+/H+ -антипортера. Соединения могут найти применение в качестве лекарственного средства при заболеваниях сердечно-сосудистой системы. 5 с. и 4 з.п. ф-лы, 4 табл.
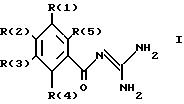
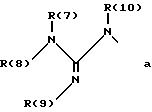
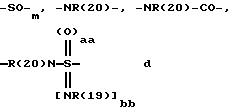
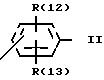
Формула
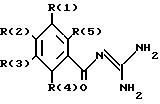
в которой один из трех заместителей R(1), R(2) и R(3) имеет значение R(6)-A-B-D-, где R(6) - основной протонируемый остаток, т.е. аминогруппа -NR(7)-R(8), амидиногруппа R(7)R(8)N-C/=N-R(9)/ или гуанидиногруппа
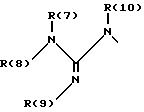
где R(7), R(8), R(9) и R(10) независимо один от другого - водород или алкил с 1 - 4 С-атомами или R(7) и R(8) вместе означают СаН2а, где а = 4,5,6 или 7, причем в случае если а = 5,7 или 7, одна метиленовая группа группы СаН2а может быть заменена гетероатомной группой О, или NR(11), или R(8) и R(9), или R(9) и R(10), или R(7) и R(10) означают группу СаН2а, где а = 2,3,4 или 5, причем в случае если а = 3,4 или 5, одна метиленовая группа группы Са Н2а может быть заменена гетероатомной группой О или NR(11), где R(11) - водород или метил; или R(6) - имидазолил, дигидроимидазолил, бензимидазолил, пиридил, хинолил, пирролидинил или фенил, которые в случае необходимости замещены (С1-С4)-алкилом; А - СbН2b, где в = 1 - 10, целое число, причем в группе СbН2b одна или две метиленовые группы могут быть заменены одной из группировок, выбранных из -SOm-, -NR(20)-, -NR(20)-CO-,
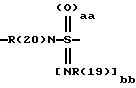
или -SOaa/NR(19)/bb-, где аа - 1 или 2, bb - 0 или 1, аа + bb = 2; R(19) - водород или алкил с 1 - 4 С-атомами; R(20) - водород или метил; В - фениленовый остаток
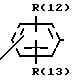
где R(12) и R(13) - водород, D -CdH2d-Xf, где d = 0, X - -O-, f = 1,
и соответственно другие заместители R(1) и R(2) и R(3) независимо один от другого означают водород, F, Cl, Br, I, (C1-C8)-алкил или R(17) - CgH2g-SO2, где g = 0, 1,2,3 или 4; R(17) - водород или CkF2k+1-, где к = 1,2 или 3;
R(4) и R(5) - водород,
а также их фармакологически переносимые соли.

где R(7), R(8), R(9) и R(10) независимо один от другого - водород или алкил с 1 - 4 С-атомами или R(7) и R(8) вместе означают СаН2а, где а = 4,5,6 или 7, причем в случае если а = 5,6 или 7, одна метиленовая группа группы СаН2а может быть заменена гетероатомной группой О или NR(11), или R(8) и R(9) - группа СаН2а, где а = 2,3,4 или 5, причем в случае если а = 3, 4 или 5, одна метиленовая группа группы СаН2а может быть заменена гетероатомной группой О или NR(11), где R(11) - водород или метил; или R(6) - имидазолил, пиридил-, хинолинил-; А - СbH2b, где b = 1,2,3,4,5, причем в группе СbН2b одна или две метиленовые группы могут быть заменены одной из группировок, выбранных из -SOm-, -NR(20)-, -NR(20)-CO-,
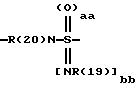
или -SOaa/NR(19)/bb, где аа = 1 или 2, bb = 0 или 1, аа + bb = 2,
R(19) - водород или алкил с 1 - 4 С атомами, R(20) - водород или метил, В - фениленовый остаток
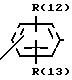
где R(12) и R(13) - водород, D - -СdH2d-Xf, где d = 0, X - -O-, f = 1,
и соответственно другие заместители R(2) и R(3) независимо один от другого - водород, F, Cl, (C1-C4)-алкил; R(4) и R(5) - водород.
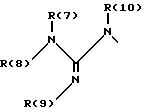
где R(7) - водород или алкил с 1,2,3 или 4 С-атомами;
R(8), R(9) и R(10) независимо один от другого - водород, метил или этил;
или R(7) и R(8) вместе - СаН2а, где а = 4 или 5, причем в случае если а = 5, одна метиленовая группа группы СaН2а может быть заменена на NR(11), где R(11) - водород или метил;
или R(6) - имидазолил - или пиридил, А - СbН2b, где в = 1,2,3,4 или 5, причем в группе СbН2b одна или две метиленовые группы могут быть заменены одной из группировок, выбранных из -NR(20)-CO-,
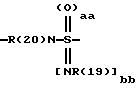
или -SOaa/NR(19)/bb-, где аа = 1 или 2, bb = 0 или 1, аа + bb = 2,
R(19) - водород или алкил с 1 - 4 С атомами, R(20) - водород или метил, В - фениленовый остаток
где R(12) и R(13) - водород,
D - -CH2-, -O-, -CO-,
и каждый другой остаток R(2) и R(3) - водород, R(4) и R(5) - водород.
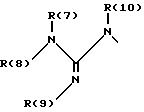
R(7) - водород или алкил с 1,2,3 или 4 С-атомами;
R(8), R(9) и R(10) независимо один от другого - водород, метил или этил;
или R(7) и R(8) вместе означают СаН2а, где а = 4 или 5, причем в случае если а = 5, одна метиленовая группа группы СаН2а может быть заменена на -NH- или -NCH3-,
или R(6) - имидазолил-; А - СbН2b, где b = 1,2,3 или 4, причем в группе СbН2b одна или две метиленовые группы могут быть заменены на
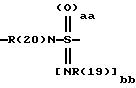
или -SOaa/NR(19)/bb-, где аа = 1 или 2, bb = 0 или 1, аа + bb = 2, R(19) - водород или алкил с 1-4 С-атомами; R(20) - водород или метил,
В - фениленовый остаток
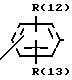
где R(12) и R(13) - водород;
и каждый другой остаток R(2) и R(3) - водород; R(4) и R(5) - водород.
4-/4-N - (диметиламиноэтил) метилсульфамоил/фенокси - 3-трифторметил-бензоилгуанидина, дигидрохлорид; 4-/4-(4-метилпиперазиносульфонил)фенокси/-3-трифторметилбензоилгуанидина дигидрохлорид; 4-/4-(2-пиролидинэтиламиносульфонил)фенокси/-3-трифторметилбензоилгуанидина дималеинат; 4-/4-(2-пиперидинэтиламиносульфонил)фенокси/-3-трифторметилбензоилгуанидина дималеинат; 4-/4-(N-диметиламино-н-пропил)сульфамоил/фенокси-3-трифторметилбензоилгуанидин; 4-/4-(N-диметиламиноэтил)сульфамоил/фенокси-3-трифторметилбензоилгуанидин; 4-(4-имидамидосульфонил)фенокси-3-трифторметилбензоилгуанидин; 3-трифторметил-4-(4-N-метилимидамидосульфонил)фенокси-бензоилгуанидин; 3-метил-4-(4-(1-метилпиперазин-4-илсульфонил)фенокси)-бензоилгуанидин; 4-(4-гуанидиносульфонил)фенокси-3-трифторметилбензоилгуанидин; 4-/4-(2-имидазолилтио-ацетил)фенокси/-3-метилсульфонилбензоилгуанидина дигидрохлорид; 4-/4-(N, N-диметил-S-изотиуронил-ацетил)фенокси/-3-метилсульфонилбензоилгуанидина дигидрохлорид; 4-/4-(2-бензимидазолилтио-ацетил)фенокси/-3-метилсульфонилбензоилгуанидина дигидрохлорид; 4-/4-(2-N-имидазолил-1-гидроксиэтил)фенокси/-3-метилсульфонилбензоилгуанидина дигидрохлорид, 4-/4-(N,N-диметилглициламино)фенокси/-3-метилсульфонилбензоилгуанидина дигидрохлорид, 4-/4-(N, N-диэтиламиноэтил)аминосульфонилфенокси/-3-метилсульфонилбензоилгуанидина дигидрохлорид; 4-/4-(4-имидазолилэтил)аминосульфонил-фенокси/-3-метилсульфонилбензоилгуанидина дигидрохлорид; 4-/4-(3-N-имидазолил-1-пропил)аминосульфонил-фенокси/-3-метилсульфонилбензоилгуанидина дигидрохлорид; 4-/4-(1-метил-2-пирролидинилэтил)аминосульфонил-фенокси/-3-метилсульфонилбензоилгуанидина дигидрохлорид; 4-/4-(N-пиперидиноэтил)аминосульфонил-фенокси/-3-метил сульфонилбензоилгуанидина дигидрохлорид; 4-/4-(2-диметиламиноэтил)сульфонилметил-фенокси/-3-метилсульфонилбензоилгуанидина дигидрохлорид; 4-/4-(2-диметиламиноэтил)сульфонилметил-фенокси/-3-трифторметилбензоилгуанидина дигидрохлорид.
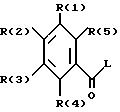
в которой R(1) - R(5) имеют указанное значение;
а L - легко нуклеофильно замещаемую отходящую группу,
подвергают взаимодействию с гуанидином и при желании полученное соединение переводят в фармакологически переносимую соль.

Комментарии