Производные сульфонамидов и фармацевтическая композиция - RU2232751C2
Код документа: RU2232751C2
Чертежи


























Описание
Настоящее изобретение относится к некоторым производным сульфонамидов, которые ингибируют С-протеиназу проколлагена, к содержащим их фармацевтическим композициям, их применению и к способам и промежуточным соединениям для получения этих соединений.
Коллагены являются неотъемлемыми компонентами соединительной ткани. В настоящее время идентифицировано девятнадцать типов коллагенов. Интерстициальные типы коллагена I, II и III являются главными коллагеновыми компонентами ткани. Эти коллагены синтезируются в виде молекул проколлагенового предшественника, имеющих амино- и карбоксиконцевые пептидные удлинения, известные также как про-участки. Эти про-участки обычно расщепляются при секреции молекулы проколлагена и образуют молекулу зрелого коллагена, которая способна ассоциироваться в высокоструктурированные коллагеновые волокна ((см., например, Fessler and Fessler, Annu. Rev. Biochem. 47, 129, (1978); Kivirikko et al., Extracellular Matrix Biochemistry (1984) and Kuhn, Structure and Function of Collagen Types (ред. Mayne, R. and Burgeson, R.E., изд-во Academic Press, Inc., Орландо, Флорида, стр. 1-42 (1987)). Хорошо установлено, что избыточное отложение коллагена связано с разнообразными фиброзными заболеваниями, такими, как интерстициальный фиброз легких, перицентральный фиброз, фиброз Симмерса, субадвентициальный фиброз стенок артерий, фиброз почек, эндокардиальный фиброэластоз, гепатит, острый респираторный дистресс-синдром, артрит, муковисцидоз, операции на сухожилиях, роговичное рубцевание, спайкообразования в результате хирургических операций, склеродермия, хроническое отторжение аллотрансплантата, фиброз в результате гемодиализного шунтирования, фиброз печени и рестеноз. Эти заболевания характеризуются избыточными отложениями фибриллярных интерстициальных коллагенов, которые устойчивы к протеолитическому расщеплению, что приводит, таким образом, к симптомам фиброза. Поэтому ингибирование патологического отложения этих коллагенов должно помочь в лечении этих заболеваний.
Недавние исследования показывают, что С-протеиназа является основным ферментом, который катализирует расщепление С-пропептидов коллагенов типов I, II и III, и поэтому является средством для образования функциональных коллагеновых волокон ((см. Fertala et al., J. Biol. Chem., 269, 11584 (1994)). Поэтому было бы желательно получить ингибиторы С-протеиназы проколлагена и тем самым обеспечить средства для борьбы с заболеваниями, вызванными избыточным отложением этих коллагенов. Соединения по данному изобретению удовлетворяют указанную и родственные потребности.
По одному из вариантов изобретение предоставляет производные сульфонамидов, выбранные из группы соединений, представленных формулой (Iа)
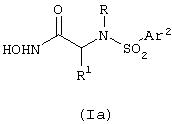
где R1 означает алкил, галоидалкил, циклоалкил, арил, аралкил, аралкенил, гетероарил, гетероаралкил, гетероаралкенил, гетероциклилалкил, циклоалкилалкил, -(алкилен)-С(O)X, где X означает алкил, галоидалкил, циклоалкил, циклоалкилалкил, аминогруппу, монозамещенную аминогруппу, дизамещенную аминогруппу, арил, аралкил, гетероарил, гетероаралкил, гетероциклический остаток, гетероциклилалкил, гидроксильную группу, алкокси-, циклоалкокси-, циклоалкилалкокси-, гетероалкилокси-, аралкилокси- или гетероаралкилоксигруппу, или –C(=NR’)NHSO2R’’ (где R’ означает водород или алкил и R’’ означает алкил, галоидалкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероарил, гетероаралкил или гетероциклилалкил);
R означает –CH(R2)Ar1 или -CH(R2)CH=CHAr1, где R2 означает водород или алкил и Аr1 означает арил или гетероарил;
Аr2 означает или
(i) фенильное кольцо формулы (а)

где R3 и R7 означают независимо друг от друга водород, алкил, алкилтиогруппу или галоген;
R4 и R6 означают независимо друг от друга водород, алкил или галоген;
R5 означает алкил, галоидалкил, гетероциклил, алкилтиогруппу, арилтиогруппу, аралкилтиогруппу, гетероарилтиогруппу, гетероаралкилтиогруппу, циклоалкилтиогруппу, циклоалкилалкилтиогруппу, алкокси-, арилокси-, аралкокси-, гетероарилокси-, гетероаралкилокси-, циклоалкокси-, циклоалкилалкоксигруппу, алкилоксикарбонил, гидроксил, галоген, циангруппу, карбоксильную группу, нитрогруппу, аминогруппу, моноалкиламиногруппу, диалкиламиногруппу, алкилсульфонил, арилсульфонил, аралкилсульфонил, гетероарилсульфонил, гетероаралкилсульфонил, циклоалкилсульфонил, циклоалкилалкилсульфонил или -Y-(алкилен)-С(O)-Z [где Y означает связь, -NRa-, -О- или -S(O)n- (где n означает число от 0 до 2), Ra означает водород или алкил и Z означает алкоксигруппу, гидроксильную группу, аминогруппу, монозамещенную аминогруппу или дизамещенную аминогруппу], или
R5 вместе с R4 образует -O-(CR8R9)n-, где n означает 2 или 3 и каждый из R8и R9 независимо друг от друга означают водород или алкил, или атомы углерода, к которым присоединены R5 и R4, принимают участие в конденсации, образуя углеродные атомы С2-С3 бензофуранового кольца,
при условии, что, как минимум, два из R3, R4, R6 и R7 не являются атомами водорода одновременно, или
(ii) нафтильное кольцо формулы (b)

где R10 означает водород, алкил, алкоксигруппу или галоген и
R11 означает водород, алкил, галоидалкил, алкилтиогруппу, алкоксигруппу, алкилоксикарбонил, арилоксигруппу, гидроксильную группу, галоген, циангруппу, карбоксильную группу, нитрогруппу, аминогруппу, моноалкиламиногруппу, диалкиламиногруппу или алкилсульфонил при условии, что и R10 и R11 не являются одновременно атомами водорода,
их фармацевтически приемлемые соли, пролекарства, отдельные изомеры и смеси изомеров.
Определения
Если не указано иначе, следующие ниже термины, использованные в спецификации и пунктах формулы изобретения, имеют приведенные ниже значения.
"Алкил" означает линейный насыщенный одновалентный углеводородный радикал с числом атомов углерода от одного до шести или разветвленный насыщенный одновалентный углеводородный радикал с числом углеродных атомов от трех до шести, например метил, этил, н-пропил, 2-пропил, трет-бутил, пентил и им подобные.
"Алкилен" означает линейный насыщенный двухвалентный углеводородный радикал с числом атомов углерода от одного до шести или разветвленный насыщенный двухвалентный углеводородный радикал из 3-6 углеродных атомов, например метилен, этилен, пропилен, 2-метилпропилен, пентилен и им подобные.
"Алкенил" означает линейный одновалентный углеводородный радикал из 2-6 атомов углерода или разветвленный одновалентный углеводородный радикал из 3-6 атомов углерода, содержащий, как минимум, одну двойную связь, например этенил, пропенил и им подобные.
"Галоген" означает фтор, хлор, бром или иод, предпочтительно фтор и хлор.
"Галоидалкил" означает алкил, замещенный одним или более одинаковыми или различными атомами галогена, например -CH2Cl, -CF3, -CH2CF3, -CH2CCl3 и им подобные.
"Циклоалкил" означает насыщенный одновалентный циклический углеводородный радикал из 3-7 кольцевых атомов. Циклоалкил может быть при необходимости замещен независимо одним, двумя или тремя заместителями, выбранными из алкила, галоидалкила, нитрогруппы, циангруппы, необязательно замещенного фенила, необязательно замещенного гетероаралкила, -OR (где R означает водород, алкил или галоидалкил), -NRR’ (где R и R’ означают независимо водород или алкил) или -C(O)R (где R означает водород, алкил или необязательно замещенный фенил). Более конкретно, термин циклоалкил включает, например, циклопропил, циклогексил, 1,2-дигидроксициклопропил и им подобные.
"Монозамещенная аминогруппа" означает радикал -NHR, где R означает алкил, галоидалкил, циклоалкил, циклоалкилалкил, гидроксиалкил, арил, аралкил, аралкенил, гетероарил, гетероаралкил, гетероаралкенил, гетероциклический остаток или гетероциклилалкил, например метиламиногруппа, этиламиногруппа, фениламин, бензиламин, дибензиламин и им подобные.
"Дизамещенная аминогруппа" означает радикал –NRR’, где R и R’ означают независимо друг от друга алкил, галоидалкил, цианалкил, циклоалкил, циклоалкилалкил, гидроксиалкил, арил, аралкил, аралкенил, гетероарил, гетероаралкил, гетероаралкенил, гетероциклический остаток или гетероциклилалкил, или R и R’ вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо. Представленные примеры включают, но не ограничиваются этим, диметиламиногруппу, метилэтиламиногруппу, ди(1-метилэтил)аминогруппу, пиперазинил и им подобные.
"Моноалкиламиногруппа" означает радикал -NHR, где R означает алкил, например метиламиногруппа, этиламиногруппа и им подобные.
"Диалкиламиногруппа" означает радикал –NRR’, где R и R’ являются независимо друг от друга алкилами. Типичные примеры включают, но не ограничиваются этим, диметиламиногруппу, метилэтиламиногруппу, ди(1-метилэтил)аминогруппу и им подобные.
"Арил" означает одновалентный моноциклический или бициклический ароматический углеводородный радикал, содержащий от 6 до 10 кольцевых атомов, который замещен независимо одним или несколькими заместителями, предпочтительно одним, двумя или тремя заместителями, выбранными из алкила, галоидалкила, тиоалкила, гетероалкила, галогена, нитрогруппы, циангруппы, необязательно замещенного фенила, гетероарила, гетероциклического остатка, гидроксильной группы, алкоксигруппы, галоидалкоксигруппы, необязательно замещенной фенилоксигруппы, гетероарилоксигруппы, метилендиоксигруппы, этилендиоксигруппы, -COR (где R означает алкил или необязательно замещенный фенил), -(алкилен)n-COOR (где n означает 0 или 1 и R означает водород, алкил, необязательно замещенный фенилалкил или гетероаралкил), -NRaRb (где Ra и Rb независимо друг от друга означают водород, алкил, циклоалкил, циклоалкилалкил, гидроксиалкил, необязательно замещенный фенил или гетероарил), -NRaCORb (где Ra означает водород или алкил и Rb означает водород, алкил, галоидалкил или необязательно замещенный фенил), -S(O)nR [где n является целым числом от 0 до 2 и R означает водород (при условии, что n означает 0), алкил, циклоалкил, циклоалкилалкил, гетероалкил, необязательно замещенный фенил, необязательно замещенный фенилалкил или гетероарил], -SO2NRa Rb (где Ra и Rb означают независимо друг от друга водород, алкил, гидроксиалкил или необязательно замещенный фенил, или Rа и Rb вместе с атомом азота, с которым они соединены, образуют гетероциклическое кольцо), -NRSO2R’ (где R означает водород или алкил и R’ означает алкил, циклоалкил, циклоалкилалкил, гетероалкил, необязательно замещенный фенил, необязательно замещенный фенилалкил или гетероарил), -NRSO2NR’R’’ (где R означает водород или алкил и R’ и R’’ независимо друг от друга означают водород, алкил или гидроксиалкил или R’ и R’’ вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо), или -(алкилен)n-СОNRaRb (где n означает 0 или 1 и Ra и Rb независимо друг от друга означают водород или алкил или Ra и Rb вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо). Более конкретно термин арил включает, но не лимитируется этим, фенил, 1-нафтил и 2-нафтил и их производные.
"Необязательно замещенный фенил" означает фенильное кольцо, которое необязательно замещено независимо одним или несколькими заместителями, предпочтительно одним или двумя заместителями, выбранными из алкила, галоидалкила, тиоалкила, гидроксиалкила, галогена, нитрогруппы, циангруппы, гидроксильной группы, алкоксигруппы, карбоксильной группы, алкоксикарбонила, аминогруппы, метилендиоксигруппы, этилендиоксигруппы, -COR (где R является алкилом), -COOR (где R является алкилом), -NRaRb (где Ra и Rb независимо друг от друга означают водород или алкил), -NRaCORb (где Raозначает водород или алкил и Rb означает алкил, галоидалкил или необязательно замещенный фенил), или -CONRaRb (где Ra и Rb означают независимо друг от друга водород или алкил). Более конкретно термин арил включает, но не ограничивается этим, фенил, 1-нафтил и 2-нафтил, и их производные.
"Гетероарил" означает одновалентный моноциклический или бициклический ароматический радикал с 5-12 кольцевыми атомами, содержащий один, два или три гетероатома, выбранных из N, О или S, остальные кольцевые атомы являются атомами углерода. Гетероарильное кольцо необязательно замещено независимо одним или несколькими заместителями, предпочтительно одним или двумя заместителями, выбранными из алкила, галоидалкила, гетероалкила, гетероциклического остатка, галогена, нитрогруппы, циангруппы, -OR (где R означает водород, алкил, галоидалкил, необязательно замещенный фенил или необязательно замещенный гетероарил), -NRR’ (где R и R’ независимо друг от друга означают водород, алкил, циклоалкил, циклоалкилалкил, гидроксиалкил или необязательно замещенный фенил), -C(O)R (где R означает водород, алкил или необязательно замещенный фенил), -(алкилен)n-СООR (где является 0 или 1 и R означает водород, алкил, необязательно замещенный фенилалкил или необязательно замещенный гетероаралкил), -S(O)nR [где n является целым числом от 0 до 2 и R означает водород (при условии, что n означает 0), алкил, циклоалкил, циклоалкилалкил, гетероалкил, необязательно замещенный фенил, необязательно замещенный фенилалкил или необязательно замещенный гетероарил], -SO2NR’R’’ (где R’ и R’’ независимо друг от друга означают водород, алкил, гидроксиалкил или необязательно замещенный фенил или R’ и R’’ вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо), -NRС(O)R’ (где R означает водород или алкил и R’ означает алкил, галоидалкил или необязательно замещенный фенил), -NRSO2R’ (где R означает водород или алкил и R’ означает алкил, циклоалкил, циклоалкилалкил, гетероалкил, необязательно замещенный фенил, необязательно замещенный фенилалкил или необязательно замещенный гетероарил), -NRSO2NR’R’’ (где R означает водород или алкил и R’ и R’’ независимо друг от друга означают водород или алкил или R’ и R’’ вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо), -(алкилен)n-СОNR’R’’ (где n является 0 или 1 и R’ и R’’ независимо друг от друга означают водород или алкил или R’ и R’’ вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо), или защитной группы аминогруппы. Более конкретно термин гетероарил включает, но не ограничивается этим, пиридил, фуранил, тиофенил, тиазолил, изотиазолил, триазолил, имидазолил, изоксазолил, пирролил, пиразолил, пиримидинил, бензофуранил, изобензофуранил, бензотиазолил, бензоизотиазолил, бензотриазолил, индолил, изоиндолил, бензоксазолил, хинолил, изохинолил, бензимидазолил, бензизоксазолил, бензотиофенил, дибензофуран и бензодиазепин-2-он-5-ил и их производные.
"Гетероциклический остаток" означает насыщенный циклический радикал из 3-8 кольцевых атомов, в котором один или два кольцевых атома являются гетероатомами, выбранными из N, О или S(O)n (где n означает целое число от 0 до 2), остальные кольцевые атомы являются атомами углерода, где один или два атома углерода могут необязательно быть замещены карбонильной группой. Гетероциклическое кольцо может быть необязательно замещено независимо одним, двумя или тремя заместителями, выбранными из алкила, галоидалкила, нитрогруппы, циангруппы, необязательно замещенного фенила, необязательно замещенного гетероарила, необязательно замещенного фенилалкила, необязательно замещенного гетероаралкила, -OR (где R означает водород, алкил или галоидалкил), -NRR’ (где R и R’ означают независимо водород или алкил), -C(O)R (где R означает водород, алкил, гетероалкил, арил, гетероарил или арилоксиалкил), -COOR (где R означает водород, алкил, арил, аралкил, гетероаралкил), -(алкилен)-СООR (где R означает водород, алкил, необязательно замещенный фенил, необязательно замещенный фенилалкил или необязательно замещенный гетероаралкил), -CONR’R’’ или -(алкилен)-COONR’R’’ (где R’ и R’’ независимо выбираются из водорода, алкила, циклоалкила, циклоалкилалкила, гетероциклического остатка, арила, аралкила, гетероарила), -S(O)nR (где n является целым числом от 0 до 2 и R является водородом (при условии, что n означает 0) или алкилом), алкоксикарбонила, -NRC(O)R’ (где R означает водород или алкил и R’ означает водород или алкил), -NRSO2R’ (где R означает водород или алкил и R’ означает алкил), -NRSO2NR’R’’ (где R, R’ и R’’ означают независимо водород или алкил) или защитной группы аминогруппы. Гетероциклическое кольцо может быть необязательно сконденсировано с арильными кольцами, как указано выше. Более точно термин "гетероцикло" включает, но не ограничивается этим, тетрагидропиранил, пиперидино, пиперазино, морфолино и тиоморфолино, тиоморфолино-1-оксид, тиоморфолино-1, 1-диоксид и их производные.
"Гетероалкил" означает алкил, циклоалкил или циклоалкилалкильный радикал, как определено выше, имеющий заместитель, выбранный из -NRaRb , -ORc или –S(O)nRd, где n означает целое число от 0 до 2, Ra означает водород, алкил или -COR (где R означает водород, алкил или галоидалкил); Rb означает водород, алкил, галоидалкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклический остаток, гетероциклилалкил, гетероциклилгидроксиалкил, -COR (где R означает водород, алкил, галоидалкил, монозамещенный аминоалкил, арилоксиалкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклилалкил или -(алкилен)-С(O)-X (где X означает алкил, галоидалкил, циклоалкил, циклоалкилалкил, аминогруппу, монозамещенную аминогруппу, дизамещенную аминогруппу, арил, аралкил, гетероарил, гетероаралкил, гетероциклический остаток или гетероциклилалкил)), -SO2R (где R означает алкил, галоидалкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклический остаток, гетероциклилалкил, аминогруппу, монозамещенную аминогруппу или дизамещенную аминогруппу), -COOR (где R означает водород, алкил, галоидалкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероарил, гетероаралкил или гетероциклилалкил), -CONR’R’’ или -(алкилен)-CONR’R’’ [где R’ и R’’ независимо выбираются из водорода, алкила, циклоалкила, циклоалкилалкила, гетероциклического остатка, арила, аралкила, гетероарила, гетероаралкила, или SO2R (где R означает алкил, галоидалкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклический остаток, гетероциклилалкил, аминогруппу, монозамещенную аминогруппу или дизамещенную аминогруппу), или R’ и R’’ вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо]; Rc означает водород, алкил, галоидалкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклилалкил, -COR (где R означает алкил, галоидалкил или гетероциклил), или –CONR’R’’ (где R’ и R’’ независимо выбираются из водорода, алкила, циклоалкила, циклоалкилалкила, арила, аралкила, гетероарила или гетероалкила) и Rd означает водород (при условии, что n означает 0), алкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклический остаток, гетероциклилалкил, аминогруппу, монозамещенную аминогруппу или дизамещенную аминогруппу. Типичные примеры включают, но не ограничиваются этим, гидроксиметил, 2-гидроксиэтил, 2-метоксиэтил, бензилоксиметил, тиофен-2-илтиометил и им подобные.
"Аралкил" означает радикал -Ra Rb, где Ra является алкиленовой группой и Rb является арильной группой, как определено выше, например бензилом, фенилэтилом, 3-(3-хлорфенил)-2-метилпентилом и им подобными соединениями.
"Аралкенил" означает радикал -RaRb, где Ra означает алкенильную группу и Rb означает арильную группу, как определено выше, например 3-фенил-2-пропенил и ему подобные.
"Гетероаралкил" означает радикал -RaRb, где Ra является алкиленовой группой и Rb является гетероарильной группой, как обозначено выше, например пиридин-3-илметилом, 3-(бензофуран-2-ил)пропилом и им подобными соединениями.
"Гетероаралкенил" означает радикал -Ra Rb, где Ra является алкенильной группой и Rb является гетероарильной группой, как определено выше, например 3-пиридин-3-илпропен-2-илом и ему подобными соединениями.
"Гетероциклилалкил" означает радикал -RaRb, где Ra является алкиленовой группой и Rb является гетероциклильной группой, как определено выше, например тетрагидропиран-2-илметилом, 4-метилпиперазин-1-илэтилом, 2- или 3-пиперидинилметилом и им подобными.
"Циклоалкилалкил" означает радикал -RaRb, где Ra является алкиленовой группой и Rb является циклоалкильной группой, как определено выше, например циклопропилметилом, циклогексилпропилом, 3-циклогексил-2-метилпропилом и им подобными соединениями.
"Алкокси-", "арилокси-", "аралкилокси-" или "гетероаралкилоксигруппа означает радикал -OR, где R означает алкил, арил, аралкил или гетероаралкил соответственно, как определено выше, например метоксигруппу, феноксигруппу, пиридин-2-илметилоксигруппу, бензилоксигруппу и им подобные.
"Гидроксиалкил" означает алкильный радикал, как определено выше, имеющий одну или несколько, предпочтительно одну, две или три гидроксильные группы, при условии, что если присутствуют две гидроксильные группы, то они обе не находятся при одном и том же атоме углерода. Типичные примеры включают, но не ограничиваются этим, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 1-(гидроксиметил)-2-метилпропил, 2-гидроксибутил, 3-гидроксибутил, 4-гидроксибутил, 2,3-дигидроксипропил, 1-(гидроксиметил)-2-гидроксиэтил, 2, 3-дигидроксибутил, 3,4-дигидроксибутил и 2-(гидроксиметил)-3-гидроксипропил, предпочтительно 2-гидроксиэтил, 2,3-дигидроксипропил и 1-(гидроксиметил)-2-гидроксиэтил.
"Необязательный" или "необязательно" означает, что описываемое далее событие или обстоятельство могут происходить, но необязательно происходят, и что описание включает примеры, где событие или обстоятельство происходит, и примеры, где это не имеет места. Например, "гетероциклогруппа, необязательно моно- или дизамещенная алкильной группой", означает, что алкил может присутствовать, но необязательно присутствует, и описание включает ситуации, где гетероциклогруппа моно- или дизамещена алкильной группой, и ситуации, где гетероциклогруппа не замещена алкильной группой.
"Защитная группа аминогруппы" относится к органическим группам, предназначенным защитить атомы азота от нежелательных реакций в процессе синтеза, например бензил, бензилоксикарбонил (КБЗ), трет-бутоксикарбонил (Бок), трифторацетил, 2-триметилсилилэтансульфонил (СЭС) и им подобные.
Соединения, имеющие одинаковые молекулярные формулы, но отличающиеся природой или последовательностью связывания их атомов или расположением атомов в пространстве, называются "изомерами".
Изомеры, различающиеся расположением атомов в пространстве, называются "стереоизомерами". Стереоизомеры, не являющиеся зеркальным отображением друг друга, называются "диастереомерами" и те, которые являются неналагаемыми зеркальными отображениями друг друга, называются "энантиомерами". Когда соединение имеет асимметрический центр, например, когда атом углерода связан с четырьмя различными группами, возможно существование пары энантиомеров. Энантиомер может быть охарактеризован абсолютной конфигурацией его асимметрического центра и описывается правилами R- и S-последовательностей Кана-Прелога или таким способом, при котором молекула вращает плоскость поляризации света и обозначается как правовращающая или левовращающая (т.е. как (+) или (-)-изомеры соответственно). Хиральное соединение может существовать или как отдельные энантиомеры, или в виде их смеси. Смесь, содержащая энантиомеры в равных пропорциях, называется "рацемической смесью".
Соединения согласно изобретению могут иметь один или несколько асимметрических центров; такие соединения могут поэтому быть получены в виде индивидуальных (R)- или (S)-стереоизомеров или их смесей. Если не указывается иначе, описание или название определенного соединения в спецификации и пунктах формулы изобретения подразумевает включение как индивидуальных энантиомеров, так и их смесей, рацемических или других. Способы определения стереохимии и разделения стереоизомеров хорошо известны в данной области (см. обсуждение в главе 4 "Advanced Organic Chemistry", 4 издание, ред. J.March, изд-во John Wiley and Sons, Нью-Йорк, 1992).
"Фармацевтически приемлемый наполнитель" означает наполнитель, который пригоден для получения фармацевтической композиции, который обычно безопасен и нетоксичен, не является нежелательным ни в биологическом отношении, ни в других отношениях и включает наполнитель, который приемлем для целей ветеринарии, а также для фармацевтического применения для человека. "Фармацевтически приемлемый наполнитель", как это указывается в спецификации и пунктах формулы изобретения, включает как один, так и более одного таких наполнителей.
"Фармацевтически приемлемая соль" соединения означает соль, которая является фармацевтически приемлемой и которая обладает желательной фармакологической активностью исходного соединения. Такие соли включают:
(1) аддитивные соли кислот, образующиеся с помощью неорганических кислот, как, например, соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и им подобные, или образующиеся с помощью органических кислот, как, например, уксусная кислота, пропионовая кислота, капроновая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфокислота, этансульфокислота, 1,2-этандисульфокислота, 2-гидроксиэтансульфокислота, бензолсульфокислота, 4-хлорбензолсульфокислота, 2-нафталинсульфокислота, 4-толуолсульфокислота, камфарсульфокислота, 4-метилбицикло[2.2.2]окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, (трет-бутил)уксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и им подобные, или
(2) соли, образующиеся, когда присутствующий в исходном соединении кислотный протон либо замещается ионом металла, ионом щелочноземельного металла или ионом алюминия, либо образует координационную связь с органическим основанием, как, например, этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и им подобные.
Термин "пролекарства" означает любое соединение, которое высвобождает in vivo активное исходное лекарство согласно формуле (I), когда такое пролекарство вводится млекопитающему. Пролекарства соединения формулы (I) получают путем модификации функциональных групп, присутствующих в соединении формулы (I), таким образом, что модифицированные производные могут быть расщеплены in vivo с высвобождением исходного соединения. Пролекарства включают соединения формулы (I), где гидроксильная группа, аминогруппа или сульфгидрильная группа в соединении (I) связана с любой группой, которая может быть расщеплена in vivo с регенерацией свободной гидроксильной группы, аминогруппы или сульфгидрильной группы соответственно. Примеры пролекарств включают, но не ограничиваются этим, сложные эфиры (например, производные ацетатов, эфиров муравьиной кислоты, бензоатов), карбаматы (например, N, N-диметиламинокарбонил), образованные по гидроксильным функциональным группам в соединениях формулы (I), и им подобные.
"Терапевтически эффективное количество" означает количество соединения, которое будучи введенным млекопитающему для лечения заболевания, является достаточным для достижения эффекта лечения.
"Терапевтически эффективное количество" будет меняться в зависимости от соединения, заболевания и его тяжести, возраста, веса и т.д. млекопитающего, подвергающегося лечению.
Названия и нумерация соединений по изобретению приводятся ниже.

Используемая в данной заявке номенклатура обычно основывается на рекомендациях ИЮПАК, например соединение формулы (I),
где R1 означает –CH(CH3)2, R означает –CH(R2)Ar1, где R2 означает водород, Аr1 означает 3,4-метилендиоксифенил, Аr2 означает 4-метоксифенил и стереохимия при атоме углерода, с которым связан R1, соответствует (R), называют N-гидрокси-2(R)-[(3, 4-метилендиоксибензил)-(4-метоксибензолсульфонил)амино]-3-метилбутирамид;
где R1 означает –СН2ОН, R означает -CH(R2)Ar1, где R2 означает водород, Аr1 означает индол-5-ил, Аr2 означает 2,3,6-триметил-4-метоксифенил и стереохимия при атоме углерода, к которому присоединен R1, соответствует (R), называют N-гидрокси-2(R)-[(1Н-индол-5-илметил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-гидроксипропионамид.
В то время как самое широкое толкование изобретения представлено выше, некоторые соединения формулы (Iа) предпочтительны.
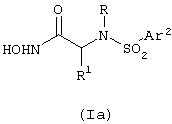
I. Более конкретно, предпочтительной группой соединений формулы (Iа) является та, где
R означает -CH(R2)Ar1, где R2 означает водород.
(а) В рамках предпочтительной группы (I) более предпочтительной группой соединений является та, где
Аr1 означает гетероарил и Аr2 означает фенильное кольцо формулы (а).
(i) В рамках этой более предпочтительной группы (I)(а), еще более предпочтительной группой соединений является та, где
R3 и R7 означают независимо друг от друга алкил, алкилтиогруппу или галоген;
R4 означает водород, алкил или галоген;
R5 означает алкил, галоидалкил, алкилтиогруппу, алкоксигруппу, алкилоксикарбонил, арилоксигруппу, гидроксильную группу, галоген, циангруппу, карбоксильную группу, нитрогруппу, аминогруппу, моноалкиламиногруппу, диалкиламиногруппу или алкилсульфонил и
R6 означает водород;
более предпочтительно R3 и R7 независимо друг от друга означают алкил или галоген;
R4 означает алкил и
R5 означает алкил, алкоксигруппу или галоген.
В рамках этих предпочтительных, более предпочтительных и даже еще более предпочтительных групп соединений особенно предпочтительной группой соединений является та, где
Аr1 означает гетероарильное кольцо, предпочтительно необязательно замещенный индолил или имидазолил, более предпочтительно индол-5-ил, 1-метилиндол-5-ил, 3-ацетилиндол-5-ил, 3-пропионилиндол-5-ил, 3-(2-метилпропионил)индол-5-ил, имидазол-5-ил, 2-метилбензимидазол-5-ил или бензимидазол-5-ил;
R3 и R7 независимо друг от друга означают алкил или галоген, более предпочтительно метил, хлор или бром;
R4 означает водород или алкил, предпочтительно метил, и
R5 означает алкил, алкоксигруппу или галоген, предпочтительно метил, метоксигруппу, хлор или бром;
более предпочтительно R3 , R4 и R7 означают метил и R5 означает метоксигруппу, хлор или бром.
В рамках этих предпочтительных, более предпочтительных и особенно предпочтительных групп соединений еще более особо предпочтительной группой соединений является такая, где
R1 означает алкил, аралкил, гетероалкил или -(алкилен)-С(O)-X, где X означает алкил, аминогруппу, монозамещенную аминогруппу, дизамещенную аминогруппу или гетероциклический остаток, более предпочтительно означает 2-пропил, гидроксиметил, трет-бутоксиметил, 2-гидроксиэтил, 2-гидроксипропил, 2-амидопропил, ацетилоксиметил, бензил, метоксиметил или -(алкилен)-С(O)-X, где X означает 2- или 4-пиридилметиламиногруппу, 1-алкоксикарбонилпиридин-4-иламиногруппу, необязательно замещенную бензиламиногруппу, необязательно замещенный по положению 4 бензилоксикарбонилпиперазин-1-ил, необязательно замещенный по положению 4 енилпиперазин-1-ил, 4-алкоксикарбонилпиперазин-1-ил или необязательно замещенный по положению 4 гетероарилпиперазин-1-ил,
наиболее предпочтительно означает 2-пропил, гидроксиметил, трет-бутоксиметил, 2-гидроксиэтил, 2-гидроксипропил, 2-амидопропил, ацетилоксиметил, бензил, метоксиметил, 2-(2- или 4-пиридилметиламинокарбонил)этил, 2-(1-этоксикарбонилпиридин-4-иламинокарбонил)этил, 2-(бензиламинокарбонил)этил, 2-(4-бензилоксикарбонилпиперазин-1-илкарбонил)этил, 2-(4-фенилпиперазин-1-илкарбонил)этил, 2-(4-метоксикарбонилпиперазин-1-илкарбонил)этил, 2-(4-ацетилпиперазин-1-илкарбонил)этил или 2-(4-пиридин-2-илпиперазин-1-илкарбонил)этил.
В рамках этих предпочтительных, более предпочтительных и особенно предпочтительных групп соединений альтернативной, еще более особо предпочтительной группой соединений является та, где
R1 означает гетероалкил или -(алкилен)-С(O)-X, где X означает алкил, аминогруппу, монозамещенную аминогруппу, дизамещенную аминогруппу или гетероциклил,
более предпочтительно означает метилсульфониламинометил, фенилсульфониламинометил, (3-нитрофенил)-CH2SO2NHCH2 , метилкарбониламинометил, 4-(метоксикарбонил)фенилкарбониламинометил, 2-(пиррол-1-ил)фенилкарбониламинометил, 3-цианфениламинокарбониламинометил, тиен-2-илкарбониламинометил, фенилкарбониламинометил, (C6H5)CHCH3-NHCO(C2H4)CONHCH2, (4-метоксифенил)СОС2Н4СONHCH2, 4-хлорфенилсульфониламинокарбониламинометил, 5-(ацетил)тиен-2-илкарбониламинометил, пиридин-3-илкарбониламинометил, (3,4,5-триметоксифенил)-C2H4CONHCH2, 3-метоксифениламинокарбониламинометил, (фенокси)СН(СН2СН3)СОNНСН2, 1-(этоксикарбонил)пиперидин-4-иламинометилкарбониламинометил, 3-(бензилоксикарбониламино)пропил, 2-[(дифенил)метиламинокарбонил]этил, 2-[2-(метил)бутиламинокарбонил]этил или 2-[(С6Н5)СНСН3NНСО]этил.
(ii) В рамках этой более предпочтительной группы (I)(а) другой еще более предпочтительной группой соединений является та, где
R4 и R6 означают водород;
R3 и R7 независимо друг от друга означают алкил или галоген и
R5 означает алкил, галоидалкил, алкилтиогруппу, алкоксигруппу, алкилоксикарбонил, арилоксигруппу, гидроксильную группу, галоген, циангруппу, карбоксильную группу, нитрогруппу, аминогруппу, моноалкиламиногруппу, диалкиламиногруппу или алкилсульфонил;
более предпочтительно R3 означает алкил, R5 означает алкил, алкоксигруппу или галоген и R7 означает алкил или галоген.
В рамках этих предпочтительных, более предпочтительных и еще более предпочтительных групп соединений особенно предпочтительной группой соединений является такая, где
Аr1 означает гетероарильное кольцо, предпочтительно необязательно замещенный индолил или имидазолил, более предпочтительно индол-5-ил, 1-метилиндол-5-ил, 3-ацетилиндол-5-ил, 3-пропионилиндол-5-ил, 3-(2-метилпропионил)индол-5-ил, имидазол-5-ил, 2-метилбензимидазол-5-ил или бензимидазол-5-ил;
R3 означает алкил, предпочтительно метил;
R5 означает алкил, алкоксигруппу или галоген, предпочтительно метил, метоксигруппу, хлор или бром и
R7 означает алкил или галоген, предпочтительно метил, хлор или бром;
более предпочтительно R3 и R7 означают метил и R5 означает метоксигруппу, хлор или бром.
В рамках этих предпочтительных, более предпочтительных и особенно предпочтительных групп соединений еще более особо предпочтительной группой соединений является такая, где
R1 означает алкил, аралкил, гетероалкил или -(алкилен)-С(O)-X, где X означает алкил, аминогруппу, монозамещенную аминогруппу, дизамещенную аминогруппу или гетероциклический остаток, более предпочтительно означает 2-пропил, гидроксиметил, трет-бутоксиметил, 2-гидроксиэтил, 2-гидроксипропил, 2-амидопропил, ацетилоксиметил, бензил, метоксиметил или -(алкилен)-С(O)-X, где X означает 2- или 4-пиридилметиламиногруппу, 1-алкоксикарбонилпиридин-4-иламиногруппу, необязательно замещенную бензиламиногруппу, необязательно замещенный по положению 4 фенилпиперазин-1-ил, 4-алкоксикарбонилпиперазин-1-ил или необязательно замещенный по положению 4 гетероарилпиперазин-1-ил,
наиболее предпочтительно означает 2-пропил, гидроксиметил, трет-бутоксиметил, 2-гидроксиэтил, 2-гидроксипропил, 2-амидопропил, ацетилоксиметил, бензил, метоксиметил, 2-(2- или 4-пиридилметиламинокарбонил)этил, 2-(1-этоксикарбонилпиридин-4-иламинокарбонил)этил, 2-(бензиламинокарбонил)этил, 2-(4-бензилоксикарбонилпиперазин-1-илкарбонил)этил, 2-(4-фенилпиперазин-1-илкарбонил)этил, 2-(4-метоксикарбонилпиперазин-1-илкарбонил)этил, 2-(4-ацетилпиперазин-1-илкарбонил)этил или 2-(4-пиридин-2-илпиперазин-1-илкарбонил)этил.
В рамках этих предпочтительных, более предпочтительных и особенно предпочтительных групп соединений альтернативной, еще более особо предпочтительной группой соединений является такая, где
R1 означает гетероалкил или -(алкилен)-С(O)-X, где X является алкилом, аминогруппой, монозамещенной аминогруппой, дизамещенной аминогруппой или гетероциклическим остатком,
более предпочтительно означает метилсульфониламинометил, фенилсульфониламинометил, (3-нитрофенил)CH2SO2NHCH2, метилкарбониламинометил, 4-(метоксикарбонил)фенилкарбониламинометил, 2-(пиррол-1-ил)фенилкарбониламинометил, 3-цианфениламинокарбониламинометил, тиен-2-илкарбониламинометил, фенилкарбониламинометил, (C6H5)CHCH3N-HCO(C2H4)CONHCH2, (4-метоксифенил)-СОС2Н4СОNНСН2, 4-хлорфенилсульфониламинокарбониламинометил, 5-(ацетил)тиен-2-илкарбониламинометил, пиридин-3-илкарбониламинометил, (3,4,5-триметоксифенил)C2H4CONHCH2, 3-метоксифениламинокарбониламинометил, (фенокси)CH(CH2CH3)CONHCH2, 1-(этоксикарбонил)пиперидин-4-иламинометилкарбониламинометил, 3-(бензилоксикарбониламино)пропил, 2-[(дифенил)метиламинокарбонил]этил, 2-[2-(метил)бутиламинокарбонил]этил или 2-[(С6Н5)СНСН3NНСО]этил.
(b) В рамках этой предпочтительной группы (I) другой более предпочтительной группой (I)(b) соединений формулы (Iа) является такая, где
Аr1 означает арил и Аr2 означает фенильное кольцо формулы (а).
(i) В рамках этой более предпочтительной группы (I)(b) еще более предпочтительной группой соединений является такая, где
R3 и R7 независимо друг от друга означают алкил, алкилтиогруппу или галоген;
R4 означает водород, алкил или галоген;
R5 означает алкил, галоидалкил, алкилтиогруппу, алкоксигруппу, алкилоксикарбонил, арилоксигруппу, гидроксильную группу, галоген, циангруппу, карбоксильную группу, нитро-, амино-, моноалкиламино-, диалкиламиногруппу или алкилсульфонил и
R6 означает водород.
В рамках этих предпочтительных, более предпочтительных и даже еще более предпочтительных групп соединений особенно предпочтительной группой соединений является такая, где
Аr1 означает фенильное кольцо, замещенное одним или двумя заместителями, выбранными из гидроксильной группы, метилендиоксигруппы или метоксикарбонила, более предпочтительно означает 3,4-метилендиоксифенил, 3,4-дигидроксифенил или 4-метоксикарбонилфенил;
R3 и R7 независимо друг от друга означают алкил или галоген, более предпочтительно метил, хлор или бром;
R4 означает алкил, предпочтительно метил, и
R5 означает алкил, алкоксигруппу или галоген, предпочтительно метил, метоксигруппу, хлор или бром;
более предпочтительно R3, R4 и R7 означают метил и R5 означает метоксигруппу, хлор или бром.
В рамках этих предпочтительных, более предпочтительных и особенно предпочтительных групп соединений еще более особо предпочтительной группой соединений является такая, где
R1 означает алкил, аралкил, гетероалкил или -(алкилен)-С(O)-X, где X означает алкил, аминогруппу, монозамещенную аминогруппу, дизамещенную аминогруппу или гетероциклический остаток,
более предпочтительно означает 2-пропил, гидроксиметил, трет-бутоксиметил, 2-гидроксиэтил, 2-гидроксипропил, 2-амидопропил, ацетилоксиметил, бензил, метоксиметил или -(алкилен)-С(О)-X, где X означает 2- или 4-пиридилметиламиногруппу, 1-алкоксикарбонилпиридин-4-иламиногруппу, необязательно замещенную бензиламиногруппу, необязательно замещенный по положению 4 бензилоксикарбонилпиперазин-1-ил, необязательно замещенный по положению 4 фенилпиперазин-1-ил, 4-алкоксикарбонилпиперазин-1-ил или необязательно замещенный по положению 4 гетероарилпиперазин-1-ил,
наиболее предпочтительно означают 2-пропил, гидроксиметил, трет-бутоксиметил, 2-гидроксиэтил, 2-гидроксипропил, 2-амидопропил, ацетилоксиметил, бензил, метоксиметил, 2-(2- или 4-пиридилметиламинокарбонил)этил, 2-(1-этоксикарбонилпиридин-4-иламинокарбонил)этил, 2-(бензиламинокарбонил)этил, 2-(4-бензилоксикарбонилпиперазин-1-илкарбонил)этил, 2-(4-фенилпиперазин-1-илкарбонил)этил, 2-(4-метоксикарбонилпиперазин-1-илкарбонил)этил, 2-(4-ацетилпиперазин-1-илкарбонил)этил или 2-(4-пиридин-2-илпиперазин-1-илкарбонил)этил.
В рамках этих предпочтительных, более предпочтительных и особенно предпочтительных групп соединений альтернативной, еще более особо предпочтительной группой соединений является такая, где
R1 означает гетероалкил или -(алкилен)-С(O)-X, где X означает алкил, аминогруппу, монозамещенную аминогруппу, дизамещенную аминогруппу или гетероциклический остаток,
более предпочтительно означает метилсульфониламинометил, фенилсульфониламинометил, (3-нитрофенил)CH2SO2NHCH2, метилкарбониламинометил, 4-(метоксикарбонил)фенилкарбониламинометил, 2-(пиррол-1-ил)фенилкарбониламинометил, 3-цианфениламинокарбониламинометил, тиен-2-илкарбониламинометил, фенилкарбониламинометил, (C6H5)CHCH3NHCO(C2H4)CONHCH2, (4-метоксифенил)СОС2Н4СОNНСН2, 4-хлорфенилсульфониламинокарбониламинометил, 5-(ацетил)тиен-2-илкарбониламинометил, пиридин-3-илкарбониламинометил, (3,4, 5-триметоксифенил)C2H4CONHCH2, 3-метоксифениламинокарбониламинометил, (фенокси)СН(СН2СН3)СONHCH2, 1-(этоксикарбонил)пиперидин-4-иламинометилкарбониламинометил, 3-(бензилоксикарбониламино)пропил, 2-[(дифенил)метиламинокарбонил]этил, 2-[2-(метил)бутиламинокарбонил]этил или 2-[(С6Н5)СНСН3NНСО]этил.
(ii) Другой еще более предпочтительной группой соединений в группе (I)(b) является такая, где
R4 и R6 означают водород;
R3 и R7 независимо друг от друга означают алкил или галоген и
R5 означает алкил, галоидалкил, алкилтиогруппу, алкоксигруппу, алкилоксикарбонил, арилоксигруппу, гидроксильную группу, галоген, циангруппу, карбоксильную группу, нитро-, амино-, моноалкиламино-, диалкиламиногруппу или алкилсульфонил.
В рамках этих предпочтительных, более предпочтительных и еще более предпочтительных групп соединений особо предпочтительной группой соединений является такая, где
Аr1 является фенильным кольцом, замещенным одним или двумя заместителями, выбранными из гидроксильной группы, метилендиоксигруппы или метоксикарбонила, более предпочтительно является 3,4-метилендиоксифенилом, 3, 4-дигидроксифенилом или 4-метоксикарбонилфенилом;
R3 означает алкил, предпочтительно метил;
R5 означает алкил, алкоксигруппу или галоген, предпочтительно метил, метоксигруппу, хлор или бром и
R7 означает алкил или галоген, предпочтительно метил, хлор или бром;
более предпочтительно R3 и R7 означают метил и R5 означает метоксигруппу, хлор или бром.
В рамках этих предпочтительных, более предпочтительных и особенно предпочтительных групп соединений еще более особо предпочтительной группой соединений является такая, где
R1 означает алкил, гидроксиалкил, аралкил, гетероалкил или -(алкилен)-С(O)-X, где X означает алкил, аминогруппу, монозамещенную аминогруппу, дизамещенную аминогруппу или гетероциклический остаток, более предпочтительно означает 2-пропил, гидроксиметил, трет-бутоксиметил, 2-гидроксиэтил, 2-гидроксипропил, 2-амидопропил, ацетилоксиметил, бензил, метоксиметил или -(алкилен)-С(O)-X, где X означает 2- или 4-пиридилметиламиногруппу, 1-алкоксикарбонилпиридин-4-иламиногруппу, необязательно замещенную бензиламиногруппу, N-(необязательно замещенный карбонил)метиламиногруппу, N-(необязательно замещенную амидо)метиламиногруппу, необязательно замещенный по положению 4 бензилоксикарбонилпиперазин-1-ил, необязательно замещенный по положению 4 фенилпиперазин-1-ил, 4-алкоксикарбонилпиперазин-1-ил или необязательно замещенный по положению 4 гетероарилпиперазин-1-ил, 4-метансульфонилпиперазин-1-ил, 4-ацетилпиперазин-1-ил, необязательно замещенный по положению 4 феноксипиперазин-1-ил, наиболее предпочтительно означает 2-пропил, гидроксиметил, трет-бутоксиметил, 2-гидроксиэтил, 2-гидроксипропил, 2-амидопропил, ацетилоксиметил, бензил, метоксиметил, 2-(2- или 4-пиридилметиламинокарбонил)этил, 2-(1-этоксикарбонилпиридин-4-иламинокарбонил)этил, 2-(бензиламинокарбонил)этил, 2-(4-бензилоксикарбонилпиперазин-1-илкарбонил)этил, 2-(4-фенилпиперазин-1-илкарбонил)этил, 2-(4-метоксикарбонилпиперазин-1-илкарбонил)этил, 2-(4-ацетилпиперазин-1-илкарбонил)этил или 2-(4-пиридин-2-илпиперазин-1-илкарбонил)этил.
В рамках этих предпочтительных, более предпочтительных и особенно предпочтительных групп соединений альтернативной, еще более особо предпочтительной группой соединений является такая, где
R1 означает гетероалкил или -(алкилен)-С(O)-X, где X означает алкил, аминогруппу, монозамещенную аминогруппу, дизамещенную аминогруппу или гетероциклический остаток,
более предпочтительно означает метилсульфониламинометил, фенилсульфониламинометил, (3-нитрофенил)CH2SO2-NHCH2, метилкарбониламинометил, 4-(метоксикарбонил)фенилкарбониламинометил, 2-(пиррол-1-ил)фенилкарбониламинометил, 3-цианфениламинокарбониламинометил, тиен-2-илкарбониламинометил, фенилкарбониламинометил, (С6Н5)СНСН3NНСО(С2H4)CONHCH2, (4-метоксифенил)COC2H4CONHCH2, 4-хлорфенилсульфониламинокарбониламинометил, 5-(ацетил)тиен-2-илкарбониламинометил, пиридин-3-илкарбониламинометил, (3,4, 5-триметоксифенил)C2H4CONHCH2, 3-метоксифениламинокарбониламинометил, (фенокси)CH(CH2CH3)CONHCH2, 1-(этоксикарбонил)пиперидин-4-иламинометилкарбониламинометил, 3-(бензилоксикарбониламино)пропил, 2-[(дифенил)метиламинокарбонил]этил, 2-[2-(метил)бутиламинокарбонил]этил или 2-[(С6Н5)СНСН3NHCO]этил.
II. Другой предпочтительной группой соединений (Iа) является такая, где
R означает -CH(R2)Аr1, где R2 означает алкил.
В рамках этой группы (II) более предпочтительной группой соединений является такая, где
(a) Аr1 означает гетероарильное кольцо, предпочтительно необязательно замещенный индолил или имидазолил, более предпочтительно индол-5-ил, 1-метилиндол-5-ил, 3-ацетилиндол-5-ил, 3-пропионилиндол-5-ил, 3-(2-метилпропионил)индол-5-ил, 3-(2-метилпропионил)индол-5-ил, имидазол-5-ил, 2-метилбензимидазол-5-ил, бензимидазол-5-ил и
Аr2 означает фенильное кольцо формулы (а).
Другой более предпочтительной группой соединений является такая, где
(b) Аr1 означает арил, предпочтительно фенильное кольцо, замещенное одним или двумя заместителями, выбранными из гидроксильной группы, метилендиоксигруппы или метоксикарбонила, более предпочтительно означает 3,4-метилендиоксифенил, 3,4-дигидроксифенил или 4-метоксикарбонилфенил, и
Аr2 означает фенильное кольцо формулы (а).
В рамках более предпочтительных групп II(а) и (b) еще более предпочтительной группой соединений является такая, где
(i) R3 и R7 независимо друг от друга означают водород, алкил, алкилтиогруппу или галоген, предпочтительно означают метил, метилтиогруппу, хлор или бром, более предпочтительно означают метил, хлор или бром;
R4 означает водород, алкил или галоген, предпочтительно метил, хлор или бром;
R5 означает алкил, галоидалкил, алкилтиогруппу, алкоксигруппу, алкилоксикарбонил, арилоксигруппу, гидроксильную группу, галоген, циангруппу, карбоксильную группу, нитро-, амино-, моноалкиламино-, диалкиламиногруппу или алкилсульфонил, предпочтительно означает алкил, алкоксигруппу или галоген, более предпочтительно означает метил, метоксигруппу, хлор или бром, и
R6 означает водород.
(ii) Другой даже более предпочтительной группой соединений в рамках групп II(а) и (b) является такая, где
R3 и R6 означают водород;
R4 и R7 независимо друг от друга означают алкил или галоген, предпочтительно означают метил, хлор или бром, и
R5 означает алкил, галоидалкил, алкилтиогруппу, алкоксигруппу, алкилоксикарбонил, арилоксигруппу, гидроксильную группу, галоген, циангруппу, карбоксильную группу, нитро-, амино-, моноалкиламино-, диалкиламиногруппу или алкилсульфонил, предпочтительно означает алкил, алкоксигруппу или галоген, более предпочтительно означает метил, метоксигруппу, хлор или бром.
(iii) Другой еще более предпочтительной группой соединений в рамках групп II(а) и (b) является такая, где
R4 и R6 означают водород,
R3 и R7 независимо друг от друга означают алкил или галоген, и
R5 означает алкил, галоидалкил, алкилтиогруппу, алкоксигруппу, алкилоксикарбонил, арилоксигруппу, гидроксильную группу, галоген, циангруппу, карбоксильную группу, нитро-, амино-, моноалкиламино-, диалкиламиногруппу или алкилсульфонил.
В рамках вышеуказанных предпочтительной, более предпочтительной и еще более предпочтительной групп (II)а и (II)b особенно предпочтительной группой соединений является такая, где
R1 означает алкил, аралкил, гетероалкил или -(алкилен)-С(О)-X, где X означает алкил, аминогруппу, монозамещенную аминогруппу, дизамещенную аминогруппу или гетероциклический остаток, более предпочтительно означает 2-пропил, гидроксиметил, трет-бутоксиметил, 2-гидроксиэтил, 2-гидроксипропил, 2-амидопропил, ацетилоксиметил, бензил, метоксиметил или -(алкилен)-С(О)-X, где X означает 2- или 4-пиридилметиламиногруппу, 1-алкоксикарбонилпиридин-4-иламиногруппу, необязательно замещенную бензиламиногруппу, необязательно замещенный по положению 4 бензилоксикарбонилпиперазин-1-ил, необязательно замещенный по положению 4 фенилпиперазин-1-ил, 4-алкоксикарбонилпиперазин-1-ил или необязательно замещенный по положению 4 гетероарилпиперазин-1-ил, наиболее предпочтительно означает 2-пропил, гидроксиметил, трет-бутоксиметил, 2-гидроксиэтил, 2-гидроксипропил, 2-амидопропил, ацетилоксиметил, бензил, метоксиметил, 2-(2- или 4-пиридилметиламинокарбонил)этил, 2-(1-этоксикарбонилпиридин-4-иламинокарбонил)этил, 2-(бензиламинокарбонил)этил, 2-(4-бензилоксикарбонилпиперазин-1-илкарбонил)этил, 2-(4-фенилпиперазин-1-илкарбонил)этил, 2-(4-метоксикарбонилпиперазин-1-илкарбонил)этил, 2-(4-ацетилпиперазин-1-илкарбонил)этил или 2-(4-пиридин-2-илпиперазин-1-илкарбонил)этил.
В рамках вышеуказанных предпочтительных, более предпочтительных и еще более предпочтительных групп (II) альтернативной, особенно предпочтительной группой соединений является такая, где
R1 означает гетероалкил или -(алкилен)-С(O)-X, где X означает алкил, аминогруппу, монозамещенную аминогруппу, дизамещенную аминогруппу или гетероциклический остаток,
более предпочтительно означает метилсульфониламинометил, фенилсульфониламинометил, (3-нитрофенил)CH2SO2 NHCH2, метилкарбониламинометил, 4-(метоксикарбонил)фенилкарбониламинометил, 2-(пиррол-1-ил)фенилкарбониламинометил, 3-цианфениламинокарбониламинометил, тиен-2-илкарбониламинометил, фенилкарбониламинометил, (С6H5)СНСН3NНСО(С2Н4)CONHCH2, (4-метоксифенил)COC2H4CONHCH2, 4-хлорфенилсульфониламинокарбониламинометил, 5-(ацетил)таен-2-илкарбониламинометил, пиридин-3-илкарбониламинометил, (3,4,5-триметоксифенил)C2H4CONHCH2, 3-метоксифениламинокарбониламинометил, (фенокси)CH(CH2CH3)CONHCH2, 1-(этоксикарбонил)пиперидин-4-иламинометилкарбониламинометил, 3-(бензилоксикарбониламино)пропил, 2-[(дифенил)метиламинокарбонил]этил, 2-[2-(метил)бутиламинокарбонил]этил или 2-[(С6Н5)СНСН3NНСО]этил.
III. Третьей предпочтительной группой соединений формулы (Iа) является такая, где
R означает –CH(R2)Ar1, где R2 означает водород;
Аr1 означает гетероарил и
Аr2 означает нафтильное кольцо формулы (b).
IV. Четвертой предпочтительной группой соединений формулы (Iа) является такая, где
R означает -CH(R2 )Аr1, где R2 означает водород;
Аr1 означает арил и
Аr2 означает нафтильное кольцо формулы (b).
V, VI. Пятой и шестой предпочтительной группой соединений формулы (Iа) является такая, где
R означает -CH(R2)СН=СНАr1, где R2 означает водород;
Аr1 означает гетероарил и
Аr2 означает фенильное кольцо формулы (а) или
Аr1 означает гетероарил и
Ar2 означает нафтильное кольцо формулы (b).
VII, VIII. Седьмая и восьмая предпочтительная группа соединений формулы (Iа) является такой, где
R означает –СH(R2 )СН=СНАr1, где R2 означает водород;
Ar1 означает арил и
Ar2 означает фенильное кольцо формулы (а) или
Ar1 означает арил и
Ar2 означает нафтильное кольцо формулы (b).
В рамках вышеуказанных предпочтительных групп III-VIII особенно предпочтительной группой соединений является такая, где
R1 означает алкил, аралкил, гетероалкил или -(алкилен)-С(O)-X, где X означает алкил, аминогруппу, монозамещенную аминогруппу, дизамещенную аминогруппу или гетероциклический остаток, более предпочтительно означает 2-пропил, гидроксиметил, трет-бутоксиметил, 2-гидроксиэтил, 2-гидроксипропил, 2-амидопропил, ацетилоксиметил, бензил, метоксиметил или -(алкилен)-С(O)-X, где X означает 2- или 4-пиридилметиламиногруппу, 1-алкоксикарбонилпиридин-4-иламиногруппу, необязательно замещенную бензиламиногруппу, необязательно замещенный по положению 4 бензилоксикарбонилпиперазин-1-ил, необязательно замещенный по положению 4 фенилпиперазин-1-ил, 4-алкоксикарбонилпиперазин-1-ил или необязательно замещенный по положению 4 гетероарилпиперазин-1-ил,
наиболее предпочтительно означает 2-пропил, гидроксиметил, трет-бутоксиметил, 2-гидроксиэтил, 2-гидроксипропил, 2-амидопропил, ацетилоксиметил, бензил, метоксиметил, 2-(2- или 4-пиридилметиламинокарбонил)этил, 2-(1-этоксикарбонилпиридин-4-иламинокарбонил)этил, 2-(бензиламинокарбонил)этил, 2-(4-бензилоксикарбонилпиперазин-1-илкарбонил)этил, 2-(4-фенилпиперазин-1-илкарбонил)этил, 2-(4-метоксикарбонилпиперазин-1-илкарбонил)этил, 2-(4-ацетилпиперазин-1-илкарбонил)этил или 2-(4-пиридин-2-илпиперазин-1-илкарбонил)этил.
В рамках вышеприведенных предпочтительных групп III-VIII альтернативной, особенно предпочтительной группой соединений является такая, где
R1 означает гетероалкил или -(алкилен)-С(O)-X, где X означает алкил, аминогруппу, монозамещенную аминогруппу, дизамещенную аминогруппу или гетероциклический остаток,
более предпочтительно означает метилсульфониламинометил, фенилсульфониламинометил, (3-нитрофенил)CH2SO2NHCH2, метилкарбониламинометил, 4-(метоксикарбонил)фенилкарбониламинометил, 2-(пиррол-1-ил)фенилкарбониламинометил, 3-цианфениламинокарбониламинометил, тиен-2-илкарбониламинометил, фенилкарбониламинометил, (С6Н5)СНСН3NНСО(С2Н4)СОNНСН2, (4-метоксифенил)СОС2Н4СОNНСН2, 4-хлорфенилсульфониламинокарбониламинометил, 5-(ацетил)тиен-2-илкарбониламинометил, пиридин-3-илкарбониламинометил, (3,4,5-триметоксифенил)C2H4CONHCH2, 3-метоксифениламинокарбониламинометил, (фенокси)СН(СН2СН3)СОNНСН2, 1-(этоксикарбонил)пиперидин-4-иламинометилкарбониламинометил, 3-(бензилоксикарбониламино)пропил, 2-[(дифенил)метиламинокарбонил]этил, 2-[2-(метил)бутиламинокарбонил]этил или 2-[(С6Н5)СНСН3NНСО]этил.
Заслуживающие особого внимания соединения вышеуказанных вариантов осуществления изобретения представлены ниже.
Образцами соединений данного изобретения являются следующие.
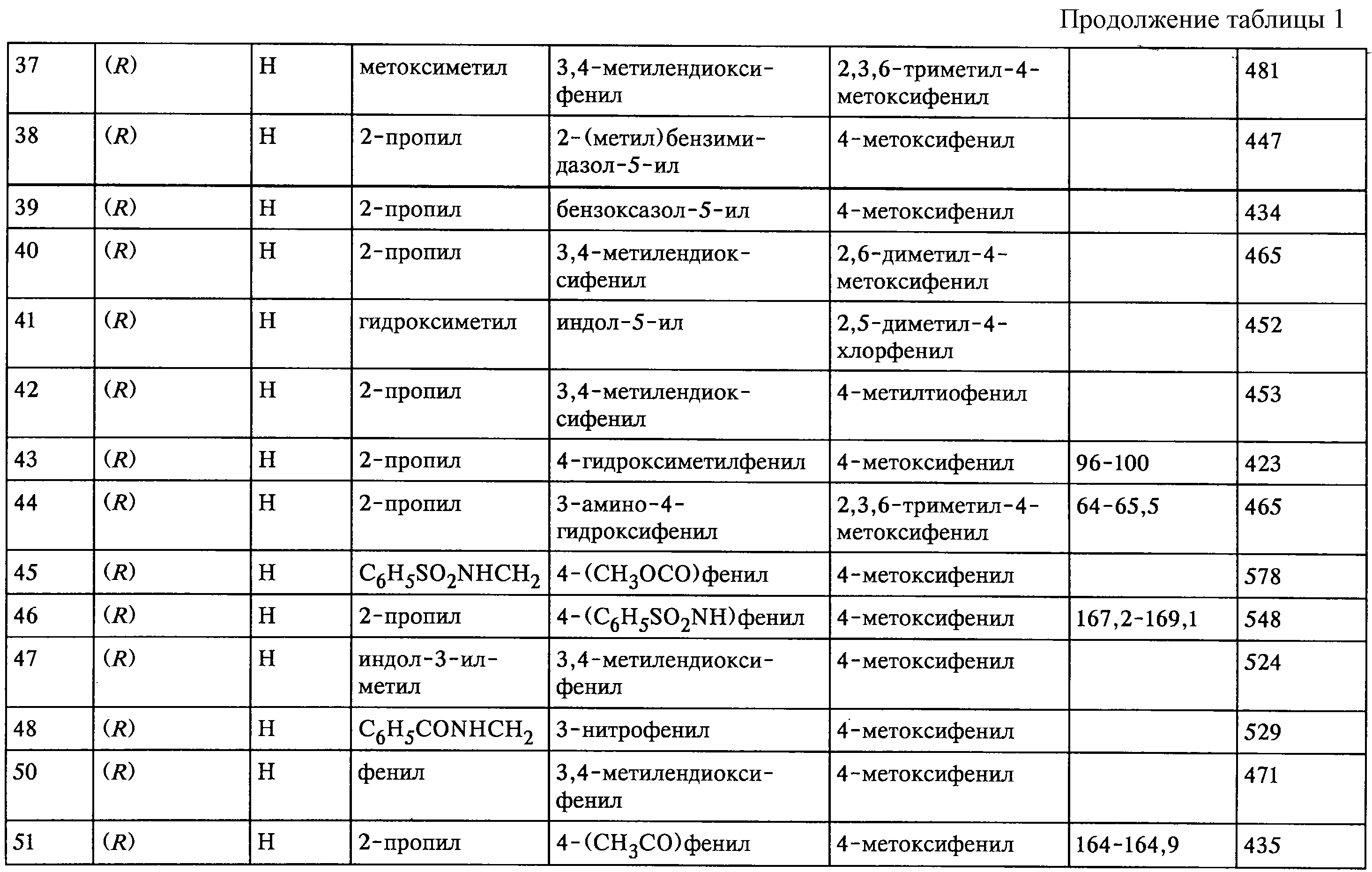
I. Соединения формул (Iа) и (Ib), где R означает -CH(R2)Аr1, и другие группы определены, как следует далее (см. таблицу 1).
I. Соединения формул (Ia) и (Ib), где R означает -CH(R2)Аr1, Аr2означает 2,3,6-триметил-4-метоксифенил или 2,6-диметил-4-метоксифенил, R2 означает водород и другие группы, характеризуются, как следует далее (см. таблицу 2).
В третьем аспекте данное изобретение предусматривает способ получения соединений формулы (Iа), способ включает
(i) взаимодействие соединения формулы 1:

где R1, R2, Ar1 и Аr2 являются такими, как определено в п.1 формулы изобретения, и Y означает гидроксил, галоген, алкил или сложный сукцинимидный эфир, с гидроксиламином формулы NHR’OR’’, где R’ означает водород или защитную группу азота и R’’ является защитной группой кислорода, сопровождаемое удалением защитной группы (групп) для получения соединения формулы (Iа), или
(ii) взаимодействие соединения формулы 2, где R1 и Ar2 являются такими, как определено в п.1 формулы изобретения, и Ra и Rb являются подходящими защитными группами кислорода и азота

с алкилирующим агентом формулы Ar1CHR2Х или Ar1CH=CHCHR2X, где Аr1и R2 являются такими, как определено в п.1 формулы изобретения, и X является уходящей группой, в условиях реакции алкилирования или со спиртом формулы Ar1CHR2ОН в присутствии реагента сочетания и триалкилфосфина, сопровождаемое удалением защитных групп для получения соединения формулы (Iа);
(iii) необязательное превращение соединения формулы (Iа), полученного на стадиях (i)-(ii) выше, в соответствующую аддитивную соль кислоты, полученную в результате обработки кислотой;
(iv) необязательное превращение соединения формулы (Iа), полученного на стадиях (i)-(ii) выше, в соответствующее свободное основание при обработке основанием, и
(v) необязательное разделение смеси стереоизомеров соединения формулы (Iа), полученного на стадиях (i)-(iv) выше, для получения индивидуального стереоизомера.
В описываемом способе понятие "защитная группа" относится к группе атомов, которая, будучи присоединенной к реакционноспособной группе в молекуле, маскирует, уменьшает или предотвращает реакционную способность последней. Примеры защитных групп могут быть найдены в сборниках T.W.Greene and P.G.Futs, Protective Groups in Organic Chemistry (Wiley, 2-ое изд., 1991) и Harrison and Harrison et al., Compendium of Synthetic Organic Methods, тома 1-8 (изд. John Wiley and Sons., 1971-1996). Примеры защитных групп аминогруппы включают формил, ацетил, трифторацетил, бензил, бензилоксикарбонил (КБЗ), трет-бутоксикарбонил (Бок), триметилсилил (ТМС), 2-триметилсилилэтансульфонил (ТМСЭС), тритил и замещенные тритильные группы, аллилоксикарбонил, 9-флуоренилметилоксикарбонил (ФМОК), нитровератрилоксикарбонил (НВОК) и им подобные. Примеры защитных групп гидроксильной группы включают те, где гидроксильная группа либо ацилирована, либо алкилирована, как, например, простые бензильные или тритильные эфиры, а также простые алкиловые эфиры, простые тетрагидропираниловые эфиры, простые триалкилсилиловые эфиры и простые аллиловые эфиры.
Термин "уходящая группа" означает то, что обычно связано с этим в синтетической органической химии, т.е. атом или группу, способную быть замененной нуклеофилом, и включает галоген (как, например, хлор, бром, иод), алкансульфонилоксигруппу, аренсульфонилоксигруппу, алкилкарбонилоксигруппу (например, ацетоксигруппу), арилкарбонилоксигруппу, мезилоксигруппу, тозилоксигруппу, трифторметансульфонилоксигруппу, арилоксигруппу (например, 2,4-динитрофеноксигруппу), метоксигруппу, N,O-диметилгидроксиламиногруппу и им подобные.
Способ введения R, где R означает -CH(R2)Аr1, включает алкилирование по азоту по реакции Митсонобу. По этому способу спирт общей формулы Ar1CHR2ОН смешивают с соединением общей формулы 13 в присутствии, например, трифенилфосфина и диэтилового эфира азодикарбоновой кислоты или дифенилпиридилфосфина и трет-бутилового эфира азодикарбоновой кислоты (см. Tetrahedron Lett., 40: 4497-4500 (1999). Алкилирование удобно проводить в растворителе, который является инертным в условиях реакции, предпочтительно в простом эфире с открытой цепочкой или в циклическом простом эфире, при температуре примерно от -20 до примерно 100°С, предпочтительно от 0 до примерно 30°С (или при комнатной температуре). Как и в других способах алкилирования, первичные и вторичные спирты являются наиболее подходящими для реакции в таких условиях.
Согласно еще одному аспекту настоящее изобретение относится к соединениям формулы (II)

где R1, R и Аr2 являются такими, как установлено для соединений формулы (Iа) выше.
Согласно другому аспекту настоящее изобретение относится к соединениям формулы (III)

где R, R1 и Аr2 являются такими, как установлено для соединений формулы (Iа) выше, и R12 означает алкил.
Согласно дополнительному аспекту настоящее изобретение относится к соединениям формулы (IV)

где R, R1 и Аr2 являются такими, как установлено для соединений формулы (Iа) выше, и R’ означает водород или защитную группу, и R’’ является защитной группой.
Соединения настоящего изобретения, включая упомянутые выше промежуточные соединения, могут быть получены с помощью способов, изображенных на схемах реакций, представленных ниже.
Исходные материалы и реагенты, используемые при получении этих соединений, либо являются коммерчески доступными от таких поставщиков, как фирмы Aldrich Chemical Co. (Милуоки, Висконсин, США), Bachem (Торранс, Калифорния, США), Emka-Chemie или Sigma (Сент-Луис, Миссури, США), Calbiochem-Novabiochem (Сан-Диего, Калифорния) или Indofine Chemical Co. (Беллмид, Нью-Джерси, США), либо их получают способами, известными специалистам в данной области, следуя методикам, представленным в ссылках, таких, как Fieser and Fieser’s Reagents for Organic Synthesis, тома 1-15 (изд. John Wiley and Sons, 1991); Rodd’s Chemistry of Carbon Compounds, тома 1-5 и Дополнения (изд. Elsevier Science Publishers, 1989), Organic Reactions, тома 1-40 (изд. John Wiley and Sons, 1991), March’s Advanced Organic Chemistry (изд. John Wiley and Sons, 4-ое издание) и Larock’s Comprehensive Organic Transformations (изд. VCH Publishers Inc., 1989). Эти схемы являются только иллюстрацией некоторых способов, с помощью которых могут быть синтезированы соединения по данному изобретению, и могут быть осуществлены различные модификации к этим схемам, имеющие отношение к этому раскрытию, и предложены специалистам в данной области.
Исходные вещества и промежуточные соединения реакций могут быть выделены и очищены, если желательно, с использованием принятых методик, включая, но не ограничиваясь этим, фильтрацию, перегонку, кристаллизацию, хроматографию и им подобные. Такие вещества могут быть охарактеризованы с использованием общепринятых средств, включая физические константы и спектральные данные.
Получение соединений формул (Iа) и (Ib)
Схемы А, Б и В описывают альтернативные способы получения соединений формулы (Iа), упомянутых выше, и (Ib), упомянутых ниже.
Соединение формулы (Iа) или (Ib), где R означает -CH(R2)Ar1, R1 и Аr2 являются такими, как определено спецификацией, получают из подходящим образом N-замещенного α-аминопроизводного 1, как показано на схеме А.

Обработка α-аминоацетата формулы 1 (где R означает алкил, как, например, метил, этил или трет-бутил, или аралкил, например бензил) соединением формулы 2, где R2 означает водород или алкил, в условиях реакции восстановительного аминирования, то есть в присутствии подходящего восстанавливающего агента (например, цианборгидрида натрия, триацетоксиборгидрида натрия и им подобных) и органической кислоты (например, ледяной уксусной кислоты, трифторуксусной кислоты и им подобных) приводит к сложному N-алкилированному α -аминоэфиру формулы 3. Подходящими растворителями для этой реакции являются галогенированные углеводороды (например, 1,2-дихлорэтан, хлороформ и им подобные).
Соединения формулы 1 являются коммерчески доступными или их можно получить с использованием хорошо известных в данной области способов. Например, сложные эфиры природных и не встречающихся в природе аминокислот, как, например, соль бензилового эфира D-валина с п-толилсульфокислотой, солянокислая соль этилового эфира D-валина, солянокислая соль трет-бутилового эфира D-валина, метиловые эфиры L-, D- или DL-серина, имеются в продаже. α-Тиометиламинокислоты могут быть получены согласно методикам, описанным Arnold, L.D., Kalantar, Т.Н., Vederas, J.C. в J. Am. Chem. Soc., 107, 7108 (1985). Остальные могут быть получены путем этерификации N-защищенных α-аминокислот (подходящими защитными группами аминогруппы являются трет-бутоксикарбонил, бензилоксикарбонил и им подобные), сопровождаемой снятием защиты с аминогруппы, как описано в примере 1.
Сульфонилирование 3 арилсульфонилхлоридом формулы 4 приводит к 2-(арилсульфониламино)ацетату формулы 5. Реакция сульфонилирования может быть проведена способами, хорошо известными в данной области, например, при взаимодействии 3 с соединением формулы 4 в присутствии триметилсилилцианида в ацетонитриле. Соединения формулы 4 имеются в продаже или они могут быть получены хорошо известными в данной области способами. Например, 4-метоксибензолсульфонилхлорид, 4-метокси-2,3,6-триметилбензолсульфонилхлорид, 4-хлор-2, 5-диметилбензолсульфонилхлорид, 2-дибензофурансульфонилхлорид, 4-бромбензолсульфонилхлорид, 2-нафталинсульфонилхлорид и 1-нафталинсульфонилхлорид имеются в продаже. Другие соединения могут быть получены с помощью методик, описанных Bosshard, E.H. et al., Helv. Chim. Acta, 42, 1653 (1959); Colter, A.K. and Turkos, R.E.C., Canadian J. of Chem., 56, 585 (1978); Buchanan, G.W. et al., J. Org. Chem., 40, 2357-2359 (1975), и Fujino, M. et al., Chem. Pharm. Bull., 10, 2825-2831 (1981). Обычно несульфонилированный арен обрабатывают хлорсульфоновой кислотой в дихлорметане при -5-10°С для получения желаемого аренсульфонилхлорида.
Превращение 5 в соответствующую карбоновую кислоту зависит от природы группы R. Например, если R является бензильной группой, то ее удаляют в условиях реакции гидрогенизации. Если R является алкильной группой, как, например, метильная или этильная группа, тогда она удаляется в условиях реакции основного гидролиза, то есть в присутствии водного основания (например, гидроокиси натрия, гидроокиси лития и им подобных) в спиртовом органическом растворителе, как, например, метанол, этанол и им подобные. Если R означает трет-бутильную группу, то она удаляется в кислотных условиях.
Соединение 6 может быть превращено в соединение формул (Iа) или (Ib) путем превращения 6 в ацильное производное формулы 7, где Y означает уходящую группу в условиях ацилирования (например, хлор, сукцинимидогруппу и им подобные). При обработке 7 N,O-бис-триметилсилилгидроксиламином с последующей кислотной обработкой или при прибавлении метанола непосредственно получают соединение формулы (Iа) или (Ib).
Ацильное производное 7 может быть получено способами, известными обычным специалистам в данной области. Например, соединение 7, где Y означает хлор, может быть получено при реакции соединения 5 с хлорирующим агентом, например с оксалилхлоридом, в подходящем органическом растворителе, как, например, хлористый метилен.
Альтернативно соединение формулы (Iа) или (Ib) может быть получено из соединения формулы 6 в две стадии, первая из которых представляет взаимодействие 6 с замещенным по кислороду гидроксиламином (например, с O-бензилгидроксиламином, O-трет-бутилгидроксиламином и им подобными) с образованием замещенного по кислороду гидроксамата формулы 8. Реакцию проводят в присутствии реагента сочетания (например, N,N-дициклогексилкарбодиимида, N-этил-N’-(3-диметиламинопропил)карбодиимида и им подобных), органического основания (например, диметиламинопиридина, триэтиламина, пиридина, N-метилморфолина и им подобных) и необязательно гидроксибензотриазола. Подходящими растворителями для реакции являются хлористый метилен, дихлорэтан, диметилформамид и им подобные растворители. Удаление защитной группы при атоме кислорода приводит затем к соединению формулы (Iа) или (Ib). Применяемые условия реакции зависят от природы группы R’, например, если R’ означает трет-бутил, то реакцию проводят в инертном растворителе, как, например, дихлорметан, в присутствии кислоты (например, безводный хлористый водород, трифторуксусная кислота и им подобные). Если R’ означает бензил, тогда необходимы условия гидрогенолиза, использующие металлический катализатор, например палладий, в инертном растворителе, таком, как этилацетат или тетрагидрофуран. Соединения формул 5, 7 или 8 могут также быть превращены в соединение формулы (Iа) или (Ib) с помощью методик, описанных в заявке РСТ, публикация №98/32748.
Соединение формулы (Iа) или (Ib), где R означает -CH(R2)Ar1 и остальные группы являются такими, как установлено в спецификации, могут также быть получены из α -аминоацетата 1, как показано на схеме Б.
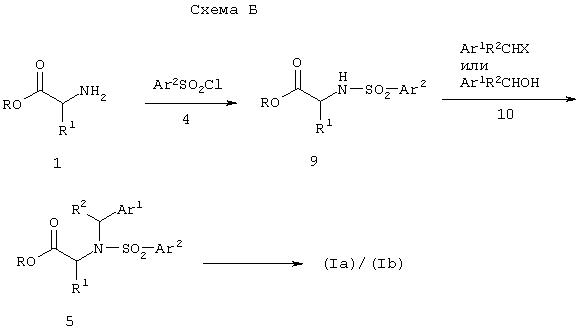
Сульфонилирование соединения формулы 1 с помощью арилсульфонилхлорида в условиях реакции, описанных в схеме А выше, приводит к 2-арилсульфонилацетату формулы 9, который превращают в соединение формулы 5 либо
(а) при взаимодействии соединения 9 с алкилирующим агентом формулы Ar1CHR2Х (где X является в условиях алкилирования уходящей группой, такой, как хлор, бром, мезилат, трифлат и им подобные) в присутствии основания (например, карбоната натрия, карбоната калия, карбоната цезия и им подобных) и в подходящем растворителе, как, например, тетрагидрофуран, диоксан, N, N-диметилформамид и им подобные, либо
(б) при взаимодействии соединения 9 со спиртом формулы Ar1CHR2ОН в присутствии триалкилфосфина или триарилфосфина, предпочтительно трибутилфосфина, трифенилфосфина, предпочтительно трибутилфосфина, и диалкилазодикарбоксилата, как, например, диэтиловый или диизопропиловый эфир азодикарбоновой кислоты или (1, 1’-азодикарбонил)дипиперидин, предпочтительно (1, 1’-азодикарбонил)дипиперидин. Подходящие растворители включают ароматические углеводороды, как, например, бензол и им подобные.
Соединение 5 затем превращают в соединение формулы (Iа) или (Ib), как описано на схеме А выше.
Соединение формулы (Iа) или (Ib), где R означает -CH(R2)Аr1 и другие группы являются такими, как установлено в спецификации, могут также быть получены из α-аминокислоты 11, как показано на схеме В.

Сульфонилирование α-аминокислоты 11 арилсульфонилхлоридом формулы 4 в присутствии основания, как, например, триэтиламин, приводит к 2-арилсульфониламиноуксусной кислоте формулы 12. Реакцию проводят в смеси органического растворителя и воды, например тетрагидрофурана и воды. Соединение 12 может быть превращено в соединение формулы (Iа) или (Ib) методом (а) или (b).
По методу (а) этерификация 12 приводит к соединению формулы 9 (где R означает алкил, например метил, трет-бутил, или аралкил, например бензил), которое затем превращают в соединение формулы (Iа) или (Ib) по методике, описанной выше в схемах А и Б.
По методу (b) соединение 12 подвергают реакции с N, О-защищенным гидроксиламином, например с O-(2,4-диметоксибензил)-N-(2,4, 6-триметоксибензил)гидроксиламином, в условиях, описанных Barlaam, В. et аl., Tet. Lett., том 39, стр. 7865 (1998), получают соединение формулы 13. Алкилирование 13 приводит к соединению формулы 14, которое при обработке трифторуксусной кислотой в хлористом метилене в присутствии триэтилсилана образует соединение формулы (Iа) или (Ib) (см. Barlaam, В. et al., Tet. Lett., том 39, 7865 (1998)).
Соединение формулы (Ia) или (Ib), где R означает -CH(R2)CH=CHAr1 и другие группы являются такими, как установлено в спецификации, также может быть получено из α-аминоацетата 1, как показано на схеме Г.
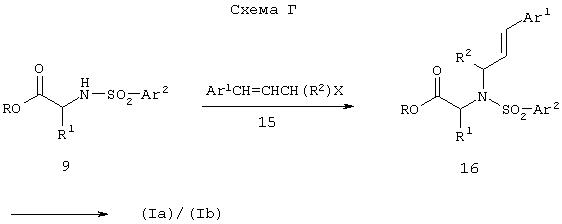
Соединение формулы (Iа) или (Ib), где R означает –CH(R2)CH=CHAr1, получают при алкилировании соединения формулы 9 (R не может быть бензилом) алкилирующим агентом формулы 15, где X является уходящей группой в условиях алкилирования (например, хлором, бромом, мезилатом, трифлатом и им подобными) в присутствии основания (например, карбоната натрия, карбоната калия, карбоната цезия и им подобных) и в подходящем растворителе, например в тетрагидрофуране, диоксане, N,N-диметилформамиде и им подобных, что приводит к соединению формулы 16. Гидролиз сложноэфирной группы в 16 приводит к соответствующей кислоте, которую затем превращают в соединение формулы (Iа) или (Ib), получая хлорангидрид кислоты, который затем обрабатывают N,O-бис-триметилсилилгидроксиламином, как описано в схеме А выше.
Соединение формулы 15, например хлористый циннамил, имеется в продаже.
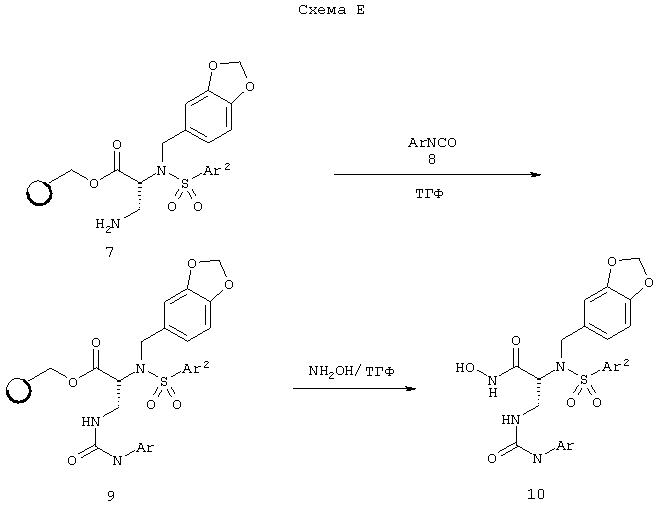
Соединение формулы (Iа) или (Ib), где Аr2 является таким, как установлено в спецификации, R означает СН2Аr1 (где Аr1 означает 3,4-метилендиоксифенил) и R1 означает –CH2NHCOOR’’ (где R’’ означает водород, алкил, галоидалкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероарил, гетероаралкил или гетероциклилалкил), может быть получено из N-замещенной диаминопропионовой кислоты 2, как показано на схеме Д и как более подробно описано в примере 16.

Соединение формулы (Ia) или (Ib), где Аr2 является таким, как указано в спецификации, R означает СН2Аr1 (где Аr1 означает 3,4-метилендиоксифенил) и R1 является –CH2NHCONHAr, может быть получено из смолы формулы 7 (из схемы Д), как показано на схеме Е и как более полно описано в примере 17.
Согласно другому аспекту данное изобретение обеспечивает фармацевтические композиции, содержащие терапевтически эффективное количество соединения формулы (Iа) в соответствии с различными вариантами осуществления изобретения, как определено выше, и фармацевтически приемлемый наполнитель.
Соединения по данному изобретению могут быть использованы в качестве терапевтически активных веществ, особенно в виде лекарственных препаратов. В частности, они полезны при лечении заболеваний, связанных с избыточным отложением интерстициальных коллагенов, примерами заболеваний служат интерстициальный фиброз легких, перицентральный фиброз, фиброз Симмерса, субадвентициальный фиброз стенок артерий, фиброз почек и печени, пневмофиброз неясного происхождения, эндокардиальный фиброэластоз, гепатит, острый респираторный дистресс-синдром, артрит, муковисцидоз, операции на сухожилиях, спайкообразование в результате хирургических операций, роговичное рубцевание и рестеноз.
Соединения по данному изобретению являются ингибиторами С-протеиназы проколлагена. Вследствие этого они ингибируют С-концевой процессинг коллагенов типа I, II и III, необходимый для их способности образовывать нерастворимые коллагеновые фибриллы. Кроме того, отобранные соединения по изобретению селективно ингибируют С-протеиназу проколлагена относительно других расщепляющих коллаген ферментов, как, например, коллагеназа-1, коллагеназа-2 и коллагеназа-3. Поэтому естественная резорбция коллагена, опосредствованная коллагеназой-1, коллагеназой-2 и коллагеназой-3, в значительной степени не подвергается воздействию, что приводит в результате к соединениям большей терапевтической эффективности. В частности, предпочтительные соединения по изобретению ингибируют С-протеиназу проколлагена с большей чем в 100 раз селективностью относительно коллагеназы-1, коллагеназы-2 и коллагеназы-3. Селективное ингибирование С-протеиназы проколлагена относительно коллагеназы-1, коллагеназы-2 и коллагеназы-3 было продемонстрировано опытами, описанными в примерах. Таким образом, данное изобретение позволяет проводить лечение фиброзных заболеваний при введении больному средства, которое селективно ингибирует С-протеиназу проколлагена относительно коллагеназы-1, коллагеназы-2 и коллагеназы-3.
Согласно еще одному аспекту данное изобретение относится к применению соединений формулы (Ib)

где R1 означает алкил, галоидалкил, гетероалкил, циклоалкил, арил, аралкил, аралкенил, гетероарил, гетероаралкил, гетероаралкенил, гетероциклилалкил, циклоалкилалкил, -(алкилен)-С(O)-X (где X означает алкил, галоидалкил, циклоалкил, циклоалкилалкил, аминогруппу, монозамещенную аминогруппу, дизамещенную аминогруппу, арил, аралкил, гетероарил, гетероаралкил, гетероциклический остаток, гетероциклилалкил, гидроксильную группу, алкоксигруппу, циклоалкоксигруппу, циклоалкилалкоксигруппу, гетероалкилоксигруппу, аралкилоксигруппу или гетероаралкилоксигруппу) или -C(=NR’)NHSO2R’’ (где R’ означает водород или алкил и R’’ означает алкил, галоидалкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероарил, гетероаралкил или гетероциклилалкил);
R означает -CH(R2)Arl или –СH(R2)CH=CHAr1, где R2 означает водород или алкил и Аr1 означает арил или гетероарил;
Аr2 означает либо
(i) фенильное кольцо формулы (а)

где R3 и R7 независимо друг от друга означают водород, алкил, алкилтиогруппу или галоген;
R4 и R6 независимо друг от друга означают водород, алкил или галоген;
R5 означает алкил, галоидалкил, гетероциклический остаток, алкилтиогруппу, арилтиогруппу, аралкилтиогруппу, гетероарилтиогруппу, гетероаралкилтиогруппу, циклоалкилтиогруппу, циклоалкилалкилтиогруппу, алкоксигруппу, арилоксигруппу, аралкоксигруппу, гетероарилоксигруппу, гетероаралкилоксигруппу, циклоалкоксигруппу, циклоалкилалкоксигруппу, алкилоксикарбонил, гидроксильную группу, галоген, циангруппу, карбоксильную группу, нитрогруппу, аминогруппу, моноалкиламиногруппу, диалкиламиногруппу, алкилсульфонил, арилсульфонил, аралкилсульфонил, гетероарилсульфонил, гетероаралкилсульфонил, циклоалкилсульфонил, циклоалкилалкилсульфонил или -Y-(алкилен)-С(O)-Z [где Y означает связь, -NRa-, -О- или -S(O)n- (где n является числом от 0 до 2), Ra означает водород или алкил и Z означает алкоксигруппу, гидроксильную группу, аминогруппу, монозамещенную аминогруппу или дизамещенную аминогруппу] или
R5 вместе с R4 образует -O-(CR8 R9)n-, где n означает 2 или 3 и каждый R8, и R9 независимо друг от друга означают водород или алкил, или
углеродные атомы, к которым присоединены R5 и R4, принимают участие в конденсации, образуя углеродные атомы С2-С3 бензофуранового кольца, либо
(ii) нафтильное кольцо формулы (b)

где R10 означает водород, алкил, алкоксигруппу или галоген и
R11 означает водород, алкил, галоидалкил, алкилтиогруппу, алкоксигруппу, алкилоксикарбонил, арилоксигруппу, гидроксильную группу, галоген, циангруппу, карбоксильную группу, нитрогруппу, аминогруппу, моноалкиламиногруппу, диалкиламиногруппу или алкилсульфонил,
и их фармацевтически приемлемых солей, пролекарств, индивидуальных изомеров и смесей изомеров для получения лекарственного средства для лечения заболевания, поддающегося лечению ингибитором С-протеиназы проколлагена, предпочтительно для лечения интерстициального фиброза легких, перицентрального фиброза, фиброза Симмерса, субадвентициального фиброза стенок артерий, фиброза почек и печени, пневмофиброза неясного происхождения, эндокардиального фиброэластоза, гепатита, острого респираторного дистресс-синдрома, артрита, муковисцидоза, для лечения при операциях на сухожилиях, для лечения спайкообразования в результате хирургических операций, лечения роговичного рубцевания и рестеноза. Предпочтительными используемыми соединениями формулы (Ib) являются такие, как представленные выше для различных вариантов осуществления изобретения для соединений формулы (Ia).
Способность соединений формул (Iа) и (Ib) ингибировать активность проколлаген-С-протеиназы (РСР) может быть продемонстрирована с помощью различных анализов in vitro, известных специалистам в данной области, таких как анализ, описанный в примере 21. Избирательное действие в отношении различных коллагеназ может быть определено с помощью анализа, описанного в примере 22.
Для отобранных соединений с помощью анализа, описанного в примере 21 и анализа, описанного в примере 22, получены следующие данные о их ингибирующем и избирательном действии (см. таблицу 3).
Эффективность in vivo соединений формул (Ia) и (Ib) в отношении фиброзных заболеваний и отложения коллагена может быть продемонстрирована с помощью многочисленных моделей с использованием животных, включая модель мышиного индуцируемого блеомицином легочного фиброза ((Phan S.H. и др. "Bleomycin-induced Pulmonary Fibrosis", Am. Res. Respir. Dis., 124: 428-434 (1981), и Piguet P.F. и др., "Effective Treatment of the Pulmonary Fibrosis Elicited in Mice by Bleomycin or Silica with anti-CD-11 Antibodies", Am. Res. Respir. Dis., 147: 435-441 (1993), модель, созданную посредством имплантации губки ((Unemori E.N. и др., "Human Relaxin Decreases Collagen Accumulation In Vivo in Two Rodent Models of Fibrosis", J. Invest. Dermatolol., 101: 280-285 (1993)), модель почечного фиброза, индуцируемого четыреххлористым углеродом или NDMU, а также другие модели с использованием на животных, описанные в WO 97/05865 ("C-Proteinase Inhibitors for the Treatment of Disorders Relating to Overproduction of Collagen"), опубликованной 20 февраля 1997 г.
Как правило, соединения формул (Iа) и (Ib) по изобретению, приведенные выше в разных примерах осуществления, могут вводиться в терапевтически эффективном количестве с помощью любого из приемлемых путей введения агентов, которые служат аналогичным целям. Фактически применяемое количество соединения по настоящему изобретению, т.е. действующего вещества, должно зависеть от многочисленных факторов, таких как серьезность заболевания, подлежащего лечению, возраст и относительное состояние здоровья пациента, эффективность используемого соединения, путь и форма введения, и от других факторов. Лекарственное средство может вводиться более одного раза в день, предпочтительно один или два раза в день.
Терапевтически эффективные количества соединений формулы (Iа) или (Ib) могут составлять примерно 0,05-50 мг на килограмм веса тела реципиента в день, предпочтительно примерно 0, 3-20 мг/кг в день. Таким образом, для пациента весом 70 кг дозы наиболее предпочтительно находятся в диапазоне примерно от 21 мг до 1,4 г в день.
Как правило, соединения по настоящему изобретению могут применяться в виде фармацевтических композиций с помощью любого из следующих путей введения: перорального, системного (например, трансдермального, интраназального или с помощью суппозитория) или парентерального (например, внутримышечного, внутривенного или подкожного) введения. Предпочтительным путем введения является системный с использованием общепринятого суточного режима дозирования, который может регулироваться в зависимости от степени поражения болезнью.
Интраназальное введение, как правило, осуществляют с помощью композиций в виде сухого порошка, жидких растворов или суспензий, пригодных для распыления, или аэрозолей с пропеллентами, которые могут применяться в ингаляторах с дозированным распылением. В другом варианте фармацевтическая субстанция может вводиться с использованием микросфер, приготовленных из таких продуктов, как желатин, декстран, коллаген или альбумин. Как правило, микросферы вводят в виде высушенной вымораживанием форме с помощью такого приспособления, как назальный инсуффлятор или заполненный под давлением аэрозольный баллон. В качестве добавок для увеличения скорости системной абсорбции лекарственного средства в ткань могут также применяться вещества, увеличивающие скорость проникновения, такие как амфифильные стероиды.
Эффективное введение также может осуществляться с помощью введения в легкие или дыхательные пути, поскольку полипептиды легко абсорбируются через клеточную выстилку альвеолярной области легкого млекопитающих. Преимуществом является то, что для такого введения часто не требуется использовать в качестве добавок вещества, увеличивающие скорость проникновения. Устройства и методы для глубокого легочного введения описаны в патенте US 5780014, выданном 14 июля 1998 г., и в патенте US 5814607, выданном 29 сентября 1998 г.
И наконец, соединения могут применяться системно путем трансдермального введения, которое, как правило, включает нанесение лекарственного средства на поверхность кожи и его последующее проникновение через кожу. В устройствах для трансдермального введения применяются такие приспособления, как липкий пластырь или т.п., служащий в качестве резервуара для лекарственного средства и приводящий лекарственное средство в диффузионный контакт с кожей. Одним из общих типов таких приспособлений является трехмерный стабильный матрикс, известный как монолитный матрикс. Такие матриксы описаны более подробно в патентах US 5804214, 5149538 и 4956171, в которых представлены матриксы, изготовленные из полимеров и сополимеров акриловых латексов, сложных акриловых эфиров, сложных метакриловых эфиров и винилацетатов.
Выбор композиции зависит от различных факторов, таких как путь введения лекарственного средства (например, для перорального введения предпочтительными являются композиции в форме таблеток, пилюль или капсул) и биологическая доступность фармацевтической субстанции. В настоящее время специально для лекарственных средств, которые обладают плохой биологической доступностью, разработаны фармацевтические композиции на основе того принципа, что биологическая доступность может быть увеличена при увеличении площади поверхности, т.е. при уменьшении размера частицы. Например, в патенте US 4107288 описана фармацевтическая композиция, размер частиц которой находится в диапазоне от 10 до 1000 нм, в которой действующее вещество нанесено на сшитый матрикс из макромолекул. В патенте US 5145684 описано получение фармацевтической композиции, в которой фармацевтическую субстанцию напыляют на ультрамалые частицы (средний размер частицы 400 нм) в присутствии вещества, изменяющего поверхность, и затем диспергируют в жидкой среде, получая фармацевтическую композицию, которая обладает исключительно высокой биологической доступностью.
Композиции, как правило, включают соединение формулы (Iа) или (Ib) в сочетании по крайней мере с одним фармацевтически приемлемым эксципиентом. Приемлемые эксципиенты являются нетоксичными, способствуют введению и не оказывают вредного воздействия на терапевтическую эффективность соединения формулы (Iа) или (Ib). Такие эксципиенты могут представлять собой любой твердый, жидкий, полутвердый или в случае аэрозольной композиции газообразный эксципиент, который обычно применяют в данной области.
Твердые фармацевтические эксципиенты включают крахмал, целлюлозу, тальк, глюкозу, лактозу, сахарозу, желатин, солод, рисовую муку, мел, силикагель, стеарат магния, стеарат натрия, моностеарат глицерина, хлорид натрия, сухое снятое молоко и т.п. Жидкие и полутвердые эксципиенты могут быть выбраны из группы, включающей глицерин, пропиленгликоль, воду, этанол и различные масла, в том числе масла, полученные из нефти, животного, растительного происхождения, или синтетические, например арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.д. Предпочтительные жидкие носители, особенно для инъецируемых растворов, включают воду, физиологический раствор, водную декстрозу и гликоли.
Для диспергирования соединения по настоящему изобретению в аэрозольной форме могут применяться сжатые газы. Пригодными для этой цели инертными газами являются азот, двуокись углерода и т.п.
Другие пригодные фармацевтические эксципиенты и композиции на их основе описаны в Remington’s Pharmaceutical Sciences, E.W.Martin (ред.) (Mack Publishing Company, 18-е изд., 1990).
Количество соединения в композиции может варьироваться во всем диапазоне, который используется специалистами в данной области. Обычно композиция может содержать (в мас.%) приблизительно 0,01-99,99 мас.% соединения формулы I в пересчете на общую массу композиции с доведением до баланса с помощью одного или нескольких пригодных фармацевтических эксципиентов. Предпочтительно соединение присутствует в концентрации приблизительно 1-80 мас.%. Репрезентативные фармацевтические композиции, содержащие соединение формулы (Iа) или (Ib), описаны в примере 18.
Ниже изобретение проиллюстрировано на примерах, не ограничивающих его объем.
Пример 1
N-Гидрокси-2(R)-[(3,4-метилендиоксибензил)-(4-метокси-2,3, 6-триметилбензолсульфанил)амино]-3-метилбутирамид (таблица 1, соединение 12)

Стадия 1
N-трет-Бутоксикарбонил-D-валин (70 г, 0,32 моля) и карбонат цезия (200,2 г, 0,615 моля) перемешивают в сухом диметилформамиде (550 мл). Прибавляют бензилбромид (40,32 мл, 0, 336 моля) и реакционную смесь перемешивают в течение ночи. Реакционную смесь концентрируют на роторном испарителе, остаток растворяют в метиленхлориде (200 мл) и метиленхлоридный слой промывают водой и рассолом, сушат над сульфатом магния и концентрируют с получением бензилового эфира N-трет-бутоксикарбонил-D-валина (97 г) в виде вязкого масла.
Стадия 2
Бензиловый эфир N-трет-бутоксикарбонил-D-валина (70,7 г, 0,23 моля) растворяют в смеси (1:4) трифторуксусной кислоты и метиленхлорида (150 мл) и реакционную смесь нагревают при 50-60°С. Через 6 ч реакционную смесь концентрируют с получением 97 г трифторацетатной соли бензилового эфира D-валина (156,8 г) в виде вязкого масла, которое непосредственно перед использованием переводят в свободный амин.
Стадия 3
Однонормальный гидроксид натрия (80 мл) добавляют в раствор трифторацетатной соли бензилового эфира D-валина (10 г, 31,1 ммоля) в метиленхлориде (80 мл) и реакционную смесь перемешивают до тех пор, пока все исходное соединение не будет превращено в свободный амин. Органическую фазу собирают и промывают рассолом, сушат над сульфатом магния и концентрируют с получением бензилового эфира D-валина (5,35 г) в виде прозрачного масла.
Стадия 4
В раствор бензилового эфира D-валина (4 г, 19,3 ммоля) и триметилсилилцианида (7,2 мл, 57,9 ммоля) в ацетонитриле (40 мл) добавляют 4-метокси-2,3,6-триметилбензолсульфонилхлорида (4,8 г, 19,3 ммоля). Через 3 ч реакционную смесь разбавляют этилацетатом (100 мл) и переносят в делительную воронку. Добавляют водную хлористоводородную кислоту (120 мл, 2,5%), органический слой отделяют и промывают 5%-ным раствором бикарбоната натрия и рассолом и затем сушат над сульфатом магния. Органику отделяют in vacuo с получением бензилового эфира 2(R)-(4-метокси-2,3,6-триметилбензолсульфониламино)-3-метилмасляной кислоты (8 г) в виде коричневого масла.
Стадия 5
К смеси бензилового эфира 2(R)-(4-метокси-2,3, 6-триметилбензолсульфониламино)-3-метилмасляной кислоты (4,5 г, 10,72 ммоля), 3,4-(метилендиокси)фенилметанола (2,04 г, 13,41 ммоля) и трибутилфосфина (3,35 мл, 13,4 ммоля) в сухом бензоле (60 мл), охлажденной на ледяной бане, прибавляют 1,1’-(азодикарбонил)дипиперидин (3,38 г, 13,4 ммоля). Реакционную смесь перемешивают в течение ночи при комнатной температуре и затем хроматографируют методом мгновенно-испарительной хроматографии в колонке с силикагелем, используя 5-10%-ный этилацетат/гексан в качестве элюента, с получением бензилового эфира 2(R)-[(3,4-метилендиоксибензил)-(4-метокси-2,3, 6-триметилбензолсульфонил)амино]-3-метилмасляной кислоты (4,8 г) в виде твердого вещества белого цвета.
Стадия 6
В раствор бензилового эфира 2(R)-[(3, 4-метилендиоксибензил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-метилмасляной кислоты (4,7 г, 8,49 ммоля) в смеси (4:1) этанола и тетрагидрофурана (40 мл) добавляют 10%-ный Pd/C (0,15 г). Реакционную смесь помещают под водородный баллон. Через 3 ч реакционную смесь фильтруют через целит и целит промывают этанолом. Фильтрат концентрируют с получением 2(R)-[(3, 4-метилендиоксибензил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-метилмасляной кислоты (3,9 г) в виде белой пены.
Стадия 7
В раствор 2(R)-[(3, 4-метилендиоксибензил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-метилмасляной кислоты (3,82 г, 8,24 ммоля) в сухом метиленхлориде (20 мл) добавляют оксалилхлорид (2,2 мл, 24,72 ммоля) и каплю диметилформамида. Реакционную смесь перемешивают в течение 4 ч и затем концентрируют. Остаток растворяют в метиленхлориде (20 мл) и добавляют N, O-бис-триметилсилилгидроксиламин (8,8 мл, 41,2 ммоля). Через 4 ч добавляют метанол (1 мл) и перемешивание продолжают в течение 30 мин. Добавляют силикагель (10 г) и смесь концентрируют досуха. Получающийся продукт хроматографируют методом мгновенно-испарительной хроматографии в колонке с силикагелем, используя 50%-ный этилацетат/гексан в качестве элюента, с получением N-гидрокси-2(R)-[(3, 4-метилендиоксибензил)-(4-метокси-2,3, 6-триметилбензолсульфонил)амино]-3-метилбутирамида (2,46 г).
Пример 2
N-Гидрокси-2(R)-[(4-метоксикарбонилбензил)-(4-метоксибензолсульфонил)амино]-3-метилбутирамид (таблица 1, соединение 21)

Стадия 1
В охлажденный на льду раствор D-валина (50,5 г, 0,43 моля) и триэтиламина (145 мл, 1,034 моля) в смеси (1:1) тетрагидрофурана и воды (350 мл) добавляют 4-метоксибензолсульфонилхлорид (88,2 г, 0,43 ммоля). Реакционную смесь перемешивают и оставляют на ночь нагреваться до комнатной температуры. Летучие органические вещества удаляют, а водную фазу экстрагируют диэтиловым эфиром. Водную фазу подкисляют до рН 3 10%-ной хлористоводородной кислотой и продукт экстрагируют этилацетатом. Этилацетатный слой промывают рассолом, сушат над сульфатом магния и затем концентрируют с получением 2(R)-(4-метоксибензолсульфониламино)-3-метилмасляной кислоты в виде твердого вещества белого цвета (90,45 г).
Стадия 2
В раствор 2(R)-(4-метоксибензолсульфониламино)-3-метилмасляной кислоты (40 г, 139,2 ммоля) и карбоната цезия (85,7 г, 444 ммоля) в диметилформамиде добавляют бензилбромид (16,1 г, 135 ммоля). Реакционную смесь перемешивают в течение ночи. Диметилформамид удаляют на роторном испарителе, остаток растворяют в этилацетате (200 мл) и делят на две части с равным объемом воды. Органическую фазу собирают и промывают равным объемом рассола. Водные фазы обратно экстрагируют этилацетатом (2×150 мл), объединяют, сушат над сульфатом магния и конденсируют, получая бензиловый эфир 2(R)-(4-метоксибензолсульфониламино)-3-метилмасляной кислоты (42,6 г) в виде кристаллического вещества белого цвета.
Стадия 3
В раствор бензилового эфира 2(R)-(4-метоксибензолсульфониламино)-3-метилмасляной кислоты (1 г, 2,65 ммоля) и 4-карбоксиметилбензилбромида (0,577 г, 2,52 ммоля) в сухом диметилформамиде (60 мл) добавляют карбонат калия (0, 55 г, 4 ммоля). Реакционную смесь перемешивают в течение ночи и затем конденсируют на роторном испарителе. Хроматографически очищают методом мгновенно-испарительной хроматографии в колонке с силикагелем, используя 5%-ный этилацетат/гексан в качестве элюента, с получением бензилового эфира 2(R)-[(4-метоксикарбонилбензил)-4-(метоксибензолсульфонил)амино]-3-метилмасляной кислоты (0,965 г), который переводят в N-гидрокси-2(R)-[(4-метоксикарбонилбензил)-4-(метоксибензолсульфонил)амино]-3-метилбутирамид методами, описанными на стадиях 6 и 7 в вышеприведенном примере 1.
Пример 3
N-Гидрокси-2(R)-[(1H-индол-5-илметил)-(4-метоксибензолсульфонил)амино]-3-метилбутирамид (таблица 1, соединение 3)

Стадия 1
В раствор 5-индолкарбоновой кислоты (5,08 г, 31,5 моля) в смеси (1:1) метанола и метиленхлорида (40 мл) добавляют порциями в течение 15 мин (триметилсилил)диазометан (33 мл, 2 М раствор в гексане). Раствор желтого цвета концентрируют на роторном испарителе с получением метил-5-индолкарбоксилата в виде белого порошка (5,5 г).
Стадия 2
В раствор 5-индолкарбоксилата (4,9 г, 27,97 ммоля) в сухом ацетонитриле (45 мл) добавляют ди-трет-бутилдикарбонат (6,41 г, 29,36 ммоля) и затем 4-диметиламинопиридин (142 мг, 1,43 ммоля). Реакционную смесь перемешивают в течение 3 ч, затем загружают в колонку с силикагелем и хроматографируют, используя этилацетат/гексан (5%) в качестве элюента, с получением метил-(N-трет-бутоксикарбонил)индол-5-карбоксилата в виде вязкого масла (7,69 г).
Стадия 3
В охлажденный (-78°С) раствор метил-(N-трет-бутоксикарбонил)индол-5-карбоксилата (7,6 г, 27,9 ммоля) в сухом тетрагидрофуране (75 мл) добавляют в течение 5 мин шприцем диизобутилалюминийгидрид (57 мл, 1,5 М в толуоле). Через 1,5 ч реакционную смесь закаляют, осторожно добавляя метанол (15 мл), и оставляют на 15 мин нагреваться до комнатной температуры. Добавляют при энергичном перемешивании воду (20 мл) и насыщенный раствор хлорида аммония (10 мл) и полученный неорганический осадок удаляют фильтрацией. Фильтрат концентрируют на роторном испарителе и остаток делят между смесью (1:1) этилацетата и воды (160 мл). Этилацетатную фазу промывают рассолом, а водную фазу обратно экстрагируют этилацетатом. Органические фазы объединяют, сушат над сульфатом магния, фильтруют и концентрируют с получением (N-трет-бутоксикарбонил)индол-5-метанола (7,35 г) в виде полувязкого масла желтого цвета, которое используют на следующей стадии без дальнейшей обработки.
Стадия 4
К охлажденной на льду смеси бензилового эфира 2(R)-(4-метоксибензолсульфониламино)-3-метилмасляной кислоты (5 г, 13,25 ммоля) [приготовленного, как описано в вышеприведенном примере 2], N-трет-бутоксикарбонил-5-индолметанола (3,8 г, 14,6 ммоля) и трибутилфосфина (3,6 мл, 14,6 ммоля) в сухом бензоле (60 мл) прибавляют [1,1’-азодикарбонил]дипиперидин (3,68 мл, 14,6 ммоля). Реакционную смесь перемешивают в течение ночи при комнатной температуре и затем хроматографируют в колонке с силикагелем, используя 5-10%-ный этилацетат/гексан в качестве элюента, с получением бензилового эфира 2(R)-[(N-трет-бутоксикарбонилиндол-5-илметил)-(4-метоксибензолсульфонил)амино]-3-метилмасляной кислоты (6,5 г) в виде пенистого полутвердого вещества белого цвета.
Стадия 5
Раствор бензилового эфира 2(R)-[(N-трет-бутоксикарбонилиндол-5-илметил)-(4-метоксибензолсульфонил)амино]-3-метилмасляной кислоты (2,7 г, 4,45 ммоля) и трифторуксусной кислоты (5 мл) в метиленхлориде (15 мл) перемешивают в течение 2 ч при комнатной температуре. Органические вещества удаляют под вакуумом, остаток растворяют в этилацетате (80 мл) и этилацетатный слой промывают 5%-ным бикарбонатом натрия и рассолом. Органический слой сушат над сульфатом магния и концентрируют с получением пенистого твердого вещества белого цвета, которое хроматографируют в колонке с силикагелем, используя 5-100%-ный этилацетат/гексан в качестве элюента. Этим методом получают бензиловый эфир 2(R)-[(1Н-индол-5-илметил)-(4-метоксибензолсульфонил)амино]-3-метилмасляной кислоты (1,7 г) в виде пенистого полутвердого вещества белого цвета, которое превращают в 2(R)-[(1Н-индол-5-илметил)-(4-метоксибензолсульфонил)амино]-3-метилмасляную кислоту методом, описанным в вышеприведенном примере 1, стадия 6.
Стадия 6
В охлажденный на льду раствор 2(R)-[(1Н-индол-5-илметил)-(4-метоксибензолсульфонил)амино]-3-метилмасляной кислоты (0,32 г, 0,77 ммоля), O-бензилгидроксиламина (0,35 мл, 2,3 ммоля), 1-гидроксибензотриазолгидрата (0,118 г, 0,77 ммоля) и N-метилморфолина (0,12 мл, 1,1 ммоля) в безводном диметилформамиде добавляют гидрохлоридную соль 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,221 г, 1,2 ммоля). Реакционную смесь перемешивают в течение ночи и затем концентрируют. Остаток растворяют в этилацетате (80 мл) и промывают 1,5%-ной хлористоводородной кислотой, 5%-ным бикарбонатом натрия и рассолом. Остаток кристаллизуют из горячей смеси CH2Cl2 и гексана с последующей очисткой маточной жидкости методом препаративной тонкослойной хроматографии, используя 5%-ный метанол/метиленхлорид в качестве элюента, с получением 2(R)-N-бензилокси-[(1Н-индол-5-илметил)-(4-метоксибензолсульфонил)амино]-3-метилбутирамида (0,31 г) в виде кристаллического порошка желтовато-коричневого цвета.
Стадия 7
В раствор 2(R)-N-бензилокси-[(1Н-индол-5-илметил)-(4-метоксибензолсульфонил)амино]-3-метилбутирамида (0,34 г, 0,58 ммоля) в смеси (1:1) этанола и тетрагидрофурана (15 мл) добавляют 10%-ный Pd/C (0,075 г).
Реакционную смесь помещают под водородный баллон. Через 2,5 ч реакционную смесь фильтруют через слой целита (3,0 г) и слой целита промывают этанолом (200 мл). Фильтрат концентрируют с получением полутвердого вещества желтовато-коричневого цвета, которое затем очищают методом препаративной тонкослойной хроматографии, используя 7%-ный метанол/метиленхлорид в качестве элюента, с получением N-гидрокси-2(R)-[(1Н-индол-5-илметил)-(4-метоксибензолсульфонил)амино]-3-метилбутирамида (200 мг) в виде твердого вещества желтовато-коричневого цвета.
Пример 4
N-Гидрокси-2(R)-[(3-нитро-4-метилбензил)-(4-метоксибензолсульфонил)амино]-3-метилбутирамид (таблица 1, соединение 23)

Стадия 1
В охлажденный на льду раствор 2(R)-(4-метоксибензолсульфонил)амино)-3-метилмасляной кислоты (30 г, 104,4 ммоля) [приготовленного, как описано в вышеприведенном примере 2, стадия 1] в метиленхлориде добавляют в течение 45 мин через дополнительную воронку 75 мл 3,5 М раствора N, N’-диизопропил-O-трет-бутилизомочевины [может быть приготовлен методом, описанным в Lon J. Mathias, Synthesis, 561-576 (1979)]. Реакционную смесь поддерживают при 0°С в течение 2 ч и затем оставляют на ночь нагреваться до комнатной температуры. Очищают методом мгновенно-испарительной хроматографии в колонке с силикагелем, используя 10-20%-ный этилацетат/гексан в качестве элюента, с получением трет-бутилового эфира 2(R)-(4-метоксибензолсульфониламино]-3-метилмасляной кислоты (18 г) в виде кристаллического вещества белого цвета.
Стадия 2
В раствор трет-бутилового эфира 2(R)-(4-метоксибензолсульфониламино]-3-метилмасляной кислоты (0,15 г, 0,44 ммоля) и карбоната калия (0,32 г, 2,32 ммоля) в сухом диметилформамиде (15 мл) добавляют 3-нитро-4-метилбензилхлорид (81,1 мг, 0,44 ммоля). Реакционную смесь перемешивают в течение ночи и затем концентрируют на роторном испарителе. Остаток растворяют в смеси (1:1) этилацетата и рассола (50 мл). Органическую фазу выделяют, сушат над сульфатом магния и концентрируют с получением трет-бутилового эфира 2(R)-[(3-нитро-4-метилбензил)-(4-метоксибензолсульфонил)амино]-3-метилмасляной кислоты (0,196 г) в виде вязкого масла желтого цвета, который переводят в 2(R)-[(3-нитро-4-метилбензил)-(4-метоксибензолсульфонил)амино]-3-метилмасляную кислоту методом, описанным в примере 10, стадия 8 (см. ниже). 2(R)-[(3-Нитро-4-метилбензил)-(4-метоксибензолсульфонил)амино]-3-метилмасляную кислоту затем превращают в N-гидрокси-2(R)-[(3-нитро-4-метилбензил)-(4-метоксибензолсульфонил)амино]-3-бутирамид методом, описанным в вышеприведенном примере 1, стадии 6 и 7.
Пример 5
N-Гидрокси-2(R)-[(3,4-метилендиоксибензил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-гидроксипропионамид (таблица 1, соединение 5)

Стадия 1
К суспензии D-серина (6,95 г, 66,1 ммоля) в ацетонитриле (100 мл) прибавляют триметилсилилцианид (40 мл, 298 ммоля) и полученный раствор нагревают до 80°С. Через 1 ч добавляют 4-метокси-2,3,6-триметилбензолсульфонилхлорид (17,3 г, 69,4 ммоля) и нагревание продолжают. Через 12 ч реакционную смесь охлаждают до комнатной температуры. Добавляют метанол (15 мл) и органические вещества удаляют in vacuo. Остаток разбавляют диэтиловым эфиром (300 мл) и после охлаждения реакционной смеси до 0° С рН доводят до 8 с помощью 6 н. водного раствора гидроксида натрия. Органический слой собирают и водный слой экстрагируют диэтиловым эфиром. Водный слой доводят до рН 4 и снова экстрагируют этилацетатом. Собранные органические вытяжки сушат над сульфатом магния и концентрируют с получением 2(R)-[(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-гидроксипропионовой кислоты (20,5 г) в виде коричневой пены, которую используют без дальнейшей очистки.
Стадия 2
В раствор 2(R)-[(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-гидроксипропионовой кислоты (27,9 г, 87,9 ммоля) в диметилформамиде (280 мл) при 0°С добавляют карбонат калия (72,9 г, 527 ммоля) и раствор 3,4-метилендиоксибензилхлорида (60 г, 170,8 ммоля, 50% (мас./мас.)) в метиленхлориде. Через 2 ч добавляют иодид лития (5,88 г, 44 ммоля) и реакционную смесь нагревают в течение 2 ч до комнатной температуры. Через 6 ч реакционную смесь делят между этилацетатом (600 мл) и водой (250 мл). Органический слой отделяют, сушат над сульфатом магния и концентрируют in vacuo. Сырой остаток хроматографируют (300 г SiO2, 15%-ный этилацетат/гексан) с получением 3, 4-метилендиоксибензилового эфира 2(R)-(4-метокси-2,3,6-триметилбензолсульфониламино)-3-гидроксипропионовой кислоты (38,4 г), который непосредственно используют в следующей реакции без дальнейшей очистки.
Стадия 3
3,4-Метилендиоксибензиловый эфир 2(R)-(4-метокси-2,3,6-триметилбензолсульфониламино)-3-гидроксипропионовой кислоты (38,4 г) растворяют в метиленхлориде (140 мл) и дигидропропане (23 мл). Реакционную смесь охлаждают до 0°С и в нее добавляют п-толуолсульфокислоту, моногидрат (0,78 г). Через 1 ч реакционную смесь выливают в насыщенный водный раствор бикарбоната натрия (200 мл). Органический слой отделяют, сушат над сульфатом магния и концентрируют in vacuo. Остаток хроматографируют (300 г SiO2, 15%-ный этилацетат/гексан) с получением 3,4-метилендиоксибензилового эфира 2(R)-(4-метокси-2,6-диметилбензолсульфониламино)-3-(тетрагидропиран-2-илокси)пропионовой кислоты (41,4 г).
Стадия 4
В раствор 3,4-метилендиоксибензилового эфира 2(R)-(4-метокси-2,6-диметилбензолсульфониламино)-3-(тетрагидропиран-2-илокси)пропионовой кислоты (9,0 г, 16,8 ммоля) в бензоле (150 мл) при 0°С добавляют 3,4-метилендиоксифенилметанол (3,8 г, 25,2 ммоля), три-н-бутилфосфин (5,1 г, 25,2 ммоля) и затем добавляют 1,1’-[азодикарбонил]дипиперидин (6,35 г, 25,2 ммоля). Реакционной смеси дают нагреться в течение 4 ч до комнатной температуры. Через 16 ч разбавляют равным объемом гексана, охлаждают до 0°С в течение 2 ч и фильтруют. Остаток хроматографируют (300 г SiO2, 15%-ный этилацетат/гексан) с получением 3,4-метилендиоксибензилового эфира 2(R)-[(3,4-метилендиоксибензил)-(4-метокси-2, 6-диметилбензолсульфонил)амино]-3-(тетрагидропиран-2-илокси)пропионовой кислоты (10,0 г) в виде бледно-оранжевого масла.
Стадия 5
В раствор 3, 4-метилендиоксибензилового эфира 2(R)-[(3,4-метилендиоксибензил)-(4-метокси-2, 6-диметилбензолсульфонил)амино]-3-(тетрагидропиран-2-илокси)пропионовой кислоты (3,26 г, 4,57 ммоля) в деоксигенированной аргоном смеси этанола (80%) и тетрагидрофурана (100 мл) добавляют 10%-ный Pd/C (2 г) и полученную в результате реакционную смесь гидрируют при атмосферном давлении в течение 45 мин. Реакционную смесь обезгаживают под аргоном, суспензию фильтруют через целит, слой целита обильно промывают смесью этанола (80%) и метиленхлорида. Фильтрат концентрируют и азеотропируют тетрагидрофураном (200 мл) и остаток растворяют в диметилформамиде (25 мл). Добавляют O-бензилгидроксиламин (1, 78 г, 14,5 ммоля), НОВТ (1-гидроксибензотриазолгидрат) (0,71 г, 5,2 ммоля) и EDAC (2,75 г) и реакционную смесь перемешивают в течение 16 ч. Реакционную смесь разбавляют этилацетатом и промывают 2,4 н. водной хлористоводородной кислотой и насыщенным водным раствором бикарбоната натрия. Затем смесь сушат над сульфатом магния и концентрируют in vacuo с получением сырого N-бензилокси-2(R)-[(3, 4-метилендиоксибензил)-(4-метокси-2,6-диметилбензолсульфонил)амино]-3-(тетрагидропиран-2-илокси)пропионамида (2,8 г), который непосредственно используют на следующей реакции без дальнейшей очистки.
Стадия 6
В раствор N-бензилокси-2(R)-[(3,4-метилендиоксибензил)-(4-метокси-2, 6-диметилбензолсульфонил)амино]-3-(тетрагидропиран-2-илокси)пропионамида (1,7 г, 4,3 ммоля) в метаноле (100 мл) при 0°С добавляют п-толуолсульфокислоту-моногидрат (150 мг). Через 12 ч реакционную смесь нагревают до комнатной температуры и дополнительно перемешивают еще в течение 5 ч. Реакционную смесь концентрируют и остаток хроматографируют (Biotage 40M; 20-50%-ный этилацетат/гексан) с получением N-бензилокси-2(R)-[(3,4-метилендиоксибензил)-(4-метокси-2, 6-диметилбензолсульфонил)амино]-3-гидроксипропионамида (1,60 г).
Стадия 7
В раствор N-бензилокси-2(R)-[(3,4-метилендиоксибензил)-(4-метокси-2, 6-диметилбензолсульфонил)амино]-3-гидроксипропионамида (3,0 г, 5,39 ммоля) в деоксигенированной аргоном смеси этанола (80%) и тетрагидрофурана (160 мл) добавляют 10%-ный Pd/C (1,3 г) и полученную в результате смесь гидрируют при атмосферном давлении в течение 45 мин. Реакционную смесь обезгаживают под аргоном, суспензию фильтруют через целит, осадок на целите обильно промывают 80%-ной смесью этанола и метиленхлорида и фильтрат концентрируют почти досуха для кристаллизации смеси. Суспензию фильтруют, промывают 50%-ной смесью диэтилового эфира и гексана с получением N-гидрокси-2(R)-[(3, 4-метилендиоксибензил)-(4-метокси-2,6-диметилбензолсульфонил)амино]-3-гидроксипропионамида (2,38 г) в виде твердого вещества белого цвета.
Пример 6
N-Гидрокси-3-ацетокси-2(R)-[(3,4-метилендиоксибензил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]пропионамид (таблица 1, соединение 14)

Стадия 1
В раствор N-бензилокси-2(R)-[(3, 4-метилендиоксибензил)-(4-метокси-2, 6-диметилбензолсульфонил)амино]-3-гидроксипропионамида (450 мг, 0,82 ммоля) в пиридине (2 мл) при 0°С добавляют уксусный ангидрид (0,09 мл, 0,98 ммоля). Реакционной смеси дают нагреться в течение 12 ч до комнатной температуры и затем делят между 2 н. водной хлористоводородной кислотой и метиленхлоридом (100 мл). Метиленхлоридный слой отделяют, сушат над сульфатом магния и концентрируют. Остаток очищают методом препаративной тонкослойной хроматографии, используя 30%-ный этилацетат/гексан в качестве элюента, с получением N-бензилокси-2(R)-[(3, 4-метилендиоксибензил)-(4-метокси-2,6-диметилбензолсульфонил)амино]-3-ацетоксипропионамида.
Стадия 2
В раствор N-бензилокси-2(R)-[(3, 4-метилендиоксибензил)-(4-метокси-2, 6-диметилбензолсульфонил)амино]-3-ацетоксипропионамида, растворенного в деоксигенированной аргоном смеси этанола (80%) и тетрагидрофурана (15 мл), добавляют 10%-ный Pd/C (100 г) и полученную в результате смесь гидрируют при атмосферном давлении в течение 45 мин. Реакционную смесь обезгаживают под аргоном, суспензию фильтруют через целит. Осадок на целите обильно промывают 80%-ной смесью этанола и метиленхлорида. Фильтрат концентрируют. Сырую смесь растворяют в этилацетате (1-2 мл) и медленно добавляют в перемешиваемый с большой скоростью гексан (100 мл) для образования осадка. Осадок фильтруют и сушат (50°С; 1 торр), получая N-гидрокси-2(R)-[(3,4-метилендиоксибензил)-(4-метокси-2,6-диметилбензолсульфонил)амино]-3-ацетоксипропионамид (171, 3 мг) в виде белого порошка.
Пример 7
N-Гидрокси-2(R)-[(4-метокси-2,5,6-триметилбензолсульфонил)-(1Н-индол-5-илметил)амино]-3-трет-бутоксипропионамид (таблица 1, соединение 15)

Стадия 1
В раствор 1Н-индол-5-карбоновой кислоты (5 г, 31,0 ммоля) в смеси метанола (70%) и метиленхлорида (105 мл) при 0°С добавляют 1 М триметилсилилдиазометан в гексане (46 мл, 46 ммолей). Через 45 мин реакционную смесь концентрируют с получением метилового эфира 1H-индол-5-карбоновой кислоты (5,2 г).
Стадия 2
В раствор метилового эфира 1Н-индол-5-карбоновой кислоты (3,6 г, 20,6 ммоля) в тетрагидрофуране (180 мл) при 0°С добавляют гидрид натрия (0,65 г, 21,9 ммоля). Через 10 мин добавляют 2-триметилсилилэтансульфонилхлорид (4,4 г, 21,9 ммоля) и реакционной смеси дают нагреться до комнатной температуры. Через 3 ч добавляют уксусную кислоту (1,6 мл, 26,8 ммоля) и реакционную смесь концентрируют. Сырой продукт хроматографируют (колонка с Biotage 40M; 2,5%-ный этилацетат/гексан) с получением метилового эфира 1-(2-триметилсилилэтансульфонил)индол-5-карбоновой кислоты (5,43 г) в виде твердого вещества белого цвета.
Стадия 3
В раствор метилового эфира 1-(2-триметилсилилэтансульфонил)индол-5-карбоновой кислоты (7,4 г, 21,9 ммоля) в тетрагидрофуране (100 мл) при -78°С прибавляют DIBALH
Стадия 4
К суспензии О-трет-бутил-D-серина (2,66 г, 16,5 ммоля) в ацетонитриле (25 мл) прибавляют триметилсилилцианид (10 мл, 74,5 ммоля) и реакционную смесь нагревают в течение 1 ч до 80°С. Добавляют 4-метокси-2,3,6-триметилбензолсульфонилхлорид (4,3 г, 17,4 ммоля) и нагревание продолжают. Через 12 ч реакционную смесь охлаждают до комнатной температуры. Добавляют метанол (15 мл). Реакционную смесь концентрируют in vacuo. Остаток разбавляют диэтиловым эфиром (100 мл). Реакционную смесь охлаждают до 0°С, рН доводят до 8 с помощью 6 н. водного раствора гидроксида натрия. Слои разделяют и водный слой экстрагируют диэтиловым эфиром. Затем водный слой доводят до рН 4 и экстрагируют диэтиловым эфиром. Объединенные органические слои сушат над сульфатом магния и концентрируют с получением 2(R)-2-(4-метокси-2,3,6-триметилбензолсульфониламино)-3-трет-бутоксипропионовой кислоты (5,1 г) в виде коричневой пены, которую используют без дальнейшей очистки.
Стадия 5
В раствор 2(R)-(4-метокси-2,3,6-триметилбензолсульфониламино)-3-трет-бутоксипропионовой кислоты (2,79 г, 7,5 ммоля) в смеси метанола (70%) и метиленхлорида (50 мл) при 0°С добавляют 1 М триметилсилилдиазометан в гексане (22,5 мл, 23 ммоля). Через 45 мин реакционную смесь концентрируют и хроматографируют методом препаративной хроматографии (9% этилацетат/гексан в качестве элюента) с получением метилового эфира 2(R)-(4-метокси-2,3,6-триметилбензолсульфониламино)-3-трет-бутоксипропионовой кислоты (2,4 г).
Стадия 6
В раствор метилового эфира 2(R)-(4-метокси-2,3,6-триметилбензолсульфониламино)-3-трет-бутоксипропионовой кислоты (1,1 г, 2,84 ммоля) в бензоле (50 мл) при 0°С добавляют [1-(2-триметилсилилэтансульфонил)индол-5-ил]метанол (1,33 г, 4,26 ммоля), три-н-бутилфосфин (1,07 мл, 4,26 ммоля) и затем 1,1’-[азодикарбонил]дипиперидин (1,08 г, 4,26 ммоля). Реакционной смеси дают нагреться в течение 4 ч до комнатной температуры. Через 16 ч разбавляют равным объемом гексана, охлаждают в течение 2 ч до 0°С и фильтруют. Остаток очищают методом препаративной хроматографии (20% этилацетат/гексан) с получением метилового эфира 2(R)-(4-метокси-2,3,6-триметилбензолсульфонил)-[1-(2-триметилсилилэтансульфонил)индол-5-илметил]амино-3-трет-бутоксипропионовой кислоты (1,79 г) в виде бледно-желтого масла.
Стадия 7
В раствор метилового эфира 2(R)-(4-метокси-2,3, 6-триметилбензолсульфонил)-[1-(2-триметилсилилэтансульфонил)индол-5-илметил]амино-3-трет-бутоксипропионовой кислоты (1,63 г, 2,55 ммоля) в тетрагидрофуране (50 мл) добавляют 1 М тетрабутанаммонийфторид (6,4 мл, 6,4 ммоля) в тетрагидрофуране и смесь нагревают до 40°С. Через 1 ч реакционную смесь делят между этилацетатом и 1 М хлористоводородной кислотой. Этилацетатный слой отделяют, сушат над сульфатом магния и концентрируют. Остаток очищают методом препаративной хроматографии (20% этилацетат/гексан) с получением метилового эфира 2(R)-{(4-метокси-2,3, 6-триметилбензолсульфонил)-[1Н-индол-5-илметил]амино}-3-трет-бутоксипропионовой кислоты (1 г), который непосредственно используют в следующей реакции.
Стадия 8
В раствор метилового эфира 2(R)-{(4-метокси-2,3,6-триметилбензолсульфонил)-[1Н-индол-5-илметил]амино}-3-трет-бутоксипропионовой кислоты (1,0 г, 1,94 ммоля) в смеси метанола (50%) и тетрагидрофурана (10 мл) добавляют раствор LiOH·H2O (160 мг, 3,88 ммоля) в воде (1 мл). Реакционную смесь нагревают в течение 12 ч до 40°С и добавляют дополнительное количество LiOH·H2O (160 мг, 3,88 ммоля) в воде (1 мл).
Через 3 ч водный раствор подкисляют 2 н. водной хлористоводородной кислотой до рН 3 и продукт экстрагируют этилацетатом. Объединенные этилацетатные слои сушат над сульфатом магния и концентрируют с получением 2(R)-[(1H-индол-5-илметил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-трет-бутоксипропионовой кислоты (0,90 г).
Стадия 9
В раствор 2(R)-[(1Н-индол-5-илметил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-трет-бутоксипропионовой кислоты (0,90 г, 1,8 ммоля) добавляют O-бензилгидроксиламин (0,67 г, 5,4 ммоля), 1-гидроксибензотриазол (0,31 г, 1,98 ммоля), N-метилморфолин (0,36 г, 3,6 ммоля) и 1-(диметиламинопропил)-3-этилкарбодиимид (1,04 г, 5,4 ммоля). Через 16 ч реакционную смесь разбавляют этилацетатом (200 мл), промывают 2,4 н. водной хлористоводородной кислотой и насыщенным водным раствором бикарбоната натрия, сушат над сульфатом магния и концентрируют, после чего очищают методом препаративной хроматографии (3% метанол/метиленхлорид) с получением 2(R)-N-бензилокси-[(1Н-индол-5-илметил)-(4-метокси-2,3, 6-триметилбензолсульфонил)амино]-3-трет-бутоксипропионамида (0,85 г).
Стадия 10
В раствор 2(R)-N-бензилокси-[(1Н-индол-5-илметил)-(4-метокси-2,3, 6-триметилбензолсульфонил)амино]-3-трет-бутоксипропионамида (0,80 г, 1,32 ммоля) в деоксигенированной аргоном смеси этанола (80%) и тетрагидрофурана (100 мл) добавляют 10%-ный Pd/C (0,4 г) и полученную в результате смесь гидрируют при атмосферном давлении в течение 60 мин. Реакционную смесь обезгаживают под аргоном и суспензию фильтруют через целит. Осадок на целите промывают 80%-ной смесью этанола и метиленхлорида. Фильтрат концентрируют. Сырую смесь растворяют в этилацетате (5 мл) и медленно добавляют в перемешиваемый с большой скоростью гексан (300 мл) для образования осадка. Осадок фильтруют и сушат (50°С; 1 торр), получая N-гидрокси-2(R)-[(1Н-индол-5-илметил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-трет-бутоксипропионамид в виде белого порошка (500 мг).
Методом, описанным в вышеприведенном примере 7, но заменяя [1-(2-триметилсилилэтансульфонил)-1Н-индол-5-ил]метанол на 3,4-(метилендиокси)фенилметанол, получают 2(R)-[(3, 4-метилендиоксибензил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-трет-бутоксипропионамид.
Пример 8
N-Гидрокси-2(R)-2-[(1Н-индол-5-илметил)-(4-метокси-2, 5-диметилбензолсульфонил)амино]-3-метилбутирамид (таблица 1, соединение 145)

Стадия 1
В раствор метилового эфира 1H-индол-5-карбоновой кислоты (16,8 г, 95,9 ммоля) в сухом ацетонитриле (150 мл) добавляют трет-бутоксикарбонилангидрид (22 г, 100,8 ммоля) и затем 4-диметиламинопиридин (0,58 г, 4,75 ммоля). Реакционную смесь перемешивают в течение 3 ч, затем концентрируют и хроматографируют (300 г SiO2, 5% этилацетат/гексан) с получением метилового эфира N-трет-бутоксикарбонилиндол-5-карбоновой кислоты (23,6 г) в виде бесцветного масла.
Стадия 2
В раствор метилового эфира N-трет-бутоксикарбонилиндол-5-карбоновой кислоты (23,6 г, 85,7 ммоля) в сухом тетрагидрофуране (225 мл) при -78°С добавляют 1,5 М DIBALH в толуоле (171 мл, 257 ммолей). Через 2 ч реакционную смесь закаляют, медленно добавляя в нее метанол (45 мл), воду (60 мл) и насыщенный водный раствор NH4Cl (30 мл). Холодную ванну удаляют и после перемешивания еще в течение 1 ч реакционную смесь фильтруют через целит. Осадок на целите промывают тетрагидрофураном и фильтрат концентрируют для удаления более летучего тетрагидрофурана. Двухфазную смесь экстрагируют этилацетатом. Объединенные органические слои промывают водой и водный слой обратно экстрагируют этилацетатом. Объединенные органические слои промывают рассолом, сушат над сульфатом магния и концентрируют с получением N-трет-бутоксикарбонилиндол-5-илметанола (21, 2 г).
Стадия 3
В раствор N-трет-бутоксикарбонилиндол-5-илметанола (2,56 г, 103,5 ммоля) в сухом метиленхлориде (60 мл) добавляют оксид магния (9 г, 103,5 ммоля). Реакционную смесь перемешивают в течение 3 ч при комнатной температуре и затем нагревают с обратным холодильником. Через 3 ч неоднородную суспензию фильтруют через целит и концентрируют с получением N-трет-бутоксикарбонил-5-формилиндола (2,5 г).
Стадия 4
В раствор бензилового эфира D-валингидрохлорида (2,49 г, 10,21 ммоля) в сухом метиленхлориде (30 мл) добавляют N-трет-бутоксикарбонил-5-формилиндол (2,5 г, 10,21 ммоля) и триацетоксиборгидрид натрия (3,24 г, 15,29 ммоля). Реакционную смесь перемешивают в течение 15 ч и затем закаляют насыщенным водным раствором бикарбоната натрия. Водный слой отделяют и экстрагируют метиленхлоридом. Объединенные метиленхлоридные слои промывают рассолом, сушат над сульфатом магния и концентриуют. Остаток хроматографируют (колонка с Biotage 40 M; 10% этилацетат/гексан) с получением О-бензилового эфира 2(R)-[N-трет-бутоксикарбонилиндол-5-ил)амино]-3-метилбутирамида (3,32 г) в виде бесцветного масла.
Стадия 5
В раствор O-бензилового эфира 2(R)-[N-трет-бутоксикарбонилиндол-5-ил)амино]-3-метилбутирамида (2,34 г, 5,36 ммоля) в ацетонитриле (15 мл) добавляют триметилсилилцианид (2,14 мл, 16,1 ммоля). Через 1 ч добавляют 4-метокси-2,5-диметилбензолсульфонилхлорид (3,18 г, 10,69 ммоля) и реакционную смесь нагревают в течение 16 ч до 70°С. Затем реакционную смесь охлаждают до комнатной температуры. Добавляют метанол (15 мл) и реакционную смесь концентрируют in vacuo. Остаток хроматографируют (колонка с Biotage 40M; 10% этилацетат/гексан) с получением O-бензилового эфира 2(R)-[(N-трет-бутоксикарбонилиндол-5-ил)-4-метокси-2,5-диметилбензолсульфонил)амино]-3-метилбутирамида (1,56 г) в виде бесцветного масла.
Стадия 6
В раствор O-бензилового эфира 2(R)-[(N-трет-бутоксикарбонилиндол-5-ил)-4-метокси-2,5-диметилбензолсульфонил)амино]-3-метилбутирамида (0,45 г, 0,71 ммоля) при 0°С в метиленхлориде (10 мл) добавляют трифторуксусную кислоту (2,5 мл). Реакционную смесь перемешивают в течение 40 мин, затем нагревают до комнатной температуры и перемешивают еще в течение 2 ч. Реакционную смесь разбавляют этилацетатом. Этот органический слой отделяют и промывают насыщенным водным раствором бикарбоната натрия, сушат над сульфатом магния и концентрируют. Остаток хроматографируют (колонка с Biotage 40M; 20% этилацетат/гексан) с получением O-бензилового эфира 2(R)-[(1H-индол-5-ил)-(4-метокси-2,5-диметилбензолсульфонил)амино]-3-метилбутирамида (0,28 г) в виде бесцветного масла.
Стадия 7
В раствор O-бензилового эфира 2(R)-[(1H-индол-5-ил)-(4-метокси-2,5-диметилбензолсульфонил)амино]-3-метилбутирамида (1,1 г, 2,06 ммоля) в деоксигенированной аргоном смеси этанола (50%) и тетрагидрофурана (30 мл) добавляют 10%-ный Pd/C (0,6 г) и полученную в результате смесь гидрируют при атмосферном давлении. Через 1,5 ч реакционную смесь обезгаживают под аргоном и суспензию фильтруют через целит. Осадок на целите обильно промывают 80%-ной смесью этанола и метиленхлорида. Фильтрат концентрируют и азеотропируют тетрагидрофураном, получая 2(R)-[(1Н-индол-5-ил)-(4-метокси-2, 5-диметилбензолсульфонил)амино]-3-метилмасляную кислоту (1,014 г), которую используют на следующей стадии без дальнейшей очистки.
Стадия 8
В охлажденный на льду раствор 2(R)-[(1Н-индол-5-ил)-(4-метокси-2,5-диметилбензолсульфонил)амино]-3-метилмасляной кислоты в диметилформамиде (20 мл) добавляют 1-гидроксибензотриазол-моногидрат (384 мг, 2,51 ммоля), O-бензилгидроксиламин (844 мг, 6,85 ммоля), N-метилморфолин (462 мг, 4,57 ммоля) и 1-(диметиламинопропил)-3-этилкарбодиимид (1,31 г, 6,85 ммоля). Реакционную смесь нагревают до комнатной температуры. Через 16 ч реакционную смесь делят между этилацетатом (300 мл) и 1,5%-ной водной хлористоводородной кислотой (50 мл). Этилацетатный слой промывают насыщенным водным раствором бикарбоната натрия, сушат над сульфатом магния и концентрируют. Остаток хроматографируют (колонка с Biotage 40M; 50% этилацетат/гексан) с получением N-бензилокси-2-[(1H-индол-5-илметил)-(4-метокси-2, 5-диметилбензолсульфонил)амино]-3-метилбутирамидгидроксамата (0,61 г).
Стадия 9
В раствор N-бензилокси-2-[(1H-индол-5-илметил)-(4-метокси-2, 5-диметилбензолсульфонил)амино]-3-метилбутирамидгидроксамата (0,61 г, 1,1 ммоля) в деоксигенированной аргоном смеси этанола (50%) и тетрагидрофурана (20 мл) добавляют 10%-ный Pd/C (600 мг). Полученную в результате смесь гидрируют при атмосферном давлении в течение 2 ч. Реакционную смесь обезгаживают под аргоном и суспензию фильтруют через целит. Осадок на целите обильно промывают 80%-ной смесью этанола и метиленхлорида. Фильтрат концентрируют. Сырую смесь растворяют в этилацетате (1 мл). Этот раствор медленно добавляют в перемешиваемый с большой скоростью гексан (100 мл) для образования осадка. Образовавшийся осадок фильтруют и сушат (50°С; 1 торр), получая 2(R)-N-гидрокси-2-[(1Н-индол-5-илметил)-(4-метокси-2, 5-диметилбензолсульфонил)амино]-3-метилбутирамид (477 мг) в виде белого порошка.
Пример 9
N-Гидрокси-2(R)-2-[(3,4-метилендиоксибензил)-(4-метокси-2, 6-диметилбензолсульфонил)амино]-3-метилбутирамид (таблица 1, соединение 40)

Стадия 1
В раствор свободного основания бензилового эфира D-валина (12,92 г, 62 ммоля) в сухом метиленхлориде (120 мл) добавляют 3,4-(метилендиокси)фенилметанол (9,45 г, 62 ммоля) и триацетоксиборгидрид натрия (18,50 г, 86,8 ммоля). Через 15 ч реакционную смесь заливают насыщенным водным раствором бикарбоната натрия (120 мл) и водный слой отделяют и экстрагируют метиленхлоридом. Объединенные метиленхлоридные слои промывают рассолом, сушат над сульфатом магния и концентриуют. Остаток хроматографируют (300 г SiO2, 5% этилацетат/гексан) с получением бензилового эфира 2(R)-(3,4-метилендиоксибензиламино)-3-метилмасляной кислоты (18 г) в виде бесцветного масла.
Стадия 2
В раствор бензилового эфира 2(R)-(3, 4-метилендиоксибензиламино)-3-метилмасляной кислоты (3,0 г, 8,79 ммоля) в ацетонитриле (15 мл) прибавляют триметилсилилцианид (3,5 мл, 26,3 ммоля). Реакционную смесь нагревают до 80°С. Через 1 ч добавляют 4-метокси-2,6-диметилбензолсульфонилхлорид (3,14 г, 10,55 ммоля) и нагревание продолжают. Через 36 ч реакционную смесь охлаждают до комнатной температуры. Добавляют метанол (15 мл) и раствор концентрируют in vacuo. Остаток хроматографируют (колонка с Biotage 40M; 10% этилацетат/гексан) с получением бензилового эфира 2(R)-2-[(3,4-метилендиоксибензил)-(4-метокси-2, 6-диметилбензолсульфонил)амино]-3-метилмасляной кислоты (4,33 г) в виде бесцветного масла.
Стадия 3
В раствор бензилового эфира 2(R)-2-[(3, 4-метилендиоксибензил)-(4-метокси-2,6-диметилбензолсульфонил)амино]-3-метилмасляной кислоты (2,6 г, 4,81 ммоля) в деоксигенированной аргоном смеси этанола (50%) и тетрагидрофурана (20 мл) добавляют 10%-ный Pd/C (2 г). Полученную в результате смесь гидрируют при атмосферном давлении в течение 3 ч. Реакционную смесь обезгаживают под аргоном и суспензию фильтруют через целит и обильно промывают 80%-ной смесью этанола и метиленхлорида. Фильтрат концентрируют, азеотропируют тетрагидрофураном (22 мл) и остаток растворяют в метиленхлориде (20 мл). Полученный раствор охлаждают до 0°С и в него добавляют оксалилхлорид (0,8 мл, 9,17 моля) и 4 капли диметилформамида. Реакционную смесь нагревают до комнатной температуры, перемешивают в течение 4 ч и затем концентрируют. Сырой хлорангидрид затем растворяют в метиленхлориде (20 мл), охлаждают до 0°С и в него добавляют N, O-бис-триметилсилилгидроксиламин (4 мл, 18,7 ммоля). Реакционную смесь нагревают до комнатной температуры и через 3 ч в нее добавляют метанол (20 мл). Через 30 мин реакционную смесь концентрируют и хроматографируют, применяя пластинки для препаративной тонкослойной хроматографии (5% метанол/метиленхлорид), с получением N-гидрокси-2(R)-2-[(3,4-метилендиоксибензил)-(4-метокси-2, 6-диметилбензолсульфонил)амино]-3-метилбутирамида (1,0 г).
Пример 10
N-Гидрокси-2(R)-[(4-метоксибензолсульфонил)-(1Н-бензимидазол-5-илметил)амино]-3-метилбутирамид (таблица 1, соединение 35)

Стадия 1
В охлажденный на льду раствор 2(R)-(4-метоксибензолсульфонил)амино)-3-метилмасляной кислоты (7,0 г, 21,25 ммоля) в сухом метиленхлориде в течение 45 мин добавляют через дополнительную воронку 12,1 мл 3,5 М раствора N, N’-диизопропил-О-трет-бутилизомочевины. Реакционную смесь поддерживают при 0°С в течение 2 ч и затем оставляют на ночь нагреваться до комнатной температуры. Реакционную смесь загружают в колонку для мгновенно-испарительной хроматографии с силикагелем и хроматографируют, используя 5%-ный этилацет/гексан в качестве элюента, с получением трет-бутилового эфира 2(R)-(4-метоксибензолсульфониламино)-3-метилмасляной кислоты (7,02 г) в виде кристаллического вещества белого цвета.
Стадия 2
К смеси 4-амино-3-нитробензойной кислоты (10 г, 54,9 ммоля) и триметилсилилцианида (20,6 мл, 3 эквивалента) в сухом ацетонитриле (120 мл) прибавляют о-фталоилдихлорангидрид (7,9 мл, 54,9 ммоля) и смесь нагревают с обратным холодильником. Через 8 ч добавляют дополнительное количество о-фталоилдихлорангидрида (1 мл, 6,94 ммоля). Через 16 ч реакционную смесь охлаждают до комнатной температуры и добавляют в нее этилацетат (100 мл). Органический слой отделяют и промывают последовательно равными объемами 5%-ной хлористоводородной кислоты и затем рассола. Водные фазы обратно экстрагируют этилацетатом (150 мл). Остаток кристаллизуют из горячей смеси этилацетата и гексана с получением 3-нитро-4-(4-аминофталоил)бензойной кислоты (5,85 г) в виде кристаллического вещества коричневого цвета.
Стадия 3
К смеси 3-нитро-4-(4-аминофталоил)бензойной кислоты (5,85 г, 18,74 ммоля) и диизопропилэтиламина (3,9 мл, 22, 49 ммоля) в тетрагидрофуране (120 мл) прибавляют гексафторфосфат бензотриазол-1-илокси-трис-(диметиламино)фосфония (9,95 г, 22,49 ммоля). Смесь перемешивают в течение 5 мин. Добавляют тремя порциями в течение 5 мин боргидрид натрия (744 мг, 19,7 ммоля) и реакционную смесь перемешивают в течение 0,5 ч. Добавляют этилацетат и органическую фазу промывают последовательно равными объемами 5%-ной хлористоводородной кислоты, 5%-ного бикарбоната натрия и рассола и обратно экстрагируют этилацетатом (150 мл). Органическую фазу концентрируют на роторном испарителе и остаток очищают методом мгновенно-испарительной хроматографии в колонке с силикагелем, используя 50%-ный этилацетат/гексан в качестве элюента, с получением 3-нитро-4-(аминофталоил)бензилового спирта в виде твердого вещества желтого цвета (4,61 г).
Стадия 4
К смеси трет-бутилового эфира 2(R)-(4-метоксибензолсульфониламино)-3-метилмасляной кислоты (1,91 г, 5,6 ммоля), 3-нитро-4-(аминофталоил)бензилового спирта (1,75 г, 5,87 ммоля) и трибутилфосфина (1,5 мл, 5,87 ммоля) в сухом бензоле (40 мл) прибавляют (1,1’-азодикарбонил)дипиперидин (1,48 г, 5,87 ммоля). Реакционную смесь перемешивают в течение ночи и затем загружают в колонку для мгновенно-испарительной хроматографии с силикагелем. Колонку элюируют этилацетат/гексаном (5-15%) с получением трет-бутилового эфира 2(R)-{[(3-нитро-4-(аминофталоил)бензил]-(4-метоксибензолсульфонил)амино}-3-метилмасляной кислоты (437 мг).
Стадия 5
В раствор трет-бутилового эфира 2(R)-{[(3-нитро-(4-аминофталоил)бензил]-(4-метоксибензолсульфонил)амино}-3-метилмасляной кислоты (420 мг, 0,673 ммоля) в смеси (1:1) этанола и тетрагидрофурана (15 мл) добавляют 10%-ный Pd/C (40 мг). Реакционную смесь помещают под водородный баллон и перемешивают в течение 4 ч. Реакционную смесь фильтруют через короткую пробку целита (2 г, на спеченной стеклянной воронке) и хорошо промывают этанолом (100 мл). Фильтрат концентрируют с получением трет-бутилового эфира 2(R)-{[(3-амино-(4-аминофталоил)бензил)]-(4-метоксибензолсульфонил)амино}-3-метилмасляной кислоты (375 мг).
Стадия 6
В раствор трет-бутилового эфира 2(R)-{[(3-амино-4-(аминофталоил)бензил)]-(4-метоксибензолсульфонил)амино}-3-метилмасляной кислоты (370 мг, 0,623 ммоля) в смеси (1:1) метанола и метиленхлорида (12 мл) добавляют гидразин (0,39 мл, 20 эквивалентов). Реакционную смесь перемешивают в течение 16 ч. Реакционную смесь фильтруют и фильтрат концентрируют на роторном испарителе. Остаток фильтруют и фильтрат снова концентрируют на роторном испарителе с получением трет-бутилового эфира 2(R)-{[(3,4-диамино)бензил]-(4-метоксибензолсульфонил)амино}-3-метилмасляной кислоты (288 мг).
Стадия 7
В раствор трет-бутилового эфира 2(R)-{[(3,4-диамино)бензил]-(4-метоксибензолсульфонил)амино}-3-метилмасляной кислоты (90 мг, 0,194 ммоля) и триметилортоформиата (0,022 мл, 1,05 эквивалентов) в сухом толуоле (10 мл) добавляют KSF монтмориллонитовую глину (25 мг). Реакционную смесь нагревают с обратным холодильником в течение 6,5 ч и затем охлаждают до комнатной температуры. После охлаждения до комнатной температуры смесь концентрируют in vacuo и остаток загружают на пластину препаративной тонкослойной хроматографии. Элюируют 10%-ным метанол/метиленхлоридом, получая трет-бутиловый эфир 2(R)-[(бензимидазол-5-илметил)-(4-метоксибензолсульфонил)амино]-3-метилмасляной кислоты (79 мг).
Стадия 8
Раствор трет-бутилового эфира 2(R)-[(бензимидазол-5-илметил)-(4-метоксибензолсульфонил)амино]-3-метилмасляной кислоты (74 мг, 0,156 ммоля) в смеси (1:4) трифторуксусной кислоты и метиленхлорида (5 мл) перемешивают в течение 2 ч. Реакционную смесь концентрируют на роторном испарителе и затем с помощью высоковакуумного насоса с получением 2(R)-[(бензимидазол-5-илметил)-(4-метоксибензолсульфонил)амино]-3-метилмасляной кислоты (приблизительно 0,135 ммоля).
Стадия 9
В раствор 2(R)-[(бензимидазол-5-илметил)-(4-метоксибензолсульфонил)амино]-3-метилмасляной кислоты (0,13 ммоля), O-бензилгидроксиламина (0,1 мл, 0,52 ммоля), 1-гидроксибензотриазолгидрата (24 мг, 0,16 ммоля) и N-метилморфолина (0,05 мл, 0,39 ммоля) в безводном диметилформамиде (10 мл) добавляют гидрохлоридную соль 1-этил-3-(3-диметиламино)пропилкарбодиимида (45 мг, 0,24 ммоля). Реакционную смесь перемешивают в течение ночи и затем концентрируют на роторном испарителе. Остаток растворяют в этилацетате (40 мл) и промывают последовательно равными объемами 2%-ного хлорида аммония, 5%-ного бикарбоната натрия и рассола и затем концентрируют in vacuo. Остаток очищают методом препаративной тонкослойной хроматографии, используя метанол/метиленхлорид (10%) в качестве элюента, с получением 2(R)-N-бензилокси[(бензимидазол-5-илметил)-(4-метоксибензолсульфонил)амино]-3-метилбутирамида (48 мг, 71%).
Стадия 10
В раствор 2(R)-N-бензилокси[(бензимидазол-5-илметил)-(4-метоксибензолсульфонил)амино]-3-метилбутирамида (42 мг, 0,08 ммоля) в смеси (3:1) этанола и тетрагидрофурана (10 мл) добавляют 10%-ный Pd/C (40 мг). Реакционную смесь помещают под водородный баллон. Через 2 ч реакционную смесь фильтруют через короткую пробку целита (1 г, на спеченной стеклянной воронке) и остаток на целите хорошо промывают этанолом (100 мл).
Фильтрат концентрируют на роторном испарителе и остаток очищают методом препаративной тонкослойной хроматографии, используя метанол/метиленхлорид (10%) в качестве элюента, с получением N-гидрокси-2(R)-[(бензимидазол-5-илметил)-(4-метоксибензолсульфонил)амино]-3-метилбутирамида (23 мг).
Пример 11
N-Гидрокси-2(R)-[(1Н-3-ацетилиндол-5-илметил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-метилбутирамид (таблица 1, соединение 126)

Стадия 1
В высушенную в печи колбу, содержащую метиловый эфир 2(R)-[(1H-3-ацетилиндол-5-илметил)-(4-метокси-2,3, 6-триметилбензолсульфонил)амино]-3-метилмасляной кислоты (1,41 г, 2,98 ммоля) [приготовленного в соответствии с примером 2, стадия 1, но вместо алкилирования карбоновой кислоты бензилбромидом в примере 1, стадия 2, метиловый эфир получают, применяя триметилсилилдиазометан (см. пример 3, стадия 1)], добавляют в атмосфере азота при энергичном перемешивании N,N’-диметилацетамид (1,75 мл, 14,9 ммоля) и затем по каплям оксихлорид трехвалентного фосфора (1,4 мл, 11,92 ммоля). По окончании добавления реагентов смесь нагревают (80-90°С, масляная баня) в течение 3,5 ч. Смесь охлаждают до температуры окружающей среды и при энергичном механическом перемешивании добавляют в нее 1 н. гидроксид натрия. Через 5 мин добавляют метиленхлорид и воду (1:1; 120 мл), смесь делят на части и органические фазы собирают. Метиленхлоридную фазу затем промывают последовательно равными объемами воды и рассола, а водные фазы обратно экстрагируют метиленхлоридом (2×60 мл). Объединенные органические фазы сушат сульфатом магния, фильтруют и концентрируют. Остаток очищают методом препаративной тонкослойной хроматографии на силикагеле, используя 3%-ный метанол/метиленхлорид в качестве элюента, с получением метилового эфира 2(R)-[(1Н-3-ацетилиндол-5-илметил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-метилмасляной кислоты (815 мг) в виде вязкого масла золотистого цвета.
Стадия 2
В раствор метилового эфира 2(R)-[(1Н-3-ацетилиндол-5-илметил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-метилмасляной кислоты (805 мг, 1,56 ммоля) в метаноле (30 мл) добавляют 1 н. гидроксид лития (3,1 мл). Смесь нагревают с обратным холодильником в течение 12 ч. Добавляют еще 1 н. гидроксида лития (3,1 мл) и смесь дополнительно нагревают еще в течение 8 ч. Смесь охлаждают до температуры окружающей среды и концентрируют in vacuo и остаток растворяют в водно-эфирной смеси (1:1, 50 мл). Слои разделяют и водный слой собирают и подкисляют (5%-ной НСl до рН=3) в присутствии равного объема этилацетата. Этилацетатную фазу собирают и промывают равным объемом рассола. Водные фазы обратно экстрагируют этилацетатом (2×80 мл), объединяют, сушат сульфатом магния, фильтруют и концентрируют, получая 2(R)-[(1Н-индол-3-ацет-5-илметил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-метилмасляную кислоту (586 мг) в виде порошка желтовато-коричневого цвета.
Стадия 3
К смеси 2(R)-[(1Н-индол-3-ацет-5-илметил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-метилмасляной кислоты (580 мг, 1,16 ммоля), 2,4-диметоксибензилгидроксиламина (255 мг, 5,15 ммоля), 1-гидроксибензотриазолгидрата (178 мг, 1,16 ммоля) и N-метилморфолина (0,2 мл, 1,74 ммоля) в сухом диметилформамиде прибавляют гидрохлоридную соль 1-(3-диметиламинопропил)-3-этилкарбодиимида (333 мг, 1,74 ммоля). Реакционную смесь перемешивают в течение ночи и затем концентрируют с помощью системы роторный испаритель/насос. Остаток растворяют в этилацетате (80 мл) и 2%-ном водном растворе хлорида аммония (80 мл) и делят на части. Органическую фазу собирают и промывают последовательно равными объемами 5%-ного водного бикарбоната натрия и рассола. Водные фазы обратно экстрагируют этилацетатом (2×80 мл), объединенные фазы сушат над сульфатом магния и концентрируют in vacuo с получением сырого N-(2, 4-диметокси)бензилокси-2(R)-[(1H-3-N-(2,4-диметоксибензилоксииминоацетил)индол-5-илметил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-метилбутирамида, который непосредственно используют на следующей стадии без дальнейшей очистки.
Стадия 4
В раствор N-(2,4-диметокси)бензилокси-2(R)-[(1H-3-N-(2,4-диметоксибензилоксииминоацетил)индол-5-илметил)-(4-метокси-2, 3,6-триметилбензолсульфонил)амино]-3-метилбутирамида (предположительно 1,1 ммоля) в смеси трифторуксусной кислоты (5%) и тетрагидрофурана (15 мл) с водой (2 мл) добавляют триэтилсилан (0,7 мл, 3,9 ммоля). Смесь перемешивают в течение 1 ч при температуре окружающей среды и затем еще добавляют трифторуксусной кислоты (0,5 мл). Смесь нагревают (60-70°С) в атмосфере азота. Через 0,5 ч прибавляют дополнительное количество трифторуксусной кислоты (0,5 мл) и нагревание поддерживают в общей сложности в течение 4 ч. Смесь охлаждают до температуры окружающей среды и разбавляют водой (60 мл) и этилацетатом (60 мл). Смесь делят на части и органическую фазу собирают и промывают равным объемом рассола. Водные фазы обратно экстрагируют этилацетатом (2×60 мл), объединяют и сушат сульфатом магния. Смесь концентрируют и остаток очищают методом препаративной тонкослойной хроматографии на силикагеле, используя 10%-ный метанол/метиленхлорид в качестве элюента, с получением N-гидрокси-2(R)-[(1Н-3-ацетилиндол-5-илметил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-метилбутирамида (320 мг) в виде порошка желтовато-коричневого цвета.
Пример 12
N-Гидрокси-2(R)-[(3,4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-(метансульфонил)аминопропионамид (таблица 1, соединение 128).

Стадия 1
В охлажденный на льду раствор N-БОК-D-серина (10 г, 48,7 ммоля) в метиленхлориде (50 мл) добавляют в течение 30 мин через дополнительную воронку N,N’-диизопропил-O-трет-бутилизомочевину (35 мл, 3,5 М). Реакционную смесь поддерживают при 0°С в течение 2 ч и затем оставляют на ночь нагреваться до комнатной температуры. Затем смесь снова охлаждают до 0°С и добавляют вторую порцию N,N’-диизопропил-O-трет-бутилизомочевины (28 мл, 3,5 М). Смесь перемешивают в течение 2 ч при 0°С и затем снова нагревают в течение ночи до комнатной температуры. Очищают методом мгновенно-испарительной хроматографии на силикагеле, используя 20%-ный этилацетат/гексан в качестве элюента, с получением О-трет-бутил-N-БОК-D-серина (7,97 г) в виде вязкого масла, которое затвердевает при стоянии.
Стадия 2
В раствор O-трет-бутил-N-БОК-O-серина (4 г, 15,31 ммоля), фталимида (3,38 г, 22,9 ммоля) и трифенилфосфина (6,03 г, 22,9 ммоля) в тетрагидрофуране (120 мл, безводный) добавляют диизопропилазодикарбоксилат (4,5 мл, 22,9 ммоля). Смесь перемешивают в течение ночи в атмосфере азота. Тетрагидрофуран удаляют на роторном испарителе, остаток растворяют в метиленхлориде (60 мл) и загружают в колонку для мгновенно-испарительной хроматографии с силикагелем, элюируют 19%-ным этилацетат/гексаном с получением трет-бутил-2(R)-[(трет-бутоксикарбонил)амино]-3-фталимидопропионата (3,74 г) в виде белого порошка.
Стадия 3
трет-Бутил-2(R)-[(трет-бутоксикарбонил)амино]-3-фталимидопропионат (8,58 г, 21,8 ммоля) растворяют в безводном растворе хлористоводородной кислоты в диоксане (100 мл, 4% (м/м)). Оборудуют колбу ловушкой роторного испарителя (rotavap trap), затыкаемой тефлоновой пробкой, и смесь нагревают до 80°С (используя для безопасности плексигласовый щит). Через 1,5 ч смесь охлаждают до температуры окружающей среды и удаляют все летучие компоненты на роторном испарителе. Твердое вещество белого цвета растворяют в метиленхлориде (100 мл) и переносят в делительную воронку. Раствор делят на две части с равным объемом водного гидроксида натрия (1,0 н.) и органическую фазу собирают. Затем органическую фазу встряхивают с рассолом (2× 100 мл, последовательно) и водные фазы обратно экстрагируют метиленхлоридом (3×100 мл). Органические фазы объединяют, сушат (MgSO4), фильтруют и концентрируют с получением трет-бутил-2-(R)-амино-3-фталимидопропионата (5,7 г) в виде белого порошка.
Стадия 4
В перемешиваемый раствор трет-бутил-2(R)-амино-3-фталимидопропионата (5,7 г, 19,63 ммоля) в сухом ацетонитриле (60 мл) добавляют триметилсилилцианид (8,6 мл, 68,7 ммоля). Через 5 мин добавляют одной порцией 2,6-диметил-4-метоксибензолсульфонилхлорид (4,84 г, 20,6 ммоля). Смесь перемешивают в течение 1 ч при температуре окружающей среды, затем добавляют этилацетат (80 мл) и смесь переводят в делительную воронку. Органическую фазу делят на две части с водной хлористоводородной кислотой (1,5%, 100 мл), собирают и промывают равными объемам рассола. Водные фазы обратно экстрагируют этилацетатом (2×80 мл), а органические фазы собирают, сушат (сульфат магния), фильтруют и концентрируют. Остаток хроматографируют методом мгновенно-испарительной хроматографии на силикагеле (30% этилацетат/гексан) с получением трет-бутил-2(R)-(2, 6-диметил-4-метоксибензолсульфониламино)-3-фталимидопропионата в виде белого порошка (6,9 г).
Стадия 5
В охлажденный (на ледяной бане) раствор трет-бутил-2(R)-(2, 6-диметил-4-метоксибензолсульфониламино)-3-фталимидопропионата (6,9 г, 14,12 ммоля) в сухом бензоле (150 мл) с пиперониловым спиртом (3,22 г, 21,2 ммоля) и трибутилфосфином (5,3 мл, 21,2 ммоля) добавляют 1,1’-(азодикарбонил)дипиперидин (5,35 г, 21,2 ммоля). Смесь оставляют нагреваться в течение ночи до температуры окружающей среды. Затем смесь загружают в колонку с силикагелем, хроматографируют методом мгновенного испарения, используя этилацетатгексан (30%) в качестве элюента, с получением трет-бутил-2(R)-[(3,4-метилендиоксибензил)-(2, 6-диметил-4-метоксибензолсульфонил)амино]-3-фталимидопропионата в виде твердого вещества белого цвета (8,59 г).
Стадия 6
В перемешиваемый раствор трет-бутил-2(R)-[(3, 4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-фталимидопропионата (3,9 г, 6,2 ммоля) в смеси метиленхлорида (78%) и метанола (47 мл) добавляют гидразингидрат (3,9 мл, 125 ммолей) и смесь перемешивают 5 ч, в течение которых наблюдается выпадение твердого осадка фталимида. Смесь фильтруют, промывая метиленхлоридом, для удаления осадка. Фильтрат затем упаривают на роторном испарителе (rotavap) и растворяют в метиленхлориде (80 мл) и переносят в делительную воронку. После разделения на части с равным объемом воды органическую фазу собирают и промывают равным объемом рассола. Водные фазы обратно экстрагируют метиленхлоридом (2×80 мл). Метиленхлоридные фазы объединяют, сушат (MgSO4), фильтруют и концентрируют с получением трет-бутил-2(R)-[(3,4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-аминопропионата в виде полутвердого вещества белого цвета (3,0 г).
Стадия 7
К смеси трет-бутил-2(R)-[(3,4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-аминопропионата (1,02 г, 2,0 ммоля) с триметилсилилцианидом (0,7 мл, 5,2 ммоля) в сухом ацетонитриле (15 мл) прибавляют метансульфонилхлорид (0,18 мл, 2,3 ммоля) и перемешивают в течение ночи. Добавляют этилацетат (80 мл) и смесь делят на две части с водной хлористоводородной кислотой (1,5%, 80 мл). Органическую фазу собирают и промывают равным объемом рассола. Водные фазы обратно экстрагируют этилацетатом (2×80 мл). Органические фазы объединяют, сушат (MgSO4), фильтруют и концентрируют с получением трет-бутил-2(R)-[(3,4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-метансульфониламинопропионата в виде полувязкого масла бледно-желтого цвета (1,4 г).
Стадия 8
Раствор трет-бутил-2(R)-[(3,4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-метансульфониламинопропионата (1,37 г, 2 ммоля) в смеси трифторуксусной кислоты (20%) и метиленхлорида (15 мл) перемешивают в течение 1 ч. Прибавляют еще трифторуксусной кислоты (0,5 мл) и перемешивание продолжают в течение 2 ч. Затем смесь концентрируют на роторном испарителе и остаток растворяют в толуоле (40 мл) и снова концентрируют. Эту процедуру повторяют дважды (2×40 мл толуола, для удаления следов трифторуксусной кислоты), получая 2(R)-[(3,4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-метансульфониламинопропионовой кислоты в виде пенистого твердого вещества коричневато-зеленого цвета (1,02 г).
Стадия 9
К смеси 2(R)-[(3,4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-метансульфониламинопропионовой кислоты (1 г, 1,9 ммоля), O-бензилгидроксиламина (0,95 мл, 6 ммоля), 1-гидроксибензотриазолгидрата (370 мг, 1,9 ммоля) и N-метилморфолина (0,7 мл, 5,7 ммоля) в безводном диметилформамиде (20 мл) прибавляют гидрохлоридную соль 1-этил-3-(3-диметиламино)пропил)карбодиимида. Смесь перемешивают в течение ночи и затем концентрируют на роторном испарителе. Остаток растворяют в этилацетате (60 мл) и делят на две части с равным объемом 5%-ной водной хлористоводородной кислоты. Этилацетатную фазу собирают и промывают последовательно равными объемами 5%-ного бикарбоната натрия и рассола. Водные фазы обратно экстрагируют этилацетатом (2×60 мл) и органические слои объединяют, сушат сульфатом магния, фильтруют и концентрируют. Остаток очищают с помощью препаративной тонкослойной хроматографии, используя 65%-ный этилацетат/гексан в качестве элюента, с получением N-бензилокси-2(R)-[(3,4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-метансульфониламинопропионамида в виде вязкого масла желтого цвета (591 мг).
Стадия 10
В раствор N-бензилокси-2(R)-[(3,4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-метансульфониламинопропионамида (580 мг, 0,94 ммоля) в смеси (3:1) этанола и тетрагидрофурана (30 мл) добавляют 10%-ный палладий на активированном угле (60 мг). Реакционную смесь помещают под водородный баллон и перемешивают в течение 6 ч. Затем реакционную смесь фильтруют через короткую пробку целита, промывая этанолом (200 мл). Фильтрат концентрируют на роторном испарителе и остаток очищают методом препаративной тонкослойной хроматографии, используя 8,5%-ный метанол/метиленхлорид в качестве элюента, с получением N-гидрокси-2(R)-[(3,4-метилендиоксибензил)-(2, 6-диметил-4-метоксибензолсульфонил)амино]-3-метансульфониламинопропионамида в виде желтовато-коричневого порошка (223 мг).
Заменяя метансульфонилхлорид на стадии 7 на
бензолсульфонилхлорид,
ацетилхлорид,
бензоилхлорид,
4-метоксикарбонилбензоилхлорид и
метилхлорформиат,
получают следующие соединения:
N-гидрокси-2(R)-[(3,4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-бензолсульфониламинопропионамид (таблица 1, соединение 129),
N-гидрокси-2(R)-[(3,4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-ацетиламинопропионамид (таблица 1, соединение 130),
N-гидрокси-2(R)-[(3, 4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-бензоиламинопропионамид (таблица 1, соединение 138),
N-гидрокси-2(R)-[(3,4-метилендиоксибензил)-(2, 6-диметил-4-метоксибензолсульфонил)амино]-3-(4-метоксикарбонилбензоил)аминопропионамид (таблица 1, соединение 133) и
N-гидрокси-2(R)-[(3,4-метилендиоксибензил)-(2, 6-диметил-4-метоксибензолсульфонил)амино]-3-метоксикарбониламинопропионамид (таблица 1, соединение 131).
Пример 13
N-Гидрокси-2(R)-[(3,4-метилендиоксибензил)-(2, 6-диметил-4-метоксибензолсульфонил)амино]-3-[(2-пиррол-1-ил)фенилкарбониламино]пропионамид (таблица 1, соединение 143)

Стадия 1
К смеси трет-бутил-2(R)-[(3,4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-аминопропионата (1,02 г, 2,0 ммоля), 1-(2-карбоксифенил)пиррола (581 мг, 3,1 ммоля), 1-гидроксибензотриазотгидрата (279 мг, 2,0 ммоля), N-метилморфолина (0,8 мл, 7,3 ммоля) и 4-диметиламинопиридина (30 мг, 0,25 ммоля) в сухом диметилформамиде (25 мл) прибавляют гидрохлоридную соль 1-этил-3-(3-диметиламино)пропилкарбодиимида (600 мг, 3,1 ммоля) и смесь перемешивают в течение ночи. Диметилформамид удаляют на роторном испарителе, остаток растворяют в этилацетате (80 мл) и делят на две части с равным объемом водной хлористоводородной кислоты (1,5%, 80 мл). Органическую фазу собирают и последовательно промывают равными объемами 5%-ного бикарбоната натрия и рассола. Водные фазы обратно экстрагируют этилацетатом (2×80 мл) и органические фазы объединяют, сушат над сульфатом магния, фильтруют и концентрируют. Полученный остаток хроматографируют, используя пластины для препаративной тонкослойной хроматографии (45% этилацетат/гексан), с получением трет-бутил-2(R)-[(3,4-метилендиоксибензил)-(2, 6-диметил-4-метоксибензолсульфонил)амино]-3-[(2-пиррол-1-ил)фенилкарбониламино]пропионата в виде пенистого твердого вещества бледно-желтого цвета (927 мг).
Стадия 2
Раствор трет-бутил-2(R)-[(3,4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-[(2-пиррол-1-ил)фенилкарбониламино]пропионата (915 мг, 1,3 ммоля) в смеси трифторуксусной кислоты (20%) и метиленхлорида (15 мл) перемешивают в течение 1 ч. Прибавляют еще трифторуксусной кислоты (0,5 мл) и перемешивание продолжают в течение 1,5 ч. Затем смесь концентрируют на роторном испарителе и остаток растворяют в толуоле (40 мл) и снова концентрируют. Эту процедуру повторяют дважды (2×40 мл толуола, для удаления следов трифторуксусной кислоты), получая 2(R)-[(3, 4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-[(2-пиррол-1-ил)фенилкарбониламино]пропионовой кислоты в виде твердого вещества золотисто-коричневого цвета (896 мг).
Стадия 3
К смеси 2(R)-[(3,4-метилендиоксибензил)-(2,6-диметил-4-метоксибензолсульфонил)амино]-3-[(2-пиррол-1-ил)фенилкарбониламино]пропионовой кислоты (приблизительно 1,3 ммоля), O-бензилгидроксиламина (0,6 мл, 3,9 ммоля), 1-гидроксибензотриазолгидрата (199 мг, 1,3 ммоля) и N-метилморфолина (0,44 мл, 3,9 ммоля) в безводном диметилформамиде (20 мл) прибавляют гидрохлоридную соль 1-этил-3-(3-диметиламино)пропилкарбодиимида (375 мг, 1,95 ммоля). Смесь перемешивают в течение ночи и затем концентрируют на роторном испарителе. Остаток растворяют в этилацетате (60 мл) и делят на две части с равным объемом 1,5%-ной водной хлористоводородной кислоты. Этилацетатную фазу собирают и промывают последовательно равными объемами 5%-ного бикарбоната натрия и рассола. Водные фазы обратно экстрагируют этилацетатом (2×60 мл) и органические слои объединяют, сушат сульфатом магния, фильтруют и концентрируют. Остаток очищают с помощью препаративной тонкослойной хроматографии (2% метанол/метиленхлорид), получая N-бензилокси-2(R)-[(3,4-метилендиоксибензил)-(2, 6-диметил-4-метоксибензолсульфонил)амино]-3-[(2-пиррол-1-ил)фенилкарбониламино]пропионамид в виде пенистого твердого вещества светло-желтого цвета (490 мг).
Стадия 4
В раствор N-бензилокси-2(R)-[(3,4-метилендиоксибензил)-(2, 6-диметил-4-метоксибензолсульфонил)амино]-3-[(2-пирроло)бензамидопропионамида (480 мг, 0,675 ммоля) в смеси (3:1) этанола и тетрагидрофурана (30 мл) добавляют 10%-ный палладий на активированном угле (60 мг). Реакционную смесь помещают под водородный баллон и перемешивают в течение 8 ч, во время которого добавляют дополнительное количество катализатора (2×60 мг). Смесь фильтруют через короткую пробку глинозема, промывая этанолом (200 мл). Фильтрат концентрируют на роторном испарителе и остаток очищают с помощью препаративной тонкослойной хроматографии (7% метанол/метиленхлорид), получая смесь N-гидрокси-2(R)-[(3,4-метилендиоксибензил)-(2, 6-диметил-4-метоксибензолсульфонил)амино]-3-[(2-пиррол-1-ил)фенилкарбониламино]пропионамида и N-гидрокси-2(R)-[(3,4-метилендиоксибензил)-(2, 6-диметил-4-метоксибензолсульфонил)амино]-3-[(2-пирролидин-1-ил)фенилкарбониламино]пропионамида (82:18) в виде желтовато-коричневого порошка (216 мг).
Пример 14
N-Гидрокси-2(R)-[(3,4-метилендиоксибензил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3(S)-гидроксибутирамид (таблица 1, соединение 94)

Стадия 1
К суспензии D-треонина (7,87 г, 66,1 ммоля) в ацетонитриле (100 мл) прибавляют триметилсилилцианид (40 мл, 298 ммолей) и полученный раствор нагревают до 80°С. Через 1 ч добавляют 4-метокси-2,3,6-триметилбензолсульфонилхлорид (17,3 г, 69,4 ммоля) и нагревание продолжают. Через 12 ч реакционную смесь охлаждают до комнатной температуры. Добавляют метанол (15 мл) и удаляют органические вещества in vacuo. Остаток разбавляют диэтиловым эфиром (300 мл) и после охлаждения реакционной смеси до 0° С рН доводят до 8 с помощью 6 н. водного раствора гидроксида натрия. Органический слой собирают и водный слой экстрагируют диэтиловым эфиром. Водный слой подкисляют до рН 4 и снова экстрагируют этилацетатом. Объединенные органические вытяжки сушат над сульфатом магния и концентрируют с получением 2(R)-[(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3(S)-гидроксимасляной кислоты (22 г) в виде коричневой пены, которую используют без дальнейшей очистки.
Стадия 2
В раствор 2(R)-(4-метокси-2,3,6-триметилбензолсульфониламино)-3(R)-гидроксимасляной кислоты (29,13 г, 87,9 ммоля) в диметилформамиде (280 мл) при 0°С добавляют карбонат калия (72,9 г, 527 ммоля) и раствор 3,4-метилендиоксибензилхлорида (60 г, 170,8 ммоля, 50% (мас./мас.)) в метиленхлориде. Через 2 ч добавляют иодид лития (5,88 г, 44 ммоля) и реакционную смесь нагревают в течение 2 ч до комнатной температуры. Через 6 ч реакционную смесь делят на части между этилацетатом (600 мл) и водой (250 мл). Органический слой отделяют, сушат над сульфатом магния и концентрируют in vacuo. Сырой остаток хроматографируют (300 г SiO2, 15% этилацетат/гексан) с получением 3, 4-метилендиоксибензилового эфира 2(R)-(4-метокси-2,3,6-триметилбензолсульфониламино)-3(S)-гидроксимасляной кислоты (40,4 г), часть которого используется непосредственно в следующей реакции без дальнейшей очистки.
Стадия 3
3,4-Метилендиоксибензиловый эфир 2(R)-(4-метокси-2,3,6-триметилбензолсульфониламино)-3(S)-гидроксимасляной кислоты (10,9 г, 23,41 ммоля) и имидазол (2,07 г, 30,43 ммоля) растворяют в тетрагидрофуране (28 мл). Реакционную смесь охлаждают до 0°С и добавляют 1 М триэтилсилилхлорид в тетрагидрофуране (28 мл, 28 ммолей). Через 1 ч реакционную смесь концентрируют и хроматографируют в колонке с Biotage 40L (элюент: 10% этилацетат/гексан) с получением 3,4-метилендиоксибензилового эфира 2(R)-(4-метокси-2,3, 6-триметилбензолсульфониламино)-3-(S)(триэтилсилилокси)масляной кислоты (13,5 г).
Стадия 4
В раствор 3,4-метилендиоксибензилового эфира 2(R)-(4-метокси-2,3, 6-триметилбензолсульфониламино)-3(S)-(триэтилсилилокси)масляной кислоты (3,3 г, 5,7 ммоля) в бензоле (100 мл) при 0°С добавляют 3,4-метилендиоксифенилметанол (1,3 г, 8,5 ммоля), три-н-бутилфосфин (2,1 мл, 8,5 ммоля) и затем 1,1’-[азодикарбонил]дипиперидин (2,2 г, 8,5 ммоля). Реакционную смесь оставляют нагреваться в течение 4 ч до комнатной температуры. Через 72 ч реакционную смесь разбавляют равным объемом гексана, охлаждают в течение 2 ч до 0°С и фильтруют. Остаток концентрируют и хроматографируют (300 г SiO2, 15% этилацетат/гексан) с получением 3, 4-метилендиоксибензилового эфира 2(R)-[(3,4-метилендиоксибензил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3(S)-(триэтилсилилокси)масляной кислоты (3,3 г) в виде желтого масла.
Стадия 5
В раствор 3,4-метилендиоксибензилового эфира 2(R)-[(3,4-метилендиоксибензил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3(S)-(триэтилсилилокси)масляной кислоты (3,3 г, 4, 62 ммоля) в деоксигенированной аргоном смеси этанола (80%) и тетрагидрофурана (100 мл) добавляют 10%-ный Pd/C (2 г) и полученную в результате реакционную смесь гидрируют при атмосферном давлении в течение 45 мин. Реакционную смесь обезгаживают под аргоном, суспензию фильтруют через целит, остаток на целите обильно промывают смесью этанола (80%) и метиленхлорида. Фильтрат концентрируют и азеотропируют тетрагидрофураном (200 мл) и остаток растворяют в диметилформамиде (25 мл). Добавляют O-бензилгидроксиламин (2,0 г, 16,2 ммоля), НОВТ (1-гидроксибензотриазолгидрат) (0, 71 г, 5,2 ммоля) и EDAC (3,1 г, 16,2 ммоля) и реакционную смесь перемешивают в течение 16 ч. Реакционную смесь разбавляют этилацетатом и промывают 2,4 н. водной хлористоводородной кислотой и насыщенным водным раствором бикарбоната натрия. Затем смесь сушат над сульфатом магния и концентрируют in vacuo с получением сырого N-бензилокси-2(R)-[(3,4-метилендиоксибензил)-(4-метокси-2,3, 6-триметилбензолсульфонил)амино]-3(S)-гидроксибутирамида (1,25 г), который непосредственно используют в следующей реакции без дальнейшей очистки.
Стадия 6
В раствор N-бензилокси-2(R)-[(3,4-метилендиоксибензил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3(R)-гидроксибутирамида (1,25 г, 2,19 ммоля) в деоксигенированной аргоном смеси этанола (80%) и тетрагидрофурана (100 мл) добавляют 10%-ный Pd/C (0,7 г) и полученную в результате смесь гидрируют при атмосферном давлении в течение 60 мин. Реакционную смесь обезгаживают под аргоном, суспензию фильтруют через целит, остаток на целите обильно промывают смесью этанола (80%) и метиленхлорида и фильтрат концентрируют почти досуха. Смесь растворяют в 4 мл этилацетата, который медленно, по каплям, добавляют в 100 мл энергично перемешиваемого гексана. Суспензию фильтруют с получением N-гидрокси-2(R)-[(3,4-метилендиоксибензил)-(4-метокси-2,3, 6-триметилбензолсульфонил)амино]-3(S)-гидроксибутирамида (0,67 г) в виде твердого вещества белого цвета.
Пример 15
N-Гидрокси-2(R)-[(1Н-бензимидазол-5-илметил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3(R)-гидроксибутирамид (таблица 1, соединение 136)

Стадия 1
Условия этерификации N-карбобензилокси-D-треонина N,N’-диизопропил-O-трет-бутилизомочевиной с получением О-трет-бутил-N-карбобензилокси-D-треонина те же, что и описанные в вышеприведенном примере 12, стадия 1.
Стадия 2
К смеси О-трет-бутил-N-карбобензилокси-О-треонина (2, 74 г, 8,86 ммоля), триэтиламина (1,9 мл, 13,29 ммоля) и 4-диметиламинопиридина (50 мг) в сухом диметилформамиде (20 мл) прибавляют трет-бутилдиметилсилилхлорид (1,47 г, 9,8 ммоля). Смесь перемешивают в течение ночи в атмосфере аргона. Добавляют дополнительное количество триэтиламина (1 мл) и трет-бутилдиметилсилилхлорида (500 мг) и смесь нагревают при 80°С в течение 6 ч. Смесь охлаждают до температуры окружающей среды и концентрируют на роторном испарителе. Остаток растворяют в метиленхлориде (80 мл) и делят на две части с равным объемом рассола. Органическую фазу собирают, а водную фазу обратно экстрагируют метиленхлоридом (2×80 мл). Метиленхлоридные фазы объединяют, сушат сульфатом магния и концентрируют. Остаток очищают с помощью мгновенно-испарительной хроматографии (силикагель, 15% этилацетат/гексан) с получением О-трет-бутил-N-карбобензилокси-β -О-трет-бутилдиметилсилил-D-треонина (3,27 г) в виде прозрачного вязкого масла.
Стадия 3
В раствор О-трет-бутил-N-карбобензилокси-β -О-трет-бутилдиметилсилил-D-треонина (3,26 г, 7,7 ммоля) в смеси (3:1) этанола и тетрагидрофурана (30 мл) добавляют 10%-ный палладий на активированном угле (80 мг). Смесь помещают под водородный баллон и перемешивают в течение 1,5 ч. Смесь фильтруют через короткую пробку целита и промывают этанолом (200 мл). Фильтрат концентрируют на роторном испарителе, получая α-О-трет-бутил-β -О-трет-бутилдиметилсилил-D-треонин (2,2 г) в виде прозрачного вязкого масла.
Стадия 4
В перемешиваемый раствор α-O-трет-бутил-β -О-трет-бутилдиметилсилил-D-треонина (2,15 г, 7,65 ммоля) в сухом ацетонитриле (30 мл) добавляют триметилсилилцианид (2,9 мл, 22,9 ммоля). Через 5 мин добавляют 2, 3, 6-триметил-4-метоксибензолсульфонилхлорид (2,02 г, 8,1 ммоля) и смесь перемешивают в течение 2 ч. Добавляют этилацетат (80 мл) и смесь делят на две части с равным объемом 1,5%-ной водной хлористоводородной кислоты. Органическую фазу собирают и встряхивают с равным объемом рассола. Этилацетатную фазу выделяют, а водные фазы обратно экстрагируют этилацетатом (2×80 мл). Органические фазы объединяют, сушат сульфатом магния и концентрируют с получением трет-бутил-2(R)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-[(R)-трет-бутилдиметилсилилокси]бутирата (3,85 г) в виде пенистого полутвердого вещества.
Стадия 5
В раствор трет-бутил-2(R)-(4-метокси-2,3,6-триметилбензолсульфонил)амино]-3-[(R)-трет-бутилдиметилсилилокси]бутирата (3, 83 г, 7,63 ммоля) и 3-нитро-4-(N-фталоил)бензилбромида (3,03 г, 8,4 ммоля) в сухом диметилформамиде (30 мл) добавляют карбонат калия (1,7 г, 12,3 ммоля). [Cинтез 3-нитро-4-(N-фталоил)бензилбромида описан ниже на стадии 5А]. Смесь перемешивают в течение 12 ч и добавляют дополнительное количество 3-нитро-4-(N-фталоил)бензилбромида (1,0 г). Еще через 6 ч смесь концентрируют на роторном испарителе. Остаток фильтруют, фильтрат снова концентрируют на роторном испарителе и затем очищают хроматографически (силикагель, 10-15% этилацетат/гексан) с получением трет-бутил-2(R)-[(3-нитро-4-(N-фталамидо)бензил)-4-метокси-2,3,6-триметилбензолсульфонил)амино)]-3-[(R)-трет-бутилдиметилсилилокси]бутирата в виде белого порошка (4,36 г).
Стадия 5А
Получение 3-нитро-4-(аминофталоил)бензилбромида
В охлажденный (на ледяной бане) раствор 3-нитро-4-(аминофталоил)бензилового спирта (5,94 г, 19,92 ммоля) [Синтез этого спирта описан в примере 10, стадии 2 и 3] и трифенилфосфина (7,83 г, 29,9 ммоля) в сухом метиленхлориде (90 мл) добавляют тетрахлорид углерода (9,92 г, 29,9 ммоля). Смесь перемешивают в течение 1 ч при 0°С и затем нагревают в течение 1 ч до температуры окружающей среды. Затем всю смесь загружают в колонку с силикагелем и хроматографируют методом мгновенно-испарительной хроматографии (элюент: 30% этилацетат/гексан) с получением 3-нитро-4-(аминофталоил)бензилбромида в виде желто-белого порошка (5,03 г).
Стадия 6
Условия восстановления трет-бутил-2(R)-[(3-нитро-4-(N-фталамидо)бензил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино)]-3-[(R)-трет-бутилдиметилсилилокси]бутирата для получения трет-бутил-2(R)-[(3-амино-4-(N-фталамидо)бензил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино)]-3-[(R)-трет-бутилдиметилсилилокси]бутирата те же, что и описанные в вышеприведенном примере 10, стадия 5.
Стадия 7
Условия дефталоилирования трет-бутил-2(R)-[(3-амино-4-(N-фталамидо)бензил)-(4-метокси-2,3, 6-триметилбензолсульфонил)амино)]-3-[(R)-трет-бутилдиметилсилилокси]бутирата для получения трет-бутил-2(R)-[(3,4-диаминобензил)-(4-метокси-2,3, 6-триметилбензолсульфонил)амино)]-3-[(R)-трет-бутилдиметилсилилокси]бутирата те же, что и описанные в вышеприведенном примере 10, стадия 6.
Стадия 8
Условия катализируемого глиной превращения трет-бутил-2(R)-[(3,4-диаминобензил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино)]-3-[(R)-трет-бутилдиметилсилилокси]бутирата в трет-бутил-2(R)-[бензимидазол-5-илметил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино)]-3-[(R)-трет-бутилдиметилсилилокси]бутират те же, что и описанные в вышеприведенном примере 10, стадия 7.
Стадия 9
В охлажденную (на ледяной бане) колбу, содержащую неразбавленный трет-бутил-2(R)-[бензимидазол-5-илметил)-(4-метокси-2,3, 6-триметилбензолсульфонил)амино)]-3-[(R)-трет-бутилдиметилсилилокси]бутират (2,53 г, 4,0 ммоля), добавляют под аргоном с помощью шприца 1,0 М раствор тетра-N-бутиламмонийфторида (16 мл). Смесь перемешивают в течение 15 мин при 0°С и затем нагревают до температуры окружающей среды. Через 30 мин добавляют дополнительное количество тетра-N-бутиламмонийфторида (5 мл) и перемешивание продолжают в течение 2 ч. К смеси прибавляют насыщенный водный раствор хлорида аммония (80 мл) и затем этилацетат (60 мл). Смесь делят на части и органическую фазу собирают и промывают последовательно тремя равными объемами рассола. Водные фазы обратно экстрагируют этилацетатом (2×80 мл). Органические фазы объединяют, сушат сульфатом магния, фильтруют и концентрируют. Остаток очищают хроматографически (силикагель, 100%-ный этилацетат в качестве элюента) с получением трет-бутил-2(R)-[бензимидазол-5-илметил)-(4-метокси-2,3, 6-триметилбензолсульфонил)амино)]-3-(R)-гидроксибутирата в виде вязкого прозрачного масла.
Стадия 10
трет-Бутил-2(R)-[бензимидазол-5-илметил)-(4-метокси-2,3, 6-триметилбензолсульфонил)амино)]-3-(R)-гидроксибутират переводят в 2(R)-[бензимидазол-5-илметил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино)]-3-(R)-гидроксимасляную кислоту методом, описанным в вышеприведенном примере 10, стадия 8.
Стадия 11
2(R)-[Бензимидазол-5-илметил)-(4-метокси-2,3,6-триметилбензолсульфонил)амино)]-3-(R)-гидроксимасляную кислоту переводят затем в N-гидрокси-2(R)-[бензимидазол-5-илметил)-(4-метокси-2,3, 6-триметилбензолсульфонил)амино)]-3-(R)-гидроксибутирамид методом, описанным в вышеприведенном примере 3, стадии 6 и 7.
Пример 16
Синтез соединений формулы, показанной на схеме Е

Стадия 1
К AgroGel-OH (формула 1) в пустом сосуде для твердофазной экстракции, оснащенном запорным краном, прибавляют 3 эквивалента соединения формулы 2 (Fmoc-D-Dpr(BOC), 3 эквивалента диизопропилкарбодиимида (DIC) и 0,05 эквивалента 0,116 М раствора диметиламинопиридина (DMAP) в тетрагидрофуране. Добавляют метиленхлорид в количестве, достаточном для набухания смолы (около 12,5 мл/г смолы). Затем реакционную смесь помещают в центрифугу и центрифугируют в течение ночи. После этого смесь фильтруют и промывают три раза метиленхлоридом, три раза метиловым спиртом и один раз смесью (1:1) уксусной кислоты и метиленхлорида, три раза метиловым спиртом и наконец три раза метиленхлоридом и сушат с получением смолы AG-D-Dpr(BOC)-Fmoc.
Полученную в результате смолу (AG-D-Dpr(BOC)-Fmoc) обрабатывают в течение 20 мин раствором 20%-ного пиперидина в диметилформамиде (pip/DMF). Затем реакционную смесь фильтруют через вакуум-фильтр и промывают три раза метиленхлоридом, три раза метиловым спиртом, один раз смесью (1:1) уксусной кислоты и метиленхлорида, три раза метиловым спиртом и наконец три раза метиленхлоридом. Получают смолу формулы 3 (AG-D-Dpr(BOC)-NH2).
Стадия 2
К смоле формулы 3 (AG-D-Dpr(BOC)-NH2) прибавляют метиленхлорид в количестве, достаточном для набухания смолы (около 12,5 мл/г смолы). Затем прибавляют 3 эквивалента сульфонилхлорида формулы 4 (Ar2SO2Cl) и 3 эквивалента триэтиламина (ТЭА). Затем реакционную смесь помещают в центрифугу и центрифугируют в течение ночи. После этого смесь фильтруют через вакуум-фильтр и промывают три раза метиленхлоридом, три раза метиловым спиртом и один раз смесью (1:1) уксусной кислоты и метиленхлорида, три раза метиловым спиртом и наконец три раза метиленхлоридом с получением смолы формулы 5 (AG-D-Dpr(BOC)-NHSO2Ar2).
Стадия 3
К смоле формулы 5 (AG-D-Dpr(BOC)-NHSO2Ar2) прибавляют смесь (1:1) толуола и метиленхлорида в количестве, достаточном для набухания смолы (около 12,5 мл/г смолы). Затем прибавляют 10 эквивалентов 1,1’-(азодикарбонил)дипиперидина (ADDP), 10 эквивалентов Bu3P и затем 10 эквивалентов пиперонилового спирта (ROH). Затем реакционную смесь помещают в центрифугу и центрифугируют в течение ночи. После этого смесь фильтруют через вакуум-фильтр и промывают три раза метиленхлоридом, три раза метиловым спиртом, один раз смесью (1:1) уксусной кислоты и метиленхлорида, три раза метиловым спиртом и наконец три раза метиленхлоридом с получением смолы формулы 6 (AG-D-Dpr(BOC)-NRSO2Ar2).
Стадия 4
Смолу формулы 6 (AG-D-Dpr(BOC)-NRSO2Ar2) обрабатывают в течение 30 мин раствором 1 М хлортриметилсилана (ТМССl) в смеси фенола (3 М) и метиленхлорида. Затем реакционную смесь фильтруют через вакуум-фильтр и промывают три раза метиленхлоридом, три раза метиловым спиртом, один раз смесью (1:1) уксусной кислоты и метиленхлорида, три раза метиловым спиртом и наконец три раза метиленхлоридом с получением смолы формулы 7 (AG-D-Dpr-NRSO2Ar2).
Стадия 5
К смоле формулы 7 (AG-D-Dpr-NRSO2Ar2) прибавляют 3 эквивалента сукцинимидилкарбоната формулы 8 (R’’OCO2Su), 3 эквивалента Et3N (TEA) и 0,05 эквивалента 0,116 М раствора 4-диметиламинопиридина (DMAP) в тетрагидрофуране. Добавляют метиленхлорид в количестве, достаточном для набухания смолы (около 12, 5 мл/г смолы). Затем реакционную смесь помещают в центрифугу и центрифугируют в течение ночи. После этого смесь фильтруют через вакуум-фильтр и промывают три раза метиленхлоридом, три раза метиловым спиртом, один раз смесью (1:1) уксусной кислоты и метиленхлорида, три раза метиловым спиртом и наконец три раза метиленхлоридом с получением смолы формулы 9 (AG-D-Dpr(COOR’’)-NRSO2Ar2).
Стадия 6
Смолу формулы 9 (AG-D-Dpr(COOR’’)-NRSO2Ar2) вначале промывают тетрагидрофураном. Добавляют тетрагидрофуран в количестве, достаточном для набухания смолы (около 12,5 мл/г смолы). Затем добавляют 25 эквивалентов 50%-ного водного раствора NH2OH и реакционную смесь центрифугируют в течение двух дней. После этого смесь фильтруют через вакуум-фильтр и промывают метиленхлоридом, метиловым спиртом и затем метиленхлоридом. Фильтрат концентрируют на приборе Speed Vac, получая соединение формулы 10 (HONH-Dpr(COOR’’)NRSO2Ar2), которое очищают с помощью жидкостной хроматографии высокого давления с обращением фаз (RP-HPLC).
Используя соответствующий сульфонилхлорид формулы 4 и соответствующий сукцинимидилкарбонат формулы 8, получают следующие соединения таблицы 1: соединение 139, соединение 140, соединение 141, соединение 146, соединение 148 и соединение 149.
Пример 17
Синтез соединений формулы, показанной на схеме F

Стадия 1
Смолу формулы 7 (AG-D-Dpr-NRSO2Ar2) вначале промывают тетрагидрофураном, затем добавляют 15 эквивалентов изоцианата формулы 8 (ArNCO). Добавляют тетрагидрофуран в количестве, достаточном для набухания смолы (около 12,5 мл/г смолы). После этого реакционную смесь помещают в центрифугу и центрифугируют в течение ночи. Затем смесь фильтруют через вакуум-фильтр и промывают три раза метиленхлоридом, три раза метиловым спиртом, один раз смесью (1:1) уксусной кислоты и метиленхлорида, три раза метиловым спиртом и наконец три раза метиленхлоридом с получением смолы формулы 9 (AG-D-Dpr(CONHAr)-NRSO2Ar2 ).
Стадия 2
Смолу формулы 9 (AG-D-Dpr(CONHAr)-NRSO2Ar2) вначале промывают тетрагидрофураном. Добавляют тетрагидрофуран в количестве, достаточном для набухания смолы (около 12,5 мл/г смолы), и затем 25 эквивалентов 50%-ного водного раствора NH2OH и реакционную смесь центрифугируют в течение двух дней. После этого смесь фильтруют через вакуум-фильтр и промывают метиленхлоридом, метиловым спиртом и затем метиленхлоридом. Фильтрат концентрируют на приборе Speed Vac, получая соединение формулы 10 (HONH-Dpr(CONHAr)NRSO2 Ar2), которое очищают с помощью жидкостной хроматографии высокого давления с обращением фаз (RP-HPLC).
Используя соответствующий изоцианат формулы 8, получают соединение 147 из таблицы 1.
Пример 18
Примеры фармацевтических композиций
Ниже представлены репрезентативные фармацевтические композиции, содержащие соединение формулы (I).
Композиция в виде таблетки
Следующие ингредиенты смешивают до однородного состояния и прессуют в виде отдельных таблеток с насечкой (делимых таблеток) (см. таблицу 4).
Композиция в виде капсулы
Следующие ингредиенты смешивают до однородного состояния и заполняют ими желатиновую капсулу с твердым покрытием (см. таблицу 5).
Композиция в виде суспензии
Следующие ингредиенты смешивают, получая суспензию для перорального введения (см. таблицу 6).
Композиция, предназначенная для инъекции
Следующие ингредиенты смешивают, получая композицию, предназначенную для инъекции (см. таблицу 7).
Композиция в виде липосом
Следующие ингредиенты смешивают, получая композицию в виде липосом (см. таблицу 8).
Образец сушат вымораживанием и лиофилизируют в течение ночи. Образец восстанавливают с помощью 1 мл 0,9%-ного физиологического раствора. Размер липосом может быть уменьшен путем облучения ультразвуком.
Пример 19
Выделение и получение проколлаген-С-протеиназы
Клонирование человеческой РСР и конструирование вектора НТ-1080
Человеческую проколлаген-С-протеиназу (РСР, также называемую костным морфогенетическим протеином-1 или ВМР-1) клонировали из библиотеки кДНК человеческих фибробластов (фирма Stratagene, Сан-Диего, штат Калифорния). Клонирование осуществляли с помощью ПЦР, основанной на использовании известной нуклеотидной последовательности (Wozney J.M., Rosen V., Celeste A.J., Mitsock L.M., Whitters M.J., Kriz R.W., Hewick R.M. и Wang E.A. (1989), прямой регистрационный номер GenBank M22488, локус HUMBMP1), с помощью полимеразы Taq, 5’-праймера:
GCGCGCGGTACCCGCCCCGCCAGCATGCCCGGCGTGGCCCGCCTGCCGCTGCTGCTCGGGCTGCTGCTGCTCCCGCGTCCCGGCCGGCCGCTGGACTTGGCCGACTACACCTATGACCTGGC (SEQ ID NO:1) (фирма Oligo Therapeutis Inc., Вилсонвилл, штат Орегон)
и 3’-праймера для обратной цепи:
CCGCTCGAGCCTCACTGGGGGGTCCGGTTTCTTTTCTGCACTCGGAATTTGAGCTGGTG (SEQ ID NO:2) (фирма Gibco)
с получением всего полноразмерного нуклеотида, кодирующего сигнальную последовательность, пропептид, каталитический домен и все С-концевые домены до природного сайта терминации трансляции. ПЦР-продукт очищали с помощью гель-электрофореза с использованием набора для очистки ДНК типа Wizard (фирма Promega, Мэдисон, штат Висконсин) и непосредственно встраивали путем лигирования в экспрессионный вектор млекопитающих pCR3.1 (фирма Invitrogen, Карслбад, штат Калифорния) с помощью ТА-метода клонирования. Полученный в результате лигирования продукт применяли для трансформации штамма Е.coli TOP10F’ (фирма Invitrogen, Карслбад, штат Калифорния) с использованием стандартного метода температурного шока, и трансформанты отбирали путем рестрикционного анализа очищенной плазмиды, используя ферменты HindIII и BamHI. Позитивные в отношении ПЦР-вставки трансформанты подвергали секвенированию с помощью системы Perkin-Elmer/ABI. Были отобраны два клона, которые при их объединении кодировали полную аминокислотную последовательность, идентичную последовательности, предсказанной Wozney с соавторами. Два клона рекомбинировали рестрикцией, используя фермент BbrI, который расщепляет встречающийся в естественных условиях внутренний сайт, и EcoRV, который расщепляет область соединения вставки и вектора. Вырезанные фрагменты повторно встраивали путем лигирования в обработанный EcoRV вектор pCR3.1. Полученная в результате конструкция содержала полную кодирующую последовательность, идентичную последовательности, описанной у Wozney с соавторами, за исключением двух молчащих мутаций в сигнальной последовательности G→A в положениях 39 и 45, считая от сайта инициации трансляции (ATG). Окончательную плазмидную конструкцию амплифицировали в штамме Е.coli DH5a и очищали с использованием анионообменной хроматографии (колонки MaxiPrep фирма Qiagen (Валенсия, штат Калифорния), каталожный номер 12162).
Трансфекция линии НТ-1080 и отбор экспрессирующего РСР клона
Линию человеческой фибросаркомы НТ-1080 (АТСС) выращивали в среде DEEM с высоким содержанием глюкозы (DMEM-HG), дополненной 10% инактивированной температурной обработкой фетальной бычьей сыворотки (HI-FBS), в 100-миллиметровых чашках для культивирования (типа Falcon, фирма Becton Dickenso, Франклин, штат Нью-Джерси), и трансфектировали 2 мг очищенной плазмиды с помощью стандартного метода для липофектамина (фирма Gibco, Бетезда, штат Мэриленд) в бессывороточной среде. Отбирали стабильные трансфектанты обработкой культуры на чашках 400 мкг/мл G418 (фирма Gibco). После отбора в течение 10 дней прикрепленные единичные колонии отбирали из чашки, переносили в 12-луночные планшеты и выращивали до конфлуэнции. Индивидуальные стабильные колонии подвергали скринингу в отношении экспрессии РСР с помощью анализа TaqMan (фирма Perkin-Elmer, Фостер Сити, штат Калифорния), используя эквивалентные количества общей РНК, 5’-праймер:
GACGAAGAGGACCTGAGGGCCTT (SEQ ID NO:3) (фирма Perkin-Elmer, Фостер Сити, штат Калифорния),
3’-праймер для обратной цепи:
TTCCTGGAACTGCAGCTTTGA (SEQ ID NO:4) (фирма Perkin-Elmer, Фостер Сити, штат Калифорния),
и зонд для обратной цепи:
TGCCGTCTGAGATCCACAGCCTGCT (SEQ ID NO:5) (фирма Perkin-Elmer).
Стабильную линию HT-1080/hPCP-23 отбирали на основе наиболее высокого уровня экспрессии мРНК РСР путем TaqMan-скрининга. Маточные растворы стабильной линии HT-1080/hPCP-23 переносили в среду DMEM-HG, дополненную 5% HI-FBS и 10% ДМСО (без добавления G418) и медленно замораживали при -70°С в течение ночи, переносили в баню с жидким азотом для длительного хранения. Восстановленную ("оживленную") линию НТ-1080/hPCP-23 поддерживали в среде DMEM-HG, дополненной 10%-ной HI-FBS и 250 мкг/мл G418, в течение 7 пассажей. Экспрессию РСР с целью получения фермента осуществляли, пересевая и выращивая HT-1080/hPCP-23 на планшетах, покрытых коллагеном типа I из хвоста крысы (типа Falcon) в бессывороточной среде OptiMem (фирма Gibco), не содержащей G418, в течение 24 ч.
Получение РСР в клетках линии НТ-1080
Клетки линии НТ-1080, трансформированные с целью производства РСР, адаптировали для выращивания в суспензии в среде OptiMem (фирма Gibco), дополненной 5% фетальной бычьей сыворотки и 4 мл/л G418 (фирма Gibco). Культуру поддерживали при 37°С и концентрации растворенного кислорода 30%. Как правило, объемы партий составляли 10 л. Когда плотность клеток достигала 4-6×105 клеток/мл, культуральную жидкость собирали и фильтровали через мембрану с размером пор 0,2 мкм. В другом варианте культуру клеток подвергали перфузии с использованием свежей среды, со скоростью 0,8-1, 0 объема культуры в день. Плотность подвергнутых перфузии культур достигала 1-2,5×106 клеток/мл и ее поддерживали до двух недель с постоянным сбором.
Выделение РСР из клеток линии НТ-1080
Колонку, упакованную Dyematrex GelGreen А (фирма Millipore, Бедфорд, штат Массачусетс), уравновешивали в противотоке 50 мМ HEPES, рН 7,2, содержащего 6 мМ СаСl2 и 0,3 М NaCl. После введения культуральной жидкости НТ-1080 колонку промывали таким количеством содержащего 1,0 М NaCl уравновешивающего буфера, которое соответствует 10 объемам колонки. РСР элюировали с помощью 50 мМ HEPES, рН 7,2, который содержит 3 М NaCl, 2 М мочевину и 6 мМ СаСl2. Фракции элюата объединяли, концентрировали до объема 150-200 мл и в течение ночи подвергали диализу в противотоке 4,0 л 50 мМ HEPES, 6 мМ СаСl2, рН 7,2. Затем продукт центрифугировали при 5000xg в течение 15 мин для удаления осадка. Содержащий РСР образец хранили при -20°С до дополнительной обработки.
Содержащий РСР образец подвергали оттаиванию и разбавляли 50 мМ HEPES, рН 7,2, который содержит 6 мМ СаСl2, при необходимости доводя концентрацию NaCl до 0,1-0,15 М. Значение рН доводили до 6,7 с помощью 2 н. НСl. Раствор протеина фильтровали через фильтр с размером пор 0,45 мкм для удаления любого осадка. Этот препарат затем вносили в колонку, упакованную Q-Sepharose High Performance (сефарозой Q для хроматографии высокого разрешения) (фирма Pharmacia, Пискатавей, штат Нью-Джерси), которую уравновешивали 50 мМ HEPES, рН 6, 7, содержащим 6 мМ СаСl2 и 0,15 М NaCl. РСР не оставалась на колонке и, следовательно, находилась в прошедших через колонку фракциях. РСР концентрировали до 1 мг/мл и использовали для скрининга.
Получение РСР в клетках Drosophila
Клетки Drosophila, трансформированные таким образом, чтобы они продуцировали РСР, выращивали в биореакторах при обычном объеме партии 10 л в среде SF900 II SF (фирма Gibco). Температуру поддерживали на уровне 30°С и концентрации растворенного кислорода 30%. Периодически клетки подкармливали смесью, содержащей глутамин, липиды и дрожжевым экстрактом (yeastolate). Когда плотность клеток достигала 30-50×106 клеток/мл, супернатанты собирали центрифугированием и концентрировали ультрафильтрацией с использованием 30 кДа-мембраны.
Выделение РСР из культуральной жидкости клеток Drosophila
Культуральную жидкость, в которой выращивали клетки Drosophila, концентрировали в 8 раз и значение рН при необходимости доводили до 7,1-7,2. Культуральную жидкость центрифугировали при 3000xg в течение 10 мин и фильтровали через фильтры с размером пор 0,45 мкм. Затем культуральную жидкость вносили в колонку, заполненную карбоксисульфоновым наполнителем (фирма J.T.Baker/Millnckordt, Филипсбург, штат Нью-Джерси), уравновешенную 0,1 М NaCl, 50 мМ HEPES, 6 мМ CaCl2, рН 7,2). После загрузки колонку промывали таким количеством уравновешивающего буфера, которое соответствует 10 объемам колонки. Оставшиеся протеины элюировали в градиенте от 0,1 до 1,0 М NaCl, используя количество элюента, соответствующее 9 объемам колонки. Фракции, в которых обнаружена РСР-активность, объединяли для дальнейшей очистки.
РСР, элюированную из колонки, заполненной карбоксисульфоновым наполнителем, вносили в колонку, упакованную Dyematrex GelGreen А (фирма Millipore, Бедфорд, штат Массачусетс), уравновешенную 50 мМ HEPES, рН 7,4, который содержал 0,3 М NaCl и 6 мМ СаСl2. Затем колонку промывали уравновешивающим буфером, содержащим 1 М NaCl. Оставшиеся протеины элюировали 50 мМ HEPES, рН 7,4, который содержал 3 М NaCl, 2 М мочевину, 6 мМ СаСl2. Полученный при элюции пик концентрировали и подвергали диализу в противотоке 50 мМ HEPES, рН 7,4, который содержал 0,3 М NaCl, 6 мМ CaCl2. Препарат центрифугировали при 3000xg в течение 10 мин. К супернатанту добавляли BriJ-35 (фирма Sigma, Мэдисон, штат Висконсин) для получения конечной концентрации 0,02%. Этот препарат использовали для скрининга.
Пример 20
Выделение коллагеназ
Каталитический домен человеческой коллагеназы-1 экспрессировали в виде слитого с убикитином протеина в Е.coli согласно методу, описанному у Gehring E.R. и др., J. Biol. Chem., 270: 22507 (1995). После очистки слитого протеина каталитический домен коллагеназы-1 выделяли обработкой 1 мМ ацетатом аминофенилртути (АФРА) в течение 1 ч при 37°С и затем очищали с помощью цинк-хелатной хроматографии.
Человеческие коллагеназу-2 и желатиназу В выделяли в активной форме из лейкоцитной пленки согласно методу, описанному у Mookhtiar K.A. и др., Biochemistry, 29: 10620 (1990).
Пропептид и часть каталитического домена человеческой коллагеназы-3 экспрессировали в Е.coli в виде N-концевого слитого с убикитином протеина. После очистки каталитический домен выделяли обработкой 1 мМ АФРА в течение 1 ч при 37°С и затем очищали с помощью цинк-хелатной хроматографии.
Крысиную коллагеназу-3 очищали в активной форме из культуральной среды клеток гладкой мускулатуры матки согласно методу, описанному у Roswit W.T. и др., Arch. Biochem. Biophys., 225: 285-295 (1983).
Пример 21
Ингибирование активности проколлаген-С-протеиназы
Способность соединений ингибировать РСР продемонстрирована с помощью следующих анализов in vitro с использованием в качестве субстрата синтетического пептида.
Анализ А
Непрерывный анализ осуществляли с использованием 20 мкМ субстрата (Dabcyl-Pro-Tyr-Tyr-Gly-Asp-Glu-Pro-h-Leu-Edans) (SEQ ID NO:6). Конечные условия анализа были следующие: 20 мкМ субстрат, 50 мМ HEPES, рН 7,5, 50 мМ NaCl, 3% ДМСО, 30°С и фермент РСР. Образовавшийся продукт оценивали с помощью флуоресцентной спектроскопии, длина волны возбуждения (Ex.) равна 335 нм, длина волны испускания (Еm.) равна 490 нм. Значение IC50 рассчитывали на основе зависимости ответа от дозы соединений.
Анализ Б
80 мкл буфера А (20 мМ HEPES), содержащего требуемые концентрации тестируемого соединения в ДМСО или носителя, смешивали с 10 мкл РСР в концентрации примерно 1 мг/мл и 10 мкл 0,1 М субстрата, в обоих случаях в 20 мМ HEPES. Содержимое перемешивали, инкубировали при комнатной температуре в течение 1-2 ч и оценивали флуоресценцию с помощью планшет-ридера типа Victor (Ex. 405 нм, Em. 460 нм, при энергии 2000-40000 ламп, 0, 1-1 с/лунку). В качестве субстрата использовали DACM-Cys-Pro-Tyr-Gly-Asp-Glu-Pro-н-Leu-Lys-FITC-OH (SEQ ID NО:7) (DACM обозначает диметиламинокумарилмалеимид, FITC обозначает флуоресцентный изотиоцианат). Значения IC50 рассчитывали из графиков зависимости начальной скорости от концентрации соединения.
Кроме того, могут применяться анализы in vitro с использованием в качестве субстрата нативного коллагена, и эти анализы описаны более подробно в WO 97/05865 ("C-Proteinase Inhibitors for the Treatment od Disorders Relating to the Overproduction of Collagen"), опубликованной 20 февраля 1997 г.
Значения IC50 соединений, представленных в таблице 1, находились в диапазоне от 0,01 до 2 мкМ.
Пример 22
Оценка коллагеназной активности
Ингибирующую активность in vitro соединений по изобретению в отношении коллагеназы-1, коллагеназы-2 и коллагеназы-3 оценивали на основе гидролиза субстрата MCA-Pro-Leu-Gly-Leu-DPA-Ala-Arg-NH2 (SEQ ID NО:8) (фирма Bachem Inc.) при 37°С согласно методу, описанному у Knight C.G. и др., FEBS Lett., 296(3): 263-266 (1992).
Коллагеназу разбавляли буфером для анализа (50 мМ Трицин, рН 7,5, 200 мМ NaCl, 10 мМ CaCl2 и 0,005% BriJ-35), содержащим 10 мкмолей указанного выше субстрата, растворенного в ДМСО. Соединения по изобретению, растворенные в ДМСО, или только ДМСО (контрольные образцы) добавляли в таком разведении, чтобы конечная концентрация ДМСО во всех опытах составляла 2, 5%. Изменение флуоресценции оценивали с помощью флуорометра типа Perkin-Elmer LS-50B с использованием длины возбуждения 328 нм и длины волны испускания 393 нм.
Отобранные соединения из таблицы 1 оказались в 100-1000 раз более эффективными ингибиторами РСР (100-1000-кратное избирательное действие), чем коллагеназы-1 и коллагеназы-3, и в 50-500 раз более эффективными ингибиторами РСР (50-500-кратное избирательное действие), чем коллагеназы-1 и коллагеназы-2.
Вышеприведенное изобретение описано более подробно с целью иллюстрации и на основе примеров, данных с целью лучшего понимания. Специалисту в данной области должно быть очевидно, что в объеме прилагаемой формулы изобретения могут быть сделаны изменения и модификации.
Перечень последовательностей
<110> F. Hoffmann-La Roche AG
124 Grenzacherstrasse
СН-4070 Базель
Швейцария
< 120> Сульфонамидные гидроксаматы
<130> 20427
<150> US 60/113311
<151> 1998-12-22
<160> 8
<170> FastSEQ для Windows Version 3.0
<210> 1
<211> 122
< 212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
< 400> 1
gcgcgcggta cccgccccgc cagcatgccc ggcgtggccc gcctgccgct gctgctcggg 60
ctgctgctgc tcccgcgtcc cggccggccg ctggacttgg ccgactacac ctatgacctg 120
gc 122
<210> 2
< 211> 59
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 2
ccgctcgagc ctcactgggg ggtccggttt cttttctgca ctcggaattt gagctggtg 59
<210> 3
< 211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 3
gacgaagagg acctgagggc ctt 23
<210> 4
<211> 21
< 212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
< 400> 4
ttcctggaac tgcagctttg a 21
<210> 5
<211> 25
<212> ДНК
< 213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 5
tgccgtctga gatccacagc ctgct 25
<210> 6
< 211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетический пептид
<400> 6

<210> 7
<211> 9
<212> PRT
< 213> Искусственная последовательность
<220>
<223> синтетический пептид
<400> 7

<210> 8
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Хаа=DPA (дифениламин)
< 400> 8
Реферат
Настоящее изобретение относится к производным сульфонамидов формулы (Iа)
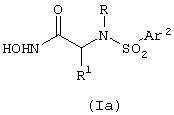
где R означает –CH(R2)Ar1, Ar1 - фенильное или нафтильное кольцо, возможно замещенное. Соединения являются ингибиторами С-протеиназы проколлагена. Описана также фармацевтическая композиция на основе соединений (Iа). 2 c. и 27 з.п. ф-лы, 8 табл.
Формула




Комментарии