Гидроксиметилфурфуральное производное - RU2621703C2
Код документа: RU2621703C2
Чертежи

















Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к гидроксиметилфурфуральным производным, фармацевтическим средствам, индукторам белков теплового шока, антистрессовым агентам, регуляторам автономной (вегетативной) нервной системы, пищевым продуктам и напиткам и способам получения гидроксиметилфурфурального производного.
Предпосылки создания изобретения
В настоящее время люди имеют длинную трудовую неделю, подвергаются различным физическим и умственным (ментальным) стрессам или т.п.; и многие из этих людей жалуются на проявление физических симптомов, таких как потеря аппетита, нарушение сна, головокружение или холодный пот, или ментальных симптомов, таких как ненависть или недоверие к другим людям, эмоциональная нестабильность, нахождение в раздраженном состоянии или депрессивное настроение, имеющих место даже тогда, когда у них не обнаружено никаких аномалий при исследовании, таком как физикальное обследование. Симптомы, ассоциированные с указанными не идентифицированными жалобами, часто диагностируют как наличие вегетативной дистонии. В настоящее время указанную вегетативную дистонию, как правило, лечат с помощью лекарственной терапии, например, с применением слабого транквилизатора или гормонального средства, для улучшения состояния применяют лечение диетой, изменение стиля жизни, например, применение физической нагрузки, или т.п.
Установлено, что нарушения автономной нервной системы, включая указанную выше вегетативную дистонию, индуцируются чрезмерными стрессовыми нагрузками. При нарушении автономной нервной системы наблюдается нарушение баланса между симпатической нервной системой и парасимпатической нервной системой (баланс автономной нервной системы), пониженная активность автономной нервной системы или т.п. Нарушение баланса автономной нервной системы означает состояние, характеризующееся повышенной активностью симпатической нервной системы или состояние, характеризующееся повышенной активностью парасимпатической нервной системы. Кроме того, установлено, что способность противостоять стрессу снижается при уменьшении активности автономной нервной системы. Например, поскольку функции желудочно-кишечного тракта в основном возбуждаются парасимпатической нервной системой, то пролонгированный тонус симпатической нервной системы, связанный со стрессовой нагрузкой, подавляет функцию желудочно-кишечного тракта, что приводит к желудочно-кишечным нарушениям, таким как потеря аппетита или констипация. Кроме того, по-видимому, когда функция парасимпатической нервной системы является недостаточной вследствие стрессовой нагрузки, а активность симпатической нервной системы остается повышенной, это может приводить к нарушению сна.
Наряду с указанной выше тесной взаимосвязью между стрессами и нарушениями автономной нервной системы, существуют также нарушения автономной нервной системы, не вызываемые стрессовыми нагрузками. Кроме того, стрессовая нагрузка не обязательно приводит к нарушению автономной нервной системы, а в некоторых случаях может вызывать другие физические симптомы.
Одним из видов белков, которые называют стрессовыми белками, являются белки теплового шока (обозначенные далее как HSP). HSP представляют собой белки с молекулярной массой от примерно нескольких десятков тысяч до ста пятидесяти тысяч, и их подразделяют на несколько семейств на основе их молекулярной массы (HSP10, HSP27, HSP40, HSP60, HSP70, HSP90, HSP110 и т.п.). HSP представляют собой группу белков, которые индуцируются в клетках, когда живые организмы находятся в условиях физического, химического, физиологического или умственного стресса. Будучи специфическими, HSP играют роль в защите клеток, и для них характерным является повышение уровня экспрессии, когда живой организм подвергается различным факторам, включая нагревание, бактериальную инфекцию, воспаление, реактивные виды кислорода, ультрафиолетовые лучи, голодание и гипоксию. Кроме того, HSP функционируют также в качестве молекулярных шаперонов, которые контролируют фолдинг белка и ингибируют агрегацию аномальных белков.
Среди HSP хорошо изучен, в частности, HSP70, и обнаружена его конститутивная экспрессия во многих внутренних органах, включая желудочно-кишечный тракт и кожу. В настоящее время обнаружено антиапоптозное и противовоспалительное действие HSP70 и описана способность HSP70 осуществлять защиту клеток от различных стрессов (см. не относящиеся к патентам литературные ссылки 1-4). По этой причине проведены исследования, в которых предпринята попытка использовать продукты, обладающие индуцирующей HSP70 активностью, в фармацевтических, косметических средствах или т.п. Касательно полученных из встречающихся в естественных условиях продуктов субстанций, обладающих индуцирующей HSP70 активностью, описан пеонифлорин, представляющий собой основной компонент Paeoniae radix (см. не относящуюся к патентам литературную ссылку 5).
Спаржа представляет собой растение, которое культивируют и собирают его урожай в различных областях, включая остров Хоккайдо в Японии. Установлено, что спаржа обладает различными видами биологической активности. В патентной литературе (ссылка 1) описано, что экстракт стебля спаржи обладает превентивным и восстанавливающим (силы) действием при различных типах усталости (такой как физическая усталость или усталость, связанная с умственным стрессом). Кроме того, в ссылке 2 на патентную литературу описано, что экстракт стебля спаржи обладает способностью улучшать функцию головного мозга. Кроме того, в ссылке 3 на патентную литературу описано, что экстракт псевдо листьев спаржи обладает способностью контролировать автономную нервную систему.
Процитированная литература
Патентная литература
Ссылка на патентную литературу 1: не рассмотренная японская заявка па патент, публикация фирмы Kokai №2007-45750.
Ссылка на патентную литературу 2: не рассмотренная японская заявка па патент, публикация фирмы Kokai №2007-230870.
Ссылка на патентную литературу 3: не рассмотренная японская заявка па патент, публикация фирмы Kokai №2011-153125.
Не относящаяся к патентам литература
Ссылка на не относящуюся к патентам литературу 1: Xiao-Rong Chang и др., World J Gastroenterol; 13(32), 2007, ce. 4355-4359.
Ссылка на не относящуюся к патентам литературу 2: Sarah M. и др., FASEB J. 22, 2008, сс.3836-3845.
Ссылка на не относящуюся к патентам литературу 3: Hirata I. и др., Digestion; 79(4), 2009, сс.243-250.
Ссылка на не относящуюся к патентам литературу 4: Tadashi Nishida и др., Journal of clinical biochemistry and nutrition; 46(1), 2010, cc. 43-51.
Ссылка на не относящуюся к патентам литературу 5: Dai Yan и др., Cell Stress & Chaperones; 9(4), 2004, сс.378-389.
Краткое изложение сущности изобретения
Техническая задача
Однако к настоящему времени отсутствуют сведения, касающиеся компонентов в экстрактах спаржи или в продуктах, полученных в результате переработки спаржи, которые участвуют в антистрессовом действии и регуляторном действии в отношении автономной нервной системы.
При создании настоящего изобретении открыто новое гидроксиметилфурфуральное производное, выведенное из продукта, полученного тепловой обработкой спаржи с использованием горячей воды, и установлено, что указанное гидроксиметилфурфуральное производное обладает очень высокой индуцирующей HSP активностью, антистрессовым действием и регуляторном действии в отношении автономной нервной системы, что представляет собой сущность настоящего изобретения. В основу настоящего изобретения была положена задача получить новое гидроксиметилфурфуральное производное, обладающее высокой эффективностью фармацевтическое средство, индуктор HSP, антистрессовый агент и регулятор автономной нервной системы. Кроме того, задачей настоящего изобретения является получение пищевых продуктов и напитков, обладающих очень высокой индуцирующей HSP активностью, антистрессовым действием и регуляторным действием в отношении автономной нервной системы. Кроме того, задачей настоящего изобретения является разработка способа получения гидроксиметилфурфурального производного, который может снижать стоимость и является простым и удобным.
Решение поставленной задачи
Настоящая задача решается с помощью гидроксиметилфурфурального производного, которое является первым вариантом осуществления изобретения, представленного общей формулой
[формула 1]
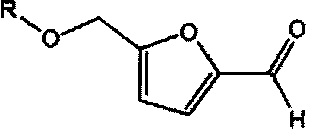
(в которой R выбран из группы, состоящей из следующих радикалов: радикала формулы (I)
[формула 2]

(II) HOOCCH2COCO-, (III) HOOCCH2CH2COCO- и (IV) атома водорода).
Вышеуказанное гидроксиметилфурфуральное производное можно получать тепловой обработкой стебля спаржи с использованием горячей воды.
Фармацевтическое средство, которое представляет собой второй вариант осуществления настоящего изобретения, содержит вышеуказанное гидроксиметилфурфуральное производное в качестве действующего вещества.
Индуктор белка теплового шока, который представляет собой третий вариант осуществления настоящего изобретения, содержит вышеуказанное гидроксиметилфурфуральное производное в качестве действующего вещества.
Антистрессовый агент, который представляет собой четвертый вариант осуществления настоящего изобретения, содержит вышеуказанное гидроксиметилфурфуральное производное в качестве действующего вещества.
Регулятор автономной нервной системы, который представляет собой пятый вариант осуществления настоящего изобретения, содержит вышеуказанное гидроксиметилфурфуральное производное в качестве действующего вещества.
Пищевой продукт или напиток, который представляет собой шестой вариант осуществления настоящего изобретения, отличается тем, что содержит вышеуказанный индуктор белка теплового шока, вышеуказанный антистрессовый агент или вышеуказанный регулятор автономной нервной системы.
Седьмым вариантом осуществления настоящего изобретения является способ получения гидроксиметилфурфурального производного, отличающийся тем, что он включает стадию тепловой обработки стебля спаржи с использованием горячей воды.
Вышеуказанный способ получения может предусматривать стадию ферментативной обработки.
Индуктор белка теплового шока, который представляет собой восьмой вариант осуществления настоящего изобретения, содержит продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, в качестве действующего вещества.
Антистрессовый агент, который представляет собой девятый вариант осуществления настоящего изобретения, содержит продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, в качестве действующего вещества.
Регулятор автономной нервной системы, который представляет собой десятый вариант осуществления настоящего изобретения, содержит продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, в качестве действующего вещества.
Преимущества изобретения
Согласно настоящему изобретению можно получать новое гидроксиметилфурфуральное производное, обладающее высокой эффективностью фармацевтическое средство, индуктор HSP, антистрессовый агент и регулятор автономной нервной системы. Кроме того, можно получать пищу и напитки, обладающие очень высокой индуцирующей HSP активностью, антистрессовым действием и регуляторным действием в отношении автономной нервной системы. Кроме того, можно применять способ получения гидроксиметилфурфурального производного, который может снижать стоимость и является простым и удобным.
Краткое описание чертежей
На чертежах показано:
на фиг. 1 - данные об индуцирующей экспрессию мРНК HSP70 активности гидроксиметилфурфурального производного;
на фиг. 2 - данные об индуцирующей экспрессию мРНК HSP70 активности содержащего гидроксиметилфурфуральное производное продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой;
на фиг. 3 - данные об индуцирующей экспрессию белка HSP70 активности содержащего гидроксиметилфурфуральное производное продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, и продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой;
на фиг. 4 - данные об изменениях уровней липид-пероксидов в сыворотке крови после введения продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, при оценке на мышиной модели депривации сна;
на фиг. 5 - данные об изменениях концентрации кортикостерона в сыворотке крови после введения продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, при оценке на мышиной модели депривации сна;
на фиг. 6 - данные об изменениях частоты встречаемости утраты волосяного покрова после введения продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, при оценке на мышиной модели депривации сна;
на фиг. 7 - данные об изменениях уровня экспрессии белка HSP70 в желудке после введения продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, при оценке на мышиной модели депривации сна;
на фиг. 8 - данные об изменениях уровня экспрессии белка HSP70 в печени после введения продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, при оценке на мышиной модели депривации сна;
на фиг. 9 - данные об изменениях уровня экспрессии белка HSP70 в почке после введения продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, при оценке на мышиной модели депривации сна;
на фиг. 10 - данные об изменениях уровня экспрессии мРНК HSP70 после введения продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, при оценке на человеке;
на фиг. 11 - данные об изменениях баланса автономной нервной системы после введения продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, при оценке на человеке;
на фиг. 12 - данные об изменениях активности автономной нервной системы после введения продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, при оценке на человеке;
на фиг. 13 - данные об изменениях уровня экспрессии мРНК HSP70 после введения продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, при оценке на человеке;
на фиг. 14 - данные об изменениях баланса автономной нервной системы после введения продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, при оценке на человеке; и
на фиг. 15 - данные об изменениях активности автономной нервной системы после введения продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, при оценке на человеке.
Описание вариантов осуществления изобретения
Ниже подробно описаны варианты осуществления настоящего изобретения.
1. Гидроксиметилфурфуральное производное
Гидроксиметилфурфуральное производное, представленное в настоящем описании, имеет указанную ниже общую формулу,
[формула 3]

В указанной выше общей формуле R выбирают из группы, состоящей из следующих радикалов: радикала формулы (I)
[формула 4]

(II) НООССН2СОСО- и (III) НООССН2СН2СОСО-, и (IV) атома водорода.
В случаях, когда R имеет указанную выше формулу (I), гидроксиметилфурфуральное производное имеет указанную ниже структурную формулу.
[формула 5]

В случаях, когда R имеет указанную выше формулу (I), гидроксиметилфурфуральное производное может находиться в форме двух следующих стереоизомеров (R-форма и S-форма).
[формула 6]

В случаях, когда R обозначает атом водорода (IV), гидроксиметилфурфуральное производное имеет следующую структурную формулу (название соединения: гидроксиметилфурфураль).
[формула 7]

Гидроксиметилфурфуральное производное, представленное в настоящем изобретении, можно получать, как это будет описано ниже, путем тепловой обработки стебля спаржи с использованием горячей воды.
Гидроксиметилфурфуральное производное, представленное в настоящем описании, как будет продемонстрировано ниже, обладает очень высокой индуцирующей активностью в отношении белка теплового шока, антистрессовым действием и регуляторным действием в отношении автономной нервной системы.
2. Способ получения гидроксиметилфурфурального производного
Способ получения гидроксиметилфурфурального производного, представленного в настоящем описании, заключается в том, что осуществляют стадию тепловой обработки стебля спаржи с использованием горячей воды.
В контексте настоящего описания фраза «тепловая обработка с использованием горячей воды» означает, что тепловую обработку осуществляют в горячей воде. В качестве стебля спаржи, указанного в настоящем описании, можно использовать часть стебля, например, зеленой спаржи, белой спаржи, лиловой спаржи или т.п. Кроме того, происхождение спаржи не имеет решающего значения; и можно использовать, как выращенную в местных условиях, так и импортированную спаржу. Поскольку спаржа представляет собой растение, позволяющее реализовывать действия, указанные в настоящем описании, то спаржу можно выбирать в качестве соответствующего растения.
Стадию тепловой обработки стебля спаржи с использованием горячей воды осуществляют, например, добавляя к стеблю спаржи от 1 до 50 объемов воды и выдерживая в горячей воде в течение от 20 до 180 мин. В этом случае температура составляет предпочтительно от 50 до 300°C. В тех случаях, когда тепловую обработку осуществляют при атмосферном давлении, предпочтительно, чтобы температура составляла, например, 100°C или более. Следует отметить, что тепловую обработку с использованием горячей воды можно осуществлять под давлением, и давление предпочтительно составляет, например, от 0,1 до 0,2 МПа (например, 0,12 МПа в тех случаях, когда используют автоклав).
Как указано выше, гидроксиметилфурфуральное производное, представленное в настоящем описании, получают тепловой обработкой стебля спаржи с использованием горячей воды. Таким образом, способ получения гидроксиметилфурфурального производного, представленного в настоящем описании, заключается в том, что осуществляют стадию тепловой обработки стебля спаржи с использованием горячей воды. При применении указанного способа получения благодаря тому, что в нем используют стеблевую часть спаржи, которая широко распространена в качестве овощной культуры, гидроксиметилфурфуральное производное можно получать с низкими затратами. Кроме того, гидроксиметилфурфуральное производное можно получать просто и удобно путем тепловой обработки спаржи с использованием горячей воды без применения усложненных методов, специальных устройств или т.п.Кроме того, поскольку спаржу, которая представляет собой пищевой продукт, подвергают тепловой обработке с использованием горячей воды, то можно считать, что гидроксиметилфурфуральное производное, полученное с помощью указанного способа получения, отличается высокой безопасностью; и может происходить стерилизация стебля спаржи, поскольку подвергается действию горячей воды. Следует отметить, что, если способ тепловой обработки с использованием горячей воды позволяет реализовывать действия, указанные в настоящем описании, то его можно выбирать в качестве соответствующего способа.
С целью повышения эффективности стадии тепловой обработки с использованием горячей воды для эффективного производства гидрокеиметилфурфуральных производных, способ получения гидроксиметилфурфурального производного, представленного в настоящем описании, может включать дополнительные стадии, проиллюстрированные ниже.
Примеры указанной выше дополнительной стадии могут включать стадию мелкой нарезки стеблей спаржи перед тепловой обработкой с использованием горячей воды. Стебель спаржи можно мелко нарезать с получением кусочков размером примерно от 0,5 до 10 см. Мелкую нарезку можно осуществлять вручную с использованием, например, ножа, резака или т.п., или машины, например, можно использовать резательную машину или мельницу. Если способ мелкой нарезки позволяет реализовывать действия, указанные в настоящем описании, то его можно выбирать в качестве соответствующего способа.
Примеры указанной выше дополнительной стадии могут включать стадию прессования стеблей спаржи перед тепловой обработкой с использованием горячей воды. Стебель спаржи можно прессовать, например, с помощью компрессора. Если способ прессования позволяет реализовывать действия, указанные в настоящем описании, то его можно выбирать в качестве соответствующего способа.
Примеры указанной выше дополнительной стадии включают стадию ферментативной обработки для разрушения тканей растения или т.п., осуществляемую перед тепловой обработкой с использованием горячей воды. Ферментативная обработка ферментом повышает эффективность стадии тепловой обработки с использованием горячей воды, что позволяет более эффективно получать гидроксиметилфурфуральные производные. Например, можно применять такой фермент как целлюлаза, гемицеллюлаза, пектиназа, амилаза или пуллуланаза; или комбинацию двух, трех или большего количества указанных ферментов, для эффективного расщепления волокон, пектина или и.п.а стебле спаржи. Если фермент позволяет реализовывать действия, указанные в настоящем описании, то его можно выбирать в качестве соответствующего фермента. На стадии ферментативной обработки можно выбирать количество, необходимое для добавления, температуру и продолжительность реакции, наиболее соответствующие ферменту, который следует применять. В случаях, когда используют целлюлазу, ферментативную обработку можно осуществлять, например, добавляя целлюлазу в количестве от 0,1 до 5 мас. %, при температуре от 30 до 60°C в течение от 1 до 72 ч. Стадию ферментативной обработки можно осуществлять перед стадией тепловой обработки с использованием горячей воды или можно осуществлять после стадии тепловой обработки с использованием горячей воды. Следует отметить, что с позиции эффективности расщепления стебля спаржи целлюлазой с целью более эффективного получения гидроксиметилфурфурального производного предпочтительно осуществлять ферментативную обработку целлюлазой после стадии тепловой обработки с использованием горячей воды. Если способ ферментативной обработки позволяет реализовывать действия, указанные в настоящем описании, то его можно выбирать в качестве соответствующего способа.
Примеры указанной выше дополнительной стадии включают стадию механического измельчения остатков после тепловой обработки с использованием горячей воды. Для измельчения можно применять, например, такое устройство, как мельница или блендер. Если способ измельчения позволяет реализовывать действия, указанные в настоящем описании, то его можно выбирать в качестве соответствующего способа.
Примеры указанной выше дополнительной стадии включают стадию центрифугирования или фильтрации после тепловой обработки с использованием горячей воды. Кроме того, включение указанных стадий позволяет эффективно удалять остаток с получением обработанной нагреванием жидкости. Центрифугирование можно осуществлять, например, со скоростью вращения от 3000 до 7000 об/мин при 4-50°C. Для фильтрации можно применять, например, поступающие в продажу фильтровальную бумагу, фильтровальную ткань или т.п. Если способ центрифугирования или способ фильтрации позволяет реализовывать действия, указанные в настоящем описании, то его можно выбирать в качестве соответствующего способа.
Примеры указанной выше дополнительной стадии включают стадию концентрирования полученной тепловой обработки жидкости при пониженном давлении после тепловой обработки с использованием горячей воды. Концентрирование можно осуществлять, например, с помощью испарителя или т.п. Если способ концентрирования позволяет реализовывать действия, указанные в настоящем описании, то его можно выбирать в качестве соответствующего способа.
Примеры указанной выше дополнительной стадии включают стадию распылительной сушки или сушки вымораживанием полученной путем нагревания жидкости после тепловой обработки с использованием горячей воды. Распылительную сушку можно осуществлять, например, при температуре выпускаемого воздуха от 70 до 90°C и температуре в камере от 80 до 100°C. Если способ распылительной сушки или способ сушки вымораживанием позволяет реализовывать действия, указанные в настоящем описании, то его можно выбирать в качестве соответствующего способа.
С помощью проиллюстрированных выше дополнительных стадий, применяемых помимо стадии тепловой обработки стебля спаржи с использованием горячей воды, можно более эффективно получать гидроксиметилфурфуральное производное. Если дополнительная стадия позволяет реализовывать действия, указанные в настоящем описании, то ее можно выбирать в качестве соответствующей стадии.
Ниже проиллюстрирована стадия тепловой обработки стебля спаржи с использованием горячей воды. Стебель спаржи мелко нарезают на кусочки размером примерно от 0,5 до 10 см и добавляют от 1 до 50 объемов воды. Тепловую обработку с использованием горячей воды осуществляют при 50-100°C или 121°C под давлением в течение от 20 до 180 мин. К полученному продукту после охлаждения добавляют целлюлазу в концентрации от 0,1 до 5 мас. %; ферментативную обработку осуществляют при 30-60°C в течение периода времени от 1 до 72 ч. Затем остатки механически измельчают и центрифугируют со скоростью вращения от 3000 до 7000 об/мин при 4-50°C с получением супернатанта. Затем указанный супернатант подвергают распылительной сушке при температуре выпускаемого воздуха от 70 до 90°C и температуре в камере от 80 до 100°C.
В контексте настоящего описания понятие «продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды» относится к продукту, полученному тепловой обработкой стебля спаржи в горячей воде, из которого затем удалены остатки с помощью центрифугирования, фильтрации или т.п. с последующим концентрированием. Кроме того, в контексте настоящего описания понятие «продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой» относится к продукту, полученному тепловой обработкой стебля спаржи с использованием горячей воды, который проходит описанную выше стадию ферментативной обработки до или после тепловой обработки с использованием горячей воды. Продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, и продукт, полученный с помощью тепловой обработки стебля спаржи с использованием горячей воды и ферментативной обработки, содержит в качестве действующего вещества вышеуказанное гидроксиметилфурфуральное производное в количестве, например, по меньшей мере 0,05% или более.
Гидроксиметилфурфуральное производное, полученное с помощью способа получения, представленного в настоящем описании, можно фракционировать, например, путем растворения продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, в воде или органическом растворителе (таком как метанол) и подвергать хроматографии на открытых колонках с носителем с обращенной фазой (например, DIAION НР-20 (торговое название) (фирма-производитель Mitsubishi Chemical Corporation) или т.п.). Его можно, например, фракционировать с использованием носителя для гель-фильтрации (например, Сефадекс LH-20 (торговое название) (фирма-производитель Pharmacia Fine Chemicals) или т.п.). Кроме того, предварительно определенную фракцию, элюированную с помощью вышеописанного метода, можно очищать, например, путем выделения с использованием жидкостной хроматографии высокого разрешения (ЖХВР).
Не вдаваясь в какую-либо конкретную теорию, можно предположить, что при тепловой обработке стебля спаржи с использованием горячей воды согласно описанному выше способу органические кислоты и сахара, выделяющиеся из стебля спаржи, взаимодействуют при высоких температурах с образованием гидроксиметилфурфурального производного, представленного с настоящем описании. Примерами органических кислот являются пироглутаминовая кислота, α-кетоглутаровая кислота и щавелевоуксусная кислота. А примерами Сахаров являются фруктоза, глюкоза, сахароза или манноза.
Например, предполагается, что на стадии тепловой обработки стебля спаржи с использованием горячей воды пироглутаминовая кислота и фруктоза, выделяющиеся из стебля спаржи, взаимодействуют при высоких температурах с образованием указанного ниже соединения.
[формула 8]

В способе получения гидроксиметилфурфурального производного, представленного в настоящем описании, при необходимости можно использовать растения, отличные от спаржи, а именно, растения, которые содержат указанные выше органическую кислоту и сахар. Например, предпочтительно можно использовать овощные культуры, которые содержат пироглутаминовую кислоту и фруктозу. Можно применять, например, такие овощные культуры как капуста, брокколи, тыква, лук, чеснок или морковь. Если растение позволяет реализовывать действия, указанные в настоящем описании, то его можно выбирать в качестве соответствующего растения.
3. Индуктор HSP, антистрессовый агент и регулятор автономной нервной системы
В настоящем описании представлены индуктор HSP, антистрессовый агент и регулятор автономной нервной системы, которые содержат гидроксиметилфурфуральное производное, указанное в настоящем описании, в качестве действующего вещества.
Индуктор HSP, указанный в настоящем описании, можно применять для индукции HSP, который присутствует in vivo или in vitro. В контексте настоящего описания HSP представляет собой, например, HSP70, HSP10, HSP27, HSP40, HSP60, HSP90, HSP110 или т.п., при этом HSP70 является предпочтительным. Индуцирующую HSP активность можно оценивать, например, путем культивирования клеток, к которым добавлен указанный индуктор HSP, и измерения с помощью известного метода индуцирующей активности в отношении экспрессии мРНК HSP, индуцирующей активности в отношении экспрессии белка HSP или т.п. Если метод оценки позволяет реализовывать действия, указанные в настоящем описании, то его можно выбирать в качестве соответствующего метода.
Антистрессовый агент, указанный в настоящем описании, можно вводить в живой организм, обеспечивая тем самым антистрессовое действие. Антистрессовое действие можно оценивать, например, путем введения указанного антистрессового агента млекопитающему и оценки показателя окислительного стресса, концентрации гормона стресса в крови или т.п. до и после введения. Если метод оценки позволяет реализовывать действия, указанные в настоящем описании, то его можно выбирать в качестве соответствующего метода.
Регулятор автономной нервной системы, указанный в настоящем описании, можно вводить живым организмам, обеспечивая тем самым регуляторное действие в отношении автономной нервной системы. Регуляторное действие в отношении автономной нервной системы можно оценивать, например, путем введения указанного регулятора автономной нервной системы млекопитающим и оценки баланса автономной нервной системы, активности автономной нервной системы или т.п. до и после введения. Если метод оценки позволяет реализовывать действия, указанные в настоящем описании, то его можно выбирать в качестве соответствующего метода.
Кроме того, в настоящем описании представлены также индуктор HSP, антистрессовый агент, регулятор автономной нервной системы, которые содержат в качестве действующего вещества продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды. Указанный продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, получают согласно описанному выше способу тепловой обработки стебля спаржи с использованием горячей воды. Таким образом, гидроксиметилфурфуральное производное, представленное в настоящем описании, входит в продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды.
4. Пищевые продукты и напитки и фармацевтические средства В настоящем описании представлены пищевые продукты и напитки, которые содержат индуктор HSP, антистрессовый агент и регулятор автономной нервной системы, указанные в настоящем описании. Указанные пищевые продукты и напитки можно подвергать технологической обработке общепринятым методом с получением формы, пригодной для поедания и питья, включая, например, форму гранулы, форму состоящего из частиц продукта, таблеток, капсул, форму геля, форму крема, форму пасты, форму суспензии, форму водного раствора, форму эмульсии и форму порошка. Кроме того, можно добавлять эксципиенты, связующие вещества, замасливатели, красители, разрыхлители, загустители, консерванты, стабилизаторы, регуляторы значения рН или т.п., которые являются общепринятыми для пищевых продуктов и напитков. Кроме того, с целью повышения вкусовых качеств можно добавлять сахара, сахарные спирты, соли, жиры и масла, аминокислоты, органические кислоты, глицерин или т.п. в количествах, не ухудшающих действия, указанные в настоящем описании. Следует отметить, что в случаях, когда индуктор HSP, антистрессовый агент и регулятор автономной нервной системы, указанные в настоящем описании, добавляют к существующим пищевым продуктам и напиткам, то можно выбирать соответствующие пищевые продукты и напитки в качестве основы пищевых продуктов и напитков, если пищевые продукты и напитки позволяют реализовывать действия, указанные в настоящем описании.
В тех случаях, когда индуктор HSP, антистрессовый агент и регулятор автономной нервной системы, указанные в настоящем описании, применяют в качестве пищевого продукта или напитка, то пищевой продукт или напиток можно потреблять в количестве, например, от 50 до 2000 мг/день и предпочтительно от 100 до 1000 мг/день, в пересчете на продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды (или продукт, полученной тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой), который применяют для достижения требуемой индуцирующей активности в отношении HSP, антистрессового действия и регуляторного действия на автономную нервную систему. Принимаемое внутрь количество можно выбирать соответственно на основе подлежащей поглощению субстанции, формы пищевого продукта или напитка или т.п.
Пищевые продукты и напитки, указанные в настоящем описании, обладают как антистрессовым действием, так и регуляторным действием на автономную нервную систему. При этом ожидается, что антистрессовое действие и регуляторное действие на автономную нервную систему обладают синергетической активностью, обеспечивая более высокое воздействие на нарушения автономной нервной системы, вызванные стрессовой нагрузкой. Кроме того, ожидается, что регуляторное действие на автономную нервную систему обеспечивает также воздействие на нарушения автономной нервной системы, которые не обусловлены стрессовыми нагрузками.
Индуктор HSP, антистрессовый агент и регулятор автономной нервной системы, указанные в настоящем описании, можно применять в качестве фармацевтических средств. Фармацевтическое средство, указанное в настоящем описании, содержит в качестве действующего вещества гидроксиметилфурфуральное производное. В этом случае фармацевтическое средство можно приготавливать общепринятым методом в виде лекарственной формы, например, таблеток, гранул, порошков, капсул, сиропов и растворов для инъекции. Кроме того, можно добавлять эксципиенты, связующие вещества, замасливатели, красители, разрыхлители, загустители, консерванты, стабилизаторы, регуляторы значения рН или т.п., которые являются общепринятыми для фармацевтических средств. Метод введения можно выбирать соответственно таким образом, чтобы он позволял реализовывать действия, указанные в настоящем описании, указанный метод включает оральное введение, внутривенное введение, внутрибрюшинное введение, внутрикожное введение и подъязычное введение.
В тех случаях, когда индуктор HSP, антистрессовый агент и регулятор автономной нервной системы, указанные в настоящем описании, применяют в качестве фармацевтического средства, фармацевтическое средство можно вводить, например, в дозе от 50 до 2000 мг/день и предпочтительно от 100 до 1000 мг/день, в пересчете на продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды (или продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой), который применяют для достижения требуемой индуцирующей активности в отношении HSP, антистрессового действия и регуляторного действия на автономную нервную систему. Дозу можно выбирать соответственно на основе подлежащей введению субстанции, лекарственной формы, возраста и веса тела пациента или т.п.
Примеры
Ниже настоящее изобретение описано более конкретно с помощью примеров. Однако настоящее изобретение не ограничено указанными примерами.
Пример 1
Получение гидроксиметилфурфураля путем тепловой обработки стебля спаржи с использованием горячей воды
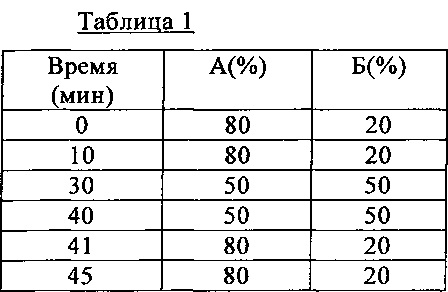
К зеленым стеблям спаржи (масса свежего продукта 1,5 кг) добавляли 1,5 л воды; и смесь, предназначенную для тепловой обработки с использованием горячей воды, автоклавировали (121°C, 20 мин) с помощью автоклава и фильтровали через фильтровальную ткань. Полученную жидкость концентрировали при пониженном давлении в испарителе с получением продукта после тепловой обработки. Полученный тепловой обработкой продукт фракционировали с помощью колоночной хроматографии (торговое название: DIAION НР-20, фирма-производитель Mitsubishi Chemical Corporation; 500 мл, элюция; Н2О, 50% метанола, 100% метанола), выход составлял 1,7 г. Затем полученный фракционированием продукт очищали с помощью препаративной ЖХВР (торговое название: Hitachi L-7100, фирма-производитель Hitachi Ltd.) с получением соединения (X) (5,0 мг). Применяли колонку с торговым названием: CAPCELL РАК С18 UG 120, 20 ϕ × 250 мм (фирма-производитель Shiseido Co., Ltd.); а подвижная фаза указана в таблице 1 (А: Н2О, Б: метанол). Скорость потока при осуществлении препаративной ЖХВР составляла 8 мл/мин и определение осуществляли с помощью детектора поглощения ультрафиолетового излучения при длине волны детекции 280 нм.
Ниже представлены данные ЯМР-спектроскопии для соединения (X), полученные с помощью описанного выше метода.
1H-ЯМР (400 МГц, DMSO-d6)
δ 4,49 (1Н, dd, J=5,2 Гц),
5,59 (1H, dt, J=5,6 Гц),
6.55 (1H, d, J=3,6 Гц),
7,48 (1H, d, J=3,6 Гц),
9,52 (1H, s);
13С-ЯМР (100 МГц, DMSO-d6)
δ 55,9,
109,7,
124,5,
151,7,
162,1,
178,0.
Для определения структуры полученного согласно описанному выше методу соединения (X) данные ЯМР-спектроскопии поступающего в продажу гидроксиметилфурфураля (торговое название: 5-гидроксиметил-2-фуральдегид, фирма Tokyo Chemical Hanbai Co., Ltd.) сравнивали с данными для соединения (X). Ниже представлены данные ЯМР-спектроскопии поступающего в продажу гидроксиметилфурфураля.
1Н-ЯМР(400 МГц, DMSO-d6)
δ 4,51 (1H, dd, J=5,2 Гц),
5.59 (1H, dt, J=5,6 Гц),
6.60 (1H, d, J=3,6 Гц),
7,49 (1H, d, J=3,6 Гц),
9.56 (1H, s);
13C-ЯМР (100 МНц, DMSO-d6)
δ 55,9,
109,7,
124,4,
151,7,
Поскольку данные ЯМР-спектроскопии полученного с помощью описанного выше метода соединения (X) соответствуют данным, полученным для поступающего в продажу продукта, это свидетельствует о том, что соединение (X) представляет собой гидроксиметилфурфураль (имеющий представленную ниже структурную формулу). Из вышеизложенного очевидно, что гидроксиметилфурфураль входит в состав продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды.
[формула 9]

Пример 2
Получение нового гидроксиметилфурфурального производного тепловой обработкой стебля спаржи с использованием горячей воды
К зеленым стеблям спаржи (масса свежего продукта 1,0 кг) добавляли 1 л воды; и смесь для тепловой обработки с использованием горячей воды автоклавировали (121°С, 20 мин) с помощью автоклава и фильтровали через фильтровальную ткань. Полученную жидкость концентрировали при пониженном давлении в испарителе с получением продукта после тепловой обработки. Полученный тепловой обработкой продукт фракционировали с помощью колоночной хроматографии (торговое название: DIAION НР-20, фирма-производитель Mitsubishi Chemical Corporation; 500 мл, элюция; H2O, 30% метанола, 100% метанола). Затем полученный фракционированием продукт массой 723,8 мг очищали с помощью колоночной хроматографии (торговое название: Сефадекс LH-20, фирма-производитель Pharmacia Fine Chemicals; 250 мл, элюция; Н2О). Затем полученный фракционированием продукт массой 12,6 мг очищали с помощью препаративной ЖХВР (торговое название: Hitachi L-7100, фирма-производитель Hitachi Ltd.) с получением соединения (Y) (2,0 мг).
Использовали такие же условия препаративной ЖХВР, что и указанные в примере 1.
Полученное согласно описанному выше методу соединение (Y), подвергали ЖХВР-анализу (торговое название: Hitachi L-7100, фирма-производитель Hitachi Ltd.) и было установлено, что время удерживания составляло 22,99 мин. Для осуществления указанной аналитической ЖХВР использовали колонку с торговым названием: CAPCELL РАК Cl8 UG 120, 4.6 ϕ × 250 мм (фирма-производитель Shiseido Co., Ltd.); а подвижная фаза указана в таблице 2 (В: 20 мМ натрий-фосфатный буфер (рН 2,3), Г: ацетонитрил). Скорость потока при осуществлении аналитической ЖХВР составляла 1 мл/мин, и определение осуществляли с помощью детектора поглощения ультрафиолетового излучения при длине волны детекции 280 нм.

Ниже представлены данные ЖХ/Tof-МС-анализа соединения (Y), полученного с помощью описанного выше метода
Обнаружено: m/z 238,0710 ([М+Н]+); C11H12NO5
Теоретическое значение: m/z 238,0715 ([М+Н]+); C11H12NO5.
Из приведенных выше данных очевидно, что полученное с помощью указанного выше метода соединение (Y) имеет молекулярную формулу C11H11NO5.
Ниже представлены данные1H-ЯМР-спектроскопии соединения (Y), полученного с помощью указанного выше метода.
1H-ЯМР(400 МНц, CD3OD)
δ 2,00 (4Н, m),
4,20 (1H, dd, J=3,9, 9,2 Гц),
5,20 (2Н, s),
6,55 (1H, d, 5=3,6 Гц),
7,37 (1H, d, J=3,6 Гц),
9,45 (1H, s).
Пример 3
Синтез нового гидроксиметилфурфурального производного Установлено, что соединение (Y) (C11H11NO5), полученное согласно методу, описанному в примере 2, образовывалось в результате взаимодействия пироглутаминовой кислоты (C5H7NO3) и фруктозы (С6Н12О6), выделявшихся из стебля спаржи при нагревании. Для подтверждения этого синтезировали соединение с помощью изложенного ниже метода, используя пироглутаминовую кислоту и фруктозу. Следует отметить, что поскольку могут присутствовать указанные ниже стререоизомеры, вероятно, что соединение (Y) можно синтезировать в S(L)-форме и R(D)-форме при использовании в качестве исходного продукта L-пироглутаминовой кислоты и использовании в качестве исходного продукта D-пироглутаминовой кислоты соответственно,
[формула 10]

Смешивали 3,0 г L-пироглутаминовой кислоты (торговое название: L-пироглутаминовая кислота, фирма Tokyo Chemical Hanbai Co., Ltd.) и 1,5 г D-фруктозы (торговое название: D(-)-фруктоза, фирма Junsei Chemical Co., Ltd.) в колбе Эрленмейера и автоклавировали (121°C, 20 мин) с помощью автоклава. Полученный в результате реакции продукт фракционировали с помощью колоночной хроматографии (торговое название: DIAION НР-20, фирма-производитель Mitsubishi Chemical Corporation; 150 мл, элюция; H2O, 30% метанола, 100% метанола). Затем полученную с использованием 100% метанола фракцию очищали с помощью препаративной колоночной ЖХВР (торговое название колонки: CAPCELL PAK C18 UG 120, 20 ϕ × 250 мм, фирма-производитель Shiseido Co., Ltd.) с получением S-формы соединения (Ζ) (24,4 мг). Использовали те же условия препаративной ЖХВР, что и указанные в примере 1.
Смешивали 2,0 г D-пироглутаминовой кислоты (торговое название: D-пироглутаминовая кислота, фирма Tokyo Chemical Hanbai Co., Ltd.) и 1,0 г D-фруктозы (торговое название: D(-)-фруктоза, фирма Junsei Chemical Co., Ltd.) в колбе Эрленмейера и автоклавировали (121°C, 20 мин) с помощью автоклава. Полученный в результате реакции продукт фракционировали с помощью колоночной хроматографии (торговое название: DIAION НР-20, фирма-производитель Mitsubishi Chemical Corporation; 100 мл, элюция; H2O, 30% метанола, 60% метанола). Полученную с использованием 60% метанола фракцию концентрировали при пониженном давлении с помощью испарителя до объема, составляющего примерно 50 мл, а затем разделяли с использованием этилацетата (50 мл × 5). Этилацетатный слой концентрировали при пониженном давлении с помощью испарителя и фракционировали с использованием колоночной хроматографии (торговое название: DIAION НР-20, фирма-производитель Mitsubishi Chemical Corporation; 10 мл, элюция; Н2О, 30% метанола, 60% метанола). Полученную с использованием 60% метанола фракцию концентрировали при пониженном давлении с помощью испарителя с получением R-формы соединения (Z) (24,6 мг).
Полученные с помощью описанного выше метода S-форму и R-форму соединения (Z) подвергали ЖХВР-анализу (торговое название: Hitachi L-7100, фирма-производитель Hitachi Ltd.), и в результате было установлено, что время удерживания каждого соединения составляло 22,89 мин. Использовали те же условия препаративной ЖХВР, что и указанные в примере 2.
Ниже представлены МС-данные и данные ЯМР-анализа полученных согласно указанному выше методу S-формы и R-формы соединений (Z) приведены ниже.
EI-MC: m/z 237,
EI-HR-MC: m/z 237,0612; C11H11NO5,
1Н-ЯМР (400 МГц, CD3OD): S-форма
δ 2,33 (4Н, m),
4,34 (1Н, dd, J=3,9, 9,0 Гц),
5,51 (2Н, s),
6,73 (1Н, d, J=3,4 Гц),
7,38 (1H, d, J=3,4 Гц),
9,57 (1H, s).
13С-ЯМР(100 МГц, CD3OD): S-форма
δ 25,8,
30,2,
57,0,
59,6,
114,0,
124,0,
154,5,
156,7,
173,4,
179,6,
181,1.
1Н-ЯМР(400 МГц, CD3OD): R-форма
δ 2,33 (4Η, m),
4,34 (1H, dd, J=3,9, 9,0 Гц),
5,27 (2H, s),
6,73 (1H, d, J=3,6 Гц),
7,38 (1H, d, J=3,6 Гц),
9,57 (1H, s).
13С-ЯМР (100 МГц, CD3OD): R-форма
δ 25,8,
30,3,
57,0,
59,6,
113,7,
124,0,
154,5,
156,8,
173,4,
179,6,
181,1.
Для определения абсолютной структуры соединения (Y), полученного согласно методу, описанному в примере 2, соединение (Y), полученное согласно 5 методу описанному в примере 2, S-форму соединения (Z) и R-форму соединения (Z), обе полученные согласно описанному выше методу, подвергали ЖХВР-анализу (торговое название: Hitachi L-7100, фирма-производитель Hitachi Ltd.), используя хиральную колонку (торговое название: CHIRAL РАК IA, 4.6 ϕ × 150 мм, фирма-производитель Daicel Corporation). Использовали такие же условия 10 аналитической ЖХВР, что и указанные в примере 2, за исключением того, что применяли другую колонку. В результате установлено, что время удерживания S-формы соединения (Z) составляло 18,92 мин, а время удерживания R-формы соединения (Z) составляло 20,57 мин. Поскольку время удерживания соединения (Y), полученного согласно методу, описанному в примере 2, составляло 19,06 15 мин, то очевидно, что соединение (Y), полученное согласно методу, описанному в примере 2, представляло собой S-форму.
При сравнении результатов ЖХВР-анализа, MC/Tof МС-анализа и1H-ЯМР-данных, представленных в примере 2, с приведенными выше в этом примере результатами анализов, установлено, что соединение (Y), полученное согласно 20 методу, описанному в примере 2, и соединение (Z), полученное согласно методу, описанному в данном примере, являются идентичными соединениями. Таким образом, очевидно, что продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, т.е. продукт, полученный с помощью метода, указанного в примере 2, по меньшей мере содержит S-форму 25 гидроксиметилфурфурального производного, которое имеет представленную ниже структурную формулу,
[формула 11]

Пример 4
Оценка индуцирующей активности в отношении экспрессии мРНК HSP70 Индуцирующую активность в отношении HSP70 поступающего в продажу гидроксиметилфурфураля (описанного в примере 1) (далее в контексте настоящего описания обозначен как образец 1), S-формы гидроксиметилфурфурального производного, синтезированного согласно методу, описанному в примере 3 (далее в контексте настоящего описания обозначено как 2-S), и R-формы гидроксиметилфурфурального производного, синтезированного согласно методу, описанному в примере 3 (далее в контексте настоящего описания обозначено как 2-R), и продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, который получали с помощью изложенного ниже метода (далее в контексте настоящего описания обозначен как образец 3), и продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой (далее в контексте настоящего описания обозначен как образец 4), оценивали на основе измерения уровня экспрессии мРНК HSP70.
Ниже изложен метод получения образца 3. К зеленым стеблям спаржи (масса свежего продукта 6,63 кг) добавляли 28,5 л воды; и с целью тепловой обработки с использованием горячей воды смесь автоклавировали (121°C, 20 мин). После охлаждения осуществляли фильтрацию с помощью фильтровальной бумаги (торговое название: Toyo Roshi No. 5А, фирма-производитель Toyo Roshi Kaisha, Ltd.); и осуществляли концентрирование с использованием испарителя. Примерно к 10 л сконцентрированной жидкости добавляли 275,4 г эксципиента (торговое название: Pinedex, фирма-производитель Matsutani Chemical Industry Co., Ltd.) и образовавшуюся смесь сушили вымораживанием с получением 542,4 г порошка, который содержал продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды (в этом варианте количество продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды из твердого содержимого стебля спаржи, составляло 267,0 г, а количество эксципиента составляло 275,4 г).
Ниже изложен метод получения образца 4. К зеленым стеблям спаржи (масса свежего продукта 12 кг) добавляли 24 л воды; и с целью тепловой обработки с использованием горячей воды смесь автоклавировали (121°C, 20 мин). Продукту давали охладиться до 45°C, к нему добавляли 20 г сукразы С (торговое название) (фирма-производитель Mitsubishi-Kagaku Foods Corporation) и 20 г мацерозима А (торговое название) (фирма-производитель Yakult Phamaceutical Industry Co., Ltd.); и ферментативную обработку осуществляли при 45°C в течение 3 дней. Затем осуществляли автоклавирование (121°C, 20 мин) и проводили фильтрацию с использованием фильтровальной ткани с получением 35 л фильтрата. Концентрирование осуществляли с помощью испарителя до достижения объема 9 л. К указанной сконцентрированной жидкости добавляли 1,20 кг эксципиента (торговое название: Pinedex, фирма-производитель Matsutani Chemical Industry Co., Ltd.); и образовавшуюся смесь вновь автоклавировали (121°C, 20 мин). Затем осуществляли сушку вымораживанием с получением 2,12 кг порошка, который содержал продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой (в этом варианте количество продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой из твердого содержимого стебля спаржи, составляло 0,92 кг, а количество эксципиента составляло 1,20 кг).
Сначала уровень экспрессии мРНК HSP70 в присутствии образца 1, образца 2-S и образца 2-R оценивали с использованием клеток промиелоцитической лейкемии человека (клетки HL-60).
Ниже описан метод оценки уровня экспрессии мРНК HSP70 с использованием клеток промиелоцитической лейкемии человека (клетки HL-60). Клетки HL-60 (получены от фирмы Dainippon Pharmaceutical Co., Ltd.) суспендировали в среде RPMI1640 (торговое название: КРМИ640-среда «NISSUI» (2), порошкообразная, фирма-производитель Nissui Pharmaceutical Co., Ltd.), дополненной 10% фетальной бычьей сыворотки (FBS) (торговое название: MultiSer, фирма-производитель Thermo Trace), и переносили в 1,5-миллилитровую пробирку для образца (500000 клеток/1 мл/пробирку). В этот же момент времени приготавливали по 0,1 мл каждого из образцов (образец 1, образец 2-S и образец 2-R) с использованием воды, полученной с помощью ионообменных адсорбентов, которую добавляли до достижения конечной концентрации 1 мг/мл. В качестве контроля использовали 0,1 мл полученной с помощью ионообменных адсорбентов воды. После культивирования при 37°C в присутствии 5% CO2 в течение 4 ч клетки собирали при 3000 об/мин и осуществляли определение мРНК. Из полученного продукта экстрагировали общую РНК с использованием реагента TRIzol (фирма-производитель Life Technologies Corporation) и концентрацию определяли с помощью устройства Nanodrop (фирма-производитель Thermo Fisher Scientific K.K.). Используя набор для синтеза кДНК (торговое название: ReverTra Асе qPCR RT Master Mix with gDNA Remover, фирма-производитель Toyobo Life Science), синтезировали кДНК. Реакционную жидкость после обратной транскрипции разводили свободной от нуклеаз водой до достижения концентрации 3 нг/мкл для применения в качестве матрицы для ПЦР в реальном времени.
Для ПЦР в качестве праймеров использовали «прямой» праймер HSP70 (SEQ ID NO: 1) и «обратный» праймер HSP70 (SEQ ID NO: 2). Применяли ген бета-2-микроглобулина в качестве внутреннего контрольного гена для коррекции экспрессии гена HSP70; и для него в качестве праймеров применяли «прямой» праймер бета-2-микроглубулина (SEQ ID NO: 3) и «обратный» праймер бета-2-микроглобулина (SEQ ID NO: 4). Осуществляли ПЦР в реальном времени, используя набор для реакции (торговое название: SsoAdvanced SYBR Green Supermix, фирма-производитель Bio-Rad Laboratories, Inc.), с помощью системы для ПЦР-анализа в реальном времени (торговое название: CFX Connect, фирма-производитель Bio-Rad Laboratories, Inc.). В целом 10 мкл жидкости для ПЦР-реакции подвергали трехминутной инкубации при 95°C (начальная денатурация), после чего осуществляли 40 повторяющихся циклов, каждый цикл включал денатурацию при 95°C в течение 1 с и отжиг при 59°C в течение 10 с.
Используя величину Cq, полученную с помощью указанной выше системы для ПЦР-анализа в реальном времени, рассчитывали относительный уровень экспрессии гена HSP70 с помощью приведенной ниже расчетной формулы (ΔΔCt-метод). Следует отметить, что величина Cq представляет собой количество реакционных циклов на момент времени, при котором уровень амплифицированного гена достигает определенного заранее установленного уровня в реакции амплификации гена.
Величина Cq для контрольного HSP70: А.
Величина Cq для контрольного В2М: В.
Величина Cq для HSP70 в образце: С.
Величина Cq для В2М в образце: D
ΔCq (контроль)=А-В
ΔCq (образец)=C-D
Δ(ΔCq)=ΔCq (образец)-ΔCq (контроль)
Относительный уровень экспрессии = 2-Δ(ΔCq).
Результаты представлены на фиг. 1. На фиг. 1 индуцирующую экспрессию мРНК HSP70 активность образца 1, образца 2-S и образца 2-R выражали в виде отношения (%) к активности контроля. По сравнению с контролем образцы 1, 2-S и 2-R обладали в 3-9 раз более высокой способностью повышать экспрессию мРНК HSP70 (образцы 2-S и 2-R, **р<0,01 при сравнении с контролем; образец 1, *р=0,069 при сравнении с контролем). Из полученных результатов следует, что гидроксиметилфурфураль и S-форма и R-форма
гидроксиметилфурфуральных производных, имеющих представленную ниже структурную формулу, обладали индуцирующей активностью в отношении HSP70 при оценке на уровне экспрессии мРНК.
формула 12

Затем уровень экспрессии мРНК HSP70 в присутствии образца 1, образца 3 и образца 4 оценивали с использованием клеток рака шейки матки человека (клетки HeLa).
Клетки рака шейки матки человека (клетки HeLa) (получены от: Incorporated administrative agency RIKEN, the Institute of Physical and Chemical Research, BioResource Center) суспендировали в модифицированной по методу Игла среде Дульбекко (DMEM) (торговое название: Dulbeccoʹs Modified Eagleʹs Medium "Nissui" 2, порошкообразная форма, фирма-производитель Nihon Pharmaceutical Co., Ltd.), дополненной 10% фетальной бычьей сыворотки (FBS) (торговое название: MultiSer, фирма-производитель Thermo Trace), и высевали в 6-луночный планшет (200000 клеток/2 мл/лунку). На следующий день среду заменяли свежей средой DMEM (1,8 мл); и добавляли 0,2 мл каждого из образцов, каждый из которых приготавливали с использованием воды, полученной с помощью ионообменных адсорбентов, которую добавляли до достижения конечной концентрации 1 мг/мл (касательно образцов 3 и 4 конечная концентрация 1 мг/мл дана в пересчете на продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, и на продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, из твердого содержимого стебля спаржи). В качестве контроля добавляли 0,2 мл полученной с помощью ионообменных адсорбентов воды. После культивирования в течение 22 ч клетки соскабливали с помощью скрепера для клеток и использовали для определения мРНК. Для этого общую РНК экстрагировали с помощью набора для экстракции РНК (торговое название набора: Fast Pure RNA kit, фирма-производитель Takara Bio Inc.),разводили в 100 раз с использованием обработанной DEPC (диэтилпирокарбонат) воды; и измеряли абсорбцию (при длине волны 260 нм) с помощью спектрофотометра. Концентрацию РНК рассчитывали с помощью расчетной формулы: абсорбция (при длине волны 260 нм) × 40 × фактор разведения = концентрация РНК (нг/мкл). Раствор РНК разводили до оптимальной концентрации с помощью ТЕ -буфера; и синтезировали кДНК с помощью набора для синтеза кДНК (торговое название набора: Prime Script 1st Strand cDNA synthesis kit, фирма-производитель Takara Bio Inc.). В качестве праймера использовали олиго дТ-праймер (торговое название: Oligo dT) (фирма-производитель Takara Bio Inc.). Реакционную жидкость после обратной транскрипции разводили ТЕ-буфером до достижения концентрации 10 нг/мкл для применения в качестве матрицы для ПЦР.
Для ПЦР в качестве праймеров использовали «прямой» праймер HSP70 (SEQ ID NO: 5) и «обратный» праймер HSP70 (SEQ ID NO: 6). Применяли ген бета-2-микроглобулина в качестве внутреннего контрольного гена для коррекции экспрессии гена HSP70; и для него в качестве праймеров применяли «прямой» праймер бета-2-микроглубулина (SEQ ID NO: 3) и «обратный» праймер бета-2-микроглобулина (SEQ ID NO: 4). Для осуществления ПЦР применяли ПЦР-фермент (торговое название: TaKaRa Ex Taq, фирма-производитель Takara Bio Inc.). В целом 20 мкл жидкости для ПЦР-реакции подвергали одноминутной инкубации при 94°C (начальная денатурация), после чего осуществляли 32 повторяющихся цикла (HSP70) или 24 цикла (бета-2-микроглобулин), каждый цикл включал денатурацию при 94°C в течение 30 с и отжиг при 57°C (HSP70) или 59°C (бета-2-микроглобулин) в течение 30 с и стадию удлинения при 72°C в течение 30 с. Реакцию удлинения при 72°C в течение 30 с осуществляли в конце всех ПЦР. Жидкость после ПЦР-реакции подвергали электрофорезу общепринятым методом; и осуществляли окрашивание бромидом этидия.
Путем измерения интенсивности флуоресценции под действием ультрафиолетового излучения с помощью устройства Alpha View (торговое название) (фирма-производитель Alpha Innotech Corporation), оценивали уровень экспрессии гена HSP70. В этом случае величину, полученную с учетом коррекции на уровень экспрессии внутреннего контрольного гена, принимали за уровень экспрессии гена HSP70.
Результаты представлены на фиг. 2. На фиг. 2 индуцирующую экспрессию мРНК HSP70 активность образцов 1, 3 и 4 выражали в виде отношения (%) к активности контроля. По сравнению с контролем образцы 1, 3 и 4 обладали примерно в 1,2-1,5 раза более высокой способностью повышать экспрессию мРНК HSP70 (образцы 1 и 4, **р<0,01 при сравнении с контролем; образец 3, *р=0,05 при сравнении с контролем). Из полученных результатов следует, что гидроксиметилфурфураль и продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, и продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, которые исследовали в данном примере, обладали индуцирующей активностью в отношении HSP70 при оценке на уровне экспрессии мРНК.
Пример 5
Оценка индуцирующей активности в отношении экспрессии белка HSP70 Индуцирующую активность в отношении HSP70 образцов 1, 3 и 4, которые представляли собой те же образцы, что и в примере 4, оценивали, измеряя уровень экспрессии белка HSP70.
Аналогично методу, описанному в примере 4, клетки HeLa, суспендированные в среде DMEM (дополненной 10% FBS), высевали в 12-луночный планшет (100000 клеток/мл/лунку). На следующий день среду заменяли свежей средой DMEM (0,9 мл); и добавляли по 0,1 мл каждого из образцов, каждый из которых приготавливали с использованием воды, полученной с помощью ионообменных адсорбентов, которую добавляли до достижения конечной концентрации 1 мг/мл (касательно образцов 3 и 4 конечная концентрация 1 мг/мл дана в пересчете на продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, и на продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, из твердого содержимого стебля спаржи). В качестве контроля добавляли 0,1 мл полученной с помощью ионообменных адсорбентов воды. После культивирования в течение 24 ч супернатант культуры удаляли и клетки промывали ЗФР(-) (забуференный фосфатом физиологический раствор, рН 7,2). Затем часть клеток соскабливали с помощью скрепера для клеток, собирали в 1,5-миллилитровую пробирку для образца и осуществляли количественное определение белка HSP70 и количественную оценку общего белка.
Количественную оценку белка HSP70 осуществляли с помощью набора HSP70 ELISA (торговое название) (фирма-производитель Enzo); а количественную оценку общего белка осуществляли с помощью набора Micro ВСА Protein Assay Reagent (торговое название) (фирма-производитель PIERCE Biotechnology). На оставшихся клетках оценивали воздействие на клеточную пролиферацию с помощью метода на основе бромида 3-(4,5-диметилтиал-2-ил)-2,5-дифенилтетразолия (МТТ). Затем данные, касающиеся количества белка HSP70, корректировали с учетом количества общих белков и количества жизнеспособных клеток.
Результаты представлены на фиг. 3. На фиг. 3 индуцирующую экспрессию белка HSP70 активность образцов 1, 3 и 4 выражали в виде отношения (%) к активности контроля. По сравнению с контролем образцы 1, 3 и 4 обладали примерно в 1,3 раза более высокой способностью повышать экспрессию белка HSP70 (*р<0,05 при сравнении с контролем). Из полученных результатов следует, что гидроксиметилфурфураль, продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, и продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, которые исследовали в данном примере, обладали индуцирующей активностью в отношении HSP70 при оценке на уровне экспрессии белка.
Из приведенных выше данных следует, что гидроксиметилфурфураль, продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, и продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, которые исследовали в данном примере, обладали очень высокой индуцирующей активностью в отношении HSP70.
Пример 6
Оценка антистрессового действия на мышиной модели депривации сна Антистрессовое действие продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, который получали согласно методу, изложенному в примере 4 («образец 3» в примере 4), оценивали с использованием мышиной модели депривации сна.
Тридцать два самца мышей линии SlcrddY возрастом 6 недель (фирма-производитель CLEA Japan, Inc.) разделяли на 4 группы (по 8 мышей в каждой группе). Группы были обозначены как здоровая группа, контрольная группа, группа, которую обрабатывали низкой дозой продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды (обозначена далее в контексте настоящего описания как группа, обработанная низкой дозой), и группа, которую обрабатывали высокой дозой продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды (обозначена далее в контексте настоящего описания как группа, обработанная высокой дозой). За 7 дней до того, как мышей начинали подвергать стрессу, связанному с депривацией сна, им начинали давать порошок, содержащий продукт, который получали тепловой обработкой стебля спаржи с использованием горячей воды, добавляя его в обычный корм на основе отрубей (торговое название: СЕ-2, фирма-производитель CLEA Japan, Inc.), и каждый день мышам из группы, обработанной низкой дозой, давали дозу 200 мг/кг (в пересчете на продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, из твердого содержимого стебля спаржи), мышам из группы, обработанной высокой дозой, давали дозу 1000 мг/кг (в указанном выше пересчете). Здоровую группу и контрольную группу кормили обычным кормом на основе отрубей. Мышей из контрольной группы, группы, обработанной низкой дозой, и группы, обработанной высокой дозой, погружали в воду на 12 ч (с 8:00 до 20:00) в день в течение 3 дней, чтобы вызвать стресс, связанный с депривацией сна. У здоровой группы не вызывали стресс, связанный с депривацией сна.
Антистрессовое действие оценивали у мышей в день после последней стрессовой нагрузки, связанной с депривацией сна, путем измерения (1) уровня липид-пероксидов в сыворотке крови (LPO) относительно количества триглицеридов (TG) в сыворотке крови (LPO/TG)) в качестве показателя окислительного стресса, (2) измерения концентрации в крови кортикостерона, который, как известно, является стрессовым гормоном, и (3) оценки частоты встречаемости утраты волосяного покрова у мышей.
На фиг.4 представлены результаты оценки уровня липид-пероксида в сыворотке крови. На указанном чертеже более высокий уровень LPO/TG свидетельствует о более выраженном окислительном стрессе в крови. Величина LPO/TG оказалась высокой в контрольной группе, в то время как величина LPO/TG снижалась как в обработанной низкой дозой группе, так и в обработанной высокой дозой группе практически до такого же уровня, который обнаружен в здоровой группе (*р<0,05 при сравнении с контролем). Из полученных результатов следует, что, когда продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, применяемый в данном примере, вводили мышам с высоким статусом окислительного стресса в крови из-за стрессовой нагрузки, связанной с депривацией сна, окислительный стресс в крови снижался до уровня, при котором связанный с депривацией сна стресс не имел места.
На фиг. 5 представлены результаты оценки концентрация кортикостерона в крови. На этом чертеже более высокая величина концентрации кортикостерона свидетельствует о более выраженном статусе стресса. Величина концентрации кортикостерона оказалась более высокой в контрольной группе, в то время как величина концентрации кортикостерона снижалась в обработанной низкой дозой группе практически до такого же уровня, который обнаружен в здоровой группе, и величина концентрации кортикостерона снижалась в обработанной высокой дозой группе, практически до такого же или более низкого уровня по сравнению с обнаруженным в здоровой группе (**р<0,01 при сравнении с контролем, *р<0,05 при сравнении с контролем). Из полученных результатов следует, что, когда продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, применяемый в данном примере, вводили мышам, которые имели более высокой статус стресса из-за стрессовой нагрузки, связанной с депривацией сна, то более высокий статус стресса снижался до уровня, при котором связанный с депривацией сна стресс не имел места, причем в обработанной более высокой дозой группе происходило дополнительное снижение до такого же или более низкого уровня, по сравнению с уровнем, при котором связанный с депривацией сна стресс не имел места.
На фиг. 6 показана частота встречаемости утраты волосяного покрова у мышей. На этом чертеже более высокая частота встречаемости утраты волосяного покрова свидетельствует о более выраженном статусе стресса. Частота встречаемости утраты волосяного покрова в здоровой группе, контрольной группе, обработанной низкой дозой группе и обработанной высокой дозой группе составляла 0%, 75,0%, 37,5% и 12,5% соответственно; и частота встречаемости утраты волосяного покрова оказалась более низкой в обработанной низкой дозой группе и в обработанной высокой дозой группе по сравнению с контрольной группой. Из полученных результатов следует, что, когда продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, применяемый в данном примере, вводили мышам, которые имели более высокой статус стресса из-за стрессовой нагрузки, связанной с депривацией сна, то более высокий статус стресса снижался.
Таким образом, выше продемонстрировано, что применяемый в данном примере продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, который содержит гидроксиметилфурфуральное производное, обладал очень высоким антистрессовым действием.
Пример 7
Оценка индуцирующей активности в отношении экспрессии белка HSP70 на мышиной модели депривации сна
На мышах, применяемых в примере 6, индуцирующую активность в отношении HSP70 продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, который получали согласно методу, изложенному в примере 4 («образец 3» в примере 4), оценивали по уровню экспрессии белка HSP70 в желудке, печени и почке.
В последний день эксперимента, описанного в примере 6, мышей из каждой группы умерщвляли; и из каждой особи извлекали желудок, печень и почку. Каждый из органов (50 мг) помещали в 1,5-миллилитровую пробирку для образца; и добавляли 500 мкл реагента для экстракции из набора HSP70 ELISA (торговое название) (фирма-производитель Enzo) и затем добавляли коктейль ингибиторов протеаз (торговое название Protease inhibitor cocktail) (фирма-производитель Sigma) в концентрации 0,2 об. % Затем каждый орган растирали на льду с помощью продолговатого пестика и центрифугировали при 4°C при 1500 об/мин в течение 30 мин и супернатант собирали. В указанном супернатанте осуществляли количественное определение белка HSP70 и количественное определение общих белков.
Аналогично методу, описанному в примере 5, количественное определение белка HSP70 осуществляли с помощью набора HSP70 ELISA (торговое название) (фирма-производитель Enzo), а количественное определение общих белков осуществляли с помощью набора Micro ВСА Protein Assay Reagent (торговое название) (фирма-производитель PIERCE Biotechnology). Данные, касающиеся количества белка HSP70, корректировали с учетом количества общих белков.
На фиг. 7-9 представлен уровень экспрессии белка HSP70 в желудке, печени и почке. На фиг. 7-9 индуцирующую экспрессию белка HSP70 активность в контрольной группе, обработанной низкой дозой группе и обработанной высокой дозой группе выражали в виде отношения (%) к активности в здоровой группе. В желудке (фиг. 7) и печени (фиг. 8) уровень экспрессии белка HSP70 снижался в контрольной группе по сравнению с здоровой группой; в то время как уровень экспрессии белка HSP70 повышался в обработанной низкой дозой группе и обработанной высокой дозой группе до такого же или более высокого уровня по сравнению с здоровой группой (*р<0,05 относительно контроля). В почке (фиг. 9), уровень экспрессии белка HSP70 повышался в обработанной низкой дозой группе и обработанной высокой дозой группе по сравнению с контрольной группой (**р<0,01 относительно контроля).
Из приведенных выше результатов следует, что применяемый в данном примере продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, который содержит гидроксиметилфурфуральное производное, даже при введении животным, обладал очень высокой индуцирующей HSP70 активностью при оценке по уровню экспрессии белка. Кроме того, можно предположить, что одним из механизмов антистрессового действия, описанного в примере 6, являлась индуцирующая активность в отношении экспрессии HSP70 применяемого в данном примере продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, который содержит гидроксиметилфурфуральное производное. Пример 8
Оценка индуцирующей активности в отношении экспрессии мРНК HSP70 у человека
Оценивали индуцирующую активность в отношении HSP70 продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, который получали согласно методу, изложенному в примере 4 («образец 3» в примере 4), на лейкоцитах человека, определяя уровень экспрессии мРНК HSP70.
Исследования проводили на трех добровольцах, которые добровольно дали согласие на участие в опыте (далее в контексте настоящего описания обозначены как индивидуум 1, индивидуум 2 и индивидуум 3). Порошок, содержащий продукт, который получали тепловой обработкой стебля спаржи с использованием горячей воды, давали дважды в день (утром и вечером) в течение 3 дней индивидууму 1 в дозе 200 мг/день, индивидууму 2 в дозе 400 мг/день, а индивидууму 3 в дозе 800 мг/день (в 200 мг (индивидуум 1), 400 мг (индивидуум 2) и 800 мг (индивидуум 3) указанного порошка продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, содержалось 98, 197 и 394 мг продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, который выделяли из твердого содержимого стебля спаржи, соответственно).
Перед началом приема внутрь продукта и в последний день приема отбирали образцы крови и оценивали уровень экспрессии мРНК HSP70 в лейкоцитах. 1 мл крови смешивали с 10 мл раствора ACK-буфера (0,15М хлорид аммония, 1,0 мМ бикарбонат калия, 0,1 мМ ЭДТК-2Na, рН 7,2) при 37°C и выдерживали при 37°C в течение 10 мин. Затем полученный продукт центрифугировали при 3000 об/мин в течение 5 мин и супернатант удаляли. К осажденным лейкоцитам вновь добавляли 10 мл раствора ACK-буфера для суспендирования. Указанную процедуру повторяли трижды; и добавляли 1,5 мл реагента Trizol (торговое название) (фирма Life Technologies) к осажденным лейкоцитам для экстракции общей РНК. Последующие процедуры, включая ПЦР-реакцию, осуществляли таким же методом, который описан в примере 4 (изучение на клетках HeLa); и оценивали экспрессируемое количество мРНК HSP70.
Результаты представлены на фиг. 10. На фиг. 10 представлены данные о уровне экспрессии в (%) мРНК HSP70 в лейкоцитах после завершения приема относительно уровня до начала приема. Уровень экспрессии мРНК HSP70 в лейкоцитах после завершения приема оказался примерно в 2,5-3,5 раза выше в зависимости от дозы продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, по сравнению с уровнем до начала приема продукта.
Из представленных выше результатов следует, что применяемый в настоящем примере продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, который содержит гидроксиметилфурфуральное производное, даже при введении человеку обладал очень высокой индуцирующей HSP70 активностью при оценке по уровню экспрессии мРНК.
Пример 9
Клиническая оценка регуляторного действия на автономную нервную систему продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды
Оценивали регуляторное действие на автономную нервную систему продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, который получали согласно методу, изложенному в примере 4 («образец 3» в примере 4).
В рандоминизированном двойном слепом плацебо-контролируемом исследовании принимало участие 30 добровольцев, которые добровольно дали согласие на участие в опыте, которые обозначены как индивидуумы. Индивидуумов распределяли по принципу лотереи в плацебо-группу (обозначена далее как P-группа), включающую 15 индивидуумов, или группу, в которой индивидуумам давали продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды (далее в контексте настоящего описания A-группа), состоящую из 15 индивидуумов. В течение 4-недельного периода опыта индивидуумы из P-группы принимали эксципиент (торговое название: Pinedex, фирма-производитель Matsutani Chemical Industry Co., Ltd.) (400 мг/день), а индивидуумы из A-группы принимали порошок, содержащий продукт, который получали тепловой обработкой стебля спаржи с использованием горячей воды (400 мг/день) дважды в день (утором и вечером) каждый день (в 400 мг указанного порошка продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, содержалось 197 мг продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, который выделяли из твердого содержимого стебля спаржи, а остальные 203 мг приходилось на долю эксципиента (аналогично указанному выше)).
Перед началом опыта и в последний день опыта оценивали баланс автономной нервной системы и активность автономной нервной системы с использованием системы для оценки ускорения пульсовой волны (торговое название; Pulse analyzer plus TAS-9, фирма-производитель YKC Corporation). Указанная система представляет собой систему, в которой ускорение пульсовых волн измеряют на кончике пальца руки, выявляя тем самым малейшие изменения частоты сердечных сокращений (изменение частоты сердечных сокращений: HRV), и оценивая функции автономной нервной системы. HRV определяет клинические последствия различных воздействий на частоту сердечных сокращений, вызываемых автономной нервной системой. Баланс автономной нервной системы оценивали, откладывая показатель активности симпатической нервной системы (низкая частота: LF) по оси X и показатель активности парасимпатической нервной системы (высокая частота: HF) по оси Y, где указанные активности были измерены с помощью указанной системы, получая двухмерный график, и, используя расстояние на таком графике между точкой, в которой баланс автономной нервной системы был наилучшим, и точкой, соответствующей измеренному значению. При этом, касательно активности автономной нервной системы, использовали численные значения, описывающие активность автономной нервной системы, полученные с помощью такой системы (численные значения рассчитывали, используя LF, HF и т.п., полученные с помощью указанной системы).
На фиг. 11 представлены данные об изменениях баланса автономной нервной системы. На чертеже численное значение, более приближенное к нулю, свидетельствует о лучшем балансе автономной нервной системы. В P-группе (плацебо-группа) баланс автономной нервной системы в последний день опыта был хуже, чем в начале опыта. С другой стороны, в A-группе (группа, в которой индивидуумам давали продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды) баланс автономной нервной системы в последний день опыта значительно улучшался по сравнению с балансом до начала опыта (*p<0,05 при сравнении с результатами, полученными до начала опыта, p<0,01 при сравнении с плацебо-группой). Полученные результаты продемонстрировали, что принятие применяемого в данном примере продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, приводило к улучшению баланса автономной нервной системы.
На фиг.12 представлены данные об изменениях активности автономной нервной системы. На чертеже более высокое численное значение соответствует более высокой активности автономной нервной системы. В P-группе (плацебо-группа) была выявлена пониженная активность автономной нервной системы в последний день опыта по сравнению с активностью до начала опыта. С другой стороны, в A-группе (группа, в которой индивидуумам давали продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды) обнаружена повышенная активность автономной нервной системы в последний день опыта по сравнению с активностью до начала опыта. Полученные результаты продемонстрировали, что принятие применяемого в данном примере продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды, приводило к повышению активности автономной нервной системы.
Из представленных выше результатов следует, что применяемый в настоящем примере продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды, который содержит гидроксиметилфурфуральное производное, обладает очень высоким регуляторным действием на автономную нервную систему.
Пример 10
Оценка индуцирующей активности в отношении экспрессии мРНК HSP70 продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, на людях и клиническая оценка регуляторного действия на автономную нервную систему
Оценку индуцирующей активности в отношении экспрессии мРНК HSP70 и клиническую оценку регуляторного действия на автономную нервную систему человека осуществляли, используя полученные капсулы, заполненные продуктом, полученным тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, согласно описанному ниже методу.
Метод получения капсул, заполненных продуктом, который получен тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой
Ниже описан метод получения капсул, заполненных продуктом, полученным тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, пригодным для приема внутрь человеком. К зеленым стеблям спаржи (масса свежего продукта 130 кг) добавляли 170 л воды; и с целью тепловой обработки с использованием горячей воды смесь подвергали тепловой стерилизации (100°C, 45 мин). После того, как смеси давали охладиться до 45°C, к полученному продукту добавляли 3,0 кг ферментов (Сумизим С и Сумизим МС; фирма-производитель Yakult Pharmaceutical Industry Co., Ltd.) и перемешивали при 45°C в течение 24 ч. Затем ферменты деактивировали (100°C, 20 мин); и осуществляли центрифугирование. Полученный продукт концентрировали с помощью испарителя, добавляли 9,0 кг эксципиента (торговое название: Pinedex, фирма-производитель Matsutani Chemical Industry Co., Ltd.) и автоклавировали (121°C, 45 мин). Затем путем распылительной сушки получали порошок, который содержал продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, в количестве 16,0 кг (при этом содержание продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой составляло 7,0 кг, а содержание эксципиента 9,0 кг). Указанный порошок, который содержал продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, в количестве 8,50 кг смешивали с 1,86 кг препятствующего слеживанию агента (антикомкователь) (торговое название: стеарат кальция, фирма-производитель Sun Асе Corporation) и 8,20 кг целлюлозы (торговое название: Ceolus, фирма-производитель Asahi Kasei Corp.) с получением порошка для капсул, который содержал 20% продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, который выделяли из твердого содержимого стебля спаржи. После заполнения указанным порошком капсул №1 из расчета 280 мг на капсулу получали капсулу, заполненную продуктом, полученным тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой.
Метод оценки
Исследования проводили на двадцати добровольцах, которые добровольно дали согласие на участие в опыте, обозначенных как индивидуумы: и осуществляли рандомизированное двойное слепое плацебо-контролируемое исследование с использованием низкой дозы. Индивидуумов случайным образом включали в плацебо-группу (далее в настоящем описании обозначена как P-группа), состоящую из 10 индивидуумов, или группу, в которой индивидуумам давали продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой (далее в настоящем описании обозначена как E-группа), состоящую из 10 индивидуумов. В течение 1 -недельного периода опыта индивидуумы из P-группы принимали капсулу с плацебо (всего 840 мг смеси, которая содержала 699,9 мг вещества с торговым названием: Pinedex, фирма-производитель Matsutani Chemical Industry Co., Ltd.) и 140,1 мг вещества с торговым названием: соловый экстракт (3 капсулы в день), каждый день, а индивидуумы из E-группы принимали капсулу, заполненную продуктом, который получали тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой (400 мг, 3 капсулы в день) каждый день после обеда (в 840 мг каждой капсулы, заполненной продуктом, полученным тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, содержалось 168 мг продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, который выделяли из твердого содержимого стебля спаржи, а остальные 672 мг приходилось на долю Pinedex, стеарата кальция и Ceolus). В качестве конечных точек использовали уровень экспрессии мРНК HSP70 в лейкоцитах, баланс автономной нервной системы и активность автономной нервной системы.
Оценка индуцирующей активности в отношении экспрессии мРНК HSP70
Сначала определяли уровень экспрессии мРНК HSP70 в лейкоцитах. Перед началом опыта и в последний день опыта отбирали образцы крови; и общую РНК экстрагировали из 400 мкл крови с помощью набора для экстракции РНК (торговое название: Núcleo Spin RNA Blood, фирма-производитель Takara Bio Inc.). Метод синтеза кДНК и ПЦР осуществляли согласно методу, описанному в примере 8.
Результаты представлены на фиг. 13. На фиг. 13 представлены данные об уровне экспрессии в (%) мРНК HSP70 в лейкоцитах после завершения приема относительно уровня до начала приема. Средняя величина уровня экспрессии мРНК HSP70 в Р-группе (плацебо-группа) составляла 175% от уровня, обнаруженного до начала приема продукта. С другой стороны, средняя величина уровня экспрессии мРНК HSP70 в E-группе (группа, в которой индивидуумам давали продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой) составляла 278% от уровня, обнаруженного до начала приема продукта; и уровень экспрессии был выше (*р=0,098 при сравнении с P-группой). Из представленных выше результатов следует, что прием применяемого в настоящем примере продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, приводил к существенному повышению уровня экспрессии мРНК HSP70.
Клиническая оценка регуляторного действия на автономную нервную систему
Далее оценивали баланс автономной нервной системы и активность автономной нервной системы с использованием системы для оценки ускорения пульсовой волны (торговое название; Pulse analyzer plus TAS-9, фирма-производитель YKC Corporation) до начала опыта и в последний день опыта. Процедура осуществления измерений была такой же, что и процедура, описанная в примере 9.
На фиг. 14 представлены данные об изменениях баланса автономной нервной системы. В P-группе (плацебо-группа) баланс автономной нервной системы в последний день опыта был хуже, чем баланс до начала опыта (*p<0,05 при сравнении с результатом, полученным до начала опыта). С другой стороны, в E-группе (группа, в которой индивидуумам давали продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой) баланс автономной нервной системы в последний день опыта значительно улучшался по сравнению с балансом до начала опыта. Полученные результаты продемонстрировали, что потребление применяемого в данном примере продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, приводило к улучшению баланса автономной нервной системы.
На фиг.15 представлены данные об изменениях активности автономной нервной системы. В P-группе (плацебо-группа) активность автономной нервной системы в последний день опыта была существенно хуже, чем до начала опыта (**p<0,01 при сравнении с результатом, полученным до начала опыта). С другой стороны, в E-группе (группа, в которой индивидуумам давали продукт, полученный тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой) активность автономной нервной системы в последний день опыта улучшалась по сравнению с активностью до начала опыта. Полученные результаты продемонстрировали, что потребление применяемого в данном примере продукта, полученного тепловой обработкой стебля спаржи с использованием горячей воды и ферментативной обработкой, препятствовало ухудшению активности автономной нервной системы.
Как указано выше, в настоящем описании представлено новое гидроксиметилфурфуральное производное, высокоэффективное фармацевтическое средство, индуктор HSP, антистрессовый агент и регулятор автономной нервной системы. Кроме того, представлены пищевые продукты и напитки, обладающие очень высокой индуцирующей HSP активностью, антистрессовым действием и регуляторным действием на автономную нервную систему. Кроме того, представлен способ получения гидроксиметилфурфурального производного, который позволяет снижать стоимость и является простым и удобным.
Следует отметить, что можно рассматривать различные варианты осуществления изобретения и модификации без отклонения от объема и -сущности настоящего изобретения в его широком смысле. Кроме того, вышеуказанные варианты осуществления изобретения даны с целью его иллюстрации и не направлены на ограничение объема настоящего изобретения. Это означает, что объем настоящего изобретения определяется формулой изобретения, а не вариантами его осуществления. При этом подразумевается, что различные модификации, подпадающие под объем формулы изобретения и имеющие смысл, эквивалентный указанному в формуле изобретения, подпадают под объем настоящего изобретения.
В основу настоящего изобретения положена заявка на японский патент №2011-277926, зарегистрированная 20 декабря 2011 г. Описание, формула изобретения и чертежи заявки на японский патент №2011-277926 полностью включены в настоящее описание в качестве ссылки.
Реферат
Изобретение относится к новому гидроксиметилфурфуральному производному, представленному общей формулой I, где R - радикал формулы (I), которое входит в состав продукта, полученного тепловой обработкой стебля спаржи с горячей водой, способу его получения, а также к способу индукции белка теплового шока или регуляции автономной нервной системы и индукции антистрессового действия. 5 н. и 4 з.п. ф-лы, 15 ил., 9 пр., 2 табл.
Формула







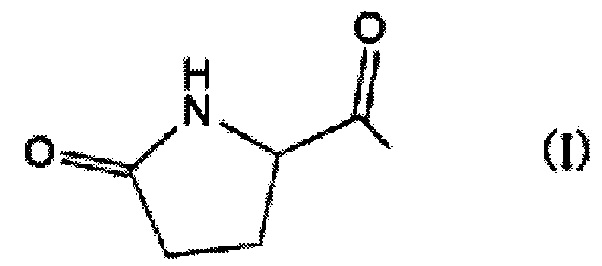

Комментарии