Новый способ получения альфа-(2,4-дисульфофенил)-n-трет-бутилнитрона и его фармакологически приемлемых солей - RU2259996C2
Код документа: RU2259996C2
Описание
Данное изобретение относится к новому способу получения α-(2,4-дисульфофенил)-N-трет-бутилнитрона и его фармакологически приемлемых солей. Ранее было описано, что эти соединения могут использоваться в качестве лекарств. Такие соединения иначе называются N-оксидными производными 4-[(трет-бутилимино)метил]бензол-1,3-дисульфокислоты.
В патенте США 5488145 описан α-(2,4-дисульфофенил)-N-трет-бутилнитрон, его фармацевтически приемлемые соли и связанные с ними фармацевтические композиции. В патенте США 5475032 описано применение таких композиций при лечении инсульта и прогрессирующей потери функции центральной нервной системы. В патенте США 5508305 описано применение таких композиций для облегчения побочных эффектов, вызванных окислительным разрушением, возникающим при лечении онкологических заболеваний. Подобное описание имеется также в WO 95/17876. В патенте США 5780510 описано применение этих же соединений при лечении контузий и сотрясений.
Для синтеза нитронов применимы различные способы. Наиболее часто применяемый способ включает реакцию конденсации производного гидроксиламина с альдегидом или кетоном, обычно без применения катализатора (J.S.Roberts в D.H.R.Barton и W.D.OIlis, Comprehensive Organic Chemistry (Полный курс органической химии), т. 2. стр. 500-504, Pergamon Press, 1979; R.D.Hinton и E.G.Jansen, J. Org. Chem., 1992, 57, стр. 2646-2651). Ценность этой реакции снижается ее восприимчивостью к стерическим затруднениям, медленными скоростями реакции и, в некоторых случаях, относительной труднодоступностью и/или нестабильностью исходного вещества - гидроксиламина. Последние проблемы иногда можно преодолеть путем получения требуемого гидроксиламина in situ восстановлением более легкодоступного соединения, например соответствующего нитропроизводного. Эта общая методика применяется в вышеописанных патентах, где описано получение α-(2,4-дисульфофенил)-N-трет-бутилнитрона, включающее реакцию 4-формил-1,3-бензолсульфокислоты с N-трет-бутилгидроксиламином в кипящем метаноле примерно в течение 18 часов.
α-(2-Сульфофенил)-N-трет-бутилнитрон был получен с помощью реакции натриевой соли 2-формилбензолсульфокислоты с N-трет-бутилгидроксиламином в кипящем этаноле в течение 2 дней (E.G.Jansen и R.V.Shetty, Tetrahedron Letters, 1979, стр. 3229-3232).
Подобная модификация методики получения α-фенил-N-метилнитрона была описана во французском патенте 1437188, выданном E.I. DuPont de Nemours and Co.
В данной заявке авторы описывают новый способ получения α-(2,4-дисульфофенил)-N-трет-бутилнитрона и его солей, который обладает значительными преимуществами и к тому же хорошо применим для крупномасштабного производства.
В одном аспекте данного изобретения предложен способ получения соединения общей формулы (I)
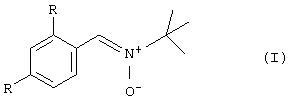
где каждая группа R независимо представляет собой группу SO3Н или ее соль.
Этот способ включает реакцию альдегида общей формулы (II)
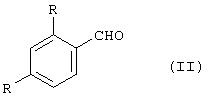
где R указано выше,
с ацетатом N-mpem-бутилгидроксиламмония (III)
(CH3)3CNHOH CH3CO2H (III)
Во втором аспекте этого изобретения предложен способ получения и выделения соединения общей формулы (I). На первой стадии этого процесса это соединение получают, как уже описано. На следующей стадии это соединение выделяют.
Продукты и исходные материалы.
В данном способе альдегид общей формулы (II) реагирует с ацетатом N-трет-бутилгидроксиламмония с образованием соединения α-(2,4-дисульфофенил)-N-трет-бутилнитрона общей формулы (I). Соединения общей формулы (I) и (II) могут быть кислотами или солями.
Соли соединений вышеприведенной формулы (I) могут быть получены путем реакции свободной кислоты (где R представляет собой SO3Н) или другой ее соли с двумя или более эквивалентами соответствующего основания, с использованием хорошо известных способов.
Соли соединений формулы (I) и (II), которые рассматривались выше, обычно являются солями, образованными с катионами, приемлемыми для фармацевтических целей. Этот катион может быть одновалентным, таким как натрий, калий, литий, аммоний, алкиламмоний или диэтаноламмоний. В другом случае он может быть поливалентным катионом, таким как кальций, магний, алюминий или цинк. Также соль может быть смешанной солью, образованной поливалентным катионом, таким как кальций или магний, в сочетании с фармацевтически приемлемым анионом, таким как галогенид (например, хлорид), фосфат, сульфат, ацетат, цитрат или тартрат.
Две группы R в этих формулах обычно одинаковы. Однако они могут быть независимо выбраны из уже перечисленных возможностей.
Предпочтительно, чтобы две группы R в приведенных выше формулах (I) и (II) были одинаковыми и чтобы каждая представляла собой SO3- Na+.
Ацетат N-трет-бутилгидроксиламмония описан в одновременно находящейся на рассмотрении патентной заявке РСТ WO 00/02848.
Альдегиды общей формулы (II) или имеются в продаже, или могут быть получены из имеющихся в продаже материалов с использованием хорошо известных способов. Имеющаяся в продаже динатриевая соль 4-формил-1, 3-бензолдисульфокислоты (II; R=SO3-Na+) обычно содержит в качестве примесей небольшие, но заметные количества соответствующего бензилового спирта, соответствующих производных бензойной кислоты и хлорида натрия. Предпочтительно, но не существенно, чтобы такой материал был очищен перед использованием в способе, соответствующем данному изобретению. Динатриевая соль 4-формил-1,3-бензолдисульфокислоты (II; R=SO3-Na+) обычно связана с различными количествами воды. Доля такой воды обычно не является критической в способе согласно данному изобретению, но обычно ее можно принимать во внимание при определении общего состава реакционной смеси, образующей соединение (I).
Процесс
Первой стадией является конденсация ацетата N-трет-бутилгидроксиламмония (III) с альдегидом (II). Эту реакцию обычно проводят в периодическом режиме при перемешивании. Если желательно, ее можно проводить в непрерывном режиме в проточной реакционной системе.
В этом способе предпочтительно, чтобы в общем на каждый эквивалент альдегида (II) использовалось примерно от 1,25 до 2,5 эквивалента ацетата N-mpem-бутилгидроксиламмония (III). Особенно предпочтительно, чтобы использовалось примерно от 1,6 до 2,0 эквивалентов ацетата N-mpem-бутилгидроксиламмония (III).
Конденсацию согласно данному изобретению проводят в растворе с использованием подходящего инертного растворителя, в котором исходные материалы достаточно растворимы. Предпочтительно в качестве растворителя использовать подходящий полярный органический растворитель, такой как спирт или смесь спиртов. Особенно предпочтительно, чтобы такой растворитель представлял собой метанол. Предпочтительно также, чтобы реакционная смесь содержала соответствующий процент воды, обычно менее 10% по объему, например от 2% до 10% по объему. Особенно предпочтительно, чтобы растворитель содержал около 5% по объему воды. Было обнаружено, что присутствие соответствующего количества воды обеспечивает значительные преимущества, особенно в отношении ингибирования превращения альдегида (II) в нежелательный побочный продукт - ацеталь (IV)

при реакции с растворителем R1OH.
Присутствие соответствующего количества воды в растворителе также увеличивает растворимость исходного вещества - динатриевой соли 4-формил-1,3-бензолдисульфокислоты (II; R=SO3-Na+) и тем самым значительно улучшает кинетику процесса и дает возможность применять более концентрированную систему.
Соотношение растворителя в реакции обычно поддерживается примерно на уровне от 2 до 8 мл растворителя на грамм продукта - нитрона или выше; при этом соотношения от 2 до 6 и особенно от 3 до 4 мл/г являются предпочтительными.
Конденсацию проводят при температуре примерно от температуры окружающей среды до примерно 150°С; хорошие результаты были получены при температурах примерно от температуры окружающей среды до 125°С, при этом предпочтительными являются температуры примерно от 40°С до 100°С.
Реакция конденсации идет относительно легко и обычно по существу завершается через промежуток времени примерно от 15 минут до 5 часов, причем типичным является время реакции от 30 до 90 минут. На практике степень протекания реакции отслеживают аналитически, и реакцию продолжают до тех пор, пока не будет достигнута необходимая степень протекания реакции.
Выделение продукта формулы (I), образованного при описанной выше конденсации, может быть достигнуто путем использования стандартных методов, которые хорошо известны. Особенно предпочтительно выделение продукта с применением соответствующего способа кристаллизации. Таким образом, при типичном способе выделения, по завершении реакции альдегида (II) с ацетатом N-mpem-бутилгидроксиламмония (III) реакционную смесь охлаждают до температуры окружающей среды, а затем фильтруют, чтобы удалить любые нерастворимые вещества. Затем фильтрат доводят до температуры, которая может составлять от 0°С до температуры кипения растворителя, но предпочтительно составляет от 35 до 50°С, и вызывают кристаллизацию путем добавления подходящего агента кристаллизации, например изопропанола или этилацетата. Оптимальная температура осаждения может изменяться в зависимости от масштаба реакции, от того, перемешивают ли суспензию или ей дают выстояться, и от желаемого размера частиц твердого продукта.
Агентом кристаллизации обычно является органическая жидкость, которая смешивается с реакционным растворителем, но в которой продукт - нитрон менее растворим. Этот агент также обычно является летучим веществом, например веществом, имеющим 5 или менее атомов углерода. Твердый продукт выделяют фильтрацией и сушат. Особенно предпочтительным является использование в качестве агента кристаллизации изопропанола.
Альтернативным образом кристаллизацию можно вызвать добавлением подходящего агента, такого как изопропанол или этилацетат, без предварительного нагревания фильтрата. И здесь особенно предпочтительным является применение изопропанола.
Содержание воды в динатриевой соли α-(2,4-дисульфофенил)-N-трет-бутилнитрона, полученной с применением способа по данному изобретению, зависит от характера методики, использованной для выделения продукта, и применяемого процесса окончательной сушки. Так, продолжительная сушка при повышенных температурах и при пониженном давлении дает по существу безводное вещество. Такое вещество, однако, является в заметной степени гигроскопичным, образуя со временем тригидрат. При сушке тригидрата регенерируется безводная форма. Форма тригидрата получается непосредственно путем кристаллизации динатриевой соли α-(2,4-дисульфофенил)-N-трет-бутилнитрона из горячей воды или пропускания увлажненного воздуха над твердым веществом.
Добавление примерно 5% об. воды к агенту кристаллизации может привести к сдвигу продукта в сторону гидратированной формы и снизить количество окклюдированных органических жидкостей в кристаллическом продукте, а также может снизить уровень содержания примесей, например непрореагировавшего альдегида.
Данное изобретение иллюстрируется, но ни в коей мере не ограничивается, следующими примерами.
Пример 1.
Динатриевая соль α-(2,4-дисульфофенил)-N-трет-бутилнитрона (масштаб 10 г).
Динатриевая соль 4-формил-1,3-бензолдисульфокислоты (10,0 г, 27,6 ммоль, 85,6% масс.), ацетат N-трет-бутилгидроксиламмония (6,1 г, 37,5 ммоль, 1,4 экв., 91,6% масс.), вода (2 г) и метанол (38 г) были помещены в 100 мл трехгорлую бутыль при комнатной температуре в атмосфере газообразного азота. Смесь перемешивали, и бутыль погрузили в масляную баню, поддерживаемую при температуре 72°С. Через 2,3 часа анализ HPLC (жидкостная хроматография высокого разрешения, определение по % площади пика) показал, что осталось <0,3% площади пика динатриевой соли 4-формил-1,3-бензолдисульфокислоты. Прозрачный фильтрат охладили до 20°С и отфильтровали. Прозрачный раствор перенесли в колбу объемом 250 мл, нагрели до кипения, а затем по каплям добавляли изопропанол (70 г). Рост кристаллов начался, когда было добавлено 40 г изопропанола. Горячую баню заменили на баню с холодной водой, и суспензию охладили до 11°С. Через 30 минут продукт отделили фильтрованием и сушили досуха отсасыванием с образованием белого твердого вещества (11,2 г). Этот материал сушили при 50°С в вакуумном сушильном шкафу в течение ночи. Вес после сушки составил 8,55 г (78,8%).
Определение чистоты хроматографическим методом (HPLC по % площади) показало содержание более 99% динатриевой соли α-(2,4-дисульфофенил)-N-трет-бутилнитрона.
Пример 2.
Динатриевая соль α-(2,4-дисульфофенил)-N-трет-бутилнитрона (масштаб 100 г).
Динатриевая соль 4-формил-1,3-бензолдисульфокислоты (100,0 г, 0,31 моль, 96,3% масс.), ацетат N-трет-бутилгидроксиламмония (66,8 г, 0,43 моль, 1,4 экв., 97,0 % масс.), вода (10 г) и метанол (337 мл) были помещены при температуре окружающей среды в 1 л трехгорлую колбу с рубашкой. Смесь перемешивали и нагревали до 72°С. Через 3 часа HPLC анализ показал, что присутствует менее 0,2% по площади динатриевой соли 4-формил-1,3- бензолдисульфокислоты. Реакционную смесь охладили и отфильтровали. Фильтрат перенесли в 2 л аппарат для кипячения с обратным холодильником и нагревали до 80°С. Когда смесь начала закипать, по каплям добавляли изопропанол (765 мл), и кипячение продолжали еще 0,5 часа. Полученную суспензию охладили до температуры ниже 11°С. Белый осадок отфильтровали и высушили в вакуумном сушильном шкафу в течение 24 ч при 50°С. Выход 83,0 г (72,8%).
Определение чистоты хроматографическим методом (HPLC по % площади) показало содержание более 99% динатриевой соли α-(2,4-дисульфофенил)-N-трет-бутилнитрона.
Пример 3.
Динатриевая соль α-(2,4-дисульфофенил)-N-трет-бутилнитрона (масштаб 500 г).
Динатриевая соль 4-формил-1,3-бензолдисульфокислоты (500,0 г, 1,4 моль, 87,0 % масс.), ацетат N-mpem-бутилгидроксиламмония (336,0 г, 2,18 моль, 1,5 экв, 97,0 % масс.), вода (20 г) и метанол (1700 мл) были помещены в 5 л трехгорлую колбу с рубашкой, снабженную введенной сверху мешалкой и нагревательной баней с циркуляцией, при комнатной температуре. Смесь перемешивали, и колбу нагревали при 72°С. Через 3,0 часа раствор отфильтровали. Затем фильтрат нагревали до 80°С и кипятили с обратным холодильником в течение 1 часа. Далее растворитель (760 мл) был удален перегонкой при атмосферном давлении. Затем был добавлен изопропанол (2200 мл), и суспензию охладили до температуры ниже 11°С, отфильтровали и высушили в вакуумном сушильном шкафу в течение 96 часов с получением продукта в виде белого кристаллического вещества.
Определение чистоты хроматографическим методом (HPLC по % площади) показало содержание более 99% динатриевой соли α-(2,4-дисульфофенил)-N-трет-бутилнитрона.
Пример 4.
Динатриевая соль α-(2,4-дисульфофенил)-N-трет-бутилнитрона (масштаб 750 г).
Динатриевая соль 4-формил-1,3-бензолдисульфокислоты (750,0 г, 2,32 моль, 85,6% масс.), ацетат N-трет-бутилгидроксиламмония (501,0 г, 3,26 моль, 1,4 экв., 91,6 % масс.), вода (150 г) и метанол (2530 мл) были помещены в 5 л трехгорлую колбу с рубашкой при температуре окружающей среды. Смесь перемешивали и нагревали до 72°С. Через 3,2 часа анализ HPLC показал, что осталось менее 0,2% по площади динатриевой соли 4-формил-1,3-бензолдисульфокислоты. Реакционную смесь профильтровали через встроенный в линию фильтр. Фильтрат перенесли в аппарат для перегонки, и затем раствор нагревали до 80°С. Затем добавили изопропанол (1000 мл) и начали перегонку. Добавили вторую порцию изопропанола (1000 мл), и перегонку продолжали до тех пор, пока температура дистиллята не достигла 80°С. Полученную суспензию охладили до температуры ниже 11°С, профильтровали, и полученное твердое вещество сушили в течение 2 часов с получением продукта в виде белого твердого вещества. Выход составил 744,5 г (80,7%).
Определение чистоты хроматографическим методом (HPLC по % площади) показало содержание более 99% динатриевой соли α-(2,4-дисульфофенил)-N-трет-бутилнитрона.
Пример 5.
Динатриевая соль α-(2,4-дисульфофенил)-N-трет-бутилнитрона (масштаб 100 г).
Динатриевая соль 4-формил-1,3-бензолдисульфокислоты (100,0 г, 0,31 моль, 96,3% масс.), ацетат N-mpem-бутилгидроксиламмония (66,8 г, 0,43 моль, 1,4 экв., 97,0 % масс.), вода (20 г) и метанол (337 мл) были помещены в 1 л трехгорлую колбу, снабженную нагревательным кожухом, при комнатной температуре. Смесь перемешивали и нагревали до 72°С. Реакционную смесь охладили до комнатной температуры. Далее был добавлен метилат натрия (3,5 г, 64,7 ммоль), и смесь перемешивали в течение 0, 5 часа. Затем смесь отфильтровали. HPLC анализ показал, что в фильтрате осталось менее 0,2 % по площади динатриевой соли 4-формил-1,3-бензолдисульфокислоты. Реакционную смесь перенесли в 1 л аппарат для перегонки, и затем раствор нагревали до 80°С. После того, как было отобрано 100 мл дистиллята, был добавлен изопропанол (400 мл), и перегонку продолжали до тех пор, пока температура дистиллята не достигла 78°С. Полученную суспензию отфильтровали при 60°С, и полученное твердое вещество сушили в вакуумном сушильном шкафу в течение 24 часов с образованием продукта в виде белого твердого вещества. Выход составил 91,1 г (82,8%).
Определение чистоты хроматографическим методом (HPLC по % площади) показало содержание более 99% динатриевой соли α -(2,4-дисульфофенил)-N-трет-бутилнитрона.
Пример 6.
Динатриевая соль α-(2,4-дисульфофенил)-N-трет-бутилнитрона (без добавления воды) (масштаб 100 г).
Динатриевую соль 4-формил-1,3-бензолдисульфокислоты (100,0 г, 0,32 моль, 99,6% масс.) поместили в 1 л круглодонную колбу, снабженную магнитной мешалкой и нагревательным кожухом. Метанол (400 мл) и ацетат N-mpem-бутилгидроксиламмония (73,9 г, 0,48 моль, 1,5 экв., 97,0 % масс.) были добавлены последовательно. Смесь перемешали и нагревали при кипении с обратным холодильником. Через 6 часов HPLC анализ показал 99,1% (по площади) α-(2,4-дисульфофенил-N-трет-бутилнитрона. Реакционная смесь представляла собой белую суспензию. Затем добавили изопропанол (800 мл), и суспензию охладили до 2°С. Продукт отфильтровали с использованием воронки Бюхнера, промыли его изопропанолом (200 мл) и затем высушили в вакуумном сушильном шкафу при 50°С в течение 7 часов. Выход составил 88,0 г (71,9%). Этот пример показывает, что конденсацию можно провести без добавления воды к реакционной смеси.
Пример 7.
Динатриевая соль α-(2, 4-дисульфофенил)-N-трет-бутилнитрона (масштаб 4600 г).
Динатриевую соль 4-формил-1,3-бензолдисульфокислоты (4590,9 г, 14,3 моль, 98,1 % масс.), ацетат N-mpem-бутилгидроксиламмония (3988, 4 г, 24,6 моль, 98,0% масс.), воду (760 мл) и метанол (12,6 л) перемешивали и нагревали в 50 л реакторе с температурой кожуха 75°С. После кипячения в течение 60 минут анализ HPLC (по площади) показал, что реакция прошла до конца (осталось менее 0,3% динатриевой соли 4-формил-1,3-бензолдисульфокислоты). Горячий прозрачный раствор был переведен через расположенный в линии фильтр во второй 50 л реактор, предварительно нагретый до 75°С. После еще 30 минут кипячения добавляли изопропанол (30,0 л) со скоростью 1,2 л/мин. Реакционную смесь охладили до температуры ниже 30°С, профильтровали, промыли изопропанолом (2×8 л), затем высушили в печи Грюнберга (Gruenberg oven) при 70°С в течение 47 часов с получением продукта в виде белого твердого вещества. Выход составил 81%.
Пример 8.
Динатриевая соль α-(2,4-дисульфофенил)-N-трет-бутилнитрона (масштаб 4600 г).
Динатриевую соль 4-формил-1, 3-бензолдисульфокислоты (4509,9 г, 14,4 моля, 98,0% масс.), ацетат N-трет-бутилгидроксиламмония (4000,0 г, 24,6 моля, 98,0% масс.), воду (750 мл) и метанол (12,6 л) перемешивали и нагревали в 50 л реакторе с температурой рубашки 75°С. После 30 минут кипячения с обратным холодильником анализ HPLC показал, что реакция прошла полностью (осталось менее 0,3% динатриевой соли 4-формил-1, 3-бензолдисульфокислоты). Горячий прозрачный раствор был переведен через встроенный в линию фильтр во второй 50 л реактор, предварительно нагретый до 75°С. Еще через 15 минут кипячения реактор охладили до 45°С и добавляли изопропанол (30,0 л) со скоростью 1,2 л/мин. Реакционную смесь охладили до 19°С и добавили воду (1400 мл). Суспензию отстаивали в течение 18 часов. Затем ее профильтровали, и осадок промыли изопропанолом (2×8 л). Продукт сушили в печи Грюнберга при 85°С в течение 23 часов с получением продукта в виде белого твердого вещества. Выход составил 76%.
Пример 9.
Динатриевая соль α-(2,4-дисульфофенил)-N-трет-бутилнитрона (масштаб 43 кг).
Динатриевая соль 4-формил-1,3-бензолдисульфокислоты (45 кг) была добавлена в твердом виде в 500 л реактор, содержащий ацетат N-mpem-бутилгидроксиламмония (39 кг), перемешиваемый со смесью воды (8,6 л) и метанола (111 кг) в атмосфере инертного газа (азота). Эту смесь перемешивали и нагревали при температуре кожуха 70°С. После того, как температура внутри реактора достигла 60°С, нагревание продолжали дополнительно от 2 до 18 часов. Реакция считалась прошедшей до конца, когда анализ HPLC (по % площади) показал наличие менее 0,3% динатриевой соли 4-формил-1,3-бензолдисульфоновой кислоты. Затем горячий прозрачный раствор был профильтрован через находящийся в линии фильтр, в то время как его переводили во второй 500 л реактор, предварительно нагретый до 35°С. Для осаждения продукта был добавлен изопропанол (267 кг). Затем была добавлена вода (13,5 л), и смесь выстаивалась в течение времени от 12 до 18 часов. Белую суспензию перенесли на фильтр-влагоотделитель, промыли изопропанолом (2×71 кг), затем высушили под вакуумом (со слабым током азота) при температуре кожуха 80°С с получением продукта в виде белого твердого вещества (43 кг).
Неожиданно обнаружено, что альдегид общей формулы (II) может реагировать непосредственно с ацетатом N-трет-бутилгидроксиламмония, что является особым преимуществом. Форма свободного основания N-трет-бутилгидроксиламина является нестабильной, имея склонность, в частности, к окислению воздухом. Это доказано возникновением синего окрашивания, что указывает на присутствие продукта окисления - 2-метил-2-нитрозопропана. Следовательно, N-трет-бутилгидроксиламин в виде свободного основания как таковой сложно хранить, но его следует получать в свежем виде непосредственно перед использованием в каждом случае, когда он может понадобиться. В этом заключается потенциальный недостаток способов, в которых требуется применение N-mpem-бутилгидроксиламина в виде свободного основания. Этот недостаток становится особенно неприятным, если реакции проводятся в крупном масштабе. Прямое использование ацетатной соли N-трет-бутилгидроксиламина в способе по данному изобретению обеспечивает решение этой проблемы. Кроме того, если в вышеописанном процессе ацетат N-трет-бутилгидроксиламмония заменить другими солями, например хлоридом N-трет-бутилгидроксиламмония, то реакция идет неудовлетворительно.
В данном изобретении не только можно использовать непосредственно ацетат N-трет-бутилгидроксиламмония, но и реакция с альдегидом формулы (II) протекает значительно быстрее, чем в случае, если N-трет-бутилгидроксиламин используется в виде свободного основания. Так, в данном процессе реакция обычно проходит до конца в пределах 1,5 часа, даже при масштабе 5000 г.
Реферат
Изобретение относится к новому способу получения α-(2,4-дисульфофенил)-N-трет-бутилнитрона формулы I:

где каждая группа R независимо представляет собой SO3Н или ее соль, взаимодействием альдегида общей формулы (II)
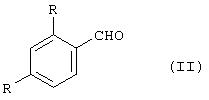
где R определено выше, с ацетатом N-трет-бутилгидроксиламмонием в среде инертного спиртсодержащего растворителя. Способ позволяет исключить использование нестабильного основания, проводить реакцию значительно быстрее, получать целевой продукт с выходом 76-83%. 7 з.п. ф-лы.
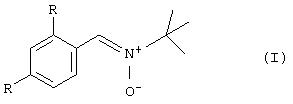
Формула


Комментарии