Бициклические производные гуанидина и их терапевтическое использование - RU2282622C2
Код документа: RU2282622C2
Описание
Настоящее изобретение относится к бициклическим производным гуанидина, которые являются полезными для лечения патологий, связанных с синдромом инсулинорезистентности.
Бициклические производные гуанидина с противогипертоническими или бактерицидными свойствами были описаны в US 3855242, US 4260628 и Yaoxue Xuebao, 1982, 17(3), 229-232.
Настоящее изобретение направлено на обеспечение новых бициклических соединений гуанидина с новыми свойствами.
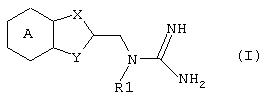
Настоящее изобретение поэтому относится к соединениям общей формулы (I):

в которой:
А обозначает бензольное или пиридиновое ядро, необязательно замещенное одной или более из следующих групп:
- разветвленной или неразветвленной (С1-С20)алкильной группой,
- OR2, где R2 обозначает:
- водород,
- разветвленный или неразветвленный (С1-С5)алкил,
- (С3-С8)циклоалкил или
- бензил,
- NR3R4, где R3 и R4 обозначают, независимо друг от друга:
- водород,
- разветвленный или неразветвленный (С1-С20)алкил,
- бензил,
- ацетил,
- (С3-С8)циклоалкил,
- или, альтернативно, R3 и R4 вместе образуют цикл, содержащий от 3-х до 8-ми атомов, включающий атом азота,
- SR5, где R5 обозначает:
- водород,
- разветвленный или неразветвленный (С1-С5)алкил,
- (С3-С8)циклоалкил или
- бензил,
- галогеном
- циано группой
- нитро группой
- CO2R6, где R6 обозначает:
- водород или
- разветвленный или неразветвленный (С1 -С5)алкил, или
- трифторметильной группой,
Х обозначает радикал -СН=,-СН2-, -N= или -NH-,
Y обозначает радикал СН2, атом кислорода или серы или группу -NR7, где R7 обозначает:
- водород,
- разветвленный или неразветвленный (С1-С5)алкил.
- бензил,
- (С3-С8)циклоалкил, или
- группу СН2CO2Н,
R1 обозначает одну из следующих групп
- водород,
- разветвленный или неразветвленный (С1-С5)алкил или
- бензил
за исключением соединений формулы (I), в которых:
а) - А обозначает бензольное ядро, Х обозначает -СН= или -СН2-, Y обозначает атом кислорода и R1 является атомом водорода;
б) - А обозначает бензольное ядро, замещенное в 5' положении двойного кольца атомом галогена, Х обозначает -СН=, Y обозначает атом серы и R1 является атомом водорода,
в) - А обозначает незамещенное бензольное ядро, Х обозначает -СН2-, R1 обозначает атом водорода или разветвленный или неразветвленный (С1-С5)алкильный радикал, и Y обозначает NR7, где R7 - атом водорода, разветвленный или неразветвленный (С1-С5)алкильный радикал или радикал бензил,
г) - А обозначает незамещенное бензольное ядро, Х обозначает -СН=, R1 - атом водорода и Y обозначает NR7, где R7 обозначает радикал этила, а также таутомерные, энантиомерные, диастереоизомерные и эпимерные формы, сольваты и фармацевтически приемлемые соли.
Среди разветвленных или неразветвленных алкильных радикалов, содержащих от 1 до 20 атомов углерода, которые можно особенно отметить, находятся радикалы метила, этила, пропила, изопропила, бутила, втор-бутила, трет-бутила, пентила, гексила, гептила, октила, нонила, децила, додецила, пентадецила и гексадецила.
В частности, к группе соединений формулы (I), в которой алкильные радикалы являются C1-C5алкильными радикалами.
Среди радикалов циклоалкила, содержащих от 3 до 8 атомов углерода, которые можно особенно отметить, находятся радикалы циклопропила, циклопентила, циклогексила и циклогептила.
Циклы, содержащие от 3 до 8 атомов, включая атом азота, которые можно особенно отметить, включают циклы азиридина, пирролила, имидазолила, пиразолила, индолила, индолинила, пирролидинила, пиперазинила и пиперидила.
Другой частной группой соединений формулы (I) является та, в которой А обозначает необязательно замещенное бензольное ядро. Одна специфическая подгруппа - та, в которой Х обозначает радикал -СН= или -СН2-. Другая специфическая подгруппа - та, в которой Х обозначает радикал -N= или -NH-.
Другой специфической группой соединений формулы (I) является та, в которой Y обозначает радикал -СН2-, атом серы или группу -NR7, где Х предпочтительно обозначает -СН= или -СН2.
Одной целевой подгруппой этих соединений формулы (I) являются соединения, в которых А обозначает замещенное бензольное ядро, более предпочтительно бензольное ядро, монозамещенное в иное, чем 5', положение двойного кольца, или бензольное ядро, замещенное, по крайней мере, двумя группами.
Одной специфической подгруппой соединений формулы (I) является та, в которой Y обозначает атом серы и А обозначает бензольное ядро, монозамещенное в иное, чем 5', положение двойного кольца, или бензольное ядро, замещенное, по крайней мере, двумя группами.
Другой специфической подгруппой соединений формулы (I) является та, в которой Y означает группу -NR7 и А обозначает замещенное бензольное ядро.
Другой специфической группой соединений формулы (I) является та, в которой Y означает радикал -СН2-, атом серы или группу -NR7, где А предпочтительно обозначает замещенное бензольное ядро, более предпочтительно бензольное ядро, монозамещенное в иное, чем 5', положение двойного кольца, или бензольное ядро, замещенное, по крайней мере, двумя группами.
Изобретение также касается таутомерных, энантиомерных, диастероизомерных и эпимерных форм соединений общей формулы (I).
Соединения общей формулы (I) содержат основные атомы азота, которые могут образовать моно- или дисоль с органическими или неорганическими кислотами.
Соединения общей формулы (I) могут быть получены из соединений общей формулы (II):
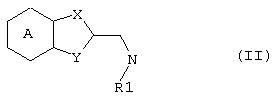
в которой А, X, Y и R1 принимают значения, указанные выше,
и согласно способам получения гуанидина, которые описаны в литературе.
В качестве примера эти способы, в частности, описаны в следующей литературе: Tetrahedron Letters. 1993, 34 (48), 7677-7680; Tetrahedron Letters, 1993, 34 (21), 3389-3392; Tetrahedron Letters, 1996, 37 (14), 2483-2486; WO 98/52917; Journal of Medicinal Chemistry, 1990, 33 (1), 434-444; Journal of Organic Chemistry, 1998, 63, 3804-3805; WO 94/29269; Tetrahedron Letters, 1994, 35 (7), 977-980; Journal of Organic Chemistry, 1992, 57, 2497-2502; Synthesis, 1986, 777-779; Synthetic Communications, 1987, 17 (15), 1861-1864.
Соединения формулы (II) получают простыми и стандартными реакциями, легко доступными специалистам, квалифицированным в данном уровне техники. В качестве примера следующие ссылки объясняют эти синтезы: Oppi Briefs, 1996, 28 (6), 702-704; Heterocycles, 1988, 27 (6), 1421-1429; Pharmazie, 1999, 54 (9), 651-654; WO 95/09159; WO 91/09023; WO 97/42183; Synthetic Communications, 1993, 23 (6), 743-748; Journal of the American Chemical Society, 1952, 74, 664-665; DE 2 739 723; Journal of Medicinal Chemistry, 1994, 37 (23), 3956-3968; WO 93/17025; WO 96/00730; Heterocycles, 1995, 41 (3), 477-486; Journal of Medicinal Chemistry, 1968, 11, 1164-1167; Monatshefte für Chemie, 1957, 1087-1094; Journal of Medicinal Chemistry, 1989, 32, 1988-1996.
Соединения, согласно настоящему изобретению, и в более общем смысле соединения формулы (I)

в которой:
А обозначает бензольное или пиридиновое ядро, необязательно замещенное одной или более из следующих групп:
- разветвленной или неразветвленной (С1-С20)алкильной группой,
- OR2, где R2 обозначает:
- водород,
- разветвленный или неразветвленный (С1-С5)алкил,
- (С3-С8)циклоалкил или
- бензил,
- NR3R4, где R3 и R4 обозначают, независимо друг от друга:
- водород,
- разветвленный или неразветвленный (С1-С20 )алкил,
- бензил,
- ацетил,
- (С3-С8)циклоалкил,
- или, альтернативно, R3 и R4 вместе образуют цикл, содержащий от 3-х до 8-ми атомов, включающий атом азота,
- SR5, где R5 обозначает:
- водород,
- разветвленный или неразветвленный (С1-С5)алкил,
- (С3-С8)циклоалкил или
- бензил,
- галогеном
- циано группой
- нитро группой СО2R6, где R6 обозначает:
- водород или
- разветвленный или неразветвленный (С1-С5)алкил, или
- трифторметильной группой,
Х обозначает радикал -СН=, -СН2-, -N= или -NH-,
Y обозначает радикал CH2, атом кислорода или серы или группу -NR7, где R7 обозначает:
- водород,
- разветвленный или неразветвленный (С1-С5)алкил,
- бензил,
- (С3-С8)циклоалкил, или
- группу СН2CO2Н.
R1 обозначает одну из следующих групп:
- водород,
- разветвленный или неразветвленный (С1-С5)алкил или
- бензил,
и также их таутомерные, энантиомерные, диастереоизомерные и эпимерные формы, их сольваты и фармацевтически приемлемые соли, полезные для лечения патологий, связанных с синдромом инсулинорезистентности (Синдром X).
Инсулинорезистентность характеризуется понижением действия инсулина (Сравни Presse Medicale, 1997, 26 (No.14), 671-677) и включает большое количество патологических состояний, таких как диабет и, более подробно, инсулинонезависимый диабет (диабет второго типа или NIDDM), дислипидоемия (dyslipidaemia), ожирение и также некоторые микрососудистые и макрососудистые осложнения, например атеросклероз, ретинопатия и невропатия.
В этом отношении можно сослаться, например, на Diabetes, Vol.37, 1988, 1595-1607; Journal of Diabetes и its Complications, 1998, 12, 110-119 или Horm. Res., 1992, 38, 28-32.
Соединения согласно изобретению в особенности обладают сильной гипогликемической активностью.
Таким образом, настоящее изобретение также касается фармацевтических композиций, содержащих в качестве активного компонента соединение согласно изобретению.
Фармацевтические композиции согласно изобретению могут быть представлены в формах, предназначенных для парентерального, перорального, ректального, пермукозного или чрезкожного применения.
Поэтому они будут представлены в форме инъекционных растворов или суспензий или мультидозных флаконов, в форме простых или покрытых оболочкой таблеток, таблеток с сахарным покрытием, пластинчатых капсул, гелевых капсул, пилюль, облаток, порошков, суппозиторий или ректальных капсул, растворов или суспензий, для чрезкожного применения в полярном растворителе или для пермукозного применения.
Инертными наполнителями, которые являются подходящими для таких применений, являются производные целлюлозы, производные микрокристаллической целлюлозы, карбонаты щелочноземельных металлов, магний фосфорнокислый, крахмалы, модифицированные крахмалы и лактоза для твердых форм.
Для ректального применения масло какао или стеараты полиэтиленгликоля являются предпочтительными инертными наполнителями.
Для парентерального применения вода, водные растворы, физиологические и изотонические растворы являются наполнителями, которые наиболее подходят для применения.
Дозировка может изменяться в широких пределах (от 0,5 мг или меньше до 1000 мг) в зависимости от терапевтического показания и способа применения, а также возраста и веса человека.
Следующие примеры объясняют получение соединений формулы (I).
ПРИМЕР 1
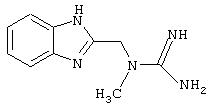
Синтез 2-(аминоиминометил(метиламино)метил)-бензотиазола гидрохлорида
Стадия 1: 2-хлорметилбензотиазол (А)
Хлорацетил хлорид (81,6 мл) прикапывали к раствору, содержащему 2-аминотиофенол (112 мл, 1,04 моль) в дихлорметане (1,2 л) и три капли диметилформамида, поддерживая при этом температуру ниже 40°С. После перемешивания в течение 18 часов образовавшийся осадок отфильтровали с помощью вакуума и растворили в минимальном количестве воды. Водную фазу экстрагировали пентаном, экстракты сконцентрировали в вакууме при комнатной температуре, получили 120 г (65%) хлопьевидного осадка.
1Н ЯМР (ДМСО-d6, 200 МГц) δ: 8,32, д. 1Н, аромат. Н; 8,21, д, 1Н, аромат. Н; 7,77-7,63, м. 2Н, аромат. Н, 5,43, с, 2Н, СН2 Cl
Стадия 2: 2-метиламинометилбензотиазол (В)
А (115 г, 0,62 моль) и 580 мл водного 40% раствора метиламина нагревали в автоклаве в течение 18 часов при 60°С. Реакционную смесь сконцентрировали, остаток очистили методом хроматографии на колонке с силикагелем (7/3 петролейный эфир / дихлорметан), получили 96 г (87%) масла оранжевого цвета.
1Н ЯМР (ДМСО-d6, 200 МГц) δ: 8,03-7,39, м, 4Н, аромат. Н; 4,24, с, 1Н, CH2; 2,61, с, 3Н, СН3
Стадия 3: 2-(аминоиминометил(метиламино)метил)бензотиазола гидрохлорид
55,7 г (0,449 моль) аминоиминометилсульфоновой кислоты прибавляли порциями к охлажденному до 5°С раствору, содержащему В (80 г, 0,449 моль) в диметилформамиде (400 мл), поддерживая при этом температуру ниже 5°С. Реакционную смесь перемешивали в течение 48 часов, охладили до 5°С и прибавили 75 мл (0,9 моль) соляной кислоты концентрированной. После перемешивания в течение 1 часа раствор сконцентрировали и оставшееся масло растворили в ацетонитриле. Образовавшийся осадок отфильтровали с помощью вакуума и затем перекристаллизовали из воды. Получили 40 г (35%) белого осадка.
Т.пл.=203-205°С
1Н ЯМР (ДМСО-d6, 200 МГц) δ: 8,32, д., 1Н, аромат. Н; 8,25-7,40, м, 8Н, аромат. Н, NH и HCl; 5,20, с, 2Н, СН2; 3,10, с, 3Н, NCH3
13С ЯМР (ДМСО-d6, 50 МГц) δ: 168, 32, 159,08, 154,12, 136,33, четвертичный С; 128,20, 127,27, 124,30 и 124,15, аромат. СН; 53,19, CH2; 38,88, NCH3
ПРИМЕР 2
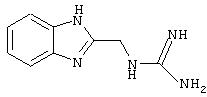
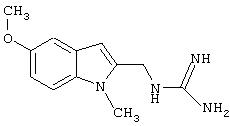
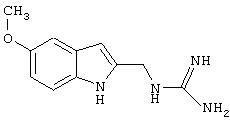
Синтез 2-(аминоиминометиламино)метилбензимидазола гидрохлорида
Стадия 1: 2-аминометилбензимидазол (С)
Раствор 2-аминоанилина (27 г, 0,25 моль) и аминоуксусной кислоты (27,7 г, 0,37 моль) в 250 мл 5,5 М соляной кислоты кипятили с обратным холодильником в течение 30 часов и затем поместили в холодильник на 24 часа. Выпавший осадок отфильтровали с помощью вакуума, растворили в 400 мл метанола и обработали активированным углем. Смесь отфильтровали, растворитель упарили и получили 22 г (49%) белого осадка.
Т.пл.=81-83°С
1Н ЯМР (ДМСО-d6, 200 МГц) δ: 7,40-6.90, м, 4Н, аромат. Н; 3,70, с, 2Н, СН2
Стадия 2: 2-(аминоиминометиламино)метилбензимидазола гидрохлорид
Раствор С (15 г, 0,101 моль) и 1-(аминоиминометил)пиразола гидрохлорида (15 г, 0,102 моль) нагревали в 50 мл диоксана с обратным холодильником в течение 18 часов и затем сконцентрировали досуха. Неочищенный продукт растворили в метаноле (300 мл) и обработали активированным углем. Смесь отфильтровали и сконцентрировали, остаток растворили в минимальном количестве воды, нерастворившиеся примеси были удалены фильтрацией. Раствор был высушен на установке для сублимационной сушки. Получили 14 г (62%) белого осадка.
Т.пл.=171-173°С
1Н ЯМР (ДМСО-d6, 200 МГц) δ: 8,20-7,10, м, 8Н, аромат. Н, NH и HCl; 4,60, с, 2Н, СН2
13С ЯМР (ДМСО-d6, 50 МГц) δ: 158,56, 151,26, 138, 98, четвертичный С; 122,88, 115,76, аромат. СН; 40,32, СН2
ПРИМЕР 3
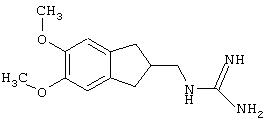
Синтез 2-(аминоиминометиламино)метилиндан сульфата
Стадия 1: 2-метилкарбоксииндан (D)
Раствор α,α'-дибром-о-ксилола (203,51 г, 0,77 моль) в 1,5 л эфира был прибавлен к смеси диэтилового эфира малоновой кислоты (127 г, 0,79 моль), метилата натрия (314 мл, 1,70 моль), этилового спирта (100 мл) и эфира (500 мл). Смесь нагревали с обратным холодильником в течение 5 часов, затем отфильтровали и, наконец, сконцентрировали. Остаток перенесли в 500 мл воды. К раствору прибавили 173 г калия гидроокиси, и смесь нагревали с обратным холодильником в течение 18 часов. Реакционную смесь вылили в раствор соляной кислоты, образовавшийся осадок отфильтровали отсасыванием и затем высушили. Полученный осадок выдерживали при 200°С в течение 20 минут, и вновь полученное твердое вещество перекристаллизовали из 400 мл гептана. Полученные кристаллы перенесли в 400 мл метанола, прибавили 5 капель концентрированной серной кислоты, смесь нагревали с обратным холодильником в течение 4 часов и затем сконцентрировали. Остаток растворили в 600 мл эфира. Эфирную фазу промывали насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлористого натрия, высушили над сульфатом натрия и сконцентрировали. Получили 73,6 г (54%) чистого масла.
1Н ЯМР (ДМСО-d6, 200 МГц) δ: 6,96, м, 4Н, аромат. Н; 3,43, с, 3Н, СН3; 3,11, м, 1Н, СН; 2,91, м, 4Н, СН2
Стадия 2: 2-карбоксамид-индан (Е)
D (102,1 г, 0,58 моль) и 500 мл концентрированного раствора аммиака помещали в автоклав, и смесь выдерживалась при 80°С в течение 18 часов. Образовавшийся осадок был отфильтрован отсасыванием и промыт водой. Получили 63.4 г (68%).
Т.пл=181-183°С
1Н ЯМР (ДМСО-d6, 200 МГц) δ: 7,39, с, 1Н, NH; 7,11, м, 4Н, аромат. Н; 6,85, с, 1Н, NH; 3,12-2,97, м, 5Н, СН2 и СН
Стадия 3: 2-аминометил-индан (F)
Раствор Е (63 г, 0,391 моль) в тетрагидрофуране (1,5 л) прикапывали при охлаждении к суспензии LiAlH4 (74,15 г, 1,95 моль) в (300 мл) тетрагидрофуране, используя сухой лед/ацетоновую баню, затем смесь нагревали с обратным холодильником в течение 2 часов. Реакционную среду нейтрализовали (75 мл воды, 75 мл 5 М раствора натрия гидроокиси и 225 мл воды) и затем отфильтровали. После удаления растворителя получили масло (56,9 г, 99%), довольно быстро образующее карбонат.
1Н ЯМР (ДМСО-d6, 200 МГц) δ: 6,95, м, 4Н, аромат. Н; 2,90-2,14, м., 7Н, 3СН2 и СН; 1, 63, с, 2H, NH2
Стадия 4: 2-(аминоиминометиламино)метилиндан сульфат
Смесь F (20,63 г, 0,140 моль) и S-метилизотиомочевины сульфата (19,5 г, 0,07 моль) и 10 мл воды выдерживалась при 90°С в течение 30 минут (до прекращения выделения газа метилмеркаптана). Полученный неочищенный осадок перекристаллизовали из водно-спиртовой смеси. Получили 12,7 г (38%) белого осадка.
Т.пл.=231-233°С
1Н ЯМР (ДМСО-d6, 200 МГц) δ: 7,05, м, 4Н, аромат. Н; 2,95, м, 2Н, СН2; 2,40, м, 5Н, 2СН2 и СН
13С ЯМР (ДМСО-d6, 50 МГц) δ: 157,07, 142,57, четвертичный С; 126,59, 124,83, аромат. СН; 45,28, CH2N; 38,74, СН; 36,57, 2СН2
ПРИМЕР 4
Синтез 2-(аминоиминометиламино)метилбензотиофена гидрохлорида
Стадия 1: 2-карбоксиэтилбензотиофен (G)
Этил 2-меркаптоацетат прибавляли к охлажденному до 0°С раствору диметилформамида (800 мл), 2-нитробензальдегида (73 г, 0,48 моль) и углекислого калия (80 г, 0,57 моль), выдерживая температуру реакционного раствора при 0°С. После перемешивания в течение 24 часов смесь вылили в 2 л воды и водную фазу экстрагировали эфиром. Эфирную фазу высушили над сульфатом натрия и сконцентрировали. Неочищенный полученный продукт очищали с помощью хроматографии на колонке с оксидом алюминия (петролейный эфир). Получили 34 г (35%) желтого масла.
1Н ЯМР (ДМСО-d6 , 200 МГц) δ: 8,04, с, 1Н, СН; 7,90, м, 2Н, аромат. СН; 7,35, м, 2Н, аромат. Н; 4,20, кв, 2H, СН2; 1,93, т, 3H, СН3
Стадия 2: 2-карбоксамидобензотиофен (Н)
G (34 г, 0,165 моль), концентрированного водного раствора аммиака (120 мл) и этилового спирта (50 мл) загружали в автоклав и выдерживали при температуре 80°С в течение 24 часов. Полученный раствор сконцентрировали, и неочищенный осадок растерли в порошок в простом изопропиловом эфире и промыли пентаном (26 г, 89%).
Т.пл=209-211°С
1Н ЯМР (ДМСО-d6, 200 МГц) δ: 8,59, с, 1Н, NH; 8,32, с, 1Н, СН; 8,15, м, 2H, аромат. Н; 7,89, с, 1Н, NH; 7,64, м, 2H, аромат. Н
Стадия 3: 2-аминометилбензотиофен (I)
Суспензию Н (26 г, 0,146 моль) в тетрагидрофуране (500 мл) прибавляли к суспензии LiAlH4 (33,5 г, 0,88 моль) в тетрагидрофуране (100 мл), и реакционную смесь нагревали с обратным холодильником в течение 6 часов. Затем реакционная смесь была охлаждена до 0°С и разложен избыток LiAlH4 (33 мл Н2О, 33 мл 5 М раствора натрия гидроокиси и 99 мл Н2О). После фильтрации и последующего концентрирования полученный неочищенный продукт очищали на колонке с силикагелем (дихлорметан и затем дихлорметан/метанол 4/1). Получили 13 г (56%) масла.
1Н ЯМР (ДМСО-d6, 200 МГц) δ: 7,65, м, 2H, аромат. Н; 7.12, м, 2H, аромат. Н; 7,08, с, 1Н, СН; 5,46, м, 2H, NH2; 4,60, д, 2H, СН2
Стадия 4: 2-(аминоиминометиламино)этилбензотиофен гидрохлорид
Раствор I (11 г, 0,067 моль), 1-(аминоиминометил)пиразола гидрохлорида (9,8 г, 0,067 моль) в изопропиловом спирте (50 мл) нагревали с обратным холодильником в течение 24 часов. Реакционную смесь сконцентрировали, и неочищенный продукт перекристаллизовали из воды (7 г, 41%).
Т.пл.=163-165°С
1Н ЯМР (200 МГц) δ: 8,44-7,26, м, 9Н, аромат. Н и обмениваемый Н; 4,70, д, 2Н, СН2
13С ЯМР (ДМСО-d6, 50 МГц) δ: 157,56, 141,73, 139,49, 139,36, четвертичный С; 124,90, 124,76, 123,88, 122,88, 122,68, аромат. СН; 40.28, СН2
Таблица 1 итоговых данных формул и характеристик соединений формулы (I).
Результаты фармакологических исследований приведены ниже.
ИЗУЧЕНИЕ АНТИДИАБЕТИЧЕСКОЙ АКТИВНОСТИ НА NOSTZ КРЫСАХ
Пероральная антидиабетическая активность соединений формулы (I) была определена на экспериментальной модели инсулинонезависимого диабета, вызываемого у крыс стептозотоцином.
Модель инсулинонезависимого диабета получена у крыс посредством инъекции стрептозотоцина новорожденным (в день рождения) крысам.
Диабетических крыс используют в возрасте восемь недель. Животных размещают, со дня рождения до дня эксперимента, в помещении для содержания животных при регулируемой температуре 21-22°С и подвергают установленному циклу освещения (с 7 утра до 19 вечера) и темноты (с 19 вечера до 7 утра). Их питание состоит из поддерживаемой диеты, и воду и пищу дают "ad libitum" (Свободно), за исключением голодной выдержки за два часа до испытаний, в течение этого периода продовольствие удаляют (постабсорбционное состояние).
Крысы подвергались действию испытуемого продукта при пероральном введении в течение одного (D1) или четырех (D4) дней. Спустя два часа после заключительного воздействия продукта и через 30 минут после того, как животных обезболили пентобарбиталом натрия (Nembutal®), с конца хвоста отбирали 300 мкл пробы крови.
В качестве примера полученные результаты сопоставлены в Таблице 2. Эти результаты показывают эффективность соединений формулы (I) для понижения гликемии у диабетических животных. Эти результаты выражены как процентное изменение в гликемии на D1 и D4 (число дней воздействия) относительно DO (до воздействия препарата).
Реферат
Изобретение относится к соединениям общей формулы (I)

в которой А обозначает бензольное кольцо, необязательно замещенное одной или более из следующих грууп: -OR2, где R2 обозначает: разветвленный или неразветвленный (С1-С5)алкил, галоген; Х обозначает -СН=, -CH2-, -N= или -NH- радикал; Y обозначает радикал СН2, атом кислорода или серы или группу -NR7, где R7 обозначает водород или разветвленный или неразветвленный (С1-С5)алкил; R1 обозначает одну из следующих групп: водород или разветвленный или неразветвленный (С1-С5)алкил, а также к их фармацевтически приемлемым солям. Также изобретение относится к фармацевтической композиции, обладающей антидиабетической активностью. Фармацевтическая композиция содержит в качестве активного компонента соединение общей формулы (I) и инертный наполнитель. Технический результат - бициклические производные гуанидина, обладающие антидиабетической активностью. 2 н. и 6 з.п. ф-лы, 2 табл.
Формула














Комментарии