Pud-0,1
a
,i
G
Cl
G
j
. U.vJ.
которых E - атом кислорода нлн серы;
Q - водород, низший аЛКИл;
, имеют указанные выше значения, стрелка
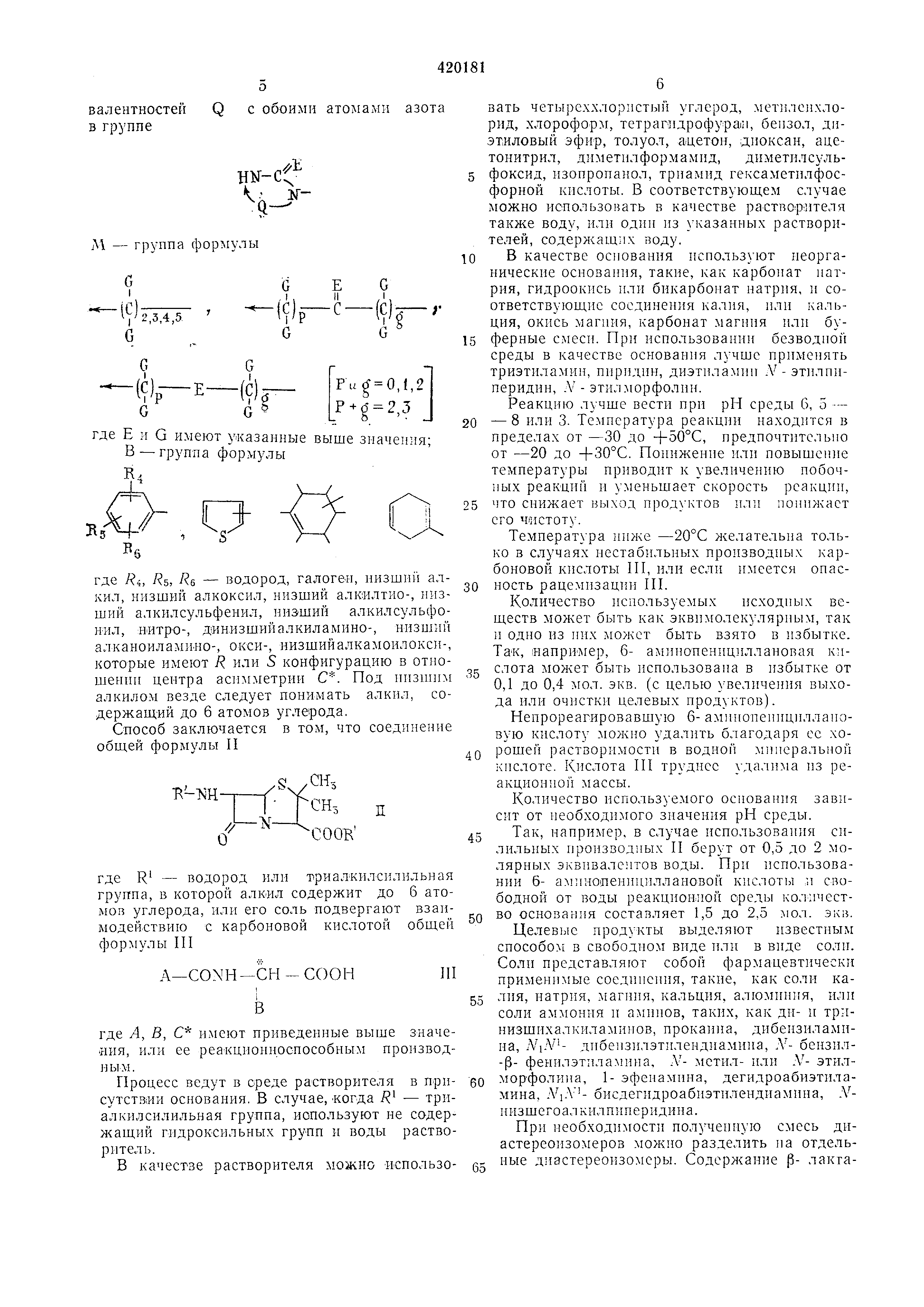
в двухвалентной группе Q означает направление присоединения обоих свободных Q с обоими атомами азота валентностей в группе HN-cf
- группа формулы где Е и G имеют указанные выше значения; В - группа формулы
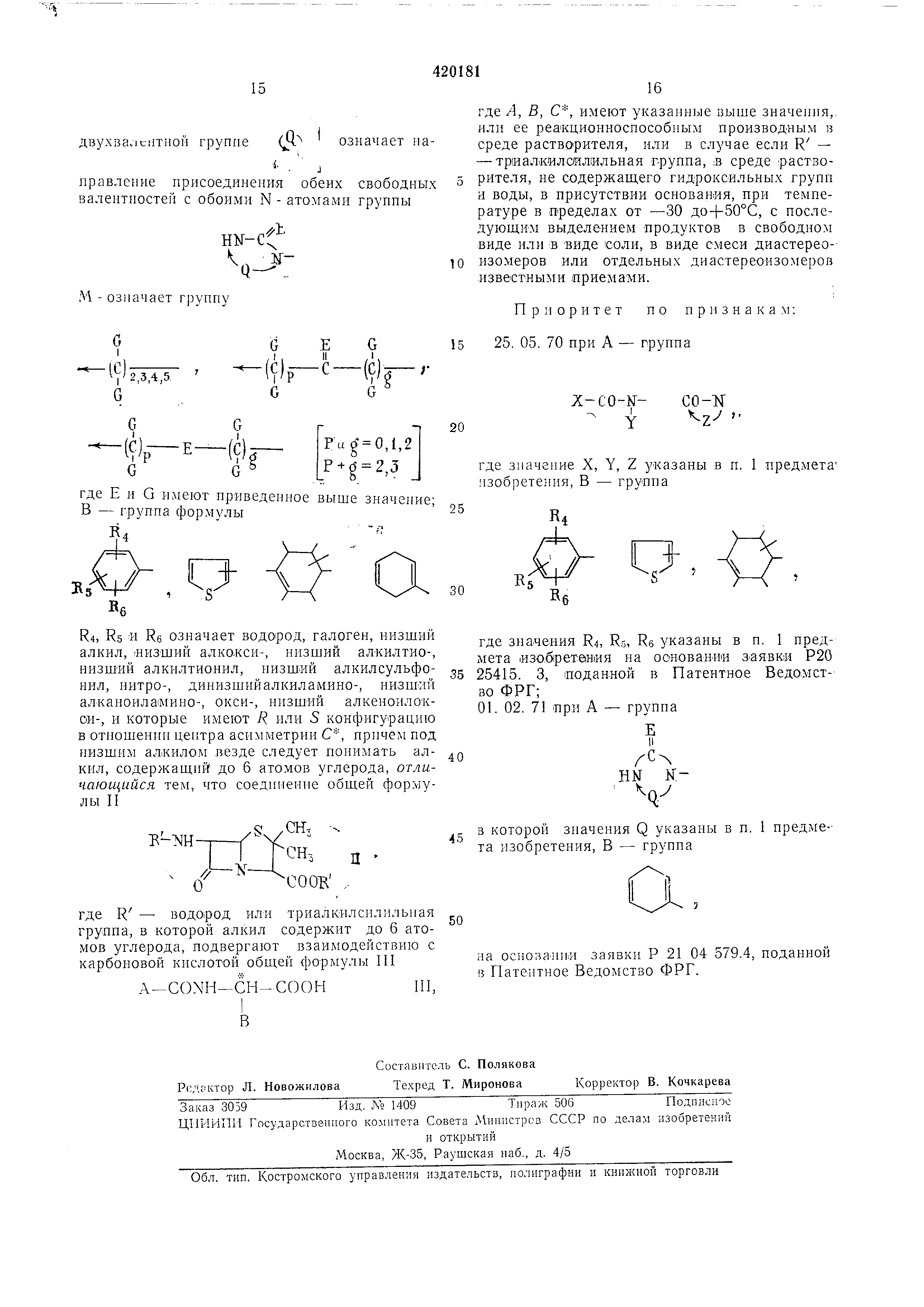
где R, , RU - водород, галоге-н, низший алкил , низший алкоксил, низший алюилтио-, низший
алкилсульфенил, низший алкилсульфонил , нитро-, дин.изшийалкиламино-, низн1ий
алкаиоиламИНО-, окси-, низшийалкамоилокси-, которые имеют R или 5 конфигурацию в отношении
центра асимметрии С. Под низшим алкилом везде следует понимать алкил, содержащий
до 6 атомов углерода. Способ заключается в том, что соединение обш,ей формулы II
, I - рСНз где R - водород или триал«илсилильная
групна, в которой алкил содержит до 6 атомоп углерода, или его соль подвергают взаимодействию
с карбоновой кислотой обш,ей формулы III А-CONH-см -- СООН
где /1, В, С имеют приведенные выше значе ния, или ее реакционноспособным производ ным.
Процесс ведут в среде растворителя в при сутств;ии основания. В случае, КОгда R - три
алкилсилильная группа, используют не содер жаш,ий гидроксильных групп и воды раство ритель.
В качестве растворителя можно использо вать четыреххлористый углерод, метилонхлорид
, хлороформ, тетрагндрофура1Н, бензол, дитиловый эфир, толуол, ацетон, диоксан, ацетонитрил
, диметилформамид, диметилсульфоксид , изопропанол, триамид гексаметилфосфорной
кислоты. В соответствуюш.ем случае можно использовать в качестве раствор:ителя
также воду, или одни из указанных растворителей , содерл ащих воду.
В качестве основания используют неорганические основання, такие, как карбонат натрия
, гидроокись или бикарбонат натр1 я, и соответствуюш ,ие соединения калия, или кальция
, окись магния, карбонат магния или буферные смеси. При использовании безводной
среды в качестве основання лучше применять триэтиламин, пиридин, диэтиламии Л-этилниперидин
, .V - этилморфолин. Реакцию лучше вести при рП среды 6, о --
- 8 или 3. Температура реакции находится в пределах от -30 до 4-50°С, предпочтительно
от -20 до +30°С. Понижение или повышен)1е температуры приводит к увеличению побочных
реакций и уменьшает скорость реакции, что снижает выход продуктов или понижает его Ч1истоту.
Температ ра ннже -20°С желательна только в случаях нестабильных производных карбоновой
кислоты III, или если имеется опасность рацемнзацин III. Количество используемых исходных веществ
может быть как эквимолекуляриым, так и одно из них может быть взято в избытке.
ТаК, иапример, 6- ам 1нопенициллановая кислота может быть использована в 1збытке от
0,1 до 0,4 гол. экв. (с целью увеличен1 я выхода или очистки целевых нродуктов).
Пепрореагировавшую б- амнноиеницнллановую кислоту можно удалить благодаря ее хорошей
растворимости в водной минеральной кнслоте. Кнслота III труднее удалима из реакционной массы.
Количество используемого основания зависит от необходимого зиачения рП среды.
Так, например, в случае использования сиЛИЛЫ1ЫХ производных II берут от 0,5 до 2 молярных
эквивалентов воды. При использовании 6- аминолениииллановой кнслот) л свободной
от воды реакционной среды количество основания составляет 1,5 до 2,5 мол. экв.
Целевые продукты выделяют известным способом в свободном виде или в виде соли.
Соли представляют собой фармацевтически применнмые соединения, такие, как соли каЛ1 я
, натрия, магния, кальция, алюминия, или соли аммония и аминов, таких, как ди- и тринизшихалкиламинов
, ирокаина, дибензилалМИиа , ..- днбензилэтилендиамина, .V- бензил-|3-
фенилэтиламина. Л- метил- или .V- этилморфолина , 1- эфенамина, дегндроабиэтиламина
, . - бисдегидроабиэтиленднамина, .Vнизшегоалкилиннеридина .
При необходимости полученную смесь диастереоизомеров можно разделить на отдельные
диастереоизомеры. Содерл :ание р- лакгама пенициллина определено йодлштрически.
Все опиеанпые здесь вещества обнаруживают соответствующий их конструкции инфракрасный
спектр. CbCiiMKa сиектра ядерного магнпт )юго резонанса (ЯМР) пенициллина происходит
в CDsOD-pacTBOpe; указанные в нрнмерах сигналы соответствуют т-шкале; они соответствуют
полностью данной конструкинн.
При вычислении значения анализа принято
во внимание содержание воды в пеиицнллине.
Пример 1. Натриевая соль
(3-ацетил-З-аллилуреидо) - беизилненициллииа .
В отсутствии влажности растворяют
5,5 вес. ч. Д-а-(3-ацетил-З-аллилуреидо)-а- феиилуксусной кислоты в 50 об. ч. дихлорметана
и охлаждая добавляют 2,0 вес. ч. триэтмламина . Зате.м охлаждают до температуры
от -5 до -10°С и добавляют 3,6 вес.ч. хлорнда тетраметилхлорформамидиния несколькими
порциями в течение иемиогих мииут . Затем размешивают в течеиие 30 мин при
этой же температуре, отсасывают от иерастворившегося осадка, ие допуская, чтобы раствор
иагревался свыше 0°С. Фильтрат охлаждают до -10°С и вводят сразу в охлажденный
раствор с.месь из 4,1 вес. ч. 6- амииопеиициллаиовой кислоты и 3,4 вес. ч. триэтиламнна в
50 об. ч. дихлорметана. 6- Аминоиенициллановую кислоту размешивают в течеиие 1,5 час
при комнатной темнературе с триэтиламииом и 2 вес. ч. растолченного молекулярного сита
(цеолит, VS 10-2); зате.м в отсутствии влаги отсасывают и исиользуют фильтрат для реакции
. Соединенные растворы оставляют стоять в течение 1 час при 0°С и затем выливают
в 100 об. ч. воды. Зиачеиие рН устанавливают на 6,5, отделяют фазу дихлорметаиа и
водяиую фазу расслаивают 200 об. ч. смеси из сложного эфира уксусной кислоты и нростого
эфира (1:1). Прн иитенсивном размешивании и ледяиом охлаждении разбавляют достаточным
количество.м 2 и. соляиой кислоты, чтобы установить в водном слое значение
рН 2,0. Отделяют органическую фазу, нромывают 2 X 40 об. ч. воды и высушивают иад
MgSO4 в течение 2 час в холодильном шкафу . Затем разбавляют 20 об. ч. 1 н. раствора
натрий - 2 - этилгексаната в содержащем метанол эфире, сильно сгущают смесь в вакууме
при 0°С, поглощают в достаточном количестве метанол и осаждают натриевую соль
пенициллина посредством добавлеиия избыточного эфира и сильно встряхивая.
Выход 67%. Содержание (З-лактама 81%.
Найдено, %: С 51,5; Н 6,0; N 10.3; S 5,5.
Вычислено, %: С 51,4; Н 5,3; N 10,9; S 6,2.
По инфракрасному спектру и хроматограмме
в тонких слоях продукт идентиче: с сравнительным препаратом, иолучениы.м из ампициллина
и хлорида Л- ацетил- Л- аллилкарбаминовой кислоты.
Пример 2. Натриевая соль D-a- (3- -хлорбутирил-3- метилуреидо)- бензнлпенициллина
. Как опи.сано в ири.мере 1, из 6,25 вес. ч.
D-0.-(3 -у- .хлорбутирил -3- метилуреидо) фенилукеусной кислоты и 3,6 вес. ч. хлорида
тетраметилхлорформамидиния приготовляют раствор, Который оставляют стоять при температуре
от -5 до -10°С в течение 1,5 час. Затем соединяют с раствором из 4,1 вес.ч. 6аминоиенициллановой
кислоты и 3,4 вес. ч. триэтиламина в дихлорметане и оставляют
етоять в течение 1 час при комнатной температуре . Затем обрабатывают, как описано в примере I.
Выход 62%. Содержание р-лактама 84%. Найдено, %: С 48,1; Н 5,2; С15,8; К 9,9;
S 6,4. Вычислено, %: С 48,0; Н 51; CI 64; N 10,2;
S 5,8.
Сигналы ЯМКп:ри ,3-2,9 (5Н), 4,45 (1Н), 4,55 (2Н), 5,8 (1Н), 6,4 (2н), 6,75 (ЗН).
7,3 (2н), 7,9 (2н) и 8,5 ipipm (6Н). Пример 3. Заменяя июпользуе.мую в примере2D a
(3 Y ---Чорбутирил -3- ме т 1луреидо ) - фенилуксусную кислоту 0,02 моль следующих соединений:
D-a- (3 -13 - хлорпроиионил - 3 - метилуреидо ) - фенилукеусной кислоты,
D - а - (3 - Y - трифторбутирил - 3 - метилуреидо ) - фенилуксусиой кислоты,
D-п- (3- -трихлорбутирил-3- метилуреидо)фенилукеусной .кислоты,
D-a - (3 - Y - трихлорбутирил - 3 - хлорэтил уреидо ) - фенплуксусной кислоты,
D-a- (3-цнннамонл -3 - метнлуреидо) -фенилуксусной кислоты,
(l, 5, 6-тетрагидробензоил) - 3-метилуреидо - фенилукеусной кпслоты
или D-a- (3 - гексагидробензоил - 3 - метилуреидо ) - фенилукеусной кислоты получают следующие
цеиициллииы в виде их натриевых солей:
D - а - (3-,р-хлорнропионил-3 - метилуреидо
) - беизилненициллин, D - а - (3 - Y - трифторбути1рил - 3 - лгстилуреидо ) - бензйлпенициллии,
D-a- (3 - Y - трихлорбутирил - 3 - вдетилуреидо ) -бензилиеиициллин,
D - а - (3 - Y - трихлорбутирил - 3 - хлорэтилурендо ) - бензилпенициллин,
D -а- (3- циннамоил -3- метилуреидо) -бензилиеннциллин ,
(1, 2, 5, 6-тетрагидробензоил)-3-метилуреидо -бензилпеннциллин,
или D - а - (3 - гексагидробензоил -3- .метилуреидо ) -бензилпенициллин.
П р и мер 4. Натриевая соль D, L - а. - (3 -бензоил - 3 - метилуреидо) - п- метилбепзнлненициллииа .
Этот пенициллии получен онисанным в примерах 1 и 2образо.м ,из 5,5 вес. ч. D, L - а - (3 -бензоил
- 3 - метилуреидо) - я - толилуксусиой кислоты, из 3 вес. ч. хлорида тетраметил
.хлорформамидиния и 4,35 вес. ч. 6 - аминопепициллановой .кислоты.
Вы.ход: 59%.
Содержание (3-лактама 84%.
Найдено, %: С 54,9; Н 5,9; N9.5; S (5,6).
Вычислено, %;: С 54,5; Н 5,3; N 9,7; S 7,9,
сигналы ЯМК при ,5 (5Н), 2,5-3,0 (4Ы), 4,3-4,65 (3,ОН), 5,8 (1Н), 6,9 (ЗН), 7,7 (ЗН), 8,2-8,5 ррт (ВН).
П ip и м ер 5. Натриевая соль D, L - а - (3 -Y-хлорбутнрил - 3 - метилуреидо)- а - (2 -тенил
) - метилиеиициллина.
Этот пенициллин получают описанны.м в
примерах и 2 способом из 5,9 вес. ч. D, L - а - (3 - Y - хлорбутнрил - 3 - метилуреидо) - а -
(2 - тенил) - уксусной кислоты, 3,5 вес. ч. .хлорида тетраметилхлорформамидииия и 4,06 «ее.
ч. 6-аминопеиициллановой кислоты.
Выход 64%.
Содержание Р - лактама 95,5%.
Сигналы ЯМК при т 2,5-3,2 (ЗН), 4,1 (1Н),
4,4 (2Н), 5,8 (1Н), 6,3 (2Н), 6,7 (ЗН), 7,2 (211),
7,9 (2Н), 8,4ррт (6Н).
Пример 6. Заменяя исно,1ьзуемую в примере 1 D - а - (3 - ацетил - 3 - аллнлуредо) - фешшуксусиую
кислоту 0,02 моль следующих соедииений:
а - (3 - ацетил - 3 - метилуреидо) - п - толилуксусной .кислоты,
а - (3 - ацетил -3 метилуреидо) - п - хлор } )енилуксусио1 1 кислоты,
а - (3- ацетил - 3 - метилуреидо) - п - метилсульфенилфеиилуксусной кнслоты,
а- (3 - ацетил - 3 - метилуреидо) - п - метоксифенилуксусной кислоты,
а - (3 - ацетил - 3 - метилуреидо) - о - хлорфенйлуксусной кислоты,
а - (3 - ацетил - 3 - метилуреидо) - м - йодфеиилуксусной кислоты,
а - (3 - ацетил - 3- метилурендо) - 2,6 -дп.члорфенилуксусной кислоты,
а - (3 - ацетил - 3 - метилуреидо) - 2,6 - диметоксифеиилуксусной ашслоты,
а - (3 - ацетил - 3 - метилурендо) - 2,4 - дибромфенилуксусной кислоты,
а - (3 - ацетил - 3 - метилуреидо) - к - метилфенилуксусиой кислоты,
а - (3 - ацетил - 3 - метилуреидо) - 2,6 - диметилфенилуксусной кислоты,
а - (3 - ацетил - 3-нетилуреидо) - 2 - хлор - 6 - фторфенилуксуоной кислоты,
а - (3 - ацетил -3- метилуреидо) -2- теннлуксусной кнслоты,
или
а - (3 - ацетнл - 3 - метнлурендо) - 3 - тенилуксуоной кислоты, получают натриевые соли
следующих пеиициллннов:
а- (3- ацетил -3- метилурендо) - п - метнлбеизнлпеннциллии
,
а - (3 - ацетйл -3- метилуреидо) - п - хлорбензнлпеннциллин ,
а - (3- ацетнл - 3 - метнлуреидо) - п - метил .сульфенилбензнлпеннциллнн,
а - (3 - ацетил - 3 - метплурепдо) - п - летоксибеизилпеиицнллин ,
а - (3 - ацетил -3- метилуреидо) -о- хлор беизилненициллии ..
U - (3 - ацетил - 3 - метилуреидо) - м - йодбензил пси и ни л л ли,
а - (3 - ацетил - 3- метнлурендо) - 2,6 -ди.хлорбеизилне шциллии ,
а - (3 - ацетил - 3 - метилуреидо) - 2,6 - ди .метоксибе;13илие1П1Ц 1ллин,
а-(3-ацетил -3- метилуреидо) - 2,4 - дибромбеизилпенициллин ,
а - (3 - ацетил - 3 - метилуреидо) - .i; - Jeтилбеизилиеи ии1ллин ,
а - (3 - ацетил - 3 - мети.чуреидо) - 2,6 - днметилбе 1311лиеииц;1ЛЛ 111 ,
а - (3 - ацетил - 3 -метнлуреидо) - 2 - хлор -6 - 4}торбеиз;;1лненициллии,
а - (3 - ацетил - 3 - метилуреидо) - а -2 - теиилметилпешщиллии,
а - (3 - ацетил - 3 - метилуреидо) - а -3 - теиилметилненициллии.
П р и .м е р 7. Натрневая сол1) D - а - (3 - .метоксикарбопил - 3 - метилуре до) - 2,6 - дихлорбензилпеи игллли 1а
.
1,35 вес. ч. хлорида тетрамети,1хлорформа.М|Идииия
растворяют i 15 об. ч. дихлорметана и
ири отсутствии влаги охлаждают до 0°С. К
этому раствору добавляют 2,4 пес. ч. D - а - (3 - .метоксикарбон:1л - 3 - метилуреидо) - 2,6 -дихлорфенилуксусио
кис.юты в небольшом количестве дн.хлормета)а. Нрн -5°С в течение
30 мин ирикапывают раствор из 1,04 об. ч.
триэтиламнна в 5 об. ч. дихлорметана. Сиустя
еще 40 лит ири -5°С соединяют с и.меющим температуру --20°С раствором трнэтиламииовой
соли 13 2,22 вес. ч. 6 - а.мнноненнци, лаиовой кнслоты i 1,6 об. ч. тр-иэтила.мниа в
25 об. ч. дихлор.метаиа. Зате.м размешивают Б течеиие 30 .ULIH нри 0°С, приче.м после
15 мин добавляЮ;Т еще раз 0,4 об. ч. триэтиламина . В заключение размешивают еще в течение
30 мин нри комиатной темнературе, выливают в воду, при значении рН 6,5 отделяют
водный слой и выделяют натриевую соль пе1П1циллина , как описано в примере 1.
Выход 28%. Содержание (3-лактама 94%. Сигналы ЯМК при т 2,6 (2,1Н), 2,7 (0,9Н),
3,4 (0,7Н), 3,8 (0,ЗН), 4,35-4,50 (2Н), 5,8 (1Н), 6,15 (ЗН), 6,8 (2,1Н), 6,85 (0,9Н), 8,45 ррт
(6Н),
Н р и м е р 8. Натриевая соль L - а - (3 - метоксикарбои л
- 3 - метнлуреидо) - 2,6 - днхлорбензнлпеиициллина .
Этот пеницилл:ии получен ошюаииым в примере 7 образом из 3,1 вес. ч. L - а - (3 - метоксика-рбонил
- 3 - метилуреидо) -2,6- дихлорфенилуксусиой кислоты, 1,74 вес. ч. хлорида тстраметилхлорформ;илам
.идиш1я и 2,87 вес. ч. 6 - аминоненици,1лановой кислоты. Выход 47%. Содержание (3-лактама 92%.
Сигналы ЯЛШприт 2,6(1,8Н), 2,7 (1,2Н), 3,35 (0,6Н), 3,8 (0,4Н), 4,4 (2Н), 5,75 (1Н),
6,15 (ЗН), 6,8 (1,8Н), 6,85 (1,2Н), 8,4 ррт (6Н).
Н р и м е р 9. Натрневая соль D, L - и - (3-метокснкарбонил - 3 - метилуреидо) - 2,6 - ди
.хлорбензилиенициллина.
К суспензии ;;3 3.0 вес. ч. мелкоразмельченного хлорида тетраметилхлорформамидниия li 20 об. ч. сухого ацетона прнкапываЕОт при
0°С ipacTBOp из 5,0 вес. ч. D, L - а- (3 - метоксикарбонил - 3 - метилуреидо) - 2,6 - дихлорфенилуксусной
кислоты в 10 об. ч. ацетона. По истечении 5 мин охлаждают до температуры
-5°С и медленно и равномерно в течение 30 мин ирикапывают 2,1 об. ч. триэтиламина
в 10 об. ч. ацетона при отсутствии влаги. Размешивая , выдерживают в течение 1 час при
0°С и затем отсасывают от осадка, следя за тем, чтобы раствор пе нагревался более че.м
до 0°С .Фильтрат несколькими порциями добавляют в имеющий температуру 0°С раствор
из 3,23 вес. ч. 6 - аминопенициллановой кислоты в 25 об. ч. 80%-ного водиого тетрагидрофурана
(добавление достаточного количества 2 в. NaOH, пока ие иаступит раствореиие
рН 8,2), причем злачен-ие рН поддерживают в пределах 7,5 - 8,0 посредством добавления
2 и. NaOH. Размешивая доводят до комнатной температуры, и продолжают добазлеиие
для поддержания значения рН 7,5-8,0 пока не потребуется больше добавления
раствора едкого натра (1 - 2 час). Затем небольшим количеством разбавлешюй соляной
кислоты устанавливают значение рН на 6,5, добавляют 20 об. ч. воды и выпаривают
тетрагидрофураи в вакууме при комнатной температуре. Оставшийся водный раствор экстрагируют
еще раз с 25 об. ч. эфира, расслаивают 50 об. ч. смеси этилацетата и эфира (1:1).
При ледяном охлаждении подкисляют разбавленной соляиой кислотой до зиачения рП 2,0
и отделяют органическую фазу. Последнюю промывают 2 раза водой каждый раз в количестве
10 об. ч., высушивают над MgS04 в течение 4 час при температуре 0°С и фильтруют
. Посредством добавления 15 об. ч. одиомоляриого раствора натрий-2-этилгексаната в
содержащем метанол эфире осаждают натриевую соль пенициллина. Из смеси почти цолаюстью
отгоияют растворитель в вакууме при 0°С, поглощают в возможно меньше.м количестве
метанола и осаждают продукт посредством добавления эфира. После того, как смесь
простояла в течение 1 час при 0°С, отсасывают , промывают содержащим метанол эфиpo
/,,, Ч-)+- П /лгт ,
RJ, -И2)Г R.- J nRrt t-;
Г., , .. .g/-; k. /
Rv
нг|П)-(сн2).-
КГЧ.. , ..
,-ff
0 R.
и затем в течение нескольких дней высушивают п вакуумэксикаторе над PaOj.
Выход 71%. Содержание р - л,актама 68%.
Найдено, %: С 41,1; Н 5,0;, С1 14,0; N 9,0;
34,9.
Вычислено, %: С 41,3; Н 4,2; С1 12,2; N 96S 5,5.
Сигналы HMRпри т 2,5 (1,95Н),. 2,6 (1,05Н),. 3,35 и 3,40 (0,65Н), 3,8 (0,.35Н),. 4,45 (2Н)),.
5,8 (1Н), 6,2 (ЗН), 6,75 (U95H),. 6,8 (1,05Н) и 8,4 ррт (6Н).
Предмет и з о б р е т е и и я
1. Способ получения пеиициллинов общей:
формулы I
A-CO-Nrt-CH-CG-NH
I В
// N-
25 где Л означает группы
в которых X - водород, алкил с количеством атомов углерода до 10, алкенил с количеством
атомов углерода до 10, винил, циклоалкил и циклоалкеиил с количеством атомов углерода
до 10, арилвинил, моно-, ди- и тригалоиднизшийалкил , моионизшийалкиламнно, дииизшийалкиламино
, моиоариламйио, арил-низший алкиламииоалкоксил с количеством атомов углерода
до 8, циклоалкоксилс количеством атомов углерода до 7, аралкоксил с количеством
атомов углерода до 8, арилоксигруина, иизший алкил - О - V -, низший алкил - S -
-V -, N С - V -, НИЗШИЙ алкил - О -
-СО - V-, т,инизшийалкилам;1но -СО -
-V-,
nr-ni
-.c
V - двухвалентный органический радикал с количеством атомов углерода от 1 до 3;
л - целое число от О до 2 включительно; 1, и каждый означает водород, литро-,
нитрил, динизшийалкиламино-, дииизшийалкиламинока-рбонил , низший алканоиламино-,
низший алкоксикарбоннл, низший алканоилокСИ- , низший алкил, низший алкоксностаток,
сульфамил, хлор, бром, йод, фтор или трифторметил; Y - алкил с количеством атомов
углерода до 10, алкенил с количеством атомов углерода до 10, вииил, пропенил, циклоалкил
и циклоалкенил с количеством атомов углерода до 10, моно-, ди- и тригалоиднизшийалкил
, аралкил с количеством атомов углерода до 8, арил или гетероциклический радикал -Z
-двухвалеитиая груипа
(сн4
21т-i f
()т озиачает целое число от трех до ияти,
стрелка в двухвалентной групие - должна означать, что соединение обоих свободных
валентностей -e-Z- с N и С - атомом груины
СО 1 ироисходит не любым образом, но
, Чсогласно направлоппо стрелки;
Q - двухвалентная груииа следуюшего вида
где Е означает кислород или ;серу;
G - водород нли низший алкил; RI и R2 - водород, иитро-, нитрил, динизшш алкиламиио-
, динизшийалкиламинокарбоиил.
низший алканоиламино-, низший алкоксикарбонил
, низший алканоилокси-, низший алкил, низший алкокси-, сульфамил, хлор, бром, йод,
фтор или трифторметилгруииа, стрелка в


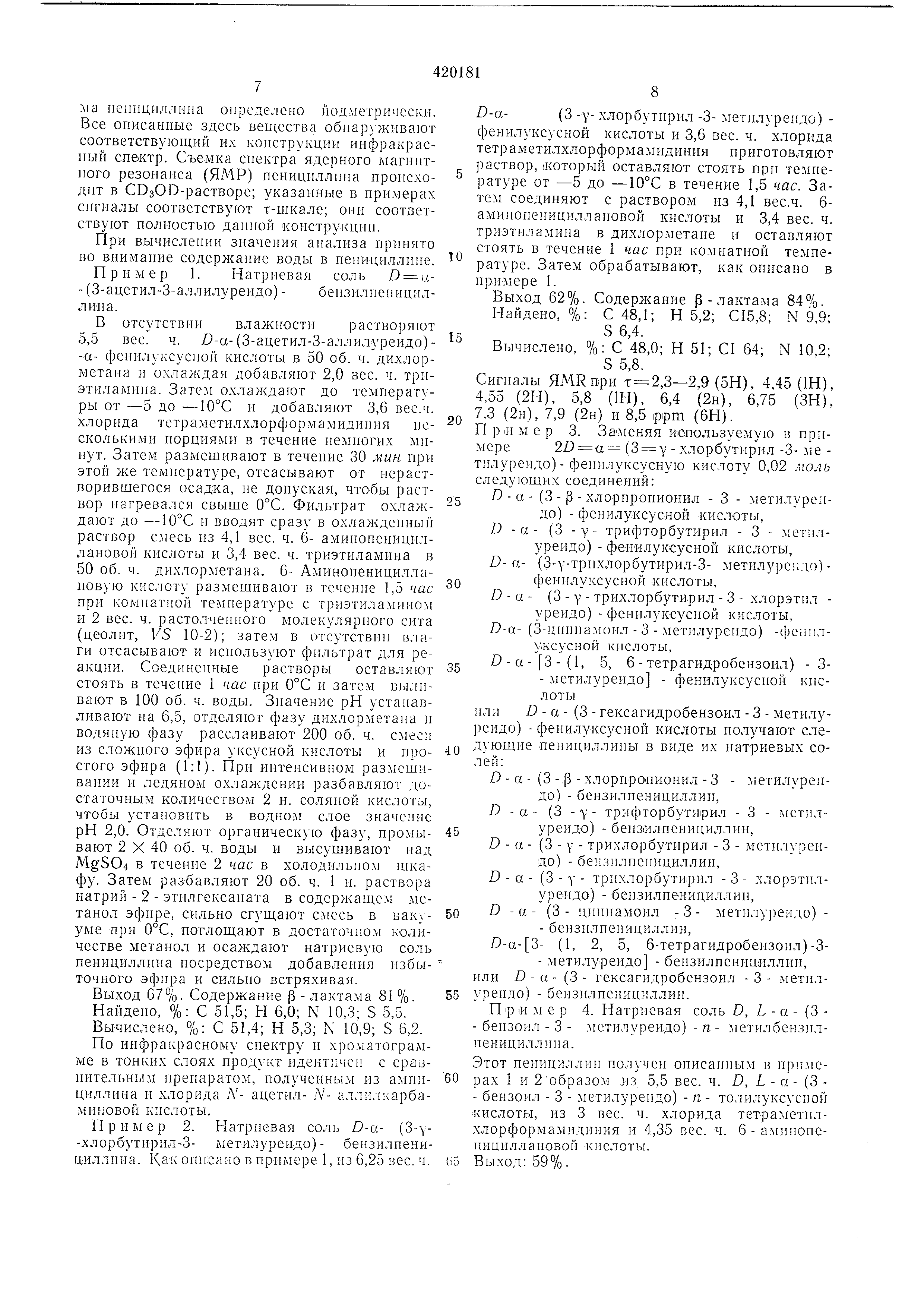






Комментарии