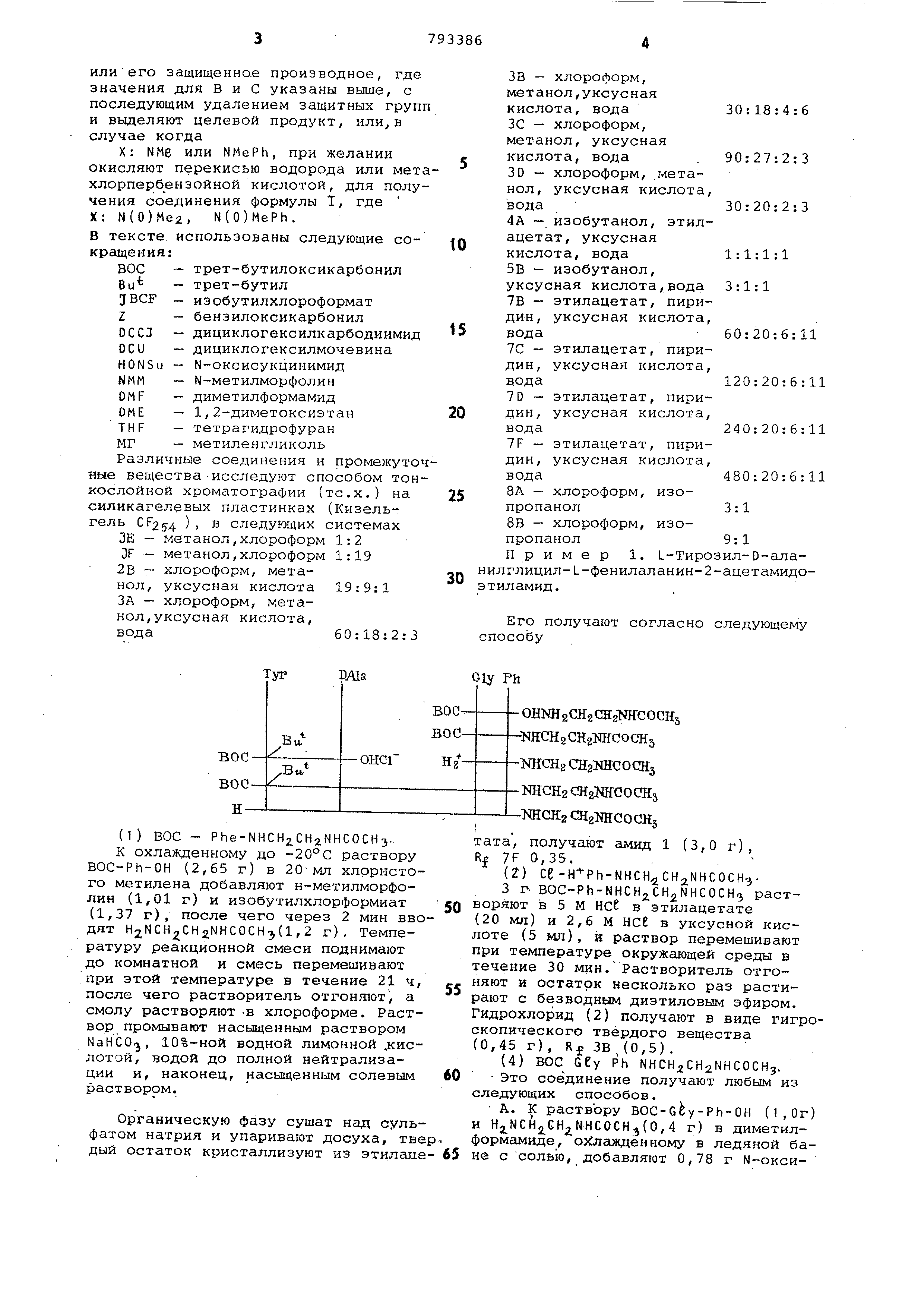
(1) BOC-MePh-NHCHiCHiCHaNMe.
Раствор N-хрет-бутилоксикарбонил-N-метилфенилаланин (2,79 г) 1,01 г. N-метилморфолина в дихлорметане 0.
(20 мл) при перемешивании охлаждают до -20с, затем к нему добавляют 1BCF (1,-37. г) и спустя 5 мин
NH2CH2 CH2 CH,jNMe2.(l,02 г). Перемешивание продолжают 1 ч при -20с, за- 5
тем температуру поднимают до комнатной и продолжают перемешивание в течение
12 ч. Смесь упаривают, остаток растворяют в этилацетате (50 мл).
Этилацетатный раствор промывают водным раствором бикарбоната натрия
(насыщенный, 50 мл), водой (2x50 мл) fi 10%-нсй водной уксусной кислотой
12x50 мл) . Кислые экстракты объединяioт подщелачивают насьпценным раствором
бикарбоната натрия и экстрагируют этилацетатом ( мл). Этилацетатньае экстракты объединяют
, сушат над сульфатом натрия и упаривают, получают названное соединение в виде масла, Ко IE 0,24;
Rn ЗА 0,37. (2)H-MePhe-NHCH2CH2.CH2NMe,. 2НСЕ. Масло, получение которого описано
в стадии (.1), растворяют в этилацетате (10 мл), добавляют НСС в уксусной кислоте (6,63 М, 6 мл) и НС в
этилацетате (5,7 М, 6 мл). Раствор перемешивают в течение 2 ч, упариваю
получают продукт в виде дихлористоводородной соли (2,2 г), Ro IE 0,02; Rr- ЗА 0,08.
(3)BOC-GCy-MePh-NHCHjCH CHjNMe. Раствор трет-бутилоксикарбонилглицича (1,05 г) и 0,606 г N-метилморфолина
в дихлорометане (12 мл) при перемешивании охлаждают до -20 С Добавляют 0,819 г (6 ммоль) изобути
хлорформиата и смесь перемешивают в течение 5 мин перед добавлением (2),
указанного выше (2,02 г) в 5 мл диметилформамида . Раствор перемешивают
в течение 1 ч при -20С и в течение 12 ч при комнатной температуре, затем упаривают. Остаток растворяют в
смеси этилацетата (50 мл) и водного раствора бикарбоната натрия (10%-ный
50 мл). Органическую фазу отделяют, промывают водным бикарбонатом натрия
(10%-ный, мл) и водой (Зл50 мл) Этнлацетатный раствор сушат над суль
фатом натрия упаривают, получают наз ванное соединение в виде масла. R IE 0,21; R ЗА 0,37.
(4) И - b t- у - М е Р h - N Н С Н 2 С Н 2 С Н N Н с Защищенный дипептид (з) обрабатывают
указанным способом (2), получаю дихлористоводородную соль (4) (2,0 г 3 виде белого твердого вещества,
Rr IE 0,03; Rr ЗА 0,03. , (5) BOC-Tyr ()-DAEa-Cey-MePh-NHCH2 CH2CH ,2NMe2 .
Раствор BOC-Tyr(BU)-D-Ata-OH (1,22. r) , H-Gey-MePh-NHCH2CH2CH2NMe2
V2HCe (1,18 r), 0,345 г N-оксисукцинимида и 0,30 г N-метилморфолина в 20 мл безводного диметилформамида
охлаждают до . Добавляют ССС (0,680 г), смесь перемешивают в течение 18 ч, затем выпаривают. Остаток
растворяют в этилацетате (50 мл и пpp 1Ь Iвaют водным бикарбонатом натрия (10%-ный, 2-.50 мл), водой (
50 мл) , отделяет этилацетатный слой, сушат, его над сульфатом натрия Т DAla Gly
и упаривают досуха. Остаток раствояют в метаноле, выносят в колонку
с силикагелем (35 к 2 см) и продукт элюируют системой IF. Фракции, содержащие
нужное соединение, собирают, упаривают и остаток растворяют в этиацетате (100 мл). Этилацетатный
раствор промывают водным бикарбонатом натрия (10%-ный, 3X100 мл), сушат,
упаривают, получают названное тетрапептидное соединение (5) в виде белого твердого вещества Кл IE 0,18;
RO ЗА 0,39..т (6) H-Tyr-D-AEa-Cey-MePh-NHCH2 .CH-2CH2NMe2.
К раствору 500 мг защищенного тетрапептида (5) в 5 мл этилацетата при
перемешивании добавляют раствор хлористого водорода Б этилацетате(5,7 М,
2,5 мл). Спустя 1 ч реакционную смесь фильтруют и остаток промывают петролейным
эфиром, сушат и лиофилизируют из воды, получают продукт (380 мг) в виде белого твердого вещества.
Rr 4А 0,27, Rr ЗВ О , 47 , oL J Jl + + 23,6 (, 0,1 М нее).
Пример 3. 1-Тирозил-0-аланилглицин-N-L-фенилаланин-2-диметиламинопропиламид-М-окись .
(1)ВОС-Туг(Ви)-0-Аеа-СЕy-MePh-NHCH2CH2 .CH2N(0)Me2.
К раствору 500 мг БОС Ту г ( Ви) - D-Aea-GEy-MePhe-NHCH2 .CH2.CH2NMe.,(500 мг)
в 10 мл метанола добавляют водный раствор перекиси водорода (30%-ная,
0,16 мл) и раствор перемешивают в течение 48 ч при комнатной температуре
. Отфильтровывают выпавший осадок, маточник упаривают, получают нужную
защищенную N-окись в виде смолы. Rr- IE 0,08; Rf ЗА 0,41. (2)HTyr-O-Ata-GSy.-MePh-NHCH2CH2CH2N
(0)Me2. Смолу, полученную в стадии (1), растворяют в 5 мл этилацетата и к
раствору добавляют раствор HCg в этилацетате (2,63 М, 1 мл). Раствор
перемешивают в течение 1 ч, отфильтровывают , сушат твердое вещество и
лиофилизируют из воды, получают нужный продукт (240 мг) в виде белого твердого вещества.
R 4А 0,56, Rj3B 0,52,roiJ/ + + 18,8° (с l; 0,1 М нее).
Пример 4. 1-Тирозил-0-аланилглицил-М-метил-1-фенилаланин-2-диметиламиноэтилам-ид .
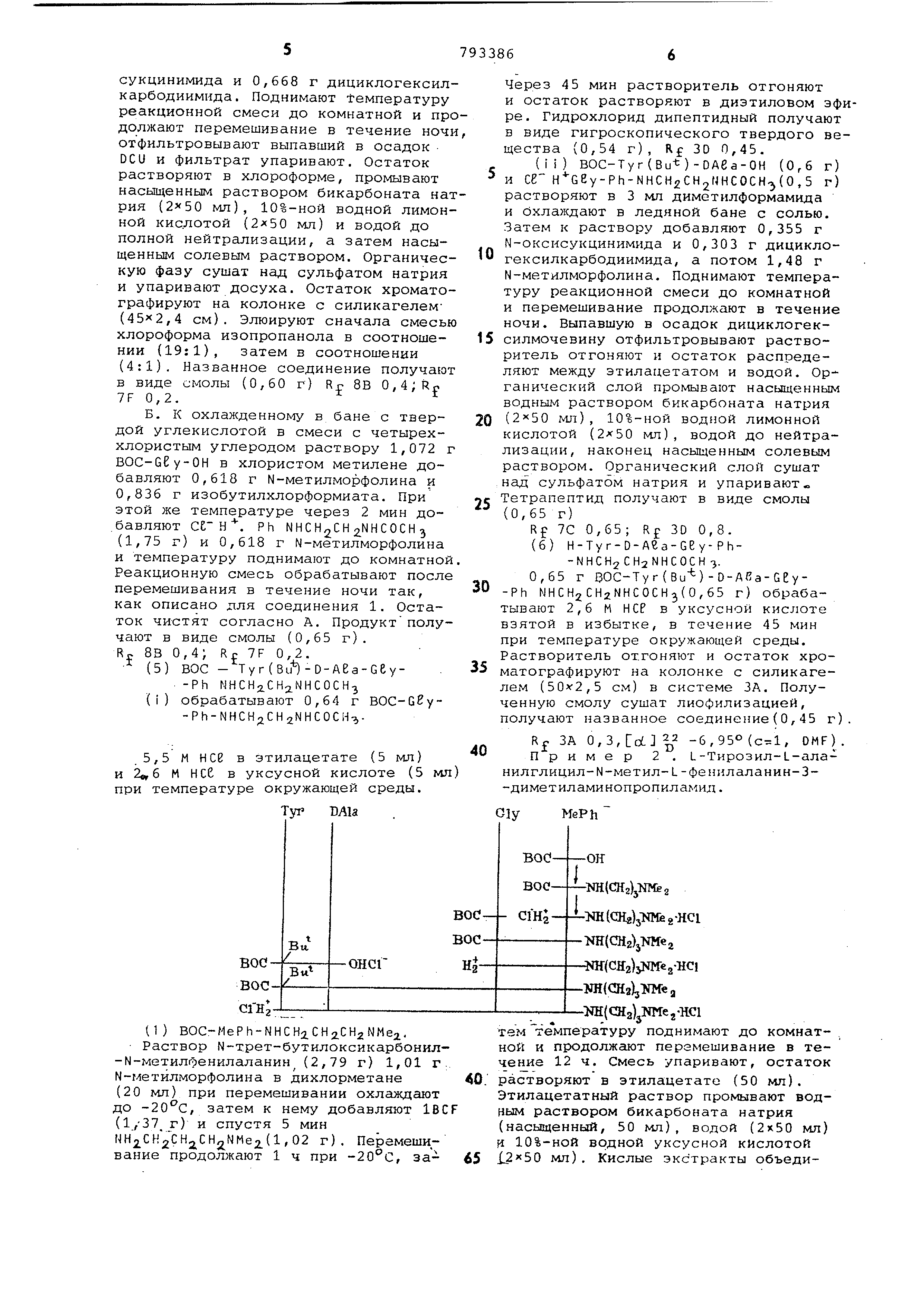
Это соединение получают согласно следующему способу. MeRh. (1)BOC-MePh-NHCH CH NMe. BOC-MePh-OH и N,N-диметилэтилендиамин
конденсируют в условиях описанных в примере 1 (1), получают амид в виде масла.
(2)HMePhe-NHCH2.CH2NMe2. 2НСе . М-Защищенный амид из указанной стадии (1) деблокируют в условиях,
описанных в примере 1 (2), получают целевую хлористоводородную соль в виде масла,
(3) BOC-Tyr(Bu--t-)-D-Ala-Gly-MePh-NHCHxNHCH CHjiNM.. К раствору 700 мг (1,5 ммоль)
BOC-Ter(Bu)-DAla-Gly-OH в 7,5 мл безводного тетрагйдрофурана добавляют 15.2 мг.(1,5 ммоль) N-метилмррфолина
,. раствор охлаждают до -15°С, не., прекращая перемешивания
добавляют 205 мг (1,5 ммоль) изобутилхлорформиата . Через 5 мин вводят
раствор 2НС IH.-MeP.h-NHCH.CH2NMe ( 568 мг, 1,5 lмoль) , а затем 303 мг
(3 ммоль) М-метил1у1Орфолина, Спустя 18 ч реакцио,нную смесь упаривают
и остаток распределяют между 50 мл этилацетата и насыщенным водным раствором бикарбоната натрия (50 мл
Отделяют этилацетатный слой, промывают его насыщенным водным раствором бикарбоната натрия (50 мл), водой
(2 X 50 мл) и рассолом (50 мл) сушат над сульфатом натрия;упариваю Остаток хроматографируют на силикаг
ле, используя систему 7В.,Подходящие фракций, содержащие продукт,объ единяют, упаривают, получают целево
тётрапептидный амид (700 мг) в вид стеклоподобного твердого вещества.
(4) 2НС I HTyr-DAIa-Gly-MePh-NHCHjCHjNMCj , Защищенный пептид, полученный ка
описано в стадии (З), деблокируют в условиях примера 2(6), получают целевой продукт.
После лиофилизации, получают тёт рапептидный амид (200 мг) в виде бе лого твердого вещества, R 7В 0,04;
Rr ЗА 0,07; Rf 4А 0,23. ,2° (с 0,50, DMF). Пример 5. и-Тирозил-О-аланилглицил-L
- фенил алани нтиоморфолин амид-S-окись. . BOC-P 1-N J
Раствор 1,32 г BOC-Ph-OH и 680 м изобутилхлорформиата в 10 мл димети
формамида, охлаждают до -2Q°C и при перемешивании добавляют к нему 520
N-метилморфолина. Спустя 2 мин ввод холодную суспензию, состоящую из 690 мг тиоморфолин гидрохлорида
(690 мг) и 520 мг N-метилморфолина в 8 мл диметилформамида. Перемешива
ние продолжают в течение 30 мин при -20°С, а затем при комнатной температуре
в течение ночи. Растворитель отгоняют, полученный материал распределяют
между этилацетатом и насыщенным водным раствором бикарбоната натрия . Этилацетатный слой отделяют и
промывают насыщенным раствором бикарбоната натрия, дважды 10%-ным раствором
лимонной кислоты в воде, а затем водой и, наконец, насыщенным раствором хлористого натрия. Этилацетатный
jpacTBOp сушат над сульфатом натрия, упаривают, получают тиоморфолинамид в виде смолы (1,5 6)г .
/- ( 2) H-Pii-:t js При перемешивании к раствору /-Л
1,05 г S в 3 мл уксусной кислоты при комнатной температуре добавляют раствор, хлористого
водорода в уксусной кислоте(2,6 М, 3 мл) и через двухчасовые интервалы
добавляют еще 3 мл двумя порциями . Растворитель и хлористый водород отгоняют, остаток растирают с
безводным диэтиловым эфиром, эфир декантируют, а остаток растирают со
свежеперегнанным безводным эфиром, получают фенилаланинтиоморфол.инамид
в виде твердого вещества (788 мг). (3)BOC---Gly-Ph --Gly-Ph-N S
384 г BOC-Glv-OH (384 мг) конденсируют с.Ph-N S-HC (572 мг) собом, описанным выше дляВОС-Pti-N S, используя 258 мг изобутилхлорформиата
и 424 мг N-метилморфолина. Получают 774 мг дипептидного амида, (4)ВОС - Tyr(Bu) -БА1а- Oly-Ph- I
697 мг BOO -O y-Ph-7 S смешивают с водной трифторуксусной кислотой (вода : трифторуксусная кислота
1:9,9 мл) в течение 1 1/2 ч.Кислоту отгоняют и остаток растирают с диэтиловым
эфиром, получают порошок, который растворяют в 5 мл безводного
1 мг (5 мл) и доводят рН до 8 с помощью N-метилморфолина (влажная индикаторная бумага). Добавляют
BOC-Tyr(Bu)-DAIa-OH (680 мг) , N-оксисукцинимид (211 мг) в 3 мл диметилформамида, а затем 377 мг
дициклогексилкарбодиимида и смесь перемешивают в течение ночи при комнатной
температуре. Твердое вещество отфильтровывают и фильтрат упаривают
осуха. В остатке получают смолу,которую распределяют мелоду этилацетатом
и насыщенным водным раствором бикарбоната натрия. Этилацетатный лой дважды промывают насыщенным
одным бикарбонатом.натрия, затем рииоды 10%-ной лимонной кислотой в
воде, потом водой и насьш енным раствором хлористого натрия. Сушат над
сульфатом натрия; упаривают и получают защищенный тетрапентидтиоморфо линамид (1,09 г). , .
(5) Tyr-BAla-Gly-Fh-J S;: Защищенный тетрапептидтиоморфол амид {1,0 г) перемешивают в водной
трифторуксусной кислоте (Н20:CFgCOO 1:9,9 мл) в течение. 11/2 ч..После
упаривания и. растирания, с диэтиловы эфиром получают твердое вещество,ко торое чистят хроматографически на
силикагеле (хлороформ:метанол:уксу ная кислота 60:18-1:1,5), а затем ионообменной хроматографией (смола
Сефадекс SP, пиридиниевая форма используя градиент от 2% пиридина в воде до 5%. пиридина и 1%-ную уксусную
кислоту в воде). Продукт лиофилизируют, получают тетрапептид тиоморфолинамид (495 мг).
Туг-БА1а -1, /-V Тур -М1а - С1у -Pii- (10 О мг)
в этаноле (50 мл),.обработанный пос ледовательно тремя порциями (20% по
объему) перекиси водорода (0,3 мл каждая) с интервалами в 45 мин при
перемешивании при комнатной температуре . После дальнейшего перемешивания
в течение 1 ч раствор упаривают досуха, остаток растворяют в воде (20 мл) и лиофилизируют, полу
чают белое твердое вещество (98 мг R ЗА 0,25} R 1C 0,06; R . 5В 0,38 „5
--+53,1(с 0,47, в 0,1 H.-I-ICI ) . Примере. 1-Тирозил-0-алани
глииил-1-фенилаланин-2-аминоэтилами Tyr-DAIa-Gl у-MePhe-NH Cfl. CH2NH Z
(полученный способом, описанным в мере 4) (350 ME) растворяют в 20 метанола и добавляют к суспензии
10% палладия на угле (100 мг) в 10 мл воды. Водород барботируют в течение 4 ч при . Катализатор
тем отфильтровывают и растворитель отгоняют при пониженном давлении.О
таток растворяют в небольшом количестве 1% пиридина в воде и вносят , в колонку с Сефадексом ЗР (элюирую
градиентом 1% водны.й пиридин - 1 водный пиридин ацетат-я 5% вод
ный пиридин аде тат) . Соответствую-. щие фракции объединяют и растворитель отгоняют в вакууме, Продукт
(220 мг) сушат вымораживанием из воды, Ri ЗВ 0,45; Ri 4А 0,56; +22,22 (с 0,98; 0,1 M
HCI). Пример.. 1-Тирозил-0-aлaнилглицил-N-мeтил-L-фeнилaлaни н-3-тpимeтилaмIvIoний пропил амид ацетат- . - .. .( 1) BQ.C;-;T:y r(-:B-u% D А la-Gly-HePhe
.-NHCH-2 CH;2;:c;H2;NHej-OAf.. К раствору;: б 4 6 мг В О С - Т у г ( В и ) -DA
I a-G.i:y.-MePh..-NHC(:l2;CH.;2.CHiNMe2 (640 мг). .в 5.;мл эт.анола добавляют
йодистый мети.л; (5;72 :Мг.) /и раствор перемешн.вают. .при. .комнатной температуре
, в течение-.-48. ч. Затем, раствор упаривают , ост.аток раствор.яют в
этилацетате и .хроматографируют на колонке, с силикагелем (40x2 см), продукт элюируют смесью этилацетат
.: Пиридин : уксусная кислота : : вода 90 : 20 : 6 : 1.1. Объединяют
фракции, содержащие целевое соединение ,, .упаривают, . получают твердое
вещество (320:мг.) . R. ЗА 0,17; R ЗВ 0,74;. ;R. 4А .0,47. (2) .Н-Ту r-D.AI a-GLy-MeP.he-
N НС И . СН, С Н Н е ,,. .АЦет ат Растворяют- .Указанный, защищенный
тетрапептид (ЗОО мг) в эт.илацетате (10 мл) и. краствору .при перемешивании
добавляют раствор HCI в этилаи ,ётате (3 , 9 М , 4. мл). Через 1 чсмесь
упаривают, остаток, растворяют в воде и. вносят на колонку с целлюлозой СМ 52 (35 X. 3 см), продукт
элюируют. линей.ным градиентом концентрации от 0,05 -ного водного пиридина
до 1%-ного-водного пиридинса1етата . .Объединяют фракции, содержащие целевое.соединение, упаривают.
и остаток лиофилизируют из воды, получают целевой продукт (110 мг) в виде белого твердого вещества.
R. ЗВ 0.17; R 4А 0,13; Rr 5В 0,05; ci ,./, -37,75°(с. 0,5,DMF).
Пример 8. 1-Тирозил-0-метиоНИЛглицил-N-метил-L-фенилал ани в- 2-димётиламиноэ тиламид-N-окись .
(1) вое-Giy-MePh-NH (01-12)2 N (О ) Meg . Краствору BOC-Gly.-MePh-NH (СНа) NMe-j,
в 200 мг метанола добавляют 1,23 г м-хлоронадбензойной кислоты. Реакционную
смесь перемешивают при 22°С в течение 2 ч, затем оставляют при на 18 ч.
. Растворитель отгоняют при пони- , женном давлении и остаток растворяют
в 150 мл этилацетата, раствор промывают насыщенным водным раствором бикарбоната натрия (2x30 мл),
над сульфатом натрия и упаривают , получают . N-OKHCb (1,9 г); Rr ЗА 0,76 ; R 4А 0,64. .(
2) НС 1 HGI y-MePh-NH (042)2.(0) Указанную .защищенную N-окись
(1,8 г) растворяют в 10 мл этилацетата и краствору добавляют уксусную
кислоту (10 мл). Затем в раствор вводят раствор хлористого водорода
в этилацетате (3,9М, 12 мл) и смесь перемешивают при 21 С в течение 30 мин. Растворитель отгоняют
в вакууме и полученное твердое вещество, растирают с безводным диэтиловым
эфиром (2 X 40 мл), Хлористоводородную соль М-окиси (1,5 г) отфильтровывают, R 4А 0,40.
(3) BOC-Tyr(But)-DMet-GI y-MePh-NH (CH,, )2 N(0)Me2.
К раствору 1,8 г ВОС-Ту г (Bu)-DMet-OH в 10 мл безводного THF добавляют 0,87 г N-оксисукцинимида,
1,5 г HCI-HGIy-MePhe-NH(CH2)2N (0)Me2 и и, 84 мл N-метилморфолина
растворяют в 2 мл безводного THF. Оба раствора смешивают,охлажда до -10°С и добавляют к смеси 0,87 г
дициклогексилкарбодиимида. Смесь перемешивают при -10°С в течение 2 ч, затем при 20°С в течение
18 ч.
Реакционную смесь отфильтровываю и прозрачный маточник упаривают под
вакуумом. Полученную смолу распределяют между этилацетатом (60 мл) и водой (10 мл), органическую фазу
отделяют и промывают 10%-ным водным раствором бикарбоната натрия (1x10 мл), а затем экстрагируют
10%-ным водным раствором лимонной кислоты (5x15 мл). Величину рН водной фазы доводят до 7, используя
твердый бикарбонат натрия, и продукт экстрагируют этилацетатом (3x40 мл). Органическую фазу сушат
над сульфатом натрия и упаривают, получают смолу (1,35 г). Rn ЗА 0,48
(4) HCI -H-Tyr-OMet-Gly-MePh-NH (CH2 )2.N(0)Me2.
1,11 г BOC-Tyr()-DMet-GI у
.-MePh-NH(CH2)2 N(0)Mea растворяют в смеси трифторуксусной кислоты (36 мл) и воды (4 мл), содержащей
анизол (0,2 мл). Смесь перемешивают в течение 30 мин при 22°С, затем упаривают в вакууме. Продукт
чистят хроматографией на силикагеле используя градиентную систему (система растворителей ) в качестве
элюента. Материал после очистки на колонке Q силикагелем переносят в колонку с карбоксиметилцеллюлозой
, элюируют градиентом от 0,1%-ного водного пиридина до 1,5%ного водного пиридинацетата.
Соответствующие фракции объединяют , выпаривают, остаток высушиваю
повторным вымораживанием из разбавленной HCI, получают целевой гидрохлорид (341 мг).
.Rf ЗВ 0,31; R 4А 0,44;Rf 5S 0,19;Cd::; g +29,30° (с 0,99, О , 1 н . Н С I ) .
.Пример 9. L-Тирозил-О-метионил
(сульфоксид) глицил-М-метил-L-фенилаланин-2-диметиламиноэтиламид-Н-окись .
К раствору 418 мг HCl-H-Tyr-DMet-Gly-MePh-NH (CH2)2N(C)Me2 в 150 мл этанола добавляют 1,46 мл
перекиси водорода. Раствор перемешивают при 21°С в течение 24 ч,
после чего растворитель отгоняют при пониженном давлении и полученный материал чистят хроматографически
на целлюлозе СМ,. используя градиент ,ное элюирование от 0,1%-ного водного
I пиридина до. 1,5%-ного водного пири дин- ацетата.
Материал, полученный после очистки на колонке, высушивают повторным
вымораживанием из HCI, -получают целевой гидрохлорид (354 мг).
R ЗВ 0,32; Rf 4А 0,43; R 5В 0,32;Со(.ъ° +9,16° (с 1,05; 0,1 н- HCI ) .
В табл.1 указаны подробности получения других соединений формулы I
способами, описанными в указанных примерах.
Ниже перечислены другие типичные
соединения по настоящему изобретению:
)Wa-Cib-Me,PVi(napa-ce,)-NHCH2CH2N(oMej
H-T4r-D№Q-Qt -Ph(nQpa-Ct)-NHCHaCH2.N(.
H-lVn-MU- Gly-KePh-NC
(о)Мвг
J it-tpef if
H-Tyr - DAla - Cly-TTePJi-N:
СНгСН2М(0)Мег
H - Тур - DAla - Cty -ИГеРЙ- К fJ
CH2CHzN(0)Me2
Л - Туг - D Ala - Cly N
ОН2СНгТ Р(о)Мег
СНгСНг
H-Tyjp - HAIa- Cly -MePh TV
CIH2CH2N(0)Me2
H-Typ-DAla-Oly-MePh N
iH-tyr-DAla-OIy-MePh N
CHgCHaWtOjKee
CHgCHs
/
H-Typ-HAla-Ciy-WePh
CHaCHsNfOlMeg
СПгСНе H-TyP-DAla-Gly-MeFh Nci
CHgCHaNlOlMea
CHg снг Cly - KePh IT
СНгОТг 10)Ме2
СНаСНгGly-WrePJh . ISTОИ
С 2СЛ2Т 1о)Гег
caijCHa OH25 H Tyi - DAla - GJy -MePn N, CH2GH2N(o)
,-л СНзСНа-С У-ОМ( |.1.,А1а-О у-МеР1да 30 CH2CH2N(0)M.2
СН2СН2Н-ТуР -DAla - Oly -MePli--N - оме CH2CH2N(0)M-e2
СЯгСТз И -Туг - DVU а - 0 y- TePh-K. оКе С1Г2СН2ТЧ(о)Меа
Н - Тут - БА1а- Gly - IePh- WiCH2.CH2K(0)MeCH2CH2 aij f- ТУР GlY-MePh-ЖСНо
СМгШзРЯ Н-Tyr-UAla- Cly-MeFH -NHOtia cHaWicoTfiicHs HzCiij.
H - Туг -DAla - Cly-Ph -N SOg H- Туг-DAla- Cly-KeFh- . li Тур HAla - Cly -HePti -(/
Me
-N N
e
H-T f-DA a-Gbv-Ph
CH,.COO
J
дле
H-T4r-DAEa-Ge.4-ANepti-N::;; 2C2P
5.CH CH NCOWEj
н-т г-вАеа-йеу-меРЪ чнсн2Сн,н(
H-Tyr-DVae. -GeN-MePhNHCH,.(.o)Me2 H -D-Ley-cey -MePti NHCH2 CH2H(.o)Me2
H-Tvr-DNbe.u-Ge-y N e,PViNHCH2 CHjNCOW62,
H-Tyr--DTra-c,ey-Me,PhNviCH.jCH2N(o),.
H -Tsr -DAta - Qe.i -Wepti NHCH- CH NHMe
20 H-jyv-D )- eph lнcн2al,.,)
H-T jr-ВКШ- aE -MePVi ННСН2 СН2 Ю:; -Ь2 Q 50
55 Q й5 H-T r-Dfkta -Gt -MePti NHCH2CH,
H-T l--DA&a-GE-J-N ePliKHCH2CH,.t2 Исходные амины формулы HNRgRX,
используемые при получении соедине ий/ описанных в вышеуказанных при Р
®сли они не являются коммерчески доступными, могут быть получены известными способами, либо так как
описано в нижеследующих примерах. П р и м е р А. N-Изoaмил-NN-диметилэтилендиамин .
(1) Me,CHCH5CONHCI-U CH2NH2: . По каплям при перемешивании добавляют раствор 5 г (38 ммоль)
хлористого изовалероила в дихлорометане к- раствору N ,N-диметилэтилендмамина
(3,38 г, 38 ммоль) и N-метилморфолина (7,75 г, 76,7 ммоль) в дихлорметане, при 0°С. Поднимают
температуру реакционной смеси до комнатной и продолжают перемешивание
в течение 4 ч, затем растворитель отгоняют. Остаток растворяют в 50 мл
5 М едкого .натра и экстрагируют этилацетатом (2x100 мл). Этиладета1Т
промывают насьш енным водным раствором хлористого натрия, сушат над
сульфатом натрия и упаривают. Остаток растворяют в диэтиловом эфире добавляют к нему 10 мл 5 М НС I в
этилацетате Выпавший в осгщок продукт отфильтровывают, промывают диэтиловым эфиром (5x10 мл) к сушат
в глубоком вакууме. Выход 5,43 г; R ЗА 0,40. (2) Me2 CHCH2,CH2.NHCH2,.
Раствор ука занного амида (5 г) в безводном тетрагидрофуране (50 мл)
по каплям, при перемешивании добавляют к суспензии LiА 1Нд (4) в безводном
тетрагидрофуране (20 мл) при
комнатной температуре. Затем реакционную смесь кипятят с обратным холодильником в течение 4 ч,по9ле чего
, используя хроматографию в тонком слое, обнаруживают отсутствие исходного материала. Избыток LiAIH гасят
насыщенным водным раствором сульфата натрия. Полученную суспензию фильтруют , маточник подкисляют 10 мл 4 М
HCI. Рартворитель отгоняют,остаток растирают с диэтиловым эфиром,фильтруют и осадок высушивают.
Выход 5,51 г.
Пример В. N-Фeнэтил-N,N-диметилэтилендиамин
(1) PhCH CONHCHj CH NH - НС I.
Указанное соединение получа(рт
способом, описанным в примере А{1), путем сочетания фенацетил хлорида
(1,0 ,47 ммоль) с N,N-димeтилэтилендиамином (0,42 г,б,47 ммоль) в присутствии N-метилморфолина.
Выход 1,38 г; R ЗА 0,80.
(2
PhCH2 CH2NHCH,CH2NH.- HCI,
Целевое соединение получают восстановлением
вышеуказанного амида (10 г) с помощью LiА IN4 , как описано в примере А(2). Полученный
продукт чистят хроматографией на колонке с силикагелем, используя в качестве элюента систему ЗА.
Выход 4,.
Пример С. N -(2-Аминоэтил)-Nм-диметилмочевина
.
(1)PhCHjiOCONHCH CH NHCONMe .
Раствор хлористого диметилкарбамоила (1,39 г) в диэтиловом эфире (15 мл) добавляют по каплям к
перемешиваемому раствору N-метилморфолина (1,57 г) и 2-бензилоксикарбнил минозтиламина (3,02 г) в
110 мл диэтилового эфира. Смесь перемешивают 4 ч, затем оставляют на два дня. Эфир отгоняют, твердый
продукт распределяют между 10%-ной водной лимонной кислотой и этилацетатом . Этилацетатный слой отделяют
и промывают 10%-ной водной лимонной кислотой, насыщенным раствором бикарбоната натрия и насыщенным
раствором хлористого натрия, а затем сушат над сульфатом натрия и упаривают, получают твердое вещество
(1,7 г). После перекристаллизации из смесей.этилацетата и петролейного эфира (т.кип. 60-80с) ,
получают продукт с т.пл. 81-82 с.
(2)H2NCH2CH2NHCONMe2.
1,06 г N-бензилоксикарбонильного соединения растворяют в 30 мл этанола , содержащем 2,1 мл 2 н. водной
соляной кислоты и подвергают гидрогенолизу над 10%-ной (100 мг)
в течение 1,5 ч. Смесь фильтруют, маточник упаривают, получают целевое
соединение в виде хлористоводородной соли, которую используют без дополнительной очистки.
- Пример D. N-Изoaмил-N-мe тилэтилендиамин.
11) BOC-Gly-N(Me)CH.jCH2 СНМе .
К раствору 17,5 (0,1 моль)
BOC-GlyOH в 100 МП безводного хлоQ ристого метилена, добавляют 10,1 г
(0,1 моль) N-метилморфолина и 13,7 г (0,1 моль) JBCF при -15°С. Спустя
2 мин добавляют 13,7 г (0,1 моль) М-метилизоамиламингидрохлорид и
10,1 г N-метилморфолина. Реакционную смесь перемешивают при в течение 15 ч и при комнатной температуре
в течение ночи. Растворитель отгоняют и масло растворяют в этнлацетате , экстрагируют насыщенньп--
бикарбонатом натрия (2x100 мл), 10%-ной водной лимонной кислотой (2x100 мл),
промывают водой до нейтральной реакции , сушат над сульфатом натрия и упаривают.
5 Получают масло. Выход 27 г (количественный ) ; RO 70 0,79.
(2) H2NCH.(Me)CH2CH CHMe2 .
0 12 г BOC-GIy-N(Me)CH2CH2CHMe2
растворяют в 90%-ной водной трифторуксусной кислоте ( : СРт,СООН 1:9,35 мл). Через 2 мин растворитель
отгоняют, оставшееся масло раствое ряют в 50 мл свежевысушенного тетрагидрофурана
и добавляют к диборану в тетрагидрофуране (1М, 150 мл) в атмосфере азота при -20°С. Температуру
поднимают до комнатной и реакционную смесь перемешивают в течение, ночи. Осторожно добавляют 100 мл
метанола для разложения избытка диборана , растворитель отгоняют, получают
масло. Затем масло обрабатывают 50 мл 6 М HCI. Реакционную 5 смесь кипятят с обратным холодильником
в течение 3 ч и смесь упаривают. Полученное масло обрабатывают 2М
NaOH в течение 1 ч, подкисляют и упаривают . Маслообразный остаток чистят
0 колоночной хроматографией на силикагеле (колонка 2,5 х 80 см), элюируя
целевой продукт системой растворителей ЗА.
Выход 4,4 г, R ЗА 0,20.
г Пример Е. Диметил-(2-aминo-4-мeтилпeнтил ) -амин .
(1) BbC-Leu-NMe2.
К раствору 4,62 г (20 ммоль) ВО С-Leu-ОН-в хлористом метилене,
0 охлажденному до -20°С, добавляют 2,25 мл (20 ммоль) N-метилморфолина
и 6,0 г (20 ммоль) хлордифенилфосфатоксид (6,0 г, 20 ммоль), спустя 15 мин добавляют 5,6 г
5 (125 ммоль) диметиламина. Через
3 ч при раствор упаривают и остаток распределяют между этилацетатом и водой (50 мл каждого). Органическую
фазу отделяют и промывают 10«-ной водной лимонной кислотой , водным бикарбонатом натрия и
насыщенным рассолом, сушат над сульфатом натрия и остаток упаривают , получают целевой амид (5,15 г
(2) Me2,NCH2CH(NH2,)CH2.CHMe2 .
Раствор 1,3 г (5 ммоль) BOC-Leu-NMe
2. в водной трифторуксусной кислоте ( : 9:1,20 мл) перемешивают в течение 1 ч. Растворитель
отгоняют и остаток растворяют в безводном тетрагидрофуране. Перемешиваемый раствор охлажд,ают
до -20°С в атмосфере азота и добавляют раствор диборана в тетрагидрофуране
(1м, 30 мл), Через 5 ч при комнатной температуре добавляют 10 мл метанола, раствор перемешивают
в течение 12 ч и затем упаривают . Остаток растворяют в 15 NUI водной 2м соляной кислоты и перемешивают
еще в течение 12 ч, реакционную смесь упаривают. Остаток чистят хроматографически на силикагеле
(система ). Соответствующие фракции объединяют, упаривают, получают целевой диамин в виде масла
которое при стоянии - кристаллизуется . При биологических испытаниях полученных препаратов самцов или
самок морских свинок (штамма Дункан Хартли) убивают ударом по голове, удаляют часть илеума и помещают
в баню для отдельных органов объемо 50 МП. Получают судорожную реакцию при низкочастотной (0,1 Гц)
HTyr-DAIa-GI y-Ph-NH (СН2)э CONH-j,
HTyr-DAIa-Gly-HePh-NH(CH),CONMe2
HTyr-DAla-Gly-MePh-NH(CH)2NH
HTyr-DAIa-Gly-MePh-NH(CH2)COOMe
HTyr-DAIa-GIу -MePh-NH(CH)COOH
СТИГ4УЛЯЦИИ прямоугольными импульсами
0,5 мс. Исследуемое соединение растворяют в дистиллированной воде ,цля получения исходного раствора
в концентрации 1 мг/мл. Делают последовательные разбавления, используя
раствор Кребса, чтобы иметь концентрации 10 мг, 1 мг и 0,1 мг/мл. Соединение испытывают посредством
добавления от 0,1 до О,3 мл растворов к бане для органов. Затем определяют зависимость реакции от дозы
и сравнивают с зависимостью для метенкефалина .
При испытаниях с отдергиванием
хвоста крысы в качестве ноцицептив5 1-ю го раздражителя используют горячую воду (поддерживаемую при ).
Результаты представлены в табл.2, получают при испытании соединений
по изобретению с помощью илеума морской свинки , активность по сравнению
с метенкефалином при испытании по Гендершоту с сотр. и в испытании с надавливанием крысиного
хвоста.
Фармацевтические составы могут быть, например, в форме, пригодной
для парентерального введения , такой , как стерильные водные или масляные
растворы или суспензии для инъекций. Дозированные парентеральные формы,
пригодные для внутривенного, внутри 1ьнIIeчнoгo или подкожного введения,
содержат от 0,1 до 50 мг/мл соединения по изобретению (или эквивалентное
количество фармацевтически допустимой его соли). Уровни дозы будут , как правило, для облегчения
боли, в пределах от 0,1 до 100 мг в зависимости от пути введения.
Таблица 1
+52,8 ( c 1,04;0,1 H.
HC I )
Гс/.3в° -43,3
(с 1; DMF)
+26,1
(с 1,0;0,1 н.
НС I )
n
Wljo +23,0
(с 0,85;0,1 н.
НС))
, +25,5
(с 1,07;0,1 н.
НС )
Продолжение табл.1
Продолжение таблГТ
25
Примечание. А- гидролиз прим.11.
Формула изобретения
Способ получения тетрапептйдов общей формулы
R -Tyr-BtGly-C-N-CCHj), Х (.j-j
R2 где R/1 - водород, метил;
26 Продолжение
793386
табл. 1
Таблица 2
В-о-А1а. 0-Het, D-Met (0) , D-NVa I , . D-Ser, d-Thr;
D-Val, 0-Leu;
C-Phe, MePh; R, - водород, алкил C, , фенэтил;
МJ
X-NHa- , NHCOCH,, NHCOOC H,,. NHCOOCHjPh, NHCONHa, NHCONMe,,
NMeiN{0)Mej, NMePh, N(O)MePh, COOCH;, , .COOH, CONHg,, CONHMe,
CONMe, CONMePh, OCONHj, -М-(СН2)„Х является группой:
Ri
. -/.
S-О
Л
1/ иаи -N ГГ;
Xph
отличающийся тем, что соединение формулы
,(II)
где Y - соответствующая N-защитная
группа;
Ми - соответствующая защищенная аминокислота или пентидный остаток, конденсируют с
соединением формулы
Н-Мг-у-( , Рг
где Й2 к X имеют указанные значения :
М - подходящая аминокислота или пептидный остаток, при условии, что М/( и М вместе означают
TyrBGIyC- или его защищенное производное, где значение для В и С указаны выше, с последующим удалением
защитных групп и выделяют целевой продукт или в случае, когда X:NMe или NMePh, при желании окисляют
перекисью водорода или метахлорпербензойной кислотой для получения соединения формулы I, где
X:N(0)Me2, N(0)MePh.
Приоритет по признакам: 15.12„77 при R, В, D,R , п - вс
значения; X - NH NHCOCH 3, NHCOOCg H , NHCOOCHaPh, NHCONH-j, NHCONMej,
NMejN(0)Me2., NMePh, N(0)MePh, COOCH COOH, CONHg, CONHMe, CONMe, , CDNMeP h , OCONH. .
08.04.78 при R, В, D, R, n - все значения; X - все значения.
Источники информации, принятые во внимание при экспертизе
1. Шредер Э., Любке К. Пептиды, ч. I., М., Мир, 1967, с. 116.















Комментарии