Производные 2-амино-4h-3,1-бензоксазин-4-она для предотвращения или лечения ожирения или сопутствующего нарушения - RU2244711C2
Код документа: RU2244711C2
Описание
Настоящее изобретение относится к известным и новым соединениям, их применению в ингибировании фермента, преимущественное действие которого заключается в катализировании гидролиза сложноэфирных функциональных групп (in vivo, поскольку фермент природного происхождения), их применении в медицине, и, в частности, в предупреждении и/или лечении ожирения или связанных с ожирением заболеваний. Предложены также способы предупреждения и/или лечения ожирения или связанных с ожирением заболеваний и промотирования/способствования снижению веса без применения медицинских средств и применения соединений в производстве лекарственных препаратов указанного выше назначения. В отношении новых соединений, согласно изобретению предложены способы их получения, составы, их содержащие, и способы получения таких составов.
В последние 20 лет, наблюдалась растущая тенденция к полноте в развитых странах мира. Увеличение числа случаев ожирения обусловлено частично широкой доступностью продуктов питания в многочисленных магазинах розничной продажи и западными диетами с использованием высоконасыщенных жиров при низком содержании клетчатки, т.е. высококалорийных продуктов. Кроме того, образ жизни населения в развитых странах становится все более малоподвижным с увеличением механизации и при постоянном снижении числа предприятий с высокой трудоемкостью ручного труда. Таким образом, возникает энергетический дисбаланс между потреблением энергии с выкокалорийной пищей и снижением расхода энергии при малоподвижном образе жизни. Некоторое количество избыточной энергии откладывается в виде жиров в жировых тканях, накапливание которых в течение некоторого периода времени приводит к ожирению и может оказаться существенным фактором при развитии других заболеваний и нарушений.
В настоящее время ожирение считается нарушением обмена веществ. В США, по оценкам, 25% взрослого населения считается подверженным клиническому ожирению (Индекс массы тела >30). Ожирение может оказаться ослабляющим здоровье состоянием, которое снижает качество жизни и увеличивает риск сопутствующих заболеваний, таких как диабет, сердечно-сосудистые заболевания и гипертония. По оценкам, в США 45 миллиардов долларов, или 8% от годовых расходов на здоровье, составляют расходы, связанные с непосредственными результатами ожирения. Традиционный подход к программам долгосрочного контроля веса, например, диеты и физические упражнения, оказались неэффективными для контроля роста ожирения. Сегодня, более чем когда-либо, существует значительный интерес к разработке безопасных, эффективных препаратов для лечения ожирения.
Фармакологический подход к лечению ожирения заключается в разработке препаратов, либо способствующих увеличению расхода энергии, либо снижению энергопотребления. Одним из подходов к снижению энергопотребления является снижение способности организма переваривать и усваивать пищу, в частности, жиры. Основными ферментами, участвующими в расщеплении жиров являются ферменты гидролиза. Наиболее важными ферментами расщепления жиров являются липазы, в первую очередь, но не исключительно, панкреатические липазы, которые выделяются поджелудочной железой в пищеварительный тракт. Ферментный ингибитор липстатин явился основой лекарственного препарата против ожирения - орлистата. Орлистат является предметом опубликованной заявки на Европейский патент ЕР 129748, который относится к соединению формулы:

Где А представляет собой -(CH2)5-, или:
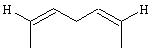
И их применение в ингибировании панкреатической липазы и лечении гиперлипемии и ожирения. Орлистат имеет в качестве основной активной группы бэта-лактоновую группу, которая реагирует с образованием сложного эфира с гидроксильной группой боковой цепи серина 152 в области активного центра панкреатической липазы. Даже несмотря на то, что орлистат представляет собой эффективное средство лечения ожирения, сохраняется потребность в альтернативном лекарственном препарате и способе для контроля и лечения ожирения, сопутствующих заболеваний и не-медицинском снижении веса. Предложены ингибиторы ферментов, участвующих в расщеплении жиров, а также показана их эффективность в предупреждении и/или лечении ожирения, сопутствующих заболеваний и/или для косметического снижения веса.
В патенте США 466576893 (Syntex) описан широкий класс соединений 2-амино-4Н-3, 1-бензоксазин-4-она формулы:
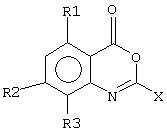
где R1 - водород или низший алкил, R2 и R3 - каждый независимо водород, галоген, низший алкил, годроксил, низший алкоксил, низший тиоалкил, NO2, N(R1)2, NR1COR1, NHCON(R1)2, NHCOOR1, a X - inter alia -NHR, где R - низший алкил, низший алкенил, низший алкинил, возможно замещенный низшим циклоалкилом или возможно замещенный фенил низшим алкилом. Соединения полезны в качестве ингибиторов протеазы серина и для лечения физиологических состояний и заболеваний, в которых, насколько известно, участвуют протеазы серина, или в качестве контрацептивов. В описании изобретения описаны различные состояния и заболевания с участием ферментационных процессов, включая воспаления, артрит, метастазы раковых клеток, эмфизема легких, синдром кожно-слизистых лимфатических узлов, респираторные расстройства у взрослых и панкреатит. Предположено также, что соединения могут иметь антипаразитарное, антикоагулирующее и/или антивирусное действие. Аналогичные соединения описаны также Krantz et al., J.Med. Chem. 1990, 33: 464-479.
Соединения 2-амино-4Н-3,1-бензоксазин-4-она в качестве ингибиторов протеазы серина также описаны Hays et al., в J. Med. Chem. 1998 41: 1060-1067. В этой работе описаны среди прочих соединения 2-(замещенный фенил) амино бензоксазинона, где заместители фенила включают галоген, метил, SMe, и ОСF3, а также некоторые 2-(гетероцикло)аминобензоксазиноны. Некоторые из этих соединений также описаны в патенте США 5,652,237 (Warner Lambert).
В заявке Германии OLS 2315303 (Bayer AG) описано получение соединений формулы

где R - алкильный или арильный остаток, который может быть замещен нитрогруппой, галогеном, алкилом, алкокси- или арильной группой, и R’ и R’’ - каждый независимо представляет собой водород, галоген, нитрогруппу, возможно замещенный алкил, циклоалкил, аралкил, арил, алкокси- или арилокси- группу. Единственными примерами R являются нитрофенил и моно- и ди-хлорофенил. Известно, что такие соединения применяются в качестве промежуточных для фармацевтических препаратов и средств защиты растений.
Нами было обнаружено, что один из классов соединений бензоксазинона проявляет активность как ингибитор липазы.
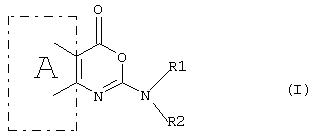
Таким образом, согласно первому аспекту настоящего изобретения предложено соединение формулы (I)

или его фармацевтически приемлемая соль, эфир, амид или предшественник, в производстве лекарственного препарата для лечения состояний, в которых требуется ингибирование фермента, преимущественное действие которого заключается в катализировании гидролиза эфирных функциональных групп, где в формуле (I)
А - шестичленное ароматическое или гетероароматическое кольцо,
R1 - разветвленный или неразветвленный алкил (углеродная цепочка которого, возможно, прервана одним или более атомами кислорода), алкенил, алкинил, циклоалкил, циклоалкенил, арил, арилалкил, восстановленный арилалкил, арилалкенил, гетероарил, гетероарилалкил, гетероарилалкенил, восстановленный арил, восстановленный гетероарил, восстановленный гетероарилалкил или их замещенное производное, в котором заместителем является один или более независимо выбранный из группы: галоген, алкил, замещенный галогеном алкил, арил, арилалкил, гетероарил, восстановленный гетероарил, восстановленный гетероарилалкил, арилалкокси-, циан-, нитро-, -C(O)R4, -CO2R4, -SOR4, -SO2R4, -NR6R7, -OR6, -SR6, -C(O)CX1X2NR6R7, -C(O)NR4R5, -C(O)N(OR5)R6, -NR6C(O)R4, -CR6(NH2)CO2R6, -NCX1X2CO2R6, -N(OH)C(O)NR6R7, -N(OH)C(O)R4, -NHC(O)NR6R7, C(O)NHNR6R7, -C(O)N(OR5)R6 или липид или стероид (природный или синтетический), при условии, что любой замещающий гетероатом в R1 или R2 должен быть отделен от экзоциклического атома азота по меньшей мере двумя атомами углерода (предпочтительно насыщенными), и
R2 является водородом или группой, такой, как определено для R1, и где
R4 представляет собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, арил, арилалкил, гетероарил, гетероарилалкил, восстановленный гетероарил или восстановленный гетероарилалкил, OR6, NHCX1X2CO2R6 или NR6R7,
R5 представляет собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, арил, арилалкил, гетероарил, гетероарилалкил, восстановленный гетероарил или восстановленный гетероарилалкил,
R6 и R7 независимо выбраны из водорода, алкила, алкенила, алкинила, циклоалкила, циклоалкенила, арила, арилалкила, гетероарила, восстановленного гетероарила, гетероарилалкила, восстановленного гетероарилалкила или -(CH2)n(OR5)m, где n - от 1 до 12, предпочтительно от 2 до 10, a m - от 1 до 3, и R5 наиболее предпочтительно алкил С2-10,
X1 и X2 независимо представляют собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, арил, арилалкил, гетероарил, восстановленный гетероарил, гетероарилалкил, или восстановленный гетероарилалкил.
В соединениях формулы (I) любая алкильная, алкенильная или алкинильная группа или группировка может представлять собой линейную (неразветвленную) или разветвленную цепь. Линейные цепи алкильных, алкенильных или алкинильных групп или группировок могут содержать от 1 до 30 атомов углерода, например, от 1 до 25 атомов углерода, предпочтительно от 1 до 20 атомов углерода. Разветвленные цепи алкильных, алкенильных или алкинильных групп или группировок могут содержать от 1 до 50 атомов углерода, предпочтительно от 1 до 30 атомов углерода.
Предпочтительные значения для R1, R4, R5, R6, R7, X1 и X2 такие же, как определены ниже для формул (I) и (IIа). В частности, предпочтительные значения для R4, R5, и R6 такие же, как для R13, и предпочтительные значения для R7 такие же, как для R14. В данном контексте "восстановленные", например, "восстановленный гетероарил", означает полностью или частично насыщенный.
Арильные группы включают, например, возможно замещенные ненасыщенные моноциклические или бициклические кольца, содержащие до 12 атомов углерода, такие как фенил и нафтил, и частично насыщенные бициклические кольца, такие, как тетрагидронафтил. Примеры заместителей, которые могут присутствовать в арильных группах, включают один или более галоген, амино, нитро, алкил, галогеноалкил, алкокси, фенокси, и фенокси, замещенные одним или более галогеном, алкилом или алкокси.
Гетероарильная группа или группировка может представлять собой, например, возможно замещенное 5- или 6-членное гетероциклическое ароматическое кольцо, которое может содержать от 1 до 4 гетероатомов, выбранных из О, N и S. Гетероциклическое кольцо возможно может быть сопряжено с фенильным кольцом. Примеры гетероарильных групп включают фурил, тиенил, пирролил, оксазолил, оксазинил, тиазолил, имидазолил, оксадиазолил, тиадиазолил, пиридил, тиазолил, тиазинил, пиридазил, пиримидинил, пиразолил, индолил, индазолил, бензофуранил, бензотиенил, бензимидазолил, беноксазолил, бензоксазинил, хиноксалинил, хинизолинил, хиннолинил, бензотиазолил, пиридопирролил. Подходящие заместители включают один или более галоген, оксо, амино, нитро, алкил, галогеноалкил, алкокси, фенокси, и фенокси, замещенные одним или более галогеном, галогеноалкилом, алкилом или алкоксигруппой.
Востановленные гетероарильные группы или группировки могут представлять собой, например, полностью или частично насыщенные производные вышеуказанных гетероарильных групп. Примеры восстановленных гетероарильных групп включают пирродинил, тетрагидрофурил, тетрагидротиенил и пиперидинил.
Соединения согласно первому аспекту изобретения являются полезными ингибиторами энзимов, участвующих в расщеплении жиров. Предпочтительно, поэтому, первый аспект изобретения включает применение соединений формулы (1) как указано выше, или их
фармацевтически приемлемой соли, эфира, амида или предшественника, в производстве лекарственного препарата для контроля или лечения ожирения, сопутствующих расстройств или для облегчения немедицинской потери веса.
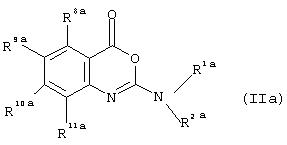
Предпочтительно соединение согласно первому аспекту изобретения представляет собой соединение формулы (II):

или его фармацевтически приемлемая соль, эфир, амид или предшественник,
где R1, R4, R5, R6, R7, X1 и X2 такие же, как определены выше для формулы (I), R2 представляет собой водород или группу, такую, как определено для R1, и R8, R9, R10, R11 каждый независимо представляют собой водород, галоген, гидрокси-, амино-, нитро-, циано- или группу R1 как определено выше, или группу R12Q, где Q представляет собой O, СО, CONH, NHCO, S, SO, SO2, SO2NH2, и R12 представляет собой водород или группу R1 как определено выше, или группу R1R2N, где R1 или R2 как определено выше, при условии, что любой замещающий гетероатом в R1 и/или R2 должен быть отделен от экзоциклического атома азота по меньшей мере двумя атомами углерода (предпочтительно насыщенными).
В соединениях формулы (II):
R1 предпочтительно представляет собой фенил, замещенный группой, выбранной из OR13, -COR13, -CO2R13, -SOR13, -SO2R13, -C(O)NR13R14, -NR14C(O)R13, C1-10алкил, C1-10алкокси, галогено C1-10алкил, арил, арил С1-10алкил, гетероарил или гетероарилС1-10алкил, где R13 и R14 каждый независимо представляют собой водород, C1-10алкил, С2-10алкенил, С2-10алкинил, С3-6циклоалкил, С3-6циклоалкенил, арил, арилC1-10алкил, гетероарил, гетероарилC1-10алкил, восстановленный гетероарил или восстановленный гетероарил C1-10алкил.
Более предпочтительно R1 представляет собой фенил, замещенный группой OR13 или -COR13, где R13 предпочтительно представляет собой арил, более предпочтительно фенил, фенил, замещенный CO2R13, где R13 представляет собой С1-10алкил, предпочтительно C1-6алкил или фенил, замещенный C1-6алкилом.
R2 предпочтительно является водородом или C1-10алкилом,
R8 R9 R10 и R11 каждый предпочтительно независимо представляет собой водород, галоген, гидрокси-, амино-, нитро-, циано-, тиол, C1-10алкил, C1-10алкокси, C1-10циклоалкил, С1-10циклоалкокси, C(O)R15, C(o)nr15r16, S(O)R15 или галогеноС1-10алкил,
R15 и R16 каждый независимо представляют собой водород или C1-10алкил,
R8 представляет собой водород или галоген, например, фтор наиболее предпочтительно водород,
R9 - предпочтительно водород или низший разветвленный или неразветвленный алкил, имеющий от 1 до 10 атомов углерода: циклоалкил, имеющий от 3 до 6 атомов углерода, например, циклопропил, галогеноС1-6алкил, например, трифторметил, или галоген, например, хлор или фтор;
R10 - предпочтительно водород, низший разветвленный или неразветвленный алкил, имеющий от 1 до 10 атомов углерода, например, этил, бутил или октил: циклоалкил, имеющий от 3 до 6 атомов углерода, например, циклопропил, галогеноС1-6алкил, например, трифторметил, или галоген, например, хлор или фтор;
R11 - предпочтительно водород, галоген, например, фтор, или низший разветвленный или неразветвленный алкил, имеющий от 1 до 10 атомов углерода.
Предпочтительно, в соединениях формулы (II) по меньшей мере один из R8, R9, R10 и R11 представляет собой заместитель, отличный от водорода. Так, например, R8 может быть атомом водорода, а R9, R10 и R11 - такими, как определено выше. В предпочтительном примере реализации каждый из R8 и R11 представляет собой атом водорода, а один или оба R9 и R10 представляет собой заместитель, такой, как определено выше.
Предпочтительно соединение для применения согласно первому аспекту изобретения содержит соединение формулы (II) или фармацевтически приемлемую соль, эфир, амид или предшественник, где
R1 представляет собой арил, например, возможно замещенный фенил или 2-нафтил, или арилалкильную группу, в которой арильная группировка имеет до 25 атомов углерода, например, до 20, или ариларильную группу, где арилалкильная группа или ариларильная группа может быть отделена спейсером, где спейсер может быть эфиром, амидом, О, СН2, или кетоном, и где арильная группа предпочтительно представляет собой фенил, возможно замещенный алкилом, галогеноалкилом, или галогеном,
R2 предпочтительно является водородом или группой, как определено для R1,
R8 - водород или фтор,
R9 - низший разветвленный или неразветвленный алкил, имеющий от 1 до 10 атомов углерода: циклоалкил, имеющий от 3 до 6 атомов углерода, например, циклопропил, галогено C1-6алкил, например, трифторметил, или галоген, например, хлор или фтор;
R10 - низший разветвленный или неразветвленный алкил, имеющий от 1 до 10 атомов углерода, например, этил, бутил или октил: циклоалкил, имеющий от 3 до 6 атомов углерода, например, циклопропил, галогеноалкил, например, трифторметил, или галоген, например, хлор или фтор;
R11 - водород, галоген, например фтор, или низший разветвленный или неразветвленный алкил, имеющий от 1 до 10 атомов углерода;
Наиболее предпочтительно R1 представляет собой незамещенный фенил или фенил, замещенный группой, выбранной из С1-8алкила, например, бутил, пентил, гексил или гептил, галоС1-8алкил, например, СF3, OR6, где R6 - фенил, или COR4, где R4 - фенил или C1-8алкил.
Согласно второму аспекту настоящего изобретения предложено соединение формулы (IIа):

или его фармацевтически приемлемая соль, эфир, амид или предшественник, где
R1a - представляет:
(1) разветвленный или неразветвленный С10-30алкил, С2-30алкенил, С2-30алкинил, циклоалкенил, арил-С10-30алкил, арил-С10-30алкенил, гетероарил, гетероарил-С1-30-алкил, гетероарил-C2-30-алкенил, восстановленный арил, восстановленный гетероарил, восстановленный гетероарил C1-30алкил или их замещенное производное, в котором заместителем является один или более независимо выбранный из группы: галоген, C1-10алкил, арил, арил-С1-30алкил, гетероарил, восстановленный гетероарил, восстановленный гетероарил C1-10алкил, арил-C1-10алкокси-, циан-, нитро-, -C(O)R13, -СО2R13, -SOR13, -SO2R13, -NR13R14, -OR13, -SR13, -C(O)NR13R14, -NR14C(O)R13, при условии, что любой замещающий гетероатом в R1 должен быть отделен от экзоциклического атома азота по меньшей мере двумя атомами углерода (предпочтительно насыщенными), или
(2) арил, замещенный одним или более заместителем, независимо выбранным из группы, включающей галогенозамещенный C1-10 алкил, арил, арил-С1-10алкил, гетероарил, восстановленный
гетероарил, восстановленный гетероарил-С1-10алкил, арил-C1-10алкокси-, циано-, -C(O)R13, -CO2R13, -SOR13, -SO2R13, -NR13R14, -OR13 (при условии, что в этом случае R13 не является арилом или алкилом), -SR13, -C(O)NR13R14, и -NR14C(O)R13,
где R13 и R14 каждый независимо представляют собой водород, С1-10алкил, С2-10алкенил, С2-10алкинил, С3-10циклоалкил, С3-6циклоалкенил, арил, арил-С1-10 алкил, гетероарил, гетероарилC1-10алкил, восстановленный гетероарил, или восстановленный гетероарил-С1-10алкил,
R2a является водородом или группой, такой, как определено выше для R1, и
R8a, R9a, R10a и R11a.
Такие, как определено выше для формулы (II).
В соединении формулы (IIа):
R1a предпочтительно представляет собой фенил, замещенный группой, выбранной из OR13 (при условии, что в этом случае R13 не является алкилом или арилом), COR13, -CO2R13, -SOR13, -SO2R13, -CONR13R14, -NR14C(O)NR13, галогено-С1-10алкил, арил, арил-С1-10алкил, гетероарил, или гетероарил C1-10алкил.
Наиболее предпочтительно R1а представляет собой фенил, замещенный COR13, где R13 предпочтительно арил, наиболее предпочтительно фенил; или фенил, замещенный -CO2R13, где R13 представляет собой C1-10алкил, предпочтительно C1-6алкил.
R2a предпочтительно представляет собой водород или C1-10алкил,
R8a, R9a, R10a и R11a каждый предпочтительно независимо представляет собой водород, галоген, гидрокси-, амино-, нитро-, циано-, тиол, С1-10алкил, C1-10алкокси, C1-10циклоалкил, C1-10циклоалкокси, C(O)R15, C(O)NR15R16, S(O)R15 или галогено С1-10алкил,
R15 и R16 каждый независимо представляют собой водород или C1-10алкил,
R8a представляет собой водород или галоген, например, фтор, наиболее предпочтительно водород,
R9a - предпочтительно водород или низший разветвленный или неразветвленный алкил, имеющий от 1 до 10 атомов углерода:
циклоалкил, имеющий от 3 до 6 атомов углерода, например, циклопропил, галогеноC1-6алкил, например, трифторметил, или галоген, например, хлор или фтор;
R10a - предпочтительно водород, низший разветвленный или неразветвленный алкил, имеющий от 1 до 10 атомов углерода, например, этил, бутил или октил; циклоалкил, имеющий от 3 до 6 атомов углерода, например, циклопропил, галогеноС1-6алкил, например, трифторметил, или галоген, например, хлор или фтор;
R11a - предпочтительно водород, галоген, например, фтор, или низший разветвленный или неразветвленный алкил, имеющий от 1 до 10 атомов углерода.
Предпочтительно, в соединениях формулы (IIа) по меньшей мере один из R8a, R9a, R10a и R11a представляет собой заместитель, отличный от водорода. Так, например, R8a может быть атомом водорода, a R9a,R9a, R10a и R11a - такими, как определено выше. В предпочтительном примере реализации каждый из R8a и R11a представляет собой атом водорода, а один или оба R9a и R10a представляет собой заместитель, такой, как определено выше.
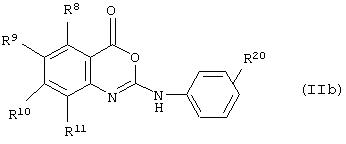
Согласно еще одному примеру реализации изобретения предложено соединение формулы (IIb),

где R8-R11a такие, как определено выше,
R20 представляет собой С1-20алкил, С1-20алкокси-, или возможно замещенный фенокси.
Предпочтительные заместители фенокси- включают один или более галогенов, СF3, низший алкил или низшую алкоксигруппу.
Когда R20 представляет собой алкильную или алкоксигруппу, он предпочтительно содержит от 6 до 12 атомов углерода.
В данном примере реализации R20 - предпочтительно представляет собой феноксигруппу.
Предпочтительные значения R8-R11a такие, как определено выше.
Соединения формулы (IIb) представляют собой новый выбор на основе их преимущественного действия в качестве ингибиторов липазы.
Примеры фармацевтически приемлемых солей этой формулы включают соли органических кислот, таких как метансульфокислота, бензолсульфокислота и п-толуолсульфокислота, соли минеральных кислот, например, соляной и серной и аналогичные, с образованием метансульфоната, бензолсульфоната, п-толуолсульфоната, хлорида, сульфата и т.п., соответственно, или производные от оснований, таких как органические и неорганические основания. Примеры подходящих неорганических оснований для образования солей соединения согласно настоящему изобретению включают годроксиды, карбонаты и бикарбонаты аммония, литий, натрий, кальций, калий, алюминий, магний, цинк и другие. Соли могут быть также образованы с подходящими органическими основаниями. Такие основания, подходящие для образования фармацевтически приемлемых солей, полученных путем присоединения оснований к соединениям настоящего изобретения, включают такие органические основания, которые нетоксичны и являются достаточно сильными для образования солей. Подобные органические основания хорошо известны специалистам и могут включать аминокислоты, например, аргинин и лизин, моно-, ди- и три-гидроксиалкиламины, такие как моно-, ди- и триэтаноламин, холин, моно-, ди- и триалкиламины, такие как метиламин, диметиламин и триметиламин, гуанидин, N-метилглюкозамин, N-метилпиперазин, морфолин, этилендиамин, N-бензилфенетиламин, трис(гидроксиметил) аминометан, и другие.
Соли могут быть приготовлены традиционным образом хорошо известными способами. Соли кислотного присоединения указанных основных соединений могут быть приготовлены путем растворения соединений со свободными основаниями согласно первому или второму аспектам настоящего изобретения, в водном или водно-спиртовом растворе или другом подходящем растворителе, содержащем требуемую кислоту. Если соединение формулы (I) содержит кислотную функциональную группу, основная соль указанного соединения может быть приготовлена путем взаимодействия этого соединения с подходящим основанием. Кислотная или основная соль могут выделиться непосредственно или могут быть получены концентрированием раствора, например, выпариванием. Соединения согласно изобретению могут также существовать в сольватированной или гидратированной формах.
Изобретение включает также предшественники указанных оснований. Предшественником считается обычно описываемое как неактивное или защищенное производное активного ингредиента или лекарственного препарата, которое затем превращают в активный ингредиент или лекарственный препарат в теле пациента.
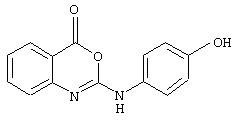
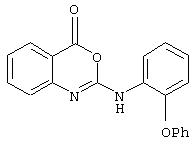
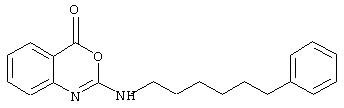
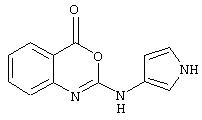
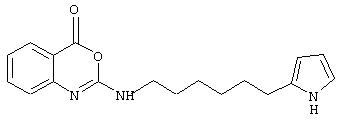
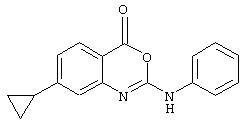
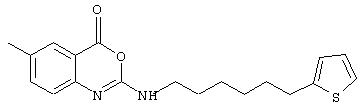
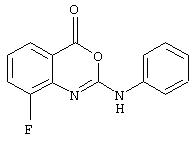
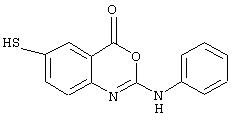
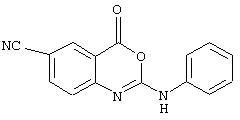
Примеры соединений согласно первому и второму аспектам настоящего изобретения включают следующие соединения, представленные в таблице 1.
Соединения 2, 3, 5, 6, 8, 11-15 и 17-70 в таблице 1, по мнению заявителей, являются новыми и таким образом, относятся к предпочтительным примерам реализации настоящего изобретения.
Предпочтительные соединения формулы (II), из перечисленных в таблице 1, включают соединения 1, 3, 5, 9, 17, 19, 20, 23 и 26.
Предпочтительные соединения формулы (IIа), из перечисленных в таблице 1, включают соединения 11, 12, 14, 25, 29 и 30.
Предпочтительные соединения формулы (IIb), из перечисленных в таблице 1, включают соединения 2, 6, 7, 8, 10, 15, 21 и 24.
В частности, предпочтительными соединениями формулы (IIа) и (IIb) являются:
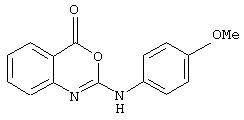
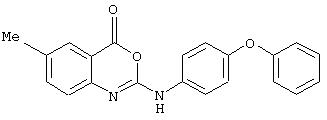
2-(4-феноксифениламино)-4H-3,1-бензоксазин-4-он;
2-(4-бутоксикарбинилфениламино)-6-метил-4H-3,1-бензоксазин-4-он;
6-метил-2-(4-феноксифениламино)-4Н-3, 1-бензоксазин-4-он;
2-(4-гексилфениламино)-6-метил-4H-3,1-бензоксазин-4-он;
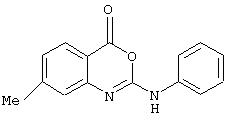
7-метил-2-(4-феноксифениламино)-4H-3,1-бензоксазин-4-он;
2-(4-бензоилфениламино)-7-метил-4H-3,1-бензоксазин-4-он;
2-(4-феноксифениламино)-7-трифторметил-4H-3,1-бензоксазин-4-он.
Предпочтительные соединения согласно настоящему изобретению включают также таутомеры перечисленных выше соединений, а также (не ограничиваясь ими) фармацевтически приемлемые соли, эфиры, амиды или предшественники этих соединений или их производных, полученных путем присоединения одной или более липидных групп (природных или синтетических).
Согласно третьему аспекту изобретения, предложен способ получения любого или нескольких новых соединений или производных согласно первому или второму аспекту изобретения. Так, в настоящем изобретении предложен способ получения нового соединения формулы (II), в частности, (IIа), который включает:
Способ (A) циклизации соединения формулы(III):

где R1 и R8-R11 как определено выше и R18 представляет собой водород или C1-6алкил,
или
Способ (В), в котором проводят реакцию соединения (IV):

с амином формулы (V)
R1R2NH
или способ (С) превращения соединения формулы (I), (II), (IIа) или (IIb) в различные соединения формулы (IIа) или (IIb), например, путем
(1) восстановления соединения формулы (I), (II), (IIа) или (IIb), где R1, R8, R9, R10 и R11 содержат алкенильную или алкинильную группу или группировку, в соответствующее соединение с алкильной или алкенильной группой или группировкой, или
(2) алкилирования соединения формулы (I), (II), (IIа) или (IIb), где один или более из R8, R9, R10 и R11 представляют собой атом галогена.
Способ (А) можно осуществить путем проведения реакции соединения (III) с дегидратирующим агентом в органическом растворителе. Подходящие дегидратирующие агенты включают серную кислоту, а если R18 представляет собой водород, 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (EDC) или EDC, нанесенный на полимер. Реакция может быть проведена при температуре в интервале от 10 до 50° С, предпочтительно при температуре окружающей среды, т.е. 20-30° С. Если используют EDC, нанесенный на полимер, его можно удалить фильтрацией в конце реакции, а продукт выделить из раствора по стандартной методике, такое как удаление растворителя и очистка колоночной флэшхроматографией. Альтернативно, циклизацию можно провести с использованием концентрированной серной кислоты.
Альтернативно, циклизацию согласно способу (А) можно провести путем реакции в избытке хлорформиата или путем добавления другого агента циклизации, который промотирует замыкание кольца. Подходящие агенты циклизации включают, например, метилхлорформиат, карбонилдиимидазол, уксусный ангидрид, фосген, оксалилхлорид, тионилхлорид или пептидный сшивающий агент, такой как дициклогексил карбодиимид (DCC). Предпочтительно, агент циклизации представляет собой фосген, трифосген или тионилхлорид. Если используют хлорформиат, то это предпочтительно низкомолекулярный хлорформиат, поскольку он дешевле и при этом легче удалить образующийся спирт.
Соединения формулы (III) могут быть получены множеством способов. Так, например, соединение формулы:

может быть подвергнуто реакции с изоцианатом формулы (VII):
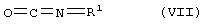
Реакцию предпочтительно проводят в инертном органическом растворителе, таком как эфир, например, тетрагидрофуране, алифатическом углеводороде, таком как пентан или гексан, галогенированном углеводороде, таком как дихлорметан, или ароматическом углеводороде, таком как бензол или толуол, как правило, при комнатной температуре. Образующаяся в качестве промежуточного продукта мочевина может подвергаться циклизации в том же реакторе без необходимости ее отделения. Альтернативно, при желании, мочевину можно отделять до циклизации. Аналогично, любую непрореагировавшую промужуточную мочевину можно подвергать циклизации на последующих стадиях реакции. Следует отметить, что вышеуказанная реакция приводит к получению соединения (III), если R2 - водород.
Альтернативно, соединение формулы (III) может быть получено путем реакции изоцианата формулы (VIII)
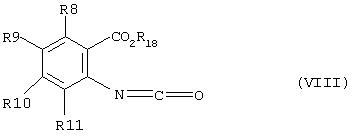
(где R8, R9, R10, R11, и R18 как указано выше)
с амином формулы (V) R1R2NH.
Соединения формулы (III) могут быть также получены из соединений формулы (IX)

путем реакции с амином формулы R1R2NH.
Соединения формулы (IX) могут быть также получены путем реакции соединения (VI) с амином формулы (V) в присутствии трихлорметил хлорформиата и в растворителе, таком как тетрагидрофуран или диметилформамид.
Способ (В) можно осуществить путем реакции соединения формулы (IV) с амином R1R2NH в присутствии основания, например, гидроксида натрия, с последующей циклизацией, например, как описано в способе (А).
Соединения формулы (IV) могут быть получены путем циклизации соединений формулы (VI), где R18 - водород, с использованием например, фосгена или его синтетического эквивалента.
В способе (С), восстановление алкенильной или алкинильной групп можно провести, например, каталитической гидрогенизацией с использованием, например, нанесенного на активированный уголь 10% палладия в спиртовом растворителе, таком как этанол, при давлении водорода 1 атмосфера.
Алкилирование согласно способу (С) (ii) можно провести по методу Stille или путем поперечной сшивки, катализируемой палладием, с применением, например, тетраалкилолова, такого как тетраметилолово, и phCh2Pd(PPH3)2 Cl в НРМА при повышенной температуре, например, при 50-100° С. В качестве исходных веществ можно использовать другие галиды или псевдогалиды, например, трифлаты.
Другие методики получения производных 2-амино-1,3-бензоксазин-4-она описаны в J. Med. Chem., 1990, 33(2), 464-479, и J.Med. Chem, 1998, 41, 1060-1067, а также патенте США 4, 657, 893.
Согласно четвертому аспекту изобретения предложено применение соединения согласно первому и/или второму аспектам изобретения (т.е., соединений формул (I), (II) и (IIа)) в медицине. Предпочтительные признаки по первому и второму аспектам изобретения справедливы также для четвертого аспекта. Другие признаки четвертого аспекта изложены далее.
Согласно пятому аспекту изобретения предложено применение соединения согласно первому и/или второму аспектам изобретения для ингибирования ферментов, преимущественное действие которых заключается в катализировании гидролиза эфирных групп. Это применение включает как применение in vivo, так и in vitro, а также другие области применения, например, в промышленности. Подобные ферменты катализируют процесс разложения основы, содержащей эфирные функциональные группы, путем добавления воды, в результате чего происходит расщепление химической связи. Такие ферменты также участвуют в ключевых процессах, протекающих в организме. Ферменты согласно изобретению включают липазы (гидролиз эфиров жирных кислот), эстеразы (гидролиз сложных эфиров), и фосфатазы (гидролиз эфиров фосфорной кислоты).
Предпочтительными ферментами являются липазы. Липазы включают липазу поджелудочной железы, липазу желудка, липопротеиновую липазу, лингвальную липазу, липазу жировой ткани, гормоночувствительную липазу, фосфолипазу А1, А2, В, С, D, и др, печеночную липазу и другие триацил-, диацил- и моноацилглицероловые липазы в организме млекопитающих. Многие другие подобные липазы также известны в растениях, грибках и микроорганизмах.
Согласно изобретению рассмотрены также такие ферменты как эстеразы и фосфатазы. Эстеразы включают эстеразу печени свиньи, холестерил эстеразу, ретинил эстеразу, 1-алкил-2-глицерофосфохолин эстеразу, гидролазу эфира карбоновой кислоты и холестерол эстеразу. Фосфатазные ферменты включают фосфатазы РР1, РР2 и РР3 серина/треонина, фосфатазу фосфопротеина, фосфатазу миозина с легкой цепью, фосфатазу 2С протеина и фосфатазу протеина тирозина.
Соединения согласно изобретению для применения в медицине, в первую очередь относятся к соединениям для применения в предотвращении и/или лечении по таким медицинским показаниям, как ожирение, гиперлипемия, гиперлипидемия, и сопутствующие заболевания, как например, гипергликемия, (диабет типа II), гипертензия, сердечно-сосудистые заболевания, инсульт, желудочно-кишечные заболевания и состояния. Соединения согласно первому и/или второму аспекту изобретения применимы в этих и других условиях благодаря их способности ингибировать ферменты, преимущественное действие которых заключается в катализировании гидролиза эфирных функциональных групп. Изобретение относится также к не-медицинскому снижению веса, такому, как косметическое снижение веса, и включает в улучшение внешнего вида в принципе. В контексте данного описания предотвращение и/или лечение любого расстройства означает любое действие, которое уменьшает любой вред или медицинское нарушение, в любой степени, и включает предотвращение и лечение их самих. Термин "лечение" означает любое улучшение в отношении нарушения, заболевания, синдрома, состояния, боли или комбинации из двух и более таких факторов.
Очевидно, что важное применение изобретения относится к снижению веса (любого из описанных выше типов) человека. Однако изобретение относится также к медицинскому и не-медицинскому снижению веса любых животных, в которых метаболизм жиров и производных жиров происходит с участием ферментов, премущественное действие которых заключается в катализировании гидролиза эфирных функциональных групп. Таким образом, изобретение имеет также ветеринарное применение и в особенности полезно в отношении животных-спутников человека, таких как домашние кошки и собаки, а также животных, которые обеспечивают потребность человека в мясе. В последнем случае, применение настоящего изобретения заключается в уменьшении содержания жиров с получением обедненного жиром мяса.
Предположительно, соединения согласно настоящему изобретению также могут оказаться полезными в снижении содержания токсинов (например, диоксинов и РСВ), которые откладываются в жировых тканях. Не желая быть связанным какой-то одной теорией, авторы полагают, что увеличение количества нерасщепленных жиров, проходящих через организм улучшает диффузию токсинов из жира, отложенного в организме, в жиры крови, и таким образом, в кишечник.
Пятый аспект изобретения имеет важное применение. Это применение включает испытания и диагностические методы и контроль и ингибирование нежелательных ферментов, предпочтительно липаз, в любом процессе или продукте. Процессы или продукты, в которых предпочтительно участвуют липазы, включают обработку сельскохозяйственных продуктов (например, жиросодержащих семян), выделение и извлечение ферментов из биотехнологических процессов (например, включающих лизис микроорганизмов), производство и извлечение сырой нефти (в частности, масел и пластиков), промышленное производство триглицеридов и других жиров, производство предметов по уходу за телом, которые включают поверхносто-активные вещества, мыла или детергенты (например, масла для ванны, кремы), производство и переработка липосом (например, предметов по уходу за телом, в диагностике, в генной терапии), переработка промышленных отходов (например, переработка бумажных отходов), и предотвращение разложения продуктов питания, содержащих жиры (например, обработка шоколада). Таким образом, изобретение относится также к этим продуктам и процессам, например, к продуктам питания с высоким содержанием жиров, таким, как торты, печенье, выпечка, и т.п., а также к шоколадным продуктам.
Предпочтительные признаки изобретения согласно пятому аспекту включая предпочтительные ферменты, такие же, как было указано для предыдущих аспектов изобретения.
Согласно шестому аспекту изобретения предложен состав, включающий новые соединения согласно первому и второму аспектам изобретения, в сочетании с фармацевтически приемлемым носителем или разбавителем. Подходящие носители и/или разбавители хорошо известны специалистам и включают фармацевтически чистый крахмал, маннитол, лактозу, стеарат марганца, сахарин натрия, тальк, целлюлозу, глюкозу, сахарозу (или другие виды сахара), карбонат марганца, желатин, масло, спирт, детергенты, эмульгаторы, или воду (предпочтительно стерильную). Состав может представлять собой смешанный препарат состава или комбинированный препарат для одновременного, раздельного или последовательного применения (включая прием).
Соединения согласно изобретению для применения согласно вышеуказанным назначениям могут быть назначены для приема любым из подходящих способов, например, перорально (включая ингаляцию), парентально, через слизистую (например, через рот или щеку, под язык, через нос), ректально или трансдермально и, соответственно адаптированы.
Для орального применения соединения могут быть изготовлены в жидком и твердом виде, например, в виде растворов, сиропов, суспензий или эмульсий, таблеток, капсул и лепешек.
Жидкие составы, как правило, состоят из суспензий или растворов или физиологически приемлемых солей в подходящих водных или неводных жидких носителях, например, в воде, этаноле, глицерине, полиэтилегликоле или в масле. Состав может также содержать суспедирующий агент, консервант, отдушку или окрашивающий агент.
Состав в виде таблетки может быть приготовлен с использованием любого подходящего фармацевтического носителя или носителей, обычно используемых в приготовлении твердых составов. Примеры таких носителей включают стеарат марганца, крахмал, лактозу, сахарозу и микрокристаллическую целлюлозу.
Состав в виде капсул может быть приготовлен с использованием обычных методик капсулирования. Например, порошки, гранулы или таблетки, содержащие активный компонент, могут быть приготовлены с использованием стандартных носителей и затем помещены в твердую желатиновую капсулу, альтернативно, может быть приготовлена дисперсия или суспензия с использованием любого фармацевтического носителя или носителей, например, водных смол, целлюлозы, силикатов или масел, и затем дисперсия или суспензия помещена в мягкую желатиновую капсулу.
Составы для орального применения могут быть разработаны для защиты активного компонента от разложения по мере прохождения через пищеварительный тракт, например, посредством нанесения внешней оболочки на состав в таблетке или капсуле.
Обычные парентеральные составы состоят из раствора или суспензии соединения или физиологически приемлемой соли в стерильном водном носителе или не-водном или парентерально приемлемом масле, например, полиэтиленгликоле, поливинилпирролидоне, лецитине, арахисовом масле или кунжутовом масле. Альтернативно, раствор может быть лиофилизирован и затем восстановлен подходящим растворителем непосредственно перед приемом.
Составы для назального или орального приема могут быть получены в виде аэрозоля, капель, геля или порошка. Аэрозольные составы обычно содержат раствор или тонкую суспензию активного вещества в физиологически приемлемом водном или не-водном растворителе и обычно представлены в количестве одной или нескольких доз в стерильной форме в герметичном контейнере, выполненного в форме картриджа или заполняемого баллона, используемого с распыляющим устройством. Альтернативно, герметичный контейнер может быть выполнен в виде единого распределительного устройства, такого как назальный ингалятор, рассчитанный на одну дозу, или аэрозольный дозатор, снабженный измерительным клапаном, который предназначен на выброс после того, как содержимое контейнера будет израсходовано. Если дозируемая форма находится в аэрозольном дозаторе, она также включает фармацевтически приемлемый пропеллент. Аэрозольные дозируемые формы могут также находиться в распылителе с сжатым газом.
Составы, пригодные для приема через рот или щеку, или под язык, включают таблетки, лепешки и пастилки, в которых активный компонент составлен с добавлением носителя, такого как сахар и акация, трагакант, или желатин и глицерин.
Составы для ректального или вагинального применения обычно назначают в форме суппозиториев (содержащих обычное основание для суппозиториев, такое как кокосовое масло), маточных колец, вагинальных таблеток, пенок или клизм.
Составы для чрезкожного приема включают мази, гели и пластыри, а также инъекции, включая порошковые инъекции.
Обычно составы находятся в дозированной форме, такой как таблетки, капсулы или ампулы.
Составы согласно шестому аспекту изобретения полезны для предотвращения и/или лечения ожирения, сопутствующих расстройств, других форм медицинского снижения веса и не-медицинского снижения веса. Предпочтительные признаки этого аспекта изобретения такие же, как описаны для первого - пятого аспектов изобретения.
Согласно седьмому аспекту изобретения, предложен способ получения состава согласно шестому аспекту изобретения. Получение состава можно осуществить по стандартной методике, хорошо известной специалистам, и оно включает приготовление композиции, включающей соединение согласно первому или второму аспектам изобретения и фармацевтически приемлемого носителя или разбавителя. Состав может быть в любой форме, например, в виде таблетки, в жидком виде, в форме капсулы и порошка, или в форме продукта питания, например, пищи функционального назначения. В последнем случае продукт питания сам по себе может выступать как фармацевтически приемлемый носитель.
Согласно восьмому аспекту изобретения предложен способ предотвращения и/или лечения ожирения или сопутствующих расстройств, причем способ включает применение соединения согласно первому или второму аспектам изобретения, предпочтительно в сочетании с фармацевтически приемлемым носителем или разбавителем (как в шестом аспекте изобретения). Сопутствующие ожирение заболевания включают гиперлипемию, гиперлипидемию, гипергликемию, гипертензию, сердечно-сосудистые заболевания, инсульт, желудочно-кишечные заболевания и желудочно-кишечные состояния. Соединения или составы предпочтительно назначают пациентам, которые в этом нуждаются, и в количествах, достаточных для предотвращения и/или лечения симптомов этих состояний, расстройств или заболеваний. Для всех аспектов изобретения, в особенности, медицинских, прием соединения или состава должен быть строго дозирован под обязательным наблюдением врача и с учетом таких факторов, как используемое соединение, тип животного, возраст, вес, серьезность симптомов, способ приема, неблагоприятные реакции и/или другие противопоказания. Конкретно назначаемые дозы могут быть определены в результате стандартно разработанных клинических испытаний при полном контроле за изменением состояния пациента и выздоровлением. В подобных испытаниях могут быть использованы возрастающие дозы, причем в качестве стартовой дозы для человека может быть взят низкий процент от максимально допустимой дозы в животных.
Физиологически приемлемые соединения согласно изобретению обычно могут назначаться в виде суточной дозы (для взрослого пациента), которая может составлять, например: для пероральной дозы
- от 1 мг до 2000 мг, предпочтительно от 30 мг до 1000 мг, например, от 10 до 250 мг, для внутривенной, подкожной или внутримышечной дозы - от 0,1 мг до 100 мг, предпочтительно от 0,1 мг до 50 мг, например, от 1 до 25 мг соединения формулы (I) или ее физиологически приемлемой соли, рассчитанной как свободное основание, причем соединение принимают от 1 до 4 раз в сутки. Соединение может быть назначено в течение периода непрерывного лечения, например, в течение недели или более.
Согласно девятому аспекту изобретения предложен способ косметического поддержания данного веса, или косметического снижения веса, при этом способ включает прием соединения согласно первому аспекту изобретения, предпочтительно в сочетании с фармацевтически приемлемым носителем или разбавителем (как в пятом аспекте изобретения). Медицинский препарат предпочтительно назначают пациенту, которые в нем нуждается, и в количестве, достаточном для поддержания данного веса или для косметического снижения веса.
Восьмой и девятый аспекты изобретения относятся к способам лечения человека и животных, в частности животных-спутников человека и других животных, которые обеспечивают потребности человека в мясе, таких как крупный рогатый скот, свиньи и овцы (любого возраста).
Изобретение далее будет описано со ссылкой на следующие неограничивающие примеры.
Методики биологических испытаний и результаты.
Испытываемые соединения.
Соединения бензоксазина, используемые в следующих обозначены номерами, которые соответствуют номерам соединений в таблице 1.
Определение активности липазы колориметрическим анализом с использованием хининдииминного красителя.
Инигибирующее действие выбранных соединений по отношению к панкреатической липазе было измерено при проведении следующего анализа, набор для которого поставляется фирмой Sigma Ltd (Lipase PSTM каталог 805-А):

Глицерол, выделенный под действием панкреатической и моноглицеридной липаз, был окислен с выделением Н2О2. Затем на стадии реакции с участием пероксидазы образуется хининный краситель, который имеет розовый цвет и поглощает свет с длиной волны 550 нм.
Ингибитор.
Индивидуальные соединения растворяли в ДМСО (диметилсульфоксиде) при 10 мМ. ДМСО использовали с тем, чтобы избежать проблем в случае нерастворимых в воде соединений.
Для индивидуальных соединений, IC50 (концентрация, при которой активность липазы ингибируется до 50% от максимальной активности) рассчитывали путем измерения ингибирующего действия по логарифмическим кривым зависимости логарифма дозы в интервале ингибирующих концентраций.
Результаты.
Методом колориметрического анализа с хининдииминным красителем, который позволяет быстро измерить ингибирующее действие липазы, был исследован ряд соединений. Ни одно из испытуемых соединений не участвовало в колориметрической реакции, т.е. не было ложных положительных результатов.
Наблюдали интервал ингибирующих концентраций испытываемых соединений бензоксазинона, что указывает на то, что эти соединения являются ингибиторами панкреатической липазы человека. Следующие соединения имели IC50≤1 мкМ: 1-3, 5-12, 14, 15, 17, 19-21, 23-26, 28-30.
Определение активности фермента липазы методом титрования NaOH.
Ингибирующее действие выбранных соединений по отношению к панкреатической липазе было измерено при проведении анализа, описанного в Pasquie et al., 1986, Vol.7, Nutritional Biochemistry, 293-302.
Логарифмические кривые зависимости ответа от логарифма дозы были построены для интервала ингибирующих концентраций.
Результаты
Выбранные соединения бензоксазинона исследовали методом титрования NaOH. В этом анализе фиксируется активность панкреатической липазы свиньи в системе, содержащей липидные мицеллы. Эти условия, таким образом, аналогичны тем, что наблюдаются в желудочно-кишечном тракте.
Наблюдали интервал ингибирующих концентраций испытываемых соединений бензоксазинона, указывающих на то, что эти соединения являются ингибиторами панкреатической липазы свиньи. Следующие соединения имели IC50≤2 мкМ: 1-3, 5, 8, 11, 12, 14-20, 24, 26, 28-30.
Таким образом, результаты показывают, что испытываемые соединения бензоксазинона являются ингибиторами расщепления жиров и что эти соединения могут быть в особенности подходящими для лечения ожирения.
Испытание на модели мыши.
Соединение 24 испытывали на модели мыши, как описано Isler et al., British Journal of Nutrition, 1995, 73, 851-862, при этом было обнаружено, что это соединение является потенциальным ингибитором липазы.
Синтез промежуточных соединений
Синтез 4-замещенной антраниловой кислоты
Пример: 4-октил антраниловая кислота (4-октил-2-аминобензойная кислота)
Способ основан на методике, описанной L.A.Paquette et al., J.Am.Soc. 99, 3734 (1981).

Раствор 1-бром-4-октилбензола (9,9 г, 36 ммоль) в серной кислоте (20 мл) охладили на ледяной бане. Затем добавили азотную кислоту (1,44 мл, 36 ммоль). Удалили ледяную баню и смесь перемешивали при комнатной температуре в течение 20 мин. Добавили еще одну порцию азотной кислоты (0,07 мл, 1,75 ммоль) и продолжали перемешивать еще 20 мин. Смесь перелили в водный раствор карбоната калия, который экстрагировали этилацетатом. Органический экстракт промывали насыщенным водным раствором карбоната калия, водой и рассол затем высушивали (MgSO4) и концентрировали. При последующей очистке сырого продукта флэш-хроматографией (1% Еtoac/гексан) происходит удаление нежелательных (основных) региоизомеров с выходом требуемого продукта в виде желтого масла (1,7 г, 5,4 ммоль).
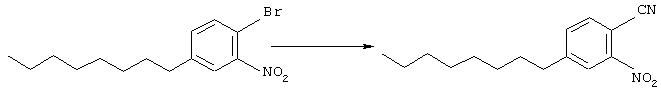
Основу (1,7 г, 5,4 ммоль), цианид меди (I) (0,533 г, 5,9 ммоль), и пиридин (20 мл) подвергали дефлегмации при 150° в течение 2 суток.
Последующее концентрирование под вакуумом и очистка флэш-хроматографией (от 10% до 20% Еtoac/гексан) дает выход требуемого продукта в виде коричневого масла (739 мг, 2,8 ммоль).

Основу (694 мг, 2,7 ммоль) нагревали при 150° в смеси с водой (2 мл), АсОН (1 мл) и серной кислоты (1 мл) в течение 2 суток. Смесь экстрагировали этилацетатом, органическую фазу промывали водой (2 раза), высушивали (Na2SO4) и концентрировали с получением требуемого материала (744 мг, 2,7 ммоль).

Исходный материал (744 мг, 2,7 ммоль) растворяли в этаноле (10 мл), и к раствору добавляли взвесь 10% палладия, нанесенного на активированный уголь, (40 мг) в этаноле (4 мл). Колбу продували азотом и затем водородом (1 атм), после чего перемешивали всю ночь. Затем добавляли следующие порции катализатора (5 мг и 25 мг), и реакция завершилась в последующие 24 часа. Реакционную смесь фильтровали на целите, тщательно ополаскивали метанолом и этилацетатом. Концентрирование дало антраниловую кислоту (597 мг, 2,4 ммоль) достаточной степени чистоты для использования без последующей очистки; σн (400 МГц, CDCl3) 0,79-0,81 (3Н, m, Me), 1,12-1,36 (10Н, m, 5× СН2), 1,52 (2Н, br.s. АrСН2СН2), 2,45 (2Н, br.s. ArCH2), 6,42 (2H, br.s. 2× ArH), 7,74 (1Н, br.s. ArH); m/z (ES+) 250 (MH+).
Синтез замещенных фенилизоцианатов
Пример: получение 4-октилфенилизоцианата

Раствор 4-октиланилина (0,3 мл, 1,3 ммоль) и диизопропиламина (0,205 мл, 5,2 ммоль) в ТГФ (тетрагидрофуране) (5 мл) охладили до минус 10° . Затем добавили 10% раствор фосгена в толуоле (1,3 мл, 2,6 ммоль), и смесь оставили нагреваться до комнатной температуры и выдержали при этой температуре 3 часа. Избыток фосгена удалили в потоке азота (которые на выходе пропускали через скруббер с водным NaOH) с получением раствора сырого изоцианата, который использовали непосредственно на следующей стадии.
4-бензолфенилизоцианат приготовляли по аналогичной методике из соответствующего анилина.
Замещенный 4-феноксифенилизоцианат может быть приготовлен известными методами из соответствующих аминов.
Синтез соединений согласно изобретению
Пример 1
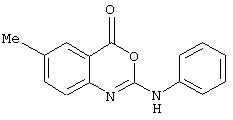
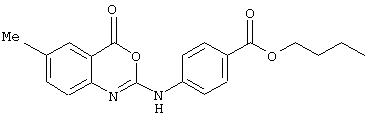
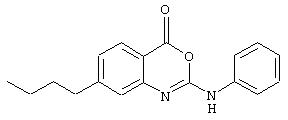
Синтез 2-(4-бутоксикарбонилфениламино)-6-метил-4Н-3,1-бензоксазин-4-она (номер 14).

Раствор 2-амино-5-метилбензойной кислоты (690 мг, 4,57 ммоль) в ТГФ (2 мл) обработали 4-н-бутоксикарбонилфенилизоцианатом (1,0 г, 4,57 ммоль). Смесь выдержали при комнатной температуре 24 ч, в течение которых происходило испарение растворителя с образованием бледно-коричневого твердого осадка (1,7 г, количественно); σ н (400 МГц, ДMCO-d6) 0,93 (3Н, t, J7, СН2CH3), 1,41 (2Н, tq, J, J’7, СН2СН3), 1,67 (2Н, tt, J, J’7, СH2CH2CH3), 2,28 (3Н, s, СН3), 4,23 (2Н, t, J7, ОСН2), 7,37 (1Н, d, J8, Ph), 7,77 (1H, s, Ph), 7,85-7,92 (4H, m, Ph), 8, 24 (1H, d, J8, Ph).

К раствору мочевины (185 мг, 0,5 ммоль) в ДМФА (10 мл) добавили нанесенный на полимер EDC (PS-EDC) (0,8 ммоль/г, 1,0 г). Полученную 5 смесь перемешивали при комнатной температуре в течение 18 ч, после чего смолу отфильтровывали и промывали ДМФА (2× 5 мл). Фильтрат и промывные воды соединяли и выпаривали при пониженном давлении с получением требуемого соединения в виде кремового твердого осадка (150 мг, 85%); σ н (400 МГц, ДМСO-d6) 0,94 (3Н, t, J7, CH2CH3) 1,42 (2Н, tq, J, J’7, СH2CH3), 1,69 (2Н, tt, J, J’7, СН2СН2СН3), 2,39 (3Н, s, СН3), 4,25 (2Н, t, J7, ОСН2), 7,36 (1Н, d, J8, Ph), 7,63 (1Н, d, J8, Ph), 7,80 (1H, s, Ph), 7,90-7,95 (4Н, m, Ph), m/z (ES-) 351 (M-H+).
Пример 2
Синтез 6-метил-2-(4-феноксифениламино)-4Н-3,1-бензоксазин-4-она (номер 15)

Раствор 2-амино-5-метилбензойной кислоты (172 мг, 1,10 ммоль) в ТГФ (1 мл) обработали 4-феноксифенилизоцианатом (241 мг, 1,10 ммоль). Смесь выдержали при комнатной температуре 24 ч, в течение которых происходило испарение растворителя с образованием бледно-коричневого твердого осадка. Осадок растворили в ДМФА (5 мл) и добавили к суспензии PS-EDC (0,8 ммоль/г, 2,8 г) в ДМФА (20 мл). Полученную смесь перемешивали при комнатной температуре в течение 18 ч, после чего смолу отфильтровывали и промывали ДМФА (2× 5 мл). Фильтрат и промывные воды соединили и выпаривали при пониженном давлении. Флэш-хроматография в колонке с силикагелем (элюент - 20% этилацетата в гексане) дала требуемое соединение в виде кремового твердого осадка (153 мг, 40%); σ н (400 МГц, ДМСО-d6) 2,36 (3Н, s, СН3), 6,96 (2Н, d, J8, Ph), 7,04 (1Н, d, J8, Ph), 7,09 (1Н, t, J8, Ph), 7,26 (1Н, d, J8, Ph), 7,34-7,38 (2Н, m, Ph), 7,55-7,56 (1H, m, Ph), 7,76-7,78 (4H, m, Ph), m/z (ES+) 345 (MH+).
Пример 3
2-(3-хлорфениламино)-6-октил-4Н-3,1-бензоксазин-4-он
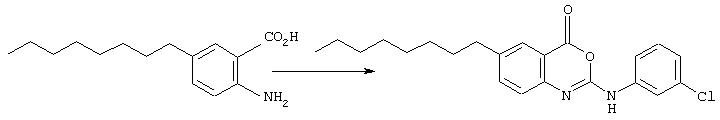

Антраниловую кислоту (200 мг, 0,8 ммоль) растворили в ТГФ (1 мл) и к полученному раствору добавили 3-хлорфенилизоцианат (117 мкл, 0,96 ммоль). Смесь перемешивали 3 ч перед концентрированном. Осадок разделился между водой и этилацетатом. Органический слой промывали 5% водной лимонной кислотой, насыщенным водным раствором бикарбоната, и рассол затем высушивали (MgSO4) и концентрировали с образованием оранжевого осадка. Осадок очищали флэш-хроматографией в колонке с силикагелем (15% ЕtOАс/гексан до 100% ЕtOАс, затем 10% ЕtOН/ЕtOАс) с элюированием бензоксазинона (18 мг, 0,05 ммоль); σ н (400 МГц, CDCl3) 0,77-0,82 (3Н, m, Me), 1,19-1,24 (10Н, m, 5× CH2) 1,55-1,57 (2H, m, ArCH2CH2), 2,56-2,62 (2Н, m, АrСН3), 7,00-7,32 (4H, m, 3× ArH, NH), 7,40-7,49 (2Н, m, 2× ArH), 7,81-7,83 (2Н, m, ArH), m/z (ES+) 385 (МН+) и мочевины (160 мг, 0,4 ммоль); m/z (ES-) 401 (М-Н)-.
Остаточную мочевину можно подвергнуть циклизации в отдельной стадии (как описано ниже) с образованием большего количества бензоксазинона, если это необходимо.
Пример 4
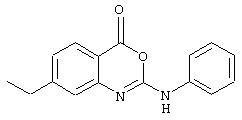
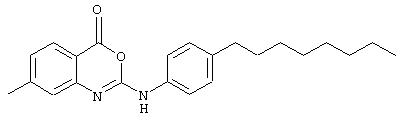
7-октил-2-фениламино-4Н-3,1-бензоксазин-4-он (соединение 23).

Мочевину (126 мг, 0,34 ммоль) суспендировали в сухом DCM (4 мл). Добавили 1-[3-(диметиламино)пропил]-3-этилкарбодиимид гидрохлорид (EDC, 131 мл, 0,68 ммоль) и полученную смесь перемешивали в течение следующих 24 ч. Смесь разбавили этилацетатом и промыли водой, насыщенным водным раствором бикарбоната и рассолом, затем высушивали (Na2SO4) и концентрировали с образованием бензоксазинона, который не требовал дальнейшей очистки; σ н (400 МГц, CDCl3) 0,92 (3Н, t, J6,7, Me), 1,30-1,36 (10Н, m, 5× CH2) 1,68-1,70 (2Н, m, ArCh2 ch2), 2,71-2,75 (2Н, m, ArCH2), 6,80 (1Н, br.s., NH), 7,13-7,21 (2Н, m, 2× ArH), 7,28 (1Н, s, ArH), 7,42-7,46 (2Н, m, 2× ArH), 7,70 (2Н, d, J 8,2, ArH), 8,04 (1H, d, J 8,1, ArH), m/z (ES+) 351 (MH+).
Пример 5
7-метил-2-(4-феноксифенил)-4Н-3,1-бензоксазин-4-он

2-амино-5-метилбензойной кислоту (207 мг, 1,37 ммоль) в ТГФ (3 мл) обработали 4-феноксифенилизоцианатом (289 мг, 1,37 ммоль). Смесь выдержали при комнатной температуре 48 ч, затем разбавили этилацетатом и промыли 2 N HCI, водой, насыщенным водным раствором бикарбоната и рассолом, затем высушили (Na2SO4) и сконцентрировали. Осадок очистили флэш-хроматографией в колонке с силикагелем (при градиенте от 50% до 100% этилацетата в гексане, затем 1% метанол/этилацетат) с образованием белого твердого осадка (217 мг, 0,6 ммоль, 44%); δн (400 МГц, AMCO-d6) 2,28 (3Н, s, Me), 6,72 (1Н, d, J8,0, ArH) 6,95 (4Н, m, ArH), 7,08 (1Н, t, J6,9, ArH), 7,36 (2Н, t, J7,9, ArH), 7,56 (2Н, d, J7,8, ArH), 7,87 (1Н, d, J7.6, ArH), 8,11 (1Н, s, ArH), 9,49 (1Н, s, NH), m/z (es-) 362 (m-h)-.

Мочевину (217 мг, 0,6 ммоль) в DCM (4 мл) обработали (EDC, 126 мг, 0,66 ммоль). Через 24 ч, 48 ч добавили следующие порции EDC (по 115 мл каждая, 0,6 ммоль). Смесь разбавили этилацетатом и промыли водой, насыщенным водным раствором бикарбоната и рассолом, затем высушили (Na2SO4) и концентрировали с образованием бензоксазинона (137 мг, 0,4 ммоль, 67%); σ н (400 МГц, CDCl3) 2,37 (3Н, s, Me), 6,7 (1Н, br.s, NH), 6,94-7,05 (6Н, m, ArH), 7,14 (1Н, s, ArH), 7,27 (2Н, t, J 7,7, ArH), 7,54 (2Н, d, J 8,7, ArH), 7, 89 (1Н, d, J 8,1, ArH), m/z (ES+) 345 (MH+).
Остальные соединения из таблицы 1 могут быть получены аналогично примерам 1-5. В частности, следующие соединения были получены при использовании указанных исходных веществ (см. табл.2)
В вышеприведенном описании подробно рассмотрены конкретные соединения, составы, способы и применения, которые могут быть использованы для осуществления настоящего изобретения. Однако специалистам в данной области должно быть понятно, как можно использовать альтернативные способы реализации альтернативных вариантов настоящего изобретения, охватываемых формулой изобретения.
Реферат
Изобретение относится к органической химии и может найти применение в медицине. Описывается способ предотвращения или лечения состояний, в которых требуется ингибирование фермента, преимущественное действие которого заключается в катализировании гидролиза эфирных функциональных групп, где указанное состояние представляет собой ожирение, или сопутствующее нарушение, при котором назначают соединение формулы 1,
или его фармацевтически приемлемую соль, эфир, амид или предшественник, где в формуле (1)
А - шестичленное ароматическое или гетероароматическое кольцо,
R1 - разветвленный или неразветвленный алкил (углеродная цепочка которого, возможно, прервана одним или более атомами кислорода), алкенил, алкинил, циклоалкил, циклоалкенил, арил, арилалкил, восстановленный арилалкил, арилалкенил, гетероарил, гетероарилалкил, гетероарилалкенил, восстановленный арил, восстановленный гетероарил, восстановленный гетероарилалкил или их замещенное производное, в котором заместителем является один или более независимо выбранный из группы: галоген, алкил, замещенный галогеном алкил, арил, арилалкил, гетероарил, восстановленный гетероарил, восстановленный гетероарилалкил, арилалкокси-, циано-, нитро-, -C(O)R4, -CO2R4, -SOR4, -SO2R4, -NR6R7, -OR6, -SR6, -C(O)CX1X2NR6R7, -C(O)NR4R5, -C(O)N(OR5)R6, -NR6C(O)R4, -CR6(NH2)CO2R6, -NCX1X2CO2R6, -N(OH)C(O)NR6N7, -N(OH)C(O)R4, -NHC(O)NR6N7, C(O)NHNR6R7, -C(O)N(OR5)R6 или липид или стероид (природный или синтетический), при условии, что любой замещающий гетероатом в R1 или R2 должен быть отделен от экзоциклического атома азота по меньшей мере двумя атомами углерода (предпочтительно насыщенными), и R2 является водородом или группой, такой, как определено для R1, и где R4 представляет собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, арил, арилалкил, гетероарил, гетероарилалкил, восстановленный гетероарил или восстановленный гетероарилалкил, OR6, NHCX1X2CO2R6 или NR6R7, R5 представляет собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, арил, арилалкил, гетероарил, гетероарилалкил, восстановленный гетероарил или восстановленный гетероарилалкил, R6 и R7 независимо выбраны из водорода, алкила, алкенила, алкинила, циклоалкила, циклоалкенила, арила, арилалкила, гетероарила, восстановленного гетероарила, гетероарилалкила, восстановленного гетероарилалкила или (CH2)n(OR5)m, где n - от 1 до 12, предпочтительно от 2 до 10, a m - от 1 до 3, и R5наиболее предпочтительно алкил С2-10, X1 и X2 независимо представляют собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, арил, арилалкил, гетероарил, восстановленный гетероарил, гетероарилалкил, или восстановленный гетероарилалкил. Также описываются соединение формулы II, IIa, IIb, способ получения соединения II, фармацевтическая композиция для предотвращения или лечения ожирения или сопутствующего нарушения, продукт питания, способ предотвращения или лечения ожирения или сопутствующих нарушений, способ ингибирования ферментов, способ снижения содержания жира в животных, косметический способ поддержания данного веса. Технический результат - раскрыта возможность предотвращения или лечения ожирения или сопутствующих нарушений. 16 н. и 14 з.п. ф-лы, 1 ил., 2 табл.

Формула























































Комментарии