Производные амидов аминокислот, способ получения, фунгицидная композиция для сельского хозяйства и садоводства - RU2128186C1
Код документа: RU2128186C1
Чертежи

































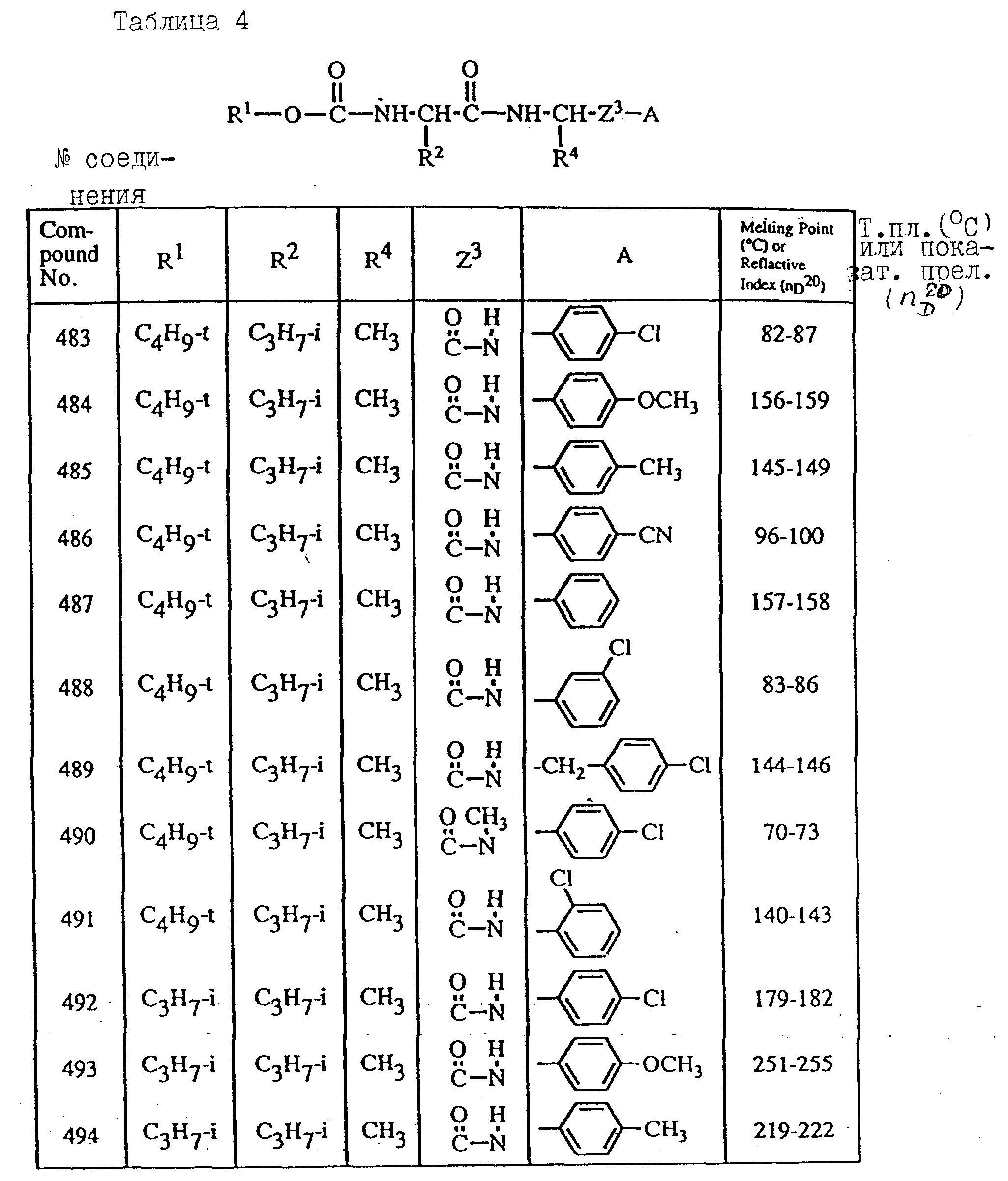
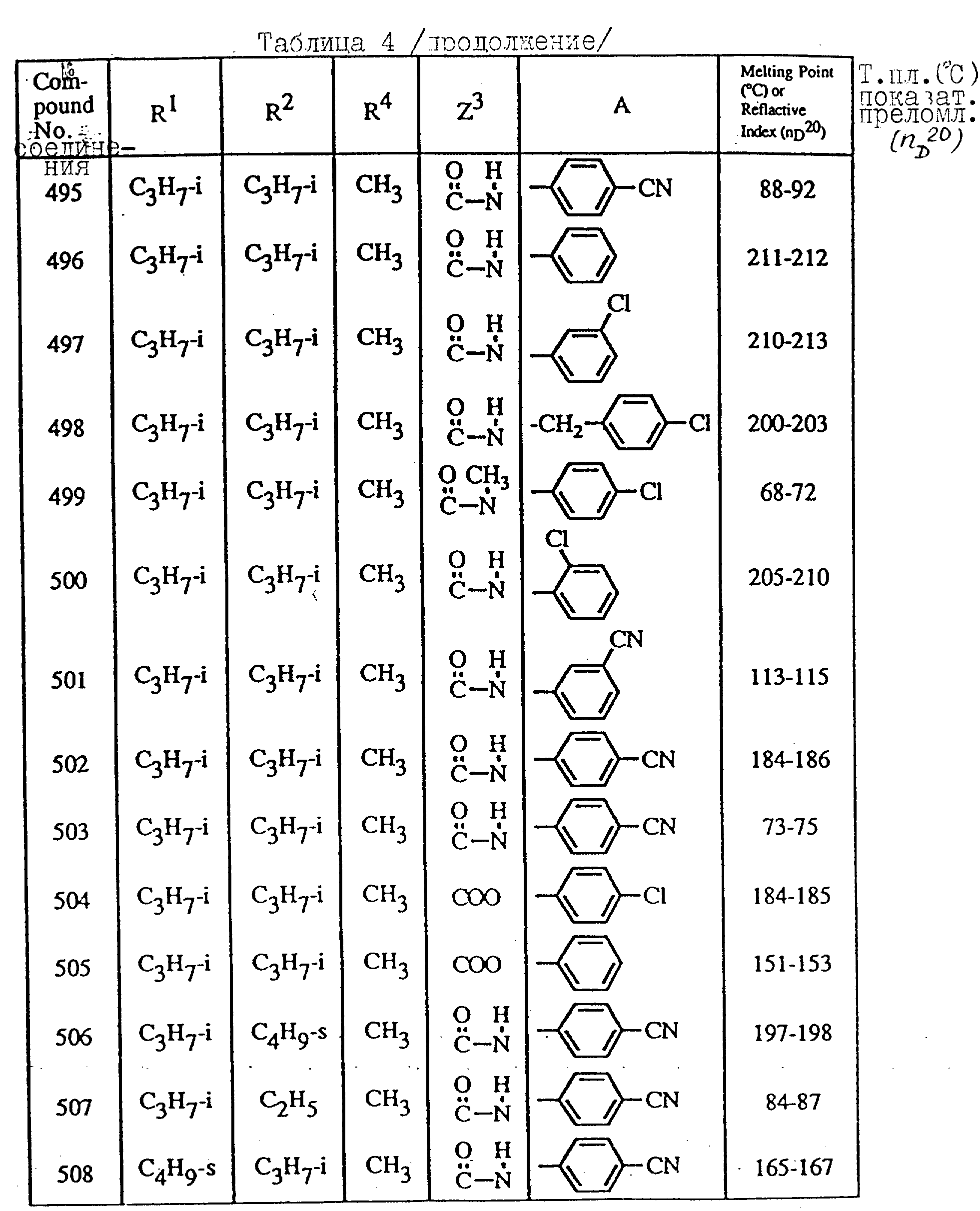































Описание
Область техники, к которой относится изобретение.
Настоящее изобретение относится к производным амидов аминокислот, а также к фунгицидам для сельского хозяйства и садоводства, содержащим такие соединения в качестве активных ингредиентов. Настоящее изобретение также относится к способам получения производных амидов аминокислот.
Предпосылка создания изобретения
Производные амидов аминокислот раскрываются в качестве промежуточных
соединений для лекарственных препаратов в заявках на патент Японии, первичные публикации NN Sho 56-8352 и Sho 62-89696. Однако эти документы не раскрывают полезность производных амидов аминокислот.
Хотя в заявках на патент Японии, первичные публикации NN Hei - 3-5451, Hei 3-153657, Hei - 4-230652, Hei 4-230653, Hei 4-283554, Hei 4-308507 и Hei 4-338372, раскрывается, что некоторые амиды
аминокислот пригодны для биоцидов, соединения, о которых идет речь в этих документах, отличаются от производных амидов аминокислот, соответствующих настоящему изобретению.
Описание
изобретения
Изобретатели синтезировали различные производные амидов аминокислот и осуществляли широкие исследования, связанные с действием этих соединений на физиологическую активность
грибов. В результате обнаружено, что соединения, соответствующие настоящему изобретению, проявляют широкий спектр противогрибковой активности, в особенности против ложной мучнистой росы огурцов,
ложной мучнистой росы винограда и фитофтороза томата.
В соответствии с отличительной особенностью настоящего изобретения предлагается производное амида аминокислоты, изображаемое
формулой (I)

в которой R1 представляет собой низшую алкильную группу (необязательно имеющую по крайней мере один из одинаковых или разных заместителей, выбираемый из группы, состоящей из атома галогена, алкоксигруппы и цианогруппы), низшую алкенильную группу, низшую алкинильную группу, циклоалкильную группу (необязательно содержащую по крайней мере один из одинаковых или различных заместителей, выбираемый из группы, состоящей из метильной группы и атома галогена), циклоалкилакильную группу, циклоалкенильную группу, алкеноксидную группу, аралкильную группу (необязательно содержащую по крайней мере один из одинаковых или различных заместителей, выбираемый из группы, состоящей из метильной группы, цианогруппы и нитрогруппы), фенильную группу (необязательно имеющую по крайней мере один из одинаковых или различных заместителей, выбираемый из группы, состоящей из атомов галогена; низшей алкильной группы, которая может быть замещена одинаковыми или разными атомами галогена; низшей алкоксигруппы, которая может быть замещена одинаковыми или разными атомами галогена; цианогруппы и нитрогруппы), или гетероциклическую группу;
R2 представляет собой этильную группу, н-пропильную группу, изопропильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, алкенильную группу, циклоалкенильную группу, фенильную группу (необязательно содержащую по крайней мере один заместитель из числа атомов галогена);
R3 представляет собой атом водорода или низшую алкильную группу;
R4 представляет собой атом водорода, низшую алкильную группу или цианогруппу;
R5, R6 и R7 независимо представляют собой атомы водорода или низшие алкильные группы;
R8 представляет собой атом водорода, низшую алкильную группу, аралкильную группу, фенильную группу, алкоксикарбонильную группу или цианогруппу,
Z1 и Z2 независимо представляют собой атомы кислорода или атомы серы;
Z3 представляет собой атом кислорода, атом серы, группу N-R10 (где R10 представляет собой атом водорода, метильную группу, метилкарбонильную группу, фенилкарбонильную группу, метоксикарбонильную группу или метоксиметильную группу), сульфинильную группу, сульфонильную группу, группу COO, группу CONR11 (где R11 представляет собой атом водорода или низшую алкильную группу),
Q представляет собой фенильную группу (необязательно содержащую по крайней мере один из одинаковых или разных заместителей, выбираемый из группы, состоящей из атома галогена; низшей алкильной группы, которая может быть замещена по крайней мере одним из атомов галогена; низшей алкоксигруппой, которая может быть замещена одинаковыми или разными атомами галогена; цианогруппы; нитрогруппы; низшей алкоксикарбонильной группы; метилсульфинильной группы; метилтиогруппы, которая может быть замещена атомом галогена; диметиламиногруппы; фенилсульфонилгруппы; ацильной группы и фенильной группы), алкиленоксидную группу, гетероциклическую группу (необязательно содержащую заместитель, выбираемый из группы, состоящей из атома галогена, алкильной группы, трифторметильной группы и нитрогруппы, алкильной группы, трифторметильной группы и нитрогруппы) или конденсированную гетероциклическую группу, необязательно содержащую заместитель, выбираемый из группы, состоящей из атома галогена и нитрогруппы;
m является целым числом от 0 до 2,
n равен 0 или 1,
и фунгицид для сельского хозяйства или садоводства, содержащий такое производное в качестве активного ингредиента.
Термины, используемые в настоящем изобретении, означают перечисленное далее. Используемый здесь термин "алкильная группа" означает линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, включая, но не ограничиваясь этими группами, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, 1-метилбутильную группу, 2-метилбутильную группу, 3-метилбутильную группу, 2, 2-диметилпропильную группу, 1,1-диметилпропильную группу, 1-этилпропильную группу, н-гексильную группу или подобные группы.
Используемый здесь термин "атом галогена" означает атом фтора, атом хлора, атом брома или атом йода.
Используемый здесь термин "низшая алкенильная группа" означает линейную или разветвленную алкенильную группу, содержащую от 2 до 6 атомов углерода и включающую, но не ограничивающуюся этими группами, винильную группу, 1-пропенильную группу, изопропенильную группу, 1-бутенильную группу, 2-бутенильную группу, 3-бутенильную группу, 1-метил-1-пропенильную группу, 2-метилпропенильную группу, 1-этилвинильную группу или подобные группы.
Используемый термин "низшая алкинильная группа" означает линейную или разветвленную алкинильную группу, содержащую от 2 до 6 атомов углерода и включающую, например, этинильную группу, пропинильную группу, бутинильную группу, 1-метил-2-пропинильную группу или подобные.
Используемый здесь термин "циклоалкильная группа" означает циклоалкильную группу, содержащую от 3 до 8 атомов углерода и включающую, но не ограничивающуюся этими группами, циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу, циклогептильную группу или подобные.
Используемый здесь термин "циклоалкенильная группа" означает циклоалкенильную группу, содержащую от 4 до 8 атомов углерода и включающую, например, циклобутинильную группу, циклопентенильную группу, циклогексенильную группу, циклогептенильную группу или подобные группы.
Используемый здесь термин "аралкильная группа" означает аралкильную группу, содержащую 7 - 8 атомов углерода и включающую, но не ограничивающуюся этими группами, бензильную группу, фенетильную группу или подобные группы.
Используемый здесь термин "алкиленоксидная группа" означает алкиленоксидную группу, содержащую от 2 до 6 атомов углерода и включающую, например, оксиранильную группу, оксиэтанильную группу, тетрагидрофуранильную группу, тетрагидропиранильную группу или подобные группы.
Предпочтительными соединениями настоящего изобретения являются соединения, изображаемые формулой I, в которой R1 является линейной или разветвленной алкильной группой, сордержащей от 2 до 6 атомов углерода; линейной или разветвленной алкенильной группой, содержащей 3 атома углерода; циклоалкильной группой, содержащей 5 - 6 атомов углерода, или фенильной группой, необязательно содержащей заместитель; R2 представляет собой этильную группу, н-пропильную группу, изопропильную группу, или втор-бутильную группу; R3 представляет собой атом водорода или метильную группу; R4 представляет собой атом водорода или метильную группу; R5 представляет собой атом водорода или метильную группу; R6 представляет собой атом водорода или метильную группу; Q представляет собой фенильную группу, необязательно содержащую заместитель; m равен целому числу - 0 или 1; n равен 0; Z1, Z2 или Z3 представляют собой атомы кислорода или атомы серы; и аминокислота является L-изомером.
Соединения, изображаемые, в соответствии с изобретением формулой I, могут существовать в виде стереоизомеров, благодаря присутствию двух или большего числа хиральных центров. Настоящее изобретение относится ко всем таким стереоизомерам, включая диастереомеры, энантиомеры и их смеси, которые могут быть разделены соответствующими способами.
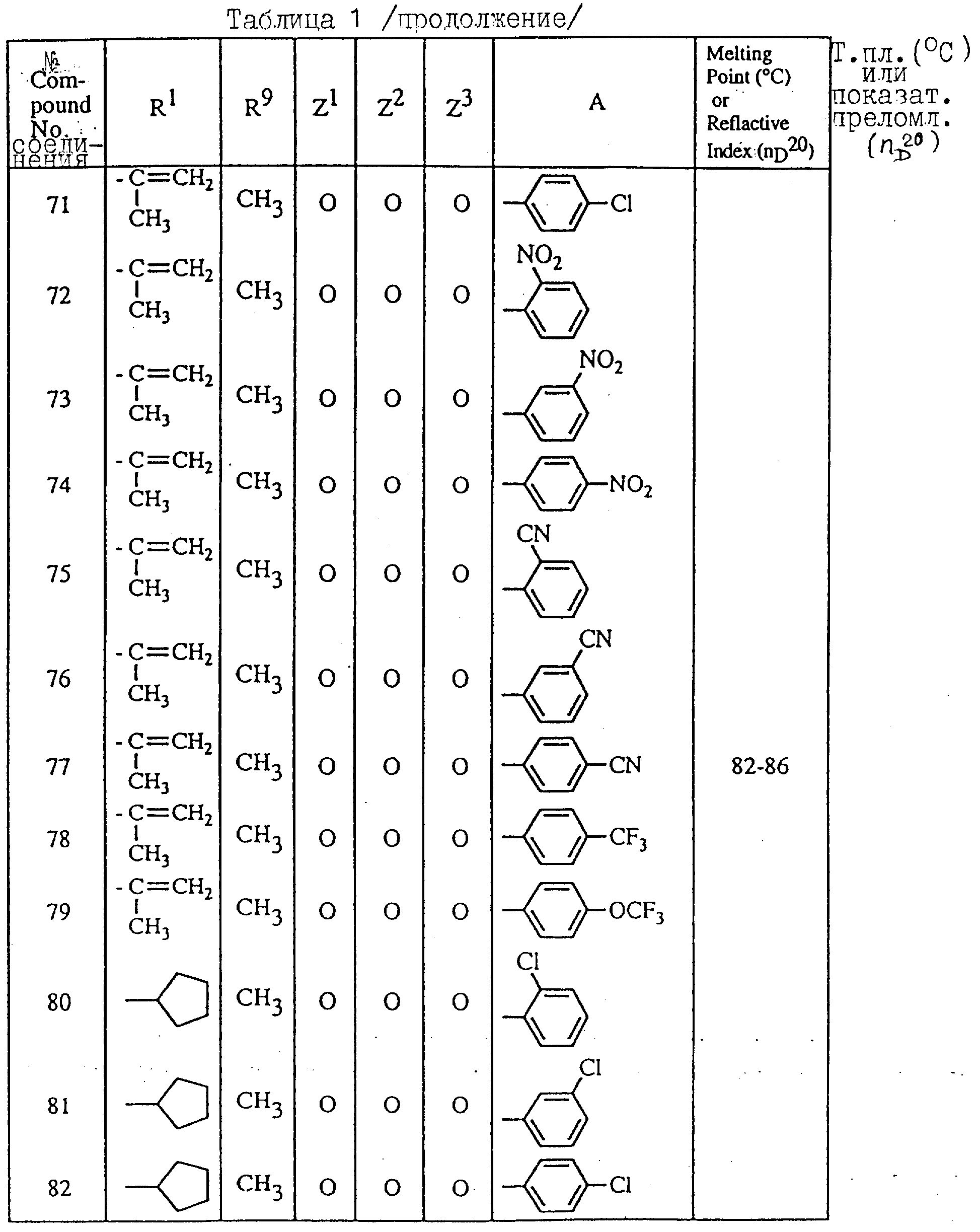
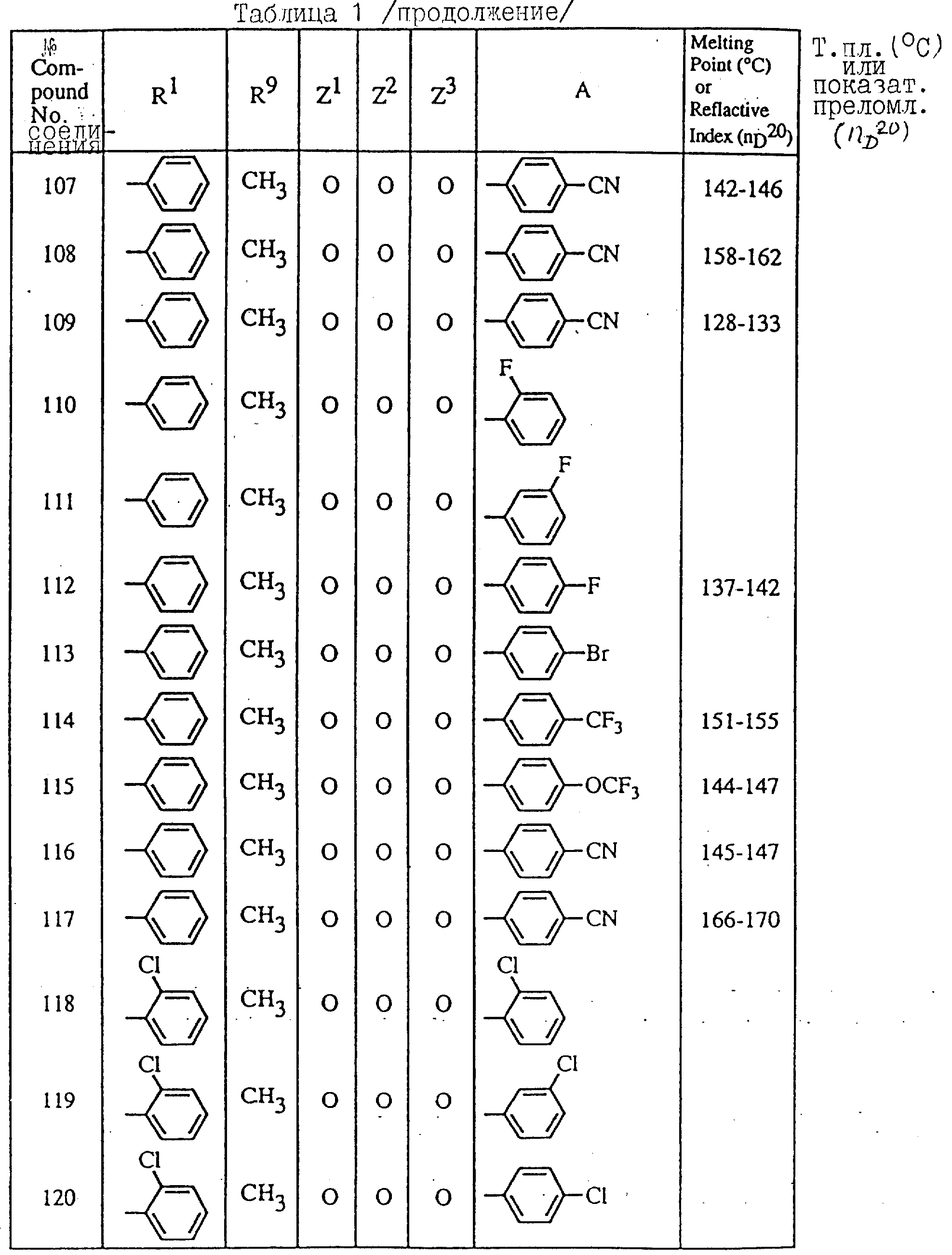
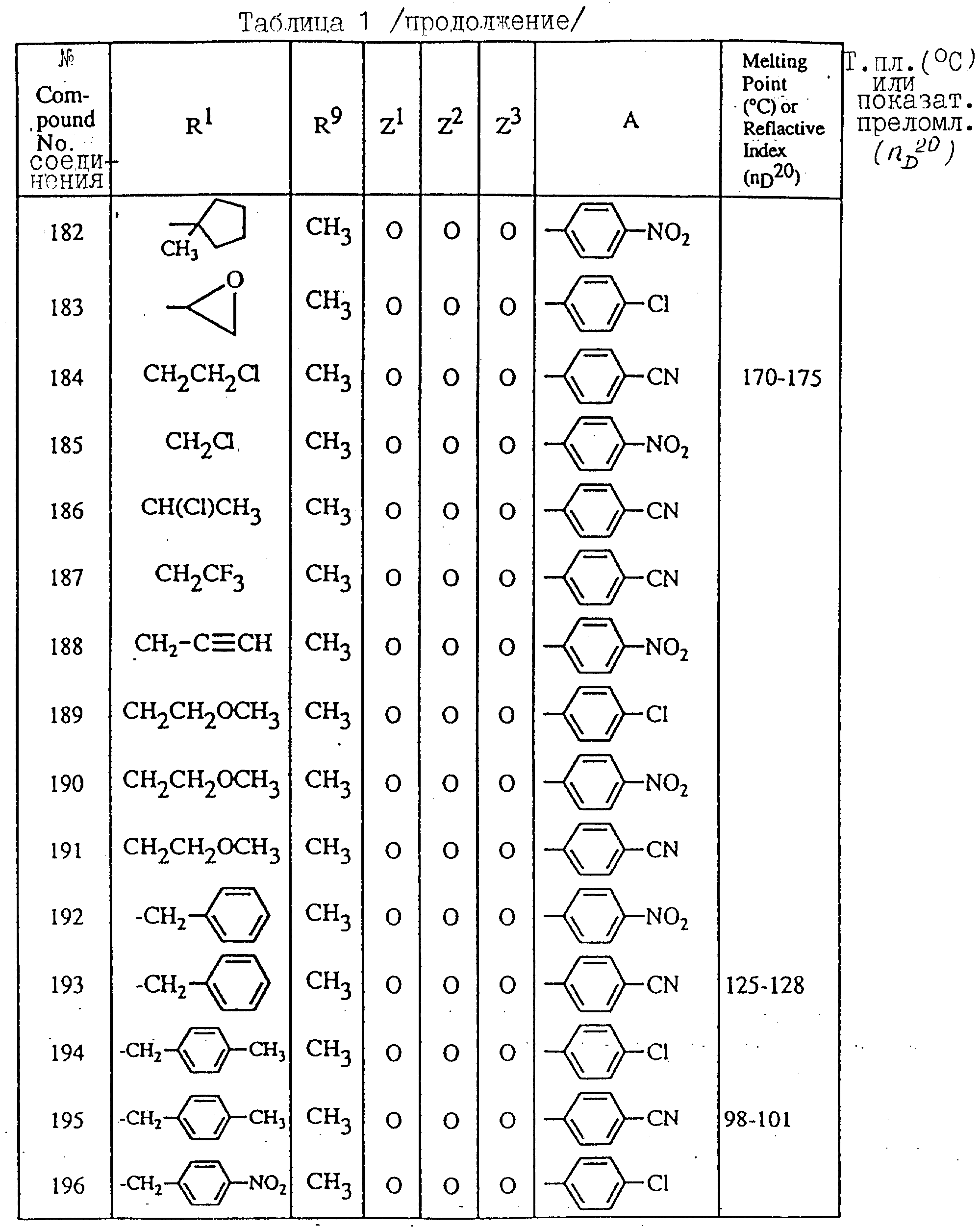
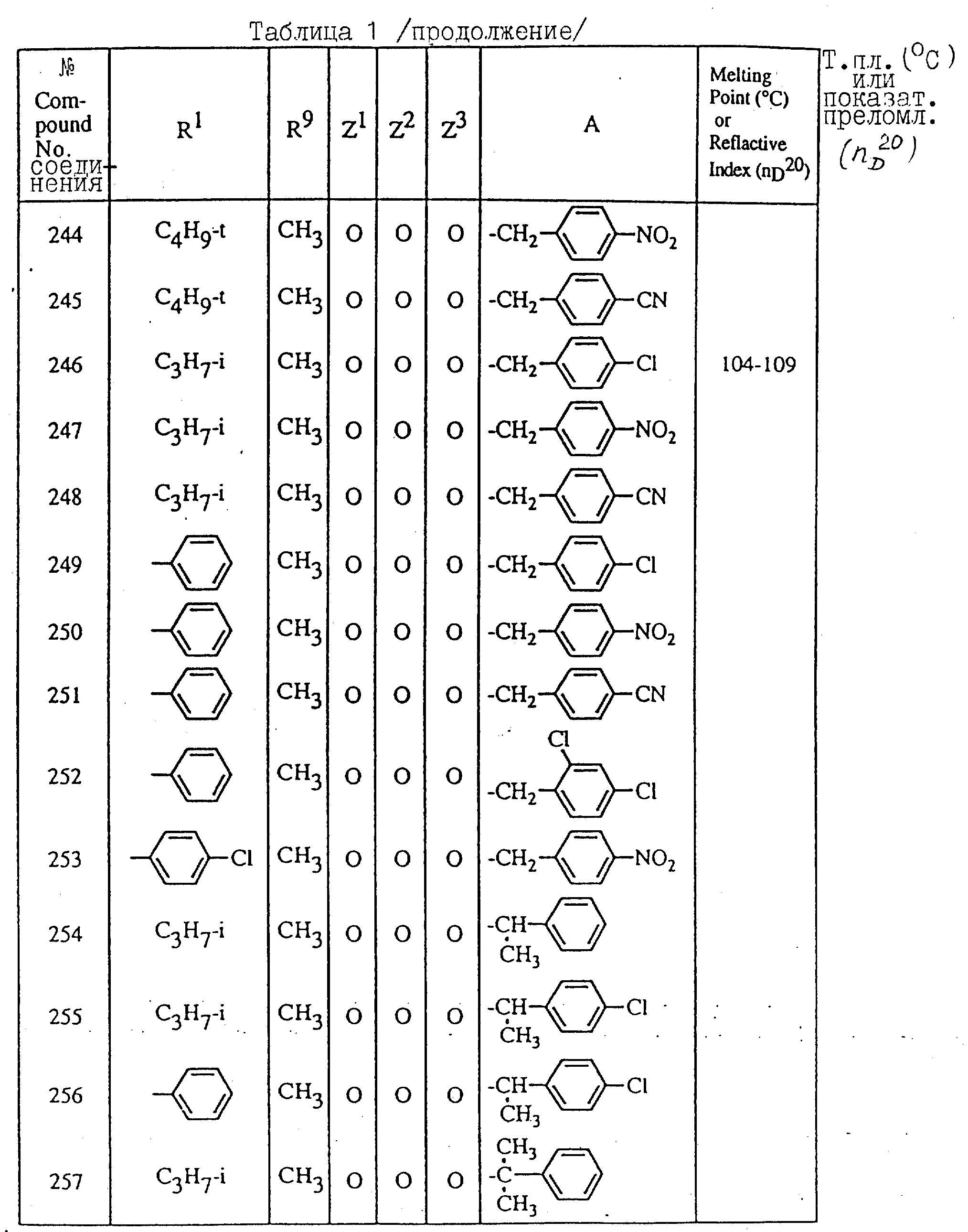
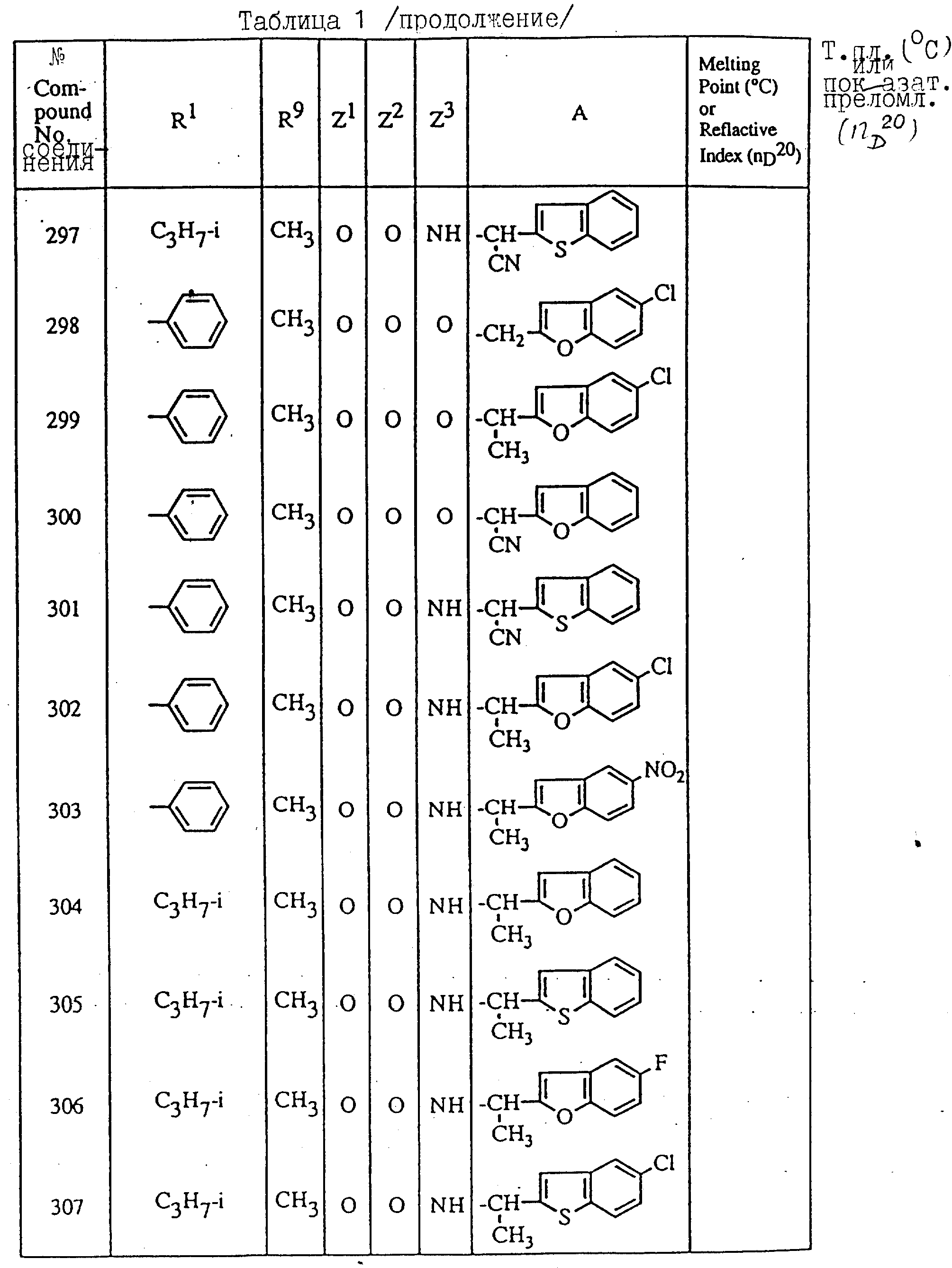
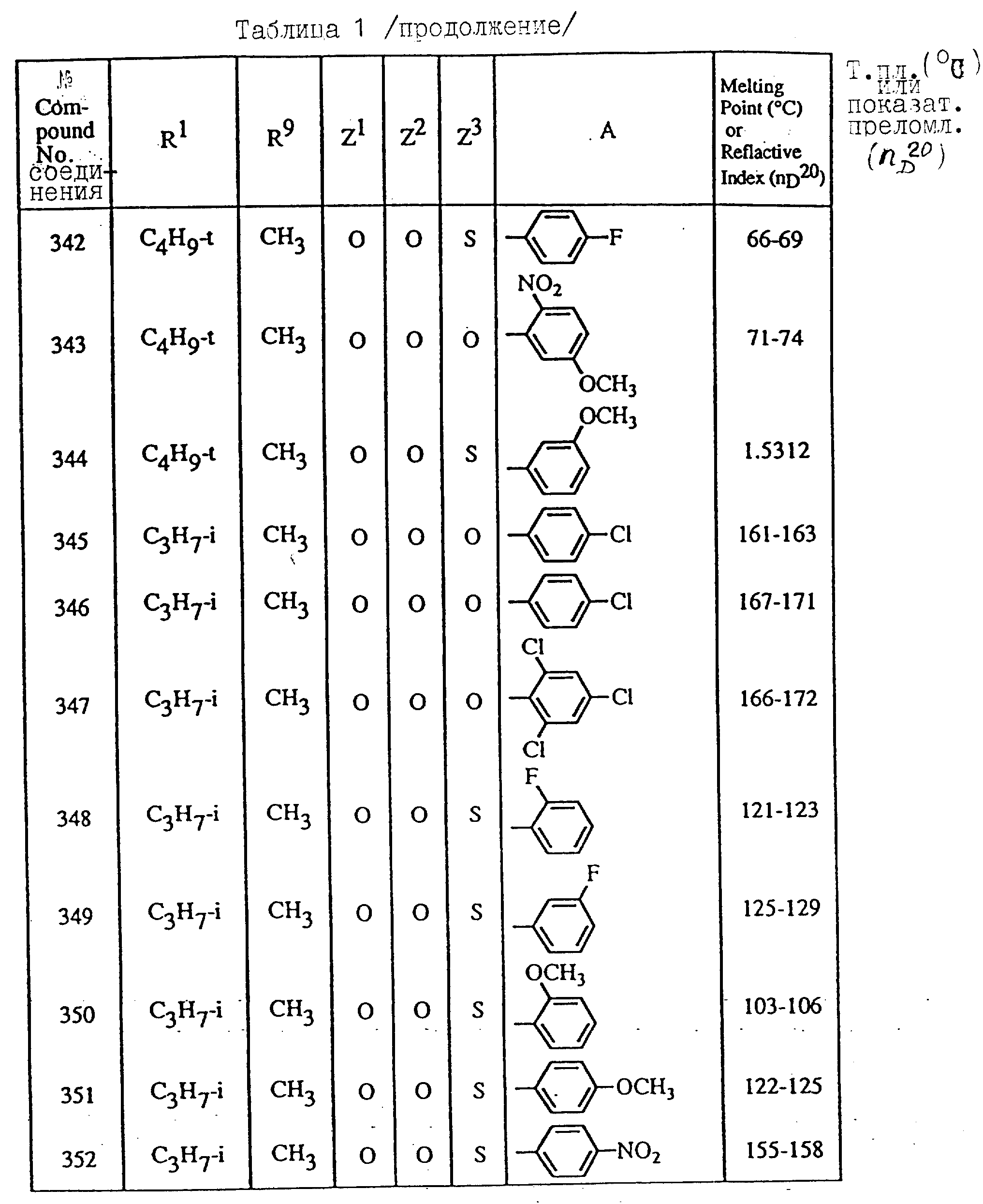
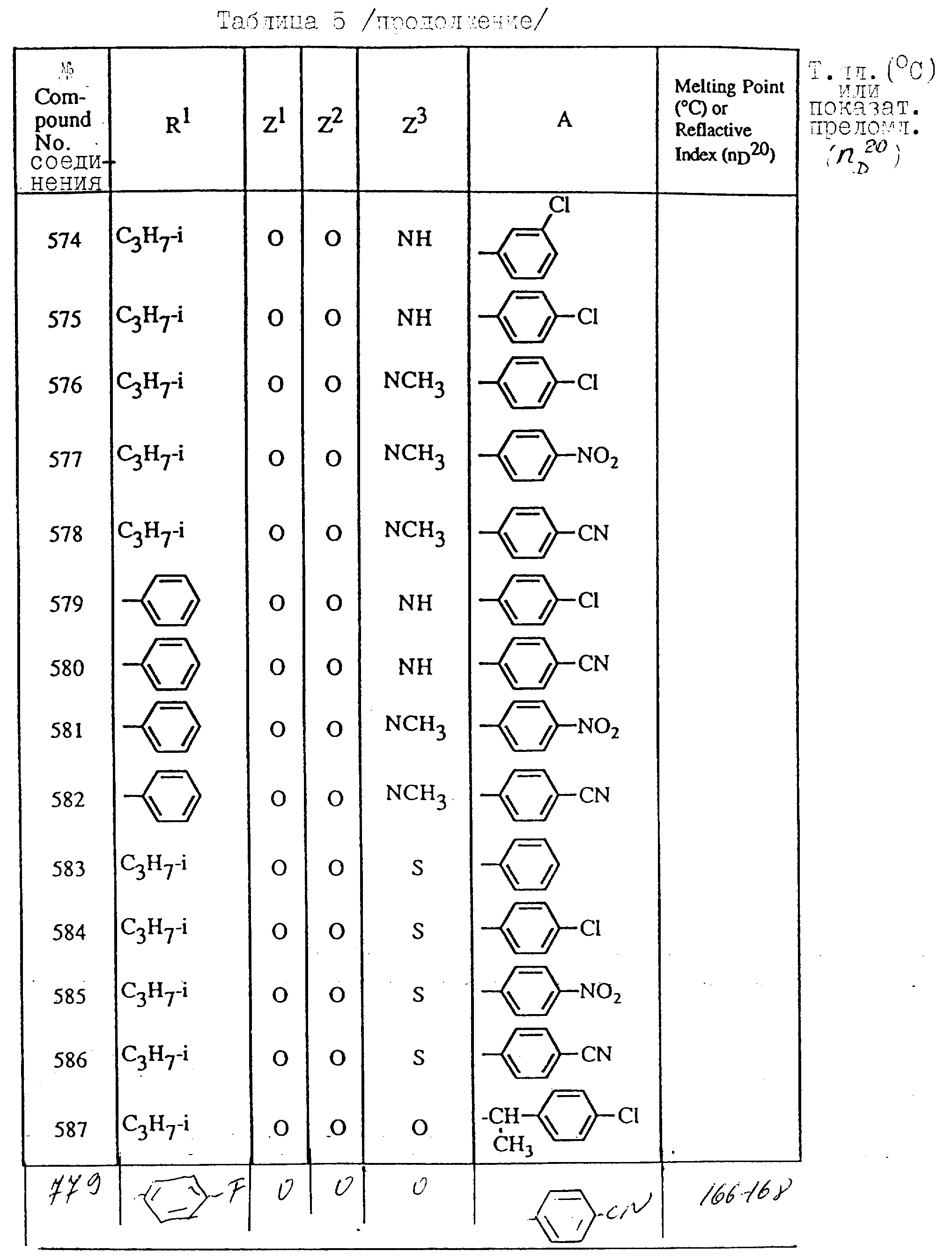
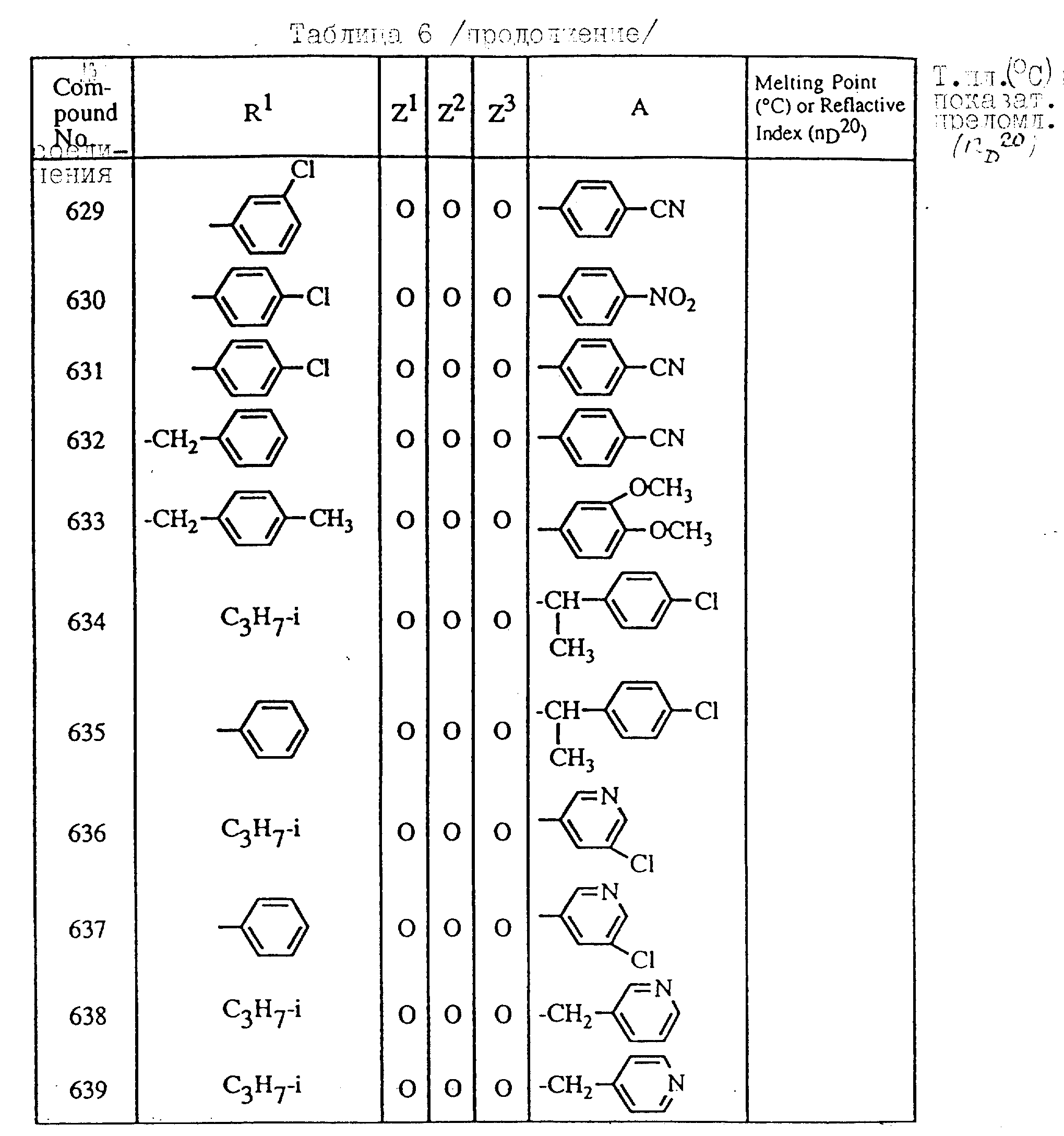
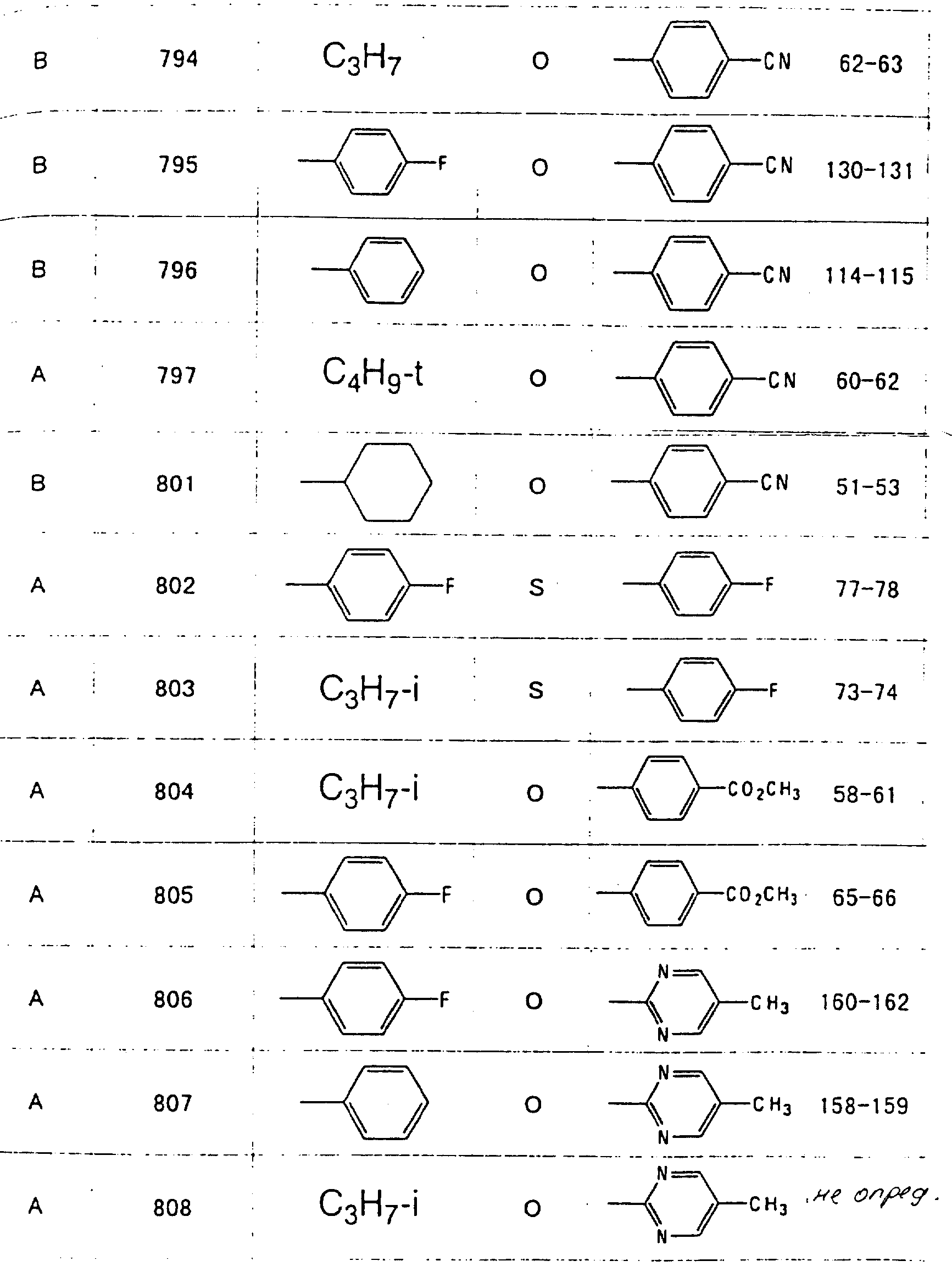
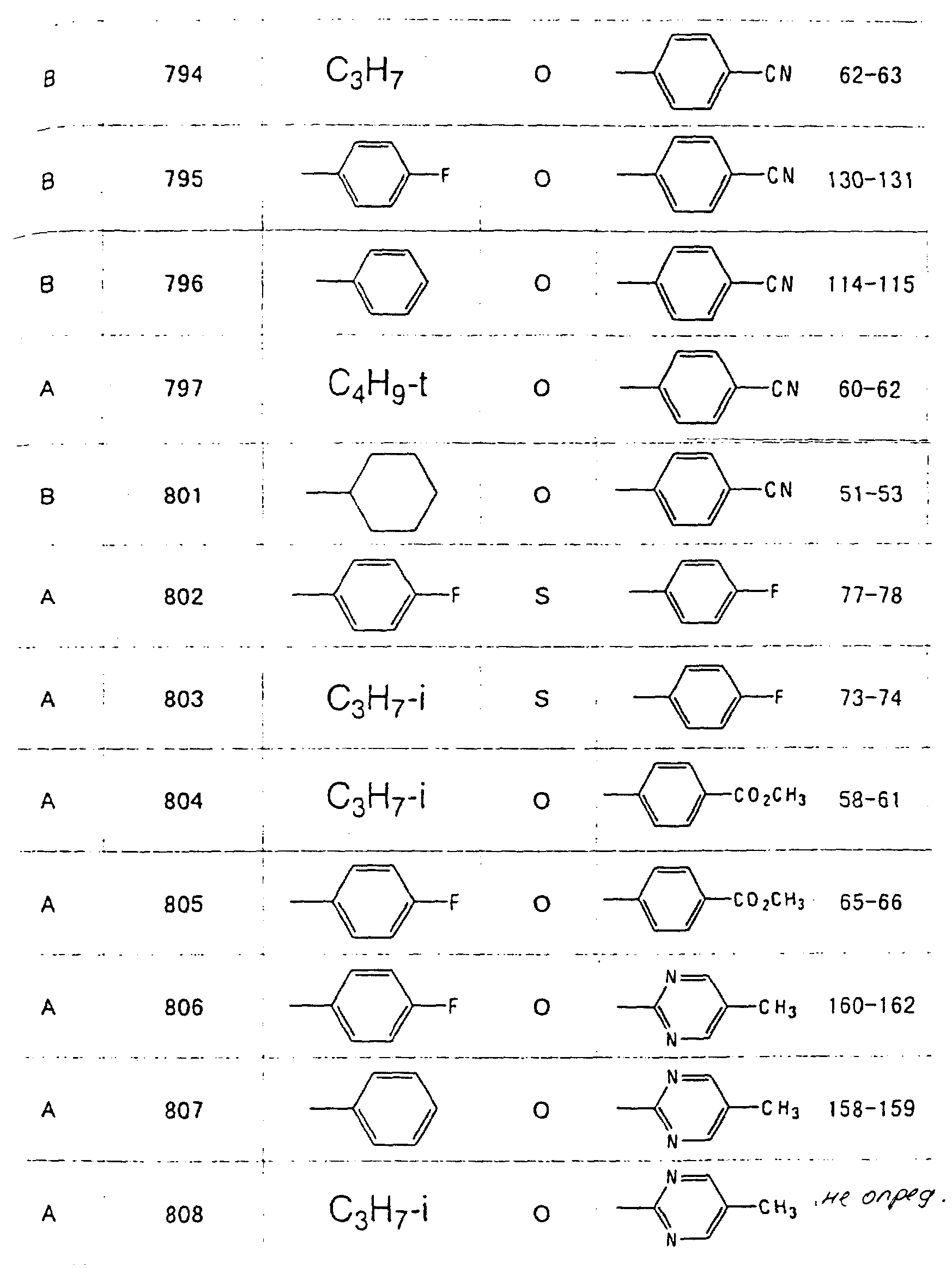
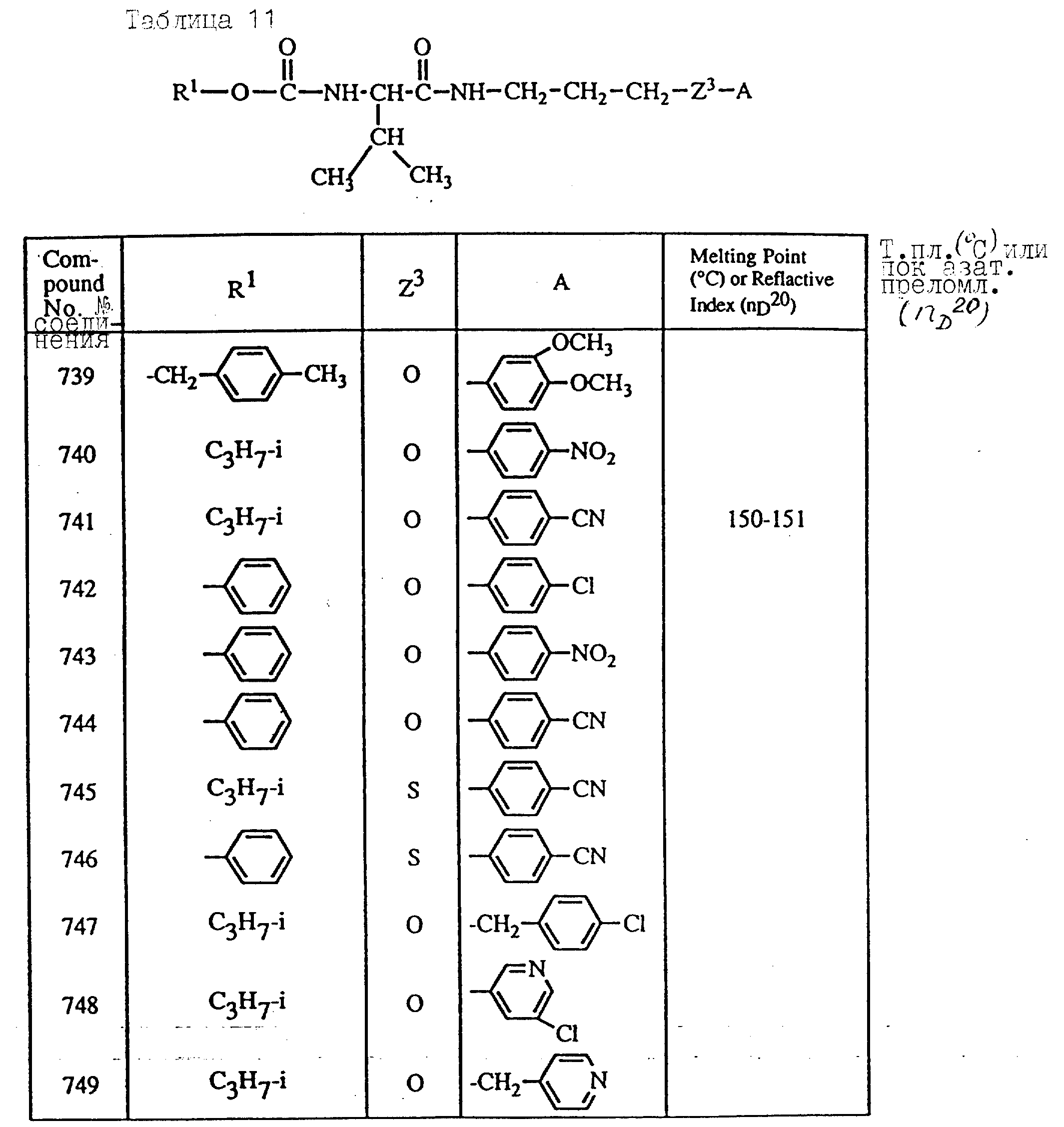
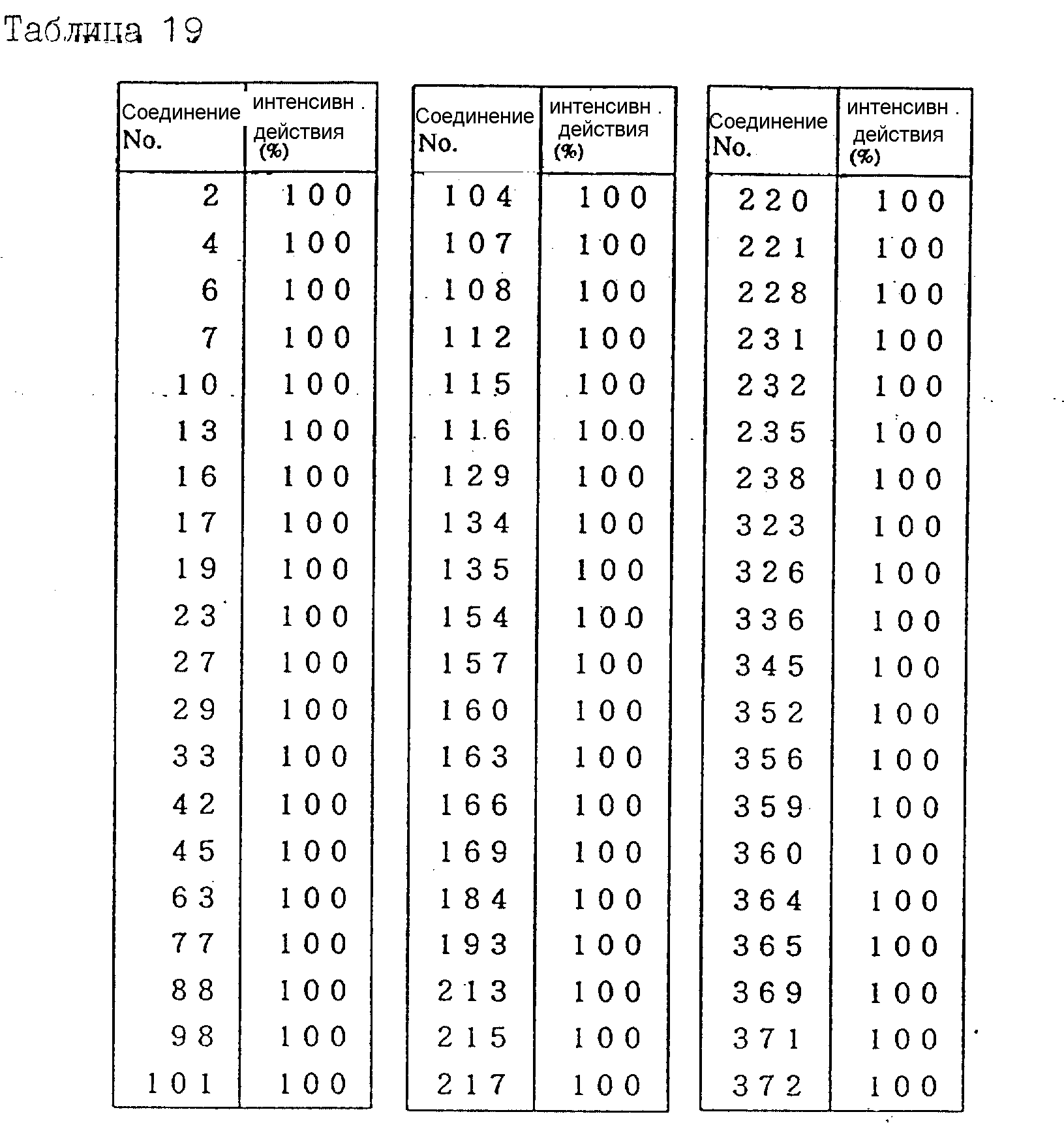
Далее в таблицах с 1 по 12 приводится список соединений формулы I в соответствии с изобретением. Однако следует понимать, что изобретение не ограничивается этими соединениями. На номера соединений, которые даны в таблицах с 1 по 12, будут даваться ссылки в последующем описании.
В таблицах с 1 по 12 соединения NN 108, 433, 456, 459, 460, 461, 462, 464, 467, 470, 471, 472 и 475 обладают частицами аминокислот с D,L-конфигурациями; соединение 109 обладает аминокислотным остатком с D-конфигурацией; соединения NN 233, 234, 235, 236, 237, 238, 425, 426, 427 обладают остатками (2S)-масляной кислоты; другие, не упомянутые выше соединения имеют аминокислотные остатки L-конфигурации. Соединения NN 33, 345 и 346; соединения NN 107, 116 и 117; соединения NN 135, 395 и 396; соединения NN 228, 414 и 415; соединения NN 452, 453 и 454 представляют собой смеси диастереомеров и также являются отдельными диастереомерами. Кроме того, соединения NN 26 и 27, соединения NN 45 и 356; соединения NN 335 и 336; соединения NN 397 и 401 и соединения NN 409 и 410 представляют собой смеси диастереомеров и также являются одним из отдельных диастереомеров соответственно. Соединение N 108 является смесью четырех изомеров и соединение N 433 является смесью двух изомеров. Соединения NN 483 - 501, 504, 505, 510 - 518, 521 и 522 представляют собой L-Val-DL-Ala; соединения NN 502, 503, 508, 509, 519 и 525 представляют собой L-Val-D-Ala; соединение N 520 является L-Val-Ala; соединения NN 506 и 523 представляют собой L-Ile-D-Ala; соединение N 526 является L-Val-Gly и соединения NN 507 и 524 являются (2S)-бутилил-D-Ala.
В таблицах, приведенных в настоящем описании, выражения "C3H7-i", "C4H9-t", "C4H9-s" и "C4H9-i" используются для того, чтобы обозначить изопропильную групп, трет-бутильную группу, втор-бутильную группу и изобутильную группу соответственно.
Соответствующие настоящему изобретению соединения, изображаемые формулой I, могут быть получены, например, описанными далее способами.
Способ
получения A
(Реакционная схема 1)

Здесь R1, R2, R3, R4, R5, R6, R7, R8, Z1, Z2, Z3, Q, m и n имеют установленные выше значения.
Соответствующие изобретению соединения, изображаемые формулой I, могут быть получены при взаимодействии производных аминокислот, изображаемых формулой IX, или производных аминокислот, в которых активирована карбоксильная группа, с амином, представленным формулой X, в присутствии основания и/или, при необходимости, катализатора.
В представленной реакции в качестве аминокислотных производных с активированной карбоксильной группой, изображаемых формулой IX, могут выступать, например, галоидангидриды кислот, такие как хлорангидриды, и ангидриды кислот, образованные двумя молекулами производных аминокислот, изображаемых формулой IX, смешанные ангидриды, образованные производными аминокислоты формулы IX и другой кислотой или О-алкилкарбоновой кислотой, и активированные эфиры, такие как п-нитрофениловый эфир, 2-тетрагидропираниловый эфир, 2-пиридиловый эфир и т.п. Такие производные аминокислот с активированными карбоксильными группами могут быть получены обычными способами (см., например, Methoden der Organischen Chemie, Vol. 15, N 2, from p. 2; Georg Thieme Verlag Stuttgart: 1974; Chemische Berichte, Vol. 38, p. 605 (1905); Journal of the American Chemical Society, Vol. 74, p. 676 (1952); и Journal of the American Chem. Soc., Vol 86, p. 1839 (1964)).
Кроме того, упомянутую реакцию можно осуществить, используя конденсирующий агент, такой как N,N'-дициклогексилкарбодиимид, карбонилдиимидазол, 2-хлор-1,3-диметилимидазолийхлорид или подобные.
Упомянутая реакция может быть осуществлена в стандартном растворителе, этот растворитель может представлять собой любой растворитель, который не мешает осуществлению реакции, например углеводород, такой как пентан, гексан, гептан, циклогексан, петролейный эфир, лигроин, бензол, толуол, ксилол и т. п. ; галогенированный углеводород, такой как дихлорметан, дихлорэтан, хлороформ, четыреххлористый углерод, хлорбензол, дихлорбензол и т. п.; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, диметиловый эфир этиленгликоля, тетрагидрофуран, диоксан и т.п.; кетон, такой как ацетон, метилэтилкетон, метилизопропилкетон, метилизобутилкетон и т.п.; сложный эфир, такой как метилацетат, этилацетат и т.п.; нитрил, такой как ацетонитрил, пропионитрил, бензонитрил и т.п.; апротонный полярный растворитель, такой как диметилсульфоксид, диметилформамид, сульфолан и т.п.; и смешанный растворитель, представляющий собой сочетание растворителей из числа упомянутых выше.
В реакции такого типа может быть использовано основание любого типа. Можно упомянуть, например, гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия и т.п.; гидроксиды щелочноземельных металлов, такие как гидроксид кальция и т.п.; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия и т.п.; бикарбонаты щелочных металлов, такие как бикарбонат натрия, бикарбонат калия и т.п.; органические основания, такие как триэтиламин, триметиламин, диметиланилин, пиридин, N-метилморфолин, N-метилпиперидин, 1,5-диазабицикло[4.3.0] нон-5-ен (DBN), 1,8-диазабицикло[5.4.0] ундец-7-ен (DBV) и т.п.; и предпочтительными являются третичные амины, такие как триэтиламин, пиридин, N-метилпиперидин и т.п.
В качестве катализатора можно упомянуть 4-диметиламинопиридин, 1-гидроксибензотриазол, диметилформамид и т.п. Такая реакция может быть осуществлена при температуре от -75oC до 100oC, предпочтительно - от -60oC до 40oC. Время реакции составляет предпочтительно от 1 до 20 часов.
Кроме того, соединения, изображаемые формулой IX, как исходные вещества, могут быть синтезированы, вообще, стандартными методами (см., например, Methoden der Organischen Chemie vol. 15, N 2, со стр. 2; Georg Thieme Verlag Stuttgart: 1974; Chemistry of the Amino Acids, vol. 2 p. 891; John Wiley и Sons., N. Y. (1964); и Juornal of the American Chemical Society, vol. 79, p. 4686 (1957)). Также могут быть рассмотрены различные способы получения соединений X, такие как методы, предложенные в заявке на патент Японии, первичная публикация N Sho 63-146876, Tetrahedron Letters, p. 21, 1973, и в заявке на патент Японии, первичная публикация N Hei5-271206.
Способ получения B
(Реакционная схема 2)

Здесь R1, R2, R3, R4, R5, R6, R7, R8, Z1, Z2, Z3, Q, m и n имеют значения, установленные выше и Y представляет собой атом галогена, 4,6-диметилпиримидинилтиогруппу, группу R1OC-(O)O- или группу -ON=C(CN)Ph (где Ph означает фенильную группу).
Соединения настоящего изобретения, изображаемые формулой I, могут быть получены при взаимодействии соединения формулы XI с амином формулы XII или с солью амина неорганической кислоты, такой, как гидрохлорид и т.п., или с солью амина и органической кислоты, так как тозилат и т.п., в присутствии основания, если требуется.
Представленная реакция может быть осуществлена в традиционном растворителе; такой растворитель может представлять собой любой растворитель, который не мешает проведению реакции, например углеводород, так как пентан, гексан, гептан, циклогексан, петролейный эфир, лигроин, бензол, толуол, ксилол и т.п.; галогенированный углеводород, такой как дихлорметан, дихлорэтан, хлороформ, четыреххлористый углерод, хлорбензол, дихлорбензол и т.п.; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, диметиловый эфир этиленгликоля, тетрагидрофуран, диоксан и т.п.; кетон, такой как ацетон, метилэтилкетон, метилизопропилкетон, метилизобутилкетон и т.п.; сложный эфир, такой как метилацетат, этилацетат и т.п.; нитрил, такой как ацетонитрил, пропионитрил, бензонитрил и т.п.; апротонный полярный растворитель, такой как диметилсульфоксид, диметилформамид, сульфолан и т.п., вода и смешанный растворитель, представляющий собой сочетание растворителей, выбираемых из числа упомянутых выше.
Для реакции такого типа может быть использовано основание любого типа. Например, можно упомянуть гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия и т.п.; гидроксиды щелочноземельных металлов, такие как гидроксид кальция и т.п.; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия и т.п.; бикарбонаты щелочных металлов, такие как бикарбонат натрия, бикарбонат калия и т.п.; органические основания, такие как триэтиламин, триметиламин, диметиланилин, N-метилморфолин, пиридин, N-метилпиперидин, 1,5-диазабицикло 4,3,0 нон-5-ен (DBN) 1,8-диазабицикло 5,4,0 ундец-7-ен (DBU) и т.п.; и предпочтительными являются третичные амины, такие как триэтиламин, пиридин, N-метилпиперидин и т.п. Упомянутая реакция осуществляется при температуре от -20oC до 100oC, предпочтительно - от 0oC до 40oC. Время реакции составляет предпочтительно от 30 минут до 20 часов.
Соединения формулы XII как исходные вещества являются новыми соединениями и могут быть получены, например, путем обработки карбаматов соединений I, синтезированных по способу получения A, при использовании обычного способа удаления защитной группы, защищающей аминогруппу в аминокислоте, такого как каталитическое восстановление, или путем обработки кислотами, такими как жидкая фтористоводородная кислота, сульфоновые кислоты, хлористоводородная кислота, бромистоводородная кислота, муравьиная кислота и т.п.
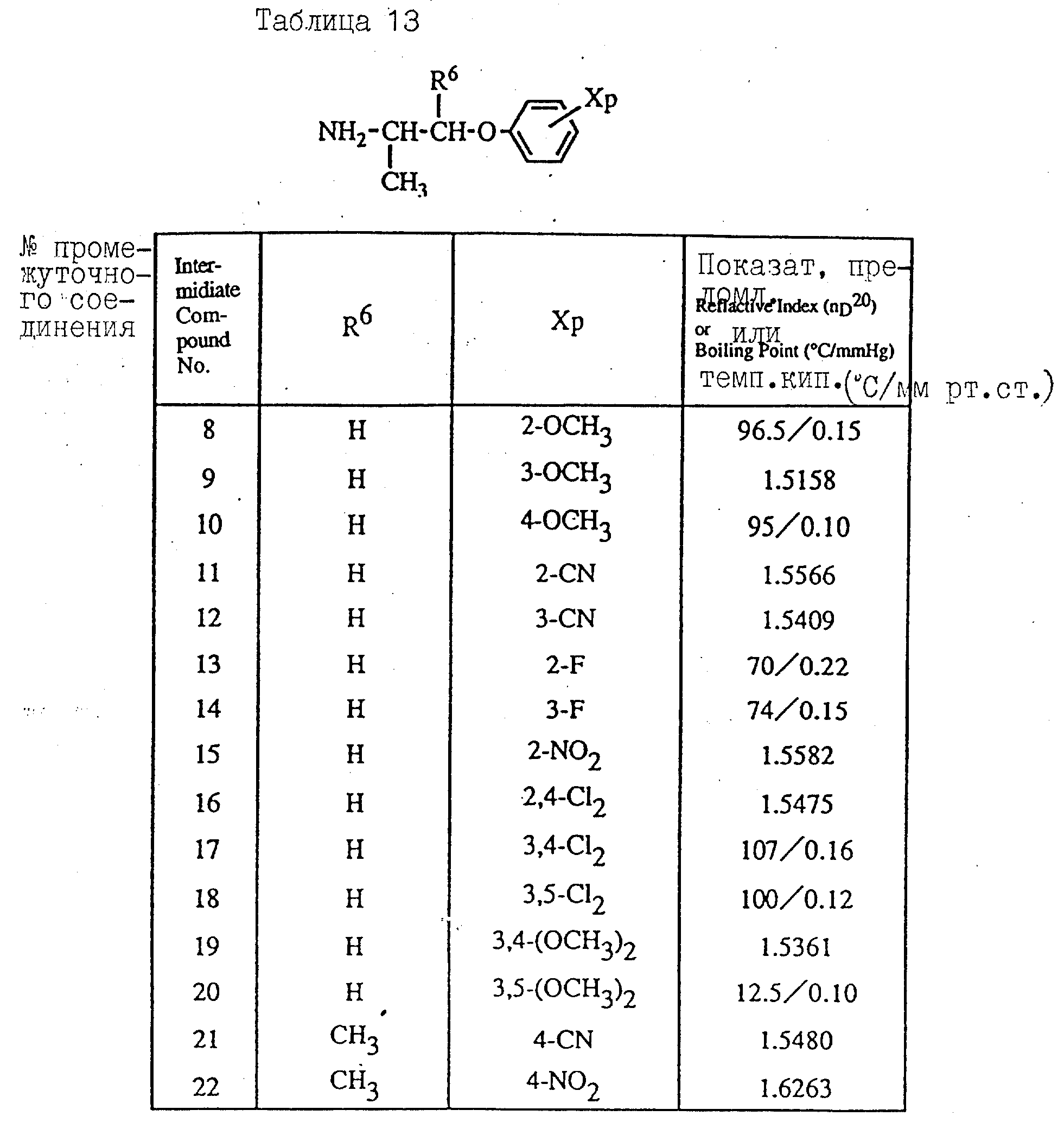
Далее в качестве ссылочных примеров приводятся примеры синтеза производных амидов аминокислот, которые являются новыми промежуточными соединениями для соединений настоящего изобретения, изображаемыми формулами X и XII.
Ссылочный
пример 1
Синтез 2-(4-цианофенокси)-1-метилэтиламина (промежуточное соединение N 1)
К раствору, содержащему 66,5 г 4-цианофеноксиацетона, растворенного в 1500 мл метанола, добавляют
293 г ацетата аммония и 16,7 г цианоборогидрида натрия и полученную в результате смесь перемешивают в течение 30 часов при комнатной температуре. Реакционную смесь затем концентрируют при пониженном
давлении и подкисляют концентрированной соляной кислотой. Затем в нее добавляют 500 мл диэтилового эфира и 300 мл воды. После этого полученный в результате водный слой подщелачивают 5% водным
раствором гидроксида натрия, раствор экстрагируют 1000 мл диэтилового эфира и эфирный слой промывают водой. Органический слой затем сушат над безводным сульфатом натрия и затем диэтиловый эфир удаляют
при пониженном давлении. Полученный остаток перегоняют при пониженном давлении и получают 13,0 г нужного продукта (19%). Температура кипения 132oC при 0,26 мм рт.ст.
Ссылочный пример 2
Синтез 2-(4-хлор-2-метилфенокси)-1-метилэтиламина (промежуточное соединение N 2)
К раствору, содержащему 31 г (4-хлор-2-метилфенокси)ацетона, растворенного в 700
мл метанола, добавляют 12 г ацетата аммония и 9,8 г цианоборогидрида натрия и полученную в результате смесь перемешивают в течение 20 часов при комнатной температуре. Затем реакционную смесь
концентрируют при пониженном давлении и к остатку добавляют 180 мл концентрированной соляной кислоты и 100 мл воды. Всю смесь перемешивают в течение 1 часа и затем экстрагируют 300 мл диэтилового
эфира. Водный слой подщелачивают, используя 5% водный раствор гидроксида натрия, и затем экстрагируют 500 мл этилацетата. Органический слой промывают водой, сушат над безводным сульфатом магния и
затем концентрируют при пониженном давлении. Из полученного маслянистого продукта удаляют фракцию с низкой температурой кипения и получают 25 г (выход 81%) нужного продукта. Показатель преломления 1,
5360.
Ссылочный пример 3
Синтез 2-(4-хлорфенокси)-1-метилпропиламина (промежуточное соединение N 3)
К раствору, содержащему 21 г 3-(4-хлорфенокси)-2-бутанона,
растворенного в 500 мл метанола, добавляют 82 г ацетата аммония и 6,7 г цианоборогидрида натрия и реакционную смесь перемешивают в течение 20 часов при комнатной температуре. Реакционную смесь затем
концентрируют при пониженном давлении и к остатку добавляют 180 мл концентрированной соляной кислоты и 100 мл воды. Всю смесь экстрагируют 300 мл диэтилового эфира. Полученный водный слой
подщелачивают, используя 5% водный раствор гидроксида натрия, и затем экстрагируют 500 мл этилацетата. Органический слой промывают водой, сушат над безводным сульфатом магния и затем концентрируют при
пониженном давлении. Из полученного маслянистого продукта удаляют фракцию с низкой температурой кипения и получают 18 г (выход 86%) нужного продукта. Показатель преломления 1,5360.
Ссылочный пример 4
Синтез 1-метил-2-(2-метилфенокси) этиламина (промежуточное соединение N 4)
Раствор, содержащий 36 г 0-метилового эфира 2-(2-метилфенокси)ацетоноксима,
растворенного в 150 мл диметоксиэтана, добавляют по каплям к суспензии, содержащей 13 г борогидрида натрия в 500 мл диметоксиэтана, при комнатной температуре. Затем смесь перемешивают в течение 15
минут при комнатной температуре и к смеси, при комнатной температуре, добавляют по каплям раствор, содержащий 66 г комплекса трифторборана с диэтиловым эфиром, растворенного в 100 мл диметоксиэтана.
Реакционную смесь перемешивают в течение 30 минут при комнатной температуре и затем кипятят с обратным холодильником в течение 3 часов. Полученную в результате смесь оставляют остывать естественным
путем до комнатной температуры и затем ее подкисляют, используя 10% соляную кислоту. Диметоксиэтановый слой концентрируют и соединяют с водным слоем. Смесь подщелачивают, используя карбонат натрия, и
затем экстрагируют дихлорметаном, после чего промывают водой. Органический слой сушат над безводным сульфатом магния и затем удаляют дихлорметан при пониженном давлении. Остаток перегоняют при
пониженном давлении и получают 6,4 г (выход 21%) нужного продукта. Температура кипения 65oC при 0,08 мм рт.ст.
Ссылочный пример 5
Синтез
2-(4-цианофенокси)-1-метилэтиламина (промежуточное соединение N 1)
При перемешивании при 0oC к смеси 29,8 г 60% гидрида натрия и 300 мл N, N-диметилформамида добавляют по каплям 50,
0 г 2-амино-1-пропанола. После перемешивания реакционной смеси в течение 30 минут при 0oC к ней добавляют по каплям раствор, содержащий 121,2 г 4-бромбензонитрила, растворенного в N,
N-диметилформамиде. Полученную в результате смесь перемешивают в течение 20 часов при комнатной температуре. После завершения реакции полученную в результате смесь выливают в воду и экстрагируют
этилацетатом. Органический слой промывают водой и затем сушат над безводным сульфатом магния. Этилацетат удаляют при пониженном давлении. Остаток перегоняют при пониженном давлении и получают 48,0 г
нужного продукта (выход 41%). Температура кипения 132oC при 0,26 мм рт.ст.
Ссылочный пример 6
Синтез (-)-2-(4-цианофенокси)-1-метилэтиламина (промежуточное
соединение N 5)
При перемешивании, при температуре от 5oC до 10oC, к смеси 14,0 г 60% гидрида натрия и 200 мл N,N-диметилформамида добавляют по каплям 25,0 г R
(-)-2-амино-1-пропанола. После перемешивания реакционной смеси в течение 30 минут к ней добавляют по каплям раствор, содержащий 45,0 г 4-хлор- бензонитрила, растворенного в N,N-диметилформамиде.
Реакционную смесь перемешивают в течение 20 часов при комнатной температуре. После завершения реакции реакционную смесь выливают в воду и экстрагируют этилацетатом. Органический слой промывают водой и
затем сушат над безводным сульфатом магния. Этилацетат удаляют при пониженном давлении. Остаток перегоняют при пониженном давлении и получают 33,0 г нужного продукта (выход 56%). Температура кипения
60 - 66oC при 0,08 мм рт.ст., [α] - 15,7o (C 1,0 CH3
OH).
Ссылочный пример 7
Синтез 1-метил-2-(2-пиримидилокси) этиламина (промежуточное соединение N 6)
При перемешивании, при комнатной температуре, к смеси 1,3 г 60%
гидрида натрия и 30 мл N,N-диметилформамида добавляют по каплям 2,0 г 2-амино-1-пропанола. После перемешивания реакционной смеси в течение 30 минут к ней добавляют по каплям раствор, содержащий 3,7 г
2-хлорпиримидина, растворенного в N,N-диметилформамиде. Реакционную смесь перемешивают в течение 2 часов при 100oC. После завершения реакции реакционную смесь охлаждают. Твердые вещества
отфильтровывают. Растворитель из фильтрата удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и получают 2,1 г нужного продукта (выход 50%). Показатель
преломления 1,5481.
Ссылочный пример 8
Синтез 1-метил-2-(4-пиридилокси)этиламина (промежуточное соединение N 7)
При перемешивании, при 5oC - 10o
C, к смеси 4,0 г 60% гидрида натрия и 50 мл N,N-диметилформамила добавляют по каплям 6,2 г 2-амино-1-пропанола. После перемешивания реакционной смеси в течение 30 минут к ней небольшими порциями
добавляют 12,5 г гидрохлорида 4-хлорпиридина. Смесь перемешивают в течение 20 часов при комнатной температуре. После завершения реакции твердые вещества отфильтровывают. Растворитель из фильтрата
удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и получают 3,8 г нужного продукта (выход 30%). Показатель преломления 1,5469.
Конкретные примеры промежуточных соединений X, полученных по методике ссылочных примеров с 1 по 8, приведены в табл. 13.
Ссылочный пример 9
Синтез гидрохлорида N1
[-2-(4-цианофенокси)-1-метилэтил] -L- валинамида (промежуточное соединение N 23)
В раствор, содержащий 3,7 г N2-трет-бутоксикарбонил- N1[-2-(4-цианофенокси)-1-метилэтил]
-L-валинамида, растворенного в 100 мл метиленхлорида, в течение 1 часа при комнатной температуре вводят газообразный хлористый водород. После завершения реакции метиленхлорид удаляют при пониженном
давлении и получают таким образом сырые кристаллы. Сырые кристаллы промывают ацетоном и получают 3,1 г нужного продукта (выход 100%). Т.пл. 59-63oC.
Ссылочный пример 10
Синтез N1[-2-(4-цианофенокси)-1-метилэтил]-L- изолейцинамида (промежуточное соединение N 24)
В раствор, содержащий 15,0 г N2-трет-бутоксикарбонил- N1
[-2-(4-цианофенокси)-1-метилэтил] -L-изолейцинамида, растворенного в 300 мл метиленхлорида, в течение 1 часа при комнатной температуре вводят газообразный хлористый водород. После завершения реакции
метиленхлорид удаляют при пониженном давлении и таким образом получают сырое кристаллическое вещество. К сырому кристаллическому веществу добавляют 200 мл насыщенного водного раствора бикарбоната
натрия и 200 мл метиленхлорида, смесь перемешивают в течение 30 минут и экстрагируют метиленхлоридом. Органический слой промывают
водой и сушат над безводным сульфатом натрия. Метиленхлорид удаляют
при пониженном давлении. Полученный сырой продукт промывают ацетоном и получают 10,0 г нужного продукта (выход 90%). Т.пл. 64-67oC.
Специфические примеры промежуточных соединений XII, получаемых по методикам ссылочных примеров 9 и 10, приводятся в табл. 14.
Предпочтительные варианты осуществления изобретения
Способы получения соединений,
соответствующих настоящему изобретению, а также применение соединений, будут подробно описаны в следующих далее примерах синтеза.
Пример синтеза 1
Синтез N2
-трет-бутоксикарбонил-N1-[1-метил-2- (4-нитрофенокси)-этил]-L-валинамида (соединение N 16)
К раствору, содержащему 1,1 г N-трет-бутоксикарбонил-L-валина, растворенного в 40 мл
метиленхлорида, при -20oC добавляют 0,5 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при той же температуре к ней добавляют 0,7 г изобутилхлорформиата уже при -40oC. К такой смеси при -60oC добавляют 1 г 1-метил-2-(4-нитрофенокси)этиламина и затем реакционную смесь оставляют нагреваться естественным путем до комнатной температуры, продолжая
перемешивание, и перемешивают в течение 15 часов при комнатной температуре. Затем к реакционной смеси добавляют воду. После того, как дихлорметановый слой последовательно промывают 5% водным раствором
бикарбоната натрия и водой, органический слой сушат над безводным сульфатом магния и метиленхлорид удаляют при пониженном давлении. Остаток, который представляет собой сырое кристаллическое вещество,
очищают колоночной хроматографией на силикагеле и получают таким образом 0,7 г нужного продукта в виде желтого порошка (выход 55%).
Пример синтеза 2
Синтез N1
-[2-(4-цианофенокси)-1-метилэтил] -N2- изопропенилоксикарбонил-L-валинамида (соединение N 77)
К раствору, содержащему 0,9 г гидрохлорида N1
-[2-(4-цианофенокси)-1-метилэтил] -L-валинамида, растворенного в 50 мл метиленхлорида, при -15oC добавляют 0,6 г N-метилморфолина и затем 0,4 г изопропилхлорформиата. Смесь оставляют
нагреваться естественным путем до комнатной температуры и затем перемешивают при комнатной температуре в течение 15 часов. Затем к реакционной смеси добавляют воду. После промывания дихлорметанового
слоя водой этот органический слой сушат над безводным сульфатом магния и затем метиленхлорид удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и получают таким
образом 0,23 г нужного продукта в виде бесцветных крупинок (выход 13%).
Пример синтеза 3
Синтез N1-[2-(4-цианофенокси)-1-метилэтил] -N2
- феноксикарбонил-L-валинамида (соединение N 107)
К раствору, содержащему 3 г N-феноксикарбонил-L-валина, растворенного в 50 мл метиленхлорида, при -20oC добавляют 1,3 г
N-метилморфолина. После перемешивания смеси в течение 10 минут при той же температуре, при -40oC к смеси добавляют 2,2 г 2-(4-цианофенокси)-1-метилэтиламина, реакционную смесь при
перемешивании оставляют нагреваться естественным путем до комнатной температуры и в течение 20 часов перемешивают при комнатной температуре. Затем к реакционной смеси добавлляют воду. Затем
метиленхлоридный слой последовательно промывают 5% водным раствором бикарбоната натрия и водой, этот органический слой сушат над безводным сульфатом магния и метиленхлорид удаляют при пониженном
давлении. Остаток который представляет собой сырое кристаллическое вещество, очищают колоночной хроматографией на силикагеле и получают таким образом 1,1 г нужного продукта в виде белого порошка
(выход 22%).
Пример синтеза 4
Синтез N2-трет-бутоксикарболнил-N1[-2-(4- цианофенокси)-1-метилэтил]-L-изолейцинамида (соединение N 228)
К
раствору, содержащему 3 г N-трет-бутоксикарбонил-L-изолейцина, растворенного в 60 мг метиленхлорида, при -20oC добавляют 1,3 г N-метилпиперидина. После перемешивания смеси в течение 10
минут при этой же температуре, при -40oC, добавляют 1,8 г изобутилхлорформиата и перемешивают смесь в течение 1 часа при -20oC. К этой смеси при -60oC добавляют 2,3 г
2-(4-цианофенокси)-1-метилэтиламина и затем смесь оставляют нагреваться естественным путем до комнатной температуры, продолжая перемешивание, и при комнатной температуре смесь перемешивают в течение
20 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой органический слой сушат над безводным
сульфатом магния и метиленхлорид удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, получая таким образом 0,6 г нужного продукта в виде белого порошка (выход
12%).
Пример синтеза 5
Синтез N2-трет-бутоксикарбонил-N1-(2-фенилтиоэтил)-L- валинамида (соединение N 551)
К раствору, содержащему 2,1 г
N-трет-бутоксикарбонил-L-валина, растворенного в 40 мл метиленхлорида, при -20oC добавляют 1 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к ней
добавляют 1,3 г изобутилхлорформиата и смесь перемешивают в течение 1 часа при -20oC. К этой смеси при -60oC добавляют 1,5 г 2-фенилтиоэтиламина и затем реакционную смесь
оставляют достигать естественным путем комнатной температуры, продолжая перемешивание, и перемешивают при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду. После
последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой, органический слой сушат над безводным сульфатом магния и метиленхлорид удаляют при пониженном
давлении. Остаток очищают колоночной хроматографией на силикагеле и получают таким образом 0,4 г нужного продукта в виде желто-кремовых крупинок (выход 12%).
Пример синтеза 6
Синтез N2-трет-бутоксикарбонил-N1-[1-метил-2- (4-нитрофенокси)пропил]-L-валинамида (соединение N 606)
К раствору, содержащему 1 г N-трет-бутоксикарбонил-L- валина,
растворенного в 40 мл метиленхлорида, при -20oC добавляют 0,5 г N-метилпиперидина. После перемешивания смеси в течение 15 минут при этой температуре к ней добавляют 0,7 г
изобутилхлорформиата и смесь перемешивают в течение 1 часа при -20oC. В этой смеси при -60oC добавляют 1 г 1-метил-2-(4-нитрофенокси)пропиламина и затем реакционную смесь при
перемешивании оставляют нагреваться естественным путем до комнатной температуры и перемешивают в течение 20 часов при комнатной температуре. Затем к реакционной смеси добавляют воду. После
последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот слой сушат над безводным сульфатом магния и метиленхлорид удаляют при пониженном давлении.
Остаток, который представляет собой маслянистое вещество, очищают колоночной хроматографией на силикагеле, получая таким образом 1,1 г нужного продукта в виде вязкой желтой жидкости (выход 56%).
Пример синтеза 7
Синтез N2-трет-бутоксикарбонил-N1[-2-(3,5- диметоксифенокси)-1-метилэтил]-L-валинамида (соединение N 22)
К раствору, содержащему 1,0
г N-трет-бутоксикарбонил-L-валина, растворенного в 100 мл метиленхлорида, при -20oC добавляют 0,5 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к
ней добавляют при -40oC 0,7 г изобутилхлорформиата и перемешивают смесь при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 1 г 2-(3,
5-цианофенокси)-1-метиламина и реакционную смесь затем оставляют нагреваться естественным путем до комнатной температуры, продолжая перемешивание, и смесь перемешивают при комнатной температуре в
течение 15 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над
безводным сульфатом магния и метилехнлорид удаляют при пониженном давлении. Остаток, который представляет собой сырое кристаллическое вещество, очищают колоночной хроматографией на силикагеле, получая
таким образом 1,3 г нужного продукта в виде белого порошка (выход 64%).
Пример синтеза 8
Синтез N2-трет-бутоксикарбонил-N1-[1-метил-2-(2,4,
6- трихлорфенокси)этил]-L-валинамида (соединение N 25)
К раствору, содержащему 3,8 г N-трет-бутоксикарбонил-L-валина, растворенного в 80 мл метилехнлорида, при -20oC добавляют 1,5
г N-метилпиперидина. После перемешивания смеси в течение 15 минут при этой температуре к ней добавляют 2,4 г изобутилхлорформиата и смесь перемешивают при -20oC в течение 1 часа. К этой
смеси при -60oC добавляют 4,5 г 1-метил-2-(2,4,6-трихлорфенокси)этиламина и реакционную смесь затем оставляют нагреваться естественным путем до комнатной температуры, продолжая
перемешивание, и перемешивают при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором
бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом магния и метиленхлорид удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, получая
таким образом 4,6 г нужного продукта в виде бесцветных игольчатых кристаллов (выход 58%).
Пример синтеза 9
Синтез N2-изопропоксикарбонил-N1
-[1-метил-2- (4-нитрофенокси)этил]-L-валинамида (соединение N 45)
К раствору, содержащему 2,5 г N-изопропоксикарбонил-L-валина, растворенного в 100 мл метиленхлорида, при -20oC
добавляют 1,2 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к ней добавляют 1,7 г изобутилхлорформиата и смесь перемешивают в течение 1 часа при -20o
C. К этой смеси при -60oC добавляют 2,2 г 2-(4-нитрофенокси)-1-метилэтиламина, реакционную смесь затем оставляют нагреваться при перемешивании и естественным путем до комнатной температуры
и смесь перемешивают при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната
натрия и водой этот слой сушат над безводным сульфатом магния и метиленхлорид удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, получая таким образом 0,3 г
нужного продукта в виде желтого стекловидного вещества (выход 6%).
1ЯМР: (CDCl3, δ) 1,16 - 1,33 (6H, м), 1,43 - 1,36 (9H, м), 2,56 (1H, м), 4,01 (2H, м), 4, 00 - 5,33 (3H, м), 6,17 (1H, д), 6,87 (2H, д), 8,06 (2H, д).
Пример синтеза 10
Синтез- N1-[2-(4-цианофенокси)-1-метилэтил] -N2
- циклогексилоксикарбонил-L-валинамида (соединение N 97)
К раствору, содержащему 2,0 г N-циклогексилоксикарбонил-L-валина, растворенного в 150 мл метиленхлорида, при -20oC
добавляют 0,8 г N-метилпиперидина. После перемешивания смеси в течение 1 минут при этой температуре к ней добавляют 1,1 г изобутилхлорформиата и смесь перемешивают при -20oC в течение 1
часа. К этой смеси при -60oC добавляют 1,5 г 2-(4-цианофенокси)-1-метилэтиламина и реакционную смесь оставляют нагреваться, продолжая перемешивание естественным путем до комнатной
температуры и смесь перемешивают при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором
бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом магния и метиленхлорид удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, получая
таким образом 0,5 г нужного продукта в виде светло-коричневого порошка (выход 16%).
Пример синтеза 11
Синтез N1-[1-метил-2-(4-трифторметилфенокси)этил]-N2
- феноксикарбонил-L-валинамида (соединение N 114)
К раствору, содержащему 4,0 г N-феноксикарбонил-L-валина, растворенного в 80 мл метиленхлорида, при -20oC добавляют 1,6 г
N-метилпиперидина. После перемешивания смеси в течение 16 минут при этой температуре к ней добавляют 2,2 г изобутилхлорформиата и смесь перемешивают при -20oC в течение 1 часа. К этой смеси
при -60oC добавляют 3,5 г 1-метил-2-(4-трифторметилфенокси)этиламина, реакционную смесь затем оставляют нагреваться естественным путем при перемешивании до комнатной температуры и смесь
перемешивают при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и
водой этот слой сушат над безводным сульфатом магния и метиленхлорид удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и получают таким образом 2,8 г нужного
продукта в виде белых кристаллов (выход 40%).
Пример синтеза 12
Синтез N1-[1-метил-2-(4-трифторметоксифенокси)этил] - N2-феноксикарбонил-L-валинамида
(соединение N 115)
К раствору, содержащему 4,0 г N-феноксикарбонил-L-валина, растворенного в 80 мл метиленхлорида, при -20oC добавляют 1,7 г N-метилпиперидина. После перемешивания
смеси в течение 15 минут при этой температуре к ней добавляют 2,3 г изобутилхлорформиата и перемешивают в течение 1 часа при -20oC.
К этой смеси при -60oC добавляют 4,0 г 1-метил-2-(4- трифторметилфенокси)этиламина, затем реакционную смесь оставляют нагреваться естественным путем, продолжая перемешивание, до комнатной температуры и перемешивают смесь при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот слой сушат над безводным сульфатом магния и метиленхлорид удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и получают 3,4 г нужного продукта в виде белых кристаллов (выход 45%).
Пример синтеза 13
Синтез N1-[2-(4-цианофенокси)-1-метилэтил] -N2- феноксикарбонил-L-валинамида (соединение N 116 и 117)
К раствору, содержащему 4,2 г N-феноксикарбонил-L-валина, растворенного в 100 мл метиленхлорида, при -20oC добавляют 1,8 г N-метилпиперидина. После перемешивания смеси в течение 10 минут
при этой температуре к ней добавляют 2,4 г изобутилхлорформиата и перемешивают смесь при -20oC в течение 1 часа. Затем к смеси при -60oC добавляют 3,1 г
2-(4-цианофенокси)-1-метилэтиламина, реакционную смесь при перемешивании оставляют нагреваться естественным путем до комнатной температуры и смесь перемешивают при комнатной температуре в течение 20
часов. Затем к реакционной смеси добавляют воду. После последовательного промывания хлоридного слоя 5% водным раствором бикарбоната натрия и водой этот слой сушат над безводным сульфатом магния и
метиленхлорид удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, получая таким образом 1,0 г белого порошка. Часть полученного белого порошка - 0,6 г - очищают,
используя жидкостную хроматографию высокого давления (далее называемую здесь "HPLC") (VMC-063-15, гексан:этилацетат = 55:45), чтобы выделить две фракции. Первая фракция с коротким временем удержания
составляет 0,3 г белого порошка (выход 7%) с температурой плавления от 145 до 147oC, а вторая фракция с длительным временем удержания составляет 0,3 г белого порошка (выход 7%) с т.пл. от
166 до 170oC.
Пример синтеза 14
Синтез N2-[2-(4-цианофенокси)-1-метилэтил] -N2- (3-метоксифеноксикарбонил)-L-валинамида (соединение N 166)
К раствору, содержащему 1,5 г гидрохлорида N1-2-(4-цианофенокси)-1-метилэтил-L-валинамида, растворенного в 100 мл метиленхлорида, при -20oC добавляют 1,0 г
N-метилморфолина. Затем к смеси при -20oC добавляют 0,9 г 3-метоксифенилхлорформиата, реакционную смесь оставляют нагреваться естественным путем при перемешивании до комнатной температуры и
перемешивают смесь при комнатной температуре в течение 2 часов. Затем к реакционной смеси добавляют воду. После промывания метиленхлоридного слоя водой этот органический слой сушат над безводным
сульфатом магния и метиленхлорид удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, получая таким образом 0,25 г нужного продукта в виде белых пластинчатых
кристаллов (выход 12%).
Пример синтеза 15
Синтез N2-(2-хлорэтоксикарбонил)-N1-[2-(4- цианофенокси)-1-метилэтил]-L-валинамида (соединение N 184)
К раствору, содержащему 1,1 г N-(2-хлорэтоксикарбонил)-L-валина, растворенного в 40 мл метиленхлорида, при -20oC добавляют 0,5 г N-метилпиперидина. После перемешивания смеси в течение 15
минут при этой температуре к смеси добавляют при -40oC 0,7 г изобутилхлорформиата и смесь перемешивают в течение 1 часа при -20oC. К этой смеси при -60oC добавляют 0,9
г 2-(4-цианофенокси)-1-метилэтиламина, реакционную смесь затем оставляют при перемешивании нагреваться естественным путем до комнатной температуры и перемешивают смесь при комнатной температуре в
течение 20 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над
безводным сульфатом магния и удаляют метиленхлорид при пониженном давлении. Остаток, который представляет собой маслянистое вещество, очищают колоночной хроматографией на силикагеле и таким образом
получают 1,0 г нужного продукта в виде бесцветных крупинок (выход 52%).
Пример синтеза 16
Синтез N1-[2-(4-цианофенокси)-1-метилэтил] -N2
- (4-метилбензилоксикарбонил)-L-валинамида (соединение N 195)
К раствору, содержащему 1,5 г N-(4-метилбензилоксикарбонил)-L-валина, растворенного в 100 мл метиленхлорида, при -20oC
добавляют 0,6 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к смеси добавляют 0,8 г изобутилхлорформиата и смесь перемешивают в течение 1 часа при -20oC. К этой смеси при -60oC добавляют 1,0 г 2-(4-цианофенокси)-1-метилэтиламина, реакционную смесь оставляют нагреваться, при перемешивании, естественным путем до комнатной температуры
и перемешивают смесь при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната
натрия и водой этот органический слой сушат над безводным сульфатом магния и удаляют метиленхлорид при пониженном давлении. Остаток, который представляет собой сырое кристаллическое вещество, очищают
колоночной хроматографией на силикагеле и таким образом получают 0,6 г нужного продукта в виде легкого белого порошка (выход 28%).
Пример синтеза 17
Синтез N1
-[2-(4-цианофенокси)-1-метилэтил] -N2- фенокситиокарбонил-L-валинамида (соединение N 208)
К суспензии, содержащей 1,1 г N1-[2-(4-цианофенокси)1-метилэтил]-L-валинамида,
суспендированного в 40 мл метиленхлорида, при -15oC добавляют 0,4 г N-метилморфолина. Затем к смеси добавляют при -15oC 0,7 г фенилхлортионоформиата, реакционную смесь оставляют
нагреваться естественным путем до комнатной температуры, продолжая перемешивание, и смесь перемешивают при комнатной температуре в течение 15 часов. Затем к реакционной смеси добавляют воду. После
промывания метиленхлоридного слоя водой этот органический слой сушат над безводным сульфатом магния и метиленхлорид удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на
силикагеле, получая при этом 1,2 г нужного продукта в виде желтого клейкого вещества (выход 75%).
1H ЯМР: (CDCl3, δ) 1,05 (6H, м), 1,35 (3H, м), 2,30 (1H, м), 4,00 (2H, м), 4,44 (1H, м), 4,54 (1H, м), 6,16, 6,25 (1H, д), 7,26 (9H, м), 7,51 (1H, ш).
Пример синтеза 18
Синтез N1-[2-(4-цианофенокси)-1-метилэтил]-N2- (фенилтио)-тиокарбонил-L-валинамида (соединение N 211)
К суспензии, содержащей 1,04 г N1-[2-(4-цианофенокси)-1-метилэтил]-L-валинамида, суспендированного в 40 мл
метиленхлорида, при -15oC добавляют 0,5 г N-метилморфолина. Затем к смеси добавляют при -15oC 0,9 г фенилхлордитиоформиата, реакционную смесь оставляют нагреваться естественным
путем до комнатной температуры, продолжая перемешивание, и смесь перемешивают при комнатной температуре в течение 15 часов. Затем к реакционной смеси добавляют воду. После промывания метиленхлоридного
слоя водой этот органический слой сушат над безводным сульфатом магния и удаляют метиленхлорид при пониженном давлении. Остаток очищают колоночной хроматографией на сигикагеле, таким образом получая 1,
4 г нужного продукта в виде желтого клейкого вещества (выход 66%).
1H ЯМР: (CDCl3, δ) 0,83 (6H, м), 1,32 (3H, м), 2,13 (1H, м), 3,96 (2H, м), 4,35 (1H, м), 4,73 (1H, д.д.), 6,04, 6,13 (1H, д), 6,96, 6,98 (2H, д), 7,15, 7,22 (1H, д), 7,57 (7H, м).
Пример синтеза 19
Синтез N1-(1-метил-2-фенилтиоэтил)-N2
-феноксикарбонил- -L-валинамида (соединение N 212)
К суспензии, содержащей 3,0 г гидрохлорида N1-(1-метил-2-фенилтиоэтил)-L-валинамида, суспендированного в 80 мл метиленхлорида,
при -15oC добавляют 1,3 г N-метилморфолина. После добавления к смеси при -15oC 1,9 г фенилхлордитиоформиата смесь оставляют нагреваться естественным путем при перемешивании до
комнатной температуры и перемешивают смесь при комнатной температуре в течение 15 часов. Затем к реакционной смеси добавляют воду. После промывания метиленхлоридного слоя водой этот органический слой
сушат над безводным сульфатом магния и удаляют метиленхлорид при пониженном давлении. Остаток очищают колоночной хроматографией на сигикагеле, получая таким образом 2,3 г нужного продукта в виде белых
кристаллов (выход 54%).
Пример синтеза 20
Синтез N1-[2-(4-хлоранилино)-1-метилэтил] -изопропоксикарбонил- -L-валинамида (соединение N 221)
К раствору,
содержащему 3,8 г N-изопропоксикарбонил-L-валина, растворенного в 80 мл метиленхлорида, при -20oC добавляют 1,9 г N-метилпиперидина. После перемешивания смеси в течение 15 минут при этой
температуре к ней добавляют 2,6 г изобутилхлорформиата, и смесь перемешивают при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 3,5 г 2-(4-хлоранилино)-1-метилэтиламина,
смесь оставляют нагреваться естественным путем при перемешивании до комнатной температуры и затем смесь перемешивают при комнатной температуре в течение 20 часов. Затем в реакционную смесь добавляют
воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом магния и удаляют метиленхлорид при
пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, получая таким образом 3,3 г нужного продукта в виде белых кристаллов (выход 47%).
Пример синтеза 21
Синтез 2-трет-бутоксикарбониламино-N-[2-(4-хлорфенокси)-1- метилэтил]-(2S)-бутирамида (соединение N 233)
К раствору, содержащему 4,1 г (2S)-2-трет-бутоксикарбониламиномасляной кислоты,
растворенной в 60 мл метиленхлорида, при -20oC добавляют 2,0 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к ней добавляют при -40oC 2,7
г изобутилхлорформиата и смесь перемешивают при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 3,7 г 2-(4-хлорфенокси)-1-метилэтиламина, затем реакционную смесь
оставляют нагреваться естественным путем при перемешивании до комнатной температуры и смесь перемешивают при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду. После
последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом натрия и удаляют метиленхлорид при пониженном
давлении. Полученное сырое кристаллическое вещество очищают колоночной хроматографией на силикагеле и получают таким образом 5,6 г нужного продукта в виде бесцветного клейкого вещества (выход 76%).
Пример синтеза 22
Синтез 2-трет-бутоксикарбониламино-N-[2-(4-цианофенокси)-1- метилэтил] -(2S)-бутирамида (соединение N 235)
К раствору, содержащему 1,0 г
(2S)-2-трет-бутоксикарбониламиномасляной кислоты, растворенной в 40 мл метиленхлорида, при -20oC добавляют 0,5 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой
температуре к ней добавляют при -20oC 0,7 г изобутилхлорформиата и смесь перемешивают при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 0,9 г
(2-(4-цианофенокси)-1-метилэтиламина, реакционную смесь оставляют нагреваться естественным путем при перемешивании до комнатной температуры и перемешивают при комнатной температуре в течение 20 часов.
Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом
магния и удаляют метиленхлорид при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, получая таким образом 1,0 г нужного продукта в виде клейкого вещества (выход 54%).
1ЯМР: (CDCl3, δ) 0,94 (3H, т), 1,20 - 1,50 (12H, м), 1,69 (2H, м), 3,83 - 4,56 (4H, м), 5,30 (1H, д), 6,60 (1H, м), 6,90 (2H, д), 7,50 (2H, д).
Пример синтеза 23
Синтез N1-[2-(4-хлорбензилокси)-1-метилэтил] -N2- изопропоксикарбонил-L-валинамида (соединение N 246)
К раствору, содержащему 1 г
N-изопропоксикарбонил-L-валина, растворенного в 40 мл метилехлорида, при -20oC добавляют 0,5 г N-метилпиперидина. После перемешивания смеси в течение 15 минут при этой температуре к ней
добавляют при -40oC 0,7 г изобутилхлорформиата и смесь перемешивают при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 1 г
2-(4-хлорбензилокси)-1-метилэтиламина, затем реакционную смесь оставляют при перемешивании нагреваться естественным путем до комнатной температуры и смесь перемешивают при комнатной температуре в
течение 20 часов. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом магния и удаляют
метиленхлорид при пониженном давлении. Полученный маслянистый остаток очищают колоночной хроматографией на силикагеле, получая таким образом 0,9 г нужного продукта в виде бесцветных пластинчатых
кристаллов (выход 48%).
Пример синтеза 24
Синтез N2-трет-бутоксикарбонил-N1-[1-метил-2- (4-метилтиофенокси)этил] -L-валинамида (соединение N 327)
К раствору, содержащему 7,5 г N-трет-бутоксикарбонил-L-валина, растворенного в 100 мл метиленхлорида, при -20oC добавляют 3,4 г N-метилпиперидина. После перемешивания смеси в течение 10
минут при этой температуре к этой смеси добавляют 4,7 г изобутилхлорформиата и смесь перемешивают при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 6,8 г
1-метил-2-(4-метилтиофенокси)этиламино, затем реакционную смесь оставляют нагреваться естественным путем при перемешивании до комнатной температуры и смесь перемешивают при комнатной температуре в
течение 20 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над
безводным сульфатом натрия и удаляют метиленхлорид при пониженном давлении. Полученный маслянистый остаток очищают колоночной хроматографией на силикагеле и таким образом получают 6,2 г нужного
продукта в виде бесцветных призматических кристаллов (выход 46%).
Пример синтеза 25
Синтез N2-трет-бутоксикарбонил-N1
-[1-метил-2-(4- метилсульфинилфенокси)этил]-L-валинамида (соединение N 328)
К раствору, содержащему 3,0 г N2-трет-бутоксикарбонил-N1-[1-метил-2-(4-метилтиофенокси) этил]
-L-валинамида, растворенного в 60 мл метиленхлорида, при 0oC добавляют 1,5 г м-хлорпербензойной кислоты. После перемешивания смеси в течение 5 часов при комнатной температуре реакционную
смесь фильтруют. Фильтрат последовательно промывают насыщенным водным раствором карбоната калия и водой, органический слой сушат над безводным сульфатом натрия и удаляют метиленхлорид при пониженном
давлении. Полученный маслянистый остаток очищают колоночной хроматографией на силикагеле и получают таким образом 1,7 г нужного продукта в виде бесцветных кристаллов (выход 56%).
Пример синтеза 26
Синтез N2-трет-бутоксикарбонил-N1-[1-метил-2- (4-метилсульфонилфенокси)этил]-L-валинамида (соединение N 329)
К раствору, содержащему 2,0 г
N2-трет-бутоксикарбонил-N1-[1-метил-2-(4-метилтиофенокси) этил] -L-валинамида, растворенного в 50 мл метиленхлорида, при 0oC добавляют 2,1 г м-хлорпербензойной
кислоты. После перемешивания смеси в течение 8 часов при температуре кипения с холодильником реакционную смесь охлаждают естественным путем до комнатной температуры и фильтруют. Фильтрат
последовательно промывают насыщенным водным раствором карбоната калия и водой, органический слой сушат над безводным сульфатом натрия и удаляют метиленхлорид при пониженном давлении. Полученный
остаток очищают колоночной хроматографией на силикагеле и получают при этом 1,3 г нужного продукта в виде бесцветных призматических кристаллов (выход 60%).
Пример синтеза 27
Синтез N1-[2-(4-хлорфенилсульфонил)-1-метилэтил]- N2-изопропоксикарбонил-L-валинамида (соединение N 354)
К раствору, содержащему 2,5 г N1
-[2-(4-фторфенилтио)-1- метилэтил]-N2-изопропоксикарбонил-L-валинамида, растворенного в 50 мл метиленхлорида, при 0oC добавляют 1,3 г м-хлорпербензойной кислоты. После
перемешивания смеси в течение 5 часов при комнатной температуре реакционную смесь фильтруют. Фильтрат последовательно промывают насыщенным водным раствором карбоната калия и водой, органический слой
сушат над безводным сульфатом натрия и удаляют метиленхлорид при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле и получают таким образом 1,8 г нужного продукта
в виде бесцветных призматических кристаллов (выход 69%).
Пример синтеза 28
Синтез N1-[2-(4-фторфенилсульфонил)-1-метилэтил]- N2
-изопропоксикарбонил-L-валинамида (соединение N 355)
К раствору, содержащему 2,2 г N1-[2-(4-фторфенилтио)-1- метилэтил]-N2-изопропоксикарбонил-L-валинамида,
растворенного в 50 мл метиленхлорида, при 0oC добавляют 3,4 г м-хлорпербензойной кислоты. После перемешивания смеси в течение 8 часов при кипячении с обратным холодильником реакционную
смесь оставляют охлаждаться до комнатной температуры и затем фильтруют. Фильтрат последовательно промывают насыщенным водным раствором карбоната калия и водой, органический слой сушат над безводным
сульфатом натрия и удаляют метиленхлорид при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле и получают таким образом 2,0 г нужного продукта в виде белых
кристаллов (выход 83%).
Пример синтеза 29
Синтез N2-изопропоксикарбонил-N1-[1-метил-2- (2-метилфенилтио)этил]-L-валинамида (соединение N 367)
К
раствору, содержащему 3,9 г N-изопропоксикарбонил-L-валина, растворенного в 80 мл метиленхлорида, при -20oC добавляют 1,9 г N-метилпиперидина. После перемешивания смеси в течение 10 минут
при этой температуре к смеси добавляют 2,6 г изобутилхлорформиата и перемешивают смесь при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 3,5 г
1-метил-2-(2-метилфенилтио)этиламина, затем реакционную смесь оставляют нагреваться, при перемешивании, естественным путем до комнатной температуры и перемешивают смесь при комнатной температуре в
течение 20 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над
безводным сульфатом натрия и удаляют метиленхлорид при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и получают таким образом 3,6 г нужного продукта в виде белых
кристаллов (выход 51%).
Пример синтеза 30
Синтез N1-[2-(4-цианофенокси)-1-метилэтил] -N2- (3-тетрагидрофуранил)оксикарбонил-L-валинамида (соединение N
376)
К суспензии, содержащей 1,5 г гидрохлорида N1-[2-(4-цианофенокси)-1-метилэтил] -L-валинамида, суспендированного в 100 мл метиленхлорида, при -20oC добавляют 1,0 г
N-метилморфолина и затем 0,7 г 3-тетрагидрофуранилхлорформиата. Смесь оставляют нагреваться естественным путем до комнатной температуры и перемешивают при комнатной температуре в течение 2 часов.
Затем к реакционной смеси добавляют воду. После промывания дихлорметанового слоя водой этот органический слой сушат над безводным сульфатом магния и затем удаляют при пониженном давлении. Остаток
очищают колоночной хроматографией на силикагеле и таким образом получают 1,1 г нужного продукта в виде белого порошка (выход 61%).
Пример синтеза 31
Синтез N1
-[2-(4-цианофенокси)-1-метилэтил] -N2- (3-метилциклогексилоксикарбонил-L-валинамида (соединение N 379)
К суспензии, содержащей 1,0 г N1
-[2-(4-цианофенокси)-1-метилэтил]-L-валинамида, суспендированного в 50 мл метиленхлорида, при -15oC добавляют 0,4 г N-метилморфолина и затем 0,8 г 3-тетрагидрофуранилхлорформиата. Смесь
оставляют нагреваться естественным путем до комнатной температуры и перемешивают при комнатной температуре в течение 15 часов. Затем к реакционной смеси добавляют воду. После промывания
метиленхлоридного слоя водой этот органический слой сушат над безводным сульфатом магния и затем удаляют метиленхлорид при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле
и получают таким образом 1,2 г нужного продукта в виде белых кристаллов (выход 80%).
Пример синтеза 32
Синтез N1-[2-(4-цианофенокси)-1-метилэтил] -N2
- пропаргилоксикарбонил-L-валинамида (соединение N 381)
К суспензии, содержащей 0,5 г N1-[2-(4-цианофенокси)- 1-метилэтил]-L-валинамида, суспендированного в 30 мл метиленхлорида,
при -15oC добавляют 0,2 г N-метилморфолина и затем 0,2 г пропаргилхлорформиата. Смесь оставляют нагреваться естественным путем до комнатной температуры и перемешивают при комнатной
температуре в течение 15 часов. Затем к реакционной смеси добавляют воду. После промывания метиленхлоридного слоя водой этот органический слой сушат над безводным сульфатом магния и затем удаляют
метиленхлорид при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и таким образом получают 0,5 г нужного продукта в виде белого порошка (выход 78%).
Пример
синтеза 33
Синтез N1-[2-(4-цианофенокси)-1-метилэтил] -N2- (2-метокси-1-метилэтил)оксикарбонил-L-валинамида (соединение N 383)
К суспензии, содержащей 1,5 г
N1-[2-(4-цианофенокси)- 1-метилэтил]-L-валинамида, суспендированного в 150 мл метиленхлорида, при -20oC добавляют 1,0 г N-метилморфолина и затем 0,7 г
2-метокси-1-метилэтилхлорформиата. Смесь оставляют нагреваться естественным путем до комнатной температуры и при комнатной температуре перемешивают в течение 2 часов. Затем к реакционной смеси
добавляют воду. После промывания метиленхлоридного слоя водой этот органический слой сушат над безводным сульфатом магния и затем удаляют метиленхлорид при пониженном давлении. Остаток очищают
колоночной хроматографией на силикагеле и получают 0,87 г нужного продукта в виде белых пластинчатых кристаллов (выход 20%).
Пример синтеза 34
Синтез N1
-[2-(4-фтор-N-метиланилино)-1-метилэтил]-N2- феноксикарбонил-L-валинамида (соединение N 391)
К раствору, содержащему 3,9 г N-феноксикарбонил-L-валина, растворенного в 80 мл
метиленхлорида, при -20oC добавляют 1,6 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к смеси добавляют 2,2 г изобутилхлорформиата и перемешивают
при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 3,0 г 2-(4-фтор-N-метиланилино)-1-метилэтиламина, смесь оставляют нагреваться при перемешивании в естественных
условиях до комнатной температуры и смесь перемешивают при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя
5% водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом натрия и метиленхлорид удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на
силикагеле и таким образом получают 1,2 г нужного продукта в виде белых кристаллов (выход 19%).
Пример синтеза 35
Синтез N2-(4-хлорфеноксикарбонил)-N1
-[2-(4- цианофенокси)-1-метилэтил] -L-валинамида (соединения NN 395 и 396)
К раствору, содержащему 4,7 г N-(4-хлорфеноксикарбонил)-L-валина, растворенного в 250 мл метиленхлорида, при -20oC добавляют 1,7 г N-метилпиперидина. После перемешивания в течение 10 минут при этой температуре к смеси добавляют 2,3 г изобутилхлорформиата и смесь перемешивают при -20oC в течение
1 часа. К этой смеси при -60oC добавляют 3,0 г 2-(4-цианофенокси)-1-метилэтиламина, затем реакционную смесь оставляют нагреваться, при перемешивании, естественным путем до комнатной
температуры и при комнатной температуре перемешивают в течение 15 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором
бикарбоната натрия и водой, этот органический слой сушат над безводным сульфатом магния и удаляют при пониженном давлении. Полученное сырое кристаллическое вещество очищают колоночной хроматографией
на силикагеле и таким образом получают 0,4 г нужного продукта в виде белого порошка. Порошок дополнительно очищают HPLC (VMC-063-15, гексан : этилацетат = 55:45) и выделяют две фракции. Одна фракция с
коротким временем удержания составляет 0,17 г белого порошка с т.пл. 137-140oC (выход 2%) и другая фракция, обладающая длительным временем удержания, составляет 0,17 г белого порошка с
т.пл. 174-179oC (выход 2%).
Пример синтеза 36
Синтез N1-[2-(4-цианофенокси)-1-метилэтил]-N2-2- нитрофеноксикарбонил-L-валинамида (соединение N
400)
К суспензии, содержащей 3,4 г N1-[2-(4-цианофенокси)-1- метилэтил]-L-валинамида, суспендированного в 100 мл метиленхлорида, при -20oC добавляют 1,3 г
N-метилморфолина и после этого 2,5 г 2-нитрофенилхлорформиата. Смесь оставляют нагреваться естественным путем до комнатной температуры и перемешивают при комнатной температуре в течение 2 часов. Затем
к реакционной смеси добавляют воду. После промывания метиленхлоридного слоя водой этот органический слой сушат над безводным сульфатом магния и затем удаляют метиленхлорид при пониженном давлении.
Остаток очищают колоночной хроматографией на силикагеле и получают таким образом 1,0 г нужного продукта в виде пластинчатых кристаллов (выход 18%).
Пример синтеза 37
Синтез
N1-[2-(4-цианофенокси)-1-метилэтил]-N2- (4-фторфеноксикарбонил-L-валинамида (соединение N 401)
К раствору, содержащему 3,0 N-(4-фторфеноксикарбонил)-L-валина,
растворенного в 80 мл метиленхлорида, добавляют 1,2 г N-метилпиперидина при -20oC. После перемешивания смеси в течение 15 минут при этой температуре к смеси добавляют 1,6 г
изобутилхлорформиата и перемешивают смесь при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 2,3 г (-)-2-(4-цианофенокси)-1-метилэтиламина, смесь затем оставляют
нагреваться естественным путем и при перемешивании до комнатной температуры и перемешивают ее при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду. После
последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом магния и удаляют метиленхлорид при пониженном
давлении. Полученное сырое кристаллическое вещество очищают колоночной хроматографией на силикагеле, получая таким образом 1,1 г нужного продукта в виде белого кристаллического вещества (выход
23%).
Пример синтеза 38
Синтез N1-[2-(4-цианофенокси)-1-метилэтил] -N2-2- (3,4-диметилфеноксикарбонил)-L-валинамида (соединение N 403)
К
суспензии, содержащей 1,5 г N1-[2-(4-цианофенокси)-1- метилэтил]-L-валинамида, суспендированного в 50 мл метиленхлорида, при -15oC добавляют 0,6 г N-метилморфолина и затем 1,2 г
3,4-диметилфенилхлорформиата. Смесь оставляют нагреваться до комнатной температуры естественным путем и перемешивают ее при комнатной температуре в течение 15 часов. Затем к реакционной смеси
добавляют воду. После промывания метиленхлоридного слоя водой этот органический слой сушат над безводным сульфатом магния и затем удаляют метиленхлорид при пониженном давлении. Остаток очищают
колоночной хроматографией на силикагеле и получают таким образом 1,7 г нужного продукта в виде белых кристаллов (выход 74%).
Пример синтеза 39
Синтез N2
-трет-бутилоксикарбонил-N1-[2-(2-пиридилокси)-1- метилэтил]-L-валинамида (соединение N 409)
К раствору, содержащему 4,3 г N-трет-бутоксикарбонил)-L-валина, растворенного в 80 мл
метиленхлорида, при -20oC добавляют 2,0 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к ней при -40oC добавляют 2,7 г
изобутилхлорформиата и смесь перемешивают при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 3,3 г 2-(2-пиридилокси)-1-метилэтиламина, затем реакционную смесь оставляют
нагреваться естественным путем и при перемешивании до комнатной температуры и смесь перемешивают при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду. После
последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом натрия и удаляют при пониженном давлении.
Полученное сырое кристаллическое вещество очищают колоночной хроматографией на силикагеле и получают таким образом 2,0 г нужного продукта в виде бесцветных крупинок (выход 28%).
Пример
синтеза 40
Синтез N1-[2-(5-хлор-2-пиридилокси)-1-метилэтил)- N2-изопропоксикарбонил-L-валинамида (соединение N 412)
К суспензии, содержащей 1,4 г гидрохлорида
N1-[2-(5- хлор-2-пиридилокси)-1-метилэтил]-L-валинамида, суспендированного в 50 мл метиленхлорида, при -15oC добавляют 0,8 г N-метилморфолина и затем 0,5 г изопропилхлорформиата.
Смесь оставляют нагреваться до комнатной температуры естественным путем и перемешивают при комнатной температуре в течение 15 часов. Затем к реакционной смеси добавляют воду. После промывания
метиленхлоридного слоя водой этот органический слой сушат над безводным сульфатом магния и затем удаляют метиленхлорид при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле
и получают 0,6 г нужного продукта в виде бесцветных крупинок (выход 38%).
Пример синтеза 41
Синтез N1-[2-(5-хлор-2-пиридилокси)-1-метилэтил] - N2
-феноксикарбонил)-L-валинамида (соединение N 413)
К суспензии, содержащей 1,4 г гидрохлорида N1-[2-(5-хлор-2-пиридилокси)-1-метилэтил] -L-валинамида, суспендированного в 50 мл
метиленхлорида, при -15oC добавляют 0,8 г N-метилморфолина и затем 0,7 г фенилхлорформиата. Смесь оставляют нагреваться до комнатной температуры естественным путем и перемешивают ее при
комнатной температуре в течение 15 часов. Затем к реакционной смеси добавляют воду. После промывания метиленхлоридного слоя водой этот органический слой сушат над безводным сульфатом магния и затем
удаляют метиленхлорид при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и таким образом получают 0,6 г нужного продукта в виде бесцветных крупинок (выход 34%).
Пример синтеза 42
Синтез N1-[2-(4-фтор-N-метиланилино)-1-метилэтил]-N2- феноксикарбонил-L-изолейцинамида (соединение N 422)
К раствору, содержащему 4,
8 г N-феноксикарбонил-L-изолейцина, растворенного в 80 мл метиленхлорида, при -20oC добавляют 1,9 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к
ней добавляют 2,6 г изобутилхлорформиата и перемешивают смесь при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 3,5 г 2-(4-фтор-N-метиланилино)-1-метилэтиламина и
затем реакционную смесь оставляют нагреваться при перемешивании и естественным путем до комнатной температуры и перемешивают при комнатной температуре в течение 20 часов. Затем к реакционной смеси
добавляют воду. После промывания метиленхлоридного слоя последовательно 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом натрия и удаляют при
пониженном давлении. Полученное сырое кристаллическое вещество очищают колоночной хроматографией на силикагеле и получают таким образом 1,1 г нужного продукта в виде белых кристаллов (выход 13%).
Пример синтеза 43
Синтез N2-(этилтио)карбонил-N1-[1-метил-2-(4-нитрофенокси)-этил]- L-валинамида (соединение N 432)
К суспензии, содержащей 0,9 г
N1-1-метил-2-(4-нитрофеноксиэтил]- L-валинамида, суспендированного в 50 мл метиленхлорида, при -15oC добавляют 0,3 г N-метилморфолина и затем 0,4 г этилхлорформиата. Смесь
оставляют нагреваться до комнатной температуры естественным путем и перемешивают смесь при комнатной температуре в течение 15 часов. Затем к реакционной смеси добавляют воду. После промывания
метиленхлоридного слоя водой этот органический слой сушат над безводным сульфатом магния и затем удаляют метиленхлорид при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле
и получают таким образом 1,0 г нужного продукта в виде желтых крупинок (выход 79%).
Пример синтеза 44
Синтез N2-трет-бутилоксикарбонил-N1
-[2-(4-цианофенокси-1- метилэтил] - L-лейцинамида (соединение N 455)
К раствору, содержащему 3,4 г N-трет-бутоксикарбонил-L-лейцина, растворенного в 60 мл метиленхлорида, при -20oC
добавляют 1,5 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре добавляют к смеси при -40oC 2,0 г изобутилхлорформиата и перемешивают смесь при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 2,6 г 2-(4-цианофенил)-1-метилэтиламина, реакционную смесь оставляют нагреваться при перемешивании и естественным путем до
комнатной температуры и перемешивают смесь при комнатной температуре в течение 15 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания смеси 5% водным раствором
бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом магния и удаляют метиленхлорид при пониженном давлении. Полученное сырое кристаллическое вещество очищают колоночной
хроматографией на силикагеле и получают таким образом 5,1 г нужного продукта в виде бесцветного клейкого вещества (выход 86%).
1ЯМР: (CDCl3, δ) 0,92 (6H, м), 1,28, 1,32 (3H, д), 1,39, 1,43 (9H, с), 1,46, 1,65 (2H, м), 1,65 (2H, м), 1,65 (1H, м), 3,98 (2H, м), 4,06 (1H, м), 4,35 (1H, м), 4,91 (1H, ш), 6,46 (1H, ш), 6,97 (2H, д), 7,57 (2H, д.д.).
Пример синтеза 45
Синтез N-трет-бутилоксикарбонил-N1-[2-(4-цианофенокси-1- метилэтил]-L-трет-лейцинамида (соединение N 457)
К раствору, содержащему 4 г
N-трет-бутоксикарбонил-L-лейцина, растворенного в 50 мл метиленхлорида, при -20oC добавляют 1,7 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к
смеси при -40oC добавляют 2,4 г изобутилхлорформиата и смесь перемешивают при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 3,1 г
2-(4-цианофенокси)-1-метилэтиламина и затем реакционную смесь оставляют нагреваться при перемешивании и естественным путем до комнатной температуры и перемешивают смесь при комнатной температуре в
течение 15 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над
безводным сульфатом магния и удаляют метиленхлорид при пониженном давлении. Полученное сырое кристаллическое вещество очищают колоночной хроматографией на силикагеле и таким образом получают 3,9 г
нужного продукта в виде бесцветного аморфного вещества (выход 58%).
Пример синтеза 46
Синтез амида
2-трет-бутоксикарбониламино-3-метил-N- [2-(4-цианофенокси)-1-метилэтил]-3-бутеновой кислоты (соединение N 460)
К раствору, содержащему 1,1 г 2-трет-бутоксикарбониламино-3-метил-3-бутеновой
кислоты, растворенной в 40 мл метиленхлорида, при -20oC добавляют 0,5 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к ней добавляют при -40oC 0,7 г изобутилхлорформиата и перемешивают смесь при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 1,9 г 2-(4-цианофенокси)-1-метилэтиламина, затем реакционную
смесь оставляют нагреваться при перемешивании и естественным путем до комнатной температуры и перемешивают смесь при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду.
После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом магния и удаляют метиленхлорид при
пониженном давлении. Полученное сырое кристаллическое вещество очищают колоночной хроматографией на силикагеле и получают таким образом 0,3 г нужного продукта в виде бесцветного клейкого вещества
(выход 32%).
Пример синтеза 47
Синтез амида N-2-(4-цианофенокси)-1-метилэтил-2- изопропилоксикарбониламиноциклопентилуксусной кислоты (соединение N 462)
К суспензии,
содержащей 1,2 г амида 2-амино-N-[2-(4-цианофенокси)-1-метилэтил] циклопентилуксусной кислоты, суспендированной в 40 мл метиленхлорида, при -15oC добавляют 0,4 г N-метилморфолина и затем 0,
5 г изопропилхлороформиата. Смесь оставляют нагреваться естественным путем до комнатной температуры и перемешивают при комнатной температуре в течение 15 часов. Затем к реакционной смеси добавляют
воду. После промывания метиленхлоридного слоя водой этот органический слой сушат над безводным сульфатом магния и затем удаляют метиленхлорид при пониженном давлении. Остаток очищают колоночной
хроматографией на силикагеле, получая таким образом 1,4 г нужного продукта в виде бесцветных пластинчатых кристаллов (выход 90%).
Пример синтеза 48
Синтез N1
-[2-(4-цианофенокси)-1-метилэтил] -N2- феноксикарбонил-L-норвалинамида (соединение N 465)
К суспензии, содержащей 1,4 г N1
-[2-(4-цианофенокси)- 1-метилэтил]-L-норвалинамида, суспендированного в 40 мл метиленхлорида, при -15oC добавляют 0,5 г N-метилморфолина и затем 0,8 г фенилхлорформиата. Смесь оставляют
нагреваться естественным путем до комнатной температуры и перемешивают при комнатной температуре в течение 15 часов. Затем к реакционной смеси добавляют воду. После промывания метиленхлоридного слоя
водой этот органический слой сушат над безводным сульфатом магния и затем метиленхлорид удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и таким образом
получают 1,4 г нужного продукта в виде бесцветных пластинчатых кристаллов (выход 57%).
Пример синтеза 49
Синтез N1-[2-(4-цианофенокси)-1-метилэтил] -N2
- феноксикарбонил-L-лейцинамида (соединение N 466)
К суспензии, содержащей 1,5 г N1-[2-(4-цианофенокси)- 1-метилэтил]-L-лейцинамида, суспендированного в 40 мл метиленхлорида, при
-15oC добавляют 0,5 г N-метилморфолина и затем 0,8 г фенилхлорформиата. Смесь оставляют нагреваться естественным путем до комнатной температуры и перемешивают при комнатной температуре в
течение 15 часов. Затем к реакционной смеси добавляют воду. После промывания метиленхлоридного слоя водой этот органический слой сушат над безводным сульфатом магния и затем метиленхлорид удаляют при
пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и получают таким образом 1,5 г нужного продукта в виде бесцветного порошка (выход 73%).
Пример синтеза
50
Синтез амида 2-(4-хлорфеноксикарбониламино)-N-[2- (4-цианофенокси)-1-метилэтил]циклопентилуксусной кислоты (соединение N 471)
К суспензии, содержащей 1,2 г амида
2-амино-N-[2- (4-цианофенокси)-1-метилэтил] циклопентилуксусной кислоты, суспендированной в 40 мл метиленхлорида, при -15oC добавляют 0,4 г N-метилморфолина и затем 0,8 г
4-хлорфенилхлорформиата. Смесь оставляют нагреваться естественным путем до комнатной температуры и перемешивают при комнатной температуре в течение 15 часов. Затем к реакционной смеси добавляют воду.
После промывания метиленхлоридного слоя водой этот органический слой сушат над безводным сульфатом магния и затем удаляют метиленхлорид при пониженном давлении. Остаток очищают колоночной
хроматографией на силикагеле и таким образом получают 0,6 г нужного продукта в виде бесцветных крупинок (выход 80%).
Пример синтеза 51
Синтез N2
-бензилоксикарбонил-N1-[2- (4-цианофенокси)-1-метилэтил]-(4-хлорфенил)глицинамида (соединение N 475)
К суспензии, содержащей 1,3 г N1
-[2-(4-цианофенокси)- 1-метилэтил]-(4-хлорфеил)глицинамида, суспендированного в 40 мл метиленхлорида, при -15oC добавляют 0,4 г N-метилморфолина, а затем 0,6 г бензилхлорформиата. Смесь
оставляют нагреваться естественным путем до комнатной температуры и перемешивают при комнатной температуре в течение 15 часов. Затем к реакционной смеси добавляют воду. После промывания
метиленхлоридного слоя водой этот органический слой сушат над безводным сульфатом магния и затем удаляют метиленхлорид при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле
и таким образом получают 1,2 г нужного продукта в виде бесцветных крупинок (выход 70%).
Пример синтеза 52
Синтез N2-(1-циано-1-метилэтоксикарбонил)-N1
- [2-(4-цианофенокси)-1-метилэтил]-L-валинамида (соединение N 476)
К суспензии, содержащей 0,7 г гидрохлорида N1-[2- (4-цианофенокси)-1-метилэтил]-L-валинамида, суспендированного в
50 мл метиленхлорида, при -20oC добавляют 0,5 г N-метилморфолина и затем 0,4 г 1-циано-1-метилэтилхлорформиата. Смесь оставляют нагреваться естественным путем до комнатной температуры и
перемешивают при комнатной температуре в течение 15 часов. Затем к реакционной смеси добавляют воду. После промывания метиленхлоридного слоя водой этот органический слой сушат над безводным сульфатом
магния и затем удаляют метиленхлорид при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и получают таким образом 0,6 г нужного продукта в виде бесцветных крупинок (выход
71%).
Пример синтеза 53
Синтез N2-(2-хлорциклогексилоксикарбонил)-N1- [2-(4-цианофенокси)-1-метилэтил]-L-валинамида (соединение N 477)
К
суспензии, содержащей 1,0 г гидрохлорида N1-[2- (4-цианофенокси)-1-метилэтил]-L-валинамида, суспендированного в 50 мл метиленхлорида, при -20oC добавляют 0,4 г N-метилморфолина и
затем 0,9 г 2-хлорциклогексилхлорформиата. Смесь оставляют нагреваться естественным путем до комнатной температуры и перемешивают при комнатной температуре в течение 15 часов. Затем к реакционной
смеси добавляют воду. После промывания метиленхлоридного слоя водой этот органический слой сушат над безводным сульфатом магния и затем удаляют метиленхлорид при пониженном давлении. Остаток очищают
колоночной хроматографией на силикагеле и получают таким образом 1,1 г нужного продукта в виде белых бесцветных кристаллов (выход 71%).
Пример синтеза 54
Синтез N2
-трет-бутилоксикарбонил)-N1- [2-(3-хлор-5-трифторметил-2-пиридилокси)-1-метилэтил]-L-валинамида (соединение N 479)
К раствору, содержащему 5,6 г N-трет-бутоксикарбонил-L-валина,
растворенного в 100 мл метиленхлорида, при -20oC добавляют 2,0 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к смеси -40oC добавляют 2,7
г изобутилхлорформиата и смесь перемешивают при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 1,5 г 2-(3-хлор-5-трифторметил-2-пиридилокси)-1-метилэтиламина, затем
реакционную смесь оставляют нагреваться при перемешивании и естественным путем до комнатной температуры и перемешивают при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют
воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом натрия и удаляют метиленхлорид при
пониженном давлении. Полученное сырое кристаллическое вещество очищают колоночной хроматографией на силикагеле и получают таким образом 7,0 г нужного продукта в виде бесцветных крупинок (выход
77%).
Пример синтеза 55
Синтез N1-[1-(5-хлор-6-этил-4-пиримидинилокси)-2-пропил] -N2-изопропоксикарбонил-L-валинамида (соединение N 481).
К раствору, содержащему 0,7 г N-изопропоксикарбонил-L-валина, растворенного в 50 мл метиленхлорида, при -20oC добавляют 0,34 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к смеси добавляют 0,47 г изобутилхлорформиата и затем перемешивают смесь при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 0,74 г 1-(5-хлор-6-этил-4-пиримидинилокси)-2-пропиламина, затем реакционную смесь оставляют нагреваться при перемешивании и естественным путем до комнатной температуры и смесь перемешивают при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот слой сушат над безводным сульфатом магния и удаляют метиленхлорид при пониженном давлении. Полученное сырое кристаллическое вещество очищают колоночной хроматографией на силикагеле и получают таким образом 0,6 г нужного продукта в виде белых призматических кристаллов (выход 43%).
Пример синтеза 56
Синтез N-трет-бутоксикарбонил-L-валил-(4-хлор-фенил)-N-метил- DL-аланинамида
(соединение N 490).
К раствору, содержащему 2,0 г N-трет-бутоксикарбонил-L-валина, растворенного в 40 мл метиленхлорида, при -20oC добавляют 0,9 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к ней добавляют 1,3 г изобутилхлорформиата и перемешивают смесь при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 2,0 г N-(4-хлорфенил)-N1-метил-DL- аланинамида, реакционную смесь оставляют нагреваться при перемешивании и естественным путем до комнатной температуры и перемешивают смесь при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом магния и удаляют метиленхлорид при пониженном давлении. Полученное сырое кристаллическое вещество очищают колоночной хроматографией на силикагеле и получают таким образом 3,4 г нужного продукта в виде бесцветных игольчатых кристаллов (выход 87%).
Пример синтеза 57
Синтез
N-изопропоксикарбонил-L-изолейцин-N-(4-цианофенил)-D- аланинамида (соединение N 506)
К раствору, содержащему 0,57 г N-изопропоксикарбонил-L-изолейцина, растворенного в 60 мл метиленхлорида,
при -20oC добавляют 0,26 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к ней добавляют 0,36 г изобутилхлорформиата и смесь перемешивают при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 0,5 г N1-(4-цианофенил)-D-аланинамида, затем реакционную смесь оставляют нагреваться при перемешивании и естественным
путем до комнатной температуры и перемешивают смесь при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5%
водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом натрия и удаляют метиленхлорид при пониженном давлении. Остаток очищают колоночной хроматографией на
силикагеле и получают таким образом 0,5 г нужного продукта в виде белого порошка (выход 49%).
Пример синтеза 58
Синтез
N-циклогексилоксикарбонил-L-валил-N-(4-цианофенил)-D-аланинамида (соединение N 509)
К суспензии, содержащей 1,0 г гидрохлорида-L-валил-N-(4- цианофенил)-аланинамида, суспендированного в 50 мл
метиленхлорида, при -20oC добавляют 0,6 г N-метилморфолина и затем 0,6 г циклопентилхлорформиата. Смесь оставляют нагреваться естественным путем до комнатной температуры и перемешивают при
комнатной температуре в течение 15 часов. Затем к реакционной смеси добавляют воду. После промывания метиленхлоридного слоя водой
этот органический слой сушат над безводным сульфатом магния и затем
удаляют метиленхлорид при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и таким образом получают 0,6 г нужного продукта в виде белых кристаллов (выход 49).
Пример синтеза 59
Синтез N-феноксикарбонил-L-валил-N-(4-хлорбензил)-DL-аланинамида (соединение N 516)
К суспензии, содержащей 0,95 г гидрохлорида
L-валил-N-(4- хлорбензил_-DL-аланиламида, суспендированного с 50 мл метиленхлорида, при -15oC добавляют 0,55 г N-метилморфолина и затем 0,43 г фенилхлорформиата. Смесь оставляют нагреваться
естественным путем до комнатной температуры и перемешивают при комнатной температуре в течение 15 часов. Затем к реакционной смеси добавляют воду. После промывания метиленхлоридного слоя водой этот
органический слой сушат над безводным сульфатом магния и затем удаляют метиленхлорид при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и получают таким образом 0,9 г
нужного продукта в виде белого порошка (выход 75%).
Пример синтеза 60
Синтез фенилового эфира N-феноксикарбонил-L-валил-DL-аланина (соединение N 522)
К раствору,
содержащему 0,57 г N-феноксикарбонил-L-валина, растворенного в 40 мл метиленхлорида, при -20oC добавляют 0,24 г N-метиленпиперидина. После перемешивания смеси в течение 10 минут при этой
температуре к ней добавляют 0,33 г изобутилхлорформиата и перемешивают смесь при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 0,5 г фенилового эфира DL-аланина, затем
реакционную смесь оставляют нагреваться при перемешивании и естественным путем до комнатной температуры и смесь перемешивают при комнатной температуре в течение 20 часов. Затем к реакционной смеси
добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом магния и удаляют
метиленхлорид при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и таким образом получают 0,2 г нужного продукта в виде белого порошка (выход 20%).
Пример синтеза 61
Синтез N1-(4-цианофенил)-N2- (2- феноксикарбониламино)- (2S)-бутирил-D-аланинамида (соединение N 524)
К раствору, содержащему 1,0 г
(2S)-2-феноксикарбонил- аминомасляной кислоты, растворенной в 50 мл метиленхлорида, при -20oC добавляют 0,45 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой
температуре к ней добавляют 0,61 г изобутилхлорформиата и перемешивают смесь при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 0,85 г N-(4-цианофенил)-D-аланинамида,
затем реакционную смесь оставляют нагреваться при перемешивании и естественным путем до комнатной температуры и перемешивают смесь при комнатной температуре в течение 20 часов. Затем к реакционной
смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом магния и удаляют
метиленхлорид при пониженном давлении. Полученное сырое кристаллическое вещество очищают колоночной хроматографией на силикагеле и таким образом получают 0,8 г нужного продукта в виде белого порошка
(выход 45%).
Пример синтеза 62
Синтез N-изопропоксикарбонил-L-валил-N-(4-цианофенил)глицинамида (соединение N 526)
К раствору, содержащему 0,6 г
N-изопропоксикарбонил-L-валина, растворенного в 40 мл метиленхлорида, при -20oC добавляют 0,3 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к ней
добавляют 0,4 г изобутилхлорформиата и перемешивают смесь при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 0,5 г N-(4-цианофенил)глицинамида, затем реакционную смесь
оставляют нагреваться при перемешивании и естественным путем до комнатной температуры и перемешивают смесь при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду. После
последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом магния и удаляют метиленхлорид при пониженном
давлении.
Остаток очищают колоночной хроматографией на силикагеле и таким образом получают 0,5 г нужного продукта в виде бесцветного порошка (выход 49%).
Пример
синтеза 63
Синтез N2-трет-бутоксикарбонил-N1-(1,2-диметил-2- феноксиэтил)-L-валинамида (соединение N 602)
К раствору, содержащему 1,3 г
N-трет-бутоксикарбонил-L-валина, растворенного в 40 мл метиленхлорида, при -20oC добавляют 0,6 г N-метилпиперидина. После перемешивания смеси в течение 15 минут при этой температуре к ней
добавляют 0,8 г изобутилхлорформиата и перемешивают смесь при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 1 г N1-(1,2-диметил-2- феноксиэтил)-L-валинамида,
затем реакционную смесь оставляют нагреваться при перемешивании и естественным путем до комнатной температуры и перемешивают смесь при комнатной температуре в течение 20 часов. Затем к реакционной
смеси добавляют воду. После промывания метиленхлоридного слоя последовательно 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом магния и удаляют
метиленхлорид при пониженном давлении. Полученное маслянистое вещество очищают колоночной хроматографией на силикагеле и получают таким образом 1,3 г нужного продукта в виде белого клейкого вещества
(выход 57%).
1H ЯМР(CDCl3) δ) 0,8 - 1,02 (6H, м), 1,18 - 1,45 (15H, м), 2,10 (1H, м), 3,65 - 4,45 (3H, м), 5,18 (1H, м), 6,38 (1H, м), 6,72 - 7,35 (6H, м).
Пример синтеза 64
Синтез N2-трет-бутоксикарбонил-N1-[2-(4- цианофенокси)-1,2-диметилэтил] -L-валинамида (соединение N 607).
К раствору, содержащему 1,1 г N-трет-бутоксикарбонил-L-валина, растворенного в 60 мл метиленхлорида, при -20oC добавляют 0,5 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к ней добавляют 0,7 г изобутилхлорформиата и перемешивают смесь при -20oC в течение 1 часа. К этой смеси при -60oC добавляют 1,0 г 2-(4-цианофенокси)-1, 2-диметилэтиламина, затем реакционную смесь оставляют нагреваться при перемешивании и естественным путем до комнатной температуры и перемешивают смесь при комнатной температуре в течение 20 часов. Затем к реакционной смеси добавляют воду. После последовательного промывания метиленхлоридного слоя 5% водным раствором бикарбоната натрия и водой этот органический слой сушат над безводным сульфатом натрия и удаляют метиленхлорид при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и таким образом получают 1,2 г нужного продукта в виде бесцветного стекловидного вещества (выход 61%).
1Н-ЯМР (CDCl3, δ) 0,79-1,03 (6H, м), 1,15 - 1,46 (15H, м), 2,03 (1H, м), 3,63 - 4,72 (3H, м), 5,06 (1H, м), 6,30 (1H, м), 6,83 - 7,60 (4H, м).
Пример синтеза 65
Синтез N1-[2-(4-цианофенокси)пропил] -N2- феноксикарбонил-L-валинамида (соединение N 750).
К суспензии, содержащей 0,25 г гидрохлорида N1-[2-(4-цианофенокси)пропил]-L-валинамида, суспендированного в 20 мл метиленхлорида, при -20oC добавляют 0,16 г N-метилпиперидина. После перемешивания смеси в течение 10 минут при этой температуре к ним по каплям добавляют 0,13 г фенилхлорформиата, смесь затем оставляют нагреваться при перемешивании и естественным путем до комнатной температуры и перемешивают смесь при комнатной температуре в течение 3 часов. После удаления метиленхлорида при пониженном давлении остаток очищают колоночной хроматографией на силикагеле и таким образом получают 0,2 г нужного продукта в виде белого клейкого вещества (выход 63%).
1Н-ЯМР: (CDCl3, δ) 1,00 (6H, м), 1,23 (3H, д), 2,13 (1H, м), 3,31 (1H, м), 4,00 (2H, м), 4,49 (1H, м), 5,93 (1H, д), 6,52 (1H, м), 6,80 - 7,56 (9H, м).
Фунгицид для сельского хозяйства или для садоводства в соответствии с настоящим изобретением представляет собой композицию, содержащую в качестве активного ингредиента производное амида аминокислоты, изображаемое формулой I. В случае, когда соединения, соответствующие настоящему изобретению, используют как фунгициды для сельского хозяйства или садоводства, соединения, действующие как активные ингредиенты, могут быть введены в соответствующие формулировки в зависимости от цели. Активный ингредиент обычно разбавляют инертной жидкостью или твердым носителем и при необходимости добавляют поверхностно-активные вещества или подобные вещества. Затем смесь известными способами готовят в виде, например, тонкого порошка, смачивающегося порошка, эмульгируемого концентрата, гранул и т.п.
Подходящими примерами носителей, применяемых в формулировках, являются твердые носители, такие как тальк, бентонит, глина, каолин, диатомовая земля, белая сажа, вермикулит, гашеная известь, кварцевый песок, сульфат аммония, мочевина и т.п.; и жидкие носители, такие как изопропиловй спирт, ксилол, циклогексанон, метилнафталин и т.п. Примеры поверхностно-активных веществ и диспергирующих веществ включают соли динафтилметансульфоновой кислоты, сульфоэфиры спиртов, алкилоксиэтиленгликоля, простые полиоксиэтиленалкилариловые эфиры, моноалкилаты полиоксиэтиленсорбитана и т.п. Примеры подходящих вспомогательных веществ включают карбоксиметил-целлюлозу и т.п. Такие препараты могут применяться непосредственно или после разбавления их до подходящей концентрации.
Фунгициды для сельского хозяйства или для садоводства по настоящему изобретению могут использоваться для различных целей, например, для обработки семян, опрыскивания стеблей и листьев, введения в воду или орошения и для внесения в почву. Количество активного ингредиента выбирают по потребности. Когда формулировка имеет вид порошка или гранул, предпочтительно содержание активного ингредиента от 0,1 вес.% до 20 вес.%. Для эмульгируемого концентрата или смачивающегося порошка адекватным является количество активного ингредиента от 5 вес.% до 80 вес.%.
Расход фунгицида для сельского хозяйства или садоводства, соответствующего настоящему изобретению, при применении может изменяться в зависимости от типа используемого активного соединения, вида вредителя или заболевания, с которыми ведется борьба, местонахождения вредителя или заболевания, степени повреждения, условий окружающей среды, формы препарата, которая используется и т. п. Когда фунгицид для сельского хозяйства или садоводства, соответствующий настоящему изобретению, применяют непосредственно в виде мелкодисперсного порошка или гранул, рекомендуется выбирать подходящую норму применения активного ингредиента в интервале от 0,1 до 5 кг на 10 ар, предпочтительно - в интервале от 1 г до 1 кг на 10 ар. Кроме того, когда фунгицид по настоящему изобретению находится в виде жидкости, такой как эмульгируемый концентрат или смачивающий порошок, подходящее количество активного ингредиента для применения рекомендуется выбирать в интервале от 0,1 ppm до 10000 ppm, предпочтительно в интервале от 10 ppm до 3000 ppm.
Соединения, соответствующие настоящему изобретению, в виде описанных выше формулировок могут быть полезны при борьбе с заболеваниями растений, вызываемыми грибами Oomycetes, A. scomycetes, Deuteromycetes и Basidiomycetes или другими патогенными грибами. К их числу относятся, но не ограничиваются ими, Pseudoperonospora, такие как ложная мучнистая роса огурцов (Pseudoperonospora cubensis), Phytophthora, фитофтороз томата (Phytophthora infestans) и Plasmopara, такие как ложная мучнистая роса винограда.
Фунгициды для сельского хозяйства или садоводства, соответствующие настоящему изобретению, могут применяться один или в сочетании с другими фунгицидами, инсектицидами, гербицидами, модификаторами роста растений, удобрениями и т.п.
Далее в примерах формулировок приводятся типичные формулировки, в которых все "%" означают "весовые проценты".
Пример формулировки 1
Мелкодисперсный порошок
Перемешивают до однородного состояния 2% соединения N 15,
15,5% диатомовой земли и 93% глины и перемалывают в мелкодисперсный порошок.
Пример формулировки 2
Смачивающийся порошок
Перемешивают до однородного состояния 50%
соединения N 16, 45% диатомовой земли, 2% динафтилметандисульфоната натрия и 3% лигносульфоната натрия и перемешивают в смачивающийся порошок.
Пример формулировки 3
Эмульгируемый концентрат
Смешивают до однородного состояния 30% соединения N 19, 20% циклогексанона, 11% алкиларилового эфира полиоксиэтилена, 4% алкилбензолсульфоната кальция и 35%
метилнафталина и получают таким образом эмульгируемый концентрат.
Пример формулировки 4
Гранулы
Смешивают и перемалывают 5% соединения N 101, 2% лаурилсульфоната
натрия, 5% лигносульфоната натрия, 2% карбометилцеллюлозы и 86% глины. К перемолотой смеси добавляют 20% воды. Получающуюся в результате смесь перемешивают и формуют в гранулы от 14 меш до 32 меш
посредством экструзионного гранулятора и затем сушат, получая нужные гранулы.
Фунгициды для сельского хозяйства или садоводства, соответствующие настоящему изобретению, обнаруживают высокую способность бороться с ростом или распространением ложной мучнистой росы огурцов (Pseudoperonospora cubensis), фитофтороза томата (Phytophthora infestans) и ложной мучнистой росы винограда (Plasmopora viticola) и являются эффективными против фитофтороза картофеля (Phytophthora infestans). Кроме того, фунгициды для сельского хозяйства и садоводства, соответствующие настоящему изобретению, не только обнаруживают способность предупреждать заражение грибом, но также обнаруживают способность устранять патогенный гриб после того, как он вторгся в растение-хозяина. Более того, фунгициды для сельского хозяйства или садоводства настоящего изобретения отличаются также тем, что они не являются вредными химикатами и обнаруживают такие отличные свойства, как системное действие, остаточная активность и устойчивость после ливня.
Действие соединений, соответствующих настоящему изобретению, иллюстрируется следующими далее испытательными примерами. Соединение для сравнения X и соединение для сравнения Y, используемые в испытательных примерах, представляют собой соединения, которые раскрываются в качестве промежуточных соединений для лекарственных средств в заявке на патент Японии, первичная публикация N Sho 62-89696. Эти соединения для сравнения используются после того, как они введены в такие же формулировки, в какие введены соединения настоящего изобретения, которые испытываются.
Соединение для сравнения X - N2-трет-бутоксикарбонил-N1-(2-феноксиэтил)-D-аланинамид
Соединение для сравнения Y - N2
-трет-бутоксикарбонил-N1-(2-фенилтиоэтил)-D-аланинамид
Испытательный пример 1
Проверка действия по предупреждению заражения ложной мучнистой росой огурца
(Pseudoperonospora cubensis).
Семена огурцов (сорт Sagami hanjiro) высевают в количестве 10 семян в каждый квадратный поливинилхлоридный (PVC) горшок, размер каждой стороны которого 9 см. Семена оставляют прорастать в теплице в течение 7 дней до стадии семядолей. Смачивающийся порошок, приготовленный так, как описано в примере формулировки 2, разбавляют водой до концентрации активного ингредиента 500 ppm (ч/млн) и полученный водный препарат применяют при норме 10 мл на горшок с сеянцами огурцов в стадии семядолей. После высыхания на воздухе растения инокулируют споровой взвесью ложной мучнистой росы огурца Pseudoperonospora cubensis, используя опрыскивание, и затем помещают во влажную камеру на 24 часа при 22oC, а затем помещают в теплицу. На седьмой день после инокуляции оценивают степень повреждений в соответствии со стандартами оценок, приведенными в табл. 15, чтобы установить предупредительное действие соединений, соответствующих настоящему изобретению. Результаты испытания приводятся в таблице 16.
Испытательный пример 2
Проверка действия обработки при заражении ложной мучнистой росой огурца (Pseudoperonospora
cubensis)
Семена огурцов (сорт "Sagami hanjiro" высевают в количестве 10 семян на квадратный поливинилхлоридный (PVC) горшок с размером стороны 9 см. Семена оставляют прорастать в теплице в
течение 7 дней до стадии семядолей. Сеянцы инокулируют споровой взвесью гриба ложной мучнистой росы огурца (Pseudoperonospora cubensis) и затем помещают во влажную камеру на 24 часа при 22o
C. Смачивающийся порошок, приготовленный так, как описано в примере формулировки 2, разбавляют водой до концентрации активного ингредиента 500 ppm и полученным водным препаратом обрабатывают сеянцы
огурцов после того, как они высохли на воздухе после обработки во влажной камере, при норме 10 мл на горшок с сеянцами огурцов. Затем сеянцы помещают в теплицу. На седьмой день после инокуляции
определяют степень повреждений в соответствии со стандартами оценок, представленными в табл. 15, чтобы установить действие обработки соединениями, соответствующими настоящему изобретению. Результаты
испытания приводятся в таблице 17.
Испытательный пример 3
Проверка действия по предупреждению заражения фитофторозом томата (Phytophtora infestans).
В фарфоровые горшки (диаметром 12 см) высаживают сеянцы томата (сорт "Ponterosa") - по одному в каждый горшок - и выращивают их в теплице. Смачивающийся порошок, приготовленный так, как описано в примере формулировки 2, разбавляют водой до концентрации активного ингредиента 500 ppm и применяют полученный водный препарат при норме 20 мл на горшок с сеянцами томатов на стадии 6-го или 7-го листа. После высыхания на воздухе растения инокулируют взвесью зооспорангия гриба фитофтороза томата (Phytophtora infestans), а затем помещают во влажную камеру при 22oC. На четвертый день после инокуляции определяют индекс охвата (index incidence) по размеру поврежденной поверхности, как показано в таблице 18.
Степень повреждения вычисляют в соответствии с уравнением (1), а индекс охвата и способность предупреждать заболевание (интенсивность подавления) вычисляют в соответствии с уравнением (2). Результаты приводятся в таблице 19.

Испытательный пример 4
Проверка действия по предупреждению заражения ложной мучнистой росой винограда (Plasmapara viticola).
Укорененные черенки винограда (сорт "Kyoho"), каждый выращенный из черенка и обрезанный, высаживают в фарфоровые горшки (диаметром 13 см) и держат в теплице. Смачивающийся порошок, приготовленный так, как описано в примере формулировки 2, разбавляют водой до концентрации активного ингредиента 500 и полученный водный препарат затем наносят при норме 20 мл на горшок на виноградные саженцы в стадии 4-го или 5-го листа. После высушивания на воздухе растения инокулируют взвесью зооспорангия гриба ложной мучнистой росы винограда (Plasmapara viticola) и затем помещают во влажную камеру на 24 часа при 22oC. На седьмой день пребывания в теплице после инокуляции растения снова помещают во влажную камеру на 24 часа при 22oC, чтобы вырастить конидиоспоры. На каждом листе проверяют область охвата, на которой растут конидиоспоры, и определяют индекс охвата в соответствии со стандартами, представленными в таблице 18. Степень повреждений вычисляют в соответствии с уравнением (1), а индекс охвата и способность предупреждать заболевание (интенсивность действия при борьбе) вычисляют в соответствии с уравнением (2). Результаты испытаний приводятся в таблице 20.
Реферат
Производное амида аминокислоты формулы I,

в которой радикалы принимают значения, указанные в п. 1 формулы изобретения, проявляют широкий спектр противогрибковой активности, особенно против ложной мучнистой росы огурцов, против ложной мучнистой росы винограда и фитофтороза томата. 4 с. и 7 з.п. ф-лы, 20 табл.
Формула

в которой R1 представляет собой (С1 - С6)алкильную группу, необязательно содержащую по крайней мере один из одинаковых или различных заместителей, выбранных из группы, состоящей из атома галогена (С1 - С6)алкоксигруппы и цианогруппы; низшую алкенильную группу, низшую алкинильную группу, (С3 - С8)циклоалкильную группу, необязательно содержащую заместитель, выбранный из группы, включающей метил или атом галогена; (С3 - С8)циклоалкил(С1 - С6)алкильную группу; аралкильную группу, необязательно содержащую заместитель из группы, состоящей из метильной группы, нитрогруппы; фенильную группу, необязательно содержащую по крайней мере один из одинаковых или различных заместителей, выбираемых из группы, состоящей из атомов галогена, (С1 - С6)алкильной группы, которая может быть замещена атомами галогена; (С1 - С6)алкоксигруппы, которая может быть замещена атомами галогена, цианогруппы, нитрогруппы; или гетероциклическую группу, выбранную из тетрагидропирана и тетрагидрофурана;
R2 представляет собой этильную группу, н-пропильную группу, изопропильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, низшую алкенильную группу, (С3 - С8)циклоалкильную группу, фенильную группу, необязательно содержащую по крайней мере один заместитель из числа атомов галогена;
R3 представляет собой атом водорода, или (С1 - С6)алкильную группу;
R4 представляет собой атом водорода, (С1 - С6)алкильную группу или цианогруппу;
R5, R6 независимо представляют собой атом водорода или (С1 - С6)алкильные группы; R7, R8 представляют собой атом водорода;
Z1 - атом О или S;
Z2 представляет собой атом кислорода или атом серы;
Z3 представляет собой атом кислорода, атом серы; группу N - R10, где R10 представляет собой атом водорода, метильную группу, метилкарбонильную группу, фенилкарбонильную группу, либо сульфинильную группу, сульфонильную группу, группу СОО; группу CONR11, где R11 представляет собой атом водорода или низшую алкильную группу;
Q представляет собой фенильную группу, необязательно замещенную по крайней мере одним из одинаковых или различных заместителей, выбираемых из группы, состоящей из атома галогена; (С1 - С6)алкильной группы, которая может быть замещена тремя атомами фтора; (С1 - С6)алкоксигруппы, которая может быть замещена одинаковыми или различными атомами галогена; цианогруппы; нитрогруппы; (С1 - С6)алкоксикарбонильной группы; метилсульфонильной группы; метилсульфинильной группы; метилтиогруппы; либо Q представляет гетероциклическую группу, выбранную из пиридила, необязательно содержащую, по меньшей мере, один заместитель, выбираемый из группы состоящей из: атома галогена, трифторметильной группы; или Q представляет пиримидильную группу, необязательно содержащую по меньшей мере один заместитель, выбираемый из группы, состоящей из атома галогена и (С1 - С3)алкила;
m представляет собой целое число от 0 до 2;
n равен 0 или 1.

в которой R1 представляет собой (а) низшую (С1 - С6)алкильную группу, необязательно содержащую по крайней мере один из одинаковых или различных заместителей, выбираемых из группы, состоящей из атома галогена и (С1 - С6)алкоксигруппы; (b) низшую алкенильную группу; (с) низшую алкинильную группу; (d) (С3 - С8)циклоалкильную группу, необязательно содержащую метильную группу; (е) аралкильную группу, необязательно содержащую заместитель из группы, состоящей из метильной группы и нитрогруппы; (f) фенильную группу, необязательно содержащую по крайней мере один из одинаковых или различных заместителей, выбираемый из группы, состоящей из атома галогена, метильной группы, метоксигруппы, цианогруппы, трифторметильной группы, трифторметоксигруппы и нитрогруппы; или (g) гетероциклическую группу, выбранную из тетрагидропирана и тетрагидрофурана;
R3 представляет собой атом водорода или (С1 - С6)алкильную группу;
R4 представляет собой атом водорода, (С1 - С6)алкильную группу или цианогруппу;
R5, R6 независимо представляют собой атом водорода или (С1 - С6)алкильные группы;
R7, R8 представляют собой атом водорода;
R9 представляет собой атом водорода, метильную группу или этильную группу;
Z1 и Z2 независимо представляют собой атомы кислорода или серы;
Z3 представляет собой атом кислорода или атом серы; группу N-R10, где R10 представляет собой атом водорода, метильную группу, метилкарбонильную группу, фенилкарбонильную группу; сульфинильную группу или сульфонильную группу;
Q представляет собой фенильную группу, необязательно содержащую по крайней мере один из одинаковых или различных заместителей, выбираемый из группы, состоящей из атома галогена; (С1 - С6)алкильной группы, которая может быть замещена тремя атомами фтора; (С1 - С6)алкоксигруппы, которая может быть замещена по крайней мере одним атомом галогена; цианогруппы; нитрогруппы; (С1 - С6)алкоксикарбонильной группы; метилсульфинильной группы; метилсульфонильной группы; метилтиогруппы; либо Q представляет гетероциклическую пиридильную группу, необязательно содержащую по меньшей мере один заместитель, выбираемый из одинаковых или различных атомов галогена или CF3; или Q представляет пиримидильную группу, необязательно содержащую по меньшей мере один из различных или одинаковых заместителей из группы, состоящей из атома галогена и (С1 - С3)алкила;
m представляет собой целое число от 0 до 2;
n равен 0 или 1.

в которой R1 представляет собой (С1 - С6)алкильную группу, необязательно содержащую по крайней мере один из одинаковых или различных заместителей, выбранный из группы, включающей атом галогена и (С1 - С6)алкоксигруппу; (С2 - С6)алкенильную группу; (С2 - С6)алкинильную группу; (С3 - С8)циклоалкильную группу, необязательно замещенную метильной группой; (С7 - С8)аралкильную группу, необязательно замещенную метильной группой; или фенильную группу, необязательно содержащую по крайней мере один из одинаковых или разных заместителей, выбранных из группы, включающей атом галогена, метильную группу, метоксигруппу, трифторметильную группу, трифторметоксигруппу и нитрогруппу;
R4 представляет собой атом водорода, (С1 - С3 )алкильную группу или цианогруппу;
R6 представляет собой атом водорода или (С1 - С3)алкильную группу;
R9 представляет собой атом водорода, метильную группу или этильную группу;
Z1 и Z2 независимо представляют собой атомы кислорода или серы;
Z3 представляет собой атом кислорода, атом серы, группу N - R10, где R10 представляет собой атом водорода, метильную группу, метилкарбонильную группу или фенилкарбонильную группу; либо представляет сульфинильную группу или сульфонильную группу;
Q представляет собой фенильную группу, необязательно содержащую по крайней мере один из одинаковых или различных заместителей, выбираемых из группы, включающей атом галогена; (С1 - С3)алкил, который может быть замещен тремя атомами фтора; (С1 - С3)алкоксигруппу, которая может быть замещена одинаковыми или различными атомами галогена; цианогруппу; нитрогруппу; метилсульфонильную группу; метилсульфинильную группу; метилтиогруппу; либо Q представляет пиримидин-2-ильную группу, пиридин-2-ильную группу, пиридин-4-ильную группу или 4-хлор-пиридин-2-ильную группу, 5-хлорпиридин-2-ил, 5-трифторметилпиридин-2-ил, 3-хлор-5-трифторметилпиридин-2-ил, 5-хлор-6-этилпиримидин-4-ил;
m представляет собой 0 или 2;
n равен 0 и 1.

в которой R1 представляет собой изопропильную группу, третбутильную группу, циклопентильную группу или фенильную группу, необязательно имеющую по крайней мере один из одинаковых или разных заместителей, выбираемых из группы, состоящей из атома галогена, метильной группы, метоксигруппы и нитрогруппы;
Х представляет собой атом галогена, цианогруппу или нитрогруппу.

в которой R1 представляет собой изопропильную группу, третбутильную группу, циклопентильную группу, циклогексильную группу, которая может быть замещена метильной группой, или фенильную группу, необязательно имеющую по крайней мере один из одинаковых или различных заместителей, выбираемый из группы, состоящей из атома галогена, метильной группы, метоксигруппы, трифторметильной группы, трифторметоксигруппы и нитрогруппы;
X представляет собой атом галогена, цианогруппу или нитрогруппу.

в которой R1 представляет собой изопропильную группу, третбутильную группу, циклопентильную группу или фенильную группу, необязательно имеющую по крайней мере один из одинаковых или разных заместителей, выбираемый из группы, состоящей из атома галогена, метильной группы, метоксигруппы и нитрогруппы;
Х представляет собой атом галогена, цианогруппу или нитрогруппу.

в которой R1 представляет собой (С1 - С6)алкильную группу, необязательно содержащую по крайней мере один заместитель - цианогруппу, (С3 - С8)циклоалкильную группу, необязательно содержащую по крайней мере один заместитель - атом галогена, (С4 - С8)циклоалкил (С1 - С3)алкильную группу, бензильную группу, фенильную группу, необязательно имеющую по крайней мере один тот или иной заместитель, выбираемый из группы, состоящей из атома галогена и дифторметоксигруппы;
R2 представляет собой н-пропильную группу, изопропильную группу, изобутильную группу, трет-бутильную группу, изопропенильную группу, (С3 - С8)циклоалкильную группу или фенильную группу, необязательно имеющую по крайней мере один заместитель - атом галогена;
Q представляет собой фенильную группу, необязательно содержащую по крайней мере один заместитель - цианогруппу, пиридильную группу, необязательно содержащую по крайней мере один из одинаковых или различных заместителей, выбранных из атомов галогена.
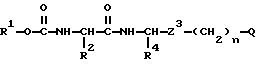
в которой R1 представляет собой (С1 - С3)алкильную группу, (С3 - С8)циклоалкильную группу или фенильную группу, необязательно имеющую по крайней мере один заместитель из числа атомов галогена;
R2 представляет собой этильную группу, изопропильную группу или втор-бутильную группу;
R4 представляет собой атом водорода или (С1 - С3)алкильную группу;
Z3 представляет собой группу СОО, группу CONR12, где R12 представляет собой атом водорода или (С1 - С3)алкильную группу;
Q представляет собой фенильную группу, необязательно имеющую по крайней мере один из одинаковых или различных заместителей, выбираемый из группы, состоящей из атома галогена, (С1 - С3)алкильной группы, (С1 - С3)алкоксигруппы и цианогруппы;
n равен 0 или 1.

где R1 = (С1 - С6)алкил, необязательно замещенный атомом галогена, циклоалкил (С5 - С6); фенильная группа, необязательно имеющая по меньшей мере один из одинаковых или разных заместителей, выбранных из группы, включающей атом галогена, (С1 - С6)алкоксигруппу и нитрогруппу, бензильная группа, необязательно замещенная метилом;
R2 - этил, изопропил, н-пропил, изобутил, втор-бутил, трет-бутил, циклопентил, алкенил, фенил, необязательно замещенный атомом галогена;
Z1 - атом кислорода или атом серы;
Z2 - атом кислорода;
R3 - водород, низший алкил;
R4 - водород, низший алкил, цианогруппа;
R5, R6 - атом водорода, низший алкил;
R7, R8 - водород;
m = 0, 1, 2;
n = 0, 1;
Z3 представляет собой атом кислорода, атом серы, группу N - R10, где R10 представляет собой атом водорода или метильную группу, группу СОО, группу CONR11, где R11 представляет собой атом водорода или метильную группу;
Q представляет собой фенильную группу, необязательно имеющую по меньшей мере один из одинаковых или разных заместителей, выбранных из группы, включающей атом галогена, (С1 - С6)алкил, который может быть замещен атомом фтора; (С1 - С6)алкоксигруппу, которая может быть замещена атомом фтора; цианогруппу; нитрогруппу; метилтиогруппу и (С1 - С6)алкоксикарбонилгруппу; аралкильную (бензильную) группу, которая может быть замещена атомом галогена; или Q представляет собой пиридильную группу, необязательно имеющую по меньшей мере один из одинаковых или разных заместителей, выбранных из группы, включающей атом галогена и трифторметильную группу; пиримидильную группу, необязательно замещенную атомом галогена или (С1 - С3)алкилом, отличающийся тем, что включает стадию взаимодействия соединения формулы IX

значения R1, R2, Z1 указаны выше, с соединением формулы Х

значения R3, R4, R5, R6, R7, R8, Z3, Q, n и m указаны выше.
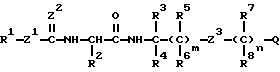
где R1 представляет собой (С1 - С6)алкил, необязательно имеющий в качестве заместителя метоксигруппу или цианогруппу; низший алкенил; (С5 - С6 )циклоалкил, необязательно имеющий в качестве заместителя метильную группу или атом галогена; (С3 - С8)циклоалкил (С1 - С6)алкил; низший алкил; фенил, необязательно имеющий по меньшей мере один из одинаковых или разных заместителей, выбранных из группы, включающей атом галогена; (С1 - С6)алкил, который может быть замещен атомом фтора; низшую алкоксигруппу, которая может быть замещена атомом фтора и нитрогруппой; аралкильную группу, необязательно имеющую в качестве заместителя нитрогруппу; тетрагидрофуран; тетрагидропиран;
R2 представляет собой этил, изопропил, н-пропил, изобутил, втор-бутил, трет-бутил, циклопентил; фенильную группу, необязательно имеющую в качестве заместителя атом галогена;
R3 - атом водорода, (С1 - С6)алкил;
R4 - атом водорода, (С1 - С6)алкил;
R5, R6 - атом водорода;
R7, R8 - атом водорода;
Z1 - атом кислорода или атом серы;
Z2 - атом кислорода или атом серы;
Z3 - атом кислорода, атом серы, группу CONH;
m = 0, 1;
n = 0, 1;
Q представляет собой фенил, необязательно имеющий по меньшей мере один из одинаковых или разных заместителей, выбранных из группы, включающей атом галогена, цианогруппу, нитрогруппу; аралкил (бензил), необязательно замещенный атом галогена; пиридил, который может быть замещен атомом галогена, отличающийся тем, что осуществляют взаимодействие соединения формулы XI

в которой Y представляет собой атом галогена, 4,6-диметилпиримидинилтиогруппу, группу R1ОС(О)О- или группу -ON=C(CN)Ph, где Ph означает фенильную группу, а значения Z1, Z2 и R1 указаны выше, с соединением формулы XII

значения R2 R3, R4, R5, R6, R7, R8, Z3, m и n указаны выше.

Комментарии