7-дезоксипроизводные таксола, производные баккатина, 10-пентафторфенилбаккатин, 7-[(метилтио)карбонотиоилокси]-13-триэтилсилилоксибаккатин, фармацевтическая композиция - RU2122545C1
Код документа: RU2122545C1
Чертежи










Описание
Настоящая заявка является частичным продолжением заявок U. S. S. N 07/955008, поданной 1 октября 1992 г, U.S.S. N. 07/981151, поданной 24 ноября 1992 г, U.S.S. N 07/996455, поданной 24 декабря 1992 г, каждая из которых является заявкой на патент США и которые в полном объеме вводятся здесь в виде ссылок.
Настоящее изобретение относится к новым противоопухолевым средствам и к применяемым для их получения промежуточным соединениям. Более конкретно, настоящее изобретение относится к 7-дизокситаксолу, 7-дезокси-10-дезацетилокситаксолу и их производным.
Впервые таксол был
выделен из коры стеблей тиса
тихоокеанского /Taxus brevifolia (Тахасеае)/ и отвечает формуле (указаны (C)2'-7-, 10- и 13-положения):

Финансированные Национальным Раковым Институтом (НРИ) клинические испытания таксола дали обнадеживающие результаты в лечении прогрессирующих случаев рака яичников, груди и других раковых заболеваний. В настоящее время одобрено использование таксола для лечения метастазной карциномы яичников.
Уникальность таксола среди антимитотических средств состоит в том, что он промотирует агрегацию стабильных микроканальцев из тубулина даже в самых неблагоприятных условиях. Лекарство связывается с микроканальцами, стабилизируя их от деполимеризации, тем самым нарушая равновесие тубулин-микроканальцы и вследствие этого ингибируя митоз. Обзор механизма действия, токсикологии, клинической эффективности и т.д. можно найти в ряде статей, например в статье Rowinsky и др. "Таксол". Новое исследованное противомикроканальцевое средство" J. Na fi Cancer Tnst 82 стр. 1247-1259 (1990 г.).
Со времени обнаружения
заметной эффективности таксола для лечения
рака многими лабораториями созданы программы синтеза аналогов таксола в поисках соединений с лучшими фармакологическими показателями. В результате одной из
таких программ был открыт, например,
таксотер формулы:

(см. "Биологически активные аналоги таксола с удаленной замещающей A-цикл боковой цепью различной конфигурацией C-2". J. Med. Chem. 34. стр. 1176-1184. 1991; "Связь строения аналогов таксола с их антимитотической активностью". J. Med. Chem., 34 стр. 992-998. 1991).
Сравнительно мало известно о зависимости строение-активность для (C)7 - и (C)10-положения таксола. К примеру, в работе Kingston и др. "Химия таксола- клинически применимого противоракового средства" Journal of Natural Products. 53 N 1, стр. 1-12 (1990) лишь в небольшом объеме обсуждается зависимость строение-активность некоторых (C)7 - эфиров и эпипроизводных. В результате реализации части нашей программы исследований зависимости особенностей строения таксола, существенных для его активности, нам удалось полностью удалить (C)7- или (C) 7-/ (C) 10- заместители таксола. Обнаружено, что такие дезоксигенированные производные таксола продолжают сохранять противоопухолевую активность. Таким образом, цель изобретения заключается в создании 7-дезокситаксола, 7-дезокси-10-дезацетилокситаксола и их производных.
Настоящее изобретение относится к производным таксола формулы

в которой
R1 представляет -CORz (Rz - группа RO - или R),
Rg представляет C1-C6 - алкил, C2-C6 - алкенил, C2 - C6 -алкинил, C3-C6-циклоалкил или радикал формулы - W-Rx (W - связь, C2 -C6-алкендиил или -(CH2)f-, f=1-6, Rx-нафтил, фенил или гетероарил, кроме того, Rx может быть замещен 1-3 одинаковыми или различными C1 -C6-алкилами, C1-C6 - алкоксигруппами, галогенами или CF3,
R2 представляет - OCOR, H, OH, -OR, -OSO2R, -OCONRgR, -OCONHR, -COO(CH2)tR или - OCOOR,
R и Rg независимо представляют C1-C6-алкил, C2 -C6-алкенил, C3-C6 -циклоалкил, C2-C6-алкинил или фенил, возможно замещенный 1-3 одинаковыми или различными C1-C6-алкилами, C1-C6-алкоксигруппами, галогенами или CF3.
Кроме того, настоящим изобретением даются фармацевтические препараты и промежуточные соединения для получения дезокситаксолов формулы I. Также дается способ лечения опухолей у млекопитающих с помощью соединения формулы I.
Настоящее изобретение относится к производным таксола
формулы

в которой
R1 представляет -ORz (Rz -группа RO- или R);
Rg представляет C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, C3-C6-циклоалкил или радикал формулы -W-Rx (W - связь, C2-C6-алкендиил или -(CH2)f, f=1-6, Rx - нафтил, фенил или гетероарил, кроме того, Rx может быть замещен 1-3 одинаковыми или различными C1-C6-алкилами, C1-C6-алкоксигруппами, галогенами или -CF3,
R2 представляет -OCOR, H, OH, -OR, -OSO2R, - OCONRgR, -OCONHR, -OCOO(CH2)t R или -OCOOR,
R и Rg независимо представляют C1-C6 -алкил, C2-C6-алкенил, C3-C6-циклоалкил, C2-C6-алкинил или фенил, возможно замещенный 1-3 различными или одинаковыми C1 -C6-алкилами, C1-C6-алкоксигруппами, галогенами или -CF3.
В данном описании дважды определенные символы сохраняют свое значение во всем описании, если не последует уточнений.
Соединения настоящего изобретения могут быть получены общим методом, иллюстрируемым схемой I. На стадии (а) схемы азетидинон формулы IV вводят в реакцию с соединением формулы II (производное III баккатина). Класс азетидинонов формулы IV хорошо известен. Их синтез или синтез их предшественников раскрыт, например см. Holto в заявке на Европейский патент 0400971 A2, опубликованной 5 декабря 1990 г, Holton в заявках на Европейский патент 0534709 A1, 0534708 A1 и 0534707, каждая из которых опубликована 31 марта 1993, Holto в РСТ-заявке WO 93/06079, опубликованной 1 апреля 1993 г, Ojima и др. Tetrahedron 48 N 34, стр. 6985-7012 (1992), Iourhal of Organic Chemistry 56 стр. 1681-1683 (1991) и Tetrahedron Letters 33 N 59, стр. 5737-5740 (1992) Brieva и др. I. Org. Chem. 58 стр. 1068-1075 и Palomo и др. Tetrahedron Letters 31, NN 44, стр. 6429-6432 (1990), все десять ссылок в полном объеме вводятся здесь в качестве ссылок. Методики, которые могут быть направлены на получение других азетидинонов, охватываемых формулой IV, но не раскрываемые здесь или в вышеперечисленных ссылках, или иной публикации, для специалиста очевидны.
В заявках на Европейские патенты 0400971 A3, 0534709 А1, 0534708 A1 и 0534707 A1 и в Tetrahedron, 48 N 34, стр. 6985-7012 (1992) также раскрыты способы, в которых проводят реакцию азетидинонов формулы IV с (C)13-гидроксигруппой производного баккатина III или ее металлалкоксидом с образованием аналогов таксола с различными боковыми (C)13-цепями. На стадии (a) схемы 1 предпочтительно превращение гидроксигруппы у (C) 13-углерода в металлалкоксид перед введением заместителя. Катион металла такого металлалкоксида рекомендуют выбрать среди металлов IA или IIA Группы. Образование целевого металлалкоксида может быть осуществлено реакцией соединения формулы с сильным основанием металла, таким как диизопропиламид лития, C1-C6 -алкиллитий, бис(триметилсилил)амид лития, фениллитий, гидрид натрия, гидрид калия, гидрид лития или аналогичные основания. Например, если хотят получить литийалкоксид, проводят реакцию соединения формулы II с н-бутиллитием в инертном растворителе, таком как тетрагидрофуран.
В настоящей заявке принята следующая нумерация производного баккатина III формулы

гидроксигруппы. Обычные радикалы для защиты гидроксигруппы - это радикалы, которые могут быть использованы для блокирования или защиты гидроксифункциональности, и такие радикалы хорошо известны специалисту. Рекомендуется, чтобы такие радикалы относились к группам, удаляемым способами, не вызывающими заметного разрушения остальной части молекулы. Примеры таких легко удаляемых радикалов для защиты гидроксигруппы включают: хлорацетил, метоксиметил, 2,2,2-трихлорэтоксиметил, 2,2, 2-трихлорэтоксикарбонил (или просто трихлорэтоксикарбонил), тетрагидропиранил, тетрагидрофуранил, трет-бутил, бензил, п-нитрофенил, п-метоксибензил, дифенилметил, три- C1-C6 -алкилсилил, трифенилсилил и т.п. Другие приемлемые защитные группы приведены в главе 2 изделия "Защитные группы в органическом синтезе", второе изд. Theodora. W. Creene и Peter G.M.Wuts (1991, Джон Вили и сыновья). В случае соединений формулы IV в качестве защитной группы особенно предпочтителен триэтилсилил. На стадии (b) защитную группу R3 удаляют. Если R3 представляет три-C1-C6-алкилсилил, например триэтилсилил, защитная группа может быть удалена действием фторид-иона или минеральной кислоты в спирте или ацетонитриле. Удаление в присутствии фторид-иона проводят в инертном растворителе, таком как тетрагидрофуран, хлористый метилен, 1,4-диоксан, ДМФА, хлороформ и т.п., и в реакционную среду в качестве буфера может быть добавлена слабая кислота, такая как уксусная кислота. Примером минеральной кислоты может служить хлористоводородная кислота.
Соединение формулы II может быть синтезировано способами, иллюстрируемыми схемами II-IV. Такие методы могут быть легко модифицированы для получения соединения, охватываемого формулой II, но не раскрытого здесь. Другие варианты способа с получением тех же соединений, но несколько иными методами также очевидны специалисту.
Ключевым моментом способа получения соединения формулы IIa, в которой Rc представляет OH, -OCOR-, OR, -OSO2R, -OCO- NRgR, -OCONHR, -OCOO(CH2) R или -OCOOR, является реакция, известная как реакция дезоксигенерирования Бартона (радикальное дезоксигенирование). Нами обнаружено, что для успешного применения этой реакции только для дезоксигенирования (C) 7-гидроксигруппы требуется очень узкий температурный интервал около 80oC. Кроме того, среди многих возможностей превращения (C) 7-гидроксигруппы в отходящую группу, например так, как это предлагается в обзорной статье Hartwig "Современные методы радикального дезоксигенирования спиртов" Tetrahedron 39, N 16, стр. 2609-2645 (1983), похоже не всякая группа приемлема для (C) 7-дезоксигенирования. К примеру, нами обнаружено, что превращение в пента/фторфенилтионокарбонат не может привести к дезоксигенированию даже при длительном нагревании при 80oC. При проведении дезоксигенирования в бензоле рекомендуется силировать соединение формулы VI (стадия b) с тем, чтобы повысить растворимость в бензоле. Но еще более предпочтительно для превращения соединения формулы VI непосредственно в соединение формулы II, если дезоксигенирование проводят в диоксане при 75oC. Рекомендуемый радикал Rc в общем способе схемы II - ацетилоксигруппа.
Соединение формулы IIb может быть синтезировано способом, иллюстрируемым схемой III.
Очень важно, что соединение формулы IX способно образовывать литийалкоксид, поскольку многие другие попытки химически дифференциировать два гидроксила у C-10 и C-13 с помощью других оснований оказались безуспешными: обе гидроксигруппы обладают почти одинаковой реакционноспособностью. Такой эффект "литийалкоксида" оказался неожиданным, но, видно, является общим и позволяет гладко функционализировать C-10, но не C-13. Другие апробированные на стадии (e), в том числе гидрид трифенилолова и трис(триметилсилил)силан, приводят к образованию многих побочных продуктов. И вновь дезоксигенирование (стадия e) рекомендуют проводить при 80oC.
В более предпочтительном способе соединение формулы IIb может быть непосредственно получено из соединения формулы VIIa его нагреванием около 6 часов при 100oC, толуольного раствора гидрида трибутилолова /АИБИ и удалением триметилсилильной защитной группы (см. схему IIIa).
Соединение формулы V может быть получено способом, иллюстрируемым схемой V, или его очевидными вариантами. Способ может быть легко модифицирован для получения соединений, охватываемых формулой V, но не раскрытых здесь. Кроме того, вариации способа с получением тех же соединений, но несколько иным путем, также очевидны специалисту.
Согласно схеме V, если соединение формулы XXVI реагирует с соединением RL, RC(= O)L, R(CH2)OCf(=O)L, ROC(=O)L, LSO2R, LCONRgR, LCONHP, O=C=N-R или их ангидридами, где L представляет типичную отходящую группу, такую как хлор, бром, мезил, трифторметансульфонил или тозил, в этом случае может быть получено соединение формулы XXVII. В данном описании Rm представляет -OR, -OCOR-, -OSO2R, -OCONRqR, -OCONHR, -OCOO(CH2)fR или -OCOOR. На стадии (a) для удаления протона из C-10 гидроксигруппы обычно требуется основание. Особенно предпочтительными для стадии (a) основаниями являются C1-C6-алкиллитий, бис(триметилсилил) амид лития или аналогичные основания, применяемые в количестве 1,1 эквивалента. Депротонирование основанием рекомендуют проводить в апротонном растворителе, таком как тетрагидрофуран, и при низкой температуре, обычно в интервале от -40 до 0oC. Удаление R3 в соединении формулы XXVII приводит к соединению формулы Va, попадающее в объем соединений, охватываемых формулой V.
В качестве другого примера превращения соединения формулы IIa на схеме II можно указать вариант, когда Rc представляет бензилоксикарбонилоксигруппу, бензилоксикарбонил, эти группы могут быть удалены каталитическим гидрированием и образовавшаяся гидроксигруппа может быть превращена в Rm радикал, отличный от бензилоксикарбонилоксигруппы, как на стадии (a) схемы V с получением других соединений в объеме формулы IIa.
В настоящей заявке цифра в виде индекса после символа "C" определяет число атомов углерода, которое может содержать данная группа. Например, C1-C6 -алкил относится к нормальному или разветвленному алкилу с одним - шестью атомами углерода и такие группы включают: метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, бутил, н-пентил, н-гексил, 3-метилпентил или аналогичные алкильные группы, C2-C6 -алкенил относится к нормальным или разветвленным алкенилам, таким как винил, аллил, 1-пропенил, изопропенил, 1-бутенил, 2-бутенил, 3-бутенил, металлил, 1,1-диметилаллил, 1-гексенил, 2-гексенил или аналогичные группы: C3-C6-циклоалкил относится к циклопропилу, циклобутилу, циклопентилу или циклогексилу, C2-C6-алкенил относится к нормальному или разветвленному алкинилу, такому как этинил, пропаргил, (2-пропинил), 1-пропил, 2-бутинил, 3-бутинил, 1-гексинил, 4-метил-2-пентинил и аналогичные группы, C2-C4-алкендиил относится к таким группам, как этилен-1,2-диил, (винилен), 2-метил-2- бутен-1,4-диил, 2-гексен-1,6-диил и аналогичные группы, C1-C6-алкилоксигруппа (алкоксигруппа) относится к нормальным или разветвленным алкилоксигруппам, таким как метокси-, этокси-, н-пропокси, изопропокси-, н-бутокси-, трет-бутокси-(трет-бутилокси), н-пентилокси, н-гексилокси-, 3-метилпентилоксигруппа, и т.д., гетероарил относится к пятичленному ароматическому циклу, содержащему по меньшей мере один гетероатом, выбранный из атомов серы, кислорода или азота, но вплоть до 1 атома серы, 1 кислорода или 4 атомов азота, гетероарил относится также к шестичленному ароматическому циклу, содержащему 1-4 атома азота, галоген относится к фтору, хлору, брому или йоду. Примеры гетероарила включают: тиенил, фурил, пирролил, имидазолил, тиазолил, изотиазолил, оксазолил, изоксазолил, триазолил, тиадиазолил, оксадиазолил, тетразолил, тиатриазолил, оксатриазолил, пиридил, пиримидил, пиразинил, пиридазинил, триазинил, тетразинил, и аналогичные циклы. Азетидинон относится к азетидин-2-ону (или 2-азетидинону). В настоящей заявке все однажды определенные символы сохраняют свои значения, пока не последуют уточнения.
В настоящем описании трет-бутилоксигруппа и трет-бутилоксигруппа взаимозаменяемы.
Нижеследующие характерные примеры иллюстрируют синтез представленных соединений настоящего изобретения и их не следует рассматривать, как ограничивающие сферу или объем изобретения. Возможны модификации для получения соединений, охватываемых настоящим изобретением, но не раскрытых здесь. Кроме того, вариации методик получения тех же соединений, но несколько иным путем, очевидны для специалиста.
Все температуры приведены в градусах Цельсия (oC), если нет особых указаний. Характеристики спектров ядерного магнитного резонанса (ЯМР) относятся к химическим сдвигам (δ), выраженным в частях на миллион (ч/млн) относительно тетраметилсилана (ТМС) в качестве ссылочного стандарта. Относительные площади, приведенные для различных сдвигов в данных протонного ЯМР, соответствуют числу атомов водорода данного функционального типа в молекуле. Природа сдвигов обозначается как широкий синглет (ш.с.), широкий дублет (ш. д. ), широкий триплет (ш.т.), широкий мультиплет (ш.м.), широкий квартет (ш. к. ), синглет (с), мультиплет (м), дублет (д), квартет (к), триплет (т), дублет дублетов (дд), дублет триплетов (дт), и дублет квартетов (дк). Для получения спектров ЯМР используют в качестве растворителей DMCO-d6 (пердейтерированный диметилсульфоксид), D2O (дейтерированная вода), CDCl3 (дейтерохлороформ) и другие обычные дейтерированные растворители. "Обмен" означает способный обмениваться с CD3OD (например "д плюс обмен". означает дублет плюс способный к обмену сигнал. Полный сигнал превращается в тот дублет после обмена протона). "Вкл". означает включая.
Инфракрасные спектральные характеристики (ИК) включают только абсорбционные волновые числа (см-1) с идентефикационным значением функциональной группы.
Целит - зарегистрированное фирменное название диатомовой земли производства Джонс-Манвилл Продактс Корпорейшн.
Применяемые в описании сокращения относятся к обычным, широко
применяемым в химии сокращениям. Вот некоторые из них:
Ac - ацетил,
Ar - арил,
Bz - бензоил,
CbZ
- бензилоксикарбонил,
ДХИ - десорбционная химическая
ионизация,
ДМФА - диметилформамид
ДМСО - диметилсульфоксид,
ББА - бомбардировка быстрыми атомами,
ч
- час(ы),
МСВР - масс-спектрометрия высокого
разрешения,
LiГМДС - литийгексаметилдисилазан или бис (триметилсилил)- амид лития
ГМДС- гексаметилдисилазан,
изо-PrOH
- изопропиловый спирт,
мин - минута(ы),
МС - масс- спектрометрия,
Ph - фенил,
комн. т-ра, - комнатная температура,
трет-Bu - третичный бутил,
ТЭС
- триэтилсилил,
ТГФ - тетрагидрофуран,
ТСХ - тонко-слойная хроматография.
Пример 1
7-/(Метилтио)карбонотиоилокси/баккатин III (VIa, соединение формулы VI, в
которой Rc - ацетилоксигруппа)
В 20 мл сухого ТГФ растворяют баккатин III (750 мг, 1,278 ммоля) и одной порцией добавляют имидазол (8,7 мг, 0,128 ммоля). При комн. т-ре прибавляют
гидрид натрия (50% в минеральном масле, 77 мг,
1.597 ммоля). После прекращения выделения газа (10 мин) одной порцией добавляют сероуглерод (4.6 мл). После выдерживания 3 ч при комн. т-ре желтый
раствор обрабатывают йодистым метилом (0.238 мл,
3.835 ммоля) и перемешивают примерно сутки. Обработкой этилацетатом и водой получают в виде сырого масла заглавный ксантат VIa. Часть полученного масла
для характеристики очищена вытеснительной
хроматографией на силикагеле с элюированием смесью этилацетат-гексан (1:1) и получением белого твердого вещества.
1H-ЯМР (CDCl3) δ: 8,8 (д. J = 8.3 Гц, 2H),
7.58 (ш.т. 1H), 7.45 (м, 1H), 6.35 (м, 1H), 6.29 (с, 1H), 5.63 (д, J = 7 Гц, 1H), 4.97 (д. J = 8.7 Гц, 1H), 4.69 (ш. к. 1H), 4.31 (д, J = 8.3 Гц, 1H), 4.15
(д, J = 8.3 Гц, 1H), 4.03 (д, J = 7 Гц,
1H), 2.91 (м, 1H), 2.44 (c, 3H), 2.29 - 1.5 (м, 16H, вкл. синглеты при 2.27, 2.13, 2.08, 1.89, 3H, каждый) 1,12 (с, 3H), 1.05 (c, 3H), 1.05 (c, 3H), ИК
(пленка): 3554 (широкая), 1734, 1718, 1708,
1266, 1244, 1220, 1204, 1070, 1052 см-1,
13C-ЯМР (DMCO-d6, 75,5 Гц) δ: 202,2, 169,9, 168,4, 165,2, 145,8,
133,4, 130,2, 130, 129,6, 128,8, 82,7; 80,5,
79,4, 76,7, 75,6, 75,2, 74, 66, 55,7, 46,8, 42,5, 31,5, 17,7, 15,2, 11,3. ББА-МС (NOBA): (M+ H) выч. для C33H41S2 O11 677, найдено 677.
Альтернативная методика 1.
В 5 мл ТГФ и 1 мл CS2 растворяют баккатин III (394 мг, 0,672 ммоля) и к полученному раствору добавляют NaH (40,3 мг, 60% 1,009 ммоля) и каталитическое количество имидазола. Затем реакционную смесь перемешивают 1,5 ч при комн. т-ре, после чего добавляют MeI (122,8 мкл, 2.016 ммоля). Спустя 40 мин растворитель удаляют в вакууме, остаток хроматографируют на силикагеле с элюированием градиента 20% - 50% - 60% этилацетата в гексане получают 260 мг (57,2%) заглавного соединения в смеси с 98,5 мг (25%) 7-эпи-баккатина.
Альтернативная методика 2.
К раствору баккатина III (3,3 г 5,62 ммоля) в 100 мл ТГФ и 25 мл C2 добавляют NaH (350 мг, 60% 8,75 ммоля) и раствор перемешивают 10 мин. Затем добавляют имидазол, реакционную смесь перемешивают 90 мин, добавляют MeI (1,05 мл, 16,8 ммоля) и раствор перемешивают еще 4 часа. Раствор разбавляют этилацетатом, промывают водой и рассолом, сушат над MgSO4 и концентрируют. Остаток хроматографируют на силикагеле с элюированием смесью этилацетатгексан (1:1) и получают 2,2 г (58%) заглавного соединения.
Пример 2
7-/(Метилтио)карбонотиоилокси/-13-триэтилсилилоксибаккатин III (VIIa)
В 5 мл сухого ТГФ растворяют в виде сырого масла соединение VIa примера 1?
обрабатывают 15 ч при комн.
т-ре имидазолом (870 мг, 12,78 ммоля) и триэтилсилилхлоридом (2,1 мл, 12,78 ммоля). Добавляют воду и экстрагируют этилацетатом. Органический слой интенсивно промывают водой
и затем сушат.
Вытеснительной хроматографией на силикагеле с элюированием 20% этилацетата в гексане получают в два этапа 209 кг (20%) соединения VIIa в виде стеклообразного вещества.1H-ЯМР
(CDCl3) δ: 8,08 (д, J = 8,3 Гц, 2H), 7,58 (ш.т. 1H), 7,44 (м, 2H), 6,34 (м, 1H) 6,3 (c, 1H), 5,62 (д, J = 7 Гц, 1H), 4,99 - 4,83 (м, 2H), 4,3 (д, J = 8,3 Гц, 1H), 4,15 (д, J = 8,3 Гц,
1H), 4,
03 (д, J = 7 Гц, 1H), 2,91 (м, 1H), 2,44 (с, 3H), 2,3 - 1,6 (м, 15H, вкл. синглеты при 2,27, 2,1, 2,05, 1,9 3H каждый), 1,15 - 1 (м, 15H), 0,65 (м, 6H), МС, выч. для C31H55O11S2Si: 790, найдено: 790.
Альтернативная методика
В 2.86 мл сухого ТГФ растворяют 7-ксантатбаккатин VIa (193,4 мг, 0,286 ммоля), к полученному
раствору
добавляют имидазол (77,9 мг, 1,14 ммоля) и затем триэтилсилилхлорид (192 мкл, 1,14 ммоля). Реакционную смесь перемешивают примерно сутки при комн. т-ре. Спустя 12 ч реакционную смесь
разбавляют EtOAc
(150 мл), органический слой промывают водой (3 х 10 мл) и рассолом (1 х 10 мл). Затем органический слой сушат и концентрируют. Остаток хроматографируют на силикагеле с элюированием
20% EtOAc в
гексане и получают 163 мг (72%) заглавного соединения.
Пример 3
7-Дезокси -13- триэтилсилилоксибаккатин III (VIIIa, соединение формулы VIII, в которой Rc
- ацетилоксигруппа)
Соединение VIIa (182 мг, 0,23 ммоля) в сухом бензоле (5 мл) нагревают при 80oC в присутствии гидрида трибутилолова (0,31 мл, 1,15 ммоля) и АИБН (2,
2'- азобисизобутиронитрил, 10 мг). Спустя 3 ч раствор охлаждают и испаряют в вакууме. Хроматографией на силикагеле с элюированием 20% этилацетата в гексане получают соединение VIIIa в виде масла.
Пример 4
7-Дезоксибаккатин III (IIaa, соединение формулы IIa, в которой Rc-ацетилоксигруппа)
В 5 мл ТГФ растворяют соединение VIIIa и обрабатывают
тетрабутиламмонийфторидом (IM в ТГФ, 0,5 мл, 0,5 ммоля) 2 ч при комн. т-ре. Разбавлением этилацетатом и промыванием водой и рассолом с последующей хроматографией на силикагеле с элюированием смесью
этилацетат-гексан (1:1) в виде белого стеклообразного вещества соединение IIaa (выход 63 мг, 58% на двух этапах).1H-ЯМР (CDCl3) δ: 8,1 (д, J=8.3 Гц, 2H), 7,59 (ш.т. 1H),
7,48 (м, 2H), 6,46 (с, 1H), 5,6 (д, J=7,4 Гц, 1H), 4,95 (ш.д. 1H), 4,84 (м, 1H), 4,3 (д, J=8,3 Гц, 1H), 4,16 (д, J=8,3 Гц, 1H), 3,83 (д, J=7,4 Гц, 1H), 2,45-1 (м, 26H, вкл. синглеты при 2,31, 2,23, 2,
03, 1,71, 1,1, 1,06 3H каждый). ИК (пленка): 3514 (широкая), 1734, 1712, 1374, 1274, 1242, 1110, 1070, 1018, 754 см-1.13C-ЯМР (CDCl3, 75,5 Гц) δ: 206,6, 170,6,
169,7, 167,2, 144,6, 133,6, 130,1 129,7, 129,5 128,6, 84,5, 81,7, 79, 75,7, 74,8, 72,4, 67,8, 52,9, 45,7, 42,5, 38,8, 35,1, 27, 26,4, 22,6, 20,9, 20,6, 14,6, 14,2. MCBP, выч. для C31H39O10 (MH+): 571, 2543, найдено: 571, 2528.
Альтернативная
методика
К раствору ксантата VIa (1,38 г, 2,03 ммоля) в 50 мг дегазированного диоксана
в атмосфере II2 прибавляют гидрид трибутилолова (2,7 мл, 10 ммолей) и каталитическое количество АИБН (107 мг). Раствор нагревают 30 мин при 70oC, охлаждают и концентрируют.
Хроматографированием остатка на силикагеле (гексан-этилацетат 1:1) получают 1,015 г (87%) заглавного 7-дезоксибаккатина III.
Пример 5
7-Триэтилсилилокси-10-дезацетилбаккатин
III(IX)
В 6 мл сухого ДМФА растворяют 10-дезацетилбаккатин III из Taxus baccata, 628 мг, 1,15 ммоля), охлаждают до 0oC и обрабатывают имидазолом (312,8 мг, 4,595 ммоля) и
хлортриэтилсиланом (0,772 мл, 4,6 ммоля). Смесь перемешивают 4 ч при 0oC, затем разбавляют этилацетатом (150 мл) и интенсивно промывают водой и рассолом. Органический слой сушат и
концентрируют. Очисткой остатка хроматографией на силикагеле с элюированием 50% этилацетата в гексане получают в виде пены 586 мг (77%) заглавного соединения. Данное соединение охарактеризовано в
работе Creene и др. J. Am. Chem Soc. 110 стр. 5917 (1988).
Пример 6
10-Пентафторфенилтионокарбонат-7-триэтилсилилоксибаккатин III(X)
В 5 мл сухого ГТФ растворяют
соединение IX (319 мг, 0,485 ммоля), охлаждают до -40oC и обрабатывают н-бутиллитием (1,58 М в гексане, 0,384 мл, 0,606 ммоля). После выдерживания 40 мин при той же температуре шприцем
добавляют в чистом виде пентфторфенилхлортионоформат (0,086 мл, 0,536 ммоля). Реакционную смесь перемешивают 90 мин при -20oC, затем нейтрализуют насыщенным раствором хлористого аммония и
экстрагируют этилацетатом. Этилацетатный слой сушат и концентрируют. Очисткой остатка хроматографией на силикагеле с элюированием 40% этилацетата в гексане получают в виде пены 320 мг (74%)
соединения
X.1H-ЯМР (CDCl3) δ: 8,09 (д, 2H), 7,56 (т. 1H), 7,44 (м, 2H), 6,78 (с, 1H), 5,64 (д, J=6,9 Гц, 1H), 4,96-4,89 (м, 2H), 4,49 (дд, J= 10,2 Гц, J'=6,6 Гц, 1H), 4,
12 (AB к,
2H), 3,8 (д, J=6,9 Гц, 1H), 2,55-0,44 (м, 43H),
MC: 884(MH+).
Пример 7
10-Дезацетилокси-7-триэтилсилилоксибаккатин III(XI)
В 3 мл
сухого толуола
растворяют тионокарбонат X (119 мг, 0,135 ммоля) и обрабатывают АИБН (2 мл). Раствор дегазируют сухим азотом, после добавляют гидрид трибутилолова (0,055 мл, 0,202 ммоля). Затем
раствор нагревают 1 ч
при 90oC. Растворитель испаряют и хроматографией остатка на силикагеле с элюированием 40% этилацетата в гексане получают в виде бесцветной пены 87 мг (99%) соединения
XI.1H-ЯМР
(CDCl3) δ: 8,07 (д, J=8.2 Гц, 2H), 7,56 (ш.т. 1H), 7,44 (м, 2H), 5,57 (д, J=6,7 Гц, 1H), 4,92 (д, J=9,3 Гц, 1H), 4,78 (ш. с., 1H), 4,48 (дд, J=10,4 Гц, J=6,6
Гц, 1H), 4,09 (AB к, 2H),
4,06 (д, J=6,7 Гц, 1H), 3,74 (д, J=14,8 Гц, 1H), 3,35 (ш.д. 1H), 2,44 (м, 1H), 2,25 (с. 3H), 2,22-0,645 (м, 42H), MC: 642 (МН+).
Пример 8
10-Дезацетилоксибаккатин
III(XII)
В 3,5 мл ацетонитрила растворяют соединение XI (120 мг, 0,187 ммоля) и раствор охлаждают до -10oC. Добавляют концентрированную HCl (36%, 0,06 мл)
и раствор перемешивают 30
мин. Смесь разбавляют этилацетатом (75 мл) и промывают насыщенным водным раствором бикарбоната натрия и рассолом, сушат и концентрируют. Очисткой остатка хроматографией на
силикагеле с элюированием
70% этилацетата в гексане получают в виде пены 75 мг (76%) десилированного 10-дезацетилоксибаккатина III(XII).1H-ЯМР (CDCl3) δ: 8,1 (д, J=7,3
Гц, 2H), 7,6 (м, 1H), 7,45
(м, 2H), 5,64 (д, J=6,9 Гц, 1H), 4,97 (ш.д. J=9,4 Гц, 1H), 4,81 (ш.т. 1H), 4,36-4,28 (м, 2H), 4,17-4,07 (м, 3H), 3,82 (д, J=15,6, 1H), 3,43 (ш.д, J=15,6 Гц, 1H), 2,6 (м,
1H), 2,28-1,73 (м, 14H, вкл.
синглеты при 2,27, 1,93, 1,62, 3H, каждый), 1,11 (с, 3H), 1,04 (с, 3H), MCBP, выч. для C29H37O9 (МН+): 529, 2438, найдено: 529,
2432.
Пример
9
7-/(Метилтио)карбонотиолокси/-10-дезацетилоксибаккатин III (XIII)
В 2 мл ТГФ и 0,5 мл сероуглерода растворяют соединение XII (75 мг, 0,142 ммоля),
затем добавляют гидрид натрия
(60% в минеральном масле, 8,5 мг, 0,213 ммоля) и смесь перемешивают 2 ч при комн. т-ре. Добавляют йодметан (0,026 мл, 0,426 ммоля) и реакционную смесь оставляют на ночь.
Растворитель удаляют и
очисткой остатка хроматографией на силикагеле с элюированием 50-70% этилацетата в гексане в виде пены 46,4 мг (53%) ксантата XIII.1H-ЯМР (CDCl3) δ
: 8,1 (д, J=7,3 Гц, 2H),
7,59 (м, 1H), 7,44 (м, 2H), 6,44 (дд, J= 10,4 Гц, J'=7,3 Гц, 1H), 5,63 (д, J=6,8 Гц, 1H), 4,97 (ш.д. J=9,4 Гц, 1H), 4,78 (ш.т. 1H), 4,31 (д, J=8,4 Гц, 1H), 4,26 (д, J=6,8 Гц,
1H), 4,13 (д, J= 8,4 Гц,
1H), 3,83 (д, J=15,4 Гц, 1H), 3,35 (ш.д. J=15,4 Гц, 1H), 2,55 (м, 1H), 2,49 (с, 3H), 2,28 (м, 14H, вкл. синглеты при 2,27, 1,95, 1,83, 3H, каждый), 1,1 (с, 3H), 1,07 (с, 3H),
МСВР, выч. для C31H39O9S2 (MH+): 619, 2036, найдено: 619, 2017.
Пример 10
7-Дезокси-10-дезацетилоксибаккатин III
(IIb)
Ксантат XIII
(36 мг, 0,058 ммоля) кипятят в бензоле (1 мл) в присутствии АИБН (2 мг) и гидрида трибутилолова (0,079 мл, 0,29 ммоля) в атмосфере аргона 2 ч. Концентрированием
реакционной смеси и вытеснительной
хроматографией остатка на силикагеле с элюированием (40%) этилацетата в гексане и последующей ЖХВД (жидкостная хроматография высокого давления) с отделением других
компонентов получают в виде пены 16,
8 мг (56%) соединения IIb.
1H-ЯМР (CDCl3) δ: 8,1 (д, J=7,3 Гц, 2H), 7,56 (м, 1H), 7,45 (м, 2H) 5,62 (д, J= 7,2 Гц, 1H), 4,94 (ш.д, 1H), 4,79 (ш.с. 1H), 4,29 (д, J=8 Гц, 1H), 4,18 (д, J=8 Гц, 1H), 4,09 (д, J=7,2 Гц, 1H), 3,83 (д, J=16,2 Гц, 1H), 3,34 (ш. д. J=16,2 Гц, 1H), 2,35-1,4 (м, 17H, вкл, синглеты при 2,27, 1,9, 1,67, 3H каждый), 1,06 (с, 3H), 1,02 (с, 3H), MCBP, выч. для C29H37O8 (МН+): 513, 2488, найдено: 513, 2502.
Альтернативная методика.
В 2 мл сухого ТГФ растворяют соединение XXIII (160 мг, 0,256 ммоля) и к полученному раствору добавляют при комн. т-ре тетрабутиламмонийфторид (766 ул. IM, 0,766 ммоля). Реакционную смесь перемешивают 1 ч при комн. т-ре. Растворитель удаляют и хроматографией остатка на силикагеле с элюированием 50-70% этилацетата в гексане получают 115 мг (87,9%) целевого заглавного соединения.
Пример 11
(3R,
4S)-4-Фенил-3-триэтилсилокси-2-азетидинон (XXII)
Гидрохлорид метилового эфира (L)-треонина (1,26 г, 7,44 ммоля) в безводном дихлорметане (15 мл) перемешивают
16 ч при комн. т-ре в присутствии
имидазола (1,01 г, 14,89 ммоля) и третбутоксидифенилсилилхлорида (2,274 г, 7,816 ммоля), реакционную смесь распределяют между водой и дихлорметаном. Органическую
фазу промывают 5%-ным водным раствором
бикарбоната натрия и водой, сушат и концентрированием получают 2,88 г сырого масла, которое используют непосредственно на следующей стадии.1H-ЯМР
(CDCl3) δ: 7,7-7,25 (м,
10H), 4,44 (м, 1H), 3,62 (с, 3H), 3,31 (д, J=3 Гц, 1H), 2,12 (ш.с., 2H), 1,3-1,15 (м, 12H).
Полученное масло (548 мг, 1,414 ммоля) в безводном дихлорметане (10 мл) обрабатывают примерно сутки при комн. т-ре бензальдегидом (0,158 мл, 1,55 ммоля) в присутствии молекулярных сит 4oA с получением in situ соединения XV. Содержащий соединение XV раствор охлаждают до -40oC, добавляют триэтиламин (0,2 мл, 1,698 ммоля) с последующим прибавлением в течение 10 мин ацетоксиацетилхлорида (XIV) (0,182 мл, 1,698 ммоля). Смесь оставляют на 4 ч нагреваться до комн. т-ры и продукт распределяют между дихлорметаном и водой. Органическую фазу еще раз промывают водой и рассолом, сушат и концентрируют. Хроматографией на силикагеле с элюированием смесью EtoAc-гексан (1: 4) получают 411 мг соединения XVI в виде смеси (≈ 10:1) 3R, 4S : 3S, 4R диастереомеров.
Полученную смесь диастереомеров (245,1 мг, 0,414 ммоля) в сухом ТГФ (2 мл) обрабатывают уксусной кислотой (0,15 мл) и тетрабутиламмонийфторидом (ТБАФ, IM в ТГФ, 1,2 мл). Раствор перемешивают 14 ч при комн. т-ре, затем распределяют между этилацетатом и 5%-ным водным раствором бикарбоната натрия. Органическую фазу сушат и концентрируют. Вытеснительной хроматографией на силикагеле с элюированием смесью этилацетат-гексан (1:1) получают в виде пены 66 мг (50%) соединения XVII (один диастереомер).
1H-ЯМР (CDCl3) δ: 7,42-7,25 (м, 5H), 5,9 (д, J=4,8 Гц, 1H), 5, 09 (д, J= 4,8 Гц, 1H), 4,28 (м, 1H), 4,01 (д, J=4,8 Гц, 1H), 3,7 (с, 3H), 1,73 (с, 3H), 1,19 (д, J=6,6 Гц, 3H).
Соединение формулы XVII (9,8 г, 0,0305 ммоля) в 100 мл сухого дихлорметана обрабатывают при -78oC триэтиламином (9,4 мл, 0,0671 ммоля) и метансульфонилхлоридом (MSCl, 3,5 мл, 0,0457 ммоля).
Раствор оставляют на ночь нагреваться до комн. т-ры. Реакционную смесь распределяют между водой и дихлорметаном. Органический слой промывают 5%-ным водным раствором бикарбоната натрия, разбавленной водной HCl, водой и рассолом и концентрированием получают в виде маслянистого остатка соединение XVIII. Сырой остаток (10 г) растворяют в дихлорметане (250 мл) и через раствор при -78oC пропускают озон до момента приобретения раствором голубой окраски. Добавлением метилсульфидом (11 мл) и концентрированием реакционной смеси получают соединение формулы XIX (сырой).
Соединение формулы XIX растворяют в ТГФ (150 мл) и обрабатывают при -78oC гидразингидратом (10 мл). Спустя 2 ч смесь переносят в разбавленную водную HCl и этилацетат и обе фазы разделяют. Органическую фазу промывают еще раз кислотой, водой и рассолом и концентрированием получают сырой продукт, который очищают хроматографией на силикагеле с элюированием 1-5% метанола в хлористом метилене и получают 4,4 г (71%) соединения формулы XX.
1H-ЯМР (CDCl3 ) δ: 7,38-7,24 (м, 5H), 6,31 (ш.с. 1H), 5,87 (ш.с, 1H), 5,04 (д, J=4,8 Гц, 1H), 1,67 (с, 3H).
К охлажденной (5oC) смеси 1 M водного KOH (140 мл) и ацетонитрила (100 мл) прибавляют по каплям раствор соединения XX (2,39 г, 11,32 ммоля) в ацетонитриле (130 мл). Смесь перемешивают 1 ч при 0oC, разбавляют этилацетатом (300 мл), водой (50 мл) и насыщенным водным бикарбонатом (50 мл). Органическую фазу отделяют и водный слой дополнительно экстрагируют этилацетатом (3 х 200 мл). Органические фазы объединяют, сушат, фильтруют и концентрированием получают соединение формулы XXI (сырое), перекристаллизацией которого из смеси гексана с ацетоном получают вещество с т.пл. 184-6o, выход 1,53 г (82%).
К азетидинону XXI (580 мг, 3, 55 ммоля) в сухом ТГФ (5 мл) добавляют имидазол (265,5 мг, 3,9 ммоля) и затем триэтилсилилхлорид (ТЭСХЛ, 0,654 мл, 3,9 ммоля). Смесь перемешивают 1 ч. Этилацетат добавляют и органический слой промывают рассолом, 10%-ной водной HCl и сушат. Хроматографией на силикагеле с элюированием 25% этилацетата в гексане получают в виде пены 670 мг (68%) соединения XXII.
Пример 12
(3R, 4S)-трет-Бутоксикарбонил-4-фенил-3-триэтилсилилокси- 2-азетидинон (VIa)

К перемешиваемому раствору (3R, 4S)-4-фенил-3-триэтилсилилокси- 2-азетидинона (XXII) (2,2 г, 7,92 ммоля) в сухом ТГФ (25 мл) при 0oC в атмосфере аргона добавляют N, N-диизопропилэтиламин (1, 65 мл, 9,51 ммоля, 1,2 экв). Раствор перемешивают 5 мин, после чего добавляют ди-третдибутилкарбонат (2,08 г, 9,51 ммоля, 1, 2 экв) и 4-диметиламинопиридин (193,6 мг, 1,581 ммоля, 0,2 экв). Реакционную смесь перемешивают 60 мин при 0oC и затем раствор разбавляют добавлением этилацетата (25 мл). Полученный раствор промывают рассолом, 10% NaHCO, 10%-ным раствором HCl, сушат над MgSO4 и концентрированием получают сырой продукт (масло). Дополнительной очисткой продукта вытеснительной хроматографией на силикагеле с элюированием 15% этилацетата в гексане в виде белого твердого вещества 2,4 г (83%) заглавного β-лактама.1H-ЯМР (CDCl3) δ: 7,28 (м, 5H), 5,03 (м, 2H), 1,39 (с, 9H), 0,76 (т, J=7,6 Гц, 9H), 0,43 (м, 6H).
Пример
13
(3R, 4S)-1-Бензоил-4-фенил-3-триэтилсилилокси-2-азетидинон (IVb)

К перемешиваемому раствору (3R, 4S)-4-фенил-3-триэтилсилилокси- 2-азетидинона (XXII) (1 г, 3,601 ммоля) в сухом CH2Cl2 при 0oC в атмосфере аргона добавляют N, N-диизопропилэтиламин (0,689 мл, 3,961 ммоля, 1,1 экв) и раствор перемешивают 5 мин, после чего добавляют бензоилхлорид (0,459 мл, 3,961 ммоля, 1,1 экв) и 4-диметиламинопиридин (96,5 мг, 0,79 ммоля, 0, 2 экв). Реакционную смесь перемешивают 1 ч при комн. т-ре и затем разбавляют этилацетатом (25 мл). Полученный раствор промывают рассолом, 10% NaHCO3, 10%-ным раствором HCl, сушат над MgSO4 и испарением получают в виде масла продукт. Дополнительной очисткой продукта вытеснительной хроматографией на силикагеле с элюированием 15% этилацетата в гексане получают в виде масла 1,04 г (80%) заглавного β-лактама.1H-ЯМР (CDCl3) δ: 8, 07-8 (м, 2H), 7,59-7,45 (м, 3H), 7,37-7,31 (м, 5H), 5,41 (д, J=6,1 Гц, 1H), 0,83-0,77 (м, 9H) 0,54-0,42 (м, 6H).
Пример 14
N-Дебензоил-N-трет-бутоксикарбонил-2'-O-триэтилсилил-7- дезокситаксол (IIIa)

В трехгорлую колбу в атмосфере аргона вносят 7-дезоксибаккатин III (IIaa) (24 мг, 0,042 ммоля). Колбу эвакуируют и трижды продувают аргоном. Шприцем вводят ТГФ (1 мл) и полученный прозрачный раствор охлаждают до -40oC (баня ацетонитрил-сухой лед). К перемещаемому раствору добавляют н-бутиллитий (1,6 М раствор в гексане, 32,5 мл, 0,052 ммоля) с последующим прибавлением в течение 2 мин азетидинона IVa (31,7 мг, 0,084 ммоля) в ТГФ (0,5 мл). Реакционную смесь сразу же нагревают до 0oC, перемешивают 40 мин и нейтрализуют насыщенным раствором NH4Cl (3 мл). Водный раствор экстрагируют этилацетатом, органическую фазу сушат (безводный сульфат магния) и испарением в вакууме получают масло. Вытеснительной хроматографией сырого продукта на силикагеле с элюированием 25% этилацетата в гексане получают 19,5 мг (52%) заглавного соединения IIIa.1H-ЯМР (CDCl3) δ: 8,11 (д, J=8,2 Гц, 2H), 7,62-7, 28 (м, 8H), 6,45 (с, 1H), 6,28 (ш.т. J=8,9 Гц, 1H), 5,66 (д, J=8,4 Гц, 1H), 5,45 (ш.д. 1H), 5,25 (ш.д. 1H), 4,95 (дд, J=8,2 Гц, J'=2,6 Гц, 1H) 4,53 (д, J= 2 Гц, 1H), 4,34 (д, J=8,5 Гц, 1H), 4,2 (д, J=8,5 Гц, 1H), 3,78 (д, J= 8,4 Гц, 1H), 2,52 (с, 3H), 2,47-2,25 (м, 2H), 2,22 (с, 3H), 2,19-1,4 (м, 11H), 1,34-1,2 (м, 12H), 1,14 (с, 3H), 0,62 (т, J=8,4 Гц, 9H), 0,22-0,48 (м, 6H).
Пример 15
N-Дебензоил-N-трет-бутоксикарбонил-7-дезокситаксол (Ia)

К перемешиваемому раствору соединения IIIa (13,5 мг, 0,0142 ммоля) при -5oC добавляют водную HCl (2,6 мл, 36% раствор) и реакционную смесь перемешивают 10 мин. Тонкослойной хроматографией установлено отсутствие к этому моменту исходного соединения. Реакцию прекращают и смесь разбавляют этилацетатом (2 мл). Объединенный раствор промывают рассолом 10%-ным водным раствором бикарбоната натрия, сушат (безводный сульфат магния) и концентрированием в вакууме получают сырой продукт. Очисткой вытеснительной хроматографией на силикагеле с элюированием 30% этилацетата в гексане получают 10,2 мг (86,4%) заглавного соединения Ia.
1H-ЯМР (CDCl3) δ:/ 8,11 (д, J=8,2 Гц, 2H), 7,66-7,23 (м, 8H) 6,47 (с, 1H), 6,2 (ш. т. J=8,3 Гц, 1H), 5,64 (д, J=8,4 Гц, 1H), 5, 39-5,17 (м, 2H), 4,92 (дд, J= 8,5 Гц, J'=2,5 Гц, 1H), 4,6 (м, 1H), 4,31 (д, J=8,4 Гц, 1H), 4,18 (д, J= 8,4 Гц, 1H), 3,76 (д, J=8,4 Гц, 1H), 3,27 (д, J=4,2 Гц, 1H), 2,45-1,92 (м, 11H), 1,87 (с, 3H), 1, 74 (с, 3H), 1,64-1,39 (м, 2H), 1,31 (с, 9H), 1,24 (с, 3H), 1,15 (с, 3H), MCBP, выч. для C45H56NO14 (МН+): 834, 3701, найдено: 834, 3691.
Пример 16
2'-O-Триэтилсилил-7-дезокситаксол (IIIb)

В двухгорлую колбу в атмосфере аргона загружают 7-дезоксибаккатин III (IIaa) (62 мг, 0,108 ммоля). Колбу эвакуируют и трижды продувают аргоном. Шприцем добавляют ТГФ (1 мл) и полученный прозрачный раствор охлаждают до -40oC (баня с сухим льдом -ацетонитрилом). К перемешиваемому раствору добавляют н-бутиллитий (1,43 М раствор в гексане, 91 мл, 0,173 ммоля) и затем азетидинон IVb (66,3 мг, 0,174 ммоля) в ТГФ (0,5 мл). Раствор сразу же нагревают до 0oC и перемешивают 45 мин, после чего нейтрализуют насыщенным раствором NH4Cl (3 мл). Водный раствор экстрагируют этилацетатом, органическую фазу сушат (безводный сульфат магния) и концентрированием в вакууме получают масло. Вытеснительной хроматографией сырого масла на силикагеле с элюированием 25% этилацетата в гексане получают в виде пены 63 мг (61%) заглавного соединения (IIIb).
1H-ЯМР (CDCl3) δ: 8,14 (д, J= 7,6 Гц, 2H), 7,73 (д, J=7,6 Гц, 2H), 7,64-7,29 (м, 11H), 7,12 (д, J=8,8 Гц, 1H), 6, 46 (с, 1H), 6,25 (т, J=8,8 Гц, 1H), 5,73-5,67 (м, 2H), 4,95 (дд, J=8,2 Гц, J'=2,6 Гц, 1H), 4,68 (д, J=2, Гц, 1H), 4,33 (д, J=8,4 Гц, 1H), 4,26 (д, J=8,4 Гц, 1H), 3,78 (д, J=7,3 Гц, 1H), 2,56 (с, 3H), 2,5-2,25 (м, 1H), 2,22 (с, 3H), 2,18-2,06 (м, 2H), 1,91 (с, 3H), 1,86-1,71 (м, 6H), 1,58 (дд, J=13,2 Гц, J'=7,5 Гц, 1H) 1,23, 1,14 (с, 3H), 0,87-0,76 (м, 9H), 0,58-0,35 (м, 6H).
Пример 17
7-Дезокситаксол (Ib)

К перемешиваемому раствору соединения IIIb (60 мг, 0, 063 ммоля) в ацетонитриле (1 мл) при - 5oC прибавляют водную HCl (15,8 мл, 36%-ный раствор) и реакционную смесь перемешивают 15 мин. Тонкослойный хроматографией установлено отсутствие к этому моменту исходного продукта. Реакцию прекращают и смесь разбавляют этилацетатом (2 мл). Объединенный раствор промывают рассолом и 10%-ным водным раствором бикарбоната натрия, сушат (безводный сульфат магния) и концентрированием в вакууме получают сырой продукт. Очисткой вытеснительной хроматографией на силикагеле с элюированием 30% этилацетата в гексане получают в виде пены 45 мг (87%) заглавного соединения Ib.1H-ЯМР (CDCl3) δ: 8,15 (д, J =7,6 Гц, 2H), 7,7 (д, J=7,6 Гц, 2H), 7,63-7,3 (м, 11H), 7,02 (д, J=8,9 Гц, 1H), 6,42 (с, 1H), 6,21 (ш.т. J=8,8 Гц, 1H), 5,79 (дд, J=8,9 Гц, J'=2,7 Гц, 1H), 5,66 (д, J=7,3 Гц, 1H), 4,91 (дд, J= 9 Гц, J'=2,2 Гц, 1H), 4,77 (дд, J=5,2 Гц, J'=2,7 Гц, 1H), 4,31 (дд, J= 8,3 Гц, 1H), 4,23 (д, J=8,3 Гц, 1H), 3,76 (д, J=7, 3 Гц, 1H), 3,59 (д, J= 5,2 Гц, 1H), 2,35-2,05 (м, 10H), 2-1,83 (м, 2H), 1,8 (с, 3H), 1,77-1,7 (м, 3H), 1,55 (дд, J= 13 Гц, J'=7,5 Гц, 1H), 1,2 (с, 3H), 1,15 (с, 3H), MCBP, выч. для C47 H52NO13 (MH+): 838, 3439, найдено: 838, 3436.
Пример 18
N-Дебензоил-N-трет-бутоксикарбонил-2'-O-триэтилсилил-7-дезокси- 10-дезацетилокситаксол
(IIIc)

В двухгорлую колбу в атмосфере аргона загружают 7-дезокси-10- дезацетилоксибаккатин III (IIb) (39 мг, 0,076 ммоля). Колбу эвакуируют и трижды продувают аргоном. Шприцем добавляют ГТФ (1 мл) и полученный прозрачный раствор охлаждают до - 40oC (баня с ацетонитрилом - сухим льдом). К перемешиваемому раствору добавляют н-бутиллитий (0,061 мл, 0,083 ммоля, 1,35 M раствор в гексане) и затем в течение 2 мин добавляют азетидинон IVa (43 мг, 0,114 ммоля) в ТГФ (0,5 мл). Реакционную смесь сразу же нагревают до 0oC и перемешивают 45 мин, после чего нейтрализуют насыщенным раствором NH4Cl (3 мл). Водный раствор экстрагируют этилацетатом, органическую фазу сушат над безводным сульфатом магния и концентрированием в вакууме получают масло. Вытеснительной хроматографией сырого продукта на силикагеле с элюированием 25% этилацетата в гексане получают 37 мг (55,3% заглавного соединения (IIIc)
1H-ЯМР(CDCl3) δ: 8,19-8, 08 (м, 2H), 7,62-7,19 (м, 8H), 6,17 (ш.т. 1H), 5,7 (д, J=7,1 Гц, 1H), 5,49 (д, J=9,5 Гц, 1H), 5,27 (д, J=9, Гц, 1H), 5,49 (д, J= 9,5 Гц, 1H), 5,27 (д, J=9 Гц, 1H) 4,94 (дд, J=9 Гц, J'=2,1 Гц, 1H), 4, 51 (д, J=1,6 Гц, 1H), 4,32 (д, J=8,4 Гц, 1H), 4,23 (д, J=8,4 Гц, 1H), 3,98 (д, J=7,1 Гц, 1H), 3,84 (д, J=16,5 Гц, 1H), 3,35 (д, J=16,5 Гц, 1H), 2,54-1,08 (м, 31H, вкл. синглеты при 2,53, 3H, 1,75, 3H, 1,71, 3H, 1,62 3H, 1,35, 9H, 1,19 3H, 1,12, 3H), 0,86-0,65 (м, 9H), 0,48-0,26 (м, 6H).
Пример 19
N-Дебензоил-N-трет-бутоксикарбонил-7-дезокси-10- дезацетилокситаксол (Ic)

К перемешиваемому раствору соединения IIIc (30 мг, 0,033 моля) в ацетонитриле (1 мл) добавляют при - 5oC водную HCl (0,0063 мл, 36%-ный раствор) и реакционную смесь перемешивают 10 мин. ТСХ обнаружено отсутствие в этот момент исходного соединения. Реакцию прекращают и смесь разбавляют этилацетатом (2 мл). Объединенный раствор промывают рассолом и 10%-ным водным раствором бикарбоната натрия, сушат над безводным сульфатом магния и после концентрирования в вакууме получают сырой продукт. Очисткой вытеснительной хроматографией с элюированием 30% этилацетата в гексане получают 20 мг (77%) заглавного соединения.1H-ЯМР (CDCl3) δ:/ 8,14-8,11 (м, 2H), 7,63-7,3 (м, 8H), 6,13 (ш. т. 1H), 5,67 (д, J=7,1 Гц, 1H), 5,42 (д, J=9,5 Гц, 1H), 5,26 (д, J= 8,9 Гц, 1H), 4,94 (дд, J=8,9 Гц, J'=2,1 Гц, 1H), 4,6 (ш.т. J=1,6 Гц, 1H), 4,31 (д, J=8,3 Гц, 1H), 4,21 (д, J=8,3 Гц), 3,96 (д, J=7 Гц, 1H), 3,83 (д, J=16,5 Гц, 1H), 3,38-3, 32 (м, 2H), 2,37-1,08 (м, 31H, вкл. синглеты при 2,37, 3H, 1,72, 3H, 1,71 3H, 1,67, 3H, 1,33, 9H, 1,19 3H, 1,12, 3H).
Пример 20
2'-O-Триэтилсилил-7-дезокси-10-дезацетилокситаксол (IIId)

В двухгорлую колбу в атмосфере аргона загружают 7-дезокси-10- дезацетилбаккатин III (IIb) (45 мг, 0,098 моля). Колбу эвакуируют и трижды продувают аргоном. Шприцем вносят ТГФ (1 мл) и полученный прозрачный раствор охлаждают до - 40oC (баня с аценитрилом - сухим льдом). К перемешиваемому раствору добавляют н-бутиллитий (0,066 мл, 0,1 ммоля, 1,52 M раствор в гексане) и затем азетидинон IVb (59,6 мг, 0,16 ммоля) в ТГФ (0,5 мл). Раствор сразу же нагревают до 0oC и перемешивают 45 мин. ТСХ обнаружены к этому моменту только следовые количества исходного соединения. Добавлено дополнительное количество н-BuLi (0,066 мл, 0,1 ммоля, 1,52 M раствора в гексане). Смесь перемешивают еще 60 мин и нейтрализуют насыщенным раствором NH4Cl (3 мл). Водный раствор экстрагируют этилацетатом, органическую фазу сушат над безводным сульфатом магния и концентрированием в вакууме получают масло. Вытеснительной хроматографией сырого масла на силикагеле с элюированием 30% этилацетата в гексане получают 18 мг (23%) заглавного соединения (IIId) в смеси с исходным соединением (IIb) (выделено 25 мг). Выход в пересчете на выделенное исходное соединение 51%.1H-ЯМР (CDCl3) δ: 8,15-8,12 (м, 2H), 7,73 (д, J=7,2 Гц, 2H), 7,27-7,24 (м, 6H), 7,13 (д, J=8,7 Гц, 1H), 6,16 (ш. т. J=8 Гц, 1H), 5,69-5,65 (м, 2H), 4,95 (дд, J=7 Гц, J'=2 Гц, 1H), 4,66 (ш. д. J=2 Гц, 1H), 4, 34 (д, J=8,6 Гц, 1H), 4,26 (д, J=8,6 Гц, 1H), 3,97 (д, J= 7,1 Гц, 1H), 3,83 (д, J=16,5 Гц, 1H), 3,34 (д, J=7,1 Гц, 1H), 3,83 (д, J= 16,5 Гц, 1H), 3,34 (д, J=16,5 Гц, 1H), 2,53-1,04 (м, 27 H, вкл. синглеты при 2,52, 3H, 1,76, 3H, 1,71, 6H, 1,14, 3H, 1, 3H), 0,85-0,78 (м, 9H), 0,52-0,37 (м, 6H).
Пример 21
7-Дезокси-10-дезацетилокситаксол (Id)

К перемешиваемому раствору соединения IIId (18,5 мг, 0, 02 ммоля) в ацетонитриле (I) при - 5oC добавляют водную HCl (0,004 мл, 36%-ный раствор) и реакционную смесь перемешивают 10 мин. ТСХ обнаружено отсутствие к этому моменту исходного соединения. Реакцию прекращают и смесь разбавляют этилацетатом (2 мл). Объединенный раствор промывают рассолом и 10%-ным водным раствором бикарбоната натрия, сушат над безводным сульфатом магния и после концентрирования в вакууме получают сырой продукт. Очисткой вытеснительной хроматографией на силикагеле с элюированием 50% этилацетата в гексане получают 7,5 мг (47%) соединения Id.1 H-ЯМР (CDCl3) δ: 8,16-8,13 (м, 2H), 7,75-7,72 (м, 2H), 7,61-7,26 (м, 6H), 7,05 (д, J=8,9 Гц, 1H), 6,11 ш.т. J=8 Гц, 1H), 5,78 (дд, J=8,9 Гц, J'=2,5 Гц, 1H), 5,67 (д, J=7,2 Гц, 1H), 4,92 (дд, J=9 Гц, J'=2,5 Гц, 1H), 4,76 (ш.с. 1H), 4,3 (д, J=8,3 Гц, 1H) 4,24 (д, J=8,3 Гц, 1H) 3,94 (д, J=7 Гц, 1H) 3,8 (д, J=16,5 Гц, 1H) 3,58 (д, J=4,7 Гц, 1H). 3,35 (д, J= 16,5 Гц, 1H), 2,43-1,07 (м, 27H, вкл. синглеты при 2,37, 3H, 1,71, 3H, 1,68, 3H, 1,65, 3H, 1,15, 3H, 1,15, 3H).
Пример 22
7-Дезокси-10-дезацетилокси-13-триэтилоксилилоксибаккатин III (XXIII)

В 10,5 мл сухого толуола растворяют соединение VIIa (416,3 мг, 0,527 ммоля), к полученному раствору добавляют каталитическое количество АИБН и раствор дегазируют 5 мин сухим N2. Добавляют гидрид трибутилолова (708,7 ул, 2,63 ммоля) и реакционную смесь нагревают 2 ч при 100oC. Затем добавляют еще одну порцию гидрида трибутилолова (425,3 ул, 1,581 ммоля) и реакционную смесь нагревают 5,5 ч при 100oC. За это время реакция завершается. Реакционную смесь охлаждают до комн. т-ры и хроматографией на силикагеле с элюированием 20% этилацетата в гексане получают 320 мг (97%) заглавного соединения.
Пример 23
Получение гидробензамида.
PhCH(-N=CHPh)
В 3-горлую колбу на
3 л, снабженную механической мешалкой и термометром, загружают 1 л концентрированной NH4OH (примерно 30%) (14,8 ммолей). Одной порцией добавляют
раствор бензальдегида (265 г, 2,5 ммоля) в
500 мл 2-пропанола. Смесь интенсивно перемешивают 43 часа примерно при 22oC. Образовавшуюся взвесь фильтруют и фильтровальный пирог промывают
водой (1 л). После высушивания в вакууме
получают 242 г (97%) гидробензамида в виде белого вещества с т.пл. 100-102oC.
Вышеприведенная методика может быть использована для
получения бисиминов общей формулы RgCH (-N = CHRg), например:
гидрофурамида (Rg - 2-фурил),
гидротиенамида (Rg - 2-тиенил).
Пример 24
(+)-цис-3-Ацетилокси-1- / (фенил)-(бензилиденимино) метил/-4-фенилазетидин-2-он (XXIXa)

В 3-горлую круглодонную колбу на 1 л, снабженную термометром, магнитной мешалкой и капельной воронкой, загружают гидробензамид (30 г, 100,5 ммоля) и этилацетат (150 мл). Реакционную смесь при перемешивании и в атмосфере аргона охлаждают до 5oC и добавляют триэтиламин (16,8 мл, 121 ммоль). Затем по каплям в течение 90 мин прибавляют раствор ацетоксиацетилхлорида (12,4 мл, 116 ммолей) в этилацетате (300 мл). Спустя 16 ч при той же температуре реакционную смесь оставляют нагреваться до 20oC (1,5 ч) и переносят в делительную воронку. Органический слой последовательно промывают водным NH4Cl (насыщ. ) (150 мл, 100 мл), водным NaHCO3 (насыщенным) (120 мл) и рассолом (120 мл). Для характеристики заглавное соединение на этой стадии может быть выделено высушиванием органической фазы над MgSO4, фильтрованием и удалением растворителя в вакууме. В результате с количественным выходом получают заглавное соединение в виде красного стеклообразного вещества.
Частота согласно ЖХВД (площадь пика) - 87,9% (смесь диастереомеров 1:1).1H-ЯМР (CDCl3, 200 МГц) δ: 8,45 (с, 1H, N=CH), 7,8-7,85 (м, 1H, Ph), 7,6-7,65 (м, 1H, Ph), 7,26-7,5 (м, 9H, Ph) 7-7,1 (м, 4H, Ph), 6,28 (с, 0,5H, NCHN) 6,23 (с, 0,5H, NCHN) 5,81 (д, J=4,8 Гц, 0,5H, H-3), 5, 76 (д, J=4,8 Гц, 0,5H, H-3), 5,3 (д, J=4, 8 Гц, 0,5H, H-4), 4,75 (д, J=4,8 Гц, 0,5H, H-4), 1,63 (с, 3H, CH CO). ИК (KBr) γ: 1763, (C=O), 1641 (C=11), см-1. УФ (метанол) γmax(нм) (нм): 216, 252.
Пример 25
(±)-цис-3-Ацетилокси-4-фенилазетидин-2-он (XXXa)

Раствор соединения примера 24, приведенного выше, в этилацетате (500 мл) осторожно в токе аргона переносят в колбу Парра на 2 л, содержащую 10% палладия на активированном угле (6 г). Полученную смесь 20 ч обрабатывают водородом (4 атм), после чего катализатор удаляют фильтрованием через слой Целита. Фильтровальный пирог переводят во взвесь в этилацетате (200 мл), перемешивают 10 мин и фильтруют. Фильтровальный пирог ополаскивают этилацетатом (100 мл) и фильтраты объединяют. Органический слой промывают 10% HCl (300 мл) и оба слоя фильтруют через воронку из плавленного стекла с выделением белого осадка (дибензиламин HCl), который ополаскивают этилацетатом (100 мл). Фазы разделяют и органический слой промывают еще одной порцией 10% HCl (200 мл). Объединенные промывные растворы 10% HCl экстрагируют этилацетатом и объединенные органические слои промывают насыщенным водным NaHCO3 (300 мл) и рассолом (250 мл). Органический слой сушат над MgCO4, фильтруют и концентрируют в вакууме до конечного объема в 75 мл. Полученный продукт охлаждают до 4oC и образовавшийся осадок отфильтровывают. Фильтровальный пирог промывают гексаном (200 мл) с получением 16,12 г (78,1% общий выход из гидробензамида) заглавного соединения в виде белых игл.
Т. пл. 150-151oC, чистота по данным ЖХВД (площадь пика) - 99,8%.1 H-ЯМР (CDCl3, 200 МГц) δ: 7,3-7,38 (м, 5H, Ph), 6,54 (ш.с. обмениваемый, 1H, NH), 5,87 (дд, J= 2,7 и 4,7 Гц, 1H, H-3), 5,04 (д, J=4,7 Гц, 1H, H-4), 1,67 (с, 3H, CH3CO), ИК(KBr) ν/ (см-1): 3210 (N-H), 1755, 1720 (C=O) КГ: 0,17%.
Анализ для C11H11NO3:
Вычислено, %: C 64,38, H 5,40 N 6,83
Найдено, %: C 64,07, H 5,34 N 6,77
Пример 26.
(±
)-цис-3-Ацетилокси-1- /(2-фурил)(2-фурилметиленимино)-метил/-4-(2-фурил)азетидин-2-он (XXIXo)

Заглавное соединение получено по методике примера 24, но с использованием гидрофурамида вместо гидробензаамида и реакция проведена в масштабе 18,6 ммоля (против 100 ммолей) Так из гидрофурамида (5 г, 18,6 ммоля), триэтиламина (3,11 мл, 22,3 ммоля), ацетоксиацетилхлорида (2,3 мл, 21,4 ммоля) получено 6,192 г, (90,4%) заглавного соединения в виде бледно-красного сиропа. Получен в виде смеси диастереомеров (1:1).1H-ЯМР (CDCl3, 200 МГц) δ: 8,211 (с, 0,5H, N=CH), 8,208 (с, 0,5H, H=CH), 7,14-7,59 (м, 3H, фурил), 6,9 (д, J= 3,5 Гц, 0,5H, фурил), 6,83 (д, J=3,5 Гц, 0,5H, фурил), 6,1-6,53 (м, 6H, фурил, NCHN), 5,9 (д, J=4,9 Гц, 0,5 H, H-3), 5,86 (д, J=4,8 Гц, 0,5H, H-3), 5,35 (д, J=4,8 Гц, 0,5H, H-4), 4,9 (д, J=4,9 Гц,) 0,5H, H-4), 1,91 (с, 1,5H, CH CO), 1, 88 (с, 1,5H, CH3CO). ИК (пленка) ν (см-1) : 1778, 1753 (C= O), 1642 (C=II). УФ (метанол) γmax (нм) : 229, 278.
Пример 27.
(+)-цис-3-(Ацетилокси)-4-(2-фурил)азетидин-2-он (XXXb)

Заглавное соединение получено по методике примера 25 за тем исключением, продукт выделен препаративной ТСХ и реакция проведена в масштабе 2,7 ммоля в пересчете на исходное количество гидрофурамида. Так, сырой продукт примера 26 (1 г) растворяют в этилацетате (50 мл) и добавляют к 10% палладия на активированном угле (150 мг). Очисткой сырого продукта препаративной ТСХ (2 мм силикагеля), элюирование смесью этилацетат-гексан 1:1) получают 386 мг (скорректированный выход из гидрояурамида 65, 8%) заглавного соединения в виде желтого вещества, перекристаллизованного из смеси ацетона с гексаном.
Т. пл. 118-119oC, чистота по данным ЖХВД (площадь пика) - 99,4%.1H-ЯМР (CDCl3), 200 МГц) δ:
7,44 (т, J=1,3 Гц, 2H, фурил), 6,39 (д, J=1,3 Гц, 1H,
фурил) 6,21 (ш. с, обмениваемый, 1H, NH), 5,88 (дд, J=2,2 Гц, 4,6 Гц, 1H, H-3), 5,05 (д, J=4,6 Гц, 1H, H-4), 1,92 (с, 3H, CH3CO). ИК
(KBr) ν (см-1): 3203 (N-H), 1756,
1726 (C=0)
УФ (метанол) γmax (нм): 222.
Пример 28.
(+)-цис-3-(Ацетилокси)-1-/(2-тиенил)(2-тиенил)метиленимино)
метил/-4-(2-тиенил)азетидин-2-он (XXIXc)

Заглавное соединение получено по методике примера 24, но с использованием гидротиенамида вместо гидробензамида. Так, из гидротиенамида (30 г, 94,7 ммоля), триэтиламина (15,84 мл, 114 ммолей) и ацетоксиацетилхлорида (11,6 мл, 108 ммолей) получено заглавное соединение в виде вязкого масла. Полученный продукт представляет собой смесь диастереомеров.1H-ЯМР (CDCl3), δ: 8,52 (с, 1H), 8,502 (с, 1H), 7,51 (д, J=4,9 Гц, 1H), 7,45 (д, J=4,4 Гц, 1H), 7,41 (д, J= 3,1 Гц, 1H), 7,37 (д, 1H), 7,3 (м, 3H), 6,89 (м, 1H), 6,81-6,74 (м, 4H), 6,48 (c, 1H), 6,43 (c, 1H), 5,85 (м, 2H), 5,59 (д, J=4,8 Гц, 1H), 5,17 (д, J=4,8 Гц, 1H), 1,87 (с, 3H), 1,86 (с, 3H).
Пример 29.
(+)-цис-3-(Ацетилокси)-4-(2-тиенил)азетидин-2-он (XXXc)

К перемешиваемому раствору соединения XXIXc (0,431 г, 1,03 ммоля) в дихлорметане (2,93 мл) одной порцией при 25oC добавляют 70%-ный водный раствор уксусной кислоты (0,35 мл ледяной уксусной кислоты и 0,15 мл воды) и реакционную смесь кипятят с перемешиванием 2,5 ч. Затем реакционную смесь разбавляют 50 мл дихлорметана и промывают двумя порциями по 75 мл насыщенного водного раствора бикарбоната натрия и затем порцией по 50 мл рассола. Органический экстракт концентрируют в вакууме до коричневого масла, которое растворяют в минимальном количестве дихлорметана и помещают в колонку с силикагелем размером 4 х 0,5 дюйма. Элюированием градиентом 10-60% EtOAc в гексане получают сначала менее полярные побочные продукты и затем заглавное соединение (выход 0,154 г, 75%) в виде белого твердого вещества.1H-ЯМР (CDCl3) δ: 7,32 (дд, J=4,7 и 1,5 Гц, 1H), 7,03 (м, 2H) 6,75 (ш.с. 1H), 5,86 (дд, J= 4,6 и 2,7 Гц, 1H), 5,27 (д, J=5,3 Гц, 1H), 1,83 (с, 3H),13C-ЯМР (CDCl3) δ: 169,3, 165,5, 138,4, 127,1, 127,07, 126,2, 78,3, 54, 20.
Пример 30.
(+)-цис-3-Триэтилсилилокси-4-(2-фурил)-азетидин-2-он (XXXIc)

Ацетоксилактам XXXo (3,78 г, 19, 4 ммоля) в 60 мл метанола перемешивают с K2CO3 (20 мг, 0,14 ммоля) 90 мин, нейтрализуют Дауэксом 50W-X8 и фильтруют. Фильтрат концентрируют, остаток растворяют в 80 мл безводного ТГФ и перемешивают 30 мин при 0oC с имидазолом (1,44 г, 21,2 ммоля) и ТЭСХЛ (3,4 мл, 20,2 ммоля). Раствор разбавляют этилацетатом, промывают рассолом, сушат над MgSO4 и концентрируют. Остаток хроматографируют на силикагеле с элюированием смесью гексан-этилацетат (3: 1) и получают в виде бесцветного масла 4,47 г (86%) заглавного соединения. ИК(пленка): 3276 (широкая), 1768, 1184, 732 см-1.1H-ЯМР (CDCl3, 300 МГц) δ: 7,38 (с, 1H), 6,39 (ш.с. 1H), 6,35 (с, 2H), 5,05 (дд, J= 4,6 и 2,3 Гц, 1H), 4,78 (д, J=4,6 Гц, 1H), 0,82 (т, J=8,5 Гц, 6H) 0,5 (дк, J=8,5 и 1,8 Гц, 9H),13C-ЯМР (CDCl3 75,5 Гц) δ: 169,6, 150,4, 142,6, 110,5, 109,1, 79,6, 53,2, 6,4, 4,4. МСВР (ДХИ) M + H выч. для C13H21NO3Si: 268, найдено: 268.
Пример 31.
(+)-цис-3-Триэтилсилилокси-4-(2-фурил)-N-трет-бутокси- карбонилазетидин-2-он (XXXIIa)

Азетидинон XXXIa (2,05 г, 7,7 ммоля) в 30 мл дихлорметана перемешивают при 0oC с диизопропилэтиламином (1,5 мл, 8,6 ммоля) и ди-трет-бутилдикарбонатом (2 г, 9,2 ммоля), а также каталитическим количеством диметиламинопиридина (ДМАП). Раствор разбавляют дихлорметаном, промывают рассолом, сушат над MgSO4 и концентрируют. Хроматографированием остатка на силикагеле с элюированием смесью гексан- этилацетат (8:1) получают в виде воскообразного вещества 2 г (70%) заглавного соединения. ИК (KBr): 1822, 1806, 1712, 1370, 1348, 1016, см-1.1H-ЯМР (CDCl3, 300 МГц) δ: 7,38 (м, 1H), 6,34 (м, 2H), 5,04 (ABк, J=12,4 Гц, 5,5 Гц, 2H), 1,39 (с, 9H), 0,82 (т, 9H), 0,5 (м, 6H).13C-ЯМР (CDCl3 75,5 Гц) δ:/ 165,7, 148, 147,7, 142,8, 110,5, 109,7, 83,4, 77,4 46, 27,8, 6,3, 4,4 MC (ДХИ) M + H, выч. для C18H29NO5Si: 368, найдено: 368.
Пример 32
(+)-цис-3-Триэтилсилилокси-4-(2-тиенил)азетидин-2-он (XXIb)

Раствор 3-ацетоксилактама XXXc (2, 5 г, 11,8 ммоля) в метаноле (10 мл) обрабатывают насыщенным водным раствором бикарбоната натрия (10 мл) и образовавшуюся взвесь перемешивают 3 ч при комнатной температуре. Реакционную смесь разбавляют этилацетатом (20 мл) и промывают водой (15 мл). Водную часть снова экстрагируют несколько раз этилацетатом, объединенную органическую фазу сушат над MgSO4 и концентрированием получают 1,7 г твердого желтого вещества. Сырой продукт растворяют в сухом тетрагидрофуране (20 мл), раствор охлаждают до 5oC в бане с ледяной водой и затем добавляют имидазол (752 мг, 1,1 экв).
После перемешивания 5 мин по каплям прибавляют триэтилхлорсилан (1,85 мл, 1,1 экв) образовавшуюся суспензию перемешивают 3 ч при той же температуре, после чего образовавшийся осадок отфильтровывают. Органическую часть промывают водой (2 х 20 мл), сушат над MgSO4 и концентрируют. Колоночной хроматографией сырого продукта на силикагеле с элюированием смесью гексан-этилацетат (7:3) получают 1,5 г (45%) целевого соединения в виде бесцветного вещества, с т. пл. 70-71oC.1H-ЯМР (CDCl3, 300 МГц), δ: 7,32-7,3 (м, 1H), 7, 05-6,98 (м, 2H), 5,06-5,05 (м, 2H), 0,82 (т, J=8 Гц, 9H), 0,55-0,46 (м, 6H),13C-ЯМР (CDCl3, 75,6 МГц) δ: 169,1, 139,7, 126,5, 126,4, 125,8, 79,4, 55,1, 4,4.
Альтернативная методика.
Ацетоксилактам XXXc (2 г, 9,37 ммоля) в 40 мл метанола перемешивают с K2CO3 (60 мг, 0,43 ммоля) 30 мин, раствор нейтрализуют Дауэксом 50W-X8 и фильтруют. Фильтрат концентрируют, остаток растворяют в 50 мл безводного ТГФ и перемешивают 30 мин при 0oC с имидазолом (0,85 г, 11,3 ммоля) и ТЭСХЛ (1,9 мл, 12,5 ммоля). Затем раствор (0,85 г, 11,3 ммоля) и ТЭСХЛ (1,9 мл, 12,5 ммоля). Затем раствор разбавляют этилацетатом, промывают рассолом, сушат над MgSO4 и концентрируют. Хроматографированием остатка на силикагеле с элюированием смесью гексан- этилацетат (3:1) получают в виде бесцветного масла 2,13 г (86%) заглавного соединения.
Пример 33
(+)-цис-3-Триэтилсилилокси-4-(2-тиенил)-11-трет- бутоксикарбонилазетидин-2-он (XXXIIb)

Раствор силилазетидинона XXXIb (425,7 г, 1,48 ммоля) и дихлорметана (10 мл) охлаждают до 5oC в бане с ледяной водой. Реакционную смесь обрабатывают каталитическим количеством ДМАП, затем диизопропилэтиламином (0,25 мл, 1 экв) и ди-трет-бутилдикарбонатом (388, 4 мг, 1,2 экв). После перемешивания 2 ч при той же температуре реакционную смесь нейтрализуют насыщенным водным раствором бикарбоната натрия (5 мл), органическую часть промывают водой, сушат над MgSO4, пропускают через короткий слой силикагеля и концентрированием получают в виде бесцветного масла 525,3 мг, (93%) целевого соединения.1H-ЯМР (CDCl3, 300 МГц) δ: 7,31 - 7,29 (м, 1H), 7,08 - 7,07 (м, 1H), 7 - 6,58 (м, 1H), 5,31 (д, J = 6 Гц, 1H), 5,03 (д, J = 6 Гц, 1H), 1,4 (с, 9H), 0,83 (т, J = 8 Гц, 9H), 0,56 - 0,47 (м, 6H),13C-ЯМР (CDCl3, 75,6 Гц) δ: 165,5, 147,5, 136, 4, 127,6, 126,2, 126,1, 83,3, 77,3, 57,9, 27,7, 6,2, 4,3.
Пример 34
По методикам, приведенным в примерах настоящей заявки, могут быть синтезированы характерные производные
таксола формулы I, представленные в табл. 1.
Пример 35.
Показательный пример селективной дериватизации C-10 положения - в 10- дезацетилбаккатине
10-Бензоил-10- дезацетил-7-триэтилсилилбаккатин (XXVIIa)

В 1 мл сухого тетрагидрофурана в атмосфере аргона растворяют соединение IX (43,5 мг, 0,066 ммоля), раствор охлаждают до -40oC и к нему медленно прибавляют н-BuLi (0,05 мл, 0,82 ммоля, 1,6 М раствор). После перемешивания 5 минут добавляют бензоилхлорид (0,03 мл, 0,26 ммоля) и реакционную смесь нагревают до 0oC. Реакционную смесь перемешивают 1,5 ч, после чего нейтрализуют насыщенным раствором хлористого аммония (2 мл). Водную среду экстрагируют этилацетатом (2 х 5 мл), сушат над сульфатом магния и испарением получают масло. Вытеснительной хроматографией на силикагеле с элюированием 50% этилацетата в гексане получают в виде пены 30 мг (60%) заглавного соединения.1H-ЯМР (CDCl3) δ: 8,17 - 8,05 (м, 4H), 7,64 - 7,42 (м, 6H), 6,67 (с, 1H), 5,67 (д, 1H), 4,95 (д, 1H), 4,81 (м, 1H), 4,56 (дд, 1H), 4,3 (д, 1H), 4,14 (д, 1H), 3,92 (д, 1H), 2,5 (м, 1H), 2,3 - 2 (м, 18H), 1,92 - 1,8 (м, 1H), 1,72 - 1,62 (ш.с. 4H), 1,3 (c, 3H), 1 (c, 3H), 0,89 (т, 3H), 0,56 (к, 6H), MCBP (ББА /NOBA), вычислено для C42H54O11Si: 762, 3435, найдено: 762, 3427.
По приведенной методике в объеме настоящего изобретения могут быть получены C-10 карбонаты, сульфонаты, карбаматы, простые эфиры и т.д. Выход повышается в случае использования гексаметилдисилазана лития.
Пример 36.
N-Дебензоил-N-трет-бутоксикарбонил-3'-(2-фурил)-7-дезокситаксол (1e)

К раствору гексаметилдисилазана лития (95 мкл, 0,45 ммоля) в 7 мл ТГФ добавляют при -55oC н-BuLi (168 мкл, 0,42 ммоля) и перемешивают 10 мин. Затем добавляют раствор 7-дезоксибаккатина III (II aa, 200 мг, 0,35 ммоля) в 3,4 мл ТГФ и еще через 10 мин при -55oC по каплям прибавляют лактам XXXIIa (562 мг, 1,53 ммоля) в 3,5 мл ТГФ. Через 15 мин холодную баню заменяют баней с температурой 0oC и перемешивание продолжают 30 мин. Раствор нейтрализуют насыщенным раствором NH4Cl, разбавляют этилацетатом и промывают рассолом. Органическую часть сушат над MgSO4 и концентрируют. Хроматографией остатка на силикагеле с элюированием смесью гексан-этилацетат (3:1) получают 397 мг исходного лактама и 194 мг сырого продукта присоединения.
Продукт присоединения в 10 мл ТГФ перемешивают 10 мин при 0oC с Bu4NF • 3H2O (75 мг, 0,23 ммоля). Раствор разбавляют этилацетатом и промывают рассолом. Органическую часть сушат над MgSO4, концентрируют и очисткой остатка на силикагеле с элюированием смесью этилацетата с гексаном (1:1) получают 147 г (51%) заглавного соединения в виде белого стеклообразного вещества.1H-ЯМР (CDCl3, 300 МГц), δ: 8,13 (д, J = 7,6 Гц, 2H), 7,6 (т, J = 7,5 Гц, 1H), 7,5 (т, J = 7,6 Гц, 2H), 7,42 (с, 1H), 6,47 (c, 1H), 6,34 (дд, J = 17,9 Гц, 3,2 Гц, 2H), 6,22 (ш.т. J = 8,7 Гц, 1H), 5,67 (д, J = 7,3 Гц, 1H), 5,35 (ш.д, J = 9,9 Гц, 1H), 5,25 (д, J = 9,8 Гц, 1H), 4,94 (ш.д. J = 7,1 Гц, 1H), 4,72 (ш. с. , 1H), 4,26 (AB к, J = 33,6 и 8,4 Гц, 2H), 3,78 (д, J = 7,2 Гц, 1H), 3,33 (ш. д, J = 5,4 Гц, 1H), 2,4 - 1,4 (м, 6H), 2,4 (c, 3H), 2,22 (с, 3H), 1,89 (c, 3H), 1, 74 (c, 3H), 1,33 (c, 9H), 1,23 (c, 3H), 1,16 (c, 3H). ИК(пленка): 3442 (широкая), 1734, 1714, 1370, 1270, 1244, 1176, 1108, 1068, 756 см-1,13C- ЯМР (CDCl3, 75,5 Гц) δ: 206,2, 172,6, 170,2, 169,6, 167,2, 155,2, 151,4, 142,5, 140,5, 133,6, 130,2, 129,2, 128, 7, 110,7, 107,4, 84,5, 82, 80,5, 79, 75,7, 74,2, 72,4, 71,8, 52,8, 51,6, 45,1, 43, 35,6, 35,1, 28,1, 27, 26,1, 22,6, 21,4, 20,8, 14,7, 14,5. МС- ББА (NOBa, NaJ, KJ), M + Na, выч. для C43H53NO15Na: 846, найдено: 846.
Пример 37
N-Дебензоил-N-трет-бутоксикарбонил-3'-дефенил-3'-(2- -тиенил)- 7-дезокситаксол (If)

К раствору 7-дезоксибаккатина III (II aa, 180 мг, 0,315 ммоля) в 6 мл ТГФ при -55oC добавляют LiГМДС (1 мл, 0,38 M, 0,38 ммоля) и перемешивают 10 мин. По каплям при - 55oC прибавляют лактам XXXIIb (679 мг, 1,77 ммоля) в 5 мл ТГФ, перемешивают 15 мин, после чего холодную баню заменяют баней с температурой 0oC и перемешивают 30 мин. Раствор нейтрализуют насыщенным раствором NH3Cl, разбавляют этилацетатом и промывают рассолом. Органическую часть сушат над MgSO4 и концентрируют. Хроматографией остатка на силикагеле с элюированием смесью гексан-этилацетат (5:1) получают 411 мг (60%) исходного соединения и 212 мг (65%) сырого продукта присоединения.
Продукт присоединения в 20 мл ТГФ перемешивают 15 мин при 0oC с 0,1 г 1 M Bu4NF (0,1 ммоля). Раствор разбавляют этилацетатом и промывают рассолом. Органическую часть сушат над MgSO4, концентрируют и очисткой остатка на силикагеле с элюированием 15% ацетонитрила в хлористом метилене получают в виде белого стеклообразного вещества 113 мг (общий выход 43%) заглавного соединения,1H-ЯМР (CDCl3, 300 МГц) δ : 8,14 (д, J=7,3 Гц, 2H), 7,61 (т, J=7,3 Гц, 1H), 7,51 (т, J=7,8 Гц, 2H), 7,27 (м, 1H), 7,08 (д, J=3,3 Гц, 1H), 7,01 (м, 1H), 6,46 (с, 1H), 6,22 (ш.т, J=8,8 Гц, 1H), 5,68 (д, J=7,3 Гц, 1H), 5,52 (ш.д. J=9,1 Гц, 1H), 5,33 (д, J=9,6 Гц, 1H), 4,94 (ш.д. J=6,9 Гц, 1H), 4,64 (д, J=2,8 Гц, 1H), 4,26 (AB к, J=33,9 и 8,4 Гц, 2H), 3,78 (д, J=7,2 Гц, 1H), 3,45 (ш.д. J=5,3 Гц, 1H), 2,39-1, 54 (м, 6H), 2,39 (с, 3H) 2,22 (с, 3H), 1,86 (с, 3H), 1,74 (с, 3H), 1,32 (с, 9H), 1,18 (с, 3H), 1,16 (с, 3H),13C-ЯМР (CDCl, 75,5 Гц) δ: 206,2, 170,1, 169,6, 167,2, 155, 141,6, 140,5, 133,6, 133,5, 130,2, 129,2, 127,1, 125,4, 84,5, 82,1, 80,4, 79, 75,7, 74,1, 73,5, 72,5, 52,8, 45,1, 43, 35,7, 35,1, 28,1, 27, 26,2, 22,7, 21,4, 20,8, 14,7, 14,5. ИК (пленка): 3440 (широкая), 1734, 1712, 1370, 1270, 1244, 1168, 1108, 756 см-1. МС-ББА (NOBA, NaJ, KJ) M + Na, выч. для C43H53NSO14Na: 862, найдено: 862.
Пример 38
(3R,
4R)-3-триэтилсилилокси-4-(2-фурил)-11-н-бутилоксикарбонилазетидин-2-он (XXXIIc)
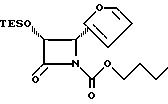
Соединение XXXIa (3R, 4R-изомер, 0,58 г, 2,17 ммоля) в 30 мл дихлорметана перемешивают с диизопропилэтиламином (0,4 мл, 2,3 ммоля) и бутилхлорформатом (0,3 мл, 2,36 ммоля), а также каталитическим количеством ДМАП. Раствор перемешивают 1 ч, разбавляют дихлорметаном, промывают рамчсолом, сушат над MgSO4 и концентрируют. Хроматографией остатка на силикагеле с элюированием смесью гексан-этилацетата (3: 1) получают 523 мг (65%) продукта. ИК (KBr): 1820, 1734, 1318, 10186, 734 см-1.1H-ЯМР (CDCl3, 300 МГц) δ: 7,38 (м, 1H), 6,35 (м, 2H) 5, 09 (AB к, J=15,5 и 5, 6 Гц, 2H), 4,14 (м, 2H), 1,56 (м, 2H), 1,28 (с, 9H), 0,87 (т, J=8,7 Гц, 3H), 0,82 (т, J=7,9 Гц, 9H), 0,5 (м, 6H),13C-ЯМР (CDCl3, 75,5 Гц) δ/ : 165,4, 149,1, 147,6, 142,9, 110,5, 109,9, 77,7, 66,6, 55,9, 30,5, 18,8, 13,6, 6,3, 4,3 МС (ДХИ) M+H, вычислено для C18H29NO5Si: 368, найдено: 368.
Пример
39
N-Дебензоил-N-изопропилоксикарбонил-3'-дефенил-3'-(2- фурил)-2'-O-триэтилсилил-7-дезокситаксол (IIIe)

К раствору ГМДС (160 мкл, 0,75 ммоля) в 5 мл ТГФ добавляют н-буттилитий (280 мкл, 2,5 M в гексане, 0,7 ммоля) и перемешивают 10 мин при - 55oC. К раствору добавляют 7-дезоксибаккатин III (323 мг, 0,566 ммоля) в 5 мл ГТФ, перемешивают 10 мин, после чего добавляют лактам XXXIId (308 мг, 0,87 ммоля) в 5 мл ТГФ. По окончании прибавления раствор нагревают 30 мин до 0oC и нейтрализуют насыщенным раствором NH4Cl. Раствор разбавляют этилацетатом, промывают насыщенным раствором NH4Cl и сушат над MgSO4. Раствор концентрируют и хроматографией остатка на силикагеле с элюированием смесью гексан-этилацетат (3: 1) получают 402 мг (76%) заглавного соединения. ИК (пленка) : 1716, 1270, 1242, 1144, 1110 см-1.1H-ЯМР (CDCl3, 300 МГц) δ: 8,1 (д, J=7,1 Гц, 2H), 7,56 (т, J=7,3 Гц, 1H), 7,47 (т, J=7,7 Гц, 2H), 7,37 (д, J=1 Гц, 1H), 6,45 (c, 1H), 6,33 (м, 1H), 6,22 (м, 2H), 5,65 (д, J=7,4 Гц, 1H), 5,35 (ш. с. 2H), 4,92 (ш.д. J= 9,5 Гц, 1H). 4,74 (ш.с., 2H), 4,25 (АВк, J=28,6 и 8,3 Гц, 2H), 3,77 (д, J=7,3 Гц, 1H), 2,44 (с, 3H), 2,41-1,51 (м, 6H), 2,19 (с, 3H), 1, 88 (с, 3H), 1,72 (с, 3H), 1,21 (с, 3H), 1,14 (м, 6H), 1,06 (д, J= 6,2 Гц, 3H), 0,83 (т, J=7,8 Гц, 9H), 0,45 (м, 6H),13C-ЯМР (CDCl3, 75,5 Гц) δ: 206,4, 170,9, 170,3, 169, 7, 167,2, 155,7, 151,9, 142, 141, 133,5, 133,2, 130,2, 129,3, 128,7, 110,7, 107,4, 84,6, 82, 79,1, 75,8, 74,1, 72,4, 70,9, 68,9, 53, 52,8, 45, 35,7, 35,2, 27,1, 26,1, 22,8, 22, 21,8, 21,6, 20,8, 14,8, 14,5, 6, 5, 4,3. МС-ББА (NOBA) M+H выч. для C48H66NO: 924, найдено: 924.
Пример 40
N-Дебензоил-N-изопропилоксикарбонил-3'-дефенил-3'-(2-фурил)-7- дезокситаксол
(Ig)
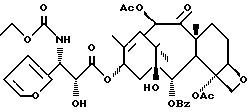
К раствору силилового эфира IIIe (114 мг, 0,123 ммоля) в 12 мл ТГФ добавляют Bu4NF (0,13 мл, 0,13 ммоля, 1 M раствор в ТГФ) и перемешивают 10 мин. Раствор разбавляют этилацетатом, промывают рассолом и сушат над MgSO4. Раствор концентрируют и хроматографией остатка на силикагеле с элюированием смесью гексан-этилацетат (2:1) получают 80 мг (98%) заглавного соединения. ИК (пленка) : 34442 (широкая), 1734, 1714, 1372, 1270, 1242, 1185, 1110, 1068, 1042, 756 см-1.1H-ЯМР (CDCl3, 300 МГц,) δ: 8,11 (д, J=7,2 Гц, 2H), 7,57 (м, 1H), 7,47 (т, J=7, 2 Гц, 2H), 7,39 (м, 1H), 6,43 (с, 1H), 6,3 (м, 1H), 6,21 (т, J = 8,9 Гц, 1H), 5,64 (д, J = 7,4 Гц, 1H), 5,35 (с, 2H), 4,9 (д, J 9,4 Гц, 1H), 4,63 (м, 2H), 4,23 (АВк, J = 30,1 и 8,4 Гц, 1H), 3,75 (д, J = 7,3 Гц, 1H), 3,36 (д, J = 5,5 Гц, 1H), 2,37 (с, 3H), 2,25 - 1,51 (с, 6H), 2,19 (с, 3H), 1,85 (с, 3H), 1,72 (с, 3H), 1,2 (с, 3H), 1,13 (д, J = 6,3 Гц, 3H), 1,12 (с, 3H), 1,06 (д, J = 6,3 Гц, 3H).13C-ЯМР (CDCl3, 75,5 Гц) δ: 206,2, 172,4, 170, 3, 169,6, 167,2, 155,7, 151,2, 142,5, 140,4, 133,6, 133,5, 130,3, 129,2, 128,7, 110,7, 107,5, 84,6, 82, 79, 77,5, 75,8, 74,1, 72,2, 71,8, 69,1, 52,8, 51,9, 45,1, 43, 35,7, 35,2, 27, 26,2, 22,6, 22, 21, 8, 21,5, 20,8, 14,7, 14,4. МС-ББА (NOBA) M+H, вычислено для C42H53NO15: 810, найдено: 810.
Пример 41
(3R,
4R)-3-Триэтилсилилокси- 4-(2-фурил)-N- изопропилокси- карбонилазетидин-2-он (XXXIId)

Соединение XXXIa (3R,4R-изомер, 0,51 г, 1,91 ммоля) в 25 мл дихлорметане перемешивают 1 ч с диизопропилэтиламином (0,78 мл, 4,4 ммоля), изопропилхлорформатом (4 мл, 4 ммоля, 1 М раствор в толуоле) и каталитическим количеством ДМАП. Затем раствор разбавляют дихлорметаном, промывают рассолом, сушат над MgSO4 и концентрируют. Хроматографией остатка на силикагеле с элюированием смесью гексан-этилацетат (5: 1) получают 649 мг (96%) заглавного соединения.
ИК (КВr): 1822, 1812, 1716, 1374, 1314, 1186, 1018, 1004, 746 см-1.1H-ЯМР (CDCl3 , 300 Мгц) δ: 7,39 (м, 1H), 6,35 (м, 2H), 5,08 (АВк J = 15,6 и 5,6 Гц, 2H), 4,96 (д, J = 10 Гц, 1H), 1,25 (д, 6,3 Гц, 3H), 1,17 (д, J 6,3 Гц, 3H), 0,83 (т, J = 7,8 Гц, 9H), 0,5 (м, 6H),13C-ЯМР (CDCl3, 75,5 Гц) δ: 165,5, 148,6, 147,8, 142,9, 110,5, 109,9, 77,6, 71,1, 55,9, 21,7, 21,6, 6,3, 4,4, МС (ДХИ) М+Н, выч. для C17H28NO5 Si: 354, найдено: 354.
Пример 42
N-Дебензоил-N-н-бутилоксикарбонил-3'- дефенил-3'-(2-фурил)-7- дезокситаксол (Ih)
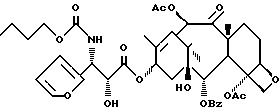
К раствору ГМДС (140 мкл, 0,66 ммоль) в 5 мл ТГФ добавляют н-бутиллитий (250 мкл, 2,5 М раствора в гексане, 0,625 ммоля) и перемешивают 10 мин при - 55oC. К раствору добавляют 7-дезоксибаккатин III (303 мг, 0,53 ммоля) в 5 мл ТГФ, перемешивают 10 мин, после чего добавляют лактам XXXII с (294 мг, 0,8 ммоля) в 5 мл ТГФ. По окончании прибавления раствор 30 мин нагревают до 0oC и нейтрализуют насыщенным раствором NH4Cl. Раствор разбавляют этилацетатом, промывают насыщенным раствором NH4Cl и сушат над MgSO4. Раствор концентрируют и хроматографией остатка на силикагеле с элюированием смесью гексан-этилацетат (1: 1) получают 342 мг (69%) N-дебензоил-N-н-бутоксикарбонил-2'-O- триэтилсилил-3'-дефенил-3'-(2-фурил)-7-дезокситаксола. ИК (пленка): 3446, 1718, 1272, 1144, 1112, 1068, 1018, 752 см-1.1H-ЯМР (CDCl3, 300 МГц) δ: 8,1 (д, J = 7 Гц, 2H), 7,56 (т, J = 7,3 Гц, 1H), 7,47 (т, J = 7,6 Гц, 2H), 7,37 (д, J = 1,4 Гц, 1H), 6,45 (с, 1H), 6,33 (дд, J = 5,1 и 1,9 Гц, 1H), 6,22 (м, 2H), 5,65 (д, J = 7,3 Гц, 1H), 5,42 (ш.д. J = 9,8 Гц, 1H), 5,33 (ш.д. J = 9,5 Гц, 1H), 4,92 (д, J = 9,5 Гц, 1H), 4,74 (д, J = 1,7 Гц, 1H), 4,24 (АВк, J = 26,7 и 8,3 Гц, 2H), 3,93 (т, J = 6,7 Гц, 2H), 3,77 (д, J = 7,3 Гц, 1H), 2,43 (с, 3H), 2,4 - 1,2 (м, 10H), 2,19 (с, 3H), 1,87 (с, 3H), 1,72 (с, 3H), 1,21 (с, 3H), 1,12 (с, 3H), 0,83 (м, 12H), 0,46 (м, 6H),13C-ЯМР (CDCl3, 75,5 Гц) δ: 206,4, 170,9, 170,3, 169,7, 167,2, 156,1, 151,8, 142, 141, 133,6, 133,2, 130,2, 129,3, 128,7, 110,7, 107,4, 84,6, 82, 79,1, 75,8, 75,8, 74,1, 72,4, 70,9, 65,4, 53, 52,8, 45, 43, 35,7, 35,2, 30,9, 27,1, 26,1, 20,8, 18,9, 14,8, 14,5, 13,7, 6,5, 4,3. МС-ББА (NOAB) M+H, выч. для C49H68NO15Si: 938, найдено: 938.
К раствору N-дебензоил-N-н-бутоксикарбонил-2'-O-триэтилсилил- 3'-дефенил-3'-(2-фурил)-7-дезокситаксола (268 мг, 0,28 ммоля) в 10 мл ТГФ добавляют Bu4NF (0,28 мл 1М раствора в ТГФ, 0,28 ммоля) и перемешивают 10 мин. Раствор разбавляют этилацетатом, промывают рассолом над MgSO4. Раствор концентрируют и хроматографией остатка на силикагеле с элюированием смесью гексан-этилацетат (1:1). Получают 222 мг (96%) заглавного соединения.
ИК (пленка): 3443 (широкая), 1716, 1270, 1242, 1108, 1068, 1018 см-1.1H-ЯМР (CDCl3, 300 МГц) δ: 8,11 (д, J=7,3 Гц, 2H), 7,57 (т, J=7,3 Гц, 1H), 7,47 (т, J=7,7 Гц, 2H), 7,39 (м, 1H), 6,43 (с, 1H), 6,35 (м, 1H), 6,22 (ш.т. J= 8,6 Гц, 1H), 5,64 (д, J=7,4 Гц, 1H), 5,39 (м, 2H), 4,9 (д, J=9, 5 Гц, 1H), 4,7 (дд, J=5,5 и 1,8 Гц, 1H), 4,23 (ABк, J=28,3 и 8,4 Гц, 2H), 4,1 (т, I=7,2 Гц, 2H), 3,94 (д, J= 6,7 Гц, 1H), 3,36 (д, J=5,5 Гц, 1H), 2,34 (c, 3H), 2,24-1,12 (м, 10H), 2,19 (с, 3H), 1, 85 (с, 3H), 1,71 (с, 3H), 1,21 (с, 3H), 1,12 (с, 3H), 0,81 (т, J=7,3 Гц, 3H),13C-ЯМР (CDCl3, 75,5 Гц) δ: 206,2, 172,3, 170,3, 169,6, 167,2, 156,1, 151,2, 142,5, 140,4, 133,6, 133,5, 130,3, 129,2, 128,7, 110,7, 107,6, 84,6, 82, 79,1, 75,8, 74,1 72,2 71,8, 65,5, 52,8, 51,9, 45,1, 42,9, 35,7, 35,2, 30,9 27, 26,2, 22,6, 21,5, 20,8, 18,9 14,7, 14,5, 13,6. MC-ББА (NOBA) M + Na выч. для C43H53NO15Na: 846, найдено: 846.
БИОЛОГИЧЕСКИЕ ДАННЫЕ
Тест M109 на мышах
Гибридным мышам Balb/c x DAB/2 F1
внутрибрюшинно имплантируют 0,5 мл 2% (масс. /об) бульона M109 рака легких. Имплантирование проводят по методике William Rose ("Применение Мэдисон 109 рака легких в качестве модели при отборе
противораковых лекарств" Cancer Treatment Reports, 65, N 3-4, 1081).
Мыши получают испытуемое соединение, вводимое инъекцией внутрибрюшинно, каждый 1,5 и 9 день после имплантации опухоли или на 5 и 8 день после имплантации.
В течение примерно 75-90 дней после имплантации опухоли ежедневно проверяют мышей на выживание. Одна группа мышей, не прошедших в эксперименте лечения, считается контрольной. Среднее время выживания получавших соединение мышей (T) сравнивают со средним временем выживания контрольных мышей (C). Отношение величин для каждой получавшей соединение группы мышей умножают на 100 и выражают в процентах (т.е. % T/C). Результат для представительного соединения приведен в табл. 2.
Соединения формулы I обладают ингибирующей активностью по отношению к опухолям млекопитающих. Таким образом, еще один аспект изобретения относится к способу ингибирвания опухолей млекопитающих, чувствительных к соединению формулы I. Настоящим изобретением даются также промежуточные соединения, применимые для получения производных 7-дезокситаксола формулы I.
Соединения формулы I могут быть также использованы для получения водорастворимых пролекарств. Описан ряд водорастворимых пролекарств таксола (см. , например, патент США N 5059699 на имя Kingston и др. от 22 октября 1991 г. , патент США N 4942184 на имя Haugwitz и др. от 17 июля 1990 г., патент США N 4960790 на имя Stella и др. от 2 октября 1990 г., все эти три патента во всей их полноте вводятся здесь в качестве ссылок). Придающие растворимость в воде фрагменты могут быть также присоединены к 2'- и/или 10-гидроксигруппе соединения формулы I с повышением его растворимости в воде. Таким образом, настоящим изобретением даются противоопухолевые соединения, которые могут быть использованы для получения из них пролекарств.
Настоящим изобретением, кроме того, даются фармацевтические препараты, содержащие соединения формулы I в смеси с одним или несколькими фармацевтически приемлемыми, инертными или физиологически активными носителями, наполнителями, разбавителями или адъювантами. Примеры препаратов таксола или родственных ему производных (том числе и возможные дозировки) приведены в многочисленных источниках, таких как патенты США NN 4960790 и 4814470, и эти примеры могут быть использованы для приготовления препаратов соединений настоящего изобретения. К примеру, новые соединения могут быть введены в виде таблеток, пилюль, порошковых смесей, инъекций, капсул, растворов, свеч, эмульсий, дисперсий, пищевых концентратов и в других приемлемых формах. Фармацевтический препарат, содержащий соединение, обычно получают смешиванием с неядовитым фармацевтическим органическим или неорганическим носителем соединения в количестве обычно 0,01-2500 мг или выше на дозированную единицу, предпочтительно 50-500 мг. Типичными фармацевтически приемлемыми носителями являются, например, маннит, мочевина, дестраны, лактоза, картофельный или кукурузный крахмал, стеарат магния, тальк, растительные масла, полиалкиленгликоли, этилцеллюлоза, поли(винилпирролидон), карбонат кальция, этилолеат, изопропилмиристат, бензилбензоат, карбонат натрия, желатин, карбонат калия, кремневая кислота и прочие обычно применяемые приемлемые носители. Фармацевтический препарат может дополнительно содержать вспомогательные вещества, такие как эмульгаторы, консерванты, смачивающие вещества и т.п., например монолаурат сорбита, олеат триэтаноламина, моностеарат полиоксиэтилена, трипальмитат глицерина, диоктилнатрийсульфосукцинат и т.п.
Соединения изобретения при желании могут быть также высушены замораживанием и смешаны с другими фармацевтически приемлемыми наполнителями с получением препарата, пригодного для парентерального введения инъекций. При подобном введении состав может быть переведен в водный раствор (нормальный, солевой) или в смесь воды с органическим растворителем, таким как пропиленгликоль, этанол и т.п.
Соединения настоящего изобретения могут быть использованы по существу таким же образом, что и таксол, при лечении опухолей млекопитающих. Способы дозировки и характер введения таксола раковым больным интенсивно исследовались (см., например, Ann. Tht. Med. III, стр. 273-279, 1989). Для соединений настоящего изобретения, вводимых либо единичной дозой, либо многоразовой дозой, либо ежедневной дозой, дозировка разумеется будет меняться в зависимости от конкретного применяемого соединения, что связано с различной активностью соединений, выбранного пути введения, массы реципиента и общего состояния больного. Вводимые дозировки не являются предметом каких-то ограничений, но, как правило, это эффективное количество или эквивалент на молярной основе фармакологически активной свободной формы, образующейся из дозированного препарата при метаболическом разрушении активного лекарства с достижением его целевого фармакологического или физиологического действия. Вводимая дозировка, как правило, будет в интервале, 0,8-8 мг/кг массы тела или 50-275 мг/м2 пациента. Опытный онколог, имеющий опыт лечения рака, без лишних экспериментов способен уточнить соответствующий план эффективного введения соединений настоящего изобретения, обратившись к известным исследователям по таксолу и его производным.
Реферат
Предложены 7-дезоксипроизводные таксола формулы I, обладающие противоопухолевой активностью, в которой R1 представляет группу формулы -C(O)Rz, где Rz является группой формулы RO или R, а R представляет C1-C6-алкил, фенил, Rg-фенил или пятичленный гетероарил с одним атомом кислорода или серы, R2 представляет атом водорода или группу формулы -COOR, где R обозначает C1-C6-алкил. Кроме того, предложены производные баккатина III формулы II, которые являются промежуточными соединениями в синтезе 7-дезоксипроизводных таксола формулы I, а также конкретные промежуточные соединения: 10-пентафторфенилтионкарбонат-7-триэтилсилилоксибаккатин III формулы III, 7-[(метилтио) карбонотиоилокси]-10-дезацетилоксибаккатин III формулы IV и 7-[(метилтио) карбонотиоилокси] - 13-триэтилсилоксибаккатин III формулы V, используемые в синтезе производных баккатина III формулы II. Кроме того, в настоящем изобретении предложена фармацевтическая композиция, содержащая соединение формулы I, которая может быть использована при лечении опухолей млекопитающих. 6 с. и 8 з.п. ф-лы, 2 табл.
Формула

где R1 представляет группу формулы -C(O)RZ, где RZ является группой формулы RO или R, R представляет C1 - C6-алкил, фенил;
Rg - фенил или пятичленный гетероарил с одним атомом кислорода или серы;
R2 представляет атом водорода или группу формулы -COOR, где R обозначает C1 - C6-алкил.

где R2 представляет атом водорода или группу формулы -COOR, где R представляет C1 - C6-алкил.

13. 7-[(Метилтио)карбонотиоилокси]-10-дезацетилоксибаккатин III
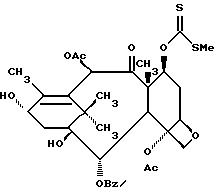
14. 7-[(Метилтио)карбонотиоилокси]-13-триэтилсилилоксибаккатин III

Приоритет по пунктам:
28.06.93 по пп.1, 2 и 13;
01.10.92 по пп.3 - 6, 14 - 21;
24.11.92 по п.7, 8 и 10;
23.12.92 по п.9;
24.12.92 по пп.19 - 21.

Комментарии