Незаряженный липид, композиция на его основе с поликатионным амфифилом и нейтральным фосфолипидом и способ ее получения для доставки нуклеиновых кислот in vitro - RU2747559C1
Код документа: RU2747559C1
Чертежи

Описание
Изобретение относится к области химии, биотехнологии, медицины и химико-фармацевтической промышленности, и раскрывает незаряженный липид, композицию на его основе для транспорта нуклеиновых кислот в клетки в присутствии сыворотки крови в ростовой среде и способ получения такой композиции. Композиция включает незаряженный липид, поликатионный амфифил и нейтральный фосфолипид, и образует комплекс с нуклеиновой кислотой.
Несмотря на огромный потенциал использования генной терапии для лечения заболеваний, ранее считавшихся неизлечимыми (наследственных, онкологических заболеваний и т.д.), на сегодняшний день к клиническому применению в мире разрешено менее 10 геннотерапевтических препаратов [Мельникова Е.В. и др. Мировой опыт регистрации и применения препаратов для генной терапии в клинической практике / Антибиотики и химиотерапия, 2019, Т. 64, №1-2, с. 58-68]. В качестве вектора доставки нуклеиновых кислот (НК) в таких препаратах используются вирусные частицы - аденовирусы, аденоассоциированные вирусы, вирусы простого герпеса, ретровирусы, обладающие высокой эффективностью трансдукции.
Однако их главным недостатком является иммуногенность и риск развития инсерционного мутагенеза, который приводит к злокачественному перерождению клеток [Nayak S. et al. Progress and prospects: immune responses to viral vectors / Gene Ther. Nature Publishing Group, 2010, V. 17, №3, pp. 295-304; Богословская Е.В. и др. Безопасность использования ретровирусных векторов в генной терапии / ВЕСТНИК РАМН, 2012, Т. 10, с. 55-61].
Для внедрения генной терапии в клиническую практику необходимо разрабатывать безопасные и эффективные системы доставки НК. Использование катионных липосом [Maslov М.А. et al. Novel cholesterol spermine conjugates provide efficient cellular delivery of plasmid DNA and small interfering RNA / J. Control. Release, 2012, V. 160, № 2, pp. 182-193; Markov O.O. et al. Novel cationic liposomes provide highly efficient delivery of DNA and RNA into dendritic cell progenitors and their immature offsets / J. Control. Release, 2012, V. 160, № 2, pp. 200-210] позволит решить проблемы, связанные с использованием вирусных векторов. Катионные липосомы должны быть нетоксичны, неиммуногенны, стабильны при хранении и обеспечивать высокую эффективность трансфекции НК.
Катионные липосомы содержат катионный амфифил, который связывает и компактизует НК при физиологических значения рН с образованием комплекса, получившего название липоплекс. Положительно заряженная группа катионного амфифила играет главную роль при формировании электростатического комплекса с отрицательно заряженными НК, при этом гидрофобные хвосты катионного амфифила взаимодействуют с неполярной областью плазматической мембраны клеток-мишеней [Dharmalingam P. et al. An anti-oxidant, α-lipoic acid conjugated oleoyl-sn-phosphatidylcholineas a helper lipid in cationic liposomal formulations / Colloids Surfaces В Biointerfaces, 2017, V. 152, pp. 133-142].
Для улучшения физико-химических свойств липоплексов и увеличения эффективности трансфекции НК в состав катионных липосом добавляют липиды-хелперы. Поглощаясь внутрь клетки, липоплексы попадают в эндосомы, где происходит закисление рН, которое оказывает разрушающее воздействие на молекулы НК. Так, в состав катионных липосом включают 1,2-ди-О-олеоилфосфатидилэтаноламин (DOPE), способный переходить из ламелярной фазы в инвертированную гексагональную, обеспечивая эффективный и своевременный выход НК из эндосом [Metwally А.А. et al. Quantitative Silencing of EGFP Reporter Gene by Self-Assembled siRNA Lipoplexes of LinOS and Cholesterol / Mol. Pharm., 2012, V. 9, №11, pp. 3384-3395]. Известно, что использование холестерина в качестве липида-хелпера приводит к улучшению стабильности липоплексов в присутствии сыворотки крови, а также способствуют слиянию с мембраной клетки-мишени [Cui S. et al. Cationic lioposomes with folic acid as targeting ligand for gene delivery / Bioorg. Med. Chem. Lett., 2016, V. 26, №16, pp. 4025-4029]. Для увеличения эффективности трансфекции в качестве липидов-хелперов также могут быть использованы фосфатидилхолин, ПЭГ-содержащие липиды, анионные липиды [Cheng X. et al. The role of helper lipids in lipid nanoparticles (LNPs) designed for oligonucleotide delivery / Adv. Drug Deliv. Rev., 2016, V. 99, pp. 129-137]. Создание новых липидов-хелперов и включение их в состав катионных липосом может привести к увеличению эффективности трансфекции.
Техническим результатом заявленного изобретения является расширение арсенала средств для эффективной доставки нуклеиновых кислот в клетки в присутствии сыворотки в ростовой среде.
Технический результат достигается незаряженным липидом 1 следующего строения:

В структуру незаряженного липида 1 входят два остатка диглицерида, необходимых для закрепления в липосомальном бислое, полиэтиленгликольный (ПЭГ) спейсер, необходимые для дестабилизации липидного бислоя липосом, и карбамоильный линкер, который обеспечивает оптимальное сочетание стабильности и токсичности липида 1.
Технический результат также достигается предлагаемой композицией для доставки протяженных и коротких нуклеиновых кислот в клетки млекопитающих, которая содержит: 1) незаряженный липид 1 в качестве липида-хелпера, 2) поликатионный амфифил 1,26-бис(холест-5ен-3β-илоксикарбониламино)-7,11,16,20-тетраазагексакозан (2X3), необходимый для связывания и упаковки НК, 3) нейтральный фосфолипид 1,2-ди-О-олеоилфосфатидилэтаноламин (DOPE) в качестве структурообразующего и промотирующего компонента.
В одном из вариантов осуществления изобретения композиция содержит (в мольных % от общего количества липидов композиции): поликатионный амфифил 1,26-бис(холест-5ен-3β-илоксикарбониламино)-7,11,16,20-тетраазагексакозан в количестве от 45 до 49 мольных % от общего количества липидов в композиции, нейтральный фосфолипид 1,2-ди-О-олеоилфосфатидилэтаноламин (DOPE) в количестве от 45 до 49 мольных % от общего количества липидов в композиции и незаряженный липид 1 в количестве от 2 до 10 мольных % от общего количества липидов композиции.
Технический результат также достигается способом получения композиции для доставки протяженных и коротких нуклеиновых кислот, в соответствии с которым липидную пленку, состоящую из трех компонентов - незаряженного липида 1, поликатионного амфифила 2X3 и нейтрального фосфолипида DOPE - гидратируют в воде, затем полученную эмульсионно-дисперсионную систему подвергают ультразвуковой обработке.
Исходным соединением в синтезе незаряженных липидов являлся rac-1-O-(4-нитрофенилоксикарбонил)-2,3-ди-O-тетрадецилглицерин, полученный согласно описанному ранее методу [Shmendel' Е.V. et al. Synthesis of neoglycolipids for the development of non-viral gene delivery systems / Russ. Chem. Bull, 2010, V. 59, №12, pp. 2281-2289]. К раствору O,O'-бис(2-аминоэтил)октадекаэтиленгликоля при перемешивании добавляли трехкратный избыток раствора rac-1-O-(4-нитрофенилоксикарбонил)-2,3-ди-O-тетрадецилглицерина в присутствии безводного триэтиламина и хлористого метилена, получая целевые незаряженные липиды.
Триэтиламин был получен от Aldrich; О,О'-бис(2-аминоэтил)октадекаэтиленгликоль получен от Fluka. Остальные растворители и реагенты были отечественного производства.
Хлористый метилен, триэтиламин кипятили над гидридом кальция и перегоняли перед реакцией.
Тонкослойную хроматографию проводили на пластинках Kieselgel 60 F254 (Merck). Обнаружение пятен на хроматограммах проводили раствором фосформолибденовая кислота-церий (IV) сульфат с последующим прогреванием. Колоночную хроматографию осуществляли на силикагеле Kieselgel 60 (0.040-0.063 мм и 0.063-0.200 мм, Merck). Спектры ЯМР1Н и13С регистрировали на приборах Bruker DPX 300 с использованием CDCl3 в качестве растворителя, если не указано иное. Химические сдвиги ЯМР1Н приведены относительно остаточного сигнала CHCl3 (δH 7.26 м.д.). Химические сдвиги ЯМР13С приведены относительно центрального сигнала растворителя (δC 77.0 м.д. для растворов в CDCl3). Масс-спектры регистрировали на спектрометре высокого разрешения Q-TOF G6550A (Agilent) с источником ионизации Dual-ESI-Jetstream и масс-спектрометре ионно-циклотронного резонанса с преобразованием Фурье (FT-ICR MS) ApexUltra (Bruker).
На основе поликатионного амфифила 2X3 [Petukhov I.A. et al. Synthesis of polycationic lipids based on cholesterol and spermine / Russ. Chem. Bull., 2010, V. 59, pp. 260-268], нейтрального фосфолипида DOPE и незаряженного липида 1 были приготовлены композиции Р2-Р10 путем гидратирования липидной пленки, состоящей из поликатионного амфифила и DOPE, взятых в соотношении 1:1 (мольн.) и липида 1, взятого в количестве 2-10 мольн. %, с последующей ультразвуковой обработкой. В качестве контроля были приготовлены композиции Н2-Н10, О2-О10, содержащие липид 1a-b [Шмендель Е.В. и др. Получение нейтральных липидов на основе 1,2-ди-О-тетрадецил-rac-глицерина с гидрофильными спейсерными группами, Сборник тезисов докладов Четверного Междисциплинарного симпозиума по медицинской, органической и биологической химии и фармацевтике, 2018, с. 196, С.А. Бахарева и др. Получение нейтральных липидов на основе 1,2-ди-О-тетрадецил-rac-глицерина с гидрофобными спейсерными группами Сборник тезисов докладов Четверного Междисциплинарного симпозиума по медицинской, органической и биологической химии и фармацевтике 2018, с. 103] в количестве 2-10 мольн. %, с последующей ультразвуковой обработкой.

Известно, что оптимальный размер катионных липосом должен быть не менее 30 нм и не более 200 нм для предотвращения их выведения почками и ретикуло-эндотелиальной системой [Cabral Н. et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size / Nat. Nanotechnol. Nature Publishing Group, 2011, V. 6, №12, pp. 815-823]. Положительный ζ-потенциал обеспечивает не только повышение эффективности загрузки плазмидной ДНК (пДНК), но также является одной из причин эффективного накопления в клетках-мишенях, а также влияет на стабильность липосом в процессе хранения. Положительные значения ζ-потенциала необходимы для обеспечения коллоидной стабильности за счет электростатического отталкивания между частицами [Elsana Н. et al. Evaluation of novel cationic gene based liposomes with cyclodextrin prepared by thin film hydration and microfluidic systems / Sci. Rep., 2019, V. 9, №1, pp. 1-17].
Для изучения размеров и ζ-потенциала полученных катионных липосом и их комплексов с плазмидной ДНК (pEGFP-C2, «Clontech» (Германия)) использовали метод динамического лазерного светорассеяния. Размеры всех полученных катионных липосом и их комплексов с плазмидной ДНК находились в оптимальном диапазоне, а ζ-потенциал был положительным.
Для изучения способности предлагаемой композиции переносить нуклеиновые кислоты в клетки млекопитающих использовали протяженную плазмидную ДНК (pEGFP-С2, «Clontech» (Германия)) и короткую 21-звенную двуцепочечную РНК (siPHК, ИХБФМ СО РАН) (последовательность смысловой цепи

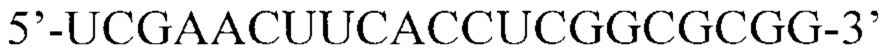
Формирование комплексов нуклеиновых кислот с предлагаемой композицией проводили путем инкубирования аликвот растворов нуклеиновых кислот и композиции, рассчитанные в соответствии с соотношением положительных зарядов аминогрупп к отрицательным зарядам фосфатных групп (соотношение N/P=6/1 и 8/1 в случае доставки плазмидной ДНК, соотношение N/P=8/1 в случае доставки siPHК).
Эффективность проникновения нуклеиновых кислот с использованием композиций Н2-Н10, О2-О10 и Р2-Р10 в клетки млекопитающих in vitro была исследована в экспериментах по трансфекции клеток плазмидной ДНК, кодирующей зеленый флуоресцирующий белок (EGFP) и короткой интерферирующей РНК, направленной на мРНК гена EGFP и подавляющей его экспрессию.
Сопоставительный анализ композиций Н2-Н10, О2-О10 и Р2-Р10 с известными и широко используемыми трансфектантами, такими как Lipofectamine®3000 и композицией L (2X3:DOPE) [Maslov М.А. et al. Novel cholesterol spermine conjugates provide efficient cellular delivery of plasmid DNA and small interfering RNA / J. Control. Release, 2012, V. 160, pp. 182-193] показал, что предлагаемые соединения обладают следующими преимуществами:
1) Заявляемая композиция с высокой эффективностью доставляет в клетки млекопитающих короткие и протяженные нуклеиновые кислоты в присутствии сыворотки крови в ростовой среде, что позволяет рассматривать ее в качестве перспективного средства доставки терапевтических нуклеиновых кислот в эукариотические клетки.
2) Заявляемая композиция не требуют сложной процедуры приготовления, для получения рабочего раствора достаточно подвергнуть ультразвуковой обработке гидратированную липидную пленку, состоящую из поликатионного амфифила, нейтрального фосфолипида (например, DOPE) и незаряженного липида 1.
3) Заявляемая композиция стабильна при хранении как в сухом виде, так и в виде водных формуляций.
4) Заявляемая композиция превосходит известные аналоги по эффективности трансфекции в эукариотические клетки.
Поиск по источникам научно-технической и патентной литературы показал, что заявляемое соединение, композиция на его основе и способ ее получения в известных из уровня техники источниках не описаны.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез незаряженного липида 1
Получение 1,59-ди[rac-2,3-ди(тетрадецилокси)пропил-1-оксикарбониламино]-O,O'-бис(2-аминоэтил)октадекаэтиленгликоля (1)
К раствору О,О'-бис(2-аминоэтил)октадекаэтиленгликоля (47.3 мг, 0.038 ммоль) в безводном CH2Cl2 (2 мл) при перемешивании добавили раствор 1-O-(4-нитрофенилоксикарбонил)-2,3-ди-O-тетрадецилглицерина [Shmendel' E.V. et al. Synthesis of neoglycolipids for the development of non-viral gene delivery systems / Russ. Chem. Bull, 2010, V. 59, №12, pp. 2281-2289] (110.2 мг, 0.169 ммоль) и безводного Et3N (0.2 мл) в безводном CH2Cl2 (3 мл). Реакционную смесь перемешивали 5 ч при 24°С, нейтрализовали 3%-ным водным раствором HCl (0.1 мл), растворители удаляли в вакууме. Продукт выделили колоночной хроматографией, элюируя системой хлороформ-метанол (100:1). Получили 48.2 мг (65%) соединения 1 в виде кристаллизуемого масла белого цвета. Найдено (%): С, 65.09; Н, 10.88; N, 1.58. C104H208N2O27. Вычислено (%): С, 65.10; Н, 10.93; N, 1.46. Спектр ЯМР1Н (300 МГц, CDCl3): 0.86 (т, J=6.7 Гц, 12Н, 4 СН3); 1.15-1.40 (м, 88Н, 4 (СН2)11,); 1.43-1.69 (м, 8Н, 4 ОСН2СН2); 3.28-3.37 (м, 4Н, 2 NHCH2); 3.39-3.89 (м, 90Н, 42 ОСН2, 2 ОСНСН2); 4.08 (дд, J=11.4 Гц, J=5.4 Гц, 2Н) и 4.18 (дд, J=11.4 Гц, J=4.4 Гц, 2Н, 2 СН2ОС(O)); 5.00-5.40 (м, 2Н, 2 NH). Спектр ЯМР13С ЯМР (60 МГц, CDCl3): 14.08, 14.30, 22.43, 22.66, 22.87, 25.79, 26.04, 26.10, 26.30, 29.33, 29.49, 29.61, 29.63, 29.67, 30.02, 31.67, 31.90, 32.13, 40.91, 46.04, 64.34, 69.32, 70.07, 70.34, 70.48, 70.53, 70.58, 71.11, 71.60, 71.76, 156.41.
Пример 2. Получение композиций L, Н2-Н10, О2-О10, Р2-Р10
Катионный амфифил 2X3 [Petukhov I.A. et al. Synthesis of polycationic lipids based on cholesterol and spermine // Russ. Chem. Bull., 2010, V. 59, pp. 260-268], нейтральный фосфолипид DOPE и незаряженный липид 1 в смеси органических растворителей упаривали до образования липидной пленки. Образовавшуюся липидную пленку сушили 4 ч в вакууме масляного насоса (0.01 Торр), гидратировали в необходимом количестве воды для инъекций в течение 12 ч, а затем озвучивали на ультразвуковой бане до получения однородной композиции. В результате получили композиции Р2 (2X3-DOPE-1, 49:49:2 мольн.), Р5 (2X3-DOPE-1, 47.5:47.5:5 мольн.), Р10 (2X3-DOPE-1, 45:45:10 мольн.).
Также были приготовлены контрольные композиции: L (2X3-DOPE, 50:50 мольн.), Н2 (2X3-DOPE-1a, 49:49:2 мольн.), Н5 (2X3-DOPE-1a, 47.5:47.5:5 мольн.), Н10 (2X3-DOPE-1a, 45:45:10 мольн.), O2 (2X3-DOPE-1b, 49:49:2 мольн.), O5 (2X3-DOPE-1b, 47.5:47.5:5 мольн.), О10 (2X3-DOPE-1b, 45:45:10 мольн.),
Пример 3. Определение размеров катионных липосом и их комплексов с плазмидной ДНК
Гидродинамический диаметр и ζ-потенциал катионных липосом и их комплексов с плазмидной ДНК измеряли с помощью метода динамического лазерного светорассеяния на приборе Zetasizer Nano ZS (Malvern Instruments, Malvern, Великобритания) при температуре 25°C в трех повторах. Измерения катионных липосом проводили при концентрации 0.05 мМ. Для изучения размеров комплексов растворы катионных липосом (100 мкл) и нуклеиновых кислот (100 мкл) в концентрациях, соответствующих необходимым соотношениям N/P, смешивали в деионизированной воде (MilliQ, США) и инкубировали 2 ч при 24°С, затем доводили объем деионизированной водой до 1 мл.
Результаты измерений гидродинамического диаметра и ζ-потенциала катионных липосом и их комплексов с плазмидной ДНК pEGFP-C2 представлены на фиг. 1(А, Б).
Пример 4. Трансфекция клеток HEK 293 плазмидной ДНК с использованием композиций Н2-Н10, О2-О10 или Р2-Р10
Изучение доставки плазмидной ДНК проводили с помощью проточной флуоциториметрии на клетках HEK 293. Эффективность трансфекции оценивали по количеству клеток, содержащих зеленый флуоресцентный белок (EGFP) от общего количества клеток в образце. Клетки HEK 293 высаживали в 24-луночные планшеты (1.2×105 клеток на лунку в 500 мкл среды DMEM с 10% эмбриональной телячьей сывороткой) и культивировали в течение суток при 37°С в атмосфере, содержащей 5% СО2. В день проведения трансфекции среду в лунках заменяли на 200 мкл среды DMEM с 10% эмбриональной телячьей сывороткой. Композицию Н2-Н10, О2-О10 или Р2-Р10 в 25 мкл среды OptiMEM смешивали с раствором pEGFP-C2 (2 мкг/мл) в 25 мкл этой же среды в оптимальном соотношении N/P=6/1 и 8/1 и инкубировали 20 мин при 25°С. Полученную смесь добавляли к клеткам и выдерживали в течение 4 ч при 37°С в атмосфере, содержащей 5% СО2, затем заменяли среду на 500 мкл DMEM с 10% эмбриональной телячьей сывороткой. Через 48 ч клетки промывали фосфатно-солевым буфером (300 мкл), добавляли 50 мкл раствора трипсина и инкубировали 2 мин (37°С, 5% СО2). По окончании инкубации в лунки добавляли 200 мкл DMEM с 10% эмбриональной телячьей сывороткой, клетки суспендировали и переносили в пробирки. Полученную клеточную суспензию центрифугировали при 1200 об/мин, отбирали среду и промывали 400 мкл фосфатно-солевого буфера. Затем клетки фиксировали 600 мкл 2% раствора формальдегида в фосфатно-солевом буфере. Анализ уровня трансфекции клеток проводили на флуоцитометре ACEA NovoCyte™ 3000 (Bioscience Inc., USA). В этих экспериментах определяли количество клеток, экспрессирующих белок EGFP, и средний уровень флуоресценции клеток при длине волны возбуждения 488 нм. В качестве объекта сравнения был выбран коммерчески доступный препарат - Lipofectamine 3000 и липосомы L.
Результаты трансфекции клеток плазмидной ДНК pEGFP-C2 в присутствии эмбриональной телячьей сыворотки в ростовой среде представлены на фиг. 2(А, Б).
Пример 5. Трансфекция клеток BHK IR780 короткой интерферирующей РНК с использованием композиций Н2-Н10, О2-О10 или Р2-Р10
Исследование проникновения siPHК, направленной на подавление синтеза зеленого флуоресцирующего белка EGFP, проводили на клетках линии BHK IR780, стабильно экспрессирующих данный белок. В качестве мишени была выбрана мРНК, кодирующая белок EGFP, таким образом по уменьшению флуоресценции клеток, определяемой этим белком, можно судить об эффективности доставки siPHК в цитоплазму клетки.
Клетки BHK IR780 высаживали в 24-луночные планшеты (0.13×105 клеток на лунку в 500 мкл среды DMEM с 10% эмбриональной телячьей сывороткой) и культивировали в течение суток при 37°С в атмосфере, содержащей 5% СО2. Перед проведением трансфекции для экспериментов в присутствии сыворотки среду в лунках заменяли на 200 мкл среды DMEM с 10% эмбриональной телячьей сывороткой. Композицию Н2-Н10, О2-О10 или Р2-Р10 в 25 мкл среды OptiMEM смешивали с раствором siPHК (с конечной концентрацией siPHК 50 нМ) в 25 мкл этой же среды при оптимальном соотношении N/P=6/1 и выдерживали 20 мин при 25°С. Полученную смесь добавляли к клеткам и выдерживали в течение 4 ч при 37°С в атмосфере, содержащей 5% СО2, затем заменяли среду на 500 мкл DMEM с 10% эмбриональной телячьей сывороткой. Через 72 ч клетки обрабатывали, как описано в примере 4. В качестве объекта сравнения был выбран коммерчески доступный препарат - Lipofectamine 3000 и липосомы L. Результаты по трансфекции клеток короткой интерферирующей РНК с композициями в присутствии сыворотки в ростовой среде, определенные по уровню снижения экспрессии белка EGFP представлены в таблице 1.

Таким образом, приведенные примеры однозначно указывают на способность предлагаемой композиции, состоящей из поликатионного амфифила. нейтрального фосфолипида и незаряженного липида, эффективно способствовать проникновению коротких и протяженных нуклеиновых кислот в клетки млекопитающих в присутствии сыворотки крови, что позволяет использовать их в качестве агентов для доставки нуклеиновых кислот в клетки млекопитающих в условиях in vitro.
Реферат
Изобретение относится к незаряженному липиду, имеющему строение 1, который может найти применение для доставки протяженных и коротких нуклеиновых кислот в клетки млекопитающих. Изобретение относится также к композиции для доставки протяженных и коротких нуклеиновых кислот в клетки млекопитающих и к способу ее получения. Композиция содержит поликатионный амфифил 1,26-бис(холест-5ен-3β-илоксикарбониламино)-7,11,16,20-тетраазагексакозан для связывания и упаковки нуклеиновых кислот, нейтральный фосфолипид 1,2-ди-О-олеоилфосфатидилэтаноламин (DOPE) в качестве структурообразующего и промотирующего компонента и незаряженный липид, имеющий строение 1. Способ получения композиции характеризуется тем, что липидную пленку, состоящую из соответствующих поликатионного амфифила, нейтрального фосфолипида и незаряженного липида, гидратируют в воде, затем полученную эмульсионно-дисперсионную систему подвергают ультразвуковой обработке. 3 н. и 1 з.п. ф-лы, 5 пр., 1 табл., 2 ил.
Формула


Комментарии