Новое производное ариламидина или его соль - RU2299195C2
Код документа: RU2299195C2
Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому производному ариламидина, имеющему противогрибковую активность или его соли. Кроме того, оно относится к противогрибковому средству, содержащему производное ариламидина в качестве активных ингредиентов.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Обширный глубокий микоз, такой как инвазивный кандидоз, часто становится смертельным заболеванием. Первоначально считали, что основным защитным механизмом со стороны организма-хозяина по отношению к Mycomycetes, таким как Candida, будет являться неспецифическая иммунизация нейтрофилами. Когда данный защитный механизм функционирует нормально, существует небольшой риск инфицирования Mycomycetes. Однако в последние годы риск развития обширного микоза увеличился вследствие увеличения количества пациентов с основными заболеваниями, уменьшающими иммунологическую функцию организма, такими как злокачественные опухоли (в частности, гемопоэтические злокачественные опухоли, такие как острая лейкемия или злокачественная лимфома) или СПИД, обширное применение противораковых средств или иммунодепрессивных средств, обширное использование антибактериальных антибиотиков или стероидного гормона, длительное использование гипералиментации центральных вен или катетеризации вен и т.д. (Rinsho to Biseibutsu (Clinics and Microorganisms), vol. 17, p. 265, 1990).
Количество средств, применяемых для лечения такого обширного микоза, намного меньше, чем количество антибактериальных средств. Существует только 6 типов средств, таких как амфотерицин В, флуцитозин, миконазол, флуконазол, интраконазол и микафунгин.
Амфотерицин В обладает крайне мощным фунгицидным действием по отношению к Mycomycetes. Однако в то же время существует проблема, касающаяся выраженных побочных эффектов, таких как нефротоксичность, и, следовательно, применение такого средства в клинической ситуации ограничено. Кроме того, проблема флукоцитозина состоит в том, что при постоянном применении данное средство вызывает быстрое развитие резистентности. Соответственно, в настоящее время данное средство редко применяют отдельно. Микафунгин обладает низкой активностью по отношению к видам Cryptococcus. Другие средства обобщенно называют азольными противогрибковыми средствами, с точки зрения их структурных характеристик. Существует общая тенденция, что фунгицидное действие данных средств по отношению к Mycomycetes является более слабым, чем действие амфотерицина В. Однако с учетом как эффективности, так и безопасности азольные противогрибковые средства наиболее часто применяются в настоящее время ((Rinsho to Biseibutsu (Clinics and Microorganisms), vol. 21, p. 277, 1994).
В настоящее время флуконазол-резистентную Candida albicans (C. albicans) обнаруживают с высокой частотой в 30% или более случаев при поражении орофарингальным кандидозом у пациентов со СПИД, которым повторно вводят флуконазол. Более того, большинство из резистентных штаммов проявляют перекрестную резистентность по отношению к итраконазолу и другим азольным средствам. Кроме того, сообщается о разделении резистентных штаммов, что касается не-СПИД пациентов, у которых развивается хронический слизисто-кожный кандидоз или обширный кандидоз (Rinsho to Biseibutsu (Clinics and Microorganisms), vol. 28, p. 57, 2001).
Таким образом, если ограниченное количество средств является проблематичным в отношении резистентности, это будет неизбежно влиять на лечение пациентов с обширным микозом, количество которых увеличивается (Rinsho to Biseibutsu (Clinics and Microorganisms), vol. 28, p. 51, 2001).
Соответственно, очень желательной является разработка противогрибкового средства, механизм действия которого отличается от механизмов действия существующих средств и которое воздействует на Mycomycetes, резистентные к азольным средствам, при наличии незначительных побочных эффектов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
При таких обстоятельствах авторы настоящего изобретения провели интенсивные исследования. В результате они обнаружили, что производное ариламидина, образованное введением амидиногруппы в арильный цикл, представленный общей формулой [1], описанной ниже, или его соль обладают превосходной противогрибковой активностью, таким образом, предложив настоящее изобретение:

где Х представляет собой незамещенную или замещенную группу низшую алкиленовую или алкениленовую группу; G1 представляет собой атом кислрода, атом серы или иминогруппу; G2 представляет собой атом углерода или атом азота; Ra представляет собой, по меньшей мере, одну группу, выбранную из группы, состоящей из атома водорода, атома галогена и незамещенной или замещенной алкильной, циклоалкильной и алкоксигруппы; R1 представляет собой незащищенную или защищенную или незамещенную или замещенную амидиногруппу; и R2 представляет собой группу, представленную следующими формулами (1), (2) или (3):
(1)

где R3 представляет собой атом водорода, аминозащитную группу или незамещенную или замещенную циклоалкильную или алкенильную группу или группу, представленную следующей формулой:
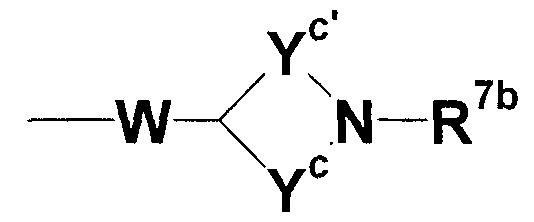
где W представляет собой незамещенную или замещенную низшую алкиленовую группу или прямую связь; Yc представляет собой незамещенную или замещенную С2-4 низшую алкиленовую группу; Yc' представляет собой незамещенную или замещенную С1-4 низшую алкиленовую группу; и R7b представляет собой атом водорода, аминозащитную группу или незамещенную или замещенную алкильную, циклоалкильную или алкенильную группу или группу, представленную следующей формулой:
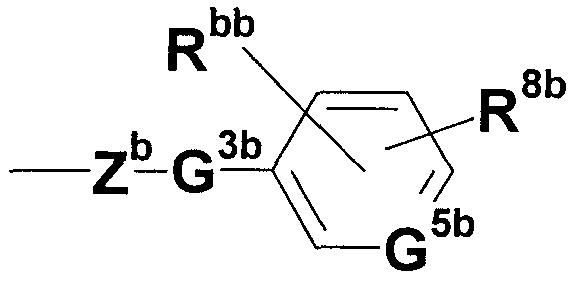
где Zb представляет собой незамещенную или замещенную низшую алкиленовую или алкениленовую группу; G3b представляет собой атом кислорода, атом серы, иминогруппу или прямую связь; G5b представляет собой атом углерода или атом азота; Rbb представляет собой, по меньшей мере, одну группу, выбранную из группы, состоящей из атома водорода, атома галогена и незамещенной или замещенной алкильной, циклоалкильной и алкоксигруппы; и R8b представляет собой незащищенную или защищенную или незамещенную или замещенную амидиногруппу, которая присоединена в пара- или мета-положение относительно места присоединенения G3b; или
R4 представляет собой атом водорода, аминозащитную группу или незамещенную или замещенную алкильную, циклоалкильную или алкенильную группу;
(2)

где Y представляет собой незамещенную или замещенную C2-6 низшую алкиленовую или C3-6алкениленовую группу; каждый из R5 и R6, которые могут быть одинаковыми или различными, представляет собой атом водорода, аминозащитную группу или незамещенную или замещенную алкильную, циклоалкильную или алкенильную группу; и R7 представляет собой атом водорода, аминозащитную группу или незамещенную или замещенную алкильную, циклоалкильную или алкенильную группу или группу, представленную следующей формулой:

где Z представляет собой незамещенную или замещенную низшую алкиленовую или алкениленовую группу; G3 представляет собой атом кислорода, атом серы, иминогруппу или прямую связь; G5 представляет собой атом углерода или атом азота; Rb представляет собой, по меньшей мере, одну группу, выбранную из группы, состоящей из атома водорода, атома галогена и незамещенной или замещенной алкильной, циклоалкильной и алкоксигруппы; и R8 представляет собой незащищенную или защищенную или незамещенную или замещенную амидиногруппу, которая присоединена в пара- или мета-положение относительно места присоединенения G3; или
(3)
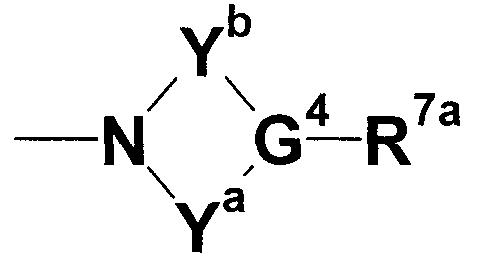
где Ya представляет собой незамещенную или замещенную C2-4 низшую алкиленовую группу; Yb представляет собой незамещенную или замещенную C1-4 низшую алкиленовую группу; G4 представляет собой атом углерода или атом азота; R7a представляет собой алкильную группу, замещенную, по меньшей мере, одной группой, выбранной из группы, состоящей из цианогруппы, нитрогруппы, атома галогена, сульфогруппы, фосфорильной группы, незащищенной или защищенной гидроксильной группы, незащищенной или защищенной аминогруппы, незащищенной или защищенной карбамоильной группы, незащищенной или защищенной гидроксикарбамоильной группы, незащищенной или защищенной аминосульфонильной группы, незащищенной или защищенной циклической аминогруппы, незащищенной или защищенной низшей алкиламиногруппы, низшей алкенильной группы, низшей алкоксигруппы, гетероциклической группы, циклоалкильной группы, низшей алкилиденовой группы, меркаптогруппы, амидинофениларилоксигруппы, арилоксигруппы, низшей алкилтиогруппы, низшей алкилсульфинильной группы, низшей алкилсульфонильной группы, низшей алкилкарбамоильной группы, низшей алкилсульфониламиногруппы, низшей алкиламиносульфонильной группы, карбоксилнизшей алкенильной группы, гидроксилгетероциклической группы, низшей алкилгетероциклической группы, низшей алкокси-низшей алкоксигруппы и низшей алкоксииминогруппы или незамещенную или замещенную фенильную, циклоалкильную или алкенильную группу или группу, представленную следующей формулой:
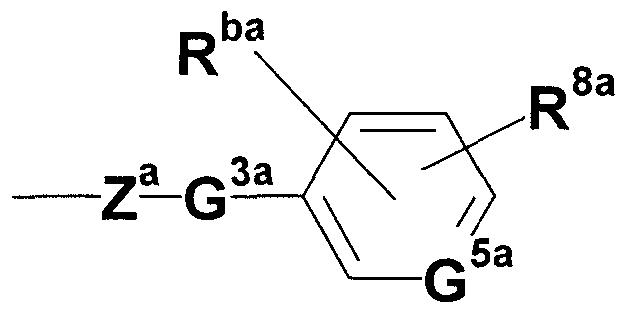
где Za представляет собой незамещенную или замещенную низшую алкиленовую или алкениленовую группу; G3а представляет собой атом кислорода, атом серы, иминогруппу или прямую связь; G5а представляет собой атом углерода или атом азота; Rba представляет собой, по меньшей мере, одну группу, выбранную из группы, состоящей из атома водорода, атома галогена и незамещенной или замещенной алкильной, циклоалкильной и алкоксигруппы; и R8а представляет собой незащищенную или защищенную или незамещенную или замещенную амидиногруппу, которая присоединена в пара- или мета-положение относительно места присоединенения с G3а; (при условии, что, когда G1 представляет собой иминогруппу, Х представляет собой незамещенную или замещенную С3-6 низшую алкиленовую группу или незамещенную или замещенную алкениленовую группу).
Кроме того, данные соединения или их соли являются в высокой степени безопасными и проявляют превосходные фармакокинетические и фармакодинамические свойства. Соответственно, они могут использоваться в качестве превосходных противогрибковых средств.
Соединения по настоящему изобретению подробно описаны далее.
В настоящем изобретении, если не указано иначе, термин "атом галогена" используют для обозначения атома фтора, атома хлора, атома брома и атома йода; термин "алкильная группа" используют для обозначения линейной или разветвленной С1-12алкильной группы, такой как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, пентил, изопентил, гексил, гептил или октил; термин "низшая алкильная группа" используют для обозначения линейной или разветвленной С1-6алкильной группы, такой как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, пентил или изопентил; термин "галоген-низшая алкильная группа" используют для обозначения линейной или разветвленной галоген-С1-6алкильной группы, такой как фторметил, хлорметил, бромметил, дихлорметил, трифторметил, трихлорметил, хлорэтил, дихлорэтил, трихлорэтил или хлорпропил; термин "низшая алкокси-низшая алкильная группа" используют для обозначения линейной или разветвленной С1-6алкокси-С1-6алкильной группы, такой как метоксиметил, этоксиметил, н-пропоксиметил, метоксиэтил или этоксиэтил; термин "гидрокси-низшая алкильная группа" используют для обозначения линейной или разветвленной гидрокси-С1-6алкильной группы, такой как гидроксиметил, гидроксиэтил или гидроксипропил; термин "амино-низшая алкильная группа" используют для обозначения линейной или разветвленной амино-С1-6алкильной группы, такой как аминометил, аминоэтил или аминопропил; термин "карбоксил-низшая алкильная группа" используют для обозначения линейной или разветвленной С1-6алкильной группы, которая замещена карбоксильной группой; термин "алкенильная группа" используют для обозначения линейной или разветвленной С2-12алкенильной группы, такой как винил, аллил, пропенил, изопропенил, бутенил, изобутенил, пентенил, гексенил, гептенил или октенил; термин "низшая алкенильная группа" используют для обозначения линейной или разветвленной С2-6алкенильной группы, такой как винил, аллил, пропенил, изопропенил, бутенил, изобутенил или пентенил; термин "циклоалкильная группа" используют для обозначения С3-7циклоалкильной группы, такой как циклопропил, циклобутил, циклопентил, циклогексил или циклогептил; термин "низшая алкиленовая группа" используют для обозначения линейной или разветвленной С1-6алкиленовой группы, такой как метилен, этилен, пропилен, бутилен, амилен или гексилен; термин "алкениленовая группа" используют для обозначения линейной или разветвленной С2-6алкениленовой группы, такой как винилен, пропенилен, 2-бутенилен, 1-бутенилен или изопропенилен; термин "арильная группа" используют для обозначения группы, такой как фенил, толил или нафтил; термин "аралкильная группа" используют для обозначения ар-С1-12алкильной группы, такой как бензил, дифенилметил, тритил, фенэтил, 4-метилбензил или нафтилметил; термин "арилоксигруппа" используют для обозначения группы, такой как фенокси или нафтокси; термин "арилоксикарбонильная группа" используют для обозначения группы, такой как феноксикарбонил или нафтоксикарбонил; термин "амидинофениларилоксигруппа" используют для обозначения арилоксигруппы, замещенной амидинофенильной группой, такой как 4-(4-амидинофенил)фенилокси, 4-(4-амидинофенил)-2-фторфенилокси или 4-(3-амидинофенил)фенилокси; термин "алкоксигруппа" используют для обозначения линейной или разветвленной С1-12алкоксигруппы, такой как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси, изопентилокси, гексилокси, гептилокси или октилокси; термин "низшая алкоксигруппа" используют для обозначения линейной или разветвленной С1-6алкоксигруппы, такой как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси или изопентилокси; термин "низшая алкоксикарбонильная группа" используют для обозначения линейной или разветвленной С1-6алкилоксикарбонильной группы, такой как метоксикарбонил, этоксикарбонил, изопропоксикарбонил или н-пропоксикарбонил; термин "низшая алкоксикарбонильная-низшая алкильная группа" используют для обозначения линейной или разветвленной С1-6алкоксикарбонильной-С1-6алкильной группы, такой как метоксикарбонилметил, этоксикарбонилметил, н-пропоксикарбонилметил, метоксикарбонилэтил или этоксикарбонилэтил; термин "низшая алкоксииминогруппа" используют для обозначения линейной или разветвленной С1-6алкоксииминогруппы, такой как метоксиимино или этоксимино; термин "низшая алкиламиногруппа" используют для обозначения линейной или разветвленной моно- или ди-С1-6алкиламиногруппы, такой как метиламино, этиламино, изопропиламино, н-пропиламино, диметиламино, диэтиламино или метилэтиламино; термин "низшая алкиламино-низшая алкильная группа" используют для обозначения моно- или ди-С1-6алкиламино-С1-6алкильной группы, такой как метиламинометил, метиламиноэтил, этиламинометил, метиламинопропил, изопропиламинометил, н-пропиламиноэтил, диметиламинометил, диэтиламинометил, диэтиламиноэтил или диметиламинопропил; термин "низшая алкилиденовая группа" используют для обозначения С1-6 алкилиденовой группы, такой как метилен, этилиден, пропилиден или изопропилиден; термин "азотсодержащая гетероциклическая группа" используют для обозначения 5- или 6-членной циклической, конденсированной циклической или мостиковой циклической гетероциклической группы, которая содержит, по меньшей мере, один атом азота в качестве гетероциклического атома, образующего описанный выше гетероциклический цикл группы, такой как пирролил, пирролидинил, пиперидил, пиперазинил, имидазолил, пиразолил, пиридил, тетрагидропиридил, пиримидинил, морфолинил, тиоморфолинил, хинолил, хинолизинил, тетрагидрохинолинил, тетрагидроизохинолинил, хинуклидинил, хиназолил, тиазолил, тетразолил, тиодиазолил, пирролинил, имидазолинил, имидазолидинил, пиразолинил, пиразолидинил, пуринил или индазолил и который может далее содержать, по меньшей мере, один атом кислорода или серы; термин "гетероциклическая группа" используют для включения вышеописанной азотсодержащей гетероциклической группы и 5- или 6-членной циклической, конденсированной циклической или мостиковой циклической гетероциклической группы, которая содержит, по меньшей мере, один гетероциклический атом, выбранный из группы, состоящей из атомов азота, кислорода и серы, и который может далее содержать, по меньшей мере, один атом кислорода или серы в качестве гетероциклического атома, образующего описанный выше гетероциклический цикл группы, такой как фурил, тиенил, бензотиенил, пиранил, изобензофуранил, оксазолил, бензофуранил, индолил, бензимидазолил, бензоксазолил, бензотиазолил, хиноксалил, дигидрохиноксалинил, 2, 3-дигидробензотиенил, 2,3-дигидробензопирролил, 2,3-дигидро-4Н-1-тианафтил, 2,3-дигидробензофуранил, бензо[b]диоксанил, имидазо[2,3-а]пиридил, бензо[b]пиперазинил, хроменил, изотиазолил, изоксазолил, тиадиазолил, оксадиазолил, пиридазинил, изоиндолил или изохинолил; термин "ацильная группа" используют для обозначения, например, формильной группы, линейной или разветвленной С2-12 алканоильной группы, такой как ацетил, изовалерил или пропионил, аралкилкарбонильной группы, такой как бензилкарбонил, ароильной группы, такой как бензоил или нафтоил, и гетероциклической карбонильной группы, такой как никотиноильная, теноильная, пирролидинкарбонильная или фуроильная группа; термин "циклическая аминогруппа" используют для обозначения, например, либо насыщенной или ненасыщенной циклической аминогруппы, которая может содержать один или более гетероциклических атомов, таких как атом азота, кислорода или серы, и карбонильный углерод, и, который может быть моноциклическим, бициклическим или трициклическим. Конкретные примеры такой циклической аминогруппы могут включать: насыщенные или ненасыщенные моноциклические 3-7-членные циклические аминогруппы, содержащие один атом азота, такие как азиридин-1-ил, азетидин-1-ил, азетидин-2-ил, пирролидин-1-ил, пирролидин-2-ил, пирролидин-3-ил, 1-метилпирролидин-2-ил, 1-метилпирролидин-3-ил, пиролин-1-ил, пиррол-1-ил, дигидропиридин-1-ил, пиперидин-1-ил, пиперидин-2-ил, пиперидин-3-ил, пиперидин-4-ил, 1-метил-пиперидин-2-ил, 1-метил-пиперидин-3-ил, 1-метил-пиперидин-4-ил, дигидроазепин-1-ил или пергидроазепин-1-ил; насыщенные или ненасыщенные моноциклические 3-7-членные циклические аминогруппы, содержащие два атома азота, такие как имидазол-1-ил, имидазолидин-1-ил, имидазолин-1-ил, пиразолидин-1-ил, пиперазин-1-ил, 4-метилпиперазин-1-ил, 1,4-дигидропиразин-1-ил, 1,2-дигидропиримидин-1-ил, 4-метилгомопиперазин-1-ил, пергидропиразин-1-ил или гомопиперазин-1-ил; насыщенные или ненасыщенные моноциклические 3-7-членные циклические аминогруппы, содержащие 3 или более атомов азота, такие как 1,2,4-триазол-1-ил, 1,2,3-триазол-1-ил, 1,2-дигидро-1,2,4-триазин-1-ил или пергидро-S-триазин-1-ил; насыщенные или ненасыщенные моноциклические 3-7-членные циклические аминогруппы, содержащие 1-4 гетероатомов, выбранных из группы, состоящей из атомов кислорода и серы, а также атомов азота, такие как оксазолидин-3-ил, изоксазолидин-2-ил, морфолино, тиазолидин-3-ил, изотиазолидин-2-ил, тиоморфолино, гомотиоморфолин-4-ил или 1,2,4-тиадиазолидин-2-ил; насыщенные или ненасыщенные бициклические или трициклические аминогруппы, такие как изоиндолин-2-ил, индолин-1-ил, 1Н-индазол-1-ил, пурин-7-ил или тетрагидрохинолин-1-ил; и спиро или мостиковые насыщенные или ненасыщенные 5-12-членные циклические аминогруппы, такие как хинуклидин-1-ил, 5-азаспиро [2,4]гептан-5-ил, 2,8-диазабицикло[4.3.0]нонан-8-ил, 3-азабицикло[3.1.0]гексан-3-ил, 2-окса-5,8-диазабицикло[4.3.0]нонан-8-ил, 2, 8-диазаспиро[4.4]нонан-2-ил или 7-азабицикло[2.2.1]гептан-7-ил. Термин "низшая алкилтиогруппа" используют для обозначения линейной или разветвленной С1-6алкилтиогруппы, такой как метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, изобутилтио, втор-бутилтио, трет-бутилтио, пентилтио или изопентилтио; термин "алкилсульфонильная группа" используют для обозначения линейной или разветвленной С1-12алкилсульфонильной группы, такой как метилсульфонил, этилсульфонил, н-пропилсульфонил, изопропилсульфонил, н-бутилсульфонил, изобутилсульфонил, втор-бутилсульфонил, трет-бутилсульфонил, пентилсульфонил, изопентилсульфонил, гексилсульфонил, гептилсульфонил или октилсульфонил; термин "арилсульфонильная группа" используют для обозначения арил-SO2-группы, такой как фенилсульфонил или нафтилсульфонил; термин "низшая алкилсульфинильная группа" используют для обозначения линейной или разветвленной С1-6алкилсульфинильной группы, такой как метилсульфинил, этилсульфинил, н-пропилсульфинил, изопропилсульфинил, н-бутилсульфинил, изобутилсульфинил, втор-бутилсульфинил, трет-бутилсульфинил, пентилсульфинил или гексилсульфинил; термин "низшая алкилсульфонильная группа" используют для обозначения линейной или разветвленной С1-6алкилсульфонильной группы, такой как метилсульфонил, этилсульфонил, н-пропилсульфонил, изопропилсульфонил, н-бутилсульфонил, изобутилсульфонил, втор-бутилсульфонил, трет-бутилсульфонил или пентилсульфонил; термин "низшая алкилкарбамоильная группа" используют для обозначения моно- или ди-С1-6алкилкарбамоильной группы, такой как метилкарбамоил, этилкарбамоил, н-пропилкарбамоил, изопропилкарбамоил, диметилкарбамоил, диэтилкарбамоил или метилэтилкарбамоил; термин "низшая алкилсульфониламиногруппа" используют для обозначения линейной или разветвленной С1-6алкилсульфониламиногруппы, такой как метилсульфониламино, этилсульфониламино, н-пропилсульфониламино, изопропилсульфониламино, н-бутилсульфониламино, изобутилсульфониламино, втор-бутилсульфониламино, трет-бутилсульфониламино или пентилсульфониламино; термин "низшая алкилсульфонилкарбамоильная группа" используют для обозначения линейной или разветвленной С1-6алкилсульфонилкарбамоильной группы, такой как метилсульфонилкарбамоил, этилсульфонилкарбамоил, н-пропилсульфонилкарбамоил, изопропилсульфонилкарбамоил, н-бутилсульфонилкарбамоил, изобутилсульфонилкарбамоил, втор-бутилсульфонилкарбамоил, трет-бутилсульфонилкарбамоил или пентилсульфонилкарбамоил; термин "низшая алкиламиносульфонилгруппа" используют для обозначения моно- или ди-С1-6алкиламиносульфонилгруппы, такой как метиламиносульфонил, этиламиносульфонил, н-пропиламиносульфонил, изопропиламиносульфонил, диметиламиносульфонил, диэтиламиносульфонил или метиэтиламиносульфонил; термин "карбоксил-низшая алкенильная группа" используют для обозначения, например, линейной или разветвленной С2-6алкенильной группы, замещенной карбоксильной группой; термин "гидроксигетероциклическая группа" используют для обозначения, например, гетероциклической группы, замещенной гидроксильной группой; термин "низшая алкилгетероциклическая группа" используют для обозначения, например, гетероциклической группы, замещенной линейной или разветвленной низшей алкильной группой; термин "низшая алкокси-низшая алкоксигруппа" используют для обозначения линейной или разветвленной С1-6алкоксигруппы, замещенной низшей алкокси; термин "удаляемая группа" используют для включения атомов галогена, таких как атом фтора, атом хлора, атом брома или атом йода, алкилсульфонилоксигрупп, таких как метансульфонилокси или трифторметансульфонилокси, арилсульфонилоксигрупп, таких как паратолуолсульфонилокси или бензолсульфонилокси и ацилоксигрупп, таких как ацетилокси или трифторацетилокси.
Любая защитная группа может применяться в качестве защитной группы для карбоксильной группы, поскольку ее можно использовать в качестве обычной карбоксилзащитной группы. Примеры такой защитной группы могут включать: алкильные группы, такие как метил, этил, н-пропил, изопропил, 1,1-диметилпропил, н-бутил или трет-бутил; арильные группы, такие как фенил или нафтил; аралкильные группы, такие как бензил, дифенилметил, тритил, п-нитробензил, п-метоксибензил или бис-(п-метоксифенил)метил; ацилалкильные группы, такие как ацетилметил, бензоилметил, п-нитробензоилметил, п-бромбензоилметил или п-метансульфонилбензоилметил; кислородсодержащие гетероциклические группы, такие как 2-тетрагидропиранил или 2-тетрагидрофуранил; галогеналкильные группы, такие как 2,2,2-трихлорэтил; алкилсилилалкильные группы, такие как 2-(триметилсилил)этил; ацилоксиалкильные группы, такие как ацетоксиметил, пропионилоксиметил или пивалоилоксиметил; азотсодержащие гетероциклические алкильные группы, такие как фталимидометил или сукцинимидометил; циклоалкильные группы, такие как циклогексил; алкоксиалкильные группы, такие как метоксиметил, метоксиэтоксиметил или 2-(триметилсилил)этоксиметил; аралкоксиалкильные группы, такие как бензилоксиметил; низшие алкилтиоалкильные группы, такие как метилтиометил или 2-метилтиоэтил; арилтиоалкильные группы, такие как фенилтиометил; алкенильные группы, такие как 1,1-диметил-2-пропенил, 3-метил-3-бутенил или аллил; и замещенные силильные группы, такие как триметилсилил, триэтилсилил, триизопропилсилил, диэтилизопропилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, дифенилметилсилил или трет-бутилметоксифенилсилил. Предпочтительные примеры могут включать алкильные группы, аралкильные группы и замещенные силильные группы.
Любая защитная группа может использоваться в качестве защитной группы для аминогруппы, поскольку ее можно применять как обычную аминозащитную группу. Примеры такой защитной группы могут включать: ацильные группы, такие как (моно-, ди- или три-)хлорацетил, трифторацетил, фенилацетил, формил, ацетил, бензоил, фталоил, сукцинил или аминокислотный остаток с незащищенным или защищенным N-концом (примеры аминокислоты могут включать глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, аспарагиновую кислоту, глутаминовую кислоту, аспарагин, глутамин, аргинин, лизин, гистидин, гидроксилизин, фенилаланин, тирозин, триптофан, пролин и гидроксипролин); алкилоксикарбонильные группы, такие как метоксикарбонил, дифенилметоксикарбонил, этоксикарбонил, трихлорэтоксикарбонил, трибромэтоксикарбонил, 1, 1-диметилпропоксикарбонил, изопропоксикарбонил, 2-этилгексилоксикарбонил, трет-пентилоксикарбонил, трет-бутоксикарбонил или 1-адамантилоксикарбонил; аралкилоксикарбонильные группы, такие как бензилоксикарбонил, п-нитробензилоксикарбонил, о-бромбензилоксикарбонил, п-метоксибензилоксикарбонил, 3,4-диметоксибензилоксикарбонил или 4-(фенилазо)бензилоксикарбонил; арилоксикарбонильные группы, такие как фенилоксикарбонил, 4-фторфенилоксикарбонил, 4-метоксифенилоксикарбонил, 8-хинолилоксикарбонил или 2-фурфурилоксикарбонил; аралкильные группы, такие как бензил, дифенилметил или тритил; алкоксиалкильные группы, такие как метоксиметил, бензилоксиметил, 2-метоксиэтоксиметил, 2,2,2-трихлорэтоксиметил, 2-(триметилсилил)этоксиметил или 1-этоксиэтил; арилтиогруппы, такие как 2-нитрофенилтио или 2,4-динитрофенилтио; алкилсульфонильные или арилсульфонильные группы, такие как метансульфонил или п-толуолсульфонил; диалкиламиноалкилиденовые группы, такие как N, N-диметиламинометилен; аралкилиденовые группы, такие как бензилиден, 2-гидроксибензилиден, 2-гидрокси-5-хлорбензилиден или 2-гидрокси-1-нафтилметилен; азотсодержащие гетероциклические алкилиденовые группы, такие как 3-гидрокси-4-пиридилметилен; циклоалкилиденовые группы, такие как циклогексилиден, 2-этоксикарбонилциклогексилиден, 2-этоксикарбонилциклопентилиден, 2-ацетилциклогексилиден или 3, 3-диметил-5-оксициклогексилиден; диарил- или диаралкилфосфорильные группы, такие как дифенилфосфорил или дибензилфосфорил; кислородсодержащие гетероциклические алкильные группы, такие как 5-метил-2-оксо-2Н-1,3-диоксол-4-ил-метил; и замещенные силильные группы, такие как триметилсилил.
Любая защитная группа может использоваться в качестве защитной группы для гидроксильной группы, поскольку ее можно применять как обычную гидроксизащитную группу. Примеры такой защитной группы могут включать: ацильные группы, такие как бензилоксикарбонил, 4-нитробензилоксикарбонил, 4-бромбензилоксикарбонил, 4-метоксибензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил, 1,1-диметилпропоксикарбонил, изопропоксикарбонил, изобутилоксикарбонил, дифенилметоксикарбонил, 2,2,2-трихлорэтоксикарбонил, 2,2,2-трибромэтоксикарбонил, 2-(триметилсилил)этоксикарбонил, 2-(фенилсульфонил)этоксикарбонил, 2-(трифенилфосфонио)этоксикарбонил, 2-фурфурилоксикарбонил, 1-адамантилоксикарбонил, винилоксикарбонил, аллилоксикарбонил, S-бензилтиокарбонил, 4-этокси-1-нафтилоксикарбонил, 8-хинолилоксикарбонил, ацетил, формил, хлорацетил, дихлорацетил, трихлорацетил, трифторацетил, метоксиацетил, феноксиацетил, пивалоил или бензоил; алкильные группы, такие как метил, изопропил, изобутил, трет-бутил, 2,2, 2-трихлорэтил или 2-триметилсилилэтил; алкенильные группы, такие как аллил; аралкильные группы, такие как бензил, п-метоксибензил, 3,4-диметоксибензил, дифенилметил или тритил; кислород- или серосодержащие гетероциклические группы, такие как тетрагидрофурил, тетрагидропиранил или тетрагидротиопиранил; алкоксиалкильные группы, такие как метоксиметил, бензилоксиметил, 2-метоксиэтоксиметил, 2,2,2-трихлорэтоксиметил, 2-(триметилсилил)этоксиметил или 1-этоксиэтил; алкилсульфонильные или арилсульфонильные группы, такие как метансульфонил или п-толуолсульфонил; и замещенные силильные группы, такие как триметилсилил, триэтилсилил, триизопропилсилил, диэтилизопропилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, дифенилметилсилил или трет-бутилметоксифенилсилил.
Любая защитная группа может использоваться в качестве защитной группы для альдегидной группы, поскольку ее можно применять как обычную альдегидзащитную группу. Примеры такой защитной группы могут включать диалкилацетали, такие как диметилацеталь и 5- или 6-членные циклические ацетали, такие как 1,3-диоксолан или 1,3-диоксан.
Любая защитная группа может использоваться в качестве защитной группы для амидиногруппы, поскольку ее можно применять как обычную амидинозащитную группу. Примеры такой защитной группы могут включать: ацильные группы, такие как (моно-, ди- или три-)хлорацетил, трифторацетил, фенилацетил, формил, ацетил, бензоил, фталоил, сукцинил или аминокислотный остаток с незащищенным или защищенным N-концом (примеры аминокислоты могут включать глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, аспарагиновую кислоту, глутаминовую кислоту, аспарагин, глутамин, аргинин, лизин, гистидин, гидроксилизин, фенилаланин, тирозин, триптофан, пролин и гидроксипролин); алкилоксикарбонильные группы, такие как метоксикарбонил, этоксикарбонил, пропилоксикарбонил, бутилоксикарбонил, пентилоксикарбонил, гексилоксикарбонил, гептилоксикарбонил, морфолиноэтоксикарбонил, трихлорэтоксикарбонил, трибромэтоксикарбонил, 1-ацетоксиэтоксикарбонил, 5-метил-2-оксо-1,3-диоксол-4-ил-метоксикарбонил, трет-пентилоксикарбонил, трет-бутоксикарбонил, дифенилметоксикарбонил, 1,1-диметилпропоксикарбонил, изопропоксикарбонил или 1-адамантилоксикарбонил; циклоалкилоксикарбонильные группы, такие как циклопентилокси или циклогексилокси; аралкилоксикарбонильные группы, такие как бензилоксикарбонил, о-бромбензилоксикарбонил, п-нитробензилоксикарбонил, п-метоксибензилоксикарбонил или 3,4-диметоксибензилоксикарбонил; арилоксикарбонильные группы, такие как фенилоксикарбонил, 4-фторфенилоксикарбонил, 4-метоксифенилоксикарбонил или 8-хинолилоксикарбонил; алкилтиокарбонильные группы, такие как этилтиокарбонил; аралкильные группы, такие как бензил, дифенилметил или тритил; алкоксиалкильные группы, такие как метоксиметил, бензилоксиметил, 2-метоксиэтоксиметил, 2,2,2-трихлорэтоксиметил, 2-(триметилсилил)этоксиметил или 1-этоксиэтил; арилтиогруппы, такие как 2-нитрофенилтио или 2,4-динитрофенилтио; алкильсульфонильные или арилсульфонильные группы, такие как метансульфонил или п-толуолсульфонил; диалкиламиноалкилиденовые группы, такие как N,N-диметиламинометилен; аралкилиденовые группы, такие как бензилиден, 2-гидроксибензилиден, 2-гидрокси-5-хлорбензилиден или 2-гидрокси-1-нафтилметилен; азотсодержащие гетероциклические алкилиденовые группы, такие как 3-гидрокси-4-пиридилметилен; циклоалкилиденовые группы, такие как циклогексилиден, 2-этоксикарбонилциклогексилиден, 2-этоксикарбонилциклопентилиден, 2-ацетилциклогексилиден или 3,3-диметил-5-оксициклогексилиден; кислородсодержащие гетероциклические алкильные группы, такие как 5-метил-2-оксо-2Н-1,3-диоксол-4-ил-метил; и замещенные силильные группы, такие как триметилсилил.
По отношению к соединению, представленному общей формулой [1] или его соли, примеры такой соли соединения могут включать общеизвестные соли по основным группам, таким как аминогруппа, или по кислотным группам, таким как гидроксильная или карбоксильная группа. Примеры такой соли по основной группе могут включать: соли, образованные минеральными кислотами, такими как хлористоводородная кислота, бромистоводородная кислота или серная кислота; соли, образованные органическими карбоновыми кислотами, такими как винная кислота, муравьиная кислота, уксусная кислота, лимонная кислота, трихлоруксусная кислота или трифторуксусная кислота; и соли, образованные сульфоновыми кислотами, такими как метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, мезитиленсульфоновая кислота или нафталинсульфоновая кислота. Примеры такой соли по кислотной группе могут включать: соли, образованные щелочными металлами, такими как натрий или калий; соли, образованные щелочно-земельными металлами, такими как кальций или магний; соли аммония; и соли, образованные азотсодержащими органическими основаниями, такими как триметиламин, триэтиламин, трибутиламин, пиридин, N,N-диметиланилин, N-метилпиперидин, N-метилморфолин, диэтиламин, дициклогексиламин, прокаин, дибензиламин, N-бензил-β-фенэтиламин или N, N'-дибензилэтилендиамин. Из вышеописанных солей предпочтительные соли соединения, представленного общей формулой [1], могут включать фармакологически приемлемые соли.
Заместители по настоящему изобретению, R3, R3c, R3f, R4, R4c, R4f, R5, R5d, R5g, R6, R6d, R6g, R7, R7a, R7b, R7d, R7g, Ra, Rb, Rba и Rbb могут далее быть замещены, по меньшей мере, одной группой, выбранной из группы, состоящей из цианогруппы, нитрогруппы, атома галогена, сульфогруппы, фосфорильной группы, незащищенной или защищенной карбоксильной, гидроксильной, амино, карбамоильной, гидроксикарбамоильной, аминосульфонильной, гидроксил-низшей алкильной, амино-низшей алкильной, циклической амино, низшей алкиламино и низшей алкиламино-низшей алкильной групп, низшей алкильной группой, низшей алкенильной группы, низшей алкоксигруппы, низшей алкоксикарбонильной группы, ацильной группы, арильной группы, гетероциклической группы, циклоалкильной группы, аралкильной группы, низшей алкилиденовой группы, меркаптогруппы, низшей алкилтиогруппы, низшей алкилсульфинильной группы, низшей алкилсульфонильной группы, низшей алкилкарбамоильной группы, низшей алкилсульфониламиногруппы, низшей алкиламиносульфонильной группы, карбоксил-низшей алкильной группы, карбоксил-низшей алкенильной группы, гидроксил-гетероциклической группы, низшей алкилгетероциклической группы, низшей алкокси-низшей алкоксигруппы, галоген-низшей алкильной группы, низшей алкокси-низшей алкильной группы, низшей алкоксикарбонил-низшей алкильной группы и низшей алкоксииминогруппы.
Заместители R1, R8, R8a, R8b, R8d, R8e, R8q и R8h могут далее быть замещены, по меньшей мере, одной группой, выбранной из группы, состоящей из незащищенной или защищенной гидроксильной группы, низшей алкильной группы, низшей алкенильной группы, низшей алкоксигруппы, низшей алкоксикарбонильной группы, ацильной группы, арильной группы, гетероциклической группы, циклоалкильной группы и аралкильной группы.
Заместители X, Y, Ya, Yc, Yd, Ye, Yg, Yh, Z, Za, Zb, Zd, Ze, Zg, Zh и W могут далее быть замещены, по меньшей мере, одной группой, выбранной из группы, состоящей из цианогруппы, нитрогруппы, атома галогена, незащищенной или защищенной амино, гидроксильной, карбоксильной, карбамоильной, гидроксикарбамоильной и низшей алкиламиногруппы, низшей алкоксикарбонильной группы, ацильной группы, арильной группы, гетероциклической группы, циклоалкильной группы, низшей алкенильной группы, низшей алкилсульфонилкарбамоильной группы, низшей алкилкарбамоильной группы, низшей алкоксигруппы и низшей алкоксикарбонильной группы.
Заместители Yb, Yc', Ye' и Yh' могут далее быть замещены, по меньшей мере, одной группой, выбранной из группы, состоящей из цианогруппы, нитрогруппы, атома галогена, незащищенной или защищенной амино, карбоксильной, карбамоильной, гидроксикарбамоильной, гидроксильной группы, низшей алкиламиногруппы, низшей алкоксикарбонильной группы, ацильной группы, арильной группы, гетероциклической группы, циклоалкильной группы, низшей алкилсульфонилкарбамоильной группы, низшей алкилкарбамоильной группы, низшей алкоксигруппы, низшей алкоксикарбонильной группы и кето-группы.
Описанные выше заместители могут далее быть замещены группами, представленными в виде примеров как заместители для каждого заместителя.
Кроме того, гетероциклическая группа и циклическая аминогруппа в качестве вышеуказанных заместителей для каждого заместителя могут также быть замещены кето-группами.
Следующие соединения могут предпочтительно применяться в качестве соединений по настоящему изобретению.
Соединение, где R1 представляет собой незащищенную или защищенную амидиногруппу, является предпочтительным. Соединение, где R1 представляет собой амидиногруппу, является более предпочтительным.
Соединение, где Х представляет собой незамещенную или замещенную низшую алкиленовую группу, является предпочтительным. Соединение, где Х представляет собой низшую алкиленовую группу, является более предпочтительным, а соединение, где Х представляет собой С2-4 низшую алкиленовую группу, является еще более предпочтительным.
Соединение, где G1 представляет собой атом кислорода, является предпочтительным.
Соединение, где G2 представляет собой атом углерода, является предпочтительным.
Соединение, где Ra представляет собой, по меньшей мере, одну группу, выбранную из атома водорода или атома галогена, является предпочтительным, а соединение, где Ra представляет собой атом водорода, является более предпочтительным.
В предпочтительном соединении R2 предпочтительно представляет группу, представленную следующими формулами (1), (2) или (3):
(1)

где R3с представляет собой атом водорода, аминозащитную группу или незамещенную или замещенную циклоалкильную или алкенильную группу; и R4c представляет собой атом водорода, аминозащитную группу, незамещенную или замещенную циклоалкильную или алкенильную группу,
(2)
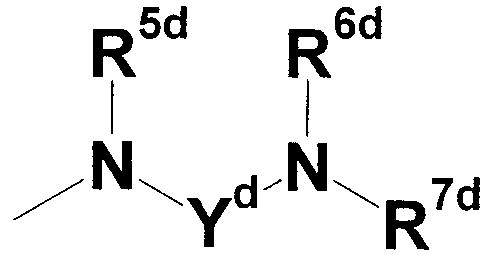
где Yd представляет собой незамещенную или замещенную С2-6 низшую алкиленовую группу или C3-6 алкениленовую группу; каждый из R5d и R6d, которые могут быть одинаковыми или различными, представляет собой атом водорода, аминозащитную группу или незамещенную или замещенную алкильную, циклоалкильную или алкенильную группу; и R7d представляет собой атом водорода, аминозащитную группу, незамещенную или замещенную алкильную, циклоалкильную или алкенильную группу или группу, представленную следующей формулой:

где Zd представляет собой незамещенную или замещенную низшую алкиленовую или алкениленовую группу; R8d представляет собой незащищенную или защищенную или незамещенную или замещенную амидиногруппу или
(3)
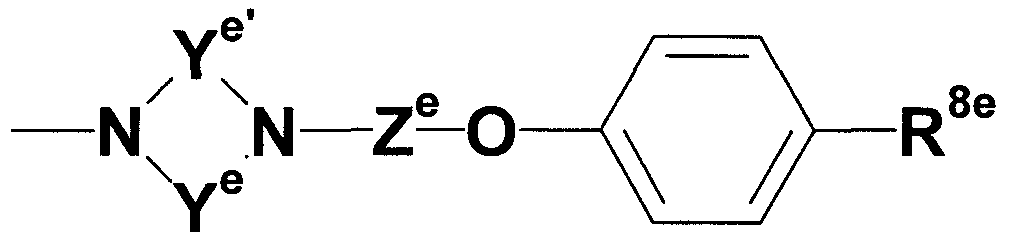
где каждый из Ye и Ye', которые могут быть одинаковыми или различными, представляет собой незамещенную или замещенную C2-4 низшую алкиленовую группу; Ze представляет собой незамещенную или замещенную низшую алкиленовую или алкениленовую группу; и R8e представляет собой незащищенную или защищенную или незамещенную или замещенную амидиногруппу. В более предпочтительном соединении R2 более предпочтительно представляет группу, представленную следующей формулой:

где каждый из Ye и Ye', которые могут быть одинаковыми или различными, представляет собой незамещенную или замещенную C2-4 низшую алкиленовую группу; Ze представляет собой незамещенную или замещенную низшую алкиленовую или алкениленовую группу; и R8e представляет собой незащищенную или защищенную или незамещенную или замещенную амидиногруппу.
Кроме того, в предпочтительном соединении R2 предпочтительно представляет группу, представленную следующими формулами (1), (2) или (3):
(1)
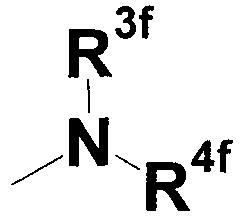
где R3f представляет собой атом водорода, аминозащитную группу, незамещенную или замещенную циклоалкильную или алкенильную группу; и R4f представляет собой атом водорода, аминозащитную группу, незамещенную или замещенную алкильную, циклоалкильную или алкенильную группу,
(2)

где Yg представляет собой незамещенную или замещенную С2-6 низшую алкиленовую группу или C3-6 алкениленовую группу; каждый из R5g и R6g, которые могут быть одинаковыми или различными, представляет собой атом водорода, аминозащитную группу, незамещенную или замещенную алкильную, циклоалкильную или алкенильную группу; и R7g представляет собой атом водорода, аминозащитную группу, незамещенную или замещенную алкильную, циклоалкильную или алкенильную группу или группу, представленную следующей формулой:
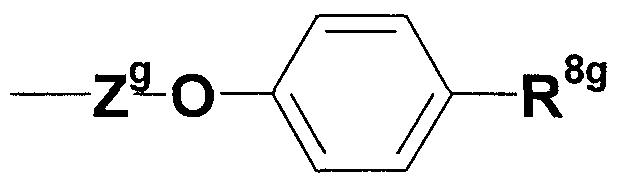
где Zg представляет собой незамещенную или замещенную низшую алкиленовую или алкениленовую группу; R8g представляет собой незащищенную или защищенную или незамещенную или замещенную амидиногруппу или
(3)
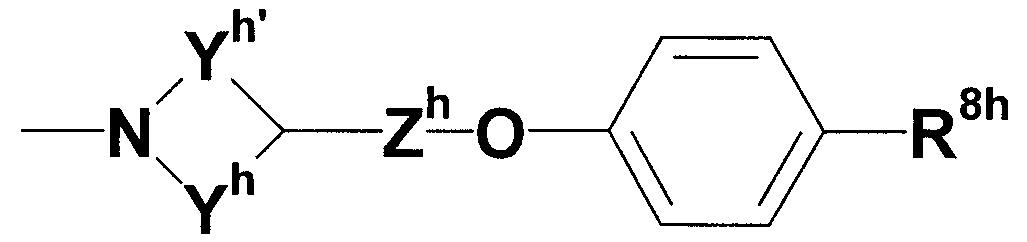
где каждый из Yh и Yh', которые могут быть одинаковыми или различными, представляет собой незамещенную или замещенную C2-4 низшую алкиленовую группу; Zh представляет собой незамещенную или замещенную низшую алкиленовую или алкениленовую группу; и R8h представляет собой незащищенную или защищенную или незамещенную или замещенную амидиногруппу. Кроме того, в более предпочтительном соединении R2 более предпочтительно представляет собой группу, представленную следующей формулой:

где каждый из Yh и Yh', которые могут быть одинаковыми или различными, представляет собой незамещенную или замещенную C2-4 низшую алкиленовую группу; Zh представляет собой незамещенную или замещенную низшую алкиленовую или алкениленовую группу; и R8h представляет собой незащищенную или защищенную или незамещенную или замещенную амидиногруппу.
В предпочтительном соединении R3c, являющийся предпочтительным заместителем R2, представляет собой атом водорода, аминозащитную группу или незамещенную или замещенную циклоалкильную группу. В более предпочтительном соединении, R3c, предпочтительный заместитель R2, представляет собой атом водорода или аминозащитную группу.
Кроме того, в предпочтительном соединении R4c, являющийся предпочтительным заместителем R2, представляет собой атом водорода, аминозащитную группу или незамещенную или замещенную алкильную или циклоалкильную группу. В более предпочтительном соединении, R4c, предпочтительный заместитель R2, представляет собой атом водорода, аминозащитную группу, или незамещенную или замещенную алкильную группу. В еще более предпочтительном соединении, R4c, предпочтительный заместитель R2, представляет собой атом водорода, аминозащитную группу или алкильную группу, которая может быть замещена карбоксильной группой.
Кроме того, в предпочтительном соединении R5d, являющийся предпочтительным заместителем R2, представляет собой атом водорода, аминозащитную группу или незамещенную или замещенную алкильную или циклоалкильную группу. В более предпочтительном соединении, R5d, предпочтительный заместитель R2, представляет собой атом водорода, аминозащитную группу, или незамещенную или замещенную алкильную группу. В еще более предпочтительном соединении, R5d, предпочтительный заместитель R2, представляет собой атом водорода или аминозащитную группу.
Более того, в предпочтительном соединении R6d, являющийся предпочтительным заместителем R2, представляет собой атом водорода, аминозащитную группу или незамещенную или замещенную алкильную или циклоалкильную группу. В более предпочтительном соединении, R6d, предпочтительный заместитель R2, представляет собой атом водорода, аминозащитную группу, или незамещенную или замещенную алкильную группу. В еще более предпочтительном соединении, R6d, предпочтительный заместитель R2, представляет собой атом водорода или аминозащитную группу.
Более того, в предпочтительном соединении R7d, являющийся предпочтительным заместителем R2, представляет собой атом водорода, аминозащитную группу или незамещенную или замещенную алкильную или циклоалкильную группу. В более предпочтительном соединении, R7d, предпочтительный заместитель R2, представляет собой атом водорода, аминозащитную группу, или незамещенную или замещенную алкильную группу. В еще более предпочтительном соединении, R7d, предпочтительный заместитель R2, представляет собой атом водорода, аминозащитную группу или алкильную группу, которая может быть замещена низшей алкоксикарбонильной или карбонильной группой.
Более того, в предпочтительном соединении R8d, являющийся предпочтительным заместителем R2, представляет собой незащищенную или защищенную амидиногруппу. В более предпочтительном соединении R8d, предпочтительный заместитель R2 , представляет собой амидиногруппу.
Более того, в предпочтительном соединении Yd, являющийся предпочтительным заместителем R2, представляет собой незамещенную или замещенную С2-6 низшую алкиленовую группу. В более предпочтительном соединении Yd, предпочтительный заместитель R2, представляет собой С2-6 низшую алкиленовую группу. В еще более предпочтительном соединении Yd, предпочтительный заместитель R2, представляет собой С2-3 низшую алкиленовую группу.
Более того, в предпочтительном соединении Zd, являющийся предпочтительным заместителем R2, представляет собой незамещенную или замещенную низшую алкиленовую группу. В более предпочтительном соединении, Zd, предпочтительный заместитель R2, представляет собой низшую алкиленовую группу. В еще более предпочтительном соединении Zd, предпочтительный заместитель R2, представляет собой С2-4 низшую алкиленовую группу.
Более того, в предпочтительном соединении Ye, являющийся предпочтительным заместителем R2, представляет собой С2-4 низшую алкиленовую группу. В более предпочтительном соединении, Ye, предпочтительный заместитель R2 , представляет собой С2-3 низшую алкиленовую группу.
Более того, в предпочтительном соединении, Ye', являющийся предпочтительным заместителем R2, представляет собой С2-4 низшую алкиленовую группу. В более предпочтительном соединении Ye', предпочтительный заместитель R2, представляет собой С2-3 низшую алкиленовую группу.
Более того, в предпочтительном соединении Ze, являющийся предпочтительным заместителем R2, представляет собой незамещенную или замещенную низшую алкиленовую группу. В более предпочтительном соединении Ze, предпочтительный заместитель R2, представляет собой низшую алкиленовую группу. В еще более предпочтительном соединении Ze, предпочтительный заместитель R2, представляет собой С2-4 низшую алкиленовую группу.
Более того, в предпочтительном соединении R8e, являющийся предпочтительным заместителем R2, представляет собой незащищенную или защищенную амидиногруппу. В более предпочтительном соединении R8e, предпочтительный заместитель R2, представляет собой амидиногруппу.
Более того, в предпочтительном соединении R8g, являющийся предпочтительным заместителем R2, представляет собой незащищенную или защищенную амидиногруппу. В более предпочтительном соединении R8g, предпочтительный заместитель R2, представляет собой амидиногруппу.
Более того, в предпочтительном соединении Yg, являющийся предпочтительным заместителем R2, представляет собой незамещенную или замещенную С2-6 низшую алкиленовую группу. В более предпочтительном соединении Yg, предпочтительный заместитель R2, представляет собой С2-6 низшую алкиленовую группу. В еще более предпочтительном соединении Yg, предпочтительный заместитель R2, представляет собой С2-3 низшую алкиленовую группу.
Более того, в предпочтительном соединении Yh, являющийся предпочтительным заместителем R2, представляет собой С2-4 низшую алкиленовую группу. В более предпочтительном соединении Yh, предпочтительный заместитель R2, представляет собой С2-3 низшую алкиленовую группу.
Более того, в предпочтительном соединении Yh', являющийся предпочтительным заместителем R2, представляет собой С2-4 низшую алкиленовую группу. В более предпочтительном соединении Yh', предпочтительный заместитель R2 , представляет собой С2-3 низшую алкиленовую группу.
Более того, в предпочтительном соединении Zg, являющийся предпочтительным заместителем R2, представляет собой незамещенную или замещенную низшую алкиленовую группу. В более предпочтительном соединении Zg, предпочтительный заместитель R2, представляет собой низшую алкиленовую группу. В еще более предпочтительном соединении Zg, предпочтительный заместитель R2, представляет собой С2-4 низшую алкиленовую группу.
Более того, в предпочтительном соединении Zh, являющийся предпочтительным заместителем R2, представляет собой незамещенную или замещенную низшую алкиленовую группу. В более предпочтительном соединении Zh, предпочтительный заместитель R2, представляет собой низшую алкиленовую группу. В еще более предпочтительном соединении Zh, предпочтительный заместитель R2, представляет собой С2-4 низшую алкиленовую группу.
Более того, в предпочтительном соединении R8h, являющийся предпочтительным заместителем R2, представляет собой незащищенную или защищенную амидиногруппу. В более предпочтительном соединении R8h, предпочтительный заместитель R2 , представляет собой амидиногруппу.
В настоящем изобретении примеры предпочтительной аминозащитной группы могут включать ацильную группу, алкилоксикарбонильную группу, арилоксикарбонильную группу, аралкилоксикарбонильную группу, аралкильную группу, алкоксиалкильную группу, арилтио группу, алкилсульфонильную группу, арилсульфонильную группу, диалкиламиноалкилиденовую группу, аралкилиденовую группу, азотсодержащую гетероциклическую аралкилиденовую группу, циклоалкилиденовую группу, кислородсодержащую гетероциклическую алкильную группу и замещенную силильную группу. Примеры более предпочтительной аминозащитной группы могут включать ацильную группу, алкилоксикарбонильную группу, арилоксикарбонильную группу, аралкилоксикарбонильную группу, аралкильную группу и алкоксиалкильную группу.
В настоящем изобретении примеры предпочтительной амидинозащитной группы могут включать ацильную группу, алкилоксикарбонильную группу, арилоксикарбонильную группу, аралкилоксикарбонильную группу, аралкильную группу, алкоксиалкильную группу, арилтиогруппу, алкилсульфонильную группу, арилсульфонильную группу, кислородсодержащую гетероциклическую алкильную группу и замещенную силильную группу. Примеры более предпочтительного примера могут включать ацильную группу, аралкильную группу и алкоксиалкильную группу.
Соединения, приведенные в табл.1 - 13 ниже, являются представительными соединениями настоящего изобретения. В таблицах, Ме представляет метил; Et представляет этил; Pr представляет пропил; Bu представляет бутил; Bn представляет бензил; c-Pr представляет циклопропил; Cbz представляет бензилоксикарбонил; Ac представляет ацетил; Ph представляет фенил; Boc представляет трет-бутоксикарбонил; и Phe представляет остаток фенилаланина.
Когда изомер (например, оптический изомер, геометрический изомер, таутомер и т.д.) присутствует в соединении, представленном общей формулой [1] или его соли, данные изомеры включены в настоящее изобретение. В дополнение, сольват, гидрат и различные формы кристаллов также включены в настоящее изобретение.
В следующем разделе будет описан способ получения соединения настоящего изобретения.
Соединение настоящего изобретения получают посредством комбинированного применения известных способов. Например, его можно получить по следующим схемам [Схема 1].
Соединение, представленное общей формулой [1], может быть получено, например, по следующей схеме:
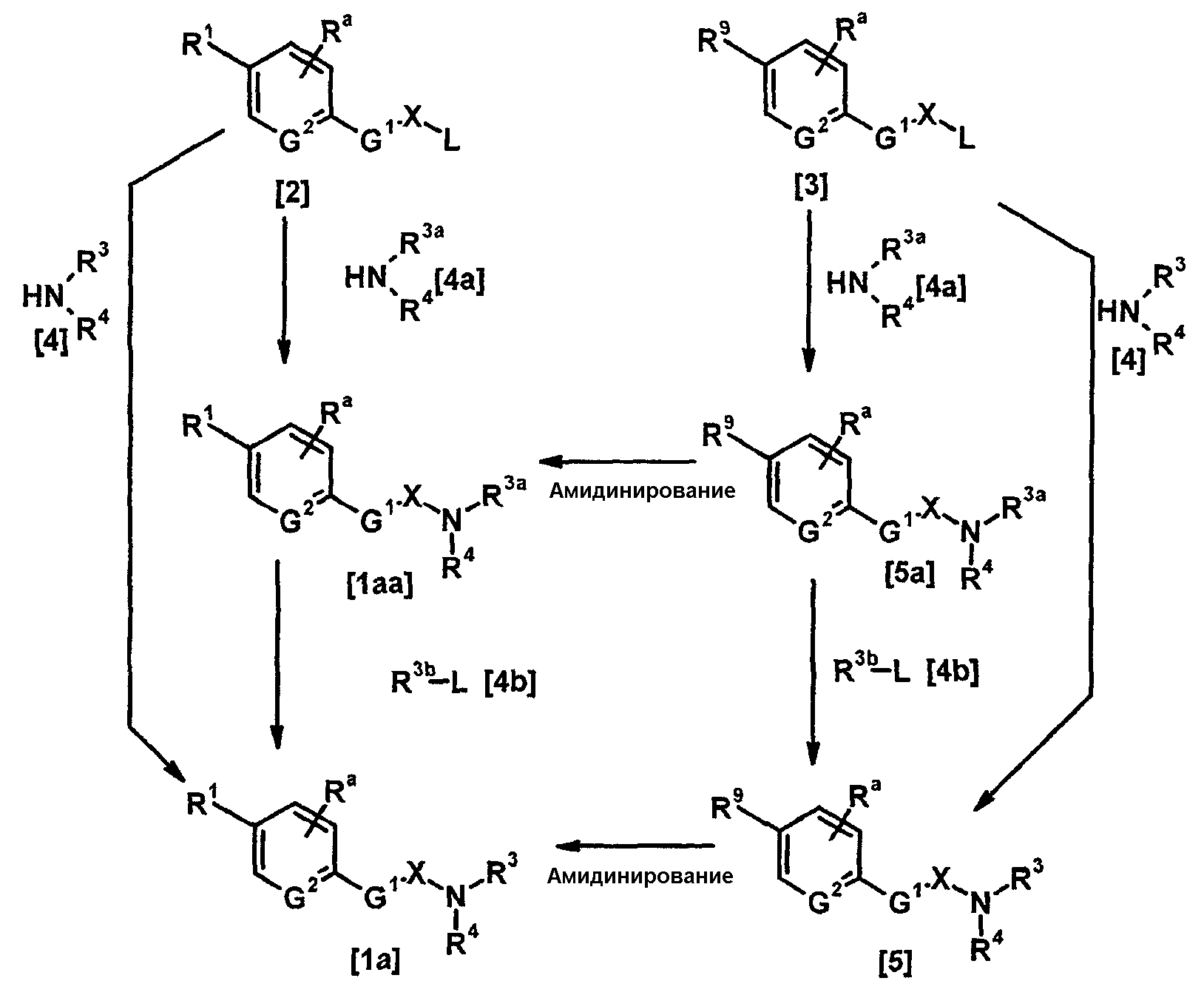
где R3a представляет собой атом водорода, R3b представляет собой такой же заместитель, что и для R3, за исключением атома водорода; R9 представляет собой цианогруппу или амидную группу; L представляет собой удаляемую группу; каждый из X, R1, R3, R4, Ra, G1 и G2 имеет такое же значение, как описано ниже.
Соединения, представленные общими формулами [2] и [3], могут быть получены способом, описанным в публикации международной заявки WO96/16947, или способами, эквивалентными данному способу.
(1-а)
Соединения, представленные общими формулами [1а] и [1аа], могут быть получены взаимодействием соединения, представленного общей формулой [2], с соединениями, представленными общими формулами [4] и [4a] соответственно, в присутствии или в отсутствие основания.
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорметан; ароматические углеводороды, такие как бензол, толуол или ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; и сульфоксиды, такие как диметилсульфоксид. Данные растворители могут применяться в сочетании.
Примеры основания, которое применяют в данной реакции, по желанию, могут включать: алкоксиды металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия или трет-бутоксид натрия; неорганические основания, такие как гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия или гидрид калия; и органические основания, такие как триэтиламин или пиридин. Такое основание может применяться по отношению к соединению, представленному общей формулой [2], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 3:1.
В данной реакции соединения, представленные общими формулами [4] и [4а], могут применяться по отношению к соединению, представленному общей формулой [2], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 5:1.
Данная реакция может осуществляться при температуре от 0 до 200°С, предпочтительно от 0 до 150°С, в течение времени от 1 минуты до 24 часов.
(1-b)
Соединение, представленное общей формулой [1а], может быть получено взаимодействием соединения, представленного общей формулой [1аа], с соединением, представленным общей формулой [4b], в присутствии или в отсутствие основания.
Данная реакция может осуществляться тем же образом, что и реакция, описанная в схеме 1-а.
В данной реакции соединение, представленное общей формулой [4b], может применяться по отношению к соединению, представленному общей формулой [1аа], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 5:1.
Данная реакция может осуществляться при температуре от 0 до 200°С, предпочтительно от 0 до 150°С, в течение времени от 1 минуты до 24 часов.
(1-с)
Каждое из соединений, представленных общими формулами [5] и [5а], может быть получено взаимодействием соединения, представленного общей формулой [3], с каждым из соединений, представленных общими формулами [4], [4а] и [4b], в соответствии со схемами 1-а и 1-b.
(1-d)
Соединения [1а] и [1аа] могут быть получены амидинированием соединений [5] и [5а] соответственно.
Когда R9 представляет собой цианогруппу, амидинирование может проводиться в соответствии со способами, описанными в публикации международной заявки WO96/16947; Journal of Medicinal Chemistry (J. Med. Chem.), vol. 36, pp. 1811-1819; Journal of Organic Chemistry (J. Org. Chem.), vol. 64, pp. 12-13, 1999; и Journal of American Chemical Society (J. Am. Chem. Soc.), vol. 107, pp. 2743-2748, 1985 или способами, эквивалентными данным способам.
Иным образом, когда амидинирование осуществляют посредством амидоксимного пути или его аналога, реакция может осуществляться в соответствии со способами, описанными в Tetrahedron, vol. 52, pp. 12047-12068, 1995; Synthetic Communication, vol. 26, pp. 4351-4367, 1996; Journal of Medicinal Chemistry (J. Med. Chem.), vol. 43, pp. 4063-4070, 2000; та же публикация, vol. 44, pp. 1217-1230, 2001; и Chemical and Pharmaceutical Bulletin (Chem. Pharm. Bull.), vol. 49, pp. 268-277, 2001, или способами, эквивалентными данным способам.
Более конкретно, реакция может осуществляться по способу, описанному как "схема 2."
Когда R9 представляет собой амидную группу, амидинирование может осуществляться в соответствии со способами, описанными в Journal of Organic Chemistry (J. Org. Chem.), vol. 33, pp. 1679-1681, 1968, или способами, эквивалентными данным способам.
(1-е)
Соединение, из которого удаляют аминозащитную группу, может быть получено должным образом из соединений, представленных общими формулами [1aa] и [5а], где в соединениях, представленных общими формулами [1a] и [5], как R3, так и R4 представляют собой аминозащитные группы, или один из R3 и R4 представляет собой аминозащитную группу.
[Схема 2]
Соединение, представленное общей формулой [1a], может быть получено, например, по следующей схеме:

где каждый из X, Ra, R1, R3, R4, G1, G2 и L имеет такое же значение, как описано выше; каждый из R10 и R11 представляет собой алкильную группу; L2 представляет собой атом галогена или ацилоксигруппу; и R13 представляет собой атом водорода или незамещенную или замещенную ацильную группу.
(2-а)
Соединение, представленное общей формулой [6], может быть получено взаимодействием соединения, представленного общей формулой [5], с соединением, представленным общей формулой [7], в присутствии кислоты.
В качестве растворителя, используемого в данной реакции, может использоваться соединение, представленное общей формулой [7], или могут применяться любые другие растворители, если они не влияют на реакцию. Примеры растворителя могут включать: простые эфиры, такие как диоксан, тетрагидрофуран, анизол или диэтиловый эфир диэтиленгликоля; кетоны, такие как ацетон или 2-бутанон; и галогенированные углеводороды, такие как метиленхлорид, хлороформ или 1,2-дихлорэтан. Данные растворители могут применяться в сочетании.
Примеры кислоты, которую применяют в данной реакции, могут включать хлористоводородную кислоту, бромистоводородную кислоту, перхлорную кислоту, п-толуолсульфоновую кислоту и метансульфоновую кислоту. Такая кислота может применяться по отношению к соединению, представленному общей формулой [5а], при молярном отношении от 1:1 до 200:1 и предпочтительно при молярном отношении, равном от 5:1 до 100:1.
В данной реакции соединение, представленное общей формулой [7], может применяться по отношению к соединению, представленному общей формулой [5а], при молярном отношении от 1:1 до 1000:1 и предпочтительно при молярном отношении, равном от 10:1 до 100:1.
Данная реакция может осуществляться при температуре от -30 до 150°С, предпочтительно от 10 до 50°С, в течение времени от 30 минут до 24 часов.
Соединение, представленное общей формулой [1a], может быть получено взаимодействием соединения, представленного общей формулой [6], с аммиаком, соединением, представленным общей формулой [8], или соединением амина или его солью, в присутствии или в отсутствие основания.
В данной реакции может использоваться любой растворитель, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; амиды, такие как N,N-диметилформамид или N,N-диметилацетамид; и сульфоксиды, такие как диметилсульфоксид. Данные растворители могут применяться в сочетании.
Примеры соединения, представленного общей формулой [8], могут включать соли аммония, такие как хлорид аммония, бромид аммония или ацетат аммония.
Примеры соединения амина могут включать алифатические амины, такие как метиламин, этиламин, аллиламин или метоксиамин; и гидроксиламин. Такое соединение амина может применяться по отношению к соединению, представленному общей формулой [6], или его соли при молярном отношении от 1:1 до 100:1 и предпочтительно при молярном отношении, равном от 1:1 до 10:1.
Данная реакция может осуществляться при температуре от 0 до 150°С, предпочтительно от 20 до 120°С, в течение времени от 1 минуты до 24 часов.
(2-b)
Соединение, представленное общей формулой [9], может быть получено взаимодействием соединения, представленного общей формулой [5], с сульфидом водорода в присутствии основания.
Примеры основания, используемого в данной реакции, могут включать аммиак, пиридин, триэтиламин и диизопропилэтиламин.
Растворитель, используемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; простые эфиры, такие как тетрагидрофуран или диоксан; кетоны, такие как ацетон или 2-бутанон; и гетероароматические соединения, такие как пиридин. Данные растворители могут применяться в сочетании.
Сульфид водорода и основание могут применяться по отношению к соединению, представленному общей формулой [5а], при молярном отношении от 1:1 до 500:1 и при от 1:1 до 100:1 соответственно.
Данная реакция может обычно осуществляться при температуре от 0 до 150°С, предпочтительно от 10 до 100°С, в течение времени от 1 минуты до 24 часов.
Соединение, представленное общей формулой [10], может быть получено взаимодействием соединения, представленного общей формулой [9], с соединением, представленным общей формулой [11].
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; сульфоксиды, такие как диметилсульфоксид; амиды, такие как N,N-диметилформамид или N,N-диметилацетамид; кетоны, такие как ацетон или 2-бутанон; и сложные эфиры, такие как этилацетат. Данные растворители могут применяться в сочетании.
Соединение, представленное общей формулой [11], может применяться по отношению к соединению, представленному общей формулой [9], при молярном отношении от 1:1 до 100:1 и предпочтительно при молярном отношении, равном от 1:1 до 10:1.
Данная реакция может осуществляться обычно при температуре от -10 до 150°С, предпочтительно от 20 до 120°С, в течение времени от 1 минуты до 24 часов.
Соединение, представленное общей формулой [1а], может быть получено взаимодействием соединения, представленного общей формулой [10], с аммиаком, соединением, представленным общей формулой [8] или соединением амина или его солью, в присутствии или в отсутствие основания.
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; амиды, такие как N,N-диметилформамид или N,N-диметилацетамид; и сульфоксиды, такие как диметилсульфоксид. Данные растворители могут применяться в сочетании.
Как и в случае, описанном выше, примеры соединения, представленного общей формулой [8], могут включать соли аммония, такие как хлорид аммония, бромид аммония или ацетат аммония. Примеры соединения амина могут включать алифатические амины, такие как метиламин, этиламин, аллиламин или метоксиамин; и гидроксиламин. Такое соединение амина может применяться по отношению к соединению, представленному общей формулой [10], при молярном отношении от 1:1 до 100:1 и предпочтительно при молярном отношении, равном от 1:1 до 10:1.
Данная реакция может осуществляться обычно при температуре от 0 до 150°С, предпочтительно от 20 до 120°С, в течение времени от 1 минуты до 24 часов.
(2-с)
Соединение, представленное общей формулой [50], может быть получено взаимодействием соединения, представленного общей формулой [5а], с гидроксиламином или его солью в присутствии или в отсутствие основания.
В данной реакции может применяться любой растворитель, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; амиды, такие как N,N-диметилформамид или N,N-диметилацетамид; сульфоксиды, такие как диметилсульфоксид и гетероароматические соединения, такие как пиридин. Данные растворители могут также применяться в сочетании.
Примеры основания, которое применяют в данной реакции, по желанию, могут включать: алкоксиды металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия или трет-бутоксид натрия; неорганические основания, такие как гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия или гидрид калия; и органические основания, такие как триэтиламин или пиридин.
Гидроксиламин или его соль могут применяться по отношению к соединению, представленному общей формулой [5а], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 3:1.
Данная реакция может осуществляться при температуре от 0 до 150°С, предпочтительно от 50 до 150° С, в течение времени от 1 минуты до 24 часов.
Соединение, представленное общей формулой [52], может быть получено взаимодействием соединения, представленного общей формулой [50], с ангидридом кислоты или галогенангидридом кислоты в присутствии или в отсутствие основания.
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; сложные эфиры, такие как этилацетат; карбоновые кислоты, такие как уксусная кислота; кетоны, такие как ацетон или 2-бутанон; и нитрилы, такие как ацетонитрил. Данные растворители могут применяться в сочетании.
Примеры ангидрида кислоты могут включать муравьино-уксусный ангидрид, уксусный ангидрид, трихлоруксусный ангидрид и трифторуксусный ангидрид. Такой ангидрид кислоты может применяться по отношению к соединению, представленному общей формулой [50], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 5:1.
Примеры галогенангидрида кислоты могут включать ацетилхлорид, трихлорацетилхлорид и трифторацетилхлорид.
Примеры основания, которое применяют в данной реакции, по желанию, могут включать метоксид натрия, этоксид натрия, трет-бутоксид калия, трет-бутоксид натрия, гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия, гидрид калия триэтиламин и пиридин.
Каждый из указанных ангидрида кислоты, галогенангидрида кислоты и основания может применяться по отношению к соединению, представленному общей формулой [50], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 3:1.
Данная реакция может осуществляться при температуре от -20 до 100°С, предпочтительно от 0 до 50°С, в течение времени от 1 минуты до 24 часов.
Соединение, представленное общей формулой [1a], может быть получено посредством восстановления соединений, представленных общими формулами [50] и [52].
Примеры реакции восстановления, применяемой в данном описании, могут включать каталитическое гидрирование, восстановление металлами или солями металлов, восстановление соединением металл-водород, восстановление комплексным соединением металл-водород и восстановление гидразином.
Более конкретно, когда соединение, представленное общей формулой [52], подвергают каталитическому гидрированию, используя металлический катализатор, растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; амиды, такие как N,N-диметилформамид, N, N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; сложные эфиры, такие как этилацетат; карбоновые кислоты, такие как уксусная кислота; минеральные кислоты, такие как хлористоводородная кислота; и нитрилы, такие как ацетонитрил. Данные растворители могут применяться в сочетании.
Примеры металлического катализатора могут включать оксид палладия, оксид платины и палладий-углерод. Металлический катализатор может применяться по отношению к соединениям, представленным общими формулами [50] и [52], при массовом отношении (М/М), равном от 0,001:1 до 1:1, и предпочтительно при массовом отношении (М/М), равном от 0,01:1 до 0,5:1.
Примеры восстанавливающего агента могут включать цинк, муравьиную кислоту, гидразин, а также водород. Восстанавливающий агент может применяться по отношению к соединениям, представленным общими формулами [50] и [52], при молярном отношении от 1:1 до 100:1 и предпочтительно от 1:1 до 10:1.
Данная реакция может осуществляться при температуре от 0 до 200°С, предпочтительно от 0 до 100°С, в течение времени от 1 минуты до 24 часов.
[Схема 3]
Соединение, представленное общей формулой [1ab], может быть получено, например, по следующей схеме:
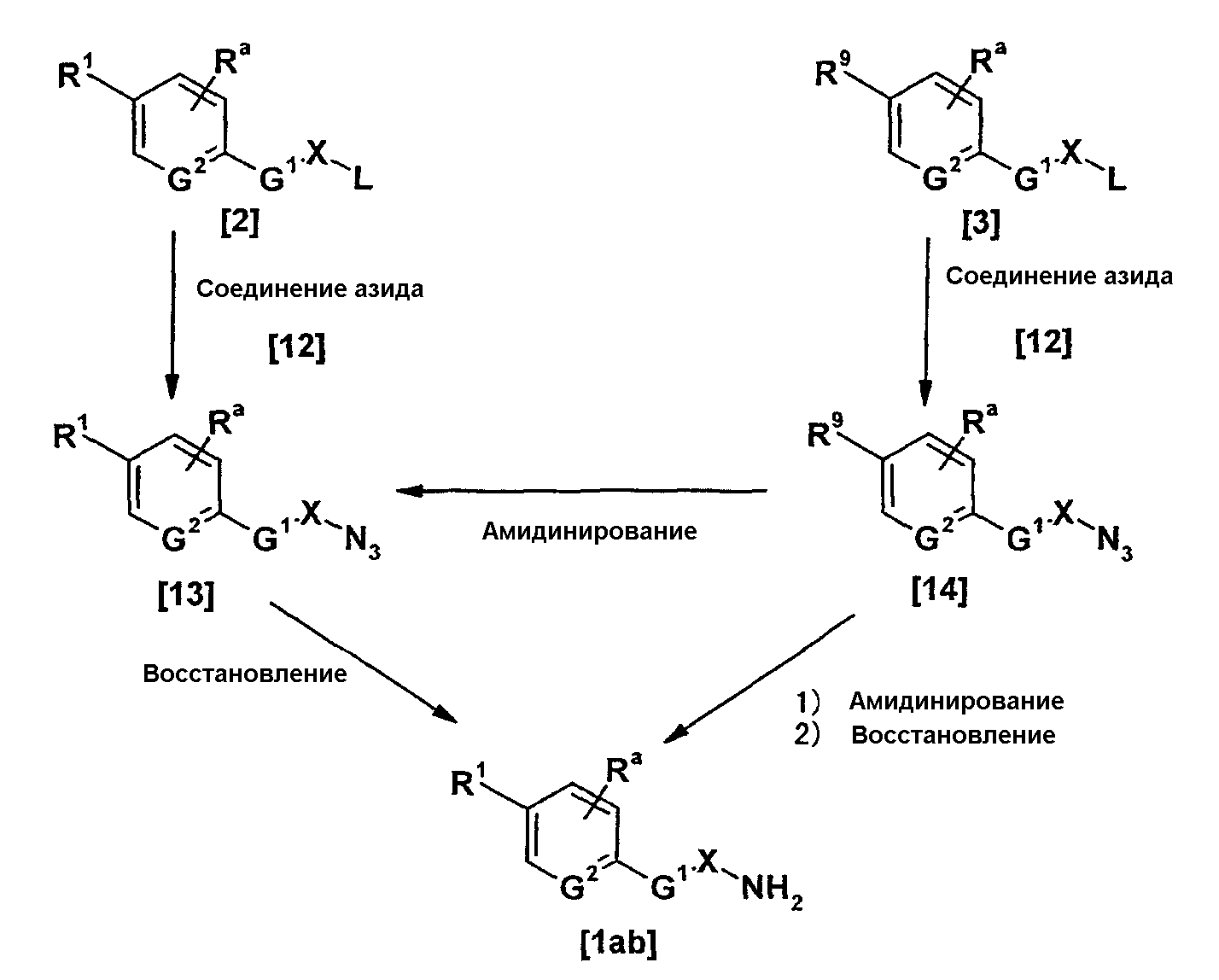
где каждый из X, Ra, R1, R9, G1, G2 и L имеет такое же значение, как описано выше.
(3-а)
Соединение, представленное общей формулой [13], может быть получено взаимодействием соединения, представленного общей формулой [2], с соединением, представленным общей формулой [12].
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; кетоны, такие как ацетон или 2-бутанон; и сульфоксиды, такие как диметилсульфоксид. Данные растворители могут применяться в сочетании.
Примеры соединения, представленного общей формулой [12], применяемого в данной реакции, могут включать азид натрия, азид лития, азид бария, азид цезия и триметилсилилазид. Соединение, представленное общей формулой [12], может применяться по отношению к соединению, представленному общей формулой [2], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении от 1:1 до 5:1.
Данная реакция может осуществляться при температуре от 0 до 200°С, предпочтительно от 0 до 150°С, в течение времени от 1 минуты до 24 часов.
Соединение, представленное общей формулой [13], может также быть получено амидинированием соединения, представленного общей формулой [14], в соответствии со схемой 1-b или схемой 2.
(3-b)
Соединение, представленное общей формулой [1ab], может быть получено восстановлением соединения, представленного общей формулой [13], известными способами, перечисленным ниже.
Примеры реакции восстановления могут включать (1) каталитическое гидрирование с использованием металлического катализатора, (2) взаимодействие с трифенилфосфином и последующую реакцию гидролиза (Tetrahedron Letters, vol. 24, pp. 763-764, 1983, и т.д.), (3) взаимодействие с боргидридом натрия (Synthesis, pp. 48-49, 1987 и т.д.) и (4) взаимодействие с неорганическими и органическими меркаптанами (the Journal of Organic Chemistry (J. Org. Chem.), vol. 44, pp. 4712-4713, 1979 и т.д.).
Более конкретно, когда применяют каталитическое гидрирование с использованием металлического катализатора, растворитель, применяемый в реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; кетоны, такие как ацетон или 2-бутанон; и нитрилы, такие как ацетонитрил. Данные растворители могут применяться в сочетании.
Примеры металлического катализатора могут включать оксид палладия, оксид платины и палладий-углерод. Металлический катализатор может применяться по отношению к соединению, представленному общей формулой [13], при массовом отношении (М/М), равном от 0,001:1 до 1:1, и предпочтительно при массовом отношении (М/М), равном от 0,01:1 до 0,5:1.
Примеры восстанавливающего агента могут включать водород и муравьиную кислоту. Восстанавливающий агент может применяться по отношению к соединению, представленному общей формулой [13], при молярном отношении от 1:1 до 100:1 и предпочтительно от 1:1 до 10:1.
Данная реакция может осуществляться при температуре от 0 до 200°С, предпочтительно от 0 до 100°С, в течение времени от 1 минуты до 24 часов.
[Схема 3-с]
Соединение, представленное общей формулой [14], может быть получено взаимодействием соединения, представленного общей формулой [3], c соединением, представленным общей формулой [12], в соответствии со схемой 3-а.
(3-d)
Соединение, представленное общей формулой [1ab], может быть получено амидинированием соединения, представленного общей формулой [14], в соответствии со схемой 1-b или схемой 2 и далее восстановлением полученного в результате продукта в соответствии со схемой 3-b.
Соединение, представленное общей формулой [1ab], подвергают взаимодействию, например, с R3a-L, (где R3a представляет собой группу для R3, отличную от атома водорода; и L представляет собой удаляемую группу) с получением таким образом еще одного соединения, представленного общей формулой [1а]. Кроме того, соединение, представленное общей формулой [14], восстанавливают и далее полученный продукт подвергают взаимодействию, например, с R3a-L (где R3a представляет собой группу для R3, отличную от атома водорода; и L представляет собой удаляемую группу) с последующим амидинированием, с получением таким образом желаемого соединения по изобретению.
[Схема 4]
Соединение, представленное общей формулой [1b], может быть получено, например, по следующей схеме:

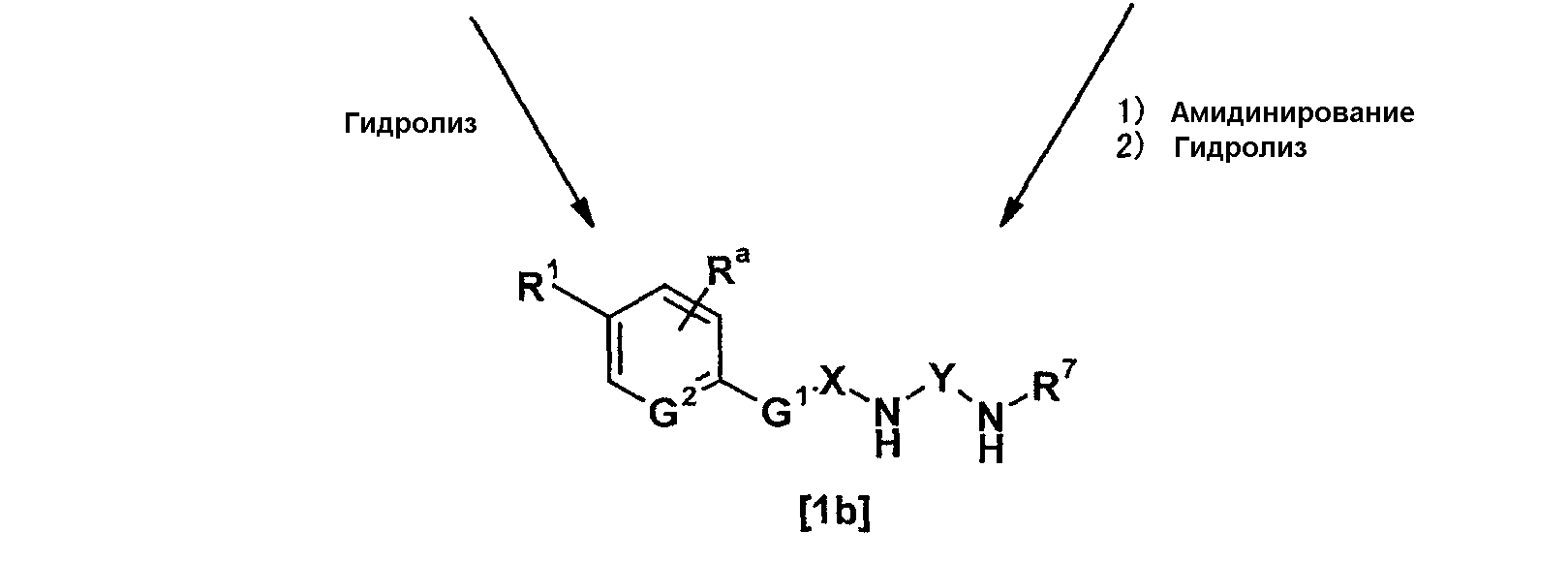
где каждый из X, Y, Ra, R1, L, R7, R9, G1 и G2 имеет такое же значение, как описано выше.
(4-а)
Соединение, представленное общей формулой [16], может быть получено взаимодействием соединения, представленного общей формулой [2], с соединением, представленным общей формулой [15], в присутствии или в отсутствие основания.
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; кетоны, такие как ацетон или 2-бутанон; и сульфоксиды, такие как диметилсульфоксид. Данные растворители могут применяться в сочетании.
Примеры основания, которое используют в данной реакции, по желанию, могут включать: алкоксиды металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия или трет-бутоксид натрия; неорганические основания, такие как гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия или гидрид калия; и органические основания, такие как триэтиламин или пиридин. Такое основание может применяться по отношению к соединению, представленному общей формулой [2], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 3:1.
В данной реакции соединение, представленное общей формулой [15], может применяться по отношению к соединению, представленному общей формулой [2], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 5:1.
Данная реакция может осуществляться при температуре от 0 до 200°С, предпочтительно от 0 до 150°С, в течение времени от 1 минуты до 24 часов.
Дополнительно, соединение, представленное общей формулой [16], может также быть получено амидинированием соединения, представленного общей формулой [17], в соответствии со схемой 1-b или схемой 2.
(4-b)
Соединение, представленное общей формулой [1b], может быть получено гидролизом соединения, представленного общей формулой [16], с использованием кислоты или основания.
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; простые эфиры, такие как тетрагидрофуран, этиловый эфир, диоксан или анизол; диметилсульфоксид, кетоны, такие как ацетон или 2-бутанон; и сульфоксиды, такие как вода. Данные растворители могут применяться в сочетании.
Примеры кислоты, применяемой в данной реакции, могут включать минеральные кислоты, такие как хлористоводородная кислота, бромистоводородная кислота или серная кислота. Такая кислота может применяться по отношению к соединению, представленному общей формулой [16], при молярном отношении от 1:1 до 1000:1 и предпочтительно при молярном отношении, равном от 1:1 до 100:1.
Примеры основания, применяемого в данной реакции, могут включать гидроксиды щелочных металлов или щелочно-земельных металлов, такие как гидроксид натрия, гидроксид калия или гидроксид бария. Такое основание может применяться по отношению к соединению, представленному общей формулой [16], при молярном отношении от 1:1 до 1000:1 и предпочтительно при молярном отношении, равном от 1:1 до 10:1.
Данная реакция может осуществляться при температуре от 0 до 150°С, предпочтительно от 0 до 100°С, в течение времени от 10 минут до 24 часов.
(4-с)
Соединение, представленное общей формулой [17], может быть получено взаимодействием соединения, представленного общей формулой [3], с соединением, представленным общей формулой [15], в присутствии или в отсутствие основания, в соответствии со схемой 4-а.
(4-d)
Кроме того, соединение, представленное общей формулой [1b], может быть получено амидинированием соединения, представленного общей формулой [17], в соответствии со схемой 1-b или схемой 2 и далее, подвергая полученный в результате продукт реакции гидролиза в соответствии со схемой 4-b.
[Схема 5]
Соединение, представленное общей формулой [1b], может быть получено, например, по следующей схеме:
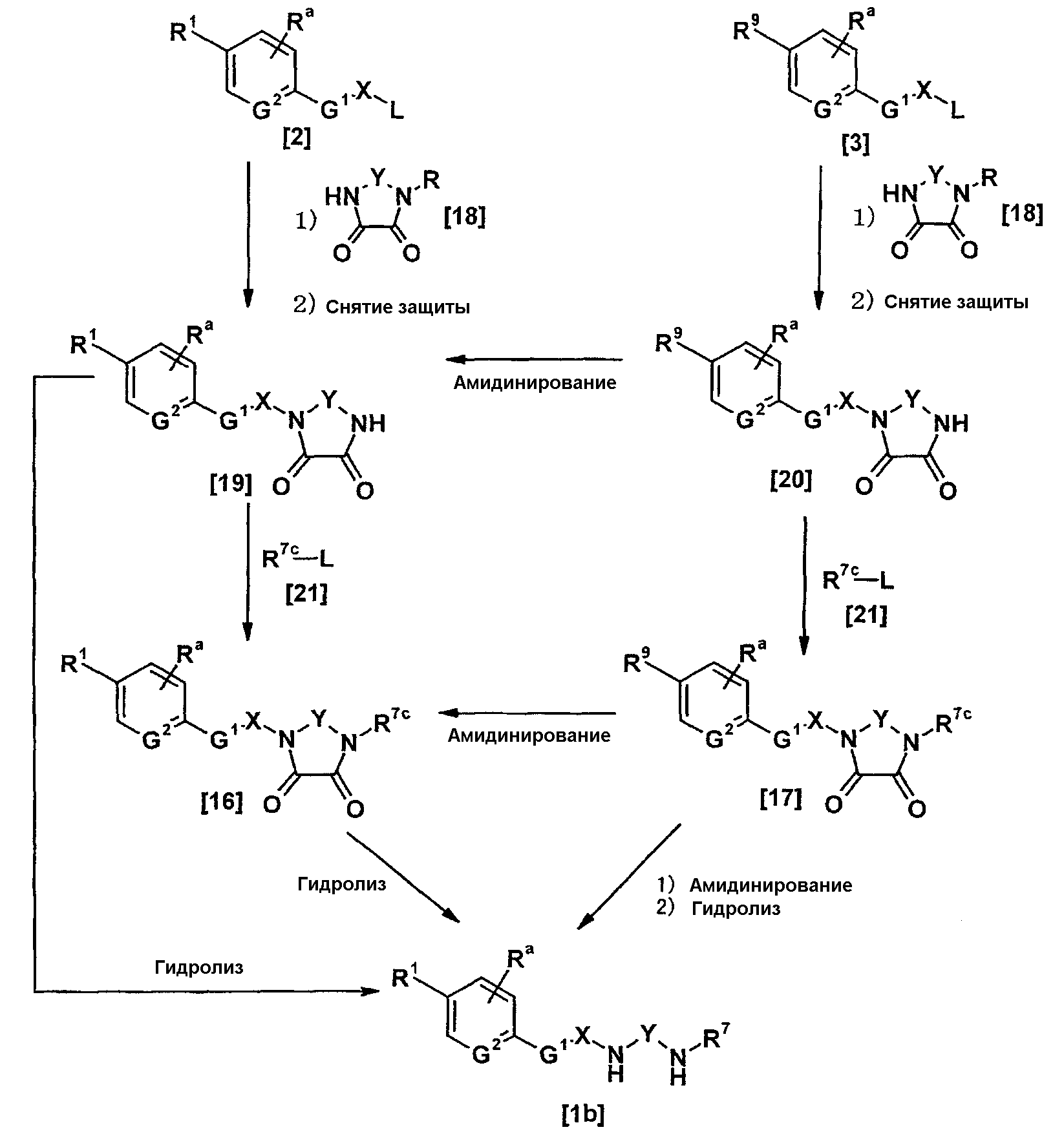
где R7c представляет собой любой из тех же заместителей, что и для R7, за исключением атома водорода; каждый из X, Y, Ra, R1, R7, L, R9, G1 и G2 имеет такое же значение, как описано выше; и R представляет собой аминозащитную группу.
Соединение, представленное общей формулой [18], может быть получено в соответствии со способом, описанным в Yakugaku Zasshi (Journal of the Pharmaceutical Society of Japan, vol. 99, pp. 929-935, 1979) и т.д., или способами, эквивалентными данному способу.
Каждое из соединений, представленных общими формулами [19] и [20], может быть получено взаимодействием каждого из соединений, представленных общими формулами [2] и [3], с соединением, представленным общей формулой [18], и далее удалением аминозащитной группы в соответствии с, например, способом, описанным в публикации международной заявки WO96/16947, или способами, эквивалентными данному способу.
Кроме того, соединение, представленное общей формулой [19], может быть получено амидинированием соединения, представленного общей формулой [20], в соответствии со схемой 1-b или схемой 2.
(5-а)
Соединение, представленное общей формулой [16], может быть получено взаимодействием соединения, представленного общей формулой [19], с соединением, представленным общей формулой [21], в присутствии или в отсутствие основания.
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; кетоны, такие как ацетон или 2-бутанон; и сульфоксиды, такие как диметилсульфоксид. Данные растворители могут применяться в сочетании.
Примеры основания, которое применяют в данной реакции, по желанию, могут включать: алкоксиды металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия или трет-бутоксид натрия; неорганические основания, такие как гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия или гидрид калия; и органические основания, такие как триэтиламин или пиридин. Такое основание может применяться по отношению к соединению, представленному общей формулой [19], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 3:1.
В данной реакции соединение, представленное общей формулой [21], может применяться по отношению к соединению, представленному общей формулой [19], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 5:1.
Данная реакция может осуществляться при температуре от 0 до 200°С, предпочтительно от 0 до 150°С, в течение времени от 1 минуты до 24 часов.
Соединение, представленное общей формулой [16], может также быть получено амидинированием соединения, представленного общей формулой [17], в соответствии со схемой 1-b или схемой 2.
(5-b)
Соединение, представленное общей формулой [1b], может быть получено гидролизом соединения, представленного общей формулой [16], или соединения, представленного общей формулой [19], в соответствии со схемой 4-b.
Кроме того, соединение, представленное общей формулой [1b], может быть получено амидинированием соединения, представленного общей формулой [17], в соответствии со схемой 1-b или схемой 2 и далее, подвергая полученный в результате продукт реакции гидролиза в соответствии со схемой 4-b.
(5-с)
Соединение, представленное общей формулой [17], может быть получено взаимодействием соединения, представленного общей формулой [20], с соединением, представленным общей формулой [21], в присутствии или в отсутствие основания в соответствии со схемой 5-а.
[Схема 6]
Соединение, представленное общей формулой [1с], может быть получено, например, по следующей схеме:

где R12 представляет собой цианогруппу, амидную группу или незащищенную или защищенную или незамещенную или замещенную амидиногруппу, которая связывается с участком связывания G3 по его пара- или мета-положению; и каждый из X, Y, Z, Ra, Rb, R1, R8, R9, L, G1, G2, G3 и G5имеет такое же значение, как описано выше.
(6-а)
Соединение, представленное общей формулой [22], может быть получено взаимодействием соединения, представленного общей формулой [19], с соединением, представленным общей формулой [2a], или взаимодействием соединения, представленного общей формулой [2], с соединением, представленным общей формулой [15а], в присутствии или в отсутствие основания.
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; кетоны, такие как ацетон или 2-бутанон; и сульфоксиды, такие как диметилсульфоксид. Данные растворители могут применяться в сочетании.
Примеры основания, которое применяют в данной реакции, по желанию, могут включать: алкоксиды металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия или трет-бутоксид натрия; неорганические основания, такие как гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия или гидрид калия; и органические основания, такие как триэтиламин или пиридин. Такое основание может применяться по отношению к соединению, представленному общей формулой [19], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 3:1.
В данной реакции соединение, представленное общей формулой [2а], может применяться по отношению к соединению, представленному общей формулой [19], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 5:1.
Кроме того, соединение, представленное общей формулой [15а], может применяться по отношению к соединению, представленному общей формулой [2], при молярном отношении 0,5:1 или больше.
Данная реакция может осуществляться при температуре от 0 до 200°С, предпочтительно от 0 до 150°С, в течение времени от 1 минуты до 24 часов.
(6-b)
Соединение, представленное общей формулой [22], может также быть получено амидинированием соединения, представленного общей формулой [23], в соответствии со схемой 1-b или схемой 2.
(6-с)
Соединение, представленное общей формулой [23], может быть получено взаимодействием соединения, представленного общей формулой [20], с соединением, представленным общей формулой [3а] или взаимодействием соединения, представленного общей формулой [3], с соединением, представленным общей формулой [15а], в присутствии или в отсутствие основания в соответствии со схемой 6-а.
(6-d)
Соединение, представленное общей формулой [1c], может быть получено гидролизом соединения, представленного общей формулой [22], в соответствии со схемой 4-b.
Кроме того, соединение, представленное общей формулой [1c], может быть получено амидинированием соединения, представленного общей формулой [23], в соответствии со схемой 1-b или схемой 2 и далее, подвергая полученный в результате продукт реакции гидролиза в соответствии со схемой 4-b.
[Схема 7]
Соединение, представленное общей формулой [1d], может быть получено, например, по следующей схеме:
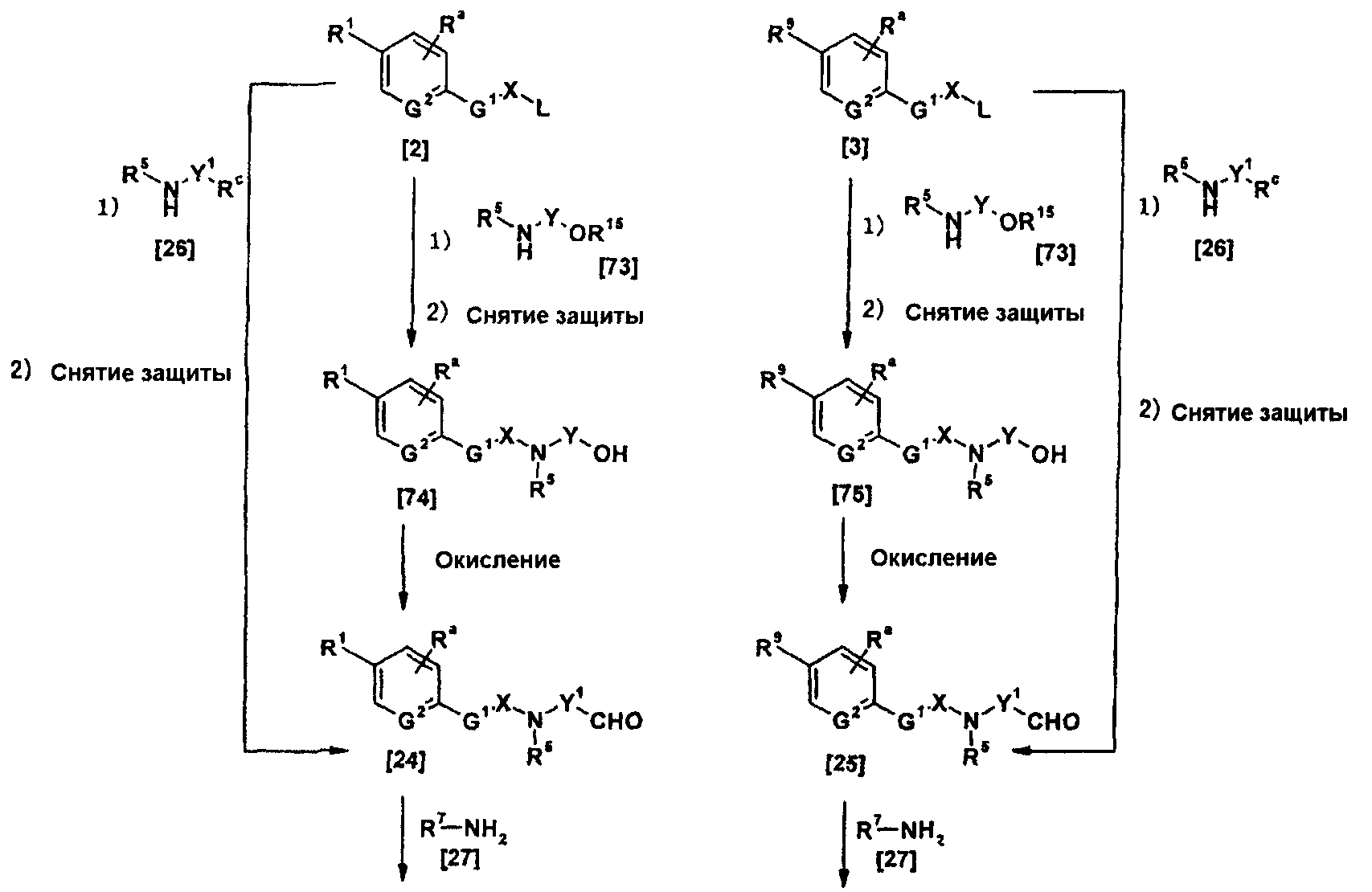
где каждый из R1, R5, R7, R9, Ra, X, Y, G1, G2, G3 и L имеет такое же значение, как описано выше; и Rc представляет собой защищенную альдегидную группу; R15 представляет собой атом водорода или гидроксилзащитную группу; Y1 представляет собой незамещенную или замещенную С1-5 низшую алкиленовую или С2-5 алкениленовую группу.
(7-а)
Соединение, представленное общей формулой [24], может быть получено взаимодействием соединения, представленного общей формулой [2], с соединением, представленным общей формулой [26], в соответствием со схемой 1-а и далее удалением защитной группы альдегида.
Кроме того, соединение, представленное общей формулой [24], может также быть получено взаимодействием соединения, представленного общей формулой [2], c соединением, представленным общей формулой [73], в соответствии со схемой 1-а и удалением R15, по желанию, c получением соединения, представленного общей формулой [74], и далее подвергая соединение, представленное общей формулой [74], реакции окисления.
Реакция окисления соединения, представленного общей формулой [74], может осуществляться в соответствии со способом, описанным в, например, "Yukikagakujikken no Tebiki [3], -Gosei Hanno [I],-" ("Guide for Organic Chemistry Experiments [3], Synthetic Reaction [I],", Kagaku Dojin, pp. 1-5.)
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид; и кетоны, такие как ацетон или 2-бутанон. Данные растворители могут применяться в сочетании.
Примеры окисляющего агента или способа окисления, применяемых в данной реакции, могут включать: хромовых кислот, таких как реагент Коллинза (оксид хрома (IV)-пиридин), хлорхромат пиридиния (PCC) или дихромат пиридиния (PDC); способ проведения реакции путем алкоксисульфониевых солей (ДМСО окисление); и реагент Десса-Мартина, описанный в Journal of Organic Chemistry (J. Org. Chem.), vol. 48, pp. 4155-4156, 1983.
Применяемое количество окислительного агента является различным в зависимости от типа окислительного агента. Например, такой окислительный агент может применяться по отношению к соединению, представленному общей формулой [74], при молярном отношении 1:1 или больше. Более предпочтительно, когда окислительный агент представляет собой хромовую кислоту, его можно применять в количестве, намного большем, чем для соединения, представленного общей формулой [74], и когда окислительный агент отличается от хромовых кислот, его можно применять по отношению к вышеуказанному соединению при молярном отношении, равном от 1:1 до 5:1.
(7-b)
Соединение, представленное общей формулой [28], может быть получено при подвергании соединения, представленного общей формулой [24], и соединения, представленного общей формулой [27], реакции дегидратации в присутствии или в отсутствие дегидратирующего агента.
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, н-гексанол, циклопентанол или циклогексанол; амиды, такие как N, N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; и сульфоксиды, такие как диметилсульфоксид. Данные растворители могут применяться в сочетании.
Примеры дегидратирующего агента, который применяется в данной реакции по желанию, могут включать безводный сульфат магния, сульфат натрия, хлорид кальция, Цеолум и молекулярные сита. Такой дегидратирующий агент может использоваться по отношению к соединению, представленному общей формулой [24], при массовом отношении (М/М) от 1:1 до 50:1 и предпочтительно при массовом отношении (М/М) от 1:1 до 10:1.
В данной реакции соединение, представленное общей формулой [27], может применяться по отношению к соединению, представленному общей формулой [24], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении от 1:1 до 5:1.
Данная реакция может осуществляться при температуре от 0 до 200°С, предпочтительно от 0 до 150°С, в течение времени от 1 минуты до 24 часов.
(7-с)
Соединение, представленное общей формулой [1d], может быть получено при подвергании соединения, представленного общей формулой [28], реакции восстановления.
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, н-гексанол, циклопентанол или циклогексанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; нитрилы, такие как ацетонитрил; и простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля. Данные растворители могут применяться в сочетании.
Примеры восстанавливающего агента, применямого в данной реакции, могут включать: гидриды металлов, такие как триацетоксиборгидрид натрия, гидрид диизобутилалюминия, соединение гидрида олова, боран, диалкилборан или гидросилан; комплексные соединения гидрида бора, такие как боргидрид натрия, боргидрид лития, боргидрид калия или боргидрид кальция; комплексные соединения гидрида алюминия, такие как алюмогидрид лития. Применяемое количество восстанавливающего агента является различным в зависимости от типа восстанавливающего агента. Например, в случае комплексного соединения гидрида бора его можно использовать по отношению к соединению, представленному общей формулой [28], при молярном отношении 0,25:1 или больше и предпочтительно при молярном отношении от 1:1 до 5:1.
В дополнение каталитическое гидрирование с применением металлического катализатора может применяться в качестве реакции восстановления. Примеры металлического катализатора, используемого в данном способе, могут включать оксид палладия, оксид платины и палладий-углерод. Металлический катализатор может применяться по отношению к соединениям, представленным общими формулами [28] и [29], при массовом отношении (М/М) от 0,001:1 до 1:1 и предпочтительно при массовом отношении (М/М) от 0,01:1 до 0,5:1.
Данная реакция может осуществляться при температуре от -50 до 120°С, предпочтительно от 0 до 80°С, в течение времени от 10 минут до 24 часов.
(7-d)
Соединение, представленное общей формулой [1d], может быть получено при подвергании соединения, представленного общей формулой [24], и соединения, представленного общей формулой [27], реакции восстановительного аминирования без выделения соединения, представленного общей формулой [28].
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, н-гексанол, циклопентанол или циклогексанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; нитрилы, такие как ацетонитрил; и простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля. Данные растворители могут применяться в сочетании.
Примеры восстанавливающего агента, применямого в данной реакции, могут включать: гидриды металлов, такие как триацетоксиборгидрид натрия, гидрид диизобутилалюминия, соединение гидрида олова, комплекс боран-тетрагидрофуран, диборан, диалкилборан или гидросилан; комплексные соединения гидрида бора, такие как боргидрид натрия, боргидрид лития, боргидрид калия или боргидрид кальция или триацетоксиборгидрид натрия; и комплексные соединения гидрида алюминия, такие как алюмогидрид лития, которые описаны в Journal of Medicinal Chemistry (J. Med. Chem.), vol. 43, pp. 27-58, 2000. Применяемое количество восстанавливающего агента является различным в зависимости от типа восстанавливающего агента. Например, в случае триацетоксиборгидрида натрия его можно использовать по отношению к соединению, представленному общей формулой [24], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении от 1:1 до 5:1.
В дополнение каталитическое гидрирование с применением металлического катализатора может применяться в качестве реакции восстановления. Примеры металлического катализатора, используемого в данном способе, могут включать оксид палладия, оксид платины и палладий-углерод. Металлический катализатор может применяться по отношению к соединениям, представленным общими формулами [24] и [25], при массовом отношении (М/М) от 0,001:1 до 1:1 и предпочтительно при массовом отношении (М/М) от 0,01:1 до 0, 5:1.
Данная реакция может осуществляться при температуре от -50 до 120°С, предпочтительно от 0 до 80°С, в течение времени от 10 минут до 24 часов.
(7-е)
Соединение, представленное общей формулой [25], может быть получено взаимодействием соединения, представленного общей формулой [3], с соединением, представленным общей формулой [26], в соответствии со схемой 1-а и далее удалением защитной группы альдегида.
В дополнение, соединение, представленное общей формулой [25], может быть получено взаимодействием соединения, представленного общей формулой [3], с соединением, представленным общей формулой [73], в соответствии со схемой 1-а и элиминированием R15 по желанию, с получением соединения, представленного общей формулой [75], и далее при подвергании соединения, представленного общей формулой [75], реакции окисления в соответствии со схемой 7-а.
Соединение, представленное общей формулой [29], может быть получено при подвергании соединения, представленного общей формулой [25], и соединения, представленного общей формулой [27], реакции дегидратации в присутствии или в отсутствие дегидратирующего агента в соответствии со схемой 7-b.
Соединение, представленное общей формулой [30], может быть получено восстановлением соединения, представленного общей формулой [29], в соответствии со схемой 7-с.
В дополнение, соединение, представленное общей формулой [30], может также быть получено при подвергании соединения, представленного общей формулой [24], и соединения, представленного общей формулой [27], реакции восстановительного аминирования в соответствии со схемой 7-d.
Соединение, представленное общей формулой [1d], может быть получено амидинированием соединения, представленного общей формулой [30], в соответствии со схемой 1-b или схемой 2.
[Схема 8]
Соединение, представленное общей формулой [1е], может быть получено, например, по следующей схеме:

где каждый из R1, R6, R7, R9, Ra, X, Y, Y1, G1 и G2 имеет такое же значение, как описано выше.
(8-а)
Соединение, представленное общей формулой [33], может быть получено при подвергании соединения, представленного общей формулой [1ab], и соединения, представленного общей формулой [32], реакции дегидратации в присутствии или в отсутствие дегидратирующего агента
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; и сульфоксиды, такие как диметилсульфоксид. Данные растворители могут применяться в сочетании.
Примеры дегидратирующего агента, который применяется в данной реакции по желанию, могут включать безводный сульфат магния, молекулярные сита, сульфат натрия, Цеолум и хлорид кальция. Такой дегидратирующий агент может использоваться по отношению к соединению, представленному общей формулой [1ab], при массовом отношении (М/М) от 1:1 до 50:1 и предпочтительно при массовом отношении (М/М) от 1:1 до 10:1.
В данной реакции соединение, представленное общей формулой [32], может применяться по отношению к соединению, представленному общей формулой [1ab], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении от 1:1 до 5:1.
Данная реакция может осуществляться при температуре от 0 до 200°С, предпочтительно от 0 до 150°С, в течение времени от 1 минуты до 24 часов.
(8-b)
Соединение, представленное общей формулой [1е], может быть получено при подвергании соединения, представленного общей формулой [33], реакции восстановления.
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, н-гексанол, циклопентанол или циклогексанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; нитрилы, такие как ацетонитрил; и простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля. Данные растворители могут применяться в сочетании.
Примеры восстанавливающего агента, применямого в данной реакции, могут включать: гидриды металлов, такие как гидрид диизобутилалюминия, соединение гидрида олова, боран, диалкилборан или гидросилан; комплексные соединения гидрида бора, такие как боргидрид натрия, боргидрид лития, боргидрид калия или боргидрид кальция; комплексные соединения гидрида алюминия, такие как алюмогидрид лития.
Применяемое количество восстанавливающего агента является различным в зависимости от типа восстанавливающего агента. Например, в случае комплексного соединения гидрида бора его можно использовать по отношению к соединению, представленному общей формулой [33], при молярном отношении 0,25:1 или больше и предпочтительно при молярном отношении от 1:1 до 5:1.
Данная реакция может осуществляться при температуре от -50 до 120°С, предпочтительно от 0 до 80°С, в течение времени от 10 минут до 24 часов.
В дополнение, соединение, представленное общей формулой [1e], может быть также получено амидинированием соединения, представленного общей формулой [35], в соответствии со схемой 1-b или схемой 2.
(8-с)
Соединение, представленное общей формулой [31], может быть получено восстановлением соединения, представленного общей формулой [14], в соответствии со способом, сходным со схемой 3-а.
Соединение, представленное общей формулой [34], может быть получено при подвергании соединения, представленного общей формулой [31], и соединения, представленного общей формулой [32], реакции дегидратации в присутствии или в отсутствие дегидратирующего агента в соответствии со способом, сходным со схемой 7-b.
Соединение, представленное общей формулой [35], может быть получено восстановлением соединения, представленного общей формулой [34], в соответствии со способом, сходным со схемой 8-а.
[Схема 9]
Соединение, представленное общей формулой [1ba], может быть получено, например, по следующей схеме:
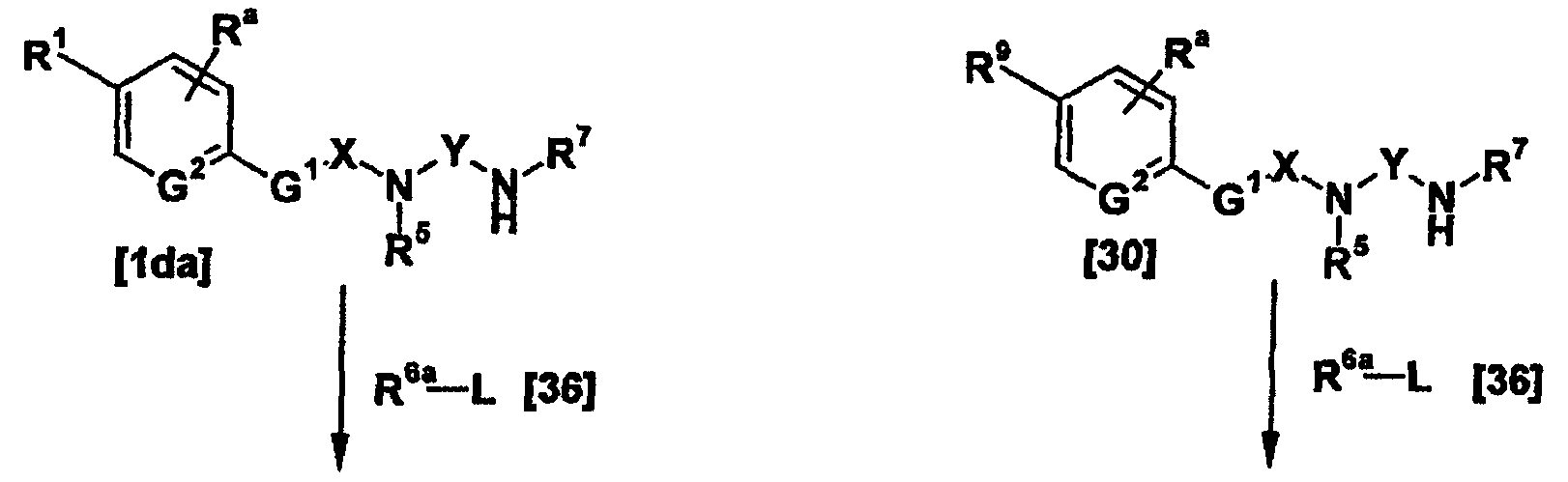

где каждый из R1, R5, R6, R7, R9, Ra, X, Y, Y1, G1, G2 и L имеет такое же значение, как описано выше; и каждый из R5a и R6a идентично или различно представляет собой аминозащитную группу, незамещенную или замещенную алкильную, циклоалкильную или алкенильную группу.
(9-а)
Соединение, представленное общей формулой [1ba], может быть получено взаимодействием соединения, представленного общей формулой [1da], с соединением, представленным общей формулой [36], или взаимодействием соединения, представленного общей формулой [1e], с соединением, представленным общей формулой [36a], в присутствии или в отсутствие основания.
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; кетоны, такие как ацетон или 2-бутанон; и сульфоксиды, такие как диметилсульфоксид. Данные растворители могут применяться в сочетании.
Примеры основания, которое применяют в данной реакции, по желанию, могут включать метоксид натрия, этоксид натрия, трет-бутоксид калия, трет-бутоксид натрия, гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия, гидрид калия, триэтиламин и пиридин. Такое основание может применяться по отношению к соединению, представленному общей формулой [1da], или соединению, представленному общей формулой [1e], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 3:1.
В данной реакции соединение, представленное общей формулой [36], и соединение, представленное общей формулой [36а], могут применяться по отношению к соединению, представленному общей формулой [1da], или соединению, представленному общей формулой [1е], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 3:1.
Данная реакция может осуществляться при температуре от 0 до 200°С, предпочтительно от 0 до 150°С, в течение времени от 1 минуты до 24 часов.
(9-b)
Соединение, представленное общей формулой [37], может быть получено взаимодействием соединения, представленного общей формулой [30], с соединением, представленным общей формулой [36], или взаимодействием соединения, представленного общей формулой [35], с соединением, представленным общей формулой [36а], в присутствии или в отсутствие основания, в соответствии со схемой 9-а.
В дополнение, соединение, представленное общей формулой [1ba], может быть также получено амидинированием соединения, представленного общей формулой [37], в соответствии со схемой 1-b или схемой 2.
[Схема 10]
Соединение, представленное общей формулой [1f], может быть получено, например, по следующей схеме:


где каждый из R1, R5, R8, R9, R12, Ra, Rb, X, Y, Y1, Z, G1, G2 G3 и G5 имеет такое же значение, как описано выше.
(10-а)
Соединение, представленное общей формулой [38], может быть получено при подвергании соединения, представленного общей формулой [24], и соединения, представленного общей формулой [1ас], реакции дегидратации в присутствии или в отсутствие дегидратирующего агента в соответствии со схемой 7-b.
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; и сульфоксиды, такие как диметилсульфоксид. Данные растворители могут применяться в сочетании.
Примеры дегидратирующего агента, который применяется в данной реакции по желанию, могут включать безводный сульфат магния, молекулярные сита, сульфат натрия, Цеолум и хлорид кальция. Такой дегидратирующий агент может использоваться по отношению к соединению, представленному общей формулой [24], при массовом отношении (М/М) от 1:1 до 50:1 и предпочтительно при массовом отношении (М/М) от 1:1 до 10:1.
В данной реакции соединение, представленное общей формулой [1ac], может применяться по отношению к соединению, представленному общей формулой [24], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении от 1:1 до 5:1.
Данная реакция может осуществляться при температуре от 0 до 200°С, предпочтительно от 0 до 150°С, в течение времени от 1 минуты до 24 часов.
(10-b)
Соединение, представленное общей формулой [1f], может быть получено при подвергании соединения, представленного общей формулой [38], реакции восстановления, в соответствии со схемой 7-а.
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, н-гексанол, циклопентанол или циклогексанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; нитрилы, такие как ацетонитрил; и простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля. Данные растворители могут применяться в сочетании.
Примеры восстанавливающего агента, применямого в данной реакции, могут включать: гидриды металлов, такие как триацетоксиборгидрид натрия, гидрид диизобутилалюминия, соединение гидрида олова, комплексное соединение боран-тетрагидрофуран, диборан, диалкилборан или гидросилан; комплексные соединения гидрида бора, такие как боргидрид натрия, боргидрид лития, боргидрид калия или боргидрид кальция; и комплексные соединения гидрида алюминия, такие как алюмогидрид лития.
Применяемое количество восстанавливающего агента является различным в зависимости от типа восстанавливающего агента. Например, в случае комплексного соединения гидрида бора его можно использовать по отношению к соединению, представленному общей формулой [38], при молярном отношении 0,25:1 или больше и предпочтительно при молярном отношении от 1:1 до 5:1.
Данная реакция может осуществляться в общем случае при температуре от -50 до 120°С, предпочтительно от 0 до 80°С, в течение времени от 10 минут до 24 часов.
В дополнение, соединение, представленное общей формулой [1f], может быть также получено амидинированием соединения, представленного общей формулой [40], в соответствии со схемой 1-b или схемой 2.
(10-с)
Соединение, представленное общей формулой [39], может быть получено при подвергании соединения, представленного общей формулой [25], и соединения, представленного общей формулой [31a], реакции дегидратации в присутствии или в отсутствие дегидратирующего агента, в соответствии со схемой 7-b.
Соединение, представленное общей формулой [40], может быть получено восстановлением соединения, представленного общей формулой [39], в соответствии со схемой 7-c.
[Схема 11]
Соединение, представленное общей формулой [1сa], может быть получено, например, по следующей схеме:


где каждый из R1, R5, R5a, R6, R6a, R8, R9, R12, Ra, Rb, X, Y, Z, G1, G2, G3, G5 и L имеет такое же значение, как описано выше.
(11-а)
Соединение, представленное общей формулой [1са], может быть получено взаимодействием соединения, представленного общей формулой [1fa], с соединением, представленным общей формулой [36], или взаимодействием соединения, представленного общей формулой [1cb], с соединением, представленным общей формулой [36a], в присутствии или в отсутствие основания.
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; кетоны, такие как ацетон или 2-бутанон; и сульфоксиды, такие как диметилсульфоксид. Данные растворители могут применяться в сочетании.
Примеры основания, которое применяют в данной реакции, по желанию, могут включать: алкоксиды металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия или трет-бутоксид натрия; неорганические основания, такие как гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия или гидрид калия; и органические основания, такие как триэтиламин или пиридин. Такое основание может применяться по отношению к соединениям, представленным общими формулами [1fa] и [1cb], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 3:1.
В данной реакции соединения, представленные общими формулами [36] и [36а], могут применяться по отношению к соединениям, представленным общими формулой [1fa] и [1cb], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 3:1 соответственно.
Данная реакция может осуществляться при температуре от 0 до 200°С, предпочтительно от 0 до 150°С, в течение времени от 1 минуты до 24 часов.
В дополнение, соединение, представленное общей формулой [1са], может быть также получено взаимодействием соединения, представленного общими формулами [2] или [2a], с соединением, представленным общей формулой [76], в соответствии со схемой 6-а.
Кроме того, соединение, представленное общей формулой [1сa], может быть также получено амидинированием соединения, представленного общей формулой [41], в соответствии со схемой 1-b или схемой 2.
(11-b)
Соединение, представленное общей формулой [41], может быть получено взаимодействием соединения, представленного общей формулой [40], с соединением, представленным общей формулой [36], в соответствии со схемой 11-а в присутствии или в отсутствие основания.
В дополнение, соединение, представленное общей формулой [41], может быть также получено взаимодействием соединения, представленного общими формулами [3] или [3a], с соединением, представленным общей формулой [76], в соответствии со схемой 6-а.
[Схема 12]
Соединение, представленное общей формулой [1g], может быть получено, например, по следующей схеме:

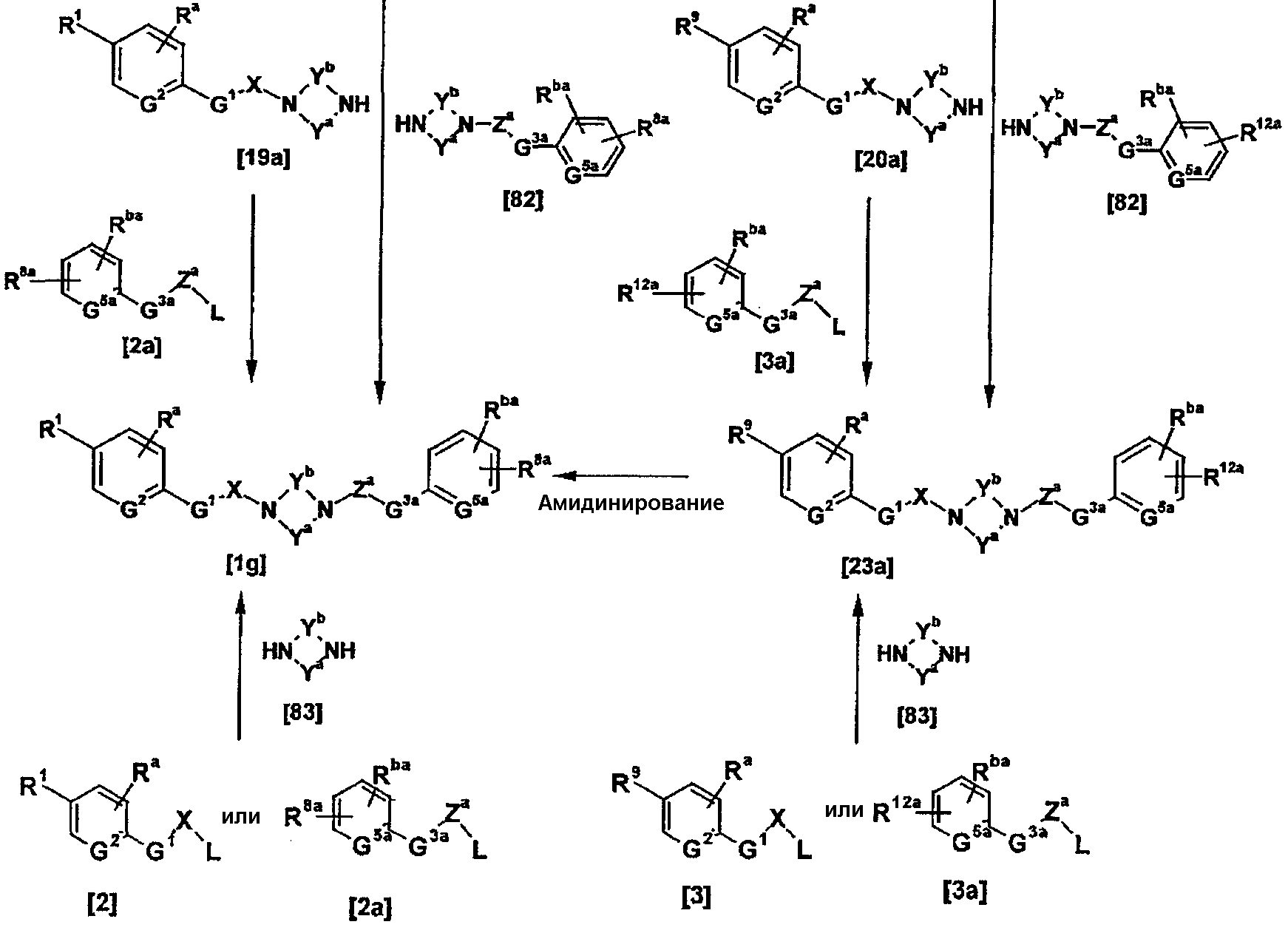
где R12a представляет собой цианогруппу, амидную группу или незащищенную или защищенную или незамещенную или замещенную амидиногруппу; и каждый из R, R1, R8a, R9, Ra, Rba, X, Ya, Yb, Za, G1, G2, G3a, G5a и L имеет такое же значение, как описано выше.
Соединения, представленные общими формулами [19а] и [20a], могут быть получены взаимодействием соединений, представленных общими формулами [2] и [3], с соединением, представленным общей формулой [77], в соответствии со способом, описанным, например, в публикации международной заявки WO96/16947, или способом, эквивалентным данному способу, и далее удалением вторичных аминозащитных групп в соответствии с общепринятыми способами.
(12-а)
Соединение, представленное общей формулой [1g], может быть получено взаимодействием соединения, представленного общей формулой [19a], с соединением, представленным общей формулой [2а], или взаимодействием соединения, представленного общей формулой [2], с соединением, представленным общей формулой [82], в соответствии со схемой 6-а.
В дополнение, соединение, представленное общей формулой [1g], может быть также получено взаимодействием соединения, представленного общей формулой [2] или [2а], с соединением, представленным общей формулой [83], в соответствии со схемой 6-а.
(12-b)
Соединение, представленное общей формулой [23а], может быть получено взаимодействием соединения, представленного общей формулой [20a], с соединением, представленным общей формулой [3а], или взаимодействием соединения, представленного общей формулой [3], с соединением, представленным общей формулой [82], в соответствии со схемой 6-а.
В дополнение, соединение, представленное общей формулой [23а], может быть также получено взаимодействием соединения, представленного общей формулой [3] или [3а], с соединением, представленным общей формулой [83], в соответствии со схемой 6-а.
Далее, соединение, представленное общей формулой [1g], может также быть получено амидинированием соединения, представленного общей формулой [23a], в соответствии со схемой 1-b или схемой 2.
[Схема 13]
Соединение, представленное общей формулой [1g], может быть получено, например, по следующей схеме:
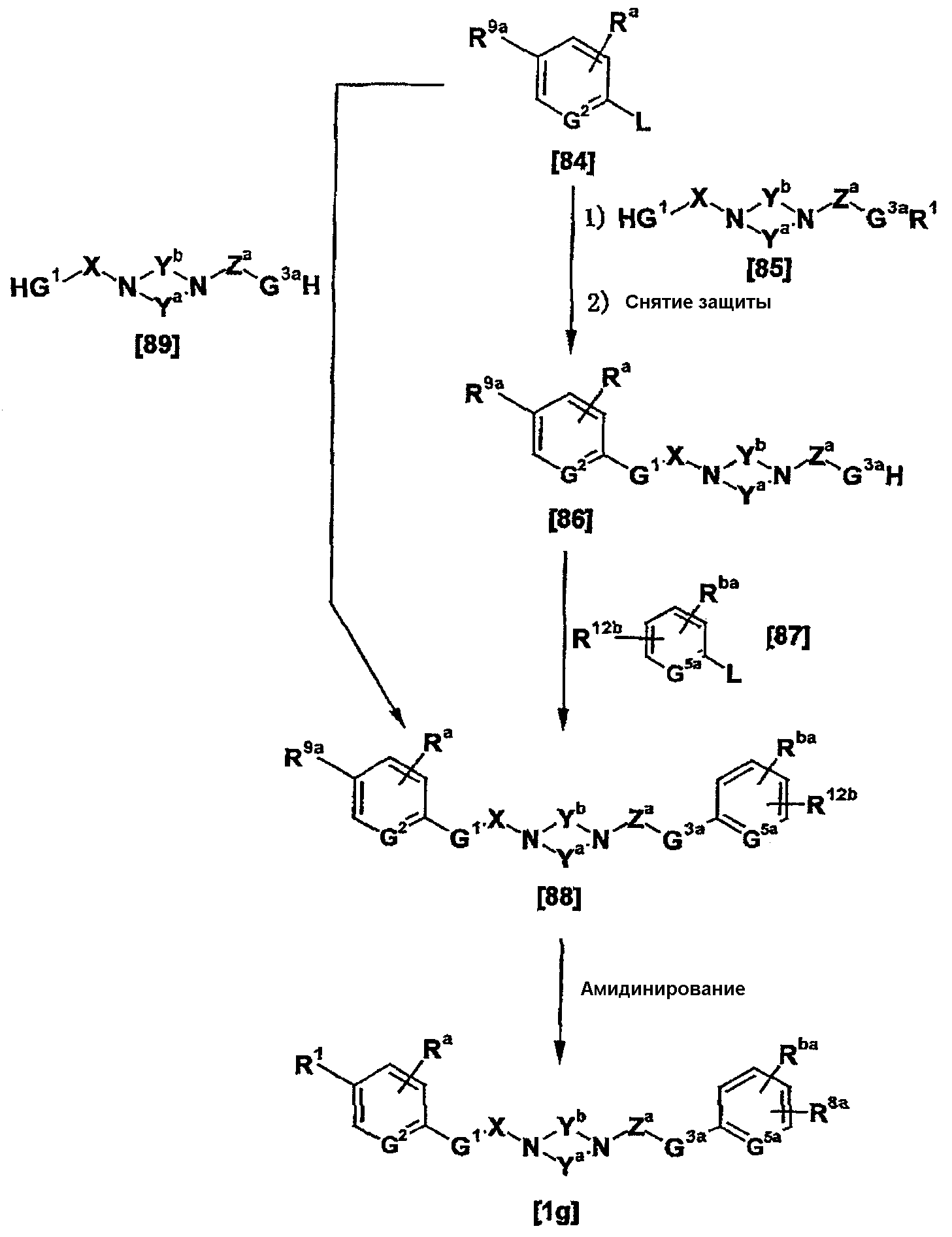
где каждый из R1, R8a, Ra, Rba, X, Ya, Yb, Za, G1, G2, G3a, G5a и L имеет такое же значение, как описано выше; и каждый из R9а и R12b представляет собой цианогруппу; и R' представляет собой защитную группу амино-, гидроксильной или тиольной группы.
(13-а)
Соединение, представленное общей формулой [86], может быть получено взаимодействием соединения, представленного общей формулой [84], с соединением, представленным общей формулой [85], в присутствии или в отсутствие основания и далее удалением защитной группы.
Растворитель, применяемый в данной реакции, конкретно не ограничивают, если он не влияет на протекание реакции. Примеры растворителя могут включать: спирты, такие как метанол, этанол, изопропанол или трет-бутанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или дихлорэтан; ароматические углеводороды, такие как бензол, толуол или ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диэтиловый эфир диэтиленгликоля или монометиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; кетоны, такие как ацетон или 2-бутанон; и сульфоксиды, такие как диметилсульфоксид. Данные растворители могут применяться в сочетании.
Примеры основания, которое применяют в данной реакции, по желанию, могут включать: алкоксиды металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия или трет-бутоксид натрия; неорганические основания, такие как гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия или гидрид калия; и органические основания, такие как триэтиламин или пиридин. Такое основание может применяться по отношению к соединению, представленному общей формулой [85], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 3:1.
В данной реакции соединение, представленное общей формулой [84], может применяться по отношению к соединению, представленному общей формулой [85], при молярном отношении 1:1 или больше и предпочтительно при молярном отношении, равном от 1:1 до 5:1.
Данная реакция может осуществляться при температуре от 0 до 200°С, предпочтительно от 0 до 150°С, в течение времени от 1 минуты до 24 часов.
Кроме того, защитная группа амино-, гидроксильной или тиольной группы, представленная R' может быть удалена известными способами.
(13-b)
Соединение, представленное общей формулой [88], может быть получено взаимодействием соединения, представленного общей формулой [86], с соединением, представленным общей формулой [87], или взаимодействием соединения, представленного общей формулой [84], с соединением, представленным общей формулой [89], в соответствии со схемой 13-а.
В данной реакции соединение, представленное общей формулой [84], может применяться по отношению к соединению, представленному общей формулой [89], при молярном отношении 2:1 или больше и предпочтительно при молярном отношении, равном от 2:1 до 5:1.
(13-с)
Соединение, представленное общей формулой [1g], может быть получено амидинированием соединения, представленного общей формулой [88], в соответствии со схемой 1-b или схемой 2.
[Схема 14]
Соединение, представленное общей формулой [1h], может быть получено, например, по следующей схеме:

где каждый из R1, R7a, R9, Ra, X, Ya, Yb, G1, G2 и L имеет такое же значение, как описано выше.
Соединение, представленное общей формулой [1h], может быть получено взаимодействием соединения, представленного общей формулой [2], с соединением, представленным общей формулой [90], в соответствии со схемой 1-а.
В дополнение, соединение, представленное общей формулой [1h], может также быть получено амидинированием соединения, представленного общей формулой [91], в соответствии со схемой 1-b или схемой 2.
Соединение, представленное общей формулой [91], может быть получено взаимодействием соединения, представленного общей формулой [3], с соединением, представленным общей формулой [90], в соответствии со схемой 1-а.
[Схема 15]
Соединение, представленное общей формулой [1i], может быть получено, например, по следующей схеме:

где G3aa представляет собой гидроксильную группу, аминогруппу или тиольную группу; и каждый из R, R1, R8a, R9, R12a, Ra, Rba, X, Ya, Yb, Za, G1, G2, G3a, G5a и L имеет такое же значение, как описано выше.
(15-а)
Соединение, представленное общей формулой [96], может быть получено взаимодействием соединения, представленного общей формулой [93], с соединением, представленным общей формулой [95], в соответствии со схемой 1-1 и далее удалением вторичной аминозащитной группы в соответствии с известными способами.
Примеры соединения, представленного общей формулой [95], могут включать: 1-трет-бутоксикарбонил-4-(йодметил)пиперидин, 1-трет-бутоксикарбонил-4-(йодэтил)пиперидин и 1-бензил-4-(2-хлорэтил)пиперидин, которые описаны в Journal of Medicinal Chemistry (J. Med. Chem.), vol. 44, pp. 2707-2717, 2001; 4-[1-(трет-бутоксикарбонил)пиперидин-4-ил]бутилбромид и 3-[1-(трет-бутоксикарбонил)пиперидин-4-ил]пропилбромид, которые описаны в той же вышеуказанной публикации, vol. 37, pp. 2537-2551, 1994; 1-(трет-бутоксикарбонил)-3-(метансульфонилоксиметил)пирролидин и 1-(трет-бутоксикарбонил)-3-(метансульфонилокси)пирролидин, которые описаны в той же вышеуказанной публикации, vol. 42, pp. 677-690, 1999; и мезилат 1-трет-бутоксикарбонил-4-(гидроксиметил)пиперидина, описанный в патенте США № 9311623.
(15-b)
Соединение, представленное общей формулой [97], может быть получено взаимодействием соединения, представленного общей формулой [94], с соединением, представленным общей формулой [95], в соответствии со схемой 1-1 и далее удалением вторичной аминозащитной группы.
Соединение, представленное общей формулой [99], может быть получено взаимодействием соединения, представленного общей формулой [97], с соединением, представленным общей формулой [3], в соответствии со схемой 1-а.
(15-с)
Соединение, представленное общей формулой [1i], может быть получено взаимодействием соединения, представленного общей формулой [96], с соединением, представленным общей формулой [2], в соответствии со схемой 1-а.
В дополнение, соединение, представленное общей формулой [1i], может также быть получено амидинированием соединения, представленного общей формулой [99], в соответствии со схемой 1-b или схемой 2.
[Схема 16]
Соединение, представленное общей формулой [1j], может быть получено, например, по следующей схеме:


где каждый из Ra, R1, R7b, R9, X, G1, G2, G3a, Yc, Yc', L и W имеет такое же значение, как описано выше; Rc представляет собой аминозащитную группу; и R4a представляет собой аминозащитную группу, отличную от Rc, или незамещенную или замещенную, алкильную, циклоалкильную или алкенильную группу.
(16-а)
Соединение, представленное общей формулой [1ja], может быть получено взаимодействием соединения, представленного общей формулой [2], с соединением, представленным общей формулой [4c], в присутствии или в отсутствие основания и, далее, подвергая реакционный продукт реакции снятия защиты для аминозащитной группы.
Соединение, представленное общей формулой [1jb], может быть получено взаимодействием соединения, представленного общей формулой [2], с соединением, представленным общей формулой [4d], в присутствии или в отсутствие основания
Данные реакции могут осуществляться в соответствии со схемой 1-а.
Примеры соединения, представленного общей формулой [4c], могут включать: 4-амино-1-бензилпиперидин, 3-амино-1-бензилпирролидин, 2-(аминометил)-1-(трет-бутоксикарбонил)пирролидин и 3-амино-1-бензилпиперидин [the Journal of Medicinal Chemistry (J. Med. Chem.), vol. 23, pp. 848-851, 1980]; 4-(аминометил)-1-бензилпиперидин и 2-(аминометил)-1-бензилпиперидин [та же вышеуказанная публикация, vol. 37, pp. 2721-2734, 1994]; 4-(2-аминоэтил)-1-бензилпиперидин и 2-(аминоэтил)-1-бензилпиперидин [та же вышеуказанная публикация, vol. 33, pp. 1880-1887, 1990]; 3-(аминометил)-1-(трет-бутоксикарбонил)пирролидин [та же вышеуказанная публикация, vol. 42, pp. 677-690, 1999]; 3-амино-1-бензилгомопиперидин [та же вышеуказанная публикация, vol. 39, pp. 4704-4716, 1996]; и 4-амино-1-бензилгомопиперидин [та же вышеуказанная публикация, vol. 44, pp. 1380-1395, 2001].
(16-b)
Соединение, представленное общей формулой [1j], может быть получено взаимодействием соединений, представленных общими формулами [1ja] и [1jb], с соединениями, представленными общими формулами [4f] и [4e] соответственно, в присутствии или в отсутствие основания.
Данные реакции могут осуществляться в соответствии со схемой 1-а.
(16-с)
Соединение, представленное общей формулой [58], может быть получено взаимодействием соединений, представленных общими формулами [56] и [59], с соединениями, представленными общими формулами [4f] и [4e] соответственно, в присутствии или в отсутствие основания. Соединения, представленные общими формулами [56] и [59], могут быть получены взаимодействием соединения, представленного общей формулой [3], с соединениями, представленными общими формулами [4с] и [4d] соответственно.
Данные реакции могут осуществляться в соответствии со схемой 1-а.
(16-d)
Соединения, представленные общими формулами [1j] и [1jb], могут быть получены амидинированием соединений, представленных общими формулами [58] и [59] соответственно.
Амидинирование может осуществляться в соответствии со схемой 1-b или схемой 2.
[Схема 17]
Соединение, представленное общей формулой [1k], может быть получено, например, по следующей схеме:


где R6b представляет собой незамещенную или замещенную алкильную группу; и каждый из R1, R7а, R9, Ra, X, Ya, Yb, G1, G2 и L имеет такое же значение, как описано выше.
(17-а)
Соединение, представленное общей формулой [1k], может быть получено взаимодействием соединения, представленного общей формулой [19a], с соединением, представленным общей формулой [79], или взаимодействием соединения, представленного общей формулой [2], с соединением, представленным общей формулой [78], в соответствии со схемой 6-а.
(17-b)
Соединение, представленное общей формулой [23b], может быть получено взаимодействием соединения, представленного общей формулой [20a], с соединением, представленным общей формулой [79], или взаимодействием соединения, представленного общей формулой [3], с соединением, представленным общей формулой [78], в соответствии со схемой 6-а.
Соединение, представленное общей формулой [1k], может быть получено амидинированием соединения, представленного общей формулой [23b], в соответствии со схемой 1-b или схемой 2.
(17-c)
Соединение, представленное общей формулой [1ea], может быть получено гидролизом соединения, представленного общей формулой [1k], в соответствии со схемой 4-a.
Могут быть также использованы соли соединений, описанных в вышеуказанных схемах 1-17. Примеры таких солей являются такими же, как описаны для соединения, представленного общей формулой [1].
Промежуточные соединения при получении продуктов, полученных по вышеописанным схемам 1-17, могут также использоваться в последующих реакциях без выделения.
В соединениях, получаемых по описанным выше схемам 1-17, имеющих функциональную группу, такую как аминогруппа, циклическая аминогруппа, гидроксильная группа, альдегидная группа или карбоксильная группа, эти функциональные группы могут прежде быть защищены обычными защитными группами, по необходимости, и данные защитные группы могут быть удалены известными способами после завершения реакции.
Таким образом, полученное соединение, представленное общей формулой [I], или его соль подвергают известным реакциям, таким как конденсация, присоединение, окисление, восстановление, перегруппировка, замещение, галогенирование, дегидратация или гидролиз, или данные реакции соответственным образом применяют в сочетании, так, чтобы вышеуказанное соединение или его соль могли быть преобразованы в другое соединение, представленное общей формулой [I] или его соль.
Кроме того, в случае, когда для соединений, получаемых по вышеуказаным схемам, имеется изомер (например, оптический изомер, геометрический изомер, таутомер и т.д.), данные изомеры также могут использоваться. Более того, также могут использоваться сольват, гидрат и различные формы кристаллов.
Когда соединение по настоящему изобретению применяют в качестве фармацевтического средства, обычно с соединением могут, соответственно, быть смешаны фармацевтические вспомогательные средства, которые применяют в фармацевтическом препарате, такие как эксципиент, носитель или разбавитель. В соответствии с общепринятыми способами получаемое таким образом фармацевтическое средство может вводиться перорально или парентерально в виде таблетки, капсулы, порошка, сиропа, гранулы, пилюли, суспензии, эмульсии, жидкости, порошкообразного препарата, суппозитория, глазных капель, капель для носа, капель для ушей, пластыря, мази или инъекции. Кроме того, способ введения, дозировка и количество введений могут выбираться, соответственно, в зависимости от возраста, массы тела и степени заболевания пациентов. Обычно для взрослого человека, количество, равное 0,01 до 1000 мг/кг, может вводиться перорально или парентерально (например, в виде инъекции, капель, введением в ректальную область и т.д.) суточно, однократно или разделено на несколько раз.
Далее, в следующем разделе, пояснено фармакологическое действие представительных соединений по настоящему изобретению.
Пример испытаний 1. Противогрибковое действие
Концентрацию, ингибирующую рост на 50% (IC50), измеряют в соответствии со способом разбавления питательной среды в микроколичествах, используя в качестве стандартного способ тестирования чувствительности к противогрибковому средству, предложенный в качестве теста на чувствительность к противогрибковому средству подкомитетом Общества медицинской микологии Японии (Japanese Society for Medical Mycology (Japanese Journal of Medical Mykology, vol. 36, No. 1, pp. 62-64, 1995)). Синтетическая аминокислотная среда для грибков (SAAMF, производимая Nippon Bio-Supp. Center) используется в качестве среды для измерения чувствительности. Candida albicans TIMM 1623 культивируют при 30°С в течение ночи на среде для планшетов, состоящей из агара Sabouraud (Eiken Chemical Co., Ltd.), и полученную культуру суспендируют в стерилизованном физиологическом солевом растворе. Далее суспензию разбавляют средой для измерения так, чтобы количество клеток стало равным 1 х 104 клеток/мл, таким образом получая раствор инокуляционного организма. 175 мкл среды, 5 мкл тестируемого средства (средство разбавляют растворителем в лунке контроля роста) и 20 мкл раствора инокуляционного организма добавляют в 96-луночный микропланшет (плоскодонный, производится Sumitomo Bakelite Co., Ltd.) и смесь перемешивают смесителем. Далее, используя луночный Reader SME3400 (Scinics Co., Ltd.), измеряют начальную мутность при длине волны 630 нм. Вышеуказанную смесь культивируют при 35°С и через 36 часов измеряют конечную мутность тем же образом. Для линии разбавления средства значения получают вычитанием начальных мутностей из конечных мутностей. Для линии контроля роста также значения получают вычитанием начальных мутностей из конечных мутностей. IC50 определяют как самую низкую концентрацию средства в ряду концентраций тестируемого средства, имеющую мутность, равную или ниже 50% значения (IC50 рассчитаного значения), полученного вычитанием начальной мутности контроля роста из ее конечной мутности. Результаты, относящиеся к значению IC50 для каждой клеточной линии, показаны в табл.14.
Пример испытаний 2. Терапевтический эффект при системной инфекции мышей Candida albicans
Candida albicans TIMM 1623 культивируют при 30°С в течение ночи на среде для планшетов из агара Sabouraud (Eiken Chemical Co., Ltd.) и полученную культуру суспендируют в стерилизованном физиологическом солевом растворе. Таким образом, получают грибковый раствор для инфекции, имеющий концентрацию, равную 1 х 107 клеток/мл. Данный грибковый раствор высевают при концентрации 0,2 мл (2 х 107 CFU/мышь) в хвостовой вене каждой из пяти самцов мышей ICR (возраст 4 недели, масса тела 20 + 1г). Через 2 часа 0,2 мл раствора, который был получен при растворении тестируемого соединения в стерилизованном физиологическом солевом растворе и установлении концентрации 0,01 мг/мл, однократно вводят в подкожную спинную область каждой мыши. Мышам из контрольной группы вводят равное количество стерилизованного физиологического солевого раствора.
Жизнеспособность мышей наблюдают до 14-го дня после инфицирования, и рассчитывают кумулятивную степень выживания (Т/С) обработанной группы по отношению к контрольной группе, и полученное значение применяют в качестве индекса эффекта продления жизни.
В результате обнаружено, что в случае соединения примера 24 Т/С составляет 180 при введении 0,1 мг/кг.
Пример испытаний 3. Терапевтический эффект при системной инфекции мышей Candida albicans
Candida albicans TIMM 1623 культивируют при 30°С в течение ночи на среде для планшетов из агара Sabouraud (Eiken Chemical Co., Ltd.) и полученную культуру суспендируют в стерилизованном физиологическом солевом растворе. Таким образом, получают грибковый раствор для инфекции, имеющий концентрацию, равную 107 клеток/мл. 0,2 мл данного грибкового раствора высевают в хвостовой вене каждой из пяти самцов мышей ICR (возраст 4 недели, масса тела 20 + 1г). Через 2 часа 0,2 мл раствора, который был получен при растворении тестируемого соединения в стерилизованном физиологическом солевом растворе и установлении концентрации 0,01 мг/мл, однократно вводят в подкожную спинную область каждой мыши. Начиная со следующего дня, такой же раствор вводят мышам один раз в день в течение 6 дней. Таким образом, вышеуказанный раствор вводят в подкожную спинную область мышам в целом 7 раз. Мышам из контрольной группы вводят равное количество стерилизованного физиологического солевого раствора. Жизнеспособность мышей наблюдают до 28-го дня после инфицирования.
В результате обнаружено, что мыши из контрольной группы умирают все на 28-й день после инфицирования, но мыши из групп, которым вводили соединения примера 24, примера 40-2 и примера 56, выживают при отношении 3/5, 4/5 и 4/5 соответственно.
ПРИМЕРЫ
Настоящее изобретение будет описано ниже в следующих ссылочных примерах и примерах. Однако подразумевают, что данные примеры не ограничивают объем настоящего изобретения.
Следует отметить, что смесевые отношения элюентов все представляют объемные отношения и что B.W. силикагель BW-127ZH (производится Fuji Silysia Chemical Ltd.) применяют в качестве носителя в колоночной хроматографии, если не указано иначе.
Символы в каждом примере представляют следующие значения:
d6-ДМСО: дейтерированный диметилсульфоксид
Me: метил
Et: этил
Bn: бензил
Ac: ацетил
Cbz: бензилоксикарбонил
Boc: трет-бутоксикарбонил
Ссылочный пример 1

2,78 г 4-Цианофенола растворяют в 40 мл 2-бутанона и затем добавляют к данному раствору 3,23 г карбоната калия и 5,00 г 1,4-дибром-2-бутена при комнатной температуре с последующим перемешиванием при 70°С в течение 4 часов. Нерастворимые продукты удаляют фильтрацией через Целит и далее растворитель удаляют при пониженном давлении. Затем полученный остаток очищают колоночной хроматографией на силикагеле [элюент; н-гексан:этилацетат = 5:1] с получением 2,49 г бесцветного маслянистого продукта, 4-{[(E)-4-бром-2-бутенил]окси}бензонитрил.
1H-ЯМР (CDCl3) δ: 3,99 (2H, дд, J = 7,3, 0,7 Гц), 4,61 (2H, дд, J = 5,1, 0,7 Гц), 5,92-6,02 (1H, м), 6,08 (1H, дтт, J = 15,4, 7,3, 0,7 Гц), 6,92-6,98 (2H, м), 7,56-7,62 (2Н, м).
Ссылочный пример 2

0,79 г 1-(2,4-Диметоксибензил)-2,3-пиперазиндиона растворяют в 9,0 мл N,N-диметилформамида и к данному раствору добавляют 0,12 г 60% гидрида натрия при охлаждении льдом с последующим перемешиванием при комнатной температуре в течение 2 часов. При охлаждении льдом 6,0 мл N, N-диметилформамидного раствора, содержащего 0,84 г 4-(4-бромбутокси)бензонитрила, добавляют по каплям к данной смеси с последующим перемешиванием при комнатной температуре в течение 75 минут. К реакционной смеси добавляют 30 мл воды и 30 мл хлороформа таким образом, чтобы органический слой отделился. Отделенный органический слой промывают последовательно водой и насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния. Далее растворитель удаляют при пониженном давлении. Полученный остаток затем очищают колоночной хроматографией на силикагеле [элюент; хлороформ:метанол = 20:1] с получением 1,16 г белого твердого вещества, 4-{4-[4-(2,4-диметоксибензил)-2,3-диоксо-1-пиперазинил]бутокси}бензонитрила.
1H-ЯМР (CDCl3 ) δ: 1,70-1,90 (4H, м), 3,42-3,48 (4H, м), 3,53 (2H, т, J = 6,8 Гц), 3,80 (3H, с), 3,81 (3H, с), 4,03 (2Н, т, J = 5,7 Гц), 4,63 (2H, с), 6,42-6,48 (2H, м), 6,90-6,94 (2H, м), 7,24-7,28 (1H, м), 7,50-7,59 (2H, м).
Ссылочный пример 3

1,09 г 4-{4-[4-(2, 4-Диметоксибензил)-2,3-диоксо-1-пиперазинил]бутокси}бензонитрила суспендируют в 2,5 мл анизола и к данной суспензии добавляют 12,5 мл трифторуксусной кислоты при комнатной температуре c последующим нагреванием с обратным холодильником в течение 2 часов. После завершения реакции растворитель удаляют при пониженном давлении и полученный остаток далее очищают колоночной хроматографией на силикагеле [элюент; хлороформ:этанол = 30:1] с получением 0,30 г белого твердого вещества, 4-[4-(2,3-диоксо-1-пиперазинил)бутокси]бензонитрила.
1H-ЯМР (CDCl3) δ: 1, 76-1,88 (4H, м), 3,54-3,62 (6H, м), 4,05 (2H, т, J = 5,6 Гц), 6,90-6,96 (2H, м), 7,50-7,60 (2H, м), 8,46 (1H, шир.с).
Ссылочный пример 4
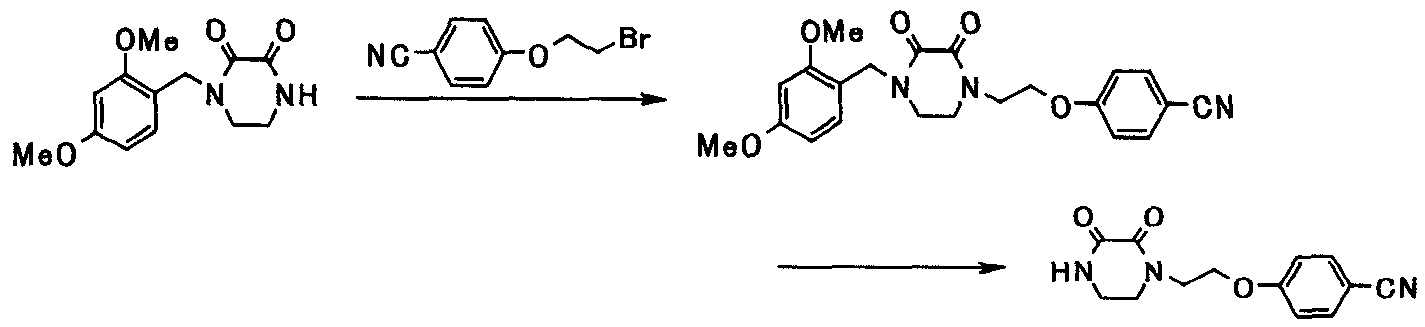
Следующее соединение получают таким же образом, что и в ссылочных примерах 2 и 3.
4-[2-(2, 3-диоксо-1-пиперазинил]этокси}бензонитрил.
1H-ЯМР (CDCl3) δ: 3,55-3,60 (2H, м), 3,75-3,82 (2H, м), 3,91 (2H, т, J = 5,0 Гц), 4,27 (2H, т, J = 5,0 Гц), 6, 91-6,96 (2H, м), 7,47 (1H, шир.с), 7,57-7,63 (2H, м).
Ссылочный пример 5
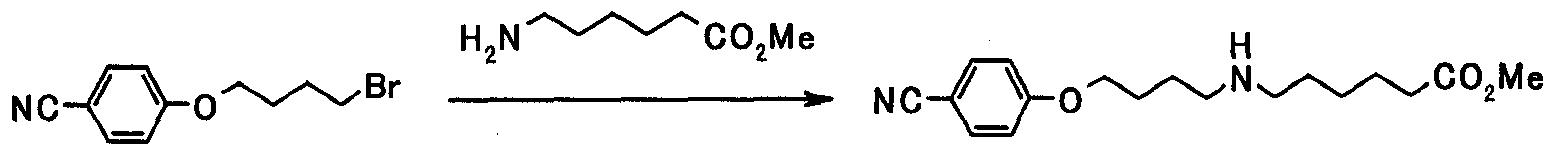
0,50 г 4-(4-Бромбутокси)бензонитрила растворяют в 5 мл этанола. Затем к этому раствору последовательно добавляют 1,1 г гидрохлорида метилового эфира 6-аминогексановой кислоты и 1,4 мл триэтиламина с последующим нагревом при кипячении с обратным холодильником в течение 4 часов. После завершения реакции смесь охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. К полученному остатку добавляют 20 мл воды и далее экстрагируют 20 мл этилацетата 5 раз. Полученный органический слой сушат над безводным сульфатом магния и затем растворитель удаляют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле [элюент; хлороформ:этанол = 30:1] с получением 0,65 г бесцветного масла продукта, метилового эфира 6-{[4-(4-цианофенокси)бутил]амино}гексановой кислоты.
1H-ЯМР (CDCl3) δ: 1,35-1,45 (2H, м), 1,58-1,70 (2H, м), 1,84-2,00 (4H, м), 2,05-2,20 (2H, м), 2,30 (2H, т, J = 7,2 Гц), 2,90-3,10 (4Н, м), 3,66 (3Н, с), 4,02 (2Н, т, J = 5,9 Гц), 6,90-6,96 (2H, м), 7,55-7,60 (2H, м), 9,41 (1Н, шир.с).
Ссылочный пример 6

0,80 г 4-(4-Бромбутокси)бензонитрила растворяют в 8,0 мл диметилсульфоксида и к раствору добавляют 0,23 г азида натрия с последующим перемешиванием при комнатной температуре в течение 12 часов. К реакционной смеси добавляют 30 мл воды и 20 мл этилацетата так, чтобы органический слой отделился. Отделенный органический слой промывают насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния. Растворитель удаляют при пониженном давлении с получением 0,71 г бесцветного масла продукта, 4-(4-азидобутокси)бензонитрила.
ИК (чистого вещества) см-1: 2224, 2098, 1606.
1H-ЯМР (CDCl3) δ: 1,74-1,96 (4H, м), 3,38 (2H, т, J = 6,6 Гц), 4,04 (2H, т, J = 6,1 Гц), 6,90-6,98 (2H, м), 7,56-7,62 (2H, м).
Ссылочный пример 7

2,19 г 4-[3-(2,3-Диоксо-1-пиперазинил)-пропокси]бензонитрила растворяют 24,0 мл N,N-диметилформамида и к раствору добавляют 0,32 г 60% гидрида натрия с последующим перемешиванием при комнатной температуре в течение 1 часа. При охлаждении льдом к раствору по каплям добавляют 8,0 мл раствора 1,92 г 4-(3-бромпропокси)бензонитрила в N, N-диметилформамиде с последующим перемешиванием при комнатной температуре в течение 3 часов. К реакционной смеси добавляют 30 мл воды и 30 мл хлороформа и смесь приводят к рН 1 с помощью хлористоводородной кислоты с концентрацией 1 моль/л. Далее органический слой отделяют. Полученный органический слой последовательно промывают водой и насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния. Растворитель далее удаляют при пониженном давлении с получением 3,30 г белого твердого вещества 4-(3-{4-[4-3-(4-цианофенокси)пропил]-2, 3-диоксо-1-пиперазинил}пропокси)бензонитрила.
ИК (KBr) см-1: 2222, 1660, 1603.
1H-ЯМР (d6-ДМСО) δ: 1,96-2,03 (4H, м), 3,50 (4H, т, J = 6,8 Гц), 3,55 (4H, с), 4,09 (4H, т, J = 6,1 Гц), 7,07-7,11 (4H, м), 7,74-7,78 (4H, м).
Ссылочный пример 8
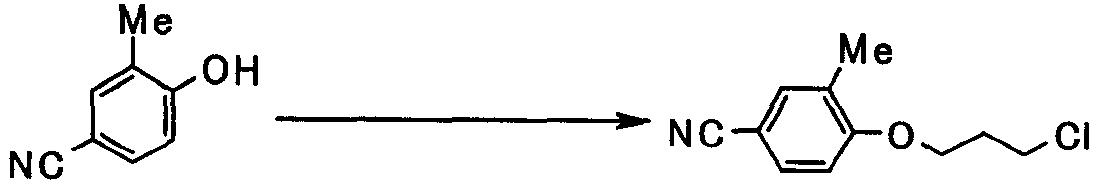
Следующее соединение получают тем же образом, что и в ссылочном примере 1.
4-(3-Хлорпропокси)-3-метилбензонитрил.
1H-ЯМР (CDCl3) δ: 2,22 (3H, с), 2,28-2,32 (2H, м), 3,77 (2H, т, J = 6,4 Гц), 4,18 (2H, т, J = 5,9 Гц), 6,87 (1H, д, J = 8,4 Гц), 7,40-7,50 (2H, м).
Ссылочный пример 9

Следующее соединение получают тем же образом, что и в ссылочном примере 1.
4-(3-Бромпропокси)-3-метоксибензонитрил.
1H-ЯМР (CDCl3) δ: 2,37-2,43 (2H, м), 3,63 (2H, т, J = 6,3 Гц), 3,88 (3H, с), 4,21 (2H, т, J = 6,0 Гц), 6,93 (1H, д, J = 8,3 Гц), 7,09 (1H, д, J = 1,7 Гц), 7,26-7,29 (1H, м).
Ссылочный пример 10

Следующее соединение получают тем же образом, что и в ссылочном примере 1.
4-(3-Бромпропокси)-2-фторбензонитрил.
1H-ЯМР (CDCl3) δ: 2,32-2,38 (2H, м), 3,59 (2H, т, J = 6,3 Гц), 4,17 (2H, т, J = 5,9 Гц), 6,72-6,80 (2H, м), 7,53 (1H, д-д, J = 7,6, 8,5 Гц).
Ссылочный пример 11
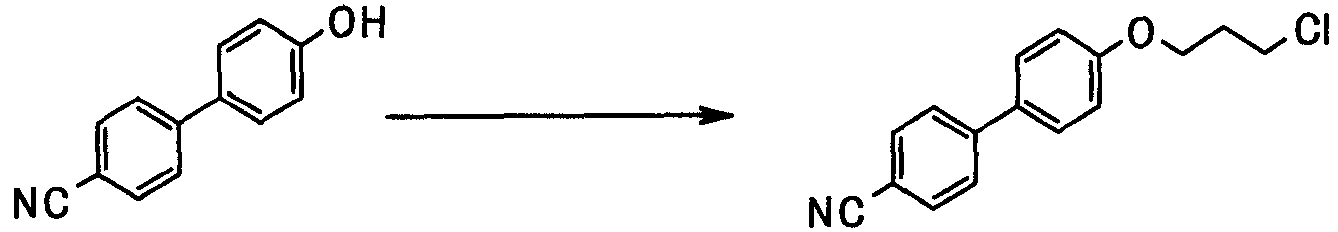
Следующее соединение получают тем же образом, что и в ссылочном примере 1.
4'-(3-Хлорпропокси)-[1,1'-бифенил]-4-карбонитрил.
1H-ЯМР (CDCl3) δ: 2,24-2,30 (2H, м), 3,77 (2H, т, J = 6,4 Гц), 4,17 (2H, т, J = 5,8 Гц), 6,99-7,02 (2H, м), 7,51-7,55 (2H, м), 7,62-7,69 (4H, м).
Ссылочный пример 12

Следующее соединение получают тем же образом, что и в ссылочном примере 1.
4-{[(E)-4-Хлор-2-бутенил]окси}бензонитрил.
1H-ЯМР (CDCl3) δ: 4,10-4,11 (2H, м), 4,60-4,61 (2H, м), 6,00-6,03 (2H, м), 6,94-6,97 (2H, м), 7,57-7,61 (2H, м).
Ссылочный пример 13

Следующее соединение получают тем же образом, что и в ссылочном примере 1.
4-(3-Хлор-2-метилпропокси)бензонитрил.
1H-ЯМР (CDCl3) δ: 1,16 (3H, д, J = 6,8 Гц), 2,35-2,42 (1H, м), 3,63-3,72 (2H, м), 3,95-4,03 (2H, м), 6,95-6,97 (2Н, м), 7,58-7,60 (2Н, м).
Ссылочный пример 14

Следующее соединение получают тем же образом, что и в ссылочном примере 1.
4-[2-(Бензилокси)-3-бромпропокси]бензонитрил.
1H-ЯМР (CDCl3) δ: 3,56-3,65 (2H, м), 3,97-4,02 (1H, м), 4,14-4,21 (2H, м), 4,66, 4,76 (2H, АВкв, J = 12,0 Гц), 6,92-6,96 (2H, м), 7,31-7,37 (5H, м), 7,56-7,60 (2H, м).
Ссылочный пример 15

9,45 г 4-Аминобензонитрила суспендируют в 20,3 мл 1,3-дибромпропана и к данной суспензии добавляют 21,0 N,N-дииизопропилэтиламина с последующим перемешиванием при 110°С в течение 2 часов. После завершения реакции к реакционному раствору добавляют хлороформ, воду и насыщенный раствор бикарбоната натрия. Далее органический слой отделяют. Отделенный органический слой промывают насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния. Далее его концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле[элюент; н-гексан:этилацетат = 5:1] с получением 5,21 г бледно-желтого твердого вещества, 4-[(3-бромпропил)амино]бензонитрила.
1H-ЯМР (CDCl3) δ: 2,13-2,20 (2H, м), 3,39 (2H, т, J = 6,6 Гц), 3,50 (2H, т, J = 6,2 Гц), 4,35 (1H, с), 6,57-6,61 (2H, м), 7,41-7,44 (2H, м).
Ссылочный пример 16
Ссылочный пример 16-1

3,85 г Этил-3-фтор-4-гидроксибензоата растворяют в 46 мл ацетона и далее к данному раствору добавляют 2,89 г карбоната калия и 3,29 г 1-бром-3-хлорпропана при комнатной температуре с последующим перемешиванием при нагревании с обратным холодильником в течение 5 часов. Далее к данной смеси добавляют 1,45 г карбоната калия и 1,65 г 1-бром-3-хлорпропана и полученную смесь перемешивают при той же температуре в течение 4 часов. Далее температуру понижают до комнатной температуры. Реакционную смесь фильтруют через Целит и полученный фильтрат концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле[элюент; н-гексан:этилацетат = 10:1] с получением 4,04 г бесцветного масла продукта, этил-4-(3-хлорпропокси)-3-фторбензоата.
1H-ЯМР (CDCl3) δ: 1,38 (3H, т, J = 7,1 Гц), 2,27-2,33 (2Н, м), 3,78 (2Н, т, J = 6,2 Гц), 4,25 (2Н, т, J= 5,8 Гц), 4, 35 (2H, кв, J = 7,1 Гц), 6,70 (1H, т, J = 8,4 Гц), 7,74-7,82 (2H, м).
Ссылочный пример 16-2

4,00 г Этил-4-(3-хлорпропокси)-3-фторбензоата растворяют в 40 мл тетрагидрофурана и далее при охлаждении льдом к данному раствору добавляют 0,70 г алюмогидрида лития раздельными частями 3 раза. Смесь перемешивают при той же температуре в течение 1,5 часов. Далее к данной смеси добавляют этилацетат и воду. Реакционную смесь фильтруют через Целит так, чтобы органический слой отделился. Отделенный органический слой сушат над безводным сульфатом магния и далее растворитель удаляют при пониженном давлении с получением 3,40 г бесцветного масла продукта, [4-(3-хлорпропокси)-3-фторфенил]метанола.
1H-ЯМР (CDCl3) δ: 1,60-2,00 (1H, шир.), 2,23-2,30 (2H, м), 3,78 (2H, т, J = 6,2 Гц), 4,19 (2H, т, J = 5, 8 Гц), 4,60-4,63 (2H, м), 6,95-7,14 (3H, м).
Ссылочный пример 16-3

3,30 г [4-(3-Хлорпропокси)-3-фторфенил]метанола растворяют в 33 мл хлороформа и к данному раствору при комнатной температуре добавляют 13,1 г диоксида марганца с поледующим перемешиванием при температуре в интервале от 50 до 60°С в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь фильтруют через Целит и полученный фильтрат концентрируют при пониженном давлении с получением 3,30 г бледно-желтого масла продукта 4-(3-хлорпропокси)-3-фторбензальдегида.
ИК (чистого вещества)см-1: 1690, 1610, 1515, 1442, 1282.
Ссылочный пример 16-4

3,30 г 4-(3-хлорпропокси)-3-фторбензальдегида растворяют в 40 мл муравьиной кислоты и к данному раствору при комнатной температуре добавляют 1,11 г гидрохлорида гидроксиламина и 2,07 г формиата натрия с последующим перемешиванием при температуре в интервале от 90 до 100°С в течение 3 часов. Реакционную смесь концентрируют при пониженом давлении до приблизительно одной третьей части ее количества и далее к ней добавляют воду и этилацетат. Далее к смеси добавляют карбонат натрия для нейтрализации. Органический слой отделяют и отделенный органический слой сушат над безводным сульфатом магния. Растворитель удаляют при пониженном давлении и полученный остаток очищают колоночной хроматографией на силикагеле[элюент; н-гексан:этилацетат = 8:1] с получением 2,87 г бесцветного масла продукта, 4-(3-хлорпропокси)-3-фторбензонитрила.
1H-ЯМР (CDCl3) δ: 2,28-2,34 (2H, м), 3,77 (2H, т, J = 6,2 Гц), 4,26 (2H, т, J = 5,8 Гц), 7,02-7,07 (1H, м), 7,35-7, 44 (2H, м).
Ссылочный пример 17
Ссылочный пример 17-1

0,70 г 5-Метил-3-гидроксиизоксазола растворяют в 10 мл пиридина и к данному раствору при охлаждении льдом добавляют 1,1 мл триэтиламина и 0,90 мл бензолсульфонилхлорида с последующим нагревом при кипячении с обратным холодильником в течение 1 часа. После охлаждения до комнатной температуры растворитель удаляют при пониженном давлении. К полученному остатку добавляют 20 мл воды и 30 мл этилацетата так, чтобы органический слой отделился. Водный слой экстрагируют дважды 20 мл этилацетата. Полученный органический слой объединяют и далее промывают водой, хлористоводородной кислотой с концентрацией 1 моль/л и насыщенным раствором бикарбоната натрия, сушат над безводным сульфатом магния с последующим концентрированием при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле[элюент; толуол:этилацетат = 20:1] с получением 1,50 г бесцветного масла продукта, 5-метил-3-изоксазолилбензолсульфоната.
1H-ЯМР (CDCl3) δ: 2,40 (3H, д, J = 0,6 Гц), 6,05 (1H, кв, J = 0,6 Гц), 7,56-7,61 (2H, м), 7,70-7,74 (1H, м), 7,97-7,99 (2H, м).
Ссылочный пример 17-2

10 мл бензола добавляют к 1,00 г 5-метил-3-изоксазолилбензолсульфоната и далее к данному раствору при комнатной температуре добавляют 1,10 г N-бромсукцинимида и 0,05 г бензоилпероксида с последующим нагревом при кипячении с обратным холодильником в течение 1 часа. Через 1 час к данной смеси добавляют 0,05 г бензоилпероксида с последующим нагревом при кипячении с обратным холодильником в течение 2 часов. Далее к данной смеси добавляют 0,05 г 2,2'-азобис(изобутиронитрила) с последующим нагревом при кипячении с обратным холодильником в течение 3 часов. Затем добавляют 0,05 г 2,2'азобис(изобутиронитрил) с последующим нагревом при кипячении с обратным холодильником в течение 6 часов. После охлаждения до комнатной температуры к реакционной смеси добавляют 30 мл толуола и 20 мл воды так, чтобы органический слой отделился. Водный слой экстрагируют дважды 20 мл толуола. Объединенный органический слой промывают насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния с последующим концентрированием при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле[элюент; н-гексан:бензол = 1:1] с получением 0,65 г бесцветного масла продукта, 5-(бромметил)-3-изоксазолилбензолсульфоната.
1H-ЯМР (CDCl3) δ: 4,37 (2H, с), 6,39 (1H, с), 7,60-7,63 (2H, м), 7,73-7,74 (1H, м), 7,97-8,00 (2H, м).
Ссылочный пример 18
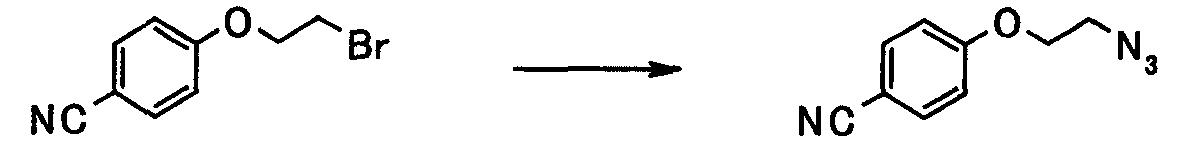
Следующее соединение получают тем же образом, что и в ссылочном примере 6.
4-(2-Азидоэтокси)бензонитрил.
1H-ЯМР (CDCl3) δ: 3,63-3,66 (2H, м), 4,18-4,21 (2H, м), 6,97-6,99 (2H, м), 7,58-7,62 (2H, м).
Ссылочный пример 19

Следующее соединение получают тем же образом, что и в ссылочном примере 6.
4[(3-Азидопропил)амино]бензонитрил.
1H-ЯМР (CDCl3) δ: 1,87-1,93 (2H, м), 3,27-3,32 (2H, м), 3,46 (2H, т, J = 6,4 Гц), 4,38 (1H, шир.с), 6,57 (2H, д, J = 8, 8 Гц), 7,43 (2H, д, J = 8,8 Гц).
Ссылочный пример 20

Следующее соединение получают тем же образом, что и в ссылочном примере 6.
4[(3-Азидопропил)сульфанил]бензонитрил.
1H-ЯМР (CDCl3) δ: 1,92-1,98 (2H, м), 3,08 (2H, т, J = 7,2 Гц), 3,48 (2H, т, J = 6,2 Гц), 7,31-7,34 (2H, м), 7,53-7,56 (2H, м).
Ссылочный пример 21

1,75 г 4-(2-Азидоэтокси)бензонитрила растворяют в 15 мл уксусной кислоты и к данному раствору при комнатной температуре добавляют 0,36 г 5% палладий-углерода с последующим перемешиванием в атмосфере водорода при комнатной температуре при атмосферном давлении в течение 7 часов. После завершения реакции катализатор удаляют фильтрацией и фильтрат концентрируют при пониженном давлении. К полученному остатку добавляют изопропанол и смесь фильтруют, таким образом получая 1,64 г белого твердого вещества гидрохлорида 4-(2-аминоэтокси)бензонитрила "гидрохлорида нитрила".
1H-ЯМР (d6-ДМСО) δ: 3,22 (2H, т, J = 5,2 Гц), 4,30 (2H, т, J = 5,2 Гц), 7,14-7,18 (2H, м), 7,79-7,83 (2H, м), 8,40 (2H, шир.с).
Ссылочный пример 22

2,00 г 4-(3-бромпропокси)бензонитрила растворяют в 20 мл диметилсульфоксида и к данному раствору добавляют 0,50 г азида натрия с последующим перемешиванием при комнатной температуре в течение 5 часов. К реакционной смеси добавляют воду и этилацетат так, чтобы органические слои разделились. Отделенный органический слой промывают насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния. Растворитель далее удаляют при пониженном давлении. Полученный остаток растворяют в 20 мл этанола и к данному раствору добавляют 0,20 г 5% палладий-углерода с последующим перемешиванием в атмосфере водорода при комнатной температуре при атмосферном давлении в течение 5 часов. После завершения реакции катализатор удаляют фильтрацией и фильтрат концентрируют при пониженном давлении. К полученному остатку добавляют этилацетат и хлористоводородную кислоту и водный слой отделяют. Органические слои экстрагируют водой и их объединяют с отделенным водным слоем с последующим концентрированием при пониженном давлении. К полученному остатку добавляют воду и хлороформ и далее к нему добавляют водный раствор гидроксида натрия с концентрацией 5 моль/л для приведения рН до 12,5. Органический слой отделяют и отделенный органический слой сушат над безводным сульфатом магния. Растворитель удаляют при пониженном давлении с получением 0,96 г бледно-желтого масла продукта, 4-(3-аминопропокси)бензонитрила.
1H-ЯМР (CDCl3) δ: 1,20-1,60 (2H, шир.), 1,92-1,98 (2H, м), 2,92 (2H, т, J = 6,7 Гц), 4,11 (2H, т, J = 6,1 Гц), 6,95 (2H, д, J = 8,9 Гц), 7,58 (2H, д, J = 8,9 Гц).
Ссылочный пример 23
Ссылочный пример 23-1
Следующее соединение получают тем же образом, что и в ссылочном примере 2
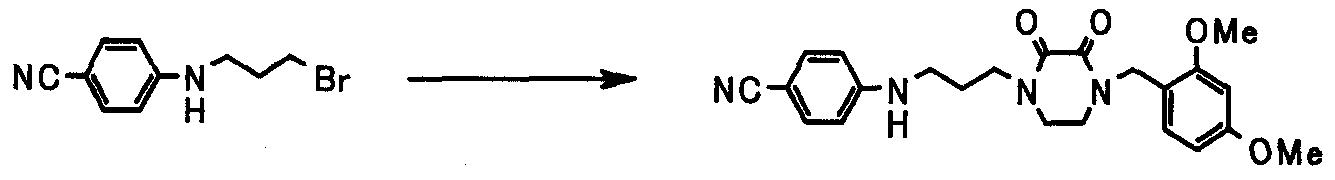
4-({3-[4-(2,4-Диметоксибензил)-2, 3-диоксо-1-пиперазинил]пропил}амино)бензонитрил.
1H-ЯМР (CDCl3) δ: 1,78-1,84 (2H, м), 3,20-3,25 (2H, м), 3,39 (4H, с), 3,55 (2H, т, J = 6,1 Гц), 3,81 (3H, с), 4,62 (2H, с), 5,22 (1H, т, J = 6,2 Гц), 6,46-6,48 (2H, м), 6,52-6,55 (2H, м), 7,25-7,27 (1H, м), 7,34-7,36 (2H, м).
Ссылочный пример 23-2
Следующее соединение получают тем же образом, что и в ссылочном примере 3.
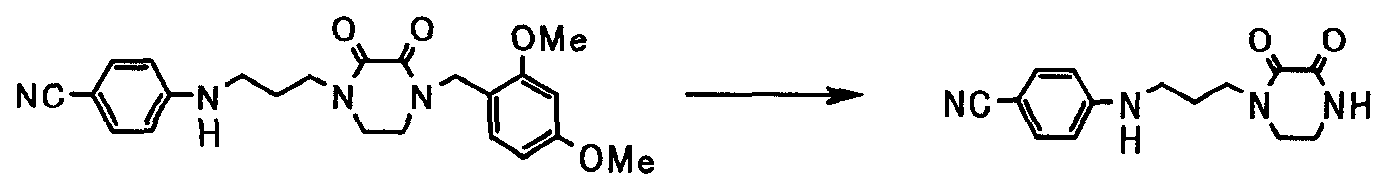
4-{[3-(2, 3-Диоксо-1-пиперазинил)пропил]амино}бензонитрил.
1H-ЯМР (CDCl3) δ: 1,84-1,90 (2H, м), 3,24 (2H, т, J = 6,0 Гц), 3,53-3,57 (4H, м), 3,62 (2H, т, J = 6,2 Гц), 5,12 (1H, шир.с), 6,56-6,59 (2H, м), 7,17 (1H, шир.с), 7,40-7,42 (2H, м).
Ссылочный пример 24
Следующее соединение получают тем же образом, что и в ссылочных примерах 2 и 3.

3-[3-(2,3-Диоксо-1-пиперазинил)пропокси]бензонитрил.
1H-ЯМР (CDCl3) δ: 2,13-2,17 (2H, м), 3,56-3,59 (2H, м), 3,62-3,64 (2H, м), 3,71 (2H, т, J = 7,1 Гц), 4,05 (2H, т, J = 5,8 Гц), 7,05 (1H, с), 7,11-7,13 (2H, м), 7,25-7,26 (1H, м), 7,37-7,39 (1H, м).
Ссылочный пример 25
Ссылочный пример 25-1

1,00 г 4-(3-Хлорпропокси)бензонитрила растворяют в 20 мл диметилформамида и далее к данному раствору добавляют 0,25 г 60% гидрида натрия при охлаждении льдом. Далее реакционную смесь нагревают до комнатной температуры. К смеси добавляют 1,50 г бензил-5-оксо-1,4-диазепан-1-карбоксилата с последующим перемешиванием при 65°С до 75°С в течение 2,5 часов. Реакционную смесь охлаждают до комнатной температуры и выливают в смешанный раствор, состоящий из ледяной воды и этилацетата. Смесь подкисляют хлористоводородной кислотой и далее органический слой отделяют. Отделенный органический слой промывают насыщенным водным раствором хлоридом натрия и далее сушат над безводным сульфатом магния. Растворитель удаляют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле [элюент; этилацетат] с получением 0,91 г бесцветного масла продукта, бензил-4-[3-(4-цианофенокси)пропил]-5-оксо-1, 4-диазепан-1-карбоксилата.
1H-ЯМР (CDCl3) δ: 2,03-2,05 (2H, м), 2,66 (2H, шир.с), 3,46-3,50 (2H, м), 3,59 (2H, т, J = 6,8 Гц), 3,67 (4H, с), 4,02 (2H, т, J = 6,2 Гц), 5,14 (2H, с), 6,92 (2H, д, J = 8,8 Гц), 7,32-7,38 (5H, м), 7,57 (2H, д, J = 8,8 Гц).
Ссылочный пример 25-2

0,62 г Бензил-4-[3-(4-цианофенокси)пропил]-5-оксо-1,4-диазепан-1-карбоксилата растворяют в смешанном растворе, состоящем из 13,0 мл этанола и 4,5 мл N,N-диметилформамида, и далее к данному раствору добавляют 0,32 г 5% палладий-углерода с последующим перемешиванием в атмосфере водорода при комнатной температуре при атмосферном давлении в течение 4 часов. После завершения реакции катализатор удаляют фильтрацией и фильтрат концентрируют при пониженном давлении с получением 0,44 г желтого масла продукта, 4-[3-(7-оксо-1, 4-диазепан-1-ил)пропокси]бензонитрила.
1H-ЯМР (CDCl3) δ: 2,00-2,08 (2H, м), 2,65-2,67 (2H, м), 2,93-2,98 (4H, м), 3,44-3,46 (2H, м), 3,57 (2H, т, J = 7,2 Гц), 4,04 (2H, т, J = 6,2 Гц), 6,93-6,96 (2H, м), 7,57-7,60 (2H, м).
Ссылочный пример 26

1,70 г гомопиперазина растворяют в 20 мл N,N-диметилформамида и далее к данному раствору добавляют 1,60 г карбоната калия и 1,00 г 4-(3-бромпропокси)бензонитрила с последующим перемешиванием при комнатной температуре в течение 12 часов. К реакционной смеси добавляют водный раствор гидроксида натрия с концентрацией 1 моль/л и хлороформ так, чтобы органический слой отделился. Отделенный органический слой сушат над безводным сульфатом магния и далее растворитель удаляют при пониженном давлении. Полученный масляный продукт очищают колоночной хроматографией на силикагеле [элюент; хлороформ:метанол = 5:1] с получением 1,00 г бесцветного масла продукта, 4-[3-(1,4-диазепан-1-ил)пропокси]бензонитрила.
1H-ЯМР (CDCl3) δ: 1,50-1,70 (1H, м), 1,73-1,79 (1H, м), 1,93-2,00 (1H, м), 2,66-2,73 (6H, м), 2,90-2,95 (4H, м), 4,08 (2H, т, J = 6,4 Гц), 6,94-6,97 (2H, м), 7,56-7,59 (2H, м).
Ссылочный пример 27

Следующее соединение получают тем же образом, что и в ссылочном примере 26.
4-[3-(3-Оксо-1-пиперазинил)пропокси]бензонитрил.
1H-ЯМР (CDCl3) δ: 1,97-2,03 (2H, м), 2,62 (2H, т, J = 7,0 Гц), 2,67-2,69 (2H, м), 3,16 (2H, с), 3,35-3,39 (2H, м), 4,08 (2H, т, J = 6,4 Гц), 6,65 (1H, шир.с), 6,93-6,96 (2H, м), 7,56-7,60 (2H, м).
Ссылочный пример 28
Ссылочный пример 28-1

1,44 г 4-трет-бутоксикарбониламинопиперидина растворяют в 14 мл N,N-диметилформамида. Далее к вышеуказанному раствору последовательно добавляют 1,99 г карбоната калия и 1,87 г 4-(3-бромпропокси)бензонитрила с последующим перемешиванием при комнатной температуре в течение 24 часов. К реакционной смеси добавляют воду и этилацетат так, чтобы органический слой отделился. Отделенный органический слой промывают насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния. Далее растворитель удаляют при пониженном давлении. Полученное твердое вещество фильтруют, промывая смешанным раствором, состоящим из н-гексана и диизопропилового эфира, получая 2,12 г трет-бутил-1-[3-(4-цианофенокси)пропил]-4-пиперидинилкарбамата.
1H-ЯМР (CDCl3) δ: 1,38-1,45 (2H, м), 1,45 (9H, с), 1, 92-2,11 (6H, м), 2,49 (2H, т, J = 7,2 Гц), 2,82-2,85 (2H, м), 3,40-3,60 (1H, м), 4,05 (2H, т, J = 6,2 Гц), 4,30-4,50 (1H, м), 6,92-6,95 (2H, м), 7,56-7,59 (2H, м).
Ссылочный пример 28-2

2,12 г трет-бутил-1-[3-(4-цианофенокси)пропил]-4-пиперидинилкарбамата растворяют в 20 мл хлористоводородной кислоты с концентрацией 6 моль/л с последующим перемешиванием при комнатной температуре в течение 3 дней. Реакционную смесь концентрируют при пониженном давлении и далее к полученному твердому веществу добавляют воду и хлороформ. Далее смесь приводят к рН 13,0 водным раствором гидроксида натрия с концентрацией 5 моль/л. Органический слой отделяют и далее водный слой экстрагируют хлороформом 4 раза. Объединенный органический слой сушат над безводным сульфатом магния и далее концентрируют при пониженном давлении с получением 1,64 г белого твердого вещества, 4-[3-(4-амино-1-пиперидинил)пропокси]бензонитрила.
1H-ЯМР (CDCl3) δ: 1,00-1,70 (4H, м), 1,78-1,85 (2H, м), 1,95-2,05 (4H, м), 2,49 (2H, т, J = 7, 2 Гц), 2,63-2,70 (1H, м), 2,82-2,90 (2H, м), 4,06 (2H, т, J = 6,3 Гц), 6,93-6,96 (2H, м), 7,56-7,59 (2H, м).
Ссылочный пример 29
Ссылочный пример 29-1

Следующее соединение получают тем же образом, что и в ссылочном примере 28-1.
трет-Бутил-1-[3-(4-цианофенокси)пропил]-3-пирроллидинилкарбамат.
1H-ЯМР (CDCl3) δ: 1,44 (9H, с), 1,52-1,65 (2H, м), 1,95-2,01 (2H, м), 2,10-2,38 (2H, м), 2, 52-2,64 (1H, м), 2,59 (2H, т, J = 6,7 Гц), 2,70-2,90 (1H, м), 4,07 (2H, т, J = 6,7 Гц), 4,10-4,20 (1H, м), 4,74-4,84 (1H, м), 6,94 (2H, д, J = 8,8 Гц), 7,58 (2H, д, J = 8,8 Гц).
Ссылочный пример 29-2

Следующее соединение получают тем же образом, что и в ссылочном примере 28-2.
4-[3-(3-Амино-1-пирроллидинил)пропокси]бензонитрил.
1H-ЯМР (CDCl3) δ: 1,36-1,75 (3H, м), 1,96-2,05 (2H, м), 2,12-2, 24 (1H, м), 2,32-2,35 (1H, м), 2,44-2,50 (1H, м), 2,52-2,67 (2H, м), 2,67-2,80 (2H, м), 3,48-3,56 (1H, м), 4,08 (2H, т, J = 6,3 Гц), 6,94 (2H, д, J = 8, Гц), 7,57 (2H, д, J = 8,8 Гц).
Ссылочный пример 30

Следующее соединение получают тем же образом, что и в ссылочном примере 28.
Гидрохлорид 3-метокси-4-[3-(1-пиперазинил)пропокси]бензонитрила.
1H-ЯМР (d6-ДМСО) δ: 2,10-2,30 (2H, м), 3,10-3,90 (10Н, м), 3,82 (3H, с), 4,16 (2H, т, J = 6,0 Гц), 7,14 (1H, д, J = 9,0 Гц), 7,42-7,44 (2H, м), 9,40-9,70 (3H, шир.).
Ссылочный пример 31
Ссылочный пример 31-1

0,75 г 4-Амино-1-бензилпиперидина растворяют в 6,0 мл N,N-диметилформамида и далее к данному раствору добавляют 0,90 г карбоната калия и 0,85 г 4-(3-бромпропокси)бензонитрила с последующим перемешиванием при комнатной температуре в течение 3 дней. К реакционной смеси добавляют воду, хлороформ и карбонат калия так, чтобы органический слой отделился. Далее водный слой экстрагируют хлороформом. Объединенный органический слой сушат над безводным сульфатом магния и растворитель далее удаляют при пониженном давлении. Полученный маслянистый продукт растворяют в 10 мл хлороформа и далее к данному раствору добавляют 1,0 мл триэтиламина и 0,85 г ди-трет-бутилдикарбоната с последующим перемешиванием при комнатной температуре в течение 12 часов. Данную реакционную смесь концентрируют при пониженном давлении. Полученный маслянистый продукт очищают колоночной хроматографией [элюент; н-гексан:этилацетат = 1:1] с получением 1,56 г бесцветного масла продукта трет-бутил-1-бензил-4-пиперидинил-[3-(4-цианофенокси)пропил]карбамата.
1H-ЯМР (CDCl3) δ: 1,45 (9H, с), 1,50-1,80 (4H, м), 1,80-2,12 (5H, м), 2,90-2,96 (2H, м), 3,29 (2H, шир.с), 3,49 (2H, с), 4,00 (2H, т, J = 6,1 Гц), 6,90-6,94 (2H, м), 7,20-7,40 (5H, м), 7,54-7,60 (2H, м).
Ссылочный пример 31-2

1,56 г трет-Бутил-1-бензил-4-пиперидинил-[3-(4-цианофенокси)пропил]карбамата растворяют в 20 мл метанола и далее к данному раствору добавляют 0,30 г 5% палладий-углерода с последующим перемешиванием в атмосфере водорода при комнатной температуре при атмосферном давлении в течение 18 часов. После завершения реакции катализатор удаляют и растворитель удаляют при пониженном давлении с получением 1,05 г трет-бутил-3-(4-цианофенокси)пропил(4-пиперидинил)карбамата.
1H-ЯМР (CDCl3) δ: 1,44 (9H, с), 1,50-2,30 (8H, м), 2,82-2,94 (2H, м), 3,26-3,34 (2H, м), 3, 46-3,54 (1H, м), 4,01 (2H, т, J = 6,2 Гц), 6,93-7,00 (2H, м), 7,54-7,60 (2H, м).
Ссылочный пример 32
Ссылочный пример 32-1

4,91 г трет-Бутил-4-(2-бромэтил)-1-пиперидинилкарбоксилата растворяют в 50 мл 2-бутанона и далее к данному раствору добавляют 2,00 г 4-цианофенола и 4,64 г карбоната калия с последующим нагревом при кипячении с обратным холодильником в течение 4 часов. После охлаждения до комнатной температуры к реакционной смеси добавляют 50 мл воды и 50 мл этилацетата так, чтобы органический слой отделился. Отделенный органический слой промывают насыщенным анодным раствором хлорида натрия, сушат над безводным сульфатом магния и растворитель далее удаляют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле [элюент; н-гексан:этилацетат = 2:1] с получением 3,61 г бесцветного масла продукта, трет-бутил-4-[2-(4-цианофенокси)этил]-1-пиперидинкарбоксилата.
1H-ЯМР (CDCl3) δ: 1,00-1,30 (2H, м), 1,46 (9H, с), 1,50-2,04 (5H, м), 2,62-2, 76 (2H, м), 4,05 (2H, т, J = 6,2 10 Гц), 4,00-4,18 (2H, м), 6,93 (2H, д, J = 8,5 Гц), 7,58 (2H, д, J = 8,5 Гц).
Ссылочный пример 32-2

Следующее соединение получают тем же образом, что и в ссылочном примере 28-2.
4-[2-(4-Пиперидинил)этокси]бензонитрил.
1H-ЯМР (CDCl3) δ: 1,16-1,27 (2H, м), 1,60-1,78 (5H, м), 1,80-2,05 (1H, м), 2,59-2,66 (2H, м), 3,08-3,11 (2H, м), 4, 05 (2H, т, J = 6,3 Гц), 6,91-6,95 (2H, м), 7,56-7,59 (2H, м).
Ссылочный пример 33

1,60 г гидрохлорида 4-(2-аминоэтокси)бензонитрила суспендируют в 16 мл N,N-диметилформамида и далее к данной суспензии при комнатной температуре добавляют 3,75 г триэтиламина и 1,21 г 4-(2-бромэтокси)бензонитрила с последующим перемешиванием при температуре в интервале от 50 до 60°С в течение 9 часов. После охлаждения до комнатной температуры к реакционной смеси добавляют воду и хлороформ и далее к ней добавляют карбонат калия так, чтобы раствор стал щелочным. Далее органический слой отделяют. Отделенный органический слой промывают насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния. Растворитель удаляют при пониженном давлении и полученный остаток очищают колоночной хроматографией на силикагеле [элюент; хлороформ:этанол = 10:1]. Полученное твердое вешество фильтруют, промывая смесью толуол-этилацетат с получением 0,36 г белого твердого вещества 4-(2-{[2-{[2-(4-цианофенокси)этил]амино}этокси)бензонитрила.
1H-ЯМР (CDCl3) δ: 3,13 (4H, т, J = 5,1 Гц), 4,15 (4H, т, J = 5,1 Гц), 6,96 (4H, д, J = 8,6 Гц), 7,58 (4H, д, J = 8,6 Гц).
Ссылочный пример 34
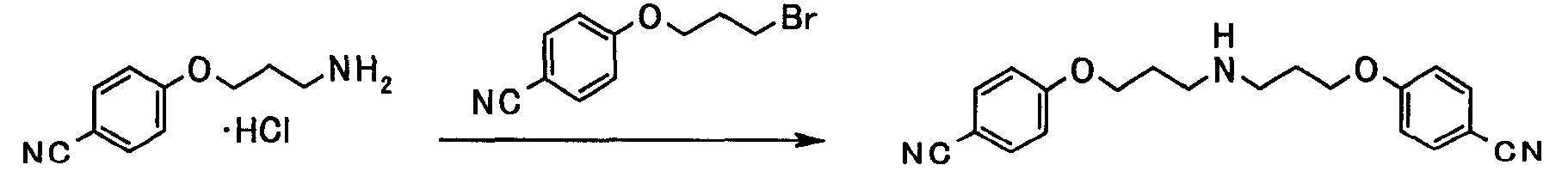
Следующее соединение получают тем же образом, что и в ссылочном примере 33.
4-(3-{[3-(4-Цианофенокси)пропил]амино}пропокси)бензонитрил.
1H-ЯМР (CDCl3) δ: 2,10-2,20 (4H, м), 2,96 (4H, т, J = 7,0 Гц), 4,12 (4H, т, J = 6, 2 Гц), 6,92-6,95 (4H, м), 7,55-7,58 (4H, м).
Ссылочный пример 35

Следующее соединение получают тем же образом, что и в ссылочном примере 33.
4-(3-{[6-(4-Цианофенокси)гексил]амино}пропокси)бензонитрил.
1H-ЯМР (CDCl3) δ: 1,38-1,58 (7H, м), 1,77-1,84 (2H, м), 1,97-2,03 (2H, м), 2,64 (2H, т, J = 7,4 Гц), 2,81 (2H, т, J = 6,8 Гц), 3,99 (2H, т, J = 6,4 Гц), 4,09 (2H, т, J = 6,2 Гц), 6,91-6,95 (4H, м), 7,56-7,60 (4H, м).
Ссылочный пример 36

Следующее соединение получают тем же образом, что и в ссылочном примере 7.
4-[(6-{4-[3-(4-Цианофенокси)пропил]-2,3-диоксо-1-пиперазинил}гексил)окси]бензонитрил.
1H-ЯМР (CDCl3) δ: 1,30-1,68 (6H, м), 1,74-1,90 (2H, м), 2,10-2,20 (2Н, м), 3,44-3,62 (6Н, м), 3,67 (2Н, т, J = 7,0 Гц), 3,99 (2Н, т, J = 6,2 Гц), 4,07 (2H, т, J = 6,2 Гц), 6,91-6,94 (4H, м), 7,56-7,59 (4H, м).
Ссылочный пример 37

Следующее соединение получают тем же образом, что и в ссылочном примере 7.
3-(3-{4-[3-(4-Цианофенокси)пропил]-2,3-диоксо-1-пиперазинил}пропокси)бензонитрил.
1H-ЯМР (d6 -ДМСО) δ: 1,94-2,04 (4H, м), 3,46-3,58 (8H, м), 4,02-4,12 (4H, м), 7,09 (2H, д, J = 8,4 Гц), 7,24-7,54 (4H, м), 7,76 (2H, д, J = 8,4 Гц).
Ссылочный пример 38

Следующее соединение получают тем же образом, что и в ссылочном примере 7.
4-[(3-{4-[3-(4-Цианофенокси)пропил]-2,3-диоксо-1-пиперазинил}пропил)амино]бензонитрил.
1H-ЯМР (d6-ДМСО) δ: 1,75-1,82 (2H, м), 1,96-2,02 (2H, м), 3,06-3,11 (2H, м), 3,42 (2H, т, J = 7,2 Гц), 3,49-3,53 (6H, м), 4,09 (2H, т, J = 6,4 Гц), 6,63 (2H, д, J = 8,8 Гц), 6,67 (1H, т, J = 5,2 Гц), 7,09 (2H, д, J = 8,8 Гц), 7,44 (2Н, д, J = 8,8 Гц), 7,76 (2Н, д, J = 8,8 Гц).
Ссылочный пример 39

Следующее соединение получают тем же образом, что и в ссылочном примере 7.
4-[(3-{4-[3-(4-Цианоанилино)пропил]-2,3-диоксо-1-пиперазинил}пропил)амино]бензонитрил.
1H-ЯМР (d6 -ДМСО) δ: 1,75-1,82 (4H, м), 3,07-3,11 (4H, м), 3,42 (4H, т, J = 7,1 Гц), 3,52 (4H, с), 6,63 (4H, д, J = 8,8 Гц), 6,67 (2H, т, J = 5,4 Гц), 7,44 (4H, д, J = 8,8 Гц).
Ссылочный пример 40
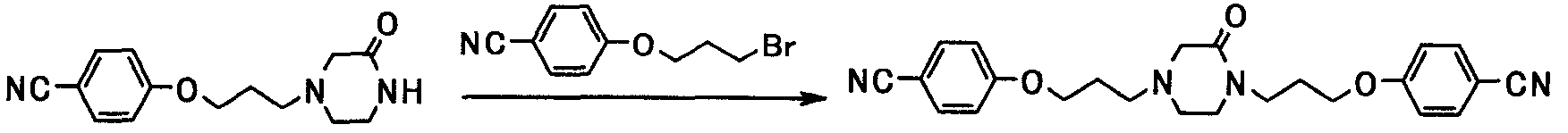
Следующее соединение получают тем же образом, что и в ссылочном примере 7.
4-[(3-{4-[3-(4-Цианофенокси)пропил]-2-оксо-1-пиперазинил}пропокси)бензонитрил.
1H-ЯМР (CDCl3) δ: 1,96-2,13 (4H, м), 2,59 (2H, т, J = 7,0 Гц), 2,71 (2H, т, J = 5,4 Гц), 3,15 (2H, с), 3,37 (2H, т, J = 5,4 Гц), 3,57 (2H, т, J = 7,0 Гц), 4,04-4,09 (4H, м), 6,93-6,95 (4H, м), 7,56-7,59 (4H, м).
Ссылочный пример 41
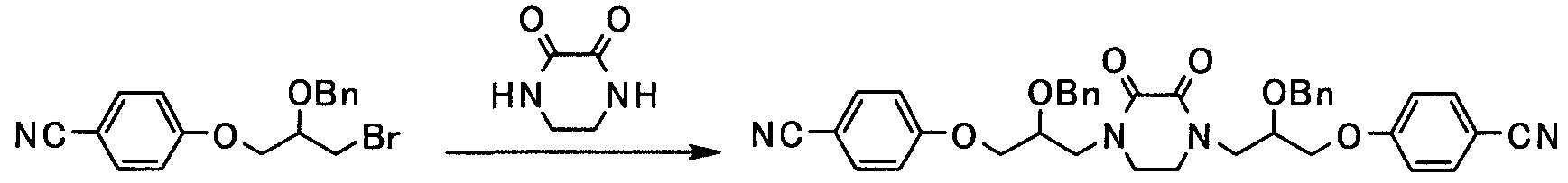
0,15 г 2,3-Пиперазиндиона суспендируют в 6,5 мл N,N-диметилформамида и далее к полученной суспензии при охлаждении льдом добавляют 0,11 г 60% гидрида натрия с последующим перемешиванием в течение 20 минут. Реакционную смесь нагревают до комнатной температуры и к ней добавляют 0, 91 г 4-[2-(бензилокси)-3-бромпропокси]бензонитрила с последующим перемешиванием в течение 7,5 часов. Далее к реакционной смеси добавляют 6,5 мл диметилсульфоксида и смесь оставляют на ночь. К реакционной смеси добавляют 20 мл воды и 20 мл этилацетата так, чтобы органический слой отделился. Водный слой экстрагируют 20 мл этилацетата 3 раза. Органические слои объединяют и полученный таким образом слой промывают насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния. Далее полученный в результате раствор концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле [элюент; н-гексан:этилацетат = 1:2] с получением 0,58 г белого твердого вещества, 4-(2-бензилокси)-3-{4-[2-(бензилокси)-3-(4-цианофенокси)пропил]-2,3-диоксо-1-пиперазинил}пропокси)бензонитрила.
1H-ЯМР (CDCl3) δ: 3,41-3,58 (6H, м), 3,78-3, 86 (2H, м), 4,00-4,06 (2H, м), 4,14-4,19 (4H, м), 4,57-4,75 (4H, м), 6,93-6,95 (4H, м), 7,27-7,33 (10Н, м), 7,57-7,59 (4H, м).
Ссылочный пример 42

0,97 г 4-[3-(1,4-диазепан-1-ил)пропокси]бензонитрила растворяют в 10 мл N,N-диметилформамида и далее к данному раствору добавляют 1,03 г карбоната калия и 0,97 г 4-(3-бромпропокси)бензонитрила с последующим перемешиванием при комнатной температуре в течение 12 часов. К реакционной смеси добавляют воду и этилацетат так, чтобы органический слой отделился. Органический слой сушат над безводным сульфатом магния и растворитель далее удаляют при пониженном давлении. Полученный маслянистый продукт очищают колоночной хроматографией на силикагеле [элюент; хлороформ:метанол = 30:1] с получением 1,13 г белого твердого вещества, 4-(3-{4-[3-(4-цианофенокси)пропил]-1, 4-диазепан-1-ил)пропокси)бензонитрила.
1H-ЯМР (CDCl3) δ: 1,70-1,90 (2H, м), 1,93-2,00 (4H, м), 2,66 (4H, т, J = 7,1 Гц), 2,71-2,74 (8H, м), 4,07 (4H, т, J = 6,3 Гц), 6,92-6,96 (4H, м), 7,56-7,59 (4H, м).
Ссылочный пример 43

Следующее соединение получают тем же образом, что и в ссылочном примере 42.
4-(3-{4-[2-(4-Цианофенокси)этил]-1-пиперазинил)пропокси)бензонитрил
1 H-ЯМР (CDCl3) δ: 1,97-2,03 (2H, м), 2,52-2,62 (10H, м), 2,84 (2H, т, J = 5,6 Гц), 4,07 (4H, т, J = 6,2 Гц), 4,15 (2H, т, J = 5,6 Гц), 6,93-6,96 (4H, м), 7,56-7,59 (4H, м).
Ссылочный пример 44

Следующее соединение получают тем же образом, что и в ссылочном примере 42.
Гидрохлорид 4'-(3-{4-[3-(4-цианофенокси)пропил]-1-пиперазинил}пропокси)[1,1'бифенил]-4-карбонитрила.
1H-ЯМР (d6 -ДМСО) δ: 2,10-2,30 (4H, м), 3,20-4,00 (12H, м), 4,16 (2H, т, J = 6,4 Гц), 4,20 (2H, т, J = 6,2 Гц), 7,08-7,14 (4H, м), 7,72-7,91 (8H, м).
Ссылочный пример 45

Следующее соединение получают тем же образом, что и в ссылочном примере 42.
4-{3-[4-(4-Цианобензил)-1-пиперазинил]пропокси}бензонитрил.
1H-ЯМР (CDCl3) δ: 1,94-2,02 (2H, м), 2,30-2,70 (10H, м), 3,55 (2H, с), 4,06 (2H, т, J = 6,4 Гц), 6,92-6,96 (2H, м), 7,45 (2H, д, J = 8,3 Гц), 7,55-7,62 (4H, м).
Ссылочный пример 46

Следующее соединение получают тем же образом, что и в ссылочном примере 42.
4-{4-[3-(4-Цианофенокси)пропил]-1-пиперазинил}бензонитрил.
1H-ЯМР (CDCl3) δ: 1,99-2,06 (2H, м), 2,56-2,62 (6H, м), 3,32-3,35 (4H, м), 4,10 (2H, т, J = 6,2 Гц), 6,84-6,88 (2H, м), 6,93-6,98 (2H, м), 7,48-7,53 (2H, м), 7,56-7,60 (2H, м).
Ссылочный пример 47

Следующее соединение получают тем же образом, что и в ссылочном примере 42.
4-{4-[5-(4-Цианофенокси)пентил]-1-пиперазинил}бензонитрил.
1H-ЯМР (CDCl3) δ: 1,48-1,65 (4H, м), 1, 81-1,88 (2H, м), 2,41-2,45 (2H, м), 2,57-2,60 (4H, м), 3,33-3,35 (4H, м), 4,01 (2H, т, J = 6,4 Гц), 6,83-6,88 (2H, м), 6,90-6,95 (2H, м), 7,47-7,52 (2H, м), 7,56-7,60 (2H, м).
Ссылочный пример 48

Следующее соединение получают тем же образом, что и в ссылочном примере 42.
4-(3-{4-[3-(4-Циано-2-метоксифенокси)пропил]-1-пиперазинил}пропокси)-3-метоксибензонитрил.
1H-ЯМР (CDCl3) δ: 2,00-2, 07 (4H, м), 2,30-2,70 (8H, м), 2,52 (4H, т, J = 7,1 Гц), 3,88 (6H, с), 4,13 (4H, т, J = 6,6 Гц), 6,92 (2H, д, J = 8,3 Гц), 7,07 (2H, д, J = 2,0 Гц), 7,25 (2H, дд, J = 2,0, 8,3 Гц).
Ссылочный пример 49

Следующее соединение получают тем же образом, что и в ссылочном примере 42.
4-(3-{4-[3-(4-цианофенокси)пропил]-7-оксо-1,4-диазепан-1-ил}пропокси)бензонитрил.
1H-ЯМР (CDCl3) δ: 1,76-2,08 (4H, м), 2,58-2,68 (8H, м), 3,46-3,48 (2Н, м), 3,54-3,58 (2Н, м), 4,03 (2Н, т, J = 6,2 Гц), 4,06 (2H, т, J = 6,0 Гц), 6,92-6,95 (4H, м), 7,56-7,60 (4H, м).
Ссылочный пример 50
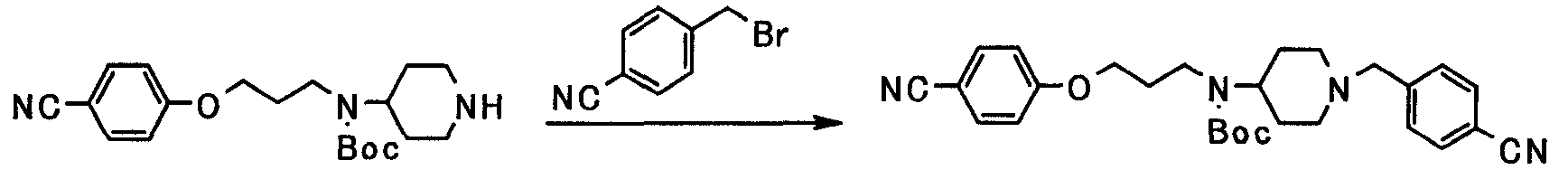
Следующее соединение получают тем же образом, что и в ссылочном примере 42.
трет-Бутил-1-(4-цианобензил)-4-пиперидинил-[3-(4-цианофенокси)пропил]карбамат
1H-ЯМР (CDCl3) δ: 1,46 (9H, с), 1,60-1,80 (4H, м), 1,90-2,20 (4H, м), 2,80-2, 90 (2H, м), 3,08-3,40 (2H, м), 3,40-3,60 (1H, м), 3,53 (2H, с), 4,02 (2H, т, J = 6,1 Гц), 6,91-6,95 (2H, м), 7,44 (2H, д, J = 8,7 Гц), 7,57-7,62 (4H, м).
Ссылочный пример 51

Следующее соединение получают тем же образом, что и в ссылочном примере 42.
трет-Бутил-3-(4-цианофенокси)пропил-{1-[3-(4-цианофенокси)пропил]-4-пиперидинил}карбамат.
1H-ЯМР (CDCl3) δ: 1,46 (9H, с), 1,65-1,80 (4H, м), 1, 96-2,10 (6H, м), 2,50 (2H, т, J = 7,3 Гц), 2,80-3,00 (3H, м), 3,20-3,40 (2H, м), 4,01 (2H, т, J = 5,9 Гц), 4,05 (2Н, т, J = 6,1 Гц), 6,91-6,95 (4Н, м), 7,58 (4Н, д, J =8,8 Гц).
Ссылочный пример 52

Следующее соединение получают тем же образом, что и в ссылочном примере 42.
4-(2-{1-[3-(4-цианофенокси)пропил]-4-пиперидинил}этокси)бензонитрил.
1H-ЯМР (CDCl3) δ: 1,20-1,40 (2H, м), 1,50-1,60 (1H, м), 1,70-1,78 (4H, м), 1,93-2,03 (4H, м), 2,47-2,51 (2H, м), 2,91-2,94 (2H, м), 4,05 (2H, т, J = 6,1 Гц), 4,06 (2H, т, J = 6,1 Гц), 6,93 (2H, д, J = 8,5 Гц), 6,94 (2H, д, J = 8,5 Гц), 7,57 (2H, д, J = 8,5 Гц), 7,58 (2H, д, J = 8,5 Гц).
Ссылочный пример 53

Следующее соединение получают тем же образом, что и в ссылочном примере 42.
4-[3-4-{[3-(4-цианофенокси)пропил]амино}пиперидинил)пропокси}бензонитрил.
1H-ЯМР (CDCl3) δ: 1,34-1,44 (2H, м), 1,45-1,70 (1H, шир.), 1,85-2,06 (8H, м), 2,40-2,60 (1H, м), 2,50 (2H, т, J = 7,2 Гц), 2,82 (2H, т, J = 6,8 Гц), 2,85-2,95 (2H, м), 4,06 (2H, т, J = 6,3 Гц), 4,10 (2H, т, J = 6,1 Гц), 6,93-6,95 (4H, м), 7,55-7,59 (4H, м).
Ссылочный пример 54

Следующее соединение получают тем же образом, что и в ссылочном примере 42.
4-[3-(3-{[3-(4-Цианофенокси)пропил]амино}-1-пирролидинил)пропокси}бензонитрил
1H-ЯМР (CDCl3) δ: 1,60-2,22 (7H, м), 2,50-2,90 (8H, м), 3,30-3,50 (1H, м), 4, 08 (2H, т, J = 6,3 Гц), 4,10 (2H, т, J = 6,3 Гц), 6,94 (4H, д, J = 8,8 Гц), 7,57 (4H, д, J = 8,8 Гц).
Ссылочный пример 55

2,98 г пиперазина растворяют в 14 мл диметилсульфоксида и далее к данному раствору при комнатной температуре добавляют 24 мл N, N-диизопропилэтиламина и 13,5 г 4-(3-хлорпропокси)бензонитрила с последующим перемешиванием при 110°С в течение 3 часов. После охлаждения до комнатной температуры осадок фильтруют, промывая его смешанным растворителем, состоящим из метиленхлорида и диизопропилового эфира с получением 6,65 г твердого вещества, 4-(3-{4-[3-(4-цианофенокси)пропил]-1-пиперазинил}пропокси)бензонитрила.
1H-ЯМР (CDCl3) δ: 1,96-2,03 (4H, м), 2,50-2,54 (12H, м), 4,07 (4H, т, J = 6,2 Гц), 6,93-6,96 (4H, м), 7,55-7,58 (4H, м).
Ссылочный пример 56
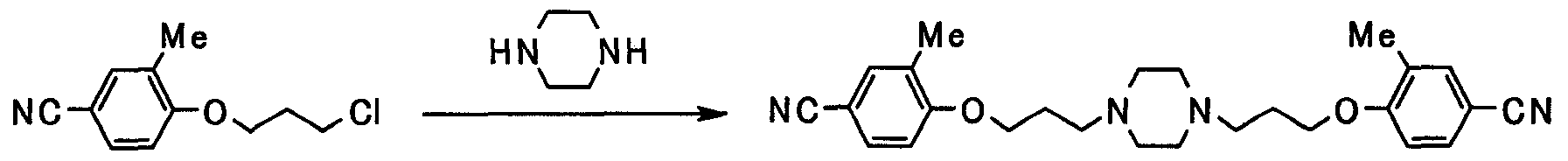
Следующее соединение получают тем же образом, что и в ссылочном примере 55.
4-(3-{4-(3-Циано-2-метилфенокси)пропил]-1-пиперазинил}пропокси)-3-метилбензонитрил.
1H-ЯМР (CDCl3) δ: 1,99-2,05 (4H, м), 2,21 (6H, с), 2,40-2, 56 (12H, м), 4,07 (4H, т, J = 6,3 Гц), 6,85 (2H, д, J = 8,4 Гц), 7,40 (2H, шир.с), 7,47 (2H, дд, J = 1,4, 8,4 Гц).
Ссылочный пример 57

Следующее соединение получают тем же образом, что и в ссылочном примере 55.
4-(3-{4-[3-(4-Циано-3-фторфенокси)пропил]-1-пиперазинил}пропокси)-2-фторбензонитрил.
1H-ЯМР (CDCl3) δ: 1,95-2,02 (4H, м), 2,30-2,70 (12H, м), 4,07 (4H, т, J = 6,3 Гц), 6,71-6,77 (4H, м), 7,50 (2H, дд, J = 7,7, 8,7 Гц).
Ссылочный пример 58

Следующее соединение получают тем же образом, что и в ссылочном примере 55.
Гидрохлорид 4-(3-{4-[3-(4-циано-2-фторфенокси)пропил]-1-пиперазинил}пропокси)-3-фторбензонитрила.
1H-ЯМР (d6-ДМСО) δ: 2,20-2,40 (4H, м), 3,10-4,00 (12H, м), 4,29 (4H, т, J = 6,0 Гц), 7,35-7,39 (2H, м), 7,70-7,72 (2H, м), 7,86-7,89 (2H, м).
Ссылочный пример 59

Следующее соединение получают тем же образом, что и в ссылочном примере 55.
4-(2-{4-[2-(4-Цианофенокси)этил]-1-пиперазинил}этокси) бензонитрил.
1H-ЯМР (CDCl3) δ: 2,50-2,70 (8H, м), 2,84 (4H, т, J = 5,7 Гц), 4,14 (4H, т, J = 5,7 Гц), 6,93-6,97 (4H, м), 7,57-7,60 (4H, м).
Ссылочный пример 60

Следующее соединение получают тем же образом, что и в ссылочном примере 55.
4-[((Е)-4-{4-[(E)-4-(4-Цианофенокси)-2-бутенил]-1-пиперазинил}-2-бутенил)окси]бензонитрил.
1H-ЯМР (CDCl3) δ: 2,30-2,70 (8H, м), 3,05 (4H, д, J = 5,6 Гц), 4,57 (4H, д, J = 4,8 Гц), 5,81-5,94 (4H, м), 6,93-6,95 (4H, м), 7,56-7,59 (4H, м).
Ссылочный пример 61

Следующее соединение получают тем же образом, что и в ссылочном примере 55.
Гидрохлорид 4-(3-{4-[3-(4-цианофенокси)-2-метилпропил]-1-пиперазинил}-2-метилпропокси)бензонитрила.
1H-ЯМР (CD3OD)δ: 1,22 (6H, д, J = 6,8 Гц), 2,50-2,70 (2H, м), 3,00-3,80 (12H, м), 4,05-4,15 (4H, м), 7,10-7,15 (4H, м), 7,66-7,70 (4H, м).
Ссылочный пример 62

Следующее соединение получают тем же образом, что и в ссылочном примере 55.
4-(2-Бензилокси)-3-{4-[2-(бензилокси)-3-(4-цианофенокси)пропил]-1-пиперазинил}пропокси)бензонитрил.
1H-ЯМР (CDCl3) δ: 2,40-2,63 (12H, м), 3,85-3,95 (2H, м), 4,07-4,21 (4H, м), 4,71 (4H, с), 6,94-6,98 (4H, м), 7,27-7,35 (10H, м), 7,55-7,59 (4H, м).
Ссылочный пример 63
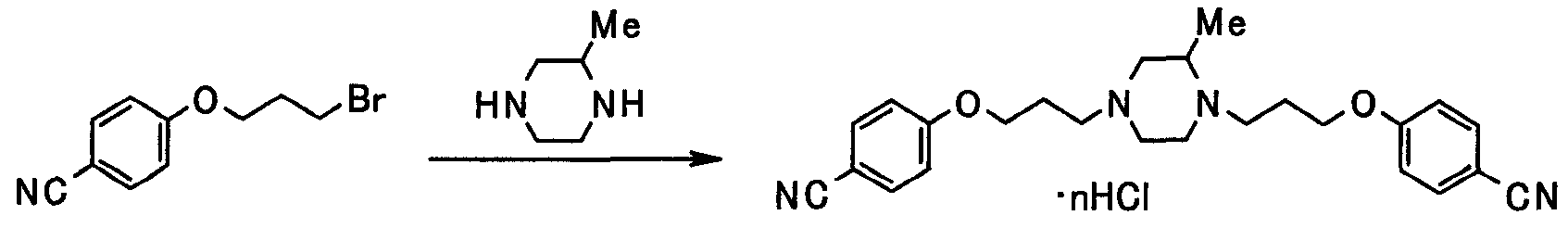
Следующее соединение получают тем же образом, что и в ссылочном примере 55.
Гидрохлорид 4-(3-{4-[3-(4-цианофенокси)пропил]-2-метил-1-пиперазинил}пропокси)бензонитрила.
1H-ЯМР (d6-ДМСО) δ: 1,30-1,50 (3H, м), 2,00-2,40 (4H, м), 3,10-4,00 (11H, м), 4,10-4,30 (4H, м), 7,11-7,15 (4H, м), 7,79 (4H, д, J = 8,4 Гц).
Ссылочный пример 64
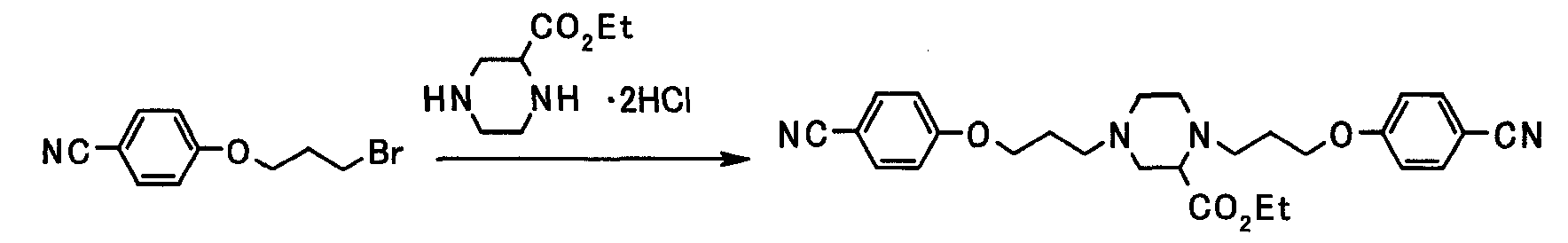
Следующее соединение получают тем же образом, что и в ссылочном примере 55.
Этил-1, 4-бис-[3-(4-цианофенокси)пропил]-2-пиперазинкарбоксилат.
1H-ЯМР (CDCl3) δ: 1,22 (3H, т, J = 7,1 Гц), 1,92-2,00 (4H, м), 2,36-2,80 (8H, м), 2,83-2,90 (1H, м), 3,10-3,15 (1H, м), 3,24-3,30 (1H, м), 4,03-4,20 (6H, м), 6,92-6,96 (4Н, м), 7,56-7,59 (4Н, м).
Ссылочный пример 65

Следующее соединение получают тем же образом, что и в ссылочном примере 55.
Гидрохлорид 4-{3-[{2-[[3-(4-цианофенокси)пропил](метил)амино]этил}(метил)амино]пропокси}бензонитрила.
1H-ЯМР (d6-ДМСО) δ: 2,23-2,29 (4H, м), 2,85 (6H, с), 3,28-3,70 (8H, м), 4,19 (4H, т, J = 6,0 Гц), 7,13 (4H, д, J = 8,6 Гц), 7,79 (4H, д, J = 8,6 Гц), 11,57 (2H, шир.с).
Ссылочный пример 66

0,40 г 3-[4-(3-Гидроксипропил)-1-пиперазинил]-1-пропанола суспендируют в 4,0 мл N,N-диметилформамида и далее к данной суспензии добавляют 0,16 г 60% гидрида натрия с последующим перемешиванием в течение 1 часа. Далее к данной смеси добавляют 0,57 г 2-хлор-5-цианопиридина и смесь перемешивают при комнатной температуре в течение 4 часов. Далее к реакционному раствору добавляют 5 мл диизопропилового эфира и 5 мл воды и осадок далее отфильтровывают с получением 0,50 г твердого вещества, 6-[3-(4-{3-[5-циано-2-пиридинил)окси]пропил}-1-пиперазинил)пропокси]никотинонитрила.
1H-ЯМР (CDCl3 + CD3OD) δ: 1,90-2,10 (4H, м), 2,50-2,62 (12H, м), 4,42 (4H, т, J = 6,4 Гц), 6,85 (2H, дд, J = 0,6, 8,8 Гц), 7,83 (2H, дд, J = 2,4, 8,8 Гц), 8,48 (2H, дд, J = 0,6, 2,4 Гц).
Ссылочный пример 67
Ссылочный пример 67-1

1,00 г 4-(3-Бромпропокси)бензонитрила растворяют в 10 мл N, N-диметилформамида, и к полученному раствору последовательно добавляют 0,73 мл 4-аминобутилового спирта и 1,06 г карбоната калия, и смесь перемешивают при комнатной температуре в течение 12 часов. Далее к реакционной смеси добавляют водный раствор гидроксида натрия с концентрацией 1 моль/л и хлороформ так, чтобы органический слой отделился. Далее водный слой экстрагируют дважды хлороформом. Отделенный органический слой объединяют, сушат над безводным сульфатом магния. Растворитель удаляют при пониженном давлении. Полученный маслянистый продукт растворяют в 10 мл хлороформа и далее к раствору добавляют 1,08 мл триэтиламина и 1,68 г ди-трет-бутилдикарбоната с последующим перемешиванием при комнатной температуре в течение 4 дней. Растворитель удаляют при пониженном давлении. Далее к остатку добавляют этилацетат и воду так, чтобы органический слой отделился. Отделенный органический слой последовательно промывают водой и насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния. Далее растворитель удаляют при пониженном давлении. Полученный маслянистый продукт очищают колоночной хроматографией на силикагеле [элюент; н-гексан:этилацетат = 1:1] с получением 0,63 г бесцветного масла продукта, трет-бутил-3-(4-цианофенокси)пропил-(4-гидроксибутил)карбамата.
1H-ЯМР (CDCl3) δ: 1,43 (9H, с), 1,53-1,80 (5H, м), 2,00-2,10 (2H, м), 3,10-3,30 (2H, м), 3,38 (2H, т, J = 6,8 Гц), 3,60-3,80 (2H, м), 4,02 (2H, т, J = 6,1 Гц), 6,90-6,95 (2H, м), 7,55-7,60 (2H, м).
Ссылочный пример 67-2

Смешанный раствор, состоящий из 0,32 мл оксалилхлорида и 14 мл тетрагидрофурана, охлаждают до -60°С и к данному раствору по каплям добавляют 0,35 мл диметилсульфоксида. Смешанный раствор перемешивают при -60°С в течение 5 минут и далее к нему по каплям добавляют 6 мл раствора 0,63 г трет-бутил-3-(4-цианофенокси)пропил-(4-гидроксибутил)карбамата в тетрагидрофуране в течение 5 минут. Полученный смешанный раствор перемешивают при -60°С в течение 2 часов и далее к нему по каплям добавляют 1,77 мл триэтиламина. После нагрева реакционной смеси до комнатной температуры к ней добавляют воду и хлороформ так, чтобы органический слой отделился. Отделенный органический слой промывают насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния. Далее растворитель удаляют при пониженном давлении. Полученный маслянистый продукт очищают колоночной хроматографией на силикагеле [элюент; н-гексан:этилацетат = 1:1] с получением 0,63 г бесцветного масла продукта, трет-бутил-3-(4-цианофенокси)пропил-(4-оксобутил)карбамата.
1H-ЯМР (CDCl3) δ: 1,56 (9H, с), 1,83-1,90 (2H, м), 1,90-2,10 (2H, м), 2,47 (2H, т, J = 6,9 Гц), 3,23 (2H, т, J = 6,9 Гц), 3,37 (2H, т, J = 6,9 Гц), 4,02 (2H, т, J = 6,1 Гц), 6,91-6,95 (2H, м), 7,55-7,60 (2H, м), 9,78 (1H, с).
Ссылочный пример 67-3

0,65 г трет-Бутил-3-(4-цианофенокси)пропил-(4-оксобутил)карбамата растворяют в 10 мл метиленхлорида. При охлаждении льдом к данному раствору добавляют 15 мл раствора 0,50 г 4-(3-аминопропокси)бензонитрила в метиленхлориде и далее к нему добавляют 0,60 г триацетоксиборгидрида натрия. После данной операции реакционную смесь нагревают до комнатной температуры, смесь перемешивают в течение 19,5 часов. Реакционную смесь медленно добавляют к смеси, состоящей из 10% водного раствора карбоната калия и хлороформа, и органический слой отделяют. Отделенный органический слой промывают насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния. Далее растворитель удаляют при пониженном давлении. Полученный маслянистый продукт растворяют в 10 мл хлороформа и далее к данному раствору добавляют 0,39 мл триэтиламина и 0,62 г ди-трет-бутилдикарбоната с последующим перемешиванием при комнатной температуре в течение 3 дней. Растворитель удаляют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле [элюент; н-гексан:этилацетат = 2:1] с получением 0,90 г бесцветного масла продукта, трет-бутил-4-{(трет-бутоксикарбонил)-[3-(4-цианофенокси)пропил]амино)бутил-[3-(4-цианофенокси)пропил]карбамата.
1H-ЯМР (CDCl3) δ: 1,42 (18H, с), 1,45-1,55 (4H, м), 1,90-2,10 (4H, м), 3,10-3,30 (4H, м), 3,30-3,50 (4H, м), 4,01 (4H, т, J = 6,0 Гц), 6,90-6,95 (4H, м), 7,58 (4H, д, J = 8,8 Гц).
Ссылочный пример 68

0,50 г 4-[3-(4-{[3-(4-Цианофенокси)пропил]амино}-1-пиперидинил)пропокси]бензонитрила растворяют в 5,0 мл N,N-диметилформамида и далее 0,21 мл этил-6-бромгексаноата и 0,49 г карбоната калия последовательно добавляют к раствору с последующим перемешиванием при комнатной температуре в течение 7 дней. К реакционной смеси добавляют этилацетат и воду так, чтобы органический слой отделился. Полученный органический слой промывают насыщенным солевым раствором и далее сушат над безводным сульфатом магния. Полученный в результате раствор далее концентрируют при пониженном давлении. Полученный маслянистый продукт очищают колоночной хроматографией на силикагеле [элюент; хлороформ:метанол = 40:1] с получением 0,40 г бесцветного масла продукта, этил-6-([3-(4-цианофенокси)пропил]{1-[3-(4-цианофенокси)пропил]-4-пиперидинил}амино)гексаноата.
1H-ЯМР (CDCl3) δ: 1,25 (3H, т, J = 7,1 Гц), 1,20-1,66 (10H, м), 1,85-1,99 (6H, м), 2,25 (2H, т, J = 7,6 Гц), 2,42-2,49 (5H, м), 2,61 (2H, т, J = 6,6 Гц), 2,90-3,10 (2H, м), 4,05 (2Н, т, J= 6,2 Гц), 4, 05 (2H, т, J = 6,0 Гц), 4,12 (2H, кв, J = 7,1 Гц), 6,91-6,96 (4H, м), 7,55-7,60 (4H, м).
Ссылочный пример 69
Ссылочный пример 69-1

1,85 г 4-[3-(1-Пиперазинил)пропокси]бензонитрила растворяют в 10 мл N,N-диметилформамида и далее к данному раствору последовательно добавляют 1,77 г карбоната калия и 1,79 г трет-бутил-6-бромгексилкарбамата с последующим перемешиванием при комнатной температуре в течение 22 часов. Далее к реакционной смеси добавляют водный раствор гидроксида натрия с концентрацией 1 моль/л и хлороформ так, чтобы органический слой отделился. Далее водный слой экстрагируют хлороформом. Органические слои объединяют и сушат над безводным сульфатом магния. Растворитель далее удаляют при пониженном давлении. Полученный маслянистый продукт очищают колоночной хроматографией [элюент; хлороформ:метанол = 10:1] с получением 3,46 г бесцветного масла продукта трет-бутил-6-{4-[3-(4-цианофенокси)пропил]-1-пиперазинил}гексилкарбамата.
1H-ЯМР (CDCl3) δ: 1,20-1,80 (8H, м), 1,44 (9H, с), 1,96-2,02 (2H, м), 2,32-2,54 (12H, м), 3,00-3,20 (2H, м), 4,06 (2H, т, J = 6,3 Гц), 4,50 (1H, шир.с), 6,92-6,96 (2Н, м), 7,55-7,59 (2Н, м).
Ссылочный пример 69-2

3,46 г трет-бутил-6-{4-[3-(4-цианофенокси)пропил]-1-пиперазинил}гексилкарбамата растворяют в 30 мл хлористоводородной кислоты с концентрацией 6 моль/л и полученный раствор перемешивают при комнатной температуре в течение 12 часов. Далее растворитель удаляют при пониженном давлении. Полученный остаток фильтруют, промывая смесью этилацетат-этанол с получением 2,51 г твердого вещества, гидрохлорида 4-{3-[4-(6-аминогексил)-1-пиперазинил]пропокси}бензонитрила.
1H-ЯМР (d6-ДМСО) δ: 1,20-1,80 (8H, м), 2,10-2,30 (2H, м), 2,74-2,79 (2H, м), 3,00-3,90 (14H, м), 4,19 (2H, т, J = 6,0 Гц), 7,12 (2H, д, J = 8,8 Гц), 7,79 (2H, д, J = 8,8 Гц), 7,91 (3H, шир.с).
Ссылочный пример 69-3

К 0,70 г гидрохлорида 4-{3-[4-(6-аминогексил)-1-пиперазинил]пропокси}бензонитрила добавляют воду и хлороформ и смесь далее приводят к рН 12,5 с помощью водного раствора гидроксида натрия с концентрацией 5 моль/л. Органический слой отделяют и водный слой далее экстрагируют хлороформом 4 раза. Органические слои объединяют и сушат над безводным сульфатом магния. Растворитель далее удаляют при пониженном давлении. Полученный маслянистый продукт растворяют в 10 мл тетрагидрофурана. Далее к данному раствору последовательно добавляют 0, 21 мл триэтиламина, 0,15 мл уксусного ангидрида и 0,01 г 4-(диметиламино)пиридина с последующим перемешиванием при комнатной температуре в течение 16 часов. К реакционной смеси добавляют воду, хлороформ и карбонат калия так, чтобы органический слой отделился. Органический слой сушат над безводным сульфатом магния и далее концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле [элюент; хлороформ:метанол = 10:1] с получением 0,75 г белого твердого вещества продукта, N-6-{4-[3-(4-цианофенокси)пропил]-1-пиперазинил}гексил)ацетамида.
1H-ЯМР (CDCl3) δ: 1,20-1,80 (8H, м), 1,97 (3H, с), 1,90-2,10 (2H, м), 2,31-2,60 (12H, м), 3,21-3,26 (2H, м), 4,06 (2H, т, J = 6,2 Гц), 5,42 (1H, шир.с), 6,94 (2H, д, J = 9,0 Гц), 7,57 (2H, д, J = 9,0 Гц).
Ссылочный пример 70
Ссылочный пример 70-1

Следующее соединение получают тем же образом, что и в ссылочном примере 7.
трет-Бутил-4-(4-{4-[3-(4-цианофенокси)пропил]-2, 3-диоксо-1-пиперазинил}бутил)-1-пиперидинкарбоксилат.
1H-ЯМР (CDCl3) δ: 1,00-1,11 (2H, м), 1,22-1,64 (9H, м), 1,45 (9H, с), 2,14 (2H, квинт, J=6,4 Гц), 2, 50-2,60 (2H, м), 3,47 (2H, т, J = 11,6 Гц), 3,50-3,59 (4H, м), 3,67 (2H, т, J = 6,8 Гц), 4,00-4,15 (2H, м), 4,07 (2H, т, J = 6,4 Гц), 6,93 (2H, д, J = 9,2 Гц), 7,59 (2H, д, J = 9,2 Гц).
Ссылочный пример 70-2

0,42 г трет-бутил-4-(4-{4-[3-(4-цианофенокси)пропил]-2,3-диоксо-1-пиперазинил}бутил)-1-пиперидинкарбоксилата растворяют в 8,2 мл метиленхлорида и далее к данному раствору при охлаждении льдом добавляют 3,1 мл трифторуксусной кислоты с последующим перемешиванием при комнатной температуре в течение 2 часов. Реакционную смесь концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле [элюент; хлороформ:этанол = 5:1] с получением 0,42 г бледно-желтого аморфного твердого вещества, 4-(3-{2, 3-диоксо-4-[4-пиперидинил)бутил]-1-пиперазинил}пропокси)бензонитрила трифторацетата.
1H-ЯМР (CDCl3) δ: 1,20-1,90 (11H, м), 2,13 (2H, квинт, J = 6,4 Гц), 2, 77-2,88 (2H, м), 3,35-3,68 (10H, м), 4,07 (2H, т, J = 6,0 Гц), 6,94 (2H, д, J = 9,0 Гц), 7,58 (2H, д, J= 9,0 Гц), 8,90-9,20 (1H, шир.), 9,30-9,50 (1H, шир.).
Ссылочный пример 71

Следующее соединение получают тем же образом, что и в ссылочном примере 42.
трет-Бутил-4-(4-{4-[3-(4-цианофенокси)пропил]-1-пиперазинил}бутил)-1-пиперидинкарбоксилат
1H-ЯМР (CDCl3) δ: 1,00-1,11 (2H, м), 1,20-1,80 (9H, м), 1,45 (9H, с), 1,94-2,02 (2H, м), 2,28-2,78 (14H, м), 3,96-4,14 (2H, м), 4,06 (2H, т, J = 6,3 Гц), 6,90-6,98 (2H, м), 7,56-7,60 (2H, м).
Ссылочный пример 72
Ссылочный пример 72-1

0,80 г алюмогидрида лития суспендируют в 14 мл тетрагидрофурана. Далее 28 мл раствора тетрагидрофурана 3,00 г этил-4-(1-метил-4-пиперидинил)бутирата добавляют по каплям к данной суспензии при 10°С в течение 45 минут. Смесь перемешивают при той же температуре в течение 30 минут и реакционную смесь нагревают до комнатной температуры с последующим дальнейшим перемешиванием в течение 1 часа. Далее к реакционному раствору добавляют 20 мл водного раствора гидроксида натрия с концентрацией 1 моль/л при охлаждении льдом и реакционную смесь фильтруют через Целит. Фильтрат концентрируют при пониженном давлении и к полученному остатку добавляют хлористоводородную кислоту с концентрацией 1 моль/л так, чтобы привести остаток к рН 2. Далее его промывают дважды 20 мл хлороформа. Водный слой приводят к рН 10,5 водным раствором гидроксида натрия с концентрацией 1 моль/л и далее экстрагируют дважды 40 мл хлороформа. Объединенный органический слой сушат над безводным сульфатом магния. Растворитель далее удаляют при пониженном давлении с получением 1,31 г бесцветного масла продукта, 4-(1-метил-4-пиперидинил)-1-бутанола.
1H-ЯМР (CDCl3) δ: 1,20-1,28 (5H, м), 1,33-1,41 (2H, м), 1,52-1,59 (2H, м), 1,66-1,69 (2H, м), 1,88 (2H, т, J = 11,6 Гц), 1,99 (1H, шир.с), 2,24 (3H, с), 2,78-2,86 (2H, м), 3,63 (2H, т, J = 6,6 Гц).
Ссылочный пример 72-2

0,38 г 4-(1-Метил-4-пиперидинил)-1-бутанола растворяют в 16 мл тетрагидрофурана и далее к данному раствору при охлаждении льдом последовательно добавляют 0,57 г трифенилфосфина и 0,73 г тетрабромида углерода. Смесь оставляют при комнатной температуре на ночь. Далее осадок отфильтровывают и фильтрат концентрируют при пониженном давлении. К полученному остатку добавляют 20 мл диэтилового эфира и 20 мл воды и смесь приводят к рН 1 хлористоводородной кислотой с концентрацией 1 моль/л. Далее водный слой отделяют. Полученный водный слой приводят к рН 10,5 водным раствором гидроксида натрия с концентрацией 1 моль/л и далее экстрагируют 20 мл этилацетата. Этилацетатный слой сушат над безводным сульфатом магния и далее концентрируют при пониженном давлении с получением 0,30 г желтого масла продукта, 4-(4-бромбутил)-1-метилпиперидина.
1H-ЯМР (CDCl3) δ: 1,21-1,29 (5H, м), 1,41-1,48 (2H, м), 1,66-1,68 (2H, м), 1,78-1,91 (4H, м), 2,25 (3H, с), 2,83 (2H, д, J = 12,0 Гц), 3,41 (2H, т, J = 6,4 Гц).
Ссылочный пример 72-3

Следующее соединение получают тем же образом, что и в ссылочном примере 42.
4-(3-{4-[4-(1-Метил-4-пиперидинил)бутил]-1-пиперазинил}пропокси)бензонитрил.
1H-ЯМР (CDCl3) δ: 1,20-1,34 (6H, м), 1,43-1,51 (2H, м), 1, 51-1,70 (5H, м), 1,85-1,90 (2H, м), 1,95-2,02 (2H, м), 2,25 (3H, с), 2,30-2,35 (2H, м), 2,40-2,50 (8H, м), 2,83 (2Н, д, J = 11,6 Гц), 4,06 (2H, т, J = 6,4 Гц), 6,94 (2H, д, J = 9,2 Гц), 7,57 (2H, д, J = 9,2 Гц).
Ссылочный пример 73
Ссылочный пример 73-1

3,00 г 1-трет-бутоксикарбонилпиперазина растворяют в 30 мл N,N-диметилформамида. Далее,6,68 г карбоната калия и 2,86 г этил-6-бромгексаноата последовательно добавляют к данному раствору и смесь перемешивают при комнатной температуре в течение 16 часов. К реакционной смеси добавляют смешанный растворитель из 30 мл этилацетата и 120 мл воды так, чтобы органический слой отделился. Отделенный органический слой промывают насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния. Полученный в результате продукт концентрируют при пониженном давлении с получением 5,68 г трет-бутил-4-(6-этокси-6-оксигексил)-1-пиперазинкарбоксилата.
5,68 трет-Бутил-4-(6-этокси-6-оксигексил)-1-пиперазинкарбоксилата растворяют в тетрагидрофуране. Далее при охлаждении льдом 52 мл тетрагидрофуранового раствора, содержащего 1 моль/л комплекса боран-тетрагидрофуран, добавляют к вышеуказанному раствору с последующим перемешиванием при комнатной температуре в течение 24 часов. Далее 11,5 мл ацетона добавляют по каплям к реакционной смеси при охлаждении льдом и к нему далее добавляют 52 мл хлористоводородной кислоты с концентрацией 2 моль/л. Растворитель удаляют, пока температура реакционной смеси не станет равной 80°С или выше. Далее смесь нагревают при кипячении с обратным холодильником в течение 4 часов. После охлаждения до комнатной температуры к реакционной смеси добавляют хлороформ и воду. Полученную смесь далее приводят к рН 11,0 водным раствором гидроксида натрия с концентрацией 5 моль/л. Органический слой отделяют и далее водный слой экстрагируют хлороформом 20 раз. Полученный органический слой сушат над безводным сульфатом магния и далее концентрируют при пониженном давлении. Полученный остаток растворяют в 35 мл хлороформа и к данному раствору при охлаждении льдом добавляют добавляют 4,42 г ди-трет-бутилдикарбоната. Смесь перемешивают при комнатной температуре в течение 15 часов. Далее к реакционной смеси добавляют хлороформ, воду и карбонат калия так, чтобы органический слой отделился. Водный слой далее экстрагируют хлороформом. Полученный органический слой объединяют и далее сушат над безводным сульфатом магния. Растворитель удаляют при пониженном давлении. 7,88 г полученного маслянистого продукта очищают колоночной хроматографией на силикагеле [элюент; хлороформ:метанол = 10:1] с получением 3,55 г бесцветного масла продукта, трет-бутил-4-(6-гидроксигексил)-1-пиперазинкарбоксилата.
1H-ЯМР (CDCl3) δ: 1,28-1,70 (9H, м), 1,46 (9H, с), 2,26-2,42 (6H, м), 3,38-3,48 (4H, м), 3,65 (2H, т, J = 6,6 Гц).
Ссылочный пример 73-2

Смешанный раствор из 1,85 мл оксалилхлорида и 70 мл хлороформа охлаждают до -60°С и к нему по каплям добавляют 2,03 мл диметилсульфоксида. Смесь перемешивают при -60°С в течение 5 минут и далее к ней по каплям добавляют 20 мл раствора в хлороформе, содержащего 3,05 г трет-бутил-4-(6-гидроксигексил)-1-пиперазинкарбоксилата в течение 5 минут. Полученную смесь перемешивают при температуре в интервале от -60 до -40°С в течение 2 часов и далее к ней по каплям добавляют 10,3 мл триэтиламина. Реакционную смесь нагревают до комнатной температуры. Далее к ней добавляют воду и карбонат калия так, чтобы органический слой отделился. Отделенный органический слой промывают насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния. Растворитель далее удаляют при пониженном давлении. Полученный маслянистый продукт очищают колоночной хроматографией на силикагеле [элюент; хлороформ:метанол = 20:1] с получением 3,07 г бесцветного масла продукта, трет-бутил-4-(6-оксогексил)-1-пиперазинкарбоксилата.
1H-ЯМР (CDCl3) δ: 1,25-1,70 (6H, м), 1,46 (9H, с), 2,25-2,50 (6H, м), 2,45 (2H, дт, J = 1,7, 7,3 Гц), 3,35-3,50 (4H, м), 9,77 (1H, т, J = 1,7 Гц).
Ссылочный пример 73-3

0,80 г трет-бутил-4-(6-оксогексил)-1-пиперазинкарбоксилата растворяют в 10 мл метиленхлорида. При охлаждении льдом 20 мл раствора в метиленхлориде, содержащего 2,12 г 4-[3-(1-пиперазинил)пропокси]бензонитрила, добавляют к раствору. Далее к нему добавляют 0,89 г триацетоксиборгидрида натрия. Реакционную смесь нагревают до комнатной температуры и смесь далее нагревают в течение 18 часов. Реакционную смесь медленно добавляют к смеси 10% водного раствора карбоната калия и хлороформа так, чтобы органический слой отделился. Отделенный органический слой сушат над безводным сульфатом магния и растворитель далее удаляют при пониженном давлении. Далее остаток очищают колоночной хроматографией на силикагеле [элюент; н-гексан:этилацетат = 2:1] с получением 1,41 г бесцветного масла продукта, трет-бутил-4-(6-{4-цианофенокси)пропил]-1-пиперазинкарбоксилата.
1H-ЯМР (CDCl3) δ: 1,25-1,70 (8H, м), 1,46 (9H, с), 1,92-2,04 (2H, м), 2,20-2,70 (18H, м), 3,35-3,50 (4H, м), 4,06 (2H, т, J = 6,3 Гц), 6,90-6,98 (4H, м), 7,54-7,62 (4H, м).
Пример 1

0,65 г метилового эфира 6-{[4-(4-цианофенокси)бутил]амино}гексановой кислоты растворяют в 7,0 мл этанола. При охлаждении льдом раствор продувают газообразным хлоридом водорода с последующим перемешиванием при комнатной температуре в течение 2 дней. После завершения реакции растворитель удаляют при пониженном давлении. Полученный остаток растворяют в 7,0 мл этанола и к данному раствору добавляют 0,38 г ацетата аммония с последующим нагревом при кипячении с обратным холодильником в течение 2 часов. После завершения реакции реакционную смесь охлаждают до комнатной температуры. Растворитель удаляют при пониженном давлении и далее к полученному остатку добавляют 10 мл этилацетата с получением твердого вещества фильтрованием. Полученное твердое вещество растворяют в 6 мл воды и к нему добавляют 2 мл хлористоводородной кислоты с концентрацией 6 моль/л с последующим нагревом при кипячении с обратным холодильником в течение 1 часа. После завершения реакции продукт реакции охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. К полученному остатку добавляют изопропанол и проводят фильтрование с получением 0,34 г бесцветного твердого вещества, гидрохлорида 6-[(4-{4-[амино(имино)метил]фенокси}бутил)амино]гексановой кислоты.
ИК (KBr) см-1: 3320, 1677, 1611.
1H-ЯМР (d6-ДМСО) δ: 1,25-1,40 (2H, м), 1,45-1,58 (2H, м), 1,58-1,69 (2H, м), 1,72-1,90 (4H, м), 2,22 (2H, т, J = 7,2 Гц), 2,80-2,99 (4H, м), 4,08-4,25 (2H, м), 7,16 (2H, д, J = 8,3 Гц), 7,86 (2H, д, J = 8,3 Гц), 8,91 (2H, шир.с), 9,00 (2H, шир.с), 9,24 (2H, шир.с).
Пример 2

Следующее соединение получают тем же образом, что и в ссылочном примере 5 и примере 1.
Гидрохлорид 4-[3-(метиламино)пропокси]бензамидина.
ИК (KBr) см-1: 3308, 3164, 2797, 1676, 1610.
1H-ЯМР (d6-ДМСО) δ: 2,13-2,21 (2H, м), 2,55 (3H, с), 3,01-3,08 (2H, м), 4,23 (2H, т, J = 6,2 Гц), 7,17 (2H, д, J = 8,8 Гц), 7,96 (2H, д, J = 8,8 Гц), 9,21 (2H, шир.с), 9,46 (4H, шир.с).
Пример 3
Пример 3-1

2,3 г гидрохлорида метилового эфира 6-аминогексановой кислоты растворяют в 8,4 мл N, N-диметилформамида. Далее к раствору добавляют 1,7 мл триэтиламина и 0,20 г 4-(3-бромпропокси)бензонитрила с последующим перемешиванием при 70-80°С в течение 1,2 часов. Далее к реакционному раствору добавляют 0,80 г 4-(3-бромпропокси)бензонитрила с последующим перемешиванием при 70-80°С в течение 6 часов. После охлаждения до комнатной температуры к реакционному раствору добавляют 20 мл воды и 20 мл этилацетата так, чтобы органический слой отделился. Водный слой приводят к рН 9 водным раствором гидроксида натрия. Далее к данному раствору добавляют хлорид натрия до тех пор, пока раствор не станет насыщенным. Далее его экстрагируют 20 мл этилацетата 5 раз. Полученный органический слой объединяют и полученные таким образом слои сушат над безводным сульфатом магния. Растворитель далее удаляют при пониженном давлении. Полученный остаток очищают колоночной хроматографией [элюент; хлороформ:этанол = 20:1] и далее к нему добавляют 20 мл метиленхлорида и 20 мл воды. Далее к смешанному раствору добавляют 1,00 г карбоната натрия и 1,1 мл ди-трет-бутилдикарбоната с последующим перемешиванием в течение 1 часа. После завершения реакции органический слой отделяют и водный слой экстрагируют дважды 30 мл хлороформа. Полученный органический слой объединяют и к нему добавляют 10 мл воды. Смесь далее приводят к рН 2 с помощью хлористоводородной кислоты с концентрацией 1 моль/л. Органический слой отделяют, промывают хлористоводородной кислотой с концентрацией 5 моль/л и водой и далее сушат над безводным сульфатом магния. Растворитель далее удаляют при пониженном давлении с получением 0,96 г желтого масла продукта, метил 6-{(трет-бутоксикарбонил)-[3-(4-цианофенокси)пропил]амино}гексаноата.
1H-ЯМР (CDCl3) δ: 1,24-1,47 (4H, м), 1,53 (9H, с), 1,60-1,72 (2H, м), 1,96-2,09 (2H, м), 2,27-2,37 (2H, м), 3,12-3,40 (4H, м), 3,67 (3H, с), 3,98-4,05 (2H, м), 6,90-6,96 (2H, м), 7,54-7,62 (2H, м).
Пример 3-2

Следующее соединение получают тем же образом, что и в примере 1.
Гидрохлорид 6-[(3-{4-[амино(имино)метил]фенокси}пропил)амино]гексановой кислоты.
ИК (KBr) см-1: 3122, 1700, 1676, 1608.
1H-ЯМР (d6 -ДМСО) δ: 1,25-1,40 (2H, м), 1,45-1,60 (2H, м), 1,60-1,72 (2H, м), 2,12-2,26 (4H, м), 2,86 (2H, шир.с), 3,02 (2H, шир.с), 4,22 (2H, т, J = 6,1 Гц), 7,16 (2H, д, J = 8,9 Гц), 7,91 (2H, д, J = 8, 9 Гц), 9,1-9,4 (6H, м), 12,1 (1H, шир.с).
Пример 4

0,70 г (4-(4-азидобутокси)бензонитрила растворяют в 7,0 мл этанола и при охлаждении льдом раствор продувают газообразным хлоридом водорода. Раствор перемешивают при комнатной температуре в течение 12 часов и растворитель далее удаляют при пониженном давлении. Полученный остаток суспендируют в 7,0 мл этанола и к нему добавляют 0,57 г ацетата аммония с последующим нагревом при кипячении с обратным холодильником в течение 3 часов. Далее реакционный раствор охлаждают до комнатной температуры и растворитель далее удаляют при пониженном давлении. К полученноме остатку добавляют 10 мл этилацетата и проводят фильтрацию с получением 0,95 г белого твердого вещества, ацетата 4-(4-азидобутокси)бензамидина.
ИК (KBr) см-1: 3252, 2957, 2096, 1700, 1612.
1H-ЯМР (d6-ДМСО) δ: 1,60-1,90 (7H, м), 3,42 (2H, т, J = 6,7 Гц), 4,12 (2H, т, J = 6,2 Гц), 7,15 (2H, д, J = 8,8 Гц), 7,3 (3H, шир.с), 7,84 (2H, д, J = 8,8 Гц).
Пример 5

0,48 г 4-(4-азидобутокси)бензамидина растворяют в 5,0 мл метанола и к данному раствору добавляют 0,08 г 5% палладий-углерода с последующим перемешиванием в атмосфере водорода при температуре окружающей среды при атмосферном давлении в течение 7,5 часов. После завершения реакции катализатор удаляют фильтрацией и растворитель удаляют при пониженном давлении. Полученный остаток растворяют в 10 мл этанола и этанольный раствор хлорида водорода с концентрацией 10 моль/л далее добавляют к раствору. Растворитель далее удаляют при пониженном давлении. Полученный остаток перекристаллизуют с изопропанолом с получением 0,20 г гидрохлорида 4-(4-аминобутокси)бензамидина.
ИК (KBr) см-1: 3043, 1668, 1608.
1H-ЯМР (d6-ДМСО) δ: 1,65-1,86 (4H, м), 2,84 (2H, т, J = 7,3 Гц), 4,11 (2H, т, J = 6,1 Гц), 7,16 (2H, д, J = 9,0 Гц), 7,8 (3H, шир.с), 7,87 (2H, д, J = 9,0 Гц), 9,0 (1H, шир.с), 9,3 (2H, шир.с).
Пример 6
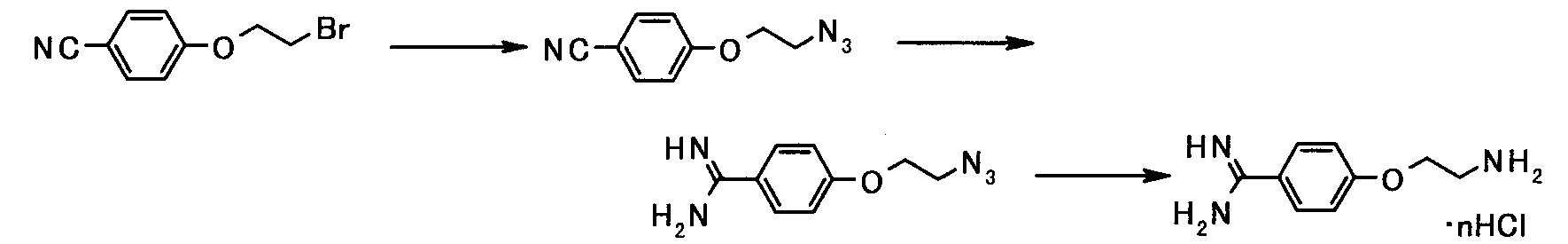
Следующее соединение получают тем же образом, что и в ссылочном примере 6 и примерах 4 и 5.
Гидрохлорид 4-(2-аминоэтокси)бензамидина.
ИК (KBr) см-1: 3121, 1669, 1611.
1H-ЯМР (d6-ДМСО) δ: 3,23 (2H, т, J = 5,1 Гц), 4,32 (2H, т, J = 5,1 Гц), 7,17-7,23 (2H, м), 7,46 (7H, шир.с), 7,85-7,92 (2H, м).
Пример 7

Следующее соединение получают тем же образом, что и в ссылочном примере 6 и примерах 4 и 5.
Гидрохлорид 4-[(5-аминопентил)окси]бензамидина.
ИК (KBr) см-1: 3353, 1676, 1610.
1H-ЯМР (d6-ДМСО) δ: 1,41-1,52 (2H, м), 1,59-1,69 (2H, м), 1, 69-1,80 (2H, м), 2,78 (2H, шир.с), 4,09 (2H, т, J= 6,3 Гц), 7,15 (2H, д, J = 9,1 Гц), 7,86 (2H, д, J = 9,1 Гц), 7,98 (2H, шир.с), 8,99 (2H, шир.с), 9,23 (2H, шир.с).
Пример 8

Следующее соединение получают тем же образом, что и в ссылочном примере 6 и примерах 4 и 5.
Гидрохлорид 4-[(6-аминогексил)окси]бензамидина.
ИК (KBr) см-1: 3039, 1677, 1609.
1H-ЯМР (d6-ДМСО) δ: 1,41 (4H, шир.с), 1,58-1,66 (2H, м), 1,69-1,78 (2H, м), 2,73-2,81 (2H, м), 4,10 (2H, т, J= 5,6 Гц), 7,15 (2H, д, J = 8,4 Гц), 7,94 (2H, д, J = 8,4 Гц), 8,24 (2H, шир.с), 9,00-9,30 (3H, шир.м), 9,43 (2H, шир.с).
Пример 9
Пример 9-1

Бензил-[4-(3-азидопропокси)фенил](имино)метилкарбамат получают из бензил-[4-(3-бромпропокси)фенил](имино)метилкарбамата тем же образом, что и в ссылочном примере 6.
1H-ЯМР (CDCl3) δ: 2,00-2,10 (2H, м), 3,52 (2H, т, J = 6,4 Гц), 4,09 (2Н, т, J = 6,0 Гц), 4,50-4,90 (1H, шир.), 5,21 (2H, с), 6,44 (1H, шир.с), 6,90-6,95 (2H, м), 7,25-7,50 (5H, м), 7,80-7, 90 (2H, м).
Пример 9-2

0,51 г бензил-[4-(3-азидопропокси)фенил](имино)метилкарбамата растворяют в 16 мл N,N-диметилформамида. Далее 0,26 г 5% палладий-углерода, суспендированного в 12 мл N,N-диметилформамида, добавляют к вышеуказанному раствору и полученную смесь перемешивают в атмосфере водорода при комнатной температуре при атмосферном давлении в течение 3,5 часов. Через 3,5 часа к реакционной смеси добавляют 0,4 мл хлористоводородной кислоты с концентрацией 6 моль/л и смесь перемешивают в атмосфере водорода при комнатной температуре в течение 1,8 часов и далее при 40-45°С в течение 1,8 часов. После завершения реакции катализатор удаляют фильтрацией и растворитель удаляют при пониженном давлении. К полученному остатку добавляют хлористоводородную кислоту с концентрацией 6 моль/л и растворитель далее удаляют при пониженном давлении. К полученному остатку добавляют изопропанол и далее осадок отфильтровывают с получением 0,12 г гидрохлорида 4-(3-аминопропокси)бензамидина.
ИК (KBr) см-1: 3346, 3100, 1668, 1609.
1H-ЯМР (d6-ДМСО) δ: 2,04-2,12 (2H, м), 2,90-3,00 (2H, шир.м), 4,21 (2H, т, J = 6,2 Гц), 7,17 (2H, д, J = 8,9 Гц), 7,89 (2H, д, J = 8,9 Гц), 8,24 (3H, шир.с), 9,11 (2H, шир.с), 9,31 (2H, шир.с).
Пример 10

0,20 г ацетата 4-[3-(2,3-диоксо-1-пиперазинил)пропокси]бензамидина растворяют в 5,0 мл хлористоводородной кислоты с концентрацией 6 моль/л с последующим нагревом при кипячении с обратным холодильником в течение 1 часа. Растворитель далее удаляют при пониженном давлении. Полученный остаток отфильтровывают с этанолом с получением 0,14 г бесцветного твердого вещества, гидрохлорида 4-{3-[(2-аминоэтил)амино]пропокси}бензамидина.
ИК (KBr) см-1: 3368, 2716, 1674, 1608.
1H-ЯМР (d6-ДМСО) δ: 2,10-2,21 (2H, м), 3,12 (2H, т, J = 6,8 Гц), 3,25 (4H, с), 4,25 (2H, т, J = 6,0 Гц), 7,18 (2H, д, J = 8,8 Гц), 7,91 (2H, д, J = 8,8 Гц), 8,63 (2H, шир.с), 9,18 (2H, шир.с), 9,36 (2H, шир.с), 9,98 (2H, шир.с).
Пример 11
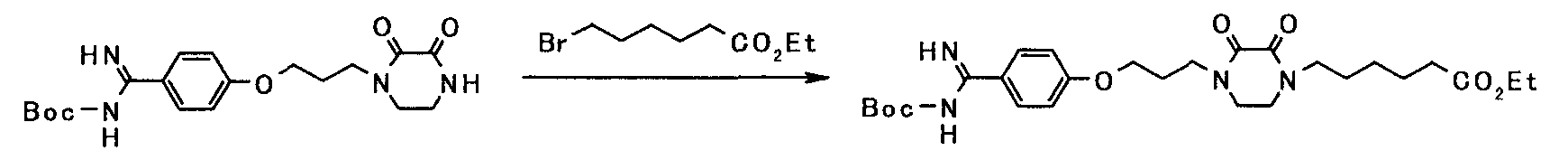
0,30 г трет-Бутил-[4-[3-(2, 3-диоксо-1-пиперазинил)пропокси]фенил}(имино)метилкарбамата растворяют в 3,9 мл N,N-диметилформамида и при охлаждении льдом к раствору добавляют 31 мг 60% гидрида натрия с последующим перемешиванием при комнатной температуре в течение 30 минут. Последовательно 0,12 мл этилового эфира 6-бромгексановой кислоты добавляют по каплям к реакционной смеси с последующим перемешиванием при комнатной температуре в течение 2 часов. 20 мл льда и 20 мл этилацетат добавляют к реакционной смеси. Смесь приводят к рН 5 с помощью хлористоводородной кислоты с концентрацией 1 моль/л и водный слой отделяют. Полученный водный слой приводят к рН 10,5 водным раствором гидроксида натрия с концентрацией 1 моль/л и далее экстрагируют 50 мл этилацетата. Полученный органический слой промывают насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния. Растворитель удаляют при пониженном давлении. К полученному остатку добавляют толуол и диизопропиловый эфир и осуществляют фильтрацию с получением 0,10 г белого твердого вещества, этилового эфира 6-[4-(3-{4-[[(трет-бутоксикарбонил)амино](имино)метил]фенокси}пропил)-2,3-диоксо-1-пиперазинил]гексановой кислоты.
ИК (KBr) см-1: 3374, 1734, 1692, 1616
1H-ЯМР (CDCl3) δ: 1,25 (3H, т, J = 7,1 Гц), 1,30-1,40 (2H, м), 1,55 (9H, с), 1,55-1,70 (4H, м), 2,10-2,20 (2Н, м), 2,29 (2Н, т, J = 7,4 Гц), 3,40-3,60 (6Н, м), 3,67 (2Н, т, J = 6,9 Гц), 4,06 (2H, т, J = 6,0 Гц), 4,11 (2H, кв, J = 7,1 Гц), 6,90 (2H, д, J = 8,8 Гц), 7,84 (2H, д, J = 8,8 Гц).
Пример 12
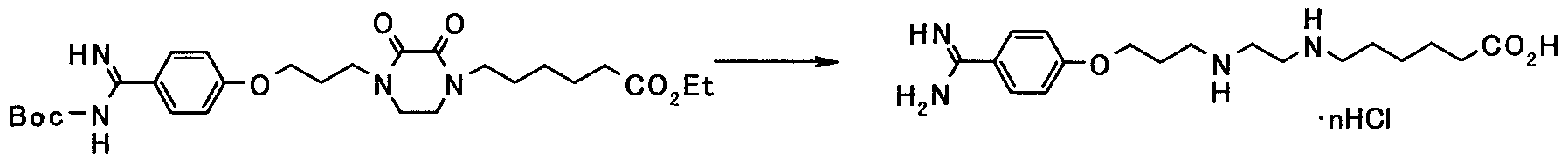
95 мг этилового эфира 6-[4-(3-{4-[[(трет-бутоксикарбонил)амино](имино)метил]фенокси}пропил)-2,3-диоксо-1-пиперазинил]гексановой кислоты растворяют в 1,8 мл хлористоводородной кислоты с концентрацией 6 моль/л с последующим нагревом при кипячении с обратным холодильником в течение 5 часов. После завершения реакции хлористоводородную кислоту с концентрацией 6 моль/л удаляют при пониженном давлении. К полученному остатку добавляют этанол и осуществляют фильтрацию с получением 73 мг белого твердого вещества, гидрохлорида 6-({2-[(3-{4-[амино(имино)метил]фенокси}пропил)амино]этил}амино)гексановой кислоты.
ИК (KBr) см-1: 3369, 2749, 1718, 1670, 1610.
1H-ЯМР (D2O) δ: 1,2-1,3 (2H, м), 1,4-1,7 (4H, м), 2,0-2,3 (4H, м), 2,9-3,1 (2H, м), 3,1-3,4 (6H, м), 4,0-4,2 (2H, м), 6,9-7,1 (2H, м), 7,6-7,7 (2H, м).
Пример 13

Следующее соединение получают тем же образом, что и в примерах 11 и 12.
Гидрохлорид 4-(3-{[2-(гексиламино)этил]амино}пропокси)бензамидина.
ИК (KBr) см-1: 2772, 1676, 1610.
1H-ЯМР (d6-ДМСО) δ: 0,88 (3H, т, J = 6,6 Гц), 1,2-1,4 (6H, м), 1,6-1,7 (2H, м), 2,1-2,2 (2H, м), 2,8-3,0 (2H, м), 3,0-3,2 (2H, м), 3,2-3, 4 (4H, м), 3,5 (2H, шир.с), 4,2-4,3 (2H, м), 7,17 (2H, д, J = 7,8 Гц), 7,87 (2H, д, J = 7,8 Гц), 9,16 (2H, шир.с), 9,25 (2H, шир.с).
Пример 14
Пример 14-1

1,74 г Метил-3-[4-(3-{4-[{[(бензилокси)карбонил]амино}(имино)метил]фенокси}пропил)-2,3-диоксо-1-пиперазинил]пропаноата растворяют в 10 мл N,N-диметилформамида. Далее 0,52 г 5% палладий-углерода, суспендированного в 7,4 мл N,N-диметилформамида и 0,85 мл хлористоводородной кислоты с концентрацией 6 моль/л, добавляют к раствору с последующим перемешиванием в атмосфере водорода при комнатной температуре при атмосферном давлении в течение 2 часов. После завершения реакции катализатор удаляют фильтрованием и остаток промывают 20 мл N,N-диметилформамида. Фильтрат далее концентрируют при пониженном давлении. К полученному остатку добавляют 20 мл ксилола и смесь далее концентрируют при пониженном давлении с получением 1,37 г гидрохлорида метил-3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-2,3-диоксо-1-пиперазинил]пропаноата.
1H-ЯМР (d6-ДМСО) δ: 1,95-2,05 (2H, м), 2,61 (2H, т, J = 6,8 Гц), 3,50-3,58 (8H, м), 3,60 (3H, с), 4,12 (2H, т, J = 6,0 Гц), 7,14 (2H, д, J = 8,8 Гц), 7,88 (2H, д, J = 8,8 Гц), 9,14 (2H, шир.с), 9,31 (2H, шир.с).
Пример 14-2
Следующее соединение получают тем же образом, что и в примере 12.
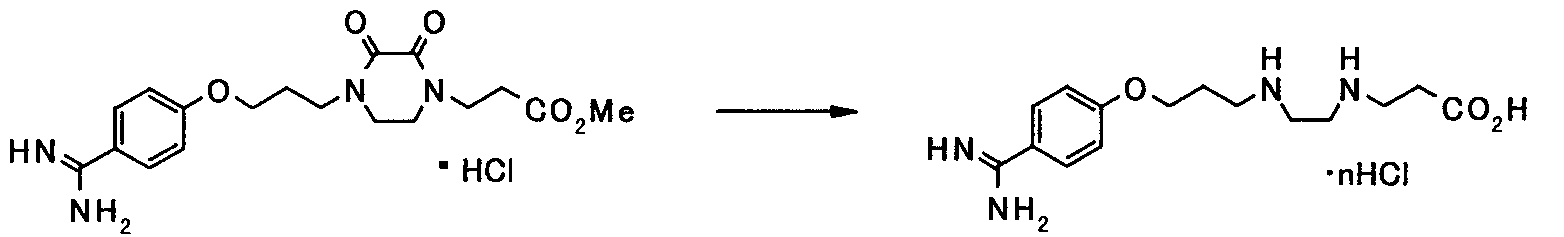
Гидрохлорида N-{2-[(3-{4-[амино(имино)метил]фенокси}пропил)амино]этил}-β-аланина.
ИК (KBr) см-1: 3377, 3237, 2763, 1724, 1684, 1609.
1 H-ЯМР (d6-ДМСО) δ: 2,10-2,20 (2H, м), 2,71 (2H, т, J = 7,2 Гц), 3,09-3,18 (4H, м), 3,29 (4H, шир.с), 3,30-3,60 (4H, м), 4,22 (2H, т, J = 6,0 Гц), 7,17 (2H, д, J = 8, Гц), 7,85 (2H, д, J = 8,8 Гц), 8,90 (2H, шир.с), 9,21 (2H, шир.с).
Пример 15
Пример 15-1
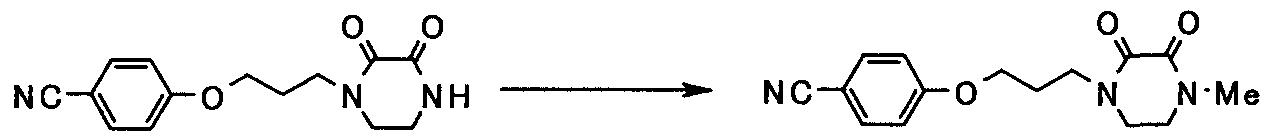
1,80 г 4-[3-(2,3-диоксо-1-пиперазинил)пропокси]бензонитрила растворяют в 33 мл N,N-диметилформамида и при охлаждении льдом к раствору добавляют 0,26 г 60% гидрида натрия с последующим перемешиванием в течение 1 часа. Последовательно к реакционной смеси добавляют 0,41 мл метилйодида и далее через 1,5 часа к ней добавляют 0,41 мл метилйодида с последующим перемешиванием при комнатной температуре. После завершения реакции реакционную смесь добавляют к смешанному раствору из воды со льдом и хлороформа и полученную смесь далее приводят к рН 7, 2 с помощью хлористоводородной кислоты. Далее органический слой отделяют. Водный слой экстрагируют дважды 20 мл хлороформа и полученный органический слой объединяют. Таким образом полученный слой промывают насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния. Полученный раствор далее концентрирую при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле [элюент; хлороформ: метанол = 20:1] с получением 1,48 г белого твердого вещества, 4-[3-(4-метил-2,3-диоксо-1-пиперазинил)пропокси]бензонитрила.
1H-ЯМР (CDCl3) δ: 2,10-2,18 (2H, м), 3,09 (3H, с), 3,56-3,63 (4H, м), 3,67 (2H, т, J = 6,8 Гц), 4,07 (2H, т, J = 6,4 Гц), 6,92-6,96 (2H, м), 7,56-7,60 (2H, м).
Пример 15-2

10 мл этанола и 2,5 мл метиленхлорида добавляют к 1,44 г 4-[3-(4-метил-2,3-диоксо-1-пиперазинил)пропокси]бензонитрила. При охлаждении льдом в смесь вводят газообразный хлорид водорода до ее насыщения. Ее оставляют в спокойном состоянии при комнатной температуре на 22,5 часа. После завершения реакции растворитель удаляют при пониженном давлении. К полученному остатку добавляют 10 мл этанола и 2,5 мл метиленхлорида и к ней далее добавляют 0,97 г ацетата аммония с последующим нагревом при температуре кипения с обратным холодильником. После завершения реакции температуру охлаждают до комнатной температуры и реакционный раствор далее концентрируют при пониженном давлении. Полученный остаток отфильтровывают с этанолом с получением белого твердого вещества. К полученному белому твердому веществу добавляют 10 мл хлористоводородной кислоты с концентрацией 6 моль/л и смесь подвергают нагреву при кипячении с обратным холодильником в течение 6 часов. Реакционную смесь концентрируют при пониженном давлении и полученное белое твердое вещество отфильтровывают с этанолом с получением 1,26 г гидрохлорида 4-(3-{[2-(метиламино)этил]амино}пропокси)бензамидина.
ИК (KBr) см-1: 2722, 1669, 1610.
1H-ЯМР (d6-ДМСО + D2O) δ: 2,14-2,21 (2H, м), 2,68 (3H, с), 3,22 (2H, т, J = 7,6 Гц), 3,30-3,37 (4H, м), 4,19-4,23 (2H, м), 7,19 (2H, д, J = 8,8 Гц), 7,82 (2H, д, J = 8,8 Гц).
Пример 16

Следующее соединение получают тем же образом, что и в примере 15.
Гидрохлорид 4-(3-{[2-(пропиламино)этил]амино}пропокси)бензамидина.
ИК (KBr) см-1: 3318, 2771, 1673, 1609.
1H-ЯМР (d6-ДМСО) δ: 0,94 (3H, т, J= 7,0 Гц), 1,6-1,8 (2H, м), 2,18 (2H, шир.с), 2,90 (2H, шир.с), 3,13 (2H, шир.с), 3,34 (4H, шир.с), 4,25 (2H, шир.с), 7,1-7,7 (2H, м), 7, 18 (2H, д, J = 6,8 Гц), 7,89 (2H, д, J = 6,8 Гц), 9,19 (2H, шир.с), 9,30 (2H, шир.с).
Пример 17
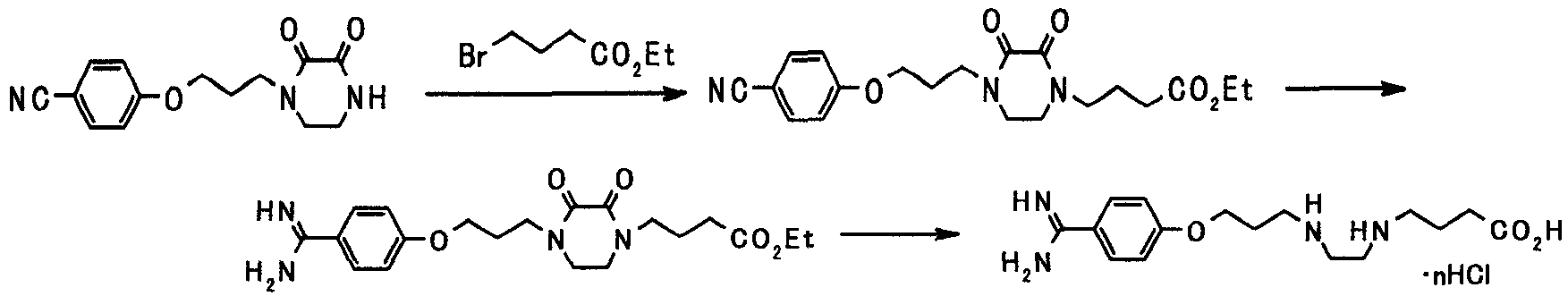
Следующее соединение получают тем же образом, что и в примере 15.
Гидрохлорид 4-({2-[3-{4-[амино(имино)метил]фенокси}пропил)амино]этил}амино)масляной кислоты.
ИК (KBr) см-1: 3418, 2770, 1718, 1670, 1609.
1H-ЯМР (d6-ДМСО - D2O) δ: 1,8-1,9 (2H, м), 2,1-2,2 (2H, м), 2,39 (2H, т, J = 7,4 Гц), 3,00 (2H, т, J = 7,6 Гц), 3,17 (2H, т, J = 7,6 Гц), 3,30 (4H, с), 4,21 (2H, т, J = 5,8 Гц), 7,17 (2H, д, J = 9,0 Гц), 7,83 (2H, д, J = 9,0 Гц).
Пример 18

2, 16 г 4-(3-{4-[3-(4-Цианофенокси)пропил]-2,3-диоксо-1-пиперазинил}пропокси)бензонитрила суспендируют в 50,0 мл этанола. При охлаждении льдом суспензию продувают газообразным хлоридом водорода с последующим перемешиванием при комнатной температуре в течение 12 часов. После завершения реакции растворитель удаляют при пониженном давлении с получением 2,95 г бледно-желтого твердого вещества, гидрохлорида этил-4-{3-[4-(3-{4-[этокси(имино)метил]фенокси}пропил)-2,3-диоксо-1-пиперазинил}пропокси}бензолкарбоксиимидоата.
ИК (KBr) см-1: 3393, 2875, 1684, 1608.
1H-ЯМР (d6-ДМСО) δ: 1,47 (6H, т, J = 7,0 Гц), 1,95-2,05 (4H, м), 3,46-3,62 (8H, м), 4,15 (4H, т, J = 6,0 Гц), 4,61 (4H,кв, J = 7,0 Гц), 7,16 (4H, д, J = 9,0 Гц), 8,16 (4H, д, J = 9,0 Гц), 11,22 (1H, шир.с), 11,96 (1H, шир.с).
Пример 19

2,69 г гидрохлорида этил-4-{3-[4-(3-{4-[этокси(имино)метил]фенокси}пропил)-2,3-диоксо-1-пиперазинил]пропокси}бензолкарбоксиимидоата суспендируют в 45,0 мл этанола и далее к суспензии добавляют 1,60 г ацетата аммония. Смесь подвергают нагреву при кипячении с обратным холодильником в течение 3 часов. Реакционную смесь охлаждают до комнатной температуры и осадок отфильтровывают с получением 2,51 г бесцветного твердого вещества, ацетата 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-2,3-диоксо-1-пиперазинил]пропокси}бензамидина.
ИК (KBr) см-1: 3117, 1670, 1609.
1H-ЯМР (CD3OD) δ: 1,90 (3H, с), 2,10-2,20 (4H, м), 3,64-3,76 (8H, м), 4,16 (4H, т, J = 5,9 Гц), 7,10-7,20 (4H, м), 7,75-7,80 (4H, м).
Пример 20
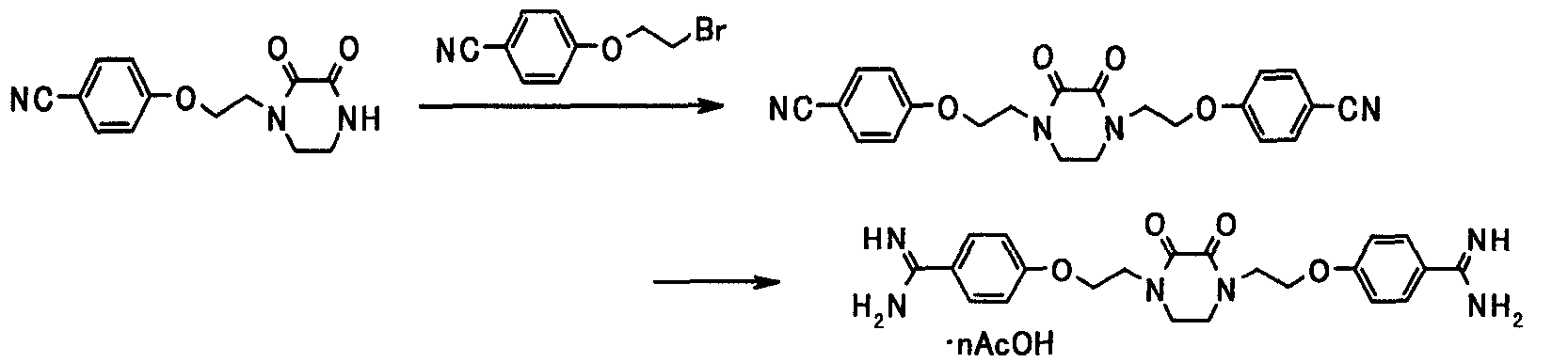
Следующее соединение получают тем же образом, что и в ссылочном примере 7 и примерах 18 и 19.
Ацетат 4-{2-[4-(2-{4-[амино(имино)метил]фенокси}этил)-2,3-диоксо-1-пиперазинил]этокси}бензамидина.
ИК (KBr) см-1: 3203, 1674, 1612.
1H-ЯМР (d6-ДМСО) δ: 1,89 (6H, с), 3,67 (4H, с), 3,76 (4H, т, J = 4,8 Гц), 4,26 (4H, т, J = 4,8 Гц), 7,16 (4H, д, J = 8,8 Гц), 7,81 (4H, д, J = 8,8 Гц).
Пример 21
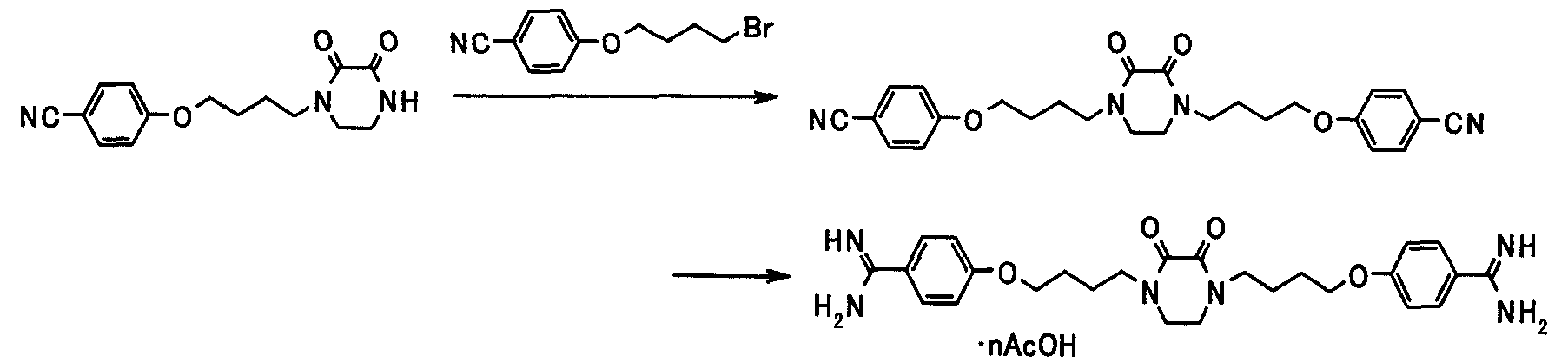
Следующее соединение получают тем же образом, что и в ссылочном примере 7 и примерах 18 и 19.
Ацетат 4-{4-[4-(4-{4-[амино(имино)метил]фенокси}бутил)-2,3-диоксо-1-пиперазинил]бутокси}бензамидина.
ИК (KBr) см-1: 3134, 3049, 1654, 1610.
1H-ЯМР (CD3OD) δ: 1,80-1,86 (8H, м), 1,90 (6H, с), 3,56 (4H, т, J = 6,6 Гц), 3,65 (4H, с), 4,14 (4H, т, J = 5,5 Гц), 7,10-7,14 (4H, м), 7,75-7,80 (4H, м).
Пример 22

Следующее соединение получают тем же образом, что и в ссылочном примере 7 и примерах 18 и 19.
Ацетат 4-{3-[4-(2-{4-[амино(имино)метил]фенокси}этил)-2, 3-диоксо-1-пиперазинил]пропокси}бензамидина.
ИК (KBr) см-1: 3346, 3128, 1670, 1608.
1H-ЯМР (d6-ДМСО) δ: 1,97-2,04 (2H, м), 2, 08 (6H, с), 3,53 (2H, т, J = 6,8 Гц), 3,55-3,60 (2H, м), 3,67-3,71 (2H, м), 3,77 (2H, т, J = 5,4 Гц), 4,11 (2H, т, J = 6,0 Гц), 4,27 (2H, т, J = 5,4 Гц), 7,12 (2H, д, J = 8,8 Гц), 7,18 (2H, д, J = 9,0 Гц), 7,86 (2H, д, J = 8,8 Гц), 7,90 (2H, д, J = 9,0 Гц), 9,22 (8H, шир.с).
Пример 23

Следующее соединение получают тем же образом, что и в ссылочном примере 7 и примерах 18 и 19.
Ацетат 4-({(Е)-4-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-2,3-диоксо-1-пиперазинил]-2-бутенил}окси)бензамидина.
ИК (KBr) см-1: 3164, 1669, 1610.
1 H-ЯМР (D2O) δ: 1,96 (6H, с), 2,10-2,20 (2H, м), 3,58-3,74 (6H, м), 4,10 (2H, д, J = 5,4 Гц), 4,21 (2H, т, J = 5,4 Гц), 4,75 (2H, д, J = 4,9 Гц), 5,86 (1H, дт, J = 15,6, 5,4 Гц), 5,93 (1H, дт, J = 15,6, 4,9 Гц), 7,04 (2H, д, J = 8,8 Гц), 7,10-7,20 (2H, м), 7,70-7,82 (4H, м).
Пример 24
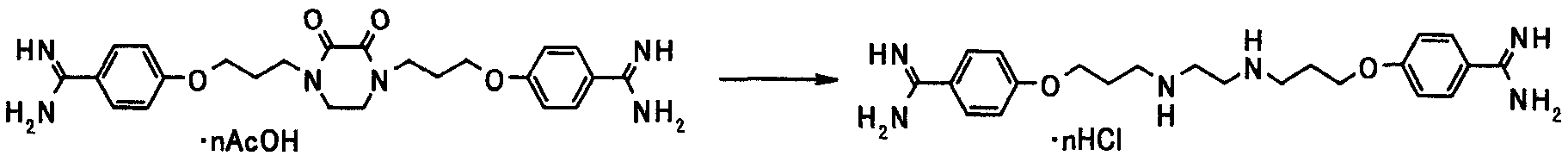
1,76 г ацетата 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-2,3-диоксо-1-пиперазинил]пропокси}бензамидина растворяют в 30,0 мл хлористоводородной кислоты с концентрацией 6 моль/л и полученный раствор подвергают нагреву при кипячении с обратным холодильником в течение 5 часов. После завершения реакции хлористоводородную кислоту с концентрацией 6 моль/л удаляют при пониженном давлении. К полученному остатку добавляют этанол и осуществляют фильтрование с получением 1,29 г бесцветного твердого вещества, гидрохлорида 4-[3-({2-[(3-{4-[амино(имино)метил]фенокси}пропил)амино]этил}амино)пропокси]бензамидина.
ИК (KBr) см-1: 3306, 3162, 2714, 1674, 1609.
1H-ЯМР (d6-ДМСО) δ: 2,14-2,22 (4H, м), 3,14 (4H, шир.с), 3,38 (4H, с), 4,24 (4H, т, J = 6,1 Гц), 7,18 (4H, д, J = 8,8 Гц), 7,87 (4H, д, J = 8,8 Гц), 9,03 (4H, шир.с), 9,27 (4H, шир.с), 9,82 (4H, шир.с).
Пример 25

Следующее соединение получают тем же образом, что и в примере 24.
Гидрохлорид 4-[2-({2-[(2-{4-[амино(имино)метил]фенокси}этил)амино]этил}амино)этокси]бензамидина.
ИК (KBr) см-1: 3312, 3097, 1662, 1609.
1H-ЯМР (d6-ДМСО) δ: 3,20-3,80 (10H, м), 4,44 (4H, шир.с), 7,24 (4H, д, J = 8,4 Гц), 7,90 (2H, д, J = 8,4 Гц), 9,11 (4H, шир.с), 9,32 (4H, шир.с), 9,98 (2H, шир.с).
Пример 26

Следующее соединение получают тем же образом, что и в примере 24.
Гидрохлорид 4-[4-({2-[(4-{4-[амино(имино)метил]фенокси}бутил)амино]этил}амино)бутокси]бензамидина.
ИК (KBr) см-1: 3320, 3164, 2717, 1676, 1609.
1H-ЯМР (d6-ДМСО) δ: 1,84 (8H, шир.с), 3,02 (4H, шир.с), 3,30-3,40 (4H, м), 4,13 (4H, шир.с), 7,17 (4H, д, J = 8,5 Гц), 7,87 (4H, д, J = 8,5 Гц), 9,04 (4H, шир.с), 9,27 (4H, шир.с), 9,68 (3H, шир.с).
Пример 27

Следующее соединение получают тем же образом, что и в примере 24.
Гидрохлорид 4-[3-({2-[(2-{4-[амино(имино)метил]фенокси}этил)амино]этил}амино)пропокси]бензамидина.
ИК (KBr) см-1: 3335, 3124, 2772, 1671, 1609.
1H-ЯМР (d6-ДМСО) δ: 2,20 (2H, шир.с), 3,14 (2H, шир.с), 3,30-3,60 (6H, шир.м), 4,26 (2H, шир.с), 4,46 (2H, шир.с), 7,17 (2H, д, J = 7,8 Гц), 7,25 (4H, д, J = 7,1 Гц), 7,80-8,00 (4H, шир.м), 9,19 (4H, шир.с), 9,30-9,50 (4H, шир.м), 10,05 (4H, шир.с).
Пример 28

Следующее соединение получают тем же образом, что и в примерах 4 и 5.
Гидрохлорид 4-[3-аминопропил)амино]бензамидина.
1H-ЯМР (d6 -ДМСО) δ: 1,84-1,91 (2H, м), 2,84-2,91 (2H, м), 3,50-4,00 (2H, шир.), 6,72 (2H, д, J = 8,8 Гц), 7,74 (2H, д, J = 8,8 Гц), 8,28 (3H, с), 8,78 (2H, с), 8,98 (2H, с).
Пример 29

Следующее соединение получают тем же образом, что и в примере 4.
4-[(3-азидопропил)сульфанил]бензамидина.
1H-ЯМР (d6-ДМСО) δ: 1,79-1,86 (2H, м), 3,07 (2H, т, J = 7,4 Гц), 3,33 (1H, с), 3,47 (2H, т, J = 6,6 Гц), 6,73 (2H, с), 7,35 (2H, д, J = 8,4 Гц), 7,72 (2H, д, J = 8,4 Гц).
Пример 30

0,24 г 4-[(3-азидопропил)сульфанил]бензамидина растворяют в 4,0 мл метанола. Далее к раствору при комнатной температуре добавляют 0,18 г 1,3-пропандитиола и 0,56 мл триэтиламина с последующим перемешиванием в течение 1 дня. Далее к данной смеси при комнатной температуре добавляют 2,16 г 1,3-пропандитиола с последующим перемешиванием в течение 5 часов. Далее к реакционной смеси добавляют 20 мл воды и 20 мл этилацетата и водный слой отделяют. Органический слой экстрагируют 10 мл воды и полученный водный слой объединяют. К водному слою добавляют 20 мл хлористоводородной кислоты с концентрацией 6 моль/л. Смесь промывают хлороформом 3 раза и далее концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле [элюент; хлороформ:метанол:трифторуксусная кислота = 2000:1000:1] с получением 0,10 г бледно-желтого твердого вещества, трифторацетата 4-[(3-аминопропил)сульфанил]бензамидина.
1H-ЯМР (d6-ДМСО) δ: 1,88-1,96 (2H, м), 2,80-3,00 (2H, м), 3,17 (1H, с), 3,21 (2H, т, J = 7,0 Гц), 7,54 (2H, д, J = 8,8 Гц), 7,80 (2H, д, J = 8,8 Гц), 8,10 (3H, с), 9,11 (2H, с), 9,37 (2H, с).
Пример 31

0,60 г 4-(2-{[2-(4-цианофенокси)этил]амино}этокси)бензонитрила растворяют в 20 мл этанола. Далее при охлаждении льдом в раствор вводят газообразный хлорид водорода, до его насыщения. Раствор оставляют в спокойном состоянии при комнатной температуре на 12 часов. После завершения реакции реакционный раствор концентрируют при пониженном давлении. Полученный остаток растворяют в 30 мл этанола и к нему далее добавляют 1,20 г ацетата аммония при комнатной температуре. Смесь перемешивают в течение 5,5 часов при нагреве с кипячением с обратным холодильником. После охлаждения до комнатной температуры растворитель удаляют при пониженном давлении. К остатку добавляют хлористоводородную кислоту и растворитель снова удаляют. Далее полученное твердое вещество отфильтровывают с промывкой смешанным раствором из изопропанола и этанола с получением 0,31 г бледно-коричневого твердого вещества, гидрохлорида 4-{2-[(2-{4-[амино(имино)метил]фенокси}этил)амино]этокси}бензамидина.
1H-ЯМР (d6-ДМСО) δ: 3,35-3,55 (4H, м), 4,50 (4H, т, J = 5,0 Гц), 7,22 (4H, д, J = 9,0 Гц), 7,93 (4H, д, J = 9,0 Гц), 9,21 (3H, с), 9,40 (4H, с), 9,88 (2H, шир.с).
Пример 32

Следующее соединение получают тем же образом, что и в примере 31.
Гидрохлорид 4-{3-[(3-{4-[амино(имино)метил]фенокси}пропил)амино]пропокси}бензамидина.
1H-ЯМР (d6-ДМСО) δ: 2,15-2,22 (4H, м), 3,00-3,20 (4H, м), 4,22 (4H, т, J = 6,1 Гц), 7,16 (4H, д, J = 9,0 Гц), 7,87 (4H, д, J = 9,3 Гц), 9,00 (4H, с), 9,29 (6H, с).
Пример 33

Следующее соединение получают тем же образом, что и в примере 31.
Ацетат 4-{3-[(6-{4-[амино(имино)метил]фенокси}гексил)амино]пропокси}бензамидина.
1H-ЯМР (D2O) δ: 1,40-1,60 (4H, м), 1,74-1,87 (4H, м), 1,94 (6H, с), 2,23-2,30 (2H, м), 3,11-3,15 (2H, м), 3,31 (2H, т, J = 7,4 Гц), 4,18 (2H, т, J = 6,2 Гц), 4,30 (2H, т, J = 5,6 Гц), 7,16-7,21 (4H, м), 7,78-7,82 (4H, м).
Пример 34

Следующее соединение получают тем же образом, что и в примерах 18 и 19.
Ацетат 4-{3-[4-(6-{4-[амино(имино)метил]фенокси}гексил)-2,3-диоксо-1-пиперазинил]пропокси}бензамидина.
1H-ЯМР (d6-ДМСО + D2O) δ: 1,26-1,36 (2H, м), 1, 40-1,60 (4H, м), 1,70-1,80 (8H, м), 1,90-2,20 (2H, м), 3,30-3,45 (2H, м), 3,50-3,62 (6H, м), 4,07-4,14 (4H, м), 7,11-7,14 (4H, м), 7,76-7,79 (4H, м).
Пример 35

Следующее соединение получают тем же образом, что и в примерах 18 и 19.
3-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-2,3-диоксо-1-пиперазинил]пропокси}бензамидин.
1H-ЯМР (d6-ДМСО) δ: 1,90-2,00 (4H, м), 3,51-3,57 (8H, м), 4, 07-4,13 (4H, м), 7,12 (2H, д, J = 8,8 Гц), 7,23-7,26 (1H, м), 7,36-7,38 (2H, м), 7,49 (1H, т, J = 8,2 Гц), 7,81 (2H, д, J = 8,8 Гц), 9,10-9,60 (6H, м).
Пример 36

Следующее соединение получают тем же образом, что и в примерах 18 и 19.
4-[3-{4-[3-{4-[амино(имино)метил]фенокси}-2-(бензилокси)пропил)-2,3-диоксо-1-пиперазинил}-2-(бензилокси)пропокси}бензамидин.
1H-ЯМР (d6-ДМСО) δ: 3,48-3,72 (6H, м), 4,00-4,08 (2H, м), 4,16-4,19 (2Н, м), 4,24-4,28 (2Н, м), 4,37 (2Н, т, J = 5,1 Гц), 4,59-4,70 (4Н, м), 7,17 (4Н, д, J = 9,0 Гц), 7,23-7,30 (10Н, м), 7,86 (4Н, д, J = 9,0 Гц), 8,80-9,40 (6Н, м).
Пример 37

Следующее соединение получают тем же образом, что и в примерах 18 и 19.
4-({3-[4-(3-{4-[амино(имино)метил]анилино}пропил)-2,3-диоксо-1-пиперазинил]пропил}амино)бензамидин.
1H-ЯМР (d6-ДМСО) δ: 1,70-1,90 (4H, м), 3,11-3,16 (4H, м), 3,20-3,50 (4H, м), 3,55 (4H, с), 6,69 (4H, д, J = 8,9 Гц), 6,93 (2H, т, J = 5,4 Гц), 7,70 (4H, д, J = 8,9 Гц), 8,10-8,90 (6H, шир.).
Пример 38

Следующее соединение получают тем же образом, что и в примерах 18 и 19.
Гидрохлорид 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-2-оксо-1-пиперазинил]пропокси}бензамидина.
1H-ЯМР (d6-ДМСО) δ: 1,97-2, 03 (2H, м), 2,20-2,40 (2H, м), 3,30-4,00 (10H, м), 4,15-4,23 (4H, м), 7,15-7,20 (4H, м), 7,90-7,94 (4H, м), 9,18-9,20 (4H, с), 9,38-9,40 (4H, м), 12,38 (1Н, шир.с).
Пример 39

Следующее соединение получают тем же образом, что и в примерах 18 и 19.
Ацетат 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-7-оксо-1,4-диазепан-1-ил]пропокси}бензамидина.
1H-ЯМР (D2O) δ: 1,94 (6H, с), 2,01-2,11 (4H, м), 2,67-2,82 (8H, м), 3,58-3,68 (4H, м), 4,18 (4H, т, J = 5,6 Гц), 7,14-7,20 (4H, м), 7,80 (4H, д, J = 8,4 Гц).
Пример 40
Пример 40-1

4,00 г 4-(3-{4-[3-(4-цианофенокси)пропил]-1-пиперазинил}пропокси)бензонитрила растворяют в 280 мл этанола. При охлаждении льдом раствор продувают газообразным хлоридом водорода с последующим перемешиванием при комнатной температуре в течение 2 дней. После завершения реакции растворитель удаляют при пониженном давлении. Полученный остаток суспендируют в 200 мл этанола и далее к суспензии при комнатной температуре добавляют 7,62 г ацетата аммония с последующим нагревом при кипячении с обратным холодильником в течение 6 часов. После охлаждения до комнатной температуры растворитель удаляют при пониженном давлении. К полученному остатку добавляют 200 мл воды и 100 мл хлороформа и смесь далее приводят к рН 13 при добавлении водного раствора гидроксида натрия с концентрацией 5,0 моль/л. Осадок отфильтровывают и осадок промывают водой, пока фильтрат не станет нейтральным с получением 4,04 г белого твердого вещества, 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперазинил]пропокси}бензамидина.
1H-ЯМР (d6-ДМСО) δ: 1,70-2,00 (4H, м), 2, 10-2,70 (12H, м), 4,03 (4H, т, J = 6,2 Гц), 6,00-6,80 (6H, шир.с), 6,92 (4H, т, J = 8,7 Гц), 7,71 (4H, т, J = 8,7 Гц).
Пример 40-2

0,25 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперазинил]пропокси}бензамидина суспендируют в 5,0 мл этанола. К суспензии добавляют 1,5 мл этанольного раствора хлорида водорода с концентрацией 2,0 моль/л. Далее добавляют 3,0 мл воды для растворения. Растворитель далее удаляют при пониженном давлении. Далее остаток отфильтровывают с этанолом с получением 0,25 г гидрохлорида 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперазинил]пропокси}бензамидина.
1H-ЯМР (d6-ДМСО) δ: 2,10-2,30 (4H, м), 3,10-3,90 (14H, м), 4,10-4,30 (4H, м), 7,17 (4H, д, J = 8,8 Гц), 7,86 (4H, д, J = 8,8 Гц), 8,99 (4H, с), 9,24 (4H, с).
Пример 41

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-{3-[4-(3-{4-[амино(имино)метил]-2-метилфенокси}пропил)-1-пиперазинил]пропокси}-3-метилбензамидина.
1H-ЯМР (d6-ДМСО) δ: 2,10-2,40 (10H, м), 3,00-4,00 (12H, м), 4,22 (4H, т, J = 5,6 Гц), 7,17 (2H, д, J = 8,3 Гц), 7,70-7,80 (4H, м), 9,06 (4H, с), 9,24 (4H, ), 12,10-12,80 (2H, шир.).
Пример 42
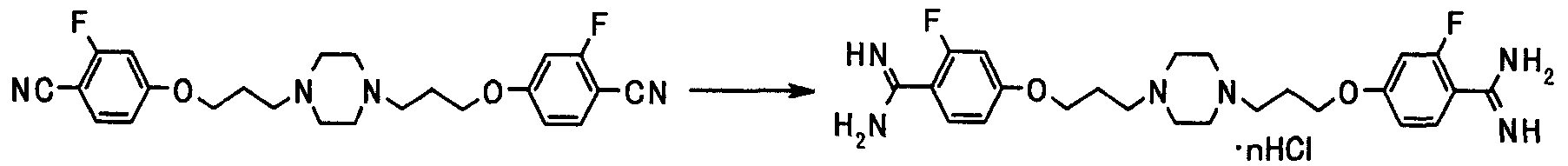
Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-{3-[4-(3-{4-[амино(имино)метил]-3-фторфенокси}пропил)-1-пиперазинил]пропокси}-2-фторбензамидина.
1H-ЯМР (d6-ДМСО + D2O) δ: 2,16-2,30 (4Н, м), 3,35 (4Н, т, J = 7,7 Гц), 3,58 (8Н, шир.с), 4,00-4,40 (4H, м), 6,99-7,09 (4H, м), 7,66 (2H, т, J = 8,5 Гц).
Пример 43

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-{3-[4-(3-{4-[амино(имино)метил]-2-фторфенокси}пропил)-1-пиперазинил]пропокси}-3-фторбензамидина.
1H-ЯМР (D2O) δ: 2,41-2,47 (4H, м), 3,63 (4H, т, J = 7,4 Гц), 3,65-4,00 (8H, м), 4,40 (4H, т, J = 5,4 Гц), 7,32-7,36 (2H, м), 7,65-7,68 (4H, м).
Пример 44
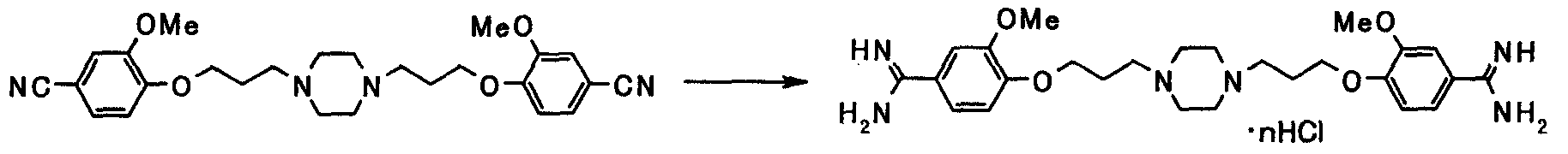
Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-{3-[4-(3-{4-[амино(имино)метил]-2-метоксифенокси}пропил)-1-пиперазинил]пропокси}-3-метоксибензамидина.
1H-ЯМР (d6-ДМСО) δ: 2,10-2,40 (4H, м), 3,10-4,00 (14H, м), 3,88 (6H, с), 4,20 (4H, т, J = 5,9 Гц), 7,20 (2H, д, J = 8,3 Гц), 7,51 (2H, с), 7,51-7,53 (2H, м), 9,01 (4Н, с), 9,29 (4Н, с).
Пример 45

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4'-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперазинил]пропокси}-[1,1'-бифенил]-4-амидина.
1H-ЯМР (d6-ДМСО) δ: 2,20-2,30 (4H, м), 3,20-3,90 (14H, м), 4,17 (2H, т, J = 5,8 Гц), 4,23 (2H, т, J = 5,8 Гц), 7,11 (2H, д, J = 8,8 Гц), 7,18 (2H, д, J = 9,2 Гц), 7,77 (2H, д, J = 8,8 Гц), 7,89-7,97 (6H, м), 9,16 (2H, с), 9,31-9,33 (4H, м), 9,49 (2H, с).
Пример 46

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}-2-метилпропил)-1-пиперазинил]-2-метилпропокси}бензамидина.
1H-ЯМР (D2 O) δ: 1,20 (6H, д, J = 6,8 Гц), 2,66-2,70 (2H, м), 3,31-3,36 (2H, м), 3,47-3,52 (2H, м), 3,55-4,00 (8H, м), 4,09-4,13 (2H, м), 4,21-4,25 (2H, м), 7,19 (4H, д, J = 8,8 Гц), 7,81 (4H, J=8,8 Гц).
Пример 47

70 мл этанола добавляют к 1,00 г 4-(2-(бензилокси)-3-{4-[2-(бензилокси)-3-(4-цианофенокси)пропил]-1-пиперазинил}пропокси)бензонитрила. При охлаждении льдом в смесь вводят газообразный хлорид водорода до ее насыщения с последующим перемешиванием при комнатной температуре в течение 18 часов. Далее к реакционной смеси добавляют 20 мл этанола. При охлаждении льдом в смесь снова вводят газообразный хлорид водорода до ее насыщения с последующим перемешиванием при комнатной температуре в течение 20 часов. Реакционную смесь концентрируют при пониженном давлении с получением 1,35 г бледно-желтого твердого вещества. 1,24 г полученного твердого вещества суспендируют в 120 мл этанола и далее к ней добавляют при комнатной температуре 2,20 г ацетата аммония с последующим перемешиванием в течение 4 часов при нагреве с кипячением с обратным холодильником. Реакционную смесь охлаждают до комнатной температуры и далее ее концентрируют при пониженном давлении. Полученный остаток растворяют в метаноле и далее к раствору добавляют этанольный раствор хлорида водорода с концентрацией 2 моль/л. Растворитель удаляют при пониженном давлении и полученное желтое твердое вещество очищают колоночной хроматографией на силикагеле [YMC-GEL, ODS-AM 120-S50, элюент; 10% водный раствор ацетонитрила] с получением бесцветного маслянистого продукта. К полученному маслянистому продукту добавляют 15 мл хлористоводородной кислоты с концентрацией 6 моль/л с последующим перемешиванием при температуре от 85 до 90°С в течение 7 часов. Реакционную смесь концентрируют при пониженном давлении. Полученное твердое вещество отфильтровывают с изопропанолом с получением 0,42 г белого твердого вещества, гидрохлорида 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}-2-гидроксипропил)-1-пиперазинил]-2-гидроксипропокси}бензамидина.
1H-ЯМР (D2O) δ: 3,50-3,70 (4H, м), 3,80-4,00 (8H, м), 4,21-4,31 (4H, м), 4,55-4,65 (2H, м), 7,10-7,30 (4H, м), 7,70-7,90 (4H, м).
Пример 48

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-{3-[4-(2-{4-[амино(имино)метил]фенокси}этил)-1-пиперазинил]пропокси}бензамидина.
1H-ЯМР (d6-ДМСО) δ: 2,20-2,30 (2H, шир.м), 3,20-3,90 (14H, м), 4,22 (2H, т, J = 6,0 Гц), 4,53 (2H, шир.с), 7,16-7,25 (4H, м), 7,87-7,92 (4H, м), 9,10 (2H, с), 9,13 (2H, с), 9,30 (2H, с), 9,32 (2Н, с).
Пример 49

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-{2-[4-(2-{4-[амино(имино)метил]фенокси}этил)-1-пиперазинил]этокси}бензамидина.
1H-ЯМР (d6-ДМСО) δ: 3,20-3,90 (14H, м), 4,40-4,60 (4H, м), 7,23 (4H, д, J = 8,8 Гц), 7,89 (4H, д, J = 8,8 Гц), 9,06 (4H, с), 9,29 (4H, с).
Пример 50
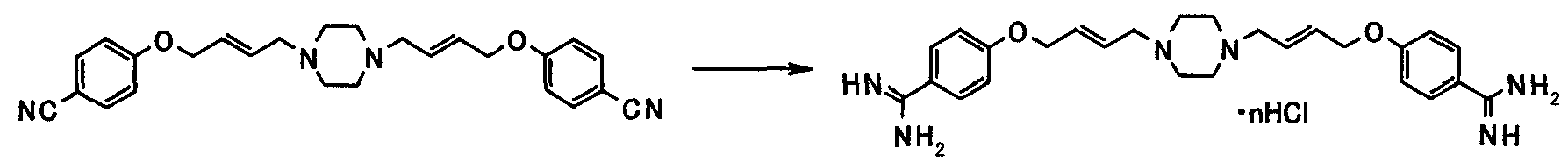
Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-({(Е)-4-[4-(Е)-4-{4-[амино(имино)метил]фенокси}-2-бутенил)-1-пиперазинил]-2-бутенил}окси)бензамидина.
1H-ЯМР (d6-ДМСО) δ: 3,10-4,00 (14H, м), 4,76 (4H, д, J = 4,4 Гц), 5,94-6,03 (2H, м), 6,10-6,30 (2H, м), 7,19 (4H, д, J = 9,0 Гц), 7,87 (4H, д, J = 9,0 Гц), 9,04 (4H, с), 9,27 (4H, с).
Пример 51

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-[3-(4-{4-[амино(имино)метил]бензил}-1-пиперазинил)пропокси]бензамидина.
1H-ЯМР (d6-ДМСО) δ: 2,10-2,30 (2H, м), 3,10-4,90 (16H, м), 7,46 (2H, д, J = 8,8 Гц), 7,91 (2H, д, J = 8,8 Гц), 7,90-8,10 (4H, м), 9,14 (2H, с), 9,33 (2H, с), 9,42 (2H, с), 9,58 (2H, с).
Пример 52

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперазинил)бензамидина.
1H-ЯМР (d6-ДМСО) δ: 2,20-2,40 (2H, м), 3,00-3,50 (8H, м), 3,50-3,70 (2H, м), 4, 10-4,20 (2H, м), 4,22 (2H, т, J = 6,6 Гц), 7,16-7,20 (4H, м), 7,82 (2H, д, J = 8,9 Гц), 7,86 (2H, д, J = 8,9 Гц), 8,77 (2H, с), 8,93 (2H, с), 9,09 (2H, с), 9,22 (2H, с).
Пример 53

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-[4-(5-{4-[амино(имино)метил]фенокси}пентил)-1-пиперазинил)бензамидина.
1H-ЯМР (d6-ДМСО) δ: 1,42-1,54 (2H, м), 1,74-1,90 (4H, м), 3,00-3,20 (4H, м), 3,20-3,50 (4H, м), 3,50-3,70 (2H, м), 4,06-4,16 (4H, м), 7,16 (2H, д, J = 9,1 Гц), 7,17 (2H, д, J = 9,1 Гц), 7,82 (2H, д, J = 9,1 Гц), 7,85 (2H, д, J = 9,1 Гц), 8,85 (2H, с), 8,99 (2H, с), 9,11 (2H, с), 9,24 (2H, с).
Пример 54

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-2-метил-1-пиперазинил]пропокси}бензамидина.
1H-ЯМР (D2O) δ: 2,20-2,50 (4H, м), 3,33-3,60 (5H, м), 3,72-4,04 (6H, м), 4,20-4,40 (4H, м), 7,17-7,20 (4H, м), 7,86 (4H, д, J = 8,4 Гц).
Пример 55

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1,4-диазепан-1-ил]пропокси}бензамидина.
1H-ЯМР (d6-ДМСО) δ: 2,10-2,40 (6H, м), 3, 20-4,00 (14H, м), 4,21 (4H, т, J = 5,9 Гц), 7,17 (4H, д, J = 8,8 Гц), 7,86 (4H, д, J = 8,8 Гц), 8,96 (4H, с), 9,23 (4H, с).
Пример 56
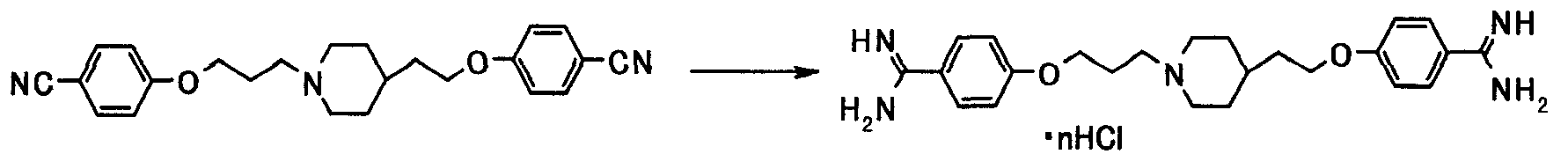
Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-{2-[1-(3-{4-[амино(имино)метил]фенокси}пропил)-4-пиперидинил]этокси}бензамидина.
1H-ЯМР (d6-ДМСО) δ: 1,60-1,80 (3H, м), 1,80-2,00 (2H, м), 2,10-2,30 (2H, м), 2,80-3,00 (2H, м), 3,10-3,40 (5H, м), 3,40-3,60 (2H, м), 4,10-4,21 (4H, м), 7,16 (4H, д, J = 8,8 Гц), 7,85 (2H, д, J = 8,8 Гц), 7,86 (2H, д, J = 8,8 Гц), 8,99-9,00 (4H, м), 9,24-9,25 (4H, м).
Пример 57
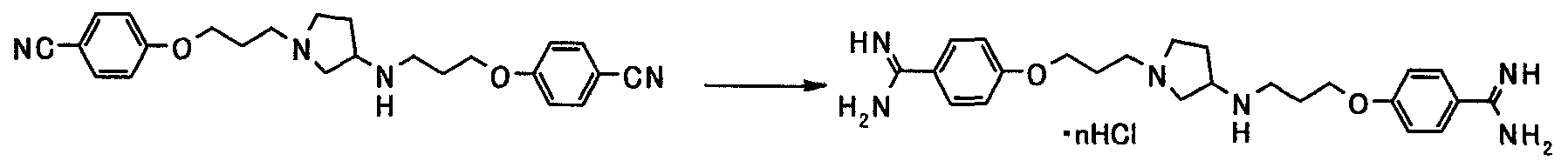
Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-(3-{3-[(3-{4-[амино(имино)метил]фенокси}пропил)амино]-1-пирролидинил}пропокси)бензамидина.
1H-ЯМР (d6-ДМСО) δ : 2,10-2,70 (6H, м), 3,00-4,10 (10H, м), 4,21-4,26 (4H, м), 7,18 (4H, д, J = 8,8 Гц), 7,86 (4H, д, J = 8,8 Гц), 8,96 (4H, шир.с), 9,24 (4H, шир.с), 9,80-10,02 (2H, шир.).
Пример 58

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-(3-{1-[(3-{4-[амино(имино)метил]фенокси}пропил)-4-пиперидинил]амино}пропокси)бензамидина.
1H-ЯМР (d6-ДМСО) δ: 2,00-2,40 (8H, м), 2,90-3,70 (10H, м), 4,10-4,30 (4H, м), 7,16 (2H, д, J = 8,8 Гц), 7,17 (2H, д, J = 8,8 Гц), 7,88 (4H, д, J = 8,8 Гц), 9,05 (4H, с), 9,28 (4H, с), 9,60-9,80 (2H, м).
Пример 59

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-{3-[(1-{4-[амино(имино)метил]бензил}-4-пиперидинил)амино]пропокси}бензамидина.
1Н-ЯМР (d6-ДМСО) δ: 2,00-2,40 (6H, м), 2,90-3,70 (7H, м), 4,22 (2H, т, J = 6,1 Гц), 4,30-4,50 (2H, м), 7,16 (2H, д, J = 8,7 Гц), 7,80-8,00 (1H, м), 7,87 (2H, д, J = 8,7 Гц), 7,90 (2H, д, J = 8,7 Гц), 7,95 (2H, д, J = 8,7 Гц), 9,03 (2H, с), 9,20-9,40 (4H, м), 9,40-9,80 (4H, м).
Пример 60

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-{3-[{2-[(3-{4-[амино(имино)метил]фенокси}пропил)(метил)амино]этил}(метил)амино]пропокси}бензамидина.
1H-ЯМР (d6-ДМСО) δ: 2,10-2,30 (4H, м), 2,85 (6H, с), 3,20-3,90 (8H, м), 4,22 (4H, т, J = 6,0 Гц), 7,17 (4H, д, J = 9,0 Гц), 7,91 (4H, д, J = 9,0 Гц), 9,17 (4H, с), 9,37 (4H, с), 11,7 (2H, шир.с).
Пример 61

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-[3-({4-[(3-{4-[амино(имино)метил]фенокси}пропил)амино]бутил}амино)
пропокси]бензамидина.
1H-ЯМР (d6-ДМСО) δ: 1,60-1,80 (4H, м), 2,10-2,30 (4H, м), 2,80-3,20 (8H, м), 4,22 (4H, т, J = 6,1 Гц), 7,17 (4H, д, J = 9,0 Гц), 7,86 (4H, д, J = 9,0 Гц), 8,97 (4H, с), 9,00-9, 60 (2H, шир.), 9,25 (6H, с).
Пример 62
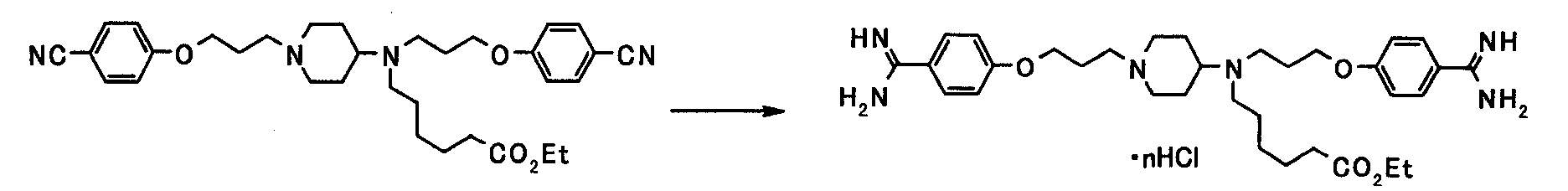
Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид этил-6-{(3-{4-[амино(имино)метил]фенокси}пропил)[1-(3-{4-[амино(имино)метил]фенокси}пропил)-4-пиперидинил]амино}гексаноата.
1H-ЯМР (d6-ДМСО) δ: 1,18 (3H, т, J = 7,1 Гц), 1,25-1,40 (2H, м), 1,45-1,65 (2H, м), 1,70-1,90 (2H, м), 2,10-2,40 (10H, м), 3,00-3,90 (11H, м), 4,06 (2H, кв, J=7,1 Гц), 4,10-4,30 (4H, м), 7,16-7,21 (4H, м), 7,86 (4H, д, J = 8,8 Гц), 8,94 (4H, с), 9,23 (4H, с), 11,05 (1H, с), 11,20 (1H, с).
Пример 63

Следующее соединение получают тем же образом, что и в примере 40.
N-{6-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперазинил]гексил}ацетамида.
1H-ЯМР (CDCl3) δ: 1,25-1,42 (4H, м), 1,44-1,54 (4H, м), 1,90-2,10 (2H, м), 1,97 (3H, с), 2,10-2,80 (15H, м), 3,21-3,26 (2H, м), 4,05 (2H, т, J = 6,3 Гц), 5,30-5,50 (1H, шир.с), 6,92 (2H, д, J = 8,7 Гц), 7,55 (2H, д, J = 8,7 Гц).
Пример 64

0,81 г 4-(3-{4-[3-(4-Цианофенокси)пропил]-1-пиперазинил}пропокси)бензонитрила растворяют в 20 мл хлороформа и к данному раствору далее добавляют 180 мл этанола. При охлаждении льдом раствор продувают газообразным хлоридом водорода. Раствор реагирует при комнатной температуре в течение 24 часов. Далее растворитель удаляют при пониженном давлении. Полученный остаток и 0,84 г гидрохлорида метоксиамина суспендируют в 30 мл этанола. При охлаждении льдом к суспензии добавляют 4,2 мл триэтиламина с последующим перемешиванием в течение 5 часов. Растворитель удаляют при пониженном давлении. К полученному остатку добавляют 30 мл хлороформа и 30 мл водного раствора гидроксида натрия с концентрацией 1 моль/л так, чтобы органический слой отделился. Отделенный органический слой сушат над безводным сульфатом натрия и далее концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле [элюент; хлороформ:метанол = 20:1] с получением 0,59 г бледно-коричневого твердого вещества. 0,50 г полученного твердого вещества растворяют в 10 мл хлороформа и данному раствору добавляют 2 мл этанольного раствора хлорида водорода с концентрацией 2 моль/л. Растворитель удаляют при пониженном давлении и полученный остаток отфильтровывают с этанолом с получением 0,51 г белого твердого вещества, гидрохлорида 4-{3-[4-(3-{4-[амино(метоксиимино)метил]фенокси}пропил)-1-пиперазинил]пропокси}-N'-метоксибензамидина.
1H-ЯМР (d6-ДМСО) δ: 2,20-2,40 (4H, м), 3,25-4,00 (14H, м), 3,86 (6H, с), 4,21 (4H, т, J = 6,0 Гц), 7,15 (4H, д, J = 9,0 Гц), 7,82 (4H, д, J = 9,0 Гц), 8,75-9,50 (4H, шир.), 12,00-13,00 (2H, шир.).
Пример 65

Следующее соединение получают тем же образом, что и в примере 64.
Гидрохлорид 4-{3-[4-(3-{4-[имино(метиламино)метил]фенокси}пропил)-1-пиперазинил]пропокси}-N-метилбензамидина.
1H-ЯМР (d6-ДМСО + D2O) δ: 2,20-2,30 (4H, м), 3,00 (6H, с), 3,30-3,40 (4H, м), 3,90-4,00 (8H, м), 4,19 (4H, т, J = 6,0 Гц), 7,16 (4H, д, J = 9,2 Гц), 7,75 (4H, д, J = 9,2 Гц).
Пример 66
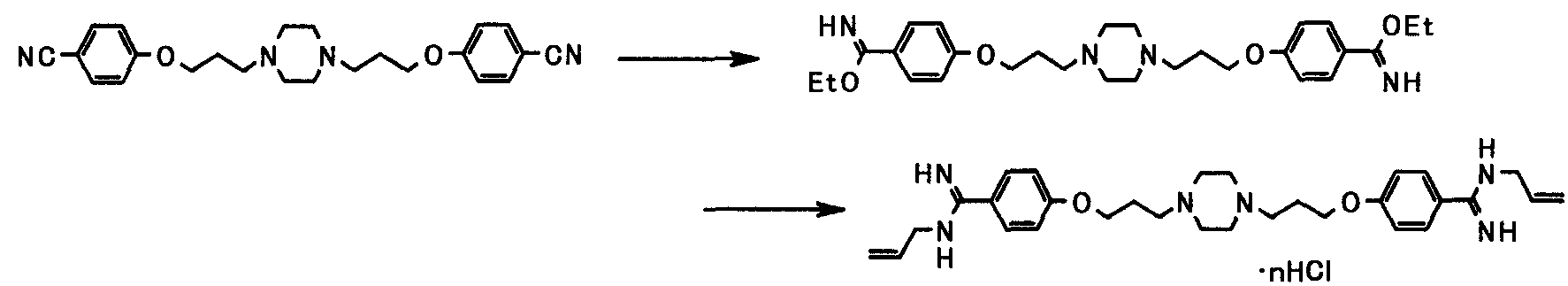
Следующее соединение получают тем же образом, что и в примере 64.
Гидрохлорид N-аллил-4-{3-[4-(3-{4-[(аллиламино)(имино)метил]фенокси}пропил)-1-пиперазинил]пропокси}бензамидина.
1H-ЯМР (d6-ДМСО) δ: 2,20-2,30 (4H, м), 3,30-4,00 (14H, м), 4,00-4,30 (8H, м), 5,23-5,33 (4H, м), 5,89-5,98 (2H, м), 7,16 (4H, д, J = 8,2 Гц), 7,85 (4H, д, J = 8,2 Гц), 9,07 (2H, с), 9,55 (2H, с), 10,05 (2H, с).
Пример 67

5,9 мл воды и 23,7 мл этанола добавляют к 2,06 г гидрохлорида гидроксиламина и 0,60 г 4-(3-{4-[3-(4-цианофенокси)пропил]-1-пиперазинил}пропокси)бензонитрила. Далее к данной смеси добавляют 4,14 мл триэтиламина и смесь подвергают нагреву при кипячении с обратным холодильником в течение 1 часа. После охлаждения до комнатной температуры осадок отфильтровывают, и к нему добавляют хлористоводородную кислоту с концентрацией 2 моль/л и этанол, и растворяют. Растворитель удаляют при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле [YMC-GEL, ODS-AM 120-S50, элюент; вода] с получением 0,44 г белого твердого вещества, гидрохлорида 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперазинил]пропокси}-N'-гидроксибензамидина.
1H-ЯМР (d6-ДМСО + D2O) δ: 2,20-2,30 (4H, м), 3,30-3,50 (4H, м), 3,50-3,90 (8H, м), 4,20 (4H, т, J = 5,6 Гц), 7,18 (4H, д, J = 9,2 Гц), 7,71 (4H, д, J = 9,2 Гц).
Пример 68
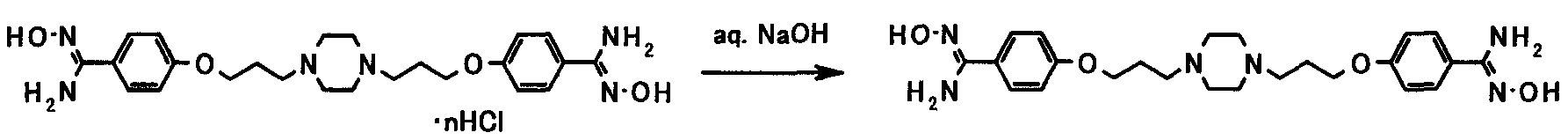
0,54 г гидрохлорида 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперазинил]пропокси}-N'-гидроксибензамидина растворяют в 20 мл воды и раствор далее приводят к рН 12 водным раствором гидроксида натрия с концентрацией 5 моль/л. Осадок отфильтровывают и его промывают водой и этанолом с получением 0,42 г белого твердого вещества, 4-{3-[4-(3-{4-[амино(гидроксиимино)метил]фенокси}пропил)-1-пиперазинил]пропокси}-N'-гидроксибензамидина.
1H-ЯМР (d6-ДМСО) δ: 1,80-2,00 (4H, м), 2,20-2,80 (12H, м), 4,02 (4H, т, J = 6,3 Гц), 5,71 (4H, с), 6,91 (4H, д, J = 8,7 Гц), 7,59 (4H, д, J = 8,7 Гц), 9,45 (2H, с).
Пример 69

0,12 г 4-{3-[4-(3-{4-[Амино(гидроксиимино)метил]фенокси}пропил)-1-пиперазинил]пропокси}-N'-гидроксибензамидина растворяют в 2, 0 мл уксусной кислоты и 0,08 мл уксусного ангидрида, далее добавляют к раствору при комнатной температуре с последующим перемешиванием в течение 1 часа. Через 1 час к реакционной смеси добавляют 0,08 г 5% палладий-углерода и смесь перемешивают в атмосфере водорода при комнатной температуре и атмосферном давлении в течение 1,5 часов. После завершения реакции катализатор удаляют фильтрованием и растворитель удаляют при пониженном давлении. Полученный остаток растворяют в метаноле и к нему добавляют 3 мл этанольного раствора хлорида водорода с концентрацией 2,6 моль/л. Далее растворитель удаляют при пониженном давлении. К полученнму остатку добавляют изопропанол и осадок отфильтровывают с получением 0,11 г бледно-коричневого твердого вещества гидрохлорида 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперазинил]пропокси}бензамидина.
Данные по физико-химическим свойствам данного соединения совпадают с данными соединения, полученного в примере 40-2.
Пример 70
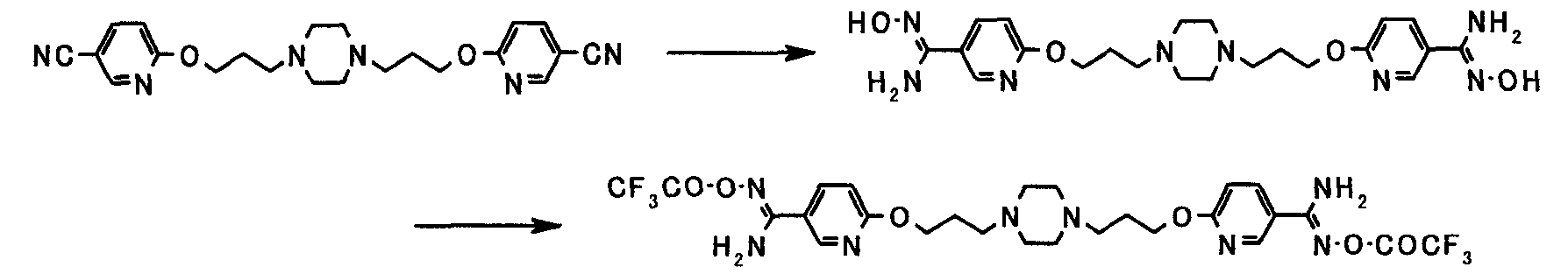
0,30 г 6-[3-(4-{3-[(5-Циано-2-пиридинил)окси]пропил}-1-пиперазинил)пропокси]никотинонитрила суспендируют в 7,4 мл этанола. К суспензии последовательно добавляют 0,21 мл триэтиламина и 0,10 г гидрохлорида гидроксиламина с последующим нагревом при кипячении с обратным холодильником в течение 2 часов. Далее к реакционному раствору последовательно добавляют 0,01 г гидрохлорида гидроксиламина и 0,02 мл триэтиламина с последующим нагревом при кипячении с обратным холодильником в течение 3,5 часов. После охлаждения твердое вещество отфильтровывают и его далее промывают 10 мл этанола с получением 0,25 г бледно-коричневого твердого вещества. 0,20 г полученного бледно-коричневого твердого вещества растворяют в 2,0 мл трифторуксусной кислоты и к раствору добавляют 0,15 мл трифторуксусного ангидрида с последующим перемешиванием в течение 0,7 часа. 0,15 мл трифторуксусного ангидрида далее добавляют к реакционному раствору и смесь перемешивают в течение 1,3 часов. К реакционному раствору добавляют 0, 29 мл триэтиламина и 1,5 мл трифторуксусного ангидрида с последующим перемешиванием в течение 62,5 часов. Растворитель удаляют при пониженном давлении. К полученному остатку добавляют 10 мл воды, 10 мл насыщенного раствора бикарбоната натрия и 20 мл этилацетата так, чтобы органический слой отделился. Отделенный органический слой промывают дважды 10 мл насыщенного раствора бикарбоната натрия и далее сушат над безводным сульфатом магния. Растворитель далее удаляют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле [элюент; н-гексан:этилацетат = 1:1] с получением 0,14 г белого твердого вещества, (6-{3-[4-(3-{[5-(амино{[(2,2,2-трифторацетил)окси]имино}метил)-2-пиридинил]окси}пропил)-1-пиперазинил]пропокси}-3-пиридинил){[(2,2, 2-трифторацетил)окси]имино}метиламина.
ИК (KBr) см-1: 1610.
Пример 71

0,13 г (6-{3-[4-(3-{[5-(амино{[(2,2,2-трифторацетил)окси]имино}метил)-2-пиридинил]окси}пропил)-1-пиперазинил]пропокси}-3-пиридинил){[(2,2, 2-трифторацетил)окси]имино}метиламина растворяют в 5,0 мл метанола, 2,0 мл этилацетата и 0,12 мл трифторуксусной кислоты. К раствору добавляют 26 мг 5% палладий-углерода и смесь перемешивают в атмосфере водорода при комнатной температуре и атмосферном давлении в течение 7,5 часов. К реакционному раствору добавляют 50 мл метанола с последующим фильтрованием и фильтрат далее концентрируют при пониженном давлении. К полученному остатку добавляют 5 мл метанольного раствора хлорида водорода с концентрацией 2 моль/л и смесь концентрируют при пониженном давлении. Далее к ней добавляют 5 мл этанола и растворитель удаляют при пониженном давлении. К полученному остатку добавляют этанол и смесь отфильтровывают с получением 0,12 г белого твердого вещества, гидрохлорида 6-(3-{4-[3-({5-[амино(имино}метил]-2-пиридинил}окси}пропил]-1-пиперазинил}пропокси)-3-пиридинкарбоксимидамида.
1H-ЯМР (d6-ДМСО) δ: 2,20-2,30 (4H, м), 3, 20-3,60 (8H, м), 3,70-3,91 (4H, шир.), 4,45 (4H, т, J = 6,0 Гц), 7,06 (2H, д, J = 8,8 Гц), 8,19 (2H, дд, J = 2,6, 8,8 Гц), 8,73 (2H, д, J = 2,6 Гц), 9,22 (4H, с), 9,50 (4H, с), 11,80-12,60 (2H, шир.).
Пример 72
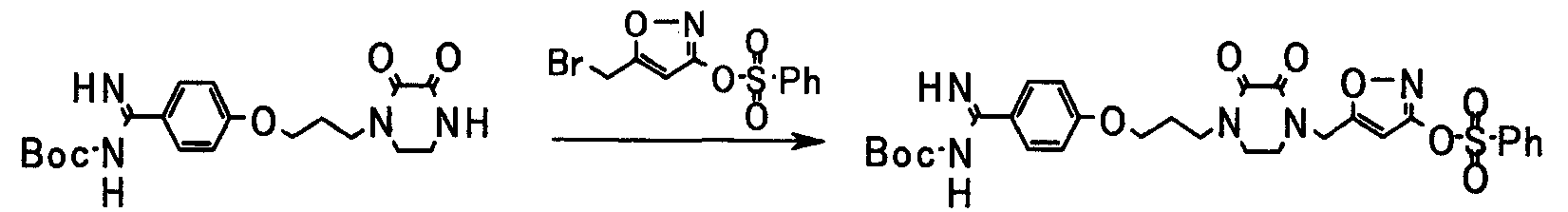
Следующее соединение получают тем же образом, что и в примере 11.
5-{[4-(3-{4-[[(трет-бутоксикарбонил)амино](имино)метил]фенокси}пропил)-2,3-диоксо-1-пиперазинил]метил}-3-изоксазолилбензолсульфонат.
1H-ЯМР (CDCl3) δ: 1,57 (11H, с), 2,10-2,20 (2H, м), 3,50-3,70 (6H, м), 4,07 (2H, т, J= 5,7 Гц), 4,69 (2H, с), 6,30 (1H, с), 6,88 (2H, д, J = 8,8 Гц), 7,50-7,70 (2H, м), 7,70-7, 80 (1H, м), 7,83 (2H, д, J = 8,8 Гц), 7,90-8,00 (2H, м).
Пример 73

Следующее соединение получают тем же образом, что и в примере 24.
Гидрохлорид 4-[3-({2-[(6-(4-[амино(имино}метил]фенокси}гексил)амино]этил}амино)пропокси]бензамидина.
1H-ЯМР (d6-ДМСО) δ: 1,35-1,50 (4H, м), 1,64-1,80 (4H, м), 2,10-2,30 (2H, м), 2,87-2,90 (2H, м), 3,07-3,20 (2H, м), 3,27-3,50 (4H, м), 4,10 (2H, т, J = 5,6 Гц), 4,20-4,30 (2H, м), 7,13-7,21 (4H, м), 7,83-7,93 (4H, м), 9,00-9,20 (4H, м), 9,20-9,40 (4H, м), 9,50-10,00 (4H, м).
Пример 74

Следующее соединение получают тем же образом, что и в примере 24.
Гидрохлорид 3-[3-({2-[(3-{4-[амино(имино)метил]фенокси}пропил)амино]этил}амино)пропокси]бензамидина.
1H-ЯМР (d6-ДМСО) δ: 2,10-2,30 (4H, м), 3,10-3,20 (4H, м), 3,30-3, 50 (4H, м), 4,20-4,30 (4H, м), 7,18 (2H, д, J = 8,2 Гц), 7,32 (1H, д, J = 7,6 Гц), 7,45 (1H, д, J = 7,6 Гц), 7,49 (1H, с), 7,54 (1H, т, J = 7,6 Гц), 7,89 (2H, д, J = 8,2 Гц), 9,12 (2H, с), 9,32 (4H, с), 9,50 (2H, с), 9,60-10,20 (4H, м).
Пример 75

Следующее соединение получают тем же образом, что и в примере 24.
Гидрохлорид 4-{[3-({2-[(3-{4-[амино(имино)метил]анилино}пропил)амино]этил}амино)пропил]амино}бензамидина.
1H-ЯМР (d6-ДМСО) δ: 1,90-2,00 (4H, м), 3,00-3,10 (4H, м), 3,27 (4H, т, J = 6,8 Гц), 3,34 (4H, шир.с), 3,50-3,90 (2H, шир.), 6,72 (4H, д, J = 8,9 Гц), 6,80-7,20 (2H, шир.), 7,69 (4H, д, J = 8,9 Гц), 8,62 (4H, с), 8,89 (4H, с), 9,75 (4H, шир.с).
Пример 76

Следующее соединение получают тем же образом, что и в примере 24.
Гидрохлорид 4-[3-({2-[(3-{4-[амино(имино)метил]фенокси}-2-гидроксипропил)амино]этил}амино)-2-гидроксипропокси]бензамидина.
1H-ЯМР (d6-ДМСО + D2O) δ: 3,00-3, 20 (2H, м), 3,20-3,40 (2H, м), 3,40-3,50 (4H, м), 4,00-4,20 (4H, м), 4,20-4,40 (2H, м), 7,10-7,30 (4H, м), 7,80-8,00 (4H, м).
Пример 77

Следующее соединение получают тем же образом, что и в примерах 18 и 24.
Гидрохлорид 4-{[3-({2-[(3-{4-[амино(имино)метил]фенокси}пропил)амино]этил}амино)пропил]амино}бензамидина.
1H-ЯМР (d6-ДМСО + D2O) δ: 1,90-2,00 (2H, м), 2, 10-2,30 (2H, м), 3,00-3,20 (4H, м), 3,24-3,30 (2H, м), 3,36 (4H, с), 4,25 (2H, т, J = 6,0 Гц), 6,73 (2H, д, J = 8,4 Гц), 7,18 (2H, д, J = 8,8 Гц), 7,71 (2H, д, J = 8,4 Гц), 7,89 (2H, д, J = 8,8 Гц).
Пример 78
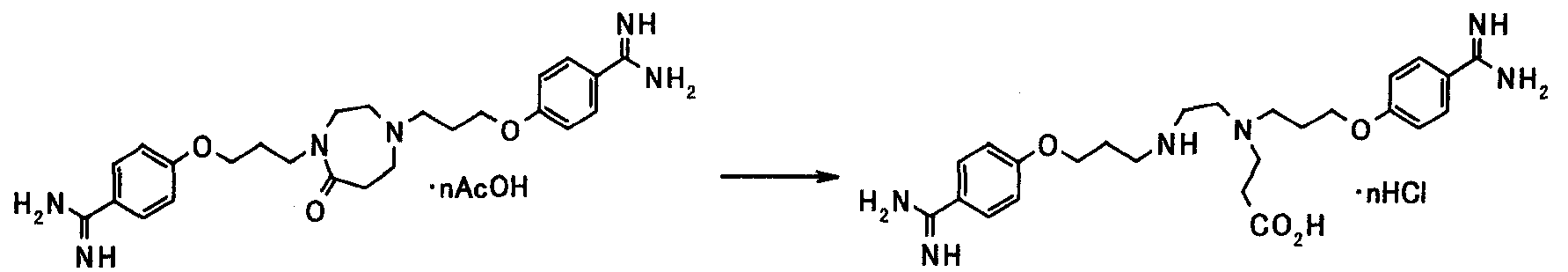
Следующее соединение получают тем же образом, что и в примере 24.
Гидрохлорид N-(3-{4-[амино(имино)метил]фенокси}пропил]-N-{2-[(3-{4-[амино(имино)метил]фенокси}пропил]амино]этил}-β-аланина.
1H-ЯМР (D2O) δ: 2,30-2,47 (4H, м), 3,04-3,12 (2H, м), 3,43-3,52 (2H, м), 3,59-3,87 (8H, м), 4,25-4,35 (4H, м), 7,15-7,23 (4H, м), 7,74-7,81 (4H, м).
Пример 79

Следующее соединение получают тем же образом, что и в примере 24.
Гидрохлорид 6-{(3-{4-[амино(имино)метил]фенокси}пропил]-[1-(3-{4-[амино(имино)метил]фенокси}пропил)-4-пиперидинил]амино}гексановой кислоты.
1H-ЯМР (d6 -ДМСО) δ: 1,20-1,40 (2H, м), 1,45-1,70 (2H, м), 1,70-1,90 (2H, м), 2,10-2,40 (10H, м), 3,00-3,80 (13H, м), 4,10-4,30 (4H, м), 7,10-7,30 (4H, м), 7,85 (4H, д, J = 8,8 Гц), 8,89 (4H, с), 9,21 (4H, с).
Пример 80

0,54 г этил-1, 4-бис[3-(4-цианофенокси)пропил]-2-пиперазинкарбоксилата суспендируют в 11,3 мл этанола. При охлаждении льдом суспензию барботируют газообразным хлоридом водорода. Суспензия реагирует при комнатной температуре в течение 13,5 часов и далее растворитель удаляют при пониженном давлении. Полученный остаток растворяют в 11,3 мл этанола и к раствору добавляют 0,78 г ацетата аммония с последующим нагревом при кипячении с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры нерастворимые продукты удаляют фильтрацией и фильтрат далее концентрируют при пониженном давлении. Полученный остаток растворяют в 22,6 мл хлористоводородной кислоты с концентрацией 2 моль/л с последующим нагревом при кипячении с обратным холодильником в течение 4 часов. Далее к данному раствору добавляют 11,3 мл хлористоводородной кислоты с концентрацией 6 моль/л с последующим нагревом при кипячении с обратным холодильником в течение 2 часов. Далее реакционную смесь охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле [YMC-GEL, ODS-AM 120-S50, элюент; вода] с получением 0,29 г белого твердого вещества гидрохлорида 1,4-бис-(3-{4-[амино(имино)метил]фенокси}пропил)-2-пиперазинкарбоновой кислоты.
1H-ЯМР (D2O) δ: 2,19-2,30 (4H, м), 3, 10-3,30 (6H, м), 3,37-3,50 (2H, м), 3,50-3,85 (3H, м), 4,26 (4H, т, J = 5,6 Гц), 7,15-7,18 (4H, м), 7,76-7,80 (4H, м).
Пример 81

0,59 г N-{6-[4-3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперазинил]гексил}ацетамида растворяют в 20 мл хлористоводородной кислоты с концентрацией 6 моль/л с последующим нагревом при кипячении с обратным холодильником в течение 5 часов. После охлаждения до комнатной температуры растворитель удаляют при пониженном давлении. Полученное твердое вещество очищают колоночной хроматографией на силикагеле [YMC-GEL, ODS-AM 120-S50, элюент; вода] с получением 0,33 г белого твердого вещества гидрохлорида 4-{3-[4-(6-аминогексил)-1-пиперазинил]пропокси}бензамидина.
1H-ЯМР (d6-ДМСО + D2O) δ: 1,20-1,40 (4H, м), 1,50-1,80 (4H, м), 2,10-2,30 (2H, м), 2,70-2,90 (2H, м), 3,00-3,90 (12H, м), 4,20 (2H, т, J = 5,9 Гц), 7,17 (2H, д, J = 8,3 Гц), 7,84 (2H, д, J = 8,3 Гц).
Пример 82
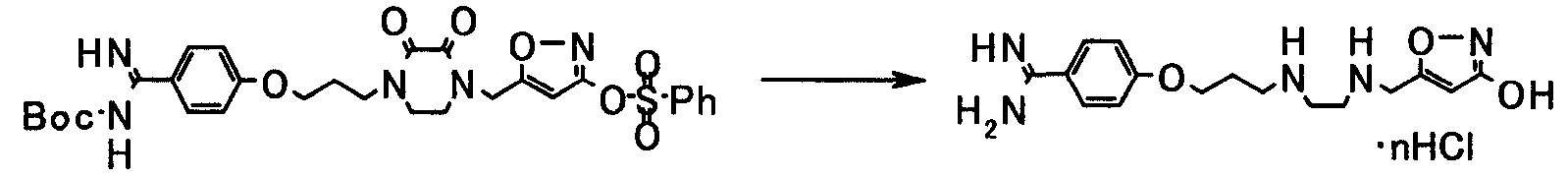
5,6 мл хлористоводородной кислоты с концентрацией 6 моль/л добавляют к 0,14 г 5-{[4-(3-{4-[[(трет-бутоксикарбонил)амино](имино)метил]фенокси}пропил)-2,3-диоксо-1-пиперазинил]метил}-3-изоксазолилбензолсульфоната и смесь подвергают нагреву при кипячении с обратным холодильником в течение 50 минут. После охлаждения до комнатной температуры растворитель удаляют при пониженном давлении. К полученному остатку добавляют этанол и осадок отфильтровывают с получением 0,06 г белого твердого вещества, гидрохлорида 4-{3-[(2-{[3-гидрокси-5-изоксазолил)метил]амино}этил)амино]пропокси}бензамидина.
1H-ЯМР (d6-ДМСО + CF3CO2D) δ: 2,05-2,20 (2H, м), 3,15 (2H, т, J = 7,2 Гц), 3,36 (4H, с), 4,22 (2H, т, J = 6,0 Гц), 4,38 (2H, с), 6,34 (1H, с), 7,17 (2H, д, J = 9,0 Гц), 7,84 (2H, д, J = 9,0 Гц).
Пример 83
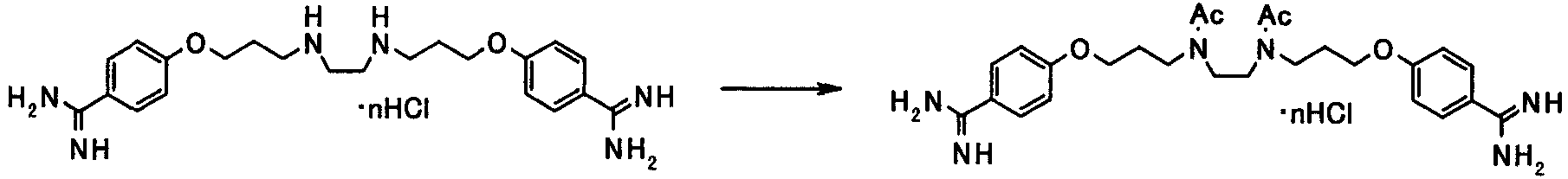
0,55 г гидрохлорида 4-[3-({2-[(3-{4-[амино(имино)метил]фенокси}пропил)амино]этил}амино)пропокси]бензамидина суспендируют в 10 мл диметилсульфоксида и далее к данной суспензии при комнатной температуре добавляют 0,66 г триэтиламина и 0,22 г уксусного ангидрида. Смесь перемешивают при той же вышеуказанной температуре в течение 5,5 часов. К реакционному раствору добавляют воду и хлороформ и далее к нему добавляют водный раствор гидроксида натрия, так чтобы смесь стала щелочной. Водный слой далее отделяют. Водный слой переводят в кислотный добавлением этанольного раствора хлорида водорода и далее его концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле [YMC-GEL, ODS-AM 120-S50, элюент; 5% водный раствор ацетонитрила] с получением 0,30 г бесцветного аморфного твердого вещества гидрохлорида N-{2-[ацетил(3-{4-[амино(имино)метил]фенокси}пропил)амино]этил}-N-(3-{4-[амино(имино)метил]фенокси}пропил)ацетамида.
1 H-ЯМР (d6-ДМСО) δ: 1,90-2,10 (10H, м), 3,30-3,50 (8H, м), 4,00-4,20 (4H, м), 7,12-7,18 (4H, м), 7,84-7,87 (4H, м), 9,02 (4H, с), 9,25 (4H, с).
Пример 84

0,31 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперазинил]пропокси}бензамидина суспендируют в 2,0 мл диметилсульфоксида и далее к данной суспензии при комнатной температуре добавляют 0,26 мл уксусного ангидрида с последующим перемешиванием в течение 4 часов. Осадок отфильтровывают и его далее промывают диметилсульфоксидом и этанолом с получением 0,21 г белого твердого вещества, ацетата N-[(4-{3-[4-(3-{4-[(ацетиламино)(имино)метил]фенокси}пропил)-1-пиперазинил]пропокси}фенил)(имино)метил]ацетамида.
1H-ЯМР (d6-ДМСО + D2O) δ: 1, 80-2,00 (4H, м), 2,07 (12H, с), 2,30-2,50 (12H, м), 4,07 (4H, т, J = 6,3 Гц), 7,02 (4H, д, J = 8,8 Гц), 7,71 (4H, д, J = 8,8 Гц).
Пример 85
Пример 85-1

5,99 г N-бензилоксикарбонил-(S)-фенилаланина и 3,34 г 4-нитрофенола растворяют в 50 мл хлороформа. 10 мл раствора в хлороформе, содержащего 4,54 г N,N'-дициклогексилкарбодиимида, добавляют по каплям к раствору при температуре 25оС или ниже и смесь перемешивают при комнатной температуре в течение 4 часов. Осадок удаляют фильтрацией и фильтрат концентрируют при пониженном давлении. К полученному остатку добавляют 50 мл этилацетата и нерастворимые продукты удаляют фильтрацией. Далее фильтрат промывают водным раствором гидроксида натрия с концентрацией 1 моль/л 3 раза и далее насыщенным водным раствором хлорида натрия однократно. Органический слой сушат над безводным сульфатом магния и далее концентрируют при пониженном давлении. К полученному остатку добавляют изопропанол и осадок отфильтровывают с получением 3,69 г бледно-желтого твердого вещества, 4-нитрофенилового эфира N-бензилоксикарбонил-(S)-фенилаланина.
1H-ЯМР (CDCl3) δ: 3,20-3,30 (2H, м), 4,86-4,91 (1H, м), 5,13 (2H, с), 5,27 (1H, д, J = 7,6 Гц), 7,10-7,38 (12H, м), 8,24 (2H, д, J = 8,8 Гц).
Пример 85-2

16,0 мл 30% раствора бромид водорода-уксусная кислота добавляют к 3,36 г 4-нитрофенилового эфира N-бензилоксикарбонил-(S)-фенилаланина при комнатной температуре и смесь перемешивают в течение 4 часов. К реакционному раствору добавляют 40 мл диэтилового эфира и осадок отфильтровывают с получением 2,72 г белого твердого вещества, гидробромида 4-нитрофенилового эфира N-(S)-фенилаланина. 1,47 г гидробромида 4-нитрофенилового эфира N-(S)-фенилаланина растворяют в 5,0 мл N,N-диметилформамида. При охлаждении льдом к данному раствору по каплям последовательно добавляют 0,40 мл уксусного ангидрида и 0,62 мл триэтиламина и далее смесь перемешивают при комнатной температуре в течение 0,5 часа. К реакционному раствору добавляют 30 мл хлороформа и хлористоводородную кислоту с концентрацией 2 моль/л так, чтобы органический слой отделился. Отделенный органический слой промывают насыщенным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и далее сушат над безводным сульфатом магния. Полученный раствор концентрируют при пониженном давлении. Таким образом, получают 1,23 г белого твердого вещества 4-нитрофенилового эфира N-ацетил-(S)-фенилаланина.
1H-ЯМР (CDCl3) δ: 2,05 (3H, с), 3,23 (1H, дд, J = 6,6, 14,0 Гц), 3,29 (1H, дд, J = 6,6, 14,0 Гц), 5,07 (1H, дт, J = 7,3, 6,6 Гц), 5,95 (1H, д, J = 7,3 Гц), 7,13-7,23 (4H, м), 7,32-7,40 (3H, м), 8,23-8,27 (2H, м).
Пример 85-3

0,35 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперазинил]пропокси}бензамидина суспендируют в 4,0 мл N,N-диметилформамида и к данной суспензии при комнатной температуре добавляют 0,58 г 4-нитрофенилового эфира N-ацетил-(S)-фенилаланина с последующим перемешиванием в течение 12 часов. К реакционной смеси добавляют этилацетат и воду и полученную смесь далее приводят к рН 12 с помощью водного раствора гидроксида натрия с концентрацией 5 моль/л. Далее органический слой отделяют. Отделенный органический слой промывают водным раствором гидроксида натрия с концентрацией 5 моль/л и насыщенным солевым раствором и далее концентрируют при пониженном давлении. Полученный остаток растворяют в 10 мл изопропанола и раствор продувают газообразным диоксидом углерода. Осадок отфильтровывают с получением 0,30 г бледно-желтого твердого вещества. 0,25 г полученного твердого вещества растворяют в 5 мл этанола и 0,50 мл этанольного раствора хлорида водорода с концентрацией 2,5 моль/л добавляют к данному раствору при комнатной температуре. Далее смесь концентрируют при пониженном давлении с получением 0,27 г бледно-желтого твердого вещества, гидрохлорида (2S)-2-(ацетиламино)-N-[(4-{3-[4-(3-{4-[{[(2S)-2-(ацетиламино)-3-фенилпропаноил]амино}(имино)метил]фенокси}пропил)-1-пиперазинил]пропокси}фенил)(имино)метил]-3-фенилпропанамида.
1H-ЯМР (d6-ДМСО) δ: 1,85 (6H, с), 2,20-2,30 (4H, м), 2,95 (2H, дд, J = 9,6,13,7 Гц), 3,20 (2H, дд, J = 5,5, 13,7 Гц), 3,25-3,90 (12H, м), 4,20-4,30 (4H, м), 4,80-5,00 (2H, м), 7,18-7,40 (14H, м), 7,23 (4H, д, J = 8,5 Гц), 8,68 (2H, д, J = 5,4 Гц), 10,87 (2H, шир.с), 11,30-11,70 (2H, шир.), 12,00-12,80 (2H, шир.).
Пример 86

Следующее соединение получают тем же образом, что и в примерах 18 и 19.
Ацетат 4-(3-{2,3-диоксо-4-[4-(4-пиперидинил)бутил]-1-пиперазинил}пропокси)бензамидина.
1H-ЯМР (d6-ДМСО) δ: 1,05-1,13 (2H, м), 1,15-1,44 (5H, м), 1,35 (1H, шир.с), 1,44-1,51 (2H, м), 1,60-1,70 (2H, м), 1,79 (3H, с), 1,96-2,04 (2H, м), 2,50-2,60 (2H, м), 2,95-3,70 (15H, м), 4,10 (2H, т, J = 6,0 Гц), 7,12 (2H, д, J = 8,8 Гц), 7,80 (2H, д, J = 8,8 Гц).
Пример 87
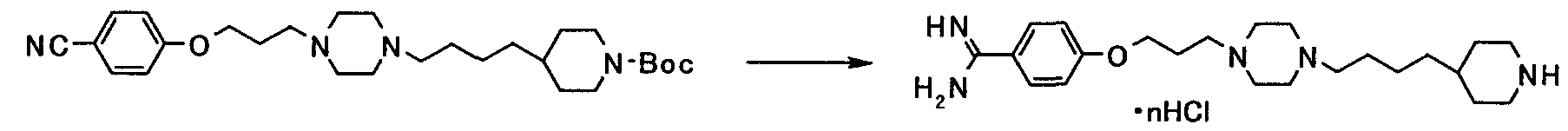
Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-(3-{4-[4-(4-пиперидинил)бутил]-1-пиперазинил}пропокси)бензамидина.
1H-ЯМР (d6-ДМСО) δ: 1,20-1,40 (6H, м), 1,51 (1H, шир.с), 1,64-1,84 (4H, м), 2,20-2,30 (2H, м), 2,72-2,88 (2H, м), 3,00-3,90 (16H, м), 4,18-4,23 (2H, м), 7,17 (2H, д, J = 8,7 Гц), 7,88 (2H, д, J = 8,7 Гц), 8,81 (1H, с), 8,96-9,14 (3H, м), 9,29 (2H, с).
Пример 88

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-(3-{4-[4-(1-метил-4-пиперидинил)бутил]-1-пиперазинил}пропокси)бензамидина.
1H-ЯМР (d6-ДМСО) δ: 1,21-1,45 (7H, м), 1,66-1,84 (4H, м), 2,20-2,29 (2H, м), 2,67 (3H, д, J = 4,8 Гц), 2,80-2,92 (2H, м), 3,00-3,20 (2H, м), 3,20-3,90 (15H, м), 4,22 (2H, т, J = 6,4 Гц), 7,17 (2H, д, J = 8,8 Гц), 7,89 (2H, д, J = 8,8 Гц), 9,12 (2H, с), 9,32 (2H, с).
Пример 89

Следующее соединение получают тем же образом, что и в примере 40.
Гидрохлорид 4-(3-{4-[6-(1-пиперазинил)гексил]-1-пиперазинил}пропокси)бензамидина
1H-ЯМР (d6-ДМСО) δ: 1,26-1,42 (4H, м), 1,62-1,82 (4H, м), 2,14-2,30 (2H, м), 2,80-4,10 (25H, м), 4,14-4,26 (2H, м), 7,17 (2H, д, J = 9,0 Гц), 7,86 (2H, д, J = 9,0 Гц), 8,95 (2H, с), 9,23 (2H, с), 9,50-9,90 (2H, м).
Пример 90

Следующее соединение получают тем же образом, что и в примере 11.
Гидрохлорид 4-{3-[(2-{[4-(4-пиперидинил)бутил]амино}этил)амино]пропокси}бензамидина
1H-ЯМР (d6 -ДМСО) δ: 1,24-1,35 (6H, м), 1,50-1,80 (5H, м), 2,12-2,23 (2H, м), 2,70-3,00 (4H, м), 3,00-3,80 (8H, м), 4,10-4,30 (2H, шир.), 7,18 (2Н, д, J = 7,4 Гц), 7,88 (2H, д, J = 7,4 Гц), 8,70-8,90 (1H, м), 8,90-9,20 (3Н, м), 9,30 (2H, с), 9,40-10,20 (4H, м).
Пример 91
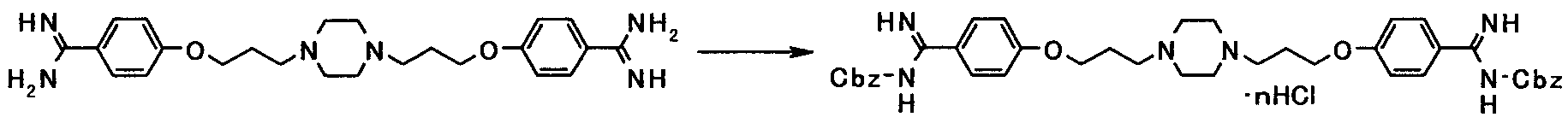
0,44 г 4-{3-[4-(3-{4-[амино(имино)метил]фенокси}пропил)-1-пиперазинил]пропокси}бензамидина суспендируют в 5,0 мл диметилсульфоксида и 0,66 г бензил-4-нитрофенилкарбоната добавляют к данной суспензии при комнатной температуре с последующим перемешиванием в течение 27 часов. К реакционному раствору добавляют 20 мл хлороформа, 50 мл воды и 4 мл водного раствора гидроксида натрия с концентрацией 1 моль/л так, чтобы органический слой отделился. Водный слой экстрагируют дважды 20 мл хлороформа. Полученный органический слой объединяют. Полученный таким образом слой сушат безводным сульфатом натрия и далее концентрируют при пониженном давлении. Полученное твердое вещество отфильтровывают, промывая этилацетатом, и продукт далее очищают колоночной хроматографией на силикагеле [элюент; хлороформ:метанол = 20:1] с получением 0,43 г твердого вещества. Хлороформ и этанол добавляют при комнатной температуре к 0,24 г полученного твердого вещества для его растворения и далее к данному раствору добавляют 1 мл этанольного раствора хлорида водорода с концентрацией 2,2 моль/л, с последующим концентрированием при пониженном давлении. Полученное твердое вещество отфильтровывают, промывая диэтиловым эфиром, и твердое вещество растворяют в метаноле. К раствору добавляют изопропанол и осадок отфильтровывают с получением 0,25 г белого твердого вещества, бензил-(4-{3-[4-(3-{4-[{[(бензилокси)карбонил}амино}(имино)метил]фенокси}пропил)-1-пиперазинил]пропокси}фенил)(имино)метилкарбамата.
1H-ЯМР (d6-ДМСО) δ: 2, 22-2,32 (4H, м), 3,20-3,90 (12H, м), 4,23 (4Н, т, J = 6,0 Гц), 5,36 (4H, с), 7,16 (4Н, д, J = 8,8 Гц), 7,36-7,54 (10H, м), 7,86 (4Н, д, J = 8,8 Гц), 10,4 (2H, с), 11,20-11,60 (2H, шир.), 12,20-12,80 (2H, шир.).
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Новое производное ариламидина, представленное общей формулой [1], или его соль имеет высокую противогрибковую активность, и оно является применимым для профилактики или лечения грибковых заболеваний людей и животных.
Реферат
Настоящее изобретение относится к производным ариламидина или его солям общей формулы I
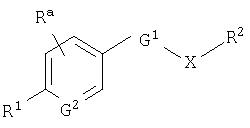
где Х представляет собой незамещенную или замещенную гидрокси, алкилом или алкокси низшую алкиленовую или алкениленовую группу; G1представляет собой атом кислорода, атом серы или иминогруппу; G2представляет собой атом углерода или атом азота; Ra представляет собой атом водорода, атом галогена и алкильную или алкоксигруппу; R1 представляет собой незащищенную или защищенную или незамещенную или замещенную гидрокси или алкилом амидиногруппу; и R2 представляет собой замещенную амино- или замещенную циклическую аминогруппу. Соединения обладают противогрибковым действием и высокой безопасностью. 9 з.п. ф-лы, 14 табл.
Формула


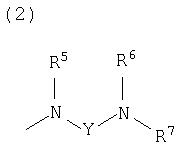






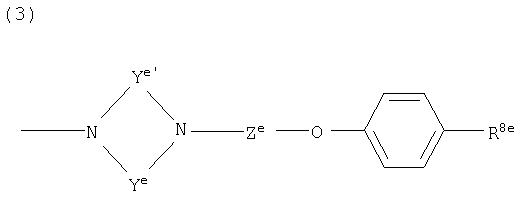






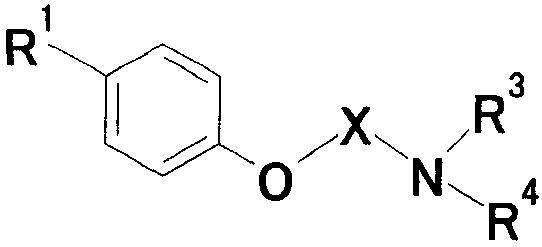

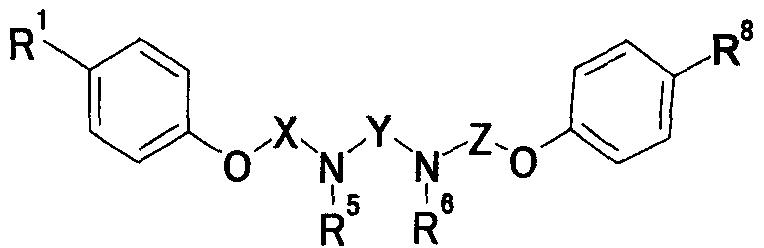
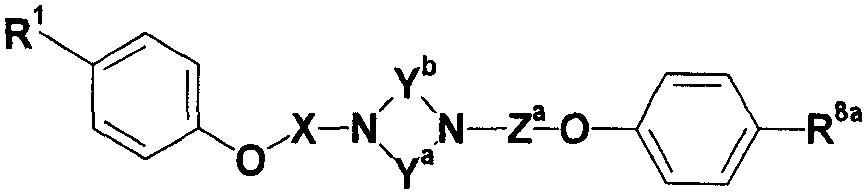


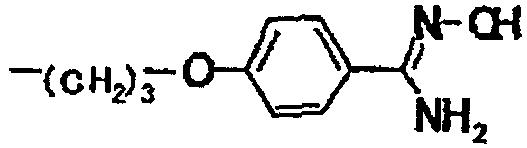

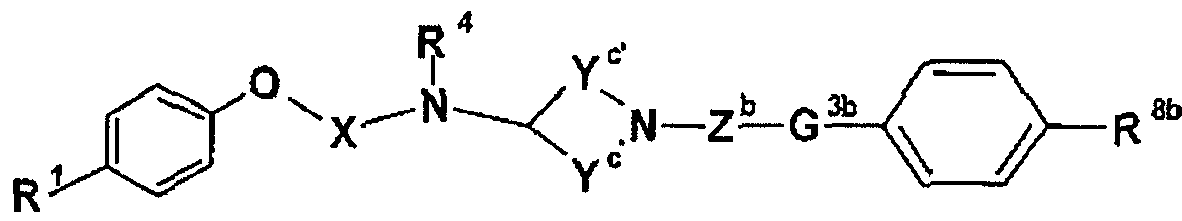

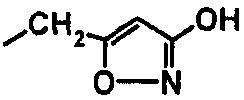
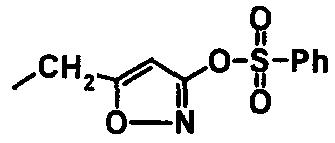

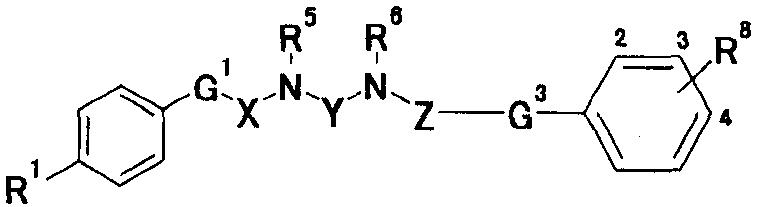
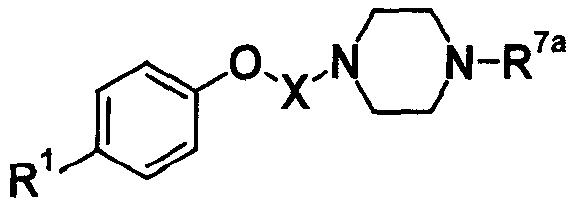



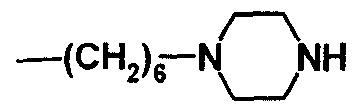

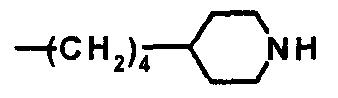





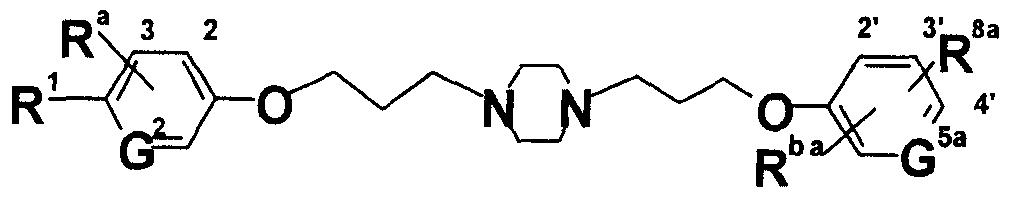
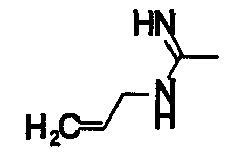




Комментарии