Применение амидов изоказол-4-карбоновой кислоты и амидов гидроксиалкилиденциануксусной кислоты - RU2084223C1
Код документа: RU2084223C1
Чертежи





Описание
В литературе описан ряд способов получения амидов из оксазол-4-карбоновой кислоты (патенты Германии N 2524959, 2655009, 3405727).
Из европейского патента N 13376 известно, что 4-трифторметиланилид 5-метилизоксазол-4-карбоновой кислоты благодаря своим фармакологическим свойствам может использоваться как противоревматическое, противовоспалительное, жаропонижающее и обезболивающее средство, а также может применяться для лечения рассеянного склероза. В этом патенте описан также способ получения этого соединения.
Ныне было обнаружено, что амиды изоксазол-4-карбоновой кислоты формулы I и амиды гидроксиалкилиден-цианоуксусной кислоты формулы Iа и их таутомерная форма Iб обладают противоопухолевой активностью. Многие из известных противоопухолевых средств во время терапии вызывают в качестве побочного действия тошноту, рвоту или понос, а также делают необходимым лечение в больнице. Эти лекарства изменяют также скорость обмена других аутогенных клеток, что приводит к таким симптомам, как, например, выпадение волос или малокровие (анемия). Эти симптомы не наблюдаются при лечении людей и животных соединениями формулы I. Эти активные вещества, в противоположность известным до сих пор цитотоксическим противораковым средствам, не наносят вреда иммунной системе (Bartlett. Inf. J. Immunopharmac. 1986, v. 8, p. 199-204). Тем самым открываются новые пути опухолевой терапии, так как аутогенной защитной системе вреда не наносится, в то время как рост опухолевых клеток затрудняется. Неожиданно большое число опухолевых клеток подавляется этими веществами, в то время как клетки иммунной системы, например Т-лимфоциты, подавляются только при 50-кратной концентрации веществ.
Итак, изобретение касается
применения
для приготовления лекарства для лечения раковых заболеваний, соединений формулы I, в случае необходимости - стереоизомерных форм и/или по крайней мере одной из его физиологически
переносимых солей,
причем
R1 означает
а) водород;
б) алкил с 1-6 C-атомами;
с) алкил с 1-4 C-атомами, однократно- или многократно замещенный с
заместителями из ряда
1) галоген, как фтор, хлор, бром или йод;
д) фенил;
R2 означает
а) водород;
б) алкил с 1-4 C-атомами;
с)
фенил-(C1-C2
)-алкил, в частности бензил;
д) алкенил с 2-3 C-атомами;
R3 означает
а) одно-, двух или трехядерную ненасыщенную
гетероциклическую группу с 3-13 C-атомами и 1-4
гетероатомами из группы: кислород, сера и азот, из которых максимум один атом отличается от азота;
б) незамещенную или одно- или многократно
замещенную с заместителями:
1) галоген,
как фтор, хлор, бром или йод;
2) алкил с 1-3 C-атомами;
3) алкил с 1-3 C-атомами, одно- или многократно замещенный, содержащий в
качестве заместителей;
3.1.) галоген, как
фтор, хлор, бром или йод;
4) алкокси с 1-3 C-атомами;
5) алкокси с 1-3 C-атомами, одно- или многократно замещенный, содержащий в
качестве заместителей
5.1.) галоген, как
фтор, хлор, бром или йод;
6) нитро;
7) гидрокси;
8) карбокси;
9) карбамоил;
10) оксогруппу;
б)
группу формулы II
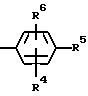
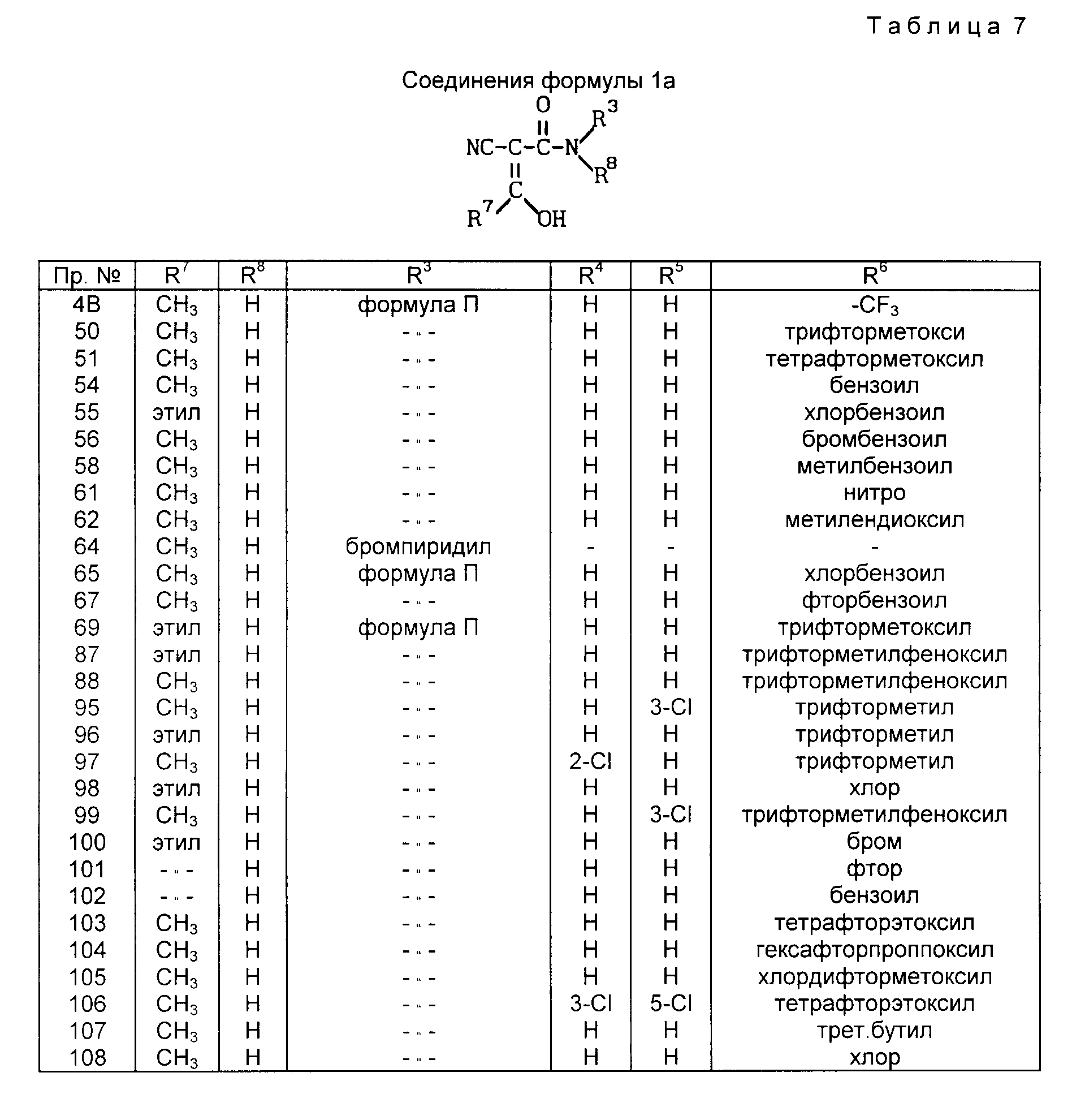
в которой R4, R5 и R6 могут быть одинаковыми или различными и означают
1) водород;
2) алкил с 1-3 C-атомами;
3) алкил с 1-3 C-атомами, одно- или многократно замещенный, содержащий в качестве заместителей
3.1) галоген, как фтор, хлор, бром или йод;
4) R4 означает водород и R5 и R6 совместно с фенильным кольцом формулы II образуют нафталиновое кольцо.
5) R4 означает водород, и R5 и R6 образуют метилендиоксигруппу;
6) алкокси с 1-3 C-атомами;
7) алкокси с 1-3
C-атомами, одно- или многократно замещенный, содержащий в качестве заместителей
7.1) галоген, как фтор, хлор, бром или йод;
8) (C1-C3)-алкилмеркапто;
9) (C1-C3)-алкилмеркапто, одно- или многократно замещенная,
содержащая в качестве заместителей
9.1) галоген, как фтор, хлор, бром или йод;
10) галоген, как
фтор, хлор, бром или йод;
11) нитро;
12) циано;
13)
гидрокси;
14) карбокси;
15) (C1-C3)-алкилсульфонил;
16) карбалкокси с
1-3 C-атомами в алкильной цепи;
17) бензоил;
18) бензоил, одно
или многократно замещенный, содержащий в качестве заместителей
18.1) галоген, как фтор, хлор, бром или йод;
18.2) (C1-C3)-алкил;
18.3) (C1
-C3)-алкокси;
19) фенил;
20) фенил, одно- или многократно замещенный, содержащий в
качестве заместителей
20.1) (C1-C3)-алкокси;
20.2) галоген, как фтор, хлор, бром или йод;
20.3) (C1-C3)-алкил;
21)
фенокси;
22) фенокси, однократно или многократно замещенный, содержащий в
качестве заместителей
22.1) (C1-C3)-алкокси, одно- или многократно замещенный,
содержащий в качестве заместителей
22.1.1) галоген, как фтор, хлор, бром или йод;
22.2) галоген, как фтор, хлор, бром или йод;
22.3) (C1-C3)-алкил,
одно- или многократно замещенный, содержащий в качестве заместителей
22.3.1) галоген,
как фтор, хлор, бром или йод;
с) группу формулы III
-(CH2)n
-COOR10,
в которой R10 означает
1) водород;
2)
алкил с 1-4 C-атомами;
n означает целое число от 1 до 12;
д) R2 и R3 вместе с азотом, с которым они связаны, образуют 4-9-звенное кольцо, замещенное, содержащее
в качестве заместителя
1) карбонил у C-атома, соседнего с N-атомом;
а) R2 и R3 вместе с азотом, с которым они связаны, образуют 5-6-звенное кольцо формулы IV

в которой W означает
1) -CH2-,
2) -CH2-CH2 -,
3)

6) -CH2-O или
7) -CH2-S-;
R7 означает
в) водород;
б) алкил с 1-17 C-атомами;
с) алкил с 1-3 C-атомами, одно- или многократно замещенный, содержащий в качестве заместителей галоген, как фтор, хлор, бром или йод;
д) фенил-(C1-C2)-алкил, в частности бензил;
R8 означает
а) водород;
б) метил;
с) алкенил с 2-3 C-атомами.
Под такими лекарствами понимают, предпочтительно, соединение (4-трифторметил)анилид 5-метилизоксазол-4-карбоновой кислоты (соединение 1) и N-(4-трифторметил)амид 2-циан-3-гидроксикротоновой кислоты (соединение 2).
Пригодными физиологически переносимыми солями соединения формулы I являются, к примеру, соли щелочных, щелочно-земельных металлов и соли аммония, включая соли органических аммониевых оснований.
К одно-, двух- или трехъядерным, ненасыщенным гетероциклическим группам с 3-13 C-атомами относятся, например, тиенил, пиридил, пиримидинил, пиразинил, пиридазинил, имидазолил, тиазолил, тиазолинил, оксазолил, тиадиазолил, бензоксазолил, бензимидазолил, хинолил, пиразолил, акридинил, индолил, тетразолил или индазолил.
Соединение формулы I и его физиологически переносимые соли пригодны, в частности, для лечения большого числа раковых заболеваний. К видам рака, которые особенно хорошо подавляются этими соединениями, относятся, например, лейкемия, в частности хроническая лейкемия T- и B-типа клеток, рак лимфатических узлов, например лимфома Ходжина и находжикинская лимфома, карциномы, саркомы, и рак кожи. Активные вещества могут применяться либо самостоятельно, например в форме микрокапсул, в смесях друг с другом, либо в комбинации с пригодными вспомогательными веществами и/или веществами-носителями.
Приготовление соединений формулы I осуществляется известным образом (патенты Германии N 2524959, 2655009, 3405727, 2524929, 2555789, 255003, 3405727; Канады N 1102341; США N 4087535).
Соединения формулы I получаются благодаря тому,
что:
а) соединение формулы V

в которой X означает атом галогена, предпочтительно хлор или бром, и R1 имеет значение, указанное в формуле I, подвергают реакции с амином формулы VI
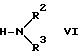
в которой R2 и R3 имеют значение, указанное в формуле I, или
б) соединение формулы VI
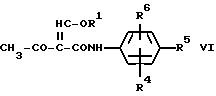
в которой R1 означает (C1-C4)-алкил и R4, R5 и R5 имеют значения, указанные в формуле I, обрабатывают по меньшей мере эквимолярным количеством гидроксиламина в органическом растворителе; или
с) соединение формулы V, в которой X и R1 имеют названные выше значения, подвергают реакции с первичным алифатическим амином формулы VII
H2N-(CH2)n-COOR10 VII,
в которой n и R10 имеют значения, указанные в формуле I; или
д) соединение формулы V, в которой X и R1 имеют названные выше значения, подвергают реакции с лактамом формулы VIII
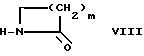
в которой m означает целое число от 1 до 6; или
е) соединение формулы V, в которой X и R1 имеют названные выше значения, подвергают реакции с амином формулы IX
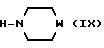
в которой W имеет значение, указанное в формуле I; или
f) соединение формулы I в присутствии основания превращают в соответствующее соединение формулы Iа или Iб.
Еще
одним предметом изобретения являются
новые соединения формулы I

их, при необходимости, стереоизомерные формы и/или, при известных условиях, их физиологически переносимые соли, причем
R1 означает
а) водород;
б) алкил с 2-6 C-атомами;
с) алкил с 1-4 C-атомами, одно- или многократно замещенный, содержащий в качестве заместителей
1) галоген, как фтор, хлор, бром или йод;
д) фенил;
R2 означает
а) водород;
б) алкенил с 2-3 C-атомами;
с) бензил;
R3 означает
а) пиридил, одно- или многократно замещенный, содержащий в качестве заместителей
1) водород;
2) галоген, как фтор, хлор, бром или йод;
3) нитро;
4) алкил с 1-3 C-атомами;
5) алкокси с 1-3 C-атомами;
б) группу формулы II

в которой R4, R5, R6 могут быть одинаковыми или различными и имеют следующие значения:
1) галоген, как фтор, хлор, бром или йод;
2) нитро;
3) водород;
4) бензоил, одно- или многократно замещенный, содержащий в качестве заместителей
4.1) галоген, как фтор, хлор, бром или йод;
4.2) метил;
4.3) метокси;
5) (C1-C3)-алкокси, одно- или многократно замещенный, содержащий в качестве заместителей
5.1) галоген, как фтор, хлор, бром или йод;
6) (C1-C4)-алкил, одно- или многократно замещенный, содержащий в качестве заместителей
6.1) галоген, как фтор, хлор, бром или йод;
7) гидрокси,
8) алкилсульфонил с 1-3 C-атомами в алкильной цепи;
9) R4 означает водород, и R5 и R6 образуют совместно метилендиоксигруппу;
10) пиано;
11) (C1-C3)-алкилмеркапто;
12) бензоил;
13) (C1-C3)-алкил;
с) пиримидинил, одно- или многократно замещенный, содержащий в качестве заместителей
1) алкил с 1-3 C-атомами;
д) индолил;
е) индазолинил.
Другим предметом изобретения
являются новые соединения формулы Iа или формулы Iб

их, при необходимости, стереозомерные формы и/или, при необходимости, их физиологически переносимые соли, причем группы R3, R7 и R8 означают:
а) R7 означает
1) водород;
2) алкил с 2-4 C-атомами;
R8 означает
1) водород;
2) метил;
R3 означает
1) фенил;
2) фенил, одно- или многократно замещенный, содержащий в качестве заместителей
2.1) галоген;
2.2) алкил с 1-3 C-атомами, одно- или многократно замещенный, содержащий в качестве заместителей галоген, как фтор, хлор, бром или йод;
б) R7 означает
1) алкил с 1-4 C-атомами;
2) водород;
3) CF3;
R8 означает
1) водород;
2) метил,
3) алкенил с 2-3 C-атомами;
R3 означает
1) пиридил;
2) пиридил, одно- или многократно замещенный, содержащий в качестве заместителей
2.1) галоген, как фтор, хлор, бром или йод;
2.2) алкил с 1-3 C-атомами;
3) пиримидинил, замещенный, как в 2),
4) тиазолил, замещенный как в 2) и
4.1) алкоксикарбонил с 1-3 C-атомами в алкильной цепи;
5) бензотиазолил, замещенный, как в 2);
6) бензимидазолил, замещенный, как в 2);
7) индазолил, замещенный, как в 2);
8) фенил, одно- или многократно замещенный, содержащий в качестве заместителей
8.1) бензоил;
8.2) бензоил, одно- или многократно замещенный, содержащий в качестве заместителей
8.2.1) галоген, как фтор, хлор, бром или йод;
8.2.2) алкил с 1-3 C-атомами;
8.2.3) алкокси с 1-3 C-атомами;
8.2.4) алкокси с 1-3 C-атомами, одно- или многократно замещенный, содержащий в качестве заместителей галоген, как фтор, хлор, бром или йод;
8.3) карбокси;
8.4) гидрокси;
с) R7 означает
1) водород;
2) алкил с 1-4 C-атомами;
R8 означает
1) водород;
2) метил;
R3 означает
1) группу формулы III
-(CH2)4-COOR10,
в которой R10 означает
1.1) водород;
1.2) алкил с 1-4 C-атомами;
д) R7 означает
1) водород;
2) алкил с 1-4 C-атомами;
R8 и R3 вместе с азотом, с которым они связаны, образуют 4-9-звенное кольцо, замещенное, содержащее в качестве заместителя
2.1) карбонил у C-атома, соседнего с N-атомом, или
R8 и R3 вместе с азотом, с которым они связаны, образуют пиперидиновое кольцо, при необходимости замещенное, содержащее в качестве заместителя алкил с 1-3 C-атомами.
Для лечения больных лейкемией взрослых пациентов (70 кг) при оральном применении показаны в зависимости от эффективности воздействия соединений формулы I и/или их физиологически переносимых солей на человека дневные дозы от приблизительно 25 до 100 мг. Смотря по обстоятельствам могут, однако, применяться более высокие или более низкие дневные дозы. Прием дневной дозы может осуществляться как в виде единичного приема в форме отдельной дозировочной единицы или нескольких меньших дозированных единиц, так и в виде многократного приема разделенной дозы через определенные интервалы времени.
Cоединения формулы I и/или по меньшей мере одна из их физиологически переносимых солей при изготовлении названных выше лекарственных форм могут входить в рецептуру также и вместе с другими пригодными активными веществами, например другими противоопухолевыми средствами, иммуноглобулинами, моноклональными антителами, иммуностимулирующими агентами или антибиотиками. Эти соединения могут также применяться в дополнение к лучевой терапии.
Фармакологические
испытания и
результаты
В качестве эффективного теста хемотерапии применялся ин витро тест пролиферации культур клеток.
Пример 1
Испытание (тест) пролиферации
Chicls-IRPMI 1640 среда (50:50) с L-глутамином без NaHCO3 в порошкообразной форме для 10 л (Серомед/Seromed/, Биохром /Biochrom/, Берлин, ФРГ) растворяется в 9 л воды и стерильно
фильтруется в бутылки (флаконы) емкостью 900 мл.
Среда для промывания
900 мл основной среды смешиваются с 9,5 мл 7%-ного раствора гидрокарбоната натрия и 5 мл HEPES
(N-2-гидроксиэтилпиперазин-N-2-этанолсульфоновая кислота) (Гибко/Gibсo, Эггенштейн, ФРГ).
Рабочая среда (среда для употребления)
900 мл основной среды плюс 19 мл NaHCO3-раствора (7,5% 10 мл HEPES-раствора и 10 мл L-глутамин-раствора (200 мм)).
Среда для митогениндуцированной пролиферации лимфоцитов
Рабочая среда смешивается с 1%
термически активированной (30 мин, 56oC) эмбриональный телячьей сывороткой.
Среда опухолевых клеток
Для выдерживания опухолевых клеток и гибридомных клеток рабочая
среда смешивается с 5% эмбриональной телячьей сыворотки (FCS).
Культурная среда для клеточных линий
Для выдерживания клеточных линий 200 мл рабочей среды смешиваются с 10%
FCS
10 мл NEA (non-essential aminoacids заменимые аминокислоты)-раствора (Гибко), 10 мл раствора пирувата натрия (100 мМ, Гибко) и 5 мл 10-2M меркаптоэтанола.
Получение и
обработка клеток селезенки для митогениндуцированной пролиферации лимфоцитов
Мыши умерщвляются посредством цервикальной дислокации, и селезенки извлекаются в асептических условиях. На
стерильном сите с размером пор 80 меш селезенки размельчаются и с помощью пластикового шприца (10 мл) осторожно вносятся в чашку Петри с рабочей средой. Для удаления эритроцитов из суспензии клеток
селезенки смесь приблизительно в течение 1 мин инкубируются при комнатной температуре при периодическом встряхивании в гипотоническом 0,17 М растворе хлорида аммония. При этом эритроциты лизируются,
в
то время как на жизненность и реактивность лимфоцитов влияния не оказывается. После центрифугирования (7 мин/340 g) лизат отбрасывается, клетки дважды промываются водой и затем вносятся в
соответствующую тестовую (опытную) среду.
Митогениндуцированная пролиферация лимфоцитов
5 х 105 обработанных клеток селезенки из женских особей NM-RI-мышей вместе
с
различными митогенами и препаратом в 200 мл тестовой среды вносились пипеткой в лунки плейтов для титрования с плоским дном. Использовались следующие концентрации митогенов и препарата:
конканавалин A
(Серва/Serva/ 0,5-0,25 0,12 мкг/мл; липополисахарид (Кельбиохем/Calbiochem): 1,0-0,5 0,1 мкг/мл фитогемагглютинин (Гибко): 0,5-0,25% исходного раствора Pokeweed митоген (Гибко)
соединение 1 или 2: 50,
25, 10, 7,5, 5, 2,5, 1, 0,5, 0,1 мкмоль.
Как положительный контроль определялась группа с добавками митогена без препарата. В случае отрицательного контроля речь идет о клетках в культурной среде с препаратом без добавок митогена. Каждая концентрация митогена перепроверялась 4 раза со всеми концентрациями препарата. После 48 ч инкубирования при 37oC/5% CO2 к клеткам добавлялось 25 мкл/лунку тритий-тимидина (Эмершем/Amercham) с активностью 0,25 мкКи/лунку (9,25 х 103 Бк). После этого проводится дальнейшее инкубирование при тех же условиях в течение 16 ч. Затем клетки при помощи прибора для сбора клеток (Флоу Лабораторис/Flow Laboratories) собираются на фильтровальную бумагу, причем невключенный тимидин собирается в специальный флакон. Фильтровальная бумага высушивается, штампуется и вместе с 2 мл оцинтиллятора (Rotiszint 22, фирма Рот/Roth) помещается в колбу, которая затем еще 2 ч охлаждается при 4oC. Количество радиоактивности "исходящей" от клеток, измеряется в Бетасчетчике (фирма Пакард (Packard) Trocard 460 с).
Подготовка опухолевых клеток и
клеточных линий для опыта по пролиферации
Используемые в опыте опухолевые клетки или клеточные линии берутся в логарифмической фазе роста, дважды промываются средой для промывания и
суспендируются в соответствующую среду.
Проведение и анализ опыта по пролиферации
Опыт по пролиферации проводился в плейтах для титрования с круглым дном. Соединение 1 и
интерлейкины растворялись в 50 мкл соответствующей
среды/ каждую лунку, и число клеток (5 х 105) устанавливалось 100 мкл/лунку, так что конечный объем получался 200 мкл/лунку. Во всех
опытах значения определялись 4 раза. Клетки без
препарата и без фактора роста определялись как отрицательный контроль, и клетки без препарата с фактором роста давали значения для положительного
контроля. Значение отрицательного контроля вычиталось
из всех установленных значений, и разность положительный контроль минус отрицательный контроль устанавливалась за 100%
Плейты
инкубировались 72 часа при 37oC/5% CO2, и
скорость пролиферации определялась соответственно тому, как это осуществлялось при митогениндуцированной пролиферации лимфоцитов.
Клеточные линии извлекались из исходного (маточного) раствора АТСС, American Type Culture Collection.
Таблица 1 показывает концентрации, при которых происходит 50%-е подавление (торможение).
Пример 2
Острая
токсичность при оральном применении
Соединение 1 для определения острой токсичности применялось per os на мышах и крысах
LD50-значения определялись по Литчфилду и
Вилкоксону.
Вес NMRI мышей (NMRI: Nabal Medical Research Institute) составлял от 20 до 25 г и вес SD-крыс (SD: Spraque-Dawleg) составлял от 120 до 165 г. Перед экспериментом мыши выдерживались без пищи приблизительно 18 ч. Через 5 ч после приема испытываемого вещества мышей снова нормально кормили. Через 3 недели животные умерщвлялись хлороформом и вскрывались. На 1 дозировку использовались 6 животных. Результаты обобщены в таблице 2.
Пример 3
Острая токсичность после
внутрибрюшинного применения испытываемых веществ определялась на NMRI-мышах (вес
20-25 г) и на SD-крысах (вес 120-195 г). Испытываемое вещество суспендировалось с 1%-ным раствором
натрий-карбоксиметилцеллюлозы. Различные дозировки тестируемого вещества вводились мышам в количестве
10 мл/кг веса тела и крысам в количестве 5 мл/кг веса тела. На одну дозировку использовались 10
животных. Через 3 недели острая токсичность определялась по методу Литчфилда и Вилкоксона. Результаты
опытов обобщены в таблице 3.
Влияние соединения примера 4А на рост опухоли у
мышей с SCJD
Процедура эксперимента
A) Самок мышей с SCJD (тяжелым комбинированным
иммунодефицитом) приобретали у Bomholdgard (Дания). Животных использовали в экспериментах в
возрасте пяти недель; вес тела составлял 17-20 г. Животных содержали в стерильном боксе при прочих
стандартных условиях кормления и содержания.
B) A20-2J является линией из B-клеточной опухоли мышей BALB/c (H-2d), которую выращивали в среде CG без сыворотки в нашей лаборатории. Мышам подкожно инъецировали 17,5 х 106 опухолевых клеток в паховую область.
C) Мышей лечили соединением примера 4A (соединение 4A), которое давали перорально, 6 дней в неделю, используя 1%-ный раствор КМЦ (карбоксиметилцеллюлозы) в качестве носителя.
Животных разделили на две группы: превентивную группу (П), в которой лечение начинали одновременно с индукцией опухоли, и лечебную группу (Л), в которой лечение соединений 4A начинали с появлением твердых опухолей. Все мыши, у которых развивалась опухоль, содержались раздельно друг от друга.
Животных П-группы лечили 35 и 70 мг/кг соединения 4A соответственно, а животным Л-группы давали дозы 35, 70 и 100 мг/кг, соответственно.
D) Оценивали выживаемость, вес тела и размеры опухоли. Размеры опухоли определяли с помощью измерителя. Для каждой опухоли измерялись длина и ширина; произведение этих двух величин представляло собой индивидуальный индекс опухоли.
E) Эксперимент заканчивали, когда опухоли у животных контрольной группы становились больше 5 см3 (Закон Германии о защите животных).
Результаты
A) Выживаемость (рис. 1)
Первый график демонстрирует
выживаемость животных в экспериментальных группах. В нелеченном отрицательном контроле выживаемость
составляла 100% к моменту окончания эксперимента. Одна мышь из пяти позитивного контроля погибла во
время эксперимента. Была также одна потеря в группе 35 мг П. В П-группе 70 мг было две потери после
двух недель и еще одна к моменту окончания эксперимента. Это последнее животное с самого начала
имело дефицит веса тела. Несмотря на то, что в Л-группе 35 мг не наблюдалось ингибирование опухолевого
роста, все мыши выжили, в то время как в Л-группе 70 мг одна мышь погибла. В Л-группе 100 мг, в
которой наблюдался самый сильный эффект в отношении опухолевого роста, две из семи мышей погибли до
окончания эксперимента.
B) Вес тела
Рис. 2 показывает небольшое
возрастание веса в отрицательном контроле, в то время как в положительном контроле было самое значительное
возрастание веса, в основном, за счет роста опухоли. П-группа 35 мг показала значительное
увеличение среднего веса тела спустя 14 дней время, когда появившиеся опухоли постоянного росли. Вес животных
П-группы 70 мг оставался стабильным в течение всего эксперимента. Значительное увеличение
ко времени окончания произошло в результате гибели мыши, имевшей самый маленький вес (12 г по сравнению со
средним весом 16-17 г). Л-группы 35 и 70 мг прибавили в весе больше, чем отрицательный
контроль, но меньше, чем положительный контроль. Л-группа 100 мг показала значительную потерю веса тела.
C) Индекс опухоли
Индекс опухоли рассчитывали по длине и ширине
опухоли и использовали в качестве главного параметра эффективности лекарственного средства. Рис. 3 показывает данные
для Л-группы. Из этого рисунка ясно, что A20-2J является весьма быстрорастущей
опухолью, которая, будучи уже видимой твердой опухолью, не поддается терапии 35 мг/кг соединения 4A. Доза 70 кг/кг была
достаточной для замедления опухолевого роста, но только 100 мг/кг могли
остановить дальнейшую экспансию опухоли. Данные, представленные в этом протоколе, ясно показывают, что соединение 4A обладает
противораковым потенциалом.
Тест на пролиферацию
Следующие тесты на пролиферацию выполнялись, как описано выше. Таблица 4 показывает концентрации, при которых достигалось
50%-ное ингибирование.
Тест на пролиферацию
Следующие тесты на пролиферацию выполнялись, как описано выше. Таблица 5 показывает концентрации, при которых достигалось 50%-ное
ингибирование.
Реферат
Изобретение относится к медицине, в частности к онкологии. Предложены известные производные амидов изоксазол-4-карбоновых кислот и производные амидов гидроксиалкилиден-цианоуксусных кислот в качестве противоопухолевого средства. 2 с и 4 з.п. ф-лы, 3 ил., 7 табл.

Формула
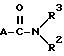
где А -
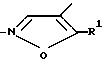
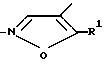
или
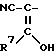
и их возможных стереоизомерных форм и/или при желании по меньшей мере их одной физиологически переносимой соли в качестве противоопухолевого средства, причем если А -
R1 метил или этил;
R2 водород или С1 С4-алкил;
R3 остаток формулы II
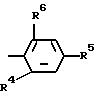
где R4, R5 и R6 являются одинаковыми и различными и означают: R4 водород и R5 и R6 совместно с фенильным кольцом формулы II образуют нафталиновое кольцо, C1 -C3 -алкокси, С1 С3-алкилмеркапто, одно- или многократно замещенную, содержащую в качестве заместителей галоген, как фтор, хлор, бром или иод; карбокси; бензоил, одно- или многократно замещенный, содержащий в качестве заместителей С2-С3-алкил или С2- С3-алкокси; фенил; фенил, одно- или многократно замещенный, содержащий в качестве заместителей С1-С3-алкокси, галоген, такой, как фтор, хлор, бром или иод, С1-С3-алкил; фенокси или одно- или многократно замещенный, содержащий в качестве заместителей С1-С3-алкокси, одно- или многократно замещенный, содержащий в качестве заместителей галоген, такой, как фтор, хлор, бром или иод, галоген, такой, как фтор, хлор, бром или иод, С1- С3-алкил, одно- или многократно замещенный, содержащий в качестве заместителей галоген, такой, как фтор, хлор, бром или иод,
или R2 и R3 вместе с азотом, с которым они связаны, образуют 4 9-звенное кольцо, замещенное, содержащее в качестве заместителя карбонил у С-атома, соседнего с N-атомом;
или R2 и R3 вместе с азотом, с которым они связаны, образуют 5 6-звенное кольцо формулы IV
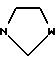
где W -
-CH2
CH2 CH2
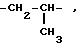
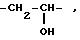
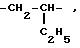
CH2 O- или CH2 S -
или, если А -
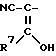
R3 остаток формулы II
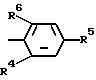
где R4, R5 и R6 одинаковые или различные водород, С1 -С3-алкил, С1-С3-алкил, который одно- или многократно замещен галогеном, например фтором, хлором, бромом или иодом;
если R4 водород, то R5 и R6 вместе с фенильным кольцом формулы II образуют нафталиновое кольцо;
если R4 водород, то R5 и R6 образуют метилендиоксиостаток, С1-С3-алкокси, С1- С3-алкокси, одно- или многократно замещенный галогеном, таким, как фтор, хлор, бром или иод, С1-С3-алкилмеркаптогруппу, С1-С3-алкилмеркаптогруппу, одно- или многократно замещенную галогеном, таким, как фтор, хлор, бром или иод; галоген, такой, как фтор, хлор, бром или иод, нитро, циано, С1-С3-алкилсульфонил, карбалкоксигруппу с 1 3 атомами углерода в алкильной цепи, фенил, фенил, одно- или многократно замещенный С1- С3-алкоксигруппой, галогеном, таким, как фтор, хлор, бром или иод, или С1-С3-алкилом, феноксигруппу или феноксигруппу, одно- или многократно замещенную С1- С3-алкоксигруппой, которая одно- или многократно замещена галогеном, таким, как фтор, хлор, бром или иод; галогеном, таким, как фтор, хлор, бром или иод; или С1- С3-алкильной группой, одно- или многократно замещенной галогеном, таким, как фтор, хлор, бром или иод;
R2 и R3 вместе с атомом азота, с которым они связаны, образуют 5- или 6-членное кольцо формулы IV

где W -
-CH2-, -CH2-CH2-,


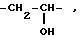
-CH2-O- или -CH2-S-;
R7 метил;
R2 водород.
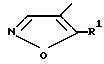
R1 метил;
R2 С1-С4-алкил;
R3 остаток формулы II

где R4, R5 и R6 одинаковые или различные - С1- С3 -алкокси, С1-С3-алкилмеркаптогруппа, одно- или многократно замещенная галогеном, таким, как фтор, хлор, бром или иод, бензоил, одно- или многократно замещенный С2 С3 -алкилом или С2-С3-алкоксилом, феноксигруппа или феноксигруппа, одно- или многократно замещенная С1 С3-алкоксигруппой, которая одно- или многократно замещена галогеном, таким, как фтор, хлор, бром или иод, галогеном, таким, как фтор, хлор, бром или иод, С1- С3-алкилом, который одно- или многократно замещен галогеном, как фтор, хлор, бром или иод или R2 и R3 вместе с атомом азота, с которым они связаны, образуют 4 9-членное кольцо, замещенное карбоксилом у атома углерода, соседнего с атомом азота.
R1 метил;
R2 водород;
R3 остаток формулы II
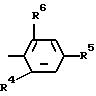
где R4, R5 и R6 одинаковые или различные бензил, одно- или многократно замещенный С2-С3-алкилом, С2-С3-алкоксилом, феноксигруппа или феноксигруппа, одно- или многократно замещенная С1-С3-алкоксигруппой, которая одно- или многократно замещена галогеном, таким, как фтор, хлор, бром или иод, галогеном, таким, как фтор, хлор, бром или иод; или С1-С3-алкилом, который одно- или многократно замещен галогеном, таким, как фтор, хлор, бром или иод.
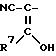
R3 остаток формулы II

где R4, R5 и R6 одинаковые или различные водород, C1-C3-алкил, C1-C3-алкил, одно- или многократно замещенный, содержащий в качестве заместителей галоген,такой, как фтор, хлор, бром или иод,
если R4 водород, то R5 и R6 образуют метилендиоксигруппу, С1-C3 -алкокси, C1-C3-алкокси, одно- или многократно замещенный, содержащий в качестве заместителей галоген, такой, как фтор, хлор, бром или иод, С1 С3 -алкилмеркапто, С1-С3-алкилмеркаптогруппа, одно- или многократно замещенная, содержащая в качестве заместителей галоген, такой, как фтор, хлор, бром или иод, галоген, такой, как фтор, хлор, бром или иод, нитро, циано, С1-С3-алкилсульфонил, фенокси или фенокси, одно- или многократно замещенный, содержащий в качестве заместителей С1-С3 -алкокси, одно или многократно замещенный, содержащий в качестве заместителей галоген, такой, как фтор, хлор, бром или иод, галоген, такой, как фтор, хлор, бром или иод, С1 -С3 -алкил, одно- или многократно замещенный, содержащий в качестве заместителей галоген, такой, как фтор, хлор, бром или иод;
R7 метил;
R2 водород.
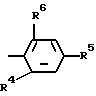
где R4, R5 и R6 одинаковые или различные водород, C1-C3- алкил, C1-C3-алкил, одно- или многократно замещенный, содержащий в качестве заместителей галоген, такой, как фтор, хлор, бром или иод; если R4 водород, то R5 и R6 образуют метилендиоксигруппу, C1-C3 -алкокси, C1 -C3-алкокси, одно- или многократно замещенный, содержащий в качестве заместителей галоген, такой, как фтор, хлор, бром или иод, галоген, такой, как фтор, хлор, бром или иод, нитро, фенокси или фенокси, одно- или многократно замещенный, содержащий в качестве заместителя С1 С3 -алкокси, одно- или многократно замещенный, содержащий в качестве заместителя галоген, такой, фтор, хлор, бром или иод; галоген, такой, как фтор, хлор, бром или иод, или С1-С3-алкил, одно- или многократно замещенный, содержащий в качестве заместителя галоген, такой, как фтор, хлор, бром или иод;
R7 метил;
R2 водород.

Комментарии