Способ получения трансформированных растительных клеток, содержащих рекомбинантную щелочную фосфатазу человека, и применение трансформированных растительных клеток, содержащих рекомбинантную щелочную фосфатазу человека - RU2698397C2
Код документа: RU2698397C2
Описание
Изобретение относится к пищевой промышленности и медицине и касается способа получения трансформированных растительных клеток, содержащих рекомбинантную человеческую щелочную фосфатазу, и его применения для поддержания гомеостаза желудочно-кишечного тракта (ЖКТ).
Известно, что кишечник является важным барьерным органом, состоящим из нормальной (синантропной) микрофлоры, слизистого слоя, эпителия и субэпителиальной иммунной системы. Основная функция кишечного барьера состоит в защите организма от бактериальной транслокации в системный кровоток. Нормальная микрофлора способна находиться в просвете кишечника без стимуляции иммунного ответа хозяина, однако эти же бактерии вызывают иммунный ответ и воспаление, если они транспонируются через кишечный барьер в кровоток и попадают в другие органы. Нарушение кишечного барьера приводит к развитию гипертрофированного иммунного ответа на компоненты синантропных бактерий и как следствие - к развитию хронических воспалительных заболеваний кишечника (ВЗК), таких как болезнь Крона, неспецифический язвенный колит (Podolsky, 2010). В индукцию этих нарушений значительный вклад вносит стресс, инфекции, старение, токсическое действие ксенобиотиков, в том числе лекарственных средств (Cadwell et al., 2010).
В настоящее время единственными доступными средствами поддержания гомеостаза желудочно-кишечного тракта, в том числе регуляции микрофлоры ЖКТ и иммунной системы организма, являются препараты и продукты на основе пробиотиков - живых культур микроорганизмов, представителей нормальной микрофлоры кишечника. Однако, убедительных доказательств клинической эффективности таких продуктов нет. Более того, вносимая извне микрофлора не приживается в организме человека, а отторгается собственной микрофлорой. Кроме этого, пробиотики - это преимущественно 2 вида бактерий - лакто- и бифидобактерии, а микрофлора человека включает в себя более 300 видов бактерий. Поэтому после прекращения приема пробиотиков, как правило, возвращаются исходные нарушения гомеостаза ЖКТ.
В то же время перспективны новые способы регуляции гомеостаза ЖКТ, основанные на применении фермента щелочная фосфатаза (ЩФ). Дело в том, что нарушения микрофлоры, состояния иммунной системы и барьерной функции кишечника, а также развитие ВЗК в значительной степени инициируются индукторами воспаления, которые являются физиологическими субстратами фермента ЩФ. Наиболее мощными индукторами воспаления являются: 1) липополисахариды (ЛПС) - бактериальные эндотоксины E.coli и других грамотрицательных бактерий; 2) внеклеточная АТФ и другие нуклеотиды и нуклеозиды. ЛПС, который постоянно высвобождается кишечной микрофлорой, попадает в кровь при нарушении кишечного барьера и даже в минимальных концентрациях на уровне нг/кг вызывает воспалительную реакцию. ЛПС при этом связывается с мембранным белком CD14 на поверхности макрофагов, вызывая их активацию, что приводит к выделению десятков биологически активных веществ: простагландинов, оксида азота и цитокинов, включая интерлейкины и TNFα (Nathan, 1987). Именно ЛПС и внеклеточная АТФ представляют собой важнейшие факторы формирования системного иммунного и воспалительного ответа на сигналы "чужой" и "опасность" (Matzinger, 2002).
Кишечная ЩФ, которая вырабатывается клетками слизистой кишечника, играет важную роль в кишечном гомеостазе именно через инактивацию (детоксикацию) ЛПС и предотвращение транслокации ЛПС, регуляцию кишечной микрофлоры и pH поверхности кишечника, (Eskandari et al., 1999; Weemaes et al., 2002; Riggle et al., 2013; Tuin et al., 2009). Катализируемое ЩФ дефосфорилирование ЛПС устраняет его провоспалительную активность и тем самым защищает организм от развития различных воспалительных и аутоиммунных заболеваний (Park, Lee, 2013).
Нарушение нормального уровня (активности) кишечной ЩФ за счет снижения экспрессии генов, кодирующих ЩФ, отмечено при воспалительных заболеваниях кишечника, целиакии, а также при ожирении. Пероральное введение ЩФ у мышей с колитом снижает уровень mRNK провоспалительного цитокина TNFα и оксида азота (Muginova et al., 2007). Molnar с коллегами (2012) показали, что уровень ЩФ в воспаленной слизистой оболочке кишечника детей с болезнью Крона и неспецифическим язвенным колитом достоверно понижен по сравнению с контрольной группой. Введение экзогенной ЩФ пациентам с активной формой воспаления кишечника может предупреждать обострение. В другом исследовании показано, что при введении экзогенной ЩФ снижалось воспаление кишечника у новорожденных животных; и сделано предположение, что ЩФ можно использовать для профилактики воспалительных заболеваний у новорожденных (Biesterveld et al., 2015).
В уровне техники известны следующие патенты и патентные заявки, описывающие применение ЩФ для коррекции микрофлоры кишечника, активности иммунной системы, а также для профилактики и лечения различных заболеваний: US 20130280232 от 24.10.2013 «Применение щелочной фосфатазы для детоксикации ЛПС, присутствующих в слизистых барьерах» («Use of alkaline phosphatase for the detoxification of LPS present at mucosal barriers»), US 20110206654 от 25.08.2011 «Способ модулирования микрофлоры желудочно-кишечного тракта с помощью щелочной фосфатазы» («Methods of Modulating Gastrointestinal Tract Flora Levels with Alkaline Phosphatase»), US 20130022591 от 24.01.2013 «Способ снижения ингибирующих токсических эффектов, связанных с бактериальной инфекцией, с использованием щелочной фосфатазы» («Methods of Reducing or Inhibiting Toxic Effects Associated with a Bacterial Infection Using Alkaline Phosphatase"), US 8574863 от 05.11.2013 «Щелочная фосфатаза для лечения воспалительных заболеваний желудочно-кишечного тракта» («Alkaline phosphatase for treating an inflammatory disease of the gastrointestinal tract»).
Наиболее близким к заявляемому способу получения пищевого продукта является способ по патентной заявке US 20110206654 от 25.08.2011 «Способ модулирования микрофлоры желудочно-кишечного тракта с помощью щелочной фосфатазы» («Methods of Modulating Gastrointestinal Tract Flora Levels with Alkaline Phosphatase»), описывающей возможность применения ЩФ для регуляции микрофлоры ЖКТ, в том числе - для защиты и восстановления нормальной микрофлоры на фоне применения антибиотиков. В прототипе и других опубликованных источниках, касающихся применения ЩФ, авторы использовали ЩФ в виде чистого белка, предварительно очищенного от посторонних белков и иных примесей. Такую ЩФ вводили животным или людям (при клинических испытаниях) в виде чистого белка или в виде фармацевтической композиции, включающей очищенную ЩФ и различные вспомогательные вещества. Очищенную ЩФ получали различными способами, включающими: выделение ЩФ из слизистой кишечника быка; выделение ЩФ из плаценты млекопитающих; получение рекомбинантной человеческой ЩФ культивированием в клетках млекопитающих с последующим выделением и очисткой. Общим признаком известных способов является получение ЩФ в виде чистого белка, что обуславливает целый ряд недостатков, указанных ниже, и практически исключает возможность его применения в качестве пищевого продукта или в составе пищевых продуктов.
Важнейшим недостатком ЩФ, выделенной из кишечника или иных органов млекопитающих, является чужеродность белка для человека (обусловленная генетическими различиями). Поэтому его применение у людей может вызвать сенсибилизацию и развитие опасных аллергических реакций при повторном применении. Кроме этого, содержание ЩФ в тканях животных незначительное, что удорожает процесс выделения и очистки фермента. Также необходимо учитывать риск заражения человека прионами и патогенными микроорганизмами животных. Надежная очистка от них подобных продуктов приводит к удорожанию продуктов в десятки раз и резко ограничивает возможность их практического применения по экономическим соображениям.
Получение рекомбинантной ЩФ человека в клеточных системах млекопитающих in vitro имеет свои недостатки, среди которых: ограниченная масштабируемость процесса, высокая себестоимость и риск заражения патогенами человека.
Общим недостатком описанных способов получения ЩФ в виде чистого белка является высокая стоимость конечного продукта (до 1000-2000 USD за 1 упаковку), обусловленная сложностью процесса выделения, очистки и контроля качества белка. Это практически исключает возможность применения ЩФ с профилактической и лечебной целью как пищевого продукта.
Другим общим недостатком описанных способов получения ЩФ в виде чистого белка является высокая чувствительность ЩФ к внешним условиям, таким как температура, pH (кислотность) среды. Например, ЩФ полностью инактивируется при попадании в кислую среду желудка. Это исключает возможность применения такой ЩФ в составе продуктов питания либо требует создания сложных лекарственных форм, устойчивых к кислой среде желудка.
Перечисленные недостатки получения ЩФ не позволяют применять ЩФ в качестве доступного продукта массового применения для поддержания нормальной микрофлоры кишечника и иммунной системы организма, а также профилактики развития воспалительных и аутоиммунных заболеваний, связанных с нарушением гомеостаза желудочно-кишечного тракта. Поэтому описанная в прототипе (US 20110206654 от 25.08.2011) возможность применения ЩФ в виде чистого белка или в виде его смеси со стандартными фармацевтическими ингредиентами для модулирования микрофлоры желудочно-кишечного тракта ограничена описанными выше недостатками и не может быть практически реализована в качестве пищевого продукта или компонента пищевого продукта.
Задача, на решение которой направлено изобретение, заключается в создании способа получения нового эффективного, безопасного и доступного пищевого продукта, содержащего ЩФ, для поддержания нормальной микрофлоры кишечника и иммунной системы организма, а также для профилактики развития воспалительных и аутоиммунных заболеваний, связанных с нарушением гомеостаза желудочно-кишечного тракта.
Поставленная задача решается получением пищевого продукта, в котором рекомбинантная щелочная фосфатаза человека находится в составе растительных клеток. Растительные клетки, содержащие ЩФ (в отличие от прототипа, где используется очищенная ЩФ), обеспечивают естественную защиту ЩФ от инактивации в агрессивной кислой среде желудка и ее доставку в кишечник, где ЩФ выполняет свою функцию - дефосфорилирует (инактивирует) бактериальные эндотоксины, вырабатываемые патогенной микрофлорой ЖКТ. Тем самым пищевой продукт, содержащий ЩФ, обеспечивает: поддержание нормальной микрофлоры ЖКТ и иммунной системы организма, профилактику нарушений нормальной микрофлоры ЖКТ и иммунной системы организма, восстановление нормальной микрофлоры ЖКТ и иммунной системы организма при токсических и стрессовых воздействиях, а также профилактику развития воспалительных и аутоиммунных заболеваний. Находящиеся в составе пищевого продукта растительные клетки с рекомбинантной ЩФ человека являются безопасными продуктами питания для человека, которые не вызывают сенсибилизацию и развитие опасных аллергических реакций при повторном применении, а также не могут вызвать заражение человека прионами и патогенными микроорганизмами животных (в отличие от ЩФ, выделенной из органов животных). Наконец, пищевой продукт на основе растительных клеток, содержащих рекомбинантную ЩФ человека, не только безопаснее, но и на 2-3 порядка дешевле препаратов на основе очищенной рекомбинантной ЩФ человека, полученной из клеток млекопитающих. Это позволяет его применять именно как пищевой продукт для массовой профилактики нарушений микрофлоры ЖКТ и иммунной системы организма, а также профилактики развития воспалительных и аутоиммунных заболеваний кишечника у широких слоев населения.
Способ получения пищевого продукта на основе растительных клеток, содержащих рекомбинантную щелочную фосфатазу человека, включает создание растительного экспрессионного вектора с геном человеческой щелочной фосфатазы, встраивание растительного экспрессионного вектора с геном человеческой щелочной фосфатазы в агробактериальные штаммы, получение каллусных растительных клеток, осуществление агробактериальной трансформации каллусных клеток с помощью агробактериальных штаммов, а пищевой продукт получают путем выращивания в суспензионной культуре трансформированных каллусных клеток растений с геном человеческой щелочной фосфатазы.
Другой вариант способа получения пищевого продукта на основе растительных клеток, содержащих рекомбинантную щелочную фосфатазу человека, включает создание растительного экспрессионного вектора с геном человеческой щелочной фосфатазы, встраивание растительного экспрессионного вектора с геном человеческой щелочной фосфатазы в агробактериальные штаммы, получение каллусных растительных клеток, осуществление агробактериальной трансформации каллусных клеток с помощью агробактериальных штаммов, и получение соматических эмбриоидов из трансформированных каллусных клеток, а пищевой продукт получают путем выращивания в суспензионной культуре соматических эмбриоидов с геном человеческой щелочной фосфатазы.
В процессе выращивания соматических эмбриоидов проводят синхронизацию развития эмбриоидов с помощью фильтрации через сита разного размера, центрифугирования, автоматического сепарирования или иным способом синхронизации. Соматические эмбриоиды выращивают в жидкой питательной среде с добавлением веществ, повышающих осмотическое давление. Оптимальная концентрация таких веществ - до 10%. В качестве веществ, повышающих осмотическое давление, используют полиэтиленгликоль, маннитол и другие повышающие осмотическое давление вещества.
В качестве рекомбинантной человеческой щелочной фосфатазы используют ткане-специфические щелочные фосфатазы, например, кишечную и плацентарную, или ткане-неспецифические щелочные фосфатазы или иные изоформы щелочных фосфатаз.
Выращенные в суспензионной культуре трансформированные каллусные клетки или соматические эмбриоиды высушивают и используют в качестве пищевого продукта, например, в виде капсул, таблеток, пакетов саше и в иных готовых формах, или добавляя в другие пищевые продукты.
Полученный пищевой продукт используют для регуляции микрофлоры желудочно-кишечного тракта; для профилактики нарушений иммунной системы организма и восстановления иммунной системы при ее нарушениях в качестве иммуномодулирующего средства.
Известно, что растительные продуценты считаются наиболее перспективными для производства высококачественных, безопасных и относительно недорогих белков (Conley et al., 2011; Sharma, Sharma, 2009; Sabalza et al., 2014). Мы использовали преимущества растительных продуцентов для создания совершенно нового продукта, который представляет собой не ЩФ в чистом виде или в составе композиций веществ, а растения, содержащие рекомбинантную щелочную фосфатазу человека. В качестве таких растений могут использоваться любые растения, пригодные в пищу и для получения рекомбинантных белков, включая, но не ограничиваясь: морковь (Daucus carota), салат (Latuca sativa), капуста китайская (Brassica pekinensis), капуста белокочанная (Brassica oleracea), укроп (Anethum graveolens), сельдерей (Apium graveolens), огурец (Cucumis sativus), тыква (Cucurbita реро), стевия (Stevia rebaudiana), табак (Nicotiana tabacum), рис (Oryza sativa), люцерна (Medicago sativa), томат (Solanum lycopersicum) и другие растения. Предпочтительно использовать растения, у которых соматический эмбриогенез возможен не менее, чем в 60% клеток. Растения могут использоваться в цельном виде или в виде их компонентов, включая, но не ограничиваясь: клетки, эмбриоиды, листья, стебли и другие составные части. Растения или их компоненты, содержащие рекомбинантную щелочную фосфатазу человека, могут использоваться для приема в пищу как в цельном, так и измельченном (вплоть до разделения на отдельные клетки) виде, как в натуральном, так и высушенном виде, с использованием различных способов сушки или без нее. Пищевой продукт может содержать ткане-специфическую щелочную фосфатазу, например, кишечную и плацентарную, или ткане-неспецифическую щелочную фосфатазу или иную щелочную фосфатазу человека.
Заявленный способ (его варианты) реализуется следующим образом.
Первый вариант способа включает следующие технологические этапы: создание растительного экспрессионного вектора с геном человеческой щелочной фосфатазы, встраивание растительного экспрессионного вектора с геном человеческой щелочной фосфатазы в агробактериальные штаммы, получение каллусных растительных клеток и осуществление агробактериальной трансформации каллусных клеток. Пищевой продукт получают путем выращивания в суспензионной культуре трансформированных каллусных клеток растений с геном человеческой щелочной фосфатазы.
Второй вариант способа включает следующие технологические этапы: создание растительного экспрессионного вектора с геном человеческой щелочной фосфатазы, встраивание растительного экспрессионного вектора с геном человеческой щелочной фосфатазы в агробактериальные штаммы, получение каллусных растительных клеток и осуществление агробактериальной трансформации каллусных клеток, получение соматических эмбриоидов из трансформированных каллусных клеток. Пищевой продукт получают путем выращивания в суспензионной культуре соматических эмбриоидов с геном человеческой щелочной фосфатазы.
Растительные клетки, содержащие рекомбинантную человеческую щелочную фосфатазу, могут быть также использованы для получения и выращивания растений. Полученная растительная биомасса может быть использована в качестве сырья для получения пищевого продукта на основе растительных клеток, содержащих рекомбинантную щелочную фосфатазу человека.
Создание растительного экспрессионного вектора с геном человеческой щелочной фосфатазы осуществляли следующим образом.
Нуклеотидную последовательность рекомбинантного гена щелочной фосфатазы человека (ЩФ) размером 1587 пар нуклеотидов синтезировали в полном соответствии с последовательностью нуклеотидов нативной мРНК гена щелочной фосфатазы человека (Homo sapiens alkaline phosphatase, intestinal (ALPI), Sequence ID: NM 001631.4). Для удобства клонирования в последовательность рекомбинантного гена ЩФ на 5'-конце до сайта инициации трансляции (atg) вводили последовательность сайта рестрикции BglII (agatct), а на 3'-конце после стоп-кодона (tga) последовательность, включающая сайт рестрикции XbaI (atctagaat). Нуклеотидную последовательность рекомбинантного гена ЩФ размером 1602 пар нуклеотидов, содержащая последовательность сайтов рестрикции BglII и XbaI, встраивали в плазмиду pAL-T vector и обозначали как pAL-T-ЩФ. Нуклеотидную последовательность гена ЩФ размером 1600 пар нуклеотидов вырезали из плазмиды pAL-T-ЩФ по сайтам рестрикции BglII и XbaI и лигировали в ранее созданную плазмиду p35S-NLS-recA-licBM3 [1], предварительно гидролизованную по сайтам рестрикции BamHI и XbaI, с получением плазмиды p35S-ЩФ, в которой рекомбинатный ген ЩФ находится под контролем промотора 35S вируса мозаики цветной капусты [2]. Точность сборки генетической конструкции p35S-ЩФ верифицировали секвенированием.
Встраивание растительного экспрессионного вектора с геном человеческой щелочной фосфатазы в агробактериальные штаммы осуществляли следующим образом.
Для встраивания растительного экспрессионного вектора с геном человеческой щелочной фосфатазы применяли метод «трехродительского скрещивания», где в качестве доноров клетки использовали Escherichia coli с плазмидой p35S-ЩФ, в качестве посредника конъюгативного переноса - клетки Е. coli штамма НВ101 pRK2013, а в качестве акцептора - клетки агробактерии Agrobacterium tumefaciens штаммов GV3101 или AGL0. В результате были получены агробактериальные штаммы с геном человеческой щелочной фосфатазы GV3101 p35S-ЩФ и AGL0 p35S-ЩФ.
Получение каллусных растительных клеток и осуществление агробактериальной трансформации каллусных клеток.
В стерильных условиях (ламинар-бокс) семена растений стерилизовали в водном растворе коммерческого хлорсодержащего препарата с добавлением Твина-20 (1 капля на 100 мл раствора), затем трехкратно промывали в стерильной дистиллированной воде, в каждой порции по 10 минут. Затем из простерилизованных семян в стерильных условиях выделяли зародыши, которые переносил в пробирки на модифицированную Мурасиге и Скуга питательную среду (МСМ), дополненную регуляторами роста 2,4-дихлорфеноксиуксусной кислотой (2,4-Д) и кинетином. Пробирки помещали в термостат и инкубировали при 23°C в темноте до образования каллуса.

В условиях ламинар-бокса с помощью стерильной микробиологической петли наносили отдельные бактериальные колонии из свежей культуры агробактериальных штаммов с геном человеческой щелочной фосфатазы GV3101 p35S-ЩФ или AGL0 p35S-ЩФ в пробирку, содержащую 3 мл стерильной жидкой среды LB с соответствующими для штамма бактерий антибиотиками. Агробактерии наращивали 20-48 часов при температуре 28°C на термостатируемой качалке с круговым вращением (амплитуда 5-10 см и скорость 150-200 об/минуту).
Использовали стандартные среды для выращивания агробактерий, например, LB, содержащую (на 1 л): триптон - 10 г, дрожжевой экстракт - 5 г, хлористый натрий - 5 г и бакто-агар - 15 г. Среду автоклавировали при стандартных условиях 15-20 мин. После остывания до 65°C добавляли антибиотики: для штамма AGL0 - канамицин и рифампицин - каждого до конечной концентрации 100 мг/л; для штамма GV3101 - канамицин и рифампицин - каждого до конечной концентрации 100 мг/л и гентамицин до конечной концентрации 25 мг/л.
В условиях ламинар-бокса каллусные клетки растений помещали на стерильную фильтровальную бумагу в чашки Петри и наносили на каждый трансплант по 10-25 мкл «ночной» культуры агробактерий штаммов AGL0. и GV3101 с геном щелочной фосфатазы. Каллус после нанесения культуры агробактерий слегка подсушивали и переносили в пробирки на питательную среду МСМ с 0,2 мг/л 2,4Д. Через 3 суток каллусы переносили на агаризованную среду того же состава, дополненную 500 мг/л цефотаксима и 100 мг/л канамицина. Культивировали в течение 10 суток в темноте при температуре 22-24°C. Далее проводили еще 1-2 пассажа на среде этого же состава до появления новых колоний каллусных клеток. Для размножения каллусные клетки переносили на питательную среду МСМ с 0,2 мг/л 2,4Д с 200 мг/л цефотаксима. Каллусную ткань можно поддерживать в культуре неограниченно длительное время, периодически разделяя ее на фрагменты и пересаживая на новую среду. Для отбора трансгенных клеток использовали способность щелочной фосфатазы дефосфорилировать п-нитрофенилфосфат, с образованием окрашенного в желтый цвет паранитрофенола. Для наработки необходимого количества пищевого продукта каллусные клетки с геном человеческой ЩФ выращивали в суспензионной культуре на жидкой питательной среде того же состава без агара.
В случае реализации 2-го варианта способа получения пищевого продукта из трансформированных каллусных клеток растений получали соматические эмбриоиды, которые затем выращивали в суспензионной культуре.
Получение соматических эмбриоидов из трансформированных каллусных клеток осуществляли следующим образом.
Для получения соматических эмбриоидов суспензию каллусных клеток культивировали в жидкой питательной среде МСМ, содержащей 0,2 мг/л ИУК (индолилуксусной кислоты) и кинетина. Полученные таким образом эмбриогенные суспензии содержали различные предзародышевые структуры, а также отдельные неэмбриогенные клетки и группы клеток. Для синхронизации (получения однородной популяции) соматических эмбриоидов суспезионную культуру пропускали через нейлоновые сита с размером ячеек 120 мкм, а затем через 50 мкм. Массу клеток, которая оставалась на втором сите, переносили в свежую среду для формирования эмбриоидов. В среднем в 1 литре среды получали до 70 тыс. зародышей.
Получение высушенного пищевого продукта на основе растительных каллусных клеток или соматических эмбриоидов с геном человеческой щелочной фосфатазы.
Каллусные клетки с геном человеческой ЩФ отмывали от остатков питательной среды дистиллированной водой и подвергали лиофильной сушке при температуре -55°C с последующим досушиванием при +30°C, не допуская денатурации белков. В высушенной массе клеток определяли активность щелочной фосфатазы по способности дефосфорилировать п-нитрофенилфосфат. Готовую массу растительных клеток с геном ЩФ упаковывали в виде капсул, таблеток, пакетов саше или в иных готовых формах, а применяли в качестве компонента продуктов питания.
К подтверждению описанного выше можно привести описание отработки и оптимизации технологических параметров получения пищевых продуктов.
Клетки растений, например, моркови с геном щелочной фосфатазы человека сушили с использованием лиофильной сушки при температуре -55°C с последующим досушиванием при 20, 30, 40, 50 и 60°C. Сухую биомассу (навеска около 1 г) растирали с 10 мл буферного раствора, содержащего 5 мМ Трис-HCl, 0,1 мМ хлорида магния, 0,1 мМ хлорида цинка, центрифугировали при 100 g в течение 30 минут. Супернатант испытывали на дефосфорилирующую способность ЩФ при добавлении к раствору 20 мМ nНФФ (п-нитрофенилфосфата). Реакционную смесь инкубировали при 37°C в течение 30 минут для развития окраски продуктом реакции. Для остановки реакции использовали 2 мл охлажденного 0,5 М NaOH. За единицу активности принимали количество фермента, необходимого для образования 1 мкМ nНФ. Специфическую активность рассчитывали в единицах на 1 г клеток моркови.

Из таблицы 2 видно, что температурный режим досушивания клеток растений влияет на активность ЩФ, наиболее оптимальные температуры для досушивания находятся в интервале от 20°C до 40°C.
Влияние состава питательной среды на каллусообразование изучали на двух сортах моркови Нантская 4 и Московская зимняя А-555, относящихся к разным сортотипам. В качестве экспланта использовали зиготические зародыши, выделенные из зрелых семян моркови. Зародыши культивировали на трех наиболее часто используемых средах МС (Murashige, Skoog, 1964), МСМ (Masuda et al, 1981) и В5 (Gamborg et al., 1976). Для индукции каллусообразования в среды добавляли 2,4Д в различных концентрациях, результаты исследований представлены в таблице 3.

Из таблицы видно, что каллусообразование у моркови происходит на всех исследуемых вариантах сред, однако наиболее оптимальный является среда МСМ для обоих сортов моркови.
Влияние регуляторов роста на способность каллусных тканей растений, например, моркови сорта Нантская 4 к соматическому эмбриогенезу изучали в суспензионной культуре на среде МСМ с различными сочетаниями регуляторов роста типа ауксинов (2,4-Д, ИУК) и цитокининов (кинетин и БАП). В качестве трансплантов использовали каллусную ткань моркови сорт Нантская 4, полученную из зиготических зародышей, клеточную суспензию культивировали в колбах объемом 100 мл на шейкере, скорость 80 об/мин, результаты исследований представлены в таблице 4.

Из таблицы 4 видно, что образование эмбриоидов может успешно осуществляться на средах, не содержащих 2,4-Д.
Для получения каллусных тканей растений использовали различные типы эксплантов: ткани корнеплода, фрагменты стебля и листа, черешок листа, семядоли и гипокотиль и зиготические зародыши моркови сорт Нантская 4. Экспланты культивировали на питательной среде МСМ с 0,2 мг/л 2,4-Д, затем для индукции эмбриогенеза образовавшийся каллус переносили на среды следующего состава: МСМ с 0,2 мг/л 2,4-Д и кинетина и среда МСМ с 0,2 мг/л ИУК и кинетина. Клеточную суспензию культивировали в колбах объемом 100 мл на шейкере, скорость 80 об/мин. Результаты исследований представлены в таблице 5.

Из таблицы 5 видно, что лучшим эксплантом для получения эмбриогенного каллуса служат зиготические зародыши.
Возможность получения и применения пищевых продуктов на основе растений, содержащих человеческую ЩФ, иллюстрируется следующими примерами.
Для удобства применения продукта, выращенные каллусные клетки или соматические эмбриоиды растений с геном человеческой щелочной фосфатазы могут подвергаться сушке любыми приемлемыми способами.
Полученный пищевой продукт на основе растений, содержащих человеческую ЩФ, можно использовать для приема внутрь в дозированных формах, в том числе, но не ограничиваясь, в виде капсул, таблеток, пакетов саше и в иных готовых формах.
Полученный пищевой продукт на основе растений, содержащих человеческую ЩФ, можно использовать в виде компонента продуктов питания для массового потребления, например, молочных продуктов, напитков, кондитерских изделий, а также в составе лечебно-диетических, лечебно-профилактических продуктов, продуктов функционального питания.
Полученный продукт на основе растительных каллусных клеток и соматических эмбриоидов, содержащих человеческую ЩФ, можно использовать для поддержания здоровья, в том числе для поддержания гомеостаза желудочно-кишечного тракта (ЖКТ), и профилактики заболеваний, связанных с нарушением гомеостаза ЖКТ. В частности, данный продукт можно использовать:
- для регуляции микрофлоры ЖКТ, в том числе для поддержания нормальной микрофлоры ЖКТ и предотвращения роста патогенной микрофлоры ЖКТ;
- для регуляции иммунной системы организма, включая поддержание нормального уровня иммунной системы и восстановление иммунной системы при ее нарушениях, связанных с различными негативными воздействиями, включая стресс, неблагоприятные экологические факторы, прием лекарственных средств и других ксенобиотиков;
- для снижения токсических эффектов, в том числе связанных с бактериальной инфекцией или воспалительными заболеваниями кишечника;
- для профилактики нарушений ЖКТ, связанных с приемом ксенобиотиков различной природы, включая лекарственные препараты.
Полученный пищевой продукт на основе растений, содержащих человеческую ЩФ, можно использовать как здоровым людям, так и людям, страдающим различными воспалительными и аутоиммунными заболеваниями, включая заболевания кишечника (язвенный колит, болезнь Крона, энтероколиты), артриты, экзему и другие системные заболевания, связанные с повышенной проницаемостью стенки кишечника. Полученный пищевой продукт можно использовать лицам, страдающим ожирением и имеющим различные косметические проблемы.
Получение пищевого продукта заявляемым способом может быть проиллюстрировано следующими примерами.
Пример 1. Получение пищевого продукта на основе моркови, содержащей человеческую ЩФ
Для встраивания гена человеческой кишечной ЩФ в растительный экспрессионный вектор нуклеотидную последовательность размером 1587 пар нуклеотидов синтезировали в полном соответствии с последовательностью нуклеотидов нативной мРНК гена щелочной ЩФ. Далее в последовательность рекомбинантного гена ЩФ на 5'-конце до сайта инициации трансляции (atg) была введена последовательность сайта рестрикции BglII (agatct), а на 3'-конце после стоп-кодона (tga) последовательность сайта рестрикции XbaI (atctagaat). Полученную нуклеотидную последовательность размером 1602 пар нуклеотидов клонировали в плазмиду pAL-T vector. Далее из полученной плазмиды pAL-T-ЩФ вырезали нуклеотидную последовательность размером 1600 пар нуклеотидов по сайтам рестрикции BglII и XbaI и лигировали в ранее созданную плазмиду p35S-NLS-recA-licBM3 с получением плазмиды p35S-ЩФ, в которой рекомбинантный ген ЩФ находится под контролем промотора 35S вируса мозаики цветной капусты. Точность сборки генетической конструкции p35S-ЩФ верифицировали секвенированием.
Агробактериальный штамм с геном человеческой ЩФ AGL0 p35S-ЩФ получали, используя в качестве доноров клетки Escherichia coli с плазмидой p35S-ЩФ, в качестве посредника конъюгативного переноса клетки Е. coli штамма НВ101 pRK2013, а в качестве акцептора клетки Agrobacterium tumefaciens штамма AGL0.
В качестве объекта агробактериальной трансформации использовали каллусные клетки из зиготических зародышей семян моркови, которые получали следующим образом: семена моркови стерилизовали в 50% водном растворе хлорсодержащего препарата «Белизна» с добавлением Твин-20 (1 капля на 100 мл раствора), затем их трехкратно промывали в стерильной дистиллированной воде; затем из простерилизованных семян в стерильных условиях выделяли зародыши, которые переносили в пробирки на питательную среду МСМ с регуляторами роста 2,4-Д и кинетином; пробирки помещали в термостат и инкубировали при температуре 23°C в темноте до образования каллуса.
Агробактерий штамма AGL0 наращивали следующим образом: в условиях ламинарного бокса с помощью стерильной микробиологической петли наносили отдельную бактериальную колонию из свежей культуры с селективными антибиотиками в пробирку, содержащую 3 мл стерильной жидкой среды LB описанного выше состава; далее агробактерий наращивали 24-48 часов при 28°C на термостатируемой качалке с круговым вращением (амплитуда 5-10 см и скорость 150-200 об /минуту).
Трансформацию и выращивание каллусных клеток моркови проводили следующим образом: в ламинарном боксе каллусы моркови из зиготических зародышей помещали на стерильную фильтровальную бумагу в чашках Петри; затем наносили на каждый трансплант по 10-25 мкл ночной культуры агробактерий штамма AGL0 с геном ЩФ; затем каллусы слегка подсушивали и переносили в пробирки на питательную среду МСМ с 0,2-0,5 мг/л 2,4Д; через 3 суток каллусы переносили на агаризованную среду того же состава, дополненную 500 мг/л антибиотика цефотаксима; каллусы культивировали 10 суток в темноте при температуре 22-24°C. Далее проводили еще 1-2 пассажа на среде этого же состава до появления новых колоний клеток моркови. Для размножения суспензионные каллусные клетки моркови переносили на питательную среду МСМ с 0,2-0,5 мг/л 2,4Д с 200 мг/л цефотаксима. Для отбора трансгенных клеток моркови использовали способность ЩФ дефосфорилировать п-нитрофенилфосфат с образованием окрашенного в желтый цвет п-нитрофенола.
Далее каллусные клетки моркови с геном человеческой ЩФ отмывали от питательной среды дистиллированной водой и подвергали лиофильной сушке при температуре -55°C; в высушенной массе определяли активность ЩФ по способности дефосфорилировать п-нитрофенилфосфат; высушенную массу фасовали в пакеты саше.
Полученный пищевой продукт использовали для поддержания нормальной микрофлоры ЖКТ и поддержания нормального состояния иммунной системы организма, добавляя в молочные продукты или напитки в расчете 0,5-1 пакет саше на человека в сутки.
Пример 2. Получение пищевого продукта на основе стевии, содержащей человеческую ЩФ
Пищевой продукт на основе растений, содержащий рекомбинантную ЩФ человека, получали аналогично описанному в примере 1, но в качестве растения использовали стевию (Stevia rebaudiana), а для выращивания клеток, содержащих ЩФ, использовали технологию соматического эмбриогенеза. Для получения соматических эмбриоидов стевии клеточную суспензию культивировали в жидкой питательной среде МСМ, содержащей 0,2 мг/л индолилуксусной кислоты и кинетина; затем для получения однородной популяции эмбриоидов суспезионную культуру пропускали через нейлоновые сита с размером ячеек 120 мкм, а затем через 50 мкм; массу клеток, полученную на втором сите, переносили в свежую среду для формирования эмбриоидов. В среднем в 1 литре среды можно получать до 70 тыс. эмбриоидов.
Полученный пищевой продукт использовали для восстановления иммунной системы организма при ее нарушениях, добавляя в пищевые продукты или напитки, не подвергающиеся тепловой обработке (нагреванию) выше 40°C, в расчете 0,5-1 пакет саше на человека в сутки.
Пример 3. Получение пищевого продукта на основе салата, содержащего человеческую ЩФ
Пищевой продукт на основе растений, содержащий рекомбинантную ЩФ человека, получали аналогично описанному в примере 1, но в качестве растения использовали салат (Latuca sativa), в растительный экспрессионный вектор клонировали ген секреторной ЩФ человека, а в качестве агробактериального штамма использовали штамм GV3101 p35S-ЩФ, который получали, используя в качестве доноров клетки Escherichia coli с плазмидой p35S-ЩФ, в качестве посредника конъюгативного переноса клетки Е. coli штамма НВ101 pRK2013, а в качестве акцептора клетки Agrobacterium tumefaciens штамма GV3101.
Полученный пищевой продукт использовали для снижения последствий интоксикаций, в том числе связанных пищевыми отравлениями, кишечными инфекциями или приемом лекарств, употребляя по 1-2 пакета саше перорально на человека в сутки в течение 7-10 дней.
Пример 4. Получение пищевого продукта на основе капусты китайской, содержащей человеческую ЩФ.
Пищевой продукт на основе растений, содержащий рекомбинантную ЩФ человека, получали и использовали аналогично описанному в примере 1, но в качестве растения использовали капусту китайскую (Brassica pekinensis), а для получения и выращивания каллусных клеток использовали культуральную среду МС с добавлением 0,1-1,0 мг/л 2,4Д.
Полученный пищевой продукт использовали для профилактики негативных побочных эффектов, связанных с приемом антибактериальных лекарственных препаратов, употребляя по 1 пакету саше перорально на человека в сутки в течение 7-10 дней.
Пример 5. Получение пищевого продукта на основе капусты белокочанной, содержащей человеческую ЩФ
Пищевой продукт на основе растений, содержащий рекомбинантную ЩФ человека, получали и использовали аналогично описанному в примере 4, но в качестве растения использовали капусту белокочанную (Brassica oleracea), а в растительный экспрессионный вектор клонировали ген плацентарной ЩФ человека.
Полученный пищевой продукт использовали на добровольцах для профилактики негативных побочных эффектов, связанных с приемом антибиотиков, употребляя по 1 пакету саше перорально на человека в сутки в течение 7-10 дней.
Пример 6. Получение пищевого продукта на основе укропа, содержащего человеческую ЩФ
Пищевой продукт на основе растений, содержащий рекомбинантную ЩФ человека, получали аналогично описанному в примере 1, но в качестве растения использовали укроп (Anethum graveolens), а для получения готового пищевого продукта клетки укропа с геном ЩФ человека лиофилизировали с последующим досушиванием при температуре до +30°C.
Полученный пищевой продукт использовали для профилактики нарушений ЖКТ и иммунной системы организма, связанных с негативным влиянием стресс-факторов, употребляя по 0,5-1 пакета саше перорально на человека в сутки в течение 7-10 дней.
Пример 7. Получение пищевого продукта на основе сельдерея, содержащего человеческую ЩФ
Пищевой продукт на основе растений, содержащий рекомбинантную ЩФ человека, получали аналогично описанному в примере 1, но в качестве растения использовали сельдерей (Apium graveolens), а для получения готового пищевого продукта клетки укропа с геном ЩФ человека лиофилизировали с последующим досушиванием при температуре от +30°C до 40°C.
Полученный пищевой продукт использовали для профилактики нарушений ЖКТ и иммунной системы организма, связанных с негативным влиянием стресс-факторов, добавляя в продукты питания или напитки повседневного употребления (при температуре продуктов не выше 40°C) в расчете 0,5-1 пакет саше на человека в сутки.
Пример 8. Получение пищевого продукта на основе огурца, содержащего человеческую ЩФ
Пищевой продукт на основе растений, содержащий рекомбинантную ЩФ человека, получали и использовали аналогично описанному в примере 1, но в качестве растения использовали огурец (Cucumis sativus), а для получения и выращивания каллусных клеток использовали культуральную среду В-5 с добавлением 0,1-1,0 мг/л 2,4Д.
Пример 9. Получение пищевого продукта на основе тыквы, содержащей человеческую ЩФ
Пищевой продукт на основе растений, содержащий рекомбинантную ЩФ человека, получали аналогично описанному в примере 1, но в качестве растения использовали тыкву (Cucurbita реро), а для получения готового пищевого продукта клетки тыквы с геном ЩФ человека смешивали со вспомогательными веществами и фасовали в желатиновые капсулы.
Полученный пищевой продукт использовали для профилактики негативных побочных эффектов, связанных с приемом антибактериальных лекарственных препаратов, употребляя по 2 капсулы внутрь на человека в сутки в течение 7-10 дней.
Пример 10. Получение пищевого продукта на основе риса, содержащего человеческую ЩФ
Пищевой продукт на основе растений, содержащий рекомбинантную ЩФ человека, получали аналогично описанному в примере 10, но в качестве растения использовали рис (Oryza sativa), а для получения готового пищевого продукта использовали распылительную сушку, которую проводили при температуре, не превышающей +50°C, чтобы не допустить денатурации белков.
Полученный пищевой продукт использовали для профилактики негативных побочных эффектов, связанных с приемом антибиотиков, употребляя по 1-3 капсулы перорально на человека в сутки в течение 7-10 дней.
Пример 11. Получение пищевого продукта на основе люцерны, содержащей человеческую ЩФ
Пищевой продукт на основе растений, содержащий рекомбинантную ЩФ человека, получали и использовали аналогично описанному в примере 2, но в качестве растения использовали люцерну (Medicago sativa), а для оптимизации содержания ЩФ проводили синхронизацию развития эмбриоидов (с помощью фильтрации через сита, центрифугирования и автоматического сепарирования) и использовали режим подращивания эмбриоидов в жидкой питательной среде с добавлением ПЭГ, маннитола или других веществ, повышающих осмотическое давление.
Пример 12. Получение пищевого продукта на основе томата, содержащего человеческую ЩФ
Пищевой продукт на основе растений, содержащий рекомбинантную ЩФ человека, получали аналогично описанному в примере 1, но в качестве растения использовали томат (Solatium lycopersicum), а для получения готового пищевого продукта клетки томата высушивали до содержания влаги 4-8% при 40°C и покрывали полимерами карбоксиметилцеллюлозой, альгинатом натрия с образованием микрокапсул/пеллет, которые фасовали в пакеты саше или желатиновые капсулы.
Полученный пищевой продукт использовали для профилактики нарушений нормальной микрофлоры ЖКТ и состояния иммунной системы организма, добавляя в продукты или напитки повседневного употребления в расчете 0,5-1 пакет саше с микрокапсулами/пеллетами на человека в сутки.
Пример 13. Восстановление с помощью клеток моркови, содержащих ген человеческой ЩФ, показателей иммунитета, нарушенных под влиянием липополисахарида
Нарушения иммунной системы, связанные с нарушением кишечного гомеостаза, в частности - нарушением нормальной микрофлоры и барьерной функции кишечника, моделировали введением мышам стока CD-1 липополисахарида E.coli (Sigma-Aldrich) в дозе 0,5 мг/кг внутрижелудочно. Под влиянием ЛПС в крови мышей наблюдалось повышение уровня провоспалительных цитокинов: ИЛ-6, ИЛ-8 и TNFα, характеризующих развитие системной воспалительной реакции Предварительное внутрижелудочное введение мышам клеток моркови, содержащих ген человеческой ЩФ, приводило к существенному снижению (на 53-77%) уровня провоспалительных цитокинов.
Пример 14. Восстановление кишечной микрофлоры после антибактериальной терапии стрептомицином при кормлении мышей клетками моркови, содержащими ген человеческой кишечной ЩФ
Изучение способности моркови, содержащей ген человеческой кишечной ЩФ, восстанавливать кишечную микрофлору, нарушенную после антибактериальной терапии, проводили на мышах стока CD-1.
Одной группе животных вводили внутрижелудочно антибиотик стрептомицин в дозе 200 мг/кг однократно; второй группе - внутрижелудочно стрептомицин 200 мг/кг однократно и лиофильно высушенные клетки моркови, содержащие ген человеческой кишечной ЩФ, 100 мг/кг; третьей группе - внутрижелудочно стрептомицин 200 мг/кг и препарат-пробиотик «Линекс», содержащий лиофилизированные молочнокислые бактерии (Lactobacillus acidophilus, Bifidobacterium infantis, Enterococcus faecium), в дозе 100 мг (капсульной массы)/кг.
Ежедневно проводили забор и посев каловых масс на питательную среду LB и анализировали наличие или отсутствие нормальной кишечной микрофлоры (таблица 6).
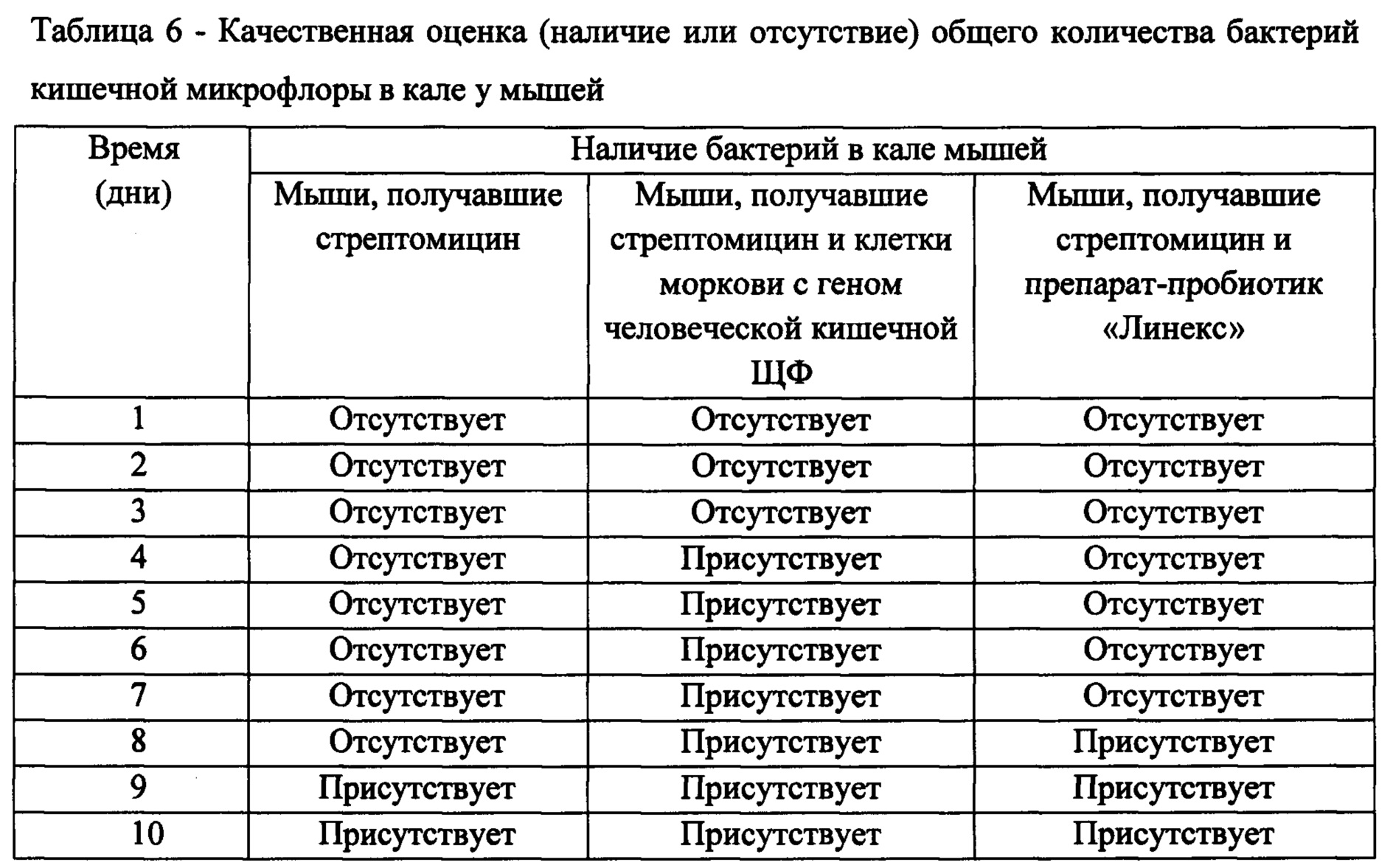
Как демонстрируют полученные данные, у мышей, получавших стрептомицин, рост бактерий был прекращен через 24 часа после приема препарата. Кал животных этой группы оставался стерильным на протяжении 8 суток и начинал восстанавливаться на 9-е сутки. У мышей, получавших стрептомицин вместе с клетками моркови содержащими ген человеческой кишечной ЩФ, микрофлора начала восстанавливаться через 4 суток. При этом, в группе животных, получавших стрептомицин и препарат сравнения - пробиотик «Линекс», восстановление микрофлоры начиналось только на 8-е сутки.
Таким образом, употребление мышами клеток моркови, содержащих ген человеческой кишечной ЩФ, способствует восстановлению микрофлоры кишечника после лечения антибиотиком стрептомицином.
Пример 15. Клетки моркови, содержащие ген человеческой кишечной ЩФ, ускоряют восстановление кишечной микрофлоры после антибактериальной терапии ампициллином
Эксперимент проводили на мышах стока CD-1. Животные первой группы в течение 7 суток получали внутрижелудочно по 50 мг/кг в сутки антибиотик ампицилин. Животные второй группы одновременно с приемом антибиотика получали лиофильно высушенные клетки моркови, содержащие ген человеческой кишечной ЩФ, в дозе 50 мг/кг в сутки. Животные третьей группы одновременно с приемом антибиотика получали препарат сравнения - пробиотик «Линекс», содержащий лиофилизированные молочнокислые бактерии (Lactobacillus acidophilus, Bifidobacterium infantis, Enterococcus faecium), в дозе 50 мг (капсульной массы)/кг в сутки. Каждый день в течение 3-х недель проводили посевы кала мышей каждой группы на среду LB. Результаты представлены в таблице 7.

Рост бактерий в кишечнике мышей, получавших антибиотик ампициллин, прекратился через 24 часа после начала лечения. В группе мышей, получавшей только ампициллин, нормальная микрофлора кишечника начала восстанавливаться только на 20-е сутки эксперимента. В тоже время, у мышей, принимавших одновременно с ампициллином клетки моркови, содержащие ген человеческой кишечной ЩФ, нормальная микрофлора кишечника начала восстанавливаться уже на 11-е сутки эксперимента. В группе животных, получавших одновременно с ампициллином препарат сравнения - пробиотик «Линекс», восстановление микрофлоры начиналось только на 18-е сутки.
Заявляемое изобретение может найти широкое применение в качестве компонентов продуктов питания для массового потребления, например, молочных продуктов, напитков, кондитерских изделий, а также в составе лечебно-диетических, лечебно-профилактических продуктов, продуктов функционального питания.
Источники информации
1. Bol-Schoenmakers М., Fiechter D., Raaben W., Hassing I., Bleumink R., Kruijswijk D., Maijoor K., Tersteeg-Zijderveld M., Brands R., Pieters R. Intestinal alkaline phosphatase contributes to the reduction of severe intestinal epithelial damage // Eur J Pharmacol. 2010 / - Vol. 633(1-3). - P. 71-77. doi: 10.1016/j.ejphar.2010.01.023. Epub 2010 Feb 2.
2. Brenchley, J.M., Prince D.A., Schacker T.W., Ascher Т.Е., Silvestri G., Rao S., Kazzaz Z. et al. Microbial translocation is a cause of systemic immune activation in chronic HIV infection / // Nat. Med. - 2006. - №1 Bird AP. CpG islands as gene markers in the vertebrate nucleus. Trends Genet 1987; 3: 342-7. 2. - P. 1365-1371. PMID: 17115046 DOI: 10.1038/nm1511.
3. Cadwell K., Patel K.K., Maloney N.S., Liu T.C., Ng A.C., Storer C.E., Head R.D., Xavier R., Stappenbeck T.S., Virgin H.W. Virus-plus-susceptibility gene interaction determines Crohn's disease gene Atg16L1 phenotypes in intestine // Cell. 2010. - Vol. 141. - P. 1135-1145. DOI: 10.1016/j.cell.2010.05.009.
4. Eskandari M.K., Kalff J.C., Billiar T.R., Lee K.K., Bauer A.J. LPS-induced muscularis macrophage Nathan CF. Secretory products of macrophages // J Clin Invest. 1987. - Vol. 79. - P. 319-326.
5. Jiang, W., Lederman M.M., Hunt P., Sieg S.F., Haley K., Rodriguez В., Landay A., Martin J., Sinclair E., Asher A.I., Deeks S.G., Douek D.C., Brenchley J.M. Plasma levels of bacterial DNA correlate with immune activation and the magnitude of immune restoration in persons with antiretroviral-treated HIV infection // J. Infect. Dis. - 2009. - №199. - P. 1177-1185. PMID: 19265479 PMCID: PMC2728622 DOI: 10.1086/597476.
6. Kats S., Brands R., Hamad M.A.S. Seinen W., Schamhorst V., Wulkan R.W., Schonberger J., P., van Oeveren W. Prophylactic treatment with cardiac surgery induces end phosphatase release // Int J Artif Organs 2012. Vol. 35. No 2. P. 144-151.
7. Maloy K.J., Powrie F. Intestinal homeostasis and its breakdown in inflammatory bowel disease // Nature. 2011. - Vol. 474. - P. 298-306. PMID: 2167774, DOI:10.1038/nature10208
8. Matzinger P. The danger model: a renewed sense of self // Science. 2002. - N. 12. Vol. 296(5566). - P. 301-305. PMID: 11951032, DOI: 10.1126/science.1071059.
9. Molnar K., Vannay A., Szebeni В., Banki N.F, Sziksz E., Cseh A.,


10. Muginova S.V., Zhavoronkova A.M., Polyakov A.E., Shekhovtsova T.N. Application of alkaline phosphatases from different sources in pharmaceutical and clinical analysis for the determination of their cofactors; zinc and magnesium ions // Anal Sci 2007. - Vol. 23. - P. 357-363 [PMID: 17372382].
11. Odell J.T., Nagy F., Chua N.H. Identification of DNA sequences required for activity of the cauliflower mosaic virus 35S promoter // Nature. 1985. V. 313. P. 810-812.
12. Park B.S, Lee J.O. Recognition of lipopolysaccharide pattern by TLR4 complexes // Exp Mol Med. 2013. - Vol. 45. - P. 66. http://dx.doi.org/10.1038/emm.2013.97.
13. Pickkers P., Snellen F., Rogiers P., Bakker J., Jorens P., Meulenbelt J., Spapen H., Tulleken J.E., Lins R., Ramael S., Bulitta M.,. van der Hoeven J.G. Clinical pharmacology of exogenously administered alkaline phosphatase // Eur J Clin Pharmacol. 2009. Vol. 65. P. 393-402.
14. Podolsky DK. Inflammatory bowel disease. // N Engl J Med. 2002. - Vol. 347. - P. 417-429.
15. Poelstra K, Bakker WW, Klok PA, et al. A physiologic function for alkaline phosphatase: Endotoxin detoxification. Lab Invest 1997. - Vol. 76(3). - P. 319-327. PMID: 9121115.
16. Rezende, A.A., J.M. Pizauro, et al. (1994). "Phosphodiesterase activity is a novel property of alkaline phosphatase from osseous plate." Biochem J. 1994. - Vol. 301 (Pt 2). - P. 517-522. PMCID: PMC1137111.
17. Riggle K.M., Rentea R.M., Welak S.R., Pritchard K.A., Jr, Oldham K.T., Gourlay D.M. Intestinal alkaline phosphatase prevents the systemic inflammatory response associated with necrotizing enterocolitis // J Surg Res. 2013. - Vol. 180. - P. 21-26. http://dx.doi.org/10.1016/j.jss.2012.10.042.
18. Sabalza M., Christou P., Capell T. Recombinant plant-derived pharmaceutical proteins: current technical and economic bottlenecks // Biotechnol Lett. - 2014. DOI 10.1007/s10529-014-1621-3.
19. Sharma A.K., Sharma M.K. Plants as bioreactors: Recent developments and emerging opportunities // Biotechnology Advances 2009. - Vol. 27. - P. 811-832.
Conley AJ, Joensuu JJ, Richman A, Menassa R Protein body-inducing fusions for high-level production and purification of recombinant proteins in plants. // Plant Biotechnol J. 2011. - Vol. 9. - P. 419-433.
20. Tuin A., Poelstra K., de Jager-Krikken A., Bok L., Raaben W., Velders M.P., Dijkstra G. Role of alkaline phosphatase in colitis in man and rats. Gut 2009; 58: 379-387 [PMID: 18852260 DOI: 10.1136/gut.2007.128868].
21. Weemaes A.M., Meijer D.K., Poelstra K.. Removal of phosphate from lipid A as a strategy to detoxify lipopolysaccharide // Shock. 2002. - Vol. 18. - P. 561-566. http://dx.doi.Org/10.1097/00024382-200212000-00013.
22. Wise A.A., Liu Z., Binns A.N. Three methods for the introduction of foreign DNA into Agrobacterium // Agrobacterium Protocols. Springer, 2006. P. 43-54.
23. Комахин P.А., Комахина B.B., Жученко A.A. 2007. Создание генетических конструкций, содержащих бактериальный ген recA Е. coli для индукции рекомбинации в растениях. Сельскохозяйственная биология. 3,25-32.
Реферат
Изобретение относится к биотехнологии и решает задачу способа получения трансформированных растительных клеток, содержащих рекомбинантную щелочную фосфатазу человека, и его применения для профилактики нарушений микрофлоры желудочно-кишечного тракта и ее восстановления при токсических и стрессовых воздействиях, а также для его применения для профилактики нарушений иммунной системы организма, связанных с нарушениями микрофлоры кишечника и барьерной функции кишечника, и восстановления иммунной системы при ее нарушениях в качестве иммуностимулирующего средства. 3 н. и 6 з.п. ф-лы, 7 табл., 15 пр.

Комментарии