Способ получения ароматического соединения, замещенного третичным нитрилом - RU2182572C2
Код документа: RU2182572C2
Чертежи

Описание
Ссылка на родственные, находящиеся на рассмотрении, заявки
Дается ссылка на заявку США 09/153762, поданную
15 сентября 1998 г., которая является частичным продолжением предварительной заявки США 60/064211, поданной 4 ноября 1997 г. и теперь аннулированной, и соответствующую Европейскую заявку 98308961.6,
основанную на указанной, являющейся частичным продолжением заявки, поданную 2 ноября 1998 г. и опубликованную под номером ЕР-А-0915089 12 мая 1999 г.
Предпосылки изобретения
Настоящее изобретение относится к новому способу получения ароматического соединения, замещенного третичным нитрилом, который применим для получения широкого крута соединений данного типа. Конечные
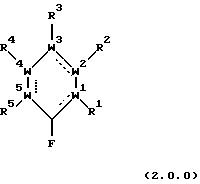
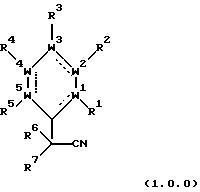
продукты, являющиеся замещенными третичным нитрилом ароматическими соединениями, включают соединения формулы (1.0.0):
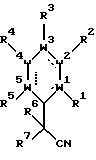
в которой составляющие части W1, W2, W3, W4 и W5 и заместители R1, R2, R3 , R4, R5, R6 и R7 все имеют значения, подробно представленные ниже. Способ настоящего изобретения может быть проиллюстрирован следующей реакционной схемой:
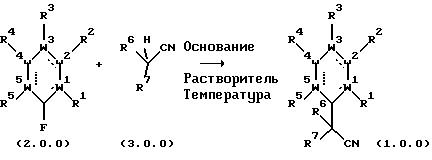
Способ настоящего изобретения представляет способ, который является как легким, так и дает приемлемые выходы целевого продукта. Способ настоящего изобретения отличается от способов, доступных ранее, широкой сферой его применимости и значимостью, которая была обнаружена в отношении химической компенсированности и условий реакции основания, используемого для ускорения реакции, а также третичной структуры нитрила в конечном продукте, которые подробно описаны ниже.
Характер основания, которое используется при осуществлении способа настоящего изобретения, является решающим для получения приемлемых выходов целевого продукта, замещенного третичным нитрилом ароматического соединения, и является отличительной особенностью способа данного изoбpeтeния, по отношению к ранее известным способам. Конъюгат кислоты и основания, которое используется, должен иметь рКа в пределах от около 17 до около 30. Примером основания, которое отвечает этим важным требованиям, является калиевая, натриевая или литиевая соль бис(триметилсилил)амида (KHMDS).
Согласно изобретению, было также обнаружено, что тип растворителя, который используется для осуществления взаимодействия между вторичным нитрилом и замещенным ароматическим соединением, олицетворяет выбор, который очень важен для получения хороших выходов целевого продукта. Выбранный растворитель должен быть апротонным и иметь диэлектрическую постоянную (ε) примерно менее 20. Примерами растворителей, подходящих для использования в способе настоящего изобретения, являются толуол и тетрагидрофуран (ТГФ). Диэлектрическая постоянная ТГФ равна 7,6, а диэлектрическая постоянная толуола равна 2,4 (Handbook of Chemistry and Physics).
Следует заметить, что нитрильный реагент в способе настоящего изобретения является "вторичным" по отношению к степени замещения углеродного атома, к которому присоединен нитрильный фрагмент. Далее очевидно понятно, что в конечных продуктах, получаемых по способу настоящего изобретения, углеродный атом, к которому присоединен нитрильный фрагмент, является "третичным", поскольку он не связан с каким-либо атомом водорода.
Выбор температуры, при которой следует поддерживать реакционную смесь, содержащую вторичный нитрил и ароматическое соединение, менее важен, чем выбор вышеупомянутого основания или растворителя. Однако, соответствующая температура реакции существенна для получения хороших выходов конечного продукта, согласно изобретению, и должна быть в пределах от около 0oС до около 120oС.
Целевые ароматические соединения, замещенные третичным нитрилом, получаемые в соответствии со способом настоящего изобретения, характеризуются широким спектром химических структур и значительным рядом различных областей практической применимости, которые включают использование таких конечных продуктов как для терапевтических, так и нетерапевтических целей.
Предпочтительными целевыми ароматическими соединениями, замещенными третичным нитрилом, получаемыми в соответствии со способом настоящего изобретения, являются продукты, которые полезны как лекарственные средства, особенно, ингибиторы фосфодиэстеразы типа IV (PDE4). Ингибиторы PDE4 применимы при лечении многих заболеваний человека и животных, болезней и болезненных состояний, которые являются аллергическими или воспалительными по происхождению, особенно, включающих астму, хроническое обструктивное заболевание легких, бронхит, ревматоидный артрит и остеоартрит, дерматит, псориаз и аллергический ринит.
Среди таких ингибиторов PDE4, к которым относятся целевые замещенные третичным нитрилом ароматические соединения, имеется предпочтительный класс селективных ингибиторов PDE4, описанный в заявке США 08/963904, поданной 1 апреля 1997 г. , которая является частичным продолжением предварительной заявки США 60/016861, поданной 3 мая 1996 г., в настоящее время аннулированной; и в международной заявке РСТ/IВ97/00323, основанной на указанной предварительной заявке, поданной 1 апреля 1997 г., указывающей США и опубликованной как WO 97/42174 13 ноября 1997 г.
Вышеуказанный предпочтительный класс селективных ингибиторов PDE4
может быть иллюстрирован следующей общей формулой (4.0.0):

в которой Ra представляет водород, (С1-С6)алкил, фенил или (С1-С3)алкилфенил, причем указанные фенильные группы необязательно замещены одним или двумя заместителями: -(C1-C4)-алкил, -O(С1-С3)алкил, Вr или Сl;
R представляет водород, (С1-С6)алкил, -(СН2)n-(С3 -С7)циклоалкил, где n равно от 0 до 2, или -(Z')b(С6-С10)арил, где b равно 0 или 1, a Z' представляет (С1-С6)алкилен или (С2 -С6)-алкенилен, причем указанные алкильные или арильные фрагменты указанных R-групп необязательно замещены одним или несколькими из галогена, предпочтительно F или Сl, гидрокси, (С1-С5)алкил, (С1-С5)алкокси или трифторметила; и
R1 представляет водород, (С1-С6)алкил, фенил или (С3 -С7)-циклоалкил, среди которых указанные алкильные или фенильные R1-группы необязательно замещены заместителями в количестве вплоть до трех: метил, этил, трифторметил или галоген. Указанный предпочтительный класс селективных ингибиторов PDE4 далее может быть проиллюстрирован на примере более предпочтительных конкретных соединений формул (4.0.1) и (4.0.2):
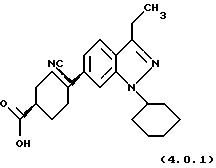
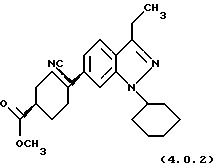
Способ получения вышеописанного класса селективных ингибиторов PDE4 раскрыт в заявке США 09/153762, поданной 15 сентября 1998 г., которая является частичным продолжением предварительной заявки США 60/064211, поданной 4 ноября 1997 г. и в настоящее время аннулированной; и в соответствующей Европейской заявке, основанной на указанной заявке с частичным продолжением, поданной и опубликованной как ЕР-А-0. В частности, в вышеупомянутых заявках раскрыта следующая процедура синтеза для обработки индазола формулы (2.1.0) цикло-гексан-1,4-дикарбонитрилом формулы (3.1.0) с получением целевого замещенного третичным нитрилом ароматического соединения формулы (4.0.3):
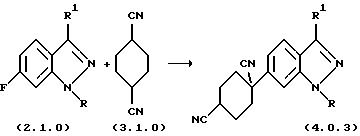
Описывается, что вышеуказанная процедура синтеза осуществляется в присутствии основания, такого как литий-бис-(триметилсилил)-амид, натрий-бис(триметилсилил} -амид, калий-бис-(триметилсилил)-амид (КНМDS), диизопропиламид лития или литий-2,2,6,6-тетраметилпиперидин. Описывается, что вышеуказанные основания являются селективными и обеспечивают довольно высокие выходы при присоединении циклогексан-1,4-дикарбонитрила формулы (2.0.1) к R- или R1-замещенному индазолу формулы (2.0.0), с вытеснением у последнего атома фтора и при сохранении на месте при этом обеих функциональных карбонитрильных групп. Дополнительно поясняется, что предпочтительно использовать калий-бис(триметилсилил)амид (KHMDS) в качестве промотирующего основания, в растворителе, например, тетрагидрофуране, толуоле или ксилоле (-ах), предпочтительно, в толуоле, при температуре между около 25oС и около 125oС, предпочтительно около 100oC, в течение времени от 1 часа до 15 часов, предпочтительно около 5 часов, для того, чтобы получить приемлемые выходы целевого, замещенного третичным нитрилом, ароматического соединения формулы (1.0.0).
Описание уровня
техники
Публикация
Loupy et al., Synth.Comm., 1990, 20, 2855-2864, касается использования катализаторов перехода твердой фазы в жидкую без растворителей для осуществления реакций SnAr на ди- или
моно-нитрогалоген-соединениях и неактивированных арилгалогенидах. Реакцию проводят с нуклеофильным агентом, например Ph2CHCN, в присутствии основания, например,
стехиометрического
количества распыленного твердого КОН, и катализатора, например, соли тетраалкиламмония, такой как Aliquat 336 или TDA-1, реакция может быть представлена следующей реакционной
схемой:

В отличие от способа настоящего изобретения, способ, описанный Loupy et al. , осуществляется с хлор-, бром- или фтор-замещенным ядром арена и обеспечивается дефицитом электронов в ядре арена, обусловленным дополнительным присутствием нитрогруппы.
Публикация
Makosza et al., J.Org.Chem.,
1994, 59, 6796-6799, также относится к нуклеофильному замещению галогена в п-галогеннитробензолах и раскрывает подробно реакцию, которая может быть представлена следующей
реакционной схемой:

Способ, описанный Makosza et al., использует этилцианоацетат и может осуществляться или с хлор-, или с фторзамещенным ядром арена. Ни один из этих признаков способа Makosza et al., однако, не может быть использован в способе настоящего изобретения.
Rose-Munch et al. ,
J.Organomet.Chem., 1990, 335(1), C1-С3, раскрывает синтез α-замещенных арилиминонитрилов путем присоединения α-иминонитрила к комплексам (фторарен)-трикарбонилхрома
в присутствии
основания, например, гексафосфотриамида (НМРТ) с предшествующим литиированием, например, диизопропиламинолитием. Включена, в частности, реакция, которая может быть представлена
следующей реакционной
схемой:
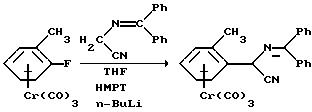
Способ, описанный Rose-Munch et al., индуцирует недостаток электронов в ядре фторзамещенного арена путем образования комплекса его с трикарбонилхромом, что позволяет последующее вытеснение фтора литиевым анионом из ядра арена. Однако, ход синтеза в способе Rose-Munch et al. существенно отличается от способа настоящего изобретения, в котором литиирование является неработоспособным.
Plevey и Sampson, J. Org.Chem.Soc., 1987, 2129-2136,
касается синтеза
4-амино-2,3,5,6-тетрафторглютетимида и, как часть этого получения, описывает реакцию гексафторбензола с этилцианоацетатом в присутствии калийкарбонатного основания, которая может
быть
проиллюстрирована следующей реакционной схемой:
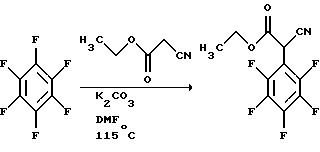
Sommer et al. , J. Org. Chem., 1990, 55, 4817-4821, описывает способ, включающий вытеснение галогена из 2-галоген-замещенного бензонитрила, присутствующего в качестве стабилизированного карбаниона, для того, чтобы получить (2-цианоарил)арилацетонитрилы. Процесс осуществляют с использованием двух эквивалентов сильного основания, например, трет-бутоксида калия, и отмечается, что он чувствителен к природе основания, растворителя, например, диметилформамида (DMF), уходящей группе, заместителям в кольце и типу рассматриваемых колец. Указывается, что способ применим также к гетероароматическим соединениям с орто-расположенными галоген- и цианогруппами. Способ Sommer et al. может быть проиллюстрирован следующей реакционной схемой:
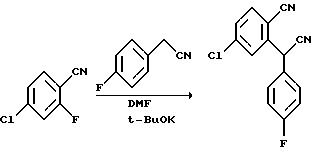
Способ Sommer et al. существенно отличается от способа данного изобретения тем, что имеет место вытеснение и хлоридного, и фторидного заместителей в ядре арена, и далее тем, что используется вторичный нитрильный заместитель, который индуцирует недостаток электронов в замещенном ядре арена для того, чтобы облегчить последующее вытеснение.
Краткое раскрытие изобретения
Настоящее изобретение включает новый способ получения ароматического соединения, замещенного третичным нитрилом, включающий обработку ароматического соединения
формулы (2.0.0):
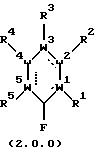
в которой составляющие части W1, W2, W3, W4 и W5 и заместители R1, R2, R3, R4 и R5 все имеют значения, представленные подробно ниже;
вторичным нитрилом формулы (3.0.0):
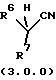
в которой заместители R6 и R7 оба имеют значения, подробно охарактеризованные ниже; в присутствии основания, имеющего числовое значение рКа в интервале примерно от 17 до 30, при условии, что разница между числовыми значениями рКа указанного основания и соответствующего вторичного нитрила формулы (3.0.0) не более 6; в апротонном растворителе с диэлектрической постоянной (ε) менее чем около 20; и при температуре в пределах примерно от 0oС до 120oС; с получением в результате целевого продукта - замещенного третичным нитрилом ароматического соединения формулы (1.0.0):

в которой R1, R2, R3, R4, R5, R6 и R7, а также W1, W2, W3, W4 и W5 все имеют значения, что определены здесь где-либо.
Подробное описание изобретения
Настоящее изобретение относится к новому способу получения ароматического соединения, замещенного третичным нитрилом. В предпочтительном варианте осуществления способа исходное вещество, подвергаемое
обработке, включает ароматическое соединение формулы (2.0.0):
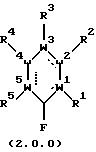
в которой: (I) каждая из пунктирных линий независимо обозначает отсутствие связи или связь, так что в соответствующих положениях ароматического соединения формулы (1.0.0) или (2.0.0) имеется простая или двойная связь, при условии, что, по крайней мере, одна из упомянутых пунктирных линий обозначает связь;
(II) W1, W2, W3, W4 и W5 каждый независимо является членом, выбранным из группы, включающей:
(A) С (углерод) и пунктирная линия, связанная с ним, представляет связь;
(B) N (азот) и пунктирная линия, связанная с ним, представляет отсутствие связи или связь;
(C) О и пунктирная линия отсутствуют;
(D) S(=O)k, где k - целое число, выбранное из 0, 1 и 2, и пунктирная линия отсутствует; и
(Е) отсутствует, что приводит к получению 5-членного кольца; при условии, что каждый из W1-W5 выбран так, что отсутствует не более одного из них, не более чем один представляет О или S(=O)k, необязательно вместе с одним N в каждом случае, и не более чем четыре представляют N, где только N присутствует;
(III) R1, R2, R3, R4 и R5 - каждый независимо выбран таким образом, что:
(A) когда соответствующий W1-W5 представляет О или S(=O)k, указанный R1-5 отсутствует;
(B) когда соответствующий W1-5 представляет С, указанный R1-5 представляет собой заместитель, независимо выбранный из группы, включающей водород; галоген, выбранный из Cl, Br или I; -N(R12)2, -SR12; -OR12; (C1-C6)-алкил, замещенный 0-3 R9, -N(R12)2, -SR12, -OR12; (C2-C6)-алкенил, замещенный 0-3 R9; (С3-С6)алкинил, замещенный 0-3 R9; (С3-С14) карбоциклическую кольцевую систему, замещенную 0-3 R9 или 0-3 R10; гетероциклическую кольцевую систему, независимо выбранную из группы, включающей фуранил, тиенил, пирролил, имидазолил, пиридил, пиразолил, пиримидинил, бензофуранил, бензотиенил, индолил, бензимидазолил, тетрагидроизохинолинил, бензотриазолил и тиазолил, причем указанная гетероциклическая кольцевая система замещена 0-2 R10; и любые два R1-5, присоединенные к примыкающим углеродным атомам, вместе образуют 3- или 4-углеродную цепочку, образующую сконденсированное 5- или 6-членное кольцо, причем указанное кольцо необязательно замещено по любому алифатическому атому углерода членом, выбранным из группы, состоящей из галогена, выбранного из Сl, Br и I; (С1-С4)алкила; (С1-С4)алкокси; и -NR15R16, где
(1) R9 - заместитель, независимо выбранный из группы, состоящей из водорода; циано; -CH2NR15R16; -NR15R16; -R15; -OR15; -(С2-С6) алкоксиалкила;
(С2 -С6)алкенила; (С3-С7)циклоалкила; (С3-С6)-циклоалкилметила; фенетила; фенокси; бензилокси; (С3-С6 )циклоалкокси; (С1-С4)алкила, замещенного членом, выбранным из группы, состоящей из метилендиокси, этилендиокси, фенил (С1-С3)алкила и (С5-С14 )карбоциклического остатка; и 5-10-членной гетероциклической кольцевой системы, содержащей 1-4 гетероатома, независимо выбранных из кислорода, азота и серы, замещенных 0-3 заместителями R15 где:
(a) R15 - заместитель, выбранный из группы, включающей фенил, замещенный 0-3 R11; бензил, замещенный 0-3 R11; (С1-С6 )алкил, замещенный 0-3 R11; (С2-С4)алкенил, замещенный 0-3 R11; и (С2-С6) -алкоксиалкил, замещенный 0-3 R11;
где R11 - заместитель, независимо выбранный из группы, включающей циано; -CH2NR18R19; -NR18R19; (С3-С6) алкоксиалкил; (С1-С4)алкил; (С2-С4)алкенил; (С3-С10)-циклоалкил; (С3-С6)циклоалкилметил; бензил; фенетил; фенокси; бензилокси; (С7-С10)арилалкил; (С3-С6)циклоалкокси; метилендиокси; этилендиокси; (С5-С14)карбоциклический остаток; и 5-10-членную гетероциклическую кольцевую систему, содержащую 1-4 гетероатома, независимо выбранных из кислорода, азота и серы;
где R18 и R19 - каждый независимо выбран из группы, включающей (С1-С6)алкил; и фенил, замещенный 0-3 R11;
(b) R16 - заместитель, выбранный из группы, включающей (С1-С4)алкил, замещенный 0-3 группами, выбранными из группы, включающей (C1-C4)-алкокси; (С2-С6)алкоксиалкил; (С2-С6)алкенил; фенил и бензил;
(2) R10, когда он является заместителем у атома углерода, представляет член, независимо выбранный из группы, включающей фенил; бензил; фенетил; фенокси; бензилокси; галоген; циано; (С1-С4)алкил; (С3-С7)-циклоалкил; (С3-С6)циклоалкилметил; (С1-С6)алкокси; (С1-С4 )алкокси-(С1-С3)алкил;
(С3-C6)циклоалкокси; (C1-C6)-алкилтио; (С1-С4)алкилтио(С1 -С3)алкил; -OR15; -NR15R16; (С1-С4)алкил, замещенный группой -NR15R16; (С2-С6 )алкоксиалкилен, необязательно замещенный группой Si[(С1-С3)алкил]3; метилендиокси; этилендиокси; -S-(O)mR15, -SO2NR15 R16; -OCH2CO2R15; -C(R16)= N(OR16); и 5-6-членную гетероциклическую кольцевую систему, содержащую 1-4 гетероатома, выбранных из кислорода, азота и серы; или
R10, когда он является заместителем у атома азота, представляет член, независимо выбранный из группы, включающей фенил; бензил; фенетил (С1 -С4)алкил; (С1-С4)алкокси; (С3-С6) циклоалкил; (С3-С6)циклоалкилметил;
(С2-С6)алкоксиалкил; -CH2NR15R16; -NR15R16 и -C(R16)=N(OR16);
где R15 и R16 имеют те же значения, что перечислены выше;
(3) R12 является заместителем, выбранным из группы, включающей (С1-С6)алкил, замещенный 0-3 R9; и (С3-С6 )алкоксиалкил, замещенный 0-3 R9;
где R10 имеет те же значения, что перечислены выше;
и
(С) когда соответствующая группа W1-5 представляет азот, указанные R1-5 являются членом, независимо выбранным из группы, включающей фенил; бензил; фенетил; фенокси; (С1-С4)алкил; (С1-С4)алкокси; (С3-С6 )циклоалкил; (С3-С6)-циклоалкилметил; -CH2NR15R16; -NR15R16; (С2-С6 )алкоксиалкил; и -C(R16 )=N(OR16);
где R15 и R16 имеют значения, определенные выше.
Вышеописанное исходное вещество, представляющее
соединение формулы (2.0.0), вводят
во взаимодействие со вторичным нитрилом формулы (3.0.0):
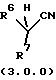
в которой заместители R6 и R7 имеют значения, подробно охарактеризованные ниже;
в присутствии основания, конъюгат которого с кислотой имеет рКа в пределах примерно от 17 до 30, при условии, что разница между числовыми значениями рКа указанного основания и указанного соответствующего вторичного нитрила формулы (3.0.0) составляет не более 6 и предпочтительно не более 4; в апротонном растворителе с диэлектрической постоянной (ε) менее чем примерно 20; и при температуре в пределах от около 0oС до около 120oС, в результате чего образуется замещенное третичным нитрилом ароматическое соединение формулы (1.0.0):

в которой R1, R2, R3, R4, R5, R6 и R7, а также W1, W2, W3, W4 и W5 все имеют значения, определенные в описании.
Одним из ключевых признаков способа настоящего изобретения является то, что требуется, чтобы нитрильный фрагмент был третичным в
конечном продукте формулы (1.0.0) и,
следовательно, для замещения этот реагент должен быть вторичным, как показано формулой (3.0.0):
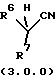
в которой R6 и R7, соответственно, не могут иметь значение водород. Способ данного изобретения дает подходящие результаты, даже когда R6 и R7 имеют значительный ряд различных значений. Соответственно, во вторичных нитрильных реагентах формулы (3.0.0):
R6 и R7 каждый независимо выбран из группы, включающей -N(R12)2; (С1-С6)алкил, замещенный 0-3 R9; -N(R12)2; -SR12; -OR12; (С2-С6)алкенил, замещенный 0-3 R9; (С3-С6)алкинил, замещенный 0-3 R9; (С3-С14)карбоциклическую кольцевую систему, замещенную 0-3 R9 или 0-3 R10; и гетероциклическую кольцевую систему, независимо выбранную из группы, включающей фуранил, тиенил, пирролил, имидазолил, тетрагидропиранил, пиридил, пиперидинил, пиразолил, пиримидинил, бензофуранил, бензотиенил, индолил, бензимидазолил, тетрагидроизохинолинил, бензотриазолил и тиазолил, причем указанная гетероциклическая кольцевая система замещена группами 0-2 R10; или
R6 и R7 взяты вместе, образуя (С3-С14)карбоциклическую кольцевую систему, замещенную 0-3 R9 или 0-3 R10; фенил, 1- или 2-нафтил, замещенный 0-3 R9 или 0-3 R10; или гетероциклическую кольцевую систему, независимо выбранную из группы, включающей фуранил, тиенил, пирролил, имидазолил, тетрагидропиранил, пиридил, пиперидинил, пиразолил, пиримидинил, бензофуранил, бензотиенил, индолил, бензимидазолил, тетрагидроизохинолинил, бензотриазолил и тиазолил, причем указанная гетероциклическая кольцевая система замещена 0-2 R10, где
R9, R10, R12, R15 и R16 каждый имеет значения, определенные выше при определении R1-5.
В соответствии со способом настоящего изобретения требуется, чтобы реакция, которая имеет место между ароматическим соединением формулы (2.0.0) и вторичным нитрилом формулы (3.0.0), протекала в присутствии основания, имеющего рКа в пределах примерно от 17 до 30, при условии, что разница между числовыми значениями рКa указанного основания и соответствующего вторичного нитрила формулы (3.0.0) составляет не более чем примерно 6 и предпочтительно не более примерно 4, в апротонном растворителе, имеющем диэлектрическую постоянную (ε) менее около 20, и при температуре в пределах от около 0oС до около 120oС.
Характер основания, которое используют при осуществлении способа настоящего изобретения, является решающим для получения приемлемых выходов целевого продукта - замещенного третичным нитрилом ароматического соединения, что является отличием способа настоящего изобретения от ранее известных способов. Относительная сила основания, которое используется в способе настоящего изобретения, должна быть как можно более близкой к относительной силе основания вторичного нитрильного реагента формулы (3.0.0), который используется в данном процессе. Далее, желательно количественно оценить относительную силу основания, которое должно использоваться. Такая количественная оценка позволит большую проницательность в выборе основания, а также позволит более точное сравнение относительной силы основания с соответствующей относительной силой вторичного нитрильного реагента.
Для того чтобы количественно определить относительную силу основания для использования в способе
настоящего изобретения, здесь используется константа диссоциации,
Ка основания и соответствующего вторичного нитрила формулы (3.0.0). Константа диссоциации определяется как константа
равновесия для переноса протона от кислоты НА к воде и вычисляется по
следующей формуле:
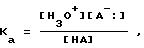
где величины в скобках означают молярные концентрации при равновесии для кислоты и ее диссоциированных составляющих. Для удобства константы диссоциации выражают в виде отрицательного логарифма, обозначенного р. Так рКа=-lоg Ка. Более сильные кислоты имеют более высокие константы диссоциации, но соответственно меньшие величины рКа. Величина, которая может использоваться для количественной оценки сравнительной разницы между силой основания и соответствующего вторичного нитрила, используемых в способе настоящего изобретения, оказывается полезной при осуществлении данного способа.
Соответственно, относительная сила основания А-: и соответствующего вторичного нитрила, о которых идет речь, удобно выражается в виде рКа его конъюгатной кислоты НА. Когда основание характеризуется как сильное основание, обратное утверждение также по существу справедливо, т.е., что его конъюгатная кислота является слабой кислотой. Таким образом, числовые значения рКа для конъюгатных кислот двух или нескольких оснований позволит легко сравнить эти основания и быстро разместить их в соответствии с тем, какое является более сильным основанием и какое из них является более слабым основанием. Более сильное основание имеет конъюгатную кислоту с более высоким числовым значением рКа. В данном описании способа настоящего изобретения, когда будет прямо или косвенно утверждаться, что за данное основание имеем какое-либо числовое значение рКа, это следует понимать, что обсуждаемое числовое значение рКа является значением конъюгатной кислоты указанного основания.
Основание, используемое в способе настоящего изобретения, предпочтительно имеет числовое
значение рКа, насколько возможно близкое к значению вторичного
нитрила формулы (3.0.0), используемого в данном процессе. Следовательно, основываясь на числовых значениях рКа
вторичного нитрила формулы (3.0.0), которые являются подходящими для
использования в способе настоящего изобретения, считается, что существенное требование состоит в том, что основание, используемое
в способе настоящего изобретения, должно иметь величину рКа
в пределах от около 17 до около 30. Другое требование заключается в том, что разница в числовых значениях рКа между
указанным основанием и указанным вторичным нитрилом формулы (3.0.0),
используемым в способе настоящего изобретения, должна быть не более около 6 и предпочтительно не более около 4. Вторичный нитрил
формулы (3.0.0), используемый в данном способе, имеет общую химическую
структуру, которая может быть представлена следующей формулой (3.0.1):

в которой кислотный протон выделен курсивом.
Предпочтительным основанием для использования в способе настоящего изобретения,
которое отвечает вышеприведенным важным требованиям, является калиевая,
натриевая или литиевая соль бис(триметилсилил)амида, называемого также гексаметилдисилазан (HMDS). Калиевая соль HMDS
предпочитается натриевой или литиевой соли, а натриевая соль HMDS предпочтительнее
литиевой соли. В предпочтительном варианте способа настоящего изобретения применяются только калиевая или натриевая
соли HMDS. Предпочтительное основание KHMDS может быть представлено формулой
(5.0.0):
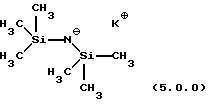
Другие основания этого типа также могут использоваться, например, основания, представленные следующей структурной формулой (5.0.1):
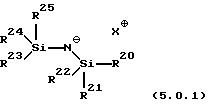
в которой R20, R21, R22, R23, R24 и R25, каждый независимо, выбран из группы, включающей (С1-С5)алкил и фенил; а Х+ представляет подходящий катион, предпочтительно выбранный из группы, включающей калий, натрий и литий. Предпочтительным основанием является основание, в котором каждый из R20-R25 является метилом, приводя к KHMDS формулы (5.0.0) выше. Еще одним предпочтительным основанием является такое, в котором одна R-группа на каждом атоме Si представляет трет-бутил, а остальные R группы все имеют значение метил, например, R21-R24 - оба трет-бутилы, a R20, R22, R23 и R25 каждый является метилом. Еще одним предпочтительным основанием является такое, в котором две R-группы на каждом атоме Si являются трет-бутильными, тогда как две остающиеся R группы обе имеют значения фенил, например, R20, R22, R23 и R25 каждый является трет-бутилом, a R21 и R24 - оба являются фенилами.
В соответствии со способом настоящего изобретения тип растворителя, который используется для проведения реакции между вторичным нитрилом и ароматическим соединением, подчиняется выбору, который также является решающим для получения приемлемых выходов конечного продукта. Выбранный растворитель должен быть апротонным и иметь значение диэлектрической постоянной (ε) менее около 20. Как это хорошо известно, растворители могут быть классифицированы в соответствии с тем, могут они действовать или нет как доноры водородных связей. Растворители, которые могут быть донорами водородных связей, такие как вода и спирты, классифицируются как протонные растворители. Те растворители, которые не могут быть донорами водородных связей, такие как гексан и четыреххлористый углерод, классифицируются как апротонные растворители. Для того чтобы растворитель был подходящим для использования в способе настоящего изобретения, он должен быть апротонным растворителем. Так что толуол и четыреххлористый углерод, два предпочтительных растворителя, используемых в способе настоящего изобретения, являются оба апротонными растворителями.
Еще одним критерием, которому
должен удовлетворять растворитель,
чтобы быть пригодным для использования в способе настоящего изобретения, является то, что он должен иметь величину диэлектрической постоянной (ε) менее чем
около 20. Диэлектрическая постоянная
(ε) растворителя есть количественная мера его способности растворителя разделять ионы. Это свойство связано в определенной степени с тем, является ли
растворитель полярным или неполярным.
Растворители с относительно низкими диэлектрическими постоянными (ε) являются
обычно неполярными; и наоборот, растворители с относительно
высокими диэлектрическими постоянными (ε
) являются обычно полярными растворителями. Примером растворителя с высокой диэлектрической постоянной (ε), который, как было найдено, неподходящ
для использования в способе настоящего
изобретения, является N-метил-α-пирролидон (ММР), чья ε =32,2. Как уже отмечалось, диэлектрические постоянные ((ε)) толуола и
тетрагидрофурана (ТГФ), двух предпочтительных
растворителей для применения в способе настоящего изобретения, равны 2,4 и 7,6, соответственно.
Как уже отмечалось, примерами подходящих растворителей для использования в способе настоящего изобретения являются толуол и тетрагидрофуран. Другие подходящие растворители, удовлетворяющие вышеуказанному требованию, включают, но не ограничиваются ими: гексан, бензол, о-, м- и п-ксилол, диэтиловый эфир, диизопропиловый эфир, метил-трет-бутиловый эфир и 1,2-диметоксиэтан. Объемом настоящего изобретения охватывается так и использование смеси двух или более подходящих растворителей из числа вышеперечисленных. Предпочтительно использовать один растворитель сам по себе, но могут возникнуть различные условия, которые потребуют или при которых окажется более выгодным использовать смесь растворителей, а не один единственный растворитель. Такие условия включают, но не ограничиваются ими, проблемы растворимости реагентов, желание регулировать температуру, при которой осуществляется процесс, доступность и стоимость растворителей, которые используются; и выделение конечного продукта из реакционной смеси и его последующая очистка.
Важность характера выбора основания и растворителя, с которыми предполагается работать вместе в качестве системы основание/растворитель в способе данного изобретения, подтвердилась при определении того, что многие такие сочетания оказались или непригодными для получения замещенного третичным нитрилом ароматического соединения, или дают неприемлемо низкие выходы целевого продукта. Например, было установлено, что при использовании системы основание/растворитель, включающей калий-бис(триметилсилил)амид (KHMDS) в качестве основания и либо толуол, либо тетрагидрофуран (THF) в качестве растворителя, можно получать конечный продукт - замещенное третичным нитрилом ароматическое соединение согласно способу настоящего изобретения с выходом 85 вес. % или более, чаще 90 вес.% или более, и часто 95 вес.% или более, в расчете на вес компонентов реакции.
Выражение "неприемлемо низкие выходы" использовано здесь для противопоставления неожиданно высоких результатов, получаемых по способу настоящего изобретения, тем неудовлетворительным результатам, которые достигались в ранее известных способах. Понятно, что удивительное повышение выхода, достигаемое в способе настоящего изобретения, не всегда должно отражаться исключительно в высоком процентном выражении выхода, самом по себе. Так, возможны случаи, когда для данного конечного продукта формулы (1.0.0) ранее известные способы не работают, что приводит к выходу 0%, или же ранее известные способы дают целевой продукт с крайне низким выходом. Соответственно понятно, что 25% выход, получаемый с использованием способа настоящего изобретения, может составить неожиданное усовершенствование по сравнению с результатами ранее известных способов, когда указанные способы дают, например, 0% или >1% выход того же конечного продукта. Процентные величины выходов, достигаемые по способу настоящего изобретения, описываются подробно в других местах описания.
Примеры таких неудач ранее известных способов давать конечный продукт обильны. Например, когда в качестве основания использовали литий-диизопропиламид (LDA), даже при использовании в качестве растворителя тетрагидрофурана (THF), который в других случаях был подходящим, происходило разрушение первоначальной реакционной смеси. Аналогично, когда в качестве системы основание/растворитель использовали трет-бутилоксид калия (t-BuOK) в тетрагидрофуране (THF), происходило разрушение начальной реакционной смеси. Когда основание выбирают из карбоната цезия, натрия или калия (СsСО3, Na2CO3 или K2СО3 соответственно) и используемый растворитель - тетрагидрофуран, реакция вообще не идет.
Компонент-растворитель в системе основания/растворитель также является важным для получения приемлемых результатов. Например, когда в качестве основания выбирают калий-бис-(триметилсилил)амид (KHMDS), который в других случаях оказывается подходящим, а растворителем является диметилсульфоксид (DMSO), реакция вообще не идет. Далее, когда основанием является калий-бис(триметилсилил)амид (KHMDS), а растворителем N-метил-α-пирролидон (NMP), процесс приводит к получению конечного продукта - ароматического соединения, замещенного третичным нитрилом с неприемлемо низким выходом около 5 вес.% или менее в расчете на вес реакционных компонентов.
Выбор температуры, при которой следует поддерживать реакционную смесь, содержащую третичный нитрил и замещенное ароматическое соединение, согласно способу настоящего изобретения, является менее решающим моментом, чем выбор вышеупомянутой системы основания и растворителя. Однако, соответствующая температура реакции существенна для получения приемлемых выходов целевого замещенного третичным нитрилом ароматического соединения в соответствии с настоящим изобретением и должна быть в пределах от около 0oС до около 120oС, предпочтительно в пределах от около 20oС до около 110oС, более предпочтительно в пределах от около 30oС до около 105oС и наиболее предпочтительно в пределах от около 40oС до около 100oС. На выбор температуры, при которой в соответствии со способам настоящего изобретения осуществляется реакция, будет влиять, помимо других факторов, количество времени, требуемое для осуществления указанной реакции до достаточной степени завершения. Было найдено, что обычно, когда температуры, используемые при осуществлении процесса, находятся в вышеуказанных пределах, и в частности, в вышеуказанном предпочтительном, более предпочтительном и наиболее предпочтительном интервале, процесс настоящего изобретения, по существу, завершается в течение от около 0,1 часа до около 50 часов, более подходяще от около 0,5 часа до около 30 часов и наиболее подходящим образом от около 1 часа до около 18 часов.
Способ получения по настоящему изобретению может быть представлен следующей
схемой:
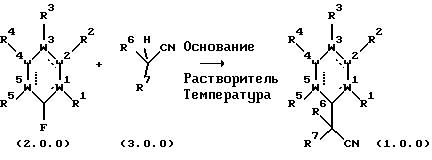
На вышеприведенной схеме исходный материал формулы (2.0.0) подвергается взаимодействию со вторичным нитрилом формулы (3.0.0) в присутствии основания, такого как калий-бис(триметилсилил)амид (KHMDS), в растворителе, таком как толуол, тетрагидрофуран, диэтиловый эфир, диизопропиловый эфир, метил-трет-бутиловый эфир, 1,2-диметоксиэтан или смеси вышеупомянутых растворителей, предпочтительно, в толуоле или тетрагидрофуране, при температуре между 0oС и 120oС, предпочтительно между 40oС и 100oС, давая конечный продукт формулы (1.0.0). Эти предпочтительные варианты воплощения изобретения далее продемонстрированы в рабочих примерах, представленных ниже. Эти примеры предназначены только для иллюстрации настоящего изобретения и никоим образом не имеют целью ограничить объем или сущность способа данного изобретения. Формула изобретения, прилагаемая к описанию, служит для установления объема и сущности настоящего изобретения.
Пример 1.
К раствору арилфторида формулы (2.0.0) в толуоле (10 объемов) добавлялся нитрил формулы (3.0.0), количество эквивалентов которого показано в таблице ниже, и 0,5 М раствор калий-бис(триметилсилил)амида в толуоле, количество эквивалентов которого показано в таблице ниже. Каждую реакционную смесь перемешивали при температуре и в течение времени, также показанных в таблице ниже, после чего каждую реакционную смесь охлаждали до комнатной температуры, выливали в 1 н. НСl и затем экстрагировали толуолом. Органические экстракты промывали водой, высушивали над сульфатом магния, фильтровали и концентрировали. Неочищенный продукт очищали хроматографией на силикагеле, получая желаемый продукт формулы (1.0.0) с выходом, показанным в таблице ниже.
Примеры 2-19.
К раствору арилфторида формулы (2.0.0) в тетрагидрофуране (10 объемов) добавляли нитрил формулы (3.0.0), количество эквивалентов которых указано в таблице ниже; и калий-бис(триметилсилил)амид, количество эквивалентов которого показано в таблице ниже. Каждую реакционную смесь перемешивали при температуре и в течение времени, указанных в таблице, после чего каждую реакционную смесь охлаждали до комнатной температуры, выливали в 1 н. НСl и затем экстрагировали метил-трет-бутиловым эфиром. Органические экстракты промывали водой, сушили над сульфатом магния, фильтровали и концентрировали. Сырой продукт очищали хроматографией на силикагеле, получая желаемый продукт формулы (1.0.0) с выходом, показанным в таблице ниже.
Пример 2. 2-Метил-2-(4-трифторметилфенил)-пропионитрил (1.1.0)
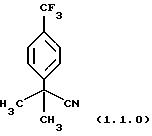
Очищен хроматографией на силикагеле (этилацетат/гексаны 15/85)
1Н-ЯМР (400 МГц, СDСl3) δ 1,73 (с, 6); 7,59 (д, 2, J=9,0); 7,64 (д, 2, J=9,0).
13С-ЯМР (100 МГц, СDСl3) δ 28,90; 37,25; 123,12 (кв., J=272,7); 123,75; 125, 64; 125,93; 130,15 (кв., J=33,2); 145,38.
ИК 2988, 2239, 1622, 1415, 1330, 1170, 1128, 1069, 842 см-1.
Анализ для C11H10F3
N:
Вычислено: С 61,97; Н 4,73; N 6,57.
Найдено: С 61,91; Н 4,96; N 6,61.
Пример 3: 4-(Цианодиметилметил)-бензонитрил (1.1.1)
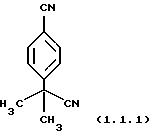
Очищен фильтрованием через слой силикагеля с элюированием этилацетатом. Т. пл.=88-89oС.
1 Н-ЯМР (300 МГц, CDCl3) δ 1,78 (с, 6); 7,64 (д, 2, J=8,1); 7,74 (д, 2, J=8,3).
13С ЯМР (100 МГц, СDСl3) δ 28,87; 37,49; 112,06; 118,19; 123, 32; 126,08; 132,85; 146,48.
ИК (СНСl3) 2989, 2233, 1611, 1505, 1463, 1408, 1371, 1100, 838 см-1.
Анализ для C11H10N2:
Вычислено: С 77,62; Н 5,92; N 16,46.
Найдено: С 77,26; Н 5,90; N 16,52.
Пример 4: 2-(3-Метоксифенил)-2-метилпропионитрил (1.1.2)
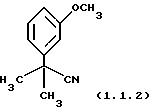
Очищен хроматографией на силикагеле (этилацетат/гексаны 10/90).
1Н ЯМР (300 МГц, CDCl3) δ 1,75 (c, 6); 3,86 (с, 3); 6,88 (дд, 1, J=2,5; 8,3); 7,04-7, 06 (м, 1); 7,07-7,11 (м, 1); 7,34 (т, 1, J=8,3).
13C ЯМР (100 МГц, СDСl3) δ 29,02; 37,09; 55,24; 111,40; 112,60; 117,23; 124,41; 129,91; 142,93; 159,83.
ИК 2983, 2940, 2236, 1602, 1586, 1489, 1463, 1434, 1294, 1268, 1048, 782 см-1.
Анализ для C11H13NO:
Вычислено: С 75,40; Н 7,48; N
7,99.
Найдено: С 75,61; Н 7,67; N 7,86.
Пример 5:
2-(2-Хлорфенил)-2-метилпропионитрил (1.1.3)
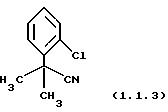
Очищен хроматографией на силикагеле (этилацетат/гексаны 10/90).
1Н ЯМР (300 МГц, СDСl3) δ 1,91 (с, 6); 7,29-7,34 (м, 2); 7,46-7,53 (м, 2).
13С ЯМР (100 МГц, CDCl3) δ 27,19; 36,24; 123,50; 127,00; 127,33; 129,41; 131,92; 133,31; 136,95.
ИК 2984, 2236, 1473, 1432, 1234, 1043, 759 см-1.
Анализ для С10Н10СlN:
Вычислено: С 66,86; Н 5,61; N 7,80.
Найдено: С 67,22; Н 5,64; N 7,63.
Пример 6: 2-(3,5-Диметоксифенил)-2-метилпропионитрил
(1.1.4)
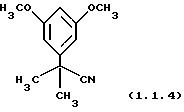
Очищен хроматографией на силикагеле (этилацетат/гексаны 15/85).
1Н ЯМР (300 МГц, СDСl3) δ 1,74 (с, 6); 3,85(с, 6); 6,43 (т, 1, J=2,2); 6,64 (д, 2, J=2,2).
13С ЯМР (100 МГц, СDСl3) δ 29,06; 37,34; 55,44; 99,12; 103,63; 124,44; 143,81; 161,10.
ИК 2982, 2939, 2236, 1598, 1459, 1427, 1207, 1159, 1067, 1052, 696 см-1.
Анализ для C12H15
NO2:
Вычислено: С 70,22; Н 7,37; N 6,82.
Найдено: С 70,17; Н 7,65; N 6,96.
Пример 7: 2-Метил-2-(4-метилпиридин-2-ил)-пропионитрил (1.1.5)
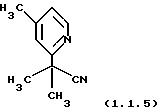
Очищен хроматографией на силикагеле (этилацетат/гексаны 20/80).
1Н ЯМР (300 МГц, СDСl3) δ 1,77 (с, 6); 2,41 (с, 3); 7,08 (дд, 1, J=0,8; 5,0); 7,43 (д, 1, J=0,8); 8,47 (д, 1, J=5,0).
13С ЯМР (75 МГц, СDСl3) δ 22,39; 29,06; 40,54; 121,98; 124,89; 125,66; 149,79; 150,48; 160,55.
ИК 2982, 2238, 1605, 1478, 1130, 995, 830 см-1.
Анализ для C10H12N2:
Вычислено: С 74,97; Н 7,55; N 17,48.
Найдено: С 74,96; Н 7,85; N 17,45.
Пример 8: 2-(4-Метоксифенил)-2-метилпропионитрил (1.1.6)
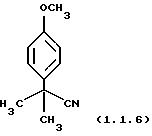
Очищен хроматографией на силикагеле (этилацетат/гексаны 20/80).
1Н ЯМР (300 МГц, СDСl3) δ 1,74 (с, 6); 3,85 (с, 3); 6,94 (д, 2, J=8,9); 7,42 (д, 2, J=8,9).
13С ЯМР (100 МГц, СDСl3) δ 29,25; 36,44; 55,34; 114,19; 124,82; 126,25; 133,50; 159,02.
ИК 2982, 2235, 1513, 1256, 1186, 1033, 831 см-1 .
Анализ для С11H13NО:
Вычислено: С 75,40; Н 7,48; N 7,
99.
Найдено: С 75,48; Н 7,55; N 8,10.
Пример 9:
2-(2-Метоксифенил)-2-метилпропионитрил (1.1.7)
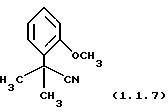
Очищен хроматографией на силикагеле (этилацетат/гексаны 20/80).
1Н ЯМР (300 МГц, СDСl3) δ 1,80 (с, 6); 3,96 (с, 3); 6,97-7,02 (м, 2); 7,29-7,39 (м, 2).
13С ЯМР (100 МГц, CDCl3) δ 27,00; 34,43; 55,51; 112,02; 120,76; 124,80; 125,92; 128,62; 129,39; 157,30.
ИК 2980, 2235, 1493, 1462, 1437, 1253, 1253, 1027, 756 см-1.
Анализ для C11H13NO:
Вычислено: С 75,40; Н 7,48; N 7,99.
Найдено: С 75,29; Н 7,30; N 8,25.
Пример 10:
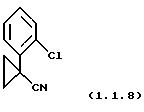
1-(2-Хлорфенил)циклопропанкарбонитрил (1.1.8)
Очищен хроматографией на силикагеле (этилацетат/гексаны 20/80).
1Н ЯМР (300 МГц, СDСl3) δ 1,28-1,38 (м, 2); 1,71-1,75 (м, 2); 7,21-7,3 (м, 4).
13С ЯМР (100 МГц, СDСl3) δ 13,17; 16,27; 121,78; 127,16; 130,07; 131,16; 133,60; 136,54.
ИК 3063, 3020, 1477, 1435, 1051, 1033, 759 см-1 .
Анализ для C10H8ClN:
Вычислено: С 67,62; Н 4,54; N 7,89.
Найдено: С 67,35; Н 4,58; N 7,88.
Пример 11:
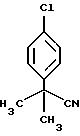
2-(4-Хлорфенил)-2-метилпропионитрил (1.1.9)
Очищен хроматографией на силикагеле (этилацетат/гексаны 10/90).
1Н ЯМР (300 МГц, СDСl3) δ 1,75 (с, 6); 7,39 (д, 2, J=9,0); 7,45 (д, 2, J=8,9).
13С ЯМР (100 МГц, СDСl3) δ 30,34; 38,06; 125,34; 127,80; 130,33; 135,03; 141,22.
ИК 2984, 2237, 1495, 1106, 1013, 828 см-1.
Анализ для C10H10ClN:
Вычислено: С 66,86; Н 5,61; N 7,80.
Найдено: С 66,51; Н 5,83; N 7,74.
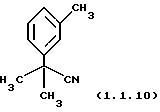
Пример 12: 2-Метил-2-м-толилпропионитрил (1.1.10)
Очищен хроматографией на силикагеле (этилацетат/гексаны 10/90).
1Н ЯМР (300 МГц, СDСl3) δ 1,75 (с, 3); 2,42 (с, 3); 7,14-7,18 (м, 1); 7, 27-7,18 (м, 3).
13С ЯМР (75 МГц, СDСl3) δ 22,81; 30,42; 38,35; 123,26; 125,95; 127, 13; 129,80; 130,09; 139,94; 142,61.
ИК 2983, 2237, 1607, 1490, 1461, 1368, 1198, 1090, 787 см-1.
Анализ для C11H13N:
Вычислено: С 82,97; Н 8,23; N 8,80.
Найдено: С 82,97; Н 8,23; N 8,80.
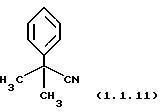
Пример 13: 2-Метил-2-фенилпропионитрил (1.1.11)
Очищен хроматографией на силикагеле (этилацетат/гексаны 10/90).
1Н ЯМР (300 МГц, СDСl3) δ 1,76 (с, 3); 7,35-7,53 (м, 5).
13С ЯМР (100 МГц, СDСl3) δ 29,15; 37,16; 124,55; 125,05; 127,79; 128,94; 141,42.
ИК 2983, 2237, 1495, 1448, 764 см-1.
Анализ для С10Н11N:
Вычислено: С 82,72; Н 7,64; N 9,65.
Найдено: С 82,76; Н 7,90; N 9,88.
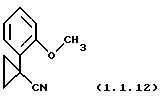
Пример 14:
1-(2-Метоксифенил)-циклопропанкарбонил (1.1.12)
Очищен хроматографией на силикагеле (этилацетат/гексаны 10/90 для получения масла, которое кристаллизуется при стоянии). Т. пл.=49-59oС.
1Н ЯМР (300 МГц, СDСl3) δ 1,26-1,30 (м, 2); 1,61-1,66 (м, 2); 3,97 (с, 3); 6,92-6,97 (м, 2); 7,24 (дд, 1, J=7,9, 1,7), 7,29-7,37 (м, 1).
13С ЯМР (100 МГц, СDСl3) δ 10,18; 15,24; 55,61; 110,89; 120,38; 123,08; 124,07; 129,82; 129,92; 158,97.
ИК 2234, 1496, 1465, 1248, 1026, 756 см-1.
Анализ для С11Н11NО:
Вычислено: С 76,28;
Н 6,40; N 8,09.
Найдено: С 76,28; Н 6,40; N 8,09.
Пример 15: (2S)-2-(2-Метоксифенил)-бицикло[2.2.1]гепт-5-ен-2-карбонитрил (1.1.13)

Очищен фильтрацией через слой силикагеля (этилацетат/гексаны 35/65 с получением масла, которое было кристаллизовано из этанола). Т.пл.=135-137oС.
1Н ЯМР (400 МГц, СDСl3) δ 1,52 (д, 1, J=9,0); 1,61-1,64 (м, 1); 2,02 (дд, 1, J=12,6, 3,4); 2,21 (дд, 1, J-11,8, 2,8); 2,99 (ш.с, 1); 3,62 (ш.с, 1); 3,91 (с, 3); 6,40 (дд, 1, J=5,8; 3,0); 6,67 (дд, 1, J=5,8, 3,0); 6,91-6,96 (м, 2); 7,24-7,30 (м, 2).
13С ЯМР (100 МГц, СDСl3) δ 41,42; 43,13; 43,68; 46,90; 48,41; 55,60; 111,66; 120,41; 124,51; 125,36; 129,02; 129,38; 134,44; 140,87; 158,08.
ИК (КВr) 2990, 2977, 2226, 1597, 1489, 1439, 1248, 1023, 764; 723 см-1.
Анализ для C15H15NO:
Вычислено: С 79,97; Н 6,71; N 6,22.
Найдено: С 79,97; Н 6,71; N 6,22.
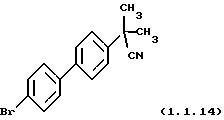
Пример 16:
2-(4'-Бромбифенил-4-ил)-2-метилпропионитрил (1.1.14)
Очищен хроматографией на силикагеле (этилацетат/гексаны 10/90). Т.пл.= 111-112oС.
1Н ЯМР (400 МГц, СDСl3) δ 1,76 (с, 6); 7,44 (дд, 2, J=6,6; 1,9); 7,52-7,57 (м, 6).
13С ЯМР (100 МГц, СDСl3) δ 29,13; 39,98; 121,90; 124,38; 125,68; 127,40; 128,64; 131,98; 139,13; 139,57; 1409,86.
ИК (КВr) 2986, 2235, 1483, 1461, 1105, 815 см-1.
Анализ для C16H14BrN:
Вычислено: С 64,02; Н 4,70; N 4,67.
Найдено: С 64,27; Н 4,70; N 4,58.
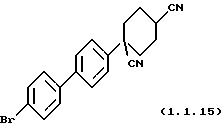
Пример 17: 1-(4'-Бромфенил-4-ил)-циклогексан-1,4-дикарбонитрил (1.1.15)
Очищен хроматографией на силикагеле (IPE/CH2Cl2/гексаны 25/25/50) с получением продукта в виде смеси диастереоизомеров 1:1. Т.пл.=211oС.
1Н ЯМР (400 МГц, CDCl3) δ 1,84-2,62 (м, 8); 3,15 (ш.с, 1); 7,41-7,62 (м, 8).
13С ЯМР (100 МГц, СDСl3) δ 25,82; 25,92; 26,41; 27,24; 33,12; 35, 74; 42,79; 43,52; 120,88; 121,11; 121,20; 121,47; 122,05; 122,11; 126,00; 126,10; 127,63; 128,62; 128,65; 132,02; 138,82; 138,91; 139,00; 140,17; 140,25.
ИК (КВr) 2945, 2235, 1484, 1455, 1388, 1081, 1003, 812 см-1.
Анализ для C20H17BrN2:
Вычислено: С 65,76; Н 4,69; N 7,67.
Найдено: С 65,76; Н 4,65; N 7,67.
Пример 18: (2S)-2-(2-метоксифенил)-бицикло[2.2.1] гептан-2-карбонитрил (1.1.16)
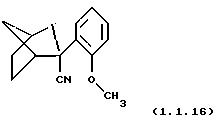
Очищен хроматографией на силикагеле (этилацетат/гексаны 5/95). Т.пл.= 87-88oС.
1Н ЯМР (400 МГц, CDCl3) δ 1,30-1,48 (м, 2); 1,52 (д, 1, J=10,0); 1,60-1,80 (м, 2); 1,98 (дт, 1, J=13,5; 3,5); 2,12-2,18 (м, 1); 2,23 (дд, 1, J= 13,5, 2,4); 2,33 (с, 1); 2,97 (д, 1, J=3,6); 3,91 (с, 3); 6,89-6,94 (м, 2); 7, 24-7,28 (м, 2).
13С ЯМР (100 МГц, СDСl3) δ 25,99; 28,64; 37,02; 37,09; 37,41; 42,97; 46,67, 55,58; 111,99; 120,14; 124,16; 125,26; 128,86; 129,68; 157, 48.
ИК (КВr) 2971, 2225, 1597, 1491, 1251, 1026, 764 см-1.
Анализ для C15H17NO:
Вычислено: С 79,26; Н 7,54; N 6,16.
Найдено: С 79, 08; Н 7,58: N 6,19.
Пример 19: 2-(3,4-Диметоксифенил)-2-метилпропионитрил (1.1.17)
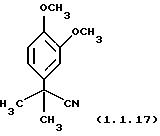
Очищен жидкостной хроматографией высокого давления (гексаны/2-пропанол 95/5) с использованием колонки (5х25 см) Chiracel OJ.
1Н ЯМР (300 МГц, СDСl3) δ 1,75 (с, 6); 3,92 (с, 3); 3,95 (с, 3); 8,89 (д, 1, J=8,1); 7,01 (с, 1); 7,03 (д, 1, J=7,9).
13С ЯМР (100 МГц, CDCl3) δ 29,24, 36,73, 55,95, 55,98, 108,71, 111,16, 117,06, 124,73, 133,94, 148,52, 149,06.
Реферат
Описывается
способ получения ароматического соединения, замещенного
третичным нитрилом формулы (1.0.0)

включающий обработку замещенного ароматического соединения формулы (2.0.0)
вторичным нитрилом формулы (3.0.0)

в присутствии основания С числовым значением рКа в пределах от около 17 до около 30, при условии, что разница между числовыми значениями рКа указанного основания и соответствующего третичного нитрила формулы (3.0.0) составляет не более около 6, в апротонном растворителе с диэлектрической постоянной (ε) менее около 20 и при температуре реакции в пределах от около 0 до 120oС; с получением целевого замещенного третичным нитрилом ароматического соединения формулы (1.0.0), в котором составляющие части W1, W2, W3, W4 и W5 и фрагменты заместителей R1, R2, R3, R4, R5, R6 и R7 в соединениях формул (1.0.0), (2.0.0) и (3.0.0) выбраны из известных органических групп и радикалов, значения которых приведены в описании. Технический результат - создание более легкого способа получения ароматического соединения, замещенного третичным нитрилом, дающего приемлемые выходы целевого продукта. 9 з.п. ф-лы, 1 табл.
Формула
включающий обработку ароматического соединения формулы (2.0.0)

вторичным нитрилом формулы (3.0.0)

в присутствии основания с числовым значением рКа в пределах от около 17 до около 30, при условии, что разница между числовыми значениями рКа указанного основания и соответствующего третичного нитрила формулы (3.0.0) составляет не более примерно 6; в апротонном растворителе с величиной диэлектрической постоянной (ε) менее примерно 20 и при температуре реакции в интервале от около 0oС до около 120oС; с образованием указанного целевого продукта - замещенного третичным нитрилом ароматического соединения формулы (1.0.0), в которой пунктирные линии, составляющие части W1, W2, W3, W4 и W5, и фрагменты заместителей R1, R2, R3, R4, R5, R6, R7, где бы они ни указывались в вышеуказанных соединениях формул (1.0.0), (2.0.0) и (3.0.0), имеют следующие значения: (I) каждая из пунктирных линий обозначает связь, (II) W1, W2, W3, W4 и W5, каждый независимо, является членом, выбранным из группы, включающей: (A) С (углерод) и пунктирная линия, связанная с ним, представляет связь; (B) N (азот) и пунктирная линия, связанная с ним, представляет связь; (III) R1, R2, R3, R4, R5, каждый независимо, выбран так, что когда соответствующий W1-5 представляет С, указанный R1-5 представляет член, независимо выбранный из группы, включающей водород; галоген, выбранный из Сl, Вr и I; -OR12; (C1-С6) алкил, замещенный 0-3 R9, (С3-С14)-карбоциклическую кольцевую систему, замещенную 0-3 R9 или 0-3 R10, где (1) R9 представляет член, независимо выбранный из группы, состоящей из водорода и циано; (2) R10, когда он является заместителем у атома углерода, представляет член, независимо выбранный из группы, состоящей из галогена и циано; (3) R12 представляет собой (C1-C6) алкил; (IV) R6 и R7 представляет каждый независимо (C1-С6) алкил, замещенный 0-3 R9, или R6 и R7, взятые вместе, образуют (С3 -С14)-карбоциклическую кольцевую систему, замещенную 0-3 R9.
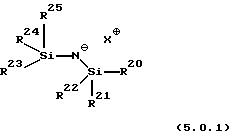
в которой R20, R21, R22, R23, R24 и R25 каждый независимо выбран из группы, включающей (С1-С5)алкил и фенил, а Х+ является подходящим катионом.

9. Способ по п. 1, в котором указанный растворитель выбран из группы, включающей толуол, тетрагидрофуран, гексан, бензол, о-, м-, п-ксилол, диэтиловый эфир, диизопропиловый эфир, метил-трет-бутиловый эфир, 1,2-диметоксиэтан и смеси, включающие один или более из вышеперечисленных растворителей.

Комментарии