Способ обработки предназначенного для проращивания семенного материала - RU2126443C1
Код документа: RU2126443C1
Чертежи



Описание
Настоящее изобретение касается способа обработки семенного материала, предназначенного для проращивания.
В контексте настоящего описания под процессом проращивания обычно понимают ту стадию процесса в общем смысле слова, которая необходима для получения продукта проращивания, когда в качестве исходного материала используют семена, хранившиеся в сухом состоянии. В частности, в пивоварной и спиртовой промышленности процесс проращивания, представляющий собой процесс осолаживания, используют при получении важного для приготовления пива или других алкогольных напитков сырья, а именно зернового солода, такого как ячменный солод, кукурузный солод или любой другой солод. Кроме того, указанный процесс проращивания используют при получении различных коммерческих продуктов, представляющих собой проростки, например проростки бобов или любые проростки, предназначенные для использования в питании человека.
Обычно процессы проращивания осуществляют в неасептических условиях. На семенах, обрабатываемых в этих условиях, встречаются микробы, присутствие которых обусловлено условиями внешней среды в ходе роста растений или хранения семян. Условия, соблюдаемые в течение процесса проращивания, наиболее благоприятны для имеющихся на семенах микробов, обычно эти микробы обильно размножаются в течение рассматриваемого процесса. Указанные микробы могут оказывать нежелательное действие на продукт проращивания либо на производимый из него конечный продукт, при этом они в равной степени могут оказывать полезное воздействие на проращиваемый продукт.
Основными стадиями процесса пивоварения являются осолаживание, получение сусла, первичное и вторичное ферментирование, а также последующая обработка. Назначением осолаживания является появление в зерне ферментов, которые на стадии разминания переводят вещества эндосперма зерна в форму, растворимую в получаемом сусле. В частности, хорошо известно, что процесс осолаживания семян ячменя включает в себя три стадии: замачивание, проращивание и запаривание. Очищенные и перебранные зерна ячменя замачивают в воде до тех пор, пока не получат желаемую степень влажности, например в пределах от 43 до 44%. Частично замачивание можно осуществлять способом так называемого воздушного покоя. Ячменю позволяют прорасти в контролируемых условиях, а полученный пророщенный ячмень запаривают в потоке горячего воздуха до тех пор, пока прорастание не будет закончено. По окончании запаривания из солода удаляют первичные корешки. Регулирование стадий осолаживания основано на контроле температуры, воздушного потока и влажности продукта или воздуха.
Кроме технологии и условий осолаживания качество солода зависит также и от микробной флоры семян, используемых для получения солода, указанная флора существенно варьирует, например, в зависимости от разновидности семян, погодных условий, места выращивания, продолжительности сезона выращивания, а также условий хранения.
Ячмень представляет собой зерновую культуру, наиболее часто используемую для осолаживания. Природная, естественная микробная флора ячменя может быть подразделена на грибы, инфицирующие ячмень в полевых условиях, грибы, инфицирующие ячмень при хранении, бактерии и дрожжи. Наиболее известным полевыми грибами ячменя являются Fusarium, Alternaria, Cladosporium, Cephalosporium, Epicoccum и Helminthosporium. Встречаемость плесневых грибов в разных странах в разные годы различна. Влажные погодные условия в ходе периода роста зерновых, особенно в течение их уборки, способствуют росту плесневого гриба Fusarium. Вызванное Fusarium заражение может быть на самом деле тяжелым в дождливые сезоны роста. Одним из наиболее известных видов бактерий, встречающихся на зерновых, является Enterobacter agglomerans. Среди прочих бактерий следует отметить Escherichia coli и бактерии родов Pseudomonas, Micrococcus и Bacillus, а также молочнокислые бактерии. Бактериальный титр в случае ячменя равен приблизительно 105-108 КОЕ/г (колониeобразующих единиц на 1 г).
Количество плесневых грибов и бактерий в ячмене увеличивается при осолаживании, достигая наивысших концентраций на стадии проращивания. В частности, наиболее сильному размножению подвержены плесневой гриб Fusarium, а также молочнокислые бактерии. В ходе осолаживания увеличивается также количество дрожжей. На стадии запаривания концентрации плесневых грибов, дрожжей и бактерии, как правило, вновь снижаются. Часть микробов, встречающихся на ячмене, оказывает полезное действие в плане осолаживания, а также на продукт, например пиво, производимый из полученного солода. Судя по проведенным оценкам, вплоть до 40-50% некоторых ферментов солода имеют бактериальное происхождение. С другой стороны, часть микробов оказывает нежелательное действие на ячмень и/или получаемые солоды.
Среди нежелательных микробов следует отметить плесневой гриб Fusarium; было обнаружено, что он чаще других плесневых грибов вызывает нежелательное вспенивание пива, при котором продуцируемые указанными плесневыми грибами пептиды образуют ядра пузырьков газа, выделяющихся из бутылки пива в виде интенсивной пены. В том случае, если более 50% осолаживаемого зерна заражено плесневыми грибами Fusarium, опасность пенообразования существенно возрастает.
Кроме того, показано, что встречающиеся на ячмене грамотрицательные бактерии, такие как виды, входящие в роды Pseudomonas и Flavobacterium, а также грамположительные бактерии из рода Leuconostoc, затрудняют фильтрацию затора для получения сусла. Различные встречающиеся на ячмене микробы могут приводить также к другим нежелательным эффектам, в том числе подавлять проращивание, вызывать посторонние запахи или нежелательные изменения качественных показателей получаемого сусла и пива.
Требования качества, предъявляемые к осолаживаемому ячменю, могут быть уточнены в ежегодно заключаемом контракте о культивировании и поставках. Плесневые грибы представляют собой группу микробов, часто упоминаемую в описаниях качества. Более того, для многих используемых для осолаживания растений, определен верхний допустимый предел для конкретных плесневых грибов. В том случае, если доля зараженных Fusarium зерен превышает 65% либо соответствующий показатель для плесневых грибов Aspergillus и Penicillum превышает 50%, такого рода ячмень может рассматриваться как низкокачественный или даже непригодный для использования в осолаживании.
Для предотвращения вызываемого плесневыми грибами пенообразования разработаны подходы, основанные на использовании высококачественного ячменя либо на смешивании партий ячменя, солода или пива. В дождливые годы почти весь урожай ячменя может быть низкого качества, в этом случае получение хорошего пива может оказаться невозможным.
Процесс проращивания, применяемый для получения проростков, предназначенных для использования в целях питания, предполагает некоторые условия, благоприятные для размножения, например, плесневых грибов и бактерий. Такого рода продукты проращивания будут быстропортящимися. Кроме того, в связи с проращиванием может наблюдаться увеличение количества пищевых патогенов, вызывающих пищевое отравление, таких как бактерии Salmonella, Yersinia и/или Listeria.
Для снижения количества плесневых грибов можно использовать также микробицидные химические вещества, однако невозможно найти безопасные и общепризнанные химические агенты.
Известен (SU авторское свидетельство 825616, кл. C 12 C 1/047, 1981) способ обработки предназначенного для проращивания семенного материала, при котором к семенному материалу в связи с процессом проращивания добавляют противомикробную добавку, представляющую собой перманганат калия. При этом на используемом семенном материале в дальнейшем будет сохраняться некоторое количество добавленного химического агента; это может нежелательным образом влиять на процесс осолаживания, так как данный агент подавляет как вредную, так и полезную микрофлору; в конечном продукте также сохранятся следовые количества добавленного перманганата калия, что может отразиться на вкусовых качествах продукта.
Задачей данного изобретения является создание такого способа обработки предназначенного для проращивания семенного материала, с помощью которого можно было бы тонко регулировать микробную флору семенного материала, ингибируя в процессе проращивания семян развитие нежелательной микрофлоры и не подавляя при этом действие полезной микрофлоры, и получить из этих семян конечный продукт, не содержащий чужеродных добавок.
Данная задача решается тем, что предложен способ обработки предназначенного для проращивания семенного материала, включающий добавление к семенному материалу в связи с процессом проращивания противомикробных добавок, характеризующийся тем, что указанные добавки, добавленные к семенному материалу, представляющему собой зерна ячменя, используемые в процессе осолаживания, или семенной материал, который будет превращен в проростки, предназначенные для использования в качестве пищи, являются препаратом молочнокислых бактерий, либо препаратом, продуцируемым молочнокислыми бактериями, который оказывает эффект подавления роста микробов.
Целесообразно, чтобы указанные молочнокислые бактерии принадлежали роду Lactococcus, Leuconostoc, Pediococcus или Lactobacillus.
Предпочтительно, когда указанный препарат молочнокислых бактерий либо препарат, продуцируемый молочнокислыми бактериями, производят из видов Lactococcus lactis, Leuconostoc mesenteroides, Pediococcus damnosus, Pediococcus parvulus, Pediococcus pentosaceus, Lactobacillus curvatus или Lactobacillus plantarum, либо из их смеси, в предпочтительном случае из видов Lactobacillus plantarum и Lactobacillus pentosaceus или из их смеси.
К зернам ячменя может быть добавлен такой препарат молочнокислых бактерий либо препарат, продуцируемый молочнокислыми бактериями, который оказывает эффект подавления роста плесневых грибов Fusarium. В этом случае предпочтительно, чтобы указанный препарат молочнокислых бактерий либо препарат, продуцируемый молочнокислыми бактериями, был добавлен на стадии замачивания или проращивания.
Настоящее изобретение базируется на исследованиях, в результате которых было сделано неожиданное наблюдение, свидетельствующее о том, что молочнокислые бактерии можно использовать с целью улучшения качества продукта, предназначенного для проращивания. Вещества, содержащие и/или продуцируемые препаратом по изобретению, то есть микробицидные агенты, подавляют рост нежелательных микроорганизмов, встречающихся в течение процесса проращивания.
Использование молочнокислых бактерий в пищевой и кормовой промышленности хорошо известно. В условиях ферментирования эти бактерии вырабатывают такие соединения, которые влияют на состав и запах получаемых продуктов, но вместе с тем подавляют рост патогенных микробов, способных испортить указанные продукты. Молочнокислые бактерии обычно использовали в молочных продуктах, мясных продуктах, продуктах ферментации овощей и выпечных продуктах, а также при хранении фуража.
Добавка молочнокислых бактерий или молочной кислоты была введена в практику при производстве определенного типа солода, так называемого Sauermalz. Указанную добавку вводят в солод на стадии запаривания перед затиранием или в процессе затирания. Назначение указанной добавки заключается исключительно в снижении pH получаемого сусла таким образом, чтобы оказать влияние на протекание процесса затирания, а также на качество получаемого в итоге пива. Однако до сих пор не использовали молочнокислые бактерии так, как это предусмотрено настоящим изобретением с целью подавления роста нежелательных микробов в ходе процесса проращивания.
Предусмотренный настоящим изобретением препарат можно добавлять к предназначенному для проращивания продукту на любой стадии процесса проращивания.
В случае особо предпочтительного варианта воплощения препарат молочнокислых бактерий либо препарат, полученный с помощью молочнокислых бактерий, добавляют к зерновому материалу, такому как зерна ячменя, в течение процесса осолаживания. Указанный добавляемый препарат подавляет рост плесневых грибов, в особенности вредных плесневых грибов Fusarium, а также бактерий, в результате чего, в частности, понижается риск вспенивания пива из-за плесневого гриба Fusarium. Однако, судя по качеству получаемого солода или производимого из него пива, указанный препарат не оказывает существенного влияния на действие полезной микробной флоры. Кроме того, не обнаружено никаких вредных воздействий указанного добавляемого препарата на качество солода, так же как и не выявлено каких бы то ни было содержащихся в препарате или продуцируемых им веществ, вредных для производимого солода или пива.
В ходе процесса осоложения указанный препарат молочнокислых бактерий или препарат, получаемый с помощью молочнокислых бактерий, можно добавлять к зернам ячменя до замачивания, на стадии замачивания или в течение стадии проращивания. В предпочтительном случае указанную добавку осуществляют на стадии замачивания или проращивания. Другие элементы процесса сбраживания можно осуществлять любым способом, известным в этой области. При желании, например, к предназначенному для сбраживания ячменю могут быть добавлены питательные вещества либо можно осуществлять регуляцию условий, в том числе с помощью добавления молочной кислоты, с целью оптимизации условий, необходимых для роста молочнокислых бактерий.
В настоящем изобретении можно использовать любую широкодоступную молочнокислую бактерию, оказывающую воздействие в плане подавления роста микробов. Можно упомянуть следующие пригодные для использования роды молочнокислых бактерий: Lactococcus, Leuconostoc, Pediococcus и Lactobacillus. В качестве предпочтительных видов можно перечислить следующие: Lactococcus lactis, Leuconostoc mesenteroides, Pediococcus damnosus, Pediococcus parvulus, Pediococcus pentosaceus, Lactobacillus curvatus и Lactobacillus plantarum либо их смеси, в которых наиболее предпочтительными являются Lactobacillus plantarum и Lactobacillus pentosaceus или их смеси. Также возможно использование генетически измененных молочнокислых бактерий.
Препарат молочнокислых бактерий может состоять из культуральной жидкости, содержащей или не содержащей клетки, либо из концентрированной культуральной жидкости (содержащей клетки). Препарат, получаемый с помощью молочнокислых бактерий может включать в себя бесклеточный фильтрат культуры, концентрированный фильтрат культуры или фракционированный фильтрат культуры, либо чистый или частично очищенный микробицидный продукт.
В соответствии с особо предпочтительным вариантом воплощения указанную обработку осуществляют с использованием концентрированной или фракционированной культуральной жидкости, которая может быть бесклеточной или может содержать клетки. Концентрирование может быть достигнуто, например, с помощью лиофилизации или выпаривания. Указанную культуральную жидкость концентрируют, например, по фактору 2 - 20 - 40.
Фракционирование, в том числе очистку микробицидных продуктов, можно осуществлять с использованием хорошо известных способов, например, с помощью методов хроматографии или ультрафильтрации.
В соответствии со способом, предусмотренным настоящим изобретением, предназначенная для добавления к семенам активность, подавляющая рост микробов и входящая в состав препарата, содержащего молочнокислые бактерии или полученного с помощью молочнокислых бактерий, соответствует, например, указанной культуральной жидкости в количестве приблизительно от 10 до 10000 мл/кг обрабатываемых семян, в приемлемом случае - от 30 до 7000 мл/кг обрабатываемых семян, в том числе от 40 до 5000 мл/кг обрабатываемых семян. Получение указанной культуральной жидкости описано в разделе "Примеры". Следует отметить, что непосредственные параметры использования активности указанного препарата определяют в зависимости от цели применения вышеупомянутой культуральной жидкости. Для специалиста очевидно, что предусмотренные настоящим изобретением препараты, обладающие эквивалентной активностью в плане подавления роста микробов, могут быть в равной мере получены с использованием иных культуральных жидкостей и/или способов.
В соответствии с настоящим изобретением указанный препарат включает в себя микробицидные соединения и/или производит микробицидные соединения в течение процесса проращивания. В том случае, если используют препарат клеток, клеточный рост может быть при необходимости индуцирован, например, с помощью регуляции условий в течение процесса проращивания либо с использованием питательных добавок. Указанный препарат также может усиливать рост других молочнокислых бактерий, встречающихся на предназначенных для проращивания семенах.
Так как использование молочнокислых бактерий в пищевой промышленности разрешено и широко распространено, указанный препарат, полученный из растущих молочнокислых бактерий, также безопасен в своем использовании. Молочнокислые бактерии обычно принадлежат к естественной микробной флоре проращиваемых семян, таких как зерна ячменя. Таким образом, предусмотренный настоящим изобретением способ является максимально естественным. Кроме того, в качестве штамма молочнокислых бактерий можно использовать штамм, естественным образом встречающийся на соответствующих семенах.
Благодаря настоящему изобретению в ходе сбраживания становится возможным уменьшать нежелательные эффекты, возникающие вследствие заражения Fusarium, такие как вспенивание пива.
Кроме того, неожиданно было обнаружено, что предлагаемый способ улучшает показатели фильтруемости в процессе производства пива. Как было установлено, указанный эффект обусловлен тем, что предусмотренный настоящим изобретением препарат также ограничивает число вредных видов, встречающихся в ходе сбраживания и препятствующих фильтрации получаемой массы, в том числе относящихся к родам Leuconostoc, Pseudomonas и Flavobacterium.
В соответствии с еще одним предпочтительным вариантом воплощения препарат молочнокислых бактерий или препарат, полученный из молочнокислых бактерий, добавляют к семенам в том случае, если образующиеся проростки используют в пищу.
Благодаря настоящему изобретению можно ограничивать рост вредных микробов в течение процесса проращивания. Это первый случай, когда изобретение предусматривает использование биологических средств для предотвращения роста нежелательных бактерий, встречающихся на предназначенных для проращивания семенах, в течение промышленного процесса проращивания.
Предусмотренный настоящим изобретением способ улучшает общий гигиенический стандарт указанного процесса проращивания в целом.
В дальнейшем настоящее изобретение будет проиллюстрировано примерами воплощения, единственной целью которых является иллюстрирование настоящего изобретения, не сводя его к приведенным примерам. Предусмотренная настоящим изобретением обработка также применима по отношению к другим процессам проращивания.
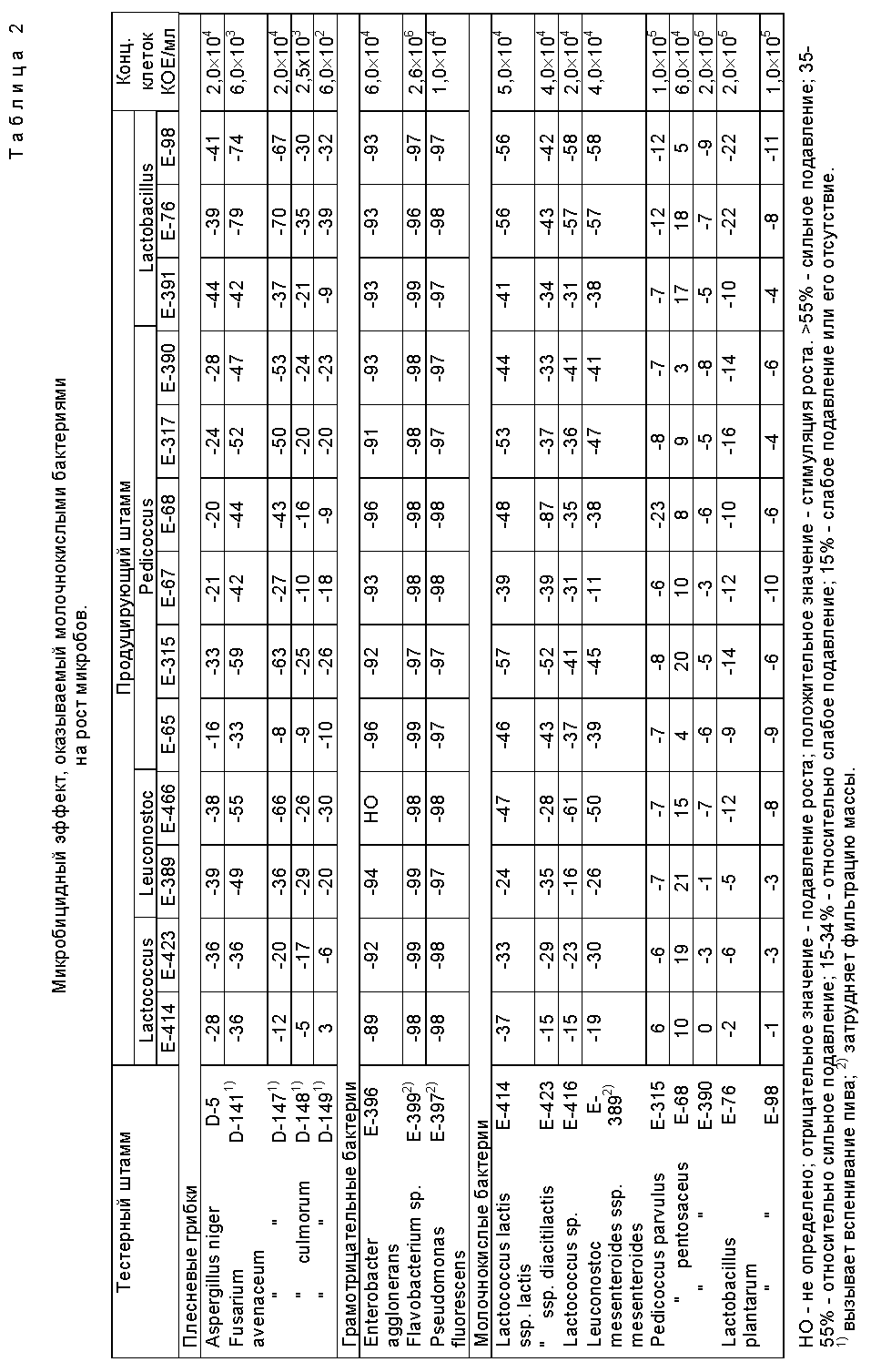
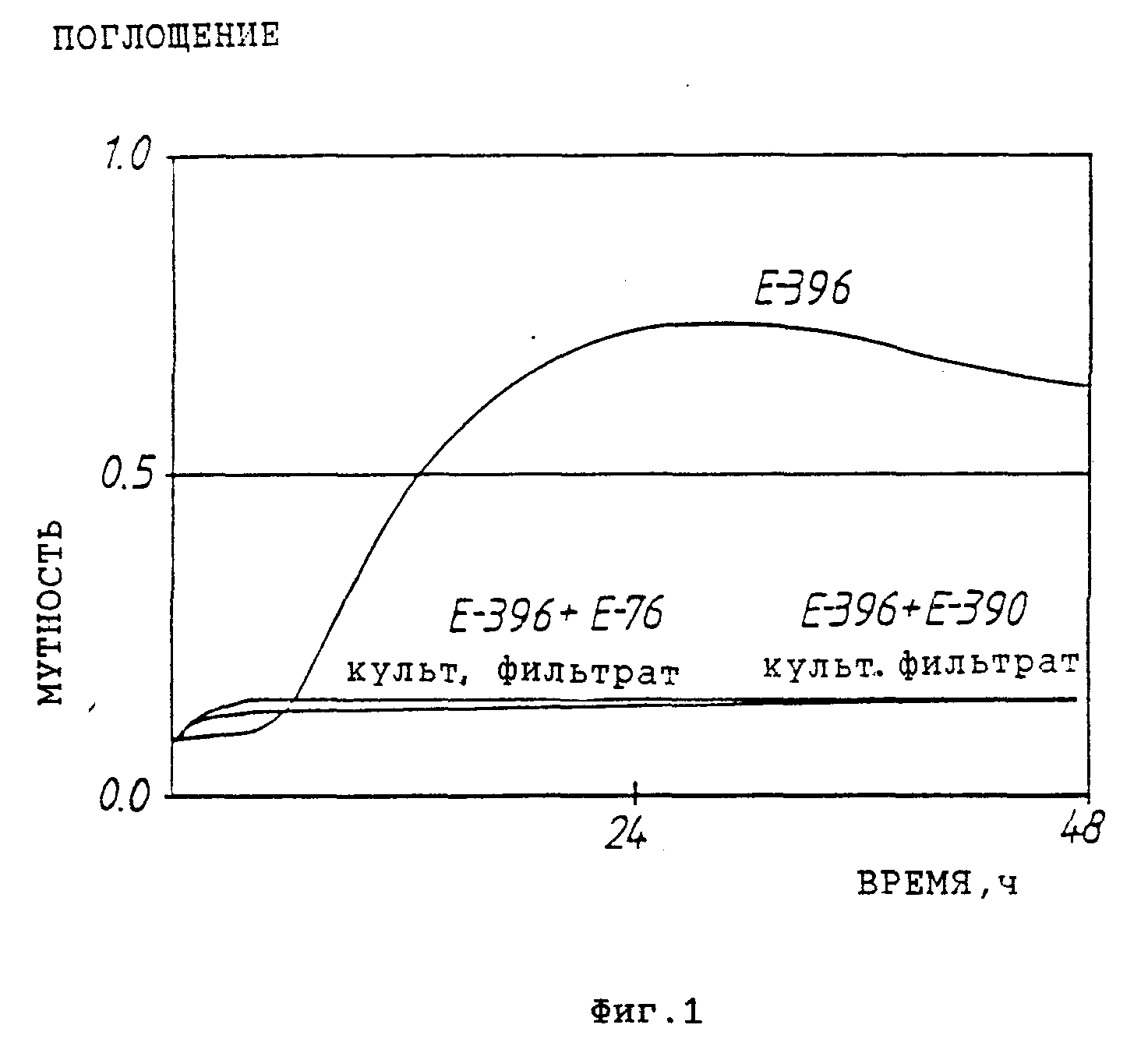
На фиг.1 представлен график, показывающий микробицидную активность, содержащуюся в фильтрате культуры молочнокислой бактерии и определенную с помощью турбидометрического метода. Нормальная кривая роста тестерного организма E. agglomerans E-396, а также ингибирующий эффект, оказываемый на рост вышеупомянутого тестерного организма фильтратами культуры продуцирующих штаммов L. plantarum E-76 и P. pentosaceus E-390.
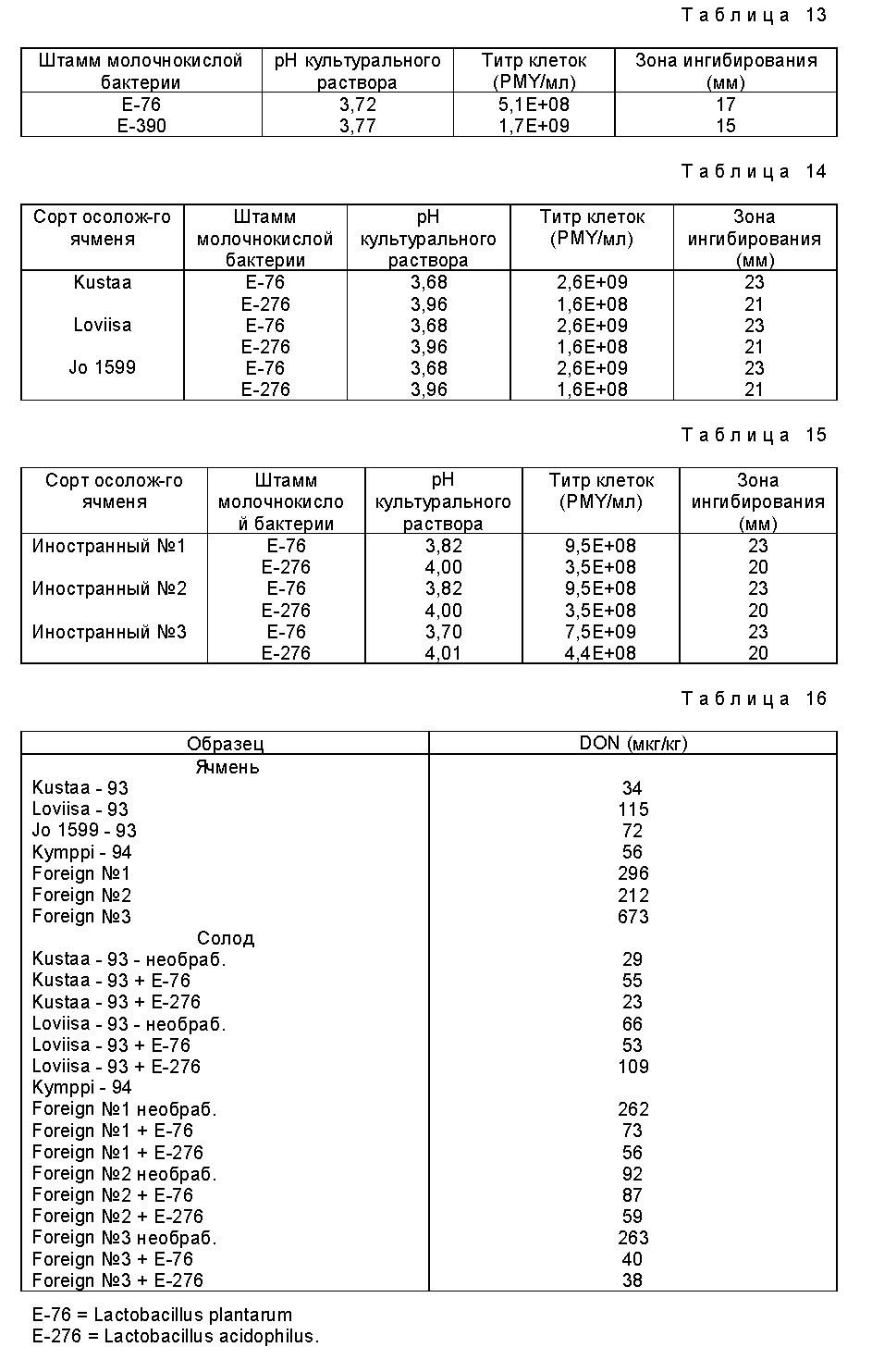
На фиг.2 представлено влияние культуральной жидкости P. pentosaceus E-390, добавленной на разных стадиях осоложения, на полный титр бактерий в ходе осоложения.
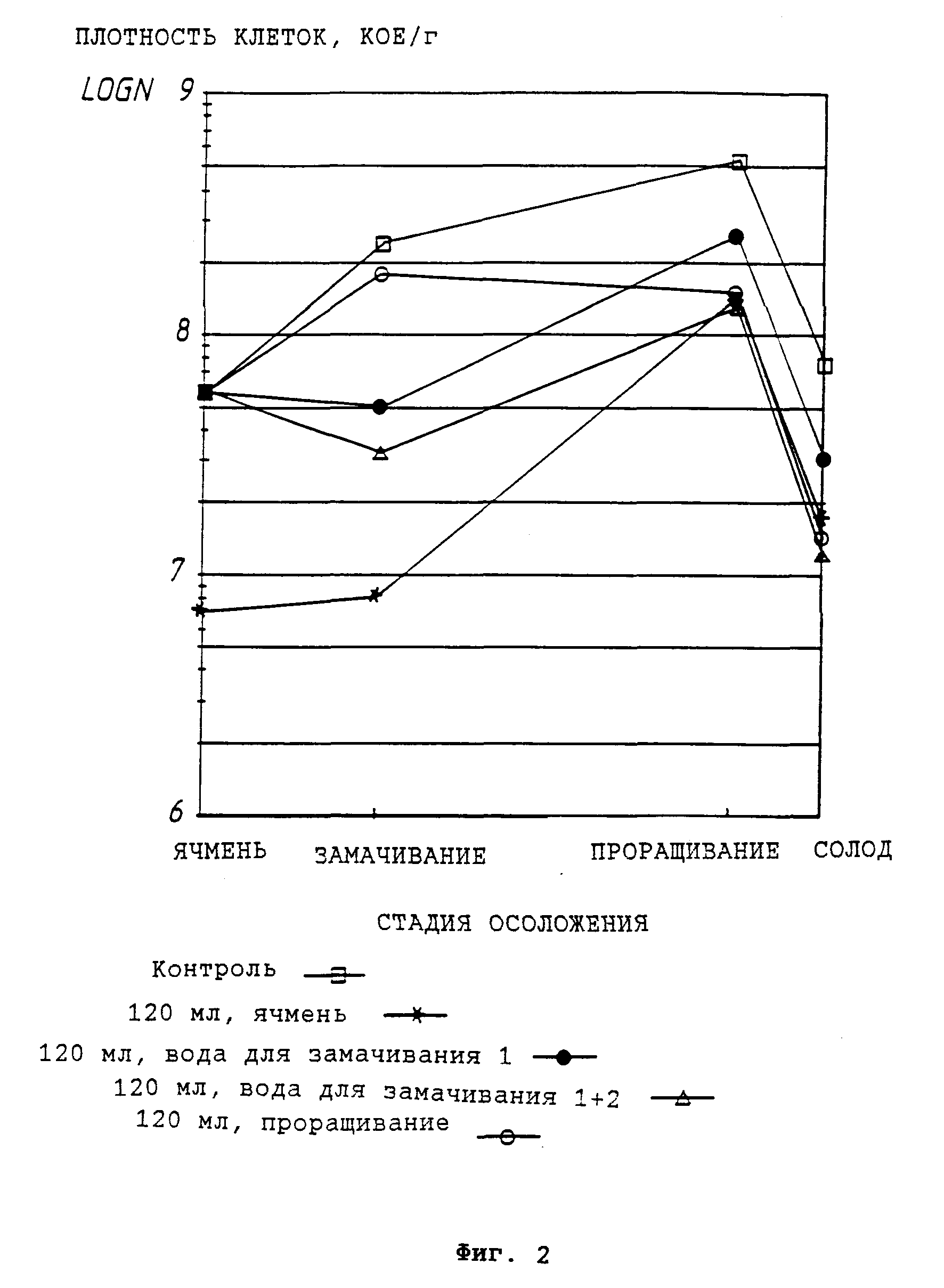
На фиг. 3 представлено влияние клеток P. pentosaceus E-390, добавленных на разных стадиях осоложения, на полный титр бактерий в ходе осоложения.
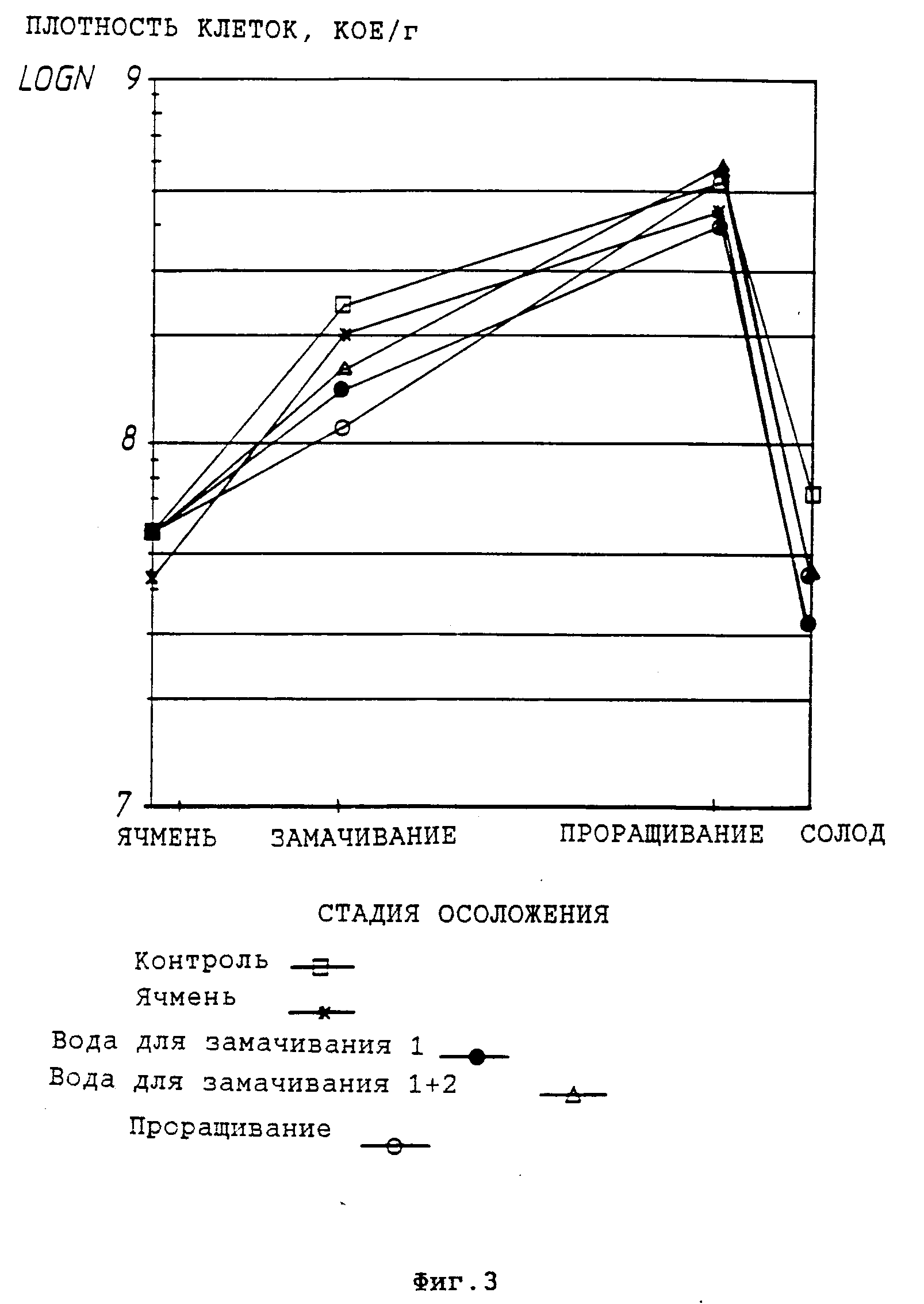
На фиг. 4 представлен полный титр бактерий в течение различных стадий лабораторного осоложения при добавлении к воде, используемой для замачивания ячменя, культуральных жидкостей P. pentosaceus E-390 и L. plantarum E-76, либо концентрированных культуральных жидкостей.
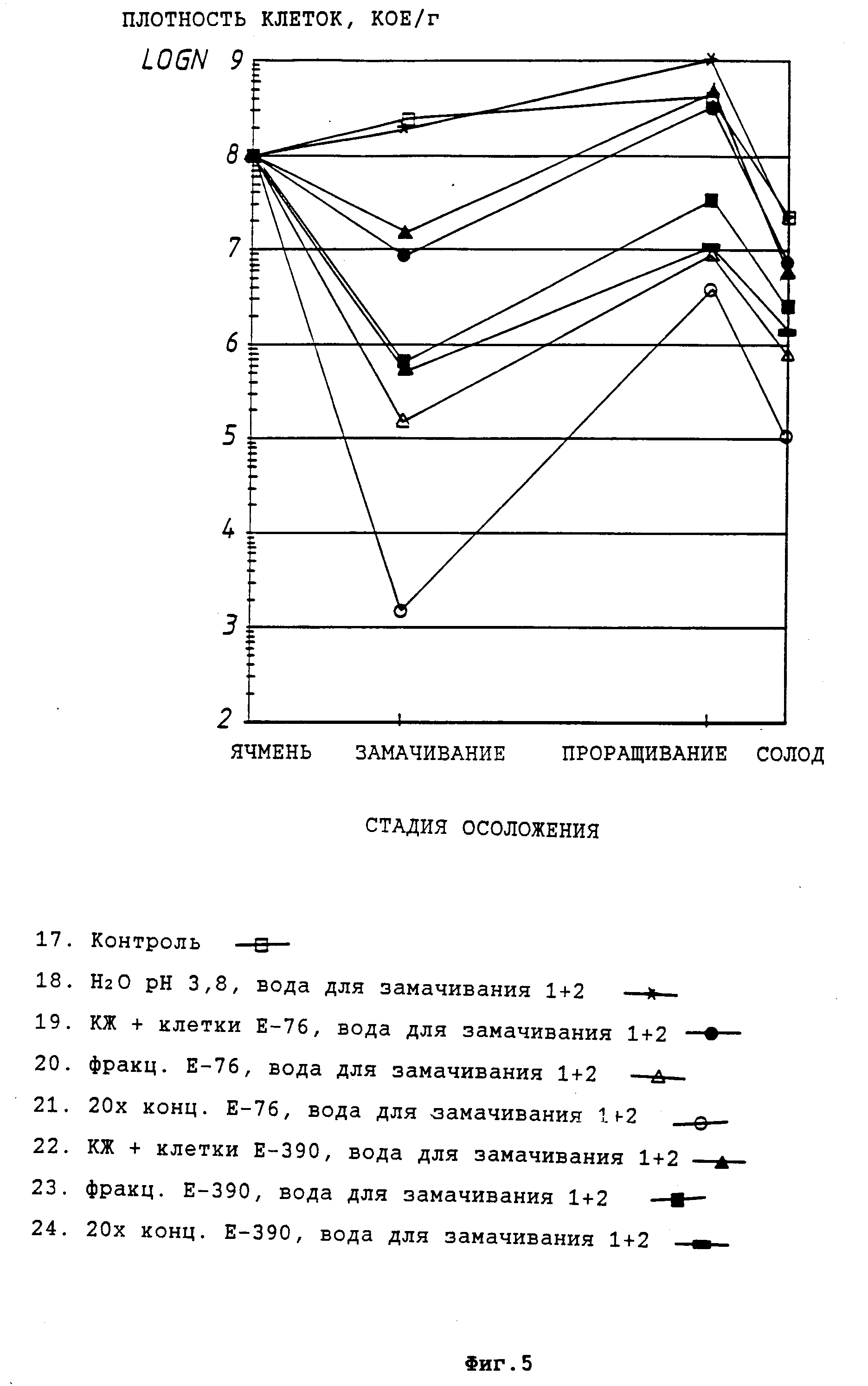
На фиг. 5 представлен полный титр бактерий в течение различных стадий лабораторного осолаживания при добавлении к воде, используемой для замачивания ячменя, культуральных жидкостей P. pentosaceus E-390 и L. plantarum E-76, либо концентрированных и фракционированных культуральных жидкостей.
На фиг.6 показано влияние культур молочнокислых бактерий, добавленных на стадии осолаживания, на фильтрацию получаемой массы (Terpal- фильтрацию).
На фиг. 7 показано влияние добавления молочнокислой бактерии на содержание дезоксиниваленола при осолаживании ячменя, зараженного штаммом F. culmorum D 148.
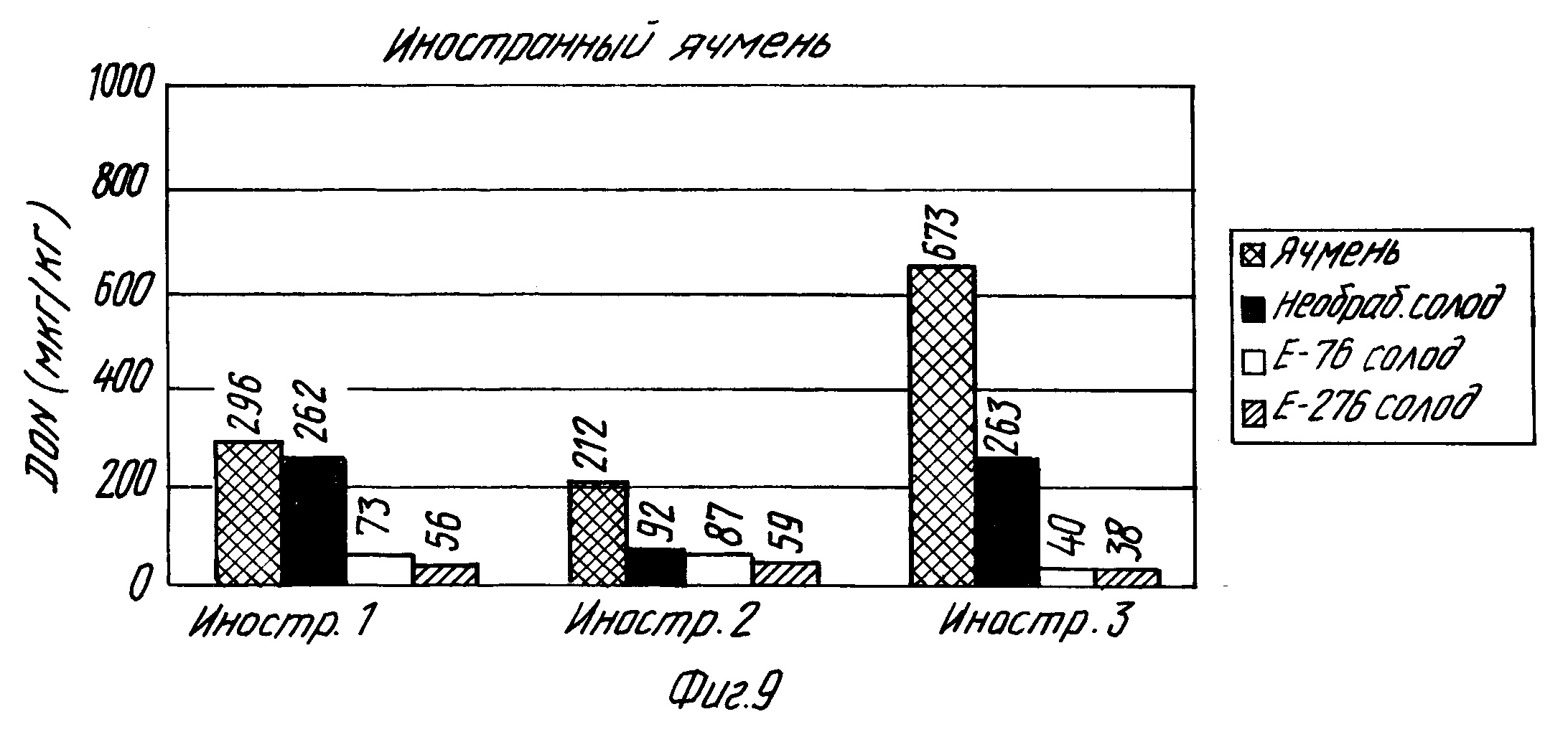
На фиг. 8 и 9 показаны концентрация дезоксиниваленола при осоложении порций финского и иностранного ячменя, а также влияние молочнокислой бактерии на образование дезоксиниваленола (DON) при осоложении ячменя, естественным образом зараженного дезоксиниваленолом и плесенью Fusarium.
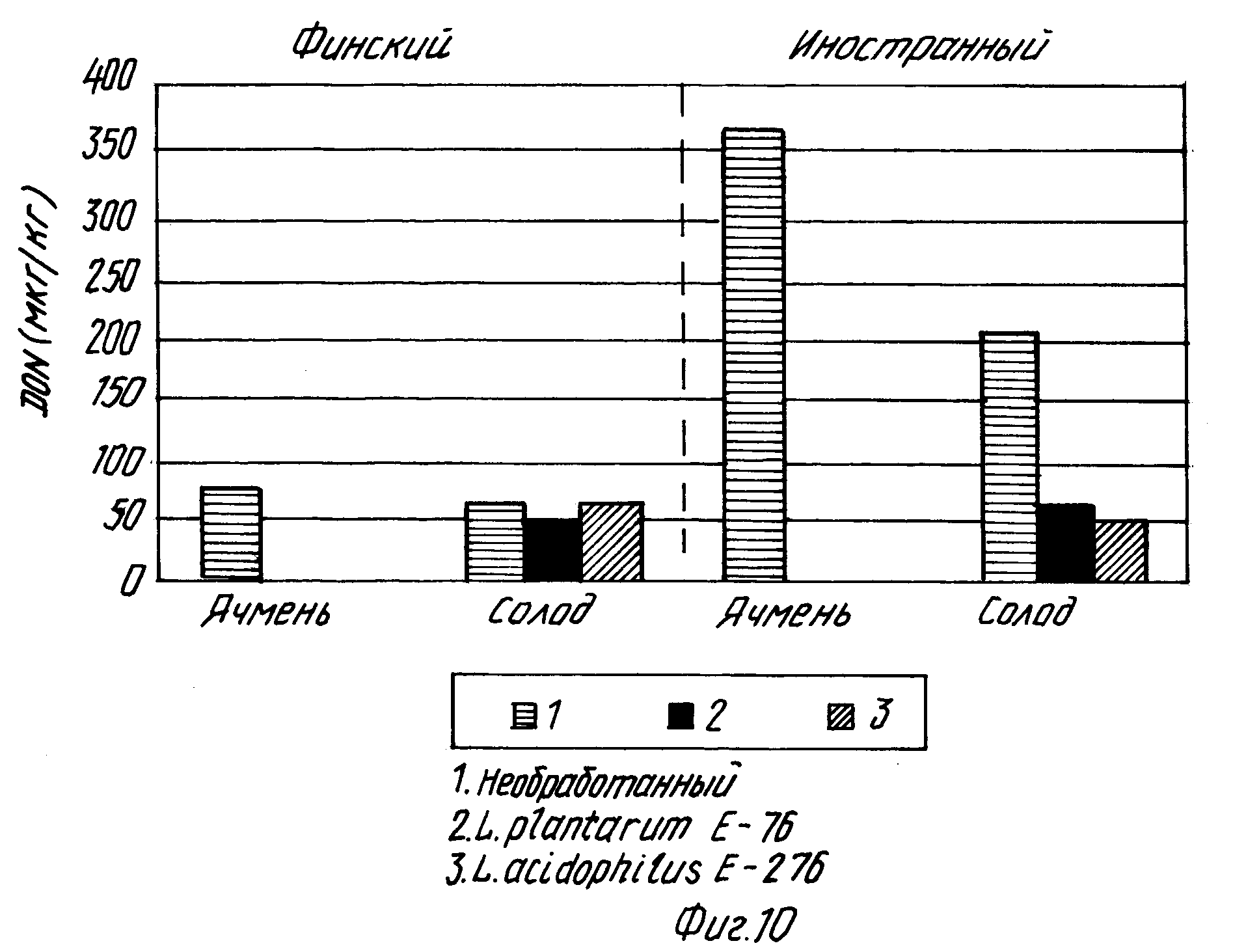
На фиг.10 показаны средние значения концентрации дезоксиниваленола трех домашних и трех иностранных образцов ячменя.
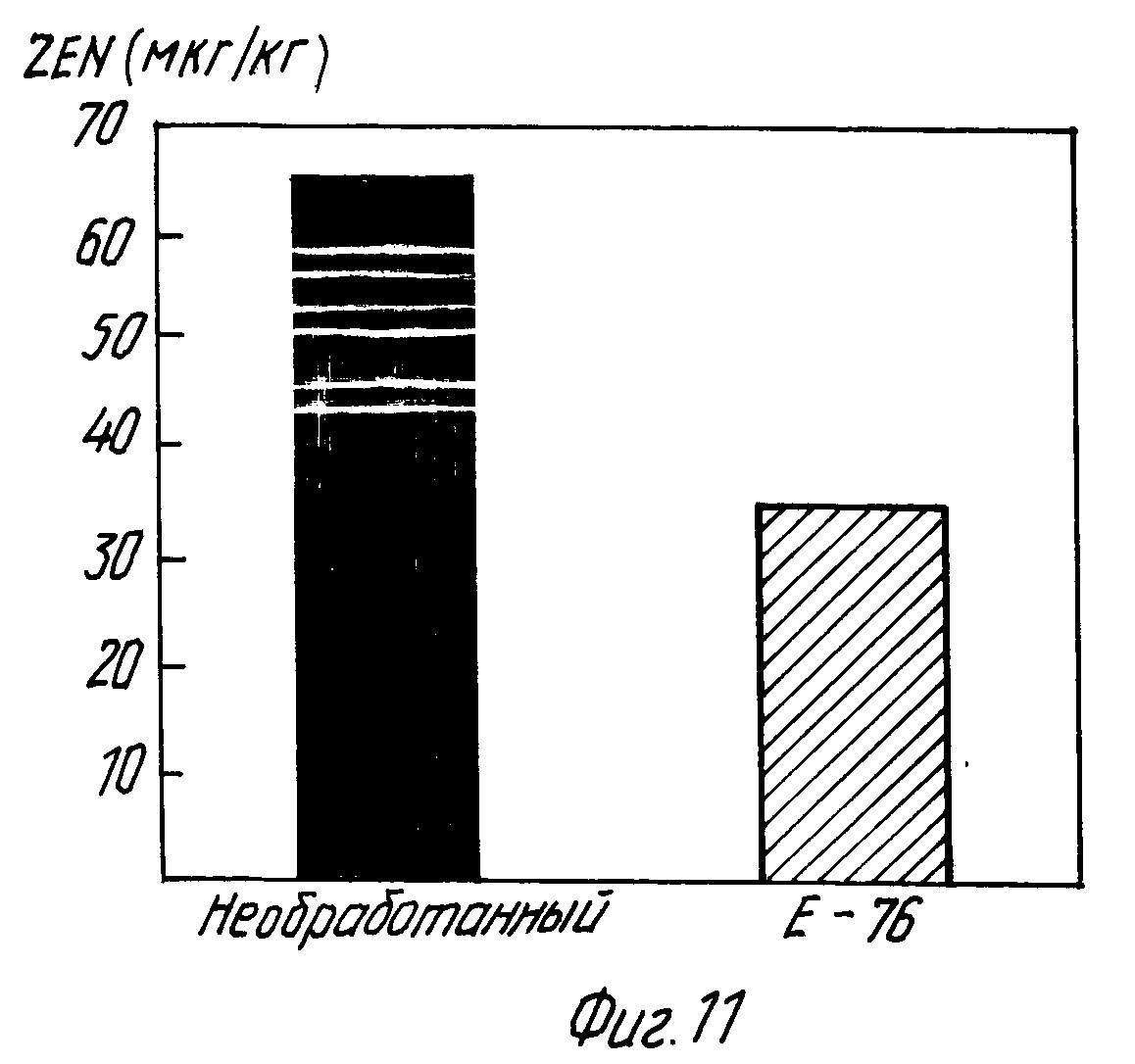
На фиг.11 показано влияние добавления молочнокислой бактерии на содержание зеараленона при осоложении ячменя, зараженного штаммом F.culmorum D 148.
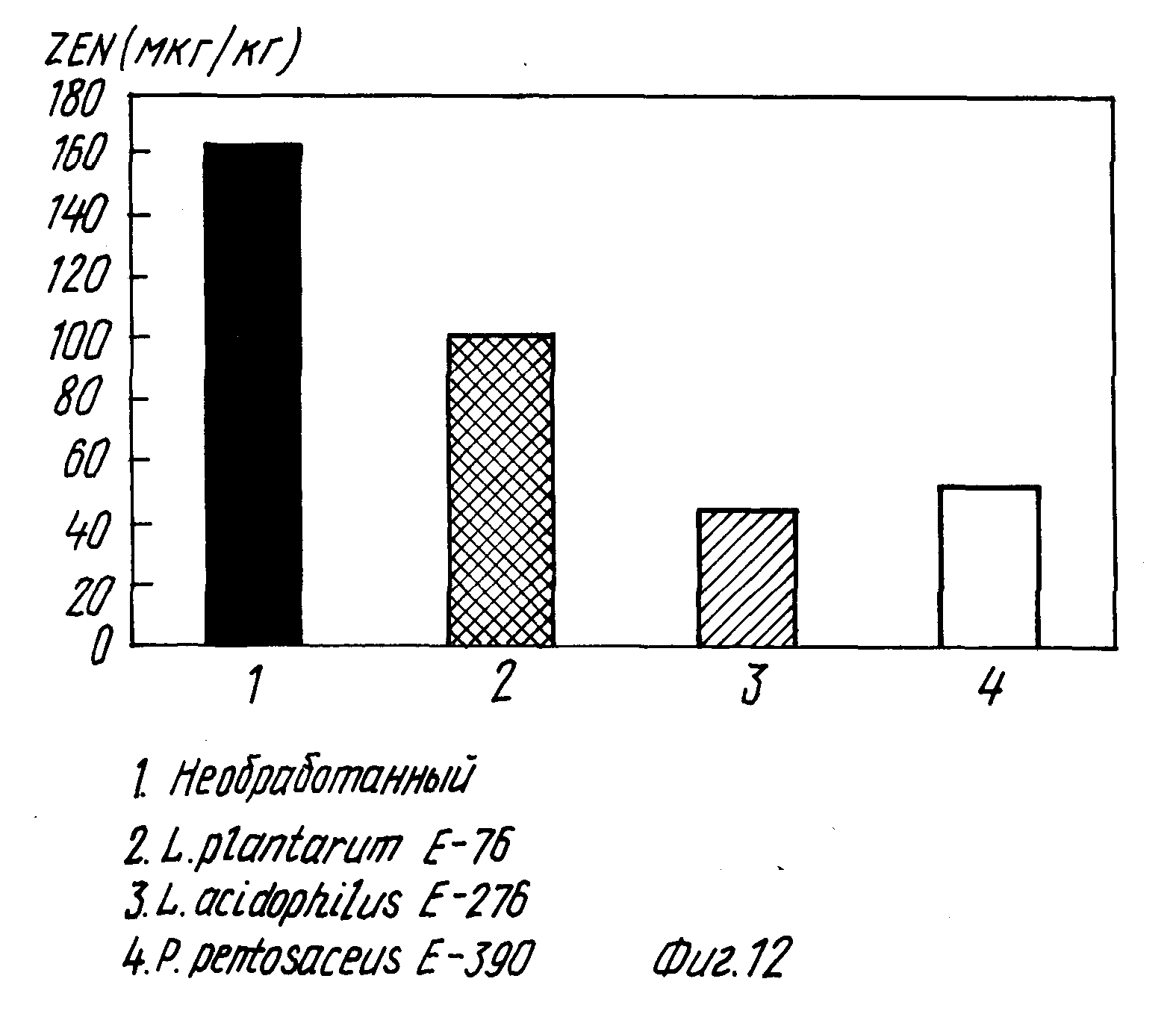
На фиг.12 показано влияние добавления молочнокислой бактерии на содержание зеараленона при осоложении ячменя, зараженного штаммом F.graminearium VTT D-95470 (D-148).
Пример 1. Микробицидное действие, оказываемое различными штаммами молочнокислых бактерий на микробы, встречающиеся в ходе осолаживания.
В эксперименте исследовали микробицидное действие, оказываемое препаратами, продуциремыми разными штаммами молочнокислых бактерий, на микробы, встречающиеся в ходе осолаживания. В качестве указанного препарата использовали культуральную жидкость, полученную методом стерильной фильтрации.
1. Продуцирующие штаммы.
В качестве продуцирующих штаммов использовали
следующие штаммы молочнокислых бактерий:
Lactobacillus lactis
ssp.
lactis - VTT-E-90414 (E-414)
ssp. diacitilactis
- VTT-E-90423 (E-423)
Leuconostoc
mesenteroides
ssp. mesenteroides - VTT-E-90389 (E-389)
ssp. mesenteroides
- VTT-E-90415 (E-415)
ssp. mesenteroides - VTT-E-90466
(E-466)
Pediococcus damnosus
- VTT-E-76065 (E-65)
Pediococcus parvulus - VTT-E-88315 (E-315)
Pediococcus
pentosaceus - VTT-E-76067 (E-67)
Pediococcus pentosaceus
- VTT-E-76068 (E-68)
Pediococcus pentosacues - VTT-E-88317 (E-317)
Pediococcus pentosaceus - VTT-E-90390 (E-390)
- (DSM 7389)
Lactobacillus curvatus - VTT-E-90391
(E-391)
Lactobacillus plantarum
- VTT-E-78076 (E-76) - (DSM 7388)
Lactobacillus plantarum - VTT-E-79098 (E-98)
Вышеперечисленные штаммы были получены из VTT, Collection of
Industrial Microorganisms (Biotechnical
Laboratory, Finland). Штамм Lactobacillus plantarum (E-76) был депонирован в DSM (Deutsche
Sammlung von Mikroorganismen und Zeilkulturen) под номером 7388.
Штамм E-76 (DSM 7388) был выделен из пива с
использованием техники, известной для жидких продуктов, и проанализирован/идентифицирован
с помощью хорошо известных методов анализа. Штамм Pediococcus
pentosaceus (E-390) был депонирован в DSM
(Deutsche Sammlung von Mikroorganismen und Zeilkulturen) под номером 7389. Штамм E-390 (DSM
7389) был выделен из гомогенизированных образцов растрескавшихся
зерен ячменя и
проанализирован/идентифицирован с помощью хорошо известных методов [1]. Депозитарии соответствуют условиям
Будапештского договора.
2. Тестерные штаммы.
В качестве тестерных штаммов среди прочих были использованы различные виды вредных микробов, встречающиеся в течение осоложения, а также штаммы молочнокислых бактерий, служившие продуцирующими штаммами.
Вредные плесневые грибки были представлены в тестах плесневыми грибками Fusarium [Gibberella avenacea (бывший Fusarium avenaceum) VTT-D-80141 (D-141) и VTT-D-80147 (D-147), а также Fusarium culmorum VTT-D-80148 (D-148) и VTT-D-80149 (D-149), Collection of Industrial Microorganisms, Biotechnical Laboratory of VTT] и одним видом Aspergillus.
Вредные грамотрицательные бактерии были представлены двумя штаммами из рода Enterobacter, а также одним видом из рода Flavobacterium и одним - из рода Pseudomonas. Штаммы молочнокислых бактерий включали в себя штаммы, использованные в качестве продуцирующих штаммов, а также штамм Lactococcus sp. E-416.
3. Культивирование продуцирующих штаммов и получение стерильно профильтрованной культуральной жидкости.
Молочнокислые бактерии культивировали в среде MRS (MRS BROTH, Oxoid). Штаммы Pediococcus E-65, E-67 и E-68 культивировали в аэробных условиях при температуре 25oC, все остальные продуцирующие штаммы - в анаэробных условиях при температуре 30oC, период культивирования составлял от 2 до 5 дней. В дальнейшем клетки осаждали с помощью центрифугирования, а полученный супернатант стерильно фильтровали.
4. Культивирование тестерных штаммов.
Суспензию спор плесневого грибка Fusarium получали, культивируя штамм указанного грибка в растворе КМЦ (карбоксиметилцеллюлозы) при температуре 25oC в течение 5-6 дней в виде интенсивно перемешиваемой культуры, суспензируя образующиеся споровые частицы в растворе TWEEN, фильтруя полученную суспензию и отбирая фильтрат.
Суспензию спор плесневого грибка Aspergillus получали непосредственно на PD-arape (Potato Dextrose, Difco) при температуре 25oC в течение 3 дней.
Грамотрицательные бактерии культивировали в аэробных условиях в среде NB (Nutrient broth, Difco) в течение 1 дня, штамм Enterobacter - при температуре 30oC, а штаммы Flavobacterium и Pseudomonas - при 25oC.
Молочнокислые бактерии культивировали в соответствии с пунктом 3 (см. выше).
5. Определение микробицидного эффекта молочнокислых бактерий.
Микробицидную активность полученной культуральной жидкости оценивали с помощью метода дисков, либо турбидометрически.
5.1. Метод дисков для определения микробицидной активности.
Стерильно профильтрованную культуральную жидкость или ее разведение раскапывали по 100 мкл на диски фильтровальной бумаги (диаметр 12,7 мм). Указанные диски помещали на чашки с агаром для подсчета бляшек, засеянные жидкой культурой тестерного организма (0,3 мл разведения 10-2 ). Полученные образцы культивировали в течение 24 ч при температуре 30oC, после чего измеряли диаметр (в мм) образовавшейся зоны подавления.
5.2. Турбидометрический метод для определения микробиологической активности.
В указанном методе использовали автоматический турбидометр (Bioscreen/ Labsystems).
Исследуемая проба состояла из 10% по объему культуры тестерного организма, 10% по объему стерильно профильтрованной культуральной жидкости (рассчитаны по отношению к объему пробы) и ростовой среды. В случае контролей стерильно профильтрованный препарат заменяли дистиллированной водой, pH которой доводили молочной кислотой до величины, соответствующей стерильно профильтрованному препарату.
В случае каждого тестерного штамма ростовая среда представляла собой среду, используемую для культивирования соответствующего тестерного штамма.
Культивирование плесневых грибков Fusarium и Aspergillus осуществляли в течение 5 дней при температуре 25oC и интенсивном перемешивании. Соответствующие условия для грамотрицательных бактерий были: в случае штамма Enterobacter - 30oC, в остальных случаях - 25oC, при перемешивании в течениe 2 дней. Выращивание молочнокислых бактерий проводили в течение 3 дней при температуре 30oC и перемешивании.
С помощью вышеупомянутого прибора определяли способность исследуемых проб поглощать видимый свет с длиной волны 420-580 нм. После культивирования выстраивали кривую роста для каждой пробы и рассчитывали площадь под полученной кривой.
Микробицидный эффект продуцирующего штамма, сказывающийся на росте тестерного штамма, выражали в виде процента подавления, определяемого путем сравнения величин площадей под кривыми роста в контроле и при использовании стерильно профильтрованного препарата продуцирующего штамма соответственно.
6. Определение фунгицидного эффекта конкретных молочнокислых бактерий.
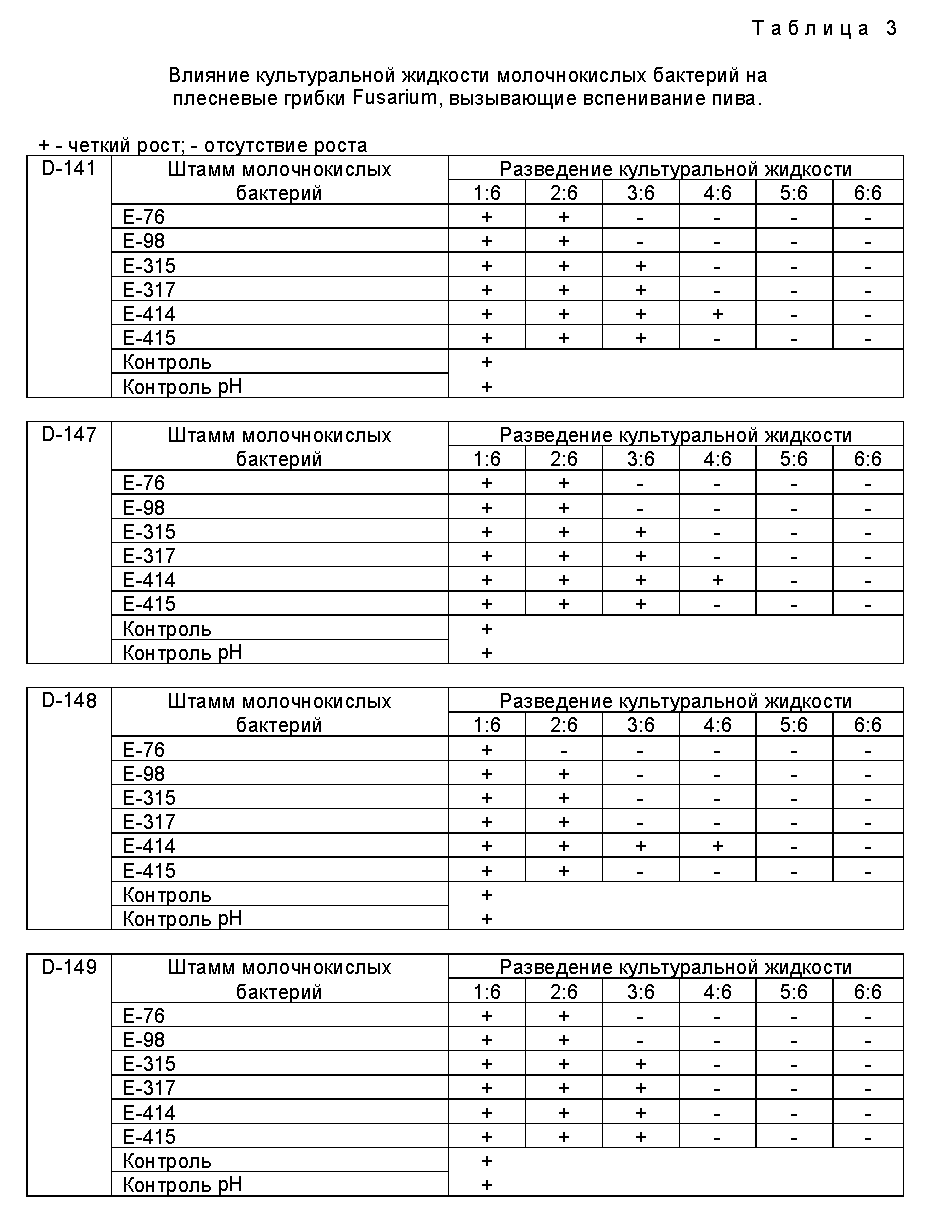
Изучали фунгицидный эффект, производимый шестью штаммами молочнокислых бактерий E-76, E-98, E-315, E-317, E-414 и E-415, по отдельности на все плесневые грибки Fusarium, используемые в качестве тестерных штаммов. В указанном эксперименте проводили визуальную оценку помутнения культур плесневых грибков, к которым были добавлены разные разведения стерильно профильтрованного препарата, полученного при культивировании каждого из штаммов молочнокислых бактерий (табл.3).
В контрольных исследованиях вместо культуральной жидкости использовали воду Milli-Q либо воду Milli-Q, доведенную молочной кислотой до pH 3,6.
Культивирование проводили в тестерных пробирках со средой КМЦ при температуре 25oC в течение 5 дней. Результаты учитывали визуально.
7. Результаты.
В табл. 1 и 2, а также на фиг. 1 представлены микробицидные активности, выявленные для разных штаммов молочнокислых бактерий методом дисков или с помощью турбидометрического способа соответственно.
В табл. 3 представлены визуально определяемые фунгицидные активности.
Полученные результаты свидетельствуют о том, что вышеупомянутые штаммы молочнокислых бактерий подавляют рост вредных плесневых грибков Fusaruim и других нежелательных микробов, встречающихся в ходе процесса сбраживания, не оказывая при этом практически никакого влияния на полезные микробы. Полученные результаты показывают возможность использования молочнокислых бактерий в способе, предусмотренном настоящим изобретением.
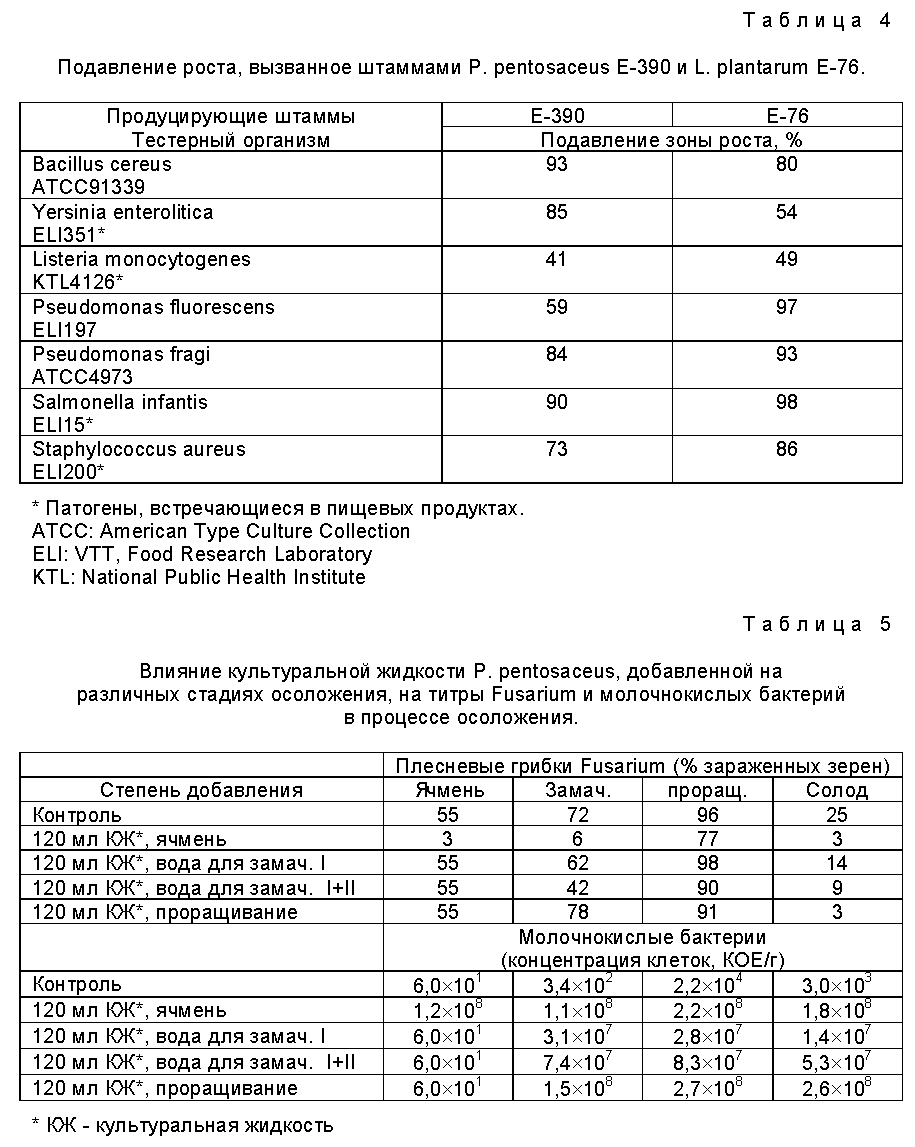
Пример 2. Микробицидное действие, оказываемое определенными штаммами молочнокислых бактерий на пищевые патогены, а также на микробы, нежелательные для пищевых продуктов.
В настоящем эксперименте исследовали микробицидный эффект, проявляемый препаратами, полученными с помощью штаммов Pediococcus pentosaceum VTT-E-90390 (E-390) и Lactobacillus plantarum VTT-E-78076 (E-76), по отношению к пищевым патогенам, а также к микробам, нежелательным для пищевых продуктов. В качестве тестерных организмов использовали штаммы, относящиеся к родам Bacillus, Yersinia, Listeria. Pseudomonas, Salmonella и Staphylococcus.
В качестве препарата использовали стерильную культуральную жидкость молочнокислых бактерий, полученную в соответствии с примером 1. Все остальные тестерные штаммы культивировали в течение 16 - 18 ч в среде Iso-Sensitest (Oxoid), за исключением штамма Listeria, который выращивали, триптозофосфатной среде. Температура культивирования была равна 30oC, за исключением штаммов Salmonella, Listeria и Staphylococcus, в случае которых она равнялась 37oC.
Микробицидную активность определяли с помощью турбидометрического способа, описанного в примере 1. Условия проведения эксперимента в плане ростового субстрата и температуры соответствуют вышеописанным. Длительность инкубирования была равна 24 ч, за исключением штаммов Bacillus и Yersinia, для которых она составляла 48 ч.
Полученные результаты, представленные в табл. 4, свидетельствуют о том, что добавление предусмотренного настоящим изобретением препарата молочнокислых бактерий вызывает подавление роста пищевых патогенов, а также микробов, нежелательных для пищевых продуктов.
Пример 3. Влияние препаратов молочнокислых бактерий, а также препаратов, полученных с помощью молочнокислых бактерий, на микрофлору осоложения и качество солода.
1. Используемые штаммы.
В эксперименте использовали штамм молочнокислой бактерии Pediococcus pentosaceus VTT-E-90390 (E-390).
Ростовой средой для инокулята служила среда MRS. Указанные бактерии культивировали в течение 2 дней в 10 мл среды MRS при температуре 30oC. Объем инокулята был равен 1% от объема ростового раствора.
2. Ячмень.
Использовали ячмень сорта Kymppi урожая 1990 г, в котором доля зерен, зараженных плесневым грибком Fusaruim, составляла 55%.
3. Процесс соложения.
Порции ячменя весом 1000 г ополаскивали в водяной бане при температуре 12oC в течение 1 ч. Используемую для ополаскивания воду заменяли на первую воду для замачивания, которую через 5 ч заменяли на вторую воду для замачивания. Через 16 ч после этого проводили стадию воздушного покоя. Назначением стадии воздушного покоя являлось удаление воды с поверхности зерен. Продолжительность этой стадии была равна 8 ч. В ходе замачивания влажность ячменя достигала 44%. В течение стадии замачивания ячмень подвергали аэрации.
Вслед за замачиванием осуществляли проращивание. Ячмень проращивали в ящиках для проращивания в течение 6 дней при температуре 14oC. Для того чтобы поддерживать влажность на уровне 44%, указанные порции ячменя ежедневно увлажняли и ворошили. Полученный таким образом зеленый солод подсушивали по 21-часовой температурной программе. В течение 4,5 ч температура равнялась 50oC. В течение следующих 4,5 ч ее повышали до 60oC, после чего поддерживали на этом уровне в течение 4 ч. На протяжении последующих 5 ч температуру равномерно повышали до 85oC и выдерживали на этом уровне в течение оставшихся 3 ч. Конечное содержание влаги в солоде становилось равным 4%. По окончании указанного процесса механически отделяли первичные корешки.
Осоложение, осуществленное в отсутствие каких бы то ни было добавок, рассматривали в качестве контроля.
4. Препарат молочнокислых бактерий и препарат, полученный с помощью молочнокислых бактерий.
Для получения указанных препаратов использовали клетки молочнокислых бактерий, выделенные из соответствующих культуральных жидкостей, а также культуральные жидкости, содержащие токсичные для микробов вещества, как в комбинации друг с другом, так и по отдельности. Содержащую клетки культуральную жидкость добавляли в количестве 120 мл на 1 кг ячменя либо проводили добавление клеток, выделенных из 120 мл культуральной жидкости. Указанное выделение осуществляли с помощью центрифугирования соответствующей культуральной жидкости, после чего выделенные клетки суспендировали в воде. В тех случаях, если проводили добавление культуральной жидкости, указанную культуральную жидкость использовали как таковую. Клеточные титры добавляемых препаратов находились в пределах приблизительно от 108 до 109 КОЕ/мл.
5. Добавки препаратов молочнокислых бактерий.
Препараты молочнокислых бактерий добавляли либо к ячменю, либо в начале I стадии замачивания, либо в начале I и II стадий замачивания, либо в начале проращивания.
6. Проводимые анализы.
Пробы отбирали на каждой стадии осоложения.
6.1. Учет плесневых грибков осуществляли следующим образом. Процент зерен, зараженных плесневым грибком Fusarium, определяли с помощью агара CZAPEK IPRODION DICLORAL (агара CZIP), который является селективным для плесневых грибков Fusarium, a также влажной фильтровальной бумаги [2]. Идентификацию плесневых грибков Fusarium проводили на основании типичной морфологии их колоний и спор, а также на основании красной окраски.
Учет плесневых грибков Aspergillus и Penicillum осуществляли с использованием селективного солодового солевого агара [2]. Учет других наиболее обычных плесневых грибков проводили на влажной фильтровальной бумаге.
6.2. Учет молочнокислых бактерий осуществляли на агаре MRS как в случае добавляемых культур, так и при анализе проб осоложения.
6.3. Учет полных бактериальных титров проводили на агаре для подсчета бляшек (Difco).
6.4. Химические показатели солода определяли с использованием методов, известных применительно к осоложению [3].
7. Результаты.
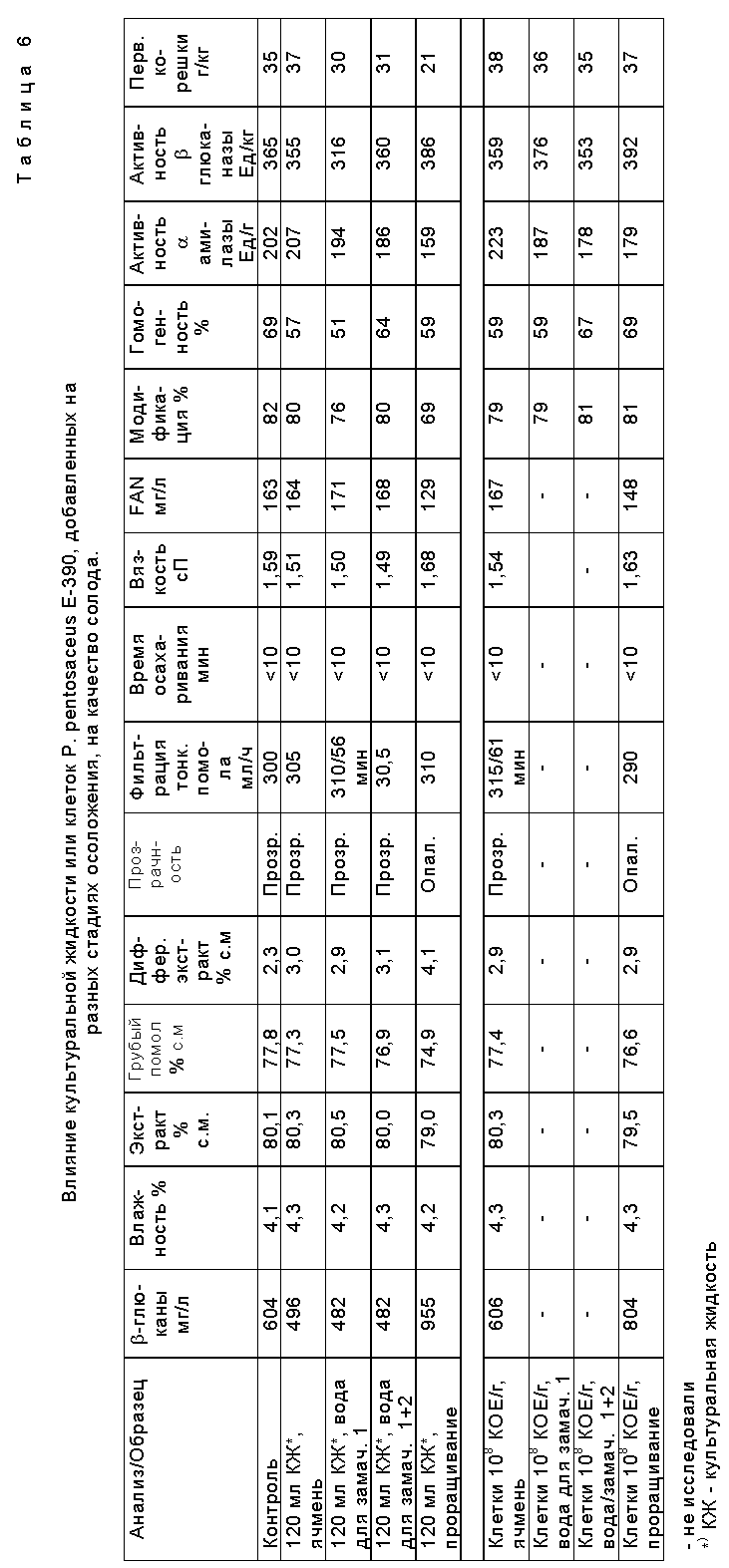
В табл. 5 приведены титры плесневых грибков Fusarium и молочнокислых бактерий на различных стадиях осоложения при добавлении культуральной жидкости E-390.
На фиг. 2 и 3 представлены полные бактериальные титры на различных стадиях осоложения в случае добавления культуральной жидкости штамма E-390 и клеток E-390.
В табл. 6 приведены результаты анализа солода при добавлении культуральной жидкости штамма E-390 или клеток E-390.
Данные результаты показывают, что обработка согласно изобретению уменьшает, в частности, количество плесневого грибка Fusarium и общий бактериальный титр на различных этапах осоложения.
Добавка препарата не оказывает нежелательного эффекта на качество солода. Обратное же верно: обработка по изобретению улучшает фильтрацию затира, полученного из сусла, и снижает содержание β- -глюкана в солоде.
Пример 4. Получение препаратов, производимых с помощью молочнокислых бактерий.
1. Получение концентрированной культуральной жидкости.
Продуцирующие штаммы Pediococcus pentosaceus VTT-E-90390 (E-390) и Lactobacillus plantarum VTT-E-78076 (E-76) культивировали в ферментере в объеме 15 л. Объем инокулята составлял от 6 до 7%, культивирование осуществляли в среде MRS при температуре 30oC в течение 2 дней при микроаэрофильных условиях. Полученные культуральные жидкости концентрировали в десять раз и в двадцать раз с помощью лиофилизации и выпаривания. Микробицидную активность полученных концентратов оценивали с использованием метода дисков.
2. Получение очищенного раствора, содержащего микробицидные соединения.
Культуральную жидкость молочнокислых бактерий подвергали очистке с помощью гель-хроматографического фракционирования в соответствии с размером молекул. Фракции, обнаружившие активность в исследовании методом дисков или с помощью турбидометрического способа, объединяли и еще раз прогоняли через гелевую колонку.
Пример 5. Влияние препаратов молочнокислых бактерий и препаратов, полученных с помощью молочнокислых бактерий, на микрофлору осоложения и на качество солода.
1. Используемые штаммы и препараты, получаемые с помощью этих штаммов:
Использовали следующие штаммы
бактерий: Lactobacillus plantarum
VTT-E-78076 (E-76) и Pediococcus pentosaceus VTT-E90390 (E-390).
Указанные штаммы были получены из VTT, Collection of Industrial Microorganisms (Biotechnical Laboratory, Finland).
Получение препаратов осуществляли так, как это описано в примере 1, пункт 3; примере 3, пункт 1; примере 4, пункты 1-2.
2. Ячмень.
Использовали ячмень сорта Kymppi урожая 1991 года.
3. Процесс осоложения.
Осоложение проводили так, как это описано в примере 3, за исключением того, что продолжительность стадии проращивания была равна 8 дням. Конечное содержание влаги в получаемом солоде становилось меньше 5%.
4. Осоложение.
Осоложение осуществляли в лабораторных условиях. Осоложение, проведенное в отсутствие каких бы то ни было добавок, рассматривали в качестве контроля.
4.1. Первый вариант осоложения.
Препаратами, используемыми в лабораторном осоложении, служили бесклеточные культуральные жидкости, концентрированные в десять раз, а также необработанные культуральные жидкости, содержащие клетки. Указанные препараты добавляли в начале стадии замачивания I либо в начале стадий замачивания I и II. Исследования осоложения 1-8 проводили следующим образом.
Тест N 1: Контроль, ячмень Kymppi 1991;
Тест N
2: В начале стадий замачивания I и II добавляют 120 мл содержащей клетки культуральной жидкости штамма E-76;
Тест N 3: В
начале стадии замачивания I добавляют 120 мл концентрированного в 10
раз фильтрата культуральной жидкости штамма E-76;
Тест N 4: В начале стадий замачивания I и II добавляют 120 мл
концентрированного в 10 раз фильтрата культуральной жидкости штамма E-76;
Тест N 5: В начале стадий замачивания I и II добавляют 120 мл культуральной жидкости штамма E-390;
Тест N
6:
В начале стадии замачивания I добавляют 120 мл концентрированного в 10 раз
фильтрата культуральной жидкости штамма E-390;
Тест N 7: В начале стадий замачивания I и II добавляют 120 мл
концентрированного в 10 раз фильтрата культуральной жидкости штамма E-390;
Тест N 8: В начале стадий замачивания I и II добавляют 60 мл содержащей клетки культуральной жидкости штамма E-76 и
60 мл содержащей клетки культуральной жидкости штамма E-390.
4.2. Второй вариант осоложения.
Препаратами, используемыми в лабораторном осоложении, служили бесклеточные концентрированные в 20 раз фильтраты культур, их бесклеточные очищенные фракции, содержащие микробицидную активность, а также необработанные, содержащие клетки культуральные жидкости. Осуществляли контроль pH воды для замачивания. Препараты добавляли в начале стадий замачивания I и II. Исследования осложнения 9-16 проводили следующим образом.
Тест N 9: Контроль,
ячмень Kymppi 1991;
Тест N 10: В начале стадий замачивания I и II добавляют
120 мл воды, pH 3,8;
Тест N 11: В начале стадий замачивания I и II добавляют 120 мл содержащей клетки
культуральной жидкости штамма E-76;
Тест N 12: В начале стадий замачивания I и
II добавляют 120 мл фракционированного концентрата штамма E-76, pH 3,8;
Тест N 13: В начале стадий
замачивания I и II добавляют 120 мл концентрированного в 20 раз фильтрата культуральной
жидкости штамма E-76;
Тест N 14: В начале стадий замачивания I и II добавляют 120 мл содержащей
клетки
культуральной жидкости штамма E-390;
Тест N 15: В начале стадий замачивания I
и II добавляют 120 мл фракционированного концентрата штамма E-390, pH 3,8;
Тест N 16: В начале
стадий
замачивания I и II добавляют 120 мл концентрированного в 20 раз фильтрата культуральной
жидкости штамма E-390.
5. Проводимые анализы.
Отбор проб осуществляли на каждой стадии осоложения.
Титры плесневых грибков и молочнокислых бактерий, полные бактериальные титры, а также физические и химические показатели качества получаемого солода определяли так, как это описано в примере 3.
6. Результаты.
На фиг. 4 и 5 представлены полные бактериальные титры на разных стадиях процесса осоложения при использовании в воде для замачивания культуральных жидкостей молочнокислых бактерий с клетками либо концентрированных или фракционированных фильтратов культуральных жидкостей.
В табл. 7, 8, 9 и 10 приведены концентрации плесневых грибков Fusarium и других плесневых грибков, а также молочнокислых бактерий на разных стадиях осоложения для обоих вариантов осоложения.
В табл. 11 и 12 представлены результаты исследования солода для обоих вариантов осоложения.
Полученные нами результаты свидетельствуют о том, что предусмотренные настоящим изобретением обработки снижают, в частности, содержание бактериальных грибков Fusarium, а также полный бактериальный титр на различных стадиях осоложения. Кроме того, отмечено, что не только культуральные жидкости, но, в частности, и концентрированные, и фракционированные культуральные фильтраты оказывают благоприятный эффект по отношению к плесневым грибкам Fusarium.
На основании проведенных анализов солода можно сделать вывод о том, что добавки культуральной жидкости штаммов E-76 и E-390 способствуют улучшению фильтруемости сусла, получаемого из соответствующего солода; также содержание β- глюкана в указанном солоде ниже, чем в контрольном.
Пример 6. Влияние препаратов, полученных с помощью молочнокислых бактерий и используемых в качестве добавок в процессе осоложения, на фильтрацию получаемой массы.
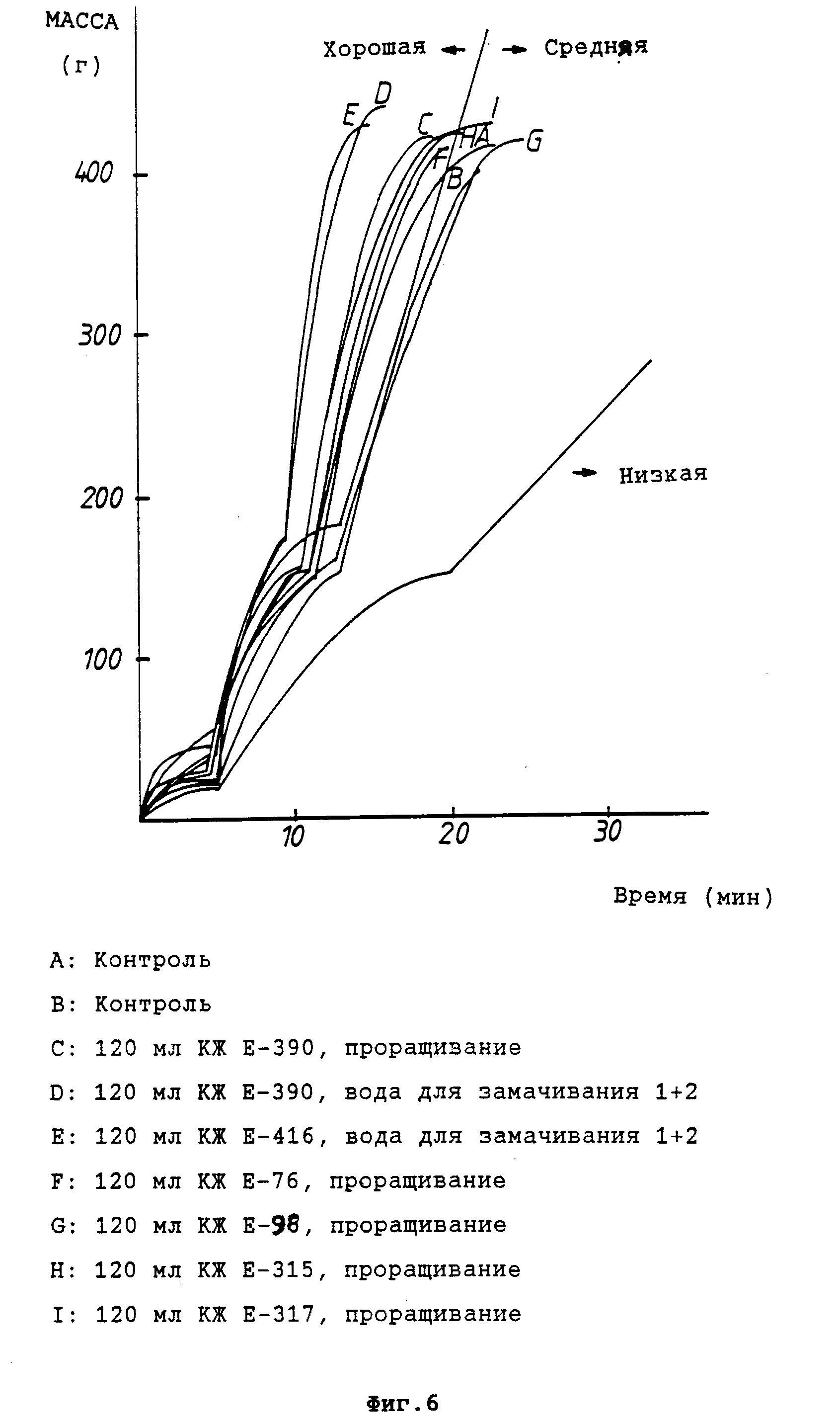
Представленная на фиг. 6 диаграмма показывает влияние предусмотренной настоящим изобретением обработки препаратами, полученными с помощью штаммов молочнокислых бактерий (120 мл культуральной жидкости на 1 кг ячменя), на фильтрацию массы, производимой из соответствующим образом обработанного солода.
В этом эксперименте используют штаммы, перечисленные в примере 1: E-390, E-416, E-98, E-317, E-390, E-76 и E-315. Анализ проводили, используя метод Terpal фильтрации [4].
Из полученных результатов видно, что предусмотренная настоящим изобретением обработка улучшает фильтрацию производимой массы.
В следующих примерах показано действие молочнокислой бактерии на концентрацию микотоксинов, дезоксиниваленола и зеараленона, продуцируемых плесенью Fusarium при осоложении ячменя.
Пример 7. Действие молочнокислой бактерии на концентрацию дезоксиниваленола (DON) при осоложении ячменя, зараженного плесенью F.culmorum D148.
1. Использованные штаммы.
В данном тесте были использованы штаммы молочнокислых бактерий Lactobacillus plantarum (E-76) и Pediococcus pentsaceus (E-390).
Эти бактерии культивировали в анaэробных условиях в MRS питательном растворе при 30o C в течение 3-4 дней. Между тестами бактериальные штаммы хранили в их питательном растворе в анaэробных условиях при 4oC.
2. Ячмень.
Использовали сорт ячменя Kymppi урожая 1994 года, к которому было добавлено 2 мл культурального раствора Fusarium на 100 г ячменя. Штамм Fusarium был выращен на качалке в растворе CMC в течение около 7 дней до образования спор. Плотность спор культурального раствора F.culmorum VTT D-80148 (D-148) составляла около 106 спор/мл раствора. Зараженный ячмень инкубировали при 25oC в течение 3 дней. Ячмень ежедневно перемешивали, и в течение ночи высушили при 30oC до его первоначальной влажности.
3. Процесс осоложения.
Программа замачивания для
1000 г порции ячменя была следующей:
промывание 1 ч,
первое замачивание 7 ч,
первый перерыв
для проветривания 16 ч,
второе замачивание
8 ч,
второй перерыв
для проветривания 15 ч,
погружение.
Температура замачивания была 12oC, а желаемая влажность ячменя составляла 46% к концу замачивания. Для того чтобы убедиться в дыхании и метаболизме ячменя, между стадиями замачивания делали перерывы для проветривания и образцы ячменя во время перерывов переносили в аэрируемую область. Обеспечивалось также проветривание сосудов для замачивания. После второго перерыва для проветривания образцы ячменя взвешивали для определения содержания влаги. Если влажность была ниже 46%, образцы ячменя погружали в воду на короткий промежуток времени. Соотношение ячменя и воды при замачивании составляло 1: 1,5. После этого пробы ячменя помещали в боксы для проращивания.
Образцы ячменя проращивали в аэрируемых боксах для проращивания в течение 6 дней при 14oC. Для доведения влажности до желаемого уровня 46%, образцы ячменя ежедневно увлажняли и ворошили. Полученный таким образом зеленый солод высушивали, используя 21-часовую температурную программу, как на стадии 3 примера 3. И, наконец, механически удаляли из солода проростки.
Осолаживание, осуществляемое без добавления молочнокислой бактерии, использовали как контрольный тест.
4. Препарат молочнокислой бактерии.
В табл. 13 представлены pH, клеточный титр и микробицидная активность (дисковый метод, пример 1, пункт 5) культуры молочнокислой бактерии, добавляемой при осолаживании.
5. Добавление препарата молочнокислой бактерии.
Препарат молочнокислой бактерии добавляли в начале стадии первого и второго замачивания. Соотношение культуры молочнокислой бактерии к воде при осолаживании поддерживается на уровне 8%.
6. Осуществленные анализы.
Концентрацию дезоксиниваленола в каждом образце ячменя определяли с помощью газовой хроматографии. Для узнавания и количественного определения дезоксиниваленола использовали масс-спектрометр.
7. Результаты.
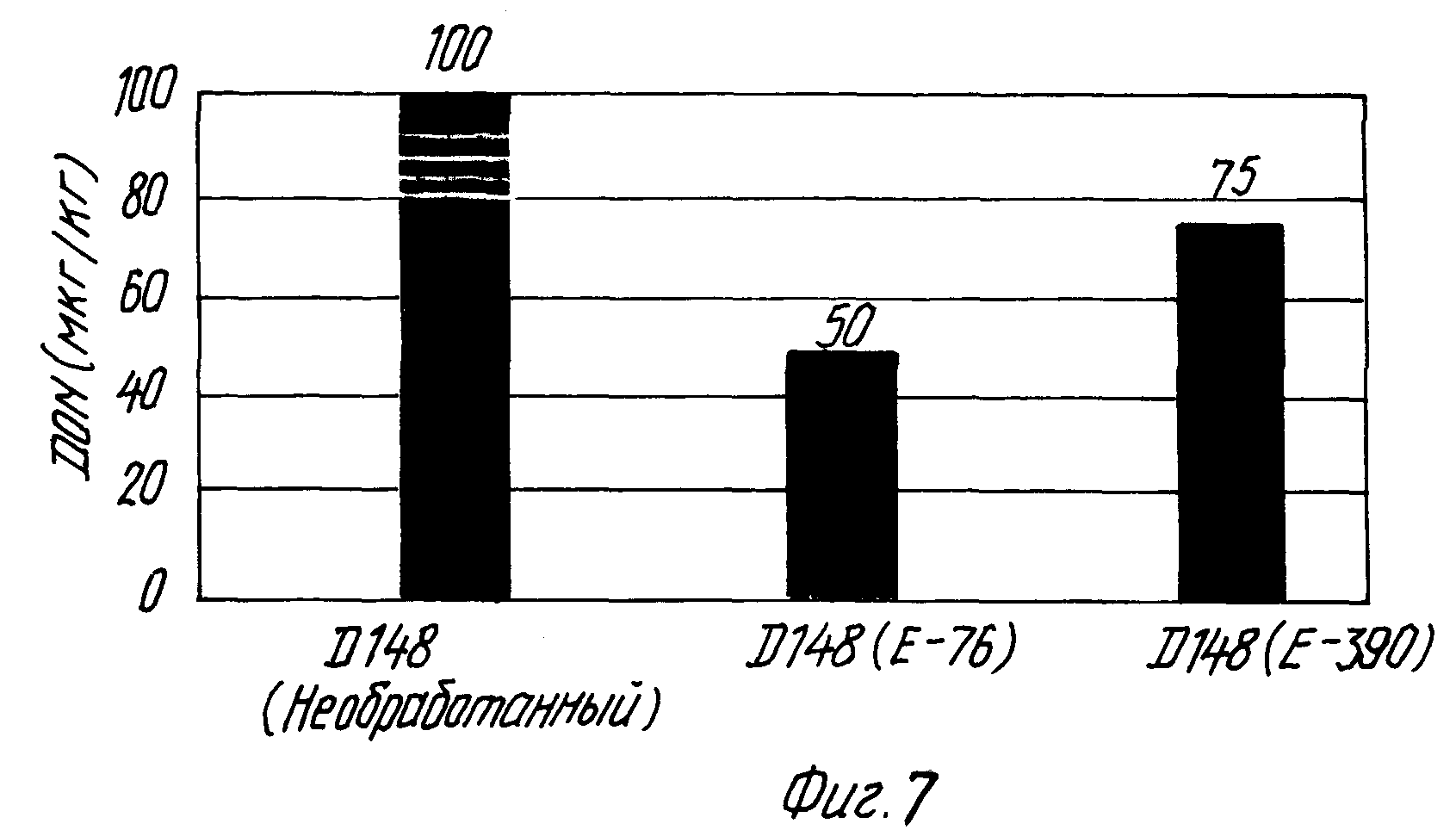
На фиг. 7 показано влияние добавления молочнокислой бактерии на содержание дезоксиниваленола при осоложении ячменя, зараженного штаммом F.culmorum D 148.
Из полученных результатов видно, что под действием штамма L.plantarum E-76 в солоде оказывается на 50% меньше дезоксиниваленола по сравнению с необработанным солодом, а под действием штамма Р.pentosaceus E-390 в солоде оказывается на 25% меньше дезоксиниваленола по сравнению с необработанным солодом.
Пример 8. Влияние молочнокислой бактерии на образование дезоксиниваленола (DON) при осоложении ячменя, естественным образом загрязненного дезоксиниваленолом и плесенью Fusarium.
1. Использованные штаммы.
В данном тесте были использованы штаммы молочнокислых бактерий Lactobacillus plantarum (E-76) и Lactobacillus acidophilus VTT E-87276 (E-276).
Штамм Lactobacillus plantarum культивировали как в примере 7. Температура культивирования для штамма Lactobacillus acidophilus была 37o C.
2. Ячмень.
Использовали сорта ячменя низкого качества Kustaa, Loviisa и Jo 1599 урожая 1993 года.
3. Процесс осоложенияю
Осолаживание
осуществляли так же, как в примере 7, за
исключением порций ячменя (100 г) и соотношения ячмень:вода при замачивании (1:4,0).
Осолаживание, осуществляемое без добавления молочнокислой бактерии, использовали как контрольный тест.
4. Препарат молочнокислой бактерии.
В табл. 14 представлены pH, клеточный титр и микробицидная активность (дисковый метод, пример 1, пункт 5.1) культуры молочнокислой бактерии, добавляемой при осолаживании.
Б. Иностранный ячмень.
1. Использованные штаммы.
Соответствует пункту А.1.
2. Ячмень.
Использованный ячмень состоял из сортов 1-3 иностранного ячменя низкого качества.
Осолаживание осуществляли так же, как в примере 7, за исключением порций ячменя (20 г) и соотношения ячмень:вода при замачивании (1:17,0).
Ячмень проращивали 6 дней в пластиковых пакетах, помещенных в пластиковый бокс в металлической рамке до желаемой влажности 46%. Пакеты ежедневно поворачивали. Для сохранения влажности некоторое количество воды выливали на дно бокса для проращивания. Зеленый солод высушивали в инкубаторе при 50oC в течение 17 ч, после чего температуру поднимали до 85oC, и ячмень сушили еще в течение 4 ч. Проростки удаляли механически.
4. Препарат молочнокислой бактерии.
В табл. 15 представлены pH, клеточный титр и микробицидная активность (дисковый метод, пример 1, пункт 5.1) культуры молочнокислой бактерии, добавляемой при осолаживании.
5. Добавление препарата молочнокислой бактерии.
Препарат молочнокислой бактерии добавляли в начале стадии первого и второго замачивания. Соотношение культуры молочнокислой бактерии к воде при осолаживании поддерживали на уровне 8%.
6. Осуществленные анализы.
Концентрацию дезоксиниваленола в каждом образце ячменя определяли с помощью теста Elisa (Ridascreen).
7. Результаты.
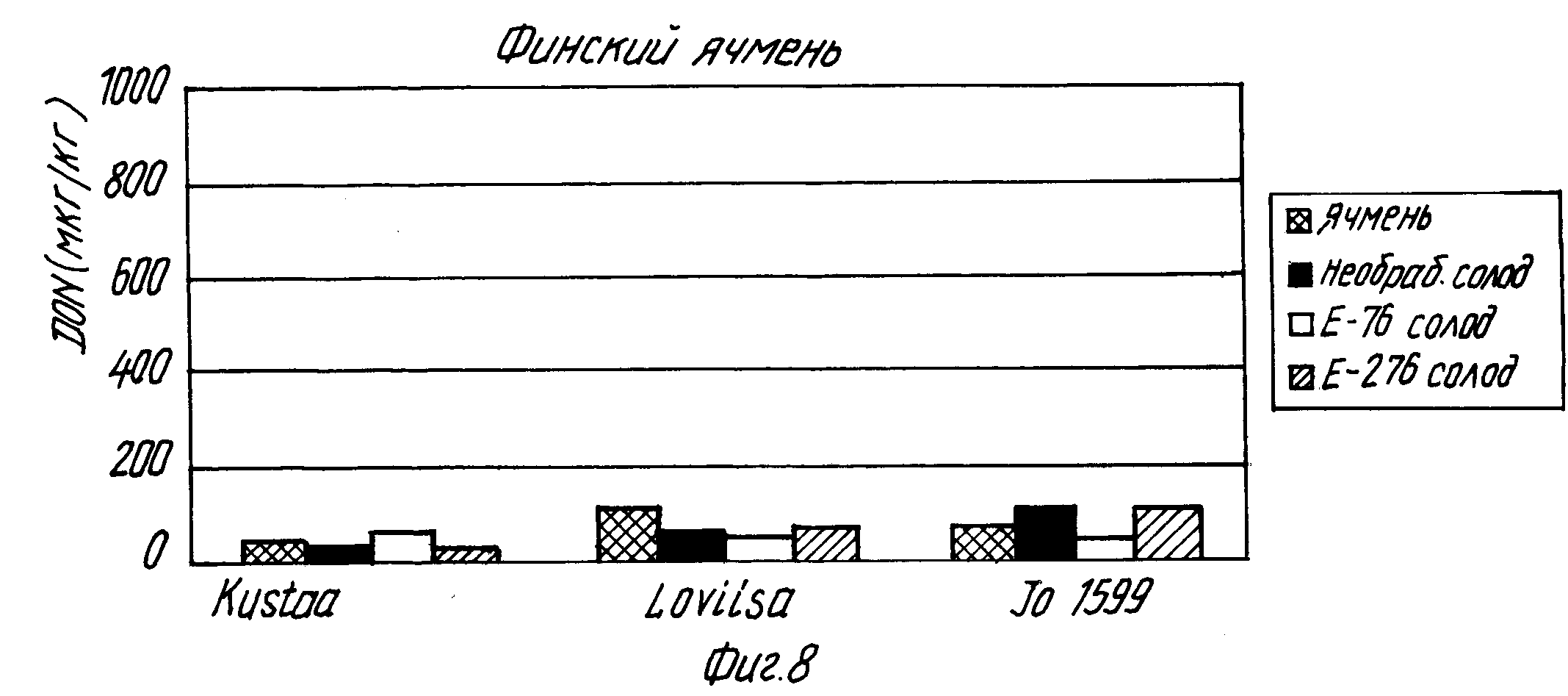
В табл. 16 и на фиг. 8 и 9 показаны концентрация дезоксиниваленола при осоложении порций финского и иностранного ячменя, а также влияние молочнокислой бактерии на образование дезоксиниваленола(DON) при осоложении ячменя, естественным образом загрязненного дезоксиниваленолом и плесенью Fusarium.
На фиг. 10 показаны средние значения концентрации дезоксиниваленола трех домашних и трех иностранных образцов ячменя, то есть влияние культур молочнокислой бактерии, добавленных к воде для первого и второго замачивания на концентрацию дезоксиниваленола (DON) при осоложении финского и иностранного ячменя, определенного с помощью теста Elisa (Ridascreen). Результаты даны в виде средних величин.
Из полученных результатов видно, когда добавлен культуральный раствор L. plantarum E-76, особенно при осолаживании образцов иностранного ячменя, концентрация дезоксиниваленола выше в необработанном солоде, чем в присутствии молочнокислой бактерии. Под действием штамма L.plantarum концентрация дезоксиниваленола (средняя для трех образцов) оказывается на 68% ниже, чем в необработанном солоде, а под действием штамма Lactobacillus acidophilus (E-276) концентрация дезоксиниваленола оказывается на 75% ниже, чем в необработанном солоде. Порции финского ячменя имеют низкие концентрации дезоксиниваленола, которые могут быть далее при осолаживании еще снижены.
Пример 9. Влияние молочнокислой бактерии на содержание зеараленона (ZEN) в солоде при осолаживании ячменя, зараженного штаммами Fusarium culmorum D-148 и F.graminearum D-470.
A: 1. Был использован штамм молочнокислых бактерий Lactobacillus plantarum (E-76).
Этот штамм, ячмень (время заражения 7 дней), процесс осолаживания, препарат молочнокислых бактерий и добавки препарата молочнокислых бактерий, использованные в этом примере, были такими же, как в пунктах 1-5 примера 7.
6. Осуществленные анализы.
Содержание зеараленона в каждом образце ячменя определяли с помощью жидкостной хроматографии.
7. Результаты.
На фиг.11 показано влияние добавления молочнокислой бактерии на содержание зеараленона при осоложении ячменя, зараженного штаммом F.culmorum D 148.
Из полученных результатов видно, что под действием штамма L.plantarum E-76 в солоде оказывается на 46% меньше зеараленона по сравнению с необработанным солодом.
Б:1. Использованные штаммы.
В данном тесте были использованы штаммы молочнокислых бактерий Lactobacillus plantarum (E-76), Lactobacillus acidophilus VTT E-87276 (E-276) и Pediococcus pentsaceus (E-390).
Культивирование осуществляли, как описано в примере 7.
2. Ячмень.
Использовали сорт ячменя Kymppi урожая 1994 года, который был заражен культуральным раствором F.graminearum VTT D95470 (D-470), как описано в пункте 2 примера 7.
Процесс осолаживания, препарат молочнокислых бактерий и добавки препарата молочнокислых бактерий, использованные в этом примере, были такими же, как в пунктах 3-5 примера 7.
Дополнительно культура молочнокислой бактерии L. acidophilus E-276, добавленная при осолаживании, имела pH 4,05, титр клеток 5,8E+08 PMY/мл и зону ингибирования 14 м (дисковый метод, пример 1, пункт 5.1).
6. Осуществленные анализы.
Содержание зеараленона в каждом образце ячменя определяли с помощью теста Elisa (Ridascreen).
7. Результаты.
На фиг. 12 показано влияние добавления молочнокислой бактерии на содержание зеараленона при осоложении ячменя, зараженного штаммом F.graminearium VTT D-95470 (D-148).
Из полученных результатов видно, что под действием молочнокислой бактерии в солоде оказывается на 37-55% меньше зеараленона по сравнению с необработанным солодом.
Список литературы
1. Haikara A. and
Home S., Mash filtration difficulties caused by split barley kernels: a
Microbiological problem. Proc. EEC Congress 1951 (Quality Control).
2. EEC-Analytica Microbiologia, Part II, 1987.
3. EEC-Analytica, 1987, 4th Ed.
4. Grandclerc J. et al., Simplification de la methode de filtration du brassin tepral description de la methode. 1988 BIOS 19: 88-92.
Реферат
Способ включает добавление к зернам ячменя, используемым в процессе осолаживания, или семенному материалу, который будет превращен в проростки, предназначенные для использования в качестве пищи, противомикробных добавок. Добавки, которые оказывают эффект подавления роста микробов, являются препаратом молочнокислых бактерий либо препаратом, продуцируемым молочнокислыми бактериями. 4 з.п. ф-лы, 16 табл., 12 ил.

Комментарии