Производные фенилалкилкарбоновой кислоты и фармацевтическая композиция на их основе - RU2169141C2
Код документа: RU2169141C2
Чертежи

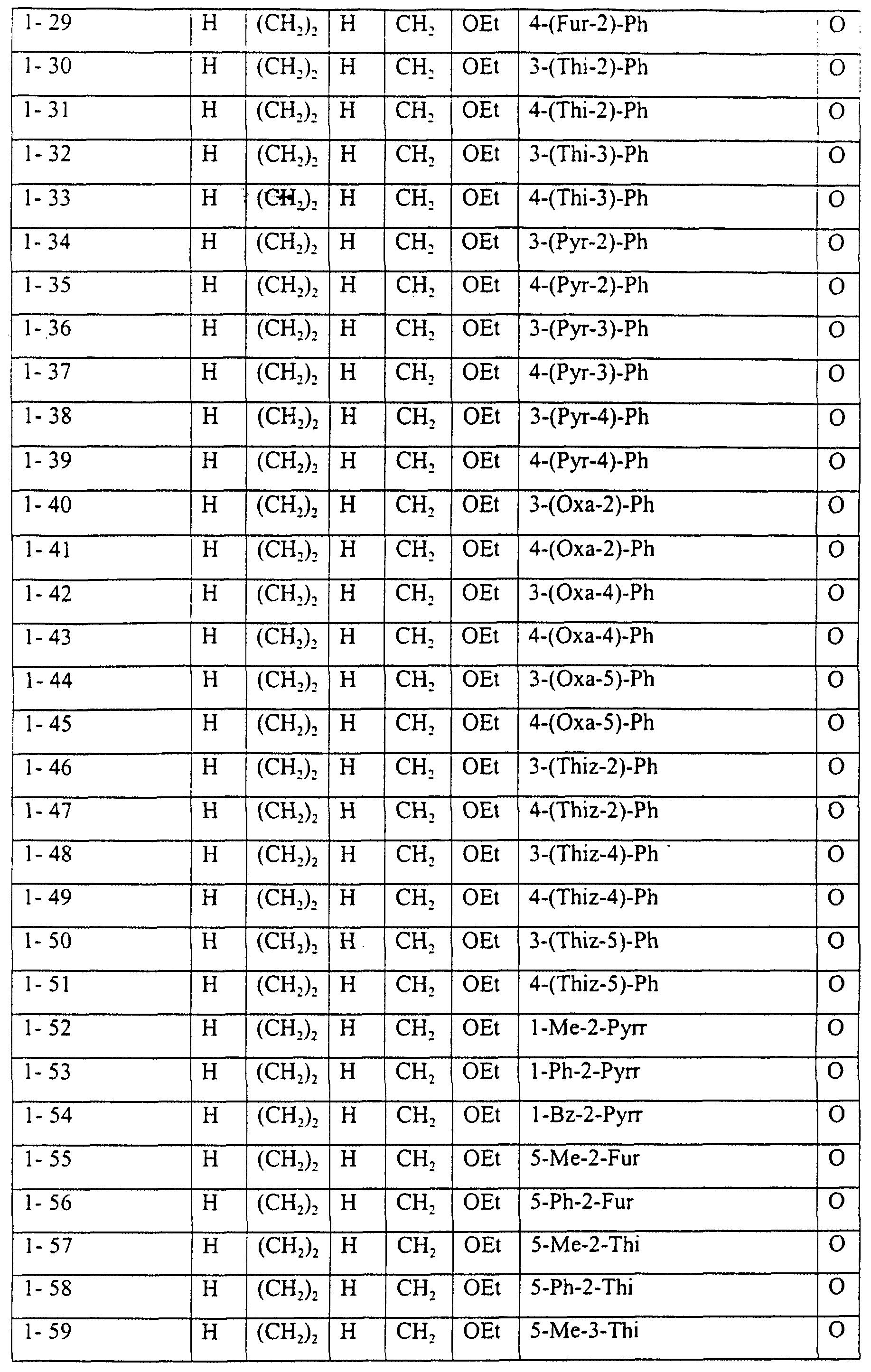






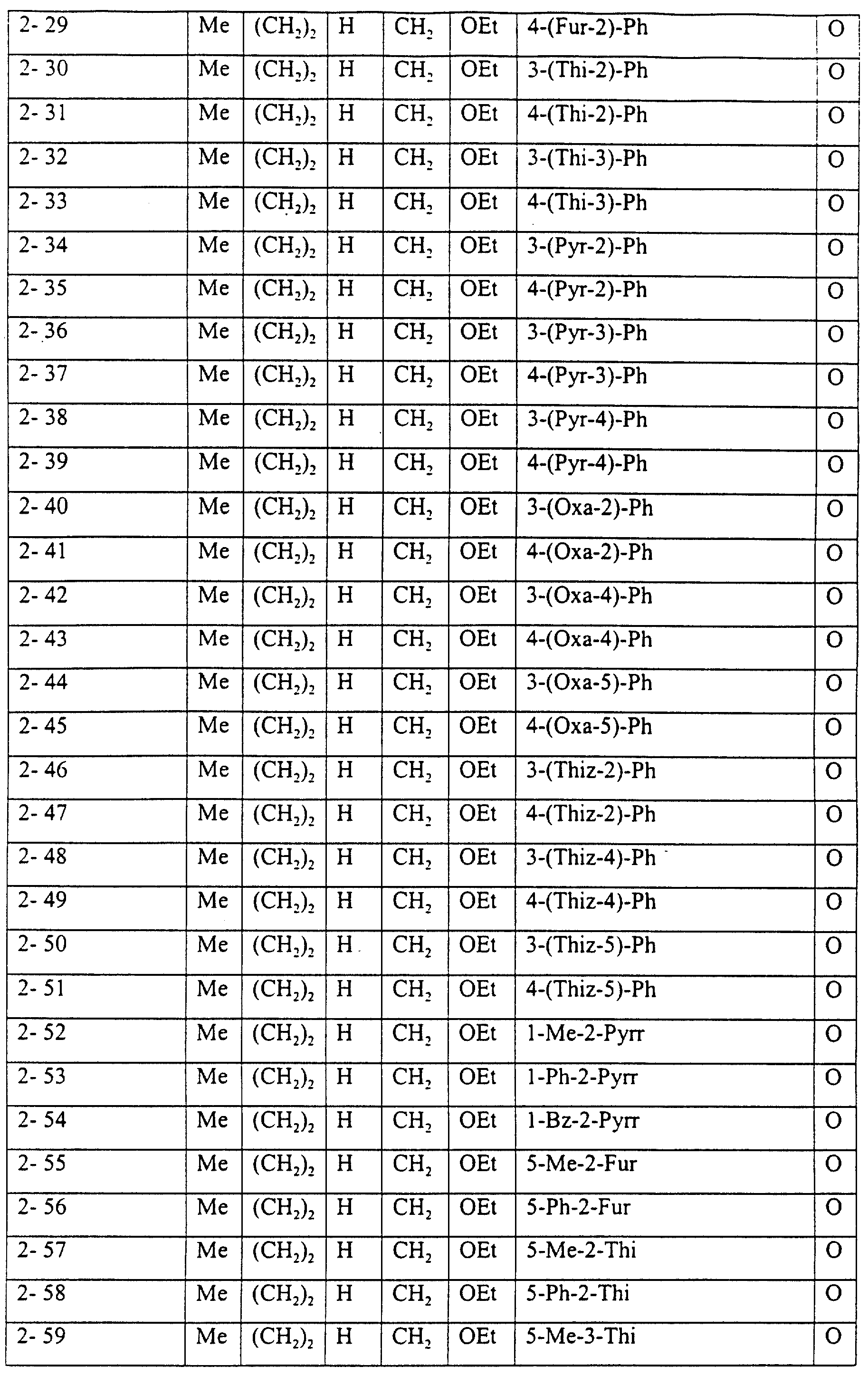





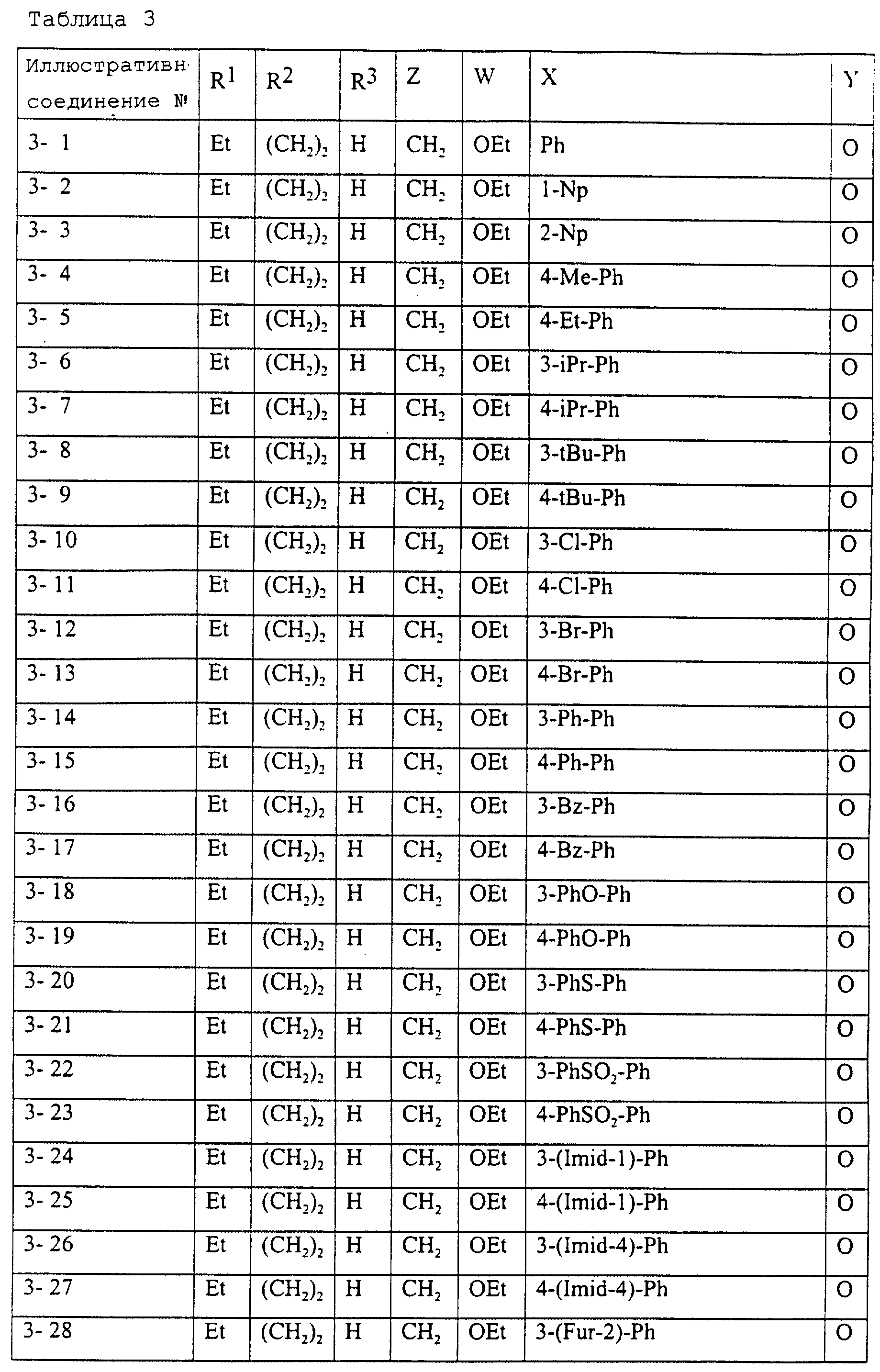






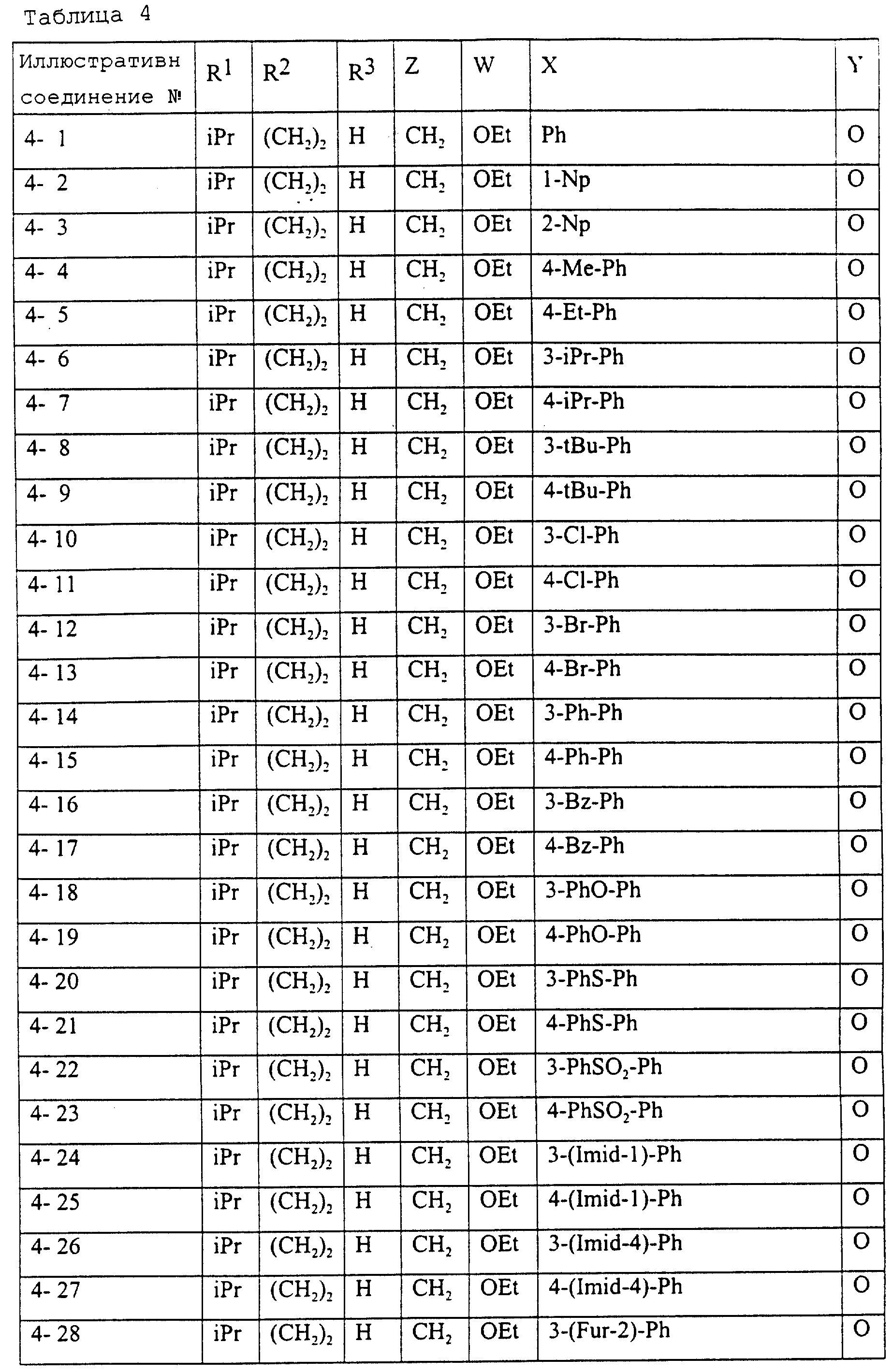
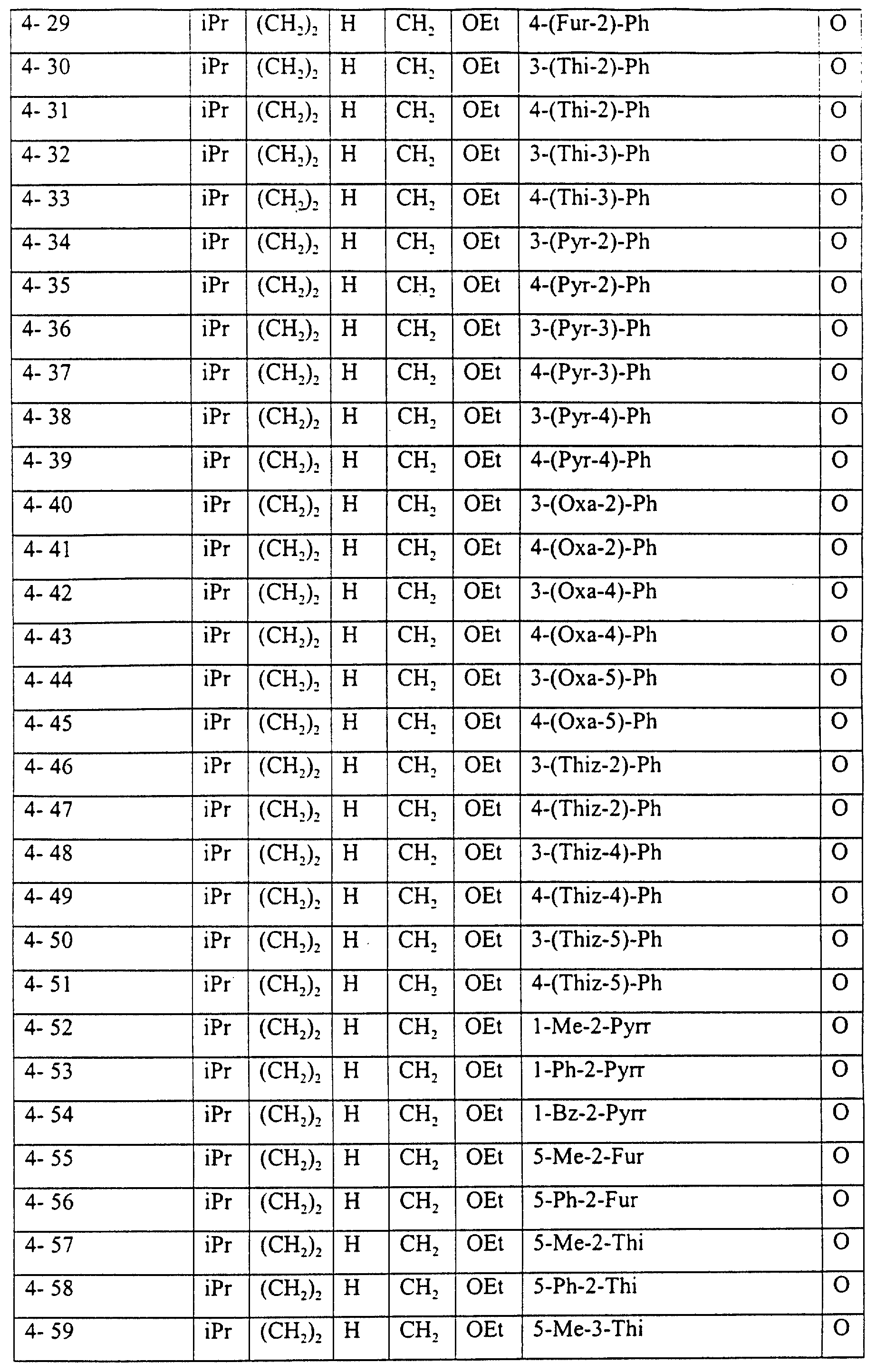


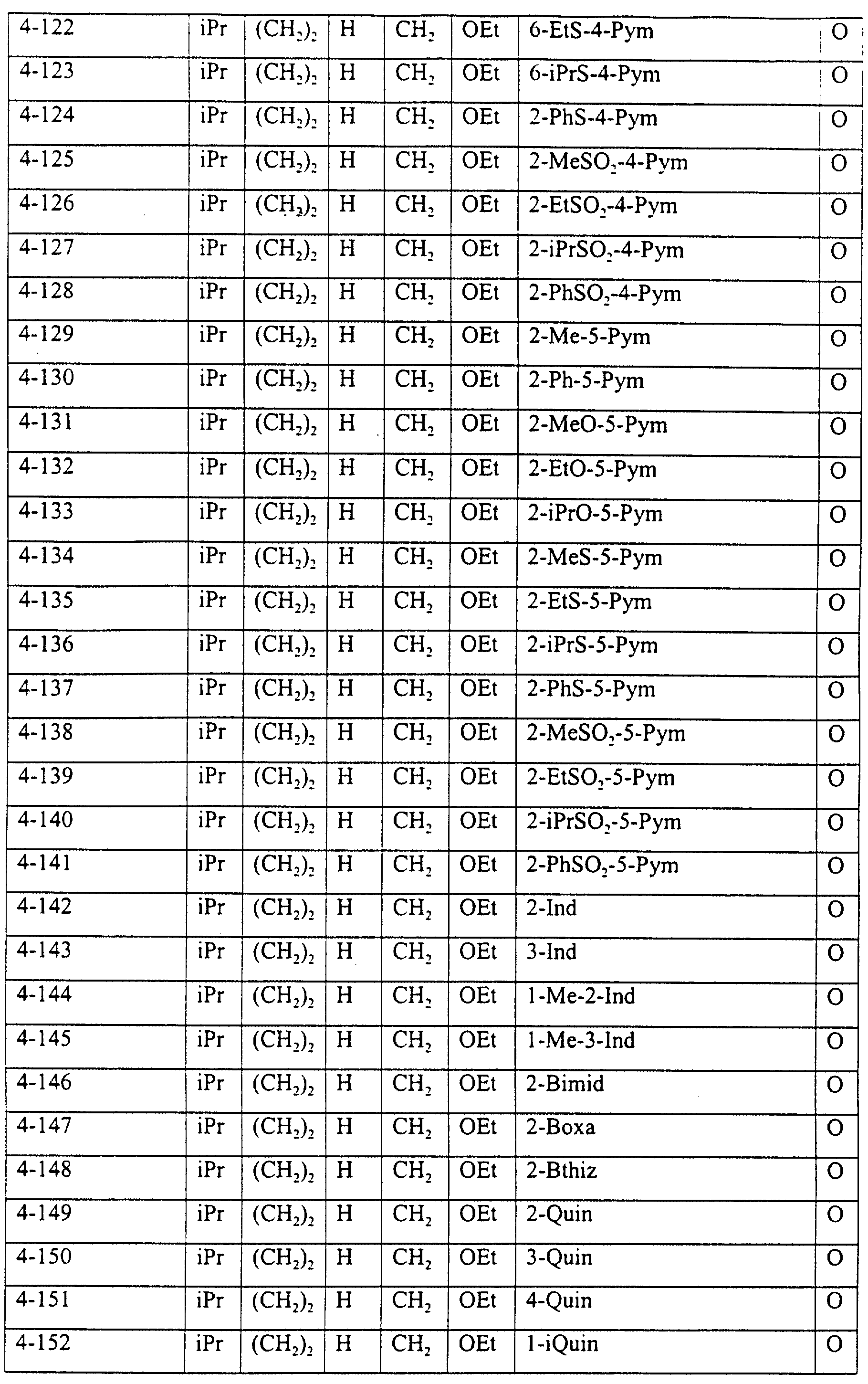
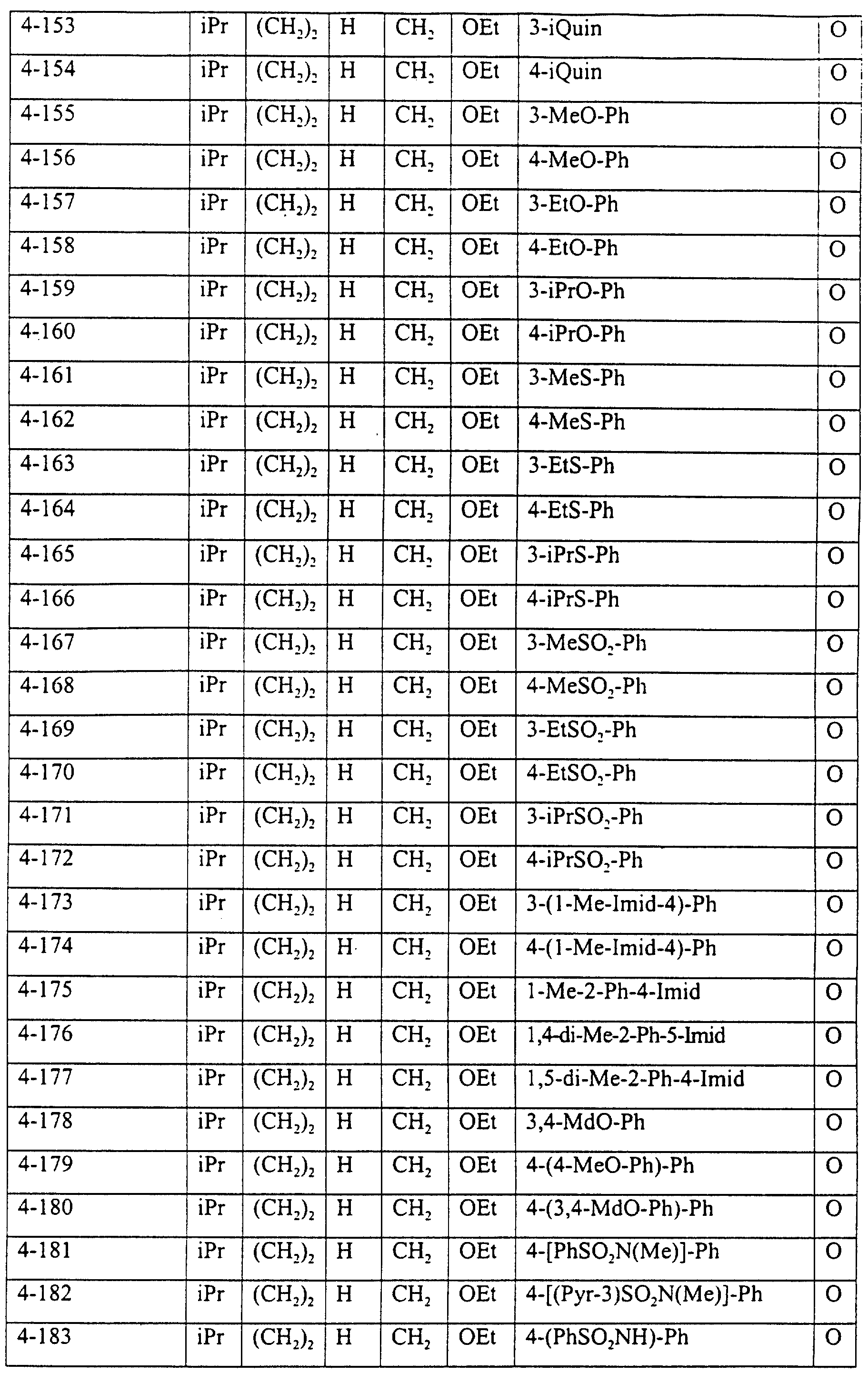


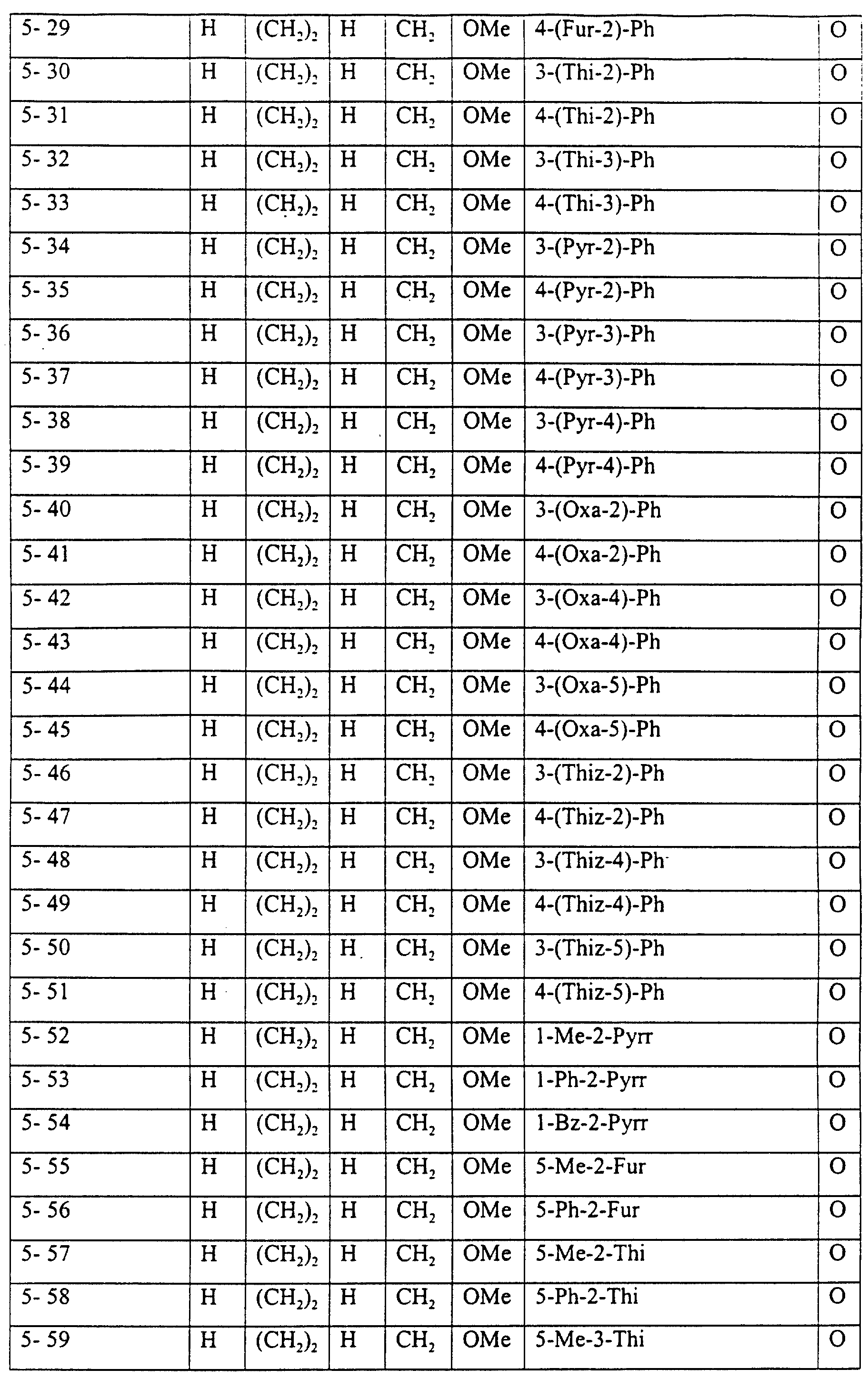






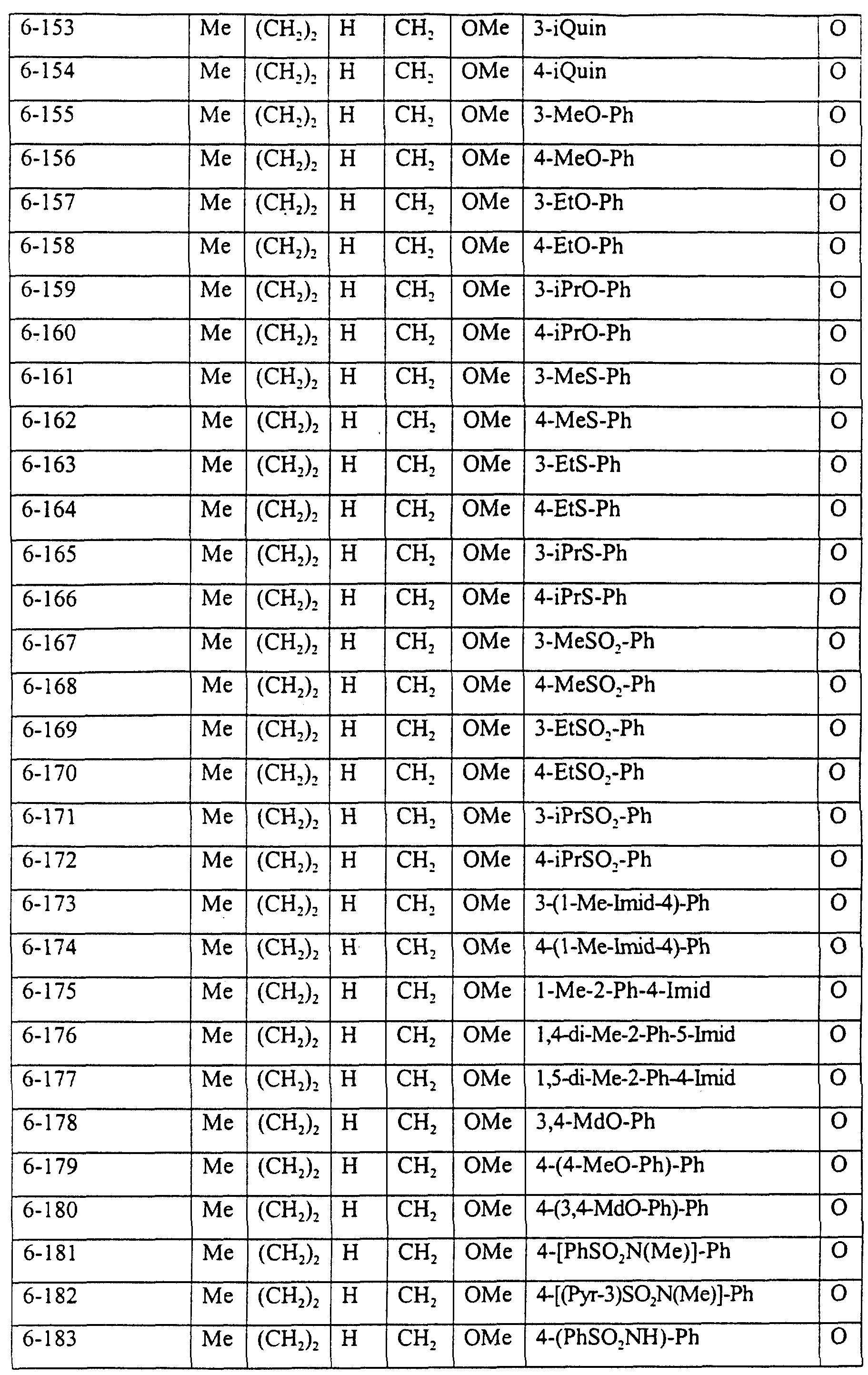

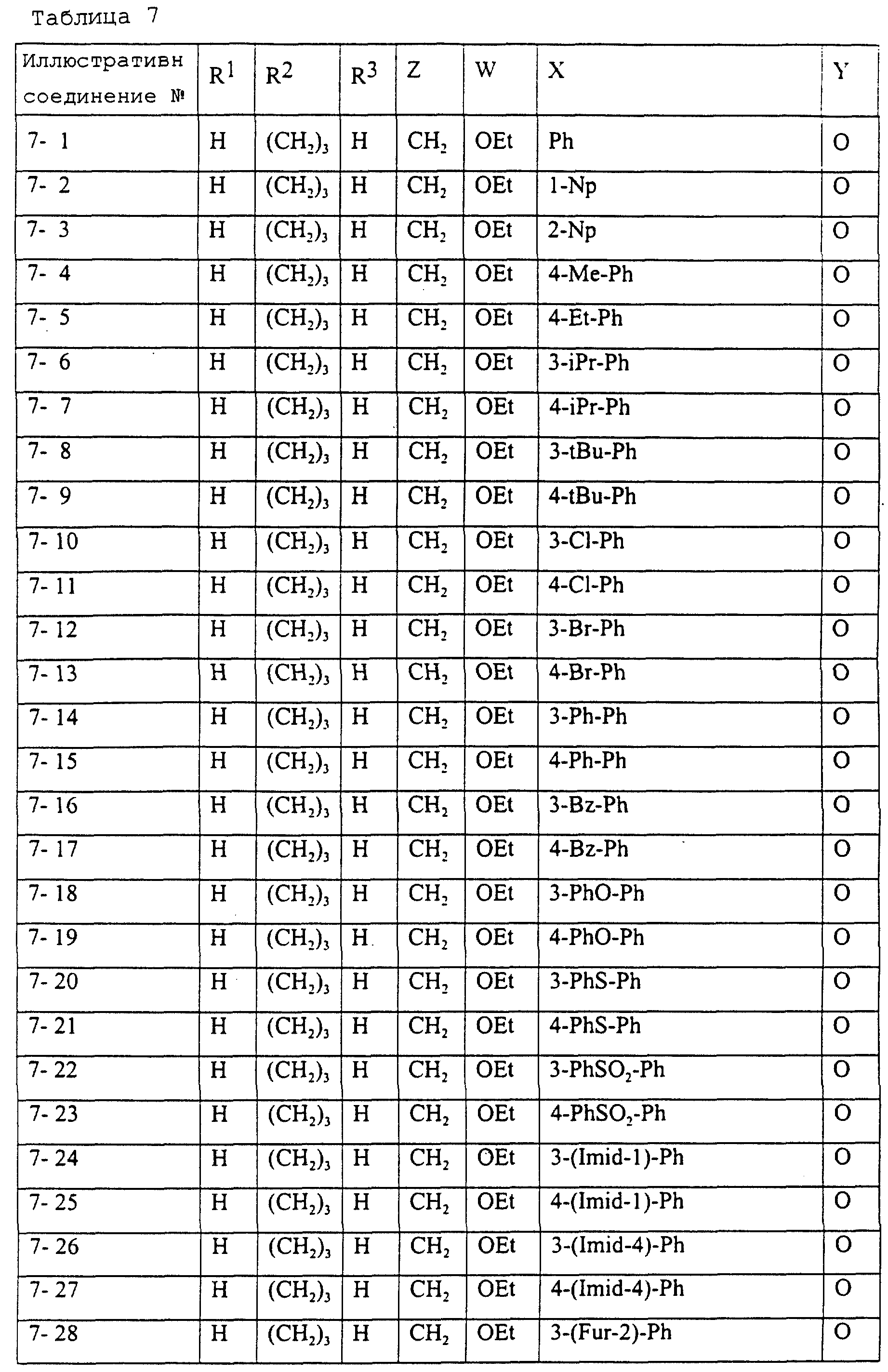
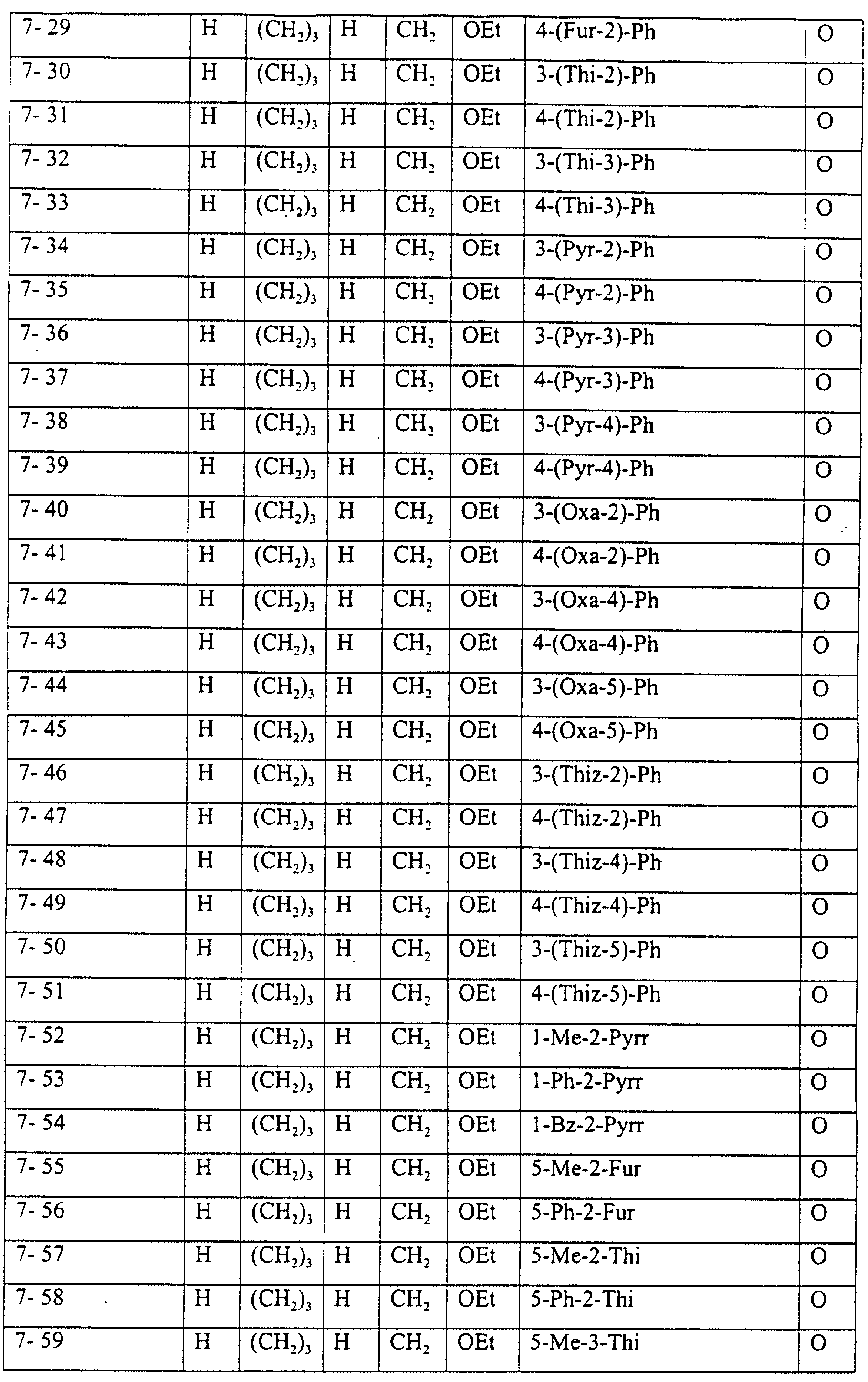







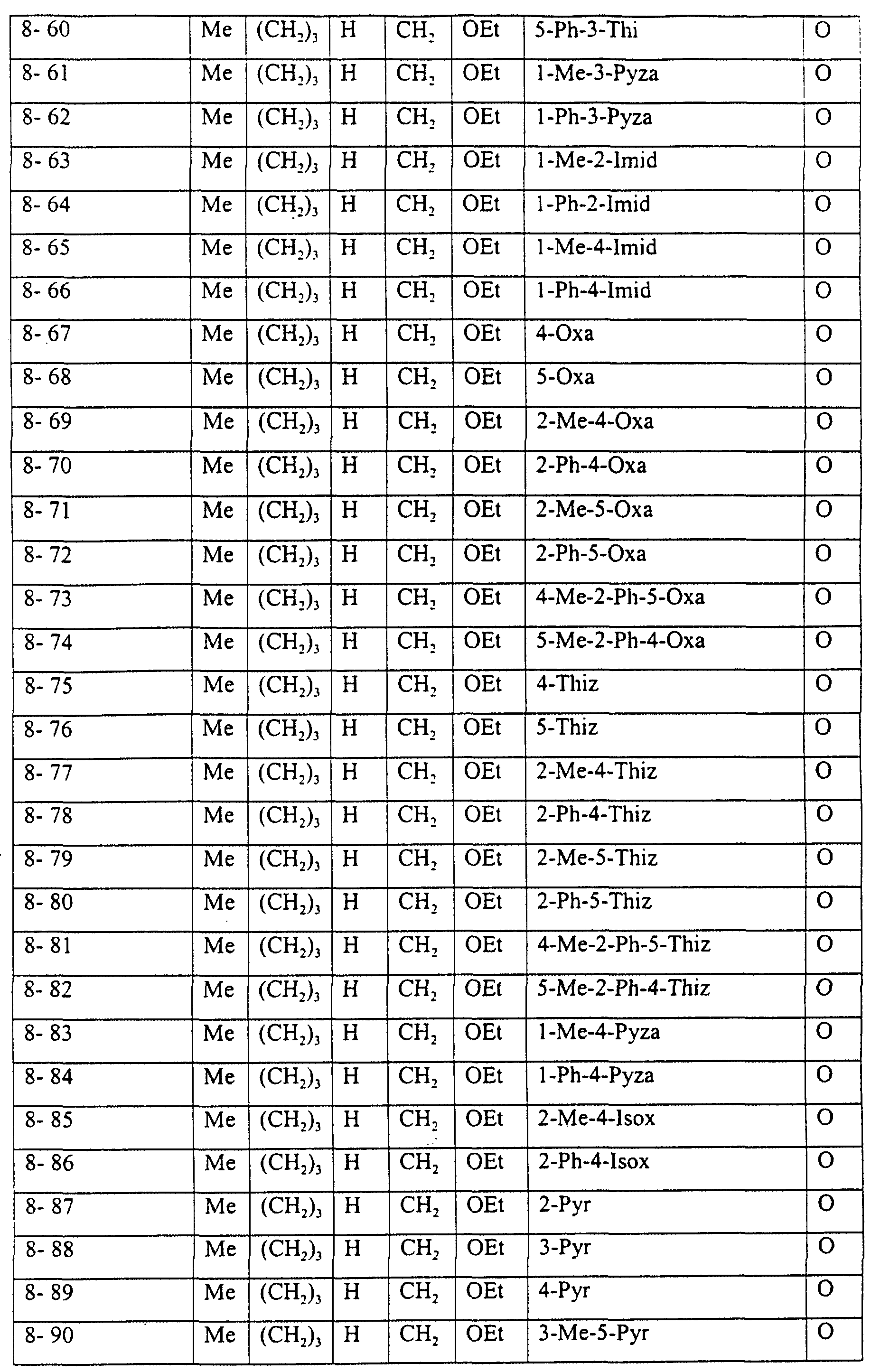

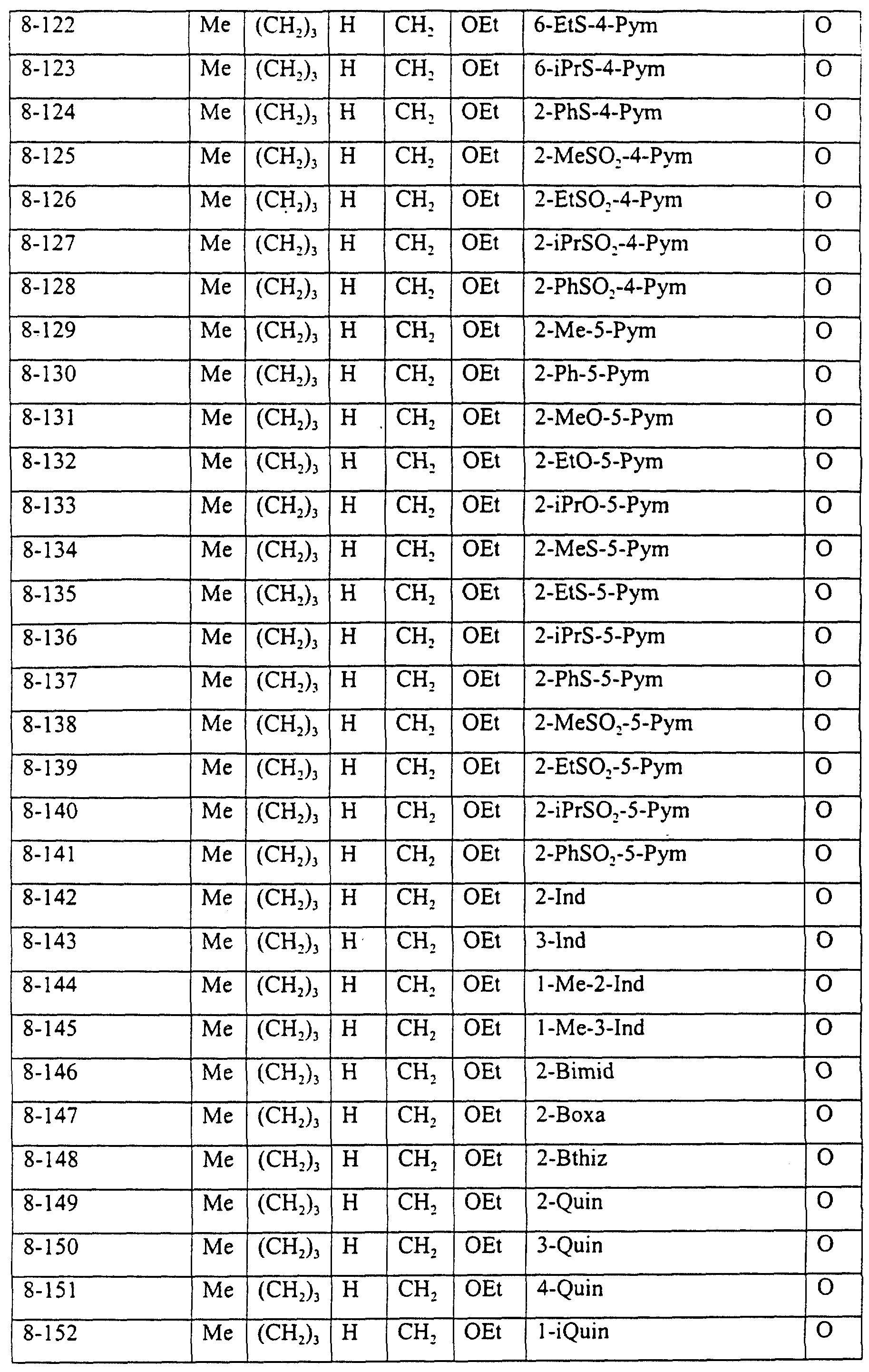



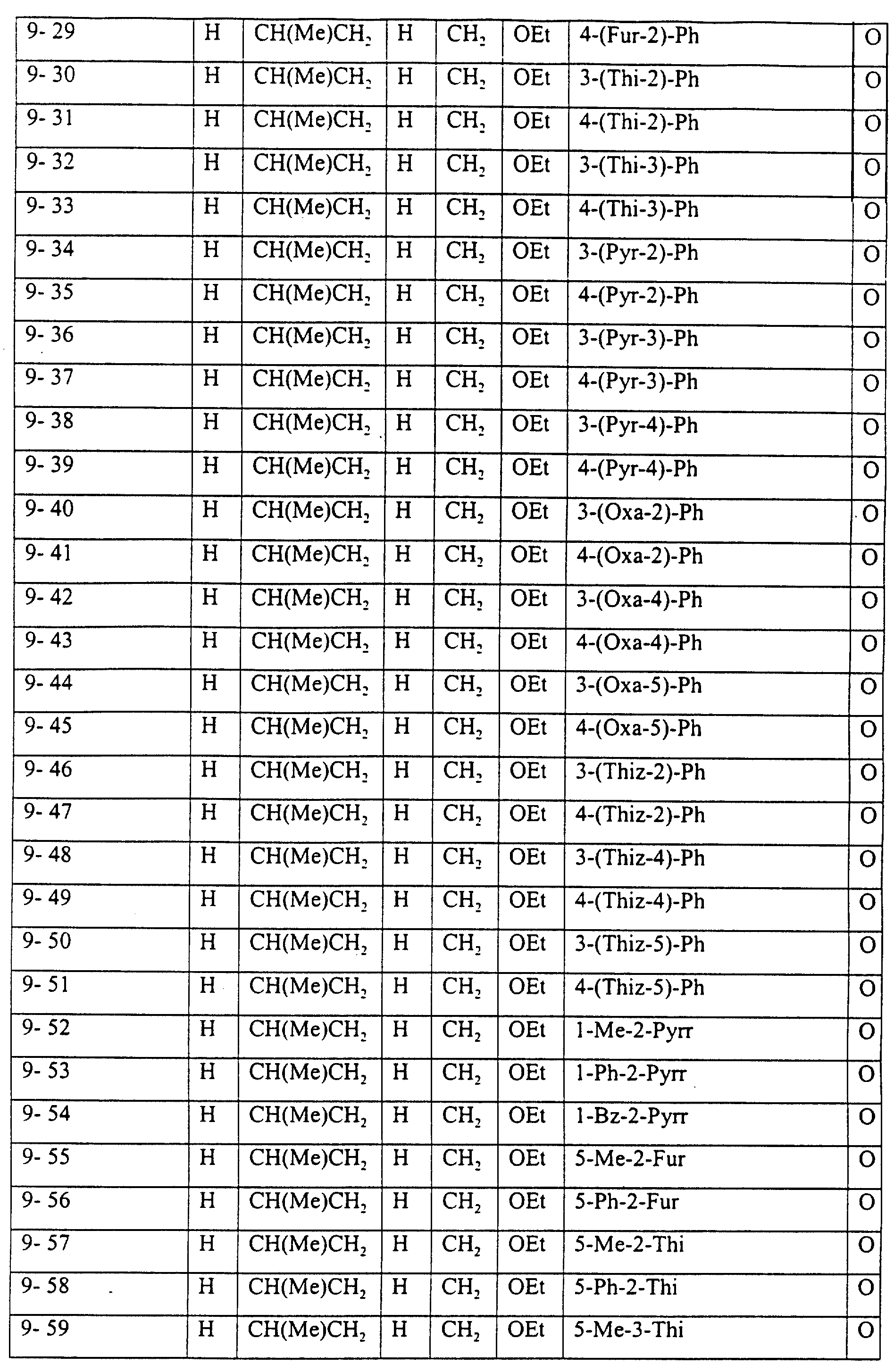

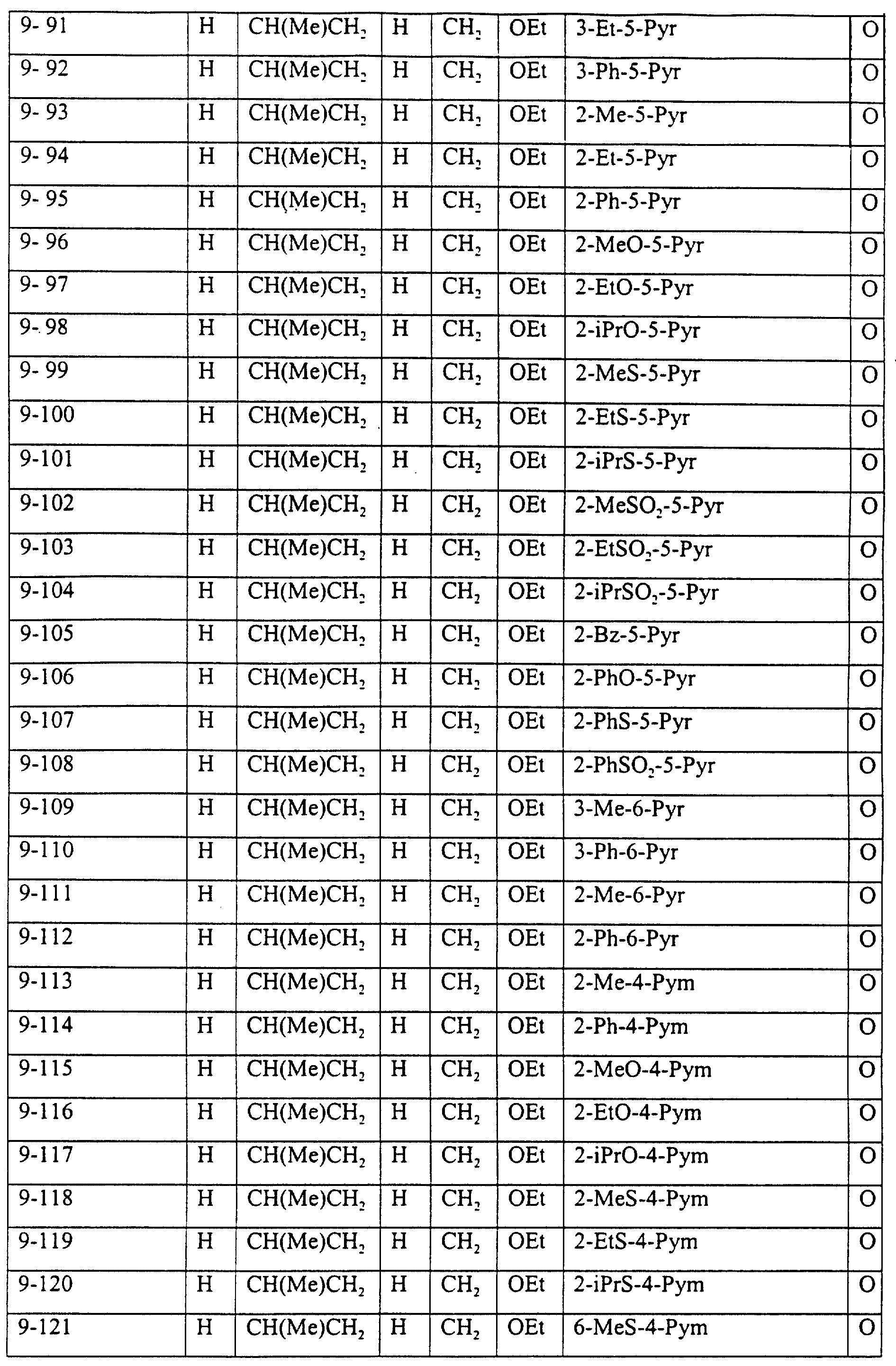






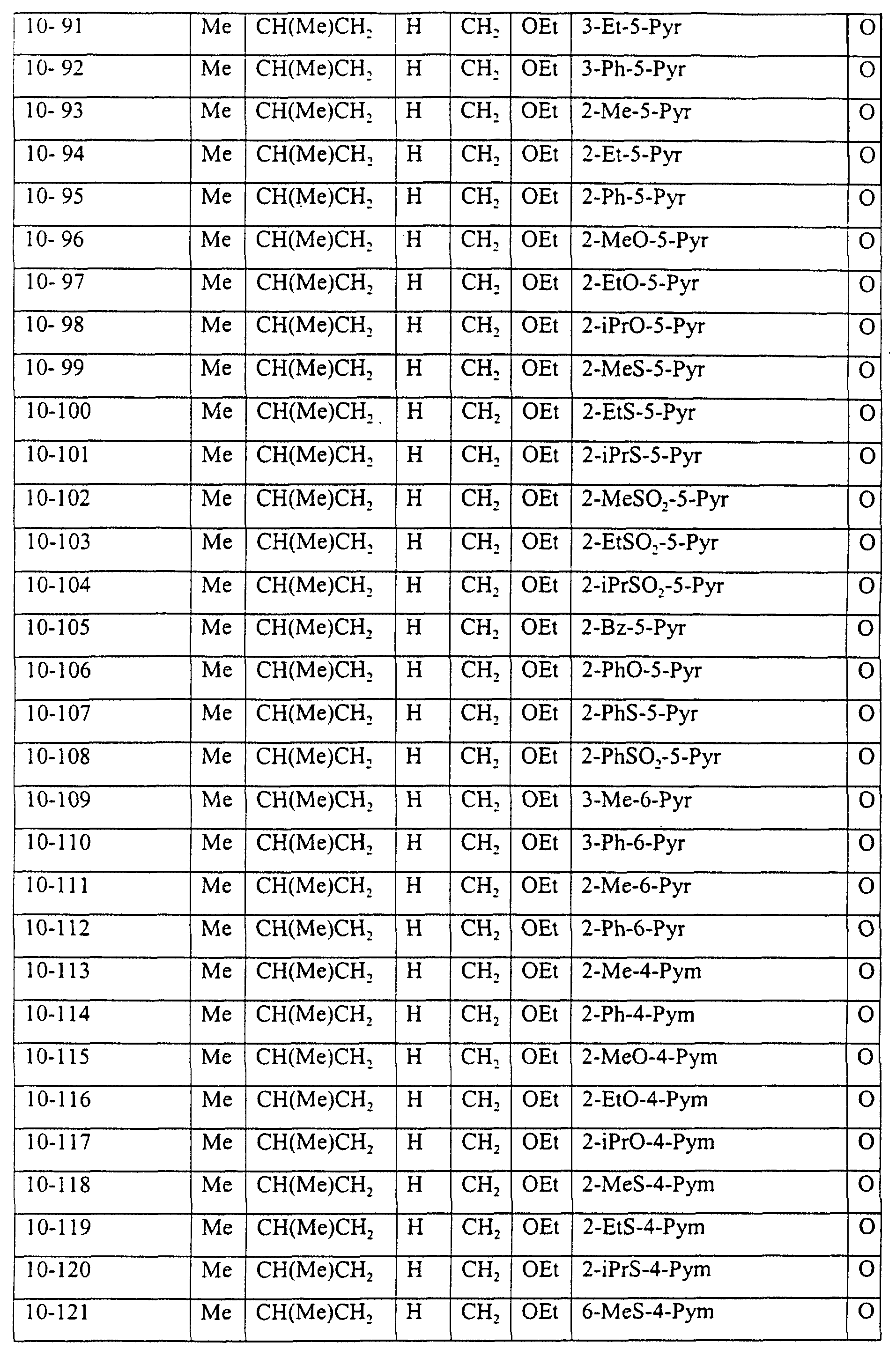



















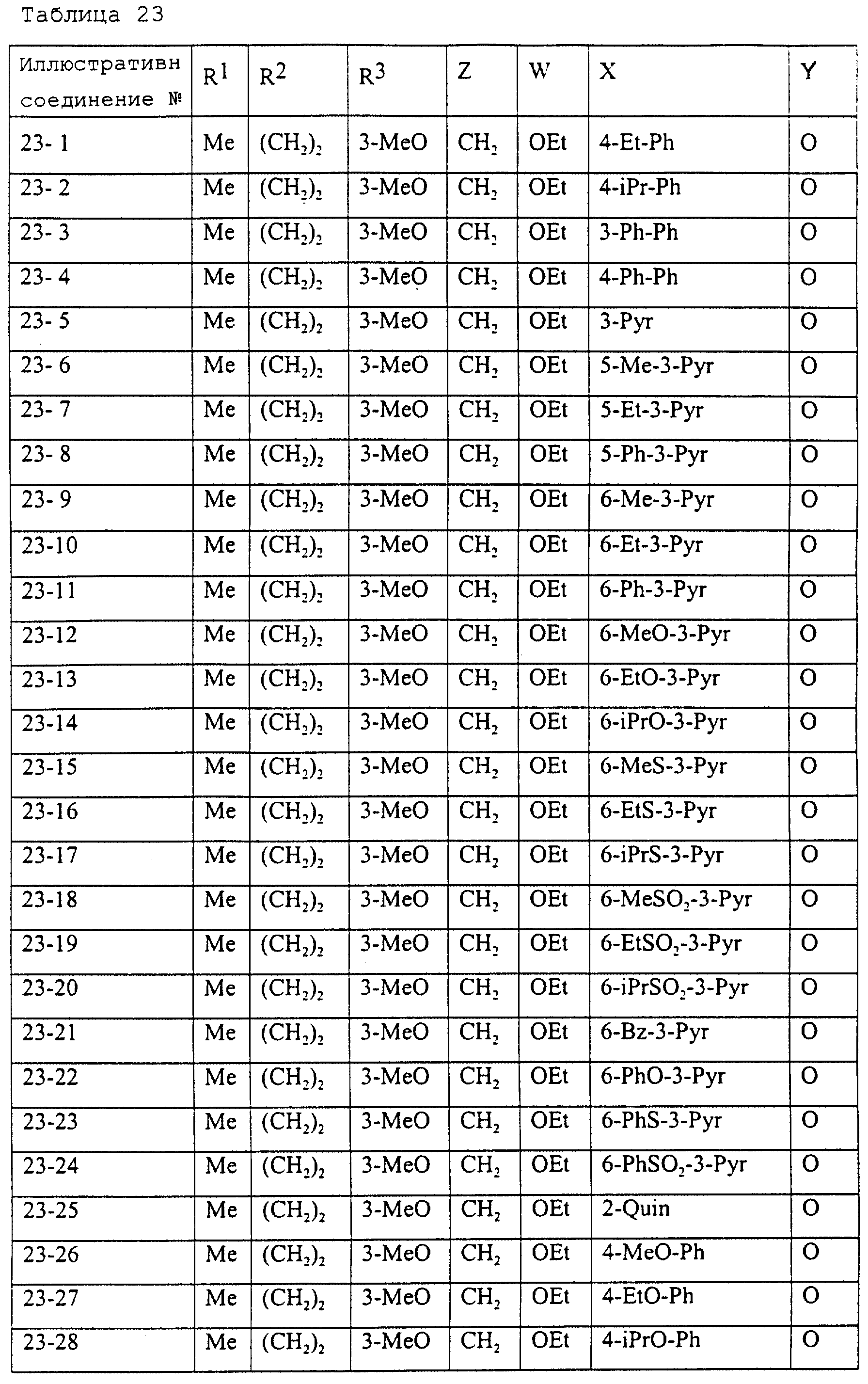
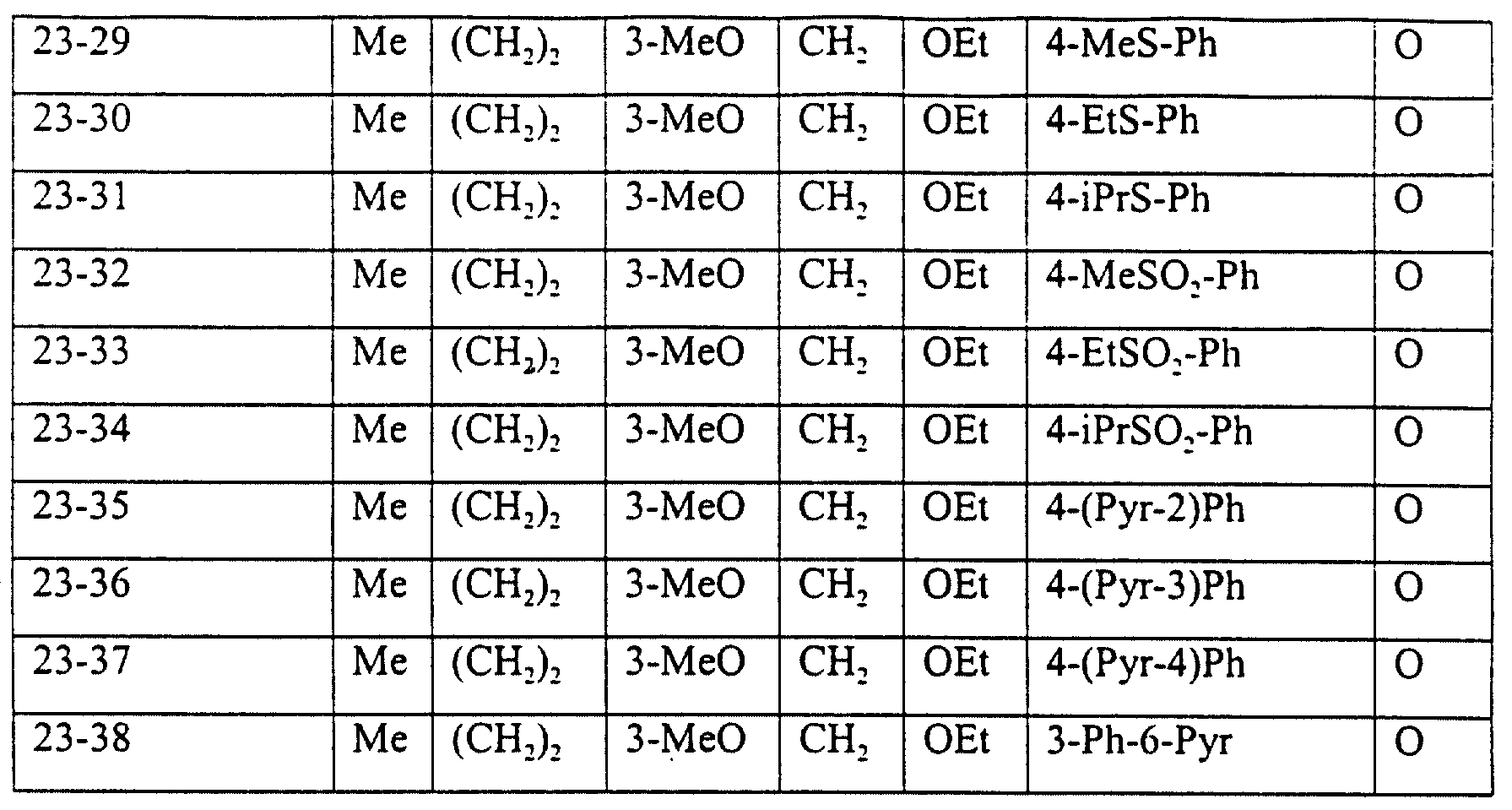
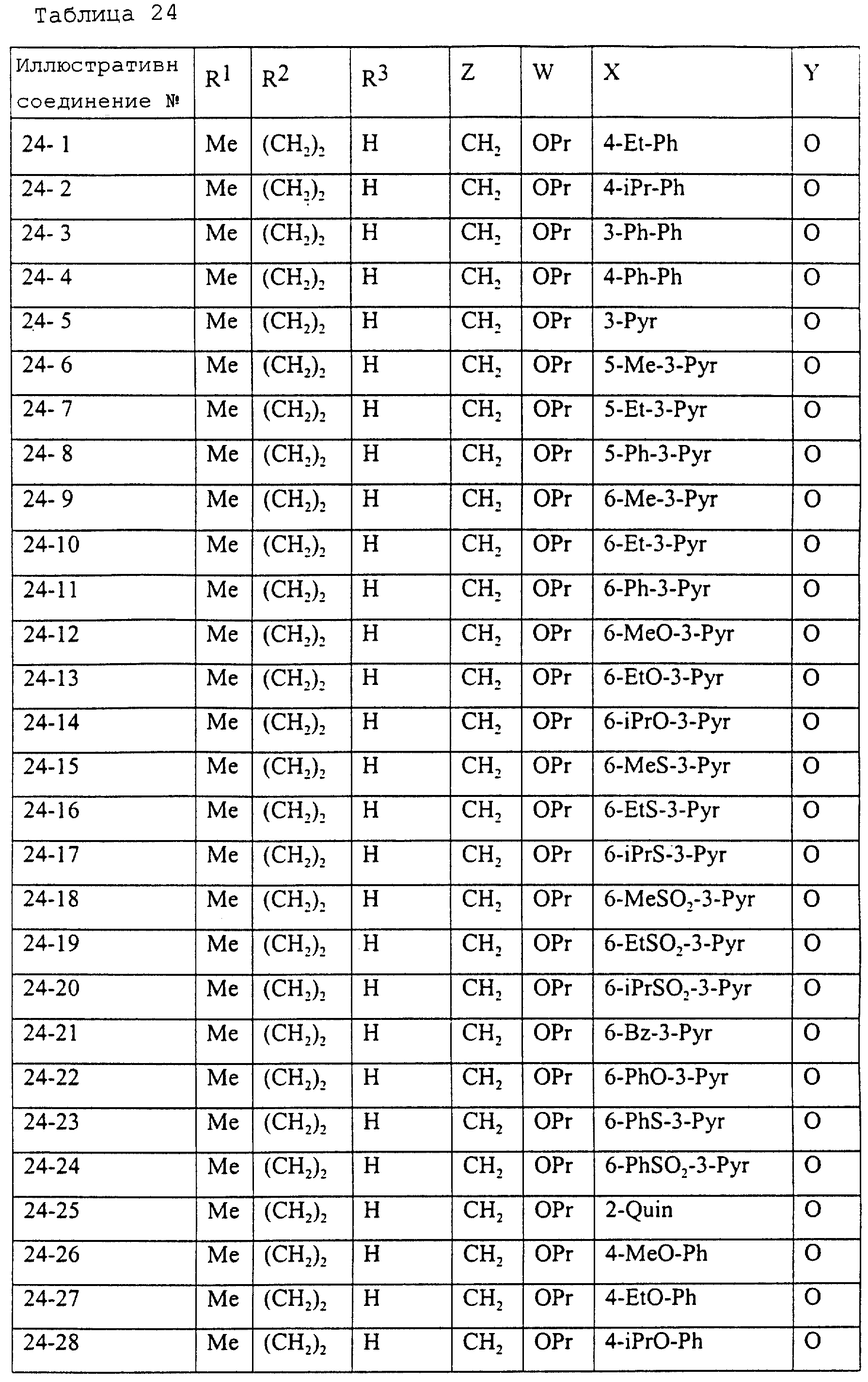

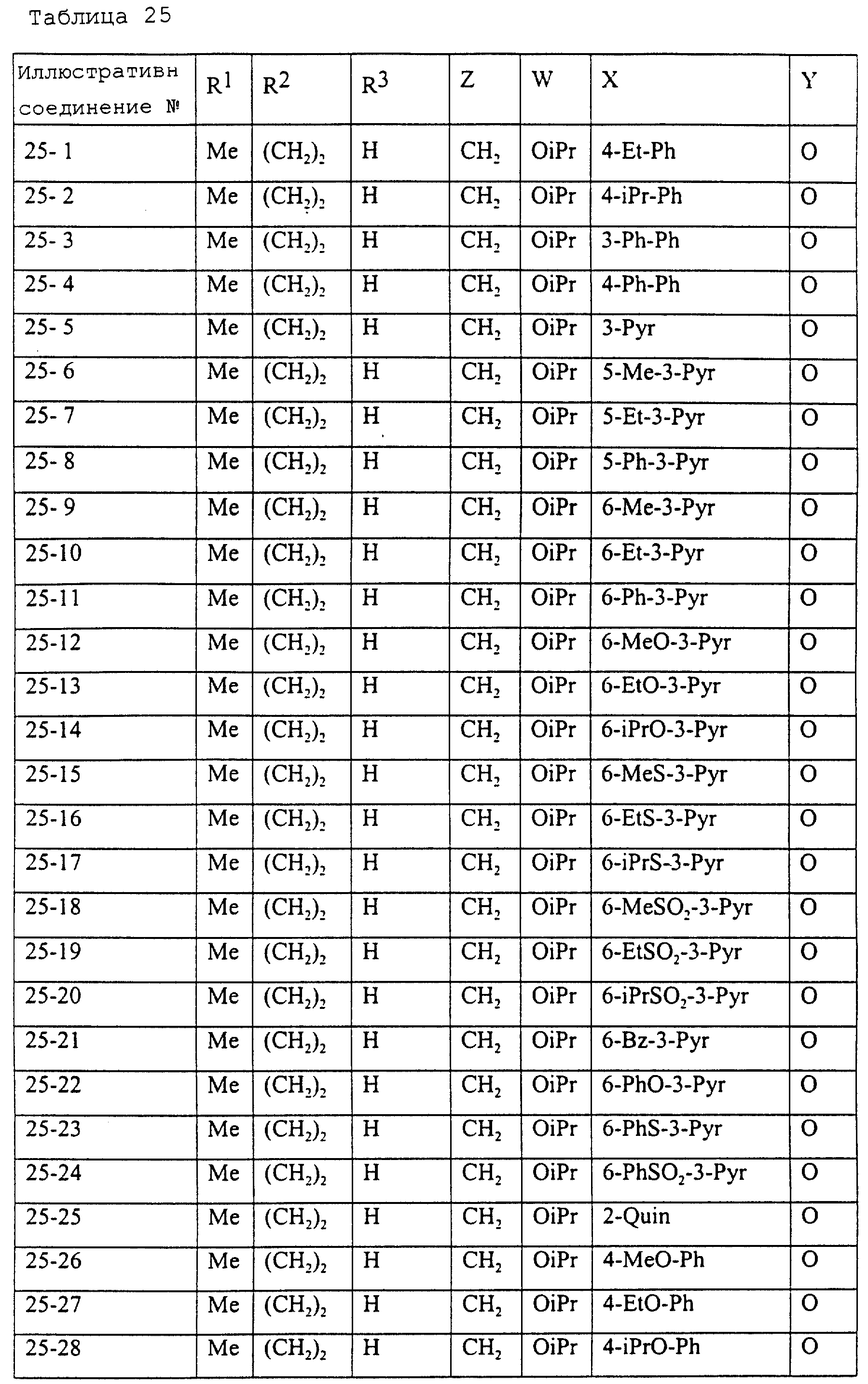



















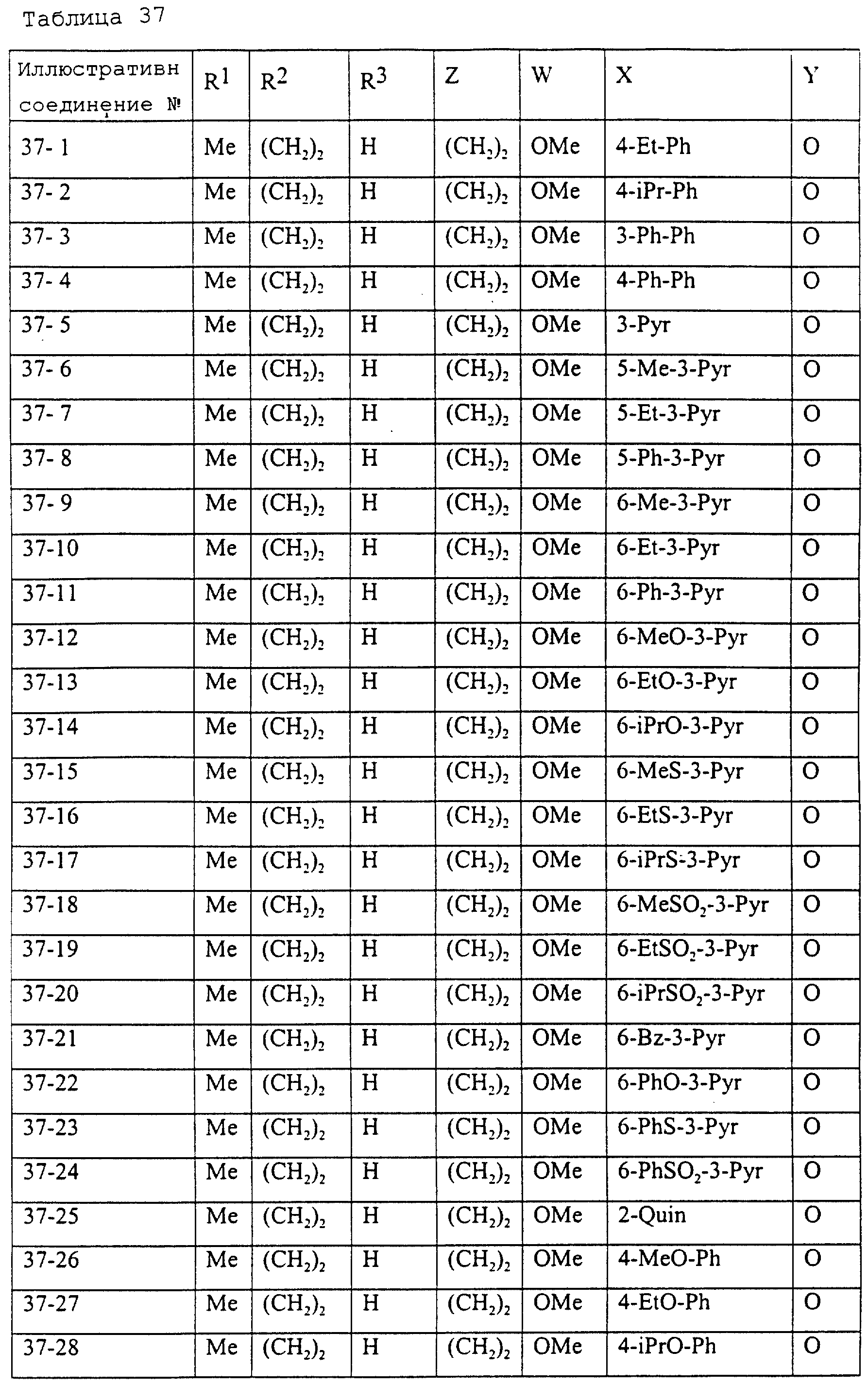
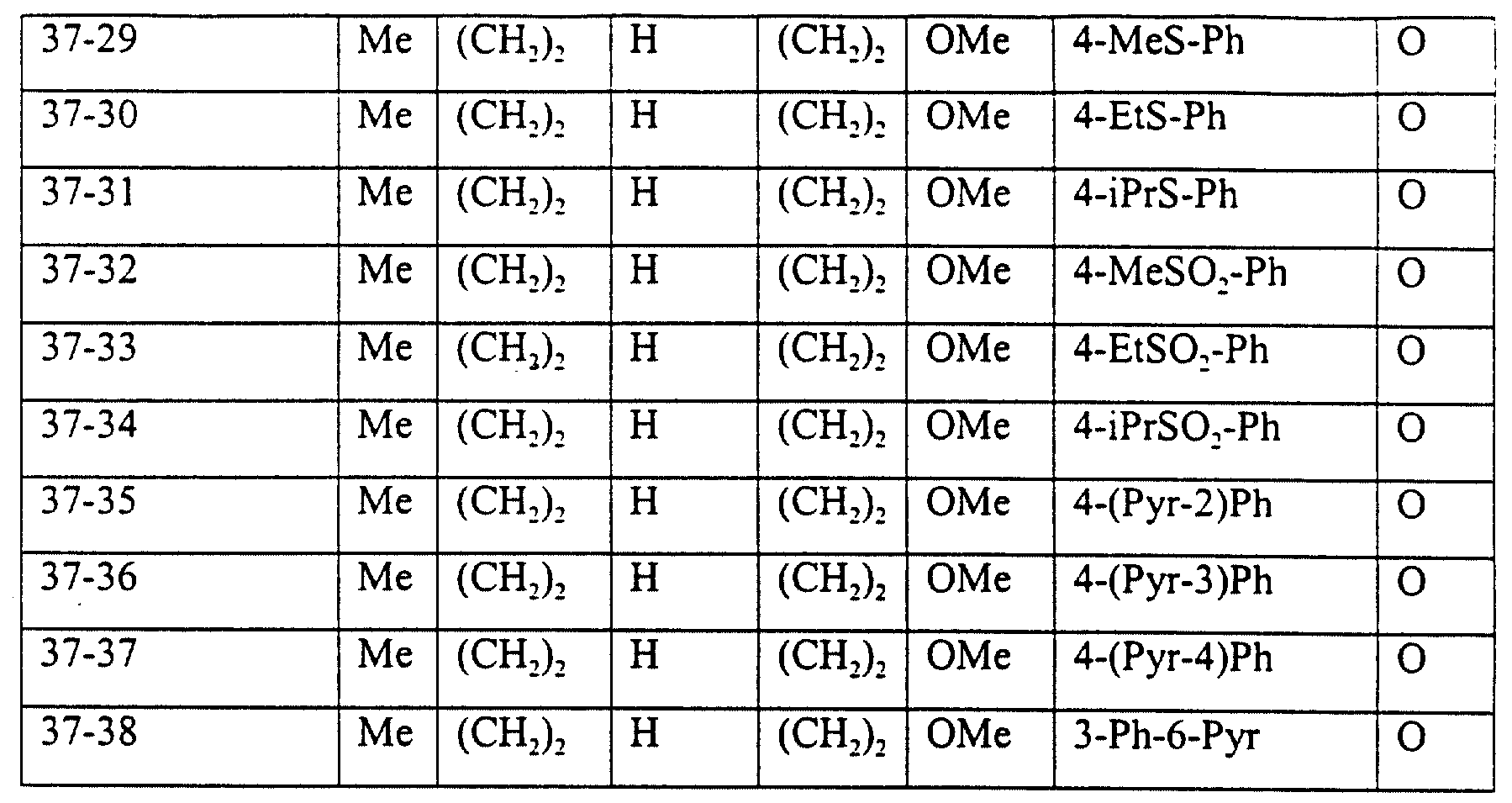
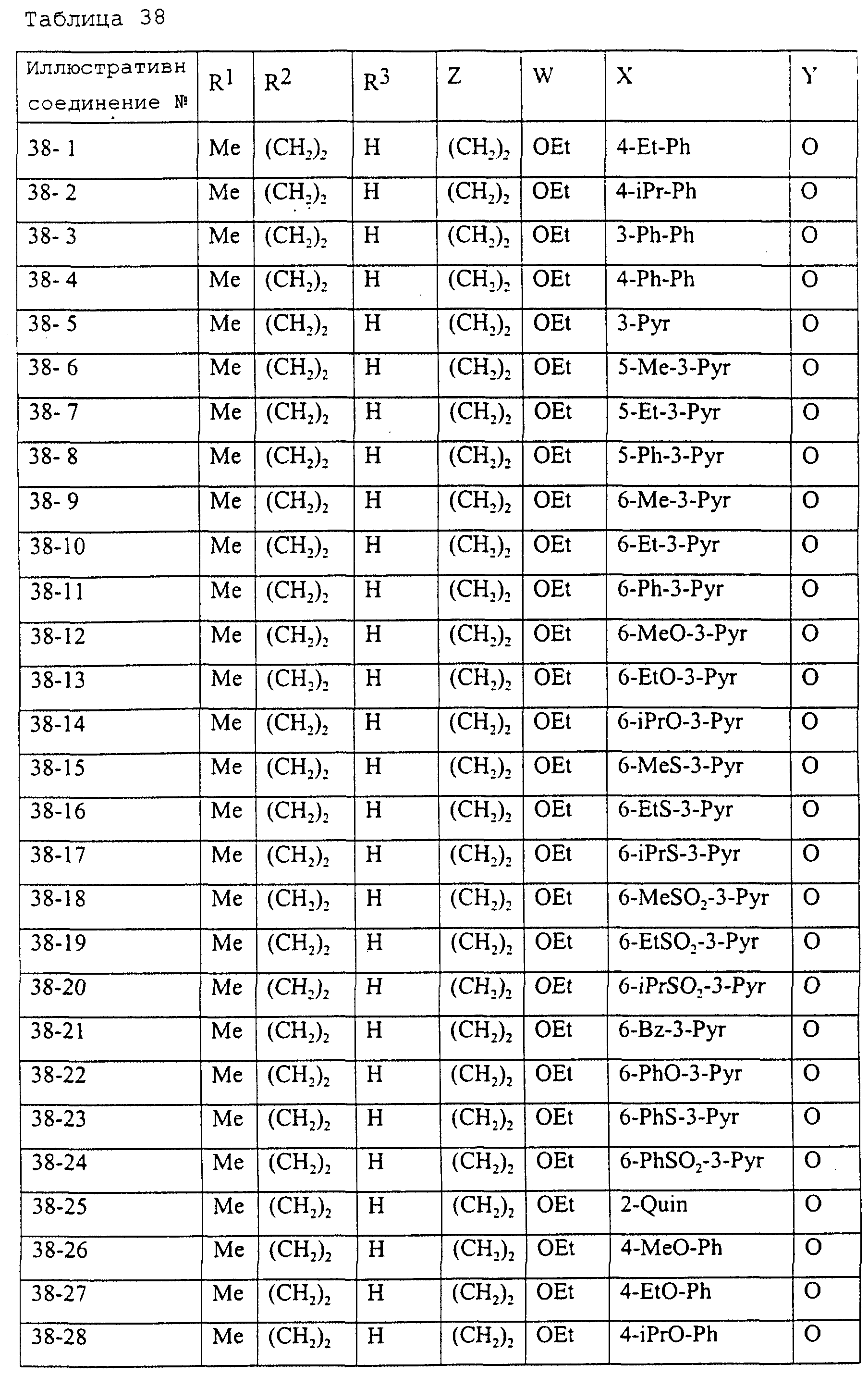


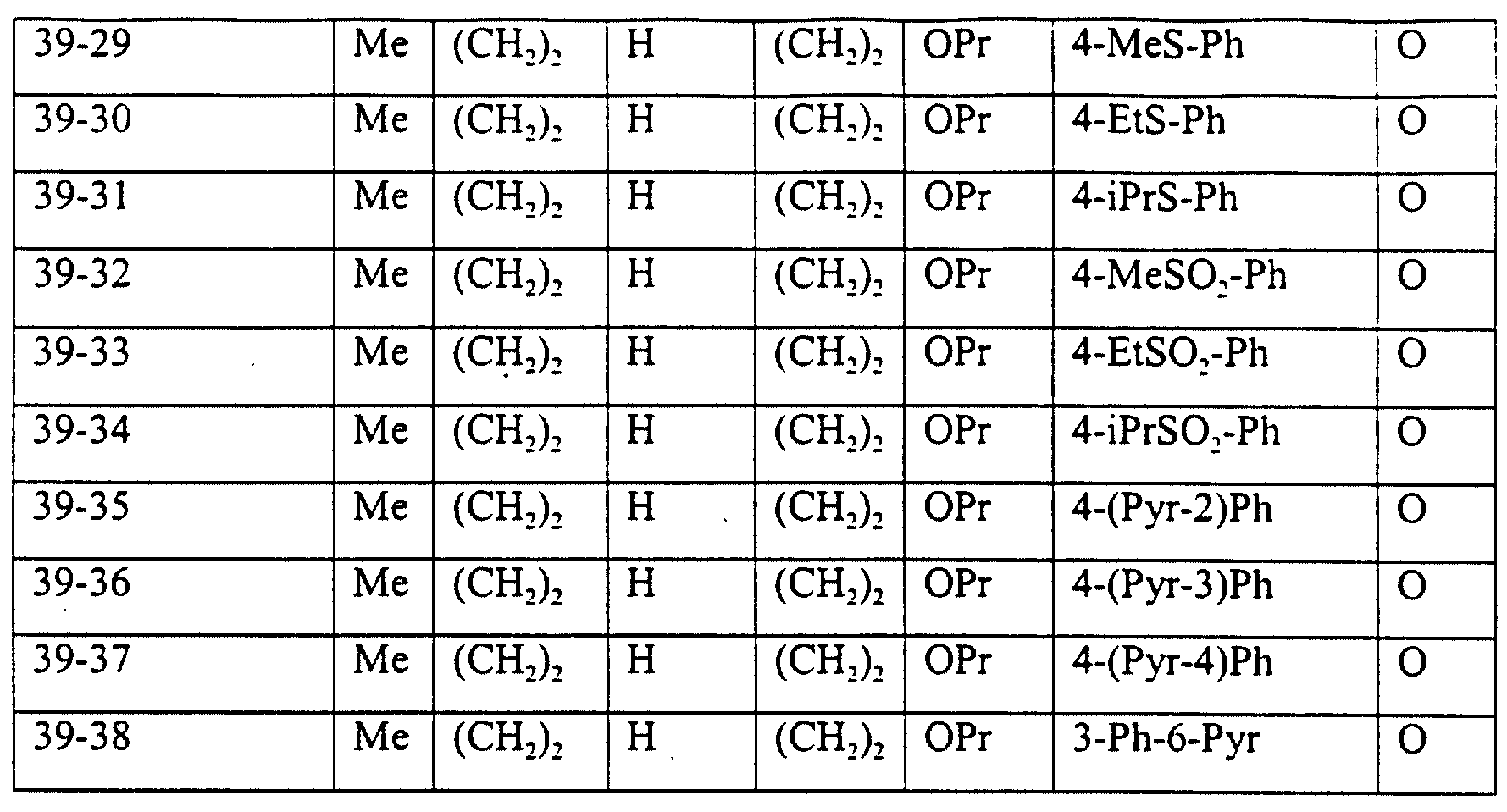
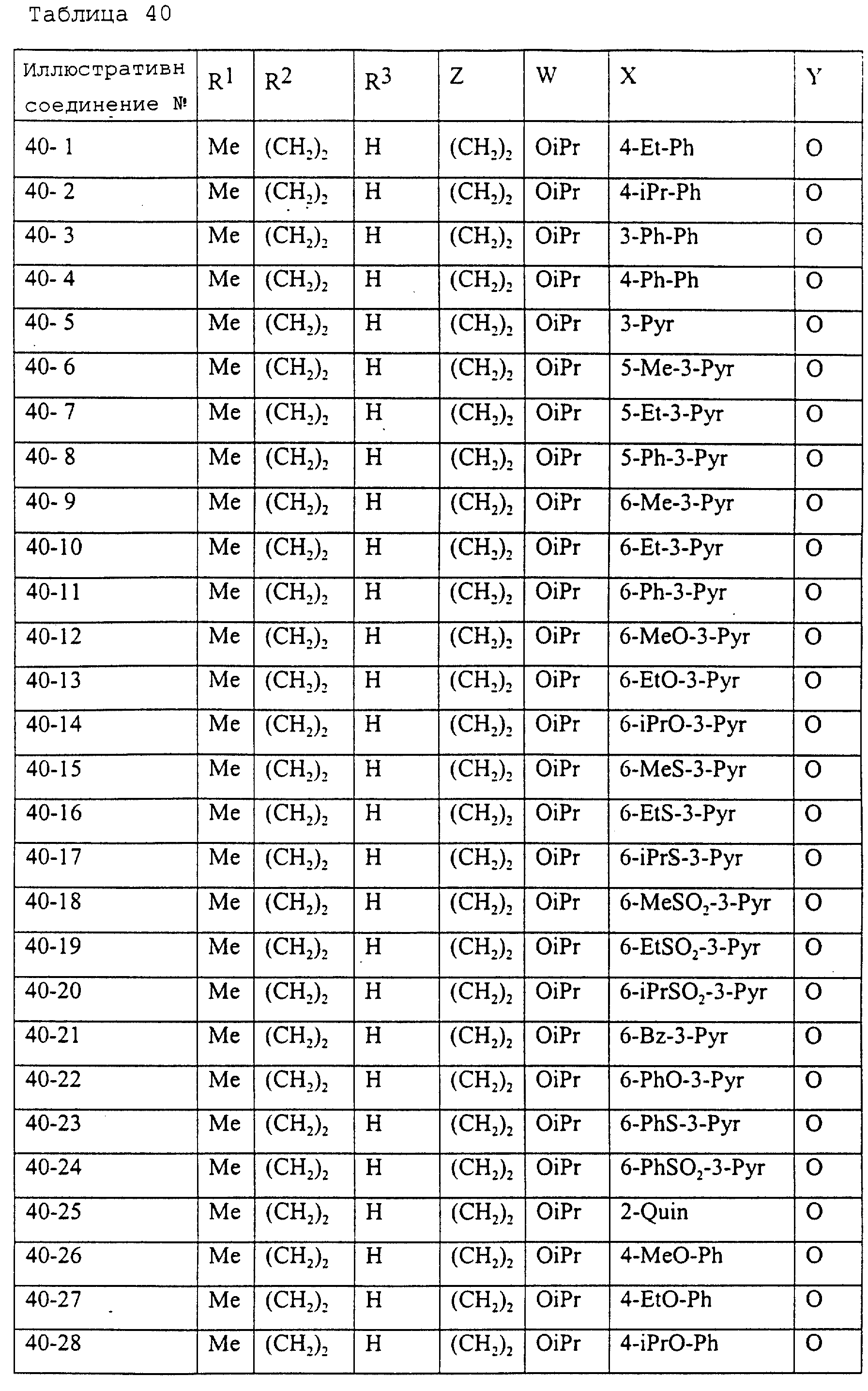





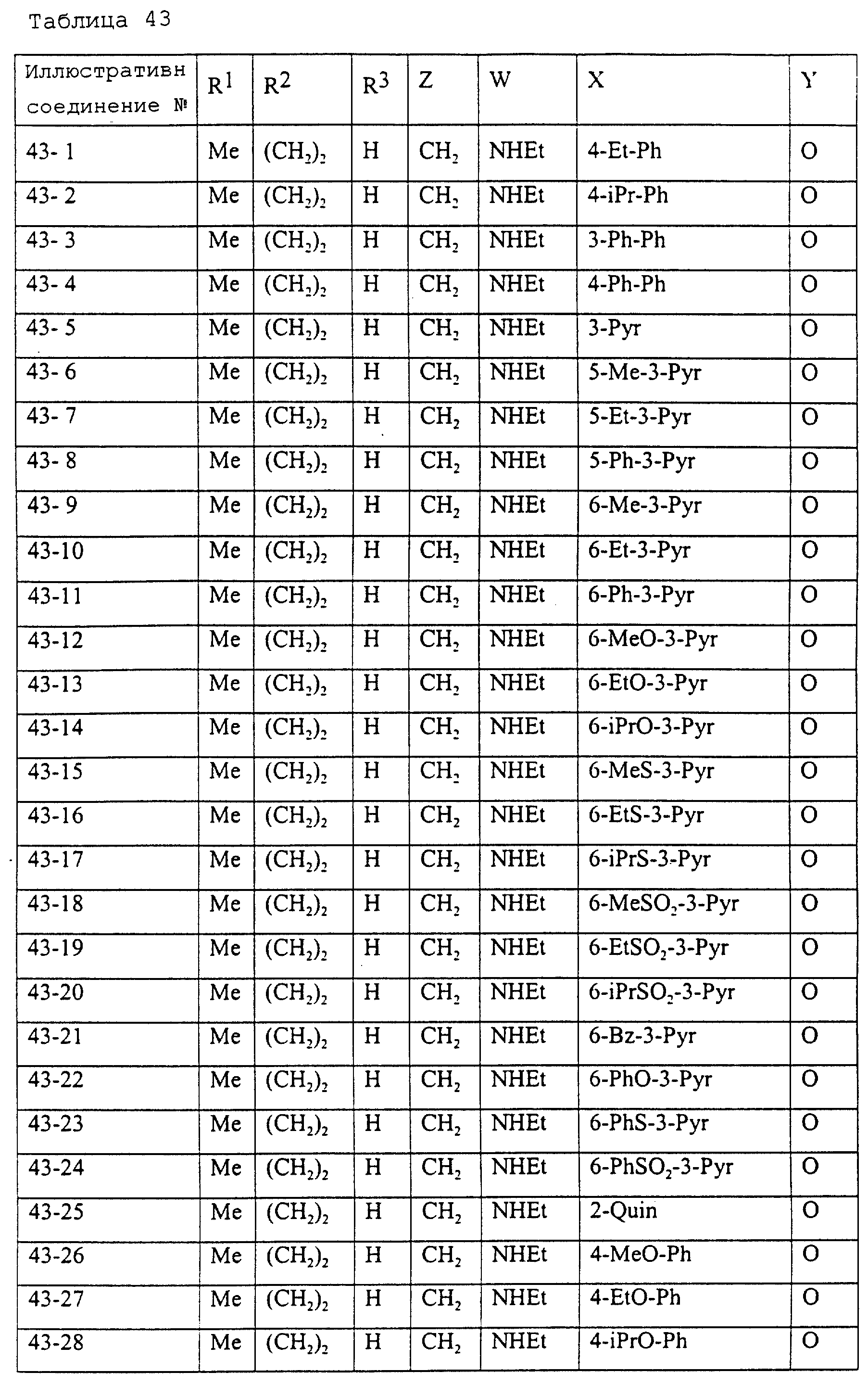
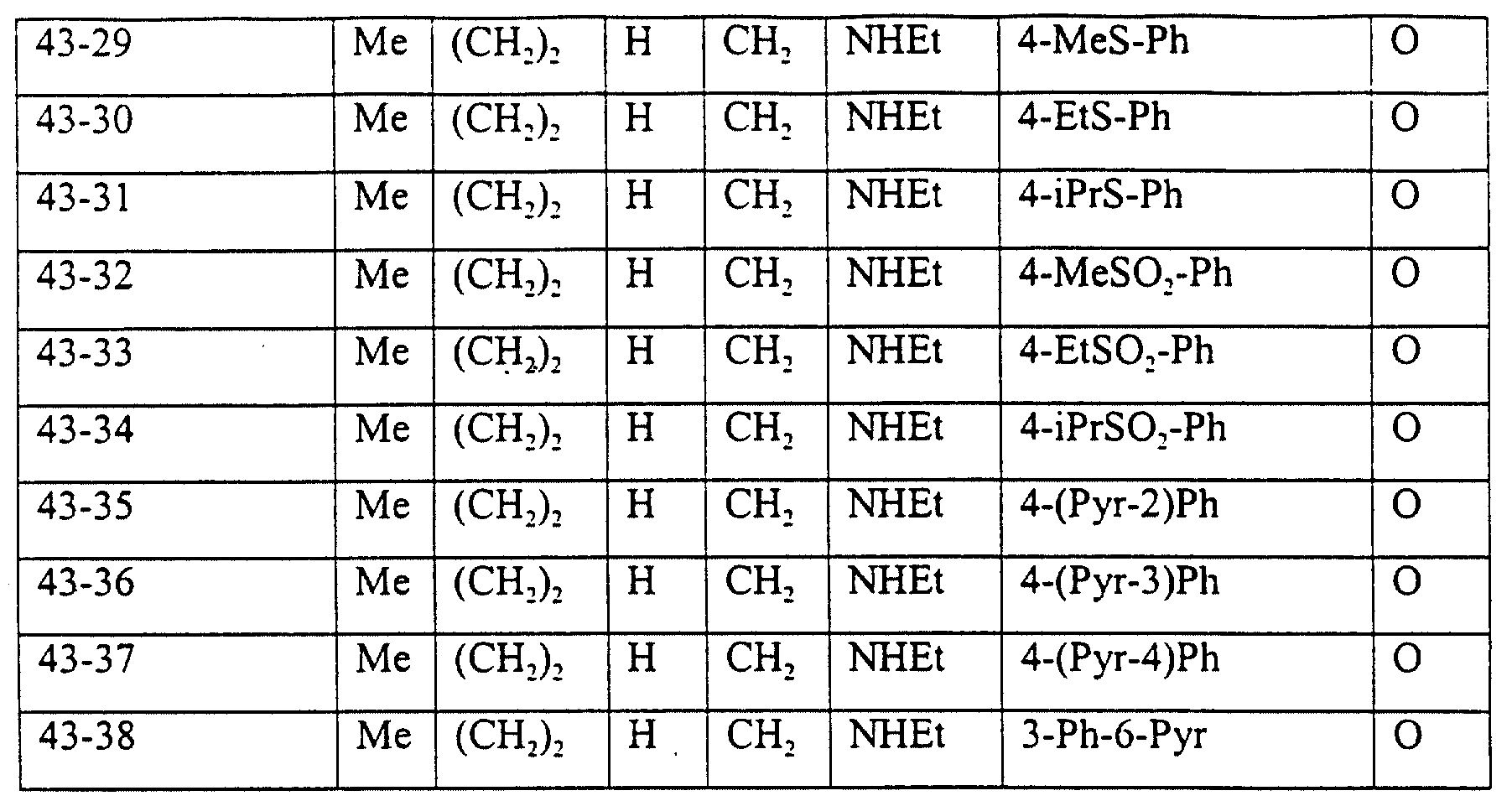


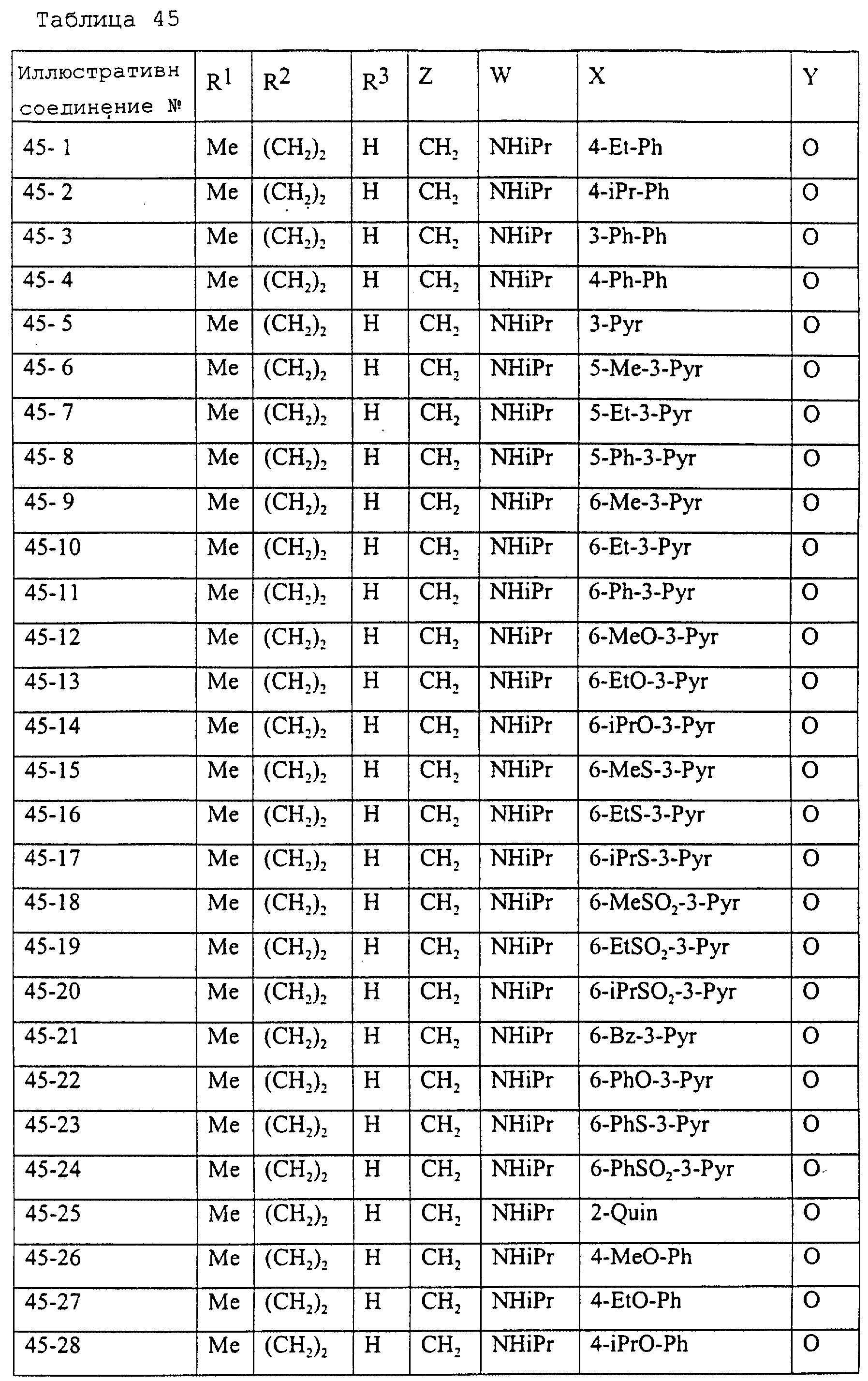
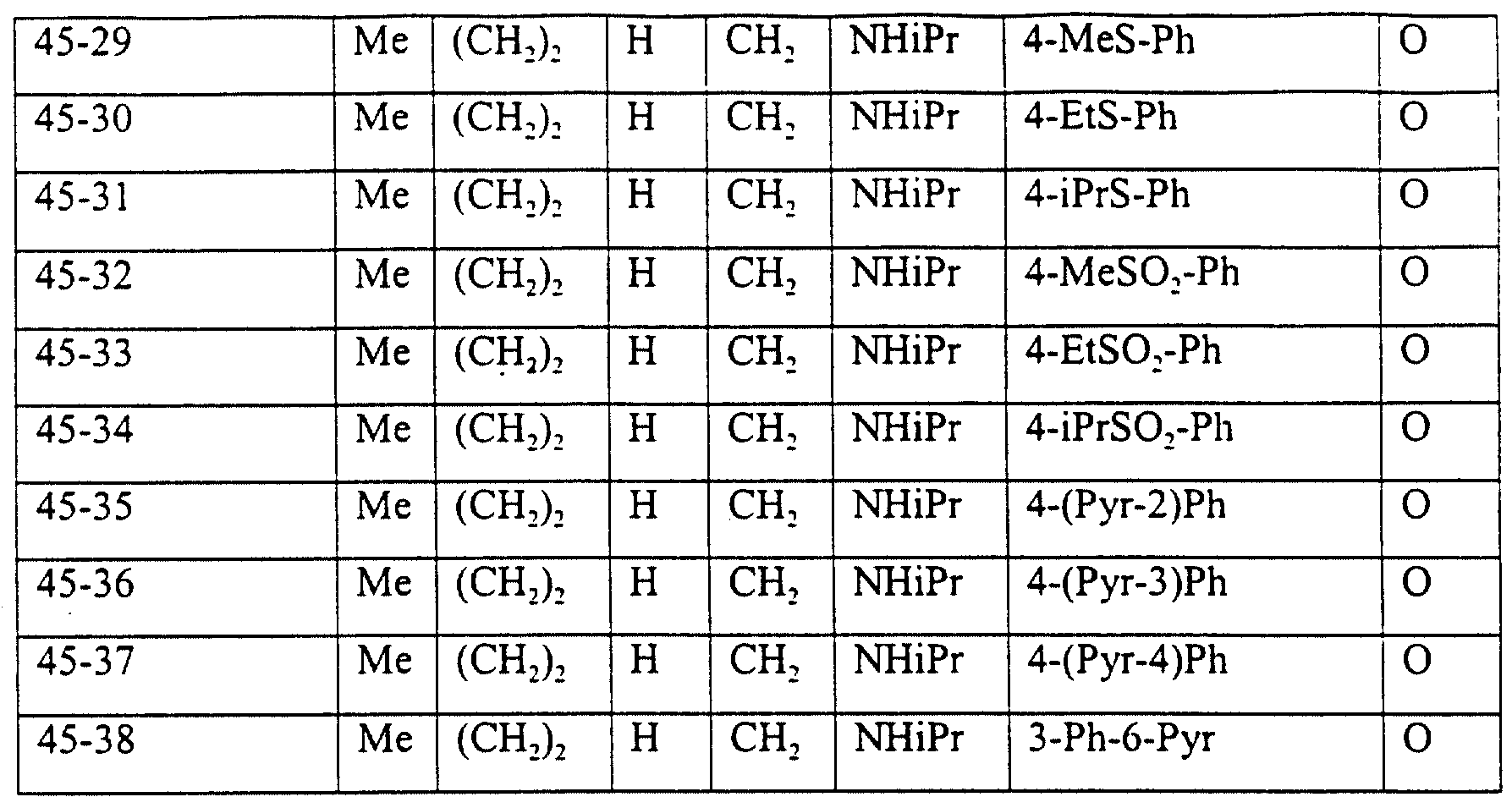
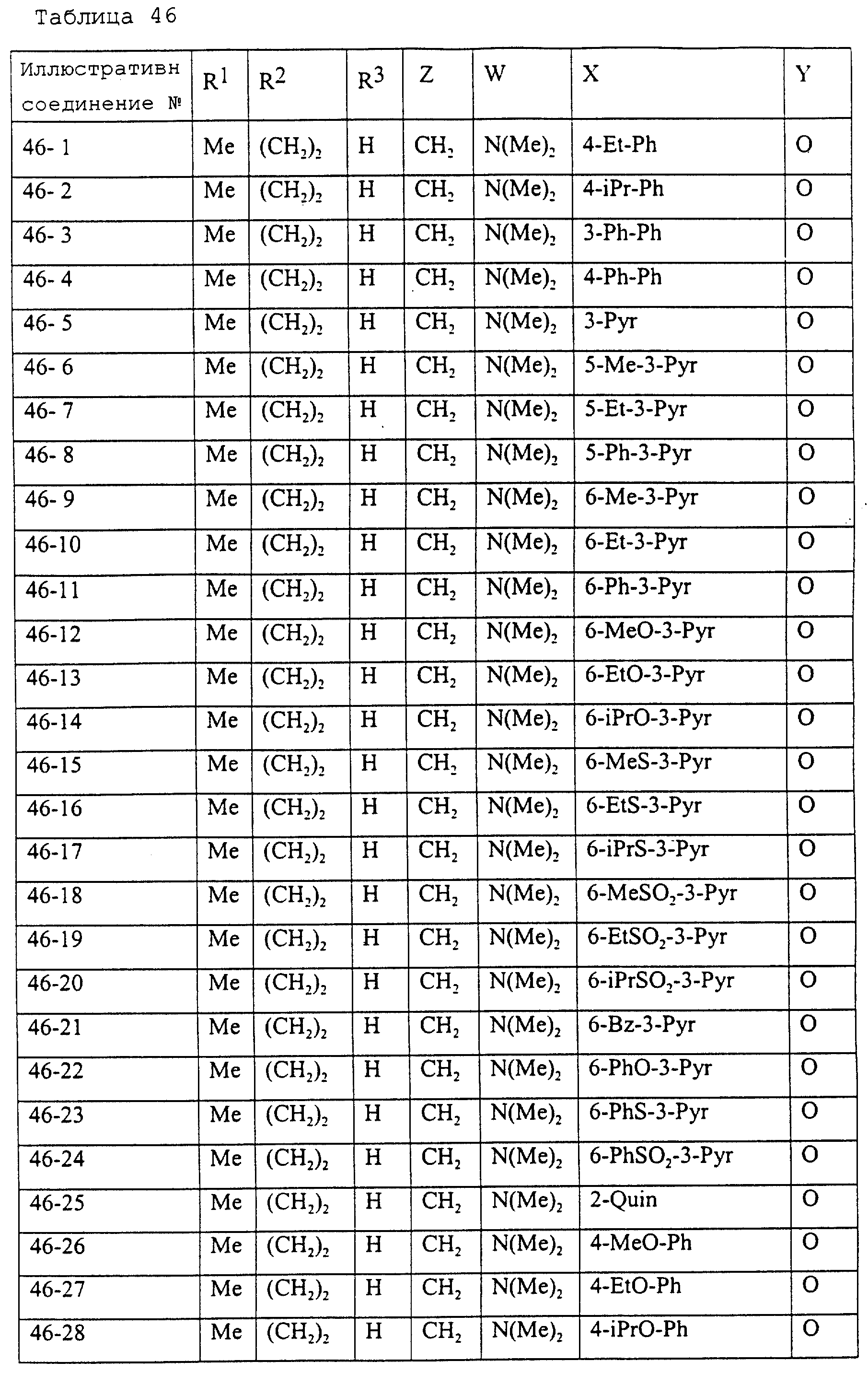

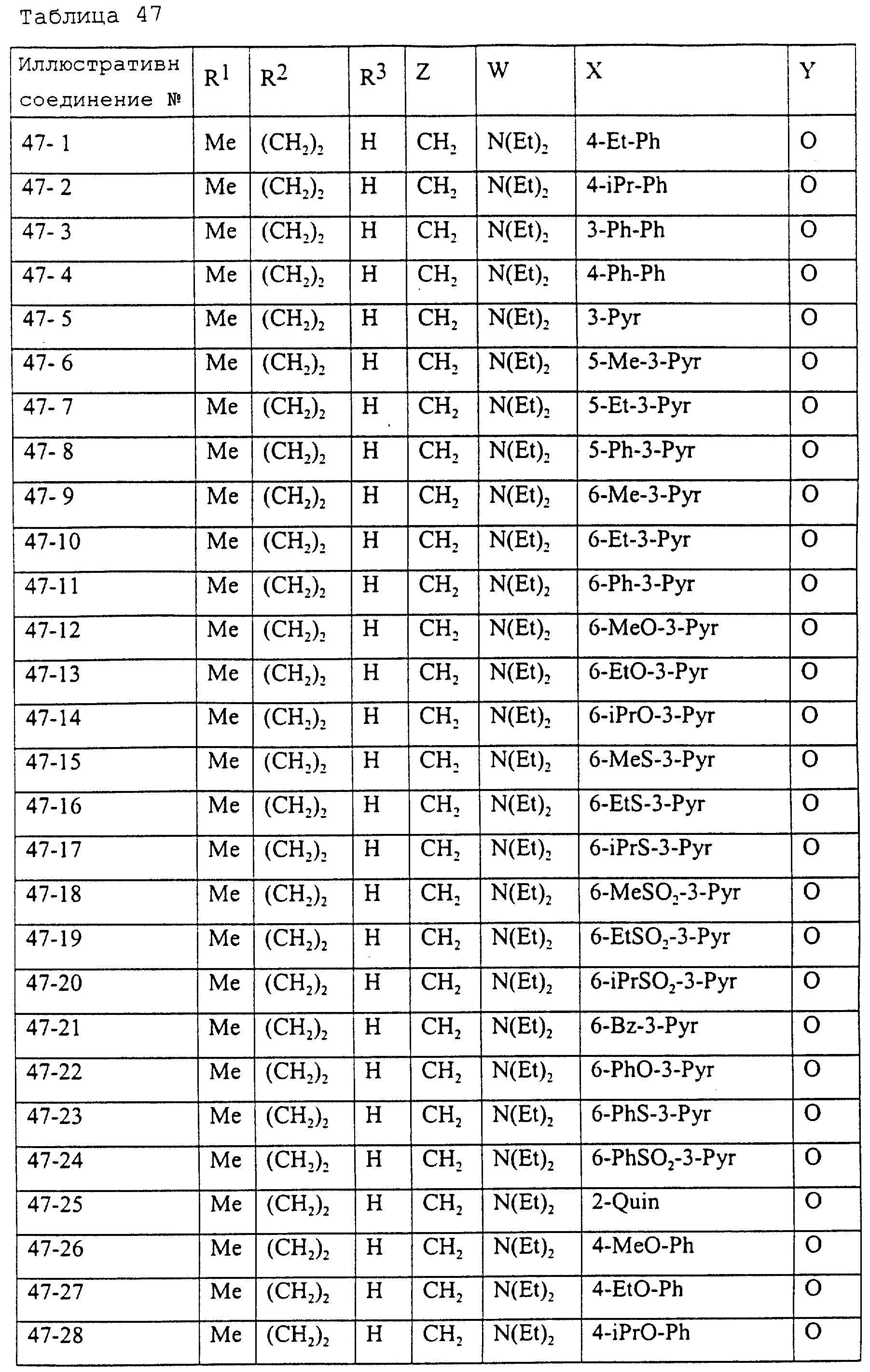



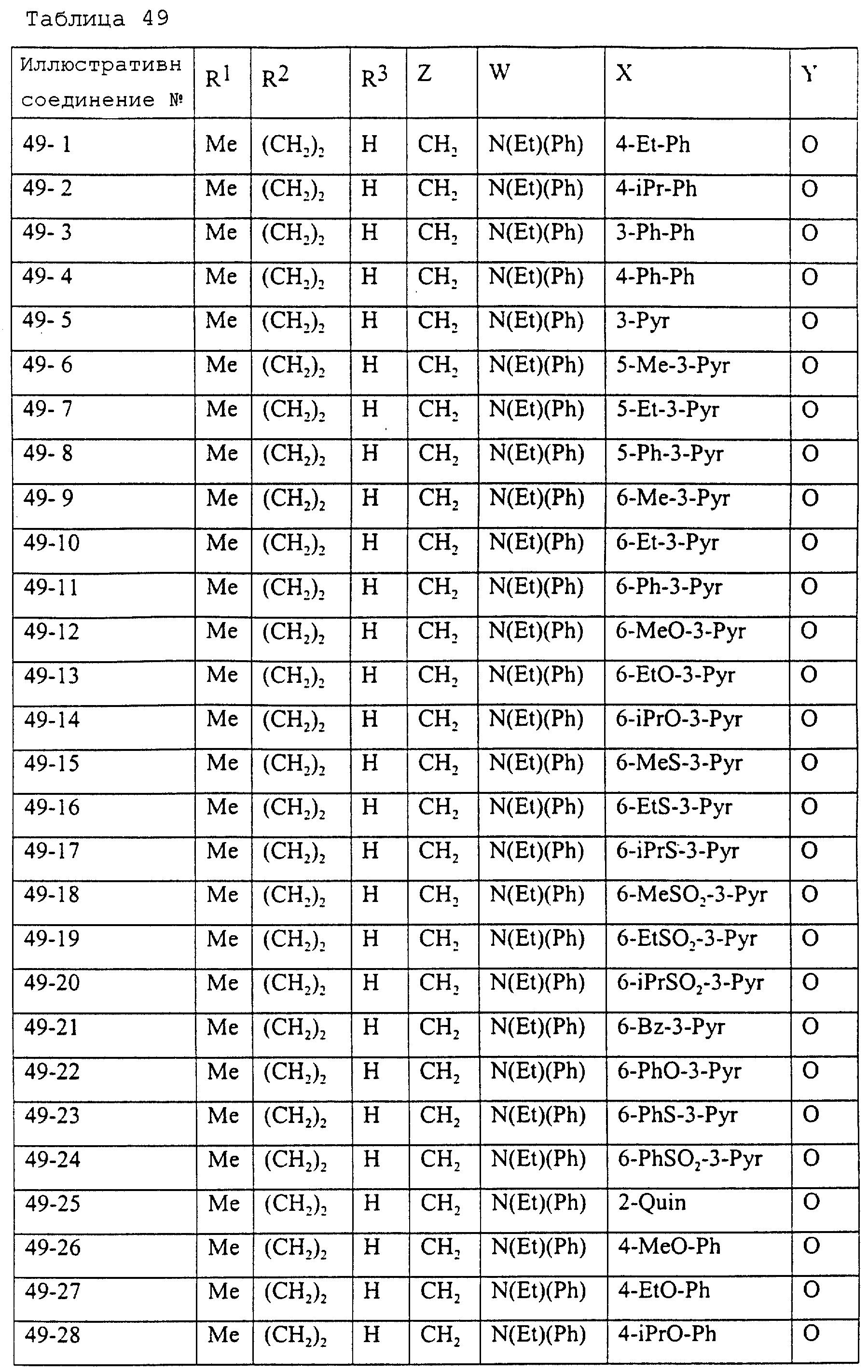


















































Описание
Изобретение относится к новым производным фенилалкилкарбоновой кислоты, имеющим превосходную активность в понижении уровня сахара в крови, и их фармакологически приемлемым солям или фармакологически приемлемым сложным эфирам; композиции, включающей указанное соединение в качестве активного ингредиента для лечения или профилактики гипергликемии; их использованию для получения лекарственного препарата для лечения или профилактики гипергликемии; или способу лечения или профилактики гипергликемии, в котором теплокровным животным вводят фармакологически эффективное количество указанного соединения.
Инсулин и соединения сульфонилмочевины, такие как трибутамид и Глипизид (Glipizide), использовали в качестве терапевтических средств для лечения диабета и гипергликемии, а
недавно сообщалось об использовании производных фенилалкилкарбоновой кислоты для лечения инсулин-независимого диабета. Эти соединения включают, например,
(1-1)
3-[4-[2-(5-метил-2-фенил-4-оксазолил)этокси] фенил]-2-(ацетилтио)пропионовая кислота и ее сложные эфиры, 2-метокси-3-[4-[2-(5-метил-2-фенил-4-оксазолил)этокси] фенил] пропионовая кислота,
3-[[4-(4-бензилоксифенил)этокси] фенил] -2-метоксипропионовая кислота, 2-фенокси-3-[4-(2-фенил) этоксифенил] пропионовая кислота и т. п., раскрываются в опубликованной заявке PCT N WO 91/19702
(Японская заявка PCT (Kokai) N Hei 5- 507920).
(1-2) 3-[4-[2-[N-(2-бензоксазолил)-N-метиламино] этокси]фенил]-2-((N-этил-N-фенил)амино)пропионовая кислота и ее сложные эфиры и т.п. раскрываются в опубликованной заявке PCT N WO 94/29285.
(1-3) 3-[4-[2-[2-бензоксазолил)-N-метиламино] этокси]фенил]-2-пирролпропионовая кислота и ее сложные эфиры и т.п. раскрываются в опубликованной заявке PCT N WO 94/29302.
(1-4) 3-[4-[2-[N-(2-бензоксазолил)-N-метиламино] этокси] фенил] -2-(пропил) пропионовая кислота и ее сложные эфиры, 3-[4-[2-[N-(2-бензоксазолил)-N-метиламино] этокси]фенил]-2- (3-фенилпропил) пропионовая кислота и ее сложные эфиры, 3-[4-[2-[N-(2-бензоксазолил)-N-метиламино] этокси]фенил]-2- (3-метилбутил) пропионовая кислота и ее сложные эфиры и т. п. раскрываются в опубликованной заявке PCT N WO 95/03288.
(1-5) 3-[4-[2-[N-(2-бензоксазолил)-N-метиламино] этокси] фенил] -2-(2,2, 2-трифторэтокси) пропионовая кислота и ее сложные эфиры и т.п. раскрываются в опубликованной заявке PCT N WO 96/04260.
Кроме того, недавно было сообщение об использовании большого ряда производных тиазолидина в качестве терапевтических средств для лечения инсулин-независимого диабета. Эти соединения включают, например, (2-1) 5-[4-[(6-гидрокси-2,5,7,8-тетраметилхроман-2-ил) метокси] бензил] -2,4-тиазолидиндион (International Non-propietary Name (INN): Троглитазон) раскрывается в USP 4572912, EP 139421A и Японской патентной публикации (Kokoku) N 2-31079.
(2-2) 5-[[4-[2-(5-этилпиридин-2-ил)этокси]фенил]метил]-2, 4-тиазолидиндион (INN: Пиоглитазон) раскрывается в EP 8203A, USP 4287200, USP 4340605, USP 4438141, USP 4444779, USP 4725610 и Японских патентных публикациях (Kоkoku) N Hei 5-66956 и sho62- 42903.
(2-3) 5-[[3,4-дигидро-2-(фенилметил)-2H-бензопиран-6- ил] метил]-2,4-тиазолидиндион (INN: Инглитазон) раскрывается в USP 4703052 и Японской патентной публикации (Kokoku) N Hei 5-86953.
(2-4) 5-[[4-[2-[N-метил-N-(пиридин-2-ил)амино] этокси] фенил]метил]-2,4-тиазолидиндион (Code Designation: BRL-49653) раскрывается в EP 306228A, USP 5002953, USP 5194443, USP 5232925, USP 5260445 и Японской патентной заявке (Kokoku) N Hei 1-131169.
Связь между этими соединениями и (лечением) заболеваний описана в нижеследующих ссылках в отношении, например, производных тиазолидина.
Действия производных тиазолидина на гипергликемию описаны в (1) Diabetes. , 32 (9), 804-810 (1983); (2) Diabetes., 37 (II), 1549-1558 (1988); (3) Prog. Clin. Biol. Res., 265, 177-192 (1988); (4) Metabolism., 37 (3), 276-280 (1988); (5) Arzneim.- Forsch., 40 (1), 37-42 (1990); (6) Arzneim.-Forsch. , 40(2, Pt. 1), 156-162 (1990); и (7) Arzneim.-Forsch., 40 (3), 263-267 (1990).
О действиях производных тиазолидина на гипергликемию сообщается в (1) Diabetes. , 40 (12), 1669-1674 (1991); (2) Am. J. Physiol., 267(1, Pt. 1), E95-E101 (1994); и Diabetes., 4.3 (10), 1203-1210 (1994).
О действиях производных тиазолидина на ухудшенную (ослабленную) толерантность к глюкозе и резистентность к инсулину сообщается в (1) Arzneim.-Forsch. , 40 (2, Pt. 1), 156-162 (1990); (2) Metabolism., 40(10), 1025-1030 (1991); (3) Diabetes. , 43(2), 204-211 (1994); и (4) N. Engl. J. Med., 331 (18), 1226-1227 (1994).
О действиях производных тиазолидина на гипертензию сообщается в (1) Metabolism. , 42 (1), 75-80 (1993); (2) Am. J. 4 Physiol., 265(4, Pt. 2), R726-R732 (1993); и (3) Diabetes., 43(2), 294-211 (1994).
О действиях производных тиазолидина на кахексию сообщается в (1) Endocrinology. , 135 (5), 2279-2282 (1994); и (2) Endocrinology., 136(4), 1474-1481 (1995).
О действиях производных тиазолидина на нефропатию сообщается в (1) Diabetes. , 38 (Special Edition), (1995) (38th Annual Technical Meeting of the Japan Diabetes Society, Program Proceedings, 38th Meeting of the Japan Diabetes Society, 1995).
О действиях производных тиазолидина на заболевания коронарной - артерии сообщается в (1) Am. J. Physiol., 265(4, Pt. 21, R726-R732 (1993); и (2) Hypertension., 24 (2), 170-175 (1994).
О действиях производных тиазолидина на артериосклероз сообщается в (1) Am. J. Physiol., 265(4, Pt. 2), R726-R732 (1993).
Кроме того, недавно в (1) N. Engl. J. Med., 331 (18), 1226-1227 (1994) было сообщение о том, что нормальные индивидуумы, имеющие инсулинорезистентность, не сопровождаемую нарушением толерантности к глюкозе, имеют высокий риск заболеть диабетом (называемый как "инсулинорезистентный, не сопровождаемый толерантностью к глюкозе ("insulin-resistant non-IGT: NGT")). Предполагают, что лекарственные препараты, которые могут улучшить резистентность к инсулину, могли бы быть полезными в качестве профилактических лекарственных средств против наступления диабета у нормальных индивидуумов, подобных тем, которые описаны выше.
Однако вышеупомянутые соединения отличаются от соединений данного изобретения тем, что они не имеют оксимной связи в их боковой цепи, в то время как соединения данного изобретения имеют оксимную связь в своей боковой цепи.
К тому же, соединения, которые имеют
оксимную связь в своей боковой
цепи и являются инсулин-независимыми лекарственными средствами для лечения диабета, действующими аналогично действиям (соединений), описанным выше, были раскрыты после
даты заявления приоритета данной
заявки. Эти соединения включают, например, ароматические оксимино производные, такие как
(4-1) 5-[4-[2-[(4-гидроксииндан-1-ил)иминокси]этокси] бензил]-2,
4-тиазолидиндион, 5-[4-[2-[(2,
3-дигидро-6- фенилбензофуран-3-ил)иминокси] этокси] бензил] -2,4-тиазолидиндион, 5-[4-[2-[(5-хлориндан-1-ил)иминокси] этокси] бензил] -2,4-тиазолидиндион,
5-[4-[2-[(5-метилиндан-1-ил)иминокси] этокси]
бензил]-2, 4-тиазолидиндион, 5-[4-[2-[(5,6-метилендиоксииндан-1-ил)иминокси] этокси] бензил] -2,4-тиазолидиндион, 5-[4-[2-[(5-фенилиндан-1- ил)иминокси]
этокси] бензил] -2,4-тиазолидиндион, и они
раскрыты в опубликованной заявке PCT N WO 96/38427 (дата публикации: 5 декабря 1996) и Японской патентной заявке (Kokai) N Hei 9-48770 (дата публикации: 18
февраля 1997);
оксимные производные,
такие как (4-2) 5-[4-[2-[[[1-(4-бифенилил) этилиден] амино] окси] этокси]бензил]тиазолидин-2,4- дион; 5-[4-[2-[[[1-[4-(2-пиридил)фенил] этилиден] амино]
окси]этокси]бензил]тиазолидин-2,4-дион;
5-[4-[2-[[[1-(2- фенил-5-пиридил)этилиден]амино]окси]этокси]бензил] тиазолидин-2,4-дион; 5-[4-[2-[[[1-(2-метокси-5-пиридил) этилиден]амино]окси]этокси]бензил]
тиазолидин-2,4-дион раскрыты в EP 708098
(дата публикации: 24 апреля 1996) и патентной заявке Японии (Kokai) N Hei 9-48779 (дата публикации: 18 февраля 1997).
Сущность изобретения
Изобретателями данного изобретения
было проведено исследование производных фенилалкилкарбоновой кислоты, имеющих чрезвычайно сильно действующую активность и чрезвычайно высокую безопасность, и
было установлено, что эти производные
улучшают (снижают) гипергликемию и т. п. и, кроме того, обладают ингибирующим действием на альдоредуктазу.
А именно, данное изобретение относится к новым производным фенилалкилкарбоновой кислоты формулы (I), имеющим превосходную активность в понижении сахара в крови, и их фармакологически приемлемым солям или фармакологически приемлемым сложным эфирам; композиции, включающей соединение формулы (I) в качестве активного ингредиента для лечения или профилактики гипергликемии; их использованию для получения лекарственного средства для лечения или профилактики гипергликемии или способу лечения или профилактики гипергликемии, в котором теплокровным животным вводят фармакологически эффективное количество соединения формулы (I).
Производные
фенилалкилкарбоновой кислоты данного изобретения имеют формулу (I):

где R1 представляет атом водорода или алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов,
R2 представляет алкиленовую группу с прямой или разветвленной цепью, имеющую от 2 до 6 углеродных атомов,
R3 представляет (i) атом водорода, (ii) алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов, (iii) алкокси группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (iv) алкилтио группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (v) атом галогена, (vi) нитро группу, (vii) диалкиламино группу с прямой или разветвленной цепью, в которой алкильные группы являются одинаковыми или отличными друг от друга и каждая имеет от 1 до 4 углеродных атомов, (viii) арильную группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, или (ix) аралкильную группу, имеющую от 7 до 12 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части,
Z представляет одинарную связь или алкиленовую группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов,
W представляет (i) алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов, (ii) гидроксильную группу, (iii) алкокси группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (iv) алкилтио группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (v) амино группу, (vi) моноалкиламино группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (vii) диалкиламино группу с прямой или разветвленной цепью, в которой алкильные группы являются одинаковыми или отличными друг от друга и каждая имеет от 1 до 4 углеродных атомов, (viii) N-алкил-N-ариламино группу, имеющую алкил с прямой или разветвленной цепью, имеющий от 1 до 4 углеродных атомов, и арильную часть, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, (ix) арильную группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, (х) арилокси группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, (xi) арилтио группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, (xii) ариламино группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, (xiii) аралкильную группу, имеющую от 7 до 12 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, (xiv) аралкилокси группу, имеющую от 7 до 12 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, (xv) аралкилтио группу, имеющую от 7 до 12 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, (xvi) аралкиламино группу, имеющую от 7 до 12 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, (xvii) 1- пирролильную группу, (xviii) 1-пирролидинильную группу, (xix) 1- имидазолильную группу, (xx) пиперидино группу или (xxi) морфолино группу,
X представляет арильную группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, или (5-10)-членную моноциклическую или бициклическую гетероароматическую группу, которая имеет от 1 до 3 заместителей α, упомянутых ниже, содержащую от 1 до 4 гетероатомов, выбранных из группы, состоящей из атомов кислорода, азота и серы,
Заместитель α представляет (i) алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов, (ii) галогенированную алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (iii) гидроксильную группу, (iv) алифатическую ацилокси группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (v) алкокси группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (vi) алкилендиокси группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (vii) аралкилокси группу, имеющую от 7 до 12 углеродных атомов, (viii) алкилтио группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (ix) алкилсульфонил группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (х) атом галогена, (xi) нитро группу, (xii) диалкиламино группу с прямой или разветвленной цепью, в которой алкильные группы являются одинаковыми или отличными друг от друга и каждая имеет от 1 до 4 углеродных атомов, (xiii) аралкильную группу, имеющую от 7 до 12 углеродных атомов, (xiv) арильную группу, имеющую от 6 до 10 углеродных атомов (арильная часть может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном, алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов), (xv) арилокси группу, имеющую от 6 до 10 углеродных атомов (арильная часть может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном, алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов), (xvi) арилтио группу, имеющую от 6 до 10 углеродных атомов (арильная часть может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном, алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов), (xvii) арилсульфонил группу, имеющую от 6 до 10 углеродных атомов (арильная часть может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном, алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов), (xviii) арилсульфониламино группу, имеющую от 6 до 10 углеродных атомов (арильная часть может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном, алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, и атом азота амино части может быть замещен алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов), (xix) (5-10)-членную моноциклическую или бициклическую гетероароматическую группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, состоящей из атомов кислорода, азота или серы, (xx) (5-10)-членную моноциклическую или бициклическую гетероароматическую окси группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, состоящей из атомов кислорода, азота и серы, (xxi) (5-10)-членную моноциклическую или бициклическую гетероароматическую тиогруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, состоящей из атомов кислорода, азота и серы, (xxii) (5-10)-членную моноциклическую или бициклическую гетероароматическую сульфонил группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, состоящей из атомов кислорода, азота и серы, или (xxiii) (5-10)-членную моноциклическую или бициклическую гетероароматическую сульфониламино группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, состоящей из атомов кислорода, азота и серы (атом азота амино части может быть замещен алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов), и
Y представляет атом кислорода, атом серы или группу формулы: >N-R4 (где R4 представляет атом водорода, алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов, или алифатическую ацильную группу с прямой или разветвленной цепью или ароматическую ацильную группу, имеющую от 1 до 8 углеродных атомов).
В случае, где R1, R3, W и R4 представляют алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов, алкильная группа включает, например, метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, втор-бутильную, трет-бутильную, пентильную, 1-метилбутильную, 2-метилбутильную, 3-метилбутильную, 1,1-диметилпропильную, 1,2-диметилпропильную, 2, 2-диметилпропильную, 1-этилпропильную, гексильную, 1- метилпентильную, 2-метилпентильную, 3-метилпентильную, 4-метилпентильную, 1,1-диметилбутильную, 1,2-диметилбутильную, 1, 3-диметилбутильную, 2, 2-диметилбутильную, 2,3-диметилбутильную, 3,3-диметилбутильную, 1-этилбутильную, 2-этилбутильную, 1,1, 2-триметилпропильную или 1,2,2-триметилпропильную группу, предпочтительно алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, более предпочтительно метильную, этильную, пропильную, изопропильную, бутильную или изобутильную группу. R1, R3 и R4 еще более предпочтительно представляют алкил с прямой или разветвленной цепью, имеющий от 1 до 3 углеродных атомов, наиболее предпочтительно алкил, имеющий один или два углеродных атома. W еще более предпочтительно представляет пропильную или бутильную группу, наиболее предпочтительно бутильную группу.
В случае, где R2 представляет алкиленовую группу с прямой или разветвленной цепью, имеющую от 2 до 6 углеродных атомов, алкиленовая группа включает, например, этиленовую, метилэтиленовую, этилэтиленовую, 1,1-диметилэтиленовую, 1, 2-диметилэтиленовую, триметиленовую, 1-метилтриметиленовую, 1-этилтриметиленовую, 2-метилтриметиленовую, 1, 1-диметилтриметиленовую, тетраметиленовую, пентаметиленовую или гексаметиленовую группу, предпочтительно алкиленовую группу с прямой или разветвленной цепью, имеющую от 2 до 5 углеродных атомов, более предпочтительно алкиленовую группу с прямой или разветвленной цепью, имеющую от 2 до 4 углеродных атомов, еще более предпочтительно этиленовую, метилэтиленовую или триметиленовую группу, наиболее предпочтительно этиленовую группу.
В случае, где Z представляет алкиленовую группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов, алкиленовая группа включает, например, метиленовую, этиленовую, метилэтиленовую, этилэтиленовую, 1,1- диметилэтиленовую, 1, 2-диметилэтиленовую, триметиленовую, 1- метилтриметиленовую, 1-этилтриметиленовую 2-метилтриметиленовую, 1,1-диметилтри-метиленовую, тетраметиленовую, пентаметиленовую или гекса-метиленовую группу, предпочтительно алкиленовую группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов (например, метиленовая, этиленовая, метилэтиленовая, этилэтиленовая, триметиленовая, 1-метилтриметиленовая или 2- метилтриметиленовая группа), более предпочтительно алкиленовую группу, имеющую один или два углеродных атома, наиболее предпочтительно метиленовую группу.
В случае, где R3 и W представляют алкокси группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, алкокси группа включает, например, метокси, этокси, пропокси, изопропокси, бутокси, втор-бутокси, трет-бутокси или изобутокси группу. R3 предпочтительно представляет алкокси группу, имеющую один или два углеродных атома, наиболее предпочтительно метокси группу, и W предпочтительно представляет алкокси группу, имеющую от 1 до 3 углеродных атомов, наиболее предпочтительно этокси группу.
В случае, где R3 и W представляют алкилтио группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, алкилтио группа включает, например, метилтио, этилтио, пропилтио, изопропилтио, бутилтио, втор-бутилтио, трет-бутилтио или изобутилтио группу. R3 предпочтительно представляет алкилтио группу, имеющую один или два углеродных атома, наиболее предпочтительно метилтио группу, и W предпочтительно представляет алкилтио группу, имеющую от 1 до 3 углеродных атомов, наиболее предпочтительно метилтио группу.
В случае, где R3 представляет атом галогена, атом галогена включает атом фтора, хлора, брома или иода, предпочтительно атом фтора, хлора или брома, более предпочтительно атом фтора или хлора.
В случае, где W представляет моноалкиламино группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, моноалкиламино группа включает, например, метиламино, этиламино, пропиламино, изопропиламино, бутиламино, втор-бутиламино, трет-бутиламино или изобутиламино группу, предпочтительно моноалиламино группу с прямой или разветвленной цепью, имеющую от 1 до 3 углеродных атомов, наиболее предпочтительно этиламино группу.
В случае, где R3 и W представляют диалкиламино группу с прямой или разветвленной цепью, в которой алкильные группы являются одинаковыми или отличными друг от друга и каждая имеет от 1 до 4 углеродных атомов, диалкиламино группа включает, например, диметиламино, диэтиламино, дипропиламино, диизопропиламино, дибутиламино, N-метил-N-этиламино или N-этил-N-изопропиламино группу, предпочтительно диметиламино или диэтиламино группу, наиболее предпочтительно диэтиламино группу.
В случае, где R3 и W представляют арильную группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, незамещенная арильная группа включает, например, фенильную или нафтильную группы, предпочтительно фенильную группу. Замещенная арильная группа включает, например, 2-метилфенильную, 3-метилфенильную, 4-метилфенильную, 4-этилфенильную, 4-пропилфенильную, 4-изопропилфенильную, 4-трифторбутилфенильную, 4-гидроксифенильную, 4-ацетоксифенильную, 4-метоксифенильную, 3,4-метилендиоксифенильную, 4-бензилоксифенильную, 4-метилтиофенильную, 4-метилсульфонилфенильную, 4-фторфенильную, 4-хлорфенильную, 4-нитрофенильную, 4-диметиламинофенильную, 4-бензилфенильную, 4-бифенилильную, 4-феноксифенильную, 4-фенилтиофенильную, 4-фенилсульфонилфенильную, 4-фенилсульфониламинофенильную, 4-(2-пиридил)фенильную, 4-(2-пиридилокси)фенильную, 4-(2-пиридилтио)фенильную или 4-(2-пиридилсульфониламино)фенильную группу, предпочтительно 4-метилфенильную, 4-этилфенильную, 4-изопропилфенильную, 4-метоксифенильную, 4-метилтиофенильную или 4-хлорфенильную группу.
В случае, где R3 и W представляют аралкильную группу, имеющую от 7 до 12 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, незамещенная аралкильная группа представляет группу, в которой алкильная группа с прямой или разветвленной цепью, имеющая от 1 до 4 углеродных атомов, замещена вышеупомянутой арильной группой и включает, например, бензильную, фенэтильную, 3-фенилпропильную, 4- фенилбутильную, 1-нафтилметильную или 2-нафтилметильную группу. R3 предпочтительно представляет бензильную или фенэтильную группу, наиболее предпочтительно бензильную группу, и W предпочтительно представляет бензильную, фенэтильную, 3- фенилпропильную или 4-фенилбутильную группу, наиболее предпочтительно фенэтильную или 3-фенилпропильную группу. Замещенная аралкильная группа включает, например, 4-метилбензильную, 4-трифторметилбензильную, 4-метоксибензильную, 3,4-метилендиоксибензильную, 4-метилтиобензильную, 4-метилсульфонилбензильную, 4-фторбензильную, 4-хлорбензильную, 2-(4-метилфенил)этильную, 2-(4-метоксифенил)этильную, 3-(4-метилфенил)пропильную, 3-(4-метоксифенил)пропильную, 4-(4-метилфенил)бутильную или 4-(4-метоксифенил)бутильную группу, предпочтительно 4-метилбензильную или 2-(4-метилфенил)этильную группу.
В случае, где W представляет N-алкил-N-ариламино группу, имеющую алкил с прямой или разветвленной цепью, имеющий от 1 до 4 углеродных атомов, и арил, имеющий от 6 до 10 углеродных атомов, который может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, и алкильная часть незамещенной N-алкил-N-ариламино группы включает, например, метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, втор-бутильную или трет-бутильную группу, предпочтительно метильную, этильную, пропильную, изопропильную, бутильную или изобутильную группу, наиболее предпочтительно метильную или этильную группу. Арильная часть включает, например, фенильную или нафтильную группу, предпочтительно фенильную группу. Пример незамещенной N- алкил-N-ариламино группы включает, например, N-метил-N-фениламино, N-этил-N-фениламино, N-пропил-N-фениламино, N-изопропил-N- фениламино, N-бутил-N-фениламино, N-изобутил-N-фениламино или N- метил-N-нафтиламино группу, предпочтительно N-метил-N-фениламино или N-этил-N-фениламино группу, наиболее предпочтительно N-этил-N-фениламино группу. Замещенная N-алкил-N-ариламино группа включает, например, N-метил- N-(4-метилфенил)амино, N-этил-N-(4-метилфенил)амино, N-метил-N-(4-метоксифенил)амино или N-этил-N-(4-метоксифенил)амино группу, предпочтительно N-метил-N-(4-метилфенил)амино или N-этил-N- (4-метилфенил)амино группу.
В случае, где W представляет арилокси группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, незамещенная арилокси группа включает, например, фенокси или нафтилокси группу, предпочтительно фенокси группу. Замещенная арилокси группа включает, например, 4-метилфенокси, 4-этилфенокси, 4-пропилфенокси, 4-изопропилфенокси, 4-метоксифенокси, 4- этоксифенокси, 4-метилтиофенокси, 4-этилтиофенокси, 4-бифенилилокси или 4-метилсульфонилфенокси группу, предпочтительно 4-метилфенокси, 4-этилфенокси или 4-изопропилфенокси группу.
В случае, где W представляет арилтио группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, незамещенная арилтио группа включает, например, фенилтио или нафтилтио группу, предпочтительно фенилтио группу. Замещенная арилтио группа включает, например, 4- метилфенилтио, 4-этилфенилтио, 4-пропилфенилтио, 4- изопропилфенилтио, 4-метоксифенилтио, 4-этоксифенилтио, 4- метилтиофенилтио, 4-этилтиофенилтио, 4-бифенилилтио или 4- метилсульфонилфенилтио группу, предпочтительно 4-метилфенилтио, 4-этилфенилтио или 4-изопропилфенилтио группу.
В случае, где W представляет ариламино группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, незамещенная ариламино группа включает, например, фениламино или нафтиламино группу, предпочтительно фениламино группу. Замещенная ариламино группа включает, например, 4-метилфениламино, 4-этилфениламино, 4-пропилфениламино, 4-изопропилфениламино, 4- метоксифениламино, 4-этоксифениламино, 4-метилтиофениламино, 4-этилтиофениламино, 4-бифенилиламино или 4-метил-сульфонилфениламино группу, предпочтительно 4-метилфениламино, 4-этилфениламино или 4-изопропилфениламино группу.
В случае, где W представляет аралкилокси группу, имеющую от 7 до 12 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, незамещенная аралкилокси группа представляет группу, в которой алкилокси группа с прямой или разветвленной цепью, имеющая от 1 до 4 углеродных атомов, замещена вышеупомянутой арильной группой и включает, например, бензилокси, фенэтилокси, 3-фенилпропилокси, 4-фенилбутилокси, 1-нафтилметилокси или 2-нафтилметилокси группу, предпочтительно бензилокси или фенэтилокси группу, наиболее предпочтительно бензилокси группу. Замещенная аралкилокси группа включает, например, 4-метилбензилокси, 4-метоксибензилокси, 2-(4- метилфенил)этокси, 2-(4-метоксифенил)этокси, 3-(4- метилфенил)пропокси, 3-(4-метоксифенил)пропокси, 4-(4- метилфенил)бутокси или 4-(4-метоксифенил)бутокси группу, предпочтительно 4-метилбензилокси или 2-(4-метилфенил)этокси группу.
В случае, где W представляет аралкилтио группу, имеющую от 7 до 12 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, незамещенная аралкилтио группа представляет группу, в которой алкилтио группа с прямой или разветвленной цепью, имеющая от 1 до 4 углеродных атомов, замещена вышеупомянутой арильной группой и включает, например, бензилтио, фенэтилтио, 3-фенилпропилтио, 4-фенилбутилтио, 1-нафтилметилтио или 2-нафтилметилтио группу, предпочтительно бензилтио или фенэтилтио группу, наиболее предпочтительно бензилтио группу. Замещенная аралкилтио группа включает, например, 4-метилбензилтио, 4-метоксибензилтио, 2-(4-метилфенил)этилтио, 2-(4- метоксифенил)этилтио, 3-(4-метилфенил)пропилтио, 3-(4- метоксифенил)пропилтио, 4-(4-метилфенил)бутилтио или 4-(4- метоксифенил)бутилтио группу, предпочтительно 4-метилбензилтио или 2-(4-метилфенил)этилтио группу.
В случае, где W представляет аралкиламино группу, имеющую от 7 до 12 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, незамещенная аралкиламино группа представляет группу, в которой алкиламино группа с прямой или разветвленной цепью, имеющая от 1 до 4 углеродных атомов, замещена вышеупомянутой арильной группой и включает, например, бензиламино, фенэтиламино, 3-фенилпропиламино, 4-фенилбутиламино, 1- нафтилметиламино или 2-нафтилметиламино группу, предпочтительно бензиламино или фенэтиламино группу, наиболее предпочтительно бензиламино группу. Замещенная аралкиламино группа включает, например, 4- метилбензиламино, 4-метоксибензиламино, 2-(4-метилфенил)этиламино, 2-(4-метоксифенил)этиламино, 3-(4-метилфенил)пропиламино, 3-(4-метоксифенил)пропиламино, 4-(4-метилфенил)бутиламино или 4-(4-метоксифенил)бутиламино группу, предпочтительно 4-метилбензиламино или 2-(4-метилфенил)этиламино группу.
В случае, где R4 представляет алифатическую ацильную группу с прямой или разветвленной цепью, имеющую от 1 до 8 углеродных атомов, или ароматическую ацильную группу, ацильная группа включает, например, формильную, ацетильную, пропионильную, бутирильную, пентаноильную, гексаноильную, гептаноильную или октаноильную группу, или бензоильную или п-толуоильную группу, предпочтительно алканоильную группу с прямой или разветвленной цепью, имеющую от 1 до 8 углеродных атомов, более предпочтительно алканоильную группу с прямой или разветвленной цепью, имеющую от 2 до 5 углеродных атомов, наиболее предпочтительно, ацетильную группу.
В случае, где X представляет арильную группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, незамещенная арильная группа включает, например, фенильную или нафтильную группу, предпочтительно фенильную группу. В случае, где X представляет арильную группу, которая замещена 1-3 заместителями α, упомянутыми ниже, число заместителей предпочтительно равно одному или двум, более предпочтительно одному.
В случае, где X представляет (5-10)-членную моноциклическую или бициклическую гетероароматическую группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, состоящей из атомов кислорода, азота и серы, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, незамещенная гетероароматическая группа включает моноциклическую кольцевую или бициклическую кольцевую систему. В случае, где группа является бициклической кольцевой системой, одно из них, по крайней мере, является гетероциклическим кольцом. В случае бициклической кольцевой системы группа является конденсированным кольцом, и это тот случай, где одно кольцо является гетероциклическим кольцом, а другое является карбоциклическим кольцом, или случай, когда оба кольца являются гетероциклическими кольцами. Гетероциклическое кольцо представляет 5- или 6-членное кольцо и содержит от 1 до 4 гетероатомов, выбранных из группы, состоящей из атомов азота, кислорода и серы. Карбоциклическое кольцо представляет арильную группу, имеющую от 6 до 10 углеродных атомов. Моноциклическую кольцевую систему и бициклическую кольцевую систему называют моноциклической гетероароматической группой и конденсированной гетероароматической кольцевой группой, соответственно. В случае кольца, имеющего четыре гетероатома, предпочтительно, чтобы все четыре гетероатома были атомами азота в отсутствие гетероатома, выбранного из группы, состоящей из атомов кислорода и серы. В случае кольца, имеющего три гетероатома, предпочтительно, чтобы три, два или один из них был атомом азота, и один или два гетероатома были выбраны из группы, состоящей из атомов кислорода и серы. В случае кольца, имеющего два гетероатома, предпочтительно, чтобы два, один или ни один из них не был атомом азота, и ни один из гетероатомов, один или два из гетероатомов не были выбраны из группы, состоящей из атомов кислорода и серы. В случае, где X представляет гетероароматическую группу, которая замещена 1-3 заместителями α, упомянутыми ниже, число заместителей предпочтительно равно одному или двум, более предпочтительно одному.
Незамещенная моноциклическая гетероароматическая группа включает, например, пирролильную группу, такую как 2-пирролил и 3-пирролил; фурильную группу, такую как 2-фурил и 3-фурил; тиенильную группу, такую как 2-тиенил и 3-тиенил; пиридильную группу, такую как 2-пиридил, 3-пиридил и 4-пиридил; имидазолильную группу, такую как 2-имидазолил и 4-имидазолил; пиразолильную группу, такую как 3-пиразолил и 4-пиразолил; оксазолильную группу, такую как 2-оксазолил, 4-оксазолил и 5-оксазолил; изоксазолильную группу, такую как 3-изоксазолил, 4-изоксазолил и 5-изоксазолил; тиазолильную группу, такую как 2-тиазолил, 4-тиазолил и 5-тиазолил; изотиазолильную группу, такую как 3-изотиазолил, 4-изотиазолил и 5-изотиазолил; триазолильную группу, такую как 1,2, 3-триазол-4-ил и 1,2,4-триазол-3-ил; тиадиазолильную группу, такую как 1,3,4-тиадиазол-2-ил; оксадиазолильную группу, такую как 1,3,4-оксадиазол-2-ил; тетразолильную группу, такую как 5-тетразолил; пиридазинильную группу, такую как 3-пиридазинил и 4-пиридазинил; пиримидинильную группу, такую как 2-пиримидинил, 4-пиримидинил и 5-пиримидинил; пиразинильную группу; оксазинильную группу, такую как 1,4-оксазин- 2-ил и 1,4-оксазин-3-ил; тиазинильную группу, такую как 1,4-тиазин-2-ил и 1,4-тиазин-3-ил.
Незамещенная конденсированная ароматическая гетероциклическая кольцевая группа включает, например, индолильную группу, такую как индол-2-ил, индол-3-ил, индол-4-ил, индол-5-ил, индол-6-ил и индол-7-ил; индазолильную группу, такую как индазол-2-ил, индазол-3-ил, индазол-4-ил, индазол-5-ил, индазол-6-ил и индазол-7-ил; бензофуранильную группу, такую как бензофуран-2-ил, бензофуран-3-ил, бензофуран-4-ил, бензофуран-5-ил, бензофуран-6-ил и бензофуран-7-ил; бензотиофенильную группу, такую как бензотиофен-2-ил, бензотиофен-3-ил, бензо-тиофен-4-ил, бензотиофен-5-ил, бензотиофен-6-ил и бензотиофен-7-ил; бензимидазолильную группу, такую как бензимидазол-2-ил, бензимидазол-4-ил, бензимидазол-5-ил, бензимидазол-6-ил и бензимидазол-7-ил; бензоксазолильную группу, такую как бензоксазол-2-ил, бензоксазол-4-ил, бензоксазол-5-ил, бензоксазол-6-ил и бензоксазол-7-ил; бензотиазолильную группу, такую как бензотиазол-2-ил, бензотиазол-4-ил, бензотиазол-5-ил, бензотиазол-6-ил и бензотиазол-7-ил; хинолильную группу, такую как 2-хинолил, 3-хинолил, 4-хинолил, 5-хинолил, 6-хинолил, 7-хинолил и 8-хинолил; изохинолильную группу, такую как 1-изохинолил, 3-изохинолил, 4-изохинолил и 8-изохинолил; бензоксазинильную группу, такую как 1, 4-бензоксазин-2-ил и 1,4-бензоксазин-3-ил; бензотиазинильную группу, такую как 1,4-бензотиазин-2-ил и 1,4- бензотиазин-3-ил; пирроло[2, 3-b]пиридильную группу, такую как пирроло[2,3-b] пирид-2-ил и пирроло[2,3-b]пирид-3-ил; фуро[2,3-b]пиридильную группу, такую как фуро[2,3-b] пирид-2-ил и фуро[2,3- b]пирид-3-ил; тиено[2,3-b] пиридильную группу, такую как тиено[2,3- b]пирид-2-ил и тиено [2,3-b] пирид-3-ил; нафтиридинильную группу, такую как 1,8-нафтиридин-2-ил, 1,8-нафтиридин-3-ил, 1,5-нафтиридин-2-ил, 1,5-нафтиридин-3-ил; имидазопиридильную группу, такую как имидазо[4,5-b]пирид-2-ил и имидазо[4,5-b]пирид-5-ил; оксазолопиридильную группу, такую как оксазоло[4,5-b]пирид-2-ил и оксазоло[5,4-b]пирид-2-ил; тиазолопиридильную группу, такую как тиазоло[4,5-b] пирид-2-ил и тиазоло[4, 5-c]пирид-2-ил.
Моноциклическая гетероароматическая группа предпочтительно представляет 5- или 6-членную кольцевую группу, имеющую от 1 до 3 гетероатомов, выбранных из группы, состоящей из атомов азота, кислорода и серы, и включает пирролильную, фурильную, тиенильную, пиридильную, имидазолильную, пиразолильную, оксазолильную, изоксазолильную, тиазолильную, триазолильную, тиадиазолильную, оксадиазолильную, пиридазинильную, пиримидинильную и пиразинильную группы, ииллюстрированные выше. Конденсированная гетероароматическая группа предпочтительно представляет конденсированную кольцевую группу бензольного кольца с 5- или 6-членной гетероароматической группой, имеющей от 1 до 3 гетероатомов, выбранных из группы, состоящей из атомов азота, кислорода и серы, упомянутой выше, и включает индолильную, бензофуранильную, бензотиофенильную, бензоимидазолильную, бензоксазолильную, бензотиазолильную, хинолильную и изохинолильную группы, иллюстрированные выше. Предпочтительные гетероароматические группы включают имидазолильную, оксазолильную, пиридильную, индолильную, хинолильную или изохинолильную группу, причем пиридильная, индолильная, хинолильная или изохинолильная группа являются более предпочтительными, еще более предпочтительными являются пиридильная, хинолильная или изохинолильная группа и наиболее предпочтительной группой является пиридильная группа.
В случае, где вышеупомянутый X представляет арильную группу, имеющую от 6 до 10 углеродных атомов, или (5-10)- членную моноциклическую или бициклическую гетероароматическую группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, состоящей из атомов кислорода, азота и серы, арильная группа и гетероароматическая группа может иметь от 1 до 3 заместителей α, упомянутых выше.
В случае, где заместительное α представляет алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов, алкокси группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, алкилтио группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, атом галогена или диалкиламино группу с прямой или разветвленной цепью, в которой алкильные группы являются одинаковыми или отличными друг от друга и каждая имеет от 1 до 4 углеродных атомов, эти группы включают те же группы, как иллюстрированные в вышеуказанном R3.
В случае, где заместитель α представляет галогенированную алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, галогенированная алкильная группа включает, например, хлорметильную, бромметильную, фторметильную, иодметильную, дифторметильную, трифторметильную, пентафторэтильную, 2,2, 2-трифторэтильную, 2,2,2-трихлорэтильную или трихлорметильную группу, предпочтительно метильную группу, имеющую от 1 до 3 атомов фтора, наиболее предпочтительно трифторметильную группу.
В случае, где заместитель α представляет алифатическую ацилокси группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, ацилокси группа включает, например, формилокси, ацетокси, пропионилокси, бутирилокси, акроилокси, метакрилоилокси или кротоноилокси группу, предпочтительно алканоилокси группы, более предпочтительно алканоилокси группы, имеющие один или два углеродных атома, наиболее предпочтительно ацетокси группу.
В случае, где заместитель α представляет алкилендиокси группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, алкилендиокси группа включает, например, метилендиокси, этилендиокси, триметилендиокси, тетраметилендиокси или пропилендиокси группу, предпочтительно метилендиокси или этилендиокси группу, наиболее предпочтительно метилендиокси группу.
В случае, где заместитель α представляет аралкилокси группу, имеющую от 7 до 12 углеродных атомов, аралкилокси группа представляет аралкилокси группу, в которой аралкильная часть - является таким же аралкилом, как указано для R3, и включает, например, бензилокси, фенэтилокси, 3-фенилпропокси, 4- фенилбутокси, 1-нафтилметокси или 2-нафтилметокси группу, предпочтительно бензилокси, фенэтилокси, 1-нафтилметокси или 2- нафтилметокси группу, наиболее предпочтительно бензилокси группу.
В случае, где заместитель α представляет алкилсульфонильную группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, алкилсульфонильная группа включает, например, метилсульфонильную, этилсульфонильную, пропилсульфонильную, изопропилсульфонильную, бутилсульфонильную, изобутилсульфонильную, втор-бутилсульфонильную или трет- бутилсульфонильную группу, предпочтительно метилсульфонильную, этилсульфонильную или изопропилсульфонильную группу, более предпочтительно алкилсульфонильную группу, имеющую один или два углеродных атома.
В случае, где заместитель α представляет аралкильную группу, имеющую от 7 до 12 углеродных атомов, аралкильная группа является группой, имеющей то же значение, как определено для R3 , и включает, например, бензильную, фенэтильную, 3-фенилпропильную, 4-фенилбутильную, 1-нафтилметильную или 2-нафтилметильную группу, предпочтительно бензильную, фенэтильную, 1-нафтилметильную или 2- нафтилметильную группу, наиболее предпочтительно бензильную группу.
В случае, где заместитель α представляет арильную группу, имеющую от 6 до 10 углеродных атомов (арильная группа может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном или алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов), причем алкил, галогенированный алкил, алкокси, галоген и алкилендиокси заместители арильной группы имеют те же значения, как определено выше для заместителя R3 и X.
Арильная группа включает, например, фенильную, 1-нафтильную, 2-нафтильную, 4- метилфенильную, 4-трифторметилфенильную, 4-метоксифенильную, 3-этоксифенильную, 4- фторфенильную, 4-хлорфенильную, 3-бромфенильную или 3,4- метилендиоксифенильную группу, предпочтительно фенильную, 4- метоксифенильную или 3,4-метилендиоксифенильную группу.
В случае, где заместитель α представляет арилокси группу, имеющую от 6 до 10 углеродных атомов (арильная часть может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном или алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов), алкил, галогенированный алкил, алкокси, галоген и алкилендиокси имеют те же значения, как определено выше.
Арилокси группа включает, например, фенокси, 1-нафтокси, 2-нафтокси, 4-метилфенокси, 4-трифторметилфенокси, 4-метокси-фенокси, 3-этоксифенокси, 4-хлорфенокси, 3-бромфенокси или 3, 4-метилендиоксифенокси группу, предпочтительно фенокси группу.
В случае, где заместитель α представляет арилтио группу, имеющую от 6 до 10 углеродных атомов (арильная часть может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном или алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов), алкил, галогенированный алкил, алкокси, галоген и алкилендиокси имеют те же значения, как определено выше.
Арилтио группа включает, например, фенилтио, 4-метилфенилтио, 4-трифторметилфенилтио, 4-метоксифенилтио, 3-этоксифенилтио, 4-хлорфенилтио, 3-бромфенилтио, 3,4-метилендиоксифенилтио, 1-нафтилтио или 2-нафтилтио группу, предпочтительно фенилтио группу.
В случае, где заместитель α представляет арилсульфонильную группу, имеющую от 6 до 10 углеродных атомов (арильная часть может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном или алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов), алкил, галогенированный алкил, алкокси, галоген и алкилендиокси имеют те же значения, как определено выше.
Арилсульфонильная группа включает, например, фенилсульфонильную, 4-метилфенилсульфонильную, 4-трифторметилфенилсульфонильную, 4-метоксифенилсульфонильную, 3-этоксифенилсульфонильную, 4-хлорфенилсульфонильную, 3-бромфенилсульфонильную, 3,4-метилендиоксифенилсульфонильную, 1-нафтилсульфонильную или 2-нафтилсульфонильную группу, предпочтительно фенилсульфонильную группу.
В случае, где заместитель α представляет арилсульфониламино группу, имеющую от 6 до 10 углеродных атомов (арильная часть может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном или алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, и атом азота амино части может быть замещен алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов), алкил, галогенированный алкил, алкокси, галоген и алкилендиокси имеют те же значения, как определено выше.
Арилсульфониламино группа включает, например, фенилсульфониламино, 4-метиленфенилсульфониламино, 4-трифторметилфенилсульфониламино, 4-метоксифенилсульфониламино, 3-этоксифенилсульфониламино, 4-хлорфенилсульфониламино, 3-бромфенилсульфониламино, 3,4-метилендиоксифенилсульфониламино, N-метилфенилсульфониламино, 1-нафтилсульфониламино, 2-нафтилсульфониламино или N-метилнафтилсульфониламино группу, предпочтительно фенилсульфониламино или N-метилфенилсульфониламино группу.
В случае, где заместитель α представляет (5-10)-членную моноциклическую или бициклическую гетероароматическую группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, состоящей из атомов кислорода, азота и серы, группа может быть, например, фурильной, тиенильной, оксазолильной, изоксазолильной, тиазолильной, имидазолильной, хинолильной, изохинолильной, индолильной или пиридильной группой, предпочтительно имидазолильной, хинолильной или пиридильной группой, наиболее предпочтительно пиридильной группой.
В случае, где заместитель α представляет (5-10)-членную моноциклическую или бициклическую гетероароматическую окси группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, состоящей из атомов кислорода, азота и серы, гетероароматическая окси группа включает, например, фурилокси, тиенилокси, оксазолилокси, изоксазолилокси, тиазолилокси, имидазолилокси, хинолилокси, изохинолилокси, индолилокси или пиридилокси группу, предпочтительно изоксазолилокси или пиридилокси группу, наиболее предпочтительно пиридилокси группу.
В случае, где заместитель α представляет (5-10)-членную моноциклическую или бициклическую гетероароматическую тио группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, состоящей из атомов кислорода, азота и серы, гетероароматическая тио группа включает, например, фурилтио, тиенилтио, оксазолилтио, изоксазолилтио, тиазолилтио, имидазолилтио, хинолилтио, изохинолилтио, индолилтио или пиридилтио группу, предпочтительно изоксазолилтио или пиридилтио группу, наиболее предпочтительно пиридилтио группу.
В случае, где заместитель α представляет (5-10)-членную моноциклическую или бициклическую гетероароматическую сульфонильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, состоящей из атомов кислорода, азота и серы, гетероароматическая сульфонильная группа включает, например, фурилсульфонильную, тиенилсульфонильную, оксазолилсульфонильную, изоксазолилсульфонильную, тиазолилсульфонильную, имидазолилсульфонильную, хинолилсульфонильную, изохинолилсульфонильную, индолилсульфонильную или пиридилсульфонильную группу, предпочтительно имидазолилсульфонильную, изоксазолилсульфонильную или пиридилсульфонильную группу, наиболее предпочтительно пиридилсульфонильную группу.
В случае, где заместитель α представляет (5-10)-членную моноциклическую или бициклическую гетероароматическую сульфониламино группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, состоящей из атомов кислорода, азота и серы (атом азота амино части может быть замещен алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов), гетероароматическая сульфониламино группа включает, например, фурилсульфониламино, тиенилсульфониламино, оксазолилсульфониламино, изоксазолилсульфониламино, тиазолилсульфониламино, имидазолилсульфониламино, N-метилимидазолилсульфониламино, хинолилсульфониламино, изохинолилсульфониламино, индолилсульфониламино, пиридилсульфониламино или N-метилпиридилсульфониламино группу, предпочтительно имидазолилсульфониламино, N-метилимидазолилсульфониламино, пиридилсульфониламино или N-метилпиридилсульфониламино группу, более предпочтительно пиридилсульфониламино или N-метилпиридилсульфониламино группу.
Поэтому в случае, где X представляет
замещенную или незамещенную арильную группу, имеющую от 6 до 10 углеродных атомов, или замещенную или незамещенную (5-10)-членную
моноциклическую или бициклическую гетероароматическую группу,
содержащую от 1 до 4 гетероатомов, выбранных из группы, состоящей из атомов кислорода, азота и серы, предпочтительные примеры включают
фенильную, 1-нафтильную, 2-нафтильную, м-толильную, п-толильную,
3-этилфенильную, 4-этилфенильную, 3-изопропилфенильную, 4-изопропилфенильную, 3-трет-бутилфенильную, 4-трет-бутилфенильную,
4-хлорметилфенильную, 4-бромметилфенильную, 4-фторметилфенильную,
4-иодметилфенильную, 3- дифторметилфенильную, 4-трифторметилфенильную, 4-пентафторэтилфенильную, 4-трихлорметилфенильную,
3-гидроксифенильную, 4-гидроксифенильную, 4-гидрокси- 3,5-диметилфенильную,
3-ацетоксифенильную, 4-ацетоксифенильную, 5-ацетокси-2-гидрокси-3,4,6- триметилфенильную), 3-метоксифенильную,
4-метоксифенильную, 3-этоксифенильную, 4-этоксифенильную, 3-изопропоксифенильную,
4-изопропоксифенильную, 3,4-метилендиоксифенильную, бензилоксифенильную, фенэтилоксифенильную,
1-нафтилметоксифенильную), 3-метилтиофенильную, 4-метилтиофенильную, 3-этилтиофенильную,
4-этилтиофенильную, 3- изопропилтиофенильную, 4-изопропилтиофенильную, 3-метилсульфонилфенильную,
4-метилсульфонилфенильную, 3-этилсульфонилфенильную, 4-этилсульфонилфенильную,
3-изопропилсульфонилфенильную, 4-изопропилсульфонилфенильную, 3-хлорфенильную, 4-хлорфенильную, 3-бромфенильную,
4-бромфенильную, 4-нитрофенильную, 4-аминофенильную, 3-метиламинофенильную,
4- этиламинофенильную, 3-пропиламинофенильную, 4-бутиламинофенильную, 3-диметиламинофенильную, 4-диэтиламинофенильную,
3-дипропиламинофенильную, 4-дибутиламинофенильную, 3-бензилфенильную,
4-бензилфенильную, 3-фенэтилфенильную, 4-(1-нафтилметил)фенильную, 3-бифенилильную, 4-бифенилильную, 3-(4- метилфенил)фенильную,
4-(4-метилфенил)фенильную, 3-(4-этилфенил)фенильную,
3-(4-трифторметилфенил)фенильную, 4-(4- трифторметилфенил)фенильную, 3-(4-метоксифенил)фенильную, 4-(4- метоксифенил)фенильную, 3-(2,
4-диметоксифенил)фенильную, 4-(2, 4-диметоксифенил) фенильную, 3-(2,
5-диметоксифенил)фенильную, 4-(2,5-диметоксифенил)фенильную, 4-(3-хлорфенил)фенильную, 4- (4-хлорфенил)фенильную,
4-(3-бромфенил)фенильную, 4-(4- бромфенил)фенильную, 3-(3,
4-метилендиоксифенил)фенильную, 4- (3,4-метилендиоксифенил)фенильную, 3-бензилфенильную, 4- бензилфенильную, 3-феноксифенильную,
4-феноксифенильную, 3- фенилтиофенильную, 4-фенилтиофенильную,
3-фенилсульфонил-фенильную, 4-фенилсульфонилфенильную, 3-(фенилсульфониламино) фенильную, 4-(фенилсульфониламино) фенильную,
3-(N- метилфенилсульфониламино)фенильную, 4-(N-метилфенилсульфонил-амино)
фенильную, 3-(имидазол-1-ил)фенильную, 4-(имидазол-1-ил) фенильную, 3-(1-метилимидазол-4-ил)фенильную,
4-(1-метил- имидазол-4-ил)фенильную, 3-(2-фурил)фенильную, 4-(2-фурил) фенильную,
3-(2-тиенил)фенильную, 4-(2-тиенил)фенильную, 3-(3- тиенил) фенильную, 4-(3-тиенил)фенильную, 3-(2-пиридил) фенильную,
4-(2-пиридил)фенильную, 3-(3-пиридил) фенильную, 4-(3- пиридил)фенильную,
3-(4-пиридил)фенильную, 4-(4-пиридил) фенильную, 4-(имидазол-1-илтио)фенильную, 4-(2-фурилтио) фенильную,
4-(2-тиенилтио)фенильную, 4-(2-пиридилтио) фенильную, 4-(4-пиридилтио)фенильную,
3-(2-пиридилсульфонил) фенильную, 4-(2-пиридил-сульфонил)фенильную, 3-(3- пиридилсульфонил)фенильную,
4-(3-пиридилсульфонил)фенильную, 3-(2-пиридилсульфониламино) фенильную,
3-(N-метил-2- пиридилсульфониламино)фенильную, 4-(2- пиридилсульфониламино)фенильную,
4-(N-метил-2- пиридилсульфониламино)фенильную, 3-(3-пиридилсульфониламино) фенильную,
3-(N-метил-3-пиридилсульфониламино)фенильную, 4-(3- пиридилсульфониламино)фенильную,
4-(N-метил-3- пиридилсульфониламино)фенильную, 3-(оксазол-2-ил)фенильную, 4-(оксазол-2-ил)фенильную,
3-(оксазол-4-ил)фенильную, 4-(оксазол-4-ил)фенильную, 3-(оксазол-5-ил)фенильную,
4-(оксазол-5- ил)фенильную, 3-(тиазол-2-ил)фенильную, 4-(тиазол-2-ил)фенильную, 3-(тиазол-4-ил)фенильную,
4-(тиазол-4-ил)фенильную, 3-(тиазол-5- ил)фенильную, 4-(тиазол-5-ил)фенильную,
1-метил-2- пирролильную, 1-фенил-2-пирролильную, 1-бензил-2-пирролильную, 5-метил-2-фурильную, 5-фенил-2-фурильную,
5-метил-2-тиенильную, 5- фенил-2-тиенильную, 5-метил-3-тиенильную,
5-фенил-3-тиенильную, 1-метил-3-пиразолильную, 1-фенил-3-пиразолильную, 1-метил-2-имидазолильную, 1-фенил-2-имидазолильную,
1-метил-4-имидазолильную, 1-фенил-4-имид-азолильную,
1-метил-2-фенил-4-имидазолильную, 1,5-диметил-2-фенил-4-имидазолильную, 1,4-диметил- 2-фенил-5-имидазолильную, 4-оксазолильную, 5-оксазолильную,
2- метил-4-оксазолильную, 2-фенил-4-оксазолильную,
2-метил-5-оксазолильную, 2-фенил-5-оксазолильную, 4-метил-2-фенил-5-оксазолильную, 5-метил-2-фенил-4-оксазолильную, 4-тиазолильную, 5-тиазолильную,
2-метил-4-тиазолильную, 2-фенил-4-тиазолильную,
2-метил-5-тиазолильную, 2-фенил-5-тиазолильную, 4-метил-2-фенил-5- тиазолильную, 5-метил-2-фенил-4-тиазолильную, 1-метил-3- пиразолильную,
1-фенил-3-пиразолильную, 3-метил-5-изоксазолильную,
3-фенил-5-изоксазолильную, 2-пиридильную, 3-пиридильную, 4-пиридильную, 3-метил-5-пиридильную, 3-этил-5-пиридильную, 3-фенил-5-пиридильную,
2-метил-5-пиридильную, 2- этил-5-пиридильную,
2-фенил-5-пиридильную, 2-гидрокси-5-пиридильную, 2-метокси-5-пиридильную, 2-этокси-5-пиридильную, 2-изопропокси-5-пиридильную, 2-бензилокси-5-пиридильную,
2-метилтио-5-пиридильную,
2-этилтио-5-пиридильную, 2-изопропилтио-5- пиридильную, 2-метилсульфонил-5-пиридильную, 2-этилсульфонил- 5-пиридильную, 2-изопропилсульфонил-5-пиридильную,
2- бензил-5-пиридильную,
2-фенокси-5-пиридильную, 2-фенилтио-5-пиридильную, 2-фенилсульфонил-5-пиридильную, 2- фенилсульфониламино-5-пиридильную, 2-(N-метилфенилсульфониламино)-5-пиридильную,
3-метил-6-пиридильную,
3-фенил-6-пиридильную, 2- метил-6-пиридильную, 2-фенил-6-пиридильную, 2-метил-4- пиримидинильную, 2-фенил-4-пиримидинильную, 2-метокси-4-
пиримидинильную,
2-этокси-4-пиримидинильную,
2-изопропокси-4-пиримидинильную, 2-метилтио-4-пиримидинильную, 2-этилтио-4-пиримидинильную, 2-изопропилтио-4-пиримидинильную, 2-фенилтио-4- пиримидинильную,
2-метилсульфонил-4-пиримидинильную,
2-этилсульфонил -4-пиримидинильную, 2-изопропилсульфонил-4- пиримидинильную, 2-фенилсульфонил-4-пиримидинильную, 2-метил- 5-пиримидинильную,
2-фенил-5-пиримидинильную, 2-метокси-5-пиримидинильную,
2-этокси-5-пиримидинильную, 2-изопропокси-5-пиримидинильную, 2-метилтио-5-пиримидинильную, 2-этилтио-5-пиримидинильную,
2-изопропилтио-5-пиримидинильную, 2-фенилтио-5- пиримидинильную,
2-метилсульфонил-5-пиримидинильную, 2-этилсульфонил-5-пиримидинильную, 2-изопропилсульфонил- 5-пиримидинильную,
2-фенилсульфонил-5-пиримидинильную, 2-индолильную, 3-индолильную, 1-метил-2-индолильную,
1-метил-3-индолильную, 2-бензимидазолильную, 1-метил-2-бензимидазолильную, 2-бензоксазолильную,
2-бензотиазолильную, 2-хинолильную, 3-хинолильную, 4-хинолильную, 1-изохинолильную, 3-изохинолильную,
4-изохинолильную и 8-изохинолильную группы, более предпочтительно фенильную, 1-нафтильную,
2-нафтильную, м-толильную, п-толильную, 3-этилфенильную, 4-этилфенильную, 3-изопропилфенильную,
4- изопропилфенильную, 4-трифторметилфенильную, 3-гидроксифенильную, 4-гидроксифенильную, 4-гидрокси-3,
5-диметилфенильную, 3- ацетоксифенильную, 4-ацетоксифенильную, 5-ацетокси-2-гидрокси- 3,4,
6-триметилфенильную, 3-метоксифенильную, 4-метоксифенильную, 3-этоксифенильную, 4-этоксифенильную,
3-изопропоксифенильную, 4- изопропоксифенильную, 3,4-метилендиоксифенильную, бензилоксифенильную,
3-метилтиофенильную, 4-метилтиофенильную, 3-этилтиофенильную, 4-этилтиофенильную,
3-метилсульфонилфенильную, 4- метилсульфонилфенильную, 3-этилсульфонилфенильную, 4-этилсульфонилфенильную,
3-хлорфенильную, 4-хлорфенильную, 3- бензилфенильную, 4-бензилфенильную, 3-бифенилильную,
4- бифенилильную, 3-(4-метилфенил)фенильную, 4-(4-метилфенил) фенильную, 3-(4-этилфенил) фенильную,
3-(4-трифторметил- фенил)фенильную, 4-(4-трифторметилфенил)фенильную, 3-(4- метоксифенил)фенильную,
4-(4-метоксифенил)фенильную, 3-(2,4- диметоксифенил)фенильную, 4-(2,4-диметоксифенил) фенильную,
3- (2,5-диметоксифенил)фенильную, 4-(2,5-диметоксифенил) фенильную, 4-(3-хлорфенил)фенильную,
4-(4-хлорфенил) фенильную, 3-(3,4-метилендиоксифенил)фенильную, 4-(3,4-метилендиоксифенил) фенильную,
3-феноксифенильную, 4-феноксифенильную, 3- фенилтиофенильную, 4-фенилтиофенильную,
3-фенилсульфонилфенильную, 4-фенилсульфонилфенильную, 3-(фенилсульфониламино) фенильную,
4-(фенилсульфониламино)фенильную, 3-(N- метилфенилсульфониламино)фенильную, 4-(N-метилфенилсульфониламино)
фенильную, 3-(2-пиридил)фенильную, 4-(2-пиридил)фенильную, 3-(3-пиридил)фенильную,
4-(3-пиридил)фенильную, 3-(4- пиридил) фенильную 4-(4-пиридил)фенильную, 4-(2-пиридилокси) фенильную,
4-(4-пиридилокси)фенильную, 4-(2-пиридилтио) фенильную, 4-(4-пиридилтио)фенильную,
3-(2-пиридилсульфонил) фенильную, 4-(2-пиридилсульфонил)фенильную, 3-(3- пиридилсульфонил)фенильную,
4-(3-пиридилсульфонил)фенильную, 3- (2-пиридилсульфониламино) фенильную,
3-(N-метил-2-пиридилсульфониламино)фенильную, 4-(2-пиридилсульфониламино) фенильную,
4-(N-метил-2-пиридилсульфониламино)фенильную, 3-(3- пиридилсульфониламино)фенильную,
3-(N-метил-3- пиридилсульфониламино)фенильную, 4-(3-пиридилсульфониламино) фенильную,
4-(N-метил-3-пиридилсульфониламино)фенильную, 2-пиридильную, 3-пиридильную, 4-пиридильную, 3-метил-5- пиридильную,
3-этил-5-пиридильную, 3-фенил-5-пиридильную, 2-метил-5-пиридильную,
2-этил-5-пиридильную, 2-фенил-5-пиридильную, 2-гидрокси-5-пиридильную, 2-метокси-5-пиридильную, 2-этокси-5- пиридильную,
2-изопропокси-5-пиридильную, 2-бензилокси-5- пиридильную,
2-метилтио-5-пиридильную, 2-этилтио-5- пиридильную, 2-изопропилтио- 5-пиридильную, 2-метилсульфонил-5-пиридильную,
2-этилсульфонил-5-пиридильную, 2-изопропилсульфонил-5-пиридильную,
2-бензил-5-пиридильную, 2-фенокси-5-пиридильную, 2-фенилтио-5-пиридильную, 2-фенилсульфонил-5-пиридильную,
2-фенил-сульфониламино-5-пиридильную, 2- (N-метилфенилсульфониламино)-5-пиридильную,
3-метил-6- пиридильную, 3-фенил-6-пиридильную, 2-метил-6-пиридильную, 2-фенил-6- пиридильную, 2-хинолильную,
3-хинолильную, 4-хинолильную, 1-изохинолильную, 3-изохинолильную, 4-изохинолильную и
8-изохинолильную группы,
наиболее предпочтительно фенильную, м-толильную, п-толильную,
3-гидроксифенильную, 4-гидроксифенильную, 4-гидрокси-3,5-диметилфенильную, 3-ацетоксифенильную,
4-ацетоксифенильную, 5-ацетокси-2-гидрокси-3,4,6-триметилфенильную, 3-хлорфенильную, 4-хлорфенильную,
3-бензилфенильную, 4- бензилфенильную, 3-бифенилильную, 4-бифенилильную, 3-феноксифенильную,
4-феноксифенильную, 3-фенилтиофенильную, 4-фенилтиофенильную, 3-фенилсульфонилфенильную,
4-фенилсульфонилфенильную, 3-(фенилсульфониламино)фенильную, 4- (фенилсульфониламино)фенильную,
3-(N-метилфенилсульфонил- амино)фенильную, 4-(N-метилфенилсульфониламино)фенильную,
3-(2- пиридил)фенильную, 4-(2-пиридил)фенильную, 3-(3- пиридил)фенильную, 4-(3-пиридил)фенильную, 3-(4-пиридил)
фенильную, 4-(4-пиридил)фенильную, 4-(2-пиридилокси)фенильную,
4-(4-пиридилокси)фенильную, 4-(2-пиридилтио)фенильную, 4-(4- пиридилтио)фенильную, 3-(2-пиридил-сульфонил)фенильную,
4- (2- пиридилсульфонил)фенильную, 3-(3-пиридилсульфонил)фенильную,
4-(3-пиридилсульфонил)фенильную, 3-(2-пиридилсульфониламино) фенильную, 2-пиридильную, 3-пиридильную, 4-пиридильную,
2-метокси- 5-пиридильную, 2-этокси-5-пиридильную, 2-изопропокси-5- пиридильную,
2-бензилокси-5-пиридильную, 2-метилтио-5-пиридильную, 2-этилтио-5-пиридильную, 2-метилсульфонил-5-пиридильную,
2- этилсульфонил-5-пиридильную, 2-бензил-5-пиридильную, 2-фенил-5- пиридильную,
3-фенил-5-пиридильную, 2-фенил-6-пиридильную, 3- фенил-6- пиридильную, 2-фенокси-5-пиридильную, 2-фенилтио-5-пиридильную,
2-фенилсульфонил-5-пиридильную, 2-фенилсульфониламино- 5-пиридильную и
2-(N-метилфенилсульфониламино)-5- пиридильную группы.
В случае, где Y представляет группу формулы > N-R4 (где R4 представляет атом водорода, алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов (которая имеет такое же значение, как определено выше для R3) или алифатическую ацильную группу с прямой или разветвленной цепью, имеющую от 1 до 8 углеродных атомов (которая включает алканоильные группы, имеющие от 1 до 8 углеродных атомов, и алкеноильные группы, имеющие от 3 до 8 углеродных атомов) или ароматическую ацильную группу), группа формулы >N-R4 включает, например, имино, метилимино, этилимино, пропилимино, изопропилимино, бутилимино, изобутилимино, втор-бутилимино, трет- бутилимино, пентилимино, 1-метилбутилимино, 2-метилбутилимино, 3- метилбутилимино, 1,1-диметилпропилимино, 1, 2-диметилпропилимино, 2,2-диметилпропилимино, 1-этилпропилимино, гексилимино, 1- метилпентилимино, 2-метилпентилимино, 3-метилпентилимино, 4- метилпентилимино, 1,1-диметилбутилимино, 1, 2-диметилбутилимино, 1,3-диметилбутилимино, 2,2-диметилбутилимино, 2,3- диметилбутилимино, 3, 3-диметилбутилимино, 1-этилбутилимино, 1,1,2- триметилпропилимино, 1,2,2-триметилпропилимино, ацетилимино, пропионилимино, бутирилимино, пентаноилимино, гексаноилимино, гептаноилимино, октаноилимино, бензоилимино или п-толуоилимино группу, предпочтительно имино, алкилимино группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, или ацетилимино группу, более предпочтительно имино, метилимино, этилимино или ацетилимино группу.
Производные фенилалкилкарбоновой кислоты формулы (I) могут быть превращены в аддитивную соль кислоты согласно стандартным способам, когда они имеют основную группу. Такая соль включает, например, соли галогенводородной кислоты, такой как фтористоводородная кислота, хлористоводородная кислота, бромистоводородная кислота и иодистоводородная кислота; соли неорганической кислоты, такие как нитрат, перхлорат, сульфат и фосфат; соли низший алкансульфоновой кислоты, такой как метансульфоновая кислота, трифторметансульфоновая кислота и этансульфоновая кислота; соли арилсульфоновой кислоты, такой как бензолсульфоновая кислота и п-толуолсульфоновая кислота; соли аминокислоты, такой как глутаминовая кислота и аспарагиновая кислота; и соли карбоновой кислоты, такой как уксусная кислота, фумаровая кислота, винная кислота, щавелевая кислота, малеиновая кислота, яблочная кислота, янтарная кислота, бензойная кислота, миндальная кислота, аскорбиновая кислота, молочная кислота, глюконовая кислота и лимонная кислота, предпочтительно соли галогенводородной кислоты.
Кроме того, соединения формулы (I) можно превратить в соль металла согласно стандартным способам, когда они имеют карбоксильную группу. Такая соль включает, например, соли щелочного металла, такого как литий, натрий и калий; соли щелочноземельного металла, такого как кальций, барий и магний; соли алюминия и т.п., предпочтительно соли щелочного металла.
Производные фенилалкилкарбоновой кислоты формулы (I) могут быть превращены в фармакологически приемлемый сложный эфир согласно стандартным способам. Фармакологически приемлемые сложные эфиры производных фенилалкилкарбоновой кислоты формулы (I) используют в виде лекарства наряду с фенилалкилкарбоновой кислотой формулы (I) и ими не ограничиваются, поскольку она фармакологически приемлема.
Сложный эфир фенилалкилкарбоновой кислоты формулы (I) данного изобретения включает, например, алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов, аралкильную группу, имеющую от 7 до 19 углеродных атомов, алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 5 углеродных атомов, которая замещена алканоилокси группой с прямой или разветвленной цепью, имеющей от 1 до 6 углеродных атомов, алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 5 углеродных атомов, которая замещена алкилоксикарбонилокси группой с прямой или разветвленной цепью, имеющей от 1 до 6 углеродных атомов, алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 5 углеродных атомов, которая замещена циклоалкилкарбонилокси группой, имеющей от 5 до 7 углеродных атомов, алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 5 углеродных атомов, которая замещена циклоалкилоксикарбонилокси группой, имеющей от 5 до 7 углеродных атомов, алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 5 углеродных атомов, которая замещена арилкарбонилокси группой, имеющей от 6 до 10 углеродных атомов, алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 5 углеродных атомов, которая замещена арилоксикарбонилокси группой, имеющей от 6 до 10 углеродных атомов, и 2-оксо-1,3- диоксолен-4-ил группу, имеющую алкил с прямой или разветвленной цепью, имеющий от 1 до 6 углеродных атомов, в качестве заместителя в 5-положении.
Здесь, алкильная группа с прямой или разветвленной цепью, имеющая от 1 до 4 углеродных атомов, и алкильная группа с прямой или разветвленной цепью, имеющая от 1 до 6 углеродных атомов, включают, например, метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, втор-бутильную, трет-бутильную, пентильную, 1- метилбутильную, 2-метилбутильную, 3-метилбутильную, 1,1- диметилпропильную, 1, 2-диметилпропильную, 2,2-диметилпропильную, 1-этилпропильную, гексильную, 1-метилпентильную, 2- метилпентильную, 3-метилпентильную, 4-метилпентильную, 1,1- диметилбутильную, 1,2-диметилбутильную, 1, 3-диметилбутильную, 2,2- диметилбутильную, 2, 3-диметилбутильную, 3,3-диметилбутильную, 1- этилбутильную, 2-этилбутильную, 1,1,2-триметилпропильную или 1,2,2-триметилпропильную группы, предпочтительно алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, более предпочтительно метильную, этильную, пропильную, изопропильную, бутильную и изобутильную, наиболее предпочтительно метильную и этильную.
Аралкильная группа, имеющая от 7 до 19 углеродных атомов, включает, например, бензильную, фенэтильную, 3-фенилпропильную, 4-фенилбутильную, 1-нафтилметильную, 2-нафтилметильную или дифенилметильную группу, предпочтительно бензильную группу.
Циклоалкильная группа, имеющая от 5 до 7 углеродных атомов, включает, например, циклопентил, циклогексил и циклогептил, предпочтительно циклогексил.
Арильная группа, имеющая от 6 до 10 углеродных атомов, включает, например, фенил или нафтил, предпочтительно фенил.
Примеры предпочтительных сложноэфирных остаточных групп включают, например, метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, трет-бутильную, бензильную, ацетоксиметильную, 1-(ацетокси) этильную, пропионилоксиметильную, 1-(пропионилокси)этильную, бутирилоксиметильную, 1-(бутирилокси) этильную, изобутирилоксиметильную, 1-(изобутирилокси)этильную, валерилоксиметильную, 1-(валерилокси) этильную, изовалерилоксиметильную, 1-(изовалерилокси)этильную, пивалоилоксиметильную, 1-(пивалоилокси)этильную, метоксикарбонилоксиметильную, 1-(метоксикарбонилокси)этильную, этоксикарбонилоксиметильную, 1-(этоксикарбонилокси)этильную, пропоксикарбонилоксиметильную, 1-(пропоксикарбонилокси)этильную, изопропоксикарбонилоксиметильную, 1-(изопропоксикарбонилокси) этильную, бутоксикарбонилоксиметильную, 1-(бутоксикарбонилокси) этильную, изобутоксикарбонилоксиметильную, 1- (изобутоксикарбонилокси)этильную, трет-бутоксикарбонилоксиметильную, 1-(трет-бутоксикарбонилокси)этильную, циклопентанкарбонилоксиметильную, 1-(циклопентанкарбонилокси) этильную, циклогексанкарбонилоксиметильную, 1- (циклогексанкарбонилокси)этильную, циклопентилоксикарбонилоксиметильную, 1-(циклопентилоксикарбонилокси)этильную, циклогексилоксикарбонилоксиметильную, 1-(циклогексилоксикарбонилокси)этильную, бензоилоксиметильную, 1-(бензоилокси)этильную, феноксикарбонилоксиметильную, 1-(феноксикарбонилокси)этильную и 5-метил-2-оксо-1,3-диоксолен-4-ил группы.
Между прочим, соединение формулы (I) имеет различные изомеры. Например, существуют оптические изомеры, получаемые вследствие асимметрии углерода в α- соположении карбоксильной группы. В формуле (I) стереоизомеры, основанные на асимметричном атоме углерода, и эквивалентные и неэквивалентные весовые смеси этих стереоизомеров, все, представляются одной формулой. Поэтому данное изобретение включает все эти изомеры и смеси этих изомеров.
Кроме того, в производных фенилалкилкарбоновой кислоты формулы (I) цис-изомеры и транс-изомеры, основанные на геометрической изомерии, могут существовать в оксимной части. В формуле (I) оба изомера, основанные на геометрической изомерии, и эквивалентная и неэквивалентная весовая смесь этих изомеров, все, представлены одной формулой. Поэтому данное изобретение включает все эти изомеры и смесь этих изомеров.
Кроме того, в случае, где фенилалкилкарбоновая кислота формулы (I) или ее соль образует сольваты (например, гидраты), данное изобретение включает все эти соединения.
Кроме того, данное изобретение включает все соединения, которые метаболизируют in vivo, превращаясь в производные фенилалкилкарбоновой кислоты формулы (I) или ее соли, например, амидные производные, т.е. пролекарства.
Производные фенилалкилкарбоновой кислоты формулы (I) включают предпочтительно
(1) соединение, в
котором R1
представляет атом водорода или алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов,
(2) соединение, в котором R1
представляет атом водорода или
алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 3 углеродных атомов,
(3) соединение, в котором R1 представляет атом водорода или
алкильную группу с прямой или
разветвленной цепью, имеющую один или два углеродных атома,
(4) соединение, в котором R1 представляет алкильную группу, имеющую один или два
углеродных атома,
(5)
соединение, в котором R2 представляет алкиленовую группу с прямой или разветвленной цепью, имеющую от 2 до 5 углеродных атомов,
(6) соединение, в
котором R2
представляет алкиленовую группу с прямой или разветвленной цепью, имеющую от 2 до 4 углеродных атомов,
(7) соединение, в котором R2 представляет этиленовую,
триметиленовую или
метилэтиленовую группу,
(8) соединение, в котором R2 представляет этиленовую группу,
(9) соединение, в котором R3 представляет атом водорода,
алкильную группу
с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, алкокси группу, имеющую один или два углеродных атома, алкилтио группу, имеющую один или два углеродных атома,
или атом
галогена.
(10) соединение, в котором R3 представляет атом водорода,
(11) соединение, в котором X представляет арильную группу, имеющую от 6 до 10
углеродных атомов,
которая может иметь от 1 до 3 заместителей α, упомянутых ниже, или (5-10)-членную гетероароматическую группу (включая моноциклическую или бициклическую), содержащую от 1 до 4
гетероатомов,
выбранных из группы, состоящей из атомов кислорода, азота и серы, которая может иметь от 1 до 3 заместителей α, упомянутых ниже,
заместитель α выбирают из группы,
состоящей из
(i) алкила с прямой или разветвленной цепью, имеющего от 1 до 6 углеродных атомов, (ii) галогенированного алкила с прямой или разветвленной цепью, имеющего от 1 до 4 углеродных атомов,
(iii) гидрокси,
(iv) алканоилокси группы с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, (v) алкокси группы с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов,
(vi)
алкилендиокси группы с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, (vii) аралкилокси группы, имеющей от 7 до 12 углеродных атомов, (viii) алкилтио группы с прямой или
разветвленной цепью, имеющей от 1 до 4 углеродных атомов, (ix) алкилсульфонила с прямой или разветвленной цепью, имеющего от 1 до 4 углеродных атомов, (х) атома фтора, (xi) атома хлора, (xii) атома
брома, (xiii) аралкила, имеющего от 7 до 12 углеродных атомов, (xiv) фенила (фенильная часть может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов,
галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном или
алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов), (xv) фенокси (фенильная часть может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1
до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных
атомов, галогеном или алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов), (xvi) фенилтио (фенильная часть может быть замещена алкилом с прямой или
разветвленной цепью, имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной
цепью, имеющей от 1 до 4 углеродных атомов, галогеном или алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов), (xvii) фенилсульфонила (фенильная часть может
быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси
группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном или алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов), (xviii)
фенилсульфониламино (фенильная часть может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью,
имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном или алкилендиокси группой с прямой или разветвленной цепью,
имеющей от 1 до 4 углеродных атомов, и атом азота амино части может быть замещен алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов), (xix) фурила, (xx) тиенила, (xxi)
оксазолила, (xxii) изоксазолила, (xxiii) тиазолила, (xxiv) пиридила, (xxv) пиридилокси, (xxvi) пиридилтио, (xxvii) пиридилсульфонила, (xxviii) имидазолила (атом азота кольца может быть замещен
алкилом
с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов) и (xxix) пиридилсульфониламино (атом азота кольца может быть замещен алкилом с прямой или разветвленной цепью, имеющим
от 1 до 6
углеродных атомов),
(12) соединение, в котором X представляет фенильную, нафтильную, имидазолильную, оксазолильную, пиридильную, индолильную, хинолильную или изохинолильную группу,
и эти
группы могут иметь от 1 до 3 заместителей α, упомянутых ниже,
заместитель α выбирают из группы, состоящей из (i) алкила с прямой или разветвленной цепью, имеющего от 1 до
6
углеродных атомов, (ii) галогенированного алкила с прямой или разветвленной цепью, имеющего от 1 до 4 углеродных атомов, (iii) гидрокси, (iv) алканоилокси группы с прямой или разветвленной цепью,
имеющей от 1 до 4 углеродных атомов, (v) алкокси группы с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, (vi) метилендиокси, (vii) аралкилокси группы, имеющей от 7 до 12
углеродных атомов, (viii) алкилтио группы с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, (ix) алкилсульфонила с прямой или разветвленной цепью, имеющего от 1 до 4 углеродных
атомов, (х) атома фтора, (xi) атома хлора, (xii) атома брома, (xiii) аралкила, имеющего от 7 до 12 углеродных атомов, (xiv) фенила (фенильная часть может быть замещена метилом, трифторметилом,
метокси,
фтором или метилендиокси), (xv) фенокси (фенильная часть может быть замещена метилом, трифторметилом, метокси, фтором или метилендиокси), (xvi) фенилтио (фенильная часть может быть замещена
метилом,
трифторметилом, метокси, фтором или метилендиокси), (xvii) фенилсульфонила (фенильная часть может быть замещена метилом, трифторметилом, метокси, фтором или метилендиокси), (xviii)
фенилсульфониламино
(фенильная часть может быть замещена метилом, трифторметилом, метокси, фтором или метилендиокси, и атом азота амино части может быть замещен алкилом с прямой или разветвленной
цепью, имеющим от 1 до 6
углеродных атомов), (xix) фурила, (xx) тиенила, (xxi) оксазолила, (xxii) изоксазолила, (xxiii) тиазолила, (xxiv) пиридила, (xxv) пиридилокси, (xxvi) пиридилтио, (xxvii)
пиридилсульфонила, (xxviii)
имидазолила (атом азота кольца может быть замещен алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов) и (xxix) пиридилсульфониламино (атом азота
кольца может быть замещен
алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов),
(13) соединение, в котором X представляет фенильную, нафтильную, имидазолильную,
оксазолильную, пиридильную,
индолильную, хинолильную или изохинолильную группу, и эти группы могут иметь от 1 до 3 заместителей α, упомянутых ниже,
заместитель α выбирают из
группы, состоящей из (i) алкила
с прямой или разветвленной цепью, имеющего от 1 до 6 углеродных атомов, (ii) галогенированного алкила с прямой или разветвленной цепью, имеющего от 1 до 4 углеродных
атомов, (iii) гидрокси, (iv)
алканоилокси группы с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, (v) алкокси группы с прямой или разветвленной цепью, имеющей от 1 до 4
углеродных атомов, (vi) метилендиокси,
(vii) бензилокси, (viii) фенэтилокси, (ix) нафтилметокси, (х) алкилтио группы с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, (xi)
алкилсульфонила с прямой или разветвленной
цепью, имеющего от 1 до 4 углеродных атомов, (xii) атома фтора, (xiii) атома хлора, (xiv) атома брома, (xv) бензила, (xvi) фенила (фенильная часть может
быть замещена метилом, трифторметилом, метокси,
фтором или метилендиокси), (xvii) фенокси (фенильная часть может быть замещена метилом, трифторметилом, метокси, фтором или метилендиокси), (xviii)
фенилтио, (xix) фенилсульфонила, (xx)
фенилсульфониламино, (xxi) N-метилфенилсульфониламино, (xxii) фурила, (xxiii) тиенила, (xxiv) оксазолила, (xxv) изоксазолила, (xxvi) тиазолила, (xxvii) пиридила,
(xxviii) пиридилокси, (xxix)
пиридилтио, (xxx) пиридилсульфонила, (xxxi) пиридилсульфониламино, (xxxii) N-метилпиридилсульфониламино и (xxxiii) имидазолила (атом азота кольца может быть замещен
алкилом с прямой или разветвленной
цепью, имеющим от 1 до 6 углеродных атомов),
(14) соединение, в котором X представляет фенильную, нафтильную, пиридильную, индолильную, хинолильную или
изохинолильную группу, и эти группы
могут иметь один или два заместителя α, упомянутых ниже,
заместитель α выбирают из группы, состоящей из алкила с прямой или разветвленной
цепью, имеющего от 1 до 3 углеродных
атомов, метила, имеющего от 1 до 3 атомов фтора, гидрокси, алканоилокси группы, имеющей один или два атома углерода, алкокси группы с прямой или разветвленной
цепью, имеющей от 1 до 3 углеродных
атомов, метилендиокси, бензилокси, алкилтио группы, имеющей один или два углеродных атома, алкилсульфонила, имеющего один или два углеродных атома, атома фтора,
атома хлора, атома брома, бензила,
фенила, 4-метилфенила, 4-трифторметилфенила, 4-метоксифенила, 4-фторфенила, 3,4-метилендиоксифенила, фенокси, фенилтио, фенилсульфонила, фенилсульфониламино,
N- метилфенилсульфониламино, фурила,
тиенила, оксазолила, тиазолила, имидазолила, N-метилимидазолила, пиридила, пиридилокси, пиридилтио, пиридилсульфонила, пиридилсульфониламино и
N- метилпиридилсульфониламино групп,
(15)
соединение, в котором X представляет фенильную, нафтильную, пиридильную, хинолильную или изохинолильную группу, и эти группы могут иметь один
заместитель α, упомянутый ниже,
заместитель α выбирают из метила, этила, изопропила, трифторметила, гидрокси, ацетокси, метокси, этокси, изопропокси, метилендиокси, бензилокси,
алкилтио группы, имеющей один или два углеродных
атома, алкилсульфонила, имеющего один или два углеродных атома, атома хлора, бензила, фенила, фенокси, фенилтио, фенилсульфонила, фенилсульфониламино,
N-метилфенилсульфониламино, пиридила, пиридилокси,
пиридилтио, пиридилсульфонила, пиридилсульфониламино и N-метилпиридилсульфониламино групп,
(16) соединение, в котором X представляет
фенильную группу, которая может иметь один заместитель
α, упомянутый ниже,
заместитель α выбирают из группы, состоящей из метила, гидрокси и ацетокси, атома хлора, бензила,
фенила, фенокси, фенилтио, фенилсульфонила,
фенилсульфониламино, N-метилфенилсульфониламино, пиридила, пиридилокси, пиридилтио и пиридилсульфонильной групп,
или
X представляет
пиридильную группу, которая может иметь один
заместитель α, упомянутый ниже,
здесь, заместитель α выбирают из группы, состоящей из метокси, этокси, изопропокси и бензилокси
групп, алкилтио группы, имеющей один или два
углеродных атома, алкилсульфонила, имеющего один или два углеродных атома, бензила, фенила, фенокси, фенилтио, фенилсульфонила, фенилсульфониламино и
N-метилфенилсульфониламино групп,
(17)
соединение, в котором X представляет фенильную группу, которая может иметь один заместитель α, упомянутый ниже,
заместитель α
выбирают из группы, состоящей из гидрокси, атома
хлора, бензила, фенила, фенокси, фенилтио, пиридила, пиридилокси и пиридилтио групп,
(18) соединение, в котором Y представляет атом кислорода
или серы, или группу формулы >N-R4 (где R4 представляет атом водорода, алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 3 углеродных атомов, или
алканоильную группу с прямой или разветвленной цепью,
имеющую от 2 до 5 углеродных атомов),
производные фенилалкилкарбоновой кислоты, их фармакологически приемлемые соли или их
фармакологически приемлемые сложные эфиры.
(19)
соединение, в котором Y представляет атом кислорода,
(20) соединение, в котором Z представляет одинарную связь или алкиленовую
группу с прямой или разветвленной цепью, имеющую от 1 до 4
углеродных атомов,
(21) соединение, в котором Z представляет алкиленовую группу с прямой или разветвленной цепью, имеющую от 1 до 4
углеродных атомов,
(22) соединение, в котором Z
представляет алкиленовую группу с прямой или разветвленной цепью, имеющую один или два углеродных атома,
(23) соединение, в котором Z
представляет метиленовую группу,
(24) соединение,
в котором W представляет (i) алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов, (ii) алкокси группу с
прямой или разветвленной цепью, имеющую от 1 до 4 углеродных
атомов, (iii) алкилтио группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (iv) моноалкиламино группу с прямой
или разветвленной цепью, имеющую от 1 до 4 углеродных атомов,
(v) диалкиламино группу с прямой или разветвленной цепью, в которой алкильные группы являются одинаковыми или отличными друг от друга и
каждая имеет от 1 до 4 углеродных атомов, (vi)
N-алкил- N-ариламино группу, в которой алкильная часть имеет алкил с прямой или разветвленной цепью, имеющий от 1 до 4 углеродных атомов, и арильная
часть имеет от 6 до 10 углеродных, атомов, которая
может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, (vii) арилокси группу, имеющую от 6 до 10 углеродных атомов, которая
может иметь от 1 до 3 заместителей α,
упомянутых ниже, в арильной части, (viii) арилтио группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α,
упомянутых ниже, в арильной части, (ix) ариламино
группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, (х) аралкильную
группу, имеющую от 7 до 12 углеродных атомов,
которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, (xi) 1-пирролильную группу, (xii) 1-пирролидинильную группу,
(xiii) 1-имидазолильную группу, (xiv) пиперидино
группу или (xv) морфолино группу,
здесь, заместитель α выбирают из группы, состоящей из (1) алкила с прямой или разветвленной цепью,
имеющего от 1 до 6 углеродных атомов, (ii)
галогенированного алкила с прямой или разветвленной цепью, имеющего от 1 до 4 углеродных атомов, (iii) гидрокси, (iv) алканоилокси группы с прямой или
разветвленной цепью, имеющей от 1 до 4 углеродных
атомов, (v) алкокси группы с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, (vi) алкилендиокси группы с прямой или
разветвленной цепью, имеющей от 1 до 4 углеродных атомов, (vii)
аралкилокси группы, имеющей от 7 до 12 углеродных атомов, (viii) алкилтио группы с прямой или разветвленной цепью, имеющей от 1 до 4
углеродных атомов, (ix) алкилсульфонила с прямой или разветвленной
цепью, имеющего от 1 до 4 углеродных атомов, (х) атома фтора, (xi) атома хлора, (xii) атома брома, (xiii) аралкила, имеющего от 7 до
12 углеродных атомов, (xiv) фенила (фенил может быть замещен
алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью,
имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой
или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном или алкилендиокси группой с прямой или разветвленной цепью,
имеющей от 1 до 4 углеродных атомов), (xv) фенокси (фенильная часть
может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с
прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов,
алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном или алкилендиокси группой с
прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов), (xvi)
фенилтио (фенильная часть может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов,
галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до
4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном или
алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4
углеродных атомов), (xvii) фенилсульфонила (фенильная часть может быть замещена алкилом с прямой или разветвленной цепью,
имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или
разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1
до 4 углеродных атомов, галогеном или алкилендиокси группой с прямой или
разветвленной цепью, имеющей от 1 до 4 углеродных атомов), (xviii) фенилсульфониламино (фенильная часть может быть замещена
алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных
атомов, галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой
или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном
или алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, и атом азота амино части может
быть замещен алкилом с прямой или разветвленной цепью, имеющим от 1 до 6
углеродных атомов), (xix) фурила, (xx) тиенила, (xxi) оксазолила, (xxii) изоксазолила, (xxiii) тиазолила, (xxiv) пиридила,
(xxv) пиридилокси, (xxvi) пиридилтио, (xxvii) пиридилсульфонила, (xxviii)
имидазолила (атом азота кольца может быть замещен алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных
атомов) и (xxix) пиридилсульфониламино (атом азота амино части может быть
замещен алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов),
(25) соединение, в котором W
представляет (i) алкильную группу с прямой или разветвленной цепью,
имеющую от 1 до 6 углеродных атомов, (ii) алкокси группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов,
(iii) алкилтио группу с прямой или разветвленной цепью, имеющую от 1 до
4 углеродных атомов, (iv) моноалкиламино группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (v)
диалкиламино группу с прямой или разветвленной цепью, в которой алкильные
группы являются одинаковыми или отличными друг от друга и каждая имеет от 1 до 4 углеродных атомов, (vi) N-алкил-N- ариламино
группу, в которой алкильная часть имеет алкил с прямой или разветвленной
цепью, имеющий от 1 до 4 углеродных атомов, и арильная часть имеет от 6 до 10 углеродных атомов, которая может иметь от 1 до 3
заместителей α, упомянутых ниже, в арильной части, (vii) арилокси
группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной
части, (viii) арилтио группу, имеющую от 6 до 10 углеродных атомов,
которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, (ix) ариламино группу, имеющую от 6 до 10
углеродных атомов, которая может иметь от 1 до 3 заместителей α,
упомянутых ниже, в арильной части, (х) аралкильную группу, имеющую от 7 до 12 углеродных атомов, которая может иметь от 1 до 3
заместителей α, упомянутых ниже, в арильной части, или (xi)
1-пирролильную группу,
заместитель α выбирают из гидрокси, атома хлора, бензила, фенила, фенокси, фенилтио, пиридила,
пиридилокси и пиридилтио групп,
(26) соединение, в
котором W представляет (i) алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (ii) алкокси группу с
прямой или разветвленной цепью, имеющую от 1 до 4 углеродных
атомов, (iii) алкилтио группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (iv) моноалкиламино группу с прямой
или разветвленной цепью, имеющую от 1 до 4 углеродных атомов,
(v) диалкиламино группу с прямой или разветвленной цепью, в которой алкильные группы являются одинаковыми или отличными друг от друга и
каждая имеет от 1 до 4 углеродных атомов, (vi)
N- алкил-N-ариламино группу, в которой алкильная часть имеет алкил с прямой или разветвленной цепью, имеющий от 1 до 4 углеродных атомов, и арильная
часть имеет от 6 до 10 углеродных атомов, (vii)
фенокси группу, (viii) фенилтио группу, (ix) фениламино группу, (х) аралкильную группу, имеющую от 7 до 10 углеродных атомов, (xi) 1-пирролильную
группу, (xii) 1-пирролидинильную группу или (хiii)
1-имидазолильную группу,
(27) соединение, в котором W представляет (i) пропильную или бутильную группу, (ii) алкокси группу с прямой или
разветвленной цепью, имеющую от 1 до 3 углеродных
атомов, (iii) алкилтио группу с прямой или разветвленной цепью, имеющую от 1 до 3 углеродных атомов, (iv) моноалкиламино группу с прямой или
разветвленной цепью, имеющую от 1 до 3 углеродных атомов,
(v) диэтиламино группу, (vi) N-фенил-N-этиламино группу, (vii) фенокси группу, (viii) фенилтио группу, (ix) фениламино группу, (х)
3-фенилпропильную группу, (xi) 4-фенилбутильную группу или (xii)
1-пирролильную группу,
(28) соединение, в котором W представляет бутильную, этокси, метилтио, этиламино, диэтиламино,
N-фенил-N-этиламино, фенокси, фенилтио, фениламино, 3-фенилпропильную или
1-пирролильную группу,
(29) соединение, в котором W представляет бутильную, этокси, метилтио, этиламино, фенокси,
фенилтио, фениламино или 3- фенилпропильную группу.
Кроме того, R1 выбирают из (1)-(4), R2 выбирают из (5)-(8), R2 выбирают из (9) и (10), X выбирают из (11)-(17), Y выбирают из (18) и (19), Z выбирают из (20)-(23) и W выбирают из (24)-(29), и соединения, полученные их комбинированием, также предпочтительны.
Производные
фенилалкилкарбоновой кислоты формулы (I) включают, например,
(30)
соединение, в котором R1 представляет атом водорода или алкильную группу с прямой или разветвленной цепью,
имеющую от 1 до 4 углеродных атомов; R2 представляет алкиленовую группу
с прямой или разветвленной цепью, имеющую от 2 до 5 углеродных атомов;
R3 представляет атом
водорода, алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 4
углеродных атомов, алкокси группу, имеющую один или два углеродных атома, алкилтио группу, имеющую один или два
углеродных атома, или атом галогена;
Z представляет одинарную связь или
алкиленовую группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов;
W представляет (i)
алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных
атомов, (ii) алкокси группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (iii) алкилтио
группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (iv)
моноалкиламино группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (v) диалкиламино группу
с прямой или разветвленной цепью, в которой алкильные группы являются одинаковыми
или отличными друг от друга и каждая имеет от 1 до 4 углеродных атомов, (vi) N-алкил-N-ариламино группу, в которой
алкильная часть имеет алкил с прямой или разветвленной цепью, имеющий от 1 до 4
углеродных атомов, и арильная часть имеет от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей
α, упомянутых ниже, в арильной части, (vii) арилокси группу, имеющую от 6 до
10 углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части,
(viii) арилтио группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3
заместителей α, упомянутых ниже, в арильной части, (ix) ариламино группу, имеющую от 6 до 10
углеродных атомов, которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной
части, (х) аралкильную группу, имеющую от 7 до 12 углеродных атомов, которая может иметь от 1 до 3
заместителей α, упомянутых ниже, в арильной части, (xi) 1-пирролильную группу, (xii)
1- пирролидинильную группу, (xiii) 1-имидазолильную группу, (xiv) пиперидино группу или (xv) морфолино
группу;
X представляет арильную группу, имеющую от 6 до 10 углеродных атомов, которая
может иметь от 1 до 3 заместителей α, упомянутых ниже, или (5-10)-членную гетероароматическую
группу (включая моноциклическую или бициклическую), имеющую от 1 до 4 гетероатомов, выбранных из
группы, состоящей из атомов кислорода, азота и серы, которая может иметь от 1 до 3 заместителей
α, упомянутых ниже;
здесь заместитель α, упомянутый ниже, выбирают из группы,
состоящей из (i) алкила с прямой или разветвленной цепью, имеющего от 1 до 6 углеродных атомов,
(ii) галогенированного алкила с прямой или разветвленной цепью, имеющего от 1 до 4 углеродных атомов,
(iii) гидрокси, (iv) алканоилокси группы с прямой или разветвленной цепью, имеющей от 1 до 4
углеродных атомов, (v) алкокси группы с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов,
(vi) алкилендиокси группы с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных
атомов, (vii) аралкилокси группы, имеющей от 7 до 12 углеродных атомов, (vili) алкилтио группы с прямой или
разветвленной цепью, имеющей от 1 до 4 углеродных атомов, (ix) алкилсульфонила с прямой или
разветвленной цепью, имеющего от 1 до 4 углеродных атомов, (х) атома фтора, (xi) атома хлора, (xii) атома
брома, (xiii) аралкила, имеющего от 7 до 12 углеродных атомов, (xiv) фенила (фенильная часть
может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов,
галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов,
алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном или
алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов), (xv)
фенокси (фенильная часть может быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1
до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до
4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных
атомов, галогеном или алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4
углеродных атомов), (xvi) фенилтио (фенильная часть может быть замещена алкилом с прямой или
разветвленной цепью, имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или
разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной
цепью, имеющей от 1 до 4 углеродных атомов, галогеном или алкилендиокси группой с прямой или
разветвленной цепью, имеющей от 1 до 4 углеродных атомов), (xvii) фенилсульфонила (фенильная часть может
быть замещена алкилом с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов,
галогенированным алкилом с прямой или разветвленной цепью, имеющим от 1 до 4 углеродных атомов, алкокси
группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, галогеном или
алкилендиокси группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов), (xviii)
фенилсульфониламино (фенильная часть может быть замещена алкилом с прямой или разветвленной цепью,
имеющим от 1 до 6 углеродных атомов, галогенированным алкилом с прямой или разветвленной цепью,
имеющим от 1 до 4 углеродных атомов, алкокси группой с прямой или разветвленной цепью, имеющей от 1 до
4 углеродных атомов, галогеном или алкилендиокси группой с прямой или разветвленной цепью,
имеющей от 1 до 4 углеродных атомов, и атом азота амино части может быть замещен алкилом с прямой или
разветвленной цепью, имеющим от 1 до 6 углеродных атомов), (xix) фурила, (xx) тиенила, (xxi)
оксазолила, (xxii) изоксазолила, (xxiii) тиазолила, (xxiv) пиридила, (xxv) пиридилокси, (xxvi) пиридилтио,
(xxvii) пиридилсульфонила, (xxviii) имидазолила (атом азота кольца может быть замещен алкилом
с прямой или разветвленной цепью, имеющим от 1 до 6 углеродных атомов) и (xxix) пиридилсульфониламино
(атом азота амино части может быть замещен алкилом с прямой или разветвленной цепью, имеющим от 1
до 6 углеродных атомов); и
Y представляет атом кислорода или серы или группу формулы >
N-R4 (где R4 представляет атом водорода, алкильную группу с прямой или
разветвленной цепью, имеющую от 1 до 3 углеродных атомов, или алканоильную группу с прямой или
разветвленной цепью, имеющую от 2 до 5 углеродных атомов);
(31) соединение, в котором R1 представляет алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 4
углеродных атомов;
R2 представляет алкиленовую группу с прямой или разветвленной цепью,
имеющую от 2 до 5 углеродных атомов;
R3 представляет атом водорода;
Z представляет алкиленовую группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов;
W представляет (i) алкильную группу с прямой или разветвленной цепью, имеющую
от 1 до 6 углеродных атомов, (ii) алкокси группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных
атомов, (iii) алкилтио группу с прямой или разветвленной цепью, имеющую от 1 до 4
углеродных атомов, (iv) моноалкиламино группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов,
(v) диалкиламино группу с прямой или разветвленной цепью, в которой алкильные
группы являются одинаковыми или отличными друг от друга и каждая имеет от 1 до 4 углеродных атомов, (vi)
N-алкил-N-ариламино группу, в которой алкильная часть имеет алкил с прямой или разветвленной
цепью, имеющий от 1 до 4 углеродных атомов, и арильная часть имеет от 6 до 10 углеродных атомов, которая
может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, (vii) арилокси
группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α,
упомянутых ниже, в арильной части, (viii) арилтио группу, имеющую от 6 до 10 углеродных атомов,
которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, (ix) ариламино
группу, имеющую от 6 до 10 углеродных атомов, которая может иметь от 1 до 3 заместителей α
, упомянутых ниже, в арильной части, (х) аралкильную группу, имеющую от 7 до 12 углеродных атомов,
которая может иметь от 1 до 3 заместителей α, упомянутых ниже, в арильной части, (xi)
1-пирролильную группу;
X представляет фенильную группу, которая может иметь один заместитель
α, упомянутый ниже;
здесь заместитель α выбирают из группы, состоящей из
гидрокси, атома хлора, бензильной, фенильной, фенокси, фенилтио, пиридильной, пиридилокси и пиридилтио
групп; и
Y представляет атом кислорода;
(32) соединение, в котором R1 представляет алкильную группу, имеющую один или два углеродных атома;
R2
представляет этиленовую группу;
R3 представляет атом водорода;
Z
представляет метиленовую группу;
W представляет (i) пропильную или бутильную группу, (ii) алкокси
группу с прямой или разветвленной цепью, имеющую от 1 до 3 углеродных атомов, (iii) алкилтио
группу с прямой или разветвленной цепью, имеющую от 1 до 3 углеродных атомов, (iv) моноалкиламино группу с
прямой или разветвленной цепью, имеющую от 1 до 3 углеродных атомов, (v) диэтиламино группу,
(vi) N-фенил-N- этиламино группу, (vii) фенокси группу, (viii) фенилтио группу, (ix) фениламино группу, (х)
3-фенилпропильную группу, (xi) 4- фенилбутильную группу или (xii) 1-пирролильную группу;
X представляет фенильную группу, которая может иметь один заместитель α, упомянутый ниже;
здесь заместитель α выбирают из группы, состоящей из метила, гидрокси, ацетокси,
атома хлора, бензила, фенила, фенокси, фенилтио, фенилсульфонила, фенилсульфониламино,
N- метилфенилсульфониламино, пиридила, пиридилокси, пиридилтио и пиридилсульфонила;
или
X
представляет пиридильную группу, которая может иметь один заместитель α, упомянутый
ниже;
здесь заместитель α выбирают из группы, состоящей из метокси, этокси, изопропокси,
бензилокси, алкилтио группы, имеющей один или два углеродных атома, алкилсульфонила, имеющего
один или два углеродных атома, бензила, фенила, фенокси, фенилтио, фенилсульфонила, фенилсульфониламино и
N- метилфенилсульфониламино групп; и
Y представляет атом кислорода;
(33)
соединение, в котором R1 представляет алкильную группу, имеющую один или два углеродных атома;
R2 представляет этиленовую группу;
R3 представляет
атом водорода;
Z представляет метиленовую группу;
W представляет (i) пропильную или бутильную
группу, (ii) алкокси группу с прямой или разветвленной цепью, имеющую от 1 до 3
углеродных атомов, (iii) алкилтио группу с прямой или разветвленной цепью, имеющую от 1 до 3 углеродных атомов, (iv)
моноалкиламино группу с прямой или разветвленной цепью, имеющую от 1 до 3
углеродных атомов, (v) диэтиламино группу, (vi) N-фенил-N-этиламино группу, (vii) фенокси группу, (viii) фенилтио группу,
(ix) фениламино группу, (х) 3-фенилпропильную группу, (xi) 4-фенилбутильную
группу или (xii) 1-пирролильную группу;
X представляет фенильную группу, которая может иметь один заместитель
α, упомянутый ниже;
здесь заместитель α выбирают из группы,
состоящей из гидрокси, атома хлора, бензила, фенила, фенокси, фенилтио, пиридила, пиридилокси и пиридилтио групп;
и
Y представляет атом кислорода;
(34) соединение, в котором R1 представляет алкильную группу, имеющую один или два углеродных атома,
R2 представляет
этиленовую группу;
R3 представляет атом водорода;
Z
представляет метиленовую группу;
W представляет бутильную, этокси, метилтио, этиламино, диэтиламино,
N-фенил-N-этиламино, фенокси, фенилтио, фениламино, 3-фенилпропильную или 1-пирролильную
группу;
X представляет фенильную группу, которая может иметь один заместитель α, упомянутый
ниже;
заместитель α выбирают из группы, состоящей из гидрокси, атома хлора,
бензила, фенила, фенокси, фенилтио, пиридила, пиридилокси и пиридилтио групп; и
Y представляет
атом кислорода; и
(35) соединение, в котором R1 представляет алкильную
группу, имеющую один или два углеродных атома;
R2 представляет этиленовую группу;
R3 представляет атом водорода;
Z представляет метиленовую группу;
W представляет бутильную, этокси, метилтио, этиламино, фенокси, фенилтио, фениламино или
3-фенилпропильную группу;
X представляет фенильную группу, которая может иметь один заместитель
α, упомянутый ниже.
здесь заместитель α выбирают из группы,
состоящей из гидрокси, атома хлора, бензила, фенила, фенокси, фенилтио, пиридила, пиридилокси и пиридилтио
групп; и
Y представляет атом кислорода.
Примеры производных фенилалкилкарбоновой кислоты формулы (I), их фармакологически приемлемой соли или их фармакологически приемлемого сложного эфира включают соединения, иллюстрируемые ниже.
В Таблицах 1-68 использованы следующие аббревиатуры.
Ac: ацетил, Bu: бутил, tBu: трет-бутил, Bimid: бензимидазолил, Boxa: бензоксазолил, Bthiz: бензотиазолил, Bz: бензил, Et: этил. Fur: фурил. Hex: гексил, Imid: имидазолил, Ind: индолил, Isox: изоксазолил, Mdo: метилендиокси. Me: метил. Mor: морфолино, Np: нафтил, Oxa: оксазолил. Pen: пентил, Ph: фенил, Pip: пиперидил, Pr: пропил, iPr: изопропил. Pym: пиримидинил, Pyr: пиридил, Pyrd: пирролидинил, Pyrr: пирролил, Pyza: пиразолил, Quin: хинолил, iQuin: изохинолил, Thi: тиенил, Thiz: тиазолил.
Соединения в Таблицах 1-55 и таблицах 66-68 имеют нижеследующую формулу (Ia), и соединения в таблицах 56-65 имеют нижеследующую формулу (Ib).
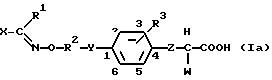
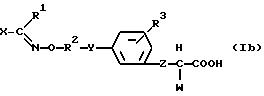
Производное фенилалкилкарбоновой кислоты формулы (1) данного изобретения, его фармакологически приемлемая соль или его фармакологически приемлемый сложный эфир легко получают согласно способу A (см. в конце описания).
Стадия A1
Стадия
A1 заключается в получении соединения формулы (IV), и соединение получают путем взаимодействия
соединения формулы (II) с соединением формулы (III).
В случае, где U представляет гидроксильную группу, реакцию проводят согласно стандартной реакции Mitsunobu [О. Mitsunobu, Synthesis, 1 (1981)].
Реакцию обычно проводят путем контактирования исходных соединений с азосоединениями и фосфинами в растворителе. Азосоединения, используемые в реакции, представляют C1-C4 алкил азодикарбоксилаты, такие как диэтилазодикарбоксилат, и азодикарбоксамиды, такие как 1,1'-(азодикарбонил)дипиперидин. В качестве фосфинов используют триарилфосфин, такой как трифенилфосфин, и три(C1-C4 алкил)фосфин, такой как трибутилфосфин.
Реакцию обычно проводят предпочтительно в растворителе. Растворитель особенно не ограничен, поскольку он не оказывает вредного воздействия на данную реакцию. Примеры подходящих растворителей включают углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; галогенированные углеводороды, такие как хлороформ, метиленхлорид, четыреххлористый углерод и 1, 2-дихлорэтан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; и их смеси, предпочтительны углеводороды, галогенированные углеводороды и простые эфиры. Температура реакции находится в диапазоне от 10 до 100oC, предпочтительно от 20 до 80oC.
Хотя время реакции варьируется в зависимости от реакционного реагента, температуры реакции и растворителя, обычно оно находится в интервале от одного часа до 3 дней, предпочтительно от 5 часов до 2 дней.
В случае, где U представляет атом галогена или группу формулы: -O-SO2-R5 (где R5 имеет такое же значение, как определено выше), реакцию проводят в присутствии основания в инертном растворителе.
Используемое основание включает, например, карбонаты щелочного металла, такие как карбонат натрия и карбонат калия; гидриды щелочного металла, такие как гидрид натрия, гидрид калия и гидрид лития; алкоксиды щелочного металла, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия и метоксид лития; литийалкилы, такие как бутиллитий и метиллитий; амиды лития, такие как диэтиламиды лития, диизопропиламид лития- и бис(триметилсилил)амид лития; гидрокарбонаты щелочного металла, такие как гидрокарбонат натрия и гидрокарбонат калия; третичные органические амины, такие как 1,5-диазабицикло [4.3.0] нон-5-ен, 1, 8-диазабицикло[5.4.0] ундец-7-ен и N,N- диизопропилэтиламин, предпочтительны карбонаты щелочного металла, гидриды щелочного металла и алкоксиды щелочного металла.
Инертный растворитель, используемый в реакции, особенно не ограничен, поскольку он не оказывает вредного воздействия на данную реакцию. Примеры подходящих растворителей включают углеводороды, такие как бензол и толуол; простые эфиры, такие как тетрагидрофуран и диоксан; спирты, такие как метанол, этанол и трет-бутанол; амиды, такие как диметилформамид, диметилацетамид и N-метилпирролидинон; кетоны, такие как ацетон и 2-бутанон; нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид, и их смесь, предпочтительны простые эфиры, амиды, кетоны и сульфоксиды.
В случае, где данную реакцию проводят в присутствии межфазного катализатора, такого как бензилтриэтиламмоний иодид и тетрабутиламмоний иодид, гидроксиды щелочного металла, такие как гидроксид натрия и гидроксид калия, используют в качестве основания. Реакцию проводят в растворителе, представляющем двухслойную систему: вола и галогенированные углеводороды, такие как метиленхлорид и хлороформ.
Температура реакции находится в диапазоне от -10 до 120oC, предпочтительно от 10 до 100oC.
Хотя время реакции варьируется в зависимости от используемого реагента, температуры реакции и т.д., оно составляет от 30 минут до 48 часов, предпочтительно от 1 до 16 часов.
Далее, в случае, где W1 представляет первичную или вторичную аминогруппу, которую защищают с помощью обычной защитной группы, такой как трет-бутоксикарбонил, после реакции, снятие защиты может быть осуществлено согласно известному способу, например, путем взаимодействия соединения формулы (IV) с кислотой, такой как хлористоводородная кислота, при комнатной температуре в течение от 30 минут до 2 часов.
Стадия A2
Стадия A2
заключается в получении производного фенилалкилкарбоновой кислоты формулы (I), и
соединение получают путем удаления сложноэфирного остатка соединения формулы (IV).
Данную стадию проводят посредством гидролиза соединения формулы (IV) основанием в растворителе.
В данной реакции растворитель особенно не ограничен, поскольку он не оказывает вредного воздействия на реакцию, и предпочтительно включает, например, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол и этанол; воду; и их смесь.
Основание, используемое в реакции, включает, например, гидроксиды щелочного металла, такие как гидроксид лития, гидроксид натрия и гидроксид калия, и карбонаты щелочного металла, такие как карбонат лития, карбонат натрия и карбонат калия, предпочтительно гидроксиды щелочного металла.
Хотя температура реакции варьируется в зависимости от растворителя и используемого основания, она составляет от 0 до 100oC, предпочтительно от 10 до 80oC.
Хотя время реакции варьируется в зависимости от растворителя, используемого основания и температуры реакции, оно составляет обычно от 10 минут до 24 часов, предпочтительно от 30 минут до 16 часов.
Далее, в случае, где сложноэфирный остаток представляет трет-бутильную, дифенилметильную или п-метоксибензильную группу, данную стадию также проводят посредством взаимодействия соединения формулы (IV) с органическими кислотами, такими как муравьиная кислота, уксусная кислота, трифторуксусная кислота, метансульфокислота, бензолсульфокислота, п-толуолсульфокислота и трифторметансульфокислота, и минеральными кислотами, такими как хлористоводородная кислота и серная кислота, в присутствии или в отсутствие растворителя. Данную стадию проводят предпочтительно путем взаимодействия с трифторуксусной кислотой или хлористоводородной кислотой.
В данной реакции, в случае, где используют растворитель, используемый растворитель особенно не ограничен, поскольку он не оказывает вредного воздействия на реакцию. Примеры подходящих растворителей включают углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; галогенированные углеводороды, такие как хлороформ, метиленхлорид и четыреххлористый углерод; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол и этанол; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; сложные эфиры, такие как метилацетат и этилацетат; воду; их смесь, предпочтительно простые эфиры.
Хотя температура реакции варьируется в зависимости от используемой кислоты, она находится в диапазоне от -10 до 120oC, предпочтительно от 0 до 100oC.
Хотя время реакции варьируется в зависимости от кислоты и температуры реакции, оно обычно составляет от 10 минут до 24 часов, предпочтительно от 30 минут до 16 часов.
Далее, в случае, где сложноэфирный остаток представляет аралкильную группу, такую как бензильная и дифенилметильная группы, данную стадию также проводят посредством каталитического гидрирования соединения формулы (IV). Используемый катализатор включает, например, палладий на углероде, палладиевую чернь, оксид платины и платиновую чернь, предпочтительно палладий, на углероде.
Реакцию обычно проводят предпочтительно в присутствии растворителя. Используемый растворитель особенно не ограничен, поскольку он не оказывает вредного воздействия на реакцию. Примеры подходящих растворителей включают углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; галогенированные углеводороды, такие как хлороформ, метиленхлорид и четыреххлористый углерод; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол, этанол и изопропанол; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; карбоновые кислоты, такие как муравьиная кислота и уксусная кислота; и их смесь, предпочтительно спирты.
Температура реакции находится в диапазоне от 10 до 140oC, предпочтительно от 20 до 120oC.
Хотя время реакции варьируется в зависимости от реакционного реагента, температуры реакции и растворителя, оно обычно составляет от 30 минут до 3 дней, предпочтительно от одного часа до одного дня.
Соединение формулы (IV), используемое в способе A, можно также получить
согласно способу B (см. в конце описания)
Стадия B1 в способе B заключается в получении соединения формулы (IV). Соединение получают посредством взаимодействия соединения формулы (V) с
соединением формулы (VI).
Реакцию проводят аналогично способу, описанному в стадии A1 способа A, который был уже детально описан.
Производное фенилалкилкарбоновой кислоты формулы (I) и соединение формулы (IV) можно также получить согласно способу C (см. в конце описания).
Аминозащитная группа представляет защитную группу, известную в органической синтетической химии. Примеры таких защитных групп, включают C7-C14 аралкильную группу, такую как бензил, дифенилметил и тритил, C1-C4 алифатическую ацильную группу, которая может быть замещена фтором, такую как формил и трифторацетил; (C1-C4 алкокси) карбонильную группу, такую как трет-бутоксикарбонил; и бензилоксикарбонильную группу, которая может быть замещена метокси или нитро, такую как бензилоксикарбонил, п-метоксибензилоксикарбонил и п-нитробензилоксикарбонил. В случае, где R6 и R7, взятые вместе, представляют аминозащитную группу, защитные группы включают, например, фталоильные группы. Предпочтительны бензильная, тритильная, трет-бутоксикарбонильная, бензилоксикарбонильная и фталоильная группы.
Стадия C1
Стадия C1 заключается в получении соединения формулы (VIII) и ее проводят посредством взаимодействия соединения формулы
(VII) с соединением формулы (III).
Данную стадию проводят аналогичным способом, описанным в cтадии A1 cпособа A.
Стадия C2
Стадия C2 заключается в получении
соединения формулы (IX) и ее проводят посредством удаления защитной группы
R7 соединения формулы (VIII).
Когда защитная группа R7 представляет группу, которая может быть удалена каталитическим восстановлением, такую как аралкильная и аралкилоксикарбонильная группы, или группу, которая может быть удалена с помощью кислоты, такую как тритильная и трет-бутоксикарбонильная группы, реакцию снятия защиты 4 проводят аналогичным способом, описанным в cтадии A2 способа A.
В случае, где защитная группа R7 представляет алифатическую ацильную группу, такую как формил и трифторацетил, ее удаляют в основных условиях.
Основание, используемое здесь, включает гидроксиды щелочного металла, такие как гидроксид натрия, гидроксид калия и гидроксид лития; карбонаты щелочного металла, такие как карбонат натрия и карбонат калия, предпочтительно гидроксиды щелочного металла.
Данную реакцию предпочтительно проводят в инертном растворителе, например, в спиртах, таких как метанол и этанол; воде; в простых эфирах, таких как тетрагидрофуран и диоксан; или в их смеси, более предпочтительно в спиртах.
Температура реакции находится в диапазоне от 0 до 100oC, предпочтительно от 10 до 80oC.
Хотя время реакции варьируется в зависимости от реагента, температуры реакции и растворителя, оно обычно составляет от 30 минут до 24 часов, предпочтительно от 1 до 16 часов.
В случае, где R6 и R7, вместе взятые, представляют аминозащитную группу, защитная группа включает фталоильную группу, и ее можно удалить обработкой гидразинами или первичными аминами.
Гидразины, используемые здесь, включают, например, гидразин, метилгидразин и фенилгидразин, предпочтительно гидразин. Кроме того, первичные амины, которые могут быть использованы, включают метиламин, этиламин, пропиламин, бутиламин, изобутиламин, пентиламин и гексиламин, предпочтительно пропиламин и бутиламин.
Данную реакцию проводят в инертном растворителе, например, в спиртах, таких как метанол и этанол; в простых эфирах, таких как тетрагидрофуран и диоксан; в галогенированных углеводородах, таких как метиленхлорид и хлороформ; или в их смеси, предпочтительны спирты.
Температура реакции находится в диапазоне от 0 до 100oC, предпочтительно от 10 до 80oC.
Хотя время реакции варьируется в зависимости от реакционного реагента, температуры реакции и растворителя, оно обычно составляет от 30 минут до 24 часов, предпочтительно от одного часа до 16 часов.
Стадия C3
Стадия C3 заключается в
получении соединения формулы (IV), и ее выполняют путем реакции
дегидратации-конденсации аминосоединения формулы (IX) с карбонильным соединением формулы (X)
Данную стадию проводят в инертном
растворителе. Используемый здесь инертный растворитель особенно
не ограничен, поскольку он не оказывает вредного влияния на реакцию. Примеры подходящих растворителей включают углеводороды, такие как
гексан, бензол и ксилол; галогенированные углеводороды, такие
как метиленхлорид, хлороформ и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран и диоксан; спирты, такие как метанол и этанол;
сложные эфиры, такие как этилацетат и бутилацетат; и амиды,
такие как диметилформамид и диметилацетамид, предпочтительно углеводороды, галогенированные углеводороды, простые эфиры и спирты.
Температура реакции находится в интервале от 0 до 120oC, предпочтительно от 10 до 100oC.
Хотя время реакции варьируется в зависимости от реакционного реагента, температуры реакции и растворителя, оно обычно составляет от 30 минут до 24 часов, предпочтительно от 1 часа до 16 часов.
Стадия C4
Стадия C4 заключается в
получении соединения формулы (I). В случае, где W1
представляет амино группу, которую защищают с помощью обычной защитной группы, такой как трет- бутоксикарбонил, при необходимости, после
удаления аминозащитной группы, соединение формулы (IV)
превращают в соединение формулы (I), удаляя сложноэфирную остаточную группу. В реакции удаление аминозащитной группы выполняют аналогичным
способом, описанным в стадии A1 способа A, и удаление
сложноэфирного остатка проводят способом, аналогичным описанному в стадии A2 способа A.
Соединение формулы (II), которое является исходным веществом в способе A, можно получить, например, согласно cпособу D (см. в конце описания).
Соединение формулы (IIa), полученное согласно данному способу, представляет соединение формулы (II), в котором U является гидроксильной группой. Соединение формулы (IIb) представляет соединение формулы (II), в котором U является атомом галогена или группой формулы: - O-SO2-R5 (где R5 имеет такое же значение, как определено выше).
Стадия D1
Стадия D1 заключается в получении соединения формулы (XII), и соединение
получают путем взаимодействия соединения
формулы (V) с соединением формулы (XI).
Настоящую реакцию выполняют способом, аналогичным уже описанному в стадии A1 способа A, где U является атомом галогена или группой формулы: -O-SO2-R5 (где R5 имеет такое же значение, как определено выше).
Стадия D2
Cтадия D2 заключается в
получении соединения формулы (IIa), и это
соединение получают путем удаления тетрагидропиранильной группы соединения формулы (XII).
Настоящую реакцию выполняют способом, аналогичным описанному для снятия защиты с помощью кислоты в стадии A2 способа A.
Стадия D3
Cтадия D3 заключается в получении соединения формулы (IIb), и это соединение получают путем
превращения гидроксильной группы в
соединении формулы (IIа) в атом галогена - или группу формулы: -O-SO2-R5 (где R5 имеет такое же значение, как определено выше).
В случае, где U1 в соединении формулы (IIb) представляет атом галогена, соединение формулы (II) получают взаимодействием соединения формулы (IIа) с галогенирующим средством в растворителе.
Используемое галогенирующее средство включает тионилгалогенид, такой как тионилхлорид и тионилбромид; пентагалогенид фосфора, такой как пентахлорид фосфора и пентабромид фосфора; оксигалогенид фосфора, такой как оксихлорид фосфора и оксибромид фосфора; оксалилхлорид и т. п., предпочтительно тионилгалогенид и оксалилхлорид.
Используемый здесь инертный растворитель особенно не ограничен, поскольку он не оказывает вредного воздействия на реакцию. Примеры подходящих растворителей включают углеводороды, такие как гексан, бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран и диоксан; и сложные эфиры, такие как этилацетат и бутилацетат, предпочтительно галогенированные углеводороды и простые эфиры.
Температура реакции находится в диапазоне от -10 до 100oC, предпочтительно от 10 до 80oC.
Хотя время реакции варьируется в зависимости от реагента, температуры и растворителя, оно обычно составляет от 30 минут до 24 часов, предпочтительно от 1 часа до 16 часов.
Альтернативно, соединение формулы (IIb) также получают путем взаимодействия соединения формулы (IIa) с галогенирующим средством, таким как тетрагалогенированный углерод, например, тетрахлорид углерода и тетрабромид углерода, и N-галогенсукцинимид, например, N-бромсукцинимид и N-хлорсукцинимид, в присутствии три-C6-C10 арил или три-C1-C4 алкилфосфинов, таких как трифенилфосфин и трибутилфосфин. Реакционные условия данной реакции аналогичны условиям реакции Mitsunobu, описанной в стадии A1 способа A.
В случае, где U1 в соединении формулы (IIa) представляет группу формулы: -O-SO2-R5 (где R5 имеет такое же значение, как определено выше), соединение формулы (IIb) получают путем взаимодействия соединения формулы (IIa) с соединением формулы: -R-SO2-Cl (где R5 имеет такое же значение, как определено выше) или соединением формулы: (R5-SO2)2O (где R5 имеет такое же значение, как определено выше) в инертном растворителе в присутствии основания.
Используемое основание включает предпочтительно третичные амины, такие как триэтиламин, N-метилморфолин и N,N-диизопропилэтиламин.
Используемый инертный растворитель особенно не ограничен, поскольку он не оказывает вредного воздействия на реакцию. Примеры подходящих растворителей включают углеводороды, такие как гексан, бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ и 1, 2-дихлорэтан; простые эфиры, такие как тетрагидрофуран и диоксан; и сложные эфиры, такие как этилацетат и бутилацетат, предпочтительно галогенированные углеводороды и простые эфиры.
Температура реакции находится в диапазоне от -10 до 100oC, предпочтительно от 0 до 60oC.
Хотя время реакции варьируется в зависимости от реагента, температуры и растворителя, оно обычно составляет от 30 минут до 24 часов, предпочтительно от 1 до 16 часов.
Кроме того, соединения формулы (V), которые являются исходными соединениями, представляют собой известные соединения или их легко получают согласно известному способу. Соединения легко получают реакцией дегидратации-конденсации соответствующих карбонильных соединений с гидроксиламином (например, Shin-jikken kagaku koza, 14 (III), P. 1325, complied by The Chemical Society of Japan, published by Maruzen K.K., "Comprehensive Organic Functional Group Transformation", 3, P. 425, authors: A.R. Katritzby et al., published by Pergamon (United Kingdom), 1995, etc.).
Требуемые соединения, полученные в Способах A-D, могут быть очищены, при необходимости, стандартным способом, например, колоночной хроматографией, перекристаллизацией, переосаждением и т.п., после каждой реакции. Очищенный продукт можно получить, например, путем соответствующей нейтрализации реакционной смеси, добавлением растворителя в реакционную смесь, чтобы экстрагировать его, выпариванием растворителя из экстракта и очисткой остатка посредством колоночной хроматографии, используя силикагель.
Производные фенилалкилкарбоновой кислоты формулы (I) данного изобретения, их фармакологически приемлемые соли или их фармакологически приемлемые сложные эфиры используют в качестве терапевтических или профилактических средств, особенно в качестве терапевтических средств, для лечения многих болезней. Примеры таких заболеваний представляют заболевания, вызванные инсулинорезистентностью, такие как гиперлипемия, гипергликемия, ожирение, состояние нарушенной толерантности к глюкозе (the state of impaired glucose tolerance (IGT)), состояние инсулинорезистентности с ненарушенной толерантностью к глюкозе (the state of insulin resistant non-IGT (NGT)), гипертензия, остеопороз, панкреатит, кахексия, жировая инфильтрация, диабетическое осложнение (например, ретинопатия, нефропатия, катаракта, болезни коронарной артерии и т.п.), артериосклероз, катаракта, гестационный (обусловленный беременностью) сахарный диабет (GDM) и синдром поликистоза яичников (PCOS), воспалительные заболевания (например, эпифизарный остеомиелит, боль, гипертермия, воспалительный энтерит и т. д.), угри, солнечная эритема (sunburn), псориаз, экзема, аллергические заболевания, астма, язва желудочно-кишечного тракта, кардиоваскулярные заболевания (например, ишемические болезни сердца (ishemic heart diseases) и т.п.), клеточное повреждение, вызванное атеросклерозом и ишемическими заболеваниями (например, повреждение головного мозга, вызванное апоплексией), аутоиммунные заболевания (например, системная красная волчанка, ревматоидный артрит, ювенильный ревматоидный артрит, Sjogren's синдром, диффузная склеродерма (diffuse scleroderma), диффузная болезнь соединительной ткани (mixed connective-tissue disease), дерматомиозит (dermatomyositis), Hashimoto's болезнь, первичная микседема (primary myxedema), тиреотоксикоз (thyrotoxicosis), пермициозная анемия (permicious anemia), язвенный колит, аутоиммунный атрофический гастрит (autoimmune athrophic gastritis), идиопатическая болезнь Аддисона, мужская стерильность, Goodpasture's синдром, острый прогрессирующий гломерулярный нефрит, миастения гравис (myasthenia gravis), полимиозит, обыкновенная пузырчатка, буллезный пемфигоид (bullous pemphigoid), симпатическая офтальмия, рассеянный склероз, аутоиммунная гемолитическая анемия, идиопатическая тромбоцитопеническая пурпура (idiopathic thrombocytopenic purpura), постинфарктный синдром, ревматическая атака, волчаночный гепатит, первичный билиарный цирроз, болезнь Бехчета (Bechet's), CREST синдром и т.п.), предпочтительно, терапевтические или профилактические средства (особенно терапевтические средства) для гипергликемии, остеогенеза, панкреатита или ревматизма, особенно гипергликемии, панкреатита или ревматизма.
Производные фенилалкилкарбоновой кислоты формулы (I), их фармакологически приемлемые соли или их сложные эфиры применяют в различных формах. Форма применения особенно не ограничена и определяется в зависимости от различных видов препаративных форм, возраста, пола, других состояний пациента и т. п. Например, соединение применяют перорально в форме таблеток, пилюль, порошков, гранул, сиропов, растворов, суспензий, эмульсий, гранул и капсул. Кроме того, в случае инъекций, их применяют внутривенно как таковое или в смеси со стандартным адъювантом, таким как глюкоза и аминокислота, и кроме того, при необходимости, его отдельно вводят внутримышечно, интрадермально, подкожно или интраперитонеально. В случае суппозиториев, его вводят (интра)ректально. Предпочтительно пероральное применение.
Различные виды этих препаратов можно получить путем смешения известного адъюванта, обычно используемого в области технологии лекарственных препаратов, такого как наполнители, связующие, дезинтегрирующие средства, смазки, солюбилизаторы, корригенты (придающие вкус и запах) и средства для покрытия, с компонентом формулы (I) согласно стандартному способу.
Когда данное соединение формуют в форме таблеток, можно широко использовать вещества, обычно известные в этой области как носители. Примеры таких
веществ включают наполнители, такие как лактоза, сахароза, хлорид натрия, глюкоза, мочевина, крахмал, карбонат кальция, каолин, кристаллическая целлюлоза и кремниевая кислота; связующие, такие как
вода, этанол, пропанол, очищенная патока (single syrop), раствор глюкозы, раствор крахмала, раствор желатина, карбоксиметилцеллюлоза, шеллак, метилцеллюлоза, фосфат калия и поливинилпирролидон;
дезинтеграторы, такие как крахмал, альгинат натрия, порошок агаpa,
порошок ламинарана, гидрокарбонат натрия, карбонат кальция, сложный эфир полиоксиэтиленсорбитана и жирной кислоты,
лаурилсульфат натрия, моноглицерид стеариновой кислоты, крахмал и лактоза; ингибирующие дезинтеграцию средства, такие как сахароза, стеариновая кислота, масло какао и гидрированное масло; ускоряющие
абсорбцию средства, такие как четвертичное аммониевое основание и лаурилсульфат натрия; увлажнители, такие как глицерин и крахмал; адсорбирующие средства, такие как крахмал, лактоза, каолин, бентонит
и коллоидная кремниевая кислота; и смазки, такие как очищенный тальк, стеарат, порошок борной кислоты и полиэтиленгликоль. Кроме того, при необходимости, можно получить таблетки, покрытые пленкой для
покрытия, например, таблетку с сахарным покрытием, таблетку с желатиновым покрытием, таблетку с энтеропокрытием, таблетку с пленочным покрытием, таблетку с двойным слоем или многослойную таблетку.
Когда данное соединение формуют в форме пилюль, можно широко использовать (соединения), хорошо известные в этой области в качестве носителей, и к ним относятся, например, наполнители, такие как глюкоза, лактоза, крахмал, масло какао, гидрированное растительное масло, каолин и тальк; связующие, такие как порошок аравийской камеди, порошок трагаканта, желатин и этанол; и дезинтегрирующие средства, такие как ламинаран и агар. Когда предлагаемое соединение формуют в форме суппозиториев, можно широко использовать вещества, хорошо известные в этой области, и они включают, например, полиэтиленгликоль, масло какао, высшие спирты, сложные эфиры высшего спирта, желатин и полусинтетический глицерид.
В случае, где данное соединение получают в виде инъекции, предпочтительно, чтобы раствор и суспензия были стерилизованы и были изотоническими по отношению к крови. Когда данное соединение формулируют в такие растворы, эмульсии и суспензии, можно широко использовать все вещества, обычно используемые в этой области в качестве разбавителей, и они включают, например, воду, этиловый спирт, пропиленгликоль, этоксилированный изостеариловый спирт, полиоксилированный изостеариловый спирт и сложный эфир полиоксиэтиленсорбитана и жирной кислоты. В этой связи, в этом случае, в фармацевтическом препарате может содержаться достаточное количество NaCl, глюкозы или глицерина для получения изотонического раствора.
Кроме того, туда могут быть также добавлены вещества, улучшающие растворимость, буферы и успокоительные средства. Кроме того, в них (препаратах), при необходимости, могут содержаться окрашивающие средства, консерванты, отдушки, корригенты, подслащивающие средства и другие фармацевтические лекарственные средства.
Количество активных ингредиентов, содержащихся в вышеупомянутых фармацевтических составах, особенно не ограничено и (это количество) соответственно подбирается в широком диапазоне, и целесообразно, чтобы содержание (активных ингредиентов) во всех композициях составляло от 1 до 70%, по весу, предпочтительно от 1 до 30%, по весу.
Доза может варьироваться в зависимости от состояния пациента, возраста, веса тела, способа применения и формы состава (лекарственной формы). Для взрослого индивидуума доза обычно составляет 0,001 мг (предпочтительно 0,01 мг, более предпочтительно 0,1 мг) как низший предел и 2000 мг (предпочтительно 200 мг, более предпочтительно 20 мг) как верхний предел при однократном приеме до нескольких раз в день.
(Предпочтительный вариант воплощения изобретения)
Ниже данное изобретение описывается более детально с помощью примеров, сравнительных примеров, примера на испытание и
примеров рецептур, но
данное изобретение ими не ограничивается.
Пример 1. Этил 2-этокси-3-[4-[2-[[1-[4-(2-пиридил) фенил]этилиден]аминокси]этокси]фенил]пропионат(этиловый сложный
эфир соединения N 2-35)
49 мг гидрида натрия (55% масляная суспензия) добавляют к смеси 242 мг этил 2-этокси-3-(4-гидроксифенил)пропионата в 4 мл N,N-диметилформамида и 2 мл толуола и смесь
перемешивают при комнатной
температуре в течение 30 минут.
Раствор 340 мг 4'-(2-пиридил)ацетофеноноксим O-2- (метансульфонилокси) этилового эфира, полученного в cсылочном примере 2, в 3 мл N,N-диметилформамида добавляют по каплям в реакционную смесь и полученную реакционную смесь перемешивают при 80oC в течение 3 часов. После реакции, к реакционной смеси добавляют этилацетат и воду, слой этилацетата отделяют, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле (этилацетат: гексан = 3: 7), получая 373 мг требуемого соединения в виде сиропа, который вскоре кристаллизуется.
1) т.пл. 59-61oC
2)1H ЯМР спектр: δ ppm;
1H ЯМР
спектр (270 МГц), определенный с использованием TMC (TMS) (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе, представляет следующее:
1,16
(3H, t, J=7 Гц), 1,23
(3H, t, J=7 Гц), 2,28 (3H, s), 2,95 (2H, d, J= 6,5 Гц), 3,29-3,40 (1H, m), 3,54-3,65 (1H, m), 3,97 (1H, t, J=6,5 Гц), 4,17 (2H, q, J=7 Гц), 4,28 (2H, t, J=5 Гц), 4,55 (2H, t,
J=5 Гц), 6,88 (2H, d, J=
8,5 Гц), 7,16 (2H, d, J=8 Гц), 7,22-7,27 (1H, m), 7,75-7,80 (2H, m), 7,76 (2H, d, J=8,5 Гц), 8,01 (2H, d, J=8,5 Гц), 8,70 (1H, d, J=5 Гц).
Пример 2.
2-этокси-3-[4-[2-[[1-[4-(2-пиридил)фенил] этилиден]аминокси] этокси]фенил] пропионовая кислота (Иллюстративное соединение N 2-35)
1,30 мл 1н. водного раствора гидроксида натрия добавляют к
раствору 310 мг этил 2-этокси-3-[4-[2-[[1-[4-(2-пиридил)фенил] этилиден]аминокси]этокси] фенил]пропионата, полученного в примере 1, в 5 мл этанола и смесь перемешивают при комнатной температуре в
течение 1,5 часов. После реакции этанол выпаривают при пониженном давлении и pH смеси доводят до значения 3 с помощью 1н. хлористоводородной кислоты. Полученную таким образом реакционную смесь
экстрагируют этилацетатом и экстракт сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный таким образом кристаллический неочищенный продукт промывают изопропиловым
эфиром и гексаном, получая 232 мг требуемого соединения.
1) т.пл. 133-135oC
2)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц),
определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе, представляет следующее: 1,18 (3H, t, J=7 Гц), 2,28 (3H, s), 2,95 (1H, d, d, J=7,5,
14
Гц), 3,08 (1H, d,d, J=4,5, 14 Гц), 3,39-3,50 (1H, m), 3,55-3,66 (1H, m), 4,04 (1H, d,d, J=4,5, 7,5 Гц), 4,29 (2H, t, J=5 Гц), 4,56 (2H, t, J= 5 Гц), 6,89 (2H, d, J=8,5 Гц), 7,17 (2H, d, J=8,5 Гц),
7,
25-7,30 (1H, m), 7,74 (2H, d, J=8,5 Гц), 7,76-7,80 (2H, m), 7,96 (2H, d, J=8,5 Гц), 8,72 (1H, d, J=4,5 Гц).
Пример 3. Метил 2-фенилтио-3-[4-[2-[[1-[4-(2-пиридил) фенил]этилиден]
аминокси] этокси] фенил] пропионат (метиловый сложный эфир иллюстративного соединения N 31-35)
3,3 мл раствора 222 мг диэтилазодикарбоксилата в толуоле добавляют по каплям к раствору 256 мг
2-[[1-[4-(2-пиридил)фенил] этилиден]аминокси]этанола, полученного в Ссылочном примере 1, 288 мг метил 3-(4-гидроксифенил)-2-(фенилтио)пропионата, полученного в Ссылочном примере 7, и 289 мг
трифенилфосфина в 5 мл тетрагидрофурана. Смесь перемешивают при комнатной температуре в течение 18 часов и реакционную смесь концентрируют. Остаток подвергают дважды колоночной хроматографии на
силикагеле (этилацетат: гексан = 1: 2 и этилацетат: бензол = 1:4), получая 366 мг требуемого соединения в виде сиропа.
1)1H ЯМР спектр: δ ppm;
1
H
ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе, представляет следующее:
2,27 (3H, s), 3,00 (1H, d,d,
J=6, 14 Гц), 3,14 (1H, d,d, J=9, 14 Гц), 3,58 (3H, s), 3,86 (1H, d,d, J=6, 9 Гц), 4,27 (2H, t, J=5 Гц), 4,55 (2H, t, J= 5 Гц), 6,87 (2H, d, J=8,5 Гц), 7,10 (2H, d, J=8,5 Гц), 7,22-7,34 (4H, m), 7,
41-7,
45 (2H, m), 7,72-7,80 (2H, m), 7,76 (2H, d, J=8,5 Гц), 8,01 (2H, d, J=8,5 Гц), 8,71 (1H, d, J=4,5 Гц).
Пример 4. 2-фенилтио-3-[4-[2-[[1-[4-(2-пиридил)фенил] этилиден]аминокси]
этокси]фенил] пропионовая кислота (Иллюстративное соединение N 31-35)
2,00 мл 1н. водного раствора гидроксида натрия добавляют к смеси 350 мл метил
2-фенилтио-3-[4-[2-[[1-[4-(2-пиридил)фенил]
этилиден]аминокси]этокси] фенил] пропионата, полученного в Примере 3, 3 мл метанола и 2 мл диоксана и смесь перемешивают при 50oC в течение 4
часов. После реакции реакционную смесь
концентрируют и разбавляют водой. Затем pH реакционной смеси доводят до значения 3 с помощью 1н. хлористоводородной кислоты и экстрагируют этилацетатом.
Экстракт сушат над безводным сульфатом магния и
концентрируют, получая 324 мг требуемого соединения в виде вспененного твердого вещества.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц),
определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе, представляет следующее:
2,24
(3H, s), 3,01 (1H, d,d, J=6, 14 Гц), 3,15 (1H,
d,d, J=9,5, 14 Гц), 3,87 (1H, d, d, J=6, 9,5 Гц), 4,30 (2H, t, J=5 Гц), 4,54 (2H, t, J=5 Гц), 6,87 (2H, d, J=8,5 Гц), 7,13 (2H, d, J=8,5 Гц), 7,23-7,32
(4H, m), 7,43-7,49 (2H, m), 7,64 (2H, d, J=8,5
Гц), 7,68-7,80 (2H, m), 7,85 (2H, d, J=8,5 Гц), 8,66 (1H, d, J=5,5 Гц).
Пример 5. Этил 2-фениламино-3-[4-[2-[[1-[4-(2-пиридил)
фенил]этилиден] аминокси] этокси]фенил]пропионат
(этиловый сложный эфир иллюстративного соединения N 32-35)
Реакцию и постобработку выполняют согласно Примеру 3, используя 256 мг
2-[[1-[4- (2-пиридил) фенил] этилиден] аминокси] этанола,
полученного в Ссылочном примере 1, 285 мг этил 3-(4-гидроксифенил)-2-(фениламино)пропионата, полученного в Ссылочном примере 5, 289 мг
трифенилфосфина и 222 мг диэтилазодикарбоксилата, получая 375 мг
требуемого соединения в виде кристаллов.
1) т. пл. 140oC
2)1H ЯМР спектр: δ
ppm;
1H ЯМР спектр (270 МГц), определенный с
использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе, представляет следующее: 1,19 (3H, t,
J=7 Гц), 2,28 (3H, s), 3,00- 3,14 (2H, m), 4,13 (2H, q, J=7 Гц),
4,15 (1H, brs), 4,26-4,34 (3H, m), 4,55 (2H, t, J=5 Гц), 6,60 (2H, d, J=8,5 Гц), 6,73 (1H, t, J=7,5 Гц), 6,88 (2H, d, J= 8,5 Гц), 7,
09 (2H, d, J=8,5 Гц), 7,13- 7,27 (3H, m), 7,75-7,78 (2H, m), 7,76
(2H, d, J=8,5 Гц), 8,01 (2H, d, J=8,5 Гц), 8,71 (1H, d, J=4,5 Гц).
Пример 6. 2-фениламино-3-[4-[2-[[1-[4-(2-пиридил)
фенил]этилиден]аминокси]этокси]фенил] пропионовая кислота
(Иллюстративное соединение N 32-35)
Реакцию проводят согласно Примеру 4, используя 260 мг этил
2-фениламино-3-[4-[2-[[1-[4-(2-пиридил)фенил] этилиден]аминокси] этокси]фенил] пропионата,
полученного в Примере 5, и 1,00 мл 1н. водного раствора гидроксида натрия. После реакции реакционную смесь
концентрируют и разбавляют водой. pH реакционной смеси доводят до значения 4 с помощью 1н.
хлористоводородной кислоты и осадок получают фильтрацией. Осадок промывают водой и изопропиловым эфиром,
получая 224 мг требуемого соединения.
1) т. пл. 149-152oC
2)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с
использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе,
представляет следующее:
2,27 (3H, s), 3,04 (1H, d,d, J=6,5, 14 Гц), 3,17 (1H, d,d, J=5,5,
14 Гц), 4,25-4,30 (3H, m), 4,54 (2H, t, J=5 Гц), 6,60 (2H, d, J=8 Гц), 6,69 (1H, d, J=7,5 Гц), 6,87
(2H, d, J=8,5 Гц), 7,12-7,17 (4H, m), 7,25-7,30 (1H, m), 7,76 (2H, d, J=8,5 Гц), 7,77-7,83 (2H, m),
8,01 (2H, d, J=8,5 Гц), 8,71 (1H, d, J=4,5 Гц).
Пример 7. Этил 2-(N,
N-диэтиламино)-3-[4-[2-[[1-[4-(2- пиридил)фенил]этилиден] аминокси] этокси]фенил] пропионат (этиловый сложный эфир
иллюстративного соединения N 47-35)
Реакцию и постобработку выполняют
согласно Примеру 1, используя 337 мг 4'-(2-пиридил)ацетофеноноксим O-2-(метансульфонилокси)этилового эфира, полученного
в Ссылочном примере 2, 243 мг этил 2-(N,N-диэтиламино)-3-(4-гидроксифенил)
пропионата, полученного в Ссылочном примере 9, и 44 мг гидрида натрия (55% масляная суспензия), получая 481 мг требуемого
соединения в виде сиропа.
1)1H ЯМР спектр:
δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве
внутреннего стандарта в дейтерированном хлороформе, представляет следующее:
1,02 (6H, t, J=7 Гц), 1,16 (3H, t, J=7 Гц), 2,28 (3H, s), 2,52 (2H, sextet, J=7 Гц), 2,78 (2H, sextet, J=7 Гц), 2,
80 (1H, d,d, J=6, 13,5 Гц), 3,01 (1H, d,d, J=9, 13,5 Гц), 3,56 (1H, d,d, J=6, 9
Гц), 4,00-4,14 (2H, m), 4,27 (2H, t, J=5 Гц), 4,55 (2H, t, J=5 Гц), 6,86 (2H, d, J=8,5 Гц), 7,12 (2H, d, J= 8,5 Гц), 7,
22-7,27 (1H, m), 7,75-7,78 (4H, m), 8,01 (2H, d, J=8,5 Гц), 8,70 (1H, d, J=4,5
Гц).
Пример 8. 2-(N,N-Диэтиламино)-3-[4-[2-[[1-[4-(2-пиридил) фенил]этилиден] аминокси] этокси] фенил]
пропионовая кислота (Иллюстративное соединение N 47-35)
2,75 мл 1н.
водного раствора гидроксида натрия добавляют к смеси 474 мг этил 2-(N,N-диэтиламино)-3-[4-[2-[[1-[4-(2-пиридил)
фенил]этилиден]аминокси] этокси]фенил] пропионата, полученного в Примере 7, 5 мл
метанола и 3 мл диоксана. Полученную смесь перемешивают при 50oC в течение 18 часов. После реакции метанол
и диоксан выпаривают при пониженном давлении и затем остаток разбавляют водой. pH
смеси доводят до значения 4 добавлением 2,75 мл 1н. хлористоводородной кислоты и осадок собирают фильтрацией. Осадок
промывают водой и изопропиловым эфиром, получая 440 мг требуемого соединения.
1) т. пл. 157-159oC
2)1H ЯМР спектр: δ ppm;
1H
ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве
внутреннего стандарта в дейтерированном диметилсульфоксиде, представляет следующее: 0,96 (6H, t, J=7 Гц), 2,23 (3H,
s), 2,54- 2,78 (5H, m), 2,96 (1H, d,d, J=7,5, 14 Гц), 3,48 (1H, t, J=7 Гц), 4,25 (2H,
t, J=5 Гц), 4,46 (2H, t, J=5 Гц), 6,88 (2H, d, J=8,5 Гц), 7,16 (2H, d, J=8,5 Гц), 7,35-7,40 (1H, m), 7,80 (2H, d,
J=8,5 Гц), 7,90 (1H, d, t, J=l,5, 7,5 Гц), 8,01 (1H, d, J=8 Гц), 8,13 (2H, d, J=8,5
Гц), 8,68 (1H, d, J=4 Гц).
Пример 9. Этил 3-[4-[2-[[1-(4-бифенилил)этилиден]аминокси] этокси]фенил] -2-(фениламино) пропионат (этиловый сложный эфир иллюстративного соединения N 32-4) Реакцию и постобработку выполняют согласно Примеру 3, используя 179 мг 2-[[1-(4- бифенилил)этилиден] аминокси]этанола, полученного в Ссылочном примере 3, 200 мг этил 3-(4-гидроксифенил)-2-(фениламино) пропионата, полученного в Ссылочном примере 5, 183 мг трифенилфосфина и 122 мг диэтилазодикарбоксилата, получая 282 мг требуемого соединения в виде сиропа.
1)1H ЯМР
спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с
использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе, представляет
следующее:
1,19 (3H, t, J=7 Гц), 2,27 (3H, s), 3,00-3,14 (2H, m), 4,12 (2H, d,
q, J=l, 7 Гц), 4,25-4,33 (3H, m), 4,54 (2H, t, J=5 Гц), 6,60 (2H, d, J=8,5 Гц), 6,73 (1H, t, J=7,5 Гц), 6,88 (2H,
d, J=8,5 Гц), 7,08 (2H, d, J=8,5 Гц), 7,16 (2H, t, J=7,5 Гц), 7,33- 7,48 (3H, m), 7,
58-7,61 (4H, m), 7,70-7,74 (2H, m).
Пример 10. 3-[4-[2-[[1-(4-бифенилил)этилиден]аминокси]
этокси]фенил]-2-(фениламино) пропионовая кислота (Иллюстративное соединение N 32-4)
Раствор 72 мг моногидрата гидроксида лития и 3 мл воды добавляют в раствор 282 мг этил
3-[4-[2-[[1-(4-бифенилил)этилиден] аминокси]этокси]фенил] -2-(фениламино) пропионата, полученного в Примере 9,
в 3 мл диоксана. Смесь перемешивают при 60oC в течение одного часа. После
реакции реакционную смесь концентрируют и разбавляют водой. Затем 1,71 мл 1н. хлористоводородной кислоты добавляют
к полученной смеси и полученный таким образом продукт экстрагируют большим
количеством горячего этилацетата. Экстракт концентрируют до приблизительно 5 мл и 229 мг требуемого соединения получают
фильтрацией.
1) т. пл. 184-187oC
2)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС
(тетраметилсилан) в качестве внутреннего стандарта в дейтерированном диметилсульфоксиде,
представляет следующее:
2,20 (3H, s), 2,90 (1H, d,d, J=8, 14 Гц), 3,00 (1H, d,d, J=6, 14 Гц), 4,05
(2H, d, d, J= 6, 8 Гц), 4,25 (2H, t, J=5 Гц), 4,46 (2H, t, J=5 Гц), 6,51-6,58 (3H, m), 6,89
(2H, d, J=8,5 Гц), 7,05 (2H, t, J=8 Гц), 7,21 (2H, t, J=8,5 Гц), 7,36-7,51 (3H, m), 7,68-7,77 (6H, m).
Пример 11. Этил 3-[4-[2-[[1-(4-бифенилил)этилиден]аминокси] этокси]фенил]
-2-[N-фенил-N-этиламино] пропионат (этиловый сложный эфир иллюстративного соединения N 49-4)
Реакцию и
постобработку выполняют согласно Примеру 3, используя 230 мг
2-[[1-(4-бифенилил)этилиден] аминокси] этанола, полученного в Ссылочном примере 3, 300 мг этил 3-(4-гидроксифенил)
-2-(N-фенил-N-этиламино)пропионата, полученного в Ссылочном примере 6, 236 мг
трифенилфосфина и 157 мг диэтилазодикарбоксилата, получая 353 мг требуемого соединения в виде сиропа.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270
МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе,
представляет следующее:
1,08 (3H, t, J=7 Гц), 1,15 (3H, t, J=7 Гц), 2,
27 (3H, s), 3,05 (1H, d,d, J= 7,5, 14 Гц), 3,24-3,46 (3H, m), 4,09 (2H, q, J=7 Гц), 4,26 (2H, t, J=5 Гц), 4,39 (1H, t,
J=7,5 Гц), 4,53 (2H, t, J=5 Гц), 6,66-6,76 (3H, m), 6,86 (2H, d, J=8,5 Гц), 7,10
(2H, d, J=8,5 Гц), 7,18-7,25 (2H, m), 7,33-7,38 (1H, m), 7,45 (2H, d, J=7,5 Гц), 7,58-7,61 (4H, m), 7,72 (2H, d, J=8,5
Гц).
Пример 12. Гидрохлорид 3-[4-[2-[[1-(4-бифенилил)этилиден]
аминокси]этокси]фенил]-2-[N-фенил-N-этиламино]пропионовой кислоты (гидрохлорид иллюстративного соединения N 49-4)
Реакцию и постобработку выполняют согласно Примеру 4, используя 353 мг этил
3-[4-[2-[[1-(4-бифенилил)этилиден]аминокси] этокси]фенил]-2-(N-фенил-N-этиламино) пропионата, полученного в Примере
11 и 2 мл 1н. водного раствора гидроксида натрия. Полученный таким образом продукт
далее обрабатывают раствором: 4н. хлористый водород-диоксан, получая 280 мг гидрохлорида требуемого соединения в
виде аморфного порошка.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве
внутреннего стандарта в дейтерированном диметилсульфоксиде, представляет следующее:
0,
94 (3H, t, J= 7 Гц), 2,21 (3H, s), 3,02 (1H, d,d, J=9, 14 Гц), 3,17 (1H, d,d, J=6, 14 Гц), 3,20-3,40 (2H,
m), 4,23 (2H, t, J=5 Гц), 4,45 (2H, t, J= = 5 Гц), 4,53 (1H, d,d, J=6, 9 Гц), 6,61-6,72 (3H,
m), 6,86 (2H, d, J=8,5 Гц), 7,12-7,17 (4H, m), 7,36-7,51 (3H, m), 7,69-7,78 (6H, m).
Пример 13. Этил 3-[4-[2-[[1-(4-бифенилил)этилиден]
аминокси]этокси]фенил]-2-пирролилпропионат
(этиловый сложный эфир иллюстративного соединения N 50-4)
Реакцию и постобработку выполняют
согласно Примеру 1, используя 333 мг 2-[[1-(4-бифенилил)этилиден] аминокси] этил метансульфоната,
полученного в Ссылочном примере 4, 260 мг этил 3-(4-гидроксифенил)-2-пирролилпропионата, полученного
в Ссылочном примере 8, и 50 мг гидрида натрия (55% масляная суспензия), получая 440 мг требуемого
соединения в виде смолы.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве
внутреннего стандарта в дейтерированном хлороформе, представляет следующее:
1,20 (3H, t, J=7 Гц),
2,27 (3H, s), 3,19 (1H, d,d, J=8,5, 14 Гц), 3,34 (1H, d, d, J= 6,5, 14 Гц), 4,17 (2H, q, J=7
Гц), 4,25 (2H, t, J=5 Гц), 4,52 (1H, t, J=5 Гц), 4,68 (1H, d, d, J=6,5, 8,5 Гц), 6,13-6,15 (2H, m), 6,
71-6,73 (2H, m), 6,82 (2H, d, J=8,5 Гц), 6,93 (2H, d, J=8,5 Гц), 7,33-7,48 (3H, m), 7,58-7,61 (4H,
m), 7,72 (2H, d, J=8,5 Гц).
Пример 14. 3-[4-[2-[[1-(4-бифенилил)этилиден]аминокси]
этокси]фенил]-2-пирролилпропионовая кислота (Иллюстративное соединение N 50-4)
Реакцию и
постобработку выполняют согласно Примеру 10, используя 167 мг этил 3-[4-[2-[[1-(4-бифенилил)этилиден]
аминокси] этокси] фенил]-2-пирролилпропионата, полученного в Примере 13, и 42 мг моногидрата
гидроксида лития, получая 135 мг требуемого соединения в виде кристаллов.
1) т. пл.
163-165oC
2)1H ЯМР спектр: δ ppm;
1H ЯМР
спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего
стандарта в дейтерированном хлороформе и небольшом количестве дейтерированного диметилсульфоксида,
представляет следующее:
2,26 (3H, s), 3,17 (1H, d,d, J=9,5, 14 Гц), 3,38 (1H, d,d, J=5,5,
14 Гц), 4,24 (2H, t, J=5 Гц), 4,51 (2H, t, J=5 Гц), 4,67 (1H, d,d, J=5,5, 9,5 Гц), 6,09-6,11 (2H, m),
6,70-6,72 (2H, m), 6,80 (2H, d, J-8,5 Гц), 6,92 (2H, d, J=8,5 Гц), 7,33-7,48 (3H, m), 7,56-7,62
(4H, m), 7,72 (2H, d, J=8,5 Гц).
Пример 15. Гидрохлорид этил
2-этиламино-3-[4-[2-[[I-[4- (2- пиридил)фенил] этилиден]аминокси]этокси]фенил] пропионата (гидрохлорид этилового сложного
эфира иллюстративного соединения N 43-35)
(а) Этил
2-(N-трет-бутоксикарбонил)этиламино-3-[4-[2- [[1-[4-(2-пиридил)фенил]этилиден]аминокси]этокси]фенил] пропионат
Реакцию и
постобработку выполняют согласно Примеру 3, используя 256 мг 2
-[[1-[4-(2-пиридил)фенил]этилиден]аминокси] этанола, полученного в Ссылочном примере 1, 337 мг этил
2-N- (трет-бутоксикарбонил)этиламино-3-(4-гидроксифенил)пропионата, полученного в Ссылочном примере
10, 289 мг трифенилфосфина и 556 мг диизопропилазодикарбоксилата, получая 320 мг требуемого
соединения в виде сиропа.
1)1H ЯМР спектр: δ ppm;
1H
ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве
внутреннего стандарта в дейтерированном хлороформе, представляет следующее:
0,92 (3H, t, J= 7 Гц), 1,18-1,
32 (3H, m), 1,45 (9H, s), 2,29 (3H, s), 2,55-2,85 (1H, m), 3,00-3,40 (3H, m), 3,85-4,
25 (3H, m), 4,28 (2H, t, J=5 Гц), 4,55 (2H, t, J=5 Гц), 6,88 (2H, d, J=8,5 Гц), 7,05-7,14 (2H, brd, J=8,5 Гц), 7,
22-7,26 (1H, m), 7,75-7,82 (4H, m), 8,01 (2H, d, J=8,5 Гц), 8,71 (1H, d, J=5 Гц).
(b) Гидрохлорид этил 2-этиламино-3-[4-[2-[[1-[4-(2-пиридил) фенил]этилиден]аминокси]этокси]фенил]
пропионата
312 мг этил
2-N-(трет-бутоксикарбонил)этиламино-3-[4-[2-[[1-[4-(2-пиридил)фенил] этилиден] аминокси]этокси]фенил]пропионата, полученного в Примере 15 (а), растворяют в 5 мл
раствора: 4N хлористый водород-диоксан
и смесь перемешивают при комнатной температуре в течение 2 часов. После реакции реакционную смесь концентрируют. Остаток превращают в порошок в этилацетате и
порошок собирают фильтрацией, получая 273
мг гигроскопичного гидрохлорида требуемого соединения.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц),
определенный с использованием ТМС
(тетраметилсилан) в качестве внутреннего стандарта в дейтерированном диметилсульфоксиде, представляет следующее:
1,10 (3H, t, J=7 Гц), 1,24 (3H, t, J=7 Гц),
2,25 (3H, s), 2,95-3,06 (2H, m),
3,39 (1H, q, J=7 Гц), 4,08 (2H, q, J=7 Гц), 4,18-4,22 (1H, m), 4,29 (2H, t, J=5 Гц), 4,50 (2H, t, J=5 Гц), 6,95 (2H, d, J=8,5 Гц), 7,16 (2H, d, J=8,5 Гц), 7,59-7,64
(1H, m), 7,85 (2H, d, J=8,5 Гц), 8,
15 (2H, d, J=8,5 Гц), 8,17-8,21 (2H, m), 8,77 (1H, d, J=5 Гц).
Пример 16. 2-Этиламино-3-[4-[2-[[1-[4-(2-пиридил)фенил]
этилиден]аминокси]этокси]фенил] пропионовая кислота
(Иллюстративное соединение N 43-35)
Реакцию проводят согласно Примеру 2, используя 273 мг этил
2-этиламино-3-[4-[2-[[1-[4-(2-пиридил)фенил]этилиден]аминокси] этокси]фенил] пропионата,
полученного в Примере 15, и 2,4 мл 1н. водного раствора гидроксида натрия. Когда pH полученной таким образом
реакционной смеси доводят до значения 4 с помощью 1н. хлористоводородной кислоты, получают
требуемое соединение в виде осадка. Осадок собирают фильтрацией и промывают водой, получая 186 мг требуемого
соединения.
т. пл. 220-222oC (разл.)
Пример 17. Этил
2-метилтио-3-[4-[2-[[1-[4-(2-пиридил) фенил]этилиден] аминокси]этокси]фенил] пропионат (этиловый сложный эфир
иллюстративного соединения N 26-35)
Реакцию и постобработку выполняют согласно
Примеру 1, используя 1,26 г 4'-(2-пиридил) ацетофеноноксим O-2-(метансульфонилокси) этилового эфира, полученного
в Ссылочном примере 2, 0,83 г этил 3-(4-гидроксифенил)-2-(метилтио) пропионата,
полученного в Ссылочном примере 11 (b), и 0,17 г гидрида натрия (55 о масляная суспензия), получая 1,50 г требуемого
соединения в виде сиропа.
1)1H ЯМР спектр: δ
ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве
внутреннего стандарта в дейтерированном хлороформе, представляет следующее:
1,
22 (3H, t, J=7 Гц), 2,16 (3H, s), 2,28 (3H, s), 2,90 (1H, d,d, J=6,5, 14 Гц), 3,15 (1H, d,d, J=9, 14 Гц), 3,40
(1H, 4 d,d, J=6,5, 9 Гц), 4,13 (2H, d,q, J=3, 7 Гц), 4,28 (2H, t, J=5 Гц), 4,55 (2H, t,
J=5 Гц), 6,89 (2H, d, J= 8,5 Гц), 7,13 (2H, d, J=8,5 Гц), 7,22-7,27 (1H, m), 7,75-7,78 (4H, m), 8,01 (2H, d, J=8,
5 Гц), 8,71 (1H, d, J=4,5 Гц).
Пример 18.
2-Метилтио-3-[4-[2-[[1-[4-(2-пиридил)фенил] этилиден]аминокси]этокси]фенил] пропионовая кислота (Иллюстративное соединение N 26-35)
5,05 мл 1н. водного раствора гидроксида натрия добавляют к
раствору 1,20 г этил 2-метилтио-3- [4-[2-[[1-[4-(2-пиридил)фенил]этилиден]аминокси]этокси] фенил] пропионата, полученного в Примере 17, в 20
мл этанола и смесь перемешивают при 50oC в
течение 30 минут. После реакции этанол выпаривают при пониженном давлении и 5,05 мл 1н. хлористоводородной кислоты добавляют к полученному таким
образом остатку с последующей экстракцией осажденного
продукта этилацетатом. Полученный таким образом экстракт сушат над безводным сульфатом магния и выпаривают при пониженном давлении. Полученный
таким образом остаточный порошок промывают изопропиловым
эфиром, получая 0,95 г требуемого соединения.
1) т. пл. 114-118oC
2)1H ЯМР спектр: δ
ppm;
1H ЯМР спектр (270 МГц),
определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе, представляет следующее:
2,
22 (3H, s), 2,25 (3H, s), 2,91 (1H, d,d, J=5,5,
14 Гц), 3,18 (1H, d,d, J= 10, 14 Гц), 3,44 (1H, d,d, J=5,5, 10 4 Гц), 4,33 (2H, t, J=5,5 Гц), 4,55 (2H, t, J=5,5 Гц), 6,89 (2H, d, J=8,5 Гц), 7,15 (2H,
d, J=8,5 Гц), 7,26-7,32 (1H, m), 7,63 (2H, d,
J=8,5 Гц), 7,71-7,84 (2H, m), 7,87 (2H, d, J=8,5 Гц), 8,70 (1H, d, J=4,5 Гц).
Пример 19. Этил
2-(3-фенилпропил)-3-[4-[2-[[1-[4-(2- пиридил)фенил] этилиден] аминокси] этокси]
фенил]пропионат (этиловый сложный эфир иллюстративного соединения N 66-8)
Реакцию и постобработку выполняют
согласно Примеру 1, используя 1,09 г 4'-(2-пиридил)ацетофеноноксим
O-2-(метансульфонилокси) этилового эфира, полученного в Ссылочном примере 2, 1,00 г этил 2-(4- гидроксибензил)-5-фенилвалерата,
полученного в Ссылочном примере 12 (с), и 160 мг гидрида натрия (55%
масляная суспензия), получая 1,54 г требуемого соединения в виде кристаллов.
1) т. пл. 53-55oC
2)1H ЯМР спектр: δ ppm;
1H
ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе,
представляет следующее:
1,14 (3H, t, J=7 Гц), 1,49-1,
75 (4H, m), 2,28 (3H, s), 2,56-2,71 (4H, m), 2,84 (1H, d,d, J=7,5, 12,5 Гц), 4,05 (2H, q, J=7 Гц), 4,27 (2H, t, J=5 Гц), 4,55 (2H, t, J=5
Гц), 6,86 (2H, d, J=8,5 Гц), 7,05 (2H, d, J=8,5 Гц), 7,12-7,
29 (6H, m), 7,75-7,78 (4H, m), 8,01 (2H, d, J=8,5 Гц), 8,70 (1H, d, J=5 Гц).
Пример 20.
2-(3-Фенилпропил)-3-[4-[2-[[1-[4-(2-пиридил) фенил]этилиден] аминокси] этокси] фенил]
пропионовая кислота (Иллюстративное соединение N 66-8)
0,67 г гидроксида калия добавляют к раствору 1,20
г этил 2-(3- фенилпропил)-3-[4-[2-[[1-[4-(2-пиридил)фенил] этилиден]
аминокси]этокси]фенил] пропионата, полученного в Примере 19, в 20 мл этанола и смесь перемешивают при 80oC в течение 2
часов. После реакции реакционную смесь концентрируют. К остатку
добавляют воду, лед и этилацетат и pH реакционной смеси доводят до значения 4 с помощью 3н. хлористоводородной кислоты, затем слой
этилацетата отделяют. Полученный таким образом экстракт сушат над
безводным сульфатом магния и затем выпаривают при пониженном давлении, получая 1,10 г требуемого соединения в виде смолы.
415 мг полученного таким образом требуемого соединения растворяют в 10 мл этанола и туда добавляют 0,80 мл 1н. водного раствора гидроксида натрия с последующим концентрированием полученной смеси. Полученное таким образом твердое вещество промывают этиловым эфиром, получая 0,42 г натриевой соли требуемого соединения в виде аморфного твердого вещества.
1)1H
ЯМР спектр: δ ppm;
1H ЯМР спектр
(270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном диметилсульфоксиде,
представляет следующее:
1,40-1,67 (5H, m), 2,24 (3H, s),
2,36-2,51 (4H, m), 2,83 (2H, d,d, J=7, 13,5 Гц), 4,23 (2H, t, J=4 Гц), 4,48 (2H, t, J=4 Гц), 6,81 (2H, d, J=8,5 Гц), 7,06-7,12 (5H, m),
7,17-7,23 (2H, m), 7,35 (1H, d,d, J=5, 6 Гц), 7,79 (2H, d, J=8,
5 Гц), 7,87 (1H, d,t, J=l,5, 8 Гц), 7,97 (1H, d, J=8 Гц), 8,12 (2H, d, J=8,5 Гц), 8,67 (1H, d, J=5 Гц).
Пример 21. Этил
2-фенокси-3-[4-[2-[[1-[4-(2-пиридил) фенил]этилиден] аминокси]
этокси] фенил] пропионат (этиловый сложный эфир иллюстративного соединения N 68-2)
Реакцию и постобработку выполняют согласно
Примеру 1, используя 1,18 г 4'-(2-пиридил)ацетофеноноксим
O-2-(метансульфонилокси)этилового эфира, полученного в Ссылочном примере 2, 1,28 г этил 3-(4-гидроксифенил)-2-феноксипропионата, полученного в
Ссылочном примере 13 (с), и 154 мг гидрида натрия (55%
масляная суспензия), получая 1,28 г требуемого соединения в виде сиропа.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с
использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе, представляет следующее:
1,19 (3H, t, J=7 Гц),
2,26 (3H, s), 3,17-3,20 (2H, m), 4,17 (2H, q,
J=7 Гц), 4,27 (2H, t, J=5 Гц), 4,54 (2H, t, J=5 Гц), 4,74 (1H, d,d, J=5,5, 6,5 Гц), 6,82-6,96 (5H, m), 7,21-7,26 (5H, m), 7,74- 7,77 (4H, m), 8,01 (2H, d,
J=8,5 Гц), 8,70 (1H, d, J=5 Гц).
Пример 22. 2-Фенокси-3- [4-[2-[[1-[4- (2-пиридил) фенил] этилиден]аминокси] этокси] фенил] пропионовая кислота (Иллюстративное соединение N 68-2)
Реакцию и постобработку выполняют
согласно Примеру 18, используя 1,28 г этил 2-фенокси-3-[4-[2-[[1-[4-(2-пиридил) 4 фенил]этилиден]аминокси]этокси] фенил] пропионата, полученного в Примере 20, и
7,00 мл 1н. водного раствора
гидроксида натрия, получая 1,13 г требуемого соединения в виде кристаллического порошка.
1) т. пл. 145-148oC
2)1H ЯМР
спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе, представляет
следующее:
2,25 (3H, s), 3,
22 (2H, d, J-6 Гц), 4,29 (2H, t, J=4,5 Гц), 4,54 (2H, t, J= 4,5 Гц), 4,81 (1H, t, J=6 Гц), 6,86-6,97 (5H, m), 7,21-7,31 (5H, m), 7,67-7,89 (6H, m), 8,72 (1H, d, J=5
Гц).
Пример 23.
Этил 2-бутил-3-[4-[2-[[1-[4-(2-пиридил)фенил] этилиден]аминокси]этокси]фенил] пропионат (этиловый сложный эфир иллюстративного соединения N 67-8)
Реакцию и
постобработку выполняют согласно
Примеру 1, используя 1,35 г 4'-(2-пиридил)ацетофеноноксим O-2-(метансульфонилокси) этилового эфира, полученного в Ссылочном примере 2, 1,00 г этил
3-(4- гидроксибензил)капроата, полученного в
Ссылочном примере 14 (с), и 200 мг гидрида натрия (55% масляная суспензия), получая 0,94 г требуемого соединения в виде сиропа.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе,
представляет следующее:
0,87 (3H, t,
J=7 Гц), 1,16 (3H, t, J=7 Гц), 1,20-1,40 (4H, m), 1,40-1,70 (2H, m), 2,28 (3H, s), 2,51-2,72 (2H, m), 2,86 (1H, d,d, J=8,5, 13,5 Гц), 4,06 (2H, q, J=7 Гц),
4,27 (2H, t, J=5 Гц), 4,54 (2H, t, J=5 Гц),
6,87 (2H, d, J=8,5 Гц), 7,07 (2H, d, J=8,5 Гц), 7,21-7,27 (1H, m), 7,71-7,80 (4H, m), 8,01 (2H, d, J=8,5 Гц), 8,71 (1H, d, J=5 Гц).
Пример
24.
2-Бутил-3-[4-[2-[[1-[4-(2-пиридил)фенил] этилиден]аминокси] этокси]фенил] пропионовая кислота (Иллюстративное соединение N 67-8)
Реакцию и постобработку выполняют согласно Примеру 18,
используя 0,94 г этил 2-бутил-3-[4-[2-[[1-[4-(2-пиридил)фенил] этилиден]аминокси]этокси] фенил] пропионата, полученного в Примере 23, и 3,86 мл 1н. водного раствора гидроксида натрия, получая 0,69 г
требуемого соединения в виде смолы.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в
качестве внутреннего стандарта в дейтерированном хлороформе, представляет следующее:
0,88 (3H, t, J=8,5 Гц), 1,23-1,37 (4H, m), 1,43-1,73 (2H, m), 2,60-2,74 (2H, m), 2,90 (1H, d,d, J=8,5, 13,
5 Гц), 4,30 (2H, t, J=5 Гц), 4,55 (2H, t, J= 5 Гц), 6,87 (2H, d, J=8,5 Гц), 7,10 (2H, d, J=8,5 Гц), 7,24-7,28 (1H, m), 7,68-7,81 (4H, m), 7,95 (2H, d, J=8,5 Гц), 8,70 (1H, d, J=5 Гц).
Пример 25. Натриевая соль 2-бутил-3-[4-[2-[[1-[4-(2- пиридил)фенил]этилиден] аминокси] этокси]фенил] пропионовой кислоты (натриевая соль иллюстративного соединения N 67-8)
0,69 г
2-Бутил-3-[4-[2-[[1-[4-(2-пиридил)фенил] этилиден] аминокси] этокси] фенил] пропионовой кислоты, полученной в Примере 24, обрабатывают 1,50 мл 1н. гидроксида натрия согласно Примеру 20, получая 0,65
г
требуемого соединения в виде порошка.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в
качестве внутреннего стандарта в дейтерированном диметилсульфоксиде, представляет следующее:
0,79 (3H, t, J=6,5 Гц), 1,04-1,30 (5H, m), 1,30-1,49 (1H, m), 2,09-2,25 (1H, m), 2,23 (3H, s), 2,
39 (1H, d,d, J=7,5, 13,5 Гц), 2,78 (1H, d,d, J=7,5, 13,5 Гц), 4,23 (2H, t, J=4,5 Гц), 4,47 (2H, t, J=4,5 Гц), 6,83 (2H, d, J=8,5 Гц), 7,07 (2H, d, J=8,5 Гц), 7,37 (1H, d,d, J=6, 7,5 Гц), 7,80 (2H, d,
J=8,5 Гц), 7,90 (1H, d,t, J=2, 8,5 Гц), 8,00 (1H, d, J=8 Гц), 8,13 (2H, d, J=8,5 Гц), 8,69 (1H, d, J=4,5 Гц).
Ссылочный пример 1. 2-[[1-[4-(2-пиридил)фенил]этилиден]
аминокси]этанол
а) 4'-(2-Пиридил)ацетофенон
После добавления по каплям 21 мл раствора: 3М метилмагнийбромид-диэтиловый эфир к раствору 3,10 г 4-(2-пиридил) бензонитрила в 120 мл
дихлорметана при охлаждении льдом в атмосфере азота смесь перемешивают при комнатной температуре в течение 20 часов. После реакции к реакционной смеси добавляют водный раствор хлорида аммония и
этилацетат с последующим перемешиванием полученной смеси. Этилацетатный слой отделяют от реакционной смеси, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток
подвергают колоночной хроматографии на силикагеле (этилацетат: гексан = 1: 2), получая неочищенное требуемое соединение в виде кристаллов. Далее, неочищенное соединение промывают смесью:
диизопропиловый эфир-гексан, получая 1,56 г требуемого соединения.
1) т. пл. 116-118oC
2)1H ЯМР спектр: δ ppm;
1H ЯМР спектр
(270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе, представляет следующее:
2,66 (3H, s), 7,30 (1H, d,d, J=4,5, 9
Гц),
7,79-7,81 (2H, m), 8,05-8,13 (4H, m), 8,74 (1H, d, J=4,5 Гц).
(b) 4'-(2-Пиридил)ацетофеноноксим
46,0 г гидрохлорида гидроксиламина добавляют к раствору: метоксид
натрия-метанол, полученному из 14,1 г натрия и 300 мл метанола, и смесь перемешивают при 50oC в течение 30 минут. 23,0 г 4'-(2-пиридил)ацетофенона, полученного в Ссылочном примере 1 (а)
добавляют к полученной суспензии и смесь перемешивают при 50oC в течение 3 часов. После реакции реакционную смесь концентрируют. 0,3 л этилацетата и 0,3 л воды добавляют к остатку и смесь
перемешивают, после чего собирают 10,98 г осажденного требуемого соединения фильтрацией. Слой этилацетата в фильтрате отделяют и сушат над безводным сульфатом магния с последующим концентрированием
при пониженном давлении. Полученный таким образом кристаллический остаток промывают диизопропиловым эфиром, получая 12,56 г требуемого соединения.
1) т. пл. 177-178oC
2)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном
хлороформе, представляет следующее:
2,20 (3H, s), 7,35 (1H, d,d, J=4, 7,5 Гц), 7,78 (2H, d, J=8,5 Гц), 7,89 (1H, d, d, J=7,5, 8 Гц), 8,00 (1H, d, J=8 Гц), 8,12 (2H, d, J=8,5 Гц), 8,68 (1H, d,
J=4 Гц).
(c) 4'-(2-Пиридил)ацетофеноноксим O-2- [(тетрагидропиран-2-ил)окси] этиловый эфир
6,00 г карбоната калия добавляют к раствору 3,20 г
2-(2-бромэтокси)тетрагидропирана,
1,30 г 4'-(2-пиридил)ацетофеноноксима, полученного в Ссылочном примере 1(b), в 27 мл N,N-диметилацетамида и смесь перемешивают при 80oC в течение 16
часов. После реакции реакционную смесь
растворяют в этилацетате и воде. Этилацетатный слой отделяют и экстракт сушат над безводным сульфатом магния. Этилацетат выпаривают при пониженном давлении и
остаток очищают с помощью колоночной
хроматографии на силикагеле (гексан: этилацетат = 3:1), получая 2,01 г требуемого соединения в виде сиропа.
(d)
2-[[1-[4-(2-Пиридил)фенил]этилиден]аминокси] этанол
1,30 г
моногидрата п-толуолсульфокислоты добавляют к раствору 2,01 г 4'-(2-пиридил)ацетофеноноксим O-2- [(тетрагидропиран-2-ил)окси]
этилового эфира, полученного в Ссылочном примере 1 (с), в 30 мл метанола и
смесь перемешивают при комнатной температуре в течение 2 часов, после чего концентрируют при пониженном давлении. Остаток
растворяют в этилацетате и водном бикарбонате натрия и нейтрализуют порошком
бикарбоната натрия. Этилацетатный слой отделяют и сушат над безводным сульфатом магния. Экстракт концентрируют при
пониженном давлении, получая неочищенное требуемое соединение в виде кристаллов. Это
неочищенное соединение промывают смесью: диизопропиловый эфир-гексан, получая 1,35 г требуемого соединения.
1) т. пл. 74-76oC
2)1H ЯМР спектр: δ
ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве
внутреннего стандарта в дейтерированном хлороформе, представляет следующее:
2,
31 (3H, s), 2,57 (1H, t, J=6 Гц), 3,95-3,99 (2H, m), 4,34-4,36 (2H, m), 7,24- 7,27 (1H, m), 7,74-7,77 (4H, m), 8,
02 (2H, d, J=8,5 Гц), 8,71 (1H, d,d, J=l,5, 5 Гц).
Ссылочный пример 2.
4'-2-(2-Пиридил)ацетофеноноксим O-2- (метансульфонилокси) этиловый эфир
0,82 мл триэтиламина по каплям
добавляют к раствору 10 мл дихлорметана, содержащего 1,00 г 2-[[1-[4-(2-пиридил) фенил]
этилиден]аминокси]этанола, полученного в Ссылочном примере 1, и 493 мг метансульфонилхлорида и смесь
перемешивают при комнатной температуре в течение 5 часов. После реакции реакционную смесь
концентрируют и остаток растворяют в этилацетате и воде. Затем этилацетатный слой отделяют и сушат над
безводным сульфатом магния. Этилацетатный слой концентрируют, получая кристаллический остаток.
Остаток промывают изопропиловым эфиром и гексаном, получая 1,26 г требуемого соединения.
1) т. пл. 99-101oC
2)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве
внутреннего стандарта в дейтерированном хлороформе, представляет следующее:
2,30 (3H, s), 3,04
(3H, s), 4,46-4,49 (2H, m), 4,55-4,58 (2H, m), 7,23-7,28 (1H, m), 7,74-7,78 (4H, m), 8,02 (2H,
d, J=8,5 Гц), 8,71 (1H, d, J=5 Гц).
Ссылочный пример 3.
2-[[1-(4-Бифенилил)]этилиден]аминокси] этанол
(а) 4-Ацетилбифенилоксим O-2-[(тетрагидропиран-2-ил)окси] этиловый
эфир
Реакцию и постобработку проводят согласно Ссылочному примеру
1(с), используя 15,8 г 2-(2-бромэтокси)тетрагидропирана, 6,40 г 4-ацетилбифенилоксима и 20,9 г карбоната калия, получая 10,2
г требуемого соединения в виде сиропа.
(b)
2- [1-(4-Бифенилил)этилиденаминокси]этанол
Реакцию и постобработку проводят согласно Ссылочному примеру 1(d), используя 10,2 г
4-ацетилбифенилоксим O-2-[(тетрагидропиран-2- ил)окси]этилового
эфира, полученного в Ссылочном примере 3(а), получая 6,53 г требуемого соединения.
1) т. пл. 128-130oC
2)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном
хлороформе, представляет следующее:
2,30 (3H, s), 2,58
(1H, br.s), 3,95-3,99 (2H, m), 4,32-4,36 (2H, m), 7,36-7,48 (3H, m), 7,59-7,62 (4H, m), 7,71 (2H, d, J=8,5 Гц).
Ссылочный пример 4. 2-[[1-(4-Бифенилил)этилиден]аминокси] этил
метансульфонат
Реакцию и постобработку проводят согласно Ссылочному примеру 2, используя 3,20 г
2-[1-(4-бифенилил)этилиденаминокси] этанола, полученного в Ссылочном примере 3, 1,49 г
метансульфонилхлорида и 1,80 г триэтиламина, получая 3,80 г требуемого соединения.
1) т. пл.
103-104oC
2)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего
стандарта в дейтерированном хлороформе, представляет следующее:
2,30 (3H, s), 3,04
(3H, s), 4,45-4,48 (2H, m), 4,54-4,58 (2H, m), 7,34-7,48 (3H, m), 7,61 (4H, d, J=8,5 Гц), 7,73 (2H, d, J=8,
5 Гц).
Ссылочный пример 5. Этил 3-(4-гидроксифенил)-2-(фениламино)
пропионат
(а) Этил 3-(4-бензилоксифенил)-2-(фениламино)пропионат
Смесь 4,00 г этил
3-(4-бензилоксифенил)-2- метансульфонилоксипропионата и 5 мл анилина перемешивают при 110oC в течение 24 часов. Реакционную смесь очищают с помощью колоночной хроматографии на силикагеле
(этилацетат: гексан = 1:4), получая 3,94 г требуемого соединения в виде сиропа.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с
использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе,
представляет следующее:
1,17 (3H, t, J=7 Гц), 3,00-3,14 (2H, m), 4,12 (2H, d,q, J=1,5, 7
Гц), 4,30 (1H, t, J=6 Гц), 5,04 (2H, s), 6,60 (2H, d, J=8,5 Гц), 6,73 (1H, t, J= 7,5 Гц), 6,89 (2H, d,
J=8,5 Гц), 7,09 (2H, d, J=8,5 Гц), 7,16 (2H, d, J=8,5 Гц), 7,31-7,44 (5H, m).
(b) Этил 3-(4-гидроксифенил)-2-(фениламино)пропионат
0,80 г 5% палладий-углерода добавляют к
смеси 3,94 г этил 3-(4- бензилоксифенил)-2-(фениламино)пропионата, полученного в Ссылочном
примере 5 (а), 40 мл этанола и 20 мл тетрагидрофурана и смесь перемешивают при 50oC в атмосфере
водорода при нормальном давлении в течение 6 часов. Из реакционной смеси
удаляют
катализатор фильтрацией и растворитель выпаривают. Остаток подвергают колоночной хроматографии на силикагеле
(этилацетат: гексан = 1:2), получая 2,95 г требуемого соединения в виде сиропа.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с
использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в
дейтерированном хлороформе, представляет следующее:
1,19 (3H, t, J=7 Гц), 3,00-3,13 (2H, m), 4,13 (2H, d,q, J=1,7 Гц),
4,30 (1H, brt, J=6 Гц), 4,88 (1H, brs), 6,60 (2H, d, J=8 Гц), 6,71-6,76
(3H, m), 7,03 (2H, d, J=8 Гц), 7,14-7,20 (2H, m).
Ссылочный пример 6. Этил
3-(4-гидроксифенил)-2-(N-фенил-N-этиламино)пропионат
(а) Этил
3-(4-бензилоксифенил)-2-(N-фенил-N-этиламино) пропионат
Реакцию и постобработку проводят согласно Ссылочному примеру 5
(а), используя 4,50 г этил
3-(4-бензилоксифенил)-2-метансульфонилоксипропионата и 5,6 мл N-этиланилина, получая 6,30 г смеси требуемого соединения и N-этиланилина в виде сиропа.
1)1H ЯМР спектр:
δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе,
представляет следующее:
1,07 (3H, t, 3H, J=7 Гц), 1,14 (3H, t, J=7 Гц), 3,01- 3,45 (4H, m), 4,09 (2H, q, J= 7 Гц), 4,39 (1H, t, J=7,5 Гц), 5,02 (2H, s), 6,66-6,75 (3H, m), 6,87 (2H, d, J=8
Гц), 7,10 (2H, d, J=8,5 Гц),
7,15-7,25 (2H, m), 7,31-7,44 (5H, m).
(b) Этил 3-(4-гидроксифенил)-2-(N-фенил-N-этиламино) пропионат
Реакцию и постобработку проводят согласно
Ссылочному примеру 5 (b),
используя 6,30 г смеси этил 3-(4-бензилоксифенил)- 2-(N-фенил-N-этиламино)пропионата и N-этиланилина, полученной в Ссылочном примере 6 (а), получая 2,37 г требуемого
соединения в виде сиропа.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве
внутреннего стандарта в
дейтерированном хлороформе, представляет следующее:
1,07 (3H, t, J=7 Гц), 1,15 (3H, t, J=7 Гц), 3,05 (1H, d,d, J=8,14 Гц), 3,26 (1H, d,d, J=7,5, 14 Гц), 3,30-3,46 (2H,
m), 4,10 (2H, q, J=7
Гц), 4,38 (1H, t, J=8 Гц), 4,75 (1H, br.s), 6,67-6,79 (5H, m), 7,05 (2H, d, J=8,5 Гц), 7,18-7,26 (2H, m).
Ссылочный пример 7. Метил
3-(4-гидроксифенил)-2-(фенилтио) пропионат
(а) Метил 3-(4-метоксиметоксифенил)-2-(фенилтио)пропионат
Раствор 15 мл N,N-диметилформамида, содержащего 745 мг метил
3-(4-метоксиметоксифенил)-2-метансульфонилоксипропионата, 310 мг
тиофенола и 390 мг карбоната калия, перемешивают при 50oC в течение 0,5 часов и к реакционной смеси добавляют этилацетат и
воду. Затем этилацетатный слой отделяют и сушат над безводным
сульфатом магния. Этилацетатный слой концентрируют при пониженном давлении и остаток подвергают колоночной хроматографии на силикагеле
(этилацетат:гексан = 1:4), получая 698 мг требуемого соединения
в виде сиропа.
1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с
использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта
в дейтерированном хлороформе, представляет следующее:
3,00 (1H, d,d, J=6,5, 14 Гц), 3,15 (1H, d,d, J=9, 14 Гц), 3,47 (3H,
s), 3,59 (3H, s), 3,86 (1H, d,d, J=6,5, 9 Гц), 5,15 (2H, s), 6,94
(2H, d, J=8,5 Гц), 7,10 (2H, d, J=8,5 Гц), 7,29-7,33 (3H, m), 7,40-7,45 (2H, m).
(b) Метил
3-(4-гидроксифенил)-2-(фенилтио)пропионат
Раствор 689 мг метил
3-(4-метоксиметоксифенил)-2- (фенилтио)пропионата, полученного в Ссылочном примере 7 (а), в 3 мл смеси: 4н. хлористый
водород-диоксан перемешивают при комнатной температуре в течение 0,5 часа и
концентрируют при пониженном давлении. Остаток растворяют в этилацетате и воде и затем этилацетатный слой отделяют и сушат
над безводным сульфатом магния. Растворитель выпаривают, получая 595 мг
требуемого соединения в виде сиропа.
1)1H ЯМР спектр: δ ppm;
1H ЯМР
спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в
качестве внутреннего стандарта в дейтерированном хлороформе, представляет следующее:
2,99 (1H, d,d, J=6,5, 14 Гц), 3,12
(1H, d,d, J=9, 14 Гц), 3,58 (3H, s), 3,86 (1H, d,d, J=6,5, 9 Гц), 4,97
(1H, br s), 6,72 (2H, d, J=8,5 Гц), 7,05 (2H, d, J=8,5 Гц), 7,23-7,34 (3H, m), 7,40-7,45 (2H, m).
Ссылочный
пример 8. Этил 3-(4-гидроксифенил)-2- пирролилпропионат
(а) Этил
3-(4-бензилоксифенил)-2-пирролилпропионат 3,30 г 1,4-дихлор-1,4-диметоксибутана добавляют к раствору 3,30 г этил
3-(4-бензилоксифенил)-2-аминопропионата в 80 мл дихлорметана и к полученной смеси
дополнительно добавляют 20 г Amberlist А-21 с последующим перемешиванием смеси при комнатной температуре в течение 18
часов. После реакции реакционную смесь фильтруют. Фильтрат концентрируют и
остаток очищают с помощью колоночной хроматографии на силикагеле (этилацетат:гексан = 1:5), получая 1,00 г требуемого
соединения в виде сиропа.
1)1H ЯМР спектр: δ
ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве
внутреннего стандарта в дейтерированном хлороформе, представляет следующее:
1,
19 (3H, t, J=7 Гц), 3,19 (1H, d,d, J=8,5, 14 Гц), 3,34 (1H, d,d, J=7, 14 Гц), 4,14 (2H, q, J=7 Гц), 4,68 (1H, d,d,
J=8,5 Гц), 5,01 (2H, s), 6,15 (2H, t, J=2 Гц), 6,73 (2H, t, J=2 Гц), 6,84 (2H, d,
J=8,5 Гц), 6,94 (2H, d, J=8,5 Гц), 7,28-7,43 (5H, m).
(b) Этил 3-(4-гидроксифенил)-2-[N-(фенил)
этиламино]пропионат
Реакцию и постобработку проводят согласно Ссылочному
примеру 5 (b), используя 1,00 г этил 3-(4- бензилоксифенил)-2-пирролилпропионата, полученного в Ссылочном примере 8
(а), и 0,12 г 5% палладий-углерода, получая 0,71 г требуемого соединения в виде
сиропа.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц),
определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в
дейтерированном хлороформе, представляет следующее:
1,20 (3H, t, J=7 Гц), 3,18 (1H, d,d, J=8,5, 14 Гц),
3,33 (1H, d,d, J=7, 14 Гц), 4,15 (2H, q, J=7 Гц), 4,67 (1H, d,d, J=7, 8,5 Гц), 4,80
(1H, s), 6,14 (2H, t, J= 2 Гц), 6,71 (2H, d, J=8,5 Гц), 6,72 (2H, d, J=2 Гц), 6,88 (2H, d, J=8,5 Гц).
Ссылочный пример 9. Этил 2-(N,N-диэтиламино)-3-(4- гидроксифенил) пропионат
0,3 мл уксусной кислоты и 0,5 мл ацетальдегида добавляют к раствору 491 мг гидрохлорида DL-тирозин
этилового сложного эфира в 5 мл метанола. Туда при охлаждении льдом добавляют цианборгидрид
натрия (126 мг) с последующим перемешиванием смеси при комнатной температуре в течение 2 часов. После
реакции реакционную смесь концентрируют. Остаток растворяют в этилацетате и воде, затем
этилацетатный слой отделяют. Экстракт промывают водным раствором бикарбоната натрия, сушат над безводным
сульфатом магния и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной
хроматографии на силикагеле (метанол: дихлорметан = 1:20), получая 420 мг требуемого соединения в виде
сиропа.
1)1H ЯМР спектр: δ ppm;
1H ЯМР
спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего
стандарта в
дейтерированном хлороформе, представляет следующее:
1,02 (6H, t, J=7 Гц), 1,16 (3H,
t, J=7 Гц), 2,53 (2H, sextet, J=7 Гц), 2,79 (2H, sextet, J=7 Гц), 2,81 (1H, d,d, J=6, 13,5 Гц), 2,99 (1H, d,
d, J=9, 13,5 Гц), 3,55 (1H, d,d, J=6, 9 Гц), 4,02-4,11 (2H, m), 6,72 (2H, d, J-8,5 Гц), 7,
02 (2H, d, J=8,5 Гц).
Ссылочный пример 10. Этил 2-N-(трет-бутоксикарбонил)
этиламино-3-(4-гидроксифенил) пропионат
(а) Этил 2-этиламино-3-(4-гидроксифенил)пропионат
Реакцию и постобработку проводят согласно Ссылочному примеру 9, используя 983 мг
гидрохлорида DL-тирозин этилового сложного эфира, 0,26 мл ацетальдегида и 100 мг цианборгидрида натрия, получая 515 мг
требуемого соединения в виде сиропа, который вскоре кристаллизуется.
1) т. пл. 87-89oC
2)1H ЯМР спектр: δ ppm;
1H ЯМР спектр
(270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве
внутреннего стандарта в дейтерированном хлороформе, представляет следующее:
1,08 (3H, t, J=7 Гц), 1,18 (3H, t, J=7
Гц), 2,48-2,72 (2H, m), 2,82-2,96 (2H, m), 3,50 (1H, t, J=7 Гц), 4,11 (2H, q,
J=7 Гц), 6,68 (2H, d, J=8,5 Гц), 7,01 (2H, d, J=8,5 Гц).
(b) Этил
2-N-(трет-бутоксикарбонил)этиламино-3-(4- гидроксифенил)пропионат
1 мл триэтиламина добавляют по каплям при
охлаждении льдом к раствору 569 мг этил 2-этиламино-3-(4-гидроксифенил)пропионата,
полученного в Ссылочном примере 10 (а), 785 мг ди-трет-бутилдикарбоната в 10 мл дихлорметана и смесь перемешивают при
комнатной температуре в течение 4 часов. После реакции реакционную смесь
концентрируют. Остаток растворяют в этилацетате и воде и затем этилацетатный слой отделяют. Экстракт сушат над безводным
сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают
колоночной хроматографии на силикагеле (этилацетат: гексан = 1:2), получая 663 мг требуемого соединения в виде сиропа.
1)1H ЯМР спектр: δ ppm;
1H
ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в
дейтерированном хлороформе, представляет следующее:
0,90 (3H, br t, J=7 Гц), 1,
21-1,31 (3H, m), 1,45 (9H, s), 3,15-3,37 (1H, m), 3,08 (1H, d,d, J=10, 14 Гц), 3,15-3,37 (1H, m), 3,24 (1H, d,d,
J=5, 14 Гц), 3,85-4,30 (3H, m), 6,76 (2H, br d, J=8,5 Гц), 7,00-7,11 (2H, m).
Ссылочный пример 11. Этил 3-(4-гидроксифенил)-2-(метилтио) пропионат
(а) Этил
3-(4-метоксиметоксифенил)-2-метилтиопропионат
Раствор 17,2 г этил
3-(4-метоксиметоксифенил)-2-метан- сульфонилоксипропионата, 4,20 г тиометоксида натрия в 300 мл N,N-диметилформамида
перемешивают при 50oC в течение 1,5 часов. После реакции к реакционной
смеси добавляют этилацетат и воду. Затем этилацетатный слой отделяют и сушат над безводным сульфатом магния.
Полученный таким образом экстракт концентрируют и остаток подвергают колоночной
хроматографии на силикагеле (этилацетат: гексан = 1:4), получая 11,37 г требуемого соединения в виде сиропа.
1)1H ЯМР спектр: δ ppm;
1H ЯМР
спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в дейтерированном
хлороформе, представляет следующее:
1,22 (3H, t, J=7 Гц), 2,17 (3H,
s), 2,91 (1H, d,d, J=6,5, 14 Гц), 3,15 (1H, d,d, J=9, 14 Гц), 3,41 (1H, d,d, J=6,5, 9 Гц), 3,47 (2H, s), 4,09-4,23 (2H, m),
5,15 (3H, s), 6,96 (2H, d, J=8,5 Гц), 7,13 (2H, d, J=8,5 Гц).
(b) Этил 3-(4-гидроксифенил)-2-(метилтио)пропионат
Реакцию и постобработку проводят согласно Ссылочному примеру
7 (b), используя 2,01 г этил
3-(4-метоксиметоксифенил)-2- (метилтио)пропионата, полученного в Ссылочном примере 11 (а), и 11 мл смеси: 4н. хлористый водород-диоксан, получая 1,70 г требуемого
соединения.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта
в дейтерированном хлороформе,
представляет следующее:
1,22 (3H, t, J=7,5 Гц), 2,17 (3H, s), 2,89 (1H, d,d, J=6,5, 14 Гц), 3,13 (1H, d,d, J=9, 14 Гц), 3,41 (1H, d,d, J=6,5, 14 Гц), 4,09-4,20
(2H, m), 5,05 (1H, s), 6,74
(2H, d, J=8,5 Гц), 7,07 (2H, d, J=8,5 Гц).
Ссылочный пример 12. Этил 2-(4-гидроксибензил)-5- фенилвалерат
(а) Диэтил
2-(4-бензилоксибензил)-2-(3-фенилпропил)малонат
0,48 г гидрида натрия (55% масляная суспензия) добавляют к смеси 2,78 г диэтил 2-(3-фенилпропил)малоната, 20 мл толуола и 10 мл N,
N-диметилацетамида и полученную смесь перемешивают при комнатной
температуре в течение 30 минут. Затем к реакционной смеси добавляют 2,45 г 4- бензилоксибензилхлорида и смесь перемешивают при
комнатной температуре в течение 30 минут и затем при 60oC в
течение 30 минут. После реакции к реакционной смеси добавляют этилацетат и воду и затем этилацетатный слой отделяют. Полученный
таким образом экстракт сушат над безводным сульфатом магния и
концентрируют. Полученный таким образом остаток подвергают колоночной хроматографии на силикагеле (этилацетат: гексан = 1:9), получая 3,91
г требуемого соединения в виде сиропа.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в
качестве внутреннего стандарта в дейтерированном хлороформе,
представляет следующее:
1,21 (6H, s), 1,57-1,66 (2H, m), 1,76-1,85 (2H, m), 2,61 (2H, t, J=6,5 Гц), 3,14 (2H, s), 4,15 (4H, d,q,
J=1,5, 7 Гц), 5,01 (2H, s), 6,79 (2H, d, J=8,5 Гц), 6,89 (2H,
d, J=8,5 Гц), 7,15-7,44 (10H, m).
(b) Этил 2-(4-бензилоксибензил)-5-фенилвалерат
2,00 г гидроксида калия
добавляют к смеси 3,91 г диэтил
2- (4-бензилоксибензил)-2-(3-фенилпропил)малоната, полученного в Ссылочном примере 12 (а), 30 мл 2-метоксиэтанола и 3 мл воды и полученную смесь перемешивают на
масляной бане при 130oC в
течение 1,5 часов. После реакции реакционную смесь концентрируют, к сконцентрированной смеси добавляют воду и этилацетат и, чтобы сделать ее кислой, туда добавляют
6н. хлористоводородную кислоту.
Затем этилацетатный слой отделяют, промывают водным раствором NaCl и сушат над безводным сульфатом магния, после чего концентрируют. Остаточный сироп растворяют в 20 мл
ксилола и смесь перемешивают в
течение одного часа и концентрируют. Полученную таким образом сиропоподобную 2-(4-бензилоксибензил)-5-фенилвалериановую кислоту растворяют в 40 мл этанола и туда
добавляют 1 мл конц. серной кислоты.
Полученную смесь перемешивают при 80oC в течение 3 часов и дают ей возможность стоять при комнатной температуре в течение 16 часов. Реакционную смесь
концентрируют и остаток растворяют в
этилацетате и воде, после чего отделяют этилацетатный слой. Полученный таким образом экстракт сушат над безводным сульфатом магния и концентрируют, получая 3,32 г
требуемого соединения в виде
сиропа.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в
качестве внутреннего стандарта в
дейтерированном хлороформе, представляет следующее:
1,13 (3H, t, J=7 Гц), 1,50-1,80 (4H, m), 2,53-2,71 (4H, m), 2,82-2,90 (1H, m), 4,04 (2H, q, J=7 Гц), 5,04
(2H, s), 6,87 (2H, d, J=8,5 Гц),
7,05 (2H, d, J=8,5 Гц), 7,10-7,44 10H, m).
(с) Этил 2-(4-гидроксибензил)-5-фенилвалерат
Реакцию и постобработку проводят согласно Ссылочному
примеру 5(b), используя 3,32 г
этил 2-(4-бензилоксибензил)-5-фенилвалерата, полученного в Ссылочном примере 12(b), и 0,4 г 5% палладий- углерода, получая 2,56 г требуемого соединения в виде сиропа.
1)1H
ЯМР спектр:δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в
дейтерированном хлороформе, представляет
следующее:
1,14 (3H, t, J=7 Гц), 1,50-1,75 (4H, m), 2,53-2,71 (4H, m), 2,78- 2,87 (1H, m), 4,05 (2H, q, J=7 Гц), 6,70 (2H, d, J=8,5 Гц), 6,98 (2H, d,
J=8,5 Гц), 7,12-7,29 (5H, m).
Ссылочный пример 13. Этил 3-(4-гидроксифенил)-2- феноксипропионат
(а) Диэтил 2-(4-бензилоксибензил)-2-феноксималонат
Реакцию и
постобработку проводят согласно Ссылочному
примеру 12 (а), используя 2,81 г диэтилфеноксималоната, 2,59 г 4-бензилоксибензилхлорида и 530 мг гидрида натрия (55% масляная суспензия), получая 3,10 г
требуемого соединения в виде сиропа.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в
качестве внутреннего стандарта в
дейтерированном хлороформе, представляет следующее:
1,12 (6H, t, J=7 Гц), 3,57 (2H, s), 4,15 (4H, q, J=7 Гц), 5,02 (2H, s), 6,84-7,14 (6H, m), 7,22-7,41 (8H,
m).
(b) Этил
3-(4-бензилоксифенил)-2-феноксипропионат
Реакцию и постобработку проводят согласно Ссылочному примеру 12 (b), используя 3,10 г диэтил
2-(4-бензилоксибензил)-2- феноксималоната, полученного в
ссылочном примере 13 (а), и 2,10 г гидроксида калия, получая 2,10 г требуемого соединения в виде сиропа через сиропоподобную
3-(4-бензилоксифенил)-2-феноксипропионовую кислоту.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС
(тетраметилсилан) в качестве внутреннего стандарта в дейтерированном хлороформе,
представляет следующее:
1,18 (3H, t, J=7 Гц), 3,11-3,20 (2H, m), 4,16 (2H, q, J=7 Гц), 4,74 (1H, d, d, J=5,5,
6,5 Гц), 5,04 (2H, s), 6,84 (2H, d, J=8 Гц), 6,91 (2H, d, J=8,5 Гц), 6,92-6,97
(1H, m), 7,05-7,09 (1H, m), 7,22 (2H, d, J=8,5 Гц), 7,20-7,43 (6H, m).
(с) Этил
3-(4-гидроксифенил)-2-феноксипропионат
Реакцию и постобработку проводят согласно Ссылочному
примеру 5(b), используя 2,10 г этил 3-(4-бензилоксифенил)-2- феноксипропионата, полученного в
Ссылочном примере 13(b), и 0,32 г 5% палладий-углерода, получая 1,01 г требуемого соединения в виде
сиропа.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр
(270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в
дейтерированном хлороформе, представляет следующее:
1,19 (3H, t, J=7 Гц), 3,10-3,24 (2H, m),
4,17 (2H, q, J=7 Гц), 4,74 (1H, d,d, J=6, 7 Гц), 5,00 (1H, s), 6,74 (2H, d, J=8,5 Гц), 6,84 (2H,
d, J=8 Гц), 6,95 (1H, t, J=7,5 Гц), 7,16 (2H, d, J=8,5 Гц), 7,21-7,26 (2H, m).
Ссылочный пример 14. Этил 2-(4-гидроксибензил)капроат
(а) Диэтил
2-(4-бензилоксибензил)-2-бутилмалонат
Реакцию и постобработку проводят согласно Ссылочному примеру 12 (а), используя
2,16 г диэтилбутилмалоната, 2,44 г 4-бензилоксибензилхлорида и 480 мг
гидрида натрия (55% масляная суспензия), получая 3,67 г требуемого соединения в виде кристаллов.
1) т. пл. 73oC
2)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта в
дейтерированном хлороформе, представляет следующее:
0,91 (3H, t,
J=7 Гц), 1,24 (6H, t, J=7 Гц), 1,20-1,38 (4H, m), 1,74-1,80 (2H, m), 3,18 (2H, s), 4,11-4,23 (4H, m), 5,02 (2H, s), 6,86 (2H,
d, J=8,5 Гц), 6,99 (2H, d, J=8,5 Гц), 7,31-7,44 (5H, m).
(b) Этил 2-(4-бензилоксибензил)капроат
Реакцию и постобработку проводят согласно Ссылочному примеру 12 (b), используя
3,60 г диэтил 2-(4- бензилоксибензил)-2-бутилмалоната, полученного в
Ссылочном примере 14 (а), и 2,00 г гидроксида калия, получая 2,71 г требуемого соединения в виде сиропа через кристаллическую
2-(4- бензилоксибензил) капроновую кислоту.
1)1H ЯМР спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан)
в качестве внутреннего стандарта в дейтерированном хлороформе,
представляет следующее:
0,87 (3H, t, J=7 Гц), 1,14 (3H, t, J=7 Гц), 1,20-1,70 (6H, m), 2,51-2,72 (2H, m), 2,85 (1H, d,d, J=8,5,
13,5 Гц), 4,05 (2H, q, J=7 Гц), 5,03 (2H, s), 6,88 (2H, d, J=8,
5 Гц), 7,07 (2H, d, J=8,5 Гц), 7,31-7,45 (5H, m).
(с) Этил 2-(4-гидроксибензил)капроат
Реакцию и постобработку
проводят согласно Ссылочному примеру 5 (b), используя 2,71 г
этил 2-(4-бензилоксибензил)капроата, полученного в Ссылочном примере 14 (b), и 0,40 г 5% палладий-углерода, получая 1,90 г требуемого
соединения в виде сиропа.
1)1H ЯМР
спектр: δ ppm;
1H ЯМР спектр (270 МГц), определенный с использованием ТМС (тетраметилсилан) в качестве
внутреннего стандарта в дейтерированном хлороформе, представляет
следующее:
0,87 (3H, t, J=7 Гц), 1,16 (3H, t, J=7 Гц), 1,20-1,35 (4H, m), 1,40-1,70 (2H, m), 2,53-2,72 (2H, m), 2,84 (1H, d,d,
J=8,5, 13,5 Гц), 4,06 (2H, q, J=7 Гц), 4,93 (1H, s), 6,72 (2H,
d,J=8,5 Гц), 7,02 (2H, d, J=8,5 Гц).
[Тест пример] Действие, понижающее уровень глюкозы в крови (Способ 1)
1
мг/кг каждого соединения смешивают в растворителе, состоящем из
полиэтиленгликоля 400 и 0,5% мас./об. карбоксиметилцеллюлозы при отношении 1:1 в физиологическом насыщенном растворе соли, и вводят
перорально гипергликемическим самцам-мышам линии KK, имеющим вес
тела 40 г или выше. Животных выдерживают при хорошем кормлении в течение 18 часов. Затем отбирают пробы крови из хвостовой вены в
отсутствие анестезии с последующим измерением уровня глюкозы в крови,
используя анализатор глюкозы (GL-101: Mitsubishi Chemical Corp.).
Степень понижения уровня глюкозы в крови
рассчитывают по следующему уравнению:
Степень понижения глюкозы
(%) =
[(уровень глюкозы группы животных, которой вводили растворитель, - уровень глюкозы группы животных, которой
вводили соединение формулы (I) /уровень глюкозы группы животных, которой
вводили растворитель] х 100
Полученные результаты представлены в Таблице 69.
Из Таблицы 69 можно видеть, что соединения данного изобретения имеют превосходное понижающее уровень глюкозы действие.
Действие, понижающее уровень глюкозы в крови (Способ 2)
Каждое из
испытываемых соединений смешивают с порошкообразной пищей F-2 (Funabashi Farms)
при соотношении 0,01% (около 10 мг/кг/день). Смесь вводят перорально гипергликемическим самцам-мышам линии KK, имеющим
вес тела 40 г или выше, на протяжении трех дней. Другой группе мышей дают только
порошкообразную пищу и эту группу используют в качестве контрольной группы. Затем отбирают образцы крови из хвостовой
вены в отсутствие анестезии и измеряют уровень глюкозы в крови в плазме,
полученной путем разделения центрифугированием, используя Glucorotor F (A & T Corp.).
Степень понижения
(уровня) глюкозы в крови (%) =
[(уровень глюкозы контрольной
группы - уровень глюкозы группы, которой вводили испытываемое соединение)/уровень глюкозы контрольной группы] х 100
Полученные результаты представлены в Таблице 70
Из таблицы 70
можно видеть, что соединения данного изобретения обладают превосходным понижающим уровень глюкозы в крови действием.
[Пример приготовления лекарственного препарата]
(1)
Капсула
Соединение примера 2 - 10 мг
Лактоза - 110 мг
Кукурузный крахмал - 58 мг
Стеарат
магния - 2 мг - 180 мг
Порошок каждого компонента, указанного
выше, хорошо перемешивают и пропускают через сито 60 меш (стандарт меш основан на Tyler). Чтобы получить капсулу, 180 мг
полученного таким образом порошка взвешивают и им заполняют желатиновую
капсулу (N 3).
(2) Таблетка
Соединение примера 2 - 10 мг
Лактоза - 85 мг
Кукурузный
крахмал - 34 мг
Тонкоизмельченная кристаллическая целлюлоза
- 20 мг
Стеарат магния - 1 мг - 150 мг
Порошок каждого компонента, представленного выше, хорошо перемешивают и
формуют прессованием в таблетку весом 150 мг. При необходимости, эти
таблетки могут быть покрыты сахаром или пленкой.
(3) Гранула
Соединение примера 2 - 10 мг
Лактоза - 839 мг
Кукурузный крахмал - 150 мг
Гидроксипропилцеллюлоза - 1 мг - 1000 мг
Порошок каждого компонента, представленного выше, хорошо перемешивают и увлажняют
чистой водой, после чего гранулируют посредством гранулятора
барабанного типа и сушат, получая гранулу.
[Промышленная применимость]
Производные фенилалкилкарбоновой кислоты,
их фармакологически приемлемые соли или их фармакологически
приемлемые сложные эфиры используют в качестве терапевтических или профилактических средств для многих заболеваний. Примеры таких
заболеваний включают гиперлипемию, гипергликемию, состояние
нарушенной толерантности к глюкозе (the state of impaired glucose tolerance), состояние инсулинорезистентности с ненарушенной толерантностью
к глюкозе (the state of insulin resistant non-IGT),
гипертензию, остеопороз, панкреатит, диабетическое осложнение, артериосклероз, катаракта, обусловленный беременностью диабет, синдром поликистоза
яичников, воспалительные заболевания, псориаз, астма,
артериосклероз, аутоиммунные болезни и т.п.
Дополнительные примеры
Все1H-ЯМР спектры определяли в указанных
растворителях, химические сдвиги приведены в единицах
δ в слабом поле относительно тетраметилсилана (ТМС), использованного в качестве внутреннего стандарта, константы межпротонного
спин-спинового взаимодействия приведены в Герцах (Гц).
Дополнительный пример 1
Этил 2- (4-хлорфенокси)-3-[4-[2-[[1-[4-(2-пиридил)фенил]
этилиден]аминоокси]этокси]фенил]пропионат
К раствору этил
2-(4-хлорфенокси)-3-(4- гидроксифенил)пропионата (504 мг), представляющего собой продукт дополнительного ссылочного примера 5(d), в
смеси диметилсульфоксида (2 мл) и толуола (2 мл) добавляли гидрид
натрия (55%, 85 мг) и смесь перемешивали при 40oC в течение часа. К смеси добавляли по каплям раствор
O-2-(метанметансульфонилокси) этилового простого эфира оксима
4'-(2-пиридил)ацетофенона (649 мг), который представляет собой продукт ссылочного примера 2, в диметилсульфоксиде (2 мл). Реакционную
смесь перемешивали при 60oC в течение 4 часов и
добавляли этилацетат и воду. Органический слой отделяли, промывали насыщенным солевым раствором и сушили над безводным сульфатом магния, а
затем концентрировали при пониженном давлении. Остаток
очищали колоночной хроматографией на силикагеле с использованием смеси гексан/этилацетат =9/1 в качестве элюента, получая указанное в заголовке
соединение (504 мг) в виде бесцветного масла.
1H ЯМР (270 МГц, CDCl3): δ м.д.
1,19 (3H, т, J=7,0 Гц), 2,26 (3H, с), 3,17 (2H, д, J=6,5 Гц), 4,17 (2H, кв, J=7,0 Гц), 4,28 (2H, т, J=5,0 Гц), 4,54 (2H, т, J=5,0 Гц), 4,69 (1H, т, J= 6,5 Гц), 6,76 (2H, д, J=8,5 Гц), 6,90 (2H, д, J=8,5 Гц), 7,16-7,26 (5H, м), 7,74-7,77 (4H, м), 8,00 (2H, д, J=8,5 Гц), 8,70-8,71 (1H, м).
Дополнительный пример 2
2-(4-Хлорфенокси)-3-[4-[2-[[1-[4-(2-пиридил)фенил] этилиден] аминоокси] этокси]фенил]пропионовая кислота
К
раствору этил
2-(4-хлорфенокси)-3-[4-[2-[[1-[4- (2-пиридил)фенил] этилиден] аминоокси] этокси]фенил] пропионата (500 мг), который представляет собой продукт дополнительного примера 1, в этаноле (8 мл)
добавляли
водный раствор гидроксида натрия (1н. , 1,79 мл) и смесь нагревали при кипении с обратным холодильником в течение 3 часов. Реакционную смесь упаривали при пониженном давлении. Для
нейтрализации
остатка добавляли соляную кислоту (1н.) и к нейтрализованному остатку добавляли этилацетат. Этилацетатный слой отделяли, промывали насыщенным солевым раствором и сушили над безводным
сульфатом магния,
а затем концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с использованием смеси хлористый метилен/метанол = 9/1 в качестве элюента,
получая указанное
в заголовке соединение (169 мг) в виде вспененной бесцветной массы.
1H ЯМР (270 МГц, CDCl3): δ м.д.
2,17 (3H, с), 2,99 (2H, ушир.с), 4,13 (2H, ушир.с), 4,45 (3H, ушир.с), 6,55-7,16 (9H, м), 7,66 (4H, д, J=8,5 Гц), 7,89 (2H, д, J=8,5 Гц), 8,63 (1H, д, J=5,0 Гц).
Дополнительный пример 3
Этил
3-[4-[2-[[1-(4'-фтор-4-бифенилил) этилиден]аминоокси]этокси]фенил] -2-(4-фторфеноксй)пропионат
Реакцию осуществляли способом, аналогичным описанному в дополнительном примере 1, с
использованием этил 2-(4-фторфенокси)-3-(4-гидроксифенил)пропионата (1,8 г), представляющего собой продукт дополнительного ссылочного примера 6(b), гидрида натрия (55%, 271 мг) и
2-[[1-(4'-фтор-4-бифенилил) этилиден] аминоокси] этилметансульфоната (2,14 г), представляющего собой продукт дополнительного ссылочного примера 7(b), и обрабатывали реакционную смесь, получая
указанное в заголовке соединение (1,45 г) в виде белого порошка.
т.пл. 103 - 105oC
1H ЯМР (270 МГц, CDCl3): δ м.д.
1, 20 (3H, т, J=7,0 Гц), 2,26 (3H, с), 3,16 (2H, д, J=6,5 Гц), 4,17 (2H, кв, J=7,0 Гц), 4,27 (2H, т, J=4,5 Гц), 4,54 (2H, т, J=4,5 Гц), 4,66 (1H, т, J= 6,5 Гц), 6,74-6,79 (2H, м), 6,88-6,94 (4H, м), 7, 13 (2H, т, J=8,5 Гц), 7,21 (2H, д, J=8,5 Гц), 7,52-7,59 (4H, м), 7,71 (2H, д, J=8,5 Гц).
Дополнительный пример 4
3-[4-[2-[[1-(4'-Фтор-4-бифенилил)этилиден] аминоокси]
этокси]
фенил]-2-(4-фторфенокси)пропионовая кислота
Реакцию осуществляли способом, аналогичным описанному в дополнительном примере 2, с использованием этил
3-[4-[2-[[1- (4'-фтор-4-бифенилил)этилиден]
аминоокси]этокси]фенил]-2- (4-фторфенокси)пропионата (1,44 г), представляющего собой продукт дополнительного примера 3, и водного раствора гидроксида
натрия (1н., 5,0 мл), и обрабатывали реакционную
смесь, получая указанное в заголовке соединение (1,13 г) в виде бесцветных кристаллов.
т.пл. 109-110oC
1
H ЯМР (270 МГц, CDCl3): δ
м.д.
2,25 (3H, с), 3,18-3,21 (2H, м), 4,27 (2H, т, J=5,0 Гц), 4,54 (2H, т, J= 5,0 Гц), 4,72 (1H, т, J=5,5 Гц), 6,75-6,80 (2H, м), 6,88- 6, 89 (4H, м), 7,13 (2H, т, J=8,5 Гц), 7,21 (2H, д, J=8,5 Гц), 7,52- 7,58 (4H, м), 7,70 (2H, д, J=8,5 Гц).
Дополнительный пример 5
2-Триметилсилилэтил
(S)-3-[4-[2-[[1-(4-бифенилил)этилиден] аминоокси]
этокси]фенил]-2-(4-метилфенокси)пропионат
К раствору 2-[1-(4-бифенилил)этилиденаминоокси]этанола (288 мг), представляющего собой продукт
ссылочного примера 3(b), 2- триметилсилилэтил
(S)-3-(4-гидроксифенил)-2-(4- метилфенокси)пропионата (280 мг), представляющего собой продукт дополнительного ссылочного примера 1(e), и трифенилфосфина
(296 мг) в толуоле (10 мл) добавляли по каплям
при 0oC раствор диизопропилазобикарбоксилата (40% в толуоле (0,61 мл)). Затем реакционную смесь перемешивали при температуре окружающей среды
в течение 16 часов. Реакционную смесь упаривали
при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле с использованием смеси гексан/этилацетат = 9/1 в качестве элюента,
получая указанное в заголовке соединение (270 мг) в
виде бесцветного масла.
1H ЯМР (270 МГц, CDCl3): δ м.д.
0,01 (9H, с), 0,92 (2H, т, J= 8,5 Гц), 2,24 (3H, с), 2,26 (3H, с), 3,14-3,17 (2H, м), 4,10-4,23 (2H, м), 4,27 (2H, т, J=5,0 Гц), 4,54 (2H, т, J= 5,0 Гц), 4,66 (1H, т, J=6,5 Гц), 6,73 (2H, д, J=8,5 Гц), 6,89 (2H, д, J= 8,5 Гц), 7, 02 (2H, д, J=8,5 Гц), 7,21 (2H, д, J=8,5 Гц), 7,33-7, 48 (3H, м), 7,58-7,62 (4H, м), 7,71 (2H, д, J=8,5 Гц).
Дополнительный пример 6
(S)-3-[4-[2-[[1-(4-Бифенилил)этилиден]
аминоокси]этокси] фенил]-2-(4-метилфенокси) пропионовая
кислота
К раствору 2-триметилсилилэтил (S)-3-[4-[2-[[1- (4-бифенилил)этилиден] аминоокси] этокси] фенил]
-2- (4-метилфенокси)-пропионата, представляющего собой продукт дополнительного примера
5, в тетрагидрофуране (5 мл) добавляли 1М раствор фторида тетрабутиламмония в тетрагидрофуране (1,1 мл) и смесь
перемешивали при температуре окружающей среды в течение 1,5 часов. Затем реакционную
смесь упаривали при пониженном давлении, для нейтрализации остатка добавляли водный раствор хлористого водорода
(1н.) и к нейтрализованному остатку добавляли этилацетат. Этилацетатный слой отделяли,
промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, а затем концентрировали при
пониженном давлении. Кристаллы собирали фильтрованием с использованием гексана, получая
указанное в заголовке соединение (210 мг) в виде бесцветных кристаллов.
т.пл. 128 - 130oC
1H ЯМР (270 МГц, CDCl3): δ м.д.
2,26 (6H, с), 3,21 (2H, д, J=6,5 Гц), 4,27 (2H, т, J=5,0 Гц), 4,54 (2H, т, J= 5,0 Гц), 4,78 (1H, т, J=6,5 Гц), 6,75 (2H, д, J=8,5 Гц), 6,89 (2H, д, J= 8,5 Гц), 7,05 (2H, д, J=8,5 Гц), 7,21 (2H, д, J=8,5 Гц), 7,31-7,48 (3H, м), 7,58-7,62 (4H, м), 7,71 (2H, д, J=8,5 Гц).
Дополнительный
пример 7
2-Триметилсилилэтил (S)-3-[4-[2-[[1-[4-(2-пиридил)фенил)
этилиден]аминоокси]этокси]фенил]-2-(4-метилфенокси)пропионат
Реакцию осуществляли способом, аналогичным описанному
в дополнительном примере 5, с использованием 2-[[1-[4-(2-пиридил)
фенил]этилиден]аминоокси] этанола (1,65 г), представляющего собой продукт ссылочного примера 1 (d), 2-триметилсилилэтил
S-3- (4-гидроксифенил)-2-(4-метилфенокси)-пропионата (1,60 г), представляющего
собой продукт дополнительного ссылочного примера 1(e), трифенилфосфина (1,69 г) и раствора диизопропилазодикарбоксилата
(40% в толуоле (3,47 мл)), и обрабатывали реакционную смесь, получая указанное в
заголовке соединение (2,20 г) в виде бесцветного масла.
1H ЯМР (270 МГц, CDCl3): δ м.д.
0,00 (9H, с), 0,91 (2H, т, J= 8,5 Гц), 2,24 (3H, с), 2,26 (3H, с), 3,14-3,17 (2H, м), 4,09-4,23 (2H, м), 4,26 (2H, т, J=5,0 Гц), 4,54 (2H, т, J= 5,0 Гц), 4,64-4,68 (1H, м), 6,71 (2H, д, J=8,5 Гц), 6,87 (2H, д, J=8,5 Гц), 7,01 (2H, д, J=8,5 Гц), 7, 19- 7,28 (3H, м), 7,73-7,79 (4H, м), 8,00 (2H, д, J=8,5 Гц), 8,70 (1H, д, J=5,5 Гц).
Дополнительный
пример 8
(S)-3-[4-[2-[1-[4-(2-Пиридил)фенил)этилиден] аминоокси]
этокси]фенил]-2-(4-метилфенокси)пропионовая кислота
Реакцию осуществляли способом, аналогичным описанному в
дополнительном примере 6, с использованием 2-триметилсилилэтил
(S)-3-[4-[2-[1-[4- (2-пиридил)фенил)-этилиден] аминоокси] этокси] фенил]-2- (4-метилфенокси) пропионата (2,20 г), представляющего собой
продукт дополнительного примера 7, и раствора фторида
тетрабутиламмония в тетрагидрофуране (1М, 9,00 мл), и реакционную смесь обрабатывали, получая указанное в заголовке соединение (1,48 г) в виде
бесцветных кристаллов.
т.пл. 54 - 56oC
1H ЯМР (270 МГц, CDCl3): δ м.д.
2,25 (6H, с), 3,21 (2H, д, J=6,0 Гц), 4,29 (2H, т, J=4,5 Гц), 4,55 (2H, т, J= 4,5 Гц), 4,78 (1H, т, J=6,0 Гц), 6,77 (2H, д, J=8,5 Гц), 6,88 (2H, д, J= 8,5 Гц), 7,03 (2H, д, J=8,5 Гц), 7,21 (2H, д, J=8,5 Гц), 7,26-7,30 (1H, м), 7,69-7,83 (4H, м), 7,89 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=5,0 Гц).
Дополнительный пример 9
2-Триметилсилилэтил (S)-3-[4-[2-[[1-(4-бифенилил)этилиден] аминоокси]
этокси]фенил]-2-(4-трет-бутилфенокси) пропионат
Реакцию осуществляли способом,
аналогичным описанному в дополнительном примере 5, с использованием
2-[1-(4-бифенилил)этилиден]аминоокси]этанола (288 мг), представляющего собой продукт ссылочного примера 3(b), 2- триметилсилилэтил
S-2-(4-трет-бутилфенокси)-3-(4-гидроксифенил) пропионата (311 мг),
представляющего собой продукт дополнительного ссылочного примера 2(e), трифенилфосфина (296 мг) и раствора
диизопропилазодикарбоксилата (40% в толуоле (0,61 мл)), и обрабатывали реакционную смесь,
получая указанное в заголовке соединение (300 мг) в виде бледно-желтого масла.
1H ЯМР (270 МГц, CDCl3): δ м.д.
0,00 (9H, с), 0,92 (2H, т, J= 8,5 Гц), 1,25 (9H, с), 2,25 (3H, с), 3,14-3,17 (2H, м), 4,21-4,28 (4H, м), 4,53 (2H, т, J=4,5 Гц), 4,67 (1H, дд, J= 6,0, 7,5 Гц), 6,75 (2H, д, J=9,0 Гц), 6,88 (2H, д, J=8,5 Гц), 7,19-7,24 (4H, м), 7,32-7,48 (3H, м), 7,57-7,62 (4H, м), 7,71 (2H, д, J=8,5 Гц).
Дополнительный пример 10
(S)-3-[4-[2-[[1-(4-Бифенилил) этилиден] аминоокси]
этокси]фенил]-2-(4-трет-бутилфенокси) пропионовая кислота
Реакцию осуществляли способом, аналогичным описанному в дополнительном
примере 6, с использованием 2-триметилсилилэтил
(S)-3-[4-[2-[1-(4-бифенилил)этилиден] аминоокси] этокси] фенил] -2- (4-трет-бутилфенокси) пропионата (300 мг), представляющего собой продукт
дополнительного примера 9, и раствора фторида
тетрабутиламмония в тетрагидрофуране (1H, 1,20 мл), и обрабатывали реакционную смесь. Затем остаток подвергали колоночной хроматографии на силикагеле с
использованием смесей хлористый
метилен/метанол=24/1 и 19/1 в качестве элюентов. Указанное в заголовке соединение (170 мг) собирали фильтрованием в виде бесцветных кристаллов с использованием смеси
изопропилового эфира и
гексана.
т.пл. 141 - 143oC
1H ЯМР (270 МГц, CDCl3): δ м.д.
1,27 (9H, с), 2,26 (3H, с), 3,21 (2H, д, J=6,5 Гц), 4,27 (2H, т, J=5,0 Гц), 4,54 (2H, т, J=5,0 Гц), 4,81 (1H, т, J=6,5 Гц), 6,79 (2H, д, J=9,0 Гц), 6,89 (2H, д, J= 8,5 Гц), 7,21 (2H, д, J=8,5 Гц), 7,27 (2H, д, J=9,0 Гц), 7,33-7,48 (3H, м), 7,58-7,62 (4H, м), 7,72 (2H, д, J=8,5 Гц).
Дополнительный пример 11
2-Триметилсилилэтил
(S)-2-(4-трет-бутилфенокси)-3-[4- [2-[[1-[4-(2-пиридил)фенил)этилиден]аминоокси]этокси]фенил]
пропионат
Реакцию осуществляли способом, аналогичным описанному в дополнительном примере 5, с
использованием 2-[[1-[4-(2-пиридил) фенил]этилиден]аминоокси] этанола (290 мг), представляющего
собой продукт ссылочного примера 1 (d), 2-триметилсилилэтил
S-2- (4-трет-бутилфенокси)-3-(4-гидроксифенил)пропионата (311 мг), представляющего собой продукт дополнительного ссылочного примера 2(e),
трифенилфосфина (296 мг) и раствора
диизопропилазодикарбоксилата (40% в толуоле (0,61 мл)), и обрабатывали реакционную смесь, получая указанное в заголовке соединение (310 мг) в виде бесцветного
масла.
1H ЯМР (270 МГц, CDCl3):δ м.д.
0,00 (9H, с), 0,92 (2H, т, J= 8,5 Гц), 1,25 (9H, с), 2,26 (3H, с), 3,13-3,17 (2H, м), 4,15-4,28 (4H, м), 4,54 (2H, т, J=4,5 Гц), 4,64-4,69 (1H, м), 6,75 (2H, д, J= 9,0 Гц), 6,88 (2H, д, J=8,5 Гц), 7,19-7,26 (5H, м), 7,72-7,76 (4H, м), 8,00 (2H, д, J=8,5 Гц), 8,69-8,71 (1H, м).
Дополнительный пример 12
(S)-2-(4-трет-Бутилфенокси)-3-[4-[2-[[1-(4-(2-пиридил)фенил] этилиден] аминоокси]этокси]фенил]пропионовая кислота
Реакцию осуществляли способом, аналогичным
описанному в дополнительном
примере 6, с использованием 2-триметилсилилэтил (3)-2-(4-трет-бутилфенокси)-3-[4-[2-[[1-[4-(2-пиридил)фенил] этилиден] аминоокси]этокси]фенил]пропионата (310 мг),
представляющего собой продукт
дополнительного примера 11, и раствора фторида тетрабутиламмония в тетрагидрофуране (1M, 1,7 мл), и обрабатывали реакционную смесь. Затем остаток подвергали колоночной
хроматографии на силикагеле с
использованием смесей хлористый метилен/метанол=24/1 и 19/1 в качестве элюентов. Указанное в заголовке соединение (180 мг) собирали фильтрованием в виде бесцветных
кристаллов с использованием смеси
изопропилового эфира и гексана.
т.пл. 148 - 150oC
1H ЯМР (270 МГц, CDCl3): δ м.д.
1, 30 (9H, с), 2,31 (3H, с), 3,26 (2H, д, J=6,0 Гц), 4,34 (2H, т, J=5,0 Гц), 4,59 (2H, т, J=5,0 Гц), 4,84 (1H, т, J=6,0 Гц), 6,86 (2H, д, J=9,0 Гц), 6,93 (2H, д, J=8,5 Гц), 7,25- 7,35 (5H, м), 7,74-7,88 (4H, м), 7,95 (2H, д, J=8,5 Гц), 8, 76 (1H, д, J=4,5 Гц).
Дополнительный пример 13
2-Триметилсилилэтил (S)-3-[4-[2-[[1-(4-бифенилил) этилиден] аминоокси]
этокси]фенил]-2-(4-фторфенокси) пропионат
Реакцию осуществляли способом, аналогичным описанному в дополнительном примере 5, с использованием 2-[1-(4-бифенилил)этилиден]аминоокси]этанола (83
мг), представляющего собой продукт
ссылочного
примера 3 (b), 2-триметилсилилэтил S-2-(4-фторфенокси)-3-(4-гидроксифенил)пропионата (100 мг), представляющего собой продукт дополнительного ссылочного
примера 3(e), трифенилфосфина (86 мг) и раствора
диизопропилазодикарбоксилата (40% в толуоле (0,14 мл)), и обрабатывали реакционную смесь, получая указанное в заголовке соединение (88 мг) в виде
бесцветного масла.
1H ЯМР (270 МГц, CDCl3): δ м.д.
0,02 (9H, с), 0,92 (2H, дд, J=7,5, 9,5 Гц), 2,26 (3H, с), 3,16 (2H, д, J= 6,5 Гц), 4, 16-4,24 (2H, м), 4,28 (2H, т, J=5,0 Гц), 4,54 (2H, т, J=5,0 Гц), 4,63 (1H, т, J=6,5 Гц), 6,76 (2H, дд, J=4,0, 9,0 Гц), 6,90 (2H, д, J= 8,5 Гц), 6,91(2H, дд, J=8,5, 9,0 Гц), 7,21 (2H, д, J=8,5 Гц), 7, 36 (1H, т, J=7,0 Гц), 7,45 (2H, дд, J=7,0, 8,5 Гц), 7, 60 (2H, д, J=8,5 Гц),7,61 (2H, д, J=8,5 Гц), 7,73 (2H, д, J=8,5 Гц).
Дополнительный пример 14
(S)-3-[4-[2-[[1-(4- Бифенилил)этилиден] аминоокси] этокси]
фенил]-2-(4- фторфенокси)пропионовая кислота
Реакцию осуществляли способом, аналогичным описанному в дополнительном примере 6, с
использованием 2-триметилсилилэтил (S)
-3-[4-[2-[[1-(4-бифенилил)этилиден] -аминоокси] этокси] фенил]-2-(4- фторфенокси)пропионата (938 мг), представляющего собой продукт дополнительного примера 13,
и раствора фторида тетрабутиламмония в
тетрагидрофуране (1М, 3,8 мл), и обрабатывали реакционную смесь, получая указанное в заголовке соединение (568 мг) в виде бесцветных кристаллов.
1H ЯМР (270 МГц, CDCl3): δ м.д.
2,26 (3H, с), 3,20 (1H, д, J=5,0 Гц), 3,21 (1H, д, J=7,5 Гц), 4,28 (2H, т, J= 5,0 Гц), 4,54 (2H, т, J=5,0 Гц), 4,73 (1H, дд, J=5,0, 7,5 Гц), 6,79 (2H, дд, J= 4, 0, 9,0 Гц), 6,90 (2H, д, J=8,5 Гц), 6,92 (2H, дд, J=8,0, 9,0 Гц), 7,22 (2H, д, J=8,5 Гц), 7,36 (1H, т, J=7,0 Гц), 7,45 (2H, дд, J=7,0, 8,5 Гц), 7,60 (2H, д, J=8, 5 Гц), 7,61 (2H, д, J=8,5 Гц), 7,72 (2H, д, J=8,5 Гц).
Дополнительный пример 15
2-Триметилсилилэтил
(S)-2-(4-фторфенокси)-3-[4-[2-[[1- (4'-метокси-4-бифенилил)этилиден]аминоокси]этокси]фенил] пропионат
Реакцию осуществляли способом, аналогичным описанному в дополнительном примере 5, с
использованием 2-[1-(4'-метокси-4-бифенилил]этилиден]аминоокси] этанола (325 мг), представляющего собой продукт
ссылочного примера 4 (b), 2-триметилсилилэтил
S-2-(4-фторфенокси)-3-(4- гидроксифенил)пропионата (286 мг), представляющего собой продукт дополнительного ссылочного примера 3(е), трифенилфосфина (299
мг) и раствора диизопропилазодикарбоксилата
(40% в толуоле (0,61 мл), и обрабатывали реакционную смесь, получая указанное в заголовке соединение (438 мг) в виде бесцветного масла.
1H ЯМР (270 МГц, CDCl3): δ м.д.
0,01 (9H, с), 0,91 (2H, дд, J=7,5, 10,0 Гц), 2,25 (3H, с), 3,15 (2H, д, J= 6,5 Гц), 3,85 (3H, с), 4,14-4,23 (2H, м), 4,26 (2H, т, J=5,0 Гц), 4,53 (2H, т, J= 5,0 Гц), 4, 62 (1H, т, J=6,5 Гц), 6,75 (2H, дд, J=4,5, 9,0 Гц), 6,89 (2H, д, J= 8,5 Гц), 6,90 (2H, дд, J=8,5, 9,0 Гц), 6,97 (2H, д, J=8,5 Гц), 7,20 (2H, д, J=8,5 Гц), 7,53 (2H, д, J=8,5 Гц), 7,54 (2H, д, J=8,5 Гц), 7,68 (2H, д, J=8,5 Гц).
Дополнительный пример 16
(S)-2-(4-Фторфенокси)-3-[4-[2-[[1-(4'-метокси-4-бифенилил) этилиден]
аминоокси]этокси]фенил]пропионовая кислота
Реакцию осуществляли способом, аналогичным описанному в дополнительном примере 6, с использованием 2-триметилсилилэтил
(S)-2- (4-фторфенокси)-3-[4-[2-[[1-(4'-метокси-4-бифенилил)этилиден]
аминоокси]этокси]фенил]пропионата (438 мг), представляющего собой продукт дополнительного примера 15, и раствора фторида
тетрабутиламмония в тетрагидрофуране (1М, 1,7 мл), и обрабатывали реакционную
смесь, получая указанное в заголовке соединение (243 мг) в виде бесцветных кристаллов.
т.пл. 118-120oC
1H ЯМР (270 МГц, CDCl3): δ
м.д.
2,25 (3H, с), 3,20 (1H, д, J=7,0 Гц), 3,21 (1H, д, J=4,0 Гц), 3,86 (3H, с), 4,27 (2H, т, J=5,0 Гц), 4,53 (2H, т, J=5,0 Гц), 4,73 (1H, дд, J=4,0, 7,0 Гц), 6,78 (2H, дд, J=4,0, 9, 0 Гц), 6,90 (2H, д, J=8,5 Гц), 6,92 (2H, дд, J= 8,0, 9,0 Гц), 6,98 (2H, д, J=8,5 Гц), 7,21 (2H, д, J=8,5 Гц), 7,54 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц), 7,68 (2H, д, J=8,5 Гц).
Дополнительный пример 17
2-Триметилсилилэтил (S)-2-(4-фторфенокси)
-3-[4-[2-[[1-[4-(2-пиридил)фенил]этилиден]аминоокси]этокси] фенил]пропионат
Реакцию осуществляли способом,
аналогичным описанному в дополнительном примере 5, с использованием
2-[[1-[4-(2-пиридил) фенил]этилиден]аминоокси] этанола (520 мг), представляющего собой продукт ссылочного примера 1 (d),
2-триметилсилилэтил S-2- (4-фторфенокси)-3-(4-гидроксифенил)-пропионата (380
мг), представляющего собой продукт дополнительного ссылочного примера 3(e), трифенилфосфина (537 мг) и раствора
диизопропилазодикарбоксилата (40% в толуоле (0,94 мл), и обрабатывали реакционную смесь,
получая указанное в заголовке соединение (531 мг) в виде бесцветного масла.
1H ЯМР (270 МГц, CDCl3): δ м.д.
0,01 (9H, с), 0,92 (2H, дд, J=7,5, 10,0 Гц), 2,26 (3H, с), 3,15 (2H, д, J= 6,5 Гц), 4,15-4,23 (2H, м), 4,28 (2H, т, J=5,0 Гц), 4,54 (2H, т, J=5,0 Гц), 4,63 (1H, т, J=6,5 Гц), 6,76 (2H, дд, J=4,0, 9,0 Гц), 6,90 (2H, д, J= 8,5 Гц), 6,91 (2H, дд, J=8,5, 9,0 Гц), 7,21 (2H, д, J=8,5 Гц), 7,22-7,27 (1H, м), 7,74-7,77 (4H, м), 8,00 (2H, д, J=8, 5 Гц), 8,71 (1H, д, J=5,0 Гц).
Дополнительный пример 18
(S)-3-[4-[2-[[1-(4-Бифенилил)этилиден] аминоокси] этокси] фенил]-2-(4-трет-бутилфенокси) пропионовая кислота
Реакцию осуществляли способом, аналогичным описанному в дополнительном примере 6,
с использованием 2- триметилсилилэтил (S)-2-(4-фторфенокси)-3-[4-[2-[[1-[4-(2- пиридил)фенил]этилиден]аминоокси]
этокси] фенил] пропионата (1,84 г), представляющего собой продукт дополнительного
примера 17, и раствора фторида тетрабутиламмония в тетрагидрофуране (1М, 7,5 мл), и обрабатывали реакционную смесь,
получая указанное в заголовке соединение (1,16 г) в виде бесцветных кристаллов.
т.пл. 88 - 90oC
1H ЯМР (270 МГц, CDCl3): δ м.д.
2,25 (3H, с), 3,20 (1H, д, J=7,0 Гц), 3,21 (1H, д, J=5,5 Гц), 4,30 (2H, т, J= 5,0 Гц), 4,55 (2H, т, J=5,0 Гц), 4,72 (1H, дд, J=5,5, 7,0 Гц), 6,81 (2H, дд, J= 4,5, 9,0 Гц), 6,89 (2H, д, J=8, 5 Гц), 6,91 (2H, дд, J=8,5, 9,0 Гц), 7,22 (2H, д, J=8,5 Гц), 7,27-7,32 (1H, м), 7,69 (2H, д, J=8,5 Гц), 7,72 (1H, д, J= 7,5 Гц), 7,80 (1H, дд, J=2,0, 7,5 Гц), 7,86 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=5, 0 Гц).
Дополнительный ссылочный пример 1
2-Триметилсилилэтил (S)-3-(4-гидроксифенил)-2- (4-метилфенокси)пропионат
(a)
(S)-4-Бензил-3-[4-метилфенокси)ацетил]оксазолидин-2-он
К раствору 4-метилфеноксиуксусной кислоты (6,73 г)
в дихлорметане (70 мл) при температуре окружающей среды добавляли оксалилхлорид (8,
83 мл) и N, N-диметилформамид (три капли). Реакционную смесь перемешивали в течение 1,5 часов. Реакционную смесь
концентрировали при пониженном давлении и остаточный кислотный газ азеотропно
упаривали с использованием толуола, получая 4-метилфеноксиацетилхлорид. Остаток сушили при пониженном давлении.
К раствору (S)-4-бензил-2-оксазолидинона (7,08 г) в тетрагидрофуране (70 мл) при -78oC добавляли по каплям раствор н- бутиллития в гексане (1,61 н., 25,2 мл) и смесь перемешивали при той же температуре в течение 30 минут. К этому раствору добавляли при -78oC раствор 4-метилфеноксиацетилхлорида, который был получен выше, в тетрагидрофуране (70 мл). Смесь перемешивали при 0oC в течение 1 часа. Реакционную смесь распределяли между этилацетатом и водой. Этилацетатный слой промывали соляной кислотой (1н.), насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Этилацетатный раствор сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с использованием смеси гексан/этилацетат = 3/1 и 1/1 в качестве элюентов, получая целевое соединение (9,00 г) в виде бесцветного масла.
1H ЯМР (270 МГц, CDCl3): δ м.д.
2,30 (3H, с), 2,84 (1H, дд, J=9,5, 13,5 Гц), 3,36 (1H, дд, J=3,0, 13,5 Гц), 4,25-4,37 (2H, м), 4,68-4,76 (1H, м), 5,22 (2H, с), 6,88 (2H, д, J=8,5 Гц), 7,11 (2H, д, J=8,5 Гц), 7,20- 7,38 (5H, м).
(b)
(S)-4-Бензил-3-[(2S, 3R)-3-(4-бензилоксифенил)-3- гидрокси-2-(4-метилфенокси) пропионил]оксазолидин-2-он
К раствору
(S)-4-бензил-3-[4-метилфенокси)ацетил] оксазолидин-2-она (9,00 г),
представляющего собой продукт дополнительного ссылочного примера 1(а), в дихлорметане (90 мл) при 0oC добавляли раствор
трифлата дибутилбора в дихлорметане (1М, 33,2 мл) и триэтиламин (5,
12 мл). Смесь перемешивали при той же температуре в течение 1 часа. К реакционной смеси добавляли по каплям при -78oС
раствор 4-бензилоксибензальдегида (6,46 г) в дихлорметане (6 мл).
Реакционную смесь дополнительно перемешивали при 0oC в течение 2 часов. По окончании этого времени к реакционной смеси
добавляли смесь насыщенного водного раствора хлорида натрия/метанола
= 1/1 (20 мл) и водного раствора пероксида водорода (31%)/метанола = 2/1 (100 мл) и перемешивали в течение 1 часа. Метанол удаляли
упариванием в вакууме. Остаток распределяли между этилацетатом и
водой и слои отделяли. Этилацетатный слой промывали соляной кислотой (1н. ) насыщенным водным раствором гидрокарбоната натрия, сушили
над безводным сульфатом магния и концентрировали при пониженном
давлении. Остаток очищали колоночной хроматографией на силикагеле с использованием смеси гексан/этилацетат = 3/1 и 1/1 в качестве
элюентов, получая целевое соединение (9,80 г) в виде вспененной
массы.
1H ЯМР (270 МГц, CDCl3): δ м.д.
2,28 (3H, с), 2,71 (1H, дд, J=9,0, 13,5 Гц), 3,04-3,10 (2H, м), 3,57 (1H, т, J=8,5 Гц), 3,99 (1H, дд, J=2,0, 8,5 Гц), 4,22-4,28 (1H, м), 5,05-5,09 (3H, м), 6,18 (1H, д, J=6,0 Гц), 6,89 (2H, д, J=8,5 Гц), 6,95 (2H, д, J=8,5 Гц), 7,04-7, 10 (4H, м), 7,25-7,44 (10H, м).
(с)
(3)-4-Бензил-3-[(2S, 3R)-3-гидрокси-3-(4- гидроксифенил)-2-(4-метилфенокси)пропионил]оксазолидин-2-он
К раствору (S)-4-бензил-3-[(2S,
3R)-3-(4-бензилоксифенил)-3-гидрокси-2- (4-метилфенокси)пропионил] оксазолидин-2-она (9,80 г), представляющего собой продукт дополнительного ссылочного примера 1(b), в этаноле (150 мл) добавляли
палладий на угле (5%, 1,00 г). Смесь перемешивали в атмосфере водорода при 50oC в течение 4 часов, по окончании данного времени катализатор удаляли фильтрованием и фильтрат концентрировали
при пониженном давлении. Остаток распределяли между этилацетатом и водой и слои отделяли. Этилацетатный слой сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении,
получая целевой продукт (9,10 г) в виде вспененной.
1H ЯМР (270 МГц, CDCl3): δ м.д.
2,28 (3H, с), 2,74 (1H, дд, J=9,0, 13,5 Гц), 3,04-3, 10 (2H, м), 3,74 (1H, т, J= 8,5 Гц), 4,04 (1H, дд, J=1,5, 8,5 Гц), 4,28-4,34 (1H, м), 5,08, (1H, т, J=5,5 Гц), 5,15 (1H, с), 6,17 (1H, д, J=5,5 Гц), 6,79 (2H, д, J=8,5 Гц), 6,88 (2H, д, J=8,5 Гц), 7, 04-7, 10 (4H, м), 7,25-7,38 (5H, м).
(d) (S)-4-Бензил-3-[(S)-3-(4-гидроксифенил)-2-(4-метилфенокси) пропионил]оксазолидин-2-он
К раствору (S)-4-бензил-3-[(2S,
3R)-3-гидрокси-3-(4- гидроксифенил)-2-(4-метилфенокси)пропионил] оксазолидин-2-она (8,15 г), представляющего собой продукт дополнительного ссылочного примера 1(c), в трифторуксусной кислоте (90 мл)
при температуре окружающей среды добавляли триэтилсилан (24,0 мл). Смесь перемешивали в течение 18 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток распределяли между
этилацетатом и водой и слои разделяли. Этилацетатный слой промывали насыщенным водным раствором гидрокарбоната натрия, соляной кислотой (1н.) и насыщенным водным раствором хлорида натрия, сушили над
безводным сульфатом магния и концентрировали при пониженном давлении. Кристаллы собирали фильтрованием с использованием смеси изопропилового эфира и гексана, получая целевое соединение (6,70 г) в
виде
бесцветных кристаллов.
т.пл. 135 - 136oC
1H ЯМР (270 МГц, CDCl3): δ м. д.
2,26 (3H, с), 2,77 (1H, дд, J=9,5, 13, 5 Гц), 3,08-3,23 (3H, м); 4,01 (1H, т, J=8,5 Гц), 4,15 (1H, дд, J=2,0, 8,5 Гц), 4,46-4,55 (1H, м), 4,80-4,88 (1H, м), 6,09 (1H, дд, J=6,0, 8,0 Гц), 6,75 (2H, д, J=8,5 Гц), 6,80 (2H, д, J= 8,5 Гц), 7, 05 (2H, д, J=8,5 Гц), 7,10- 7,15 (2H, м), 7,21-7,33 (5H, м).
(e) 2-Триметилсилилэтил (S)-3-(4- гидроксифенил)-2-(4-метилфенокси) пропионат
К суспензии
(S)-4-бензил-3-[(S)-3-(4-гидроксифенил)-2-(4- метилфенокси)пропионил] оксазолидин-2-она (6,50 г), представляющего собой продукт дополнительного ссылочного примера 1 (d), в метаноле (80 мл) добавляли
по каплям смесь водного раствора гидроксида лития (1н., 37,7 мл) и водный раствор пероксида водорода (31%, 4,14 мл). После перемешивания смеси при температуре окружающей среды в течение 1 часа к
реакционной смеси добавляли раствор дитионита натрия (6,56 г) в воде (20 мл) и смесь перемешивали в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении. К остатку для
подщелачивания добавляли водный раствор гидроксида натрия (1н.). Водный раствор промывали дихлорметаном и затем подкисляли добавлением соляной кислоты. Добавляли этилацетат и смесь перемешивали,
этилацетатный слой отделяли, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток кристаллизовали из смеси изопропилового эфира и гексана, получая
(S)-3-(4-гидроксифенил)-2-(4-метилфенокси)пропионовую кислоту (3,38 г) в виде белого порошка. К суспензии этой карбоновой кислоты (3,25 г) в дихлорметане (40 мл) при температуре окружающей среды
добавляли оксалилхлорид (5,21 мл) и N,N- диметилформамид (5 капель). Смесь перемешивали в течение 1 часа. По окончании этого времени реакционную смесь концентрировали при пониженном давлении.
Остаточный кислотный газ удаляли азеотропной отгонкой с использованием толуола для удаления избытка реагента. К раствору остатка в дихлорметане (40 мл) добавляли триметилсилилэтанол (8,55 мл). Эту
смесь перемешивали при температуре окружающей среды в течение 15 часов. К смеси добавляли триэтиламин (4,16 мл) и 4-N,N- диметиламинопиридин (146 мг). Эту смесь перемешивали при температуре
окружающей
среды в течение 1 часа.
Реакционную смесь концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и водой и слои отделяли. Этилацетатный слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с использованием смесей гексан/этилацетат = 6/1 и 4/1 в качестве элюентов, получая целевое соединение в виде бесцветных кристаллов.
т.пл. 94 - 95oC
1H ЯМР
(270 МГц,
CDCl3): δ м.д.
0,02 (9H, с), 0,92 (2H, т, J=8,5 Гц), 2,25 (3H, с), 3,13-3,19 (2H, м), 4,10-4,28 (2H, м), 4,66 (1H, дд, J=6,0, 7,0 Гц), 4,77 (1H, с), 6,73 (2H, д, J= 8,5 Гц), 6,75 (2H, д, J=8,5 Гц), 7,02 (2H, д, J=8,5 Гц), 7,16 (2H, д, J= 8,5 Гц).
Дополнительный ссылочный пример 2
2-Триметилсилилэтил
(S)-2-(4-трет-бутилфенокси)-3-(4- гидроксифенил)пропионат
(a) (S)-4-Бензил-3-[(4-трет-бутилфенокси) ацетил] оксазолидин-2-он
Реакцию осуществляли способом, аналогичным описанному в
дополнительном ссылочном примере 1(а), с использованием 4-трет-бутилфеноксиуксусной кислоты (17,0 г), оксалилхлорида (17,8 мл), (S)-4-бензил-2-оксазолидинона (14,2 г) и раствора н-бутиллития в
гексане
(1,61 н., 50,4 мл), и обрабатывали реакционную смесь, получая указанное в заголовке соединение (28,3 г) в виде бесцветных кристаллов.
т.пл. 107 - 108oC
1
H ЯМР (270 МГц, CDCl3): δ м.д.;
1,30 (9H, с), 2,85 (1H, дд, J=9,5, 13,5 Гц), 3,36 (1H, дд, J=3,0, 13,5 Гц), 4,25-4,37 (2H, м), 4,68-4,77 (1H, м), 5,22 (2H, с),
6,91 (2H, д,
J=8,5 Гц), 7,20-7,38 (7H, м).
(b) (S)-4-Бензил-3-[(2S,3R)-3-(4-бензилоксифенил)-2-(4- трет-бутилфенокси)-3-гидроксипропионил]оксазолидин-2-он
Реакцию
осуществляли способом,
аналогичным описанному в дополнительном ссылочном примере 1(b), с использованием (S)-4-бензил-3-[(4-трет-бутилфенокси)ацетил] оксазолидин-2-она (28,2 г), представляющего собой
продукт дополнительного
ссылочного примера 2 (а), раствора трифлата дибутилбора в дихлорметане (1H, 92,1 мл), триэтиламина (13,9 мл) и 4-бензилоксибензальдегида (17,9 г), и реакционную смесь
обрабатывали, получая указанное в
заголовке соединение (30,0 г) в виде бесцветного масла.
1H ЯМР (270 МГц, CDCl3): δ м.д.
1,28 (9H, с), 2, 73 (1H, дд, J=9,0, 13,5 Гц), 3, 03-3,12 (2H, м), 3,58 (1H, т, J= 8,5 Гц), 3,97 (1H, дд, J=1,5, 8,5 Гц), 4,23-4,29 (1H, м), 5,05 (2H, с), 5,08 (1H, т, J=5,5 Гц), 6,19 (1H, д, J=5,5 Гц), 6,92 (2H, д, J=8,5 Гц), 6,95 (2H, д, J=8,5 Гц), 7,06-7,08 (2H, м), 7,25-7,40 (12H, м).
(с) (S)-4-Бензил-3-[(2S, 3R)-2-(4-трет-бутилфенокси)
-3-гидрокси-3-(4-гидроксифенил)-пропионил]оксазолидин-2-он
Реакцию осуществляли
способом, аналогичным описанному в дополнительном ссылочном примере 1(c), с использованием
(S)- 4-бензил-3-[(2S,3R)-3-(4-бензилоксифенил)-2-(4-трет- бутилфенокси)-3-гидроксипропионил]оксазолидин-2-она
(30,0 г), представляющего собой продукт дополнительного ссылочного примера 2(b) и
палладия на угле (5%, 3,00 г), и реакционную смесь обрабатывали, получая указанное в заголовке соединение (27,0 г) в
виде вспененной массы.
1H ЯМР (270 МГц, CDCl3 ): δ м.д.
2,05 (9H, с), 2,76 (1H, дд, J=9,0, 13,5 Гц), 3,07-3,13 (2H, м), 3,75 (1H, т, J= 8,5 Гц), 4,05 (1H, дд, J=2,0, 8,5 Гц), 4,29-4,34 (1H, м), 5,08, (1H, т, J=5,5 Гц), 5, 32 (1H, с), 6,18 (1H, д, J=5,5 Гц), 6,80 (2H, д, J=8,5 Гц), 6,92 (2H, д, J=8,5 Гц), 7,06-7,09 (2H, м), 7,25-7,36 (7H, м).
(d) (S)-4-Бензил-3-[(S)-2-(4-трет-бутилфенокси)
-3-(4-гидроксифенил)пропионил]оксазолидин-2-он
Реакцию осуществляли способом, аналогичным описанному в дополнительном
ссылочном примере 1 (d), с использованием (S)-4-бензил-3-[(2S,
3R)-2-(4-трет-бутилфенокси)-3-гидрокси-3- (4-бензилоксифенил)пропионил]оксазолидин-2-она (30,0 г), представляющего собой продукт
дополнительного ссылочного примера 2 (с), и триэтилсилана (66 мл) и
обрабатывали реакционную смесь, получая указанное в заголовке соединение (18,2 г) в виде бесцветных кристаллов.
т.пл. 160 - 161oC
1H ЯМР (270 МГц,
CDCl3): δ м.д.
1,26 (9H, с), 2,79 (1H, дд, J=9,5, 13,5 Гц), 3,08-3,23 (3H, м), 4,03 (1H, т, J= 8,5 Гц), 4,17 (1H, дд, J=2,5, 8,5 Гц), 4,48-4,56 (1H, м), 4,77 (1H, ушир. с), 6,08 (1H, дд, J=5,5, 8,0 Гц), 6,75 (2H, д, J=8,5 Гц), 6,83 (2H, д, J=8,5 Гц), 7,11- 7,14 (2H, м), 7,22-7,32 (7H, м).
(e) 2-Триметилсилилэтил
(S)-2-(4-трет-бутилфенокси)- 3-(4-гидроксифенил) пропионат
Реакцию осуществляли способом, аналогичным описанному в дополнительном ссылочном примере 1(e), с
использованием
(S)-4-бензил-3-[(S)-2-(4-трет-бутилфенокси)-3-(4-гидроксифенил) пропионил] оксазолидин-2-она (24,3 г), представляющего собой продукт дополнительного ссылочного примера 2(d), водного
раствора
гидроксида лития (1н., 128 мл) и водного раствора пероксида водорода (31%, 14,1 мл), и обрабатывали реакционную смесь, получая (S)-2-(4-трет-бутилфенокси)-3-(4-гидроксифенил)пропионовую
кислоту (13,4
г) в виде белого порошка.
Способом, аналогичным описанному в дополнительном ссылочном примере 1(e), осуществляли реакцию с использованием данной карбоновой кислоты (13,3 г) оксалилхлорида (18,45 мл) и 2-триметилсилилэтанола (30,3 мл) и обрабатывали реакционную смесь, получая указанное в заголовке соединение (16,0 г) в виде бесцветных кристаллов.
т.пл.
71 - 72oC
1H ЯМР (270 МГц, CDCl3): δ м.д.
0,06 (9H, с), 0,93 (2H, т, J=8,5 Гц), 1,31 (9H, с), 3,18-3,21 (2H, м), 4,18-4,33 (2H, м), 4, 69-4,73 (2H, м), 6,79 (2H, д, J=8,5 Гц), 6,80 (2H, д, J=8,5 Гц), 7,21 (2H, д, J=8,5 Гц), 7,28 (2H, д, J=8,5 Гц).
Дополнительный ссылочный пример 3
2-Триметилсилилэтил
(S)-2-(4-фторфенокси)-3-(4- гидроксифенил) пропионат
(a) (S)-4-Бензил-3-[(4-фторфенокси)ацетил]оксазолидин-2-он
Реакцию осуществляли способом, аналогичным описанному в
дополнительном
ссылочном примере 1(а), с использованием 4-фторфеноксиуксусной кислоты (1,70 г), оксалилхлорида (2,18 мл), (3)-4-бензил-2-оксазолидинона (1,77 г) и раствора н-бутиллития в гексане (1,
61н., 7,14 мл), и
обрабатывали реакционную смесь, получая указанное в заголовке соединение (2,76 г) в виде бесцветных кристаллов.
т.пл. 113-115oC
1H ЯМР
(270 МГц, CDCl3): δ м.д.
2,85 (1H, дд, J=9,5, 13,5 Гц), 3,36 (1H, дд, J=3,0, 13,5 Гц), 4,26-4,38 (2H, м), 4,68-4,77 (1H, м), 5,21 (2H, с), 6,90-7,04 (4H, м), 7,20-7, 38 (5H, м).
(b) (S)-4-Бензил-3-[(2S, 3R)-3-(4-бензилоксифенил)-2- (4-фторфенокси)-3-гидроксипропионил]оксазолидин-2-он
Реакцию осуществляли способом, аналогичным описанному в
дополнительном
ссылочном примере 1(b), с использованием (S)-4-бензил-3-[(4-фторфенокси)ацетил]оксазолидин-2-она (1,96 г), представляющего собой продукт дополнительного ссылочного примера 3(а),
раствора трифлата
дибутилбора в дихлорметане (1М, 7,14 мл), триэтиламина (1,08 мл) и 4-бензилоксибензальдегида (1,39 г), и реакционную смесь обрабатывали, получая указанное в заголовке соединение (2,
68 г) в виде
вспененной массы.
1H ЯМР (270 МГц, CDCl3): δ м.д.
2,72 (1H, дд, J=9,0, 13,5 Гц), 2,97-3,11 (1H, м), 3,05 (1H, дд, J=3,0, 13, 5 Гц), 3,57 (1H, т, J=8,5 Гц), 3,97 (1H, дд, J=2,0, 8,5 Гц), 4,21-4,27 (1H, м), 5,03-5,13 (1H, м), 5,05 (2H, с), 6,16 (1H, д, J=5,5 Гц), 6,85-7,06 (6H, м), 7,07-7,12 (2H, м), 7,25-7,43 (10H, м).
(с) (S)-4-Бензил-3-[(2S, 3R)-2-(4-фторфенокси) -3-гидрокси-3-(4-гидроксифенил)-пропионил]оксазолидин-2-он
Реакцию осуществляли способом, аналогичным описанному в дополнительном
ссылочном
примере 1(с), с использованием (S)-4-бензил-3- [(2S,3R)-3-(4-бензилоксифенил)-2- (4-фторфенокси)-3-гидроксипропионил] оксазолидин-2-она (2,33 г), представляющего собой продукт
дополнительного
ссылочного примера 3(b) и палладия на угле (5%, 490 мг), и реакционную смесь обрабатывали, получая указанное в заголовке соединение (1,94 г) в виде вспененной массы.
1H ЯМР (270 МГц, CDCl3): δ м.д.
2,75 (1H, дд, J=9,0, 13,5 Гц), 3,03-3,10 (1H, м), 3,07 (1H, дд, J=3,0, 13,5 Гц), 3,75 (1H, т, J=8,5 Гц), 4,06 (1H, дд, J=2,0, 8,5 Гц), 4, 26-4,34 (1H, м), 5,08, (1H, дд, J=4,5, 5,5 Гц), 6,16 (1H, д, J=5,5 Гц), 6,81 (2H, д, J= 8,5 Гц), 6,89-7,01 (4H, м), 7,02-7,10 (2H, м), 7,24-7,30 (5H, м), 7,34 (2H, д, J=8,5 Гц).
(d)
(S)-4-Бензил-3-[(S)-2-(4-фторфенокси)-3-(4-гидроксифенил) пропионил] оксазолидин-2-он
Реакцию осуществляли способом, аналогичным описанному в дополнительном ссылочном
примере 1(d), с
использованием (S)- 4-бензил-3-[(2S,3R)-3-гидрокси-2-(4-фторфенокси)-3-(4- гидроксифенил)пропионил] оксазолидин-2-она (1,89 г), представляющего собой продукт дополнительного
ссылочного примера 3(с), и
триэтилсилана (5,4 мл) и обрабатывали реакционную смесь, получая указанное в заголовке соединение (1,21 г) в виде бесцветных кристаллов.
т.пл. 137
- 138oC
1H ЯМР (270 МГц, CDCl3): δ м.д.
2,77 (1H, дд, J= 9,0, 13,5 Гц), 3,08-3,20 (3H, м), 4,02 (1H, т, J=8,5 Гц), 4,17 (1H, дд, J=2,5, 8,5 Гц), 4,46-4,54 (1H, м), 4, 82-4,92 (1H, м), 6,06 (1H, дд, J=6,0, 7,5 Гц), 6,76 (2H, д, J=8,5 Гц), 6,86 (2H, дд, J=4,5, 9,0 Гц), 6,94 (2H, дд, J=8,0, 9,0 Гц), 7,09-7,12 (2H, м), 7,22 (2H, д, J=8,5 Гц), 7,26-7,30 (5H, м).
(e) 2-Триметилсилилэтил (S)-2-(4-фторфенокси)-3-(4- гидроксифенил)пропионат
Реакцию осуществляли способом, аналогичным описанному в дополнительном
ссылочном примере 1(e), с
использованием (S)-4-бензил-3-[(S)-2-(4-фторфенокси)-3-(4-гидроксифенил) -пропионил]оксазолидин-2-она (4,20 г), представляющего собой продукт дополнительного ссылочного
примера 3 (d), водного раствора
гидроксида лития (1н., 24,1 мл) и водного раствора пероксида водорода (31%, 2,64 мл), и обрабатывали реакционную смесь, получая
(S)-2-(4-фторфенокси)-3-(4-гидроксифенил)-пропионовую кислоту (2,31 г) в
виде белого порошка.
В соответствии со способом, аналогичным описанному в дополнительном ссылочном примере 1(e), осуществляли реакцию с использованием данной карбоновой кислоты (2,30 г), оксалилхлорида (1,80 мл) и 2-триметилсилилэтанола (15,96 мл), и обрабатывали реакционную смесь, получая указанное в заголовке соединение (1,81 г) в виде бесцветных кристаллов.
т.
пл. 99 - 100oC
1H ЯМР (270 МГц, CDCl3): δ м.д.
0,02 (9H, с), 0,93 (2H, дд, J=7,5, 10,0 Гц), 3,15 (2H, д, J=6,5 Гц), 4,16-4,24 (2H, м), 4,62 (1H, т, J=6,5 Гц), 4,82 (1H, ушир.с), 6,74-6,79 (4H, м), 6,91 (2H, дд, J=8,5, 9,0 Гц), 7,16 (2H, д, J=8,5 Гц).
Дополнительный ссылочный пример 4
2-[1-(4'-Метокси-4-бифенилил)этилиден]аминоокси]этанол
(а) Оксим 4'-(4-метоксифенил)ацетофенона
К раствору
гидроксида калия (2,9 г) в смеси метанола (40 мл) и воды (8 мл) добавляли
гидрохлорид гидроксиламина (3,07 г). Смесь перемешивали при 50oC в течение 30 минут, а затем добавляли
4-(4- метоксифенил)-ацетофенон (5,0 г). Реакционную смесь перемешивали при 50oC в течение 7 часов, а затем добавляли гидроксид калия (2,9 г) и гидрохлорид гидроксиламина (3,07 г).
Реакционную смесь дополнительно перемешивали при 50oC в течение 65 часов и затем
концентрировали при пониженном давлении. К остатку добавляли этилацетат и воду и осажденные из раствора
кристаллы собирали фильтрованием и промывали водой и этилацетатом. Кристаллы дополнительно
промывали изопропиловым эфиром, получая указанное в заголовке соединение (4,05 г) в виде бесцветных
кристаллов.
т.пл. 82 - 84oC
1H ЯМР (270 МГц,
ДМСО-d6: δ м.д.
2,18 (3H, с), 3,80 (3H, с), 7,03 (2H, д, J=8,5 Гц), 7,64 (4H, д, J=8,0 Гц,), 7,71 (2H, д, J=8,5 Гц).
(b)
2-[1-(4'-Метокси-4-бифенилил)этилиден]аминоокси]этанол
К раствору 2-(2-бромэтокси)тетрагидропирана (494 мг) и оксима
4'-(4-метоксифенил)ацетофенона (380 мг), представляющего собой продукт
дополнительного ссылочного примера 4 (а), в 10 мл N,N-диметилацетамида добавляли карбонат калия (660 мг), и полученную смесь
перемешивали при 80oC в течение 16 часов. По окончании
взаимодействия реакционную смесь растворяли в смеси этилацетата и воды. Этилацетатный слой отделяли и сушили над безводным сульфатом
магния, после чего растворитель отгоняли при пониженном давлении.
Затем полученный остаток очищали колоночной хроматографией на силикагеле с использованием смеси 5/1 по объему гексана и этилацетата,
получая простой 0-2-[(тетрагидропиран-2- ил)окси] этиловый эфир
оксима 4'-(4-метоксифенил)ацетофенона (590 мг) в виде белого твердого вещества. К раствору простого O-2- [(тетрагидропиран-2-ил)окси]
этилового эфира оксима 4'-(4- метоксифенил)ацетофенона (561 мг) в
30 мл метанола добавляли моногидрат п-толуолсульфоновой кислоты (290 мг) и полученную смесь перемешивали при комнатной температуре в
течение 2 часов, а затем концентрировали упариванием при пониженном
давлении. Концентрат растворяли в этилацетате. Полученный раствор промывали водным раствором гидрокарбоната натрия и затем сушили
над безводным сульфатом магния. Затем растворитель удаляли отгонкой
при пониженном давлении. Кристаллы собирали фильтрованием с использованием изопропилового эфира, получая указанное в заголовке
соединение (390 мг) в виде бесцветных кристаллов.
т.пл.
164 - 166oC
1H ЯМР (270 МГц, CDCl3): δ м.д.
2,30 (3H, с), 3, 80 (3H, с), 3,94-3,98 (2H, м), 4,32- 4,35 (2H, м), 6,99 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц), 7,56 (2H, д, J=8,5 Гц), 7,68 (2H, д, J=8,5 Гц).
Дополнительный ссылочный пример
5
Этил 2-(4-хлорфенокси)-3-(4-гидроксифенил)пропионат
(а)
Этил 3-(4-бензилоксифенил)лактат
Бромистый бензил (21,9 г) и карбонат калия (35,3 г) добавляли к раствору этил
3-(4-гидроксифенил)лактата (22,4 г) в N,N-диметилформамиде (220 мл). Смесь
перемешивали при 50oC в течение 2 часов. Реакционную смесь распределяли между этилацетатом и водой. Этилацетатный
слой отделяли, сушили над сульфатом магния и затем концентрировали при
пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с использованием смеси гексан/этилацетат = 7/3 в
качестве элюента, получая целевое соединение (31,0 г) в виде
бледно-желтого масла.
(b) Этил 3-(4-бензилоксифенил)-2-метансульфонилоксипропионат
К раствору этил
3-(4-бензилоксифенил)лактата (3,32 г), представляющего собой продукт
дополнительного ссылочного примера 5 (а), в безводном дихлорметане (30 мл) добавляли метансульфонилхлорид (0,94 мл). К этой смеси
добавляли по каплям на ледяной бане триэтиламин (2,47 мл). Смесь
перемешивали при температуре окружающей среды в течение 3 часов Реакционную смесь концентрировали при пониженном давлении. Остаток
распределяли между этилацетатом и водой. Этилацетатный слой отделяли,
сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток кристаллизовали из гексана, получая
целевой продукт (3,60 г) в виде бесцветных кристаллов.
т.пл. 81 - 83oC
1H ЯМР (270 МГц, CDCl3): δ м.д.
1,27 (3H, т, J=7,0 Гц), 2,80 (3H, с), 3,02-3,29 (2H, м), 4,24 (2H, кв, J= 7,0 Гц), 5,05 (2H, с), 5,05-5,14 (1H, м), 6,93 (2H, д, J=8,5 Гц), 7,17 (2H, д, J=8,5 Гц), 7,28-7,45 (5H, м).
(с) Этил
3-(4-бензилоксифенил)-2-(4-хлорфенокси)пропионат
К раствору этил
3-(4-бензилоксифенил)-2-метансульфонилоксипропионата (8,82 г), представляющего собой продукт дополнительного ссылочного
примера 5(b), и 4-хлорфенола (3,00 г) (2,85 г) в N,N-диметилформамиде (110 мл)
добавляли карбонат калия (6,44 г). Эту смесь перемешивали при 70oC в течение 16 часов. Реакционную смесь
распределяли между этилацетатом и водой и слои разделяли. Этилацетатный слой сушили
над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией
на силикагеле с использованием смеси гексан/этилацетат = 9/1 в качестве элюента,
получая целевое
соединение (5,99 г) в виде бесцветных кристаллов.
т. пл.63 - 64o
C
1H ЯМР (270 МГц, CDCl3): δ м.д.
1,18 (3H, т, J=7,0 Гц), 3,17 (2H, д, J=6,5 Гц), 4,16 (2H, кв, J=7,0 Гц), 4,69 (1H, т, J=6,5 Гц), 5,04 (2H, с), 6, 75 (2H, д, J=9,0 Гц), 6,91 (2H, д, J=8,5 Гц), 7,13-7,23 (4H, м), 7,25-7,55 (5H, м).
(d) Этил 2-(4-хлорфенокси)-3-(4-гидроксифенил)пропионат
Раствор этил
3-(4-бензилоксифенил)-2-(4-хлорфенокси)-пропионата (5,99 г), представляющего собой продукт
дополнительного ссылочного примера 5 (с), в растворе бромистого водорода в уксусной кислоте (25%, 60 мл)
перемешивали при температуре окружающей среды в течение 3 часов. Реакционную смесь
концентрировали при пониженном давлении. К раствору остатка в этаноле (70 мл) добавляли карбонат калия (4,68 г).
Данную смесь перемешивали при температуре окружающей среды в течение 4 часов.
Реакционную смесь концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и водой и слои
разделяли. Этилацетатный слой сушили над безводным сульфатом магния и концентрировали
при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с использованием смеси
гексан/этилацетат = 9/1
- 4/1 в качестве элюента, получая целевое соединение (3,85 г) в виде
бесцветных кристаллов.
т.пл. 90 - 93oC
1H ЯМР (270 МГц,
CDCl3): δ м.д.
1,19 (3H, т, J=7,0 Гц), 3,16 (2H, д, J=6,5 Гц), 4,17 (2H, кв, J=7,0 Гц), 4,69 (1H, т, J=6,5 Гц), 4,95 (1H, ушир.с), 6,76 (4H, д, J=8,5 Гц), 7,15 (2H, д, J=8,5 Гц), 7,18 (2H, д, J=8,5 Гц).
Дополнительный ссылочный пример 6
Этил 2-(4-фторфенокси)-3-(4-гидроксифенил)пропионат
(а) Этил
3-(4-бензилоксифенил)-2-(4-фторфенокси)пропионат
Раствор диэтилазодикарбоксилата (40% раствор в толуоле, 6,40 мл) в
толуоле (3,0 мл) добавляли по каплям к раствору этил
3-(4-бензилоксифенил)лактата (10,0 г), представляющего собой продукт дополнительного ссылочного примера 5 (а), 4-фторфенола (4,15 г) и
трифенилфосфина (10,6 г) в толуоле (10 мл) при температуре
окружающей среды. После перемешивания смеси в течение 2 часов при температуре окружающей среды реакционную смесь концентрировали при
пониженном давлении. Остаток очищали колоночной хроматографией на
силикагеле с использованием смеси дихлорметан/этилацетат = 3/2 в качестве элюента, получая указанное в заголовке соединение (7,00 г) в
виде бесцветного масла.
1H ЯМР (270 МГц, CDCl3): δ м.д.
1,18 (3H, т, J=7,0 Гц), 3,16 (2H, д, J=6,5 Гц), 4,16 (2H, кв, J=7,0 Гц), 4,66 (1H, т, J=6,5 Гц), 5,04 (2H, с), 6,72-6,80 (2H, м), 6,89-6,97 (4H, м), 7,21 (2H, д, J=8,5 Гц), 7,31-7,48 (5H, м).
(b) Этил 2-(4-фторфенокси)-3-(4-гидроксифенил)пропионат
Раствор
этил 3-(4-бензилоксифенил)-2-(4- фторфенокси)пропионата (7,00
г), представляющего собой продукт дополнительного ссылочного примера 6 (а), в растворе бромистого водорода в уксусной кислоте (25%, 70 мл)
перемешивали при температуре окружающей среды в течение 3
часов. Реакционную смесь концентрировали при пониженном давлении. К раствору остатка в этаноле (70 мл) добавляли карбонат калия (6,90 г). Эту
смесь перемешивали при температуре окружающей среды в
течение 4 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и водой и слои разделяли.
Этилацетатный слой сушили над безводным сульфатом магния
и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с использованием смеси гексан/этилацетат =
9/1 и 4/1 в качестве элюентов, получая целевое соединение
(2,75 г) в виде белого порошка.
т. пл. 80 - 81oC
1H ЯМР (270 МГц, CDCl3): δ
м.д.
1,19 (3H, т, J=7,0 Гц), 3,15 (2H, д, J=6,5 Гц), 4,17 (2H, кв, J=7,0 Гц), 4,65. (1H, т, J=6,5 Гц), 4,76 (1H, с), 6,71-6,80 (4H, м), 6,87-6,95 (2H, м), 7,16 (2H, д, J=8,5 Гц).
Дополнительный ссылочный пример 7
2-[[1'-(4-Фтор-4-бифенилил)этилиден]аминоокси]этилметансульфонат
(а) 2-[[1'-(4-Фтор-4-бифенилил)этилиден]аминоокси]этанол
В
соответствии с методикой, аналогичной описанной в
ссылочных примерах 1(с) и (d), но с использованием 6,84 г 2-(2-бромэтокси)тетрагидропирана, 5,00 г оксима 4'(4- фторфенил)ацетофенона, 6,02 г
карбоната калия и каталитического количества моногидрата
п-толуолсульфоновой кислоты получали 3,84 г указанного в заголовке соединения в виде белых кристаллов.
т.пл. 131 - 133oC
1H ЯМР (270 МГц, CDCl3): δ м.д.
2,30 (3H, с), 3,96 (2H, т, J=4,5 Гц), 4,34 (2H, т, J=4,5 Гц), 7,14 (2H, т, J=8,5 Гц), 7,53-7,59 (4H, м), 7,69 (2H, д, J=8,5 Гц).
(b)
2-[[1'-(4-Фтор-4-бифенилил)этилиден]аминоокси] -этилметансульфонат
К раствору метансульфонилхлорида (1,15 мл) и
2-[[1'-(4-фтор-4-бифенилил)этилиден] аминоокси] этанола (3,70 г),
представляющего собой продукт дополнительного ссылочного примера 7 (а), в дихлорметане (40 мл) добавляли по каплям при 0oC
триэтиламин (2,83 мл). После перемешивания смеси перемешивали при
температуре окружающей среды в течение 2 часов, реакционную смесь концентрировали при пониженном давлении. Остаток распределяли между
этилацетатом и водой и слои разделяли. Этилацетатный слой
промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Кристаллы
собирали фильтрованием с использованием гексана и
изопропилового эфира, получая указанное в заголовке соединение (4,70 г) в виде бесцветных кристаллов.
т.пл. 103 - 106oC
1H ЯМР (270 МГц, CDCl3
): δ м.д.
2,29 (3H, с), 3,04 (3H, с), 4,46 (2H, т, J=4,5 Гц), 4,56 (2H, т, J=4,5 Гц), 7,14 (2H, т, J=8,5 Гц), 7,54-7,59 (4H, м), 7,72 (2H, д, J=8,5 Гц). Т Т7
Реферат
Описываются новые производные фенилалкилкарбоновой кислоты формулы (I), где R1 представляет алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов, R2 представляет алкиленовую группу с прямой или разветвленной цепью, имеющую от 2 до 6 углеродных атомов, R3 представляет атом водорода, Z представляет алкиленовую группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов, W представляет (i) алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов, (ii) алкокси группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (iii) алкилтио группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (iv) амино группу, (v) моноалкиламино группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (vi) диалкиламино группу с прямой или разветвленной цепью, в которой алкильные группы являются одинаковыми или отличаются друг от друга и каждая имеет от 1 до 4 углеродных атомов, (vii) N-алкил-N-ариламино группу, имеющую алкил с прямой или разветвленной цепью, имеющий от 1 до 4 углеродных атомов, и арильную часть, имеющую от 6 до 10 углеродных атомов, (viii) арилокси группу, имеющую от 6 до 10 углеродных атомов, которая может иметь 1 заместитель α, указанный ниже, в арильной части, (ix) арилтио группу, имеющую от 6 до 10 углеродных атомов, (х) ариламино группу, имеющую от 6 до 10 углеродных атомов, (xi) аралкильную группу, имеющую от 7 до 12 углеродных атомов или (xii) 1-пирролильную группу, Х представляет арильную группу, имеющую от 6 до 10 углеродных атомов, которая может иметь 1 заместитель α, указанный ниже, причем заместитель α представляет (i) алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов, (i) галогенированную алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (iii) атом галогена, (iv) арильную группу, имеющую от 6 до 10 углеродных атомов (арильная часть может быть замещена алкокси группой с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, или атомом галогена) или (v) пиридил, и Y представляет атом кислорода, их фармакологически приемлемые соли или их фармакологически приемлемые сложные эфиры. Вышеуказанные новые производные фенилалкилкарбоновой кислоты имеют превосходную активность в понижении уровня сахара в крови, а также их фармакологически приемлемые соли или фармакологически приемлемые сложные эфиры. Описывается также композиция, включающая указанное соединение в качестве активного ингредиента для лечения или профилактики гипергликемии; использование для получения лекарственного препарата для лечения или профилактики гипергликемии.

2 с. и 28 з.п.ф-лы, 70 табл.
Формула
где R1 представляет алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов;
R2 представляет алкиленовую группу с прямой или разветвленной цепью, имеющую от 2 до 6 углеродных атомов;
R3 представляет атом водорода;
Z представляет алкиленовую группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов,
W представляет (i) алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов, (ii) алкоксигруппу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (iii) алкилтиогруппу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (iv) аминогруппу, (v) моноалкиламиногруппу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (vi) диалкиламиногруппу с прямой или разветвленной цепью, в которой алкильные группы являются одинаковыми или отличаются друг от друга и каждая имеет от 1 до 4 углеродных атомов, (vii) N-алкил-N-ариламиногруппу, имеющую алкил с прямой или разветвленной цепью, имеющий от 1 до 4 углеродных атомов, и арильную часть, имеющую от 6 до 10 углеродных атомов, (viii) арилоксигруппу, имеющую от 6 до 10 углеродных атомов, которая может иметь 1 заместитель α, указанный ниже, в арильной части, (ix) арилтиогруппу, имеющую от 6 до 10 углеродных атомов, (x) ариламиногруппу, имеющую от 6 до 10 углеродных атомов, (xi) аралкильную группу, имеющую от 7 до 12 углеродных атомов или (xii) 1-пирролильную группу,
X представляет арильную группу, имеющую от 6 до 10 углеродных атомов, которая может иметь 1 заместитель α, указанный ниже,
причем заместитель α представляет (i) алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 углеродных атомов, (ii) галогенированную алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, (iii) атом галогена, (iv) арильную группу, имеющую от 6 до 10 углеродных атомов (арильная часть может быть замещена алкоксигруппой с прямой или разветвленной цепью, имеющую от 1 до 4 углеродных атомов, или атомом галогена) или (v) пиридил:
Y представляет атом кислорода,
их фармакологически приемлемые соли или их фармакологически приемлемые сложные эфиры.
2-этокси-3-[4-[2-[[1-[4-(2-пиридил) фенил] этилиден] аминокси] этокси] фенил] пропионовая кислота,
2-метилтио-3-[4-[2-[[1-[4-(2-пиридил) фенил] этилиден] аминокси] этокси] фенил] пропионовая кислота,
2-фенилтио-3-[4-[2-[[1-[4-(2-пиридил) фенил] этилиден] аминокси] этокси] фенил] пропионовая кислота,
3-[4-[2-[[1-(4-бифенилил) этилиден] аминокси] этокси] фенил] -2-(фениламино) пропионовая кислота,
2-фениламино-3-[4-[2-[[1-[4-(2-пиридил) фенил] этилиден] аминокси] этокси] фенил] пропионовая кислота,
2-этиламино-3-[4-[2-[[1-[4-(2-пиридил) фенил] этилиден] аминокси] этокси] фенил] пропионовая кислота,
2-(N, N-диэтиламино)-3-[4-[2-[[1-[4-(2-пиридил) фенил] этилиден] аминокси] этокси] фенил] пропионовая кислота,
3-[4-[2-[[1-(4-бифенилил) этилиден] аминокси] этокси] фенил]-2-[N-фенил-N-этиламино] пропионовая кислота,
3-[4-[2-[[1-(4-бифенилил) этилиден] аминокси] этокси] фенил]-2-пирролилпропионовая кислота,
2-(3-фенилпропил)-3-[4-[2-[[1-[4-(2-пиридил) фенил] этилиден] аминокси] этокси] фенил] пропионовая кислота,
2-бутил-3-[4-[2-[[1-[4-(2-пиридил) фенил] этилиден] аминокси] этокси] фенил] пропионовая кислота и
2-фенокси-3-[4-[2-[[1-[4-(2-пиридил) фенил] этилиден] аминокси] этокси] фенил] пропионовая кислота.
2-этокси-3-[4-[2-[[1-[4-(2-пиридил) фенил] этилиден] аминокси] этокси] фенил] пропионовая кислота,
2-метилтио-3-[4-[2-[[1-[4-(2-пиридил) фенил] этилиден] аминокси] этокси] фенил] пропионовая кислота,
2-фенилтио-3-[4-[2-[[1-[4-(2-пиридил) фенил] этилиден] аминокси] этокси] фенил] пропионовая кислота,
3-[4-[2-[[1-(4-бифенилил) этилиден] аминокси] этокси] фенил] -2-(фениламино) пропионовая кислота,
2-этиламино-3-[4-[2-[[1-[4-(2-пиридил) фенил] этилиден] аминокси] этокси] фенил] пропионовая кислота,
2-(3-фенилпропил)-3-[4-[2-[[1-[4-(2-пиридил) фенил] этилиден] аминокси] этокси] фенил] пропионовая кислота,
2-бутил-3-[4-[2-[[1-[4-(2-пиридил) фенил] этилиден] аминокси] этокси] фенил] пропионовая кислота и
2-фенокси-3-[4-[2-[[1-[4-(2-пиридил) фенил] этилиден] аминокси] этокси] фенил] пропионовая кислота.

Комментарии