Производные мочевины (варианты), фармацевтическаякомпозиция (варианты) и способ лечения заболевания, связанного с ростом раковых клеток (варианты) - RU2319693C9
Код документа: RU2319693C9
Описание
Область техники, к которой относится изобретение
Данное изобретение касается применения группы арилмочевин для лечения raf-опосредованных заболеваний и фармацевтических композиций для использования в данном способе терапии.
Уровень техники
Данная заявка представляет собой частичное продолжение Serial No 09/257266, поданной 25 февраля 1999 г., и частичное продолжение Serial No. 60/115877, поданной 13 января 1999 г.
Онкоген p21ras представляет собой главный агент, участвующий в возникновении и развитии солидных форм рака у человека, и является мутантным в 30% всех случаев рака у человека (см. статьи Bolton и соавт., Ann. Rep. Med. Chem., 29, 165-74, (1994); Bos, Cancer Res., 40, 4682-9, (1989)). В своей нормальной немутантной форме белок ras является ключевым элементом каскада сигнальной трансдукции, направляемого рецепторами фактора роста почти во всех тканях (см. статью Avruch и соавт., Trends Biochem. Sci., 19, 279-83, (1994)). С точки зрения биохимии ras представляет собой белок, связывающий нуклеотид гуанин, и цикл ГТФ-связанная активированная - ГТФ-покоящаяся форма жестко контролируется активностью эндогенной ГТФазы ras и других регуляторных белков. У ras-мутантов в раковых клетках активность эндогенной ГТФазы ослаблена и, вследствие этого белок доставляет конститутивные сигналы роста действующим после него эффекторам, таким как коназа raf. Это приводит к раковому росту клеток, которые несут данные мутации (Magnuson и соавт., Semin. Cancer Biol., 5, 247-53, (1994)). Было показано, что ингибирование эффекта активного газ путем подавления сигнального пути киназы raf посредством введения дезактивирующих антител против киназы raf или коэкспрессии доминантно отрицательной киназы raf или доминантно отрицательного MEK, субстрата киназы raf, приводит к реверсии трансформированных клеток с фенотипу нормального роста (см. статьи Daum и соавт., Trends Biochem., Sci., 19, 474-80, (1994); Fridman и соавт., J. Biol. Chem., 269, 30105-8, (1994)). Кроме того, Kolch и соавт. (Nature, 349, 426-28, (1991)) показали, что ингибирование экспрессии raf антисмысловой РНК блокирует пролиферацию клеток при мембрана-ассоциированных онкогенах. Аналогично ингибирование киназы raf (антисмысловыми олигодезоксинуклеотидами) коррелировало in vitro и in vivo с ингибированием роста множества типов опухолей человека (Monia и соавт., Nat. Med., 2, 668-75, (1996)).
Сущность изобретения
Данное изобретение представляет соединения, которые являются ингибиторами фермента киназы raf. Поскольку фермент является действующим по типу обратной связи эффектором p21ras, ингибиторы используют в фармацевтических композициях для человека или для применения в ветеринарии, когда предписано ингибирование пути raf, например, при лечении опухолей, и/или роста раковых клеток, опосредованного киназой raf. В частности, соединения используют при лечении солидных опухолей человека или животных, например рака у мышей, поскольку развитие данных форм рака зависит от каскада сигнальной трансдукции белка ras и вследствие этого является чувствительным к лечению путем прерывания каскада, т.е. ингибирования киназы raf. Соответственно соединения, соответствующие изобретению, используют для лечения форм рака, включая солидные раки, такие как, например, карциномы (например, легких, поджелудочной железы, щитовидной железы, мочевого пузыря или ободочной кишки), и миелоидные нарушения (например, миелоидный лейкоз) или аденомы (например, ворсинчатая аденома ободочной кишки).
Вследствие этого в данном изобретении представляют соединения, в общем описанные как арилмочевины, включающие как арильные, так и гетероарильные аналоги, которые ингибируют путь киназы raf. Изобретение также представляет способ лечения raf-опосредованного болезненного состояния у человека или млекопитающих животных. Таким образом, изобретение направлено на соединения, которые ингибируют фермент киназу raf, а также соединения, композиции и способы лечения роста раковых клеток, опосредованного киназой raf, в которых используют соединение Формулы I или его фармацевтически приемлемые соли.

В формуле I D представляет собой -NH-C(O)-NH-, A - замещенная структура, содержащая до 40 атомов углерода формулы: -L-(M-L1)q, где L представляет собой С5-6арил, возможно замещенный галогеном или С1-4алкилом, или 6-членную азотсодержащую гетероциклическую структуру, связанную непосредственно с D; L1 содержит возможно замещенные С5-7 арильную или С5-8 азотсодержащую гетероциклическую группу, М является мостиковой группой, содержащей по меньшей мере один атом, выбранный из -О-, -S-, -CO-NH-, -NH-CO-, q - целое число от 1 до 3, В представляет собой замещенные или незамещенные С6-14арильную группу, или шестичленную гетероарильную группу, содержащую 1-4 гетероатома, выбранных из азота, кислорода и серы,
причем L1 является замещенным по меньшей мере одним заместителем, выбранным из группы, состоящей из -SO2Rx, -C(О)Rх и -C(NRy)Rz,
Ry - С1-4алкоксигруппа,
Rz - гидроксигруппа, С1-4алкильная или С1-4алкоксигруппа,
Rx означает Rz или NRаRb, где Ra и Rb
a) независимо представлены водородом; С1-4алкильной группой, возможно замещенной гидроксигруппой, С1-4алкоксигруппой или С3-13 гетероциклической группой, содержащей 1-2 гетероатома, выбранных из N и О, которая может быть замещена С1-4алкилом, или аминогруппой, возможно замещенной С1-4алкильными группами, или фенилом, или -OSi(Rf)3, где Rf - С1-4алкильная группа; фенилом, возможно замещенным галогеном, аминогруппой, которая может быть замещенной С1-4алкильными группами, или С3-13гетероциклической группой, содержащей 1-2 гетероатома, выбранных из N и О, которая может быть замещена пиридилом; пиридилом, возможно замещенным С1-4алкокси группой; или
b) Ra и Rb вместе образуют 5-7-членную гетероциклическую азотсодержащую группу, замещенную фенилом, который может быть замещен С1-4алкилкарбонилом, пиридилом или галогеном;
где В является замещенным, L является замещенным или L1 является дополнительно замещенным, при этом заместители выбраны из группы, состоящей из галогена до образования пергалоидного соединения, и Wn, где n=1-3;
при этом каждый из W независимо выбран из группы, состоящей из С1-4алкила, возможно замещенного галогеном вплоть до пергалогена; С1-4алкокси, замещенной галогеном вплоть до пергалогена; феноксигруппы, замещенной в фенильном кольце моно-С1-4алкиламиногруппой; 5-6-членной азотсодержащей гетероарильной группы, замещенной С1-4алкильными группами;
L1 может быть дополнительно замещен одним заместителем, выбранным из группы, состоящей из С1-4алкила и С1-4алкокси.
В формуле I подходящие группы гетероарила включают без ограничения -CO2R7, -C(O)NR7R7, -C(O)-R7, -NO2, -OR7, -SR7, -NR7R7, -NR7C(O)OR7, -NR7C(O)R7, -Q-Ar и структур на основе углерода, содержащих до 24 атомов углерода, необязательно содержащих гетероатомы, выбранные из N, S и О, и необязательно замещенные одним или более заместителей, независимо выбранных из группы, состоящей из -CN, -CO2R7, -C(O)R7, -C(O)NR7R7, -OR7, -SR7, -NR7R7, -NO2, -NR7 C(O)R7, -NR7C(O)OR7 и галогена вплоть до образования пергалоидного соединения при том, что каждый из R7независимо выбран из Н или структуры на основе углерода, содержащей до 24 атомов углерода, необязательно содержащей гетероатомы, выбранные из N, S и О, и необязательно замещенной галогеном,
где Q представляет собой -O-, -S-, -N(R7)-, -(СН2)m-, -С(O)-, -СН(ОН)-, -(СН2)mО-, -(CH2)mS-, -(CH2)mN(R7)-, -O(CH2 )m- СНХa-, -CXa2, -S-(CH2)m- и -N(R7)(CH2)m-, где m=1-3, а Хa представляет собой галоген, и
Ar представляет собой 5- или 6-членную ароматическую структуру, содержащую 0-2 члена, выбранных из группы, состоящей из азота, кислорода и серы, которая является необязательно замещенной галогеном до образования пергалоидного соединения и необязательно замещенной Zn1, где n1=0-3 и каждый Z независимо выбран из группы, состоящей из -CN, -CO2R7, -C(O)R7, -C(O)NR7R7, -NO2, -OR7, -SR7, -NR7R7, -NR7C(O)OR7, -NR7C(O)R7 и структурой на основе углерода, содержащей до 24 атомов углерода, необязательно содержащей гетероатомы, выбранные из N, S и О, и необязательно замещенной одним или более заместителей, выбранных из группы, состоящей из -CN, -CO2R7, -COR7, -C(O)NR7R7, -OR7, -SR7, -NO2, -NR7 R7, -NR7C(O)R7 и -NR7C(O)OR7 при R7 таком, как определено выше.
В формуле I подходящие группы гетероарила включают без ограничения перечисленным ароматические циклы из 5-12 атомов углерода или циклические системы, содержащие 1-3 цикла, по меньшей мере один из которых является ароматическим, в котором один или более, например, 1-4 атома углерода в одном или более циклов можно заместить атомами кислорода, азота или серы. Каждый цикл, как правило, содержит 3-7 атомов, например, В может быть 2- или 3-фурилом, 2- или 3-тиенилом, 2- или 4-триазинилом, 1-, 2- или 3-пирролилом, 1-, 2-, 4- или 5-имидазолилом, 1-, 3-, 4- или 5-пиразолилом, 2-, 4- или 5-оксазолилом, 3-, 4- или 5-изоксазолилом, 2-, 4- или 5-тиазолилом, 3-, 4- или 5-изотиазолилом, 2-, 3- или 4-пиридилом, 2-, 4-, 5- или 6-пиримидинилом, 1,2,3-триазол-1-, -4- или -5-илом, 1,2,4-триазол-1-, -3- или -5-илом, 1- или 5-тетразолилом, 1,2,3-оксадиазол-4- или -5-илом, 1,2,4-оксадиазол-3- или -5-илом, 1,3,4-тиадиазол-2- или -5-илом, 1,2,4-оксадиазол-3- или -5-илом, 1,3,4-тиадиазол-2- или -5-илом, 1,3,4-тиадиазол-3- или -5-илом, 1,2,3-тиадиазол-4- или -5-илом, 2-, 3-, 4-, 5- или 6-2Н-тиопиранилом, 2-, 3- или 4-4Н-тиопиранилом, 3- или 4-пиридазинилом, пиразинилом, 2-, 3-, 4-, 5-, 6- или 7-бензофурилом, 2-, 3-, 4-, 5-, 6- или 7-бензотиенилом, 1-, 2-, 3-, 4-, 5-, 6- или 7-индолилом, 1-, 2-, 4- или 5-бензимидазолилом, 1-, 3-, 4-, 5-, 6- или 7-бензопиразолилом, 2-, 4-, 5-, 6- или 7-бензоксазолилом, 3-, 4-, 5- 6- или 7-бензизоксазолилом, 1-, 3-, 4-, 5-, 6- или 7-бензотиазолилом, 2-, 4-, 5-, 6- или 7- бензизотиазолилом, 2-, 4-, 5-, 6- или 7-бенз-1,3-оксадиазолилом, 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолилом, 1-, 3-, 4-, 5-, 6-, 7-, 8- изохинолилом, 1-, 2-, 3-, 4- или 9-карбазолилом, 1-, 2-, 3-, 4-, 5-, 6-, 7-, 8- или 9-акридинилом или 2-, 4-, 5-, 6-, 7- или 8-хиназолинилом или дополнительно необязательно замещенными фенилом, 2- или 3-тиенил, 1,3, 4-тиадиазолилом, 3-пиррилом, 3-пиразолилом, 2-тиазолилом или 5-тиазолилом и т.п. Например, В может быть 4-метилфенилом, 6-метил-2-тиенилом, 4-метил-2-тиенилом, 1-метил-3-пиррилом, 1-метил-3-пиразолилом, 5-метил-2-тиазолилом или 5-метил-1,2,4-тиадиазол-2-илом.
Подходящие алкильные группы или алкильные фрагменты групп, например, алкоксигруппа и т.п. во всех случаях включают метил, этил, пропил, бутил и т.п., в том числе все изомеры с прямой цепью и разветвленные изомеры, такие как изопропил, изобутил, втор-бутил, трет-бутил и т.п.
Подходящие арильные группы, которые не содержат гетероатомы, включают, например, фенил и 1- и 2-нафтил.
Термин "циклоалкил", как используют в данном контексте, относится к циклическим структурам, содержащим или не содержащим алкильные заместители, так, например, "С4 циклоалкил" включает метилзамещенные группы циклопропила, а также группы циклобутила. Термин "циклоалкил", как используют в данном контексте, включает также насыщенные гетероциклические группы.
Подходящие галогеновые группы включают F, Cl, Br и/или I от одной до образования пергалоидного соединения (т.е. когда все атомы Н в группе замещены атомами галогена), что является возможным, когда алкильная группа замещена галогеном, смешанное замещение типами атомов галогенов также является возможным в данной структуре.
Изобретение относится также к соединениям формулы I, как таковым.
Данное изобретение направлено также на фармацевтически приемлемые соли соединений формулы I. Подходящие фармацевтически приемлемые соли хорошо известны компетентным специалистам в данной области и включают основные соли неорганических и органических кислот, такие как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, фосфорная кислота, метансульфоновая кислота, трифторметансульфоновая кислота, бензолсульфоновая кислота, р-толуолсульфоновая кислота, 1-нафталинсульфоновая кислота, 2-нафталинсульфоновая кислота, уксусная кислота, трифторуксусная кислота, яблочная кислота, винная кислота, лимонная кислота, молочная кислота, щавелевая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, бензойная кислота, салициловая кислота, фенилуксусная кислота и миндальная кислота. Кроме того, фармацевтически приемлемые соли включают соли кислот неорганических оснований, такие как соли, содержащие катионы щелочных металлов (например, Li+, Na+или K+), катионы щелочно-земельных металлов (например, Mg2+, Ca2+ или Ва2+), катион аммония, а также соли кислот или органических оснований, включая аммоний, замещенный алифатической или ароматической группой, и катионы четвертичного аммония, такие как катионы, появляющиеся при протонировании или пералкилировании триэтиламина, N,N-диэтиламина, N,N-дициклогексиламина, лизина, пиридина, N,N-диметиламинопиридина (DMAP), 1,4-диазабицикло[2.2.2]октана (DABCO), 1,5-диазабицикло[4.3.0]нон-5-ена (DBN) и 1,8-диазабицикло[5.4.0]ундек-7-ена (DBU).
Ряд соединений формулы I содержит асимметричные атомы углерода и вследствие этого может существовать в рацемической и оптически активной формах. Способы разделения энантиомерных и диастереомерных смесей хорошо известны компетентным специалистам в области техники. Данное изобретение охватывает любую выделенную рацемическую или оптически активную форму соединений, описанных в Формуле I, которое обладает активностью ингибирования raf.
Сведения, подтверждающие возможность осуществления изобретения
Основные способы получения
Соединения Формулы I могут быть получены с помощью известных химических реакций и процедур, где некоторые из исходных материалов имеются в продаже. Тем не менее, основные способы получения приведены ниже, чтобы помочь компетентному в данной области специалисту синтезировать данные соединения при том, что более детальные примеры приведены в Экспериментальном разделе ниже.
Замещенные анилины могут быть получены с использованием стандартных способов (см. монографии March, Успехи органической химии (Advanced Organic Chemistry), 3 изд., под ред. John Wiley, New York (1985); Larock, Всесторонние органические трансформации (Comprehensive Organic Transformations), VCH Publishers, New York, (1989)). Как показано в Синтезе I, ариламины обычно синтезируют восстановлением нитроарилов, используя в качестве катализатора металл, такой как Ni, Pd или Pt, и Н2 или агент, переносящий гидрид, такой как формиат, циклогексадиен или боргидрид (см. монографию Rylander, Способы гидрирования (Hydrogenation Methods), Academic Press, London, UK, (1985)). Нитроарилы можно также восстановить прямым способом с использованием источника сильного гидрида, такого как LiAlH4 (см. монографию Seyden-Penne Восстановление алюминий- и боргидридов в органическом синтезе (Reductions by the Alumino- and Borohydrides in Organic Synthesis), VCH Publishers, New York, (1991)) или используя металл с нулевой валентностью, такой как Fe, Sn или Са, часто в кислых средах. Имеется много способов синтеза нитроарилов (см. монографии March, Успехи органической химии (Advanced Organic Chemistry), 3 изд., под ред. John Wiley, New York, (1985); Larock, Всесторонние органические трансформации (Comprehensive Organic Transformations), VCH Publishers, New York, (1989)).

Синтез I
Восстановление нитроарилов до ариламинов
Нитроарилы обычно получают путем электрофильного нитрования ароматических соединений с использованием HNO3 или альтернативного источника NO2-. Нитроарилы могут быть далее обработаны перед восстановлением. Так, в нитроарилах,
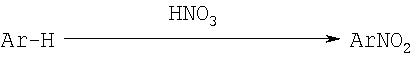
замещенных потенциальными уходящими (отщепляемыми) группами (например, F, Cl, Br и т.п.) могут проходить реакции замещения при обработке нуклеофильными соединениями, такими как тиолат (примеры приведены в Синтезе II) или феноксид. Нитроарилы могут также подвергнуться реакциям связывания типа реакции Ульмана (Ullman) (см. Синтез II).
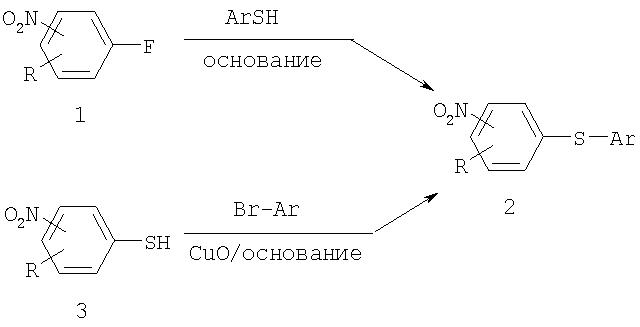
Синтез II
Выбранное нуклеофильное замещение ароматического соединения с использованием нитроарилов
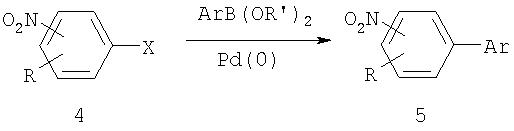
Нитроарилы могут также подвергаться опосредованным переходными металлами реакциям перекрестного связывания, например, нитроарильные электрофильные соединения, такие как бромиды, иодиды или трифталаты нитроарилов участвуют в опосредованных палладием реакциях перекрестного связывания с арильными нуклеофилами, такими как арилбороновые кислоты (реакции Suzuki, примеры которых приведены ниже), соединения арилов (реакции Stille) или арилцинка (реакция Negishi) с образованием биарила (5).
Либо нитроарилы, либо анилины могут быть превращены в соответствующий аринсульфонилхлорид (7) при обработке хлорсульфоновой кислотой. Реакция сульфонилхлорида с источником фторида, таким как KF приводит затем к образованию сульфонилфторида (8). Реакция сульфонилфторида 8 с триметилсилилтрифторметаном в присутствии источника фторида, такого как трис(диметиламино)сульфоний дифтортриметилсиликонат (TASF), приводит к образованию соответствующего трифторметилсульфона (9). Альтернативно сульфонилхлорид 7 можно восстановить до арентиола (10), например, с помощью цинковой амальгамы. Реакция тиола 10 с CHCLF2 в присутствии основания дает дифторметилмеркаптам (11), который может быть окислен до сульфона (12) любым из множества окислителей, включая CrO3-уксусный ангидрид (см. статью Sedova и соавт., Zh.Org. Khim., 6, 568, (1970)).
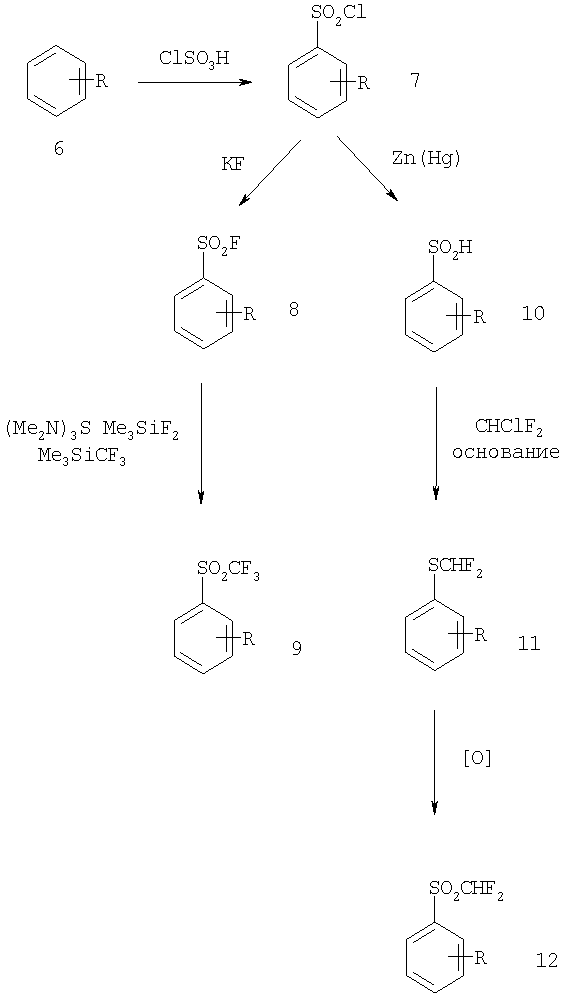
Синтез III
Выбранные способы синтеза фторированного арилсульфона
Как показано в Синтезе IV, образование асимметричной мочевины может включать реакцию арилизоцианата (14) с ариламином (13). Гетероарилизоцианат может быть синтезирован из гетероариламина путем обработки фосгеном или эквивалентом фосгена, таким как трихлорметилхлорформиат (дифосген), бис(трихлорметил)карбонат (трифосген) или N,N'-карбонилдиимидазол (CDI). Изоцианат может быть также получен из производного гетероциклической карбоновой кислоты, такого как сложный эфир, галогенид кислоты или ангидрид, с помощью перегруппировки Curtius-типа. Таким образом, после реакции производного кислоты 16 с источником азида следует перегруппировка, приводящая к образованию изоцианата. Соответствующая карбоновая кислота (17) может быть также подвергнута перегруппировкам Curtius-типа с использованием дифенилфосфорил азида (DPPA) или подобного реагента.
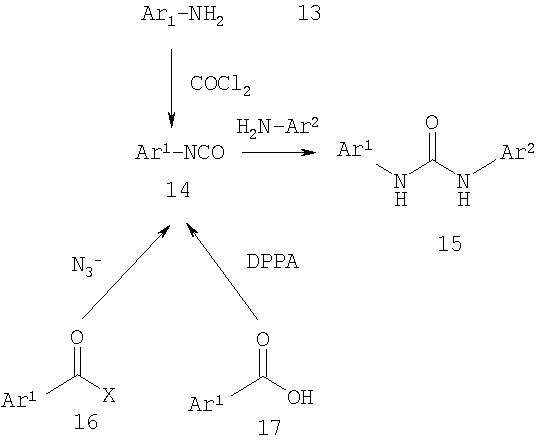
Синтез IV
Выбранные способы образования асимметричной мочевины
Наконец, с мочевинами могут быть проведены дальнейшие манипуляции с использованием способов, известных компетентным специалистам в данной области.
Изобретение включает также фармацевтические композиции, содержащие соединение Формулы I и физиологически приемлемый носитель.
Соединения могут применяться перорально, наружно, парентерально, путем ингаляции или в виде спрея или ректально в лекарственных формах препаратов. Термин "введение путем инъекции" включает внутривенную, внутримышечную, подкожную и парентеральную инъекции, а также применение способов инфузии. Одно или более соединений могут присутствовать в ассоциации с одним или более нетоксических фармацевтически приемлемых носителей и, если это желательно, других активных ингредиентов.
Композиции, предназначенные для перорального применения, могут быть приготовлены в соответствии с любым подходящим способом, известным в области техники, которым получают фармацевтически композиции. Данные композиции могут содержать один или более агентов, выбранных из группы, состоящей из разбавителей, подсластителей, вкусовых добавок, окрашивающих агентов и консервирующих агентов с целью получения приятных на вкус препаратов. Таблетки содержат активный ингредиент в смеси с нетоксическими фармацевтически приемлемыми наполнителями, которые являются походящими для производства таблеток. Данные наполнители могут быть представлены, например, инертными разбавителями, такими как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; агентами, вызывающими грануляцию или дезинтеграцию, например кукурузным крахмалом или альгиновой кислотой, и связующими агентами, например стеаратом магния, стеариновой кислотой или тальком. Таблетки могут быть непокрытыми или они могут быть покрыты с помощью известных технологий с целью задержки дезинтеграции и всасывания в желудочно-кишечном тракте и таким образом обеспечения задержанного действия в течения более длительного периода. Например, может быть использован такой задерживающий время материал, как глицерилмоностеарат или глицерилдистеарат. Данные соединения могут быть также приготовлены в твердой форме с быстрым освобождением.
Препараты для перорального применения могут быть также представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым наполнителем, например карбонатом кальция фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом.
Водные суспензии содержат активные материалы в смеси с наполнителями, пригодными для приготовления водных суспензий. Данные наполнители представляют собой суспендирующие агенты, например натриевую соль карбоксиметилцеллюлозы, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, камедь трагаканта и камедь акации; диспергирующие или увлажняющие компоненты могут быть представлены природным фосфатидом, например лецитином, или продуктами конденсации алкиленоксида с жирными кислотами, например полиоксиэтилен стеаратом, или продуктами конденсации этиленоксида с алифатическими спиртами с длинной цепью, например гептадекаэтилен оксицетанолом, или продуктами конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот, и гекситола, такими как полиоксиэтиленсорбитол моноолеат или продуктами конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот, ингидридами гекситола, например полиэтиленсорбитан моноолеатом. Водные суспензии могут также содержать один или более консервирующих агентов, например этил п-пропил р-гидроксибензоат, один или более окрашивающих агентов, одну или более вкусовых добавок и один или более подсластителей, таких как сахароза или сахарин.
В диспергирующихся порошках и гранулах, подходящих для приготовления водной суспензии путем добавления воды, активный ингредиент представлен в смеси с диспергирующими или увлажняющими агентами и суспендирующими агентами, примеры которых уже приведены выше. Могут также присутствовать дополнительные наполнители, например подсластители, вкусовые добавки и окрашивающие агенты.
Соединения могут также быть в форме неводных жидких препаратов, например масляных суспензий, которые можно приготовить суспендированием активных ингредиентов в растительном масле, например арахисовом масле, оливковом масле, кунжутном масле, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загущающий компонент, например пчелиный воск, твердый парафин или цетиловый спирт. Подсластители, такие как приведенные выше, и вкусовые добавки могут быть добавлены для получения приятных на вкус пероральных препаратов. Данные композиции могут быть законсервированы добавлением антиоксиданта, такого как аскорбиновая кислота.
Фармацевтические композиции, соответствующие изобретению, могут быть также в форме эмульсий масло в воде. Масляная фаза может быть представлена растительным маслом, например оливковым маслом или арахисовым маслом, или минеральным маслом, например жидким парафином, или их смесями. Подходящие эмульгирующие агенты могут быть представлены природными камедями, например камедью акации или камедью трагаканта, природными фосфатидами, например соевым лецитином, и сложными эфирами или частичными сложными эфирами, полученными из жирных кислот и ангидридом гекситола, например сорбитан моноолеатом, и продуктами конденсации данных частичных сложных эфиров, например, полиоксиэтиленсорбитан моноолеатом. Эмульсии могут также содержать подсластители и вкусовые добавки.
Сиропы и эликсиры могут быть приготовлены с подсластителями, например глицерином, пропиленгликолем, сорбитом или сахарозой. Данные препараты могут также содержать деэмульгатор, консервант и вкусовую добавку и окрашивающий агент.
Соединения могут также применяться в форме суппозиториев для ректального введения лекарственного вещества. Данные композиции можно приготовить путем смешивания лекарственного вещества с подходящим нераздражающим наполнителем, который является твердым при обычных температурах, но жидким при ректальной температуре и будет вследствие этого плавиться в прямой кишке с освобождением лекарственного вещества. Данные материалы включают масло какао и полиэтиленгликоли.
Для всех режимов применения, описанных в данном контексте для соединений формулы I, будет предпочтительным режим ежедневного перорального введения дозы от 0,01 до 200 мг/кг общей массы тела. Дневная доза для инъекционного введения, включая внутривенную, внутримышечную, подкожную и парентеральную инъекции и использование методик инфузии, будет предпочтительно составлять от 0,01 до 200 мг/кг общей массы тела. Режим дневной ректальной дозировки будет предпочтительно составлять от 0,01 до 200 мг/кг общей массы тела. Режим дневной наружной дозировки будет предпочтительно составлять от 0,1 до 200 мг, которые применяют от одного до четырех раз в день. Режим дневной ингаляционной дозировки будет предпочтительно составлять от 0,01 до 10 мг/кг общей массы тела.
Компетентные специалисты в данной области оценят, что определенный способ введения будет зависеть от множества факторов, все из которых рутинно предполагаются при введении терапевтических препаратов. Компетентными специалистами в данной области также будет оценено, что специфический уровень доз для данного пациента зависит от множества факторов, включая специфическую активность применяемого соединения, возраст, массу тела, состояние здоровья, пол, питание и способ введения, скорость выведения и т.п. Кроме того, компетентный специалист в данной области оценит, что оптимальный курс лечения, т.е. способ лечения и число доз соединения Формулы I или его фармацевтически приемлемой соли в день, которые дают в течение определенного числа дней, может быть определено компетентными специалистами в данной области с использованием принятых тестов для оценки лечения.
Следует понимать, однако, что специфический уровень дозы для какого-либо определенного пациента будет зависеть от ряда факторов, включая активность специфического применяемого соединения, возраст, массу тела, общее состояние здоровья, пол, питание, время введения, способ введения и скорость выведения, комбинацию лекарственных веществ и тяжесть состояния, пациента, проходящего лечение.
Полное описание всех заявок, патентов и публикаций, приведенных выше и ниже, включено в данном контексте в виде ссылки, включая предварительную заявку Serial No. 60/115877, поданную 13 января 1999 г. и непредварительную заявку Serial No. 09/257266, поданную 25 февраля 1999.
Соединения могут быть получены из известных соединений (или из исходных материалов, которые, в свою очередь, могут быть получены из известных соединений), например, посредством основных способов получения, представленных ниже. Активность данного соединения ингибировать киназу raf может быть оценена рутинными способами, например, в соответствии с процедурами, описанными ниже. Следующие примеры служат только для иллюстративных целей и не предназначены и не должны рассматриваться как ограничивающие изобретение каким-либо образом.
ПРИМЕРЫ
Все реакции проводят в стеклянной посуде, высушенной на огне или высушенной в печи под положительным давлением сухого аргона или сухого азота и перемешивают с помощью магнита, если не указано иначе. Чувствительные жидкости и растворы переносят с помощью шприца или канюли и вносят в реакционные сосуды через резиновую перегородку. Если не отмечено иначе, термин "концентрирование при пониженном давлении" относится к роторному испарителю Buchi, обеспечивающему приблизительно 15 мм Hg. Если не отмечено иначе, термин, "под высоким вакуумом" относится к вакууму 0,4-1,0 мм Hg.
Все температуры приведены без поправок в градусах Цельсия (С). Пока не указано иначе, все части и проценты даны по массе.
Реагенты и растворители коммерческого качества используют без дальнейшей очистки. N-циклогексил-N'-(метилполистирол)карбодиимид приобретают в фирме Calbiochem-Novabiochem Corp. 3-трет-бутиланилин, 5-трет-бутил-2-метоксианилин, 4-бром-3-(трифторметил)анилин, 4-хлор-3-(трифторметил)анилин, 2-метокси-5-(трифторметил)анилин, 4-трет-бутил-2-нитроанилин, 3-амино-2-нафтол, этил 4-изоцианатбензоат, N-ацетил-4-хлор-2-метокси-5-(трифторметил)анилин и 4-хлор-3-(трифторметил)фенилизоцианат приобретают и используют без дальнейшей очистки. Способы синтеза 3-амино-2-метоксихинолина (см. заявку Е. Cho и соавт. WO 98/00402; заявку A.Cordi и соавт. ЕР 542609; публикацию IBID Bioorg. Med. Chem., 3, 1995, 129), 4-(3-карбамоилфенокси)-1-нитробензола (см. статьи К.Ikawa, Yakugaku Zasshi, 79, 760, (1959); Chem. Abstr., 53, 12761b, (1959)), 3-трет-бутилфенилизоцианата (см. работу O.Rohr и соавт. DE 2436108) и 2-метокси-5-(трифторметил)фенилизоцианата (см. работы К.Inukai и соавт. JP 42025067; IBID Kogyo Kagaku Zasshi 70, 491, (1967)) описаны ранее.
Тонкослойную хроматографию (ТСХ) проводят, используя предварительно покрытые силикагелем стеклянные пластинки 60А F-254 толщиной 250 мкм Whatman®. Визуализацию пластинок осуществляют одной из следующих методик: (а) освещение ультрафиолетом, (b) обработка парами иода, (с) погружение пластинки в 10% раствор фосфомолибденовой кислоты в этаноле с последующим нагреванием, (d) погружение пластинки в раствор сульфата серия с последующим нагреванием и/или (е) погружение пластинки в кислый раствор 2,4-динитрофенилгидразина в этаноле с последующим нагреванием. Колоночную хроматографию (флеш-хроматографию) проводят с использованием силикагеля ЕМ Science® с зернистостью 230-400.
Температуры плавления (т.пл.) определяют с использованием устройства для определения температуры плавления Thomas-Hoover или автоматизированного устройства для определения температуры плавления Mettler FP66 и дают без учета ошибки. Переход инфракрасного спектра Фурье (Fourier) получают, используя спектрофотометр Mattson 4020 Galaxy Series. Спектры протонного (1H) ядерно-магнитного резонанса (ЯМР) измеряют с помощью спектрометра GN-Omega 300 (300 МГц) General Electric либо с использованием Me4Si ( 0,00), либо растворителя с остаточным протонированием (CHCl3 7,26; МеОН 3,30; ДМСО 2,49) в качестве стандарта. Углеродные (13C) ЯМР-спектры измеряют с помощью спектрометра GN-Omega 300 (75 МГц) General Electric с растворителем (CDCl3 77,0; MeOD-d3; 49,0; ДМСО-d6 39,5) в качестве стандарта. Масс-спектры низкого разрешения (MS) и масс-спектры высокого разрешения (HRMS) получают либо как масс-спектры с использованием электронного удара (EI), либо как масс-спектры с бомбардировкой быстрыми атомами (FAB). Масс-спектры с использованием электронного удара (EI-MS) получают с использованием масс-спектрометра Hewlett Packard 5989A, оснащенного десорбционным датчиком для измерения химической ионизации Vacumetrics для введения образцов. Источник ионов поддерживают при 250°С. Ионизацию электронным ударом проводят при энергии электрона 70 эВ и токе захвата 300 мкА. Масс-спектры с использованием жидкого цезиевого вторичного иона (FAB-MS), современный вариант бомбардировки быстрыми атомами, получают при использовании спектрометра Kratos Concept 1-H. Масс-спектры с использованием химической ионизации (CI-MS) получают, используя Hewlett Packard MS-Engine (5989A) с метаном или аммонием в качестве газов-реагентов (1·10-4 тор - 2,5·10-4 тор). Прямое введение десорбционного датчика для измерения химической ионизации (DCI) (Vaccumetrics, Inc.) прыгает от 0 до 1,5 amps в течение 10 с и поддерживается на уровне 10 amps до тех пор, пока все следы образца не исчезнут (приблизительно 1-2 мин). Спектры сканируют от 50-800 amu при времени 2 с/скан. Получение масс-спектра с помощью ВЭЖХ - электроспрей (ВЭЖХ ES-MS) осуществляют с использованием прибора для ВЭЖХ Hewlett-Packard 1100, оснащенного четвертичным насосом, детектором с изменяющейся длиной волны, колонкой С-18 и захватывающим ион масс-спектрометром Finnigan LCQ и электроспрей-ионизацией. Спектры сканируют от 120-800 amu, используя различное ионное время, соответствующее числу ионов в источнике. Ион-селективные масс-спектры получают методом газовой хроматографии (GC-MS) с использованием газового хроматографа Hewlett Packard 5890, оборудованного метилсиликоновой колонкой НР-1 (покрытие 0,33 мМ coating; 25 м 0,2 мм) и масс-избирательным детектором Hewlett Packard 5971 (энергия ионизации 70 эВ). Элементный анализ проводят с помощью Robertson Microlit Labs, Madisoon NJ.
Для всех соединений показаны ЯМР-спектры, LRMS и либо данные элементного анализа, либо данные HRMS в соответствии с предполагаемыми структурами.
Список сокращений и акронимов
АсОН - уксусная кислота
anh - безводный
atm (атм) - атмосфера(ы)
ВОС - трет-бутоксикарбонил
CDI -1,1'-карбонилдиимидазол
conc - концентрированный
d - день (дни)
dec - разложение
DMAC - N,N-диметилацетамид
DT.пл.U - 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон
ДМФ - N,N-диметилформамид
ДМСО - диметилсульфоксид
DPPA - дифенилфосфорил азид
EDCI - 1-(3-диметиламинопропил)-3-этилкарбодиимид
EtOAc - этилацетат
EtOH - этанол (100%)
Et2O - диэтиловый эфир
Et3N - триэтиламин
h (ч) - час(ы)
НОВТ - 1-гидроксибензотриазол
m-СРВА - 3-хлорпероксибензойная кислота
МеОН - метанол
pet. Ether - петролейный эфир (интервал температуры кипения 30-60° С)
tmp.(темп.) - температура
ТГФ - тетрагидрофуран; TFA - трифторАсОН
Tf - трифторметансульфонил
HPLC - ВЭЖХ
А Основные способы синтеза замещенных анилинов
А1. Основные способы получения ариламинов путем образования простого эфира с последующим омылением до сложного эфира, перегруппировкой по Curtius и снятием защиты с карбамата.
Синтез 2-амино-3-метоксинафталина.
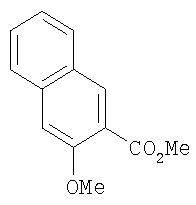
Стадия 1. Метил 3-метокси-2-нафтоат
Метил 3-гидрокси-2-нафтоат (10,1 г, 50,1 ммоль) в виде суспензии и K2СО3 (7,96 г, 57,6 ммоль) в ДМФ (200 мл) перемешивают при комнатной температуре в течение 15 мин, затем обрабатывают иодометаном (3,43 мл, 55,1 ммоль). Смеси позволяют перемешиваться при комнатной температуре в течение ночи, затем обрабатывают водой (200 мл). Полученную смесь экстрагируют EtOAc (2мл). Объединенные органические слои промывают насыщенным раствором NaCl (100 мл), сушат (MgSO4), концентрируют при пониженном давлении (приблизительно 0,4 мм Hg в течение ночи) с образованием метил 3-метокси-2-нафтоат в виде янтарного масла (10,30 г):1H-ЯМР-спектроскопия: (ДМСО-d6) 2,70 (s, 3Н), 2,85 (s, 3H), 7, 38 (прибл. t, J=8,09 Гц, 1H), 7,44 (s, 1H), 7,53 (прибл. t, J=8,09 Гц, 1Н), 7,84 (d, J=8,09 Гц, 1H), 7,90 (s, 1H), 8,21 (s, 1H).
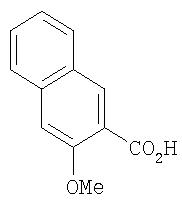
Стадия 2. 3-метокси-2-нафтойная кислота
Раствор метил 3-метокси-2-нафтоата (6,28 г, 29,10 ммоль) и воду (10 мл) в МеОН (100 мл) при комнатной температуре обрабатывают 1 н. раствором NaOH (33,4 мл, 33,4 ммоль). Смесь нагревают при температуре перегонки, в течение 3 ч, охлаждают до комнатной температуры и подкисляют 10% раствором лимонной кислоты. Полученный раствор экстрагируют EtOAc (2мл). Объединенные органические слои промывают насыщенным раствором NaCl, сушат (MgSO4) и концентрируют при пониженном давлении. Остаток растирают в порошок с гексаном, затем промывают несколько раз гексаном с получением 3-метокси-2-нафтойной кислоты в виде белого твердого вещества (5,40 г, 92%):1 H-ЯМР-спектроскопия (ДМСО-d6) 3.88 (s, 3Н), 7,34-7,41 (m, 2Н), 7,49-7,54 (m, 1H), 7,83 (d, J=8,09 Гц, 1H), 7,91 (d, J=8,09 Гц, 1H), 8,19 (s, 1H), 12,83 (br s, 1H).
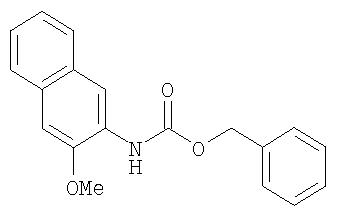
Стадия 3. 2-(N-(карбобензилокси)амино-3-метоксинафталин
Раствор 3-метокси-2-нафтойной кислоты (3,36 г, 16,6 ммоль) и Et3N (2,59 мл, 18,6 ммоль) в безводном толуоле (70 мл) перемешивают при комнатной температуре в течение 15 мин, затем обрабатывают раствором DPPA (5,12 г, 18,6 ммоль) в толуоле (10 мл) с использованием пипетки. Полученную смесь нагревают при 80°С в течение 2 ч. После охлаждения смеси до комнатной температуры с помощью шприца добавляют бензиловый спирт (2,06 мл, 20 ммоль). Затем смесь нагревают при 80°С в течение ночи. Полученную смесь охлаждают до комнатной температуры, гасят реакцию 10% раствором лимонной кислоты экстрагируют EtOAc (2мл). Объединенные органические слои промывают насыщенным раствором NaCl, сушат (MgSO4) и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (14% EtOAc/86% гексана) с получением 2-(N-(карбобензилокси)амино-3-метоксинафталина в виде светло-желтого масла (5,1 г, 100%):1H-ЯМР-спектроскопия (ДМСО-d6) 3,89 (s, 3Н), 5,17 (s, 2Н), 7,27-7,44 (m, 8H), 7,72-7,75 (m, 2H), 8,20 (s, 1H), 8,76 (s, 1H).
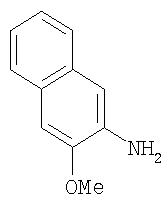
Стадия 4. 2-Амино-3-метоксинафталин
2-(N-(карбобензилокси)амино-3-метоксинафталин в виде суспензии (5,0 г, 16,3 ммоль) и 10% Pd/C (0,5 г) в EtOAc (70 мл) выдерживают в атм. Hg (баллон) при комнатной температуре в течение ночи. Полученную смесь фильтруют через Celite® и концентрируют при пониженном давлении с получением 2-амино-3-метоксинафталина в виде бледно-розового порошка (2,40 г, 85%):1H-ЯМР-спектроскопия (ДМСО-d6) 3,86 (s, 3Н), 6,86 (s, 2H), 7,04-7,16 (m, 2H), 7,43 (d, J=8,0 Гц, 1Н), 7, 56 (d, J=8,0 Гц, 1Н); EI-MS m/z 173 (M+).
A2. Синтез карбамиланилинов путем образования карбамилпиридина с последующим нуклеофильным связыванием с ариламином.
Синтез 4-(2-N-метилкарбамил-4-пиридилокси)анилина
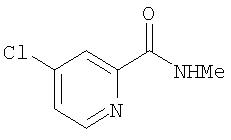
Стадия 1a. Синтез 4-хлор-N-метил-2-пиридинкарбоксамида с помощью реакции Menisci
Предостережение: это очень опасная, потенциально взрывчатая реакция. К перемешиваемому раствору 4-хлорпиридина (10,0 г) в N-метилформамиде (250 мл) при комнатной температуре добавляют концентрированную H2SO4 (3,55 мл) для получения экзотермического раствора. К данной смеси добавляют H2 O2 (30 мас.% в H2O, 17 мл) с последующим добавлением FeSO4·Н2О (0,56 г) для получения другого экзотермического раствора. Полученную смесь перемешивают в темноте при комнатной температуре в течение 1 ч, затем медленно нагревают в течение 4 ч до 45°С. При появлении пузырьков по краям реакцию нагревают при 60°С в течение 16 ч. Полученный непрозрачный коричневый раствор разбавляют Н2О (700 мл), а затем 10% раствором NaOH (250 мл). Полученную смесь экстрагируют EtOAc (3 мл). Органические фазы раздельно промывают насыщенным раствором NaCl (3 мл), затем их объединяют, сушат (MgSO4) и фильтруют через слой силикагеля с помощью EtOAc. Полученное коричневое масло очищают с помощью колоночной хроматографии (градиент от 50% EtOAc/50% гексана до 80% EtOAc/20% гексана). Полученное желтое масло кристаллизуют при 0°С в течение 72 ч с получением 4-хлор-N-метил-2-пиридинкарбоксамид (0,61 г, 5,3%): ТСХ (50% EtOAc/50% гексана) Rf 0,50;1H ЯМР-спектроскопия (CDCl3) 3,04 (d, J=5,1 Гц, 3Н), 7,43 (dd, J=5,4, 2,4 Гц, 1Н), 7,96 (br s, 1H), 8,21 (s, 1H), 8,44 (d, J=5,1 Гц, 1 H); CI-MS m/z 171 ((M+H)+).
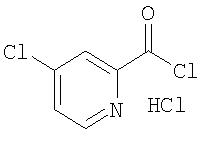
Стадия 1b. Синтез 4-хлорпиридин-2-карбонил хлорида, соли HI через пиколиновую кислоту
Безводный ДМФ (6,0 мл) медленно добавляют к SOCl2 (180 мл) при температуре между 40 и 50°С. Раствор перемешивают в данном интервале температур в течение 10 мин, затем добавляют пиколиновую кислоту (60,0 г, 487 ммоль) по частям в течение 30 мин. Полученный раствор нагревают при 72°С (сильное выделение SO2) в течение 16 ч для получения желтого твердого осадка. Полученную смесь охлаждают до комнатной температуры, разводят толуолом (500 мл) и концентрируют до 200 мл. Процесс добавления толуола/концентрирования повторяют дважды. Полученный практически сухой остаток фильтруют, твердые вещества промывают толуолом (2 мл) и сушат под высоким вакуумом в течение 4 ч для получения 4-хлорпиридин-2-карбонил хлорида, соли HCl, в виде желто-оранжевого твердого вещества (92,0 г, 89%).
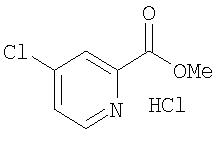
Стадия 2. Синтез метил 4-хлорпиридин-2-карбоксилата в виде соли HCl
Безводный ДМФ (10,0 мл) медленно добавляют к SOCl2 (300 мл) при 40-48°С. Раствор перемешивают в данном интервале температур в течение 10 мин, затем добавляют пиколиновую кислоту (100 г, 812 ммоль) в течение 30 мин. Полученный раствор нагревают при 72°С (сильное выделение SO2) в течение 16 ч для получения желтого твердого вещества. Полученную смесь охлаждают до комнатной температуры, разводят толуолом (500 мл) и концентрируют до 200 мл. Процесс добавления толуола/концентрирования повторяют дважды. Полученный практически сухой остаток фильтруют, твердые вещества промывают толуолом (50 мл) и сушат под высоким вакуумом в течение 4 ч для получения 4-хлорпиридин-2-карбонил хлорида, соли HCl, в виде белого твердого вещества (27,2 г, 16%). Данный материал удаляют.
Фильтрат красного цвета добавляют к МеОН (200 мл) со скоростью, которая поддерживает внутреннюю температуру смеси 55С. Содержимое перемешивают при комнатной температуре в течение 45 мин, охлаждают до 5°С и обрабатывают Et2O (200 мл) путем внесения по каплям. Полученные твердые вещества фильтруют, промывают Et2O (200 мл) и сушат при пониженном давлении при 35°С для получения соли HCl метил 4-хлорпиридин-2-карбоксилата в виде белого твердого вещества (110 г, 65%): температура плавления 108-112°С;1H-ЯМР-спектроскопия (ДМСО-d6) 3,88 (s, 3H), 7,82 (dd, J=5,5, 2, 2 Гц, 1Н), 8,08 (d, J=2,2 Гц, 1Н); 8,68 (d, J=5,5 Гц, 1H); 10,68 (brs, 1Н); ВЭЖХ ES-MS m/z 172 ((M+H)+).
Стадия 3а. Синтез 4-хлор-N-метил-2-пиридинсарбоксамида из метил 4-хлорпиридин-2-карбоксилата
Суспензию метил 4-хлорпиридин-2-карбоксилата соли HCl (89,0 г, 428 ммоль) в МеОН (75 мл) при 0°С обрабатывают 2,0 М раствором метиламина в ТГФ (тетрагидрофуране) (1 л) со скоростью, которая поддерживает внутреннюю температуру смеси ниже 5°С. Полученную смесь выдерживают при 3°С в течение 5 ч, затем концентрируют при пониженном давлении. Полученные твердые вещества суспендируют в EtOAc (1 л) и фильтруют. Фильтрат промывают насыщенным раствором NaCl (500 мл), сушат (Na2SO4) и концентрируют при пониженном давлении с получением 4-хлор-N-метил-2-пиридинкарбоксамида в виде светло-желтых кристаллов (71,2 г, 97%): температура плавления 41-43°С;1H-ЯМР-спектроскопия (ДМСО-d6) 2,81 (s, 3H), 7,74 (dd, J=5,1, 2,2 Гц, 1Н), 8,00 (d, J=2,2, 1Н), 8,61 (d, J=5,1 Гц, 1Н), 8,85 (brd, 1Н); CI-MS m/z 171 ((M+H)+).

Стадия 3b. Синтез 4-хлор-N-метил-2-пиридинкарбоксамида из 4-хлорпиридин-2-карбонил хлорида
4-Хлорпиридин-2-карбонил хлорид, соль HCl (7,0 г, 32,95 ммоль) добавляют по частям к смеси 2,0 М раствора метиламин в ТГФ (100 мл) и МеОН (20 мл) при 0°С. Полученную смесь выдерживают при 3°С в течение 4 ч, затем концентрируют при пониженном давлении. Полученные практически сухие твердые вещества суспендируют в EtOAc (100 мл) и фильтруют. Фильтрат промывают насыщенным раствором NaCl (2 мл), сушат (Na2SO4) и концентрируют при пониженном давлении с получением 4-хлор-N-метил-2-пиридинкарбоксамид в виде желтого кристаллического твердого вещества (4,95 г, 88%): температура плавления 37-40°С.
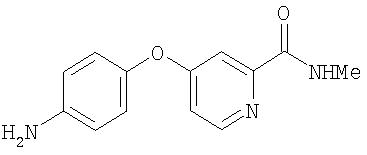
Стадия 4. Синтез 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилина
Раствор 4-аминофенола (9,60 г, 88,0 ммоль) в безводном ДМФ (150 мл) обрабатывают трет-бутоксидом калия (10,29 г, 91,7 ммоль), красновато-коричневую смесь перемешивают при комнатной температуре в течение 2 ч. Содержимое обрабатывают 4-хлор-N-метил-2-пиридинкарбоксамидом (15,0 г, 87,9 ммоль) и K2СО3 (6,50 г, 47,0 ммоль), а затем нагревают при 80°С в течение 8 ч. Смесь охлаждают до комнатной температуры и разделяют между EtOAc (500 мл) и насыщенным раствором NaCl (500 мл). Водную фазу снова экстрагируют EtOAc (300 мл). Объединенные органические слои промывают насыщенным раствором NaCl (4 мл), сушат (Na2SO4) и концентрируют при пониженном давлении. Полученные сухие вещества сушат при пониженном давлении при 35°С в течение 3 ч для получения 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилина в виде светло-коричневого твердого вещества (17,9 г, 84%);1H-ЯМР-спектроскопия (ДМСО-d6) 2,77 (d, J=4,8 Гц, 3Н), 5,17 (br s, 2H), 6, 64, 6,86 (AA'BB' квартет, J=8,4 Гц, 4Н), 7,06 (dd, J=5,5, 2,5 Гц, 1Н), 7,33 (d, J=2,5 Гц, 1 H), 8,44 (d, J=5,5 Гц, 1H), 8,73 (br d, 1H); ВЭЖХ ES-MS m/z 244 ((M+H)+).
A3. Общий способ синтеза анилинов путем нуклеофильного присоединения ароматической группы с последующим восстановлением нитроарена
Синтез 5-(4-аминофенокси)изоиндолин-1,3-диона
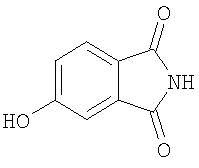
Стадия 1. Синтез 5-гидроксиизоиндолин-1,3-диона
К смеси карбоната аммония (5,28 г, 54,9 ммоль) в конц. АсОН (25 мл) медленно добавляют 4-гидроксифталевую кислоту (5,0 г, 27,45 ммоль). Полученную смесь нагревают при 120°С в течение 45 мин, затем прозрачную ярко-желтую смесь нагревают при 160°С в течение 2 ч. Полученную смесь выдерживают при 160°С и концентрируют до приблизительно 15 мл, затем охлаждают до комнатной температуры и подводят до рН 10 с помощью 1 н. раствора NaOH. Данную смесь охлаждают до 0°С и медленно подкисляют до рН 5, используя 1 н. раствор HCl. Полученный осадок собирают путем фильтрации и сушат при пониженном давлении с получением 5-гидроксиизоиндолин-1,3-дион в виде бледно-желтого порошка в качестве продукта (3,24 г, 72%);1H ЯМР-спектроскопия (ДМСО-d6) 7,00-7,03 (m, 2H), 7,56 (d, J=9,3 Гц, 1Н).
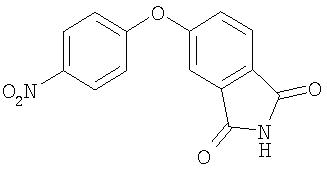
Стадия 2. Синтез 5-(4-нитрофенокси)изоиндолин-1, 3-диона
К перемешиваемой пасте NaH (1,1 г, 44,9 ммоль) в ДМФ (40 мл) при 0°С по каплям добавляют раствор 5-гидроксиизоиндолин-1,3-диона (3,2 г, 19,6 ммоль) в ДМФ (40 мл). Смеси ярко-желтого цвета позволяют нагреться до комнатной температуры и перемешивают в течение 1 ч, затем с помощью шприца в 3-4 порциях добавляют 1-фтор-4-нитробензол (2,67 г, 18,7 ммоль). Полученную смесь нагревают при 70°С в течение ночи, затем охлаждают до комнатной температуры, и медленно разбавляют водой (150 мл) и экстрагируют EtOAc (2 мл). Объединенные органические слои сушат (MgSO4) и концентрируют при пониженном давлении с получением 5-(4-нитрофенокси)изоиндолин-1,3-дион в виде желтого твердого вещества (3,3 г, 62%); при ТСХ (30% EtOAc/70% гексан) получают Rf 0,28;1H ЯМР-спектрометрия (ДМСО-d6) 7,32 (d, J=12 Гц, 2Н), 7,52-7,57 (m, 2H), 7,89(d, J=7,8 Гц, 1H), 8,29 (d, J=9 Гц, 2H), 11,43 (br s, 1H); CI-MS m/z 285 ((M+H)+), 100%).
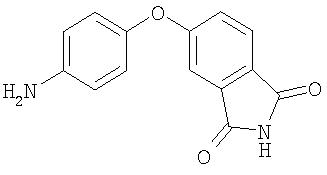
Стадия 3. Синтез 5-(4-аминофенокси)изоиндолин-1,3-диона
Раствор 5-(4-нитрофенокси)изоиндолин-1,3-диона (0,6 г, 2,11 ммоль) в конц. АсОН (12 мл) и воде (0,1 мл) перемешивают под током аргона при медленном добавлении порошка железа (0,59 г, 55,9 ммоль). Данную смесь перемешивают при комнатной температуре в течение 72 ч, затем разбавляют водой (25 мл) и экстрагируют EtOAc (3 мл). Объединенные органические слои сушат (MgSO4) и концентрируют при пониженном давлении с получением 5-(4-аминофенокси)изоиндолин-1,3-диона в виде коричневатого твердого вещества (0,4 г, 75%): при ТСХ (50% EtOAc/50% гексан) получают Rf 0,27;1 H ЯМР-спектрометрия (ДМСО-d6) 5,14 (brs, 2H), 6,62 (d, J=8,7 Гц, 2H), 6,84 (d, J=8,7 Гц, 2H), 7,03 (d, J=2,1 Гц, 1Н), 7,23 (dd, 1H), 7,75 (d, J=8,4 Гц, 1Н), 11,02 (s, 1Н); ВЭЖХ ES-MS m/z 255 ((M+H)+) 100%).
А4. Общий способ синтеза пирролиланилинов.
Синтез 5-трет-бутил-2-(2,5-диметилпирролил)анилина
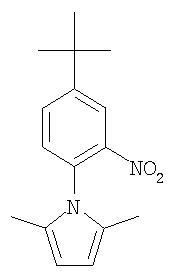
Стадия 1. Синтез 1-(4-трет-бутил-2-нитрофенил)-2,5-диметилпиррола
К перемешиваемому раствору 2-нитро-4-трет-бутиланилина (0,5 г, 2,57 ммоль) в циклогексане (10 мл) добавляют АсОН (0,1 мл) и ацетонилацетон (0,299 г, 2,63 ммоль) с помощью шприца. Реакционную смесь нагревают при 120°С в течение 72 ч с азеотропным удалением летучих веществ. Реакционную смесь охлаждают до комнатной температуры, разбавляют СН2Cl2 (10 мл) и последовательно промывают раствором 1 н. HCl (15 мл), раствором 1 н. NaOH (15 мл) и насыщенным раствором NaCl (15 мл), сушат (MgSO4) и концентрируют при пониженном давлении. Полученные оранжево-коричневые твердые вещества очищают с помощью колоночной хроматографии (60 г SiO2; градиент от 6% EtOAc/94% гексана до 25% EtOAc/75% гексана) с получением 1-(4-трет-бутил-2-нитрофенил)-2,5-диметилпиррол в виде оранжево-желтого твердого вещества (0,34 г, 49%): при ТСХ (15% EtOAc/85% гексан) получают Rf 0,67;1H ЯМР-спектроскопия (CDCl3) 1,34 (s, 9H), 1,89 (s, 6H), 5,84 (s, 2H), 7,19-7,24 (m, 1H), 7,62 (dd, 1H), 7,88 (d, J=2,4 Гц, 1Н); данные CI-MS m/z 273 ((М+Н)+) 50%).
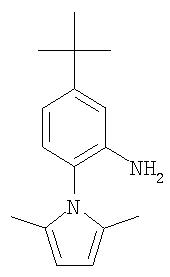
Стадия 2. Синтез 5-трет-бутил-2-(2,5-диметилпирролил)анилина
1-(4-трет-бутил-2-нитрофенил)-2,5-диметилпиррол в виде суспензии (0311 г, 1, 25 ммоль), 10% Pd/C (0,056 г) и EtOAc (50 мл) в атмосфере Н2 (баллон) перемешивают в течение 72 ч, затем фильтруют через слой Celite®. Фильтрат концентрируют при пониженном давлении с получением 5-трет-бутил-2-(2,5-диметилпирролил)анилин в виде желтоватого твердого вещества (0,30 г, 99%): при ТСХ (10% EtOAc/90% гексан) получают Rf 0,43;1H ЯМР-спектроскопия (CDCl3) 1,28 (s, 9H), 1,87-1,91 (m, 8H), 5,85 (br s, 2H), 6,73-6,96 (m, 3H), 7,28 (br s, 1H).
А5. Общий способ синтеза анилинов из анилинов путем нуклеофильного замещения в ароматическом ядре.
Синтез 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-метиланилина соли HCl
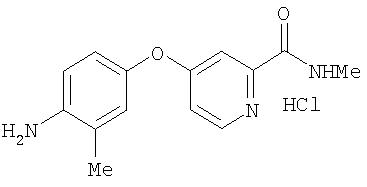
Раствор 4-амино-3-метилфенола (5,45 г, 44,25 ммоль) в сухом диметилацетамиде (75 мл) обрабатывают трет-бутоксидом калия (10,86 г, 96,77 ммоль) и черную смесь перемешивают при комнатной температуре до тех пор, пока содержимое колбы не достигнет комнатной температуры. Затем содержимое обрабатывают 4-хлор-N-метил-2-пиридинкарбоксамидом (Способ А2, Стадия 3b; 7,52 г, 44,2 ммоль) и нагревают при 110°С в течение 8 ч. Смесь охлаждают до комнатной температуры и разводят водой (75 мл). Органический слой экстрагируют EtOAc (5 мл). Объединенные органические слои промывают насыщенным раствором NaCl (200 мл), сушат (MgSO4) и концентрируют при пониженном давлении. Остаточное черное масло обрабатывают Et2O (50 мл) и подвергают воздействию ультразвука. Затем раствор обрабатывают HCl (1 М в Et2O; 100 мл) и перемешивают при комнатной температуре в течение 5 мин. Полученное темно-розовое твердое вещество (7,04 г, 24,1 ммоль) удаляют из раствора путем фильтрации и хранят в анаэробных условиях при 0°С до использования:1H ЯМР-спектроскопия (ДМСО-d6) 2,41 (s, 3Н), 2,78 (d, J=4,4 Гц, 3Н), 4,93 (br s, 2H), 7,19 (dd, J=8,5, 2,6 Гц, 1Н), 7,23 (dd, J=5,5, 2,6 Гц, 1Н), 7,26 (d, J=2,6 Гц, 1Н), 7,55 (d, J=2,6 Гц, 1Н), 7,64 (d, J=8,8 Гц, 1Н), 8,55 (d, J=5,9 Гц, 1Н), 8,99 (q, J=4, 8 Гц, 1Н).
А6. Общий способ синтеза анилинов из гидроксианилинов с помощью N-защиты нуклеофильного замещения в ароматическом ядре и снятия защиты.
Синтез 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-хлоранилина
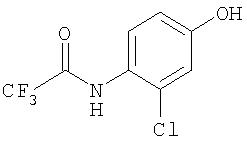
Стадия 1: Синтез 3-Хлор-4-(2,2,2-трифторацетиламино)фенола
Железо (3,24 г, 58,00 ммоль) добавляют к перемешиваемому TFA (200 мл). К данной суспензии добавляют 2-хлор-4-нитрофенол (10,0 г, 58,0 ммоль) и трифторуксусный ангидрид (20 мл). Данную серую суспензию перемешивают при комнатной температуре в течение 6 дней. Железо отфильтровывают из раствора и оставшийся материал концентрируют при пониженном давлении. Полученное серое твердое вещество растворяют в воде (20 мл). К полученному желтому раствору добавляют насыщенный раствор NaHCO3 (50 мл). Твердое вещество, которое осаждают из раствора, удаляют. Фильтрат медленно гасят раствором бикарбоната натрия до того, как продукт видимо не выделяется из раствора (определяют, используя рабочую мини-колбу). Немного мутный желтый раствор экстрагируют EtOAc (3 мл). Объединенные органические слои промывают насыщенным раствором NaCl (125 мл), сушат (MgSO4) и концентрируют при пониженном давлении.1H ЯМР-спектроскопия (ДМСО-d6) показывает соотношение 1:1 исходного материала, содержащего нитрофенол, и предусмотренного продукта 3-хлор-4-(2,2,2-трифторацетиламино)фенола. Сырец используют в следующей стадии без дальнейшей очистки.
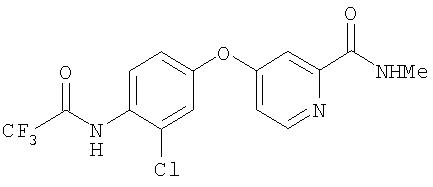
Стадия 2: Синтез 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-хлорфенил (2,2,2-трифтор)ацетамида
Раствор неочищенного 3-хлор-4-(2,2,2-трифторацетиламино)фенола (5,62 г, 23,46 ммоль) в сухом диметилацетамиде (50 мл) обрабатывают трет-бутоксидом калия (5,16 г, 45,98 ммоль) и коричневато-черную смесь перемешивают при комнатной температуре до тех пор, пока колба не охладится до комнатной температуры. Полученную смесь обрабатывают 4-хлор-N-метил-2-пиридинкарбоксамидом (Способ А2, Стадия 3b; 1,99 г, 11,7 ммоль) и нагревают при 100°С под аргоном в течение 4 дней. Черную реакционную смесь охлаждают до комнатной температуры и затем выливают в холодную воду (100 мл). Смесь экстрагируют EtOAc (3 мл) и объединенные органические слои концентрируют при пониженном давлении. Остаточное коричневое масло очищают с помощью колоночной хроматографии (градиент от 20% EtOAc/петролейный эфир до 40% EtOAc/петролейный эфир) с получением 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-хлорфенил(2,2,2-трифтор)ацет амид в виде желтого твердого вещества (8,59 г, 23,0 ммоль).
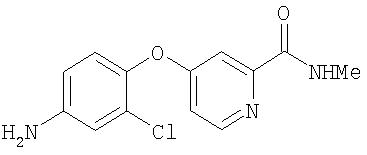
Стадия 3. Синтез 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-хлоранилина
Раствор неочищенного 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-хлорфенил(2,2,2-трифтор)ацетамида (8,59 г, 23,0 ммоль) в сухом 4-диоксане (20 мл) обрабатывают 1 н. раствором NaOH (20 мл). Данному коричневому раствору дают перемешиваться в течение 8 ч. К данному раствору добавляют EtOAc (40 мл). Зеленый органический слой экстрагируют EtOAc (3 мл) и растворитель концентрируют с получением 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-хлоранилин в виде зеленого масла, которое отверждают путем выстаивания (2,86 г, 10,30 ммоль):1H ЯМР-спектроскопия (ДМСО-d6) 2,77 (d, J=4, 8 Гц, 3Н), 5,51 (s, 2H), 6,60 (dd, J=8,5, 2,6 Гц, 1Н), 6,76 (d, J=2,6 Гц, 1Н), 7,03 (d, J=8,5 Гц, 1Н), 7,07 (dd, J=5,5, 2,6, Гц, 1Н), 7,27 (d, J=2,6 Гц, 1Н), 8,46 (d, 7-5,5 Гц, 1Н), 8,75 (q, J=4,8, 1Н).
A7. Общий способ снятия защиты с ацилированного анилина.
Синтез 4-Хлор-2-метокси-5-(трифторметил)анилина
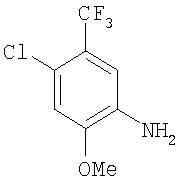
Суспензию 3-хлор-6-(N-ацетил)-4-(трифторметил)анизола (4,00 г, 14,95 ммоль) в 6 М растворе HCl (24 мл) нагревают до температуры перегонки в течение 1 ч. Полученному раствору дают охладиться до комнатной температуры, за данное время он немного отверждается. Полученную смесь разбавляют водой (20 мл), затем обрабатывают смесью твердого NaOH и насыщенного раствора NaHCO3до тех пор, пока раствор не станет основным. Органический слой экстрагируют CH2Cl2 (3 мл). Объединенные органические вещества сушат (MgSO4) и концентрируют при пониженном давлении с получением 4-хлор-2-метокси-5-(трифторметил)анилин в виде коричневого масла (3,20 г, 14,2 ммоль);1H ЯМР-спектрометрия (ДМСО-d6) 3,84 (s, 3Н), 5,30 (s, 2H), 7,01 (s, 2H).
А8. Общий способ синтеза ω-алкокси-ω-карбоксифениланилинов.
Синтез 4-(3-(N-метилкарбамоил)-4-метоксифенокси)анилина.
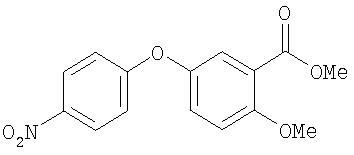
Стадия 1. 4-(3-метоксикарбонил-4-метоксифенокси)-1-нитробензол:
К раствору 4-(3-карбокси-4-гидроксифенокси)-1-нитробензола (полученного из 2,5-дигидроксибензойной кислоты способом, аналогичным описанному в Способе А13, Стадии 1, 12 ммоль) в ацетоне (50 мл) добавляют К2СО3 (5 г) и диметилсульфат (3,5 мл). Полученную смесь нагревают при температуре перегонки в течение ночи, затем охлаждают до комнатной температуры и фильтруют через слой Celite®. Полученный раствор концентрируют при пониженном давлении, адсорбируют на SiO2 и очищают с помощью колоночной хроматографии (50% EtOAc/50% гексан) с получением 4-(3-метоксикарбонил-4-метоксифенокси)-1-нитробензол в виде желтого порошка (3 г): температура плавления 115-118°С.
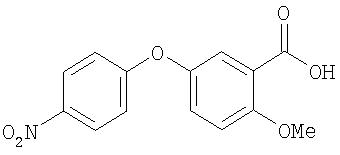
Стадия 2. 4-(3-Карбокси-4-метоксифенокси)-1-нитробензол:
Смесь 4-(3-метоксикарбонил-4-метоксифенокси)-1-нитробензола (1,2 г), КОН (0,33 г) и воды (5 мл) в МеОН (45 мл) перемешивают при комнатной температуре в течение ночи и затем нагревают при температуре перегонки в течение 4 ч. Полученную смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток растворяют в воде (50 мл) и водную смесь подкисляют 1 н. раствором HCl. Полученную смесь экстрагируют EtOAc (50 мл). Органический слой сушат (MgSO4) и концентрируют при пониженном давлении с получением 4-(3-карбокси-4-метоксифенокси)-1-нитробензол (1,04 г).
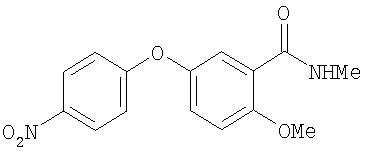
Стадия 3. 4-(3-(М-метилкарбамоил)-4-метоксифенокси)-1-нитробензол:
К раствору 4-(3-карбокси-4-метоксифенокси)-1-нитробензола (0,50 г, 1,75 ммоль) в CH2Cl2 (12 мл) добавляют SOCl2 (0,64 мл, 8,77 ммоль) по частям. Полученный раствор нагревают до температуры перегонки в течение 18 ч, охлаждают до комнатной температуры и концентрируют при пониженном давлении. Полученное твердое вещество желтого цвета растворяют в CH2Cl2 (3 мл), затем полученный раствор обрабатывают раствором метиламина (2,0 М в ТГФ, 3,5 мл, 7,02 ммоль) по частям (Предостережение: происходит выделение газа) и перемешивают при комнатной температуре в течение 4 ч. Полученную смесь обрабатывают 1 н. раствором NaOH, затем экстрагируют CH2Cl2 (25 мл). Органический слой сушат (Na2SO4) и концентрируют при пониженном давлении с получением 4-(3-(N-метилкарбамоил)-4-метоксифенокси)-1-нитробензол в виде твердого вещества желтого цвета (0,50 г, 95%).
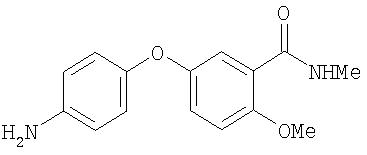
Стадия 4. 4-(3-(N-метилкарбамоил)-4-метоксифенокси)анилин:
Суспензию 4-(3-(N-метилкарбамоил)-4-метоксифенокси)-1-нитробензола (0,78 г, 2,60 ммоль) и 10% Pd/C (0,20 г) в EtOH (55 мл) перемешивают в 1 атм Н2 (баллон) в течение 2,5 дней, затем фильтруют через слой Celite®. Полученный раствор концентрируют при пониженном давлении с образованием 4-(3-(N-метилкарбамоил)-4-метоксифенокси)анилина в виде белого твердого вещества (0,68 г, 96%): при ТСХ (0, 1% Et3N/99,9% EtOAc) получают Rf 0,36.
A9. Общий способ получения ω-алкилфталимидсодержащих анилинов.
Синтез 5-(4-аминофенокси)-2-метилизоиндолин-1,3-диона
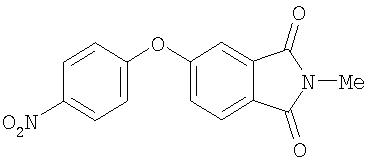
Стадия 1. Синтез 5-(4-нитрофенокси)-2-метилизоиндолин-1,3-диона:
Суспензию 5-(4-нитрофенокси)изоиндолин-1,3-диона (см. A3, Стадия 2; 1,0 г, 3,52 ммоль) и NaH (0,13 г, 5,27 ммоль) в ДМФ (15 мл) перемешивают при комнатной температуре в течение 1 ч, затем обрабатывают метилиодидом (0,3 мл, 4,57 ммоль). Полученную смесь перемешивают при комнатной температуре, в течение ночи, затем охлаждают и обрабатывают водой (10 мл). Полученные сухие вещества собирают и сушат при пониженном давлении с получением 5-(4-нитрофенокси)-2-метилизоиндолин-1,3-дион в виде твердого вещества ярко-желтого цвета (0, 87 г, 83%): при ТСХ (35% EtOAc/65% гексана) получают Rf 0,61.
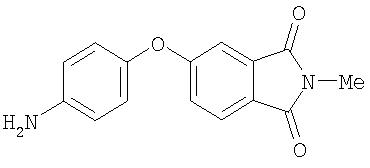
Стадия 2. Синтез 5-(4-аминофенокси)-2-метилизоиндолин-1,3-диона:
Суспензию нитрофенокси)-2-метилизоиндолин-1,3-диона (0,87 г, 2,78 ммоль) и 10% Pd/C (0,10 г) в МеОН перемешивают под 1 атм Н2 (баллон) в течение ночи. Полученную смесь фильтруют через слой Celite® и концентрируют при пониженном давлении. Полученные твердые вещества желтого цвета растворяют в EtOAc (3 мл) и фильтруют через слой SiO2 (60% EtOAc/40% гексана) с получением 5-(4-аминофенокси)-2-метилизоиндолин-1,3-дион в виде твердого вещества желтого цвета (0,67 г, 86%): при ТСХ (40% EtOAc/60% гексана) получают Rf 0,27.
А10. Общий способ синтеза ω-карбамоилариланилинов посредством реакции предшественников ω-алкоксикарбониларила с аминами.
Синтез 4-(2-(N-(2-морфолин-4-илэтил)карбамоил)пиридилокси)анилина
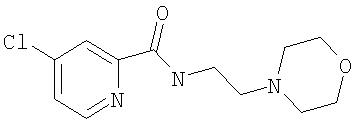
Стадия 1. Синтез 4-хлор-2-(N-(2-морфолин-4-илэтил)карбамоил)пиридина
К раствору метил 4-хлорпиридин-2-карбоксилата соли HCl (см. Способ А2, Стадия 2; 1,01 г, 4,86 ммоль) в ТГФ (20 мл) по каплям добавляют 4-(2-аминоэтил)морфолин (2,55 мл, 19,4 ммоль) и полученный раствор нагревают при температуре перегонки в течение 20 ч, охлаждают до комнатной температуры и обрабатывают водой (50 мл). Полученную смесь экстрагируют EtOAc (50 мл). Органический слой сушат (MgSO4) и концентрируют при пониженном давлении с получением 4-хлор-2-(N-(2-морфолин-4-илэтил)карбамоил)пиридин в виде желтого масла (1,25 г, 95%): при ТСХ (10% МеОН/90% EtOAc) получают Rf 0,50.
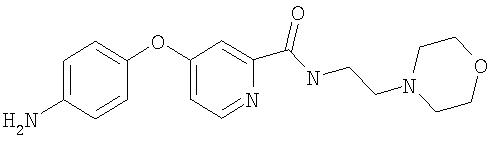
Стадия 2. Синтез 4-(2-(N-(2-морфолин-4-илэтил)карбамоил)пиридилокси)анилина
Раствор 4-аминофенола (0,49 г, 4,52 ммоль) и трет-бутоксида калия (0,53 г, 4,75 моль) в ДМФ (8 мл) перемешивают при комнатной температуре в течение 2 ч, затем последовательно обрабатывают 4-хлор-2-(N-(2-морфолин-4-илэтил)карбамоил)пиридином (1,22 г, 4,52 ммоль) и K2СО3 (0,31 г, 2,26 ммоль). Полученную смесь нагревают при 75С в течение ночи, охлаждают до комнатной температуры и разделяют между EtOAc (25 мл) и насыщенным раствором NaCl (25 мл). Водный слой вторично экстрагируют EtOAc (25 мл). Объединенные органические слои промывают насыщенным раствором NaCl (3 мл) и концентрируют при пониженном давлении. Полученные твердые вещества коричневого цвета очищают с помощью колоночной хроматографии (58 г; градиент от 100% EtOAc до 25% МеОН/75% EtOAc) с получением 4-(2-(N-(2-морфолин-4-илэтил)карбамоил)пиридилокси)анилин (1,0 г, 65%): при ТСХ (10% МеОН/90% EtOAc) получают Rf 0,32.
А11. Общий способ восстановления нитроаренов до ариламинов.
Синтез 4-(3-карбоксифенокси)анилина.
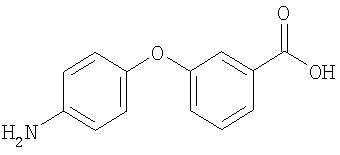
Суспензию 4-(3-карбоксифенокси)-1-нитробензола (5,38 г, 20,7 ммоль) и 10% Pd/C (0,50 г) в МеОН (120 мл) перемешивают в атмосфере H2 (баллон) в течение 2 дней. Полученную смесь фильтруют через слой Celite®, затем концентрируют при пониженном давлении с получением 4-(3-карбоксифенокси)анилин в виде твердого вещества коричневого цвета (2,26 г, 48%): при ТСХ (10% МеОН/90% CH2 Cl2) получают Rf 0,44 (нанесение вещества в виде штриха).
А12. Общий способ синтеза изоиндолинонсодержащих анилинов.
Синтез 4-(1-оксоизоиндолин-5-илокси)анилина.
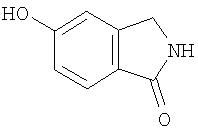
Стадия 1. Синтез 5-гидроксиизоиндолин-1-она
К раствору 5-гидроксифталимида (19,8 г, 121 ммоль) в АсОН (500 мл) медленно добавляют цинковую пыль (47,6 г, 729 ммоль) по частям, затем смесь нагревают при температуре перегонки в течение 40 мин, фильтруют в горячем виде и концентрируют при пониженном давлении. Реакцию повторяют в том же объеме, объединенный маслянистый остаток очищают с помощью колоночной хроматографии (1,1 кг SiO2; градиент от 60% EtOAc/40% гексана до 25% МеОН/75% EtOAc) с получением 5-гидроксиизоиндолин-1-он (3,77 г): при ТСХ (100% EtOAc) получают Rf 0,17; ВЭЖХ ES-MS m/z 150((M+H)+).
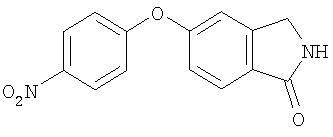
Стадия 2. Синтез 4-(1-изоиндолинон-5-илокси)-1-нитробензол
К суспензии NaH (0,39 г, 16,1 ммоль) в ДМФ при 0°С добавляют 5-гидроксиизоиндолин-1-он (2,0 г, 13,4 ммоль) по частям. Полученной суспензии дают нагреться до комнатной температуры и перемешивают в течение 45 мин, потом добавляют 4-фтор-1-нитробензол и затем смесь нагревают при 70°С в течение 3 ч. Смесь охлаждают до 0°С и обрабатывают водой, добавляя ее по каплям до тех пор, пока на образуется осадок. Полученное сухое вещество собирают, что дает 4-(1-изоиндолинон-5-илокси)-1-нитробензол в виде твердого вещества темно-желтого цвета (3,23 г, 89%); при ТСХ (100% EtOAc) получают Rf 0,35.
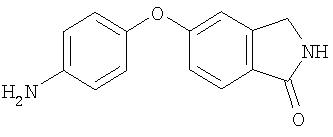
Стадия 3. Синтез 4-(1-охоизоиндолин-5-илокси)анилина
Суспензию 4-(1-изоиндолинон-5-илокси)-1 -нитробензола (2,12 г, 7,8 ммоль) и 10% Pd/C (0,20 г) в EtOH (50 мл) перемешивают в атмосфере H2 (баллон) в течение 4 ч, затем фильтруют через слой Celite®. Фильтрат концентрируют при пониженном давлении получая 4-(1-охоизоиндолин-5-илокси)анилин в виде твердого вещества темно-желтого цвета: при ТСХ (100% EtOAc) получают Rf 0,15.
А13. Общий способ синтеза ω-карбамоиланилинов через EDCI-опосредованное получение амида с последующим восстановлением нитроарена
Синтез 4-(3-N-метилкарбамоилфенокси)анилина.
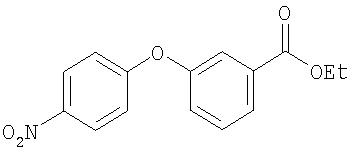
Стадия 1. Синтез 4-(3-этоксикарбонилфенокси)-1-нитробензола
Смесь 4-фтор-1-нитробензола (16 мл, 150 ммоль), этил 3-гидроксибензоата (25 г, 150 ммоль) и K2СО3 (41 г, 300 ммоль) в ДМФ (125 мл) нагревают при температуре перегонки в течение ночи, охлаждают до комнатной температуры и обрабатывают водой (250 мл). Полученную смесь экстрагируют EtOAc (3 мл). Объединенные органические фазы последовательно промывают водой (3 мл) и насыщенным раствором NaCl (2 мл), сушат (Na2SO4) и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (10% EtOAc/90% гексана) с получением 4-(3-этоксикарбонилфенокси)-1-нитробензол в виде масла (38 г).
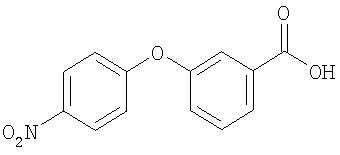
Стадия 2. Синтез 4-(3-карбоксифенокси)-1-нитробензола
К интенсивно перемешиваемой смеси 4-(3-этоксикарбонилфенокси)-1-нитробензола (5,14 г, 17,9 ммоль) в растворе 3:1 ТГФ/воды (75 мл) добавляют раствор LiOH·H2O (1,50 г, 35,8 ммоль) в воде (36 мл). Полученную смесь нагревают при 50°С в течение ночи, затем охлаждают до комнатной температуры, концентрируют при пониженном давлении и подводят до рН 2 1 М раствором HCl. Полученные твердые вещества ярко-желтого цвета удаляют фильтрацией и промывают гексаном, давая 4-(3-карбоксифенокси)-1-нитробензол (4,40 г, 95%).
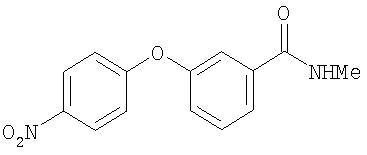
Стадия 3. Синтез 4-(3-(N-метилкарбамоил)фенокси)-1-нитробензола
Смесь 4-(3-карбоксифенокси)-1-нитробензола (3,72 г, 14, 4 ммоль), EDCI (3,63 г, 18,6 ммоль), N-метилморфолина (1,6 мл, 14,5 ммоль) и метиламина (2,0 М в ТГФ; 8 мл, 16 ммоль) в CH2Cl2 (45 мл) перемешивают при комнатной температуре в течение 3 дней, затем концентрируют при пониженном давлении. Остаток растворяют в EtOAc (50 мл) и полученную смесь экстрагируют 1 М раствором HCl (50 мл). Водный слой вторично экстрагируют EtOAc (2 мл). Объединенные органические фазы промывают насыщенным раствором NaCl (50 мл), сушат (Na2SO4) и концентрируют при пониженном давлении с получением 4-(3-(N-метилкарбамоил)фенокси)-1-нитробензол в виде масла (1,89 г).
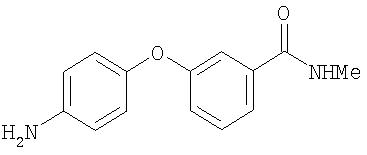
Стадия 4. Синтез 4-(3-(N-метилкарбамоил)фенокси)анилина
Суспензию 4-(3-(N-метилкарбамоил)фенокси)-1-нитробензола (1,89 г, 6,95 ммоль) и 5% Pd/C (0,24 г) в EtOAc (20 мл) перемешивают в атмосфере H2 (баллон) в течение ночи. Полученную смесь фильтруют через слой Celite® и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (5% МеОН/95% CH2Cl2). Полученное масло отверждают под вакуумом в течение ночи, что дает 4-(3-(N-метилкарбамоил)фенокси)анилин в виде твердого вещества желтого цвета (0,95 г, 56%).
А14. Общий способ синтеза ω-карбамоиланилинов через EDCI-опосредованное образование амида с последующим восстановлением нитроарена.
Синтез 4-3-(5-метилкарбамоил)пиридилокси)анилина
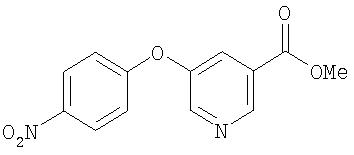
Стадия 1. Синтез 4-(3-(5-метоксикарбонил)пиридилокси)-1-нитробензола
К суспензии NaH (0,63 г, 26,1 ммоль) в ДМФ (20 мл) добавляют раствор метил 5-гидроксиникотината (2,0 г, 13,1 ммоль) в ДМФ (10 мл). Полученную смесь добавляют к раствору 4-фторнитробензола (1,4 мл, 13,1 ммоль) в ДМФ (10 мл) и полученную смесь нагревают при 70°С в течение ночи, охлаждают до комнатной температуры и обрабатывают МеОН (5 мл), а затем водой (50 мл). Полученную смесь экстрагируют EtOAc (100 мл). Органическую фазу концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (30% EtOAc/70% гексана) с получением 4-(3-(5-метоксикарбонил)пиридилокси)-1-нитробензол (0,60 г).
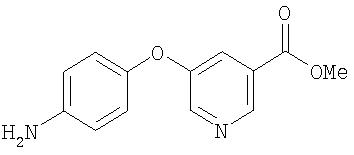
Стадия 2. Синтез 4-(3-(5-метоксикарбонил)пиридилокси)анилина
Суспензию 4-(3-(5-метоксикарбонил)пиридилокси)-1-нитробензола (0,60 г, 2,20 ммоль) и 10% Pd/C в МеОН/EtOAc перемешивают в атмосфере Н2 (баллон) в течение 72 ч. Полученную смесь фильтруют и фильтрат концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (градиент от 10% EtOAc/90% гексана до 30% EtOAc/70% гексана до 50% EtOAc/50% гексана) с получением 4-(3-(5-метоксикарбонил)пиридилокси)анилин (0,28 г, 60%);1H ЯМР-спектроскопия (CDCl3) 3,92 (s, 3H), 6,71 (d, 2H), 6,89 (d, 2H), 7,73 (, 1Н), 8,51 (d, 1H), 8,87 (d, 1H).
A15. Синтез анилина через электрофильное нитрование с последующим восстановлением.
Синтез 4-(3-метилсульфамоилфенокси)анилина.
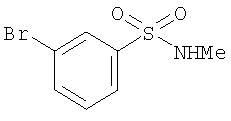
Стадия 1. Синтез N-метил-3-бромбензолсульфонамида
К раствору 3-бромбензолсульфонилхлорида (2,5 г, 11,2 ммоль) в ТГФ (15 мл) при 0°С добавляют метиламин (2,0 М в ТГФ; 28 мл, 56 ммоль). Полученному раствору дают нагреться до комнатной температуры и перемешивают при комнатной температуре в течение ночи. Полученную смесь разделяют между EtOAc (25 мл) и 1 М раствором HCl (25 мл). Водную фазу вторично экстрагируют EtOAc (2 мл). Объединенные органические фазы последовательно промывают водой (2 мл), насыщенным раствором NaCl (25 мл), сушат (MgSO4) и концентрируют при пониженном давлении с получением N-метил-3-бромбензолсульфонамида в виде твердого вещества белого цвета (2,8 г, 99%).
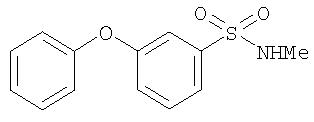
Стадия 2. Синтез 4-(3-(N-метилсульфамоил)фенилокси)бензола
К суспензии фенола (1,9 г, 20 ммоль), K2СО3 (6,0 г, 40 ммоль) и CuI (4 г, 20 ммоль) в ДМФ (25 мл) добавляют N-метил-3-бромбензолсульфонамид (2,5 г, 10 ммоль) и полученную смесь перемешивают при температуре перегонки в течение ночи, охлаждают до комнатной температуры, и разделяют между EtOAc (50 мл) и 1 н. раствором HCl (50 мл). Водный слой вторично экстрагируют EtOAc (2 мл). Объединенные органические фазы последовательно промывают водой (2 мл), насыщенным раствором NaCl (50 мл), сушат (MgSO4) и концентрируют при пониженном давлении. Остаток в виде масла очищают с помощью колоночной хроматографии (30% EtOAc/70% гексана), что дает 4-(3-(N-метилсульфамоил)фенилокси)бензол (0,30 г).
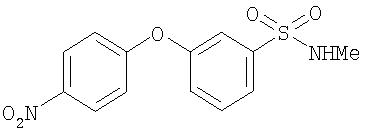
Стадия 3. Синтез 4-(3-(N-метилсульфамоил)фенилокси)-1-нитробензола
К раствору 4-(3-(N-метилсульфамоил)фенилокси)бензола (0,30 г, 1,14 ммоль) в TFA (6 мл) при -10°С добавляют NaNO3 (0,097 г, 1,14 ммоль) по частям в течение 5 мин. Полученный раствор перемешивают при -10°С в течение 1 ч, затем дают нагреться до комнатной температуры и концентрируют при пониженном давлении. Остаток разделяют между EtOAc (10 мл) и водой (10 мл). Органическую фазу последовательно промывают водой (10 мл) и насыщенным раствором NaCl (10 мл), сушат (MgSO4) и концентрируют при пониженном давлении с получением 4-(3-(N-метилсульфамоил)фенилокси)-1-нитробензол (0,20 г). Данный материал переносят на следующую стадию без дальнейшей очистки.
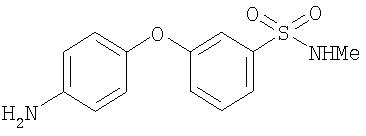
Стадия 4. Синтез 4-(3-(N-метилсульфамоил)фенилокси)анилина
Суспензию 4-(3-(N-метилсульфамоил)фенилокси)-1-нитробензола (0,30 г) и 10% Pd/C (0,030 г) в EtOAc (20 мл) перемешивают в атмосфере Н2 (баллон) в течение ночи. Полученную смесь фильтруют через слой Celite®. Фильтрат концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (30% EtOAc/70% гексана) с получением 4-(3-(N-метилсульфамоил)фенилокси)анилин (0,070 г).
А16. Модификация -кетонов.
Синтез 4-(4-(1-(N-метокси)иминоэтил)феноксианилина соли HCl
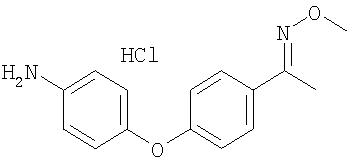
К суспензии 4-(4-ацетилфенокси)анилина соли HCl (получают способом, аналогичным Способу А13, стадия 4; 1,0 г, 3,89 ммоль) в смеси EtOH (10 мл) и пиридина (1,0 мл) добавляют O-метилгидроксиламин соль HCl (0,65 г, 7,78 ммоль, 2.0 экв.). Полученный раствор нагревают при температуре перегонки в течение 30 мин, охлаждают до комнатной температуры и концентрируют при пониженном давлении. Полученные сухие вещества растирают в порошок с водой (10 мл) и промывают водой с получением 4-(4-(1-(N-метокси)иминоэтил)феноксианилин соль HCl в виде твердого вещества желтого цвета (0,85 г): при ТСХ (50% EtOAc/50% петролейный эфир) получают Rf 0,78;1H ЯМР-спектроскопия (ДМСО-d6) 3,90 (s, 3Н), 5,70 (s, 3Н); ВЭЖХ-MS m/z 257 ((M+H)+).
А17. Синтез N-(-силилоксиалкил)амидов.
Синтез 4-(4-(2-(N-(2-триизопропилсилилокси)этилкарбамоил)пиридилоксианилина.
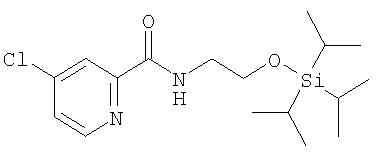
Стадия 1. 4-Хлор-N-(2-триизопропилсилилокси)этилпиридин-2-карбоксамид
К раствору 4-хлор-N-(2-гидроксиэтил)пиридин-2-карбоксамида (получают способом, аналогичным способу А2, Стадия 3b; 1,5 г, 7,4 ммоль) в безводном ДМФ (7 мл) добавляют триизопропилсилилхлорид (1,59 г, 8,2 ммоль, 1,1 экв.) и имидазол (1,12 г, 16,4 ммоль, 2,2 экв.). Полученный раствор желтого цвета перемешивают в течение 3 ч при комнатной температуре, затем концентрируют при пониженном давлении. Остаток разделяют между водой (10 мл) и EtOAc (10 мл). Водный слой экстрагируют EtOAc (3 мл). Объединенные органические фазы сушат (MgSO4) и концентрируют при пониженном давлении с получением 4-хлор-2-(N-(2-триизопропилсилилокси)этил)пиридинкарбоксамид в виде оранжевого масла (2,32 г, 88%). Данный материал используют в следующей стадии без дальнейшей очистки.
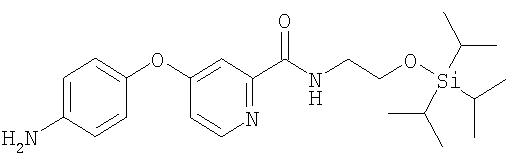
Стадия 2. 4-(4-(2-(N-(2-триизопропилсилилокси)этилкарбамоил)пиридилоксианилин
К раствору 4-гидроксианилина (0,70 г, 6,0 ммоль) в безводном ДМФ (8 мл) добавляют трет-бутоксид калия (0,67 г, 6,0 ммоль, 1,0 экв.) за один прием, вызывая экзотермическую реакцию. Когда данную смесь охлаждают до комнатной температуры, добавляют раствор 4-хлор-2-(N-(2-триизопропилсилилокси)этил)пиридинкарбоксамида (2,32 г, 6 ммоль, 1 экв.) в ДМФ (4 мл), а затем K2СО3 (0,42 г, 3,0 ммоль, 0,50 экв.). Полученную смесь нагревают при 80°С в течение ночи. Затем добавляют дополнительную порцию трет-бутоксида калия (0,34 г, 3 ммоль, 0,5 экв.) и перемешивают смесь при 80°С дополнительно в течение 4 ч. Смесь охлаждают до 0°С в бане со льдом и водой, затем медленно по каплям добавляют воду (приблизительно 1 мл). Органический слой экстрагируют EtOAc (3 мл). Объединенные органические слои промывают насыщенным раствором NaCl (20 мл), сушат (MgSO4) и концентрируют при пониженном давлении. Коричневый маслянистый остаток очищают с помощью колоночной хроматографии (SiO2, 30% EtOAc/ 70% петролейный эфир) с получением 4-(4-(2-(N-(2-триизопропилсилилокси)этилкарбамоил)пиридилоксианилин в виде прозрачного светло-коричневого масла (0,99 г, 38%).
А18. Синтез сложных эфиров 2-пиридинкарбоксилата путем окисления 2-метилпиридинов.
Синтез 4-(5-(2-метоксикарбонил)пиридилокси)анилина.
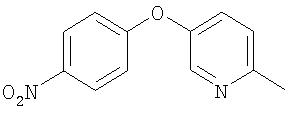
Стадия 1. 4-(5-(2-метил)пиридилокси-1-нитробензола.
Смесь 5-гидрокси-2-метилпиридина (10,0 г, 91,6 ммоль), 1-фтор-4-нитробензола (9,8 мл, 91,6 ммоль, 1,0 экв.), K2CO3 (25 г, 183 ммоль, 2,0 экв.) в ДМФ (100 мл) нагревают при температуре перегонки в течение ночи. Полученную смесь охлаждают до комнатной температуры, обрабатывают водой (200 мл) и экстрагируют EtOAc (3 мл). Объединенные органические слои последовательно промывают водой (2 мл) и насыщенным раствором NaCl (100 мл), сушат (MgSO4) и концентрируют при пониженном давлении с получением 4-(5-(2-метил)пиридилокси)-1-нитробензол в виде коричневого твердого вещества (12,3 г).
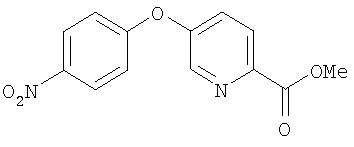
Стадия 2. Синтез 4-(5-(2-метоксикарбонил)пиридилокси)-1-нитробензола.
Смесь 4-(5-(2-метил)пиридилокси)-1-нитробензола (1,70 г, 7,39 ммоль) и диоксида селена (2, 50 г, 22,2 ммоль, 3,0 экв.) в пиридине (20 мл) нагревают при температуре перегонки в течение 5 ч, затем охлаждают до комнатной температуры. Полученную суспензию фильтруют, затем концентрируют при пониженном давлении. Остаток растворяют в МеОН (100 мл). Раствор обрабатывают концентрированным раствором HCl (7 мл), затем нагревают при температуре перегонки в течение 3 ч, охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток разделяют между EtOAt (50 мл) и 1 н. раствором NaOH (50 мл). Водный слой экстрагируют EtOAc (2 мл). Объединенные органические слои последовательно промывают водой (2 мл) и насыщенным раствором NaCl (50 мл), сушат (MgSO4) и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (SiO2; 50% EtOAc/50% гексана) с получением 4-(5-(2-метоксикарбонил)пиридилокси)-1-нитробензол (0,70 г).
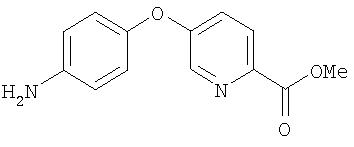
Стадия 3. Синтез 4-(5-(2-метоксикарбонил)пиридилокси)анилина.
Суспензию 4-(5-(2-метоксикарбонил)пиридилокси)-1-нитробензола (0,50 г) и 10% Pd/C (0,050 г) в смеси EtOAc (20 мл) и МеОН (5 мл) помещают в атмосферу Н2 (баллон) в течение ночи. Полученную смесь фильтруют через слой Celite® и фильтрат концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (SiO2; 70% EtOAc/30% гексана) с получением 4-(5-(2-метоксикарбонил)пиридилокси)анилин (0,40 г).
А19. Синтез ω-сульфонилфениланилинов.
Синтез 4-(4-метилсульфонилфенилокси)анилина.
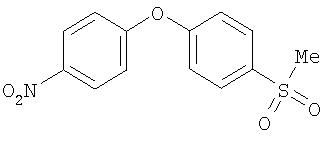
Стадия 1. 4-(4-метилсульфонилфенокси)-1-нитробензол:
К раствору 4-(4-метилтиофенокси)-1-нитробензола (2,0 г, 7,7 ммоль) в CH2Cl2 (75 мл) при 0°С медленно добавляют m-СРВА (57-86%, 4,0 г) и перемешивают реакционную смесь при комнатной температуре в течение 5 ч. Реакционную смесь обрабатывают 1 н. раствором NaOH (25 мл). Органический слой последовательно промывают 1 н. раствором NaOH (25 мл), водой (25 мл) и насыщенным раствором NaCl (25 мл), сушат (MgSO4) и концентрируют при пониженном давлении с получением 4-(4-метилсульфонилфенокси)-1-нитробензол в виде твердого вещества (2,1 г).
Стадия 2. 4-(4-Метилсульфонилфенокси)-1-анилин:
4-(4-метилсульфонилфенокси)-1-нитробензол восстанавливают до анилина способом, аналогичным описанному в Способе А 18, стадия 3.
В. Синтез предшественников мочевины
В1. Общий способ синтеза изоцианатов из анилинов с использованием CDI.
Синтез 4-бром-3-(трифторметил)фенилизоцианата.
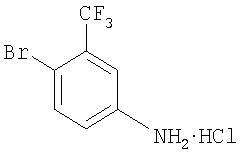
Стадия 1. Синтез 4-бром-3-(трифторметил)анилина соли HCl
К раствору 4-бром-3-(трифторметил)анилина (64 г, 267 ммоль) в Et2O (500 мл) по каплям добавляют раствор HCl (1 М в Et2O; 300 мл), и полученную смесь перемешивают при комнатной температуре в течение 16 ч. Полученный осадок розово-белого цвета удаляют путем фильтрации и промывают Et2O (50 мл) и получают 4-бром-3-(трифторметил)анилин соль HCl (73 г, 98%).
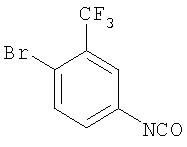
Стадия 2. Синтез 4-бром-3-(трифторметил)фенилизоцианата
Суспензию 4-бром-3-(трифторметил)анилина соли HCl (36,8 г, 133 ммоль) в толуоле (278 мл) обрабатывают введением по каплям трихлорметилхлорформиата и полученную смесь нагревают при температуре перегонки в течение 18 ч. Полученную смесь концентрируют при пониженном давлении. Остаток обрабатывают толуолом (500 мл), затем концентрируют при пониженном давлении. Остаток обрабатывают CH2Cl2 (500 мл), затем концентрируют при пониженном давлении. Процесс обработки СН2Cl2/концентрирования повторяют и полученное в результате масло янтарного цвета хранят при -20°С в течение 16 ч с получением 4-бром-3-(трифторметил)фенилизоцианат в виде твердого вещества рыжевато-коричневого цвета (35,1 г, 86%): GC-MS m/z 265 (M+).
С. Способы получения мочевины
С1а. Общий способ синтеза мочевин путем реакции изоцианата с анилином.
Синтез
N-хлор-3-(трифторметил)фенил)-N'-(4-(2-(N-метилкарбамоил)-4-пиридилокси)фенил) мочевины
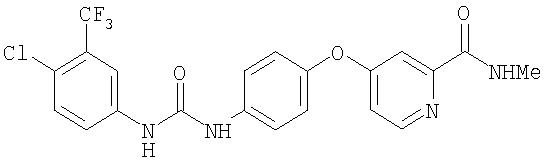
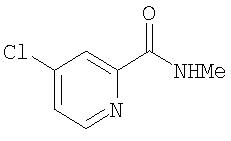
Раствор 4-хлор-3-(трифторметил)фенил изоцианата (14,60 г, 65,90 ммоль) в СН2Cl2 (35 мл) добавляют по каплям к суспензии 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилина (Способ А2, Стадия 4; 16,0 г, 65,77 ммоль) в CH2Cl2 (35 мл) при 0°С. Полученную смесь перемешивают при комнатной температуре в течение 22 ч. Полученные твердые вещества желтого цвета удаляют фильтрацией, затем промывают CH2Cl2 (2 мл) и сушат при пониженном давлении (приблизительно 1 мм Hg) с получением N-(4-хлор-3-(трифторметил)фенил)-N'-(4-(2-(N-метилкарбамоил)-4-пиридилокси)фенил)мочевине в виде твердого вещества небелого цвета (28,5 г, 93%): температура плавления 207-209°С;1H-ЯМР-спектроскопия (ДМСО-d6) 2,77 (d, J=4,8 Гц, 3Н), 7,16 (m, 3H), 7,37 (d, J=2,5 Гц, 1 Н), 7,62 (m, 4H), 8,11 (d, J=2,5 Гц, 1H), 8,49 (d, J=5,5 Гц, 1H), 8,77 (br d, 1H), 8,99 (s, 1H), 9,21 (s, 1H); ВЭЖХ ES-MS m/z 465 ((M+H)+).
C1b. Общий способ синтеза мочевин путем реакции изоцианата с анилином.
Синтез N-(4-бром-3-(трифторметил)(1)енил)-N'-(4-(2-(N-метилкарбамоил)-4-пиридилокси)фенил)мочевины
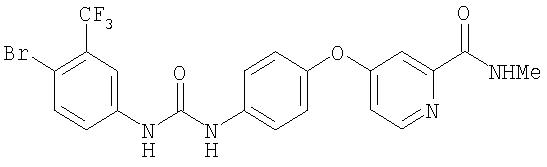
Раствор 4-бром-3-(трифторметил)фенилизоцианата (Способ В1, Стадия 2; 8,0 г, 30,1 ммоль) в СН2Cl2 (80 мл) добавляют по каплям к раствору 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилина (Способ А2, Стадия 4; 7,0 г, 28,8 ммоль) в СН2Cl2 (40 мл) при 0°С. Полученную смесь перемешивают при комнатной температуре в течение 16 ч. Полученные твердые вещества желтого цвета удаляют фильтрацией, затем промывают CH2Cl2 (2 мл) и сушат при пониженном давлении (приблизительно 1 мм Hg) при 40°С с получением N-(4-бром-3-(трифторметил)фенил)-N'-(4-(2-(N-метилкарбамоил)-4-пиридилокси)фенил)мочевину в виде твердого вещества светло-желтого цвета (13,2 г, 90%): температура плавления 203-205°С;1H-ЯМР-спектроскопия (ДМСО-d6) 2,77 (d, J=4,8 Гц, 3Н), 7,16 (m, 3Н), 7,37 (d, J=2,5 Гц, 1H), 7,58 (m, 3Н), 7,77 (d, J=8,8 Гц, 1H), 8,1 1 (d, J=2,5 Гц, 1H), 8,49 (d, J=5,5 Гц, 1H), 8,77 (brd, 1H), 8,99 (s, 1H), 9,21 (s, 1H); ВЭЖХ ES-MS m/z 509 ((M+H)+).
С1с. Общий способ синтеза мочевин путем реакции изоцианата с анилином.
Синтез N-(4-хлор-3-(трифторметил)фенил)-N'-(2-метил-4-(2-(N-метилкарбамоил)(4-пиридилокси))фенил)мочевины
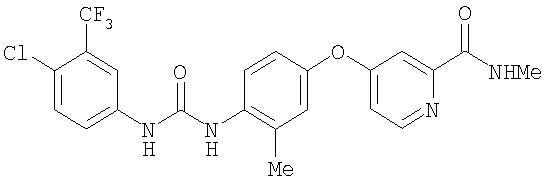
Раствор 2-метил-4-(2-(N-метилкарбамоил)(4-пиридилокси))анилина (Способ А5; 0,11 г, 0,45 ммоль) в CH2Cl2 (1 мл) обрабатывают Et3N (0,16 мл) и 4-хлор-3-(трифторметил)фенилизоцианатом (0,10 г, 0,45 ммоль). Полученный коричневый раствор перемешивают при комнатной температуре в течение 6 дней, затем обрабатывают водой (5 мл). Водный слой повторно экстрагируют EtOAc (3 мл). Объединенные органические слои сушат (MgSO4) и концентрируют при пониженном давлении с получением N-(4-хлор-3-(трифторметил)фенил)-N'-(2-метил-4-(2-(N-метилкарбамоил)(4-пиридилокси))фенил)мочевине в виде масла коричневого цвета (0,11 г, 0,22 ммоль):1H ЯМР-спектроскопия (ДМСО-d6) 2,27 (s, 3H), 2,77 (d, J=4,8 Гц, 3Н), 7,03 (dd, J=8,5, 2,6 Гц, 1Н), 7,11 (d, J=2,9 Гц, 1Н), 7,15 (dd, J=5,5, 2,6, Гц, 1Н), 7,38 (d, J=2,6 Гц, 1Н), 7,62 (app d, J=2,6 Гц, 2Н), 7,84 (d, J=8,8 Гц, 1Н), 8,12(s, 1Н), 8,17 (s, 1Н), 8,50 (d, J=5,5 Гц,,1Н), 8,78 (q, J=5,2, 1Н), 9,52 (s, 1Н); ВЭЖХ ES-MS m/z 479 ((M+H)+).
C1d. Общий способ синтеза мочевин путем реакции изоцианата с анилином.
Синтез N-(4-хлор-3-(трифторметил)фенил)-N'-(4-аминофенил)мочевины
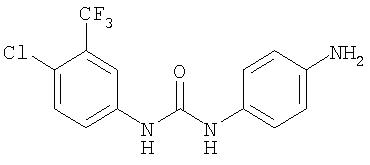
К раствору 4-хлор-3-(трифторметил)фенилизоцианата (2,27 г, 10,3 ммоль) в CH2Cl2 (308 мл) добавляют р-фенилендиамин (3,32 г, 30,7 ммоль) в одной порции. Полученную смесь перемешивают при комнатной температуре в течение 1 ч, обрабатывают CH2Cl2 (100 мл) и концентрируют при пониженном давлении. Полученные твердые вещества розового цвета растворяют в смеси EtOAc (110 мл) и МеОН (15 мл), и прозрачный раствор промывают 0,05 н. раствором HCl. Органический слой концентрируют при пониженном давлении получая неочищенную N-(4-хлор-3-(трифторметил)фенил)-N'-(4-аминофенил)мочевину (3,3 г): при ТСХ (100% EtOAc) получают Rf 0,72.
С1е. Общий способ синтеза мочевин путем реакции изоцианата с анилином.
Синтез N-(4-хлор-3-(трифторметил)фенил)-N'-(4-этоксикарбонилфенил)мочевины
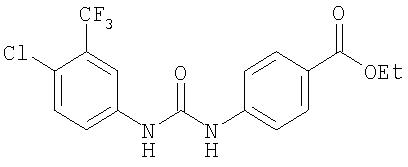
К раствору этил 4-изоцианатобензоата (3,14 г, 16,4 ммоль) в CH2Cl2 (30 мл) добавляют 4-хлор-3-(трифторметил)анилин (3,21 г, 16,4 ммоль) и раствор перемешивают при комнатной температуре в течение ночи. Полученную суспензию разводят CH2Cl2 (50 мл) и фильтруют с получением N-(4-хлор-3-(трифторметил)фенил)-N'-(4-этоксикарбонилфенил)мочевину в виде твердого вещества белого цвета (5,93 г, 97%): при ТСХ (40% EtOAc/60% гексана) получают Rf 0,44.
C1f. Общий способ синтеза мочевин путем реакции изоцианата с анилином.
Синтез N-(4-хлор-3-(трифторметил)фенил)-N'-(3-карбоксифенил)мочевины
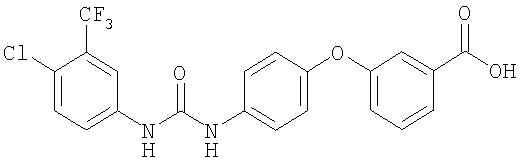
К раствору 4-хлор-3-(трифторметил)фенилизоцианата (1,21 г, 5,46 ммоль) в CH2Cl2 (8 мл) добавляют 4-(3-карбоксифенокси)анилин (Способ А11; 0,81 г, 5,76 ммоль) и полученную смесь перемешивают при комнатной температуре, в течение ночи, затем обрабатывают МеОН (8 мл) и перемешивают дополнительно в течение 2 ч. Полученную смесь концентрируют при пониженном давлении. Полученные твердые вещества коричневого цвета растирают в порошок с раствором 1:1 EtOAc/гексана с получением N-(4-хлор-3-(трифторметил)фенил)-N'-(3-карбоксифенил)мочевину в виде небелого твердого вещества (1,21 г, 76%).
С2а. Общий способ синтеза мочевины путем реакции анилина с N, N'-карбонилдиимидазолом с последующим введением второго соединения анилина.
Синтез
N-(2-метокси-5-(трифторметил)фенил)-N'-(4-(2-(N-метилкарбамоил)-4-пиридилокси)фенил)мочевины
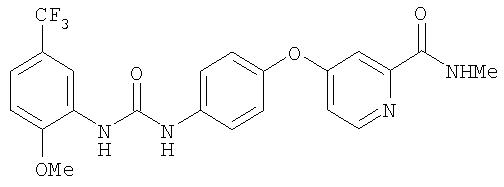
К раствору 2-метокси-5-(трифторметил)анилина (0,15 г) в безводном СН2Cl2 (15 мл) при 0°С добавляют CDI (0,13 г). Полученному раствору дают нагреться до комнатной температуры в течение 1 ч, перемешивают при комнатной температуре в течение 16 ч, затем обрабатывают 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилином (0,18 г). Полученный желтый раствор перемешивают при комнатной температуре в течение 72 ч, затем обрабатывают H2O (125 мл). Полученную водную смесь экстрагируют EtOAc (2 мл). Объединенные органические фракции промывают насыщенным раствором NaCl (100 мл), сушат (MgSO4) и концентрируют при пониженном давлении. Остаток растирают в порошок (90% EtOAc/10% гексана). Полученные твердые вещества белого цвета собирают путем фильтрации и промывают EtOAc. Фильтрат концентрируют при пониженном давлении и остаточное масло очищают с помощью колоночной хроматографии (градиент от 33% EtOAc/67% гексана до 50% EtOAc/50% гексана до 100% EtOAc) с получением N-(2-метокси-5-(трифторметил)фенил)-N'-(4-(2-(N-метилкарбамоил)-4-пиридилокси)фенил)мочевине в виде твердого вещества светло-рыжевато-коричневого цвета (0, 098 г, 30%); при ТСХ (100% EtOAc) получают Rf 0,62;1H ЯМР-спектроскопия (ДМСО-d6) 2,76 (d, J=4,8 Гц, 3Н), 3,96 (s, 3Н), 7,1-7,6 и 8,4-8,6 (m, 11H), 8,75 (d, J=4,8 Гц, 1H), 9,55 (s, 1 H); FAB-MS m/z 461 ((M+H)+).
C2b. Общий способ синтеза мочевины путем реакции анилина с карбонилдиимидазолом с последующим введением второго соединения анилина. Симметричные мочевины как побочные продукты способа реакции N,N'-карбонилдиимидазола.
Синтез бис(4-(2-([N-метилкарбамоил)-4-пиридилокси)фенил)мочевины
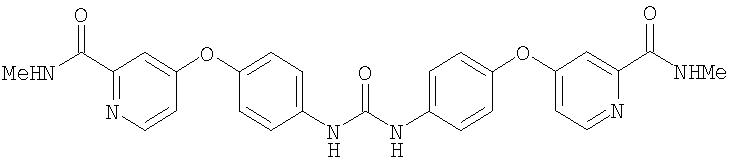
К перемешиваемому раствору 3-амино-2-метоксихинолина (0,14 г) в безводном CH2Cl2 (15 мл) при 0°С добавляют CDI (0,13 г). Полученному раствору дают нагреться до комнатной температуры в течение 1 ч, затем перемешивают при комнатной температуре в течение 16 ч. Полученную смесь обрабатывают 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилином (0,18 г). Полученный раствор желтого цвета перемешивают при комнатной температуре в течение 72 ч, затем обрабатывают водой (125 мл). Полученную водную смесь экстрагируют EtOAc (2 мл). Объединенные органические фазы промывают насыщенным раствором NaCl (100 мл), сушат (MgSO4) и концентрируют при пониженном давлении. Остаток растирают в порошок (90% EtOAc/10% гексана). Полученные твердые вещества белого цвета собирают путем фильтрации и промывают EtOAc с получением бис(4-(2-(N-метилкарбамоил)-4-пиридилокси)фенил)мочевину (0,081 г, 44%): при ТСХ (100% EtOAc) получают Rf 0,50;1H ЯМР-спектроскопия (ДМСО-d6) 2,76 (d, J=5,1 Гц, 6Н), 7,1-7,6 (m, 12H), 8,48 (d, J=5,4 Гц, 1Н), 8,75 (d, J=4,8 Гц, 2H), 8,86 (s, 2H); ВЭЖХ ES-MS m/z 513 ((M+H)+).
С2с. Общий способ синтеза мочевин путем реакции изоцианата с анилином.
Синтез N-(2-метокси-5-(трифторметил)фенил-N'-(4-(1,3-диоксоизоиндолин-5-илокси)фенил)мочевины
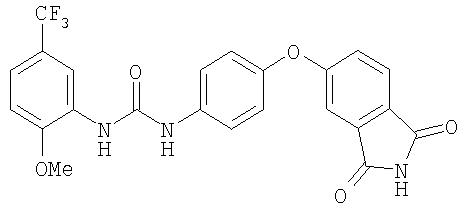
К перемешиваемому раствору 2-метокси-5-(трифторметил)фенилизоцианата (0,10 г, 0,47 ммоль) в CH2Cl2 (1,5 мл) добавляют 5-(4-аминофенокси)изоиндолин-1,3-дион (Способ A3, Стадия 3; 0,12 г, 0,47 ммоль) в одной порции. Полученную смесь перемешивают в течение 12 ч, затем обрабатывают CH2Cl2 10 мл) и МеОН (5 мл). Полученную смесь последовательно промывают 1 н. раствором HCl (15 мл) и насыщенным раствором NaCl (15 мл), сушат (MgSO4) и концентрируют при пониженном давлении с получением N-(2-метокси-5-(трифторметил)фенил-N'-(4-(1,3-диоксоизоиндолин-5-илокси)фенил)мочевину в виде твердого вещества белого цвета (0,2 г, 96%): при ТСХ (70% EtOAc/30% гексана) получают Rf 0,50;1H ЯМР-спектроскопия (ДМСО-d6) 3,95 (s, 3Н), 7,31-7,10 (m, 6Н), 7,57 (d, J=9,3 Гц, 2H), 7,80 (d, J=8,7 Гц, 1H), 8,53 (br s, 2H), 9,57 (s, 1H), 11,27 (br s, 1Н); ВЭЖХ ES-MS 472,0 ((М+Н)+), 100%).
C2d. Общий способ синтеза мочевины путем реакции анилина с N,N'-карбонилдиимидазолом с последующим введением второго соединения анилина.
Синтез N-(5-(трет-бутил)-2-(2,5-диметилпирролил)фенил)-N'-(4-(2-(N-метилкарбамоил)-4-пиридилокси)фенил)мочевины
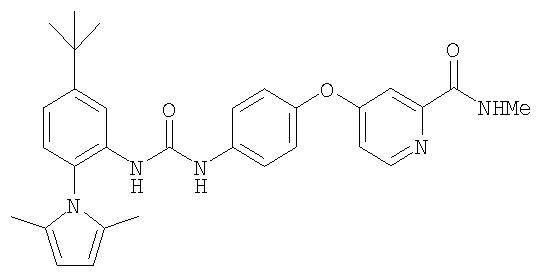
К перемешиваемому раствору CDI (0,21 г, 1,30 ммоль) в CH2Cl2 (2 мл) добавляют 5-(трет-бутил)-2-(2,5-диметилпирролил)анилин (Способ А4, Стадия 2; 0,30 г, 1,24 ммоль) в одной порции. Полученную смесь перемешивают при комнатной температуре в течение 4 ч, затем в одной порции добавляют 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилин (0, 065 г, 0,267 ммоль). Полученную смесь нагревают при 36°С в течение ночи, затем охлаждают до комнатной температуры и разбавляют EtOAc (5 мл). Полученную смесь последовательно промывают водой (15 мл) и 1 н. раствором HCl (15 мл), сушат (MgSO4) и фильтруют через слой силикагеля (50 г) с получением N-(5-(трет-бутил)-2-(2, 5-диметилпирролил)фенил)-N'-(4-(2-(N-метилкарбамоил)-4-пиридилокси)фенил)мочевину в виде твердого вещества желтого цвета (0,033 г, 24%): при ТСХ (40% EtO Ас/60% гексана) получают Rf 0,24;1H ЯМР-спектроскопия (ацетон-d6) 1,37 (s, 9H), 1,89 (s, 6H), 2,89 (d, J=4,8 Гц, 3Н), 5,83 (s, 2H), 6,87-7,20 (m, 6H), 7,17 (dd, 1Н), 7,51-7,58 (m, 3H), 8,43 (d, J=5,4 Гц, 1Н), 8, 57 (d, 1Н), 8,80 (br s, 1Н); ВЭЖХ ES-MS 512 ((M+H)+), 100%).
С3. Комбинаторный способ синтеза дифенилмочевин с использованием трифосгена
Один из анилинов, предназначенных для связывания, растворяют в дихлорэтане (0,10 М). Данный раствор вносят в сосуд объемом 8 мл (0,5 мл), содержащий дихлорэтан (1 мл). К данной смеси добавляют раствор бис(трихлорметил)карбоната (0,12 М в дихлорэтан, 0,2 мл, 0,4 эквивалента), в затем диизопропилэтиламин (0,35 М в дихлорэтан, 0,2 мл, 1,2 эквивалента). Емкость закрывают крышкой и нагревают при 80°С в течения 5 ч, затем дают охладиться до комнатной температуры в течение приблизительно 10 ч. Добавляют второе соединения анилина (0,10 М в дихлорэтане, 0,5 мл, 1,0 эквивалент), а затем диизопропилэтиламин (0,35 М в дихлорэтане, 0,2 мл, 1,2 эквивалента). Полученную смесь нагревают при 80°С в течение 4 ч, охлаждают до комнатной температуры и обрабатывают МеОН (0,5 мл). Полученную смесь концентрируют при пониженном давлении и очищают продукты ВЭЖХ с обращенной фазой.
С4. Общий способ синтеза мочевины путем реакции анилина с фосгеном с последующим введением второго соединения анилина.
Синтез N-(2-метокси-5-(трифторметил)фенил)-N'-(4-(2-(N-метилкарбамоил)-4-пиридилокси)фенил)мочевины
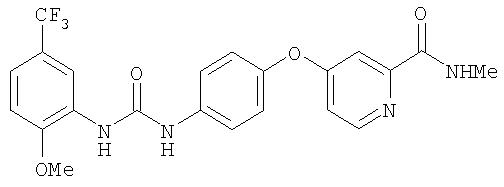
К перемешиваемому раствору фосгена (1,9 М в толуоле; 2,07 мл, 0,21 г, 1,30 ммоль) в CH2Cl2 (20 мл) при 0°С добавляют безводный пиридин (0,32 мл), а затем 2-метокси-5-(трифторметил)анилин (0,75 г). Желтому раствору дают нагреться до комнатной температуры, в процессе чего образуется осадок. Смесь желтого цвета перемешивают в течение 1 ч, затем концентрируют при пониженном давлении. Полученные сухие вещества обрабатывают безводным толуолом (20 мл), а затем 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилином (полученным, как описано в Способе А2; 0,30 г), и полученную суспензию нагревают при 80°С в течение 20 ч, затем дают охладиться до комнатной температуры. Полученную смесь разбавляют водой (100 мл), затем подщелачивают насыщенным раствором NaHCO3 (2-3 мл). Основной раствор экстрагируют EtOAc (2 мл). Органические слои раздельно промывают насыщенным раствором NaCl, объединяют, сушат (MgSO4) и концентрируют при пониженном давлении. Полученный розово-коричневый остаток растворяют в МеОН и адсорбируют на SiO2 (100 г). При колоночной хроматографии (300 г SiO2; градиент от 1% Et3N/33% EtOAc/66% гексана до 1% Et3N/99% EtOAc до 1% Et3N/20% МеОН/79% EtOAc) с последующим концентрированием при пониженном давлении при 45°С получают теплый концентрированный раствор в EtOAc, который обрабатывают гексаном (10 мл) с целью медленного образования кристаллов N-(2-метокси-5-(трифторметил)фенил)-N'-(4-(2-(N-метилкарбамоил)-4-пиридиноокси)фенил)мочевины (0,44 г): при ТСХ (1% Et3N/99% EtOAc) получают Rf 0,40.
D. Взаимопревращение мочевин
D1a. Превращение ω-аминофенилмочевин в ω-(ароиламино)фенилмочевины.
Синтез N-(4-хлор-3-((трифторметил)фенил)-N'-(4-(3-метоксикарбонилфенил)карбоксиаминофенил)мочевины
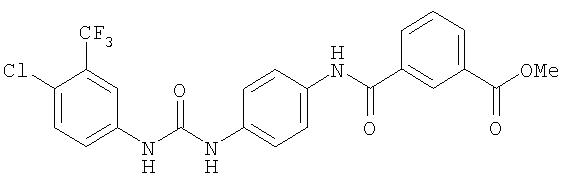
К раствору N-(4-хлор-3-((трифторметил)фенил)-N'-(4-аминофенил)мочевины (Способ C1d; 0,050 г, 1,52 ммоль), моно-метилизофталата (0,25 г, 1,38 ммоль), HOBT·H2O (0,41 г, 3,03 ммоль) и N-метилморфолина (0,33 мл, 3,03 ммоль) в ДМФ (8 мл) добавляют EDCI·HCl (0,29 г, 1,52 ммоль). Полученную смесь перемешивают при комнатной температуре в течение ночи, разводят EtOAc (25 мл) и последовательно промывают водой (25 мл) и насыщенным раствором NaHCO3 (25 мл). Органический слой сушат (Na2SO4) и концентрируют при пониженном давлении. Полученные сухие вещества растирают в порошок с раствором EtOAc (80% EtOAc/20% гексана) с получением N-(4-хлор-3-((трифторметил)фенил)-N'-(4-(3-метоксикарбонилфенил)карбоксиаминофенил)мочевину (0,27 г, 43%): температура плавления 121-122°С; при ТСХ (80% EtOAc/20% гексана) получают Rf 0,75.
D1b. Преващение ω-карбоксифенилмочевин в ω-(арилкарбамоил)фенилмочевины.
Синтез N-(4-хлор-3-((трифторметил)фенил)-N'-(4-(3-метилкарбамоилфенил)карбамоилфенил) мочевины
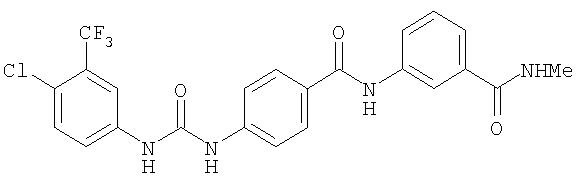
К раствору N-(4-хлор-3-((трифторметил)фенил)-N'-(4-(3-метилкарбамоилфенил)карбок-сиаминофенил)мочевины (0,14 г, 0,48 ммоль), 3-метилкарбамоиланилина (0,080 г, 0,53 ммоль), НОВТ·Н2О (0,14 г, 1,07 ммоль) и N-метилморфолина (0,5 мл, 1,07 ммоль) в ДМФ (3 мл) при 0С добавляют EDCI·HCl (0,10 г, 0,53 ммоль). Полученной смеси дают нагреться до комнатной температуры и перемешивают в течение ночи. Полученную смесь обрабатывают водой (10 мл) и экстрагируют EtOAc (25 мл). Органическую фазу концентрируют при пониженном давлении. Полученные твердые вещества желтого цвета растворяют в EtOAc (3 мл), затем фильтруют через слой силикагеля (17 г, градиент от 70% EtOAc/30% гексана до 10% МеОН/90% EtOAc) с получением N-(4-хлор-3-((трифторметил)фенил)-N'-(4-(3-метилкарбамоилфенил)карбамоилфенил)мочевину в виде твердого вещества белого цвета (0,097 г, 41%): температура плавления 225-229°С; при ТСХ (100% EtOAc) получают Rf 0,23.
D1c. Комбинаторный подход к превращению ω-карбоксифенилмочевин в ω-(арилкарбамоил)фенилмочевины.
Синтез N-(4-хлор-3-((трифторметил)фенил)-N'-(4-(N-(3-(N-(3-пиридил)карбамоил)фенил)карбамоил)фенил)мочевины
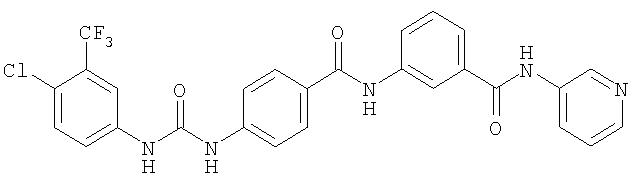
Смесь N-(4-хлор-3-((трифторметил)фенил)-N'-(3-карбоксифенил)мочевины (Способ C1f; 0,030 г, 0,067 ммоль) и N-циклогексил-N'-(метилполистирол)карбодиимида (55 мг) в 1,2-дихлорэтан (1 мл) обрабатывают раствором 3-аминопиридина в CH2Cl2 (1 М; 0,074 мл, 0,074 ммоль). (В случаях нерастворимости или мутности добавляют ДМСО в маленьких количествах). Полученную смесь нагревают при 36°С в течение ночи. Мутные реакции затем обрабатывают ТГФ (1 мл) и продолжают нагревание в течение 18 ч. Полученные смеси обрабатывают поли(4-(изоцианатометил)стиролом) (0, 040 г), и полученную смесь перемешивают при 36°С в течение 72 ч, затем охлаждают до комнатной температуры и фильтруют. Полученный раствор фильтруют через слой силикагеля (1 г). Концентрирование при пониженном давлении приводит к получению N-(4-хлор-3-((трифторметил)фенил)-N'-(4-(N-(3-(N-(3-пиридил)карбамоил)фенил)карбамоил)фенил)мочевины (0,024 г, 59%): при ТСХ (70% EtOAc/30% гексана) получают Rf 0,12.
D2. Превращение ω-карбоалкоксиарилмочевин в ω-карбамоиларилмочевины.
Синтез N-(4-хлор-3-((трифторметил)фенил)-N'-(4-(3-метилкарбамоилфенил)карбоксиаминофенил)мочевины
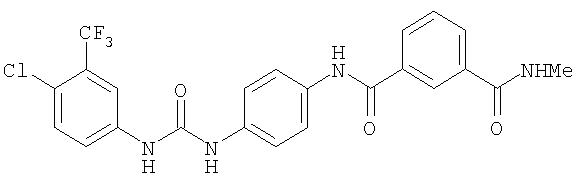
К образцу N-(4-хлор-3-((трифторметил)фенил)-N'-(4-(3-карбометоксифенил) карбоксиаминофенил)мочевины (0,17 г, 0,34 ммоль) добавляют метиламин (2 М в ТГФ; 1 мл, 1,7 ммоль) и полученную смесь перемешивают при комнатной температуре в течение ночи, затем концентрируют при пониженном давлении с получением N-(4-хлор-3-((трифторметил)фенил)-N'-(4-(3-метилкарбамоилфенил)карбоксиаминофенил)мочевину в виде твердого вещества белого цвета: температура плавления 247°С; при ТСХ (100% EtOAc) получают Rf 0,35.
D3. Превращение ω-карбоалкоксиарилмочевин в ω-карбоксиарилмочевины.
Синтез N-(4-хлор-3-((трифторметил)фенил)-N'-(4-карбоксифенил)мочевины
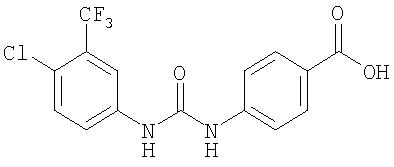
К суспензии N-(4-хлор-3-((трифторметил)фенил)-N'-(4-этоксикарбонилфенил)мочевины (см. Способ С1е; 5,93 г, 15,3 ммоль) в МеОН (75 мл) добавляют водный раствор KOH (2,5 М, 10 мл, 23 ммоль). Полученную смесь нагревают при температуре перегонки в течение 12 ч, охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток разбавляют водой (50 мл), затем обрабатывают 1 н. раствором HCl для подведения рН до 2-3. Полученные сухие вещества собирают и сушат при пониженном давлении с получением N-(4-хлор-3-((трифторметил)фенил)-N'-(4-карбоксифенил)мочевины в виде твердого вещества белого цвета (5,05 г, 92%).
D4. Общий способ превращения ω-алкокси сложных эфиров в ω-алкиламиды.
Синтез N-(4-хлор-3-((трифторметил)фенил-N'-((4-(3-(5-(2-диметиламиноэтил)карбамоил)пиридил)оксифенил)мочевины
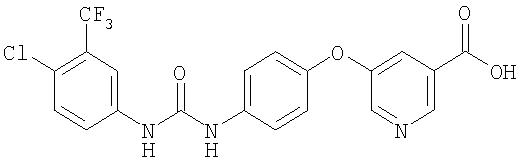
Стадия 1. Синтез N-(4-хлор-3-(трифторметил)фенил)-N'-((4-(3-(5-карбоксипиридил) оксифенил)мочевины
N-(4-[хлор-3-(трифторметил)фенил)-N'-((4-(3-(5-метоксикарбонилпиридил) оксифенил)мочевину синтезируют из 4-хлор-3-(трифторметил)фенилизоцианата и 4-(3-(5-метоксикарбонилпиридил)оксианилина (Способ А14, Стадия 2) методом, аналогичным Способу С1а. Суспензию N-(4-хлор-3-(трифторметил)фенил)-N-((4-(3-(5-метоксикарбонилпиридил)оксифенил)мочевины (0,26 г, 0,56 ммоль) в МеОН (10 мл) обрабатывают раствором КОН (0,14 г, 2,5 ммоль) в воде (1 мл) и перемешивают при комнатной температуре в течение 1 ч. Полученную смесь подводят до рН 5 1 н. раствором HCl. Полученный осадок удаляют фильтрацией и промывают водой. Полученные сухие вещества растворяют в EtOH (10 мл), и полученный раствор концентрируют при пониженном давлении. Процедуру EtOH/концентрирования повторяют дважды с получением N-(4-хлор-3-(трифторметил)фенил)-N'-((4-(3-(5-карбоксипиридил)оксифенил)мочевины (0,18 г, 71%).
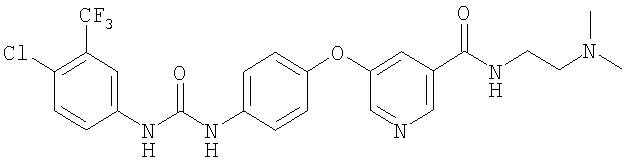
Стадия 2. Синтез N-(хлор-3-(трифторметил)фенил)-N'-((4-(3-(5-(2-диметиламиноэтил)карбамоил)пиридил)оксифенил)мочевины
Смесь N-(4-хлор-3-(трифторметил)фенил)-N'-((4-(3-(5-карбоксипиридил)-оксифенил)мочевины (0,050 г, 0,011 ммоль), N,N-диметилэтилендиамина (0,22 мг, 0,17 ммоль), НОВТ (0,028 г, 0,17 ммоль), N-метилморфолина (0,035 г, 0,28 ммоль) и EDCI·HCl (0,032 г, 0,17 ммоль) в ДМФ (2,5 мл) перемешивают при комнатной температуре в течение ночи. Полученный раствор разделяют между EtOAc (50 мл) и водой (50 мл). Органическую фазу промывают водой (35 мл), сушат (MgSO4) и концентрируют при пониженном давлении. Остаток растворяют в минимальном количестве CH2Cl2 (приблизительно 2 мл). Полученный раствор обрабатывают добавлением по каплям Et2O с получением N-(4-хлор-3-(трифторметил)фенил)-N'-((4-(3-(5-(2-диметил- аминоэтил)карбамоил)пиридил)оксифенил)мочевины в виде осадка белого цвета (0,48 г, 84%):1H ЯМР-спектроскопия (ДМСО-d6) 2,10 (s, 6H), 3,26 (s, H), 7,03 (d, 2H), 7,52 (d, 2H), 7,60 (m, 3H), 8,05 (s, 1H), 8,43 (s, 1H), 8,58 (t, 1H), 8, 69 (s, 1H), 8,90 (s, 1H), 9,14 (s, 1H); ВЭЖХ ES-MS m/z 522 ((М+Н)+).
D5. Общий способ снятия защиты с N-(-силилоксиалкил)амидов.
Синтез N-(4-хлор-3-((трифторметил)фенил)-N'-(4-(4-(2-(N-(2-гидрокси)этилкарбамоил)пиридилоксифенил)мочевины.
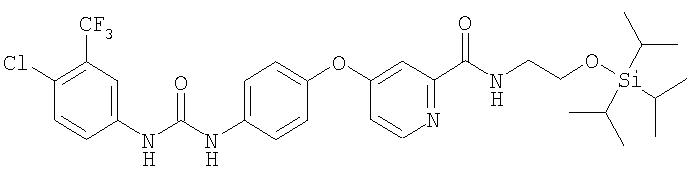
К раствору N-(4-хлор-3-((трифторметил)фенил)-N'-(4-(4-(2-(N-(2-триизопропилсилилок-си)этилкарбамоил)пиридилоксифенил)мочевины (получают методом, аналогичным Способу С1а; 0,25 г, 0,37 ммоль) в безводном ТГФ (2 мл) добавляют тетрабутиламмонийфторид (1,0 М в ТГФ; 2 мл). Смесь перемешивают при комнатной температуре в течение 5 мин, затем обрабатывают водой (10 мл). Водную смесь экстрагируют EtOAc (3 мл). Объединенные органические слои сушат (MgSO4) и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (SiO2; градиент от 100% гексана до 40% EtOAc/60% гексана) с получением N-(4-хлор-3-((трифторметил)фенил)-N'-(4-(4-(2-(N-(2-гидрокси)этилкарбамоил)пиридилоксифенил)мочевину в виде твердого вещества белого цвета (0,019 г, 10%).
Ниже представлены соединения, приведенные далее в Таблицах, которые синтезируют согласно вышеприведенным Детальным экспериментальным процедурам:
Синтез примеров соединения
(для получения характеристик соединений см. Таблицы)
Номер 1: 4-(3-N-метилкарбамоилфенокси)анилин получают согласно способу А13. Согласно способу С3, 3-трет-бутиланилин реагирует с бис(трихлорметил)карбонатом, а затем с 4-(3-N-метилкарбамоилфенокси)анилином с получением мочевины.
Номер 2: 4-Фтор-1-нитробензол и р-гидроксиацетофенон реагируют согласно Способу А13, Стадия 1, с получением 4-(4-ацетилфенокси)-1-нитробензола. 4-(4-ацетилфенокси)-1-нитробензол восстанавливают согласно Способу А13, Стадия 4 с получением 4-(4-ацетилфенокси)анилин. Согласно способу С3, 3-трет-бутиланилин реагирует с бис(трихлорметил)карбонатом, а затем с 4-(4-ацетилфенокси)анилином с получением мочевины.
Номер 3: Согласно способу C2d, 3-трет-бутиланилин обрабатывают CDI, а затем 4-(3-N-метилкарбамоил)-4-метоксифенокси)анилином, который получают согласно способу А8, с образованием мочевины.
Номер 4: 6-трет-бутил-2-метоксианилин превращают в 5-трет-бутил-2-метоксифенилизоцианат согласно способу В1. 4-(3-N-метилкарбамоилфенокси)анилин, полученный соответственно способу А13, реагирует с изоцианатом согласно способу С1а с получением мочевины.
Номер 5: Согласно способу C2d, 6-трет-бутил-2-метоксианилин реагирует с CDI, а затем с 4-(3-N-метилкарбамоил)-4-метоксифенокси)анилином, который получают согласно способу А8, с образованием мочевины.
Номер 6: 5-(4-аминофенокси)изоиндолин-1,3-дион получают согласно способу A3. В соответствии со способом 2d, 5-трет-бутил-2-метоксианилин реагирует с CDI, а затем с 5-(4-аминофенокси)изоиндолин-1,3-дионом с получением мочевины.
Номер 7: 4-(1-оксоизоиндолин-5-илокси)анилин синтезируют согласно способу А12. Согласно способу 2d, 5-трет-бутил-2-метоксианилин реагирует с CDI, а затем с 4-(1-оксоизоиндолин-5-илокси)анилином с получением мочевины.
Номер 8: 4-(3-N-метилкарбамоилфенокси)анилин синтезируют согласно способу А13. В соответствии со способом С2а, 2-метокси-5-(трифторметил)анилин реагирует с CDI, а затем с 4-(3-N-метилкарбамоилфенокси)анилином с получением мочевины.
Номер 9: 4-Гидроксиацетофенон реагируете 2-хлор-5-нитропиридином с образованием 4-(4-ацетилфенокси)-5-нитропиридина согласно способу A3, Стадия 2. В соответствии со способом А8, Стадия 4, 4-(4-ацетилфенокси)-5-нитропиридин восстанавливают до 4-(4-ацетилфенокси)-5-аминопиридина. 2-Метокси-5-(трифторметил)анилин превращают в 2-метокси-5-(трифторметил)фенилизоцианат согласно способу В1. Изоцианат реагирует с 4-(4-ацетилфенокси)-5-аминопиридином в соответствии со способом С1а с образованием мочевины.
Номер 10: 4-фтор-1-нитробензол и р-гидроксиацетофенон реагируют согласно способу А13, Стадия 1, с образованием 4-(4-ацетилфенокси)-1-нитробензола. 4-(4-ацетилфенокси)-1-нитробензол восстанавливают согласно способу А13, Стадия 4 с получением 4-(4-ацетилфенокси)анилин. В соответствии со способом С3, 5-(трифторметил)-2-метоксибутиланилин реагирует с бис(трихлорметил)карбонатом, а затем с 4-(4-ацетилфенокси)анилином с получением мочевины.
Номер 11: 4-Хлор-N-метил-2-пиридинкарбоксамид, который синтезируют согласно способу А2, Стадия 3а, реагирует с 3-аминофенолом согласно способу А2, стадия 4, с использованием DMAC вместо ДМФ, что дает 3-(-2-(N-метилкарбамоил)-4-пиридилокси)анилин. В соответствии со способом С4, 2-метокси-5-(трифторметил)анилин реагирует с фосгеном, а затем с 3-(-2-(N-метилкарбамоил)-4-пиридилокси)анилином с получением мочевины.
Номер 12: 4-хлорпиридин-2-карбонилхлорид, соль HCl реагирует с аммонием согласно способу А2, Стадия 3b, с образованием 4-хлор-2-пиридинкарбоксамида. 4-хлор-2-пиридинкарбоксамид реагирует с 3-аминофенолом согласно способу А2, Стадия 4, с использованием DMAC вместо ДМФ, что дает 3-(2-карбамоил-4-пиридилокси)анилин. В соответствии со способом С2а, 2-метокси-5-(трифторметил)анилин реагирует с фосгеном, а затем с 3-(2-карбамоил-4-пиридилокси)анилином с получением мочевины.
Номер 13: 4-Хлор-N-метил-2-пиридинкарбоксамид синтезируют согласно способу А2, Стадия 3b. 4-Хлор-N-метил-2-пиридинкарбоксамид реагирует с 4-аминофенолом согласно способу А2, Стадия 4 с использованием DMAC вместо ДМФ, что дает 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилин. Согласно способу С2а, 2-метокси-5-25(трифторметил)анилин реагирует с CDI, а затем с 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилином с получением мочевины.
Номер 14: 4-Хлорпиридин-2-карбонил хлорид соль HCl реагирует с аммонием согласно способу А2, Стадия 3b, с образованием 4-хлор-2-пиридинкарбоксамида. 4-Хлор-2-пиридинкарбоксамид реагирует с 4-аминофенолом согласно способу А2, Стадия 4, при использовании DMAC вместо ДМФ, что дает 4-(2-карбамоил-4-пиридилокси)анилин. Согласно способу С4, 2-метокси-5-(трифторметил)анилин реагирует с фосгеном, а затем с 4-(2-карбамоил-4-пиридилокси)анилином с получением мочевины.
Номер 15: Согласно способу C2d, 5-(трифторметил)-2-метоксианилин реагирует с CDI, а затем с 4-(3-N-метилкарбамоил)-4-метоксифенокси)анилином, который получают согласно способу А8, с образованием мочевины.
Номер 16: 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-метиланилин синтезируют согласно способу А5. 5-(трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. Изоцианат реагирует с 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-метиланилином согласно способу С1 с с получением мочевины.
Номер 17: 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-хлоранилин синтезируют согласно способу А6. 5-(Трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 5-(Трифторметил)-2-метоксифенилизоцианат реагирует с 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-хлоранилином в соответствии со способом С1а с получением мочевины.
Номер 18: Согласно способу А2, Стадия 4, 5-амино-2-метилфенол реагируете 4-хлор-N-метил-2-пиридинкарбоксамидом, который синтезируют согласно способу А2, Стадия 3b, что дает 3-(2-(N-метилкарбамоил)-4-пиридилокси)-4-метиланилин. 5-(трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 5-(Трифторметил)-2-метоксифенилизоцианат реагирует с 3-(2-(N-метилкарбамоил)-4-пиридилокси)-4-метиланилином согласно способу С1а с получением мочевины.
Номер 19: 4-Хлорпиридин-2-карбонилхлорид реагирует с этиламином согласно способу А2, Стадия 3b. Полученный 4-хлор-N-этил-2-пиридинкарбоксамид реагирует с 4-аминофенолом согласно способу А2, Стадия 4, что дает 4-(2-(N-этилкарбамоил)-4-пиридилокси)анилин. 5-(Трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат в соответствии со способом В1. 5-(Трифторметил)-2-метоксифенилизоцианат реагирует с 4-(2-(N-этилкарбамоил)-4-пиридилокси)анилином согласно способу С1а с получением мочевины.
Номер 20: Согласно способу А2, Стадия 4, 4-амино-2-хлорфенол реагирует с 4-хлор-N-метил-2-пиридинкарбоксамидом, который синтезируют в соответствии со способом А2, Стадия 3b, что дает 4-(2-(N-метилкарбамоил)-4-пиридилокси)-3-хлоранилин. 5-(трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 5-(трифторметил)-2-метоксифенилизоцианат реагирует с 4-(2-(N-метилкарбамоил)-4-пиридилокси)-3-хлоранилином в соответствии со способом С1а с образованием мочевины.
Номер 21: 4-(4-метилтиофенокси)-1-нитробензол окисляют согласно способу А19, Стадия 1, что приводит к образованию 4-(4-метилсульфонилфенокси)-1-нитробензола. Нитробензол восстанавливают согласно способу А19, Стадия 2 с образованием 4-(4-метилсульфонилфенокси)-1-анилина. Согласно способу С1а, 5-(трифторметил)-2-метоксифенилизоцианат реагирует с 4-(4-метилсульфонилфенокси)-1-анилином с образованием мочевины.
Номер 22: 4-(3-карбамоилфенокси)-1-нитробензол восстанавливают до 4-(3-карбамоилфенокси)анилина согласно способу А15, Стадия 4. В соответствии со способом С1а, 5-(трифторметил)-2-метоксифенилизоцианат реагирует с 4-(3-карбамоилфенокси)анилином с получением мочевины.
Номер 23: 5-(4-аминофенокси)изоиндолин-1,3-дион синтезируют согласно способу A3. 5-(трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 5-(трифторметил)-2-метоксифенил изоцианат реагирует с 5-(4-аминофенокси)изоиндолин-1,3-дионом согласно способу С1а с получением мочевины.
Номер 24: 4-хлорпиридин-2-карбонилхлорид реагирует с диметиламином в соответствии со Способом А2, Стадия 3b. Полученный 4-хлор-N,N-диметил-2-пиридинкарбоксамид реагирует с 4-аминофенолом согласно Способу А2, Стадия 4, что дает 4-(2-(N,N-диметилкарбамоил)-4-пиридилокси)анилин. 5-(Трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 5-(трифторметил)-2-метоксифенилизоцианат реагирует с 4-(2-(N,N-диметилкарбамоил)-4-пиридилокси)анилином согласно способу С1а с получением мочевины.
Номер 25: 4-(1-оксоизоиндолин-5-илокси)анилин синтезируют согласно способу А12. 5-(трифторметил)-2-метоксианилин обрабатывают CDI, а затем 4-(1-оксоизоиндолин-5-илокси)анилином согласно способу C2d с получением мочевины.
Номер 26: 4-Гидроксиацетофенон реагирует с 4-фторнитробензолом в соответствии со Способом А13, Стадия 1, что дает 4-(4-ацетилфенокси)нитробензол. Нитробензол восстанавливают согласно способу А13, Стадия 4, с получением 4-(4-ацетилфенокси)анилин, который превращают в 4-(4-(1-(N-метокси)иминоэтил)феноксианилин соль HCl в соответствии со Способом А16. 5-(трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 5-(трифторметил)-2-метоксифенилизоцианат реагирует с 4-(4-(1-(N-метокси)иминоэтил)феноксианилином солью HCl в соответствии со Способом С1а с получением мочевины.
Номер 27: 4-хлор-N-метилпиридинкарбоксамид синтезируют, как описано в Способе А2, Стадия 3b. Хлорпиридин реагирует с 4-аминотиофенолом согласно способу А2, Стадия 4, с образованием 4-(4-(2-(N-метилкарбамоил)фенилтио)анилина. 5-(Трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 5-(Трифторметил)-2-метоксифенилизоцианат реагирует с 4-(4-(2-(N-метилкарбамоил)фенилтио)анилином согласно способу С1а с получением мочевины.
Номер 28: 5-(4-аминофенокси)-2-метилизоиндолин-1,3-дион синтезируют согласно способу А9. 5-(трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 5-(трифторметил)-2-метоксифенил изоцианат реагирует с 5-(4-аминофенокси)-2-метилизоиндолин-1,3-дион согласно способу С1а с получением мочевины.
Номер 29: 4-Хлор-N-метилпиридинкарбоксамид синтезируют, как описано в Способе А2, Стадия 3b. Хлорпиридин реагирует с 3-аминотиофенолом в соответствии со Способом А2, Стадия 4, с образованием 3-(4-(2-(N-метилкарбамоил)фенилтио)анилина. 5 - (Трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 5-(Трифторметил)-2-метоксифенилизоцианат реагирует с 3-(4-(2-(N-метилкарбамоил)фенилтио)анилином согласно способу С1а с получением мочевины.
Номер 30: 4-хлорпиридин-2-карбонил хлорид реагирует с изопропиламином согласно способу А2, Стадия 3b. Полученный 4-хлор-N-изопропил-2-пиридинкарбоксамид реагирует с 4-аминофенолом согласно способу А2, Стадия 4, с образованием 4-(2-(N-изопропилкарбамоил)-4-пиридилокси)анилина. 5-(трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенил изоцианат согласно способу В1. 5-(трифторметил)-2-метоксифенилизоцианат реагирует с 4-(2-(N-изопропилкарбамоил)-4-пиридилокси)анилином согласно способу С1а с получением мочевины.
Номер 31: 4-(3-(5-метоксикарбонил)пиридилокси)анилин синтезируют согласно способу А14. 5-(трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 5-(трифторметил)-2-метоксифенилизоцианат реагирует с 4-(3-(5-метоксикарбонил)пиридилокси)анилином в соответствии со Способом С1а с получением мочевины. N-(5-(трифторметил)-2-метоксифенил)-N-(4-(3-(5-метоксикарбонилпиридил)окси)фенил)мочевину омыляют согласно способу D4, Стадия 1, соответствующую кислоту связывают с 4-(2-аминоэтил)морфолином с получением амид согласно способу D4, Стадия 2.
Номер 32: 4-(3-(5-метоксикарбонил)пиридилокси)анилин синтезируют согласно способу А14. 5-(трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 5-(трифторметил)-2-метоксифенилизоцианат реагирует с 4-(3-(5-метоксикарбонил)пиридилокси)анилином в соответствии со способом С1а с образованием мочевины. N-(5-(трифторметил)-2-метоксифенил)-N'-(4-(3-(5-метоксикарбонилпиридил)окси)фенил)мочевину омыляют согласно способу D4, Стадия 1, соответствующую кислоту связывают с метиламином согласно способу D4, Стадия 2 с получением амид.
Номер 33: 4-(3-(5-метоксикарбонил)пиридилокси)анилин синтезируют согласно способу А14. 5-(трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 5-(трифторметил)-2-метоксифенилизоцианат реагирует с 4-(3-(5-метоксикарбонил)пиридилокси)анилин в соответствии со Способом С1а с получением мочевины. N-(5-(трифторметил)-2-метоксифенил)-N'-(4-(3-(5-метоксикарбонилпиридил)окси)фенил)мочевину омыляют согласно способу D4, Стадия 1, и соответствующую кислоту связывают с N, N-диметилэтилендиамином согласно способу D4, Стадия 2 с получением амид.
Номер 34: 4-(3-карбоксифенокси)анилин синтезируют согласно способу А11. 5-(трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенил изоцианат согласно способу В1. 4-(3-карбоксифенокси)анилин реагирует с 5-(трифторметил)-2-метоксифенилизоцианатом согласно способу С1f с получением N-(5-(трифторметил)-2-метоксифенил)-N'-(3-карбоксифенил)мочевину, которую связывают с 3-аминопиридин согласно способу D1c.
Номер 35: 4-(3-карбоксифенокси)анилин синтезируют согласно способу А11. 5-(трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 4-(3-карбоксифенокси)анилин реагирует с 5-(трифторметил)-2-метоксифенилизоцианатом согласно способу С1f с образованием N-(5-(трифторметил)-2-метоксифенил)-N'-(3-карбоксифенил)мочевины, которую связывают с N-(4-фторфенил)пиперазином согласно способу D1c.
Номер 36: 4-(3-карбоксифенокси)анилин синтезируют согласно способу А11. 5-(трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 4-(3-карбоксифенокси)анилин реагирует с 5-(трифторметил)-2-метоксифенилизоцианатом согласно способу C1f с образованием N-(5-(трифторметил)-2-метоксифенил)-N'-(3-карбоксифенил)мочевины, которую связывают с 4-фторанилином согласно способу D1c.
Номер 37: 4-(3-карбоксифенокси)анилин синтезируют согласно способу А11. 5-(Трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 4-(3-карбоксифенокси)анилин реагирует с 5-(трифторметил)-2-метоксифенилизоцианатом согласно способу C1f с образованием N-(5-(трифторметил)-2-метоксифенил)-N'-(3-карбоксифенил)мочевины, которую связывают с 4-(диметиламино)анилином согласно способу D1c.
Номер 38: 4-(3-карбоксифенокси)анилин синтезируют согласно способу А11. 5-(трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 4-(3-карбоксифенокси)анилин реагирует с 5-(трифторметил)-2-метоксифенилизоцианатом согласно способу C1f с образованием N-(5-(трифторметил)-2-метоксифенил)-N'-(3-карбоксифенил)мочевины, которую связывают с 6-амино-2-метоксипиридином согласно способу D1c.
Номер 39: 4-(3-карбоксифенокси)анилин синтезируют согласно способу А11. 5-(трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 4-(3-карбоксифенокси)анилин реагирует с 5-(трифторметил)-2-метоксифенилизоцианатом согласно способу C1f с образованием N-(5-(дифторметил)-2-метоксифенил)-N'-(3-карбоксифенил)мочевины, которую связывают с 4-морфолиноанилином согласно способу D1c.
Номер 40: 4-(3-карбоксифенокси)анилин синтезируют согласно способу А11. 5-(трифторметил)-2-метоксианилин превращают в 5-(трифторметил)-2-метоксифенилизоцианат согласно способу В1. 4-(3-Карбоксифенокси)анилин реагирует с 5-(трифторметил)-2-метоксифенилизоцианатом согласно способу C1f с образованием N-(5-(трифторметил)-2-метоксифенил)-N'-(3-карбоксифенил) мочевины, которую связывают с N-(2-пиридил)пиперазином согласно способу D1c.
Номер 41: 4-(3-(N-метилкарбамоил)фенокси)анилин синтезируют согласно способу А13. В соответствии со Способом С3, 4-хлор-3-(трифторметил)анилин превращают в изоцианат, затем проводят реакцию с 4-(3-(N-метилкарбамоил)фенокси)анилином с получением мочевины.
Номер 42: 4-(2-N-метилкарбамил-4-пиридилокси)анилин синтезируют согласно способу А2. 4-Хлор-3-(трифторметил)фенил изоцианат реагирует с 4-(2-N-метилкарбамил-4-пиридилокси)анилином согласно способу С1а с получением мочевины.
Номер 43: 4-Хлорпиридин-2-карбонилхлорид, соль HCl реагирует с аммиаком согласно способу А2, Стадия 3b, с образованием 4-хлор-2-пиридинкарбоксамида. 4-хлор-2-пиридинкарбоксамид реагирует с 4-аминофенолом согласно способу А2, Стадия 4, с образованием 4-(2-карбамоил-4-пиридилокси)анилина. В соответствии со способом С1а, 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(2-карбамоил-4-пиридилокси)анилином с образованием мочевины.
Номер 44: 4-хлорпиридин-2-карбонил хлорид, соль HCl реагирует с аммонием согласно способу А2, Стадия 3b, с образованием 4-хлор-2-пиридинкарбоксамида. 4-хлор-2-пиридинкарбоксамид реагирует с 3-аминофенолом согласно способу А2, Стадия 4, с образованием 3-(2-карбамоил-4-пиридилокси)анилина. Согласно способу С1а, 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 3-(2-карбамоил-4-пиридилокси)анилином с получением мочевины.
Номер 45: 4-хлор-N-метил-2-пиридинкарбоксамид, который синтезируют в соответствии со Способом А2, Стадия 3а, реагирует с 3-аминофенолом согласно способу А2, Стадия 4, с образованием 3-(-2-(N-метилкарбамоил)-4-пиридилокси)анилина. Согласно способу С1а, 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 3-(2-(N-метилкарбамоил)-4-пиридилокси)анилином с получением мочевины.
Номер 46: 5-(4-аминофенокси)изоиндолин-1,3-дион синтезируют согласно способу A3. В соответствии со способом С1а 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 5-(4-аминофенокси)изоиндолин-1,3-дионом с получением мочевины.
Номер 47: 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-метиланилин синтезируют согласно способу А5. В соответствии со способом С1 с 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 5-(4-аминофенокси)изоиндолин-1,3-дионом с получением мочевины.
Номер 48: 4-(3-N-метилсульфамоил)фенилокси)анилин синтезируют согласно способу А15. В соответствии со способом С1а 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(3-N-метилсульфамоил)фенилокси)анилином с получением мочевины.
Номер 49: 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-хлоранилин синтезируют согласно способу А6. В соответствии со способом С1а 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-хлоранилином с получением мочевины.
Номер 50: Согласно способу А2, Стадия 4, 5-амино-2-метилфенол реагирует с 4-хлор-N-метил-2-пиридинкарбоксамидом, который синтезируют согласно способу А2, Стадия 3b, с образованием 3-(2-(N-метилкарбамоил)-4-пиридилокси)-4-метиланилина. В соответствии со способом С1а, 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 3-(2-(N-метилкарбамоил)-4-пиридилокси)-4-метиланилином с получением мочевины.
Номер 51: 4-хлорпиридин-2-карбонил хлорид реагирует с этиламином согласно способу А2, Стадия 3b. Полученный 4-хлор-N-этил-2-пиридинкарбоксамид реагирует 4-аминофенолом согласно способу А2, Стадия 4, с образованием 4-(2-(N-этилкарбамоил)-4-пиридилокси)анилина. Согласно Способу С1а, 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(2-(N-этилкарбамоил)-4-пиридилокси)анилином с получением мочевины.
Номер 52: Согласно способу А2, Стадия 4, 4-амино-2-хлорфенол реагирует с 4-хлор-N-метил-2-пиридинкарбоксамидом, который синтезируют согласно способу А2, Стадия 3b, с образованием 4-(2-(N-метилкарбамоил)-4-пиридилокси)-3-хлоранилина. В соответствии со Способом С1а, 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(2-(N-метилкарбамоил)-4-пиридилокси)-3-хлоранилином с получением мочевины.
Номер 53: 4-(4-метилтиофенокси)-1-нитробензол окисляют согласно способу А19, Стадия 1, с образованием 4-(4-метилсульфонилфенокси)-1-нитробензола. Нитробензол восстанавливают согласно способу А19, Стадия 2, с образованием 4-(4-метилсульфонилфенокси)-1-анилина. Согласно способу С1а, 4-хлор-3-(трифторметил)фенил изоцианат реагирует с 4-(4-метилсульфонилфенокси)-1-анилином с получением мочевины.
Номер 54: 4-бромбензолсульфонил хлорид реагирует с метиламином согласно способу А15, Стадия 1, с образованием N-метил-4-бромбензолсульфонамида. N-метил-4-бромбензолсульфонамид связывают с фенолом согласно способу А15, Стадия 2, с получением 4-(4-(N-метилсульфамоил)фенокси)бензол. 4-(4-(N-метилсульфамоил)фенокси)бензол превращают в 4-(4-(N-метилсульфамоил)фенокси)-1-нитробензол согласно способу А15, Стадия 3. 4-(4-(N-метилсульфамоил)фенокси)-1-нитробензол восстанавливают до 4-(4-N-метилсульфамоил)фенилокси)анилина согласно способу А15, Стадия 4. В соответствии со способом С1а 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(3-N-метилсульфамоил)фенилокси)анилином с получением мочевины.
Номер 55: 5-гидрокси-2-метилпиридин связывают с 1-фтор-4-нитробензолом согласно способу А18, Стадия 1, с образованием 4-(5-(2-метил)пиридилокси)-1-нитробензола. Метилпиридин окисляют в соответствии с карбоновой кислотой, затем эстерифицируют согласно способу А18, Стадия 2, с образованием 4-(5-(2-метоксикарбонил)пиридилокси)-1-нитробензола. Нитробензол восстанавливают согласно Способу А18, Стадия 3, с образованием 4-(5-(2-метоксикарбонил)пиридилокси)анилина. Анилин реагирует с 4-хлор-3-(трифторметил)фенилизоцианатом согласно способу С1а с получением мочевины.
Номер 56: 5-гидрокси-2-метилпиридин связывают с 1-фтор-4-нитробензолом в соответствии со Способом А18, Стадия 1, с образованием 4-(5-(2-метил)пиридилокси)-1-нитробензола. Метилпиридин окисляют в соответствии с карбоновой кислотой, затем эстерифицируют согласно Способу А18, Стадия 2, с образованием 4-(5-(2-метоксикарбонил)пиридилокси)-1-нитробензола. Нитробензол восстанавливают согласно Способу А18, Стадия 3, с образованием 4-(5-(2-метоксикарбонил)пиридилокси)анилина. Анилин реагирует с 4-хлор-3-(трифторметил)фенилизоцианатом согласно способу С1а с образованием N-(4-хлор-3-(трифторметил)фенил)-N'-(4-(2-(метоксикарбонил)-5-пиридилокси)фенил)мочевины. Сложный метиловый эфир реагирует с метиламином согласно способу D2 с получением N-(4-хлор-3-(трифторметил)фенил)-N'-(4-(2-(N-метилкарбамоил)-5-пиридилокси)фенил)мочевины.
Номер 57: N-(4-хлор-3-(трифторметил)фенил-N'-(4-аминофенил)мочевину получают согласно способу C1d. N-(4-хлор-3-(трифторметил)фенил-N'-(4-аминофенил)мочевину связывают с моно-метилизофталатом согласно способу D1a с получением мочевины.
Номер 58: N-(4-хлор-3-(трифторметил)фенил-N'-(4-аминофенил)мочевину получают согласно способу C1d. N-(4-хлор-3-(трифторметил)фенил-N'-(4-аминофенил)мочевину связывают с моно-метилизофталатом согласно способу D1a с получением N-(4-хлор-3-(трифторметил)фенил-N'-(4-(3-метоксикарбонилфенил)карбоксиаминофенил)мочевину. Согласно способу D2, N-(4-хлор-3-(трифторметил)фенил-N'-(4-(3-метоксикарбонилфенил)карбоксиаминофенил)мочевина реагирует с метиламином с образованием соответствующего метиламида.
Номер 59: 4-хлорпиридин-2-карбонил хлорид реагирует с диметиламином согласно способу А2, Стадия 3b. Полученный 4-хлор-N,N-диметил-2-пиридинкарбоксамид реагирует с 4-аминофенолом согласно способу А2, Стадия 4, что дает 4-(2-(N,N-диметилкарбамоил)-4-пиридилокси)анилин. В соответствии со способом С1а, 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(2-(N,N-диметилкарбамоил)-4-пиридилокси)анилином с получением мочевины.
Номер 60: 4-гидроксиацетофенон реагирует с 4-фторнитробензолом согласно способу А13, Стадия 1, с образованием 4-(4-ацетилфенокси)нитробензола. Нитробензол восстанавливают согласно способу 13, Стадия 4, с получением 4-(4-ацетилфенокси)анилин, который превращают в 4-(4-(1-(N-метокси)иминоэтил)феноксианилин соль HCl согласно способу А16. В соответствии со способом С1а 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(4-ацетилфенокси)анилином с получением мочевины.
Номер 61: 4-(3-карбоксифенокси)-1-нитробензол синтезируют согласно способу А13, Стадия 2. 4-(3-карбоксифенокси)-1-нитробензол связывают с 4-(2-аминоэтил)морфолином согласно Способу А13, Стадия 3, что дает 4-(3-(N-(2-морфолинилэтил)карбамоил)фенокси)-1-нитробензол. В соответствии со способом А13, Стадия 4, 4-(3-(N-(2-морфолинилэтил)карбамоил)фенокси)-1-нитробензол восстанавливают до 4-(3-(N-(2-морфолинилэтил)карбамоил)фенокси)анилина. Согласно Способу С1а 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(3-(N-(2-морфолинилэтил)карбамоил)фенокси)анилином с образованием мочевины.
Номер 62: 4-(3-карбоксифенокси)-1-нитробензол синтезируют согласно способу А13, Стадия 2. 4-(3-карбоксифенокси)-1-нитробензол связывают с 1-(2-аминоэтил)пиперидином согласно способу А13, Стадия 3, что дает 4-(3-(N-(2-пиперидилэтил)карбамоил)фенокси)-1-нитробензол. Согласно способу А13, Стадия 4, 4-(3-(N-(2-5 пиперидилэтил)карбамоил)фенокси)-1-нитробензол восстанавливают до 4-(3-(М-(N-пиперидилэтил)карбамоил)фенокси)анилина. Согласно способу С1а 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(3-(N-(2-пиперидилэтил)карбамоил)фенокси)анилином с получением мочевины.
Номер 63: 4-(3-карбоксифенокси)-1-нитробензол синтезируют согласно способу А13, Стадия 2. 4-(3-карбоксифенокси)-1-нитробензол связывают с тетрагидрофурфуриламином согласно способу А13, Стадия 3, что дает 4-(3-(N-(тетрагидрофурилметил)карбамоил)фенокси)-1-нитробензол. Согласно способу А13, Стадия 4, 4-(3-(N-(тетрагидрофурилметил)карбамоил)фенокси)-1-нитробензол восстанавливают до 4-(3-(N-(тетрагидрофурилметил)карбамоил)фенокси)анилина. Согласно способу С1а 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(3-(N-(тетрагидрофурилметил)карбамоил)фенокси)анилином с получением мочевины.
Номер 64: 4-(3-карбоксифенокси)-1-нитробензол синтезируют согласно способу А13, Стадия 2. 4-(3-карбоксифенокси)-1-нитробензол связывают с 2-аминометил-1-этилпирролидином в соответствии со Способом А13, Стадия 3, что дает 4-(3-(N-((1-метилпирролидинил)метил)карбамоил)фенокси)-1-нитробензол. Согласно способу А13, Стадия 4, 4-(3-(N-((1-метилпирролидинил)метил)карбамоил)фенокси)-1-нитробензол восстанавливают до 4-(3-(N-((1-метилпирролидинил)метил)карбамоил)фенокси)анилина. В соответствии со Способом С1а 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(3-(N-((1-метилпирролидинил)метил)карбамоил)фенокси)анилином с получением мочевины.
Номер 65: 4-Хлор-N-метилпиридинкарбоксамид синтезируют, как описано в Способе А2, Стадия 3b. Хлорпиридин реагирует с 4-аминотиофенолом согласно способу 30 А2, Стадия 4, что дает 4-(4-(2-(N-метилкарбамоил)фенилтио)анилин. Согласно способу С1а 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(4-(2-(N-метилкарбамоил)фенилтио)анилином с получением мочевины.
Номер 66: 4-хлорпиридин-2-карбонил хлорид реагирует с изопропиламином согласно способу А2, Стадия 3b. Полученный 4-хлор-N-изопропил-2-пиридинкарбоксамид реагирует с 4-аминофенолом в соответствии со Способом А2, Стадия 4, что дает 4-(2-(N-5 изопропилкарбамоил)-4-пиридилокси)анилин. Согласно способу С1а 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(2-(N-изопропилкарбамоил)-4-пиридилокси)анилином с образованием мочевины.
Номер 67: N-(4-хлор-3-(трифторметил)фенил-N'-(4-этоксикарбонилфенил)мочевину синтезируют согласно Способу С1е. N-(4-хлор-3-(трифторметил)фенил-N'-(4-этоксикарбонилфенил)мочевину омыляют согласно способу D3 с образованием N-(4-хлор-3-(трифторметил)фенил-N'-(4-карбоксифенил)мочевины. N-(4-Хлор-3-(трифторметил)фенил-N'-(4-карбоксифенил)мочевину связывают с 3-метилкарбамоиланилином согласно способу D1b с образованием N-(4-хлор-3-(трифторметил)фенил-N'-(4-(3-метилкарбамоилфенил)карбамоилфенил)мочевины.
Номер 68: 5-(4-аминофенокси)-2-метилизоиндолин-1,3-дион синтезируют согласно способу А9. В соответствии со способом С1а, 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 5-(4-аминофенокси)-2-метилизоиндолин-1,3-дионом с получением мочевины.
Номер 69: 4-хлор-N-метилпиридинкарбоксамид синтезируют, как описано в Способе А2, Стадия 3b. Хлорпиридин реагирует с 3-аминотиофенолом согласно способу А2, Стадия 4, что дает 3-(4-(2-(N-метилкарбамоил)фенилтио)анилин. Согласно способу С1а 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 3-(4-(2-(N-метилкарбамоил)фенилтио)анилином с получением мочевины.
Номер 70: 4-(2-(N-(2-морфолин-4-илэтил)карбамоил)пиридилокси)анилин синтезируют согласно способу А10. По С1а, 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(2-(N-(2-морфолин-4-илэтил)карбамоил)пиридилокси)анилином с образованием мочевины.
Номер 71: 4-(3-(5-метоксикарбонил)пиридилокси)анилин синтезируют согласно способу А14. 4-Хлор-3-(трифторметил)-2-метоксифенилизоцианат реагирует с 4-(3-(5-метоксикарбонил)пиридилокси)анилином согласно способу С1а с получением мочевины. N-(4-хлор-3-(трифторметил)фенил)-N'-(4-(3-(5-метоксикарбонилпиридил)окси)фенил)мочевину омыляют согласно способу D4, Стадия 1, и соответствующую кислоту связывают с 4-(2-аминоэтил)морфолином с получением амид.
Номер 72: 4-(3-(5-метоксикарбонил)пиридилокси)анилин синтезируют согласно способу А14. 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(3-(5-метоксикарбонил)пиридилокси)анилином согласно способу С1а с получением мочевины. N-(5-(трифторметил)-2-метоксифенил)-N'-(4-(3-(5-метоксикарбонилпиридил)окси)фенил)мочевину омыляют по способу D4, Стадия 1, и соответствующую кислоту связывают с метиламином согласно способу D4, Стадия 2, получая амид.
Номер 73: 4-(3-(5-метоксикарбонил)пиридилокси)анилин синтезируют согласно способу А14. 4-Хлор-3-(трифторметил)фенил изоцианат реагирует с 4-(3-(5-метоксикарбонил)пиридилокси)анилином согласно способу С1а с получением мочевины. N-(5-(трифторметил)-2-метоксифенил)-N'-(4-(3-(5-метоксикарбонилпиридил)окси)фенил)мочевину омыляют согласно способу D4, Стадия 1, и соответствующую кислоту связывают с N,N'-диметилэтилендиамином согласно способу D4, Стадия 2, с получением амид.
Номер 74: 4-хлорпиридин-2-карбонил хлорид, соль HCl реагирует с 2-гидроксиэтиламином согласно способу А2, Стадия 3b, с образованием 4-хлор-N-(2-триизопропилсилилокси)этилпиридин-2-карбоксамида. 4-хлор-N-(2-триизопропилсилилокси)этилпиридин-2-карбоксамид реагирует с триизопропилсилил хлоридом, а затем с 4-аминофенолом согласно способу А17 с образованием 4-(4-(2-(N-(2-триизопропилсилилокси)этилкарбамоил)пиридилоксианилина. Согласно способу С1а 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(4-(2-(N-(2-триизопропилсилилокси)этилкарбамоил)пиридилоксианилином с образованием N-(4-хлор-3-((трифторметил)фенил)-N'-(4-(4-(2-(N-(2-триизопропилсилилокси) этилкарбамоил)пиридилоксифенил)мочевины.
Номер 75: 4-(3-карбоксифенокси)анилин синтезируют согласно способу А11. 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(3-(5-метоксикарбонил)пиридилокси)анилином согласно способу C1f с получением мочевины, которую связывают с 3-аминопиридином согласно способу D1c.
Номер 76: 4-(3-карбоксифенокси)анилин синтезируют согласно способу А11. 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(3-карбоксифенокси)анилином по Способу C1f с образованием мочевины, которую связывают с N-(4-ацетилфенил)пиперазином согласно способу D1c.
Номер 77: 4-(3-карбоксифенокси)анилин синтезируют согласно способу А11. 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(3-карбоксифенокси)анилином согласно способу C1f с получением мочевины, которую связывают с 4-фторанилином согласно способу D1c.
Номер 78: 4-(3-карбоксифенокси)анилин синтезируют согласно способу А11. 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(3-карбоксифенокси)анилином согласно способу C1f с получением мочевины, которую связывают с 4-(диметиламино)анилином согласно способу D1c.
Номер 79: 4-(3-карбоксифенокси)анилин синтезируют согласно способу А11. 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(3-карбоксифенокси)анилином согласно способу C1f с получением мочевины, которую связывают с N-фенилэтилендиамином согласно способу D1c.
Номер 80: 4-(3-гарбоксифенокси)анилин синтезируют согласно способу А11. 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(3-карбоксифенокси)анилином согласно способу C1f с получением мочевины, которую связывают с 2-метоксиэтиламином согласно способу D1c.
Номер 81: 4-(3-карбоксифенокси)анилин синтезируют согласно способу А11. 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(3-карбоксифенокси)анилином согласно способу C1f с получением мочевины, которую связывают с 6-амино-2-метоксипиридином согласно способу D1c.
Номер 82: 4-(3-карбоксифенокси)анилин синтезируют согласно способу А11. 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(3-карбоксифенокси)анилином согласно способу C1f с получением мочевины, которую связывают с 4-морфолиноанилином согласно способу D1c.
Номер 83: 4-(3-карбоксифенокси)анилин синтезируют согласно способу А11. 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(3-карбоксифенокси)анилином согласно способу C1f с получением мочевины, которую связывают с N-(2-пиридил)пиперазином согласно способу D1c.
Номер 84: 4-хлорпиридин-2-карбонилхлорид, соль HCl реагирует с 2-гидроксиэтиламином по Способу А2, Стадия 3b, с образованием 4-хлор-N-(2-триизопропилсилилокси)этилпиридин-2-карбоксамида. 4-хлор-N-(2-триизопропилсилилокси)этилпиридин-2-карбоксамид реагирует с триизопропилсилил хлоридом, а затем с 4-аминофенолом согласно Способу А17 с образованием 4-(4-(2-(N-(2-триизопропилсилилокси)этилкарбамоил)пиридилоксианилина. Согласно способу С1а 4-хлор-3-(трифторметил)фенилизоцианат реагирует с 4-(4-(2-(N-(2-триизопропилсилилокси)этилкарбамоил)пиридилоксианилином, что дает N-(4-хлор-3-((трифторметил)фенил)-N'-(4-(4-(2-(N-(2-триизопропилсилилокси)этилкарбамоил)пиридилоксифенил)мочевину. С мочевины снимают защиту согласно способу D5 с получением N-(4-хлор-3-((трифторметил)фенил)-N'-(4-(4-(2-(N-(2-гидрокси)этилкарбамоил)пиридилоксифенил)мочевину.
Номер 85: 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилин синтезируют согласно способу А2. 4-бром-3-(трифторметил)анилин превращают в 4-бром-3-(трифторметил)фенилизоцианат согласно способу В1. Согласно способу С1а, 4-бром-3-(трифторметил)фенилизоцианат реагирует с 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилином с получением мочевины.
Номер 86: 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-хлоранилин синтезируют согласно способу А6. 4-Бром-3-(трифторметил)анилин превращают в 4-бром-3-(трифторметил)фенилизоцианат согласно способу В1. В соответствии со способом С1а, 4-бром-3-(трифторметил)фенилизоцианат реагирует с 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-хлоранилином с получением мочевины.
Номер 87: Согласно способу А2, Стадия 4, 4-амино-2-хлорфенол реагируете 4-хлор-N-метил-2-пиридинкарбоксамидом, который синтезируют согласно способу А2, Стадия 3b, что дает 4-(2-(N-метилкарбамоил)-4-пиридилокси)-3-хлоранилин. 4-бром-3-(трифторметил)анилин превращают в 4-бром-3-(трифторметил)фенилизоцианат согласно способу В1. По способу С1а, 4-бром-3-(трифторметил)фенилизоцианат реагирует с 4-(2-(N-метилкарбамоил)-4-пиридилокси)-3-хлоранилином с получением мочевины.
Номер 88: 4-хлорпиридин-2-карбонил хлорид реагирует с этиламином согласно способу А2, Стадия 3b. Полученный 4-хлор-N-этил-2-пиридинкарбоксамид реагирует с 4-аминофенолом согласно способу А2, Стадия 4, с образованием 4-(2-(N-этилкарбамоил)-4-пиридилокси)анилина. 4-бром-3-(трифторметил)анилин превращают в 4-бром-3-(трифторметил)фенил изоцианат согласно способу В1. По способу С1а, 4-бром-3-(трифторметил)фенил изоцианат реагирует с 4-(2-(N-этилкарбамоил)-4-пиридилокси)анилином с получением мочевины.
Номер 89: 4-хлор-N-метил-2-пиридинкарбоксамид, который синтезируют согласно способу А2, Стадия 3а, реагирует с 3-аминофенолом согласно способу А2, Стадия 4, с образованием 3-(-2-(N-метилкарбамоил)-4-пиридилокси)анилина. 4-бром-3-(трифторметил)анилин превращают в 4-бром-3-(трифторметил)фенил изоцианат согласно способу В1. По способу С1а 4-бром-3-(трифторметил)фенил изоцианат реагирует с 3-(-2-(N-метилкарбамоил)-4-пиридилокси)анилином с получением мочевины.
Номер 90: Согласно способу А2, Стадия 4, 5-амино-2-метилфенол реагируете 4-хлор-N-метил-2-пиридинкарбоксамидом, который синтезируют согласно способу А2, Стадия 3b, с образованием 3-(2-(N-метилкарбамоил)-4-пиридилокси)-4-метиланилина. 4-бром-3-(трифторметил)анилин превращают в 4-бром-3-(трифторметил)фенил изоцианат согласно способу В1. Согласно способу С1а, 4-бром-3-(трифторметил)фенил изоцианат реагирует с 2-(2-(N-метилкарбамоил)-4-пиридилокси)-4-метиланилином с получением мочевины.
Номер 91: 4-хлорпиридин-2-карбонил хлорид реагирует с диметиламином согласно способу А2, Стадия 3b. Полученный 4-хлор-N,N-диметил-2-пиридинкарбоксамид реагирует с 4-аминофенолом согласно способу А2, Стадия 4, с образованием 4-(2-(N,N-диметилкарбамоил)-4-пиридилокси)анилина. 4-бром-3-(трифторметил)анилин превращают в 4-бром-3-(трифторметил)фенил изоцианат согласно способу В1. По способу С1а 4-бром-3-(трифторметил)фенил изоцианат реагирует с 4-(2-(N,N'-диметилкарбамоил)-4-пиридилокси)анилином с получением мочевины.
Номер 92: 4-хлор-N'-метилпиридинкарбоксамид синтезируют, как описано в Способе А2, Стадия 3b. Хлорпиридин реагирует с 4-аминотиофенолом согласно способу А2, Стадия 4, с образованием 4-(4-(2-(N-метилкарбамоил)фенилтио)анилина. 4-бром-3-(трифторметил)анилин превращают в 4-бром-3-(трифторметил)фенил изоцианат согласно способу В1. В соответствии со способом С1а 4-бром-3-(трифторметил)фенил изоцианат реагирует с 4-(4-(2-(N-метилкарбамоил)фенилтио)анилином с образованием мочевины.
Номер 93: 4-Хлор-N-метилпиридинкарбоксамид синтезируют как описано в Способе А2, Стадия 3b. Хлорпиридин реагирует с 3-аминотиофенолом согласно способу А2, Стадия 4, с образованием 3-(4-(2-(N-метилкарбамоил)фенилтио)анилина. 4-бром-3-(трифторметил)анилин превращают в 4-бром-3-(трифторметил)фенилизоцианат согласно способу В1. По способу С1а 4-бром-3-(трифторметил)фенилизоцианат реагирует с 3-(4-(2-(N-метилкарбамоил)фенилтио)анилином с получением мочевины.
Номер 94: 4-(2-(N-(2-морфолин-4-илэтил)карбамоил)пиридилокси)анилин синтезируют согласно способу А10. 4-бром-3-(трифторметил)анилин превращают в 4-бром-3-(трифторметил)фенилизоцианат согласно способу В1. Согласно способу С1а 4-бром-3-(трифторметил)фенилизоцианат реагирует с 4-(2-(N-(2-морфолин-4-илэтил)карбамоил)пиридилокси)анилином с получением мочевины.
Номер 95: 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилин синтезируют в соответствии со Способом А2. 4-хлор-2-метокси-5-(трифторметил)анилин синтезируют в соответствии со Способом А7. 4-хлор-2-метокси-5-(трифторметил)анилин превращают в 4-хлор-2-метокси-5-(трифторметил)фенил изоцианат согласно способу В1. По способу С1а 4-хлор-2-метокси-5-(трифторметил)фенил изоцианат реагирует с 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилином с получением мочевины.
Номер 96: 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-хлоранилин синтезируют согласно способу А6. 4-Хлор-2-метокси-5-(трифторметил)анилин синтезируют согласно способу А7. 4-Хлор-2-метокси-5-(трифторметил)анилин превращают в 4-хлор-2-метокси-5-(трифторметил)фенил изоцианат по способу В1.
В соответствии со способом С1а 4-хлор-2-метокси-5-(трифторметил)фенил изоцианат реагирует с 4-(2-(N-метилкарбамоил)-4-пиридилокси)-2-хлоранилином с образованием мочевина.
Номер 97: Согласно способу А2, Стадия 4, 4-амино-2-хлорфенол реагирует с 4-хлор-N-метил-2-пиридинкарбоксамидом, который синтезируют согласно способу А2, Стадия 3b, с образованием 4-(2-(N-метилкарбамоил)-4-пиридилокси)-3-хлоранилина. 4-хлор-2-метокси-5-(трифторметил)анилин синтезируют согласно способу А7. 4-Хлор-2-метокси-5-(трифторметил)анилин превращают в 4-хлор-2-метокси-5-(трифторметил)фенилизоцианат согласно способу В1. Соответственно способу С1а 4-хлор-2-метокси-5-(трифторметил)фенил изоцианат реагирует с 4-(2-(N-метилкарбамоил)-4-пиридилокси)-3-хлоранилином с получением мочевины.
Номер 98: 4-хлор-N-метил-2-пиридинкарбоксамид, который синтезируют согласно способу А2, Стадия 3а, реагирует с 3-аминофенолом согласно способу А2, Стадия 4, с образованием 3-(2-(N-метилкарбамоил)-4-пиридилокси)анилина. 4-хлор-2-метокси-5-(трифторметил)анилин синтезируют согласно способу А7. 4-хлор-2-метокси-5-(трифторметил)анилин превращают в 4-хлор-2-метокси-5-(трифторметил)фенилизоцианат согласно способу В1. Соответственно способу С1а 4-хлор-2-метокси-5-(трифторметил)фенил изоцианат реагирует с 3-(-2-(N-метилкарбамоил)-4-пиридилокси)анилином с получением мочевины.
Номер 99: 4-хлорпиридин-2-карбонил хлорид реагирует с этиламином в соответствии со Способом А2, Стадия 3b. Полученный 4-хлор-N-этил-2-пиридинкарбоксамид реагирует с 4-аминофенолом согласно способу А2, Стадия 4, с образованием 4-(2-(N-этилкарбамоил)-4-пиридилокси)анилина. 4-хлор-2-метокси-5-(трифторметил)анилин синтезируют согласно способу А7. 4-хлор-2-метокси-5-(трифторметил)анилин превращают в 4-хлор-2-метокси-5-(трифторметил)фенилизоцианат согласно Способу В1. Соответственно способу С1а 4-хлор-2-метокси-5-(трифторметил)фенилизоцианат реагирует с 4-(2-(N-этилкарбамоил)-4-пиридилокси)анилином с получением мочевины.
Номер 100: 4-хлорпиридин-2-карбонил хлорид реагирует с диметиламином согласно способу А2, Стадия 3b. Полученный 4-хлор-N,N-диметил-2-пиридинкарбоксамид реагирует с 4-аминофенолом согласно способу А2, Стадия 4, с образованием 4-(2-(N,N-диметилкарбамоил)-4-пиридилокси)анилина. 4-хлор-2-метокси-5-(трифторметил)анилин синтезируют согласно способу А7. 4-Хлор-2-метокси-5-(трифторметил)анилин превращают в 4-хлор-2-метокси-5-(трифторметил)фенил изоцианат согласно способу В1. По способу С1а 4-хлор-2-метокси-5-(трифторметил)фенил изоцианат реагирует с 4-(2-(N,N-диметилкарбамоил)-4-пиридилокси)анилином с получением мочевины.
Номер 101: 4-Хлор-N-метил-2-пиридинкарбоксамид, который синтезируют согласно способу А2, Стадия 3а, реагирует с 3-аминофенолом согласно способу А2, Стадия 4, с образованием 3-(-2-(N-метилкарбамоил)-4-пиридилокси)анилина. 2-амино-3-метоксинафталин синтезируют, как описано в Способе A1. Согласно способу С3 2-амино-3-метоксинафталин реагирует с бис(трихлорметил)карбонатом, а затем с 3-(-2-(N-метилкарбамоил)-4-пиридилокси)анилином с образованием мочевины.
Номер 102: 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилин синтезируют согласно способу А2. 5-трет-бутил-2-(2,5-диметилпирролил)анилин синтезируют в соответствии со Способом А4. 5-трет-бутил-2-(2,5-диметилпирролил)анилин реагирует с CDI, а затем с 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилином согласно способу C2d с получением мочевины.
Номер 103: 4-хлор-N-метил-2-пиридинкарбоксамид синтезируют согласно способу А2, Стадия 3b. 4-хлор-N-метил-2-пиридинкарбоксамид реагирует с 4-аминофенолом согласно способу А2, Стадия 4, с использованием DMAC вместо ДМФ с образованием 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилина. Согласно способу С2b после реакции 3-амино-2-метоксихинолина с CDI проводят реакцию с 4-(2-(N-метилкарбамоил)-4-пиридилокси)анилином с образованием бис(4-(2-(N-метилкарбамоил)-4-пиридилокси)фенил)мочевины.
В Таблицах ниже приведены соединения, которые синтезируют в соответствии с представленными выше детальными экспериментальными процедурами.
Таблицы
Соединения, приведенные в Таблицах 1-6 ниже, синтезируют в соответствии с основными способами, представленными выше, и более детальными примерами процедур, которые находятся в перечне пунктов выше, а характеристические признаки указаны в таблицах.
3-трет-бутилфенилмочевины
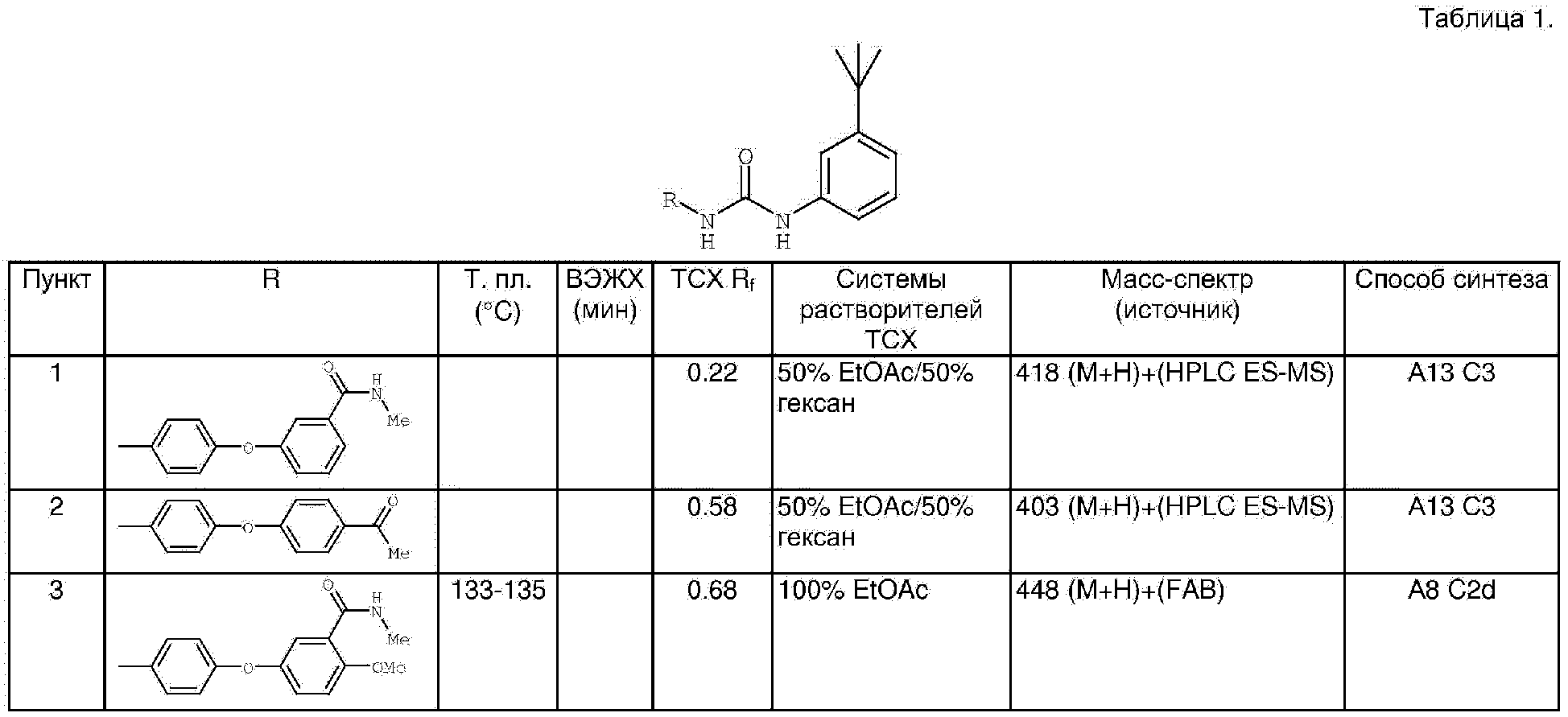
5-трет-бутил-2-метоксифенилмочевины
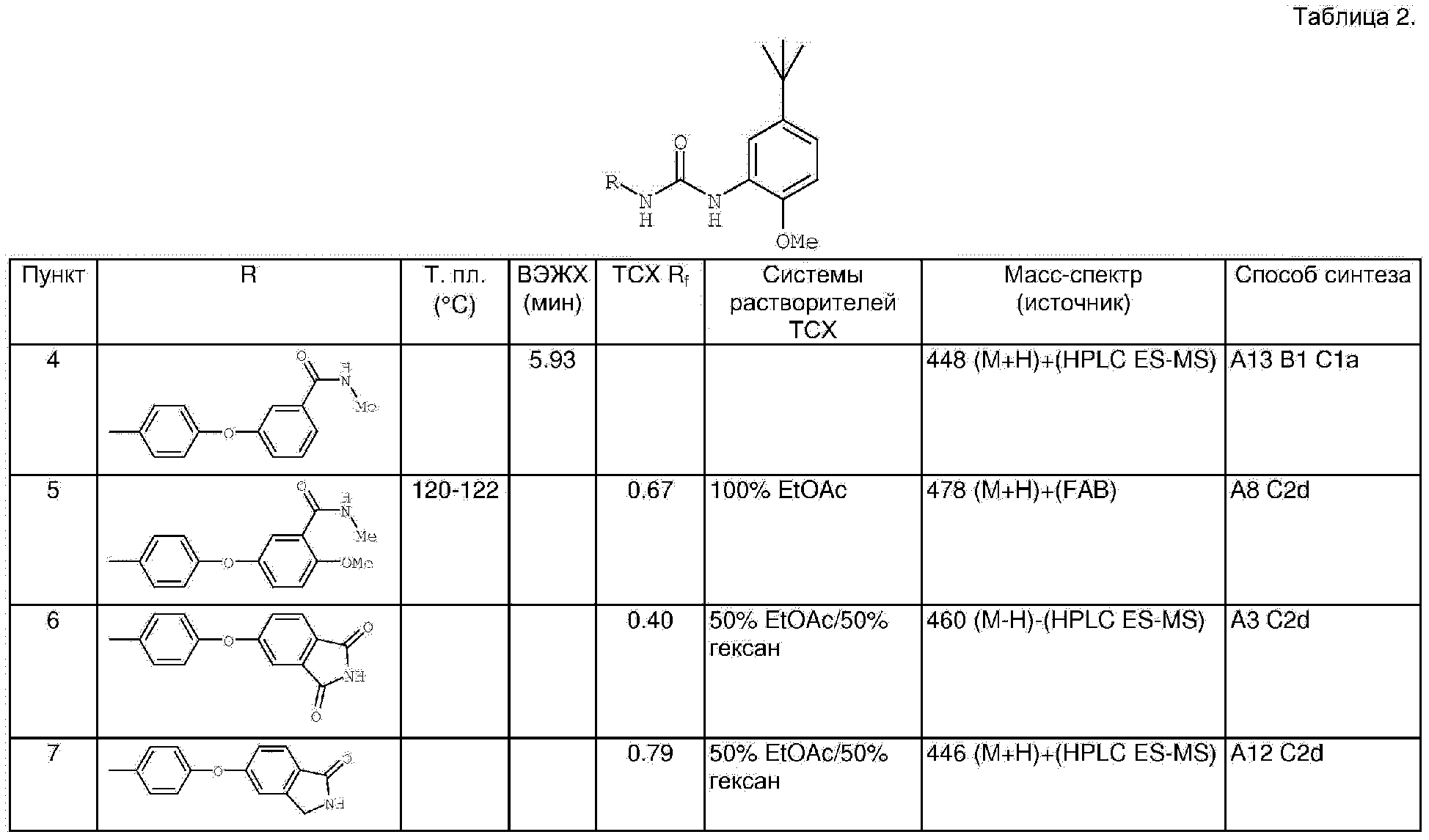
5-(трифторметил)-2-метоксифенилмочевины
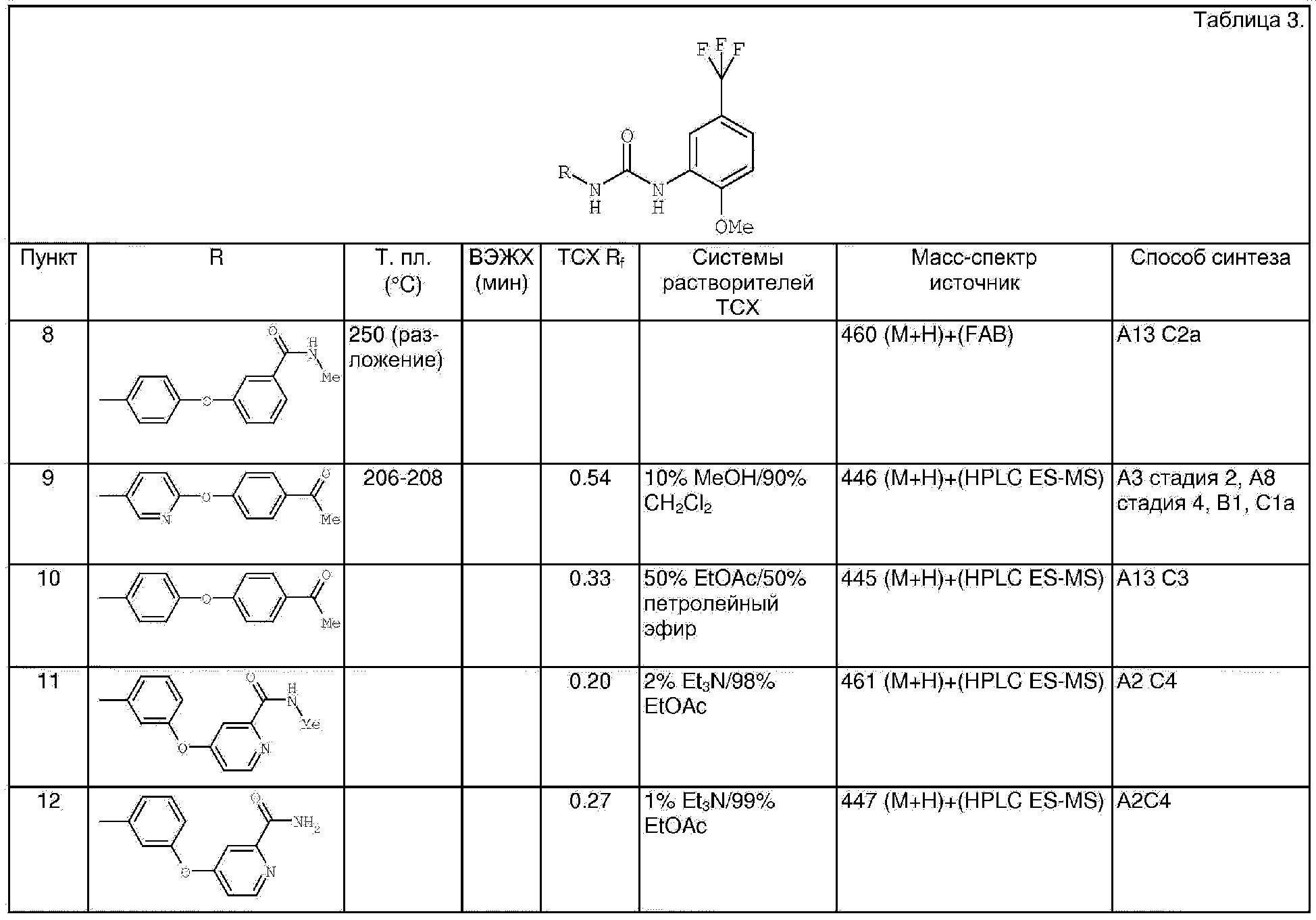
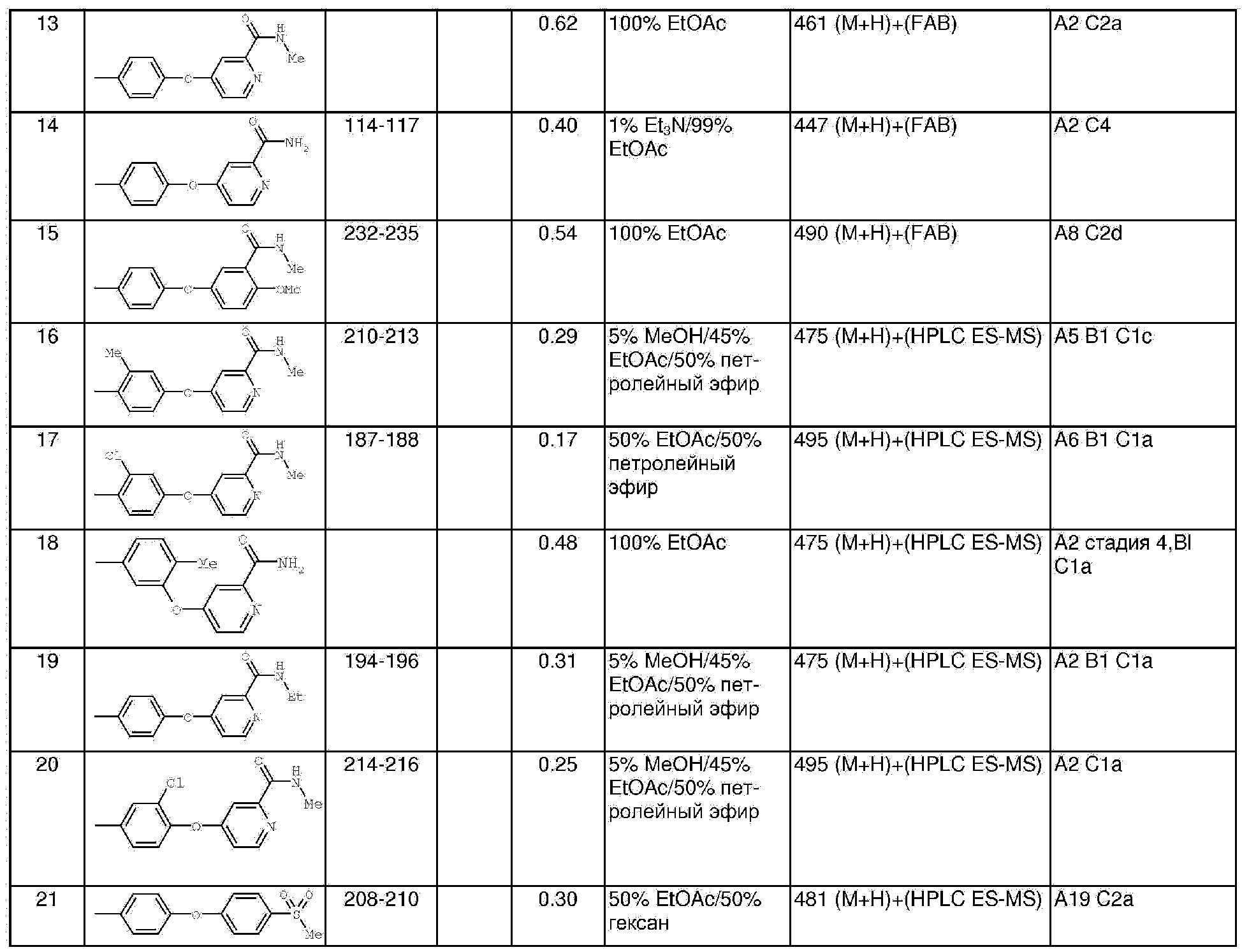
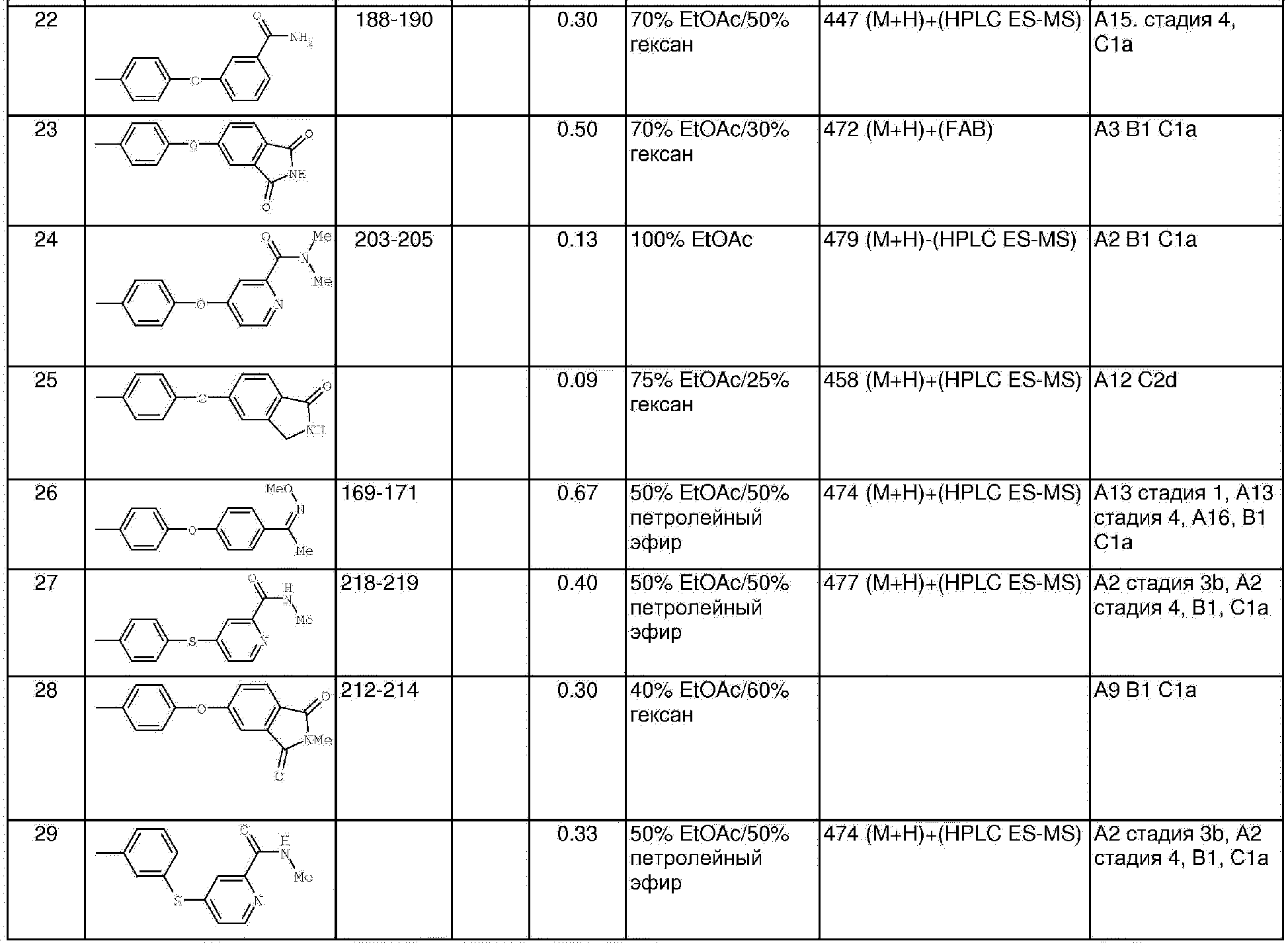
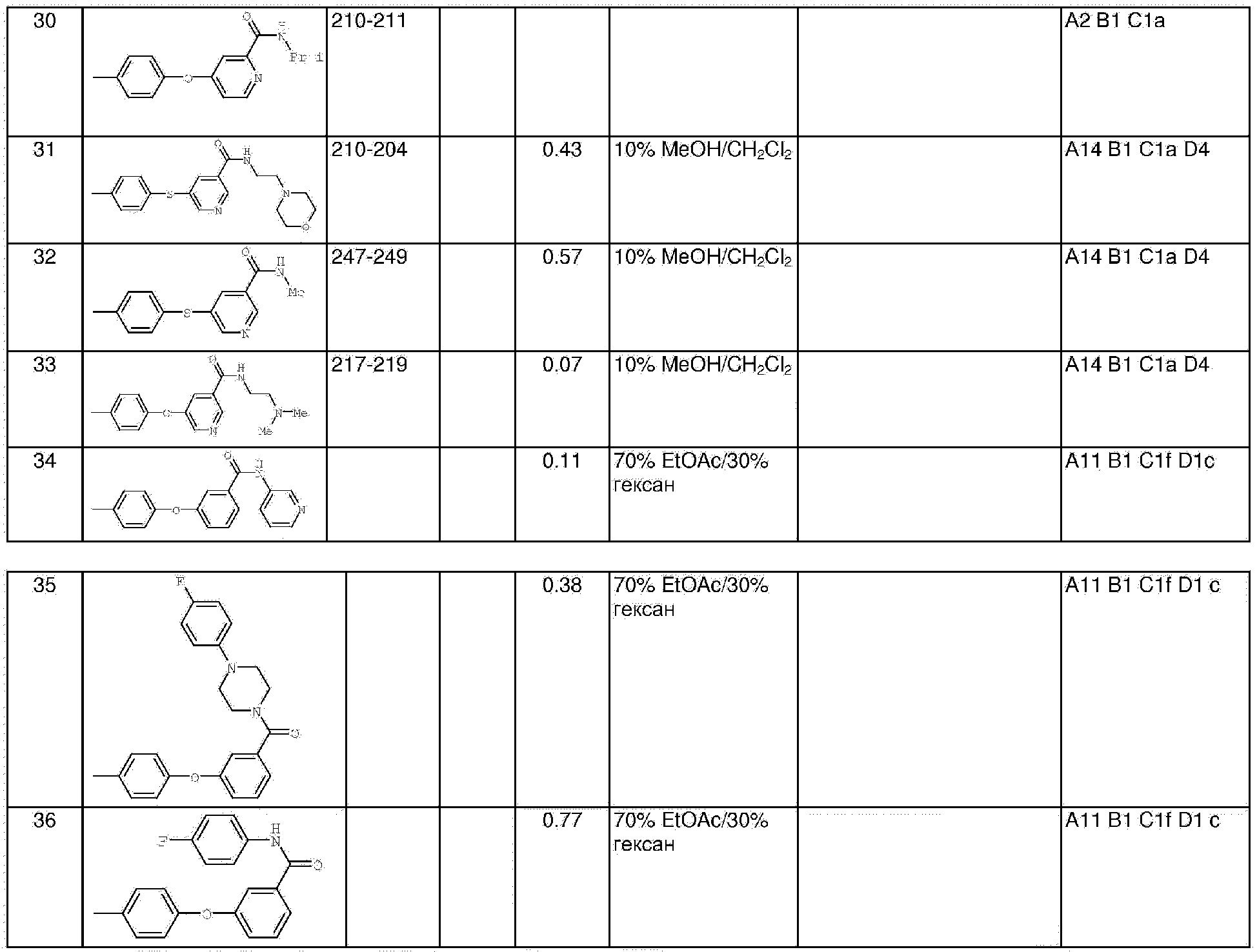
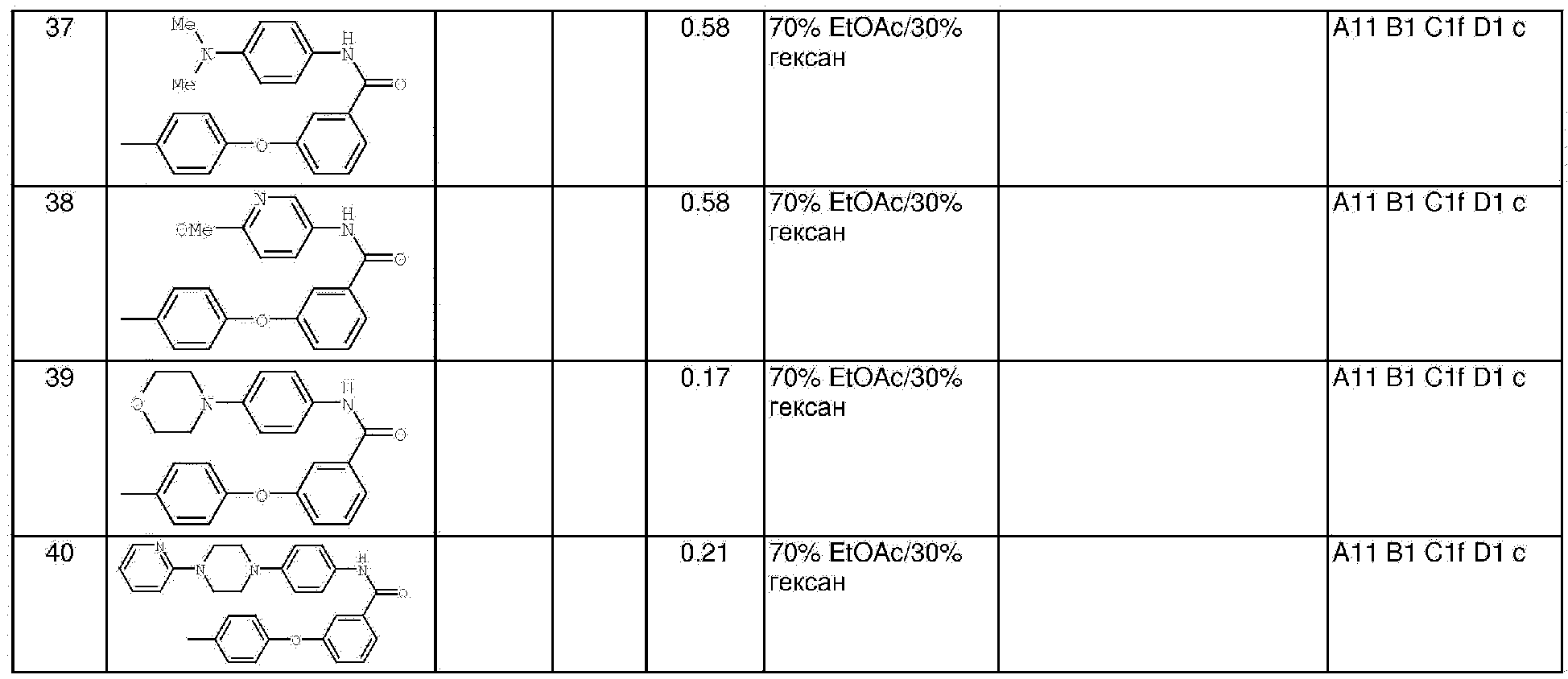
3-(трифторметил)-4-хлорфенилмочевины
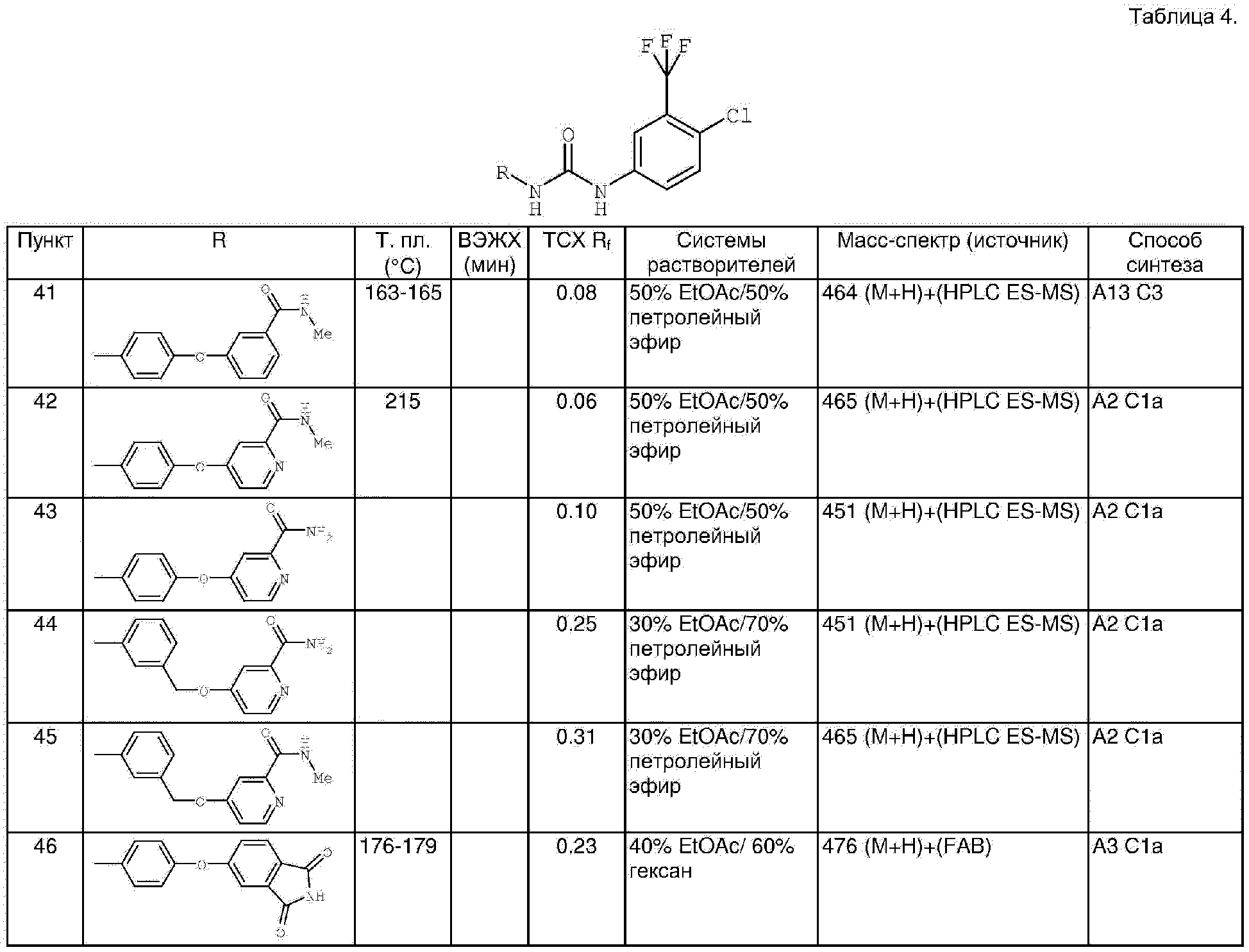
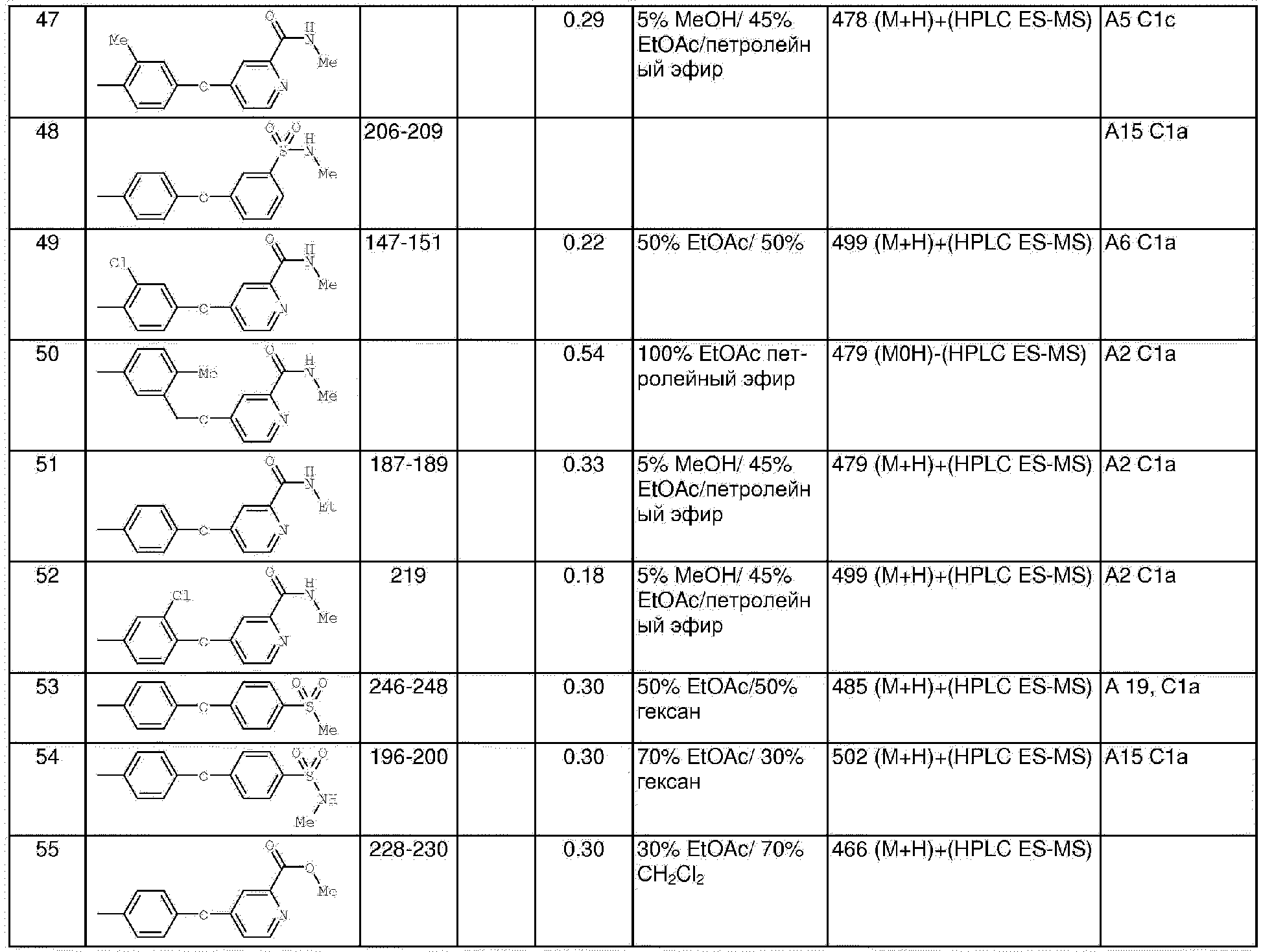
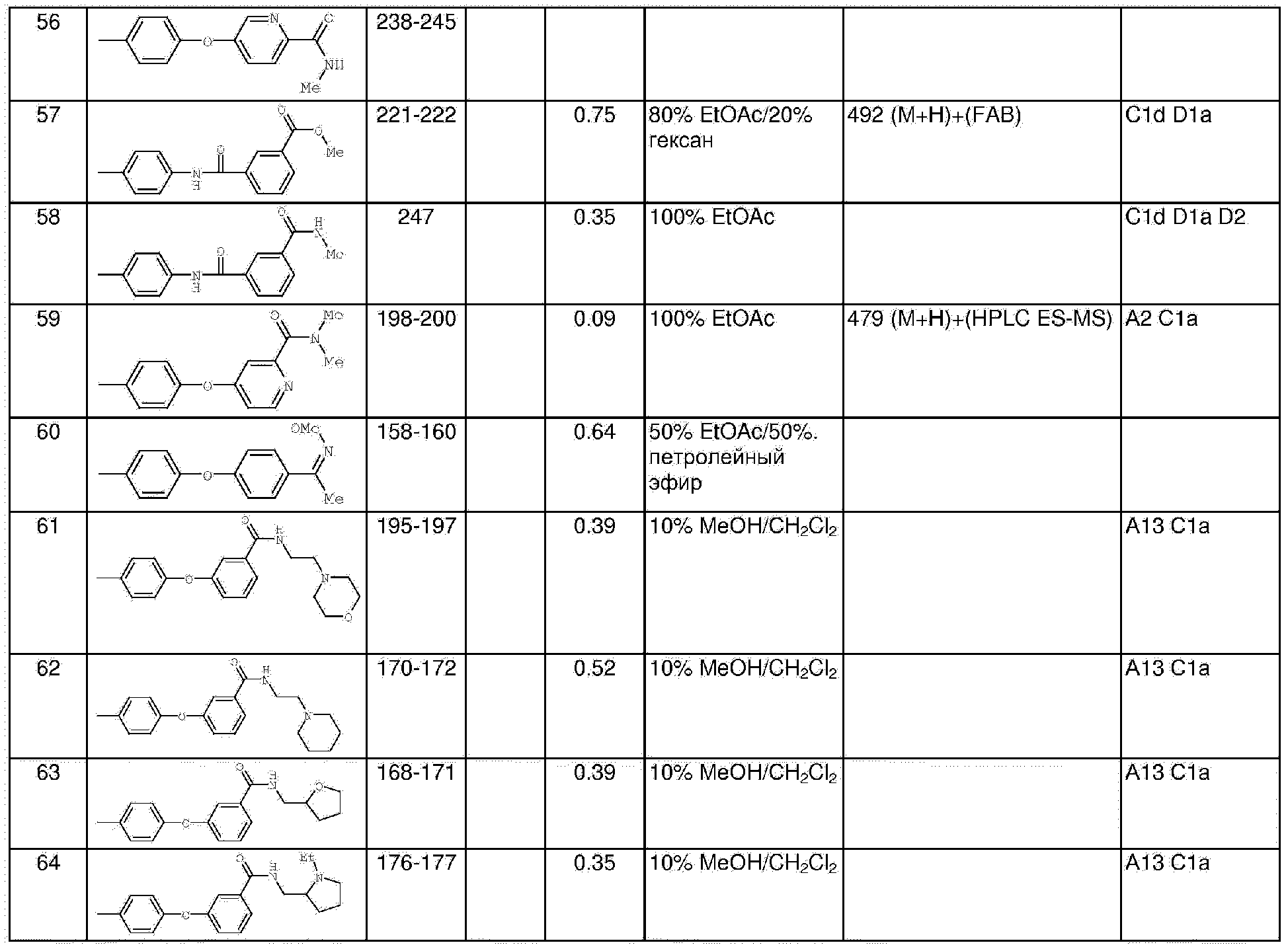
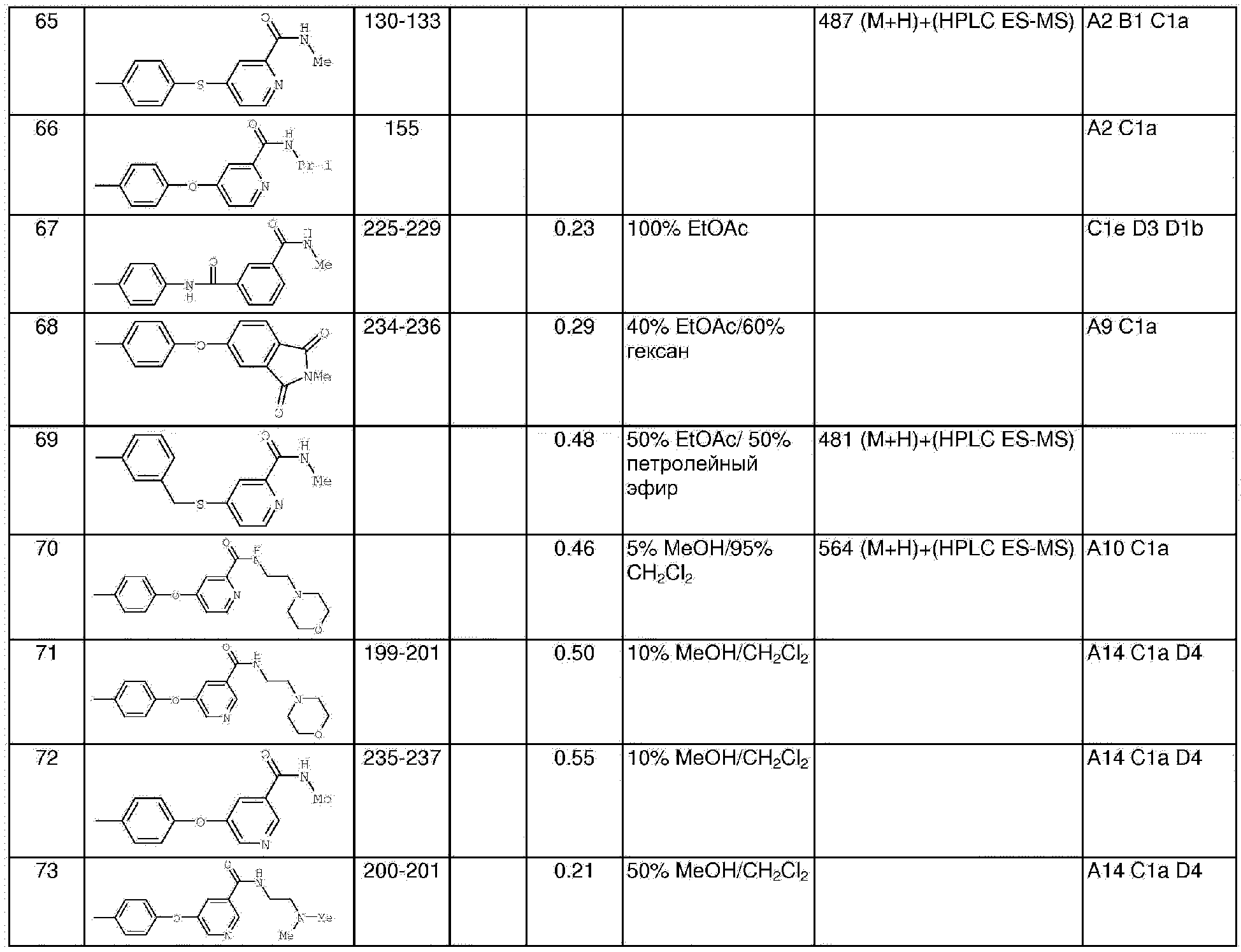
3-(трифторметил)-4-бромфенилмочевины
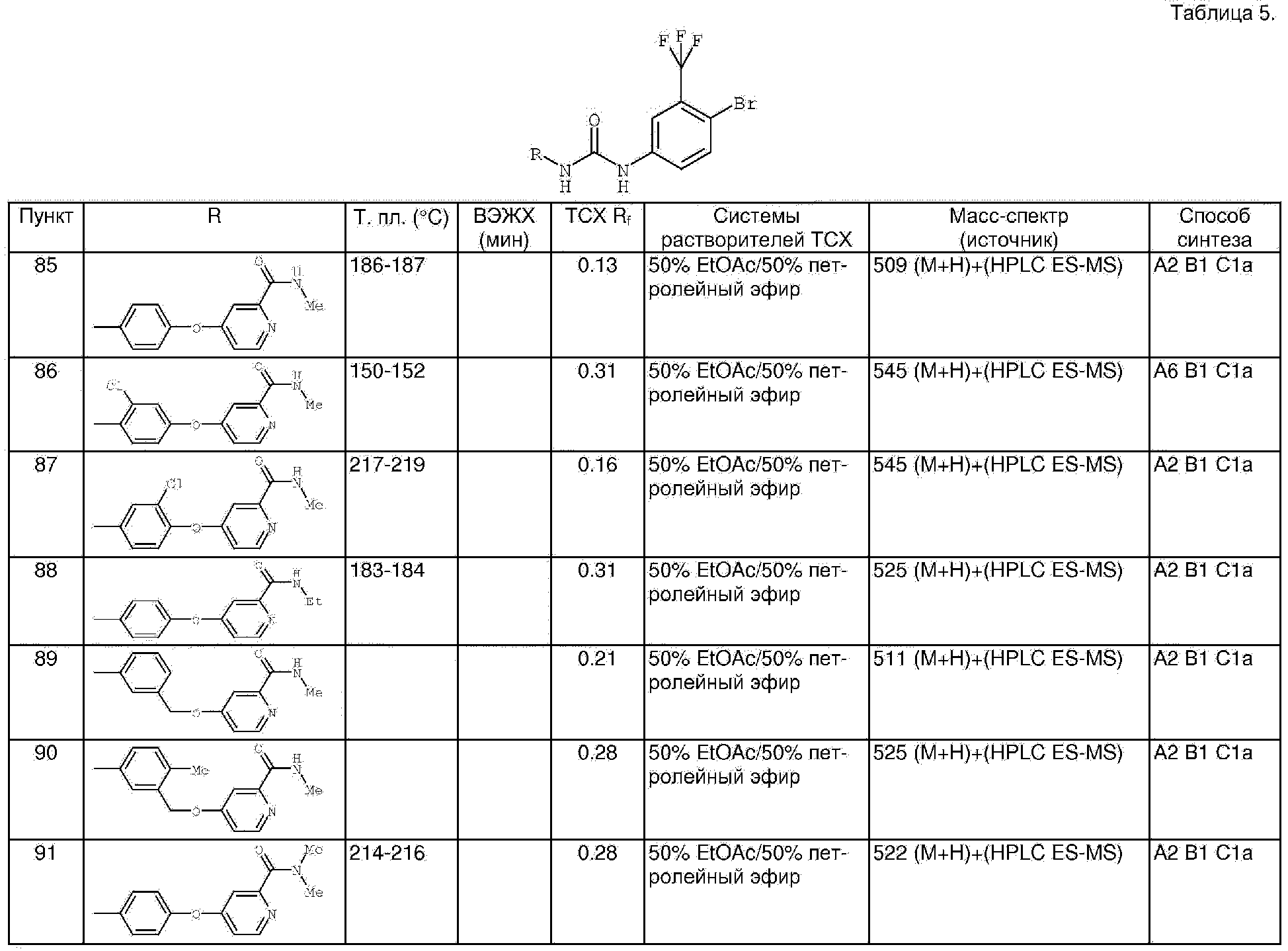
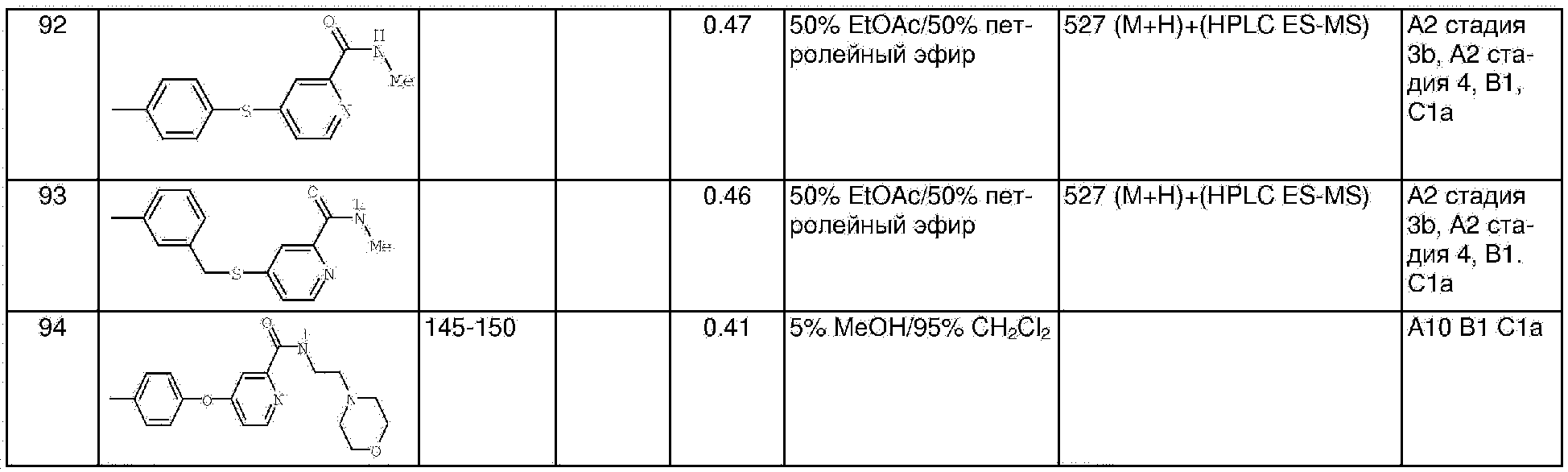
5-(трифторметил)-4-хлор-2-метоксифенилмочевины
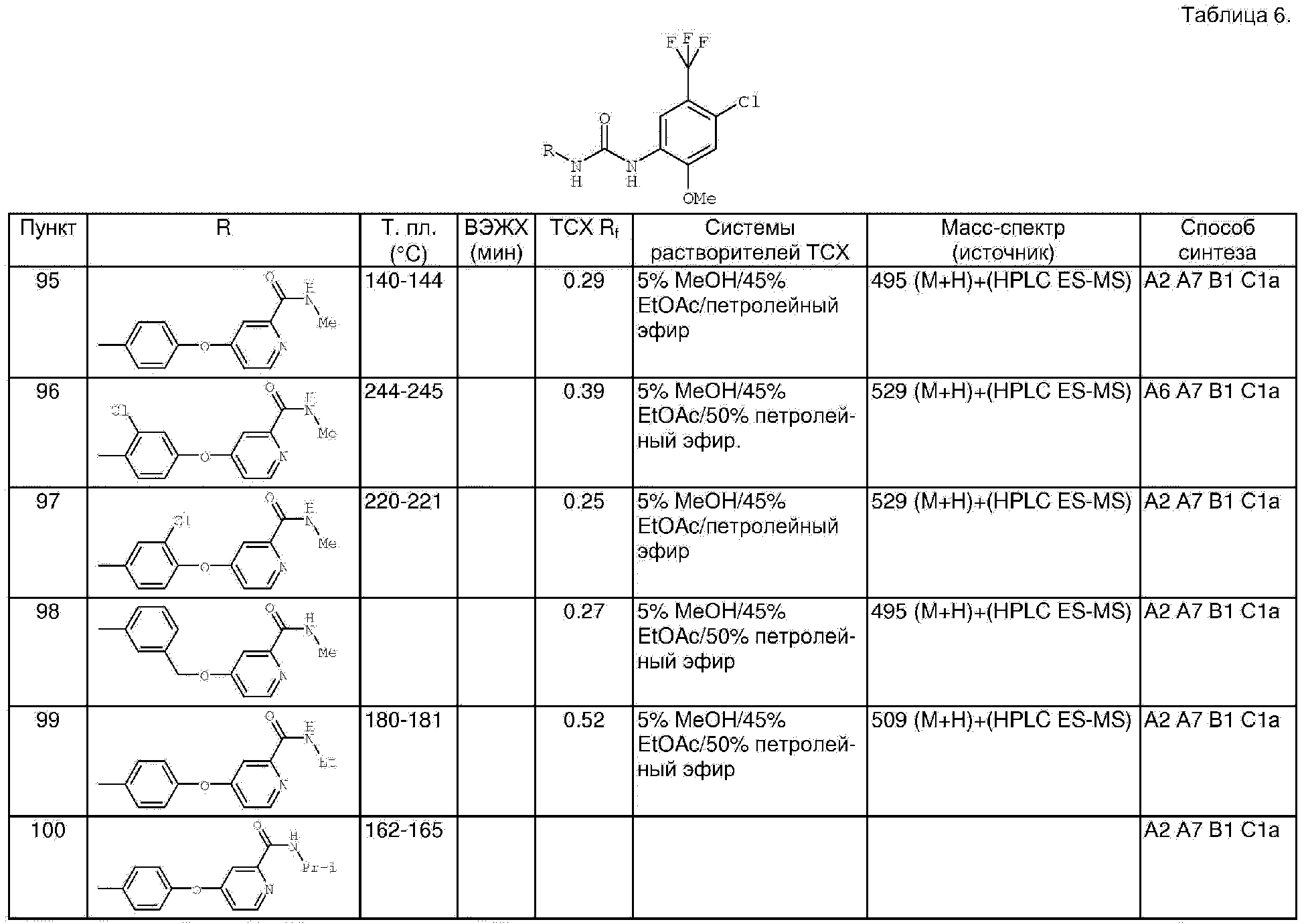
Дополнительные мочевины
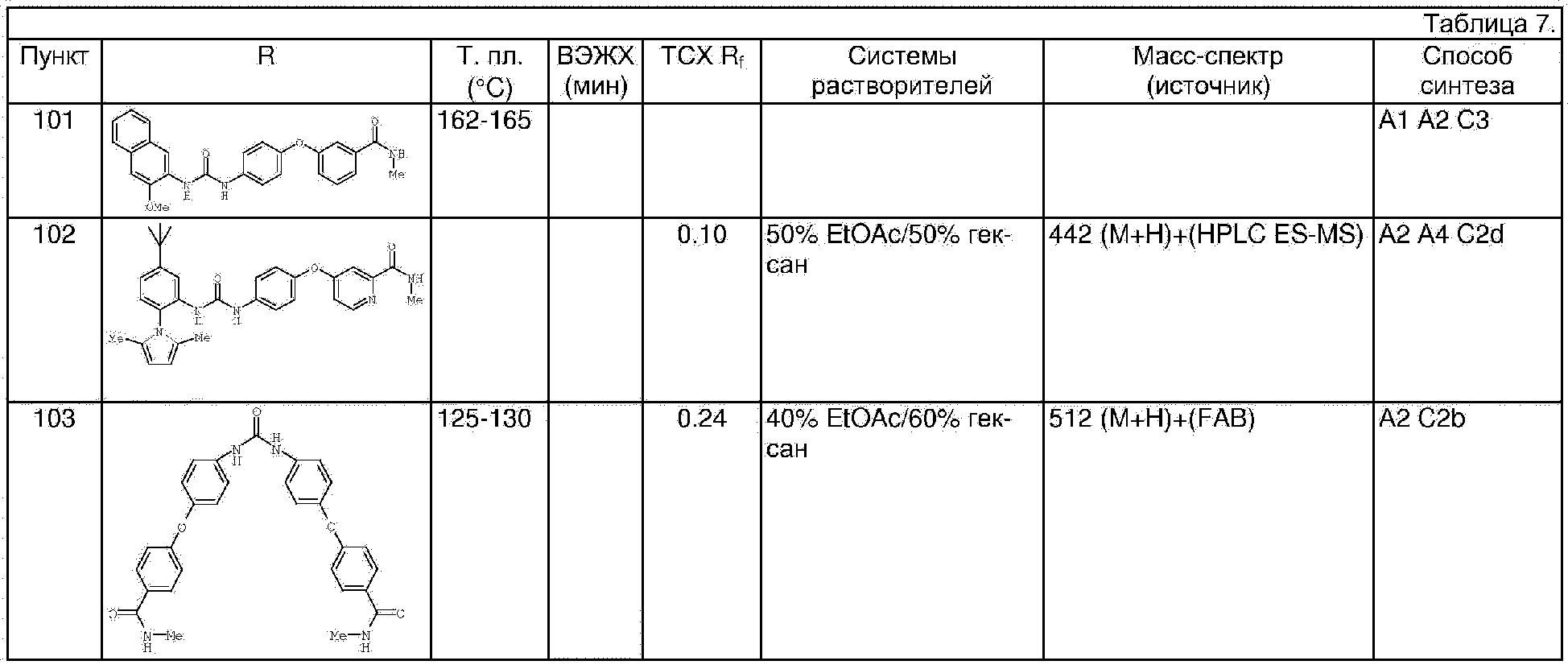
Предшествующие примеры можно повторить с подобным успехом при замене приведенных в основном или специальном описании реагентов и/или оперируя условиями проведения реакции, соответствующими данному изобретению, для соединений, использованных в предшествующих примерах.
Из предшествующего описания компетентный в данной области специалист может легко установить основные характеристики данного изобретения и, не выходя из рамок его идеи и объема, может получить различные изменения и модификации изобретения с целью адаптации его к различными вариантам применения и условиям.
Реферат
Изобретение относится к новым соединениям общей формулы A-D-B (I) или его фармацевтически приемлемым солям, которые обладают свойствами ингибиторов киназы raf и могут найти применение для лечения заболевания, связанного с ростом раковых клеток, опосредованным действием этой киназы. В соединениях общей формулы A-D-B (I) значение D представлено -NH-C(O)-NH-, А - замещенная структура, содержащая до 40 атомов углерода формулы -L-(M-L1)q, где L представляет собой пиридил или фенил, замещенный галогеном или C1-4алкилом, или 6-членную азотсодержащую гетероциклическую структуру, связанную непосредственно с D, L1 содержит возможно замещенные С5-7арильную или C5-8 азотсодержащую гетероциклическую группу, М является мостиковой группой, имеющей по меньшей мере один атом, выбранный из -О-, -S-, -CO-NH-, -NH-CO-, q - целое число, равное 1 или 2, и В представляет собой замещенные или незамещенные С6-14арильную группу, или шестичленную гетероарильную группу, содержащую 1-4 гетероатома, выбранных из азота, кислорода и серы, причем L1 является замещенной по меньшей мере одним заместителем, выбранным из группы, состоящей из -SO2Rx, -C(O)Rx и -C(NRy)Rz, причем если L1 является фенилом, то -
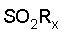
Формула




Комментарии