Способ получения флуоксастробина - RU2653542C2
Код документа: RU2653542C2
Описание
Область техники
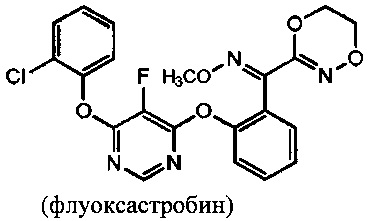
[0001] Настоящее изобретение предусматривает новый способ получения флуоксастробина
Уровень техники
[0002] Флуоксастробин представляет собой соединение типа стробилурина с фунгицидной активностью для контроля грибковых заболеваний, таких как альтернариоз, фитофтороз, пятнистость листьев, листовая ржавчина и ризоктониоз (Rhizoctonia solani). Флуоксастробин зарегистрирован как средство для внекорневого опрыскивания арахиса, клубневых и луковичных растений, растений с черешковыми листьями, плодоносящих растений и дерна, а также для протравливания семенного картофеля, семян арахиса и семян дерновых трав. Применение, связанное с обработкой дерна (почвы), должны осуществлять профессионалы-специалисты по борьбе с сельскохозяйственными вредителями.
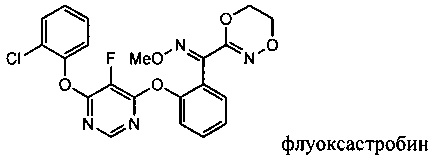
[0003] Фирма Bayer предлагает несколько способов синтеза флуоксастробина, но все они включают последовательную реакцию 4,6-дихлор-5-фторпиримидина (5) с 2-хлорфенолом и О-метилоксимом (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил) метанона (13), описанную в патенте США №6,734,304.
[0004] Необходимость в новых эффективных, масштабируемых и экономичных методах синтеза флуоксастробина остается до сих пор.
Сущность изобретения
[0005] В настоящем изобретении предусматривается способ получения флуоксастробина с использованием
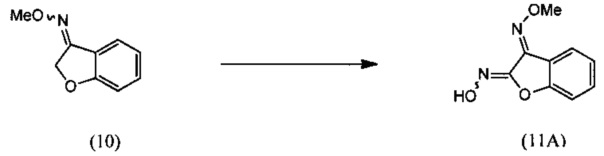
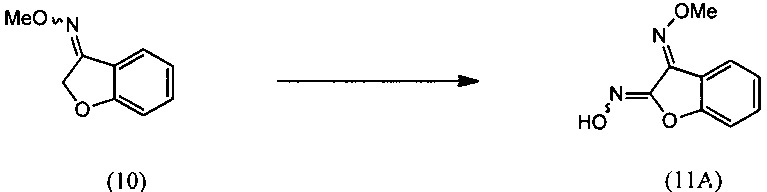
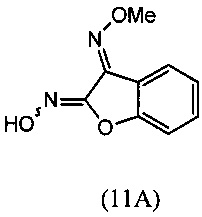
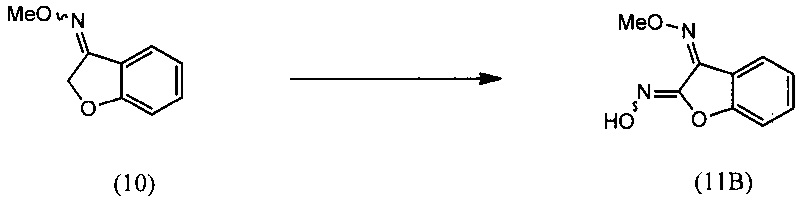
(i) взаимодействия О-метилоксима бензофуран-3(2Н)-она (10) с алкилнитритом в присутствии кислоты с региоселективным образованием преимущественно изомера О3-метилдиоксима (3E)-2,3-бензофурандиона (11А):
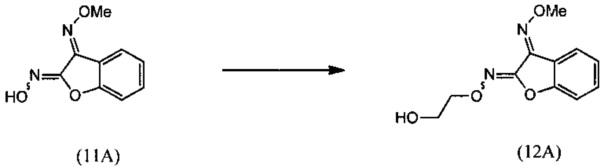
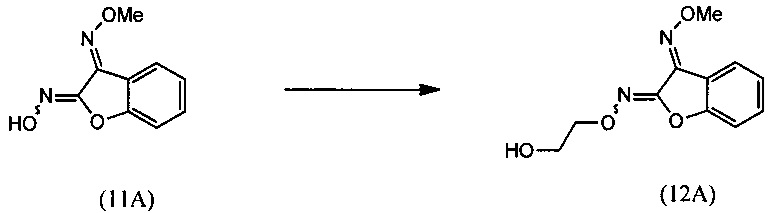
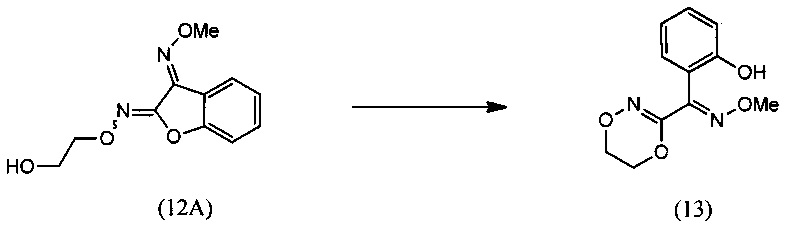
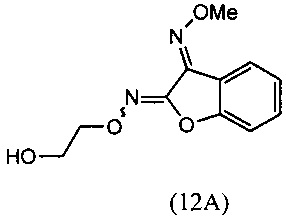
(ii) взаимодействия О3-метилдиоксима (3E)-2,3-бензофурандиона (11А) с 2-галогенэтанолом с образованием О2-(2-гидроксиэтил)-O3-метилдиоксима (3E)-бензофуран-2,3-диона (12А):
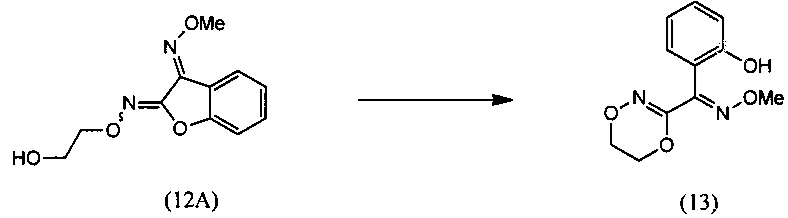
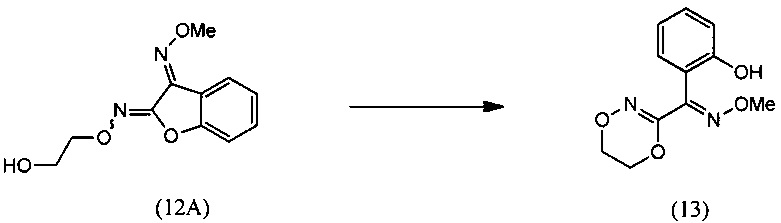
(iii) реакции О2-(2-гидроксиэтил)-O3-метилдиоксима (3E)-бензофуран-2,3-диона (12А) с основанием с региоселективным образованием О-метилоксима (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13):
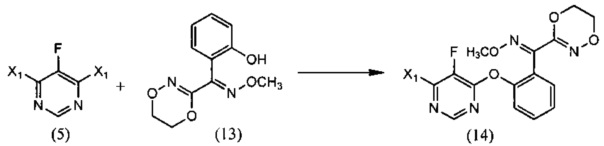
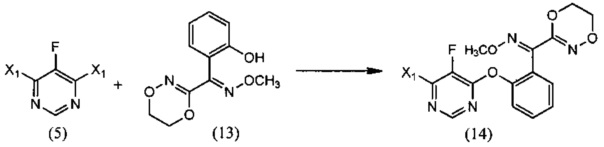
(iv) реакции 4,6-дигалоген-5-фторпиримидина (5), где X1 обозначает галоген, с О-метилоксимом (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13) в растворителе, и Настоящее изобретение необязательно, в присутствии основания, с образованием О-метилоксима (E)-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (14):
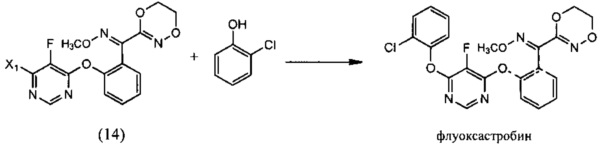
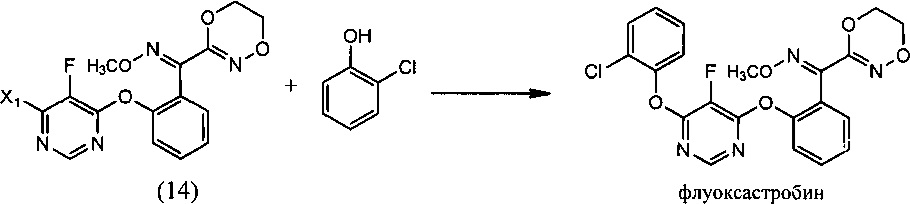
(v) реакции О-метилоксима (E)-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (14) с 2-хлорфенолом в растворителе, и необязательно в присутствии основания. с образованием флуоксастробина без примеси (Z)-флуоксастробина даже в следовых количествах:
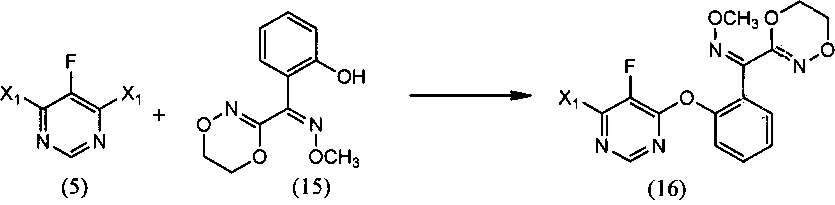
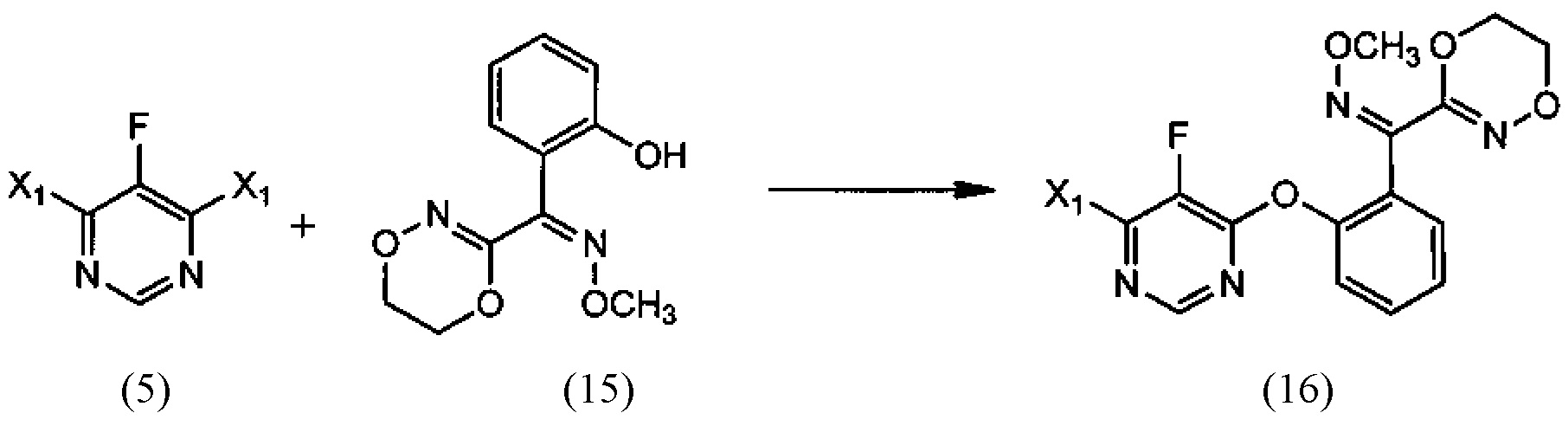
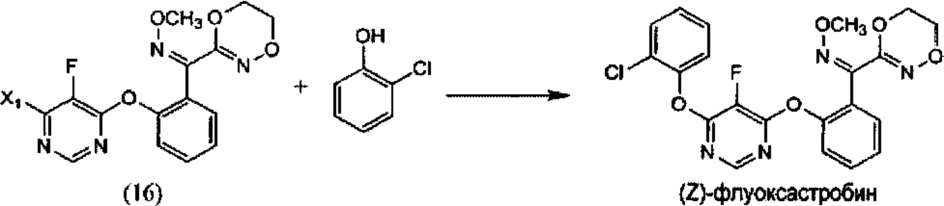
[0006] Настоящее изобретение предусматривает также способ получения флуоксастробина, включающий:
(i) реакцию 4,6-дигалоген-5-фторпиримидина (5), где X1 обозначает галоген, с О-метилоксимом (Z)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (15), необязательно в среде растворителя и необязательно в присутствии основания, с образованием О-метилоксима (Z)-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил) метанона (16):
(ii) реакцию О-метилоксима (Z)-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (14) с 2-хлорфенолом, необязательно в растворителе и необязательно в присутствии основания, с образованием (Z)-флуоксастробина:
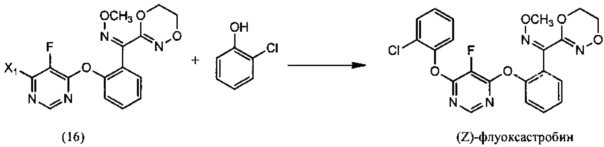
(iii) изомеризацию (Z)-флуоксастробина с образованием флуоксастробина:

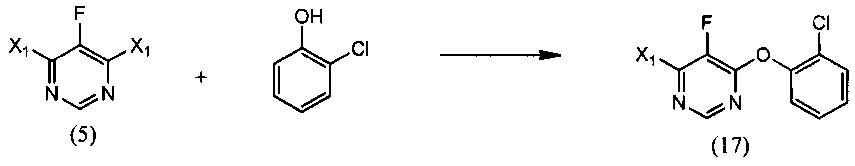
[0007] Изобретение предусматривает также способ получения флуоксастробина, включающий:
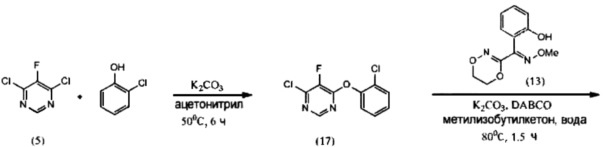
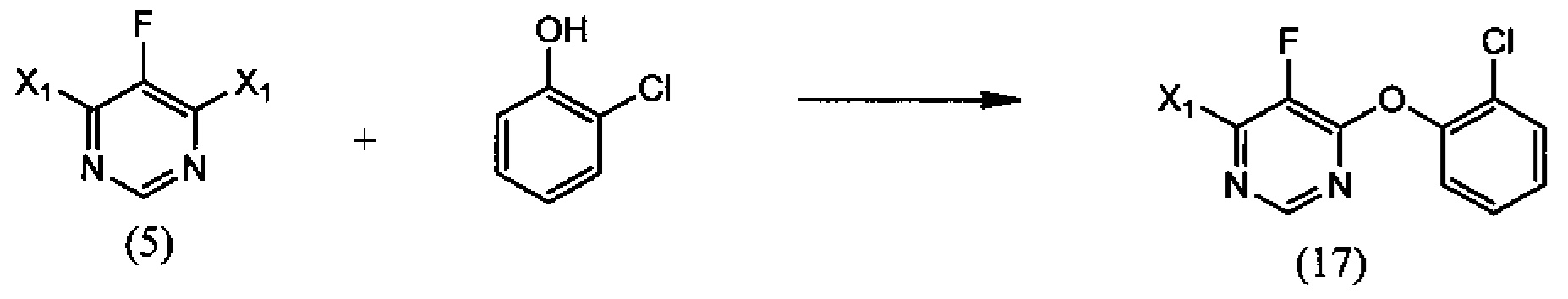
(i) реакцию 4,6-дигалоген-5-фторпиримидина (5), где X1 обозначает галоген, с 2-хлорфенолом, необязательно в растворителе и необязательно в присутствии основания, с образованием 4-галоген-6-(2-хлорфенокси)-5-фторпиримидина (17):
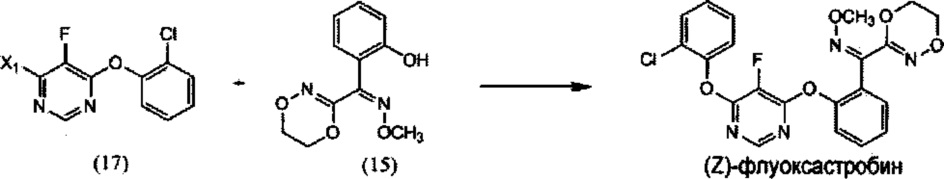
(ii) реакцию 4-галоген-6-(2-хлорфенокси)-5-фторпиримидина (17) с О-метилоксимом (Z)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (15), необязательно в растворителе и необязательно в присутствии основания, с образованием (Z)-флуоксастробина:
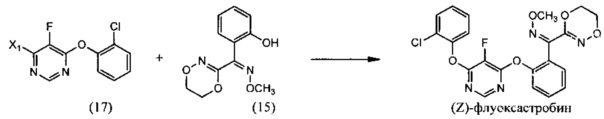
(iii) изомеризацию (Z)-флуоксастробина с образованием флуоксастробина:

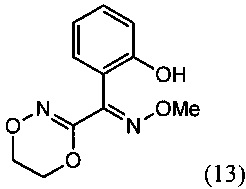
[0008] В изобретении также предусматривается способ получения О-метилоксима (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13)
включающий:
(i) реакцию О-метилоксима бензофуран-3(2H)-она (10) с алкилнитритом в присутствии кислоты с региоселективным образованием преимущественно изомера О3-метилдиоксима (3E)-2,3-бензофурандиона (11А):
(ii) реакцию О3-метилдиоксима (3E)-2,3-бензофурандион (11А) с 2-галогенэтанолом с образованием О3-метилдиоксима (3E)-бензофуран-2,3-диона О2-(2-гидроксиэтил) (12А):
(iii) реакцию О2-(2-гидроксиэтил)-O3-метилдиоксима (3E)-бензофуран-2,3-диона (12А) с основанием с региоселективным образованием О-метилоксима (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13):
[0009] Изобретение включает также способ региоселективного получения О-метилоксима (Z)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (15)
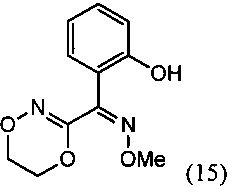
включающий:
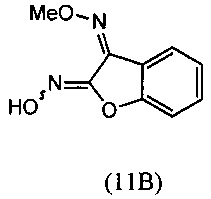
(i) взаимодействие О-метилоксима бензофуран-3(2H)-она (10) с алкилнитритом в присутствии основания с региоселективным образованием преимущественно изомера О3-метилдиоксима (3Z)-2,3-бензофурандиона (11В):
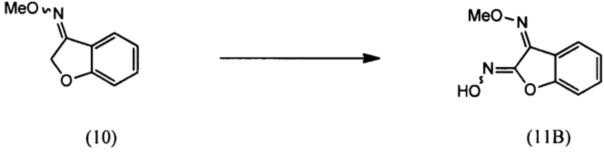
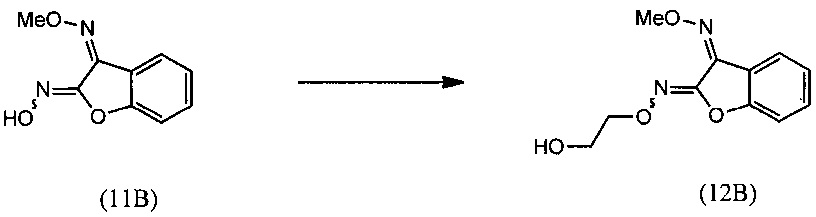
(ii) взаимодействие О3-метилдиоксима (3Z)-2,3-бензофурандион (11В) с 2-галогенэтанолом с образованием О2-(2-гидроксиэтил)-O3-метилдиоксима (3Z)-бензофуран-2,3-диона (12В);
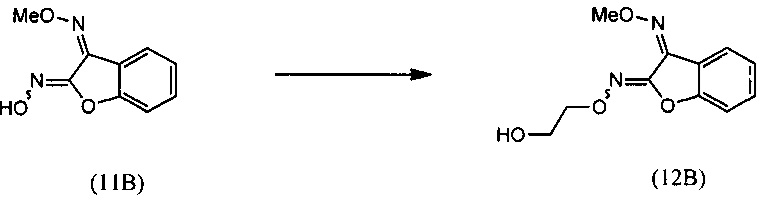
и
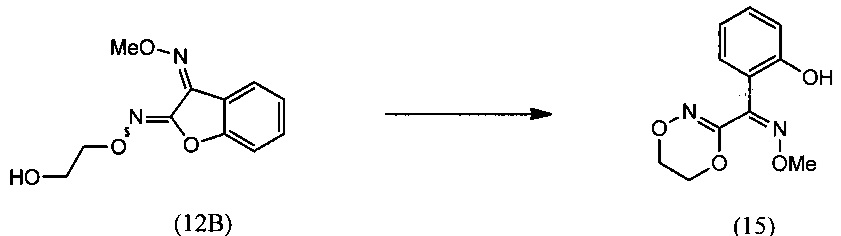
(iii) реакцию O2-(2-гидроксиэтил)-O3-метилдиоксима (3Z)-бензофуран-2,3-диона (12В) с региоселективным образованием О-метилоксима (Z)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (15):

Подробное описание изобретения
[0010] Ниже следует подробное описание изобретения, проиллюстрированное прилагаемыми рисунками. Однако это изобретение может быть воплощено во множестве различных форм и не ограничивается представленными вариантами. Скорее эти варианты предоставляются для того, чтобы это раскрытие было подробным и исчерпывающим и полностью описывало объем изобретения специалистам в данной области техники. По всему описанию одинаковые цифры (номера позиций) относятся к одинаковым соединениям.
[0011] Способ получения флуоксастробина включает:
(i) взаимодействие О-метилоксима бензофуран-3(2H)-она (10) с алкилнитритом в присутствии кислоты с региоселективным образованием преимущественно изомера О3-метилдиоксима (3E)-2,3-бензофурандиона (11А);

(ii) взаимодействие O3-метилдиоксима (3E)-2,3-бензофурандиона (11А) с 2-галогенэтанолом с образованием О2-(2-гидроксиэтил)-O3-метилдиоксима (3E)-бензофуран-2,3-диона (12А);
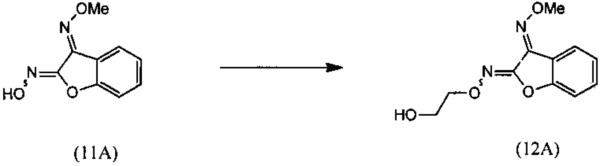
(iii) взаимодействие О2-(2-гидроксиэтил)-O3-метилдиоксима (3E)-бензофуран-2,3-диона (12А) с основанием с региоселективным образованием О-метилоксима (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13):
(iv) взаимодействие 4,6-дигалоген-5-фторпиримидина (5), где X1 обозначает галоген, с О-метилоксимом (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13) в растворителе, и необязательно, в присутствии основания, с образованием О-метилоксима (E)-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (14):
(v) взаимодействие О-метилоксима (E)-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (14) с 2-хлорфенолом в растворителе, и необязательно в присутствии основания, с образованием флуоксастробина без примеси (Z)-флуоксастробина даже в следовых количествах:
[0012] При осуществлении указанного выше способа О-метилоксим бензофуран-3(2H)-онА (10) может взаимодействовать с алкилнитритом в присутствии растворителя, и необязательно в присутствии кислоты, с образованием исключительно или в преобладающем количестве О3-метилдиоксима (3E)-2,3-бензофурандиона (11А) в смеси О3-метилдиоксима (3E)-2,3-бензофурандиона (11А) и О3-метилдиоксима (3E)-2,3-бензофурандиона (должно быть (3Z)-) (11В). Алкилнитрит может представлять собой бутилнитрит или трет.бутилнитрит. Кислота может быть соляной кислотой, серной кислотой, метансульфоновой кислотой, фосфорной кислотой или их комбинациями. Растворитель может представлять собой сложноэфирный растворитель, например, метилацетат, этилацетат, изопропилацетат, н-бутилацетат или их комбинации.
[0013] Согласно одному из вариантов содержание О3-метилдиоксима (3E)-2,3-бензофурандиона (11А) в смеси изомеров (3E)- и (3Z)-, (11А) and (11В), соответственно, может составлять от 90% до 94%. Содержание О3-метилдиоксима (3E)-2,3-бензофурандиона (11А) в смеси изомеров может быть определено различными аналитическими методами, которые известны среднему специалисту в данной области техники. Например, содержание О3-метилдиоксима (3E)-2,3-бензофурандиона (11А) в смеси изомеров (3Е)- и (3Z)- может быть определено методом HPLC (ВЭЖХ).
[0014] Взаимодействие О-метилоксима бензофуран-3(2H)-она (10) с алкилнитритом с образованием О3-метилдиоксима (3E)-2,3-бензофурандиона (11А) можно осуществлять при температуре от примерно 0°С до примерно 60°С, и, в частности, от примерно 0°С до примерно 40°С.
[0015] В соответствии со способом, описанным выше, O3-метилдиоксим (3E)-2,3-бензофурандиона (11А) может реагировать с 2-галогенэтанолом, в присутствии растворителя, и необязательно в присутствии основания, с образованием O2-(2-гидроксиэтил)-O3-метилдиоксима (3E)-бензофуран-2,3-диона (12А). 2-галогенэтанол может представлять собой 2-хлорэтанол или 2-бромэтанол. Применяемое основание может быть гидроксидом металла, таким как гидроксид лития, гидроксид натрия, гидроксид калия, или их комбинациями. Используемый растворитель может представлять собой кетонный растворитель, нитрильный растворитель, амидный растворитель, сульфоксидный растворитель, сульфонный растворитель, воду или комбинацию указанных растворителей. Неограничивающие примеры кетонных растворителей включают ацетон, метилэтилкетон и метилизобутилкетон. Неограничивающий пример нитрильных растворителей включает ацетонитрил. Неограничивающие примеры амидного растворителя включает N,N-диметилформамид ("DMF"), N,N-диметилацетамид ("DME"), N-метилформамид, N-метилпирролидон ("NMP") и гексаметилфосфортриамид ("НМРА"). Неограничивающий пример сульфоксидного растворителя включает диметилсульфоксид ("DMSO"). Неограничивающий пример сульфонного растворителя включает сульфолан.
[0016] Взаимодействие O3-метилдиоксима (3E)-2,3-бензофурандиона (11А) с 2-галогенэтанолом с образованием О2-(2-гидроксиэтил)-O3-метилдиоксима (3E)-бензофуран-2,3-диона (12А) можно осуществлять при температуре от примерно 20°С до примерно 100°С, и в частности, от примерно 70°С до примерно 85°С.
[0017] В соответствии со способом, описанным выше, О2-(2-гидроксиэтил)-O3-метилдиоксим (3E)-бензофуран-2,3-диона (12А) может быть обработан основанием с получением О-метилоксима (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13). Основание может представлять собой гидроксид металла, такой как гидроксид лития, гидроксид натрия, гидроксид калия или их комбинации.
[0018] Взаимодействие O2-(2-гидроксиэтил)-O3-метилдиоксима (3E)-бензофуран-2,3-диона (12А) с образованием О-метилоксима (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13) можно осуществлять при температуре от примерно 20°С до примерно 100°С, и в частности, от примерно 65°С до примерно 75°С.
[0019] В соответствии со способом, описанным выше, X1 может обозначать фтор, хлор, бром и йод. В частности, X1 может быть хлором.
[0020] Стадию взаимодействия О-метилоксима (E)-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (14) с 2-хлорфенолом можно проводить в присутствии третичного амина, в частности, 1,4-диазабицикло[2.2.2]октана ("DABCO"), 1,5-диазабицикло[4.3.0]нон-5-ена ("DBN") или 1,8-диазабицикло[5.4.0]ундец-7-ена ("DBU"), и, предпочтительно, 1,4-диазабицикло[2.2.2]октана ("DABCO").
[0021] Согласно одному из вариантов количество 1,4-диазабицикло[2.2.2]октана может быть равно от примерно 0.02 до примерно 0.4 молей на моль О-метилоксима (E)-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (14).
[0022] Согласно другому варианту количество 1,4-диазабицикло[2.2.2]октана может составлять от примерно 0.02 до примерно 0.2 молей на моль О-метилоксима (E)-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (14).
[0023] Стадии (ii), (iii), (iv) и (v) при осуществлении способа получения флуоксастробина можно проводить в одном реакционном сосуде, то есть, без выделения и очистки интермедиатов (12А), (13) и (14).
[0024] На стадии взаимодействия 4,6-дигалоген-5-фторпиримидина (5), где X1 обозначает галоген, с О-метилоксимом (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13) количество 4,6-дигалоген-5-фторпиримидина (5) может составлять от примерно 1 до примерно 4 молей на один моль О-метилоксима (Е)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13).
[0025] На стадии взаимодействия О-метилоксима (E)-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (14) с 2-хлорфенолом количество 2-хлорфенола может быть равно от примерно 0.8 до примерно 4 молей на один моль О-метилоксима (E)-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (14).
[0026] Стадии (iv) и (v) способа получения флуоксастробина можно осуществлять в присутствии растворителя. Согласно одному из вариантов растворитель может включать углеводородный растворитель, галогенсодержащий углеводородный растворитель, простой эфир, кетонный растворитель, нитрильный растворитель, амидный растворитель, сложноэфирный растворитель, сульфоксидный растворитель, сульфонный растворитель, воду или их комбинацию. Углеводородный растворитель может включать алифатический растворитель, алициклический растворитель, ароматический растворитель или их комбинацию. Неограничивающие примеры углеводородного растворителя включают петролейный эфир, пентан, гексан, гептан, циклогексан, метилциклогексан, бензол, толуол, 1,2-ксилол, 1,3-ксилол, 1,4-ксилол, этилбензол и кумол. Неограничивающие примеры галогенсодержащего углеводородного растворителя включают хлорбензол, дихлорбензол, дихлорметан, хлороформ, четыреххлористый углерод, 1,1-дихлорэтан, 1,2-дихлорэтан, 1,1,1-трихлорэтан и 1,1,2-трихлорэтан. Неограничивающие примеры простых эфиров включают диэтиловый эфир, диизопропиловый эфир, метилтрет.бутиловый эфир, метилтрет.амиловый эфир, 1,4-диоксан, тетрагидрофуран ("THF"), 2-метилтетрагидрофуран, 1,2-диметоксиэтан ("DME") и анизол. Неограничивающие примеры кетонных растворителей включают ацетон, 2-бутанон, метилизобутилкетон, циклопентанон и циклогексанон. Согласно одному из вариантов кетонный растворитель может включать метилизобутилкетон. Неограничивающие примеры нитрильного растворителя включают ацетонитрил ("ACN"), пропионитрил, н-бутиронитрил, изобутиронитрил и бензонитрил. Неограничивающие примеры амидных растворителей включают N,N-диметилформамид ("DMF"), N,N-диметилацетамид ("DMA"), N-метилформамид, N-метилпирролидон ("NMP") и гексаметилфосфортриамид ("НМРА"). Неограничивающие примеры сложноэфирных растворителей включают метилацетат и этилацетат. Неограничивающим примером сульфоксидного растворителя является диметилсульфоксид ("DMSO"). Неограничивающим примером сульфонного растворителя является сульфолан.
[0027] Согласно одному из вариантов растворитель может представлять собой смесь углеводородного растворителя и амидного растворителя.
[0028] Например, растворитель может быть смесью ароматического углеводорода и амидного растворителя. Неограничивающими примерами ароматического углеводородного растворителя в этой смеси могут быть бензол, толуол, 1,2-ксилол, 1,3-ксилол, 1,4-ксилол, этилбензол и кумол. Неограничивающие примеры амидных растворителей включают N,N-диметилформамид ("DMF"), N,N-диметилацетамид ("DMA"), N-метилформамид, N-метилпирролидон ("NMP") и гексаметилфосфортриамид ("НМРА"). В частности, растворитель может представлять собой смесь ароматического углеводородного растворителя, такого как любой ксилол или толуол, и амидного растворителя, который может представлять собой, например, N,N-диметилформамид ("DMF"), N,N-диметилацетамид ("DMA"), N-метилформамид, N-метилпирролидон ("NMP") и гексаметилфосфортриамид ("НМРА"). Чаще растворитель может представлять собой смесь ароматического углеводородного растворителя, такого как любой ксилол, и амидного растворителя, например, N,N-диметилформамида ("DMF"), N,N-диметилацетамида ("DMA"), N-метилформамида, N-метилпирролидона ("NMP") и гексаметилфосфортриамида ("НМРА"). Еще чаще растворитель может представлять собой смесь ароматического углеводородного растворителя, такого как толуол, и амидного растворителя, такого как N,N-диметилформамид ("DMF"), N,N-диметилацетамид ("DMA"), N-метилформамид, N-метилпирролидон ("NMP") и гексаметилфосфортриамид ("НМРА").
[0029] Кроме того, стадии (iv) и (v) этого способа получения флуоксастробина можно осуществлять в присутствии основания. Согласно одному из вариантов основание может включать неорганическое основание, органическое основание или их комбинации. Неорганическое основание может включать гидроксид, гидрид, ацетат (это не неорганическое основание), карбонат, бикарбонат или их комбинаций. Неограничивающие примеры неорганических оснований включают гидроксид натрия, гидроксид калия, гидрид натрия, гидрид калия, гидрид кальция, ацетат натрия, ацетат калия, карбонат натрия, карбонат калия, карбонат рубидия, карбонат цезия, бикарбонат натрия и бикарбонат калия. Неограничивающие примеры органических оснований включают триметиламин, триэтиламин, трибутиламин, N,N-диметиламин, N,N-диизо-пропилэтиламин, N,N-диметилбензиламин, пиридин, 2-метилпиридин (2-пиколин), 2,6-диметилпиридин (2,6-лутидин), N-метилпиперидин, N-метилморфолин ("NMM"), N,N-диметиламинопиридин ("DMAP"), 1,5-диазабицикло[4.3.0]нон-5-ен ("DBN") и 1,8-диазабицикло[5.4.0]ундец-7-ен ("DBU").
[0030] При осуществлении способа получения флуоксастробина стадию взаимодействия 4,6-дигалоген-5-фторпиримидина (5), где X1 обозначает галоген, с О-метилоксимом (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13) можно осуществлять при температуре от примерно 0°С до примерно 100°С, и в частности, от примерно 40°С до примерно 80°С. Время реакции может колебаться от примерно 1 до примерно 10 ч, например, от примерно 1 до примерно 6 ч.
[0031] Также при осуществлении способа получения флуоксастробина стадию взаимодействия О-метилоксима (E)-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (14) с 2-хлорфенолом можно осуществлять при температуре от примерно 0°С до примерно 100°С, и в частности, от примерно 40°С до примерно 90°С и, предпочтительно, от примерно 50°С до примерно 80°С. Время реакции может колебаться от примерно 15 мин до примерно 3 ч, в частности, от примерно 30 мин до примерно 1.5 ч.
[0032] Другой способ получения флуоксастробина, предусмотренный данным изобретением, включает:
(i) взаимодействие 4,6-дигалоген-5-фторпиримидина (5), где X1 обозначает галоген, с О-метилоксимом (Z)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (15), необязательно в присутствии растворителя и необязательно в присутствии основания, с образованием О-метилоксима (Z)-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (16):
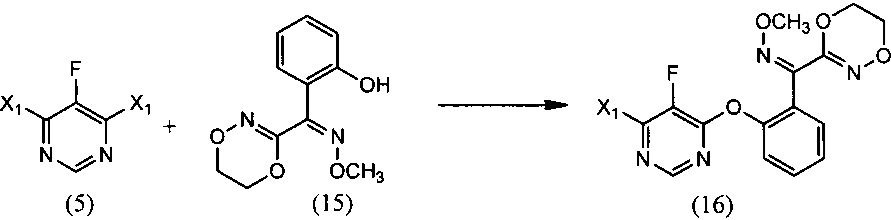
(ii) взаимодействие О-метилоксима (Z)-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (16) с 2-хлорфенолом, необязательно в присутствии растворителя и необязательно в присутствии основания, с образованием (Z)-флуоксастробина:
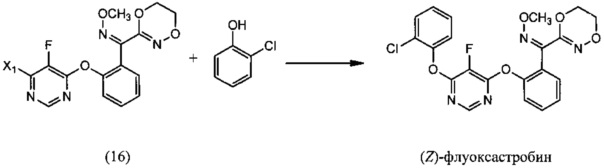
(iii) изомеризацию (Z)-флуоксастробина с получением флуоксастробина:

[0033] Еще один способ получения флуоксастробина согласно настоящему изобретению включает:
(i) взаимодействие 4,6-дигалоген-5-фторпиримидина (5), где Х1 обозначает галоген, с 2-хлорфенолом, необязательно в присутствии растворителя и необязательно в присутствии основания с получением 4-галоген-6-(2-хлорфенокси)-5-фторпиримидина (17):
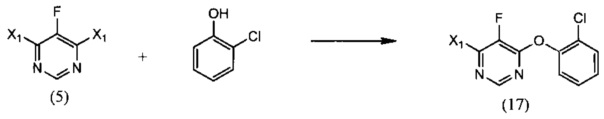
(ii) взаимодействие 4-галоген-6-(2-хлорфенокси)-5-фторпиримидина (17) с О-метилоксимом (Z)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (15), необязательно в присутствии растворителя и необязательно в присутствии основания, с получением (Z)-флуоксастробина:
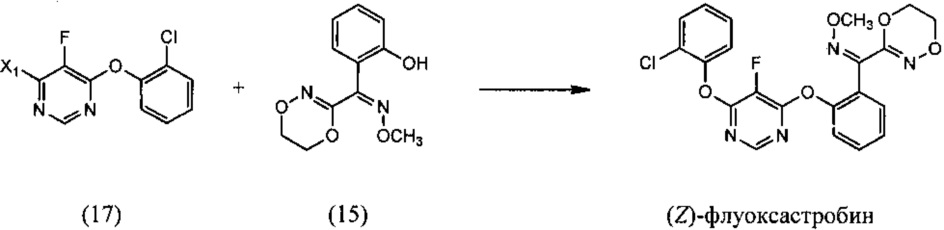
(iii) изомеризацию (Z)-флуоксастробина с образованием флуоксастробина:

[0034] Стадию изомеризации (Z)-флуоксастробина с образованием флуоксастробина можно осуществлять в присутствии растворителя и необязательно в присутствии кислого катализатора.
[0035] Кислый катализатор для изомеризации (Z)-флуоксастробина с образованием флуоксастробина может представлять собой органическую кислоту, неорганическую кислоту или их смесь. Неограничивающим примером органической кислоты может быть метансульфоновая кислота. Неограничивающим примером неорганической кислоты могут быть серная кислота и фосфорная кислота. Количество кислого катализа гора может составлять от примерно 0.2 молей до примерно 1.5 молей на один моль (Z)-флуоксастробина. Конкретно, количество кислого катализатора может составлять от примерно 0.8 молей до примерно 1.1 моля на один моль (Z)-флуоксастробина.
[0036] Растворитель, применяемый для изомеризации (Z)-флуоксастробина с получением флуоксастробина, может представлять собой нитрильный растворитель, амидный растворитель, сульфоксидный растворитель и сложноэфирный растворитель или их комбинацию. Неограничивающим примером нитрильного растворителя может быть ацетонитрил. Неограничивающим примером амидного растворителя может быть N,N-диметилформамид ("DMF"), N,N-диметилацетамид ("DME"), N-метилформамид, N-метилпирролидон ("NMP" и гексаметилфосфортриамид ("НМРА"). Неограничивающий пример сульфоксидного растворителя включает диметилсульфоксид ("DMSO"). Неограничивающие примеры сложноэфирного растворителя включают метилацетат, этилацетат, изопропилацетат и н-бутилацетат.
[0037] О-метилоксим (Z)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2 гидроксифенил)метанона (15), используемый в описанном выше способе, может быть получен следующим образом:
(i) осуществляют взаимодействие О-метилоксима бензофуран-3(2H)-она (10) с алкилнитритом в присутствии основания с получением О3-метилдиоксима (Z)-2,3-бензофурандиона (11В) в качестве преобладающего изомера:
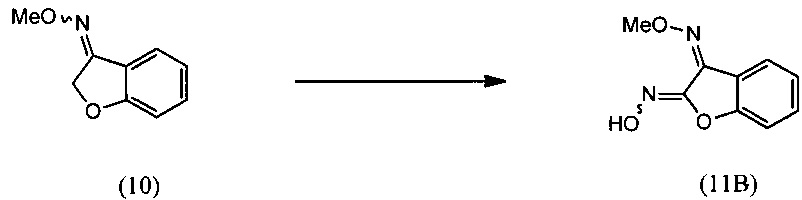
(ii) осуществляют взаимодействие О3-метилдиоксима (Z)-2,3-бензофурандиона (11В) с 2-галогенэтанолом с получением O2-(2-гидроксиэтил)- О3-метилдиоксима (Z)-бензофуран-2,3-диона (12В):
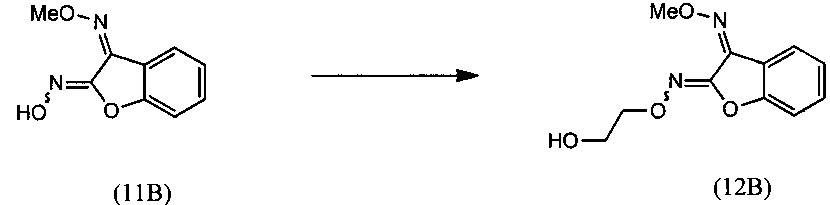
и (iii) осуществляют взаимодействие О2-(2-гидроксиэтил)- О3-метилдиоксима (Z)-бензофуран-2,3-диона (12В) с основанием с получением О-метилоксима (Z)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (15):
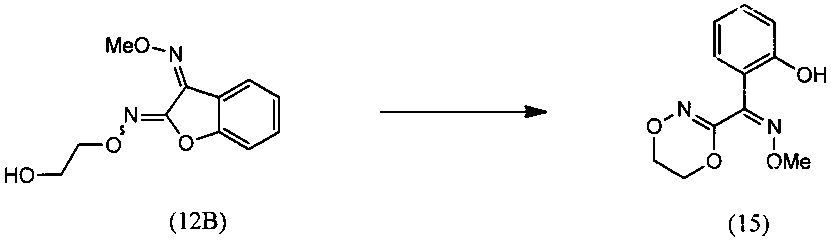
[0038] При осуществлении описанного выше способа О-метилоксим бензофуран-3(2H)-она (10) может реагировать с алкилнитритом в присутствии растворителя, и необязательно в присутствии основания, с образованием О3-метилдиоксима (Z)-2,3-бензофурандиона (11В), исключительно или в качестве преобладающего изомера, в смеси О3-метилдиоксима (E)-2,3-бензофурандиона (11А) и О3-метилдиоксима (Z)-2,3-бензофурандиона (11В). Алкилнитрит может представлять собой н-бутилнитрит или трет.бутилнитрит. Основание может быть гидроксидом металла, гидридом металла, алкоксидом металла или их комбинациями. Гидроксид металла может представлять собой гидроксид лития, гидроксид натрия, гидроксид калия или их комбинации. Гидрид металла может быть гидридом натрия. Алкоксид металла может быть трет.бутоксидом калия. Растворитель может представлять собой сложноэфирный растворитель, сульфоксидный растворитель или их комбинацию. Неограничивающими примерами амидного растворителя могут быть N,N-диметилформамид ("DMF"), N,N-диметилацетамид ("DME"), N-метилформамид, N-метилпирролидон ("NMP" и гексаметилфосфортриамид ("НМРА"). Неограничивающий пример сульфоксидного растворителя включает диметилсульфоксид ("DMSO").
[0039] Содержание О3-метилдиоксима (Z)-2,3-бензофурандиона (11В) в смеси изомеров (3Е)- и (3Z)-, (11А) и (11В) соответственно, может составлять от 95% до 98%. Содержание О3-метилдиоксима (Z)-2,3-бензофурандиона (11В) в смеси изомеров (3Е)- и (3Z)- может быть определено различными аналитическими методами, известными среднему специалисту в данной области техники. Например, содержание О3-метилдиоксима (Z)-2,3-бензофурандиона (11В) в смеси изомеров (3E)- и (3Z)- может быть определено методом HPLC.
[0040] Взаимодействие О-метилоксима бензофуран-3(2H)-она (10) с алкилнитритом с образованием О3-метилдиоксима (Z)-2,3-бензофурандиона (11В) можно осуществлять при температуре от примерно 5°С до примерно 60°С, в частности, от примерно 20°С до примерно 40°С.
[0041] При осуществлении описанного выше способа O3-метилдиоксим (Z)-2,3-бензофурандиона (11В) может реагировать с 2-галогенэтанолом в присутствии растворителя, и необязательно в присутствии основания, с образованием O2-(2-гидроксиэтил)-O3-метилдиоксима (Z)-бензофуран-2,3-диона (12В). 2-галогенэтанол может представлять собой 2-хлорэтанол или 2-бромэтанол. Основание может представлять собой гидроксид металла, такой как гидроксид лития, гидроксид натрия; гидроксид калия или их комбинации. Растворитель может представлять собой кетонный растворитель, нитрильный растворитель, амидный растворитель, сульфоксидный растворитель, сульфонный растворитель, воду или комбинацию указанных растворителей. Неограничивающие примеры кетонных растворителей включают ацетон, метилэтилкетон и метилизобутилкетон. Неограничивающий пример нитрильных растворителей включает ацетонитрил. Неограничивающие примеры амидного растворителя включает N,N-диметилформамид ("DMF"), N,N-диметилацетамид ("DME"), N-метилформамид, N-метилпирролидон ("NMP" и гексаметилфосфортриамид ("НМРА"). Неограничивающий пример сульфоксидного растворителя включает диметилсульфоксид ("DMSO"). Неограничивающий пример сульфонного растворителя включает сульфолан.
[0042] Взаимодействие О3-метилдиоксим (Z)-2,3-бензофурандиона (11В) С 2-галогенэтанолом с образованием О2-(2-гидроксиэтил)-O3-метилдиоксима (Z)-бензофуран-2,3-диона (12В) можно проводить при температуре от примерно 20°С до примерно 100°С, и в частности, от примерно 70°С до примерно 85°С.
[0043] При осуществлении описанного выше способа O2-(2-гидроксиэтил)-O3-метилдиоксим (Z)-бензофуран-2,3-диона (12В) может быть обработан основанием с получением О-метилоксима (Z)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (15). Основание может представлять собой гидроксид металла, такой как гидроксид лития, гидроксид натрия, гидроксид калия или их комбинации.
[0044] Взаимодействие O2-(2-гидроксиэтил)-O3-метилдиоксима (Z)-бензофуран-2,3-диона (12В) с образованием О-метилоксима (Z)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13) можно проводить при температуре от примерно 20°С до примерно 100°С, и в частности, от примерно 65°С до примерно 75°С.
[0045] Настоящее изобретение далее иллюстрируется примерами, которые не следует рассматривать как ограничительные.
ПРИМЕРЫ
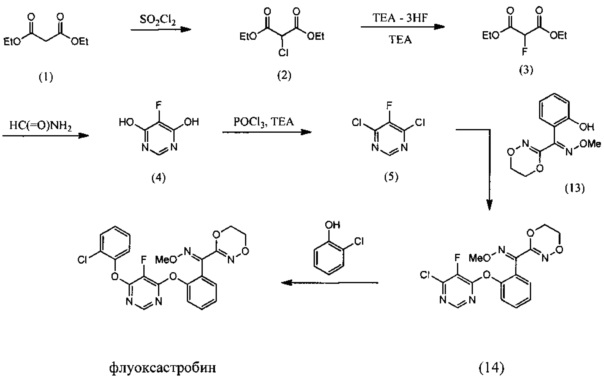
[0046] Примерный подход к получению флуоксастробина показан на Схеме 1. Согласно Схеме 1 синтез начинается с хлорирования диэтилмалоната (1) при помощи подходящего хлорирующего агента, например, сульфурилхлорида. Полученный диэтил-2-хлормалонат (2) превращают в диэтил-2-фтормалонат (3), используя подходящий фторирующий реагент, такой как комплекс фтористый водород-триэтиламин. Последующая циклизация в среде формамида приводит к получению 5-фторпиримидин-4,6-диола (4), который обрабатывают подходящим хлорирующим агентом, например, оксихлоридом фосфора, с получением 4,6-дихлор-5-фторпиримидина (5). Как далее указано на Схеме 2, 4,6-дихлор-5-фторпиримидин (5) взаимодействует с О-метилоксимом (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13) в подходящем растворителе и в присутствии основания с получением О-метилоксима (Е)-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (14), который далее реагирует с 2-хлорфенолом с образованием флуоксастробина. Как описано выше, последние две стадии синтеза можно осуществлять в одном реакционном сосуде, то есть, без выделения интермедиата, О-метилоксима (E)-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (14).
Схема 1
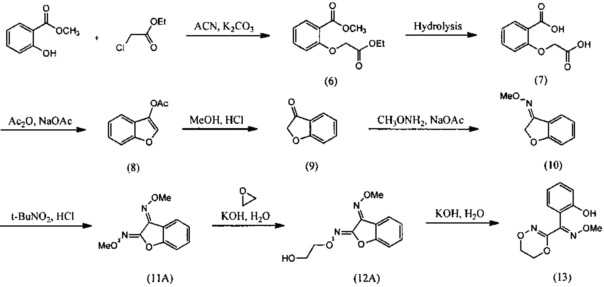
[0047] Синтез О-метилоксима (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13) проиллюстрирован на Схеме 2А. В соответствии с этим способом осуществляют взаимодействие метилсалицилата с этилхлорацетатом в присутствии карбоната калия с получением метил-2-(2-этокси-2-оксоэтокси)бензоата (6). Гидролиз метил-2-(2-этокси-2-оксоэтокси)бензоата (6) с последующей последовательной циклизацией 2-(карбоксиметокси)бензойной кислоты (7) при помощи уксусного ангидрида в присутствии ацетата натрия приводит к получению бензофуран-3-илацетата (8), который превращают в бензофуран-3(2H)-он (9) путем метанолиза. Обработка бензофуран-3(2H)-она (9) О-метилгидроксиламином и ацетатом натрия обеспечивает получение О-метилоксима бензофуран-3(2H)-она (10), который окисляют трет.бутилнитратом в среде соляной кислоты с получением О3-метилдиоксима (3E)-бензофуран-2,3-диона (11А). В присутствии гидроксида калия происходит раскрытие этиленоксидной группы О3-метилдиоксима (3E)-бензофуран-2,3-диона (11А) с получением О2-(2-гидроксиэтил)-O3-метилдиоксима (3E)-бензофуран-2,3-диона (12А), который подвергают циклизации, катализируемой гидроксидом калия с образованием О-метилоксима (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13).
Схема 2А
[0048] Другой способ синтеза О-метилоксима (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13) проиллюстрирован на Схеме 2В. В соответствии с этим способом осуществляют взаимодействие метилсалицилата с этилхлорацетатом в присутствии карбоната калия с получением метил-2-(2-этокси-2-оксоэтокси)бензоата (6). Гидролиз метил-2-(2-этокси-2-оксоэтокси)бензоата (6) с последующей последовательной циклизацией 2-(карбоксиметокси)бензойной кислоты (7) при помощи уксусного ангидрида в присутствии ацетата натрия приводит к получению бензофуран-3-илацетата (8), который превращают в бензофуран-3(2H)-он (9) путем метанолиза. Обработка бензофуран-3(2H)-она (9) О-метилгидроксиламином и ацетатом натрия обеспечивает получение О-метилоксима бензофуран-3(2H)-она (10), который окисляют трет.бутилнитратом в среде соляной кислоты с получением исключительного или преобладающего О3-метилдиоксима (3E)-бензофуран-2,3-диона (11А). В присутствии гидроксида калия и 2-галоидэтанола О3-метилдиоксим (3E)-бензофуран-2,3-диона (11А) может образовать О2-(2-гидроксиэтил)-O3-метилдиоксим (3E)-бензофуран-2,3-диона (12А), который может подвергаться циклизации, катализируемой гидроксидом калия с образованием О-метил-оксима (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13).
Схема 2В
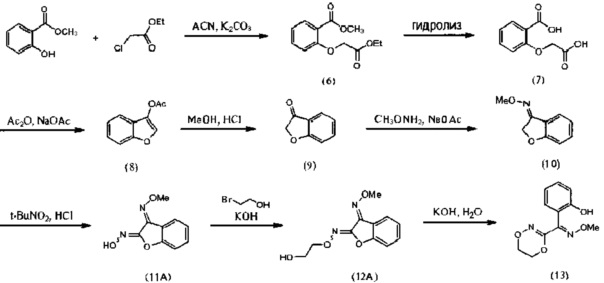
[0049] Флуоксастробин может быть также получен, как показано на Схеме 3. В частности, 4,6-дихлор-5-фторпиримидин (5) взаимодействует с 2-хлорфенолом в подходящем растворителе в присутствии подходящего основания с образованием интермедиата 4-хлор-6-(2-хлорфенокси)-5-фторпиримидина (17), который затем реагирует с О-метилоксимом (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13) с получением флуоксастробина.
Схема 3
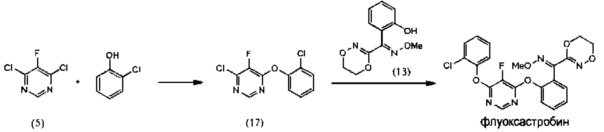
[0050] Как показано на Схеме 4, флуоксастробин может быть получен путем последовательного взаимодействия 4,6-дихлор-5-фторпиримидина (5) с О-метилоксимом (Z)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (15) и затем с 2-хлорфенолом с образованием (Z)-флуоксастробина, который в подходящих условиях подвергается изомеризации с получением флуоксастробина.
Схема 4
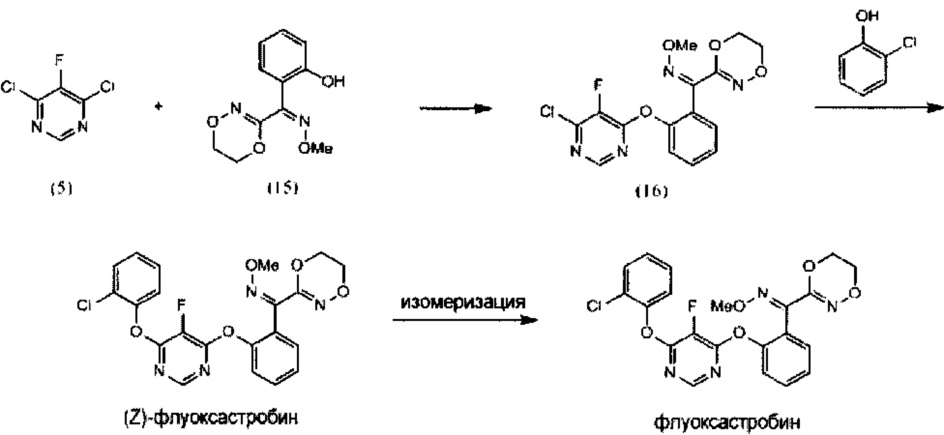
[0051] Как показано далее на Схеме 5, флуоксастробин может быть получен путем последовательного взаимодействия 4,6-дихлор-5-фторпиримидина (5) с 2-хлорфенолом, что приводит к получению 4-хор-6-(2-хлорфенокси)-5-фторпиримидина (17), который далее при взаимодействии с О-метилоксимом (Z)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (15) обеспечивает получение (Z)-флуоксастробина, который в подходящих условиях подвергается изомеризации с получением флуоксастробина.
Схема 5
[0052] Синтез флуоксастробина далее иллюстрируется на примере следующих экспериментальных процедур:
Метил-2-(2-этокси-2-оксоэтокси)бензоат (6)
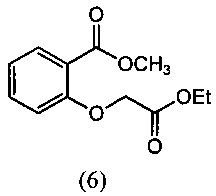
[0053] Хлорэтилацетат медленно добавляли к смеси метилсалицилата (100 г, 0.657 моль), K2СО3 (100 г, 0.723 моль) в DMF (400 мл) при комнатной температуре (20-30°С). Реакционную смесь нагревали при 65-75°С в течение 12-18 ч. Протекание реакции контролировали методом ВЭЖХ (HPLC). После завершения реакции неорганические вещества отфильтровывали и промывали DMF. DMF отделяли от фильтрата с получением продукта, отвечающего нужным требованиям. Выход - 91-95%.
ИК (см-1) 2985.71 m, 1725.89 s, 1598.81 s, 1489.10 s, 1448.49 s, 1378.78 m, 1300.25 m, 1250.90 m, 1193.64 s, 1136.53 w, 1088.35 s, 959.50 w, 834.93 w, 756.49 s, 706.30 w, 658.81 w. 1H ЯМР (400 MHz; CDCl3) δ 1.306-1.271 (t, J=3.2 Hz, 3H), 3.906 (s, 3H), 4.292-4.238 (q, 2H), 4.713 (s, 2H), 6.897-6.877 (d, J=8 Hz, 1H), 7.068-7.028 (m, 1H,), 7.464-7.420 (m, 1H), 7.844-7.820 (dd, 1H, J=8 Hz). Степень чистоты согласно HPLC составляла 98.63%.
2-(Карбоксиметокси)бензойная кислота (7)
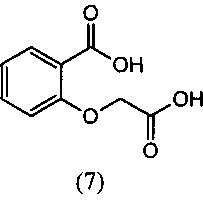
[0054] К раствору NaOH (40 г, 0.838 моль) в воде (300 мл) медленно добавляли метил-2-(2-этокси-2-оксоэтокси)бензоат (6) (100 г, 0.419 моль) при температуре 20-30°С (экзотермичность наблюдалась до температуры 50°С), и затем реакционную смесь перемешивали в течение 1-2 ч. Протекание реакции контролировали методом ВЭЖХ (HPLC). После завершения реакции реакционную смесь подкисляли разбавленной (1:1 по объему) H2SO4 (50 мл) до рН=2-3 при температуре 20-35°С. Полученный сырой продукт осаждали при выдержке при перемешивании в течение 1 ч при температуре 20-30°С, затем сырой продукт отфильтровывали и промывали водой, получая продукт, который отвечал желаемым характеристикам. Выход этого продукта составил 71-87%.
ИК (KВr) (см-1) 3467.78 w, 3178.72 m, 2756.30 w, 1743.43 s, 1678.65 s, 1367.36 s, 1236.72 s, 1056.69 s. 1H ЯМР (400 MHz; DMSO-d6) δ 4.734 (s, 2H), 6.975-6.954 (d, J=8.4 Hz, 1H), 7.008-6.954 (m, 1H), 7.457-7.413 (m, 1H), 7.633-7.610 (m, J=1.6 Hz, 1H), 12.791 (bs, 2H). MC (EI) m/z: 195.2 (M-1); 137.2, 117,97. Степень чистоты согласно HPLC была равна 99,605%.
Бензофуран-3-илацетат (8)
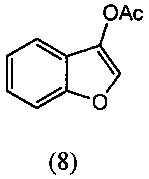
[0055] К уксусному ангидриду (300 мл) добавляли 2-(карбоксиметокси)бензойную кислоту (7) (100 г, 0.510 моль) при комнатной температуре и нагревали до 130-140°С. Эту температуру реакции поддерживали в течение 14-20 ч при перемешивании. Протекание реакции контролировали методом ВЭЖХ (HPLC). После завершения реакции реакционную смесь охлаждали до 50-80°С, уксусный ангидрид выделяли при температуре 50-80°С при пониженном давлении, и сырой продукт экстрагировали дихлорметаном (500 мл). Отделяли полностью дихлорметановый слой и получали продукт, который отвечал желаемым характеристикам. Выход этого продукта составил 76-85%.
ИК (см-1) 3060.43 w, 1759.45 s, 1577.24 s, 1449.18 s, 1361.45 s, 1179.20 s, 1090.38 s, 890.75, 742.41.1Н ЯМР (400 MHz; DMSO-d6) δ 2.384 (s, 3H), 7.332-7.292 (dd, 1H), 7.411-7.37 (dd, 1H), 7.62-7.576 (dd, J=9 Hz, 2H), 8.2 (s, 1H). ГХ-МС (EI) m/z: 176. Степень чистоты согласно HPLC была равна 99.81%.
Бензофуран-3 (2Н)-он (9)
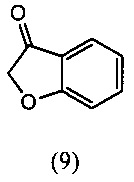
[0056] К раствору бензофуран-3-илацетата (8) (100 г, 1.42 моль) в метаноле (350 мл) добавляли разбавленную (7.5%) H2SO4 (500 мл) при комнатной температуре с последующим нагреванием с обратным холодильником в течение 1-3 ч. Протекание реакции контролировали методом ВЭЖХ (HPLC). После завершения реакции реакционную смесь охлаждали, отфильтровывали и полученную суспензию промывали водой и сушили под вакуумом, получали продукт, который отвечал желаемым характеристикам. Выход этого продукта составил 83-100%.
ИК (см-1) 2935.34, 1725.66, 1468.50, 1193.97. 1H ЯМР (400 MHz; DMSO) δ 4.807 (s, 2Н), 7.176-7.138 (t, 1Н), 7.303-7.283 (d, J=8 Hz, 1H), 7.657-7.635 (m, 1H), 7.748-7.705 (m, 1H). ГХ-МС (EI) m/z: 134.13. Температура плавления была равна 101-103°С. Степень чистоты согласно HPLC была равна 99.51%.
Бензофуран-3(2H)-она О-метилоксим (10)
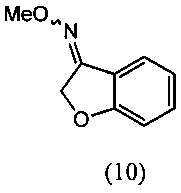
[0057] К раствору бензофуран-3(2H)-она (9) (100 г, 0.745 моль) в метаноле (700 мл) при комнатной температуре добавляли гидрохлорид О-метилгидроксиламина (68.5 г, 0.820 моль) и NaOAc (67.3 г, 0.820 моль) с последующим нагреванием с обратным холодильником в течение 1-3 ч. Протекание реакции контролировали методом ВЭЖХ (HPLC). После завершения реакции неорганические вещества отфильтровывали и отделяли от фильтрата метанол, получая остаток. Остаток подвергали экстракции с использованием дихлорметана (500 мл) и воды (1 л) с последующим выделением органического слоя, получали продукт, который отвечал желаемым характеристикам. Выход этого продукта составил 75-83%.
ИК (см-1) 3070.02, 2898.40, 1604.89 s, 1398.80 s, 1537.36, 1465.17, 1041.49, 985.45 s, 747.70 s, 628.55 s, 554.54 s. 1H ЯМР (400 MHz; CDCl3) δ 3.990 (s, 3H), 5.081 (s, 2H), 6.997-6.931 (m, 1H), 7.354-7.311 (m, 1H), 7.610-7.589 (m, J=7.8 Hz, 1H). MC (EI) m/z: 164 (M+l); MC (EI) (m/z): 164 (M+l), 132.9. Температура плавления была равна 35-37°С. Степень чистоты согласно HPLC была равна 98.92%.
(3E)-бензофуран-2,3-диона О3-метилдиоксим (11А)
[0058] К примерно 13%-ному раствору НСl в этилацетате (173 г, 0.613 моль) добавляли трет.-ВUNO2 (69.5 г, 0.675 моль) при температуре 0-5°С с последующим добавлением раствора О-метилоксима бензофуран-3(2H)-она (10) (100 г, 0.613 моль) в этилацетате (400 мл) при температуре 0-35°С. Протекание реакции контролировали методом ВЭЖХ (HPLC). После завершения реакции полученный продукт выделяли путем экстракции с использованием системы этилацетат-вода, полученный продукт отвечал желаемым характеристикам. Выход этого продукта составил 70-73%.
ИК (см-1) 3243.39 s, 3109.24 m, 2935.39 m, 2830.17 m, 1599.15 s.1Н ЯМР (400 MHz; CDCl3) δ 4.112 (s, 3Н), 7.259-7.221 (m, J=1.6 Hz, 1Н), 7.347-7.327 (d, J=8 Hz, 1H), 7.605, 7.563 (m, 1H), 8.043-8.022 (m, J=7.6 Hz, 1H), 11.351 (s, 1H). MC (EI) m/z: 193.1 (M+l); MC (EI) (m/z): 193.1 (M+l), 195.3, 175.9, 162.1, 149.2. Температура плавления была равна 180-182°С. Степень чистоты согласно HPLC была равна 99.84%.
(3Z)-Бензофуран-2,3-диона 03-метилдиоксим (11В)
[0059] К перемешиваемой суспензии NaH (60% суспензия; 8.1 г; 202.4, ммоля) в DMF (300 мл) медленно добавляли н-бутилнитрит (20.87 г; 202.4 ммоля) при температуре от 0 до 5°С. Полученную реакционную массу перемешивали в течение 10-15 мин при указанной температуре. Затем медленно добавляли раствор монооксима бензофурана (Соединение 10, 30 г; 184 ммоля) в DMF (30 мл), поддерживая температуру реакции равной от 0 до 5°С. Затем реакционную массу перемешивали в течение 30 мин при температуре от 0 до 5°С с последующим перемешиванием при 20-30°С в течение 2-4 ч. Протекание реакции контролировали методом HPLC, и после завершения реакции реакционную массу обрабатывали DM (деминерализованной) водой (300 мл) при температуре от 0 до 10°С. Устанавливали величину рН реакционной массы равной 1-2, используя 50% водный раствор серной кислоты при температуре от 0 до 5°С. Полученную суспензию перемешивали в течение 30 мин при температуре от 5 до 10°С. Полученный таким образом осадок отфильтровывали и промывали суспензию DM водой (3×60 мл). Полученный продукт высушивали при 60-70°С, получая 27.3 g (77.32% от теоретического выхода) O3-метилдиоксима (3Z)-бензофуран-2,3-диона (11В) с высокой степенью чистоты. Мониторинг реакции методом HPLC (% площади поверхности): диоксим (3Z)-бензофурана (11В): 81.78% и диоксим 3E-бензофурана (11А): 2.19%. Степень чистоты выделенного продукта согласно HPLC (% площади поверхности): диоксима (3Z)-бензофурана (11В): 98.61% и диоксима 3E-бензофурана (11А): 0.77%.
O2-(2-гидроксиэтил)-O3-метилдиоксим (3E)-бензофуран-2,3-диона (12А)
[0060] К раствору O3-метилдиоксима (3E)-бензофуран-2,3-диона (11А) (100 г, 0.520 моля) в DMSO (300 мл) при комнатной температуре добавляли 2-хлорэтанол (50.31 г, 0.624 моля) с последующим добавлением K2СО3 (100.6 г, 0.728 моля). Реакционную смесь перемешивали при 75-80°С в течение 10-12 ч. Протекание реакции контролировали методом HPLC, и после завершения реакции реакционную массу обрабатывали водой (2 л) и перемешивали при температуре 20-30°С в течение 1 ч. Полученный продукт отфильтровывали, суспензию промывали водой и сушили с отсасыванием, получали продукт, который отвечал желаемым характеристикам. Выход был равен 83-87%.
ИК (см-1, KВr) 3434.29 s, 3078.21 w, 2939.71 s, 2819.94 w, 1594.86 s, 1456.72 s, 1345.45 m, 1301.57 w, 1064.99 s, 933.28 w, 868.16 w.1H ЯМР (CDCl3, 400 MHz) δ 2.126-2.140 (t, J=5.6 Hz, 1H), 3.974-3.980 (m, 2H), 4.220 (s, 3H), 4.379-4.389 (m, 2H), 7.162-7.196 (m, 2H), 7.448-7.487 (t, J=8 Hz, 1H), 8.056-8.076 (d, J=8 Hz, 1H).13C ЯМР (CDCl3, 400 MHz) δ 59.534 (-CH2-), 64.342, 77.543 (-CH2-), 111.742, 118.106, 124.788, 128.187, 134.436, 142.573, 147.753, 157.036. MC (EI) m/z 236.8 (M+l); MC2 (EI) m/z 237, 193.1, 162.0, 144.0 130.1, 119.1, 104.1, 90.0, 65.2. HPLC (площадь поверхности, %): 99.47%. Температура плавления была равна 89-91°С.
O2-(2-гидроксиэтил)-O3-метилдиоксим (3Z)-бензофуран-2,3-диона (12В)
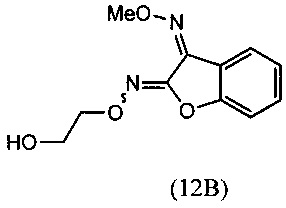
[0061] К раствору O3-метилдиоксима (3Z)-бензофуран-2,3-диона (11В) (100 г, 0.520 моля) в DMSO (300 мл) добавляли 2-хлорэтанол (50.31 г, 0.624 моля) с последующим добавлением K2СО3 (100.6 г, 0.728 моля) при комнатной температуре. Реакционную смесь перемешивали при температуре 75-80°С в течение 10-12 ч. Протекание реакции контролировали методом HPLC, и после завершения реакции реакционную массу обрабатывали водой (2 л) и перемешивали при 20-30°С в течение 1 ч. Сырой продукт отфильтровывали, суспензию промывали водой и сушили с отсасыванием, получали продукт, который отвечал желаемым характеристикам. Выход был равен 83-87%.
1Н ЯМР (CDCl3, 400 MHz) δ 3.663-3.698 (m, 2Н), 4.118 (s, 3Н), 4.167-4.191 (t, J=4.8 Hz, 2H), 4.797-4.822 (t, J=4.8 Hz, 1H), 7.233-7.270 (t, J=7.6 Hz, 1H), 7.328-7.348 (d, J=8 Hz, 1H) 7.521-7.559 (t, J=8 Hz, 1H), 7.641-7.659 (d, J=7.2 Hz, 1H).13C ЯМР (CDCl3, 400 MHz) δ 64.379, 69.349, 82.456, 116.550, 125.329, 126.351, 129.486, 137.692, 144.660, 150.969, 161.219. MS (El) m/z 237.0 (M+l).
О-метилоксим (E)-(5,6-дигидро-1,4,2-диоксазин-3-илl)(2-гидроксифенил)метанона (13)
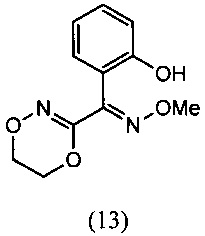
[0062] К суспензии O2-(2-гидроксиэтил)-O3-метилдиоксима (3E)-бензофуран-2,3-диона (12А) (100 г, 0.0423 моля) в воде (400 мл) добавляли NaOH (25.3 г, 0.0635 моля) в воде (200 мл) при температуре 60-70°С с последующим перемешиванием реакционной смеси при температуре 80-85°С в течение 1-2 ч. Протекание реакции контролировали методом HPLC, и после завершения реакции реакционную массу охлаждали до комнатной температуры и подкисляли, используя 50% уксусную кислоту (100 мл), до величины рН = от 5.0 до 5.5. Затем реакционную смесь перемешивали при комнатной температуре е течение 1 ч, твердые вещества отфильтровывали и промывали водой и затем сушили при 50-60°С с получением продукта, который отвечал желаемым характеристикам. Выход был равен 88-98%.
ИК (см-1, KBr) 3449.71 s, 2977.41 w, 2939.54 w, 1584.48 s, 1453.48 s, 1354.02 m, 1186.98 m, 1089.72 m, 1111.90 m, 1046.19 s, 998.09 m, 906.95 m, 809.57 w, 759.61 w.1ЯМР (CDCl3, 400 MHz) δ 4.098 (s, 3H), 4.194-4.215 (t, J=4Hz, 2H), 4.182-4.503 (t, J=5.2 Hz, 2H), 6.244 (s, 1H), 6.957-7.001 (m, 2H), 7.212-7.229 (d, J=7.8 Hz, 1H), 7.336-7.357 (m; 1H).13ЯМР (CDCl3, 400 MHz) δ 63.536, 64.100, 64.621, 117.718, 120.224, 130.352, 131.508, 148.369, 152.639, 153.733. MC (EI) m/z 237.0 (M+l); MC2 (EI) m/z 205.0, 178.1, 161.1, 145.1, 133.0, 119.0. HPLC (площадь поверхности, %): 99.29%. Температура плавления была равна 159-161°С.
О-метилоксим (Z)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (15)
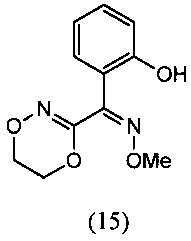
[0063] К суспензии O2-(2-гидроксиэтил)-O3-метилдиоксима (3Z)-бензофуран-2,3-диона (12В) (100 г, 0.0423 моль) в воде (400 мл) добавляли NaOH (25.3 г, 0.0635 моль) в воде (200 мл) при температуре 60-70°С с последующим перемешиванием реакционной смеси при температуре 80-85°С в течение 1-2 ч. Протекание реакции контролировали методом HPLC. После завершения реакции реакционную массу охлаждали до комнатной температуры и подкисляли до величины рН=5.0, используя 50% уксусную кислоту (100 мл). Затем реакционную смесь перемешивали при комнатной температуре в течение 1 ч, твердые вещества отфильтровывали и промывали водой и затем сушили при температуре 50-60°С с получением продукта, который отвечал желаемым характеристикам. Выход был равен 88-98%.
1Н ЯМР (CDCl3, 400 MHz) δ 3.960 (s, 3Н), 4.149-4.169 (t, J=4 Hz, 2H), 4.411-4.431 (t, J=4 Hz, 2H), 6.844-6.907 (m, 4H), 7.270-7.313 (m, 1H), 7.367-7.390 (dd, J=1.2 Hz, J=1.6 Hz, 1H). HPLC (площадь поверхности, %): 98.93%. Температура плавления была равна 110-114°С.
О-метилоксим (E)-(2-((6-хлор-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (14)
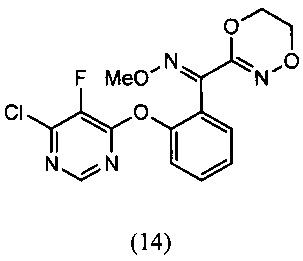
[0064] К раствору 4,6-дихлор-5-фторпиримидина (DCFP) (100 г, 0.564 моля) в толуоле (500 мл) добавляли О-метилоксим (Z)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (15) (77.8 г, 0.466 моля), K2СО3 (76 г, 0.55 моля), затем при комнатной температуре добавляли DMF (50 мл), реакционную смесь перемешивали при температуре 80-85°С в течение 1-2 ч. Протекание реакции контролировали методом HPLC. После завершения реакции реакционную массу промывали водой (500 мл) и 10% соляным раствором (250 мл) с получением продукта в толуольном слое, который отвечал желаемым характеристикам. Выход этого продукта был равен 88-98%.
ИК (см-1, KBr) 3075.01 w, 2980.39 w, 2940.78 s, 2824.82 w, 2410.77 w, 1559.81 s, 1445.46 s, 1415.78 m, 1304.99 m, 1180.73 s, 1110.89 w, 1092.02 w, 1053.57 s, 1001.30 m, 964.01 m, 908.97 m, 764.16 m.1Н ЯМР (DMSO d6, 400 MHz) δ 3.664(s, 3H), 4.034-4.054 (t, J=4 Hz, 2H), 4.343-4.363 (t, J=4.4 Hz, 2H), 7.358-7.381 (m, 2H), 7.439-7.459 (d, J=8 Hz 1H), 7.517-7.552 (m, 1H), 8.469 (s, 1H).13C ЯМР (DMSO d6, 400 MHz) δ 62.855, 64.411, 64.535, 123.116, 123.526, 126.182, 128.613, 129.31, 130.758, 131.083, 140.823, 143.494, 145.771, 146.173, 146.32, 148.682, 151.895, 152.429, 152.546, 157.671, 157.764. MS (EI) m/z 366.9 (M+l); MS2 (EI) m/z 334.9, 291.1, 275.3, 248.4, 223.0, 188.2. HPLC (площадь поверхности, %): 97.41%. Температура плавления была равна 83-85°С.
О-метилоксим ((Z)-(2-((6-хлор-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (16)
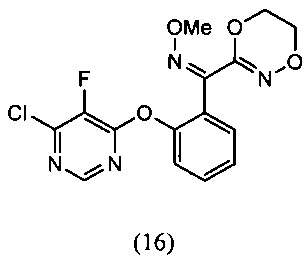
[0065] К раствору 4,6-дихлор-5-фторпиримидина (DCFP) (100 г, 0.564 моля) в толуоле (500 мл) добавляли О-метилоксим (E)-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (13) (77.8 г, 0.466 моля), K2СО3 (76 г, 0.55 моля) с последующим добавлением DMF (50 мл) при комнатной температуре. Реакционную смесь перемешивали при температуре 80-85°С в течение 1-2 ч. Протекание реакции контролировали методом HPLC. После завершения реакции реакционную массу промывали водой (500 мл) и 10% соляным раствором (250 мл) и получали в толуольном слое продукт, который отвечал желаемым характеристикам. Выход этого продукта был равен 88-98%.
О-метилоксим (E)-(2-((6-(2-хлорфенокси)-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона [флуоксастробин]
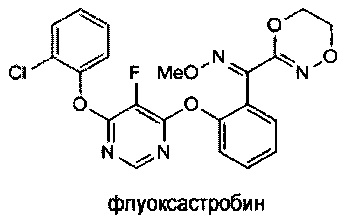
[0066] К раствору О-метилоксима (E)-(2-((6-хлор-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (14) (100 г, 0.564 моля) в толуоле при комнатной температуре добавляли 2-хлорфенол (54 г, 0.846 моля), K2СО3 (50 г, 0.733 моля) и DMF (50 мл). Реакционную смесь перемешивали при температуре 50-60°С в течение 3-4 ч. Протекание реакции контролировали методом HPLC. После завершения реакции добавляли водный раствор NaOH (10%) (200 мл) с последующим добавлением воды (300 мл). Перемешивали полученную смесь и отделяли толуольный слой. Этот толуольный слой промывали соляным раствором (рассолом) (600 мл). Затем толуольный слой полностью выделяли, получая сырой продукт. К этому сырому продукту добавляли метанол и нагревали до температуры 60°С до получения прозрачного раствора. Этот раствор перемешивали при комнатной температуре, получая осадок чистого продукта. Чистый флуоксастробин отфильтровывали и промывали метанолом. Этот продукт затем сушили с получением чистого флуоксастробина, который отвечал желаемым характеристикам. Выход продукта был равен 75-88%.
ИК (см-1, KBr) 3072.99 w, 2981.58 w, 2936.76 s, 2819.79 w, 2502.01 w, 1601.14 s, 1572.37 s, 1447.88 s, 1305.43 m, 1268.11 m, 1217.15 m, 1191.21 m, 1092.60 m, 1049.05 m, 1001.26 w, 910.25 w, 762.81 w.1H ЯМР (CDCl3, 400 MHz) δ 3.846 (s, 3H), 4.170-4.160 (t, J=4Hz, 2H), 4.464-4.484 (t, J=4 Hz, 2H), 7.261-7.295 (m, 2H), 7.322-7.409 (2, 4H), 8.069 (s, 1H).13C ЯМР (CDCl3, 400 MHz) δ 63.103, 64.153, 64.550, 122.659, 123.259, 123.823, 125.712, 127.150, 127.397, 128.094, 130.511, 130.679, 130.776, 131.473, 134.138, 146.004, 148.166, 148.943, 150.354, 150.478, 151.819, 157.395, 157.466, 157.783, 157.854. MS (EI) m/z 459.1 (M+l); MS2 (EI) m/z 427.1, 383.0, 366.9, 342.1, 306.2, 246.0, 231.1, 188.0. HPLC (площадь поверхности, %): 99.40%. Температура плавления была равна 108-112°С.
О-метилоксим (Z)-(2-((6-(2-хлорфенокси)-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона [(Z)-флуоксастробин]
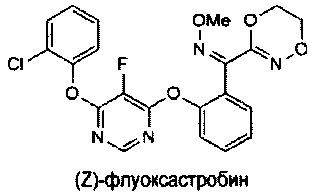
[0067] Изомеризация (Z)-флуоксастробина с получением (E)-флуоксастробина с использованием метансульфоновой кислоты.
К перемешиваемому раствору (Z)-флуоксастробина (0.3 г; 0.65 ммоля) в ацетонитриле (3 мл) по каплям при комнатной температуре добавляли метансульфоновую кислоту (0.04 мл, 0.65 ммоля). Реакционную смесь перемешивали при той же температуре в течение 2-3 ч. Протекание реакции контролировали методом тонкослойной хроматографии (ТЕС). К реакционной массе при комнатной температуре добавляли дихлорметан (5 мл) и DM воду (5 мл). После осуществления энергичного перемешивания слои разделяли. Водный слой подвергали обратной экстракции с применением дихлорметана (5 мл) и соединенные дихлорметановые слои промывали 10%-ным водным раствором бикарбоната натрия (20 мл) с последующей промывкой 10% соляным раствором (20 мл). Дихлорметан отгоняли при пониженном давлении при температуре 35-45°С с получением (E)-флуоксастробина в виде сырого продукта (0.25 г, 83% от теоретического выхода). Сырой флуоксастробин после очистки в этаноле обеспечил получение чистого (E)-флуоксастробина.
Степень чистоты выделенного продукта согласно HPLC (% площади поверхности): (Z-флуоксастробин: 1.02% и (Е)-флуоксастробин: 95.92%.
[0068] Изомеризация (Z)-флуоксастробина с получением (E)-флуоксастробина с использованием фосфорной кислоты.
К перемешиваемому раствору (Z)-флуоксастробина (0.25 г; 0.54 ммоля) в ацетонитриле (4 мл) при комнатной температуре по каплям добавляли фосфорную кислоту (0.03 г, 0.54 ммоля). При той же температуре реакционную смесь перемешивали в течение 2-3 ч. Протекание реакции контролировали методом тонкослойной хроматографии/HPLC. При комнатной температуре в реакционную смесь добавляли дихлорметан (5 мл) и DM воду (5 мл). После осуществления энергичного перемешивания слои разделяли. Водный слой подвергали обратной экстракции с применением дихлорметана (5 мл). Соединенные дихлорметановые слои промывали 10%-ным водным раствором бикарбоната натрия (20 мл) с последующей промывкой 10% соляным раствором (20 мл). Дихлорметан отгоняли при пониженном давлении при температуре 40-45°С и получали (E)-флуоксастробин (0.22 г, 88% от теоретического выхода). Протекание реакции контролировали методом HPLC (% площади поверхности): (Z)-флуоксастробин: 6.79% и (Е)-флуоксастробин: 88.84%. Степень чистоты выделенного продукта согласно HPLC (% площади поверхности): (Z-флуоксастробин: 6.94% и (Е)-флуоксастробин: 84.43%.
ИК (см-1, KBr) 3066.28 w, 2981.58 w, 2939.36 s, 2825.71 w, 2500.61 w, 1602.36 s, 1572.76 s, 1441.05 s, 1297.05 m, 1218.17 m, 1116.52 s, 1046.15 m 1000.86 w, 904.73 s, 764.71 w.1H ЯМР (CDCl3, 400 MHz) δ 3.983 (s, 3H), 4.163-4.218 (t, 2H), 4.432-4.440 (t, J=3.2 Hz, 2H), 7.217-7.352 (m, 4H), 7.371-7.390 (m, 2H), 7.483-7.516 (m, 2H), 7.702-7.722 (d, J=8 Hz, 1H), 8.016 (s, 1H). MC (EI) m/z 459.1 (M+l); MC2 (EI) m/z 427.0, 382.9, 366.7, 340.0, 305.8, 246.1, 188.0. HPLC (площадь поверхности, %): 99.11%. Температура плавления была равна 150-152°С.
[0069] Настоящее изобретение охватывает заявленные соединения со всеми изотопами атомов, содержащихся в этих соединениях. Изотопы включают атомы, имеющие тот же самый атомный номер, но разные массовые числа. Например, но без ограничения, изотопы водорода включают тритий и дейтерий и изотопы углерода включают11С,13С и14С.
[0070] Используемая в данной заявке терминология предназначена для описания только конкретных вариантов и не ограничивает настоящее изобретение. Используемые формы в единственном числе включают и множественное число, в том числе, и "по меньшей мере один," если только из контекста не следует иное. Союз "или" означает "и/или." Применяемый в данной заявке термин "и/или" включает любую и все комбинации одного или более перечисленных элементов. Следует также указать, что термины "содержит" и/или "содержащий" или "включает" и/или "включающий", используемые в данной заявке, означают наличие указанных признаков, областей, целых чисел, стадий, операций, элементов и/или компонентов, но не исключают присутствия или добавления одного или более других признаков, областей, целых чисел, стадий, операций, элементов и/или компонентов и/или групп.
[0071] Термины в единственном числе не означают ограничение количества, но скорее обозначают наличие по меньшей мере одного из указанных компонентов. Термин "или" означает "и/или". Открытый термин "содержащий" охватывает промежуточную переходную фразу "состоящий в сущности из" и ограничивающую фразу "состоящий из". Формула изобретения, содержащая одну из этих трех фраз или чередующуюся переходную фразу, такую как "содержащий" или "включающий" может быть изложена с любой другой переходной фразой, которая ясно исключена контекстом данной заявки или предшествующим уровнем техники. Указание интервалов просто служит для сокращения при отдельном указании каждой отдельной величины, находящейся в данном интервале, если не указано иное, и каждая такая отдельная величина включена в данное описание, как если бы она была указана в отдельности. Предельные значения всех интервалов входят в эти интервалы и могут комбинироваться независимо. Все способы, описанные в данной заявке, могут осуществляться в подходящем порядке, если не указано иное или если это ясно не противоречит контексту заявки. Описание любого и всех примеров или терминология этих примеров (например, "такой как") предназначено только для лучшей иллюстрации настоящего изобретения и не ограничивает объем этого изобретения, если не заявлено иное. Ни один из терминов (фраз) нельзя рассматривать как указывающий(-ую) любой незаявленный элемент в качестве существенного в практике осуществления данного изобретения, используемого в данной заявке. Если не указано иное, использованные в данной заявке технические и научные термины имеют то же значение, которое является общепринятым для специалиста в области техники, к которой относится настоящее изобретение.
[0072] Используемый в данной заявке термин "галоген" относится к фтору, хлору, брому или йоду.
[0073] Если не указано иное, использованные в данной заявке технические и научные термины имеют то же значение, которое является общепринятым для специалиста в области техники, к которой относится настоящее изобретение. Следует также отметить, что термины, значение которых определено в обычно используемых словарях (справочниках), следует интерпретировать как имеющие значение, которое согласуется с их значением в контексте релевантного уровня техники и данного изобретения и их не следует понимать в идеализированном или чересчур формальном смысле, если это четко не вытекает из данного описания.
[0074] Хотя настоящее изобретение было описано на примере одного из вариантов, специалисты в данной области должны понимать, что могут быть сделаны различные изменения, и различные элементы могут быть заменены элементами, являющимися эквивалентными без выхода за рамки настоящего изобретения. Кроме того, могут быть сделаны различные модификации для адаптации к конкретной ситуации или к конкретному веществу в рамках существа данного изобретения. Следовательно, настоящее изобретение не ограничено конкретным вариантом, описанным как лучшая форма осуществления данного изобретения, но данное изобретение будет включать все варианты, охваченные прилагаемой формулой изобретения.
Реферат
Изобретение относится к способу получения флуоксастробина, который включает:(i) взаимодействие 4,6-дигалоген-5-фторпиримидина (5) с О-метилоксимом ()-(5,6-дигидро-1,4,2-диоксазин-3-ил)(2-гидроксифенил)метанона (15) с образованием О-метилоксима ()-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (16):(ii) взаимодействие О-метилоксима ()-(2-((6-галоген-5-фторпиримидин-4-ил)окси)фенил)(5,6-дигидро-1,4,2-диоксазин-3-ил)метанона (16) с 2-хлорфенолом, с образованием ()-флуоксастробина:(iii) изомеризацию ()-флуоксастробина с образованием флуоксастробина:Технический результат: разработан новый эффективный, масштабируемый и экономически выгодный способ получения флуоксастробина, который позволяет получить продукт с высокими выходами. 2 н. и 5 з.п. ф-лы.
Формула


Документы, цитированные в отчёте о поиске
Способ борьбы с конкретными насекомыми-вредителями путем нанесения антраниламидных соединений

Комментарии