Стабильный полимеризуемый уф-поглощающий краситель для интраокулярной линзы - RU2635918C1
Код документа: RU2635918C1
Чертежи


Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к красителю для интраокулярных линз. В частности, настоящее изобретение относится к полимеризуемому красителю, обладающему способностью поглощать ультрафиолетовый свет (УФ) и свет в голубой области.
УРОВЕНЬ ТЕХНИКИ
Катаракта представляет собой заболевание, при котором в хрусталике глаза возникают помутнение и пигментация, посредством этого вызывая состояние, при котором все поле зрение затуманивается. Что касается способа ее лечения, хирургическую операцию проводят так, чтобы удалить замутненный хрусталик глаза и ввести интраокулярную линзу (IOL) и установить в капсулу хрусталика глаза. Большинство материалов для интраокулярной линзы, которые применяют для лечения, основаны на акриловом или силиконовом полимере. В частности, например, до настоящего времени применяли полиметилметакрилат (PMMA).
Однако собственный хрусталик глаза обладает таким свойством, что через него не проходит ультрафиолетовый свет. Напротив, ультрафиолетовый свет проходит через традиционный полимер для интраокулярной линзы. Следовательно, существует риск, что сетчатка может быть повреждена.
Кроме того, собственный хрусталик глаза является слегка желтоватым, за счет чего обладает таким свойством, что часть света в синей области задерживается и не проходит через него. Однако свет в синей области практически полностью проходит через традиционный прозрачный полимер для интраокулярной линзы. Следовательно, пациенты жалуются на слепящий свет во многих случаях после операции по введению интраокулярной линзы. Кроме того, также есть риск того, что может быть вызвано заболевание, возникающее в сетчатке, включая, например, дегенерацию желтого пятна, когда свет в синей области, который имеет короткую длину волны и большую энергию, достигает внутренней части глаза.
Ввиду приведенного выше, требуется материал для интраокулярной линзы, который обладает способностью поглощать ультрафиолетовый свет, и окрашивание, осуществляемое желтым красителем. В последние годы, с точки зрения безопасности, поглощающий УФ мономер и/или мономер, придающий желтый цвет, сополимеризуют во многих полимерах для интраокулярной линзы. До настоящего времени были разработаны различные мономерные соединения, как описано выше (патентные документы 1-4). Также разработаны мономерные соединения, которые являются сополимеризуемыми с другими мономерами для материала интраокулярной линзы, каждый из которых имеет хромофор, такой как азогруппа или подобная, и поглощающую УФ часть, такую как на основе бензофеноновой структуры или подобной, в одной молекуле (патентные документы 5 и 6).
ДОКУМЕНТЫ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
Патентные документы:
Патентный документ 1: JP2685980B2;
Патентный документ 2: JPH10-251537A;
Патентный документ 3: JPH07-028911B2;
Патентный документ 4: JP2604799B2;
Патентный документ 5: JPH02-232056A;
Патентный документ 6: JP2006-291006A.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Проблемы, решаемые настоящим изобретением:
Полимеризуемые поглощающие УФ-свет окрашивающие мономеры, описанные в патентных документах 5 и 6, создают следующую проблему. А именно, мономеры недостаточно стабильны при изменении значения pH, особенно не стабильны в щелочных условиях, и окрашивающий фрагмент (хромофор и поглощающая УФ-свет часть) легко удаляется из полимера. В частности, в случае материала для интраокулярной линзы, который имплантируют в глаз на длительный период времени, риск удаления окрашивающего фрагмента дополнительно увеличивается. Ввиду приведенного выше, задача настоящего изобретения заключается в получении полимеризуемого поглощающего УФ-свет окрашивающего мономера, который является стабильным даже в щелочных условиях.
Способы решения проблем:
Изобретатели настоящего изобретения провели тщательные исследования для того, чтобы решить проблему, как описано выше. Как результат, было обнаружено, что проблема стабильности при изменении значения pH вызвана присутствием любой сложноэфирной связи между окрашивающим фрагментом и полимеризуемой группой в мономере. Кроме того, было обнаружено, что полимеризуемое поглощающее УФ-свет окрашивающее мономерное соединение, представленное следующей общей формулой (1), может решить проблему, как описано выше.
А именно, настоящее изобретение является следующим.
Один аспект настоящего изобретения относится к соединению, представленному следующей общей формулой (1) (далее называемому также "окрашивающее соединение настоящего изобретения").

в общей формуле (1) R1 представляет собой атом водорода, гидроксигруппу, карбоксигруппу, алкильную группу, имеющую от 1 до 8 атомов углерода, алкоксигруппу, имеющую от 1 до 8 атомов углерода, группу сульфоновой кислоты или бензилоксигруппу, и предпочтительно атом водорода, метильную группу или этильную группу. R2 представляет собой атом водорода, гидроксигруппу или алкоксигруппу, имеющую от 1 до 4 атомов углерода, и предпочтительно атом водорода, гидроксигруппу, метоксигруппу или этоксигруппу. R3 представлен следующей формулой (2):

где R4 представляет собой атом водорода или метильную группу. Кроме того, R5 представляет собой одинарную связь или алкиленовую группу, имеющую от 1 до 4 атомов углерода, которая может иметь заместитель или заместители, предпочтительно алкиленовую группу, имеющую от 1 до 4 атомов углерода, которая не имеет заместителя.
Другой аспект настоящего изобретения относится к полимеру (далее называемому также "полимер настоящего изобретения"), содержащему окрашивающее соединение настоящего изобретения, описанное выше, и один или два или более видов других полимеризуемых мономеров, которые сополимеризуют друг с другом.
Еще один аспект настоящего изобретения относится к интраокулярной линзе (далее также называемой "интраокулярная линза настоящего изобретения"), содержащей полимер настоящего изобретения, описанный выше, который формуют.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложен полимеризуемый поглощающий УФ-свет окрашивающий мономер, который стабилен даже в щелочных условиях. Соединение, которое представлено общей формулой (1), имеет, в своей молекуле, бензофеноновую структуру, которая способна поглощать ультрафиолетовый свет, азобензольную структуру, которая способна поглощать свет в синей области, и полимеризуемую группу. Следовательно, соединение, представленное общей формулой (1), можно сополимеризовать с другим полимеризуемым мономером или полимеризуемыми мономерами, чтобы получить полимер. Полимер является пригодным в качестве материала для интраокулярной линзы.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 показывает график, иллюстрирующий спектры поглощения в УФ и видимой области полимерного листа, полученного в примере 13.
Фиг. 2 показывает график, иллюстрирующий спектры поглощения в УФ и видимой области полимерного листа, полученного в примере 14.
Фиг. 3 показывает график, иллюстрирующий спектры поглощения в УФ и видимой области фильтратов, полученных после щелочной обработки полимеров.
СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение будет объяснено подробно ниже.
<1> Окрашивающее соединение настоящего изобретения
Окрашивающее соединение настоящего изобретения представлено следующей общей формулой (1).

В общей формуле (1) R1 представляет собой атом водорода, гидроксигруппу, карбоксигруппу, алкильную группу, имеющую от 1 до 8 атомов углерода, алкоксигруппу, имеющую от 1 до 8 атомов углерода, группу сульфоновой кислоты или бензилоксигруппу. Среди них, предпочтительно применять атом водорода, метильную группу или этильную группу с точки зрения реакционной эффективности при получении. В общей формуле (1) R2 представляет собой атом водорода, гидроксигруппу или алкоксигруппу, имеющую от 1 до 4 атомов углерода. Среди них предпочтительно применять атом водорода, гидроксигруппу, метоксигруппу или этоксигруппу с точки зрения реакционной эффективности при получении, и особенно предпочтительно применять гидроксигруппу с точки зрения характеристики поглощения лучей света. Как показано в общей формуле (1), окрашивающее соединение настоящего изобретения имеет бензофеноновую структуру и азобензольную структуру, и они представляют собой окрашивающие фрагменты. В общей формуле (1) R3 представлен следующей формулой (2).

В общей формуле (2) R4 представляет собой атом водорода или метильную группу.
В общей формуле (2) R5 представляет собой одинарную связь или алкиленовую группу, имеющую от 1 до 4 атомов углерода, которая может иметь заместитель или заместители, предпочтительно алкиленовую группу, имеющую от 1 до 4 атомов углерода, которая не имеет заместитель. Алкиленовая группа, имеющая от 1 до 4 атомов углерода, заданно обозначает метиленовую группу, этиленовую группу, пропиленовую группу или бутиленовую группу. Алкиленовая группа, как описано выше, может иметь заместитель или заместители, или алкиленовая группа, как описано выше, может не иметь заместителя. Когда алкиленовая группа, как описано выше, имеет заместитель или заместители, можно привести в качестве примера такой вариант, что заместитель или заместители включают, например, алкильную группу, имеющую от 1 до 2 атомов углерода, галогеновую группу, карбоксильную группу, карбокси-C1-C2-алкильную группу, гидрокси группу, гидроксиалкильную группу, имеющую от 1 до 2 атомов углерода, аминогруппу и аминоалкильную группу, имеющую от 1 до 2 атомов углерода, соединенных с атомом углерода или атомами алкиленовой группы.
Как описано выше, заместитель R3 представляет собой группу, в которой спейсер соединен с (мет)акрилоиламиногруппой, которая представляет собой полимеризуемую группу, и заместитель R3 представляет собой фрагмент, который участвует в сополимеризации, в окрашивающем соединении настоящего изобретения. Благодаря структуре, представленной общей формулой (2), окрашивающее соединение настоящего изобретения обладает таким свойством, что реакционная эффективность является высокой относительно других полимеризуемых мономеров.
Термин "(мет)акрилоил" обозначает "акрилоил" или "метакрилоил".
В общей формуле (1) предпочтительно, чтобы заместитель R3 был соединен с 3 положением или 4 положением азофенильной группы.
Окрашивающее соединение настоящего изобретения, представленное общей формулой (1), особым образом не ограничено, например, можно предпочтительно привести примеры соединений, имеющих следующую структуру.





Окрашивающее соединение настоящего изобретения содержит, в одной молекуле, бензофеноновую структуру (поглощающая УФ-свет часть), которая обладает способностью поглощать ультрафиолетовый свет, и азобензольную структуру (хромофор), которая обладает способностью поглощать свет в синей области. Благодаря присутствию его окрашивающей группы, окрашивающее соединение настоящего изобретения обладает способностью (храктеристика поглощения лучей света) подавлять пропускание лучей света в УФ области (длина волны: не более чем 380 нм) и в синей области (длина волны: от 380 до 500 нм). Окрашивающее соединение настоящего изобретения обладает превосходной характеристикой поглощения лучей света по сравнению с любым традиционным окрашивающим соединением (например, 2,4-дигидрокси-5-(4-(2-(N-2-метакрилоилоксиэтил)карбамоилокси)этилфенилазо)бензофеноном (BMAC), описанным в патентном документе 6. В особенности, когда измеряют спектры поглощения в УФ и видимой области, резкий рост кривой на графике возникает вблизи 420-500 нм, и соединение обладает превосходной способностью подавлять пропускание лучей света в УФ/синей области.
Кроме того, что касается окрашивающего соединения настоящего изобретения, часть, поглощающая УФ-свет, и хромофор (вместе также называемые "окрашивающий фрагмент") присутствуют в одной молекуле. Следовательно, почти не возникает неудобства, при котором хромофор повреждается ультрафиолетовым светом и краситель подвергается обесцвечиванию со временем.
Кроме того, полимеризуемая группа и окрашивающий фрагмент соединены амидной связью в окрашивающем соединении настоящего изобретения. Связь, как описано выше, является стабильной даже в щелочных условиях, и поэтому окрашивающий фрагмент не удаляется из полимера настоящего изобретения, как описано впоследствии. Как результат, достигается стабильность в щелочных условиях, которой обычно не хватает любому традиционному окрашивающему соединению, содержащему сложноэфирную связь, и любому сополимеру в данном применением.
Способ получения окрашивающего соединения настоящего изобретения особым образом не ограничен. Однако, например, окрашивающее соединение настоящего изобретения можно получить согласно способам синтеза 1-3, описанным ниже.
Способ синтеза 1
Данный способ включает стадию диазотирования аминоарильного соединения для получения соли диазония, стадию диазосочетания полученной соли диазония и бензофенонового соединения для получения диазосоединения, и стадию амидирования, заключающуюся в реакции полученного в результате диазосоединения, например, с соединением акриловой кислоты или с соединением метакриловой кислоты, посредством реакции амидирования для ввода полимеризуемой группы.
Краткое содержание способа синтеза 1 показано на следующей схеме реакций. В формуле R представляет собой блокирующую группу, R' представляет собой гидроксигруппу или атом галогена, и R1-R5 представляют собой одинаковые или эквивалентные заместители, как заместители, описанные выше.

Способ ситеза 2
Данный способ включает стадию амидирования аминоарильного соединения, например, соединением акриловой кислоты или соединением метакриловой кислоты, посредством реакции амидирования для ввода полимеризуемой группы, стадию диазотирования полученного полимеризуемого аминоарильного соединения для получения соли диазония, и стадию диазосочетания, заключающуюся в диазосочетании полученной в результате соли диазония с бензофеноновым соединением, для получения окрашивающего соединения настоящего изобретения.
Краткое содержание способа синтеза 2 показано на следующей схеме реакций. В формуле R представляет собой блокирующую группу, R' представляет собой гидроксигруппу или атом галогена, и R1-R5 представляют собой одинаковые или эквивалентные заместители, как заместители, описанные выше.
На стадии амидирования введения полимеризуемой группы в аминоарильное соединение, предпочтительно, чтобы аминогруппа в ароматической группе блокировалась блокирующей группой, и блокирующую группу удаляют, например, посредством кислотной обработки перед стадией диазотирования.

Способ синтеза 3
Данный способ включает стадию амидирования, заключающейся в применении нитроарильного соединения в качестве исходного соединения вместо аминоарильного соединения и реакции нитроарильного соеднинения, например, с соединением акриловой кислоты или с соединением метакриловой кислоты, посредством реакции амидирования для ввода полимеризуемой группы, стадию восстановления нитрогруппы полученного полимеризуемого нитроарильного соединения до аминогруппы, стадию диазотирования полученного полимеризуемого аминоарильного соединения для получения соли диазония, и стадию диазосочетания полученной в результате соли диазония с бензофеноновым соединением для получения окрашивающего соединения настоящего изобретения.
Краткое содержание способа синтеза 3 показано на следующей схеме реакций. В формуле R' представляет собой гидрокси группу или атом галогена, и R1-R5 представляют собой одинаковые или эквивалентные заместители, как заместители, описанные выше.

Альтернативно, окрашивающее соединение настоящего изобретения можно также получить, например, согласно способу синтеза, включающему стадию блокирования, заключающуюся в вводе блокирующей группы в алифатический амин аминоарильного соединения, стадию диазотирования аминоарильного соединения, в котором алифатический амин блокирован для получения соли диазония, стадию диазосочетания полученной в результате соли диазония с бензофеноновым соединением для получения диазосоединения, стадию деблокирования, заключающуюся в удалении блокирующей группы алифатического амина, например, посредством кислотной обработки, и стадию амидирования, заключающуюся в реакции полученного диазосоединения, например, с соединением акриловой кислоты или с соединением метакриловой кислоты, посредством реакции амидирования для ввода полимеризуемой группы.
Стадию диазотирования, которая включена в соответствующие способы синтеза, описанные выше, можно осуществлять согласно любому известному способу.
Можно применять, например, в качестве диазотирующего агента, нитрит натрия или водный раствор нитрита натрия, нитрит калия или водный раствор нитрита калия, изоамилнитрит и/или нитрозилсульфат (раствор серной кислоты). Применяемое количество диазотирующего агента особым образом не ограничено. Однако применяемое количество диазотирующего агента предпочтительно составляет 1,00-1,20 молей и более предпочтительно 1,02-1,10 молей на 1 моль аминоарильного соединения, содержащего полимеризуемую группу. Температура реакции на стадии диазотирования находится в диапазоне от -78°C до 50°C. Температура реакции предпочтительно находится в диапазоне от -20°C до 20°C и более предпочтительно в диапазоне от -20°C до 10°C. Предпочтительно, чтобы стадию диазотирования проводили в нейтральных или кислых условиях. Можно подходящим образом добавлять кислоту, такую как хлористоводородная кислота или подобная, к растворителю реакции.
Предпочтительно, чтобы стадию диазосочетания, которая включена в способы синтеза 2 и 3, проводили в слабо основных условиях, применяя слабое основание в качестве катализатора, по следующей причине. А именно, в случае сильного основания, включая, например, гидроксид натрия и гидроксид калия, обычно применяемые в реакции диазосочетания, амидная структура, которая находится в соли диазония полимеризуемого аминоарильного соединения, разлагается или удаляется, и выход целевого соединения снижается. Напротив, когда применяют слабое основание, то разложение заметно подавляется, и можно обеспечить достаточную реакционноспособность. Как результат, можно существенно повысить выход реакции. Дополнительно, известно, что винильная группа, которая находится в соли диазония, также полимеризуется в присутствии сильного основания, как описано выше, что вызывает заметное снижение выхода. Однако когда применяют слабое основание вместо сильного основания, также можно подавить данный недостаток.
Слабое основание, которое является пригодным в данном способе, особым образом не ограничено при условии, что слабое основание представляет собой соль, состоящую из сильной щелочи и слабой кислоты, где ее водный раствор не гидролизует амидную связь при 1 атм и 0°C-25°C, не вызывая реакции полимеризации винильной группы. Предпочтительно применять слабое основание, включая, например, карбонат натрия, гидрокарбонат натрия, карбонат калия, ацетат натрия и ацетат калия. Применяемое количество слабого основания предпочтительно составляет 4,0-10,0 молей и более предпочтительно 6,0-8,0 молей на 1 моль диазониевой соли, при переводе в натриевый эквивалент. Кроме того, температура реакции на стадии диазосочетания находится в диапазоне от -10°C до 10°C и более предпочтительно в диапазоне от -5°C до 5°C.
Можно применять, в качестве растворителя в реакции на стадии диазосочетания, органические растворители (спиртовой растворитель, такой как метанол, этанол, изопропиловый спирт и подобные, амидный растворитель, такой как N,N-диметилацетамид, N,N-диметилформамид, 1-метил-2-пирролидон и подобные, сульфоновый растворитель, такой как сульфоран и подобные, сульфоксидный растворитель, такой как диметилсульфоксид и подобные, уреидный растворитель, такой как тетраметилмочевина и подобный, галогенированный растворитель, такой как дихлорметан, хлороформ, 1,2-дихлорэтан и подобные, сложноэфирный растворитель, такой как этилацетат, бутилацетат и подобные, эфирный растворитель, такой как диэтиловый эфир, тетрагидрофуран и подобные, и пиридиновый растворитель, такой как пиридин, α-пиколин, 2,6-лутидин и подобные) отдельно или в виде смеси, состоящей из множества типов, а также в виде смеси, состоящей из органического растворителя и воды, и в виде системы, состоящей отдельно из воды. Однако среди них, предпочтительно применять спиртовой растворитель. Кроме того, также предпочтительно применять спиртовой растворитель при смешении его с водой. Кроме того, также допустимо добавлять и применять амидный растворитель, сложноэфирный растворитель и/или эфирный растворитель в добавление к спиртовому растворителю и воде, в зависимости от реакции.
Аминоарильное соединение, на которое ссылаются в настоящем изобретении, представлено (i) или (v) в схеме, описанной выше, и нитроарильное соединение представлено (ix) в схеме реакций. Кроме того, полимеризуемое аминоарильное соединение представлено (vi) или (vii) в схеме реакций, описанной выше, и полимеризуемое нитроарильное соединение представлено (x) в схеме реакций.
Полимеризуемое аминоарильное соединение или полимеризуемое нитроарильное соединение, описанные выше, можно получить, например, реакцией амидирования замещенного аминогруппой ароматического амина или замещенного нитрогруппой ароматического амина и (мет)акриловой кислоты, реакцией амидирования замещенного аминогруппой ароматического алкиламина или замещенного нитрогруппой ароматического алкиламина и (мет)акриловой кислоты, реакцией амидирования замещенного аминогруппой ароматического амина или замещенного нитрогруппой ароматического амина и хлорангидрида (мет)акриловой кислоты или реакцией амидирования замещенного аминогруппой ароматического алкиламина или замещенного нитрогруппой ароматического алкиламина и хлорангидрида (мет)акриловой кислоты. Что касается замещенного аминогруппой ароматического соединения, можно применять соединения, в которых амидная группа замещена блокирующей группой, включая, например, трет-бутоксикарбонильную группу, бензилоксикарбонильную группу, 9-флуоренилметилоксикарбонильную группу, 2,2,2-трихлорэтоксикарбонильную группу, аллилоксикарбонильную группу, п-толуолсульфонильную группу и 2-нитробензолсульфонильную группу.
Примеры полимеризуемого аминоарильного соединения, описанного выше, включают, например, N-(4-аминофенил)(мет)акриламид, N-[(4-аминофенил)метил](мет)акриламид, N-[2-(4-аминофенил)этил](мет)акриламид, N-[3-(4-аминофенил)пропил](мет)акриламид, N-[4-(4-аминофенил)бутил](мет)акриламид, N-[(3-аминофенил)метил](мет)акриламид, N-[2-(3-аминофенил)этил](мет)акриламид, N-[3-(3-аминофенил)пропил](мет)акриламид и N-[4-(3-аминофенил)бутил](мет)акриламид.
Дополнительно, примеры полимеризуемого нитроарильного соединения, описанного выше, включают, например, N-(4-нитрофенил)(мет)акриламид, N-[(4-нитрофенил)метил](мет)акриламид, N-[2-(4-нитрофенил)этил](мет)акриламид, N-[3-(4-нитрофенил)пропил](мет)акриламид, N-[4-(4-нитрофенил)бутил](мет)акриламид, N-[(3-нитрофенил)метил](мет)акриламид, N-[2-(3-нитрофенил)этил](мет)акриламид, N-[3-(3-нитрофенил)пропил](мет)акриламид и N-[4-(3-нитрофенил)бутил](мет)акриламид.
В качестве способа получения окрашивающего соединения настоящего изобретения, предпочтительно применять способ синтеза, в котором стадию амидирования проводят перед стадией диазосочетания, как в способе синтеза 2 или способе синтеза 3, по следующей причине. А именно, на стадии диазотирования способа синтеза 1, описанного выше, опасаются, что может образовываться любой побочный продукт, обладающий высокой реакционноспособностью, диазотированием ароматического амина. Напротив, согласно способу синтеза 2 или способу синтеза 3, описанным выше, стадию диазотирования проводят после предварительного введенния полимеризуемой группы, посредством, например, реакции амидирования. Следовательно, можно избежать образования побочного продукта, как описано выше. Как результат, согласно способу синтеза 2 или способу синтеза 3, реакционная эффективность является удовлетворительной, и можно получить окрашивающее соединение настоящего изобретения с высоким выходом.
Кроме того, нитроарильное соединение, которое применяют в качестве исходного соединения в способе синтеза 3, является более дешевым, чем аминоарильное соединение. Кроме того, в реакции амидирования, побочный продукт, в который введены две молекулы полимеризуемых групп относительно аминогруппы, обычно образуется при введении полимеризуемой группы. Однако, побочный продукт, который образуется при амидировании нитроарильного соединения, удаляется более легко, чем побочный продукт, который образуется, например, при амидировании аминоарильного соединения. Следовательно, принимая во внимание экономичность и также простоту рассматриваемой операции, способ синтеза 3, в котором нитроарильное соединение применяют в качестве исходного соединения, является особенно предпочтительным в качестве способа получения окрашивающего соединения настоящего изобретения. Окрашивающее соединение настоящего изобретения можно получить в промышленном масштабе, получая его согласно способу синтеза 2 или способу синтеза 3. Окрашивающее соединение настоящего изобретения является пригодным в качестве подходящего красителя или полимеризуемого поглощающего УФ-свет окрашивающего мономера.
<2> Полимер настоящего изобретения
Окрашивающее соединение настоящего изобретения можно превратить в полимер сополимеризацией окрашивающего соединения настоящего изобретения с одним видом или двумя или более видами другого сополимеризуемого мономера или мономеров. В окрашивающем соединении настоящего изобретения, хромофор и полимеризуемая группа стерически отделены друг от друга и, следовательно, полимеризация не ингибируется. Следовательно, окрашивающее соединение настоящего изобретения можно применять в качестве сополимеризуемого мономера, который обладает удовлетворительной реакционноспособностью относительно других сополимеризуемых мономеров. Другие сополимеризуемые мономеры, как описано выше, особым образом не ограничены, при условии, что мономеры применяют обыкновенным способом. Однако, например, примеры включают следующие мономеры.
Алкил(мет)акрилаты с нормальной, разветвленной цепью или циклические алкил(мет)акрилаты включают, например, метил(мет)акрилат, этил(мет)акрилат, пропил(мет)акрилат, изопропил(мет)акрилат, бутил(мет)акрилат, трет-бутил (мет)акрилат, изобутил (мет)акрилат, пентил(мет)акрилат, трет-пентил(мет)акрилат, гексил(мет)акрилат, гептил(мет)акрилат, октил(мет)акрилат, 2-этилгексил(мет)акрилат, нонил(мет)акрилат, децил(мет)акрилат, додецил(мет)акрилат, стеарил(мет)акрилат, циклопентил(мет)акрилат, циклогексил(мет)акрилат и фенокси(мет)акрилат;
кремнийсодержащие (мет)акрилаты, включая, например, пентаметилдисилоксанилметил(мет)акрилат, пентаметилдисилоксанилпропил(мет)акрилат, метилбис(триметилсилокси)силилпропил(мет)акрилат, трис(триметилсилокси)силилпропил(мет)акрилат, моно(метилбис(триметилсилокси)силокси)бис(триметилсилокси)силилпропил(мет)акрилат, трис(метилбис(триметилсилокси)силокси)силилпропил(мет)акрилат, метилбис(триметилсилокси)силилпропилглицерил(мет)акрилат, трис(триметилсилокси)силилпропилглицерил(мет)акрилат, моно(метилбис(триметилсилокси)силокси)бис(триметилсилокси)силилпропилглицерил(мет)акрилат, триметилсилилэтилтетраметилдисилоксанилпропилглицерил(мет)
акрилат, триметилсилилметил(мет)акрилат, триметилсилилпропил(мет)акрилат, триметилсилилпропилглицерил(мет)акрилат, пентаметилдисилоксанилпропилглицерил(мет)акрилат, метилбис(триметилсилокси)силилэтилтетраметилдисилоксанилметил(мет)акрилат, тетраметилтриизопропилциклотетрасилоксанилпропил(мет)акрилат и тетраметилтриизопропилциклотетрасилоксибис(триметил-силокси)силилпропил(мет)акрилат;
фторсодержащие (мет)акрилаты, включая, например, трифторэтил(мет)акрилат, тетрафторпропил(мет)акрилат, пентафторпропил(мет)акрилат, гексафторизопропил(мет)акрилат, тетрафтор-трет-пентил(мет)акрилат, гексафторбутил(мет)акрилат, гексафтор-трет-гексил(мет)акрилат, октафторпентил(мет)акрилат, 2,3,4,5,5,5-гексафтор-2,4-бис(трифторметил)пентил(мет)акрилат, додекафторгептил(мет)акрилат, 2-гидроксиоктафтор-6-трифторметилгептил(мет)акрилат, 2-гидроксидодекафтор-8-трифторметилнонил(мет)акрилат и 2-гидроксигексадекафтор-10-трифторметилундецил(мет)акрилат;
стирольные производные, включая, например, стирол, пентафторстирол, метилстирол, триметилстирол, трифторметилстирол, (пентаметил-3,3-бис(триметилсилокси)трисилоксанил)стирол, (гексаметил-3-триметилсилокситрисилоксианил)стирол и диметиламиностирол;
(мет)акрилаты, содержащие гидроксигруппу, включая, например, гидроксиэтил(мет)акрилат, гидроксипропил(мет)акрилат, гидроксибутил(мет)акрилат, дигидроксипропил(мет)акрилат, дигидроксидибутил(мет)акрилат, диэтиленгликольмоно(мет)акрилат, триэтиленгликольмоно(мет)акрилат и дипропиленгликольмоно(мет)акрилат;
(мет)акриловую кислоту;
винильные лактамы, включая, например, N-винилпирролидон, α-метилен-N-метилпирролидон, N-винилкапролактам и N-(мет)акрилоилпирролидон;
(мет)акриламиды, включая, например, (мет)акриламид, N-метил(мет)акриламид, N-этил(мет)акриламид, N-гидроксиэтил(мет)акриламид, N,N-диметил(мет)акриламид, N,N-диэтил(мет)акриламид и N-этил-N-аминоэтил(мет)акриламид;
аминоалкил(мет)акрилаты, включая, например, аминоэтил(мет)акрилат, N-метиламиноэтил(мет)акрилат и N,N-диметиламиноэтил(мет)акрилат;
(мет)акрилаты, содержащие алкоксигруппу, включая, например, метоксиэтил(мет)акрилат, этоксиэтил(мет)акрилат и метоксидиэтиленгликоль(мет)акрилат;
(мет)акрилаты, содержащие ароматическое кольцо, включая, например, бензил(мет)акрилат;
алкиловые эфиры, которые могут быть замещены алкильной группой, фторсодержащей алкильной группой или силоксанилалкильной группой, итаконовой кислоты, кротоновой кислоты, малеиновой кислоты, фумаровой кислоты и подобных;
глицидил(мет)акрилат;
тетрагидрофурфурил(мет)акрилат;
4-винилпиридин;
гетероциклические N-винильные мономеры, включая, например, винилимидазол, N-винилпиперидон, N-винилпиперидин и N-винилсукцинимид;
N-(мет)акрилоилпиперидин; и
N-(мет)акрилоилморфолин.
Термин "(мет)акрилат" обозначает "акрилат" или "метакрилат", и данное значение сохраняется тем же способом относительно производных (мет)акриловой кислоты.
Один вид или два или более видов сополимеризуемых мономеров, описанных выше, можно также выбирать и полимеризовать, получая макромономер, который можно применять в качестве одного из сополимеризуемых мономеров для получения полимера.
Полимер настоящего изобретения можно получить смешением окрашивающего соединения настоящего изобретения и одного вида или двух или более видов других сополимеризуемых мономеров в произвольных количествах, смешением их однородно или гомогенно, и затем их сополимеризацией. На соотношение, при котором окрашивающее соединение настоящего изобретения смешивают при сополимеризации полимера настоящего изобретения, влияет применение полимера, например, толщина в случае интраокулярной линзы. Однако соотношение предпочтительно составляет 0,001-5 масс. частей, более предпочтительно 0,005-2 масс. частей, и еще более предпочтительно 0,01-0,06 масс. частей на 100 масс. частей смеси всех сополимеризуемых мономеров. Если соотношение является меньшим чем 0,001 масс. частей, опасаются, что формирование цвета полимера может ухудшаться. С другой стороны, если соотношение превышает 5 масс. частей, опасаются, что прозрачность может снижаться из-за избыточной плотности окрашивания полимера, физические свойства (например, прочность) полимера могут ухудшаться, и/или окрашивающее соединение настоящего изобретения может легко вымываться из полимера.
Полимер настоящего изобретения можно синтезировать согласно любому способу, обычно осуществляемому в соответствующей области техники. Например, полимеризацию можно проводить однородным или гомогенным смешением окрашивающего соединения настоящего изобретения с одним видом или двумя или более видами других сополимеризуемых мономеров, добавлением инициатора полимеризации, при необходимости, и проведением постепенного нагревания в диапазоне температур от комнатной температуры до приблизительно 130°C, или подвергая воздействию электромагнитных волн, включая, например, микроволны, ультрафиолетовый свет и радиацию (гамма-излучение). Что касается полимеризации, можно приспособить различные способы, широко и обычно применяемые специалистами в данной области техники, включая, например, радикальную полимеризацию, полимеризацию в массе и полимеризацию в растворе (растворная полимеризация). При проведении полимеризации с нагреванием, также допустимо, чтобы температура повышалась постепенно.
Примеры инициатора полимеризации, описанного выше, включают, например, радикальные инициаторы полимеризации, включая, например, азобисизобутиронитрил, азобисдиметилвалеронитрил, 2,2'-азобис(2,4-диметилвалеронитрил), бензоилпероксид, трет-бутилгидропероксид, гидропероксид кумола и бензоилпероксид. Можно применять один вид или два или более видов из них. Предпочтительно, чтобы инициатор полимеризации применяли в количестве в диапазоне приблизительно 0,01-1 масс. частей на 100 масс. частей смеси всех сополимеризуемых мономеров. Когда полимеризацию проводят, применяя лучи света (излучение) или подобные, предпочтительно дополнительно добавлять фотоинициатор (фотоинициатор полимеризации) и сенсибилизатор.
При синтезировании полимера настоящего изобретения также можно применять в комбинации известный полимеризуемый поглотитель ультрафиолетовых лучей (поглотитель или абсорбент ультрафиолетовых лучей) (который в основном поглощает часть ультрафиолетового света) и полимеризуемый краситель (не обладающий способностью поглощать УФ-свет, в основном поглощает свет в синей области), а также полимеризуемый поглощающий УФ-свет краситель. Когда полимеризуемый поглотитель ультрафиолетовых лучей, полимеризуемый краситель и полимеризуемый поглощающий УФ-свет краситель, как описано выше, применяют в комбинации, посредством этого можно получить возможность точно регулировать баланс между способностью поглощать УФ-свет и способностью поглощать свет в синей области полимера. В частности, когда полимер настоящего изобретения применяют в качестве материала для интраокулярной линзы, как описано далее, применение в комбинации, как описано выше, является пригодным для того, чтобы регулировать цветовой тон интраокулярной линзы и/или в достаточной степени придавать способность поглощать УФ-свет. Регулирование осуществляют так, чтобы добавляемое количество являлось предпочтительно не большим чем 0,01 масс. частей и более предпочтительно не большим чем 0,05 масс. частей на 100 масс. частей смеси всех сополимеризуемых мономеров. Кроме того, для того чтобы обеспечить достаточную скорость полимеризации и достаточную степень полимеризации, регулирование осуществляют так, чтобы добавляемое количество являлось предпочтительно не большим чем 5 масс. частей и более предпочтительно не большим чем 3 масс. части на 100 масс. частей смеси всех сополимеризуемых мономеров.
Что касается полимеризуемого поглотителя ультрафиолетовых лучей, который можно применять в комбинации для целей, как описано выше, можно применять, например, бензофеноновые полимеризуемые поглотители ультрафиолетовых лучей, описанные в открытой японской патентной заявке No. 2003-253248, и бензотриазольные полимеризуемые поглотители ультрафиолетовых лучей, описанные в японском патентном документе No. 2685980. Заданные примеры включают, например, бензофеноновые полимеризуемые поглотители ультрафиолетовых лучей, включая, например, 2-гидрокси-4-(мет)акрилоилоксибензофенон, 2-гидрокси-4-(мет)акрилоилокси-5-трет-бутилбензофенон, 2-гидрокси-4-(мет)акрилоилокси-2',4'-дихлорбензофенон и 2-гидрокси-4-(2'-гидрокси-3'-(мет)акрилоилоксипропокси)бензофенон; бензотриазольные полимеризуемые поглотители ультрафиолетовых лучей, включая, например, 2-(2'-гидрокси-5'-(мет)акрилоилоксиэтилфенил)-2H-бензотриазол, 2-(2'-гидрокси-5'-(мет)акрилоилоксиэтилфенил)-5-хлор-2H-бензотриазол, 2-(2'-гидрокси-5'-(мет)акрилоилоксипропилфенил)-2H-бензотриазол, 2-(2'-гидрокси-5'-(мет)акрилоилоксипропил-3'-трет-бутилфенил)-5-хлор-2H-бензотриазол и 2-(2'-гидрокси-5'-(2"-метакрилоилоксиэтокси)-3'-трет-бутилфенил)-5-метил-2H-бензотриазол; полимеризуемые поглотители ультрафиолетовых лучей, являющиеся производными салициловой кислоты, включая, например, фениловый эфир 2-гидрокси-4-метакрилоилоксиметилбензойной кислоты; и метиловый эфир 2-циано-3-фенил-3-(3'-(мет)акрилоилоксифенил)пропеновой кислоты. Данные соединения можно применять отдельно, или два или более видов данных соединений можно применять в смеси.
Что касается полимеризуемого красителя, который можно применять в комбинации для цели, как описано выше, можно применять, например, азо, антрахиноновые, нитро и фталоцианиновые полимеризуемые красители, описанные в открытой японской патентной заявке No. 10-251537. Данные красители можно применять отдельно, или два или более видов данных красителей можно применять в смеси.
Заданные примеры полимеризуемого азокрасителя включают, например, 1-фенилазо-4-(мет)акрилоилоксинафталин, 1-фенилазо-2-гидрокси-3-(мет)акрилоилоксинафталин, 1-нафтилазо-2-гидрокси-3-(мет)акрилоилоксинафталин, 1-(α-антрилазо-2-гидрокси-3-(мет)акрилоилоксинафталин, 1-((4'-(фенилазо)фенил)азо)-2-гидрокси-3-(мет)акрилоилоксинафталин, 1-(2',4'-ксилилазо)-2-(мет)акрилоилоксинафталин и 1-(o-толилазо)-2-(мет)акрилоилоксинафталин, 2-(м-(мет)акрилоиламиданилино)-4,6-бис(1'-(o-толилазо)-2'-нафтиламино)-1,3,5-триазин, 2-(м-виниланилино)-4-(4'-нитрофенилазо)анилино)-6-хлор-1,3,5-триазин, 2-(1'-(o-толилазо)-2'-нафтилокси)-4-(м-виниланилино)-6-хлор-1,3,5-триазин, 2-(п-виниланилино)-4-(1'-(o-толилазо)-2'-нафтиламино)-6-хлор-1,3,5-триазин, моноамид N-(1'-(o-толилазо)-2'-нафтил)-3-винилфталевой кислоты, моноамид N-(1'-(o-толилазо)-2'-нафтил)-6-винилфталевой кислоты, (4'-(п-сульфонилазо)-1'-нафтиловый) моноэфир 3-винилфталевой кислоты и (4'-(п-сульфонилазо)-1'-нафтиловый) моноэфир 6-винилфталевой кислоты, 3-(мет)акрилоиламид-4-фенилазофенол, 3-(мет)акрилоиламид-4-(8'-гидрокси-3',6'-дисульфо-1'-нафтилазо)фенол, 3-(мет)акрилоиламид-4-(1'-фенилазо-2'-нафтилазо)фенол, 3-(мет)акрилоиламид-4-(п-толилазо)фенол, 2-амино-4-(м-(2'-гидрокси-1'-нафтилазо)анилино)-6-изопропенил-1,3,5-триазин, 2-амино-4-(N-метил-п-(2'-гидрокси-1'-нафтилазо)анилино)-6-изопропенил-1,3,5-триазин, 2-амино-4-(м-(4'-гидрокси-1'-фенилазо)анилино)-6-изопропенил-1,3,5-триазин, 2-амино-4-(N-метил-п-(4'-гидроксифенилазо)анилино)-6-изопропенил-1,3,5-триазин, 2-амино-4-(м-(3'-метил-1'-фенил-5'-гидрокси-4'-пиразолилазо)анилино)-6-изопропенил-1,3,5-триазин, 2-амино-4-(N-метил-п-(3'-метил-1'-фенил-5'-гидрокси-4'-пиразолилазо)анилино)-6-изопропенил-1,3,5-триазин, 2-амино-4-(п-фенилазоанилино)-6-изопропенил-1,3,5-триазин и 4-фенилазо-7-(мет)акрилоиламид-1-нафтол.
Заданные примеры полимеризуемого антрахинонового красителя включают, например, 1,5-бис((мет)акрилоиламино)-9,10-антрахинон, 1-(4'-винилбензоиламид)-9,10-антрахинон, 4-амино-1-(4'-винилбензоиламид)-9,10-антрахинон, 5-амино-1-(4'-винилбензоиламид)-9,10-антрахинон, 8-амино-1-(4'-винилбензоиламид)-9,10-антрахинон, 4-нитро-1-(4'-винилбензоиламид)-9,10-антрахинон, 4-гидрокси-1-(4'-винилбензоиламид)-9,10-антрахинон, 1-(3'-винилбензоиламид)-9,10-антрахинон, 1-(2'-винилбензоиламид)-9,10-антрахинон, 1-(4'-изопропенилбензоиламид)-9,10-антрахинон, 1-(3'-изопропенилбензоиламид)-9,10-антрахинон, 1-(2'-изопропенилбензоиламид)-9,10-антрахинон, 1,4-бис(4'-винилбензоиламид)-9,10-антрахинон, 1,4-бис(4'-изопропенилбензоиламид)-9,10-антрахинон, 1,5'-бис(4'-винилбензоиламид)-9,10-антрахинон, 1,5-бис(4'-изопропенилбензоиламид)-9,10-антрахинон, 1-метиламино-4-(3'-винилбензоиламид)-9,10-антрахинон, 1-метиламино-4-(4'-винилбензоилоксиэтиламино)-9,10-антрахинон, 1-амино-4-(3'-винилфениламино)-9,10-антрахинон-2-сульфокислоту, 1-амино-4-(4'-винилфениламино)-9,10-антрахинон-2-сульфокислоту, 1-амино-4-(2'-винилбензиламино)-9,10-антрахинон-2-сульфокислоту, 1-амино-4-(3'-(мет)акрилоиламинофениламино)-9,10-антрахинон-2-сульфокислоту, 1-амино-4-(3'-(мет)акрилоиламинобензиламино)-9,10-антрахинон-2-сульфокислоту, 1-(β-этоксикарбонилаллиламино)-9,10-антрахинон, 1-(β-карбоксиаллиламино)-9,10-антрахинон, 1,5-ди-(β-карбоксиаллиламино)-9,10-антрахинон, 1-(β-изопропоксикарбонилаллиламино)-5-бензоиламид-9,10-антрахинон, 2-(3'-(мет)акрилоиламиданилино)-4-(3'-(3"-сульфо-4"-аминоантрахинон-1"-ил)аминоанилино)-6-хлор-1,3,5-триазин, 2-(3'-(мет)акрилоиламиданилино)-4-(3'-(3"-сульфо-4"-аминоантрахинон-1"-ил)аминоанилино)-6-гидразино-1,3,5-триазин, 2,4-бис((4"-метоксиантрахинон-1"-ил)амино)-6-(3'-виниланилино)-1,3,5-триазин и 2-(2'-винилфенокси)-4-(4'-(3"-сульфо-4"-аминоантрахинон-1"-ил-амино)анилино)-6-хлор-1,3,5-триазин.
Заданные примеры полимеризуемого нитрокрасителя включают, например, o-нитроанилинометил(мет)акрилат.
Заданные примеры полимеризуемого фталоцианинового красителя включают, например, (мет)акрилированный тетрааминофталоцианин меди и (мет)акрилированный (додеканоилированный тетрааминофталоцианин меди).
Заданные примеры полимеризуемого поглощающего УФ-свет красителя, который можно применять в комбинации для целей, как описано выше, включают, например, бензофеноновые полимеризуемые поглощающие УФ-свет красители, включая, например, 2,4-дигидрокси-3-(п-стиреноазо)бензофенон, 2,4-дигидрокси-5-(п-стиреноазо)бензофенон, 2,4-дигидрокси-3-(п-(мет)акрилоилоксиметилфенилазо)бензофенон, 2,4-дигидрокси-5-(п-(мет)акрилоилоксиметилфенилазо)бензофенон, 2,4-дигидрокси-3-(п-(мет)акрилоилоксиэтилфенилазо)бензофенон, 2,4-дигидрокси-5-(п-(мет)акрилоилоксиэтилфенилазо)бензофенон, 2,4-дигидрокси-3-(п-(мет)акрилоилоксипропилфенилазо)бензофенон, 2,4-дигидрокси-5-(п-(мет)акрилоилоксипропилфенилазо)бензофенон, 2,4-дигидрокси-3-(o-(мет)акрилоилоксиметилфенилазо)бензофенон, 2,4-дигидрокси-5-(o-(мет)акрилоилоксиметилфенилазо)бензофенон, 2,4-дигидрокси-3-(o-(мет)акрилоилоксиэтилфенилазо)бензофенон, 2,4-дигидрокси-5-(o-(мет)акрилоилоксиэтилфенилазо)бензофенон, 2,4-дигидрокси-3-(o-(мет)акрилоилоксипропилфенилазо)бензофенон, 2,4-дигидрокси-5-(o-(мет)акрилоилоксипропилфенилазо)бензофенон, 2,4-дигидрокси-3-(п-(N,N-ди(мет)акрилоилоксиэтиламино)фенилазо)бензофенон, 2,4-дигидрокси-5-(п-(N,N-ди(мет)акрилоилоксиэтиламино)фенилазо)бензофенон, 2,4-дигидрокси-3-(o-(N,N-ди(мет)акрилоилоксиэтиламино)фенилазо)бензофенон, 2,4-дигидрокси-5-(o-(N,N-ди(мет)акрилоилэтиламино)фенилазо)бензофенон, 2,4-дигидрокси-3-(п-(N-этил-N-(мет)акрилоилоксиэтиламино)фенилазо)бензофенон, 2,4-дигидрокси-5-(п-(N-этил-N-(мет)акрилоилоксиэтиламино)фенилазо)бензофенон, 2,4-дигидрокси-3-(o-(N-этил-N-(мет)акрилоилоксиэтиламино)фенилазо)бензофенон, 2,4-дигидрокси-5-(o-(N-этил-N-(мет)акрилоилоксиэтиламино)фенилазо)бензофенон, 2,4-дигидрокси-3-(п-(N-этил-N-(мет)акрилоиламино)фенилазо)бензофенон, 2,4-дигидрокси-5-(п-(N-этил-N-(мет)акрилоиламино)фенилазо)бензофенон, 2,4-дигидрокси-3-(o-(N-этил-N-(мет)акрилоиламино)фенилазо)бензофенон и 2,4-дигидрокси-5-(o-(N-этил-N-(мет)акрилоиламино)фенилазо)бензофенон; и полимеризуемые поглощающие УФ-свет красители на основе бензойной кислоты, включая, например, фениловый эфир 2-гидрокси-4-(п-стиреноазо)бензойной кислоты. Данные соединения можно применять отдельно, или два или более видов данных соединений можно применять в смеси.
Когда сополимеризуют полимер настоящего изобретения, можно получать трехмерную поперечно-сшитую структуру в полимере, полученном смешением сшивающего агента и/или применяя, в качестве сополимеризуемого мономера, макромер, содержащий две или более полимеризуемых групп в молекуле. Соответственно, можно увеличивать механическую прочность и твердость полимера, и/или можно подавлять выделение мономера (включая окрашивающее соединение настоящего изобретения) из полимера. Кроме того, когда полимер настоящего изобретения применяют в качестве материала для интраокулярной линзы, как описано далее, то также можно получить интраокулярную линзу, которая является однородной и прозрачной, которая не имеет искривлений или деформаций, и которая обладает превосходными оптическими характеристиками, и/или также можно придавать устойчивость (стойкость к химическим веществам, стойкость к нагреванию и стойкость к растворителям) интраокулярной линзе.
Когда смешивают сшивающий агент и/или макромер, предпочтительно, чтобы сшивающий агент и/или макромер применяли при соотношении компонентов в смеси в диапазоне соотношений 0,01-10 масс. частей на 100 масс. частей смеси всех сополимеризуемых мономеров. Если соотношение является меньшим, чем 0,01 масс. частей, вряд ли будет получен эффект. С другой стороны, если соотношение превышает 10 масс. частей, имеется тенденция к тому, что полученный полимер становится хрупким.
Примеры макромера, как описано выше, включают, например, бутандиолди(мет)акрилат, этиленгликольди(мет)акрилат, диэтиленгликольди(мет)акрилат, триэтиленгликольди(мет)акрилат, пропиленгликольди(мет)акрилат, дипропиленгликольди(мет)акрилат, диаллилфумарат, аллил(мет)акрилат, винил(мет)акрилат, триметилолпропантри(мет)акрилат, метакрилоилоксиэтил(мет)акрилат, дивинилбензол, диаллилфталат, диаллиладипат, триаллилдиизоцианат, α-метилен-N-винилпирролидон, 4-винилбензил(мет)акрилат, 3-винилбензил(мет)акрилат, 2,2-бис((мет)акрилоилоксифенил)гексафторпропан, 2,2-бис((мет)акрилоилоксифенил)пропан, 1,4-бис(2-(мет)акрилоилоксигексафторизопропил)бензол, 1,3-бис(2-(мет)акрилоилоксигексафторизопропил)бензол, 1,2-бис(2-(мет)акрилоилоксигексафторизопропил)бензол, 1,4-бис(2-(мет)акрилоилоксиизопропил)бензол, 1,3-бис(2-(мет)акрилоилоксиизопропил)бензол и 1,2-бис(2-(мет)акрилоилоксиизопропил)бензол.
Кроме того, также можно вводить различные функциональные группы в полимер настоящего изобретения, выбирая подходящий сополимеризуемый мономер или мономеры.
Когда полимеру настоящего изобретения придают проницаемость для кислорода, уместно выбирать, в качестве сополимеризуемого мономера, например, кремнийсодержащие мономеры, такие как кремнийсодержащие (мет)акрилаты, кремнийсодержащие стирольные производные и подобные, и фторсодержащие алкил(мет)акрилаты.
Когда повышают прочность полимера и/или регулируют твердость, уместно выбирать, в качестве сополимеризуемого мономера, например, алкил (мет)акрилаты и стирольные производные, включая стирол или (мет)акриловую кислоту.
Когда фторсодержащие мономеры, которые включают, например, фторсодержащие алкил(мет)акрилаты и фторсодержащие стирольные производные, выбирают в качестве сополимеризуемого мономера, можно придавать способность, защищающую от загрязнения жиром, когда полимер настоящего изобретения применяют в качестве материала для интраокулярной линзы, как описано далее.
Когда полимеру настоящего изобретения придают гидрофильность, уместно выбирать, в качестве сополимеризуемого мономера, мономеры, содержащие гидрофильные группы, включая, например, гидрокси(мет)акрилаты, (мет)акриламиды, аминоалкил(мет)акрилаты, (мет)акрилат и N-виниллактамы. Можно получить водосодержащую и мягкую интраокулярную линзу, когда полимер настоящего изобретения применяют в качестве материала для интраокулярной линзы, как описано далее.
Когда мономеры, содержащие ароматические кольца, включая, например, стирольные мономеры и (мет)акрилаты, содержащие ароматическое кольцо, выбирают в качестве сополимеризуемого мономера, полимер настоящего изобретения можно применять в качестве материала для линзы, имеющей высокий показатель преломления.
Когда сополимеризуемый мономер, который является пригодным для введения различных функциональных групп в полимер настоящего изобретения, выбирают и смешивают, как описано выше, регулирование соответственно осуществляют так, чтобы сополимеризуемый мономер предпочтительно составлял не больше чем 0,01 масс. частей и более предпочтительно не больше чем 0,05 масс. частей на 100 масс. частей смеси всех сополимеризуемых мономеров, и сополимеризуемый мономер составлял не более чем 5 масс. частей и более предпочтительно не более чем 3 масс. части на 100 масс. частей смеси всех сополимеризуемых мономеров.
Как описано выше, окрашивающее соединение настоящего изобретения обладает способностью поглощать лучи света в УФ области (длина волны: не более чем 380 нм) и в синей области (длина волны: 380-500 нм). Следовательно, полимер настоящего изобретения может останавливать ультрафиолетовый свет, и полимер настоящего изобретения может снижать интенсивность света в синей области. Задано, предпочтительно, чтобы пропускание лучей света снижалось при длине волны в районе 500 нм, и пропускание лучей света составляло 0% при длинах волн не более чем 400 нм. Более предпочтительно, когда измеряют спектры поглощения в УФ и видимой области, то возникает резкий рост кривой на графике в районе 420-500 нм, и окрашивающее соединение настоящего изобретения показывает лучшие результаты способности пропускания лучей света при подавлении пропускания в УФ/синей области, чем традиционное окрашивающее соединение (например, BMAC). Кроме того, для того чтоб обеспечить пропускание света, имеющего длину волны не более чем 400 нм, предпочтительно применять любой другой поглотитель ультрафиолетовых лучей. Следовательно, когда окрашивающее соединение настоящего изобретения применяют в качестве материала для интраокулярной линзы, как описано далее, можно подавлять вредное воздействие лучей света на глаз.
В полимере настоящего изобретения, окрашивающее соединение настоящего изобретения непосредственно соединено с полимерной цепью посредством сополимеризации. Следовательно, окрашивающее соединение настоящего изобретения не вымывается из полимера настоящего изобретения. Этот признак можно подтвердить тем фактом, что отсутствуют изменения в спектре пропускания лучей света до и после погружения полимера настоящего изобретения на 24 часа в этанол при 40°C.
Кроме того, как описано выше, амидная связь, которая соединяет полимеризуемую группу и окрашивающий фрагмент в окрашивающем соединении настоящего изобретения, является стабильной даже в щелочных условиях (например, при значении pH, равном не меньше чем 12). Следовательно, окрашивающий фрагмент не удаляется из полимера настоящего изобретения. Как результат, обеспечивают стабильность в щелочных условиях, которая недостаточна в любом сополимере на основе применения традиционного окрашивающего соединения, имеющего эфирную связь. Способность эффективно поглощать лучи света также можно сохранять в полимере после щелочной обработки. Данный признак можно подтвердить тем фактом, что пропускание лучей света, которое вызывается раствором для погружения после погружения полимера настоящего изобретения в 4N водный раствор гидроксида натрия при комнатной температуре на 4 часа, составляет по существу 100%.
<3> Интраокулярная линза настоящего изобретения
Полимер настоящего изобретения можно применять в качестве материала для интраокулярной линзы.
В общем случае, когда окрашивающее соединение добавляют к полимеру, окрашивающее соединение повышает твердость. Напротив, окрашивающее соединение настоящего изобретения обладает превосходной мягкостью или гибкостью. Следовательно, можно ожидать, что интраокулярная линза настоящего изобретения, которую формуют, применяя полимер настоящего изобретения в качестве материала для интраокулярной линзы, будет сохранять мягкость, и интраокулярная линза настоящего изобретения легка в обращении при проведении хирургической операции.
Кроме того, полимер настоящего изобретения обладает превосходной стойкостью к свету и химическим реагентам, полимер настоящего изобретения обладает высокой стойкостью, и также окрашивающий фрагмент не вымывается из полимера. Следовательно, можно получить превосходную интраокулярную линзу, которая является высокобезопасной и которая не подвергается ни обесцвечиванию, ни изменению цвета.
Помимо приведенного выше, полимер настоящего изобретения можно применять в качестве материалов, например, для очков, солнцезащитных очков, контактных линз, и полимер настоящего изобретения можно также применять для красок и строительных материалов.
Кроме того, полимер настоящего изобретения содержит химически стабильный окрашивающий фрагмент, и полимер настоящего изобретения можно применять без любого снижения качеств даже на открытом воздухе и в тяжелых условиях окружающей среды, для которых предполагается значительное изменение температуры и изменение значения pH.
Когда полимер настоящего изобретения применяют в качестве материала для интраокулярной линзы, формование можно проводить согласно любому известному способу. Например, в качестве примеров можно привести следующие способы. А именно, реакцию полимеризации проводят в подходящей форме или реакторе для получения полимера в форме бруска, брикета или пластины. После этого, полимер обрабатывают посредством механической обработки так, чтобы он имел требуемую форму, включая, например, способ штампелирования и шлифования. Альтернативно, реакцию полимеризации проводят в форме, соответствующей требуемой форме для получения полимерного отформованного изделия, с последующей завершающей механической обработкой, при необходимости.
Часть подложки интраокулярной линзы можно получить отдельно от интраокулярной линзы и впоследствии можно прикреплять часть подложки. Альтернативно, не возникает проблем, даже когда часть подложки интраокулярной линзы формуют одновременно (интегрально) с интраокулярной линзой.
Когда полимер настоящего изобретения формуют для получения интраокулярной линзы, также допустимо применять обработку для модификации поверхности, при необходимости, для того чтобы сделать поверхность линз гидрофильной. Предпочтительно проводить плазменную обработку или обработку на основе ультрафиолетового света. Более предпочтительно проводить обработку коронным разрядом, обработку тлеющим разрядом или обработку УФ/озоном. Когда обработку проводят, как описано выше, любой стандартный аппарат и любые стандартные способы, которые являются известными к настоящему времени, можно применять в качестве аппарата для обработки и способа обработки.
ПРИМЕРЫ
Получение полимеризуемого аминоарильного соединения 1
Пример, в котором аминоарильное соединение применяли в качестве исходного соединения, показан ниже, в связи с примерным синтезом полимеризуемого аминоарильного соединения, применяемого для синтезирования окрашивающего соединения настоящего изобретения.
Пример получения 1
Синтез N-[2-[4-(трет-бутоксикарбониламино)фенил]этил]метакриламида

2-[4-(трет-Бутоксикарбонил)фенил]этиламин (3,54 г) и метакриловую кислоту (1,57 г) растворяли в хлороформе (80 мл), к которым добавляли при охлаждении на льду растворимый в воде карбодиимид (2,88 г). Смесь перемешивали при 4°C в течение 1 часа, затем при комнатной температуре в течение ночи, и концентрировали при пониженном давлении. Остаток промывали 5% гидросульфатом калия, насыщенным гидрокарбонатом натрия и соляным раствором, сушили безводным сульфатом магния и концентрировали при пониженном давлении. Полученный в результате остаток подвергали колоночной хроматографии на силикагеле и элюировали смесью гексан-этилацетат (объемное соотношение: 2:1), и затем смесью гексан-этилацетат (объемное соотношение: 1:1). Требуемое соединение получали в виде белых игольчатых кристаллов. Выход составлял 2,92 г. Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
δ: 1,52 (с, 9H), 1,91 (с, 3H), 2,80 (т, 2H, J=6,8 Гц), 3,54 (кв, 2H, J=6,8 Гц), 5,28 (т, 1H, J=1,4 Гц), 5,59 (с, 1H), 5,76 (уш.с, 1H), 6,46 (уш.с, 1H), 7,12 (д, 2H, J=8,3 Гц), 7,31 (д, 2H, J=8,3 Гц).
Пример получения 2
Синтез N-[2-[4-(трет-бутоксикарбониламино)фенил]этил]акриламида

2-[4-(трет-Бутоксикарбонил)фенил]этиламин (2,36 г) и акриловая кислота (0,84 г) реагировали так же, как в примере получения 1, и целевое соединение получали в виде белых игольчатых кристаллов. Выход составлял 2,02 г. Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
δ: 1,52 (с, 9H), 2,80 (т, 2H, J=6,8 Гц), 3,57 (кв, 2H, J=6,8 Гц), 5,51 (уш.с, 1H), 5,62 (дд, 1H, J=10,5 Гц, 0,9 Гц), 6,01 (дд, 1H, J=17,4 Гц, 10,5 Гц), 6,26 (дд, 1H, J=17,4 Гц, 0,9 Гц), 6,45 (уш.с, 1H), 7,12 (д, 2H, J=8,2 Гц), 7,30 (д, 2H, J=8,2 Гц).
Пример получения 3
Синтез N-[4-(трет-бутоксикарбониламино)бензил]метакриламида

4-(трет-бутоксикарбониламино)бензиламин (5,38 г) и метакриловая кислота (1,89 г) реагировали так же, как в примере получения 1, и целевое соединение получали в виде белых игольчатых кристаллов. Выход составлял 4,15 г. Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
δ: 1,50 (с, 9H), 1,96 (с, 3H), 4,43 (д, 2H, J=5,4 Гц), 5,32 (т, 1H, J=0,3 Гц), 5,68 (с, 1H), 5,96 (уш.с, 1H), 6,46 (уш.с, 1H), 7,21 (д, 2H, J=8,8 Гц), 7,32 (д, 2H, J=8,8 Гц).
Получение полимеризуемого аминоарильного соединения 2
Пример, в котором нитроарильное соединение применяли в качестве исходного соединения, показан ниже, в связи с примерным синтезом полимеризуемого аминоарильного соединения, применяемого для синтезирования окрашивающего соединения настоящего изобретения.
Пример получения 4
Синтез N-[2-(4-аминофенил)этил]метакриламида
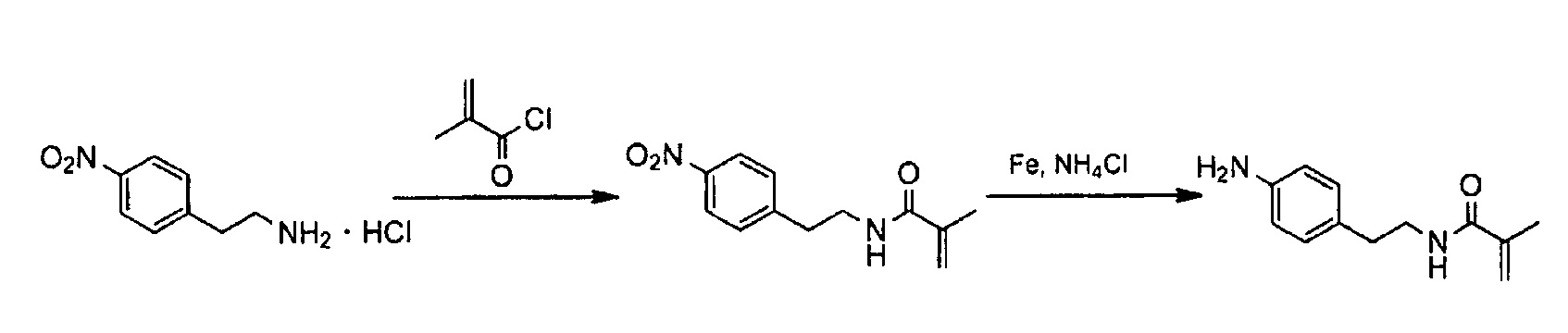
Гидрохлорид 2-(4-нитрофенил)этиламина (1,72 г) и гидрокарбонат натрия (5,00 г) растворяли в воде (25 мл), к которым добавляли этилацетат (25 мл), с последующим перемешиванием на бане со льдом. К смеси по каплям добавляли метакрилоилхлорид (1,79 г). После перемешивания в течение 10 минут органический слой отделяли. Водный слой экстрагировали этилацетатом, органические слои объединяли, промывали водой и соляным раствором, сушили над безводным сульфатом натрия и выпаривали при пониженном давлении. Перекристаллизацию проводили, применяя смесь растворителей гексана и этилацетата. N-[2-(4-нитрофенил)этил]метакриламид получали в виде бледно-желтоватых кристаллов. Выход составлял 1,25 г (63%). Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
δ: 1,93 (с, 3H), 2,99 (т, 2H, J=6,8 Гц), 3,60 (кв, 2H, J=6,8 Гц), 5,32 (т, 1H, J=1,2 Гц), 5,61 (с, 1H), 5,82 (уш.с, 1H), 7,37 (д, 2H, J=8,6 Гц), 8,17 (д, 2H, J=8,6 Гц).
Затем, N-[2-(4-нитрофенил)этил]метакриламид (1,20 г) растворяли в этаноле (15 мл) и воде (5 мл). Добавляли хлорид аммония (364 мг) и железный порошок (933 мг), и кипячение с обратным холодильником проводили при 80°C в течение 4 часов. Железный порошок собирали фильтрованием, и фильтрат выпаривали при пониженном давлении. К маслянистому остатку добавляли воду и этилацетат, и органический слой отделяли. Органический слой промывали водой и соляным раствором, сушили над безводным сульфатом натрия и выпаривали, получая требуемое соединение в виде бледно-красного маслянистого вещества. Выход составлял 1,01 г (97%). Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
δ: 1,91 (с, 3H), 2,74 (т, 2H, J=6,8 Гц), 3,51 (кв, 2H, J=6,8 Гц), 3,61 (уш.с, 2H), 5,27 (т, 1H, J=1,4 Гц), 5,59 (с, 1H), 5,76 (уш.с, 1H), 6,64 (д, 2H, J=8,3 Гц), 6,98 (д, 2H, J=8,3 Гц).
Пример получения 5
Синтез N-(4-аминобензил)метакриламида

Гидрохлорид 4-нитробензиламина (1,51 г) и гидрокарбонат натрия (4,13 г) растворяли в воде (25 мл), к которой добавляли этилацетат (25 мл), с последующим перемешиванием на бане со льдом. К смеси по каплям добавляли метакрилоилхлорид (1,26 г). После перемешивания в течение 10 минут, смесь экстрагировали этилацетатом. После промывки водой и соляным раствором, органический слой сушили над безводным сульфатом натрия и выпаривали. После этого проводили перекристаллизацию, применяя смесь гексана и этилацетата. N-(4-нитробензил)метакриламид получали в виде бледно-желтоватых кристаллов. Выход составлял 1,05 г (60%). Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
δ: 2,01 (с, 3H), 4,61 (д, 2H, J=6,0 Гц), 5,41 (т, 1H, J=1,0 Гц), 5,76 (т, 1H, J=1,0 Гц), 6,29 (уш.с, 1H), 7,45 (д, 2H, J=8,8 Гц), 8,17 (д, 2H, J=8,8 Гц).
Затем, N-(4-нитробензил)метакриламид (811 мг) растворяли в этаноле (12 мл) и воде (4 мл). Добавляли хлорид аммония (183 мг) и железный порошок (573 мг), и кипячение с обратным холодильником проводили при 80°C в течение 4 часов. Железный порошок собирали фильтрованием, и фильтрат выпаривали. Добавляли к остатку воду и этилацетат, и органический слой отделяли. Органический слой сушили над безводным сульфатом натрия и выпаривали, получая бледно-красное маслянистое вещество. Выход составлял 580 мг (89%). Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
δ: 1,97 (т, 3H, J=1,3 Гц), 3,67 (уш.с, 2H), 4,37 (д, 2H, J=5,6 Гц), 5,31 (т, 1H, J=1,4 Гц), 5,68 (уш.т, 1H), 5,92 (уш.с, 1H), 6,65 (д, 2H, J=8,3 Гц), 7,09 (д, 2H, J=8,3 Гц).
Получение полимеризуемого поглощающего УФ-свет красителя
Полимеризуемый поглощающий УФ-свет краситель настоящего изобретения синтезировали, применяя полимеризуемое аминоарильное соединение, полученное, как описано выше. В связи с этим, ниже показаны примеры 1-12.
Пример 1. Синтез 2,4-дигидрокси-5-[4-[2-(метакриламид)этил]фенилазо]бензофенона (называемого далее в виде аббревиатуры "HBZ-PHM")

N-[2-[4-(трет-бутоксикарбониламино)фенил]этил]метакриламид (609 мг) растворяли в этилацетате (2 мл), к которому добавляли 4 M хлороводород в этилацетате (5 мл). Смесь перемешивали в течение 40 минут при комнатной температуре, с последующим концентрированием при пониженном давлении. Остаток растворяли в 1 M хлористоводородной кислоте (4 мл), к которой по каплям добавляли водный раствор (10 мл) нитрита натрия (145 мг) при охлаждении на льду, с последующим перемешиванием при 4°C в течение 40 минут, для получения соли диазония. Затем, 2,4-дигидроксибензофенон (428 мг) растворяли в этаноле (20 мл), к которому добавляли водный раствор (20 мл) карбоната натрия (423 мг). Раствор, содержащий соль диазония, описанную выше, по каплям добавляли к смеси при охлаждении на льду. Смесь перемешивали при 4°C в течение 1 часа, и затем при комнатной температуре в течение 4 часов, при этом по каплям добавляли 4 M хлористоводородную кислоту, доводя значение pH до равного 6. Добавляли к смеси воду (40 мл), и осадок собирали фильтрованием, с последующей промывкой водой. Осадок растворяли в хлороформе без сушки, который сушили над безводным сульфатом магния и выпаривали. Добавляли к остатку метанол и оставляли при 4°C в течение ночи. После этого, выпавшее в осадок целевое соединение получали в виде оранжевых кристаллов. Выход составлял 326 мг (38%). Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,93 (т, 3, J=1,0 Гц), 2,94 (т, 2H, J=6,8 Гц), 3,61 (кв, 2H, J=6,8 Гц), 5,31 (т, 1H, J=1,0 Гц), 5,61 (т, 1H, J=1,0 Гц), 5,80 (уш.т, 1H), 6,58 (с, 1H), 7,33 (д, 2H, J=8,8 Гц), 7,56 (т, 2H, J=7,2 Гц), 7,64 (тт, 1H, J=7,3 Гц, 2,4 Гц), 7,73-7,76 (м, 4H), 8,23 (с, 1H), 12,89 (с, 1H), 13,94 (с, 1H).
Пример 2. Синтез 2-гидрокси-5-[4-[2-(метакриламид)этил]фенилазо]бензофенона (называемого далее в виде аббревиатуры "NBZ-PHM")

Тем же способом, как в примере 1, N-[2-[4-(трет-бутоксикарбониламино)фенил]этил]метакриламид (609 мг) подвергали кислотной обработке, с последующим превращением в соль диазония для проведения диазосочетания с 2-гидроксибензофеноном (396 мг). Целевое соединение получали в виде оранжевых кристаллов. Выход составлял 630 мг (76%). Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,92 (с, 3H), 2,93 (т, 2H, J=6,8 Гц), 3,61 (кв, 2H, J=6,8 Гц), 5,29 (т, 1H, J=1,2 Гц), 5,61 (с, 1H), 5,79 (уш.т, 1H), 7,20 (д, 1H, J=8,8 Гц), 7,32 (д, 2H, J=8,3 Гц), 7,57 (т, 2H, J=7,3 Гц), 7,66 (т, 1H, J=7,3 Гц), 7,77-7,81 (м, 4H), 8,15 (дд, 1H, J=9,3 Гц, 2,4 Гц), 8,26 (д, 1H, J=2,4 Гц), 12,44 (с, 1H).
Пример 3. Синтез 2-гидрокси-5-[4-[2-(метакриламид)этил]фенилазо]-4-метоксибензофенона (называемого далее в виде аббревиатуры "MBZ-PHM")

Тем же способом, как в примере 1, N-[2-[4-(трет-бутоксикарбониламино)фенил]этил]метакриламид (609 мг) подвергали кислотной обработке, с последующим превращением в соль диазония для проведения диазосочетания с 2-гидрокси-4-метоксибензофеноном (456 мг). Целевое соединение получали в виде оранжевых кристаллов. Выход составлял 553 мг (62%). Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,92 (с, 3H), 2,92 (т, 2H, J=6,8 Гц), 3,60 (кв, 2H, J=6,8 Гц), 4,09 (с, 3H), 5,29 (т, 1H, J=1,4 Гц), 5,60 (с, 1H), 5,76 (уш.т, 1H), 6,71 (с, 1H), 7,29 (д, 2H, J=8,8 Гц), 7,53 (т, 2H, J=8,8 Гц), 7,61 (т, 1H, J=7,8 Гц), 7,71 (д, 2H, J=6,8 Гц), 7,76 (д, 2H, J=6,8 Гц), 8,03 (с, 1H), 12,91 (с, 1H).
Пример 4. Синтез 4-этокси-2-гидрокси-5-[4-[2-(метакриламид)этил]фенилазо]бензофенона (называемого далее в виде аббревиатуры "EBZ-PHM")

Тем же способом, как в примере 1, N-[2-[4-(трет-бутоксикарбониламино)фенил]этил]метакриламид (609 мг) подвергали кислотной обработке, с последующим превращением в соль диазония для проведения диазосочетания с 4-этокси-2-гидроксибензофеноном (485 мг). Целевое соединение получали в виде оранжевых кристаллов. Выход составлял 652 мг (71%). Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,59 (т, 3H, J=6,8 Гц), 1,92 (с, 3H), 2,92 (т, 2H, J=6,8 Гц), 3,60 (кв, 2H, J=6,8 Гц), 4,33 (кв, 2H, J=6,8 Гц), 5,29 (т, 1H, J=1,2 Гц), 5,60 (с, 1H), 5,77 (уш.т, 1H), 6,68 (с, 1H), 7,30 (д, 2H, J=8,3 Гц), 7,53 (т, 2H, J=7,3 Гц), 7,61 (т, 1H, J=7,3 Гц), 7,71 (д, 2H, J=7,3 Гц), 7,78 (д, 2H, J=8,4 Гц), 8,03 (с, 1H), 12,90 (с, 1H).
Пример 5. Синтез 5-[4-[2-(акриламид)этил]фенилазо]-2,4-дигидроксибензофенона (называемого далее в виде аббревиатуры "HBZ-PHA")

Тем же способом, как в примере 1, N-[2-[4-(трет-бутоксикарбониламино)фенил]этил]акриламид (581 мг) подвергали кислотной обработке, с последующим превращением в соль диазония для проведения диазосочетания с 2,4-дигидроксибензофеноном (428 мг). Получали целевое соединение. Выход составлял 313 мг (38%). Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
δ: 2,94 (т, 2H, J=6,8 Гц), 3,64 (кв, 2H, J=6,4 Гц), 5,56 (уш.т, 1H), 5,64 (дд, 1H, J=10,8 Гц, 1,5 Гц), 6,03 (дд, 1H, J=17,1 Гц, 10,8 Гц), 6,28 (дд, 1H, J=17,1 Гц, 1,5 Гц), 6,58 (с, 1H), 7,33 (д, 2H, J=8,3 Гц), 7,54-7,59 (м, 2H), 7,65 (т, 1H, J=78 Гц), 7,73-7,76 (м, 4H), 8,23 (с, 1H), 12,90 (с, 1H), 13,94 (с, 1H)
Пример 6. Синтез 5-[4-[2-(акриламид)этил]фенилазо]-2-гидрокси-4-метоксибензофенона (называемого далее в виде аббревиатуры "MBZ-PHA")

Тем же способом, как в примере 5, N-[2-[4-(трет-бутоксикарбониламино)фенил]этил]акриламид (581 мг) подвергали кислотной обработке, с последующим превращением в соль диазония для проведения диазосочетания с 2-гидрокси-4-метоксибензофеноном (456 мг). Получали целевое соединение. Выход составлял 510 мг (59%). Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
δ: 2,92 (т, 2H, J=6,8 Гц), 3,62 (кв, 2H, J=6,8 Гц), 4,09 (с, 3H), 5,56 (уш.т, 1H), 5,63 (дд, 1H, J=10,2 Гц, 1,5 Гц), 6,02 (дд, 1H, J=17,1 Гц, 10,2 Гц), 6,26 (дд, 1H, J=17,1 Гц, 1,5 Гц), 6,70 (с, 1H), 7,29 (д, 2H, J=8,3 Гц), 7,53 (т, 2H, J=7,3 Гц), 7,61 (т, 1H, J=7,8 Гц), 7,70-7,76 (м, 4H), 8,03 (с, 1H), 12,92 (с, 1H).
Пример 7. Синтез 5-[4-[2-(акриламид)этил]фенилазо]-4-этокси-2-гидроксибензофенона (называемого далее в виде аббревиатуры "EBZ-PHA")

Тем же способом, как в примере 5, N-[2-[4-(трет-бутоксикарбониламино)фенил]этил]акриламид (581 мг) подвергали кислотной обработке, с последующим превращением в соль диазония для проведения диазосочетания с 4-этокси-2-гидроксибензофеноном (485 мг). Получали целевое соединение. Выход составлял 583 мг (66%). Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
δ: 1,59 (т, 3H, J=7,1 Гц), 2,93 (т, 2H, J=6,9 Гц), 3,64 (кв, 2H, J=6,9 Гц), 4,33 (кв, 2H, J=7,1 Гц), 5,52 (уш.т, 1H), 5,63 (дд, 1H, J=10,4 Гц, 1,3 Гц), 6,02 (дд, 1H, J=16,9 Гц, 10,4 Гц), 6,27 (дд, 1H, J=16,9 Гц, 1,3 Гц), 6,68 (с, 1H), 7,29 (д, 2H, J=8,5 Гц), 7,50-7,55 (м, 2H), 7,61 (т, 1H, J=7,4 Гц), 7,69-7,72 (м, 2H), 7,96 (д, 2H, J=8,3 Гц), 8,02 (с, 1H), 12,89 (с, 1H).
Пример 8. Синтез 5-[4-[2-(акриламид)этил]фенилазо]-2-гидроксибензофенона (называемого далее в виде аббревиатуры "NBZ-PHA")

Тем же способом, как в примере 5, N-[2-[4-(трет-бутоксикарбониламино)фенил]этил]акриламид (581 мг) подвергали кислотной обработке, с последующим превращением в соль диазония для проведения диазосочетания с 2-гидроксибензофеноном (396 мг). Получали целевое соединение. Выход составлял 525 мг (66%). Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
δ: 2,94 (т, 2H, J=6,8 Гц), 3,64 (кв, 2H, J=6,8 Гц), 5,56 (уш.т, 1H), 5,63 (дд, 1H, J=10,3 Гц, 1,5 Гц), 6,02 (дд, 1H, J=17,1 Гц, 10,3 Гц), 6,27 (дд, 1H, J=17,1 Гц, 1,5 Гц), 7,20 (д, 1H, J=9,3 Гц), 7,32 (д, 2H, J=8,3 Гц), 7,57 (тт, 2H, J=7,3 Гц, 1,5 Гц), 7,66 (т, 1H, J=7,8 Гц), 7,77-7,81 (м, 4H), 8,15 (дд, 1H, J=9,3 Гц, 2,4 Гц), 8,26 (д, 1H, J=2,4 Гц), 12,45 (с, 1H).
Пример 9. Синтез 2,4-дигидрокси-5-[4-[2-(метакриламид)этил]фенилазо]бензофенона (HBZ-PHM)

HBZ-PHM синтезировали согласно следующему способу, отличному от способа примера 1.
1 M хлористоводородную кислоту (15 мл) добавляли к N-[2-[4-аминофенил]этил]метакриламиду (930 мг), к которому по каплям добавляли водный раствор (5 мл) нитрита натрия (355 мг) при охлаждении на льду, с последующим перемешиванием при 4°C в течение 1 часа для получения соли диазония. Затем, 2,4-дигидроксибензофенон (975 мг) растворяли в этаноле (40 мл), к которому добавляли водный раствор (40 мл) карбоната натрия (970 мг). Раствор, содержащий соль диазония, описанную выше, по каплям добавляли к смеси при охлаждении на льду. Смесь перемешивали при 4°C в течение 1 часа, и затем при комнатной температуре в течение 2 часов, к которой добавляли порциями 4 M хлористоводородную кислоту, доводя значение pH до равного 6. Добавляли к смеси воду (40 мл), и осадок собирали фильтрованием, с последующей промывкой водой. Осадок растворяли в хлороформе после сушки и наносили на силикагель. Колоночную хроматографию проводили, применяя этилацетат, и получали оранжевые кристаллы. Добавляли к кристаллам метанол для проведения кипячения с обратным холодильником, с последующим выдерживанием при комнатной температуре в течение ночи. Выпавшее в осадок целевое соединение получали в виде оранжевых кристаллов. Выход составлял 774 мг (40%). Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
δ: 1,93 (т, 3H, J=1,0 Гц), 2,94 (т, 2H, J=6,8 Гц), 3,61 (кв, 2H, J=6,8 Гц), 5,31 (т, 1H, J=1,0 Гц), 5,61 (т, 1H, J=1,0 Гц), 5,81 (уш.т, 1H), 6,58 (с, 1H), 7,33 (д, 2H, J=8,5 Гц), 7,56 (т, 2H, J=7,2 Гц), 7,64 (тт, 1H, J=7,2 Гц, 2,4 Гц), 7,72-7,76 (м, 4H), 8,22 (с, 1H), 12,89 (с, 1H), 13,93 (с, 1H).
Пример 10. Синтез 5-[4-[2-(метакриламид)метил]фенилазо]-2,4-дигидроксибензофенона (называемого далее в виде аббревиатуры"HBZ-BZM")

Тем же способом, как в примере 1, N-[4-(трет-бутоксикарбониламино)бензил]метакриламид (581 мг) подвергали кислотной обработке, с последующим превращением в соль диазония для проведения диазосочетание с 2,4-дигидроксибензофеноном (428 мг). Получали целевое соединение. Выход составлял 470 мг (57%). Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
δ: 1,99 (с, 3H), 4,56 (д, 2H, J=5,9 Гц), 5,37 (с, 1H), 5,73 (с, 1H), 6,13 (уш.т, 1H), 6,57 (с, 1H), 7,25 (с, 1H), 7,41 (д, 2H, J=8,8 Гц), 7,53-7,57 (м, 2H), 7,63 (т, 1H, J=7,3 Гц), 7,72-7,76 (м, 4H), 8,22 (с, 1H), 12,88 (с, 1H), 13,89 (с, 1H).
Пример 11. Синтез 5-[4-[2-(метакриламид)метил]фенилазо]-2-гидрокси-4-метоксибензофенона (называемого далее в виде аббревиатуры "MBZ-BZM")

Тем же способом, как в примере 10, N-[4-(трет-бутоксикарбониламино)бензил]метакриламид (581 мг) подвергали кислотной обработке, с последующим превращением в соль диазония для проведения диазосочетания с 2-гидрокси-4-метоксибензофеноном (456 мг). Получали целевое соединение. Выход составлял 511 мг (59%). Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
δ: 2,00 (с, 3H), 4,09 (с, 3H), 4,56 (д, 2H, J=5,9 Гц), 5,37 (с, 1H), 5,73 (с, 1H), 6,10 (уш.т, 1H), 6,70 (с, 1H), 7,39 (д, 2H, J=8,8 Гц), 7,51-7,55 (м, 2H), 7,61 (т, 1H, J=7,8 Гц), 7,69-7,72 (м, 2H), 7,78 (д, 2H, J=8,3 Гц), 8,03 (с, 1H), 12,92 (с, 1H).
Пример 12. Синтез 5-[4-[2-(метакриламид)метил]фенилазо]-2-гидрокси-4-метоксибензофенона (MBZ-BZM)

MBZ-BZM получали согласно следующему способу, отличному от способа примера 11.
1 M хлористоводородную кислоту (9 мл) добавляли к N-[4-аминобензил]метакриламиду (574 мг), к которому по каплям добавляли водный раствор (3 мл) нитрита натрия (210 мг) при охлаждении на льду, с последующим перемешиванием при 4°C в течение 1 часа для получения соли диазония. Затем, 2,4-дигидроксибензофенон (637 мг) растворяли в этаноле (25 мл), к которому добавляли водный раствор (25 мл) карбоната натрия (644 мг). Раствор, содержащий соль диазония, описанную выше, по каплям добавляли к смеси при охлаждении на льду. Смесь перемешивали при 4°C в течение 1 часа, и затем при комнатной температуре в течение 2 часов, к которой по каплям добавляли 4 M хлористоводородную кислоту, доводя значение pH до равного 6. Добавляли к смеси воду (25 мл), и осадок собирали фильтрованием, с последующей промывкой водой. Осадок растворяли в хлороформе перед сушкой и наносили на силикагель. Колоночную хроматографию проводили этилацетатом, и получали оранжевые кристаллы. К кристаллам добавляли метанол для проведения кипячения с обратным холодильником, с последующим выдерживанием при комнатной температуре в течение ночи. Выпавшее в осадок целевое соединение получали в виде оранжевых кристаллов. Выход составлял 370 мг (29%). Спектральные данные1H-ЯМР (400 МГц, CDCl3) показаны для полученного соединения.
δ: 2,00 (т, 3H, J=1,1 Гц), 4,57 (д, 2H, J=6,0 Гц), 5,38 (т, 1H, J=1,4 Гц), 5,73 (уш.т, 1H), 6,16 (уш.с, 1H), 6,57 (с, 1H), 7,41 (д, 2H, J=8,5 Гц), 7,56 (т, 2H, J=7,4 Гц), 7,63 (тт, 1H, J=7,3 Гц, 2,4 Гц), 7,71-7,78 (м, 4H), 8,22 (с, 1H), 12,88 (с, 1H), 13,89 (с, 1H).
<Пример сополимеризации полимеризуемого поглощающего УФ-свет красителя и других полимеризуемых мономеров>
Полимеризуемый поглощающий УФ-свет краситель, полученный в примере, сополимеризовали с другим полимеризуемым мономером.
Пример 13
0,03 масс. частей полимеризуемого поглощающего УФ-свет красителя (HBZ-PHM), полученного в примере 1, 60 масс. частей 2-феноксиэтилакрилата, 40 масс. частей этилакрилата и 0,5 масс. частей 2,2'-азобис(2,4-диметилвалеронитрила) смешивали однородно или гомогенно, с последующей полимеризацией при 80°C в течение 40 минут, для получения полимерного листа, имеющего толщину 1 мм. Полученный полимерный лист применяли в качестве образца для измерения пропускания лучей света при длинах волн 220-800 нм. Результат показан на фиг. 1.
Кроме того, данный образец погружали в этанол при 40°C на 24 часа для проведения обработки по вымыванию, и затем снова измеряли пропускание лучей света. Как результат, спектр не изменялся до и после обработки по вымыванию. Данный факт показывает, что полимеризуемый поглощающий УФ-свет краситель химически соединен с материалом. Было успешно подтверждено, что вымывание не протекает после полимеризации, даже когда окрашивающее соединение настоящего изобретения применяют для синтеза полимера, применяя его в комбинации с другим поглотителем ультрафиолетовых лучей. Спектрофотометр в УФ/видимой части спектра применяли для измерения пропускания лучей света (его также применяли в следующих способах).
<Пример сополимеризации полимеризуемого поглощающего УФ-свет красителя, полимеризуемого поглотителя ультрафиолетовых лучей и другого полимеризуемого мономера>
Полимеризуемый поглощающий УФ-свет краситель, полученный в примере, сополимеризовали с другим полимеризуемым мономером вместе с другим полимеризуемым поглотителем ультрафиолетовых лучей.
Пример 14
Полимерный лист получали тем же способом, как в примере 13, за исключением того, что 0,15 масс частей 2-[2'-гидрокси-5'-(2"-метакрилоилоксиэтокси)-3'-трет-бутилфенил]-5-метил-2H-бензотриазола дополнительно смешивали в качестве поглотителя ультрафиолетовых лучей. Пропускание лучей света измеряли при длинах волн 220-800 нм тем же способом, как в примере 13, применяя полученный лист в качестве образца. Результат показан на фигуре 2. Спектр пропускания лучей света не изменялся до и после обработки по вымыванию. Было успешно подтверждено, что полимеризуемый поглощающий УФ-свет краситель настоящего изобретения вводится в качестве сополимерного компонента в полимер, и полимеризуемый поглощающий УФ-свет краситель настоящего изобретения не вымывается после полимеризации, даже когда полимеризуемый поглощающий УФ-свет краситель настоящего изобретения применяют в комбинации с другим полимеризуемым поглотителем ультрафиолетовых лучей.
<Сравнение стабильности в щелочных условиях>
HBZ-PHM (1 масс. часть), полученный в примере 1, и метилметакрилат (26 масс. частей) загружали в смесь диоксана (52 масс. части), N,N-диметилформамида (22 масс. части) и воды (20 масс. частей), к которым добавляли 2,4 масс. части 2,2'-азобис(2,4-диметилвалеронитрила), с последующей полимеризацией при 75°C в течение 5 часов в атмосфере аргона, получая HBZ-PHM сополимер.
В качестве сравнительного примера, 2,4-дигидрокси-5-(4-(2-(N-2-метакрилоилоксиэтил)карбамоилокси)этилфенилазо)бензофенон (BMAC), который синтезировали согласно способу, описанному в примере синтеза 1 патентного документа 6 (JP2006-291006A), применяли вместо HBZ-PHM для проведения реакции полимеризации тем же способом, как описано выше, и получали BMAC сополимер.
Порошки полимеров (200 мг), которые получены после проведения Soxhlet экстракции в течение 12 часов этанолом для порошков соответствующих полученных сополимеров, суспендировали в этаноле (5 мл), соответственно, к каждому из которых добавляли 4 N NaOH (5 мл), с последующим перемешиванием при комнатной температуре в течение 4 часов. Испытуемый раствор в данной ситуации показывал, что значение pH было равным 12-14 по pH индикаторной бумаге. После завершения перемешивания, раствор нейтрализовали 4 N HCl, к которому дополнительно добавляли этанол. Нерастворимые вещества удаляли фильтрованием, и получали фильтрат. Как результат, фильтрат был бесцветным и прозрачным в случае HBZ-PHM сополимера. С другой стороны, фильтрат был окрашенным в желтый цвет в случае BMAC сополимера. Кроме того, фиг. 3 показывает результаты измерения пропускания лучей света при длинах волн 220-800 нм для соответствующих фильтратов. Фильтрат BMAC сополимера после щелочной обработки показывал график пропускания, который был таким же как или эквивалентным графику пропускания BMAC сополимера. Данный факт дает веское основание предполагать, что окрашивающая группа BMAC удаляется из сополимера вследствие щелочной обработки. С другой стороны, любые лучи света, имеющие любую длину волны, проходят через фильтрат HBZ-PHM сополимера после щелочной обработки, и окрашивающий компонент не освобождается или высвобождается из сополимера даже в случае значения pH, равного не меньше чем 12, обусловленным щелочной обработкой. То есть, было подтверждено, что HBZ-PHM сополимер является стабильным при изменении значения pH по сравнению с BMAC сополимером, и на HBZ-PHM сополимер почти не влияет изменение значения pH.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Согласно настоящему изобретению предложен полимеризуемый поглощающий УФ-свет окрашивающий мономер, который является стабильным даже в щелочных условиях. Окрашивающее соединение настоящего изобретения содержит, в своей молекуле, бензофеноновую структуру, которая обладает способностью поглощать ультрафиолетовый свет, азобензольную структуру, которая обладает способностью поглощать свет в синей области, и полимеризуемую группу. Следовательно, окрашивающее соединение настоящего изобретения можно сополимеризовать с другим полимеризуемым мономером для получения полимера, и полимер является пригодным в качестве материала, например, для интраокулярной линзы.
Реферат
Изобретение относится к соединению общей формулы (1), которое представляет собой полимеризуемый поглощающий УФ-свет окрашивающий мономер, обладающий превосходной стабильностью в щелочных условиях и являющийся пригодным полимерным материалом для интраокулярной линзы. В формуле (1) Rпредставляет собой атом водорода, Rпредставляет собой атом водорода, гидроксигруппу или алкоксигруппу, имеющую от 1 до 4 атомов углерода, и Rпредставлен формулой (2), где Rпредставляет собой атом водорода или метильную группу и Rпредставляет собой алкиленовую группу, имеющую от 1 до 4 атомов углерода. Изобретение относится также к полимеру, содержащему указанное соединение, и интраокулярной линзе на его основе. 3 н. и 2 з.п. ф-лы, 3 ил., 14 пр.
Формула


Документы, цитированные в отчёте о поиске
Интраокулярные линзы с уникальной отсечкой сине-фиолетового света и уникальными характеристиками пропускания синего света

Комментарии