Амидиногидразонпроизводные или их кислотно-аддитивные соли и средство, обладающее ингибирующим действием на фермент samdc - RU2066311C1
Код документа: RU2066311C1
Чертежи
Описание
Изобретение касается соединений формулы I

где А прямая связь или -(СН2)-,
Х -С(=Y)-NR6R7, Y-NH, Z-NH
R1 водород, R2 водород, низший алкил,
R3 и R4 водород, R5 водород или гидрокси,
R6, R7 водород,
или их кислотно-аддитивных солей, и средства, обладающего ингибирующим действием на фермент SAMDC, содержащего соединения 1 или их соли.
Соединения 1 могут существовать в виде таутомеров.
О таутомерах речь может идти в том случае, если, например, Z=NH и R3 и/или R4 и/или R5 водород.
Соответствующий гуанил-радикал, представленный в формуле 1 как -N(R3)-C(= Z)-NR4R5, может существовать также в таутомерных формах -N=C(-ZH)-NR4R5, -N(R3)-C(-ZH)=NR5 или NH-C(-ZH)=NR4. В случае, если Y обозначает NH и R6 и/или R7 водород, то соответствующая амидино-структура, обозначенная в формуле I как Х= -С(= Y)-NR6R7, также может существовать в таутомерных формах -С(-YH)=NR7 или -C(-YH)=NR6. Существование таких или аналогичных таутомеров известно. Все эти таутомеры могут быть представлены общей формулой I.
Используемые
ранее и в
последующем общие понятия в рамках настоящего изобретения имеют, в основном, следующие значения:
"Низший" обозначает радикал, содержащий до 7, в частности до 4-х атомов
углерода.
Низший алкил это, например, н-пропил, изопропил, н-бутил, изобутил, втор. -бутил, трет. -бутил, н-пентил, неопентил, н-гексил или н-гептил, предпочтительнее, этил и прежде всего метил.
Соли предлагаемых в изобретении соединений представляют собой, в первую очередь, применяемые в фармацевтической промышленности, нетоксичные соли. Например, соединения формулы (I) с основными группами могут образовывать в результате присоединения соли с неорганическими кислотами, такими как соляная кислота, серная и фосфорная кислоты, или подходящими для этой цели органическими кислотами, например, карбоновой и сульфокислотами, в частности уксусной, фумаровой или метансульфоновой кислотами, или с аминокислотами, типа аргинина или лизина. В присутствии нескольких основных групп могут получаться моно- или полисоли.
Для выделения или очистки могут быть использованы также непригодные для фармацевтики соли, как, например, пикраты или перхлораты. Для использования в качестве лекарств берутся только применяемые в фармацевтической промышленности нетоксичные соли, которые именно поэтому считаются более предпочтительными.
В зависимости от структурных особенностей предлагаемые в изобретении соединения могут существовать в форме смеси изомеров или чистых изомеров. Если, например, R2 отличающийся от водорода заместитель, то соответствующие соединения формулы I могут иметь форму рацематов или чистых энантиомеров.
Предлагаемые в изобретении соединения обладают ценными, особенно в фармакологическом отношении, свойства. В частности, они проявляют сильное специфическое ингибирующее действие на фермент S-аденозилметионинкарбоксилазу (SAMDC). Известно, что SAMDC как ключевой фермент играет важную роль в синтезе полиаминов, характерном практически для всех клеток млекопитающих, включая человека. Под действием SAMDC регулируется концентрация полиамина в клетках. Ингибирование фермента SAMDC приводит к снижению концентрации полиаминов. Поскольку снижение концентрации фермента вызывает торможение роста клеток, прием препаратов, содержащих ингибирующие SAMDC-вещества, может "заморозить" рост эукариотических и прокариотических клеток или даже "убить" клетки или ингибировать механизм деления клеток.
"Ингибирование диаминоксидазы описано в публикации J.Jaenne и D.R.Morris, Biochem. J. 218, 945-947 (1984), в которой речь идет о соединении с аналогичным механизмом действия метилглиоксаль бис(гуанилгидразона) (MGBG), которое, однако, имеет менее выраженное ингибирующее действие по сравнению с заявленным соединением SAMDC и отличную от него структуру. Более того, это ингибирующее действие неблагоприятно, т.к. оно может привести к аккумулированию путрескина и косвенной активации SAMDC".
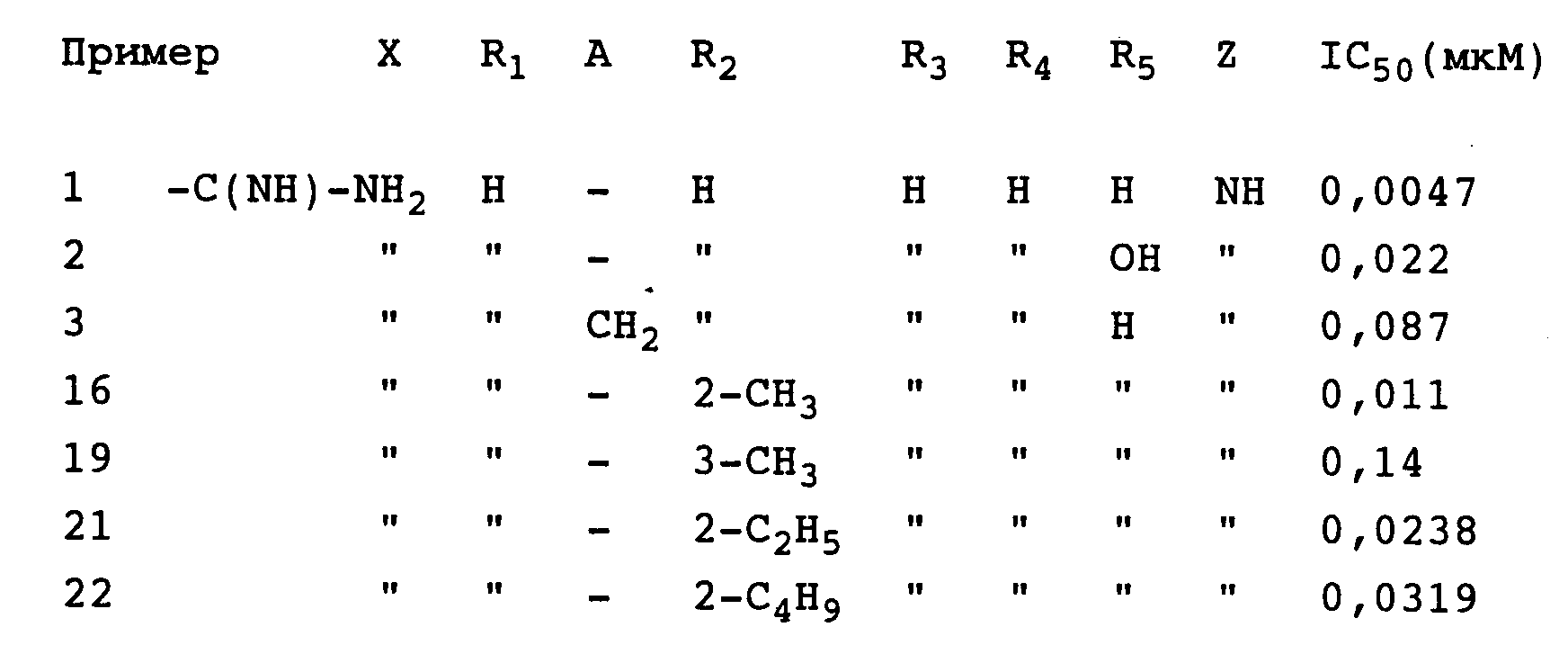
По методу Williams-Ashman и Schenone, Biochem. Biophys. Res. Commun. 46, 288 (1972), определяется ингибирование
фермента S-аденозилметиониндекарбоксилазы (SAMDC). На основании
измерений, полученных при различных концентрациях каждого из ингибиторов, значение IC50 определяется как такая концентрация,
при которой степень активности фермента SAMDC снижается
наполовину по сравнению с контрольным веществом без ингибитора. В качестве сравнительного вещества использовался метилглиоксаль
бисгуанилгидразона (МGBG), являющийся прототипом. Полученные данные
представлены ниже в таблице
Таким образом, как видно из таблицы, соединения I имеют min. значение IC50≈0,
005 мм.
Ближайшее известное соединение MGBG
формулы:
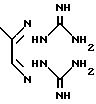
имеет IC50 0, 65.
Т. е. все указанные соединения имеют лучшие показатели ингрибирования, чем сравнительное вещество, MGBG.
Преимущество предлагаемых в изобретении соединений состоит и в том, что они только в ограниченной степени, в сравнении с их сильным ингибирующим действием на SAMDC, ингибируют диаминоксидазу и совместимы с ней. Торможение диаминоксидазы, по данным J.Jaenne и D.R. Morris, Biochem. 218, 974 (1984), является неблагоприятным явлением, так как может приводить к накапливанию путресцина и косвенному активированию SAMDC. Поэтому соединения формулы I используются, например, для лечения злокачественных и доброкачественных опухолей. Они способны вызывать регрессию опухоли, а также торможение процесса размножения клеток и роста клеток микрометастаз. Кроме того они могут применяться, например, для лечения протозо-инфекций, таких как трипаносомиаз, малярия и воспаление легких, вызванного Pneumocystis Carinii.
В качестве селективных ингибиторов SAMDC могут быть использованы соединения формулы I сами по себе или в комбинации с другими фармакологически активными веществами. Возможна, например, комбинация с (а) ингибиторами других ферментов в биосинтезе полиаминов, например, ингибиторами орнитиндекарбоксилазы, (б) ингибиторами протеинкиназы С, (в) ингибиторами тирозинпротеинкиназы, (г) цитокиназы, (д) отрицательными регуляторами роста, (е) ингибиторами ароматазы, (ж) антиэстрогенами или (з) классическими цитостатическими веществами.
В первую очередь наиболее предпочтительными являются соединения формулы I, где А прямая связь, X-C(=NH)NH2; Z-NH R1 водород, R2, R3 и R4 водород, R5 водород или гидрокси, в том числе их таутомер и применяемые в фармацевтической промышленности соли.
В качестве подгруппы из группы соединений формулы I следует выделить:
соединения формулы I, в которых А прямая связь;
соединения формулы I, где Х -С(= NH)=NH2;
соединения формулы I, где Z-NH, R4 водород, R5 водород или гидрокси; соединения формулы I, где R1 и R2
водород.
Изобретение касается прежде всего описанных в примерах соединений и их солей.
Соединения формулы I можно получить известным способом, например,
(а)
путем конденсации соединения формулы II

где группа CW1W1 карбонил, функционально преобразованный карбонил или защищенный карбонил, А, Х, R1 и R2 имеют значения, указанные в формуле I, с амином формулы (III).

где Z, R3, R4 и R5 имеют значения, указанные в формуле I, или
(б) переводом группы W3 в соединении формулы IV

где W3 радикал, который может быть переведен в группу Х формулы I и A, Z, R1, R2, R3, R4 и R5 имеют значения, указанные в формуле I и при желании полученное соединение формулы I преобразуется в другое соединение формулы I и/или полученная соль превращается в свободное соединение или другую соль, и/или полученное свободное соединение формулы I с солеобразующими свойствами преобразуется в соль.
В последующих более подробных описаниях методов а), б) символы, А, Х, Y, Z и R1 R7 имеют значения, указанные в формуле I.
Метод (а).
В качестве функционально трансформированного или защищенного карбонила CW1W2 имеют в виду, например, ди-низший алкоксиметил, С1-C2 алкилендиоксиметил, дигалоидметил, ди-низший алкилтиометил или С1-С2 алкилендитиометил.
Предпочтительным в соединении II является карбонил.
Реакция конденсации по методу а) протекает при известных условиях с образованием гидразонов. Реакция лучше всего катализируется кислотой. В соединениях формулы II используют для этой цели такие защищенные карбонильные группы CW1W2, которые в условиях конденсации переходят в свободный карбонил.
Промежуточные продукты формулы II, где Y
в Х-радикале группа NH, получают путем обработки
соединения формулы V

сероводородом с преобразованием в соответствующий тиокарбоксамид (-С(= S)-NH2). Последний можно получать и другим способом, исходя из аналогичного карбоксамида (-С(= 0)-NH2) путем реакции с реагентом Lawessou'd (2,4-бис-(4-метоксифенил)-2, 4-дитиоксо-1,2,3,4-дитиадифосфетаном).
Тиокарбоксамиды при взаимодействии, например, с низшим алкилйодидом или три-низшим алкилксонийтетрафторборатом подвергаются s-алкилированию и преобразуются в имино-низший алкилтиолоэфиргидройодиды (-С(=NH)-S-алкил.НI) или -тетрафторбораты, которые при реакции с аммиаком легко превращаются в желаемые карбоксимидамиды формулы II (ср. S. Patai (изд.)). Химия амидинов и имидатов, Wiley, Лондон, 1975, стр. 303-304).
Получение карбоксамидов формулы II из цианосоединений формулы V протекает аналогично описанному выше (см. метод б) получению карбоксамидов формулы I из цианосоединений формулы IV, где приводится детальное рассмотрение процесса.
Другой вариант получения соединений формулы II состоит в том, что соединения формулы V, где группа CW1W2 имеет те же значения, что в формуле II, обрабатывается, например, этанолом и соляной кислотой в хлороформе или диэтиловом эфире с образованием соответствующего гидрохлорида иминоэтилового эфира. Последний при взаимодействии, например, с аммиаком и первичным или вторичным амином формулы NHR6R7 и метанолом может преобразоваться в желаемый карбоксимидамид формулы II. Однако в некоторых случаях этот метод оказывается несостоятельным.
Исходные соединения формулы V сами по себе достаточно известны и получаются аналогично описанным ранее соединениям.
Соединения формулы V можно,
например, получать через внутримолекулярное ацилирование w-фенилнизших алкановых кислот
формулы VI,

где W4 циано или предшественник этой группы (предцианогруппа) и их производные, например, ангидридов или хлорангидридов кислот по методу Фриделя-Крафтса. В качестве катализаторов в случае использования свободных кислот, могут применяться, например, полифосфорная кислота, за хлорангидридов и ангидридов кислот, например, AlCl3.
При этой реакции предпочтительно использовать соединения формулы VI, где W4 не цианогруппа, а ее предшественник, например, галоид, в частности бром, или защищенный аминорадикал, например, ацетиламино. Тогда после стадии циклизации предцианогруппа известным способом может преобразовываться в цианогруппу, например, бром при взаимодействии с цианидом меди (I) или ацетиламино в результате отщепления защитной ацетильной группы, диазотирования и взаимодействия с цианидом меди (I).
Соединения формулы V, где группа CW1W2 карбонил, могут кроме того
получаться, например, в процессе окисления, например, трехокисью хрома (CrO3) из
соответствующих некарбонильных соединений формулы VII

где W4 циано- или предцианогруппа, имеющая вышеуказанное значение. В случае использования предцианогруппы, последняя в процессе окисления преобразуется в цианогруппу по описанному выше методу.
Также известен способ получения соединений формулы V, где группа CW1W2 карбонил, состоит в том, что исходят из соединений формулы II, где Х водород, вводят цианогруппу, например, в соответствии с патентом США 3956363, (пример 10), проводя в процесс в следующей последовательности нитрование, восстановление нитрогруппы в амино, диазотирование и взаимодействие с цианидом меди (I) (реакция Зандмайера).
Получение аминогуанидинов, аминомочевин и аминотиомочевин формулы III хорошо известно. Аминотиомочевины (=полу-(тио)-карбазиды) получают, например, тем же способом, что и соответствующие простые (тио)-мочевины. При этом, например, вместо аминов используют соответствующие гидразины формулы Н2N-NHR3. Происходит реакция, например, с изоцианатом формулы R4N=C=O или R5= C= 0, с изотиоцианатом формулы R4 N=C=S или R5N=C=S, с карбамоилхлоридом формулы R4R5N-COCl или тиокарбамоилхлоридом формулы R4R5N-CSCl. Возможна также последующая реакция гидразина формулы H2N-NHR3 с ацилизотиоцианом, например, ацетилизотиоцианатом, и дальнейший кислый гидролиз.
Аминогуанидины формулы III, где Z-NH и R3, R4, R5, имеют значения, указанные в формуле I, сами по себе известны и могут быть получены, например, из соответствующих аминотиомочевин формулы III при реакции последних в процессе ацилирования с алкилтозилатом или алкилгалогенидом с образованием соответствующих S-алкилизотиурониевых солей и с последующим их взаимодействием с амином формулы NHR4R5 .
Способ (б).
В промежуточных продуктах формулы IV W3 представляет собой свободный или функционально преобразованный карбоксил, в частности галоидкарбонил, циан, амино-низший алкоксикарбонил или имино-низший алкилтиолкарбонил.
Группа W3 в соединении формулы IV при получении амидинов формулы I(Y=NH) может обозначать: соль имино-низших алкиловых эфиров (простого и сложного) или имино-низших алкилтиоловых эфиров, например, -С(-NH)-OC2H5•HCl или -C(= NH)=SC2H5•H1 или циан.
При реакции имино-низших алкиловых эфиров формулы IV (в виде соли) с аммиаком или первичными или вторичными аминами получают незамещенные или моно- и дизамещенные амидины формулы I. Цианосоединения формулы IV в ходе реакции, например, с амидом щелочного металла (KNH2) или взаимодействия с первичным и вторичным (ди)-низший алкиламмонийгалогенидом, таким как+NH3CH3Cl-, могут преобразовываться в моноили дизамещенный амидин формулы I. Группа W3 в соединении формулы IV при получении карбамоильных соединений формулы I (Y= 0) может иметь следующие значения: карбокси, галоидкарбонил (например СОCl), низший алкоксикарбонил или циан. Образование моно- и дизамещенных карбамоильных соединений формулы I из соответствующих промежуточных продуктов формулы IV, где W3 - карбокси, галоидкарбонил или низший алкоксикарбонил, при реакции с аммиаком или первичными или вторичными аминами само по себе известно. Промежуточные продукты формулы IV, где W3 циано-группа, можно в процессе частичного гидролиза по типу реакции Графа-Риттера, или через эфиримидные соли карбоновой кислоты преобразовывать в моно- или дизамещенные карбамоильных соединений формулы I. Условия гидролиза промежуточных цианосоединений можно выбрать таким образом, чтобы реакция прерывалась на стадии получения амида. Для этой цели, в частности, подходит гидролиз с использованием кислот, например, с 80%-ной серной кислотой (при нагревании), полифосфорной кислотой (при 110-150oC), бромистоводородной уксусной кислотой (при комнатной температуре в присутствии муравьиной кислоты или растворителя) или газообразного HCl в эфирном растворе с добавлением воды или водного раствора соляной кислоты, или взаимодействия с боргалогенидами.
С помощью реакции Графа-Риттера удается также получать N-замещенные амиды из нитрилов формулы IV. При этом происходит реакция нитрилов в присутствии сильной кислоты, предпочтительно 85-90%-ной серной, а также полифосфорной, муравьиной кислот, фторида бора и других кислот Льюиса (но не хлорида алюминия) с соединениями, способными образовывать в кислой среде ионы карбония, т.е. с олефинами, типа пропилена, или спиртами, например, этанолом.
Эфиримиды карбоновой кислоты получают, например, путем катализируемого кислотой присоединения спиртов к нитрилам формулы IV. Из эфиримидов получают амиды расщеплением по методу Пиннера путем термического разложения эфиримидных солей при температурах выше ≈80oC.
Соединения формулы IV, где W3 циан, можно получать путем реакции соединения формулы V с соединением формулы III по способу а). Из соединений формулы IV, где W3 циан, по описанному выше или другому известному методу можно получать другие соединения формулы IV, где W3 свободный или функционально преобразованный карбоксирадикал.
Соединения формулы I можно преобразовывать в другие соединения формулы I.
Так, например, соединения формулы I, где X- -C(=S)-NH2-радикал, в процессе S-алкирования, например, три-низший алкилоксоний-тетрафторборатом и последующей реакции с аммиаком соответствующей солью аммония преобразуются в соединения формулы I, где X группа-С(=NH)-NR6R7.
Соединения формулы I, где X-N-гидроксиамидиногруппа-С(=NH)-NHOH, путем реакции с пентакарбонилом железа (Fe(CO)5) можно превращать в другие соединения формулы I, где Х аналогичный амидинорадикал -С(=NH)-NH2 (см. например, J.Chem. Soc.Chem.Com.1975, 761). Полученные по этим методам свободные соединения формулы I, обладающие солеобразующими свойствами, можно переводить в их соли по известному методу. Соединения с основными свойствами - путем обработки, например, кислотами или подходящими их производными.
Соединения, включая их соли, можно получать также в форме гидратов. Кристаллы их могут содержать используемый для кристаллизации растворитель.
Полученные в соответствии с изобретением смеси изомеров можно разделять известным способом на отдельные изомеры, рацематы, например, путем образования солей с оптически чистыми солеобразующими реагентами и разделения получающейся при этом смеси диастереомеров, например, с помощью фракционной кристаллизации.
Вышеуказанные реакции могут проводиться в известных условиях в присутствии или отсутствии растворителей и разбавителей, преимущественно таких, которые инертны в данной реакции, и растворяют реагенты в присутствии или отсутствии катализаторов, конденсирующих средств или нейтрализующих агентов, в зависимости от типа реакции и/или реакционных компонентов при повышенных, нормальных и пониженных температурах, например, в температурном диапазоне от -70o до 190oC, преимущественно 20 до 150oC, например, при температуре кипения применяемого растворителя при атмосферном давлении или в закрытом сосуде под давлением и/или в атмосфере инертного газа, например, в атмосфере азота.
В предлагаемом изобретении предпочтительно использовать такие исходные вещества, которые с самого начала ведут к образованию особенно ценных соединений.
Возможно также использование таких методов способа, при которых исходят из соединения, полученного на одной из любых стадий процесса как промежуточного продукта, или таких, при которых в условиях реакции образуется исходное вещество или его производное, например, соль.
Настоящее изобретение касается также фармацевтического средства, содержащего в качестве активного вещества соединения формулы I, имеющие фармацевтическое значение. Особое значение имеют средства энтерального применения, в частности, орального и парентерального применения. Дозировка активного вещества зависит от стадии заболевания, его специфики, возраста, веса и индивидуального состояния больного, а также способа применения лекарства.
Фармацевтический состав содержит от ≈ 0,1% до ≈ 95% активного вещества, причем одноразовые дозы содержат преимущественно от одного процента до девяносто процентов, а недозируемые формы соответственно от ≈ 0,1% до ≈ 20% Дозировочные формы такие, как драже, таблетки или капсулы, содержат от ≈ 1 мг до ≈ 500 мг активного вещества.
Фармацевтические составы, предлагаемые в соответствии с изобретением, получают с помощью таких известных методов, как например, смешивание, гранулирование, дражирование, растворение. Таким образом можно получать фармацевтические составы для орального применения, комбинируя активное вещество с одним или несколькими твердыми веществами-носителями. Полученная смесь гранулируется, и гранулят после добавления вспомогательных веществ перерабатывается в таблетки и драже.
В качестве веществ-носителей могут быть использованы наполнители, такие как сахар, например, лактоза, сахароза, маннит или сорбит, целлюлозные препараты и/или фосфаты кальция, например, трикальций-фосфат или кислый фосфат кальция, кроме того связывающие средства, такие как крахмал, самого различного происхождения (маисовый, пшеничный, рисовый или картофельный), метилцеллюлозы, гидроксипропилметилцеллюлоза, натрий-карбоксиметилцеллюлоза и/или поливинилпирролидон, и/или, по желанию, карбоксиметилкрахмал, поливинилпирролидон с поперечными сетчатыми структурами, альгиновая кислота или ее соль, например, альгинат натрия.
Добавляемые вспомогательные вещества это, в первую очередь, средства, регулирующие поток и смазывание, например, кремниевая кислота, тальк, стеариновая кислота или ее соли, такие как стеарат магния и кальция, и/или полиэтиленгликоль и его производные.
Зернышки драже заключают в подходящие, устойчивые в отношении желудочного сока, покрытия, используя для этой цели концентрированные растворы сахара, содержащие гуммиарабику, тальк, поливинилпирролидон, полиэтиленгликоль и/или двуокись титана растворы лака в подходящих органических растворителях или смеси растворителей, а для получения устойчивых к желудочному соку покрытий растворы соответствующих целлюлозных препаратов, таких как фталат ацетилцеллюлозы и фталат гидроксипропилметилцеллюлозы. В таблетки или зерна драже с покрытиями могут добавляться красители или пигменты, например, для идентификации или маркировки различных доз активного вещества.
Применяемые перорально фармацевтические составы пpедставляют собой мягкие, закрытые желатиновые капсулы с использованием мягчителей, таких как глицерин или сорбит. Капсулы могут содержать активное вещество в форме гранулята, например, в смеси с наполнителями, такими, как крахмал, связывающими средствами и/или смазывающими веществами, например, тальком или стеарином магния, а также стабилизаторами. В мягких капсулах активное вещество растворяется или суспендируется, главным образом, в подходящих жидких вспомогательных веществах, таких как жирные масла, парафиновое масло или жидкие полиэтиленгликоли, также с добавлением стабилизаторов.
Другие применяемые через рот лекарственные формы это приготовляемые обычным способом сиропы, содержащие активное вещество, например, в суспендированном виде в концентрации от 0,1 до 10% предпочтительнее порядка 1% или в этих пределах, которое вводится в виде однократной дозы при отмеривании 5-10 мл сиропа. Кроме того широко используются порошкообразные или жидкие концентраты в различных средах, например, в молоке. Такие концентраты могут расфасовываться в виде однократных доз.
Фармацевтические составы для ректального применения представляют собой свечи, изготовленные из комбинации активного вещества с суппозиторной основой. В качестве свечной (суппозиторной) массы используются, например, натуральные или синтетические триглицериды, парафиновые углеводороды, полиэтиленгликоли или высшие алканолы.
Для парентерального применения используются, в первую очередь, водные растворы активного вещества в растворимой в воде форме, например, водорастворимые соли, или суспензии для инъекций в воде, содержащие вещества повышенной вязкости, например, натрийкарбоксиметилцеллюлоза, сорбит и/или декстран и иногда стабилизаторы.
При этом активное вещество вместе с вспомогательными средствами может существовать также в виде лиофилизата и перед парентеральным введением растворяться при добавлении подходящих растворителей.
Растворы для парентерального применения, могут быть аналогичны растворам для внутривенного введения.
Предлагаемые в соответствии с изобретением соединения могут иметь терапевтическое или профилактическое применение, главным образом, в форме фармацевтических препаратов. При этом при весе тела ≈ 70 кг ежедневная доза колеблется от 1 до 1000 мг, предпочтительно от 25 до 100 мг при оральном и от 2 до 50 мг при парентеральном применении.
Последующие примеры иллюстрируют предмет изобретения, температуры приводятся в градусах Цельсия. Используемые сокращения: ДМФ N, N - диметилформамид, эфир-диэтиловый эфир, эфир уксусной кислоты этиловый эфир уксусной кислоты, ТГФ= тетрагидрофуран, МС(FAB)=масс-спектр ("бомбардировка тяжелыми атомами").
П р и м е р 1.
4-амидино-1-инданон-2'-амидиногидразон-гидрохлорид.
Раствор 3,8 г (27,9 ммолей) кислого аминогуанидинкарбоната в 200 мл воды и 14,7 мл 2-х нормальной соляной кислоты нагревается до 60o и при перемешивании в течение 30 минут разбавляется раствором 5,85 г (27,8 ммолей) 4-амидин-1-инданонгидрохлорида в 200 мл метанола. Реакционная смесь кипятится в течение 24 часов до флегмы и после охлаждения выпаривается досуха. Остаток суспендируется в 50 мл этанола, фильтруется, промывается этанолом и эфиром. Получается указанное в заголовке соединение, содержащее 1 моль кристаллической воды, с т.пл.>330o; МС(FAB):(M+H)+=231;1 H-ЯМР(D2O); δ=8,08 (d, 1H); 7,75 (d, 1H); 7,58 (t, 1H); 3,35 (m, 2H); 2,96 (m, 2H).
Исходные соединения получают следующим образом:
a)
4-тиокарбамоил-1-инданон
Раствор 12,1 г (77 ммолей) 4-циано-1-инданона [Coll. Czechoslov. Chem. Commun. 43, 3227 (1978)] в 200 мл пиридина и 10,6 мл (77 ммолей) триэтиламина насыщается при
температуре 40oC в течение 3 часов сероводородом и перемешивается при той же температуре еще в течение 16 часов. После охлаждения реакционная смесь выпаривается досуха, и остаток
разбавляется 300 мл воды. Выкристаллизовывающийся продукт желтого цвета отсасывается, промывается водой, высушивается и перекристаллизовывается из эфира уксусной кислоты. Получают исходное соединение
(а) с точкой плавления 197oC (при разложении).
б) 4-амидино-1-инданон-гидрохлорид.
Раствор 9,8 г (51,3 ммоля) 4-тиокарбамоил-1-инданона в 500 мл абсолютного метиленхлорида разбавляли при комнатной температуре в атмосфере аргона 10,8 г (54 ммолями) триэтилоксоний тетрафторбората. Через 16 часов к реакционному раствору добавляли смесь 4,2 г карбоната калия и 4,2 г воды. Затем смесь короткое время перемешивали, фильтровали и фильтрат промывали водой. Органическую фазу высушивали над сульфатом магния, фильтровали и выпаривали. Полученный таким образом сырой этилтиоиминоэфир растворяли в 160 мл абсолютного этанола, разбавляли 3,3 г (60 ммолями) хлорида аммония и нагревали в течение 20 часов до флегмы. После охлаждения реакционную смесь выпаривали досуха. Исходное соединение (б) очищали методом хроматографии на 1000 мл амберлита амберлита® (смола ER180) с использованием воды как вымывающего средства и перекристаллизовывали из смеси этанола/эфира. Точка плавления продукта 215-218oC (при разложении).
П р и м е р 2.
4-амидино-1-индадон-2'-(N-гидроксиамидино)-гидразон-дигидрохлорид.
Раствор 316 мг (1,5 ммоля) 4-амидино-1-инданон-гидрохлорида (пример 1б) в 7 мл метанола разбавляли раствором 394 мг (1,5 ммолей) 1-амино-3-гидроксигуанидин-4-толуолсульфоната в 6 мл воды и 0,75 мл (1,5 ммолями) 2-нормальной соляной кислоты. Затем смесь нагревали 2 часа до флегмы, перемешивали в течение 16 часов при комнатной температуре, выпаривали и остаток очищали методом хроматографии (на фармацевтической колонке SR 28-100) на кизельгеле ОРТI-UP С12 (в качестве вымывающего средства используется вода, 5 мл фракции, скорость прогона 27,5 мл/час). Фракции 58-70 соединяли, выпаривали и остаток выкристаллизовывали из этанола. Получали указанное в заголовке соединение в виде воскообразных кристаллов. МС(FAB):(M+H)+=247;1H-ЯМР(D2O); δ=8,06 (d, 1H); 7,73 (d, 1H); 7,58 (t, 1H); 3,36 (m, 2H).
П р и м е р 3.
5-амидино-1-тетралон-2'-амидиногидразон-дигидрохлорид.
Раствор 0,41 г (3 ммоля) кислого аминогуанидинкарбоната в 31,5 мл 0,1 - нормальной соляной кислоты разбавляли 0,675 г
(3 ммолями)
5-амидино-1-тетралон-гидрохлорида и в течение 72 часов кипятили до флегмы. После охлаждения выпаривали досуха и перекристаллизовывали из смеси метанол/эфир указанное в заголовке
соединение с точкой
плавления >250oC: MC(FAB): (M+H)+= 245;1Н-ЯМР(DMSO-d6); d 11,3 (s, 1H); 9,5 (m, 4H); 8,65 (d, 1H); 7,92 (m, 3H); 7,
52 (d, 1H); 7,46 (t,
1H); 2,7-2,85 (m, 4H); 1,9 (m, 4H). Исходное соединение получали следующим образом:
(а) 5-циано-1-тетралон.
Раствор 1,0 г (4,4 ммоля) 5-бром-1-тетралона [J.Org.Chem. 49, 4226 (1984)] в 1,3 мл ДМФ разбавляли 0,41 г (4,5 ммолями) цианида меди (1) и перемешивали в течение 6 часов при 160o. После этого реакционную смесь охлаждали до 80o и добавляли раствор 1,6 г гексагидрата хлорида железа (III) в 2,5 мл воды и 0,44 мл концентрированной соляной кислоты. Перемешивали еще в течение 45 минут, охлаждали, разбавляли смесь водой и экстрагировали толуолом. Органическую фазу промывали водой, высушивали над сульфатом магния, фильтровали и выпаривали. Получали исходное соединение (а) в виде желто-оранжевых кристаллов. ИК(CH2Cl2): 2220, 1690 см-1;1H-ЯМР (CDCl3): d=8,26 (q, 1H); 7,81 (q, 1H); 7,43 (t, 1H); 3,21 (t, 2H); 2,72 (t, 2H); 2,23 (m, 2H).
б) 5-тиокарбамоил-1-тетралон.
Аналогично примеру (1а), 10,6 г (62 ммоля) 5-циано-1-тетралона в 200 мл пиридина и 8,6 мл триэтилламина обрабатывали сероводородом. После соответствующей обработки получали соединение (б) в виде желтых кристаллов. Точка плавления вещества 200-205oC.
(в) 5-амидино-1-тетралон-гидрохлорид.
Аналогично примеру 1б, 8,6 г (42 ммоля) 5-тиокарбамоил-1-тетралона обрабатывали 8,8 г (44 ммолями) триэтилоксоний-тетрафторбората и 2,6 г (49 ммолями) хлорида аммония. Получали указанное в заголовке соединение (в), имеющее вид слегка розоватых кристаллов. МС(FAB):(M+H)+=189.
П р и м е р 4.
4-тиокарбамоил-1-индадон-2'-амидиногидразон-гидрохлорид.
Раствор 1,9 г (10 ммолей) 4-тиокарбамоил-1-инданона (пример 1а) в 50 мл этанола разбавляли 1,36 г (10 ммолями) кислого аминогуанидин-карбоната и 10 мл 2-нормальной соляной кислоты и кипятили до флегмы 24 часа. После охлаждения реакционную смесь выпаривали до суха, получая указанное в заголовке соединение.
П р и м е р 5.
4-амидино-1-инданон-2'-амидиногидразон-дигидрохлорид.
Аналогично примеру 1, проводили взаимодействие 4-тиокарбамоил1-инданон-2'-амидиногидразон-гидрохлорида (пример 4) с тетрафторборатом триэтилоксония и хлоридом аммония. Получали указанное в заголовке соединение с точкой плавления >330o; MC(FAB):(M+H)+=231;1Н-ЯМР (D2O); d=8,08 (d, 1H); 7,75 (d, 1H); 7,58 (t, 1H); 3,35 (m, 2H); 2,96 (m, 2H).
П р и м е р 6.
4-амидино-1-инданон-2'-амидиногидразон-дигидрохлорид.
Раствор 0,26 г (1 ммоль) 4-циано-1-инданон-2-амидиногидразон-гидрохлорида в 5 мл абсолютного метанола разбавляли 1,2 мл 1-нормального раствора метоксида натрия в метаноле и нагревали в течение 16 часов до флегмы. После охлаждения к реакционной смеси добавляли 0,16 г (3 ммоля) твердого хлорида аммония и перемешивали в течение 1 часа при 60oC. После выпаривания реакционной смеси остаток кристаллизовали из разбавленного этанола. Получали указанное в заголовке соединение с точкой плавления >330oC.
Исходные соединения получали следующим
образом:
(a) 4-циано-1-инданон-2-амидиногидразон-гидрохлорид.
Аналогично примеру (1), 314 мг (2 ммоля) 4-циан-1-инданона растворяли в 20 мл метанола, разбавляли раствором 272 мг (2 ммолями) кислого аминогуанидинкарбоната в 9 мл воды и 1 мл 2-нормальной серной кислоты и перемешивали в течение 4 дней при температуре флегмы. После охлаждения реакционную смесь выпаривали досуха, а остаток выкристаллизовывали из воды. Получали указанное в заголовке соединение (а) с точкой плавления > 230oC;1Н-ЯМР (DMSO-d6/D2O); d= 8, 16 (d, 1H); 7,9 (d, 1H); 7,55 (t, 1H); 3,28 (m, 2H); 2,9 (m, 2H); ИК (нужол): 2190 см-1 (CN).
П р и м е р 7.
4-(N-гидроксиамидино)-1-инданон-2'-амидиногидразон-дигидрохлорид.
0,2 г (3 ммоля) гидроксиламингидрохлорида суспендировали в 1 мл абсолютного этанола и разбавляли 2 мл 1-нормального раствора этоксида натрия в этаноле. Смесь перемешивали в течение 1 часа и фильтровали. К фильтрату добавляли раствор 0,26 г (1 ммоля) 4-циано-1-инданон-2-амидиногидразон-гидрохлорида (пример 6а) в 2 мл воды и кипятили 6 часов до флегмы. После охлаждения смесь выпаривали и выкристаллизовывали из воды указанное в заголовке соединение с точкой плавления >250oC.1Н-ЯМР (DMSO-d6 + D2O):d=8,12 (m, 1H); 7,55 (m, 2H); 3,22 (m, 2H); 2,83 (m, 2H).
П р и м е р 8.
4-амидино-2-метил-1-инданон-2'-амидиногидразон-дигидрохлорид.
Аналогично примеру 1, исходя из 4-циан-2-метил-инданона (см. патент США 3956363) получали указанное в заголовке соединение.
П р и м е р 9.
5-амидино-6-метокси-1-тетралон-2'-амидиногидразон-дигидрохлорид.
По аналогии с примером 1, исходя из 5-циано-6-метокси-1-тетралона [Chem. Pharm. Bull. 31, 2329 (1983)] получали указанное в заголовке соединение.
П р и м е р 10.
4-амидино-6-метил-1-инданон-2'-амидиногидразон-дигидрохлорид.
По аналогии с примером 3, исходя из 4-бром-6-метил-1-инданона (Bull.Soc. France, 1964, 3103), получали указанное в заголовке соединение.
П р и м е р 11.
4-амидино-6-метокси-7-метил-1-инданон-2'-амидиногидразон-дигидрохлорид.
По аналогии с примером 3, исходя из 4-бром-6-метокси-7-метил-1-инданона (J. Chem. Soc. Perkin. Trans. 1, 1974, 1911) получали указанное в заголовке соединение.
П р и м е р 12.
4-амидино-6, 7-диметил-1-инданон-2'-амидиногидразон-дигидрохлорид.
По аналогии с примером 3, исходя из 4-бром-6,7-диметил-1-инданона [J. Het.Chem. 24. 677 (1987)] получали указанное в заголовке соединение.
П р и м е р 13.
4-амидино-7-гидрокси-3-метил-1-инданон-2'-амидиногидразон-дигидрохлорид.
По аналогии с примером 3, исходя из 4-бром-7-гидрокси-3-метил-1-инданона [Indian J. Chem. Sect.B, 24 B, 1061 (1985)] получали указанное в заголовке соединение.
П р и м е р 14.
4-(метиламидино)-1-инданон-2'-амидиногидразон-дигидрохлорид.
По аналогии с примером 1б, проводили реакцию тиокарбамоил-1-инданон-2-амидиногидразон-гидрохлорида (пример 4) с тетрафторборатом триэтилоксония и метиламмонийхлоридом. Получали указанное в заголовке соединение.
П р и м е р 15.
4-амидино-инданон-2'-амидиногидразон-дигидрохлорид.
Раствор 6,12 г (45 ммолей) кислого аминогуанидин-карбоната в 100 мл воды и 46 мл 1-нормальной соляной кислоты разбавляли 9,45 г (44, 9 ммолями) 4-амидино-1-инданон-гидрохлорида (см. пример 1б) и в течение 24 часов перемешивали при 24oC. Выкристаллизовавшийся продукт отсасывали, промывали небольшим количеством воды и перекристаллизовывали из 300 мл воды. Получали указанное в заголовке соединение, содержащее 1 моль кристаллической воды. Точка плавления >330oC; MC(FAB):(M+H)+=231;1H-ЯМР(D2O); d=8,08 (d, 1H); 7,75 (d, 1H); 7,58 (t, 1H); 3,35 (m, 2H); 2,96 (m, 2Н).
П р и м е р 16.
4-амидино-2-метил-1-инданон-2'-амидиногидразон-дигидрохлорид.
Раствор 1,0 г (5,0 ммоля) 4-амидино-2-метил-1-инданон-гидрохлорида перемешивали с 0,68 г (5,0 ммолями) кислого аминогуанидин-карбоната в 10 мл 0,5-нормальной соляной кислоты в течение 120 часов при 25oC. Выкристаллизовавшийся продукт отсасывали, промывали небольшим количеством воды и высушивали. Получали указанное в заголовке соединение с точкой плавления >250oC; MC(FAB); (M+H)+= 245;1H-ЯМР (D2O); d=7,95 (d, 1H); 7,66 (d, 1H); 7,48 (t, 1H); 3,45 (m, 2H); 2,85 (d. 1H); 1,12 (d, 3H).
Исходные соединения получали описанным ниже способом:
а) 4-тиокарбамоил-2-метил-1-инданон.
По аналогии с примером 1а, 11,1 г (65 ммолей) 4-циано-2-метил-1-инданона (см. патент США 3956363) в 200 мл пиридина и 9,7 мл триэтиламина обрабатывали сероводородом. После обработки получали исходные соединения (а) в виде желтых кристаллов с точкой плавления 195-198o (при разложении);1Н-ЯМР(DMSO-d6: d= 9,91 (s, 1H); 7,71 (m, 2H); 7,48 (m, 1H); 3,48 (m, 1H); 2,81 (m, 2H); 1,23 (s, 3H); 1,19 (s, 3H).
4-амидино-2-метил-1-инданон-гидрохлорид.
По аналогии с примером 1б, 10,2 г (50 ммолей) исходного соединения (а) обрабатывали 11,0 г (55 ммолями) тетрафторбората триэтилоксония и 3,2 г (60 ммолями) хлорида аммония. Получали исходное соединение (б) в виде розовых кристаллов. Соединение использовали для следующих реакций.
П р и м е р 17.
4-амидино-6,7-диметил-1-инданон-2'-амидиногидразон-дигидрохлорид.
По аналогии с примером 1, исходя из 4-амидино-6,7-диметил-1-инданон-гидрохлорида, получали указанное в заголовке соединение с точкой плавления >240oC; MC(FAB):(M+H)+=259;1H-ЯМР (D2O):d=7,43 (s, 1H); 3,12 (m, 2H); 2,75 (m, 2H); 2, 43 (s, 3H); 2,24 (s, 3H).
Исходные соединения получали следующим образом:
(а): 4-циано-6,7-диметил-1-инданон.
Смесь 17,8 г (74,5 ммоля) 4-бром-6, 7-диметил-1-инданона [J.Het.Chem. 24, 677 (1987)] и 7,3 г (82 ммолей) цианида меди (1) в 18 мл ДМФ перемешивали в течение 6 часов при 170oC. Затем реакционную смесь охлаждали до 100oC и последовательно разбавляли 200 мл толуола и раствором 31,2 гексагидрата хлорида железа (III) в 47 мл воды и 8,2 мл концентрированной соляной кислоты. Перемешивали в течение 20 минут при 70o C, охлаждали и разбавляли смесь толуолом и водой. Органическую фазу отделяли, промывали водой, полунасыщенным раствором кислого карбоната натрия, снова водой, после чего высушивали и выпаривали. Остаток выкристаллизовывали из эфира уксусной кислоты и простого эфира. Получали продукт, соответствующий по своему составу исходному соединению (а), в виде бежевых кристаллов с точкой плавления 160-163oC; ИК (CH2Cl2): 2220, 1710 cм-1.
б) 4-тиокарбамоил-6,7-диметил-1-инданон
По аналогии с примером 1а, 10 г (54
ммоля)
исходного соединения (а) в 200 мл пиридина и 7,5 мл триэтиламина обрабатывали сероводородом. После произведенной обработки получали исходное соединение (б) в виде желтых кристаллов с точкой
плавления
207-208oC.1H-ЯМР (DMSO-d6); d=10,03 (s, 1H); 9,49 (s, 1H); 7,49 (s, 1H); 3,12 (m, 2H); 2,61 (m, 2H); 2,54 (s, 3H); 2,29 (s, 2 H).
в) 4-амидино-6, 7-диметил-1-инданон-дигидрохлорид соединения (б) обрабатывали 4,26 г (21 ммолями) тетрафторбората триэтилоксония и 1,2 г (24 ммолями) хлорида аммония. Получали исходное соединение (в) в виде бежевых кристаллов.
П р и м е р 18.
4-амидино-6,7-диметокси-1-инданон-2'-амидиногидразон-дигидрохлорид.
Раствор 0,4 г (3 ммоля) кислого аминогуанидин-карбоната в 6 мл 0,5-нормальной соляной кислоты разбавляли 0,73 г (2,7 ммолями) 4-амидино-6,7-диметокси-1-инданон-гидрохлорида и перемешивали в течение 24 часов при 50oC. После охлаждения выкристаллизовавшийся продукт отсасывали, промывали небольшим количеством воды и высушивали. Получали указанное в заголовке соединение с точкой плавления >220; МС(FAB); (M+H)+=291;1H-ЯМР(D2O); d=7,45 (s, 1H); 3,97 (s, 6H); 3,27 (m, 2H); 2,98 (m, 2H).
Исходные соединения получали следующим образом:
a)
4-циано-6,7-диметокси-1-инданон.
Смесь 6,5 г (24,2 ммоля) 4-бром-6,7-диметокси-1-инданона [Can.J.Chem. 57, 1603 (1979)] и 2,5 г (28 ммолей) цианида меди в 7 мл ДМФ перемешивали в течение 5,75 часов при 170oC. После охлаждения реакционной смеси до 100oC, последовательно разбавляли 70 мл толуола и раствором 9,7 г (36 ммолями) гексагидрата хлорида железа в 15,6 мл воды и 3,5 мл концентрированной соляной кислоты. Перемешивали в течение 30 минут при 80o, охлаждали, разбавляли смесь толуолом и водой. Органическую фазу отделяли, промывали водой, полунасыщенным раствором кислого карбоната натрия и снова водой, затем просушивали и выпаривали. Остаток перегоняли при 150-160oC/0,1 мбар в круглой перегонной колбе. Получали продукт, соответствующий исходному соединению (а) с точкой плавления 150oC; ИК(СН2Cl2): 2200, 1710 см-1;1H-ЯМР (CDCl3): d 7,33 (s, 1H); 4,12 (s, 3H); 3,90 (s, 3H); 3,19 (m, 2H); 2,76 (m, 2H).
б) 4-тиокарбамоил-6,7-диметокси-1-инданон.
По аналогии с примером 1а, 3,7 г (1 ммолей) исходного соединения (а) в 100 мл пиридина и 2,4 мл триэтиламина обрабатывали сероводородом. Получали исходное соединение (б) в виде светло-желтых кристаллов с точкой плавления 196-199o;1H-ЯМР (DMSO-d6): d= 10,06 (s, 1H); 9,50 (s, 1H); 7,41 (s, 1H); 3,84 (s, 6H); 3,13 (m, 2H); 2,63 (m, 2H).
в) 4-амидино-6,7-диметокси-1-инданон-гидрохлорид.
По аналогии с примером 1б, 3,3 г (13 ммолей) исходного соединения (б) обрабатывали 2,8 г (14 ммолями) тетрафторбората триэтилоксония. Получали исходное соединение (в) в виде бежевых кристаллов с точкой плавления 188o (при разложении);1H-ЯМР (DMSO-d6): d=9,4 (s, 3H); 7,63 (s, 1H); 3,92 (s, 3H); 3,89 (s, 3H); 3,18 (m, 2H); 2,68 (m, 2H).
П р и м е р 19.
4-амидино-3-метил-1-инданон-2-амидиногидразон-дигидрохлорид.
Раствор 300 мг (1,3 ммоля) 4-амидино-3-метил-1-инданон-дигидрохлорида в 6 мл воды разбавляли 300 мг (2,3 ммолями) кислого аминогуанидин-карбоната в 4 мл 0,5-нормальной соляной кислоты и перемешивали в течение 24 часов при 80o. Реакционную смесь охлаждали, выпаривали и остаток очищали методом хроматографии на 180 мл амберлита амберлита® (ЕР-180-смола) при использовании) воды в качестве элюента. Указанное в заголовке соединение перекристаллизовывали из смеси метанол/эфир. Точка плавления >250oC. Rf=0,18 (кизельгель), метиленхлорид (метанол) концентрированный аммиак 5:3:1; MC(FAB):(M+H)+=245;1H-ЯМР (D2 O): δ=7,97 (d, 1H); 7,64 (d, 1H); 7,49 (t, 1H); 3,86 (m, 1H); 3,17 (q, 1H); 2,49 (d, 1H); 1,24 (d, 3H).
Исходные соединения получали следующим образом:
а)
4-циано-3-метилинданон.
Смесь 2,6 г (11,5 ммолей) 4-бром-3-метил-1-инданона [(J.Org.Chem. 22, 1019 (1957)] и 1,14 г (12,7 ммолей) цианида меди (1) в 2,5 мл ДМФ перемешивали в течение 6 часов при 170oC. После этого реакционную смесь охлаждали до 100oC и последовательно разбавляли 50 мл толуола и раствором 4,5 г (16,5 ммолей) гексагидрата хлорида железа в 7 мл воды и 1,7 мл концентрированного раствора соляной кислоты. Перемешивали в течение 20 минут при 70oC, затем охлаждали и разбавляли смесь толуолом и водой. Органическую фазу отделяли, промывали водой, полунасыщенным раствором кислого карбоната натрия и снова еще раз водой, просушивали и выпаривали. Остаток перегоняли при 100-120o/0,05 мбар в трубке с шаровым расширением. Получали продукт, соответствующий соединению в заголовке с точкой плавления 109-111oC; ИК(СН2Cl2): 2220; 1710 см-1;1H-ЯМР(CDCl3): d=7,92 (m, 2H); 7,52 (t, 1H); 3,73 (m, 1H); 3,03 (q, 1H); 2,40 (q, 1H); 1,55 (d, 3H).
б) 4-тиокарбамоил-3-метилинданон.
По аналогии с примером 1а, 1,45 г (8,47 ммолей) исходного соединения (а) в 25 мл пиридина и 1,2 мл триэтиламина обрабатывали сероводородом. Получали соединение (б) в виде бледно-желтых кристаллов с точкой плавления 198-200o C;1 H-ЯРМ(DMSO-d6): d= 9,78 (s, 1H); 7,65 (m, 2H)l 7,46 (m, 1H); 3,98 (m, 1H); 2,95 (q, 1H); 2,26 (q, 1H); 1,25 (d, 3H).
в) 4-амидино-3-метил-1-инданон-гидрохлорид.
По аналогии с примером 1б, 0,96 г (4,68 ммолей) соединения (б) обрабатывали 1,0 г (4,93 ммолями) тетрафторбората триэтилоксония и 0,3 г (6 ммолями) хлорида аммония. Получали исходное соединение (в) в виде бежевых кристаллов.1Н-ЯМР (DMSO-d6):d=9,59 (s, 4H); 7,65 (m, 2H); 7,46 (m, 1H); 3,98 (m, 1H); 2,95 (q, 1H); 2, 26 (q, 1H); 1,25 (d, 3H).
П р и м е р 20.
4-амидино-1-инданон-2'-амидиногидразон-дигидрохлорид.
Смесь 0,32 г (1 ммоля) 4-(N-гидроксиамидино) 1-инданон-2'-амидиногидразон-дигидрохлорида (пример 7), 0,36 мл (2 ммоля) триэтиламина и 0,2 г (1 ммоль) пентакарбонила железа в 10 мл абсолютного ТГФ кипятили 16 часов до флегмы. Затем реакционную смесь выпаривали, и остаток выкристаллизовывали из разбавленной соляной кислоты. Получали указанное в заголовке соединение с точкой плавления >330oC.
П р и м е р 21.
4-амидино-2-этил-1-инданон-2'-амидиногидразон-дигидрохлорид.
3-(2-бромфенил)-2-этилпропионовую кислоту (Германский патент 2733868) циклизовали при нагревании с полифосфорной кислотой с образованием 1-инданон и, по аналогии с примером 3, преобразовывали в указанное в заголовке соединение.
П р и м е р 22.
4-амидино-2-н-бутил-1-инданон-2'-амидиногидразондигидрохлорид.
3-(2-бромфенил)-2-н-бутилпропионовую кислоту (Германский патент 2733868) циклизовали при нагревании с полифосфорной кислотой с образованеим соответствующего 1-инданона и, по аналогии с примером 3, преобразовывали в указанное в заголовке соединение.
П р и м е р 23.
Капсулы,
содержащие 0,25 г активного вещества, например, одно из соединений примеров 1-22, получали следующим образом:
Состав (для 5000 капсул)
Активное вещество 1250 г
Тальк 180
г
Пшеничный крахмал 120 г
Стеарат магния 80 г
Лактоза 20 г
Порошкообразные вещества просеивали через сито с размером отверстий 0,6 мм и смешивали. Порции смеси по
0,
33 г, с помощью специальной машины для капсулирования заключали в желатиновые капсулы.
П р и м е р 24.
Изготавливали 10000 таблеток, содержащих по 5 мг активного вещества, например, соединений, полученных в соответствии с примерами 1-22.
Состав
Активное вещество 50,000 г
Молочный сахар 2535,00 г
Маисовый крахмал 125,
00 г
Полиэтиленгликоль 150,00 г
Стеарат магния 40,00 г
Стерильная вода достаточное кол-во.
Все порошкообразные компоненты просеивали через сито с размером отверстий 0,6 мм. Затем активное вещество, молочный сахар, стеарат магния и половинное количество крахмала смешивали в миксере. Вторую половину крахмала суспендировали в 65 мл воды, и полученную суспензию добавляли к кипящему раствору полиэтиленгликоля в 260 мл воды. Образующуюся пасту вводили в порошкообразную смесь и при добавлении воды гранулировали. Гранулят высушивали в течение ночи при 35oC, пропускали через сито с размером отверстий 1,2 мм и прессовали в таблетки с нанесенными бороздками для разделения на две половинки.
П р и м е р 25.
4-амидино-1-инданон-2'-амидиногидразон.
Раствор 9,63 г (30 ммоль) 4-амидино-1-инданон-2'-амидиногидразон-дигидрохлорид (пример 1) по каплям и при постоянном перемешивании смешали в 900 мл дистиллированной воды с 30 мл 2N едкого натра. Полученный продукт выделяли, промывали ледяной водой и высушивали. Получали указанный в заголовке продукт с точкой плавления 250oC.
Токсичность 4-амидино-1-инданон-2'-амидиногидразон-дигидрохлорид.
При опытах на мышах была установлена максимально допустимая доза (DTM - доза, при которой погибло 10% подопытных животных, т.е. LD10), вводимая внутрибрюшинной инъекцией из расчета 65 мг/кг) (данные веса из расчета на дигидрохлоридную соль).
При опытах на мышах при оральном введении была установлена DTМ больше, чем 500 мг/кг (данные веса из расчета на дигидрохлоридную соль).
Таким образом, заявленное соединение обладает от небольшой до средней токсичностью.
Реферат
Использование: в медицине, т.к. продукт обладает фармацевтической активностью. Сущность изобретения: новые амидиногидразонпроизводные ф-лы 1, при соответствующих значениях
радикалов и средство, обладающее ингибирующим действием на фермент SAMDC. Структура соединения ф-лы 1:

Формула

где A прямая связь или CH2;
X C(=Y)-NR6R7; где Y NH;
Z NH;
R1 водород;
R2 водород, низший алкил;
R3 и R4 водород;
R5 водород или гидрокси;
R5 водород или гидрокси;
R6 и R7 водород,
или их кислотно-аддитивные соли.

где A прямая связь или -СН2-;
X радикал -С(=Y)-NR6R7, где Y NH;
Z NH;
R1 водород;
R2 водород или низший алкил;
R3 и R4 водород;
R5 водород или гидрокси;
R6 и R7 водород,
или его кислотно-аддитивные соли в количестве 0,1 95,0%

Комментарии