Изобретение относится к способу получения новых антибиотиков цефалоспори-
ново.го ряда, которые в силу своего антибактериального действия могут найти
применение в медицине для лечения и/или предупреждения инфекционных заболеваний .
Целью изобретения является получение новых антибиотиков цефалоспоринового
ряда, обладающих высокой активностью одновременно как против грамположительных
, так и против грамотрицательных микроорганизмов.
Пример 1. Получение (6R, 7R)(2- амино-4-тиазолил)-2-{2-(4-ацетокси-2-кар
бокси-5-гидроксифенил)-метил -оксиимино }-ацетамидо -3-(2-карбокси-5-метил-5-три
азоло 1,5-а пиримидин-7-ил)-тиометил -8- оксо-5-тиа-1-азабицикло 4.2.0 окт-2-ен-2-к-
арбоновой кислоты (соединение 5).
Стадия 1. Получение дифенилметилово-
го эфира 2-бромметил-4,5-диацетоксибен- зойной кислоты.
К суспензии 11,9 г 4,5-диацетокси-2- метлибензойной кислоты в 140 мл бензола
добавляют хлористый тионил (14,3 мл) и 2 капли диметилформамида, затем смесь перемешивают
при 50-70°С в течение 1 ч. Рас- творитель удаляют при пониженном
давлении и остаток заново растворяют в бензоле и концентрируют при пониженном
давлении, чтобы удалить остающийся хлористый тионил. Остаток кипятят с обратным
холодильником вместе с 240 мл бензола, 8,45 г N-бромсукцинимида и 230 мг перекиси
бензоила в течение 2 ч. Кипячение с обратным холодильником продолжают в
течение дополнительных 2 ч после добавления 8,45 г N-бромсукцинимида и 230 мг перекиси
бензоила. Полученный раствор оставляют стоять до тех пор, пока он не
достигнет комнатной температуры, а затем концентрируют при пониженном давлении.
Остаток растворяют в четыреххлористом углероде , нерастворимые вещества отфильтровывают
, а фильтрат концентрируют при пониженном давлении. К раствору остатка в
250 мл хлористого метилена добавляют 8,7 г дифенилметанола и 3,82 мл пиридина
при охлаждении льдом и раствор перемешивают в течение ночи при комнатной температуре
. Полученный раствор промывают 1 н.раствором хлористоводородной кислоты
и рассолом, а затем высушивают над безводным сульфатом натрия. Высушенный
раствор концентрируют при пониженном давлении и остаток очищают колоночной
хроматографией на силикагеле, получая 8,8 г целевого соединения.
ЯМР( 5): 7,9-7,2 (12Н, м), 7,1(1 Н, с), 5,0(2Н, с), 2,3(6Н, с).
Стадия 2. Получение дифенилметило- вого эфира 5-ацетокси-4-гидрокси-2-М-фта-
лоилоксиметилбензойной кислоты.
К суспензии 2,9 г N-гидроксифталимида
в 100 мл ацетонитрила добавляют 2,46 мл триэтиламина при охлаждении льдом. Затем
продукт, полученный на стадии 1 (8,8 г), растворяют а 65 мл ацетонитрила и по каплям
добавляют к суспензии. Полученную смесь перемешивают в течение 15 мин при
охлаждении льдом. Добавляют 2,9 г N-гидроксифталимида и перемешивание продолжают
в течение дополнительных 10 мин.
Полученный раствор выливают в 1 н.раствор
лимонной кислоты при охлаждении льдом и экстрагируют дважды этилацетатом. Органический
слой промывают насыщенным раствором кислого углекислого натрия, водои
и рассолом в указанном порядке и высушивают над безводным сульфатом
натрия. Высушенный раствор концентрируют при пониженном давлении и остаток очи-
щают колоночной хроматографией на
силикагеле, получая 3,03 г целевого соединения
.
ЯМР (СОС1з, 5): 7,9-7,2 (16Н, м), 7,0 (1 Н, с), 5,6(2Н.с), 2,3(ЗН,с).
Стадия 3. Получение 2-(2-трифенилметиламино-4-тиазолил )-2-{2-(4-ацетокси-5гидрокси-2-дифенилметилоксикарбонилфенил
)-метил -оксиимино}-уксусной кислоты.
К раствору 1,5 г продукта, полученного
на стадии 2, в 30 мл хлористого метилена
добавляют 0,15 мл метилгидразина медленно
, при охлаждении при -60°С. Раствор перемешивают при -60°С в течение 10 мин и
при 0°С в течение дополнительных 4ч. После отфильтровывания нерастворимых веществ
фильтрат концентрируют при
пониженном давлении и остаток растворяют в метаноле. Этот раствор добавляют к
раствору 0,7 г (2-трифенилметиламино-4-ти- азолил)-глиоксиловой кислоты в 40 мл метанола
. Смесь перемешивают при комнатной температуре в течение 1 ч. Полученный раствор
концентрируют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле, получая
0,65 г целевого соединения в виде бледно- желтых кристаллов.
ЯМР(DMCO-de, 5): 8,8(1Н, уш.с), 7,8-7,0 (28Н, м), 6,8 (1Н, с), 5.4 (2Н, с), 2,3 (ЗН, с).
Стадия 4. Получение дифенилметилово- го эфира (6R, 7Р)-7-(2-(2-трифенилметила-
мино-4-тиазолил)-2-{2-(4-ацетокси-2-дифе- нилметилоксикарбонил-5-гидроксифенил)-
-метил -оксиимино}-ацетамидоЗ-3-(2-дифе- нилметилоксикарбонил-5-метил-5-триазо-
,5-а пиримидин-7-ил)-тиометил -8-оксо- 5-тиа-3-азабицикло 4.2.0 окт-2-ен-2-карбо новой кислоты.
К охлаждаемому льдом раствору 0,63 г продукта, полученного на стадии 3, и 0,5 г
дифенилметилового эфира (6R, 7Я)-7-амино- 3-(2-дифенилметилоксикарбонил-5-метил
5-триазоло 1,5-а пиримидин-7-ил)-тиомет- ил -8-оксо-5-тиа-1-азабицикло 4.2.0 окт-2-
ен-2-карбоновой кислоты в 20 мл сухого хлористого метилена добавляют 0,178гди-
циклогексилкарбодиимида. Смесь перемешивают в течение ночи при комнатной
температуре. После отфильтровыва- ния нерастворимых веществ фильтрат
концентрируют при пониженном давлении и остаток очищают колоночной хроматографией
на силикагеле, получая 0,15 г целевого соединения.
ЯМР (DMCO-de), 10,5, (1 Н, с), 9,6 (1 Н. д), 8,8 (1 Н, уш. с), 7,8 (1 Н, с), 7,7-6,9 (50Н, м),
б,8(1Н,с),5,9(1Н,д.д),5,4(2Н,с),5,3(1Н,д), 4,3 (2Н, уш. с), 3,7 (2Н, АВ кв), 2,6 (ЗН, с), 2,3 (ЗН, с).
Стадия 5. Получение (6R, 7R)(2- амино-4-тиазолил)-2-{2-(4-ацетокси-2-кар-
бокси-5-гидроксифенил)-метил -оксиимино }-ацетамидо -3-(2-карбокси-5-метил-5-три-
а зол о- 1, и ри миди н-7-ил)-тиометил -8- оксо-5-тиа-1-аэабицикло 4.2,0 окт-2-ен-2- карбоновой кислоты.
К охлаждаемому льдом раствору 0,3 г продукта, полученного на стадии 4, в 5,5 мл
дихлорэтана добавляют 0,2 мл анизола и 0,7 мл трифторуксусной кислоты. Смесь пе ре-
мешивают при комнатной температуре в течение 2 ч. После удаления растворителя
декантацией, остаток промывают дихлорэтаном и кристаллизуют с помощью эфира,
получая 0,105 г целевого соединения в виде
бледно-желтых кристаллов (в виде соли
трифторуксусной кислоты).
ИК (КВг), 1772, 1676, 1637, 1598, 1511,1202.
ЯМР (DMCO-de, (5): 9,7 (1Н, д, J - 8 Гц),
7,6 (1Н, с), 7,4 (1Н, с), 7,0 (1Н, с), 6,8 (1Н, с),
5,9 (1 Н, д д, J 5 и 8 Гц), 5,5 (2Н, с), 5,2 (1 Н, д, J 5 Гц), 4,4 (2Н, уш. с), 3,6 (2Н, АВ кв), 2,6
(ЗН,с), 2,2 (ЗН, с).
П р и м е р 2. Получение (6R, 7R)(2-
а м и н о-4-тиа зол и л)-2-{2- 1 -(3,4-д и гидрокси- бензоил)-1-метилэтил -оксиимино}-ацетам-
(2-карбокси-5-метил-5-триазоло 1,5 -а пиримидин-7-ил)-тиометил -8-оксо-5-тиа
-1-азабицикло 4.2.0 окт-2-ен-2-карбоновой кислоты (соединение 6).
Стадия 1. Получение дифенилметилового эфира (6R, 7Р)(2-трифенилметилами-
но-4-тиазолил}-2-{2-{1-{3,4-диацетоксибензоил )-1-метилэтил -оксиимино}-ацетамидо -3-
(2-дифенилметилоксикарбонил-5-метил-5- триазоло 1,5-а пиримидин-7-ил)-тиометил
-8-оксо-5-тиа-1-азабицикло 4.2.0 окт-2-ен-2 -карбоновой кислоты.
К раствору 5,1 г2-(2-трифенилметилами- но-4-тиазолил)-2-{1- 1-(3,4-диацетоксибенз-
оил)-1-метилэтил -оксиимино -уксусной кислоты в 50 мл сухого хлористого
метилена добавляют 5,0 г дифенилметилового эфира (6R , 7Р)-7-амино-3-(2-дифенил-
метилоксикарбонил-5-метил-5-триазоло 1, 5-а пиримидин-7-ил)-тиометил -8-оксо-5-ти
а-1-азабицикло 4.2.0 окт-2-ен-2-карбоновой кислоты и 50 мл диоксана. К смеси добавляют
1,5 г дициклогексилкарбодиимида при охлаждении со льдом и перемешивание
продолжают при комнатной температуре в течение 3 ч. После отфильтровывания нерастворимых
веществ фильтрат концентрируют при пониженном давлении и этилацетат
добавляют к остатку. Нерастворимые вещества отфильтровывают и фильтрат концентрируют
при пониженном давлении. Остаток очищают колоночной хроматографией на
силикагеле, получая 3,85 г целевого соединения .
ИК (КВг), 1781, 1735, 1686, 1596, 1508,1372,1242,701;
ЯМР (DMCO-d6, 5): 9,7 (1Н, д, J 9 Гц), 8,9 (1Н, с), 8,3-7,2 (40Н, м), 6, 9 (1Н, с), 6,7
(1Н,с), 5,9(1Н,дд), Гц), 5,3 (1Н, д, J 5 Гц), 4,4 (2Н, уш. с), 3,7 (2Н, АВ кв), 2,6
(ЗН, с), 2,3 (6Н, с). 1,5(6Н,с).
Стадия 2. Получение (6R,7R)(2-aMMно-4-тиазолил
)-2-{2- 1-(3,4-диацетоксибензоил )-1-метилэтил -оксиимино}-ацетамидо 3-
(2-карбокси-5-метил-5-триазоло 1,5-а пиримидин-7-ил )-тиометил -8-оксо-5-тиа-1 -аз абицикло 4 .2.0 окт-2-ен-2-карбоновой кислоты .
К охлаждаемому льдом раствору 3,8 г продукта, полученного на стадии 1, в 28 мл
дихлорэтана добавляют 1,95 мл анизола и 3,8 мл трифторуксусной кислоты. Смесь перемешивают
при комнатной температуре в течение 3,5 ч. После удаления растворителя декантацией остаток промывают дважды
дихлорэтаном и кристаллизуют с помощью эфира, получая 1,8 г целевого соединения (в
виде соли трифторуксусной кислоты).
ИК (КВг), см 1: 1774, 1685, 1636, 1598,
1509,1373,1203,1112.
ЯМР (DMCO-de, 5): 9,7 (1Н, д, J 9 Гц),
8,1-7,3 (4Н, м), 6,7 (1Н, с), 5,9(1Н,дд, J- 5 и 9 Гц), 5,2 (1Н. д, J 5 Гц), 4,4 (2Н, уш. с),
3,7 (2Н, АВ кв), 2,6 (ЗН, с), 2,3 (6Н, с), 1,5 (6Н, с).
Стадия 3. Получение (6R, 7В)(2-ами- но-4-тиазолил)-2-{2- 1-(3,4-дигидроксибен-
зоил)-1-метилэтил -оксиимино}-ацетамидо -3 -(2-карбокси-5-метил-5-триазоло 1,5-а
пиримидин-7-ил)-тиометил -8-оксо-5-тиа-1 -азабицикло- 4.2.0 окт-2-ен-2-карбоновой кислоты.
Продукт, полученный на стадии 2 (0,6 г), суспендируют в 20 мл воды и рН суспензии
доводят до 8,0 с помощью кислого углекислого натрия. После перемешивания при 30°С
в течение 5 ч, полученный раствор наносят на колонку с носителем типа Диайон HP 10.
Фракции целевого продукта, элюируе- мые с помощью смеси метанола и воды,
собирают и лиофилизируют, получая 0,34 г целевого соединения (в виде натриевой соли).
ИК (КВг), 1772, 1598, 1513. 1406, 1363,1189,1163.
ЯМР (DMCO-de, 3): 9,6 (1Н, д, J 9 Гц), 7,7-6,6 (4Н, м), 6,6 (1 Н, с), 5,8 (1 Н, д д, J -
5 и 9 Гц), 5,1 (1Н, д, J - 5 Гц), 4,6 (2Н, АВ, кв), 3,7 (2Н, АВ кв), 2,6 (ЗН, с), 1,5 (6Н, с).
ПримерЗ. Получение (6R, 7R)(2- амино-4-тиазолил)-2-{2-(5)-карбокси(3,4-д-
иацетоксифенил)-метил -оксиимино -ацета- мидо}-3-(2-карбокси-5-метил-5-триазоло 1
,5-а пиримидин-7-ил)-тиометил -8-оксо-5- тиа-1-азабицикло 4,2.0 окт-2-ен-2-карбоно-
вой кислоты (соединение 7).
Стадия 1. Получение 2-бром(3,4-диаце-
токсифенил)-уксусной кислоты.
К суспензии 51,1 г 3,4-диацетоксифени-
луксусной кислоты в 105 мл четыреххлори- стого углерода добавляют 60 мл хлористого
тионила и смесь нагревают при 70°С а течение 1 ч. После охлаждения до комнатной
температуры добавляют 42,3 г N-бромсук- цинимида, 105 мл четыреххлористого углерода и малое количество бромистоводород- ной кислоты, затем смесь нагревают в течение
еще 1 ч. Полученную смесь концентрируют при пониженном давлении
и остаток снова растворяют вчетыреххлори- стом углероде. После отфильтровывания нерастворимых
веществ фильтрат растворяют в 400 мл ацетона и рН раствора доводят до
4,0 с помощью насыщенного водного раствора кислого углекислого натрия при охлаждении
со льдом. Полученную смесь экстрагируют хлороформом. Хлороформный слой промывают рассолом и высушивают
над безводным сульфатом натрия. Высушенный раствор концентрируют при
пониженном давлении, получая 61,4 г целевого соединения.
ЯМР (CDCI3, б): 9,0 (1Н, уш. с), 7,5-7,1 (ЗН, м), 5,3 (1Н, с), 2,3 (6Н, с).
Стадия 2. Получение дифенилметилово- го эфира 2-бром-(3,4-диацетоксифенил)-ук- сусной кислоты.
К раствору 61,4 г продукта, полученного на стадии 1, в .500 мл ацетона добавляют
дифенилдиазометан, и полученный раствор перемешивают при комнатной температуре
в течение 1 ч. Полученный раствор концентрируют при пониженном давлении и остаток
очищают колоночной хроматографией на силикагеле, получая 48,4 целевого соединения .
ИК (КВг), см 1: 1772, 1756, 1752, 1505, 1371, 1259, 1212, 1113,701.
ЯМР (CDCIs,5): 7,4-7,1 (13Н, м), 6,9(1 Н, с), 5,4(1 Н, с), 2,3 (6Н, с).
Стадия 3, Получение дифенилметило- вого эфира 2-М-фталоилокси-(3,4-диацеток-
сифенил)-уксусной кислоты,
К охлаждаемой льдом суспензии 15,9 г
N-гидроксифталимида в 300 мл ацетонитри- ла добавляют 13,6 мл триэтиламина и раствор
48,4 г продукта, полученного на стадии 2. в 200 мл ацетонитрила, Смесь перемешивают
при охлаждении со льдом в течение 1,5 ч. Полученный раствор концентрируют
при пониженном давлении и снова растворяют в этилацетате. Раствор промывают водой
, 1 н.раствором лимонной кислоты и рассолом в указанном порядке. Промытый
раствор высушивают над безводным сульфатом натрия, концентрируют при пониженном
давлении и остаток очищают колоночной хроматографией на силикагеле,
получая 15,3 г целевого соединения.
ИК (КВг), см 1:-1772, 1735, 1506, 1371,
1260, 1209, 1186, 1114,700.
ЯМР (CDCI3, 5): 7,7 (4Н, с), 8,0-7,1 (13Н,
м), 6,9 (1Н, с), 2,3 (6Н, с).
Стадия 4. Получение дифенилметило-
вого эфира 2-аминоокиси-(3,4-диацетокси- фенил)-уксусной кислоты.
К раствору 15,3 г продукта, полученного на стадии 3, в 200 мл хлористого метилена
добавляют. 1,34 мл метилгидразина медленно при -60°С, и полученную смесь оставляют
стоять до тех пор, пока не достигнет комнатной температуры. После перемешивания
в течение 2 ч к смеси добавляют 0,07 мл метилгидразина, за которым следует
перемешивание в течение еще 30 мин. Нерастворимые вещества отфильтровывают,
фильтрат концентрируют при пониженном давлении и остаток очищают колоночной
хроматографией на силикагеле, получая 8,7 г целевого соединения.
ИК (КВг), см т: 1772, 1752, 1506, 1371, 1256,1210,1180,1113,702.
ЯМР (CDCIa, 5): 7,7-7,0 (13Н, м), 6,9 (1Н, с), 5,2 (1 Н, с), 2,27 (ЗН, с), 2,26 (ЗН, с).
Стадия 5. Получение 2-(2-трифенилме- тиламино-4-тиазолил)-2-{2- дифенилметил-
оксикарбонил-(3,4-диацетоксифенил)-ме- тил -оксиимино}-уксусной кислоты.
К раствору 7,62 г (2-трифенилметилами- но-4-тиазолил)-глиоксиловой кислоты в
400 мл метанола по каплям добавляют раствор 8,7 г продукта, полученного на стадии
4, в 150 мл метанола. Смесь перемешивают при комнатной температуре в течение 1,5 ч
и концентрируют при пониженном давлении , получая 16,0 г целевого соединения в виде сырого продукта,
ИК(КВг)1: 1772, 1256, 1209, 1180, 754, 701.
ЯМР (DMCO-de, 5): 8,9 (1Н, с), 7,8-7,2 (28Н, м), 6,9 (1 Н, с), 6,8 (1 Н, с), 5,9 (1 Н, с), 2,3 (6Н, с).
Стадия 6. Получение дифенилметилово- го эфира (6R, 7Р)(2-трифенилметилэми-
но-4-тиазолил)-2-{2- дифенилметилоксикар- бонил-(3,4-диацетоксифенил)-метил -оксии
мино}-ацетамидо -3-(2-дифенилметилокси- карбонил-5-метил-5-триазоло 1,
иммдин-7-ил)-тиометил -8-оксо-5-тиа-1-аза- бицикло 4.2.0 окт-2-ен-2-карбоновой кислоты .
К охлаждаемому льдом раствору 5,6 г сырого продукта, полученного на
стадии 5, и 5,0 г дифенилмети- лового эфира (6R, 7К)-7-амино-3-(2- дифенилметилоксикарбонил-5-метил
-5-триазоло 1,5-а1пиримидин-7-ил)-тио метил -8-оксо-5-тиа-1-азабицикло-
4.2,0 окт-2-ен-2-карбоновой кислоты в 170 мл хлористого метилена добавляют
1,4 г дициклогексилкарбодиимида. Затем полученную смесь перемешивают при комнатной температуре в течение 5 ч. После отфильтровывания нерастворимых веществ
фильтрат концентрируют при пониженном давлении. Остаток растворяют в этилацета-
те и нерастворимые вещества отфильтровывают . Фильтрат промывают рассолом и
высушивают над безводным сульфатом натрия . Высушенный раствор концентрируют
при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле
, получая 0,73 г (менее полярная форма) и 1,39 г (более полярная форма) целевых соединений.
Менее полярная форма.
ИК (КВг), 1780, 1742, 1737, 1507,
1249,1205,1182,700.
ЯМР (DMCO-de, 5): 9,7 (1Н, д, J 8 Гц),
8,9 (1Н, уш. с). 7,5-7,1 (50Н, м), 6,9 (1Н, с), 6,82 (1 Н, с), 6,78 (1 Н, с), 5,9 (1 Н, с), 5,8 (1 Н, д
д, J 4 и 8 Гц), 5,2 (1Н, д, J 4 Гц), 4,3 (2Н, уш. с), 3,6 (2Н, АВ, кв), 2,6 (ЗН, с), 2,2 (6Н, с).
Более полярная форма.
ИК (КВг), 1780, 1742, 1596, 1507,
1450, 1372, 1205, 1182,700.
ЯМР (DMCO-de, 5): 9,7 (1Н, д, J 9 Гц),
8,9 (1Н, с), 7,4-7,2 (50Н. м), 7,0 (1Н, с), 6,82 (1Н, с), 6,76 (1Н, с), 5,9 (1Н, с), 5,9 (1Н, д д,
J 4 и 9 Гц), 5,2 (1Н, д, J - 4 Гц), 4.3 (2Н, уш. с), 3,7 (2Н, АВ кв), 2,6 (ЗН, с), 2,20 (6Н, с).
Стадия 7. Получение (6R, 7Я)(2-ами- но-4-тиазолил)-2-{Е-(5)-карбокси-(3,4-диа-
цетоксифенил)-метил -оксиимино}-ацетам- (2-карбокси-5-метил-5-триазоло 1,5
-а пиримидин-7-ил)-тиометил -8-оксо-5-тиа -1-азабицикло 4.2.0 окт-2-ен-2-карбоновой кислоты.
К раствору 0,73 г менее полярной формы продукта, полученного на стадии 6, в
3 мл дихлорэтана добавляют 0,4 мл анизола и 0,8 мл трифторуксусной кислоты при охлаждении
льдом, и полученный раствор перемешивают при комнатной температуре в
течение 3 ч. Добавляют дополнительное количество трифторуксусной кислоты (0,6 мл)
и смесь перемешивают в течение 30 мин. После удаления растворителя декантацией
остаток промывают дихлорэтаном и кристаллизуют с помощью эфира, получая 0,3 г
целевого соединения (в виде соли трифторуксусной кислоты).
ИК (КВг), 1773, 1735, 1684, 1637, 1598, 1509, 1373, 1206, 1186.
ЯМР (DMCO-de, 5): 9,6 (1Н, д, J - 8 Гц), 7,6-7,2 (4Н,м), 6,8(1 Н, с), 5,8(1Н,дд, J
4 и 8 Гц), 5,6 (1 Н, с), 5,2 (1 Н, д, J - 4 Гц), 4,4 (2Н, уш. с), 3,72 (1 Н, д, J 22 Гц), 3,48 (1 Н, д,
J 22 Гц), 2,6 (ЗН, с), 2,2 (6Н, с).
-2,9° (с 1,0, метанол : ацетон
1:1).
Пример 4. Получение (6R, 7R)(2-
амино-4-тиазолил)-2-{г-(5)-карбокси(3,4- дигидроксифенил)метил -оксиимино}-аце-
тамидо -3-(2-карбокси-5-метил-5-триазоло 1,5-а пиримидин-7-ил)-тиометил -8-окоо- 5-
тиа-1-азабицикло 4.2.0 окт-2-ен-2-карбоно- вой кислоты (соединение 9).
В 11 мл воды суспендируют 0,27 г продукта , полученного в стадии 7 примера 3, и
рН смеси доводят до 8,0 с помощью кислого углекислого натрия. После перемешивания
при комнатной температуре в течение 6 ч полученный раствор наносят на колонку с
насадкой из Диайона HP 10. Фракции целевого продукта элюируют с помощью воды,
собирают и лиофилизируют, получая 0,14 г целевого соединения (в виде натриевой соли ).
И К (KB г), см 1: 1763, 1599, 1514, 1474, 1404,1360,1314.
. ЯМР (D20, 5):7,2 (1Н, с), 7,0-6,8 (4Н, м), 5,7(1Н,д, , 5,4 (1Н, с), 5,0 (1Н, д,
J 5 Гц), 4,3 (2Н, АВ, кв), 3,4 (2Н, АВ, кв), 2,6 (ЗН,с).
а о25+27,4° (с 1,0, вода).
Пример 5. Получение (6R, (2-
амино-4-тиазолил)-2-{2-)-карбокси(3,4- дигидроксифенил)-метил -оксиимино}-аце-
тамидо -3-(2-карбокси-5-метил-5-триазоло 1, римиди н-7-ил)-тиометил -8-о ксо-5
-тиа-1-азабицикло 4.2.0 окт-2-ен-2-карбоно- вой кислоты (соединение 10).
Стадия 1, Получение (6R, 7R)(2-aMH- но-4-тиазолил)-2-{г-)-карбокси-(3,4-диа-
цетоксифенил)-метил -оксиимино}-аце- тамидо -3-(2-карбокси-5-метил-5-триа--
,5-а пиримидин-7-ил)-тиометил -8-QKCO-5 -тиа-1-азабицикло 4.2. 2-ен-2-карбоновой кислоты.
К раствору более полярной формы продукта , полученного на стадии 6 примера 3
(1,3 г), в 6 мл дихлорэтана добавляют 0,8 мл анизола и 1,6 мл трифторуксусной кислоты
при охлаждении льдом. Полученный раствор перемешивают при комнатной температуре
в течение 4 ч. После добавления 6 мл дихлорэтана растворитель удаляют декантацией
. Остаток промывают дихлорэтаном и кристаллизуют с помощью эфира, получая
0,78 г целевого соединения (в виде соли трифторуксусной кислоты).
ИК (КВг), 1773, 1735, 1683, 1598, 1636, 1509, 1373, 1205, 1185.
ЯМР (DMCO-de, 5): 9,7 (1Н, д, J - 9 Гц), 7,4-7,2 (4Н, м), 6,8 (1Н, с), 5,8 (1Н, д д, J
4 и 9 Гц), 5,6 (1Н, с), 5,2 (1 Н, д, J 4 Гц), 4,5 (2Н, уш. с), 3,79 (1Н, д, J - 17 Гц), 3,60 (1Н, д,
J - 17 Гц), 2,6 (ЗН, с), 2,3 (6Н, с).
-17,4° (с 1,0; метанол: -1:1).
: ацетон
Стадия 2. Получение (6R, 7R)(2-
амино-4-тиазолил)-2-{г-)-карбокси-(3,4- дигидроксифенил)-метилЗ-оксиимино}-аце-
тамидо -3-(2-карбокси-5-метил-5-триазоло
1,5-а пиримидин-7-ил)-тиометил -8-оксо-5-
тиа-1-азабицикло 4.2.0 окт-2-ен-карбонов- ой кислоты.
В 20 мл воды суспендируют 0,5 г продукта , полученного на стадии 1, и рН смеси
доводят до 7,6-8,0 с помощью кислого углекислого натрия. После перемешивания при
комнатной температуре в течение 6 ч полученный раствор наносят на колонку с ди-
айоном HP 10. Фракции целевого продукта,
элюируемые с помощью воды, собирают и
лиофилизируют, получая 0,2 г целевого соединения (в виде натриевой соли).
И К (КВг), 1763, 1601, 1516, 1474, 1404, 1358, 1314.
ЯМР(020, 5): 7,2(1 Н, с), 7,0-6,9 (4Н,м), 5,6 (1 Н, д, J - 5 Гц), 5,4 (1 Н, с), 5,0 (1 Н, д, J
5 Гц), 4,4 (2Н, АВ, кв), 3,4 (2Н, АВ кв), 2,6 (ЗН, с).
а о25+21,8° (с 1,0; вода).
Примерб. Получение (6R, 7R)(2амино-4-тиазолил
)-2-{2- карбокси-(3,4-ди- гидроксифенил)-метил -оксиимино}-ацетам- (2-карбокси-5-метил-5-триазоло
1,5-а пиримидин-7-ил)-тиометил -8-оксо-5тиа-1-азабицикло 4 .2.0 окт-2-ен-2-карбоно- вой кислоты.
Стадия 1. Получение 2-(2-амино-4-тиа- золил)-2-{2- дифенилметилоксикарбонил(3
,4-диацетоксифенил)-метил}-оксиимино}-ук
сусной кислоты.
К охлаждаемому льдом раствору 5,3 г продукта, полученного на стадии 4 примера
3, в 18 мл диметилформамида добавляют 2,03 г (2-аминотиазолил-4-ил)-глиоксиловой
кислоты. Смесь перемешивают в течение ночи при комнатной температуре. Полученный
раствор выливают в ледяную воду (100 мл) и смесь подкисляют (рН 2) с помощью
1 н.раствора хлористоводородной
кислоты и экстрагируют этилацетатом. Органический
слой промывают рассолом и высушивают над безводным сульфатом магния. Высушенный раствор концентрируют
при пониженном давлении и остаток
кристаллизуют с помощью эфира, получая
6,30 г целевого соединения.
ЯМР (DMCO-de, 5): 7,5-7,2 (15Н, м), 6,85
(1Н, с), 6,83 (1Н, с), 5,9 (1Н, с). 2,3 (6Н, с). Стадия 2. Получение дифенилметилового
эфира (6R, 7Р)(2-амино-4-тиазо- лил)-2-{г- дифенилметилоксикарбонил-(3,4
-диацетоксифенил)-метил -оксиимино}-аце- тамидо -3-(2-дифенилметилоксикарбонил-
5-метил-8-триазоло 1,5-а пиримидин-7-ил)тиометил -8-оксо-5-тиа-1-азабицикло 4 ,2.0
окт-2-ен-2-карбоновой кислоты.
К охлаждаемому льдом раствору, содержащему
3,0 г продукта, полученного на стадии 1 и 3,75 гдифенилметиловогоэфира(6К,
7Р)-7-амино-3-(2-дифенилметилоксикарбо- нил-5-метил-3-триазолр 1,5-а пиримидин-7
-ил)-тиометил -8-оксо-5-тиа-1-азабицикло 4.2.0 окт-2-ён-2-карбоновой кислоты в
100 мл хлористого метилена, добавляют 1,54 г дициклогексилкарбодиимида. Смесь
перемешивают при комнатной температуре . После отфильтровывания нерастворимых
веществ фильтрат концентрируют при пониженном давлении и остаток очищают
колоночной хроматографией на силикагеле, получая 4,8 г целевого соединения.
ЯМР (DMCO-de, 5): 9,9 и 9,8 (1Н, д, J 8 Гц), 7,4-6,8 (38Н, м), 5,9 (1Н, м), 5,9 (1Н, с),
5,3 и 5,2 (1Н , д, J 5 Гц), 4,3 (2Н, уш. с), 3,6 (2Н, АВ кв), 2,6 (ЗН, с), 2,3 (ЗН, с), 2,2 (ЗН, с).
Стадия 3. Получение (6R, 7R)(2- амино-4-тиазолил)-2-{2- карбокси-(3,4-диа-
цетоксифенил)-метил -оксиимино}-ацетам- (2-карбокси-5-метил-3-трйазоло 1,5
и ри м и д и н-7-ил)-тиомети ксо-5-тиа -1-азабицикло 4.2.0 окт-2-ен-2-карбоновой кислоты.
К раствору 0,87 г продукта, полученного на стадии 2, в 1,6 мл дихлорэтана добавляют
0,8 мл анизола и 2,4 мл трифторуксусной кислоты при охлаждении со льдом. Полученный
раствор перемешивают при комнатной температуре в течение 2 ч. После удаления
растворителя декантацией остаток промывают дихлорэтаном и кристаллизуют с помощью
эфира, получая 0,6 г целевого соединения (в виде соли трифторуксусной кислоты).
ЯМР (DMCO-de, (5): 9,8 и 9,6 (1Н, д, J 8 Гц), 7,4-6,9 (4Н, м), 6,83 и 6,79 (1 Н, с), 5,8
(1Н, м), 5,6 (1Н, с), 5,2 (1Н, м), 4,4 (2Н, уш. с), 3,7 (2Н, АВ кв), 2,6 (ЗН, с), 2,26 (ЗН, с), 2,24
(ЗН, с).
Стадия 4. Получение (6R, 7R)(2-
амино-4-тиазолил)-2-{2- карбокси-(3,4-диг- идроксифенил)-метил -оксиимино -ацетам-
идо}-3-(2-карбокси-5-метил-3-триазоло 1,5 -а пиримидин-7-ил)-тиометил -8-оксо-5-тиа
-1-азабицикло 4.2.0 окт-2-ен-2-карбоновой кислоты.
В 10 мл воды суспендируют 0,25 г продукта , полученного на стадии 3, и рН смеси
доводят до 8,0 с помощью кислого углекислого натрия. После перемешивания при
комнатной температуре в течение 6 ч полученный раствор наносят на колонку с насадкой
типа Диайон HP 10. Фракции целевого продукта, элюируемые с помощью
воды, собирают и лиофилизируют, получая 0,14 г целевого соединения (в виде натриевой соли).
ЯМР (D20, д): 7,2-6,9 (5Н, м), 5,7 (1Н, м),
5,4(1Н,с),5,0(1Н,м),4,3(2Н,АВкв),3,4(2Н,
АВ кв), 2,6 (ЗН, с).
Пример 7. Получение (6R, 7R)(2-
амино-4-тиазолил)-2-{2-{1-карбокси-1-(3,4- дигидроксифенил)-этил -оксиимино}-ацетамидо -3-
(2-карбокси-5-метил-3-триазоло 1 ,5-а пиримидин-7-ил)-тиометил -8-оксо-5-
тиа-1-азабицикло 4.2.0 окт-2-ен-карбоно- вой кислоты (соединение 11).
Стадия 1. Получение дифенилметилового эфира альфа-бром-альфа-метил-3,4-диа-
цетоксифенилуксусной кислоты.
К суспензии 10,0 г альфа-метил-3,4-диа-
цетоксифенилуксусной кислоты в 10 мл че- тыреххлористого углерода добавляют 12 мл
хлористого тионила и малое количество ди- метилформамида. Смесь перемешивают
при 70°С в течение 30 мин. Растворитель удаляют при пониженном давлении и остаток
заново растворяют в четыреххлористом
углероде (20 мл). К раствору добавляют 5 мл
хлористого тионила, 7,22 г N-бромсукцини- мида и 0,1 мл бромистоводородной кислоты.
Смесь перемешивают при 85°С в течение 1,5ч.
После отфильтровывания нерастворимых веществ фильтрат концентрируют при
пониженном давлении. Остаток растворяют в 60 мл ацетона и рН раствора доводят до 5
с помощью насыщенного раствора кислого
углекислого натрия при охлаждении льдом,
затем доводят рН до 1 с помощью 1 н.раствора хлористоводородной кислоты. Подкисленную
смесь экстрагируют с помощью 400 мл этилацетата и экстракт промывают
рассолом и высушивают над безводным сульфатом натрия. Высушенный раствор
концентрируют при пониженном давлении и остаток растворяют в ацетоне (60 мл) и
добавляют к смеси 7,0 г дифенилдиазометана . Раствор перемешивают в течение ночи и
полученный раствор концентрируют при пониженном давлении. Остаток очищают колоночной
хроматографией на силикагеле, получая 4,1 г целевого соединения.
ЯМР (CDCI3, (5): 7,4-7,0 (13Н, м), 6,9 (1 Н, с), 2,28 (6Н, с), 2,27 (ЗН, с).
Стадия 2. Получение дифенилметилово- го эфира альфа-метил-альфа-фталоилокси-
3,4-диацетоксифенилуксусной кислоты.
К охлажденному льдом раствору 4,1 г
продукта, полученного на стадии 1, добавляют 1,31 г N-гидроксифталимида, а затем безводный
карбонат калия в течение 10 мин. После перемешивания при комнатной температуре в течение 1,5 ч полученный раствор выливают в 1 н.водный раствор лимонной
кислоты (100 мл) и экстрагируют 100 мл этилацетата. Экстракт промывают трижды
рассолом и высушивают над безводным сульфатом натрия. После концентрирования
раствора при пониженном давлении остаток очищают колоночной хроматографией
на силикагеле, получая 1,3 г целевого соединения .
ИК (КВг), 1773, 1741, 1736, 1372, 1263, 1208, 1191, 1170, 1119,702.
ЯМР (CDCIa, 3): 7,8 (4Н, м), 7,4-7,2 (13Н, м), 6,9 (1 Н, с), 2,28 (ЗН, с), 2,27 (ЗН, с), 1,9 (ЗН, с).
Стадия 3. Получение дифенилметилово- го эфира альфа-аминоокси-альфа-метил-3,4-
диацетоксифенилуксусной кислоты.
К раствору 1,3 г продукта, полученного
на стадии 2, в 20 мл сухого хлористого метилена добавляют 0,2 г метилгидразина при
-70°С под потоком азота и раствор перемешивают при -70°С в течение 10 мин, а затем
при 0°С в течение 40 мин. После отфильтро- вывания нерастворимых веществ фильтрат
концентрируют при пониженном давлении и остаток очищают колоночной хроматографией
на силикагеле, получая 0,61 г целевого соединения.
ЯМР (CDCI3, 5): 7,3-7,0 (13Н, м), 6.9 (1 Н, с), 2,28 (ЗН, с), 2,26 (ЗН, с), 1,19 (ЗН, с).
Стадия 4. Получение 2-(2-трифенилме- тиламино-4-тиазолил)-2-{г- 1-дифенилмети-
локсикарбонил-1-(3,4-диацетоксифенил)-э- тил -оксиимино}-уксусной кислоты.
К раствору 0,49 г (2-трифенилметилами- но-4-тиазолил)-глиоксиловой кислоты в
25 мл метанола добавляют по каплям раствор 0,61 г продукта, полученного на стадии
3, в 10 мл метанола. Смесь перемешивают при комнатной температуре в течение 1,5 ч
и концентрируют при пониженном давлении . Остаток очищают колоночной хроматографией
на силикагеле, получая 0,8 г целевого соединения.
ИК (КВг), 1773, 1751, 1743, 1262, 1209, 1168, 1115,701.
ЯМР (DMCO-de, 5): 8,8 (1Н, с), 7,3-7,1 (28Н,м).6,8(1Н,с),6,7(1Н,с),2,3(6Н,с). 1,9 (ЗН.с).
Стадия 5. Получение дифенилметилово- го эфира (6R, 7В)(2-трифенилметмл-
амино-4-тиазолил)-2-{г- 1-дифенилметилок- сикарбонил-1-(3,4-диацетоксифенил)-этил
-оксиимино}-ацетамидо -3-(2-дифенилмет- илоксикарбонил-5-метил-5-триазоло 1,5-а
пиримидин-7-ил)-тиометил -8-оксо-5-тиа-1 -азабицикло 4,2.0 окт-2-ен-2-карбоновой кислоты.
К охлаждаемому льдом раствору 0,8 г продукта, полученного на стадии 4 и 0,7 г
(дифенилметилового эфира (6R, 7Н)-7-ами- но-3-(2-дифенилметилоксикарбонил-5-метил-5-триазоло 1
,5-а пиримидин-7-ил)-тио - метил }-8-оксо-5-тиа-1-азабицикло 4.2.
-2-ен-2-карбоновой кислоты в 30 мл хлористого метилена добавляют 0,19 г дицикло-
гексилкарбодиимида. Смесь перемешивают
в течение ночи при комнатной температуре.
После отфильтровывания нерастворимых веществ фильтрат концентрируют при пониженном
давлении и остаток очищают колоночной хроматографией на силикагеле,
получая 0,6 г целевого соединения.
ИК (КВг), см 1: 1791, 1774, 1741, 1736,
1507, 1207, 1171,700.
ЯМР (DMCO-de, (5): 9,9 и 9,7 (1Н, д, J
8 Гц), 8,9 (1Н, с), 7,5-6,8 (53Н, м), 5,9-5,7
(1 Н, м), 5,2 (1Н, д, J 5 Гц), 4,3 (2Н, уш. с), 3,7
(2Н, АВ кв), 2,6 (ЗН, с), 2,23 (ЗН, с), 2,19 (ЗН, с), 1,9(ЗН,с).
Стадия 6. Получение (6R, 7R)(2- амино-4-тиазолил)-2-{1-{1-карбокси-1-(3,4диацетоксифенил
)-этил -оксиимино -ацета- (2-карбокси-5-метил-5-триазоло 1,5-а пиримидин-7-ил)-тиометил -8-оксо-5
тиа-1-азабицикло 4.2.0 окт-2-ен-2-карбоно- вой кислоты.
К раствору 0,6 г продукта, полученного на стадии 5, в 1 мл дихлорэтана добавляют
0,5 мл анизола и 1 мл трифторуксусной кислоты при охлаждении льдом. Смесь перемешивают
при комнатной температуре в
течение 2 ч. Затем добавляют 1 мл трифторуксусной
кислоты и смесь перемешивают в течение ночи при комнатной температуре.
После добавления 20 мл диэлорэтана к полученному раствору декантацией удаляют
растворитель и остаток кристаллизуют с помощью эфира, получая 0,31 г целевого соединения
(в виде соли трифторуксусной кислоты).
ИК (КВг), 1772, 1735, 1683, 1636,
1597,1509,1263, 1232, 1203, 1172.
ЯМР (DMCO-d6, fy: 9,8-9,7 (1Н, м), 7,4-
7,0 (4Н, м), 6,78 и 6,74(1 Н, с), 5,8-5,7 (1Н,м), 5,3-5,2 (1Н, м), 4,4 (2Н, уш. с), 3,7-3,6 (2Н, м),
2,6 (ЗН, с), 2,2 (6Н, с), 1,8 (ЗН, уш. с).
Стадия 7. Получение (6R, 7Р)(2-ами-
но-4-тиазолил)-2-{7- 1-карбокси-1-(3,4-диг- идроксифенил)-этил -оксиимино}-ацетами-
(2-кар5окси-5-метил-5-триазоло 1,5- а пиримидин-7-ил)-тиометил -8-оксо-5-тиа1-азабицикло 4
.2.0 окт-2-ен-2-карбоновой кислоты.
В 11 мл суспендируют 0,28 г продукта,
полученного на стадии 6, и рН смеси доводят до 8,5 с помощью кислого углекислого
натрия. Смесь перемешивают при комнатной температуре в течение 5,5 ч и полученный
раствор наносят на колонку с насадкой типа Диайон HP 10. Фракции целевого продукта
собирают и лиофилизируют, получая 0,094 г целевого соединения (в виде натриевой соли).
ИК (КВг), 1772, 1596, 1509, 1404, 1395, 1389, 1355, 1311.
ЯМР (D20, 5): 7,2-6,8 (5Н, м), 50,8-5,7 (1 Н, м), 5,2-5,1 (1Н, м),4,5(2Н, АВ кв), 3,5(2Н,
АВ кв), 2,6 (ЗН, с), 1,8 (ЗН, с).
Примере. Получение (6R, 7R)(2-
амино-4-тиазолил)-3-{2- карбокси-(3,4,5- тригидроксифенил)-метил -оксиимино}-аце-
тамидо -3-(2-карбокси-5-метил-3-триазоло ,5-а -пиримидин-7-ил)-тиометил -8-оксо-
5-тиа-1-азабицикло 4.2.0 окт-2-ен-2-карбо- новой кислоты (соединение 12).
Стадия 1. Получение дифенилметило- вого эфира альфа-бром-3,4,5-триацетокси- фенилуксусной кислоты.
К суспензии 34,5 г 3,4,5-триацетоксифе- нилуксусной кислоты в 90 мл четыреххлори-
стого углерода добавляют 32,5 мл хлористого тионила и 0,2 мл диметилформа-
мида. Смесь перемешивают при 60°С в течение 1 ч и охлаждают до комнатной
температуры, Затем добавляют 23,7 г N- бромсукцинимида, 60 мл четыреххпористо-
го углерода и малое количество бромистоводородной кислоты, смесь перемешивают
при в течение 3 ч. Нерастворимые вещества отфильтровывают и фильтрат концентрируют при пониженном
давлении. Остаток растворяют в 200 мл ацетона и рН раствора доводят до 5,0 с помощью
насыщенного раствора кислого углекислого натрия, затем до 1,0 с помощью
1 н.раствора хлористоводородной кислоты при охлаждении льдом. Подкисленную
смесь разбавляют водой и экстрагируют этилацетатом. Экстракт промывают рассо-
лом, высушивают над безводным сульфатом натрия и концентрируют при пониженном
давлении. Остаток растворяют в 200 мл ацетона и добавляют 20,5 г дифенилдиазомета-
на. Раствор перемешивают при комнатной температуре в течение 1 ч. Полученный раствор
концентрируют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле, получая
30 г целевого соединения.
ЯМР (DMCO-de, 5): 7,5-7,3 (12Н, м), 6,9
(1Н, с), 6,2 (1Н, с), 2,3 (9Н, с).
Стадия 2. Получение дифенилметилово-
го эфира альфа-М-фталоилокси-3,4,5-триа- цетоксифенилуксусной кислоты.
К охлажденному льдом раствору 8,8 г М-гидроксифталимида в 180 мл ацетонитрила добавляют 7,5 мл триэтиламина, затем раствор 30 г продукта, полученного на стадии
1, в 120 мл ацетонитрила. Полученную смесь перемешивают при охлаждении
льдом в течение 15 мин, добавляют 1,5 л этилацетата и полученный раствор промывают
с помощью 600 мл охлажденного льдом раствора 1 н.лимонной кислоты и рассолом
, а затем высушивают над безводным
сульфатом натрия. Высушенный раствор
концентрируют при пониженном давлении и остаток очищают колоночной хроматографией
на силикагеле, получая 10 г целевого соединения.
ИК (КВг), см 1: 1782, 1735, 1372, 1208,
1187,1054,700.
ЯМР (DMCO-de, 3): 7,7 (4Н, с), 6,9 (1 Н, с), 6,2 (1Н, с), 2,32 (ЗН, с), 2,29 (6Н, с).
Стадия 3. Получение дифенилметилового эфира альфа-эминоокси-3,4,5-триацеток- сифенилуксусной кислоты.
К раствору 10 г продукта, полученного на стадии 2, в 120 мл хлористого метилена
добавляют 0,83 мл метилгидразина медленно при -60°С. Смесь перемешивают при 0°С
в течение 40 мин. Нерастворимые вещества отфильтровывают и фильтрат концентрируют
при пониженном давлении. Остаток очищают колоночной хроматографией на
силикагеле, получая 2,2 г целевого соединения .
ЯМР (CDCIs, 5): 7,3-7.1 (12Н, м), 6,9 (1 Н, с), 5,2 (1 Н, с), 2,27 (ЗН, с), 2,23 (6Н, с).
Стадия 4. Получение 2-(2-трифенилметиламино-4-тиазолил )-2- 7- дифенилметил -
оксикарбонил-(3,4,5-триацетоксифенил)-ме- тил -оксиимино -уксусной кислоты.
К раствору 1,7 г (2-трифенилметилами- нотиазол-4-ил)-глиоксиловой кислоты в
100 мл метанола по каплям добавляют раствор 2,2 г продукта, полученного на стадии
3, в 40 мл метанола. Раствор перемешивают при комнатной температуре в течение 1 ч, и
полученный раствор концентрируют при пониженном давлении. Остаток очищают колоночной
хроматографией на силикагеле, получая 2,2 г целевого продукта.
ИК (КВг), см 1: 1780, 1752, 1496, 1370, 1206, 1186, 1053,701.
ЯМР (DMCO-de, 5): 8,9 (1Н, с), 7,3-7,2 (27Н, м), 6,86 (1Н, с), 6,83 (1Н, с), 5,9 (1Н, с),
2,30 (ЗН, с), 2,28 (6Н, с).
Стадия 5. Получение дифенилметило-
вого эфира (6R, 7В)(2-трифенилметиламино-4-тиазолил )-2-{2- дифенилметилокси-
карбонил(3,4,5-триацетоксифенил)-метил - оксиимино}-ацетамидо -3-(2-дифенилмети
локсикарбонил-5-метил-5-триазоло 1,5-а пиримидин-7-ил)-тиометил -8-оксо-5-тиа-1
-азабицикло 4.2.0 окт-2-ен-2-карбоновой кислоты.
К охлаждаемому льдом раствору, содержащему 2,2 г продукта, полученного на стадии
4, и 1,84 г дифенилметилового эфира (6R, 7Р)-7-амино-3-(2-дифенилметилокси-
карбонил-5-метил-3-триазоло 1,5-а пирим иди н-7-ил)-тиометил -8-оксо-5-тиа-1 -азаби
цикло 4.2.0 окт-2-ен-2-карбоновой кислоты в 65 мл хлористого метилена, добавляют
0,59 г дициклогексилкарбодиимида. Смесь перемешивают в течение ночи при комнатной
температуре. Нерастворимые вещества отфильтровывают и фильтрат концентрируют
при пониженном давлении. Остаток растворяют в этилацетате и нерастворимые
вещества удаляют фильтрованием. Фильтрат промывают рассолом и высушивают над
безводным сульфатом натрия. Высушенный раствор концентрируют при пониженном
давлении и остаток очищают колоночной хроматографией на силикагеле, получая
0,86 г (менее полярная форма) и 0,94 г (более полярная форма) целевого соединения.
Менее полярная форма (З)-изомер.
И К (KB г), см 1: 1782, 1742, 1521, 1508,
1498,1371,1185,1054,700.
ЯМР (DMCO-de, 5): 9,6 (1Н, д, J 9 Гц),
8,7 (1Н, с), 7,5-7,2 (49Н, м), 6,9 (1Н, с), 6,83 (1Н, с), 6,80 (1Н, с), 5,9 (1Н, с), 5,8 (1 Н, д, J
5 и 9 Гц), 5,2 (1Н, д, J 5 Гц), 4,3 (2Н, уш. с), 3,6 (2Н, АВ кв), 2,6 (ЗН, с), 2,20 (ЗН, с), 2,18
(6Н, с).
Более полярная форма (3)-изомер,
ПК (КВг), см 1: 1782, 1742, 1596, 1498, 1450,1371,744,700.
ЯМР (DMCO-de, д): 9,8 (1Н, д, J 7 Гц), 8,9 (1Н, с), 7,5-7,2 (49Н, м), 6,9 (1Н, с), 6,82
(1Н, с), 6,76 (1Н, с), 5,9(1 Н, с), 5,8 (1Н, д д, J 5 и 7 Гц), 5,2 (1 Н, д, J - 5 Гц), 4,3 (2Н, уш.
с), 3,6 (2Н, АВ кв), 2,6 (ЗН, с), 2,3 (ЗН, с), 2,2 (6Н, с).
Стадия 6. Получение (6R, 7R)(2- амино-4-тиазолил)-2-{2-(3)-карбокси(3,4,5-
триацетоксифенил)-метил -оксиимино} -ацетамидо -3-(2-карбокси-5-метил-3-
триазоло 1,5-а пиримидин-7-ил)-тиоме- тил -8-оксо-5-тиа-1-азабицикло 4.2.0
окт-2-ен-2-карбоновой кислоты.
К раствору 0,8 г продукта, полученного
на стадии 5 в виде менее полярной формы, в 7 мл дихлорэтана добавляют 0,36 мл анизола
и 0,73 мл трифторуксусной кислоты при охлаждении с льдом. Затем полученный
раствор перемешивают при комнатной температуре в течение 3 ч. Растворитель удаляют
декантацией, остаток промывают 5 мл дихлорэтана и кристаллизуют с помощью
эфира, получая 0,45 г целевого соединения (в виде соли трифторуксусной кислоты).
ИК (КВг), 1774, 1676, 1630, 1597, 1509 1193
ЯМР (DMCO-de, 3): 9,5 (1Н, д, J 9 Гц),
7,4 (1 Н, с), 7,3 (2Н, с), 6,8 (1 Н, с), 5,8 (1 Н, д д,
J 5 и 9 Гц), 5,6 (1 Н, с), 5,2 (1 Н, д, J 5 Гц), 4,4 (2Н, уш. с), 3,7 (2Н, АВ кв), 2,6 (ЗН, с), 2,3
(9Н, с).
Стадия 7. Получение (Rj-изомера соединения
, полученного в примере 8, стадия 6. Соединение, полученное на стадии 5 в
виде более полярной формы, подвергают обработке по способу, описанному в стадии
6, получая 0,25 г целевого соединения.
ИК (КВг), см т: 1774, 1676, 1636, 1625,
1597, 1374, 1194.
ЯМР (DMCO-de, 5): 9,8 (1Н, д, J 7 Гц),
7,4 (1 Н, с), 7,3 (2Н, с), 6,8 (1 Н, с), 5,8 (1 Н, д д,
J 5 и 7 Гц), 5,6 (1 Н, с), 5,2 (1 Н, д. J 5 Гц),
4,4 (2Н, уш. с), 3,7 (2Н, АВ кв), 2,6 (ЗН, с), 2,3 (9Н, с).
Стадия 8. Получение (6R, 7Р)(2-ами- но-4-тиазолил)-2-{2-(3)-карбокси(3,4,5-тригидроксифенил
)-метил -оксиимино}ацетам- (2-карбокси-5-метил-3-триазоло 1,5
-а пиримидин-7-ил)-тиометил -8-оксо-5-тиа- -1-азабицикло 4,2.0 окт-2-ен-2-карбоновой кислоты,
В 12 мл воды суспендируют 0,43 г соединения , полученного на стадии 6, и рН смеси
доводят до 8,0 с помощью кислого углекислого натрия под потоком азота. После
перемешивания при комнатной температуре в течение 5 ч, полученный раствор
наносят на колонку с насадкой типа Диайон HP 10. Фракции целевого соединения, элю-
ируемые с помощью воды, собирают и лио- филизируют, получая 0,15 г целевого
соединения (в виде натриевой соли).
ИК (КВг), 1772, 1597, 1513, 1402, 1318.
ЯМР (D20, 5): 7,2 (1Н, с), 7,0 (1Н, с), 6,6 (2Н, с), 5,6(1 Н, д, J 5 Гц), 5,3 Q1 Н, с), 5,0(1 Н,
д, J - 5 Гц), 4,3 (2Н, АВ кв), 3,4 (2Н, Аб кв), 2,6 (ЗН, с).
Стадия 9. Получение (Р)-изомера соединения , полученного на стадии 8.
Соединение, полученное на стадии 7 в
виде более полярной формы, подвергают
обработке по способу, описанному на стадии 8, получая 0,1 г целевого соединения (в
виде натриевой соли).
ИК(КВг), см 1: 1773, 1596, 1517,1311.
ЯМР (D20, 5): 7,2 (1Н, с), 7,0 (1Н, с), 6,6 (2Н,с),5,6(1Н,д,),5,3(1Н,с),5,0(1Н,
д, J 4 Гц), 4,4 (2Н, АВ кв), 3,3 (2Н, кв), 2,6 (ЗН, с).
Пример 9. Получение (6R, 7R)-7-{2-(2- амино-4-тиазолил)-2-{2- карбокси(3,4-ди-
гидроксифенил)-метил -оксиимино}-ацета (8-карбокситетразоло 1,5-в пири-
дазин-6-ил)-тиометил -8-оксо-5-тиа-1-азаб - ицикло 4.2.0 окт-2-ен-2-карбоновой кислоты .
Стадия 1. Получение дифенилметило- вого эфира (6R, 7В)(2-трифенилметила-
мино-4-тиазолил)-2-{2- дифенилметилокси- карбонил-(3,4-диацетоксифенил)-метил -ок-
сиимино}-ацетамидо -3-(8-дифенилметил- оксикарбонилтетразоло 1,5-в пиридазин-6-
ил)-тиометил -8-оксо-5-тиа-1-азабици- кло 4.2.0 окт-2-ен-2-карбоновой кислоты.
К охлаждаемому льдом раствору, содержащему 1,0 г соединения, полученного на
стадии 5 примера 8, и 0,90 г дифенилмети- лового эфира (6R, 7Р)-7-амино-3-(8-дифе-
нилметилоксикарбонилтетразоло 1, - ридазин-6-ил)-тиометил -8-оксо-5-тиа-1-аз
абицикло 4.2.0 окт-2-ен-2-карбоновой кислоты в 50 мл хлористого метилена, добавляют
0,24 г дициклогексилкарбодиимида, Смесь перемешивают в течение ночи при
комнатной температуре. Нерастворимые вещества отфильтровывают, фильтрат концентрируют
при пониженном давлении. Остаток снова растворяют в ацетоне, и нерастворимые вещества отфильтровывают
. Фильтрат концентрируют при пониженном давлении, остаток очищают колоночной
хроматографией на силикагеле, получая 0,75 г целевого соединения.
ИК (КВг), 1774, 1734, 1363, 1297, 1225,1083,700.
ЯМР (CDCIs, 5): 8,1-6,7(551-1, м), 6,1 и 6,0 (1Н, с), 5,9 (1Н, м), 4,9 (1Н, м), 4,7 (2Н, АВ кв),
3,2(2Н,АВкв), 2,3 (6Н, с).
Стадия 2. Получение(6R, 7Р)(2-ами-
но-4-тиазолил)-2-{2- карбокси-(3,4-диацето ксифенил)-метил -оксиимино}-ацетамидо}-
3-(8-карбокси-тетразоло 1,5-в пиридазин- 6-ил)-тиометил -8-оксо-5-тиа-1-азабицикло
4.2.0 окт-2-ен-2-карбоновой кислоты.
К раствору 0,75 г соединения, полученного
на стадии 1, в 3 мл дихлорэтана добав- ляют 0,05 мл анизола и 3 мл
трифторуксусной кислоты при охлаждении льдом. Полученный раствор перемешивают
при комнатной температуре в течение 3,5 ч. Полученный раствор концентрируют при
пониженном давлении и остаток снова растворяют в 15 мл дихлорэтана. Растворитель
удаляют декантацией, а остаток промывают 20 мл дихлорэтана и кристаллизуют с помощью
эфира, получая 0,27 г целевого соединения (в виде соли трифторуксусной кислоты).
ИК (КВг), см 1: 1773, 1676, 1638, 1374, 1208;.
ЯМР (DMCO-de, 5): 9,7 (1Н, м), 8,1 (1 Н, с), 7,4-7,0 (ЗН, м), 6,81 и 6,76 (1 Н, с), 5,8 (1 Н, м),
5,6 (1 Н, с), 5,1 (1 Н, м), 4,3 (2Н, АВ кв), 3,6 (2Н, АВ кв), 2,3 (6Н, с).
Стадия 3. Получение (6R, 7R)(2-aMH- но-4-тиазолил)-2-{2- карбокси-{3,4-дигидро-
ксифенил)-метил -оксиимино}-ацетамидо - 3-{(8-карбокси-тетразоло 1,5-а пиридазин-
6-ил)-тиометил -8-оксо-5-тиа-1-азабицикло 4.2.0 окт-2-ен-2-карбоновой кислоты.
В 6 мл воды суспендируют 0,25 г соединения , полученного на стадии 2, и рН смеси
доводят до 8,5 с помощью кислого углекислого натрия. Смесь перемешивают под атмосферой
азота при комнатной температуре в течение 5 ч и полученный раствор наносят на колонку с насадкой типа
Диайон HP 10. Фракции целевого соединения , элюируемые с помощью воды, собирают
и лиофилизируют, получая 0,15 г целевого соединения (в виде натриевой соли ).
ИК (КВг), 1766, 1589, 1388,
ЯМР (DaO, (5): 7,8 (1 Н, с), 7,2-6,8 (4Н, м),
5,7 (1 Н, м), 5,4 (1 Н, с), 5,0 (1 Н, м), 4,1 (2Н, АВ кв), 3,4 (2Н, АВ кв).
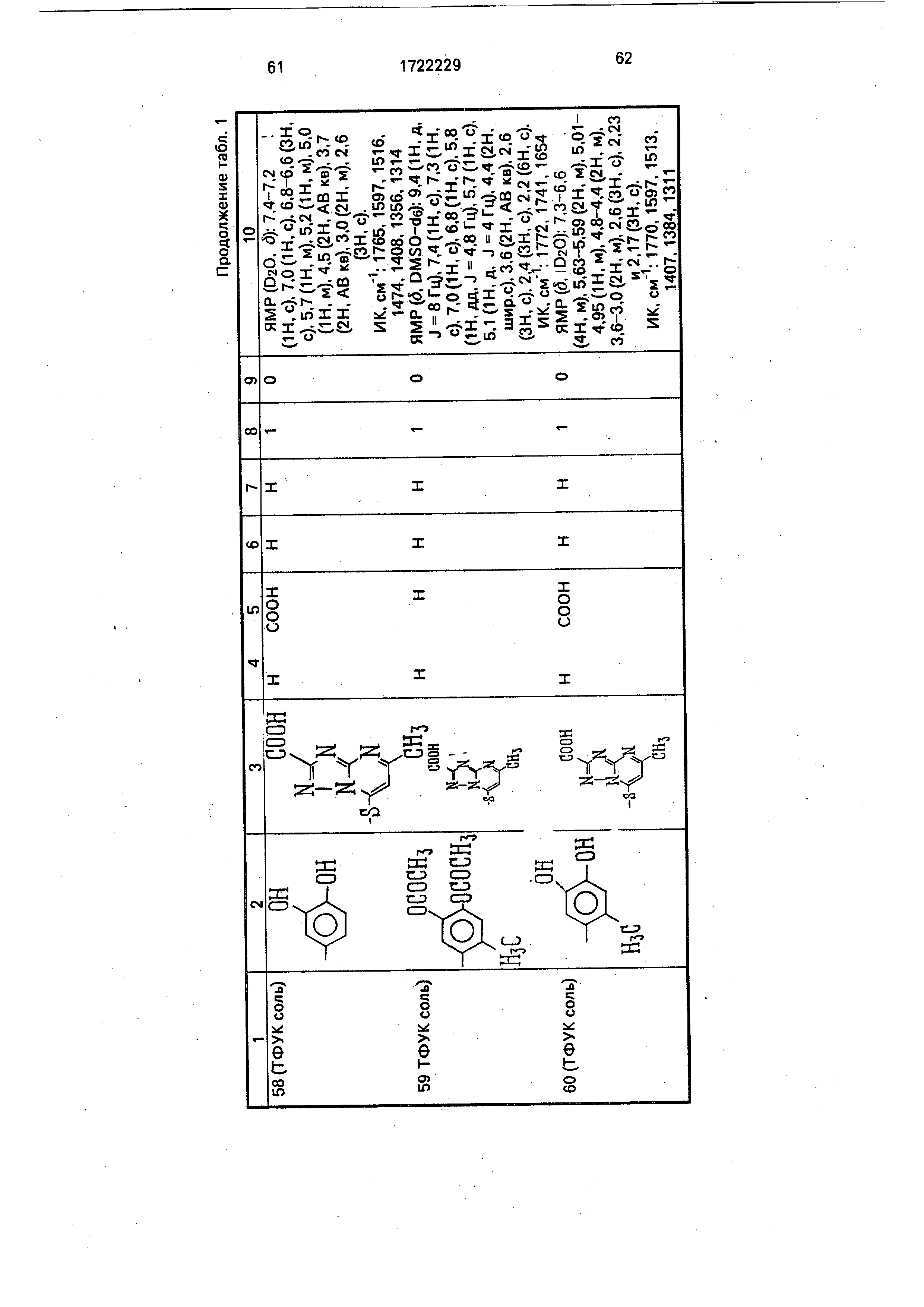
Физико-химические характеристики производных цефалоспорина приведены в табл.1.
Чтобы продемонстрировать полезность соединений, получаемых по предлагаемому
способу ниже показаны данные по антибак- териальной активности отдельных соединений .
Соединение 1: (6R, 7Р)(2-амино-4- тиазолил)-2-{2-(3,4,5-тригидроксибензоил)-
оксиимино -ацетамидо}-3-(2-карбокси-5- метил-5-триазоло 1,5-а пиримидин-7-ил)-
тиометил -8-оксо-5-тиа-1-азабицикло 4.2.0 окт-2-ен-2-карбоновая кислота.
Соединение 2: (6R, 7Р)(2-амино-4- тиазолил)-2-{7-(4,5-диацетокси-2-метилбен
зоил)-оксиимино -ацетамидо}-3-(2-карбок - си-5-метил-3-триазоло 1,5-а пиримидин-7-
ил)-тиометил -8-оксо-5-тиа-1-аза бицикл о 4.2.0 окт-2-ен-2-карбоновая кислота,
Соединение 3: (6R, 7Р)(2-амино-4- тиазолил)-2-{7-(4,5-дигидрокси-2-метилбен-
зоил)-оксиимино -ацетамидо}-3-(карбокси -5-метил-5-триазоло 1,5-а пиримидин-7-ил)
-тиометил -8-о ксо-5-тиа-1 -азаби ци кл .2.0 окт-2-ен-2-карбоновая кислота.
Соединение 4: (6R, 7Р)(2-амино-4- тиазолил)-2-{2-(4,5-дигидрокси-2-метилбен-
зоил)-оксиимино -ацетамидо}-3-(7-метил- 5Н-5-ОКСО-1,3,4-тиадиазоло 1,5-а пиримид
ин-2-ил)-тиометил -8-оксо-5-тиа-1-азабиц№- .2.0 окт-2-ен-2-карбоновая кислота.
Соединение 5: (6R, 7К)(2-амино-4- тиазолил)-2-{2-(4-ацетокси-2-карбокси-5г
гидррксифенил)-метил -оксиимино -аце тамид-3-(2-карбокси-5-метил-3-триазо-
,5-а пиримидин-7-ил)-тиометил -8-ок- со-5-тиа-1-азабицикло 4.2.0 окт-2-ен-2-ка- рбоновая кислота.
Соединение 6: (6R, 7Я)(2-амино-4- тиазолил)-2-{2- 1-{3,4-дигидроксибензоил)-
1-метилэтил -оксиимино -ацетамид}-3-(2- карбокси-5-метил-3-триазоло 1,5-а пирими-
дин-7-ил)-тиометил -8-оксо-5-тиа-1-азабиц- икло- 4.2.0 окт-2-ен-2-карбоновая кислота.
Соединение 7: (6R, 7В)(2-амино-4- тиазолил)-2-{2-(3)-карбокси-(3,4-диацеток-
сифенил)-метил -оксиимино}-ацетамидо -3- (2-карб9кси-5-метил-3-триазоло 1,
имидин-7-ил)-тиометил -8-оксо-5-тиа-1-аза- бицикло 4.2.0 окт-2-ен-карбоновая кислота.
Соединение 8: (6R, 7R)(2-aMHHo-4- тиазолил)-2-{2-)-карбокси-(3,4-диацеток-
сифенил)-метил -оксиимино}-ацетамидо -3- (2-карбокси-5-метил-3-триазоло 1,
имидин-7-ил)-тиометил -8-оксо-5-тиа-1-аза- бицикло 4,2.0 окт-2-ен-2-карбоновая кислота .
Соединение 9: (6R, (2-амино-4- тиазолил)-2-{7-(3)-карбокси-{3,4-дигидрок-
сифенил)-метил -оксиимино}-ацетамидо -3- (2-карбокси-5-метил-3-триазоло 1,
имидин-7-ил)-тиометил -8-о ксо-5-тиа-1-аза бицикло 4.2.0 окт-2-ен-2-карбоновая кислота .
Соединение 10: (6R, 7R)(2-aMHHO-4- тиазолил)-2-{2-(Р)-карбокси-(3,4-дигидрок-
сифенил)-метилЗ-оксиимино}-ацетамидо-3- (2-карбокси-5-метил-3-триазоло 1,
ими ди н-7-ил)-тиометилЗ-8-оксо-5-тиа-1 -аза - бицикло 4.2.0 окт-2-ен-2-карбоновая кислота .
Соединение 11: (6R, 7R)(2-aMHHO-4- тиазолил)-2-{2-(1-карбокси-1-(3,4-дигидрок-
сифенил)-этил -оксиимидо}-ацетамидо -3-( 2-карбокси-5-метил-3-триазоло 1, -
мидин-7-ил)-тиометил -8-оксо-5-тиа-1 -азаб - ицикло 4.2.0 окт-2-ен-2-карбоновая кислота .
Соединение 12: (6R, 7Р)(2-амино-4- тиазолил)-2-{2- карбокси-(3,4,5-тригидрокс-
ифенил)-метилЗ-оксиимино}-ацетамидо -3- (2-ка рбо кси-5-метил-3-триазоло 1, ир -
имидинил-7)-тиометил -8-оксо-5-тиа-1-аза- бицикло 4.2.0 окт-2-ен-2-карбоновая кислота .
Соединение 13: (6R, (2-амино-4- тиазолил)-2-{2- карбокси-(3,4-дигидроксиф-
енил)-метил -оксиимино}-ацетамидо -3-(80
5
0
5
0
5
0
5
0
5
карбокситетразоло 1,5-в пиридазин-6-ил)
тиометил -8-оксо-5-тиа-1-азабицикло 4.2.0 окт-2-ен-2-карбоновая кислота.
Соединение 14: (6R, 7Р)(2-амино-4- тиазолил)-2-(3,4-Дигидроксибензоиламино)
-ацетамидо -3-(2-карбокси-5-метил-3-триа- ,5-а пиримидин-7-ил)-тиометил -8-ок-
со-5-тиа-1-азабицикло 4.2.0 окт-2-ен-2-кар- боковая кислота.
Антибактериальная активность ин вит- ро определяют согласно методу разбавления агаровой пластины.
Каждую платиновую петлю испытуемых бактерий (106 клеток/мл), культивируемых в
жидкой среде Мюллера Хинтона, заражают на агаровых пластинах Мюллера Хинтона,
которые содержат испытуемые соединения при различных концентрациях. После культивирования
при 37°С в течение 20 ч, определяют минимальную ингибирующую концентрацию (МИК, мкг/мл).
Результаты экспериментов представлены в табл. 2.
Защитную способность против систематической инфекции определяют следующим образом. Водную суспензию
испытуемых бактерий иньекцируют внутри- брюшинно 10 мышам вида 1CR четырехнедельного
возраста. Через 1 ч после инфекции внутривенно вводят испытуемые
соединения. Количество выживших мышей подсчитано через 1 неделю после инъекции,
чтобы определить дозу, при которой 50% испытуемых животных были животными (ЕДбО, мг/кг).
Величины эффективных доз испытуемых соединений (EDso, мг/кг) приведены в табл. 3.
Величины LDso предлагаемых соединений представлены в табл. 4 (величины LDso
определены пробитанализом).
Предлагаемые соединения являются активными
против как грамположительных аэробных бактерий, таких как Scaphylococcus aureus, Streptococci, так и
против грамотрицательных аэробных бактерий , таких как Escherichia coli, Klebsiella
pneunioniae, Proteus mirabilis, Proteus morganii, Serratia marcescens, Pseudomonas
aeruginosa, Citrobacter, Enterobacter, Flavobacter, а также анаэробных бактерий,
таких как Peptococci, Peptostreptococci, Bacteroides, и являются исключительно полезными
для лечения инфекционных заболеваний , таких как абсцисс головного мозга,
вызванный Staphylococcus aureus, бактериальный менингит и гнойный менингит, вызванный
с помощью Escherichia coli, Hemophilus influenzae и Streptococcus
pneumoniae, инфекционный эндокартит с
помощью Streptococcus epidermidis, Staphylococcus aureus и Klebslella pneumoniae, пневмония с помощью
Pseudomonas aeruginosa, Hemophllus influenzae, Klebsiella pneumoniae, и
Stapholococcus aureus, и пиелонефрит с помощью Escherichia cot, Klebsiella, Proreus и Pseudomonas.
Производные цефалоспорина, получаемые no предлагаемому способу, могут быть
применены в виде фармацевтических композиций , например в форме фармацевтических композиций, содержащих
производные цефалоспорина вместе с соответствующими фармацевтическими приемлемыми
носителями. Фармацевтическая композиция может быть в твердой форме
(например, таблетки, капсулы) или в жидкой форме (например, инъекции). Композиции
могут быть стерилизованы и содержать вспомогательные вещества, обычно применяемые
в фармацевтической практике.
Кроме того, является предпочтительным
использование соединений после того, как они образуются в виде продукции, высушенной
замораживанием, или в виде, порошков , за которыми следует растворение
их в обычном растворителе, например воде или физиологическом растворе, для их последующего
использования. Соединения могут быть использованы орально или парентерально
. Доза варьируется в зависимости от возраста и состояния пациента,
обстоятельств и вида болезней доза примерно 0,1-10 г, предпочтительно 0,2-5 г.
Они могут быть использованы в виде каждодневной дозы для взрослой особи. Паренте-
ральный прием соединений является особенно предпочтительным.
Формул а и зобретени я Способ получения производных цефалоспорина общей формулы I
R, S,
(j-tfMJk-x
S
к-т-с-зскн-T-rh /sj
я,кн
CQOR6
в виде син-изомеров,
где RI - водород или аминозащитная группа;
R2 - водород или метил;
R3 - водород, метил или свободная или защищенная карбоксигруппа, или R2 и R3 вместе - кислород;
R4 и RS - каждый водород, или RA и RS вместе - кислород;
Re - водород или сложноэфирная защитная группа;
а и b каждый равен 0 или 1;
X - водород, гидроксильная группа или группа общей формулыft.n
ч
(NH)DHp-R9
Hi Re
где R - водород или хлор, метил, гидрокси-, изопропил, метокси-, ацетокси- или карбок- сигруппа;
RS и Rg - одинаковые или различные, каждый - водород, гидрокси-, ацетокси-, метил
, метокси-, этокси-, хлорацетокси-, бута- ноилокси-, метансульфонилокси-, амино-,
нитро-, ацетамино-, бензилоксикар.бонила- мино-, метансульфонил- или паратолуол-
сульфонилоксигруппа, или, взятые вместе, образуют этилендиокси- или карбонилдиок- сигруппу.
Rio - водород, гидрокси-, метил, метокси- , нитро-, хлорацетокси- или ацетоксиг-
руппа;
Z - азот или метиновая группа;
с 0 или 1;
Y - галоген, ацетоксигруппа или группа общих формул$Н1
Ч- г ИаО-ОД тт0 - Ч-f1 rV-У -3 -зАгТогОДтпнв н-Ч
1а оон -да«
N-#Y н-нЛлООЕя N-Mf-NA N
-SWcH,-SW . H.
где Rn - водород или свободная или защищенная карбоксигруппа;
R12 - водород или карбоксилзащитная группа;
Ri3 - метил, гидрокси-, или свободная или защищенная карбокси- или карбоксиме- тильная группа;
Ri4 - водород, или свободная, или защищенная карбокси-или гидроксисульфониль-
ная группа,
или их солей, гидратов или солей их гидратов
, отличающийся тем, что соединение общей формулы ЭД.ЭДо
0
5
0
5
0
5
0
5
ад
COQR6
где Re и Y имеют указанные значения при условии, в случае наличия в заместителе У
карбокси- или гидроксисульфонильной групп, они защищены в виде бензгидрило-
вого сложного эфира, подвергают взаимо- действию с соединением общей формулы
Rt Q4CV4CVX н ij R5 к-т-с-соон
л
R,KK
ст
в виде син-изомера,
где RI-RS, a, b и X имеют указанные значения
, при условии, в случае наличия в заместителе X карбоксигрупп они защищены в
виде бензгидрилового сложного эфира, в среде инертного органического растворителя
, такого, как метиленхлорид, тетрагид- рофуран или их смесь, в присутствии в
качестве конденсирующего агента, N.N -ди- циклогексилкарбодиимида или в присутст-
вии в качестве конденсирующего агента оксихлорида фосфора и одновременно с ок-
сихлоридом фосфора деацилирующего агента, такого, как N.N-диэтиланилин, при
температуре от -30°С до комнатной темпе- ратуры с последующим, в случае необходимости
, снятием защитных групп и выделяют целевой продукт в свободном виде или в
виде гидрата, или их переводят в соль обра- боткой основанием или кислотой.
Приоритетно признакам: 01.04.85 при Ri, Re, а и b имеют указанные в формуле изобретения значения; Ra -
водород или метил, RS- водород, метил или карбоксигруппа; R4 и RS - вместе кислород,
X - группа общей формулы в
. X уъ
RT He
где R - водород или хлор, метил, гидрокси-,
изопропил, метокси-или ацетоксигруппа, RS и Rg одинаковые или различные, каждый -
водород, гидрокси-, ацетокси-, метокси-, этокси-, хлорацетокси-, бутанолокси-, мета-
нсульфонилокси-, амино-, нитро-, ацетами- но- или метансульфонил или взятые вместе
образуют этилендиокси- или карбонилдиок- сигруппу, у - группа общей формулы
S
где Rn - свободная или защищенная карбоксигруппа;
17.05.85 при Ri, R4, RS, Re. а и b имеют
указанные в формуле изобретения значения , R2 - водород или метил, RS - водород,
метил или свободная или защищенная карбоксигруппа , X - группа общей формулы
Л
Rg
RP
где Re и Rg одинаковые или различные, каждый - гидрокси- или ацетоксигруппа, Z -
азот или метиновая группа, Y - группа общей формулы -S
5 0
5
0
5 0
5
0
5
ВД
-к-к
где Rn - свободная или защищенная карбоксигруппа;
04.07.85 при Ri, Re, а и b имеют указанные
в формуле изобретения значения, R2 - водород или метил, RG - водород, метил или
свободная или защищенная карбоксигруппа , R4 и RS - вместе кислород, X - группа общей формулы
RIO
пи.-/
/Л р
«КОУ-онИЛИ Г9
R7 R&
где R - водород или хлор, метил, гидрокси-, изопропил или карбоксигруппа, Re - водород
, гидрокси- или ацетоксигруппа, Rg - водород , гидрокси-, ацетокси- или
аминогруппа, Rio водород, гидрокси- или ацетоксигруппа, Y - группа общей формулы
1оно
AN-Nм-К уСОгН N-NA,
Н/ -Ч-Чй , -S -W ИМ| -VSrCHj
где Ri3 - метил или свободная или защищенная
карбоксигруппа, Ri4 имеет указанные в формуле изобретения значения;
27.07,85 при RI и Re имеют указанные в формуле изобретения значения, R2 - водород
, RS - свободная или защищенная карбоксигруппа , а 1; b О, X - группа общей формулы -O-Rg
R8
где Re и Rg одинаковые или различные, каждый
- водород или гидроксигруппа, Y - группа формул н-к
-S
ЛN-К Н-Н H--N
V г -УЧ, Hf
to3 (Ьыад- , s s-w:
-s
HjC
A-M 11
toW гпн
S Nон
N-MV°U11
1 II-. к Г
Mw,HMHV.
или
H3C
COOH
-Л
10.03.86-устанавливается по всем признакам
формулы изобретения.
Н- НгмЛ
R2 RI,
W-jVicM Rj R5
СОНН-г- -rS
COOH
Таблица 1
-4 ГО
го го ю
0
-j ю ю to ю
(Ј
-j ю to го го со
-j ю ю кз го
tO
Bzl - бензильная группа.
Ts - п-толуолсульфонильная группа.
Штамм, устойчивый к метициллину.
Таблица 2
Таблица 3









































Комментарии