Карбоксамиды, способ их получения и фармацевтическая композиция - RU2163232C2
Код документа: RU2163232C2
Чертежи












Описание
Настоящее изобретение относится к соединениям и их фармацевтически приемлемым солям, обладающим способностью ингибировать матричные металлопротеазы и, следовательно, пригодным для лечения болезненных состояний у млекопитающих, облегчаемых в результате ингибирования таких матричных металлопротеаз.
Предпосылки создания изобретения
Матричные металлопротеазы (ММП) представляют
собой семейство протеаз
(ферментов), участвующих в разложении и реконструировании соединительных тканей. Представители этого семейства ферментов-эндопептидаз присутствуют в различных типах клеток,
которые находятся в
соединительной ткани или связаны с ней, таких, как фибробласты, моноциты, макрофаги, эндотелиальные клетки и инвазивные или метастатические клетки опухоли. Экспрессия ММП
стимулируется факторами роста
и цитокинами в ближайшем окружении ткани, где эти ферменты вызывают специфическое разложение протеиновых компонентов внеклеточного матрикса, таких, как коллаген,
протеогликаны (протеиновое ядро),
фибронектин и ламинин. Эти повсеместно распространенные компоненты внеклеточного матрикса присутствуют в выстилках суставов, интерстициальных соединительных тканях,
базальных мембранах и хрящах.
Избыточное разложение внеклеточного матрикса с помощью ММП обусловливает патогенез различных заболеваний, в том числе ревматоидного артрита, остеоартрита, периодонтита,
аберрантного ангиогенеза,
разрастания опухоли и метастаз, изъязвления роговицы и осложнения при диабете. Следовательно, ингибирование ММП представляет собой хорошую мишень для терапевтического
вмешательства.
ММП обладают многочисленными свойствами, в том числе цинк- и кальций-зависимостью, секрецией в виде проферментов и 40-50%-ной гомологией последовательности аминокислот. Семейство ММП включает коллагеназы, стромелизины, желатиназы и матрилизин, как более детально описано ниже.
Интерстициальные коллагеназы катализируют начальное расщепление и расщепление с ограниченной скоростью нативного коллагена типов I, II, III и X. Коллаген - главный структурный протеин у млекопитающих - является основным компонентом матрикса многих тканей, например, хрящевой, костной, ткани сухожилий и кожи. Интерстициальные коллагеназы являются очень специфичными матричными металлопротеазами, расщепляющими коллаген с получением двух фрагментов, которые спонтанно денатурируют при физиологических температурах и поэтому становятся чувствительными к расщеплению менее специфическими ферментами. Расщепление с помощью коллагеназы приводит к потере структурной целостности ткани-мишени, и оно представляет собой практически необратимый процесс.
Желатиназы включают два различных, но очень близких фермента: фермент 72 кДа, секретируемый фибробластами и широким разнообразием других типов клеток, и фермент 92 кДа, высвобождаемый из одноядерных фагоцитов, нейтрофилов, эпителиальных клеток роговицы, клеток опухоли, цитотропобластов и кератиноцитов. Было установлено, что эти желатиназы обладают способностью разлагать желатины (денатурированные коллагены), коллаген типов IV (базальную мембрану) и V, фибронектин и нерастворимый эластин.
Было установлено, что стромелизины (1 и 2) обладают способностью расщеплять широкий спектр матричных субстратов, в том числе ламинин, фибронектин, протеогликаны и коллаген типов IV и IX в их неспирализированных областях.
Матрилизин (мнимая металлопротеаза или PUMP) является недавно открытым представителем семейства матричных металлопротеаз. Было установлено, что матрилизин обладает способностью разлагать широкий спектр матричных субстратов, в том числе протеогликаны, желатины, фибронектин, эластин и ламинин. Его экспрессия была зафиксирована в одноядерных фагоцитах, эксплантатах матки крыс и в единичных случаях в опухолях.
Ингибиторы матричных металлопротеаз пригодны для лечения заболеваний, обусловленных избыточным разложением внеклеточного матрикса, таких, как артриты (ревматоидный артрит и остеоартрит), болезни, связанные с резорбцией кости (такие, как остеопороз), увеличение деструкции коллагена, связанное с диабетом, периодонтит, изъязвление роговицы, изъязвление кожи, разрастание опухоли и метастаз, а также аберрантный ангиогенез.
Создание и применение ингибиторов ММП описано, например, в J. Enzyme Inhibition (1987), т. 2, стр. 1-22; Drug News & Prospectives (1990), т. 3, N 8, стр. 453-458; Arthritis and Rheumatism (1993), т. 36, N 2, стр. 181-189; Arthritis and Rheumatism (1991), т. 34, N 9, стр. 1073-1075; Seminars in Arthritis and Rheumatism (1990), т. 19, N 4, Приложение 1 (февраль), стр. 16-20; Drugs of the Future (1990), т. 15, N 5, стр. 495-508; и в J. Enzyme Inhibition (1987), т. 2, стр. 1-22. Ингибиторы матричных металлопротеаз также являются предметом различных патентов и заявок на патенты, например, патентов США 5189178 (Galardy) и 5183900 (Galardy), европейских опубликованных заявок на патенты 0438223 (Beecham) и 0276436 (F. Hoffmann-La Roche) и опубликованных Международных заявок PCT 92/21360 (Merck), 92/06966 (Beecham) и 92/09563 (Glycomed).
Краткое изложение сущности
изобретения
Изобретение относится к новым соединениям, которые могут быть использованы в качестве ингибиторов матричных металлопротеаз
и которые эффективны для лечения болезненных состояний,
обусловленных избыточной активностью матричных металлопротеаз.
Таким образом, один предмет изобретения относится к соединениям
формулы (I):

где R1 обозначает меркапто, ацетилтио, карбокси, гидроксикарбамоил, N-гидроксиформиламино, алкоксикарбонил, арилоксикарбонил, аралкоксикарбонил, бензилоксикарбамоил или группу формулы

где R6 обозначает арил или гетероарил;
R2 обозначает алкил, циклоалкил, арил, гетероциклоалкил или гетероарил;
R3 обозначает алкил, циклоалкил, аралкил или гетероаралкил;
R7 обозначает арил, гетероарил или гетероциклоалкил;
X обозначает группу формулы -(CH2)m-Y-(CH2)n-, где
Y обозначает О, S или простую связь,
m обозначает целое число от 0 до 4,
n обозначает целое число от 0 до 4 и
m+n обозначает целое число от 0 до 4;
p обозначает целое число от 0 до 4 при условии, что R2-X обозначает бифенилалкил, когда p не равно 0;
и к их фармацевтически приемлемым солям.
Другой предмет изобретения относится к способу синтеза соединений и солей формулы (I).
Еще один предмет изобретения относится к подсемейству соединений формулы
(I), т.е. к представленным ниже соединениям формулы
(II)
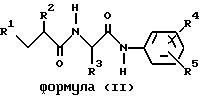
где R1 обозначает меркапто, ацетилтио, карбокси, гидроксикарбамоил, алкоксикарбонил, арилоксикарбонил, аралкоксикарбонил, бензилоксиаминокарбонил или группу формулы

где R6 обозначает арил или гетероарил;
R2 обозначает алкил, аралкил или циклоалкилалкил;
R3 обозначает циклоалкил, алкил (необязательно замещенный циклоалкилом, гидрокси-, меркапто-, алкилтио-, аралкокси-, карбокси-, амино-, алкиламино-, гуанидиногруппой, карбамоилом, пиридилом или индолилом) или аралкил (необязательно замещенный гидрокси-, карбоксигруппой, алкилом или алкоксигруппой);
R4 обозначает нитро, амино, циано, гидрокси, алкокси, карбокси, алкоксикарбонил, алкилсульфонил, галоидалкил, алкоксикарбонилалкил, тетразолил, карбамоил (необязательно замещенный алкилом или диалкиламиноалкилом) или аминосульфонил (необязательно замещенный алкилом); и
R5 обозначает водород, галоген или гидрокси;
в виде отдельного стереоизомера или их смеси; и к их фармацевтически приемлемым солям.
Еще один
предмет изобретения относится к соединениям
формулы

где R2 обозначает алкил, арил или гетероарил; и
X обозначает группу формулы -(CH2)m-Y-(CH2)n-, где
Y обозначает О, S или простую связь,
m обозначает целое число от 0 до 4,
n обозначает целое число от 0 до 4 и
m+n обозначает целое число от 0 до 4; или же
R2 и X вместе обозначают низший алкенил.
Другой предмет изобретения относится к способам
синтеза соединения формулы

где R2 обозначает арил или гетероарил, путем
(а) гидрирования соединения формулы
в присутствии палладия на угле в качестве катализатора; или
(б) взаимодействия соединения формулы

с гексаметилдисилазидом натрия или трет-бутилбромацетатом.
Еще один предмет изобретения относится к соединениям формулы
где R2 обозначает арил или гетероарил, и к способу синтеза этих соединений путем
(а) взаимодействия соединения формулы
где
R2 обозначает водород, арил или гетероарил, с избытком мезилхлорида в пиридине с последующим кипячением с обратным холодильником в основных условиях и
(б) когда R2 обозначает водород, на стадии (а) путем взаимодействия продукта со стадии (а) с галоидарилом или галоидгетероарилом в присутствии основания и палладиевого катализатора.
Другой предмет изобретения относится к способу ингибирования активности матричных металлопротеаз у млекопитающего, включающему введение млекопитающему в случае необходимости терапевтически эффективного количества соединения формулы (I), как оно определено выше, в виде отдельного стереоизомера либо их смеси или его фармацевтически приемлемой соли.
Еще один предмет изобретения относится к фармацевтической композиции, пригодной для ингибирования активности матричных металлопротеаз у млекопитающего, причем эта композиция включает терапевтически эффективное количество соединения формулы (I), как оно определено выше, в виде отдельного стереоизомера либо их смеси или его фармацевтически приемлемой соли и фармацевтически приемлемый эксципиент.
Подробное описание изобретения
Определения
В описании изобретения и в
формуле изобретения, если не указано иное, следующие
понятия имеют указанные ниже значения.
"ВОС" обозначает трет-бутоксикарбонил.
"КБЗ" обозначает бензилоксикарбонил (карбобензилокси).
"ДЦК" обозначает N, N-дициклогексилкарбодиимид.
"ДМАП" обозначает N,N-диметиламинопиридин.
"ДМФ" обозначает N,N-диметилформамид.
"ЭДКИ" обозначает N-этил-N'-(3-диметиламинопропил)карбодиимид.
"ГОБТ" обозначает 1-гидроксибензтриазол.
"Гидрокси" обозначает радикал - ОН.
"Амино" обозначает радикал -NH2.
"Ацетилтио" обозначает радикал -SC(O)CH3.
"Галоген" обозначает бром, хлор или фтор.
"Карбамоил" обозначает радикал -C(O)NH2.
"Карбокси" обозначает радикал - С(O)ОН.
"Гидроксиамино" обозначает радикал -NHOH.
"Гидроксикарбамоил" обозначает радикал -C(O)NHOH.
"N-Гидроксиформиламино" обозначает радикал -N(OH)C(O)H.
"Бензилоксикарбамоил" обозначает -С(O)N(Н)OCH2С6H5.
"Ациламино" обозначает -NHC(O)Ra, где Ra обозначает алкил.
"Меркапто" обозначает радикал -SH.
"Алкил" обозначает одновалентный радикал с прямой или разветвленной цепью, состоящий только из углерода и водорода, не содержащий ненасыщенных связей и имеющий от одного до десяти атомов углерода, например, метил, этил, н-пропил, 2-метилпропил (изобутил), 1-метилэтил (изопропил), н-бутил и 1,1-диметилэтил (трет-бутил), гептил и т.п., который необязательно может быть замещен циклоалкилом, гидрокси-, меркапто-, алкилтио-, аралкокси-, карбокси-, амино-, моно- и диалкиламино-, гуанидино-, N,N- диалкилгуанидиногруппой, карбамоилом, арилом и гетероарилом.
"Алкандиил" или "алкилен" обозначает двухвалентный радикал с прямой цепью, состоящий только из углерода и водорода, не содержащий ненасыщенных связей и имеющий от одного до пяти атомов углерода, например, метилен, этилен, пропилен (или пропан-1,3- диил) и т.п.
"Низший алкенил" обозначает одновалентный углеводородный радикал с прямой цепью, содержащий от двух до шести атомов углерода и имеющий по крайней мере одну ненасыщенную связь, например, проп-2-енил, пент-4-енил и т.п.
"Алкиламино" обозначает радикал формулы -NHRa, где Ra обозначает алкил, как определено выше, например, метиламино, этиламино, изопропиламино, н-бутиламино и т.п.
"Галоидалкил" обозначает радикал формулы -RaRd, где Ra обозначает алкил, как определено выше, замещенный одной или несколькими галоидными группами (Rd), как определено выше, например, 2-хлорэтил, 2-бромэтил, трифторметил и т.п.
"Диалкиламиноалкил" обозначает радикал формулы RaN(Ra)2, где каждый Ra независимо друг от друга обозначает алкильный радикал, как определено выше, например, диметиламиноэтил, диэтиламино-н-пропил, диметиламино-н-пропил и т. п.
"Аминосульфонил" обозначает -S(O)2NH2.
"Алкилсульфонил" обозначает радикал формулы -S(O)2Ra, где Ra обозначает алкил, как определено выше, например, метилсульфонил, этилсульфонил, изопропилсульфонил и т.п.
"Алкилсульфинил" обозначает радикал
формулы -S(O)Ra, где Ra обозначает алкил, как определено выше
"Алкилтио" обозначает радикал формулы -SRa, где Ra обозначает необязательно
замещенный алкил, как
определено выше, например, метилтио, этилтио, изопропилтио, н-бутилтио и т.п.
"Алкокси" обозначает радикал формулы -ORa, где Ra обозначает алкил, как определено выше, например, метокси, этокси, н-пропокси, 1- метилэтокси, н-бутокси, трет-бутокси и т.п.
"Алкоксикарбонилалкил" обозначает радикал формулы -Ra C(O)Rb, где Ra обозначает алкил, как определено выше, a Rb обозначает алкокси, как определено выше, например, метоксикарбонилэтил, этоксикарбонилэтил, метоксикарбонилизопропил и т.п.
"Арил" обозначает одновалентный ненасыщенный ароматический карбоциклический радикал, который имеет одно кольцо (например, фенил), два сконденсированных кольца (например, нафтил) или три сконденсированных кольца (например, фенантренил или фторенил) и который необязательно может быть замещен одним или несколькими заместителями, независимо выбранными из алкила, гидрокси-, карбоксигруппы, галогена, циано-, амино-, нитрогруппы, тетразолила, тетероарила, аминоалкокси-, алкилтиогруппы, галоидалкила, алкоксигруппы, алкоксикарбонила, алкоксикарбонилалкила, алкилсульфонила, алкилсульфинила, аминосульфонила, необязательно замещенного алкилом, карбамоила, необязательно замещенного алилом или диалкиламиноалкилом, или же заместитель может представлять собой другую алкильную группу, как она определена в настоящем описании (например, с образованием необязательно замещенного бифенильного радикала).
"Арилокси" обозначает радикал формулы -ORb, где Rb обозначает арил, как определено выше, например, фенокси, хинол-2-илокси, нафт-1-илокси или нафт-2-илокси.
"Аралкил" обозначает радикал формулы -RaRb, где Ra обозначает алкил, как определено выше, a Rb обозначает арил, как определено выше, например, бензил, фенилэтилен, 3-фенилпропил и т.п.
"Аралкокси" обозначает радикал формулы -ORaRb, где Ra обозначает алкил, как определено выше, a Rb обозначает арил, как определено выше, например, бензилокси, 3-нафт-2- илпропокси и т.п.
"Алкоксикарбонил" обозначает радикал формулы - C(O)Rb, где Rb обозначает алкокси, как определено выше, например, метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил и т.п.
"Аралкоксикарбонил" обозначает радикал формулы -C(O)Rc, где Rc обозначает аралкокси, как определено выше, например, бензилоксикарбонил и т.п.
"Циклоалкил" обозначает одновалентный циклический радикал, состоящий только из атомов углерода и водорода, не содержащий ненасыщенных связей и имеющий от пяти до семи атомов углерода, например, циклопентил, циклогексил и циклогептил.
"Циклоалкилалкил" обозначает радикал формулы -Re Ra, где Ra обозначает алкил, как определено выше, a Re обозначает циклоалкил, как определено выше, например, циклогексилметил, циклогексилэтил, циклопентилметил и т.п.
"Гетероарил" обозначает одновалентный ненасыщенный ароматический карбоциклический радикал, имеющий одно кольцо или несколько сконденсированных колец, включающих по крайней мере один гетероатом, такой, как N, О, S (например, пиридил, хинолил, индолил, карбазолил, дибензфуранил, дибензтиофенил, фенантридинил), которые необязательно могут быть замещены одним или несколькими заместителями, независимо выбранными из алкила, гидрокси-, карбокси-, галогена-, циано-, амино-, нитрогруппы, тетразолила, арила, аминоалкокси, алкилтиогруппы, галоидалкила, алкоксигруппы, алкоксикарбонила, алкоксикарбонилалкила, алкилсульфонила, алкилсульфинила, аминосульфонила, необязательно замещенного алкилом, и карбамоила, необязательно замещенного алкилом или диалкиламиноалкилом.
"Гетероаралкил" обозначает радикал формулы -RaRb, где Ra обозначает алкил, как определено выше, a Rb обозначает гетероарил, как определено выше.
"Гетероциклоалкил" обозначает одновалентный насыщенный карбоциклический радикал, имеющий одно кольцо или несколько сконденсированных колец, включающих по крайней мере один гетероатом, такой, как N, О, S (например, морфолино, пиперазинил, пиперидинил, пирролидинил).
"Необязательный" или "необязательно" обозначает, что последовательно описанные действия или обстоятельства могут иметь место или их может не быть и что определение включает ситуации, когда указанные действия или обстоятельства имеют место, и ситуации, когда они отсутствуют. Например, "необязательно замещенный хинол-2-ил" обозначает, что хинол-2-ильный радикал может быть замещенным или может быть незамещенным и что определение включает как замещенные хинол-2-ильные радикалы, так и хинол-2-ильные радикалы, не имеющие замещения.
"Аминозащитная группа" в контексте настоящего описания обозначает органические группы, предназначенные для защиты атомов азота от нежелательных реакций во время процессов синтеза, и включает, но не ограничена ими, бензил, ацил, ацетил, бензилоксикарбонил (карбобензилокси), пара- метоксибензилоксикарбонил, пара-нитробензилоксикарбонил, трет- бутоксикарбонил, трифторацетил и т.п.
"Основание" в контексте настоящего описания включает как сильные неорганические основания, такие, как гидроксид натрия, гидроксид лития, гидроксид аммония, карбонат калия и т.п., так и органические основания, такие, как пиридин, диизопропилэтиламин, N-метилморфолин, триэтиламин, диметиламинопиридин и т.п.
"Фармацевтически приемлемая соль" обозначает такие соли, которые сохраняют биологическую активность и свойства свободных оснований или свободных кислот и которые не являются нежелательными ни по биологическим, ни по каким-либо иным причинам. Если соединение существует в виде свободного основания, требуемая соль может быть получена способами, известными обычным специалистам в данной области техники, такими как обработка соединения неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п.; или органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, пара- толуолсульфоновая кислота, салициловая кислота и т. п. Если соединение представлено в виде свободной кислоты, требуемая соль может быть также получена способами, известными обычным специалистам в данной области техники, такими как обработка соединения неорганическим или органическим основанием. Соли, образованные с неорганическими основаниями, включают, но не ограничены ими, соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т.п. Соли, образованные с органическими основаниями, включают, но не ограничены ими, соли первичных, вторичных и третичных аминов, замещенных аминов, включая встречающиеся в естественных условиях замещенные амины, циклические амины и основные ионобменные смолы, такие, как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, 2-диметиламиноэтанол, 2- диэтиламиноэтанол, триметамин, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминные смолы и т.п.
"Млекопитающие" включают людей и всех домашних и диких животных, в том числе, но не ограничиваясь ими, крупный рогатый скот, лошадей, свиней, овец, коз, собак, кошек и т.п.
"Терапевтически эффективное количество" относится к такому количеству соединения формулы (I), которое, будучи при необходимости назначенным млекопитающему, является достаточным для лечения, как определено ниже, болезненных состояний, облегчаемых в результате ингибирования активности матричных металлопротеаз, таких, как активность стромелизина, желатиназы, матрилизина и/или коллагеназы. Количество соединения формулы (I), которое составляет "терапевтически эффективное количество", будет изменяться в зависимости от соединения, болезненного состояния и серьезности заболевания, а также от млекопитающего, подвергающегося лечению, однако оно может быть определено общепринятым образом обычным специалистом в данной области техники с учетом его собственных знаний и данного описания.
Понятия "лечение" или "лечить" в контексте настоящего описания
включают лечение болезненного состояния у млекопитающего, прежде всего у человека, которое облегчается
в результате ингибирования активности матричных металлопротеаз, таких, как активность
стромелизина, желатиназы, матрилизина и/или коллагеназы и т.п., и включает:
(I) предупреждение
наступления болезненного состояния у млекопитающего, в частности, если указанное млекопитающее
предрасположено к болезненному состоянию, но еще не установлено, что таковое наступило;
(II)
ингибирование болезненного состояния, т.е. прекращение его развития; или
(III)
облегчение болезненного состояния, т.е. обеспечение регрессии болезненного состояния.
"Стереоизомеры" относятся к соединениям, имеющим одинаковую молекулярную формулу и природу или последовательность связей, но отличающимся по ориентации их атомов в пространстве.
Соединения формулы (I) или их фармацевтически приемлемые соли имеют в своей структуре по крайней мере два асимметричных атома углерода и, следовательно, могут существовать в виде отдельных стереоизомеров, рацематов и в виде смесей энантиомеров и диастереомеров. Все указанные отдельные стереоизомеры, рацематы и их смеси включены в объем настоящего изобретения.
При обозначении отдельных стереоизомеров соединений формулы (I) абсолютный дескриптор R или S может быть отнесен к хиральным атомам углерода в соответствии с методикой "Правила Последовательности" Кана, Ингольда и Прелога.
Номенклатура
Используемая в настоящем описании
номенклатура в основном представляет собой модифицированную форму номенклатуры I.U.P.A.C. (Международного
союза теоретической и прикладной химии), согласно которой соединения по изобретению названы
как производные пептидов. Когда R3 в формуле (I) включает боковую цепь аминокислотного остатка,
то той части химической структуры, которая включает R3 вместе с соседним атомом
азота (показанным ниже и обозначенным как атом азота N в отличие от атома азота N') и карбонильную группу,
присваивается название соответствующей аминокислоты. Название и нумерация соединений по
настоящему изобретению показаны ниже для характерных соединений формулы (I).
Например, следующее
соединение формулы (I)

в котором R1 обозначает карбокси; R2 обозначает бифенил; R3 обозначает 4-(циан)бензилтиоизопропил; R7 обозначает фенил; X обозначает пропан-1,3-диил и p равно 0, названо N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-S-((4-цианфенил) метил) пеницилламин-N'-(фенил)карбоксамидом.
Другое название этого соединения N-(5-(бифен-4-ил)-2R- карбоксиметилпентаноил)-L-S-((4-цианфенил)метил)пеницилламин-N' - (фенил)карбоксамид.
Для удобства ссылки части структуры связывают с соответствующей им номенклатурой.
Структуры и названия нескольких других характерных соединений формулы (I) приведены ниже.
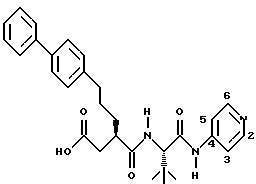
Вышеприведенное соединение названо N-(2R-карбоксиметил-5- (бифен-4-ил)пентаноил)-L-трет-бутилглицин-N'-(пирид-4-ил)карбоксамидом. Название трет-бутилглицин может быть равнозначно заменено на трет-лейцин, а название пиридил может быть заменено на пиридинил. Другим названием вышеприведенного соединения является N-(5-(бифен-4-ил-2R-карбоксиметилпентаноил)-L-трет-лейцин-N'- (пиридин-4-ил)карбоксамид.

Вышеприведенное соединение названо N-(2R-карбоксиметил-5-(7- (глицил)аминофторен-2-ил)пентаноил)-L-лейцин-N'-(4- метоксикарбонил)фенил)карбоксамидом.
Другим названием этого соединения является N-(5-(7-(глицил) аминофлуорен-2-ил)-2R-карбоксиметилпентаноил)-L-лейцин-N'- (4-(метоксикарбонил)фенил)карбоксамид.
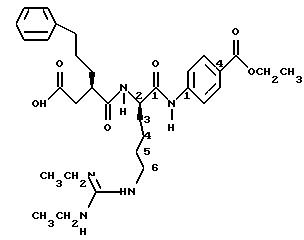
Вышеприведенное соединение названо N-((2R-карбоксиметил- 5-фенил)пентаноил)-L-6-(N, N'-диэтилгуанидо)лизил-N'-(4- этоксикарбонил)фенил)карбоксамидом. Название гуанидо может быть равнозначно заменено на гуанидино. Другое название этого соединения N-((5-фенил-2R-карбоксиметил)пентаноил)-L-6-(N,N'- диэтилгуанидино)лизил-N'-(4-этоксикарбонил) фенил) карбоксамид.
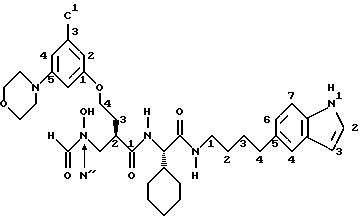
Вышеприведенное соединение названо N-((2R-(N''-формил-N''- гидроксиамино)метил)-4-(((3-хлор-5-морфолино)фен-1- ил)оксибутаноил)-L-циклогексилглицин-N'-(4-(индол-5- ил)бутил)карбоксамидом. Другое название этого соединения N-(4- (3-хлор-5-морфолино)фен-1-ил)-2R-((N''-формил-N''- гидроксиамино)метилоксибутаноил)-L-циклогексилглицин-N'-(4- (индол-5-ил)бутил)карбоксамид.
Применение, исследования и
назначение
Применение
Соединения формулы (I) ингибируют матричные металлопротеазы млекопитающих, такие, как стромелизины, желатиназы, матрилизин и коллагеназы, и, следовательно,
пригодны для лечения заболеваний, обусловленных избыточным разложением матрикса и соединительной ткани у млекопитающего, которое индуцируется ММР, таких, как артриты (ревматоидный артрит и
остеоартрит), заболевания, связанные с резорбцией кости (такие, как остеопороз), усиленное разложение коллагена, связанное с диабетом, болезни периодонта, изъязвление роговицы, изъязвление кожи,
разрастание опухоли и метастазы и аберрантный ангиогенез.
Исследования
Способность соединений формулы (I) ингибировать активность матричной металлопротеазы, в частности
активность стромелизина, желатиназы, матрилизина и/или коллагеназы, может быть продемонстрирована на различных опытах in vitro и in vivo, известных обычным специалистам в данной области техники,
например, на таких опытах, которые описаны в Anal.Biochem. (1985), т. 147, стр. 437, и с помощью ферментативного анализа ММП, описанного в FEBS (1992), т. 296(3), стр. 263, или с помощью их
модификаций.
Назначение
Введение соединений формулы (I) или их фармацевтически приемлемых солей в чистом виде или в виде соответствующей фармацевтической композиции может
быть
осуществлено с помощью любых приемлемых способов введения или агентов, служащих подобным целям. Таким образом, введение может осуществляться, например, оральным, назальным, парентеральным,
локальным,
трансдермальным или ректальным путем в виде твердых, полутвердых дозируемых форм, лиофилизированного порошка или в виде жидких дозируемых форм, например, таких, как таблетки, суппозитории,
пилюли,
желатиновые капсулы с мягкой эластичной или твердой оболочкой, порошки, растворы, суспензии или аэрозоли и т.п., предпочтительно в формах унифицированных доз, пригодных для простого введения
с точной
дозировкой. Композиции могут включать обычный фармацевтический носитель или эксципиент и соединение формулы (I) в качестве действующего вещества и, кроме того, могут включать другие
лекарственные
средства, фармацевтические средства, носители, адъюванты и т.д.
Обычно в зависимости от назначаемого способа введения фармацевтически приемлемые композиции могут содержать от приблизительно 1 мас.% до приблизительно 99 мас. % соединения(ий) формулы (I) или его (их) фармацевтически приемлемой(ых) соли(ей) и от 99 мас.% до 1 мас.% фармацевтически пригодного эксципиента. Предпочтительно композиция должна содержать от приблизительно 5 мас.% до приблизительно 75 мас.% соединения(ий) формулы (I) или его (их) фармацевтически приемлемой(ых) соли(ей), при этом остальное приходится на долю фармацевтически приемлемых эксципиентов.
Предпочтительным путем введения является оральный с использованием обычной суточной схемы приема, которая может корректироваться в зависимости от степени серьезности подлежащего лечению болезненного состояния. Для такого орального введения фармацевтически приемлемую композицию, содержащую соединение(я) формулы (I) или его(их) фармацевтически приемлемую(ые) соль (и), получают путем включения любых обычно используемых эксципиентов, таких, как, например, фармацевтически чистые маннит, лактоза, крахмал, прежелатинизированный крахмал, стеарат магния, натрийсахарин, тальк, эфирные производные целлюлозы, глюкоза, желатин, сахароза, цитрат, пропилгаллат и т.п. Такие композиции имеют форму растворов, суспензий, таблеток, пилюль, капсул, порошков, композиций с непрерывным высвобождением лекарства и т.п.
Предпочтительно такие композиции должны иметь форму капсул, капель или таблеток и, кроме того, должны включать разбавитель, такой, как лактоза, сахароза, дифосфат кальция и т.п., агент, способствующий дезинтеграции, такой, как натрийкроскармелоза или ее производные; замасливатель, такой, как стеарат магния и т.п., и связующее вещество, такое, как крахмал, смола акации, поливинилпирролидон, желатин, эфирные производные целлюлозы и т.п.
Соединения формулы (I) или их фармацевтически приемлемые соли могут также быть приготовлены в форме суппозитория с использованием, например, от приблизительно 0,5% до приблизительно 50% действующего вещества, распределенного в медленно растворяющемся внутри организма носителе, например, в полиоксиэтиленгликолях и полиэтиленгликолях (ПЭГ), например, ПЭГ 1000 (96%) и ПЭГ 4000 (4%).
Жидкие композиции, предназначенные для фармацевтических целей, могут, например, быть приготовлены путем растворения, диспергирования и т.д. соединения(ий) формулы (I) (от приблизительно 0,5% до приблизительно 20%) или его фармацевтически приемлемой(ых) соли(ей) и необязательно фармацевтических адъювантов в носителе, таком, как, например, вода, физиологический раствор, водная декстроза, глицерин, этанол и т.п., с получением раствора или суспензии.
При необходимости фармацевтическая композиция по изобретению может также содержать небольшие количества добавочных веществ, таких, как смачивающие или эмульгирующие агенты, забуферивающие pH агенты, антиоксиданты и т.п., такие, как, например, лимонная кислота, сорбитанмонолаурат, триэтаноламинолеат, бутилированный гидрокситолуол и т.д.
Практические способы получения таких дозируемых форм известны или очевидны для специалистов в данной области техники, например, см. в Remington's Pharmaceutical Sciences, 18-е издание (Mack Publishing Company, Easton, Pennsylvania, 1990). Применяемая композиция в любом случае должна содержать терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли для лечения болезненного состояния, которое может быть облегчено в результате ингибирования активности матричных металлопротеаз в соответствии с рекомендациями настоящего изобретения.
Соединения формулы (I) или их фармацевтически приемлемые соли применяют в терапевтически эффективном количестве, которое в значительной степени должно зависеть от различных факторов, включающих активность конкретного применяемого соединения, метаболическую стабильность и продолжительность действия соединения, возраст, вес тела, общее состояние здоровья, пол пациента, диету, режим и время введения, скорость экскреции, комбинацию лекарств, серьезность конкретного болезненного состояния и терапию, которой подвергается пациент. Обычно терапевтически эффективная суточная доза составляет от приблизительно 0,14 мг до приблизительно 14,3 мг/кг веса тела в день для соединения формулы (I) или его фармацевтически приемлемой соли, предпочтительно от приблизительно 0,7 мг до приблизительно 10 мг/кг веса тела в день и наиболее предпочтительно от приблизительно 1,4 мг до приблизительно 7,2 мг/кг веса тела в день. Например, при назначении человеку весом 70 кг диапазон доз может составлять от приблизительно 10 мг до приблизительно 1,0 г соединения формулы (I) или его фармацевтически приемлемой соли в день, предпочтительно от приблизительно 50 мг до приблизительно 700 мг в день и наиболее предпочтительно от приблизительно 100 мг до приблизительно 500 мг в день.
Предпочтительные варианты осуществления
изобретения
Предпочтительными являются
соединения формулы (I), в которых X обозначает алкан-диил и в которых p равно 0, 2 или 3.
Среди соединений, в которых p равно 2 или 3, особенно предпочтительными являются такие соединения, в которых R1 обозначает карбокси, R2 обозначает бифенил, R3 обозначает циклогексил и R7 обозначает необязательно замещенный фенил [в частности, 4-(аминосульфонил)фенил] или N-морфолино.
Среди соединений, в которых p равно 0, особенно предпочтительной является группа соединений, в
которых R2 обозначает алкил,
необязательно замещенный фенил или группу формулы

и R7 обозначает 4-пиридил или необязательно замещенный фенил.
В этой группе предпочтительной подгруппой соединений являются такие соединения, в которых R1 обозначает карбокси, гидроксикарбамоил или N-гидроксиформиламино; R2 обозначает фенил, бифенил, 4-(пиридил)фенил или 2-метилпропил; R3 обозначает трет-бутил, 4-аминобутил, алкиламинобутил, диалкиламинобутил, 4-(N, N'-диэтилгуанидино)бутил, пропил, 2- метилпропил, 1-гидроксиизопропил, 1-гидроксиэтил или циклогексил; и X обозначает простую связь, этилен или пропан-1, 3-диил.
В этой подгруппе предпочтительным классом соединений являются такие соединения, в которых R2 обозначает бифенил, R3 обозначает трет-бутил и R7 обозначает 4-пиридил, в частности, в которых R1 обозначает карбокси, N- гидроксиформиламино или гидроксикарбамоил.
Также предпочтительной является подгруппа соединений, в которых R2 обозначает группу формулы.

где А обозначает CH2; R10 обозначает H или ациламино; R11 обозначает H; R7 обозначает необязательно замещенный фенил; и X обозначает пропан-1,3-диил.
В этой подгруппе предпочтительными являются соединения, в которых R1 обозначает карбокси, гидроксикарбамоил или N- гидроксиформиламино; R3 обозначает алкил (особенно 2-метилпропил); и R7 обозначает алкоксикарбонилфенил [особенно 4-(метоксикарбонил) фенил].
Также в этой группе предпочтительной является подгруппа соединений, в которых R1 обозначает карбокси; R2 обозначает фенил; R3 обозначает алкил [особенно 4-(амино)бутил и 4-(диэтилгуанидино)-N-бутил] или циклоалкил (или прежде всего циклогексил); и X обозначает этилен или пропан-1,3-диил.
В этой группе также предпочтительной является подгруппа соединений, в которых R1 обозначает меркапто, карбокси, гидроксикарбамоил или N-гидроксиформиламино; R2 обозначает 2- метилпропил; R3 обозначает алкил (прежде всего пропил, 2- метилпропил), циклоалкил (или прежде всего циклогексил) или гетероаралкил (прежде всего 3-метилиндолил); R7 обозначает необязательно замещенный фенил [прежде всего 4- метоксифенил, 4- карбоксифенил, 4-(метоксикарбонил)фенил или 4- (диметиламиноэтилкарбамоил)фенил]; и X обозначает простую связь.
Кроме того, в этой группе предпочтительной является подгруппа соединений, в которых R1 обозначает карбокси, R2 обозначает 4-(2-гидроксиэтил)фенил, 4-(2-гидроксипропил)фенил, 4-(2- гидроксибутил)фенил, 4-(пиридил)фенил, бифенил, 4'- (аминоэтокси)бифенил, 4'-(циан)бифенил или 4'-(гидрокси)бифенил; R3 обозначает 2-метилпропил; R7 обозначает 4- (метоксикарбонил)фенил; и X обозначает пропан-1,3-диил.
Особенно предпочтительной является подгруппа соединений, в которых R2 обозначает бифенил, прежде всего в которых R7 обозначает необязательно замещенный фенил.
В этой особенно предпочтительной подгруппе предпочтительными являются соединения, в которых R1 обозначает карбокси; R3 обозначает алкил или циклоалкил [особенно циклогексил, 4-(амино) бутил, 4-(изопропиламино)бутил, 1-гидроксиизопропил или трет-бутил]; X обозначает пропан-1,3-диил; и R7 обозначает фенил, 4-(гидроксиэтиламиносульфонил)фенил, 4- (диметиламиноэтиламиносульфонил)фенил, 4-(этоксикарбонил)фенил, 4- (N-морфолинопропиламиносульфонил)фенил, 4- (метиламиносульфонил)фенил, 4-(гидроксиэтиламиносульфинил)фенил или 4-(метилсульфинил) фенил.
Другой предпочтительной группой, в частности для ингибирования матрилизина, являются соединения формулы (II), прежде всего такие соединения, в которых R1 обозначает меркапто или ацетилтио.
В этой второй группе предпочтительной подгруппой соединений являются такие соединения, в которых R2 обозначает алкил, аралкил, циклоалкилалкил; R3 обозначает циклоалкил или алкил (необязательно замещенный циклоалкилом, гидрокси-, аралкокси-, алкилтиогруппой, пиридилом или индолилом); R4 обозначает циано, карбокси, гидрокси, алкокси, алкоксикарбонил, алкоксикарбонилалкил, карбамоил (необязательно замещенный аралкиламиноалкилом) или аминосульфонил (необязательно замещенный алкилом); и R5 обозначает водород.
В этой подгруппе предпочтительным классом соединений являются такие соединения, в которых R2 обозначает алкил; R3 обозначает циклогексил, алкил (необязательно замещенный циклогексилом, гидрокси-, бензилокси-, метилтиогруппой, пиридилом или индолилом); и R4 обозначает карбокси, алкоксикарбонил и аминосульфонил.
В этом классе соединений предпочтительными являются соединения, в которых R2 обозначает 2-метилпропил. Особенно предпочтительными являются соединения, в которых R3 обозначает 2-метилпропил.
Третьей группой, предпочтительной для ингибирования матрилизина, являются соединения формулы (II), в которых R1 обозначает карбокси.
В этой третьей группе предпочтительной подгруппой соединений являются такие соединения, в которых R2 обозначает алкил, аралкил, циклоалкилалкил; R3 обозначает циклоалкил или алкил (необязательно замещенный циклоалкилом, гидрокси-, аралкокси-, алкилтиогруппой, пиридилом или индолилом); R4 обозначает циано, гидрокси, алкокси, карбокси, алкоксикарбонил, алкоксикарбонилалкил, карбамоил (необязательно замещенный аралкиламиноалкилом) или аминосульфонил (необязательно замещенный алкилом); и R5 обозначает водород.
Внутри этой подгруппы предпочтительным классом соединений являются такие соединения, в которых R2 обозначает алкил; R3 обозначает циклогексил, алкил (необязательно замещенный циклогексилом, гидрокси-, бензилокси-, метилтиогруппой, пиридилом или индолилом); и R4 обозначает карбокси, алкоксикарбонил и аминосульфонил.
В этом классе соединений предпочтительными являются такие соединения, в которых R2 обозначает 2-метилпропил. Особенно предпочтительными являются такие соединения, в которых R3 обозначает циклогексил, 2-метилпропил, пиридин-3-илметил, 1-бензилоксиэтил, 1-метилпропил, 1,1-диметилэтил, 1-гидроксиэтил и индол-2-илметил; и R4 обозначает метоксикарбонил.
Четвертой группой, предпочтительной для ингибирования матрилизина, являются соединения формулы (II), в которых R1 обозначает гидроксикарбамоил.
В этой четвертой группе предпочтительной подгруппой соединений являются такие соединения, в которых R2 обозначает алкил, аралкил, циклоалкилалкил; R3 обозначает циклоалкил или алкил (необязательно замещенный циклоалкилом, гидрокси-, аралкокси-, алкилтиогруппой, пиридилом или индолилом); R4 обозначает циано, гидрокси, алкокси, карбокси, алкоксикарбонил, алкоксикарбонилалкил, карбамоил (необязательно замещенный аралкиламиноалкилом) или аминосульфонил (необязательно замещенный алкилом); и R5 обозначает водород.
В этой подгруппе предпочтительным классом соединений являются такие соединения, в которых R2 обозначает алкил; R3 обозначает циклогексил, алкил (необязательно замещенный циклогексилом, гидрокси-, бензилокси-, метилтиогруппой, пиридилом или индолилом); и R4 обозначает карбокси, алкоксикарбонил и аминосульфонил.
В этом классе соединений предпочтительными являются такие соединения, в которых R2 обозначает 2-метилпропил. Особенно предпочтительными являются такие соединения, в которых R3 обозначает циклогексил, 2-метилпропил, пиридин-3-илметил, 1- бензилоксиэтил, 1-метилпропил, 1, 1-диметилэтил, 1-гидроксиэтил и индол-2-илметил.
Таким образом, наиболее предпочтительными
соединениями формулы (I) являются следующие:
N-(2R-(N''-гидроксикарбамоил)метил-4-(метил)пентаноил) -L-триптофан-N'-(4-(карбокси)фенил)карбоксамид;
N-(2R-(N''-гидроксикарбамоил)метил-4-(метил)пентаноил)
-L-лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид;
N-(2R-(N''-гидроксикарбамоил)метил-4-(метил)пентаноил)
-L-лейцин-N'-(4-(карбокси)фенил)карбоксамид;
N-(2R-меркаптометил-4-(метил)пентаноил)-L-лейцин- N'-(4-(метоксикарбонил)фенил)карбоксамид;
N-(2R-ацетилтиометил-4-(метил)пентаноил)-L-лейцин-N'-(4- (метоксикарбонилфенил)карбоксамид;
N-(2R-карбоксиметил-4-(метил)пентаноил)-L-лeйцин-N'- (4-(метоксикарбонил)фенил)карбоксамид;
N-(2R-(N''-гидроксикарбамоил)метил-4-(метил)пентаноил)
-L-циклогексилглицин-N'-(4-(метоксикарбонил)фенил)карбоксамид;
N-(2R-(N''-гидроксикарбамоил)метил-4-(метил)пентаноил)-L- трет-лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид;
N-(2R-(N''-гидpoкcикapбaмoил)метил-5-(бифен-4-ил)пентаноил)
-L-трет-лейцин-N'-(4-(пирид-4-ил)карбоксамид;
N-(2R-кapбoкcиметил-5-(бифен-4-ил)пентaнoил)-L-тpет-лейцин-N'-(4- (пиридин-4-ил)карбоксамид;
N-(2R-карбоксиметил-5- (бифен-4-ил)пентаноил)-L-трет-лейцин-N'-(4-((2-гидроксиэтил)
аминосульфонил)фенил)карбоксамид;
N-(2R-карбоксиметил-5-(4-(пирид-4-ил)фенил)пентаноил)-L-лейцин-N'- (4-(метоксикарбонил)фенил)карбоксамид;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L- β
- гидроксивалин-N'-(фенил)карбоксамид;
N-(N''-формил-N''-гидроксиамино)метил-5-(бифен-4- ил)пентаноил)-L-трет-лейцин-N'-(пиридин-4-ил)карбоксамид;
N-(2R,
S)-(N''-формил-N''-гидроксиамино)метил-4- (метил)пентаноил)-L-лейцин-N'-(4- (метоксикарбонил)фенил)карбоксамид;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-трет-лейцин-N' -(4R,
S-(метилсульфинил)фенил)карбоксамид;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил) -L-трет-лейцин-N'-(4-(метиламиносульфонил)фенил)карбоксамид;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)- L-трет-лейцин-N'-(4-(3-(морфолин-4- ил)пропиламиносульфонил)фенил)карбоксамид;
N-(2R-карбоксиметил-5- (бифен-4-ил)пентаноил)-L-циклогексилглицин-N'-(4-((2- гидроксиэтил)аминосульфонил)фенил)карбоксамид;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-циклогексилглицин-N'- (4-((2-(диметиламино)этил)аминосульфонил)фенил)карбоксамид;
N-(2R-(N''-гидроксикарбамоил)метил-4-(метилил)пентаноил)-D,
L- норвалин-N'-(4-(диметиламиноэтилкарбамоил)фенил)карбоксамид;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-лизин-N'-(4- (этоксикарбонил)фенил)карбоксамид;
N-(2R-карбоксиметил-5-(фенил)пентаноил)-L-(N-лизин-N'- (4-(этоксикарбонил)фенил)карбоксамид;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-(Nε
-изопропил)лизин-N'-(4-(этоксикарбонил)фенил) карбоксамид;
N-(2R-карбоксиметил-4-(фенил)бутаноил) -L-циклогексилглицин-N'-(4- (N'', N''-диметиламиноэтиламиносульфонил)фенил)карбоксамид; и
N-(2R-карбоксиметил-5-(фенил)пентаноил)-L-(N, N'-диэтилгуaнидо) лизин-N-(4-(этоксикарбонил)фенил)карбоксамид.
Синтез соединений формулы (I)
Соединения формулы (I)
получают описанными ниже способами, например, в соответствии с реакционными схемами 1-7, в которых показанные замещающие группы (например, R1, R2 и т.д.) имеют те же значения,
которые, если не оговорено иное, указаны в "Кратком изложении сущности изобретения". Некоторые из реакционных схем иллюстрируют структуры формулы (I), где p равно 0 и R7 обозначает
необязательно замещенную фенильную группу [заместители R4 и R5 имеют значения, указанные для формулы (II) в "Кратком изложении сущности изобретения"] . Для специалистов в данной
области техники очевидно, что аналогичным образом могут быть получены соответствующие соединения, в которых p равно 1-4 и R7 имеет другие значения, причем комбинации заместителей и/или
переменных в соединениях формулы (I) и в их промежуточных продуктах допустимы только тогда, когда такие комбинации приводят к получению стабильных соединений.
Соединения формулы (I) и их фармацевтически приемлемые соли как в виде отдельных стереоизомеров, так и в виде их смесей являются производными пептидов, все или часть которых могут быть получены из производного(ых) α -аминокислот, составляющих эти пептиды. Стандартные способы образования пептидных связей приведены у М.Bodanszky и др. в The Practice of Peptide Synthesis (1984), Springer-Verlag; у М.Bodanszky в Principles of Peptide Synthesis (1984), Springer-Verlag; у J.P.Greenstein и др. в Chemistry of the Amino Acids (1961), т. 1-3, John Wiley and Sons Inc.; у G.R. Pettit в Synthetic Peptides (1970), т. 1-2, Van Nostrand Reinhold Company.
Параметры реакции синтеза
Понятия "растворитель", "инертный органический растворитель" или "инертный растворитель" обозначают
растворитель,
инертный в реакционных условиях, в которых он используется [они включают, например, бензол, толуол, ацетонитрил, тетрагидрофуран ("ТГФ"), диметилформамид ("ДМФ"), хлороформ,
метиленхлорид (или
дихлорметан), диэтиловый эфир, метанол, пиридин и т.п.]. Если не указано иное, растворители, используемые в реакциях по настоящему изобретению, представляют собой инертные
органические
растворители.
Понятие "q. s. " обозначает добавление такого количества, которого достаточно для достижения заданной функции, например, доведение раствора до требуемого объема.
Если не указано иное, реакции, приведенные в данном описании, осуществляют при атмосферном давлении в диапазоне температур от 5oC до 100oC (предпочтительно от 10oC до 50oC; наиболее предпочтительно при "комнатной" температуре или температуре "окружающей среды", например, при 20oC). Кроме того, если отсутствуют другие указания, время и условия реакции необходимо понимать как приблизительные, например, реакцию осуществляют при приблизительно атмосферном давлении в диапазоне температур от приблизительно 5oC до приблизительно 100oC (предпочтительно от приблизительно 10oC до приблизительно 50oC; наиболее предпочтительно при приблизительно 20oC) в течение периода времени от приблизительно 1 до приблизительно 10 часов (предпочтительно приблизительно в течение 5 часов). Подразумевается, что параметры, указанные в примерах, являются конкретными, а не приблизительными.
Амидные сочетания, используемые для образования соединений формулы (I), обычно выполняют с помощью карбодиимидного метода с такими реагентами, как дициклогексилкарбодиимид или N'-этил-N'-(3-диметиламинопропил)карбодиимид (ЭДКИ), в присутствии 1-гидроксибензтриазола (ГОБТ) в инертном растворителе, таком, как диметилформамид (ДМФ). Другие способы образования амидной или пептидной связи включают, но не ограничены ими, способы синтеза с использованием хлорангидрида кислоты, ацилазида, смешанного ангидрида или активированного сложного эфира, такого, как нитрофениловый эфир. Обычно амидные сочетания проводят в фазе раствора с пептидными фрагментами или без них.
Выбор защитных групп для концевых амино- или карбоксильных групп соединений, используемых для получения соединений формулы (I), частично определяется конкретными условиями амидного или пептидного сочетания, а также частично компонентами аминокислоты и/или пептида, участвующими в сочетании. Обычно используемые аминозащитные группы включают таковые, хорошо известные в данной области техники, например, пара-метоксибензилоксикарбонил, бензилоксикарбонил (также называемый карбобензилокси или КБЗ), паранитробензилоксикарбонил, трет-бутоксикарбонил (ВОС) и т.п. Предпочтительно применять либо ВОС, либо КБЗ в качестве защитной группы для α -аминогруппы из-за относительной простоты ее удаления слабыми кислотами [например, трифторуксусной кислотой (ТФК) или соляной кислотой в этилацетате] или с помощью каталитического гидрирования.
Выделение и очистка соединений и промежуточных продуктов, представленных в настоящем описании, могут быть осуществлены при необходимости с помощью любого пригодного для этой цели способа разделения или очистки, такого, как, например, фильтрация, экстракция, кристаллизация, хроматография на колонках, тонкослойная хроматография или хроматография в толстом слое или с помощью комбинации этих методов. Конкретные примеры соответствующих методов разделения и выделения приведены ниже в примерах. Очевидно, однако, что также могут быть использованы и другие эквивалентные методы разделения или очистки.
Индивидуальные стереоизомеры соединений формулы (I) можно разделять способами, известными специалистам в данной области техники, например, селективной кристаллизацией или хроматографией, и/или способами, приведенными в описании.
Получение соединений формулы (Е)
Соединения формулы (Е)
являются промежуточными продуктами, применяемыми для
получения соединений формулы (I), и их получают в соответствии с реакционной схемой 1, где R12 обозначает мезил или тозил.
Исходные продукты
Соединения формулы
(Ea) могут быть получены в соответствии со способами, известными специалистам в данной области техники (например, см. публикацию Европейской
заявки 0276436), или могут быть получены в соответствии со
способом, описанным ниже в примере 1. Соединения формулы (Ed) являются коммерчески доступными или могут быть получены в соответствии со
способами, известными специалистам в данной области техники.
Формула (Eb): Обычно соединения формулы (Е) получают сначала обработкой соединения формулы (Ea) параформальдегидом в апротонном растворителе, предпочтительно в тетрагидрофуране и метиленхлориде при 0-15oC, предпочтительно при 0oC в присутствии основания, предпочтительно диизопропилэтиламина и бис(триметилсилил)ацетамида. Образовавшийся раствор доводят до 25-37oC, предпочтительно до 37oC, в течение 18 часов. Затем спирт формулы (Eb) выделяют с помощью стандартных способов, предпочтительно выпариванием растворителя, экстракцией и фильтрацией.
Формула (Ec): Затем спирт формулы (Eb) в апротонном растворителе, предпочтительно в метиленхлориде,
охлаждают до температуры в интервале от -20oС до
приблизительно 0oC, предпочтительно до приблизительно -20oC, и затем подвергают этерификации путем стандартной
обработки спирта либо мезилхлоридом, либо тозилхлоридом в
количестве от по крайней мере стехиометрического до приблизительно 100%-ного избытка. Этерификацию
осуществляют в течение первого
промежутка времени (предпочтительно в течение 15 минут) при
-20oC, а затем в течение второго промежутка времени (предпочтительно в течение 3,5 часов) при комнатной температуре. Затем
сложный эфир формулы (Ес) выделяют из реакционной смеси с помощью
стандартных методов, предпочтительно путем экстракции, фильтрации и упаривания.
Формула (Ee): Затем сложный эфир формулы (Ec) в апротонном растворителе, предпочтительно в ДМФ, подвергают взаимодействию с солью соединения формулы (Ed) (предпочтительно с натриевой солью, образовавшейся в результате взаимодействия соединения формулы (Ed) с гидридом натрия в апротонном растворителе, предпочтительно в ДМФ) в течение приблизительно 16-20 часов, предпочтительно в течение 18 часов, при начальной температуре приблизительно 0oC и медленном нагревании до комнатной температуры. Образовавшееся меркапто-соединение формулы (Ee) выделяют из реакционной смеси с помощью стандартных методов, таких как экстракция, упаривание и быстрая хроматография.
Формула (E): Затем соединение формулы (Ee) подвергают гидролизу в щелочных условиях, предпочтительно в присутствии гидроксида натрия, с получением соединения формулы (Е), которое выделяют из реакционной смеси с помощью стандартных методов.
Получение соединений формулы (Ia)
Соединения формулы (Ia) являются
соединениями формулы (I), в которых R1
обозначает группу формулы

(где, если R6 обозначает арил, то он предпочтительно представляет собой нафт-1-ил, нафт-2-ил или фенил и, если R6 обозначает гетероарил, то он предпочтительно представляет собой пиридил или хинол-2-ил; R2 предпочтительно обозначает алкил; и R5 предпочтительно обозначает водород) получают в соответствии с реакционной схемой 2.
Исходные продукты
Аминокислоты с защищенным атомом азота формулы
(A) и соединения формулы (B) являются коммерчески доступными или могут быть получены в соответствии со способами, известными специалистам в данной
области техники. Соединения формулы (Е) получают в
соответствии с реакционной схемой 1.
Формула (С): Обычно соединения формулы (1a) получают сначала путем сочетания соединения формулы (А) с соединением формулы (В) [или с другим соединением формулы H2N-(CH2)p-R7] в стандартных условиях амидного сочетания, получая соединение формулы (С). Например, к холодному (0-5oC) раствору соединения формулы (А) и избыточному молярному количеству ГОБТ в ДМФ добавляют избыточное молярное количество ЭДКИ. Образовавшийся раствор перемешивают в течение от приблизительно 1 до приблизительно 2 часов, предпочтительно в течение приблизительно 1 часа при 0-5oC, предпочтительно при 0oC. Затем к холодному раствору добавляют раствор, содержащий эквимолярное количество соединения формулы (В), в присутствии основания, предпочтительно ДМАП. Образовавшуюся смесь перемешивают в течение промежутка времени от 12 до 24 часов, предпочтительно в течение 24 часов, при комнатной температуре, предпочтительно при 25oC. Затем соединение формулы (С) выделяют из реакционной смеси с помощью методов, стандартных в области химии пептидов.
Формула (D): Аминозащитную группу соединения формулы (С) затем удаляют в слабокислых условиях, предпочтительно в присутствии трифторуксусной кислоты, получая соединение формулы (D).
Альтернативные способы получения соединений формулы (D)
Другой способ получения соединения формулы (D), в частности,
когда R3 обозначает трет-бутил, другую β -разветвленную
боковую цепь аминокислоты или циклогексил, p равно 0 и R7 обозначает арил или гетероарил, включает использование
промежуточного продукта (А-1), получение которого показано на реакционной
схеме 2А. Другой альтернативный способ получения соединения
формулы (D), в частности, когда R3 обозначает
1-гидроксиизопропил или другую β -гидрокси-боковую цепь аминокислоты и
R7 обозначает арил или гетероарил, показан на реакционной схеме 2Б.
Как показано на реакционной схеме 2А, соединение формулы (А) подергают сочетанию с приблизительно 1 молярным эквивалентом N- гидроксисукцинимида в ацетонитриле при 0oC в присутствии ДЦК. Реакцию осуществляют при перемешивании и при температуре от 0oC до 25oC в течение 8-16 часов с получением соответствующего N- гидроксисукцинимидного эфира формулы (А-1). Затем этот сложный эфир подвергают взаимодействию с соединением формулы (В) или с другим соединением формулы H2N-(CH2)p-R7 в инертном растворителе при 100o C, предпочтительно в течение 3 часов; образовавшееся соединение формулы (С) выделяют и удаляют защитную группу, получая соединение формулы (D) в соответствии с описанной выше реакционной схемой 2.
Как показано на реакционной схеме 2Б, соединение формулы (С- 1) в инертном безводном растворителе, таком, как ТГФ, перемешивают с н-бутиллитием при температуре ниже 10oC, предпочтительно при 0oC, в течение приблизительно 1 часа, затем охлаждают до приблизительно -70oC и подвергают взаимодействию с 3 молярными эквивалентами ацетона. Соединение формулы (С-2) в виде рацемической смеси выделяют и очищают с помощью стандартных способов. После удаления защитной группы КБЗ с помощью гидрогенолиза получают соединение формулы (D-1).
Формула (Ia): Как показано на реакционной схеме 2, соединение формулы (D) подвергают сочетанию с соединением формулы (Е) в стандартных условиях пептидного сочетания. Например, к холодному (0-5oC, предпочтительно 0oC) раствору соединения формулы (D) в инертном растворителе, предпочтительно в ТГФ, добавляют 1,1'-карбонилдиимидазол. Образовавшуюся смесь перемешивают в течение промежутка времени от 60 до 90 минут, предпочтительно в течение 75 минут, при 0-5oC, предпочтительно при 0oC, и затем подвергают взаимодействию с соединением формулы (Е) в течение приблизительно 12-17 часов, предпочтительно в течение приблизительно 15 часов. Образовавшееся соединение формулы (Ia) затем выделяют из реакционной смеси с помощью методов, стандартных в области химии пептидов, например, путем экстракции и ЖХВР с обращенной фазой.
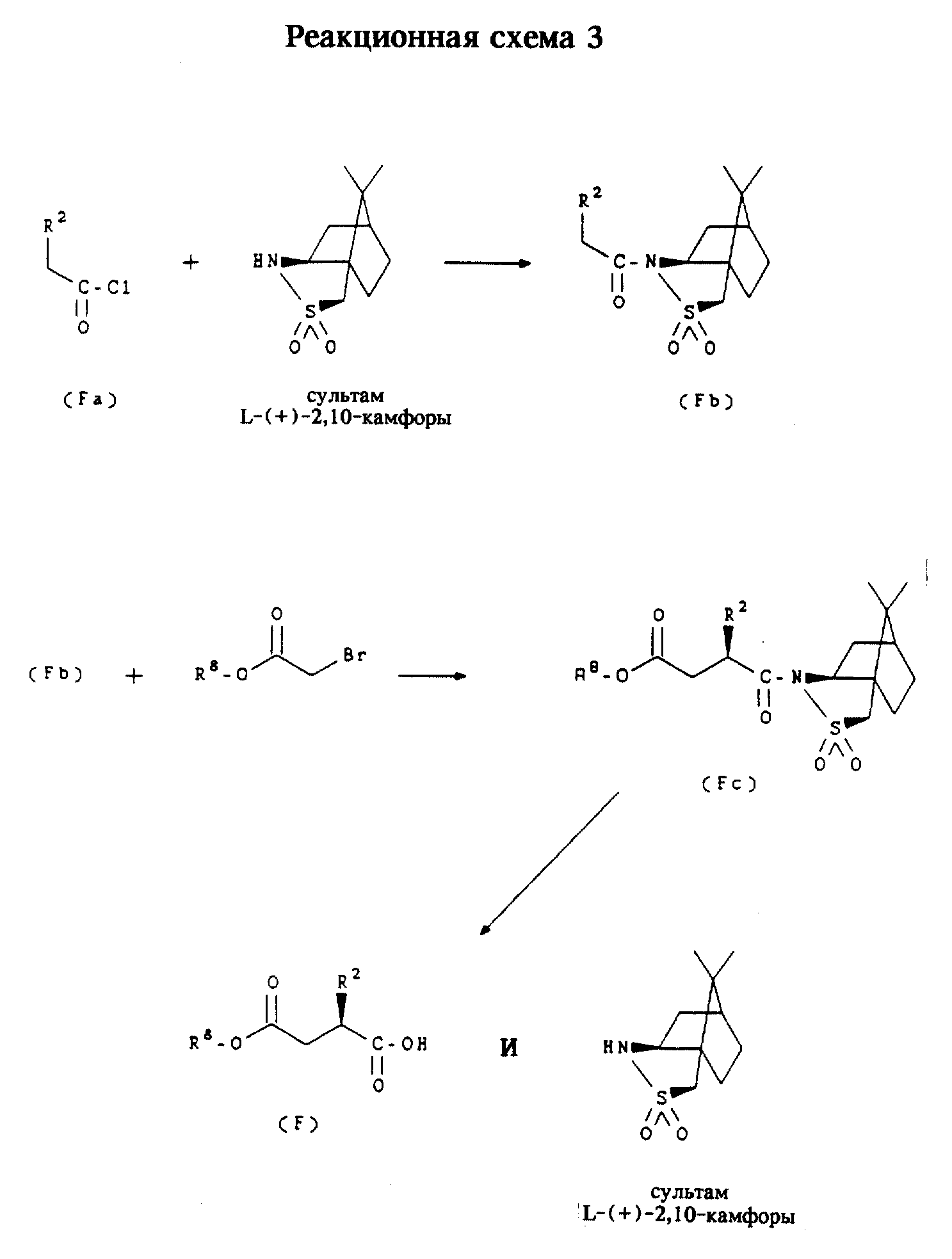
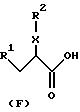
Получение соединений формулы (F)
Соединения формулы (F)

где R8 обозначает трет-бутил, являются промежуточными продуктами для получения соединений формулы (I) в соответствии с приведенной ниже реакционной схемой 4. Соединения формулы (F) получают в соответствии с реакционной схемой 3.
Исходные продукты
Соединения формулы (Fa)
являются коммерчески доступными или могут быть получены в соответствии со способами, известными специалистам в
данной области техники, например, способом, описанным ниже в примере 11. Сультам
L-(+)- 2,10-камфоры и сультам D-(-)-2,10-камфоры являются коммерчески доступными, например, они выпускаются фирмой
Aldrich.
Формула (Fb): Обычно соединения формулы (F) (на схеме показан один из двух изомеров, получаемых путем этого синтеза) получают сначала конденсацией соединения формулы (Fa) [где R2 включает группу "X" формулы (I) и может представлять собой, например, бифенилпропиленовую или фторенилпропиленовую группу] с сультамом L-(+)-2,10-камфоры с образованием соединения формулы (Fb).
Формула (Fc): Используют натрийгексаметилдисилазид для образования аниона в течение 1 часа, затем реакцию прекращают с помощью трет-бутилбромацета с получением соответствующего сложного эфира формулы (Fc).
Формула (F): Затем удаляют камфорную группу в щелочной среде, такой, как гидропероксид лития (полученный in situ из гидроксида лития и перекиси водорода), сначала при пониженной температуре (предпочтительно при 0oC) в течение 15 минут, после чего нагревают до комнатной температуры в течение 2 часов. Смесь вновь охлаждают до 0oC и добавляют при перемешивании водную смесь сульфита натрия и бикарбоната натрия, после чего смеси дают нагреться до комнатной температуры и доводят значение pH до нейтрального, получая индивидуальный стереоизомер формулы (F), в котором углерод, к которому присоединена группа -X-R2, находится в (R) -конфигурации. По аналогичной методике, но заменяя сультам D-(-)-2, 10-камфоры на сультамам L-(+)-2,10-камфоры, можно получить соответствующий индивидуальный стереоизомер в (S) -конфигурации.
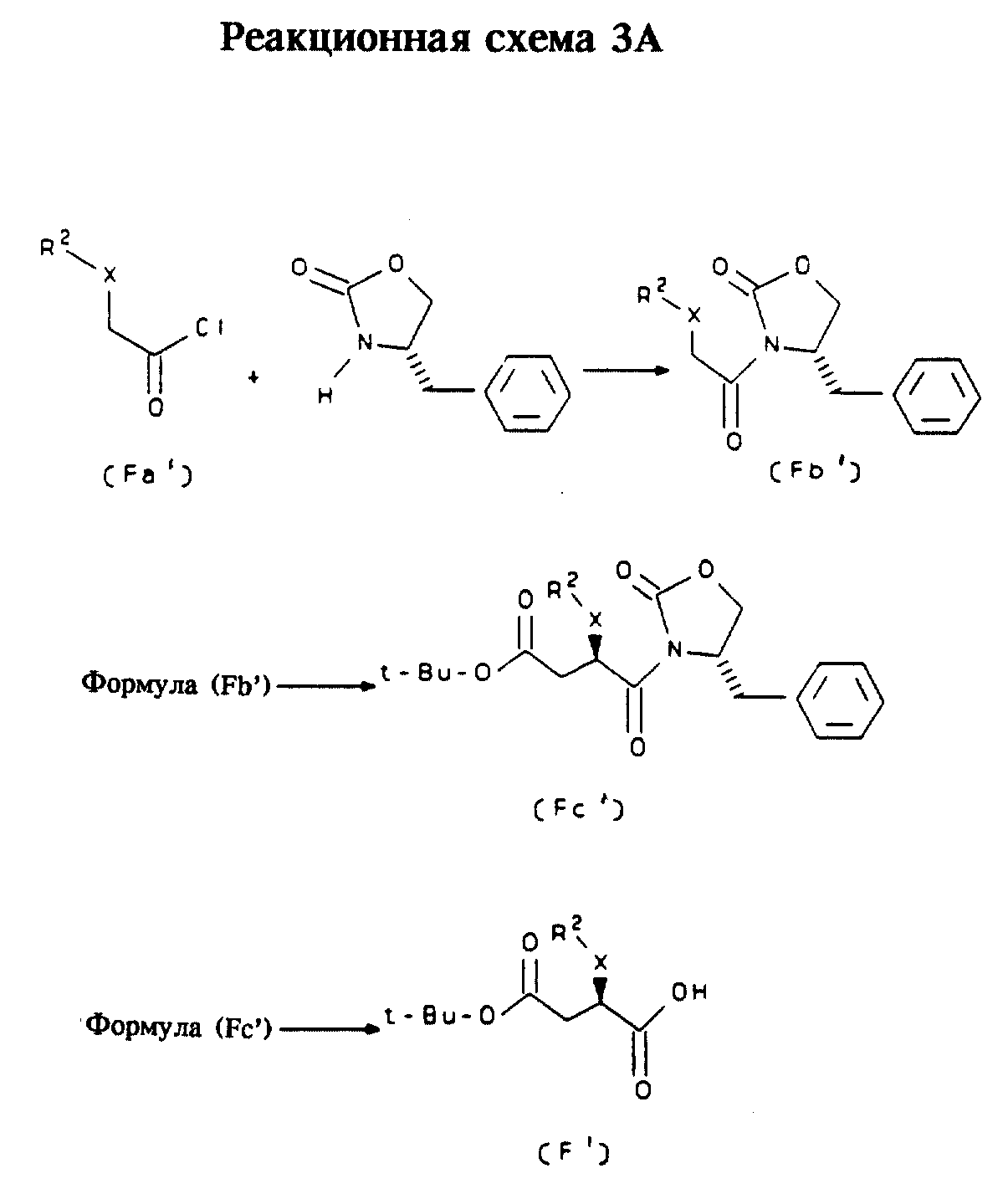
Альтернативный способ получения соединений формулы (F)
Другой способ получения стереоизомеров формулы (F)
основан на использовании коммерчески доступного хирального соединения, а именно, 4S-фенилметилоксазолидинона, как показано ниже на реакционной
схеме 3А [приведенной ниже за параграфом "Исходные
продукты", где показано получение соединений, применяемых в качестве исходных продуктов формулы (Fa')].
Исходные продукты
Соединения формулы (Fa'), в которых X обозначает
-O-СН2-CH2-, получают в соответствии с реакционной схемой 3А-1.
Коммерчески доступный спирт (а) подвергают взаимодействию с этил-4-бромкротонатом (b) в присутствии стехиометрического количества гидрида натрия в растворителе, таком, как ДМФ, при температуре от 0oC до комнатной либо в случае фенола (а) путем кипячения в течение нескольких часов с обратным холодильником соединения (b) в ацетоне в присутствии избытка карбоната калия. Образовавшийся ненасыщенный сложный эфир (с) превращают гидрированием в присутствии платины на угле в насыщенный сложный эфир (d), который затем омыляют водным гидроксидом натрия в этаноле до кислоты (e). Кислоту (e) превращают в хлорангидрид (Fa'-1) путем обработки оксалилхлоридом в диапазоне температур от комнатной до 50oC.
Соединения формулы (Fa'), в которых X обозначает -S-CH2-CH2-, получают в соответствии с реакционной схемой 3A-2.
Коммерчески доступный тиол (f) подвергают взаимодействию в течение нескольких часов с гидридом лития в ДМФ при комнатной температуре с образованием тиолата лития. Добавляют избыток бутирлактона (g) и нагревают до температуры кипения с обратным холодильником в атмосфере аргона, получая кислоту (h). Затем кислоту (h) превращают в хлорангидрид (Fa'-2) путем обработки оксалилхлоридом, как описано ранее.
Соединения формулы (Fa'), в которых X обозначает -CH2-CH2-О, получают в соответствии с реакционной схемой 3А-3.
Соединения формул (l) и (k) во многих случаях являются коммерчески доступными. В противном случае их получают следующим образом. Соединения формулы (j), в которых R2 обозначает арил или гетероарил, превращают в алкены (k) обработкой в течение нескольких часов винилтрибутилоловом (которое выпускается фирмой Aldrich Chemical Со.) в присутствии тетракис(трифенилфосфин) палладия в качестве катализатора при температуре дефлегмации в толуоле. Кроме того, алкены (k) могут быть превращены в спирты (l) путем гидроборирования бораном в ТГФ при температуре от 0o C до комнатной в течение нескольких часов с последующим окислением щелочной перекисью водорода. Спирты (l) превращают в кислоты (m) обработкой хлоруксусной кислотой и избытком гидрида натрия в ДМФ при повышенной температуре, предпочтительно при 60oC. Кислоты (m) превращают в хлорангидриды (Fa'-3) путем обработки оксалилхлоридом, как описано ранее.
Соединения формулы (Fa'), в которых X обозначает -CH2-CH2-S, получают в соответствии с реакционной схемой 3А-4.
Спирты (l) превращают в тиоацетаты (n) добавлением тиоуксусной кислоты к реагенту, полученному из трифосфина и диэтилазодикарбоксилата в ТГФ при 0oC. Тиоацетаты (n) превращают в кислоты (р) путем обработки карбонатом калия в метаноле в присутствии хлоруксусной кислоты. Кислоты (р) превращают в хлорангидриды (Fa'-4) обработкой оксалилхлоридом, как описано ранее.
Формула (Fb'): Сначала соединение формулы (Fa') конденсируют в стандартных условиях с 4S-фенилметилоксазолидиноном с получением соответствующего соединения формулы (Fb').
Формула (Fc'): Приблизительно эквимолярное количество гексаметилдисилазида натрия добавляют к соединению формулы (Fb') в инертном растворителе, таком, как ТГФ. Реакцию осуществляют при температуре от -80oC до -95oC в течение приблизительно 15 минут.
К этой смеси добавляют избыток трет-бутилбромацетата и раствор перемешивают в течение приблизительно 2 часов при температуре от -90oC до -60oC, получая отдельный стереоизомер формулы (Fc'), который очищают с помощью стандартных в органической химии способов.
Формула (F'): Группу оксазолидинона соединения формулы
(Fc') удаляют в основных
условиях с получением индивидуального стереоизомера формулы (F'), например, в соответствии со способом получения соединения формулы (F), представленным на реакционной схеме 3.
Соединения формулы (F')
могут применяться наряду с таковыми формулы (F) в описанных ниже реакциях
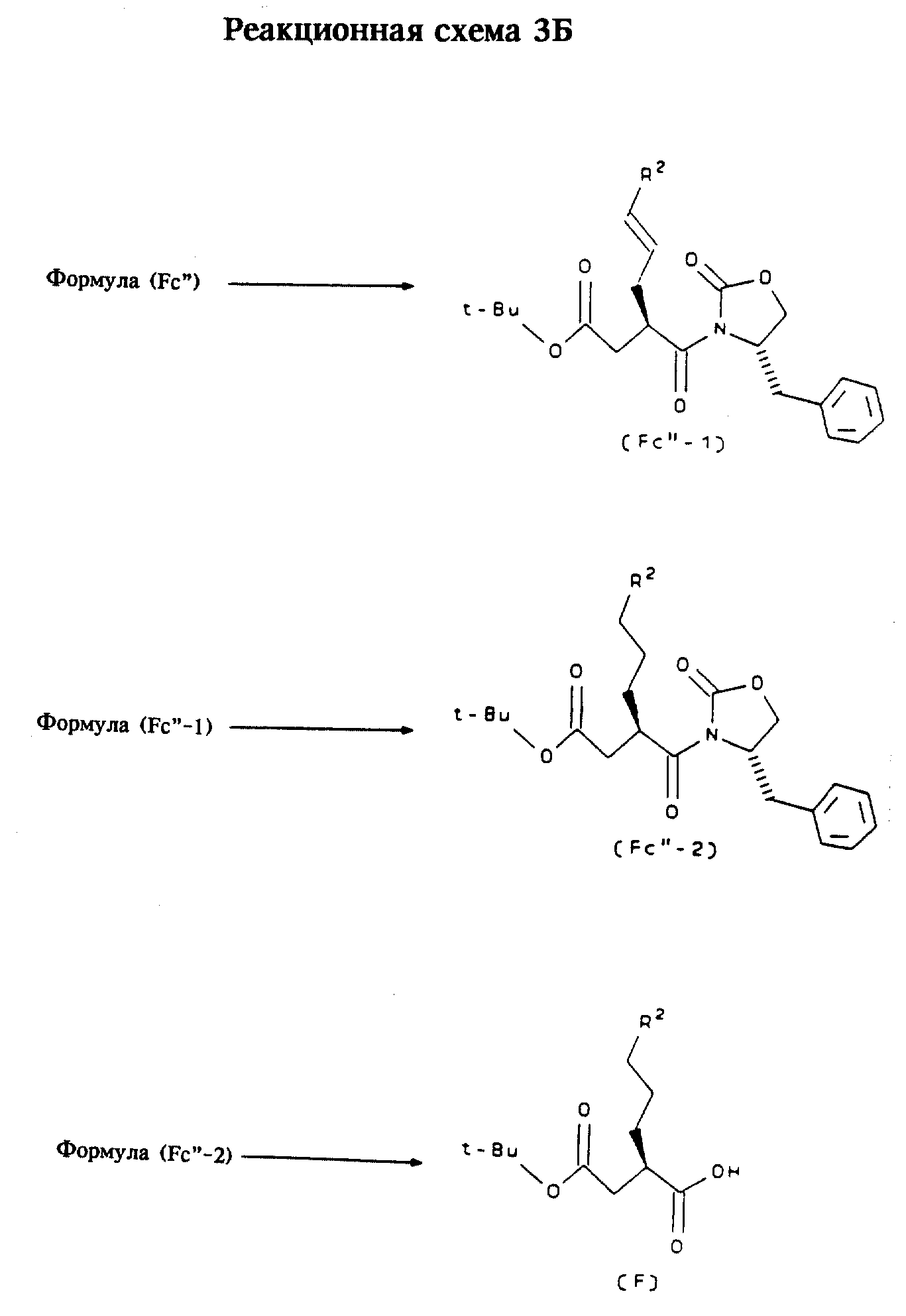
Альтернативный способ получения соединений формулы (F)
Соединения формулы (F) также
могут быть получены в
соответствии со способом, представленным на реакционной схеме 3Б.
Исходные продукты
Соединение, обозначенное как соединение формулы (Fc''), может быть
получено способом,
аналогичным способу получения соединения формулы (Fc'), представленному на реакционной схеме 3А, путем замены соединения формулы (Fa') на соответствующее алилльное соединение, в
котором группа,
обозначенная X, представляет собой проп-2-енил, a R2 обозначает Н.
Формула (Fc''-1): Арилирование или гетероарилирование соединения формулы (Fc'') осуществляют в присутствии основания и палладиевого катализатора добавлением арил- или гетероарилгалогенида, предпочтительно бромида или йодида, и выдержки реакционной смеси в течение 2-4 часов, предпочтительно 4 часов, при температуре приблизительно 100oC с образованием соединения формулы (Fc''-1).
Формула (Fc''-2): Каталитическое гидрирование (Pd/C) аллильного соединения формулы (Fc''-1) приводит к получению соответствующего алкильного соединения формулы (Fc''-2).
Формула (F): Соединение формулы (Fc''-2) обрабатывают в щелочной среде, такой, как гидропероксид лития (полученный in situ из гидроксида лития и перекиси водорода), сначала при пониженной температуре (предпочтительно при 0oC) в течение 15 минут и затем нагревают до комнатной температуры в течение 2 часов. Смесь вновь охлаждают до 0oC и добавляют при перемешивании водную смесь сульфита натрия и бикарбоната натрия, после чего смеси дают нагреться до комнатной температуры, значение pH доводят до нейтрального, получая соединение формулы (F) с помощью стандартных методов выделения.
Получение соединений формул (Ib), (Ic), (Id) и
(Ie)
Соединения формул (Ib), (Ic), (Id) и (Ie), каждая из которых представляет подкласс соединений формулы (I), в которых заместитель R1 имеет различные значения, получают
последовательно в соответствии с реакционной схемой 4, где R8 обозначает трет-бутил. В соединениях формулы (Ib) R1 обозначает алкоксикарбонил или аралкоксикарбонил. В
соединениях
формулы (Ic) R1 обозначает карбокси. В соединениях формулы (Id) R1 обозначает бензилоксикарбамоил. В соединениях формулы (Ie) R1 обозначает
гидроксикарбамоил.
Исходные продукты
Соединения формулы (D) получают в соответствии с реакционными схемами 2, 2А и 2Б. Соединения формулы (F) получают в соответствии с
реакционными схемами 3 и 3А.
О- бензилгидроксиламин является коммерчески доступным, например, в виде гидрохлоридной соли, выпускаемой фирмой Aldrich Chemical Со.
Формула Ib: Соединение формулы (F) подвергают сочетанию с соединением формулы (D) в стандартных условиях амидного сочетания, получая соединение формулы (Ib). Например, к раствору соединения формулы (F) в апротонном растворителе, предпочтительно в ДМФ, содержащему небольшое избыточное молярное количество ГОБТ, добавляют избыточное молярное количество ЭДКИ. Образовавшуюся смесь перемешивают в течение 1-2 часов (предпочтительно в течение 1 часа) при 0-5oC (предпочтительно при 0oC). Затем к холодному раствору добавляют эквимолярное количество соединения формулы (D) в присутствии основания, предпочтительно ДМАП. Образовавшуюся смесь затем перемешивают в течение 12-24 часов (предпочтительно в течение 24 часов) при комнатной температуре (предпочтительно при 25oC). Затем соединение формулы (Ib) выделяют из реакционной смеси с помощью методов, стандартных в области химии пептидов, например, выпариванием растворителей, экстракцией, быстрой хроматографией и/или ЖХВР.
Формула Ic: Соединение формулы (Ib) подвергают гидролизу в слабокислых условиях, предпочтительно в присутствии трифторуксусной кислоты, получая соединение формулы (Ic).
Формула Id: Соединение формулы (Ic) затем обрабатывают O- бензилгидроксиламином в стандартных условиях амидного сочетания, получая соединение формулы (Id). Например, холодный (0-5oC) раствор соединения формулы (Ic) и ГОБТ в инертном растворителе, предпочтительно в ДМФ, обрабатывают избыточным молярным количеством ЭДКИ. После перемешивания образовавшейся смеси в течение 0,5-1 ч при 0-5oC (предпочтительно при 0oC) добавляют эквимолярное количество О-бензилгидроксиламина. Реакционной смеси дают нагреться и выдерживают при комнатной температуре в течение ночи (8-16 часов). Соединение формулы (Id) затем выделяют из реакционной смеси с помощью стандартных методов, например, экстракцией и быстрой хроматографией.
Формула Ie: Гидроксизащитную группу (бензил) соединения формулы (Id) удаляют в условиях каталитического гидрирования (Pd/C), получая соединение формулы (Ie).
Альтернативный способ получения соединений формулы (Ie)
Альтернативный способ получения соединений формулы (Ie) (в которых R4 обозначает, в частности, серусодержащий
фрагмент, такой, как алкилсульфинил) состоит в обработке соответствующего
соединения формулы (Ic) гидроксиламин-гидрохлоридом и реагентом пептидного сочетания, предпочтительно бензтриазол -1 - илокси
- трис (диметиламино) фосфонийгексафторфосфатом, в присутствии третичного
аминного основания, такого, как N-метилморфолин, в таком растворителе, как ДМФ. Образовавшееся соединение формулы (Ie)
выделяют из реакционной смеси с помощью стандартных методов, например, путем
экстракции и концентрирования.
Альтернативный способ получения соединений формулы (Ib)
Наиболее
предпочтительный способ получения соединений формулы (Ib), где R2
обозначает арил или гетероарил и где X (не показан) обозначает пропан-1,3-диил, а p (не показано) равно 0, приведен на
реакционной схеме 4А.
Исходные продукты
Соединение,
обозначенное как соединение формулы (Fc''), может быть получено способом, аналогичным способу получения соединения
формулы (Fc'), представленному на реакционной схеме 3А, путем замены соединения
формулы (Fa') на соответствующее алилльное соединение, в котором R2 обозначает проп-2-енил. Соединение
формулы (D') представляет собой соединение формулы (D) и может быть получено в
соответствии с реакционной схемой 2. Галоидарил- или галоидгетероарильные реагенты, используемые для получения
соединения формулы (D'-2), являются коммерчески доступными или могут быть получены в
соответствии с методами, известными специалистам в данной области техники, например, согласно примеру 41В.
Соединение формулы (F'') получают путем щелочного гидролиза оксазолидиноновой группы соединения формулы (Fc''). После выделения стандартными способами соединение формулы (Fc'') подвергают сочетанию с соединением формулы (D') в стандартных условиях пептидного сочетания, как описано выше на реакционной схеме 2, получая соединение формулы (D'-1). Арилирование или гетероарилирование соединения формулы (D'-1) осуществляют, добавляя арил- или гетероарилгалогенид (предпочтительно арил- или гетероарилбромид, йодид или трифлат) и выдерживая реакционную смесь в течение приблизительно 2 часов при температуре приблизительно 100oC с получением соединения формулы (D'-2). Путем каталитического гидрирования (Pd/C) соединения формулы (D'-2) получают соединение формулы (Ib').
Получение соединений формулы (G)
Соединения формулы (G)

являются промежуточными продуктами для получения соединений формулы (I), получение которых показано ниже на реакционной схеме 6. Соединения формулы (G) получают в соответствии с реакционной схемой 5.
Исходные продукты
Соединения формулы (Ga)
и тиоуксусная кислота являются коммерчески доступными, например, они выпускаются фирмами TCI America Organic Chemicals и Aldrich
Company соответственно.
Формула (Gb): Соединение формулы (Ga) подвергают гидролизу с эквимолярным количеством основания, например, гидроксида калия, получая соединение формулы (Gb).
Формула (Gc): Соединение формулы (Gb) подвергают депротонированию в основных условиях, например, в присутствии триэтиламина, при 0-5oC (предпочтительно при 0oC) и затем подвергают взаимодействию с формальдегидом с последующей обработкой водным основанием, предпочтительно карбонатом калия, получая соединение формулы (Gc), которое выделяют из реакционной смеси с помощью стандартных методов.
Формула (Gd): Соединение формулы (Gc) подвергают гидролизу в основных условиях, предпочтительно в присутствии гидроксида лития, получая соединение формулы (Gd).
Формула (G): Соединение формулы (Gd) затем подвергают взаимодействию с избыточным молярным количеством тиоуксусной кислоты при 90- 100oC (предпочтительно при 95oC), в атмосфере инертного газа. Затем соединение формулы (G) выделяют из реакционной смеси с помощью стандартных методов, например, путем экстракции и упаривания.
Получение соединений формул (If) и (lg)
Соединения формул
(If) и (Ig), каждая из которых представляет подкласс соединений формулы I, где заместитель R1
обозначает серусодержащее соединение, получают последовательно в соответствии с реакционной
схемой 6. В соединениях формулы (If) R1 обозначает ацетилтио. В соединениях формулы (Ig) R1 обозначает меркапто.
Формула (If): Соединение формулы (G) подвергают сочетанию с соединением формулы (D) в стандартных условиях амидного сочетания, получая соединение формулы (If). Например, к раствору соединения формулы (G) и ГОБТ в апротонном растворителе, предпочтительно в ДМФ, добавляют избыточное молярное количество ЭДКИ. Затем добавляют соединение формулы (D) и образовавшуюся смесь перемешивают в течение ночи при комнатной температуре. После этого образовавшееся соединение формулы (If) выделяют из реакционной смеси с помощью стандартных методов, например, путем выпаривания растворителя, экстракции и быстрой хроматографии.
Формула (Ig): Соединение формулы (If) подвергают гидролизу в щелочных условиях, предпочтительно в протонном растворителе, таком, как метанол, в присутствии гидроксида аммония, получая соединение формулы (Ig).
Получение соединений формулы (Ih)
Соединения формулы (Ih) представляют
собой подкласс соединений формулы (I), в которых R1 обозначает
N-гидроксиформиламино, и их получают в соответствии с реакционной схемой 7.
Исходные продукты
Соединение, обозначенное как соединение формулы (Fb''), может быть получено
способом, аналогичным способу получения соединения формулы (Fb'), представленному на реакционной схеме 3А, путем замены
соединения формулы (Fa') на соответствующее алилльное соединение, в котором
R2 обозначает проп-2-енил.
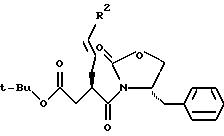
Формула (Р-1): Соединение формулы (Fb'') подвергают гидроксиметилированию путем инкубации с тетрахлоридом титана при пониженной температуре, предпочтительно при 0oC, в щелочных условиях в течение 1-3 часов, предпочтительно в течение 1 часа, с последующим добавлением S-триоксана и тетрахлорида титана и с продолжением инкубации при 0oC в течение 3-5 часов, предпочтительно 4 часов. Соединение формулы (Р-1) затем выделяют стандартными способами, например, путем экстракции и хроматографии на колонках.
Формула (Р-2): Соединение формулы (Р-1) подвергают взаимодействию с избыточным молярным количеством О- бензилгидроксиламина и триметилалюминия при пониженной температуре, предпочтительно при 0oC. Реакции дают протекать при перемешивании в течение 5-7 часов, предпочтительно 6 часов, и при 0oC в атмосфере аргона. Образовавшееся соединение формулы (Р-2) выделяют стандартными способами.
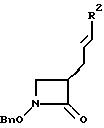
Формула (Р-3): Избыток мезилхлорида подвергают взаимодействию с соединением формулы (Р-2) в пиридине при 0oC в течение нескольких часов, предпочтительно в течение 3 часов. Реакционную смесь охлаждают на льду, экстрагируют органическим растворителем и концентрируют. Концентрированный экстракт кипятят с обратным холодильником в щелочной среде в течение нескольких часов, предпочтительно в течение 3 часов, получая таким образом азетидиноновое соединение формулы (Р-3), которое очищают стандартными способами.
Формула (Р-4): Соединение формулы (Р-3) подвергают взаимодействию с соответствующей галогенирующей R2 -группой (например, с арил- или гетероарилгалогенидом, предпочтительно с бромидом или йодидом) в инертном растворителе в присутствии основания, такого, как триэтиламин, и палладиевого катализатора, предпочтительно образованного из ацетата палладия (II) и приблизительно двух молярных эквивалентов три-орто-толилфосфина. После выдержки реакционной смеси в течение 15-20 часов, предпочтительно в течение 18 часов, при 100oC соответствующее соединение формулы (Р-4) выделяют и очищают стандартными способами.
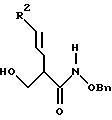
Формула (Р-5): Расщепление азетидинонового кольца соединения формулы (Р-4) осуществляют в основных условиях при комнатной температуре в течение 1-3 часов, предпочтительно 1 часа. Образовавшееся соединение экстрагируют органическим растворителем, концентрируют, повторно растворяют в содержащем основание растворителе (например, в пиридине) и карбоксилируют муравьиным ангидридом при пониженной температуре, предпочтительно при 0oC, в течение 30 минут, получая соответствующее соединение формулы (Р-5), которое выделяют стандартными способами.
Формула (Р-6): Соединение формулы (Р-5) подвергают сочетанию с соединением формулы (D') в стандартных условиях амидного сочетания с образованием соответствующего соединения формулы (Р-6), которое выделяют стандартными способами.
Формула (Ih): Каталитическое гидрирование соединения формулы (Р-6) с помощью Pd/C с последующим удалением катализатора фильтрацией позволяет получить соответствующее соединение формулы (Ih).
Получение солей
Все соединения формулы (I), которые существуют либо в форме свободной кислоты, либо в
форме свободного основания, кроме того, могут быть превращены в их фармацевтически
приемлемые соли обработкой соответствующим неорганическим или органическим основанием или соответствующей
неорганической или органической кислотой соответственно. Соли соединений формулы (I) также
могут быть превращены в свободную кислоту или свободное основание либо в другую соль. Например, соединение
формулы (I), имеющее фрагмент карбоновой кислоты, может быть превращено в карбоксилат
добавлением 1 эквивалента NaOH или КОН в спиртовом растворителе с последующим выпариванием растворителя.
Соединение формулы (I) в форме свободного основания может быть превращено в хлоридную соль,
например, добавлением 1 эквивалента HCl в органическом растворителе с последующим концентрированием.
Предпочтительные способы синтеза и заключительные стадии
В целом,
соединения формул (I) получают путем:
(А) взаимодействия соединения формулы (D)

с соединением формулы (F)
где R1 обозначает алкоксикарбонил, аралкоксикарбонил, арил- или гетероарилтиометилсульфосфиноил или ацетилтио; в присутствии основания и реагента амидного сочетания с получением соответствующего соединения формулы (I); или
(Б) каталитического гидрирования соответствующего соединения, где X и R2 вместе обозначают необязательно арил- или гетероарилзамещенный алкенил; или
(В) обработки соединения формулы (I), где R1 обозначает алкоксикарбонил или аралкоксикарбонил, в слабокислой среде с получением соответствующего соединения формулы (I), где R1 обозначает карбокси; или
(Г) взаимодействия соединения формулы (I), где R1 обозначает карбокси, с О-бензилгидроксиламином с получением соединения формулы (I), где R1 обозначает бензилоксикарбамоил; или
(Д) каталитического гидрирования соединения формулы (I), где R1 обозначает бензилоксикарбамоил, с получением соответствующего соединения формулы (I), где R1 обозначает гидроксикарбамоил; или
(Е) взаимодействия соединения формулы (I), где R1 обозначает карбокси, с гидроксиламином с получением соответствующего соединения формулы (I), где R1 обозначает гидроксикарбамоил; или
(Ж) каталитического гидрирования соединения формулы

где BnO обозначает бензилокси, с получением соответствующего соединения формулы (I), где R1 обозначает N-гидроксиформиламино; или
(З) взаимодействия соединения формулы (I), где R1 обозначает ацетилтио, с гидроксидом аммония в протонном растворителе с получением соответствующего соединения формулы (I), где R1 обозначает меркапто.
Предпочтительный способ получения соединений формулы (I), где R1
обозначает N-гидроксиформиламино, включает превращение соединения формулы (Р-4)

где R2 обозначает арил или гетероарил, путем щелочного гидролиза с последующим формилированием с получением соединения формулы (Р-5)

взаимодействия соединения формулы (Р-5) с соединением формулы (D) с получением соединения формулы (Р-6)

и каталитического гидрирования соединения формулы (Р-6).
Соединения, полученные с помощью вышеописанного способа по изобретению, могут быть идентифицированы по наличию определяемого количества одного или нескольких соединений формул (Р-3), (Р-4) или (Р-6). Хотя, как это хорошо известно, фармацевтические средства должны удовлетворять фармакопейным стандартам перед их утверждением и/или продажей, а чистота реагентов для синтеза (таких, как О-бензилгидроксиламин) или предшественников [таких как (Р-3), (Р-4) или (Р-6)] должна находиться в пределах, определяемых фармакопейными стандартами, конечные соединения, полученные способом согласно настоящему изобретению, могут содержать малые, но определяемые количества таких продуктов, присутствующих, например, в концентрациях 50 част./млн или ниже. Такие концентрации соединения формулы (Р-3) могут быть обнаружены, например, с помощью ГХ-МС, соединения формулы (Р-4) могут быть обнаружены, например, с помощью ЖХВР-МС или ЖХВР с флуоресцентным обнаружением, соединения формулы (Р-6) могут быть обнаружены, например, с помощью ЖХВР с флуоресцентным обнаружением. Поскольку важно контролировать чистоту фармацевтических соединений на наличие в них указанных веществ, то в объем изобретения также включен метод их обнаружения, применяемый при осуществлении способа по настоящему изобретению.
Примеры
Описанные ниже способы получения,
композиции и примеры предназначены для более подробного пояснения сущности
настоящего изобретения, что должно обеспечить возможность практического осуществления настоящего изобретения специалистами
в данной области техники. Эти примеры не следует рассматривать как
ограничивающие объем изобретения, и они являются только иллюстративными и репрезентативными.
Пример 1
Соединения формулы (Ea)
1А. Кристаллическую фосфиновую кислоту
(8,4 г, 0,13 моля) перемешивали в чистом триэтилортоформиате (22 мл, 0,20 моля) в течение 90 минут при комнатной температуре.
Затем этот продукт переносили с помощью канюли в перемешиваемый раствор
этилизобутилакрилата (8 г, 0,036 моля) и тетраметилгуанидина (4,5 мл, 0,036 моля), который охлаждали до 0oC в
течение 10 минут. Ледяную баню удаляли и реакционную смесь перемешивали в
течение 4 часов. Смесь разбавляли 200 мл диэтилового эфира и раствор промывали 1н. HCl (100 мл), водой (4х100 мл), соляным
раствором (100 мл) и сушили над сульфатом магния. Этот продукт упаривали с
помощью роторного испарителя, получая 8,15 г этилового эфира 2- (этокси)фосфиноилметил-4-метилпентановой кислоты в виде
слегка желтоватого масла, МС: 349 (М-H2O)+.
1Б. Аналогичным способом получали следующие соединения формулы (Ea):
этиловый эфир
2-(этокси)фосфиноилметил-5-фенилпентановой кислоты;
этиловый эфир
2-(этокси)фосфиноилметил-4-фенилбутановой кислоты;
этиловый эфир 2-(этокси)фосфиноилметил-3-фенилпропановой кислоты;
этиловый эфир 2-(этокси)фосфиноилметил-3-циклогексилпропановой
кислоты; и
этиловый эфир 2-((этокси)фосфиноилметил)пентановой кислоты.
Пример 2
Соединения
формулы (Eb)
2А. Неочищенный этиловый эфир
2- (этокси)фосфиноилметил-4-метилпентановой кислоты (26 г) растворяли в 600 мл ТГФ/CH2CI2 (50/50) и охлаждали до 0o
C. К раствору добавляли диизопропилэтиламин (32 мл)
и 90,8 мл бис(триметилсилил)ацетамида и образовавшуюся смесь перемешивали в течение 20 минут с последующим добавлением параформальдегида (5,5 г).
Температуру раствора доводили до комнатной и
выдерживали при 37oC в течение 18 часов. Растворитель удаляли с помощью выпаривания и образовавшееся масло растворяли в 200 мл этилацетата.
Раствор промывали 50 мл 1н. HCl (2 раза), 50 мл
соляного раствора (2 раза), сушили над MgSO4, фильтровали и упаривали, получая 19,3 г этилового эфира 2-(этокси)
(гидроксиметил)фосфиноилметил-4-метилпентановой кислоты в виде
бледно-желтого масла, МС: 281,2 (МН+).
2Б. Аналогичным способом получали следующие соединения формулы
(Eb):
этиловый эфир
2- (этокси)(гидроксиметил)фосфиноилметил-5-фенилпентановой кислоты;
этиловый эфир 2-(этокси)(гидроксиметил)фосфиноилметил-4- фенилбутановой кислоты;
этиловый эфир
2- (этокси)(гидроксиметил)фосфиноилметил-3-фенилпропановой кислоты;
этиловый эфир 2-(этокси)(гидроксиметил)фосфиноилметил-3- циклогексилпропановой кислоты; и
этиловый
эфир
2- ((этокси)(гидроксиметил)фосфиноилметил)пентановой кислоты.
Пример 3
Соединения формулы (Ec)
3А. Этиловый эфир
2- (этокси)(гидроксиметил)фосфиноилметил-4-метилпентановой кислоты (5 г) растворяли в 20 мл CH2Cl2 и охлаждали до -20oC (с дублированием). К раствору по каплям
добавляли метансульфонилхлорид (1,5 мл) и триэтиламин (3,0 мл). Через 15 минут баню удаляли и реакционную смесь оставляли при комнатной температуре на 3,5 часа. Затем каждый раствор
промывали с
помощью 10 мл холодной 2%-ной HCl, 10 мл NaHCO3 (насыщенного), 10 мл соляного раствора, сушили над MgSO4, фильтровали и упаривали, получая 12,8 г (объединенный выход) этилового
эфира 2-(этокси) (метансульфонилоксиметил)фосфиноилметил-4-метилпентановой кислоты.
3Б. Аналогичным способом, но заменяя метансульфонилхлорид на пара-толуолсульфонилхлорид, получали этиловый эфир 2-(этокси)(пара- толуолсульфонилоксиметил)фосфиноилметил-4-метилпентановой кислоты.
3В. Аналогичным способом получали следующие соединения формулы (Ec):
этиловый эфир 2- (этокси)(метансульфонилоксиметил)фосфиноилметил-5-фенилпентановой кислоты;
этиловый эфир 2- (этокси)(метансульфонилоксиметил)фосфиноилметил-4-фенилбутановой кислоты;
этиловый эфир 2- (этокси)(метансульфонилоксиметил)фосфиноилметил-3-фенилпропановой кислоты;
этиловый эфир 2- (этокси)(метансульфонилоксиметил)фосфиноилметил-3- циклогексилпропановой кислоты;
этиловый эфир 2- ((этокси)(метансульфонилоксиметил)фосфиноилметил)пентановой кислоты;
этиловый эфир 2-(этокси)(пара- толуолсульфонилоксиметил)фосфиноил-метил-5-фенилпентановой
кислоты;
этиловый эфир 2-(этокси)(пара- толуолсульфонилоксиметил)фосфиноил-метил-4-фенилбутановой кислоты;
этиловый эфир 2-(этокси)(пара-толуолсулсульфонилоксиметил)фосфиноилметил
- 3 - фенилпропановой кислоты;
этиловый эфир 2- (этокси)(пара-толуолсулсульфонилоксиметил)фосфиноилметил-3- циклогексилпропановой кислоты; и
этиловый эфир
2-((этокси)(пара- толуолсульфонилоксиметил)фосфиноилметил)пентановой кислоты.
Пример 4
Соединения формулы (Ee)
4А. Гидрид натрия (1,52 г, (60%-ный)) и 2-хинолинтиол
(6 г) перемешивали вместе при 0oC в 50 мл ДМФ. После прекращения первоначального выделения H2 смесь перемешивали при комнатной температуре в течение 2,5 часов. Затем смесь
охлаждали до 0oC и добавляли с помощью канюли этиловый эфир 2-(этокси)(метансульфонилоксиметил)фосфиноил-метил-4- метилпентановой кислоты (12,8 г) в 10 мл ДМФ, после чего образовавшуюся
смесь перемешивали в течение 18 часов, медленно нагревая до комнатной температуры. ДМФ удаляли путем выпаривания, остаток растворяли в 50 мл этилацетата и промывали 50 мл H2О (2 раза),
соляным раствором (50 мл), сушили над MgSO4 и упаривали до желтого полутвердого продукта. Путем очистки с помощью быстрой хроматографии с использованием для элюирования смеси от 10%- до
80%-ного этилацетата/гексана получали 10 г этилового эфира 2- (этокси)(хинолин-2-илтиометил)фосфиноилметил-4-метилпентановой кислоты (Rf 0,35 для 80%-ного этилацетата/гексана), МС: 424,1
(МН+).
4Б. Аналогичным способом, но заменяя 2-хинолинтиол на 1-нафталинтиол, 2-нафталинтиол или тиофенол, получали следующие соединения формулы (Ee):
этиловый
эфир
2-(этокси) (нафт-1- илтиометил)фосфиноилметил-4-метилпентановой кислоты;
этиловый эфир 2-(этокси) (нафт-2-илтиометил)фосфиноилметил-4-метилпентановой кислоты и
этиловый эфир
2-(этокси)(фенилтиометил)фосфиноилметил- 4-метилпентановой кислоты.
4В. Аналогичным способом получали следующие соединения формулы (Ee):
этиловый эфир 2-(этокси)
(хинолин-2-илтиометил)фосфиноилметил-5-фенилпентановой кислоты;
этиловый эфир 2-(этокси)(хинолин-2-илтиометил)фосфиноилметил-4- фенилбутановой кислоты;
этиловый эфир
2-(этокси)(хинолин-2- илтиометил)фосфиноилметил-3-фенилпропановой кислоты;
этиловый эфир 2-(этокси)(хинолин-2- илтиометил)фосфиноилметил-3-циклогексилпропановой кислоты;
этиловый
эфир 2-((этокси)(хинолин-2-илтиометил)фосфиноилметил)пентановой кислоты;
этиловый эфир 2-(этокси)(нафт-1- илтиометил)фосфиноилметил-5-фенилпентановой кислоты;
этиловый эфир
2-(этокси)(нафт-1-илтиометил)фосфиноилметил-4-фенилбутановой кислоты;
этиловый эфир 2-(этокси)(нафт-1- илтиометил)фосфиноилметил-3-фенилпропановой кислоты;
этиловый эфир
2-(этокси)(нафт-1-илтиометил)фосфиноилметил-3- циклогексилпропановой кислоты;
этиловый эфир 2-((этокси)(нафт-1- илтиометил)фосфиноилметил)пентановой кислоты;
этиловый эфир
2- (этокси)(нафт-2-илтиометил)фосфиноилметил-5-фенилпентановой кислоты;
этиловый эфир 2-(этокси)(нафт-2- илтиометил)фосфиноилметил-4-фенилбутановой кислоты;
этиловый эфир
2-(этокси)(нафт-2-илтиометил)фосфиноилметил-3-фенилпропановой кислоты;
этиловый эфир 2-(этокси)(нафт-2- илтиометил)фосфиноилметил-3-циклогексилпропановой кислоты;
этиловый эфир
2-((этокси)(нафт-2-илтиометил)фосфиноилметил)пентановой кислоты;
этиловый эфир 2- (этокси)(фенилтиометил)фосфиноилметил-5-фенилпентановой кислоты;
этиловый эфир
2-(этокси)(фенилтиометил)фосфиноилметил-4- фенилбутановой кислоты;
этиловый эфир 2- (этокси)(фенилтиометил)фосфиноилметил-3-фенилпропановой кислоты;
этиловый эфир
2-(этокси)(фенилтиометил)фосфиноилметил-3- циклогексилпропановой кислоты и
этиловый эфир 2- ((этокси)(фенилтиометил)фосфиноилметил)пентановой кислоты.
Пример 5
Соединения Формулы (Е)
5А. Этиловый эфир 2-(этокси)(хинолин-2- илтиометил)фосфиноилметил-4-метилпентановой кислоты (4,5 г) растворяли в 100 мл ТГФ и добавляли 12,5 мл 2н. NaOH вместе с
метанолом в количестве, достаточном для получения гомогенного раствора. Через 18 часов ТГФ удаляли путем выпаривания, остаток растворяли в 50 мл H2О и промывали 50 мл этилацетата. Затем
водную фазу подкисляли до pH 4 и продукт экстрагировали 50 мл этилацетата (2 раза). Этилацетатную фракцию промывали 20 мл соляного раствора, сушили над MgSO4 и упаривали, получая 3,8 г
2-(гидрокси)(хинолин-2-илтиометил)фосфиноилметил-4-метилпентановой кислоты в виде желтого масла, МС: 368 (МН+).
5Б. Аналогичным способом получали следующие соединения
формулы (Е):
2-(гидрокси)(нафт-1-илтиометил)фосфиноилметил-4-метилпентановую кислоту;
2-(гидрокси)(нафт-2-илтиометил)фосфиноилметил-4-метилпентановую кислоту и
2-(гидрокси)(фенилтиометил)фосфиноилметил-4- метилпентановую кислоту.
5В. Аналогичным способом получают следующие соединения формулы (Е):
2-(гидрокси)(хинолин-2- илтиометил)фосфиноилметил-5-фенилпентановую кислоту;
2-(гидрокси) (хинолин-2-илтиометил)фосфиноилметил-4-фенилбутановую кислоту;
2-(гидрокси)(хинолин-2-илтиометил)фосфиноилметил-3-фенилпропановую кислоту;
2-(гидрокси)(хинолин-2- илтиометил)фосфиноилметил-3-циклогексилпропановую кислоту;
2-((гидрокси)
(хинолин-2-илтиометил)фосфиноилметил)пентановую кислоту;
2-(гидрокси)(нафт-1-илтиометил)фосфиноилметил-5- фенилпентановую кислоту;
2-(гидрокси)(нафт-1- илтиометил)фосфиноилметил-4-фенилбутановую кислоту;
2-(гидрокси)(нафт-1-илтиометил)фосфиноилметил-3-фенилпропановую кислоту;
2-(гидрокси)(нафт-1-илтиометил)
фосфиноилметил-3- циклогексилпропановую кислоту;
2-((гидрокси)(нафт-1-илтиометил) фосфиноилметил)пентановую кислоту;
2-(гидрокси)(нафт-2- илтиометил)фосфиноилметил-5-фенилпентановую
кислоту;
2-(гидрокси)(нафт-2-илтиометил)фосфиноилметил-4-фенилбутановую кислоту;
2-(гидрокси)(нафт-2-илтиометил)фосфиноилметил-3-фенилпропановую кислоту;
2-(гидрокси)(нафт-2-илтиометил)фосфиноилметил-3- циклогексилпропановую кислоту;
2-((гидрокси)(нафт-2- илтиометил)фосфиноилметил)пентановую кислоту;
2-(гидрокси)(фенилтиометил)фосфиноилметил-5-фенилпентановую кислоту;
2-(гидрокси)(фенилтиометил)фосфиноилметил-4-фенилбутановую кислоту;
2-(гидрокси)(фенилтиометил)фосфиноилметил-3-фенилпропановую кислоту;
2-(гидрокси)(фенилтиометил)фосфиноилметил-3- циклогексилпропановую кислоту и
2-((гидрокси)(фенилтиометил)фосфиноилметил)пентановую кислоту.
Пример 6
Разделение соединения формулы (Е)
2-(гидрокси)(хинолин-2-илтиометил)фосфиноилметил-4-метилпентановую кислоту (5,3 г) растворяли в 50 мл теплого этанола (абсолютного) и добавляли 4,2 г (-)-цинхонидина.
Через 30 минут
при комнатной температуре начинала осаждаться соль. Колбу покрывали фольгой и выдерживали в течение 2 дней. Затем соль удаляли путем фильтрации под вакуумом и фильтрат упаривали до желтой пены. Соль
и
фильтрат по отдельности растворяли в 100 мл этилацетата и промывали последовательно 1%-ной HCl для удаления цинхонидина, поддерживая при этом значение pH выше 4. Оба раствора сушили по отдельности
над
MgSO4 и упаривали, получая 2,4 г отдельного стереоизомера [α]4 =
+10,
68o (9,73 мг в метаноле (2 мл)) и 2,5 г другого отдельного стереоизомера [α]
Пример 7
Соединения формулы (В)
7А. К холодной (0oC) суспензии
4-ацетамидобензолсульфонилхлорида
(4,0 г, 17 ммолей) в CH2Cl2 (40 мл) добавляли пиридин (1,7 мл, 20 ммолей) и ДМАП (209 мг, 1,7 ммоля). (В результате образовывался прозрачный
раствор). Безводный метиламин
барботировали в растворе в течение 1 часа при 0oC, а затем раствор оставляли для перемешивания при 25oC в течение 2 часов. Раствор экстрагировали
1M NaOH (3х15 мл) и объединенные
экстракты доводили до значения pH 6 при 0oC с помощью 3М HCl. Продукт, который осаждался в виде пушистых белых кристаллов, фильтровали и промывали холодной
водой, получая 3,2 г (82%)
4-ацетамидо-N-метилбензолсульфонамида;1H-ЯМР (300 МГц, MeOH) δ 2,35 (s,3H), 2,70 (s,3H), 7,96 (s,4H).
7Б. Смесь 4-ацетамидо-N-метилбензолсульфонамида (3,2 г, 14 ммолей) и 100 мл 1M HCl выдерживали при температуре кипения с обратным холодильником в атмосфере аргона в течение 3 часов. После охлаждения до 25oC добавляли CH2Cl2 (10 мл) и водную фазу нейтрализовали с помощью 1M NaOH при 0oC. Водную фазу отделяли и экстрагировали CH2Cl2 (2х25 мл). Объединенные органические фазы промывали соляным раствором (10 мл), сушили (Na2SO4) и концентрировали, получая 1,5 г (58%) соединения формулы (В), где R4 обозначает N- метилсульфонамид, в виде бесцветного твердого продукта;1H-ЯМР (300 МГц, MeOH) δ 2,46 (s,3H), 6,67-6,72 (AA1 часть от AA1XX1,2H), 7, 48-7,52 (XX1 часть от AA1XX1,2H).
Пример 8
Соединения формулы (С)
8А. К холодному (0oC) раствору
N-трет-бутоксикарбонил-L-лейцина (1,4 г, 6,3 ммоля) и ГОБТ (1,5 г, 9,8 ммоля)
в ДМФ (30 мл) порциями добавляли ЭДКИ (2,5 г, 14 ммолей). Раствор, образовавшийся после перемешивания в течение 1 часа
при 0oC, обрабатывали метил-4-аминобензоатом (1,09 мл, 6,8 ммоля) и
ДМАП (0,32 г, 2,6 ммоля). После перемешивания в течение 24 часов при 25oC ДМФ удаляли под вакуумом. Остаток
растворяли в CH2Cl2 и промывали насыщенным раствором
NaHCO3, 1М HCl (дважды) и соляным раствором. После сушки над Na2SO4 и концентрирования под
вакуумом получали неочищенный продукт, который очищали с помощью быстрой
хроматографии на SiO2 (20%-ный этилацетат/гексан в качестве растворителя для элюирования). В результате получали 1,
0 г (85%)
N-трет-бутоксикарбонил-L-лейцин-N'- (4-метоксикарбонилфенил)карбоксамида в виде вспененного твердого вещества, МС (БТЯ): 363 (М-Н)-.
8Б. Аналогичным способом
получали
следующие соединения формулы (С):
N-трет-бутоксикарбонил-L-триптофан-N'-фенилметилкарбоксамид;
N-трет-бутоксикарбонил-L-триптофан-N'-фенилкарбоксамид;
N-трет-бутоксикарбонил-L-триптофан-N'-(4- метоксикарбонилфенил)карбоксамид;
N-трет-бутоксикарбонил-L-триптофан-N'-(4- этоксикарбонилфенил)карбоксамид;
N-трет-бутоксикарбонил-L-лейцин-N'-(4- (N''-метиламиносульфонил)фенил)карбоксамид;
N-трет-бутоксикарбонил-L-аланин-N'-(4-метоксикарбонилфенил) карбоксамид;
N-трет-бутоксикарбонил-L-метионин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-трет-бутоксикарбонил-L- лейцин-N'-(3-этоксикарбонилфенил)карбоксамид;
N-трет-бутоксикарбонил-L-лейцин-N'-(2-метоксикарбонилфенил) карбоксамид;
N-трет-бутоксикарбонил-L-лейцин-N'-(4-(1- метилэтилоксикарбонил)фенил)карбоксамид;
N-трет-бутоксикарбонил-L-лейцин-N'-(аминосульфонилфенил)карбоксамид;
N-трет-бутоксикарбонил-L-лейцин-N'- (4-метоксикарбонилметилфенил)карбоксамид;
N-трет-бутоксикарбонил- L-пиридин-3-илаланин-N'-(4-метоксикарбонилфенил) карбоксамид;
N-трет-бутоксикарбонил-L-циклогексилглицин-N'- (4-метоксикарбонилфенил)карбоксамид;
N-трет-бутоксикарбонил-L-изолейцин-N'-(4-метоксикарбонилфенил) карбоксамид;
N-трет-бутоксикарбонил-L-O- бензилтреонин-N'-(4-метоксикарбонилфенил)карбоксамид;
N-тpeт-бутoкcикapбoнил-L-тpeт-лeйцин-N'- (4-метоксикарбонилфенил)карбоксамид;
N-трет-бутоксикарбонил-L-лейцин-N'-(4-цианфенил)карбоксамид;
N-трет-бутоксикарбонил-L-лейцин-N'-(4-(N''-(2- диметиламиноэтил)карбамоил)фенил)карбоксамид и
N-трет-бутоксикарбонил-L-лейцин-N'-(4- (N''-(3-диметиламинопропил)карбамоил)фенил)карбоксамид.
8В. Аналогичным способом получали следующие соединения формулы (С):
N-трет-бутоксикарбонил-L-триптофан-N'- (4-нитрофенил)карбоксамид;
N-трет-бутоксикарбонил-L-триптофан-N'- (4-аминофенил)карбоксамид;
N-трет-бутоксикарбонил-L-лейцин-N'- (4-метилсульфонилфенил)карбоксамид;
N-тpeт-бутoкcикapбoнил-L-лeйцин-N'-(4-этилсульфонилфенил) карбоксамид и
N-трет-бутоксикарбонил-L- лейцин-N'-(4-тетразолилфенил)карбоксамид.
Пример 9
Соединения
формулы (D)
9A. К холодному (0oC) раствору
N-трет-бутоксикарбонил-L-лейцин-N'-фенилкарбоксамида (3,4 г, 11 ммолей) в безводном CH2Cl2 (10 мл) добавляли ТФК (2
мл). Раствор оставляли для перемешивания при 25oC
в течение 6 часов и затем концентрировали под вакуумом. Остаток распределяли между CH2Cl2 и Н2О и водный
слой подщелачивали насыщенным раствором K2CO3 при 0oC. Органическую фазу отделяли и водный слой трижды экстрагировали CH2Cl2. Объединенные
органические слои промывали соляным раствором и сушили над Na2SO4. Путем концентрирования получали L-лейцин-N'-фенилкарбоксамид.
9В. Аналогичным способом
получали следующие соединения:
L-лейцин-N'-(4-метоксикарбонилфенил)карбоксамид;
L-триптофан-N'-фенилметилкарбоксамид;
L-триптофан-N'-фенилкарбоксамид;
L-триптофан-N'-(4-метоксикарбонилфенил)карбоксамид;
L-триптофан-N'-(4-этоксикарбонилфенил)карбоксамид;
L-лейцин-N'-(4-(N''-метиламиносульфонил)фенил)карбоксамид;
L-аланин-N'-(4-метоксикарбонилфенил)карбоксамид;
L-метионин-N'-(4-метоксикарбонилфенил)карбоксамид;
L-лейцин-N'-(3-этоксикарбонилфенил)карбоксамид;
L-лейцин-N'-(2-метоксикарбонилфенил)карбоксамид;
L-лейцин-N'-(4-(1-метилэтилоксикарбонил)фенил)карбоксамид;
L-лейцин-N'-(аминосульфонилфенил)карбоксамид;
L-лейцин-N'-(4-метоксикарбонилметилфенил)карбоксамид;
L-пиридин-3-илаланин-N'-(4-метоксикарбонилфенил)карбоксамид;
L-спироциклопентилглицин-N'-(4-метоксикарбонилфенил)карбоксамид;
L-циклогексилглицин-N'-(4-метоксикарбонилфенил)карбоксамид;
L-изолейцин-N'-(4-метоксикарбонилфенил)карбоксамид;
L-О-бензилтреонин-N'-(4-метоксикарбонилфенил)карбоксамид;
L-трет-лейцин-N'-(4-метоксикарбонилфенил)карбоксамид;
L-лейцин-N'-(4-цианфенил)карбоксамид;
L-лейцин-N'-(4-(N''-(2-диметиламиноэтил)карбамоил)фенил) карбоксамид и
L-лейцин-N'-(4-(N''-(3- диметиламинопропил)карбамоил)фенил)карбоксамид.
9В. Аналогичным способом получали следующие соединения формулы (D):
L-триптофан-N'-(4-нитрофенил)карбоксамид;
L-триптофан-N'-(4-аминофенил)карбоксамид;
L-лейцин-N'-(4-метилсульфонилфенил)карбоксамид;
L-лейцин-N'-(4-этилсульфонилфенил)карбоксамид и
L-лейцин-N'-(4-тeтpaзoлилфенил)кapбoкcaмид.
Пример 10
Соединения формулы (Ia)
10А. К холодному (0o
C) раствору 2-(гидрокси)(хинолин-2-илтиометил)фосфиноилметил-4-метилпентановой кислоты (0,20 г, 0,54 ммоля) в ТГФ (6 мл) добавляли 1,1'-карбонилдиимидазол (0,12 г, 0,7 ммоля). Смесь
перемешивали в
течение 75 минут при 0oC и затем обрабатывали L-триптофан-N'-(4-этоксикарбонилфенил)карбоксамидом (0,22 г, 0,62 ммоля) и перемешивали при 25oC в течение 15 часов.
ТГФ выпаривали
и остаток растворяли в этилацетате (60 мл). Раствор промывали H2О (10 мл), соляным раствором (10 мл) и сушили над MgSO4. Путем концентрирования с помощью ЖХВР с
обращенной фазой
с использованием градиента ацетонитрила и 50 мМ буфера NH4OAc получали 30 мг
N-(2-(гидрокси)(хинолин-2-илтиометил)фосфиноилметил-4-метилпентаноил)-L- триптофан-N'-(4-этоксикарбонилфенил)карбоксамида в виде беловатого твердого вещества, МС (БТЯ): 701 (М-Н)+ (смесь
диастереоизомеров).
10Б. Аналогичным способом получали следующие соединения формулы (Ia):
N-(2-(гидрокси)(хинолин-2-илтиометил)фосфиноилметил-4- метилпентаноил)-L-триптофан-N'-(4- метоксикарбонилфенил)карбоксамид, МС (БТЯ): 687 (М+Н)+;
N-(2-(гидрокси)
(хинолин-2-илтиометил)фосфиноилметил-4- метилпентаноил)-L-аланин-N'-(4- метоксикарбонилфенил)карбоксамид, МС (БТЯ): 572 (М+Н)+;
N-(2-(гидрокси)(хинолин-2-илтиометил)фосфиноилметил-4- метилпентаноил)-L-метионин-N'-(4- метоксикарбонилфенил)карбоксамид, МС (БТЯ): 632 (М+Н)+;
N-(2-(гидрокси)(хинолин-2-илтиометил)фосфиноилметил-4- метилпентаноил)-L-лейцин-N'-(4-метоксикарбонилфенил)карбоксамид, МС (БТЯ): 614 (М+Н)+;
N-(2-(гидрокси)(хинолин-2-илтиометил)фосфиноилметил-4-метилпентаноил)- L-лейцин-N'-(3-этоксикарбонилфенил)карбоксамид,1H-ЯМР (300 МГц, MeOH) δ 0,73-1,01 (m, 12H), 1,28-2,00 (m,14H),
2,4-3,61 (m,2H), 4,27- 4,45 (m,3H), 7,23-7,44 (m,3H), 7,65-7,98 (m,6H), 8,29 (s,0,5 Н), 8,50 (s,0,5H);
N-(2-(гидрокси)(хинолин-2- илтиометил)фосфиноилметил-4-метилпентаноил)-L-лейцин-N'-(2- метоксикарбонилфенил)карбоксамид,1H-ЯМР (300 МГц, MeOH) δ 0,78-0,99 (m, 13H), 1,3-2,4 (m,7H),
2,90-3,05 (m,1H), 3,5-3,75 (m,2H), 3,89, 3,90, 3,94 (3s,3H полн.), 4,35-3,50 (m,1H), 7,05- 8,10 (m,11H), 8,32, 8,55, 8,60 (3d, J=8,7,1H);
N-(2-(гидрокси)(хинолин-2-илтиометил)фосфиноилметил-4-метилпентаноил)- L-лейцин-N'-(4-(1,1-диметилэтоксикарбонил)фенил)карбоксамид, МС (БТЯ): 642 (МН)+;
N-(2-(гидрокси)(хинолин-2-илтиометил)фосфиноилметил-4- метилпентаноил)-L-лейцин-N'-(4-аминосульфонилфенил)карбоксамид,1H-ЯМР (300 МГц, MeOH) δ 0,76 (d, J=6,5, 3H), 0,81 (d, J=6,5,
3H), 0,85-1,1 (m,7H), 1,2-2,1 (m,7H), 2,92-2,95 (m,1H), 3,45- 3,70 (m,2H), 4,35-4,45 (m,1H), 7,28 (d, J=8,7, 1H), 7,45 (t, J=8,7, 1H), 7,68 (t,J=8,7,1H), 7,7-7,8 (m,3H), 7,87 (d, J=8,7, 1H), 7,95-8,1
(m,3H);
N-(2-(гидрокси)(хинолин-2-илтиометил)фосфиноилметил-4-метилпентаноил) -L-лейцин-N'-(4-метоксикарбонилметилфенил)карбоксамид, МС (БТЯ): 628 (МН)+.
10В.
Аналогичным способом получали следующие соединения формулы (Ia):
N-(2-(гидрокси)(хинолин-2- илтиометил)фосфиноилметил-5-фенилпентаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(2-(гидрокси)(хинолин-2- илтиометил)фосфиноилметил-4-фенилбутаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(2-(гидрокси)(хинолин-2- илтиометил)фосфиноилметил-3-фенилпропаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(2-(гидрокси)(хинолин-2- илтиометил)фосфиноилметил-3-циклогексилпропаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(2-((гидрокси)(хинолин-2- илтиометил)фосфиноилметил)пентаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(2-(гидрокси)(нафт-1- илтиометил)фосфиноилметил-5-фенилпентаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(2-(гидрокси)(нафт-1- илтиометил)фосфиноилметил-4-фенилбутаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(2-(гидрокси)(нафт-1- илтиометил)фосфиноилметил-3-фенилпропаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(2-(гидрокси)(нафт-1- илтиометил)фосфиноилметил-3-циклогексилпропаноил)-L-лейцин-N'- (4-метоксикарбонилфенил)карбоксамид;
N-(2-((гидрокси)(нафт-1- илтиометил)фосфиноилметил)пентаноил)-L-лейцин-N'-(4- мeтoкcикapбoнилфeнил)кapбoкcaмид;
N-(2-(гидрокси)(нафт-2- илтиометил)фосфиноилметил-5-фенилпентаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(2-(гидрокси)(нафт-2- илтиометил)фосфиноилметил-4-фенилбутаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(2-(гидрокси)(нафт-2- илтиометил)фосфиноилметил-3-фенилпропаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(2-(гидрокси)(нафт-2- илтиометил)фосфиноилметил-3-циклогексилпропаноил)-L-лейцин-N'- (4-метоксикарбонилфенил)карбоксамид;
N-(2-((гидрокси)(нафт-2- илтиометил)фосфиноилметил)пентаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(2-(гидрокси)(фенилилтиометил)фосфиноилметил-5- фенилпентаноил)-L-лейцин-N'-(4-метоксикарбонилфенил) карбоксамид;
N-(2-(гидрокси)(фенилилтиометил)фосфиноилметил-4- фенилбутаноил)-L-лейцин-N'-(4-метоксикарбонилфенил)карбоксамид;
N-(2-(гидрокси)(фенилилтиометил)фосфиноилметил-3-фенилпропаноил)-L- лейцин-N'-(4-метоксикарбонилфенил)карбоксамид;
N-(2-(гидрокси)(фенилилтиометил)фосфиноилметил-3-циклогексилпропаноил)
-L-лейцин-N'-(4-метоксикарбонилфенил)карбоксамид и
N-(2-((гидрокси)(фенилилтиометил)фосфиноилметил)пентаноил) -L-лейцин-N'-(4-метоксикарбонилфенил)карбоксамид.
10Г. Раствор N-(2-(гидрокси) (хинолин-2-илтиометил)фосфиноилметил-4-метилпентаноил)-L- тpиптoфaн-N'-(4-метоксикарбонилфенил)карбоксамида в ТГФ (2 мл) и 1M NaOH (1 мл) перемешивали в течение 24 часов при 25oC. Органические растворители выпаривали и остаток растворяли в этилацетате/H2О. Водную фазу подкисляли с помощью 1M HCl и отделенную водную фазу дважды экстрагировали этилацетатом. Объединенные органические слои промывали соляным раствором, сушили (MgSO4) и концентрировали до получения 27 мг N-(2- (гидрокси)(хинолин-2-илтиометил)фосфиноилметил-4-метилпентаноил)-L- триптофан-N'-(4-карбоксифенил)карбоксамида в виде желтого порошка.
10Д. Аналогичным способом, но используя в качестве исходного материала N-(2-(гидрокси)(хинолин-2- илтиометил)фосфиноилметил-4-метилпентаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид (30 мг, 0,048 ммоля), после растирания с этилацетатом получали 10 мг N-(2-(гидрокси)(хинолин- 2-илтиометил)фосфиноилметил-4-метилпентаноил)-L-лейцин-N'-(4- карбоксифенил)карбоксамида в виде полутвердого продукта;1H-ЯМР (300 МГц, MeOH) δ 0,81-1,02 (m, 12H), 1,1-2,3 (m,10H), 2,82-3,00 (m,1H), 3,49, 3,56, (2s,2H), 3,53-3,8 (m, 2H), 4,45-4,55 (m,1H), 7,09 (d,J=8,2,1H), 7,19 (d,J=8,2,1H), 7,45 (t, J= 8,2,1H), 7,45-7,6 (m, 3H), 7,65-7,80 (m,1H), 7,82-7,98 (m,2H), 8,10-8,20 (m,1H).
Пример 11
Соединения формулы (Fa)
11А. К 4-метилпентановой кислоте (25 г, 0,215 ммоля) в водяной бане при
25oC медленно добавляли тионилхлорид (20,4 мл, 1,3 г). Смесь нагревали до 50oC в атмосфере аргона в течение 3 часов (пока не прекращалось выделение газа). Неочищенную
реакционную
смесь перегоняли при атмосферном давлении, получая 4-метилпентаноилхлорид (25,3 г, 87,3%), tкип 143oC.
11 Б. Аналогичным способом, но заменяя 4-метилпентановую кислоту на 5-фенилпентановую кислоту (5 г), получали 5- фенилпентаноилхлорид (4,4 г) в виде бесцветной жидкости, tкип 91-93oC.
Пример 12
Соединения
формулы (Fb)
12А. К суспензии 60%-ного NaH (836 мг, 1,5 экв.) в толуоле (200 мл) при комнатной температуре в атмосфере аргона порциями добавляли сультам L-(+)- 2,10-камфоры
(3,0 г, 13,9
ммоля). Смесь интенсивно перемешивали при комнатной температуре в течение 1 часа. Затем к раствору осторожно по каплям при 0oC добавляли 4-метилпентаноилхлорид. После
перемешивания
реакционной смеси при комнатной температуре в течение 3 часов реакцию прекращали смешением с 10 мл охлажденной воды и добавляли 70 мл простого эфира. Реакционную смесь промывали сначала
0,5н. HCl
(2х50 мл), далее 5%-ным К2СО3 (3х50 мл) и в завершение соляным раствором (1х50 мл). Органический слой сушили над MgSO4, фильтровали и упаривали досуха.
Путем очистки с
помощью хроматографии на колонках (смесь 1:6 этилацетат/петролейный эфир в качестве растворителя для элюирования) получали сультам N-4-метилпентаноил-L-(+)-2,10-камфоры (3,39 г,
78%).
12Б. Аналогичным способом, но заменяя 4-метилпентаноилхлорид соответствующим хлоридом, получали следующие соединения формулы (Fb):
сультам N-3-фенилпропаноил-L-(+)-2,
10-камфоры, МС: 347
(М+);
сультам N-5-фенилпентаноил-L-(+)-2,10-камфоры, МС: 375 М+;
сультам N-пентаноил-L-(+)-2,10-камфоры, МС: 300 (М+Н)+.
Пример
13
Соединения формулы (Fc)
13А. К раствору сультама N-4-метилпентаноил-L-(+)-2,10-камфоры (3,39 г, 10,8 ммоля) в 75 мл безводного ТГФ при -78oC в
атмосфере аргона по
каплям в течение 5 минут добавляли NaN(TMS)2 [NaN(триметилсилан)2] (1,0 М в ТГФ, 11,34 мл, 1,05 экв.). После перемешивания при -78oC в течение 1
часа к смеси добавляли
гексаметилфосфорамид (5 мл), далее третбутилбромацетат (5,2 мл, 3 экв. ), а затем в виде одной порции добавляли 400 мг тетра-н-бутиламмонийиодида. Образовавшийся раствор
выдерживали при -78o
C в атмосфере аргона в течение ночи. На следующее утро реакцию останавливали смешением с охлажденной водой (100 мл) и затем экстрагировали простым эфиром (3х100 мл).
Объединенные эфирные слои
промывали соляным раствором, затем сушили над Na2SO4, фильтровали и концентрировали. Путем очистки с помощью хроматографии на колонках (смесь от 5:95
этилацетат/петролейный эфир
до 10:90 этилацетат/петролейный эфир в качестве растворителя для элюирования) получали сультам N-(4- метил-2-трет-бутоксикарбонилметил)пентаноил-L-(+)-2,10-камфоры (4,0 г,
86,5%).
13Б. Аналогичным способом, но заменяя сультам N- 4-метилпентаноил-L-(+)-2,10-камфоры соответствующим соединением формулы (Fb), получали следующие соединения формулы (Fc):
сультам
N-(3-фенил-2-трет-бутоксикарбонилметил)пропаноил-L- (+)-2,10-камфоры, МС: 461 (М)+;
сультам N-(5-фенил-2-трет- бутоксикарбонилметил)пентаноил-L-(+)-2,10-камфоры, МС:
490,1
(М+Н)+;
сультам N-(2-трет-бутоксикарбонилметил)пентаноил-L- (+)-2,10-камфоры, МС: 414 (М+Н)+.
Пример 14
Соединения формулы (F)
14А. К
перемешанному раствору сультама N-(4-метил-2-трет-бутоксикарбонилметил)пентаноил-L-(+)-2,10-камфоры (5,45 г, 12,7 ммоля) в 50%-ном водном ТГФ (150 мл) при 0oC в атмосфере аргона
добавляли
кристаллы LiOH·H2O (2,14 г, 4 экв. ), а затем 30%-ную H2О2 (11,5 мл). Затем ледяную баню удаляли и образовавшуюся эмульсию перемешивали в течение 3
часов, пока
она не становилась прозрачной. Большую часть ТГФ удаляли при пониженном давлении при 35oC. Затем добавляли CH2Cl2 (150 мл) и при перемешивании добавляли
4н. HCl до pH
2. После добавления NaCl водный слой экстрагировали CH2Cl2 (3х150 мл). При пониженном давлении и при 35oC удаляли CH2Cl2 и затем
остаток
растворяли в этилацетате (150 мл). Затем этот раствор экстрагировали 5%-ным К2CO3 (3х50 мл) и объединенные экстракты промывали простым эфиром (50 мл). К водному слою
добавляли
CH2Cl2 и затем при перемешивании добавляли NaCl, водный слой экстрагировали CH2Cl2 (3х70 мл) и объединенные экстракты сушили над Na2
SO4
, фильтровали и концентрировали, получая (2R)-4-метил-2-трет- бутоксикарбонилметилпентановую кислоту в виде бесцветного масла (2,95 г, количественный выход).
14Б.
Аналогичным способом,
но заменяя сультам N-(4-метил-2-трет-бутоксикарбонилметил)пентаноил-L-(+) -2,10-камфоры соответствующим соединением формулы (Fc), получали следующие соединения формулы (F):
(2R)-3-фенил-2-трет-бутоксикарбонилметилпропановую кислоту, МС: 265(М+Н)+;
(2R)-5-фенил-2-трет-бутоксикарбонилметилпентановую кислоту, МС: 293,1 (М+Н)+;
(2R)-2-трет-бутоксикарбонилметилпентановую кислоту (бесцветное масло, 1,09 г).
14В. (2R)-3-фенил-2-трет-бутоксикарбонилметилпропановую кислоту (55 мг) растворяли в ледяной уксусной кислоте (20 мл) и добавляли PtO2 (25 мг) в уксусной кислоте. Затем химический стакан помещали в сосуд Парра высокого давления, откачивали воздух и подавали H2 при давлении 100 фунт/кв.дюйм. После перемешивания в течение 3 дней смесь фильтровали под вакуумом через слой целита в 1 см. Затем фильтрат концентрировали, получая (2R)-3-циклогексил-2-трет-бутоксикарбонилметилпропановую кислоту (56 мг) в виде желтого масла, МС: 269,5 (М-Н)-.
Пример 15
Соединения формулы (Ib)
15А. К
раствору 4-метил-2-трет-бутоксикарбонилметилпентановой кислоты (0,28 г, 1,2 ммоля) в ДМФ (5 мл), содержащему ГОБТ (0,22 г, 1,8 ммоля), добавляли ЭДКИ (0,31 г, 1,8 ммоля). Смесь перемешивали при 0oC в течение 1 часа и затем обрабатывали L-циклогексилглицин-N'-(4-метоксикарбонилфенил)карбоксамидом (1,2 ммоля) и ДМАП (27 мг, 0,24 ммоля). Перемешивание продолжали в течение 24 часов при
25oC и затем выпаривали ДМФ. Остаток растворяли в CH2Cl2 (20 мл) и раствор промывали 1М HCl (10 мл), насыщенным NaHCO3 (10 мл), соляным раствором (10 мл) и
сушили над Na2SO4. После концентрирования под вакуумом получали масло, которое очищали с помощью быстрой хроматографии на SiO2, используя в качестве растворителя для
элюирования 20%-ный этилацетат/гексан. Таким образом получали 0,22 г (22%) N-(4-метил-2-трет-бутоксикарбонилметилпентаноил) -L-циклогексилглицин-N'-(4-метоксикарбонилфенил)карбоксамида в виде
твердого
продукта, МС (БТЯ): 503 (М+Н)+.
15Б. Аналогичным способом получали следующие соединения:
N-(4-метил-2-трет-бутоксикарбонилметилпентаноил)-L-пиридин
-3-илаланин-N'-(4-метоксикарбонилфенил)карбоксамид;
N-(4-метил- 2-трет-бутоксикарбонилметилпентаноил)-L-O-бензилтреонин-N'- (4-метоксикарбонилфенил)карбоксамид;
N-(4-метил-2-трет-бутоксикарбонилметилпентаноил)-L-изолейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(4-метил-2-трет-бутоксикарбонилметилпентаноил)-L-лейцин-N'- (4-метоксикарбонилфенил)карбоксамид;
N-(4-метил-2-трет-бутоксикарбонилметилпентаноил)-L-трет-лейцин-N'-
(4-метоксикарбонилфенил)карбоксамид;
N-(4-метил-2-трет-бутоксикарбонилметилпентаноил)-L-лейцин-N'-
(4-цианфенил)карбоксамид;
N-(4-метил-2-трет-бутоксикарбонилметилпентаноил)-L-лейцин-N'-(4-(N''-(3-диметиламинопропил)карбамоил)фенил)карбоксамид;
N-(4-метил-2-трет-бутоксикарбонилметилпентаноил)-L- лейцин-N'-(4-(N''-(2-диметиламиноэтил)карбамоил)фенил)карбоксамид;
N-(4-метил-2-трет-бутоксикарбонилметилпентаноил)-L-лейцин-N'- (4-аминосульфонилфенил)карбоксамид;
N-(4-метил-2-трет-бутоксикарбонилметилпентаноил)-L-лейцин-N'- (4-метиламиносульфонилфенил)карбоксамид;
N-(2-трет-бутоксикарбонилметилпентаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(3-фенил-2-трет-бутоксикарбонилметилпропаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(3-циклогексил-2-трет- бутоксикарбонилметилпропаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(4-фенил-2-трет- бутоксикарбонилметилбутаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид и
N-(5-фенил-2-трет-бутоксикарбонилметилпентаноил)-L-лейцин-N'- (4-метоксикарбонилфенил)карбоксамид.
Пример 16
Соединения формулы (Ic)
16А. К холодному раствору
(0oC) N-(4-метил-2-трет- бутоксикарбонил-метилпентаноил)-L-циклогексилглицин-N'-(4- метоксикарбонилфенил)карбоксамида (70 мг, 0,14 ммоля) в CH2Cl2 (2 мл) добавляли
ТФК (0,5
мл). После перемешивания в течение 5 часов при 25oC раствор концентрировали под вакуумом и продукт очищали с помощью ЖХВР с обращенной фазой с использованием градиента
ацетонитрила и 50 мМ
NH4OAc-буфер, получая 44 мг (71%) N-(4-метил-2-карбоксиметилпентаноил)-L-циклогексилглицин-N'-(4- метоксикарбонилфенил)карбоксамида в виде белого твердого продукта, МС
(БТЯ): 445 (М-Н)-.
16Б. Аналогичным способом получали следующие соединения:
N-(4-метил-2-карбоксиметилпентаноил)
-L-изолейцин-N'-(4-метоксикарбонилфенил)карбоксамид, МС (БТЯ): 419
(М-Н)-;
N-(4-метил-2-карбоксиметилпентаноил)-L-лейцин- N'-(4-метоксикарбонилфенил)карбоксамид, МС (БТЯ): 419
(М-Н)-;
N-(4-метил-2-карбоксиметилпентаноил)-L-трет-лейцин-N'- (4-метоксикарбонилфенил)карбоксамид;
N-(4-метил-2-карбоксиметилпентаноил)-L-лейцин-N'-(4-цианфенил)
карбоксамид,1H-ЯМР (300
МГц, MeOH) δ 0,84-0,99 (m,12H), 1,15-1,82 (m,6H), 2,36-2,41 (m, 1H), 2,52-2,65 (m,1H), 2,8-2,95 (m,1H), 4,49-4,54 (m,1H), 7,4-7,9 (m,4H);
N-(4-метил-2-карбоксиметилпентаноил)-L-лейцин-N'- (4-аминосульфонилфенил)карбоксамид,1H-ЯМР (300 МГц, MeOH) δ 0,85-1,00 (m,12H), 1,1-1,3 (m,2H), 1,52-1,85 (m,4H), 2,31-2,95 (m,3H),
4,49-4,55 (m,1H), 7,75-7,91 (m,4H);
N-(4-метил-2-карбоксиметилпентаноил)-L-лейцин-N'-(4-метиламиносульфонилфенил) карбоксамид, МС (БТЯ): 459 (М-Н)-;
N-(2-карбоксиметилпентаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид, МС (БТЯ): 405 (М-Н)-;
N-(3-фенил-2-карбоксиметилпропаноил)-L-лейцин-N'-(4-метоксикарбонилфенил)
карбоксамид, МС (БТЯ): 455 (М+Н)+;
N-(3-циклогексил-2-карбоксиметилпропаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид, МС (БТЯ): 459 (М-Н)-;
N-(4-фенил-2-карбоксиметилбутаноил)-L-лейцин-N'- (4-метоксикарбонилфенил)карбоксамид, МС (БТЯ): 467 (М-Н)-;
N-(4-фенил-2-карбоксиметилбутаноил)-L-циклогексилглицин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(4-фенил-2-карбоксиметилбутаноил)-L-трет-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(5-фенил-2-карбоксиметилпентаноил)-L-лейцин-N'- (4-метоксикарбонилфенил)карбоксамид, МС (БТЯ): 481 (М-Н)- и
N-(4-метил-2-карбоксиметилпентаноил)-L-О-бензилтреонин-N'-(4- метоксикарбонилфенил)карбоксамид, МС (БТЯ): 497 (М-Н)-.
16В. Аналогичным способом, но путем растирания
неочищенного продукта с простым эфиром и последующего декантирования эфира получали следующие соединения в виде солей ТФК:
N-(4-метил-2-карбоксиметилпентаноил)-L-пиридин-3-илаланин- N'-(4-метоксикарбонилфенил)карбоксамид, МС (БТЯ): 456 (М+Н)+;
N-(4-метил-2-карбоксиметилпентаноил)-L-лейцин-N'-(4-(N''-(3- диметиламинопропил)карбамоил)фенил)карбоксамид, МС (БТЯ): 491 (М+Н)+
и
N-(4-метил-2-карбоксиметилпентаноил)-L-лейцин-N'-(4- (N''-(2-диметиламиноэтил)карбамоил)фенил)карбоксамид, МС (БТЯ): 491 (М+Н)+.
16Г. Смесь N-(4-метил-2-трет- бутоксикарбонилметилпентаноил)-L-O-бензилтреонин-N'-(4- метоксикарбонилфенил)карбоксамида (60 мг) и Pd/C в этилацетате/ТГФ (1:1,25 мл) гидрировали в течение ночи при давлении 1 атм. Путем фильтрации через целит, концентрирования фильтрата и растирания остатка с эфиром/гексаном получали N-(4- метил-2-трет-бутоксикарбонилметилпентаноил)-L-треонин-N'-(4- метоксикарбонилфенил)карбоксамид, МС (БТЯ): 407 (М-Н)-.
16Д. Аналогично способу, описанному в разделе А,
но заменяя N-(4-метил-2-трет-бутоксикарбонилметилпентаноил) -L-циклогексилглицин-N'-(4-метоксикарбонилфенил)карбоксамид на следующие соединения:
N-(2R-(трет-бутоксикарбонил)метил-5- (бифен-4-ил)пентаноил)-L-лизин-N'-(4-(этоксикарбонил)фенил) карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5- (фенил)пентаноил)-L-лизин-N'-(4-(этоксикарбонил)фенил) карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5- (бифен-4-ил)пентаноил)-L-(Nε
-изопропил)лизин-N'-(4 - (этоксикарбонил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-4-(фенил)бутаноил)-L- циклогексилглицин-N'-(4-(N'',N''-диметиламиноэтиламиносульфонил)
фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5- (фенил)пентаноил)-L-(N, N'-диэтилгуанидо)лизин-N'-(4- (этоксикарбонил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4-ил)пентаноил)-L-трет- лейцин-N'-(4-(метилтио)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4-ил)пентаноил)-L-трет- лейцин-N'-(3-(2-гидроксиэтил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4- ил)пентаноил)
-L-S-((4-цианфенил)метил)пеницилламин-N'- (фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен- 4-ил)пентаноил)-L-циклогексилглицин-N'-(2-(4- аминосульфонил)фенилэтил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4-ил)пентаноил)-L- циклогексилглицин-N'-(3-(морфолин-4-ил)пропил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4-ил)пентаноил)-L- трет-лейцин-N'-(4-(метиламиносульфонил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4-ил)пентаноил)-L- циклогексилглицин-N'-(4-((2-гидроксиэтил)аминосульфонил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4-ил)пентаноил)-L- циклогексилглицин-N'-(4-(N'',N''-диметиламиноэтиламиносульфонил) фенил)карбоксамид и
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4-ил)пентаноил)-L- трет-лейцин-N'-(4-((3-(морфолин-4- ил)пропил)аминосульфонил)фенил)карбоксамид,
получали
N-(2R,
S)-(N''-формил-N''-гидроксиамино)метил-4- (метил)пентаноил)-L-лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид: МС: 434,2 (М-Н)-, 388 (M-HCO-OH);
N-(2R-(N''-гидроксикарбамоил)метил-4-(метил)пентаноил) -D, L-норвалин-N'-(4-((2-(диметиламино)этил)карбамоил)фенил)карбоксамид: МС: 478(М+Н)+;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-лизин-N'-(4- (этоксикарбонил)фенил)карбоксамид: МС: 588,3 (М+Н)+;
N-(2R-карбоксиметил-5-(фенил)пентаноил)-L-лизин-N'-(4- (этоксикарбонил)фенил)карбоксамид: МС: 512,3 (М+Н)+;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L- (Nε
- изопропил)лизин-N'-(4-(этоксикарбонил)фенил)карбоксамид: МС: 630 (М+Н)+;
N-(2R-карбоксиметил-4-(фенил)бутаноил)-L- циклогексилглицин-N'-(4-(N'',
N''- диметиламиноэтиламиносульфонил)фенил)карбоксамид: МС: 586 (М+Н)+;
N-(2R-карбоксиметил-5-(фенил)пентаноил)-L- (N,
N'-диэтилгуанидо)лизин-N'-(4-(этоксикарбонил)фенил)карбоксамид: МС: 610,4 (М+Н)+;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-трет- лейцин-N'-(4-(метилтио)фенил)карбоксамид:
МС-БТЯ (M+Na)+: рассчитанное 569,2450; полученное 569,2461;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-трет-лейцин-N' -(3-(2-гидроксиэтил)фенил)карбоксамид: МС-БТЯ (М+Н)+: рассчитанное 545,3015; полученное 545,3021;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-S-((4-цианфенил)метил) пеницилламин-N'-(фенил)карбоксамид: МС-БТЯ (М+Н)+:
рассчитанное 634,2740; полученное 634,2749;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-циклогексилглицин-N'- (2-(4-аминосульфонил)фенилэтил)карбоксамид: МС-БТЯ (М+Н)+:
рассчитанное 634,2951; полученное 634,2963;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-циклогексилглицин-N'- (3-(морфолин-4-ил)пропил)карбоксамид: МС-БТЯ (М+Н)+: рассчитанное
578,3594; полученное 578,3583;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-трет-лейцин-N'-(4- (метиламиносульфонил)фенил)карбоксамид;1H-ЯМР (300 МГц, ацетон-d6)
δ 9,73 (br, s, 1H), 7,91 (d, 2H, J=9 Гц), 7,79 (d, 2H, J=9 Гц), 7,56 (d, 2H, J=8 Гц), 7,25-7,45 (m,6H), 7,19 (d, 2H, J=8 Гц), 4,48 (d, 1H, J=9 Гц), 2,38-3,00 (m, 9H), 1,43-1,72 (m,4H), 1,04 (s,
9H);
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-циклогексилглицин-N'-(4-((2- гидроксиэтил)аминосульфонил)фенил)карбоксамид: МС-БТЯ (M+Cs)+: рассчитанное 782,1876; полученное
782,1896;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил) -L-циклогексилглицин-N'-(4-((2-диметиламино)этил)аминосульфонил)фенил) карбоксамид: МС-БТЯ (M+Cs)+: рассчитанное 809,2349;
полученное 809,2369 и
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-трет- лейцин-N'-(4-((3-(морфолин-4-ил)пропил)аминосульфонил)фенил)карбоксамид: МС-БТЯ (М+Н)+: рассчитанное 707,
3478; полученное 707,3489.
Пример 17
Соединения формулы (Id)
17А. Раствор N-(4-метил-2-карбоксиметилпентаноил)-L- лейцин-N'-(4-метоксикарбонилфенил)карбоксамида (0,
28 г, 0,66 ммоля) и ГОБТ (0,12 г) в безводном ДМФ (20 мл) охлаждали до 0oC и обрабатывали ЭДКИ (0,32 г). После перемешивания в течение 0,5 ч при 0oC добавляли
О-бензилгидроксиламин (0,30 мл) и реакционной смеси давали нагреться до 25oC в течение ночи. ДМФ отгоняли под вакуумом и остаток растворяли в CH2Cl2, промывали смесью
5%-ная HCl/5%-ный NaHCO3 и соляным раствором и раствор сушили над Na2SO4. После концентрирования продукт очищали с помощью быстрой хроматографии (SiO2,
Rf= 0,6, 10% MeOH/CH2Cl2). Фракции, содержащие продукт, далее очищали растиранием с CH2Cl2, получая
N-(4-метил-2-(N''-бензилоксикарбамоил)метилпентаноил)-L-лейцин- N'-(4-метоксикарбонилфенил)карбоксамид в виде твердого вещества с tпл 198-199oC.
17Б.
Аналогичным
способом получали следующие соединения:
N-(2-(N''-бензилоксикарбамоил)метилпентаноил)-L-лейцин-N'- (4-метоксикарбонилфенил)карбоксамид;
N-(4-фенил-2-(N''-бензилоксикарбамоил)метилбутаноил)-L-лейцин-N''-(4- метоксикарбонилфенил)карбоксамид и
N-(4-фенил-2-(N''-бензилоксикарбамоил)метилпентаноил)-L-триптофан-N'- (4-метоксикарбонилфенил)карбоксамид.
17В. N-(4-метил-2-(N''-бензилоксикарбамоил)метилпентаноил) -L-лейцин-N'-(4-метоксикарбонилфенил)карбоксамид (210 мг) подвергали гидролизу с помощью 1M NaOH (1,4 мл) при 50-60oC в течение 2 часов в ТГФ (20 мл) и MeOH (5 мл). Органические растворители выпаривали и остаток растворяли в 10 мл H2О и промывали простым эфиром (2х10 мл). Водную фазу подкисляли до pH 2 с помощью 10%-ной HCl и экстрагировали этилацетатом (3х10 мл). Объединенные экстракты промывали соляным раствором, сушили над Na2SO4 и концентрировали, получая N-(4-метил-2-(N''- бензилоксикарбамоил)метилпентаноил)-L-лейцин-N'-(4- карбоксифенил)карбоксамид (110 мг).
Пример 18
Соединения формулы (Ie)
18А. К раствору
N-(4-фенил-2-(N''- бензилоксикарбамоил)метилбутаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамида (25 мг) в 20 мл MeOH и 10 мл ТГФ добавляли 10%-ный Pd/C (20 мг). Суспензию гидрировали в
течение
1 часа и затем фильтровали под вакуумом через целит. Полученный в результате концентрирования продукт очищали на кремнеземе (2,5% MeOH/CH2Cl2), получая 8 мг
N-(4-фенил-2-(N''-гидроксикарбамоил)метилбутаноил) -L-лейцин-N'-(4-метоксикарбонилфенил)карбоксамида, МС (БТЯ): 482 (М-Н)-.
18Б. Аналогичным способом получали следующие
соединения:
N-(4-метил-2-(N''-гидроксикарбамоил)метилпентаноил) -L-лейцин-N'-(4-карбоксифенил)карбоксамид;
N-(4-метил-2-(N''-гидроксикарбамоил)метилпентаноил)-L-лейцин-N'- (4-метоксикарбонилфенил)карбоксамид, МС (БТЯ): 436 (М+Н)+;
N-(2-(N''-гидроксикарбамоил)метилпентаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид, МС (БТЯ): 420 (М-Н)-;
N-(4-фенил-2-(N''-гидроксикарбамоил)метилбутаноил)
-L-трет-лейцин-N'-(4-метоксикарбонилфенил)карбоксамид;
N-(4-фенил-2-(N''-гидроксикарбамоил)метилбутаноил) -L-циклогексил-глицин-N'-(4-метоксикарбонилфенил)карбоксамид;
N-(4-фенил-2-(N''-гидроксикарбамоил)метилбутаноил) -L-лейцин-N'-(4-метоксикарбонилфенил)карбоксамид;
N-(4-метил-2-(N''-гидроксикарбамоил)метилпентаноил)
-L-трет-лейцин-N'-(4-метоксикарбонилфенил)карбоксамид;
N-(4-метил-2-(N''- гидроксикарбамоил)метилпентаноил) -L-триптофан-N'-(4-метоксикарбонилфенил)карбоксамид, МС (БТЯ): 507 (М-Н)-
и
N-(4-фенил-2-(N''-гидроксикарбамоил)метилбутаноил) -L-лейцин-N'-(4-метоксикарбонилфенил)карбоксамид.
18В. Аналогичным способом получали следующие соединения:
N-(3-фенил-2-(N''-гидроксикарбамоил)метилпропаноил)-L- лейцин-N'-(4-метоксикарбонилфенил)карбоксамид;
N-(5-фенил-2-(N''-гидроксикарбамоил)метилпентаноил)
-L-лейцин-N'-(4-метоксикарбонилфенил)карбоксамид и
N-(3-циклогексил-2-(N''- гидроксикарбамоил)метилпропаноил) -L-лейцин-N'-(4-метоксикарбонилфенил)карбоксамид.
Пример 19
Соединения формулы (Gb)
19А. К холодному (0oC) раствору диэтилизобутилмалоната (21,6 г, 0,1 моля) в 150 мл этанола медленно в течение 30 минут добавляли раствор КОН (5,89 г,
0,1 моля). Прозрачный раствор перемешивали при 25oC в течение 60 часов. Этанол удаляли при пониженном давлении и твердый остаток растворяли в 50 мл Н2О. Водный раствор
подкисляли
до pH 2 с помощью 4М HCl и экстрагировали простым эфиром (2х50 мл). Объединенные экстракты сушили над MgSO4 и упаривали, получая 19,0 г (100%) этилизобутилмалоната в виде
бесцветного
масла.
19Б. Аналогичным способом получали следующие соединения формулы (Gb):
этил-трет-бутилмалонат;
этилпропилмалонат;
этилбензилмалонат и
этилциклогексилметилмалонат.
Пример 20
Соединения формул (Gc) и (Gd)
20А. К чистому этилизобутилмалонату (25 г, 0,13 моля) при 0oC медленно
добавляли
охлажденный на льду диэтиламин (15,1 мл, 0,15 моля). После перемешивания в течение 15 минут по каплям добавляли формалин (11,1 мл 37%-ного водного формальдегида) и смесь оставляли для
перемешивания
при 25oC в течение 3 дней. Реакционную смесь обрабатывали раствором, содержащим 20 г К2СО3 в 40 мл H2О, и экстрагировали простым эфиром
(2х100 мл).
Объединенные эфирные слои промывали соляным раствором, сушили над MgSO4 и упаривали при 20oC на роторном испарителе. Неочищенный продукт, а именно,
этил-4-метил-2-метиленпентаноат (содержащий некоторое количество эфира), растворяли в 250 мл абсолютного этанола и обрабатывали ацетонитрилом (250 мл), IM LiOH (9,7 г в 250 мл H2О, 0,23
моля). После перемешивания в течение ночи органические растворители выпаривали и водный остаток экстрагировали этилацетатом (2х150 мл). Объединенные экстракты промывали соляным раствором, сушили
(MgSO4) и упаривали, получая 10,5 г 4-метил-2-метиленпентановой кислоты в виде бесцветного масла.
20Б. Аналогичным способом получали следующие соединения формулы (Gd):
4-фенил-2-метиленбутановую кислоту;
3-циклогексил-2-метиленпропановую кислоту;
5-фенил-2-метиленпентановую кислоту;
2-метиленпентановую кислоту и
3,
3-диметил-2- метиленбутановую кислоту.
Пример 21
Соединения формулы (G)
Смесь 4-метил-2-метиленпентановой кислоты (5,0 г) и тиоуксусной кислоты (25 мл) выдерживали
при 95oC в атмосфере аргона в течение 3 дней. Избыток тиоуксусной кислоты выпаривали и оставшееся масло растворяли в этилацетате (40 мл) и экстрагировали насыщенным NaHCO3 (3х40
мл). Объединенные NaHCO3 - экстракты соединяли и подкисляли до pH 2 при 0oC с помощью 1M HCl. Водный слой экстрагировали CH2Cl2 (3х40 мл), объединенные
органические фазы сушили (MgSO4) и упаривали, получая 3,0 г 4-метил-2-ацетилтиометилпентановой кислоты;1H-ЯМР (80 МГц, CDCl3) δ 0,95 (d, J=8,0 Гц, 6H), 1,20-1,
90 (m,4H), 2,35 (s,3H), 2,50-3,20 (m,3H), 6,7 (br s,1H).
Пример 22
Соединения формулы (If)
22А. К раствору 4-метил-2-ацетилтиометилпентановой кислоты (204 мг, 1,0
ммоль) в безводном ДМФ (15 мл), содержащему ГОБТ (92 мг, 0,6 ммоля) и L-лейцин-N'-(4-метоксикарбонилфенил)карбоксамид (0,6 моля), добавляли ЭДКИ (345 мг, 1,8 ммоля). Раствор перемешивали в течение
ночи при 25oC и затем под вакуумом удаляли ДМФ. Остаток растворяли в этилацетате (35 мл) и промывали 1M HCl, 1M NaOH и соляным раствором. После сушки над MgSO4 и упаривания
получали полутвердый продукт, который подвергали быстрой хроматографии на силикагеле (этилацетат/петролейный эфир 1:2), получая N-(4
- метил-2-ацетилтиометилпентаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид (190 мг) в виде белого твердого вещества.
22Б. Аналогичным способом получали следующие соединения
формулы (If):
N-(5-фенил-2-ацетилтиометилпентаноил)-L-лейцин-N'- (4-метоксикарбонилфенил)карбоксамид;
N-(4-фенил-2-ацетилтиометилбутаноил)-L-лейцин-N'- (4-метоксикарбонилфенил)карбоксамид;
N-(3-фенил-2-ацетилтиометилпропаноил)-L-лeйцин-N'- (4-метоксикарбонилфенил)карбоксамид;
N-(3-циклогексил-2-ацетилтиометилпропаноил)-L-лейцин-N'- (4-метоксикарбонилфенил)карбоксамид;
N-(2-ацетилтиометилпентаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(5-фенил-2-ацетилтиометилпентаноил)-L-лейцин-N'- (4-аминокарбонилфенил)карбоксамид;
N-(4-фенил-2-ацетилтиометилбутаноил)-L-лейцин-N'- (4-карбоксифенил)карбоксамид;
N-(3-фенил-2-ацетилтиометилпропаноил)-L-лейцин-N'- (4-метилсульфонилфенил)карбоксамид;
N-(3-циклогексил-2-ацетилтиометилпропаноил)-L-лейцин-N'- (4-карбамоилфенил)карбоксамид;
N-(2-ацетилтиометилпентаноил)-L-лейцин-N'-(4-цианфенил)карбоксамид;
N-(5-фенил-2-ацетилтиометилпентаноил)-L-триптофан-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(4-фенил-2-ацетилтиометилбутаноил)-L-триптофан-N'- (4-метоксикарбонилфенил)карбоксамид;
N-(3-фенил-2-ацетилтиометилпропаноил)-L-триптофан-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(3-циклогексил-2-ацетилтиометилпропаноил)-L-триптофан-N'- (4-метоксикарбонилфенил)карбоксамид и
N-(2-ацетилтиометилпентаноил)-L-триптофан-N'-(4- метоксикарбонилфенил)карбоксамид.
Пример 23
Соединения формулы (Ig)
23А. К раствору N-(4-метил-2-ацетилтиометилпентаноил)-L- лейцин-N'-(4-метоксикарбонилфенил)карбоксамида (85 мг, 0,19 ммоля) в MeOH (8 мл)
при 0oC добавляли концентрированный HN4OH (0,4 мл). После перемешивания при 0oC в течение 5 часов метанол выпаривали и добавляли простой эфир (30 мл). Эфирный раствор
промывали 0,5М HCl, соляным раствором и сушили над MgSO4. Путем концентрирования получали N-(4-метил-2-меркаптометилпентаноил)-L-лейцин-N'- (4-метоксикарбонилфенил)карбоксамид в виде белой
пены, количественный выход, МС (БТЯ): 407 (М-H)-.
23 Б. Аналогичным способом получали следующие соединения формулы (Ig):
N-(5-фенил-2-меркаптометилпентаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(4-фенил-2-меркаптометилбутаноил)-L-лейцин-N'- (4-метоксикарбонилфенил)карбоксамид;
N-(3-фенил-2-меркаптометилпропаноил)-L-лейцин-N'- (4-метоксикарбонилфенил)карбоксамид;
N-(3-циклогексил-2-меркаптометилпропаноил)-L-лейцин-N' -(4-метоксикарбонилфенил) карбоксамид;
N-(2-меркаптометилпентаноил)-L-лейцин-N'-(4- метоксикарбонилфенил)карбоксамид;
N-(5-фенил-2-меркаптометилпентаноил)-L-лейцин-N'-(4-аминокарбонилфенил) карбоксамид;
N-(4-фенил-2-меркаптометилбутаноил)-L-лейцин-N'-(4- карбоксифенил)карбоксамид;
N-(3-фенил-2-меркаптометилпропаноил) -L-лейцин-N'-(4-метилсульфонилфенил)карбоксамид;
N-(3-циклогексил-2-меркаптометилпропаноил)-L-лейцин-N'-(4- карбамоилфенил)карбоксамид;
N-(2-меркаптометилпентаноил)-L- лейцин-N'-(4-цианфенил)карбоксамид;
N-(5-фенил-2-меркаптометилпентаноил)-L-тpиптoфaн-N'-(4-метоксикарбонилфенил) карбоксамид;
N-(4-фенил-2-меркаптометилбутаноил)-L-триптофан- N'-(4-метоксикарбонилфенил)карбоксамид;
N-(3-фенил-2-меркаптометилпропаноил)-L-триптофан-N'- (4-метоксикарбонилфенил) карбоксамид;
N-(3-циклогексил-2-меркаптометилпропаноил)-L- триптофан-N'-(4-метоксикарбонилфенил)карбоксамид и
N-(2-меркаптометилпентаноил)-L-триптофан-N'- (4-метоксикарбонилфенил)карбоксамид.
Пример 24
Соединения формулы (Fc'')
К перемешиваемому раствору, содержащему 6,
48 г (25,0 ммолей) N-(4-пентеноил)-4S-фенилметил-2-оксазолидинона в 50 мл безводного ТГФ, в атмосфере аргона при -95oC с помощью шприца добавляли 27,5 мл (27,5 ммоля) 1,0 М
гексаметилдисилазида натрия в ТГФ с такой скоростью, чтобы поддерживать температуру реакционной смеси ниже -75oC. Через 15 минут при температуре от -80oC до -95oC с
помощью шприца в течение 1 минуты добавляли 5,65 мл (6,83 г, 35 ммолей) трет-бутилбромацетата, который предварительно непосредственно перед применением фильтровали через основный оксид алюминия.
Раствор перемешивали при температуре от -90oC до -60oC в течение 2 ч и затем распределяли между гексаном (100 мл) и разбавленным водным NaHSO4. Органический слой
промывали насыщенным водным NaCl, содержащим небольшое количество 1М фосфатного буфера (pH 7), сушили над Na2SO4 и концентрировали. Остаток перекристаллизовывали из 75 мл
гексана,
получая 5,56 г (60%) N-(2R-(трет- бутоксикарбонил)метил-4-пентеноил)-4S-фенилметил-2-оксазолидинона в виде светло-желтых игольчатых кристаллов: tпл 75-76oC.
Элементарный анализ:
рассчитано для С21H27NO5: С 67,54; H 7,29; N 3,75; обнаружено: С 67,76; H 7,34; N 3,87.
Пример 25
Соединения формулы
(Fc''-1), в которых
R2 обозначает бифенил
К раствору, содержащему 4,75 г (12,7 ммоля) N-(2R-(трет- бутоксикарбонил)метил-4-пентеноил)-4S-фенилметил-2- оксазолидинона, 3,73 г (16,0
ммолей)
4-бромбифенила, 0,234 г (0,77 ммоля) три-орто-толилфосфина и 2,22 мл (1,62 г, 16,0 ммолей) триэтиламина в 10 мл безводного ДМФ, в атмосфере аргона добавляли 0,086 г (0,385 ммоля) ацетата
палладия
(II). Раствор выдерживали при 100oC в течение 4 ч, охлаждали до комнатной температуры и разбавляли этилацетатом. Осадок удаляли путем фильтрации и фильтрат распределяли между 150
мл
этилацетата:гексана (2:1) и 50 мл фосфатного буфера с pH 7 (0,5М), содержащего небольшое количество сульфата натрия. Органический слой промывали 0,2н. водным бисульфатом натрия и соляным
раствором/фосфатным буфером с pH 7, сушили над сульфатом натрия и концентрировали. Остаток растворяли в 50 мл этилацетата, разбавляли 250 мл изооктана и вносили для затравки несколько кристаллов
продукта. Твердое вещество удаляли путем фильтрации и после перекристаллизации из 250 мл изооктана:этилацетата (4:1) получали 4,20 г (63%) продукта, а именно,
N-(2R-(трет-бутоксикарбонил)метил-(5-(бифен-4-ил)-4- пентеноил)-4S-фенилметил-2-оксазолидинона, в виде тонких белых игольчатых кристаллов: tпл 118-119oC;1H-ЯМР (300
МГц, CDCl3) δ 7,25-7,60 (m, 14H), 6,47 (d, 1H, J=16 Гц), 6,25 (dt, 1H, J=16 и 8 Гц), 4,65-4,70 (m, 1H), 4,34-4,44 (m, 1H), 4,11 (dd, 1H, J=9 и 2 Гц), 4,01 (t, 1H, J=8 Гц), 3,33 (dd,
1H, J=14 и 3 Гц), 2,89 (dd, 1H, J=17 и 11 Гц), 2,76 (dd, 1H, J=14 и 10 Гц), 2,40-2,57 (m, 3H), 1,43 (s, 9H). Элементарный анализ: рассчитано для C33H35NO5: С 75,40; H
6,77; N 2,66; обнаружено: С 75,17; H 6,84; N 2,58.
Пример 26
Соединения формулы (Fc''-2), в которых R2 обозначает бифенил
Раствор, содержащий 5,23 г (10,
0
ммолей) N-(2R-(трет- бутоксикарбонил)метил-(5-(бифен-4-ил)-4-пентеноил)-4S- фенилметил-2-оксазолидинона в 50 мл этилацетата, гидрировали при давлении водорода 1 атм в присутствии 500 мг 10%-ного
Pd/C
в течение 2 ч при комнатной температуре. Катализатор удаляли путем фильтрации через целит и фильтрат концентрировали до приблизительно 20 мл, а затем разбавляли приблизительно 75 мл изооктана. В
раствор для затравки вносили несколько кристаллов продукта и смесь концентрировали до приблизительно 50 мл, а затем охлаждали до -20oC. После фильтрации осадка получали 4,91 г (94%)
N-(2R-(трет-бутоксикарбонил)метил-(5-(бифен-4-ил)пентаноил) -4S-фенилметил-2-оксазолидинона в виде белого порошка: tпл 75-76oC;1H-ЯМР (300 МГц, CDCl3)
δ 7,22-7,59 (m, 14H), 4,61-4,70 (m, 1H), 4,18-4,24 (m, 1H), 4,14 (d, 2H, J=5 Гц), 3,34 (dd, 1H, J=13 и 3 Гц), 2,57-2,89 (m, 4H), 2,48 (dd, 1H, J=13 и 5 Гц), 1,65-1,83 (m, 3H), 1,50-1,60 (m,
1H),
1,42 (s, 9H). Элементарный анализ: рассчитано для С33H37NO5: С 75,11; H 7,07; N 2,65; обнаружено: С 75,34; H 7,11; N 2,69.
Пример 27
Соединения формулы (F), в которых R2 обозначает бифенил
К раствору, содержащему 4,02 г (7,62 ммоля) N(2R-(трет-бутоксикарбонил)метил-(5-(бифен-4-ил)пентаноил)
- 4S-фенилметил-2-оксазолидинона в 60 мл ТГФ, при 0oC добавляли 2,8 мл 30%-ной водной перекиси водорода, а затем 8,0 мл 2н. водного гидроксида лития. Смесь интенсивно перемешивали при
0oC в течение 15 минут и затем давали нагреться до комнатной температуры. Через 2 ч смесь охлаждали до 0oC и добавляли 20 мл 2н. водного сульфита натрия и 30 мл насыщенного
водного
раствора бикарбоната натрия. После выдержки в течение 10 минут при 0oC смесь дополнительно перемешивали в течение 1 ч при комнатной температуре и затем сливали на 1М фосфатный
буфер с pH 7.
Водную фазу подкисляли до pH 6, добавляя твердый бисульфат натрия, и затем смесь экстрагировали этилацетатом:гексаном (1:1) (200 мл).
Органический слой промывали
соляным раствором,
сушили над сульфатом натрия и концентрировали. Остаток хроматографировали на 125 г силикагеля,
элюируя 20-30%-ным этилацетатом:гексаном, содержащим 0,5%-ную уксусную
кислоту. Фракции,
содержащие продукт, концентрировали и затем несколько раз подвергали азеотропной перегонке с толуолом, получая 2,93 г (> 100%) продукта, а именно,
2R-(трет-бутоксикарбонил)метил-(5-(бифен-4-ил)пентановой кислоты, в виде густого сиропа, который медленно затвердевал при хранении при -20oC: tпл 44-45oC (после сушки
твердого продукта под вакуумом);1H-ЯМР (300 МГц, CDCl3) δ 7,22-7,59 (m, 9H), 2,82-2,90 (m, 1H), 2,59-2,75 (m, 3H), 2,40 (dd, 1H, J=14 и 5 Гц), 1,55- 1,80 (m, 4H), 1,42
(s,
9H). Элементарный анализ: рассчитано для C23H28O4: С 74,97; H 7,66; обнаружено: С 75,08; H 7,76.
Пример 28
Соединения формулы (А-1)
К раствору, содержащему 5,00 г (21,6 ммоля) N-(трет- бутоксикарбонил)-L-трет-лейцина и 2,50 г (21,7 ммоля) N- гидроксисукцинимида в 40 мл ацетонитрила, при 0oC по каплям добавляли
раствор,
содержащий 4,12 г (20 ммолей) дициклогексилкарбодиимида в 40 мл ацетонитрила. Смесь перемешивали при температуре от 0oC до комнатной в течение ночи, а затем смесь фильтровали с
целью
удалить осажденную дициклогексилмочевину. Фильтрат концентрировали и остаток растирали с этилацетатом/дихлорметаном, получая 5,06 г (80%) N- гидроксисукцинимидного эфира
N-(трет-бутоксикарбонил)-L-трет- лейцина в виде белого твердого продукта: tпл 136- 137oC;1H-ЯМР (300 МГц, CDCl3) δ 5,07 (br d, 1H), 4,43 (d, 1H,
J=10 Гц), 2,84 (s, 4H), 1,46 (s, 9H), 1,10 (s, 9H).
Пример 29
Соединения формулы (С), в которых R3 обозначает трет-бутил и R7 обозначает 4-пиридин
(вместо показанной на схеме фенильной группы)
Раствор, содержащий 2,00 г (6,32 ммоля) N- гидроксисукцинимидного эфира N-(трет-бутоксикарбонил)-L-трет-лейцина и 2,98 г (31,6 ммоля)
4-аминопиридина в 20 мл диоксана, выдерживали при 100oC в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали. Остаток очищали с помощью хроматографии на
силикагеле, элюируя 5-10%-ным метанолом в дихлорметане и получая 1,06 г (54%) N-(трет-бутоксикарбонил) -L-трет-лейцин-N'-(пирид-4-ил)карбоксамида в виде белого твердого вещества:1H-ЯМР
(300 МГц, CDCl3) δ 8,47 (d, 2H, J=6 Гц), 8,35 (br s, 1H), 7,50 (d, 2H, J=6 Гц), 5,23 (br d, 1H), 4,00 (br d, 1H), 1,44 (s, 9H), 1,05 (s, 9H). МС-БТЯ (M+H)+: рассчитанное
308,1974, полученное 308,1970.
Пример 30
30А. Соединения формулы (D), в которых R3 обозначает трет-бутил и R7 обозначает 4-пиридин (вместо показанной
на
схеме фенильной группы)
К раствору, содержащему 132 мг (0,43 ммоля) L-(трет-бутоксикарбонил)-L-трет-лейцин-N'-(пирид-4-ил)карбоксамида в 2 мл дихлорметана, добавляли 1 мл трифторуксусной
кислоты. После выдержки в течение 1 ч при комнатной температуре раствор разбавляли приблизительно 5 мл толуола и концентрировали. Путем повторного растворения в толуоле/дихлорметане/метаноле и
концентрирования в итоге получали 190 мг (100%) L-трет-лейцин-N'- (пирид-4-ил)карбоксамидбис(трифторацетата) в виде белого твердого вещества:1H-ЯМР (300 МГц, DMCO-d6) δ
11,58 (br s, 1H), 8,68 (d, 2H, J=6 Гц), 8,35 (br s, 2H), 7,91 (d, 2H, J= 6 Гц), 3,81 (s, 1H), 1,04 (s, 9H). МС-БТЯ (М+Н)+: рассчитанное 208,1500, полученное 208,1496.
30Б.
Соединения формулы (D), в которых R3 обозначает трет- бутил и R7 обозначает 4-(метилтио)фенил
Способом, аналогичным описанному в разделе А, получали
L-трет-лейцин-N'-(4-(метилтио)фенил)карбоксамид:1H-ЯМР (300 МГц, CDCl3) δ 9,02 (s, 1H), 7,49 (d, 2H, J=6,5 Гц), 7,23 (d, 2H, J=6,5 Гц), 3,23 (s, 2H), 2,44 (s, 3H), 1,
03
(s, 9H).
Пример 31
31A. Соединения формулы (Ib), в которых R2 обозначает бисфенил (и X обозначает пропан-1,3-диил), R3 и R8 обозначают
трет-бутил и R7 обозначает 4-пиридин (вместо показанной на схеме фенильной группы)
К раствору, содержащему 357 мг (0,97 ммоля)
2R-(трет-бутоксикарбонил)метил-(5-(бифен-4-ил)пентановой кислоты, 422 мг (0,97 ммоля) L-трет-лейцин-N'-(4-(пирид-4-ил))карбоксамидбис(трифторацетата) и 0,50 мл (3,6 ммоля) триэтиламина в 5 мл ДМФ,
добавляли 442 мг (1,00 ммоль) бензтриазол-1-ил- трис(диметиламино)фосфонийгексафторфосфата. Через 4 ч реакционную смесь распределяли между этилацетатом и водой. Водный слой дважды экстрагировали
этилацетатом и объединенные органические слои промывали водой и соляным раствором, сушили над сульфатом натрия и концентрировали. После очистки остатка с помощью хроматографии на силикагеле с
элюированием 25-75%-ным этилацетатом в гексане получали 360 мг (66%) N-(2R-(трет- бутоксикарбонил)метил-(5-(бифен-4-ил)пентаноил)-L-трет-лейцин- N'-(пирид-4-ил)карбоксамида:1H-ЯМР (300
МГц,
CDCl3) δ 8,52 (s, 1H), 8,42 (d, 2H, J=6 Гц), 7,54 (d, 2H, J=7 Гц), 7,40-7,48 (m, 6H), 7,32 (t, 1H, J=7 Гц), 7,13 (d, 2H, J=8 Гц), 6,62 (d, 1H, J= 9 Гц), 4,35 (d, 1H, J=9 Гц), 2,
58-2,
68 (m, 4H), 2,40 (dd, 1H, J=16 и 3 Гц), 1,40-1,75 (s над m, закрытый H2О, 13H), 1,08 (s, 9H).
31Б. Соединения формулы (Ib) с различными значениями R7
Аналогично способу, описанному в разделе А, заменяя L-трет-лейцин-N'-(4- (пирид-4-ил))карбоксамидбис(трифторацетат) на следующие соединения:
L-трет-лейцин-N'-(4-((2- гидроксиэтил)аминосульфонил)фенил)карбоксамид;
L-трет-лейцин-N'-(4-(метилтио)фенил)карбоксамид;
получали
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4-ил)пентаноил) -L-трет-лейцин-N'-(4-((2-гидроксиэтил)аминосульфонил)фенил) карбоксамид: tпл 89-92oC;1H-ЯМР (300 МГц,
метанол-d4) δ 7,80 (s, 4H), 7,51 (d, 2H, J=7 Гц), 7,41 (d, 2H, J=7 Гц), 7,36 (d, 2H, J=8 Гц), 7,28 (t, 1H, J=7 Гц), 7,14 (d, 2H, J=8 Гц), 4,47 (s, 1H), 3,47 (t, 2H, J=6 Гц), 2,85-2,
95 (t, перекрывающий m, 3H), 2,52-2,62 (m, 3H), 2,32 (dd, 1H, J=16,5 и 5 Гц), 1,48-1,62 (m, 4H), 1,41 (s, 9H), 1,09 (s, 9H); элементарный анализ: рассчитано для C37H49N3O7S: С 65,37; H 7,26; N 6,18; S 4,72; обнаружено: С 65,13; H 7,33; N 6,22; S 4,63 и
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4- ил)пентаноил)-L-трет-лейцин-N'-(4-(метилтио)фенил)карбоксамид:1H-ЯМР (300 МГц, CDCl3) δ 7,79 (s, 1H), 7,53 (d, 2H, J=7 Гц),
7,31-7,44 (m, 7H), 7,19 (d, 2H, J=9 Гц), 7,13 (d, 2H, J=8 Гц), 6,58 (d, 1H, J=9 Гц), 4,36 (d, 1H, J=9 Гц), 2,55-2,67 (m, 4H), 2,34-2,40 (s, перекрывающий m, 4H), 1,38-1,75 (s, перекрывающий m, 13H),
1,
07 (s, 9H); элементарный анализ: рассчитано для С36H46NO4S·0,25 H2О: С 71,19; H 7,72; N 4,61; S 5,28; обнаружено: С 71,20; H 7,78; N 4,58; S 5,
28.
Пример 32
32A. Соединения формулы (Ic), в которых R2 обозначает бифенил (и X обозначает пропан-1,3-диил), R3 обозначает трет-бутил и R7
обозначает 4-пиридин (вместо показанной на схеме фенильной группы)
К раствору, содержащему 360 мг (0,64 ммоля) N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4-ил)пентаноил)
-L-трет-лейцин-N'-(пирид-4-ил)карбоксамида в 4 мл дихлорметана, добавляли 2 мл трифторуксусной кислоты. После выдержки в течение 1 ч при комнатной температуре раствор разбавляли толуолом и
концентрировали. Остаток растворяли в этилацетате (15 мл) и промывали 0,5М цитратным буфером с pH 4 (2х15 мл). Объединенные водные слои экстрагировали этилацетатом (2х15 мл) и объединенные
органические слои промывали соляным раствором, сушили над сульфатом натрия и концентрировали. Остаток растирали с этилацетатом/гексаном, получая 230 мг (71%)
N-(2R-карбоксиметил- 5-(бифен-4-ил)пентаноил)-L-трет-лейцин-N'-(пиридин-4-ил) карбоксамида в виде белого твердого вещества: tпл 198-201oC;1H-ЯМР (300 МГц, MeOH-d4) δ 8,32 (d, 2H, J=7 Гц), 7,64 (d, 2H, J=5 Гц), 7,45 (d, 2H, J=7 Гц), 7,24-7,38 (m, 7H), 7,10 (d, 2H, J=8 Гц), 4,42 (s, 1H), 2,85-3,00 (m, 1H), 2,33-2,65 (m, 4H), 1,40-1,62 (m, 4H), 1,
02
(s, 9H). Элементарный анализ: рассчитано для C30H36N3O4·0,5H2O·0,5 этилацетат (сольват): С 69,29; H 7,27; N 7,58; обнаружено: С
69,
46; H 7,09; N 7,55.
32Б. Соединения формулы (Ic) с различными значениями R7
Аналогично способу, описанному в разделе А, заменяя
N-(2R-(трет-бутоксикарбонил)метил-(5-(бифен-4-ил)пентаноил) -L-трет-лейцин-N'-(пирид-4-ил)карбоксамид на следующие соединения:
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4-ил)пентаноил)-L-трет- лейцин-N'-(4-((2-гидроксиэтил)аминосульфонил)фенил) карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4-ил)пентаноил)
-L-трет-лейцин-N'-(4R/S-(метилсульфинил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(флуорен-2- ил)пентаноил)-L-лейцин-N'-(4-(метоксикарбонил) фенил) карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(7- (глицил)аминофлуорен-2-ил)пентаноил)-L-лeйцин-N'-(4- (метоксикарбонил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5- (4-(пирид-4-ил)фенил)пентаноил)-L-лeйцин-N'-(4- (метоксикарбонил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4-ил)пентаноил)-L- β
-гидроксивалин-N'-(фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4-ил)пентаноил) -L-трет-лейцин-N'-(4-(метилсульфонил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(4- (2-гидроксиэтил)фенил)пентаноил)-N'- лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(4'-гидроксибифен-4-ил)пентаноил)-L-лeйцин-N-(4- (метоксикарбонил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(4'-цианбифен-4-ил)пентаноил)
-L-лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4-ил)пентаноил) -L-лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(4'(2-аминоэтокси)бифен-4-ил) пентаноил)-L-лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(4-(пиридин-4-ил)фенил)пентаноил) -L-циклогексилглицин-N'-(4-((2-гидроксиэтил)аминосульфонил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4- ил)пентаноил)-L-треонин-N'-(4S-(метилсульфинил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(2-фторбифен-4-ил)пентаноил)-L-лейцин- N'-(4-(метоксикарбонил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-4-((бифен-4-ил)тио)бутаноил)-L-трет- лейцин-N'-(пиридин-4-ил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(4- (2-аминопиридин-5-ил)фенил)пентаноил)-L-треонин-N'-(4S- (метилсульфинил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(2-гидроксибифен-4- ил)пентаноил)-L-треонин-N'-(4S-(метилсульфинил)фенил)карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(4'-цианбифен-4-ил)пентаноил)
- L-(транс-4-гидроксициклогексил)глицин-N'-(4S-(метилсульфинил)фенил) карбоксамид;
N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4- ил)пентаноил)-L-(4-гидрокситетрагидропиран-4-ил)глицин-N'-(4S- (метилсульфинил)фенил) карбоксамид и
N-(2R-(трет-бутоксикарбонил)метил-5-(2R/S-гидрокси-3,3,3- трифторпропил)фенил)пентаноил)-L-(циклогексил)глицин-N'-(4S- (4-((2-гидроксиэтил)аминосульфонил)фенил) карбоксамид,
получали
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил) -L-трет-лейцин-N'-(4- ((2-гидроксиэтил)аминосульфонил)фенил)карбоксамид:1Н-ЯМР (300 МГц, МеОН-d4) δ 7,80 (s, 4Н), 7,50 (d,
2Н,
J=7 Гц), 7,25-7,42 (m, 5Н), 7,15 (d, 1H, J=8 Гц), 4,47 (s, 1H), 3,47 (t, 2H, J=6 Гц), 2,89-3,00 (m, 1H), 2,87 (t, 2H, J=6 Гц), 2,49-2,70 (m, 3H), 2,39 (dd, 1H, J=16 и 5 Гц), 1,46-1,67 (m, 4Н), 1,
07
(s, 9Н); элементарный анализ: рассчитано для C33H41N3O7S · 0,5 H2O: С 62,64; H 6,69; N 6,64; S 5,07; обнаружено: С 62,61; H 6,80; N 6,
31;
S 4,97;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L- трет-лейцин-N'-(4R/S-(метилсульфинил)фенил)карбоксамид:1H-ЯМР (300 МГц, MeOH-d4) δ 8,03 (d, 1H, J= 9
Гц),
7,76 (d, 2H, J=9 Гц), 7,57 (dd, 2H, J=9 и 2 Гц), 7,44 (d, 2H, J=7 Гц), 7,36 (t, 2H, J=7 Гц), 7,23-7,28 (m, 3H), 7,10 (d, 2H, J=8 Гц), 4,45 (d, 1H, J=9 Гц), 2,85-2,98 (m, 1H, J=8 Гц), 2,44-2,64
(m, 7H),
2,35 (dd, 1H, J= 16 и 5 Гц), 1,43-1,62 (m, 4H), 1,03 (s, 9H);
N-(2R-карбоксиметил-5-(флуорен-2-ил)пентаноил)-L-лейцин-N'-(4- (метоксикарбонил)фенил)карбоксамид: tпл
188-190oC;1H-ЯМР (300 МГц, CDCl3) δ 12,06 (s, 1H), 10,30 (s, 1H), 8,19 (d, 1H, J=8 Гц), 7,86 (d, 2H, J=9 Гц), 7,68-7,77 (m, 3H), 7,62 (d, 1H, J=8 Гц), 7,48 (d,
IH, J=7 Гц),
7,20-7,35 (m, 3H), 7,10 (d, 1H, J=7 Гц), 4,48 (m, 1H), 3,76 (s, 3H), 3,70 (s, 2H), 2,15-2,75 (m, 5H), 1,35-1,75 (m, 5H), 0,90-0,99 (m, 4H); элементарный анализ: рассчитано для С34H38N2O6: С 71,56; H 6,71; N 4,91; обнаружено: С 71,51; H 6,97; N 4,84;
N-(2R-карбоксиметил-5-(7-(глицил)аминофлуорен-2-ил)пентаноил)
-L-лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид: tпл 222-224oC; МС-БТЯ (М+Н)+: рассчитано для С40H51N4O7: 699,3758;
получено 699,3770;
N-(2R-карбоксиметил-5-(4-(пирид-4-ил)фенил)пентаноил) -L-лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид:1H-ЯМР (300 МГц, d4-MeOH) δ 8,52 (d,
2H, J=5,5 Гц), 7,92 (d, 2H, J=9,19 Гц), 7,67 (d, 2H, J=8,82 Гц), 7,58 (d, 2H, J= 6,25 Гц), 7,46 (d, 2H, J=8,45 Гц), 7,20 (d, 2H, J=8,46 Гц), 4,6-4,4 (m, 1H), 3,84 (s, 3H), 2,83-2,59 (m, 4H), 2,38 (dd,
1H, J=16,7 и 5 Гц), 1,71-1,57 (m, 7H), 0,96 (dd, 6H, J=9,92 и 6,3 Гц);
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L- β - гидроксивалин-N'-(фенил)карбоксамид:1H-ЯМР (300
МГц, CDCl3) δ 8,73 (s, 1H), 8,07 (d, 1H, J= 8,09 Гц), 7,52-7,25 (m, 11H), 7,10 (t, 1H, J=7,54 Гц), 6,97 (d, 2H, J=8,08 Гц), 4,41 (d, IH, J=8,45 Гц), 3,02-3,00 (m, 1H), 2,75 (dd, 1H,
J= 16,55 и 8,45 Гц), 2,53-2,51 (m, 2H), 2,44 (dd, 1H, J=17,1 и 4,6 Гц), 1,85-1,47 (m, 4H), 1,45 (s, 3H), 1,21 (s, 3H); элементарный анализ: рассчитано для C3H3N4O4: С 71,69; H 6,82; N 5,57; обнаружено: С 71,65; H 6,86; N 5,53;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-трет-лейцин-N'-(4- (метилсульфонил)фенил)карбоксамид:1H-ЯМР
(300 МГц, MeOH- d4) δ 8,10 (d, 1H, J=9 Гц), 7,81 (s, 4H), 7,47 (d, 2H, J=8 Гц), 7,25-7,40 (m, 5H), 7,13 (d, 2H, J= 8 Гц), 4,48 (d, 1H, J=9 Гц), 2,95 (s, 3H), 2,44-2,70 (m, 4H), 2,36
(dd, 1H, J=16 и 5 Гц), 1,47-1,63 (m, 4H), 1,06 (s, 9H);
N-(2R-карбоксиметил-5-(4-(2-гидроксиэтил)фенил)пентаноил)-L-лейцин- N'-(4-(метоксикарбонил)фенил)карбоксамид:1H-ЯМР (300
МГц, d4-MeOH) δ 7,91 (d, 2H, J=9 Гц), 7,64 (d, 2H, J=9 Гц), 6,96 (s, 4H), 4,47-4,51 (m, 1H) 3,84 (s, 3H), 3,63 (t, 2H, J=7 Гц), 2,68 (t, 2H, J=7 Гц), 2,46-2,75 (m, 4H), 2,37 (dd, 1H,
J=16 и 5 Гц), 1,51- 1,73 (m, 7H), 0,93 и 0,89 (2d, 6H, J=7 Гц);
N-(2R-карбоксиметил-5-(4'-гидроксибифен-4- ил)пентаноил)-L-лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид: tпл
195-197oС; МС-БТЯ (М+Н): рассчитанное 575,2757; полученное 595,2750;
N-(2R-карбоксиметил-5-(4'-цианбифен-4-ил)пентаноил)-L- лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид:1H-ЯМР (300 МГц, MeOH-d4) δ 10,02 (s, 1H), 8,37 (d, 1H, J=7 Гц), 7,87 (d, 2H, J=8 Гц), 7,71 (d, 2H, J=8,5 Гц), 7,64 (d, 4H,J=9 Гц), 7,35 (d, 2H, J=8 Гц), 7,16 (d, 2H, J=8 Гц),
4,50-4,53 (m, 1H), 3,81 (s, 3H), 2,49- 2,78 (m, 4H), 2,35 (dd, 1H, J=16 и 5 Гц), 1,46-1,72 (m, 7H), 0,88 и 0,90 (2d, 2H, J=7 Гц);
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-лейцин-N'-(4- (метоксикарбонил)фенил)карбоксамид: tпл 191-193oC;
N-(2R-карбоксиметил-5- (4'-(2-аминоэтокси)бифен-4-ил)пентаноил)-L- лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид: МС-БТЯ (М+Н): рассчитанное 618,3179; полученное 618,3189;
N-(2R-карбоксиметил-5-(4-(пиридин-4-ил)фенил)пентаноил)-L- циклогексилглицин-N'-(4- ((2-гидроксиэтил)аминосульфонил)фенил)карбоксамид;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-треонин-N'-(4S- (метилсульфинил) фенил) карбоксамид;
N-(2R-карбоксиметил-5-(2- фторбифен-4-ил)пентаноил)-L-лейцин-N'-(4-(метоксикарбонил)
фенил)
карбоксамид;
N-(2R-карбоксиметил-4-((бифен-4- ил)тио)бутаноил)-L-трет-лейцин-N'-(пиридин-4-ил)карбоксамид;
N-(2R-карбоксиметил-5-(4-(2-аминопиридин-5-ил)фенил)пентаноил)-L- треонин-N'-(4S-(метилсульфинил)фенил)карбоксамид;
N-(2R-карбоксиметил-5-(2-гидроксибифен-4-ил)пентаноил)-L-треонин-N'-(4S- (метилсульфинил)фенил)карбоксамид;
N-(2R-карбоксиметил-5- (4'-цианбифен-4-ил)пентаноил)-L-(транс-4- гидроксициклогексил)глицин-N'-(4S-(метилсульфинил)фенил)карбоксамид;
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L- (4-гидрокситетра-гидропиран-4-ил)глицин-N'-(4S- (метилсульфинил)фенил)карбоксамид и
N-(2R-карбоксиметил-5- (2R/S-гидрокси-3,3,
3-трифторпропил)фенил)пентаноил)-L-(циклогексил)глицин-N'-(4S-(4-((2-гидрокси-этил) аминосульфонил) фенил) карбоксамид.
Пример 33
33А. Соединения формулы (Ie), в которых R
обозначает бифенил (и X обозначает пропан-1,3-диил), R2 обозначает трет-бутил и R3 обозначает 4-пиридин (вместо показанной на схеме фенильной группы)
К раствору,
содержащему 127,4 мг (0,200 ммоля) N-(2R- карбоксиметил-5-(бифен-4-ил)пентаноил)-L-трет-лейцин-N'- (пиридин-4-ил)карбоксамида и 40 мкл N-метилморфолина в 1,0 мл ДМФ, при комнатной температуре
добавляли 115 мг (0,26 ммоля) бензтриазол-1-ил-трис(диметиламино)фосфонийгексафторфосфата. Через 15 минут в виде одной порции добавляли 42 мг (0,60 ммоля) гидрохлорида гидроксиламина, а затем
дополнительно еще 70 мкл N- метилморфолина. Смесь перемешивали в течение 24 ч при комнатной температуре, затем распределяли между 30 мл этилацетата и 25 мл 0,5М водного бикарбоната натрия.
Органический слой промывали дополнительной порцией водного бикарбоната натрия и соляным раствором/буфером с pH 7, сушили над сульфатом натрия и концентрировали. После перекристаллизации из
этилацетата
получали 42,2 мг N-(2R-(N-гидроксикарбамоил)метил-5-(бифен-4- ил)пентаноил)-L-трет-лейцин-N'-(пирид-4-ил)карбоксамида. Путем концентрирования фильтрата и очистки с помощью радиальной
хроматографии
(пластина 1 мм, 5-10%-ный этанол:дихлорметан) после перекристаллизации из этилацетата:гексана (2:1) получали дополнительно 21,0 мг продукта. Общий выход составил 63,1 мг (61%)
N-(2R-(N-гидроксикарбамоил)метил-5-(бифен-4-ил)пентаноил)-L-трет-лейцин-N'- (пирид-4-ил)карбоксамида в виде белого порошка:1H-ЯМР (300 МГц, ДМСО-d6) δ 10,45 (s, 1H), 10,
34 (s, 1H), 8,68 (s, 1H), 8,38 (d, 2H, J=7 Гц), 8,04 (d, 1H, J=9 Гц), 7,25-7,60 (m, 9H), 7,12 (d, 2H, J=7 Гц), 4,39 (d, 1H, J=9 Гц), 2,86-2,97 (m, 1H), 2,36-2,60 (m, 2H, закрытый резонансом от
ДМСО-d5), 2,14 (dd, 1H, J=15 и 7 Гц), 2,02 (dd, IH, J=15 и 8 Гц), 1,30-1,53 (m, 4H), 0,94 (s, 9H). Элементарный анализ: рассчитано для C30H36N4О4
·0,25 H2O: С 69,14; H 7,06; N 10,75; обнаружено: С 69,15; H 7,23; N 10,56.
33Б. Соединения формулы (Ie) с различными значениями R2, R3 и R7
Аналогично способу, описанному в разделе А, заменяя N-(2R- карбоксиметил-5-(бифен-4-ил)пентаноил)-L-тpeт-лейцин-N'- (пиридин-4-ил)карбоксамид на следующие соединения:
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L-треонин-N'- (4-S-(метилсульфинил)фенил) карбоксамид;
N-(2R-карбоксиметил-5-(4-(пиридин-4-ил)фенил)пентаноил)-L- (β
- гидрокси)валин-N'-(4S-(метилсульфинил)фенил)карбоксамид и
N-(2R-(карбоксиметил-4-метилпентаноил)-L-трет-лейцин-N'- (пиридин-4-ил)карбоксамид;
N-(2R-(карбоксиметил-(5-(4-(2S- гидроксипропил)фенил)пентаноил)-L-(транс-4- гидроксициклогексил)глицин-N'-(пиридин-4-ил)карбоксамид;
N-(2R-(карбоксиметил-5-(4-(2-метилтиазол-4-ил)фенил)пентаноил)-L- (β-гидрокси)валин-N'-(пиридин-4-ил)карбоксамид и
N-(2R-карбоксиметил-5-(4-(2R/S-гидрокси-3,3,
3-трифторпропил)фенил)пентаноил) -L-(β-гидрокси)валин-N'-(пиридин-4-ил)карбоксамид,
получали
N-(2R-(N-гидроксикарбамоил)метил-5-(бифен-4-ил)пентаноил)-L-треонин-N'- (4S-(метилсульфинил)фенил)карбоксамид;
N-(2R-(N-гидроксикарбамоил)метил-5-(4-(пиридин-4-ил)фенил)пентаноил)
-L-(β
-гидрокси)валин-N'-(4S-(метилсульфинил)фенил) карбоксамид;
N (2R-(N-гидроксикарбамоил)метил-4- метилпентаноил)-L-трет-лейцин-N'-(пиридин-4-ил)карбоксамид;
N-(2R-(N-гидроксикарбамоил)метил-(5-(4-(2S-гидроксипропил)фенил) пентаноил)-L-(транс-4-гидроксициклогексил)глицин-N'- (пиридин-4-ил)карбоксамид;
N-(2R-(N-гидроксикарбамоил)метил-5-(4-(2-метилтиазол-4-ил)фенил)пентаноил) -L- (β-гидрокси)валин-N'-(пиридин-4-ил)карбоксамид;
N-(2R-(N-гидpoкcикapбaмoил)метил-5-(4-(2R/S- гидpoкcи-3,
3,
3- трифторпропил)фенил)пентаноил)-L-(β-гидрокси)валин-N'-(пиридин-4-ил)карбоксамид;
N-(2R-(N-гидроксикарбамоил)метил-(5-(4-(2S-гидроксипропил)фенил)
пентаноил)-L-(транс-4-гидроксициклогексил)глицин- N'-(пиридин-4-ил)карбоксамид;
N-(2R-(N-гидроксикарбамоил)метил-5-(4-(2-метилтиазол-4- ил)фенил)пентаноил)-L-(β
-гидрокси)валин-N'-(пиридин- 4-ил)карбоксамид и
N-(2R-(N-гидроксикарбамоил)метил-5-(4-(2R/S- гидрокси-3,3,3-трифторпропил)фенил)пентаноил)-L-(β
-гидрокси)валин-N'-(пиридин-4-ил)карбоксамид.
Пример 34
34А. Соединения формулы (С), в которых R3 обозначает трет-бутил, a R4 и R5
обозначают
H
Раствор, содержащий 2,00 г (6,32 ммоля) N-гидроксисукцинимидного эфира N-(трет-бутоксикарбонил)-L-трет-лейцина в 9 мл дистиллированного анилина, перемешивали и выдерживали при
100oC в течение 30 минут. Смеси давали охладиться до комнатной температуры и разбавляли 40 мл этилацетата. Раствор промывали 1н. водным бисульфатом натрия (4х50 мл) и объединенные водные
слои
экстрагировали 25 мл этилацетата. Объединенные органические слои промывали соляным раствором, сушили над сульфатом натрия и концентрировали. Остаток очищали с помощью хроматографии на силикагеле
(2-10%-ный этилацетат в дихлорметане), получая 1,36 г (74%) N-(трет-бутоксикарбонил)-L- трет-лейцин-N'-фенилкарбоксамида в виде белого твердого продукта:1H-ЯМР (300 МГц, CDCl3)
δ 7,49 (d, 2H, J=8 Гц), 7,31 (t, 2H, J=8 Гц), 7,11 (t, 1H, J=7 Гц), 5,30-5,36 (m, 1H), 3,95 (d, 1H, J=9 Гц), 1,44 (s, 9H), 1,07 (s, 9H).
34Б. Соединения формулы (С), в которых
R3 обозначает трет- бутил, R4 обозначает 4-метилтио и R5 обозначают H
Аналогично способу, описанному в разделе А, получали
N-(трет-бутоксикарбонил)-L-трет-лейцин-N'-(4- (метилтио)фенил)карбоксамид:1H-ЯМР (300 МГц, CDCl3) δ 7,65 (br s, 1H), 7,42 (d, 2H, J=8,5 Гц), 7,21 (d, 2H, J=8,5 Гц), 5,32
(br d, 1H), 3,95 (d, 1H, J=8,5 Гц), 2,45 (s, 3H), 1,44 (s, 9H), 1,06 (s, 9H). Элементарный анализ: рассчитано для С18H23N2О3S: С 61,33; H 8,01; N 7,95; S 9,
09; обнаружено: С 61,34; H 8,06; N 8,00; S 9,18.
Пример 35
Соединения формулы (С) с трифторацетильной защитной группой, в которых R3 обозначает трет-бутил и R4 и R5 обозначают H
К раствору, содержащему 1,36 г (4,4 ммоля) N-(трет-бутоксикарбонил)-L-трет-лейцин-N'-фенилкарбоксамида в 10 мл дихлорметана, добавляли 5 мл
трифторуксусной кислоты. После выдержки в течение 45 минут при комнатной температуре раствор разбавляли толуолом и концентрировали. Остаток еще дважды концентрировали из толуола для удаления избытка
трифторуксусной кислоты, а затем сушили под вакуумом (приблизительно 1 мм рт.ст.). Затем остаток растворяли в 15 мл дихлорметана и последовательно обрабатывали пиридином (0,90 мл, 11 ммолей) и
трифторуксусным ангидридом (0,70 мл, 4,84 ммоля). Через 30 минут смесь распределяли между дихлорметаном (25 мл) и 1н. водным бисульфатом натрия. Органический слой промывали дополнительной порцией
водного бисульфата натрия, соляным раствором, сушили над сульфатом натрия и концентрировали, получая 1,22 г (91%) N-(трифторацетил)-L-трет-лейцин-N'-фенилкарбоксамида в виде белого твердого продукта:
tпл 201-203oC;1H-ЯМР (300 МГц, CDCl3) δ 7,50 (d, 2H, J=8 Гц), 7,36 (t, 2H, J=8 Гц), 7,17 (t, 1H, J=7 Гц), 4,43 (d, 1H, J=9 Гц), 1,10 (s, 9H).
Элементарный анализ: рассчитано для C14H17F3N2O2: С 55,62; H 5,67; N 9,27; обнаружено: С 55,57; H 5,60; N 9,18.
Пример 36
Соединения формулы (С) с трифторацетильной защитной группой, в которых R3 обозначает трет-бутил, R4 обозначает 4-(2- гидроксиэтил)аминосульфонил и R5 обозначают
Н
К раствору, содержащему 250 мг (0,83 ммоля) N-(трифторацетил)-L-трет-лейцин-N'-фенилкарбоксамида в 5 мл хлороформа, добавляли 0,4 мл (6 ммолей) хлорсульфоновой кислоты. Смесь кипятили с
обратным холодильником в течение 35 минут и затем охлаждали до 0oC и разбавляли этилацетатом. Добавляли этаноламин (1,5 мл) и смесь перемешивали при 0oC в течение 15 минут.
Смесь
распределяли между водой и этилацетатом и органический слой промывали 1н. водным бисульфатом натрия, сушили над сульфатом натрия и концентрировали, получая 140 мг (40%)
N- (трифторацетил)-L-трет-лейцин-N'-(4-((2- гидроксиэтил)аминосульфонил)фенил)карбоксамида:1H-ЯМР (300 МГц, CDCl3) δ 7,93 (s, 1H), 7,84 (d, 2H, J=9 Гц), 7,67 (d, 2H, J=9
Гц), 7,15 (br d, 1H), 4,90 (br t, 1H), 4,49 (d, 1H, J=9 Гц), 3,70 (t, 2H, J=5 Гц), 3,11 (q, 2H, J=5 Гц), 1,12 (s, 9H).
Пример 37
Соединения формулы (D), в которых R3 обозначает трет-бутил, R4 обозначает 4-(2-гидроксиэтил)аминосульфонил и R5 обозначают H
К раствору, содержащему 257 мг (0,6 ммоля)
N-(трифторацетил)-L-трет- лейцин-N'-(4-((2-гидроксиэтил)аминосульфонил)фенил)карбоксамида в 8 мл этанола, добавляли 227 мг (6 ммолей) борогидрида натрия. Смесь нагревали до 55oC в течение
15 минут, давали охладиться до комнатной температуры и реакцию прекращали охлажденным 10%-ным гидроксидом аммония в метаноле. После выдержки в течение 20 ч при комнатной температуре смесь фильтровали
и фильтрат абсорбировали на силикагеле. С помощью хроматографии (от чистого дихлорметана до смеси дихлорметан:метанол:гидроксид аммония 90:9:1) получали 110 мг (56%)
L-трет-лейцин-N'-(4-((2-гидроксиэтил)аминосульфонил)фенил) карбоксамида в виде масла:1H-ЯМР (300 МГц, CDCl3) δ 9,48 (br s, 1H), 7,81 (d, 2H, J=9 Гц), 7,72 (d, 2H, J=9
Гц),
3,67 (t, 2H, J=5 Гц), 3,30 (s, 1H), 3,08 (q, 2H, J=5 Гц), 1,06 (s, 9H). МС-БТЯ (М+Н)+: рассчитанное 330,1488, полученное 330,1480.
Пример 38
Соединения
формулы
(Ib), в которых R2 обозначает бифенил (X обозначает пропан-1,3-диил), R3 обозначает трет-бутил, R4 обозначает 4R/S-метилсульфинил и R5 обозначают
H
К раствору, содержащему 60,3 мг (0,100 ммоля) N-(2R-(трет-бутоксикарбонил)метил-5-(бифен-4-ил)пентаноил) -L-трет-лейцин-N'-(4-(метилтио)фенил)карбоксамида в 2 мл дихлорметана, при -78oC
добавляли раствор, содержащий 26 мг (0,15 ммоля) мета-хлорпербензойной кислоты в 1 мл дихлорметана. Реакционную смесь перемешивали при -78oC в течение 50 минут и затем добавляли 0,
2 мл
диметилсульфида. Смеси давали нагреться до комнатной температуры и затем распределяли между дихлорметаном и насыщенным водным раствором бикарбоната натрия. Органический слой промывали соляным
раствором, сушили над сульфатом натрия и концентрировали, получая 59,6 мг (96%) N-(2R- (трет-бутоксикарбонил)метил-5-(бифен-4-ил)пентаноил)-L-трет- лейцин-N'-(4R/S-метилсульфинил)фенил)карбоксамида в
виде белого твердого вещества:1H-ЯМР (300 МГц, CDCl3) δ 8,46 (br s, 1H), 7,32-7,68 (m, 11H), 7,14 (d, 2H, J= 8 Гц), 6,63 (d, 1H, J=9 Гц), 4,42 (d, 1H, J=9 Гц), 2,36-2,72
(m, 8H), 1,42-1,76 (s, перекрывающий m, 13H), 1,09 (s, 9H).
Пример 39
Соединения формулы (F'')
К раствору, содержащему 2,779 г (7,50 ммоля)
N-(2R-(трет-бутоксикарбонил)метил-4-пентеноил) -4S-фенилметил-2-оксазолидинона в 30 мл ТГФ, при 0oC добавляли 2,55 мл (22,5 ммоля) 30%-ной водной перекиси водорода, а затем добавляли 7,5
мл
(15 ммолей) 2,О н. водного гидроксида лития. Смесь перемешивали в течение 2 ч при 0oC и затем в течение 0,5 ч при комнатной температуре. После повторного охлаждения смеси до 0oC
добавляли 15 мл 2М водного сульфита натрия и 23 мл насыщенного водного бикарбоната натрия. Смесь перемешивали дополнительно в течение 30 минут при 0oC и затем большую часть ТГФ
удаляли
путем концентрирования под вакуумом. Остаток распределяли между CH2Cl2 и H2О и водный слой экстрагировали дополнительной порцией CH2Cl2.
Объединенные органические слои экстрагировали водным бикарбонатом натрия и затем органические водные слои подкисляли до pH 2 бисульфатом натрия. Образовавшуюся смесь экстрагировали дважды
этилацетатом
и объединенные органические слои промывали насыщенным водным NaCl, разбавляли 0,25 объема гексана, сушили над Na2SO4 и концентрировали, получая 1,47 г (92%)
2R-(трет-бутоксикарбонил) метил-4-пентеновой кислоты в виде бесцветного масла:1H-ЯМР (300 МГц, CDCl3) δ 5,68-5,82 (m, 1H), 5,07-5,15 (m, 2H), 2,86-2,96 (m, 1H), 2,60 (dd,
1H, J=18 и 10 Гц), 2,25-2,52 (m, 3H), 1,43 (s, 9H).
Пример 40
Соединения формулы (D'-1), в которых R3 обозначает трет-бутил и R7 обозначает
4-(метоксикарбонил) фенил
Аналогично способу, описанному в примере 31, заменяя 2R-(трет- бутоксикарбонил)метил-(5-(бифен-4-ил)пентановую кислоту на
2R- (трет-бутоксикарбонил)метил-4-пентеновую кислоту и заменяя L-трет-лейцин-N'-(4-(пирид-4-ил)карбоксамид на L-лейцин-N'-(4- (метоксикарбонил)фенил)карбоксамид, получали
N-(2R-(трет- бутоксикарбонил)метил-4-пентеноил)-L-лейцин-N'-(4- (метоксикарбонил)фенил)карбоксамид: tпл 118- 119oC (циклогексан);1H-ЯМР (300 МГц, CDCl3)
δ 8,96 (s, 1H), 7,95 (d, 2H, J=9 Гц), 7,57 (d, 2H,J=9 Гц), 6,32 (d, 1H, J=7 Гц), 5,63- 5,77 (m, 1H), 4,95-5,08 (m, 2H), 4,52-4,60 (m, 1H), 3,88 (s, 3H), 2,36-2,77 (m, 4H), 2,14-2,27 (m, 1H), 1,
60-1,87 (m, 3H), 1,45 (s, 9H), 0,97 (d, 3H,J=7 Гц), 0,91 (d, 3H, J=7 Гц). Элементарный анализ: рассчитано для C25H36N2O6: С 65,20; H 7,88; N 6,08;
обнаружено: С 65,04; H 7,80; N 6,06.
Пример 41
41A. Соединения формулы (D'-2), в которых R2 обозначает флуорен-2-ил (X обозначает пропан-1.3-диил), R3
обозначает трет-бутил и R7 обозначает 4-(метоксикарбонил) фенил
К раствору, содержащему 167 мг (0,36 ммоля)
N-(2R-(трет-бутоксикарбонил)метил-4-пентеноил)-L-лейцин-N'-(4- (метоксикарбонил)фенил)карбоксамида, 108 мг (0,44 ммоля) 2-бромфлуорена, 21 мг (0,07 ммоля) три-орто-толилфосфина и 69 мкл (50 мг, 0,50
ммоля) триэтиламина в 1,0 мл ДМФ, в атмосфере аргона добавляли 8,0 мг (0,035 ммоля) диацетата палладия. Раствор выдерживали при 100oC в течение 2 ч, охлаждали до комнатной температуры и
затем распределяли между этилацетатом: гексаном (3:1) и водой. Органический слой промывали 1н. водным бисульфатом натрия и соляным раствором/буфером с рН 7, сушили над сульфатом натрия и
концентрировали. После очистки с помощью быстрой хроматографии (20 г двуокиси кремния, 5-10%-ный трет-бутилметиловый эфир в дихлорметане) получали 185 мг (82%) продукта в виде твердого вещества,
содержащего по данным ТСХ следовые количества примесей. После перекристаллизации из третбутилметилового эфира/изооктана получали 115 мг (51%)
N-(2R- (трет-бутоксикарбонил)метил-5-(флуорен-2-ил)-4E-пентеноил)-L- лейцин-N'-(4-(метоксикарбонил) фенил) карбоксамида в виде тонких белых игольчатых кристаллов: tпл 189-192oC;1H-ЯМР (300 МГц, CDCl3) δ 8,32 (s, 1H), 7,79 (d, 2H, J=8 Гц), 7,72 (d, 1H, J=8 Гц), 7,57 (d, 1H, J=8 Гц), 7,45-7,53 (m, 3H), 7,36 (t, 1H, J= 7,5 Гц), 7,25-7,32 (m, 2H), 7,
17 (d, 1H, J=7 Гц), 4,52-4,60 (m, 1H), 3,75 (s, 5H), 2,33-2,87 (m, 5H), 1,60-1,90 (m, 3H), 1,45 (s, 9H), 0,92 (видимый t, 6H). Элементарный анализ: рассчитано для С38H44О6·0,5H2О: С 72,01; H 7,16; N 4,42; обнаружено: С 71,87; H 7,07; N 4,32.
41Б. Соединения формулы (D'-2), в которых R2 обозначает
7-(N-(бензилоксикарбонил)глицил)аминофлуорен-2-ил (X обозначает пропан-1,3-диил), R3 обозначает трет-бутил и R7 обозначает 4-(метоксикарбонил)фенил
К раствору,
содержащему 600 мг (2,31 ммоля) 2-амино-7-бромфлуорена и 483 мг (2,31 ммоля) N- (бензилоксикарбонил)глицина в 10 мл безводного пиридина, добавляли 442 мг (2,31 ммоля) гидрохлорида EDС. Реакционную
смесь выдерживали при 60oC в течение 4 дней и затем раствор концентрировали. Остаток распределяли между этилацетатом и 1н. водной соляной кислотой и органический слой промывали насыщенным
водным раствором бикарбоната натрия и соляным раствором, сушили над сульфатом магния и концентрировали, получая 813 мг (78%) N- (бензилоксикарбонил)глицин-N'-(7-бромфлуорен-2-ил)карбоксамида в виде
желтовато-коричневого твердого вещества: tпл 194-195oC.
Аналогично способу, описанному в разделе А, заменяя 2-бромфлуорен на N-(бензилоксикарбонил)глицин-N'-(7-бромфлуорен-2- ил)карбоксамид, получали N-(2R-(трет-бутоксикарбонил)метил-5- (7-(N-(бензилоксикарбонил)глицил)аминофлуорен-2-ил)-4E-пентеноил) -L-лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид: tпл 213-214 С; МС-БТЯ (M+Cs)+: рассчитано для C48H54N4O9·Cs 963,2945; получено 963,2960. Элементарный анализ: рассчитано для C47H54N4O9: С 69,40; H 6,51; N 6,75; обнаружено: С 69,47; H 6,51; N 6,70.
41В.
Соединения формулы (D'-2), в которых R2 обозначает 4-(пирид-4-ил)фенил (X обозначает пропан-1,3-диил), R3 обозначает трет-бутил и R7 обозначает 4- (метоксикарбонил)
фенил
К суспензии, содержащей 400 мг (2,0 ммоля) 4-бромпиридина в 2 мл бензола, добавляли водный 2М карбонат натрия (3 мл) с получением двух выраженных фаз и смесь барботировали аргоном в
течение нескольких минут с последующим добавлением 115 мг (0,10 ммоля) тетракис(трифенилфосфин) палладия. К образовавшейся смеси добавляли раствор, содержащий 200 мг (1,00 ммоль) 4- бромфенилборной
кислоты в 1 мл этанола, и смесь кипятили с обратным холодильником в течение 4 ч. После охлаждения до комнатной температуры смесь распределяли между этилацетатом (25 мл) и водой (25 мл). Органический
слой сушили над сульфатом натрия и концентрировали. После очистки остатка с помощью хроматографии на силикагеле с элюированием 25-50%-ным этилацетатом в гексане получали 193 мг (82%)
4-(4-бромфе-нил)пиридина в виде белого твердого вещества: tпл 124-126oC;
Аналогично способу, описанному в разделе А, заменяя 2-бромфлуорен на 4-(4-бромфенил)пиридин,
получали N-(2R- (трет-бутоксикарбонил)метил-5-(4-(пирид-4-ил)фенил) -4E-пентеноил)-L-лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид:1H-ЯМР (300 МГц, CDCl3) δ 8,80 (s,
1H), 8,64 (d, 2H, J=6 Гц), 7,85 (d, 2H, J=8,5 Гц), 7,49 (d, 2H,J=9 Гц), 7,45 (d, 2H, J= 6 Гц), 7,19 (d, 2H, J=8 Гц), 6,40 (d, 1H,J=16 Гц), 6,33 (d, 1H,J=8 Гц), 6,09-6,17 (m, 1H), 4,54-4,57 (m, 1H), 3,
80 (s, 3H), 2,38-2,81 (m, 5H), 1,48-1,84 (m, 3H), 1,44 (s, 9H), 0,90 и 0,94 (2d, 6H, J=7 Гц).
Пример 42
42A. Соединения формулы (Ib'), в которых R2 обозначает
флуорен-2-ил (X обозначает пропан-1,3-диил), R3 обозначает трет-бутил и R7 обозначает 4-(метоксикарбонил) фенил
Раствор, содержащий 111 мг (0,177 ммоля)
N-(2R-(трет-бутоксикарбонил)метил-5-(флуорен-2-ил)-4-пентеноил)-L-лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамида в 7 мл этилацетата:этанола (4:3) гидрировали при давлении водорода 1 атм в
присутствии 30 мг 10%-ного палладия на угле в течение 3 ч. Катализатор удаляли с помощью фильтрации через целит и фильтрат концентрировали. Путем растирания с трет- бутилметиловым эфиром получали 110
мг (99%) N-(2R-(трет- бутоксикарбонил)метил-5-(флуорен-2-ил)пентаноил)-L-лейцин-N'- (4-(метоксикарбонил)фенил)карбоксамида в виде белого твердого вещества: tпл 166-167oC
(размягчение при 161oC). Элементарный анализ: рассчитано для С37H46N2О6: С 72,29; H 7,54; N 4,56; обнаружено: С 72,32; H 7,54; N 4,62.
42Б. Соединения формулы (Ib') с различными значениями R2
Аналогично способу, описанному в разделе А, заменяя
N-(2R-(трет-бутоксикарбонил)метил-5-(флуорен-2-ил)-4-пентеноил) -L-лейцин-N'-(4-(метоксикарбонил)фенил) карбоксамид на:
N-(2R-(трет-бутоксикарбонил)метил-5-(7-(N- (бензилоксикарбонил)глицил)аминофлуорен-2-ил)-4E-пентеноил) -L-лeйцин-N'-(4-(метоксикарбонил) фенил) карбоксамид и
N-(2R-(трет-бутоксикарбонил)метил-5-(4-(пирид-4-ил)фенил)-4E- пентеноил)-L-лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид, получали:
N-(2R-(трет-бутоксикарбонил)метил-5-(7- глицил)аминофлуорен-2-ил)пентаноил)-L-лейцин-N'-(4- (метоксикарбонил)фенил)карбоксамид: МС-БТЯ (М+Н)+: рассчитано для C40H51
N4O7: 699,3758; получено 699,3770 и
N-(2R-(трет-бутоксикарбонил)метил-5-(4- (пирид-4-ил)фенил)пентаноил)-L- лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид: tпл 174-176oC;1H-ЯМР (300 МГц, CDCl3) δ 8,85 (s, 1H), 8,63 (d, 2H, J=5 Гц), 7,95 (d, 2H, J=8 Гц), 7,57 (d, 2H, J=9 Гц), 7,41-7,47 (m, 4H), 7,07 (d, 2H,
J=8 Гц), 6,19 (d, 1H, J=7 Гц), 4,53-4,56 (m, 1H), 3,85 (s, 3H), 2,37-2,66 (m, 5H), 1,45-1,83 (m, 7H), 1,42 (s, 9H), 0,91 и 0,95 (2d, 6H, J=7 Гц).
Пример 43
Соединения
формулы
(С-1), в которых R4 и R5 обозначают H
К перемешиваемой суспензии, содержащей 4,18 г (20,0 ммолей) N-(бензилоксикарбонил)глицина, 2,73 мл (2,79 г, 30,0 ммолей)
анилина и
110 мг (1,0 ммоль) 4-диметиламинопиридина в 55 мл дихлорметана, при 0oC добавляли в виде одной порции 6,53 г (22 ммоля) метиодида EDC. Смесь перемешивали в течение 18 ч при
комнатной
температуре и затем распределяли между 200 мл этилацетата: гексана (3:1) и водой. Органический слой промывали 1н. водным бисульфатом натрия, насыщенным водным бикарбонатом натрия и в
завершение
соляным раствором/фосфатным буфером с pH 7, сушили над сульфатом натрия и концентрировали. После перекристаллизации из этилацетата/изооктана (1:1) получали 3,69 г (65%)
N-(бензилоксикарбонил)глицин-N'-фенилкарбоксамида: tпл 143-144oC.
Пример 44
Соединения формулы (С-2), в которых R4 и R5
обозначают
H
К перемешиваемому раствору, содержащему 1,42 г (5,00 ммолей) N-(бензилоксикарбонил)глицин-N'-фенилкарбоксамида в 35 мл безводного ТГФ, при -5oC с помощью шприца
добавляли 6,15 мл
(16,0 ммолей) 2,6М н-бутиллития в гексане с такой скоростью, чтобы поддерживать температуру реакционной смеси ниже 10oC. После добавления приблизительно 2/3 от всего
количества н-бутиллития
появлялся устойчивый желтый цвет, добавление прекращали приблизительно на 10 минут и затем вновь начинали добавлять по каплям так, чтобы поддерживать температуру реакционной
смеси на уровне
приблизительно 0oC. По завершении добавления оранжевый раствор перемешивали при 0oC в течение приблизительно 45 минут и затем охлаждали до -70oC. При
помощи шприца
добавляли ацетон (1,10 мл, 15 ммолей) в виде одной порции. Через 10 минут реакционную смесь распределяли между 1М фосфатным буфером с pH 7 и этилацетатом:гексаном (3: 1). Органический
слой промывали
соляным раствором, сушили над сульфатом натрия и концентрировали. Остаток очищали с помощью хроматографии на 75 г двуокиси кремния, элюируя 40%-ным этилацетатом:гексаном. Первыми
элюировались фракции
чистого продукта (пул N1), затем фракции, содержащие продукт и исходный глицинанилид (пул N2). Остаток после пула N2 перекристаллизовывали из этилацетата: изооктана, получая
практически чистое
исходное вещество в виде твердого продукта и маточные растворы, содержащие в основном продукт. Остаток после концентрирования маточных растворов очищали с помощью радиальной
хроматографии (пластинка 4
мм, 30%-ный этилацетат:гексан) и фракции продукта объединяли с пулом 1, получая после растирания смолообразного остатка с гексаном/трет-бутилметиловым эфиром 423 мг (25%)
N-(бензилоксикарбонил)-DL- β -гидроксивалин- N'-(фенил)карбоксамида в виде светло-желтого твердого вещества: tпл 128-129oC;1H-ЯМР (300 МГц, CDCl3)
δ 8,30 (br s, 1H), 7,39 (d, 2H, J=8 Гц), 7,18-7,28 (m, 7H), 7,06 (t, 1H, J=7 Гц), 5,83 (br d, 1H), 5,05 (s, 2H), 4,04 (d, IH, J=9 Гц) 3,73 (s, 1H), 1,33 (s, 3H), 1,16 (s, 3H). Элементарный
анализ: рассчитано для C19H22N2O4: С 66,65; H 6,48; N 8,18; обнаружено: С 66,66; H 6,57; N 8,14.
Пример 45
Соединения формулы
(С-2), в которых R4 и R5 обозначают H
Раствор, содержащий 400 мг (1,17 ммоля) N-(бензилоксикарбонил)-DL- β -гидроксивалин-N'-(фенил)карбоксамида в 10 мл
этилацетата, гидрировали при давлении водорода 1 атм в присутствии 50 мг 10%-ного палладия на угле в течение 1,5 ч. Катализатор удаляли с помощью фильтрации через целит и фильтрат концентрировали,
получая 259 мг (>100%) DL- β -гидроксивалин-N'-(фенил)карбоксамида, который использовали без дополнительной очистки; tпл 97-99oC. Элементарный анализ: рассчитано
для С11H16N2O2: С 63,44; H 7,74; N 13,45; обнаружено: С 63,52; H 7,79; N 13,40.
Пример 46
Соединения формулы (Ib), в которых
R2 обозначает бисфенил, R3 обозначает гидрокси-трет-бутил, a R4 и R5 обозначают H
К раствору, содержащему 203 мг (0,55 ммоля)
2R-(трет- бутоксикарбонил)метил-(5-(бифен-4-ил)пентановой кислоты, 104 мг (0,50 ммоля) DL- β -гидроксивалин-N'-(фенил)карбоксамида и 90 мкл (0,65 ммоля) триэтиламина в 2,5 мл ДМФ, добавляли
265
мг (0,60 ммоля) бензтриазол-1-илтрис(диметиламино)фосфонийгексафторфосфата. Через 24 ч реакционную смесь распределяли между этилацетатом:гексаном (3:1) и приблизительно 0,2н. водным бикарбонатом
натрия. Органический слой промывали 1н. водным бисульфатом натрия и соляным раствором/буфером с pH 7, сушили над сульфатом натрия и концентрировали. Остаток очищали с помощью радиальной хроматографии
(пластина 4 мм), элюируя 25-30%-ным этилацетатом в гексане. Первыми элюировались 121 мг (43%) N-(2R- (трет-бутоксикарбонил)метил-(5-(бифен-4-ил)пентаноил)-D- β
-гидроксивалин-N'-(фенил)карбоксамида (диастереоизомер), а затем 140 мг (50%) N-(2R-(трет- бутоксикарбонил)метил- (5-(бифен-4-ил)пентаноил)-L- β -гидроксивалин-N'- (фенил)карбоксамида в виде
смолообразного полутвердого продукта, содержащего в соответствии с ЯМР-анализом приблизительно 1 моль- эквивалент изооктана (растворитель, из которого концентрировали окончательный образец):1H-ЯМР (300 МГц, CDCl3) δ 8,77 (s, 1H), 7,24-7,56 (m, 11H), 7,03-7,14 (m, 3H), 6,89 (d, 1H, J=8,5 Гц), 4,46 (d, 1H, J= 8,5 Гц), 4,17 (s, 1H), 2,52-2,70 (m, 4H), 2,36 (br d, 1H,
J=12,5 Гц), 1,50-1,70 (m, 4H), 1,43 (s, 3H), 1,40 (s, 9H), 1,25 (s, 3H).
Пример 47
Соединения формулы (P-1)
К раствору, содержащему 510 мг (1,97 ммоля)
N-(4-пентеноил)-4S-фенилметил-2- оксазолидинона в 8 мл дихлорметана, при 0oC добавляли 2,2 мл (2,2 ммоля) 1М тетрахлорида титана в дихлорметане. Через 15 минут к густой эмульсии добавляли
0,
42 мл (2,4 ммоля) диизопропилэтиламина, получая раствор темно-красного цвета. После выдержки в течение 1 ч при 0oC через канюлю добавляли 216 мг (2,4 ммоля) s-триоксана в 2 мл
дихлорметана,
а затем дополнительно добавляли 2,2 мл 1М тетрахлорида титана в дихлорметане. После выдержки в течение 4 ч при 0oC раствор распределяли между водным хлоридом аммония и
дихлорметаном.
Органический слой промывали 1н. водной HCl, соляным раствором, содержащим фосфатный буфер с pH 7, сушили над сульфатом натрия и концентрировали. Остаток очищали с помощью хроматографии
на 20 г
двуокиси кремния, элюируя 30-40%-ным этилацетатом в гексане. После перекристаллизации очищенного продукта из трет-бутилметилового эфира/изооктана получали 404 мг (71%)
N-(2R-гидроксиметил-4-пентеноил)-4S-фенилметил-2-оксазолидинона: tпл 71-72oC;1H-ЯМР (300 МГц, CDCl3) δ 7,22-7,37 (m, 5H), 5,78 (dddd, J=10, 7, 4 и
3
Гц), 5,03- 5,15 (m, 2H), 4,69 (dddd, 1H, J=10, 6, 4 и 3 Гц), 4,17-4,24 (m, 2H), 4,02-4,10 (m, 1H), 3,85-3,91 (m, 2H), 3,29 (dd, 1H, J=4 и 3 Гц), 2,82 (dd, 1H, J=14 и 10 Гц), 2,44 (dt, 1H, J=14 и 7
Гц),
2,31 (dd, 1H, J=14 и 7 Гц), 2,17 (br s, 1H).
Пример 48
Соединения формулы (Р-2)
К суспензии, содержащей 4,0 г (25,1 ммоля) гидрохлорида O-бензилгидроксиламина
в 50
мл ТГФ, при 0oC в атмосфере аргона добавляли 11,4 мл (22,8 ммоля) 2М триметилалюминия в толуоле. По завершении добавления раствору давали нагреться до комнатной температуры. Через 15
минут
этот раствор при 0oC в атмосфере аргона добавляли через канюлю к раствору, содержащему 2,40 г (8,30 ммоля) N-(2R-гидроксиметил-4- пентеноил)-4S-фенилметил-2-оксазолидинона в 100 мл
ТГФ.
Реакционную смесь перемешивали в течение 6 ч при 0oC и затем распределяли между 1н. HCl/соляным раствором и этилацетатом/диэтиловым эфиром. Органический слой с 1М фосфатным буфером с
pH 7 и
с соляным раствором сушили над сульфатом натрия и концентрировали. Остаток очищали с помощью хроматографии на двуокиси кремния, элюируя 35-45%-ным этилацетатом в гексане, получая после
элюирования
4S-фенилметил-2-оксазолидинона 2,01 г продукта. После перекристаллизации из этилацетата: изооктана получали 1,90 г (97%) N-бензилокси-2R-гидроксиметил-4-пентенамида в виде белого порошка:
tпл 58-59oC;1H-ЯМР (300 МГц, CDCl3) δ 8,40 (s, 1H), 7,38 (m, 5H), 5,71 (m, 1H), 5,03-5,06 (m, 1H), 4,91 (dd, 1H, J=16 и 12 Гц), 3,73 (m, 1H), 2,20
(m,
2H). Элементарный анализ: рассчитано для C13H17NO3: С 66,36; H 7,28; N 5,95; обнаружено: С 66,15; H 7,32; N 5,99.
Пример 49
Соединения
формулы (P-3)
К раствору, содержащему 1,92 г (8,17 ммоля) N-бензилокси-2R-гидроксиметил-4-пентенамида в 10 мл безводного пиридина, при 0oC добавляли 1,24 мл (16,3 ммоля)
мезилхлорида. Через 3 ч реакционную смесь сливали на лед и смесь распределяли между этилацетатом и 1н. водным бисульфатом натрия. Органический слой промывали дополнительной порцией бисульфата натрия
и
объединенные водные слои экстрагировали этилацетатом. Объединенные органические слои сушили над сульфатом натрия и концентрировали. Оставшееся масло растворяли в 30 мл ацетона и добавляли 3,38 г
порошкообразного карбоната калия. Смесь кипятили с обратным холодильником в течение 3 ч и затем охлаждали до комнатной температуры. Осадок удаляли с помощью фильтрации через целит и осадок на фильтре
тщательно промывали этилацетатом. Фильтрат концентрировали и остаток очищали с помощью хроматографии на двуокиси кремния, элюируя 25%-ным этилацетатом в гексане и получая 1,64 г (93%)
N-бензилокси-3R-(2-пропен-1-ил)-2-азетидинона в виде бледно-оранжевого масла:1H-ЯМР (300 МГц, CDCl3) δ 7,37-7,42 (m, 5H), 5,65-5,75 (m, 1H), 5,00-5,06 (m, 1H), 4,93 (s,
2H), 3,32 (ddd, 1H, J= 5, 4 и 2 Гц), 2,95 (m, 2H), 2,40-2,47 (m, 1H), 2,20-2,28 (m, 1H). Элементарный анализ: рассчитано для C13H15NO2: С 71,86; H 6,96; N 6,45;
обнаружено: С 71,59; H 6,88; N 6,37.
Пример 50
Соединения формулы (Р-4), в которых R2 обозначает бифенил
Раствор, содержащий 434 мг (2,00 ммоля)
N-бензилокси-3R-(2-пропен-1-ил)-2-азетидинона, 583 мг (2,5 ммоля) 4-бромбифенила, 0,34 мл (2,5 ммоля)) триэтиламина, 35 мг (0,11 ммоля) три-(орто- толил)фосфина и 14 мг (0,06 ммоля) диацетата
палладия
в 7 мл ДМФ, выдерживали при 100oC в течение 18 ч. Реакционный раствор охлаждали до комнатной температуры и распределяли между этилацетатом и водой. Органический слой промывали
водой, сушили
над сульфатом натрия и концентрировали. Остаток хроматографировали на двуокиси кремния, элюируя 25%-ным этилацетатом в гексане и получая продукт с небольшим количеством примесей,
который
перекристаллизовывали из этилацетата/изооктана с получением 315 мг (43%) N-бензилокси-3R-(3-(бифен-4-ил)-2- пропен-1-ил)-2-азетидинона в виде небольших белых хлопьев: tпл
109-110o
C;1H-ЯМР (300 МГц, CDCl3) δ 7,31-7,61 (m, 14H), 6,43 (d, 1H, J=15 Гц), 6,18 (ddd, 1H, J=15, 9 и 7 Гц), 4,94 (s, 2H), 3,36 (dd, 1H, J=10 и 5 Гц), 3,
00- 3,04 (m, 2H), 2,
60-2,75 (m, 1H), 2,20-2,50 (m, 1H). Элементарный анализ: рассчитано для C25H23NO2: С 81,27; H 6,28; N 3,79; обнаружено: С 81,09; H 6,31; N 3,
71.
Пример 51
Соединения формулы (P-5), в которых R2 обозначает бифенил
К перемешиваемому раствору, содержащему 62,0 мг (0,168 ммоля)
N- бензилокси-3R-(3-(бифен-4-ил)-2-пропен-1-ил)-2-азетидинона в 5 мл ТГФ:этанола (4: 1), добавляли 2 мл 1н. водного гидроксида лития. Смесь интенсивно перемешивали в течение 1 ч при комнатной
температуре и разбавляли 10 мл 0,5М цитратного буфера с pH 4. Смесь распределяли между 20 мл трет-бутилметилового эфира и соляным раствором и органический слой после разбавления приблизительно 5 мл
гексана сушили над сульфатом натрия и концентрировали до стекловидного остатка. Этот остаток немедленно растворяли в 5 мл дихлорметана, охлажденного до 0oС, и добавляли 0,10 мл пиридина, а
затем добавляли 1,2 мл раствора муравьиного ангидрида в дихлорметане, который получали в результате взаимодействия при 0oC в течение 15 минут 297 мг (1,00 ммоль) метиодида EDC и 80 мкл (2,
00 ммоля) муравьиной кислоты в 5 мл дихлорметана. Через 30 минут реакционную смесь распределяли между дихлорметаном и 0,5М цитратным буфером с pH 3. Органический слой сушили над сульфатом натрия и
концентрировали. После хроматографии остатка на 5 г двуокиси кремния, элюируя в градиенте от 5 до 10% этанола в дихлорметане, получали 58 мг (83%)
N-((N''-формил-N''- бензилоксиамино)метил-5-(бифен-4-ил)-4-пентеновой кислоты в виде стекловидного вещества.1H-ЯМР-спектр при комнатной температуре в CDCl3 показал наличие
широких пиков амидных ротамеров.
Пример 52
Соединения формулы (Р-6), в которых R2 обозначает бифенил, R3 обозначает трет-бутил, R7
обозначает
4-пиридил и p равно 0
К раствору, содержащему 99,6 мг (0,24 ммоля) N-((N''-формил-N''- бензилоксиамино)метил-5-(бифен-4-ил)-4-пентеновой кислоты, 125 мг (0,288 ммоля)
L-трет-лейцин-N'-(пиридин-4-ил)карбоксамид- бис(трифторацетата) и 0,125 мл (0,90 ммоля) триэтиламина в 4 мл ДМФ, добавляли 133 мг (0,30 ммоля)
бензтриазол-1-ил- трис(диметиламино)фосфонийгексафторфосфата. После выдержки в течение 16 ч при комнатной температуре реакционную смесь распределяли между этилацетатом и приблизительно 0,5М водным
бикарбонатом натрия. Органический слой промывали 1М фосфатным буфером с pH 7 и соляным раствором, сушили над сульфатом натрия и концентрировали. После очистки остатка с помощью хроматографии при
элюировании 40-75%-ным этилацетатом в гексане и последующей перекристаллизации из этилацетата/изооктана получали 97,4 мг (67%)
N-((N''-формил-N''- бензилоксиамино)метил-5-(бифен-4-ил)-4-пентеноил)-L-трет- лейцин-N'-(пиридин-4-ил)карбоксамида: tпл 215-216oC.
Пример 53
53А.
Соединения формулы (Ih), в которых R2 обозначает бифенил, R3 обозначает трет-бутил, R7 обозначает 4-пиридил и p равно 0
Раствор, содержащий 87,1 мг (0,143
ммоля) N-((N''-формил-N''- бензилоксиамино)метил-5-(бифен-4-ил)пентаноил)-L-трет-лейцин-N'- (пиридин-4-ил)карбоксамида в 5 мл этилацетата/этанола (3:2), гидрировали в присутствии 25 мг 10%-ного
палладия на угле при давлении водорода 1 атм в течение 6 ч. Катализатор удаляли путем фильтрации через целит и фильтрат концентрировали. После перекристаллизации остатка из этилацетата получали 59,0
мг (80%) N-((N''-формил-N''-гидроксиамино)метил-5-(бифен-4-ил)пентаноил)-L- трет-лейцин-N'-(пиридин-4-ил)карбоксамида в виде белого порошка: tпл 190-191oC;1H-ЯМР
(300
МГц, ДМСО-d6) δ 10,52 (br s, 1H), (9,97 (br s, 1H), 9,53 (br s, 1H), 8,38 (d, 2H, J=7 Гц), 7,20 (br s, 1H), 7,14 (br d, 1H, J=8 Гц), 7,23-7,60 (m, 9H), 7,12 (d, 2H, J=7 Гц), 4,
41 (d,
1H, J=9 Гц), 3,40-3,62 (m, 2H), 2,90-3,10 (m, 1H), 2,4-2,6 (m, 2H, частично закрытый резонансом от ДМСО-d5), 1,28-1,52 (m, 4H), 0,94 (s, 9H). Элементарный анализ: рассчитано для
C30H36N4O4·0,5H2O: С 68,55; H 7,10; N 10,66; обнаружено: С 68,48; H 7,04; N 10,63.
53Б. Соединения формулы (Ih) с
различными
значениями R2, R3 и R7
Аналогично способам, описанным в примерах 50-52, получали следующие соединения формулы (Р-6):
N-(2R-(N''-формил-N''-бензилоксиамино)метил-5-(4-(2RS-гидрокси-3,3,3- трифторпропил)фенил)-4-пентеноил)-L-трет-лейцин-N'-(пиридин-4-ил) карбоксамид;
N-(2R-(N''-формил-N''-бензилоксиамино)метил-5-(4- (имидазол-4-ил)фенил)-4-пентеноил)-L-треонин-N'-((4S- метилсульфинил)фенил)карбоксамид;
N-(2R-(N''-формил-N''-бензилоксиамино)метил-5-(4-(2RS- гидрокси-3,3,3-трифторпропил)фенил)-4-пентеноил)-L-трет-лейцин- N'-(пирид-4-ил) карбоксамид;
N-(2R-(N''-формил-N''-бензилоксиамино)метил-5-(4- (имидазол-4-ил)фенил)-4-пентеноил)- L-треонин-N'-((4S-метилсульфинил)фенил)карбоксамид;
N-(2R-(N''-формил-N''-бензилоксиамино)метил-5-(4-(пиридин-4-ил) фенил)-4-пентеноил)-L-трет-лейцин-N'-(4-((2-гидроксиэтил)аминосульфонил) фенил)карбоксамид;
N-(2R-(N''-формил-N''-бензилоксиамино)метил-5- (4-(пиридин-4-ил)фенил)-4-пентеноил)-L- (β-гидрокси)валин-N'- (4S-метилсульфинил)фенил)карбоксамид;
N-(2R,
S-(N''-формил-N''-бензилоксиамино)метил-(4-(метил)-4-пентеноил) -L-лейцин-N'-(4-(метоксикарбонил)фенил)карбоксамид и
N-(2R-(N''-формил-N''-бензилоксиамино)метил-5- (бифен-4-ил)пентаноил)-L-циклогексилглицин-N'-(4-((2- (диметиламино)этил)аминосульфонил)фенил)карбоксамид, при замене которыми
N-((N''-формил-N''-бензилоксиамино)метил-5- (бифен-4-ил)пентаноил)-L-тpeт-лeйцин-N'-(пиридин-4-ил)карбоксамида в способе из примера 53А получали следующие соответствующие соединения:
N-(2R-(N''-формил-N''-гидроксиамино)метил-5-(4- (4-(2RS-гидрокси-3,3,3-трифторпропил)фенил) пентаноил)-L-трет-лейцин-N'-(пиридин-4-ил)карбоксамид;
N-(2R-(N''-формил-N''-гидроксиамино)метил-5-(4-(имидазол-4-ил) фенил)пентаноил)-L-треонин-N'-((4S-метилсульфинил) фенил) карбоксамид;
N-(2R-(N''-формил-N''-гидроксиамино)метил-5- (4- (пирид-4-ил) фенил) пентаноил)-L-трет-лейцин-N'-(4-((2 - гидроксиэтил)аминосульфонил) фенил) карбоксамид;
N-(2R-(N''-формил-N''-гидроксиамино)метил-5-(4-(пирид-4- ил)фенил)пентаноил)-L-(β-гидрокси)валин-N'-(4S-метилсульфинил) фенил)карбоксамид;
N-(2R,
S-(N''-формил-N''-гидроксиамино)метил-(4-(метил) пентаноил)-L-лейцин-N'-(4-(метoкcикapбoнил)фенил)кapбoкcaмид; МС (М-Н)-: 434,2; (M-СO, H2О): 388 и
N-(2R-(N''-формил-N''-гидроксиамино)метил-5-(бифен-4- ил)пентаноил)-L-циклогексилглицин-N'-(4-((2- (диметиламино)этил)аминосульфонил)фенил)карбоксамид.
Примеры 54-59
В этих
примерах проиллюстрировано получение репрезентативных фармацевтических композиций, содержащих в качестве действующего вещества соединения формулы (I), например,
N-(2R-карбоксиметил-5-(бифен-4-ил)пентаноил)-L- β -гидроксивалин-N'-(фенил)карбоксамид или его фармацевтически приемлемую соль. При изготовлении композиций в этих примерах в качестве
действующего вещества могут применяться другие соединения формулы (I).
Пример 54
В этом примере проиллюстрировано получение репрезентативных фармацевтических композиций для
орального применения.
Вариант А
Ингредиенты, мас.%:
Соединение формулы (I) - 20,0
Лактоза - 79,5
Стеарат магния - 0,5
Вышеуказанные
ингредиенты смешивают и заполняют ими желатиновые капсулы с твердой оболочкой, каждая из которых содержит по 100 мг композиции, причем одна капсула должна включать приблизительно полную суточную
дозу.
Вариант Б
Ингредиенты, мас.%:
Соединение формулы (I) - 20,0
Стеарат магния - 0,9
Крахмал - 8,6
Лактоза - 69,6
ПВП(поливинилпирролидин) - 0,9
Вышеуказанные ингредиенты, за исключением стеарата магния, объединяют и гранулируют, используя воду в качестве жидкости для гранулирования. Затем состав сушат,
смешивают со стеаратом магния и с помощью соответствующей таблетирующей машины формуют таблетки.
Вариант В
Ингредиенты
Соединение формулы (I) - 0,1 г
Пропиленгликоль - 20,0 г
Полиэтиленгликоль 400 - 20,0 г
Полисорбат 80 - 1,0 г
Вода - q.s. до 100 мл
Соединение формулы (I) растворяют в пропиленгликоле,
полиэтиленгликоле 400 и полисорбате 80. Затем при перемешивании добавляют воду в количестве, достаточном для получения 100 мл раствора, который фильтруют и разливают во флаконы.
Вариант Г
Ингредиенты, мас.%:
Соединение формулы (I) - 20,0
Масло арахисовое - 78,0
Спан 60 - 2,0
Вышеуказанные ингредиенты расплавляют, перемешивают и
заполняют ими мягкие эластичные капсулы.
Пример 55
В этом примере проиллюстрировано получение репрезентативной фармацевтической композиции для парентерального введения.
Ингредиенты
Соединение формулы (I) - 0,02 г
Пропиленгликоль - 20,0 г
Полиэтиленгликоль 400 - 20,0 г
Полисорбат 80 - 1,0 г
0,9%-ный
физиологический раствор - q.s. до 100 мл
Соединение формулы (I) растворяют в пропиленгликоле, полиэтиленгликоле 400 и полисорбате 80. Затем при перемешивании добавляют 0,9%-ный
физиологический раствор в количестве, достаточном для получения 100 мл внутривенного раствора, который фильтруют через мембранный фильтр с размером пор 0,2 мкм и фасуют в стерильных условиях.
Пример 56
В этом примере проиллюстрировано получение репрезентативной фармацевтической композиции в форме суппозитория.
Ингредиенты, мас.%:
Соединение
формулы (I) - 1,0
Полиэтиленгликоль 1000 - 74,5
Полиэтиленгликоль 4000 - 24,5
Ингредиенты расплавляют вместе и смешивают в паровой бане, а затем разливают в формы,
содержащие 2,5 г общего веса.
Пример 57
В этом примере проиллюстрировано получение репрезентативной фармацевтической композиции для инсуффляции.
Ингредиенты,
мас.%:
Тонкоизмельченное соединение формулы (I) - 1,0
Тонкоизмельченная лактоза - 99,0
Ингредиенты размалывают, смешивают и упаковывают в инсуффлятор, снабженный
дозирующим
насосом.
Пример 58
В этом примере проиллюстрировано получение репрезентативной фармацевтической композиции в распыляемой форме.
Ингредиенты,
мас.%:
Соединение формулы (I) - 0,005
Вода - 89,995
Этанол - 10,000
Соединение формулы (I) растворяют в этаноле и смешивают с водой. Затем композицию упаковывают в
распылитель,
снабженный дозирующим насосом.
Пример 59
В этом примере проиллюстрировано получение репрезентативной фармацевтической композиции в аэрозольной форме.
Ингредиенты, мас.%:
Соединение формулы (I) - 0,10
Пропеллент 11/12 - 98,90
Олеиновая кислота - 1,00
Соединение формулы (I) диспергируют в олеиновой
кислоте и
пропеллентах. Затем образовавшуюся смесь заливают в аэрозольную упаковку, снабженную мерным клапаном.
Пример 60
Изучение in vitro активности в отношении
матрилизина
Матрилизин из клонированной культуры клеток млекопитающих очищали с помощью голубой сефарозной и цинк-хелатирующей сефарозной колонки с последующей быстрой жидкостной
хроматографией протеинов на
колонке типа MONO S. Фермент активировали путем инкубации с 1 ммолем АРМА в течение 1 ч при 35-37oC.
Соединения формулы (I) растворяли в ДМСО и добавляли в кювету, содержащую 0,4 мкг матрилизина в 1 мл ТС-буфера (20 мМ Трис, 5мМ CaCl2, pH 7,5) (конечная концентрация ДМСО 2%). Концентрации соединений формулы (I) выбирали таким образом, чтобы для каждых 20% изменения активности иметь по крайней мере одну экспериментальную точку. Ферменту и соединению давали возможность пройти предварительную 3-минутную инкубацию при 37oC. Для инициирования реакции к каждым 20 мкМ добавляли N-(7-диметиламино-4-метил-3-кумаринил)малеимил ("DACM") (фирма Sigma) и тиопептид (Ac-Pro-Leu-Gly-S-"Leu"-Leu-Gly-OEt, фирма Bachem Bioscience Inc.). Увеличение флуоресценции регистрировали при длинах волн возбуждения и эмиссии 395 и 485 нм соответственно. Каждую экспериментальную точку получали усреднением по повторяемым дважды экспериментам. Для определения значения IC50 с помощью программы Enzfitter использовали по крайней мере шесть экспериментальных точек, показывающих зависимость изменения флуоресценции в минуту от концентрации соединения.
Этот анализ подтверждает, что соединения формулы (I) обладают способностью ингибировать матрилизин.
Пример 61
Анализ in
vitro
Этот
анализ позволяет определить, обладают ли соединения формулы (I) способностью ингибировать выход меченных по35S гликозаминогликанов (GAG) из хрящевых эксплантатов.
Небольшие хрящевые эксплантаты (3 мм в диаметре) получали из коленных суставов свежеумерщвленных быков и метили с помощью35SO4. Меченные по35S гликозаминогликаны (GAG) выходят в питательную среду в ответ на добавление rhIL-1-альфа, индуцирующего экспрессию хондроцитных матричных металлопротеаз (ММП), включая стромелизин и коллагеназу. Процент ингибирования меченных GAG был скорректирован с учетом спонтанного выхода в отсутствие rhIL-1-альфа. Результаты для каждой группы представляют собой средние значения ± среднеквадратичная ошибка по пяти эксплантатам.
Соединения формулы (I) при тестировании этим методом проявили способность ингибировать выход меченных по35S GAG из хрящевых эксплантатов.
Пример 62
Анализ in vitro
Для изучения in vitro влияния соединений формулы (I) на резорбцию кости в качестве модели использовали длинную
кость крысиного эмбриона. Для индуцирования
резорбции кости in vitro использовали бычий паращитовидный гормон (ПЩГ). Влияние на резорбцию кости определяли по количеству45Ca, вышедшего в
питательную среду из предварительно меченных
по45Ca длинных костей крысиных эмбрионов. Ингибирующее действие соединений формулы (I) по отношению к индуцированной бычьим ПЩГ резорбции
кости выражали в виде среднего процента
ингибирования ± среднеквадратичная ошибка.
Предварительно меченные по45Ca длинные кости крысиных эмбрионов (из предплечья) рассекали и культивировали в чашках Linbro при 37oC в течение ночи в среде BGJb с добавлением 1 мг/мл БСА. В каждой группе использовали по 5 пар костей. Соединения формулы (I) предварительно растворяли в этаноле, затем разбавляли до различных концентраций и добавляли в первый день одновременно с бычьим ПЩГ (1-34) в концентрации 1·10-8 М. Концентрации этанола в растворах соединений были ниже 0,05%, что не оказывает влияния на анализ. Опыт заканчивали на шестой день с одной заменой среды на третий день.
В конце каждой замены среды подсчитывали количество45Ca, присутствующее в среде для культивирования. Оставшиеся кости разлагали с помощью 0,1н. HCl и также подсчитывали количество3Ca, присутствующее в продукте разложения кости. Результаты выражали в виде процентов по отношению к общему количеству45Ca, вышедшему из каждой пары костей. Бычий ПЩГ в концентрации 1·10-8 М индуцирует резорбцию кости до максимального уровня, который принят за 100%, и эту концентрацию использовали в качестве стандартной. За 0% принимали уровень базисной линии резорбции кости в присутствии только среды. Все обработанные соединением группы сравнивали с таковыми, обработанными бычьим ПЩГ (1-34) в концентрации 1·10-8 М. Концентрации, при которых соединение ингибировало резорбцию кости на 50%, обозначали как IC50.
Соединения формулы (Ia) при тестировании этим методом проявили способность ингибировать резорбцию кости, индуцированную бычьим ПЩГ.
Пример 63
Изучение in vitro активности в отношении стромелизина
63А. Ферментативную активность стромелизина измеряли с помощью
флуорогенного анализа переноса энергии в
условиях резонанса с использованием пептидного субстрата МСА: 7- метоксикумарин-4-илацетил-pro-leu-gly-leu-3-(2,4- динитрофенил) -L-2,
3-диаминопропионил-ala-arg-NH2. Расщепление субстрата
по связи gly-leu приводит к потере переноса энергии в условиях резонанса к 2,4-динитрофенильной группе и к увеличению флуоресценции
МСА (7-метоксикумарин-4-илацетильной) группы.
Анализ проводили при 37oC в буфере, содержащем 50 мМ Трицин, pH 7,5, 10 мМ CаCl2, 200 мМ NaCl, 1% ДМСО и 1,4 нМ стромелизина. Концентрация субстрата МСА составляла 10 или 20 мкМ в конечном объеме 1,6 мл. В отсутствие соединений, тестируемых на ингибирующую активность, или в присутствии быстро связывающихся ингибиторов флуоресценцию измеряли с помощью спектрофлуориметров LS-5B и LS-50B фирмы Perkin-Elmer при длинах волн λвозбуждения= 328 нм и λэмиссии= 393 нм в течение 3 -5 минут и данные аппроксимировали прямой линией. Для медленно связывающихся ингибиторов данные об ингибировании регистрировали в течение периода времени от 45 минут до 1 часа. Стационарные скорости изменения флуоресценции оценивали на основе аппроксимации кривой уравнением для простого экспоненциального распада, содержащего линейную фазу, а также принимая полученное на основе аппроксимации значение линейной фазы за стационарную скорость.
Были исследованы соединения формулы (I) и установлено, что они проявляют активность в этом опыте в качестве ингибиторов активности ММП.
63 Б. МСА-анализ также может применяться при использовании других матричных металлопротеаз, таких как матрилизин или желатиназа А, путем замены стромелизина на 0,063 нМ матрилизин или на 0,030 нМ желатиназу A (табл.1).
Хотя настоящее изобретение описано на примере конкретных вариантов его осуществления, специалистам в данной области техники должно быть очевидно, что могут быть сделаны различные изменения и эквивалентные замены, не выходя за объем изобретения.
Специальных работ по определению токсичности в отношении выбранных соединений согласно изобретению не проводилось. Однако, при проведении основного скринирования некоторых веществ серьезного токсикологического эффекта не наблюдали.
Он не был обнаружен в вышеописанных анализах.
Реферат
Описываются новые соединения общей формулы I, где R1 обозначает меркапто, ацетилтио, карбокси, гидроксикарбамоил, N-гидроксиформиламино, алкоксикарбонил, арилоксикарбонил, аралкоксикарбонил, бензилоксикарбамоил или группу формулы II, где R6 обозначает арил или гетероарил, R2 обозначает алкил, циклоалкил, арил, гетероциклоалкил или гетероарил, R3 обозначает алкил, циклоалкил, аралкил или гетероалкил, R7 обозначает арил, гетероарил или гетероциклоалкил, X обозначает группу формулы -(CH2)m-Y-(CH2)n-, где Y обозначает O, S или простую связь, m обозначает целое число от 0 до 4, n обозначает целое число от 0 до 4 и m + n обозначает целое число от 0 до 4, p обозначает целое число от 0 до 4, при условии, что R2-X обозначает бифенилалкил, когда p не равно 0, и R2-X не является алкилом, аралкил или циклоалкилалкилом, если p равно 0 и R7 является фенилом, или его фармацевтически приемлемая соль. Карбоксамиды формулы I являются ингибиторами активного матричных металлопротеаз и могут использоваться для лечения болезненных состояний у млекопитающих. Описывается также способ получения соединений формулы I и фармацевтическая композиция. 3 с. и 23 з.п. ф-лы, 1табл.


Формула

где R1 обозначает меркапто, ацетилтио, карбокси, гидроксикарбамоил, N-гидроксиформиламино, алкоксикарбонил с 1 - 10 атомами углерода, арилоксикарбонил, аралкоксикарбонил, бензилоксикарбамоил или группу формулы
где R6 обозначает арил или гетероарил;
R2 обозначает алкил с 1 - 10 атомами углерода, циклоалкил с 5 - 7 атомами углерода, арил, гетероциклоалкил или гетероарил;
R3 обозначает алкил с 1 - 10 атомами углерода, циклоалкил с 5 - 7 атомами углерода, аралкил или гетероаралкил;
R7 обозначает арил, гетероарил или гетероциклоалкил;
Х обозначает группу формулы -(СН2)m-Y-(СН2)n-, где
Y обозначает O, S или простую связь,
m обозначает целое число от 0 до 4,
n обозначает целое число от 0 до 4 и m + n обозначает целое число от 0 до 4;
р обозначает целое число от 0 до 4, при условии, что R2-Х обозначает бифенилалкил, когда р не равно 0, и R2-Х не является алкилом, аралкил или циклоалкилалкилом, если р равно 0 и R7 является фенилом;
или их фармацевтически приемлемые соли.

где А обозначает СН2, О, NН, S, СН2-СН2 или NН-СН2;
R10 обозначает Н, алкил, алкокси, алкиламино или ациламино;
R11 обозначает Н или галоген;
R7 обозначает 4-пиридил или необязательно замещенный фенил;
р равно 0.

где А обозначает СН2;
R10 обозначает Н или ациламино;
R11 обозначает Н;
R7 обозначает необязательно замещенный фенил;
Х обозначает пропан-1,3-диил.

где R1 обозначает меркапто, ацетилтио, карбокси, гидроксикарбамоил, N-гидроксиформиламино, алкоксикарбонил с 1 - 10 атомами углерода, арилоксикарбонил, аралкоксикарбонил, бензилоксикарбамоил или тиометилфосфиноильную группу формулы

где R6 обозначает арил или гетероарил;
R2 обозначает алкил с 1 - 10 атомами углерода, циклоалкил с 5 - 7 атомами углерода, арил, гетероциклоалкил или гетероарил;
R3 обозначает алкил с 1 - 10 атомами углерода, циклоалкил с 5 - 7 атомами углерода, аралкил или гетероаралкил;
R7 обозначает арил, гетероарил или гетероциклоалкил;
Х обозначает группу формулы -(СН2)m-Y-(СН2)n-, где
Y обозначает O, S или простую связь, m обозначает целое число от 0 до 4, n обозначает целое число от 0 до 4 и m + n обозначает целое число от 0 до 4;
р обозначает целое число от 0 до 4, при условии, что R2-Х обозначает бифенилалкил, когда р не равно 0, и R2-Х не является алкилом, аралкил или циклоалкилалкилом, если р равно 0 и R7 является фенилом;
или их фармацевтически приемлемой соли, отличающийся тем, что соединение формулы D

подвергают взаимодействию с соединением формулы F

где R1 обозначает алкоксикарбонил с 1 - 10 атомами углерода, аралкоксикарбонил, арил- или гетероарилтиометилфосфиноил или ацетилтио,
в присутствии основания и реагента амидного сочетания с получением соответствующего соединения формулы I и с последующей, в случае необходимости, обработкой полученного соединения формулы I, где R1 обозначает алкоксикарбонил с 1 - 10 атомами углерода или аралкоксикарбонил, в слабокислой среде с получением соответствующего соединения формулы I, где R1 обозначает карбоксигруппу, которое, в случае необходимости, либо подвергают взаимодействию с О-бензилгидроксиамином с получением соединения формулы I, где R1 обозначает бензилоксикарбамоил, с последующим, в случае необходимости, каталитическим гидрированием с получением соответствующего соединения формулы I, где R1 обозначает гидроксикарбамоил, либо подвергают взаимодействию с гидроксиламином с получением соответствующего соединения формулы I, где R1 обозначает гидроксикарбамоил, или с последующей в случае необходимости обработкой соединения формулы I, где R1 обозначает ацетилтиогруппу, гидроксилом аммония в протонном растворителе с получением соответствующего соединения формулы I, где R1 обозначает меркаптогруппу.

Комментарии