N-фенилалкилазамещенные производные α -аминокарбоксамида, способ их получения, фармакологически активная композиция на их основе и способ предупреждения развития болезни - RU2097371C1
Код документа: RU2097371C1
Чертежи

Описание
Изобретение относится к N-фенилалкилзамещенным производным аминокарбоксамида, к использованию указанных соединений в качестве терапевтических средств, к способу их получения и к фармацевтической композиции, содержащей указанные соединения.
Другие производные N-замещенных α-аминокарбоксамида известны специалистам как соединения, обладающие фармакологическими свойствами [1] Соединения, описанные в указанном патенте, используются для лечения и профилактики таких заболеваний, как ишемическая болезнь сердца и атеросклероз; кроме того, они используются также при лечении воспалительных заболеваний, таких как ревматоидный артрит.
Кроме того, производные замещенных аминокислот известны как ингибиторы энкофалиназы,
анальгетики и гипотензивные средства [2]
Помимо
этого, в [3] раскрываются производные замещенного глицина и аланина. Эти соединения, согласно указанному документу, используются в качестве
аналгетиков для перорального введения.
При работе над настоящим изобретением было установлено, что N-фенилалкил замещенные производные альфа-аминокарбоксамида общей формулы (1), определенные ниже, и их фармацевтически приемлемые соли являются активными антиэпилептическими средствами, средствами против паркинсонизма, нейрозащитными средствами, антидепрессантами, спазмолитическими средствами и/или снотворными средствами.
Соответственно, настоящее изобретение относится, во-первых, к способу предупреждения развития судорожных состояний и
повышения нейрозащитных свойств организма путем введения лекарственного препарата,
содержащего соединение формулы (1)

где R представляет собой пиридил, тиенил или фурил, или фенил, незамещенный или замещенный атомом галогена, C1-C4-алкил, C1 -C4 алкокси или CF3;
A представляет собой -(CH2) или -(CH2)p-X- группу, где p 0 или целое от 1 до 4, а X представляет собой -O-, -S- или -NH;
R1 и R2 каждый независимо представляет собой водород или C1-C4-алкил;
n 0 или 1;
R3 представляет собой водород или C1-C4-алкил, незамещенный или замещенный фенилом или гидрокси-группой;
R4 представляет собой водород; или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют C3-C6-циклоалкил;
каждый R5 и R6 независимо представляют собой водород или C1 -C4-алкил;
или его фармацевтически приемлемой соли, взятое в эффективном количестве.
Указанные соединения и их соли в дальнейшем будут именоваться "активными соединениями" и "соединениями настоящего изобретения".
Настоящее изобретение включает в себя также указанное соединение формулы 1 и все возможные оптические изомеры соединений формулы (1) и их смеси, а также метаболиты соединений общей формулы (1). В объем настоящего изобретения также входят фармацевтически приемлемые биопредшественники и пролекарства соединений формулы (1), т.е. соединения, которые имеют формулу, отличную от формулы (1), но которые, тем не менее, могут непосредственно или опосредованно превращаться in vivo в соединение формулы (1) при введении их человеку.
Фармацевтически приемлемыми солями соединений (1) являются кислые аддитивные соли, образованные неорганическими кислотами, такими как азотная, соляная, бромистоводородная, серная, перхлорная и фосфорная кислоты, или органическими кислотами, такими как уксусная, пропионовая, гликолевая, молочная, щавелевая, малоновая, яблочная, винная, лимонная, бензойная, коричная, миндальная, метасульфоновая и салициловая кислоты.
Алкильная, алкиамино, алкилтио и алкокси-группы могут быть прямыми или разветвленными группами. Если R5 и R6 оба являются алкильными группами, то алкильная группа, представленная R5, и алкильная группа, представленная R6, могут быть одинаковыми или различными. Атомом галогена являются предпочтительно атом фтора, хлора или брома, а особенно предпочтительно, атомы фтора или хлора.
C1 -C8-алкильной группой является предпочтительно C1 -C6-алкильная группа.
C1-C6-алкильной группой является предпочтительно C1-C4-алкильная группа.
C1 -C4-алкильной группой является, например, метил, этил, пропил, изопропил, 5-бутил или трет-бутил, а предпочтительно метил или этил.
C1-C6-алкокси группой является, например, метокси, этокси, пропокси, изопропокси, бутокси или трет-бутокси, а предпочтительно, метокси или этокси.
C3-C8-циклоалкильной группой является предпочтительно циклопентил, циклогексил или циклогептил.
C3-C6-циклоалкильным кольцом является предпочтительно циклопропиловое или циклопентиловое кольцо.
Тиениловым кольцом является, например, 2- или 3-тиениловое кольцо.
Пиридиловым кольцом является, например, 2-, 3- или 4-пиридиловое кольцо, а предпочтительно, 3-пиридиловое кольцо.
Фуриловым кольцом является, например, 2- или 3-фуриловое кольцо.
Замещенным фенильным кольцом является предпочтительно кольцо, замещенное одним или двумя заместителями, выбранными независимо от атома галогена, C1-C4-алкила и трифторметила.
Если в -(CH2)m-, -(CH2)p- или -(CH2)q-группа m, p и/или q является больше 1, то такая группа может прямой или разветвленной алкиленовой группой, -(CH2)m- группой является, например, -CH(R14)-группа, в которой R14 является водородом или C1-C3 -алкилом, или -CH2-CH2- или -CH2-CH2 -CH2-группа.
C1-C4-алкильной группой, замещенной гидрокси, является предпочтительно, гидроксиметил или 1-гидроксиэтил.
C1 -C4-алкильной группой, замещенной фенильным кольцом, является предпочтительно бензильная или фенетильная группа.
m предпочтительно равно 1 или 2.
Каждое из p и q является целым числом от 1 до 4, а предпочтительно 1 или 2.
Предпочтительными соединениями
настоящего изобретения являются соединения формулы (1), где:
R является
фенильным кольцом, незамещенным или замещенным одним или двумя заместителями, независимо выбранными из атома галогена,
C1-C4-алкила и трифторметила;
A представляет
собой -(CH2)m- или -(CH2)p-X-(CH2)q-группу, где m равно 1
или 2, один из p и q равен нулю, 1 или 2, а X является -O-, -S- или
-NH-;
n является 0 или 1;
R1 и R2 независимо являются водородом или C1-C4-алкилом;
R3 является водородом или C1-C4-алкилом, необязательно замещенным гидрокси-группой;
R
является водородом;
R5 и R6 независимо являются водородом или C1-C4-алкилом;
и их фармацевтически приемлемые соли.
Более
предпочтительными соединениями настоящего изобретения являются соединения формулы (1), где:
R является фенильным кольцом,
незамещенным или замещенным галогеном;
A представляет собой
-(CH2)m- или -(CH2)p-X-(CH2)q- группу, где m 1 или 2; один из p и
q равен 0, а другой либо равен 0, либо 1, а X является -O-, -S- или
-NH-;
n 0;
R1 является водородом;
R2 является водородом или C1-C4-алкилом;
R3 является водородом или C1-C2-алкилом, необязательно замещенным гидрокси;

R5 и R6 независимо являются водородом или C1-C4-алкилом;
и их фармацевтически приемлемые соли.
Примерами особенно предпочтительных
соединений настоящего изобретения являются следующие соединения:
2-(4-бензилоксибензил)аминопропионамид;
2-[4-(2-хлоробензил)оксибензил]амино-3-гидрокси-N-метилпропионамид;
2-[4-(2-хлорбензил)оксибензил]аминопропионамид;
2-[4-(3-фторбензил)оксибензил]амино-3-гидрокси-N-метилпропионамид;
2-(4-бензиламинобензил)аминопропионамид;
[4-(3-фторобензил)оксибензил]аминопропионамид;
2-[4-(2-фторобензил)оксибензил]амино-3-гидрокси-N-метилпропионамид;
2-[N-(4-бензилбензил)-N-метил]аминопропионамид;
2-[4-(3-хлорбензил)-оксибензил]амино-3-гидрокси-N-метилпропионамид;
2-(4-бензилоксибензил)амино-3-гидрокси-N-метилпропионамид;
2[4-(3-хлорбензил)оксибензил]аминопропионамид;
2-[N-[4-(3-хлорбензил)оксибензил]-N-метил]аминоацетамид;
2-[4-(3-хлорбензил)оксибензил]амино-N-метилацетамид;
2(4-фенилоксибензил)амино-3-гидрокси-N-метилпропионамид;
2-(4-бензилбензил)аминопропионамид;
2-[4-2-фенилэтил)бензил]аминопропионамид;
2-(4-фенилоксиметилбензил)аминопропионамид;
2-(4-бензилтиобензил)аминопропионамид;
2-[4-(2-хлорбензил)оксибензил]амино-N-метилпропионамид;
2-(4-бензилоксибензил)амино-N-метилпропионамид;
2-[4-(3-хлоробензил)-оксибензил]аминоацетамид;
а также их (S) и
(R)-изомеры, как по отдельности, так и в смеси;
и их
фармацевтически приемлемые соли.
При рассмотрении работ, цитированных выше, было обнаружено, что некоторые соединения, охватываемые общей формулой (1), определенной выше, входят в объем общих формул некоторых из прототипов, однако, конкретно в этих работах не упоминаются; тогда как другие соединения общей формулы (1) не входят в объем цитированных документов.
Отдельным классом активных соединений формулы (1) являются соединения формулы (1а):

где R7 представляет собой C1-C8-алкил; C3-C8-циклоалкильное фурильное, тиенильное или пиридильное кольцо; или фенильное кольцо, незамещенное или замещенное 1-4 заместителями, независимо выбранными из атома галогена, C1-C6-алкила, C1-C6 алкокси и трифторометила;
Z представляет собой -(CH2 )r- или (CH2)s-Y-(CH2)t-группу, где r является целым числом от 1 до 4, один из S и t равен нулю, а другой либо равен нулю, либо целому числу от 1 до 4, а Y является -O-, -S- или -NR13-, где R13 является водородом или C1-C4 -алкилом;
V 0 или 1;
R8 и R9 независимо являются водородом или C1-C4-алкилом;
R10 является водородом; C1 -C4-алкилом, незамещенным или замещенным гидрокси или фенильным кольцом, необязательно замещенным 1-4 заместителями, независимо выбранными из атома галогена, C1-C6 -алкила, C1-C6- алкокси или трифторметила;
R

R11 и R12 независимо являются водородом или C1-C6-алкилом и их фармацевтически приемлемые соли; и при этом:
а) если R7 является C1-C8-алкилом, то Z представляет собой -(CH2)s-Y-(CH2)t- группу, в которой S и t оба равны нулю, а Y определен выше;
b) если R7 является C1 -C8-алкилом и в то же время является -(CH2)s-Y-(CH2)t-группой, в которой s и t оба равны нулю, а Y является -O-; R10 является водородом или C1-C4-алкилом,
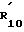
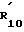
c) если Z является -(CH2)s-Y-(CH2)t-группой, в которой s, t и Y определены выше, и в то же время R7 является фурильным, тиенильным или пиридильным кольцом или фенильным кольцом, незамещенным или замещенным 1 или 2 заместителями, выбранными из атома галогена, C1-C6-алкила, C1-C6-алкокси и трифторметила; R10 является водородом или C1-C4-алкилом,

d) если R7 является фенилом, незамещенным или замещенным 1-4 заместителями, выбранными из атома галогена и C1-C4-алкила, и в то же время Z представляет собой -(CH)R14- или -(CH2)s-Y-(CH2)t- группу, в которой R14 является водородом или C1-C3-алкилом, Y является -O- или -S-, S и t оба равны нулю, R8 и R9 является водородом, 0, а R10, R'10 , R11 и R12 определены выше, то R10 не является водородом или незамещенным C1-C4-алкилом.
Соединения общей формулы (1а) и их фармацевтически приемлемые соли являются новыми соединениями, а поэтому также являются предметом настоящего изобретения. Еще одним предметом настоящего изобретения является фармацевтическая композиция, содержащая в качестве активного компонента соединение формулы (1а) или его фармацевтически приемлемую соль.
Предпочтительные значения заместителей R, A, R1, R2, R3,


Предпочтительными соединениями формулы (1а),
определенной выше, являются соединения, в которых:
R7 является фенильным кольцом, незамещенным или замещенным одним или двумя заместителями, независимо выбранными из атома
галогена, C1-C4-алкила и трифторметила;
Z представляет собой -(CH2)r- или -(CH2)s-Y-(CH2)t-группу, где r
является 1 или 2; один из s и t равен нулю, а другой 0, 1 или 2; а Y
является -O-, -S- или -NH-; V 0 или 1;
R8 и R9 независимо являются водородом или C1
-C4-алкилом;
R10 является водородом или
C1-C4-алкилом, необязательно замещенным гидрокси;
R'10 является водородом;
R11 и R12 независимо являются водородом или C1-C4-алкилом; и их фармацевтически приемлемые соли; причем:
a) если Z представляет собой группу
-(CH2)-Y-(CH2)-, в которой s, t и Y определены выше, и в
то же время R7 является фенильным кольцом, определенным выше, R10 является водородом или
незамещенным C1-C4-алкилом, V, R8 и R9
определены выше, то по крайней мере один из R11 и R12 не являются водородом; и
b)
если R7 является фенильным кольцом, незамещенным или замещенным одним или
двумя заместителями, выбранными из атома галогена и C1-C4-алкила, и в то же время Z является
-(CH)R14-или -(CH2)s-Y-(CH2)t
-группой, в которой R14 является водородом или C1-C3-алкилом, Y является -O- или
-S-, а s и t оба равны нулю, R8 и R9 являются водородом, V равен
0, а R11 и R12 определены выше; то R10 является C1-C4
-алкилом, замещенным гидрокси.
Примерами предпочтительных соединений формулы
(1а) являются следующие соединения:
2-[4-(2-хлорбензол)оксибензил]амино-3-гидрокси-N-метилпропионамид;
2-[4-(3-фторбензил)оксибензил]амино-3-гидрокси-N-метилпропионамид;
2-[4-(2-фторбензил)оксобензил]амино-3-гидроокси-N-метилпропионамид;
2-[N-(4-бензилбензил)-N-метил]аминопропионамид;
2-[4-(3-хлорбензил)оксибензил]амино-3-гидрокси-N-метилпропионамид;
2-(4-бензилоксибензил)амино-3-гидрокси-N-метилпропионамид;
2-[4-(3-хлоробензил)оксибензил]амино-N-метилацетамид;
2-(4-фенилоксибензил)амино-3-гидрокси-N-метилпропионамид;
2-[4-(2-фенилэтил)бензил]аминопропионамид;
2-[4-(2-хлорбензил)оксибензил]амино-N-метилпропионамид;
2-(4-бензилоксибензил)амино-N-метилпропионамид;
а также их (S)
и
(R)-изомеры, как по отдельности, так и в смеси; и их фармацевтически приемлемые соли.
Ни одно из соединений формулы (1), упомянутых в настоящем описании в качестве отдельной химической единицы, и входящих в объем общих формул документов прототипа, ни в одном документе ранее конкретно не упоминалось. Указанные соединения и их фармцевтически приемлемые соли являются новыми соединениями и, следовательно, являются предметом настоящего изобретения.
Примерами указанных новых соединений являются следующие соединения:
2-(4-бензилоксибензил)аминопропионамид;
2-[4-хлорбензил)оксибензил]аминопропионамид;
2-(4-бензиламинобензил)аминопропионамид;
2-[4-(3-фторобензил)оксибензил]аминопропионамид;
2-[4-(3-хлорбензил)оксибензил]аминоацетамид;
2-[N-[4-(3-хлоробензил)оксибензил]-N-метил аминоацетамид;
2-(4-бензилбензил)аминопропионамид;
2-(4-фенилоксиметилбензил)аминопропионамид;
2-(4-бензилтиобензил)аминопропионамид;
а также их (S)- или (R)-изомеры, как по отдельности,
так и в смеси, и их фармацевтически приемлемые
соли.
Эти новые химические соединения могут быть представлены следующей общей формулой (Ib):

где R
Z' представляет собой -(CH2)r- или -(CH2)s-Y-(CH2)t -группу, в которой r 1, один из s и t равен нулю, а другой либо равен нулю, либо 1, а Y является -O-, -S-или -NH-;
R
W 0;


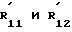
Соединения формулы (Ib) и их фармацевтически приемлемые соли также являются предметом настоящего изобретения.
Еще одним предметом настоящего изобретения являются
фармацевтические композиции, содержащие в качестве активного компонента соединение формулы (Ib) или его фармацевтически приемлемую соль;
в частности, соединение, выбранное из группы, содержащей:
2-(4-бензилоксибензил)аминопропионамид;
2-[4-(2-хлоробензил) оксибензил]аминопропионамид;
2-(4-бензиламинобензил)аминопропионамид;
2-[4-(3-фторобензил)оксибензил]аминопропионамид;
2-[4-(3-хлоробензил)оксибензил]аминопропионамид;
2-[N-[4-(3-хлоробензил)оксибензил]-N-метил]аминоацетамид;
2-[4-(3-хлоробензил)оксибензил]аминоацетамид;
2-(4-бензилбензил)аминопропионамид;
2-(4-фенилоксиметилбензил)аминопропионамид;
2-(4-бензилтиобензил)аминопропионамид;
как в случае отдельных изомеров (S) и (R), так и в случае их смеси, либо фармацевтически
приемлемая соль указанных соединений.
N-фенилалкил-замещенных производных α -аминокарбоксамида формулы (I) могут быть получены способом, описанным ниже. Производные формулы (Ia) могут быть получены аналогичным способом с использованием в качестве исходных соединений соединения (IIa) (IXa), X и XI, где символы R7-R12, R10, Z и V, соответственно, заменяют символы R, R1 R3, R5, R6, R3, A и n в соединениях (II) -(IX). Производные формулы (Ib) могут быть также получены аналогичным способом с использованием в качестве исходных соединений соединения (IIb) и (IVb) (IXb), (X) и (XI), в которых символы


а) соединения формулы (II) или (III), соответственно:

где R, R1 и A определены выше, подвергают реакции взаимодействия с соединением формулы (IV):

где R2, R3 и

b) соединение формулы (V) или его алкиловый сложный эфир;

где R, A, R1, R2, R3, R'3 и n определены выше, подвергают взаимодействию с амином формулы (VI):
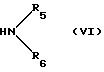
где R5 R6 определены выше; или
c) соединение формулы (VII):
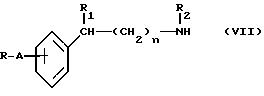
где R, A, R1, n и R2 определены выше, подвергают с соединением формулы (VIII):

где W является атомом галогена, а R5 и R6 определены выше;
в результате чего получают соединение настоящего изобретения, где R3 и

d) соединение формулы (IX):

где R, A, R1, n, R3,


где W является атомом галогена;

Аналогично, производные формулы 1a и 1b, которые могут быть представлены следующей формулой 1c:

где R7 представляет собой пиридил, тиенил или фурил, или фенил, незамещенный или замещенный атомом галогена;
Z представляет собой -(CH2)- или -(CH2)v-Y-группу, где V целое число от 1 до 4, а Y представляет собой -O-, -S- или -NH-;
R9 представляет собой водород или C1-C4-алкил;
R10 представляет собой C1-C4-алкил, незамещенный или замещенный фенилом или гидрокси-группой;

R11 и R12 независимо представляют собой водород или C1-C4-алкил;
или его фармацевтически приемлемой соли; и где
а) когда Z -(CH2)v -Y, где V и Y определены выше, R10 -водород или незамещенный C1-C4алкил; и R7 и R9 определены выше, то тогда по крайней мере один из R11 и R12 не является водородом; или
б) когда Z -CH2- и R9 водород, и R7, R11 и R12 определены выше, то тогда R10 не является водородом или незамещенным C1-C4алкилом,
получают способом, который включает следующие стадии:
а) взаимодействие соединения формулы IIc

где R7 и Z определены выше,
с соединением формулы (IIIc)

где R9, R10 и

где R11 и R12 определены выше, и при этом оба не являются C1 -C4-алкилом; или
б) взаимодействие соединения формулы (Vс) или его алкиловый сложный эфир:

где R7, Z, R8, R9, R10,


где R11 и R10 определены выше, получая в результате соединение формулы Ic; или
в) взаимодействие соединения формулы (IXc)

где R7, Z, R10,


где W галоген;


Все описанные выше способы являются аналогичными способами и могут быть осуществлены в соответствии со стандартной техникой, обычно используемой в органической химии.
Реакция соединения формулы (II) или (III) с соединением формулы (IV) является реакцией гидроаминирования, которая может быть осуществлена в соответствии со стандартными способами. В предпочтительном варианте осуществления настоящего изобретения указанная реакция может быть проведена в атмосфере азота, в соответствующем органическом растворителе, таком как спирт, например низший алканол, в частности, метанол, или в ацетонитриле, при температуре приблизительно в пределах 0oC-40oC, и в присутствии восстановителя, предпочтительно цианоборогидрида натрия. В некоторых случаях для облегчения реакции к реакционной смеси могут быть добавлены молекулярные сита.
Алкиловый сложный эфир соединения формулы (V) является, например, C1-C4-алкиловым сложным эфиром, таким как C1-C4 -алкиловый сложный эфир, а в частности, метиловый, этиловый или пропиловый сложный эфир, который может быть незамещенным или замещенным фенильным кольцом, необязательно замещенным нитро-группой.
Предпочтительно использовать алкиловый сложный эфир соединения формулы (V).
Реакция соединения общей формулы (V) или его сложного алкилового эфира с амином формулы (VI) может быть проведена при избытке амина, а в некоторых случаях, в присутствии воды или органического растворителя, такого как диметилформамид. Температура реакции может варьироваться в пределах приблизительно от 20oC до 100oC.
В соединении формулы (VIII) W предпочтительно является бромом или хлором. Реакция соединения общей формулы (VII) с соединением общей формулы (VIII) может быть осуществлена в соответствующем органическом растворителе, таком как спирт, например, этанол, или в диметилформамиде, при температуре приблизительно от 40oC до 140oC, и в присутствии подходящего акцептора кислоты, например, безводного карбоната натрия.
В соединении формулы (X) галогеном W предпочтительно является иод. Реакция алкилирования соединения формулы (IX) с соединением формулы (X) может быть осуществлена в соответствующем органическом растворителе, таком как спирт, например, метанол, этанол или изопропанол, а предпочтительно, в метаноле, при температуре, приблизительно, в пределах от 0oC до 50oC.
Реакция алкилирования соединения формулы (IX) с альдегидом формулы (XI) может быть проведена в соответствующем органическом растворителе, таком как спирт, например, метанол, ацетонитрил, и в присутствии восстановителя, такого как цианоборогидрид натрия, при температуре в пределах приблизительно от 0oC до 30oC.
Соединение настоящего изобретения может быть трансформировано в другое соединение настоящего изобретения с помощью стандартной техники. Описанный выше вариант способа (d) может рассматриваться как пример необязательного превращения одного соединения настоящего изобретения в другое соединение настоящего изобретения.
Необязательные стадии превращения соединения настоящего изобретения в соль, а также превращение соли в свободное соединение, и разделение смеси изомеров на отдельные изомеры могут быть также проведены в соответствии со стандартной техникой.
Соединения формул (II), (III), (IV), (V), (VI), (VII), (VIII), (X) и (XI) являются известными соединениями или могут быть получены стандартными способами из известных соединений.
Например, карбоновые кислоты формулы (V) и их сложные алкиловые эфиры могут быть получены способом, описанным в
GB-A-1140748 (Derwent 30027F). Кислота формулы (V), где n 0 или 1, может быть также
получена с помощью реакции соединения формулы (II) или (III), соответственно, описанных выше, с соединением формулы
(XII):

где R2, R3 и

Реакция соединения формулы (XII) с соединением формулы (II) или (III) может быть проведена способом, описанным выше в варианте (a). Соединения формулы (IX) являются соединениями настоящего изобретения, где R2 является водородом, и могут быть получены способами, описанными в вариантах (a) и (b) (см. выше).
Соединения формулы (XII) являются известными соединениями и могут быть получены стандартными способами.
Если в соединениях настоящего изобретения и в их промежуточных продуктах имеются группы, нуждающиеся в защите перед осуществлением описанных выше реакций, то перед указанными реакциями они могут быть блокированы, а затем они могут быть подвергнуты разблокированию в соответствии со стандартной техникой, применяемой в органической химии.
Промежуточные соединения, используемые в описанных выше способах для получения соединений настоящего изобретения, могут существовать либо в виде отдельных изомеров, либо их смеси.
Предпочтительно, если они представляют собой отдельный изомер.
Фармакология
Соединения настоящего изобретения и их отдельные классы формул (Ia) и (Ib), определенные
выше, обладают способностью к воздействию на центральную нервную систему (ЦНС) и могут быть использованы
при лечении эпилепсии и болезни Паркинсона, а также в качестве нейрозащитных средств при
дегенеративных процессах, связанных с нормальным старением организма или патологическими нарушениями, такими
как ишемия головного мозга; соединения настоящего изобретения могут быть также использованы
в качестве антидепрессантов, снотворных и спазмолитических средств.
Оценку воздействия соединений настоящего изобретения на ЦНС проводили на основе фармакологических методов, например, таких как антагонизм к судорогам и летальности у мышей, вызванным посредством внутривенного введения бикуккулина (Antiepileptic Drug. D.M. Wood bury et al. eds. 2nd edition, Raven Press Нью-Йорк, 1982) или антагонизм к судорогам у мышей, вызванным посредством подкожного введения 3-меркаптопропионовой кислоты (W. Loscher, Biochem, Pharmacol. 28; 1397-1407, 1979). В соответствии с указанной методикой были проведены испытания соединений настоящего изобретения, результат которых для некоторых характерных соединений представлены в табл.1 и 2, где даны дозы защиты 50% мышей (т.е. ED50) от летальности и тонических судорог, индуцированных бикуккулином и 3-меркаптопропионовой кислотой, соответственно.
Лекарственное средство вводилось перорально за 1 ч до введения бикуккулина 0,6 мг/кг.
Антагонизм к тоническим судорогам у меньшей, индуцированным посредством введения 3-меркаптопропионовой кислоты, представлен в табл.2.
Лекарственное средство вводилось перорально за 1 ч до введения МРА (60 мг/кг, подкожно).
Данные ED50, представленные в табл. 1 и 2, показали, что соединения настоящего
изобретения обладают высокой активностью в качестве противоэпилептических средств.
Фактически, значения ED50, полученные с использованием Вальпроата (Valproate), хорошо известного и широко
применяемого противоэпилептического средства, значительно превышают данные,
полученные для соединений настоящего изобретения. Внутренние FCE-коды, указанные в табл.1 и 2, обозначают следующие
соединения (в скобках указан внутренний FCE-код):
25989
2-[4-(3-хлоробензил)оксибензил]аминоацетамид;
[26550](S) 2-[4-(бензилоксибензил)аминопропионамид;
[26502] (S)
2-[4-(2-хлоробензил)оксибензил]амино-3- гидроксиметилпропионамид;
[26700](S) 2-[4-(2-хлоробензил)оксибензил]аминопропионамид;
[26650] (S)
2-[4-(3-фторобензил)оксибензил]амино-3- гидроксиметилпропионамид;
[26749](S)
2-(4-бензиламинобензил)аминопропионамид;
[26743](S) 2-[4-(3-фторобензил)оксибензил]аминопропионамид;
[26649] (S) 2-[4-(2-фторобензил)оксибензил]амино-3- гидроксиметилпропионамид;
[26762](S) 2[N-(4-бензилбензил)-N-метил]аминопропионамид;
[26359] (S)
- 2[4-(3-хлоробензил)оксибензил]амино-3-гидрокси-N-метилпропионамид;
[26358](S)
2-(4-бензилоксибензил)амино-3-гидрокси-N-метилпропионамид;
[26312](R)
2-[4-(3-хлоробензил)оксибензил]аминопропионамид;
[26723](S) 2-(4-бензилбензил)аминопропионамид;
[25699] 4-(3-хлоробензил)оксифенетиламин гидрохлорид
[26105]
[4-(3-хлоробензилокси)-α-метил-бензил]аминоацетамид гидрохлорид;
[27023](S)
2-[4-(3-фенилпропил)оксибензил]аминопропионамид
Соединения настоящего изобретения являются также
сильными ингибиторами моноаминоксидазы (МАО). Для конкретного примера проводили испытания с
использованием в качестве источника МАО митохиндрии крысиной печени и в качестве субстрата 2-фенил-этиламин,
в результате которых для соединения FCE 25989 получили величину IC50 2•
10-7 по отношению к МАО типа В. Активность МАО-В головного мозга обнаруживает тенденцию к
возрастанию по мере старения и при дегенеративных расстройствах (см. M. Strolin Benedetti и P.
Dostert. Biochem. Pharmacol. 38: 555-561, 1988). Соединения настоящего изобретения способствуют также
повышению уровня серотонина (5-НТ) и его основного метаболита, 5-гидрокси-индол-3-уксусной
кислоты (5-HIAA), в различных областях головного мозга. Например, введение (200 мг/кг: р.с.) соединения FCE
25989 мышам приводило к возрастанию 5-НТ (48% и 5-HIAA 37%) в передней части головного
мозга. Введение a-триптофена, натурального биопредшественника 5-НТ и 5-HIAA, является эффективным при лечении
эффективных расстройств и слабо действует при умеренной асомнии (см. B. Boman, Aust. New
Zealand J. Psychiatry 22: 83-97, 1988).
Поскольку токсичность соединений настоящего изобретения весьма незначительна, они с успехом могут быть использованы в терапии. Токсичность соединений определяли следующим образом: мышей, которых не кормили в течение 9 ч, обрабатывали перорально с помощью однократного введения соединений в возрастающих дозах, после чего мышей помещали в их клетки и нормально кормили. На седьмой день после обработки определяли ориентационную острую токсичность (LD50). Соединения настоящего изобретения могут быть введены в различных лекарственных формах, например, в виде таблеток, капсул, таблеток, покрытых сахаром или оболочкой, жидких растворов и т.п. для перорального введения; в виде суппозиториев для ректального введения; а также в виде инъекций для парентерального введения, например, внутримышечных или внутривенных инъекций или вливаний. Терапевтическая схема применения для различных клинических синдромов должна быть адаптирована к типу патологии, принимая в расчет также способ введения, лекарственную форму, возраст, вес и состояние пациента.
Как правило, при всех состояниях, требующих использования соединений настоящего изобретения, они могут быть введены перорально. Однако в критических состояниях предпочтительно применять внутривенные инъекции.
Дозы для перорального введения соединений настоящего изобретения могут варьироваться в пределах приблизительно от 50 до 1500 мг/день. Само собой разумеется, для получения оптимального терапевтического ответа указанные дозы могут корректироваться.
Настоящее изобретение также обеспечивает создание фармацевтической
композиции, обладающей противосудорожным или нейрозащитным действием, и
включает активный ингредиент и фармакологически приемлемый носитель или разбавитель, при этом активный ингредиент представляет
собой соединение, выбираемое из группы, включающей
[4-(3-фторбензил)оксибензил]амино-3-гидрокси-N-метилпропионамид;
2-[4-(3-фторбензил)оксибензил]аминопропионамид;
2-[4'-(3-фенилпропил)оксибензил] аминопропионамид, или его
фармацевтически приемлемую соль, взятое в эффективном количестве.
Форма фармацевтических композиций, содержащих соединение настоящего изобретения в сочетании с фармацевтически приемлемыми носителями или разбавителями, зависит от выбранного пути введения.
Указанные композиции могут быть изготовлены в соответствии со стандартной техникой и с использованием стандартных ингредиентов. Например, соединения настоящего изобретения могут быть введены в виде водных или масляных растворов или суспензий, таблеток, драже, желатиновых капсул, сиропов, капель или суппозиториев. Например, для перорального введения композиции, содержащие соединения настоящего изобретения, предпочтительно изготавливать в виде таблеток, драже или желатиновых капсул, которые содержат активный ингредиент в сочетании с разбавителями, такими как лактоза, декстроза, сахароза, маннит, сорбит, целлюлоза; замасливателями, такими как двуокись кремния, тальк, стеариновая кислота, стеарат магния или кальция, и/или полиэтиленгликоли; либо они могут содержать связующие, такие как крахмалы, желатин, метилцеллюлоза, карбоксиметилцеллюлоза, аравийская камедь, трагакант, поливинилпирролидон; дезагрирующие агенты, такие как крахмалы, альгиновая кислота, альгинаты, натрийсодержащий гликолят крахмала; шипучие смеси; красители; подслащивающие вещества; смачивающие агенты, такие как лецитин, полисорбаты, лаурилсульфаты; и другие, в основном, нетоксичные и фармацевтически инертные вещества, которые обычно используются в фармацевтической практике. Указанные фармацевтические препараты могут быть изготовлены в соответствии со стандартной техникой, например, путем смешивания, гранулирования, таблетирования с последующим покрытием таблеток сахаром или оболочкой.
Жидкие дисперсии для перорального введения могут быть изготовлены, например, в виде сиропов, эмульсий и суспензий.
Сиропы могут содержать в качестве наполнителя, например, сахарозу или сахарозу с глицерином и/или маннит, и/или сорбит.
Суспензии и эмульсии могут содержать в качестве наполнителя, например, натуральную камедь, агар, альгинат натрия, пектины, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт.
Суспензии или растворы для внутримышечных инъекций могут содержать вместе с активным соединением фармацевтически приемлемый носитель, например, стерильную воду, оливковое масло, этилолеат, гликоли, такие как пропиленгликоль, и по желанию, соответствующее количество лигнокаингидрохлорида.
Растворы для внутривенных инъекций или вливаний могут содержать в качестве носителя, например, стерильную воду, или предпочтительно, они могут быть изготовлены в виде водных изотонических солевых растворов.
Суппозитории могут содержать в сочетании с активным соединением фармацевтически приемлемый носитель, например, какао-масло, полиэтиленгликоль, поверхностно-активное вещество в виде жирно-кислых сложных эфиров полиоксиэтиленсорбитана или лецитина.
Приведенные ниже примеры иллюстрируют но не ограничивают осуществление настоящего изобретения.
Пример 1. 22,4 г (0,203 М) глицинамидгидрохлорида суспендировали в 1000 мл безводного метанола и 10,2 г (0,162 М) цианоборгидрида натрия добавляли, перемешивая, в атмосфере азота. После солюбилизации смеси добавляли одной порцией 50 г (0,203 М) 3-хлоробензилоксибензальдегида. Реакционную смесь перемешивали в течение 8 ч при комнатной температуре, а затем оставляли на 16 ч. После чего раствор фильтровали и выпаривали; разбавляли водой и три раза экстрагировали метиленхлоридом. После осушки и выпаривания неочищенный остаток хроматографировали на силикагеле, элюируя смесью хлороформа, метанола и концентрированной NH4OH (97:3:0,3), в результате чего получали 2-[4-(3-хлоробензил)оксибензил]аминоацетамид, который с помощью реакции со стехиометрическим количеством газообразного HCl в этаноле превращали в его гидрохлорид (32,1 г, 46,3% т.пл. 225-230oC).
Аналогичным образом
могут быть
получены следующие соединения с использованием в качестве исходных соединений соответствующий альдегид или кетон и соответствующий a-аминоамид и, по необходимости, кислотный агент:
(4-бензилоксибензил)аминоацетамид, гидрохлорид, т.пл. 250oC;
[4-(3-хлоробензилокси)-a-метил-бензил] аминоацетамид, гидрохлорид, т.пл. 199,5-202oC;
(R)-2-[4-(3-хлоробензил)оксибензил] амино-3-гидроокси-пропионамид, т.пл. 110-110,5oC;
(S)-2-[4-(3-хлоробензил)оксибензил] амино-3-гидроокси-пропионамид, т.пл. 110-113oC;
2-[4-(3-хлоробензил)оксибензил]амино-N-метилацетамид, гидрохлорид, т.пл. 226-228oC;
(S)-2-[4-(3-хлоробензил оксибензил] амино-N-метилпропионамид, гидрохлорид; т.пл. 176,
5-178,5oC;
(S)-2-[4-(3-хлоробензил)оксибензил] амино-3-гидрокси-N-метилпропионамамид, т.пл. 128-130oC;
(S)-2-[4-(3-хлоробензил)оксибензил]аминопропионамид,
т.пл. 198,5oC;
(S)-2-(4-бензилоксибензил)амино-N-метилпропионамид, т.пл. 189-191,5oC;
(S)-2-(4-бензилоксибензил)амино-3-гидрокси-N-метилпропионамид, т. пл.
102-104oC;
(R)-2-[4-(3-хлоробензил)оксибензил] аминопропионамид, гидрохлорид, т.пл. 198,5-200oC;
(R)-2-(4-бензилоксибензил)амино-3-гидрокси-N-метил-пропионамид,
т. пл. 100-103oC;
(S)-2-[4-(3-метоксибензил)оксибензил] амино-3-гидрокси-N-метилпропионамид, т.пл. 83-87oC;
(S)-2-[4-(2-хлоробензил)оксибензил]
амино-3-гидрокси-N-метилпропионамид, т.пл. 131-134oC;
(S)-2-[4-(4-хлоробензил)оксибензил] амино-3-гидрокси-N-метилпропионамид, т.пл. 139-141oC;
1-[(4-бензилоксибензил)амино] циклопентан-1-N-метил-карбоксамид, гидрохлорид, т.пл. 218-221oC;
2-(4-бензилоксибензил)амино-N-метилацетамид, гидрохлорид, т. пл. 238-242o
C;
1-[(4-бензилоксибензил)амино] циклопропан-1-N-метил-карбоксамид, гидрохлорид, т.пл. 194-200oC (разложение);
1-[(4-бензилоксибензил)амино] циклопентан-1-карбоксамид,
гидрохлорид, т. пл. 229-234oC;
(S)-2-(4-бензилоксибензил)аминопропионамид, т.пл. 229-232oC;
(S)-2-(4-бензилоксибензил)амино-3-метил-N-метил-бутанамид,
гидрохлорид, т.пл.160-163oC;
(R)-2-(4-бензилоксибензил)амино-3-метил-N-метилбутанамид, гидрохлорид, т.пл. 161-165oC;
(R)-2-(4-бензилоксибензил)амино-3-фенил-N-метилпропионамид, т. пл. 222,5-227,5oC;
1-[(4-бензилоксибензил)амино] циклопропан-1-карбоксамид, метансульфонат, т.пл. 219-228o
C (разложение);
(R)-2-(4-бензилоксибензил)аминопропионамид, гидрохлорид, т. пл. 228-231oC;
(2R, 3S)-2-(4-бензилоксибензил)амино-3-гидрокси-N-метил-бутанамид, гидрохлорид,
т.пл. 187,5-191oC;
(2S, 3R)-2-(4-бензилоксибензил)амино-3-гидрокси-N-метил-бутанамид, гидрохлорид. т.пл. 187-191oC;
(S)-2-(4-бензилоксибензил)амино-4-метил-N-метил-петанамид, гидрохлорид, т.пл. 141-144oC;
(S)-2-(4-бензилоксибензил)амино-3-гидрокси-пропионамид, т.пл. 128-130oC;
(R)-2-(4-бензилоксибензил)амино-3-гидрокси-пропионамид, т.пл. 117-122oC;
(S)-2-[4-(2-метилбензил)оксибензил] амино-3-гидрокси-N-метилпропионамид, метансульфонат, т.пл.
170-172oC;
(S)-2-[4-(3-метилбензил)оксибензил] амино-3-гидрокси-N-метилпропионамид, метансульфонат, т.пл. 80-82oC (вода 0,57%);
(S)-2-[4-(3-трифторметилбензил)оксибензил]
амино-3-гидрокси-N-метилпропионамид, метансульфонат, т.пл. 120,5-124oC;
(S)-2-[4-(2-трифторметилбензил)оксибензил]
амино-3-гидрокси-N-метилпропионамид, метансульфонат, т.пл.
60-70oC;
(S)-2-[4-(2-фторобензил)оксибензил] амино-3-гидрокси-N-метилпропионамид, метансульфонат, т.пл. 137-140oC;
(S)-2-[4-(3-фторобензил)оксибензил]
амино-3-гидрокси-N-метилпропионамид, метансульфонат, т.пл. 135-138oC;
(S)-2-[4-(2-хлоробензил)оксибензил] аминопропионамид,
метансульфонат, т. пл. 219-220oC;
(S)-2-[4-(2-хлоробензил)оксибензил]амино-N-метил-пропионамид, метансульфонат, т.пл. 80-90oC (вода 1,21%);
(R)-2-[4-(2-хлоробензил)оксибензил]амино-N-метил-пропионамид,
метансульфонат, т.пл. 130-134oC;
(R)-2-[4-(2-хлоробензил)оксибензил] аминопропионамид, метансульфонат, т. пл.
218-221oC;
(R)-2-(бензилоксибензил)амино-N-метилпропионамид, метансульфонат, т.пл. 134,5-138,5oC;
(S)-2-(4-фенилоксибензил)аминопропионамид, метансульфонат,
т.пл. 210-213oC;
(S)-2-(4-фенилоксибензил)амино-3-гидрокси-N-метилпропионамид, метансульфонат, т. пл. 112-116oC;
(S)-2-(4-бензилбензил)аминопропионамид,
метансульфонат, т.пл. 182-185oC;
(S)-2-[4-(2-фенилэтил)бензил] аминопропионамид, метансульфонат, т. пл. 235-238oC;
(S)-2-(4-бензилбензил)амино-3-гидрокси-N-метил-пропионамид, метансульфонат,
т.пл. 126-128oC;
(S)-2-(4-фенилэтилоксибензил)аминопропионамид, метансульфонат, т. пл. 178-181oC;
(S)-2-(4-бензилтиобензил)аминопропионамид, метансульфонат,
т.пл. 250oC;
(S)-2-2(4-бензилтиобензил)амино-3-гидрокси-N-метил-пропионамид, метансульфонат, т.пл.
151-155oC;
(S)-2-(4-фенилэтиленбензил)амино-3-гидрокси-N-метилпропионамид, метансульфонат, т.пл. 143-146oC;
(S)-2-[4-(2-фенилэтил)оксибензил]
амино-3-гидрокси-N- метилпропионамид,
метансульфонат, т.пл. 108-110oC;
(S)-2-(4-фенилоксиметилбензил)аминопропионамид, метансульфонат, т. пл. 212-217oC;
(S)-2-[4-(2-фторобензил)оксибензил]аминопропионамид, т.пл. 237- 241oC;
(S)-2-[4-(3-фторобензил)оксибензил]аминопропионамид, т.пл. 208-212oC;
(S)-(+)-2-(4-фенилоксиметилбензил)амино-3-гидрокси-метилпропионамид, дигидрохлорид, т.пл. 193-195oC;
(S)-2-(4-бензиламинобензил)аминопропионамид, дигидрохлорид, т.пл. 173oC;
(S)-2-(4-бензилоксифенетил)аминопропионамид, метансульфонат;
(S)-2-[4-(2-хлоробензил)оксифенетил]аминопропионамид, метансульфонат;
2-[4-(3-хлоробензилокси)-a-метил-бензил] аминопропионамид, метансульфонат;
(S)-2-[4-(3-фенилпропил)оксибензил]аминопропионамид, метансульфонат;
2-[(4-бензил)-a-метил-бензил]аминопропионамид, метансульфонат;
(R)-2-4-бензилоксибензил)аминобутанамид, метансульфонат, т. пл. 197-200oC;
(S)-2-(4-бензилоксибензил)аминобутанамид, метансульфонат, т. пл. 196-199oC;
(S)-2-(2-бензилоксибензил)аминопропионамид, метансульфонат, т.пл. 134-137oC;
(S)-2-(3-бензилоксибензил)аминопропионамид, метансульфонат, т.пл. 178-181oC;
(S)-2-(4-циклогексилметиламинобензил) аминопропионамид, дигидрохлорид;
(S)-2-(4-циклопропилметиламинобензил)аминопропионамид, дигидрохлорид;
(S)-2-(4-фениламинометилбензил)аминопропионамид, дигидрохлорид, т. пл. 132-137oC;
(S)-2-(4-бензиламинометилбензил)аминопропионамид, дигидрохлорид;
(S)-2-[4-(3-фурфурил)оксибензил]аминопропионамид, метансульфонат;
(S)-2-[4-(2-фурфурил)оксибензил]аминопропионамид,
метансульфонат;
(S)-2-[4-(3-пиридил)метилоксибензил]аминопропионамид, метансульфонат;
(S)-2-[4-(2-пиридил)метилоксибензил]аминопропионамид, метансульфонат;
(S)-2-[4-(4-пиридил)метилоксибензил]аминопропионамид, метансульфонат;
(S)-2-[4-(3-тиенил)оксибензил]аминопропионамид, метансульфонат; и
(S)-2-[4-(2-тенил)оксибензил]аминопропионамид,
метансульфонат.
Пример 2. 0,8 г (0,00298 М) (S)-(+)-2-(4-бензилбензил)аминопропионамида растворяли в 45 мл ацетонитрила в потоке азота. К полученной смеси при комнатной температуре
добавляли 2,98 мл (0,0149 М) 37% формальдегида и 0,27 г (0,00432 М) цианоборгидрида натрия. Через 40 мин по капле добавляли ледяную уксусную кислоту до нейтрализации раствора. После чего смесь
упаривали досуха и добавляли 40 мл 2 н. КОН. Затем смесь экстрагировали этилацетатом, промывали н/2 КОН, а затем водой и соляным раствором, после чего раствор высушивали сульфатом натрия, фильтровали
и упаривали, в результате чего получали неочищенный маслянистый продукт, после хроматографирования которого (в качестве элюента использовали смесь CHCl3 MeOH концентрированный NH4
OH 200: 3: 0,2) получали 0,58 г (69%) бесцветного маслянистого продукта. Этот продукт растворяли в метаноле и подвергали взаимодействию с эквимолярным количеством щавелевой кислоты, в
результате чего
получали белые кристаллы соединения:
(S)-2-[N-(4-бензилбензил)-N-метил] аминопропионамид оксалат, т.пл. 58-64oC.
Аналогичным образом с
использованием
соответствующих вторичных аминов могут быть получены следующие соединения:
(R)-2-[N-(4-бензилоксибензил(-N-метил] амино-3-гидрокси-N- метилпропионамид, т.пл. 73-77o
C;
(S)-2-[N-(4-фенилоксиметилбензил)-N-метил]аминопропионамид;
(S)-2-[N-(4-бензилэтилбензил)-N-метил]аминопропионамид;
(S)-2-[N-(4-бензилбензил)-N-метил]амино-3-гидрокси-N- метилпропионамид;
(S)-2-[N-(4-бензилтиобензил)-N-метил]аминопропионамид;
(S)-2-[N-(4-бензиламинобензил)-N-метил]аминопропионамид;
ЯМР (CDCl3) d: 1,05 (д, 3H, Me); 2,02 (c, 3H, N-Me); 3,55 (кв, IH, CH-CONH2); 4,20(c, 2H, ArCH2NMe);
4,28 (c, 2H, ArCH2NHar); 6,55-7,30 (м, 11H,
аром + CONH2);
(S)-2-[N-(4-(2-хлоробензил)оксибензил-N-метил] амино-3-гидрокси-N-метилпропионамид, метансульфонат;
(S)-2-[N-(4-(3-фторобензил)оксибензил)-N-метил]
амино-3-гидрокси-N-метилпропионамид, метансульфонат;
(S)-2[N-(4-(2-фторобензил)оксибензил-N-метил] амино-3-гидрокси-N-метилпропионамид,
метансульфонат;
(S)-2-[N-(4-(3-фторобензил)оксибензил)-N-метил] аминопропионамид, метансульфонат; и
(S)-2-[N-(4-(2-хлоробензил)оксибензил-N-метил] аминопропионамид,
метансульфонат.
Пример 3. 33,5 г (0,149 М) N-бензилицен-тирамина добавляли к смеси 4,45 г (0,193 М) натрия в 400 мл безводного этанола. После охлаждения до 0-5oC к полученной смеси по капле добавляли раствор 3-хлоробензилхлорида (28,8 г, 0,193 М) в безводном этаноле (150 мл). Затем смесь перемешивали в течение 1 ч при комнатной температуре и нагревали в сосуде с обратным холодильником в течение 6 ч. Горячую смесь фильтровали, а раствор концентрировали досуха. Остаток разбавляли 10% HCl (170 мл) и нагревали при 70-75oC в течение 1 ч. Белый твердый осадок фильтровали и промывали н-гексаном. После перекристаллизации из этанола получали 31 г 4-(3-хлоробензил)оксифенетиламина гидрохлорида, т.пл. 195-200oC (разложение).
31 г (0,104 М)
4-(3-хлоробензилокси)фенетиламингидрохлорида суспендировали в 450 мл безводного этанола. К полученной смеси добавляли 9,7 г (0,104 М) хлороацетамида и 28,8 г (0,208 М)
безводного карбоната калия.
После нагревания до температуры перегонки смесь продолжали размешивать в течение 40 ч. После чего горячую смесь фильтровали, упаривали досуха и неочищенный осадок
хроматографировали на силикагеле,
элюируя смесью CHCl3 MeOH концентрированный NH4OH 97:3:0,3. Полученное свободное соединение (20,2 г, 60,7%) обрабатывали газообразным HCl в
этаноле, в результате чего получали
количественный выход соединения: [4-(3-хлоробензил)оксифенетил]аминоацетамида гидрохлорид, т.пл. 248-251oC. Аналогичным образом, с использованием в
качестве исходных соединений
соответствующих первичных аминов, могут быть получены следующие соединения:
[4-(3-хлоробензилокси)-a-метил-бензил] аминоацетамид, гидрохлорид, т.пл. 199,
5-202oC;
2-[(4-бензилфенилэтил)]аминоацетамид; и
2-[2-(4-бензиламино)фенилэтил]аминоацетамид.
Пример 4. 7,07 г (0,066 М) глицинэтилового сложного эфира, гидрохлорида разбавляли в 200 мл безводного метанола и добавляли 3,32 г (0,053 М) цианоборогидрида натрия, перемешивая при этом в атмосфере азота. Затем к этому раствору одной порцией добавляли 15 г (0,0608 М) 3-хлоробензилоксибензальдегид. После чего смесь продолжали размешивать в течение 18 ч при комнатной температуре, затем выпаривали досуха, а полученный остаток хроматографировали на силикагеле, элюируя смесью циклогексана и этилацетата (60:40). В результате получали 6,8 г (34% ) сложного этилового эфира [4-(3-хлоробензил)оксибензил]аминоуксусной кислоты, т.пл. 114-115o C (в виде гидрохлорида).
3 г (0,0090 М) вышеуказанного сложного эфира (свободное основание) нагревали в 70 мл диметиламина при 60oC в течение 7 ч. Полученный раствор оставляли на ночь при комнатной температуре, затем выпаривали, а остаток очищали на силикагеле, элюируя смесью хлороформ метанол 0% NH4OH 95:5:0,5, в результате чего получали 0,7 г (23%) [4-(3-хлоробензил)оксибензил] амино-N1N-диметилацетамида гидрохлорида, т.пл. 120-125oC.
Аналогичным образом, с использованием в качестве исходных соединений
соответствующих сложных этиловых эфиров, могут быть получены следующие соединения:
2-(4-бензилоксибензил)амино-N1N-диметилацетамид;
2-(4-бензилоксибензил)амино-3-гидрокси-N1N-диметилпропионамид;
2-(4-бензилбензил)амино-N1N-диметилацетамид;
2-(4-бензиламинобензил)амино-N1
N-диметилацетамид;
(S)-2-[4-(2-хлоробензил)оксибензил]амино-3-гидрокси-N1N-диметилпропионамид, метансульфонат;
(S)-2-[4-(3-фторобензил)оксибензил]амино-3-гидрокси-N1N-диметилпропионамид, метансульфонат;
(S)-2-[4-(2-фторобензил)оксибензил]амино-3-гидрокси-N1N-диметилпропионамид, метансульфонат;
(S)-2-[4-(3-фторобензил)оксибензил] амино-N1N- диметилпропионамид, метансульфонат;
(S)-2-[4-(2-хлоробензил)оксибензил] амино-N1N- диметилпропионамид, метансульфонат;
(S)-2-[4-(2-хлоробензил)оксибензил]амино-3-гидрокси-N1N-диметилпропионамид, метансульфонат;
(S)-2-(4-бензилоксибензил)амино-N1N-диметилпропионамид,
метансульфонат.
Пример 5. 8 г (0,026 М) [4-(3-хлоробензил)оксибензил]аминоацетамида растворяли в метаноле (100 мл) и к полученному раствору добавляли 3,6 г (0,026 М) безводного карбоната калия. Затем к смеси по капле добавляли метилиодид (3 мл, 0,050 М) и реакционную смесь размешивали в течение 2 ч при комнатной температуре, после чего смесь выпаривали досуха. Неочищенный остаток хроматографировали на силикагеле, элюируя хлороформом и метанолом (95:5).
В результате получали 4,25 г (51,3%) 2-[N-(4-3-хлоробензил) оксибензил)-N-метил]аминоацетамида, т.пл.
108-111oC. Аналогичным образом могут быть получены следующие соединения, и если требуется, они могут быть превращены в соль с использованием кислотного агента:
(S)-2-[N-(4-бензилоксибензил)-N-метил] амино-N-метилпропионамид, т. пл. 80-82,5oC;
(S)-2-[N-(4-(3-хлоробензил)оксибензил)-N-метил] амино-3-гидрокси-N-метилпропионамид, фумарат,
т.пл. 87,5-95,5oC (разложение).
(S)-2-[N-(4-бензилоксибензил)-N-метил] амино-3-гидрокси-N- метилпропионамид, т.пл. 75-78oC;
(S)-2-[N-(4-(3-хлоробензил)оксибензил)-N-метил] амино-N- метилпропионамид, оксалат, т.пл. 75-85oC (1,54% воды);
(S)-N-[(4-бензилоксибензил)-N-метил]аминопропионамид, т.пл.
102-104oC; и
(S)-2-[N-(4-(3-хлоробензил)оксибензил)-N-метил] аминопропионамид, т.пл. 81-84oC.
Пример 6. Таблетки (каждая весом 300 мг и содержащая 100
мг
активного соединения) были изготовлены следующим образом:
Композиция (для 5000 таблеток), г:
4-3-хлоробензил оксибензил аминоацетамид, гидрохлорид 500
Лактоза 710
Кукурузный крахмал 237,5
Порошок талька 37,5
Стеарат магния 15
2-[4-(3-хлоробензил)оксибензил]аминоацетамида гидрохлорид, лактозу и половину количества кукурузного
крахмала
смешивали вместе, и полученную смесь пропускали через сито с размером отверстий 0,5 мм. Кукурузный крахмал (18 г) суспендировали в теплой воде (180 мл).
Полученную пасту использовали для гранулирования порошка. Полученные гранулы осушали, измельчали на сите с размером отверстий 1,4 мм и добавляли к ним оставшееся количество крахмала, тальк и стеарат магния, после чего смесь тщательно размешивали и прессовали в таблетки.
Пример 7. Таблетки, каждая из которых имела вес 300 мг и содержала 100 мг активного соединения, были изготовлены следующим
образом:
Композиция (для 500 таблеток), г:
(S)-2-(4-бензилбензил)аминопропионамид, метансульфонат 500
Лактоза 710
Кукурузный крахмал 237,5
Порошок талька
37,5
Стеарат магния 15
(S)-2-(4-бензилбензил)аминопропионамида метансульфонат, лактозу и половину количества кукурузного крахмала смешивали вместе и полученную смесь пропускали
через сито с
размером отверстий 0,5 мм. Кукурузный крахмал (18 г) суспендировали в теплой воде (180 мл).
Полученную пасту использовали для гранулирования порошка. Полученные гранулы осушали, измельчали на сите с размером отверстий 1,4 мм, добавляли оставшееся количество крахмала, тальк и стеарат магния, тщательно размешивали и полученную смесь прессовали в таблетки.
Реферат
Изобретение относится к производным N-фенил-алкил-замещенного
альфа-аминокарбоксамида формулы (1):

где R - представляет собой фурил, тиенил, пиридил или незамещенный или замещенный фенил; A представляет собой -(CH2)m- или -(CH2)p-X-группу, в которой X является -O-, -S- или -NR4-; R1, R2, R3, R4, n, m, p определены в описании изобретения; и R5 и R6 независимо являются водородом или C1-C6-алкилом, и к их фармацевтически приемлемым солям. Указанные соединения обладают способностью к воздействию на центральную нервную систему, а поэтому могут быть использованы в качестве противоэпилептических средств, средств против паркинсонизма, нейрозащитных средств, антидепрессантов, спазмолитических и/или снотворных средств для лечения человека и животных. 5 с. и 3 з.п. ф-лы, 2 табл.
Формула

где R пиридил, тиенил, фурил или фенил, незамещенный или замещенный атомом галогена, C1 C4-алкилом, C1 C4-алкокси или CF3;
A -CH2- или -(CH2)p X-группа, где p целое число от 1 до 4;
X O, S или NH;
R1 и R2 каждый независимо водород или C1 - C4-алкил;
n 0 или 1; R3 водород или C1 C4-алкил, незамещенный или замещенный фенилом или гидроксигруппой;
R4 водород или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют С3 С6- циклоалкил;
R5 и R6 независимо водород или C1 - C4-алкил,
или его фармацевтически приемлемую соль в эффективном количестве.
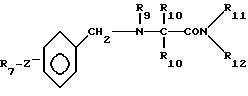
где R7 пиридил, тиенил, фурил или фенил, незамещенный или замещенный атомом галогена;
Z -(CH2)- или -(CH2)- Y -группа, где v целое число от 1 до 4, Y O, S или NH;
R9 водород или C1 C4-алкил;
R10 C1 C4-алкил, незамещенный или замещенный фенилом или гидроксигруппой;
R

R11 и R12 каждый независимо водород или C1 C4-алкил,
при этом а) если Z -(CH2)v Y -группа, где v и Y имеют указанные значения, и в то же время R10 водород или незамещенный C1 C4-алкил, а R7 и R9 имеют указанные значения, то по крайней мере один из R11 и R12 не являются водородом; б) если Z -(CH2)-группа и в то же время R9 водород, а R7, R11 и R12 имеют указанные значения, то R10 не является незамещенным C1 С4-алкилом,
или его фармацевтически приемлемая соль.

где R
Z -CH2- или -(CH2)v Y -группа, где v целое число от 1 до 4, Y O, NH,
или его фармацевтически приемлемая соль.

где R7 пиридил, тиенил, фурил или фенил, необязательно замещенный атомом галогена;
Z -CH2- или -(CH2)v Y -группа, где v целое число от 1 до 4, а Y O, S или NH;
R9 водород или C1 C4-алкил;
R10 C1 C4 -алкил, необязательно замещенный фенилом или гидрокси;


R11 и R12 независимо водород или C1 C4-алкил, или их фармацевтически приемлемых солей, при этом а) если Z -(CH2)v- Y -группа, где v и Y имеют указанные значения, R10 незамещенный C1 C4-алкил, R7 и R9 имеют указанные значения, то по крайней мере один из R11 и R12 не являются водородом, или б) если Z -CH2-группа и R9 водород, R7, R11 и R12 имеют указанные значения, то R10 не является незамещенным C1 C4-алкилом, отличающийся тем, что соединение формулы IIс

где R7 и Z имеют указанные значения,
подвергают взаимодействию с соединением формулы IVс

где

при этом R11 и R12 оба не являются C1 C4-алкилом, в присутствии восстановителя с последующим, в случае необходимости, превращением соединения Iс в его фармацевтически приемлемую соль и/или разделением, в случае необходимости, смеси изомеров соединения Iс на отдельные изомеры.
25.05.89 п. 1 способ с использованием соединения формулы I, где R - фенил, незамещенный или замещенный галогеном, C1 C4-алкилом или C1 C4-алкокси, A (CH2)pX-группа, где p - целое число от 1 до 4, X -O-, R1 и R2 водород или C1 C4-алкил, n 0 или 1, R3 водород, C1 - C4-алкил или гидроксиметил, R4 водород, R5 и R6 водород или C1 C4-алкил, или его фармацевтически приемлемой соли, п. 2 все соединения, п.3 способ с использованием соединений в дозе 50 1500 мг/кг. п. 4 соединения формулы Iа, где R7 фенил, незамещенный или замещенный галогеном, C1 C4-алкил или C1 - C4-алкокси, R9 водород или C1 C4-алкил, R10 водород, C1 C4-алкил или гидроксиметил, R10 водород, R10 и R12 -водород или C1 C4-алкил, или его фармацевтически приемлемая соль, п.5 фармацевтически приемлемая соль соединения формулы Iв, п.6 следующие соединения: 2-[4-(3-хлорбензил)оксибензил] аминоацетамид, 2-[4-(3-хлорбензил)оксибензил] аминопропионамид, 2-(4-бензилоксибензил)амино-3-гидрокси-N-метилпропионамид, 2-[4(3-хлорбензил)оксибензил] амино-3-гидрокси-N-метилпропионамид, 2-[4-(2-хлорбензил)оксибензил]амино-3-гидрокси-N-метилпропионамид, 2-(4-бензилоксибензил)аминопропионамид, 2-[4-(2-фторбензил)оксибензил] амино-3-гидрокси-N-метилпропионамид, 2-[4-(3-фторбензил)оксибензил]амино-3-гидрокси-N-метилпропионамид, 2-[4-(2-хлорбензил)оксибензил]аминопропионамид, 2-[4-(3-хлорбензил)оксибензил]аминопропионамид, 4-(3-хлорбензил)оксифенетиламин, [4-(3-хлорбензилокси)-N-метилбензил]аминоацетамид, 2-[4-(3-фенилпропил)оксибензил] аминопропионамид, [4-(3-хлорбензил)оксибензил] амино-N, N-диметилацетамид, 2-[4-(3-метоксибензил)оксибензил] амино-3-гидрокси-N-метилпропионамид, 2-[4-(2-метилбензил)оксибензил]амино-3-гидрокси-N-метилпропионамид, 2-[4-(3-метилбензил)оксибензил] амино-3-гидрокси-N-метилпропионамид;
04.04.90 п.1 соединения формулы I, где R пиридил, тиенил, или фурил, или фенил, замещенный CF3, A (CH2) или (CH2)pX, где p целое число от 1 до 4, X S или NH, п. 4 соединения формулы Iа, где R7 пиридил, тиенил, или фурил, или фенил, замещенный CF3, Z - CH2 или (CH2 )vY, где v целое число от 1 до 4, Y S или NH, п.5 соединения формулы Ib, где

25.05.90 п. 1 соединения формулы I, где R3 C1 - C4-лкил, замещенный OH (включая гидроксиметил) или фенил, или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют C3 C6- циклоалкил, п.4 соединения формулы Iа, где R10 C1 C4-алкил, замещенный OH (включая гидроксиметил), или фенил, R10 и R


Комментарии