Производные андростен(ан)она или его фармацевтически приемлемый сольват, способы их получения, фармацевтический препарат, способ лечения - RU2144037C1
Код документа: RU2144037C1
Чертежи
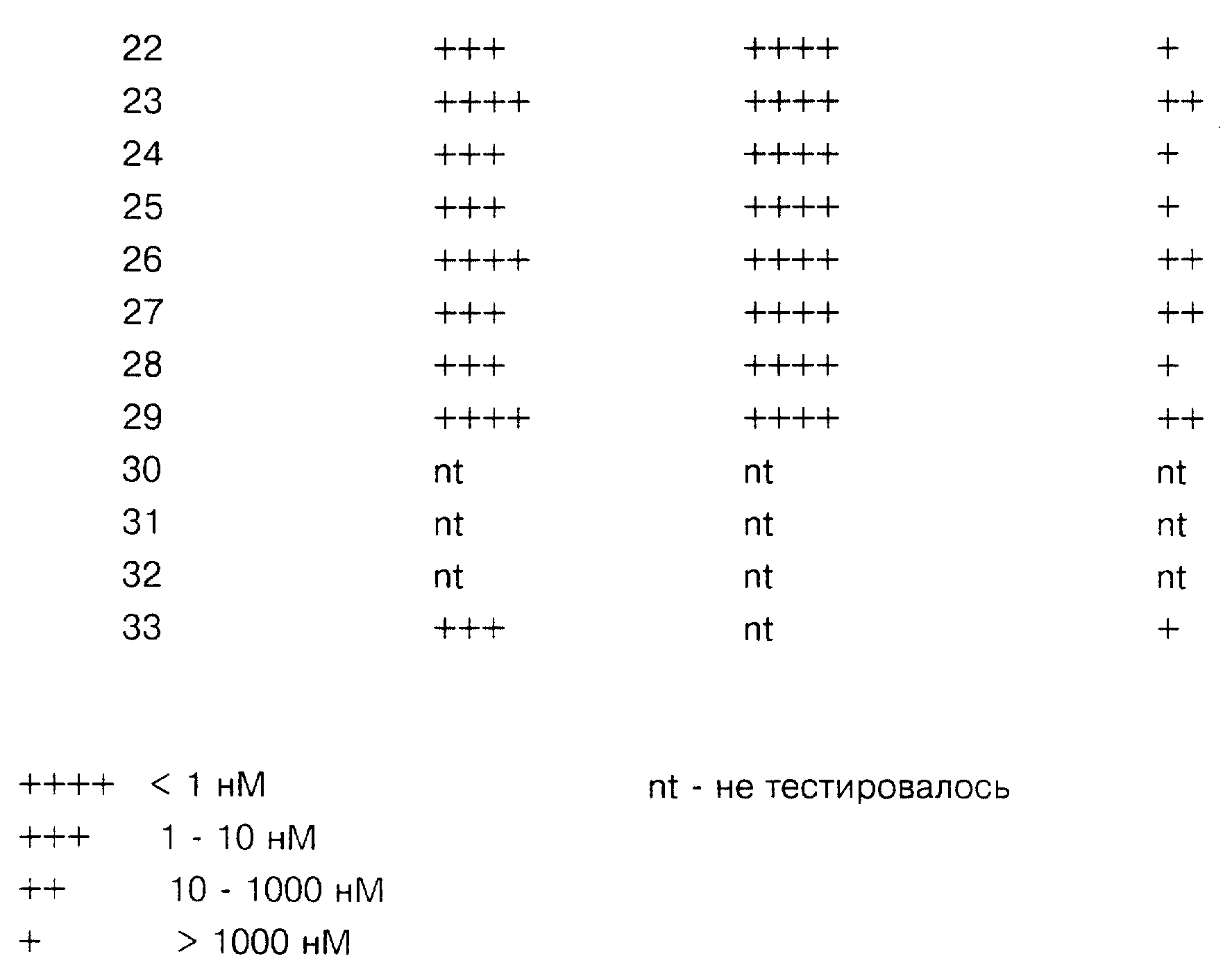
Описание
Данное изобретение относится к некоторым замещенным 17β-анилид-4-аза-5α-андростан-3-онам, в частности, как удивительно мощным и селективным ингибиторам человеческой 5α-редуктазы 1 и 2 типа.
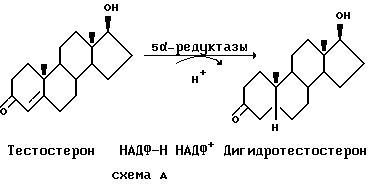
Андрогены отвечают за многие физиологические функции у мужчин и женщин. Действие андрогенов опосредовано специфическими внутриклеточными рецепторами к гормонам, выраженными в андрогенреактивных клетках. Тестостерон, основной циркулирующий андроген, вырабатывается клетками Лейдига в яичках под стимулирующим воздействием гипофизарного лютеинизирующего гормона (ЛГ). Однако восстановление двойной связи 4,5 тестостерона до дигидротестостерона (ДГТ) требуется в некоторых тканях-мишенях, таких как предстательная железа и кожа, для проявления андрогенного действия. Стероидные 5α-редуктазы в тканях-мишенях катализируют переход тестостерона в ДГТ НАДФ-Н зависимым образом, как показано в схеме A.
Необходимость действия ДГТ в качестве агониста в этих тканях-мишенях была освещена исследованиями лиц с дефицитом стероидной 5α-редуктазы, имеющих рудиментарные предстательные железы и не страдающих угревой сыпью или облысением по мужскому типу (см. McGinley, J. et al., The New England J. of Medicine, 300, 1233 (1979)). Таким образом, ожидается, что ингибирование перехода тестостерона в ДГТ в этих тканях-мишенях будет полезным в лечении разнообразных андрогенреактивных заболеваний, например доброкачественной гиперплазии предстательной железы, рака предстательной железы, угрей, облысения по мужскому типу и гирсутизма.
Вдобавок недавно было обнаружено, что у человека существует два изоэнзима 5α-редуктазы, различающихся по распределению в тканях, сродству к тестостерону, профилю pH и чувствительности к ингибиторам (см. Russell, D.W. et al., J.Clin. Invest., 89, 293 (1992); Russell, D.W. et al., Nature, 354, 159 (1991)). Лица с дефицитом стероидной 5α-редуктазы, изученные Imperato-McGinley страдают дефицитом фермента 5α-редуктазы 2 типа (Russell, D.W. et al. , J. Clin.Invest., 90, 799 (1992); Russell, D.W. et al., New England J. Med. , 327, 1216 (1992)), являющегося преобладающим изоэнзимом в предстательной железе, в то время как изоэнзим 1 типа преобладает в коже. Относительная ценность изоэнзимспецифичных и двойных ингибиторов двух изоэнзимов 5α-редуктазы будет зависеть от типа излечиваемого заболевания (доброкачественная гиперплазия предстательной железы, рак предстательной железы, угри, облысение по мужскому типу или гирсутизм) так же, как и от стадии заболевания (предотвращение или лечение) и ожидаемых побочных эффектов у выбранных пациентов (например лечение угревой сыпи у лиц мужского пола в периоде полового созревания).
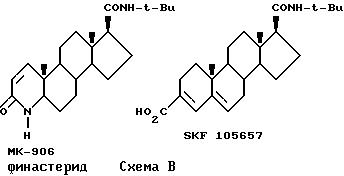
Вследствие своего значительного терапевтического потенциала, ингибиторы тестостероновой 5α-редуктазы (далее по тексту "ингибиторы 5α-редуктазы") были предметом повсеместного активного исследования, к примеру см. Hsia, S. и Voight, W. , J. lnvest. Derm., 62, 224 (1973); Robair, в et al., J.Steroid Biochem., 8, 307 (1977); Petrow, V. et al., Steroids, 38, 121 (1981); Liang, Т. et al., J.Steroid Biochem., 19, 385 (1983); Holt, D. et al., J.Med.Chem., 33, 937 (1990); US Patent N 4377584, US Patent N 4760071 и US Patent N 5017568. Двумя особенно многообещающими ингибиторами 5α -редуктазы являются МК-906 (Merck), известный под общим названием финастерид и распространяемый под торговой маркой Проскар, и SKF-105657 (SmithKline Beecham), показанные на схеме B.
Мощная ингибиция

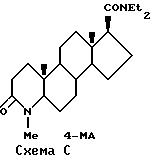
(Tan, C. H. ; Fong, C.Y.; Chan, W.K. Biochem. Biophys. Res. Comm., 144, 166 (1987) и Brandt, M.; Levy, M.A. Biochemistry, 28, 140 (1989)) вместе с критической ролью 3BHSD в биосинтезе стероидов (Potts, G.0. et al., Steroids, 32, 257 (1978)) предполагают, что оптимальные ингибиторы 5α-редуктазы 1 и 2 типов также должны быть селективны к 3BHSD надпочечника человека. Важность селективности ингибиторов 5α-редуктазы также была подчеркнута сообщениями о гепатотоксичности некоторых 4-азастероидов, таких как 4-МА (McConnell, J.D. The Prostate Suppl., 3, 49 (1990) и Rasmusson, G.H. et al. J. Med. Chem., 27, 1690 (1984)).
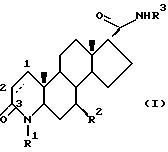
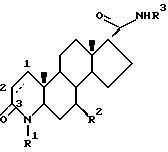
Одним из аспектов данного изобретения является соединение формулы I
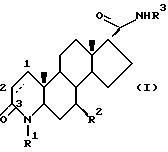
где углероды 1 и 2 соединены либо одиночной, либо двойной связью:
R1 - это водород или метил;
R2 - это водород или метил:
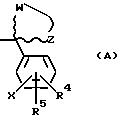
R3 - это соединение (A),
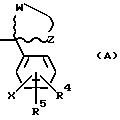
в котором R4 и R5 - это, независимо друг от друга, водород, низший алкил, низшее алкоксисоединение, трифторметил, циан, галоген или фенил (возможно, замещенный одним или несколькими галогенами), или, когда R4 и R5 находятся на соседних атомах углерода, они формируют вместе 5-, 6- или 7-членное кольцо, возможно содержащее один или несколько атомов кислорода или серы;
W и Z - это метиленовые группы, которые, будучи взятыми вместе с атомом углерода, к которому они присоединены, формируют насыщенную кольцевую систему с числом членов от 3 до 12, причем возможно:
1) независимо замещенную одной или несколькими низшими алкильными группами,
2) содержащую атом кислорода или серы,
3) две вышеуказанных метиленовых группы указанного кольца с числом членов от 3 до 12 соединены с (C1-6) алкиленовой группой с образованием бицикличной кольцевой системы; и
X - это водород или галоген;
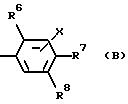
или (B)
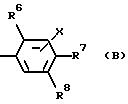
в котором R6 - это трифторметил или фенил, возможно замещенный одним(ой) или несколькими галогенами или разветвленными (C4-7) алкильными группами, или разветвленный (C4-7) алкил;
либо R7, либо R8 - это трифторметил, галоген или фенил, возможно замещенный одним(ой) или несколькими галогенами или разветвленными (C4-7) алкильными группами, или разветвленный (C4-7) алкил, а другой радикал - водород или галоген; и
X - это водород или галоген, и его фармацевтически приемлемые сольваты.
Другими аспектами изобретения являются:
1. Способ ингибирования тестостероновой 5α-редуктазы, представляющий собой контакт тестостероновой 5α-редуктазы с соединением формулы I.
2. Способ лечения андрогенреактивных или опосредованных андрогенами заболеваний, представляющий собой воздействие эффективным количеством соединения формулы I на пациента, нуждающегося в таком лечении.
3. Фармацевтические препараты, содержащие соединение формулы I в качестве действующего начала.
4. Способ лечения андрогенреактивных или опосредованных андрогенами заболеваний, представляющий собой воздействие эффективным количеством соединения формулы I на пациента, нуждающегося в таком лечении в сочетании с антиандрогеном, таким как флютамид.
5. Способ лечения доброкачественной гиперплазии предстательной железы, представляющий собой воздействие эффективным количеством соединения формулы I на пациента, нуждающегося в таком лечении в сочетании с блокатором альфа-1-адренорецепторов (например, теразозином).
6. Способ лечения доброкачественной гиперплазии предстательной железы, представляющий собой воздействие эффективным количеством соединения формулы I на пациента, нуждающегося в таком лечении в сочетании с антиэстрогеном.
7. Некоторые промежуточные химические соединения, используемые при приготовлении соединений формулы I.
Соединения.
Сведущие в искусстве органической химии признают, что многие органические соединения могут образовывать комплексы с растворителями, в которых они реагируют, или из которых они осаждаются или кристаллизуются. Эти комплексы известны как "сольваты". К примеру, комплекс с водой называется "гидрат". Сольваты соединения формулы I находятся в пределах данного изобретения.
Сведущие в органической химии также признают, что многие органические соединения могут существовать в более чем одной кристаллической форме. К примеру, кристаллическая форма может быть разной в разных сольватах. Таким образом, все кристаллические формы соединений формулы I или их фармакологически приемлемые сольваты находятся в пределах данного изобретения.
Примененный здесь термин "низший" по отношению к алкилам и алкоксисоединениям означает от 1 до 6 атомов углерода, в особенности от 1 до 4, прямую или разветвленную цепь. Примененный здесь термин "разветвленный (C4-7) алкил" означает 3-6 атомов углерода, присоединенных через четвертичный углерод, например t-бутил, t-амил и т.д. Термин "галоген" означает фтор, хлор, бром и йод.
Примеры кольцевых систем, образованных W и Z включают в себя: циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклододецил и т.д., норборнил, бицикло[3.3.1.]нонил, тетрагидрофурил, тетрагидропиранил, или тетрагидротиопиранил, но не ограничиваются этим. Предпочтительны кольцевые системы с числом членов от 3 до 8.
Примеры бициклических кольцевых систем, образующихся когда одна из метиленовых групп W соединяется с одной из метиленовых групп Z с помощью (C1-6)
алкиленовой группы, включают в себя
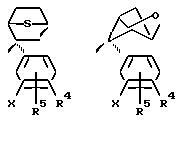
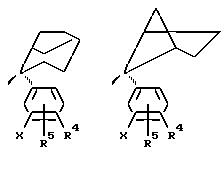
но не ограничиваются этим.
Примеры 5-, 6- или 7-членных колец, образованных R4 и R5, включают в себя
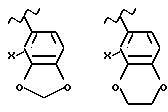
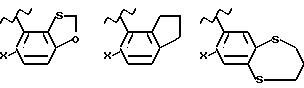
но не ограничиваются этим.
Сведующими в искусстве органической химии будет признано, что "четвертичный углерод" фрагмента (A), т.е. углерод к которому присоединены
-NH-, фенильная
группа, W и Z, может быть асимметричен. Эта асимметрия четвертичного углерода порождает пару стереоизомеров (см. March, J., Advanced Organic Chemistry, 3rd Ed., Chap.4, "Stereochemistry",
John Wiley and Sons, New York (1985)). Более того, когда W и Z замещаются алкильными группами или соединяются с алкиленовой группой, могут возникнуть другие асимметричные атомы углерода, что также
порождает другие пары стереоизомеров. Все стереоизомеры новых соединений, описанных здесь, находятся в пределах данного изобретения.
Использованные здесь волнистые линии, изображающие одиночные связи между четвертичным углеродом и W и Z, обозначают, что эти две связи могут быть в положении α или β по отношению к четвертичному углероду. Термин "альфа" означает, что связь и соответствующий фрагмент располагаются ниже плоскости страницы, в то время как термин "β" обозначает, что связь и соответствующий фрагмент располагаются выше плоскости страницы и изображается здесь жирной клиновидной связью. Использование этих терминов соответствует стандартной химической терминологии.
В частной группе соединений формулы (I) X - это водород. В другой частной группе соединений формулы (I) R2 - это водород. В еще одной группе соединений формулы (I) R6 - это трифторметил или фенил, возможно замещенный одним или несколькими галогенами или разветвленным (C4-7) алкилом; и либо R7, либо R8 - это трифторметил, галоген или фенил, возможно замещенный одним или несколькими галогенами или разветвленным (C4-7) алкилом, в то время как другой радикал - водород или галоген. В другой частной группе соединений формулы (I) атомы углерода 1 и 2 соединены двойной связью.
Частной группой соединений формулы I являются соединения формулы IA
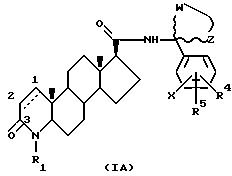
в которой атомы углерода 1 и 2 соединены либо одиночной, либо двойной связью;
R1 - это водород или метил;
R4 и R5 - это, независимо друг от друга, водород, низший алкил, низшее алкоксисоединение, трифторметил, циан, галоген или фенил (возможно, замещенный одним или несколькими галогенами), или, когда R4 и R5 находятся на соседних атомах углерода, они формируют вместе 5, 6 или 7-членное кольцо, возможно содержащее один или несколько атомов кислорода или серы;
W и Z - это метиленовые группы, которые, будучи взятыми вместе с атомом углерода, к которому они присоединены, формируют насыщенную кольцевую систему с числом членов от 3 до 12, причем возможно:
1) независимо замещенную одной или несколькими низшими алкильными группами,
2) содержащую атом кислорода или серы,
3) две вышеуказанных метиленовых группы указанного кольца с числом членов от 3 до 12 соединены с (C1-6) алкиленовой группой с образованием бицикличной кольцевой системы; и
X - это водород или галоген.
В частной группе соединений формулы IA:
R4 и R5
- это, независимо друг от друга, водород, низший алкил, низшее алкоксисоединение, трифторметил, циан, галоген или фенил (возможно замещенный одним или несколькими галогенами), а X представляет собой
водород.
Предпочтительны соединения формулы IA, где хотя бы один из радикалов X, R4 и R5 не является водородом. Фрагменты в положении пара (4-) в фенильном кольце особо предпочтительны.
В частной группе соединений формулы IA по меньшей мере один из радикалов R4 и R5 - это низший алкил, низшее алкоксисоединение, трифторметил, циан, галоген или фенил, в особенности разветвленный алкил, например t-бутил, трифторметил или галоген.
В четырех других частных группах соединений формулы IA:
1) W и Z - это
метиленовые группы, которые, будучи взяты вместе с атомом углерода, к которому они присоединены, формируют насыщенную кольцевую систему с числом членов от 3 до 12, содержащую только атомы углерода, и
которые могут быть независимо замещены одной или несколькими низшими алкильными группами; или
2) W и Z - это метиленовые группы, которые, будучи взяты вместе с атомом углерода, к которому они
присоединены, формируют насыщенную кольцевую систему с числом членов от 3 до 12, содержащую атом кислорода или серы, и которые могут быть независимо замещены одной или несколькими низшими алкильными
группами; или
3) W и Z - это метиленовые группы, которые, будучи взяты вместе с атомом углерода, к которому они присоединены, формируют насыщенную кольцевую систему с числом членов от 3 до 12,
содержащую только атомы углерода, и которые могут быть независимо замещены одной или несколькими низшими алкильными группами, и две указанные метиленовые группы соединяются (C1-6)
алкиленовой группой с образованием бициклической кольцевой системы; или
4) W и Z - это метиленовые группы, которые, будучи взяты вместе с атомом углерода, к которому они присоединены,
формируют насыщенную кольцевую систему с числом членов от 3 до 12, содержащую атом кислорода или серы, и которые могут быть независимо замещены одной или несколькими низшими алкильными группами, и две
указанные метиленовые группы соединяются (C1-6) алкиленовой группой с образованием бициклической кольцевой системы.
Другой частной группой соединений формулы I являются
соединения формулы IB
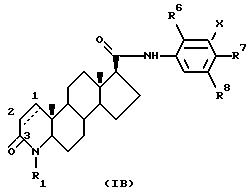
где атомы углерода 1 и 2 соединены либо одиночной, либо двойной связью;
R1 - это водород или метил;
R6 - это трифторметил, или фенил, возможно замещенный одним(ой) или несколькими галогенами или разветвленными (C4-7) алкильными группами, или разветвленный (C4-7) алкил;
либо R7, либо R8 - это трифторметил, галоген или фенил, возможно замещенный одним(ой) или несколькими галогенами или разветвленными (C4-7) алкильными группами, или разветвленный (C4-7) алкил, а другой радикал - водород или галоген; и
X - это водород или галоген.
В частной группе соединений формулы IB, когда R7 или R8 - это разветвленный (С4-7) алкил, а X - это водород, R6 - это трифторметил или фенил, возможно замещенный одним или несколькими галогенами.
В другой частной группе соединений формулы IB:
R6 - это трифторметил или разветвленный (C4-7) алкил;
и
либо R7, либо R8 - это трифторметил, галоген или фенил, замещенный одним или несколькими галогенами, а другой радикал - это водород или галоген.
В
другой частной группе соединений формулы IB:
R6 - это трифторметил или разветвленный (C4-7) алкил;
либо R7, либо R8 - это трифторметил, а
другой радикал - это водород; и
X - это водород.
В другой частной группе соединений формулы (IB) R6 и R8 - это независимо друг от друга трифторметил или t-бутил, а R7 и X это водород.
Конкретными соединениями формулы I являются:
Соединение/Пример
1. 17β- N-1-(4-Хлорфенил)циклопентилкарбамоил-4-аза
-5α- андростан-3-он
2. 17β- N-1-(4-Хлорфенил)циклопентилкарбамоил-4-метил-4-аза -5α- андростан-3-он
3. 17β- N-1-(4-Хлорфенил)циклопентилкарбамоил-4-аза
-5α- андрост-1- ен-3-он
4. 17β- N-1-(4-t-Бутилфенил)циклопентилкарбамоил-4-аза -5α-андрост-1-ен-3-он
5. 17β
- N-1-(4-t-Бутилфенил)циклогексилкарбамоил-4-аза -5α-андрост-1-ен-3-он
6. 17β- N-1-(4-Хлорфенил)циклогексилкарбамоил-4-аза -5α-андрост-1-ен-3-он
7. 17β
- N-1-(4-Трифторметилфенил)циклопентилкарбамоил-4-аза -5α-андрост-1-ен-3-он
8. 17β- N-1-(4-Метоксифенил)циклопентилкарбамоил-4-аза -5α-андрост-1-ен-3-он
9.
17β- N-1-(4-Фтopфeнил)циклопентилкарбамоил-4-аза -5α-андрост-1-ен-3-он
10. 17β- N-1-(4-Фторфенил)циклогексилкарбамоил-4-аза -5α-андрост- 1-ен-3-он
11.
17β- N-1-(4-Метоксифенил)циклогексилкарбамоил-4-аза -5α-андрост-1-ен-3-он
12. 17β- N-1-(3,4-Метилендиоксифенил) циклогексилкарбамоил-4-аза -5α-андрост-1-ен-3-он
13. 17β- N-1-(4-t-Бутилфенил) циклогептилкарбамоил-4-аза -5α-андрост-1-ен-3-он
14. 17β- N-1-(4-t-Бутилфенил)тетpaгидpoпиpaнилкapбaмoил-4-aзa -5α
-андрост-1-ен-3-он
15. 17β- N-1-(2,4-Дихлорфенил)циклопропилкарбамоил-4-аза -5α-андрост-1-ен-3-он
16. 17β- N-1-(4-Трифторметилфенил)-2,
2-диэтилциклопропилкарбамои-4-аза -5α-андрост-1-ен-3-он
17. 17β- N-1-(4-t-Бутилфенил)-4,4-диметилциклогексилкарбамоил-4- аза-5α-андрост-1-ен-3-он
18. 17β
- N-1-(4-t-Бутилфенил)-4-t-бутилциклогексилкарбамоил-4-аза -α-андрост-1-ен-3-он
19. 17β- N-1-(3-Трифторметилфенил)циклопентилкарбамоил-4-аза -5α-андрост-1-ен-3-он
20. 17β- N-1-(4-t-Бутилфенил)тетрагидротиопиранилкарбамоил-4-аза -5α-андрост-1-ен-3-он
21. 17β- N-1-(4-Бифенил)-2,2-диэтилциклoпpoпилкapбaмoил-4-aзa -5α
-андрост-1-ен-3-он
22. 17β- N-(2,5-Биc(Tpифтopметил))фенилкapбaмoил-4-aзa -5α-андростан-3-он
23. 17β- N-(2,5-Бис(Трифторметил))фенилкарбамоил-4-метил-4-аза
-5α-андростан-3-он
24. 17β- N-(2-t-Бутил-5-трифторметил)фенилкарбамоил-4-аза -5α-андрост-1-ен-3-он
25. 17β
- N-(2-t-Бутил-5-трифторметил)фенилкарбамоил-4-аза -5α-андростан-3-он
26. 17β- N-(2-t-Бутил-5-трифторметил)фенилкарбамоил-4-метил-4-аза- 5α-андростан-3-он
27.
17β- N-(2,5-Ди-t-бутил)фенилкарбамоил-4-аза -5α-андрост-1-ен-3-он
28. 17β- N-(2,5-Ди-t-бутил)фенилкарбамоил-4-аза -5α-андростан-3-он
29. 17β- N-(2,
5-Ди-t-бутил)фенилкарбамоил-4-метил-4-аза -5α-андростан-3-он
30. 17β- N-(2,5-Бис(Трифторметил))фенилкарбамоил-4-аза-7β- метил-5α-андрост-1-ен-3-он
31.
17β- N-(2-t-Бутил-5-трифторметил)фенилкарбамоил-4-аза-7β- метил-5α-андрост-1-ен-3-он
32. 17β- N-1-(4-Xлopфенил)циклoпeнтилкapбaмoил-4-aзa-7β- метил-5α
-андрост-1 -ен-3-он
33. 17β- N-9-(4-t-Бутилфенил)бицикло[3.3.1] нонилкабрамоил-4-аза -5α-андрост-1-ен-3-он.
В частности, конкретным соединением формулы I
является:
17β- N-1-(4-хлорфенил)циклопентилкарбамоил-4-аза -5α-андрост-1-ен-3-он.
Конкретными промежуточными соединениями формул III, IV и IVa являются:
17β- N-1-(4-хлорфенил)циклопентилкарбамоил-андрост-4-ен-3-он,
17β- N-1-(4-хлорфенил)циклопентилкарбамоил-5-оксо-A-нор-3,5- секоандростан-3-оевая кислота; и
17β
- N-1-(4-хлорфенил)циклопентилкарбамоил-4-аза-андрост-5-ен-3-он.
Приготовление соединений.
Соединения данного изобретения могут быть приготовлены способами, описанными в патентах США 4377584 (далее по тексту "584") и 4760071 (далее по тексту "071"), на которые в тексте дана только ссылка. Например, соединения формулы I, в которых атомы углерода 1 и 2 соединены одиночной связью, могут быть приготовлены способом, показанным на схеме I.
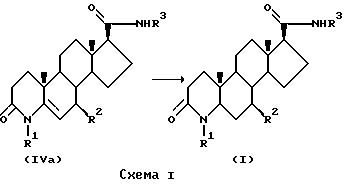
На схеме I 4-аза-андрост-5-ен-3-оновое соединение формулы (IVa) превращается в соответствующий 4-аза-5α-андростан-3-он формулы I путем гидрогенизации. Например, гидрогенизация может быть проведена в уксусной кислоте при температуре от 60 до 70oC и давлении водорода 40-60 psi в присутствии катализирующего оксида платины.
Соединения формулы IVa могут быть приготовлены способом, показанным на схеме IA.
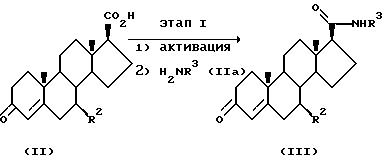
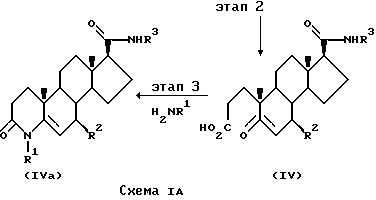
На этапе I схемы IA, 3-оксо-4-андростен-17β-карбоновая кислота II превращается в соответствующий амид формулы III. Это может быть совершено путем активации кислоты и реакции с соединением формулы IIa. Например, последовательность реакций может представлять собой превращение соединения формулы II в галогенангидрид путем воздействия галогенизирующего агента, такого как оксалилхлорид или тионилхлорид в апротонном растворителе, таком как толуол, метиленхлорид или тетрагидрофуран при температуре от -5 до 10oC в присутствии основания, такого как пиридин. Промежуточный галогенангидрид, например хлорангидрид кислоты, может реагировать с амином формулы IIa (где заместители соответствуют определенным для формулы I), возможно в присутствии катализатора, такого как 4-N,N-диметиламинопиридин, при температуре от 25 до 70oC, в апротонном растворителе, таком как тетрагидрофуран, с образованием амида формулы III.
Соединения формулы IIa, где R3 - это (A), т.е. циклоалкилбензиламины, приготовляются Куртиусовой перегруппировкой соответствующей кислоты, когда это доступно, или способом Не, X. et al. J.Med. Chem., 36, 1188 (1993), т.е. путем реакции соответствующего циклоалканона с приемлемым арильным реагентом Гриньяра с последующим превращением получившегося спирта в амин путем воздействия азидом натрия и трифторуксусной кислотой с последующим восстановлением азида литий-алюминий гидридом. Замещенные циклопропилбензиламины формулы IIa приготовляются путем катализируемой радием вставки подходящего арил-альфа-диазоэфира (приготовленного способом Baum, J.S. et al., Synthetic Comm., 17, 1709 (1987)) в подходящий олефин (как описано Davies, H.W. et al. , Tetrahedron Lett., 30, 5057 (1989)) с последующим омылением эфира и Куртиусовой перегруппировкой кислоты с образованием желаемого амина. Соединения формулы IIa, где R3 - это (B), т.е. замещенные анилины, доступны в продаже или удобным образом приготавливаются способами, известными специалистам (см. Blakitnyi et al., J.Org.Chem. USSR (English translation) (Блакитный и соавт. Органическая химия СССР. (англ.перевод)) 10, 512 (1974), кратко изложенный в СА 80 (25): 14623f и Reetz, M.T. et al., Angew.Chem.Int. Ed.Engl., 19, 900 and 901 (1980)).
На этапе 2 соединение формулы III превращается в производное 5-оксо-A-нор-3,5-секоандростан-3-оевой кислоты формулы IV путем окисления, например путем воздействия водным перманганатом натрия и перодатом натрия при нормальных условиях при дефлегмации в t-бутаноле.
На этапе 3 соединение формулы IV превращается в соответствующее соединение формулы IVa путем воздействия соединением с формулой NH2R1, например аммиака (R1=Н) или метиламина (R1=метил), при повышенной температуре в протонном или апротонном растворителе, например при дефлегмации в этиленгликоле.
Соединения формулы I также могут быть приготовлены путем взаимного превращения из других соединений формулы I. Например, процесс, показанный на схеме IB может быть использован для приготовления соединения формулы I, где имеет место двойная связь между атомами углерода 1 и 2 и R1 - это водород, т. е. соединения формулы Ib из соответствующего соединения формулы I, т.е. соединения формулы Ia.
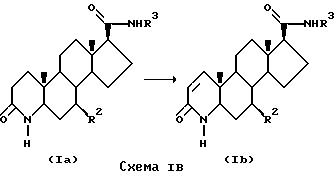
На схеме IB соединение формулы Ia дегидрогенизируется с образованием соответствующего 4-аза-5α-андрост-1-ен-3-она формулы Ib путем воздействия дегидронизирующей системы, например 2,3-дихлор-5,6-дициано-1,4-бензохинона (DDQ) и бис(три-метилсилил)трифторацетамида в сухом диоксане при комнатной температуре в течение 2-5 ч с последующим нагреванием при дефлегмации в течение 10-20 ч (cм. Bhattacharya, A. et al., J.Am.Chem.Soc., 110, 3318 (1988).
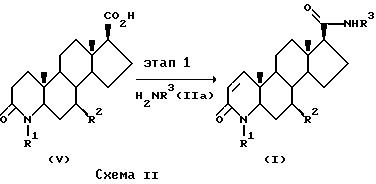
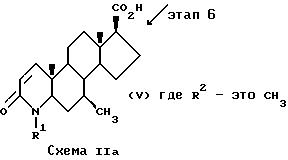
В альтернативном случае на схеме II соединения формулы I, в которых атомы углерода 1 и 2 соединены двойной связью, могут быть приготовлены из 3-оксо-4-аза-5α-андрост-1-ен-17β- карбоновых кислот формулы V путем реакции с соединением формулы IIa так, как описано на схеме IA, этап 1. Соединения формулы V, в которых R2 - это водород, могут быть приготовлены способом Rasmusson, G. H. et al., J. Med. Chem., 29, 2298 (1986). Соединения формулы V, в которых R2 - это метил, могут быть приготовлены в соответствии со схемой IIa.
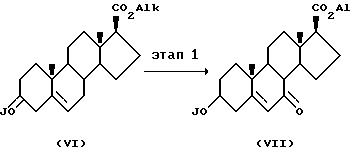
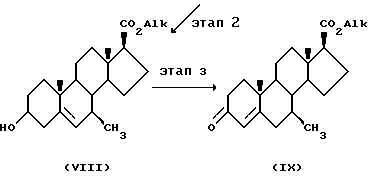
На Этапе 1 соединение формулы (VI), в котором JO - это защищенная гидроксигруппа, например триизопропилсилилоксигруппа, a CO2Alk - это группа эфира карбоновой кислоты, например метиловый эфир, реагирует с сильным окисляющим комплексом тяжелого металла, например хромовая кислота/3, 5-диметил пиразол в апротонном растворителе, например дихлорметане, образуя соответствующее соединение формулы (VII). Соединения формулы (VI) могут быть приготовлены из эфира 3β -гидроксиэтиеновой кислоты (J.Med.Chem. 27, 1690) способом, описанным в заявке на патент РСТ W0 94/14833. Например, метиловый эфир 3β-гидроксиэтиеновой кислоты может реагировать с реагентом, защищающим гидроксигруппу, таким как триизопропилсилилхлорид, в присутствии основания, например имидазола в апротонном растворителе, таком как диметиловый формамид или дихлорметан, при умеренных температурах от 25 до 55oC.
На этапе 2 фрагмент 7-оксо соединения формулы VII превращается в соответствующую алкильную группу, например метиловую группу, путем воздействия виттиговым реагентом с последующей каталитической гидрогенизацией и снятием защиты с 3-гидроксигруппы с образованием соответствующего соединения формулы VIII. Например, соединение формулы VII может реагировать с йодидом метил трифенилфосфония и n-бутил-литием в апротонном растворителе, таком как тетрагидрофуран, в диапазоне температур от примерно -5 до 10oC, например при 0o C, с образованием соответствующего 7-алкилиденового производного. Экзоциклическая двойная связь может затем быть избирательно восстановлена путем воздействия хлоридом трис(трифенилфосфин)родия в водородной атмосфере с образованием преимущественно замещенного 7β-алкильного соединения. Защищающая группа на 3-гидрокси затем удаляется с образованием соединения формулы VIII. Например, если защищающая группа - это триизопропилсилил, она может быть удалена путем обработки фторидом тетрабутиламмония в тетрагидрофуране.
На этапе 3 3-гидроксигруппа соединения формулы VIII окисляется с образованием соответствующего 3-оксо-фрагмента с миграцией двойной связи с образованием соединения формулы IX. Например, окисление может совершаться реагентом Джонса в алкилкетоне, таком как ацетон, при температуре, примерно равной комнатной.
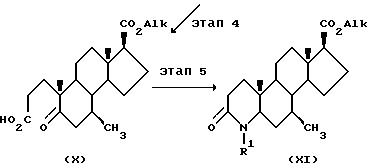
На этапе 4 соединение формулы IX окисляется способом, аналогичным описанному на этапе 2 схемы Ia с образованием соответствующего производного 5-оксо-A-нор-3,5-секоандростан-3-оевой кислоты формулы X.
На этапе 5 соединение формулы X превращается в соответствующее соединение формулы XI способом, аналогичным описанному на схеме I.
На этапе 6 соединение формулы XI дегидрогенизируется способом, аналогичным описанному на схеме IB, с образованием соответствующего 4-аза-5α -андрост-1-ен-3-онового производного. Группа эфира 17-карбоновой кислоты затем превращается путем омыления в соответствующую группу 17-карбоновой кислоты с образованием соединения формулы V. Например, группа эфира карбоновой кислоты может быть превращена в карбоксильную группу путем воздействия от среднего до сильного основания в протонном или апротонном растворителе, например воздействием гидроксида металла, такого как гидроксид лития, в диоксане/воде при температуре, примерно равной комнатной.
Очевидно, что на ранних стадиях приготовления соединения формулы I или его сольвата может быть необходимым и/или желательным защитить одну или несколько чувствительных групп молекулы для предотвращения нежелательных побочных реакций.
Защищающие группы, используемые в соединениях формулы I, могут использоваться обычным способом. Например, см. Protective Groups in Organic Chemistry, Ed. J.F.W. McOmie, Plenum Press, London (1973) или Protective Groups in Organic Synthesis, Theodora Green. John Wiley and Sons, New York (1981).
Удаление каких-либо имеющихся защищающих групп может выполняться обычным способом. Арилалкильная группа, такая как бензил, может отщепляться путем гидрогенолиза в присутствии катализатора, например палладированного угля; ацильная группа, такая как N-бензилоксикарбонил может быть удалена путем гидролиза, например с бромидом водорода в уксусной кислоте, или путем восстановления, например путем каталитической гидрогенизации.
Очевидно, что в любом из вышеописанных общих процессов может быть желательно или даже необходимо защитить любые чувствительные группы молекул, как только что было описано. Таким образом, этап реакции, включающий в себя депротекцию защищенного производного общей формулы I, или его соли, может быть проведен следом за любым из вышеописанных процессов.
Таким образом, в соответствии с дальнейшим аспектом изобретения, следующие реакции могут, если
необходимо и/или желательно, быть проведены в любой приемлемой последовательности следом за любым из общих процессов:
(i) удаление любых защищающих групп; и
(ii) превращение
соединения формулы I или его сольвата в его фармацевтически приемлемый сольват.
Помимо использования в последнем главном этапе последовательности приготовления, общие способы, описанные выше для приготовления соединений данного изобретения, могут также быть использованы для введения желаемых групп на промежуточных стадиях приготовления требуемого соединения. Поэтому следует обратить внимание, что в таких многостадийных процессах последовательность реакций должна быть выбрана таким образом, чтобы условия реакций не влияли на те имеющиеся в молекуле группы, которые желательны в конечном продукте.
Соединения формулы I и промежуточные соединения II - XI, указанные на схемах I и II могут быть очищены известными традиционными способами, например хроматографией или кристаллизацией.
Анализы In vitro.
5α-Редуктазы стероидов.
Ферментативная активность может быть определена с использованием микросом, полученных из 1) ткани предстательной железы пациентов с доброкачественной гиперплазией предстательной железы; 2) инфицированных рекомбинантным бакуловирусом клеток SF9, которые вырабатывают человеческую 5α-редуктазу 1 типа; или 3) инфицированных рекомбинантным бакуловирусом клеток SF9, которые вырабатывают человеческую 5α-редуктазу 2 типа. Микросомы были приготовлены путем гомогенизации ткани или клеток с последующим дифференцирующим центрифугированием гомогената. Экстракты микросом были инкубированы с разными концентрациями [1,2,6,7-3H]-тестостерона, 1 мМ НАДФ-Н и различными количествами соединений формулы I, т. е. тестируемого соединения, в буфере, содержащем систему регенерации НАДФ-Н, способную поддерживать концентрацию НАДФ-Н в течение периода от 0, 5 до 240 минут. В качестве контрольного исследования проводились соответствующие инкубации без тестируемого соединения.
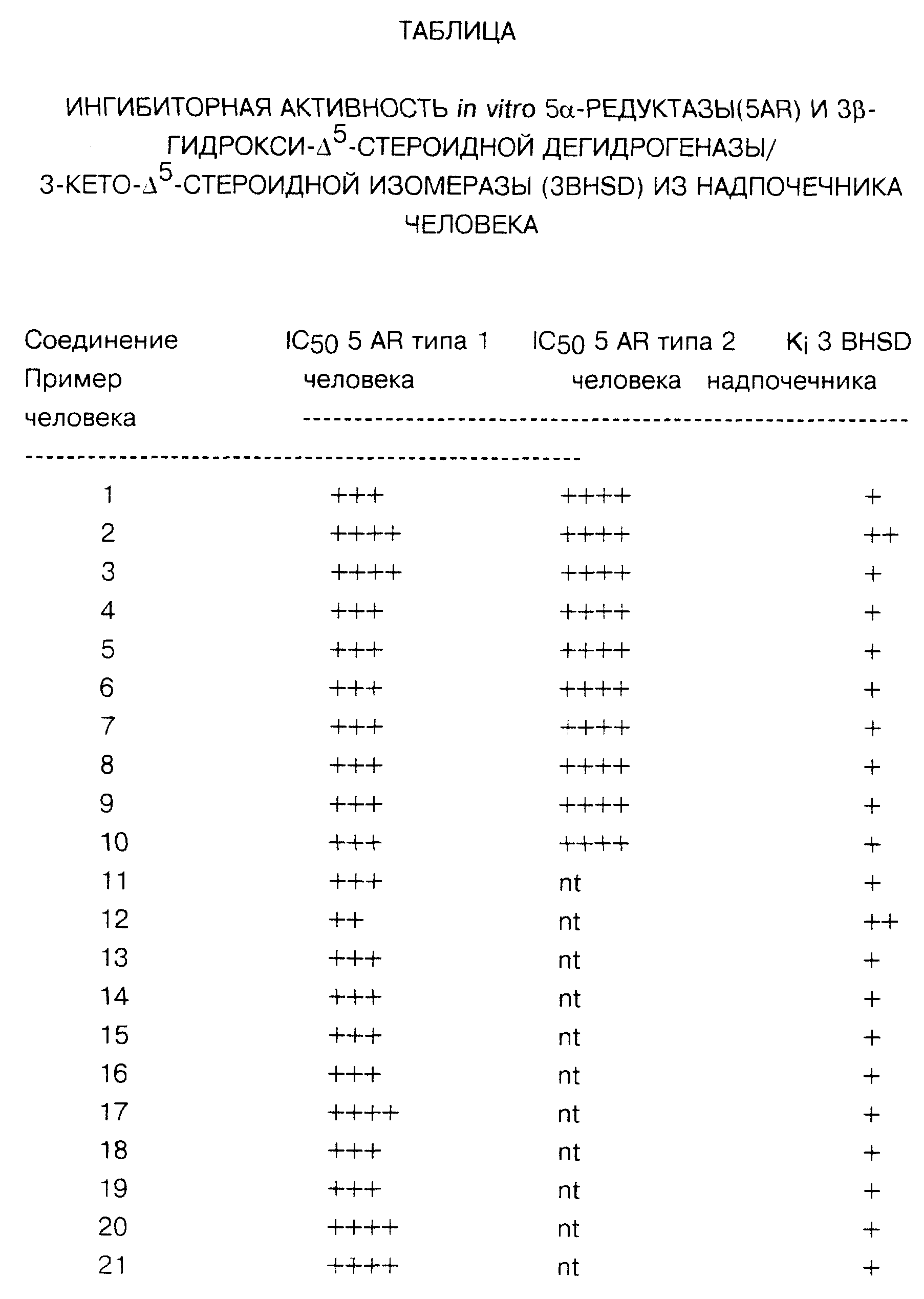
Для измерений IC50 1 типа компоненты пробы, исключая тестостерон, преинкубировались в течение 10 минут при pH 7,0, и после добавления 100 нМ тестостерона пробы оставляли для прохождения реакции на 10-120 мин. Для измерений IC50 2 типа компоненты пробы, исключая тестостерон, преинкубировались в течение 20 минут при pH 6,0, и после добавления 8 нМ тестостерона пробы оставляли для прохождения реакции на 20-40 минут. Процент превращения тестостерона в ДГТ в присутствии тестируемых соединений в сравнении с соответствующим превращением в контрольном исследовании оценивался с использованием высокоэффективной жидкостной хроматографии (HPLC) с радиохимическим определением. Результаты этих анализов приведены как IC50, указанные в таблице.
3β-Гидрокси-Δ5-стероидная дегидрогеназа/3-кето-Δ5-стероидная изомераза.
Ферментативная активность определяется, используя микросомы, полученные из ткани надпочечника человека. Микросомы были приготовлены путем гомогенизации ткани или клеток с последующим дифференцирующим центрифугированием гомогената. Экстракты микросом были инкубированы с разными концентрациями дегидроэпиандростерона (ДГЭА), 1 мМ НАД+, и различными концентрациями соединений формулы I, т.е. тестируемого соединения, в буфере с pH 7,5 в течение периода от 1 до 60 минут. В качестве контрольного исследования проводились соответствующие инкубации без тестируемого соединения.
Процент превращения ДГЭА в андростендион в присутствии тестируемых соединений в сравнении с соответствующим превращением в контрольном исследовании оценивался с использованием HPLC с радиохимическим определением. Результаты этих анализов приведены как Ki, указанные в таблице.
In vivo оценка ингибиторов 5α-редуктазы стероидов.
Активность ингибиторов 5α-редуктазы стероидов in vivo может быть определена в хронической модели крысы (Brooks, J.R. et al., Steroids, 47, 1 (1986)). Хроническая модель использует кастрированных самцов крысы, ежедневно получавших тестостерон в дозе 20 мкг на крысу подкожно и тестируемые соединения (0,01-10 мг/кг) или носитель перорально в течение 7 дней. Затем животные умерщвлялись и их предстательные железы взвешивались. Уменьшение веса предстательной железы, стимулированной тестостероном, демонстрировало активность тестируемого соединения. Параллельно испытывались известные ингибиторы стероидной 5α-редуктазы с целью убедиться в состоятельности способа исследования.
Применимость.
Ингибиторы 5α-редуктазы стероидов, описанные в данном изобретении, полезны в лечении андроген-реактивных заболеваний, например доброкачественных и злокачественных заболеваний предстательной железы, в особенности доброкачественной гиперплазии предстательной железы, способом, подобным тому, как применяются другие ингибиторы 5α-редуктазы, такие как финастерид и SKF105657. По вопросу корреляции данных in vitro, in vivo у крыс, и клинических данных у человека по отношению ингибитору 5α-редуктазы, см. Stoner, E. et al., J.Steroid Biochem. Molec. Biol., 37, 375 (1990); Brooks, J.R. et al. , Steroids, 47, 1 (1986) и Rasmusson, G.H. et al., J.Med.Chem, 29, 2298 (1986)).
Соединения данного изобретения также полезны в лечении простатита, рака предстательной железы, опосредованных андрогенами заболеваний кожи, таких как угри, гирсутизм и облысение по мужскому типу. Другие связанные с гормонами заболевания, например поликистоз яичников, также могут лечиться данными соединениями.
Количество соединения формулы I, требуемое для эффекта действия в качестве ингибитора 5α-редуктазы, будет, конечно, варьироваться у разных индивидуальных млекопитающих и подлежит полностью определению лечащим врачом или ветеринаром. Факторы, подлежащие рассмотрению, включают излечиваемое заболевание, способ применения, природу препарата, массу тела млекопитающего, площадь поверхности тела, возраст и общее состояние и конкретное применяемое соединение. Однако приемлемая эффективная ингибирующая 5α-редуктазу доза находится в пределах от 0,001 до примерно 2 мг/кг массы тела в день, предпочтительно в пределах от 0,005 до примерно 1 мг/кг в день.
Общая дневная доза может быть дана как однократная доза, несколько доз, например от 2 до 6 раз в день, или внутривенным вливанием заданной продолжительности. Дозы, превышающие пределы, указанные выше, или не достигающие их, входят в настоящее изобретение и могут применяться у конкретных пациентов, если это желательно или необходимо. Например, для млекопитающего весом 75 кг диапазон доз будет от примерно 0,4 мг до примерно 75 мг в день, а типичная доза будет примерно 10 мг в день. Если показаны отдельные многократные дозы, лечение может обычно состоять из 2,5 мг соединения формулы I, даваемых 4 раза в день.
Препараты.
Препараты данного изобретения для использования в медицине состоят из действующего начала, т.е. соединения формулы I, и его приемлемого носителя и по желанию из других терапевтически активных ингредиентов. Носитель должен быть фармацевтически приемлемым в смысле совместимости с другими ингредиентами препарата и отсутствия вреда для реципиента.
Поэтому данное изобретение в дальнейшем предоставляет фармацевтический препарат, состоящий из соединения формулы I и его фармацевтически приемлемого носителя.
Препараты включают в себя пригодные для перорального, ректального, местного или парентерального (включая подкожное, внутримышечное и внутривенное) применения формы. Предпочтительны формы, пригодные для перорального или парентерального применения.
Препараты могут быть удобным образом предоставлены в форме дозированной расфасовки и могут быть приготовлены любым из методов, хорошо известных в искусстве фармацевтики. Все методы включают в себя этап совмещения действующего начала с носителем, составляющим один или несколько дополнительных ингредиентов. Обычно препараты приготовляются путем унифицированного однородного совмещения действующего начала с жидким носителем или тонко измельченным твердым носителем и затем, если необходимо, придание продукту формы желаемой дозированной расфасовки.
Препараты данного изобретения, пригодные для перорального применения, могут быть представлены как дискретные единицы, такие как капсулы, таблетки, пастилки или облатки, каждая из которых содержит предопределенное количество действующего начала; как порошок или гранулы; или как суспензия, или раствор в водной жидкости, или неводной жидкости, например сироп, эликсир, эмульсия или вытяжка.
Таблетка может быть приготовлена путем прессования или формовки, по желанию с одним или несколькими дополнительными ингредиентами. Прессованные таблетки могут быть приготовлены путем прессования в подходящем устройстве действующего начала в свободно текущей форме, например в порошке или в гранулах, смешанного при желании с дополнительными ингредиентами, например связующими, любрикантами, инертными растворителями, поверхностно-активными или распределяющими агентами. Формованные таблетки могут быть приготовлены путем формования смеси порошка действующего начала с любым подходящим носителем в подходящем устройстве.
Сироп или суспензия могут быть приготовлены путем добавления действующего начала к концентрированному водному раствору сахара, например сахарозы, к которому также могут быть добавлены любые дополнительные ингредиенты. Такие дополнительные ингредиенты могут включать ароматизатор, агент, задерживающий кристаллизацию сахара, или агент, увеличивающий растворимость любого другого ингредиента, например такой как многоатомный спирт, например глицерин или сорбит.
Препараты для ректального применения могут быть представлены в форме свечей с обычным носителем, например маслом какао или Witepsol S55 (товарный знак Dynamite Nobel Chemical, Germany) в качестве основы свечи.
Препараты, пригодные для парентерального применения, традиционно состоят из стерильного вводного раствора действующего начала, предпочтительно изотоничного крови реципиента. Таким образом, подобные препараты могут содержать дистиллированную воду, 5% декстрозу в дистиллированной воде или физиологический раствор. Применяемые препараты также включают концентрированные растворы или твердые вещества, содержащие соединение формулы I, которые при разведении соответствующим растворителем дают вышеуказанный пригодный для парентерального применения раствор.
Местные препараты включают в себя мази, кремы, гели и лосьоны, которые могут быть приготовлены обычными методами, известными в фармацевтике. Кроме действующего начала и основы мази, крема, геля или лосьона, подобный местный препарат может также содержать консерванты, отдушки и дополнительные фармацевтически активные агенты.
В добавление к вышеупомянутым ингредиентам препараты данного изобретения могут также включать в себя один или несколько возможных дополнительных ингредиентов, используемых в фармацевтических препаратах, например разбавителей, буферов, ароматизаторов, связывающих агентов, поверхностно-активных агентов, сгустителей, любрикантов, суспендирующих агентов, консервантов (включая антиоксиданты) и т.п.
Нижеследующие примеры иллюстрируют аспекты данного изобретения, но не должны истолковываться как ограничения. Символы и описания, используемые в данных примерах, соответствуют используемым в современной химической литературе, например Journal of the American Chemical Society.
Пример 1.
17β- N-1-(4-Хлорфенил)циклопентилкарбамоил-4-аза -5α-андростан-3-он (соединение 1).
A. 17β - N-1-(4-Хлорфенил)циклопентилкарбамоил-андрост-4-ен-3-он.
К суспензии 3-оксо-4-андростен -17β-карбоновой кислоты (Rasmusson, G.H. et al., J. Med.Chem., 27, 1690 (1984)) (10,44 г, 32,9 ммоль), в толуоле (330 мл) и сухом пиридине (3,75 мл) при 0oC добавляется тионил хлорид (3,6 мл, 49 ммоль). Реакционная смесь перемешивается в течение 15 минут при 0oC и затем перемешивается при комнатной температуре в течение 1 часа. Затем реакционная смесь охлаждается до 0oC, обрабатывается 4-N,N-диметиламинопиридином (1,01 г, 8,28 ммоль) и 1-амино-1-(4- хлорфенил)-циклопентаном (12,90 г, 65,9 ммоль; приготовлен Куртиусовой перегруппировкой соответствующей кислоты), затем нагревается до комнатной температуры и перемешивается в течение ночи. Затем реакционная смесь последовательно экстрагируется 1N HCl, 10%-ным NaOH, водой и солевым раствором, высушивается на сульфате натрия и фильтруется. Фильтрат концентрируют и подвергают флэш-хроматографии на силикагеле, элюируя 35-50% градиентом этилацетат-гексана с получением, после концентрации, 17β-N-1-(4-хлорфенил) циклопентилкарбамоил-андрост-4-ен-3-она в форме беловатой пены; выход: 8,44 г (52%).
B. 17β-N-1-(4-Хлорфенил) циклопентилкарбамоил-5-оксо-A-нор-3,5- секоандростан-3-оевая кислота.
К находящемуся при дефлегмации раствору 17β-N-1-(4-хлорфенил) циклопентилкарбамоил-андрост-4-ен-3-она (8,44 г, 17,1 ммоль), приготовленному как указано выше на стадии A, t-бутанола (130 мл), карбоната натрия (3,18 г, 25,6 ммоль) и воды (35 мл) в течение 35 минут добавляют находящийся при 75oC раствор перманганата калия (0,67 г, 4,3 ммоль), перйодата натрия (25,57 г, 120 ммоль) и воды (190 мл). После дополнительных 35 минут дефлегмации гетерогенную смесь охлаждают до комнатной температуры, фильтруют через слой броунмиллерита, твердую часть смывают водой, а фильтрат концентрируют in vacuo для удаления t-бутанола. Получившийся водный раствор подкисляют до pH 2 с помощью 6N HCl и затем экстрагируют с помощью CH2Cl2 (4х100мл). Фазы CH2Cl2 комбинируются и промываются водой, высушиваются на сульфате натрия, фильтруются и концентрируются in vacuo с получением 17β-N-1-(4-хлорфенил) циклопентилкарбамоил-5-оксо-A-нор-3,5- секоандростан-3-оевой кислоты в форме беловатого твердого вещества; выход: 7,30 г (неочищенных 83%).
Этот материал непосредственно переносится на нижеследующий этап C.
C. 17β-N-1-(4-Хлорфенил) циклопентилкарбамоил-4-аза-андрост-5-ен-3-он.
К суспензии 17β-N-1-(4-хлорфенил) циклопентилкарбамоил-5- оксо-A-нор-3,5-секоандростан-3-оевой кислоты (4,78 г, 9,30 ммоль), полученной на этапе B, в сухом этиленгликоле (20 мл) при -5oC добавляют аммиак (рассч. 3,5 мл, 0,14 моль) и смесь перемешивают в течение 30 минут при 0oC. Получившийся раствор нагревают до 170oC в течение 1 часа и после 1 часа при температуре 170oC реакционную смесь охлаждают до 30oC и добавляют воду. Получившуюся суспензию разводят 1N HCl, экстрагируют хлороформом (4х100 мл), после чего экстракт высушивают на сульфате натрия, фильтруют и концентрируют с получением 17β-N-1-(4-хлорфенил)циклопентилкарбамоил -4-аза-андрост-5-ен-3-она в форме бурого твердого вещества; выход 5,08 г (неочищенных 100%). Этот материал непосредственно переносится на нижеследующий этап D.
D. 17β -N-1- (4-Хлорфенил)циклопентилкарбамоил -4-аза-5α-андростан-3-он.
К раствору 17β-N-1- (4-хлорфенил)циклопентилкарбамоил-4-аза- андрост-5-ен-3-она (см. выше, рассч. 9,30 ммоль) в уксусной кислоте (120 мл) добавляют оксид платины (0,32 г). Получившуюся смесь наводороживают до 56 psi и выдерживают в течение 5 часов при 75oC, после чего остывает до комнатной температуры в течение ночи. После замены водородной атмосферы на азот реакционную смесь фильтруют через целит (броунмеллерит) и целитовые пластины промываются CH2Cl2. Добавляют толуол и фильтрат концентрируют in vacuo до масла, очищаемого проточной хромотографией (толуол/ацетон/этилацетат, от 6: 3: 1 до 1:3:1) с получением 17β- N-1-(4- хлорфенил)циклопентилкарбамоил -4-аза-5α-андростан-3-она в виде смеси с соответствующим 17β первичным амидом; выход: 0,69 г (15%). Последующее очищение этого материала с помощью HPLC (колонка BDS Hypersil C8, 50% CH3CN/вода) и тритурация горячим этилацетатом дают чистый образец: температура плавления 261-263oC, состав, рассч. для C30H41ClN2O2 • 1/4H2O: C 71,83; H 8,34; N 5,58. Обнаруженный: C 71,85; H 8,23; N 5,59.
Пример 2.
17β-N-1- (4-Хлорфенил)циклопентилкарбамоил -4-метил-4-аза-5α-андростан-3-он (соединение 2).
Начиная с 17β-N-1(4-хлорфенил)циклопентилкарбамоил-5- оксо-A-нор-3,5- секоандростан-3-оевой кислоты (1,73г, 3,36 ммоль), полученной на этапе B примера 1, и следуя способу примера 1, этапы C и D, с заменой аммиака на метиламин на этапе C приготавливают 17β-N-1- (4-хлорфенил) циклопентилкарбамоил-4-метил-4-аза-5α-андростан-3-он, температура плавления 125-130oC.
Состав, рассч. для C31H43ClN2O2 • 1/2H2O: C 71,37; H 8,38; N 5,31.
Обнаруженный: C 71,58; H 8,53; N 5,39.
Пример 3.
17β -N-1- (4-Хлорфенил)циклопентилкарбамоил-4-аза-5α-андрост -1-ен-3-он (соединение 3).
К суспензии 3-оксо-4-аза-5α-андрост-1-ен- 17β-карбоновой кислоты (Rasmusson, G.H. et al., J.Med.Chem., 29, 2298 (1986)) (0,159 г, 0,50 ммоль) в толуоле (5 мл), диметилформамиде (0,5 мл) и пиридине (0,06 мл, 0,7 ммоль) при 0oC добавляют тионилхлорид (0,05 мл, 0,7 ммоль). Через 15 минут ледяную баню удаляют и реакционная смесь самостоятельно нагревается до комнатной температуры. Через 1 час реакционную смесь концентрируют in vacuo. Остаток растворяют в сухом CH2Cl2 и 1-амино-1-(4-хлорфенил)-циклопентан (0,49 г, 2,5 ммоль; приготовлен Куртиусовой перегруппировкой соответствующей кислоты) добавляют при комнатной температуре с последующим добавлением 4-N,N-диметиламинопиридина (0,061 г, 0,50 ммоль). Через 4 часа добавляют 1N HCl, смесь экстрагируют CHCl3 (3x100 мл), затем CHCl3 высушивают на MgSO4, фильтруют и концентрируют. Остаток подвергают флэш-хроматографии на силикагеле (толуол/ацетон/этилацетат, от 26:3:1 до 11:3:1) с получением твердого белого вещества при концентрации. Этот материал тритурируют этилацетатом с получением 17β-N-1-(4-хлорфенил) циклопентилкарбамоил -4-аза-5α-андрост-1-ен-3-она в виде белого твердого вещества; выход: 129 мг, (52%); температура плавления 307-309oC (разложение).
Состав, рассч. для C30H39ClN2O2: C 72,78; H 7,94; N 5,66.
Обнаруженный: C 72, 59; H 7,93; N 5,54.
Примеры 4-21.
Данные соединения были приготовлены способом, описанным в примере 3. Амины, недоступные на рынке, были приготовлены способом, описанным в заявке PCT WO 94/14833.
Пример 4.
17β-N-1- (4-t-Бутилфенил)циклопентилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 4).
Температура плавления: 282-285oC.
Состав, рассч. для C34H48N2O2 • 1/4H2O: C 78,34; H 9,38; N 5,37.
Обнаруженный: C 78,29; H 9,40; N 5,38.
Пример 5.
17β-N-1- (4-t-Бутилфенил)циклогексилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 5).
Температура плавления: 233-236oC.
Состав, рассч. для C35H50N2O2 • 1/2H2O: C 77,88; H 9,52; N 5, 19.
Обнаруженный: C 77,82; H 9,54; N 5,21.
Пример 6.
17β-N-1- (4-Хлорфенил)циклогексилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 6).
Температура плавления: 270-272oC.
Состав, рассч. для C31H47ClN2O2: C 73,13; H 8,12; N 5,50.
Обнаруженный: C 73,06; H 8,14; N 5,47.
Пример 7.
17β-N-1-. (4-Трифторметилфенил)циклопентилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 7).
Температура плавления: 294-297oC.
Состав, рассч. для C31H39F3N2O2: C 70,43; H 7,44; N 5,30.
Обнаруженный: C 70,34; H 7,46; N 5,23.
Пример 8.
17β-N-1- (4-Метоксифенил)циклопентилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 8).
Температура плавления: 257-260oC.
Состав, рассч. для C31H42N2O3: C 75,88; H 8,63; N 5,71.
Обнаруженный: C 75,86; H 8,57; N 5,60.
Пример 9.
17β-N-1- (4-Фторфенил)циклопентилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 9).
Температура плавления: 290oC.
Состав, рассч. для C30H39FN2O2: C 75,28; H 8,21; N 5,85.
Обнаруженный: C 75,09; H 8,26; N 5,75.
Пример 10.
17β-N-1- (4-Фторфенил)циклогексилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 10).
Температура плавления: 283-285oC.
Состав, рассч. для C31H41FN2O2: C 75,58; H 8,39; N 5,69.
Обнаруженный: C 75,63; H 8,45; N 5,67.
Пример 11.
17β-N-1- (4-Метоксифенил)циклогексилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 11).
Температура плавления: 238-240oC.
Состав, рассч. для C32H44N2O3 • 1/4H2O: C 75,48; H 8,81; N 5,50.
Обнаруженный: C 75,42; H 8,78; N 5,51.
Пример 12.
17β-N-1- (3,4-Метилендиоксифенил)циклогексилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 12).
Температура плавления: 255-257oC.
Состав, рассч. для C32H42N2O4: C 74,10; H 8,16; N 5,40.
Обнаруженный: C 74,07; H 8,17; N 5,37.
Пример 13.
17β-N-1- (4-t-Бутилфенил)циклогекптилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 13).
Температура плавления: 152-162oC.
Состав, рассч. для C36H52N2O2 • 1/2 H2O: C 78,07; H 9,65; N 5,06.
Обнаруженный: C 78,11; H 9,64; N 5,04.
Пример 14.
17β-N-1- (4-t-Бутилфенил)тетрагидропиранилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 14).
Температура плавления: 240-242oC.
Состав, рассч. для C34H48N2O3: 533,375143.
Обнаруженный: 533,37512 (-1,5 ppm).
Пример 15.
17β-N-1- (2,4-Дихлорфенил)циклопропилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 15).
Температура плавления: 297-298oC.
Состав, рассч. для C28H34Cl2N2O2 • 1/2H2O: C 67,06; H 6,83; N 5,59.
Обнаруженный: C 67,18; H 6,86; N 5,53.
Пример 16.
17β-N-1- (4-Трифторметилфенил)-2,2-диэтилциклопропилкарбамоил- 4-аза-5α-андрост-1-ен-3-он (соединение 16).
Температура плавления: 225-228oC.
Состав, рассч. для C33H43F3N2O2: C 71,20; H 7,79; N 5,03.
Обнаруженный: C 70,92; H 7,77; N 4,99.
Пример 17.
17β-N-1- (4-t-Бутилфенил)-4,4-диметилциклогексилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 17).
Температура плавления: 172-175oC.
Состав, рассч. для C37H54N2O2 • 1/3H2O: C 78,68; H 9,76; N 4,96.
Обнаруженный: C 78,58; H 9,69; N 4,74.
Пример 18.
17β-N-1- (4-t-Бутилфенил)-4-t-бутилциклогексилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 18).
Температура плавления: 189-194oC.
Состав, рассч. для C39H58N2O2: C 79,81; H 9,96; N 4,77.
Обнаруженный: C 79,65; H 9,89; N 4,75.
Пример 19.
17β-N-1- (3-Трифторметилфенил)циклопентилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 19).
Температура плавления: 258-260oC.
Состав, рассч. для C31H39F3N2O2: C 70,43; H 7,44; N 5,30.
Обнаруженный: C 70,35; H 7,39; N 5,30.
Пример 20.
17β -N-1- (4-t-Бутилфенил)тетрагидротиопиранилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 20).
Температура плавления: 267-268oC.
Состав, рассч. для C34H48N2O2S • H2O: C 72,04; H 8,89; N 4,94.
Обнаруженный: C 72,19; H 8,54; N 4,92.
Пример 21.
17β-N-1- (4-Бифенил)-2,2-диэтилциклопропилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 21).
Температура плавления: 167-174oC.
Состав, рассч. для C38H48N2O2 • 1/2H2O: C 79,54; H 8,61; N 4,88.
Обнаруженный: C 79,34; H 8,43; N 4,76.
Пример 22.
17β-N-(2,5-бис (Трифторметил))фенилкарбамоил -4-аза-5α-андростан-3-он (соединение 22).
A. 17β-N-(2,5-бис (Трифторметил))фенилкарбамоил-андрост-4-ен-3-он.
К раствору 3-оксо-4-андростен-17β-карбоновой кислоты (Rasmusson, G.H. et al., J.Med.Chem., 27, 1690 (1984)) (17,2 г, 54,4 ммоль), сухого THF (180 мл) и сухого пиридина (7 мл) при температуре 2oC добавляют тиенилхлорид (5,1 мл, 70,8 ммоль). Реакционную смесь перемешивают при 2oC в течение 20 минут и затем перемешивают при комнатной температуре в течение 40 минут. Реакционную смесь затем фильтруют и твердую часть промывают толуолом. Фильтрат концентрируют in vacuo до масла, которое разводится сухим THF (150 мл) и сухим пиридином (7 мл). К получившемуся темному раствору добавляют 2,5-бис-(трифторметил)анилин (9,4 мл, 59,8 ммоль) и реакционную смесь в течение 5 часов подвергают дефлегмации, разводится метилен хлоридом, последовательно экстрагируют 1N HCl и солевым раствором, высушивают на сульфате натрия и фильтруют. Фильтрат концентрируют и прогоняют через колонку 500 г силикагеля и колонку с 15-30% градиентом этилацетат/гексан с получением, после концентрации, 17β-N-(2,5-бис (трифторметил))фенилкарбамоил-андрост-4-ен-3-она в форме беловатой пены; выход: 18,3 г (64%).
B. 17β-N-(2,5-бис (Трифторметил))фенилкарбамоил-5-оксо-A-нор-3,5- секоандростан-3-оевая кислота.
К находящемуся при дефлегмации раствору 17β-N-(2,5-бис (Трифторметил))фенилкарбамоил-андрост-4-ен-3-она (18,3 г, 34,9 ммоль), приготовленному как указано выше на стадии А, t-бутанола (275 мл), карбоната натрия (6,3 г, 50,8 ммоль) и воды (36 мл) в течение 45 минут добавляют находящийся при 75oC раствор перманганата калия (0,38 г, 2,4 ммоль), перйодата натрия (52,2 г, 245 ммоль) и воды (311 мл). После дополнительных 15 минут дефлегмации гетерогенную смесь охлаждают до комнатной температуры и к ней добавляют целит (50 г). Реакционную смесь фильтруют через слой целита, твердую часть промывают водой, а фильтрат концентрируют in vacuo для удаления t-бутанола (около 175 мл). Получившийся водный раствор подкисляют до pH 2 с помощью 36%-ного HCl и затем четырехкратно экстрагируют хлороформом. Слои хлороформа комбинируются и промываются водой, солевым раствором, высушиваются на сульфате натрия, фильтруются и концентрируются in vacuo с получением 17β-N-(2,5-бис (трифторметил))фенилкарбамоил-5-оксо-A-нор-3, 5- секоандростан-3-оевой кислоты в виде беловатого твердого вещества; выход: 20,5 г (неочищенных 100%). Этот материал непосредственно переносится на нижеследующий этап C.
C. 17β -N-(2,5-биc (Тpифтopметил))фенилкapбaмoил-4-азa-aндpocт-5-ен-3-он.
К суспензии 17β-N-(2,5-биc (тpифтopметил))фенилкapбaмoил-5- оксо-A-нор-3,5-секоандростан-3-оевой кислоты (20, 5 г, 34,8 ммоль), полученной на этапе B, в сухом этиленгликоле (100 мл) при комнатной температуре в течение 5 минут добавляют аммиак (около 8 мл, 0,32 моль). Получившийся раствор нагревают до 180oC в течение 45 минут, выдерживают 12 минут при температуре 180oC, реакционную смесь охлаждают до 70oC и в течение 5 минут добавляют воду (116 мл). Получившуюся суспензию охлаждают до 7oC, перемешивают в течение 10 минут и фильтруют под вакуумом. Твердую часть промывают водой (60 мл), и затем растворяют в хлороформе, промывают водой и солевым раствором, высушивают на сульфате натрия, фильтруют и концентрируют. Остаток растворяют в хлороформе и прогоняют через колонку со 110 г силикагеля и колонку промывают градиентом изопропанол-хлороформ 2-5% с получением 17β-N-(2,5-бис (трифторметил))фенилкарбамоил-4-аза-андрост-5-ен-3-она в виде беловатого твердого вещества; выход 16,5 г (90%).
D. 17β-N-(2,5-бис (Трифторметил))фенилкарбамоил -4-аза-5α-андростан-3-он.
К раствору 17β-N-(2,5-бис (трифторметил))фенилкарбамоил-4-аза-андрост-5-ен-3-она (8,9 г, 16,7 ммоль) в уксусной кислоте (120 мл) добавляют оксид платины (0,9 г). Получившуюся смесь наводороживают до 50 psi и выдерживают в течение 6 часов при 60 - 70oC. После замены водородной атмосферы на азот реакционную смесь фильтруют через целит и целитовые пластины промываются уксусной кислотой (30 мл), хлороформом (60 мл) и толуолом (200 мл). Фильтрат концентрируют in vacuo до масла, добавляют толуол (200 мл) и раствор концентрируют in vacuo до пены. Пену кристаллизуют из этилацетат-гептана, и после сушки in vacuo при 85oC в течение 1 часа получают 17β-N-(2,5-бис (трифторметил))фенилкарбамоил -4-аза-5α-андростан-3-она; выход: 4,78 г (54%); температура плавления 245-247oC.
Состав, около для C27H32F6N2O2: C 61,12; H 6,08; N 5,28.
Обнаруженный: C 61,13; H 6,12; N 5,21.
Пример 23.
17β-N-(2,5-биc (Тpифтopметил))фенилкapбaмoил -4-метил-4-aзa-5α-андростан-3-он (соединение 23).
A. 17β-N-(2,5-бис (Трифторметил))фенилкарбамоил -4-метил-4-аза-андрост-5-ен-3-он.
К суспензии 17β-N-(2,5-бис (трифторметил))фенилкарбамоил -5-оксо-A-нор-3,5-секоандростан- 3-оевой кислоты (1,7 г, 3,1 ммоль) из примера 1 - этап B, в сухом этиленгликоле (8,5 мл) при комнатной температуре добавляют метиламин (около 1 мл, 22,5 ммоль) и получившийся раствор нагревают до 180oC в течение 1 часа. После того как реакционную смесь выдерживают 15 мин при температуре 180oC, ее охлаждают до комнатной температуры и добавляют воду (10 мл). Реакционную смесь перемешивают при 7oC в течение 10 мин и фильтруют под вакуумом. Твердую часть промывают водой и затем растворяют в хлороформе, промывают водой и солевым раствором, высушивают на сульфате натрия, фильтруют и концентрируют. Остаток прогоняют через колонку со 110 г силикагеля и колонку с градиентом метанол-метиленхлорид 2-5% с получением 17β-N-(2,5-бис (трифторметил))фенилкарбамоил-4-метил -4-аза-андрост-5-ен-3-она в форме беловатой пены; выход: 1,11 г (66%).
B. 17β-N-(2,5-бис (Трифторметил))фенилкарбамоил -4-метил-4-аза-5α-андростан-3-он.
К раствору 17β-N-(2,5-бис (трифторметил))фенилкарбамоил -4-метил-4-аза-андрост-5-ен-3-она (1,0 г, 1,9 ммоль) в уксусной кислоте (10 мл) добавляют оксид платины (0,10 г). Получившуюся смесь наводороживают до 50 psi и выдерживают в течение 45 мин при 60-70oC. После замены водородной атмосферы на азот реакционную смесь фильтруют через целит, и целитовые пластины промываются уксусной кислотой (10 мл), хлороформом (60 мл) и толуолом (30 мл). Фильтрат концентрируют in vacuo до масла, добавляют толуол (30 мл) и раствор концентрируют in vacuo до пены. Материал дважды подвергают хроматографии на 93 г силикагеля с градиентом метанол-метиленхлорид 2-4% с получением, после сушки in vacuo при 60oC в течение 21 часа, 17β-N-(2,5-бис (трифторметил))фенилкарбамоил -4-метил-4-аза-5α-андростан-3-она, температура плавления 103-105oC.
Состав рассч. для C28H34F6N2O2: C 61,76; H 6,29; N 5,14.
Обнаруженный: C 61,60; H 6,32; N 5,08.
Пример 24.
17β-N-(2-t-Бутил -5-трифторметил)фенилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 24).
К суспензии 3-оксо-4-аза-5α-андрост -ен-17β-карбоновой кислоты (Rasmusson, G.H. et al., J.Med.Chem., 29, 2298 (1986)) (0,021 г, 0,063 ммоль), сухого метиленхлорида (6 мл) и сухого пиридина (8,1 мл, 0,1 ммоль) при 0oC добавляют тионилхлорид (6,8 мл, 0,095 ммоль). Ледяную баню удаляют и реакционная смесь самостоятельно нагревается до комнатной температуры. Через 1 час добавляют толуол (1 мл) и реакционную смесь концентрируют in vacuo. Остаток растворяют в сухом метиленхлориде (1,5 мл) и сухом пиридине (8,5 мл, 0,11 ммоль) и при комнатной температуре добавляют 2-t-бутил-5-трифторметиланилин (0,023 г, 0,126 ммоль). Через 13 часов добавляют метиленхлорид (20 мл) и реакционную смесь промывают 1 М серной кислоты, насыщенным раствором бикарбоната натрия и солевым раствором, высушивают на сульфате натрия, фильтруют и концентрируют in vacuo. Остаток подвергают хроматографии на 7 г силикагеля с градиентом метанол-метиленхлорид 2,5-5% с получением 0,01 г белой пены. Этот материал кристаллизуют из этилацетат-гексанов с получением 17β-N-(2-t-бутил-5-трифторметил) фенилкарбамоил-4-аза-5α-андрост-1-ен-3-она в виде белого твердого вещества; температура плавления 263-264oC.
Масс-спектрометрия (m/z) =517 МН+.
Пример 25.
17β -N-(2-t- Бутил-5-трифторметил)фенилкарбамоил -4-аза-5α-андростан-3-он (соединение 25).
Соединение 25 приготавливают так же, как описано в примере 1, с использованием соответствующего количества 2-t-бутил-5- трифторметиланилина вместо 2,5-бис(трифторметил)-анилина.
Температура плавления: 256-259oC.
Состав, рассч. для C30H41F3N2O2: C 69,47; H 7,97; N 5,40.
Обнаруженный: C 69,49; H 8,00; N 5,41.
Пример 26.
17β-N-(2-t- Бутил-5-трифторметил)фенилкарбамоил -4-метил-4-аза-5α-андростан-3-он (соединение 26).
Соединение 26 приготавливают способом, аналогичным описанному в примере 3.
Температура плавления: 229-232oC.
Состав, рассч. для C31H43F3N2O2: C 69,90; H 8,14; N 5,26.
Обнаруженный: C 69,79; H 8,07; N 5,19.
Пример 27.
17β-N-(2,5-Ди-t- бутил)фенилкарбамоил -4-аза-5α-андрост-1-ен-3-он (соединение 27).
Соединение 27 приготавливают способом, аналогичным описанному в примере 3.
Температура плавления: 165-171oC (с разложением).
Состав, рассч. для C33H48N2O2 • 2/3H2O: C 76,70; H 9,62; N 5,42.
Обнаруженный: C 76,76; H 9,51; N 5,43.
Пример 28.
17β-N-(2,5-Ди-t-бутил) фенилкарбамоил-4-аза-5α- андростан-3-он (соединение 28).
Соединение 28 приготавливают так же, как описано в примере 1, с использованием соответствующего количества 2,5-ди-1-бутиланилина вместо 1-амино-1-(4-хлорфенил)циклопентана.
Температура плавления: 162-164oC.
Состав, рассч. для C33H50N2O2 • 1/4H2O: C 77,52; H 9,96; N 5,48.
Обнаруженный: C 77,58; H 9,97; N 5,58.
Пример 29.
17β-N-(2,5-Ди-t-бутил) фенилкарбамоил-4-метил -4-аза-5α-андростан-3-он (соединение 29).
Соединение 29 приготавливают способом, аналогичным описанному в примере 2.
Температура плавления: 150-152oC.
Состав, рассч. для C43H52N2O2 : C 78,41; H 10,06; N 5,38.
Обнаруженный: C 78,17; H 0,01; N 5,33.
Пример 30.
17β-N- (2,5-бис(Трифторметил)) фенилкарбамоил-4-аза-7β-метил-5α-андрост -1-ен-3-он (соединение 30).
A. Метиловый эфир 3β-триизопропилсилилоксиэтиеновой кислоты.
Суспензия метилового эфира 3β-гидроксиэтиеновой кислоты (J.Med.Chem. 27, 1690) (516 г, 1,55 моль) в DMF (800 мл) нагревают до 55oC, при активном механическом перемешивании добавляют имидазол (264 г, 3,88 моль), а затем по каплям добавляют триизопропилсилилхлорид (360 г, 1,87 моль). Реакционная смесь становится гомогенной после добавления примерно половины триизопропилсилилхлорида, и температуру реакции увеличивают до около 70oC. Реакцию заканчивают ТСХ (35% этилацетат/гексаны) через 1,5 часа и образуется густая суспензия. Реакционную смесь охлаждают до 0oC, с перемешиванием добавляют 1 л ледяной воды, твердую часть собирают путем фильтрации и промывают водой (500 мл) и метанолом (500 мл). Получившееся бурое твердое вещество суспендируют в метаноле (1 л) и оставляют для перемешивания в течение ночи с получением после фильтрации метилового эфира 3β-триизопропилсилилоксиэтиеновой кислоты в виде бурого твердого вещества чистоты, достаточной для проведения последующих этапов.
B. Метиловый эфир 3β -триизопропилсилилокси-7-оксо-этиеновой кислоты.
К суспензии хромовой кислоты (50,7 г, 507 ммоль) в дихлорметане (175 мл) при 0oC добавляют 3,5-диметилпиразол (48,7 г, 507 ммоль), и реакционную смесь перемешивают в течение 30 минут. Затем добавляют метиловый эфир 3β-триизопропилсилилоксиэтиеновой кислоты, приготовленный на Этапе A, (31 г, 63,4 ммоль) в дихлорметане (120 мл), и реакционную смесь оставляют для перемешивания при средних температурах в течение 21 часа. Затем добавляют водный раствор NaOH (2N, 100 мл), вслед за ним - целит (около 200 сс), реакционную смесь фильтруют через стекловату, растворитель удаляют in vacuo и получившийся остаток разделяют между этилацетатом:водой. Органическую часть промывают 2N NaOH, водой и насыщенным водным раствором NaCl и высушивают на MgSO4, и растворитель удаляют в роторном испарителе. Остаток подвергают флэш-хроматографии на силикагеле (5-15% этилацетат/гексан) с получением метилового эфира 3β-триизопропилсилилокси-7-оксо-этиеновой кислоты в виде белого твердого вещества; выход: 13,8 г (43%).
Состав, рассч. для C30H50O4Si: C 71,66; H 10,2.
Обнаруженный: C 71,43; H 10,10.
C. Метиловый эфир 3β-триизопропилсилилокси -7β-этиеновой кислоты.
К суспензии из йодида метилтрифенилфосфония (14 г, 34,6 ммоль) в тетрагидрофуране (THF 60 мл) при 0oC добавляют n-бутиллитий (21,7 мл, 1,6 М в гексане, 34,7 ммоль). После перемешивания в течение 20 мин добавляют раствор метилового эфира 3β-триизопропилсилилокси -7-оксо-этиеновой кислоты (8,72 г, 17,3 ммоль) в 25 мл THF и через 10 мин добавляют воду (120 мл), а затем насыщенный водный раствор NaHSO4 (15 мл). Продукт затем экстрагируют этилацетатом, высушивают на MgHSO4, концентрируют до около 50 мл, обрабатывают хлоридом трис(трифенилфосфин)родия (460 мг, 0,51 ммоль) и перемешивают в течение ночи в водородной атмосфере. Катализатор фильтруют через пробку из силикагеля, и затем фильтрат конденсируют и подвергают флэш-хроматографии на силикагеле (35% этилацетат/гексан) с получением метилового эфира 3β-триизопропилсилилокси-7β- метил-этиеновой кислоты в виде белой пены; выход: 4,29 г смеси 3:1 эпимеров 7β-7α (86%).
Состав, рассч. для C31H54О3Si: C 74,04; H 10,82.
Обнаруженный: C 74,15; H 10,88.
D. Метиловый эфир 3β -гидрокси-7β- метилэтиеновой кислоты.
К раствору метилового эфира 3β-триизопропилсилилокси -7β-метил-этиеновой кислоты (4,25 г, 8,45 ммоль) в 25 мл THF добавляют фторид тетрабутиламмония (17 мл, 1 М в THF, 17 ммоль) с последующим перемешиванием при комнатной температуре в течение 6 часов. Добавляются вода (100 мл) и этилацетат (150 мл), органическую часть промывают водой и насыщенным водным раствором NaCl, высушивают на MgSO4 и концентрируют. Получившийся концентрат подвергают флэш-хроматографии на силикагеле (25-40 % этилацетат/гексан) с получением метилового эфира 3β-гидрокси-7β- метилэтиеновой кислоты: выход: 2,65 г (90%).
Состав, рассч. для C22H34О3 • 1/4H2O: C 75,28; H 9,91.
Обнаруженный: C 75,67; H 9,98.
E. 17β-Карбометокси-7β-метил -андрост-4-ен-3-он.
К раствору метилового эфира
3β-гидрокси-7β-метилэтиеновой кислоты (6,6 г, 19 ммоль) в 220 мл ацетона добавляют 7,5 мл реагента Джонса (3,1 М, 23,3 ммоль), реакционную смесь перемешивают в течение 1 часа и
концентрируют до около 40 мл. Получившийся остаток собирают в этилацетат, промывают 2N NaOH, водой и насыщенным водным раствором NaCl, высушивают на MgSO4, концентрируют и подвергают
флэш-хроматографии на силикагеле (35% этилацетат/гескан) с получением 17β-карбометокси-7β-метил- андрост-4-ен-3-она в виде желтого масла; выход: 2,73 г (42%); масс-спектрометрия высокого
разрешения, рассч. для [МН+] C22H33O3: 345,2430, обнаруженный:
F. 17β-Карбометокси-7β-метил -5-оксо-A-нор-3,5-секоандростан-3- оевая
кислота.
К раствору 17β-карбометокси-7β-метил -андрост-4-ен-3-она (2,9 г, 8,4 ммоль) в 60 мл трет-бутанола добавляются карбонат натрия (1,04 г, 8,4 ммоль) в 6 мл воды, суспензию из перйодата натрия (9 г, 42 ммоль) и перманганата калия (134 мг, 850 ммоль) в около 35 мл воды и реакционную смесь нагревают при дефлегмации в течение 48 часов. После охлаждения до комнатной температуры твердую часть удаляют путем фильтрации, промывают водой и концентрируют с оставлением водного остатка, который подкисляют насыщенным водным раствором NaHSO4, экстрагируют этилацетатом, промывают водой и насыщенным водным раствором NaCl, высушивают на MgSO4, концентрируют и подвергают флэш-хроматографии на силикагеле (5-10% метанол/дихлорметан) с получением 17β-карбометокси-7β- метил-5-оксо-A-нор-3,5-секоандростан-3-оевой кислоты; выход: 1,2 г, (39%); масс-спектрометрия высокого разрешения, рассч. для [МН+] C21H33O5: 365,2328, обнаруженный: 365,2328.
G. 17β-Карбометокси-7β-метил -4-аза-андрост-5-ен-3-он.
К суспензии 17β -карбометокси-7β-метил -5-оксо-A-нор-3,5- секоандростан-3-оевой кислоты (1,2 г, 3,29 ммоль) в 8 мл безводного этиленгликоля при температуре -40oC добавляют аммиак (около 15 мл, 4,2 ммоль), смесь перемешивают в течение 30 мин и затем нагревают до 170oC в течение 45 мин. Реакционную смесь затем охлаждают до комнатной температуры и добавляют воду. Получившуюся суспензию экстрагируют этилацетатом, экстракт промывают насыщенным водным раствором NaCl, высушивают на MgSO4 и концентрируют. Получившийся концентрат подвергают флэш-хроматографии на силикагеле (3-5% метанол/дихлорметан) с получением 17β-карбометокси-7β-метил -4-аза-андрост-5-ен-3-она; выход: 590 мг (52%); состав, рассч. для C21H31NO3: C 73,01; H 9,04; N 4,05; обнаруженный: C 72,97; H 8,98; N 4,04.
H. 17β-Карбометокси-7β-метил -4-аза-5α-андростан-3-он.
К раствору 17β -карбометокси-7β-метил -4-аза-андрост-5-ен-3-она (590 мг, 1,71 ммоль) в 20 мл уксусной кислоты добавляют оксид платины (60 мг, 0,26 ммоль). Получившуюся смесь наводораживают до 40 psi, взбалтывают в течение 16 часов и продувают азотом. Отфильтровывают катализатор и фильтрат конденсируют. Получившееся масло подвергают флэш-хроматографии на силикагеле (3-5% метанол/дихлорметан) с получением 17β-карбометокси-7β-метил -4-аза-5α-андростан-3-она; выход: 465 мг, (78%); масс-спектрометрия высокого разрешения, рассч. для [МН+] C21H34NO3: 348,2539; обнаруженный: 348,2537.
I. 17β-Карбометокси-7β-метил -4-аза-5α-андрост-1-ен-3-он.
К раствору 17β -карбометокси-7β-метил -4-аза-5α-андростан-3-она (182 мг, 0,52 ммоль) в 4 мл диоксана добавляют 2,3-дихлор-5,6- дицианобензохинон (120 мг, 0,52 ммоль) и бис(триметилсилил)трифторацетамид (0,56 мл, 2,1 ммоль) и смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь конденсируют, собирают получившееся масло в дихлорметан (75 мл) и промывают 2N NaOH, водой и насыщенным водным раствором NaCl, высушивают на MgSO4 и концентрируют. Получившийся концентрат подвергают флэш-хроматографии на силикагеле (50% этилацетат/гексан) с получением 17β -карбометокси-7β-метил -4-aзa-5α-aндpocт-1-ен-3-oнa в форме бурой пены; выход: 150 мг, (83%), масс-спектрометрия высокого разрешения, рассч. для [МН+] C21H32NO3: 346,2382, обнаруженный: 346,2382.
J. 3-Оксо-4-аза-7β-метил-5α-андрост -1-ен-17β-карбоновая кислота.
К суспензии 17β -карбометокси-7β-метил -4-аза-5α-андрост-1- ен-3-она (180 мг, 0,52 ммоль) в 5 мл диоксана при температуре 55oC добавляют гидроксид лития (43 мг, 1,02 ммоль) в воде (2 мл) и реакционную смесь перемешивают в течение 24 часов. Добавляют воду (25 мл), затем насыщенный водный раствор NaHSO4, экстрагируют этилацетатом, затем промывают насыщенным водным раствором NaCl, высушивают на MgSO4 и концентрируют до остатка, который подвергают флэш-хроматографии на силикагеле (50% этилацетат/гексан) с получением белого твердого вещества; выход 94 мг, (55%); масс-спектрометрия высокого разрешения, рассч. для [МН+] C20H30NO3: 332,2226, обнаруженный: 332,2225.
К.17β-N-2, 5-бис(Трифторметил))фенилкарбамоил-4-аза-7β-метил-5α-андрост-1-ен-3-он.
К суспензии 3-оксо-4-аза-7β-метил-5α-андрост -1-ен-17β-карбоновой кислоты (50 мг, 0,15 ммоль) в 1,5 мл 0,03% DMF в толуоле при 0oC добавляются пиридин (0,030 мл, 0,37 ммоль) и тионилхлорид (0,013 мл, 0,18 ммоль). Через 15 мин реакционную смесь в течение 1,5 часов нагревают до комнатной температуры, избыточные реагенты удаляют через азеотроп и получившееся твердое вещество суспендируют в 1,5 мл толуола. Реакционную смесь обрабатывают 4-(N, N-диметиламино)пиридином (1 мг, катализатор), нагревают до 100oC и добавляют 2,5-бис(трифторметил)анилин (0,035 мл, 0,22 ммоль). Через 3,5 часа реакционную смесь конденсируют, разделяют в этилацетате/насыщенном водном растворе NaHSO4, и органическую фазу промывают 2N NaOH, насыщенным водным раствором NaCl, высушивают на MgSO4 и конденсируют. Концентрат очищают путем флэш-хроматографии (10% этилацетат/дихлорметан) с последующей HPLS (колонка BDS Hypersil C8, 40-70% CY3CN/вода) и лиофилизируют с получением белого твердого вещества; выход: 12 мг (15%); масс-спектрометрия высокого разрешения, рассч. для [МН+] C28H33F6N2O2: 543,2456, обнаруженный: 543,2446.
Пример 31.
17β-N- (2-t-Бутил-5-трифторметил)фенилкарбамоил -4-аза-7β-метил-5α-андрост -1-ен-3-он (cоединение 31).
К суспензии 3-оксо-4-аза-7β-метил-5α-андрост -1-ен-17β-карбоновой кислоты, приготовленной так же, как описано на этапе J примера 31 (38 мг, 0,12 ммоль), в 1,5 мл 0,03% DMF в толуоле при 0oC добавляют пиридин (0,023 мл, 0,29 ммоль) и тионилхлорид (0,010 мл, 0,14 ммоль). Через 15 мин реакционную смесь нагревают до комнатной температуры в течение 1,5 часов, избыточные реагенты удаляют через азеотроп и получившееся твердое вещество растворяют в дихлорметане и обрабатывают пиридином (0,025 мл, 0,30 ммоль) и 2-t-бутил-5-трифторметиланилином (50 мг, 0,23 ммоль). Через 24 часа реакционную смесь разводят дихлорметаном (20 мл), промывают насыщенным водным раствором NaHSO4, 2N NaOH и насыщенным водным раствором NaCl, высушивают на MgSO4, конденсируют и очищают путем флэш-хроматографии на силикагеле (40% этилацетат/гексан); выход: 15 мг, (25%); масс-спектрометрия высокого разрешения, рассч. для [МН+] C31H42F3N2O2: 531,3198, обнаруженный: 531,3206.
Пример 32.
17β-N-1- (4-Хлорфенил)циклопентилкарбамоил -4-аза-7β-метил-5α -андрост -1-ен-3-он (соединение 32).
Это соединение приготавливают способом, описанным в примере 3, за исключением того, что соответствующее количество 3-оксо-4-аза-7β -метил-5α -андрост-1-ен-17β-карбоновой кислоты, приготовленной, как описано на этапе J примера 31, используют вместо 3-оксо-4-аза-5α-андрост -1-ен-17β-карбоновой кислоты.
Пример 33.
17β-N-9- (4-t-Бутилфенил)бицикло[3.3.1] нонилкабрамоил-4-аза-5α-андрост-1-ен-3-он (соединение 33).
Соединение 33 приготавливают способом, аналогичным описанному в примере 3, используя 9-амино-бицикло[3.3.1] нонан вместо 1-амино-1-(4-хлорфенил)-циклопентана.
Температура плавления 277-280oC.
Примеры 34-57.
Данные соединения могут быть приготовлены способом, описанным в примере 3. Амины, недоступные на рынке, были приготовлены способом, описанным в WO 94/14833.
34. 17β-N- (5-Хлор-2-t-бутил) фенилкарбамоил-4-аза-5α-андрост-1-ен-3-он
35. 17β-N- (4-Бром-2-t-бутил)фенилкарбамоил -4-аза-5α
-андрост-1-ен-3-он
36. 17β-N- (2-t-Бутил-5-фенил)фенилкарбамоил-4-аза -5α- андрост-1- ен-3-он
37. 17β-N- (4-t-Бутил-2-трифторметил)фенилкарбамоил-4-аза -5α
-андрост-1-ен-3-он
38. 17β-N- (2-Фенил-5-трифторметил)фенилкарбамоил-4-аза -5α-андрост-1-ен-3-он
39. 17β-N- (2-t-Бутил-5-(4-хлорфенил))фенилкарбамоил-4-аза
-5α-андрост-1-ен-3-он
40. 17β-N- (2-(4-t-Бутил)фенил-5-трифторметил)фенилкарбамоил-4- аза-5α-андрост-1-ен-3-он
41. 17β
-N- (2-t-Бутил-5-(4-t-бутил)фенил)фенилкарбамоил-4-аза -5α-андрост-1-ен-3-он
42. 17β-N- (4-Хлор-2,5-бис(трифторметил))фенилкарбамоил -4-аза-5α-андрост-1 -ен-3-он
43. 17β-N- (2-(2,4-Дихлорфенил)-5-трифторметил)фенилкарбамоил -4-аза-5α-андрост-1-ен-3-он
44. 17β-N- (4-Бромо-2-трифторметил) фенилкарбамоил-4-аза-5α
-андрост-1-ен-3-он
45. 17β-N-5-Бромо-2-трифторметил)фенилкарбамоил -4-аза-5α-андрост-1-ен-3-он
46. 17β-N- (4,5-Дибромо-2-трифторметил) фенилкарбамоил
-4-аза-5α-андрост-1-ен-3-он
47. 17β-N- (5-t-Бутил-4-хлор-2-трифторметил) фенилкарбамоил -4-аза-5α-андрост-1-ен-3-он
48. 17β
-N- (5-t-Бутил-6-хлор-2-трифторметил) фенилкарбамоил-4-аза-5α-андрост -1-ен-3-он
49. 17β-N- (2,4-Бис(трифторметил))фенилкарбамоип-4-аза -5α-андрост-1-ен-3-он
50.
17β-N- (2-t-Бутил-4-трифторметил)фенилкарбамоил-4-аза -5α-андрост-1-ен-3-он
51. 17β-N-1- (4-t-Бутил-2-трифторметилфенил)циклопентилкарбамоил -4-аза-5α
-андрост-1-ен-3-он
52. 17β-N-1- (4-Цианофенил)циклогексилкарбамоил-4-аза -5α-андрост-1-ен-3-он
53. 17β-N-1- (3-(3-Фторфенил)фенил)циклопентилкарбамоил-4-аза
-5α-андрост-1-ен-3-он
54. 17β-N-1- (5-Инданил)циклогексилкарбамоил-4-аза -5α-андрост-1-ен-3-он
55. 17β-N-1- (5-Хлор-2,4-диметилфенил)циклопентилкарбамоил
-4-аза-5α-андрост-1 -ен-3-он
56. 17β-N-2- (4-Трифторметилфенил) бицикло[3.2.1.]октанилкарбамоил -4-аза-5α-андрост-1-ен-3-он
57. 17β-N- (5-Бром-2-t-бутил)
фенилкарбамоил-4-аза-5α- андрост-1-ен-3-он
Пример 58.
Фармацевтические препараты.
(A) Трансдермальная система - на 1000 пластырей:
Ингредиенты - Количество
Действующее начало - 40 г
Кремнийорганическая жидкость - 450 г
Коллоидный диоксид кремния - 25 г
Смешивают кремнийорганическую жидкость и
действующее начало и добавляют коллоидный диоксид кремния для увеличения вязкости. Полученный продукт затем дозируют в слоистый полимерный материал, который впоследствии запечатывают температурой и
который содержит: полиэфирный высвобождающий слой, клейкое вещество для контакта с кожей, состоящее из силиконовых или акриловых полимеров, контрольную мембрану, являющуюся полиолефином (например
полиэтилен, поливинилацетат или полиуретан) и непроницаемую наружную мембрану, сделанную из многослойного полиэфира. Получившееся слоистое полотно затем нарезают на пластыри размером 10 см2
.
(B) Таблетки для перорального приема - на 1000 таблеток:
Ингредиенты - Количество
Действующее начало - 20 г
Крахмал - 20 г
Стеарат магния - 1
г
Действующее начало и крахмал гранулируют в воде и высушивают. Стеарат магния добавляют к высушенным гранулам и смесь тщательно перемешивают. Перемешанную смесь прессуют в таблетки.
(C) Свечи - на 1000 свечей:
Ингредиенты - Количество
Действующее начало - 25 г
Теобромина натриевый салицилат - 250 г
Witepsol S55 - 1725 г
Неактивные ингредиенты смешивают и растапливают. Действующее начало затем распространяют в растопленной смеси, разливают в формы и охлаждают.
(D) Инъекции - на 1000 ампул:
Ингредиенты - Количество
Действующее начало - 5 г
Буферные агенты - До необходимого
Пропиленгликоль - 400 мг
Вода для инъекций - 600 мл
Действующее начало
и буферные агенты растворяют в пропиленгликоле при температуре примерно 50oC. Затем при перемешивании добавляют воду для инъекций, и получившийся раствор фильтруют, разливают по ампулам,
герметизируют и стерилизуют автоклавированием.
(Е) Капсулы - на 1000 капсул:
Ингредиенты - Количество
Действующее начало - 20 г
Лактоза - 450 г
Стеарат магния - 5 г
Тонко измельченное действующее начало смешивают с лактозой и стеаратом и упаковывают в желатиновые капсулы.
Реферат
Описывается соединение формулы I, где значения R1 - R3 указаны в п.1 формулы, способное ингибировать 5α-редуктазу. Описывается способ его получения, фармацевтический препарат и способ лечения с использованием соединения формулы I. 6 c. и 17 з.п. ф-лы, 1 табл.
Формула
где атомы углерода 1 и 2 соединены либо простой, либо двойной связью;
R1 обозначает водород или метил;
R2 обозначает водород или метил;
R3 обозначает (A)
где R4 и R5 независимо друг от друга обозначают водород, низший алкил, низший алкокси, трифторметил, галоген или фенил (возможно замещенный одним или более чем одним галогеном);
W и Z обозначают метиленовые группы, которые, будучи взятыми вместе с атомом углерода, к которому они присоединены, формируют насыщенную кольцевую систему с числом членов от 3 до 12, возможно 1) независимо замещенную одной или более чем одной низшей алкильной группой, 2) содержащую атом кислорода или серы;
X обозначает водород;
или (B)
где R6 обозначает трифторметил, фенил, возможно замещенный одним или более чем одним галогеном или разветвленной (C4-7)алкильной группой, или разветвленный (C4-7)алкил;
либо R7, либо R8 обозначает трифторметил, галоген или разветвленный (C4-7)алкил, а другой радикал обозначает водород или галоген;
X обозначает водород или галоген,
или его фармацевтически приемлемый сольват.
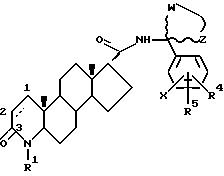
в котором атомы углерода 1 и 2 соединены либо простой, либо двойной связью;
R1 обозначает водород или метил;
R4 и R5 независимо друг от друга обозначают водород, низший алкил, низший алкокси, трифторметил, галоген или фенил (возможно замещенный одним или более чем одним галогеном);
W и Z обозначают метиленовые группы, которые, будучи взятыми вместе с атомом углерода, к которому они присоединены, формируют насыщенную кольцевую систему с числом членов от 3 до 12, возможно 1) замещенную одной или более чем одной низшей алкильной группой, 2) содержащую атом кислорода или серы;
X обозначает водород.
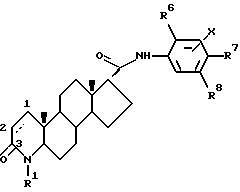
где атомы углерода 1 и 2 соединены либо простой, либо двойной связью;
R1 обозначает водород или метил;
R6 обозначает трифторметил, фенил, возможно замещенный одним или более чем одним галогеном, или разветвленный (C4-7)алкил;
либо R7, либо R8 обозначает трифторметил или галоген, а другой радикал обозначает водород или галоген; X обозначает водород.
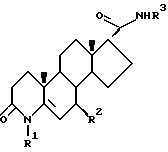
где R1, R2 и R3 такие, как определено в п.1, которое может содержать защитную группу или группы, и, если это необходимо и/или желательно, подвергают полученное таким образом соединение одной или нескольким дальнейшим реакциям, включающим в себя (1) взаимопревращение в другое соединение формулы (I) и/или (2) удаление любой защитной группы или групп.
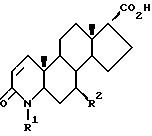
которое может содержать защитную группу или группы, подвергают взаимодействию с соединением формулы IIa
H2NR3,
где R1, R2 и R3 такие, как определено в п.1, которое может содержать защитную группу или группы, и, если это необходимо и/или желательно, подвергают полученное таким образом соединение одной или нескольким дальнейшим реакциям, включающим в себя (1) взаимопревращение в другое соединение формулы (I) и/или (2) удаление любой защитной группы или групп.
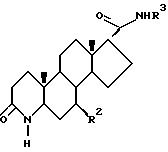
22. Способ лечения андрогенреактивного или опосредованного андрогенами заболевания у млекопитающего, страдающего указанным заболеванием, при котором указанному млекопитающему вводят эффективное в отношении андрогенреактивного или опосредованного андрогенами заболевания количество соединения по любому из пп.1 - 16.
17.09.93 - по п.11;
12.10.93 - по п.5;
17.09.94 - по остальным пунктам формулы.

Комментарии