Новые производные катехола и лекарственное средство на их основе - RU2180898C2
Код документа: RU2180898C2
Чертежи
Описание
Изобретение относится к новым синтетическим производным катехола, в которых ароматические азометинкарбоновые кислоты, бензгидразоны, аминокислоты, аминобензойные кислоты или дипептиды, пирролидин- и/или оксазолидинкарбоновые кислоты или формилкарбоксиметилоксимы являются структурными элементами, а также к их конъюгатам с биологически активными веществами, прежде всего с антибиотиками.
Известно, что определенные катехольные структуры в природных сидерофорах играют важную роль в качестве структурных элементов, образующих комплексы с железом ("Iron Transport in Microbes, Plants and Animals", издатели: Winkelmann G. , van Helm D., Neilands J.B., изд-во V. Ch. - Verlagsgesellschaft, Вайнгейм, 1987), например энтеробактин, сидерофор у Е.соli и других штаммов микроорганизмов, представляет собой тример из N-(2,3-дигидроксибензоил)-L-серина. Мономер также обладает соответствующим действием в качестве сидерофора (Hantke К., FEMS Microbiol. Lett. 67 (1990), 5). N-(2,3-дигидроксибензоил)глицин был обнаружен в качестве сидерофора у B.subtilis (Ito Т., Neilands J.B., Journ. Amer. Chem. Soc. 80 (1958), 4645). Уже были синтезированы некоторые катехолзамещенные производные аминокислот, например N-(2, 3-дигидроксибензоил)-L-треонин (Kanai, F. , Kaneko, Т., Morishima H., Isshiki К., Taketa Т. , Takeuchi Т., Umezawa H., Journ. Antibiot. 38 (1985), 39); N2, N6-биc(2, 3-дигидpoкcибeнзoил)-L-лизин (Corbin J.L., Bulen W.A., Biochemistry 8 (1969), 757; McKee J.A., Sharma S.K., Miller M.J., Bioconjugate Chem. 2 (1991), 281) и N2, N6-биc(2, 3-дигидpoкcибeнзoил)-лизил-N6- (2,3-дигидpoкcибeнзoил)лизин (Chimiak A., Neilands J.B., Structure and Bonding 58 (1984), 89). Известно далее, что у различных штаммов бактерий определенные бензгидразоны глиоксиловой кислоты, производные оксаниловой кислоты и др. могут служить в качестве сидерофоров (Reissbrodt R., Heinisch L., Moellmann U., Rabsch W., Ulbricht H., Bio. Metals 6 (1993), 155). Некоторые дигидроксибензилиденаминобензойные кислоты уже описаны в литературе, однако отсутствуют данные касательно их сидерофорной эффективности (Takita H., Noda S., Inada К. , Mukaida Y. S. , Toji M.K., Kobayashi H., DE 3414049 (1984), H. Wolf, ежемесячный журнал Monatsheft Chem. 31 (1910), 903).
Хотя различные катехольные соединения и удалось "связать" с β-лактамами, с помощью которых было достигнуто повышение антибактериальной эффективности этих антибиотиков благодаря их внедрению в бактериальную клетку по путям переноса железа в организме (см., например, Arisawa M., Sekine Y., Shimizu S., Takano H. , Angehrn P., Then R.L., Antimicrob. Agents Chemother. 35 (1991), 653), тем не менее существует большая потребность в создании других новых синтетических сидерофоров с более совершенными фармакологическими и фармакокинетическими свойствами, способных образовывать конъюгаты с антибиотиками.
С другой стороны, сидерофоры в качестве железосодержащих хелатов обладают потенциальной способностью оказывать различное влияние на биологический обмен железа в организме и на связанные с этим фактором заболевания. Так, сидерофор десферриоксамин (десферал) с успехом применяют при заболеваниях, обусловленных повышенным содержанием железа в организме (например, при талассемии).
С учетом вышеизложенного в основу изобретения была положена задача по получению новых синтетических производных катехола с помощью ароматических азометинкарбоновых кислот, бензгидразонов, аминокислот, аминобензойных кислот, соответственно дипептидов, пирролидин- или оксазолидинкарбоновых кислот, а также формилкарбоксиметилоксимов в качестве основной структуры, которые могут выполнять роль сидерофоров и/или биологических железосодержащих хелатов и которые в виде их конъюгатов с активными веществами, прежде всего антибиотиками, способствуют более эффективному проникновению этих соединений в бактериальные клетки, повышая тем самым их антибактериальное действие, и позволяют более успешно бороться с бактериальными инфекциями, лечение которых осложнено устойчивостью к антибиотикам, обусловленной проблемами пенетрации.
Соединения по изобретению эффективны в качестве сидерофоров по отношению к грамотрицательным бактериям, иными словами, они могут снабжать бактерии ионами железа и в виде их конъюгатов с биологически активными веществами, прежде всего с антибиотиками ("конъюгаты сидерофоры-антибиотики"), внедрять последние по путям переноса железа в бактериальную клетку и повышать тем самым их эффективность и, более того, даже расширять диапазон их действия. Как указывалось выше, эти соединения могут применяться прежде всего для устранения устойчивости к антибиотикам, обусловленной недостаточной пенетрацией. Кроме того, предлагаемые соединения представляют собой железосодержащие хелаты и могут оказывать различное воздействие на биологический обмен железа в организме и на связанные с этим фактором заболевания.
Кроме того, соединения по изобретению обладают более эффективным действием и могут быть получены более простым путем по сравнению с известными на сегодняшний день соединениями, а также позволяют в виде их конъюгатов с активными веществами успешнее бороться с устойчивостью к антибиотикам, обусловленной недостаточной пенетрацией, при бактериальных инфекциях. Далее, благодаря настоящему изобретению предлагаются новые железосодержащие хелаты, которые различным образом могут влиять на биологический обмен железа в организме и на связанные с этим фактором заболевания.
Согласно изобретению были получены новые синтетические производные катехола общей формулы I
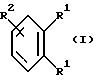
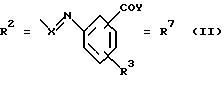
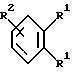
в которой R1 имеют идентичные значения или обозначают независимо друг от друга ОН и/или О-ацил, а R2 в положении 3 и/или 4 представляет собой следующие группы:
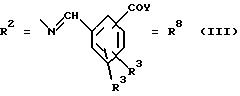
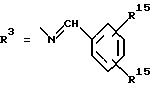
а. остатки ароматических азометинкарбоновых кислот и/или остатки азобензолкарбоновых кислот
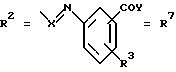
X обозначает СН, N, CH=CH-CH
Y обозначает ОА, где А представляет собой Н, алкил, арил, аралкил, ион щелочного металла (предпочтительно Na, К), ион аммония либо замещенный ион аммония, или
Y обозначает остаток активного вещества, содержащий ОН- или NH-группу,
R3 представляет собой один либо два О-ацильных остатка, если R1 обозначает ОН или О-ацил, или
R3 представляет собой Н, если R1 обозначает О-ацил, или
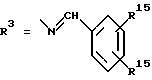
R15 имеют идентичные значения или обозначают независимо друг от друга Н и/или О-ацил, или
Y обозначает ОА, где А представляет собой Н, алкил, арил, аралкил, ион щелочного металла (прежде всего Na, К), ион аммония либо замещенный ион аммония, или
Y обозначает остаток активного вещества, содержащий NH- или ОН-группу,
R3 имеют идентичные значения или обозначают независимо друг от друга Н, ОН, О-ацил;
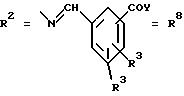
б. бензгидразоновые остатки:
R15 имеют идентичные значения или обозначают независимо друг от друга Н, ОН, О-ацил,
R4 и/или R5 обозначают Н, COY, где
Y обозначает ОА, где А представляет собой Н, алкил, арил, аралкил, ион щелочного металла (предпочтительно Na, К), ион аммония либо замещенный ион аммония, или
Y обозначает остаток активного вещества, содержащий NH- или ОН-группу;
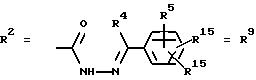
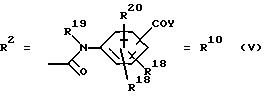
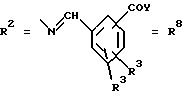
в. остатки аминобензойных кислот:
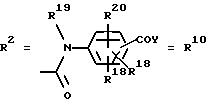
Y обозначает ОА, где А представляет собой Н, алкил, арил, аралкил, ион щелочного металла (предпочтительно Na, К), ион аммония либо замещенный ион аммония, или
Y обозначает остаток активного вещества, содержащий NH- или ОН-группу;
R19 обозначает Н, алкил,
R20 обозначает Н, алкил, галоген, ОН, О-алкил, О-ацил, или
R18 и R21 каждый имеют идентичные значения или обозначают независимо друг от друга Н, ОН, О-ацил, О-алкил в положении 2, 3 и/или 3, 4;
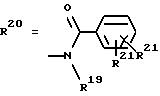
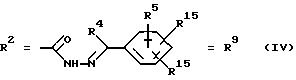
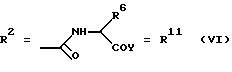
г. остатки аминокислот:

Y обозначает ОА, где А представляет собой Н, алкил, арил, аралкил, ион щелочного металла (предпочтительно Na, К), ион аммония либо замещенный ион аммония, или
Y обозначает остаток активного вещества, содержащий NH- или ОН-группу,
R6 представляет собой алкил, гидроксиалкил (с С1-С5, если R1 обозначает О-ацил, и с С3-С5, если R1 обозначает ОН), алкоксиалкил, ацилоксиалкил, арилалкоксиалкил, или
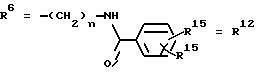
R15 имеют идентичные значения или обозначают независимо друг от друга Н, ОН, О-ацил,
n обозначает целое число в пределах от 1 до 5, если R1 обозначает О-ацил, а R15 обозначает Н и/или О-ацил, или
n обозначает целое число в пределах от 1 до 3, если R1 обозначает ОН, а R15 обозначает Н и/или ОН, или
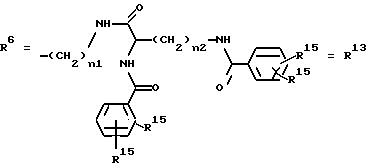
R15 имеют идентичные значения или обозначают независимо друг от друга Н, ОН, О-ацил, n1 и n2 обозначают целое число в пределах от 1 до 5;
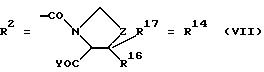
д. остатки пирролидин- и/или оксазолидинкарбоновых кислот:
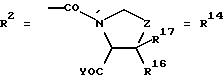
Z обозначает О, СН2,
R16 и R17 имеют идентичные значения или обозначают независимо друг от друга Н, алкил либо арил,
Y обозначает ОА, где А представляет собой Н, алкил, арил, аралкил, ион щелочного металла (предпочтительно Na, К), ион аммония либо замещенный ион аммония, или
Y обозначает остаток активного вещества, содержащий NH- или ОН-группу;
е. формил-О-карбоксиметилоксимы:
R2 представляет собой CH=NOCH2COY, где
Y обозначает ОА, где А представляет собой Н, алкил, арил, аралкил, ион щелочного металла (предпочтительно Na, К), ион аммония либо замещенный ион аммония, или
Y обозначает остаток активного вещества, содержащий NH- или ОН-группу.
В приведенных выше формулах и в последующем под понятием ацил понимают прежде всего неразветвленный либо разветвленный C1-С6алканоил или неразветвленный либо разветвленный C1-С6 алкоксикарбонил, неразветвленный либо разветвленный алкил и неразветвленный либо разветвленный алкокси, равным образом сказанное относится и к понятию неразветвленный либо разветвленный алкоксиалкил или ацилоксиалкил, включающему прежде всего неразветвленный либо разветвленный С1-С8алкил или C1-С8алкокси, арил, прежде всего фенил и замещенный фенил, такой как фенил, замещенный неразветвленным либо разветвленным алкилом, галогеном, прежде всего Cl, F, неразветвленной либо разветвленной алкокси-, гидрокси-, карбоксигруппой, разветвленным либо неразветвленным алкоксикарбонилом и галогензамещенным алкилом, и аралкил, прежде всего фенилметил и 1- или 2-фенилэтил. Вышеуказанные остатки R3, R5, R5, R20 и COY могут находиться во всех возможных положениях. В качестве замещенного иона аммония можно назвать, например, ион аммония, замещенный алкилом.
Остаток активного вещества представляет собой прежде всего остаток любого приемлемого антибактериального активного вещества со свободной NH- или ОН-группой, причем активное вещество по этой NH- или ОН-группе этерифицировано, соответственно амидировано катехольным остатком. Связь между производным катехола и антибиотиком может осуществляться как непосредственно, так и через обычно используемые в этих случаях линкерные группы, каковыми являются, например, аминокарбоновые кислоты, гидроксикарбоновые кислоты, диамины или диолы.
Под понятием антибиотик имеется в виду, в частности, соответствующий β-лактам, содержащий NH- или ОН-группу, например цефалоспорин, такой как цефалексин, цефадроксил или клафоран, или пенициллин, такой как ампициллин, амоксициллин, или производное тетрациклина, такое как аминодоксициклин, или же антибиотик типа аминогликозидов, макролидов, хинолонов или карбапенемов.
В случае наличия асимметричных С-атомов соответствующие D- и L-формы, энантиомеры и диастереомеры, равно как и рацематы, соответственно смеси энантиомеров и диастереомеров также являются объектом настоящего изобретения.
Соединения по изобретению получают,
например, следующим образом:
а. катехолзамещенные бензальдегиды (формула I, где R2 обозначает СНО) в соответствующем растворителе, таком как
этанол или толуол, с использованием
водоотделителя либо связывающих воду средств, таких как молекулярное сито, в аппарате Сокслета при температурах в интервале от +50 до +120oС, как
правило, при температуре кипения
растворителя подвергают взаимодействию с соответствующими аминобензойными кислотами с получением в результате ароматических азометинкарбоновых кислот (формула I, где
R2 идентичен R7 или R8), или
б. катехолзамещенные бензгидразиды (формула I, где R2 обозначает CONHNH2) в соответствующем растворителе,
таком как вода, этанол или
уксусная кислота, при температурах в интервале от +10 до +120oС, предпочтительно при температуре кипения растворителя, подвергают взаимодействию с
соответствующими замещенными
формилбензойными кислотами или с фенилглиоксиловыми кислотами с получением в результате соответствующих бензгидразонов (формула I, где R2 идентичен R9), или
в.
ди(ацилокси)бензоилхлориды (формула I, где, например, R1 обозначает OCOCH3, a R2 обозначает COCI) подвергают взаимодействию с
аминобензойными кислотами или их эфирами
в соответствующем растворителе, таком как тетрагидрофуран, совместно с третичным амином, например с триэтиламином, при температуре в интервале от -30 до
+20oС или в водном растворе
бикарбоната натрия при температуре в интервале от 0 до +10oС c получением в результате N-[ди(ацилокси)бензоил] аминобензойных кислот, соответственно
их эфиров и последние при необходимости
превращают в свободые кислоты (формула I, где R2 идентичен R10), или
г. 2,3-ди(бензилокси)бензоилхлорид (формула I, где R1 обозначает ОСН2С6Н5, а R2 обозначает COCI) в соответствующем растворителе, таком как тетрагидрофуран, совместно с третичным амином, например, с
триэтиламином, при температуре в интервале
от -30 до +20oС или в водном растворе бикарбоната натрия при температуре в интервале от 0 до +10oС подвергают взаимодействию с
аминокислотами, диаминокислотами или дипептидами с
получением в результате соответствующих защищенных N-[(2,3-ди(бензилокси)бензоил] аминокислот, которые затем с помощью обычных методов для удаления
защитных групп, например, путем каталитического
гидрирования в этаноле, превращают в свободные катехолзамещенные производные аминокислот, соответственно производные пептидов (формула I, где R2 идентичен R11, R12,
R13 или R14, где Z обозначает СН2), или
д. дигидрокси-, соответственно диацилоксибензоилхлорид (формула I,
где R1 обозначает ОН, О-ацил, а R2 обозначает COCI) подвергают взаимодействию с оксазолидинкарбоксилатом, получаемым по известным методам из серина и альдегидов, например
формальдегида, в едком щелоке с последующим подкислением,
в соответствующем растворителе, например в этаноле или в смеси этанола и воды, при температуре в интервале от -10 до +10oС c
получением в результате замещенных производных
оксазолидинкарбоновых кислот (формула I, где R2 идентичен R14, a Z обозначает О), или
е. катехолзамещенные бензальдегиды
(формула I, где R2 обозначает СНО) в
соответствующем растворителе подвергают взаимодействию с О-карбоксиметилгидроксиламином или его солями с получением соответствующих
формил-О-карбоксиметилоксимов (формула I, где R2
обозначает CH=NHCH2COOH).
Соединения по изобретению формулы I, где Y в R2 представляет собой остаток активного вещества, содержащий свободную NH- или ОН-группу, получают, например, благодаря тому, что соединение формулы I, где Y в R2 обозначает ОН, например, по методу смешанных ангидридов подвергают взаимодействию сначала с эфиром хлормуравьиной кислоты и третичным амином, например с триэтиламином, а затем с соответствующим активным веществом, содержащим свободную NH- или OH-группу, а также необязательно обычно используемую в таких случаях линкерную группу, как, например, остатки диаминокарбоновой кислоты, гидроксикарбоновой кислоты, соответственно диамина или диола, совместно с соответствующим третичным амином, например триэтиламином, в соответствующем растворителе, например тетрагидрофуране.
Соединения формулы I с карбоксильной группой могут быть представлены в качестве свободных кислот, в виде их солей или в виде легко отщепляемых, прежде всего в физиологических условиях, эфиров. Очистку таких соединений осуществляют по обычным, известным из уровня техники методам, например, путем перекристаллизации или посредством хроматографии.
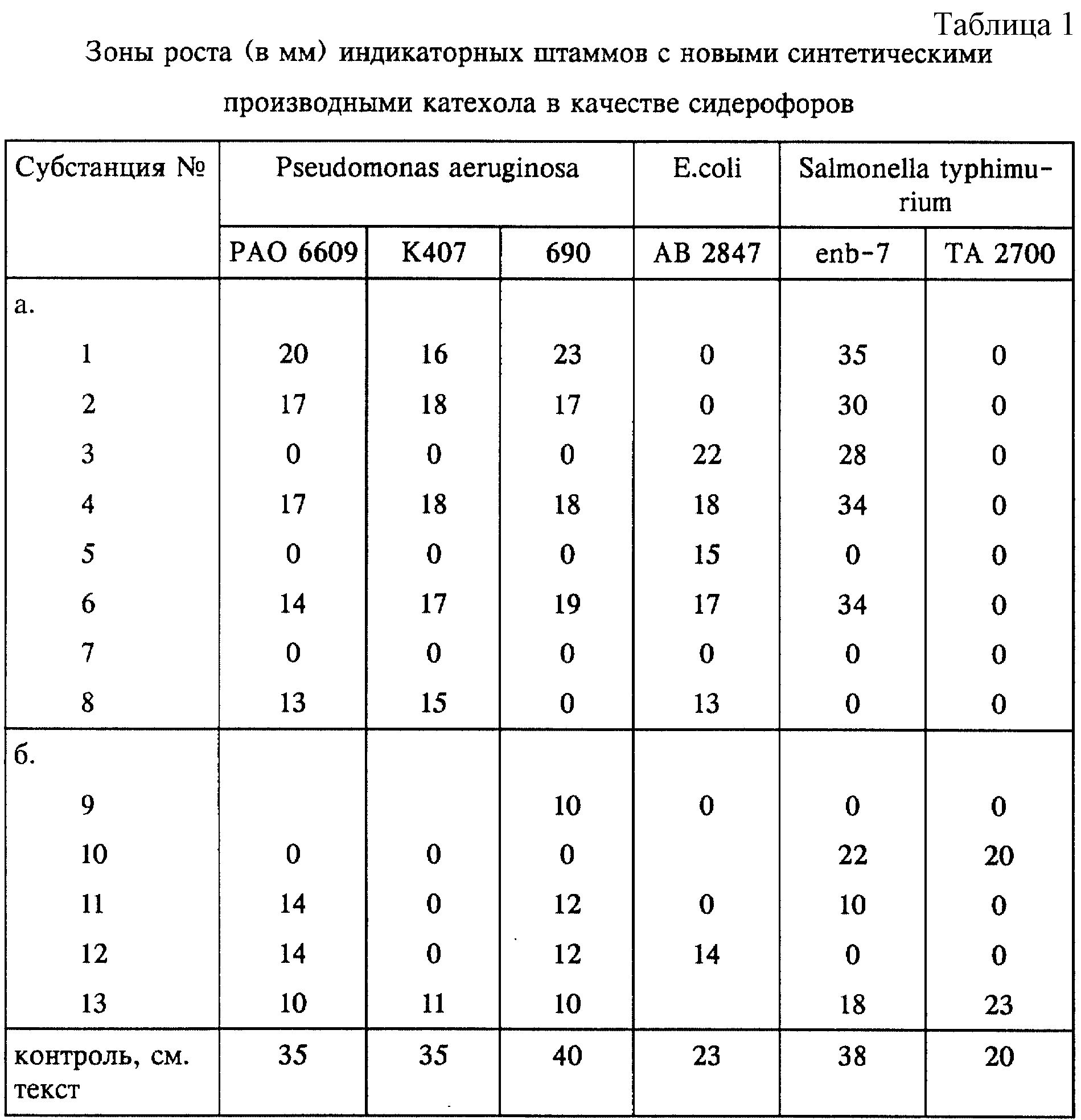
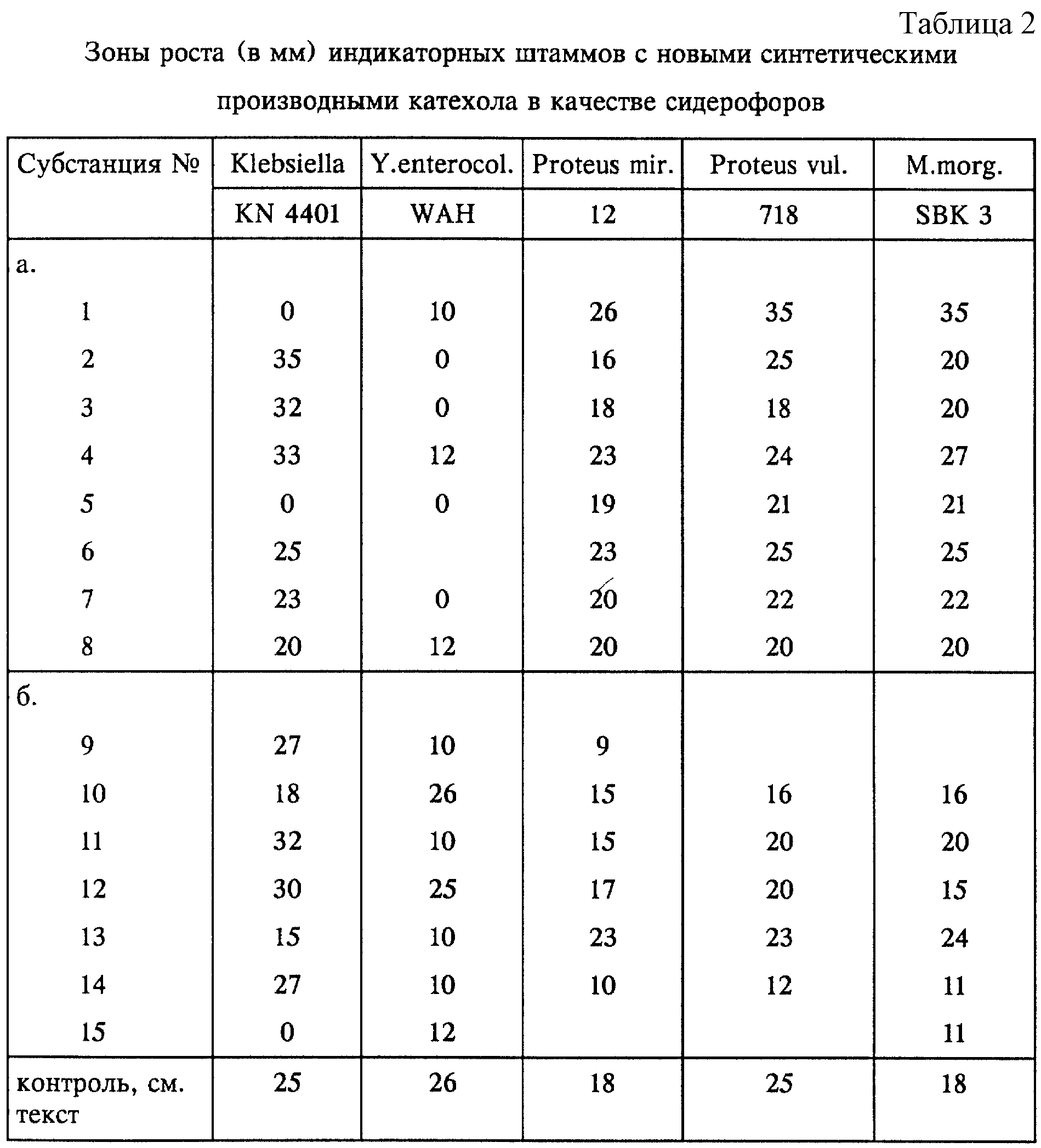
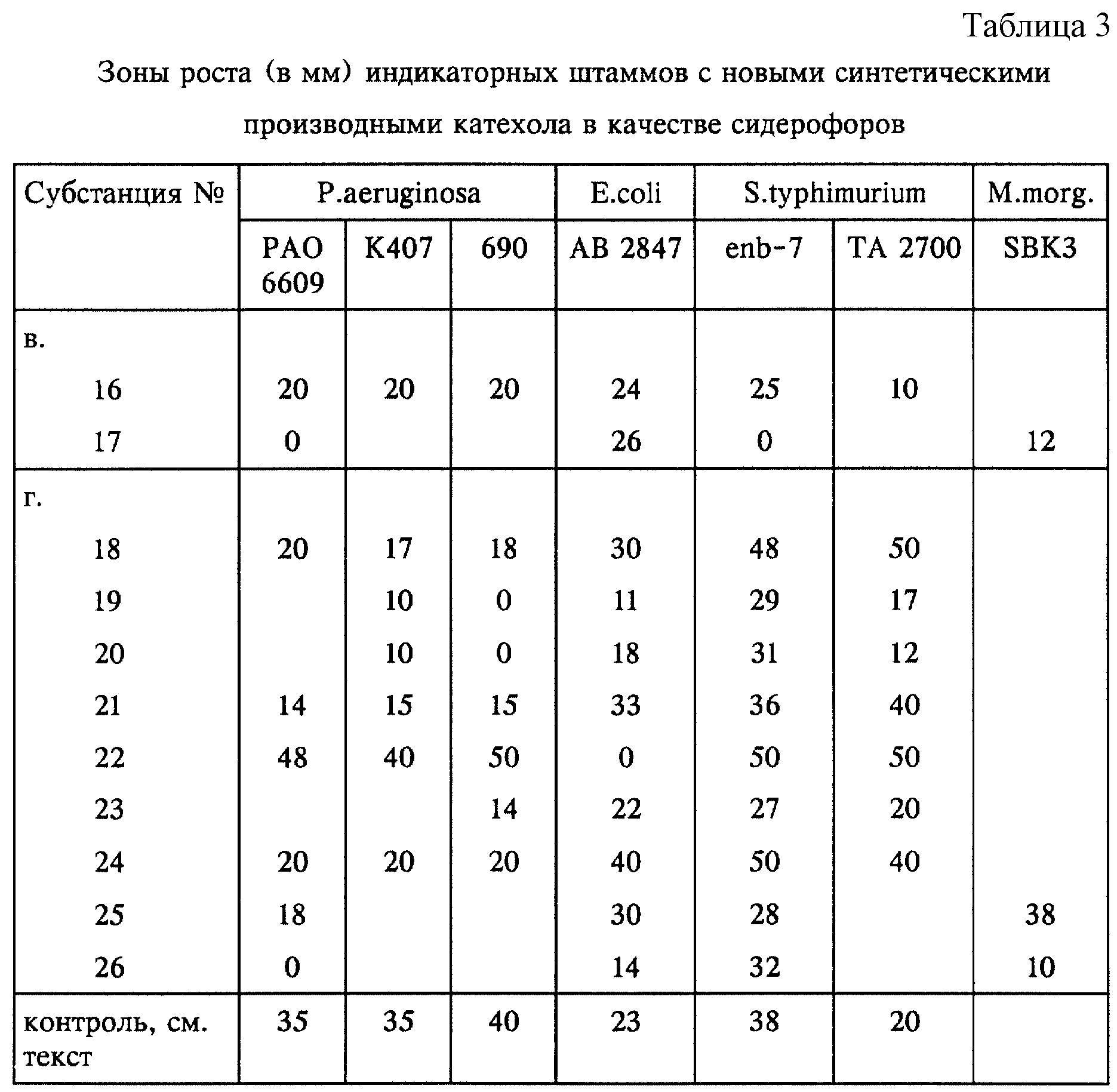
Предлагаемые согласно изобретению соединения проявляют у различных штаммов грамотрицательных бактерий сидерофорную эффективность.
Исследования сидерофорной эффективности проводили на различных индикаторных бактериях-мутантах, которые ввиду отсутствия сидерофоров проявляют лишь слабую тенденцию к росту и которые после добавления тестируемых субстанций в качестве заменителей сидерофоров приобретают способность к увеличению роста. У индикаторных мутантов биосинтез соответствующих сидерофоров, таких, например, как пиовердин, пиохелин, энтеробактин, аэробактин, ерсиниабактин, или биосинтез ароматических углеводородов блокирован или же отсутствуют рецепторы энтеробактина, пиохелина, соответственно пиовердина, равно как и другие важные компоненты бактериального переноса железа (например, мембранные белки Cir, Fiu, FepA, TonB). По этой причине эти мутанты в условиях дефицита железа могут либо совсем не расти, либо расти крайне незначительно. В экспериментах использовали, в частности, следующие индикаторные мутанты: Pseudomonas aeruginosa PAO 6609, К 407, 690, E.Coli AB 2847, Salmonella typhimurium enb-7, ТА 2700; Klebsiella pneumoniae KN 4401; Yersinia enterocolitica WAH; Proteus mirabilis 12 (дикого типа); Proteus vulgaris 718 (дикого типа) и Morganella morganii SBK3 (дикого типа). Штаммы, обозначаемые как штаммы "дикого типа", располагают лишь ограниченной системой поглощения железа, и поэтому введение сидерофоров способствует повышению их роста. В качестве контроля использовали для штаммов Pseudomonas ферриоксамин Е, для штаммов Salmonella - ферриоксамин G и энтеробактин, для штаммов E.coli, Klebsiella и Y. enterocolitica - феррихром и для штаммов Proteus, а также Morganella morganii - 3, 4-дигидроксибензилиден-2,4,6-триметиланилин (см. вышеуказанную публикацию R.Reissbrodt и др.).
В случае E. coli-мутантов IR 112 и Н 1728, у которых отсутствуют мембранные белки TonB, соответственно Cir и Fiu, играющие важную роль в активном переносе железа, все испытуемые субстанции никакого действия не проявили.
Это является еще одним практическим подтверждением сидерофорной эффективности предлагаемых субстанций.
Зоны роста индикаторных мутантов (диаметр в мм), подвергавшихся воздействию испытуемых субстанций, представлены в нижеследующих таблицах 1-3. Пометы +, соответственно (+) относятся к степени неспецифического роста.
Благодаря их свойствам в качестве бактериальных сидерофоров соединения общей формулы I могут служить переносчиками, соответственно ускорителями пенетрации антимикробных антибиотиков и других биологически активных веществ, т.е. в конъюгатах с антибиотиками, соответственно с другими активными веществами они способны транспортировать их по путям переноса железа и тем самым повышать их эффективность.
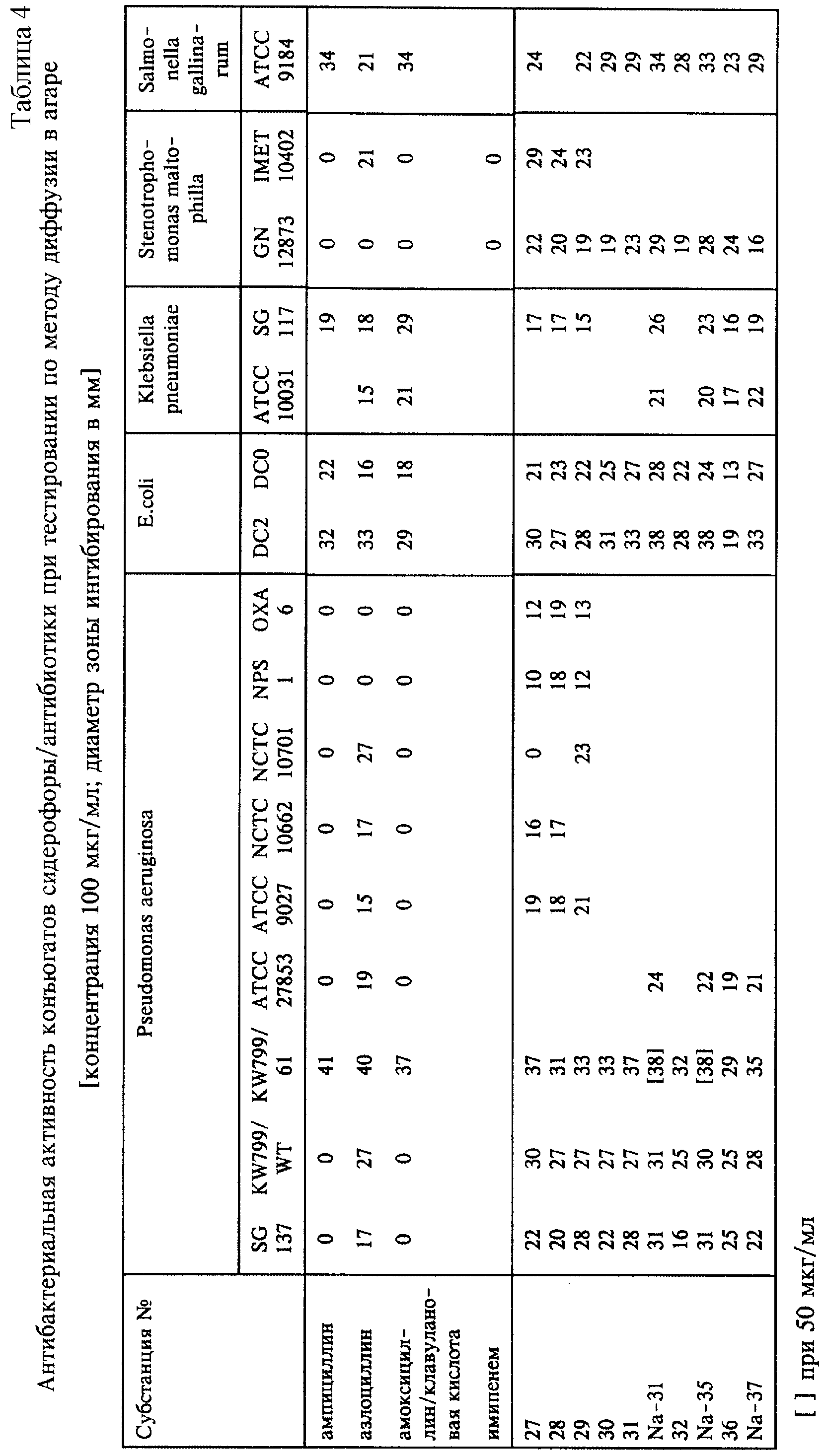
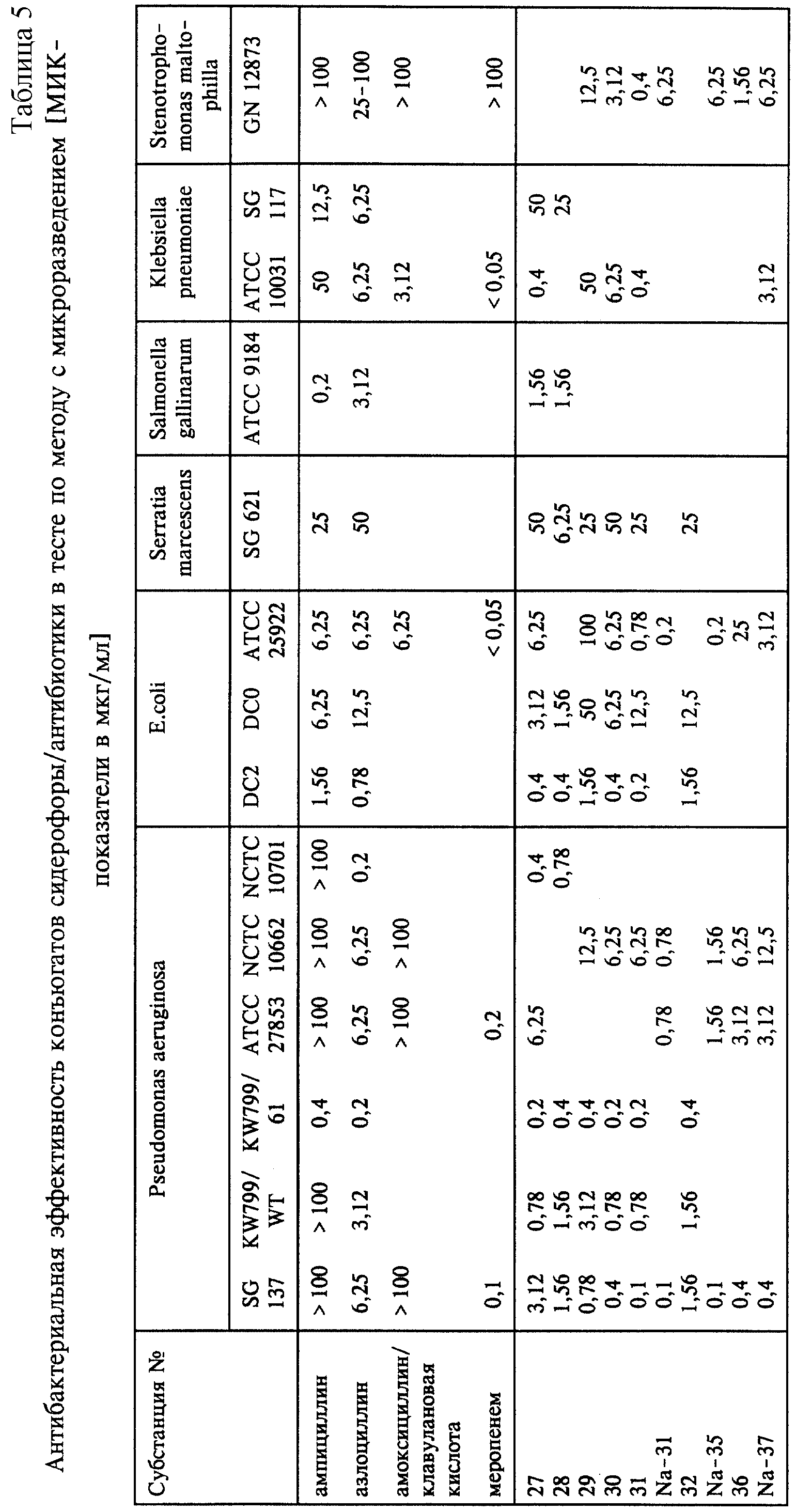
Соединения общей формулы I, где Y в R2 представляет собой остаток активного вещества, обладают антибактериальным действием, в том числе частично по отношению к бактериям, устойчивым к другим β-лактамам. С этой целью при тестировании по методу диффузии в агаре некоторые из соединений общей формулы I при Y, представляющем собой остаток активного вещества, например, субстанции 28-37, выборочно испытывали на штаммах бактерий, обладающих частичной устойчивостью к другим β-лактамам (таблица 4). В этой серии опытов использовали следующие штаммы: Pseudomonas aeruginosa SG 137 (устойчив к карбенициллину), KW 799/WT (дикий тип), KW 799/61 (пенетрационные мутанты, стенки клеток повреждены, более высокая пенетрация), АТСС 27853 (дикий тип), АТСС 9027 (дикий тип), NCTC 10662 (АТСС 25668, возбудитель, выделенный в клинических условиях, восприимчив к карбенициллину), NCTC 10701 (восприимчив к карбенициллину), NPS1 и Окса 6 (кодированная плазмидой β-лактамаза); E. coli DCO (дикий тип), DC2 (пенетрационные мутанты, стенки клеток повреждены, более высокая пенетрация), Klebsiella pneumoniae АТСС 10031 (дикий тип), а также SG 117; Salmonella gallinarum АТСС 9184; Stenotrophomonas maltophilia GN 12873 (устойчив к ампициллину, азлоциллину и карбапенему) и IMET 10402.
Неожиданным образом было установлено, что
испытуемые субстанции проявляют исключительно высокую эффективность не только по отношению к штаммам дикого типа,
устойчивым к ампициллину и/или к ингибиторам β-лактамазы, но и что они также
эффективны по отношению к двум штаммам Pseudomonas с кодированной плазмидой β-лактамазой (NPS1, Окса 6) и к
мультирезистентным штаммам Stenotrophomonas, тогда как, например, азлоциллин и
частично также меропенем или имипенем остаются неэффективными
Результаты тестирования по методу микроразведений
также подтвердили неожиданно высокую эффективность конъюгатов по изобретению.
Минимальную ингибирующую концентрацию (МИК) определяли на следующих штаммах бактерий: Pseudomonas aeruginosa NCTC 10701,
NCTC 10662, SG 137, АТСС 27853, KW 799/WT и KW 799/61; E.coli DSO, DC2 и АТСС
25922, Serratia marcescens SG621; Salmonella gallinarium ATCC 9184; Klebsiella pneumoniae ATCC 10031 и SG 117.
Результаты представлены в таблице 5. Согласно этим результатам все конъюгаты сидерофоры/ампициллин по сравнению с ампициллином и азлоциллином в качестве стандарта проявляют высокую эффективность, прежде всего по отношению к Pseudomonas aeruginosa SG 137, микроорганизму, устойчивому к карбенициллину, а также по отношению к штаммам дикого типа Pseudomonas и частично также по отношению к E.coli и Serratia.
На использовавшихся в тестах бактериях KW 799/WT и /61 рода Pseudomonas и DCO и DC2 E.coli исследовали степень повышения пенетрации под действием предлагаемых субстанций. KW 799/61 и DC2 представляют собой мутанты с проницаемой наружной мембраной по сравнению с дикими типами KW 799/WT, соответственно DCO. Касательно сравнительных субстанций азлоциллин и ампициллин в силу значительных различий в их активности по отношению к дикому типу и мутантам можно констатировать, что они обладают более или менее слабой способностью к пенетрации в отличие от конъюгатов, проявляющих высокую пенетрационную способность.
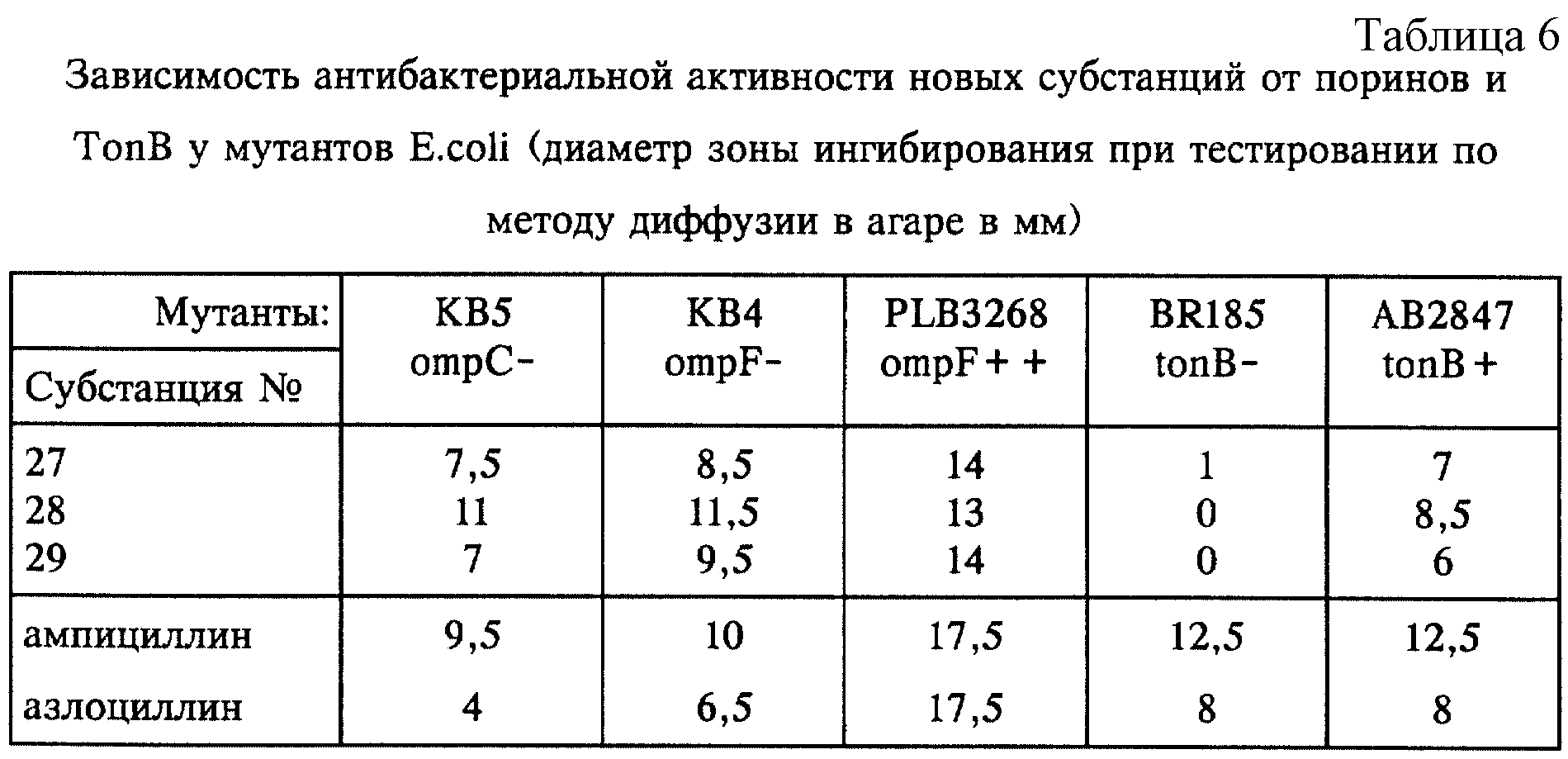
Результаты испытаний, полученные на пенетрационных мутантах Pseudomonas, KW 799/61, и E.coli DC2 и их диких типах, уже сами по себе подтверждают тот факт, что большинство новых субстанций обладают существенно лучшей способностью к пенетрации по сравнению с ампициллином и азлоциллином. Ряд других экспериментов, где выборочно использовали E.coli-мутанты, в которых отсутствуют порины ompC и ompF, по которым β-лактамы обычно попадают в бактериальную клетку, или незаменимый для активного транспорта железа мембранный белок tonB, показал, что описанные конъюгаты сидерофоры/антибиотики могут использовать два пенетрационных пути (порины ompC и ompF и путь переноса железа tonB), тогда как антибактериальная активность ампициллина и азлоциллина зависит только лишь от наличия поринов. Следовательно, эффективность по отношению к продуцентам β-лактамазы и мультирезистентным микроорганизмам можно объяснить механизмом нового типа по преодолению пенетрационной резистентности, благодаря которому соотношение между активным веществом и ферментом в бактериальной клетке подвергается такому воздействию, что не все молекулы антибиотика инактивируются, прежде чем достигнут клетку-мишень (таблица 6).
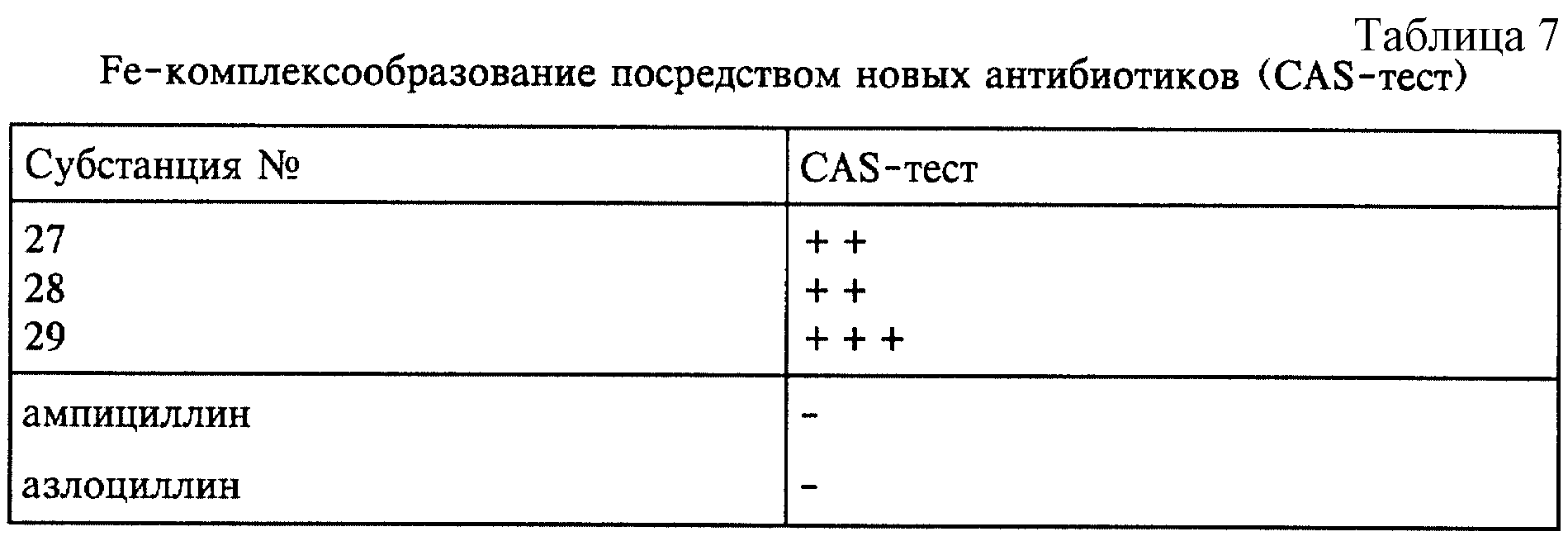
В приведенной ниже таблице 7 представлены результаты CAS-теста. CAS-тест (хромазурол-S-тест) согласно Швину и Нейланду (см. Anal. Biochem. 160, 47 (1987)) основан на цветной реакции, обусловленной удалением Fe из хромазурол-S-комплекса и связыванием катехольным соединением, чем подтверждается сидерофорное свойство соединения. Результаты CAS-теста с применением новых субстанций были положительными, тогда как при использовании ампициллина и азлоциллина результаты оказались полностью отрицательными. Это также является неожиданным подтверждением того факта, что новые антибиотики в качестве дополнительного пути для проникновения в бактериальную клетку наряду с пуринами используют путь транспорта железа.
Соединения общей формулы I, а при наличии кислых групп также их соли и расщепляемые в физиологических условиях сложные эфиры благодаря их свойствам в качестве сидерофоров, соответственно железосодержащих хелатов могут применяться в качестве лекарственных средств при заболеваниях, связанных с нарушением физиологического обмена железа. Соединения общей формулы I, где Y в R2 представляет собой остаток активного вещества, например остаток антибиотика с NH- или OH-группой, а при наличии кислых групп также их соли и расщепляемые в физиологических условиях сложные эфиры благодаря их антибактериальной эффективности пригодны для применения в качестве лекарственных средств против бактериальных инфекций у человека и домашних животных. При вышеназванных заболеваниях соединения общей формулы I могут применяться как таковые либо в виде фармацевтических препаратов с физиологически приемлемыми, известными из уровня техники вспомогательными веществами или носителями, причем в принципе возможно применение всех обычных фармакологических форм.
Примеры
а. Ароматические азометинкарбоновые
кислоты
Общие положения для примеров 1, 2 и 7:
2 ммоля соответствующего бензальдегида и 2 ммоля соответствующей аминобензойной кислоты нагревали с обратным холодильником в 100 мл
сухого толуола в течение 4-5 часов с использованием водоотделителя.
Выпавшие после охлаждения до комнатной температуры, соответственно концентрирования растворителя кристаллы отфильтровывали с помощью
вакуум-фильтра и перекристаллизовывали.
Общие
положения для примеров 3, 4, 5, 6 и 8:
2 ммоля соответствующего бензальдегида и 2 ммоля соответствующей аминобензойной кислоты (1
ммоль при использовании диаминосоединений) нагревали с
обратным холодильником в 80 мл сухого этанола в течение 3-4 часов. При этом для связывания образующейся в ходе реакции воды использовали
заполненную
молекулярным ситом экстракционную насадку
Сокслета. Выпавшие после охлаждения до комнатной температуры, соответственно после концентрирования растворителя кристаллы отфильтровывали с
помощью вакуум-фильтра и перекристаллизовывали.
Пример 1
3-[3,4-ди(метоксикарбонилокси)бензилиденамино]бензойная кислота (1)
Формула I, где R1 обозначает
OCOOCH3, R2 идентичен R7 в положении 4, где R3 обозначает Н, COY в положении 3, Х обозначает СН, Y обозначает ОН.
Субстанцию (1) получили взаимодействием 3, 4-ди(метоксикарбонилокси)-бензальдегида и 3-аминобензойной кислоты с выходом 53% от теории в виде слабоокрашенного в желтый цвет твердого вещества и tпл 198-199o С (толуол).
Пример 2
3[3,4-ди(метоксикарбонилокси)бензилиденамино] -4-гидроксибензойная кислота (2)
Формула I, где R1 обозначает ОСООСН3, R2
идентичен R7 в положении 4, где R3 обозначает 2-ОН, COY в положении 5, Х обозначает СН, W обозначает ОН.
Субстанцию (2) получили взаимодействием 3, 4-ди(метоксикарбонилокси)-бензальдегида и 3-амино-4-гидроксибензойной кислоты с выходом 30% от теории в виде слабоокрашенного в желтый цвет твердого вещества и tпл 221-223oС (толуол).
Пример 3
3-[2,3-дигидроксибензилиденамино]- 4-гидроксибензойная кислота (3)
Формула I, где R1 обозначает ОН, R2 идентичен R7
в положении 3, где R3 обозначает 2-ОН, COY в положении 5, Х обозначает СН, Y обозначает ОН.
Субстанцию (3) получили взаимодействием 2,3-дигидроксибензальдегида и 3-амино-4-гидроксибензойной кислоты с выходом 59% от теории в виде красных кристаллов и tпл 273-274oС (этанол).
Пример 4
3,5-бис[3,
4-ди(метоксикарбонилокси)бензилиденамино]бензойная кислота (4)
Формула I, где R1 обозначает OCOOCH3, R1 идентичен R7 в положении 4, где R3 представляет собой
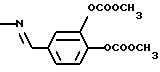
в положении 3, COY в положении 5, Х обозначает СН, Y обозначает ОН.
Субстанцию (4) получили взаимодействием 3,4-ди(метоксикарбонилокси)-бензальдегида и 3,5-диаминобензойной кислоты с выходом 49% от теории в виде слабоокрашенного в желтый цвет твердого вещества с tпл 145-148oС (толуол).
Пример 5
4-[2,3-дигидроксибензилиденамино]- 3-гидроксибензойная кислота (5)
Формула I, где R1 обозначает ОН, R2 идентичен R7 в положении 3, где R3 обозначает 2-ОН, COY в положении 4, Х обозначает СН, Y обозначает ОН.
Субстанцию (5) получили взаимодействием 2,3-дигидроксибензальдегида и 4-амино-3-гидроксибензойной кислоты с выходом 85% от теории в виде красных кристаллов и tпл 278-280oС (этанол).
Пример 6
4-(3,4-диацетоксибензилиденамино) бензойная кислота (6)
Формула I, где R1 обозначает OCOCH3, R2 идентичен R7 в
положении 4, где R3 обозначает Н, COY в положении 4, Х обозначает СН, Y обозначает ОH.
Субстанцию (6) получили взаимодействием 3,4-диацетоксибензальдегида и 4-аминобензойной кислоты с выходом 77% от теории в виде желтого твердого вещества с tпл 180-182oС (толуол).
Пример 7
3-[(3,4-диацетоксифенилимино)метил]
- 4,
5-дигидроксибензойная кислота (7).
Формула I, где R1 обозначает OCOCH3, R2 идентичен R8 в положении 3, где R3 обозначает 2, 3-ОН, COY в положении 5, Y обозначает ОН.
Субстанцию (7) получили взаимодействием 3-формил-4,5-дигидроксибензойной кислоты и 3,4-ди(ацетокси)анилина с выходом 79% от теории в виде красных кристаллов с tпл 240-243oС.
1H-ЯМР (диоксан-d8, δ в част./млн): 8,79 (s, 1Н, CH=N), 7,76 (s, 1H, ArH), 7,56 (s, 1H, ArH), 7, 28 (m, 3H, ArH), 2,26 (s, 3Н, СН3СО), 2,24 (s, 3H, СН3СО).
Пример 8
3-(3,4-дигидроксифенилазо)бензойная кислота (8)
Формула I, где R1
обозначает
ОН, R2 идентичен R7 в положении 4, где Х обозначает N, R3 обозначает Н, COY в положении 3, Y обозначает ОН.
3-аминобензойную кислоту (612 мг, 4,5 ммоля) диазотировали в 15 мл этанола и 2,5 мл концентрированной соляной кислоты с помощью 312 мг нитрита натрия при 0oС. К раствору соли диазония при перемешивании добавляли при 0oС раствор из 0,97 г (4,5 ммоля) монобензоата пирокатехина в 20 мл этанола. Затем добавляли еще 5 мл 25%-ного раствора Na2CO3, значение рН при этом должно было быть равным 9. Перемешивание продолжали еще в течение 2 часов при 0oС, соляной кислотой устанавливали на рН 2 и реакционную смесь экстрагировали дихлорметаном. Органическую фазу промывали водой и сушили над сульфатом натрия. Полученный после удаления под вакуумом растворителя сырой продукт перекристаллизовывали из этанола/воды. Выход: 327 мг (28% от теории). Красно-коричневые кристаллы, tпл: 213-215oС (этанол).
1Н-ЯМР (ДМСО-d6) δ в част./млн; J в Гц): 8,28 (m, 1H, ArH), 8,04 (dd, J= 1,8, 7,8, 2H, ArH), 7,69 (t, J-7,8, 1H, ArH), 7,42 (dd, J=2,3, 8,3, 1H, ArH), 7,36 (d, J=2,3, 1H, ArH), 6,94 (d, J=8,3, 1H, ArH).
б. Бензгидразоны
Пример 9
[(3,4-дигидроксибензоил)гидразоно]
фенилуксусная
кислота (9)
Формула I, где R1 обозначает ОН, R2 идентичен R9 в положении 4, где R4 обозначает СООН, R5 обозначает Н,
R15
обозначает Н.
1,2 г фенилглиоксиловой кислоты (0,01 моля) в 5 мл этанола и 1,7 г 3,4-дигидроксибензгидразида (0,01 моля) в 5 мл 2н. соляной кислоты перемешивали в течение 1 часа при комнатной температуре. Бесцветные кристаллы (этанол), выход 1,18 г (40% от теории), tпл 194-195oС (разложение).
1Н-ЯМР (AMCO-d6, δ в част./млн): 12,8 (s, 1H, NHCO), 6,86-7,69 (m, 8Н, ArH).
Пример 10
4-[(2,3-дигидроксибензоил)гидразонометил]бензойная кислота (10)
Формула I, где
R1
обозначает ОН, R2 идентичен R9 в положении 3, где R4 обозначает Н, R15 обозначает Н, R5 обозначает 4-СООН.
0,6 г (5 ммолей) 4-формилбензойной кислоты и 0,85 г (5 ммолей) 2,3-дигидроксибензгидразида кипятили с обратным холодильником в 10 мл этанола в течение 1 часа. Бесцветные кристаллы (этанол/вода), выход 909 мг (61% от теории), tпл 301-302oС.
Пример 11
4-[(3,4-дигидроксибензоил)гидразонометил]бензойная кислота (11)
Формула I, где R1
обозначает ОН,
R2 идентичен R9 положении 4, где R4 обозначает Н, R15 обозначает Н, R5 обозначает 4-СООН.
0,6 г (5 ммолей) 4-формилбензойной кислоты и 0,85 г (5 ммолей) 3,4-дигидроксибензгидразида кипятили с обратным холодильником в 10 мл этанола в течение 1 часа. Бесцветные кристаллы, очистка растворением в диметилформамиде, фильтрация и осаждение водой, выход 889 мг (61% от теории), tпл 314-315oС.
Пример 12
{ [3,4-ди(метоксикарбонилокси)бензоил] гидразон}
фенилуксусная кислота (12).
Формула I, где R1 обозначает ОСООСН3, R2 идентичен R9 в положении 4, где R4 обозначает СООН, R5 обозначает Н, R15 обозначает Н.
300 мг (1 ммоль) [(3,4-дигидроксибензоил)гидразоно]фенилуксусной кислоты - продукт из примера 9 (1 ммоль) - перемешивали в 2 мл 2 н. едкого 10 натра и 3 мл воды при 0oС в течение 10 минут с 2 мл метилового эфира хлормуравьиной кислоты. Затем подщелачивали 2 н. едким натром, добавляли 1 мл метилового эфира хлормуравьиной кислоты и повторно перемешивали в течение 30 минут. В завершение 2 н. соляной кислотой устанавливали на рН 2. Бесцветные кристаллы (из метанола/воды), выход 221 мг (53% от теории), tпл 171-172oС (разложение).
1Н-ЯМР (ДМСО-d6, δ в част./млн): 7,4-7,9 (m, 8H, АrН), 3,87, 3,85 (s, 2•3Н ОСОСН3).
Пример 13
(2,
3-дигидроксибензгидразон) 3-формил-4,5-дигидроксибензойной кислоты (13).
Формула I, где R1 обозначает ОН, R2 идентичен R9 в положении 3, где R5 обозначает 5-СООН, R4 обозначает Н, R15 обозначает 3,4-ОН.
Смесь из 364 мг 3-формил-4,5-дигидроксибензойной кислоты, растворенных в горячей воде, и 340 мг 2,3-дигидроксибензгидразида, растворенных в 5 мл 2 н. соляной кислоты, при перемешивании кипятили в течение 10 минут. Бесцветные кристаллы (ледяная уксусная кислота), выход 431 мг (65% от теории), tпл 280-281oС.
1Н-ЯМР (ДМСО-d6, δ в част./млн): 8,72 (s, 1Н, CH=N), 6,8-7,6 (m, 5Н, АrН), 7,74-7,75 (2• 1Н, d, J=1,6, 2-, соотв. 6-СН бензойной кислоты), 7,35-7,39 и 6,98-7,02 (2•1Н, d, J=8,4 и 6-СН бензгидразона), 6,74-6,82 (1Н, t, J= 8,5, CH бензгидразона).
Пример 14
4{ [3,
4-ди(метоксикарбонилокси)бензоил]гидразонометил} бензойная кислота (14).
Формула I, где R1 обозначает OCOOCH3, R2 идентичен R9 в положении 4, 5 где R5 обозначает 4-СООН, R4 обозначает Н, R15 обозначает Н.
300 мг (1 ммоль) 4[(3,4-дигидроксибензоил) гидразонометил] бензойной кислоты - продукта из примера 11 растворяли в 1 мл 2н. едкого натра и 3 мл воды, раствор охлаждали до 0oС и при перемешивании смешивали с 2 мл метилового эфира хлормуравьиной кислоты. Смесь продолжали перемешивать еще в течение 30 минут при 0oС, а затем соляной кислотой устанавливали на рН 3. Бесцветные кристаллы (этанол/вода), выход 205 мг (49% от теории), tпл 184-187oС (разложение).
1Н-ЯМР (ДМСО-d6, δ в част./млн): 8,50 (s, 1H, CH=N), 7,62-8,04 (m, 7H, ArH), 3,88 (s, 6H, 2•ОСООСН3).
Пример 15
6[(3,4-дигидроксибензоил)гидразонометил] -2,3-дигидроксибензойная кислота (15).
Формула I, где R1 обозначает ОН, R2 идентичен R в положении 4, где R5 обозначает 2-СООН, R4 обозначает Н, R15 обозначает 3,4-ОН.
Смесь из 182 мг (1 ммоль) 6-формил-2, 3-дигидроксибензойной кислоты, растворенных в горячей воде, и 168 мг (1 ммоль) 3,4-дигидроксибензгидразида, растворенных в 5 мл 2 н. соляной кислоты, кипятили при перемешивании в течение 10 минут. Бледно-желтые кристаллы (вода), выход 215 мг (65% от теории), tпл 252oС.
1Н-ЯМР (ДМСО-d6, δ в част./млн): 8,53 (s, 1H, CH=N), 6,8-7,3 (m, 5Н, ArH).
в.
Производные аминобензойной кислоты
Пример 16
2-(2,3-диацетоксибензоиламино)бензойная кислота (16)
Формула I, где R1 обозначает
ОСОСН3, R2
идентичен R10 в положении 3, где COY находится в положении 2, Y обозначает ОН, R18-R20 обозначают Н.
Способ 1
1,50 г (0,011 моля) антраниловой
кислоты суспендировали в 100 мл 0,5 М раствора NаНСО3 и при температуре в интервале от 0 до 10oС смешивали в ультразвуковой бане при
перемешивании с 2,56 г (0,01 моля) 2,
3-диацетоксибензоилхлорида в 8 мл тетрагидрофурана. Образовавшийся по истечении 45 минут мутный раствор фильтровали и осторожно подкисляли концентрированной
соляной кислотой. Полученные бесцветные
кристаллы промывали небольшим количеством этилацетата и сушили под вакуумом. tпл 203-204oС, выход 2,7 г (75% от теории).
1H-ЯМР (ДМСО-d6, δ в част./млн): 11,8 (s, 1H, NHCO), 7,2-8,5 (m, 7H, ArH), 2,15 и 2,25 (s, 2•3H, ОСОСН3).
Способ 2
К 1,4 г (0,
01 моля) антраниловой кислоты в 100 мл
раствора бикарбоната натрия добавляли при 0oС 2,57 г 2,3-диацетоксибензоилхлорида в 50 мл тетрагидрофурана. Реакцию со смесью проводили сначала в
течение 1 часа в интервале температур
0-10oС, а затем в течение 30 минут при комнатной температуре в ультразвуковой бане. Далее частично концентрировали и осторожно подкисляли 2н. соляной
кислотой. Таким путем получили
бледно-желтые кристаллы (этилацетат) с выходом 2,3 г (64% от теории) и tпл 198-200oС.
Пример 16а
4-[(2,
3-диметоксикарбонилоксибензоил)метиламино]бензойная кислота
Формула I, где R1 обозначает OCOOCH3, R2 идентичен R10 в положении 3, R19
обозначает CH3, R18 идентичен R20 и обозначает Н, COY в положении 4, Y обозначает ОН.
По описанному выше способу 1 аналогичным путем из 4-метиламинобензойной кислоты и 2,3-ди(метоксикарбонилокси)бензоилхлорида получили указанное в заголовке соединение с выходом 65% от теории.
Пример 16б
3,5-бис(2,
3-диацетоксибензоиламино)бензойная кислота.
Формула I, где R1 обозначает ОСОСН3, R2 идентичен R10 в положении 3, R18 идентичен R19 и обозначает Н, R20 обозначает (2,3-диацетокси)бензоиламино в положении 5, COY в положении 3, Y обозначает ОН.
По описанному выше способу 1 аналогичным путем из 3,5-диаминобензойной кислоты и 2,3-диацетоксибензоилхлорида получили указанное в заголовке соединение с выходом 55% от теории.
Пример 17
4-(2,3-диацетоксибензоиламино)
бензойная кислота (17)
Формула I, где R1 обозначает OCOCH3, R2 идентичен R10 в положении 3, где COY находится в положении 4, Y обозначает ОН,
R18-R20 обозначают Н.
К 137 мг (1 ммоль) 4-аминобензойной кислоты и 0,14 мл триэтиламина в 10 мл тетрагидрофурана добавляли при -20oС 257 мг 2, 3-диацетоксибензоилхлорида в 5 мл тетрагидрофурана. Смесь перемешивали сначала в течение 30 минут при -20oС, а затем также в течение 30 минут при комнатной температуре. Далее частично концентрировали и осторожно подкисляли 2н. соляной кислотой. Бледно-желтые кристаллы (этилацетат), выход 215 мг (60% от теории), tпл 134-135oС.
1Н-ЯМР (ДМСО-d6, δ в част./млн): 7,3-7,9 (m, 7Н, АrН), 2,1 и 2,3 (s, 2•3Н, ОСОСН3).
г. Производные аминокислоты
Общие положения для примеров 19,
20, 22, 23 и 25:
Стадия 1 (ацилирование)
2,5 ммоля соответствующей аминокислоты или дипептда (представленных в свободном виде либо в виде гидрохлорида, соответственно ацетата)
растворяли в 10 мл водного раствора NaOH (2,5 ммоля NaOH для аланина, 7,6 ммолей для диаминокислот, 11,5 ммолей для дипептида). При 0oС добавляли медленно по каплям при перемешивании
раствор 2,3-ди(бензилокси)бензоилхлорида (2,5 ммоля для аланина, 5,1 ммолей для диаминокислот, 9 ммолей для дипептида) в 10 мл тетрагидрофурана, после чего нагревали до 20-25oС. При этой
температуре перемешивали в течение 4 часов и затем реакционную смесь с помощью 2М соляной кислоты устанавливали на рН 2. Далее реакционную смесь экстрагировали этилацетатом, органическую фазу
промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и удаляли под вакуумом растворитель. Сырой продукт очищали путем перекристаллизации (этанол/вода в случае
производного
аланина) либо посредством колоночной хроматографии (силикагель 60, фирма Merck, элюенты: хлороформ: этилацетат: ледяная уксусная кислота в соотношении 30:10:1 либо
этилацетат:толуол:ледяная уксусная
кислота в соотношении 10:10:2).
Стадия 2 (дебензилирование)
500 мг полученного на стадии 1 продукта растворяли в смеси из 9 мл этанола и 1
мл ледяной уксусной кислоты,
смешивали с 50 мг палладия на активированном угле (10% Pd) и при 20oС при нормальном давлении перемешивали в атмосфере водорода до поглощения требуемого
стехиометрического количества
водорода (обычно в течение 4-6 часов). Затем реакционную смесь фильтровали через броунмиллерит, растворитель отгоняли и остаток сушили под вакуумом.
Общие положения для примеров 21, 24
и 26:
Стадия 1 (ацилирование)
2 ммоля гидрохлорида или тозилата бензилового эфира аминокислоты растворяли в 10 мл дихлорметана и раствор
смешивали с 4 ммолями триэтиламина (8 ммолей
в случае производных диаминокислоты). При -30oС медленно по каплям добавляли раствор из 2 ммолей 2,3-диацетоксибензоилхлорида (4 ммоля для
производных диаминокислоты) в 10 мл дихлорметана.
Затем продолжали перемешивание соответственно еще в течение 1 часа при 25-30oС и в течение 1 часа при 20-25oС. Далее
реакционный раствор промывали последовательно 1М соляной
кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органическую фазу сушили над
сульфатом натрия, растворитель удаляли под вакуумом и остаток
очищали путем перекристаллизации из этанола либо толуола (в случае производного серина) или посредством колоночной хроматографии
(производное лизина: силикагель 60, фирма Merck, элюенты: этилацетат:
толуол в соотношении 2:1).
Стадия 2 (расщепление бензилового эфира)
1 г полученного на стадии 1 продукта
растворяли в смеси из 20 мл этанола и 1 мл ледяной уксусной кислоты,
смешивали со 100 мл палладия на активированном угле (10% Pd) и при 20oС при нормальном давлении перемешивали в
атмосфере водорода в течение 2 часов. Полученный продукт фильтровали через
броунмиллерит и растворитель удаляли под вакуумом. Остаток растворяли с помощью этилацетата, промывали насыщенным водным
раствором хлорида натрия и органическую фазу сушили над сульфатом натрия. После
удаления под вакуумом растворителя продукт выпадал в виде кристаллов или его очищали путем перекристаллизации.
Пример 18
L-2,5-бис(2,3-дигидроксибензоиламино) пентановая
кислота (18)
Формула I, где R1 обозначает ОН, R2 идентичен R11 в положении 3,
где R6 идентичен R12, n равно 3, R15 обозначает
2,3-ОН, Y обозначает ОН, L-форма.
Субстанцию (18) получили из моногидрохлорида L-орнитина с выходом 66% от теории в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, δ в част./млн): 7,41 (dd, 1H, ArH), 7,27 (dd, 1H, ArH), 6,92 (m, 2H, ArH), 6,69 (m, 2H, ArH), 4,46 (m, 1H, CH-N), 3,36 (m, 2H, CH2-N), 1,84 (m, 2H, CH2 ), 1,65 (m, 2H, CH2).
Пример 19
L-2-(2,3-дигидроксибензоиламино) пропионовая
кислота (19)
Формула I, где R1 обозначает ОН, R2
идентичен R11 в положении 3, где R6 обозначает СH3, Y обозначает ОН, L-форма.
Субстанцию (19) получили из L-аланина с выходом 88% от теории в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, δ в част./млн): 7,40 (dd, 1H, ArH), 6,94 (dd, 1H, ArH), 6,72 (dd, 1H, ArH), 4,44 (m, 1H, CH), 1,42 (d, 3Н, СН3).
Пример 20
L-2-(2,3-диацетоксибензоиламино) пропионовая кислота (20)
Формула I, где R1 обозначает ОСОСН3, R2 идентичен R11 в положении 3, где R6 обозначает CH3, Y обозначает ОН, L-форма.
Субстанцию (20) получили из гидрохлорида бензилового эфира L-аланина с выходом 75% от теории в виде бесцветных кристаллов с tпл 109-111oС.
1H-ЯМР (ДМСО-d6, δ в част./млн): 7,50 (dd, 1H, ArH), 7,39 (m, 2H, ArH), 4,33 (m, 1H, СН), 2,29 (s, 3H, СН3СО), 2,23 (s, 3H, СН3СО), 1,34 (d, 3H, СН3).
Пример 21
L-2,4-бис(2,3-дигидроксибензоиламино) масляная кислота (21)
Формула I, где R1 обозначает ОН, R2 идентичен R11 в положении 3,
где R6 идентичен R12, n равно 2, R15 обозначает 2,3-ОН, Y
обозначает ОН, L-форма.
Субстанцию (21) получили из дигидрохлорида L-2,4-диаминохлорноватой кислоты с выходом 81% от теории в виде серо-белого твердого вещества.
1H-ЯМР (ДМСО-d6, δ в част./млн): 7,42 (dd, 1H, ArH), 7,27 (dd, 1H, ArH), 6,94 (m, 2H, ArH), 6,72 (m, 2H, ArH), 4,48 (m, 1H, CH-N), 3,42 (m, 2H, СН2), 2,21 (m, 1H, СH2), 2,05 (m, 1H, CH2).
Пример 22
L-3[2,6-бис(2,
3- дигидроксибензоиламино) гексаноиламино] -2- (2,3-дигидроксибензоиламино) пропионовая кислота (22)
Формула I, где R1 обозначает ОН, R2 идентичен R11 в
положении 3, где R6 идентичен R13, n1 равно 1, n2 равно 4, R15 обозначает 2,3-ОН, Y обозначает ОН, L-форма.
Субстанцию (22) получили из L-2-амино-3-(2,6-диаминогексаноиламино) пропионовой кислоты с выходом 70% от теории в виде белого твердого вещества.
1H-ЯМР (AMCO-d6, δ в част./млн): 7,42 (dd, 1H, ArH), 7,26 (m, 2H, ArH), 6,91 (m, 3H, ArH), 6,69 (m, 2H, ArH), 6,67 (m, 3H, ArH), 4,55-4, 28 (m, 3H, CH-N, CH2-N), 4,10-3,09 (m, 3H, CH-N, СН2-N), 1,72 (m, 2H, CH2), 1,51-1,28 (m, 4H, CH2).
Пример 23
L-2[2,
3-(диацетоксибензоиламино)- 3-гидроксипропионовая кислота (23)
Формула I, где R1 обозначает ОСОСН3, R2 идентичен R11 в положении 3, где R6 обозначает СН2, ОН, Y обозначает ОН, L-форма.
Субстанцию (23) получили из гидрохлорида бензилового эфира L-серина с выходом 53% от теории в виде бесцветных игольчатых кристаллов с tпл 165-168oС (ацетон/н-гексан).
1H-ЯМР (ДМСО-d6, δ в част. /млн): 7,59 (dd, 1H, ArH), 7,42 (m, 2H, 5 ArH), 4, 42 (m, 1H, СН), 3,76 (m, 2H, СH2O), 2,29 (s, 3Н, СН3СО), 2,28 (s, 3Н, СН3СО).
Пример 23а
L-3-бензилокси-2- (2,
3-диацетоксибензоиламино)пропионовая кислота
Формула I, где R1 обозначает OCOCH3, R2
идентичен R11 в положении 3, где R6 обозначает
СН2ОСН2 (С6Н5), Y обозначает ОН, L-форма.
Эту субстанцию получили из гидрохлорида бензилового эфира O-бензил-L-серина аналогично субстанции (23), однако на стадии 2 применяли палладий на активированном угле (10% Pd) и циклогексадиен, в виде белых кристаллов.
Пример 24
D-2,5-бис(2,3-дигидроксибензоиламино)
пентановая кислота (24)
Формула I, где R1 обозначает ОН, R2 идентичен R11 в положении 3,
где R6 идентичен R12, n равно 3, R15
обозначает 2,3-ОН, Y обозначает ОН, D-форма.
Субстанцию (24) получили из моногидрохлорида D-орнитина с выходом 66% от теории в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, δ в част./млн): 7,41 (dd, 1H, ArH), 7,27 (dd, 1H, ArH), 6,93 (m, 2H, ArH), 6,70 (m, 2H, ArH), 4,46 (m, 1H, CH-N), 3,33 (m, 2H, СН2-N), 1,84 (m, 2H, СH2), 1,64 (m, 2H, СH2).
Пример 25
L-2,6-бис(2,3-диацетоксибензоиламино)
гексановая кислота (25)
Формула I, где R1 обозначает
OCOCH3, R2 идентичен R11 в положении 3, где R6 идентичен R12, n равно 4,
R15 обозначает 2,3-ОСОСН3, Y обозначает ОН,
L-форма.
Субстанцию (25) получили из дитозилата бензилового эфира L-лизина с выходом 71% от теории в виде белого твердого вещества.
1H-ЯМР (СDС13, δ в част./млн, J в Гц): 7,65 (dd, J=1,9, 7,4, 1H, ArH), 7,47 (dd, J= 2,3, 7,2, 1H, ArH), 7,32-7,22 (m, J=1,8, 7,3, 5Н, ArH, CONH), 6,59 (t, J= 5,7, 1H, CONH), 4,75 (m, J=5,2, 7,2, 1H, CH-N). 3, 38 (m, 2H, CH2-N), 2,34 (s, 3Н, СН3СО), 2,30 (s, 3Н, СН3СО), 2,30 (s, 3Н, СН3СО), 2,29 (s, 3Н, СН3СО), 1,99 (m, 1H, СH2), 1,85 (m, 1H, СH2), 1,60 (m, 2H, СH2), 1,28 (m, 2Н, СH2).
д. Остатки
оксазолидинкарбоновой кислоты
Пример 26
(S)-3(2,3-диацетоксибензоил)
оксазолидин-4-карбоновая кислота (26)
Формула I, где R1 обозначает ОСОСН3, R2 идентичен R14 в положении 3, где Z обозначает О, R16
идентичен R17 и обозначает Н, Y обозначает ОН, S-форма
L-серин (105 мг, 1 ммоль) растворяли в 0,
5 мл 2М едкого натра и при 0oС смешивали с 0,1 мл водного раствора
формальдегида (36,5%-ного). Реакционную смесь выдерживали в течение 24 часов при 0oС, после чего добавляли 84
мг (1 ммоль) гидрокарбоната натрия и 1 мл ацетона и охлаждали до -5o
С. При перемешивании добавляли порциями 257 мг (1 ммоль) 2,3-15 ди(ацетокси)бензоилхлорида. После перемешивания в
течение 1 часа при температуре в интервале от -5 до 0oС разбавляли 10 мл
воды и реакционную смесь экстрагировали диэтиловым эфиром. Водную фазу подкисляли 1М соляной кислотой до рН 2-3 и
повторно экстрагировали диэтиловым эфиром (3•20 мл). Органическую фазу сушили
над сульфатом натрия и растворитель удаляли под вакуумом. Полученный продукт сушили под вакуумом. Выход: 263 мг
(78% от теории). Пенистое вещество белого цвета.
1H-ЯМР (СDС13, δ в част./млн): 7,35-7,27 (m, 3Н, АrН), 4,90 (s, 2H, O-CH2-N), 4,82 (m, 1H, СН), 4,39 (m, 1H, CH2), 4,28 (m, 1H, СH2), 2,33 (s, 3Н, СН2), 2,31 (s, 3Н, СН2).
е. Конъюгаты антибиотики
Пример 27
N-[L-2(2,
3-диацетоксибензоиламино)пропионил]ампициллин (согласно номенклатуре ИЮПАК:
6{2-[2-(2,3-диацетоксибензоилами-но)пропиониламино]-2-фенилацетиламино} -3,3-диметил-7-оксо-4-тиа-1-азабицикло [3.2.0]
гептан-2-карбоновая кислота (27)
Формула I, где R1 обозначает
ОСОСН3, R2 идентичен R11 в положении 3, где R6 обозначает СН3
(L-форма), Y обозначает N-ампициллино.
500 мг (1,62 ммоля) L-2-(2, 3-диацетоксибензоиламино)пропионовой кислоты (субстанция 20) растворяли в 15 мл тетрагидрофурана и к этому раствору при перемешивании по каплям добавляли при -20oС 0,18 мл (1,62 ммоля) N-метилморфолина, а затем 0,21 мл (1,62 ммоля) изобутилового эфира хлормуравьиной кислоты. После перемешивания в течение 1 часа по каплям добавляли охлажденный до 0oС раствор из 565 мг (1, 62 ммоля) тригидрата ампициллина в 5 мл 80%-ного тетрагидрофурана. Далее смесь перемешивали в течение 1 часа при -20oС и в течение 1 часа при комнатной температуре и затем концентрировали под вакуумом. После этого добавляли воду и этилацетат и с помощью 1М соляной кислоты осторожно подкисляли до рН 2. Смесь встряхивали до достижения полной растворимости реагентов, этилацетатную фазу отделяли, промывали раствором поваренной соли до нейтрального состояния и сушили над сульфатом натрия. После концентрирования под вакуумом осаждали с помощью петролейного эфира. Выход сырого продукта: 1 г, чистота согласно ЖХВР (Europher 100-7): приблизительно 75%. Очистку осуществляли посредством препаративной ЖХВР (колонка RP 18, ацетонитрил/вода в соотношении 40:60+0,50% трифторуксусной кислоты, скорость потока 10 мл/мин). Фракции, содержавшие продукт, сразу же экстрагировали этилацетатом, органическую фазу промывали водой, сушили, концентрировали и осаждали с помощью петролейного эфира. Чистота согласно ЖХВР: 95%.
1H-ЯМР (300 МГц, СDС13, δ в част./млн, J в Гц): 7,63 (dd, J=1,9, 7,4, ArH), 7,33-7,19 (m, 7Н, ArH), 5,61 (m, J=4,1, 2H, CH-N), 5,42 (d, J=4,1, 1H, CH-S), 5,00 (m, J= 7,3, 1H, CH-Me), 4,29 (s, 1H, CH-COO), 2,30 (s, 3H, СН3СО), 2,27 (s, 3H, CH3CO), 1,43 (s, 3H, CH3), 1,40 (d, J=7,1, 3H, СН3), 1,37 (s, 3H, СН3).
Пример 28
N-[2-(2,
3-диацетоксибензоиламино) бензоил] ампициллин (согласно номенклатуре ИЮПАК: 6-{2-[2-(2,
3-диацетоксибензоиламино)бензоиламино]-2-фенилацетиламино] -3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]
гептан-2-карбоновая кислота) (28).
Формула I, где R1 обозначает ОСОСН3, R2 идентичен R10 в положении 3, R18-R20 обозначают Н, где COY находится в положении 2, Y обозначает N-ампициллино.
К раствору из 357 мг (1 ммоль) 2-(2,3-диацетоксибензоиламино)бензойной кислоты (субстанция 16) в 5 мл абсолютного тетрагидрофурана при -20oС добавляли сначала 0,11 мл (1 ммоль) N-метилсорфолина и каталитическое количество 4-диметиламинопиридина, а затем при перемешивании 126 мкл изобутилового эфира хлормуравьиной кислоты. Смесь перемешивали в течение 1 часа при -20oС, после чего порциями добавляли раствор из 371 мг (1 ммоль) натриевой соли ампициллина в 3 мл 80%-ного тетрагидрофурана. Далее перемешивали в течение 1 часа при -20oС и в течение 2 часов при комнатной температуре. Затем растворитель отгоняли под вакуумом и к остатку добавляли 20 мл воды и 20 мл этилацетата. Смесь осторожно подкисляли 1М соляной кислотой до рН 3 и интенсивно встряхивали. Органическую фазу отделяли, трижды промывали водным раствором поваренной соли и сушили над сульфатом натрия. После концентрирования осаждали с помощью петролейного эфира. Выход сырого продукта: 420 мг. Сырой продукт разделяли посредством препаративной ЖХВР (Nucleosil 7 С 18, фирма Macherey & Nagel, элюенты ацетонитрил/вода в соотношении 50:50+0,05% трифторуксусной кислоты).
Фракция 2
N-[2(2,3-диацетоксибензоиламино) бензоил]ампициллин
Выход 420 мг сырого продукта: приблизительно 90 мг согласно ЖХВР (Europher 100 С 18-7,
элюенты ацетонитрил/вода в соотношении 60:40+0,05% трифторуксусной кислоты).
1H-ЯМР (ДМСО-d6, δ в част./млн): 7,3-8,4 (m, 12H, ArH), 5,9 (d, 1H, J= 7,7 Гц, CH), 5,53 (q, 1H, СН), 5,42 (d, 1H, J=4,0 Гц, СН), 4,2 (s, 1H, CH), 2,32, 2,24 (s, 2•3H, СН3 ), 1,40, 1,50 (s, 2•3H, СН3).
Пример 29
N-[4(2,
3-диацетоксибензоиламино)бензоил]ампициллин (29)
Формула I, где R1 обозначает OCOCH3, R2 идентичен R10 в положении 3, где R18-R20 обозначают Н, при COY в положении 4, Y обозначает N-ампициллино.
Субстанцию (29) получили аналогично субстанции 28 из 4-(2,3-диацетоксибензоиламино)бензойной кислоты (субстанция 17) и натриевой соли ампициллина. Сырой продукт разделяли посредством препаративной ЖХВР (Nucleosil 7 С 18, фирма Macherey & Nagel, элюенты ацетонитрил/вода в 5 соотношении 50: 50+0, 05% трифторуксусной кислоты).
1H-ЯМР (ДМСО-d6, δ в част. /млн): 7, 3-7,9 (m, 12H, ArH), 5,9 (d, 1H, α-CH), 5,53 (q, 1H, 6-CH), 5,41 (d, 1H, 7-CH), 4, 2 (s, 1H, 3-CH), 2,20, 2,28 (s, 2•3H, СН3), 1,40, 1,52 (s, 2•3H, СН3).
Пример 30
(S)-N-[3(2,3-ди
(метоксикарбонилоксибензоил)оксазолидин-4-оил)ампициллин (согласно номенклатуре ИЮПАК: (S)-6-(2-{[3-(2,
3-диметоксикарбонилоксибензоил)оксазолидин-4-карбонил] амино} -2-фенилацетиламино)- 3,
3-диметил-7-оксо-4-тиа-1-азабицикло [3.2.0]гептан-2-карбоновая кислота) (30).
Формула I, где R1 обозначает ОСООСН3, R2 идентичен R14 в положении 3, где Z обозначает О, R16 и R17 обозначают Н, (S-форма), Y обозначает N-ампициллино.
Субстанцию (30) получили аналогично субстанции 28 из (S)-3-(2, 3-диметоксикарбонилоксибензоил)оксазолидин-4-карбоновой кислоты и тригидрата ампициллина.
Пример 31
N-[L-2,6-бис (2,3-диацетоксибензоиламино)гексаноил]ампициллин (согласно
номенклатуре ИЮПАК: 6-{L-2-[2,6-бис(2,3-диацетоксибензоиламино) гексаноиламино]-2- фенилацетиламино}-3,
3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновая кислота) (31).
Формула I, где R1 обозначает OCOCH3, R2 идентичен R11 в положении 3, где R6 идентичен R12, n равно 4, R15 обозначает 2, 3-ОСОСН3, (L-форма), Y обозначает N-ампициллино.
Субстанцию (31) получили аналогично субстанции 28 из L-2,6-бис(2,3-диацетоксибензоиламино)гексановой кислоты (субстанция 25) и тригидрата ампициллина.
Пример 32
N-[L-3-ацетокси-2 (2,
3-диацетоксибензоиламино)пропионил] ампициллин (согласно номенклатуре ИЮПАК: 6-{L-2-[3-ацетокси-2-(2,
3-диацетоксибензоиламино) пропиониламино] -2-фенилацетиламино} -3,
3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2- карбоновая кислота) (32).
Формула I, где R1 обозначает ОСОСН3, R2 идентичен R11 в положении 3, где R6 обозначает CH2OCOCH3, (L-форма), Y обозначает N-ампициллино.
Субстанцию (32) получили аналогично субстанции 27 из L-3-ацетокси-2-(2,3-диацетоксибензоиламино)пропионовой кислоты и тригидрата ампициллина с чистотой сырого продукта согласно ЖХВР (Nucleosil 7 С 18, фирма Macherey & Nagel, элюенты: ацетонитрил/вода в соотношении 40:60+0,05% трифторуксусной кислоты) 85%.
Пример 33
N-[L-2-(2,3-диацетоксибензоиламино) пропионил]
цефадроксил (согласно номенклатуре ИЮПАК:
7-{L-2-[2-(2,3-диацетоксибензоиламино)пропиониламино]-2- (4-гидроксифенил)ацетиламино} -3-метил-8-оксо-5-тиа- 1-азабицикло[4.2.0] окт-2-ен-2-карбоновая
кислота) (33)
Формула I, где R1 обозначает OCOCH3, R2 идентичен R11 в положении 3, где R1 обозначает CH3, L-форма, Y
обозначает N-цефадроксил.
Субстанцию (33) получили аналогично субстанции 28 из L-2-(2,3- диацетоксибензоиламино)пропионовой кислоты (субстанция 20) и цефадроксила. Очистку осуществляли посредством препаративной ЖХВР (колонка RP 18, ацетонитрил/вода в соотношении 30: 70+0,1% трифторуксусной кислоты). Полученное соединение (33) имело чистоту 91%.
Пример
34
N-[L-3-бензилокси-2 (2,
3-диацетоксибензоиламино)пропионил] ампициллин (34)
Формула I, где R1 обозначает OCOCH3, R2 идентичен R11 в
положении 3, где R6
обозначает СН2ОСН2 (С6H5), L-форма, Y обозначает N-ампициллино.
Эту субстанцию получили аналогично субстанции 28 из L-3-бензилокси-2-(2, 3-диацетоксибензоиламино)пропионовой кислоты (субстанция 23а) и тригидрата ампициллина.
Пример 35
N-[L-2,6-бис(2,
3- диацетоксибензоиламино) гексаноил]амоксициллин (35)
Формула I, где R1 обозначает OCOCH3, R2 идентичен R11 в положении 3, где R6
идентичен R12, n равно 4, R15 обозначает
2,3-ОСОСН3, L-форма, Y обозначает N-амоксициллино.
Эту субстанцию получили аналогично субстанции 28 из L-2, 6-бис(2,3-диацетоксибензоиламино)гексановой кислоты (субстанция 25) и тригидрата амоксициллина с выходом 84% от теории.
Пример 36
N-[3,5-бис(2,3- диацетоксибензоиламино)
бензоил]ампициллин (36)
Формула I, где R1
обозначает OCOCH3, R2 идентичен R10 в положении 3, R18 идентичен R19 и обозначает Н,
R20 обозначает (2,3-диацеток-си)бензоиламино в
положении 5, COY в положении 3, Y обозначает N-ампициллино.
Эту субстанцию получили аналогично субстанции 28 из 3,5-бис(2, 3-диацетоксибензоиламино)бензойной кислоты (субстанция 16б) и натриевой соли ампициллина.
Пример 37
N-{ 4[(2,3- диметоксикарбонилоксибензоил) метиламино]бензоил}ампициллин
(37)
Формула I, где R1 обозначает
ОСООСН3, R2 идентичен R11 в положении 3, R19 обозначает СН3, R18 идентичен R20 и обозначает Н, COY в положении 4, Y
обозначает N-ампициллино.
К раствору из 245 мг натриевой соли ампициллина в 5 мл водного тетрагидрофурана (80%-ный ТГФ) при -5o С при перемешивании добавляли по каплям раствор из 280 мг 4-[(2,3-диметоксикарбонилоксибензоил) метиламино]бензоилхлорида (полученного из 4-[2,3-диметоксикарбонилоксибензоил) метиламино] бензойной кислоты - субстанции 16а - и пентахлорида фосфора) в 3 мл абсолютного тетрагидрофурана. Смесь перемешивали в течение 1 часа при 0oС и в течение 1 часа при 20oС соответственно и затем упаривали под вакуумом. Остаток с помощью 1н. соляной кислоты устанавливали на рН 3 и экстрагировали этилацетатом. Экстракты промывали водным раствором хлорида натрия и сушили над сульфатом натрия. После практически полного концентрирования смешивали с петролейным эфиром. Таким путем получили 425 мг (88% от теории) указанного в заголовке соединения в виде белого порошка.
Натриевые соли субстанций 27, 28,
30, 31, 35 и 37
Натриевые соли вышеназванных субстанций получали по следующей общей технологии.
Раствор из 1,1 г кислоты в 5 мл этилацетата смешивали с раствором из 0,5 г 2-этилгексаноата натрия в 3 мл этилацетата и смесь разбавляли 30 мл петролейного эфира (tкип 40-65oС). Образующиеся при этом натриевые соли выделяли, сушили под вакуумом и очищали посредством препаративной ЖХВР на колонке RP 18. Выход составлял 50-80%.
Реферат
Изобретение относится к новым соединениям общей формулы (I), где R1 обозначает ОН, 0-ацил; R2 обозначает группы следующих формул II, III, IV, V, VI, VII. Эти соединения обладают сидерофорной активностью, а также дополнительно обладают антибактериальной активностью. Благодаря этим свойствам эти соединения можно использовать в качестве действующего вещества в лекарственных средствах, прежде всего для устранения устойчивости к антибиотикам, обусловленной недостаточной пенетрацией. 2 с. и 21 з.п. ф-лы, 7 табл.
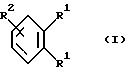
Формула
в которой R1 имеют идентичные значения или обозначают независимо друг от друга ОН и/или O-ацил;
R2 в положении 3 и/или 4 представляет собой следующие группы:
а. остатки ароматических азометинкарбоновых кислот и/или остатки азобензолкарбоновых кислот

Х обозначает СН, N;
Y обозначает ОА, где А представляет собой Н;
R3 представляет собой один либо два O-ацильных остатка, если R1 обозначает ОН или O-ацил, или R3 представляет собой Н, если R1 обозначает O-ацил, или
R15 имеют идентичные значения или обозначают независимо друг от друга Н и/или O-ацил,
или
Y обозначает ОА, где А представляет собой Н;
R3 имеют идентичные значения или обозначают независимо друг от друга Н, ОН,
б. бензгидразоновые остатки

R15 имеют идентичные значения или обозначают независимо друг от друга Н, ОН, O-ацил;
R4 и/или R5 обозначают Н, COY, где Y обозначает ОА, где А представляет собой Н,
в. остатки аминобензойных кислот
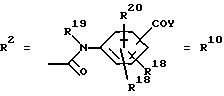
Y обозначает ОА, где А представляет собой Н, или Y обозначает остаток активного вещества, содержащий NH- или ОН-группу;
R19 обозначает Н, алкил;
R20 обозначает Н или
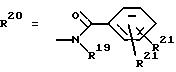
R18 и R21 каждый имеют идентичные значения или обозначают независимо друг от друга Н или O-ацил,
г. остатки аминокислот
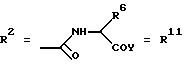
Y обозначает ОА, где А представляет собой Н, или Y обозначает остаток активного вещества, содержащий NH- или ОН-группу;
R6 представляет собой алкил, гидрокси(С1-С5)алкил, если R1 обозначает O-ацил, или арилалкоксиалкил, или
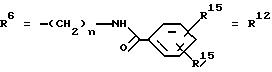
R15 имеют идентичные значения или обозначают независимо друг от друга Н, ОН, O-ацил;
n обозначает целое число в пределах от 1 до 5, если R1 обозначает O-ацил, a R15 обозначает Н и/или O-ацил, или n обозначает целое число в пределах от 1 до 3, если R1 обозначает ОН, а R15 обозначает Н и/или ОН,
или
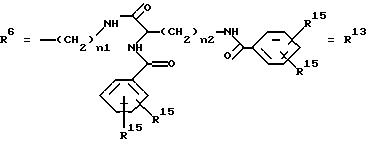
R15 имеют идентичные значения или обозначают независимо друг от друга Н, ОН, O-ацил, n1 и n2 обозначают целое число в пределах от 1 до 3,
д. остатки пирролидини- и/или оксазолидинкарбоновых кислот
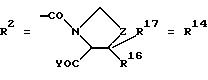
Z обозначает О;
R16 и R17 имеют идентичные значения или обозначают независимо друг от друга Н;
Y обозначает ОА, где А представляет собой Н, или Y обозначает остаток активного вещества, содержащий NH- или ОН-группу,
е. формил-O-карбоксиметилоксимы:
R2 представляет собой CH= NOCH2COY, где Y обозначает ОА, где А представляет собой Н, ион щелочного металла, или Y обозначает остаток активного вещества, содержащий NH- или ОН-группу.

Комментарии