Производные амида коричной кислоты - RU2318802C2
Код документа: RU2318802C2
Описание
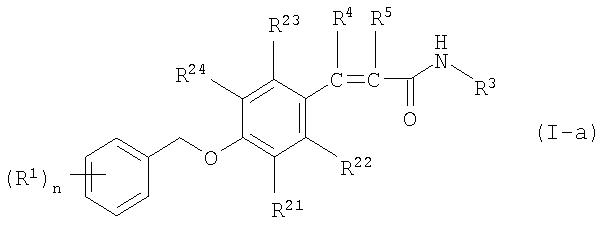
Настоящее изобретение относится к 3-фенилпропионамидо-, 3-фенил-акриламидо- и 3-фенилпропинамидопроизводным, способам их получения, композициям, содержащим эти соединения, и применению указанных производных в качестве ингибиторов моноаминооксидазы В (МАО-В). В частности, настоящее изобретение относится к соединениям формулы I или Ia

где
R1 представляет собой (С1-С3)-алкил, галоген, галоген-(С1-С6)-алкил, циано, (С1-С6)-алкокси или галоген-(С1 -С6)-алкокси;
R21, R22, R23 и R24 каждый независимо выбирают из группы, состоящей из водорода и фтора;
R3 представляет собой водород или (С1-С3)-алкил;
А представляет собой бивалентную группу формулы (а), (б) или (в)

R4 означает водород или (С1-С3)-алкил;
R5, R6 и R7 каждый независимо представляет собой водород или (C1-С6)-алкил; и
n означает 1, 2 или 3.
Соединения общей формулы I являются селективными ингибиторами моноаминоксидазы В.
Моноаминоксидаза (МАО, КФ 1.4.3.4) представляет собой флавинсодержащий фермент, отвечающий за окислительное деаминирование эндогенных трансмиттеров - моноаминов, таких как допамин, серотонин, адреналин или норадреналин, и аминов, присутствующих в следовых количествах, например, таких как фенилэтиламин, а также ряд аминов-ксенобиотиков. Фермент существует в двух формах, МАО-А и МАО-В, кодируемых различными генами [Bach et al., Proc. Natl. Acad. Sci. USA 85:4934-4938 (1988)] и различающимися по распределению в тканях, структуре и субстратной специфичности. МАО-А обладает высоким сродством к серотонину, октопамину, адреналину и норадреналину; в то время как естественными субстратами для МАО-В являются фенилэтиламин и тирамин. Допамин, как полагают, окисляется обеими изоформами. МАО-В широко распространен в некоторых органах, включая мозг [Cesura, Pletscher, Prog. Drug Research 38:171-297 (1992)]. Активность присутствующего в мозге МАО-В, по-видимому, возрастает с возрастом. Это повышение объясняют глиозом, связанным со старением [Fowler et al., J. Neural. Transm. 49:1-20 (1980)]. В дополнение, активность МАО-В значительно выше в мозге пациентов, страдающих болезнью Альцгеймера [Dostert et al., Biochem. Pharmacol. 38:555-561 (1989)], причем было обнаружено, что МАО-В в значительной степени экспрессируется в астроцитах вокруг старческих бляшек [Saura et al., Neuroscience 70:755-774 (1994)]. В таком контексте, поскольку окислительное дезаминирование первичных моноаминов под действием МАО приводит к продуцированию NH3, альдегидов и Н2О2, агентов с установленной или потенциальной токсичностью, предполагают, что рационально использовать селективные МАО-В ингибиторы для лечения слабоумия и болезни Паркинсона. Ингибирование активности МАО-В вызывает уменьшение ферментативной инактивации допамина и таким образом приводит к пролонгированию возможности использования нейромедиаторов в допаминовых нейронах. Процессы дегенерации, связанные со старением и болезнями Альцгеймера и Паркинсона, также могут быть обусловлены окислительным стрессом вследствие повышения активности МАО и последующего увеличения образования Н2О2 под воздействием МАО-В. Следовательно, ингибиторы МАО-В могут оказывать воздействие, как посредством снижения образования кислородных радикалов, так и посредством повышения содержания моноаминов в мозге.
Учитывая роль МАО-В в указанных выше неврологических нарушениях и расстройствах, представляет значительный интерес получить эффективные и селективные ингибиторы, которые могли бы позволить осуществить контроль такой ферментативной активности. Фармакология некоторых известных ингибиторов МАО-В, например, обсуждается в статье: Bentué-Ferrer et al. CNS Drugs 6:217-236 (1996). Поскольку главным ограничением при неизменяемой и неселективной активности ингибитора МАО является необходимость соблюдать предписания в отношении диеты вследствие риска индуцирования гипертензивного кризиса, в том случае, когда в соответствии с диетой получают тирамин, а также возможность взаимодействия с другими лекарственными средствами [Gardner et al., J. Clin. Psychiatry 57:99-104 (1996)], такие нежелательные проявления в меньшей степени относятся к обратимым и селективным ингибиторам МАО, в частности к МАО-В. Таким образом, существует необходимость получения ингибиторов МАО-В, обладающих высокой селективностью и не имеющих нежелательных побочных эффектов, которые характерны для необратимых ингибиторов МАО, характеризующихся низкой селективностью по отношению к ферменту.
Было обнаружено, что соединения согласно настоящему изобретению являются высокоселективными ингибиторами МАО-В. Таким образом, еще одной целью настоящего изобретения является получение композиций, содержащих одно или более соединение, являющееся предметом настоящего изобретения, и фармацевтически приемлемый носитель. Кроме того, целью изобретения является разработка способа получения соединений согласно настоящему изобретению, а также применение соединения, являющегося предметом настоящего изобретения, для контроля или профилактики заболеваний, медиаторами при которых являются ингибиторы моноаминоксидазы В, и соответственно, применение этих соединений для получения соответствующих лекарственных средств.
Следующие определения общих терминов, используемые в описании настоящей заявки, применяются вне зависимости от других рассматриваемых терминов, используемых отдельно или в комбинации. Следует отметить, что при употреблении в тексте заявки и в формуле изобретения термины, приведенные в грамматической форме единственного числа, включают также эти же самые термины, выраженные во множественном числе, если контекст ясно не указывает на иное.
Термин "(С1-С6)-алкил" ("низший алкил"), используемый в тексте настоящей заявки, означает остаток насыщенного углеводорода с линейной или разветвленной цепью, содержащий 1-6 атомов углерода, предпочтительно, 1-3 атома углерода, например, такой как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутл и подобные им. Соответствующим образом, термин "(С1-С3)-алкил" означает остаток насыщенного углеводорода с линейной или разветвленной цепью, содержащий 1-3 атома углерода.
Термин "галоген" означает фтор, хлор, бром и иод.
Термины "галоген-(С1-С6)-алкил" или "галоген-(С1-С6)-алкокси" означают низший алкильный радикал или радикал низший алкокси, соответственно, как определяется в тексте настоящей заявки, замещенный в любом положении одним или более атомом галогена, как определено в тексте настоящей заявки. Примеры галогеналкильных радикалов включают, не ограничиваясь указанным, 1,2-дифторпропил, 1,2-дихлорпропил, трифторметил, 2, 2,2-трифторэтил, 2,2,2-трихлорэтил и 1,1,1-трифторпропил и подобные им радикалы. "Галоген-алкокси" включает трифторметилокси.
Термин "(С1-С6)-алкокси" означает радикал -O-R, в котором R представляет собой низший алкильный радикал, как он определен в тексте настоящей заявки. Примеры радикалов алкокси включают, не ограничиваясь указанным, радикалы метокси, этокси, изопропокси и подобные им радикалы.
Термин "фармацевтически приемлемые соли" соединения означает соли, которые фармацевтически приемлемы и, в общем, безопасны, нетоксичны, и не являются нежелательными ни в биологическом, ни в каком-либо другом отношении, и которые обладают целевой фармакологической активностью соединения, которое их образует. Такие соли являются производными неорганических или неорганических кислот или оснований. Если возможно, соединения формулы I могут быть превращены в фармацевтически приемлемые соли. Необходимо отметить, что фармацевтически приемлемые соли могут входить в объем настоящего изобретения, и что все указания на фармацевтически приемлемые соли включают соли - продукты присоединения растворителя (сольваты) или кристаллические формы (полиморфные формы) указанной соли - продукта присоединения кислоты.
Среди соединений согласно настоящему изобретению некоторые соединения формулы I являются предпочтительными.
Соединения формулы I замещаются одним, двумя или тремя радикалами R1, выбранными из группы, состоящей из (С1-С3)-алкила, галогена, галоген-(С1 -С6)-алкила, циано, (С1-С6)-алкокси или галоген-(С1-С6)-алкокси, предпочтительно, они замещены одним радикалом R1. Предпочтительные соединения формулы I являются такими соединениями, в которых R1 представляет собой галоген или галоген-(С1-С6)-алкил. В особенности предпочтительны такие соединения формулы I, в которых R1 означает фтор или трифторметил. Если присутствуют два или три радикала R1, то они могут быть одинаковыми или различными.
R21, R22, R23 и R24 независимо друг от друга выбирают из группы, состоящей из водорода или фтора. Предпочтительно, R21, R22, R23 и R24 представляют собой водород.
R3 означает водород или (С1-С3)-алкил. Предпочтительно, R3 означает водород или метил, и даже более предпочтительно, R3 означает метил.
Предпочтительными являются соединения формулы I, в которой А представляет собой бивалентную группу формулы (а), т.е. соединения, соответствующие формуле I-а:

Предпочтительны соединения формулы I-а, в которой R4 и R5 независимо друг от друга означают водород или (С1-С3)-алкил. Все цис- и транс-изомеры также входят в объем настоящего изобретения. В особенности предпочтительны соединения формулы I-а, в которой R3 означает метил.
Предпочтительной группой соединений среди указанной группы являются такие соединения, в которых R1 представляет собой (С1-С3)-алкил или (C1-C6)-алкокси.
Примерами таких соединений являются:
N-метил-3-[4-(4-метилбензилокси)фенил]акриламид и
3-[4-(3-метоксибензилокси)фенил]-N-метилакриламид.
Даже более предпочтительными являются соединения формулы I-а, в которых R4 и R5 каждый независимо представляют собой водород или (C1-С3)-алкил, R3 означает метил, и R1 представляет собой фтор или трифторметил.
Примерами этого являются следующие соединения:
3-[4-(3-фторбензилокси)фенил]-2,N-диметилакриламид,
3-[4-(3-фторбензилокси)фенил]-N-метилакриламид,
N-метил-3-[4-(4-трифторметилбензилокси)фенил]акриламид,
3-[4-(3,4-дифторбензилокси)фенил]-N-метилакриламид, и
3-[4-(4-фторбензилокси)фенил]-N-метилакриламид.
Также предпочтительны соединения формулы I, в которой А означает бивалентную группу формулы (б), и R4, R5, R6 и R7 каждый независимо представляют собой водород или (С1-С3)-алкил, т.е. соединения, соответствующие формуле I-б

Примерами таких соединений являются следующие соединения:
3-[4-(3-фторбензилокси)фенил]-2, N-диметилпропионамид,
3-[4-(3,4-дифторбензилокси)фенил]пропионамид, и
3-[4-(3-фторбензилокси)фенил]-N-метилбутирамид.
Кроме того, предпочтительными являются соединения формулы I, в которой А представляет собой бивалентную группу формулы (в), т.е. соединения формулы I, соответствующие формуле I-в:

Примером таких соединений является метиламид 3-[4-(3-фторбензилокси)-фенил]пропиновой кислоты.
Соединения общей формулы I могут быть получены посредством взаимодействия соединения формулы II:
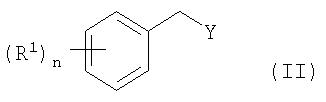
в которой R1 и n имеют указанные выше значения, и Y представляет собой отщепляемую группу, с соединением формулы III:

где R3, R21, R22, R23, R24 и А имеют указанные выше значения,
или, в качестве альтернативы,
посредством взаимодействия соединения формулы IV:

где R1, R21, R22, R23, R24 и n имеют указанные выше значения, и R8 означает водород или (С1-С6 )-алкил,
с амином формулы V:

где R3 является таким, как определено выше,
с получением при этом соединения формулы I.
Возможность получения соединений общей формулы I в соответствии с настоящим изобретением показана на схеме 1:
Схема 1
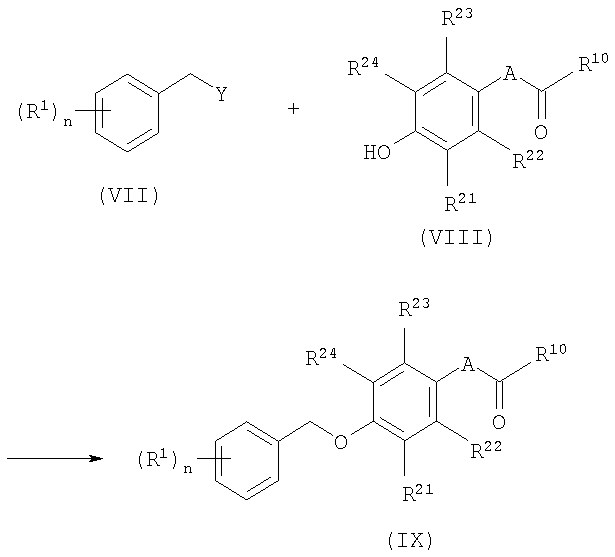
где Y означает отщепляемую группу (галоген, OTf и т.п.) или ОН (реакция конденсации по Мицунобу), R10 означает O-алкил или HNR3, и R1, R10, R21, R22, R23, R24, А и n являются такими, как определено выше.
Соединения вида IX образуются в соответствии с методикой синтеза Вильямсона (Williamson) с применением простых эфиров, с использованием в качестве исходных соединений соответствующих n-замещенных фенолов VIII и бензилгалогенидов, тозилатов, мезилатов или трифлатов VII. Могут быть использованы основания, например, алкоголяты или карбонаты (карбонат натрия, калия или цезия). Предпочтительными растворителями являются низшие спирты, ацетонитрил или низшие кетоны при температуре между 20°С и температурой образования флегмы. Другим подходом является конденсация по Мицунобу (Mitsunobu) бензиловых спиртов с соответствующими фенолами VIII. Взаимодействие проводят обычным образом в инертных растворителях, например таких как простой диэтиловый эфир или тетрагидрофуран (ТГФ), используя диалкилазодикарбоксилаты в присутствии фосфинов (например, таких как трибутил- или трифенилфосфин). В том случае, когда R10 означает NHR3, такие реакции приводят непосредственно к получению целевых соединений формулы I. В том случае, когда R10 означает O-алкил, сложный эфир формулы IX может быть превращен в целевой конечный продукт общей формулы I по обычной методике: аминолиз с R3NH2 в среде растворителя, например, такого как метанол, ТГФ и т.п., омыление до кислоты (например, с использованием КОН в метаноле), активация кислоты превращением в соответствующий хлорангидрид (с использованием тионилхлорида или оксалилхлорида) или активация с использованием N, N'-дициклогексилкарбодиимида (ДГК), N,N'-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорида (EDC) и т.п. и конденсация с амином R3NH2.
Другой способ (схема 2) получения соединений формулы I, в которых А представляет собой бивалентную группу формулы (a) -CR4=CR5-, включает конденсацию Кневенагеля-Дебнера (Knoevenagel-Doebner) кетонов или альдегидов Х с малонатом или диалкилмалонатом. Эти реакции проводят в общепринятых условиях, используя пиридин в качестве растворителя, с использованием или без использования катализатора - пиперидина, предпочтительно, при кипячении с обратным холодильником.
Схема 2

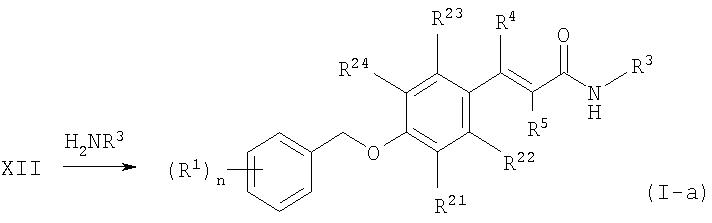
где R11 представляет собой O-алкил или ОН, и R1, R4, R5, R21, R22, R23, R24 и n имеют значения, определенные выше.
Сложные эфиры XII (R11=O-алкил) или кислоты XII (R11=ОН) затем превращают, как описано выше, в целевые амиды формулы I-а. В качестве альтернативы соединения XII могут быть восстановлены в производные I-b, в которых А = -CHR4 -CHR5-, до или после превращения в амиды (схема 3). Такое восстановление предпочтительно осуществляют посредством каталитического гидрирования с использованием водорода и платины на углероде в среде таких растворителей как метанол, диоксан или этилацетат при комнатной температуре.
Схема 3

Соединения Х могут быть получены алкилированием необязательно замещенных 4-гидроксибензальдегидов или 4-гидроксиацетофенонов с бензилгалогенидами, тозилатами, мезилатами или трифлатами по реакции, подобной приведенной на схеме 1.
Соединения формулы I, в которой А означает -CR4=CR5- также могут быть получены по реакции Реформатского из соединений Х (схема 4).
Схема 4

где Х означает галоген, и R5 имеет значения, определенные выше. Указанные реакции конденсации карбонильных соединений с альфа-галогенсодержащими сложными эфирами проводят в обычных условиях в среде простых эфиров, например, таких как диэтиловый эфир, ТГФ или диоксан с предпочтительным использованием цинка в качестве металла. Соединения XII могут быть дополнительно превращены, как описано выше, в целевые амиды формулы I-а.
Другой способ (схема 5) получения соединений вида I-а или I-в включает конденсацию по Хеку (Heck)-Соногашира (Sonogashira) арилгалогенидов или трифлатов Е, соответственно, с алкенами и с алкинами.
Схема 5
Реакция Хека

Реакция Соногашира

где R12 представляет собой O-алкил или NHR3, R13 представляет собой Н, Si(алкил)3, СОО-алкил или CONHR3, и R1, R4, R5, R21, R22, R23, R24, n и Y имеют значения, указанные выше.
Реакцию Хека осуществляют по общепринятой методике [см.: Greenspan et al., J.Med. Chem. 42:164 (1999); или: Hanack et al., Eur. J. Org. Chem. 3441 (1999)].
Конденсацию Соногашира (Sonogashira) можно проводить с использованием палладиевого катализатора в стандартных условиях [Lau et al., J.Org. Chem. 46:2280 (1981) или Ipaktschi et al., Synth. Commun. 28:327 (1998)].
Соединения вида XVI, в которых R12 представляет собой O-алкил, превращают в амиды I-а (А=-CR3=CR4-) по методике, описанной выше. Соединения вида XVIII, в которых R представляет собой -Si(алкил)3, превращают в амиды I-в (А=-С∉С-) по обычным методикам, как показано, например, на схеме 6.
Схема 6

Соединения формулы I являются, как уже указывалось выше, ингибиторами моноаминоксидазы В и могут быть использованы для лечения или профилактики заболеваний, при которых ингибиторы МАО-В могут оказывать благоприятное воздействие. Такие заболевания включают острые и хронические неврологические нарушения или расстройства, когнитивные нарушения или расстройства и нарушения памяти. Лечению могут подвергаться такие неврологические нарушения и расстройства как, например, травматические и хронические дегенеративные процессы нервной системы, такие как болезнь Альцгеймера, другие виды слабоумия, незначительные когнитивные расстройства или болезнь Паркинсона. Другие показания включают психиатрические заболевания, например, такие как депрессия, беспокойство, острое тревожное состояние с реакцией паники, социальная фобия, шизофрения, нарушения и расстройства, связанные с приемом пищи и метаболические нарушения или расстройства, такие как ожирение, а также показания включают профилактику и лечение синдрома отмены, вызванного отказом от злоупотребления алкоголем, никотином и иными вызывающими привыкание лекарственными средствами. Другие подлежащие лечению показания могут включать синдром приобретенного иммунодефицита (WO 01/34,172), периферическую невропатию, вызванную химиотерапией опухолей (WO 97/33,572), или лечение рассеянного склероза (WO 96/40,095) и других нейровоспалительных заболеваний.
Соединения формулы I в особенности пригодны для лечения и профилактики болезни Альцгеймера и старческого слабоумия.
Фармакологическая активность соединений протестирована с использованием следующей методики:
кДНК, кодирующую МАО-А и МАО-В человека, транзиентно трансфектируют в EBNA клетках с использованием методики, описанной в: Schlaeger, Christensen Transient Gene Expression in Mammalian Cells Grown in Serum-free Suspension Culture; Cytotechnology, 15:1-13 (1998). После трансфекции клетки гомогенизируют, используя гомогенизатор "Polytron homogenizer" в 20 мМ Трис HCl буфера, рН 8,0, содержащего 0,5 мМ EGTA и 0,5 мМ фенилметансульфонилфторида. Клеточные мембраны получают посредством центрифугирования при 45000 × g и затем, после двух промывок с использованием 20 мМ Трис HCl буфера, рН 8,0, содержащего 0,5 мМ EGTA, мембраны в заключение ресуспендируют в вышеуказанном буфере, аликвоты хранят при температуре -80°С до начала использования.
Ферментативную активность МАО-А и МАО-В исследуют в 96-луночных планшетах, используя модифицированную спектрофотометрическую методику, в основе которой лежит метод, описанный в: Zhou, Panchuk-Voloshina [A One-Step Fluorometric Method for the Continuous Measurement of Monoamine Oxidase Activity, Analytical Biochemistry 253:169-174 (1997)]. Коротко, аликвоты мембран инкубируют в 0,1 М буфере на основе фосфата калия, рН 7,4, в течение 30 мин при 37°С с различными концентрациями соединения или без соединения. После инкубирования ферментативную реакцию запускают добавлением тирамина - МАО субстрата совместно с 1 Ед/мл пероксидазы хрена (фирма "Roche Biochemicals") и 80 мкМ N-ацетил-3,7-дигидроксифеноксазина (Amplex Red, Molecular Probes). Затем образцы инкубируют в течение 30 мин при 37°С при конечном объеме 200 мкл, после чего измеряют поглощение при длине волны 570 нм, используя устройство для прочтения планшетов "SpectraMax" (Molecular Devices). Фоновое (неспецифическое) поглощение определяют в присутствии 10 мкМ клоргилина для МАО-А или 10 мкМ L-депренила для МАО-В.
Значения IC50 определяют по графику зависимости ингибирования от концентрации, полученному для девяти концентраций, по два измерения для каждой, с использованием компьютерной программы для вычисления соответствия этих данных четырехпараметрическому логистическому уравнению.
Соединения, являющиеся предметом настоящего изобретения, являются специфическими ингибиторами МАО-В. Значения IC50 предпочтительных соединений формулы I, измеренные по описанной выше методике, находятся в интервале 1 мкМ или менее, обычно 0,1 мкМ или менее, и наилучшим образом, 0,02 мкМ или менее.
В приведенной ниже таблице указаны некоторые конкретные значения IC50 предпочтительных соединений:
Соединения формулы I могут быть использованы в качестве лекарственных средств, например, в виде фармацевтических препаратов. Фармацевтические препараты могут быть введены перорально, например, в виде таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсии или суспензии. Однако введение также может быть осуществлено ректально, например, в виде суппозиториев, или парентерально, например, в виде растворов для инъекций.
Соединения формулы I могут быть использованы для получения фармацевтических препаратов вместе с фармацевтически инертными, неорганическими или органическими носителями. В качестве подходящих носителей для таблеток, таблеток, таблеток с покрытием, драже и твердых желатиновых капсул могут быть использованы, например, лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и подобные соединения. Подходящие носители для мягких желатиновых капсул, представляют собой, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и подобные им вещества; однако в зависимости от природы активного соединения, в случае мягких желатиновых капсул может не использоваться носитель. Подходящие носители для получения растворов и сиропов представляют собой, например, воду, полиолы, сахарозу, инвертный сахар, глюкозу и подобные им соединения. Вспомогательные агенты, такие как спирты, полиолы, глицерин, растительные масла и подобные им вещества, могут быть использованы для приготовления растворов для инъекций водорастворимых солей соединений формулы I, но, как правило, в них нет необходимости. Подходящие носители для суппозиториев представляют собой, например, природные и отвержденные масла, воски, жиры, полутвердые или жидкие полиолы и подобные им соединения.
В дополнение, фармацевтические препараты могут содержать консерванты, вещества, улучшающие растворимость, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, подкрашивающие агенты, агенты, улучшающие вкус и запах, соли для регулирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать другие терапевтически значимые вещества.
Как указывалось выше, лекарственные средства, содержащие соединение формулы I и терапевтически инертный наполнитель, также являются объектом настоящего изобретения, как и способ получения таких лекарственных средств, которые включают одно или более соединение формулы I и, если это необходимо, одно или более терапевтически значимое соединение в виде дозированной галеновой формы совместно с одним или более терапевтически приемлемым инертным носителем.
Дозировка может варьироваться в широких пределах и, безусловно, должна соответствовать в каждом конкретном случае индивидуальным требованиям. Как правило, эффективная дозировка для перорального или парентерального введения составляет 0, 01-20 мг/кг/день, причем для всех указанных показаний предпочтительна дозировка, составляющая 0,1-10 мг/ кг/ день. Дневная дозировка для взрослых людей, масса тела которых 70 кг, соответственно, составляет 0,7-1400 мг в день, предпочтительно, от 7 до 700 мг в день.
Для иллюстрации изобретения приводятся следующие примеры. Эти примеры не следует рассматривать как ограничивающие объем настоящего изобретения, но, главным образом, принимать во внимание как примеры, приведенные только для иллюстрации. Используются следующие сокращения: RT: комнатная температура; ТГФ: тетрагидрофуран.
Пример 1: 3-[4-(3-фторбензилокси)фенил]-2-метилакриламид
а) 1-(3-Фторбензилокси)-4-иод-бензол
К раствору 3,0 г (15,9 ммоль) 4-иодфенола и 3,49 г (15,9 ммоль) 3-фторбензилбромида в 30 мл этанола добавляют по каплям при комнатной температуре 20 мл 1 молярного раствора этанолата натрия в этаноле. Реакционную смесь кипятят с обратным холодильником в течение 4 ч и затем отфильтровывают выпавший в осадок бромид натрия. Полученный фильтрат упаривают досуха, обрабатывают, используя 100 мл воды, подкисляют добавлением лимонной кислоты и экстрагируют три раза дихлорметаном. После сушки и упаривания остаток подвергают хроматографии на силикагеле (смесь гексан/этилацетат в соотношении 9:1), получая при этом 4,23 г (выход 81%) бесцветного твердого вещества. Т.пл. = 48°С.
б) Метиловый эфир 3-[4-(3-фторбензилокси)фенил]-2-метилакриловой кислоты
Смесь 1,2 г (3,7 ммоль) 1-(3-фторбензилокси)-4-иодбензола, 2,06 г (14,9 ммоль) карбоната калия и 1,70 г (52,8 ммоль) тетрабутиламмонийбромида в 10 мл диметилформамида обрабатывают в атмосфере Ar, используя 48 мг (0,21 ммоль) ацетата палладия-(II). Добавляют 1,49 г (14,9 ммоль) метилметакрилата и полученную смесь нагревают при 90°С в течение приблизительно 40 мин. Реакционную смесь выливают в 150 мл дихлорметана, фильтруют и промывают последовательно 0,1 молярной хлороводородной кислотой, насыщенным водным растворома гидрокарбоната натрия и водой. Раствор высушивают над сульфатом магния. После экспресс-хроматографии (силикагель, смесь гексан/этилацетат в соотношении 95:5) получают 461 мг (выход 42%) бесцветного твердого вещества. Масс-спектроскопия: m/e=301,3 (М++Н).
в) 3-[4-(3-Фторбензилокси)фенил]-2-металакриловая кислота
383 мг (1,28 ммоль) метилового эфира 3-[4-(3-фторбензилокси)фенил]-2-метилакриловой кислоты добавляют к раствору 143 мг (2,55 ммоль) гидроксида калия в 7 мл метанола. Полученный раствор перемешивают при 65°С в течение приблизительно 3 ч, упаривают досуха, обрабатывают водным 0,1 молярным раствором хлороводородной кислоты и экстрагируют 3 раза этилацетатом. После упаривания растворителя получают чистую кислоту - 305 мг (выход 84%) бесцветного твердого вещества. Масс-спектроскопия (отрицательно заряженные ионы): m/e=285,0 (М-Н).
г) 3-[4-(3-Фторбензилокси)фенил]-2-метилакриламид
305 мг (1,07 ммоль) 3-[4-(3-фторбензилокси)фенил]-2-метилакриловой кислоты растворяют в 8 мл дихлорметана и добавляют одну каплю диметилформамида. Раствор охлаждают до 0°С и добавляют по каплям 676 мг (5,33 ммоль) оксалилхлорида. Полученный раствор перемешивают при 0°С дополнительно в течение 30 минут, затем 2 часа при комнатной температуре. После упаривания растворителя получают неочищенный хлорангидрид кислоты, который растворяют в 5 мл ТГФ. Этот раствор медленно добавляют при перемешивании к 10 мл концентрированного раствора аммиака. Образовавшийся осадок отфильтровывают и перекристаллизовывают из метанола, получая при этом 199 мг (выход 65%) бесцветного твердого вещества. Масс-спектроскопия: m/e=286,2 (М++Н).
Пример 2: 3-[4-(3-фторбензилокси)фенил]-2,N-диметилакриламид Указанное в заголовке соединение получают по методике, аналогичной описанной в примере 1 г), используя водный раствор метиламина вместо водного раствора аммиака. Выход составляет 99%, получают светло-желтое твердое вещество. Масс-спектроскопия: m/е=300,2 (М++Н).
Пример 3: 3-[4-(3-фторбензилокси)фенил1-2-метилпропионамид
Раствор 50 мг 3-[4-(3-фторбензилокси)фенил]-2-метилакриламида в 10 мл метанола обрабатывают, используя 4 мг диоксида платины и проводя гидрирование при комнатной температуре и нормальном давлении в течение приблизительно 4 ч. Катализатор отфильтровывают, и полученный фильтрат упаривают досуха. После растирания осадка в приблизительно 2 мл диэтилового эфира получают 12 мг (выход 23%) бесцветного твердого вещества. Масс-спектроскопия: m/е=288,2 (М++Н).
Пример 4: 3-[4-(3-фторбензилокси)фенил]-2,N-диметилпропионамид
Указанное в заголовке соединение получают по методике, аналогичной описанной в примере 3, используя в качестве исходного соединения 3-[4-(3-фторбензилокси)фенил]-2,N-диметилакриламид. Получают бесцветное твердое вещество с выходом 52%. Масс-спектроскопия: m/е=302,3 (М++Н).
Пример 5: амид 3-[4-(3-фторбензилокси)фенил]пропиновой кислоты
а) [4-(3-Фторбензилокси)фенилэтинил]триметилсилан
К хорошо перемешиваемой суспензии 4,0 г (12,2 ммоль) 1-(3-фторбензилокси)-4-иодбензола, 0,23 г (1,22 ммоль) иодида меди и 0,856 мг (1,22 ммоль) дихлор-бис(трифенилфосфин) палладия (II) в смеси 20 мл ТГФ и 10 мл триэтиламина добавляют по каплям 1,44 г (14,6 ммоль) триметилсилилацетилена. Реакция экзотермическая. Полученную смесь перемешивают в течение ночи при комнатной температуре, обрабатывают насыщенным водным раствором хлорида аммония и экстрагируют три раза этилацетатом. Органическую фазу высушивают, концентрируют и подвергают экспресс-хроматографии (силикагель, циклогексан), получая при этом 3,48 г (выход 95%) светло-оранжевого маслянистого вещества. ЯМР (CDCl3; 300 МГц): 0,24 м.д. (s, 9H); 5,06 м.д. (s, 2H); 6,85-7,45 м.д. (m, 8H).
б) 1-(3-Фторбензилокси)-4-этинилбензол
Раствор 2,06 г (6,9 ммоль) [4-(3-фторбензилокси)фенилэтинил]триметил-силана в 35 мл метанола обрабатывают, используя 95 мг (0,69 ммоль) твердого карбоната калия. Полученную смесь перемешивают при комнатной температуре в течение 3 ч, концентрируют и обрабатывают насыщенным водным раствором. Соединение экстрагируют три раза дихлорметаном, высушивают над сульфатом магния и концентрируют, получая при этом 1,53 г (выход 98%) светло-коричневого маслянистого вещества. Масс-спектроскопия (отрицательно заряженные ионы): m/е=225,4 (М-Н).
в) [4-(3-Фторбензилокси)фенил]пропиновая кислота
1,93 г (8,5 ммоль) 1-(3-фторбензилокси)-4-этинилбензола растворяют в 30 мл ТГФ и охлаждают до -78°С. Медленно добавляют при перемешивании 5,8 мл (9,4 ммоль) 1,6-молярного раствора н-бутиллития. Полученный раствор перемешивают при -78°С в течение 30 минут. Добавляют избыток твердого диоксида углерода и полученной суспензии медленно дают нагреться до комнатной температуры. Добавляют воду и подкисляют смесь добавлением водного 0,1 молярного раствора хлороводородной кислоты. После экстракции этилацетатом получают полутвердый остаток, который растирают в диэтиловом эфире, получая при этом 1,58 г (выход 68%) бесцветного твердого вещества. Масс-спектроскопия (отрицательно заряженные ионы): m/е=269,1 (М-Н).
г) Амид 3-[4-(3-фторбензилокси)фенил]пропиновой кислоты
50 мг (0,19 ммоль) [4-(3-фторбензилокси)фенил]пропиновой кислоты растворяют в 3 мл ТГФ и обрабатывают, используя 27 мг (0,2 ммоль) 1-гидроксибензотриазола и 37 мг (0,19 ммоль) N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорида. Полученную смесь перемешивают при комнатной температуре в течение 30 минут, охлаждают до 0°С и обрабатывают 1 мл концентрированного раствора аммиака. Полученную суспензию перемешивают в течение ночи при комнатной температуре, разбавляют водой и экстрагируют три раза дихлорметаном После экспресс-хроматографии (силикагель, смесь дихлорметан/метанол) получают 29 мг (выход 59%) бесцветного твердого вещества. Масс-спектроскопия: m/е=270,2 (М++Н).
Пример 6: метиламид 3-[4-(3-фторбензилокси)фенил]пропиновой кислоты
Указанное в заголовке соединение получают по методике, аналогичной описанной в примере 5 г), используя в качестве исходных соединений [4-(3-фторбензилокси)фенил]пропиновую кислоту и водный раствор метиламина. Выход бесцветного твердого вещества составляет 45%. Масс-спектроскопия: m/е=284,1 (М++Н).
Пример 7: 3-[4-(3,4-дифторбензилокси)фенил]пропионамид
Смесь 106 мг (0,64 ммоль) 3-(4-гидроксифенил)пропионамида, 178 мг (1,29 ммоль) карбоната калия и 140 мг (0,68 ммоль) 3,4-дифторбензилбромида в 5 мл этилметилкетона выдерживают при 50°С в течение 24 часов. Реакционную смесь охлаждают, разбавляют водой и экстрагируют диэтиловым эфиром. После кристаллизации из н-гексана получают 77 мг бесцветного твердого вещества (выход 41%). Масс-спектроскопия: m/е=291,3 (М+).
Пример 8: 3-[4-(3-фторбензилокси)фенил]-N-метилакриламид
а) 3-Фторбензиловый сложный эфир 3-[4-(3-фторбензилокси)фенил]-акриловой кислоты
Смесь 5,0 г (30,5 ммоль) n-кумаровой кислоты, 8,4 г (61 ммоль) карбоната калия и 11,5 г (61 ммоль) 3-фторбензилбромида в 500 мл этилметилкетона выдерживают в течение ночи при 80°С. Реакционную смесь охлаждают, разбавляют водой и экстрагируют этилацетатом. После хроматографии (силикагель, смесь н-гексан / этилацетат в соотношении 4:1) получают 6,48 г бесцветного твердого вещества (выход 56%). Масс-спектроскопия: m/е=380,2 (М+).
б) 3-[4-(3-Фторбензилокси)фенил]акриловая кислота
6,48 г (17 ммоль) 3-фторбензилового сложного эфира 3-[4-(3-фторбензилокси)фенил]акриловой кислоты растворяют в 100 мл ТГФ и добавляют 1,36 г (34 ммоль) твердого гидроксида натрия. Реакционную смесь нагревают при 50°С в течение ночи, охлаждают и подкисляют добавлением 1Н раствора хлороводородной кислоты. Осадок отфильтровывают и промывают холодной водой, получая при этом 4,43 г (выход 96%) бесцветного твердого вещества. Масс-спектроскопия: m/е=271,2 (М-Н).
в) 3-[4-(3-Фторбензилокси)фенил]акрилоилхлорид
В 50 мл дихлорметана суспендируют 3,0 г (11 ммоль) 3-[4-(3-фторбензилокси)фенил]акриловой кислоты и затем добавляют 4,0 мл (55 ммоль) тионилхлорида. Реакционную смесь выдерживают при комнатной температуре в течение 1 часа, затем нагревают при 50°С в течение ночи. После упаривания получают 3,56 г (выход 111%) неочищенного хлорангидрида кислоты в виде желтоватого твердого вещества, Масс-спектроскопия: m/е=290,2 (М+).
г) 3-[4-(3-Фторбензилокси)фенил]-N-метилакриламид
500 мг (1, 72 ммоль) неочищенного 3-[4-(3-фторбензилокси)фенил]-акрилоилхлорида растворяют в 2 мл дихлорметана и добавляют 0,4 мл 41%-ного раствора метиламина в воде. Реакционную смесь кипятят с обратным холодильником в течение приблизительно 3 часов, охлаждают, фильтруют и промывают холодным дихлорметаном, получая при этом 149 мг (выход 30%) бесцветного твердого вещества. Масс-спектроскопия: m/е=286, 2 (М+).
Пример 9: 3-[4-(3-фтор-бензилокси)фенил]акриламид
500 мг (1,72 ммоль) неочищенного 3-[4-(3-фторбензилокси)фенил]-акрилоилхлорида, полученного таким образом, как описано в примере 8в), растворяют в 2 мл дихлорметана и добавляют 4 мл концентрированного аммиака. Полученную смесь кипятят с обратным холодильником в течение приблизительно 4 часов, охлаждают и фильтруют. Полученное твердое вещество подвергают колоночной хроматографии (силикагель, дихлорметан/метанол/аммиак в соотношении 140:10:1), получая при этом 89 мг (выход 19%) бесцветного твердого вещества. Масс-спектроскопия: m/е=272,2 (М++Н).
Пример 10: N-этил-3-[4-(3-фторбензилокси)фенил]акриламид
Указанное в заголовке соединение получают по методике, аналогичной описанной в примере 9, используя неочищенный 3-[4-(3-фторбензилокси)-фенил]акрилоилхлорид и 2 М раствор этиламина в дихлорметане. Выход бесцветного твердого вещества составляет 72%. Масс-спектроскопия: m/е=300,3 (М++Н).
Пример 11: N-Метил-3-[4-(4-трифторметилбензилокси)фенил]акриламид
а) 3-(4-Гидроксифенил)-N-метилакриламид
6,0 г (36,5 ммоль) n-кумаровой кислоты растворяют в 10 мл дихлорметана. Добавляют 3 капли N,N-диметилформамида, а затем 10 мл тионилхлорида. Полученную смесь перемешивают при комнатной температуре в течение 15 минут, концентрируют и обрабатывают, используя 5 мл 41%-ного раствора метиламина в воде. После перемешивания при комнатной температуре в течение приблизительно 2 часов метиламин удаляют и остаток обрабатывают водой, экстрагируют дихлорметаном и подвергают колоночной хроматографии (силикагель, смесь дихлорметан/метанол/аммиак в соотношении 140:10:1), получая при этом 670 мг (10%) бесцветного твердого вещества. Масс-спектроскопия: m/е=177 (М+).
б) N-Метил-3-[4-(4-трифторметилбензилокси)фенил]акриламид
195 мг (1,1 ммоль) 3-(4-гидроксифенил)-N-метилакриламид растворяют в 25 мл этилметилкетона и добавляют 304 мг (2,2 ммоль) карбоната калия, а затем 289 мг (1,2 ммоль) 4-(трифторметил)бензилбромида. Реакционную смесь перемешивают в течение ночи при комнатной температуре, нагревают до 50°С в течение 3 часов, обрабатывают водой и экстрагируют 3 раза дихлорметаном. Полученный экстракт высушивают над сульфатом магния, концентрируют и обрабатывают эфиром, получая при этом 260 мг (выход 70%) бесцветного твердого вещества. Масс-спектроскопия: m/е=336,1 (М++Н).
Пример 12: 3-[4-(3,4-дифторбензилокси)фенил]-N-метилакриламид
а) 3-[4-(3, 4-Дифторбензилокси)фенил]акриловая кислота
2,5 г (15,2 ммоль) n-кумаровой кислоты растворяют в 100 мл этилметилкетона. Добавляют 4,21 г (30,5 ммоль) карбоната калия и 6,31 г (30,5 ммоль) 3,4-дифторбензилбромида и реакционную смесь выдерживают при 70°С в течение ночи. После разбавления водой и экстрагирования этилацетатом получают твердое вещество, которое перекристаллизовывают из смеси диэтилового эфира и н-гексана. Полученный таким образом неочищенный сложный эфир растворяют в 100 мл ТГФ и обрабатывают, используя 30,5 мл (30,5 ммоль) водного раствора 1Н гидроксида натрия. Полученную смесь нагревают до 50°С в течение 6 часов, охлаждают и подкисляют 1Н раствором хлороводородной кислоты. Полученный осадок отфильтровывают и высушивают, получая при этом 3,24 г (выход 73%) бесцветного твердого вещества. Масс-спектроскопия: m/е=288,9 (М-Н).
б) 3-[4-(3,4-Дифторбензилокси)фенил]-N-метилакриламид
500 мг (1,72 ммоль) 3-[4-(3,4-дифторбензилокси)фенил]акриловой кислоты суспендируют в 5 мл дихлорметана. Добавляют 0,62 мл (8,6 ммоль) тионилхлорида и реакционную смесь нагревают до 45°С в течение ночи. После концентрирования остается желтоватая смола, которую опять растворяют в 10 мл дихлорметана и обрабатывают 1,1 мл 33%-ного раствора метиламина в этаноле. После нагревания при 45°С в течение 3 часов реакционную смесь фильтруют и полученный фильтрат концентрируют. После хроматографии (силикагель, дихлорметан/метанол) получают 136 мг (выход 26%) бесцветного твердого вещества. Масс-спектроскопия: m/е=304,1 (М++Н).
Пример 13: 3-[4-(4-фторбензилокси)фенил]-N-метилакриламид
а) 3-[4-(4-Фторбензилокси)фенил]акриловая кислота
Указанное в заголовке соединение получают по методике, аналогичной описанной в примере 12 а) из n-кумаровой кислоты и 4-фторбензилбромида. Выход бесцветного твердого вещества составляет 56%. Масс-спектроскопия: m/е=271,0 (М-Н).
б) 3-[4-(4-Фторбензилокси)фенил]-N-метилакриламид
Указанное в заголовке соединение получают по методике, аналогичной описанной в примере 12 б) из 3-[4-(4-фторбензилокси)фенил]акриловой кислоты и метиламина. Выход бесцветного твердого вещества составляет 21%. Масс-спектроскопия: m/е=286,0 (М++Н).
Пример 14: 3-[4-(3-цианобензилокси)фенил]-N-метилакриламид
Указанное в заголовке соединение получают по методике, аналогичной описанной в примере 11 б), из 3-(4-гидроксифенил)-N-метилакриламида и 3-бромметилбензонитрила. Выход бесцветного твердого вещества составляет 75%. Масс-спектроскопия: m/е=293,2 (М++Н).
Пример 15: N-метил-3-[4-(4-метилбензилокси)фенил]акриламид
Указанное в заголовке соединение получают по методике, аналогичной описанной в примере 11 б), из 3-(4-гидроксифенил)-N-метилакриламида и 1-бромметил-4-метилбензола. Выход бесцветного твердого вещества составляет 44%. Масс-спектроскопия: m/е=282,0 (М++Н).
Пример 16: 3-[4-(3-метоксибензилокси)фенил]-N-метилакриламид
Указанное в заголовке соединение получают по методике, аналогичной описанной в примере 11 б) из 3-(4-гидроксифенил)-N-метилакриламида и 1-бромметил-3-метоксибензола. Выход бесцветного твердого вещества составляет 60%. Масс-спектроскопия: m/е=298,2 (М++Н).
Пример 17: метиламид 3-[4-(3-фторбензилокси)фенил]-бут-2-еновой кислоты
а) 1-[4-(3-Фторбензилокси)фенил]этанон
Смесь 7,5 г (55,1 ммоль) 4-гидроксиацетофенона, 10,93 г (57,8 ммоль) 3-фторбензилбромида и 19,74 г (60,6 ммоль) карбоната цезия в 75 мл ацетонитрила перемешивают в течение 1 часа при комнатной температуре, затем выдерживают 3 часа при температуре образования флегмы. Реакционную смесь концентрируют и обрабатывают приблизительно 200 мл ледяной воды. После экстракции этилацетатом получают 12,82 г (выход 95%) несколько желтоватого твердого вещества. Масс-спектроскопия: m/е=245,3 (М++Н).
б) Метиловый эфир 3-[4-(3-фторбензилокси)фенил]-бут-2-еновой кислоты
6,72 г (40 ммоль) триметилфосфоноацетата добавляют к 40 мл 1 М раствора метанолята натрия в метаноле. Полученную смесь перемешивают в течение 15 минут при комнатной температуре. Медленно добавляют при комнатной температуре раствор 4,89 г (20 ммоль) 1-[4-(3-фторбензилокси)фенил]этанона в 40 мл метанола. Полученную смесь кипятят с обратным холодильником в течение 20 часов и концентрируют, получая при этом 4,98 г желтоватого твердого вещества. После хроматографии на силикагеле (смесь циклогексан/этилацетат в соотношении 9:1) получают 1,169 г (выход 19%) желтоватого маслянистого вещества, которое кристаллизуется при стоянии. Масс-спектроскопия: m/е=301,3 (М++Н).
в) Метиламид 3-[4-(3-фторбензилокси)фенил]бут-2-еновой кислоты
0,224 г (4 ммоль) КОН растворяют в 10 мл метанола. Добавляют 0,4 г метилового эфира (1,33 ммоль) 3-[4-(3-фторбензилокси)фенил]бут-2-еновой кислоты и полученный раствор кипятят с обратным холодильником в течение б часов, концентрируют и подкисляют 2 Н водным раствором хлороводородной кислоты. После экстракции этилацетатом получают 325 мг (выход 85%) неочищенной кислоты. Эту кислоту растворяют в 10 мл дихлорметана, добавляют 2 капли N, N-диметилформамида и полученную смесь охлаждают до 0°С. После медленного добавления 0,380 г (3 ммоль) оксалилхлорида получают желтый раствор, который перемешивают дополнительно в течение 1,5 часов при комнатной температуре. Упаривание реакционной смеси приводит к получению желтоватой смолы, которую растворяют в 5 мл ТГФ и медленно добавляют при 0°С к смеси 5 мл ТГФ и 5 мл водного раствора метиламина (40%). Полученную суспензию перемешивают при комнатной температуре в течение 1 часа, упаривают, разбавляют водой и экстрагируют три раза этилацетатом. После хроматографии на силикагеле (смесь циклогексан/этилацетат в соотношении 1:1) получают 220 мг (выход 50%) бесцветного твердого вещества. Масс-спектроскопия: m/е=300,2 (М++Н).
Пример 18: 3-[4-(3-фторбензилокси)фенил]-N-метилбутирамид
100 мг (0,33 ммоль) метиламида 3-[4-(3-фторбензилокси)фенил]бут-2-еновой кислоты растворяют в 7 мл метанола. Добавляют 25 мг платины на углероде (5%) и полученную смесь гидрируют при комнатной температуре и нормальном давлении. Катализатор отфильтровывают и полученный фильтрат упаривают досуха, получая при этом 81 мг бесцветного твердого вещества. Масс-спектроскопия: m/е=302,3 (М++Н).
Пример А
Таблетки приведенного ниже состава получают по общепринятой методике:
Пример Б
Таблетки приведенного ниже состава получают по общепринятой методике:
Пример В
Получают капсулы следующего состава:
Активный ингредиент с подходящим размером частиц, кристаллическую лактозу и микрокристаллическую целлюлозу гомогенно смешивают, просеивают и после этого смешивают вместе с тальком и стеаратом магния. Полученной в результате этого смесью наполняют твердые желатиновые капсулы подходящего размера.
Пример Г
Раствор для инъекций может иметь приведенный ниже состав и приготавливается обычным образом:
Реферат
Изобретение относится к соединению формулы I, в которой R1представляет собой (С1-С3)алкил, галоген, галоген(С1-С6)алкил, циано, (C1-С6)-алкокси или галоген(С1-С6)алкокси; R21, R22, R23 и R24 каждый независимо выбирают из группы, состоящей из водорода и фтора; R3 представляет собой водород или (С1-С3)алкил; А означает бивалентную группу формулы (а), (б) или (в); R4 представляет собой водород или (С1-С3)-алкил; R5, R6 и R7 каждый независимо представляет собой водород или (С1-С6)алкил; и n означает 1, 2 или 3, при условии, что 3-[4-(3-хлорбензилокси)фенил]-N-этилпропионамид и 3-[4-(4-бромбензиокси)фенил]пропионамид исключены. Изобретение также относится к лекарственному средству, обладающему ингибирующей активностью в отношении моноаминоксидазы В, содержащему одно или более соединений формулы I и фармацевтически приемлемые наполнители. Технический результат - производные коричной кислоты, обладающие ингибирующей активностью в отношении моноаминоксидазы В. 2 н. и 7 з.п. ф-лы, 1 табл.


Формула





Комментарии