Производные амидокарбоновой кислоты, фармацевтическая композиция на их основе и способ снижения глюкозы в крови - RU2176999C2
Код документа: RU2176999C2
Чертежи
























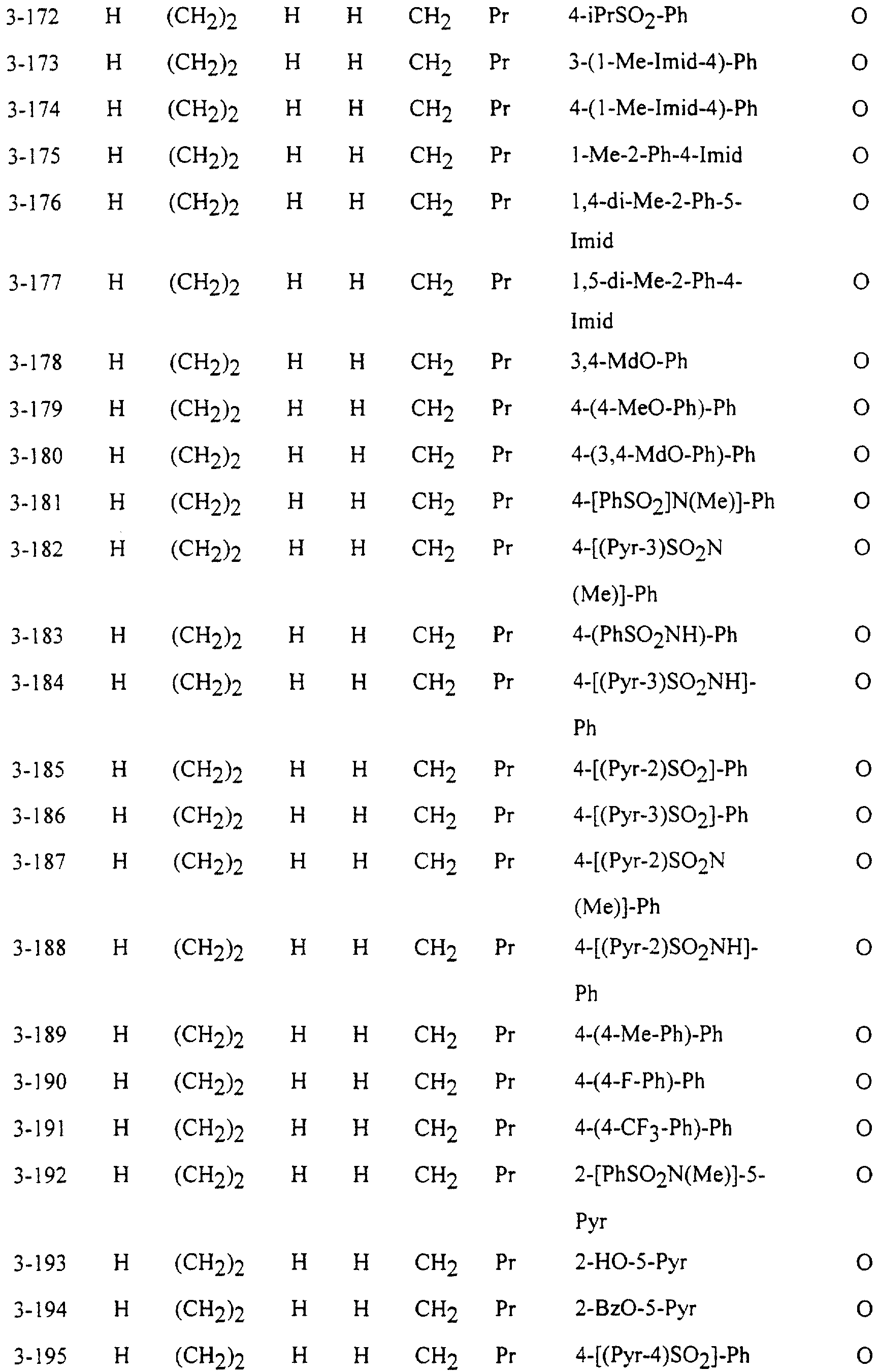

















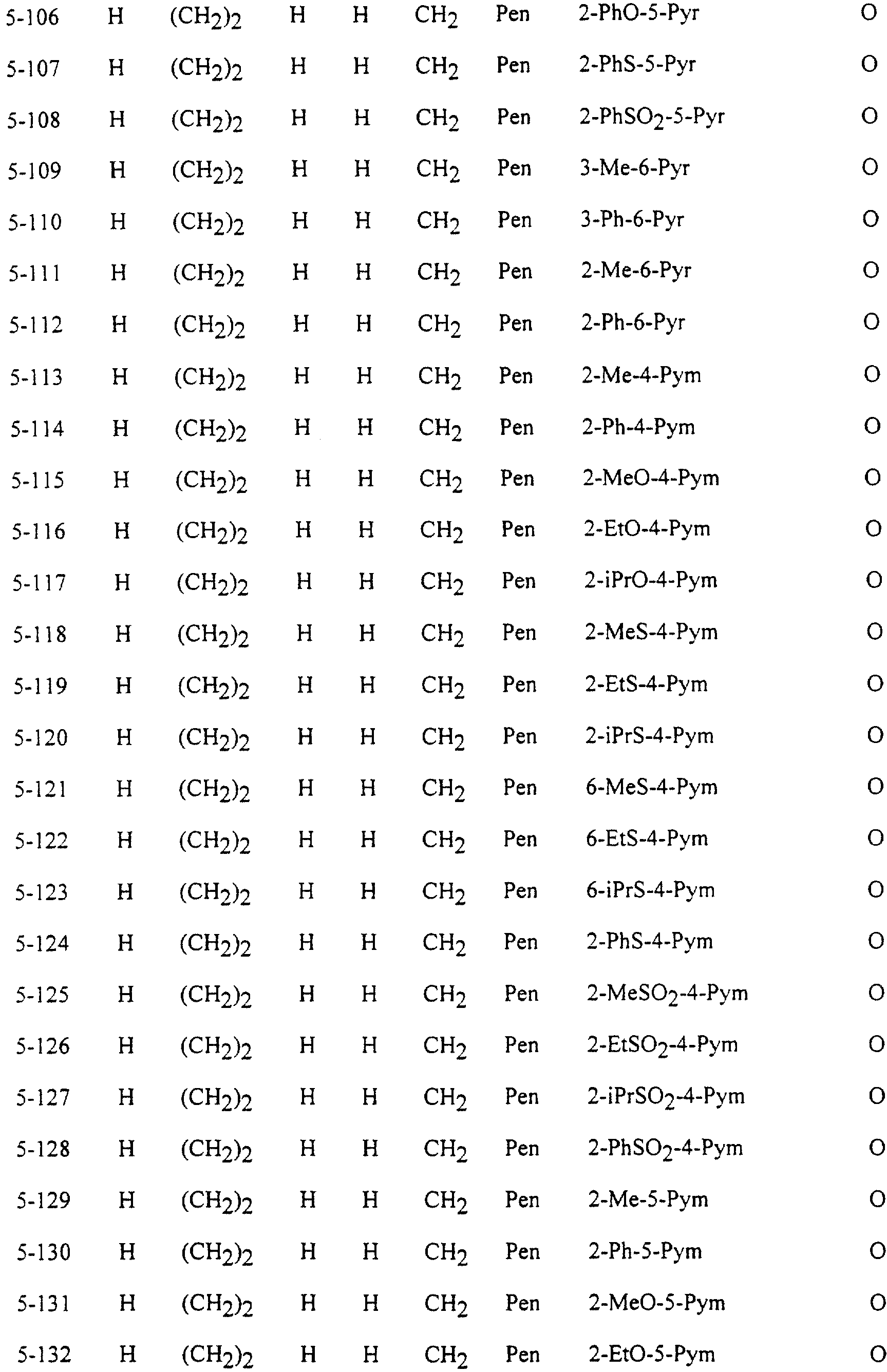




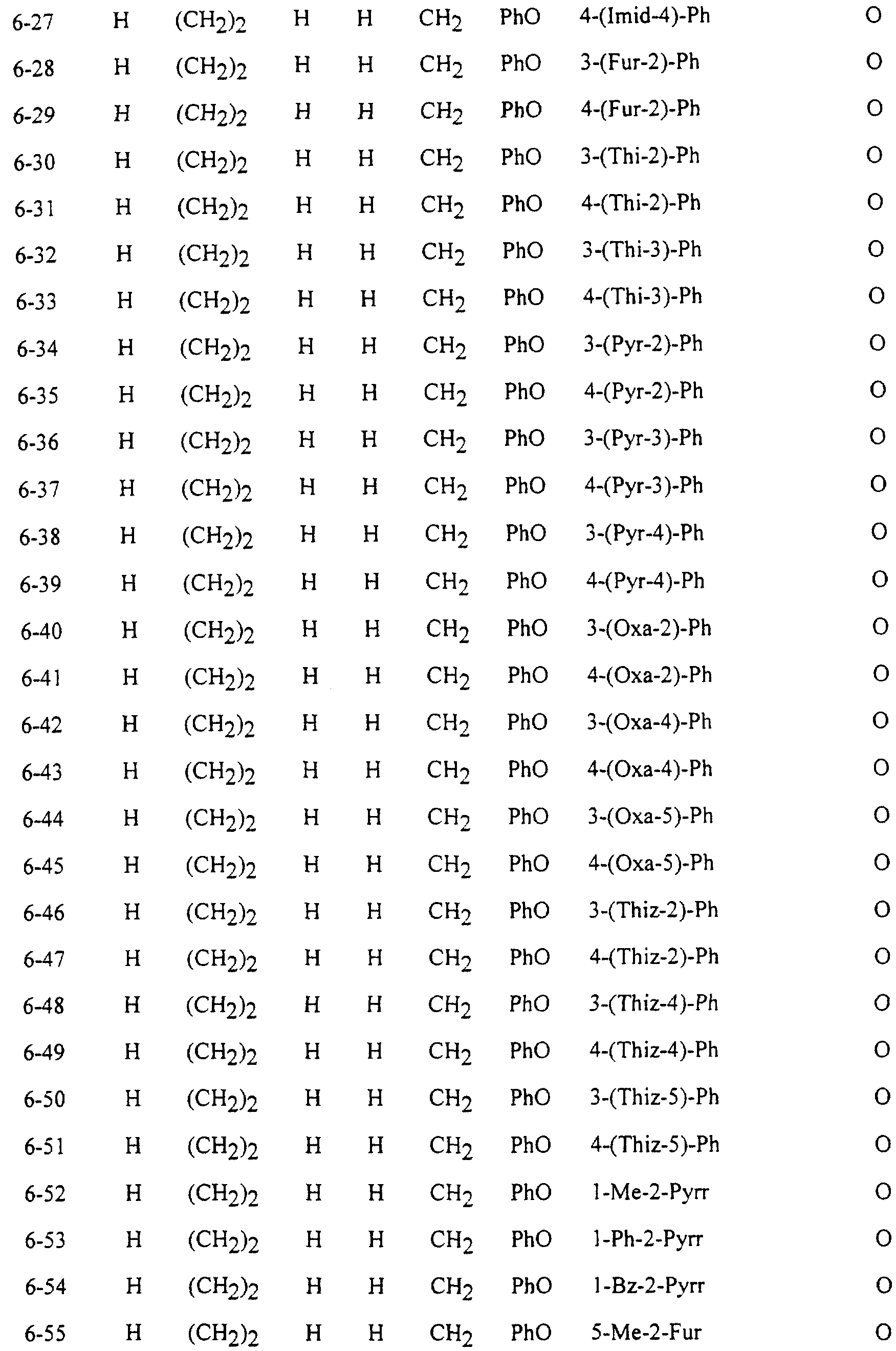







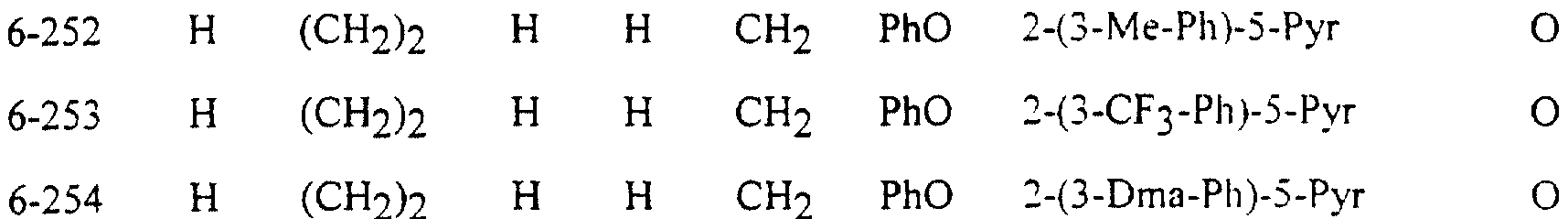










































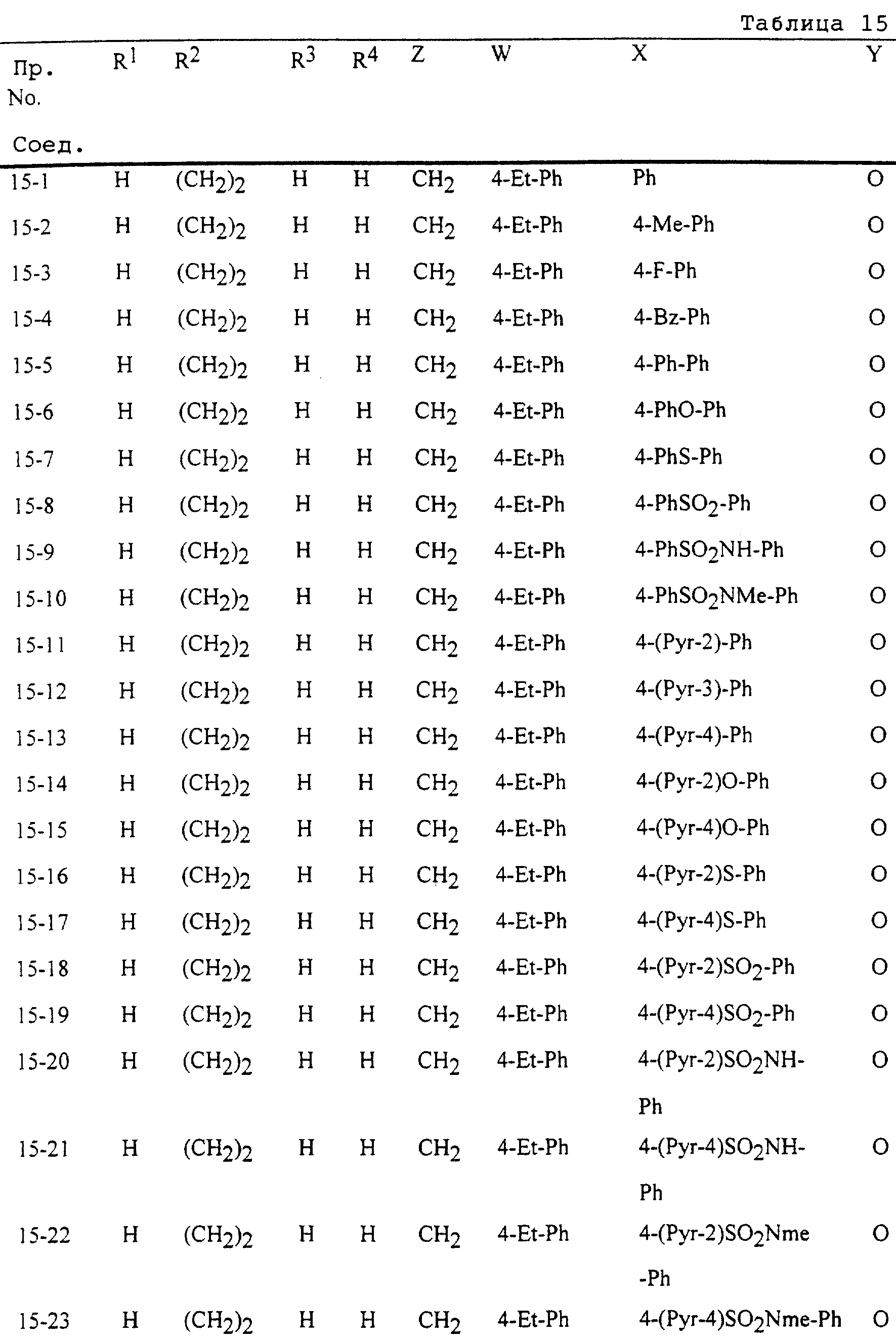



























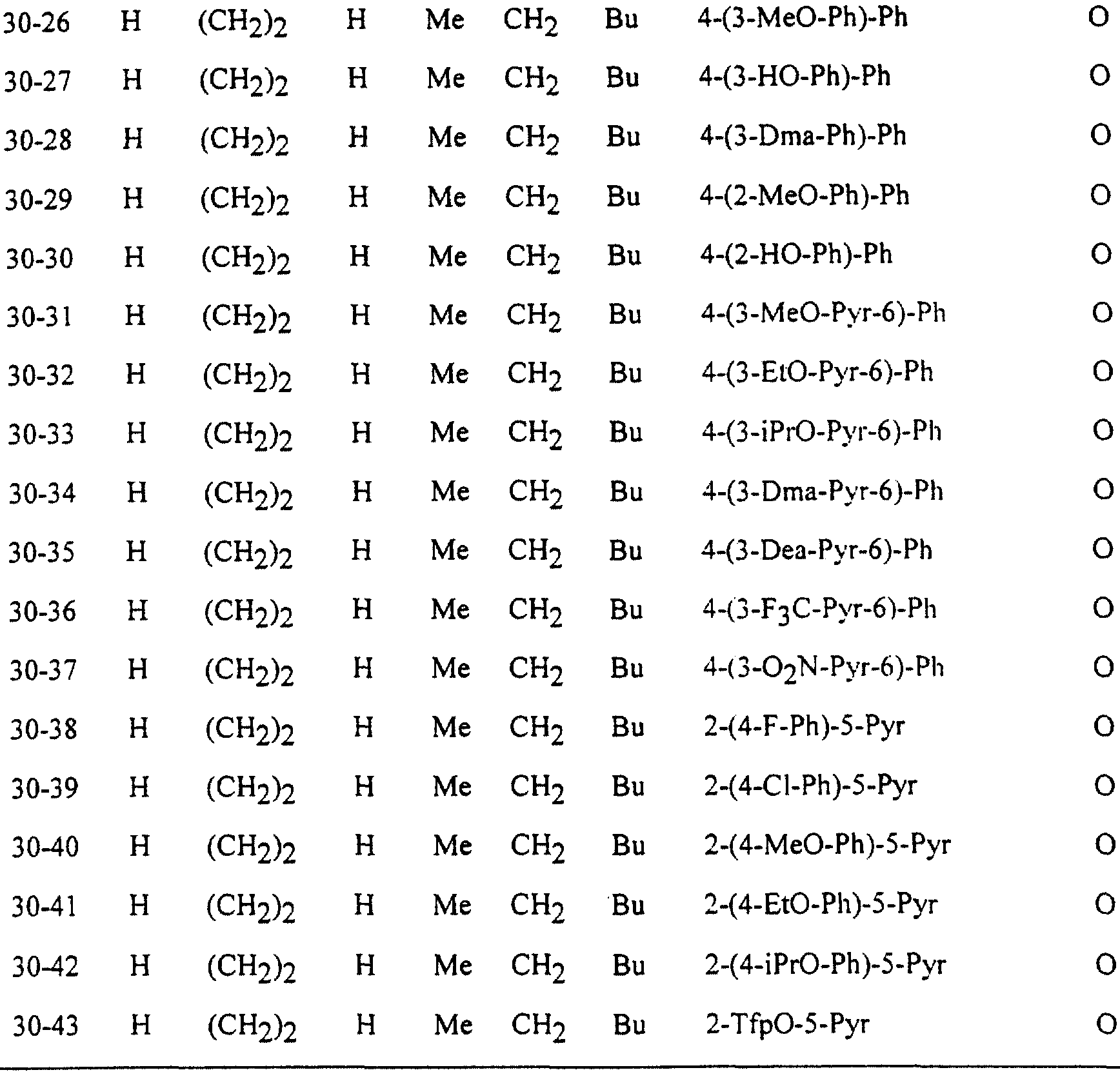














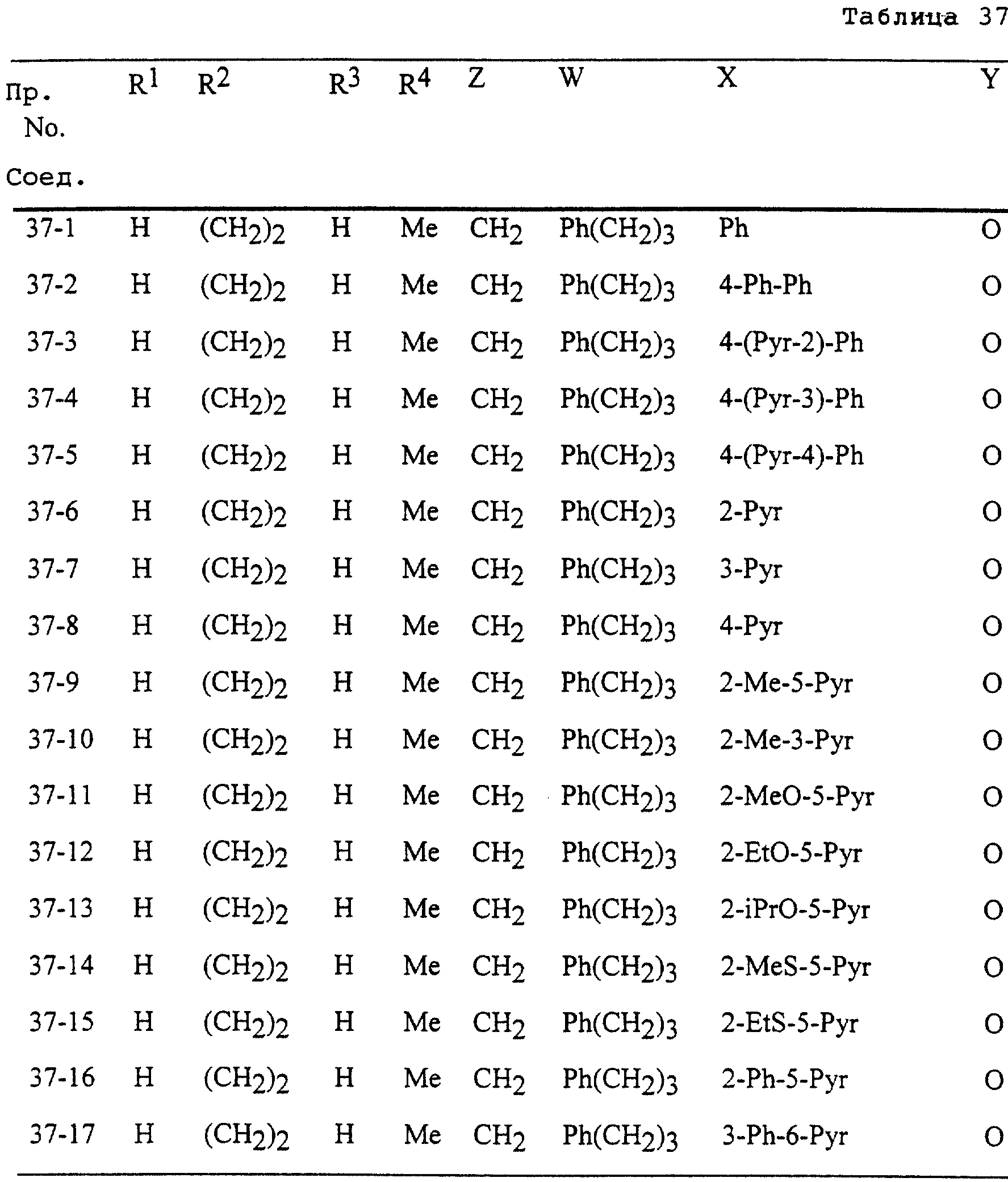





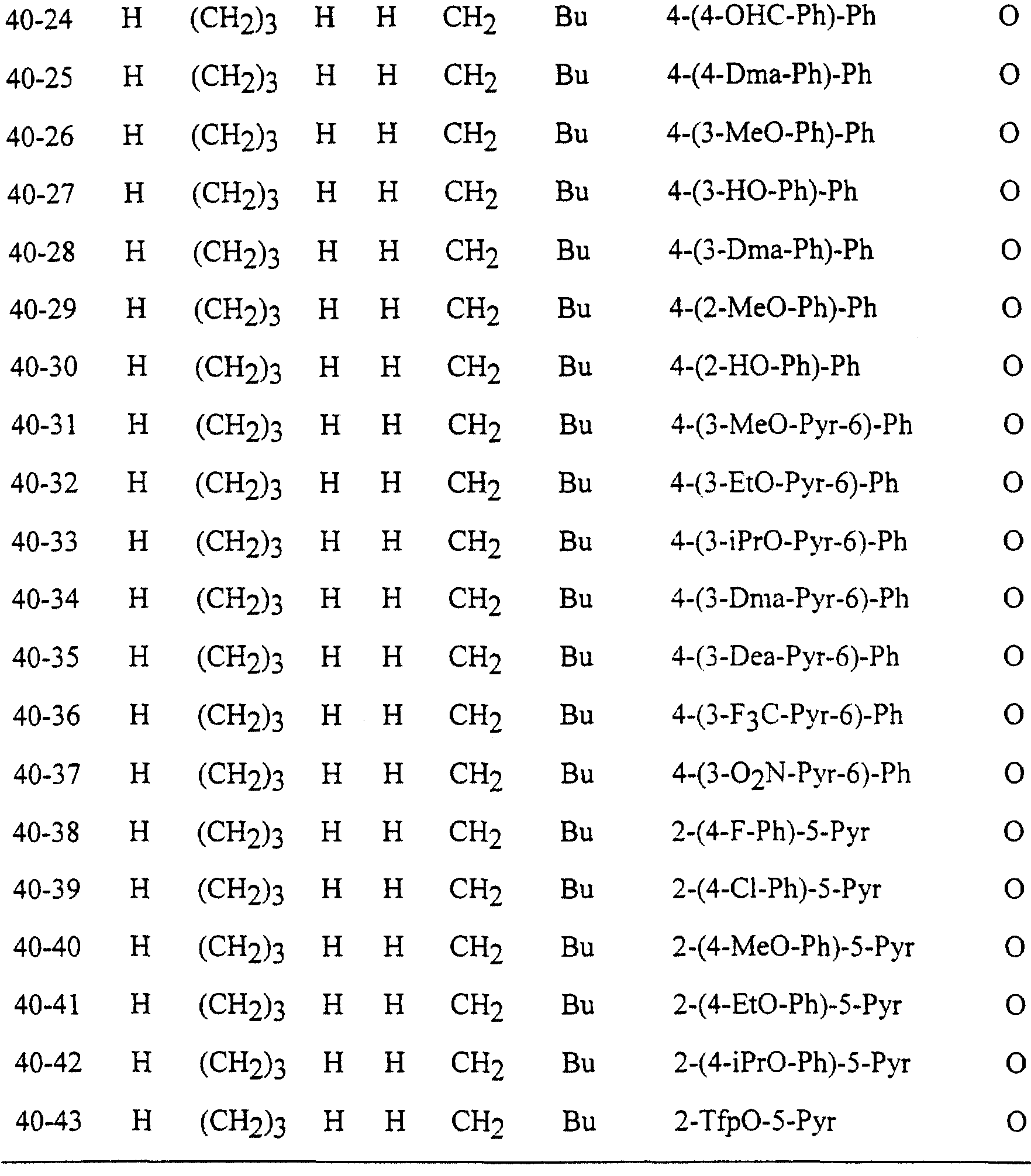




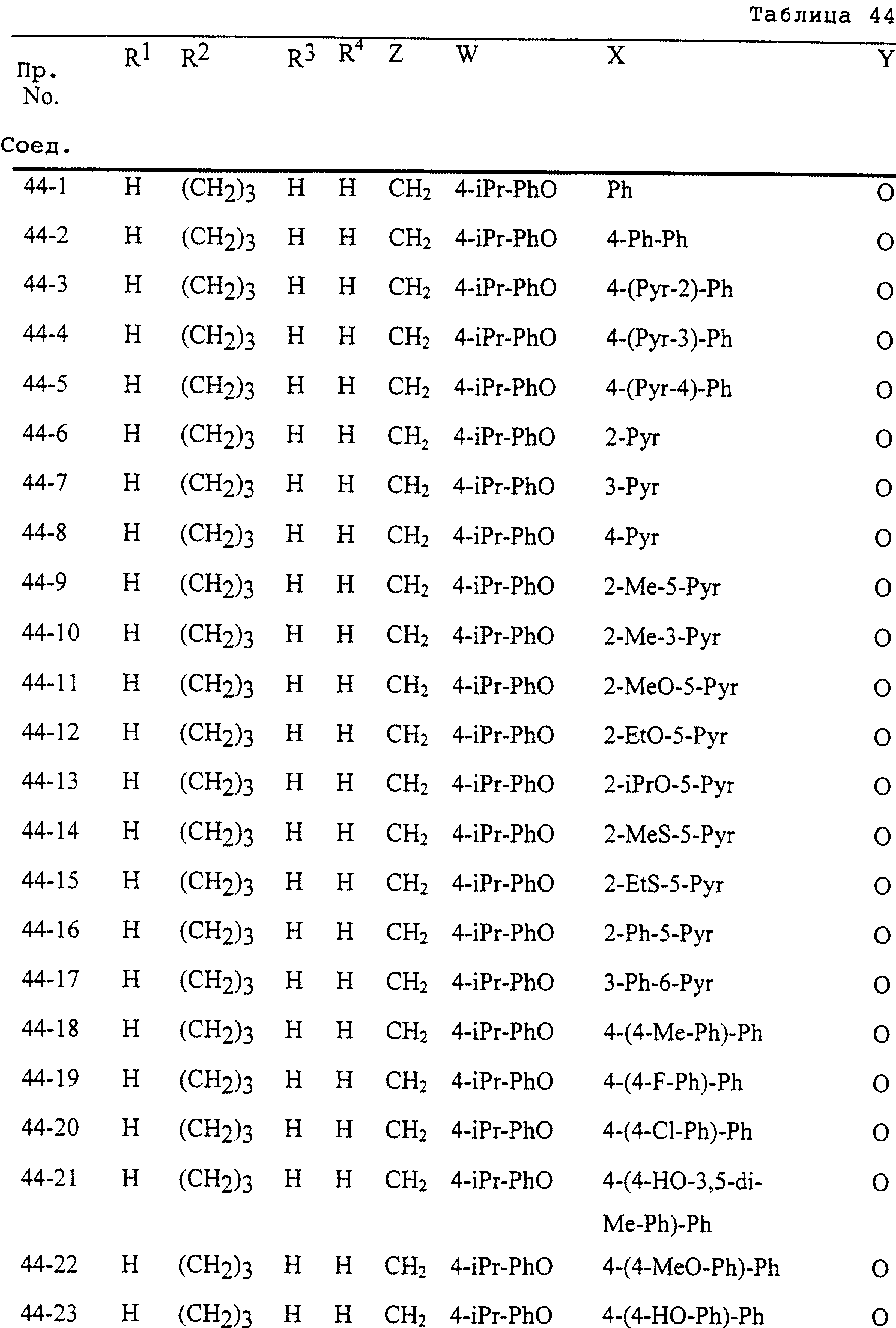
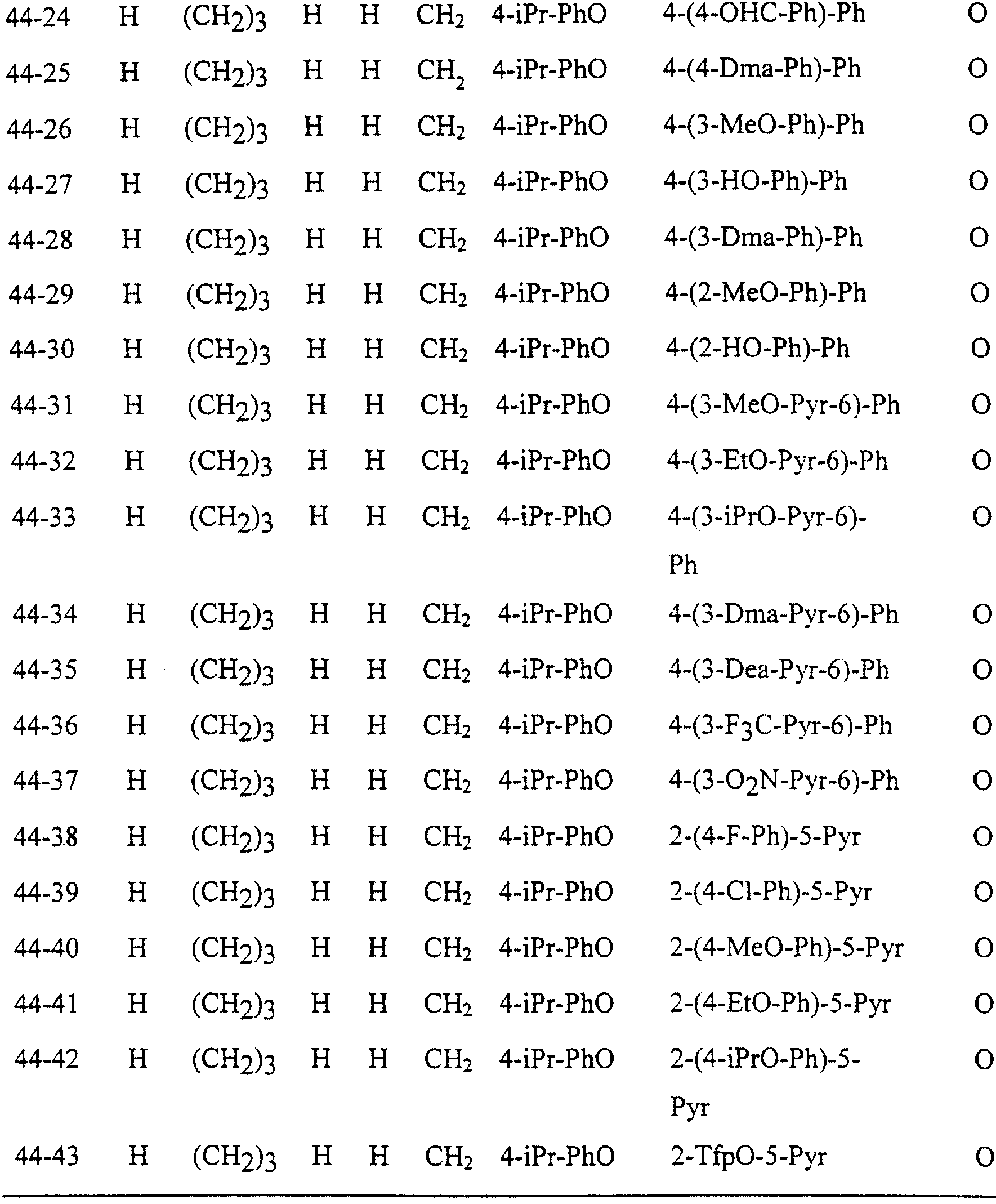


































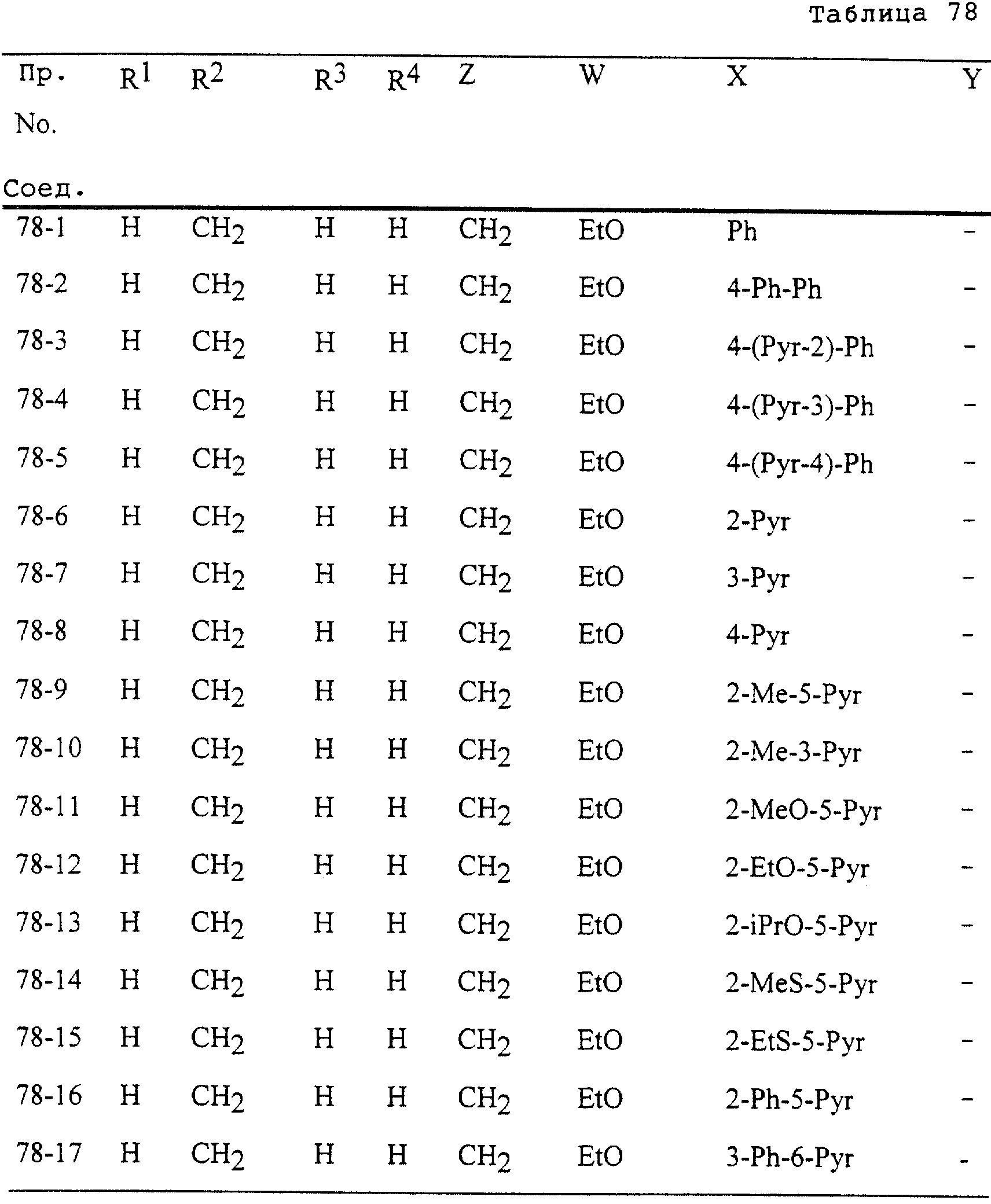



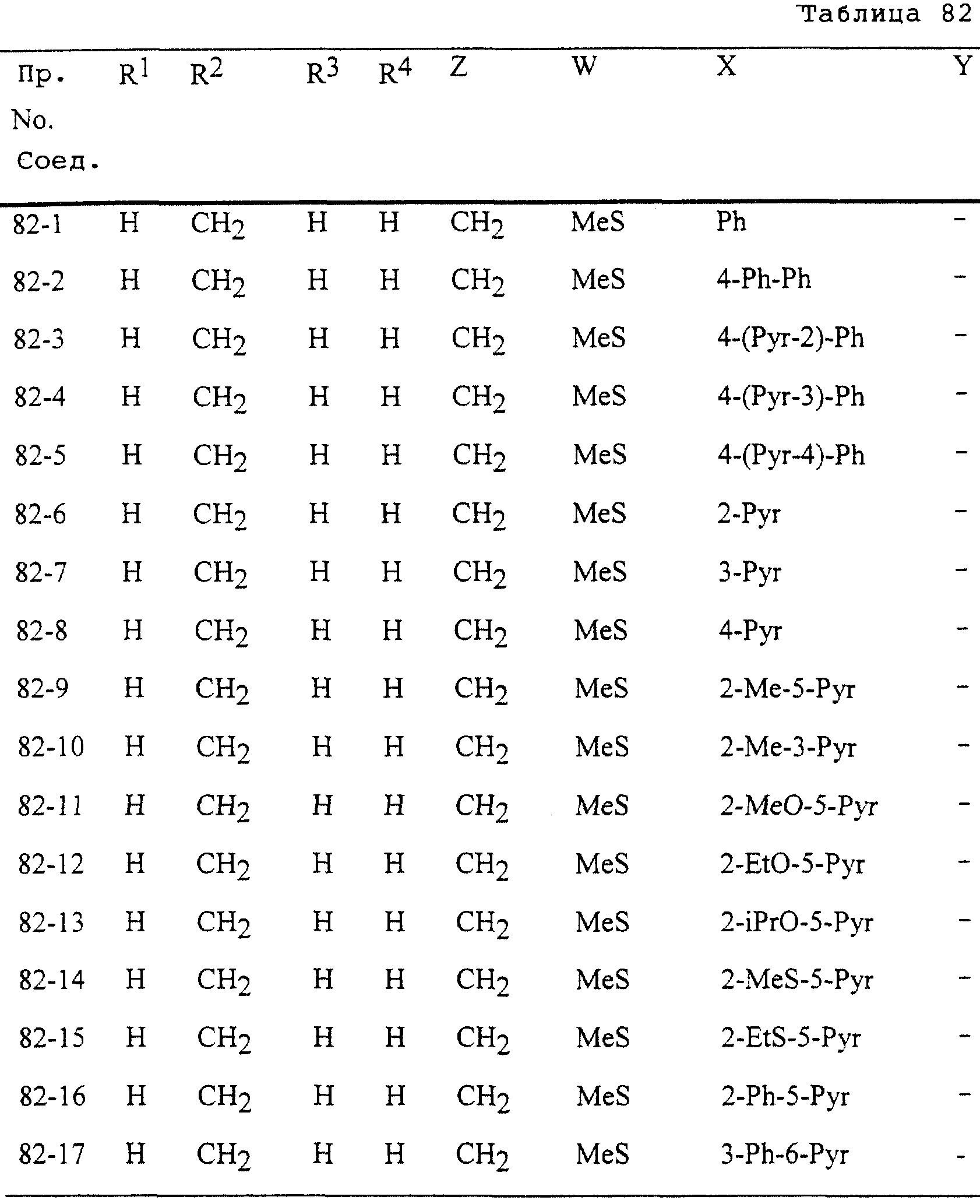









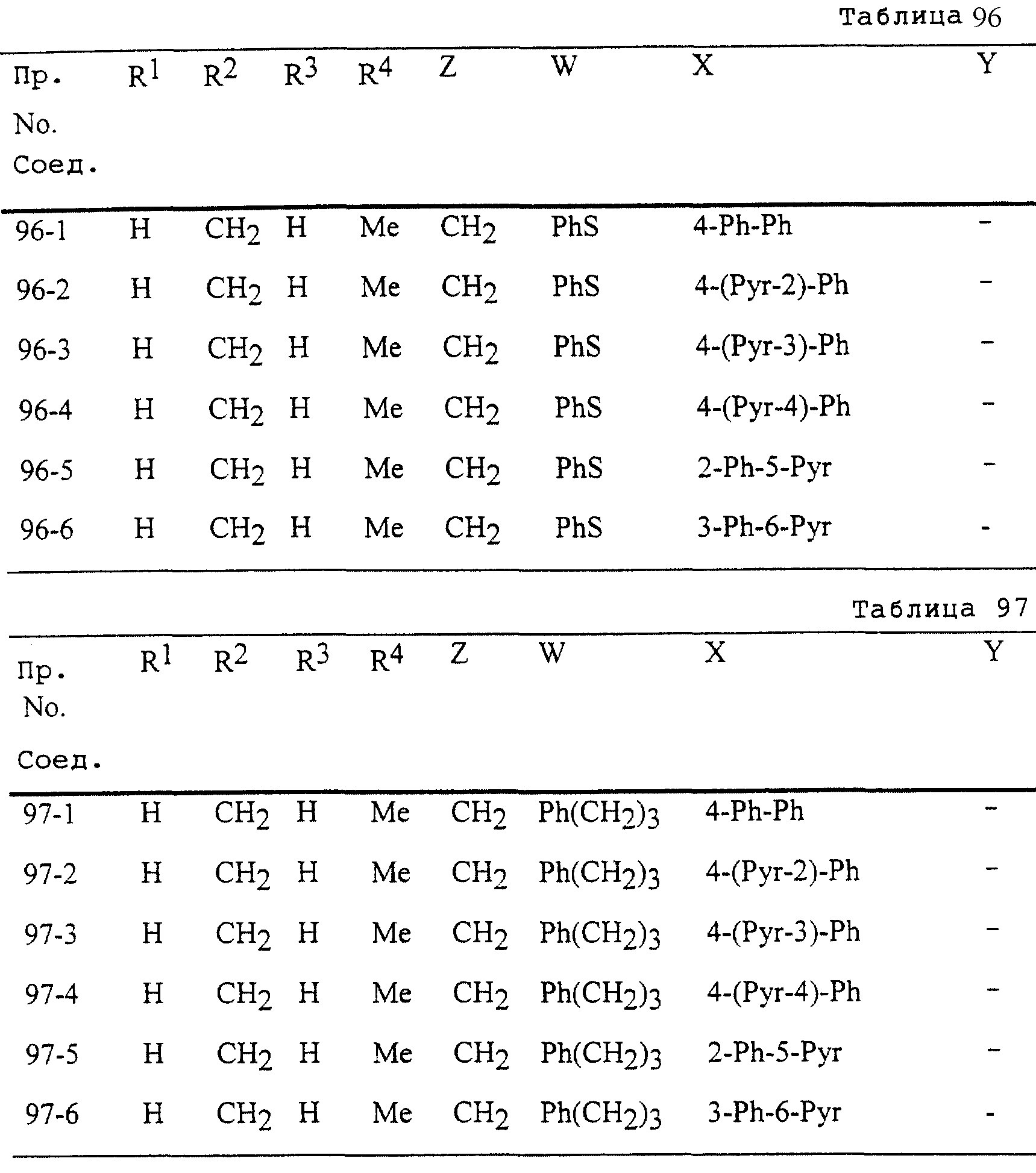


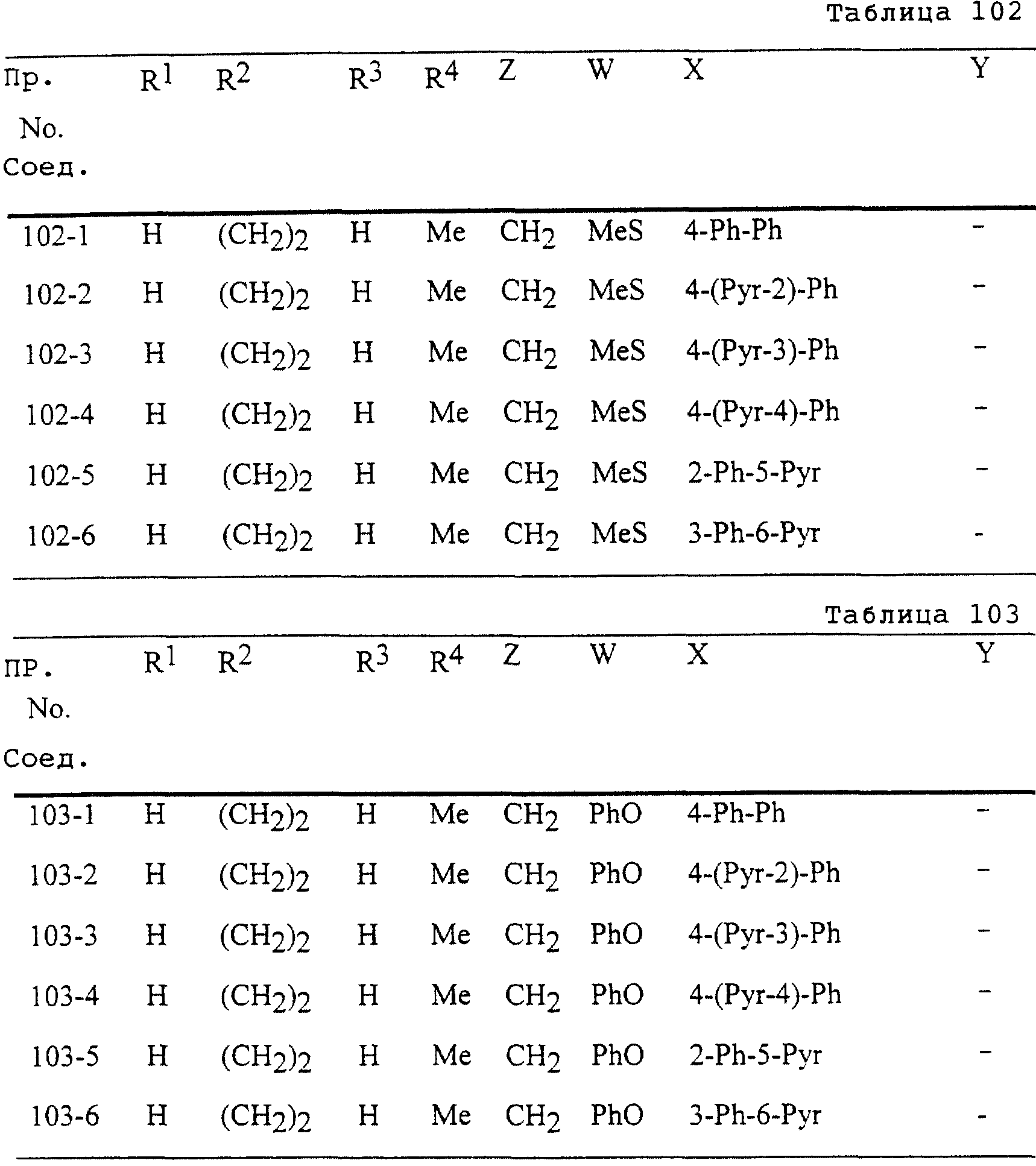

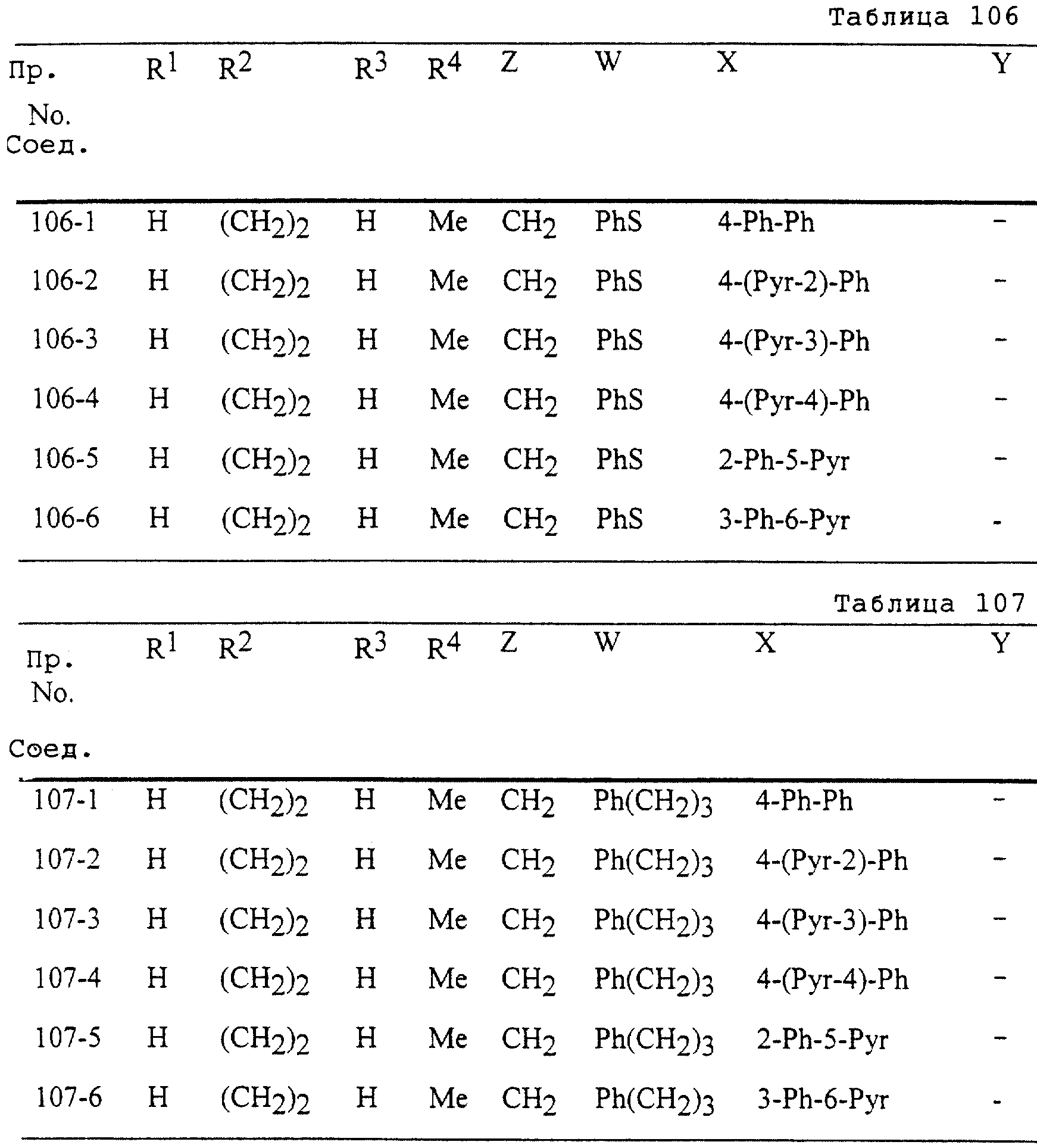

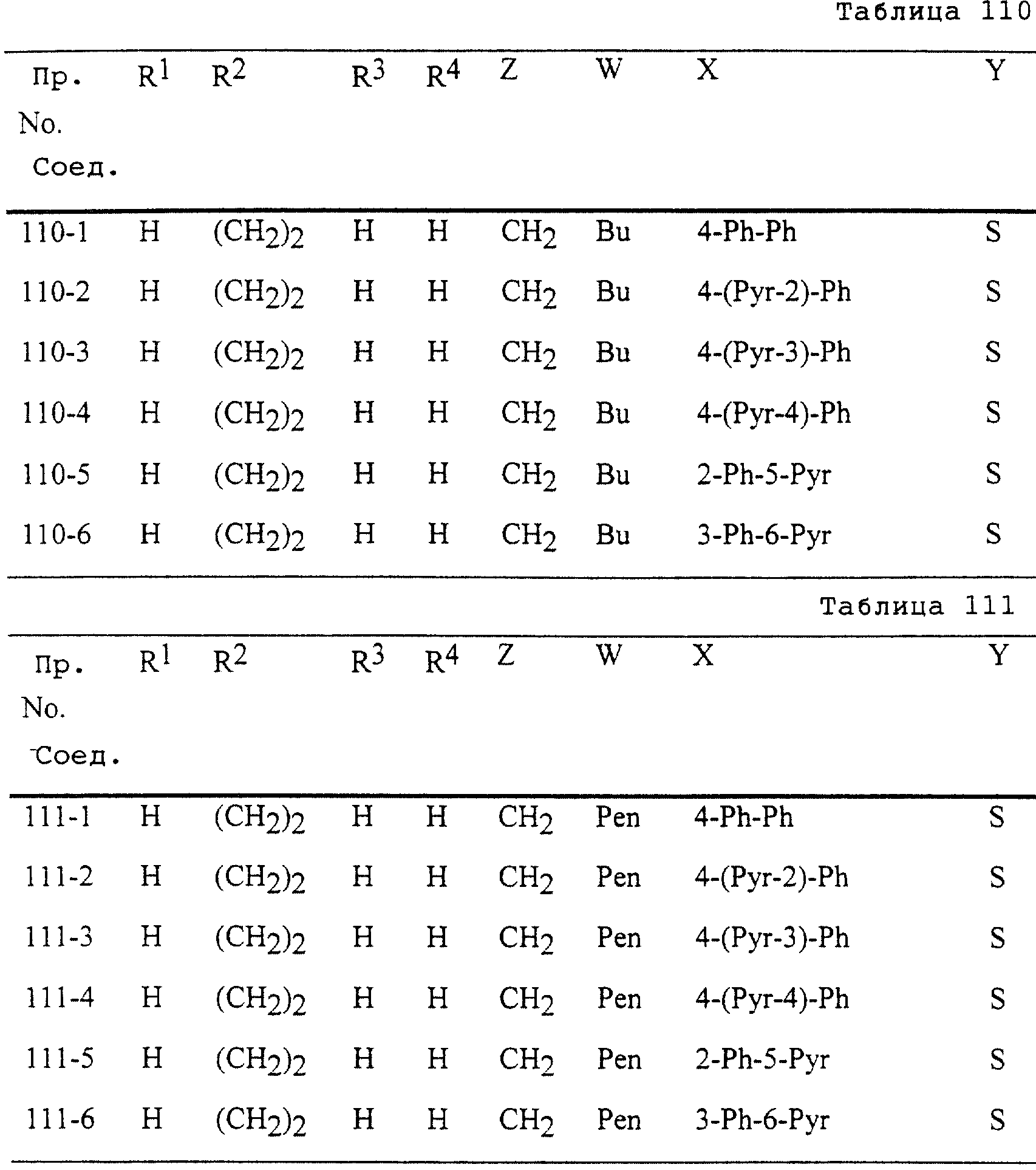




























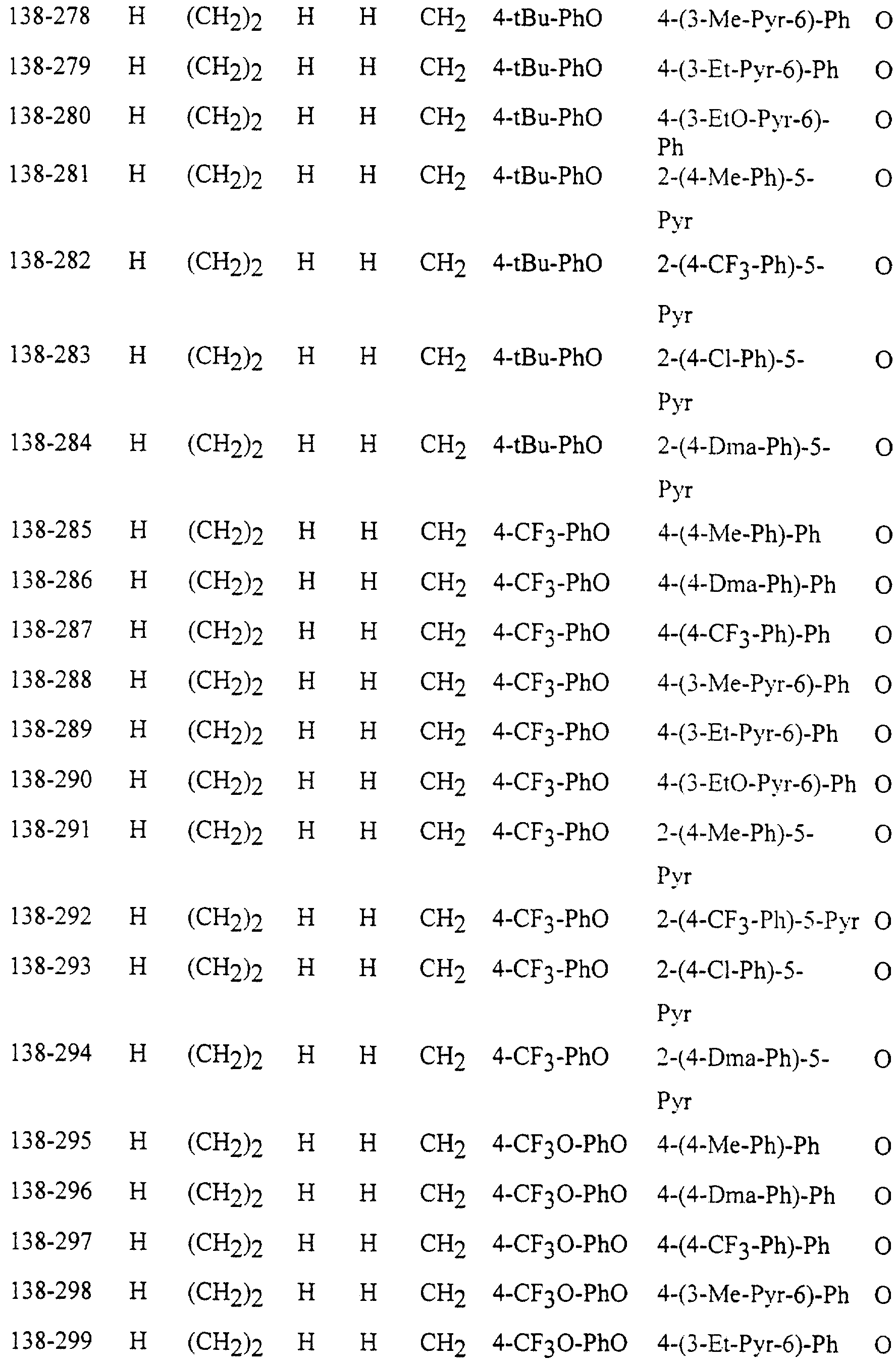
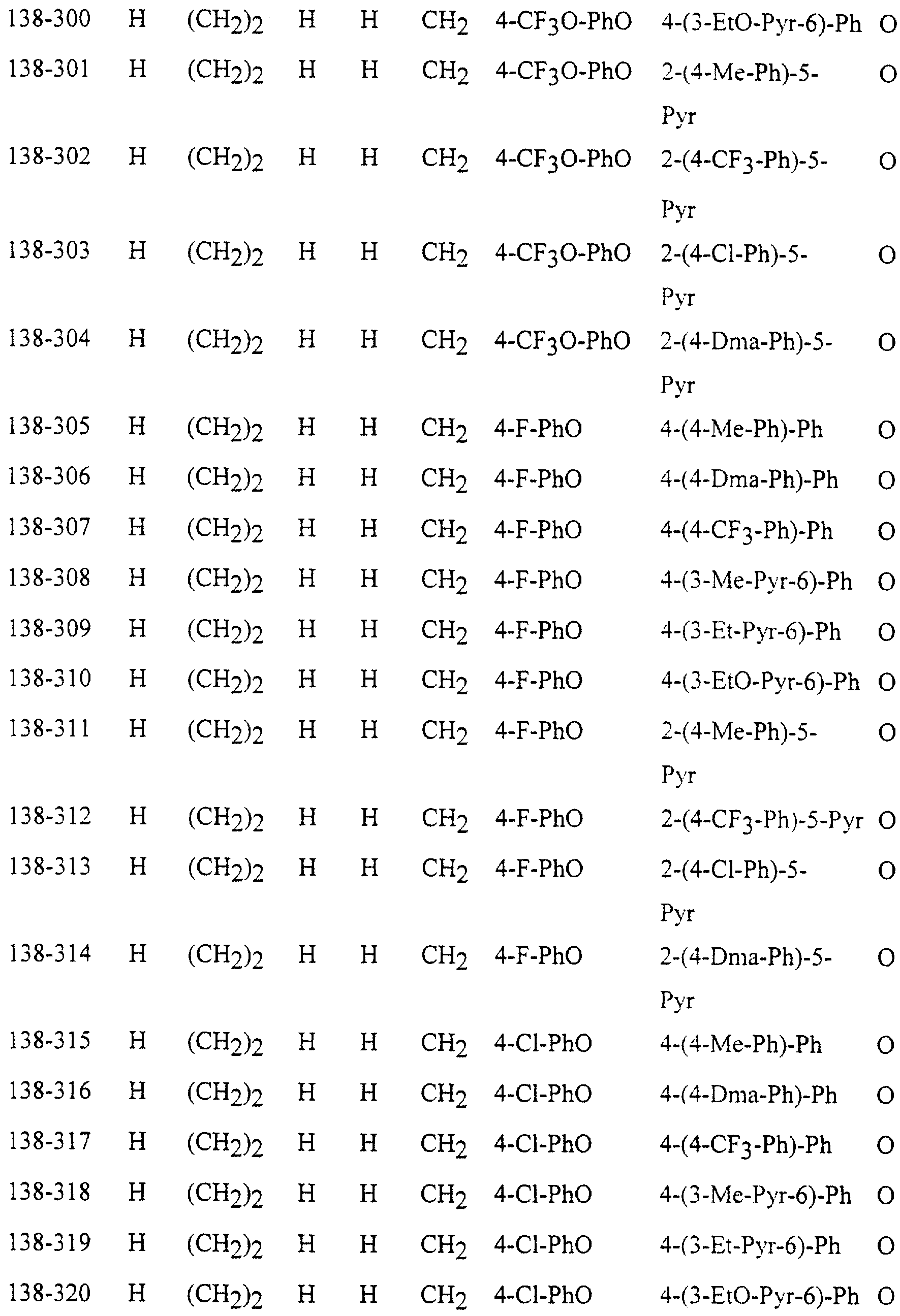





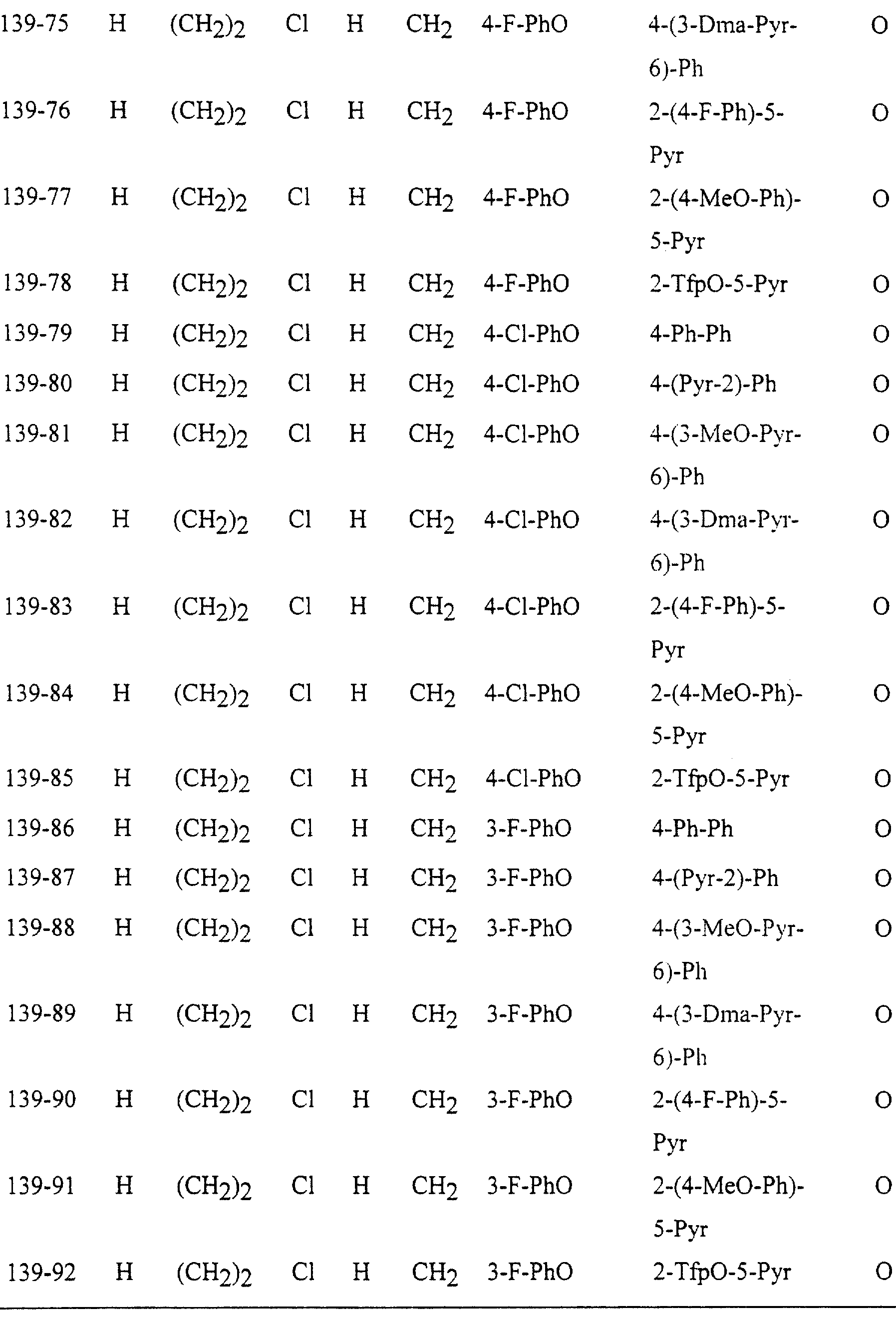




























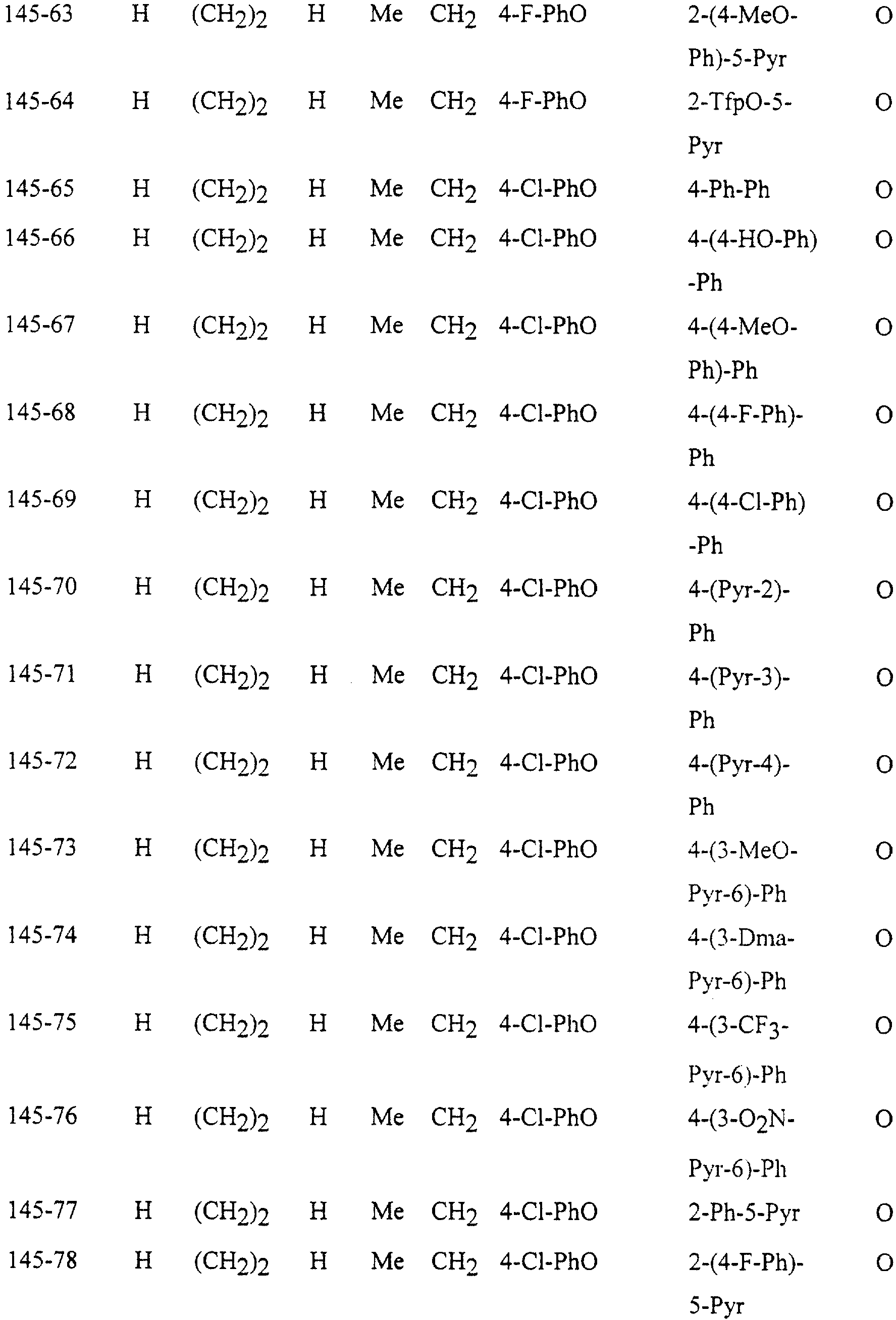










































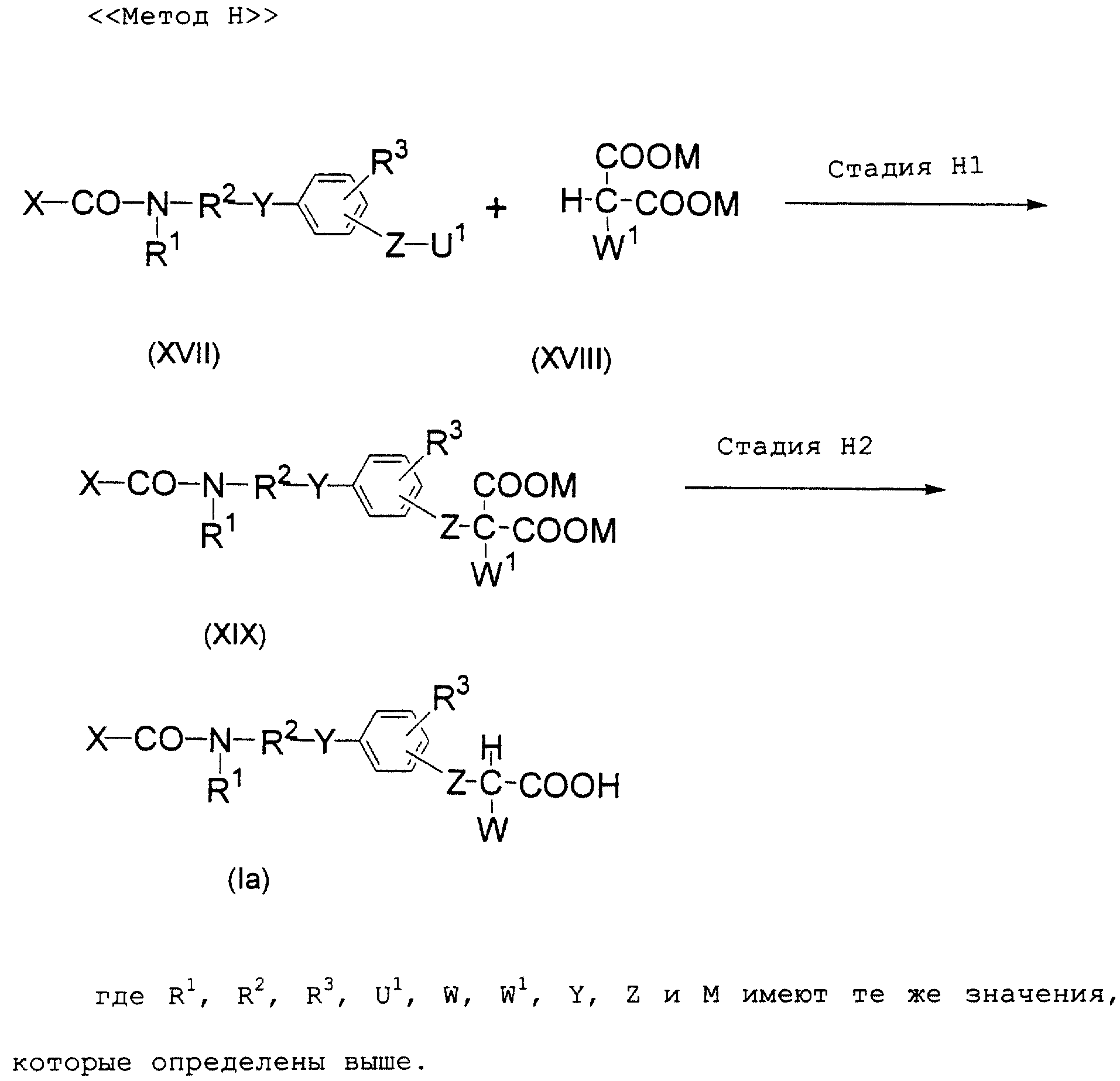
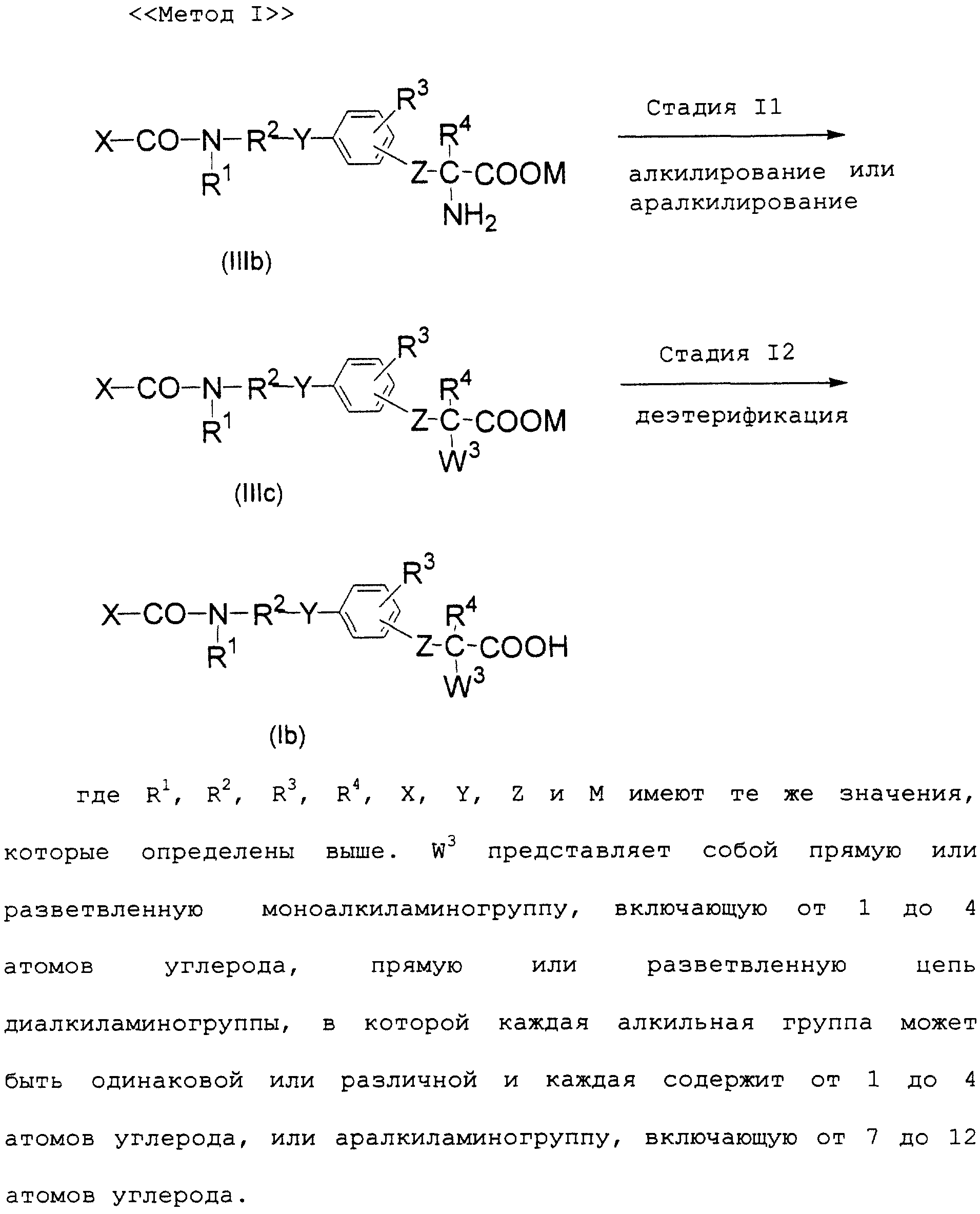
Описание
Область
техники
Изобретение относится к производным амидокарбоновой кислоты, или их фармакологически приемлемым солям, или их фармакологически приемлемым эфирам. Эти соединения обладают прекрасным
действием по понижению уровня глюкозы в крови, снижению содержания липидов, улучшению инсулиновой резистентности, ослаблению воспалительных заболеваний, иммунорегуляции, ингибированию альдозной
редуктазы, ингибированию 5-липоксигеназы, подавлению перекисного окисления липидов, активированиго PPAR (активирование рецептора пероксисомальной пролиферации) и ослаблению остеопороза.
Далее изобретение относится к композиции, содержащей вышеуказанные производные амидокарбоновой кислоты, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры в качестве активного ингредиента, применяемой при лечении или профилактики следующих заболеваний. Эти заболевания включают заболевания, вызванные, главным образом, резистентностью к инсулину, такие как сахарный диабет, гиперлипемия, ожирение, ослабление толерантности к глюкозе (IGT), толерантность к глюкозе не-IGT (NGT), гипертония, жировая печень, диабетические осложнения (например, ретинопатия, нефропатия, невроз, катаракты, коронарные заболевания и тому подобное), артериосклероз, сахарный диабет беременных (GDM), поликистозный синдром яичника (PCOS) и повреждения клеток, вызванные атеросклерозом (например мозговые повреждения, вызванные апоплексией и тому подобное); воспалительные болезни типа эпифизарного остеомиелита, боли, гипертермия, ревматический артрит, воспалительный энтерит, угри, солнечный ожог, псориаз, экзема, аллергические заболевания, астма, гастроинтестинальные язвы, рак, кахексия, аутоиммунные заболевания и панкреатит; остеопороз; катаракты; и тому подобное.
Настоящее изобретение относится к применению этих соединений, их солей и эфиров в производстве лекарств для профилактики и лечения данных заболеваний или к способу лечения или профилактики этих заболеваний путем введения фармакологически эффективного количества таких соединений теплокровным животным.
Предпосылки изобретения
Хотя обычно применяли инсулин и
соединения сульфонилмочевины, такие как толбутамид и глипизид, в качестве терапевтических агентов при сахарном диабете и гипергликемии, недавно были представлены производные карбоновой кислоты для
использования в качестве терапевтических агентов при инсулин независимом диабете. Эти соединения описаны, например, в следующих публикациях:
(1-1) Международная патентная публикация WО
91/19702 (Японская заявка PCT (Kokai) N. Hei 5-507920);
(1-2) Международная патентная публикация WО 94/29285;
(1-3) Международная патентная публикация WО 94/29302;
(1-4)
Международная патентная публикация WО 95/03288; и
(1-5) Международная патентная публикация WО 96/04260.
Однако соединения, описанные выше, отличаются от соединений по настоящему изобретению, описанных ниже, тем, что первые соединения не имеют структурных характеристик соединений, описанных далее, которые содержат амидную связь в боковой цепи производного карбоновой кислоты.
Соединения, имеющие амидные связи в боковых цепях, описаны, например, в следующих публикациях:
(2-1) Японская патентная заявка (Kokai) N. Hei 6-172339;
(2-2)
Международная патентная публикация WО 92/07850 (= Японская заявка PCT (Kokai) N. Hei 6-502144);
и
(2-3) патент США 5330998.
Однако эти соединения отличаются от соединений по данному изобретению, описанных ниже, тем, что первые соединения на конце молекулы имеют тиазолидильные и тому подобное группы.
Хотя производные карбоновой
кислоты, имеющие
амидную связь в боковых цепях, описаны, например, в следующих публикациях:
(3-1) Японская патентная заявка (Kokai) N. Hei 5-155828; и
(3-2) Японская патентная
заявка (Kokai) N. Hei
5-279353,
соединение (3-1) и соединение (3-2) отличаются от соединений по настоящему изобретению по фармакологической активности и химической структуре. Соединение
(3-1) обладает действием по
ингибированию агрегации, и в молекуле соединения (3-1) имеется амино или тому подобная группа в положениях 2-5 карбоновой кислоты и гетероциклическая группа или тому
подобное на конце боковой цепи.
Соединение (3-2) обладает ингибирующей активностью в отношении повреждения ишемической ткани и представляет собой производное уксусной кислоты.
Описание
изобретения
Авторы
настоящего изобретения провели интенсивное исследование производных амидокарбоновой кислоты и их фармацевтически приемлемых солей и эфиров, которые обладают сильным
действием по понижению уровня
глюкозы в крови, снижению содержания липидов, улучшению инсулиновой резистентности, ослаблению воспалительных заболеваний, иммунорегуляции, ингибированию альдозной
редуктазы, ингибированию
5-липоксигеназы, подавлению перекисного окисления липидов, активированию PPAR (активирование рецептора пероксисомальной пролиферации) и ослаблению остеопороза и создали
настоящее изобретение.
Более подробно, настоящее изобретение относится к новым производным амидокарбоновой кислоты, их фармакологически приемлемым солям и фармакологически приемлемым эфирам, которые могут использоваться в качестве терапевтических или профилактических средств при заболеваниях, вызванных, главным образом, инсулиновой резистентностью, таких как сахарный диабет, гиперлипемия, ожирение, ослабление толерантности к глюкозе (IGT), толерантность к глюкозе не-IGT (NGT), гипертония, жировая печень, диабетические осложнения (например, ретинопатия, нефропатия, невроз, катаракты, заболевания коронарной артерии и тому подобное), артериосклероз, сахарный диабет беременных (GDM), поликистозный синдром яичника (PCOS) и повреждения клеток, вызванные атеросклерозом (например, мозговые повреждения, вызванные апоплексией и тому подобное); воспалительные заболевания типа эпифизарного остеомиелита, боли, гипертермия, ревматический артрит, воспалительный энтерит, угри, солнечный ожог, псориаз, экзема, аллергические заболевания, астма, гастроинтестинальные язвы, рак, кахексия, аутоиммунные заболевания (например, системная красная волчанка, юношеский ревматоидный артрит, синдром Шегрена, прогрессирующий системный склероз, смешанные заболевания соединительной ткани, дерматомиозит, болезнь Хашимото, первичная миксома, тиреотоксикоз, перницитозная анемия, язвенный колит, аутоиммунный атрофический гастрит, идиопатическая болезнь Аддисона, мужская стерильность, синдром Гудпасчера, острый прогрессирующий гломерулонефрит, миастения гравис, полимиозит, обычная пузырчатка, пузырный пемфигоид, симпатическия офталмия, рассеянный склероз, аутоиммунная гемолитическая анемия, идиопатическая тромбоцитопеническая пурпура, ревматическая атака, волчаночный гепатит, первичный билиарный цирроз, болезнь Бекчета, синдром CREST, тому подобное) и панкреатит; остеопороз и катаракты.
Далее изобретение относится к лекарственным средствам, содержащим в качестве активного компонента новые производные амидокарбоновой кислоты, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры.
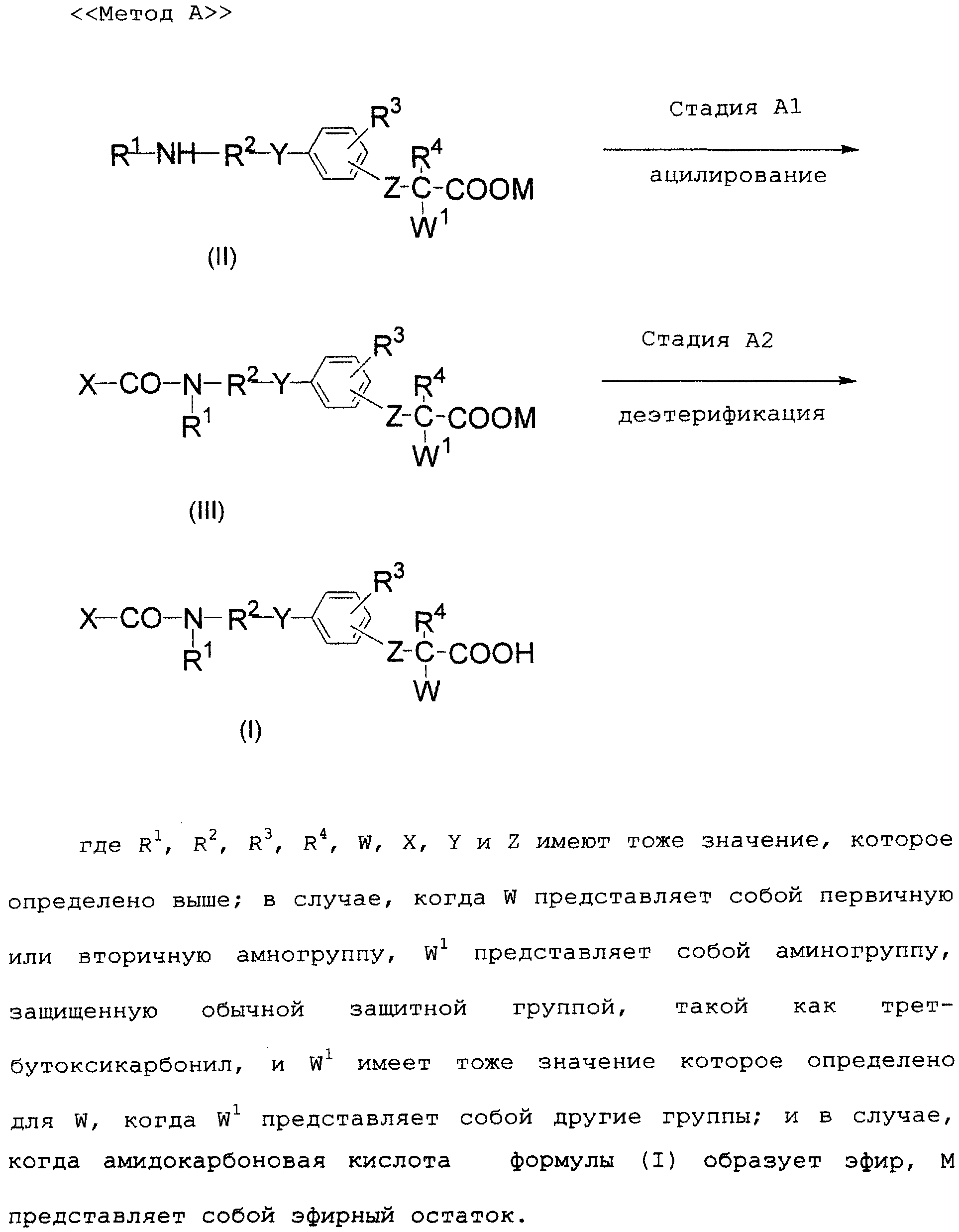
Изобретение относится к производному
амидокарбоновой кислоты формулы (I):

его фармакологически приемлемой соли или его фармакологически приемлемому эфиру.
В формуле
R1 представляет собой атом водорода, прямую или разветвленную алкильную
группу, содержащую от 1 до 6 атомов углерода
или аралкильную группу, включающую от 7 до 12 атомов углерода;
R2 представляет собой прямую или разветвленную алкиленовую группу,
включающую от 1 до 6 атомов углерода;
R3 представляет собой (i) атом водорода, (ii) прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (iii) прямую
или разветвленную алкоксигруппу, включающую от 1
до 4 атомов углерода, (iv) прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, (v) атом галогена, (vi) нитрогруппу, (vii)
прямую или разветвленную диалкиламиногруппу, в
которой каждая алкильная группа может быть одинаковой или различной и каждая включает от 1 до 4 атомов углерода, (viii) арильную группу, включающую от 6
до 10 атомов углерода, которая может иметь от 1
до 5 заместителей α, описанных далее, (ix) аралкильную группу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 5
заместителей α, описанных далее, на арильной
группе, (х) гидроксильную группу или (xi) прямую или разветвленную алифатическую ацильную группу, включающую от 1 до 5 атомов углерода;
R4 представляет собой атом водорода или
прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода;
Z представляет собой прямую или разветвленную алкиленовую
группу, включающую от 1 до 6 атомов углерода;
W представляет собой (i) прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) гидроксильную группу, (iii) прямую
или разветвленную алкоксигруппу, включающую от 1
до 4 атомов углерода, (iv) прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, (v) арильную группу, включающую от 6 до 10
атомов углерода, которая может иметь от 1 до 5
заместителей α, описанных далее, (vi) арилоксигруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей
α, описанных далее, на арильной группе, (vii)
арилтиогруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей α, описанных далее, на арильной группе,
(viii) аралкильную группу, включающую от 7 до 12
атомов углерода, которая может содержать от 1 до 5 заместителей α, описанных далее, на арильной группе, (ix) аралкилоксигруппу, включающую от
7 до 12 атомов углерода, которая может содержать от
1 до 5 заместителей α, описанных далее, на арильной группе, (х) аралкилтиогруппу, включающую от 7 до 12 атомов углерода, которая может
содержать от 1 до 5 заместителей α, описанных далее,
на арильной группе, (xi) арилоксиалкильную группу, арильная группа которой содержит от 6 до 10 атомов углерода, которая может иметь от 1 до
5 заместителей α, описанных далее, и алкильную
группу с прямой или разветвленной алкильной цепью, включающую от 1 до 4 атомов углерода, (xii) моно- или дициклическую 5-10-членную
гетероарильную группу, содержащую от 1 до 4 гетероатомов, выбранных
из группы, включающей атом кислорода, атом азота и атом серы, (xiii) моно- или дициклическую 5-10-членную гетероарилоксигруппу,
содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом
кислорода, атом азота и атом серы, (xiv) моно- или дициклическую 5-10-членную гетероарилтиогруппу, содержащую от 1 до 4
гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом
серы, (xv) моно- или дициклическую 5-10 членную насыщенную гетероциклическую группу, содержащую от 1 до 4 гетероатомов,
выбранных из группы, включающей атом кислорода, атом азота и атом серы, (xvi)
аминогруппу, (xvii) прямую или разветвленную моноалкиламиногруппу, в которой алкильная группа имеет от 1 до 4 атомов
углерода, (xviii) прямую или разветвленную диалкиламиногруппу, в которой каждая
алкильная группа может быть одинаковой или различной и каждая имеет от 1 до 4 атомов углерода, (xix)
N-алкил-N-ариламиногруппу, включающую прямую или разветвленную алкильную группу, содержащую от 1 до
4 атомов углерода, и арильную группу, содержащую от 6 до 10 атомов углерода, которая может иметь от
1 до 5 заместителей α, (хх) ариламиногруппу, включающую от 6 до 10 атомов углерода, которая
может содержать от 1 до 5 заместителей α, описанных далее, на арильной группе, (xxi)
аралкиламиногруппу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 5 заместителей
α, описанных далее, на арильной группе или (xxii) аралкилоксикарбониламиногруппу,
включающую аралкильную группу, содержащую от 7 до 12 атомов углерода, которая может иметь от 1 до 5
заместителей α, описанных далее, на арильной группе;
Х представляет собой арильную
группу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α
, описанных далее, или моно- или дициклическую 5-10-членную гетероарильную группу, включающую от
1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая
может содержать от 1 до 3 заместителей α, описанных далее, когда W представляет собой (1)
прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (2) гидроксильную
группу, (3) прямую или разветвленную алкоксильную группу, включающую от 1 до 4 атомов углерода, (4)
прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, (5) арильную группу,
включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей α,
описанных далее, (6) арилоксигруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1
до 5 заместителей α, описанных далее, на арильной группе, (7) арилтиогруппу, включающую
от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей α, описанных далее, на
арильной группе, (8) аралкильную группу, включающую от 7 до 12 атомов углерода, которая может
содержать от 1 до 5 заместителей α, описанных далее, на арильной группе, (9) аралкилоксигруппу,
включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 5 заместителей α,
описанных далее, на арильной группе, (10) аралкилтиогруппу, включающую от 7 до 12 атомов углерода,
которая может содержать от 1 до 5 заместителей α, описанных далее, на арильной группе, (11)
арилоксиалкильную группу, в которой арильная группа является арильной группой, включающей от 6 до 10
атомов углерода, которая может содержать от 1 до 5 заместителей α, описанных далее, и
алкильная группа является прямой или разветвленной алкильной группой, включающей от 1 до 4 атомов углерода,
(12) моно- или дициклическую 5-10-членную гетероарильную группу, содержащую от 1 до 4
гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, (13) моно- или дициклическую
5-10-членную гетероарилоксильную группу, содержащую от 1 до 4 гетероатомов,
выбранных из группы, включающей атом кислорода, атом азота и атом серы, (14) моно- или дициклическую 5-10-членную
гетероарилтиогруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы,
включающей атом кислорода, атом азота и атом серы или (15) моно- или дициклическую 5-10-членную насыщенную
гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей
атом кислорода, атом азота и атом серы, или
Х представляет собой арильную группу, включающую от 6
до 10 атомов углерода, которая может иметь от 1 до 3 заместителей α, описанных далее,
когда W представляет собой (1) аминогруппу, (2) прямую или разветвленную моноалкиламиногруппу, в которой
алкильная группа включает от 1 до 4 атомов углерода, (3) прямую или разветвленную
диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной и каждая включает от 1 до 4
атомов углерода, (4) N-алкил-N-ариламиногруппу, включающую прямую или
разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, и арильную группу, включающую от 6 до 10 атомов углерода,
которая может иметь от 1 до 5 заместителей α, (5)
ариламиногруппу, включающую от 6 до 10 атомов углерода, которая может иметь от 1 до 5 заместителей α, описанных далее, на арильной
группе, (6) аралкиламиногруппу, включающую от 7 до 12 атомов
углерода, которая может иметь от 1 до 5 заместителей α, описанных далее, на арильной группе или (7) аралкилоксикарбониламиногруппу,
включающую аралкильную группу, состоящую из от 7 до 12
атомов углерода, которая может иметь от 1 до 5 заместителей α, описанных далее, на арильной группе.
Вышеуказанный заместитель α редставляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, (iii) гидроксилгруппу, (iv) прямую или разветвленную алифатическую ацилоксигруппу, включающую от 1 до 5 атомов углерода, (v) прямую или разветвленную алифатическую ацильную группу, включающую от 1 до 5 атомов углерода, (vi) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (vii) прямую или разветвленную галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (viii) прямую или разветвленную алкилендиоксигруппу, включающую от 1 до 4 атомов углерода, (ix) аралкилоксигруппу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей β, описанных далее, (х) прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, (xi) прямую или разветвленную алкилсульфонилгруппу, включающую от 1 до 4 атомов углерода, (xii) атом галогена, (xiii) нитрогруппу, (xiv) цианогруппу, (xv) аминогруппу, (xvi) прямую или разветвленную моноалкиламиногруппу, в которой алкильная группа имеет от 1 до 4 атомов углерода, (xvii) прямую или разветвленную алкоксикарбониламиногруппу, в которой алкоксигруппа имеет от 1 до 4 атомов углерода, (xiii) аралкилоксикарбониламиногруппу, в которой аралкильная группа имеет от 7 до 12 атомов углерода, (xix) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной и каждая включает от 1 до 4 атомов углерода, (xx) аралкильную группу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей β, описанных далее, на арильной группе, (xxi) арильную группу, включающую от 6 до 10 атомов углерода и которая может содержать от 1 до 3 заместителей β, которые могут быть одинаковыми или различными, описанные далее, (xxii) арилоксигруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей β, описанных далее, на арильной группе, (xxiii) арилтиогруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей β, описанных далее, на арильной группе, (xxiv) арилсульфонильную группу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей β, описанных далее, на арильной группе, (xxv) арилсульфониламиногруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей β, описанных далее, на арильной группе (атом азота аминогруппы может быть замещен прямой или разветвленной алкильной группой, включающей от 1 до 6 атомов углерода), (xxvi) моно- или дициклическую 5-10-членную гетероарильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей β, описанных далее, (xxvii) моно- или дициклическую 5-10-членную гетероарилоксигруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей β, описанных далее, (xxviii) моно- или дициклическую 5-10-членную гетероарилтиогруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей β, описанных далее, (xxix) моно- или дициклическую 5-10-членную гетероарилсульфонильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей β, описанных далее, (xxx) моно- или дициклическую 5-10-членную гетероарилсульфониламиногруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей β, описанных далее, на гетероарильной группе (атом азота аминогруппы может быть замещен прямой или разветвленной цепью алкильных групп, включающих от 1 до 6 атомов углерода) и (xxxi) моно- или дициклическую 5-10- членную насыщенную гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы.
Вышеуказанный заместитель β представляет собой (i) прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую или
разветвленную галогенированную алкильную
группу, включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода,
(v) прямую или разветвленную
галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (vi) прямую или разветвленную алкилендиоксигруппу, включающую от 1 до 4 атомов углерода, (vii) прямую
или разветвленную
гидроксиалкильную группу, включающую от 1 до 4 атомов углерода, (viii) прямую или разветвленную алифатическую ацильную группу, включающую от 1 до 5 атомов углерода, (ix) атом
галогена, (х)
нитрогруппу, (xi) цианогруппу, (xii) карбоксильную группу, (xiii) аминогруппу, (xiv) прямую или разветвленную моноалкиламиногруппу, в которой алкильная группа имеет от 1 до 4 атомов
углерода, (xv)
прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной и каждая имеет от 1 до 4 атомов углерода, (xvi) прямую или
разветвленную
аминоалкильную группу, включающую от 1 до 4 атомов углерода, (xvii) моноалкиламиноалкильную группу, в которой моноалкиламиногруппа включает одну прямую или разветвленную алкильную группу,
включающую
от 1 до 4 атомов углерода, и алкильная группа представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, (xviii) диалкиламиноалкильную группу, в
которой
диалкиламиногруппа имеет две прямые или разветвленные алкильные группы, которые могут быть одинаковыми или различными и каждая имеет от 1 до 4 атомов углерода, и алкильная группа представляет
собой
прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, (xix) прямую или разветвленную алкоксикарбониламиногруппу, в которой алкокси группа имеет от 1 до 4 атомов
углерода
или (xx) аралкилоксикарбониламиногруппу, в которой аралкильная группа имеет от 7 до 12 атомов углерода; и
Y представляет собой одинарную связь, атом кислорода, атом серы или группу
формулы:
>N-R5 (где R5 представляет собой атом водорода, прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, прямую или разветвленную
алифатическую
ацильную группу, включающую от 1 до 8 атомов углерода или ароматическую ацильную группу, включающую от 7 до 11 атомов углерода).
В случае, когда R1, R3, R4, R5 или W представляют прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, алкильная группа включает в себя, например, группу метила, этила, пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, 1-метилбутила, 2-метилбутила, 3-метилбутила, 1,1-диметилпропила, 1,2-диметилпропила, 2,2-диметилпропила, 1-этилпропила, гексила, 1- метилпентила, 2-метилпентила, 3-метилпентила, 4-метилпентила, 1,1- диметилбутила, 1,2-диметилбутила, 1,3-диметилбутила, 2,2- диметилбутила, 2,3-диметилбутила, 3,3-диметилбутила, 1-этилбутила, 2-этилбутила, 1,1,2-триметилпропила или 1,2,2-триметилпропила; предпочтительно каждый R1, R3, R4 и R5 представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, и W представляет собой прямую или разветвленную алкильную группу, включающую от 2 до 6 атомов углерода; более предпочтительно, каждый R1, R3, R4 и R5 представляет собой группу метила, этила, пропила, изопропила, бутила или изобутила, и W представляет собой группу этила, пропила, изопропила, бутила, изобутила или пентила. Еще более предпочтительно, каждый R1 и R5 представляет собой алкильную группу, включающую один или два атома углерода (в частности, группу метила), R3 представляет собой группу метила, этила или изопропила (в частности, группу метила или изопропила), R4 представляет собой алкильную группу, включающую один или два атома углерода (в частности, группу метила), и W представляет собой группу пропила, бутила или пентила (в частности группу пропила или бутила).
В случае, когда R1 представляет собой аралкильную группу, включающую от 7 до 12 атомов углерода, аралкильная группа представляет собой группу, в которой прямая или разветвленная алкильная группа, включающая от 1 до 4 атомов углерода, является замещенной арильной группой и включает в себя, например, группу бензила, фенетила, 3-фенилпропила, 4-фенилбутила, 5-фенилпентила, 6-фенилгексила, 1-нафтилметила или 2-нафтилметила, предпочтительна группа бензила, фенетила или 3-фенилпропила, более предпочтительна группа 3-фенилпропила.
В случае, когда R2 или Z представляют собой прямую или разветвленную алкиленовую группу, включающую от 1 до 6 атомов углерода, алкиленовая группа включает в себя, например, группу метилена, этилена, метилэтилена, этилэтилена, 1,1- диметилэтилена, 1, 2-диметилэтилена, триметилена, 1- метилтриметилена, 1-этилтриметилена, 2-метилтриметилена, 1,1-диметилтриметилена, тетраметилена, пентаметилена или гексаметилена, предпочтителен R2, представляющий собой прямую или разветвленную алкиленовую группу, включающую от 2 до 5 атомов углерода, более предпочтителен R2, представляющий собой прямую или разветвленную алкиленовую группу, включающую от 2 до 4 атомов углерода, еще более предпочтителен R2, представляющий собой группу этилена, триметилена или метилэтилена, более предпочтителен R2, представляющий собой группу этилена. Предпочтительно, Z представляет собой прямую или разветвленную алкиленовую группу, включающую от 1 до 4 атомов углерода (например, группа метилена, этилена, метилэтилена, этилэтилена, триметилена, 1- метилтриметилена или 2-метилтриметилена), более предпочтительна алкиленовая группа, имеющая один или два атома углерода, еще более предпочтительна группа метилена.
В случае, когда R3 или W представляет собой прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, алкоксигруппа включает в себя, например, группу метокси, этокси, пропокси, изопропокси, бутокси, втор-бутокси, трет-бутокси или изобутокси; предпочтителен R3, представляющий собой алкоксигруппу, включающую от 1 до 3 атомов углерода (в частности, группа метокси, этокси или изопропокси); более предпочтительна алкоксигруппа, включающая один или два атома углерода (в частности, метоксигруппа). Предпочтительно W представляет собой алкоксигруппу, включающую от 1 до 3 атомов углерода, более предпочтительна этоксигруппа.
В случае, когда R3 или W представляет собой прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, алкилтиогруппа включает в себя, например, группу метилтио, этилтио, пропилтио, изопропилтио, бутилтио, втор-бутилтио, трет-бутилтио или изобутилтио; предпочтителен R3, представляющий собой алкилтиогруппу, включающую один или два атома углерода; более предпочтительна метилтиогруппа. Предпочтительно W представляет алкилтиогруппу, включающую от 1 до 3 атомов углерода (например, группа метилтио, этилтио, пропилтио или изопропилтио); более предпочтительна метилтиогруппа.
В случае, когда R3 представляет собой атом галогена, атом галогена включает в себя атом фтора, атом хлора, атом брома или атом йода; предпочтителен атом фтора, атом хлора или атом брома; более предпочтителен атом фтора или атом хлора.
В случае, когда R3 или W представляет собой прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной и каждая имеет от 1 до 4 атомов углерода, диалкиламиногруппа включает в себя, например, группу диметиламино, диэтиламино, дипропиламино, диизопропиламино, дибутиламино, N-метил-N-этиламино или N-этил-N-изопропиламино; предпочтительна группа диметиламино или диэтиламино; более предпочтительна группа диэтиламино.
В случае, когда R3 или W представляет собой арильную группу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей α, описанных далее, незамещенная арильная группа включает в себя, например, группу фенила или нафтила, предпочтительна группа фенила. Замещенная арильная группа включает в себя, например, группу метилфенила, этилфенила, пропилфенила, изопропилфенила, трифторметилфенила, гидроксифенила, ацетилфенила, метоксифенила, метилендиоксифенила, бензилоксифенила, метилтиофенила, метансульфонилфенила, фторфенила, дифторфенила, хлорфенила, дихлорфенила, нитрофенила, (диметиламино)фенила, бензилфенила, бифенилила, феноксифенила, фенилтиофенила, фенилсульфонилфенила, (фенилсульфониламино)фенила, пиридилфенила, пиридилоксифенила, пиридилтиофенила, (пиридилсульфониламино)фенила, метилнафтила, трифторнафтила, гидроксинафтила, метоксинафтила, фторнафтила, хлорнафтила или пиридилнафтила; предпочтительна арильная группа, включающая от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α, описанных далее; более предпочтительна группа метилфенила, этилфенила, изопропилфенила, метоксифенила, метилтиофенила или хлорфенила.
В случае, когда R3 или W представляет собой аралкильную группу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 5 заместителей α, описанных далее, на арильной группе, аралкильная группа представляет собой группу, в которой прямая или разветвленная алкильная группа, включающая от 1 до 4 атомов углерода, замещена вышеуказанной арильной группой и включает в себя, например, группу бензила, фенетила, 3-фенилпропила, 4-фенилбутила, 5-фенилпентила, 6-фенилгексила, нафтилметила, метилбензила, трифторметилбензила, метоксибензила, метилендиоксибензила, метилтиобензила, метансульфонилбензила, фторбензила, хлорбензила, 2-(метилфенил) этила, 2-(метоксифенил)этила, 3-метилфенил)пропила, 3-(метоксифенил)пропила, 4-(метилфенил)бутила или 4-(метоксифенил)бутила; предпочтителен R3, представляющий собой группу бензила или фенетила; более предпочтительна группа бензила. Предпочтителен W, представляющий собой аралкильную группу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей α, описанных далее, на арильной группе; более предпочтительна аралкильная группа, включающая от 7 до 10 атомов углерода (например, группа бензила, фенетила, 3-фенилпропила или 4-фенилбутила); наиболее предпочтительна группа 3-фенилпропила или 4-фенилбутила (в частности, группа 3-фенилпропила).
В случае, когда R3 представляет собой прямую или разветвленную алифатическую ацильную группу, включающую от 1 до 5 атомов углерода, алифатическая ацильная группа включает в себя, например, группу формила, ацетила, пропионила, бутирила, изобутирила, пентаноила или пивалоила, предпочтительна группа формила, ацетила или пивалоила; наиболее предпочтительна группа формила или ацетила.
В случае, когда W представляет собой арилоксигруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей α, описанных далее, на арильной группе, незамещенная арилоксигруппа включает в себя, например, группу фенокси или нафтилокси; предпочтительна феноксигруппа.
Замещенная арилоксигруппа включает в себя, например, группу метилфенокси, этилфенокси, пропилфенокси, изопропилфенокси, трет-бутилфенокси, трифторметилфенокси, метоксифенокси, этоксифенокси, изопропоксифенокси, трифторметоксифенокси, метилтиофенокси, этилтиофенокси, цианофенокси, формилфенокси, фторфенокси, дифторфенокси, трифторфенокси, пентафторфенокси, хлорфенокси, дихлорфенокси, трихлорфенокси, пиридилфенокси, бифенилилокси, метансульфонилфенокси, метилнафтилокси, этилнафтилокси, пропилнафтилокси, изопропилнафтилокси, трет-бутилнафтилокси, трифторметилнафтилокси, метоксинафтилокси, этоксинафтилокси, изопропоксинафтилокси, трифторметоксинафтилокси, метилтионафтилокси, этилтионафтилокси, цианонафтилокси, формилнафтилокси, фторнафтилокси, дифторнафтилокси, трифторнафтилокси, пентафторнафтилокси, хлорнафтилокси, дихлорнафтилокси, трихлорнафтилокси, пиридилнафтилокси, бифенилилокси или метансульфонилнафтилокси; предпочтительна арилоксигруппа, включающая от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α, описанных далее, на арильной группе; более предпочтительна феноксигруппа, которая может содержать от 1 до 3 заместителей α, описанных далее, на фенильной группе (в частности феноксигруппа, которая может иметь один заместитель α, описанный далее, на фенильной группе); более предпочтительна метилфенокси, этилфенокси, изопропилфенокси, трет-бутилфенокси, трифторметилфенокси, метоксифенокси, этоксифенокси, трифторметоксифенокси, цианофенокси, формилфенокси, фторфенокси, дифторфенокси, трифторфенокси, пентафторфенокси, хлорфенокси, дихлорфенокси, трихлорфенокси, пиридилфенокси или метансульфонилфенокси; еще более предпочтительна группа метилфенокси, этилфенокси, изопропилфенокси, трет-бутилфенокси, трифторметилфенокси, метоксифенокси, этоксифенокси, трифторметоксифенокси, цианофенокси, формилфенокси, фторфенокси, дифторфенокси, трифторфенокси, пентафторфенокси, хлорфенокси, дихлорфенокси, трихлорфенокси или метансульфонилфенокси; в частности более предпочтительна группа 4-метилфенокси, 4-изопропилфенокси, 4-трет-бутилфенокси, 4-метоксифенокси, 4-трифторметоксифенокси, 3-фторфенокси, 4-фторфенокси или 4-хлорфенокси.
В случае, когда W представляет собой арилтиогруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей α, описанных далее, на арильной группе, незамещенная арилтиогруппа включает в себя, например, группу фенилтио или нафтилтио; предпочтительна фенилтиогруппа. Замещенная арилтиогруппа включает в себя, например, группу метилфенилтио, этилфенилтио, пропилфенилтио, изопропилфенилтио, метоксифенилтио, этоксифенилтио, метилтиофенилтио, этилтиофенилтио, бифенилилтио, 4-метансульфонилфенилтио, метилнафтилтио, этилнафтилтио, пропилнафтилтио, изопропилнафтилтио, метоксинафтилтио, этоксинафтилтио, метилтионафтилтио, этилтионафтилтио или 4-метансульфонилнафтилтио; предпочтительна арилтиогруппа, включающая от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α, описанных далее; более предпочтительна фенилтиогруппа, которая может содержать от 1 до 3 заместителей α, описанных далее, на фенильной группе; наиболее предпочтительна группа метилфенилтио, изопропилфенилтио или метоксифенилтио.
В случае, когда W представляет собой аралкилоксигруппу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 5 заместителей α, описанных далее, на арильной группе, незамещенная аралкилоксигруппа представляет собой группу, в которой прямая или разветвленная алкилоксигруппа, включающая от 1 до 4 атомов углерода, замещена вышеуказанной арильной группой и включает в себя, например, группу бензилокси, фенетилокси, 3-фенилпропилокси, 4-фенилбутилокси, 1-нафтилметилокси или 2- нафтилметилокси; предпочтительна аралкилоксигруппа, включающая от 7 до 10 атомов углерода; более предпочтительна группа бензилокси или фенетилокси (в частности, группа бензилокси). Замещенная аралкилоксигруппа включает в себя, например, группу метилбензилокси, метоксибензилокси, 2-(метилфенил)этокси, 2- (метоксифенил)этокси, 3-(метилфенил)пропокси, 3- (метоксифенил)пропокси, 4-(метилфенил)бутокси или 4-(метоксифенил)бутокси; предпочтительна аралкилоксигруппа, включающая от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей α, описанных далее, на арильной группе; более предпочтительна группа метилбензилокси или 2-(метилфенил)этокси.
В случае, когда W представляет собой аралкилтиогруппу, включающую от 7 до 12 атомов углерода в арильной группе, которая может содержать от 1 до 5 заместителей α, описанных далее, незамещенная аралкилтиогруппа представляет собой группу, в которой прямая или разветвленная алкилтиогруппа, включающая от 1 до 4 атомов углерода, замещена вышеуказанной арильной группой и включает в себя, например, группу бензилтио, фенетилтио, 3-фенилпропилтио, 4-фенилбутилтио, 1-нафтилметилтио или 2-нафтилметилтио; предпочтительна группа бензилтио или фенетилтио; более предпочтительна бензилтиогруппа. Замещенная аралкилтиогруппа включает в себя, например, группу метилбензилтио, метоксибензилтио, 2-(метилфенил)этилтио, 2-(метоксифенил)этилтио, 3-(метилфенил)пропилтио, 3-(метоксифенил)пропилтио, 4-(метилфенил)бутилтио или 4-(метоксифенил)бутилтио; предпочтительна аралкилтиогруппа, включающая от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей α, описанных далее, на арильной группе; более предпочтительна группа метилбензилтио или 2-(метилфенил) этилтио.
В случае, когда W представляет собой арилоксиалкильную группу, в которой арильная группа представляет собой арильную группу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей α, описанных далее, и алкильная группа представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, арилоксиалкильная группа включает в себя, например, группу феноксиметила, 2-феноксиэтила, 3-феноксипропила, 4-феноксибутила, нафтилоксиметила, 2-нафтилоксиэтила, 3-нафтилоксипропила или 4-нафтилоксибутила; предпочтительна арилоксиалкильная группа в которой арильная группа представляет собой арильную группу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α, описанных далее, и алкильная группа представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода; более предпочтительна арилоксиалкильная группа, в которой арильная группа имеет от 6 до 10 атомов углерода, и алкильная группа является прямой или разветвленной и имеет от 1 до 4 атомов углерода; еще более предпочтительна группа феноксиметила, 2-феноксиэтила, 3-феноксипропила или 4-феноксибутила; и наиболее предпочтительна группа 2-феноксиэтила или 3-феноксипропила (в частности, группа 2- феноксиэтила).
В случае, когда W представляет собой моно- или дициклическую 5-10-членную гетероарильную группу, содержащую 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, гетероарильная группа включает в себя, например, группу фурила, тиенила, пирролила, азепинила, пиразолила, имидазолила, оксазолила, изоксазолила, тиазолила, изотиазолила, 1,2,3-оксадиазолила, триазолила, тетразолила, тиадиазолила, пиранила, пиридила, пиридазинила, пиримидинила, пиразинила, хинолила или бензоксазолила; предпочтительна группа пирролила, имидазолила, фурила, тиенила или пиридила; более предпочтительна группа пирролила или имидазолила.
В случае, когда W представляет собой моно- или дициклическую 5-10-членную гетероарилоксигруппу, содержащую 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, гетероарилоксигруппа включает в себя, например, группу фурилокси, тиенилокси, пирролилокси, азепинилокси, пиразолилокси, имидазолилокси, оксазолилокси, изоксазолилокси, тиазолилокси, изотиазолилокси, 1,2,3-оксадиазолилокси, триазолилокси, тетразолилокси, тиадиазолилокси, пиранилокси, пиридилокси, пиридазинилокси, пиримидинилокси, пиразинилокси или бензоксазолилокси; предпочтительна группа фурилокси, тиенилокси, пирролилокси, имидазолилокси, тиазолилокси или пиридилокси; более предпочтительна пиридилоксигруппа.
В случае, когда W представляет собой моно- или дициклическую 5-10-членную гетероарилтиогруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, гетероарилтиогруппа включает в себя, например, группу фурилтио, тиенилтио, пирролилтио, азепинилтио, пиразолилтио, имидазолилтио, оксазолилтио, изоксазолилтио, тиазолилтио, изотиазолилтио, 1,2,3- оксадиазолилтио, триазолилтио, тетразолилтио, тиадиазолилтио, пиранилтио, пиридилтио, пирилазинилтио, пиримидинилтио, пиразинилтио или бензоксазолилтио; предпочтительна группа фурилтио, тиенилтио, пирролилтио, имидазолилтио, тиазолилтио, пиридилтио или бензоксазолилтио; более предпочтительна группа бензоксазолилтио.
В случае, когда W представляет собой моно- или дициклическую 5-10-членную насыщенную гетероциклическую группу, содержащую 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, насыщенная гетероциклическая группа включает в себя, например, группу морфолинила, тиоморфолинила, пирролидинила, пирролинила, имидазолидинила, имидазолинила, пиразолидинила, пиразолинила, пиперидила или пиперазинила; предпочтительна группа морфолинила, тиоморфолинила, пирролидинила, имидазолинила, пиперидила или пиперазинила.
В случае, когда W представляет собой прямую или разветвленную моноалкиламиногруппу, в которой алкильная группа включает от 1 до 4 атомов углерода, моноалкиламиногруппа включает в себя, например, группу метиламино, этиламино, пропиламино, изопропиламино, бутиламино, втор-бутиламино, трет-бутиламино или изобутиламино; предпочтительна прямая или разветвленная моноалкиламиногруппа, включающая от 1 до 3 атомов углерода; более предпочтительна пропиламиногруппа.
В случае, когда W представляет собой N-алкил-N-ариламиногруппу, включающую прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, и арильную группу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей α, описанных далее, алкильная группа незамещенной N-алкил-N-ариламиногруппы включает в себя, например, группу метила, этила, пропила, изопропила, бутила, изобутила, втор-бутила или трет-бутила; предпочтительна группа метила, этила, пропила, изопропила, бутила или изобутила; более предпочтительна группа метила или этила. Арильная группа включает в себя, например, группу фенила или нафтила; предпочтительна группа фенила. Конкретные примеры незамещенной N-алкил-N-ариламиногруппы включают в себя, например, группу N-метил-N-фениламино, N-этил-N-фениламино, N-пропил-N-фениламино, N-изопропил-N-фениламино, N-бутил-N-фениламино, N-изобутил-N-фениламино или N-мeтил-N-нaфтилaминo; предпочтительна группа N-мeтил-N-фeнилaминo или N-этил-N-фeнилaминo; более предпочтительна группа N-этил-N-фениламино. Замещенная N-алкил-N-ариламиногруппа включает в себя, например, группу N-метил-N-(метилфенил)амино, N- этил-N-(мeтилфeнил)aминo, N-метил-N-(метоксифенил)амино или N-этил-N-(мeтoкcифeнил)aминo; предпочтительна N-метил-N-(метилфенил)аминогруппа или N-этил-N-(метилфенил) аминогруппа.
В случае, когда W представляет собой ариламиногруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей α, описанных далее, на арильной группе, незамещенная ариламиногруппа включает в себя, например, группу фениламино или нафтиламино; предпочтительна фениламиногруппа. Замещенная ариламиногруппа включает в себя, например, группу (метилфенил)амино, (этилфенил)амино, (пропилфенил)амино, (изопропилфенил)амино, (метоксифенил)амино, (этоксифенил)амино, (метилтиофенил)-амино, (этилтиофенил)амино, бифенилиламино или (метансульфонилфенил)амино; предпочтительна (метилфенил)аминогруппа, (изопропилфенил)аминогруппа или (метоксифенил)аминогруппа.
В случае, когда W представляет собой аралкиламиногруппу, включающую от 7 до 12 атомов углерода в аралкильной группе, в которой арильная группа может содержать от 1 до 5 заместителей α, описанных далее, незамещенная аралкиламиногруппа представляет собой группу, в которой прямая или разветвленная алкиламиногруппа, включающая от 1 до 4 атомов углерода, замещена вышеуказанной арильной группой и включает в себя, например, группу бензиламино, фенетиламино, (3-фенилпропил)амино, (4-фенилбутил)амино, (1-нафтилметил)амино или (2-нафтилметил)амино; предпочтительна бензиламиногруппа или фенетиламиногруппа; более предпочтительна бензиламиногруппа. Замещенная аралкиламиногруппа включает в себя, например, группу (метилбензил)амино, (метоксибензил)амино, [2-(метилфенил)-этил] амино, [2- (метоксифенил)этил] амино, [3-(метилфенил)-пропил] амино, [3-(метоксифенил)пропил]амино, [4-(метилфенил)-бутил] амино или [4--(метоксифенил)бутил]амино; предпочтительна (метилбензил)аминогруппа или [2-(метилфенил)этил] аминогруппа.
В случае, когда W представляет собой аралкилоксикарбониламиногруппу, содержащую аралкильную группу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 5 заместителей α, описанных далее, на арильной группе, группа включает в себя, например, бензилоксикарбонильную группу.
В случае, когда W представляет собой аминогруппу, прямую или разветвленную моноалкиламиногруппу, в которой алкильная группа включает от 1 до 4 атомов углерода, прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной и каждая имеет от 1 до 4 атомов углерода, N-алкил-N-ариламиногруппу, содержащую прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода и арильную группу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей α, описанных далее, ариламиногруппу, включающую от 6 до 10 атомов углерода в арильной группе, которая может содержать от 1 до 5 заместителей α, описанных далее, или аралкиламиногруппу, включающую от 7 до 12 атомов углерода в аралкильной группе, в которой арильная группа может содержать от 1 до 5 заместителей α, описанных далее, предпочтительно W представляет собой: аминогруппу; прямую или разветвленную моноалкиламиногруппу, в которой алкильная группа имеет от 1 до 4 атомов углерода; прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной и каждая имеет от 1 до 4 атомов углерода; N-алкил-N-ариламиногруппу, содержащую прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, и арильную группу, включающую от 6 до 10 атомов углерода, которая может включать от 1 до 5 заместителей α; или ариламиногруппу, включающую от 6 до 10 атомов углерода в арильной группе, которая может содержать от 1 до 5 заместителей α описанных далее.
В случае, когда R5 представляет собой прямую или разветвленную алифатическую ацильную группу, включающую от 1 до 8 атомов углерода, или ароматическую ацильную группу, включающую от 7 до 11 атомов углерода, ацильная группа включает в себя, например, группу формила, ацетила, пропионила, бутирила, пентаноила, гексаноила, гептаноилоктаноила, бензоила или п-толуоила; предпочтительна прямая или разветвленная алифатическая ацильная группа, включающая от 1 до 8 атомов углерода; более предпочтительна прямая или разветвленная алифатическая ацильная группа, включающая от 2 до 5 атомов углерода; наиболее предпочтительна ацетильная группа.
В случае, когда Х представляет собой арильную группу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α, описанных далее, незамещенная арильная группа включает в себя, например, группу фенила или нафтила, предпочтительна фенильная группа.
В случае, когда Х представляет собой арильную группу, которая замещена от 1 до 3 заместителями α, описанными далее, предпочтительным числом заместителей является один или два, более предпочтителен один.
В случае, когда Х представляет собой моно- или дициклическую 5-10-членную гетероарильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей α, описанных далее, незамещенная гетероарильная группа включает моноциклическую систему или дициклическую систему. В случае дициклической системы по меньшей мере одно кольцо представляет собой гетероциклическую группу. В случае дициклической системы два кольца являются конденсированными, когда одно кольцо представляет собой гетероцикл и другое является карбоциклом, или оба кольца являются гетероциклами. Гетероцикл представляет собой 5- или 6- членное кольцо и содержит от 1 до 4 гетероатомов, выбранных из группы, включающей атом азота, атом кислорода и атом серы. Карбоцикл представляет собой арильную группу, включающую от 6 до 10 атомов углерода. Моноциклическая система называется моноциклической гетероарильной группой, и дициклическая система называется конденсированной гетероарильной группой. В случае, когда кольцо содержит четыре гетероатома, все четыре гетероатома являются предпочтительно атомами азота и число гетероатомов, выбранных из группы, включающей атом кислорода и атом серы, равно нулю. В случае, когда кольцо содержит три гетероатома, предпочтительно три, два или один гетероатом являются атомами азота, и один или два гетероатома выбраны из группы, включающей атом кислорода и атом серы. В случае, когда кольцо содержит два гетероатома, предпочтительно чтобы два, один или ноль гетероатомов являлись атомами азота и ноль, один или два гетероатома, такие, как выбраны из группы, включающей атом кислорода и атом серы. В случае, когда Х представляет собой гетероарильную группу, замещенную от 1 до 3 заместителями α, описанными далее, число заместителей равно предпочтительно одному или двум, более предпочтительно одному.
Незамещенная моноциклическая гетероарильная группа включает в себя, например, группу пирролила, такую как группа 2-пирролила или 3-пирролила; группу фурила, такую как группа 2-фурила или 3-фурила; группу тиенила, такую как группа 2-тиенила или 3-тиенила; группу пиридила, такую как группа 2-пиридила, 3-пиридила или 4-пиридила; группу имидазолила, такую как группа 2-имидазолила или 4-имидазолила; группу пиразолила, такую как группа 3-пиразолила или 4-пиразолила; группу оксазолила, такую как группа 2-оксазолила, 4-оксазолила или 5-оксазолила; группу изоксазолила, такую как группа 3-изоксазолила, 4-изоксазолила или 5-изоксазолила; группу тиазолила, такую как группа 2-тиазолила, 4-тиазолила или 5-тиазолила; группу изотиазолила, такую как группа 3-изотиазолила, 4-изотиазолила или 5-изотиазолила; группу триазолила, такую как группа 1,2, 3-триазол-4-ила или 1,2,4-триазол-3-ила; группу тиадиазолила, такую как группа 1,3,4-тиадиазол-2-ила; группу оксадиазолила, такую как группа 1,3,4- оксадиазол-2-ила; группу тетразолила, такую как группа 5-тетразолила; группу пиридазинила, такую как группа 3-пиридазинила или 4-пиридазинила; группу пиримидинила, такую как группа 2-пиримидинила, 4-пиримидинила или 5-пиримидинила; группу пиразинила; группу оксазинила, такую как группа 1,4-оксазин-2-ила или 1,4-оксазин-3-ила; и группу тиазинила, такую как группа 1,4-тиазин-2-ила или 1,4-тиазин-3-ила; и незамещенная конденсированная гетероарильная группа, включает в себя, например, индолильную группу, такую как группа индол-2-ила, индол-3-ила, индол-4-ила, индол-5-ила, индол-6-ила или индол-7-ила; индазолильную группу, такую как группа индазол- 2-ила, индазол-3-ила, индазол-4-ила, индазол-5-ила, индазол-6-ила или индазол-7-ила; группу бензофуранила, такую как группа бензофуран-2-ила, бензофуран-3-ила, бензофуран-4-ила, бензофуран-5-ила, бензофуран-6-ила или бензофуран-7-ила; группу бензотиофенила, такую как группа бензотиофен-2-ила, бензотиофен-3-ила, бензотиофен-4-ила, бензотиофен-5-ила, бензотиофен-6-ила или бензотиофен-7-ила; группу бензимидазолила, такую как группа бензимидазол-2-ила, бензимидазол-4-ила, бензимидазол-5-ила, бензимидазол-6-ила или бензимидазол-7-ила; группу бензоксазолила, такую как группа бензоксазол-2-ила, бензоксазол-4-ила, бензоксазол-5-ила, бензоксазол-6-ила или бензоксазол-7-ила; группу бензотиазолила, такую как группа бензотиазол-2-ила, бензотиазол-4-ила, бензотиазол-5-ила, бензотиазол-6-ила или бензотиазол-7-ила; группу хинолила, такую как группа 2-хинолила, 3-хинолила, 4-хинолила, 5-хинолила, 6-хинолила, 7-хинолила или 8-хинолила; группу изохинолила, такую как группа 1-изохинолила, 3-изохинолила, 4-изохинолила или 8-изохинолила; группу бензоксазинила, такую как группа 1,4-бензоксазин-2-ила или 1,4-бензоксазин-3-ила; группу бензотиазинила, такую как группа 1, 4-бензотиазин-2-ила или 1,4-бензотиазин-3-ила; группу пирроло[2,3-b] пиридила, такую как группа пирроло[2,3-b]пирид-2-ила или пирроло[2,3-b]пирид-3-ила; группу фуро[2,3-b] пиридила, такую как группа фуро[2,3-b]пирид-2-ила или фуро[2,3-b]пирид-3-ила; группу тиено[2,3-b]пиридила, такую как группа тиено[2,3-b] пирид-2-ила или тиено[2,3-b]пирид-3-ила; группу нафтилидинила, такую как группа 1, 8-нафтилидин-2-ила, 1,8-нафтилидин-3-ила, 1,5-нафтилидин-2-ила и 1,5-нафтилидин-3-ила; группу имидазопиридила, такую как группа имидазо[4,5-b]пирид-2-ила или имидазо[4,5-b]пирид-5-ила; группу оксазолопиридила, такую как группа оксазоло[4,5-b]пирид-2-ила или оксазоло[5,4-b]пирид-2-ила; и группу тиазолопиридила, такую как группа тиазоло[4,5-b]пирид-2-ила или тиазоло [4,5-c]пирид-2-ила.
Моноциклическая гетероарильная группа представляет собой предпочтительно 5- или 6-членную кольцевую группу, включающую от 1 до 3 гетероатомов, выбранных из группы, включающей в себя атом азота, атом кислорода и атом серы, и включает в себя приведенную выше в качестве примера группу пирролила, группу фурила, группу тиенила, группу пиридила, группу имидазолила, группу пиразолила, группу оксазолила, группу изоксазолила, группу тиазолила, группу триазолила, группу тиадиазолила, группу оксадиазолила, группу пиридазинила, группу пиримидинила или группу пиразинила. Конденированная гетероарильная группа представляет собой предпочтительно конденсированную кольцевую группу бензольного кольца с 5- или 6-членной моноциклической гетероарильной группой, включающей от 1 до 3 гетероатомов, выбранных из группы, включающей атом азота, атом кислорода и атом серы, и включает в себя приведенную выше в качестве примера группу индолила, группу бензофуранила, группу бензотиофенила, группу бензимидазолила, группу бензоксазолила, группу бензотиазолила, группу хинолила или группу изохинолила; более предпочтительно группу имидазолила, группу оксазолила, группу пиридила, группу индолила, группу хинолила или группу изохинолила; еще более предпочтительно группу пиридила, группу индолила, группу хинолила или группу изохинолила; и наиболее предпочтительно группу пиридила, группу хинолила или группу изохинолила; в частности наиболее предпочтительна группа пиридила.
В случае, когда вышеуказанная группа Х представляет собой арильную группу, включающую от 6 до 10 атомов углерода, или моно- или дициклическую 5-10-членную гетероарильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, арильная группа и гетероарильная группа могут содержать от 1 до 3 заместителей α, как описано выше.
В случае, когда заместитель α представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, атом галогена, или прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной и каждая имеет от 1 до 4 атомов углерода, эти группы могут включать в себя группы, такие, как описано выше в определении R3. Однако в случае, когда заместитель α представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, алкильная группа предпочтительно включает в себя группу метила, этила, пропила, изопропила, бутила или трет- бутила, более предпочтительна группа метила, изопропила или трет-бутила.
В случае, когда заместитель α представляет собой аралкилоксикарбониламиногруппу, в которой аралкильная группа имеет от 7 до 12 атомов углерода, группа включает в себя, например, бензилоксикарбониламиногруппу.
В случае, когда заместитель α представляет собой прямую или разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, галогенированная алкильная группа включает в себя, например, группу хлорметила, бромметила, фторметила, йодметила, дифторметила, трифторметила, пентафторэтила, 2, 2,2-трифторэтила, 2,2,2-трихлорэтила или трихлорметила; предпочтительна группа фторметила, включающая от 1 до 3 атомов фтора; более предпочтительна группа трифторметила.
В случае, когда заместитель α представляет собой прямую или разветвленную алифатическую ацилоксигруппу, включающую от 1 до 5 атомов углерода, ацилоксигруппа включает в себя, например, группу формилокси, ацетокси, пропионилокси, бутирилокси, акроилокси, метакроилокси или кротоноилокси; предпочтительна группа алканоилокси, включающая от 1 до 4 атомов углерода; более предпочтительна группа алканоилокси, включающая один или два атома углерода; наиболее предпочтительна ацетоксигруппа.
В случае, когда заместитель α представляет собой прямую или разветвленную галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, галогенированная алкоксигруппа включает в себя, например, хлорметокси, бромметокси, фторметокси, йодметокси, дифторметокси, трифторметокси, пентафторэтокси, 2,2,2-трифторэтокси, 2, 2,2-трихлорэтокси, трихлорметокси или 2,2,3,3-тетрафторпропокси; предпочтительна прямая или разветвленная галогенированная алкоксигруппа, включающая от 1 до 3 атомов углерода; более предпочтительна метоксигруппа, включающая от 1 до 3 атома фтора или 2,2,3,3- тетрафторпропоксигруппа; наиболее предпочтительна группа трифторметокси или 2,2,3, 3-тетрафторпропокси (в частности, 2,2, 3, 3-тетрафторпропоксигруппа).
В случае, когда заместитель α представляет собой прямую или разветвленную алифатическую ацильную группу, включающую от 1 до 5 атомов углерода, ацильная группа включает в себя, например, группу формила, ацетила, пропионила, бутирила, акроила, метакроила или кротоноила; предпочтительна прямая или разветвленная алифатическая ацильная группа, включающая 2 или 3 атома углерода; более предпочтительна ацетильная группа.
В случае, когда заместитель α представляет собой прямую или разветвленную алкилендиоксигруппу, включающую от 1 до 4 атомов углерода, алкилендиоксигруппа включает в себя, например, группу метилендиокси, этилендиокси, триметилендиокси, тетраметилендиокси или пропилендиокси; предпочтительна группа метилендиокси или этилендиокси; более предпочтительна метилендиоксигруппа.
В случае, когда заместитель α представляет собой аралкилоксигруппу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей β, описанных далее, аралкилоксигруппа включает в себя, например, группу бензилокси, фенетилокси, 3-фенилпропокси, 4-фенилбутокси, 1-нафтилметокси или 2-нафтилметокси; предпочтительна незамещенная группа аралкилокси, включающая от 7 до 12 атомов углерода (например, группа бензилокси, 2-фенетилокси, 1-нафтилметокси или 2-нафтилметокси); более предпочтительна бензилоксигруппа.
В случае, когда заместитель α представляет собой прямую или разветвленную алкилсульфонильную группу, включающую от 1 до 4 атомов углерода, алкилсульфонильная группа включает в себя, например, группу метансульфонила, этансульфонила, пропансульфонила, изопропансульфонила, бутансульфонила, изобутансульфонила, втор-бутансульфонила или трет-бутансульфонила, предпочтительна группа метансульфонила, этансульфонила или изопропансульфонила; в частности предпочтительна алкилсульфонильная группа, включающая один или два атома углерода (в частности метансульфонильная группа).
В случае, когда заместитель α представляет собой прямую или разветвленную моноалкиламиногруппу, в которой алкильная группа имеет от 1 до 4 атомов углерода, моноалкиламиногруппа включает в себя, например, группу метиламино, этиламино, пропиламино, изопропиламино, бутиламино, изобутиламино, втор-бутиламино или трет-бутиламино; предпочтительна группа метиламино, этиламино, изопропиламино или трет-бутиламино; более предпочтительна метиламиногруппа.
В случае, когда заместитель α представляет собой прямую или разветвленную алкоксикарбониламиногруппу, в которой алкоксигруппа имеет от 1 до 4 атомов углерода, алкоксикарбониламиногруппа включает в себя, например, группу метоксикарбониламино, этоксикарбониламино или третбутоксикарбониламино; предпочтительна третбутоксикарбониламиногруппа.
В случае, когда заместитель α представляет собой аралкильную группу, включающую от 7 до 12 атомов углерода в арильной группе, которая может содержать от 1 до 3 заместителей β, описанных далее, аралкильная группа включает в себя, например, группу бензила, фенетила, 3-фенилпропила, 4- фенилбутила, 5-фенилпентила, 6-фенилгексила, 1-нафтилметокси или 2-нафтилметокси; предпочтительна группа бензила, которая может содержать от 1 до 3 заместителей β, описанных далее, на фенильной группе; более предпочтительна группа бензила.
В случае, когда заместитель α представляет собой арильную группу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей β, которые могут быть одинаковыми или различными, описанные далее, арильная группа включает в себя, например, группу фенила, нафтила, метилфенила, (трифторметил) фенила, гидроксифенила, метоксифенила, этоксифенила, (трифторметокси) фенила, метилендиоксифенила, (гидроксиметил) фенила, фторфенила, хлорфенила, бромфенила, нитрофенила, формилфенила, цианофенила, карбоксифенила, аминофенила, (диметиламино) фенила, (аминометил) фенила, (2-аминоэтил)фенила, [(N, N- диметиламино)метил]фенила, (трет-бутоксикарбониламино) фенила, (бензилоксикарбониламино) фенила или 4-гидрокси-3,5-диметилфенила; предпочтительна фенильная группа, которая может содержать от 1 до 3 заместителей β, описанных далее, (в частности группа фенила, метилфенила, (трифторметил)фенила, гидроксифенила, метоксифенила, (трифторметокси)фенила, метилендиоксифенила, (гидроксиметил)-фенила, фторфенила, хлорфенила, нитрофенила, формилфенила, цианофенила, карбоксифенила, диметиламинофенила, аминометилфенила, (N, N-диметиламинометил) фенила или 4-гидрокси-3, 5-диметилфенила); более предпочтительна группа фенила, метилфенила, (трифторметил)фенила, гидроксифенила, метоксифенила, (трифторметокси) фенила, метилендиоксифенила, (гидроксиметил)фенила, фторфенила, хлорфенила, нитрофенила, формилфенила, цианофенила, карбоксифенила, (диметиламино)фенила, (аминометил)фенила, (N,N-диметиламинометил)фенила или 4-гидрокси-3,5-диметоксифенила; наиболее предпочтительна группа фенила, (трифторметил)фенила, метоксифенила, (гидроксиметил)фенила, (трифторметокси)фенила, фторфенила, хлорфенила, нитрофенила, формилфенила, карбоксифенила, диметиламинофенила, (N,N- диметиламинометил)фенила или 4-гидрокси-3, 5-диметилфенила; в частности наиболее предпочтительна группа фенила, (трифторметокси)фенила, метоксифенила, фторфенила, хлорфенила, формилфенила, карбоксифенила или (диметиламино)фенила.
В случае, когда заместитель α представляет собой арилоксигруппу, включающую от 6 до 10 атомов углерода в арильной группе, которая может содержать от 1 до 3 заместителей β, описанных далее, арилоксигруппа включает в себя, например, группу фенокси, нафтокси, метилфенокси, (трифторметил)фенокси, метоксифенокси, этоксифенокси, фторфенокси, хлорфенокси, бромфенокси или метилендиоксифенокси; предпочтительна феноксигруппа, которая может содержать от 1 до 3 заместителей β, описанных далее, (в частности феноксигруппа).
В случае, когда заместитель α представляет собой арилтиогруппу, включающую от 6 до 10 атомов углерода в арильной группе, которая может содержать от 1 до 3 заместителей β, описанных далее, арилтиогруппа включает в себя, например, группу фенилтио, метилфенилтио, (трифторметил)фенилтио, метоксифенилтио, этоксифенилтио, хлорфенилтио, бромфенилтио, метилендиоксифенилтио или нафтилтио; предпочтительна фенилтиогруппа, которая может содержать от 1 до 3 заместителей β, описанных далее, (в частности фенилтиогруппа).
В случае, когда заместитель α представляет собой арилсульфонильную группу, включающую от 6 до 10 атомов углерода в арильной группе, которая может содержать от 1 до 3 заместителей β, описанных далее, арилсульфонильная группа включает в себя, например, группу фенилсульфонила, метилфенилсульфонила, (трифторметил) фенилсульфонила, метокси- фенилсульфонила, этоксифенилсульфонила, хлорфенилсульфонила, бромфенилсульфонила, метилендиоксифенилсульфонила или нафтилсульфонила; предпочтительна фенилсульфонильная группа, которая может содержать от 1 до 3 заместителей β, описанных далее.
В случае, когда заместитель α представляет собой арилсульфониламиногруппу, включающую от 6 до 10 атомов углерода в арильной группе, которая может содержать от 1 до 3 заместителей β, описанных далее, (атом азота аминогруппы может быть замещен прямой или разветвленной алкильной группой, включающей от 1 до 6 атомов углерода), алкильная группа заместителя на атоме азота имеет несколько значений, определенных выше. Арилсульфониламиногруппа включает в себя, например, (фенилсульфонил) аминогруппу, (метилфенилсульфонил)аминогруппу, (трифторметилфенилсульфонил) аминогруппу, (метоксифенилсульфонил) аминогруппу, (этоксифенилсульфонил) -аминогруппу, хлорфенилсульфониламиногруппу, бромфенил-сульфониламиногруппу, метилендиоксифенилсульфониламиногруппу, N-метил- фенилсульфониламиногруппу, (нафтилсульфонил) -аминогруппу или N- метил-нафтилсульфониламиногруппу; предпочтительна (фенилсульфонил) аминогруппа, которая может содержать от 1 до 3 заместителей β, описанных далее, на фенильной группе, или N-метил-фенилсульфониламиногруппа (в частности, фенилсульфониламиногруппа или N-метил-фенилсульфониламиногруппа).
В случае, когда заместитель α представляет собой моно- или дициклическую 5-10-членную гетероарильную группу содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей β, описанных далее, незамещенная гетероарильная группа включает в себя, например, группу фурила, тиенила, оксазолила, изоксазолила, тиазолила, имидазолила, хинолила, изохинолила, индолила или пиридила; предпочтительна группа имидазолила, хинолила или пиридила; в частности предпочтительна группа пиридила. Группа, содержащая заместитель, включает в себя группу метилпиридила, (трифторметил)пиридила, гидроксипиридила, метоксипиридила, этоксипиридила, (трифторметокси)пиридила, (гидроксиметил)пиридила, фторпиридила, хлорпиридила, бромпиридила, нитропиридила, формилпиридила, цианопиридила, карбоксипиридила, аминопиридила, (диметиламино)пиридила, (аминометил)пиридила, (2-аминоэтил)пиридила, (N, N-диметиламинометил)пиридила, (трет-бутоксикарбониламино)пиридила или (бензилоксикарбониламино)пиридила; предпочтительна группа пиридила, которая может содержать от 1 до 3 заместителей β, описанных далее, (например, группа метилпиридила, (трифторметил)пиридила, гидроксипиридила, метоксипиридила, (трифторметокси)пиридила, фторпиридила, хлорпиридила, нитропиридила, формилпиридила, цианопиридила, карбоксипиридила, аминопиридила, диметиламинопиридила или (N, N-диметиламинометил)пиридила) или имидазолильная группа (атом азота в кольце может быть замещен прямой или разветвленной алкильной группой, включающей от 1 до 6 атомов углерода, в частности группой N-метилимидазолила); более предпочтительна группа (трифторметил)пиридила, метоксипиридила, фторпиридила, хлорпиридила, нитропиридила, цианопиридила, аминопиридила или диметиламинопиридила.
В случае, когда заместитель α представляет собой моно- или дициклическую 5-10-членную гетероарилоксигруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей β, описанных далее, гетероарилоксигруппа включает в себя, например, группу фурилокси, тиенилокси, оксазолилокси, изоксазолилокси, тиазолилокси, имидазолилокси, хинолилокси, изохинолилокси, индолилокси или пиридилокси; предпочтительна пиридилоксигруппа, которая может содержать от до 3 заместителей β, описанных далее; в частности предпочтительна пиридилоксигруппа.
В случае, когда заместитель α представляет собой моно- или дициклическую 5-10-членную гетероарилтиогруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителя β, описанных далее, гетероарилтиогруппа включает в себя, например, группу фурилтио, тиенилтио, оксазолилтио, изоксазолилтио, тиазолилтио, имидазолилтио, хинолилтио, изохинолилтио, индолилтио или пиридилтио; предпочтительна пиридилтиогруппа, которая может содержать от 1 до 3 заместителей β, описанных далее; в частности предпочтительна пиридилтиогруппа.
В случае, когда заместитель α представляет собой моно- или дициклическую 5-10-членную гетероарилсульфонильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителя β, описанных далее, гетероарилсульфонил группа включает в себя, например, группу фурилсульфонила, тиенилсульфонила, оксазолилсульфонила, изоксазолилсульфонила, тиазолилсульфонила, имидазолилсульфонила, хинолилсульфонила, изохинолилсульфонила, индолилсульфонила или пиридинсульфонила; предпочтительна группа пиридилсульфонила, которая может содержать от 1 до 3 заместителей β, описанных далее; в частности предпочтительна группа пиридилсульфонила.
В случае, когда заместитель α представляет собой моно- или дициклическую 5-10-членную гетероарилсульфониламино-группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей β, описанных далее, в гетероарильной группе (атом азота аминогруппы может быть замещен прямой или разветвленной алкильной группой, включающей от 1 до 6 атомов углерода), гетероарилсульфониламиногруппа включает в себя, например, группу фурилсульфониламино, тиенилсульфониламино, оксазолилсульфониламино, изоксазолилсульфониламино, тиазолилсульфониламино, имидазолилсульфониламино, N-метил-имидазолилсульфониламино, хинолилсульфониламино, изохинолилсульфониламино, индолилсульфониламино, пиридилсульфониламино или N- метилпиридилсульфониламино; предпочтительна пиридилсульфониламиногруппа, которая может содержать от 1 до 3 заместителей β, описанных далее, на пиридильной группе (атом азота аминогруппы может быть замещен прямой или разветвленной алкильной группой, включающей от 1 до 6 атомов углерода); в частности предпочтительна группа пиридинсульфониламино или N- метил-пиридинсульфониламино.
В случае, когда заместитель α представляет собой моно- или дициклическую 5-10-членную насыщенную гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, насыщенная гетероциклическая группа включает в себя, например, группу морфолинила, тиоморфолинила, пирролидинила, пирролинила, имидазолидинила, имидазолинила, пиразолидинила, пиразолинила, пиперидила или пиперазинила; предпочтительна группа морфолинила, тиоморфолинила, пирролидинила, пиперидила или пиперазинила (в частности, группа пиперидила).
В случае, когда заместитель β представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, атом галогена, или прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной и каждая имеет от 1 до 4 атомов углерода, эти группы могут включать в себя те же группы, которые описаны выше в определении R3 .
В случае, когда заместитель β представляет собой прямую или разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, прямую или разветвленную галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, прямую или разветвленную алкилендиоксигруппу, включающую от 1 до 4 атомов углерода, прямую или разветвленную алифатическую ацильную группу, включающую от 1 до 5 атомов углерода, прямую или разветвленную моноалкиламиногруппу, в которой алкильная группа включает от 1 до 4 атомов углерода, прямую или разветвленную алкоксикарбониламиногруппу, в которой алкоксигруппа включает от 1 до 4 атомов углерода, или аралкилоксикарбониламиногруппу в которой аралкильная группа имеет от 7 до 12 атомов углерода, эти группы могут быть такими же, как группы, описанные выше в определении α .
В случае, когда заместитель β представляет собой прямую или разветвленную цепь гидроксиалкильной группы, включающую от 1 до 4 атомов углерода, гидроксиалкильная группа включает в себя, например, группу гидроксиметила, 2-гидроксиэтила, 3-гидроксипропила или 4-гидроксибутила, предпочтительна гидроксиметильная группа.
В случае, когда заместитель β представляет собой прямую или разветвленную аминоалкильную группу, включающую от 1 до 4 атомов углерода, аминоалкильная группа включает в себя, например, группу аминометила, 2-аминоэтила, 3-аминопропила или 4-аминобутила; предпочтительна группа аминометила или аминоэтила; более предпочтительна аминометильная группа.
В случае, когда заместитель β представляет собой моноалкиламиноалкильную группу, в которой моноалкиламиногруппа имеет одну прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, и алкильная группа представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, моноалкиламиноалкильная группа включает в себя, например, группу N-метиламинометила, N-этиламинометила, N- метиламиноэтила, N-этиламиноэтила, N-метиламинопропила или N-метиламинобутила; предпочтительна группа N-метиламинометила или N-метиламиноэтила.
В случае, когда заместитель β представляет собой диалкиламиноалкильную группу, в которой диалкиламиногруппа имеет две прямые или разветвленные алкильные группы, включающие от 1 до 4 атомов углерода, которые могут быть одинаковыми или различными, и алкильная группа представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, диалкиламиноалкильная группа включает в себя, например, группу N, N-диметиламинометила, N,N-диэтиламинометила, N,N-диметиламиноэтила, N,N-диэтиламиноэтила, N, N-диметиламинопропила или N-диметиламинобутила; предпочтительна группа N, N-диметиламинометила или N, N-диметиламиноэтила; более предпочтительна группа N,N-диметиламинометила.
Следовательно, в случае, когда Х представляет собой замещенную или незамещенную арильную группу, включающую от 6 до 10 атомов углерода, или насыщенную, или ненасыщенную моно- или дициклическую 5-10-членную гетероарильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, конкретные примеры этих групп предпочтительно включают в себя группу фенила, 1-нафтила, 2-нафтила, м-толила, п-толила, 3-этилфенила, 4-этилфенила, 3-изопропилфенила, 4-изопропилфенила, 3-трет-бутилфенила, 4-трет-бутилфенила, 4-хлорметилфенила, 4-бромметилфенила, 4-фторметилфенила, 4-йодметилфенила, 3-дифторметилфенила, 4-трифторметилфенила, 4-пентафторэтилфенила, 4-трихлорметилфенила, 3-гидроксифенила, 4-гидроксифенила, 3-ацетоксифенила, 4-ацетоксифенила, 5-ацетокси-2-гидрокси-3,4,6-триметилфенила, 3-метоксифенила, 4-метоксифенила, 3-этоксифенила, 4-этоксифенила, 3-изопропоксифенила, 4-изопропоксифенила, 3,4-метилендиоксифенила, бензилоксифенила, фенетилоксифенила, 1-нафтилметоксифенила, 3-метилтиофенила, 4-метилтиофенила, 3-этилтиофенила, 4-этилтиофенила, 3-изопропилтиофенила, 4-изопропилтиофенила, 3-метансульфонилфенила, 4-метансульфонил-фенила, 3-этансульфонилфенила, 4-этансульфонилфенила, 3-изопропансульфонилфенила, 4-изопропансульфонилфенила, 3-фторфенила, 4-фторфенила, 3-хлорфенила, 4-хлорфенила, 3-бромфенила, 4-бромфенила, 4-нитрофенила, 4-аминофенила, 3-метиламинофенила, 4-этиламинофенила, 3-пропиламинофенила, 4-бутиламинофенила, 3-диметиламинофенила, 4-диэтиламинофенила, 3-дипропиламинофенила, 4-дибутиламинофенила, 3-бензилфенила, 4-бензилфенила, 3-фенетилфенила, 4-(1-нафтилметил)фенила, 3-бифенилила, 4-бифенилила, 3-(4-метилфенил)фенила, 4-(4-метилфенил)фенила, 3-(4-этилфенил)фенила, 3-(4-трифторметилфенил)фенила, 4-(4-трифторметилфенил)фенила, 4-(2-гидроксифенил)фенила, 4-(3-гидроксифенил)фенила, 4-(4-гидроксифенил)фенила, 4-(4-гидрокси-3,5-диметилфенил)фенила, 3-(4-метоксифенил)фенила, 4-(2-метоксифенил)фенила, 4-(3-метоксифенил)фенила, 4-(4-метоксифенил)фенила, 3-(2,4-диметоксифенил)фенила, 4-(2, 4-диметоксифенил)фенила, 3-(2,5-диметоксифенил)фенила, 4-(2, 5-диметоксифенил)фенила, 4-(3-гидроксиметилфенил)фенила, 4-(4-гидроксиметилфенил)фенила, 4-(3-фторфенил)фенила, 4 -(4-фторфенил)фенила, 4-(3-хлорфенил)фенила, 4-(4-хлорфенил)фенила, 4-(3-бромфенил)фенила, 4-(4-бромфенил)фенила, 3-(3, 4-метилендиоксифенил)фенила, 4-(3, 4-метилендиоксифенил)фенила, 4-(2-формилфенил)фенила, 4-(3-формилфенил)фенила, 4-(4-формилфенил)фенила, 4-(3-карбоксифенил) фенила, 4-(4-карбоксифенил)фенила, 4-(3-N, N-диметиламинометилфенил)фенила, 4-(4-N, N-диметиламинометилфенил) фенила, 3-бензилфенила, 4-бензилфенила, 3-феноксифенила, 4-феноксифенила, 3-фенилтиофенила, 4-фенилтиофенила, 3-фенилсульфонилфенила, 4-фенилсульфонилфенила, 3-(фенилсульфониламино)фенила, 4-(фенилсульфониламино)фенила, 3-(N-метилфенилсульфониламино)-фенила, 4-(N-метилфенилсульфониламино)фенила, 3-(имидазол-1-ил)фенила, 4-(имидазол-1-ил)фенила, 3-(1-метилимидазол-4-ил)фенила, 4-(1-метилимидазол-4-ил)фенила, 3-(2-фурил)фенила, 4-(2-фурил)фенила, 3-(2-тиенил)фенила, 4-(2-тиенил)фенила, 3-(3- тиенил)фенила, 4-(3-тиенил)фенила, 3-(2-пиридил)фенила, 4-(2-пиридил)фенила, 4-(2-трифторметилпиридин-5-ил)фенила, 4-(2- метоксипиридин-5-ил)фенила, 4-(2-нитропиридин-5-ил)фенила, 4-(2-N, N-димeтилaминoпиpидин-5-ил)фенила, 3-(3-пиридил)-фенила, 4-(3-пиридил)фенила, 3-(4-пиридил)фенила, 4-(4-пиридил)фенила, 4-(имидазол-1-илтио)фенила, 4-(2-фурилтио)-фенила, 4-(2-тиенилтио)фенила, 4-(2-пиридилтио)фенила, 4-(4-пиридилтио)фенила, 3-(2-пиридилсульфонил)фенила, 4-(2-пиридилсульфонил)фенила, 3-(3-пиридилсульфонил)фенила, 4-(3-пиридилсульфонил)фенила, 3-(2-пиридилсульфониламино)фенила, 3-(N-мeтил-2-пиpидилcульфoнилaминo)фенила, 4-(2-пиридилсульфониламино)фенила, 4-(М-метил-2-пиридилсульфониламино)-фенила, 3-(3-пиридилсульфониламино)фенила, 3-(N-метил-3-пиридилсульфониламино)фенила, 4-(3-пиридилсульфониламино)-фенила, 4-(N-метил-3-пиридилсульфониламино)фенила, 3-(оксазол-2-ил) фенила, 4- (оксазол-2-ил) фенила, 3-(оксазол-4-ил)фенила, 4-(оксазол-4-ил)фенила, 3-(оксазол-5-ил) фенила, 4-(оксазол-5-ил)фенила, 3-(тиазол-2-ил)фенила, 4-(тиазол-2-ил)фенила, 3-(тиазол-4-ил)фенила, 4-(тиазол-4-ил)фенила, 3-(тиазол-5-ил)фенила, 4-(тиазол-5-ил)фенила, 4-(пиперидин-1-ил)фенила, 1-метил-2-пирролила, 1-фенил-2-пирролила, 1-бензил-2-пирролила, 5-метил-2-фурила, 5-фенил-2-фурила, 5-метил-2-тиенила, 5-фенил-2-тиенила, 5-метил-3-тиенила, 5-фенил-3-тиенила, 1-метил-3-пиразолила, 1-фенил-3-пиразолила, 3-имидазолила, 1-метил-2-имидазолила, 1-фенил-2-имидазолила, 1-метил-4-имидазолила, 1-фенил-4-имидазолила, 1-метил-2-фенил-4-имидазолила, 1,5-диметил-2-фенил-4-имидазолила, 1, 4-диметил-2-фенил-5-имидазолила, 4-оксазолила, 5-оксазолила, 2-метил-4-оксазолила, 2- фенил-4-оксазолила, 2-метил-5-оксазолила, 2-фенил-5-оксазолила, 4-метил-2-фенил-5-оксазолила, 5-метил-2-фенил-4-оксазолила, 4- тиазолила, 5-тиазолила, 2-метил-4-тиазолила, 2-фенил-4-тиазолила, 2-метил-5-тиазолила, 2-фенил-5-тиазолила, 4-метил-2-фенил-5-тиазолила, 5-метил-2-фенил-4-тиазолила, 1-метил-3-пиразолила, 1-фенил-3-пиразолила, 3-метил-5-изоксазолила, 3-фенил-5-изоксазолила, 2-пиридила, 3-пиридила, 4-пиридила, 3-метил-5-пиридила, 3-этил-5-пиридила, 3-фенил-5-пиридила, 2-метил-5-пиридила, 2-этил-5-пиридила, 2-фенил-5-пиридила, 2-(4-метоксифенил)-5-пиридила, 2-(4-фторфенил)-5-пиридила, 2-гидрокси-5-пиридила, 2-метокси-5-пиридила, 2-этокси-5-пиридила, 2- изопропокси-5-пиридила, 2-(2,2,3,3-тетрафторпропоксифенил)-5-пиридила, 2-бензилокси-5-пиридила, 2-метилтио-5-пиридила, 2-этилтио-5-пиридила, 2-изопропилтио-5-пиридила, 2-метансульфонил-5-пиридила, 2-этансульфонил-5-пиридила, 2-изопропансульфонил-5-пиридила, 2-бензил-5-пиридила, 2-фенокси-5-пиридила, 2-фенилтио-5-пиридила, 2-фенилсульфонил-5-пиридила, 2-фенилсульфониламино-5-пиридила, 2-(N-метил-фенилсульфониламино)-5-пиридила, 3-метил-6-пиридила, 3-фенил-6-пиридила, 2-метил-6-пиридила, 2-фенил-6-пиридила, 2-метил-4-пиримидинила, 2-фенил-4-пиримидинила, 2-метокси-4-пиримидинила, 2-этокси-4-пиримидинила, 2-изопропокси-4-пиримидинила, 2-метилтио-4-пиримидинила, 2-этилтио-4-пиримидинила, 2-изопропилтио-4-пиримидинила, 2-фенилтио-4-пиримидинила, 2-метансульфонил-4-пиримидинила, 2-этансульфонил-4-пиримидинила, 2-изопропилсульфонил-4-пиримидинила, 2-фенилсульфонил-4-пиримидинила, 2-метил-5-пиримидинила, 2-фенил-5-пиримидинила, 2-метокси-5-пиримидинила, 2- этокси-5-пиримидинила, 2-изопропокси-5-пиримидинила, 2-метилтио-5-пиримидинила, 2-этилтио-5-пиримидинила, 2-изопропилтио-5-пиримидинила, 2-фенилтио-5-пиримидинила, 2-метансульфонил-5-пиримидинила, 2-этансульфонил-5-пиримидинила, 2-изопропилсульфонил-5-пиримидинила, 2-фенилсульфонил-5-пиримидинила, 2-индолила, 3-индолила, 1-метил-2-индолила, 1-метил-3-индолила, 2-бензимидазолила, 1-метил-2-бензимидазолила, 2-бензоксазолила, 2-бензотиазолила, 2-хинолила, 3-хинолила, 4-хинолила, 1-изохинолила, 3-изохинолила, 4-изохинолила или 8- изохинолила; предпочтительна группа фенила, 1-нафтила, 2-нафтила, м-толила, п-толила, 3-этилфенила, 4-этилфенила, 3-изопропилфенила, 4-изопропилфенила, 4-трифторметилфенила, 3-гидроксифенила, 4-гидроксифенила, 4-гидрокси-3,5-диметилфенила, 3-ацетоксифенила, 4-ацетоксифенила, 5-ацетокси-2-гидрокси-3,4, 6-триметилфенила, 3- метоксифенила, 4-метоксифенила, 3-этоксифенила, 4-этоксифенила, 3- изопропоксифенила, 4-изопропоксифенила, 3, 4-метилен-диоксифенила, бензилоксифенила, 3-метилтиофенила, 4-метилтиофенила, 3-этилтиофенила, 4-этилтиофенила, 3-метансульфонилфенила, 4-метансульфонилфенила, 3-этансульфонилфенила, 4- этансульфонилфенила, 3-фторфенила, 4-фторфенила, 3-хлорфенила, 4- хлорфенила, 4-диэтиламинофенила, 3-бензилфенила, 4-бензилфенила, 3-бифенилила, 4-бифенилила, 3-(4-метилфенил) фенила, 4-(4-метилфенил)фенила, 3-(4-этилфенил)фенила, 3-(4-трифторметилфенил)фенила, 4-(4-трифторметилфенил)фенила, 4-(2-гидроксифенил) фенила, 4-(3-гидроксифенил)фенила, 4-(4-гидроксифенил)фенила, 4-(4-гидрокси- 3, 5-диметилфенил)фенила, 3-(4-метоксифенил)фенила, 4-(2- метоксифенил)фенила, 4-(3-метоксифенил)фенила, 4-(4- метоксифенил)фенила, 3-(2,4-диметоксифенил) фенила, 4-(2, 4- диметоксифенил)фенила, 3-(2,5-диметоксифенил)фенила, 4-(2, 5- диметоксифенил)фенила, 4-(3-гидроксиметилфенил)фенила, 4-(4- гидроксиметилфенил)фенила, 4-(3-фторфенил)фенила, 4-(4-фторфенил)фенила, 4-(3-хлорфенил)фенила, 4-(4-хлорфенил)фенила, 3-(3, 4-метилендиоксифенил)фенила, 4-(3, 4-метилендиоксифенил) фенила, 2-формилфенила, 3-формилфенила, 4-формилфенила, 3-карбоксифенила, 4-карбоксила, 3-N, N-диметиламинометилфенила, 4-N, N-димeтилaминoмeтилфeнилa, 3-феноксифенила, 4-феноксифенила, 3-фенилтиофенила, 4-фенилтиофенила, 3-фенил сульфонилфенила, 4-фенилсульфонил-фенила, 3-(фенилсульфониламино)фенила, 4-(фенилсульфониламино) фенила, 3-(N-метилфенилсульфониламино)фенила, 4-(N-метилфенилсульфониламино)фенила, 3-(2-пиридил)фенила, 4-(2-пиридил)фенила, 4-(2-трифторметилпиридин-5-ил)фенила, 4-(2-метоксипиридин-5-ил)фенила, 4-(2-нитропиридин-5-ил)фенила, 4-(2-N,N-диметиламинопиридин-5-ил)фенила, 3-(3-пиридил)фенила, 4-(3-пиридил)фенила, 3-(4-пиридил)фенила, 4-(4-пиридил)фенила, 4-(2-пиридилокси)фенила, 4-(4-пиридилокси)фенила, 4-(2-пиридилтио) фенила, 4-(4-пиридилтио)фенила, 3-(2-пиридилсульфонил)фенила, 4-(2-пиридилсульфонил)фенила, 3-(3-пиридилсульфонил)фенила, 4-(З-пиридилсульфонил)фенила, 3-(2-пиридилсульфониламино)фенила, 3-(N-метил-2-пиридилсульфониламино)фенила, 4-(2-пиридил-сульфониламино)фенила, 4-(N-метил-2-пиридилсульфониламино)-фенила, 3-(3-пиридилсульфониламино)фенила, 3-N-метил-3-пиридилсульфониламино) фенила, 4-(3-пиридилсульфониламино)-фенила, 4-(N-метил-3-пиридилсульфониламино) фенила, 4-(1-пиперидинил) фенила, 3-имидазолила, 2-пиридила, 3-пиридила, 4-пиридила, 3-метил-5- пиридила, 3-этил-5-пиридила, 3-фенил-5-пиридила, 2-метил-5-пиридила, 2-этил-5-пиридила, 2-фенил-5-пиридила, 2-гидрокси-5-пиридила, 2-метокси-5-пиридила, 2-этокси-5-пиридила, 2-изопропокси-5-пиридила, 2-(2,2,3,3-тетрафторпропокси)-5-пиридила, 2-бензилокси-5-пиридила, 2-метилтио-5-пиридила, 2- этилтио-5-пиридила, 2-изопропилтио-5-пиридила, 2-метансульфонил-5-пиридила, 2-этансульфонил-5-пиридила, 2-изопропансульфонил-5-пиридила, 2-бензил-5-пиридила, 2-фенокси-5-пиридила, 2-фенилтио-5-пиридила, 2-фенилсульфонил-5-пиридила, 2-фенилсульфониламино-5- пиридила, 2-(N-метилфенилсульфониламино)-5-пиридила, 2-(4-метоксифенил)-5-пиридила, 2-(4-фторфенил)-5-пиридила, 3-метил-6-пиридила, 3-фенил-6-пиридила, 2-метил-6-пиридила, 2-фенил-6-пиридила, 2-хинолила, 3-хинолила, 4-хинолила, 1-изохинолила, 3-изохинолила, 4-изохинолила или 8-изохинолила; более предпочтительна группа фенила, м-толила, п-толила, 3-гидроксифенила, 4-гидроксифенила, 4-гидрокси-3,5-диметилфенила, 3-ацетоксифенила, 4-ацетоксифенила, 5-ацетокси-2-гидрокси-3,4,6-триметилфенила, 3-хлорфенила, 4-хлорфенила, 3-бензилфенила, 4-бензилфенила, 3-бифенилила, 4-бифенилила, 4-(4-трифторметилфенил)фенила, 4-(2-гидроксифенил)фенила, 4-(3-гидроксифенил)фенила, 4-(4-гидроксифенил)фенила, 4-(2-метоксифенил)фенила, 4-(3-метоксифенил)фенила, 4-(4-метоксифенил)фенила, 4-(4-гидрокси-3,5-диметилфенил)фенила, 4-(4-фторфенил)фенила, 4-(4-хлорфенил)фенила, 4-(2-формилфенил)фенила, 4-(3-формилфенил)фенила, 4-(4-формилфенил)фенила, 4-(3-карбоксифенил)фенила, 4-(4-карбоксифенил)фенила, 4-(3-гидроксиметилфенил)фенила, 4-(4-гидроксиметилфенил)фенила, 4-(3-N, N-диметиламинометилфенил)фенила, 4-(4-N, N-диметиламинометилфенил)фенила, 3-феноксифенила, 4-феноксифенила, 3-фенилтиофенила, 4-фенилтиофенила, 3-фенилсульфонилфенила, 4-фенилсульфонилфенила, 3-(фенилсульфониламино)фенила, 4-(фенилсульфониламино)фенила, 3-(N-метилфенилсульфониламино)фенила, 4-(N-метилфенил-сульфониламино)фенила, 3-(2-пиридил) фенила, 4-(2-пиридил)фенила, 4-(3-трифторметилпиридин-6-ил)фенила, 4-(3-метоксипиридин-6-ил)фенила, 4-(3-нитропиридин-6-ил)фенила, 4-(3-N,N-диметиламинопиридин-6-ил)фенила, 3-(3-пиридил)фенила, 4-(3-пиридил)фенила, 3-(4-пиридил)фенила, 4-(4-пиридил)фенила, 4-(2-пиридилокси)фенила, 4-(4-пиридилокси)фенила, 4-(2-пиридилтио)фенила, 4-(4-пиридилтио)фенила, 3-(2-пиридилсульфонил)фенила, 4-(2-пиридилсульфонил)фенила, 3-(3-пиридилсульфонил)фенила, 4-(3-пиридилсульфонил)фенила, 3-(2-пиридилсульфониламино)фенила, 2-пиридила, 3-пиридила, 4-пиридила, 2-метокси-5-пиридила, 2-этокси-5-пиридила, 2-изопропокси-5-пиридила, 2-(2,2,3,3-тетрафторпропокси)-5-пиридила, 2-бензилокси-5-пиридила, 2-метилтио-5-пиридила, 2-этилтио-5-пиридила, 2-метансульфонил-5-пиридила, 2-этансульфонил-5-пиридила, 2-бензил-5-пиридила, 2-фенил-5-пиридила, 2-(4-метоксифенил)-5-пиридила, 2-(4-фторфенил)-5-пиридила, 3-фенил-5-пиридила, 2-фенил-6-пиридила, 3-фенил-6-пиридила, 2-фенокси-5-пиридила, 2-фенилтио-5-пиридила, 2-фенилсульфонил-5-пиридила, 2-фенилсульфониламино-5-пиридила, 2-(N-метилфенилсульфонил-амино)-5-пиридила, 2-метил-5-пиридила, 3-хинолила, 3-метил-5-пиридила, 3-хинолила или 3-индолила; наиболее предпочтительна группа фенила, п-толила, 4-фторфенила, 4-бензилфенила, 4-бифенилила, 4-(4-трифторметилфенил) фенила, 4-(2-гидроксифенил)фенила, 4-(3-гидроксифенил)фенила, 4- (4-гидроксифенил)фенила, 4-(2-метоксифенил)фенила, 4-(3- метоксифенил)фенила, 4-(4-метоксифенил)фенила, 4-(4-гидрокси- 3,5-диметилфенил)фенила, 4-(4-фторфенил)фенила, 4-(4-хлорфенил)фенила, 4-(2-формилфенил)фенила, 4-(3-формилфенил)фенила, 4-(4-формилфенил)фенила, 4-(3-карбоксифенил)фенила, 4-(4-карбоксифенил)фенила, 4-(3-гидроксиметилфенил)фенила, 4-(4-гидроксиметилфенил)фенила, 4-(3-N, N-диметиламинометилфенил)-фенила, 4-(4-N, N- диметиламинометилфенил)фенила, 4-феноксифенила, 4-фенилтиофенила, 4-фенилсульфонилфенила, 4-(фенилсульфониламино)фенила, 4-(2-пиридил)фенила, 4-(3- трифторметилпиридин-6-ил) фенила, 4-(3-метоксипиридин-6-ил) фенила, 4-(3-нитропиридин-6-ил)фенила, 4-(3-N,N- диметиламинопиридин-6-ил)фенила, 4-(3-пиридил)фенила, 4-(4- пиридил)фенила, 2-пиридила, 3-пиридила, 4-пиридила, 2-метокси-5-пиридила, 2-этокси-5-пиридила, 2-изопропокси-5-пиридила, 2-(2,2,3,3-тетрафторпропокси)-5-пиридила, 2-бензилокси-5-пиридила, 2-метилтио-5-пиридила, 2-этилтио-5-пиридила, 2-метансульфонил-5-пиридила, 2-этансульфонил-5-пиридила, 2-бензил-5-пирилила, 2-фенил-5-пиридила, 3-фенил-5-пиридила, 3-фенил-6-пиридила, 2-(4-метоксифенил)-5-пиридила, 2-(4-фторфенил)-5-пиридила, 2-фенил-6-пиридила, 2-фенокси-5-пиридила, 2-фенилтио-5-пиридила, 2-фенилсульфонил-5-пиридила, 2-фенилсульфониламино-5-пиридила, 2-(N-метилфенилсульфонил-амино)-5-пиридила, 2-метил-5-пиридила или 3-метил-5-пиридила.
В случае, когда Y представляет собой группу формулы: >N-R5 (где R5 представляет собой атом водорода, прямую или
разветвленную
алкильную группу, включающую от 1 до 6 атомов углерода (алкильная группа имеет те же значения, как описано выше в определении R3) или прямую или разветвленную алифатическую
ацильную группу,
включающую от 1 до 8 атомов углерода (алифатическая ацильная группа включает в себя, например, группу алканоила, включающую от 1 до 8 атомов углерода, и группу алкеноила, включающую
от 3 до 8
атомов
углерода) или ароматическую ацильную группу, включающую от 7 до 11 атомов углерода), группа формулы: >N-R5 включает в себя, например, группу имино,
метилимино,
этилимино, пропилимино, изопропилимино, бутилимино, изобутилимино, втор-бутилимино, трет-бутилимино, пентилимино, 1-метилбутилимино, 2-метилбутилимино, 3-метилбутилимино, 1,
1-диметилпропилимино, 1,
2-диметилпропилимино, 2,2-диметилпропилимино, 1-этилпропилимино, гексилимино, 1- метилпентилимино, 2-метилпентилимино, 3-метилпентилимино, 4-метилпентилимино, 1,
1-диметилбутилимино, 1,
2-диметилбутилимино, 1,3-диметилбутилимино, 2,2-диметилбутилимино, 2,3-диметилбутилимино, 3,3-диметилбутилимино, 1-этилбутилимино, 1,1,2-триметилпропилимино, 1,2,
2-триметилпропилимино, ацетилимино,
пропионилимино, бутирилимино, пентаноилимино, гексаноилимино, гептаноилимино, октаноилимино, бензоилимино или п-толуоилимино;
предпочтительна иминогруппа,
прямая или разветвленная
алкилиминогруппа, включающая от 1 до 4 атомов углерода или ацетилиминогруппа;
наиболее предпочтительна иминогруппа, метилиминогруппа, этилиминогруппа или
ацетилиминогруппа.
Производные амидокарбоновой кислоты формулы (I) по данному изобретению могут быть преобразованы в кислотно-аддитивные соли кислот в соответствии с обычными методами в том случае, когда есть основная группа. Такие соли включают в себя соли галогенводородных кислот, таких как фтористоводородная кислота, хлористоводородная кислота, бромистоводородная кислота и йодистоводородная кислота; соли неорганических кислот, такие как нитрат, перхлорат, сульфат и фосфат; соли низших алкансульфоновых кислот, таких как метансульфоновая кислота, трифторметансульфоновая кислота и этансульфоновая кислота; соли арилсульфоновой кислоты, такой как бензолсульфоновая кислоты и п-толуолсульфоновой кислоты; соли аминокислот, таких как глутаминовая кислота и аспарагиновая кислота; и соли карбоновых кислот, таких как уксусная кислота, фумаровая кислота, винная кислота, щавелевая кислота, малеиновая кислота, яблочная кислота, янтарная кислота, бензойная кислота, миндальная кислота, аскорбиновая кислота, молочная кислота, глюконовая кислота и лимонная кислота; предпочтительны соли галогенводородных кислот.
Более того, производные амидокарбоновой кислоты формулы (I) могут быть преобразованы в соли металлов в соответствии с обычными методами, так как они имеют карбоксильную группу. Такие соли включают в себя соли щелочных металлов, таких как литий, натрий и калий; соли щелочноземельных металлов, таких как кальций, барий и магний; и соли алюминия, предпочтительны соли щелочных металлов.
Производные мидокарбоновой кислоты формулы (I) по настоящему изобретению могут быть преобразованы в фармакологически приемлемый эфир в соответствии с обычными методами. Фармакологически приемлемый эфир производного амидокарбоновой кислоты (I), в частности, не ограничивается применением в медицинских целях и фармакологически приемлем по сравнению с амидокарбоновой кислотой формулы (I).
Эфиры производных амидокарбоновой кислоты формулы (I) по настоящему изобретению включают в себя прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода; аралкильную группу, включающую от 7 до 19 атомов углерода; прямую или разветвленную алкильную групп, включающую от 1 до 5 атомов углерода, которая замещена прямой или разветвленной алканоилоксигруппой, включающей от 1 до 6 атомов углерода; прямую или разветвленную алкильную группу, включающую от 1 до 5 атомов углерода, которая замещена прямой или разветвленной алкилоксикарбонилоксигруппой, включающей от 1 до 6 атома углерода; прямую или разветвленную алкильную группу, включающую от 1 до 5 атомов углерода, которая замещена циклоалкилкарбонилоксигруппой, включающей от 5 до 7 атомов углерода; прямую или разветвленную алкильную группу, включающую от 1 до 5 атомов углерода, которая замещена циклоалкилоксикарбонилоксигруппой, включающей от 5 до 7 атомов углерода; прямую или разветвленную алкильную группу, включающую от 1 до 5 атомов углерода, которая замещена арилкарбонилоксигруппой, включающей от 6 до 10 атомов углерода; прямую или разветвленную алкильную группу, включающую от 1 до 5 атомов углерода, которая замещена арилоксикарбонилоксигруппой, включающей от 6 до 10 атомов углерода; или 2-оксо-1,3-диоксолен-4-илметильную группу, включающую прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, в качестве заместителя по 5-положению.
Прямая или разветвленная алкильная группа, включающая от 1 до 4 атомов углерода, и прямая или разветвленная алкильная группа, включающая от 1 до 6 атомов углерода, включает в себя группу метила, этила, пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, 1-метилбутила, 2-метилбутила, 3-метилбутила, 1,1-диметилпропила, 1, 2-диметилпропила, 2,2-диметилпропила, 1-этилпропила, гексила, 1- метилпентила, 2-метилпентила, 3-метилпентила, 4-метилпентила, 1,1-диметилбутила, 1,2-диметилбутила, 1,3-диметилбутила, 2, 2- диметилбутила, 2,3-диметилбутила, 3,3-диметилбутила, 1-этилбутила, 2-этилбутила, 1,1,2-триметилпропила или 1,2,2-триметилпропила; предпочтительна прямая или разветвленная алкильная группа, включающая от 1 до 4 атомов углерода; более предпочтительна группа метила, этила, пропила, изопропила, бутила или изобутила; наиболее предпочтительна группа метила или этила.
Аралкильная группа, включающая от 7 до 19 атомов углерода, включает в себя группу бензила, фенетила, 3-фенилпропила, 4-фенилбутила, 1-нафтилметила, 2-нафтилметила или дифенилметила; предпочтительна группа бензила.
Циклоалкильная группа, включающая от 5 до 7 атомов углерода, включает в себя группу циклопентила, циклогексила или циклогептила; предпочтительна группа циклогексила.
Арильная группа, включающая от 6 до 10 атомов углерода, включает в себя группу фенила или нафтила; предпочтительна фенильная группа.
Конкретные примеры предпочтительных эфирных остатков включают в себя группу метила, этила, пропила, изопропила, бутила, изобутила, трет-бутила, бензила, ацетоксиметила, 1-(ацетокси)этила, пропионилоксиметила, 1-(пропионилокси)этила, бутирилоксиметила, 1-(бутирилокси)этила, изобутирилоксиметила, 1-(изобутирилокси)этила, валерилоксиметила, 1-(валерилокси)этила, изовалерилоксиметила, 1- (изовалерилокси)этила, пивалоилоксиметила, 1-(пивалоилокси) этила, метоксикарбонилоксиметила, 1-(метоксикарбонилокси)этила, этоксикарбонилоксиметила, 1-(этоксикарбонилокси)этила, пропоксикарбонилоксиметила, 1-(пропоксикарбонилокси)этила, изопропоксикарбонилоксиметила, 1-(изопропоксикарбонилокси)этила, бутоксикарбонилоксиметила, 1-(бутоксикарбонилокси)этила, изобутоксикарбонилоксиметила, 1-(изобутоксикарбонилокси)этила, трет-бутоксикарбонилоксиметила, 1-(трет-бутоксикарбонилокси) этила, циклопентанкарбонилоксиметила, 1-(циклопентанкарбонилокси) этила, циклогексанкарбонилоксиметила, 1-(циклогексанкарбонилокси)этила, циклопентилоксикарбонилоксиметила, 1-(циклопентилоксикарбонилокси)этила, циклогексилоксикарбонилоксиметила, 1-(циклогексилоксикарбонилокси)этила, бензоилоксиметила, 1-(бензоилокси)этила, феноксикарбонилоксиметила, 1-(феноксикарбонилокси) этила или 5-метил-2-оксо-1,3-диоксолен-4-илметила.
В некоторых случаях производные амидокарбоновой кислоты формулы (1), их фармакологически приемлемые соли или их фармакологически приемлемые эфиры имеют различные изомеры. Например, оптический изомер образуется из-за асимметричного углерода находящегося в α-положении карбоновой кислоты. В формуле (1) все стереоизомеры, образованные из-за этих асимметричных атомов углерода, и эквивалентные, и неэквивалентные смеси этих изомеров показаны одной формулой. Поэтому настоящее изобретение включает в себя все эти изомеры и смеси этих изомеров.
Более того, по настоящему изобретению, в случае, когда производное амидокарбоновой кислоты формулы (I), его фармакологически приемлемые соли и фармакологически приемлемые эфиры образуют сольваты (например, гидраты), настоящее изобретение включает в себя все эти сольваты.
Кроме того, настоящее изобретение включает в себя все соединения, которые преобразуются в живом организме и преобразуются в производные амидокарбоновой кислоты формулы (I) или их соль, например так называемые пролекарства, такие как производные амида.
Производные амидокарбоновой кислоты формулы (I) предпочтительно включают в себя:
(1) производные
амидокарбоновой кислоты, где R представляет собой атом водорода, прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, или аралкильную группу, включающую от 7 до 9 атомов
углерода, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(2) производные амидокарбоновой кислоты, где R1 представляет собой атом водорода или прямую
или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(3) производные амидокарбоновой
кислоты,
где R1 представляет собой атом водорода или алкильную группу, содержащую один или два атома углерода, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(4) производные амидокарбоновой кислоты, где R1 представляет собой атом водорода, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(5)
производные
амидокарбоновой кислоты, где R2 представляет собой прямую или разветвленную алкиленовую группу, включающую от 2 до 5 атомов углерода, их фармакологически приемлемые соли или их
фармакологически приемлемые эфиры;
6) производные амидокарбоновой кислоты, где R2 представляет собой прямую или разветвленную алкиленовую группу, включающую от 2 до 4 атомов
углерода, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(7) производные амидокарбоновой кислоты, где R2 представляет собой этиленовую группу,
триметиленовую группу или метилэтиленовую группу, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(8) производные амидокарбоновой кислоты, где R2
представляет собой этиленовую группу, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(9) производные амидокарбоновой кислоты, где R3 представляет
собой атом водорода, прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, алкоксигруппу, содержащую один или два атома углерода, алкилтиогруппу, содержащую один или два
атома углерода, атом галогена, нитрогруппу, гидроксильную группу или прямую или разветвленную алифатическую ацильную группу, включающую от 1 до 5 атомов углерода, их фармакологически приемлемые соли
или их фармакологически приемлемые эфиры;
(10) производные амидокарбоновой кислоты, где R3 представляет собой атом водорода, атом галогена или нитрогруппу, их фармакологически
приемлемые соли или их фармакологически приемлемые эфиры;
(11) производные амидокарбоновой кислоты, где R3 представляет собой атом водорода, их фармакологически приемлемые соли
или
их фармакологически приемлемые эфиры;
(12) производные амидокарбоновой кислоты, где R4 представляет собой атом водорода или прямую, или разветвленную алкильную группу,
включающую
от 1 до 4 атомов углерода, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры,
(13) производные амидокарбоновой кислоты, где R4 представляет
собой атом
водорода или алкильную группу, содержащую один или два атома углерода, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(14) производные
амидокарбоновой кислоты,
где R4 представляет собой атом водорода или метильную группу, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(15)
производные амидокарбоновой кислоты,
где R4 представляет собой атом водорода, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(16) производные
амидокарбоновой кислоты, где R4
представляет собой метильную группу, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(17) производные амидокарбоновой
кислоты, где Z представляет собой прямую
или разветвленную алкиленовую группу, включающую от 1 до 4 атомов углерода, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(18) производные амидокарбоновой
кислоты, где Z представляет собой алкиленовую группу, содержащую один или два атома углерода, их фармакологически приемлемые соли или их фармакологически
приемлемые эфиры;
(19) производные
амидокарбоновой кислоты, где Z представляет собой метиленовую группу, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(20) производные амидокарбоновой кислоты,
где W представляет собой (i) прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) гидроксильную группу, (iii) прямую или
разветвленную алкоксигруппу, включающую от 1
до 4 атомов углерода, (iv) прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, (v) арильную группу, включающую от 6 до 10
атомов углерода, которая может содержать от 1 до 3
заместителей α1, описанных далее, (vi) арилоксигруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3
заместителей α1, описанных далее, на
арильной группе, (vii) арилтиогруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α1,
описанных далее, на арильной группе, (viii)
аралкильную группу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей α1, описанных далее, на
арильной группе, (ix) аралкилоксигруппу, включающую
от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей α1, описанных далее, на арильной группе, (х)
аралкилтиогруппу, включающую от 7 до 12 атомов углерода,
которая может содержать от 1 до 3 заместителей α1, описанных далее, на арильной группе, (xi) арилоксиалкильную группу, в
которой арильная группа представляет собой арильную группу,
включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α1, описанных далее, и алкильная
группа представляет собой прямую или разветвленную алкильную
группу, включающую от 1 до 4 атомов углерода, (xii) моно- или дициклическую 5-10-членную гетероарильную группу, содержащую от 1 до 4
гетероатомов, выбранных из группы, включающей атом кислорода, атом
азота и атом серы, (xiii) моно- или дициклическую 5-10-членную гетероарилоксигруппу, содержащую от 1 до 4 гетероатомов, выбранных из
группы, включающей атом кислорода, атом азота и атом серы, (xiv)
моно- или дициклическую 5-10-членную гетероарилтиогруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом
кислорода, атом азота и атом серы или (xv) моно- или дициклическую
5-10-членную насыщенную гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода,
атом азота и атом серы,
здесь заместитель α1 представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную группу, включающую от 1 до 6
атомов углерода, (ii) прямую или разветвленную галогенированную
алкильную группу, включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) прямую или разветвленную алифатическую
ацилоксигруппу, включающую от 1 до 5 атомов углерода, (v) прямую или
разветвленную алифатическую ацильную группу, включающую от 1 до 5 атомов углерода, (vi) прямую или разветвленную алкоксигруппу,
включающую от 1 до 4 атомов углерода, (vii) прямую или разветвленную
галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (viii) прямую или разветвленную алкилендиоксигруппу,
включающую от 1 до 4 атомов углерода, (ix) аралкилоксигруппу, включающую от 7
до 12 атомов углерода, которая может содержать от 1 до 3 заместителей β1, описанных далее, (х) прямую
или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, (xi)
прямую или разветвленную алкилсульфонильную группу, включающую от 1 до 4 атомов углерода, (xii) атом галогена, (xiii)
нитрогруппу, (xiv) цианогруппу, (xv) аминогруппу, (xvi) прямую или разветвленную
моноалкиламиногруппу, в которой алкильная группа имеет от 1 до 4 атомов углерода, (xvii) прямую или разветвленную
алкоксикарбониламиногруппу, в которой алкоксигруппа имеет от 1 до 4 атомов углерода,
(xviii) аралкилоксикарбониламиногруппу, в которой аралкильная группа имеет от 7 до 12 атомов углерода, (xix)
прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть
одинаковой или различной и каждая имеет от 1 до 4 атомов углерода, (xx) аралкильную группу, включающую от 7
до 12 атомов углерода, которая может содержать от 1 до 3 заместителей β1,
описанных далее, на арильной группе, (xxi) арильную группу, включающую от 6 до 10 атомов углерода, которая
может содержать от 1 до 3 заместителей β1, которые могут быть одинаковым
или различными, описанных далее, (xxii) арилоксигруппу, включающую от 6 до 10 атомов углерода, которая может
содержать от 1 до 3 заместителей β1, описанных далее, на арильной группе,
(xxiii) арилтиогруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3
заместителей β1, описанных далее, на арильной группе, (xxiv) арилсульфонильную группу,
включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей β1, описанных далее, на арильной группе, (xxv) арилсульфониламиногруппу, включающую от 6 до 10
атомов углерода, которая может содержать от 1 до 3 заместителей β1,
описанных далее, на арильной группе (атом азота аминогруппы может быть замещен прямой или разветвленной алкильной
группой, включающей от 1 до атомов углерода), (xxvi) моно- или дициклическую
5-10-членную гетероарильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом
азота и атом серы, которая может содержать от 1 до 3 заместителей β1, описанных далее, (xxvii) моно- или дициклическую 5-10-членную гетероарилоксигруппу, содержащую от 1 до 4
гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом
серы, которая может содержать от 1 до 3 заместителей β1, описанных далее, (xxviii) моно- или
дициклическую 5-10-членную гетероарилтиогруппу, содержащую от 1 до 4 гетероатомов,
выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3
заместителей β1, описанных далее, (xxix) моно- или дициклическую,
5-10-членную гетероарилсульфонильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом
кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей
β1, описанных далее, (xxx) моно- или дициклическую 5-10-членную гетероарилсульфониламиногруппу,
содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода,
атом азота и атом серы, которая может содержать от 1 до 3 заместителей β1, описанных далее, на
гетероарильной группе (атом азота аминогруппы может быть замещен прямой или
разветвленной алкильной группой, включающей от 1 до 6 атомов углерода) и (xxxi) моно- или дициклическую 5-10-членную
насыщенную гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных
из группы, включающей атом кислорода, атом азота и атом серы,
здесь заместитель β1
представляет собой группу, выбранную, из группы, включающей (i) прямую или разветвленную
алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную галогенированную
алкильную группу, включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) прямую
или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (v) прямую или разветвленную
галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (vi) прямую или разветвленную
алкилендиоксигруппу, включающую от 1 до 4 атомов углерода, (vii) прямую или разветвленную
гидроксиалкильную группу, включающую от 1 до 4 атомов углерода, (viii) атом галогена, (ix) нитрогруппу, (х)
формильную группу, (XI) цианогруппу, (xii) карбоксильную группу, (xiii) аминогруппу, (xiv)
прямую или разветвленную моноалкиламиногруппу, в которой алкильная группа имеет от 1 до 4 атомов углерода,
(xv) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может
быть одинаковой или различной и каждая имеет от 1 до 4 атомов углерода, (xvi) прямую или разветвленную
аминоалкильную группу, включающую от 1 до 4 атомов углерода, (xvii) моноалкиламиноалкильную
группу, в которой моноалкиламино- группа содержит одну прямую или разветвленную алкильную группу,
включающую от 1 до 4 атомов углерода, и алкильная группа представляет собой прямую или разветвленную
алкильную группу, включающую от 1 до 4 атомов углерода, (xviii) диалкиламиноалкильную группу, в
которой диалкиламиногруппа содержит две прямые или разветвленные алкильные группы, включающие от 1 до 4
атомов углерода, которые могут быть одинаковыми или различными, и алкильная группа представляет
собой прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, (xix) прямую или
разветвленную алкоксикарбониламиногруппу, в которой алкоксигруппа имеет от 1 до 4 атомов
углерода или (xx) аралкилоксикарбониламиногруппу, в которой арильная группа имеет от 6 до 10 атомов углерода и
алкильная группа имеет от 1 до 4 атомов углерода,
их фармакологически
приемлемые соли и их фармакологически приемлемые эфиры;
(21) производные амидокарбоновой кислоты, в которой W
представляет собой (i) прямую или разветвленную алкильную группу, включающую от
1 до 6 атомов углерода, (ii) гидроксильную группу, (iii) прямую или разветвленную алкоксигруппу, включающую от 1 до 4
атомов углерода, (iv) прямую или разветвленную цепь алкилтиогруппу, включающую от
1 до 4 атомов углерода, (v) арильную группу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3
заместителей α2, описанных далее, (vi) арилоксигруппу,
включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α2 описанных далее, на
арильной группе, (vii) арилтиогруппу, включающую от 6 до 10 атомов
углерода, которая может содержать от 1 до 3 заместителей α2, описанных далее, на арильной группе, (viii)
аралкильную группу, включающую от 7 до 12 атомов углерода, которая может
содержать от 1 до 3 заместителей α2, описанных далее, на арильной группе, (ix) аралкилоксигруппу, включающую
от 7 до 12 атомов углерода, которая может содержать от 1 до 3
заместителей α2, описанных, далее, на арильной группе, (x) аралкилтиогруппу, включающую от 7 до 12 атомов углерода,
которая может содержать от 1 до 3 заместителей α2, описанных далее, на арильной группе, (xi) арилоксиалкильную группу, в которой арильная группа представляет собой арильную группу,
включающую от 6 до 10 атомов углерода, которая может
содержать от 1 до 3 заместителей α2, описанных далее, и алкильная группа представляет собой прямую или разветвленную алкильную
группу, включающую от 1 до 4 атомов углерода, (xii)
моно- или дициклическую 5-10-членную гетероарилокси-группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом
азота и атом серы или (xiii) моно- или
дициклическую 5-10-членную гетероарилтиогруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы,
здесь заместитель α2 представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую
или разветвленную галогенированную
алкильную группу, включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) прямую или разветвленную алифатическую ацилоксигруппу, включающую от 1 до 5
атомов углерода, (v) прямую или
разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (vi) прямую или разветвленную галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода,
(vii) прямую или разветвленную
алкилтиогруппу, включающую от 1 до 4 атомов углерода, (viii) прямую или разветвленную алкилсульфонильную группу, включающую 1 до 4 атомов углерода, (ix) атом галогена,
(х) нитрогруппу, (xi)
цианогруппу, (xii) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной и каждая имеет от 1 до 4 атомов углерода,
(xiii) арильные группы,
включающие от 6 до 10 атомов углерода, которые могут быть одинаковыми или различными и иметь от 1 до 3 заместителей β2, описанных далее, (xiv) арилоксигруппу,
включающие от 6 до 10
атомов углерода, которая может содержать от 1 до 3 заместителей β2, описанных далее, на арильной группе, (xv) арилтиогруппу, включающую от 6 до 10 атомов
углерода, которая может
содержать от 1 до 3 заместителей β2, описанных далее, на арильной группе, (xvi) моно- или дициклическую 5-10-членную гетероарильную группу, содержащую от 1 до
4 гетероатомов,
выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей β2, описанных далее, (xvii) моно- или
дициклическую
5-10- членную гетероарилоксигруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3
заместителей β2, описанных далее, (xviii) моно- или дициклическую 5-10-членную гетероарилтиогруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода,
атом азота и атом
серы, которая может содержать от 1 до 3 заместителей β2, описанных далее, и (xix) моно- или дициклическую 5-10-членную насыщенную гетероциклическую группу,
содержащую от 1 до 4
гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы,
здесь заместитель β2 представляет собой группу, выбранную из
группы, включающей (i)
прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов
углерода, (iii) прямую
или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (iv) прямую или разветвленную гидроксиалкильную группу, включающую от 1 до 4 атомов углерода, (v) атом
галогена, (vi)
нитрогруппу, (vii) формильную группу, (viii) карбоксильную группу, (ix) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или
различной, и каждая
имеет от 1 до 4 атомов углерода или (х) диалкиламиноалкильную группу, в которой диалкиламиногруппа содержит две прямые или разветвленные алкильные группы, включающие от 1 до 4
атомов углерода,
которые могут быть одинаковыми или различными, и алкильная группа представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода,
их
фармакологически
приемлемые соли или их фармакологически приемлемые эфиры;
(22) производные амидокарбоновой кислоты, где W представляет собой (i) прямую или разветвленную алкильную группу,
включающую от 1 до
6 атомов углерода, (ii) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (iii) арилоксигруппу, включающую от 6 до 10 атомов углерода, которая может
содержать от 1 до 3
заместителей α3, описанных далее, на арильной группе, (iv) арилтиогруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей
α3,
описанных далее, на арильной группе, (v) аралкильную группу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей α3, описанных
далее, на арильной
группе, (vi) аралкилоксигруппу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей α3, описанных далее, на арильной группе,
(vii)
арилоксиалкильную группу, в которой арильная группа представляет собой арильную группу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α3,
описанных далее, и алкильная группа представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, (viii) моно- или дициклическую 5-10-членную
гетероарилоксигруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы или (ix) моно- или дициклическую 5-10-членную гетероарилтиогруппу,
содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы,
здесь заместитель α3 представляет собой группу, выбранную из
группы, включающей (i) прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов
углерода, (iii) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (iv) прямую или разветвленную галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (v)
прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, (vi) прямую или разветвленную алкилсульфонильную группу, включающую от 1 до 4 атомов углерода, (vii) атом галогена,
(viii) цианогруппу и (ix) пиридильную группу,
их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(23) производные амидокарбоновой кислоты, где W
представляет собой (i) прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (iii)
феноксигруппу, которая может содержать от 1 до 3 заместителей α4, описанных далее, на фенильной группе, (iv) фенилтиогруппу, включающую от 6 до 10 атомов углерода, которая может
содержать от 1 до 3 заместителей α4, описанных далее, на фенильной группе, (v) аралкильную группу, включающую от 7 до 10 атомов углерода, (vi) аралкилоксигруппу, включающую от 7 до
10 атомов углерода, (vii) арилоксиалкильную группу, в которой арильная группа содержит от 6 до 10 атомов углерода, и алкильная группа представляет собой прямую или разветвленную группу и включает от
1
до 4 атомов углерода, (viii) моно- или дициклическую 5-10-членную гетероарилоксигруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы или
(ix) моно- или дициклическую 5-10-членную гетероарилтиогруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы,
здесь заместитель
α4 представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную группу, включающую от 1 до б атомов углерода, (ii) прямую или разветвленную
галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, (iii) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (iv) прямую или разветвленную
галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (v) прямую или разветвленную алкилтиогруппу, содержащую один или два атома углерода, (vi) прямую или разветвленную
алкилсульфонильную группу, содержащую один или два атома углерода, (vii) атом галогена, (viii) цианогруппу или (ix) пиридильную группу,
их фармакологически приемлемые соли или их
фармакологически приемлемые эфиры;
(24) производные амидокарбоновой кислоты, где W представляет собой феноксигруппу, которая может содержать один заместитель α5, описанный
ниже, на фенильнои группе,
здесь заместитель α5 представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную группу, включающую от 1 до
6 атомов углерода, (ii) прямую или разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, (iii) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов
углерода, (iv) прямую или разветвленную галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (v) прямую или разветвленную алкилтиогруппу, содержащую один или два атомов углерода,
(vi)
прямую или разветвленную алкилсульфонильную группу, включающую один или два атома углерода, (vii) атом галогена, (viii) цианогруппу или (ix) пиридильную группу,
их фармакологически
приемлемые
соли или их фармакологически приемлемые эфиры;
(25) производные амидокарбоновой кислоты, где W представляет собой феноксигруппу, которая может иметь один заместитель α6,
описанный ниже, на фенильной группе,
здесь заместитель α6 представляет собой группу, выбранную из группы, включающей группы метила, этила, изопропила, трет- бутила,
трифторметила, метокси и трифторметокси и атом фтора, и атом хлора,
их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(26) производные амидокарбоновой
кислоты, где W представляет собой группу фенокси, метилфенокси, этилфенокси, изопропилфенокси, трет-бутилфенокси, трифторметилфенокси, метоксифенокси, трифторметоксифенокси, фторфенокси или
хлорфенокси, их фармацевтически приемлемые соли или их фармацевтически приемлемые эфиры,
(27) производные амидокарбоновой кислоты, где Х представляет собой арильную группу, включающую от 6
до
10 атомов углерода, которая может содержать от 1 до 3 заместителей α7, описанных ниже, или моно- или дициклическую 5-10-членную гетероарильную группу, содержащую от 1 до 4
гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей α7, описанных ниже,
здесь заместитель
α7 представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную
галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) прямую или разветвленную алифатическую ацилоксигруппу, включающую от 1 до 5 атомов углерода,
(v) прямую или разветвленную алифатическую ацильную группу, включающую от 1 до 5 атомов углерода, (vi) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (vii) прямую или
разветвленную галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (viii) прямую или разветвленную алкилендиоксигруппу, включающую от 1 до 4 атомов углерода, (ix) аралкилоксигруппу,
включающую от 7 до 12 атомов углерода, которые могут содержать от 1 до 3 заместителей β3, описанных далее, (х) прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов
углерода, (xi) прямую или разветвленную алкилсульфонилгруппу, включающую от 1 до 4 атомов углерода, (xii) атом галогена, (xiii) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная
группа может быть одинаковой или различной, и каждая имеет от 1 до 4 атомов углерода, (xiv) аралкильную группу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей
β3, описанных ниже, (xv) фенильную группу, которая может содержать от 1 до 3 заместителей β3, описанных ниже, (xvi) феноксигруппу, которая может содержать от 1 до
3
заместителей β3, описанных ниже, (xvii) фенилтиогруппу, которая может содержать от 1 до 3 заместителей β3, описанных ниже, (xviii)
фенилсульфонильную группу,
которая может содержать от 1 до 3 заместителей β3, описанных ниже, (xix); фенилсульфониламиногруппу, которая может содержать от 1 до 3 заместителей β3, описанных
ниже, на фенильной группе (атом азота аминогруппы может быть замещен прямой или разветвленной алкильной группой, включающей от 1 до 6 атомов углерода), (хх) фурильную группу, (ххi) тиенильную группу,
(xxii) оксазолильную группу, (xxiii) изоксазолильную группу, (xxiv) тиазолильную группу, (xxv) пиридильную группу, которая может содержать от 1 до 3 заместителей β3, описанных ниже,
(xxvi) пиридилоксигруппу, которая может содержать от 1 до 3 заместителей β3, описанных ниже, (xxvii) пиридилтиогруппу, которая может содержать от 1 до 3 заместителей β3, описанных ниже, (xxviii) пиридилсульфонильную группу, которая может содержать от 1 до 3 заместителей β3, описанных ниже, (xxix) имидазолильную группу (атом азота в кольце
может быть замещен прямой или разветвленной алкильной группой, включающей от 1 до 6 атомов углерода), (xxx) пиридилсульфониламиногруппу, которая может содержать от 1 до 3 заместителей β3, описанных ниже, на пиридильной группе (атом азота аминогруппы может быть замещен прямой или разветвленной алкильной группой, включающей от 1 до 6 атомов углерода) и (xxxi) моно- или
дициклическую 5-10-членную насыщенную гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы,
здесь заместитель
β3 представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную
галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (v) прямую или
разветвленную галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (vi) прямую или разветвленную алкилендиоксигруппу, включающую от 1 до 4 атомов углерода, (vii) прямую или
разветвленную гидроксиалкильную группу, включающую от 1 до 4 атомов углерода, (viii) атом галогена, (ix) нитрогруппу, (х) формильную группу, (xi) цианогруппу, (xii) карбоксильную группу, (xiii)
прямую
или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной и каждая имеет от 1 до 4 атомов углерода и (xiv) диалкиламиноалкильную группу, в
которой
диалкиламиногруппа имеет две прямые или разветвленные алкильные группы, включающие от 1 до 4 атомов углерода, которые могут быть одинаковыми или различными, и алкильная группа представляет
собой
прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода,
их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(28) производные
амидокарбоновой кислоты, где Х представляет собой арильную группу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α8, описанных ниже, или
моно- или дициклическую 5-10-членную гетероарильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до
3
заместителей α8, описанных ниже,
здесь заместитель α8 представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную
группу, включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) прямую или
разветвленную алифатическую ацилоксигруппу, включающую от 1 до 5 атомов углерода, (v) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (vi) прямую или разветвленную
галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (vii) прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, (viii) атом галогена, (ix) прямую или
разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной и каждая имеет от 1 до 4 атомов углерода, (х) фенильную группу, которая может содержать от 1 до
3 заместителей β4, описанных ниже, (xi) феноксигруппу, которая может содержать от 1 до 3 заместителей β4, описанных ниже, (xii) фенилтиогруппу, которая может
содержать от 1 до 3 заместителей β4, описанных ниже, (xiii) фурильную группу, (xiv) тиенильную группу, (xv) оксазолильную группу, (xvi) изоксазолильную группу, (xvii) тиазолильную
группу, (xviii) пиридильную группу, которая может содержать от 1 до 3 заместителей β4, описанных ниже, (xix) имидазолильную группу (атом азота в кольце может быть замещен прямой или
разветвленной алкильной группой, включающей от 1 до 6 атомов углерода) и (xx) моно- или дициклическую 5-10-членную насыщенную гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных из
группы, включающей атом кислорода, атом азота и атом серы,
здесь заместитель β4 представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную
алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) прямую
или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (v) прямую или разветвленную галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (vi) прямую
или
разветвленную алкилендиоксигруппу, включающую от 1 до 4 атомов углерода, (vii) прямую или разветвленную гидроксиалкильную группу, включающую от 1 до 4 атомов углерода, (viii) атом галогена, (ix)
нитрогруппу, (х) формильную группу, (xi) цианогруппу, (xii) карбоксильную группу, (xiii) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или
различной и каждая имеет от 1 до 4 атомов углерода и (xiv) диалкиламиноалкильную группу, в которой диалкиламиногруппа содержит две прямые или разветвленные алкильные группы, включающие от 1 до 4
атомов углерода, которые могут быть одинаковыми или различными, и алкильная группа представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода,
их
фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(29) производные амидокарбоновой кислоты, где Х представляет собой арильную группу, включающую от 6 до 10 атомов
углерода, которая может содержать от 1 до 3 заместителей α9, описанных ниже, или моно- или дициклическую 5-10-членную гетероарильную группу, содержащую от 1 до 4 гетероатомов,
выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей α9, описанных ниже,
здесь заместитель α9 представляет собой группу, выбранную из группы, включающей (i) гидроксильную группу, (ii) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (iii) прямую или
разветвленную галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (iv) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или
различной и каждая имеет от 1 до 4 атомов углерода, (v) фенильную группу, которая может содержать от 1 до 3 заместителей β5, описанных ниже, (vi) феноксигруппу, которая может
содержать от 1 до 3 заместителей β5, описанных ниже, (vii) пиридильную группу, которая может содержать от 1 до 3 заместителей β5, описанных ниже и (viii) W
моно- или дициклическую 5-10-членную насыщенную гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы,
здесь
заместитель β5 представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую или
разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода,
(v) прямую или разветвленную гидроксиалкильную группу, включающую от 1 до 4 атомов углерода, (vi) атом галогена, (vii) нитрогруппу, (viii) формильную группу, (ix) карбоксильную группу, (х) прямую или
разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной, и каждая имеет от 1 до 4 атомов углерода и (xi) диалкиламиноалкильную группу, в которой
диалкиламиногруппа содержит две прямые или разветвленные алкильные группы, включающие от 1 до 4 атомов углерода, которые могут быть одинаковыми или различными, и алкильная группа представляет собой
прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода,
их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(30) производные
амидокарбоновой кислоты, где Х представляет собой группу фенила, нафтила, имидазолила, оксазолила, пиридила, индолила, хинолила или изохинолила, которая может содержать от 1 до 3 заместителей α10, описанных ниже;
здесь заместитель α10 представляет собой группу, выбранную из группы, включающей (i) гидроксильную группу, (ii) прямую или разветвленную
алкоксигруппу, включающую от 1 до 4 атомов углерода, (iii) прямую или разветвленную галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (iv) прямые или разветвленные
диалкиламиногруппы, которые могут быть одинаковыми или различными и в которых каждая алкильная группа имеет от 1 до 4 атомов углерода, (v) фенильную группу, которая может содержать от 1 до 3
заместителей β6, описанных ниже, (vi) феноксигруппу, которая может содержать от 1 до 3 заместителей β6, описанных ниже, (vii) пиридильную группу, которая может
содержать от 1 до 3 заместителей β6, описанных ниже и (viii) 5-10-членную насыщенную гетероциклическую группу одного кольца или двух колец, содержащую от 1 до 4 гетероатомов,
выбранных из группы, включающей атом кислорода, атом азота и атом серы,
здесь заместитель β6 представляет собой группу, выбранную из группы, включающей (i) прямую или
разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу,
(iv) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (v) прямую или разветвленную гидроксиалкильную группу, включающую от 1 до 4 атомов углерода, (vi) атом галогена,
(vii) нитрогруппу, (viii) формильную группу, (ix) карбоксильную группу, (х) прямые или разветвленные диалкиламиногруппы, которые могут быть одинаковыми или различными и в которых каждая из алкильных
групп имеет от 1 до 4 атомов углерода, и (xi) диалкиламиноалкильную группу, в которой диалкиламиногруппа содержит две прямые или разветвленные алкильные группы, включающие от 1 до 4 атомов углерода,
которые могут быть одинаковыми или различными, и алкильная группа представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода,
их фармацевтически
приемлемые соли или их фармацевтически приемлемые эфиры;
(31) производные амидокарбоновой кислоты, где Х представляет собой группу фенила, индолила, пиридила или хинолила, которая может
содержать от 1 до 3 заместителей α11, описанных ниже;
здесь заместитель α11 представляет собой группу, выбранную из группы, включающей (i) гидроксильную
группу, (ii) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (iii) прямую или разветвленную галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (iv)
прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной и каждая имеет от 1 до 4 атомов углерода, (v) фенильную группу, которая может
содержать от 1 до 3 заместителей β7, описанных ниже, (vi) феноксигруппу, которая может содержать от 1 до 3 заместителей β7, описанных ниже, (vii) пиридильную
группу,
которая может содержать от 1 до 3 заместителей β7, описанных ниже, и (viii) моно- или дициклическую 5-10-членную насыщенную гетероциклическую группу, содержащую от 1 до 4
гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы,
здесь заместитель β7 представляет собой группу, выбранную из группы, включающей (i)
прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, (iii)
гидроксильную группу, (iv) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (v) прямую или разветвленную гидроксиалкильную группу, включающую от 1 до 4 атомов углерода,
(vi) атом галогена, (vii) нитрогруппу, (viii) формильную группу, (ix) карбоксильную группу, (х) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой
или
различной, и каждая имеет от 1 до 4 атомов углерода и (xi) диалкиламиноалкильную группу, в которой диалкиламиногруппа содержит две прямые или разветвленные алкильные группы, включающие от 1 до 4
атомов углерода, которые могут быть одинаковыми или различными, и алкильная группа представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода,
их
фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(32) производные амидокарбоновой кислоты, где Х представляет собой фенильную группу, которая может иметь один
заместитель α12, описанный ниже,
здесь заместитель α12 представляет собой группу, выбранную из группы, включающей метил, изопропил и гидроксил, атом фтора,
атом хлора, диэтиламино и бензильную группу, группы фенила (фенильная группа может быть замещена от 1 до 3 заместителями, которые могут быть одинаковыми или различными, включают в себя группы метила,
этила, трифторметила, гидроксила, метокси, этокси, изопропокси, трифторметокси, метилендиокси и гидроксиметила, атомы фтора, атомы хлора, нитрогруппу, группы формила, циано, карбоксила, диметиламино,
диэтиламино и N,N-диметиламинометила), фенокси, фенилтио, фенилсульфонила, фенилсульфониламино, N-метилфенилсульфониламино и пиридила (пиридильная группа может быть замещена группой метила, этила,
трифторметила, метокси, этокси, изопропокси или трифторметокси, атомом фтора, атомом хлора или нитрогруппой, диметиламиногруппой или диэтиламиногруппой), пиридилокси, пиридилтио, пиридилсульфонила и
пиперидила,
или
X представляет собой пиридильную группу, которая может содержать один заместитель α13, описанный ниже,
здесь заместитель α13 представляет собой группу, выбранную из группы, включающей группы метила, изопропила, метокси, этокси, изопропокси, 2,2,3,3-тетрафторпропокси и бензилокси, алкилтиогруппу, содержащую один
или
два атома углерода, алкилсульфонильную группу, содержащую один или два атома углерода, бензильную группу, фенильную группу (фенильная группа может быть замещена группой метила, этила,
трифторметила,
метокси, этокси или изопропокси, атомом фтора, атомом хлора или нитрогруппой, диметиламиногруппой или диэтиламиногруппой), группы фенокси, фенилтио, фенилсульфонила,
фенилсульфониламино и
N-метилфенилсульфониламино,
их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(33) производные амидокарбоновой кислоты, где Х
представляет собой фенильную
группу, которая может содержать один заместитель α12, описанный ниже,
здесь заместитель α12 представляет собой группу,
выбранную из группы, включающей
метил, изопропил и гидроксильную группу, атом фтора, атом хлора, группы диэтиламино и бензила, фенильную группу (фенильная группа может быть замещена от 1 до 3
заместителями, которые могут быть
одинаковыми или различными, включают в себя группы метила, этила, трифторметила, гидроксила, метокси, этокси, изопропокси, трифторметокси, метилендиокси и
гидроксиметила, атомы фтора, атомы хлора,
нитрогруппу, группы формила, циано, карбоксила, диметиламино, диэтиламино и N,N-диметиламинометила), группы фенокси, фенилтио, фенилсульфонила,
фенилсульфониламино и N-метилфенилсульфониламино,
пиридильную группу (пиридильная группа может быть замещена группой метила, этила, трифторметила, метокси, этокси, изопропокси, или трифторметокси,
атомом фтора, атомом хлора или нитрогруппой,
диметиламиногруппой или диэтиламиногруппой), группы пиридилокси, пиридилтио, пиридилсульфонил и пиперидила,
их фармакологически приемлемые соли
или их фармакологически приемлемые эфиры;
(34) производные амидокарбоновой кислоты, в которой Х представляет собой пиридильную группу, которая может содержать один заместитель α13, описанный ниже,
здесь
заместитель α13 представляет собой группу, выбранную из группы, включающей группы метила, изопропила, метокси, этокси, изопропокси, 2,2,3,
3-тетрафторпропокси и бензилокси,
алкилтиогруппу, содержащую один или два атома углерода, алкилсульфонильную группу, содержащую один или два атома углерода, бензильную группу, фенильную группу
(фенильная группа может быть замещена
группой метила, этила, трифторметила, метокси, этокси или изопропокси, атомом фтора, атомом хлора или нитрогруппой, диметиламиногруппой или диэтиламиногруппой),
группы фенокси, фенилтио,
фенилсульфонила, фенилсульфониламино и N-метилфенилсульфониламино,
их фармакологически приемлемые соли и фармакологически приемлемые эфиры;
(35)
производные амидокарбоновой кислоты,
где Х представляет собой 2,2,3,3 тетрафторпропоксипиридильную группу или фенилпиридильную группу (фенильная группа может быть замещена группой метила, этила,
трифторметила, метокси, этокси или
изопропокси, атомом фтора, атомом хлора или нитрогруппой, диметиламиногруппой или диэтиламиногруппой), их фармакологически приемлемые соли или их фармакологически
приемлемые эфиры;
(36)
производные амидокарбоновой кислоты, где X представляет собой бифенилильную группу (каждая фенильная группа может быть замещена одним заместителем, который может быть
одинаковым или различным,
включающим группу метила, трифторметила, гидроксила, метокси или гидроксиметила, атом фтора, атом хлора или группу формила, карбоксила, нитро, диметиламино или N,
N-диметиламинометила),
пиридилфенильную группу (пиридильная группа может быть замещена одним заместителем, включающим группу метила, этила, трифторметила, метокси, этокси, изопропокси или
трифторметокси, атом фтора, атом
хлора или нитро, диметиламиногруппу или диэтиламиногруппу) или фенилпиридильную группу (фенильная группа может быть замещена одним заместителем, включающим группу
метила, этила, трифторметила, метокси,
этокси или изопропокси, атом фтора, атом хлора, нитрогруппу или диметиламиногруппу), их фармакологически приемлемые соли или их фармакологически приемлемые
эфиры;
(37) производные
амидокарбоновой кислоты, где X представляет собой группу бифенилила, (метилфенил)фенила, (трифторметилфенил)фенила, (гидроксифенил)фенила, (метоксифенил)фенила,
(гидроксиметифенил)фенила,
(фторфенил)фенила, (хлорфенил)фенила, (формилфенил)фенила, (карбоксифенил)фенила, (нитрофенил)фенила, (диметиламинофенил)фенила или (N, N-диметиламинометилфенил)фенила, их
фармакологически приемлемые
соли или их фармакологически приемлемые эфиры;
(38) производные амидокарбоновой кислоты, где X представляет собой группу бифенилила, (метилфенил)фенила,
(трифторметилфенил)фенила,
(метоксифенил)фенила, (фторфенил)фенила или (хлорфенил)фенила, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(39) производные
амидокарбоновой кислоты, где X
представляет собой группу бифенилила, (фторфенил)фенила или (хлорфенил) фенила, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(40) производные амидокарбоновой
кислоты, где X представляет собой группу пиридилфенила (пиридильная группа может содержать одну группу метила, этила, трифторметила, метокси, этокси или изопропокси,
атом фтора, атом хлора или
нитрогруппу, диметиламиногруппу или диэтиламиногруппу), их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(41) производные
амидокарбоновой кислоты, где X
представляет собой группу пиридилфенила, (метилпиридил)фенила, (метоксипиридил) фенила или (диметиламинопиридил)фенила, их фармакологически приемлемые соли или их
фармакологически приемлемые эфиры;
(42) производные амидокарбоновой кислоты, где X представляет собой фенилпиридильную группу (фенильная группа может содержать одну группу метила, этила,
метокси, этокси или изопропокси, атом
фтора, атом хлора или диметиламиногруппу), их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(43) производные
амидокарбоновой кислоты, где X представляет собой
группу фенилпиридила, (метоксифенил)пиридила или (фторфенил)пиридила, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(44) производные амидокарбоновой кислоты,
где Y представляет собой одинарную связь, атом кислорода, атом серы или группу формулы: >N-R5 (где R5 представляет
собой атом водорода, прямую или разветвленную алкильную
группу, содержащую один или два атома углерода, или прямую или разветвленную алифатическую ацильную группу, включающую от 2 до 5 атомов
углерода), их фармакологически приемлемые соли или их
фармакологически приемлемые эфиры;
(45) производные амидокарбоновой кислоты, где Y представляет собой одинарную связь или атом кислорода,
их фармакологически приемлемые соли или их
фармакологически приемлемые эфиры;
(46) производные амидокарбоновой кислоты, где Y представляет собой атом кислорода, их фармакологически
приемлемые соли или их фармакологически приемлемые
эфиры.
Более того, соединения, в которых R1 выбран из (1)-(4), R2 выбран из (5)- (8), R3 выбран из (9)-(11), R4 выбран из (12)-(16), Z выбран из (17)-(19), W выбран из (20)-(26), X выбран из (27)-(43) и Y выбран из (44)- (46) в сочетании друг с другом являются предпочтительными.
Например, фенилалкилкарбоновая кислота
формулы (1) включает в себя:
(47) производные амидокарбоновой кислоты, где
R1 представляет собой атом водорода, прямую
или разветвленную алкильную группу, включающую от 1
до 4 атомов углерода, или аралкильную группу, включающую от 7 до 9 атомов углерода;
R2 представляет собой прямую или
разветвленную алкиленовую группу, включающую от 2 до 4 атомов
углерода;
R3 представляет собой атом водорода, прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов
углерода, алкоксигруппу, включающую один или два атома
углерода, алкилтиогруппу, включающую один или два атома углерода, атом галогена, нитрогруппу, гидроксильную группу или прямую или разветвленную
алифатическую ацильную группу, включающую от 1 до 5
атомов углерода;
R4 представляет собой атом водорода или прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов
углерода;
Z представляет собой прямую или
разветвленную алкиленовую группу, включающую от 1 до 4 атомов углерода;
W представляет собой (i) прямую или разветвленную алкильную группу,
включающую от 1 до 6 атомов углерода, (ii)
гидроксильную группу, (iii) прямую или разветвленную алкоксигруппу, ключающую от 1 до 4 атомов углерода, (iv) прямую или разветвленную алкилтиогруппу,
включающую от 1 до 4 атомов углерода, (v)
арильную группу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α1, описанных далее, (vi)
арилоксигруппу, включающую от 6 до 10 атомов углерода,
которая может содержать от 1 до 3 заместителей α1, описанных далее, на арильной группе, (vii) арилтиогруппу, включающую от 6
до 10 атомов углерода, которая может содержать от 1 до 3
заместителей α1, описанных далее, на арильной группе, (viii) аралкильную группу, включающую от 7 до 12 атомов углерода,
которая может содержать от 1 до 3 заместителей α1, описанных далее, на арильной группе, (ix) аралкилоксигруппу, включающую от 7 до 12 атомов углерода, которая может содержать от 1
до 3 заместителей α1, описанных далее, на
арильной группе, (х) аралкилтиогруппу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей α1, описанных далее, на арильной группе, (xi)
арилоксиалкильную группу, в которой арильная группа представляет собой арильную группу, включающую от 6 до 10 атомов углерода, которая может
содержать от 1 до 3 заместителей α1,
описанных далее, и алкильная группа представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, (xii)
моно- или дициклическую 5-10-членную гетероарильную группу,
включающую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, (xiii) моно- или дициклическую
5-10-членную гетероарилоксигруппу, содержащую от 1 до 4
гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, (xiv) моно- или дициклическую 5-10-членную
гетероарилтиогруппу, содержащую от 1 до 4 гетероатомов, выбранных из
группы, включающей атом кислорода, атом азота и атом серы, или (xv) моно- или дициклическую 5-10-членную насыщенную
гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных из группы,
включающей атом кислорода, атом азота и атом серы,
Здесь заместитель α1 представляет собой
группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную
группу, включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную галогенированную алкильную группу,
включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) прямую или
разветвленную алифатическую ацилоксигруппу, включающую от 1 до 5 атомов углерода, (v) прямую или разветвленную
алифатическую ацильную группу, включающую от 1 до 5 атомов углерода, (vi) прямую или
разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (vii) прямую или разветвленную галогенированную
алкоксигруппу, включающую от 1 до 4 атомов углерода, (viii) прямую или разветвленную
алкилендиоксигруппу, включающую от 1 до 4 атомов углерода, (ix) аралкилоксигруппу, включающую от 7 до 12 атомов
углерода, которая может содержать от 1 до 3 заместителей β1, описанных
далее, (х) прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, (xi) прямую или
разветвленную алкилсульфонильную группу, включающую от 1 до 4 атомов углерода, (xii) атом
галогена, (xiii) нитрогруппу, (xiv) цианогруппу, (xv) аминогруппу, (xvi) прямую или разветвленную
моноалкиламиногруппу, в которой алкильная группа имеет от 1 до 4 атомов углерода, (xvii) прямую или
разветвленную алкоксикарбониламиногруппу, в которой алкоксигруппа имеет от 1 до 4 атомов углерода,
(xviii) аралкилоксикарбониламиногруппу, в которой аралкильная группа имеет от 7 до 12 атомов углерода,
(xix) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть
одинаковой или различной и каждая имеет от 1 до 4 атомов углерода, (xx) аралкильную группу, включающую
от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей β1,
описанных далее, на арильной группе, (xxi) арильную группу, включающую от 6 до 10 атомов углерода,
которая может содержать от 1 до 3 заместителей β1, которые могут быть одинаковыми
или различными, описанных далее, (xxii) арилоксигруппу, включающую от 6 до 10 атомов углерода,
которая может содержать от 1 до 3 заместителей β1, описанных далее, на арильной группе,
(xxiii) арилтиогруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до
3 заместителей β1, описанных далее, на арильной группе, (xxiv) арилсульфонильную
группу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей β1, описанных далее, на арильной группе, (xxv) арилсульфониламиногруппу, включающую от
6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей β1, описанных
далее, на арильной группе (атом азота аминогруппы может быть замещен прямой или разветвленной
алкильной группой, включающей от 1 до 6 атомов углерода), (xxvi) моно- или дициклическую 5-10-членную
гетероарильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом
кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей β1,
описанных далее, (xxvii) моно- или дициклическую 5-10-членную гетероарилоксигруппу, содержащую
от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая
может содержать от 1 до 3 заместителей β1, описанных далее, (xxviii)
моно- или дициклическую 5-10-членную гетероарилтиогруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы,
включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3
заместителей β1, описанных далее, (xxix) моно- или дициклическую 5-10-членную
гетероарилсульфонильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом
кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей β1, описанных далее, (xxx) моно- или дициклическую 5-10-членную гетероарилсульфониламиногруппу,
содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и
атом серы, которая может содержать от 1 до 3 заместителей β1, описанных далее, на
гетероарильной группе, (атом азота аминогруппы может быть замещен прямой или разветвленной алкильной
группой, включающей от 1 до 6 атомов углерода) и (xxxi) моно- или дициклическую 5-10-членную
насыщенную гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей
атом кислорода, атом азота и атом серы,
здесь заместитель β1
представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную группу,
включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную галогенированную
алкильную группу, включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) прямую или разветвленную
алкоксигруппу, включающую от 1 до 4 атомов углерода, (v) прямую или разветвленную
галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (vi) прямую или разветвленную
алкилендиоксигруппу, включающую от 1 до 4 атомов углерода, (vii) прямую или разветвленную
гидроксиалкильную группу, включающую от 1 до 4 атомов углерода, (viii) атом галогена, (ix) нитрогруппу, (х)
формильную группу, (xi) цианогруппу, (xii) карбоксильную группу, (xiii) аминогруппу, (xiv)
прямую или разветвленную моноалкиламиногруппу, в которой алкильная группа имеет от 1 до 4 атомов углерода,
(xv) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группу может
быть одинаковой или различной, и каждая имеет от 1 до 4 атомов углерода, (xvi) прямую или разветвленную
аминоалкильную группу, включающую от 1 до 4 атомов углерода, (xvii) моноалкиламиноалкильную
группу, в которой моноалкиламиногруппа содержит одну прямую или разветвленную алкильную группу, включающую
от 1 до 4 атомов углерода, и алкильная
группа представляет собой прямую или разветвленную
алкильную группу, включающую от 1 до 4 атомов углерода, (xxviii) диалкиламиноалкильную группу, в которой
диалкиламиногруппу содержит две прямые или разветвленные алкильные группы, включающие от 1 до
4 атомов углерода, которые могут быть одинаковыми или различными, и алкильная группа представляет собой
прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, (xix) прямую
или разветвленную алкоксикарбониламиногруппу, в которой алкоксигруппа представляет собой прямую или
разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода и (xx)
аралкилоксикарбониламиногруппу, в которой арильная группа включает от 6 до 10 атомов углерода и алкильная группа включает от 1
до 4 атомов углерода;
X представляет собой арильную группу,
включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α7, описанных далее, или
моно- или дициклическую 5-10-членную гетероарильную группу, содержащую
от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3
заместителей α7, описанных ниже,
здесь
заместитель α7 представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную
группу, включающую от 1 до 6 атомов углерода, (ii) прямую или
разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (vi) прямую или
разветвленную алифатическую ацилоксигруппу, включающую от 1 до 5
атомов углерода, (v) прямую или разветвленную алифатическую ацильную группу, включающую от 1 до 5 атомов углерода, (vi) прямую или
разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода,
(vii) прямую или разветвленную галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (viii) прямую или разветвленную
алкилендиоксигруппу, включающую от 1 до 4 атомов углерода, (ix)
аралкилоксигруппу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей β3, описанных
далее, (х) прямую или разветвленную алкилтиогруппу, включающую
от 1 до 4 атомов углерода, (xi) прямую или разветвленную алкилсульфонильную группу, включающую от 1 до 4 атомов углерода, (xii) атом
галогена, (xiii) прямую или разветвленную диалкиламиногруппу, в
которой каждая алкильная группа может быть одинаковой или различной и каждая имеет от 1 до 4 атомов углерода, (xiv) аралкильную группу,
включающую от 7 до 12 атомов углерода, которая может содержать
от 1 до 3 заместителей β3, описанных далее, (xv) фенильную группу, которая может содержать от 1 до 3 заместителей
β3, описанных далее, (xvi) феноксигруппу, которая
может содержать от 1 до 3 заместителей β3, описанных далее, (xvii) фенилтиогруппу, которая может содержать от 1 до
3 заместителей β3, описанных далее, V (xviii)
фенилсульфонильную группу, которая может содержать от 1 до 3 заместителей β3, описанных далее, на фенильной группе,
(xix) фенилсульфониламиногруппу, которая может содержать от 1 до
3 заместителей β3, описанных далее, на фенильной группе (атом азота аминогруппы может быть замещен прямой или
разветвленной алкильной группой, включающей от 1 до 6 атомов углерода),
(xx) фурильную группу, (xxi) тиенильную группу, (xxii) оксазолильную группу, (xxiii) изоксазолильную группу, (xxiv) тиазолильную
группу, (xxv) пиридильную группу, которая может содержать от 1 до 3
заместителей β3, описанных далее, (xxvi) пиридилоксигруппу, которая может содержать от 1 до 3 заместителей β3, описанных далее, (xxvii) пиридилтиогруппу, которая
может содержать от 1 до 3 заместителей β3, описанных далее, (xxviii) пиридилсульфонильную группу, которая может
содержать от 1 до 3 заместителей β3, описанных
далее, (xxix) имидазолильную группу (атом азота в кольце может быть замещен прямой или разветвленной алкильной группой, включающей от 1
до 6 атомов углерода), (xxx) пиридилсульфониламиногруппу,
которая может содержать от 1 до 3 заместителей β3, описанных далее, на пиридильной группе (атом азота аминогруппы может быть
замещен прямой или разветвленной алкильной группой,
включающей от 1 до 6 атомов углерода) и (xxxi) моно- или дициклическую 5-10-членную насыщенную гетероциклическую группу, содержащую от 1 до 4
гетероатомов, выбранных из группы, включающей атом
кислорода, атом азота и атом серы,
здесь заместитель β3 представляет собой группу, выбранную из группы, включающей (i)
прямую или разветвленную алкильную группу, включающую
от 1 до 6 атомов углерода, (ii) прямую или разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, (iii)
гидроксильную группу, (iv) прямую или разветвленную
алкоксигруппу, включающую от 1 до 4 атомов углерода, (v) прямую или разветвленную галогенированную алкоксигруппу, включающую от 1 до 4 атомов
углерода, (vi) прямую или разветвленную
алкилендиоксигруппу, включающую от 1 до 4 атомов углерода, (vii) прямую или разветвленную гидроксиалкильную группу, включающую от 1 до 4 атомов углерода, (viii)
атом галогена, (ix) нитрогруппу, (х)
формильную группу, (xi) цианогруппу, (xii) карбоксильную группу, (xiii) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть
одинаковой или различной и каждая
имеет от 1 до 4 атомов углерода и (xiv) диалкиламиноалкильную группу, в которой диалкиламиногруппа содержит две прямые или разветвленные алкильные группы, включающие
от 1 до 4 атомов углерода,
которые могут быть одинаковыми или различными, и алкильная группа представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода; и
Y представляет собой
одинарную связь или атом кислорода,
их фармакологически приемлемые соли или их фармакологически приемлемые эфиры;
(48) производные амидокарбоновой кислоты,
где
R1
представляет собой атом водорода, прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, или аралкильную группу, включающую от 7 до 9 атомов
углерода;
R2
представляет собой прямую или разветвленную алкиленовую группу, включающую от 2 до 4 атомов углерода;
R3 представляет собой атом водорода, атом
галогена или нитрогруппу;
R4 представляет собой атом водорода или прямую
или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода;
Z представляет
собой метиленовую группу;
W представляет собой (i) прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) гидроксильную группу, (iii) прямую или разветвленную
алкоксигруппу, включающую от 1 до 4
атомов углерода, (iv) прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, (v) арильную группу, включающую от 6 до 10 атомов углерода,
которая может содержать от 1 до 3
заместителей α2, описанных далее, (vi) арилоксигруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α2, описанных далее,
на арильной группе, (vii) арилтиогруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α2, описанных далее, на
арильной группе, (viii)
аралкильную группу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей α2, описанных далее, на арильной группе, (ix)
аралкилоксигруппу, включающую
от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей α2, описанных далее, на арильной группе, (х) аралкилтиогруппу, включающую от
7 до 12 атомов углерода,
которая может содержать от 1 до 3 заместителей α2, описанных далее, на арильной группе, (xi) арилоксиалкильную группу, в которой арильная группа представляет
собой арильную группу,
включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α2, описанных далее, и алкильная группа представляет собой прямую или
разветвленную алкильную
группу, включающую от 1 до 4 атомов углерода, (xii) моно- или дициклическую 5-10-членную гетероарилоксигруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы,
включающей атом кислорода, атом
азота и атом серы или (xiii) моно- или дициклическую 5-10-членную гетероарилтиогруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода,
атом азота и атом серы,
здесь заместитель α2 представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную группу, включающую от 1 до 6
атомов углерода, (ii)
прямую или разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) прямую или разветвленную алифатическую
ацилоксигруппу, включающую от
1 до 5 атомов углерода, (v) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (vi) прямую или разветвленную галогенированную алкоксигруппу,
включающую от 1 до 4 атомов
углерода, (vii) прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, (viii) прямую или разветвленную алкилсульфонильную группу, включающую от 1 до
4 атомов углерода, (ix)
атом галогена, (х) нитрогруппу, (xi) цианогруппу, (xii) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной и
каждая имеет от 1 до 4
атомов
углерода, (xiii) арильную группу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей β2, которые могут быть
одинаковыми или
различными, описанных далее, (xiv) арилоксигруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей β2, описанных далее, на
арильной группе,
(xv) арилтиогруппу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей β2, описанных далее, на арильной группе, (xvi) моно- или
дициклическую
5-10-членную гетероарильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3
заместителей β2, описанных далее, (xvii) моно- или дициклическую 5-10-членную гетероарилоксигруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода,
атом азота и атом
серы, которая может содержать от 1 до 3 заместителей β2, описанных далее, (xviii) моно- или дициклическую 5-10-членную гетероарилтиогруппу, содержащую от 1 до 4
гетероатомов,
выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей β2, описанных далее, и (xix) моно- или
дициклическую
5-10-членную насыщенную гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы,
здесь заместитель
β2 представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную
галогенированную
алкильную группу, включающую от 1 до 4 атомов углерода, (iii) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (iv) прямую или разветвленную
гидроксиалкильную группу,
включающую от 1 до 4 атомов углерода, (v) атом галогена, (vi) нитрогруппу, (vii) формильную группу, (viii) карбоксильную группу, (ix) прямую или разветвленную
диалкиламиногруппу, в которой каждая
алкильная группа может быть одинаковой или различной, и (х) диалкиламиноалкильную группу, в которой диалкиламиногруппа содержит две прямые или разветвленные
алкильные группы, включающие от 1 до 4
атомов углерода, которые могут быть одинаковыми или различными, и алкильная группа представляет собой прямую или разветвленную алкильную группу, включающую от 1
до 4 атомов углерода;
X
представляет собой арильную группу, включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α8, описанных ниже, или
моно- или дициклическую
5-10-членную гетероарильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3
заместителей α8, описанных ниже,
здесь заместитель α8 представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную
группу, включающую от 1
до 6 атомов углерода, (ii) прямую или разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) прямую или
разветвленную алифатическую
ацилоксигруппу, включающую от 1 до 5 атомов углерода, (v) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (vi) прямую или разветвленную
галогенированную алкоксигруппу,
включающую от 1 до 4 атомов углерода, (vii) прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, (viii) атом галогена, (ix) прямую или
разветвленную диалкиламиногруппу, в
которой каждая алкильная группа может быть одинаковой или различной и каждая имеет от 1 до 4 атомов углерода, (х) фенильную группу, которая может содержать от 1 до
3 заместителей β4,
описанных далее, (xi) феноксигруппу, которая может содержать от 1 до 3 заместителей β4, описанных далее, (xii) фенилтиогруппу, которая может
содержать от 1 до 3 заместителей
β4, описанных далее, (xiii) фурильную группу, (xiv) тиенильную группу, (xv) оксазолильную группу, (xvi) изоксазолильную группу, (xvii) тиазолильную
группу, (xviii) пиридильную
группу, которая может содержать от 1 до 3 заместителей β4, описанных далее, (xix) имидазолильную группу (атом азота в кольце может быть замещен прямой или
разветвленной алкильной
группой, включающей от 1 до 6 атомов углерода) и (xx) моно- или дициклическую 5-10-членную насыщенную гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных из
группы, включающей атом
кислорода, атом азота и атом серы,
здесь заместитель β4 представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную
алкильную группу, включающую
от 1 до 6 атомов углерода, (ii) прямую или разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) прямую
или разветвленную
алкоксигруппу, включающую от 1 до 4 атомов углерода, (v) прямую или разветвленную галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (vi) прямую или разветвленную
алкилендиоксигруппу, включающую от 1 до 4 атомов углерода, (vii) прямую или разветвленную гидроксиалкильную группу, включающую от 1 до 4 атомов углерода, (viii) атом галогена, (ix) нитрогруппу, (х)
формильную группу, (xi) цианогруппу, (xii) карбоксильную группу, (xiii) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной и содержать
от 1 до 4 атомов углерода и (xiv) диалкиламиноалкильную группу, в которой диалкиламиногруппа содержит две прямые или разветвленные алкильные группы, включающие от 1 до 4 атомов углерода, которые
могут
быть одинаковыми или различными, и алкильная группа представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода; и
Y представляет собой атом
кислорода,
их фармакологически приемлемые соли и фармакологически приемлемые эфиры;
(49) производные амидокарбоновой кислоты, где
R1 представляет собой атом
водорода,
прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода, или аралкильную группу, включающую от 7 до 9 атомов углерода;
R2 представляет собой
прямую или
разветвленную алкиленовую группу, включающую от 2 до 4 атомов углерода;
R3 представляет собой атом водорода, атом галогена или нитрогруппу;
R4
представляет
собой атом водорода или прямую или разветвленную алкильную группу, включающую от 1 до 4 атомов углерода;
Z представляет собой метиленовую группу;
W представляет собой
(i) прямую или
разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (iii) арилоксигруппу,
включающую от 6 до 10
атомов углерода, которая может содержать от 1 до 3 заместителей α3, описанных далее, на арильной группе, (iv) арилтиогруппу, включающую от 6 до 10 атомов
углерода, которая может
содержать от 1 до 3 заместителей α3, описанных далее, на арильной группе, (v) аралкильную группу, включающую от 7 до 12 атомов углерода, которая может
содержать от 1 до 3
заместителей α3, описанных далее, на арильной группе, (vi) аралкилоксигруппу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 3
заместителей α3, описанных далее, на арильной группе, (vii) арилоксиалкильную группу, в которой арильная группа представляет собой арильную группу, включающую от 6 до 10 атомов
углерода, которая может
содержать от 1 до 3 заместителей α3, описанных далее, и алкильная группа представляет собой прямую или разветвленную алкильную группу, включающую от 1 до 4
атомов углерода, (viii)
моно- или дициклическую 5-10-членную гетероарилоксигруппу, включающую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, или (ix)
моно- или дициклическую
5-10-членную гетероарилтиогруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы,
здесь заместитель α3
представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную
галогенированную алкильную
группу, включающую от 1 до 4 атомов углерода, (iii) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (iv) прямую или разветвленную
галогенированную алкоксигруппу,
включающую от 1 до 4 атомов углерода, (v) прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, (vi) прямую или разветвленную
алкилсульфонильную группу, включающую от 1 до 4
атомов углерода, (vii) атом галогена, (viii) цианогруппу и (ix) пиридильную группу;
X представляет собой арильную группу, включающую от 6 до
10 атомов углерода, которая может содержать от 1
до 3 заместителей α9, описанных ниже, или моно- или дициклическую 5-10-членную гетероарильную группу, содержащую от 1 до 4
гетероатомов, выбранных из группы, включающей атом
кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей α9, описанных ниже,
здесь заместитель
α9 представляет собой группу,
выбранную из группы, включающей (i) гидроксильную группу, прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (iii) прямую
или разветвленную галогенированную алкоксигруппу,
включающую от 1 до 4 атомов углерода, (iv) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группу может быть одинаковой или
различной и содержать от 1 до 4 атомов углерода, (v)
фенильную группу, которая может содержать от 1 до 3 заместителей β5, описанных ниже, (vi) феноксигруппу, которая может содержать
от 1 до 3 заместителей β5,
описанных ниже, (vii) пиридильную группу, которая может содержать от 1 до 3 заместителей β5, описанных ниже и (viii) моно- или
дициклическую 5-10-членную насыщенную гетероциклическую
группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы,
здесь заместитель
β5 представляет собой группу, выбранную
из группы, включающей (i) прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную
галогенированную алкильную группу, включающую от 1 до 4 атомов
углерода, (iii) гидроксильную группу, (iv) прямую или разветвленную алкоксигруппу, включающую от 1 до 4 атомов углерода, (v) прямую или
разветвленную гидроксиалкильную группу, включающую от 1 до 4
атомов углерода, (vi) атом галогена, (vii) нитрогруппу, (viii) формильную группу, (ix) карбоксильную группу, (х) прямую или разветвленную
диалкиламиногруппу, в которой каждая алкильная группу может
быть одинаковой или различной и содержит от 1 до 4 атомов углерода и (xi) диалкиламиноалкильную группу, в которой диалкиламиногруппа
содержит две прямые или разветвленные алкильные группы, включающие
от 1 до 4 атомов углерода, которые могут быть одинаковыми или различными, и алкильная группа представляет собой прямую или
разветвленную алкильную группу, включающую от 1 до 4 атомов углерода; и
Y представляет собой атом кислорода,
их фармакологически приемлемые соли или фармакологически приемлемые эфиры;
(50) производные амидокарбоновой кислоты, в которой
R1 представляет собой атом водорода;
R2 представляет собой этиленовую группу;
R3 представляет собой атом водорода;
R4
представляет собой атом водорода;
Z представляет собой метиленовую группу;
W представляет собой феноксигруппу,
которая может содержать один заместитель α5,
описанный ниже, на фенильной группе;
здесь заместитель α5 представляет собой группу, выбранную из группы,
включающей (i) прямую или разветвленную алкильную группу,
включающую от 1 до 6 атомов углерода, (ii) прямую или разветвленную галогенированную алкильную группу, включающую от 1 до 4 атомов углерода,
(iii) прямую или разветвленную алкоксигруппу, включающую от
1 до 4 атомов углерода, (iv) прямую или разветвленную галогенированную алкоксигруппу, включающую от 1 до 4 атомов углерода, (v) прямую или
разветвленную алкилтиогруппу, включающую один или два атома
углерода, (vi) прямую или разветвленную алкилсульфонильную группу, включающую один или два атома углерода, (viii) цианогруппу и (ix)
пиридильную группу;
X представляет собой фенильную группу,
которая может содержать один заместитель α12, описанный ниже,
здесь заместитель α12
представляет собой группу, выбранную из группы, включающей метил,
изопропил и гидроксил, атом фтора, атом хлора, группы диэтиламино и бензила, фенильную группу (фенильная группа может быть замещена
от 1 до 3 заместителями, которые могут быть одинаковыми или
различными, включающими в себя группы метила, этила, трифторметила, гидроксила, метокси, этокси, изопропокси, трифторметокси, метилендиокси
и гидроксиметила, атом фтора, атом хлора и нитрогруппу,
группы формила, циано, карбоксила, диметиламино, диэтиламино и N,N-диметиламинометил), группы фенокси, фенилтио, фенилсульфонила,
фенилсульфониламино и N- метилфенилсульфониламино, пиридильную группу
(пиридильная группа может быть замещена группой метила, этила, трифторметила, метокси, этокси, изопропокси или трифторметокси,
атомом фтора, атомом хлора или нитрогруппой, диметиламиногруппой или
диэтиламиногруппой), группы пиридилокси, пиридилтио, пиридилсульфонила и пиперидила,
или
X представляет собой
пиридильную группу, которая может содержать один заместитель α13, описанный ниже,
Здесь заместитель α13 представляет собой группу, выбранную из группы,
включающей метил, изопропил, метокси, этокси, изопропокси, 2,2,3,
3-тетрафторпропокси и бензилокси, арилтиогруппу, содержащую один или два атома углерода, алкилсульфонильную группу, содержащую один
или два атома углерода, бензильную группу, фенильную группу
(фенильная группа может быть замещена группой метила, этила, трифторметила, метокси, этокси или изопропокси, атомом фтора, атомом хлора или
нитрогруппой, диметиламиногруппой или диэтиламиногруппой),
группы фенокси, фенилтио, фенилсульфонила, фенилсульфониламино и N-метилфенилсульфониламино; и
Y представляет собой атом кислорода,
их фармакологически приемлемые соли или их
фармакологически приемлемые эфиры; и
(51) производные амидокарбоновой кислоты, где
R1 представляет собой атом
водорода;
R2 представляет собой
этиленовую группу;
R3 представляет собой атом водорода;
R4 представляет собой атом водорода;
Z
представляет собой метиленовую группу;
W
представляет собой феноксигруппу, которая может содержать один заместитель α6, описанный ниже, на фенильной группе,
здесь
заместитель α6 представляет собой
группу, выбранную из группы, включающей метил, этил, изопропил, трет-бутил, трифторметил, метокси и трифторметокси, и атомов фтора и хлора;
X представляет собой бифенилильную группу
(заместители каждой фенильной группы могут быть одинаковыми или различными и один из них может быть замещен группой метила, трифторметила, гидроксила,
метокси или гидроксиметила, атомом фтора, атомом
хлора или группой формила, карбоксила, нитрогруппой, диметиламиногруппой или N,N-диметиламинометильной группой), пиридилфенильную группу (пиридильная
группа может быть замещена одним заместителем,
выбранным из группы метила, этила, трифторметила, метокси, этокси, изопропокси и трифторметокси, атомов фтора, атомов хлора и нитрогруппы,
диметиламиногруппы и диэтиламиногруппы) или фенильную группу
(фенильная группа может быть замещена одним заместителем, выбранным из группы метила, этила, трифторметила, метокси, этокси и изопропокси,
атома фтора, атома хлора и нитрогруппы, и диметиламиногруппы);
и
Y представляет собой атом кислорода,
их фармакологически приемлемые соли и их фармакологически приемлемые эфиры.
Более того, является предпочтительным соединение,
содержащее следующую комбинацию:
(52) производные амидокарбоновой кислоты, где
R1 представляет собой атом
водорода или прямую или разветвленную алкильную группу,
включающую от 1 до 6 атомов углерода;
R2 представляет собой прямую или разветвленную алкиленовую группу, включающую от 1 до
6 атомов углерода;
R3 представляет
собой (i) атом водорода, (ii) прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода, (iii) прямую или разветвленную
алкоксигруппу, включающую от 1 до 4 атомов углерода, (iv)
прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, (v) атом галогена, (vi) нитрогруппу, (vii) прямую или
разветвленную диалкиламиногруппу, в которой каждая алкильная группа
может быть одинаковой или различной и содержать от 1 до 4 атомов углерода, (viii) арильную группу, включающую от 6 до 10 атомов
углерода, которая может содержать от 1 до 3 заместителей α,
описанных далее, или (ix) аралкильную группу, включающую от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей
α, описанных далее, на арильной группе;
R4
представляет собой атом водорода или прямую или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода;
Z
представляет собой прямую или разветвленную алкиленовую группу,
включающую от 1 до 4 атомов углерода;
W представляет собой группу этила, пропила, бутила, пентила, метокси, этокси, пропокси,
изопропокси, метилтио, этилтио, пропилтио, изопропилтио, фенокси,
4-метилфенокси, 4-этилфенокси, 4-изопропилфенокси, 4-метоксифенокси, 4-хлорфенокси, фенилтио, бензила, фенетила, 3-фенилпропила или
4-фенилбутила;
Х представляет собой арильную группу,
включающую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α, описанных далее, или моно- или
дициклическую 5-10-членную гетероарильную группу, содержащую от 1 до 4
гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3
заместителей α, описанных ниже,
здесь заместитель α
представляет собой группу, выбранную из группы, включающей (i) прямую или разветвленную алкильную группу, включающую от 1 до
6 атомов углерода, (ii) прямую или разветвленную галогенированную алкильную
группу, включающую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) прямую или разветвленную алифатическую
ацилоксигруппу, включающую от 1 до 5 атомов углерода, (v) прямую или разветвленную
алкоксигруппу, включающую от 1 до 4 атомов углерода, (vi) прямую или разветвленную алкилендиоксигруппу, включающую
от 1 до 4 атомов углерода, (vii) аралкилоксигруппу, включающую от 7 до 12 атомов
углерода, (viii) прямую или разветвленную алкилтиогруппу, включающую от 1 до 4 атомов углерода, (ix) прямую или
разветвленную алкилсульфонильную группу, включающую от 1 до 4 атомов углерода, (х) атом
галогена, (xi) нитрогруппу, (xii) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная
группу может быть одинаковой или различной иметь от 1 до 4 атомов углерода, (xiii) аралкильную
группу, включающую от 7 до 12 атомов углерода, (хiv) арильную группу, включающую от 6 до 10 атомов
углерода (арильная группа может быть замещена прямой или разветвленной алкильной группой, включающей
от 1 до 6 атомов углерода, прямой или разветвленной галогенированной алкильной группой, включающей
от 1 до 4 атомов углерода, прямой или разветвленной алкоксигруппой, включающей от 1 до 4 атомов
углерода, атомом галогена или прямой или разветвленной алкилендиоксигруппой, включающей от 1 до 4
атомов углерода), (xv) арилоксигруппу, включающую от 6 до 10 атомов углерода (арильная группа может
быть замещена прямой или разветвленной алкильной группой, включающей от 1 до 6 атомов углерода,
прямой или разветвленной галогенированной алкильной группой, включающей от 1 до 4 атомов углерода,
прямой или разветвленной алкоксигруппой, включающей от 1 до 4 атомов углерода, атомом галогена или
прямой или разветвленной алкилендиоксигруппой, включающей от 1 до 4 атомов углерода), (xvi)
арилтиогруппу, включающую от 6 до 10 атомов углерода (арильная группу может быть замещена прямой или
разветвленной алкильной группой, включающей от 1 до 6 атомов углерода, прямой или разветвленной
галогенированной алкильной группой, включающей от 1 до 4 атомов углерода, прямой или разветвленной
алкоксигруппой, включающей от 1 до 4 атомов углерода, атомом галогена или прямой или разветвленной
алкилендиоксигруппой, включающей от 1 до 4 атомов углерода), (xvii) арилсульфонильную группу,
включающую от 6 до 10 атомов углерода (арильная группа может быть замещена прямой или разветвленной
алкильной группой, включающей от 1 до 6 атомов углерода, прямой или разветвленной галогенированной
алкильной группой, включающей от 1 до 4 атомов углерода, прямой или разветвленной алкоксигруппой,
включающей от 1 до 4 атомов углерода, атомом галогена или прямой или разветвленной
алкилендиоксигруппой, включающей от 1 до 4 атомов углерода), (xviii) арилсульфониламиногруппу, включающую от 6 до 10
атомов углерода (арильная группа может быть замещена прямой или разветвленной
алкильной группой, включающей от 1 до 6 атомов углерода, прямой или разветвленной галогенированной алкильной группой,
включающей от 1 до 4 атомов углерода, прямой или разветвленной алкоксигруппой,
включающей от 1 до 4 атомов углерода, атомом галогена или прямой или разветвленной алкилендиоксигруппой, включающей от 1
до 4 атомов углерода, и атом азота аминогруппы может быть замещен прямой или
разветвленной алкильной группой, включающей от 1 до 6 атомов углерода), (xix) моно- или дициклическую 5-10-членную
гетероарильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы,
включающей атом кислорода, атом азота и атом серы, (xx) моно- или дициклическую 5-10-членную гетероарилоксигруппу,
содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода,
атом азота и атом серы, (xxi) моно- или дициклическую 5-10-членную гетероарилтиогруппу, содержащую от 1 до 4
гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы,
(xxii) моно- или дициклическую 5-10-членную гетероарилсульфонильную группу, содержащую от 1 до 4 гетероатомов,
выбранных из группы, включающей атом кислорода, атом азота и атом серы и (xxiii)
моно- или дициклическую 5-10-членную гетероарилсульфониламиногруппу, содержащую от 1 до 4 гетероатомов, выбранных из
группы, включающей атом кислорода, атом азота и атом серы (атом азота аминогруппы
может быть замещен прямой или разветвленной алкильной группой, включающей от 1 до 6 атомов углерода); и
Y
представляет собой одинарную связь, атом кислорода, атом серы или группу формулы
>N-R5 (где R5 представляет собой атом водорода, прямую или разветвленную алкильную группу,
включающую от 1 до 6 атомов углерода, прямую или разветвленную алифатическую
ацильную группу, включающую от 1 до 8 атомов углерода, или ароматическую ацильную группу, включающую от 7 до 11 атомов
углерода),
их фармакологически приемлемые соли или их фармакологически
приемлемые эфиры.
Иллюстративные соединения амидокарбоновой кислоты формулы (I), их фармакологически приемлемые соли или их фармакологически приемлемые эфиры по настоящему изобретению иллюстрируются в таблицах 1-155.
В данном случае в таблицах 1-155 используются следующие аббревиатуры.
Ex.No.Comp: номер иллюстративного соединения Ас: ацетил, Bu: бутил, tBu: трет-бутил, Bimid: бензимидазолил, Boxa: бензоксазолил, Bthiz: бензотиазолил, Bz: бензил, Dea: диэтиламино, Dma: диметиламино, Dmam: диметиламинометил, Et: этил. Fur: фурил. Hex: гексил, Imid: имидазолил, Ind: индолил, Isox: изоксазолил, MdO: метилендиокси, Me: метил. Mor: морфолино, Np: нафтил, Oxa: оксазолил. Pen: пентил, Ph: фенил, Pip: пиперидинил, PPr: 3-фенилпропил, Pr: пропил, iPr: изопропил. Pym: пиримидинил. Pyr: пиридил, Pyrd: пирролидинил, Pyrr: пирролил, Pyza: пиразолил, Quin: хинолил, iQuin: изохинолил, Tfp: 2,2,3,3-тетрафторпропил, Thi: тиенил, Thiz: тиазолил, di: ди, tri: три, penta: пента.
Надо отметить, что соединения таблиц 1-145 имеют следующую формулу (Ia) и соединения таблиц 146-155 имеют следующую формулу (Ib).


Производные амидокарбоновой кислоты формулы (I) по настоящему изобретению, их фармакологически приемлемые соли или их фармакологически приемлемые эфиры легко получить в соответствии со следующим методом А (см. схему в конце описания).
Метод А
Стадия A1
В стадии A1
получают соединение формулы (III) путем ацилирования соединения формулы (II).
Настоящая реакция, являющаяся реакцией получения амидной связи, широко известна в химии органических синтезов и предпочтительно обычно проводится в присутствии растворителя.
Растворитель, применяемый здесь, особенно не ограничен, пока это не имеет никакого неблагоприятного эффекта и включает, например, инертный растворитель, предпочтительно галогенированные углеводороды, такие как дихлорметан и хлороформ; сложные эфиры, такие как этилацетат; простые эфиры, такие как тетрагидрофуран и диоксан; и амиды, такие как N,N-диметилацетамид и N, N-диметилформамид.
Реакцию проводят путем обработки конденсирующим агентом.
Конденсирующий агент, применяемый здесь, включает в себя карбодиимиды, такие как N,N-дициклогексилкарбодиимид и 1-(3- диметиламинопропил)-3-этилкарбодиимидгидрохлорид; фосфорильные соединения, такие как дифенилфосфорилазид и диэтилфосфорилцианид; карбонилдиимидазол; и трифенилфосфиндиэтилазодикарбонат; предпочтительно карбонилдиимидазол и карбодиимиды. В случае, когда используются фосфорильные соединения, реакцию предпочтительно проводят в присутствии третичного амина, такого как триэтиламин и N-метилморфолин.
Альтернативно, настоящая реакция завершается путем взаимодействия карбоновой кислоты, используемой в настоящей реакции, или ее соли с низшим алкильным эфиром хлормуравьиной кислоты, таким как этилхлорформиат и изобутилхлорформиат, в присутствии третичного амина, такого как триэтиламин и N- метилморфолин, с получением смеси ангидрида карбоновой кислоты, или путем взаимодействия карбоновой кислоты, используемой в данной реакции, или ее соли, с N-гидроксисукцинимидом, N- гидроксибензотриазолом или п-нитрофенолом в присутствии карбодиимидов, такого как N,N-дициклогексилкарбодиимид, с получением соответствующего активированного эфира, и затем путем конденсирования этих соединений аминами.
Реакцию предпочтительно обычно проводят в присутствии растворителя. Растворитель, применяемый здесь, особенно не ограничен, пока это не имеет никакого неблагоприятного эффекта на реакцию и включает в себя, например, инертный растворитель, предпочтительно галогенированные углеводороды, такие как дихлорметан и хлороформ; простые, такие как тетрагидрофуран и диоксан; и ароматические углеводороды, такие как бензол и толуол.
В качестве дополнительной альтернативы соединение получают путем взаимодействия кислоты, используемой в данной реакции, или ее соли, с галогенирующим агентом, предпочтительно пентахлоридом фосфора, оксалилхлоридом или тионилхлоридом, с получением соответствующего галогенангидрида и затем путем взаимодействия галогенангидрида с аминами так же, как описано выше.
Реакцию предпочтительно обычно проводят в присутствии растворителя. Растворитель, используемый здесь, особенно не ограничен, пока это не имеет никакого неблагоприятного эффекта на настоящую реакцию, и включает, например, инертный растворитель, предпочтительно галогенированные углеводороды, такие как дихлорметан; простые эфиры, такие как тетрагидрофуран и диоксан; и ароматические углеводороды, такие как бензол и толуол.
Реакцию проводят при температуре от -20oC до 100oC, предпочтительно от -5oC до 50oC.
Несмотря на то что реакционное время меняется в зависимости от реагента, реакционной температуры и растворителя, оно обычно составляет от 30 минут до 24 часов, предпочтительно от 1 часа до 16 часов.
Стадия A2
В стадии A2 получают производное фенилалкилкарбоновой кислоты
формулы (I) и эту стадию проводят путем удаления эфирного остатка из соединения формулы (III).
Настоящая стадия заканчивается гидролизом с основанием в присутствии растворителя.
В настоящей реакции используемый растворитель особенно не ограничен, пока это не имеет никакого неблагоприятного эффекта на реакцию, и предпочтительно включает, например, эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол, этанол и метоксиэтанол; воду; или смесь этих растворителей.
Основания, используемые в реакции, включают, например, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; и карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия; предпочтительны гидроксиды щелочных металлов.
Реакционная температура меняется в зависимости от используемого растворителя и основания, но составляет от 0oC до 140oC, предпочтительно от 10oC до 120oC.
Несмотря на то что реакционное время меняется в зависимости от используемых растворителя, основания и реакционной температуры, оно обычно составляет от 10 минут до 24 часов, предпочтительно от 30 минут до 16 часов.
Альтернативно, в случае, когда эфирный остаток представляет собой группу трет-бутила, группу дифенилметила или группу п-метоксибензила, настоящую стадию проводят путем взаимодействия эфира с органической кислотой, такой как муравьиная кислота, уксусная кислота, трифторуксусная кислота, метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота и трифторметансульфоновая кислота, или с минеральной кислотой, такой как хлористоводородная кислота и серная кислота, предпочтительно трифторуксусная кислота или хлористоводородная кислота в присутствии или отсутствие растворителя.
В случае, когда в данной реакции используется растворитель, растворитель особенно не ограничен, пока это не имеет никакого неблагоприятного эффекта на реакцию, и включает, например, углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; гелогенированные углеводороды, такие как хлороформ, метиленхлорид и тетрахлорид углерода; эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол и этанол; амиды, такие как N, N-диметилформамид, N,N-диметилацетамид и триамид гексаметилфосфора; сложные эфиры, такие как метилацетат и этилацетат; воду; или смесь этих растворителей; предпочтительны эфиры.
Несмотря на то что реакционная температура меняется в зависимости от используемой кислоты, она составляет от -10oC до 120oC, предпочтительно от 0oC до 100oC.
Несмотря на то что реакционное время меняется в зависимости от используемой кислоты и реакционной температуры, оно обычно составляет от 10 минут до 24 часов, предпочтительно от 30 минут до 16 часов.
В качестве дополнительной альтернативы настоящая стадия заканчивается путем проведения каталитической реакции гидрогенирования соединения формулы (III) в случае, когда эфирный остаток представляет собой аралкильную группу, такую как группу бензила или группу дифенилметила. Катализатор, используемый здесь, включает в себя, например, палладий на углероде, палладий на угле, оксид платины и платиновую чернь, предпочтителен палладий на углероде.
Реакцию предпочтительно обычно проводят в присутствии растворителя. Растворитель, используемый здесь, особенно не ограничен, пока это не имеет никакого неблагоприятного эффекта на настоящую реакцию, и включает, например, углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; галогенированные углеводороды, такие как хлороформ, метиленхлорид и тетрахлорид углерода; эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол, этанол и изопропанол; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и триамид гексаметилфосфора; карбоновые кислоты, такие как муравьиная кислота и уксусная кислота; или смесь этих растворителей; предпочтительны спирты.
Реакционная температура составляет от 10oC до 140oC, предпочтительно от 20oC до 120oC.
Реакционное время изменяется в зависимости от реагента, реакционной температуры и растворителя и обычно составляет от 30 минут до 3 дней, предпочтительно от 1 часа до 24 часов.
В качестве другой альтернативы в случае, когда W1 представляет собой первичную или вторичную аминогруппу, защищенную обычными защитными группами, такими как трет-бутоксикарбонил, после завершения реакции реакция снятия защиты может быть проведена в соответствии с известными способами, например путем взаимодействия защищенного аминосоединения с кислотой, такой как хлористоводородная кислота, при комнатной температуре в течение от 30 минут до 2 часов.
В формуле (II) метода А, соединение (IIa), в котором R1 содержит атом водорода, может быть получено в соответствии с методом В или методом С (см. схемы в конце описания).
Метод В
Стадия B1
В стадии B1 в методе В получают соединение формулы (VI)
и соединение получают путем взаимодействия соединения формулы (IV) с соединением формулы (V).
В случае когда U представляет собой гидроксильную группу, реакцию проводят в соответствии с обычной реакцией Mitsunobu [О. Mitsunobu, Synthesis, стр. 1, (1981)].
Реакцию обычно проводят путем взаимодействия азосоединений с фосфинами в присутствии растворителя. В качестве азосоединения реагента используют C1-C4 алкилазодикарбоксилаты, такие как диэтилазодикарбоксилат, и азодикарбоксамиды, такие как 1,1'-(азодикарбонил)дипиперидин. В качестве фосфинов используют триарилфосфины, такие как трифенилфосфин, и три(C1-C4 алкил)фосфины, такие как трибутилфосфин.
Реакцию предпочтительно обычно проводят в присутствии растворителя. Растворитель, используемый здесь, особенно не ограничен, пока это не имеет никакого неблагоприятного эффекта на настоящую реакцию, и включает, например, углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; галогенированные углеводороды, такие как хлороформ, метиленхлорид, тетрахлорид углерода и 1,2-дихлорэтан; эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как N,N- диметилформамид, N,N-диметилацетамид и триамид гексаметилфосфора; или смесь этих растворителей; предпочтительны углеводороды, галогенированные углеводороды и эфиры. Реакционная температура составляет от 10oC до 100oC, предпочтительно от 20oC до 80oC.
Несмотря на то что реакционное время изменяется в зависимости от реагента, реакционной температуры и растворителя, оно обычно составляет от 1 часа до 3 дней, предпочтительно, от 5 часов до 2 дней.
В случае, когда U представляет собой атом галогена или группу формулы -O-SO2-R6 (где R6 имеет то же значение, которое определено выше), реакцию проводят в инертном растворителе в присутствии основания.
Основание, используемое здесь, предпочтительно включает в себя карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия; гидриды щелочных металлов, такие как гидрид натрия, гидрид калия и гидрид лития; алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия и метоксид лития; алкилы лития, такие как бутил лития и метил лития; амиды лития, такие как диэтиламид лития, диизопропиламид лития и бис(триметилсилил)амид лититя; гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия и гидрокарбонат калия; и третичные органические амины, такие как 1,5-диазабицикло[4.3.0]нон-5-ен, 1, 8-диазабицикло[5.4.0]ундец-7-ен и N, N-диизопропилэтиламин; более предпочтительны карбонаты щелочных металлов, гидриды щелочных металлов или алкоксиды щелочных металлов.
Инертный растворитель, используемый здесь, особенно не ограничен, пока это не имеет никакого неблагоприятного эффекта на настоящую реакцию, и включает углеводороды, такие как бензол и толуол; эфиры, такие как тетрагидрофуран и диоксан; спирты, такие как метанол, этанол и трет-бутанол; амиды, такие как N,N-диметилформамид, N, N-диметилацетамид и N-метилпирролидинон; кетоны, такие как ацетон и 2-бутанон; нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид; или их смесь; предпочтительны эфиры, амиды, кетоны или сульфоксиды.
В случае, когда настоящую реакцию проводят в присутствие катализатора фазового переноса, такого как йодид бензилтриэтиламмония и йодид тетрабутиламмония, гидроксиды щелочных металлов, такие как гидроксид натрия и гидроксид калия, используются в качестве основания, и реакцию проводят в растворителе, который содержит двухслойную систему из воды и галогенированного углеводорода, таком как метиленхлорид и хлороформ.
Реакционная температура составляет от -10oC до 120oC, предпочтительно от 10oC до 100oC.
Несмотря на то что реакционное время изменяется в зависимости от используемого реагента и реакционной температуры, оно обычно составляет от 30 минут до 48 часов, предпочтительно от 1 часа до 16 часов.
Стадия B2
В стадии B2 получают соединение формулы (VII) и ее проводят путем удаления гидроксизащитной группы, такой как группа
2-тетрагидропиранила, из соединения формулы (VI).
Настоящую реакцию проводят тем же методом, как метод удаления защиты с использованием кислоты, описанный в стадии A2 метода А.
Стадия B3
В стадии B3 получают соединение формулы (VIII)
и ее проводят путем преобразования гидроксильной группы соединения формулы (VII) в атом галогена или группу формулы
-O-SO2-R6 (где R6 имеет то же значение, которое
определено выше).
Галогенирование проводят путем взаимодействия соединения (VII) с галогенводородной кислотой, такой как хлористоводородная кислота и бромистоводородоная кислота; с галидами органических кислот, таких как тионилхлорид, тионилбромид, трихлорид фосфора, трибромид фосфора, пентахлорид фосфора и оксихлорид фосфора; реагентом Вильсмайера, таким как N, N-диметилхлорформин и N, N-диметилбромформин; или галогенированными реагентами, содержащими фосфорные соединения, такие как трифенилфосфин, и тетрахлорид углерода или тетрабромид углерода, и дихлоридтриэтилфосфин и дибромидтриэтилфосфин, в инертном растворителе или без растворителя.
Растворитель, используемый здесь, особенно не ограничен, пока это не имеет никакого неблагоприятного эффекта на настоящую реакцию, и включает, например, углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; галогенированные углеводороды, такие как хлороформ, метиленхлорид, тетрахлорид углерода и 1,2-дихлорэтан; эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как N, N-диметилформамид, N,N-диметилацетамид и гексаметилфосфорный триамид; или их смеси; предпочтительны углеводороды, галогенированные углеводороды или эфиры.
Реакционная температура составляет от -50oC до 150oC, предпочтительно от 0oC до 80oC.
Несмотря на то что реакционное время изменяется в зависимости от реагента, реакционной температуры и растворителя, оно обычно составляет от 30 минут до 3 дней, предпочтительно от 1 часа до 24 часов.
Реакцию сульфонирования проводят путем взаимодействия соединения (VII) с реагентом формулы R6-SO2-U2 или (R6-SO2)2 (где R6 имеет то же значение, которое определено выше, и U2 представляет собой атом галогена (предпочтительно атом хлора)) в инертном растворителе в присутствии основания.
Растворитель, используемый здесь, особенно не ограничен, пока это не имеет никакого неблагоприятного эффекта на настоящую реакцию, и включает, например, углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; галогенированные углеводороды, такие как хлороформ, метиленхлорид, тетрахлорид углерода и 1,2-дихлорэтан; эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и гексаметилфосфорный триамид; азотсодержащие ароматические соединения, такие как пиридин и коллидин; или их смеси; предпочтительны галогенированные углеводороды или азотсодержащие ароматические соединения.
Основание, используемое здесь, включает в себя карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия; гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия и гидрокарбонат калия; и третичные органические амины, такие как N-диметилморфолин, N,N-диизопропилэтиламин 1,5-диазабицикло[4.3.0]нон-5-ен и 1,8-диазабицикло[5.4.0]ундец-7-ен; предпочтительны третичные органические амины.
Реакционная температура составляет от -70oC до 100oC, предпочтительно от 0oC до 80oC.
Несмотря на то что реакционное время изменяется в зависимости от реагента, реакционной температуры и растворителя, оно обычно составляет от 30 минут до 48 часов, предпочтительно от 1 часа до 16 часов.
Стадия B4
В стадии B4 получают соединение
формулы (IX) и ее проводят путем преобразования атома галогена или группы формулы -O-SO2-R6 (где
R6 имеет то же значение, которое определено выше) соединения формулы
(VIII) в азидную группу.
Настоящую реакцию проводят путем взаимодействия азида металла, такого как азид натрия, или органического азида, такого как азид тетрабутиламмония, в инертном растворителе.
Растворитель, используемый здесь, особенно не ограничен, пока это не имеет никакого неблагоприятного эффекта на настоящую реакцию, и включает, например, углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; галогенированные углеводороды, такие как хлороформ, метиленхлорид, тетрахлорид углерода и 1,2-дихлорэтан; эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как N,N- диметилформамид, N,N-диметилацетамид и гексаметилфосфорный триамид; или их смеси; предпочтительны эфиры или амиды.
Реакционная температура составляет от 0oC до 150oC, предпочтительно от 20oC до 100oC.
Несмотря на то что реакционное время изменяется в зависимости от реагента, реакционной температуры и растворителя, оно обычно составляет от 1 часа до 3 дней, предпочтительно от 1 часа до 24 часов.
Стадия B5
В стадии B5 получают соединение
формулы (IIa) и ее проводят путем преобразования азидной группы соединения формулы (IX) в аминогруппу.
Настоящую реакцию заканчивают путем каталитического восстановления с использованием палладия на углероде, никеля Ренея, катализа Линдлара и тому подобного в качестве катализатора или восстановления с использованием трифенилфосфина, тому подобного в инертном растворителе.
Растворитель, используемый здесь, особенно не ограничен, пока это не имеет никакого неблагоприятного эффекта на настоящую реакцию и включает, например, углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; спирты, такие как метанол и этанол; эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как N,N-диметилформамид, N, N-диметилацетамид и гексаметилфосфорный триамид; или их смеси; предпочтительны спирты или эфиры.
Реакционная температура составляет от 0oC до 150oC, предпочтительно от 20oC до 100oC.
Несмотря на то что реакционное время изменяется в зависимости реагента, реакционной температуры и растворителя, оно обычно составляет от 1 часа до 3 дней, предпочтительно от 1 часа до 24 часов.
Метод С
Стадия C1
В стадии C1 получают соединение формулы (XI) и ее
проводят путем
взаимодействия соединения формулы (X) с соединением формулы (V).
Настоящую стадию проводят тем же методом, который описан в стадии B1 метода В.
Стадия
C2
В
стадии C2 получают соединение формулы (IIa) и проводят путем удаления аминозащитной группы из соединения формулы (XI).
В случае, когда защитная группа R7 или R8 представляет собой группу, которая может быть удалена путем каталитического восстановления, такую как аралкильная группа и аралкилоксикарбонильная группа, или группу, которая может быть удалена с помощью кислоты, такую как тритильная группа и трет-бутоксикарбонильная группа, реакцию удаления защитной группы проводят тем же методом, который описан в стадии A2 в методе А.
В случае, когда защитная группа R7 или R8 представляет собой алифатическую ацильную группу, такую как формил и трифторацетил, защитную группу удаляют в основных условиях.
Основание, используемое здесь, включает в себя гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия и гидроксид лития; и карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия; предпочтительны гидроксиды щелочных металлов.
Настоящую реакцию предпочтительно проводят в инертном растворителе, например спиртах, таких как метанол и этанол; воде; эфирах, таких как тетрагидрофуран и диоксан; и их смесях; более предпочтительны спирты.
Реакционная температура составляет от 0oC до 100o C, предпочтительно, от 10oC до 80oC.
Несмотря на то что реакционное время изменяется в зависимости от реагента, реакционной температуры и растворителя, оно обычно составляет от 30 минут до 24 часов, предпочтительно от 1 часа до 16 часов.
В случае, когда R7 вместе с R8 представляет собой аминозащитную группу и она является фталоильной группой, защитная группа может быть удалена обработкой гидразинами или первичными аминами.
Гидразины, используемые здесь, включают в себя, например, гидразин, метилгидразин и фенилгидразин, предпочтителен гидразин. Первичные амины, используемые здесь, включают в себя метиламин, этиламин, пропиламин, бутиламин, изобутиламин, пентиламин и гексиламин, предпочтительны пропиламин или бутиламин.
Настоящую реакцию проводят в инертном растворителе, например спиртах, таких как метанол и этанол; эфирах, таких как тетрагидрофуран и диоксан; галогенированных углеводородах, таких как метиленхлорид и хлороформ; и предпочтительно используют их смеси. Использование спиртов является более предпочтительным.
Реакционная температура составляет от 0oC до 100oC, предпочтительно от 10oC до 80oC.
Несмотря на то что реакционное время изменяется в зависимости от реагента, реакционной температуры и растворителя, оно обычно составляет от 30 минут до 24 часов, предпочтительно 1 часа до 16 часов.
В формуле (II) метода А соединение, в котором R1 представляет собой алкильную группу или аралкильную группу, может быть также получено в соответствии с методом D или методом Е.
Метод D (см. схему в конце
описания)
Стадия D1
В стадии D1 получают соединение формулы (IIb) и ее проводят путем взаимодействия соединения формулы (VIII) с амином формулы (XII).
Настоящую реакцию проводят в инертном растворителе в присутствии или отсутствие основания.
Растворитель, используемый здесь, особенно не ограничен, пока это не имеет никакого неблагоприятного эффекта на настоящую реакцию, и включает, например, углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; спирты, такие как метанол и этанол; эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как N,N-диметилформамид, N,N-димeтилaцeтaмид и триамид гексаметилфосфора; или их смеси; предпочтительны эфиры или амиды.
Основание, используемое здесь, включает карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия; гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия и гидрокарбонат калия; и третичные органические амины, такие как триэтиламин, Т-метилморфолин, N,N- диизопропилэтиламин, 1,5-диазабицикло[4.3.0] нон-5-ен и 1,8-диазабицикло[5.4.0]ундец-7-ен; предпочтительны карбонаты щелочных металлов или третичные органические амины.
Реакционная температура составляет от 0oC до 150oC, предпочтительно от 20oC до 100o C.
Несмотря на то что реакционное время изменяется в зависимости от реагента, реакционной температуры и растворителя, оно обычно составляет от 1 часа до 3 дней, предпочтительно 1 часа до 24 часов.
Метод Е
(см. схему в конце описания)
Стадия E1
В стадии E1 получают соединение формулы (IIb) и ее проводят путем взаимодействия соединения формулы
(IIa) с карбонильным соединением формулы
(XIII).
Настоящую реакцию проводят в инертном растворителе при восстановительных условиях, используя гидрид металла, такой как боргидрат натрия и цианоборгидрид натрия, или в условиях каталитического восстановления, используя палладий на углероде или никель Ранея в качестве катализатора.
Растворитель, используемый здесь, особенно не ограничен, пока это не имеет никакого неблагоприятного эффекта на настоящую реакцию, и включает углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; спирты, такие как метанол и этанол; эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и триамид гексаметилфосфат; или их смеси; предпочтительны спирты или амиды.
Реакционная температура составляет от 0oC до 150oC, предпочтительно от 20oC до 100oC.
Несмотря на то что реакционное время изменяется в зависимости от реагента, реакционной температуры и растворителя, оно обычно составляет от 1 часа до 3 дней, предпочтительно 1 часа до 24 часов.
В формуле (III) метода А, соединение (IIIa), в котором W представляет собой арилоксигруппу, гетероарилоксигруппу, арилтиогруппу или гетероарилтиогруппу, может быть также получено в соответствии с методом F.
Метод F (см. схему в конце
описания)
Стадия F1
В стадии F1 метода F получают соединение формулы (IIIa) и соединение получают путем взаимодействия
соединения формулы (XIV) с соединением формулы (XV).
Настоящую стадию проводят тем же методом, который описан в стадии B1 метода В.
В формуле (XI) метода С соединение (XIa) в котором W представляет собой арилоксигруппу, гетероарильную группу, арилтиогруппу или гетероарилтиогруппу, может быть получено в соответствии с методом G.
Метод G (см. схему
в конце описания)
Стадия G1
В стадии
G1 метода G получают соединение формулы (XIa) и соединение получают путем взаимодействия соединения формулы (XVI) с соединением формулы (XV).
Настоящую стадию проводят тем же методом, который описан в стадии B1 метода В.
В формуле (I) метода А соединение (Ia), в котором R4 представляет собой атом водорода, может быть получено в соответствии с методом Н.
Метод H (см. схему в конце описания)
Стадия H1
В стадии H1 метода H получают соединение формулы (XIX) и
соединение получают путем взаимодействия соединения
формулы (XVII) с соединением формулы (XVIII).
Настоящую реакцию проводят путем взаимодействия соединений в инертном растворителе в присутствии основания.
Основание, используемое здесь, предпочтительно включает в себя гидриды щелочных металлов, такие как гидрид натрия, гидрид калия и гидрид лития; алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия и метоксид лития; алкилы лития, такие как бутил лития и метил лития; амиды лития, такие как диэтиламид лития, диизопропиламид лития и бис(триметилсилил)амид лития; или третичные органические амины, такие как 1, 5-диазабицикло[4.3.0] нон-5-ен и 1,8- диазабицикло[5.4.0]ундец-7-ен; более предпочтительны гидриды щелочных металлов, алкоксиды щелочных металлов или амиды лития.
Инертный растворитель, используемый здесь, особенно не ограничен, пока это не имеет никакого неблагоприятного эффекта на настоящую реакцию, и включает, например, углеводороды, такие как бензол и толуол; эфиры, такие как тетрагидрофуран и диоксан; спирты, такие как метанол, этанол и трет-бутанол; амиды, такие как N, N- диметилформамид, N,N-диметилацетамид и N-метилпирролидинон; кетоны, такие как ацетон и 2-бутанон; нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид; и их смеси; предпочтительны эфиры, амиды, кетоны или сульфоксиды.
В случае, когда настоящую реакцию проводят в присутствии катализатора фазового переноса, такого как йодид бензилтриэтиламмония и йодид тетрабутиламмония, реакцию проводят в растворителе, который содержит двухслойную систему из воды и галогенированного углеводорода, таком как метиленхлорид и хлороформ, используя гидроксиды щелочных металлов, такие как гидроксид натрия и гидроксид калия, в качестве основания.
Реакционная температура составляет от -10oC до 120oC, предпочтительно от 10oC до 100oC.
Несмотря на то что реакционное время изменяется в зависимости от используемого реагента и реакционной температуры, оно обычно составляет от 30 минут до 48 часов, предпочтительно 1 часа до 16 часов.
Стадия H2
В стадии H2 получают производное фенилалкилкарбоновой кислоты формулы (Ia) и ее
проводят путем удаления
остатков эфира производного диэфира малоновой
кислоты формулы (XIX) и затем путем декарбоксилирования.
Удаление остатка эфира в настоящей стадии завершается путем использования того же метода, который описан в стадии A2 метода А.
Стадия декарбоксилирования заканчивается путем нагревания производного малоновой кислоты, получаемого при удалении эфирных остатков соединения формулы (XIX) в присутствии растворителя.
Растворитель, используемый здесь, особенно не ограничен, пока это не имеет никакого неблагоприятного эффекта на настоящую реакцию и включает, например, углеводороды, такие как бензол, толуол, ксилол и гептан; галогенированные углеводороды, такие как хлороформ и тетрахлорид углерода; эфиры, такие как тетрагидрофуран и диоксан; спирты, такие как этанол, пропанол, метоксиэтанол и этиленгликоль; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и триамид гексаметилфосфора; и их смеси; углеводороды или спирты.
Реакционная температура составляет от 60oC до 180oC, предпочтительно от 80oC до 150oC.
Несмотря на то что реакционное время изменяется в зависимости от реагента, реакционной температуры и растворителя, оно обычно составляет от 30 минут до 2 дней, предпочтительно ст 1 часа до 24 часов.
В формуле (I) метода А соединение (Ib), в котором W представляет собой алкиламиногруппу, диалкиламиногруппу или аралкиламиногруппу, может быть также получено в соответствии с методом I.
Метод I (см.
схему в конце описания)
Стадия I1
В стадии I1 получают соединение формулы (IIIc) и ее проводят путем алкилирования или аралкилирования соединения формулы (IIIb).
Настоящую реакцию проводят тем же методом, который описан в стадии B1 метода В в случае, когда алкилгалогенид, аралкилгалогенид, алкилсульфонат или аралкилсульфонат используют в качестве алкилирующих реагентов.
В случае, когда алкилирование является восстановительным и его проводят с использованием карбонильного соединения, его проводят тем же методом, который описан в стадии E1 метода Е.
Стадия I2
В стадии 12 получают соединение формулы (Ib) и ее проводят путем удаления эфирного остатка соединения формулы (IIIc).
Настоящую стадию проводят тем же методом, который описан в стадии A2 метода А.
Желаемое соединение, полученное в каждой стадии, описанной выше, может быть очищено, если необходимо, путем обычных методов, например колоночной хроматографией, перекристаллизацией и переосаждением после реакции. Например, реакционную смесь соответственно нейтрализуют, к реакционной смеси добавляют растворитель для ее экстракции и растворитель отгоняют из экстракта. Осадок, полученный таким образом, очищают путем помещения на хроматографическую колонку с силикагелем с получением чистого продукта желаемого соединения.
Производные амидокарбоновой кислоты формулы (I), их фармакологически приемлемые соли или их фармакологически приемлемые эфиры, имеют прекрасные результаты по снижению глюкозы, снижению липидов, улучшению устойчивости к инсулину, ослаблению воспалительных заболеваний, иммунорегуляции, ингибированию альдозной редуктазы, ингибированию 5-липоксигеназы, подавлению перекисного окисления липидов, активированию PPAR (активирование рецептора пероксисомальной пролиферации) и ослаблению остеопороза и полезны в качестве профилактического и/или терапевтического агента (особенно терапевтического агента) при сахарном диабете, гиперлипемии, ожирении, при снижении толерантности к глюкозе, инсулиновой резистентности не-IGT, гипертонии, жировой печени, диабетических осложнениях (например, при ретинопатии, нефропатии, неврозе, катаракте, коронарных заболеваниях и тому подобное), артериосклерозе, сахарном диабете беременных, поликистозном синдроме яичника, повреждении клеток при атеросклерозе и ишемических заболеваниях сердца (например мозговые повреждения, вызванные апоплексией); при воспалительных заболеваниях, таких как эпифизарный остеомиелит, при боли, гипертермии, ревматическом артрите, воспалительном энтерите, угрях, солнечном ожоге, псориазе, экземе, аллергических заболеваниях, астме, гастроинтестинальных язвах, раке, кахексии, аутоиммунных заболеваниях и панкреатите; при остеопорозе; катарактах, тому подобное.
Производные амидокарбоновой кислоты формулы (I) настоящего изобретения, их фармакологически приемлемые соли и эфиры вводят в различных формах. Введение, в частности, не ограничено и определяется в зависимости от различных видов форм фармацевтических составов, возраста, пола и других условий, степени заболевания у пациента, тому подобное. Например, соединение может быть введено перорально в случае таблеток, пилюль, порошков, гранул, сиропов, растворов, суспензий, эмульсий, гранул и капсул. Тем временем, в случае инъекций, его вводят внутривенно одиночно или в смеси с применением раствора адъюванта, такого как глюкоза, аминокислота, тому пободное. Более того, при необходимости, оно может быть одиночно введено внутримышечно, внутрикожно, подкожно или внутрибрюшинно. В случае суппозиториев, оно вводится интраректально. Пероральное введение является предпочтительным. Различные виды этих фармацевтических составов могут быть получены с использованием известных адъювантов, применяемых в известной области фармацевтических составов, таких как эксципиенты, связывающие вещества, дезинтеграторы, смазывающие вещества, солюбилизаторы, модификаторы лекарственных веществ и покрывающие основное вещество агенты, в соответствии с обычными методами.
Когда настоящий компонент формуют в виде таблеток, могут быть широко использованы носители, известные специалистам в данной области и включающие эксципиенты, такие как лактоза, сахароза, хлорид натрия, глюкоза, мочевина, крахмал, карбонат кальция, каолин, кристаллическая целлюлоза и кремниевая кислота; связывающие вещества, такие как вода, этанол, пропанол, одиночный сироп, раствор глюкозы, раствор желатина, карбоксиметилцеллюлоза, шеллак, метилцеллюлоза, фосфат калия и поливинилпирролидон; дезинтеграторы, такие как сухой крахмал, альгинат натрия, агарозный порошок, порошок ламинарана, гидрокарбонат натрия, карбонат кальция, эфир полиоксиэтиленсоритана алифатической кислоты, лаурилсульфат натрия, моноглицерид стеариновой кислоты, крахмал и лактоза; агенты, препятствующие дезинтеграции, такие как сахароза, стеариновая кислота, масло какао и рафинированное масло; агенты, ускоряющие абсорбцию, такие как четвертичное аммонийное основание и лаурилсульфат натрия; увлажнители, такие как глицерин и крахмал; адсорбенты, такие как крахмал, лактоза, каолин, бентонит и коллоидная кремниевая кислота; и смазывающие вещества, такие как очищенный тальк, стеарат, порошок борной кислоты и полиэтиленгликоль. Далее, таблетки могут быть получены при необходимости в виде таблеток, на которые нанесена покрывающая пленка, например таблетка покрытая сахаром, таблетка покрытая желатином, тонкокишечная таблетка, таблетка покрытая пленкой, двухслойная таблетка или многослойная таблетка.
Когда настоящее соединение формируют в виде пилюль, могут быть широко использованы носители, известные специалистам в данной области и включающие, например, эксципиенты, такие как глюкоза, лактоза, крахмал, масло какао, рафинированное растительное масло, каолин и тальк; связывающие агенты, такие как порошок аравийской камеди, порошок трагаканта, желатин и этанол; и дезинтеграторы, такие как ламинарановый агар. Когда настоящее соединение формируют в виде суппозиториев, могут быть широко использованы носители, известные специалистам в данной области и включающие, например, полиэтиленгликоль, масло какао, высшие спирты, эфиры высших спиртов, желатин и полусинтетические глицериды.
В случае, когда настоящее соединение формируют в виде инъекции, предпочтительно чтобы растворитель и суспендирующие агенты были стерильны и изотоничны крови. Когда настоящее соединение формируют в виде растворов, эмульсий и суспензий, могут быть использованы все носители, известные специалистам в данной области и включающие, например, воду, этиловый спирт, пропиленгликоль, этоксилированный изостеариловый спирт, полиоксилированный изостеариловый спирт и полиоксиэтиленсоритан эфира алифатической кислоты. Кстати, в этом случае в фармацевтических составах может содержаться достаточное количество NaCl, глюкозы или глицерина, чтобы получить изоосмотический раствор. Далее, к ним могут быть также добавлены обычные агенты, улучшающие солюбилизацию, буфера и успокаивающие средства.
Более того, если необходимо, в них могут содержаться красители, консерванты, вкусовые агенты, подсластители и другие фармацевтические вещества.
Количество активного ингредиента, содержащегося в вышеуказанных фармацевтических препаратах, в частности, не ограничено и соответственно выбрано из широкого круга, и предпочтительно, чтобы содержание обычно составляло от 1 до 70% по массе во всех композициях, более предпочтительно от 1 до 30% по массе.
Несмотря на то что доза может меняться в зависимости от симптомов, возраста, массы тела, способа введения и формы фармацевтического препарата, его обычно вводят в количестве 0,001 мг (предпочтительно 0,01 мг, более предпочтительно, 0,1 мг) в качестве нижнего предела и 2000 мг (предпочтительно 200 мг, более предпочтительно 20 мг) в качестве верхнего предела, от одного до нескольких раз в день взрослому.
Наилучшие способы выполнения по
изобретению
Следующие примеры,
ссылочные примеры, примеры экспериментов и примеры получения даны далее в качестве иллюстрации данного изобретения и никоим образом не ограничивают
изобретение.
Все указанные1H-ЯМР спектры определялись в указанных растворителях, и химические сдвиги даны в единицах δ химического сдвига относительно внутреннего стандарта тетраметилсилана (TMS), константы межпротонного взаимодействия даны в герцах (Гц).
(Пример 1)
Этил
2-этокси-3-[4-[2-(4-пиридин-2- илбензоиламино)-этокси]фенил]пропионат (этиловый эфир иллюстративного
соединения N 1-35)
Гидразингидрат (80%, 0,125 мл) добавляли к раствору этил
2-этокси-3-[4-(2-фталоилиминоэтокси) фенил] пропионата (760 мг), который является продуктом ссылочного примера 1, в
метаноле (5 мл) и смесь оставляли стоять при комнатной температуре в течение 1,5
часов. По завершении этого времени реакционную смесь концентрировали. Остаток распределяли между этилацетатом и водой и
слои разделяли. Этилацетатный слой сушили над безводным сульфатом натрия и
концентрировали путем упаривания в вакууме с получением аминопроизводного.
Отдельно добавляли карбонилдиимидазол (400 мг) к суспензии 4-пиридин-2-илбензойной кислоты (400 мг) в безводном дихлорметане (10 мл) и смесь перемешивали при комнатной температуре в течение 1,5 часов с получением прозрачного раствора. К этому прозрачному раствору добавляли раствор аминопроизводного, полученного, как описано выше, в дихлорметане (5 мл), и смесь перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавляли 4-пиридин-2-илбензойную кислоту (200 мг) и карбонилдиимидазол (170 мг). Затем смесь оставляли стоять в течение ночи, реакционную смесь концентрировали путем упаривания в вакууме. Остаток распределяли между этилацетатом и водой и слои разделяли. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем, используя дихлорметан/метанол = 20/1 в качестве элюента с получением соединения, указанного в заголовке (135 мг) в виде смолы.
1 H-ЯМР (270 МГц, CDCl3): δ ppm 1,08-1,29 (6H, м), 2,95 (2H, д, J=6,5 Гц), 3,35 (1H, квинтуплет, J= 7,0 Гц), 3,60 (1H, квинтуплет, J=7,0 Гц), 3,83-4,30 (7H, м), 6,72 (1H, т, J=4,5 Гц), 6,86 (1H, т, J=8,5 Гц), 7,17 (2H, д, J=8,5 Гц), 7,25-7,40 (1H, м), 7,72-8, 01 (4H, м), 8,07 (2H, д, J=8,5 Гц), 8,70-8,80 (1H, м).
(Пример 2)
Натрий
2-этокси-3-[4-[2-(4-пиридин-2- илбензоиламино)-этокси]фенил]пропионат (иллюстративное соединения N
1-35)
К раствору этил 2-этокси-3-[4-[2-(4-пиридин-2- илбензоиламино)этокси] фенил]
пропионата (135 мг), который является продуктом примера 1, в метаноле (2 мл) добавляли водный раствор
гидроксида натрия (1 н., 0,55 мл). Смесь перемешивали при комнатной температуре в течение 2 часов.
По завершении этого времени метанол упаривали при пониженном давлении и к остатку добавляли водный
раствор соляной кислоты (1 н., 0,55 мл) и этилацетат. Этилацетатный слой разделяли и сушили над
безводным сульфатом магния и затем концентрировали при пониженном давлении с получением желаемого
соединения (121 мг) в виде смолы.
Водный раствор 1 н. гидроксида натрия (0,28 мл) добавляли к раствору желаемого продукта в метаноле (3 мл) и смесь концентрировали в вакууме с получением соединения, указанного в заголовке, (128 мг) в виде аморфного твердого продукта.
1H-ЯМР (270 МГц, дейтерированный диметилсульфоксид): δ ppm 1,00 (3H, т, J= 7,0 Гц), 2,66 (2H, дд, J-9,0, 14,0 Гц), 2,88 (2H, дд, J=3,5, 14,0 Гц), 3,42-3,70 (5H, м), 4,05-4, 13 (1H, м), 6,83 (2H, д, J=8,5 Гц), 7,14 (2H, д, J= 8,5 Гц), 7,32-41 (1H, м), 7,85-8,09 (4H, м), 8,17 (2H, д, J=8,5 Гц), 8,69 (1H, д, J=4,0 Гц), 8,80 (1H, т, J=5,5 Гц).
(Пример 3)
Этил 2-(3-фенилпропил)-3-[4-[2-(4-пиридин-2- илбензоиламино)-этокси] фенил]пропионат(этиловый
эфир иллюстративного соединения N 9-35)
Тем же способом, который описан в примере 1,
реакцию проводили, используя этил 2-(3-фенилпропил)-3-[4-(2- фталоилиминоэтокси) фенил] пропионат (1,50
г), который является продуктом ссылочного примера 2,4-пиридин-2-илбензойную кислоту (285 мг) и
карбонилдиимидазол (255 мг) и реакционную смесь обрабатывали с получением соединения, указанного в
заголовке, (984 мг) в виде смолы.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,14
(3H, т, J=7,0 Гц), 1,47-1,73 (4H, м), 2,50-2,70 (4H, м), 2,80-2,92 (1H, м), 3,89 (2H, дт, J=5,0, 5,0
Гц), 4,04 (2H, кв, J= 7,0 Гц), 4,15 (2H, т, J=5,0 Гц), 6,67 (1H, т, J=5,0 Гц), 6,84 (2H, д, J=8,5
Гц), 7,07 (2H, д, J=8,5 Гц), 7,10-7,20 (3H, м), 7,20-7,31 (3H, м), 7,73-7,79 (2H, м), 7,90 (2H, д,
J=8,5 Гц), 8,08 (2H, д, J-8,5 Гц), 8,71 (1H, д, J=5,0 Гц).
(Пример 4)
2-(3-фенилпропил)-3-[4-[2-(4-пиридин-2-илбензоиламино)-этокси] фенил] пропионовая кислота
(иллюстративное соединение N 9-35)
Тем же способом, который описан в примере 2, этил
2-(3-фенилпропил)-3-[4-[2-(4-пиридин- 2-илбензоиламино)этокси]-фенил]пропионат (767 мг), который является
продуктом примера 3, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 2,
86 мл) и реакционную смесь обрабатывали. Остаток кристаллизовали из смеси диизопропилового эфира и
этилацетата с получением соединения, указанного в заголовке, (361 мг) в виде бесцветных кристаллов.
Т.пл. 114-116oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,50-1,79
(4H, м), 2,57-2,75 (4H, м), 2,80-2,94 (1H, м), 3,85 (2H, кв, J=5,5 Гц), 4,13-4,20 (2H, м), 6,69 (1H, т,
J=5,5 Гц), 6,83 (2H, д, J=8,5 Гц), 7,07 (2H, д, J=8,5 Гц), 7,10-7,20 (3H, м), 7,22-7,32 (3H, м),
7,70-7,84 (4H, м), 7,97 (2H, д, J=8,5 Гц), 8,67-8,71 (1H, м).
(Пример 5)
Этил 2-(2-феноксиэтил)-3-[4-[2-(4-пиридин-2-илбензоиламино)-этокси] фенил] пропионат (этиловый эфир
иллюстративного соединения N 138-2)
Карбонилдиимидазол (272 мг) добавляли к суспензии
4-пиридин-2-илбензойной кислоты (279 мг) в дихлорметане (8 мл). Смесь перемешивали при комнатной
температуре в течение 30 минут с получением прозрачного раствора. К этому раствору добавляли раствор
этил 3-[4-(2-аминоэтокси)фенил]-2-(2-феноксиэтил)пропионата (476 мг), который является продуктом
ссылочного примера 3, в метиленхлориде (5 мл) и смесь перемешивали при комнатной температуре в течение
30 минут и оставляли на ночь. По завершении этого времени реакционную смесь концентрировали и
остаток распределяли между этилацетатом и водой. Этилацетатный слой отделяли и сушили над безводным
сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали с помощью
хроматографии на колонке с силикагелем, используя дихлорметан/этилацетат = 1/1 в качестве элюента, с
получением соединения, указанного в заголовке, (374 мг) в виде смолы.
1 H-ЯМР (270 МГц, CDCl3): δ ppm 1,14 (3H, т, J=7,0 Гц), 1,90-2,21 (2H, м), 2,76-3,10 (3H, м), 3,87-4,19 (8H, м), 6,65-6,69 (1H, м), 6,82-6,89 (4H, м), 6,93 (1H, т, J= 7,5 Гц), 7,12 (2H, д, J=8,5 Гц), 7,23-7,32 (3H, м), 7,76-7,83 (2H, м), 7,90 (2H, д, J=8,5 Гц), 8,09 (2H, д, J=8,5 Гц), 8,72-8,75 (1H, м).
(Пример 6)
2-(2-Феноксиэтил)-3-[4-[2-(4-пиридин-2- илбензоиламино)-этокси] фенил] пропионовая кислота (иллюстративное соединение N 138-2)
Водный
раствор гидроксида калия (85%, 0,13 г) добавляли к
раствору этил 2-(2-феноксиэтил)-3-[4-[2-(4-пиридин-2-илбензоиламино) этокси] фенил] пропионата (350 мг) в этаноле (8 мл). Смесь перемешивали при
80oC в течение 3 часов. По завершении этого
времени этанол упаривали при пониженном давлении. К остатку добавляли водный раствор соляной кислоты (1 н., 2,0 мл) и этилацетата. Этилацетатный
слой отделяли и сушили над безводным сульфатом магния,
и концентрировали при пониженном давлении с получением соединения, указанного в заголовке, (260 мг) в виде пенной массы.1H-ЯМР (270
МГц, CDCl3): δ ppm 1,93-2,22 (2H, м),
2,78-3,02 (3H, м), 3,86 (2H, дт, J=5,0, 5,5 Гц), 4,00-4,08 (2H, м), 4,16-4,21 (2H, м), 6,65-6,69 (1H, м), 6,82-6,97 (5H, м), 7,12 (2H, д, J=8,5
Гц), 7,22-7,34 (3H, м), 7,72-7,85 (4H, м), 7,97 (2H, д,
J=8,5 Гц), 8,68-8,71 (1H, м).
Водный раствор гидроксида натрия (1 н., 0,51 мл) добавляли к раствору пенной массы в этаноле (3 мл). Смесь концентрировали с получением твердого продукта, который промывали диэтиловым эфиром с получением соединения, указанного в заголовке, (203 мг) в виде аморфного твердого продукта.
(Пример 7)
Этил
2-фенокси-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]-фенил]пропионат (этиловый эфир иллюстративного соединения N 6-35)
Реакцию проводили тем же способом,
который описан в примере 5,
используя этил 3-[4-(2-аминоэтокси)фенил]-2-феноксипропионат (660 мг), который является продуктом ссылочного примера 4, 4-пиридин-2-илбензойную кислоту (428 мг) и
карбонилдиимидазол (418 мг) и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (367 мг) в виде белого порошка. Т.пл. 118,5-120oC.1H-ЯМР (270 МГц,
CDCl3): δ
ppm 1,19 (3H, т, J=7,0 Гц), 3,17-3,22 (2H, м), 3,89 (2H, дт, J=5,0, 5,5 Гц), 4,13-4,22 (4H, м), 4,74 (1H, дд, J= 5,5, 7,0 Гц), 6,63-6,69 (1H, м), 6,84 (2H, д, J=9,0 Гц), 6,
87 (2H, д, J= 9,0 Гц), 6,94
(1H, т, J=7,5 Гц), 7,20-7,30 (5H, м), 7,75-7,80 (2H, м), 7,90 (2H, д, J=8,5 Гц), 8,07 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=4,5 Гц).
(Пример 8)
2-Фенокси-3-[4-[2-(4-пиридин-2-илбензоиламино) этокси] -фенил] пропионовая кислота (иллюстративное соединение No. 6-35)
Тем же способом, который описан в примере 6, этил
2-фенокси-3-[4-[2-(4-пиридин-2-илбензоиламино) этокси]фенил]-пропионат (327 мг), который является продуктом примера 7, подвергали взаимодействию с водным раствором гидроксида калия (85%, 200 мг) и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (280 мг) в виде бесцветных кристаллов. Т.пл. 149-151oC.1H-ЯМР (270 МГц, CDCl3):
δ ppm 3,21 (2H, д, J=7,0 Гц), 3,87 (2H, дт, J=5,0, 5,5 Гц), 4,14-4,18 (2H, м), 4,73 (1H, т, J=7,0 Гц), 6,84-6,94 (6H, м), 7,19-7,31 (5H, м), 7,75-7,80 (2H, м), 7,88 (2H, д, J=8,5 Гц), 8,05 (2H,
д, J=8,5 Гц), 8,71 (1H, д, J=4,5 Гц).
(Пример 9)
Этил 2-(4-изопропилфенокси)-3-[4-[2-(4-пиридин-2- илбензоиламино) этокси] фенил] пропионат (этиловый эфир иллюстративного
соединения N 7-35)
Реакцию проводили тем же способом, который описан в примере 5, используя этил 3-[4-(2-аминоэтокси) фенил]-2-(4-изопропилфенокси)пропионат (13,52 г), который является
продуктом ссылочного примера 5,4-пиридин-2-илбензойную кислоту (7,97 г) и карбонилдиимидазол (6,49 г), и реакционную смесь обрабатывали, и затем остаток кристаллизовали из диизопропилового эфира с
получением соединения, указанного в заголовке, (8,38 г) в виде бесцветных кристаллов. Т. пл. 77-79oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,14-1,25 (9H, м), 2,72-2,
90 (1H, м), 3,12-3,19 (2H, м), 3,89 (2H, дт, J=5,0, 5,5 Гц), 4,11-4,22 (4H, м), 4,69 (1H, дд, J=5,5, 7,5 Гц), 6,65 (1H, ушир.т), 6,75 (2H, д, J= 8,5 Гц), 6,86 (2H, д, J=8,5 Гц), 7,08 (2H, д, J=8,5
Гц),
7,20-7,31 (3H, м), 7,76-7,81 (2H, м), 7,88 (2H, д, J=8,5 Гц), 8,07 (2H, д, J=8,5 Гц), 8,69-8,75 (1H, м).
(Пример 10)
2-(4-изопропилфенокси)-3-[4-[2-(4-пиридин-2- илбензоиламино)-этокси] фенил]пропионовая кислота (иллюстративное соединение N 7-35)
Тем же способом, который описан в примере 2, этил
2-(4-изопропилфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)-этокси] фенил] пропионат (8,38 г), который является продуктом примера 9, подвергали взаимодействию с водным раствором гидроксида натрия (1
н., 30,32 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (7,95 г) в виде белого порошка.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,16 (6H, д,
J=7,0 Гц), 2,70-2,88 (1H, м), 3,19 (2H, д, J=6,0 Гц), 3,80-3,89 (2H, м), 4,11-4,18 (2H, м), 4,77 (1H, т, J=6,0 Гц), 6,77-6,88 (5H, м), 7,07 (2H, д, J=8,5 Гц), 7,21 (2H, д, J= 8,5 Гц), 7,25-7,35 (1H,
м), 7,70 (1H, д, J=8,5 Гц), 7,75-7,86 (3H, м), 7,89 (2H, д, J=8,5 Гц), 8,70-8,77 (1H, м).
(Пример 11)
Этил
2-бутил-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]-фенил]пропионат
(этиловый эфир иллюстративного соединения N 4-35)
Реакцию проводили тем же способом, который описан в примере 5, используя
этил 3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (1,49 г), который
является продуктом ссылочного примера 6, 4-пиридин-2-илбензойную кислоту (996 мг) и карбонилдиимидазол (810 мг) и реакционную смесь
обрабатывали с получением соединения, указанного в заголовке, (1,04
г) в виде белого порошка. Т.пл. 112-115oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,86 (3H, т, J=6,
5 Гц), 1,16 (3H, т, J=7,0 Гц), 1,20-1,37 (4H, м), 1,39-1,68 (2H, м),
2,35-2,63 (1H, м), 2,68 (1H, дд, J=6,5, 13,5 Гц), 2,86 (1H, дд, J=8,5, 13,5 Гц), 3,89 (2H, т, J=5,0 Гц), 4,06 (2H, KB, J=7,0 Гц),
4,15 (2H, т, J=5,0 Гц), 6,66 (1H, ушир.с), 6,84 (2H, д, J=8,5 Гц), 7,
08 (2H, д, J=8,5 Гц), 7,21-7,31 (1H, м), 7,77-7,79 (2H, м), 7,89 (2H, д, J=8,5 Гц), 8,08 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=4,5
Гц).
(Пример 12)
2-бутил-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] -фенил] пропионовая кислота (иллюстративное соединение N 4-35)
Тем же способом, который описан
в примере 2, этил
2-бутил-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (0,92 г), который является продуктом примера 11, подвергали взаимодействию с водным раствором гидроксида натрия
(1 н., 3,80 мл) и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (1,06 г) в виде белого порошка. Т.пл. 137-139oC.1Н-ЯМР (270 МГц, CDCl3): δ ppm
0,87 (3H, т, J=7,0 Гц), 1,21-1,42 (4H, м), 1,45-1,70 (2H, м), 2,57-2,80 (1H, м), 2,70 (1H, дд, J=5,0, 13,5 Гц), 2,87 (1H, дд, J=9,0, 13,5 Гц), 3,86 (2H, т, J=5,0 Гц), 4,17 (2H,
т, J= 5,0 Гц), 6,77 (1H,
ушир.с), 6,83 (2H, д, J=8,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,23-7,38 (1H, м), 7,72-7,75 (2H, м), 7,79 (2H, д, J=8,5 Гц), 7,98 (2H, д, J=8,5 Гц), 8,70 (1H, д, J=4,5 Гц).
(Пример 13)
Этил 2-метил-2-(3-фенилпропил)-3-[4-[2-(4-пиридин-2-ил-бензоиламино)этокси]фенил]пропионат(этиловый эфир иллюстративного соединения N 37-3)
Реакцию проводили
тем же способом, который
описан в примере 5, используя этил 3-[4-(2-аминоэтокси)фенил]-2-метил-2-(3-фенилпропил)пропионат (796 мг), который является продуктом ссылочного примера 7,
4-пиридин-2-илбензойную кислоту (438 мг) и
карбонилдиимидазол (428 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (285 мг) в виде бесцветного масла.
1H-ЯМР (270 МГц, CDCl3): δ ppm 1,05 (3H, с), 1,24 (3H, т, J=7,0 Гц), 1,38-1,80 (4H, м), 2,56-2,65 (3H, м), 2,94 (1H, д, J=13,0 Гц), 3,89 (2H, дт, J=5,0, 5,5 Г), 4,07-4,18 (4H, м), 6,65 (1H, ушир.с), 6,80 (2H, д, J=8,5 Гц), 6,99 (2H, д, J=8,5 Гц), 7,14-7,30 (6H, м), 7,75-7,79 (2H, м), 7,89 (2H, д, J=8,5 Гц), 8,08 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=5,0 Гц).
(Пример 14)
Hатрий
2-метил-2-(3-фенилпропил)-3-[4-[2-(4- пиридин-2-ил-бензоиламино)этокси]фенил]пропионат (иллюстративное соединение N 37-3)
Тем же способом, который
описан в примере 6, этил
2-метил-2-(3-фенилпропил)-3-[4-[2-(4-пиридин-2-илбензоиламино)-этокси] фенил] пропионат (0,131 мг), который является продуктом примера 13, подвергали взаимодействию с водным
раствором гидроксида калия
(85%, 0,24 г), и реакционную смесь обрабатывали. Остаток подвергали хроматографии на колонке с силикагелем, используя дихлорметан/метанол = 20/1 в качестве элюента, с
получением желаемого соединения.
Водный раствор гидроксида натрия (1 н., 0,37 мл) добавляли к желаемому соединению, и смесь концентрировали с получением твердого продукта. Твердый продукт промывали
диизопропиловым эфиром с получением
соединения, указанного в заголовке, (177 мг) в виде белого порошка. Т.пл. 108-111oC.1H-ЯМР (270 МГц, дейтерированный диметилсульфоксид):
δ ppm 1,01 (3H, с), 1,15-1,85 (4H,
м), 2,55-2,78 (3H, м), 3,03 (1H, д, J=13,0 Гц), 3,71-3,93 (2H, м), 4,13-4,38 (2H, м), 6,97 (2H, д, J=8,5 Гц), 7,21-7,69 (8H, м), 8,08-8,45 (6H, м), 8,86-8,98
(1H, м), 9,09-9,15 (1H, м).
(Пример 15)
Этил 2-метил-2-фенокси-3-[4-[2-(4-пиридин-2- илбензоиламино)-этокси] фенил] пропионат (этиловый эфир иллюстративного соединения N
33-3)
Реакцию проводили тем
же способом, который описан в примере 5, используя этил 3-[4-(2-аминоэтокси)фенил]-2-метил-2-феноксипропионат (760 мг), который является продуктом ссылочного
примера 8, 4-пиридин-2-илбензойную кислоту
(460 мг) и карбонилдиимидазол (440 мг) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (930 мг) в виде сиропа.
1H-ЯМР (270 МГц, CDCl3): δ ppm 1,22 (3H, т, J=7,0 Гц), 1,40 (3H, с), 3,11 (1H, д, J=14,0 Гц), 3,29 (1H, д, J=14,0 Гц), 3,89 (2H, дт, J=5,0, 5,5 Гц), 4,10-4,25 (2H, м), 4,18 (2H, кв, J=7,0 Гц), 6,71 (1H, ушир.с), 6,75-6,86 (4H, м), 6,97 (1H, т, J=7,0 Гц), 7,13-7,33 (5H, м), 7,74-7,84 (2H, м), 7,89 (2H, д, J=8,5 Гц), 8,07 (2H, д, J=8,5 Гц), 8,71 (1H, д, J=5, 0 Гц).
(Пример 16)
2-Метил-2-фенокси-3-[4-[2-(4-пиридин-2-илбензоиламино)-этокси] фенил] пропионовая кислота (иллюстративное соединение N 33-3)
Тем же способом,
который описан в примере 2, этил
2-метил-2-фенокси-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] -фенил]пропионат (930 мг), который является продуктом примера 15, подвергали взаимодействию с водным
раствором гидроксида натрия (1 н., 3,
60 мл) при 70oC и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (545 мг) в виде белого порошка. Т.пл. 76-79oC.1H-ЯМР (270 МГц,
CDCl3): δ ppm 1,44 (3H, с), 3,15 (1H, д, J=14,0 Гц), 3,28 (1H, д, J=14,0 Гц), 3,87 (2H, т, J=5,0 Гц), 4,16 (2H, т, J= 5,0 Гц), 6,75 (1H,
ушир.с), 6,84 (2H, д, J=8,5 Гц), 6,92 (2H, д,
J=8,5 Гц), 6,97 (1H, т, J=7,0 Гц), 7,15-7,34 (5H, м), 7,70-7,88 (4H, м), 7,97 (2H, д, J=8,5 Гц), 8,73 (1H, д, J=4,0 Гц).
(Пример 17)
Этил
2-(4-изопропилфенокси)-2-метил-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил] пропионат (этиловый эфир иллюстративного соединения N 34-3)
Реакцию проводили тем же способом,
который описан
в примере 5, используя этил 3-[4-(2-аминоэтокси)фенил]-2-(4-изопропилфенокси)-2-метилпропионат (510 мг), который является продуктом ссылочного примера 9, 4-пиридин-2- илбензойную
кислоту (279 мг) и
карбонилдиимидазол (272 мг) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (487 мг) в виде бесцветного масла.1H-ЯМР (270 МГц,
CDCl3): δ
ppm 1,19 (6H, д, J=7,0 Гц), 1,23 (3H, т, J=7,0 Гц), 1,37 (3H, с), 2,83 (1H, септет, J=7,0 Гц), 3,10 (1H, д, J= 13,5 Гц), 3,26 (1H, д, J=13,5 Гц), 3,90 (2H, дт, J=5,0, 5,0
Гц), 4,17 (2H, т, J= 5,0 Гц),
4,21 (2H, кв, J=7,0 Гц), 6,69 (1H, ушир.т, J=5,0 Гц), 6,75 (2H, д, J=8,5 Гц), 6,86 (2H, д, J=8,5 Гц), 7,06 (2H, д, J=8,5 Гц), 7,19 (2H, д, J=8,5 Гц), 7,25-7,32 (1H, м),
7,76-7,79 (2H, м), 7,89 (2H, д,
J=8,5 Гц), 8,07 (2H, д, J=8,5 Гц), 8,71-8,73 (1H, м).
(Пример 18)
2-(4-Изопропилфенокси)-2-метил-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил]пропионовая кислота
(иллюстративное соединение N 34-3)
Тем же способом, который описан в примере 6, этил
2-(4-изопропилфенокси)-2-метил-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионат (486 мг),
который является продуктом примера 17, подвергали взаимодействию с водным раствором гидроксида
калия (85%, 0,17 г) и реакционную смесь обрабатывали. Остаток промывали диизопропиловым эфиром с
получением соединения, указанного в заголовке, (335 мг) в виде белого порошка. Т.пл. 141-143oC.
1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (6H, д, J=7, 0 Гц), 1,43 (3H, с), 2,84 (1H, септет, J-7,0 Гц), 3,15 (1H, д, J=14,0 Гц), 3,25 (1H, д, J=14,0 Гц), 3,83-3,93 (2H, м), 4,17 (2H, т, J=5,0 Гц), 6,70 (1H, ушир.т, J=6,0 Гц), 6,85 (2H, д, J=8,5 Гц), 6,86 (2H, д, J=8,5 Гц), 7,09 (2H, д, J-8,5 Гц), 7,21 (2H, д, J=8,5 Гц), 7,27-7,33 (1H, м), 7,72-7, 80 (2H, м), 7,83 (2H, д, J=8,5 Гц), 8,00 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=4,5 Гц).
(Пример 19)
Этил 2-бутил-2-метил-3-[4-[2-(4-пиридин-2- илбензоиламино)-этокси]фенил]
пропионат (этиловый эфир иллюстративного соединения N 30-3)
Реакцию проводили тем же способом,
который описан в примере 5, используя этил 3-[4-(2- аминоэтокси)
фенил]-2-бутил-2-метилпропионат (2,42 г), который является продуктом ссылочного примера 10, 4-пиридин-2-илбензойную кислоту (1,72 г) и
карбонилдиимидазол (1,69 г), и реакционную смесь обрабатывали с
получением соединения, указанного в заголовке, (970 мг) в виде белого порошка.1H-ЯМР (270 МГц, CDCl3): δ
ppm 0,89 (3H, т, J=7,0 Гц), 1,06 (3H, с), 1,12-1,46 (8H, м), 1,
60-1,77 (1H, м), 2,63 (1H, д, J=13,5 Гц), 2,97 (1H, д, J= 13,5 Гц), 3,86-3,93 (2H, м), 4,07-4,18 (4H, м), 6,68 (1H, ушир.т, J=5,0 Гц), 6,
82 (2H, д, J= 8,5 Гц), 7,03 (2H, д, J=8,5 Гц), 7,24-7,31 (1H,
м), 7,76-7,80 (2H, м), 7,89 (2H, д, J=8,5 Гц), 8,08 (2H, д, J=8,5 Гц), 8,71-8,73 (1H, м).
(Пример 20)
2-Бутил-2-метил-3-[4-[2-(4-пиридин-2-илбензоиламино) этокси] -фенил]
пропионовая кислота (иллюстративное соединение N 30-3)
Тем же способом, который описан в примере 6, этил
2-бутил-2-метил-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] -фенил]пропионат (350 мг),
который является продуктом примера 19, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 2,00
мл) и водным раствором гидроксида калия (85%, 0,1 г) и реакционную смесь
обрабатывали. Остаток подвергали хроматографии на колонке с силикагелем, используя дихлорметан/метанол = 19/1 в качестве
элюента, с получением твердого продукта, который промывали смесью
диизопропилового эфира и гексана с получением соединения, указанного в заголовке, (133 мг) в виде белого порошка. Т.пл. 105,5- 107,
5oC.1H-ЯМР (270 МГц, CDCl3):
δ ppm 0,91 (3H, т, J=7,0 Гц), 1,09 (3H, с), 1,20-1,48 (5H, м), 1,66-1,78 (1H, м), 2,64 (1H, д, J-13,5 Гц), 3,00 (1H, д, J=13,5 Гц),
3,83-3,93 (2H, м), 4,09-4,18 (2H, м), 6,79-6,83 (1H, м), 6,
81 (2H, д, J=8,5 Гц), 7,07 (2H, д, J= 8,5 Гц), 7,25-7,32 (1H, м), 7,73-7,83 (2H, м), 7,87 (2H, д, J=8,5 Гц), 8,03 (2H, д, J=8,5 Гц), 8,71
(1H, д, J=5,0 Гц).
(Пример 21)
Этил
3-[4-[2-(бифенил-4-карбониламино)этокси] фенил] -2-бутилпропионат (этиловый эфир иллюстративного соединения N 4-15)
Реакцию
проводили тем же способом,
который описан в примере 5, используя
этил 3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (666 мг), который является продуктом ссылочного примера 6, бифенил-4-карбоновую
кислоту (450 мг) и карбонилдиимидазол (442 мг), и реакционную смесь
обрабатывали с получением соединения, указанного в заголовке, (705 мг) в виде желтого порошка. Т.пл. 89-90oC.1
H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0
Гц), 1,16 (3H, т, J= 7,0 Гц), 1,22-1,32 (4H, м), 1,40-1,69 (2H, м), 2,53-2,63 (1H, м), 2,69 (1H, дд, J=6,5, 13,5 Гц), 2,86 (1H, дд,
J-8,5, 13,5 Гц), 3,89 (2H, кв, J-5,0 Гц), 4,07 (2H, кв, J=7,0 Гц),
4,15 (2H, т, J=5,0 Гц), 6,63 (1H, т, J=5,0 Гц), 6,85 (2H, д, J= 8,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,37-7,50 (3H, м), 7,60-7,68 (4H, м),
7,86 (2H, д, J=8,5 Гц).
(Пример 22)
3-[4-[2-(Бифенил-4-карбониламино)этокси] фенил] -2-бутил-пропионовая кислота (иллюстративное соединение N 4-15)
Тем же способом,
который описан в примере 2, этил
3-[4-[2-(бифенил-4-карбониламино)этокси] фенил] -2-бутилпропионат (450 мг), который является продуктом примера 21, подвергали взаимодействию с водным раствором
гидроксида натрия (1 н., 3,00 мл) и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (388 мг) в виде белого порошка. Т.пл. 130- 131oC.1H-ЯМР (270
МГц, CDCl3): δ
ppm 0,88 (3H, т, J=7,0 Гц), 1,25-1,43 (4H, м), 1,46-1,73 (2H, м), 2,58-2,66 (1H, м), 2,72 (1H, дд, J=6,5, 13,5 Гц), 2,89 (IH, дд, J=8,5, 13,5 Гц), 3,87 (2H, кв, J=5,0
Гц), 4,13 (2H, т, J= 5,0 Гц), 6,
71 (1H, т, J=5,0 Гц), 6,84 (2H, д, J=8,5 Гц), 7,10 (2H, д, J=8,5 Гц), 7,35-7,49 (3H, м), 7,58-7,70 (4H, м), 7,85 (2H, д, J=8,5 Гц).
(Пример 23)
Этил 2-бутил-3-[4-[2-(4'
-метоксибифенил-4- карбониламино)-этокси]фенил] пропионат(этиловый эфир иллюстративного соединения N 4-179)
Реакцию проводили тем же способом, который описан в
примере 5, используя этил
3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (540 мг), который является продуктом ссылочного примера 6, 4'-метоксибифенил-4-карбоновую кислоту (420 мг) и карбонилдиимидазол
(370 мг), и реакционную
смесь обрабатывали с получением соединения, указанного в заголовке, (486 мг) в виде белого порошка. Т.пл. 121-123oC.1H-ЯМР (270 МГц, CDCl3):
δ ppm 0,87 (3H, т,
J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,21-1,38 (4H, м), 1,42-1,70 (2H, м), 2,51-2,72 (2H, м), 2,80-2,92 (IH, м), 3,86 (3H, с), 3,87-3,92 (2H, м), 4,07 (2H, кв, J=7,0 Гц), 4,14
(2H, т, J=5,0 Гц), 6,62
(1H, т, J=5,5 Гц), 6,84 (2H, д, J=8,5 Гц), 7,00 (2H, д, J=8,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц), 7,62 (2H, д, J=8,5 Гц), 7,83 (2H, д, J=8,5 Гц).
(Пример 24)
2-Бутил-3-[4-[2-(4'-метоксибифенил-4-карбониламино)этокси]-фенил]пропионовая кислота (иллюстративное соединение N 4-179)
Тем же способом, который описан в
примере 2, этил
2-бутил-3-[4-[2-(4'-метоксибифенил-4-карбониламино)этокси]-фенил]пропионат (400 мг), который является продуктом примера 23, подвергали взаимодействию с водным раствором гидроксида
натрия (1 н., 4,00
мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (350 мг) в виде бледно-оранжевого порошка. Т. пл. 166,5-168oC.1H-ЯМР
(270 МГц, CDCl3): δ ppm 0,87 (3H, т, J= 7,0 Гц), 1,23-1,40 (4H, м), 1,43- 1,71 (2H, м), 2,57-2,78 (2H, м), 2,85-2,97 (1H, м), 3,86 (3H, с), 3,82-3,90 (2H, м), 4,13 (2H, т, J=5,0 Гц),
6,69 (1H, т, J= 5,
5 Гц), 6,83 (2H, д, J=8,5 Гц), 6,98 (2H, д, J=8,5 Гц), 7,10 (2H, д, J= 8,5 Гц), 7,55 (2H, д, J=8,5 Гц), 7,60 (2H, д, J=8,5 Гц), 7,81 (2H, д, J= 8,5 Гц).
(Пример
25)
Этил
2-бутил-3-[4-[2-(4'-гидроксибифенил-4-карбониламино)-этокси]фенил] пропионат(этиловый эфир иллюстративного соединения N 4-206)
К суспензии 4'-гидроксибифенил-4-карбоновой
кислоты (383 мг) в
дихлорметане (10 мл) при комнатной температуре добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (359 мг) и 1- гидроксибензотриазолмоногидрат (287 мг). Смесь
перемешивали в течение 4
часов при комнатной температуре. Затем в реакционную смесь добавляли раствор этил 3-[4-(2-аминоэтокси)фенил] -2-бутилпропионата (500 мг), который является продуктом ссылочного
примера 6, в
дихлорметане (10 мл). Смесь перемешивали при комнатной температуре в течение 2 часов и затем оставляли на ночь. По завершении этого времени реакционную смесь концентрировали путем
упаривания. Остаток
распределяли между этилацетатом и водой. Слои отделяли. Этилацетатный слой промывали водным раствором соляной кислоты (0,5 н.), насыщенным водным раствором бикарбоната натрия и
насыщенным водным
раствором хлорида натрия, и сушили над безводным сульфатом магния, и затем концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем,
используя в
качестве элюента дихлорметан/этилацетат = 5/1, с получением соединения, указанного в заголовке, (270 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ
ppm 0,86 (3H,
т, J=7,0 Гц), 1,15 (3H, т, J=7,0 Гц), 1,21-1,37 (4H, м), 1,40-1,70 (2H, м), 2,55-2,64 (1H, м), 2,68 (1H, дд, J= 6,5, 13,5 Гц), 2,86 (1H, дд, J=8,5, 13,5 Гц), 3,88 (2H, кв, J=5,0 Гц), 4,
05 (2H, KB,
J=7,0 Гц), 4,14 (2H, т, J=5,0 Гц), 6,36 (1H, ушир.с), 6,65 (1H, т, J= 5,0 Гц), 6,83 (2H, д, J=8,5 Гц), 6,93 (2H, д, J=8,5 Гц), 7,08 (2H, д, J= 8,5 Гц), 7,49 (2H, д, J=8,5 Гц), 7,60 (2H, д,
J=8,5 Гц),
7,82 (2H, д, J=8,5 Гц).
(Пример 26)
2-Бутил-3-[4-[2-(4'-гидроксибифенил-4-карбониламино) этокси] -фенил] пропионовая кислота (иллюстративное соединение N 4-206)
Тем
же способом, который описан в примере 2, этил 2-бутил-3-[4-[2-(4'-гидроксибифенил-4-карбониламино)этокси] -фенил] пропионат (260 мг), который является продуктом примера 25, подвергали
взаимодействию
с водным раствором гидроксида натрия (1 н., 2,20 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (230 мг) в виде белого порошка. Т. пл. 182-184oC.1H-ЯМР (270 МГц, дейтерированный диметилсульфоксид): δ ppm 0,79 (3H, т, J=6,5 Гц), 1,15-1,30 (4H, м), 1,34-1,53 (2H, м), 2,40-2,50 (1H, м), 2,57 (1H, дд, J=6,0, 13,5 Гц), 2,
71 (1H,
дд, J-8,5, 13,5 Гц), 3,59 (2H, кв, J=5,5 Гц), 4,05 (2H, т, J-5,5 Гц), 6,83 (4H, д, J=8,5 Гц), 7,06 (2H, д, J= 8,5 Гц), 7,53 (2H, д, J=8,5 Гц), 7,63 (2H, д, J=8,5 Гц), 7,87 (2H, д, J= 8,5 Гц),
8,63
(1H, т, J=5,5 Гц), 9,61 (1H, с).
(Пример 27)
2-Бутил-3-[4-[2-(4'-формилбифенил-4-карбониламино)этокси] -фенил] пропионовая кислота (иллюстративное соединение N 4-207)
Тем же способом, который описан в примере 2, этил 2-бутил-3-[4-[2-(4'-диметоксиметилбифенил-4-карбониламино)-этокси] фенил]пропионат (1,88 г), который является продуктом ссылочного примера 11,
подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 6,80 мл), и реакционную смесь обрабатывали с получением
2-бутил-3-[4-[2-(4'- диметоксиметилбифенил-4-карбониламино)этокси]фенил]-пропионовой кислоты (1,78 г) в виде бледно-коричневого твердого продукта.
К раствору этого соединения (521 мг) в ацетоне (15 мл) добавляли воду (0,17 мл) и затем при комнатной температуре добавляли amberlyst 15 (100 мг). Смесь оставляли стоять в течение 40 минут. Amberlyst 15 удаляли путем фильтрации и фильтрат концентрировали. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента дихлорметан/метанол = 20/1 с получением соединения, указанного в заголовке, (336 мг) в виде белого твердого продукта. Т.пл. 122-124oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,88 (3H, т, J= 7,0 Гц), 1,20-1,37 (4H, м), 1,40-1,59 (1H, м), 1,61-1, 71 (1H, м), 2,58-2,69 (1H, м), 2,72 (1H, дд, J=6,5, 13,5 Гц), 2,90 (1H, дд, J=8,5, 13,5 Гц), 3,89 (2H, кв, J=5,0 Гц), 4,15 (2H, т, J=5,0 Гц), 6,71 (1H, ушир.т), 6,84 (2H, д, J=8,5 Гц), 7,11 (2H, д, J=8,5 Гц), 7,69 (2H, д, J=8,5 Гц), 7,76 (2H, д, J= 8,5 Гц), 7,89 (2H, д, J=8,5 Гц), 7,97 (2H, д, J=8,5 Гц), 10,08 (1H, с).
(Пример 28)
2-Бутил-3-[4-[2-(4'-гидроксиметилбифенил-4- карбониламино)-этокси]фенил] пропионовая кислота (иллюстративное соединение N 4-211)
К раствору
2-бутил-3-[4-[2-(4'-формилбифенил-4- карбониламино)этокси] фенил] пропионовой кислоты (366 мг) в этаноле (10 мл) при комнатной температуре добавляли боргидрид натрия (95%, 34 мг). Смесь перемешивали
в
течение 1,5 часов. По завершении этого времени в реакционную смесь добавляли 50% уксусную кислоту. Смесь концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и водой.
Этилацетатный слой отделяли и промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. К остатку добавляли
диизопропиловый эфир с получением соединения, указанного в заголовке, (331 мг) в виде бесцветных кристаллов. Т.пл. 111-113oC1H-ЯМР (270 МГц, дейтерированный метанол): δ
ppm 0,88 (3H, т, J=7,0 Гц), 1,22-1,39 (4H, м), 1,40-1,65 (2H, м), 2,52-2,61 (1H, м), 2,67 (1H, дд, J=6,5, 13,5 Гц), 2,86 (1H, дд, J=8,0, 13,5 Гц), 3,80 (2H, т, J=5,5 Гц), 4,16 (2H, т, J=5,5 Гц), 4,68
(2H, с), 6,87 (2H, д, J=8,5 Гц), 7,10 (2H, д, J=8,5 Гц), 7,46 (2H, д, J= 8,5 Гц), 7,63 (2H, д, J=8,5 Гц), 7,70 (2H, д, J=8,5 Гц), 7,90 (2H, д, J=8,5 Гц).
(Пример 29)
2-Бутил-3-[4-[2-(4'-диметиламинометилбифенил-4-карбонил-амино)этокси]фенил]пропионовая кислота (иллюстративное соединение N 4-208)
К триэтиламину (0,56 мл), диметиламиногидрохлориду (167 мг)
и тетраизопропоксиду титана (0,59 мл) добавляли суспензию 2-бутил-3-[4-[2-(4'-формилбифенил-4-карбониламино)этокси] -фенил] пропионовой кислоты (474 мг) в этаноле (20 мл) при комнатной температуре с
получением прозрачного раствора. В раствор добавляли натрий боргидрид (60 мг) и смесь перемешивали в атмосфере азота в течение 18 часов. По завершении этого времени в реакционную смесь добавляли 50%
уксусную кислоту. Эту смесь концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и водой. Этилацетатный слой отделяли и промывали насыщенным водным раствором хлорида
натрия
и сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. К остатку добавляли диизопропиловый эфир с получением соединения, указанного в заголовке, (135 мг) в
виде
бесцветных кристаллов. Т.пл. 125- 127oC.1H-ЯМР (400 МГц, дейтерированный метанол): δ ppm 0,87 (3H, т, J= 6,5 Гц), 1,22-1,38 (4H, м), 1,41-1,62 (2H, м), 2,50-2,59
(1H, м),
2,66 (1H, дд, J=6,0, 13,5 Гц), 2,82 (1H, дд, J=8,5, 13,5 Гц), 2,86 (6H, с), 3,78 (2H, т, J=5,5 Гц), 4,15 (2H, т, J=5,5 Гц), 4,33 (2H, с), 6,87 (2H, д, J=8,5 Гц), 7,10 (2H, д, J=8,5 Гц), 7,60
(2H, д,
J=8,5 Гц), 7,76 (2H, д, J=8,5 Гц), 7,81 (2H, д, J=8,5 Гц), 7,93 (2H, д, J=8,5 Гц).
(Пример 30]
2-Бутил-3-[4-[2-(4'-карбоксибифенил-4-карбониламино)-этокси]фенил]пропионовая
кислота (иллюстративное соединение N 4-210)
Тем же способом, который описан в примере 2, этил
2-бутил-3-[4-[2-(4'-метоксикарбонилбифенил-4-карбониламино)-этокси] фенил] пропионат (243 мг),
который является продуктом ссылочного примера 12, подвергали взаимодействию с водным раствором
гидроксида натрия (1 н., 1,83 мл), и реакционную смесь обрабатывали с получением соединения, указанного в
заголовке, (163 мг) в виде белого порошка. Т.пл. 199-201oC.1H-ЯМР (270
МГц, дейтерированный диметилсульфоксид): δ ppm 0,83 (3H, т, J=6,5 Гц), 1,18-1,31 (4H, м), 1,37-1,52
(2H, м), 2,40- 2,50 (1H, м), 2,61 (1H, дд, J=6,0, 13,5 Гц), 2,74 (IH, дд, J= 8,5, 13,5 Гц),
3,66 (2H, т, J=5,5 Гц), 4,10 (2H, т, J=5,5 Гц), 6,87 (2H, д, J= 8,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,85 (2H, д,
J=8,0 Гц), 7,87 (2H, д, J= 8,0 Гц), 7,99 (2H, д, J=8,5 Гц), 8,05 (2H, дд, J=2,5, 8,5 Гц),
8,78 (1H, д, J=5,5 Гц).
(Пример 31)
Этил
2-бутил-3-[4-[2-(3'-метоксибифенил-4-карбониламино)-этокси] фенил] пропионат (этиловый эфир иллюстративного соединения N 4-212)
Реакцию проводили тем же способом, который описан в примере 5,
используя этил 3-[4-(2- аминоэтокси) фенил]-2-бутилпропионат (620 мг), который является продуктом ссылочного примера 6,
3'-метоксибифенил-4-карбоновую кислоту (456 мг) и карбонилдиимидазол (389 мг), и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (740 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,
16 (3H, т, J= 7,0 Гц), 1,21-1,31 (4H, м), 1,41-1,68 (2H, м), 2,53-2,64 (1H, м), 2,69 (1H, дд, J=6,5, 13,5 Гц), 2,
86 (1H, дд, J=8,5, 13,5 Гц), 3,87 (3H, с), 3,88 (2H, кв, J= 5,0 Гц), 4,05 (2H, кв, J=7,
0 Гц), 4,15 (2H, т, J=5,0 Гц), 6,62 (1H, т, J=5,0 Гц), 6,84 (2H, д, J=8,5 Гц), 6,92-6,95 (1H, м), 7,09 (2H, д,
J= 8,5 Гц), 7,11-7,14 (1H, м), 7,18-7,21 (1H, м), 7,38 (1H, т, J=8,0 Гц), 7,65 (2H, д,
J=8,5 Гц), 7,85 (2H, д, J=8,5 Гц).
(Пример 32)
2-Бутил-3-[4-[2-(3'-метоксибифенил-4-карбониламино)этокси] -фенил] пропионовая кислота (иллюстративное соединение N 4-212)
Тем же способом, который описан в примере 2, этил
2-бутил-3-[4-[2-(3'-метоксибифенил-4-карбониламино)этокси]-фенил]пропионат (730 мг), который является продуктом примера 31, подвергали
взаимодействию с водным раствором гидроксида натрия (1 н., 4,50
мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (520 мг) в виде белого порошка. Т. пл. 107-109oC.1H-ЯМР (270 МГц, CDCl3):
δ ppm 0,87 (3H, т, J=7,0 Гц), 1,21-1,38 (4H, м), 1,45- 1,71 (2H, м), 2,58-2,67 (IH, м), 2,71 (1H, дд, J-6,5, 13,5 Гц), 2,90 (1H, дд, J=8,
5, 13,5 Гц), 3,83-3,90 (5H, м), 4,13 (2H, т, J=5,0 Гц),
6,71 (1H, т, J=5,0 Гц), 6,83 (2H, д, J=8,5 Гц), 6,93 (1H, дд, J=2,5, 8,0 Гц), 7,10 (2H, д, J=8,5 Гц), 7,12 (1H, д, J=2,5 Гц), 7,18 (2H, д, J= 8,
0 Гц), 7,37 (IH, т, J=8,0 Гц), 7,64 (2H, д, J-8,5 Гц),
7,85 (2H, д, J= 8,5 Гц).
(Пример 33)
Этил 2-бутил-3-[4-[2-(3'-гидроксибифенил-4- карбониламино)-этокси]фенил] пропионат
(этиловый эфир иллюстративного соединения N 4-213)
Реакцию проводили тем же способом, который описан в примере 25, используя этил 3-[4-(2- аминоэтокси)фенил]-2-бутилпропионат (678 мг),
который является продуктом ссылочного примера 6,
3'-гидроксибифенил-4-карбоновую кислоту (450 мг), которая является продуктом ссылочного примера 13,
1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (443 мг) и 1-гидроксибензотриазолмоногидрат
(354 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (291 мг) в
виде белого порошка. Т.пл. 76-77,5oC.1H-ЯМР (270 МГц, CDCl3):
δ ppm 0,86 (3H, т, J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,21-1,36 (4H, м), 1,40-1,69 (2H, м), 2,
52-2,65 (1H, м), 2,68 (1H, дд, J=6,5, 13,5 Гц), 2,86 (1H, дд, J=8,5, 13,5 Гц), 3,89 (2H, кв, J=5,0
Гц), 4,06 (2H, кв, J=7,0 Гц), 4,14 (2H, т, J=5,0 Гц), 6,10 (1H, с), 6,70 (1H, т, J=5,0 Гц), 6,83 (2H,
д, J=8,5 Гц), 6,83-6,91 (1H, м), 7,08 (2H, д, J= 8,5 Гц), 7,09-7,16 (2H, м), 7,31 (1H, т, J=8,0
Гц), 7,58 (2H, д, J=8,5 Гц), 7,83 (2H, д, J=8,5 Гц).
(Пример 34)
2-Бутил-3-[4-[2-(3'-гидроксибифенил-4-карбониламино)этокси]-фенил]пропионовая кислота (иллюстративное
соединение N 4-213)
Тем же способом, который описан в примере 2, этил
2-бутил-3-[4-[2-(3'-гидроксибифенил-4-карбониламино)этокси] -фенил] пропионат (350 мг), который является продуктом
примера 33, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 2,
85 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (290 мг) в виде белого
порошка. Т. пл. 98-100oC.1H-ЯМР (270 МГц, CDCl3):
δ ppm 0,84-0,89 (3H, м), 1,21-1,40 (4H, м), 1,45-1,68 (2H, м), 2,51-2,90 (3H, м), 3,80-3,88 (2H, м), 4,12-4,
20 (2H, м), 6,82-6,92 (3H, м), 7,04-7,15 (4H, м), 7,27 (1H, т, J=8,0 Гц), 7,55-7,70
(3H, м), 7,90 (2H, д, J=8,0 Гц), 8,91-9,08 (1H, ушир. с).
(Пример 35)
2-Бутил-3-[4-[2-(3'-формилбифенил-4- карбониламино)этокси] -фенил] пропионовая кислота (иллюстративное
соединение N 4-214)
Тем же способом, который описан в примере 27, этил
2-бутил-3-[4-[2-(3'-диметоксиметилбифенил-4-карбониламино)-этокси] фенил]пропионат (1,46 г), который является продуктом
ссылочного примера 14, подвергали взаимодействию с водным раствором гидроксида
натрия (1 н., 5,40 мл), и реакционную смесь обрабатывали с получением
2-бутил-3-[4-[2-(3'-диметоксиметилбифенил-4-карбониламино)этокси]фенил]-пропионовой кислоты (1,39 г) в виде сиропа. Это
соединение (365 мг) вступало в реакцию и реакционную смесь обрабатывали тем же
способом, который описан в примере 27, с получением соединения, указанного в заголовке, (335 мг) в виде
желтовато-коричневого твердого продукта.1H-ЯМР (270 МГц, CDCl3): δ
ppm 0,88 (3H, т, J=6,5 Гц), 1,18-1,38 (4H, м), 1,40-1,78 (2H, м), 2,61-2,68 (1H, м), 2,73 (1H, дд, J=6,
5, 13,5 Гц), 2,92 (1H, дд, J= 8,0, 13,5 Гц), 3,89 (2H, кв, J=5,0 Гц), 4,15 (2H, т, J=5,0 Гц), 6,
69 (1H, ушир. т), 6,85 (2H, д, J=8,5 Гц), 7,11 (2H, д, J=8,5 Гц), 7,64 (1H, т, J-8,0 Гц), 7,69 (2H, д,
J=8,5 Гц), 7,86-7,91 (2H, м), 7,89 (2H, д, J=8,5 Гц), 8,12 (1H, с), 10,10 (1H, с).
(Пример 36)
Натрий 2-бутил-3-[4-[2-(3'-гидроксиметилбифенил-4-карбонил-амино)этокси]
фенил]пропионовая кислота (иллюстративное соединение N 4-218)
К суспензии натрия
2-бутил-3-[4-[2-(3'-метоксиметоксиметилбифенил-4- карбониламино)этокси] фенил] -пропионата (238 мг), который
является продуктом ссылочного примера 15, в этаноле (20 мл) при комнатной температуре
добавляли раствор соляной кислоты в диоксане (4 н., 1,2 мл). Смесь оставляли стоять в течение ночи. По завершении
этого времени реакционную смесь концентрировали при пониженном давлении. Остаток
распределяли между этилацетатом и водой. Этилацетатный слой отделяли и промывали насыщенным водным раствором хлорида
натрия и сушили над безводным сульфатом магния и затем концентрировали при
пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента
дихлорметан/метанол = 20/1-10/1, с получением свободной кислоты. Соединение,
указанное в заголовке (140 мг), в виде желтовато-коричневого твердого продукта, получали путем реакции свободной кислоты с
гидроксидом натрия. Т.пл. 124-126oC.1H-ЯМР (270 МГц,
дейтерированный метанол): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,18-1,39 (4H, м), 1,44-1,63 (2H, м), 2,32-2,47 (1H, м), 2,
51 (1H, дд, J=7,0, 13,5 Гц), 2,85 (1H, дд, J= 6,0, 13,5 Гц), 3,76 (2H, т, J=5,
5 Гц), 4,14 (2H, т, J=5,5 Гц), 4,68 (2H, с), 6,84 (2H, д, J=8,5 Гц), 7,12 (2H, д, J=8,5 Гц), 7,36 (1H, д, J= 7,5 Гц), 7,
44 (1H, т, J=7,5 Гц), 7,56 (1H, д, J=7,5 Гц), 7,66 (1H, с), 7,72 (2H, д, J=8,5
Гц), 7,90 (2H, д, J=8,5 Гц).
(Пример 37)
Этил
2-бутил-3-[4-[2-(3'-формилбифенил-4-карбониламино)-этокси] фенил] пропионат(этиловый эфир иллюстративного соединения N 4-214)
Реакцию проводили тем же способом, который описан в примере 5,
используя этил 3-[4-(2-аминоэтокси) фенил]-2-бутилпропионат (683 мг), который является продуктом ссылочного примера 6,
3'-формилбифенил-4-карбоновую кислоту (635 мг) и карбонилдиимидазол (500 мг), и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (506 мг) в виде бледно-коричневого
масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,86 (3H, т, J=7,
0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,21-1,39 (4H, м), 1,41-1,73 (2H, м), 2,53-2,66 (1H, м), 2,69 (1H, дд, J=6,5, 13,5
Гц), 2,86 (1H, дд, J=8,5, 13,5 Гц), 3,90 (2H, кв, J= 5,0 Гц), 4,06 (2H, кв, J=7,0 Гц),
4,16 (2H, т, J=5,0 Гц), 6,64 (1H, ушир. т), 6,84 (2H, д, J=8,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,64 (1H, т, J=7,5
Гц), 7,70 (2H, д, J=8,5 Гц), 7,86-7,92 (2H, м), 7,90 (2H, д, J=8,5 Гц), 8,12 (1H, с),
10,10 (1H, с).
(Пример 38)
Этил
2-бутил-3-[4-[2-(3'-диметиламинометилбифенил-4-карбониламино)этокси]фенил]пропионат (этиловый эфир иллюстративного соединения N 4-215)
Реакцию проводили тем же способом, который описан в
примере 29, используя этил 2-бутил-3-[4-[2-(3'-формилбифенил-4-карбониламино)этокси]фенил] пропионат (415 мг), который является продуктом
примера 37, триэтиламин (0,23 мл), диметиламингидрохлорид (139
мг), тетраизопропоксид титана (0,49 мл) и боргидрат натрия (56 мг), и затем реакционную смесь обрабатывали с получением соединения,
указанного в заголовке, (263 мг) в виде бесцветного сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,86 (3H, т, J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,20-1,37 (4H, м), 1,39-1,75
(2H, м), 2,23 (6H, с), 2,55-2,63 (1H, м), 2,68 (1H, дд, J=6,5, 13,5
Гц), 2,86 (1H, дд, J=8,5, 13,5 Гц), 3,52 (2H, с), 3,89 (2H, кв, J=5,0 Гц), 4,06 (2H, кв, J=7,0 Гц), 4,15 (2H, т, J=5,0 Гц), 6,63
(1H, ушир.т), 6,84 (2H, д, J=8,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,34 (1H,
д, J=7,5 Гц), 7,42 (1H, т, J=7,5 Гц), 7,52 (1H, д, J-7,5 Гц), 7,58 (1H, с), 7,68 (2H, д, J=8,5 Гц), 7,84 (2H, д, J=8,5 Гц).
(Пример 39)
2-Бутил-3-[4-[2-(3'-диметиламинометилбифенил-4-карбониламино)этокси] фенил]пропионовая кислота (иллюстративное соединение N 4-215)
Тем же способом, который
описан в примере 2, этил
2-бутил-3-[4-[2-(3'-диметиламинометилбифенил-4-карбониламино)-этокси] фенил] пропионат (263 мг), который является продуктом примера 38, подвергали взаимодействию с водным
раствором гидроксида натрия
(1 н., 1,00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (121 мг) в виде белого порошка. Т.пл. 95-97oC.1
H-ЯМР (270 МГц, дейтерированный
метанол): δ ppm 0,86 (3H, т, J=7,0 Гц), 1,14-1,34 (4H, м), 1,35-1,61 (2H, м), 2,46-2,57 (1H, м), 2,62 (1H, дд, J=6,5, 13,5 Гц), 2,77 (6H, с), 2,81 (1H, дд, J=8,
5, 13,5 Гц), 3,76 (2H, т, J=5,5
Гц), 4,15 (2H, т, J=5,5 Гц), 4,25 (2H, с), 6,86 (2H, д, J= 8,5 Гц), 7,08 (2H, д, J=8,5 Гц), 7,49 (1H, д, J=7,5 Гц), 7,57 (1H, т, J= 7,5 Гц), 7,74-7,79 (1H, м), 7,75
(2H, д, J-8,5 Гц), 7,82 (1H, с), 7,
91 (2H, д, J=8,5 Гц).
(Пример 40)
Этил 2-бутил-3-[4-[2-(3' -карбоксибифенил-4- карбониламино)-этокси]фенил] пропионат (этиловый эфир
иллюстративного соединения N 4-217)
К раствору этил 2-бутил-3- [4-[2-(3'-формилбифенил-4-карбониламино)этокси] фенил]пропионата (390 мг), который является продуктом примера 37, в ацетонитриле
(6 мл) добавляли натрий
дигидрогенфосфатдигидрат (24 мг) и воду (0,3 мл). В смесь на ледяной бане добавляли водный раствор гидрогенпероксида (30%, 0,12 мл) и водный раствор (0,3 мл) натрийхлорита
(104 мг). Смесь на ледяной
бане перемешивали в течение 1 часа и затем перемешивали при комнатной температуре в течение 2,5 часов. После этого реакционную смесь гасили тиосульфатом натрия и
реакционную смесь распределяли между
этилацетатом и водой. Этилацетатный слой отделяли и промывали насыщенным водным хлоридом натрия, и сушили над безводным сульфатом магния, и затем концентрировали
при пониженном давлении. К остатку
добавляли диизопропиловый эфир с получением соединения, указанного в заголовке, (217 мг) в виде белого твердого продукта.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,86 (3H, т, J=6,5
Гц), 1,15 (3H, т, J=7,0 Гц), 1,20-1,39 (4H, м), 1,40-1,51 (1H, м), 1,53-1,68 (1H, м), 2,51-2,63 (1H, м), 2,68 (1H, дд, J=6,5, 13,5 Гц), 2,86 (1H, дд, J=8,5,
13,5 Гц), 3,83-3,95 (2H, м), 4,05 (2H, кв,
J=7,0 Гц), 4,12-4,20 (2H, м), 6,70 (1H, ушир.т), 6,84 (2H, д, J=8,5 Гц), 7,08 (2H, д, J=8,5 Гц), 7,53-7,61 (1H, м), 7,63-7,77 (2H, м), 7,79-7,94 (3H, м), 8,
08-8,19 (1H, м), 8,36 (1H, с).
(Пример 41)
2-Бутил-3-[4-[2-(3'-карбоксибифенил-4-карбониламино)этокси] -фенил] пропионовая кислота (иллюстративное соединение N 4-217)
Тем же способом, который описан в
примере 2, этил 2-бутил-3-[4-[2-(3'-карбоксибифенил-4-карбониламино)этокси] -фенил] пропионат (273 мг), который является продуктом примера 40, подвергали
взаимодействию с водным раствором гидроксида
натрия (1 н., 1,10 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (196 мг) в виде бесцветных кристаллов. Т. пл.
142-143oC.1H-ЯМР (270 МГц,
дейтерированный метанол): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,20-1,44 (4H, м), 1,44-1,65 (2H, м), 2,49-2,60 (1H, м), 2,66 (1H, дд, J=6,0, 13,5 Гц),
2,82 (1H, дд, J=8,5, 13,5 Гц), 3,77 (2H, кв, J-5,
5 Гц), 4,15 (2H, т, J=5,5 Гц), 6,87 (2H, д, J=8,5 Гц), 7,09 (2H, д, J= 8,5 Гц), 7,58 (1H, т, J=7,5 Гц), 7,75 (2H, д, J=8,5 Гц), 7,90 (1H, д, J= 7,5
Гц), 7,93 (2H, д, J=8,5 Гц), 8,04 (1H, д, J=7,5 Гц),
8,30 (1H, с), 8,72 (1H, ушир.т).
(Пример 42)
Этил 2-бутил-3-[4-[2-(2'-метоксибифенил-4-карбониламино)-этокси] фенил]
пропионат (этиловый эфир иллюстративного соединения N
4-219)
Реакцию проводили тем же способом, который описан в примере 5, используя этил 3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (643
мг), который является продуктом ссылочного примера 6,
2'-метоксибифенил-4-карбоновую кислоту (500 мг) и карбонилдиимидазол (426 мг), и реакционную смесь обрабатывали с получением соединения,
указанного в заголовке, (750 мг) в виде бледно-желтого масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,91 (3H, т, J=6,5 Гц), 1,20 (3H, т, J-7,0 Гц), 1,28-1,40 (4H, м), 1,45-1,73
(2H, м), 2,59-2,79 (2H, м), 2,85-2,97 (1H,м), 3,86 (3H, с), 3,
93 (2H, кв, J=5,0 Гц), 4,10 (2H, кв, J=7,0 Гц), 4,18 (2H, т, J=5,0 Гц), 6,67 (1H, т, J=5,0 Гц), 6,86 (2H, д, J=8,5 Гц), 7,06 (2H, т, J=8,
0 Гц), 7,13 (2H, д, J=8,5 Гц), 7,35- 7,44 (2H, м), 7,65 (2H, д,
J=8,0 Гц), 7,86 (2H, д, J=8,0 Гц).
(Пример 43)
2-Бутил-3-[4-[2-(2'-метоксибифенил-4-карбониламино)этокси]
-фенил] пропионовая кислота (иллюстративное соединение N 4-219)
Тем же способом, который описан в примере 2, этил 2-бутил-3-[4-[2-(2'-метоксибифенил-4-карбониламино)этокси] -фенил] пропионат
(750 мг), который является продуктом примера 42, подвергали
взаимодействию с водным раствором гидроксида натрия (1 н., 5,00 мл), и реакционную смесь обрабатывали с получением соединения, указанного в
заголовке, (625 мг) в виде бледно- оранжевого порошка. Т.пл.
190-192oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J= 7,0 Гц), 1,21-1,38 (4H, м), 1,43-1,71
(2H, м), 2,58-2,78 (2H, м), 2,85-2,97 (1H, м), 3,80 (3H, с), 3,
87 (2H, кв, J=5,0 Гц), 4,13 (2H, т, J=5,0 Гц), 6,67 (1H, т, J=5,0 Гц), 6,83 (2H, д, J=8,5 Гц), 6,98-7,06 (2H, м), 7,10 (2H, д, J=8,5 Гц),
7,28-7,38 (2H, м), 7,59 (2H, д, J=8,5 Гц), 7,81 (2H, д, J=8,5
Гц).
(Пример 44)
Этил 2-бутил-3-[4-[2-(2'-гидроксибифенил-4-карбониламино)-этокси]фенил] пропионат (этиловый
эфир иллюстративного соединения N 4-220)
Реакцию
проводили тем же способом, который описан в примере 25, используя этил 3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (249 мг), который является
продуктом ссылочного примера 6,
2'-гидроксибифенил-4-карбоновую кислоту (200 мг), которая является продуктом ссылочного примера 16, 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (195 мг) и
1-гидроксибензотриазолмоногидрат
(138 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (386 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т,
J=6,5 Гц), 1,16
(3H, т, J=7,0 Гц), 1,21-1,32 (4H, м), 1,40-1,69 (2H, м), 2,53-2,72 (2H, м), 2,86 (1H, дд, J=8,5, 13,5 Гц), 3,89 (2H, кв, J=5,0 Гц), 4,01-4,
18 (4H, м), 5,27 (1H, с), 6,61-6,69
(1H, м), 6,83 (2H, д, J=8,5 Гц), 6,95-7,11 (4H, м), 7,21-7,28 (2H, м), 7,58 (2H, д, J=8,0 Гц), 7,88 (2H, д, J=8,0 Гц).
(Пример 45)
Натрий
2-бутил-3-[4-[2-(2'-гидроксибифенил-4- карбониламино)этокси]фенил]пропионат (иллюстративное соединение N 4-220)
Тем же способом, который описан в примере 2, этил
2-бутил-3-[4-[2-(2'-гидроксибифенил-4-карбониламино)этокси]фенил]пропионат (345 мг), который является продуктом примера 44, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 2,82
мл) и реакционную смесь обрабатывали с получением сырой свободной кислоты, которую подвергали тонкослойной хроматографии на силикагеле, используя в качестве элюента дихлорметан/метанол = 10/1.
Продукт
преобразовывали в соль натрия с получением соединения, указанного в заголовке, (200 мг) в виде бесцветных кристаллов. Т.пл. 153-156oC.1H-ЯМР свободной кислоты (270 МГц,
CDCl3): δ ppm 0,88 (3H, т, J=7,0 Гц), 1,25-1,37 (4H, м), 1,44-1,71 (2H, м), 2,55-2,78 (2H, м), 2,86 (1H, дд, J= 8,5, 13,5 Гц), 3,83 (2H, кв, J=5,0 Гц), 4,10 (2H, т, J=5,0 Гц), 6,
69-6,79 (1H,
м), 6,80 (2H, д, J=8,5 Гц), 6,95-7,10 (4H, м), 7,22-7,30 (2H, м), 7,55 (2H, д, J=8,0 Гц), 7,80 (2H, д, J=8,5 Гц).
(Пример 46)
Этил
2-бутил-3-[4-[2-(2'-формилбифенил-4- карбониламино)этокси] фенил] пропионат (этиловый эфир иллюстративного соединения N 4-221)
Реакцию проводили тем же способом, который описан в примере 5,
используя этил 3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (414 мг), который является продуктом ссылочного примера 6, 2'-формилбифенил-4-карбоновую кислоту (350 мг) и карбонилдиимидазол (296 мг), и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (314 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц),
1,
16 (3H, т, J=7,0 Гц), 1,19-1,33 (4H, м), 1,41-1,68 (2H, м), 2,53-2,72 (2H, м), 2,87 (1H, дд, J= 8,5, 13,5 Гц), 3,91 (2H, кв, J=5,0 Гц), 4,01-4,20 (4H, м), 6,65-6,72 (1H, м), 6,84 (2H, д, J= 8,5 Гц),
7,
09 (2H, д, J=8,5 Гц), 7,42-7,59 (4H, м), 7,63-7,70 (1H, м), 7,89 (2H, д, J=8,0 Гц), 8,04 (1H, д, J=7,5 Гц), 9,96 (1H, с).
(Пример 47)
2-Бутил-3-[4-[2-(2'-формилбифенил-4- карбониламино)этокси] фенил]пропионовая кислота (иллюстративное соединение N 4-221)
Тем же способом, который описан в примере 2, этил
2-бутил-3-[4-[2-(2'-формилбифенил-4-карбониламино)этокси]фенил]пропионат (314 мг), который является продуктом примера 46, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 2,50
мл)
и реакционную смесь обрабатывали с получением сырой свободной кислоты, которую подвергали тонкослойной хроматографии на силикагеле, используя в качестве элюента дихлорметан/метанол = 10/1, с
получением соединения, указанного в заголовке, (152 мг) в виде пенной массы.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,86 (3H, т, J=7,0 Гц), 1,22-1,40 (4H, м), 1,42-1,70 (2H, м),
2,
55-2,78 (2H, м), 2,88 (1H, дд, J=8,5, 13,5 Гц), 3,83-3,93 (2H, м), 4,07-4,18 (2H, м), 6,81 (2H, д, J=8,0 Гц), 6,95-7,06 (1H, м), 7,09 (2H, д, J=8,5 Гц), 7,38-7,46 (3H, м), 7,48-7,56 (1H, м), 7,61-7,
69
(1H, м), 7,89 (2H, д, J=8,0 Гц), 8,02 (1H, д, J=7,5 Гц), 9,92 (1H, с).
(Пример 48)
Натрий 2-бутил-3-[4-[2-(4'-гидрокси-3',
5'-диметилбифенил-4-карбониламино)этокси]фенил]пропионат (иллюстративное соединение N 4-205)
Тем же способом, который описан в примере 36, 2-бутил-3-[4-[2-(4'-метоксиметокси-3',
5'-диметилбифенил-4- карбониламино)этокси]фенил]пропионовую кислоту (1,00 г), которая является продуктом ссылочного примера 17, подвергали взаимодействию с раствором хлороводорода в диоксане (4 н., 0,
69 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (528 мг) в виде бледно-коричневого твердого продукта. Т.пл. 137-139oC.1H-ЯМР (270 МГц,
смесь CDCl3 и дейтерированного метанола (10/3)): δ ppm 0,85 (3H, т, J=7,0 Гц), 1,20-1,40 (5H, м), 1,43-1,60 (1H, м), 2,27 (6H, с), 2,34-2,47 (1H, м), 2,52 (1H, дд, J=7,5, 13,5 Гц),
2,
85 (1H, дд, J=7,5, 13,5 Гц), 3,74 (2H, т, J=5,5 Гц), 4,13 (2H, т, J=5,5 Гц), 6,84 (2H, д, J=8,5 Гц), 7,12 (2H, д, J=8,5 Гц), 7,62 (2H, д, J=8,5 Гц), 7,84 (2H, д, J=8,5 Гц).
(Пример
49)
Этил 2-бутил-3-[4-[2-(2-гидроксипиридин-5- карбониламино)этокси]фенил] пропионат (этиловый эфир иллюстративного соединения N 4-193)
Реакцию проводили тем же способом, который
описан в примере 25, используя этил
3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (843 мг), который является продуктом ссылочного примера 6, 6-гидроксиникотиновую кислоту (400 мг),
1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (660 мг) и 1-гидроксибензотриазолмоногидрат (528 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (636 мг)
в
виде белого порошка. Т. пл. 102-104oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,17 (3H, т, J=7,0 Гц), 1,21-1,32 (4H, м), 1,40-1,70 (2H, м), 2,
53-2,72 (2H, м), 2,80-2,91 (1H, м), 3,81 (2H, кв, J=5,0 Гц), 4,02-4,12 (4H, м), 6,42-6,52 (1H, м), 6,56 (1H, д, J=9,5 Гц), 6,81 (2H, д, J=8,5 Гц), 7,08 (2H, д, J=8,5 Гц), 7,80 (1H, дд, J=2,5, 9,5 Гц),
8,00 (1H, д, J=2,5 Гц).
(Пример 50)
2-Бутил-3-[4-[2-(2-гидроксипиридин-5- карбониламино)этокси]фенил]пропионовая кислота (иллюстративное соединение N 4-193)
Тем же
способом, который описан в примере 2, этил 2-бутил-3-[4-[2-(2-гидроксипиридин-5-карбониламино)этокси]фенил]пропионат (300 мг), который является продуктом примера 49, подвергали взаимодействию с
водным
раствором гидроксида натрия (1 н., 3,00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (240 мг) в виде бледно-желтого порошка. Т. пл. 69-71oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,90 (3H, т, J=7,0 Гц), 1,30-1,45 (4H, м), 1,50-1,79 (2H, м), 2,57-2,68 (1H, м), 2,77 (1H, д, J= 7,5 Гц), 3,68-3,77 (2H, м), 4,00-4,09 (2H,
м), 6,
42 (1H, д, J=10,0 Гц), 6,71 (2H, д, J=8,5 Гц), 7,05 (2H, д, J=8,5 Гц), 7,10-7,20 (1H, м), 7,75-7,80 (2H, м).
(Пример 51)
Этил
2-бутил-3-[4-[2-(2-метоксипиридин-5- карбониламино)этокси] фенил] пропионат (этиловый эфир иллюстративного соединения N 4-96)
Реакцию проводили тем же способом, который описан в примере 5,
используя этил 3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (766 мг), который является продуктом ссылочного примера 6, 6-метоксиникотиновую кислоту (400 мг) и карбонилдиимидазол (508 мг) и реакционную
смесь обрабатывали с получением соединения, указанного в заголовке, (783 мг) в виде бесцветных кристаллов. Т.пл. 129-130oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87
(3H, т, J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,22-1,33 (4H, м), 1,40-1,70 (2H, м), 2,52-2,63 (1H, м), 2,68 (1H, дд, J=6,5, 13,5 Гц), 2,86 (1H, дд, J=8,5, 13,5 Гц), 3,85 (2H, кв, J= 5,0 Гц), 4,00 (3H,
с),
4,06 (2H, кв, J=7,0 Гц), 4,12 (2H, т, J=5,0 Гц), 6,46-6,55 (1H, м), 6,78 (1H, д, J=8,5 Гц), 6,82 (2H, д, J=8,5 Гц), 7,08 (2H, д, J=8,5 Гц), 7,99 (1H, дд, J=2,5, 8,5 Гц), 8,59 (1H, д, J=2,5
Гц).
(Пример 52)
2-Бутил-3-[4-[2-(2-метоксипиридин-5- карбониламино)этокси] фенил]пропионовая кислота (иллюстративное соединение N 4-96)
Тем же способом, который
описан в
примере 2, этил 2-бутил-3-[4-[2-(2-метоксипиридин-5-карбониламино)этокси] фенил]пропионат (500 мг), который является продуктом примера 51, подвергали взаимодействию с водным раствором
гидроксида
натрия (1 н, 4,00 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (293 мг) в виде белого порошка. Т. пл. 144-145oC.1H-ЯМР (270
МГц,
CDCl3): δ ppm 0,89 (3H, т, J=7,0 Гц), 1,24-1,40 (4H, м), 1,47-1,75 (2H, м), 2,62-2,90 (3H, м), 3,71-3,97 (2H, м), 3,98 (3H, с), 4,11-4,26 (2H, м), 6,48-6,60 (1H, м), 6,78 (1H,
д, J=8,
5 Гц), 6,85 (2H, д, J= 8,5 Гц), 7,11 (2H, д, J=8,5 Гц), 8,03 (1H, дд, J=2,5, 8,5 Гц), 8,31 (1H, д, J=2,5 Гц).
(Пример 53)
Этил
2-бутил-3-[4-[2-(2-изопропоксипиридин-5- карбониламино)этокси]фенил]пропионат (этиловый эфир иллюстративного соединения N 4-98)
Реакцию проводили тем же способом, который описан в примере 5,
используя этил 3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (156 мг), который является продуктом ссылочного примера 6, 6-изопропоксиникотиновую кислоту (106 мг), которая является продуктом ссылочного
примера 18, и карбонилдиимидазол (112 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (170 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,20-1,40 (10Н, м), 1,41-1,71 (2H, м), 2,61-2,73 (2H, м), 2,86 (1H, дд, J=8,5, 13,5 Гц), 3,83 (2H, кв, J= 5,0 Гц), 4,05 (2H, кв,
J=7,0 Гц), 4,11 (2H, т, J=5,0 Гц), 5,35 (2H, септет, J= 6,0 Гц), 6,56-6,62 (1H, м), 6,69 (1H, д, J=8,5 Гц), 6,81 (2H, д, J= 8,5 Гц), 7,07 (2H, д, J=8,5 Гц), 7,97 (1H, дд, J=2,5, 8,5 Гц), 8,58 (1H, д,
J=2,5 Гц).
(Пример 54)
2-Бутил-3-[4-[2-(2-изопропоксипиридин-5-карбониламино)этокси] фенил] пропионовая кислота (иллюстративное соединение N 4-98)
Тем же способом,
который описан в примере 2, этил 2-бутил-3-[4-[2-(2-изопропоксипиридин-5-карбониламино)этокси] фенил]пропионат (170 мг), который является продуктом примера 53, подвергали взаимодействию с водным
раствором гидроксида натрия (1 н., 0,75 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (137 мг) в виде бесцветных кристаллов. Т. пл. 117-118oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,89 (3H, т, J=7,0 Гц), 1,22-1,40 (9H, м), 1,46-1,80 (3H, м), 2,59-2,82 (2H, м), 2,85 (1H, дд, J= 9,0, 13,5 Гц), 3,73-3,96 (2H, м), 4,10-4,22
(2H,
м), 5,31 (2H, септет, J= 6,0 Гц), 6,48-6,57 (1H, м), 6,70 (1H, д, J=8,5 Гц), 6,84 (2H, д, J=8,5 Гц), 7,11 (2H, д, J= 8,5 Гц), 8,00 (1H, дд, J=2,5, 8,5 Гц), 8,35 (1H, д, J=2,5 Гц).
(Пример 55)
Этил 2-бутил-3-[4-[2-(2-феноксипиридин-5-карбониламино)этокси] фенил] пропионат (этиловый эфир иллюстративного соединения N 4-106)
Реакцию проводили тем же
способом,
который описан в примере 5, используя этил 3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (158 мг), который является продуктом ссылочного примера 6, 6-феноксиникотиновую кислоту (125 мг) и
карбонилдиимидазол (112 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (225 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3):
δ
ppm 0,86 (3H, т, J=7,0 Гц), 1,15 (3H, т, J=7,0 Гц), 1,20-1,36 (4H, м), 1,41-1,70 (2H, м), 2,52-2,72 (2H, м), 2,85 (1H, дд, J= 8,5, 13,5 Гц), 3,78-3,89 (2H, м), 4,01-4,15 (4H, м), 6,65-6,82
(3H, м), 6,
92 (1H, д, J= 8,5 Гц), 7,06 (2H, д, J=8,5 Гц), 7,13 (2H, д, J=7,5 Гц), 7,20-7,26 (1H, м), 7,38-7,45 (2H, м), 8,12. (1H, дд, J=2,5, 8,5 Гц), 8,58 (1H, д, J=2,5 Гц).
(Пример
56)
2-Бутил-3-[4-[2-(2-феноксипиридин-5- карбониламино)этокси]-фенил]пропионовая кислота (иллюстративное соединение N 4-106)
Тем же способом, который описан в примере 2, этил
2-бутил-3-[4-[2-(2-феноксипиридин-5-карбониламино)этокси] фенил]пропионат (215 мг), который является продуктом примера 55, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 1,32
мл) и реакционную смесь обрабатывали с получением сырой свободной кислоты, которую подвергали тонкослойной хроматографии на силикагеле, используя в качестве элюента дихлорметан/метанол = 10/1, с
получением соединения, указанного в заголовке, (137 мг) в виде бесцветных кристаллов. Т.пл. 124-125oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,85-0,95 (3H, м), 1,25-1,
39 (4H, м), 1,40-1,71 (2H, м), 2,53-2,88 (3H, м), 3,70-3,97 (2H, м), 4,08-4,28 (2H, м), 6,58-6,68 (1H, м), 6,81 (2H, д, J=8,5 Гц), 6,93 (1H, д, J=8,5 Гц), 7,08 (2H, д, J=8,5 Гц), 7,13 (2H, д, J=8,5
Гц), 7,20-7,29 (1H, м), 7,39-7,48 (2H, м), 8,15 (1H, дд, J=8,5 Гц), 8,29 (1H, с).
(Пример 57)
Этил 2-бутил-3-[4-[2-(хинолин-3-карбониламино)этокси] фенил] пропионат
(этиловый
эфир иллюстративного соединения N 4-150)
Реакцию проводили тем же способом, который описан в примере 5, используя этил 3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (529 мг), который
является
продуктом ссылочного примера 6, хинолин-3-карбоновую кислоту (312 мг) и карбонилдиимидазол (350 мг) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (760 мг)
в виде
желтого масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=6,5 Гц), 1,16 (3H, т, J=7,0 Гц), 1,22-1,37 (4H, м), 1,40-1,70 (2H, м), 2,55-2,63 (1H, м), 2,69 (1H, дд,
J= 6,5,
13,5 Гц), 2,86 (1H, дд, J=8,5, 13,5 Гц), 3,95 (2H, кв, J=5,0 Гц), 4,06 (2H, кв, J=7,0 Гц), 4,19 (2H, т, J=5,0 Гц), 6,76-6,82 (1H, м), 6,85 (2H, д, J= 8,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,63
(1H, т, J=8,
0 Гц), 7,78-7,85 (1H, м), 7,92 (1H, д, J=8,0 Гц), 8,16 (1H, д, J=8,0 Гц), 8,60 (1H, д, J=2,5 Гц), 9,28 (1H, д, J=2,5 Гц).
(Пример 58)
Натрий
2-бутил-3-[4-[2-(хинолин-3-карбониламино)этокси]фенил]пропионовая кислота (иллюстративное соединение N 4-150)
Тем же способом, который описан в примере 2, этил
2-бутил-3-[4-[2-(хинолин-3-карбониламино)этокси] фенил] пропионат (760 мг), который является продуктом примера 57, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 6,00 мл) и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (386 мг) в виде белого порошка. Т.пл. 245- 248oC.1H-ЯМР свободной кислоты (270 МГц, CDCl3): δ ppm 0,90 (3H, т, J= 7,0 Гц), 1,28-1,48 (4H, м), 1,50-1,80 (2H, м), 2,58-2,90 (3H, м), 3,80-4,07 (2H, м), 4,20-4,39 (2H, м), 6,68-6,84 (1H, м), 6,87 (2H, д, J=8,5 Гц), 7,12 (2H, д,
J=8,5 Гц), 7,62 (1H, т, J=8,0 Гц), 7,81 (1H, т, J=8,0 Гц), 7,91 (1H, д, J=8,0 Гц), 8,13 (1H, д, J=8,0 Гц), 8,70 (1H, с), 8,81 (1H, с).
(Пример 59)
Этил
2-бутил-3-[4-[2-(индол-3-карбониламино)этокси] фенил] пропионат (этиловый эфир иллюстративного соединения N 4-143)
Реакцию проводили тем же способом, который описан в примере 25, используя
этил 3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (546 мг), который является продуктом ссылочного примера 6, индол-3-карбоновую кислоту (300 мг), 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид
(428 мг) и 1-гидроксибензотриазолмоногидрат (342 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (650 мг) в виде желтого масла.1H-ЯМР (270 МГц,
CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,15 (3H, т, J=7,0 Гц), 1,22-1,32 (4H, м), 1,40-1,68 (2H, м), 2,55-2,64 (1H, м), 2,69 (1H, дд, J= 6,5, 13,5 Гц), 2,86 (1H, дд, J=8,5, 13,5 Гц),
3,91 (2H, кв, J=5,0 Гц), 4,05 (2H, кв, J= 7,0 Гц), 4,17 (2H, т, J=5,0 Гц), 6,44 (1H, т, J=5,0 Гц), 6,86 (2H, д, J=8,5 Гц), 7,08 (2H, д, J=8,5 Гц), 7,24-7,29 (2H, м), 7,41-7,45 (1H, м), 7,74 (1H, д,
J=3,0 Гц), 7,95-7,99 (1H, м), 8,59-8,70 (1H, м).
(Пример 60)
2-Бутил-3-[4-[2-(индол-3-карбониламино)этокси] фенил]пропионовая кислота (иллюстративное соединение N 4-143)
Тем же способом, который описан в примере 2, этил 2-бутил-3-[4-[2-(индол-3-карбониламино)этокси] фенил] пропионат (650 мг), который является продуктом примера 59, подвергали взаимодействию с
водным раствором гидроксида натрия (1 н., 5,00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (500 мг) в виде белого порошка. Т.пл. 171-173oC.1H-ЯМР свободной кислоты (270 МГц, CDCl3): δ ppm 0,86 (3H, т, J= 7,0 Гц), 1,22-1,37 (4H, м), 1,40-1,68 (2H, м), 2,40-2,62 (1H, м), 2,68 (1H, дд, J=6,5, 13,5 Гц), 2,90 (1H, дд,
J=8,5, 13,5 Гц), 3,88 (2H, кв, J=5,0 Гц), 4,17 (2H, т, J=5,0 Гц), 6,73 (1H, т, J=5,0 Гц), 6,85 (2H, д, J=8,5 Гц), 7,11 (2H, д, J=8,5 Гц), 7,17-7,24 (2H, м), 7,42-7,47 (1H, м), 7,78 (1H, д, J=3,0 Гц),
8,00-8,05 (1H, м).
(Пример 61)
Этил 2-бутил-3-[4-[2-(4-N, N-диэтиламинобензоиламино)этокси] фенил]пропионат (этиловый эфир иллюстративного соединения N 4-230)
Реакцию проводили тем же способом, который описан в примере 5, используя этил 3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (455 мг), который является продуктом ссылочного примера 6, 4-N,
N-диэтиламинобензойную кислоту (300 мг) и карбонилдиимидазол (302 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (346 мг) в виде бесцветного масла.1
H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,13-1,20 (9H, м), 1,24-1,37 (4H, м), 1,40-1,70 (2H, м), 2,53-2,63 (1H, м), 2,68 (1H, дд, J= 6,5, 13,5 Гц), 2,86 (1H, дд, J=8,5,
13,5 Гц), 3,39 (4H, кв, J=7,0 Гц), 3,83 (2H, кв, J=5,5 Гц), 4,01-4,14 (4H, м), 6,40 (1H, т, J=5,5 Гц), 6,63 (2H, д, J= 8,5 Гц), 6,82 (2H, д, J=8,5 Гц), 7,07 (2H, д, J=8,5 Гц), 7,66 (2H, д, J= 8,5
Гц).
(Пример 62)
2-Бутил-3-[4-[2-(4-N, N-диэтиламинобензоиламино)этокси]фенил]пропионовая кислота (иллюстративное соединение N 4-230)
Тем же способом, который
описан
в примере 2, этил 2-бутил-3-[4-[2-(4-N, N-диэтиламинобензоиламино)этокси] фенил]пропионат (340 мг), который является продуктом примера 61, подвергали взаимодействию с водным раствором
гидроксида
натрия (1 н., 2,20 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (257 мг) в виде белого порошка. Т.пл. 76-78oC.1H-ЯМР (270
МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,17 (6H, т, J= 7,0 Гц), 1,11-1,21 (4H, м), 1,45-1,70 (2H, м), 2,57-2,65 (1H, м), 2,70 (1H, дд, J=6,5, 13,5 Гц), 2,90 (1H, дд, J=8,0, 13,5
Гц), 3,38 (4H,
кв, J=7,0 Гц), 3,80 (2H, кв, J=5,0 Гц), 4,08 (2H, т, J=5,0 Гц), 6,48 (1H, т, J=5,0 Гц), 6,62 (2H, д, J=8,5 Гц), 6,82 (2H, д, J=8,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,65 (2H, д, J=8,5
Гц).
(Пример 63)
Этил 2-бутил-3-[4-[2-(4-пиперидин-1-илбензоиламино)этокси]фенил]пропионат (этиловый эфир иллюстративного соединения N 4-229)
Реакцию проводили тем
же способом, который
описан в примере 5, используя этил 3-[4-(2-аминоэтокси) фенил]-2-бутилпропионат (428 мг), который является продуктом ссылочного примера 6, 4-пиперидин-1-илбензойную кислоту (300
мг) и
карбонилдиимидазол (284 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (420 мг) в виде белого порошка. Т.пл. 87-89oC.1H-ЯМР (270
МГц,
CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,15 (3H, т, J= 7,0 Гц), 1,20-1,37 (4H, м), 1,40-1,73 (8H, м), 2,52-2,61 (1H, м), 2,68 (1H, дд, J=6,5, 13,5 Гц), 2,86 (1H, дд, J=8,5, 13,5
Гц),
3,26-3,33 (4H, м), 3,83 (2H, кв, J= 5,0 Гц), 4,01-4,16 (4H, м), 6,48 (1H, т, J=5,0 Гц), 6,82 (2H, д, J=8,5 Гц), 6,87 (2H, д, J=9,0 Гц), 7,07 (2H, д, J=8,5 Гц), 7,67 (2H, д, J=9,0 Гц).
(Пример 64)
2-Бутил-3-[4-[2-(4-пиперидин-1-илбензоиламино)этокси] фенил] пропионовая кислота (иллюстративное соединение N 4-229)
Тем же способом, который описан в примере
2, этил
2-бутил-3-[4-[2-(4-пиперидин-1-илбензоиламино)этокси]фенил]пропионат (370 мг), который является продуктом примера 63, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 2,
30 мл) и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (324 мг) в виде белого порошка. Т.пл. 112,5-114oC.1H-ЯМР (270 МГц, CDCl3):
δ
ppm 0,90 (3H, т, J=6,5 Гц), 1,28-1,44 (4H, м), 1,48-1,77 (8H, м), 2,61-2,69 (1H, м), 2,73 (1H, дд, J=6,5, 13,5 Гц), 2,92 (1H, дд, J=8,0, 13,5 Гц), 3,27-3,33 (4H, м), 3,84 (2H, кв, J= 5,0 Гц),
4,11 (2H,
т, J=5,0 Гц), 6,54 (1H, т, J=5,0 Гц), 6,84 (2H, д, J=8,5 Гц), 6,89 (2H, д, J=9,0 Гц), 7,12 (2H, д, J=8,5 Гц), 7,70 (2H, д, J=9,0 Гц).
(Пример 65)
Этил
2-бутил-3-[4-[2-(N-(3-фенилпропил)-(4-пиридин-2- илбензоил)амино)этокси] фенил]пропионат (этиловый эфир иллюстративного соединения N 20-71)
К раствору этил
2-бутил-3-[4-[2-(3-фенилпропиламино)этокси]фенил]пропионата (460 мг), который является продуктом ссылочного примера 19, и 4-пиридин-2-илбензоилхлоридгидрохлорида (341 мг) в дихлорметане (10 мл) при
комнатной температуре добавляли триэтиламин (0,37 мл). Затем смесь перемешивали в течение 5 часов при комнатной температуре, растворитель отгоняли при пониженном давлении. Остаток распределяли между
этилацетатом и водой, и этилацетатный слой отделяли и сушили над безводным сульфатом магния, и затем концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с
силикагелем, используя в качестве элюента дихлорметан/метанол = 19/1, с получением соединения, указанного в заголовке, (275 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3
):
δ ppm 0,87 (3H, т, J= 7,0 Гц), 1,12-2,05 (11H, м), 2,42-2,91 (5H, м), 3,35-4,30 (8H, м), 6,70-6,88 (2H, м), 7,00- 7,60 (10H, м), 7,73-7,85 (2H, м), 7,99-8,06 (2H, м), 8,72 (1H, д, J=5,0
Гц).
(Пример 66)
Гидрохлорид 2-бутил-3-[4-[2-(N-(3-фенилпропил)-(4-пиридин-2-илбензоил)амино)этокси] фенил]пропионовой кислоты (иллюстративное соединение N 20-71)
Тем же
способом, который описан в примере 2, этил 2-бутил-3-[4-[2-(N-(3-фенилпропил)-(4-пиридин-2-илбензоил)амино)этокси] фенил] пропионат (275 мг), который является продуктом примера 65, подвергали
взаимодействию с водным раствором гидроксида натрия (1 н., 1,00 мл) и реакционную смесь обрабатывали. Соединение, указанное в заголовке (230 мг), получали в виде пенной массы путем обработки продукта
раствором диоксана серной кислоты (4 н.).1H-ЯМР свободной кислоты (270 МГц, CDCl3): δ ppm 0,92 (3H, т, J=7,0 Гц), 1,30-1,45 (4H, м), 1,50-2,10 (4H, м), 2,55-2,82 (5H, м),
3,48-3,83 (4H, м), 4,00-4,36 (2H, м), 6,57-6,86 (2H, м), 7,02-7,39 (10H, м), 7,68-7,89 (4H, м), 8,69 (1H, д, J=5,0 Гц).
(Пример 67)
Этил
2-бутил-3-[4-[2-[N-бутил-(4-пиридин-2- илбензоил)амино]этокси]фенил] пропионат (этиловый эфир иллюстративного соединения N 20-53) Реакцию проводили тем же способом, который описан в примере 65,
используя этил 2-бутил-3-[4-[2-(бутиламино)этокси] фенил] пропионат (390 мг), который является продуктом ссылочного примера 20, 4-пиридин-2-илбензоилхлоридгидрохлорид (340 мг) и триэтиламин (0,37 мл),
и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (165 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,78-1,71 (19H, м), 2,
55- 2,77 (2H, м), 2,82-2,91 (1H, м), 3,34-3,47 (1H, м), 3,65-3,80 (3H, м), 3,83-3,94 (1H, м), 4,06 (2H, кв, J= 7,0 Гц), 4,23-4,32 (1H, м), 6,68-6,91 (2H, м), 7,01-7,15 (2H, м), 7,23-7,30 (1H, м), 7,
43-7,81 (4H, м), 8,02 (2H, д, J=8,5 Гц), 8,70 (0,6H, д, J=5,0 Гц), 8,90 (0,4H, д, J=5,0 Гц).
(Пример 68)
Гидрохлорид
2-бутил-3-[4-[2-[N-бутил-(4-пиридин-2- илбензоил)амино]этокси]фенил]пропионовой кислоты (иллюстративное соединение N 20-53)
Тем же способом, который описан в примере 2, этил
2-бутил-3-[4-[2-[N-бутил-(4-пиридин-2-илбензоил)амино] этокси]фенил]пропионат (165 мг), который является продуктом примера 67, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 1,
00 мл) и реакционную смесь обрабатывали. Соединение, указанное в заголовке (110 мг), получали в виде пенной массы путем обработки продукта раствором диоксана серной кислоты (4 н.).1H-ЯМР
свободной кислоты (270 МГц, CDCl3): δ ppm 0,80-1,01 (6H, м), 1,10-1,85 (10Н, м), 2,60-2,85 (3H, м), 3,30-3,90 (4H, м), 4,11-4,38 (2H, м), 6,58-6,90 (2H, м), 7,02-7,14 (2H, м), 7,
28-7,
40 (3H, м), 7,68-7,90 (4H, м), 8,69 (1H, д, J= 5,0 Гц).
(Пример 69)
Этил 2-бутил-3-[4-[3-(4-пиридин-2-илбензоиламино)пропокси] фенил]пропионат (этиловый эфир
иллюстративного
соединения N 40-3)
Реакцию проводили тем же способом, который описан в примере 5, используя этил 3-[4-(3-аминопропокси)фенил] -2-бутилпропионат (500 мг), который является
продуктом ссылочного
примера 21, 4-пиридин-2-илбензойную кислоту (340 мг) и карбонилдиимидазол (333 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (178 мг) в
виде белого порошка.
Т.пл. 110-112oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,16 (3H, т, J= 7,0 Гц), 1,21-1,33 (4H, м), 1,42-1,70 (2H, м), 2,
14 (2H, квинтуплет, J=6,
0 Гц), 2,53-2,73 (2H, м), 2,80-2,91 (1H, м), 3,71 (2H, кв, J=6,0 Гц), 4,06 (2H, кв, J=7,0 Гц), 4,13 (2H, т, J=6,0 Гц), 6,76-6,80 (1H, м), 6,83 (2H, д, J=8,5 Гц), 7,10 (2H, д,
J=8,5 Гц), 7,25-7,32 (1H,
м), 7,76-7,81 (2H, м), 7,89 (2H, д, J=8,5 Гц), 8,08 (2H, д, J=8,5 Гц), 8,73 (1H, д, J=5,0 Гц).
(Пример 70)
2-Бутил-3-[4-[3-(4-пиридин-2-илбензоиламино)пропокси] фенил]
пропионовая кислота (иллюстративное соединение N 40-3)
Тем же способом, который описан в примере 2, этил
2-бутил-3-[4-[3-(4-пиридин-2-илбензоиламино)пропокси]фенил]пропионат (161 мг), который
является продуктом примера 69, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 1,20 мл) и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (117 мг)
в виде белого порошка. Т.пл. 151-152oC.1H-ЯМР (270 МГц, CDCl3): δ ppm
0,90 (3H, т, J=7,0 Гц), 1,28-1,44 (4H, м), 1,51-1,64 (1H, м), 1,65-1,78 (1H, м), 2,15 (2H,
квинтуплет, J=6,0 Гц), 2,58-2,92 (3H, м), 3,60-3,80 (2H, м), 4,15-4,21 (2H, м), 6,84 (2H, д, J= 8,5 Гц), 6,
87-6,95 (1H, м), 7,16 (2H, д, J=8,5 Гц), 7,30-7,35 (1H, м), 7,74-7,90 (6H, м), 8,69 (1H, д,
J=5,5 Гц).
(Пример 71)
Этил
2-бутил-3-[4-[3-[N-метил-(4-пиридин-2- илбензоил)амино] пропокси] фенил]пропионат (этиловый эфир иллюстративного соединения N 20-80)
Реакцию проводили тем же способом, который описан в
примере 65, используя этил 2-бутил-3-[4-(3-метиламинопропокси)фенил] пропионат (380 мг), который является продуктом ссылочного примера 22,
4-пиридин-2-илбензоилхлоридгидрохлорид (360 мг) и
триэтиламин (0,40 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (259 мг) в виде белого порошка. Т.пл.
58-60oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,86 (3H, т, J= 7,0 Гц), 1,15 (3H, т, J= 7,0 Гц), 1,20-1,38 (4H, м), 1,40-1,70 (2H, м), 1,96-2,23 (2H, м), 2,52-2,72 (2H,
м), 2,80-2,91 (1H, м), 3,00-3,19 (3H, м), 3,49-3,60
(1H, м), 3,71-3,89 (2H, м), 4,00-4,12 (3H, м), 6,61-6,70 (1H, м), 6,79-6,89 (1H, м), 6,99-7,10 (2H, м), 7,23-7,28 (1H, м), 7,41- 7,55 (2H, м), 7,
70-7,81 (2H, м), 7,91-8,06 (2H, м), 8,71 (1H, д, J=5,0
Гц).
(Пример 72)
2-Бутил-3-[4-[3-[N-метил-(4-пиридин-2- илбензоил)амино] пропокси]фенил] пропионовая кислота
(иллюстративное соединение N 20-80)
Тем же способом,
который описан в примере 2, этил 2-бутил-3-[4-[3-[N-метил-(4-пиридин-2-илбензоил)амино] пропокси]фенил]пропионат (200 мг), который
является продуктом примера 71, подвергали взаимодействию с водным
раствором гидроксида натрия (1 н., 1,20 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (127 мг)
в виде белого порошка. Т.пл. 110-112oC.1
H-ЯМР (270 МГц, CDCl3): δ ppm 0,91 (3H, т, J=7,0 Гц), 1,21-1,41 (4H, м), 1,48-1,61 (1H, м), 1,64-1,83 (1H, м), 1,93-2,
23 (2H, м), 2,58-2,83 (3H, м), 3,00-3,17 (3H, м), 3,37-3,60 (1H,
м), 3,68-4,26 (3H, м), 6,66-7,01 (2H, м), 7,10-7,30 (2H, м), 7,33-7,60 (3H, м), 7,70-8,20 (4H, м), 8,76-9,05 (1H, м).
(Пример 73)
Этил
2-пропил-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил]пропионат (этиловый эфир иллюстративного соединения N 3-35)
Раствор этил
3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]-2-пропилпропионата (2,20 г) в диоксане, содержащий соляную кислоту (4 н., 30 мл) оставляли стоять при комнатной температуре в течение 40 минут. По
завершении этого времени реакционную смесь концентрировали при пониженном давлении и соляную кислоту азеотропно отгоняли толуолом с получением остатка. К раствору остатка, полученного выше (этил
3-[4-(2-аминоэтокси)фенил]-2-пропилпропионатгидрохлорид), 4-пиридин-2-илбензойной кислоты (1,21 г) и триэтиламина (1,80 мл) в N,N-диметилформамиде (8,0 мл) на ледяной бане добавляли раствор
диэтилцианофосфоната (0,97 мл) в N,N-диметилформамиде (4,0 мл). Смесь перемешивали на ледяной бане в течение 1 часа и при комнатной температуре в течение 3 часов. Реакционную смесь распределяли между
этилацетатом и водой, этилацетат отделяли, промывали насыщенным водным гидрокарбонатом натрия и сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с
помощью хроматографии на колонке с силикагелем, используя в качестве элюента дихлорэтан/этилацетат = 7/3, с получением соединения, указанного в заголовке, (2,20 г) в виде бледно-желтого порошка. Т.
пл. 90,5-92oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,88 (3H, т, J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,21-1,71 (4H, м), 2,50-2,72 (2H, м), 2,80-2,92 (1H, м), 3,81-3,
95
(2H, м), 4,00-421 (4H, м), 6,60-6,71 (1H, м), 6,84 (2H, д, J=8,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,20-7,31 (1H, м), 7,70-7,80 (2H, м), 7,88 (2H, д, J=8,5 Гц), 8,07 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=5,
0
Гц).
(Пример 74)
2-Пропил-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионовая кислота (иллюстративное соединение N 3-53)
Тем же способом, который
описан в
примере 2, этил 2-пропил-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (2,10 г), который является продуктом примера 73, подвергали взаимодействию с водным раствором гидроксида
натрия (1
н., 15,0 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (1,96 г) в виде белого порошка. Т.пл. 81-82,5oC.1H-ЯМР (270 МГц,
CDCl3
): δ ppm 0,90 (3H, т, J=7,0 Гц), 1,20-1,71 (4H, м), 2,55-2,75 (2H, м), 2,75-2,92 (1H, м), 3,74-3,90 (2H, м), 4,03-421 (2H, м), 6,71-6,89 (3H, м), 7,09 (2H, д, J=8,5 Гц), 7,21-7,
31 (1H, м), 7,
66-7,83 (4H, м), 7,97 (2H, д, J=8,5 Гц), 8,71 (1H, д, J=4,5 Гц).
(Пример 75)
Этил 3-[4-[2-(бифенил-4-карбониламино)этокси] фенил]-2-феноксипропионат (этиловый
эфир
иллюстративного соединения N 6-15)
Реакцию проводили тем же способом, который описан в примере 5, используя этил 3-[4-(2-аминоэтокси)фенил]-2-феноксипропионат (666 мг), который является
продуктом ссылочного примера 4, бифенил-4-карбоновую кислоту (400 мг) и карбонилдиимидазол (393 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (280 мг) в виде
белого порошка. Т.пл. 103-104,5oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,19 (3H, т, J=7,0 Гц), 3,15-3,22 (2H, м), 3,89 (2H, кв, J=5,0 Гц), 4,13-4,22 (4H, м), 4,74
(1H, дд, J= 6,0, 7,5 Гц), 6,62 (1H, т, J=5,0 Гц), 6,84 (2H, д, J=9,0 Гц), 6,87 (2H, д, J= 9,0 Гц), 6,94 (1H, т, J=7,5 Гц), 7,19-7,25 (4H, м), 7,35-7,50 (3H, м), 7,57-7,63 (2H, м), 7,65 (2H, д, J=8,5
Гц), 7,85 (2H, д, J=8,5 Гц).
(Пример 76)
3-[4-[2-(Бифенил-4-карбониламино)этокси] фенил] -2-феноксипропионовая кислота (иллюстративное соединение N 6-15)
Тем же
способом, который описан в примере 2, этил 3-[4-[2-(бифенил-4-карбониламино)этокси] фенил] -2-феноксипропионат (270 мг), который является продуктом примера 75, подвергали взаимодействию с водным
раствором гидроксида натрия (1 н., 2,00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (250 мг) в виде белого порошка. Т.пл. 171-173oC.1
H-ЯМР (270 МГц, CDCl3): δ ppm 3,20 (2H, д, J=6,5 Гц), 3,82-3,90 (2H, м), 4,15 (2H, т, J=5,0 Гц), 4,71 (1H, т, J=6,5 Гц), 6,86 (4H, д, J=8,0 Гц), 6,91 (1H, т, J=7,5 Гц), 7,01-7,12
(1H,
м), 7,18-7,27 (4H, м), 7,35-7,50 (3H, м), 7,61 (2H, д, J=8,5 Гц), 7,65 (2H, д, J=8,5 Гц), 7,88 (2H, д, J=8,0 Гц).
(Пример 77)
Этил
3-[4-[2-(4'-фторбифенил-4-карбониламино)этокси]фенил]-2-феноксипропионат (этиловый эфир иллюстративного соединения N 6-190)
Реакцию проводили тем же способом, который описан в примере 5,
используя этил 3-[4-(2-аминоэтокси)фенил]-2-феноксипропионат (1,63 г), который является продуктом ссылочного примера 4, 4'-фторбифенил-4-карбоновую кислоту (1,20 г) и карбонилдиимидазол (1,08 г), и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (915 мг) в виде белого порошка. Т. пл. 99-101oC.1H-ЯМР (270 МГц, CDCl3): δ ppm
1,25 (3H, т, J=7,0 Гц), 3,22-3,26 (2H, м), 3,94 (2H, кв, J=5,0 Гц), 4,20 (2H, т, J=5,0 Гц), 4,22 (2H, кв, J= 7,0 Гц), 4,79 (1H, дд, J=5,5, 7,5 Гц), 6,67 (1H, т, J=5,0 Гц), 6,86-6,93 (4H, м), 6,96-7,
01
(1H, м), 7,19 (2H, т, J=8,5 Гц), 7,28 (2H, д, J=8,5 Гц), 7,59-7,68 (4H, м), 7,89 (2H, д, J=8,5 Гц).
(Пример 78)
3-[4-[2-(4'-Фторбифенил-4-карбониламино)этокси] фенил]
-2-феноксипропионовая кислота (иллюстративное соединение N 6-190)
Тем же способом, который описан в примере 2, этил 3-[4-[2-(4'-фторбифенил-4-карбониламино)этокси] фенил] -2-феноксипропионат
(915 мг), который является продуктом примера 77, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 5,00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в
заголовке, (866 мг) в виде белого порошка. Т. пл. 195-196oC.1H-ЯМР (270 МГц, дейтерированный диметилсульфоксид): δ ppm 3,08-3,17 (2H, м), 3,63 (2H, кв, J=5,5 Гц), 4,10
(2H, т, J=5,5 Гц), 4,83-4,89 (1H, м), 6,83 (2H, д, J=8,5 Гц), 6,88-6,95 (3H, м), 7,23-7,39 (6H, м), 7,73-7,84 (4H, м), 7,95 (2H, д, J=8,0 Гц), 8,75 (1H, т, J=5,5 Гц).
(Пример 79)
Этил 3-[4-[2-(4'-хлорбифенил-4-карбониламино)этокси]фенил]-2-феноксипропионат (этиловый эфир иллюстративного соединения N 6-204)
К раствору этил
3-[4-(2-аминоэтокси)фенил]-2-феноксипропионата (1,50 г), 4'-хлорбифенил-4-карбоновой кислоты (1,17 г) и триэтиламина (0,70 мл) в тетрагидрофуране (20 мл) на ледяной бане добавляли раствор
диэтилцианофосфоната (0,76 мл) в тетрагидрофуране (10 мл). Смесь на ледяной бане перемешивали в течение 1 часа и при комнатной температуре в течение 4 часов. По завершении этого времени растворитель
отгоняли при пониженном давлении. Остаток распределяли между этилацетатом и водой, и этилацетатный слой отделяли и промывали насыщенным водным раствором гидрогенкарбоната натрия, и сушили над
безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента дихлорэтан/этилацетат = 19/1, с
получением соединения, указанного в заголовке, (0,90 г) в виде бледно-желтого масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,19 (3H, т, J=7,0 Гц), 3,12-3,21 (2H, м), 3,79-3,90
(2H, м), 4,05-4,21 (4H, м), 4,69-4,79 (1H, м), 6,68-6,78 (1H, м), 6,80-6,89 (4H, м), 6,90-6,96 (1H, м), 7,16-7,27 (4H, м), 7,41 (2H, д, J=8,5 Гц), 7,51 (2H, д, J=8,5 Гц), 7,58 (2H, д, J=8,5 Гц), 7,84
(2H, д, J=8,5 Гц).
(Пример 80)
3-[4-[2-(4'-Хлорбифенил-4-карбониламино)этокси] фенил] -2-феноксипропионовая кислота (иллюстративное соединение N 6-204)
Тем же
способом, который описан в примере 2, этил 3-[4-[2-(4'-хлорбифенил-4-карбониламино)этокси] фенил] -2-феноксипропионат (900 мг), который является продуктом примера 79, подвергали взаимодействию с
водным раствором гидроксида натрия (1 н., 5,00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (638 мг) в виде белого порошка. Т. пл. 194,5-197oC.1H-ЯМР (270 МГц, дейтерированный диметилсульфоксид): δ ppm 3,05-3,15 (2H, м), 3,58-3,67 (2H, м), 4,01-4,12 (2H, м), 4,80-4,89 (1H, м), 6,78-6,95 (5H, м), 7,18-7,28 (4H, м), 7,55 (2H,
д,
J=8,5 Гц), 7,71-7,81 (4H, м), 7,96 (2H, д, J=8,0 Гц), 8,71-8,79 (1H, м).
(Пример 81)
Этил 3-[4-[2-(4'-трифторметилбифенил-4-карбониламино)этокси] фенил]
-2- феноксипропионат
(этиловый эфир иллюстративного соединения N 6-191)
Реакцию проводили тем же способом, который описан в примере 5, используя этил 3-[4-(2-аминоэтокси)фенил]
-2-феноксипропионат (1,60 г),
который является продуктом ссылочного примера 4, 4'-трифторметилбифенил-4-карбоновую кислоту (1,30 г) и карбонилдиимидазол (0,95 г), и реакционную смесь обрабатывали с
получением соединения,
указанного в
заголовке, (1,10 г) в виде бледно-желтого масла.1 H-ЯМР (270 МГц, CDCl3): δ ppm 1,25 (3H, т, J=7,0 Гц), 3,18-3,25 (2H, м), 3,95 (2H,
кв, J=5,0 Гц), 4,20 (2H,
т, J=5,0 Гц), 4,22 (2H, кв, J= 7,0 Гц), 4,79 (1H, дд, J=5,5, 7,5 Гц), 6,70 (1H, т, J=5,0 Гц), 6,82-6,98 (5H, м), 7,20-7,32 (4H, м), 7,65-7,76 (6H, м), 7,93 (2H, д, J=8,5
Гц).
(Пример
82)
3-[4-[2-(4'-Трифторметилбифенил-4-карбониламино)этокси] -фенил] -2-феноксипропионовая кислота (иллюстративное соединение N 6-191)
Тем же способом,
который описан в примере 2,
этил 3-[4-[2-(4'-трифторметилбифенил-4-карбониламино)этокси] фенил] -2-феноксипропионат (1,10 г), который является продуктом примера 81, подвергали взаимодействию с водным
раствором гидроксида натрия
(1 н., 5,00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (850 мг) в виде белого порошка. Т.пл. 217-218,5oC.1
H-ЯМР (270 МГц,
дейтерированный диметилсульфоксид): δ ppm 3,06-3,16 (2H, м), 3,66 (2H, кв, J=5,5 Гц), 4,11 (2H, т, J=5,5 Гц), 4,85 (1H, дд, J=5,0, 7,5 Гц), 6,80-6,96 (5H, м), 7,20-7,28 (4H, м),
7,85 (4H, д,
J=8,5 Гц), 7,94-8,02 (4H, м), 8,80 (1H, т, J=5,5 Гц).
(Пример 83]
Натрий 3-[4-[2-(4'-гидрокси-3',
5'-диметилбифенил-4- карбониламино)этокси]фенил]-2-феноксипропионат
(иллюстративное соединение N 6-205)
Тем же способом, который описан в примере 36, 3-[4-[2-(4'-метоксиметокси-3',
5'-диметилбифенил-4- карбониламино)этокси]фенил]-2-феноксипропионовая кислота
(330 мг), который является продуктом ссылочного примера 24, подвергали взаимодействию с раствором хлороводорода в
диоксане (4н., 3,30 мл), и реакционную смесь обрабатывали с получением соединения,
указанного в заголовке, (257 мг) в виде белого порошка. Т.пл. 134-135oC.1H-ЯМР (270 МГц,
дейтерированный диметилсульфоксид): δ ppm 2,23 (6H, с), 2,90 (1H, дд, J=9,5, 14,5
Гц), 3,05 (1H, дд, J=1,5, 14,5 Гц), 3,61 (2H, кв, J=5,5 Гц), 4,07 (2H, т, J= 5,5 Гц), 4,32 (1H, дд, J=1,5, 9,5
Гц), 6,74 (2H, д, J=7,5 Гц), 6,78 (1H, д, J=7,5 Гц), 6,85 (2H, д, J=8,5 Гц), 7,13 (2H, д,
J=7,5 Гц), 7,19 (2H, д, J= 8,5 Гц), 7,31 (2H,s), 7,66 (2H, д, J=8,5 Гц), 7,89 (2H, д, J=8,5 Гц), 8,54 (1H,
ушир.с), 8,68 (1H, ушир.т).
(Пример 84)
Этил
3-[4-[2-(2-метоксипиридин-5-карбониламино)этокси] фенил]-2- феноксипропионат (этиловый эфир иллюстративного соединения N
6-96)
Реакцию проводили тем же способом, который описан в примере 5,
используя этил 3-[4-(2-аминоэтокси)фенил] -2-феноксипропионат (753 мг), который является продуктом ссылочного примера 4,
6-метоксиникотиновую кислоту (350 мг) и карбонилдиимидазол (445 мг), и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (355 мг) в виде белого порошка. Т.пл.
114-116oC.1H-ЯМР (270 МГц, CDCl3): δ ppm
1,20 (3H, т, J=7,0 Гц), 3,17-3,20 (2H, м), 3,85 (2H, кв, J=5,0 Гц), 3,98 (3H, с), 4,12 (2H, т, J=5,0 Гц), 4,18 (2H,
кв, J=7,0 Гц), 4,73 (1H, дд, J=6,0, 7,0 Гц), 6,48 (1H, т, J= 5,0 Гц), 6,77 (1H, д,
J=8,5 Гц), 6,82-6,86 (4H, м), 6,94 (1H, т, J=7,5 Гц), 7,20-7,28 (4H, м), 7,98 (1H, дд, J=2,5, 8,5 Гц), 8,59 (1H, д,
J=2,5 Гц).
(Пример 85)
3-[4-[2-(2-Метоксипиридин-5-карбониламино)этокси] фенил] -2- феноксипропионовая кислота (иллюстративное соединение N 6-96)
Тем же способом,
который описан в примере 2, этил
3-[4-[2-(2-метоксипиридин-5-карбониламино)этокси] фенил] -2-феноксипропионат (330 мг), который является продуктом примера 84, подвергали взаимодействию с водным
раствором гидроксида натрия (1 н., 2,50
мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (260 мг) в виде бесцветных кристаллов. Т.пл. 145-146,5oC.1H-ЯМР (270 МГц, CD3
Cl): δ ppm 3,18-3,23 (2H, м), 3,81 (2H, кв, J=5,0 Гц), 3,97 (3H, с), 4,14 (2H, т, J=5,0 Гц), 4,71 (1H, дд, J=5,5, 7,0 Гц), 6,76 (1H, д, J=8,5 Гц), 6,85 (2H,
д, J=8,5 Гц), 6,86 (2H, д, J=8,5 Гц),
6,93 (1H, т, J=8,0 Гц), 7,02-7,11
(1H, м), 7,17-7,27 (4H, м), 8,02 (1H, дд, J=2,5, 8,5 Гц), 8,60 (1H, д, J=2,5 Гц).
(Пример 86)
Этил
3-[4-[2-(бифенил-4-карбониламино)этокси]фенил]-2-(4- изопропилфенокси)пропионат (этиловый эфир иллюстративного соединения N 7-15)
Реакцию проводили тем же способом, который описан
в примере
73, используя этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-(4-изопропилфенокси)пропионат (723 мг), который является продуктом ссылочного примера 25, бифенил-4-карбоновую кислоту
(303 мг),
диэтилцианофосфонат (0,25 мл) и триэтиламин (0,47 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (630 мг) в виде желтого масла.1H-ЯМР
(270 МГц,
CDCl3): δ ppm 1,18 (6H, д, J=7,0 Гц), 1,21 (3H, т, J=7,0 Гц), 2,82 (1H, септет, J=7,0 Гц), 3,15-3,20 (2H, м), 3,89 (2H, кв, J=5,0 Гц), 4,15 (2H, т, J= 5,0 Гц), 4,20 (2H,
кв, J=7,0
Гц), 4,69 (1H, дд, J=5,5, 7,5 Гц), 6,64 (1H, т, J= 5,0 Гц), 6,76 (2H, д, J=8,5 Гц), 6,86 (2H, д, J=8,5 Гц), 7,08 (2H, д, J= 8,5 Гц), 7,24 (2H, д, J=8,5 Гц), 7,35-7,51 (3H, м), 7,59-7,63 (2H,
м), 7,66
(2H, д, J=8,5 Гц), 7,86 (2H, д, J=8,5 Гц).
(Пример 87)
3-[4-[2-(Бифенил-4-карбониламино)этокси] фенил] -2-(4-изопропилфенокси)пропионовая кислота (иллюстративное
соединение N
7-15)
Тем же способом, который описан в примере 2, этил 3-[4-[2-(бифенил-4-карбониламино)этокси] фенил] -2-(4-изопропилфенокси)пропионат (630 мг), который является продуктом
примера 86,
подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 2,00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (510 мг) в виде белого
порошка. Т. пл.
172-173oC.1H-ЯМР (270 МГц, CD3Cl): δ ppm 1,18 (6H, д, J=7,0 Гц), 2,82 (1H, септет, J=7,0 Гц), 3,21 (2H, д, J=6,0 Гц), 3,86 (2H, кв, J= 5,0 Гц),
4,12 (2H, т,
J=5,0 Гц), 4,78 (1H, т, J=6,0 Гц), 6,68 (1H, т, J=5,0 Гц), 6,79 (2H, д, J=8,5 Гц), 6,85 (2H, д, J=8,5 Гц), 7,10 (2H, д, J=8,5 Гц), 7,23 (2H, д, J=8,5 Гц), 7,35-7,49 (3H, м), 7,57-7,62
(2H, м), 7,65
(2H, д, J=8,5 Гц), 7,85 (2H, д, J=8,5 Гц).
(Пример 88)
Этил 2-(4-изопропилфенокси)-3-[4-[2-(4'-метоксибифенил-4-карбониламино)этокси]фенил]пропионат (этиловый
эфир
иллюстративного соединения N 7-179)
Реакцию проводили тем же способом, который описан в примере 73, используя этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]
-2-(4-изопропилфенокси)пропионат (723 мг), который является продуктом ссылочного примера 25, 4'-метокси-бифенил-4-карбоновую кислоту (350 мг), диэтилцианофосфонат (0,25 мл) и триэтиламин (0,47 мл), и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (600 мг) в виде белого порошка. Т.пл. 116-117oC.1H-ЯМР (270 МГц, CDCl3): δ ppm
1,18 (6Н, д, J=7,0 Гц), 1,20 (3H, т, J=7,0 Гц), 2,82 (1H, септет, J=7,0 Гц), 3,15-3,21 (2H, м), 3,86 (3H, с), 3,86-3,91 (2H, м), 4,14 (2H, т, J=5,0 Гц), 4,18 (2H, кв, J=7,0 Гц), 4,69 (1H, дд, J= 6,0,
7,0 Гц), 6,62 (1H, т, J=5,0 Гц), 6,76 (2H, д, J=8,5 Гц), 6,86 (2H, д, J=8,5 Гц), 6,99 (2H, д, J=8,5 Гц), 7,08 (2H, д, J=8,5 Гц), 7,23 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц), 7,61 (2H, д, J=8,0 Гц),
7,83 (2H, д, J=8,0 Гц).
(Пример 89)
2-(4-Изопропилфенокси)-3-[4-[2-(4'-метоксибифенил-4-карбониламино)этокси]фенил]пропионовая кислота (иллюстративное соединение N
7-179)
Тем же способом, который описан в примере 2, этил 2-(4-изопропилфенокси)-3-[4-[2-(4'-метоксибифенил-4-карбониламино)этокси] фенил] пропионат (580 мг), который является продуктом
примера 88,
подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 2,00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (450 мг) в виде белого
порошка. Т.пл.
159-160oC.1H-ЯМР (270 МГц, CD3Cl): δ ppm 1,18 (6H, д, J= 6,5 Гц), 2,77-2,80 (1H, м), 3,18-3,27 (2H, м), 3,80-3,90 (5H, м), 4,10-4,18 (2H, м), 4,
76-4,82 (1H, м),
6,67-6,70 (1H, м), 6,78 (2H, д, J=8,0 Гц), 6,84 (2H, д, J=8,0 Гц), 6,98 (2H, д, J=8,0 Гц), 7,09 (2H, д, J=8,0 Гц), 7,22 (2H, д, J=8,0 Гц), 7,54 (2H, д, J=8,0 Гц), 7,59 (2H, д, J=8,0
Гц), 7,81 (2H, д,
J=8,0 Гц).
(Пример 90)
Этил 3-[4-[2-(4'-фторбифенил-4-карбониламино)этокси] фенил] -2-(4-изопропилфенокси)пропионат (этиловый эфир иллюстративного
соединения N 7-190)
Реакцию проводили тем же способом, который описан в примере 73, используя этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-(4-изопропилфенокси)пропионат (723 мг),
который является продуктом
ссылочного примера 25, 4'-фторбифенил-4-карбоновую кислоту (331 мг), диэтил цианофосфонат (0,25 мл) и триэтиламин (0,47 мл), и реакционную смесь обрабатывали с получением
соединения, указанного в
заголовке, (460 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,18 (6H, д, J=7,0 Гц), 1,20 (3H, т, J=7,0 Гц), 2,82 (1H, септет, J=
7,0 Гц), 3,12-3,18 (2H,
м), 3,88 (2H, кв, J=5,0 Гц), 4,13 (2H, т, J= 5,0 Гц), 4,18 (2H, кв, J=7,0 Гц), 4,69 (1H, дд, J=6,0, 7,0 Гц), 6,63 (1H, т, J= 5,0 Гц), 6,75 (2H, д, J=8,5 Гц), 6,86 (2H, д, J=8,
5 Гц), 7,00-7,29 (6H, м),
7,53-7,60 (2H, м), 7,60 (2H, д, J=8,5 Гц), 7,84 (2H, д, J=8,5 Гц).
(Пример 91)
3-[4-[2-(4'-Фторбифенил-4-карбониламино)этокси] фенил]
-2-(4- изопропилфенокси)пропионовая
кислота (иллюстративное соединение N 7-190)
Тем же способом, который описан в примере 2, этил 3-[4-[2-(4'-фторбифенил-4-карбониламино)этокси] фенил]
-2-(4-изопропилфенокси)пропионат (450 мг),
который является продуктом примера 90, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 2,00 мл) и реакционную смесь обрабатывали с
получением соединения, указанного в заголовке,
(380 мг) в виде белого порошка. Т.пл. 192-193oC.1H-ЯМР (270 МГц, CD3Cl): δ ppm 1,17 (6H, д, J= 7,0 Гц), 2,84
(1H, септет, J=7,0 Гц), 3,18 (2H, д, J=6,0 Гц), 3,
84 (2H, кв, J=5,0 Гц), 4,16 (2H, т, J=5,0 Гц), 4,66 (1H, т, J=6,0 Гц), 6,77 (2H, д, J= 8,5 Гц), 6,86 (2H, д, J=8,5 Гц), 7,07 (2H, д, J=8,5 Гц), 7,
10-7,19 (2H, м), 7,22-7,33 (3H, м), 7,55-7,62 (4H, м),
7,90 (2H, д, J=8,5 Гц).
(Пример 92)
Этил
2-(4-изопропилфенокси)-3-[4-[2-(3'-метоксибифенил-4-карбониламино)этокси]фенил]пропионат (этиловый эфир иллюстративного соединения N
7-212)
Реакцию проводили тем же способом, который описан
в примере 73, используя этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-(4-изопропилфенокси)пропионат (723 мг), который
является продуктом ссылочного примера 25, 3'-метоксибифенил-4-карбоновую
кислоту (350 мг), диэтилцианофосфонат (0,25 мл) и триэтиламин (0,47 мл), и реакционную смесь обрабатывали с получением
соединения, указанного в заголовке, (700 мг) в виде бледно-желтого масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,22 (6H, д, J=7,0 Гц), 1,24 (3H, т, J=7,0 Гц), 2,85 (1H, септет,
J=7,0 Гц), 3,18-3,25 (2H, м), 3,91 (3H, с), 3,92-3,99 (2H, м), 4,12-4,28 (4H,
м), 4,73 (1H, дд, J=6,0, 7,0 Гц), 6,62-6,70 (1H, м), 6,79 (2H, д, J= 8,5 Гц), 6,90 (2H, д, J=8,5 Гц), 6,97 (1H, дд, J=2,5,
8,0 Гц), 7,12 (2H, д, J=8,5 Гц), 7,17 (1H, д, J=2,5 Гц), 7,20-7,30 (3H, м),
7,41 (1H, т, J=8,0 Гц), 7,69 (2H, д, J=8,5 Гц), 7,88 (2H, д, J=8,5 Гц).
(Пример 93)
2-(4-Изопропилфенокси)-3-[4-[2-(3'-метоксибифенил-4-карбониламино)этокси]фенил]пропионовая кислота (иллюстративное соединение N 7-212)
Тем же способом, который описан в примере 2, этил
2-(4-изопропилфенокси)-3-[4-[2-(3'-метоксибифенил-4-карбониламино)этокси] фенил] пропионат (700 мг), который является продуктом примера 92, подвергали взаимодействию с водным раствором гидроксида
натрия (1 н., 3,00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (310 мг) в виде белого порошка. Т.пл. 138-139oC.1H-ЯМР (270 МГц, CD3Cl): δ ppm 1,24 (6H, д, J= 7,0 Гц), 2,89 (1H, септет, J=7,0 Гц), 3,27 (2H, д, J=6,0 Гц), 3,93 (3H, с), 3,84-3,96 (2H, м), 4,18 (2H, т, J=5,0 Гц), 4,85 (1H, т, J=6,0 Гц), 6,74 (1H, т,
J=5,
0 Гц), 6,85 (2H, д, J=8,5 Гц), 6,91 (2H, д, J=8,5 Гц), 6,99 (1H, дд, J=2,5, 8,0 Гц), 7,16 (2H, д, J=8,5 Гц), 7,20-7,27 (2H, м), 7,29 (2H, д, J= 8,5 Гц), 7,44 (1H, т, J=8,0 Гц), 7,70 (2H, д, J=8,0
Гц),
7,90 (2H, д, J= 8,0 Гц).
(Пример 94)
Этил 2-(4-изопропилфенокси)-3-[4-[2-(2'-метоксибифенил-4-карбониламино)этокси]фенил]пропионат (этиловый эфир иллюстративного
соединения N
7-219)
Реакцию проводили тем же способом, который описан в примере 73, используя этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-(4-изопропилфенокси)пропионат (723 мг),
который
является продуктом ссылочного примера 25, 2'-метоксибифенил-4-карбоновую кислоту (350 мг), диэтилцианофосфонат (0,25 мл) и триэтиламин (0,47 мл), и реакционную смесь обрабатывали с получением
соединения, указанного в заголовке, (710 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,18 (6H, д, J=7,0 Гц), 1,20 (3H, т, J=7,0 Гц), 2,82 (1H, септет,
J=7,
0 Гц), 3,15-3,20 (2H, м), 3,81 (3H, с), 3,88 (2H, кв, J= 5,0 Гц), 4,14 (2H, т, J=5,0 Гц), 4,18 (2H, кв, J=7,0 Гц), 4,66-4,72 (1H, м), 6,62 (1H, т, J=5,0 Гц), 6,76 (2H, д, J=8,5 Гц), 6,86 (2H, д,
J=8,5
Гц), 6,98-7,10 (4H, м), 7,21-7,38 (4H, м), 7,60 (2H, д, J=8,0 Гц), 7,81 (2H, д, J=8,0 Гц).
(Пример 95)
Натрий
2-(4-изопропилфенокси)-3-[4-[2-(2'-метоксибифенил-4-карбониламино)этокси]фенил]пропионат (иллюстративное соединение N 7-219)
Тем же способом, который описан в примере 2, этил
2-(4-изопропилфенокси)-3-[4-[2-(2'-метоксибифенил-4-карбониламино)этокси] фенил] пропионат (700 мг), который является продуктом примера 94, подвергали взаимодействию с водным раствором гидроксида
натрия (1 н., 3,60 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (528 мг) в виде белого порошка. Т.пл. 205-208oC.1H-ЯМР свободной
кислоты
(270 МГц, CD3Cl): δ ppm 1,18 (6H, д, J=7,0 Гц), 2,82 (1H, септет, J=7,0 Гц), 3,21 (2H, д, J= 6,5 Гц), 3,80 (3H, с), 3,86 (2H, кв, J=5,0 Гц), 4,12 (2H, т, J=5,0 Гц), 4,78 (1H,
т, J=6,
5 Гц), 6,66 (1H, т, J=5,0 Гц), 6,78 (2H, д, J=8,5 Гц), 6,84 (2H, д, J=8,5 Гц), 6,97-7,07 (2H, м), 7,10 (2H, д, J=8,5 Гц), 7,22 (2H, д, J=8,5 Гц), 7,28-7,37 (2H, м), 7,59 (2H, д, J=8,5 Гц), 7,
80 (2H, д,
J=8,5 Гц).
(Пример 96)
Этил 2-(4-изопропилфенокси)-3-[4-[2-(2-фенилпиридин-5-карбониламино)этокси]фенил]пропионат (этиловый эфир иллюстративного соединения N
7-95)
Реакцию проводили тем же способом, который описан в примере 5, используя этил 3-[4-(2-аминоэтокси)фенил] -2-(4-изопропилфенокси)пропионат (743 мг), который является продуктом
ссылочного примера 5,
6-фенилникотиновую кислоту (438 мг) и карбонилдиимидазол (357 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (196 мг) в виде бесцветных
кристаллов. Т. пл.
113-114oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,10-1,23 (9H, м), 2,72-2,88 (1H, м), 3,12-3,19 (2H, м), 3,82-3,93 (2H, м), 4,10-4,23 (4H, м), 4,
69 (1H, дд, J=5,5, 7,
5 Гц), 6,61-6,69 (1H, м), 6,75 (2H, д, J=8,5 Гц), 6,86 (2H, д, J= 8,5 Гц), 7,08 (2H, д, J=8,5 Гц), 7,24 (2H, д, J=8,5 Гц), 7,41-7,53 (3H, м), 7,81 (1H, д, J=8,5 Гц), 8,00-8,08
(2H, м), 8,12-8,20 (1H,
м), 9,01-9,39 (1H, м).
(Пример 97)
2-(4-Изопропилфенокси)-3-[4-[2-(2-фенилпиридин-5-карбониламино)этокси] фенил]пропионовая кислота (иллюстративное
соединение N 7-95)
Тем же способом, который описан в примере 2, этил 2-(4-изопропилфенокси)-3-[4-[2-(2-фенилпиридин-5-карбониламино)этокси]фенил]пропионат (169 мг), который является
продуктом примера 96, подвергали
взаимодействию с водным раствором гидроксида натрия (1 н., 0,60 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (126 мг) в виде
бесцветных кристаллов. Т.пл.
174-176oC.1H-ЯМР (270 МГц, CD3Cl): δ ppm 1,19 (6H, д, J= 7,0 Гц), 2,79-2,90 (1H, м), 3,27 (2H, д, J=5,5 Гц), 3,71-3,88 (1H, м), 3,
88-4,01 (1H, м), 4,28-4,40
(2H, м), 4,94 (1H, т, J=5,5 Гц), 6,50-6,59 (1H, м), 6,84 (2H, д, J=8,5 Гц), 6,95 (2H, д, J=8,5 Гц), 7,11 (2H, д, J=8,5 Гц), 7,30 (2H, д, J=8,5 Гц), 7,42-7,49 (3H, м), 7,
75-7,81 (1H, м), 7,85-7,92 (2H,
м), 8,25-8,31 (2H, м).
(Пример 98)
Этил 2-(4-изопропилфенокси)-3-[4-[2-(2-(4-метоксифенил)пиридин-5- карбониламино)этокси] фенил]пропионат
(этиловый эфир иллюстративного
соединения N 7-233)
Реакцию проводили тем же способом, который описан в примере 5, используя этил 3-[4-(2-аминоэтокси)фенил] -2-(4-изопропилфенокси)пропионат
(743 мг), который является
продуктом ссылочного примера 5, 6-(4-метоксифенил)никотиновую кислоту (504 мг), которая является продуктом ссылочного примера 26, и карбонилдиимидазол (357 мг), и
реакционную смесь обрабатывали с
получением соединения, указанного в заголовке, (182 мг) в виде бесцветных кристаллов. Т. пл. 100-101oC.1H-ЯМР (270 МГц, CDCl3):
δ ppm 1,13-1,23 (9H, м), 2,74-2,
89 (1H, м), 3,12-3,19 (2H, м), 3,88 (3H, с), 3,86-3,93 (2H, м), 4,11-4,23 (4H, м), 4,69 (1H, дд, J=5,5, 7,5 Гц), 6,59-6,65 (1H, м), 6,75 (2H, д, J=8,5 Гц), 6,85
(2H, д, J=8,5 Гц), 7,01 (2H, д, J=8,5
Гц), 7,08 (2H, д, J= 8,5 Гц), 7,24 (2H, д, J=8,5 Гц), 7,74 (1H, д, J=8,5 Гц), 8,00 (2H, д, J=8,5 Гц), 8,13 (1H, дд, J=2,0, 8,5 Гц), 9,01 (1H, д, J=2,0 Гц).
(Пример 99)
2-(4-Изопропилфенокси)-3-[4-[2-[2-(4-метоксифенил)пиридин-5- карбониламино]этокси]фенил]пропионовая кислота (иллюстративное соединение N 7-233)
Тем же
способом, который описан в примере 2,
этил 2-(4-изопропилфенокси)-3-[4-[2-[2-(4-метоксифенил)пиридин-5- карбониламино]этокси]фенил]пропионат (170 мг), который является продуктом примера 98,
подвергали взаимодействию с водным раствором
гидроксида натрия (1 н., 0,58 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (153 мг) в виде бесцветных кристаллов.
Т.пл. 166-167oC.1H-ЯМР
(270 МГц, CD3Cl): δ ppm 1,20 (6H, д, J=7,0 Гц), 2,78-2,90 (1H, м), 3,27 (2H, д, J=5,5 Гц), 3,86 (3H, с), 3,70-4,01 (2H, м), 4,29-4,39
(2H, м), 4,95 (1H, т, J=5,5 Гц), 6,43-6,51 (1H,
м), 6,84 (2H, д, J=8,5 Гц), 6,90-7,00 (4H, м), 7,12 (2H, д, J=8,5 Гц), 7,30 (2H, д, J=8,5 Гц), 7,73 (1H, д, J=8,5 Гц), 7,80-7,88 (2H, м), 8,19 (1H, д,
J= 2,5 Гц), 8,27 (1H, дд, J=2,5, 8,5 Гц).
(Пример 100)
Этил 3-[4-[2-[2-(4-фторфенил)пиридин-5-карбониламино] этокси]фенил]-2-(4-изопропилфенокси)пропионат (этиловый эфир
иллюстративного соединения N 7-231)
Реакцию
проводили тем же способом, который описан в примере 73, используя этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]
-2-(4-изопропилфенокси)пропионат (718 мг), который является продуктом ссылочного
примера 25, 6-(4-фторфенил)никотиновую кислоту (330 мг), которая является продуктом ссылочного примера 27,
диэтилцианофосфонат (0,25 мл) и триэтиламин (0,47 мл), и реакционную смесь обрабатывали с
получением соединения, указанного в заголовке, (560 мг) в виде белого порошка. Т.пл. 117-118oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,18 (6H, д, J=7,0 Гц), 1,21 (3H,
т, J=7,0 Гц), 2,82 (1H, септет, J=7,0 Гц), 3,15-3,20 (2H, м), 3,90 (2H, кв, J=5,0 Гц), 4,13-422 (4H, м),
4,69 (1H, дд, J=5,5, 7,0 Гц), 6,66 (1H, т, J=5,0 Гц), 6,75 (2H, д, J=8,5 Гц), 6,86 (2H, д, J=8,
5 Гц), 7,08 (2H, д, J=8,5 Гц), 7,14- 7,25 (4H, м), 7,76 (1H, д, J= 8,5 Гц), 8,00-8,07 (2H, м), 8,16 (1H,
дд, J=2,0, 8,5 Гц), 9,03 (1H, д, J=2,0 Гц).
(Пример 101)
3-[4-[2-[2-(4-Фторфенил)пиридин-5-карбониламино]этокси]фенил]-2-(4-изопропилфенокси)пропионовая кислота
(иллюстративное соединение N 7-231)
Тем же способом, который описан в примере 2, этил
3-[4-[2-[2-(4-фторфенил)пиридин-5-карбониламино] этокси]фенил]-2-(4-изопропилфенокси)пропионат (540 мг),
который является продуктом примера 100, подвергали взаимодействию с водным раствором гидроксида
натрия (1 н., 3,00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке,
(495 мг) в виде белого порошка. Т.пл. 199-200oC.1H-ЯМР (270 МГц, CD3Cl): δ ppm 1,20 (6H, д, J=7,0 Гц), 2,84 (1H, септет, J=7,0 Гц), 3,20-3,23 (2H, м), 3,86
(2H, кв, J= 5,5 Гц), 4,21 (2H, т, J=5,5 Гц), 4,70 (1H, дд, J=5,5, 7,0 Гц), 6,80 (2H, д, J=8,5 Гц),
6,89 (2H, д, J=8,5 Гц), 7,10 (2H, д, J=8,5 Гц), 7,13-7,30 (4H, м), 7,79 (1H, д, J=8,5 Гц), 7,92 (1H,
т, J=5,5 Гц), 8,03-8,09 (2H, м), 8,25 (1H, дд, J=2,0, 8,5 Гц), 9,12 (1H, д, J=2,0 Гц).
(Пример 102)
Этил 3-[4-[2-[2-(2,2,3,3-тетрафторпропокси)пиридин-5-карбониламино]
этокси] -фенил] -2-(4-изопропилфенокси)пропионат (этиловый эфир иллюстративного соединения N
7-236)
Реакцию проводили тем же способом, который описан в примере 5, используя этил
3-[4-(2-аминоэтокси)фенил] -2-(4-изопропилфенокси)пропионат (500 мг), который является продуктом
ссылочного примера 5, 6-(2,2,3,3-тетрафторпропокси)никотиновую кислоту (375 мг), которая является
продуктом ссылочного примера 28, и карбонилдиимидазол (240 мг), и реакционную смесь обрабатывали с
получением соединения, указанного в заголовке, (137 мг) в виде бесцветного масла.1H-ЯМР
(270 МГц, CDCl3): δ ppm 1,11-1,28 (9H, м), 2,82 (1H, септет, J= 7,0 Гц), 3,10-3,20
(2H, м), 3,83 (2H, кв, J=7,0 Гц), 4,08-4,25 (4H, м), 4,68-4,87 (3H, м), 5,99 (1H, тт, J=4,5, 53
Гц), 6,63-6,89 (6H, м), 7,08 (2H, д, J= 8,5 Гц), 7,22 (2H, д, J=8,5 Гц), 8,05 (1H, дд, J=2,5, 8,5 Гц), 8,
58 (1H, д, J=2,5 Гц).
(Пример 103)
Натрий 3-[4-[2-[2-(2,2,3,
3-тетрафторпропокси)пиридин-5-карбониламино] этокси] фенил] -2-(4-изопропилфенокси)пропионат (иллюстративное
соединение N 7-236)
Тем же способом, который описан в примере 2, этил
3-[4-[2-[2-(2,2,3,3-тетрафторпропокси)пиридин-5-карбониламино] этокси] фенил] -2-(4-изопропилфенокси)пропионат (73 мг),
который является продуктом примера 102, подвергали взаимодействию с водным
раствором гидроксида натрия (1 н., 0,13 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке,
(51 мг) в виде бесцветных кристаллов. Т.пл. 204-207oC.1H-ЯМР (270 МГц, дейтерированный метанол): δ ppm 1,11-1,21 (6H, м), 2,77 (1H, септет, J=7,0 Гц), 2,99-3,17 (2H, м),
3,73 (2H, т, J=5,5 Гц), 4,12 (2H, т, J=5,5 Гц), 4,78-4,90 (3H, м), 6,
30 (1H, тт, J=5,0, 53 Гц), 6,74 (2H, д, J=8,5 Гц), 6,85 (2H, д, J=8,5 Гц), 6,93 (1H, д, J=8,5 Гц), 7,01 (2H, д, J=8,5 Гц), 7,25 (2H,
д, J=8,5 Гц), 8,13 (1H, дд, J=2,5, 8,5 Гц), 8,64 (1H, д, J=2,5
Гц).
(Пример 104)
(S)-2-(4-Изопропилфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионовая
кислота (оптически активное соединение иллюстративного соединения
N 7-35)
К раствору 2-триметилсилилэтил(S)-2-(4-изопропилфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионата
(562 мг), который является продуктом ссылочного примера 29, в
тетрагидрофуране (4,0 мл) при комнатной температуре добавляли раствор фторида тетрабутиламмония в тетрагидрофуране (1М, 2,25 мл). 3атем
смесь перемешивали в течение 1 часа, реакционную смесь
концентрировали при пониженном давлении. Остаток разделяли между этилацетатом и водой. Этилацетатный слой промывали водным раствором
хлороводородной кислоты (0,5 н.) и насыщенным водным раствором
хлорида натрия, и сушили над безводным сульфатом магния, и затем концентрировали при пониженном давлении. Остаток очищали с помощью
тонкослойной хроматографии, используя в качестве элюента
дихлорметан/метанол = 5/1. Продукт кристаллизовали из диизопропилового эфира с получением соединения, указанного в заголовке, (278 мг) в виде
бесцветных кристаллов. Т.пл. 100-101oC.
[α]D25 +13,9o (c = 0,9, хлороформ).1H-ЯМР (400 МГц, CDCl3): δ ppm 1,11
(6H, д, J=7,0 Гц), 2,74 (1H, септет, J= 7,0 Гц), 3,
02-3,16 (2H, м), 3,73-3,82 (2H, м), 3,98-4,07 (2H, м), 4,63-4,74 (1H, м), 6,69-6,80 (4H, м), 6,95-7,01 (3H, м), 7,11 (2H, д, J=8,0 Гц), 7,25-7,31(1H,
м), 7,68 (1H, д, J=8,0 Гц), 7,72-7,85 (3H, м), 7,
93 (2H, д, J= 8,0 Гц), 8,69 (1H, д, J=4,5 Гц).
(Пример 105)
(R)-2-(4-Изопропилфенокси)-3-[4-[2-(4-пиридин-2-илбензоилимино)этокси] фенил] пропионовая кислота (оптически
активное соединение иллюстративного соединения N 7-35)
Реакцию проводили тем же
способом, который описан в примере 104, используя
2-триметилсилилэтил(R)-2-(4-изопропилфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (270 мг), который является продуктом
ссылочного примера 30, и фторид тетрабутиламмония в
тетрагидрофуране (1М, 1,08 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (117 мг) в виде бесцветных
кристаллов. Т.пл. 95-96oC. [α]D25 -10,5o (c = 1,5, хлороформ).1H-ЯМР (400 МГц, CDCl3): δ ppm 1,11 (6H, д, J= 7,
0 Гц), 2,73 (1H, септет, J=7,0 Гц), 3,02-3,16 (2H,
м), 3,73-3,82 (2H, м), 3,98-4,07 (2H, м), 4,63-4,74 (1H, м), 6,69-6,80 (4H, м), 6,95-7,02 (3H, м), 7,12 (2H, д, J= 8,0 Гц), 7,25-7,31(1H, м), 7,65
(1H, д, J=8,0 Гц), 7,72-7,83 (3H, м), 7,88 (2H, д,
J=8,0 Гц), 8,70 (1H, д, J=4,5 Гц).
(Пример 106)
Этил
2-(4-изопропилфенокси)-3-[4-[2-[4-(3-трифторметилпиридин-6-ил)бензоиламино] этокси] фенил]пропионат (этиловый эфир
иллюстративного соединения N 7-227)
К раствору
3-трифторметилпиридин-6-илбензойной кислоты (546 мг) в толуоле (28,0 мл) при комнатной температуре добавляли одну каплю N,N-диметилформамида и
тионилхлорида (0,75 мл). Затем смесь перемешивали в
течение 4 часов при 85oC, растворитель отгоняли и тионилхлорид азеотропно упаривали досуха толуолом при пониженном давлении. К раствору
остатка, полученного выше, и этил
3-[4-(2-аминоэтокси)фенил]-2-(4-изопропилфенокси)пропионата (201 мг), который является продуктом ссылочного примера 5, в дихлорметане (10 мл) на ледяной бане
добавляли триэтиламин (1,23 мл). Затем
смесь перемешивали в течение 30 минут, реакционную смесь концентрировали. Остаток разделяли между этилацетатом и водой. Этилацетатный слой отделяли, промывали
насыщенным водным хлоридом натрия и
сушили над безводным сульфатом магния, и затем упаривали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем используя в
качестве элюента гексан/этилацетат =
3/2-1/1, с получением соединения, указанного в заголовке, (570 мг) в виде желтой пенистой массы.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,18
(6H, д, J=7,0 Гц), 1,21 (3H, т, J=7,0
Гц), 2,81 (1H, септет, J=7,0 Гц), 3,17 (2H, д, J=6,5 Гц), 3,90 (2H, кв, J=5,0 Гц), 4,14 (2H, т, J=5,0 Гц), 4,18 (2H, т, J= 7,0 Гц), 4,70 (1H, т, J=6,5 Гц), 6,67
(1H, ушир.т), 6,75 (2H, д, J=8,5 Гц), 6,
86 (2H, д, J=8,5 Гц), 7,07 (2H, д, J=8,5 Гц), 7,24 (2H, д, J=8,5 Гц), 7,88 (1H, д, J= 8,5 Гц), 7,91 (2H, д, J=8,5 Гц), 8,01 (1H, д, J=8,5 Гц), 8,12 (2H, д, J=8,
5 Гц), 8,99 (1H, с).
(Пример 107)
2-(4-изопропилфенокси)-3-[4-[2-[4-(3-трифторметилпиридин-6-ил)бензоиламино] этокси]фенил]пропионовая кислота (иллюстративное соединение N
7-227)
Тем же способом, который
описан в примере 2, этил 2-(4-изопропилфенокси)-3-[4-[2-[4-(3-трифторметилпиридин-6-ил)бензоиламино]этокси]фенил]пропионат (500 мг), который является
продуктом примера 106, подвергали взаимодействию с
водным раствором гидроксида натрия (1 н 1,60 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (383 мг) в виде
белого порошка. Т.пл. 212-214oC.1H-ЯМР (270 МГц, дейтерированный диметилсульфоксид): δ ppm 1,13 (6Н, д, J=7,0 Гц), 2,78 (1H, септет, J=7,0 Гц), 3,07 (1H, д, J= 7,0 Гц),
3,09 (1H, д, J=5,0 Гц), 3,64 (2H, кв, J=5,5 Гц), 4,
11 (2H, т, J= 5,5 Гц), 4,77 (1H, дд, J=5,0, 7,0 Гц), 6,74 (2H, д, J=8,5 Гц), 6,90 (2H, л, J=8,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,23 (2H, д, J=8,5 Гц),
8,02 (2H, д, J=8,5 Гц), 8,27 (2H, д, J=8,5 Гц), 8,
30-8,36 (2H, м), 8,84 (1H, ушир.т), 9,08 (1H, с).
(Пример 108)
Этил
2-(4-изопропилфенокси)-3-[4-[2-[4-(3-нитропиридин-6-ил)бензоиламино]этокси]фенил]пропионовая кислота
(этиловый эфир иллюстративного соединения N 7-228)
Реакцию проводили тем же способом,
который описан в примере 79, используя этил 3-[4-(2-аминоэтокси)фенил] -2-(4-изопропилфенокси)пропионат
(290 мг), который является продуктом ссылочного примера 5, 3-нитропиридин-6-илбензойную кислоту
(277 мг), которая является продуктом ссылочного примера 32, диэтилцианофосфонат (0,18 мл) и триэтиламин
(0,29 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке,
(379 мг) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,18 (6H, д, J=7,0 Гц),
1,21 (3H, т, J=7,0 Гц), 2,82 (1H, септет, J=7,0 Гц), 3,17 (1H, д, J=5,0 Гц), 3,18 (1H, д,
J=7,5 Гц), 3,90 (2H, кв, J=5,0 Гц), 4,06-4,39 (4H, м), 4,69 (1H, дд, J= 5,0, 7,5 Гц), 6,68 (1H, ушир.т), 6,75
(2H, д, J=8,5 Гц), 6,86 (2H, д, J= 8,5 Гц), 7,13 (2H, д, J=8,5 Гц), 7,24 (2H, д, J=8,5
Гц), 7,93 (2H, д, J=8,5 Гц), 7,95 (1H, д, J=8,5 Гц), 8,17 (2H, д, J=8,5 Гц), 8,56 (1H, дд, J=2,0, 8,5 Гц), 9,51
(1H, д, J=2,0 Гц).
(Пример 109)
2-(4-Изопропилфенокси)-3-[4-[2-[4-(3-нитропиридин-6- ил)бензоиламино]этокси]фенил]пропионовая кислота (иллюстративное соединение N 7-228)
Тем же способом, который описан в примере 2, этил
2-(4-изопропилфенокси)-3-[4-[2-[4-(3-нитропиридин-6-ил)бензоиламино]этокси]фенил]пропионат (397 мг), который является продуктом примера 108,
подвергали взаимодействию с водным раствором гидроксида
натрия (1 н., 1,30 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (216 мг) в виде белого порошка. Т.пл.
198-199oC.1H-ЯМР (270 МГц,
дейтерированный диметилсульфоксид): δ ppm 1,13 (6H, д, J=7,0 Гц), 2,79 (1H, септет, J=7,0 Гц), 3,07 (1H, д, J= 7,5 Гц), 3,09 (1H, д, J=5,5 Гц),
3,65 (2H, кв, J=5,5 Гц), 4,11 (2H, т, J= 5,5 Гц),
4,78 (1H, дд, J=5,5, 7,5 Гц), 6,74 (2H, д, J=8,5 Гц), 6,90 (2H, д, J=8,5 Гц), 7,10 (2H, д, J=8,5 Гц), 7,23 (2H, д, J=8,5 Гц), 8,04 (2H, д, J=8,5 Гц),
8,31 (2H, д, J=8,5 Гц), 8,36 (1H, д, J=8,5 Гц),
8,70 (1H, дд, J=2,0, 8,5 Гц), 8,86 (1H, ушир.т), 9,47 (1H, д, J=2,0 Гц).
(Пример 110)
Этил
2-(4-изопропилфенокси)-3-[4-[2-[4-(3-метоксипиридин-6-ил)бензоиламино] этокси]
фенил]пропионат (этиловый эфир иллюстративного соединения N 7-222)
Реакцию проводили тем же способом, который
описан в примере 106, используя этил 3-[4-(2-аминоэтокси)фенил]
-2-(4-изопропилфенокси)пропионат (301 мг), который является продуктом ссылочного примера 5, 3-метоксипиридин-6-илбензойную кислоту (195
мг), которая является продуктом ссылочного примера 33,
тионилхлорид (0,31 мл) и триэтиламин (0,36 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (199 мг) в виде
белого порошка. Т.пл. 118-119oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,18 (6H, д, J=7,0 Гц), 1,23 (3H, т, J=7,0 Гц), 2,82 (1H, септет, J=7,0 Гц), 3,16 (1H, д, J= 5,0
Гц), 3,18 (1H, д, J=7,5 Гц), 3,89 (2H, кв, J=5,
0 Гц), 3,92 (3H, с), 4,15 (2H, т, J=5,0 Гц), 4,18 (2H, кв, J=7,0 Гц), 4,69 (1H, дд, J=5,0, 7,5 Гц), 6,63 (1H, ушир.т), 6,76 (2H, д, J=8,5 Гц), 6,86 (2H,
д, J=8,5 Гц), 7,08 (2H, д, J= 8,5 Гц), 7,23
(2H, д, J=8,5 Гц), 7,28 (1H, дд, J=3,0, 8,5 Гц), 7,71 (1H, д, J=8,5 Гц), 7,86 (2H, д, J=8,5 Гц), 8,01 (2H, д, J=8,5 Гц), 8,41 (1H, д, J=3,0 Гц).
(Пример 111)
2-(4-Изопропилфенокси)-3-[4-[2-[4-(3-метоксипиридин-6- ил)бензоиламино] этокси]фенил]пропионовая кислота (иллюстративное соединение N 7-222)
Тем же способом,
который описан в примере 2, этил
2-(4-изопропилфенокси)-3-[4-[2-[4-(3-метоксипиридин-6- ил)бензоиламино] этокси]фенил]пропионат (210 мг), который является продуктом примера 110, подвергали
взаимодействию с водным раствором
гидроксида натрия (1 н., 0,72 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (185 мг) в виде белого порошка. Т.пл. 145-146oC.1H-ЯМР (270
МГц, CDCl3): δ ppm 1,19 (6H, д, J=7,0 Гц), 2,83 (1H, септет, J=7,0 Гц), 3,22 (2H, д, J=6,0 Гц), 3,88 (2H, кв, J=5,0 Гц), 3,91 (3H, с), 4,20 (2H, т,
J=5,0 Гц), 4,82 (1H, т, J=6,0 Гц),
6,65 (1H, ушир.т), 6,83 (2H, д, J=8,5 Гц), 6,86 (2H, д, J=8,5 Гц), 7,11 (2H, д, J= 8,5 Гц), 7,21 (2H, д, J=8,5 Гц), 7,32 (1H, дд, J=3,0, 9,0 Гц), 7,67 (1H, д, J=9,0
Гц), 7,75 (2H, д, J=8,5 Гц), 7,88
(2H, д, J=8,5 Гц), 8,41 (1H, д, J=3,0 Гц).
(Пример 112)
Этил 3-[4-[2-[4-(3-диметиламинопиридин-6- ил)бензоиламино]этокси]фенил]
-2-(4-изопропилфенокси)пропионат (этиловый
эфир иллюстративного соединения N 7-225)
Реакцию проводили тем же способом, который описан в примере 106, используя этил 3-[4-(2-аминоэтокси)фенил]
-2-(4-изопропилфенокси)пропионат (370 мг),
который является продуктом ссылочного примера 5, 3-диметиламинопиридин-6-илбензойную кислоту (221 мг), которая является продуктом ссылочного примера 34,
тионилхлорид (0,34 мл) и триэтиламин (0,51 мл),
и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (456 мг) в виде пенной массы.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,18 (6H, д, J=7,0 Гц), 1,
20 (3H, т, J=7,0 Гц), 2,82 (1H, септет, J=7,0 Гц), 3,04 (6H, с), 3,16 (1H, д, J=5,0 Гц), 3,17 (1H, д, J=7,5 Гц), 3,88 (2H, кв, J=5,0 Гц), 4,14 (2H, т,
J= 5,0 Гц), 4,18 (2H, кв, J=7,0 Гц), 4,69 (1H,
дд, J=5,0, 7,5 Гц), 6,76 (2H, д, J= 8,5 Гц), 6,86 (2H, д, J=8,5 Гц), 7,06 (1H, дд, J=2,5, 9,0 Гц), 7,08 (2H, д, J=8,5 Гц), 7,23 (2H, д, J=8,5 Гц), 7,45
(1H, ушир.т), 7,64 (1H, д, J= 9,0 Гц), 7,83 (2H,
д, J=8,5 Гц), 8,00 (2H, д, J=8,5 Гц), 8,23 (1H, д, J= 2,5 Гц).
(Пример 113)
3-[4-[2-[4-(3-Диметиламинопиридин-6-ил)бензоиламино] этокси] фенил]
-2-(4-изопропилфенокси)пропионовая кислота (иллюстративное соединение N 7-225)
Тем же способом, который описан в примере 2,
этил 3-[4-[2-[4-(3-диметиламинопиридин-6-ил)бензоиламино] этокси]
фенил] -2-(4- изопропилфенокси)пропионат (429 мг), который является продуктом примера 112, подвергали взаимодействию с водным
раствором гидроксида натрия (1 н., 1,44 мл) и реакционную смесь
обрабатывали с получением соединения, указанного в заголовке, (219 мг) в виде белого порошка. Т.пл. 150-151oC.1
H-ЯМР (270 МГц, CDCl3/дейтерированный метанол = 1/5):
δ ppm 1,15 (6H, д, J=7,0 Гц), 2,77 (1H, септет, J= 7,0 Гц), 3,04 (6H, с), 3,10 (1H, дд, J=8,5, 14,5 Гц), 3,15 (1H, дд, J= 4,5,
14,5 Гц), 3,76 (2H, т, J=5,5 Гц), 4,14 (2H, т, J=5,5 Гц), 4,58
(1H, дд, J= 4,5, 8,5 Гц), 6,74 (2H, д, J=8,5 Гц), 6,87 (2H, д, J=8,5 Гц), 7,02 (2H, д, J=8,5 Гц), 7,22 (1H, дд, J=3,0, 9,0 Гц), 7,23 (2H,
д, J= 8,5 Гц), 7,72 (1H, д, J=9,0 Гц), 7,85-7,95 (4H, м), 8,
11 (1H, д, J=3,0 Гц).
(Пример 114)
Этил 2-(4-метилфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]
фенил]пропионат (этиловый эфир иллюстративного соединения N 14-11)
Реакцию проводили тем же способом, который описан в примере 73, используя этил
3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-(4-метилфенокси)пропионат (798 мг), который является продуктом
ссылочного примера 35, 4-пиридин-2-илбензойную кислоту (365 мг), диэтилцианофосфонат (0,
28 мл) и триэтиламин (0,46 мл), и реакционную смесь обрабатывали с получением соединения, указанного в
заголовке, (680 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3):
δ ppm 1,23 (3H, т, J=7,0 Гц), 2,28 (3H, с), 3,14-3,22 (2H, м), 3,88-3,96 (2H, м), 4,11-4,27 (4H, м),
4,73 (1H, т, J=6,0 Гц), 6,62-6,71 (1H, м), 6,76 (2H, д, J=8,5 Гц), 6,90 (2H, д, J=8,5 Гц), 7,
05 (2H, д, J=8,5 Гц), 7,22-7,33 (3H, м), 7,78-7,83 (2H, м), 7,92 (2H, д, J=8,5 Гц), 8,11 (2H, д, J=8,5
Гц), 8,71-8,78 (1H, м).
(Пример 115)
2-(4-Метилфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил]пропионовая кислота (иллюстративное соединение N 14-11)
Тем
же способом, который описан в примере 2, этил
2-(4-метилфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил]пропионат (680 мг), который является продуктом примера 114, подвергали взаимодействию
с водным раствором гидроксида натрия (1 н., 2,
60 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (570 мг) в виде белого порошка. Т. пл. 129-131oC.1H-ЯМР (270 МГц, CDCl3):
δ ppm 2,25 (3H, с), 3,21 (2H, д, J= 6,0 Гц), 3,81-3,90 (2H, м), 4,15-4,21 (2H, м), 4,80 (1H, т, J=6,0 Гц), 6,68-6,75 (1H, м), 6,79 (2H, д, J=8,5
Гц), 6,85 (2H, д, J=8,5 Гц), 7,03 (2H, д, J=8,5
Гц), 7,21 (2H, д, J=8,5 Гц), 7,29-7,36 (1H, м), 7,70-7,88 (4H, м), 7,92 (2H, д, J=8,5 Гц), 8,69-8,73 (1H, м).
(Пример 116)
Этил
2-(4-трет-бутилфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионат (этиловый эфир иллюстративного соединения N 138-8)
Реакцию проводили тем же способом, который описан
в
примере 73, используя этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-(4-трет-бутилфенокси)пропионат (530 мг), который является продуктом ссылочного примера 36, 4-пиридин-2-илбензойную
кислоту
(227 мг), диэтилцианофосфонат (0,18 мл) и триэтиламин (0,33 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (370 мг) в виде пенистой массы.1
H-ЯМР
(270 МГц, CDCl3): δ ppm 1,21 (3H, т, J=7,0 Гц), 1,25 (9H, с), 3,15-3,20 (2H, м), 3,89 (2H, кв, J= 5,0 Гц), 4,10-422 (4H, м), 4,69 (1H, дд, J=5,5, 7,5 Гц), 6,66 (1H, т, J= 5,0
Гц), 6,
76 (2H, д, J=8,5 Гц), 6,86 (2H, д, J=8,5 Гц), 7,23-7,30 (5H, м), 7,74-7,80 (2H, м), 7,89 (2H, д, J=8,5 Гц), 8,07 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=4,5 Гц).
(Пример 117)
2-(4-Трет-бутилфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионовая кислота (иллюстративное соединение N 138-8)
Тем же способом, который описан в примере 2, этил
2-(4-трет-бутилфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионат (360 мг), который является продуктом примера 116, подвергали взаимодействию с водным раствором гидроксида натрия (1
н., 2,00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (315 мг) в виде белого порошка. Т. пл. 94-96oC.1H-ЯМР (270 МГц, CDCl3
):
δ ppm 1,24 (9H, с), 3,20 (2H, д, J=6,0 Гц), 3,80-3,90 (2H, м), 4,13-4,20 (2H, м), 4,79 (1H, т, J=6,0 Гц), 6,76 (1H, т, J=5,0 Гц), 6,82 (2H, д, J=8,0 Гц), 6,85 (2H, д, J=8,0 Гц), 7,22 (2H, д,
J=8,0 Гц), 7,25 (2H, д, J=8,0 Гц), 7,28-7,35 (1H, м), 7,70-7,90 (4H, м), 7,91 (2H, д, J=8,5 Гц), 8,73 (1H, д, J=4,5 Гц).
(Пример 118)
Этил
2-(4-фторфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил] пропионат (этиловый эфир иллюстративного соединения N 138-56)
Реакцию проводили тем же способом, который описан в примере
65, используя этил 3-[4-(2-аминоэтокси)фенил]-2-(4-фторфенокси)пропионат (2,10 г), который является продуктом ссылочного примера 37, 4-пиридин-2-илбензоилхлорид гидрохлорид (1,90 г) и триэтиламин (2,
20 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (2,50 г) в виде белого порошка. Т.пл. 116-118oC.1H-ЯМР (270 МГц, CDCl3):
δ ppm 1,20 (3H, т, J= 7,0 Гц), 3,17 (2H, д, J=6,5 Гц), 3,80-3,91 (2H, м), 4,08-4,21 (4H, м), 4,66 (1H, т, J=6,5 Гц), 6,62-6,70 (1H, м), 6,70-6,80 (2H, м), 6,80-6,92 (4H, м), 7,20-7,30 (3H, м),
7,71-7,80 (2H, м), 7,88 (2H, д, J=8,5 Гц), 8,07 (2H, д, J=8,5 Гц), 8,71 (1H, д, J=5,0 Гц).
(Пример 119)
2-(4-Фторфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил]пропионовая кислота (иллюстративное соединение N 138-56)
Тем же способом, который описан в примере 2, этил
2-(4-фторфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (2,45 г), который является продуктом примера 118, подвергали взаимодействию с водным раствором гидроксида натрия (1 н.,
15,0 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (2,30 г) в виде белого порошка. Т. пл. 139-140,5oC.1H-ЯМР (270 МГц, CDCl3
):
δ ppm 3,20 (2H, д, J=6,5 Гц), 3,80-3,91 (2H, м), 4,16-4,22 (2H, м), 4,74 (1H, т, J=6,5 Гц), 6,69-6,77 (1H, м), 6,77-6,92 (6H, м), 7,19 (2H, д, J=8,5 Гц), 7,30-7,37 (1H, м), 7,69-7,80 (3H,
м), 7,
80-7,90 (3H, м), 8,71 (1H, д, J=4,0 Гц).
(Пример 120)
Этил 2-(4-хлорфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламиноэтокси]фенил] пропионат (этиловый эфир иллюстративного
соединения N 138-72)
Реакцию проводили тем же способом, который описан в примере 73, используя этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-(4-хлорфенокси)пропионат (1,23 г),
который является продуктом ссылочного примера 38, 4-пиридин-2-илбензойную кислоту (539 мг), диэтил цианофосфонат (0,41 мл) и триэтиламин (0,68 мл), и реакционную смесь обрабатывали с получением
соединения, указанного в заголовке, (977 мг) в виде бесцветных кристаллов. Т. пл. 134-135oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (3H, т, J=7,0 Гц), 3,17 (2H, д,
J=6,5 Гц), 3,83-3,92 (2H, м), 4,08-4,21 (4H, м), 4,69 (1H, т, J=6,5 Гц), 6,60-6,68 (1H, м), 6,75 (2H, д, J=8,5 Гц), 6,87 (2H, д, J=8,5 Гц), 7,13-7,30 (5H, м), 7,72-7,79 (2H, м), 7,89 (2H, д, J=8,5
Гц),
8,08 (2H, д, J=8,5 Гц), 8,70-8,73 (1H, м).
(Пример 121)
2-(4-Хлорфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионовая кислота (иллюстративное
соединение N
138-72)
Тем же способом, который описан в примере 2, этил 2-(4-хлорфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (950 мг), который является продуктом
примера 120,
подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 3,49 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (834 мг) в виде
бесцветных кристаллов.
Т. пл. 155-156oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,21 (2H, д, J=6,0 Гц), 3,80-3,90 (2H, м), 4,12-4,22 (2H, м), 4,76 (1H, т, J=6,0 Гц), 6,
70-6,88 (5H, м), 7,15
(2H, д, J=8,5 Гц), 7,20 (2H, д, J=8,5 Гц), 7,30-7,38 (1H, м), 7,79-7,90 (6H, м), 8,70-8,74 (1H, м).
(Пример 122)
Этил
3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]
фенил]-2-(4-трифторметилфенокси)пропионат (этиловый эфир иллюстративного соединения N 138-24)
К раствору этил
2-гидрокси-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионата (332 мг),
который является продуктом ссылочного примера 39, 4-трифторметилфенола (186 мг) и трифенилфосфина (300 мг) в толуоле
(10 мл) при комнатной температуре добавляли по каплям раствор
диэтилазодикарбоксилата (40% раствор толуола, 0,52 мл) в толуоле (3,0 мл). Затем смесь перемешивали в течение 2 часов при комнатной
температуре, в реакционную смесь добавляли трифенилфосфин (100 мг) и
диэтилазокарбоксилат (40% раствор толуола, 0,19 мл). Смесь перемешивали в течение 18 часов. Реакционную смесь концентрировали при
пониженном давлении. Остаток очищали с помощью хроматографии на
колонке с силикагелем, используя в качестве элюента дихлорметан/этилацетат = 3/2, с получением соединения, указанного в заголовке, (283
мг, содержит некоторые примеси) в виде белого порошка.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (3H, т, J= 7,0 Гц), 3,21 (2H, д, J=6,5 Гц), 3,89 (2H, кв, J=5,0 Гц), 4,16 (2H,
т, J= 5,0 Гц), 4,21 (2H, кв, J=7,0 Гц), 4,77 (1H, т, J=6,5
Гц), 6,66 (1H, ушир. т), 6,88 (2H, д, J=8,5 Гц), 6,90 (2H, д, J=8,5 Гц), 7,23 (2H, д, J= 8,5 Гц), 7,26-7,34 (1H, м), 7,49 (2H, д, J=8,5 Гц),
7,75-7,83 (2H, м), 7,89 (2H, д, J=8,5 Гц), 8,07 (2H, д, J=8,
5 Гц), 8,72 (1H, д, J=5,0 Гц).
(Пример 123)
3-[4-[2-(4-Пиридин-2-илбензоиламино)этокси] фенил]
-2-(4-трифторметилфенокси)пропионовая кислота (иллюстративное соединение N
138-24)
Тем же способом, который описан в примере 2, этил 3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]
фенил]-2-(4-трифторметилфенокси)пропионат (269 мг), который является продуктом примера
122, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 0,55 мл) и реакционную смесь
обрабатывали с получением соединения, указанного в заголовке, (138 мг) в виде белого порошка.
Т.пл. 154-155oC.1H-ЯМР (270 МГц, дейтерированный диметилсульфоксид): δ ppm
3,02 (1H, дд, J=5,0, 13,5 Гц), 3,16 (1H, дд, J=2,0, 13,5 Гц), 3,63 (2H, кв, J= 5,5 Гц), 4,10
(2H, T, J=5,5 Гц), 4,64 (1H, дд, J=2,0, 5,0 Гц), 6,88 (2H, д, J=8,5 Гц), 6,95 (2H, д,
J= 8,5 Гц),
7,23 (2H, д, J=8,0 Гц), 7,41 (1H, дд, J=6,0, 7,5 Гц), 7,54 (2H, д, J=8,5 Гц), 7,88-7,97 (1H,
м), 7,98 (2H, д, J=8,5 Гц), 8,05 (1H, д, J= 7,5 Гц), 8,18 (2H, д, J=8,0 Гц), 8,70 (1H, д, J=3,5 Гц), 8,78
(1H, ушир. т).
(Пример 124)
Этил
2-(4-метоксифенокси)-3-[4-[2-(4-пиридин-2- илбензоиламино)этокси] фенил]пропионат (этиловый эфир иллюстративного соединения N 8-35)
Реакцию проводили тем же способом, который описан в примере
122, используя этил 2-гидрокси-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (433 мг), который является продуктом ссылочного
примера 39, 4-метоксифенол (247 мг), трифенилфосфин (523 мг)
и диэтилазодикарбоксидат (40% раствор толуола, 0,65 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке,
(320 мг) в виде желтого масла.
1 H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (3H, т, J=7,0 Гц), 3,17 (2H, д, J= 6,5 Гц), 3,72 (3H, с), 3,89 (2H, кв, J=5,5 Гц), 4, 10-4,21 (4H, м), 4,63 (1H, т, J= 6,5 Гц), 6,66 (1H, т, J=5,5 Гц), 6,87 (2H, д, J=8,5 Гц), 7,23 (2H, д, J= 8,5 Гц), 7,23-7,30 (1H, м), 7,40-7,70 (4H, м), 7,75-7,80 (2H, м), 7,88 (2H, д, J=8,5 Гц), 8, 08 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=4,5 Гц).
(Пример 125)
2-(4-Метоксифенокси)-3-[4-[2-(4-пиридин-2- илбензоиламино)этокси]фенил] пропионовая кислота (иллюстративное
соединение N 8-35)
Тем же способом, который описан в примере
2, этил 2-(4-метоксифенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (310 мг), который является продуктом
примера 124, подвергали взаимодействию с водным раствором гидроксида
натрия (1 н., 2,00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (150 мг) в виде белого
порошка. Т.пл. 67,5-70oC.1H-ЯМР (270 МГц,
CDCl3): δ ppm 3,20 (2H, д, J=6,0 Гц), 3,73 (3H, с), 3,82-3,92 (2H, м), 4,16-4,25 (2H, м), 4,74 (1H, т, J=6,5 Гц), 6,
65-6,90 (7H, м), 7,21 (2H, д, J=8,5 Гц), 7,27-7,37 (1H, м), 7,70-7,
89 (4H, м), 7,93 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=5,0 Гц).
(Пример 126)
Этил
3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил]-2-(4- трифторметоксифенокси)пропионат
(этиловый эфир иллюстративного соединения N 138-40)
Этил
3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]-2-(4- трифторметоксифенокси) пропионат (2,11 г), который является продуктом ссылочного
примера 40, растворяли в растворе хлороводорода в диоксане (4 н.,
30 мл). Смесь оставляли стоять в течение 40 минут при комнатной температуре. Затем реакционную смесь концентрировали при пониженном
давлении и хлороводород азеотропно упаривали толуолом. Остаток,
который представляет собой этил 3-[4-(2-аминоэтокси)фенил]-2-(4-трифторметокси-фенокси)пропионат соляной кислоты, и
4-пиридин-2-илбензоилхлоридгидрохлорид (1,25 г) суспендировали в дихлорметане (70
мл). К этой суспензии на ледяной бане добавляли триэтиламин (2,28 мл) и смесь перемешивали в течение 1 часа при той же
температуре. Реакционную смесь концентрировали при пониженном давлении. Остаток
разделяли между этилацетатом и водой, и этилацетатный слой отделяли и промывали насыщенным водным раствором хлорида
натрия, и сушили над безводным сульфатом магния, и концентрировали при пониженном
давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента
гексан/этилацетат = 2/3, с получением соединения, указанного в заголовке, (1,75 г) в виде
бесцветных кристаллов. Т.пл. 87-88oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,
17 (3H, т, J=7,0 Гц), 3,18 (2H, д, J=6,5 Гц), 3,89 (2H, кв, J=5,0 Гц), 4,10-4,25 (4H, м),
4,70 (1H, т, J=6,5 Гц), 6,65 (1H, ушир.т), 6,81 (2H, д, J= 8,5 Гц), 6,88 (2H, д, J=8,5 Гц), 7,08 (2H, д, J=8,5
Гц), 7,14-7,31 (1H, м), 7,23 (2H, д, J=8,5 Гц), 7,72-7,82 (2H, м), 7,89 (2H, д, J=8,5
Гц), 8,07 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=4,5 Гц).
(Пример 127)
3-[4-[2-(4-Пиридин-2-илбензоиламино)этокси] фенил]-2-(4- трифторметоксифенокси)пропоновая кислота
(иллюстративное соединение N 138-40)
Тем же способом, который описан в примере 2, этил
3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] -2-(4- трифторметоксифенокси)пропионат (1,65 г),
который является продуктом примера 126, подвергали взаимодействию с водным раствором гидроксида
натрия (1 н., 5,54 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке,
(1,33 г) в виде бесцветных кристаллов. Т.пл. 180-181oC.1H-ЯМР (270 МГц,
дейтерированный метанол): δ ppm 3,16 (1H, дд, J=8,0, 14,5 Гц), 3,22 (1H, дд, J=4,5, 14,5 Гц), 3,
78 (2H, кв, J=5,5 Гц), 4,16 (2H, т, J=5,5 Гц), 4,83 (1H, дд, J=4,5, 8,0 Гц), 6,89 (2H, д, J=8,5
Гц), 6,91 (2H, д, J=8,5 Гц), 7,13 (2H, д, J=8,5 Гц), 7,24 (2H, д, J=8,5 Гц), 7,36-7,45 (1H, м), 7,88-7,
99 (2H, м), 7,94 (2H, д, J= 8,5 Гц), 8,05 (2H, д, J=8,5 Гц), 8,64 (1H, д, J=5,0 Гц), 8,77 (1H,
ушир. т).
(Пример 128)
Этил
2-(4-цианофенокси)-3-[4-[2-(4-пиридин-2- илбензоиламино)этокси]фенил]пропионат (этиловый эфир иллюстративного соединения N 138-104)
Реакцию проводили тем же способом, который описан в
примере 126, используя этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]-2-(4- цианофенокси)пропионат (237 мг), который является продуктом
ссылочного примера 41,
4-пиридин-2-илбензоилхлоридгидрохлорид (131 мг) и триэтиламин (0,29 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (244 мг) в виде
сиропа.1H-ЯМР
(270 МГц, CDCl3): δ ppm 1,20 (3H, т, J= 7,0 Гц), 3,21 (2H, д, J=6,5 Гц), 3,89 (2H, кв, J=5,0 Гц), 4,16 (2H, т, J= 5,0 Гц), 4,19 (2H, кв, J=7,0 Гц), 4,79 (1H,
т, J=6,5 Гц), 6,65 (1H,
ушир.т), 6,88 (2H, д, J=8,5 Гц), 7,21 (2H, д, J=8,5 Гц), 7,24-7,31 (1H, м), 7,54 (2H, д, J=8,5 Гц), 7,70-7,84 (2H, м), 7,88 (2H, д, J=8,5 Гц), 8,07 (2H, д, J=8,5 Гц), 8,72 (1H,
д, J=5,0 Гц).
(Пример 129)
2-(4-Цианофенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионовая кислота (иллюстративное соединение N 138-104)
Тем же
способом, который
описан в примере 2, этил 2-(4-цианофенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил]пропионат (244 мг), который является продуктом примера 128, подвергали взаимодействию с
водным раствором
гидроксида натрия (1 н., 0,92 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (184 мг) в виде бесцветных кристаллов. Т.пл. 92-93oC.1H-ЯМР
(270 МГц, дейтерированный метанол): δ ppm 3,24 (2H, д, J=6,0 Гц), 3,86 (2H, кв, J=5,5 Гц), 4,15-4,25 (2H, м), 4,85 (1H, т, J= 6,0 Гц), 6,76 (1H, ушир.т), 6,85 (2H, д, J=8,0
Гц), 6,91 (2H, д,
J=8,5 Гц), 7,20 (2H, д, J=8,5 Гц), 7,37 (1H, дд, J=5,0, 6,0 Гц), 7,48 (2H, д, J= 7,5 Гц), 7,73 (3H, д, J=8,0 Гц), 7,84 (2H, д, J=7,5 Гц), 7,87 (1H, дд, J= 6,0, 8,0 Гц), 8,71 (1H, д,
J=5,0 Гц).
(Пример 130)
Метил 2-(4-метилтиофенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионат (метил эфир иллюстративного соединения N 138-120)
Реакцию проводили
тем же способом, который описан в примере 126, используя метил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]-2-(4-метилтиофенокси)пропионат (265 мг), который является продуктом
ссылочного примера 42,
4-пиридин-2-илбензоилхлоридгидрохлорид (175 мг) и триэтиламин (0,32 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (164 мг) в виде
бесцветных кристаллов. Т.пл.
94-95oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 2,41 (3H, с), 3,17 (2H, д, J=6,5 Гц), 3,71 (3H, с), 3,89 (2H, кв, J=5,0 Гц), 4,16 (2H, т,
J=5,0 Гц), 4,72 (1H, т, J=6,5
Гц), 6,66 (1H, ушир. т), 6,77 (2H, д, J=8,5 Гц), 6,87 (2H, д, J=8,5 Гц), 7,18 (2H, д, J=8,5 Гц), 7,21 (2H, д, J=8,0 Гц), 7,23-7,30 (1H, м), 7,73-7,84 (2H, м), 7,88 (2H, д,
J=8,0 Гц), 8,07 (2H, д, J=8,
5 Гц), 8,72 (1H, д, J=4,5 Гц).
(Пример 131)
2-(4-Метилтиофенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионовая кислота
(иллюстративное соединение N
138-120)
Тем же способом, который описан в примере 2, метил 2-(4-метилтиофенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (203 мг), который
является продуктом примера
130, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 0,74 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (153
мг) в виде бесцветных
кристаллов. Т. пл. 168-169oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 2,40 (3H, с), 3,22 (2H, д, J= 6,0 Гц), 3,87 (2H, кв, J=5,0 Гц), 4,21 (2H, т,
J=5,0 Гц), 4,80 (1H,
т, J=6,0 Гц), 6,72 (1H, ушир.т), 6,84 (2H, д, J=8,5 Гц), 6,86 (2H, д, J=8,5 Гц), 7,20 (2H, д, J=8,5 Гц), 7,21 (2H, д, J=8,5 Гц), 7,34 (1H, дд, J= 5,0, 7,0 Гц), 7,74 (1H, дд, J=7,0,
7,5 Гц), 7,75 (2H,
д, J=8,5 Гц), 7,83 (1H, д, J=7,5 Гц), 7,90 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=5,0 Гц).
(Пример 132)
Метил
2-(4-метансульфонилфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил]пропионат (метил эфир иллюстративного соединения N 138-136)
Реакцию проводили тем же способом, который описан в
примере 126, используя метил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-(4-метансульфонилфенокси)пропионат (387 мг), который является продуктом ссылочного примера 43,
4-пиридин-2-илбензоилхлоридгидрохлорид (219 мг) и триэтиламин (0,44 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (278 мг) в виде бесцветных кристаллов. Т.пл.
80-81oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 2,99 (3H, с), 3,23 (2H, д, J=6,5 Гц), 3,74 (3H, с), 3,89 (2H, кв, J=5,0 Гц), 4,16 (2H, т, J=5,0 Гц), 4,85 (1H, т, J=6,5
Гц), 6,65 (1H, ушир.т), 6,88 (2H, д, J=8,5 Гц), 6,94 (2H, д, J=9,0 Гц), 7,21 (2H, д, J=8,5 Гц), 7,23-7,38 (1H, м), 7,74-7,82 (2H, м), 7,82 (2H, д, J=9,0 Гц), 7,89 (2H, д, J=8,5 Гц), 8,08 (2H, д, J=8,
5
Гц), 8,73 (1H, д, J=4,5 Гц).
(Пример 133)
2-(4-Метансульфонилфенокси)-3-[4-[2-(4-пиридин-2- илбензоиламино)этокси] фенил]пропионовая кислота (иллюстративное соединение N
138-136)
Тем же способом, который описан в примере 2, метил 2-(4-метансульфонилфенокси)-3-[4-[2-(4-пиридин-2- илбензоиламино)этокси]фенил]пропионат (263 мг), который является продуктом
примера 132, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 0,94 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (195 мг) в виде
бесцветных
кристаллов. Т.пл. 231-233oC.1H-ЯМР (270 МГц, дейтерированный диметилсульфоксид): δ ppm 3,03-3,24 (2H, м), 313 (3H, с), 3,64 (2H, кв, J=5,5 Гц), 4,10 (2H, т,
J=5,5 Гц), 5,
10 (1H, дд, J=4,5, 7,5 Гц), 6,90 (2H, д, J= 8,5 Гц), 7,07 (2H, д, J=9,0 Гц), 7,25 (2H, д, J=8,5 Гц), 7,40 (1H, дд, J= 5,0, 7,5 Гц), 7,78 (2H, д, J=9,0 Гц), 7,92 (1H, дд, J=7,5, 8,0 Гц),
7,98 (2H, д,
J=8,5 Гц), 8,05 (1H, д, J=8,0 Гц), 8,18 (2H, д, J=8,5 Гц), 8,70 (1H, д, J=5,0 Гц), 8,78 (1H, т, J=5,5 Гц).
(Пример 134)
Этил
2-(4-пиридин-2-илфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионат (этиловый эфир иллюстративного соединения N 138-264)
Реакцию проводили тем же способом, который описан в
примере 122, используя этил 2-гидрокси-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил]пропионат (370 мг), который является продуктом ссылочного примера 39, 4-(пиридин-2-ил)фенол (292 мг),
трифенилфосфин (447 мг) и диэтилазодикарбоксилат (40% раствор толуола, 0,56 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (500 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (3H, т, J=7,0 Гц), 3,22 (2H, д, J=6,0 Гц), 3,89 (2H, кв, J=5,0 Гц), 4,16 (2H, т, J=5,0 Гц), 4,18 (2H, кв, J= 7,0 Гц), 4,82 (1H, т, J=6,
0 Гц), 6,66 (1H, т, J=5,0 Гц), 6,88 (2H, д, J=8,5 Гц), 7,93 (2H, д, J=8,5 Гц), 7,10-7,30 (3H, м), 7,45-7,80 (5H, м), 7,89 (4H, д, J= 8,5 Гц), 8,07 (2H, д, J=8,5 Гц), 8,63 (1H, д, J=4,5 Гц), 8,71 (1H,
д, J=4,5 Гц).
(Пример 135)
2-(4-Пиридин-2-илфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионовая кислота (иллюстративное соединение N 138-264)
Тем
же способом, который описан в примере 2, этил 2-(4-пиридин-2-илфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионат (500 мг), который является продуктом примера 134, подвергали
взаимодействию с водным раствором гидроксида натрия (1 н., 2,00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (390 мг) в виде белого порошка. Т. пл. 98-101oC.1H-ЯМР (270 МГц, дейтерированный диметилсульфоксид): δ ppm 3,08-3,22 (2H, м), 3,60-3,70 (2H, м), 4,05-4,15 (2H, м), 4,90-5,00 (1H, м), 6,92 (2H, д, J=7,5 Гц), 6,95 (2H, д,
J=8,5 Гц), 7,27 (3H, д, J= 7,5 Гц), 7,40 (1H, т, J=6,0 Гц), 7,50-7,70 (1H, м), 7,77-8,10 (7H, м), 8,18 (2H, д, J= 7,5 Гц), 8,60 (1H, д, J=4,0 Гц), 8,70 (1H, д, J=5,0 Гц), 8,75-8,82 (1H, м).
(Пример 136)
Этил 2-(3-фторфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил] пропионат (этиловый эфир иллюстративного соединения N 138-88)
Реакцию проводили тем
же способом, который описан в примере 122, используя этил 2-гидрокси-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (500 мг), который является продуктом ссылочного примера 39,
3-фторфенол (258 мг), трифенилфосфин (604 мг) и диэтилазодикарбоксилат (40% раствор толуола, 0,75 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (524 мг) в
виде
белого порошка. Т.пл. 133-134,5oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (3H, т, J=7,0 Гц), 3,18 (2H, д, J=6,5 Гц), 3,81-3,92 (2H, м), 4,10-4,22 (4H, м), 4,
72 (1H,
т, J=6,5 Гц), 6,51-6,70 (4H, м), 6,88 (2H, д, J=8,5 Гц), 7,11-7,30 (4H, м), 7,71-7,82 (2H, м), 7,89 (2H, д, J=8,5 Гц), 8,07 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=5,0 Гц).
(Пример
137)
2-(3-Фторфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионовая кислота (иллюстративное соединение N 138-88)
Тем же способом, который описан в примере 2, этил
2-(3-фторфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (500 мг), который является продуктом примера 136, подвергали взаимодействию с водным раствором гидроксида натрия (1 н.,
2,
00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (410 мг) в виде белого порошка. Т. пл. 136,5-138oC.1H-ЯМР (270 МГц, дейтерированный
диметилсульфоксид): δ ppm 3,00-3,20 (2H, м), 3,56-3,70 (2H, м), 4,01-4,12 (2H, м), 4,90-5,00 (1H, м), 6,62-6,80 (3H, м), 6,91 (2H, д, J=8,5 Гц), 7,16-7,31 (3H, м), 7,37-7,43 (1H, м), 7,85-8,08
(4H, м), 8,19 (2H, д, J=8,5 Гц), 8,70 (1H, д, J=5,0 Гц), 8,71-8,82 (1H, м).
(Пример 138)
Этил 2-(3,5-дифторфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]
фенил]пропионат (этиловый эфир иллюстративного соединения N 138-168)
Реакцию проводили тем же способом, который описан в примере 122, используя этил
2-гидрокси-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил]пропионат (400 мг), который является продуктом ссылочного примера 39, 3,5-дифторфенол (240 мг), трифенилфосфин (483 мг) и
диэтилазодикарбоксилат (40% раствор толуола, 0,60 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (460 мг) в виде белого порошка. Т.пл. 146-147oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,21 (3H, т, J=7,0 Гц), 3,18 (2H, д, J=6,5 Гц), 3,89 (2H, д, J=5,0 Гц), 4,16 (2H, т, J=5,0 Гц), 4,19 (2H, кв, J=7,0 Гц), 4,68 (1H, т, J=6,5
Гц), 6,31-6,45 (3H, м), 6,66 (1H, т, J=5,0 Гц), 6,86 (2H, д, J=8,5 Гц), 7,21 (2H, д, J=8,5 Гц), 7,26-7,31 (1H, м), 7,75-7,80 (2H, м), 7,89 (2H, д, J=8,5 Гц), 8,07 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=5,
0
Гц).
(Пример 139)
2-(3,5-Дифторфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионовая кислота (иллюстративное соединение N 138-168)
Тем же
способом,
который описан в примере 2, этил 2-(3,5-дифторфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (410 мг), который является продуктом примера 138, подвергали
взаимодействию с водным
раствором гидроксида натрия (1 н., 2,00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (350 мг) в виде белого порошка. Т.пл. 149,
5-151oC.1
H-ЯМР (270 МГц, дейтерированный диметилсульфоксид): δ ppm 3,05-3,25 (2H, м), 3,65 (2H, д, J=5,5 Гц), 4,11 (2H, т, J=5,5 Гц), 5,08 (1H, т, J=5,5 Гц), 6,65 (2H, д,
J=9,0 Гц), 6,70-6,83 (1H, м), 6,
91 (2H, д, J=7,5 Гц), 7,23 (2H, д, J=7,5 Гц), 7,38-7,45 (1H, м), 7,90-8,10 (4H, м), 8,18 (2H, д, J=8,5 Гц), 8,70 (1H, д, J=4,5 Гц), 8,79 (1H, т, J=5,0 Гц).
(Пример 140)
Этил
2-(3,4-дифторфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионат (этиловый эфир иллюстративного соединения N 138-152)
Реакцию проводили
тем же способом, который описан в
примере 122, используя этил 2-гидрокси-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (312 мг), который является продуктом ссылочного примера 39, 3,
4-дифторфенол (187 мг), трифенилфосфин
(377 мг) и диэтилазодикарбоксилат (40% раствор толуола, 0,65 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (213 мг) в
виде белого порошка. Т.пл. 133-134oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,21 (3H, т, J=7,0 Гц), 3,17 (2H, д, J=6,5 Гц), 3,90 (2H, кв, J=5,0 Гц), 4,16 (2H, т, J=5,
0 Гц), 4,18 (2H, кв, J= 7,0 Гц), 4,64
(1H, т, J=6,5 Гц), 6,48-6,60 (1H, м), 6,62-6,84 (2H, м), 6,88 (2H, д, J= 8,5 Гц), 7,00 (1H, кв, J=9,5 Гц), 7,21 (2H, д, J=8,5 Гц), 7,26-7,31 (1H, м), 7,72-7,82
(2H, м), 7,89 (2H, д, J=8,5 Гц), 8,07
(2H, д, J=8,5 Гц), 8,72 (1H, д, J=5,0 Гц).
(Пример 141)
2-(3,4-Дифторфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]
пропионовая кислота (иллюстративное
соединение N 138-152)
Тем же способом, который описан в примере 2, этил 2-(3,4-дифторфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат
(281 мг), который является продуктом
примера 140, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 1,02 мл) и реакционную смесь обрабатывали с получением соединения, указанного в
заголовке, (246 мг) в виде белого
порошка. Т.пл. 135-136oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,20 (2H, д, J=6,5 Гц), 3,80 (2H, кв, J=5,5 Гц), 4,23 (2H, т, J=5,5
Гц), 4,73 (1H, т, J=6,5 Гц), 6,56-6,
66 (1H, м), 6,68-6,77 (2H, м), 6,86 (2H, д, J=8,5 Гц), 7,00 (1H, кв, J= 9,5 Гц), 7,19 (2H, д, J=8,5 Гц), 7,36 (1H, дд, J=5,5, 7,5 Гц), 7,74 (1H, д, J=7,5 Гц), 7,74
(2H, д, J=8,5 Гц), 7,84-7,87 (1H, м),
7,88 (2H, д, J=8,5 Гц), 8,71 (1H, д, J=4,5 Гц).
(Пример 142)
Этил 2-(3,4,5-трифторфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]
фенил]пропионат (этиловый эфир
иллюстративного соединения N 138-184)
Реакцию проводили тем же способом, который описан в примере 122, используя этил
2-гидрокси-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат
(385 мг), который является продуктом ссылочного примера 39, 3,4,5-трифторфенол (262 мг), трифенилфосфин (465 мг) и
диэтилазодикарбоксилат (40% раствор толуола, 0,58 мл), и реакционную смесь
обрабатывали с получением соединения, указанного в заголовке, (415 мг) в виде белого порошка. Т.пл. 150-152oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,22 (3H, т, J=7,0
Гц), 3,16 (2H, д, J= 6,5 Гц), 3,90 (2H, кв, J=5,0 Гц), 4,16 (2H, т, J=5,0 Гц), 4,19 (2H, кв, J= 7,0 Гц), 4,62 (1H, т,
J=6,5 Гц), 6,41-6,50 (2H, м), 6,66 (1H, т, J=5,0 Гц), 6,88 (2H, д, J=8,5 Гц), 7,20
(2H, д, J=8,5 Гц), 7,25-7,30 (1H, м), 7,73-7,81 (2H, м), 7,89 (2H, д, J=8,5 Гц), 8,08 (2H, д, J=8,5 Гц), 8,72 (1H, д,
J=5,0 Гц).
(Пример 143)
2-(3,4,
5-Трифторфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионовая кислота (иллюстративное соединение N 138-184)
Тем же
способом, который описан в примере 2, этил 2-(3,4,
5-трифторфенокси)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионат (380 мг), который является продуктом примера 142, подвергали
взаимодействию с водным раствором гидроксида натрия (1 н., 2,
00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (320 мг) в виде белого порошка. Т.пл. 144-146oC.1H-ЯМР (270 МГц, CDCl3):
δ ppm 3,16-3,23 (2H, м), 3,80-3,90 (2H, м), 4,17-4,25 (2H, м), 4,66 (1H, т, J=6,0 Гц), 6,41-6,58 (2H, м), 6,75-6,82 (1H, м), 6,84 (2H,
д, J=8,5 Гц), 7,17 (2H, д, J=8,5 Гц), 7,38 (1H, т, J=6,0
Гц), 7,70-7,90 (6H, м), 8,72 (1H, д, J=5,0 Гц).
(Пример 144)
Этил
2-пентафторфенокси-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионат (этиловый эфир
иллюстративного соединения N 138-200)
Реакцию проводили тем же способом, который описан в
примере 122, используя этил 2-гидрокси-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат
(500 мг), который является продуктом ссылочного примера 39, пентафторфенол (424 мг), трифенилфосфин
(604 мг) и диэтилазодикарбоксилат (40% раствор толуола, 1,10 мл), и реакционную смесь обрабатывали с
получением соединения, указанного в заголовке, (918 мг, содержащее некоторую примесь) в виде
белого порошка.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,22 (3H, т, J=7,0 Гц), 3,12-3,
33 (2H, м), 3,82-3,94 (2H, м), 4,10-4,27 (4H, м), 4,91 (1H, дд, J= 5,0, 7,5 Гц), 6,62-6,72
(1H, м), 6,88 (2H, д, J=8,5 Гц), 7,18-7,30 (3H, м), 7,70-7,80 (2H, м), 7,90 (2H, д, J=8,5 Гц), 8,08 (2H, д,
J=8,5 Гц), 8,72 (1H, д, J=5,0 Гц).
(Пример 145)
2-Пентафторфенокси-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил]пропионовая кислота (иллюстративное соединение N
138-200)
Тем же способом, который описан в примере 2, этил
2-пентафторфенокси-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил]пропионат (910 мг), который является продуктом примера 144,
подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 2,
00 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (240 мг) в виде белого порошка. Т. пл.
145-146oC.1H-ЯМР (270 МГц, CDCl3):
δ ppm 3,19-3,41 (2H, м), 3,75-4,10 (2H, м), 4,21-432 (2H, м), 5,04 (1H, т, J=6,0 Гц), 6,70-6,85 (1H, м), 6,90 (2H, д, J=8,5
Гц), 7,26 (2H, д, J=8,5 Гц), 7,38-7,46 (1H, м), 7,68-7,81 (3H, м), 7,
81-7,98 (3H, м), 8,77 (1H, д, J=4,5 Гц).
(Пример 146)
Метил 3-[4-[2-(бифенил-4-карбониламино)этокси]
фенил] -2-(4- фторфенокси)пропионат (метиловый эфир иллюстративного
соединения N 138-51)
Реакцию проводили тем же способом, который описан в примере 73, используя метил
3-[4-(2-трет-бутоксикарбонил-аминоэтокси)фенил] -2-(4-фторфенокси)пропионат (314 мг),
который является продуктом ссылочного примера 44, бифенил-4-карбоновую кислоту (158 мг), диэтилцианофосфонат (0,12
мл) и триэтиламин (0,30 мл), и реакционную смесь обрабатывали с получением
соединения, указанного в заголовке, (276 мг) в виде белого порошка. Т.пл. 105-106oC.1H-ЯМР (270 МГц,
CDCl3): δ ppm 3,17 (2H, д, J=6,5 Гц), 3,72 (3H, с), 3,89
(2H, кв, J=5,0 Гц), 4,16 (2H, т, J=5,0 Гц), 4,68 (1H, т, J=6,5 Гц), 6,63 (1H, ушир. т), 6,76 (2H, дд, J=4,0, 9,0 Гц), 6,88
(2H, д, J=8,5 Гц), 6,91 (2H, т, J=9,0 Гц), 7,22 (2H, д, J=8,5 Гц), 7,41 (1H,
т, J=7,0 Гц), 7,44 (1H, т, J=7,0 Гц), 7,47 (1H, т, J=7,0 Гц), 7,61 (2H, д, J=7,0 Гц), 7,66 (2H, д, J=8,5 Гц), 7,85 (2H, д,
J=8,5 Гц).
(Пример 147)
3-[4-[2-(бифенил-4-карбониламино)этокси]фенил]-2-(4-фторфенокси)пропионовая кислота (иллюстративное соединение N 138-51)
Тем же способом,
который описан в примере 2, метил
3-[4-[2-(бифенил-4-карбониламино)этокси] фенил] -2-(4-фторфенокси)пропионат (266 мг), который является продуктом примера 146, подвергали взаимодействию с водным
раствором гидроксида натрия (1 н., 1,
04 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (241 мг) в виде бесцветных кристаллов. Т. пл. 162-163oC.1H-ЯМР (270 МГц, CDCl3/дейтерированный метанол = 10/1): δ ppm 3,19 (1H, д, J=7,5 Гц), 3,20 (1H, д, J=5,0 Гц), 3,87 (2H, кв, J= 5,0 Гц), 4,14 (2H, т, J=5,0 Гц), 4,66 (1H, дд,
J=5,0, 7,5 Гц), 6,78 (2H, дд, J=
4,5, 9,0 Гц), 6,87 (2H, д, J=8,5 Гц), 6,91 (2H, т, J=9,0 Гц), 7,24 (2H, д, J=8,5 Гц), 7,38 (1H, т, J=7,0 Гц), 7,43 (1H, т, J=7,0 Гц), 7,46 (1H, т, J= 7,0 Гц), 7,60 (2H,
д, J=7,0 Гц), 7,65 (2H, д, J=7,
0 Гц), 7,85 (2H, д, J=8,5 Гц).
(Пример 148)
Этил 2-(4-изопропилфенокси)-3-[4-[2-[6-(4-метоксифенил)пиридин-3- карбониламино] этокси] фенил]
-2-метилпропионат (этиловый эфир
иллюстративного соединения N 34-40)
Реакцию проводили тем же способом, который описан в примере 73, используя этил
3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]
-2-(4-изопропилфенокси)-2-метилпропионат (400 мг), который является продуктом ссылочного примера 45, 6-(4-метоксифенил)никотиновую кислоту (208 мг),
который является продуктом ссылочного примера 26,
диэтилцианофосфонат (0,14 мл) и триэтиламин (0,23 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (355 мг) в
виде бесцветных кристаллов. Т.пл. 92-94o
C.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,01-1,28 (9H, м), 1,36 (3H, с), 2,76-2,91 (1H, м), 3,10 (1H, д, J=14,0 Гц), 3,26 (1H,
д, J=14,0 Гц), 3,87 (3H, с), 3,81-3,94 (2H, м), 4,
10-4,27 (4H, м), 6,60-6,68 (1H, м), 6,75 (2H, д, J=8,5 Гц), 6,85 (2H, д, J=8,5 Гц), 7,01 (2H, д, J=9,0 Гц), 7,06 (2H, д, J=8,5 Гц), 7,19 (2H, д, J=8,5
Гц), 7,74 (1H, д, J=8,5 Гц), 8,01 (2H, д, J=8,5
Гц), 8,13 (1H, дд, J=2,0, 8,5 Гц), 9,01 (1H, д, J=2,0 Гц).
(Пример 149)
2-(4-Изопропилфенокси)-3-[4-[2-(2-(4-метоксифенил)пиридин-5-карбониламино] этокси]
фенил]-2-метилпропионовая кислота (иллюстративное соединение N 34-40)
Тем же способом, который описан в
примере 2, этил
2-(4-изопропилфенокси)-3-[4-[2-[2-(4-метоксифенил)пиридин-5-карбониламино]этокси]фенил]-2-метилпропионат (341 мг), который является продуктом примера 148, подвергали взаимодействию с
водным раствором
гидроксида натрия (1 н., 1,14 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (144 мг) в виде бесцветных кристаллов. Т.пл. 194-196oC.1
H-ЯМР (270 МГц, дейтерированный диметилсульфоксид): δ ppm 1,15 (6H, д, J=7,0 Гц), 1,27 (3H, с), 2,72-2,89 (1H, м), 3,06 (1H, д, J=13,5 Гц), 3,17 (1H, д, J=13,5 Гц), 3,61-3,70 (2H,
м), 3,83 (3H,
с), 4,08-4,16 (2H, м), 6,74 (2H, д, J=8,5 Гц), 6,91 (2H, д, J=8,5 Гц), 7,07 (2H, д, J=8,5 Гц), 7,12 (2H, д, J=8,5 Гц), 7,17 (2H, д, J=8,5 Гц), 8,01 (1H, д, J=8,5 Гц), 8,12 (2H, д, J=8,5
Гц), 8,24
(1H, дд, J=2,0, 8,5 Гц), 8,86-8,94 (1H, м), 9,05 (1H, д, J=2,0 Гц).
(Пример 150)
Этил 3-[4-[2-[2-(2,2,3,3-тетрафторпропокси)пиридин-5-карбониламино]этокси] фенил]
-2-(4-изопропилфенокси)-2-метилпропионат (этиловый эфир иллюстративного соединения N 34-43)
Реакцию проводили тем же способом, который описан в примере 73, используя этил
3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-(4-изопропилфенокси)-2-метилпропионат (600 мг), который является продуктом ссылочного примера 45, 6-(2,2,3,3-тетрафторпропокси)никотиновую кислоту
(344 мг), которая является продуктом ссылочного примера 28, диэтилцианофосфонат (0,21 мл) и триэтиламин (0,38 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке,
(260 мг) в виде бесцветного масла.1H-ЯМР (400 МГц, CDCl3): δ ppm 1,16-1,28 (9H, м), 1,37 (3H, с), 2,83 (1H, септет, J=7,0 Гц), 3,11 (1H, д, J=13,5 Гц), 3,26 (1H, д, J=13,
5 Гц), 3,83-3,89 (2H, м), 4,10-4,18 (2H, м), 4,21 (2H, кв, J=7,0 Гц), 4,75 (2H, т, J= 12,5 Гц), 6,00 (1H, тт, J=4,5, 53 Гц), 6,53-6,60 (1H, м), 6,75 (2H, д, J=8,5 Гц), 6,81-6,90 (3H, м), 7,06 (2H, д,
J=8,5 Гц), 7,19 (2H, д, J=8,5 Гц), 8,07 (1H, д, J=8,5 Гц), 8,59 (1H, с).
(Пример 151)
3-[4-[2-[2-(2,2,3,3-Тетрафторпропокси)пиридин-5-карбониламино] этокси] фенил]
-2-(4-изопропилфенокси)-2-метилпропионовая кислота (иллюстративное соединение N 34-43)
Тем же способом, который описан в примере 2, этил 3-[4-[2-[2-(2,2,3,
3-тетрафторпропокси)пиридин-5-карбониламино] этокси] фенил] -2-(4-изопропилфенокси)-2-метилпропионат (210 мг), который является продуктом примера 150, подвергали взаимодействию с водным раствором
гидроксида натрия (1 н., 0,51 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (140 мг) в виде бесцветных кристаллов. Т.пл. 173-175oC.1
H-ЯМР
(400 МГц, CDCl3/дейтерированный метанол = 20/1): δ ppm 1,20 (6H, д, J=7,0 Гц), 1,40 (3H, с), 2,84 (1H, септет, J=7,0 Гц), 3,13 (1H, д, J=14,0 Гц), 3,26 (1H, д, J=14,0 Гц), 3,
80-3,89
(2H, м), 4,14-4,20 (2H, м), 4,78 (2H, т, J= 12,5 Гц), 6,00 (1H, тт, J=4,5, 53 Гц), 6,80-6,92 (5H, м), 7,09 (2H, д, J= 8,5 Гц), 7,22 (2H, д, J=8,5 Гц), 8,09 (1H, д, J=8,5 Гц), 8,55 (1H, с).
(Пример 152)
Метил 2-фенилтио-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионат (метиловый эфир иллюстративного соединения N 17-11)
Реакцию проводили тем же
способом, который описан в примере 126, используя метил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]-2-фенилтиопропионат (209 мг), который является продуктом ссылочного примера 46,
4-пиридин-2-илбензоилхлоридгидрохлорид (135 мг) и триэтиламин (0,27 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (146 мг) в виде бесцветных кристаллов. Т.пл.
102-104oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,00 (1H, дд, J=6,0, 13,5 Гц), 3,14 (1H, дд, J=9,0, 13,5 Гц), 3,58 (3H, с), 3,86 (1H, дд, J=6,0, 9,0 Гц), 3,90 (2H,
кв,
J=5,0 Гц), 4,15 (2H, т, J=5,0 Гц), 6,65 (1H, ушир.т), 6,85 (2H, д, J=8,5 Гц), 7,12 (2H, д, J= 8,5 Гц), 7,16-7,37 (4H, м), 7,38-7,48 (2H, м), 7,71-7,81 (2H, м), 7,89 (2H, д, J=8,5 Гц), 8,05 (2H, д,
J=8,5 Гц), 8,72 (1H, д, J=5,0 Гц).
(Пример 153)
2-Фенилтио-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]пропионовая кислота (иллюстративное соединение N 17-11)
Тем же способом, который описан в примере 2, метил 2-фенилтио-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (150 мг), который является продуктом примера 152, подвергали взаимодействию
с
водным раствором гидроксида натрия (1 н., 0,58 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (138 мг) в виде бесцветных кристаллов. Т. пл. 75-77o
C.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,00 (1H, дд, J=5,0, 13,5 Гц), 3,11 (1H, дд, J=10,5, 13,5 Гц), 3,82 (2H, т, J=5,0 Гц), 3,87 (1H, дд, J=5,0, 10,5 Гц), 4,24 (1H, дд, J=5,
0, 9,
5 Гц), 4,33 (1H, дд, J=5,0, 9,5 Гц), 6,53 (1H, ушир. т), 6,84 (2H, д, J=8,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,27-7,38 (4H, м), 7,51-7,54 (2H, м), 7,61 (2H, д, J=8,5 Гц), 7,71 (1H, д, J= 8,0 Гц), 7,
82-7,
89 (1H, м), 7,87 (2H, д, J=8,5 Гц), 8,63 (1H, д, J=5,0 Гц).
(Пример 154)
Метил 3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]-2-(пиридин-3-илокси)пропионат
(метиловый
эфир иллюстративного соединения N 138-216)
Реакцию проводили тем же способом, который описан в примере 126, используя метил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]
-2-(пиридин-3-илокси)пропионат (345 мг), который является продуктом ссылочного примера 47, 4-пиридин-2-илбензоилхлорид гидрохлорид (261 мг) и триэтиламин (0,60 мл), и реакционную смесь обрабатывали с
получением соединения, указанного в заголовке, (271 мг) в виде бесцветных кристаллов. Т.пл. 101-103oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,22 (2H, д, J=6,5 Гц), 3,
73 (3H, с), 3,90 (2H, кв, J=5,0 Гц), 4,16 (2H, т, J=5,0 Гц), 4,78 (1H, т, J=6,5 Гц), 6,66 (1H, ушир.т), 6,88 (2H, д, J=8,5 Гц), 7,09-7,18 (2H, м), 7,22 (2H, д, J=8,5 Гц), 7,26-7,33 (1H, м), 7,73-7,82
(2H, м), 7,89 (2H, д, J=8,5 Гц), 8,07 (2H, д, J=8,5 Гц), 8,16-8,26 (2H, м), 8,72 (1H, д, J=5,0 Гц).
(Пример 155)
3-[4-[2-(4-Пиридин-2-илбензоиламино)этокси] фенил]
-2-(пиридин-3-илокси)пропионовая кислота (иллюстративное соединение N 138-216)
Тем же способом, который описан в примере 2, метил 3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]
-2-(пиридин-3-илокси)пропионат (248 мг), который является продуктом примера 154, подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 1,00 мл) и реакционную смесь обрабатывали с
получением соединения, указанного в заголовке, (212 мг) в виде бесцветных кристаллов. Т.пл. 194-196oC.1H-ЯМР (270 МГц, дейтерированный диметилсульфоксид): δ ppm 3,10 (1H,
дд, J=8,5, 14,5 Гц), 3,18 (1H, дд, J=4,0, 14,5 Гц), 3,64 (2H, кв, J=5,5 Гц), 4,10 (2H, т, J=5,5 Гц), 5,04 (1H, дд, J=4,0, 8,5 Гц), 6,91 (2H, д, J=8,5 Гц), 7,25 (2H, д, J=8,5 Гц), 7,26 (1H, дд, J=6,5,
8,0 Гц), 7,27 (1H, д, J=6,5 Гц), 7,40 (1H, дд, J=4,5, 8,0 Гц), 7,92 (1H, т, J= 8,0 Гц), 7,98 (2H, д, J=8,5 Гц), 8,05 (1H, д, J=8,0 Гц), 8,14 (1H, с), 8,18 (2H, д, J=8,5 Гц), 8,18 (1H, д, J=8,0 Гц),
8,
70 (1H, д, J=4,5 Гц), 8,79 (1H, ушир.т).
(Пример 156)
Метил 2-(бензоксазол-2-илтио)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (метиловый эфир
иллюстративного соединения N 138-248)
Реакцию проводили тем же способом, который описан в примере 126, используя метил 2-(бензоксазол-2-илтио)-3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]
пропионат (665 мг), который является продуктом ссылочного примера 48, 4-пиридин-2-илбензоилхлорид гидрохлорид (444 мг) и триэтиламин (0,81 мл), и реакционную смесь обрабатывали с получением
соединения,
указанного в заголовке, (582 мг) в виде пенной массы.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,30 (1H, дд, J=7,5, 15,0 Гц), 3,35 (1H, дд, J=7,5, 15,0 Гц), 3,71 (3H,
с), 3,88 (2H,
кв, J= 5,0 Гц), 4,13 (2H, т, J=5,0 Гц), 4,77 (1H, т, J=7,5 Гц), 6,68 (1H, ушир.т), 6,86 (2H, д, J=8,5 Гц), 7,18 (2H, д, J=8,5 Гц), 7,24-7,38 (3H, м), 7,42 (1H, д, J=7,5 Гц), 7,60 (1H, д,
J=6,0 Гц), 7,
75-7,82 (2H, м), 7,89 (2H, д, J=8,5 Гц), 8,08 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=5,0 Гц).
(Пример 157)
2-(Бензоксазол-2-илтио)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]
фенил]пропионовая кислота (иллюстративное соединение N 138-248)
Тем же способом, который описан в примере 2, метил
2-(бензоксазол-2-илтио)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]
фенил]пропионат (361 мг), который является продуктом примера 156, подвергали взаимодействию с водным раствором гидроксида натрия (1
н., 1,30 мл) и реакционную смесь обрабатывали с получением
соединения, указанного в заголовке, (248 мг) в виде бесцветных кристаллов. Т.пл. 66-67oC.1H-ЯМР (270 МГц,
дейтерированный метанол): δ ppm 3,20-3,36 (2H, м), 3,75 (2H, т,
J=5,5 Гц), 4,10 (1H, т, J=5,5 Гц), 4,19 (1H, т, J= 5,5 Гц), 6,85 (1H, д, J=8,5 Гц), 6,89 (1H, д, J=8,5 Гц), 7,15 (1H, д, J= 8,5
Гц), 7,21 (2H, д, J=8,5 Гц), 7,28 (1H, т, J=4,5 Гц), 7,40 (1H, дд, J= 4,
5, 8,5 Гц), 7,48 (1H, дд, J=4,0, 5,0 Гц), 7,54 (1H, дд, J=4,0, 5,0 Гц), 7,92 (2H, д, J=4,0 Гц), 7,95 (2H, д, J=8,5 Гц), 8,06
(2H, д, J=8,5 Гц), 8,64 (1H, д, J=4,5 Гц).
(Пример 158)
Метил 2-бензилокси-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (метиловый эфир иллюстративного
соединения N 138-232)
Реакцию проводили тем же способом, который описан в
примере 126, используя метил 2-бензилокси-3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] пропионат (195 мг), который
является продуктом ссылочного примера 49, 4-пиридин-2-илбензоилхлорид гидрохлорид
(127 мг) и триэтиламин (0,25 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке,
(106 мг) в виде бесцветных кристаллов. Т.пл. 122-123oC.1H-ЯМР
(270 МГц, CDCl3): δ ppm 3,00 (1H, д, J=7,5 Гц), 3,01 (1H, д, J=5,5 Гц), 3,71 (3H, с), 3,91 (2H,
кв, J=5,0 Гц), 4,10 (1H, дд, J=5,5, 7,5 Гц), 4,17 (2H, т, J= 5,0 Гц), 4,37 (1H, д,
J=12,0 Гц), 4,66 (1H, д, J=12,0 Гц), 6,68 (1H, ушир. т), 6,86 (2H, д, J=8,5 Гц), 7,15 (2H, д, J=8,5 Гц), 7,19 (2H, д,
J=8,0 Гц), 7,22-7,37 (4H, м), 7,76-7,83 (2H, м), 7,90 (2H, д, J=8,5 Гц), 8,08 (2H,
д, J=8,5 Гц), 8,72 (1H, д, J=5,0 Гц).
(Пример 159)
2-Бензилокси-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионовая кислота (иллюстративное соединение N
138-232)
Тем же способом, который описан в примере 2, метил
2-бензилокси-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (94 мг), который является продуктом примера 158,
подвергали взаимодействию с водным раствором гидроксида натрия (1 н., 0,36
мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (86 мг) в виде бесцветных кристаллов.
Т.пл. 138-139oC.1H-ЯМР (270 МГц, CDCl3):
δ ppm 3,01 (1H, дд, J=7,0, 14,5 Гц), 3,12 (1H, дд, J=5,0, 14,5 Гц), 3,90 (2H, кв, J=5,5 Гц), 4,18 (1H, дд, J= 5,0, 7,0
Гц), 4,20 (2H, т, J=5,5 Гц), 4,48 (1H, д, J=11,5 Гц), 4,67 (1H, д, J=11,5
Гц), 6,69 (1H, ушир.т), 6,85 (2H, д, J=8,5 Гц), 7,16 (2H, д, J= 8,5 Гц), 7,22-7,43 (6H, м), 7,75 (1H, д, J=8,0 Гц), 7,79 (1H,
дд, J=8,0, 9,0 Гц), 7,81 (2H, д, J=8,5 Гц), 8,00 (2H, д, J= 8,5 Гц), 8,72
(1H, д, J=4,5 Гц).
(Пример 160)
2-(3-Фенилпропил)-2-[4-[3-(4-пиридин-2-илбензоиламино)пропил]фенил]пропионовая кислота (иллюстративное соединение N 77-3)
К раствору
дибензил
2-(3-фенилпропил)-2-[4-[3-(4-пиридин-2-илбензоиламино)пропил] бензил]малоната (0,65 г), который является продуктом ссылочного примера 50, в этаноле (20 мл) добавляли палладий на углероде (5%,
0,12 г).
Смесь перемешивали в атмосфере водорода при 60oC в течение 5 часов. Катализатор затем удаляли путем фильтрации, фильтрат концентрировали. Остаток растворяли в 2-метоксиэтаноле
(10 мл).
Раствор перемешивали при 150oC в течение 4 часов и затем концентрировали. Остаток очищали путем хроматографии на колонке с силикагелем, используя в качестве элюента
дихлорметан/метанол =
9/1, с получением соединения, указанного в заголовке, (330 мг) в виде кристаллов. Т. пл. 118-119oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,75-1,
82 (4H, м), 1,99 (2H,
квинтуплет, J=7,5 Гц), 2,58-2,77 (6H, м), 2,96 (1H, дд, J=11,0, 15,0 Гц), 3,51 (2H, дт, J=5,5, 7,5 Гц), 6,16 (1H, ушир.т, J=5,5 Гц), 7,12-7,18 (6H, м), 7,23-7,33 (4H, м), 7,60
(2H, д, J=8,0 Гц), 7,71
(1H, дд, J= 1,0, 8,0 Гц), 7,80 (1H, дд, J=2,0, 8,0 Гц), 7,93 (2H, д, J=8,5 Гц), 8,65-8,67 (1H, м).
(Пример 161)
Этил
3-[3-хлор-4-[2-(4-пиридин-2-илбензоиламино)этокси]
фенил]-2-феноксипропионат (этиловый эфир иллюстративного соединения N 139-24)
Реакцию проводили тем же способом, который описан в примере
126, используя метил
3-[4-(2-трет-бутоксикарбониламиноэтокси)-3-хлорфенил]-2-феноксипропионат (738 мг), который является продуктом ссылочного примера 51, 4-пиридин-2-илбензоилхлорид гидрохлорид (445
мг) и триэтиламин (0,
89 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (677 мг) в виде пенистой массы.1H-ЯМР (270 МГц, CDCl3): δ
ppm 1,20 (3H, т, J= 7,
0 Гц), 3,16 (1H, д, J=5,5 Гц), 3,17 (1H, д, J=7,0 Гц), 3,93 (2H, кв, J= 5,0 Гц), 4,19 (2H, кв, J=7,0 Гц), 4,22 (2H, т, J=5,0 Гц), 4,73 (1H, дд, J= 5,5, 7,0 Гц), 6,83 (2H, д, J=8,
5 Гц), 6,91 (1H, д,
J=8,5 Гц), 6,95 (1H, т, J= 8,0 Гц), 7,18 (1H, дд, J=2,0, 8,5 Гц), 7,24 (2H, т, J=8,0 Гц), 7,26-7,33 (1H, м), 7,35 (1H, д, J=2,0 Гц), 7,77-7,85 (2H, м), 7,85 (2H, д, J=8,5 Гц), 8,
08 (2H, д, J=8,5 Гц),
8,72 (1H, д, J=4,5 Гц).
(Пример 162)
3-[3-хлор-4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] -2-феноксипропионовая кислота (иллюстративное соединение
N 139-24)
Тем
же способом, который описан в примере 2, этил 3-[3-хлор-4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]-2-феноксипропионат (540 мг), который является продуктом примера 161,
подвергали взаимодействию с
водным раствором гидроксида натрия (1 н., 1,98 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (404 мг) в виде бесцветных кристаллов.
Т.пл. 59-61oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,19 (2H, д, J=6,0 Гц), 3,83-3,98 (2H, м), 4,23 (2H, ушир.т), 4,79 (1H, т, J=6,0 Гц), 6,86 (2H, д, J= 8,0 Гц), 6,
87 (1H, д, J=8,5 Гц), 6,93
(1H, т, J=8,0 Гц), 7,12 (1H, дд, J= 2,0, 8,5 Гц), 7,23 (2H, т, J=8,0 Гц), 7,33 (1H, дд, J=4,5, 7,5 Гц), 7,36 (1H, д, J=2,0 Гц), 7,72 (1H, д, J=8,0 Гц), 7,80 (2H, д, J=8,5
Гц), 7,84 (1H, дд, J=7,5, 8,0
Гц), 7,91 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=4,5 Гц).
(Пример 163)
Этил 3-[3-бром-4-[2-(4-пиридин-2-илбензоиламино)этокси]
фенил]-2-феноксипропионат (этиловый эфир
иллюстративного соединения N 141-23)
Реакцию проводили тем же способом, который описан в примере 126, используя метил
3-[3-бром-4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-феноксипропионат
(466 мг), который является продуктом ссылочного примера 52, 4-пиридин-2-илбензоилхлорид гидрохлорид (254 мг) и триэтиламин (0,
51 мл), и реакционную смесь обрабатывали с получением соединения,
указанного в заголовке, (498 мг) в виде пенистой массы.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,21 (3H, т, J=7,
0 Гц), 3,16 (1H, д, J=5,5 Гц), 3,17 (1H, д, J=7,0 Гц), 3,94 (2H, кв,
J=5,0 Гц), 4,19
(2H, кв, J= 7,0 Гц), 4,22 (2H, т, J=5,0 Гц), 4,73 (1H, дд, J=5,5, 7,0 Гц), 6,82-6,98 (1H, м), 6,83 (2H, д,
J=8,5 Гц), 6,88 (1H, д, J=8,5 Гц), 6,95 (1H, т, J= 7,5 Гц), 7,21-7,
32 (1H, м), 7,24 (2H, дд, J=7,5, 8,0 Гц), 7,25 (1H, дд, J= 2,0, 8,5 Гц), 7,52 (1H, д, J=2,0 Гц), 7,76-7,80 (2H, м), 7,95 (2H, д,
J=8,5 Гц), 8,08 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=4,5 Гц).
(Пример 164)
3-[3-Бром-4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] -2- феноксипропионовая кислота
(иллюстративное соединение N 141-23)
Тем же способом, который описан
в примере 2, этил 3-[3-бром-4-[2- (4-пиридин-2-илбензоиламино)этокси] фенил] -2-феноксипропионат (237 мг), который
является продуктом примера 163, подвергали взаимодействию с водным раствором
гидроксида натрия (1 н., 0,80 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (174
мг) в виде бесцветных кристаллов. Т.пл. 83-84oC.1H-ЯМР
(270 МГц, дейтерированный метанол): δ ppm 3,12 (1H, дд, J=7,5, 14,0 Гц), 3,20 (1H, дд, J=5,0, 14,0 Гц), 3,81 (2H,
т, J=5,5 Гц), 4,24 (2H, т, J=5,5 Гц), 4,86 (1H, дд, J=5,0, 7,5 Гц), 6,84 (2H, д,
J= 8,0 Гц), 6,91 (1H, т, J=7,5 Гц), 7,02 (1H, д, J=8,5 Гц), 7,17 (1H, д, J=8,0 Гц), 7,22 (2H, дд, J=7,5, 8,0 Гц), 7,26
(1H, дд, J=2,0, 8,5 Гц), 7,40 (1H, дд, J= 4,5, 8,0 Гц), 7,52 (1H, д, J=2,0 Гц),
7,93 (1H, т, J=4,5 Гц), 7,95 (2H, д, J=8,5 Гц), 8,05 (2H, д, J=8,5 Гц), 8,64 (1H, д, J=4,5 Гц).
(Пример 165)
Этил 3-[3-нитро-4-[2-(4-пиридин-2-илбензоиламино)-этокси]
фенил]- 2-феноксипропионат(этиловый эфир иллюстративного соединения N 142-23)
Реакцию проводили тем же
способом, который описан в примере 126, используя метил
3-[3-нитро-4-(2-трет-бутоксикарбониламиноэтокси)фенил]-2- феноксипропионат (723 мг), который является продуктом ссылочного примера 53,
4-пиридин-2-илбензоилхлорид гидрохлорид (465 мг) и триэтиламин (0,
85 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (843 мг) в виде пенистой массы.1
H-ЯМР (270 МГц, CDCl3): δ ppm 1,22 (3H, т, J= 7,
0 Гц), 3,24 (2H, д, J=6,0 Гц), 3,96 (2H, кв, J=5,0 Гц), 4,21 (2H, кв, J= 7,0 Гц), 4,31 (2H, т, J=5,0 Гц), 4,76 (1H, т, J=6,0 Гц), 6,
83 (2H, д, J=8,5 Гц), 6,96 (1H, т, J=7,5 Гц), 7,05 (1H, д, J=8,5 Гц),
7,09 (1H, ушир. т), 7,22-7,30 (1H, м), 7,24 (2H, дд, J=7,5, 8,0 Гц), 7,53 (1H, дд, J= 2,5, 8,5 Гц), 7,75-7,80 (2H, м), 7,88 (1H,
д, J=2,5 Гц), 7,97 (2H, д, J=8,5 Гц), 8,09 (2H, д, J=8,5 Гц), 8,72 (1H,
д, J=4,5 Гц).
(Пример 166)
3-[3-Нитро-4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил]
-2- феноксипропионовая кислота (иллюстративное соединение N 142-23)
Тем же
способом, который описан в примере 2, этил 3-[3-нитро-4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил]
-2-феноксипропионат (223 мг), который является продуктом примера 165, подвергали взаимодействию с
водным раствором гидроксида натрия (1 н., 0,80 мл) и реакционную смесь обрабатывали с получением
соединения, указанного в заголовке, (137 мг) в виде бесцветных кристаллов. Т. пл. 178-179oC.1H-ЯМР (270 МГц, CDCl3/дейтерированный метанол = 1/9): δ ppm 3,22
(1H, дд, J=8,0, 14,5 Гц), 3,26 (1H, дд, J=5,0, 14,5 Гц), 3,84 (2H, кв, J=5,0 Гц), 4,36 (2H, т, J=5,0 Гц),
4,83 (1H, дд, J=5,0, 8,0 Гц), 6,85 (2H, д, J=8,0 Гц), 6,92 (1H, т, J=7,5 Гц), 7,23 (2H, дд,
J=7,5, 8,0 Гц), 7,24 (1H, д, J=6,5 Гц), 7,40 (1H, дд, J-4,5, 6,5 Гц), 7,58 (1H, дд, J=2,0, 8,5 Гц), 7,84 (1H,
д, J=2,0 Гц), 7,91 (1H, т, J=8,5 Гц), 7,92 (1H, т, J= 4,5 Гц), 7,96 (2H, д, J=8,5 Гц), 8,
03 (2H, д, J=8,5 Гц), 8,65 (1H, д, J= 4,5 Гц).
(Пример 167)
Метил
(S)-2-бензилоксикарбониламино-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат (метиловый эфир
иллюстративного соединения N 144-63)
Реакцию проводили тем же способом, который
описан в примере 73, используя метил
(S)-2-бензилоксикарбониламино-3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] пропионат (368 мг), который является продуктом ссылочного примера 54,
4-пиридин-2-илбензойную кислоту (175 мг),
диэтилцианофосфонат (0,13 мл) и триэтиламин (0,22 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (300 мг) в виде
бесцветных кристаллов. Т.пл. 150-151oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 2,90-3,12 (2H, м), 3,72 (3H, с), 3,82-3,94 (2H, м), 0,15 (2H, т, J=5,0 Гц), 4,55-4,69 (1H,
м), 5,09 (2H, ABq, J= 12,5 Гц, 8=0,03
ppm), 5,21 (1H, д, J=8,0 Гц), 6,61-6,72 (1H, м), 6,83 (2H, д, J=8,5 Гц), 7,01 (2H, д, J=8,5 Гц), 7,22-7,41 (6H, м), 7,72-7,82 (2H, м), 7,89 (2H, д, J=8,5 Гц), 8,
08 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=5,
0 Гц).
(Пример 168)
(S)-2-бензилоксикарбониламино-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]-фенил] пропионовая кислота
(иллюстративное соединение N 144-63)
Тем же
способом, который описан в примере 2, метил (S)-2-бензилоксикарбониламино-3-[4-[2- (4-пиридин-2-илбензоиламино)этокси] фенил]-пропионат (200 мг),
который является продуктом примера 167, подвергали
взаимодействию с водным раствором гидроксида натрия (1 н., 0,72 мл) и реакционную смесь обрабатывали с получением соединения, указанного в заголовке,
(144 мг) в виде пенистой массы.1H-ЯМР
(270 МГц, CDCl3): δ ppm 3,08 (2H, д, J=5,0 Гц), 3,68-4,00 (2H, м), 4,08-4,30 (2H, м), 4,55-4,69 (1H, м), 5,11 (2H, с), 5,37 (1H, д,
J=8,0 Гц), 6,70-6,90 (3H, м), 6,99 (2H, д, J=8,5
Гц), 7,20-7,41 (6H, м), 7,70-7,93 (6H, м), 8,70 (1H, д, J=4,5 Гц).
(Пример 169)
Метил
(S)-2-пропиламино-3-[4-[2-(4-пиридин-2- илбензоиламино)-этокси] фенил]пропионат
(метиловый эфир иллюстративного соединения N 144-13)
Реакцию проводили тем же способом, который описан в
ссылочном примере 1 (d), используя метил
(S)-2-бензилоксикарбониламино-3-[4-[2-(4-пиридин-2- илбензоиламино)-этокси] фенил]пропионат (1,53 г) и палладий на углероде (5%, 150 мг), и реакционную смесь
обрабатывали с получением метил
(S)-2-амино-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] -фенил] пропионата (1,14 г). К раствору аминопроизводного (1,12 г), полученного выше, в N,N-диметилформамиде (10
мл) добавляли пропилбромид (0,
24 мл) и карбонат калия (387 мг). Смесь перемешивали при 70oC в течение 16 часов. Реакционную смесь распределяли между этилацетатом и водой, этилацетатный слой
отделяли и сушили над
безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя дихлорметан/метанол = 19/1, с
получением соединения,
указанного в заголовке, (196 мг) в виде бесцветных кристаллов. Т.пл. 86-87oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,86 (3H, т, J=7,5 Гц), 1,
39-1,59 (2H, м), 2,39-2,
60 (2H, м), 2,90 (2H, д, J=7,0 Гц), 3,48 (1H, т, J=7,0 Гц), 3,64 (3H, с), 3,87-3,95 (2H, м), 4,10-4,20 (2H, м), 6,60-6,71 (1H, м), 6,86 (2H, д, J=8,5 Гц), 7,11 (2H, д, J=8,5
Гц), 7,25-7,30 (1H, м), 7,
78-7,80 (2H, м), 7,89 (2H, д, J=8,5 Гц), 8,09 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=5,0 Гц).
(Пример 170)
(S)-2-пропиламино-3-[4-[2-(4-пиридин-2-илбензоиламино)-этокси] фенил]
пропионовая кислота (иллюстративное соединение N 144-13)
Тем же способом, который описан в примере 2, метил
(S)-2-пропиламино-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] -фенил] пропионат
(169 мг), который является продуктом примера 169, подвергали взаимодействию с водным раствором гидроксида натрия (1 н.,
0,73 мл) и реакционную смесь обрабатывали с получением соединения, указанного в
заголовке, (144 мг) в виде бесцветных кристаллов. Т.пл. 242-244oC.1H-ЯМР натриевой соли (270 МГц,
дейтерированный диметилсульфоксид): δ ppm 0,76 (3H, т, J=7,5 Гц), 1,
15-1,35 (2H, м), 1,60-1,72 (1H, м), 2,04-2,21 (1H, м), 2,31-2,50 (1H, м), 2,70-2,81 (2H, м), 3,30-3,41 (1H, м), 3,58-3,72 (2H,
м), 4,00-4,12 (2H, м), 6,80 (2H, д, J=8,5 Гц), 7,12 (2H, д, J=8,5 Гц), 7,
37-7,45 (1H, м), 7,88-8,11 (4H, м), 8,19 (2H, д, J=8,5 Гц), 8,70 (1H, д, J=4,5 Гц), 8,80-8,88 (1H,
(Пример 171)
Этил 2-фениламино-3-[4-[2-(4-пиридин-2-илбензоиламино)-этокси] фенил]
пропионат (этиловый эфир иллюстративного соединения N 144-68)
Реакцию проводили тем же способом, который описан в
примере 122, используя 2-(4-пиридин-2-илбензоиламино)этанол, который
является продуктом ссылочного примера 61, этил 3-(4-гидроксифенил)-2-(фениламино)пропионат, который является продуктом ссылочного
примера 55(b), трифенилфосфин и диэтилазодикарбоксилат с получением
соединения, указанного в заголовке.
(Пример 172)
2-Фениламино-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]-фенил] пропионовая кислота (иллюстративное соединение N 144-68)
Этил 2-фениламино-3-[4-[2-(4-пиридин-2-илбензоиламино)-этокси] фенил]
пропионат гидролизовали гидроксидом натрия в метаноле с получением соединения, указанного в заголовке.
(Пример 173)
Этил 3-[4-[2-(бифенил-4-карбониламино)этокси]
фенил]-2-фениламинопропионат (этиловый эфир иллюстративного соединения N 144-67)
Реакцию проводили тем же способом,
который описан в примере 122, используя 2-(бифенил-4-карбониламино) этанол,
этил 3-(4-гидроксифенил)-2-(фениламино) пропионат, который является продуктом ссылочного примера 55(b); трифенилфосфин и
диэтилазодикарбоксилат с получением соединения, указанного в заголовке.
(Пример 174)
3-[4-[2-(бифенил-4-карбониламино)этокси] фенил] -фенил-аминопропионат (иллюстративное
соединение N 144-67)
Этил 3-[4-[2-(бифенил-4-карбониламино)этокси]
фенил]-2-фениламинопропионат, который является продуктом примера 173, гидролизовали гидроксидом натрия в метаноле с
получением соединения, указанного в заголовке.
(Пример 175)
Этил 2-этиламино-3-[4-[2-(4-пиридин-2-илбензоиламино)-этокси] фенил]пропионат гидрохлорид (этиловый эфир
иллюстративного соединения N 144-8)
(а) Этил
2-(N-трет-третбутоксикарбонил)этиламино-3-[4-[2-(4-пиридин-2-илбензоиламино) этокси]фенил]пропионат
Реакцию проводили тем же способом,
который описан в примере 122, используя
2-(4-пиридин-2-илбензоиламино)этанол, который является продуктом ссылочного примера 61, этил 2-(N-трет-бутоксикарбонил)этиламино-3-(4-гидроксифенил) пропионат,
который является продуктом ссылочного
примера 59(b), трифенилфосфин и диэтилазодикарбоксилат с получением соединения, указанного в заголовке.
(b) Этил
2-этиламино-3-[4-[2-(4-пиридин-2-илбензоиламино)-этокси] фенил]
пропионат гидрохлорид (этиловый эфир иллюстративного соединения N 144-8)
Этил
2-(N-трет-бутоксикарбонил)этиламино-3-[4-[2- (4-пиридин-2-илбензоиламино)-этокси] фенил] пропионат обрабатывали
раствором хлороводорода в диоксане (4 н.) с получением соединения, указанного в
заголовке.
(Пример 176)
2-Этиламино-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]-фенил]
пропионат (иллюстративное соединение N 144-8)
Этил
2-этиламино-3-[4-[2-(4-пиридин-2- илбензоиламино)-этокси] фенил] пропионат гидрохлорид, который является продуктом примера 175(b),
гидролизовали гидроксидом натрия в метаноле с получением соединения,
указанного в заголовке.
(Пример 177)
Этил 3-[4-[2-(бифенил-4-карбониламино)
этокси]фенил]-2-этиламинопропионат гидрохлорид (этиловый эфир иллюстративного соединения N
144-7)
(а) Этил 3-[4-[2-(бифенил-4-карбониламино)этокси]фенил]-2-(N-трет-бутоксикарбонил)
этиламинопропионат
Реакцию проводили тем же способом, который описан в примере 122,
используя 2-(бифенил-4-карбониламино)этанол, этил
2-(N-трет-бутоксикарбонил)этиламино-3-(4-гидроксифенил)- пропионат, который является продуктом ссылочного примера 59(b), трифенилфосфин и
диэтилазодикарбоксилат с получением соединения, указанного в
заголовке.
(b) Этил 3-[4-[2-(бифенил-4-карбониламино)этокси]фенил]-2-этиламинопропионат гидрохлорид (этиловый эфир
иллюстративного соединения N 144-7)
Этил
3-[4-[2-(бифенил-4-карбониламино)этокси]фенил]-2- (N-трет-бутоксикарбонил)этиламинопропионат, который является продуктом примера 177(а), обрабатывали
раствором хлороводорода в диоксане (4 н.) с
получением соединения, указанного в заголовке.
(Пример 178)
3-[4-[2-(Бифенил-4-карбониламино)этокси]
фенил]-2-этиламино-пропионовая кислота (иллюстративное соединение N
144-7)
Этил 3-[4-[2-(бифенил-4-карбониламино)этокси] фенил] -2-этиламинопропионат гидрохлорид, который является продуктом
примера 177(b), гидролизовали гидроксидом натрия в метаноле с
получением соединения, указанного в заголовке.
(Пример 179)
Этил
2-(N-этил-N-фениламино)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] -фенил]пропионат (этиловый эфир
иллюстративного соединения N 144-33)
Реакцию проводили тем же способом, который описан в
примере 122, используя 2-(4-пиридин-2-илбензоиламино)этанол, который является продуктом ссылочного
примера 61, этил 2-(N-этил-N-фениламино)-3-(4-гидроксифенил)пропионат, который является продуктом
ссылочного примера 56(b), трифенилфосфин и диэтилазодикарбоксилат с получением соединения, указанного
в заголовке.
(Пример 180)
2-(N-этил-М-фениламино)-3-[4-[2-(4-пиридин-2-илбензоиламино)-этокси]фенил]пропионовая кислота (иллюстративное соединение N 144-33)
Этил
2-(N-этил-N-фениламино)-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] пропионат, который является продуктом примера 179, гидролизовали гидроксидом натрия в метаноле с получением соединения,
указанного в заголовке.
(Пример 181)
Этил 3-[4-[2-(бифенил-4-карбониламино) этокси]фенил]-2-(N-этил-N-фениламино)пропионат (этиловый эфир иллюстративного соединения N
144-32)
Реакцию проводили тем же способом, который описан в примере 122, используя 2-(бифенил-4- карбониламино)этанол, этил 2-(N-этил-N-фениламино)-3-(4- гидроксифенил)пропионат, который
является продуктом ссылочного примера 56(b), трифенилфосфин и диэтилазодикарбоксилат с получением соединения, указанного в заголовке.
(Пример 182)
3-[4-[2-(бифенил-4-карбониламино) этокси] фенил] -2-(N-этил-N-фениламино)-пропионовая кислота (иллюстративное соединение N 144-32)
Этил 3-[4-[2-(бифенил-4-карбониламино)этокси] фенил]
-2-(N-этил-N-фениламино)пропионат, который является продуктом примера 181, гидролизовали гидроксидом натрия в метаноле с получением соединения, указанного в заголовке.
(Пример
183)
Этил 2-пропиламино-3-[4-[2-(4-пиридин-2- илбензоиламино)-этокси]фенил] пропионат гидрохлорид (этиловый эфир иллюстративного соединения N 144-13)
(а) Этил
2-(N-трет-бутоксикарбонил)пропиламино-3-[4-[2-(4-пиридин- 2-илбензоиламино)-этокси]фенил]пропионат
Реакцию проводили тем же способом, который описан в примере 122, используя
2-(4-пиридин-2- илбензоиламино)этанол, который является продуктом ссылочного примера 61, этил 2-(N-трет-бутоксикарбонил) пропиламино-3-(4-гидроксифенил)-пропионат, который является продуктом
ссылочного примера 60(b) трифенилфосфин и диэтилазодикарбоксилат с получением соединения, указанного в заголовке.
(b) Этил
2-пропиламино-3-[4-[2-(4-пиридин-2-илбензоиламино)-этокси]фенил] пропионат гидрохлорид (этиловый эфир иллюстративного соединения N 144-13)
Этил
2-(N-трет-бутоксикарбонил)пропиламино-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси]фенил]пропионат, который является продуктом примера 183(а), обрабатывали раствором хлороводорода в диоксане (4 н.) с
получением соединения, указанного в заголовке.
(Пример 184)
2-Пропиламино-3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] -фенил] пропионовая кислота (иллюстративное соединение
N
144-13)
Этил 2-пропиламино-3-[4-[2-(4-пиридин-2-илбензоиламино)-этокси] фенил] пропионат гидрохлорид, который является продуктом примера 183(b) гидролизовали гидроксидом натрия в метаноле
с
получением соединения, указанного в заголовке.
(Пример 185)
Этил 3-[4-[2-(бифенил-4-карбониламино)этокси] фенил] -2-пропиламинопропионат гидрохлорид (этиловый эфир
иллюстративного соединения N 144-12)
(а) Этил 3-[4-[2-(бифенил-4-карбониламино)этокси]фенил]-2-(N-трет-бутоксикарбонил) пропиламинопропионат
Реакцию проводили тем же способом,
который описан в примере 122, используя 2-(бифенил-4-карбониламино) этанол, этил 2-(N-трет-бутоксикарбонил)пропиламино-3-(4-гидроксифенил)пропионат, который является продуктом ссылочного примера
60(b),
трифенилфосфин и диэтилазодикарбоксилат с получением соединения, указанного в заголовке.
(b) Этил 3-[4-[2-(бифенил-4-карбониламино)этокси]фенил]-2-пропиламинопропионат
гидрохлорид
(этиловый эфир иллюстративного соединения N 144-12)
Этил 2-(N-трет-бутоксикарбонил)пропиламино-3-[4-[2-(4- фенилбензоиламино)этокси]фенил]пропионат, который является продуктом
примера 185(а),
обрабатывали раствором хлороводорода в диоксане (4 н.) с получением соединения, указанного в заголовке.
(Пример 186)
3-[4-[2-(Бифенил-4-карбониламино)этокси]
фенил]
-2-пропиламино-пропионовая кислота (иллюстративное соединение N 144-12)
Этил 3-[4-[2-(бифенил-4-карбониламино) этокси]фенил]-2-пропиламинопропионат гидрохлорид, который является
продуктом
примера 185(b), гидролизовали гидроксидом натрия в метаноле с получением соединения, указанного в заголовке.
(Пример 187)
Этил 2-(N,
N-диэтиламино)-3-[4-[2-(4-пиридин-2-бензоиламино)- этокси]фенил]пропионат (этиловый эфир иллюстративного соединения N 144-28)
Реакцию проводили тем же способом, который описан в примере 122,
используя 2-(4-пиридин-2-илбензоиламино) этанол, который является продуктом ссылочного примера 61, этил 2-(N,N-диэтиламино)-3-(4-гидроксифенил)пропионат, который является продуктом ссылочного примера
58, трифенилфосфин и диэтилазодикарбоксилат с получением соединения, указанного в заголовке.
(Пример 188)
2-(N, N-Диэтиламино)-3-[4-[2-(4-пиридин-2-илбензоиламино)-этокси]
фенил] пропионовая кислота (иллюстративное соединение N 144-28)
Этил 2-(N,N-диэтиламино)-3-[4-[2-(4-пиридин-2-бензоиламино)этокси]фенил] пропионат, который является продуктом примера 187,
гидролизовали гидроксидом натрия в метаноле с получением соединения, указанного в заголовке.
(Пример 189)
Этил 3-[4-[2-(бифенил-4-карбониламино) этокси]фенил]-2-(N,
N-диэтиламино)пропионат (этиловый эфир иллюстративного соединения N 144-27)
Реакцию проводили тем же способом, который описан в примере 122, используя 2-(бифенил-4-карбониламино) этанол,
этил
2-(N,N-диэтиламино)-3-(4-гидроксифенил)пропионат, который является продуктом ссылочного примера 58, трифенилфосфин и диэтилазодикарбоксилат с получением соединения, указанного в заголовке.
(Пример 190)
3-[4-[2-(Бифенил-4-карбониламино) этокси] фенил] -2-(N, N-диэтиламино)пропионовая кислота (иллюстративное соединение N 144-27)
Этил 2-(N,
N-диэтиламино)-3-[4-[2-(4-фенилбензоиламино)-этокси] фенил] пропионат, который является продуктом примера 189, гидролизовали гидроксидом натрия в метаноле с получением соединения, указанного в
заголовке.
(Пример 191)
Этил 3-[4-[2-(4-пиридин-2-илбензоиламино)этокси] фенил] -2-(пиррол-1-ил)пропионат (этиловый эфир иллюстративного соединения N 144-38)
Реакцию
проводили тем же способом, который описан в примере 122, используя 2-(4-пиридин-2-илбензоиламино)этанол, который является продуктом ссылочного примера 61, этил
3-(4-гидроксифенил)-2-(пиррол-1-ил)пропионат, который является продуктом ссылочного примера 57(b), трифенилфосфин и диэтилазодикарбоксилат с получением соединения, указанного в заголовке.
(Пример 192)
3-[4-[2-(4-пиридин-2-илбензоиламино) этокси] фенил] -2-(пиррол-1-ил)пропионовая кислота (иллюстративное соединение N 144-38)
Этил
3-[4-[2-(4-пиридин-2-илбензоиламино) этокси] фенил]-2-(пиррол-1-ил)пропионат, который является продуктом примера 191, гидролизовали гидроксидом натрия в метаноле с получением соединения, указанного в
заголовке.
(Пример 193)
Этил 3-[4-[2-(бифенил-4-карбониламино)этокси] фенил] -2-(пиррол-1-ил)пропионат (этиловый эфир иллюстративного соединения N 144-37)
Реакцию
проводили тем же способом, который описан в примере 122, используя 2-(бифенил-4-карбониламино)этанол, этил 3-(4-гидроксифенил)-2-(пиррол-1-ил)пропионат, который является продуктом ссылочного примера
57(b), трифенилфосфин и диэтилазодикарбоксилат с получением соединения, указанного в заголовке.
(Пример 194)
3-[4-[2-(Бифенил-4-карбониламино)
этокси]фенил]-2-(пиррол-1-ил)пропионовая кислота (иллюстративное соединение N 144-37)
Этил 3-[4-[2-(4-фенилбензоиламино)этокси]фенил]-2-(пиррол-1-ил)пропионат, который является продуктом
примера 193, гидролизовали гидроксидом натрия в метаноле с получением соединения, указанного в заголовке.
(Ссылочный пример 1)
Этил
2-этокси-3-[4-(2- фталиминоэтокси)фенил]пропионат
(a) N-[2-(метансульфонилокси)этил] фталимид
К раствору N-(2-гидpoкcиэтил)фтaлимидa (19,1 г) в безводном дихлорметане (200 мл)
добавляли метансульфонилхлорид (12,7 г), затем в смесь на ледяной бане добавляли по каплям триэтиламин (20 мл). Смесь перемешивали при комнатной температуре в течение 4 часов. По завершении этого
времени реакционную смесь концентрировали при пониженном давлении. Остаток твердого продукта промывали этилацетатом и водой и затем кристаллизовали из этилацетата с получением желаемого соединения
(18,
2 г). Т.пл. 138-139oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,02 (3H, с), 4,05 (2H, т, J=5,5 Гц), 4,49 (2H, т, J=5,5 Гц), 7,70-7,80 (2H, м), 7,83-7,93 (2H,
м).
(b) Этил 3-(4-бензилоксифенил)лактат
К раствору этил 3-(4-гидроксифенил)лактата (22,4 г) в диметилформамиде (220 мл) добавляли бензилбромид (21,9 г) и карбонат калия (35,
3 г).
Смесь перемешивали при 50oC в течение 2 часов. Реакционную смесь распределяли между этилацетатом и водой. Этилацетатный слой отделяли и сушили над сульфатом магния, затем
концентрировали
при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента гексан/этилацетат = 7/3, с получением желаемого соединения (31,
0 г) в виде
бледно-желтого масла.
(с) Этил 3-(4-бензилоксифенил)-2-этоксипропионат
В раствор этил 3-(4-бензилоксифенил)лактата (10,30 г), который является продуктом
ссылочного примера
1(b), в смеси с N,N-диметилацетамидом (50 мл) и толуолом (50 мл), добавляли гидрид натрия (55% суспензия в масле, 1,65 г). Смесь перемешивали при 40oC в течение 30
минут. В реакционную
смесь добавляли этилйодид (3,3 мл) и толуол (5 мл). Эту смесь перемешивали при 40oC в течение 2 часов. По завершении этого времени реакционную смесь распределяли между
этилацетатом и водой.
Этилацетатный слой отделяли, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем,
используя в качестве элюента
гексан/этилацетат = 5/1, с получением желаемого соединения (5,50 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,11-1,26 (6H, м), 2,95 (2H,
д, J=6,5 J Гц), 3,36 (1H,
квинтуплет, J=7,0 Гц), 3,60 (1H, квинтуплет, J=7,0 Гц), 3,97 (1H, т, J=6,5 Гц), 4,15 (2H, кв, J=7,0 Гц), 5,05 (2H, с), 6,89 (2H, д, J=8,5 Гц), 7,16 (2H, д, J=8,5 Гц) 7,30-7,
48 (5H, м).
(d) Этил 2-этокси-3-гидроксифенилпропионат
К раствору этил 3-(4-бензилоксифенил)-2-этоксипропионата (5,50 г), который является продуктом ссылочного примера 1(с),
в этаноле (60 мл) добавляли
палладий на углероде (5%, 0,70 г). Смесь перемешивали в атмосфере водорода при 40oC в течение 2 часов. По завершении этого времени катализатор удаляли путем
фильтрации и фильтрат
концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и водой и слои разделяли. Этилацетатный слой сушили над безводным сульфатом магния и затем
концентрировали при
пониженном давлении с получением желаемого продукта (3,80 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,12-1,28 (6H, м), 2,95 (2H, д, J=6,5 Гц),
3,37 (1H, квинтуплет,
J= 7,0 Гц), 3,60 (1H, квинтуплет, J=7,0 Гц), 3,99 (1H, т, J=6,5 Гц), 4,19 (2H, кв, J=7,0 Гц), 5,38 (1H, с), 6,73 (2H, д, J=8,5 Гц), 7,10 (2H, д, J=8,5 Гц).
(e)
Этил
2-этокси-3-[4-(2-фталоиминоэтокси)фенил] пропионат
К раствору этил 2-этокси-3-гидроксифенилпропионата (1,00 г), который является продуктом ссылочного примера 1(d), в смеси
диметилацетамида
(10 мл) и толуола (10 мл) добавляли гидрид натрия (55% суспензия в масле, 200 мг). Смесь перемешивали при комнатной температуре в течение 20 минут. В реакционную смесь добавляли
N-[2-(метансульфонилокси)этил]фталимид (1,50 г), который является продуктом ссылочного примера 1(а), и смесь перемешивали при 70oC в течение 2,5 часов и затем при 60oC в течение
24 часов. По завершении этого времени реакционную смесь распределяли между этилацетатом и водой. Этилацетат отделяли, сушили над безводным сульфатом магния и упаривали при пониженном давлении.
Остаток
очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента бензол/этилацетат = 8/1, с получением соединения, указанного в заголовке (0,31 г) в виде сиропа.1
H-ЯМР (270 МГц, CDCl3): δ ppm 1,09-1,28 (6H, м), 2,92 (2H, д, J=6,5 Гц), 3,37 (1H, квинтуплет, J= 7,0 Гц), 3,58 (1H, квинтуплет, J=7,0 Гц), 3,93 (1H, т, J=6,5 Гц), 4,06-4,25
(6H, м),
6,79 (2H, д, J=8,5 Гц), 7,11 (2H, д, J=8,5 Гц), 7,68-7,91 (4H, м).
(Ссылочный пример 2)
Этил 2-(3-фенилпропил)-3-[4-(2-фталиминоэтокси)фенил]- пропионат
(а) Диэтил
2-(4-бензилоксибензил)-2-(3- фенилпропил)малонат
В раствор диэтил 2-(3-фенилпропил)малоната (2,78 г) в смеси N,N-диметилацетамида (10 мл) и толуола (20 мл) добавляли гидрид натрия
(55%
суспензия в масле, 0,48 г). Смесь перемешивали при комнатной температуре в течение 30 минут. В реакционную смесь добавляли 4-бензилоксибензилхлорид (2,45 г) и смесь перемешивали при комнатной
температуре в течение 30 минут и затем при 60oC в течение 30 минут. По завершении этого времени реакционную смесь распределяли между этилацетатом и водой. Этилацетатный слой отделяли и
сушили над безводным сульфатом магния, и концентрировали. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента гексан/этилацетат = 9/1, с получением
желаемого
соединения (3,91 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,21 (6H, т, J=7,0 Гц), 1,57-1,66 (2H, м), 1,76-1,85 (2H, м), 2,61 (2H, т, J=6,5 Гц), 3,14 (2H,
с), 4,15
(4H, dq, J= 1,5, 7,0 Гц), 5,01 (2H, с), 6,79 (2H, д, J=8,5 Гц), 6,89 (2H, д, J=8,5 Гц), 7,15-7,44 (10H, м).
(b) Этил 2-(4-бензилоксибензил)-5-фенилвалериат
К
раствору диэтил
2-(4-бензилоксибензил)-2-(3-фенилпропил)малоната (3,91 г) в смеси 2-метоксиэтанола (30 мл) и воды (3 мл) добавляли гидроксид калия (2,00 г). Смесь перемешивали при 130oC на
масляной бане 1,
5 часов. По завершении этого времени реакционную смесь распределяли между этилацетатом и водой, и смесь подкисляли водным раствором соляной кислоты (6 н.). Этилацетатный слой отделяли
и промывали
водным раствором хлорида натрия, сушили над безводным сульфатом магния и концентрировали. Раствор остатка сиропа в ксилоле (20 мл) перемешивали в течение 1 часа и затем концентрировали. К
раствору
сиропа остатка 2-(4-бензилоксибензил)- 5-фенилвалериановой кислоты в этаноле (40 мл) добавляли концентрированную серную кислоту (1 мл). Смесь перемешивали при 80oC в течение 3
часов и
оставляли стоять при комнатной температуре в течение 16 часов. По завершении этого времени реакционную смесь концентрировали и остаток распределяли между этилацетатом и водой. Этилацетатный
слой
отделяли, сушили над безводным сульфатом магния и концентрировали досуха с получением желаемого соединения (3,32 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,
13 (3H,
т, J=7,0 Гц), 1,50-1,80 (4H, м), 2,53-2,71 (4H, м), 2,82-2,90 (1H, м), 4,04 (2H, кв, J=7,0 Гц), 5,04 (2H, с), 6,87 (2H, д, J=8,5 Гц), 7,05 (2H, д, J=8,5 Гц), 7,10-7,44 (10H, м).
(с)
Этил 2-(4-гидроксибензил)-5-фенилвалериат
Реакцию проводили тем же способом, который описан в ссылочном примере 1(d), используя этил 2-(4-бензилоксибензил)-5-фенилвалериат (3,
32 г) и палладий
на углероде (5%, 0,40 г), и реакционную смесь обрабатывали с получением желаемого соединения (2,56 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,14
(3H, т, J=7,0 Гц),
1,50-1,75 (4H, м), 2,53-2,71 (4H, м), 2,78-2,87 (1H, м), 4,05 (2H, кв, J=7,0 Гц), 6,70 (2H, д, J=8,5 Гц), 6,98 (2H, д, J=8,5 Гц), 7,12-7,29 (5H, м).
(d) Этил
2-(3-фенилпропил)-3-[4-(2-фталиминоэтокси) фенил]-пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 1(e), используя этил 2-(4-гидроксибензил)-5-фенилвалериат (1,
42 г), который является продуктом ссылочного примера 2(с), гидрид натрия (55% суспензия в масле, 228 мг) и N-[2-(метансульфонилокси)этил]фталимид (1,25 г), который является продуктом ссылочного
примера 1(а), и реакционную смесь обрабатывали с получением желаемого соединения (1,34 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,12 (3H, т, J=7,0 Гц), (1,46-1,70
(4H, м), 2,50-2,70 (4H, м), 2,76-2,89 (1H, м), 4,02 (2H, кв, J=7,0 Гц), 4,10 (2H, т, J=5,5 Гц), 4,19 (2H, т, J=5,5 Гц), 6,77 (2H, д, J=8,5 Гц), 7,00 (2H, д, J=8,5 Гц), 7,10-7,20 (3H, м), 7,21-7,29
(2H,
м), 7,69-7,76 (2H, м), 7,82-7,89 (2H, м).
(Ссылочный пример 3)
Этил 3-[4-(2-аминоэтокси)фенил] -2-(2-феноксиэтил)пропионат
(а) Диэтил
2-(4-метоксибензилиден)малонат
К раствору 4-метоксиметоксибензальдегида (16,2 г) в этаноле (160 мл) добавляли пиперидин (1,5 мл) и диэтилмалонат (14,9 мл). Смесь кипятили с обратным
холодильником в течение 7 часов. По завершении этого времени в реакционную смесь добавляли этилацетат, этилацетат промывали водным раствором соляной кислоты (0,8 н,), насыщенным водным раствором
гидрокарбоната натрия, и насыщенным водным хлоридом натрия и сушили над безводным сульфатом магния, и затем концентрировали. Остаток очищали с помощью хроматографии на колонке с силикагелем,
используя
в качестве элюента гексан/этилацетат = 9/1-3/1, с получением желаемого соединения (5,00 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,33 (6H, т, J=7,0 Гц),
3,48 (3H,
с), 4,29 (2H, кв, J= 7,0 Гц), 4,36 (2H, кв, J=7,0 Гц), 5,20 (2H, с), 7,03 (2H, д, J=9,0 Гц), 7,42 (2H, д, J=9,0 Гц), 7,67 (1H, с).
(b) Диэтил
2-(4-метоксиметоксибензил)малонат
Реакцию проводили тем же способом, который описан в ссылочном примере 1(d), используя диэтил 2-(4-метоксиметоксибензилиден)малонат (4,98 г) и палладий на
углероде (5%, 0,50 г), и реакционную смесь
обрабатывали с получением желаемого соединения (5,00 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,24 (6H, т, J=7,0 Гц), 3,
18 (2H, д, J=8,0 Гц), 3,49 (3H, с), 3,62
(1H, т, J=8,0 Гц), 4,18 (4H, кв, J=7,0 Гц), 5,17 (2H, с), 6,97 (2H, д, J=8,5 Гц), 7,15 (2H, д, J=8,5 Гц).
[с) Диэтил
2-(4-метоксиметоксибензил)-2-(2-феноксиэтил) малонат
Реакцию проводили тем же способом, который описан в ссылочном примере 2(а), используя диэтил 2-(4- метоксиметоксибензил)малонат (1,58 г),
который является продуктом ссылочного примера 3(b), гидрид
натрия (55% суспензия в масле, 0,24 г) и 2-феноксиэтилбромид (1,23 г), и реакционную смесь обрабатывали с получением желаемого соединения (1,
72 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,22 (6H, т, J=7,5 Гц), 2,30 (2H, т, J=6,5 Гц), 3,30 (2H, с), 3,47 (3H, с), 4,08 (2H, т, J=6,5 Гц), 4,19 (4H, кв, J=7,
5 Гц), 5,14 (2H, с), 6,84-6,96 (5H, м), 7,05 (2H, д, J=9,0
Гц), 7,16-7,30 (2H, м).
(d) Этил 2-(4-гидроксибензил)-4-феноксибутират
Реакцию проводили тем же способом, который
описан в ссылочном примере 2(b), используя диэтил
2-(4-метоксиметоксибензил)-2-(2-феноксиэтил)малонат (1,71 г) и гидроксид калия, и реакционную смесь обрабатывали с получением желаемого соединения (1,
25 г) в виде сиропа.1H-ЯМР (270 МГц,
CDCl3): δ ppm 1,13 (3H, т, J=7,0 Гц), 1,90-2,20 (2H, м), 2,74-2,98 (3H, м), 3,90-4,14 (4H, м), 4,71 (1H, с), 6,74 (2H, д, J=8,5 Гц),
6,85 (2H, д, J=8,5 Гц), 6,93 (1H, т, J=7,5 Гц), 7,
05 (2H, д, J=8,5 Гц), 7,22-7,30 (2H, м).
(e) Этил 2-(2-феноксиэтил)-3-[4-[2-(тетрагидропиран-2- илокси)этокси]фенил] пропионат
К раствору этил
2-(4-гидроксибензил)-4-феноксибутирата (620 мг), который является продуктом ссылочного примера 3(d), в 2-бутаноне (8 мл) добавляли 2-(2-бромэтокси)тетрагидропиран (1,24 г) и
карбонат калия (1,09 г).
Смесь перемешивали при 100oC в течение 5 часов. В реакционную смесь добавляли диметилацетамид (10 мл) и смесь перемешивали при 100oC в течение 1,5
часов. По завершении этого
времени реакционную смесь распределяли между этилацетатом и водой. Этилацетатный слой отделяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным
сульфатом магния и затем
концентрировали. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента гексан/этилацетат = 4/1, с получением желаемого соединения
(738 мг) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,13 (3H, т, J= 7,0 Гц), 1,50-2,10 (8H, м), 2,73-2,98 (3H, м), 3,48-3,58 (1H, м), 3,77-4,17 (9H, м), 4,71 (1H, т,
J=3,5 Гц), 6,82-6,87 (4H, м), 6,
93 (1H, т, J=7,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,23-7,29 (2H, м).
(f) Этил 3-[4-(2-гидроксиэтокси) фенил]-2-(2- феноксиэтил)-пропионат
К
раствору этил
2-(2-феноксиэтил)-3-[4-[2- (тетрагидропиран-2-илокси)этокси] фенил] пропионата (738 мг), который является продуктом ссылочного примера 3(е), в этаноле (10 мл) добавляли моногидрат
п-толуолсульфоновой
кислоты (0,40). Смесь перемешивали при комнатной температуре в течение 2 часов. По завершении этого времени реакционную смесь концентрировали. Остаток распределяли между
этилацетатом и насыщенным
водным раствором гидрокарбоната натрия. Этилацетатный слой отделяли, сушили над безводным сульфатом магния и затем концентрировали. Остаток очищали с помощью хроматографии
на колонке с силикагелем,
используя в качестве элюента гексан/этилацетат = 7/3-3/2, с получением желаемого соединения (503 мг) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ
ppm 1,13 (3H, т, J=7,0 Гц),
1,90-2,10 (3H, м), 2,75-3,00 (3H, м), 3,92-4,11 (8H, м), 6,82-6,87 (4H, м), 6,93 (1H, т, J=7,5 Гц), 7,10 (2H, д, J=8,5 Гц), 7,23-7,29 (2H, м).
(g) Этил
3-[4-(2-метансульфонилоксиэтокси) фенил] -2-(2- феноксиэтил) пропионат
К раствору этил 3-[4-(2-гидроксиэтокси)фенил]-2-(2-феноксиэтил)пропионата (503 мг), который является продуктом
ссылочного примера 3(f), в безводном дихлорметане (10 мл) добавляли триэтиламин (0,29 мл) и метансульфонилхлорид (0,12 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов.
По завершении этого времени реакционную смесь концентрировали. Остаток распределяли между этилацетатом и водой. Этилацетатный слой отделяли и сушили над безводным сульфатом магния и затем
концентрировали. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента гексан/этилацетат = 2/1-3/2, с получением желаемого соединения (632 мг) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,13 (3H, т, J= 7,0 Гц), 1,90-2,20 (2H, м), 2,75-3,00 (3H, м), 3,09 (3H, с), 3,89-4,02 (2H, м), 4,07 (2H, кв, J=7,0 Гц), 4,20-4,23 (2H, м),
4,54-4,58 (2H, м), 6,80-6,87 (4H, м), 6,93 (1H, т, J-7,5 Гц), 7,11 (2H, д, J=8,5 Гц), 7,23-7,30 (2H, м).
(h) Этил 3-[4-(2-азидоэтокси)фенил]-2- (2-феноксиэтил)-пропионат
К
раствору этил 3-[4-(2- метансульфонилоксиэтокси) фенил]-2-(2-феноксиэтил)пропионата, который является продуктом ссылочного примера 3(g), в диметилформамиде (8 мл) добавляли азид натрия (0,29 г).
Смесь
перемешивали при 70oC в течение 2 часов. По завершении этого времени реакционную смесь распределяли между этилацетатом и водой. Этилацетатный слой отделяли, сушили над безводным
сульфатом
магния и затем концентрировали с получением желаемого соединения (546 мг) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,13 (3H, т, J=7,0 Гц), 1,90-2,20 (2H,
м), 2,75-3,
00 (3H, м), 3,58 (2H, т, J=5,0 Гц), 3,89-4,14 (6H, м), 6,81-6,87 (4H, м), 6,93 (1H, т, J=7,5 Гц), 7,11 (2H, д, J=8,5 Гц), 7,22-7,30 (2H, м).
(i) Этил 3-[4-(2-аминоэтокси)
фенил]-2-(феноксиэтил) пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 1(d), используя этил 3-[4-(2-азидоэтокси) фенил]-2-(2-феноксиэтил)пропионат (538 мг) и
палладий на углероде (5%, 500 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (476 мг) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ
ppm
1,13 (3H, т, J=7,0 Гц), 1,66 (2H, ушир. с), 1,90-2,21 (2H, м), 2,75-3,07 3H, м), 3,08 (2H, т, J=5,0 Гц), 3,90-4,12 (6H, м), 6,82-6,88 (4H, м), 6,93 (1H, т, J=7,5 Гц), 7,10 (2H, д, J=8,5 Гц), 7,
23-7,30
(2H, м).
(Ссылочный пример 4)
Этил 3-[4-(2-аминоэтокси)фенил]-2-феноксипропионат
(а) Диэтил 2-(4-бензилоксибензил)-2-феноксималонат
Реакцию
проводили тем же
способом, который описан в ссылочном примере 2(а), используя диэтил 2-феноксималонат (2,81 г), 4-бензилоксибензилхлорид (2,59 г) и гидрид натрия (55% суспензия в масле, 530 мг), и
реакционную смесь
обрабатывали с получением желаемого соединения (3,10 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,12 (6H, т, J=7,0 Гц), 3,57 (2H, с), 4,15 (4H, кв,
J=7,0 Гц), 5,02
(2H, с), 6,84-7,14 (6H, м), 7,22-7,41 (8H, м).
(b) Этил 3-(4-бензилоксифенил)-2-феноксипропионат
Реакцию проводили тем же способом, который описан в
ссылочном примере 2(b),
используя диэтил 2-(4-бензилоксибензил)-2-феноксималонат (3,10 г) и гидроксид калия (2,10 г), и реакционную смесь обрабатывали с помощью сиропа
3-(4-бензилоксифенил)-2-феноксипропионовой кислоты с
получением желаемого соединения (2,10 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,18 (3H, т, J= 7,0 Гц), 3,
11-3,20 (2H, м), 4,16 (2H, кв, J=7,0 Гц), 4,74 (1H, дд,
J= 5,5, 6,5 Гц), 5,04 (2H, с), 6,84 (2H, д, J=8,0 Гц), 6,91 (2H, д, J=8,5 Гц), 6,92-6,97 (1H, м), 7,05-7,09 (1H, м), 7,22 (2H, д, J=8,5 Гц), 7,
20-7,43 (6H, м).
(с) Этил
3-(4-гидроксифенил)-2-феноксипропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 1(d), используя этил
3-(4-бензилоксифенил)-2-феноксипропионат (2,10 г), который
является продуктом ссылочного примера 4(b), и палладий на углероде (5%, 0,32 г), и реакционную смесь обрабатывали с получением желаемого
соединения (1,01 г) в виде сиропа.1H-ЯМР (270 МГц,
CDCl3): δ ppm 1,19 (3H, т, J= 7,0 Гц), 3,10-3,24 (2H, м), 4,17 (2H, кв, J=7,0 Гц), 4,74 (1H, дд, J=6,0, 7,0 Гц), 5,00
(1H, с), 6,74 (2H, д, J=8,5 Гц), 6,84 (2H, д, J=8,0 Гц), 6,95
(1H, т, J-7,5 Гц), 7,16 (2H, д, J=8,5 Гц), 7,21-7,26 (2H, м).
(d) Этил 2-фенокси-3-[4-[2-(тетрагидропиран-2-илокси)
этокси] -фенил] пропионат
Реакцию проводили тем же
способом, который описан в ссылочном примере 3(e), используя этил 3-(4-гидроксифенил)-2-феноксипропионат (3,33 г), который является
продуктом ссылочного примера 4 (с), 2-(2- бромэтокси)тетрагидропиран
(7,27 г) и карбонат калия (6,41 г) в диметилацетамиде, и реакционную смесь обрабатывали с получением желаемого соединения (4,53 г)
в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ
ppm 1,19 (3H, т, J=7,0 Гц), 1,50-1,88 (6H, м), 3,16-3,20 (2H, м), 3,48-3,56 (1H, м), 3,76-3,93 (2H, м), 4,00-4,21 (5H, м), 4,
69-4,76 (2H, м), 6,83 (2H, д,
J= 8,5 Гц), 6,86 (2H, д, J=8,5 Гц),
6,94 (1H, т, J=7,0 Гц), 7,18-7,26 (4H, м).
(e) Этил 3-[4-(2-гидроксиэтокси)фенил]-2-феноксипропионат
Реакцию проводили тем же способом, который описан в ссылочном примере
3(f), используя этил 2-фенокси-3-[4-[2- (тетрагидропиран-2-илокси)этокси] фенил] пропионат (4,53 г), который является
продуктом ссылочного примера 4(d), и моногидрат п-толуолсульфоновой кислоты (2,70
г), и реакционную смесь обрабатывали с получением желаемого соединения (3,28 г) в виде сиропа.1H-ЯМР (270
МГц, CDCl3): δ ppm 1,19 (3H, т, J=7,0 Гц), 1,98-2,02 (1H, ушир.
с), 3,14-3,20 (2H, м), 3,90-4,00 (2H, м), 4,06 (2H, т, J=4,5 Гц), 4,17 (2H, кв, J=7,0 Гц), 4,74 (1H, дд, J=6,0, 7,5
Гц), 6,82-6,88 (4H, м), 6,95 (1H, т, J=7,0 Гц), 7,21-7,26 (4H, м).
(f) Этил 3-[4-(2-метансульфонилоксиэтокси)фенил]-2-феноксипропионат
Реакцию проводили тем же способом,
который описан в ссылочном примере 3(g), используя этил 3-[4-(2-гидроксиэтокси)
фенил]-2-феноксипропионат (3,27 г), который является продуктом ссылочного примера 4(e), триэтиламин (2,07 мл) и
метансульфонилхлорид (0,84 мл), и реакционную смесь обрабатывали с получением желаемого
соединения (4,20 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (3H, т, J=7,
0 Гц), 3,07 (3H, с), 3,19 (2H, д, J=7,0 Гц), 4,14-4,25 (4H, м), 4,56 (2H, т, J=4,5 Гц),
4,74 (1H, т, J=7,0 Гц), 6,84 (4H, d. J=8,5 Гц), 6,95 (1H, т, J=7,0 Гц), 7,20-7,29 (4H, м).
(g)
Этил 3-[4-(2-азидоэтокси)фенил]-2-феноксипропионат
Реакцию проводили тем же
способом, который описан в ссылочном примере 3(h), используя этил
3-[4-(2-метансульфонилоксиэтокси)фенил]-2-феноксипропионат (4,00 г), который является продуктом ссылочного примера 4(f), и азид натрия
(1,93 г), и реакционную смесь обрабатывали с
получением
желаемого соединения (3,40 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,19 (3H, т, J=7,0 Гц), 3,14-3,22 (2H,
м), 3,58 (2H, т, J=5,0 Гц), 4,13 (2H, т, J=5,0 Гц), 4,
18 (2H, кв, J=7,0 Гц), 4,74 (1H, dd. J=6,0, 7,5 Гц), 6,82-6,97 (5H, м), 7,21-7,29 (4H, м).
(h) Этил
3-[4-(2-аминоэтокси)фенил]-2-феноксипропионат
Реакцию проводили тем же
способом, который описан в ссылочном примере 1(d), используя этил 3-[4-(2-азидоэтокси)фенил]-2-феноксипропионат (3,40 г),
который является продуктом ссылочного примера 4(g), и палладий на углероде
(5%, 350 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (3,10 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,19 (3H, т, J=7,0
Гц), 3,07 (2H, т, J=5,0 Гц), 3,14-3,20 (2H, м), 3,90-4,15 (2H, м), 4,17 (2H, кв, J=7,0 Гц), 4,74 (1H, dd. J=6,0, 7,0 Гц), 6,84
(4H, д, J=8,5 Гц), 6,94 (1H, т, J=7,5 Гц), 7,19-7,30 (4H, м).
(Ссылочный пример 5)
Этил 3-[4-(2-аминоэтокси)фенил] -2-(4-изопропилфенокси)-пропионат
(а) Диэтил
2-(4-изопропилфенокси)малонат
К раствору 4-изопропилфенола (15,
0 г) в смеси диметилформамида (63 мл) и толуола (75 мл) добавляли гидрид натрия (55% суспензия в масле, 5,22 г). Смесь
перемешивали при комнатной температуре в течение 1 часа. В реакционную смесь
добавляли диэтил 2-хлормалонат (18,5 г). Смесь перемешивали при 60oC в течение 2,5 часов. По завершении этого
времени в реакционную смесь добавляли этилацетат. Этилацетатный слой отделяли,
промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали.
Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в
качестве элюента гексан/этилацетат = 4/1, с получением желаемого соединения (21,5 г) в виде сиропа.1H-ЯМР (270
МГц, CDCl3): δ ppm 1,21 (6H, д, J=7,0 Гц), 2,81-2,95 (1H,
м), 3,85 (6H, с), 5,21 (1H, с), 6,88 (2H, д, J= 8,5 Гц), 7,15 (2H, д, J=8,5 Гц).
(b) Диэтил
2-(4-бензилоксибензил)-2-(4-изопропилфенокси)-малонат
Реакцию проводили тем же
способом, который описан в ссылочном примере 2(а), используя диэтил 2-(4-изопропилфенокси)малонат (21,5 г),
который является продуктом ссылочного примера 5(а), 4-бензилоксибензилхлорид (19,7 г) и
гидрид натрия (55% суспензия в масле, 3,53 г), и реакционную смесь обрабатывали с получением желаемого
соединения (32,3 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,
21 (6H, д, J=6,5 Гц), 2,79-2,92 (1H, м), 3,55 (2H, с), 3,68 (6H, с), 5,02 (2H, с), 6,86 (4H, д, J=8,5
Гц), 7,09 (4H, д, J=8,5 Гц), 7,30-7,43 (5H, м).
(с) Диэтил
3-(4-гидроксифенил)-2-(4-изопропилфенокси) малонат
Реакцию проводили тем же способом, который описан в ссылочном
примере 1 (d), используя диэтил
2-(4-бензилоксибензил)-2-4-изопропилфенокси)малонат (32,3 г), который является продуктом ссылочного примера 5(b), и палладий на углероде (5%, 2,00 г), и реакционную
смесь обрабатывали с получением
желаемого соединения (25,2 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,21 (6H, д, J=7,0 Гц), 2,75-2,95 (1H, м), 3,54 (2H, с), 3,68
(6H, с), 4,93 (1H, ушир. с), 6,
69 (2H, д, J=8,5 Гц), 6,87 (2H, д, J=8,5 Гц), 7,04 (2H, д, J=8,5 Гц), 7,09 (2H, д, J=8,5 Гц).
(d) Этил
3-(4-гидроксифенил)-2-(4-изопропилфенокси)пропионат
Реакцию проводили
тем же способом, который описан в ссылочном примере 2(b), используя диэтил
3-(4-гидроксифенил)-2-(4-изопропилфенокси)малонат (25,2 г), который является продуктом ссылочного примера 5(с), и гидроксид
калия (20,0 г), и реакционную смесь обрабатывали с помощью кристаллов
3-(4-гидроксифенил)-2-(4-изопропилфенокси)пропионовой кислоты с получением желаемого соединения (19,8 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,13-1,22 (9H, м), 2,
75-2,88 (1H, м), 3,11-3,18 (2H, м), 4,17 (2H, кв, J=7,5 Гц), 4,69 (1H, дд, J=5,5, 7,5 Гц), 4,77 (1H, ушир.с), 6,76 (4H, д,
J=8,5 Гц), 7,08 (2H, д, J=8,5 Гц), 7,17 (2H, д, J=8,5 Гц).
(е) Этил 2-(4-изопропилфенокси)-3-[4-[2-(тетрагидропиран-2-илокси)этокси]фенил] пропионат
Реакцию проводили тем же
способом, который описан в ссылочном примере 3(e), используя этил
3-(4-гидроксифенил)-2-(4- изопропилфенокси)пропионат (14,8 г), который является продуктом ссылочного примера 5(d),
2-(2-бромэтокси)тетрагидропиран (28,2 г) и карбонат калия (24,9 г) в диметилформамиде,
и реакционную смесь обрабатывали с получением желаемого соединения (20,6 г) в виде сиропа.
(f)
Этил 3-[4-(2-гидроксиэтокси)фенил]-2-(4-изопропилфенокси) пропионат
Реакцию
проводили тем же способом, который описан в ссылочном примере 3(f), используя этил
2-(4-изопропилфенокси)-3-[4-[2-(тетрагидропиран-2-илокси)этокси] -фенил] пропионат (20,6 г), который является
продуктом ссылочного примера 5(e), и моногидрат п-толуолсульфоновую кислоту (7,85 г), и
реакционную смесь обрабатывали с получением желаемого соединения (16,2 г) в виде сиропа.1H-ЯМР (270
МГц, CDCl3): δ ppm 1,15-1,22 (9H, м), 2,75-3,00 (1H, м), 3,12-3,20
(2H, м), 3,90-3,99 (2H, м), 4,06 (2H, т, J=4,5 Гц), 4,17 (2H, кв, J= 7,5 Гц), 4,69 (1H, дд, J=5,5, 7,5 Гц), 6,76
(2H, д, J=8,5 Гц), 6,84 (2H, д, J=8,5 Гц), 7,08 (2H, д, J=8,5 Гц), 7,22 (2H, д, J=8,5
Гц).
(g) Этил 2-(4-изопропилфенокси)-3-[4-(2-метансульфонилоксиэтокси) фенил] пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 3(g), используя
этил 3-[4-(2-гидроксиэтокси)фенил] -2-(4-изопропилфенокси)пропионат (16,2 г), который является продуктом
ссылочного примера 5(f), триэтиламин (12,1 мл) и метансульфонилхлорид (5,05 мл), и реакционную
смесь обрабатывали с получением желаемого соединения (19,6 г) в виде сиропа.1H-ЯМР (270 МГц,
CDCl3): δ ppm 1,16-1,23 (9H, м), 2,72-2,90 (1H, м), 3,07 (3H, с), 3,12-3,19
(2H, м), 4,10-4,23 (4H, м), 4,51-4,58 (2H, м), 4,69 (1H, дд, J= 5,5, 7,5 Гц), 6,76 (2H, д, J=8,5 Гц), 6,83
(2H, д, J=8,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,23 (2H, д, J=8,5 Гц).
(h) Этил
3-[4-(2-азидоэтокси)фенил]-2-(4- изопропилфенокси)-пропионат
Реакцию проводили тем же способом,
который описан в ссылочном примере 3(h), используя этил
2-(4-изопропилфенокси)-3-[4-(2-метансульфонилоксиэтокси)фенил] -пропионат (19,6 г), который является продуктом ссылочного примера 5(g), и азид
натрия (7,06 г), и реакционную смесь обрабатывали с
получением желаемого соединения (15,8 г) в виде сиропа.
(i) Этил 3-[4-(2-аминоэтокси) фенил]-2-(4- изопропилфенокси)-пропионат
Реакцию проводили тем же способом, который
описан в ссылочном примере 1(d), используя этил 3-[4-(2-азидоэтокси)фенил] -2-(4-изопропилфенокси)пропионат (15,8 г), который является продуктом
ссылочного примера 5(h), и палладий на углероде (5%, 1,
60 г), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке (13,5 г) в виде сиропа.
(Ссылочный
пример 6)
Этил
3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат
(а) Диэтил 2-(4-бензилоксибензил)-2-бутилмалонат
Реакцию проводили тем же способом, который описан в ссылочном
примере 2(а), используя
диэтил 2-бутилмалонат (2,16 г), 4-бензилоксибензил хлорид (2,44 г) и гидрид натрия (55% суспензия в масле, 480 мг), и реакционную смесь обрабатывали с получением желаемого
соединения (3,67 г) в виде
кристаллов. Т.пл. 73oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,91 (3H, т, J=7,0 Гц), 1,24 (6H, т, J= 7,0 Гц), 1,20-1,38 (4H, м), 1,74-1,80
(2H, м), 3,18 (2H, с), 4,
11-4,23 (4H, м), 5,02 (2H, с), 6,86 (2H, д, J-8,5 Гц), 6,99 (2H, д, J=8,5 Гц), 7,31-7,44 (5H, м).
(b) Этил 2-(4-бензилоксибензил)капроат
Реакцию
проводили тем же способом,
который описан в ссылочном примере 2(b), используя диэтил 2-(4-бензилоксбензил)-2-бутилмалонат (3,60 г), который является продуктом ссылочного примера 6(а), и гидроксид
калия (2,00 г), и реакционную
смесь обрабатывали с помощью кристаллов 2-(4-бензилоксибенэил)-2-капроновой кислоты с получением желаемого соединения (2,71 г) в виде сиропа.1H-ЯМР (270 МГц,
CDCl3): δ
ppm 0,87 (3H, т, J=7,0 Гц), 1,14 (3H, т, J= 7,0 Гц), 1,20-1,70 (6H, м), 2,51- 2,72 (2H, м), 2,85 (1H, дд, J=8,5, 13,5 Гц), 4,05 (2H, кв, J=7,0 Гц), 5,03 (2H, с), 6,88 (2H,
д, J=8,5 Гц), 7,07 (2H, д,
J=8,5 Гц), 7,31-7,45 (5H, м).
(с) Этил 2-(4-гидроксибензил)капроат
Реакцию проводили тем же способом, который описан в ссылочном примере 1(d),
используя этил
2-(4-бензилоксибензил)капроат (2,71 г), который является продуктом ссылочного примера 6(b), и палладий на углероде (5%, 0,40 г), и реакционную смесь обрабатывали с получением желаемого
соединения (1,
90 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,20-1,35 (4H, м), 1,40-1,70 (2H, м), 2,53-2,72 (2H, м),
2,84 (1H, дд,
J= 8,5, 13,5 Гц), 4,06 (2H, кв, J=7 Гц), 4,93 (1H, с), 6,72 (2H, д, J=8,5 Гц), 7,02 (2H, д, J-8,5 Гц).
(d) Этил 2-бутил-3-[4-[2-(тетрагидропиран-2-илокси)этокси]-фенил]
пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 3(е), используя этил 2-(4-гидроксибензил)капроат (2,40 г), который является продуктом ссылочного примера 6(с),
2-(2-бромэтокси)тетрагидропиран (1,63 г) и карбонат калия (3,23 г) в диметилацетамиде, и реакционную смесь обрабатывали с получением желаемого соединения (2,47 г) в виде сиропа.1H-ЯМР
(270
МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,21-1,36 (4H, м), 1,38-1,90 (8H, м), 2,51-2,63 (1H, м), 2,67 (1H, дд, J=6,5, 13,5 Гц), 2,85 (1H, дд, J=8,5,
13,5
Гц), 3,48-3,56 (1H, м), 3,72-3,94 (3H, м), 3,96-4,16 (4H, м), 4,70 (1H, т, J=3,5 Гц), 6,83 (2H, д, J=8,5 Гц), 7,06 (2H, д, J=8,5 Гц).
(е) Этил
2-бутил-3-[4-(2-гидроксиэтокси)фенил]пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 3(f), используя этил
2-бутил-3-[4-[2-(тетрагидропиран-2-илокси)этокси]фенил] пропионат (2,47 г), который является продуктом ссылочного примера 6(d), и моногидрат п-толуолсульфоновой кислоты (1,24 г), и реакционную смесь
обрабатывали с получением желаемого соединения (1,44 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,20-1,37 (3H, м), 1,
39-1,70 (3H, м), 2,08 (1H, ушир.с), 2,51-2,63 (1H, м), 2,68 (1H, дд, J= 6,5, 13,5 Гц), 2,86 (1H, дд, J=8,5, 13,5 Гц), 3,89-4,00 (2H, м), 4,02-4,11 (4H, м), 6,82 (2H, д, J=8,5 Гц), 7,08 (2H, д, J=8,5
Гц).
(f) Этил 2-бутил-3-[4-(2-метансульфонилоксиэтокси)- фенил] пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 3(g), используя этил
2-бутил-3-[4-(2-гидроксиэтокси)фенил]пропионат (1,44 г), который является продуктом ссылочного примера 6(e), триэтиламин (2,04 мл) и метансульфонил хлорид (0,76 мл), и реакционную смесь обрабатывали
с
получением желаемого соединения (1,65 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,22-1,39 (4H, м), 1,40-1,70 (2H,
м),
2,52-2,61 (1H, м), 2,69 (1H, дд, J=6,5, 13,5 Гц), 2,86 (1H, дд, J=8,5, 13,5 Гц), 3,09 (3H, с), 4,06 (2H, кв, J=7,0 Гц), 4,21 (2H, т, J=4,5 Гц), 4,55 (2H, т, J=4,5 Гц), 6,81 (2H, д, J=8,5 Гц), 7,
09
(2H, д, J=8,5 Гц).
(g) Этил 3-[4-(2-азидоэтокси)фенил]-2-бутилпропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 3(h), используя этил
2-бутил-3-[4-(2-метансульфонилоксиэтокси)фенил]пропионат (1,65 г), который является продуктом ссылочного примера 6(f), и азид натрия (0,95 г), и реакционную смесь обрабатывали с получением желаемого
соединения (1,62 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,20-1,39 (3H, м), 1,40-1,70 (3H, м), 2,53-2,64 (1H, м),
2,68 (1H, дд, J=6,5, 13,5 Гц), 2,86 (1H, дд, J=8,5, 13,5 Гц), 3,58 (2H, т, J=5,0 Гц), 4,06 (2H, кв, J=7,0 Гц), 4,12 (2H, т, J=5,0 Гц), 6,82 (2H, д, J=8,5 Гц), 7,08 (2H, д, J=8,5 Гц).
(h) Этил 3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 1(d), используя этил 3-[4-(2-азидоэтокси)фенил]-2-бутилпропионат (1,
62 г), который является продуктом ссылочного примера 6 (g), и палладий на углероде (5%, 243 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (1,49 г) в виде
сиропа.
(Ссылочный пример 7)
Этил 3-[4-(2-аминоэтокси)фенил]-2-метил-2-(3-фенилпропил)-пропионат
(а) Диэтил 2-метил-2-(3-фенилпропил)малонат
Реакцию
проводили тем же способом, который описан в ссылочном примере 2(а), используя диэтил 2-метилмалонат (3,48 г), 3-фенилпропилбромид (3,98 г) и гидрид натрия (55% суспензия в масле, 0,96 г), и
реакционную смесь обрабатывали с получением желаемого соединения (4,63 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,22 (6H, т, J=7,0 Гц), 1,34 (3H, с), 1,50-1,63
(2H,
м), 1,88-1,94 (2H, м), 2,62 (2H, т, J=7,5 Гц), 4,16 (4H, кв, J=7,0 Гц), 7,15-7,30 (5H, м).
(b) Этил 2-метил-5-фенилвалерат
Реакцию проводили тем же способом, который
описан
в ссылочном примере 2(b), используя диэтил 2-метил-2-(3-фенилпропил)малонат (4,63 г) и гидроксид калия (3,55 г), и реакционную смесь обрабатывали с получением желаемого соединения (3,18 г) в
виде
сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,14 (3H, д, J=7,0 Гц), 1,24 (3H, т, J=7,0 Гц), 1,37-1,54 (1H, м), 1,55-1,87 (3H, м), 2,37-2,44 (1H, м), 2,61 (2H, т, J=7,5
Гц), 4,
12 (2H, кв, J=7,0 Гц), 7,10-7,35 (5H, м).
(с) Этил 2-(4-бензилоксибензил)-2-метил-5-фенилвалерат
К раствору диизопропиламина (3,23 г) в безводном тетрагидрофуране (60
мл) по
каплям добавляли раствор н-бутиллития в гексане (1,65 М, 19,4 мл) в течение 20 минут при -60oC. Смесь перемешивали при 0oC в течение 30 минут. К этой смеси по каплям
добавляли
раствор 2-метил-5-фенилвалерата (7,05 г) в безводном тетрагидрофуране (30 мл) в течение 20 минут при -70oC и смесь перемешивали при -70oC в течение 40 минут. К
реакционной смеси
добавляли по каплям раствор 4-бензилоксибензилхлорида (9,68 г) в безводном тетрагидрофуране (80 мл) при -70oC. Смесь перемешивали при -70oC в течение 3 часов.
По завершении этого
времени реакционную смесь распределяли между этилацетатом и водой. Этилацетатный слой отделяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным
сульфатом магния и затем
концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента гексан/этилацетат = 15/1, с получением
желаемого соединения (1,
88 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,06 (3H, с), 1,19 (3H, т, J=7,0 Гц), 1,38-1,87 (4H, м), 2,51-2,61 (2H, м), 2,62 (1H, д, J=13,
5 Гц), 2,93 (1H, д, J=13,
5 Гц), 4,08 (2H, кв, J=7,0 Гц), 5,01 (2H, с), 6,84 (2H, д, J=8,5 Гц), 6,97 (2H, д, J=8,5 Гц), 7,14-7,49 (10H, м).
(d) Этил
2-(4-гидроксибензил)-2-метил-5-фенилвалерат
Реакцию
проводили тем же способом, который описан в ссылочном примере 1(d), используя этил 2-(4-бензилоксибензил)-2-метил-5-фенилвалерат (1,88 г),
который является продуктом ссылочного примера 7(с), и
палладий на углероде (5%, 0,28 г), и реакционную смесь обрабатывали с получением желаемого соединения (1,58 г) в виде сиропа.1H-ЯМР
(270 МГц, CDCl3): δ ppm 1,06 (3H, с),
1,20 (3H, т, J=7,0 Гц), 1,35-1,85 (4H, м), 2,56-2,68 (2H, м), 2,60 (1H, д, J= 13,5 Гц), 2,92 (1H, д, J=13,5 Гц), 4,09 (2H, кв, J=7,0 Гц), 5,18
(1H, ушир.с), 6,68 (2H, д, J=8,5 Гц), 6,91 (2H, д, J=8,5
Гц), 7,05-7,36 (5H, м).
(e) Этил 2-метил-2-(3-фенилпропил)-3-[4-[2-(тетрагидропиран-2-илокси) этокси]фенил]пропионат
Реакцию проводили тем же способом, который описан в
ссылочном примере 3(e), используя этил 2-(4-гидроксибензил)-2-метил-5-фенилвалерат (1,58 г), который является продуктом ссылочного примера 7(d),
2-(2-бромэтокси)тетрагидропиран (0,94 г) и карбонат
калия (1,86 г) в диметилацетамиде, и реакционную смесь обрабатывали с получением желаемого соединения (1,64 г) в виде сиропа.1H-ЯМР
(270 МГц, CDCl3): δ ppm 1,05 (3H, с),
1,21 (3H, т, J= 7,10 Гц), 1,35-1,90 (10H, м), 2,50-2,64 (2H, м), 2,62 (1H, д, J=13,5 Гц), 2,93 (1H, д, J=13,5 Гц), 3,45-3,56 (1H, м), 3,67-4,15
(7H, м), 4,71 (1H, т, J= 3,5 Гц), 6,80 (2H, д, J=8,5 Гц),
6,96 (2H, д, J=8,5 Гц), 7,11-7,31 (5H, м).
(f) Этил 3-[4-(2-гидроксиэтокси)фенил]-2-метил-2-(3- фенилпропил)пропионат
Реакцию проводили тем же способом, который описан в
ссылочном примере 3(f), используя этил 2-метил-2-(3-фенилпропил)-3-[4-[2-(тетрагидропиран-2-илокси)этокси] фенил] -пропионат (1,64 г),
который является продуктом ссылочного примера 7(e), и моногидрат
п-толуолсульфоновой кислоты (0,68 г), и реакционную смесь обрабатывали с получением желаемого соединения (0,95 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,06 (3H,
с), 1,21 (3H, т, J=7,0 Гц), 1,38-1,82 (4H, м), 2,04 (1H, ушир.с), 2,56-2,65 (3H, м), 2,94 (1H, д, J= 13,5 Гц), 3,87-3,97 (2H, м), 3,
99-4,14 (4H, м), 6,79 (2H, д, J=8,5 Гц), 6,98 (2H, д, J=8,5 Гц), 7,
10-7,31 (5H, м).
(g) Этил 3-[4-(2-метансульфонилоксиэтокси)фенил] -2-метил-2-(3-фенил-пропил)пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере
3(g), используя этил 3-[4-(2-гидроксиэтокси)фенил]-2-метил-2-(3-фенилпропил)пропионат (0,95 г), который является продуктом
ссылочного примера 7(f), триэтиламин (1,07 мл) и метансульфонилхлорид (0,40
мл), и реакционную смесь обрабатывали с получением желаемого соединения (1,16 г) в виде сиропа.1H-ЯМР (270 МГц,
CDCl3): δ ppm 1,05 (3H, с), 1,21 (3H, т, J=7,0 Гц), 1,38-1,
82 (4H, м), 2,59 (2H, т, J=7,0 Гц), 2,62 (1H, д, J=13,5 Гц), 2,94 (1H, д, J= 13,5 Гц), 3,08 (3H, с), 4,09 (2H, кв, J=7,0
Гц), 4,21 (2H, т, J=4,5 Гц), 4,56 (2H, т, J= 4,5 Гц), 6,77 (2H, д, J=8,5 Гц), 6,
99 (2H, л, J=8,5 Гц), 7,15-7,31 (5H, м).
(h) Этил
3-[4-(2-азидоэтокси)фенил]-2-метил-2-(3- фенилпропил) пропионат
Реакцию проводили тем же способом, который описан в
ссылочном примере 3(h), используя этил
3-[4-(2-метансульфонилоксиэтокси)фенил]-2-метил-2-(3-фенилпропил)-пропионат (1,16 г), который является продуктом ссылочного примера 7 (g), и азида натрия (0,50
г), и реакционную смесь обрабатывали с
получением желаемого соединения (0,86 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,06 (3H, с), 1,21 (3H, т, J=7,0 Гц), 1,38-1,
82 (4H, м), 2,56-2,65 (3H, м), 2,94
(1H, д, J=13,5 Гц), 3,58 (2H, т, J=5,0 Гц), 4,05-4,14 (4H, м), 6,78 (2H, д, J=8,5 Гц), 6,99 (2H, д, J=8,5 Гц), 7,15-7,31 (5H, м).
(i) Этил
3-[4-2-аминоэтокси)фенил]-2-метил-2-(3-фенилпропил)пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 1(d), используя этил 3-[4-(2-азидоэтокси)фенил]
-2-метил-2-(3-фенилпропил)пропионат (0,86 г), который является продуктом ссылочного примера 7(h), и палладий на углероде (5%, 129 мг), и реакционную смесь обрабатывали с получением соединения,
указанного в заголовке, (0,80 г) в виде сиропа.
(Ссылочный пример 8)
Этил 3-[4-(2-аминоэтокси)фенил]-2-метил-2-феноксипропионат
(а) Этил
3-(4-бензилоксифенил)-2-метил-2-феноксипропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 7(с), используя этил 2-феноксипропионат (6,15 г),
4-бензилоксибензилхлорид (9,62 г) и дициклогексиламин (5,78 г) вместо диизопропиламина, и реакционную смесь обрабатывали с получением желаемого соединения (4,97 г) в виде сиропа.1H-ЯМР
(270 МГц, CDCl3): δ ppm 1,20 (3H, т, J=7,0 Гц), 1,40 (3H, с), 3,11 (1H, д, J=14,0 Гц), 3,28 (1H, д, J=14,0 Гц), 4,19 (2H, кв, J=7,0 Гц), 5,04 (2H, с), 6,75-7,02 (5H, м), 7,11-7,47
(9H, м).
(b) Этил 3-(4-гидроксифенил)-2-метил-2-феноксипропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 1(d), используя этил
3-(4-бензилоксифенил)-2-метил-2-феноксипропионат (4,97 г), который является продуктом ссылочного примера 8(а), и палладий на углероде (5%, 0,75 г), и реакционную смесь обрабатывали с получением
желаемого соединения (3,85 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (3H, т, J= 7,0 Гц), 1,40 (3H, с), 3,10 (1H, д, J=14,0 Гц), 3,24 (1H, д, J=14,0 Гц), 4,20
(2H, кв, J=7,0 Гц), 6,13 (1H, ушир.с), 6,74 (2H, д, J=8,5 Гц), 6,83 (2H, д, J=8,5 Гц), 6,96 (1H, т, J=7,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,20 (2H, дд, J=7,5, 8,5 Гц).
(с) Этил
2-метил-2-фенокси-3-[4-[2-(тетрагидропиран-2-илокси)этокси]фенил] пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 3(е), используя этил
3-(4-гидроксифенил)-2-метил-2-феноксипропионат (1,55 г), который является продуктом ссылочного примера 8(b), 2-(2-бромэтокси)тетрагидропиран (1,08 г) и карбонат калия (2,14 г) в диметилацетамиде, и
реакционную смесь обрабатывали с получением желаемого соединения (1,60 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,21 (3H, т, J=7,0 Гц), 1,39 (3H, с), 1,45-1,90
(6H,
м), 3,11 (1H, д, J=13,5 Гц), 3,27 (1H, д, J=13,5 Гц), 3,49-3,56 (1H, м), 3,75-4,15 (5H, м), 4,20 (2H, кв, J=7,0 Гц), 4,71 (1H, т, J = 3,5 Гц), 6,78-6,90 (4H, м), 6,97 (1H, т, J-7,5 Гц), 7,11-7,
25 (4H,
м).
(d) Этил 3-[4-(2-гидроксиэтокси) фенил]-2-метил-2- феноксипропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 3(f), используя этил
2-метил-2-фенокси-3-[4-[2-(тетрагидропиран-2-илокси)этокси] фенил] пропионат (1,60 г), который является продуктом ссылочного примера 8(с), и моногидрат п-толуолсульфоновой кислоты (0,70 г), и
реакционную смесь обрабатывали с получением желаемого соединения (1,10 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,22 (3H, т, J=7,0 Гц), 1,40 (3H, с), 2,09 (1H,
ушир.с), 3,11 (1H, д, J=13,5 Гц), 3,28 (1H, д, J=13,5 Гц), 3,91-4,00 (2H, м), 4,07 (2H, т, J=4,5 Гц), 4,21 (2H, кв, J=7,0 Гц), 6,81-6,90 (4H, м), 6,97 (1H, т, J=7,5 Гц), 7,13-7,28 (4H, м).
(e) Этил 3-[4-(2-метансульфонилоксиэтокси) фенил]-2-метил-2-феноксипропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 3(g), используя этил
3-[4-(2-гидроксиэтокси) фенил]-2-метил-2-феноксипропионат (1,10 г), который является продуктом ссылочного примера 8(d), триэтиламин (0,49 мл) и метансульфонилхлорид (0,25 мл), и реакционную смесь
обрабатывали с получением желаемого соединения (1,42 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,22 (3H, т, J=7,0 Гц), 1,40 (3H, с), 3,07 (3H, с), 3,11 (1H, д,
J=14,
0 Гц), 3,29 (1H, д, J=14,0 Гц), 4,17-4,25 (4H, м), 4,56 (2H, т, J=4,5 Гц), 6,81-6,93 (4H, м), 6,98 (1H, т, J=7,5 Гц), 7,17-7,26 (4H, м).
(f) Этил 3-[4-(2-азидоэтокси)
фенил]-2-метил-2-феноксипропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 3(h), используя этил
3-[4-(2-метансульфонилоксиэтокси)фенил]-2-метил-2-феноксипропионат
(1,42 г), который является продуктом ссылочного примера 8(e), и азид натрия (0,66 г), и реакционную смесь обрабатывали с получением
желаемого соединения (0,82 г) в виде сиропа.1H-ЯМР (270
МГц, CDCl3): δ ppm 1,22 (3H, т, J= 7,0 Гц), 1,40 (3H, с), 3,12 (1H, д, J=14,0 Гц), 3,29 (1H, д, J= 14,0 Гц), 3,58
(2H, т, J=5,0 Гц), 4,13 (2H, т, J=5,0 Гц), 4,20 (2H, кв, J= 7,0 Гц),
6,82-6,89 (4H, м), 6,97 (1H, т, J=7,5 Гц), 7,17-7,27 (4H, м).
(g) Этил 3-[4-(2-аминоэтокси)
фенил]-2-метил-2-феноксипропионат
Реакцию проводили тем же способом, который
описан в ссылочном примере 1(d), используя этил 3-[4-(2- азидоэтокси)фенил]-2-метил-2-феноксипропионат (0,82 г),
который является продуктом ссылочного примера 8(f), и палладий на углероде (5%, 123 мг),
и реакционную смесь обрабатывали с получением соединения, указанного в заголовке (0,76 г) в виде сиропа.
(Ссылочный пример 9)
3-[4-(2-аминоэтокси)фенил]-2-(4-изопропилфенокси)-2-метилпропионат
(а) Этил 3-(4-бензилоксифенил)-2-(4-изопропилфенокси)-2-метилпропионат
Реакцию проводили тем же способом, который
описан в ссылочном примере 7(с), используя этил 2-(4-изопропилфенокси)пропионат (4,72 г) и 4-бензилоксибензил хлорид (6,00 г) и дициклогексиламин (3,62 г)
вместо диизопропиламина, и реакционную смесь
обрабатывали с получением желаемого соединения (6,16 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (6H, д, J=7,0 Гц),
1,21 (3H, т, J=7,5 Гц), 1,38 (3H, с), 2,83
(1H, септет, J=7,0 Гц), 3,11 (1H, д, J=13,5 Гц), 3,25 (1H, д, J=13,5 Гц), 4,20 (2H, кв, J=7,5 Гц), 5,05 (2H, с), 6,75 (2H, д, J=8,5 Гц), 6,91 (2H, д, J=8,5
Гц), 7,06 (2H, д, J=8,5 Гц), 7,18 (2H, д,
J=8,5 Гц), 7,30-7,45 (5H, м).
(b) Этил 3-(4-гидроксифенил)-2-(4-изопропилфенокси)-2-метилпропионат
Реакцию проводили тем же
способом, который описан в ссылочном примере 1(d),
используя этил 3-(4-бензилоксифенил)-2-(4-изопропилфенокси)-2-метилпропионат (6,16 г), который является продуктом ссылочного примера 9(а), и
палладий на углероде (5%, 1,00 г), и реакционную смесь
обрабатывали с получением соединения, указанного в заголовке (4,18 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm
1,20 (6H, д, J=7,0 Гц), 1,22 (3H, т, J=7,5 Гц), 1,38
(3H, с), 2,83 (1H, септет, J=7,0 Гц), 3,10 (1H, д, J=13,5 Гц), 3,24 (1H, д, J= 13,5 Гц), 4,20 (2H, кв, J=7,5 Гц), 4,81 (1H, с), 6,75 (4H, д, J=8,5
Гц), 7,06 (2H, д, J=8,5 Гц), 7,13 (2H, д, J=8,5
Гц).
(с) Этил 2-(4-изопропилфенокси)-2-метил-3-[4-[2-(тетрагидропиран- 2-илокси)-этокси]фенил]пропионат
Реакцию проводили тем
же способом, который описан в ссылочном примере
3(e), используя этил 3-(4-гидроксифенил)-2-(4-изопропилфенокси)-2- метилпропионат (1,00 г), который является продуктом ссылочного примера 9(b),
2-(2-бромэтокси)тетрагидропиран (1,84 г) и карбонат
калия (1,62 г) в диметилацетамиде, и реакционную смесь обрабатывали с получением желаемого соединения (1,06 г) в виде сиропа.1H-ЯМР
(270 МГц, CDCl3): δ ppm 1,20 (6H, д,
J= 7,0 Гц), 1,23 (3H, т, J=7,0 Гц), 1,36 (3H, с), 1,48-1,90 (6H, м), 2,83 (1H, септет, J=7,0 Гц), 3,10 (1H, д, J=13,5 Гц), 3,25 (1H, д, J=13,5
Гц), 3,48-3,57 (1H, м), 3,78-3,96 (2H, м), 4,01-4,25 (5H,
м), 4,70-4,73 (1H, м), 6,75 (2H, д, J=8,5 Гц), 6,86 (2H, д, J=8,5 Гц), 7,06 (2H, д, J=8,5 Гц), 7,17 (2H, д, J=8,5 Гц).
(d)
Этил 2-(4-изопропилфенокси)-3-[4-(2-гидроксиэтокси)-фенил]
-2-метилпропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 3(f), используя этил
2-(4-изопропилфенокси)-2-метил-3-[4-[2-(тетрагидропиран-2-илокси)-этокси]фенил]пропионат (1,06 г), который является продуктом ссылочного примера 9(с), и моногидрат п-толуолсульфоновой кислоты (0,60
г),
и реакционную смесь обрабатывали с получением желаемого соединения (0,66 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (6H, д, J=7,0 Гц), 1,23 (3H, т, J=7,0
Гц),
1,37 (3H, с), 2,01 (1H, т, J=6,0 Гц), 2,83 (1H, септет, J=7,0 Гц), 3,11 (1H, д, J=13,5 Гц), 3,26 (1H, д, J=13,5 Гц), 3,93-4,00 (2H, м), 4,05-4,10 (2H, м), 4,21 (2H, кв, J=1,0 Гц), 6,75 (2H, д,
J=8,5
Гц), 6,85 (2H, д, J=8,5 Гц), 7,06 (2H, д, J=8,5 Гц), 7,19 (2H, д, J-8,5 Гц).
(e) Этил 2-(4-изопропилфенокси)-3-[4-(2-метансульфонилоксиэтокси)фенил] -2-метилпропионат
Реакцию
проводили тем же способом, который описан в ссылочном примере 3(g), используя этил 2-(4-изопропилфенокси)-3-[4-(2-гидроксиэтокси)фенил]-2-метил-пропионат (0,66 г), который является продуктом
ссылочного примера 9(d), триэтиламин (0,36 мл) и метансульфонил хлорид (0,15 мл), и реакционную смесь обрабатывали с получением желаемого соединения (0,64 г) в виде сиропа.1H-ЯМР (270 МГц,
CDCl3): δ ppm 1,20 (6H, д, J=7,0 Гц), 1,23 (3H, т, J=7,0 Гц), 1,37 (3H, с), 2,83 (1H, септет, J=7,0 Гц), 3,09 (3H, с), 3,11 (1H, д, J=13,5 Гц), 3,26 (1H, д, J=13,5 Гц), 4,21 (2H,
кв,
J-7,0 Гц), 4,22-4,26 (2H, м), 4,55-4,59 (2H, м), 6,75 (2H, д, J=8,5 Гц), 6,83 (2H, д, J=8,5 Гц), 7,06 (2H, д, J=8,5 Гц), 7,20 (2H, д, J=8,5 Гц).
(f) Этил
3-[4-(2-азидоэтокси)фенил]-2-(4-изопропилфенокси)-2-метилпропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 3(h), используя этил
2-(4-изопропилфенокси)-3-[4-(2-метансульфонилоксиэтокси)-фенил] -2-метилпропионат (0, 64 г), который является продуктом ссылочного примера 9(e), и азид натрия (0,27 г), и реакционную смесь
обрабатывали с получением желаемого соединения (0,56 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (6H, д, J=7,0 Гц), 1,23 (3H, т, J=7,0 Гц), 1,37 (3H, с), 2,83
(1H, септет, J=7,0 Гц), 3,11 (1H, д, J=13,5 Гц), 3,26 (1H, д, J= 13,5 Гц), 3,59 (2H, т, J=5,0 Гц), 4,14 (2H, т, J=5,0 Гц), 4,21 (2H, кв, J= 7,0 Гц), 6,75 (2H, д, J=8,5 Гц), 6,85 (2H, д, J=8,5 Гц), 7,
06 (2H, д, J=8,5 Гц), 7,19 (2H, д, J=8,5 Гц).
(g) Этил 3-[4-(2-аминоэтокси)фенил]-2-(4-изопропилфенокси)-2-метилпропионат
Реакцию проводили тем же способом, который описан в
ссылочном примере 1(d), используя этил 3-[4-(2-азидоэтокси)фенил]-2-(4-изопропилфенокси)-2-метилпропионат (0,56 г), который является продуктом ссылочного примера 9(f), и палладий на углероде (5%, 60
мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (0,51 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (6H, д, J=7,0 Гц), 1,23
(3H, т, J=7,0 Гц), 1,37 (3H, с), 1,63 (2H, ушир.с), 2,83 (1H, септет, J=7,0 Гц), 3,08 (2H, т, J=5,0 Гц), 3,10 (1H, д, J=13,5 Гц), 3,25 (1H, д, J=13,5 Гц), 3,92-4,13 (2H, м), 4,21 (2H, кв, J= 7,0 Гц),
6,75 (2H, д, J=8,5 Гц), 6,84 (2H, д, J=8,5 Гц), 7,06 (2H, л, J=8,5 Гц), 7,18 (2H, д, J=8,5 Гц).
(Ссылочный пример 10)
Этил
3-[4-(2-аминоэтокси)фенил]-2-бутил-2-метилпропионат
(а) Этил 2-(4-бензилоксибензил)-2-метилкапроат
Реакцию проводили тем же способом, который описан в ссылочном примере 7(с),
используя этил 2-(4-бензилоксибензил)капроат (2,04 г) и метилйодид (1,12 мл) вместо 4-бензилоксибензилхлорида, и циклогексилизопропиламин (1,48 мл) вместо диизопропиламина, и реакционную смесь
обрабатывали с получением желаемого соединения (1,80 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,89 (3H, т, J=7,0 Гц), 1,06 (3H, с), 1,10-1,45 (8H, м), 1,63-1,79
(1H, м), 2,63 (1H, д, J=13,5 Гц), 2,96 (1H, д, J=13,5 Гц), 4,10 (2H, кв, J=7,0 Гц), 5,03 (2H, с), 6,86 (2H, д, J=8,5 Гц), 7,02 (2H, д, J=8,5 Гц), 7,25-7,46 (5H, м).
(b) Этил
2-бутил-3-(4-гидроксифенил)-2-метилпропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 1(d), используя этил 2-(4-бензилоксибензил)-2-метилкапроат (3,95 г),
который
является продуктом ссылочного примера 10(а), и палладий на углероде (5%, 0,40 г), и реакционную смесь обрабатывали с получением желаемого соединения (2,95 г) в виде сиропа.1H-ЯМР
(270 МГц,
CDCl3): δ ppm 0,89 (3H, т, J=7,0 Гц), 1,06 (3H, с), 1,10-1,45 (8H, м), 1,62-1,79 (1H, м), 2,61 (1H, д, J=13,5 Гц), 2,95 (1H, д, J=13,5 Гц), 4,10 (2H, кв, J=7,0 Гц), 4,80
(1H, ушир.с),
6,71 (2H, д, J=8,5 Гц), 6,96 (2H, д, J=8,5 Гц).
(с) Этил 2-бутил-2-метил-3-[4-[2-(тетрагидропиран-2- илокси)этокси]фенил] пропионат
Реакцию проводили тем же
способом,
который описан в ссылочном примере 3(e), используя этил 2-бутил-3-(4-гидроксифенил)-2-метилпропионат (2,95 г), который является продуктом ссылочного примера 10(b),
2-(2- бромэтокси)тетрагидропиран (4,
66 г) и карбонат калия (4,62 г) в диметилацетамиде, и
реакционную смесь обрабатывали с получением желаемого соединения (4,18 г) в виде сиропа.1H-ЯМР
(270 МГц, CDCl3): δ
ppm 0,89 (3H, т, J=7,0 Гц), 1,05 (3H, с), 1,11-1,43 (8H, м), 1,47-1,90 (7H, м), 2,62 (1H, д, J=13,5 Гц), 2,95 (1H, д, J=13,5 Гц), 3,48-3,57 (1H, м), 3,64-4,18
(7H, м), 4,67-4,72 (1H, м), 6,81 (2H, д,
J=8,5 Гц), 7,00 (2H, д, J=8,5 Гц).
(d) Этил 2-бутил-3-[4-(2-гидроксиэтокси)фенил]-2-метилпропионат
Реакцию проводили тем же способом,
который описан в ссылочном примере 3(f),
используя этил 2-бутил-2-метил-3-[4-[2- (тетрагидропиран-2-илокси)этокси] -фенил] пропионат (4,18 г), который является продуктом ссылочного примера 10(с), и
моногидрат п-толуолсульфоновой кислоты (2,
61 г), и реакционную смесь обрабатывали с получением желаемого соединения (2,73 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm
0,90 (3H, т, J=7,0 Гц), 1,06 (3H, с), 1,
10-1,47 (8H, м), 1,65-1,78 (1H, м), 2,04 (1H, ушир.с), 2,63 (1H, д, J=13,5 Гц), 2,96 (1H, д, J=13,5 Гц), 3,91-3,98 (2H, м), 4,04-4,17 (4H, м), 6,81 (2H, д,
J- 8,5 Гц), 7,02 (2H, д, J-8,5 Гц).
(e) Этил 2-бутил-3-[4-(2-метансульфонилоксиэтокси)фенил]-2-метилпропионат
Реакцию проводили тем же способом, который описан в ссылочном
примере 3(g), используя этил
2-бутил-3-[4-(2- гидроксиэтокси)фенил]-2-метилпропионат (2,73 г), который является продуктом ссылочного примера 10(d), триэтиламин (1,85 мл) и метансульфонил хлорид (0,75
мл), и реакционную смесь
обрабатывали с получением желаемого соединения (3,17 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,89 (3H, т, J=7,0 Гц), 1,06 (3H, с), 1,
10-1,44 (8H, м), 1,66-1,80
(1H, м), 2,62 (1H, д, J=13,5 Гц), 2,97 (1H, д, J=13,5 Гц), 3,08 (3H, с), 4,11 (2H, кв, J=7,5 Гц), 4,20-4,23 (2H, м), 4,54-4,58 (2H, м), 6,79 (2H, д, J=8,5 Гц), 7,03 (2H, д,
J=8,5 Гц).
(f) Этил 3-[4-(2-азидоэтокси) фенил]-2-бутил-2- метилпропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 3(h), используя этил
2-бутил-3-[4-(2-метансульфонилоксиэтокси)фенил]-2-метилпропионат (3,17 г), который является продуктом ссылочного примера 10(е), и азид натрия (1,60 г), и реакционную смесь обрабатывали с получением
желаемого соединения (2,80 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,90 (3H, т, J=7,0 Гц), 1,06 (3H, с), 1,10-1,44 (8H, м), 1,66-1,78 (1H, м), 2,63 (1H, д, J= 13,
5 Гц), 2,96 (1H, д, J=13,5 Гц), 3,58 (2H, т, J=5,0 Гц), 4,11 (2H, кв, J= 7,5 Гц), 4,12 (2H, т, J=5,0 Гц), 6,81 (2H, д, J=8,5 Гц), 7,03 (2H, д, J-8,5 Гц).
(g) Этил
3-[4-(2-аминоэтокси)фенил]-2-бутил-2-метилпропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 1(d), используя этил
3-[4-(2-азидоэтокси)фенил]- 2-бутил-2-метилпропионат (2,73 г), который является продуктом ссылочного примера 10(f), и палладий на углероде (5%, 270 мг), и реакционную смесь обрабатывали с получением
соединения, указанного в заголовке, (2,42 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,89 (3H, т, J=7,0 Гц), 1,06 (3H, с), 1,10-1,43 (9H, м), 1,71 (2H, ушир.с), 2,
62
(1H, д, J=13,5 Гц), 2,96 (1H, д, J=13,5 Гц), 3,07 (2H, т, J= 5,0 Гц), 3,91-4,10 (2H, м), 4,11 (2H, кв, J=7,0 Гц), 6,80 (2H, д, J=8,5 Гц), 7,01 (2H, д, J=8,5 Гц).
(Ссылочный пример
11)
Этил 2-бутил-3-[4-[2-(4'-диметоксиметилбифенил-4-карбониламино)этокси] фенил]пропионат
(а) Метил 4'-диметоксиметилбифенил-4-карбоксилат
К раствору метил
4'-формилбифенил-4-карбоксилата (2,00 г) в метаноле (20 мл) добавляли метилортоформиат (4,55 мл) и amberlyst 15 (200 мг). Смесь оставляли стоять при комнатной температуре в течение 14 часов.
Amberlyst
удаляли путем фильтрации и фильтрат концентрировали при пониженном давлении. Избыток метилортоформиата азеотропно упаривали толуолом. Остаток кристаллизовали из диизопропилового эфира с
получением
желаемого соединения (2,23 г) в виде бесцветных кристаллов. Т.пл. 76-77oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,37 (6H, с), 3,94 (3H, с), 5,45 (1H, с),
7,55 (2H, д,
J= 8,5 Гц), 7,64 (2H, д, J= 8,5 Гц), 7,67 (2H, д, J=8,5 Гц), 8,11 (2H, д, J=8,5 Гц).
(b) 4'-Диметоксиметилбифенил-4-карбоновая кислота
Реакцию проводили тем же
способом,
который описан в примере 2, используя метил 4'-диметоксиметилбифенил-4-карбоксилат (1,89 г), который является продуктом ссылочного примера 11(а), и водный гидроксид натрия (1 н., 9,90 мл) и
реакционную смесь обрабатывали с получением желаемого соединения (1,80 г) в виде бесцветных кристаллов. Т.пл. 164oC.1H-ЯМР (270 МГц, дейтерированный диметилсульфоксид): δ
ppm 3,28 (6H, с), 5,45 (1H, с), 7,51 (2H, д, J= 8,5 Гц), 7,76 (2H, д, J= 8,5 Гц), 7,81 (2H, д, J- 8,5 Гц), 8,02 (2H, д, J= 8,5 Гц).
(с) Этил
2-бутил-3-[4-[2-(4'-диметоксиметилбифенил-4-карбониламино)этокси]фенил]пропионат
Реакцию проводили тем же способом, который описан в примере 5, используя этил
3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (1,81 г), который является продуктом ссылочного примера 6, 4'-диметоксиметилбифенил-4-карбоновую кислоту (1,68 г), который является продуктом ссылочного
примера 11(b), и карбонилдиимидазол (1,20 г), и реакционную смесь обрабатывали с получением желаемого соединения (2,77 г) в виде бледно-коричневого твердого продукта.1H-ЯМР (270 МГц,
CDCl3): δ ppm 0,86 (3H, т, J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,22-1,36 (4H, м), 1,38-1,49 (1H, м), 1,51-1,71 (1H, м), 2,52-2,63 (1H, м), 2,68 (1H, дд, J=6,5, 13,5 Гц), 2,86 (1H, дд,
J=8,5, 13,5 Гц), 3,36 (6H, с), 3,88 (2H, кв, J=5,0 Гц), 4,05 (2H, кв, J=7,0 Гц), 4,14 (2H, т, J=5,0 Гц), 5,45 (1H, с), 6,65 (1H, ушир.т), 6,83 (2H, д, J=8,5 Гц), 7,08 (2H, д, J=8,5 Гц), 7,54 (2H, д,
J=8,5 Гц), 7,62 (2H, д, J=8,5 Гц), 7,66 (2H, д, J=8,5 Гц), 7,85 (2H, д, J=8,5 Гц).
(Ссылочный пример 12)
Этил 2-бутил-3-[4-[2-(4'-метоксикарбонилбифенил-4-карбониламино)
этокси] фенил]пропионат
Реакцию проводили тем же способом, который описан в примере 5, используя этил 3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (375 мг), который является продуктом
ссылочного примера 6, 4'-метоксикарбонилбифенил-4-карбоновую кислоту (328 мг) и карбонилдиимидазол (225 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (257 мг)
в виде бесцветных кристаллов. Т. пл. 93-95oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,86 (3H, т, J=6,5 Гц), 1,16 (3H, т, J=7,0 Гц), 1,21-1,36 (4H, м), 1,40-1,67 (2H,
м), 2,52-2,63 (1H, м), 2,68 (1H, дд, J=6,5, 13,5 Гц), 2,88 (1H, дд, J=8,5, 13,5 Гц), 3,89 (2H, т, J=5,0 Гц), 3,95 (3H, с), 4,05 (2H, кв, J=7,0 Гц), 4,15 (2H, т, J=5,0 Гц), 6,63 (1H, ушир.с), 6,84 (2H,
д, J=8,5 Гц), 7,09 (2H, д, J= 8,5 Гц), 7,68 (2H, д, J-8,5 Гц), 7,69 (2H, д, J=8,5 Гц), 7,88 (2H, д, J=8,5 Гц), 8,12 (2H, д, J=8,5 Гц).
(Ссылочный пример 13)
3'-Гидроксибифенил-4-карбоновая кислота к раствору метил 3'-метоксибифенил-4-карбоксилата (2,00 г) в безводном дихлорметане (10 мл) добавляли раствор трибромида бора в дихлорметане (1 н., 24,8 мл)
при
-70oC. Смесь перемешивали при комнатной температуре в течение 4 часов и в реакционную смесь на ледяной бане добавляли смесь льда и воды, и затем смесь перемешивали в течение 30 минут.
Реакционную смесь концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и водой, и слои разделяли. Этилацетатный слой сушили над безводным сульфатом магния и
концентрировали
при пониженном давлении. Остаток кристаллизовали из смеси гексана и диизопропилового эфира с получением соединения, указанного в заголовке, (1,82 г) в виде бледно-желтых кристаллов.
Т.пл. 250 -
253oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 6,89 (1H, д, J=8,0 Гц), 7,11 (1H, д, J=8,0 Гц), 7,13 (1H, с), 7,28 (1H, т, J=8,0 Гц), 7,64 (2H, д,
J=8,5 Гц), 8,12
(2H, д, J=8,5 Гц).
(Ссылочный пример 14)
Этил 2-бутил-3-[4-[2-(3'-диметоксиметилбифенил-4-карбониламино)этокси] -фенил]пропионат
(а) Метил
3'-формилбифенил-4-карбоксилат
К раствору 3-формилфенилборной кислоты (3,00 г) и метил 4-бромбензойной кислоты (4,30 г) в смеси толуола (30 мл), этанола (50 мл) и насыщенного водного
раствора
гидрогенкарбоната натрия (30 мл) при комнатной температуре добавляли раствор тетракис(трифенилфосфин) палладия (297 мг). Смесь кипятили с обратным холодильником в течение 2 часов при 100oC.
Реакционную смесь распределяли между этилацетатом и водой и слои разделяли. Этилацетатный слой промывали насыщенным водным раствором хлорида натрия, и сушили над безводным сульфатом магния
и
концентрировали при пониженном давлении. Остаток кристаллизовали из диизопропилового эфира с получением соединения, указанного в заголовке (3,37 г) в виде бесцветных кристаллов. Т.пл. 95-97o
C.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,96 (3H, с), 7,65 (1H, д, J=7,5 Гц), 7,70 (2H, д, J=8,5 Гц), 7,88-7,93 (2H, м), 8,14 (1H, с), 8,15 (2H, д, J=8,5 Гц), 10,11 (1H,
с).
(b) Метил 3'-диметоксиметилбифенил-4-карбоксилат
Реакцию проводили тем же способом, который описан в примере 11(а), используя метил 3'-формилбифенил-4-карбоксилат (1,60
г),
который является продуктом ссылочного примера 14(а), метилортоформиат (3,64 мл) и amberlyst 15 (160 мг), и реакционную смесь обрабатывали с получением желаемого соединения (1,91 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,37 (6H, c), 3,94 (3H, с), 5,46 (1H, с), 7,47 (1H, д, J= 4,5 Гц), 7,49 (1H, д, J= 2,5 Гц), 7,57-7,64 (1H, м), 7,68 (2H, д, J= 8,5 Гц), 7,
72 (1H,
с), 8,11 (2H, д, J=8,5 Гц).
(с) 3'-Диметоксиметилбифенил-4-карбоновая кислота
Реакцию проводили тем же способом, который описан в примере 2, используя метил
3'-диметоксиметилбифенил-4-карбоксилат (1,91 г), который является продуктом ссылочного примера 14(b), и водный гидроксид натрия (1 н., 10,0 мл) и реакционную смесь обрабатывали с получением желаемого
соединения (1,55 г) в виде бесцветных кристаллов. Т.пл. 130-131oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,38 (6H, с), 5,48 (1H, с), 7,49 (1H, д, J= 5,0 Гц), 7,49 (1H,
д, J= 3,5 Гц), 7,59-7,66 (1H, м), 7,73 (2H, д, J= 8,5 Гц), 7,75 (1H, с), 8,19 (2H, д, J=8,5 Гц).
(d) Этил 2-бутил-3-[4-[2-(3'-диметоксиметилбифенил-4-карбониламино)этокси]фенил]
пропионат
Реакцию проводили тем же способом, который описан в примере 5, используя этил 3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (1,55 г), который является продуктом ссылочного примера 6,
3'-диметоксиметилбифенил-4-карбоновую кислоту (1,44 г), которая является продуктом ссылочного примера 14(с), и карбонилдиимидазол (1,03 г), и реакционную смесь обрабатывали с получением желаемого
соединения (2,72 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,21-1,35 (4H, м), 1,39-1,56 (1H, м), 1,58- 1,67 (1H, м),
2,53-2,65 (1H, м), 2,69 (1H, дд, J=6,5, 13,5 Гц), 2,86 (1H, дд, J=8,5, 13,5 Гц), 3,37 (6H, с), 3,89 (2H, кв, J=5,0 Гц), 4,06 (2H, кв, J=7,0 Гц), 4,15 (2H, т, J=5,0 Гц), 5,45 (1H, с), 6,64 (1H,
ушир.т),
6,84 (2H, д, J=8,5 Гц), 7,08 (2H, д, J=8,5 Гц), 7,46 (1H, д, J=5,0 Гц), 7,47 (1H, д, J=3,0 Гц), 7,54-7,61 (1H, м), 7,68 (2H, д, J=8,5 Гц), 7,71 (1H, с), 7,85 (2H, д, J=8,5 Гц).
(Ссылочный пример 15)
Натрий 2-бутил-3-[4-[2-(3'-метоксиметоксиметилбифенил-4-карбониламино)этокси]фенил]пропионат
(а) Метил 3'-гидроксиметилбифенил-4-карбоксилат
К раствору
метил 3'-формилбифенил-4-карбоксилата (720 мг), который является продуктом ссылочного примера 14 (а), в этаноле (50 мл) добавляли натрий боргидрид (132 мг) при комнатной температуре.
Смесь
перемешивали в атмосфере азота в течение 50 минут. Реакционную смесь гасили 50% уксусной кислотой и концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и водой и
слои
разделяли. Этилацетатный слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток кристаллизовали из
диизопропилового эфира с получением желаемого соединения (522 мг) в виде бесцветных кристаллов. Т. пл. 88-89oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,95 (3H, с), 4,
79 (2H, с), 7,40 (1H, д, J=7,5 Гц), 7,47 (1H, т, J= 7,5 Гц), 7,56 (1H, д, J=7,5 Гц), 7,64 (1H, с), 7,67 (2H, д, J=8,5 Гц), 8,11 (2H, д, J=8,5 Гц).
(b) Метил
3'-метоксиметоксиметилбифенил-4-карбоксилат
К раствору метил 3'-гидроксиметилбифенил-4-карбоксилата (504 мг), который является продуктом ссылочного примера 15(а), в безводоном дихлорметане
(10 мл) добавляли хлорметилметиловый эфир (0,24 мл) и диизопропилэтиламин (0,74 мл) при 0oC. Смесь перемешивали при 0oC в течение 1 часа и затем оставляли стоять при комнатной
температуре в течение 14 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и водой и слои разделяли. Этилацетатный слой промывали насыщенным
водным раствором хлорида натрия, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в
качестве
элюента гексан/этилацетат = 2/1, с получением желаемого соединения (467 мг) в виде бесцветных кристаллов. Т. пл. 54-55oC.1H-ЯМР (270 МГц, CDCl3): δ
ppm 3,44
(3H, с), 3,94 (3H, с), 4,67 (2H, с), 4,75 (2H, с), 7,39 (1H, д, J=7,5 Гц), 7,46 (1H, т, J= 7,5 Гц), 7,56 (1H, д, J=7,5 Гц), 7,63 (1H, с), 7,67 (2H, д, J=8,5 Гц), 8,11 (2H, д, J=8,5 Гц).
(с) 3'-Метоксиметоксилметилбифенил-4-карбоновая кислота
Реакцию проводили тем же способом, который описан в примере 2, используя метил
3'-метоксиметоксиметилбифенил-4-карбоксилат
(445 мг), который является продуктом ссылочного примера 15(b), и водный гидроксид натрия (1 н., 3,10 мл), и реакционную смесь обрабатывали с получением
желаемого соединения (342 мг) в виде бесцветных
кристаллов. Т.пл. 126-127oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,45 (3H, с), 4,68 (2H, с), 4,76 (2H, с), 7,41 (1H,
д, J=7,5 Гц), 7,47 (1H, т, J= 7,5 Гц), 7,58 (1H,
д, J=7,5 Гц), 7,64 (1H, с), 7,71 (2H, д, J=8,5 Гц), 8,17 (2H, д, J=8,5 Гц).
(d) Этил
2-бутил-3-[4-[2-(3'-метоксиметоксиметилбифенил-4-карбониламино)этокси]фенил]пропионат
Реакцию проводили тем же способом, который описан в примере 5, используя этил
3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (358 мг), который является продуктом ссылочного примера 6,
3'-метоксиметоксиметилбифенил-4-карбоновую кислоту (333 мг), которая является продуктом
ссылочного примера 15 (с), и карбонилдиимидазол (238 мг) и реакционную смесь обрабатывали с получением желаемого
соединения (573 мг) в виде коричневого сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,22-1,39 (4H, м), 1,40-1,51 (1H, м), 1,54-1,
67 (1H, м), 2,53-2,63 (1H, м), 2,68 (1H, дд, J= 6,5, 13,5 Гц), 2,86 (1H, дд, J=8,5,
13,5 Гц), 3,44 (3H, с), 3,88 (2H, кв, J= 5,0 Гц), 4,05 (2H, кв, J=7,0 Гц), 4,14 (2H, т, J=5,0 Гц), 4,67 (2H, с), 4,
74 (2H, с), 6,69 (1H, ушир.т), 6,84 (2H, д, J=8,5 Гц), 7,08 (2H, д, J=8,5 Гц), 7,38
(1H, д, J=7,5 Гц), 7,45 (1H, т, J=7,5 Гц), 7,54 (2H, д, J=7,5 Гц), 7,60 (1H, с), 7,66 (2H, д, J=8,5 Гц), 7,86 (2H, д,
J=8,5 Гц).
(e) Натрий
2-бутил-3-[4-[2-(3'-метоксиметоксиметилбифенил-4-карбониламино)этокси]фенил] пропионат
Реакцию проводили тем же способом, который описан в примере 2,
используя этил
2-бутил-3-[4-[2-(3'-метоксиметоксиметилбифенил-4-карбониламино)этокси] фенил] - пропионат (573 мг), который является продуктом ссылочного примера 15(d), и водный гидроксид натрия (1 н.,
2,00 мл), и
реакционную смесь обрабатывали с получением желаемого соединения (472 мг) в виде белого порошка. Т. пл. 216-218oC.1H-ЯМР (270 МГц, дейтерированный метанол): δ
ppm 0,85
(3H, т, J=7,0 Гц), 1,17-1,40 (4H, м), 1,46-1,60 (2H, м), 2,36-2,46 (1H, м), 2,52 (1H, дд, J=7,0, 13,5 Гц), 2,86 (1H, дд, J=7,5, 13,5 Гц), 3,41 (3H, с), 3,77 (2H, т, J=5,5 Гц), 4,14 (2H, т,
J=5,5 Гц),
4,66 (2H, с), 4,73 (2H, с), 6,84 (2H, д, J=8,5 Гц), 7,13 (2H, д, J=8,5 Гц), 7,38 (1H, д, J=7,5 Гц), 7,45 (1H, т, J=7,5 Гц), 7,60 (1H, д, J=7,5 Гц), 7,66 (1H, с), 7,72 (2H, д, J=8,5 Гц), 7,
91 (2H, д,
J=8,5 Гц).
(Ссылочный пример 16)
2'-Гидроксибифенил-4-карбоновая кислота
Реакцию проводили тем же способом, который описан в примере 2, используя метил
2'-гидроксибифенил-4-карбоксилат (498 мг) и водный гидроксид натрия (1 н. , 4,81 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (434 мг) в виде бесцветных
кристаллов. Т.пл. 176-178oC.1H-ЯМР (270 МГц, CDCl3/дейтерированный метанол = 20/1): δ ppm 6,92-7,05 (2H, M), 7,21-7,32 (2H, м), 7,64 (2H, д, J=8,5 Гц), 8,15
(2H, д, J=8,5 Гц).
(Ссылочный пример 17)
2-Бутил-3-[4-[2-(4'- метоксиметокси-3', 5'-диметилбифенил-4-карбониламино)этокси]фенил]пропионовая кислота
(а) Метил
4'-метоксиметокси-3',5'-диметилбифенил-4-карбоксилат
К суспензии магния (327 мг) в тетрагидрофуране (45 мл) по каплям добавляли раствор 5-бром-2- метоксиметокси-1,3-диметилбензола (3,35 г) в
тетрагидрофуране (7,0 мл) в течение 15 минут при 65oC. Смесь перемешивали при 80oC в течение 1 часа с получением реактива Гриньяра. Этот раствор по каплям добавляли к раствору
триметилбората (2,00 мл) в безводоном диэтиловом эфире (20 мл) в течение 30 минут при -50oC. Смесь перемешивали при комнатной температуре в течение 2 часов. По завершении этого времени
реакцию гасили гидрогенсульфатом калия и распределяли между этилацетатом и водой. Этилацетатный слой отделяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом
магния и затем концентрировали при пониженном давлении. Остаток кристаллизовали из диизопропилового эфира с получением 4'-метоксиметокси-3',5'-диметилфенил бората (1,04 г) в виде бесцветных
кристаллов. Реакцию проводили тем же способом, который описан в ссылочном примере 14(а), используя 4'-метоксиметокси-3',5'-диметилфенил борат, полученный выше, (1,04 г), метил 4-бромбензойную кислоту
(1,06 г) и тетракис(трифенилфосфин) палладия (96 мг), и реакционную смесь обрабатывали с получением желаемого соединения (1,36 г) в виде бесцветных кристаллов. Т.пл. 100-101oC.1
H-ЯМР (270 МГц, CDCl3): δ ppm 2,37 (6H, с), 3,64 (3H, с), 3,93 (3H, с), 5,01 (2H, с), 7,28 (2H, с), 7,61 (2H, д, J= 8,5 Гц), 8,07 (2H, д, J=8,5 Гц).
(b)
4'-Метоксиметокси-3',5'-диметилбифенил-4-карбоновая кислота
Реакцию проводили тем же способом, который описан в примере 2, используя метил 4'-метоксиметокси-3',
5'-диметилбифенил-4-карбоксилат
(1,24 г), и водный гидроксид натрия (1 н., 8,20 мл), и реакционную смесь обрабатывали с получением желаемого соединения (0,99 г) в виде бесцветных кристаллов. Т.пл.
153-154oC.1
H-ЯМР (270 МГц, CDCl3): δ ppm 2,38 (6H, с), 3,64 (3H, с), 5,02 (2H, с), 7,30 (2H, с), 7,65 (2H, д, J= 8,5 Гц), 8,14 (2H, д, J=8,5 Гц).
(с) Этил
2-бутил-3-[4-[2-(4'-метоксиметокси-3', 5'-диметилбифенил-4-карбониламино)этокси]фенил]пропионат
Реакцию проводили тем же способом, который описан в примере 5, используя
этил
3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (880 мг), который является продуктом ссылочного примера 6, 4'-метоксиметокси-3',5'-диметилбифенил-4-карбоновую кислоту (859 мг), которая является
продуктом
ссылочного примера 17(b), и карбонилдиимидазол (577 мг), и реакционную смесь обрабатывали с получением желаемого соединения (1,18 г) в виде бесцветных кристаллов. Т.пл. 70-71oC.1
H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,16 (3H, т, J= 7,0 Гц), 1,22-1,40 (4H, м), 1,41-1,77 (2H, м), 2,36 (6H, с), 2,52-2,63 (1H, м), 2,68 (1H, дд, J=6,5,
13,5 Гц), 2,
86 (1H, дд, J=8,0, 13,5 Гц), 3,63 (3H, с), 3,88 (2H, кв, J=5,0 Гц), 4,05 (2H, кв, J=7,0 Гц), 4,14 (2H, т, J= 5,0 Гц), 5,00 (2H, с), 6,62 (1H, ушир.т), 6,83 (2H, д, J-8,5 Гц), 7,08 (2H, д,
J=8,5 Гц), 7,
60 (2H, д, J=8,5 Гц), 7,82 (2H, д, J=8,5 Гц).
(d) 2-Бутил-3-[4-[2-(4'-метоксиметокси-3', 5- диметилбифенил-4-карбониламино)-этокси]фенил] пропионовая кислота
Реакцию
проводили тем же способом, который описан в примере 2, используя этил 2-бутил-3-[4-[2-(4'-метоксиметокси-3', 5'-диметилбифенил-4-карбониламино)этокси] фенил]пропионат (1,01 г), который
является
продуктом ссылочного примера 17(с), и водный раствор гидроксида натрия (1 н 3,60 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (1,00 г) в виде
пенного порошка.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J= 7,0 Гц), 1,21-1,39 (4H, м), 1,40-1,70 (2H, м), 2,35 (6H, с), 2,56-2,65 (1H, м), 2,71 (1H, дд, J=6,5, 13,5
Гц), 2,89 (1H, дд,
J=8,5, 13,5 Гц), 3,63 (3H, с), 3,86 (2H, кв, J=5,0 Гц), 4,12 (2H, т, J=5,0 Гц), 5,00 (2H, с), 6,73 (1H, ушир. т), 6,82 (2H, д, J=8,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,58 (2H, д, J=8,5
Гц), 7,81 (2H, д,
J=8,5 Гц).
(Ссылочный пример 18)
6-Изопропоксиникотиновая кислота
(а) Изопропил 6-изопропоксиникотинат
К раствору 6-хлорникотинилхлорида
(1,56 г) в
изопропаноле (20 мл) добавляли карбонат цезия (7,94 г). Смесь кипятили с обратным холодильником в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток
распределяли между
этилацетатом и водой и слои разделяли. Этилацетатный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии
на колонке с
силикагелем, используя в качестве элюента гексан/этилацетат = 4/1, с получением желаемого соединения (143 мг) в виде бесцветной жидкости.1H-ЯМР (270 МГц, CDCl3):
δ ppm 1,
36 (12H, д, J=6,5 Гц), 5,24 (1H, септет, J=6,5 Гц), 5,39 (1H, септет, J=6,5 Гц), 6,68 (1H, д, J=8,5 Гц), 8,12 (1H, дд, J=2,5, 8,5 Гц), 8,81 (1H, д, J=2,5 Гц).
(b)
6-Изопропоксиникотиновая кислота
Реакцию проводили тем же способом, который описан в примере 2, используя изопропил 6-изопропоксиникотинат (130 мг), который является продуктом ссылочного
примера 18(а), и водный раствор гидроксида натрия (1 н., 0,87 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (106 мг) в виде кристаллов.1H-ЯМР (270
МГц, CDCl3): δ ppm 1,38 (6H, д, J= 6,0 Гц), 5,42 (1H, септет, J=6,0 Гц), 6,73 (1H, д, J=8,5 Гц), 8,18 (1H, дд, J=2,5, 8,5 Гц), 8,92 (1H, д, J=2,5 Гц).
(Ссылочный
пример 19)
Этил 2-бутил-3-[4-[2-(3-фенилпропиламино)этокси]фенил]-пропионат
К раствору этил 3-[4-(2-аминоэтокси)фенил]-2-бутилпропионата (500 мг), который является продуктом
ссылочного примера 6, в этаноле (10 мл) добавляли 3-фенилпропиональдегид (0,23 мл), натрий цианоборгидрид (117 мг) и уксусную кислоту (одна капля). Смесь перемешивали при комнатной температуре в
течение 18 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и водой и слои разделяли. Этилацетатный раствор сушили над безводным сульфатом
магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента дихлорметан/метанол = 19/1, с получением желаемого
соединения (460 мг) в виде бледно-желтого масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,15 (3H, т, J=7,0 Гц), 1,23-1,32 (4H, м), 1,40-1,95 (4H, 681 м),
2,
52-3,00 (9H, м), 3,99-4,09 (4H, м), 6,80 (2H, д, J=8,5 Гц), 7,06 (2H, д, J=8,5 Гц), 7,15-7,31 (5H, м).
(Ссылочный пример 20)
Этил
2-бутил-3-[4-[2-(бутиламино)этокси]фенил]пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 19, используя этил 3-[4-(2-аминоэтокси)фенил]-2-бутилпропионат (500
мг), который является продуктом ссылочного примера 6, бутилальдегид (0,15 мл), натрий цианоборгидрид (107 мг) и уксусную кислоту (одна капля), и реакционную смесь обрабатывали с получением соединения,
указанного в заголовке, (390 мг) в виде желтого масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 0,94 (3H, т, J=7,5 Гц), 1,17 (3H, т, J=7,0 Гц), 1,22-1,73
(10H, м), 2,52-3,00 (5H, м), 3,20-3,28 (2H, м), 3,99-4,20 (4H, м), 6,84 (2H, д, J=8,5 Гц), 7,07 (2H, д, J=8,5 Гц).
(Ссылочный пример 21)
Этил
3-[4-(3-аминопропокси)фенил]-2-бутилпропионат
(а) 2-бутил-3-[4-[3-(тетрагидропиран-2-илокси)пропокси]-фенил] пропионат
Реакцию проводили тем же способом, который описан в ссылочном
примере 3(е), используя этил 2-(4-гидроксибензил)капроат (3,02 г), 2-(3-бромпропокси)-тетрагидропиран (3,23 г) и карбонат калия (5,00 г), и реакционную смесь обрабатывали с получением желаемого
соединения (4,42 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,15 (3H, т, J= 7,0 Гц), 1,22-1,35, (4H, м), 1,47-1,88 (8H, м), 2,06
(2H, квинтуплет, J= 6,0 Гц), 2,52-2,63 (1H, м), 2,67 (1H, дд, J=6,5, 13,5 Гц), 2,85 (1H, дд, J= 8,5, 13,5 Гц), 3,46-3,61 (2H, м), 3,80-3,97 (2H, м), 4,01-4,10 (4H, м), 4,60 (1H, т, J=3,5 Гц), 6,80
(2H,
д, J=8,5 Гц), 7,06 (2H, д, J=8,5 Гц).
(b) Этил 2-бутил-3-[4-(3-гидроксипропокси)фенил]пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере
3(f),
используя этил 2-бутил-3-[4-[3- (тетрагидропиран-2-илокси)пропокси]фенил] пропионат (4,42 г) и моногидрат п-толуолсульфоновой кислоты (2,57 г), и реакционную смесь обрабатывали с получением
желаемого
соединения (3,02 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,22-1,35 (4H, м), 1,40-1,70 (2H,
м), 1,77 (1H,
т, J=5,5 Гц), 2,03 (2H, квинтуплет, J=5,5 Гц), 2,53-2,65 (1H, м), 2,68 (1H, дд, J=6,5, 13,5 Гц), 2,86 (1H, дд, J=8,5, 13,5 Гц), 3,86 (2H, кв, J=5,5 Гц), 4,02-4,17 (4H, м), 6,81 (2H, д,
J=8,5 Гц), 7,
07 (2H, д, J=8,5 Гц).
(с) Этил 2-бутил-3-[4-(3-метансульфонилоксипропокси)-фенил] пропионат
Реакцию проводили тем же способом, который описан в ссылочном
примере 3(g),
используя этил 2-бутил-3-[4-(3-гидроксипропокси)фенил]пропионат (3,02 г), триэтиламин (2,05 мл) и метансульфонилхлорид (0,83 мл), и реакционную смесь обрабатывали с получением желаемого
соединения (3,
49 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,16 (3H, т, J= 7,0 Гц), 1,22-1,34 (4H, м), 1,40-1,70 (2H, м), 2,21
(2H, квинтуплет,
J= 6,0 Гц), 2,52-2,64 (1H, м), 2,68 (1H, дд, J=6,5, 13,5 Гц), 2,86 (1H, дд, J=8,5, 13,5 Гц), 2,98 (3H, с), 4,02-4,11 (4H, м), 4,44 (2H, т, J= 6,0 Гц), 6,80 (2H, д, J=8,5 Гц), 7,07
(2H, д, J-8,5
Гц).
(d) Этил 3-[4-(3-азидопропокси)фенил]-2-бутилпропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 3(h), используя этил
2-бутил-3-[4-(3-метансульфонилоксипропокси)фенил]пропионат (2,98 г) и азид натрия (1,50 г), и реакционную смесь обрабатывали с получением желаемого соединения (2,45 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,20-1,34 (4H, м), 1,40-1,70 (2H, м), 2,03 (2H, квинтуплет, J=6,5 Гц), 2,51-2,63 (1H, м), 2,67
(1H, дд, J=6,5, 13,5 Гц), 2,85 (1H, дд, J=8,5, 13,5 Гц), 3,51 (2H, т, J=6,5 Гц), 4,02 (2H, т, J=6,5 Гц), 4,05 (2H, кв, J=7,0 Гц), 6,80 (2H, д, J=8,5 Гц), 7,06 (2H, д, J=8,5 Гц).
(e)
Этил 3-[4-(3-аминопропокси)фенил]-2-бутилпропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 1(d), используя этил 3-[4-(3-азидопропокси) фенил]- 2-бутилпропионат
(2,45 г) и палладий на углероде (5%, 250 мг), и реакционную смесь обрабатывали с получением желаемого соединения (1,62 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3):
δ ppm 0,87 (3H, т, J=6,5 Гц), 1,16 (3H, т, J=7,0 Гц), 1,22-1,34 (4H, м), 1,40-1,70 (2H, м), 1,80-2,10 (2H, м), 2,52-2,94 (6H, м), 4,00-4,11 (4H, м), 6,80 (2H, д, J=8,5 Гц), 7,06 (2H, д, J=8,5
Гц).
(Ссылочный пример 22)
Этил 2-бутил-3-[4-(3-метиламинопропокси)фенил]пропионат
К раствору этил 2-бутил-3-[4-(3-метансульфонил-оксипропокси)фенил]пропионата (500
мг), который является продуктом ссылочного примера 21(с), в толуоле (10 мл) добавляли раствор метиламина в метаноле (40%, 5,0 мл). Смесь перемешивали при 90oC в течение 2 дней. Реакционную
смесь концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и водой и слои разделяли. Этилацетатный раствор сушили над безводным сульфатом магния и концентрировали при
пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента дихлорметан/метанол = 5/1, с получением соединения, указанного в заголовке, (389
мг)
в виде бледно-желтого масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,87 (3H, т, J= 6,5 Гц), 1,15 (1,5H, т, J=7,0 Гц), 1,16 (1,5H, т, J=7,0 Гц), 1,22-1,35 (4H, м), 1,42-1,70
(2H,
м), 1,92-2,02 (1H, м), 2,17-2,27 (1H, м), 2,52-3,09 (8H, м), 3,92-4,10 (4H, м), 6,73-6,81 (2H, м), 7,00-7,09 (2H, м).
(Ссылочный пример 23)
Этил
3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]-2-пропилпропионат
(а) Диэтил 2-(4-бензилоксибензил)-2-пропилмалонат
Реакцию проводили тем же способом, который описан в ссылочном
примере 2(а), используя диэтил 2-пропилмалонат (5,00 г), 4-бензилоксибензилхлорид (6,32 г) и гидрид натрия (55% суспензия в масле, 1,13 г), и реакционную смесь обрабатывали с получением желаемого
соединения (9,80 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,92 (3H, т, J=7,0 Гц), 1,23 (6H, т, J=7,0 Гц), 1,23-1,38 (2H, м), 1,71- 1,80 (2H, м), 3,18
(2H, с), 4,08-4,21 (4H, м), 5,02 (2H, с), 6,86 (2H, д, J=8,5 Гц), 6,99 (2H, д, J=8,5 Гц), 7,30-7,48 (5H, м).
(b) 3-(4-бензилоксифенил)-2-пропилпропионовая кислота
Реакцию
проводили тем же способом, который описан в ссылочном примере 2(b), используя диэтил 2-(4-бензилоксибензил)-2- пропилмалонат (9,85 г), который является продуктом ссылочного примера 23(а), и гидроксид
калия (5,25 г), и реакционную смесь обрабатывали с получением желаемого соединения (3,96 г) в виде коричневатых кристаллов. Т.пл. 83-85oC.1H-ЯМР (270 МГц, CDCl3):
δ ppm 0,90 (3H, т, J=7,0 Гц), 1,24-1,70 (4H, м), 2,59-3,00 (3H, м), 5,03 (2H, с), 6,90 (2H, д, J=8,5 Гц), 7,10 (2H, д, J=8,5 Гц), 7,21-7,48 (5H, м).
[с) Этил
3-(4-бензилоксифенил)-2-пропилпропионат (с)
К раствору 3-(4-бензилоксифенил)-2-пропилпропионовой кислоты (3,90 г), которая является продуктом ссылочного примера 23(b), в N,N-диметилформамиде
(40 мл) добавляли 1,8-диазабицикло[5,4,0]ундец-7-ен (2,34 мл) и этилйодид (1,57 мл). Реакционную смесь перемешивали при 60oC в течение 4 часов. Реакционную смесь распределяли между
этилацетатом и водой и слои разделяли. Этилацетатный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с
силикагелем, используя в качестве элюента гексан/этилацетат = 5/1-4/1, с получением желаемого соединения (4,00 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm
0,89 (3H, т, J=7,0 Гц), 1,14 (3H, т, J=7,0 Гц), 1,20-1,70 (4H, м), 2,56-2,62 (1H, м), 2,68 (1H, дд, J=6,0, 13,0 Гц), 2,86 (1H, дд, J=8,0, 13,0 Гц), 4,05 (2H, кв,
J=7,0 Гц), 5,03 (2H, с), 6,88 (2H, д,
J=8,5 Гц), 7,07 (2H, д, J=8,5 Гц), 7,28-7,47 (5H, м).
(d) Этил 3-(4-гидроксифенил)-2-пропилпропионат
Реакцию проводили тем же способом, который описан в ссылочном примере
1(d), используя этил 3-(4-бензилоксифенил)-2-пропилпропионат (4,00 г) и палладий на углероде (5%, 0,40 г), и реакционную смесь обрабатывали с получением желаемого соединения (3,10 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,89 (3H, т, J=7,0 Гц), 1,15 (3H, т, J=7,0 Гц), 1,21-1,70 (4H, м), 2,53-2,72 (2H, м), 2,84 (1H, дд, J=8,5, 13,0 Гц), 4,05 (2H, кв, J=7,0
Гц),
4,75-4,82 (1H, м), 6,72 (2H, д, J=8,5 Гц), 7,02 (2H, д, J=8,5 Гц).
(e) Этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]-2-пропилпропионат
Реакцию проводили тем же
способом, который описан в примере 122, используя этил 3-(4-гидроксифенил)- 2-пропилпропионат (1,65 г), который является продуктом ссылочного примера 23(d), трет-бутил 2-гидроксиэтилкарбамат (5,63 г),
трифенилфосфин (9,16 г) и диэтилазодикарбоксилат (6,14 мл), и реакционную смесь обрабатывали с получением желаемого соединения (2,22 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,88 (3H, т, J=7,0 Гц), 1,16 (3H, т, J=7,0 Гц), 1,20-1,70 (4H, м), 1,45 (9H, с), 2,55-2,71 (2H, м), 2,86 (1H, дд, J=8,0, 13,0 Гц), 3,51 (2H, кв, J=5,0 Гц), 3,90-4,15 (4H, м), 4,
93-5,03 (1H, м), 6,79 (2H, д, J=8,5 Гц), 7,07 (2H, д, J=8,5 Гц).
(Ссылочный пример 24)
3-[4-[2-(4'-Метоксиметокси-3',5' -диметилбифенил-4-карбониламино)этокси]
фенил]-2- феноксипропионовая кислота
(а) Этил 3-[4-[2-(4'-метоксиметокси-3', 5'-диметилбифенил-4-карбониламино) этокси]фенил]-2-феноксипропионат
Реакцию проводили тем же способом,
который описан в примере 5, используя этил 3-[4-(2-аминоэтокси)фенил]-2-феноксипропионат (2,07 г), который является продуктом ссылочного примера 4, 4'-метоксиметокси-3',5'-диметилбифенил-4-карбоновую
кислоту (1,50 г), которая является продуктом ссылочного примера 17(b), и карбонилдиимидазол (1,10 г), и реакционную смесь обрабатывали с получением желаемого соединения (720 мг) в виде бесцветного
масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (3H, т, J=7,0 Гц), 2,36 (6H, с), 3,18 (1H, д, J=5,5 Гц), 3,19 (1H, д, J=7,5 Гц), 3,64 (3H, с), 3,88 (2H, кв, J=5,0 Гц), 4,15
(2H,
т, J=5,0 Гц), 4,18 (2H, кв, J=7,0 Гц), 4,74 (1H, дд, J=5,5, 7,5 Гц), 5,00 (2H, с), 6,61 (1H, ушир.т), 6,83 (2H, д, J=8,5 Гц), 6,87 (2H, д, J=8,5 Гц), 6,94 (1H, т, J=7,5 Гц), 7,20-7,30 (6H, м), 7,
60
(2H, д, J=8,5 Гц), 7,82 (2H, д, J=8,5 Гц).
(b) 3-[4-[2-(4'-Метоксиметокси-3', 5' -диметилбифенил-4-карбониламино)этокси]-фенил]-2- феноксипропионовая кислота
Реакцию
проводили тем же способом, который описан в примере 2, используя этил 3-[4-[2-(4'-метоксиметокси-3', 5'-диметилбифенил-4-карбониламино)-этокси]фенил]-2-фенокси-пропионат (720 мг), который является
продуктом ссылочного примера 24 (а) и водный гидроксид натрия (1 н., 2,40 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (520 мг) в виде белого порошка. Т.пл.
142-143oC.1H-ЯМР (270 МГц, дейтерированный метанол): δ ppm 2,35 (6H, с), 3,14 (1H, д, J=7,5 Гц), 3,16 (1H, д, J= 4,5 Гц), 3,60 (3H, с), 3,77 (2H, кв, J=5,5 Гц), 4,16 (2H,
т, J=5,5 Гц), 4,86 (1H, дд, J=4,5, 7,5 Гц), 5,00 (2H, с), 6,83 (2H, д, J=7,5 Гц), 6,86-6,93 (1H, м), 6,90 (2H, д, J=8,5 Гц), 7,19 (2H, д, J=7,5 Гц), 7,24 (2H, д, J= 8,5 Гц), 7,33 (2H, с), 7,65 (2H,
J=8,5 Гц), 7,86 (2H, д, J=8,5 Гц), 8,68 (1H, ушир.т).
(Ссылочный пример 25)
Этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-(4-изопропилфенокси)пропионат
К
раствору этил 3-(4-гидроксифенил)-2-(4- изопропилфенокси)пропионата (18,2 г), который является продуктом ссылочного примера 5(d), в смеси N,N-диметилформамида (200 мл) и толуола (100 мл) добавляли
карбонат калия (23,5 г) при комнатной температуре. К этой суспензии добавляли по каплям раствор трет-бутил 2-метансульфонилоксиэтилкарбамата (12,2 г) в толуоле (40 мл) при 70oC и смесь
перемешивали при той же температуре в течение 2 часов. Далее в реакционную смесь добавляли раствор трет-бутил 2-метансульфонилоксиэтилкарбамата (12,2 г) в смеси N,N- диметилформамида (10 мл) и
толуола
(40 мл) и смесь перемешивали при 70oC в течение ночи. Реакционную смесь распределяли между этилацетатом и водой. Этилацетатный слой промывали насыщенным водным раствором хлорида
натрия,
сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента
толуол/этилацетат = 20/1
- гексан/этилацетат = 3/1, с получением желаемого соединения (18,7 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,19 (6H, д, J=7,0
Гц), 1,45 (9H, с), 2,82
(1H, септет, J-7,0 Гц), 3,16 (1H, д, J=5,0 Гц), 3,18 (1H, д, J=7,5 Гц), 3,52 (2H, кв, J=5,0 Гц), 3,99 (2H, т, J=5,0 Гц), 4,18 (2H, кв, J= 7,0 Гц), 4,69 (1H, дд, J=5,0, 7,5 Гц),
4,97 (1H, ушир.т), 6,76
(2H, д, J= 8,5 Гц), 6,81 (2H, д, J=8,5 Гц), 7,08 (2H, д, J=8,5 Гц), 7,21 (2H, д, J=8,5 Гц).
(Ссылочный пример 26)
6-(4-Метоксифенил) никотиновая
кислота
Реакцию
проводили тем же способом, который описан в примере 2, используя метил 6-(4-метоксифенил)никотинат (3,95 г) и водный раствор гидроксида натрия (1 н., 32,5 мл), и реакционную
смесь обрабатывали с
получением соединения, указанного в заголовке, (2,63 г) в виде бесцветных кристаллов. Т. пл. 252 - 253oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,
84 (3H, с), 7,08 (2H,
д, J= 9,0 Гц), 8,04 (1H, д, J-8,5 Гц), 8,14 (2H, д, J=9,0 Гц), 8,27 (1H, дд, J= 2,5, 8,5 Гц), 9,09 (1H, д, J=2,5 Гц).
(Ссылочный пример 27)
6-(4-Фторфенил) никотиновая
кислота
Реакцию проводили тем же способом, который описан в примере 2, используя метил 6-(4-фторфенил)никотинат (390 мг) и водный раствор гидроксида натрия (1 н. ,
5,00 мл), и реакционную
смесь обрабатывали с получением соединения, указанного в заголовке, (345 мг) в виде бледно-желтого твердого продукта.1H-ЯМР (270 МГц, CDCl3): δ
ppm 7,35 (2H, т, J=8,5 Гц),
8,11 (1H, д, J=8,5 Гц), 8,15-8,29 (2H, м), 8,32 (1H, дд, J=2,0, 8,5 Гц), 9,13 (1H, д, J=2,0 Гц).
(Ссылочный пример 28)
6-(2,2,3,
3-тетрафторпропокси)никотиновая кислота
Реакцию проводили тем же способом, который описан в ссылочном примере 1(с), используя 2,2,3,3-тетрафторпропанол (5,23 мл), гидрид натрия (55% суспензия
в масле, 1,91 г) и метил 6-хлорникотинат
(5,00 г), и обрабатывали с получением сырого метил 6-(2,2,3,3-тетрафторпропокси) никотината (5,42 г) в виде бесцветного масла. Реакцию проводили тем же
способом, который описан в примере 2, используя
сырой продукт, описанный выше (2,70 г), и водный раствор гидроксида натрия (2н., 15 мл), и реакционную смесь обрабатывали с получением сырого
соединения, указанного в заголовке, (1,60 г). Этот продукт
использовали в примере 102 и примере 150 без дополнительной очистки.
(Ссылочный пример 29)
2-Триметилсилилэтил
(S)-2-(4-изопропилфенокси)-3-[4-[2-(4-пиридин-2-ил-бензоиламино)этокси]фенил]пропионат
(а) (S)-4-бензил-3-[(4-изопропилфенокси)ацетил] оксазолидин-2-он
К раствору
4-изопропилфеноксиуксусной кислоты (15,0 г) в дихлорметане (75 мл) добавляли оксалилхлорид (16,8 мл) и N,N-диметилформамид (три капли) при комнатной температуре. Реакционную смесь перемешивали в
течение 1,5 часов. Реакционную смесь концентрировали при пониженном давлении и остатки реагентов азеотропно упаривали толуолом. Остаток сушили при пониженном давлении.
К раствору (S)-4-бензилоксазолидин-2-она (12,4 г) в тетрагидрофуране (150 мл) по каплям добавляли раствор н-бутил лития в гексане (1,61 н., 48,0 мл) при -78oC, и смесь перемешивали при той же температуре в течение 30 минут. К этому раствору добавляли раствор 4-изопропилфеноксиацетил-хлорида, который был получен выше, в тетрагидрофуране (100 мл) при -78oC. Смесь перемешивали при 0oC в течение 1 часа. Реакционную смесь распределяли между этилацетатом и водой. Этилацетатный слой промывали водным раствором соляной кислоты (1 н.), насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Этилацетатный раствор сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток кристаллизовали из смеси гексана/этилацетата = 6/1 с получением желаемого соединения (20,9 г) в виде бесцветных кристаллов. Т.пл. 104,5-105oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,23 (6H, д, J=7,0 Гц), 2,79-2,92 (2H, м), 3,36 (1H, дд, J= 3,0, 13,5 Гц), 4,24-4,37 (2H, м), 4,68-4,78 (1H, м), 5,22 (2H, с), 6,91 (2H, д, J=8,5 Гц), 7,13-7,38 (7H, м).
(b)
(S)-4-бензил-3-[(2S, 3R)-3-(4-бензилоксифенил)- 3-гидрокси-2-(4-изопропилфенокси)пропионил]оксазолидин-2-он
К раствору (S)-4-бензил-3-[(4-изопропил-фенокси)ацетил]оксазолидин-2-она (20,0 г)
в
дихлорметане (150 мл) добавляли раствор дибутилбортрифлата в дихлорметане (1 М, 67,9 мл) и триэтиламин (10,2 мл) при 0oC. Смесь перемешивали при той же температуре в течение 1 часа. В
реакционную смесь по каплям добавляли раствор 4-бензилоксибензальдегида (13,2 г) в дихлорметане (20 мл) при -78oC и затем перемешивали при той же температуре в течение 40 минут.
Реакционную
смесь в дальнейшем перемешивали при 0oC в течение 1 часа. По завершении этого времени в реакционную смесь добавляли смесь насыщенного водного раствора хлорида натрия/метанола =
1/1 (50 мл)
и водный раствор перекиси водорода (31%)/метанола = 2/1 (150 мл) и перемешивали в течение 1 часа. Смесь концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и
водой и слои
разделяли. Этилацетатный слой промывали водным раствором соляной кислоты (1 н.), насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия и сушили
над безводным
сульфатом магния, и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента гексан/этилацетат = 3/1-1/1,
с получением
желаемого соединения (25,7 г) в виде пенистой массы.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (6H, д, J=7,0 Гц), 2,73 (1H, дд, J=9,5, 13,5 Гц), 2,85 (1H, септет,
J=7,0 Гц), 3,
07 (1H, дд, J=3,0, 13,5 Гц), 3,58 (1H, т, J=8,5 Гц), 3,97 (1H, д, J=9,0 Гц), 4,23-4,29 (1H, м), 5,04 (2H, с), 5,09 (1H, д, J=5,5 Гц), 6,18 (1H, д, J=5,5 Гц), 6,91 (2H, д, J=8,5 Гц), 6,94
(2H, д, J=8,5
Гц), 7,05-7,10 (2H, м), 7,14 (2H, д, J=8,5 Гц), 7,23-7,44 (10H, м).
(с) (S)-4-бензил-3-[(2S,
3R)-3-гидрокси-3-(4- гидроксифенил)-2-(4-изопропилфенокси)пропионил]оксазолидин-2-он
Реакцию проводили тем же способом, который описан в ссылочном примере 1(d), используя (3)-4-бензил-3-[(2S,
3R)-3-(4-бензилоксифенил)-3-гидрокси-2-(4-изопропилфенокси) -пропионил] оксазолидин-2-он
(25,0 г), который является продуктом ссылочного примера 29(b), и палладий на углероде (5%, 2,50 г), и
реакционную смесь обрабатывали с получением желаемого соединения (19,1 г) в виде пенистой массы.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,21 (6H, д, J=7,0 Гц), 2,76 (1H, дд, J=9,
0, 13,5 Гц), 2,85 (1H, септет, J=7,0 Гц), 3,07 (1H, дд, J= 3,0, 13,5 Гц), 3,17 (1H, д, J=4,5 Гц),
3,73 (1H, т, J=8,5 Гц), 4,04 (1H, д, J=8,5 Гц), 4,25-4,35 (1H, м), 5,07 (1H, т, J=5,0 Гц), 5,52 (1H,
с), 6,18 (1H, д, J= 5,5 Гц), 6,78 (2H, д, J=8,5 Гц), 6,92 (2H, д, J=8,5 Гц), 7,02-7,12 (2H, м), 7,
14 (2H, д, J=8,5 Гц), 7,22-7,29 (3H, м), 7,32 (2H, д, J=8,5 Гц).
(d)
(S)-4-бензил-3-[(S)-3-(4-гидроксифенил)-2-(4- изопропил-фенокси)пропионил]-оксазолидин-2-он
К раствору
(S)-4-бензил-3-[(2S,
3R)-3-гидрокси-3-(4-гидроксифенил)-2-(4-изопропилфенокси)пропионил] оксазолидин-2-она (18,0 г), который является продуктом ссылочного примера 29(с), в трифторуксусной кислоте (150
мл), добавляли
триэтилсилан (30,2 мл) при комнатной температуре. Смесь перемешивали в течение 18 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток распределяли между
этилацетатом и водой и
слои разделяли. Этилацетатный слой промывали насыщенным водным раствором гидрокарбоната натрия, водным раствором соляной кислоты (1 н.) и насыщенным водным раствором хлорида
натрия, сушили над
безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента
гексан/этилацетат = 3/1, с
получением желаемого соединения (10,7 г) в виде бесцветных кристаллов. Т.пл. 142 - 143oC.1H-ЯМР (400 МГц, CDCl3): δ ppm 1,19 (6H, д,
J=7,0 Гц), 2,75-2,88 (2H,
м), 3,10-3,21 (3H, м), 4,03 (1H, т, J=8,0 Гц), 4,17 (1H, д, J=9,0 Гц), 4,48-4,55 (1H, м), 4,89 (1H, с), 6,08 (1H, дд, J=5,5, 8,0 Гц), 6,74 (2H, д, J=8,5 Гц), 6,83 (2H, д, J=8,
5 Гц), 7,05-7,16 (4H, м),
7,21-7,36 (5H, м).
(e) 2-Триметилсилилэтил (S)-3-(4-гидроксифенил)-2-(4-изопропилфенокси)пропионат
К суспензии
(S)-4-бензил-3-[(3)-3-(4-гидроксифенил)-2-(4-изопропилфенокси)пропионил] оксазолидин-2-она (10,6 г), который является продуктом ссылочного примера 29(d), в смеси метанола (140 мл) и тетрагидрофурана
(15 мл) по каплям добавляли смесь водного раствора гидроксида лития (1 н., 57,0 мл) и водного раствора перекиси водорода (31%, 6,34 мл). Затем смесь перемешивали при комнатной температуре в течение 6
часов, в реакционную смесь добавляли раствор дитионата натрия (10,1 г) в воде (50 мл) и смесь перемешивали в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении. К остатку
добавляли водный раствор гидроксида натрия (1 н.) для того, чтобы сделать его основным. Раствор промывали дихлорметаном и распределяли между водным раствором соляной кислоты и этилацетатом.
Этилацетатный слой отделяли, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток кристаллизовали из гексана с получением
(S)-3-(4-гидроксифенил)-2-(4-изопропилфенокси)пропионовая кислота (6,00 г) в виде белого порошка. К суспензии этой карбоновой кислоты (4,43 г) в дихлорметане (100 мл) добавляли оксалилхлорид (5,50
мл)
и N,N-диметилформамид (5 капель) при комнатной температуре. Смесь перемешивали в течение 1 часа. По завершении этого времени реакционную смесь концентрировали при пониженном давлении. Остаток
азеотропно отгоняли, используя толуол, для удаления избытка реагента. К раствору остатка в дихлорметане (50 мл) добавляли 2-триметил-силилэтанол (9,06 мл). Эту смесь перемешивали при комнатной
температуре в течение 15 часов. В смесь добавляли триэтиламин (4,40 мл) и 4-N,N-диметиламинопиридин (155 мг). Эту смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь
концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и водой и слои разделяли. Этилацетатный слой промывали насыщенным водным раствором хлорида натрия, сушили над
безводным
сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента гексан/этилацетат = 5/1-4/1, с
получением
желаемого соединения (5,30 г) в виде бледно-желтого масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,00 (9H, с), 0,92 (2H, т, J=8,5 Гц), 1,18 (6H, д, J=7,0 Гц), 2,81
(1H, септет,
J=7,0 Гц), 3,10-3,17 (2H, м), 4,19 (2H, т, J=8,5 Гц), 4,66 (1H, дд, J= 6,0, 7,0 Гц), 6,73 (2H, д, J=8,5 Гц), 6,74 (2H, д, J=8,5 Гц), 7,07 (2H, д, J=8,5 Гц), 7,15 (2H, д, J=8,5 Гц).
(f) 2-Триметилсилилэтил (3)-3-[4-(2-трет-бутоксикарбонил-аминоэтокси)фенил]-2-(4-изопропилфенокси) пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере
25,
используя 2-триметилсилилэтил (S)-3-(4- гидроксифенил)-2-(4-изопропил-фенокси)пропионат (4,80 г), который является продуктом ссылочного примера 29(e), трет-бутил 2-метансульфонилоксиэтилкарбамат
(7,17
г) и карбонат калия (8,28 г), и реакционную смесь обрабатывали с получением желаемого соединения (5,94 г) в виде бесцветного масла.
[α] -6,0o (с = 0,9, хлороформ).1H-ЯМР (400 МГц, CDCl3): δ ppm 0,00 (9H, с), 0,91 (2H, т, J=8,5 Гц), 1,17 (6H, д, J=7,0 Гц), 1,45 (9H, с), 2,81 (1H, септет, J=7,0 Гц), 3,08-3,18 (2H, м), 3,45-3,54 (2H, м), 3,93-4,00 (2H, м), 4,10-4,25 (2H, м), 4,65 (1H, дд, J=5,5, 7,5 Гц), 4,93-5,00 (1H, м), 6,74 (2H, д, J=8,5 Гц), 6,80 (2H, д, J=8,5 Гц), 7,06 (2H, д, J=8,5 Гц), 7,20 (2H, д, J=8,5 Гц).
(g) 2-Триметилсилилэтил
(S)-2-(4-изопропилфенокси)-3-[4- [2-(4-пиридин-2-ил-бензоиламино)этокси]фенил]пропионат
Реакцию проводили тем же способом, который описан в примере 73, используя 2-триметилсилилэтил
(S)-3-[4-(2-трет-бутоксикарбониламиноэтокси) фенил] -2-(4-изопропилфенокси)-пропионат (0,95 г), 4-пиридин-2-илбензойную кислоту (382 мг), диэтилцианофосфонат (0,29 мл) и триэтиламин (0,53 мл), и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (0,62 г) в виде бесцветного масла.
[α]
(Ссылочный пример 30)
2-Триметилсилилэтил
(R)-2-(4-изопропилфенокси)-3-[4-[2-(4-пиридин-2-ил-бензоиламино) этокси]фенил]пропионат
(a) (R)-4-бензил-3-[(4-изопропилфенокси)ацетил]оксазолидин-2-он
Реакцию проводили тем же
способом, который описан в ссылочном примере 29(а), используя 4-изопропилфеноксиуксусную кислоту (14,1 г), оксалилхлорид (15,8 мл), (R)-4-бензилоксазолидин-2-он (11,7 г) и раствор н-бутиллития в
гексане (1,61 н. , 45,0 мл), и реакционную смесь обрабатывали с получением желаемого соединения (18,6 г) в виде бесцветных кристаллов. Т.пл. 104,5-105,5oC.1H-ЯМР (400 МГц,
CDCl3): δ ppm 1,23 (6H, д, J=7,0 Гц), 2,80-2,91 (2H, м), 3,36 (1H, дд, J=3,0, 13,5 Гц), 4,28 (1H, дд, J=3,0, 9,0 Гц), 4,33 (1H, дд, J= 8,0, 9,0 Гц), 4,68-4,78 (1H, м), 5,22 (2H, с),
6,91 (2H, д, J= 8,5 Гц), 7,14-7,38 (7H, м).
(b) (R)-4-бензил-3-[(2R, 3R)-3-(4-бензилоксифенил)- 3-гидрокси-2-(4-изопропилфенокси)пропионил]оксазолидин-2-он
Реакцию проводили
тем же способом, который описан в ссылочном примере 29(b), используя (R)-4-бензил-3-[(4-изопропилфенокси)ацетил]оксазолидин-2-он (10,0 г), который является продуктом ссылочного примера 30(а), раствор
дибутилбортрифлата в дихлорметане (1М, 34,0 мл), триэтиламин (5,11 мл) и 4-бензилоксибензальдегид (6,60 г), и реакционную смесь обрабатывали с получением желаемого соединения (12,1 г) в виде пенистой
массы.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,21 (6H, д, J=7,0 Гц), 2,73 (1H, дд, J=9,0, 13,5 Гц), 2,85 (1H, септет, J=7,0 Гц), 3,02-3,12 (1H, м), 3,53-3,63 (1H, м), 3,93-4,01
(1H, м), 4,21-4,32 (1H, м), 5,02-5,12 (3H, м), 6,18 (1H, д, J=6,0 Гц), 6,88-7,46 (18H, м).
(с) (R)-4-бензил-3-[(2R,
3S)-3-гидрокси-3-(4- гидроксифенил)-2-(4-изопропилфенокси)пропионил]оксазолидин-2-он
Реакцию проводили тем же способом, который описан в ссылочном примере 1(d), используя (R)-4-бензил-3-[(2R,
3S)-3-(4-бензилоксифенил)-3-гидрокси-2-(4-изопропилфенокси)- пропионил] оксазолидин-2-он (9,00 г), который является продуктом
ссылочного примера 30(b) и палладий на углероде (5%, 1,80 г), и
реакционную смесь обрабатывали с получением желаемого соединения (7,48 г) в виде пенистой массы.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,21 (6H, д, J=7,0 Гц), 2,75 (1H, дд, J= 9,
0, 13,5 Гц), 2,85 (1H, септет, J=7,0 Гц), 3,05-3,14 (2H, м), 3,70-3,79 (1H, м), 4,01-4,09 (1H, м), 4,26-4,35 (1H, м), 5,04-5,12 (1H, м), 5,34 (1H, ушир.с), 6,18 (1H, д, J=6,0 Гц), 6,80 (2H, д, J=8,5
Гц), 6,92 (2H, д, J=8,5 Гц), 7,04-7,37 (9H, м).
(d) (R)-4-бензил-3-[(R)-3-(4-гидроксифенил)-2-(4- изопропил-фенокси)пропионил]-оксазолидин-2-он
Реакцию проводили тем же
способом, который описан в ссылочном примере 29(d), используя (R)-4-бензил-3-[(2R,3S)-3-гидрокси-3-(4-гидроксифенил)-2-(4-изопропилфенокси)-пропионил] оксазолидин-2-он (7,00 г), который является
продуктом ссылочного примера 30(с), и триэтилсилан (18,8 мл), и реакционную смесь обрабатывали с получением желаемого соединения (4,89 г) в виде бесцветных кристаллов. Т.пл. 147-148oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,19 (6H, д, J=7,0 Гц), 2,71-2,88 (2H, м), 3,09-3,22 (3H, м), 3,97-4,07 (1H, м), 4,15 (1H, дд, J= 2,5, 7,0 Гц), 4,47-4,57 (1H, м), 4,88 (1H,
с),
6,08 (1H, д, J= 5,5, 8,0 Гц), 6,75 (2H, д, J=8,5 Гц), 6,83 (2H, д, J=8,5 Гц), 7,05-7,30 (9H, м).
(e) 2-Триметилсилилэтил
(R)-3-(4-гидроксифенил)-2-(4-изопропилфенокси)пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 29(e), используя
(R)-4-бензил-3-[(R)-3-(4-гидроксифенил)-2-(4-изопропил-фенокси)пропионил] оксазолидин-2-он (3,78 г),
который является продуктом ссылочного примера 30(d), водный раствор гидроксида лития (1 н., 20,6
мл) и водный раствор перекиси водорода (31%, 2,26 мл), и реакционную смесь обрабатывали с получением
(R)-3-(4-гидроксифенил)-2-(4- изопропилфенокси)пропионовой кислоты (2,18 г) в виде белого порошка.
Эта кислота (1,95 г) реагировала с оксалилхлоридом (2,73 мл) и 2-триметилсилилэтанолом (4,66 мл), и
реакционную смесь обрабатывали тем же способом, который описан в ссылочном примере 29(e), с
получением желаемого соединения (2,26 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,00 (9H, с), 0,92 (2H, т, J=8,5 Гц), 1,18 (6H, д, J= 7,0 Гц), 2,81 (1H,
септет, J=7,0 Гц), 3,07-3,18 (2H, м), 4,11-4,25 (2H, м), 4,70 (1H, дд, J=5,5, 7,0 Гц), 5,75 (1H, с), 6,
72 (2H, д, J= 8,5 Гц), 6,75 (2H, д, J=8,5 Гц), 7,07 (2H, д, J=8,5 Гц), 7,12 (2H, д, J= 8,5
Гц).
(f) 2-Триметилсилилэтил (R)-3-[4-(2-трет-бутоксикарбониламиноэтокси)
фенил]-2-(4-изопропилфенокси)пропионат
Реакцию проводили тем же способом, который описан в
ссылочном примере 25, используя 2-триметилсилилэтил (R)-3-(4- гидроксифенил)-2-(4-изопропил-фенокси)
пропионат (221 мг), который является продуктом ссылочного примера 30(e), трет-бутил
2-метансульфонилоксиэтилкарбамат (330 мг) и карбонат калия (381 мг), и реакционную смесь обрабатывали с получением
желаемого соединения (264 мг) в виде бесцветного масла.
[α
]
(g) 2-Триметилсилилэтил
(R)-2-(4-изопропилфенокси)-3-[4-[2-(4-пиридин-2-ил-бензоиламино)этокси]фенил]пропионат
Реакцию проводили тем же способом,
который описан в примере 73, используя 2-триметилсилилэтил
(R)-3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2- (4-изопропилфенокси)-пропионат (356 мг), 4-пиридин-2-илбензойную кислоту (143 мг),
диэтилцианофосфонат (0,11 мл) и триэтиламин (0,10 мл), и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (307 мг) в виде бесцветного масла.
[α
]
(Ссылочный пример 31)
3-Трифторметилпиридин-6-илбензойная кислота
(а) Метил 3-трифторметилпиридин-6-илбензоат
К суспензии бисбензонитрилдихлорпалладия (119 мг) и
1,4-бисдифенилфосфинобутана (131 мг) в
толуоле (10 мл) добавляли 4-метоксикарбонилфенилборную кислоту (541 мг) и 2-хлор-5-трифторпиридин (718 мг) при комнатной температуре, и в смесь добавляли этанол
(5 мл) и насыщенный водный раствор
гидрокарбоната натрия (5 мл). Эту смесь кипятили с обратным холодильником в течение 5 часов при 100oC. Реакционную смесь распределяли между этилацетатом и
водой. Этилацетатный слой
отделяли и промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К остатку добавляли
диизопропиловый эфир с получением
желаемого соединения (841 мг) в виде белого порошка, который содержал некоторые примеси.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,96 (3H, с), 7,
91 (1H, д, J= 8,5 Гц), 8,04 (1H, д,
J= 8,5 Гц), 8,12 (2H, д, J= 8,5 Гц), 8,18 (2H, д, J=8,5 Гц), 8,98 (1H, с).
(b) 3-Трифторметилпиридин-6-илбензойная кислота
Реакцию
проводили тем же способом, который описан
в примере 2, используя метил 3-трифторметилпиридин-6-илбензоат (791 мг) и водный раствор гидроксида натрия (1 н., 5,60 мл), и реакционную смесь обрабатывали с
получением соединения, указанного в
заголовке, (546 мг), которое содержит некоторые примеси, и использовали в примере 106 без дополнительной очистки.1H-ЯМР (270 МГц, дейтерированный
диметилсульфоксид): δ ppm 8,05 (1H,
д, J= 8,5 Гц), 8,10 (2H, д, J=8,5 Гц), 8,29 (2H, д, J= 8,5 Гц), 8,35 (1H, д, J=8,5 Гц), 9,10 (1H, с).
(Ссылочный пример 32)
3-Нитропиридин-6-илбензойная кислота
(а) Метил 3-нитропиридин-6-илбензоат
Реакцию проводили тем же способом, который описан в ссылочном примере 14(а), используя
4-метоксикарбонилфенил борную кислоту (3,24 г),
2-бром-5-нитропиридин (4,75 г) и тетракис(трифенилфосфин) палладий (1,04 г) и обрабатывали с получением желаемого соединения (3,67 г) в виде бесцветных
кристаллов. Т. пл. 197-199oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,97 (3H, с), 7,98 (1H, д, J=8,5 Гц), 8,19 (4H, с), 8,58 (1H, дд, J=2,5, 8,5 Гц), 9,53 (1H, д, J=2,
5 Гц).
(b)
3-Нитропиридин-6-илбензойная кислота
Реакцию проводили тем же способом, который описан в примере 2, используя метил 3-нитропиридин-6-илбензоат (545 мг), который
является продуктом ссылочного
примера 32(а), и водный раствор гидроксида натрия (1 н., 3,16 мл) при 90oC, и реакционную смесь обрабатывали с получением соединения, указанного в заголовке,
(370 мг) в виде бесцветных
кристаллов. Т.пл. 262-264oC.1H-ЯМР (270 МГц, дейтерированный диметилсульфоксид): δ ppm 8,11 (2H, д, J= 8,0 Гц), 8,33 (2H, д, J=8,0 Гц), 8,36
(1H, д, J=8,0 Гц), 8,71 (1H,
дд, J= 2,0, 8,0 Гц), 9,48 (1H, д, J=2,0 Гц).
(Ссылочный пример 33)
3-Метоксипиридин-6-илбензойная кислота
(а) Метил
3-аминопиридин-2-илбензоат
Реакцию
проводили тем же способом, который описан в ссылочном примере 1(d), используя метил 3-нитропиридин-6-илбензоат (1,13 г), который является продуктом
ссылочного примера 32(а), и палладий на углероде
(221 мг), и обрабатывали с получением желаемого соединения (738 мг) в виде бесцветных кристаллов. Т.пл. 188-189oC.1H-ЯМР (270
МГц, CDCl3): δ ppm 3,83 (2H,
ушир. с), 3,93 (3H, с), 7,06 (1H, дд, J=3,0, 8,5 Гц), 7,61 (1H, д, J= 8,5 Гц), 7,98 (2H, д, J=8,5 Гц), 8,09 (2H, д, J=8,5 Гц), 8,20 (1H, д, J=3,0 Гц).
(b) Метил
3-метоксипиридин-6-илбензоат
К суспензии метил 3-аминопиридин-6-илбензоата (425 мг) и бромида натрия (383 мг) в воде при 0oC (10 мл) добавляли
концентрированную серную кислоту (0,
14 мл) и затем в смесь по каплям добавляли раствор нитрита натрия (295 мг) в воде (1,5 мл) при 80oC. Смесь перемешивали при той же температуре в течение
15 минут. По завершении этого
времени в реакционную смесь добавляли раствор амидосерной кислоты и концентрированной серной кислоты (0,21 мл) в воде (1,60 мл) и эту смесь перемешивали при 80o
C в течение 1,5 часов и при
комнатной температуре в течение 1 часа и затем оставляли стоять в течение 14 часов. pH реакционной смеси доводили до pH 8 водным раствором гидроксида натрия (1 н. ). После
добавления в раствор
уксусного ангидрида (2,00 мл) смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь распределяли между этилацетатом и водой и этилацетатный слой
отделяли, промывали
насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Этилацетатный слой отгоняли при пониженном давлении с получением смеси (457 мг) метил
5-ацетоксипиридин-2-илбензоата и метил 5-гидроксипиридин-2-илбензоата. Реакцию проводили тем же способом, который описан в примере 2, используя смесь, полученную выше, и водный раствор гидроксида
натрия (1 н., 2,10 мл), и реакционную смесь обрабатывали с получением 5-гидроксипиридин-2-илбензойной кислоты в виде белого порошка. Реакцию проводили тем же способом, который описан в ссылочном
примере 1(с), используя 5-гидроксипиридин-2-илбензойную кислоту, полученную выше, гидрид натрия (55% суспензия в масле, 174 мг) и метилйодид (0,35 мл), и реакционную смесь обрабатывали с получением
желаемого соединения (429 мг) в виде бесцветных кристаллов Т. пл. 130-132oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 3,93 (3H, с), 3,94 (3H, с), 7,30 (1H, дд, J=3,0, 9,
0
Гц), 7,74 (1H, д, J= 9,0 Гц), 8,02 (2H, д, J=8,5 Гц), 8,12 (2H, д, J=8,5 Гц), 8,43 (1H, д, J=3,0 Гц).
(с) 3-Метоксипиридин-6-илбензойная кислота
Реакцию проводили тем же
способом, который описан в примере 2, используя метил 3-метоксипиридин-6-илбензоат (249 мг), который является продуктом ссылочного примера 33(b), и водный раствор гидроксида натрия (1 н., 1,20 мл), и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (206 мг) в виде бесцветных кристаллов. Т.пл. 221-223oC.1H-ЯМР (270 МГц, CDCl3
/дейтерированный метанол = 3/1): δ ppm 3,94 (3H, с), 7,35 (1H, дд, J= 3,0, 8,5 Гц), 7,75 (1H, д, J= 8,5 Гц), 7,96 (2H, д, J=8,5 Гц), 8,13 (2H, д, J= 8,5 Гц), 8,38 (1H, д, J=3,0 Гц).
(Ссылочный пример 34)
3-Диметиламинопиридин-6-илбензойная кислота
(а) Метил 3-диметиламинопиридин-6-илбензоат
К суспензии метил 3-нитропиридин-6-илбензоата (519
мг) в смеси метанола (25 мл) и 2-метоксиэтанола (5 мл) добавляли водный раствор формальдегида (35%, 3,20 мл) и палладий на углероде (5%, 640 мг). Смесь перемешивали в атмосфере водорода при 50oC в течение 3 дней. Катализатор удаляли путем фильтрации и фильтрат концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и водой. Этилацетатный слой отделяли,
промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток
кристаллизовали из диизопропилового эфира с получением желаемого продукта (288 мг) в виде бесцветных кристаллов. Т. пл. 161-163oC.1H-ЯМР (270 МГц, CDCl3): δ
ppm 3,05 (6H, с), 3,93 (3H, с), 7,05 (1H, дд, J= 3,0, 8,5 Гц), 7,66 (1H, д, J=8,5 Гц), 8,00 (2H, д, J=8,5 Гц), 8,09 (2H, д, J= 8,5 Гц), 8,24 (1H, д, J=3,0 Гц).
(b)
3-Диметиламинопиридин-6-илбензойная кислота
Реакцию проводили тем же способом, который описан в примере 2, используя метил 3-диметиламинопиридин-6-илбензоат (277 мг), который является
продуктом ссылочного примера 34(а), и водный раствором гидроксида натрия (1 н., 2,20 мл), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (237 мг) в виде бесцветных
кристаллов. Т.пл. 234-236oC.1H-ЯМР (270 МГц, дейтерированный диметилсульфоксид): δ ppm 3,01 (6H, с), 7,18 (1H, дд, J= 3,0, 9,0 Гц), 7,87 (1H, д, J= 9,0 Гц), 7,97 (2H, д,
J= 8,5 Гц), 8,10 (2H, д, J= 8,5 Гц), 8,23 (1H, д, J=3,0 Гц).
(Ссылочный пример 35)
Этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]-2- (4-метилфенокси) пропионат
(а) Этил 3-(4-бензилоксифенил)-2-метансульфонилоксипропионат
К раствору этил 3-(4-бензилоксифенил)лактата (3,32 г), который является продуктом ссылочного примера 1(b), в безводном
дихлорметане (30 мл) добавляли метансульфонил хлорид (0,94 мл). К этой смеси на ледяной бане по каплям добавляли триэтиламин (2,47 мл). Смесь перемешивали при комнатной температуре в течение 3 часов.
Реакционную смесь концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и водой. Этилацетатный слой отделяли, сушили над безводным сульфатом магния и концентрировали при
пониженном давлении. Остаток кристаллизовали из гексана с получением желаемого продукта (3,60 г) в виде бесцветных кристаллов. Т.пл. 81-83oC.1H-ЯМР (270 МГц, CDCl3):
δ ppm 1,27 (3H, т, J=7,0 Гц), 2,80 (3H, с), 3,02-3,29 (2H, м), 4,24 (2H, кв, J=7,0 Гц), 5,05 (2H, с), 5,05-5,14 (1H, м), 6,93 (2H, д, J=8,5 Гц), 7,17 (2H, д, J=8,5 Гц), 7,28-7,45 (5H, м).
(b) Этил 3-(4-бензилоксифенил)-2-(4-метилфенокси)пропионат
К раствору этил 3-(4-бензилоксифенил)-2-метансульфонилоксипропионата (11,1 г), который является продуктом ссылочного
примера 35(а), и п-крезолу (2,85 г) в N,N- диметилформамиде (110 мл) добавляли карбонат калия (8,09 г). Эту смесь перемешивали при 70oC в течение 16 часов. Реакционную смесь распределяли
между этилацетатом и водой и слои разделяли. Этилацетатный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с
силикагелем, используя в качестве элюента гексан/этилацетат = 9/1, с получением желаемого соединения (2,84 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,
23
(3H, т, J=7,0 Гц), 2,30 (3H, с), 3,15-3,28 (2H, м), 4,15-4,25 (2H, м), 4,70-4,79 (1H, м), 5,08 (2H, с), 6,78 (2H, д, J=8,5 Гц), 6,95 (2H, д, J=8,5 Гц), 7,07 (2H, д, J=8,5 Гц), 7,26 (2H, д, J=8,5
Гц),
7,32-7,60 (5H, м).
(с) Этил 3-(4-гидроксифенил)-2-(4-метилфенокси)пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 1(d), используя этил
3-(4-бензилоксифенил)-2-(4- метилфенокси)пропионат (2,84 г), который является продуктом ссылочного примера 35(b), и палладий на углероде (284 мг), и реакционную смесь обрабатывали с получением
желаемого соединения (2,27 г) в виде сиропа. ЯМР (270 МГц, CDCl3): δ ppm 1,19 (3H, т, J= 7,0 Гц), 2,25 (3H, с), 3,09-3,18 (2H, м), 4,16 (2H, кв, J=7,0 Гц), 4,64-4,72 (1H, м), 4,76
(1H, ушир.с), 6,65-6,79 (4H, м), 7,02 (2H, д, J=8,5 Гц), 7,16 (2H, д, J=8,5 Гц).
(d) Этил 3-[4-(2-трет-бутоксикарбониламиноэтокси) фенил]-2-(4-метилфенокси) пропионат
Реакцию
проводили тем же способом, который описан в ссылочном примере 25, используя этил 3-(4-гидроксифенил)-2-(4-метилфенокси) пропионат (300 мг), который является продуктом ссылочного примера 35(с),
трет-бутил 2-метансульфонилоксиэтилкарбамат (598 мг) и карбонат калия (691 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (261 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (3H, т, J=7,0 Гц), 1,45 (9H, с), 2,25 (3H, с), 3,12-3,18 (2H, м), 3,45-3,55 (2H, м), 3,99 (2H, т, J= 5,0 Гц), 4,17 (2H, кв, J=7,0 Гц),
4,69 (1H, дд, J=5,5, 7,5 Гц), 4,96 (1H, ушир.с), 6,72 (2H, д, J=8,5 Гц), 6,82 (2H, д, J=8,5 Гц), 7,02 (2H, д, J=8,5 Гц), 7,21 (2H, д, J=8,5 Гц).
(Ссылочный пример 36)
Этил
3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-(4-трет-бутилфенокси) пропионат
(а) Этил 3-(4-бензилоксифенил)-2-(4-трет-бутилфенокси) пропионат
Реакцию проводили тем же способом,
который описан в примере 122, используя этил 3-(4-бензилоксифенил)лактат (5,00 г), который является продуктом ссылочного примера 1(b), 4-третбутилфенол (2,50 г), трифенилфосфин (5,24 г) и раствор
диэтилазодикарбоксилата в толуоле (40%, 8,80 мл), и реакционную смесь обрабатывали с получением желаемого соединения (3,00 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3):
δ ppm 1,19 (3H, т, J=7,0 Гц), 1,26 (9H, с), 3,12-3,21 (2H, м), 4,17 (2H, кв, J=7,0 Гц), 4,70 (1H, дд, J=5,5, 7,5 Гц), 5,04 (2H, с), 6,76 (2H, д, J=8,5 Гц), 6,90 (2H, д, J=8,5 Гц), 7,20-7,26
(4H,
м), 7,31-7,45 (5H, м).
(b) Этил 2-(4-трет-бутилфенокси)-3-(4-гидроксифенил) пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 1(d),
используя
этил 3-(4-бензилоксифенил)-2-(4- трет-бутилфенокси) пропионат (3,00 г), который является продуктом ссылочного примера 36(а), и палладий на углероде (5%, 300 мг), и реакционную смесь
обрабатывали с
получением желаемого соединения (2,37 г) в виде бесцветного масла. ЯМР (270 МГц, CDCl3): δ ppm 1,20 (3H, т, J=7,0 Гц), 1,26 (9H, с), 3,13-3,20 (2H, м), 4,18 (2H, кв,
J= 7,0 Гц), 4,69
(1H, дд, J=5,5, 7,5 Гц), 4,81 (1H, ушир.с), 6,75 (2H, д, J= 8,5 Гц), 6,76 (2H, д, J=8,5 Гц), 7,17 (2H, д, J=8,5 Гц), 7,24 (2H, д, J=8,5 Гц).
(с) Этил
3-[4-(2-трет-бутоксикарбониламиноэтокси) фенил]-2-(4-трет-бутилфенокси) пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 25, используя этил
2-(4-трет-бутилфенокси)-3-(4-гидроксифенил) пропионат (2,37 г), который является продуктом ссылочного примера 36(b), трет-бутил 2-метансульфонилоксиэтилкарбамат (3,60 г) и карбонат калия (4,78 г), и
реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (3,13 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,21 (3H, т, J=7,0 Гц),
1,
26 (9H, с), 1,45 (9H, с), 3,13-3,19 (2H, м), 3,51 (2H, кв, J= 5,0 Гц), 3,99 (2H, т, J=5,0 Гц), 4,18 (2H, кв, J=7,0 Гц), 4,66-4,72 (1H, м), 4,90-5,02 (1H, м), 6,76 (2H, д, J=8,5 Гц), 6,82 (2H, д,
J=8,5
Гц), 7,22 (2H, д, J=8,5 Гц), 7,24 (2H, д, J=8,5 Гц).
(Ссылочный пример 37)
Этил 3-[4-(2-аминоэтокси)фенил] -2-(4-фторфенокси)пропионат
(а) Этил
3-(4-бензилоксифенил)-2-(4- фторфенокси) пропионат
Реакцию проводили тем же способом, который описан в примере 122, используя этил 3-(4-бензилоксифенил)лактат (10,0 г), который является
продуктом ссылочного примера 1(b), 4-фторфенол (4,15 г), трифенилфосфин (10,6 г) и диэтилазодикарбоксилат (6,40 мл), и реакционную смесь обрабатывали с получением желаемого соединения (7,00 г) в виде
бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,18 (3H, т, J=7,0 Гц), 3,16 (2H, д, J=6,5 Гц), 4,16 (2H, кв, J= 7,0 Гц), 4,66 (1H, т, J=6,5 Гц), 5,04 (2H, с), 6,72-6,
80
(2H, м), 6,89-6,97 (4H, м), 7,21 (2H, д, J=8,5 Гц), 7,31-7,48 (5H, м).
(b) Этил 2-(4-фторфенокси)-3-(4-гидроксифенил)пропионат
Раствор этил
3-(4-бензилоксифенил)-2-(4-фторфенокси)пропионата (7,00 г), который является продуктом ссылочного примера 37(а), в растворе гидробромида в уксусной кислоте (25%, 70 мл) перемешивали при комнатной
температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. К раствору остатка в этаноле (70 мл) добавляли карбонат калия (6,90 г). Эту смесь перемешивали при комнатной
температуре в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и водой и слои разделяли. Этилацетатный слой сушили над безводным
сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента гексан/этилацетат = 9/1-4/1, с получением
желаемого соединения (2,75 г) в виде белого порошка. Т.пл. 80-81oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,19 (3H, т, J=7,0 Гц), 3,15 (2H, д, J-6,5 Гц), 4,17 (2H, кв,
J= 7,0 Гц), 4,65 (1H, т, J=6,5 Гц), 4,76 (1H, с), 6,71-6,80 (4H, м), 6,87-6,95 (2H, м), 7,16 (2H, д, J=8,5 Гц).
(с) Этил 2-(4-фторфенокси)-3-[4-[2-(тетрагидропиран-2-илокси)этокси]
фенил]пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 3(e), используя этил 2-(4-фторфенокси)-3-(4-гидроксифенил) пропионат (2,75 г), который является
продуктом
ссылочного примера 37(b), 2-(2-бромэтокси)тетрагидропиран (2,08 г) и карбонат калия (3,75 г), и реакционную смесь обрабатывали с получением желаемого соединения (3,75 г) в виде бесцветного
масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (3H, т, J=7,0 Гц), 1,48-1,90 (6H, м), 3,16 (2H, д, J=6,5 Гц), 3,49-3,57 (1H, м), 3,77-3,95 (2H, м), 4,00-4,21 (5H, м), 4,60-4,
73 (2H, м), 6,
74- 6,79 (2H, м), 6,84-6,95 (4H, м), 7,20 (2H, д, J=8,5 Гц).
(d) Этил 2-(4-фторфенокси)-3-[4-(2-гидроксиэтокси)- фенил]пропионат
Реакцию проводили тем же
способом, который
описан в ссылочном примере 3(f), используя этил 2-(4-фторфенокси)-3-[4- [2-(тетрагидропиран-2-илокси)этокси] -фенил] пропионат (3,75 г), который является продуктом ссылочного
примера 37(с), и
моногидрат п-толуолсульфоновой кислоты (2,15 г), и реакционную смесь обрабатывали с получением желаемого соединения (2,68 г) в виде бесцветного масла.1H-ЯМР (270 МГц,
CDCl3):
δ ppm 1,25 (3H, т, J=7,0 Гц), 2,06 (1H, т, J=6,5 Гц), 3,20-3,23 (2H, м), 3,98-4,02 (2H, м), 4,10-4,13 (2H, м), 4,22 (2H, кв, J=7,0 Гц), 4,71 (1H, дд, J=6,0, 7,0 Гц), 6,80-7,
00 (6H, м), 7,25-7,
28 (2H, м).
(e) Этил 2-(4-фторфенокси)-3-[4-(2-метансульфонилоксиэтокси)фенил] пропионат
Реакцию проводили тем же способом, который описан в ссылочном
примере 3(g), используя
этил 2-(4-фторфенокси)-3-[4-(2-гидроксиэтокси)фенил]пропионат (2,68 г), который является продуктом ссылочного примера 37(d), триэтиламин (1,61 мл) и метансульфонилхлорид (0,65
мл), и реакционную смесь
обрабатывали с получением желаемого соединения (3,17 г) в виде бледно-желтого масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (3H, т, J=7,0 Гц), 3,08
(3H, с), 3,17 (2H, д, J=6,
5 Гц), 4,18 (2H, кв, J=7,0 Гц), 4,20-4,24 (2H, м), 4,54-4,58 (2H, м), 4,66 (1H, т, J=6,5 Гц), 6,74-6,96 (6H, м), 7,23 (2H, д, J=8,5 Гц).
(f) Этил
3-[4-(2-азидоэтокси)фенил]-2-(4-фторфенокси)- пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 3(h), используя этил
2-(4-фторфенокси)-3-[4-(2-метансульфонилоксиэтокси)фенил] пропионат (3,16 г), который является продуктом ссылочного примера 37(e), и азид натрия (1,45 г), и реакционную смесь обрабатывали с
получением
желаемого соединения (2,67 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (3H, т, J=7,0 Гц), 3,17 (2H, д, J=6,5 Гц), 3,58 (2H, т, J= 5,0 Гц),
4,08-4,23
(4H, м), 4,66 (1H, т, J=6,5 Гц), 6,74-6,96 (6H, м), 7,20-7,25 (2H, м).
(g) Этил 3-[4-(2-аминоэтокси)фенил]-2-(4-фторфенокси)- пропионат
Реакцию проводили тем же
способом,
который описан в ссылочном примере 1(d), используя этил 3-[4-(2-азидоэтокси)фенил]-2-(4-фторфенокси)пропионат (2,60 г), который является продуктом ссылочного примера 37(f), и палладий на
углероде (5%,
250 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (2,30 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm
1,20 (3H, т,
J=7,0 Гц), 2,99-3,15 (2H, м), 3,16 (2H, д, J=6,5 Гц), 3,97 (2H, т, J=5,0 Гц), 4,17 (2H, кв, J=7,0 Гц), 4,66 (1H, т, J=6,5 Гц), 6,72-6,96 (6H, м), 7,1-7,27 (2H, м).
(Ссылочный пример
38)
Этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-(4-хлорфенокси)пропионат
(а) Этил 3-(4-бензилоксифенил)-2-(4-хлорфенокси)пропионат
Реакцию
проводили тем же
способом, который описан в ссылочном примере 35(b), используя этил 3-(4-бензилоксифенил)-2- метансульфонилоксипропионат (8,82 г), который является продуктом ссылочного примера 35(а),
4-хлорфенол (3,00
г) и карбонат калия (6,44 г), и реакционную смесь обрабатывали с получением желаемого соединения (5,99 г) в виде бесцветных кристаллов. Т.пл. 63-64oC.1H-ЯМР
(270 МГц, CDCl3): δ ppm 1,18 (3H, т, J=7,0 Гц), 3,17 (2H, д, J= 6,5 Гц), 4,16 (2H, кв, J=7,0 Гц), 4,69 (1H, т, J=6,5 Гц), 5,04 (2H, с), 6,75 (2H, д, J=9,0 Гц), 6,91 (2H, д, J=8,5
Гц), 7,13-7,23 (4H, м),
7,25-7,55 (5H, м).
(b) Этил 2-(4-хлорфенокси)-3-(4-гидроксифенил)пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере
37(b), используя этил
3-(4-бензилоксифенил)-2-(4-хлорфенокси)пропионат (5,99 г), который является продуктом ссылочного примера 38(а), раствор гидробромида в уксусной кислоте (25%, 60 мл) и карбонат
калия (4,68 г), и
реакционную смесь обрабатывали с получением желаемого соединения (3,85 г) в виде бесцветных кристаллов. Т.пл. 90-93oC.1H-ЯМР (270 МГц, CDCl3):
δ ppm 1,19 (3H,
т, J=7,0 Гц), 3,16 (2H, д, J=6,5 Гц),) 4,17 (2H, кв, J=7,0 Гц), 4,69 (1H, т, J= 6,5 Гц), 4,95 (1H, ушир.с), 6,76 (4H, д, J=8,5 Гц), 7,15 (2H, д, J=8,5 Гц), 7,18 (2H, д, J=8,5
Гц).
(с)
Этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]-2-(4-хлорфенокси) пропионат
Реакцию проводили тем же способом, который описан в примере 122, используя этил
2-(4-хлорфенокси)-3-(4-гидроксифенил) пропионат (1,01 г), который является продуктом ссылочного примера 38(b), трет-бутил 2-гидроксиэтилкарбамат (1,27 г), трифенилфосфин (2,06 г) и
диэтилазодикарбоксилат (1,37 г), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (1,14 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3):
δ ppm 1,20 (3H, т, J=7,0 Гц), 1,45 (9H, с), 3,17 (2H, т, J=6,5 Гц), 3,43-3,57 (2H, м), 3,99 (2H, т, J=5,0 Гц), 4,17 (2H, кв, J=7,0 Гц), 4,69 (1H, т, J=6,5 Гц), 4,96 (1H, ушир.с), 6,76 (2H, д,
J=8,5 Гц), 6,82 (2H, д, J=8,5 Гц), 7,10-7,20 (4H, м).
(Ссылочный пример 39)
Этил 2-гидрокси-3-[4-[2-(4-пиридин-2-илбензоиламино)-этокси]фенил]пропионат
(а) Этил
3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]-2-гидроксипропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 25, используя этил 4-гидроксифенилактат (224 мг),
трет-бутил 2-метансульфонилоксиэтилкарбамат (638 мг) и карбонат калия (737 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (205 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,29 (3H, т, J=7,0 Гц), 1,45 (9H, с), 2,72 (1H, д, J=6,0 Гц), 2,91 (1H, дд, J=6,5, 14,0 Гц), 3,07 (1H, дд, J=4,5, 14,0 Гц), 3,52 (2H, кв,
J=5,0 Гц), 3,99 (2H, т, J=5,0 Гц), 4,22 (2H, кв, J=7,0 Гц), 4,39 (1H, ддд, J=4,5, 6,0, 6,5 Гц), 4,98 (1H, ушир. т), 6,82 (2H, д, J=8,5 Гц), 7,13 (2H, д, J=8,5 Гц).
(b) Этил
2-гидрокси-3-[4-[2-(4-пиридин-2-илбензоиламино)-этокси]фенил] пропионат
Реакцию проводили тем же способом, который описан в примере 126, используя этил
3-[4-(2-трет-бутоксикарбонил-аминоэтокси)фенил]-2- гидроксипропионат (168 мг), 4-пиридин-2-илбензоилхлоридгидрохлорид (126 мг) и триэтиламин (0,28 мл), и реакционную смесь обрабатывали с получением
соединения, указанного в заголовке, (188 мг) в виде бесцветных кристаллов. Т.пл. 97-99oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,29 (3H, т, J=7,0 Гц), 2,92 (1H, д,
J=
6,5, 14,0 Гц), 3,07 (1H, дд, J=4,5, 14,0 Гц), 3,90 (2H, кв, J=5,0 Гц), 4,16 (2H, т, J= 5,0 Гц), 4,22 (2H, кв, J=7,0 Гц), 4,39 (1H, дд, J=4,5, 6,5 Гц), 6,66 (1H, ушир.т), 6,87 (2H, д, J=8,5 Гц), 7,
15
(2H, д, J=8,5 Гц), 7,27-7,32 (1H, м), 7,73-7,84 (2H, м), 7,89 (2H, д, J=8,5 Гц), 8,07 (2H, д, J=8,5 Гц), 8,73 (1H, д, J=5,0 Гц).
(Ссылочный пример 40)
Этил
3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-(4-трифторметоксифенокси)пропионат
(а) Этил 3-(4-бензилоксифенил)-2-(4-трифторметоксифенокси)-пропионат
Реакцию проводили тем же
способом, который описан в примере 122, используя этил 3-(4-бензилоксифенил)лактат (4,50 г), который является продуктом ссылочного примера 1(b), 4-трифторметоксифенол (2,33 мл), трифенилфосфин (4,71
г) и раствор диэтилазодикарбоксилата в толуоле (40%, 8,15 мл), и реакционную смесь обрабатывали с получением желаемого соединения (4,19 г) в виде бесцветных кристаллов. Т.пл. 34-36oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,19 (3H, т, J= 7,0 Гц), 3,18 (2H, д, J=6,5 Гц), 4,18 (2H, кв, J=7,0 Гц), 4,70 (1H, т, J=6,5 Гц), 5,04 (2H, с), 6,82 (2H, д, J=8,5 Гц), 6,91 (2H,
д, J=8,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,21 (2H, д, J=8,5 Гц), 7,29-7,46 (5H, м).
(b) Этил 3-(4-гидроксифенил)-2-(4-трифторметоксифенокси)-пропионат
Реакцию проводили тем же
способом, который описан в ссылочном примере 37(b), используя этил 3-(4-бензилоксифенил)-2-(4-трифторметоксифенокси)пропионат (4,08 г), который является продуктом ссылочного примера 40(а), раствор
гидробромида в уксусной кислоте (25%, 40 мл) и карбонат калия (1,68 г), и реакционную смесь обрабатывали с получением желаемого соединения (2,98 г) в виде бесцветного масла.1H-ЯМР (270
МГц,
CDCl3): δ ppm 1,20 (3H, т, J= 7,0 Гц), 3,17 (2H, д, J=6,5 Гц), 3,50 (1H, ушир.с), 4,18 (2H, кв, J=7,0 Гц), 4,70 (1H, т, J=6,5 Гц), 6,76 (2H, д, J=8,5 Гц), 6,82 (2H, д, J=8,5
Гц), 7,
09 (2H, д, J=8,5 Гц), 7,15 (2H, д, J=8,5 Гц).
(с) Этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]-2-(4-трифторметоксифенокси)пропионат
Реакцию проводили тем же
способом,
который описан в ссылочном примере 25, используя этил 3-(4-гидроксифенил)-2-(4-трифторметоксифенокси)пропионат (2,93 г), трет-бутил 2-метансульфонилоксиэтилкарбамат (4,73 г) и карбонат
калия (5,46 г),
и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (2,28 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20
(3H, т, J=7,0 Гц),
1,44 (9H, с), 3,18 (2H, д, J=6,5 Гц), 3,51 (2H, кв, J=5,0 Гц), 3,99 (2H, т, J=5,0 Гц), 4,19 (2H, кв, J=7,0 Гц), 4,70 (1H, т, J=6,5 Гц), 4,97 (1H, ушир.т), 6,81 (2H, д, J=8,5 Гц), 6,
83 (2H, д, J=8,5
Гц), 7,08 (2H, д, J=8,5 Гц), 7,21 (2H, д, J=8,5 Гц).
(Ссылочный пример 41)
Этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]
-2-(4-цианофенокси)пропионат
(а) Этил
3-(4-бензилоксифенил)-2-(4-цианофенокси)пропионат
Реакцию проводили тем же способом, который описан в примере 122, используя этил
3-(4-бензилоксифенил)лактат (1,01 г), который является
продуктом ссылочного примера 1(b), 4-цианофенол (481 мг), трифенилфосфин (1,06 г) и раствор диэтилазодикарбоксилата в толуоле (40%, 0,73 мл), и
реакционную смесь обрабатывали с получением желаемого
соединения (619 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (3H, т, J=7,0 Гц), 3,21 (2H, д,
J=6,5 Гц), 4,17 (2H, кв, J=7,0 Гц), 4,79 (1H, т, J=6,5
Гц), 5,04 (2H, с), 6,88 (2H, д, J= 8,5 Гц), 6,91 (2H, д, J=8,5 Гц), 7,19 (2H, д, J=8,5 Гц), 7,28-7,48 (5H, м), 7,54 (2H, д, J=8,5 Гц).
(b) Этил
2-(4-цианофенокси)-3-(4-гидроксифенил)пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 1(d), используя этил
3-(4-бензилоксифенил)-2-(4-цианофенокси)пропионат
(376 мг), который является продуктом ссылочного примера 41(а), и палладий на углероде (5%, 65 мг), и реакционную смесь обрабатывали с получением
соединения, указанного в заголовке, (293 мг) в виде
бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,19 (3H, т, J=7,0 Гц), 3,19 (2H, д, J=6,5 Гц), 4,18 (2H, кв, J=7,0
Гц), 4,78 (1H, т, J=6,5 Гц), 6,76 (2H, д, J=8,5 Гц),
6,88 (2H, д, J=9,0 Гц), 7,14 (2H, д, J=8,5 Гц), 7,62 (2H, д, J=9,0 Гц).
(с) Этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]
-2-(4-цианофенокси) пропионат
Реакцию
проводили тем же способом, который описан в ссылочном примере 25, используя этил 2-(4-цианофенокси)-3-(4-гидроксифенил) пропионат (293 мг), трет-бутил
2-метансульфонилоксиэтилкарбамат (560 мг) и
карбонат калия (520 мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (245 мг) в виде бесцветного масла.1
H-ЯМР (270 МГц, CDCl3): δ
ppm 1,20 (3H, т, J=7,0 Гц), 1,45 (9H, с), 3,21 (2H, д, J=6,5 Гц), 3,52 (2H, кв, J=5,0 Гц), 3,99 (2H, т, J=5,0 Гц), 4,19 (2H, кв, J=7,0 Гц), 4,79 (1H, т,
J=6,5 Гц), 4,97 (1H, ушир.т), 6,83 (2H, д, J=8,
5 Гц), 6,88 (2H, д, J=8,5 Гц), 7,20 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц).
(Ссылочный пример 42)
Метил
3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]
-2-(4-метилтиофенокси)пропионат
Реакцию проводили тем же способом, который описан в примере 122, используя метил
3-[4-(2-трет- бутоксикарбониламиноэтокси)фенил]-2-гидроксипропионат (389 мг),
который получали тем же способом, который описан в ссылочном примере 39(а), 4-метилтиофенол (241 мг), трифенилфосфин (463
мг) и раствор диэтилазодикарбоксилата в толуоле (40%, 0,31 мл), и реакционную
смесь обрабатывали с получением желаемого соединения (265 мг) в виде бесцветного масла, которое содержит некоторые
примеси.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,45 (9H, с), 2,
43 (3H, с), 3,17 (2H, д, J=6,5 Гц), 3,52 (2H, кв, J=5,0 Гц), 3,72 (3H, с), 3,99 (2H, т, J=5,0 Гц), 4,72 (1H, т,
J=6,5 Гц), 4,98 (1H, ушир.т), 6,78 (2H, д, J=8,5 Гц), 6,82 (2H, д, J=8,5 Гц), 7,20 (4H,
д, J=8,5 Гц).
(Ссылочный пример 43)
Метил
3-[4-(2-трет- бутоксикарбониламиноэтокси)фенил] -2-(4-метансульфонилфенокси) пропионат
Реакцию проводили тем же способом,
который описан в примере 122, используя метил
3-[4-(2-трет- бутоксикарбониламиноэтокси)фенил]-2-гидроксипропионат (518 мг), который был получен тем же способом, который описан в ссылочном примере
39(а), 4-метансульфонилфенол (394 мг),
трибутилфосфин (0,57 мл) вместо трифенилфосфина и 1,1'-(азодикарбонил)дипиперидин (578 мг) вместо диэтилазодикарбоксилата, и реакционную смесь обрабатывали с
получением желаемого соединения (441 мг)
в виде пенистой массы.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,44 (9H, с), 3,00 (3H, с), 3,22 (2H, д, J=6,5 Гц), 3,51 (2H, кв, J=5,0 Гц),
3,74 (3H, с), 3,99 (2H, т, J=5,0 Гц), 4,
84 (1H, т, J=6,5 Гц), 4,97 (1H, ушир. т), 6,83 (2H, д, J=8,5 Гц), 6,94 (2H, д, J=9,0 Гц), 7,19 (2H, д, J=8,5 Гц), 7,82 (2H, д, J=9,0 Гц).
(Ссылочный пример 44)
Метил
3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-(4-фторфенокси)пропионат
Реакцию проводили тем же способом, который описан в примере 122, используя
метил
3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]- 2-гидроксипропионат (420 мг), который был получен тем же способом, который описан в ссылочном примере 39(а), 4-фторфенол (284 мг), трифенилфосфин
(666
мг) и раствор диэтилазодикарбоксилата в толуоле (40%, 1,10 мл), и реакционную смесь обрабатывали с получением желаемого соединения (314 мг) в виде бесцветного масла.1H-ЯМР (270 МГц,
CDCl3: δ ppm 1,45 (9H, с), 3,16 (2H, д, J=6,5 Гц), 3,52 (2H, кв, J=5,0 Гц), 3,72 (3H, с), 3,99 (2H, т, J=5,0 Гц), 4,67 (1H, т, J= 6,5 Гц), 4,96 (1H, ушир.т), 6,76 (2H, дд, J=4,0, 9,
0
Гц), 6,83 (2H, д, J= 8,5 Гц), 6,92 (2H, дд, J=8,0, 9,0 Гц), 7,20 (2H, д, J=8,5 Гц).
(Ссылочный пример 45)
Этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]
-2-(4-изопропилфенокси)-2-метилпропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 25, используя этил 3-(4-гидроксифенил)-2-(4-изопропилфенокси)-2-метилпропионат
(4,85 г), который является продуктом ссылочного примера 9(b), трет-бутил 2-метансульфонилоксиэтилкарбамат (8,47 г) и карбонат калия (9,78 г), и реакционную смесь обрабатывали с получением соединения,
указанного в заголовке, (6,23 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,15-1,28 (9H, м), 1,37 (3H, с), 1,45 (9H, с), 2,83 (1H, септет, J=7,0 Гц), 3,10
(1H, д, J=13,5 Гц), 3,25 (1H, д, J=13,5 Гц), 3,46-3,58 (2H, м), 4,00 (2H, т, J=5,0 Гц), 4,21 (2H, кв, J=7,0 Гц), 4,95-5,05 (1H, м), 6,75 (2H, д, J= 8,5 Гц), 6,81 (2H, д, J=8,5 Гц), 7,06 (2H, д, J=8,5
Гц), 7,17 (2H, д, J= 8,5 Гц).
(Ссылочный пример 46)
Метил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-фенил-тиопропионат
Реакцию проводили тем же способом,
который описан в примере 122, используя метил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2- гидроксипропионат (366 мг), который получали тем же способом, который описан в ссылочном примере 39(а),
тиофенол (0,17 мл), трифенилфосфин (438 мг) и раствор диэтилазодикарбоксилата в толуоле (40%, 0,29 мл), и реакционную
смесь обрабатывали с получением желаемого соединения (209 мг) в виде
бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,45 (9H, с), 3,00 (1H, дд, J=6,5, 13,5 Гц), 3,13 (1H, дд, J=9,5, 13,5 Гц), 3,52 (2H, т, J=5,0 Гц), 3,58 (3H, с), 3,86
(1H, дд, J=6,5, 9,5 Гц), 3,98 (2H, т, J=5,0 Гц), 5,00 (1H, ушир.т), 6,80 (2H, д, J=8,5 Гц), 7,10 (2H, д, J=8,5 Гц), 7,30-7,40 (3H, м), 7,41-7,56 (2H, м).
(Ссылочный пример 47)
Метил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]-2- (пиридин-3-илокси) пропионат
Реакцию проводили тем же способом, который описан в примере 122, используя метил
3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]-2-гидроксипропионат (404 мг), который получали тем же способом, который описан в ссылочном примере 39(а), 3-гидроксипиридин (227 мг), трифенилфосфин
(938
мг) и раствор диэтилазодикарбоксилата в толуоле (40%, 0,65 мл), и реакционную смесь обрабатывали с получением желаемого соединения (345 мг) в виде бесцветного масла.1H-ЯМР (270 МГц,
CDCl3): δ ppm 1,44 (9H, с), 3,21 (2H, д, J=6,5 Гц), 3,52 (2H, кв, J=5,0 Гц), 3,74 (3H, с), 3,99 (2H, т, J=5,0 Гц), 4,78 (1H, т, J= 6,5 Гц), 4,96 (1H, ушир.т), 6,84 (2H, д, J=8,5 Гц),
7,11 (1H, д, J=8,5 Гц), 7,18 (1H, дд, J=5,0, 8,5 Гц), 7,20 (2H, д, J=8,5 Гц), 8,23 (1H, д, J= 5,0 Гц), 8,24 (1H, с).
(Ссылочный пример 48)
Метил
2-(бензоксазол-2-илтио)-3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] пропионат
Реакцию проводили тем же способом, который описан в примере 122, используя метил
3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]-2-гидроксипропионат (415 мг), который получали тем же способом, который описан в ссылочном примере 39(а), 2-меркаптобензоксазол (277 мг), трибутилфосфин
(0,46 мл) вместо трифенилфосфина и 1,1'- (азодикарбонил)дипиперидин (460 мг) вместо диэтилазодикарбоксилата, и реакционную смесь обрабатывали с получением желаемого соединения (665 мг) в виде
бесцветного масла, которое содержит некоторые примеси.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,46 (9H, с), 3,26 (1H, дд, J= 7,0, 14,0 Гц), 3,35 (1H, дд, J=7,5, 14,0 Гц), 3,51
(2H,
кв, J=5,0 Гц), 3,71 (3H, с), 3,96 (2H, т, J=5,0 Гц), 4,76 (1H, дд, J=7,0, 7,5 Гц), 4,89 (1H, ушир.т), 6,81 (2H, д, J=8,0 Гц), 7,17 (2H, д, J=8,0 Гц), 7,22-7,29 (2H, м), 7,43 (1H, д, J=7,5 Гц), 7,
60
(1H, д, J=6,0 Гц).
(Ссылочный пример 49)
Метил 2-бензилокси-3-[4-(2-трет-бутоксикарбониламиноэтокси)-фенил] пропионат
Реакцию проводили тем же способом, который
описан в ссылочном примере 1(с), используя метил 3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-гидроксипропионат (398 мг), который получали тем же способом, который описан в ссылочном примере
39(а), бензилбромид (0,28 мл), гидрид (55% суспензия в масле, 168 мг) и йодид тетрабутиламмония (43 мг), и реакционную смесь обрабатывали с получением желаемого соединения (133 мг) в виде бесцветного
масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,46 (9H, с), 2,99 (1H, д, J=7,5 Гц), 3,00 (1H, д, J=5,5 Гц), 3,53 (2H, кв, J=5,0 Гц), 3,71 (3H, с), 4,00 (2H, т, J= 5,0 Гц), 4,09
(1H, дд, J=5,5, 7,5 Гц), 4,37 (1H, д, J=12,0 Гц), 4,65 (1H, д, J=12,0 Гц), 5,00 (1H, ушир.т), 6,81 (2H, д, J=8,5 Гц), 7,13 (2H, д, J=8,5 Гц), 7,17-7,22 (2H, м), 7,25-7,31 (3H, м).
(Ссылочный пример 50)
Дибензил 2-(3-фенилпропил)-2-[4-[3-(4-пиридин-2-илбензоиламино)пропил] бензил]малонат
(а) 4-(3-Бензилоксикарбониламинопропил)бензиловый спирт
К
суспензии литий алюминия гидрида (4,00 г) в тетрагидрофуране (180 мл) на ледяной бане по каплям добавляли раствор метил 4-(2-цианоэтил)бензоата (10,0 г) в тетрагидрофуране (80 мл). Смесь перемешивали
при комнатной температуре в течение 1 часа и при 60oC в течение 3 часов. В реакционную смесь последовательно добавляли воду (4 мл), водный раствор гидроксида натрия (15%, 4 мл) и воду (12
мл) и смесь перемешивали в течение 1 часа. Нерастворимый продукт в реакционной смеси удаляли путем фильтрации и промывали тетрагидрофураном. В смесь фильтрата добавляли
N-бензилоксикарбонил-5-норборнен-2,3-дикарбоксиимид (16,5 г) и раствор тетрагидрофурана, и эту смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали.
Остаток распределяли между этилацетатом и водой. Этилацетатный слой отделяли, промывали насыщенным водным раствором хлорида натрия и насыщенным водным раствором гидрокарбоната натрия, сушили над
безводным сульфатом магния и концентрировали. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента гексан/этилацетат = 1/1, с получением желаемого соединения
(5,67 г) в виде кристаллов.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,82 (2H, квинтуплет, J=7,5 Гц), 2,64 (2H, т, J=7,5 Гц), 3,22 (2H, дт, J=6,5, 7,5 Гц), 4,65 (2H, с), 4,75 (1H,
ушир.с), 5,09 (2H, с), 7,16 (2H, д, J=8,0 Гц), 7,26-7,36 (7H, м).
(b) 4-[3-(4-Пиридин-2-илбензоиламино)пропил]спирт
К раствору
4-(3-бензилоксикарбониламинопропил)-бензилового
спирта (1,00 г), который является продуктом ссылочного примера 50 (а), в этаноле (20 мл) добавляли палладий на углероде (5%, 0,15 г). Смесь
перемешивали в атмосфере водорода при комнатной температуре
в течение 2 часов. Катализатор удаляли путем фильтрации и фильтрат концентрировали с получением 4-(3-аминопропил)бензилового спирта в виде
смолы. Реакцию проводили тем же способом, который описан в
примере 5, используя 4-(3-аминопропил)бензиловый спирт, 4-пиридин-2-илбензойную кислоту (668 мг) и карбонилдиимидазол (650 мг), и
реакционную смесь обрабатывали с получением желаемого соединения (0,74
г) в виде бесцветных кристаллов. Т.пл. 118-120oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 2,00
(2H, квинтуплет, J=7,5 Гц), 2,75 (2H, т, J=7,5 Гц),
3,53 (2H, дт,
J=6,5, 7,5 Гц), 4,65 (2H, с), 6,10 (1H ушир.с), 7,20-7,31 (5H, м), 7,72-7,80 (4H, м), 8,02 (2H, д, J=8,5 Гц), 8,71 (1H, д,
J=5,0 Гц).
(с) 4-[3-(4-пиридин-2-илбензоиламино)пропил]
бензилхлорид
К раствору 4-[3-(4-пиридин-2-илбензоиламино)-пропил] спирта (0,74 г) в дихлорметане (20 мл)
последовательно добавляли метансульфонилхлорид (294 мг) и триэтиламин (0,37 мл). Смесь
оставляли стоять при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали. Остаток
распределяли между этилацетатом и водой. Этилацетатный слой отделяли, промывали насыщенным
водным раствором хлорида натрия, сушили над безводным сульфатом магния и концентрировали с получением
кристаллов. Кристаллы промывали небольшим количеством диизопропилового эфира с получением
желаемого соединения (0,68 г). Т. пл. 115-117oC.1H-ЯМР (270 МГц, CDCl3):
δ ppm 1,99 (2H, квинтуплет, J=7,5 Гц), 2,75 (2H,
т, J=7,5 Гц), 3,53 (2H, дт, J=6,5, 7,
5 Гц), 6,15 (1H, ушир. с), 7,21-7,34 (5H, м), 7,76-7,82 (4H, м), 8,06 (2H, д, J=8,5 Гц), 8,70-8,73 (1H
м).
(d) Дибензил
2-(3-фенилпропил)-2-[4-[3-(4-пиридин-2-илбензоиламино)пропил]бензил]малонат
Реакцию проводили тем же способом, который описан в ссылочном примере 2(а),
используя
4-[3-(4-пиридин-2-илбензоиламино)пропил] бензилхлорид (488 мг), который является продуктом ссылочного примера 50(с), гидрид натрия (55% суспензия в масле, 64 мг) и бензил
(3-фенилпропил)малонат (540
мг), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (0,65 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm
1,44-1,58 (2H, м), 1,78-1,87
(2H, м), 1,92 (2H, т, J=7,5 Гц), 2,52 (2H, т, J=7,5 Гц), 2,65 (2H, т, J= 7,5 Гц), 3,19 (2H, с), 3,49 (2H, дт, J=6,0, 7,5 Гц), 5,05 (1H, д, J= 12,0 Гц), 5,09 (1H, д, J=12,
0 Гц), 6,16 (1H, ушир.т, J=6,0
Гц), 6,78 (2H, д, J= 8,0 Гц), 6,96 (2H, д, J=8,0 Гц), 7,05 (2H, д, J=8,0 Гц), 7,17-7,35 (14H, м), 7,76-7,82 (4H, м), 8,06 (2H, д, J=8,5 Гц), 8,71 (1H, д, J=5,0 Гц).
(Ссылочный пример
51)
Этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)-3-хлорфенил]-2-феноксипропионат
(а) Этил 3-(3-хлор-4-гидроксифенил)-2-феноксипропионат
К
раствору этил
3-(4-гидроксифенил)-2-феноксипропионата (1,43 г) в диэтиловом эфире (20 мл) по каплям добавляли раствор сульфурилхлорида (0,71 мл) в диэтиловом эфире (5 мл) при комнатной температуре.
Смесь
перемешивали в течение 8 часов и оставляли стоять в течение ночи. Реакционную смесь распределяли между этилацетатом и водой. Этилацетатный слой отделяли, промывали насыщенным водным раствором
гидрокарбоната натрия и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке
с силикагелем, используя в качестве элюента гексан/этилацетат = 10/3, с получением желаемого соединения (1,09 г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm
1,
20 (3H, т, J=7,0 Гц), 3,15 (1H, д, J=5,0 Гц), 3,16 (1H, д, J= 7,5 Гц), 4,19 (2H, кв, J=7,0 Гц), 4,73 (1H, дд, J=5,0, 7,5 Гц), 5,49 (1H, с), 6,84 (2H, д, J=8,0 Гц), 6,94 (1H, д, J=8,5 Гц), 6,96 (1H,
т,
J= 8,0 Гц), 7,12 (1H, дд, J=2,0, 8,5 Гц), 7,25 (2H, т, J=8,0 Гц), 7,28 (1H, д, J-2,0 Гц).
(b) Этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)-3-хлорфенил]-2-феноксипропионат
Реакцию проводили тем же способом, который описан в примере 122, используя этил 3-(3-хлор-4-гидроксифенил)-2-феноксипропионат (761 мг), который является продуктом ссылочного примера 51(а),
трет-бутил-2-гидроксиэтилкарбамат (0,96 г), трифенилфосфин (1,55 г) и раствор диэтилазодикарбоксилата в толуоле (40%, 2,69 мл), и реакционную смесь обрабатывали с получением желаемого соединения (1,
03
г) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,21 (3H, т, J=7,0 Гц), 1,45 (9H, с), 3,15 (1H, д, J=5,5 Гц), 3,16 (1H, д, J=7,5 Гц),2 3,56 (2H, кв, J=5,0
Гц),
4,05 (2H, т, J=5,0 Гц), 4,19 (2H, кв, J=7,0 Гц), 4,73 (1H, дд, J=5,5, 7,5 Гц), 5,06 (1H, ушир.т), 6,84 (2H, д, J=8,0 Гц), 6,85 (1H, д, J=8,5 Гц), 6,96 (1H, т, J=8,0 Гц), 7,15 (1H, дд, J=2,0, 8,5
Гц),
7,25 (2H, т, J=8,0 Гц), 7,33 (1H, д, J=2,0 Гц).
(Ссылочный пример 52)
Этил 3-[3-бром-4-(2-трет-бутоксикарбониламиноэтокси)фенил] -2-феноксипропионат
(а) Этил
3-(3-бром-4-гидроксифенил)-2-феноксипропионат
К раствору этил 3-(4-гидроксифенил)-2-феноксипропионата (1,43 г), который является продуктом ссылочного примера 4 (с) в хлороформе (20 мл),
добавляли N-бромсукцинимид (1,12 г) при комнатной температуре. Смесь перемешивали при 70oC в течение 4 часов и концентрировали при пониженном давлении. Остаток распределяли между
этилацетатом и водой. Этилацетатный слой отделяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток
очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента гексан/этилацетат = 4/1, с получением желаемого соединения (1,41 г) в виде бесцветного масла.1H-ЯМР
(270 МГц, CDCl3): δ ppm 1,20 (3H, т, J=7,0 Гц), 3,148 (1H, д, J=5,5 Гц), 3,153 (1H, д, J=7,0 Гц), 4,18 (2H, кв, J=7,0 Гц), 4,72 (1H, дд, J=5,5, 7,0 Гц), 5,45 (1H, ушир.с), 6,84 (2H,
д, J=8,0 Гц), 6,94 (1H, д, J=8,5 Гц), 6,96 (1H, т, J=8,0 Гц), 7,16 (1H, дд, J=2,0, 8,5 Гц), 7,25 (2H, т, J=8,0 Гц), 7,42 (1H, д, J=2,0 Гц).
(b) Этил
3-[3-бром-4-(2-трет-бутоксикарбониламиноэтокси)-фенил]-2-феноксипропионат
Реакцию проводили тем же способом, который описан в примере 122, используя этил
3-(3-бром-4-гидроксифенил)-2-феноксипропионат (374 мг), который является продуктом ссылочного примера 52(а), трет-бутил 2-гидроксиэтилкарбамат (403 мг), трифенилфосфин (672 мг) и раствор
диэтилазодикарбоксилата в толуоле (40%, 1,16 мл), и реакционную смесь обрабатывали с получением желаемого соединения (466 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3):
δ ppm 1,21 (3H, т, J=7,0 Гц), 1,45 (9H, с), 3,15 (1H, д, J=5,5 Гц), 3,16 (1H, д, J= 7,0 Гц), 3,56 (2H, кв, J=5,0 Гц), 4,04 (2H, т, J=5,0 Гц), 4,19 (2H, кв, J= 7,0 Гц), 4,72 (1H, дд, J=5,5, 7,0
Гц), 5,08 (1H, ушир.т), 6,82 (1H, д, J=8,5 Гц), 6,85 (2H, д, J=8,0 Гц), 6,96 (1H, т, J=7,5 Гц), 7,20 (1H, дд, J=2,0, 8,5 Гц), 7,25 (2H, дд, J=7,5, 8,0 Гц), 7,50 (1H, д, J=2,0 Гц).
(Ссылочный пример 53)
Этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)-3-нитрофенил]-2- феноксипропионат
(а) Этил 3-(4-гидрокси-3-нитрофенил)-2-феноксипропионат
К раствору
этил
3-(4-гидроксифенил)-2-феноксипропионата (1,00 г), который является продуктом ссылочного примера 4(с), в смеси дихлорметана (4,0 мл) и диэтилового эфира (8,0 мл) добавляли воду (2,5 мл),
концентрированный водный раствор соляной кислоты (1,17 мл) и нитрат натрия (297 мг) при комнатной температуре. Смесь перемешивали в течение 2,5 часов при той же температуре и оставляли стоять в
течение 14 часов. Реакционную смесь распределяли между этилацетатом и водой. Этилацетатный слой отделяли и промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором
хлорида натрия, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента
гексан/этилацетат = 4/1, с получением желаемого соединения (935 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,23 (3H, т, J=7,0 Гц), 3,23 (2H, д, J=6,0
Гц),
4,21 (2H, кв, J= 7,0 Гц), 4,76 (1H, т, J=6,0 Гц), 6,83 (2H, д, J=8,0 Гц), 6,97 (1H, т, J= 7,5 Гц), 7,11 (1H, д, J=8,5 Гц), 7,25 (2H, дд, J=7,5, 8,0 Гц), 7,56 (1H, дд, J=2,0, 8,5 Гц), 8,08 (1H, д,
J=2,
0 Гц).
(b) Этил 3-[4-(2-трет-бутоксикарбониламиноэтокси)-3- нитрофенил]-2-феноксипропионат
Реакцию проводили тем же способом, который описан в примере 122, используя
этил
3-(4-гидрокси-3-нитрофенил)-2-феноксипропионат (270 мг), который является продуктом ссылочного примера 53(а), трет-бутил 2-гидроксиэтилкарбамат (322 мг), трифенилфосфин (535 мг) и раствор
диэтилазодикарбоксилата в толуоле (40%, 0,93 мл), и реакционную смесь обрабатывали с получением желаемого соединения (349 мг) в виде бесцветного масла.1H-ЯМР (270 МГц, CDCl3):
δ ppm 1,23 (3H, т, J=7,0 Гц), 1,44 (9H, с), 3,23 (2H, д, J=6,0 Гц), 3,57 (2H, кв, J= 5,0 Гц), 4,14 (2H, т, J=5,0 Гц), 4,21 (2H, кв, J=7,0 Гц), 4,76 (1H, т, J=6,0 Гц), 5,14 (1H, ушир.т), 6,83
(2H, д, J=8,0 Гц), 6,97 (1H, т, J= 7,5 Гц), 7,00 (1H, д, J=8,5 Гц), 7,25 (2H, дд, J=7,5, 8,0 Гц), 7,50 (1H, дд, J=2,0, 8,5 Гц), 7,85 (1H, д, J=2,0 Гц).
(Ссылочный пример 54)
Метил (S)-2-бензилоксикарбониламино-3-[4-(2-трет-бутоксикарбониламиноэтокси)фенил]пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 25, используя метиловый эфир
N-бензилоксикарбонил-L-тирозина (4,94 г), трет-бутил 2-метансульфонилоксиэтилкарбамат (8,97 г) и карбонат калия (10,4 г), и реакционную смесь обрабатывали с получением соединения, указанного в
заголовке, (3,32 г) в виде бесцветных кристаллов. Т.пл. 89-91oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,62 (9H, с), 3,00-3,10 (2H, м), 3,48-3,56 (2H, м), 3,72 (3H,
с),
3,98 (2H, т, J=5,0 Гц), 4,56-4,68 (1H, м), 4,99 (1H, ушир.с), 5,10 (2H, ABq, J= 12,5 Гц, δ =0,03 ppm), 5,15-5,24 (1H, м), 6,79 (2H, д, J=8,5 Гц), 7,00 (2H, д, J=8,5 Гц), 7,23-7,41 (5H,
м).
(Ссылочный пример 55)
Этил 3-(4-гидроксифенил)-2-(фениламино)пропионат
(а) Этил 3-(4-бензилоксифенил)-2-(фениламино) пропионат
Смесь этил
3-(4-бензилоксифенил)-2- метансульфонилокси-пропионата (4,00 г) и анилина (5 мл) перемешивали при 110oC в течение 24 часов. Реакционную смесь очищали с помощью хроматографии на колонке с
силикагелем, используя в качестве элюента этилацетат/гексан = 1/4, с получением желаемого соединения (3,94 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,17 (3H, т,
J=7 Гц), 3,00-3,14 (2H, м), 4,12 (2H, dq, J=1,5, 7 Гц), 4,30 (1H, т, J=6 Гц), 5,04 (2H, с), 6,60 (2H, J=8,5 Гц), 6,73 (1H, т, J=7,5 Гц), 6,89 (2H, д, J=8,5 Гц), 7,09 (2H, д, J=8,5 Гц), 7,16 (2H, д,
J=8,5 Гц), 7,31-7,44 (5H, м).
(b) Этил 3-(4-гидроксифенил)-2-(фениламино)пропионат
К раствору этил 3-(4-бензилоксифенил)-2-(фениламино)пропионата (3,94 г), который является
продуктом ссылочного примера 55(а), в смеси этанола (40 мл) и тетрагидрофурана (20 мл) добавляли палладий на углероде (5%, 0,80 г).
Смесь перемешивали в атмосфере водорода при 50oC в течение 6 часов. Катализатор удаляли путем фильтрации и фильтрат концентрировали. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента этилацетат/гексан = 1/2, с получением соединения, указанного в заголовке, (2,95 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm, 1,19 (3H, т, J= 1 Гц), 3,00-3,13 (2H, м), 4,13 (2H, dq, J=1, 7 Гц), 4,30 (1H, ушир.т, J=6 Гц), 4,88 (1H, ушир.с), 6,60 (2H, д, J=8 Гц), 6,71-6,76 (3H, м), 7,03 (2H, д, J=8 Гц), 7,14-7,20 (2H, м).
(Ссылочный пример 56)
Этил 3-(4-гидроксифенил)-2-(N- этил-N-фениламино) пропионат
(а) Этил 3-(4-бензилоксифенил)-2-(N-этил-N-фениламино)- пропионат
Реакцию проводили тем же способом, который описан
в
ссылочном примере 55(а), используя этил 3-(4-бензилоксифенил)-2-метансульфонилоксипропионат (4,50 г) и N-этиланилин (5,6 мл), и реакционную смесь обрабатывали с получением смеси желаемого
соединения и
N-этиланилина (6,30 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,07 (3H, т, 3H, J=7 Гц), 1,14 (3H, т, J=7 Гц), 3,01-3,45 (4H, м), 4,09 (2H, кв, J= 7
Гц), 4,39 (1H, т,
J=7,5 Гц), 5,02 (2H, с), 6,66-6,75 (3H, м), 6,87 (2H, д, J=8 Гц), 7,10 (2H, д, J=8,5 Гц), 7,15-7,25 (2H, м), 7,31-7,44 (5H, м).
(b) Этил
2-(N-этил-N-фениламино)-3-(4-гидроксифенил)пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 55(b), используя смесь (6,30 г), которая является продуктом
ссылочного примера 56(а), и реакционную смесь обрабатывали с получением соединения, указанного в заголовке, (2,37 г) в виде сиропа.1Н-ЯМР (270 МГц, CDCl3): δ ppm 1,07
(3H,
т, J=7 Гц), 1,15 (3H, т, J=7 Гц), 3,05 (1H, дд, J=8, 14 Гц), 3,26 (1H, д, д, J= 7,5, 14 Гц), 3,30-3,46 (2H, м), 4,10 (2H, кв, J=7 Гц), 4,38 (1H, т, J=8 Гц), 4,75 (1H, ушир. с), 6,67-6,79 (5H, м),
7,
05 (2H, д, J=8,5 Гц), 7,18-7,26 (2H, м).
(Ссылочный пример 57)
Этил 3-(4-гидроксифенил)-2-(пиррол-1-ил)пропионат
(а) Этил
3-(4-бензилоксифенил)-2-(пиррол-1-ил)пропионат
К раствору этил 3-(4-бензилоксифенил)-2-аминопропионата (3,30 г) в дихлорметане (80 мл) добавляли 1,4-дихлор-1,4-диметоксибутан (3,30 г) и
затем
в смесь добавляли amberlyst А-21 (20 г). Смесь перемешивали при комнатной температуре в течение 18 часов и реакционную смесь фильтровали. Фильтрат концентрировали и остаток очищали с помощью
хроматографии на колонке с силикагелем, используя в качестве элюента этилацетат/гексан = 1/5, с получением желаемого соединения (1,00 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3):
δ ppm 1,19 (3H, т, J= 7 Гц), 3,19 (1H, дд, J=8,5, 14 Гц), 3,34 (1H, дд, J=7, 14 Гц), 4,14 (2H, кв, J=7 Гц), 4,68 (1H, дд, J=7, 8,5 Гц), 5,01 (2H, с), 6,15 (2H, т, J=2 Гц), 6,73 (2H, т, J=2 Гц),
6,84 (2H, д, J=8,5 Гц), 6,94 (2H, д, J=8,5 Гц), 7,28-7,43 (5H, м).
(b) Этил 3-(4-гидроксифенил)-2-(пиррол-1-ил)пропионат
Реакцию проводили тем же способом, который описан в
ссылочном примере 55(b), используя этил 3-(4-бензилоксифенил)-2-(пиррол-1-ил)эпропионат (1,00 г), полученный в ссылочном примере 57(а), и палладий на углероде (5%, 0,12 г), и реакционную смесь
обрабатывали с получением соединения, указанного в заголовке, (0,71 г) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,20 (3H, т, J= 7 Гц), 3,18 (1H, дд, J=8,5, 14 Гц), 3,
33 (1H, дд, J=7, 14 Гц), 4,15 (2H, кв, J=7 Гц), 4,67 (1H, дд, J-7, 8,5 Гц), 4,80 (1H, с), 6,14 (2H, т, J=2 Гц), 6,71 (2H, д, J=8,5 Гц), 6,72 (2H, д, J=2 Гц), 6,88 (2H, д, J=8,5 Гц).
(Ссылочный пример 58)
Этил 2-(N,N-диэтиламино)-3-(4-гидроксифенил)пропионат
К раствору гидрохлорида этилового эфира DL-тирозина (491 мг) в метаноле (5 мл) добавляли уксусную кислоту
(0,3 мл) и ацетальдегид (0,5 мл). В смесь добавляли цианоборгидрид натрия (126 мг) и смесь перемешивали при комнатной температуре в течение 2 часов. По завершении этого времени реакционную смесь
концентрировали. Остаток распределяли между этилацетатом и водой. Этилацетатный слой отделяли, промывали водным раствором гидрокарбонатат натрия, сушили над безводным сульфатом магния и
концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента метанол/дихлорметан = 1/20, с получением желаемого соединения
(420 мг) в виде сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,02 (6H, т, J=7 Гц), 1,16 (3H, т, J=7 Гц), 2,53 (2H, секстет, J=7 Гц), 2,79 (2H, секстет, J=7 Гц), 2,81 (1H, дд,
J=6, 13,5 Гц), 2,99 (1H, дд, J=9, 13,5 Гц), 3,55 (1H, дд, J=6, 9 Гц), 4,02-4,11 (2H, м), 6,72 (2H, д, J-8,5 Гц), 7,02 (2H, д, J=8,5 Гц).
(Ссылочный пример 59)
Этил
2-N-(трет-бутоксикарбонил)этиламино-3-(4-гидроксифенил)-пропионат
(а) Этил 2-этиламино-3-(4-гидроксифенил)пропионат
Реакцию проводили тем же способом, который описан в ссылочном
примере 9, используя гидрохлорид этилового эфира DL-тирозина (983 мг), ацетальдегид (0,26 мл) и натрий цианоборгидрид (100 мг), и реакционную смесь обрабатывали с получением желаемого соединения (515
мг) в виде сиропа, который оставляли стоять до получения кристаллов. Т.пл. 87-89oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 1,08 (3H, т, J=7 Гц), 1,18 (3H, т, J=7 Гц),
2,
48-2,72 (2H, м), 2,82-2,96 (2H, м), 3,50 (1H, т, J=7 Гц), 4,11 (2H, кв, J=7 Гц), 6,68 (2H, д, J=8,5 Гц), 7,01 (2H, д, J=8,5 Гц).
(b) Этил
2-N-(трет-бутоксикарбонил)этиламино-3-(4- гидроксифенил)пропионат
К раствору этил 2-этиламино-3-(4-гидроксифенил)пропионата (569 мг), который является продуктом ссылочного примера 59(а), и
ди-трет-бутилкарбоната (785 мг) в дихлорметане (10 мл) на ледяной бане по каплям добавляли триэтиламин (1 мл). Смесь перемешивали при комнатной температуре в течение 4 часов. По завершении этого
времени реакционную смесь концентрировали. Остаток распределяли между этилацетатом и водой. Этилацетатный слой отделяли, сушили над безводным сульфатом магния и концентрировали при пониженном
давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента этилацетат/гексан = 1/2, с получением соединения, указанного в заголовке, (663 мг) в виде
сиропа.1H-ЯМР (270 МГц, CDCl3): δ ppm 0,90 (3H, ушир. т, J=7 Гц), 1,21-1,31 (3H, м), 1,45 (9H, с), 3,15-3,37 (1H, м), 3,08 (1H, дд, J=10, 14 Гц), 3,15-3,37 (1H, м), 3,24
(1H, дд, J=5, 14 Гц), 3,85-4,30 (3H, м), 6,76 (2H, ушир. д, J=8,5 Гц), 7,00-7,11 (2H, м).
(Ссылочный пример 60)
Этил
2-N-(трет-бутоксикарбонил)пропиламино-3-(4-гидроксифенил)
пропионат
(а) Этил 3-(4-гидроксифенил)-2-пропиламинопропионат
Реакцию проводили тем же способом, который описан в ссылочном
примере 59(а), используя гидрохлорид этилового эфира
DL-тирозина, пропиональдегид и натрий цианоборгидрид, и реакционную смесь обрабатывали с получением желаемого соединения.
(b)
Этил
2-N-(трет-бутоксикарбонил)пропиламино-3-(4-гидроксифенил) пропионат
Реакцию проводили тем же способом, который описан в ссылочном примере 59(b), используя этил
3-(4-гидроксифенил)-2-пропиламинопропионат, который является продуктом ссылочного примера 60(а), и трет-бутилдикарбонат, и реакционную смесь обрабатывали с получением соединения, указанного в
заголовке.
(Ссылочный пример 61)
2-(4-пиридин-2-илбензоиламино) этанол
К суспензии 4-пиридин-2-илбензоилхлоридгидрохлорида (254 мг) в дихлорметане (2 мл) добавляли
триэтиламин (0,14 мл). В смесь добавляли раствор этаноламина (0,060 мл) в дихлорметане (3 мл). Эту смесь перемешивали в течение 30 минут. По завершении этого времени реакционную смесь концентрировали
и остаток распределяли между этилацетатом и водой. Этилацетатный слой отделяли и промывали водным хлоридом натрия, сушили над безводным сульфатом магния, и концентрировали с получением кристаллов.
Кристаллы промывали изопропиловым эфиром с получением соединения, указанного в заголовке, (111 мг). Т.пл. = 86-88oC.1H-ЯМР (270 МГц, CDCl3): δ ppm 2,52 (1H, т,
J=4,5 Гц), 3,68 (2H, дт, J=5,0, 5,5 Гц), 3,88(2H, дт, J=4,5, 5,5 Гц), 6,68 (1H, ушир. с), 7,24-7,33 (1H, м), 7,77-7,82 (1H, м), 7,90 (2H, д, J=8,5 Гц), 8,09 (2H, д, J=8,5 Гц), 8,72 (1H, д, J=5
Гц).
[Испытательный пример]
Воздействие на подавление глюкозы крови (Метод 1)
Каждый состав, примешиваемый с порошковым кормом F-2 (Funabashi Farm) вводился самцам
мышей КК
с гипергликемией, вес каждой составлял 40 г или больше, с коэффициентом 0,01 % (приблизительно 10 мг/кг/день) в течение трех дней. Тем временем мышей из контрольной группы кормили только
порошковым
кормом. Затем у каждой мыши под анастезией из хвостовой вены брали пробу крови и центрифугировали. Полученная таким образом глюкоза плазмы крови была определена с использованием
Glucoloader F (Product
of A & T Co., Ltd.).
Коэффициент уменьшения глюкозы крови был оценен в соответствии со следующим уравнением:

Результаты суммированы в таблице 156.
Данные таблицы 156 показывают, что соединения по данному изобретению демонстрируют прекрасную гипогликемическую активность.
Препаративный пример
(1) Капсулы
Соединение примера 2 - 10 мг
Лактоза - 110 мг
Кукурузный
крахмал - 58 мг
Стеарат магния - 2 мг - 180 мг
Порошки всех компонентов, указанных выше, смешивали и пропусками через сито 60 меш (стандарты меш по Tyier). Порошковую смесь (180 мг)
загружали в желатиновые
капсулы (N 3) с получением капсул.
(2) Таблетки
Соединение примера 2 - 10 мг
Лактоза - 85 мг
Кукурузный крахмал - 34 мг
Мелкокристаллизованная
целлюлоза - 20 мг
Стеарат магния - 1 мг - 150 мг
Порошки всех компонентов, указанные выше, смешивают и прессуют в машине для получения таблеток (150 мг). Если
необходимо, таблетки
могут быть покрыты сахаром или пленкой.
(3) Гранулы
Соединение примера 2 - 10 мг
Лактоза - 839 мг
Кукурузный крахмал - 150 мг
Гидроксипропилцеллюлоза - 1 мг - 1000 мг
Порошки всех компонентов, указанных выше, смешивали и смачивали чистой водой, гранулировали с использованием форменного гранулятора и сушили с
получением гранул.
Промышленное применение
Производные амидокарбоновой кислоты, их фармакологически приемлемые соли и их фармакологически приемлемые эфиры настоящего
изобретения используются как профилактический агент и/или терапевтический агент при сахарном диабете, гиперлипемии, ожирении, ослаблении толерантности к глюкозе, толерантности к глюкозе не-IGT (NGT),
гипертонии, жировой печени, диабетических осложнений, артериосклерозе, сахарном диабете беременных, поликистозном синдроме яичника и повреждении клеток, вызванном атеросклерозом, эпифизарном
остеомиелите, ревматическом артрите, аллергических заболеваниях, астме, раке, аутоиммунных заболеваниях, панкреатите, остеопорозе, катарактах, тому подобное. Т Т Т Т$
Реферат
Изобретение относится к новым соединениям формулы I, где R1 - Н, алкил, арил, R2 - алкил, R3 - Н, галоген, нитрогруппа, R4 - Н, алкил, Z - алкил, W - алкил, алкокси, замещенный арил, замещенный гетероарил, где в качестве гетероатома может быть O, N, S, а также замещенная аминогруппа и замещенная оксигруппа, Х - замещенный арил или замещенный гетероарил, где в качестве гетероатома может быть O, N, S. Соединения формулы I обладают гипогликемической активностью и поэтому могут найти применение в качестве лекарства, предназначенного для снижения уровня глюкозы в крови. 3 с. и 35 з.п. ф-лы, 156 табл.

Формула

где R1 представляет собой атом водорода, алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 6 атомов углерода или аралкильную группу, содержащую от 7 до 12 атомов углерода;
R2 представляет собой алкиленовую группу с прямой или разветвленной цепью, содержащую от 1 до 6 атомов углерода;
R3 представляет собой (i) атом водорода, (ii) атом галогена или (iii) нитрогруппу;
R4 представляет собой атом водорода или алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 6 атомов углерода;
Z представляет собой алкиленовую группу с прямой или разветвленной цепью, содержащую от 1 до 6 атомов углерода;
W представляет собой (i) алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 6 атомов углерода, (ii) алкоксигруппу с прямой или разветвленной цепью, содержащую от 1 до 4 атомов углерода, (iii) арилоксигруппу, содержащую от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей α, определенных ниже, на арильной группе, (iv) арилтиогруппу, содержащую от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей α, определенных ниже, на арильной группе, (v) аралкильную группу, содержащую от 7 до 12 атомов углерода, которая может содержать от 1 до 5 заместителей α, определенных ниже, на арильной группе, (vi) аралкилоксигруппу, содержащую от 7 до 12 атомов углерода, которая может содержать от 1 до 5 заместителей α, определенных ниже, на арильной группе, (vii) арилоксиалкильную группу, в которой арильная группа содержит от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей α, определенных ниже, и алкильная группа представляет собой прямую или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, (viii) моно- или дициклическую, 5-10-членную гетероарилоксигруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, (ix) моно- или дициклическую, 5-10-членную гетероарилтиогруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, (х) прямую или разветвленную моноалкиламиногруппу, в которой алкильная группа содержит от 1 до 4 атомов углерода, (xi) аралкиламиногруппу, содержащую от 7 до 12 атомов углерода, которая может содержать от 1 до 5 заместителей α, определенных ниже, на арильной группе;
X представляет собой арильную группу, содержащую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α, определенных ниже, или моно- или дициклическую, 5-10-членную гетероарильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей α, определенных ниже, когда W представляет собой (i) прямую или разветвленную моноалкиламиногруппу, в которой алкильная группа включает от 1 до 6 атомов углерода, (ii) алкоксигруппу с прямой или разветвленной цепью, содержащую от 1 до 4 атомов углерода, (iii) арилоксигруппу, содержащую от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей α, определенных ниже, на арильной группе, (iv) арилтиогруппу, содержащую от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей α, определенных ниже, на арильной группе, (v) аралкильную группу, содержащую от 7 до 12 атомов углерода, которая может содержать от 1 до 5 заместителей α, определенных ниже, на арильной группе, (vi) аралкилоксигруппу, содержащую от 7 до 12 атомов углерода, которая может содержать от 1 до 5 заместителей α, определенных ниже, на арильной группе, (vii) арилоксиалкильную группу, в которой арильная группа содержит от 6 до 10 атомов углерода, которая может содержать от 1 до 5 заместителей α, определенных ниже, и алкильная группа представляет собой прямую или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, (viii) моно- или дициклическую, 5-10-членную гетероарилоксигруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, или (ix) моно- или дициклическую, 5-10-членную гетероарилтиогруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, или
Х представляет собой арильную группу, содержащую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α, определенных ниже, когда W представляет собой (i) прямую или разветвленную моноалкиламиногруппу, в которой алкильная группа содержит от 1 до 4 атомов углерода, (ii) аралкилоксикарбониламиногруппу, в которой аралкильная группа включает от 7 до 12 атомов углерода, которая может содержать от 1 до 3 заместителей α, определенных ниже, на арильной группе;
заместитель α представляет собой группу, выбранную из группы, включающей (i) алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 6 атомов углерода, (ii) прямую или разветвленную галогенированную алкильную группу, содержащую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) алкоксигруппу с прямой или разветвленной цепью, содержащую от 1 до 4 атомов углерода, (v) прямую или разветвленную галогенированную алкоксигруппу, содержащую от 1 до 4 атомов углерода, (vi) прямую или разветвленную алкилтиогруппу, содержащую от 1 до 4 атомов углерода, (vii) прямую или разветвленную алкилсульфонилгруппу, содержащую от 1 до 4 атомов углерода, (viii) атом галогена, (ix) цианогруппу, (х) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной, и каждая включает от 1 до 4 атомов углерода, (xi) арильную группу, содержащую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей β, которые могут быть одинаковыми или различными, определенных ниже, (xii) арилоксигруппу, содержащую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей β, определенных ниже, на арильной группе, (xiii) моно- или дициклическую, 5-10-членную гетероарильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей β, определенных ниже, и (xiv) моно- или дициклическую, 5-10-членную гетероарилоксигруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы;
заместитель β представляет собой (i) алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 6 атомов углерода, (ii) прямую или разветвленную галогенированную алкильную группу, содержащую от 1 до 4 атомов углерода, (iii) гидроксильную группу, (iv) алкоксигруппу с прямой или разветвленной цепью, содержащую от 1 до 4 атомов углерода, (v) прямую или разветвленную гидроксиалкильную группу, содержащую от 1 до 4 атомов углерода, (vi) прямую или разветвленную алифатическую ацильную группу, содержащую от 1 до 5 атомов углерода, (vii) атом галогена, (viii) нитрогруппу, (ix) карбоксильную группу, (х) прямую или разветвленную диалкиламиногруппу, в которой каждая алкильная группа может быть одинаковой или различной и каждая содержит от 1 до 4 атомов углерода, и (xi) диалкиламиноалкильную группу, в которой диалкиламиногруппа включает две прямые или разветвленные алкильные группы, которые могут быть одинаковыми или различными и каждая включает от 1 до 4 атомов углерода, и алкильная группа представляет собой алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 4 атомов углерода;
Y представляет собой одинарную связь, атом кислорода или атом серы;
или их фармакологически приемлемые соли или их фармакологически приемлемые эфиры.
в которой диалкиламиногруппа включает две прямые или разветвленные алкильные группы, включающие от 1 до 4 атомов углерода, которые могут быть одинаковыми или различными, и алкильная группа представляет собой алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 4 атомов углерода.
Х представляет собой арильную группу, содержащую от 6 до 10 атомов углерода, которая может содержать от 1 до 3 заместителей α7, определенных ниже, или моно- или дициклическую, 5-10-членную гетероарильную группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей атом кислорода, атом азота и атом серы, которая может содержать от 1 до 3 заместителей α7, определенных ниже; заместитель α7 такой, как определен в п.19; и Y представляет собой одинарную связь или атом кислорода.
2-этокси-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] -2-пропилпропионовая кислота,
2-бутил-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] -фенил] пропионовая кислота,
3-[4-[2-(бифенил-4-карбониламино)этокси] фенил] -2-бутил-пропионовая кислота,
2-бутил-3-[4-[2-(4'-формилбифенил-4-карбониламино)этокси] фенил] пропионовая кислота,
2-бутил-3-[4-[2-(4'-диметиламинометилбифенил-4-карбониламино)этокси]фенил]пропионовая кислота,
2-бутил-3-[4-[2-(4'-карбоксибифенил-4-карбониламино)этокси]фенил]пропионовая кислота,
2-бутил-3-[4-[2-(3'-метоксибифенил-4-карбониламино)этокси] фенил]пропионовая кислота,
2-бутил-3-[4-[2-(3'-гидроксибифенил-4-карбониламино)этокси]фенил]пропионовая кислота,
2-бутил-3-[4-[2-(2'-метоксибифенил-4-карбониламино)этокси] фенил]пропионовая кислота,
2-бутил-3-[4-[2-(4'-гидрокси-3,5-диметилбифенил-4-карбониламино)этокси] фенил]пропионовая кислота,
2-бутил-3-[4-[2-(2-метоксипиридин-5-карбониламино)этокси] фенил] пропионовая кислота,
2-бутил-3-[4-[2-(4-диэтиламинобензоиламино)этокси]фенил]пропионовая кислота,
2-бутил-3-[4-[3-(4-пиридил-2-илбензоиламино)пропокси] фенил] пропионовая кислота,
2-фенокси-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
3-[4-[2-(бифенил-4-карбониламино)этокси]фенил]-2-феноксипропионовая кислота,
3-[4-[2-(4'-фторбифенил-4-карбониламино)этокси] фенил] -2-феноксипропионовая кислота,
3-[4-[2-(4'-хлорбифенил-4-карбониламино)этокси] фенил] -2-феноксипропионовая кислота,
3-[4-[2-(4'-трифторметилбифенил-4-карбониламино)этокси] фенил] -2-феноксипропионовая кислота,
2-(4-изопропилфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси]фенил] пропионовая кислота,
3-[4-[2-(бифенил-4-карбониламино)этокси] фенил] -2-(4-изопропилфенокси)пропионовая кислота,
2-(4-изопропилфенокси)-3-[4-[2-(2-фенилпиридин-5-карбониламино)этокси] фенил]пропионовая кислота,
2-(4-изопропилфенокси)-3-[4-[2-[2-(4-метоксифенил)-пиридин-5-карбониламино]этокси]фенил]пропионовая кислота,
3-[4-[2-[2-(4-фторфенил)пиридин-5-карбониламино] этокси]фенил]-2-(4-изопропилфенокси)пропионовая кислота,
3-[4-[2-[2-(2,2,3,3-тетрафторпропокси)пиридин-5-карбониламино] этокси] фенил]-2-(4-изопропилфенокси)пропионовая кислота,
2-(4-изопропилфенокси)-3-[4-[2-[4-(3-трифторметилпиридин-6-ил)бензоиламино]этокси]фенил]пропионовая кислота,
2-(4-изопропилфенокси)-3-[4-[2-[4-(3-нитропиридин-6-ил)бензоиламино] этокси]фенил]пропионовая кислота,
2-(4-изопропилфенокси)-3-[4-[2-[4-(3-метоксипиридин-6-ил)бензоиламино] этокси]фенил]пропионовая кислота,
2-(4-изопропилфенокси)-3-[4-[2-[4-(3-диметиламинопиридин-6-ил)бензоиламино]этокси]фенил]пропионовая кислота,
2-(4-метоксифенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
2-(3-фенилпропил)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
2-(4-метилфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
2-(4-трет-бутилфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил]пропионовая кислота,
2-(4-фторфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
2-(4-хлорфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
2-(4-трифторметилфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси]фенил]пропионовая кислота,
2-(4-трифторметоксифенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил]пропионовая кислота,
2-(3-фторфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
2-(3,5-дифторфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
2-(3,4-дифторфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
2-(3,4, 5-трифторфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил]пропионовая кислота,
2-(2,3,4,5,6-пентафторфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси]фенил]пропионовая кислота,
2-метил-2-фенокси-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
2-(4-изопропилфенокси)-2-метил-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси]фенил]пропионовая кислота,
2-(4-изопропилфенокси)-3-[4-[2-[2-(4-метоксифенил)-пиридин-5-карбониламино]этокси]фенил]-2-метилпропионовая кислота и
3-[4-[2-[2-(2,2,3, 3-тетрафторпропокси)пиридин-5-карбониламино] этокси] фенил]-2-(4-изопропилфенокси)-2-метилпропионовая кислота.
2-этокси-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] -2-пропилпропионовая кислота,
2-бутил-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
2-бутил-3-[4-[2-(4'-формилбифенил-4-карбониламино)этокси] фенил] пропионовая кислота,
2-бутил-3-[4-[2-(4'-гидрокси-3,5-диметилбифенил-4-карбониламино)этокси] фенил]пропионовая кислота,
2-фенокси-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
3-[4-[2-(бифенил-4-карбониламино)этокси] фенил] -2-фенокси-пропионовая кислота,
3-[4-[2-(4'-фторбифенил-4-карбониламино)этокси] фенил] -2-феноксипропионовая кислота,
3-[4-[2-(4'-хлорбифенил-4-карбониламино)этокси] фенил] -2-феноксипропионовая кислота,
2-(4-изопропилфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси]фенил] пропионовая кислота,
3-[4-[2-(бифенил-4-карбониламино)этокси] фенил] -2-(4-изопропилфенокси)пропионовая кислота,
2-(4-изопропилфенокси)-3-[4-[2-(2-фенилпиридин-5-карбониламино)этокси] фенил]пропионовая кислота,
2-(4-изопропилфенокси)-3-[4-[2-[2-(4-метоксифенил)-пиридин-5-карбониламино]этокси]фенил]пропионовая кислота,
3-[4-[2-[2-(4-фторфенил)пиридин-5-карбониламино] этокси]фенил]-2-(4-изопропилфенокси)пропионовая кислота,
3-[4-[2-[2-(2,2,3,3-тетрафторпропокси)пиридин-5-карбониламино] этокси] фенил]-2-(4-изопропилфенокси)пропионовая кислота,
2-(4-изопропилфенокси)-3-[4-[2-[4-(3-метоксипиридин-6-ил)бензоиламино] этокси]фенил]пропионовая кислота,
2-(4-изопропилфенокси)-3-[4-[2-[4-(3-диметиламинопиридин-6-ил)бензоиламино]этокси]фенил]пропионовая кислота,
2-(4-метоксифенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
2-(4-метилфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
2-(4-трет-бутилфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил]пропионовая кислота,
2-(4-фторфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
2-(4-хлорфенокси)-3-[4-[2-(4-пиpидил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
2-(4-трифторметилфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси]фенил]пропионовая кислота,
2-(4-трифторметоксифенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил]пропионовая кислота,
2-(3-фторфенокси)-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
2-(3,4,5-трифторфенокси)-3-[4-[2-(4-пкридил-2-илбензоиламино)этокси] фенил]пропионовая кислота,
2-метил-2-фенокси-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси] фенил] пропионовая кислота,
2-(4-изопропилфенокси)-2-метил-3-[4-[2-(4-пиридил-2-илбензоиламино)этокси]фенил]пропионовая кислота,
2-(4-изопропилфенокси)-3-[4-[2-[2-(4-метоксифенил)-пиридин-5-карбониламино]этокси]фенил]-2-метилпропионовая кислота и
3-[4-[2-[2-(2,2,3,3-тетрафторпропокси)пиридин-5-карбониламино)этокси] фенил]-2-(4-изопропилфенокси)-2-метилпропионовая кислота.

Комментарии