Мостиковые производные спиро[2.4]гептана в качестве агонистов рецептора alx и/или fprl2 - RU2540274C2
Код документа: RU2540274C2
Описание
Настоящее изобретение относится к мостиковым производным спиро[2.4]гептана формулы (I) и их применению в качестве лекарственных средств. Настоящее изобретение также относится к родственным вопросам, включая способы получения соединений, фармацевтические композиции, содержащие одно или большее количество соединении формулы (I), и предпочтительно к их применению в качестве агонистов рецептора ALX и/или FPRL2.
ALXR (alias рецептор липоксина А4, FPRL1, FPR2; раскрытый в WO 2003/082314, как нуклеотидная последовательность SEQ ID NO:1 и аминокислотная последовательность SEQ ID NO:2) является представителем семейства рецепторов, связанных с белком G. Установлено, что ALXR опосредует мобилизацию кальция в ответ на высокую концентрацию формилметионин-лейцилфенилаланинокого пептида. Кроме того, установлено, что метаболит липида, липоксин А4 (LXA4), и его аналоги с высоким сродством связывают ALXR и усиливают выработку арахидоновой кислоты и активацию белка G в трансфицированных посредством ALXR клетках (Chiang et al., Pharmacol. Rev., 2006, 58, 463-487). Влияние LXA4 исследовано с помощью множества моделей заболеваний на животных и установлено, что LXA4 обладает высокой противовоспалительной и способствующей разрешению заболеваний активностью. Модели заболеваний, в которых LXA4 или производные или стабильные аналоги проявляют активность in vivo, включают, например, воспаление кожи, дорсального воздушного кармана, ишемию/реперфузионное поражение, перитонит, колит, мезангиопролиферативный нефрит, плеврит, астму, муковисцидоз, сепсис, повреждение роговицы, ангиогенез, периодонтит, вызванную каррагенаном гипералгезию и реакцию трансплантат против хозяина (GvHD) (Schwab and Serhan, Current Opinion in Pharmacology, 2006, 414-420). ALXR также идентифицировали как функциональный рецептор различных пептидов, включая фрагмент прионного белка, пептид, полученный из штамма gpl20 вируса иммунодефицита человека (ВИЧ)-1LAI и амилоида-бета 1-42 (Аb42) (обзор, см. Le et al, Protein Pept Lett., 2007, 14, 846-853), и было предположено, что он участвует в патогенезе болезни Альцгеймера (БА) в некоторых решающих путях (Yazawa et al, FASEB J., 2001, 15, 2454-2462). Активация ALXR в макрофагах и микроглиальных клетках инициирует опосредуемый белком G каскад сигналов, который усиливает направленную миграцию клеток, фагоцитоз и высвобождение медиатора. Эти явления могут обеспечивать рекрутмент мононуклеарных клеток вблизи от старческих бляшек в областях поражения головного мозга с помощью БА, где чрезмерно продуцируется и накапливается Аb42. Хотя накопление лейкоцитов на участках поражения ткани можно считать врожденным ответом хозяина, направленным на устранение токсичных агентов, активированные мононуклеарные фагоциты также выделяют различные вещества, такие как супероксидные анионы, которые могут быть токсичными для нейронов. Таким образом, ALXR может опосредовать провоспалительные ответы, вызванные Аb42 в пораженном БА головном мозге, и обострять прогрессирование заболевания. Также сообщали, что гуманин (HN), пептид, способный выполнять нейропротективное воздействие, воздействует совместно с ALXR человека с Аb42 на мононуклеарные фагоциты и линии нервных клеток и было предположено, что нейропротективная активность HN может быть приписана конкуренцией с занятостью посредством ALXR (Ying et al., J. Immunol., 2004, 172, 7078-7085).
FPRL2 (alias формилпептидный рецептор типа-2, FPR3; раскрытый в US 2006/0078559, как нуклеотидная последовательность SEQ ID NO:1 и аминокислотная последовательность SEQ ID NO: 2) является представителем семейства рецепторов, связанных с белком G. иРНК FPRL2 обнаружен в различных тканях, включая сердце, аорту, вены, селезенку, легкие, трахею, печень, поджелудочную железу, надпочечники, шейку матки, прямую кишку, тонкий кишечник, хроническое воспаление подвздошной кишки, плаценту, спинной мозг, лимфатические узлы, дорсальные центры разложения, мосты, мягкие мозговые оболочки, постцентральную извилину, лобную долю мозга, пораженного болезнью Альцгеймера, и опухоль молочной железы. FPRL2 экспрессируется в моноцитах, макрофагах, миелоидных дендритных клетках, плазмоцитоидных дендритных клетках, эозинофилах, но не в нейтрофилах человека (Migeotte et al, J. Exp. Med., 2005, 201, 83-89; Devosee et al., J. Immunol., 2009, 4974-4984). Установлено, что гуманин и его аналоги связывают FPRL2 с высоким сродством (Harada et al, Biochem. Biophys. Res. Commun., 2004, 324, 255-261). Установлено, что гуманин защищает нервные клетки от целого ряда токсических поражений. Они включают нейротоксичность, опосредуемую тремя мутантными генами, которые вызывают САД, а также абеталипопротеинемия (Hashimoto et al., Biochem. Biophys. Res. Commun., 2001, 283, 460-468). Также сообщали, что гуманин обладает способностью защищать нейроны от потери сыворотки (Takahashi et al., Neuroreport, 2002, 13, 903-907) и от эксайтотоксичной гибели (Caricasole et al., FASEB J., 2002, 1331-1333). Также установлено, что гуманин защищает кортикальные нейроны от вызванного прионным пептидом апоптоза. Также установлено, что гуманин уменьшает нарушение способности к обучению и памяти у мышей, что свидетельствует о его применимости в качестве лечебного средства, предназначенного для предупреждения или лечения нарушения способности к обучению и памяти (Mamiya et al., 2001, Br. J. Pharmacol., 134, 1597-1599). Также установлено, что гуманин защищает мышечные клетки и цереброваскулярные гладкомышечные клетки от вызванной абеталипопротеинемией токсичности. Кроме того, установлено, что FPRL2 распознает F2L, полипептид, представляющий собой связывающий гем белок (HBP) (Migeotte et al., US 2006/0078559). Migeotte et al. (J. Exp. Med., 2005, 201, 83-89) предположили, что F2L может выделяться из HBP после воздействия на клетки или гибели клеток. Затем эта молекула опосредует рекрутмент моноцитов и дендритных клеток посредством FPRL2. Незрелые и зрелые дендритные клетки (iDC и mDC соответственно) мигрируют в различные анатомические центры, например, центры отложения антигена (Ag) и вторичные лимфоидные органы соответственно и выполняют свою роль по индуцированию первичных, Ag-специфических иммунных ответов. Направление миграции iDC и mDC основано на проводимом ими экспрессировании функциональных хемотаксических рецепторов и центрах in vivo, экспрессирования соответствующих лигандов, включая хемокины и/или классические хемоаттрактанты. FPRL2, экспрессирующийся посредством ДК, должен быть функциональным и опосредовать влияние различных известных лигандов на ДК и это свидетельствует о том, что взаимодействие FPRL2 и его эндогенного лиганда (лигандов) может участвовать в регуляции направленной миграции ДК при поступлении Ag и процессинге на периферии, а также стимулирующей Т-клетки фазы иммунных ответов. Kang et al. (J. Immunol, 2005, 175, 685-692) показали, что лиганды FPRL2, полученный из Helicobacter pylori пептид Нр(2-20) и F2L, ингибируют продуцирование IL-12 в полученном из моноцитов ДК (MoDC), индуцируемое посредством ЛПС, что свидетельствует в пользу заключения о том, что FPRL2 участвует в ингибировании созревания MoDC посредством ЛПС. Поэтому FPRL2 может участвовать в инициировании различных воспалительных заболеваний, основанных на гибели клеток, и может представлять собой привлекательный объект для терапевтических воздействий.
Биологические характеристики агонистов ALXR включают, но не ограничиваются только ими, миграцию/активацию моноцитов/макрофагов/микроглиальных/дендритных клеток, миграцию/активацию нейтрофилов, регуляцию активации, пролиферации и дифференциации лимфоцитов, регуляцию воспаления, регуляцию продуцирования и/или высвобождения цитокинов, регуляцию продуцирования
и/или высвобождения провоспалительного медиатора, регуляцию иммунной реакции.
Биологические характеристики агонистов FPRL2 включают, но не ограничиваются только ими, миграцию/активацию моноцитов/макрофагов/микроглиальных клеток, регуляцию активации, пролиферации и дифференциации лимфоцитов, созревания и миграции дендритных клеток, регуляцию воспаления, регуляцию продуцирования и/или высвобождения цитокинов, регуляцию продуцирования и/или высвобождения провоспалительного медиатора, регуляцию иммунной реакции.
Настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, которые являются непептидными агонистами рецептора человека ALX и/или FPRL2. Различные мостиковые производные спиро[2.4]гептана раскрыты в WO 9502587. Соединения применимы для предупреждения или лечения заболеваний, которые отвечают на модулирование рецептора ALX и/или FPRL2, таких как воспалительные заболевания, обструктивные заболевания дыхательных путей, аллергические патологические состояния, опосредуемые с помощью ВИЧ ретровирусные инфекции, сердечнососудистые нарушения, нейровоспаление, неврологические нарушения, боль, опосредуемые прионом заболевания и опосредуемые амилоидом нарушения (предпочтительно болезнь Альцгеймера); кроме того, они применимы для предупреждения или лечения аутоиммунных заболеваний и для модулирования иммунных ответов (предпочтительно вызванных вакцинацией).
Ниже описаны различные варианты осуществления настоящего изобретения:
1) Настоящее изобретение относится к соединениям формулы (I),

в которой
W обозначает -CH2CH2- или -СН=СН-;
Y обозначает связь или (С1-С4)алкандиильную группу и R1 обозначает
- арильную или гетероарильную группу и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, (С1-С4)алкоксигруппу, (С1-С2)алкилкарбонил, (С1-С2)фторалкил, (С1-С2)фторалкоксигруппу, нитрогруппу, цианогруппу и фенил, где фенил является незамещенным или монозамещенным галогеном; или
- бензо[d][1,3]диоксолил; или
- арилоксигруппу; или
- циклогексильную или циклогексенильную группу и эти группы независимо являются незамещенными или монозамещенными (С1-С4)алкилом; или
- (С1-С2)алкилкарбонил; или
- (С1-С4)алкоксикарбонил;
или Y вместе с R1 обозначает (С4-С6)алкильную группу или амино-(С4-С6)алкильную группу;
Z обозначает -C(O)NR3-* или -CH2NR4C(O)-*,
где звездочки обозначают связь, соединяющую с R2;
R2 обозначает
- (С3-С6)циклоалкил, который является незамещенным или монозамещенным гидроксигруппой, гидроксиметилом, R5R6N-CH2-, гетероциклилметилом или -CONH2; или
- (С1-С6)алкил, который является незамещенным или монозамещенным фтором, трифторметилом, (С1-С4)алкилтиогруппой, (С1-С4)алкоксикарбонилом, гидроксигруппой, цианогруппой, -NR5R6, -СООН, -C(O)NR7R8 или необязательно монозамещенным (С1-С4)алкоксигруппой, где заместитель выбран из группы, включающей гидроксигруппу и гетероциклил; или
- (С1-С6)алкил (предпочтительно (С1-С5)алкил), который является монозамещенным
- (С3-С6)циклоалкилом и этот циклоалкил является незамещенным или монозамещенным группой -NR5R6 или гидроксигруппой;
- гетероциклилом и этот гетероциклил является незамещенным или монозамещенным по атому азота (С1-С4)алкилом, (С1-С2)алкилкарбонилом или трет-бутоксикарбонилом, и/или моно- или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей галоген, (С1-С4алкил и (С1-С2)алкокси-(С1-С2)алкил; или
- арильной или гетероарильной группой и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4алкил, -CH2NHR9, -SO2NH2 и фенил; или
- (С3-С5)фторалкил, который является монозамещенным гетероциклилом, и этот гетероциклил является незамещенным (предпочтительный) или моно- или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей галоген и (С1-С4)алкил; или
- гетероциклил, который является незамещенным или монозамещенным по атому азота (С1-С6)алкилом, бензилом или трет-бутоксикарбонилом или монозамещенным по атому углерода пирролидин-1-илметилом; или
- арильную или гетероарильную группу и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил и фенил; или
- группу, выбранную из группы, включающей 1-карбамоил-2-фенилэтил, 1-метоксиметил-2-фенилэтил, 2-морфолино-2-фенилэтил, 2-фенилвинил, 2,2-дихлор-1-метилциклопропил;
R3 обозначает водород, (С1-С3)алкил или 2-метоксиэтил; или
R2 и R3 вместе со связанным с ними атомом азота образуют 5-7-членное кольцо
и это кольцо замещено амино-(С1-С4)алкилом;
R4 обозначает водород или метил;
R5 обозначает водород, (C1-С3)алкил или трет-бутоксикарбонил; R6 обозначает водород или (С1-С3)алкил;
R7 и R8 независимо друг от друга обозначают водород или метил; или
R7 и R8 вместе со связанным с ними атомом азота образуют пирролидиновое или пиперидиновое кольцо; и
R9 обозначает водород или трет-бутоксикарбонил;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
Для исключения какого-либо сомнения отметим, что термин "Z обозначает -C(O)NR3-*, где звездочка обозначает связь, соединяющую с R2", означает, что остаток R2 связан с атомом азота амидного фрагмента.
Конфигурация соединений формулы (I), соответствующих варианту осуществления 1), такова, что заместитель R1-Y-NH-C(O)- расположен относительно близко к группе W (эндо-положение), а заместитель R2-Z-расположен относительно близко к циклопропильному фрагменту (экзо-положение).
Формула I включает соединения формулы ISt1 и формулы ISt2 и их смеси.


Для исключения какого-либо сомнения отметим, что соединения формулы (I) названы по аналогии со следующими примерами: смесь энантиомеров структуры
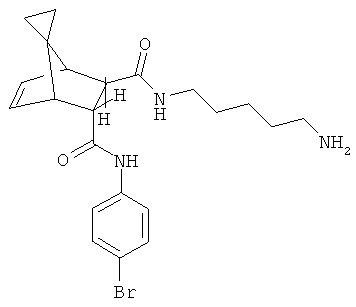
названа, как (5R*)-N5-(4-бромфенил)-(6R*)-N6-(5-аминопентил)-(4S*,7R*)-[4,7-этениленспиро[2,4]гептан]-5,6-дикарбоксамид;
чистый стереоизомер структуры

назван, как (5R)-N5-(5-ацетилфуран-2-илметил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид; и смесь энантиомеров структуры

названа, как (5R*)-N5-(4-бромфенил)-(6R*)-6-[(3-(3,5-диметилпиразол-1-ил)-пропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид.
Соединения формулы (I), соответствующие варианту осуществления 1), могут содержать один или большее количество стереогенных или асимметрических центров, таких как один или большее количество асимметрических атомов углерода. Заместители у двойной связи могут находиться в (Z)- или (E)-конфигурации, если не указано иное. Таким образом, соединения формулы (I) могут находиться в виде смесей стереоизомеров или предпочтительно в виде чистых стереоизомеров. Смеси стереоизомеров можно разделить по методикам, известным специалисту в данной области техники.
В следующих абзацах приведены определения различных химических фрагментов соединений, предлагаемых в настоящем изобретении, и они применимы во всем описании и формуле изобретения, если в других определениях не приведены более широкие или более узкие определения.
Термин "алкил" при использовании по отдельности или в комбинации означает обладающую линейной или разветвленной цепью алкильную группу, содержащую от 1 до 6 атомов углерода. Термин "(Сх-Су)алкил" (х и у являются целыми числами), означает алкильную группу, определенную выше, содержащую от х до у атомов углерода. Например, (С1-С6)алкильная группа содержит от 1 до 6 атомов углерода. Типичные примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, изомерные пентилы и изомерные гексилы. Алкильная группа может быть незамещенной или замещенной, как это явно определено.
В случае, если (С1-С4алкильная группа является заместителем арильной, гетероарильной или гетероциклильной группы, термин "(С1-С4)алкил" означает (С1-С4)алкильные группы, определенные выше. Примерами указанных групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Предпочтительными являются метил, этил и изобутил и наиболее предпочтительным является метил.
В случае, если (С1-С6)алкильная группа является заместителем гетероциклильной группы, термин "(С1-С6)алкил" означает (С1-С6)алкильные группы, определенные выше. Примерами указанных групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, изомерные пентилы и изомерные гексилы. Предпочтительными являются метил, этил и 3-метилбут-1-ил. Наиболее предпочтительным является 3-метилбут-1-ил.
В случае, если (С1-С4)алкильная группа является заместителем циклогексильной или циклогексенильной группы, термин "(С1-С4)алкил" означает (С1-С4)алкильные группы, определенные выше. Примерами указанных групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Предпочтительными являются метил и трет-бутил и наиболее предпочтительным является метил.
В случае, если "R2" обозначает "(C1-C6)алкил, который является незамещенным или монозамещенным фтором, трифторметилом, (C1-С4)алкилтиогруппой, (С1-С4)алкоксикарбонилом, гидроксигруппой, цианогруппой, -NR5R6, -СООН, -C(O)NR7R8 или необязательно монозамещенным (С1-С4)алкоксигруппой, где заместитель выбран из группы, включающей гидроксигруппу и гетероциклил", термин "(С1-С6)алкил" означает (С1-С6)алкильные группы, определенные выше. Примерами указанных групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил,
трет-бутил, изомерные пентилы и изомерные гексилы. Предпочтительными являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, 2,2-диметилпроп-1-ил, 3-метилбут-1-ил, 3,3-диметилбут-1-ил, пент-1-ил, пент-2-ил, 4-метилпент-2-ил и гекс-1-ил. Наиболее предпочтительными являются метил, этил, н-пропил, н-бутил, изобутил, 2,2-диметилпроп-1-ил и пент-1-ил. Указанные выше (C1-C6)алкильные группы являются незамещенными или монозамещенными фтором, трифторметилом, (С1-С4)алкилтиогруппой, (С1-С4)алкоксикарбонилом, гидроксигруппой, цианогруппой, -NR5R6, -СООН, -C(O)NR7R8 или необязательно монозамещены (С1-С4)алкоксигруппой, где заместитель выбран из группы, включающей гидроксигруппу и гетероциклил. Предпочтительный заместитель выбран из группы, включающей фтор, трифторметил, метоксигруппу, этоксигруппу, этилтиогруппу, гидроксигруппу, цианогруппу, -NR5R6 или -C(O)NR7R8.
В другом случае, если "R2" обозначает "(С1-С6)алкил", термин означает (C1-С6)алкильные группы, определенные выше. Примерами указанных групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, изомерные пентилы и изомерные гексилы. Предпочтительными являются метил, этил, н-пропил, н-бутил и н-пентил. Более предпочтительными являются н-бутил и н-пентил и наиболее предпочтительным является н-бутил. Указанные выше (С1-С6)алкильные группы являются монозамещенными (С3-С6)циклоалкилом и этот циклоалкил является незамещенным или монозамещенным группой -NR5R6 или гидроксигруппой; гетероциклилом и этот гетероциклил является незамещенным или монозамещенным по атому азота (C1-С4)алкилом, (С1-С2)алкилкарбонилом или трет-бутоксикарбонилом, и/или моно-или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил и (C1-С2)алкокси-(С1-С2)алкил; или арильной или гетероарильной группой и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, -CH2NHR9, -SO2NH2 и фенил. В предпочтительном варианте осуществления (С1-С6)алкильные группы замещены гетероциклильной группой, которая является незамещенной, монозамещенной по атому азота метилом или этилом или монозамещенной по атому углерода фтором. В другом предпочтительном варианте осуществления (С1-С6)алкильные группы замещены арильной или гетероарильной группой и эти группы независимо являются незамещенными, моно- или дизамещенными (предпочтительно незамещенными или монозамещенными), где заместители независимо выбраны из группы, включающей галоген, метил, этил, -CH2NH2 и -SO2NH2.
В случае, если "R3" обозначает "(С1-С3)алкил", термин означает (C1-С3)алкильные группы, определенные выше. Примерами указанных групп являются метил, этил, н-пропил и изопропил. Предпочтительными являются метил, этил и н-пропил. Наиболее предпочтительными являются метил и этил.
В случае, если "R5" обозначает "(С1-С3)алкил", термин означает (C1-С3)алкильные группы, определенные выше. Примерами указанных групп являются метил, этил, н-пропил и изопропил. Предпочтительными являются метил, этил и н-пропил. Наиболее предпочтительными являются метил и этил.
В случае, если "R6" обозначает "(С1-С3)алкил", термин означает (C1-С3)алкильные группы, определенные выше. Примерами указанных групп являются метил, этил, н-пропил и изопропил. Предпочтительными являются метил, этил и н-пропил. Наиболее предпочтительными являются метил и этил.
Термин "(С1-С4)алкандиильная группа" при использовании для Y означает углеродную цепь, содержащую от 1 до 4 атомов углерода, которая присоединена к остатку R1 и к амидному атому азота остатка молекулы, как это показано в формуле (I). Два соответствующих остатка могут быть присоединены к одному или к разным атомам углерода алкандиильной группы. Предпочтительными примерами (С1-С4)алкандиильных групп являются метандиил, этан-1,1-диил, этан-1,2-диил, пропан-1,3-диил и бутан-1,4-диил. Более предпочтительными являются метандиил и этан-1,2-диил. Наиболее предпочтительным является метандиил.
В случае, если ''Y вместе с R1" обозначает "(С4-С6)алкил", термин означает (С4-С6)алкильные группы, определенные выше. Примерами указанных групп являются н-бутил, изобутил, втор-бутил, трет-бутил, изомерные пентилы и изомерные гексилы. Предпочтительными являются н-бутил, 3-метилбутил, 2-этилбутил и н-пентил. Наиболее предпочтительным является н-пентил.
В случае, если "Y вместе с R1" обозначает "амино-(С4-С6)алкильную" группу, термин означает (С4-С6)алкильную группу, определенную выше, в которой один атом водорода заменен аминогруппой. Примерами указанных групп являются 4-аминобутил, 5-аминопентил и 6-аминогексил. Наиболее предпочтительными являются 4-аминобутил и 5-аминопентил.
Термин "амино-(С1-С4)алкил" означает (С1-С4)алкильную группу, определенную выше, в которой один атом водорода заменен аминогруппой. Предпочтительным примером является аминометил.
Термин "(С3-С6)циклоалкил" при использовании по отдельности или в комбинации означает циклоалкильную группу, содержащую от 3 до 6 атомов углерода. Примерами (C3-C6)циклоалкильных групп являются циклопропил, циклобутил, циклопентил и циклогексил. (C3-C6)Циклоалкильная группа может быть незамещенной или замещенной, как это явно определено.
В случае, если "R2" обозначает "(C3-C6)циклоалкил", термин означает (С3-С6)циклоалкильные группы, определенные выше. Примерами указанных групп являются циклопропил, циклобутил, циклопентил и циклогексил. Предпочтительными являются циклопропил, циклопентил и циклогексил. Наиболее предпочтительными являются циклопентил и циклогексил. Указанные выше (C3-C6)циклоалкильные группы являются незамещенными или монозамещенными гидроксигруппой, гидроксиметилом, R5R6N-CH2-, гетероциклилметилом или -CONH2 (предпочтительно гидроксигруппой или пирролидин-1-илметилом).
В случае, если "R2" обозначает "(С1-С6)алкил, который является монозамещенным (C3-C6)циклоалкилом", термин "(C3-C6)циклоалкил" означает указанные выше группы. Предпочтительными являются циклопропил и циклогексил. Указанные выше (C3-C6)циклоалкильные группы являются незамещенными или монозамещенными -NR5R6 или гидроксигруппой (предпочтительно гидроксигруппой).
Термин "алкоксигруппа" при использовании по отдельности или в комбинации означает группу алкил-О-, где алкильная группа является такой, как определено выше. Термин "(Сх-Су)алкоксигруппа" (х и у являются целыми числами) означает алкоксигруппу, определенную выше, содержащую от х до у атомов углерода. Например, (С1-С4)алкоксигруппа содержит от 1 до 4 атомов углерода. Типичные примеры алкоксигрупп включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу и трет-бутоксигруппу. Алкоксигруппа может быть незамещенной или замещенной, как это явно определено.
В случае, если (C1-C4)алкоксигруппа является заместителем арильной или гетероарильной группы, термин "(C1-C4)алкоксигруппа" означает (С1-С4)алкоксигруппы, определенные выше. Примерами указанных групп являются метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа и трет-бутоксигруппа. Предпочтительными являются метоксигруппа, этоксигруппа и изопропоксигруппа. Наиболее предпочтительным является метоксигруппа.
В случае, если "R2" обозначает "(С1-С6)алкил, который является монозамещенным необязательно монозамещенной (С1-С4)алкоксигруппой", термин "необязательно монозамещенная (С1-С4)алкоксигруппа" означает (C1-С4)алкоксигруппу, определенную выше, которая является незамещенной или монозамещенной. Примерами указанных групп являются метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа и трет-бутоксигруппа. Предпочтительными являются метоксигруппа и этоксигруппа. Указанная выше (С1-С4)алкоксигруппа является незамещенной или монозамещенной гидроксигруппой или гетероциклилом и предпочтительно незамещенной или монозамещенной гетероциклилом.
Термин "(С1-С2)алкокси-(С1-С2)алкил" означает (С1-С2)алкильную группу, определенную выше, в которой один атом водорода заменен (C1-С2)алкоксигруппой, определенной выше. Примерами (С1-С2)алкокси-(С1-С2)алкильных групп являются метоксиметил, метоксиэтил, этоксиметил и этоксиэтил. Предпочтительным является метоксиметил.
Термин "алкилтиогруппа" при использовании по отдельности или в комбинации означает группу алкил-S-, где алкильная группа является такой, как определено выше. Термин "(Сх-Су)алкилтиогруппа" (х и у являются целыми числами) означает алкилтиогруппу, определенную выше, содержащую от х до у атомов углерода. Например, (С1-С4)алкилтиогруппа содержит от 1 до 4 атомов углерода. Типичные примеры алкилтиогрупп включают метилтиогруппу, этилтиогруппу, н-пропилтиогруппу, изопропилтиогруппу, н-бутилтиогруппу, изобутилтиогруппу, втор-бутилтиогруппу и трет-бутилтиогруппу.
Предпочтительными являются метилтиогруппа и этилтиогруппа. Наиболее предпочтительной является этилтиогруппа.
Термин "(С1-С2)алкилкарбонил" при использовании по отдельности или в комбинации означает группу (С1-С2)алкил-С(O)-, в которой (С1-С2)алкильная группа является такой, как определено выше. Типичные примеры (C1-С2)алкилкарбонильных групп включают метилкарбонил (ацетил) и этилкарбонил (пропионил). Предпочтительным является ацетил.
Термин "(C1-C4)алкоксикарбонил" при использовании по отдельности или в комбинации означает группу (С1-С4)алкокси-С(O)-, где (С1-С4)алкоксигруппа является такой, как определено выше. Типичные примеры (C1-С4)алкоксикарбонильных групп включают метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил и трет-бутоксикарбонил. Предпочтительными являются метоксикарбонил и трет-бутоксикарбонил. Наиболее предпочтительным является метоксикарбонил.
Термин "(Сх-Су)фторалкил" (х и у являются целыми числами) означает алкильную группу, определенную выше, содержащую от х до у атомов углерода, в которой один или большее количество (и, возможно, все) атомов водорода заменены фтором. Фторалкильная группа может быть незамещенной или замещенной, как это явно определено.
В случае, если (С1-С2)фторалкильная группа является заместителем арильной или гетероарильной группы, термин "(С1-С2)фторалкил" означает (C1-С2)фторалкильные группы, определенные выше. Примерами указанных групп являются трифторметил, дифторметил и 2,2,2-трифторэтил. Предпочтительными являются трифторметил и 2,2,2-трифторэтил. Наиболее предпочтительным является трифторметил.
В случае, если "R2" обозначает "(С3-С5)фторалкил", термин означает (С3-С5)фторалкильную группу, определенную выше. Примерами указанных групп являются 2-фторпропил, 2,2-дифторпропил, 2-фторбутил, 2,2-дифторбутил, 3-фторбутил, 3,3-дифторбутил, 2-фторпентил, 2,2-дифторпентил, 3-фторпентил, 3,3-дифторпентил, 4-фторпентил и 4,4-дифторпентил. Предпочтительными являются 3-фторбутил и 3,3-дифторбутил. Наиболее предпочтительным является 3-фторбутил. Указанные выше (С3-С5)фторалкильные группы являются монозамещенными гетероциклилом.
Термин "(Сх-Су)фторалкоксигруппа" (х и у являются целыми числами) означает алкоксигруппу, определенную выше, содержащую от х до у атомов углерода, в которой один или большее количество (и, возможно, все) атомов водорода заменены фтором. Например, (С1-С2)фторалкоксигруппа содержит от 1 до 2 атомов углерода, в которой от 1 до 5 атомов водорода заменены фтором. Типичные примеры фторалкоксигрупп включают трифторметоксигруппу, дифторметоксигруппу и 2,2,2-трифторэтоксигруппу. Предпочтительными являются (С1)фторалкоксигруппы, такие как трифторметоксигруппа и дифторметоксигруппа. Наиболее предпочтительной является трифторметоксигруппа.
Термин галоген означает фтор, хлор, бром или йод.
В случае, если галоген является заместителем арильной или гетероарильной группы, термин предпочтительно означает фтор, хлор или бром и наиболее предпочтительно хлор или бром.
В случае, если галоген является заместителем гетероциклильной группы, термин наиболее предпочтительно означает фтор.
Термин "арил" при использовании по отдельности или в любой комбинации означает фенильную или нафтильную группу. Предпочтительной является фенильная группа. Арильная группа может быть незамещенной или замещенной, как это явно определено.
В случае, если R1 обозначает "арил", термин означает указанные выше группы (предпочтительно фенил) и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными (предпочтительно незамещенными, моно- или дизамещенными и наиболее предпочтительно моно-или дизамещенными), где заместители независимо выбраны из группы, включающей галоген, (C1-C4)алкил, (С1-С4)алкоксигруппу, (C1-С2)алкилкарбонил, (С1-С2)фторалкил, (С1-С2)фторалкоксигруппу, нитрогруппу, цианогруппу и фенил, где фенил является незамещенным или монозамещенным галогеном. Предпочтительные заместители независимо выбраны из группы, включающей галоген, (C1-C4)алкил, (С1-С4)алкоксигруппу, (C1-С2)алкилкарбонил, трифторметил и трифторметоксигруппу (и наиболее предпочтительно фтор, бром, метоксигруппу и трифторметил). Примерами таких арильных групп являются фенил, 4-метилфенил, 2,4-диметилфенил, 2,5-диметилфенил, 3,4-диметилфенил, 3,5-диметилфенил, 2-метоксифенил, 4-метоксифенил, 2,4-диметоксифенил, 3,4-диметоксифенил, 4-этоксифенил, 2-изопропоксифенил, 4-изопропоксифенил, 3-ацетилфенил, 4-ацетилфенил, 4-трифторметилфенил, 3-дифторметоксифенил, 4-трифторметоксифенил, 4-фторфенил, 2,3,5-трифторфенил, 2,4,6-трифторфенил, 4-хлорфенил, 2,4-дихлорфенил, 3-бромфенил, 4-бромфенил, 4-йодфенил, 3-хлор-2-фторфенил, 2-хлор-3,6-дифторфенил, 2-бром-4-фторфенил, 3-бром-4-фторфенил, 4-бром-2-фторфенил, 4-бром-3-фторфенил, 4-бром-2,3-дифторфенил, 4-бром-2,5-дифторфенил, 4-бром-2,6-дифторфенил, 4-бром-3,5-дифторфенил, 4-бром-3-хлорфенил, 5-метил-2-метоксифенил, 4-бром-2-метилфенил, 2-хлор-6-фтор-3-метилфенил, 2,3-дифтор-4-метоксифенил, 2,6-дифтор-4-метоксифенил, 3,5-дифтор-4-метоксифенил, 3-фтор-4-метоксифенил, 3-хлор-4-метоксифенил, 3-бром-4-метоксифенил, 2-фтор-3-трифторметилфенил, 2-фтор-5-трифторметилфенил, 3-фтор-5-трифторметилфенил, 4-фтор-3-трифторметилфенил, 2-хлор-5-трифторметилфенил и 4-бром-3-трифторметилфенил (и предпочтительно 4-метоксифенил, 4-трифторметилфенил, 2,4-дихлорфенил, 4-бромфенил, 4-бром-2-фторфенил, 4-бром-3-фторфенил и 4-бром-2,6-дифторфенил).
В случае, если R2 обозначает "арил", термин означает указанные выше группы (предпочтительно фенил) и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными (предпочтительно моно- или дизамещенными), где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил и фенил (и предпочтительно галоген). Примерами таких арильных групп являются 4-бромфенил и 2-хлор-3-фторфенил.
В случае, если R2 обозначает "(С1-С6)алкил, который является монозамещенным арильной группой", термин "арил" означает указанные выше группы (предпочтительно фенил) и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными (предпочтительно незамещенными или монозамещенными и наиболее предпочтительно монозамещенными), где заместители независимо выбраны из группы, включающей галоген, (C1-C4)алкил, -CH2NHR9, -SO2NH2 и фенил.
Предпочтительные заместители независимо выбраны из группы, включающей галоген, -CH2NHR9 и -SO2NH2 (и наиболее предпочтительно -CH2NH2 и -SO2NH2). Примерами таких арильных групп являются 4-фторфенил, 2-хлорфенил, 3-аминометилфенил, 4-аминометилфенил, 3-(трет-бутоксикарбониламинометил)-фенил, 4-(трет-бутоксикарбониламинометил)-фенил и 4-сульфамоилфенил (и предпочтительно 3-аминометилфенил, 4-аминометилфенил и 4-сульфамоилфенил).
Термин "арилоксигруппа" при использовании по отдельности или в комбинации означает группу арил-О-, где арильная группа является такой, как определено выше. Предпочтительным примером арилоксигруппы является феноксигруппа.
Термин "гетероарил" при использовании по отдельности или в любой комбинации означает 5-10-членное моноциклическое или бициклическое ароматическое кольцо, содержащее 1, 2 или 3 гетероатома, независимо выбранных из группы, включающей кислород, азот и серу. Примерами таких гетероарильных групп являются фуранил, оксазолил, изоксазолил, оксадиазолил, тиенил, тиазолил, изотиазолил, тиадиазолил, пирролил, имидазолил, пиразолил, триазолил, пиридил, пиримидил, пиридазинил, пиразинил, индолил, изоиндолил, бензофуранил, изобензофуранил, бензотиофенил, индазолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензоизотиазолил, бензотриазолил, бензо[2,1,3]оксадиазолил, бензо[2,1,3]тиадиазолил, бензо[1,2,3]тиадиазолил, хинолинил, изохинолинил, нафтиридинил, циннолинил, хиназолинил, хиноксалинил и фталазинил. Гетероарильная группа может быть незамещенной или замещенной, как это явно определено.
В случае, если R1 обозначает "гетероарил", термин означает указанные выше группы. Предпочтительными гетероарильными группами, использующимися в R1, являются фуранил (предпочтительно фуран-2-ил), оксазолил (предпочтительно оксазол-2-ил и оксазол-5-ил), изоксазолил (предпочтительно изоксазол-3-ил), оксадиазолил (предпочтительно [1,2,5]оксадиазолил), тиенил (предпочтительно тиофен-2-ил и тиофен-3-ил), тиазолил (предпочтительно тиазол-2-ил, тиазол-4-ил и тиазол-5-ил), тиадиазолил (предпочтительно [1,2,4]тиадиазол-5-ил и [1,3,4]тиадиазол-5-ил), имидазолил (предпочтительно имидазол-1-ил и имидазол-2-ил), пиридил (предпочтительно пиридин-2-ил и пиридин-3-ил), пиримидил (предпочтительно пиримидин-5-ил), пиразинил (предпочтительно пиразин-2-ил), индолил (предпочтительно индол-1-ил и индол-5-ил), бензимидазолил (предпочтительно бензимидазол-2-ил), бензоксазолил (предпочтительно бензоксазол-6-ил), бензотиазолил (предпочтительно бензотиазол-2-ил и бензотиазол-5-ил), бензоизотиазолил (предпочтительно бензоизотиазол-5-ил) и бензо[2,1,3]оксадиазолил (предпочтительно бензо[2,1,3]оксадиазол-4-ил). Наиболее предпочтительными гетероарильных групп являются фуранил (предпочтительно фуран-2-ил), тиазолил (предпочтительно тиазол-2-ил), пиридил (предпочтительно пиридин-2-ил и пиридин-3-ил), пиразинил (предпочтительно пиразин-2-ил) и бензотиазолил (предпочтительно бензотиазол-5-ил). Указанные выше гетероарильными группами, использующимися в R1, являются незамещенными, моно-, ди- или тризамещенными (предпочтительно незамещенными или монозамещенными), где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, (С1-С4)алкоксигруппу, (С1-С2)алкилкарбонил, (С1-С2)фторалкил, (C1-С2)фторалкоксигруппу, нитрогруппу, цианогруппу и фенил, где фенил является незамещенным или монозамещенным галогеном. Предпочтительные заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, (C1-С2)алкилкарбонил, (С1-С2)фторалкил, нитрогруппу, цианогруппу и фенил, где фенил является незамещенным или монозамещенным галогеном. Наиболее предпочтительные заместители независимо выбраны из группы, включающей галоген, метил и ацетил. Примерами таких незамещенных, моно-, ди- или тризамещенных гетероарильных групп, использующихся в R1, являются фуран-2-ил, 5-ацетилфуран-2-ил (предпочтительный), 5-метилфуран-2-ил, 4-метилоксазол-2-ил, 2-ацетилоксазол-4-ил, 2-ацетилоксазол-5-ил, 4-ацетилоксазол-2-ил, 5-метилизоксазол-3-ил, 5-изобутилизоксазол-3-ил, 5-трет-бутилизоксазол-3-ил, 5-ацетилтиофен-2-ил, 5-бромтиофен-3-ил, 5-хлортиазол-2-ил, 2-бромтиазол-5-ил, 4-бромтиазол-2-ил, 5-бромтиазол-2-ил (предпочтительный), 4-метилтиазол-2-ил, 5-метилтиазол-2-ил, 4,5-диметилтиазол-2-ил, 4-трет-бутилтиазол-2-ил, 2-ацетилтиазол-4-ил, 2-ацетилтиазол-5-ил, 4-ацетилтиазол-2-ил, 5-ацетилтиазол-2-ил, 4-трифторметилтиазол-2-ил, 5-нитротиазол-2-ил, 5-цианотиазол-2-ил, 4-(4-хлорфенил)-тиазол-2-ил, 4-метил-[1,2,5]оксадиазол-3-ил, 3-фенил-[1,2,4]тиадиазол-5-ил, 2-трифторметил-[1,3,4]тиадиазол-5-ил, имидазол-1-ил, 4,5-диметилимидазол-2-ил (предпочтительный), пиридин-2-ил, 2-метоксипиридин-4-ил, 2,6-дихлорпиридин-4-ил, 5-бромпиридин-2-ил (предпочтительный), 5-метилпиридин-2-ил (предпочтительный), 5-трифторметилпиридин-2-ил, 6-хлорпиридин-3-ил (предпочтительный), 6-бромпиридин-3-ил (предпочтительный), 6-бром-5-фторпиридин-3-ил, 6-метоксипиридин-3-ил, 6-трифторметилпиридин-3-ил, 2-хлорпиримидин-5-ил, 5-бромпиразин-2-ил (предпочтительный), индол-1-ил, 2-метилиндол-1-ил, индол-5-ил, 1-метилбензимидазол-2-ил, бензоксазол-6-ил, бензотиазол-2-ил, 6-фторбензотиазол-2-ил, 6-хлорбензотиазол-2-ил, бензотиазол-5-ил (предпочтительный), 2-метилбензотиазол-5-ил, 3-метилбензоизотиазол-5-ил и бензо[2,1,3]оксадиазол-4-ил.
В случае, если R2 обозначает "гетероарил", термин означает указанные выше группы. Предпочтительными гетероарильными группами, использующимися в R2, являются изоксазолил (предпочтительно изоксазол-4-ил), пиразолил (предпочтительно пиразол-3-ил, пиразол-4-ил и пиразол-5-ил) и пиридил (предпочтительно пиридин-3-ил). Указанные выше гетероарильные группы, использующиеся в R2, являются незамещенными, моно-, ди- или тризамещенными (предпочтительно монозамещенными), где заместители независимо выбраны из группы, включающей галоген, (С1-С4алкил и фенил. Предпочтительные заместители независимо выбраны из группы, включающей метил и фенил. Примерами таких незамещенных, моно-, ди- или тризамещенных гетероарильных групп, использующихся в R2, являются 5-фенилизоксазол-4-ил (предпочтительный), 1,5-диметилпиразол-3-ил, 5-хлор-1,3-диметилпиразол-4-ил, 1-фенилпиразол-5-ил (предпочтительный) и 4-метилпиридин-3-ил.
В случае, если R2 обозначает "(С1-С6)алкил, который является монозамещенным гетероарильной группой" термин "гетероарил" означает указанные выше группы. Предпочтительными гетероарильными группами являются фуранил (предпочтительно фуран-3-ил), изоксазолил (предпочтительно изоксазол-4-ил), тиазолил (предпочтительно тиазол-4-ил), имидазолил (предпочтительно имидазол-1-ил и имидазол-2-ил), пиразолил (предпочтительно пиразол-1-ил, пиразол-3-ил, пиразол-4-ил и пиразол-5-ил), триазолил (предпочтительно [1,2,4]триазол-1-ил), пиридил (предпочтительно пиридин-2-ил и пиридин-3-ил), индолил (предпочтительно индол-3-ил) и бензимидазолил (предпочтительно бензимидазол-2-ил). Указанные выше гетероарильные группы являются незамещенными, моно-, ди- или тризамещенными (предпочтительно незамещенными, моно- или дизамещенными), где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, -CH2NHR9, -SO2NH2 и фенил. Предпочтительные заместители независимо выбраны из группы, включающей (С1-С4)алкил и фенил. Примерами таких незамещенных, моно-, ди-или тризамещенных гетероарильных групп являются фуран-3-ил, 5-метил-3-фенилизоксазол-4-ил, 2-метилтиазол-4-ил, 2,5-диметилтиазол-4-ил, имидазол-1-ил (предпочтительный), 4,5-диметилимидазол-2-ил (предпочтительный), пиразол-1-ил (предпочтительный), 3,5-диметилпиразол-1-ил (предпочтительный), 1-этил-5-метилпиразол-3-ил (предпочтительный), 5-метилпиразол-4-ил, 1-этил-3-метилпиразол-5-ил, [1,2,4]триазол-1-ил (предпочтительный), пиридин-2-ил, пиридин-3-ил, индол-3-ил), бензимидазол-2-ил (предпочтительный) и 1-метилбензимидазол-2-ил.
Термин "гетероциклил" при использовании по отдельности или в комбинации означает 4-7-членное (предпочтительно 4-6-членное) насыщенное моноциклическое кольцо, содержащее 1 или 2 гетероатома, независимо выбранных из группы, включающей серу, кислород и азот (предпочтительно кислород и азот), где 1 или 2 метиленовые группы, соседние с атомом азота, необязательно замещены карбонильными группами. Примерами таких гетероциклильных групп являются азетидинил, оксетанил, пирролидинил, пирролидинонил, тетрагидрофуранил, тетрагидротиофенил, имидазолидинонил, оксазолидинил, оксазолидинонил, тиазолидинил, тиазолидинонил, пиперидинил, пиперидонил, пиперазинил, пиперазинонил, пиперазиндионил, тетрагидро-2H-пиранил, морфолинил, морфолинонил, тиоморфолинил, тиоморфолинонил, диоксанил, 1,4-диазепанил и 1,4-диазепанонил. Предпочтительными примерами являются азетидинил, пирролидинил, пирролидинонил, тетрагидрофуранил, имидазолидинонил, пиперидинил, пиперидонил, пиперазинил, тетрагидро-2#-пиранил, морфолинил, диоксанил и 1,4-диазепанил. Гетероциклильная группа может быть незамещенной или замещенной, как это явно определено.
В случае, если R2 обозначает "(С3-С6)циклоалкил, который является монозамещенным гетероциклиметилом", термин "гетероциклил" означает указанные выше группы. Предпочтительными гетероциклильными группами являются азетидинил (предпочтительно азетидин-1-ил), пирролидинил (предпочтительно пирролидин-1-ил) и пиперидинил (предпочтительно пиперидин-1-ил). Наиболее предпочтительным является пирролидинил (предпочтительно пирролидин-1-ил).
В случае, если R2 обозначает "гетероциклил", термин означает указанные выше группы. Предпочтительными гетероциклильными группами, использующимися в R2, являются азетидинил (предпочтительно азетидин-3-ил), пирролидинил (предпочтительно пирролидин-3-ил), пиперидинил (предпочтительно пиперидин-3-ил и пиперидин-4-ил) и тетрагидро-2H-пиранил (предпочтительно тетрагидро-2H-пиран-3-ил). Наиболее предпочтительными являются пирролидин-3-ил, пиперидин-3-ил, пиперидин-4-ил и тетрагидро-2H-пиран-3-ил. Указанные выше гетероциклильные группы являются незамещенными или монозамещенными по атому азота (С1-С6)алкилом, бензилом или трет-бутоксикарбонилом или монозамещенным по атому углерода пирролидин-1-илметилом. Примерами таких незамещенных или монозамещенных гетероциклильных групп являются азетидин-3-ил, 1-трет-бутоксикарбонилазетидин-3-ил, пирролидин-3-ил (предпочтительный), 1-трет-бутоксикарбонилпирролидин-3-ил, пиперидин-3-ил (предпочтительный), 1-трет-бутоксикарбонилпиперидин-3-ил, пиперидин-4-ил (предпочтительный), 1-метилпиперидин-4-ил, 1-этилпиперидин-4-ил, 1-(3-метилбутил)-пиперидин-4-ил, 1-бензилпиперидин-4-ил, 1-трет-бутоксикарбонилпиперидин-4-ил и 6-(пирролидин-1-илметил)-тетрагидро-2H-пиран-3у1.
В случае, если R2 обозначает "(С1-С6)алкил, который является монозамещенным гетероциклилом", термин "гетероциклил" означает указанные выше группы. Предпочтительными гетероциклильными группами являются азетидинил (предпочтительно азетидин-1-ил), пирролидинил (предпочтительно пирролидин-1-ил и пирролидин-2-ил), пирролидинонил (предпочтительно пирролидин-2-он-1-ил), тетрагидрофуранил (предпочтительно тетрагидрофуран-2-ил), имидазолидинонил (предпочтительно имидазолидин-2-он-1-ил), пиперидинил (предпочтительно пиперидин-1-ил, пиперидин-2-ил, пиперидин-3-ил и пиперидин-4-ил), пиперазинил (предпочтительно пиперазин-1-ил), морфолинил (предпочтительно морфолин-4-ил), диоксанил (предпочтительно 1,4-диоксан-2-ил) и 1,4-диазепанил (предпочтительно 1,4-диазепан-1-ил). Наиболее предпочтительными являются азетидинил (предпочтительно азетидин-1-ил), пирролидинил (предпочтительно пирролидин-1-ил и пирролидин-2-ил), тетрагидрофуранил (предпочтительно тетрагидрофуран-2-ил), имидазолидинонил (предпочтительно имидазолидин-2-он-1-ил), пиперидинил (предпочтительно пиперидин-1-ил, пиперидин-2-ил и пиперидин-4-ил), пиперазинил (предпочтительно пиперазин-1-ил), морфолинил (предпочтительно морфолин-4-ил) и 1,4-диазепанил (предпочтительно 1,4-диазепан-1-ил). Указанные выше гетероциклильные группы являются незамещенными или монозамещенными по атому азота (С1-С4)алкилом, (С1-С2)алкилкарбонилом или трет-бутоксикарбонилом и/или моно- или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил и (С1-С2)алкокси-(С1-С2)алкил. Предпочтительно гетероциклильные группы являются незамещенными или монозамещенными по атому азота (С1-С4)алкилом (предпочтительно метилом или этилом) или моно-или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей фтор, метил и метоксиметил. Примерами таких незамещенных или замещенных гетероциклильных групп являются азетидин-1-ил, пирролидин-1-ил, 3-фторпирролидин-1-ил (предпочтительно (R)-3-фторпирролидин-1-ил и (S)-3-фторпирролидин-1-ил), 3,3-дифторпирролидин-1-ил, 2,5-диметилпирролидин-1-ил, 2-метоксиметилпирролидин-1-ил, пирролидин-2-ил, 1-метилпирролидин-2-ил, 1-этилпирролидин-2-ил, 1-трет-бутоксикарбонилпирролидин-2-ил, пирролидин-2-он-1-ил, тетрагидрофуран-2-ил, имидазолидин-2-он-1-ил, пиперидин-1-ил, пиперидин-2-ил, пиперидин-3-ил, 1-трет-бутоксикарбонилпиперидин-3-ил, пиперидин-4-ил, 1-трет-бутоксикарбонилпиперидин-4-ил, 4-метилпиперазин-1-ил, 4-этилпиперазин-1-ил, 4-ацетилпиперазин-1-ил, морфолин-4-ил, 1,4-диоксан-2-ил и 4-метил-1,4-диазепан-1-ил. Предпочтительными примерами таких незамещенных или монозамещенных гетероциклильных групп являются азетидин-1-ил, пирролидин-1-ил, (R)-3-фторпирролидин-1-ил, (S)-3-фторпирролидин-1-ил, 3,3-дифторпирролидин-1-ил, 2,5-диметилпирролидин-1-ил, 2-метоксиметилпирролидин-1-ил, пирролидин-2-ил, 1-метилпирролидин-2-ил, тетрагидрофуран-2-ил, имидазолидин-2-он-1-ил, пиперидин-1-ил, пиперидин-2-ил, пиперидин-4-ил, 4-метилпиперазин-1-ил, морфолин-4-ил, 1,4-диоксан-2-ил и 4-метил-1,4-диазепан-1-ил.
В случае, если R2 обозначает "(С1-С6)алкил, который является монозамещенным необязательно монозамещенной (С1-С4)алкоксигруппой, в котором заместителем является гетероциклил", термин "гетероциклил" означает указанные выше группы. Предпочтительными гетероциклильными группами являются азетидинил (предпочтительно азетидин-1-ил), пирролидинил (предпочтительно пирролидин-1-ил) и пиперидинил (предпочтительно пиперидин-1-ил). Наиболее предпочтительным является пирролидин-1-ил.
В случае, если R2 обозначает "(С3-С5)фторалкил, который является монозамещенным гетероциклилом", термин "гетероциклил" означает указанные выше группы. Предпочтительными гетероциклильными группами являются азетидинил (предпочтительно азетидин-1-ил), пирролидинил (предпочтительно пирролидин-1-ил и пирролидин-2-ил), пирролидинонил (предпочтительно пирролидин-2-он-1-ил), тетрагидрофуранил (предпочтительно тетрагидрофуран-2-ил), имидазолидинонил (предпочтительно имидазолидин-2-он-1-ил), пиперидинил (предпочтительно пиперидин-1-ил, пиперидин-3-ил и пиперидин-4-ил), пиперазинил (предпочтительно пиперазин-1-ил), морфолинил (предпочтительно морфолин-4-ил), диоксанил (предпочтительно 1,4-диоксан-2-ил) и 1,4-диазепанил (предпочтительно 1,4-диазепан-1-ил). Более предпочтительными гетероциклильными группами являются азетидинил (предпочтительно азетидин-1-ил), пирролидинил (предпочтительно пирролидин-1-ил) и пиперидинил (предпочтительно пиперидин-1-ил). Наиболее предпочтительным является пирролидин-1-ил. Указанные выше гетероциклильные группы являются незамещенными (предпочтительно) или моно- или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей галоген (предпочтительно фтор) и (С1-С4)алкил (предпочтительно метил).
Термин "кольцо, содержащее от 5 до 7 элементов" при использовании в случае "R2 и R3 вместе со связанным с ними атомом азота образуют кольцо, содержащее от 5 до 7 элементов", означает гетероциклическое кольцо, выбранное из группы, включающей пирролидинил (предпочтительно пирролидин-1-ил), пиперидинил (предпочтительно пиперидин-1-ил) и азепанил (предпочтительно азепан-1-ил). Предпочтительным является пиперидинил (предпочтительно пиперидин-1-ил). Кольцо, содержащее от 5 до 7 элементов, замещено амино-(С1-С4)алкилом.
Для соединений формулы IР предпочтительными являются следующие определения:
- Термин "алкил" при использовании по отдельности или в комбинации означает обладающую линейной или разветвленной цепью алкильную группу, содержащую от 1 до 6 атомов углерода. Термин "(Сх-Су)алкил" (х и у являются целыми числами), означает алкильную группу, определенную выше, содержащую от х до у атомов углерода. Например, (С1-С6)алкильная группа содержит от 1 до 6 атомов углерода. Типичные примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, изомерные пентилы и изомерные гексилы. Алкильная группа может быть незамещенной или замещенной, как это явно определено.
В случае, если (С1-С4)алкильная группа является заместителем арильной, гетероарильной или гетероциклильной группы, термин "(C1-С4)алкил" означает (С1-С4)алкильные группы, определенные выше. Примерами указанных групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Предпочтительными являются метил, этил и изобутил и наиболее предпочтительным является метил.
В случае, если (С1-С6)алкильная группа является заместителем гетероциклильной группы, термин "(С1-С6)алкил" означает (C1-С6)алкильные группы, определенные выше. Примерами указанных групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, изомерные пентилы и изомерные гексилы. Предпочтительными являются метил, этил и 3-метилбут-1-ил. Наиболее предпочтительным является 3-метилбут-1-ил.
В случае, если "Y вместе с R1" обозначает "(С4-С6)алкил", термин означает (С4-С6)алкильные группы, определенные выше. Примерами указанных групп являются н-бутил, изобутил, втор-бутил, трет-бутил, изомерные пентилы и изомерные гексилы. Предпочтительными являются н-бутил, 3-метилбутил, 2-этилбутил и н-пентил. Наиболее предпочтительным является н-пентил.
В случае, если "R2" обозначает "(С1-С6)алкил", термин означает (C1-С6)алкильные группы, определенные выше. Примерами указанных групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, изомерные пентилы и изомерные гексилы. Предпочтительными являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, 2,2-диметилпроп-1-ил, 3-метилбут-1-ил, 3,3-диметилбут-1-ил, пент-1-ил, пент-2-ил, 4-метилпент-2-ил и гекс-1-ил. Наиболее предпочтительными являются этил, н-пропил, н-бутил, изобутил, 2,2-диметилпроп-1-ил и пент-1-ил. Указанные выше (С1-С6)алкильные группы являются незамещенными или монозамещенными фтором, трифторметилом, (С1-С4)алкоксигруппу, (С1-С4)алкилтиогруппу, (С1-С4)алкоксикарбонил, гидроксигруппу, цианогруппу, -NR5R6 или -C(O)NR7R8. Предпочтительный заместитель выбран из группы, включающей фтор, трифторметил, метоксигруппу, этоксигруппу, этилтиогруппу, гидроксигруппу, цианогруппу, -NR5R6 или -C(O)NH2.
В случае, если "R2" обозначает "(С1-С4)алкил", термин означает (C1-С4)алкильные группы, определенные выше. Примерами указанных групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Предпочтительными являются метил, этил, н-пропил и н-бутил. Наиболее предпочтительным является н-бутил. Указанные выше (С1-С4)алкильные группы являются монозамещенными (С3-С6)циклоалкилом; гетероциклилом, который является незамещенным или монозамещенным по атому азота (C1-C4)алкилом или трет-бутоксикарбонилом; или арильной или гетероарильной группой и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, -CH2NHR9, -SO2NH2 и фенил. В предпочтительном варианте осуществления (С1-С4)алкильные группы замещены гетероциклильной группой, которая является незамещенной или монозамещенной по атому азота метилом или этилом. В другом предпочтительном варианте осуществления (С1-С4)алкильные группы замещены арильной или гетероарильной группой и эти группы независимо являются незамещенными, моно- или дизамещенными (предпочтительно незамещенными или монозамещенными), где заместители независимо выбраны из группы, включающей галоген, метил, этил, -CH2NH2 и -SO2NH2.
В случае, если "R3" обозначает "(С1-С3)алкил", термин означает (C1-С3)алкильные группы, определенные выше. Примерами указанных групп являются метил, этил, н-пропил и изопропил. Предпочтительными являются метил, этил и н-пропил. Наиболее предпочтительными являются метил и этил.
В случае, если "R5" обозначает "(С1-С3)алкил", термин означает (C1-С3)алкильные группы, определенные выше. Примерами указанных групп являются метил, этил, н-пропил и изопропил. Предпочтительными являются метил, этил и н-пропил. Наиболее предпочтительными являются метил и этил.
В случае, если "R6" обозначает "(С1-С3)алкил", термин означает (C1-С3)алкильные группы, определенные выше. Примерами указанных групп являются метил, этил, н-пропил и изопропил. Предпочтительными являются метил, этил и н-пропил. Наиболее предпочтительными являются метил и этил.
- Термин "(С1-С4)алкандиильная группа" при использовании для Y означает углеродную цепь, содержащую от 1 до 4 атомов углерода, которая присоединена к остатку R1 и к амидному атому азота остатка молекулы, как это показано в формуле (I). Два соответствующих остатка могут быть присоединены к одному или к разным атомам углерода алкандиильной группы. Предпочтительными примерами (C1-С4)алкандиильных групп являются метандиил, этан-1,1-диил, этан-1,2-диил, пропан-1,3-диил и бутан-1,4-диил. Более предпочтительными являются метандиил и этан-1,2-диил. Наиболее предпочтительным является метандиил.
- Термин "(С3-С6)циклоалкил" при использовании по отдельности или в комбинации означает циклоалкильную группу, содержащую от 3 до 6 атомов углерода. Примерами (С3-С6)циклоалкильных групп являются циклопропил, циклобутил, циклопентил и циклогексил. (С3-С6)Циклоалкильная группа может быть незамещенной или замещенной, как это явно определено.
В случае, если "R2" обозначает "(С3-С6)циклоалкил", термин означает (C3-C6)циклоалкильные группы, определенные выше. Примерами указанных групп являются циклопропил, циклобутил, циклопентил и циклогексил. Предпочтительными являются циклопропил, циклопентил и циклогексил. Наиболее предпочтительными являются циклопентил и циклогексил. Указанные выше (C3-C6)циклоалкильные группы являются незамещенными или монозамещенными гидроксигруппой (предпочтительный) или -CONH2.
В случае, если "R2" обозначает "(С1-С4)алкил, который является монозамещенным (C3-C6)циклоалкилом" термин "(C3-C6)циклоалкил" означает указанные выше группы. Предпочтительной (С3-С6)циклоалкильной группой является циклопропил.
- Термин "алкоксигруппа" при использовании по отдельности или в комбинации означает группу алкил-О-, где алкильная группа является такой, как определено выше. Термин "(Сх-Су)алкоксигруппа" (х и у являются целыми числами) означает алкоксигруппу, определенную выше, содержащую от х до у атомов углерода. Например, (С1-С4)алкоксигруппа содержит от 1 до 4 атомов углерода. Типичные примеры алкоксигрупп включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу и трет-бутоксигруппу. Предпочтительными являются метоксигруппа и этоксигруппа. Наиболее предпочтительной является метоксигруппа.
- Термин "алкилтиогруппа" при использовании по отдельности или в комбинации означает группу алкил-S-, где алкильная группа является такой, как определено выше. Термин "(Сх-Су)алкилтиогруппа" (х и у являются целыми числами) означает алкилтиогруппу, определенную выше, содержащую от х до у атомов углерода. Например, (C1-С4)алкилтиогруппа содержит от 1 до 4 атомов углерода. Типичные примеры алкилтиогрупп включают метилтиогруппу, этилтиогруппу, н-пропилтиогруппу, изопропилтиогруппу, н-бутилтиогруппу, изобутилтиогруппу, втор-бутилтиогруппу и трет-бутилтиогруппу. Предпочтительными являются метилтиогруппа и этилтиогруппа. Наиболее предпочтительной является этилтиогруппа.
- Термин "(С1-С2)алкилкарбонил" при использовании по отдельности или в комбинации означает группу (С1-С2)алкил-С(O)-, где (С1-С2)алкильная группа является такой, как определено выше. Типичные примеры (C1-С2)алкилкарбонильных групп включают метилкарбонил (ацетил) и этилкарбонил (пропионил). Предпочтительным является ацетил.
- Термин "(С1-С4)алкоксикарбонил" при использовании по отдельности или в комбинации означает группу (С1-С4) алкокси-С(О)-, где (C1-С4)алкоксигруппа является такой, как определено выше. Типичные примеры (С1-С4)алкоксикарбонильных групп включают метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил и трет-бутоксикарбонил. Предпочтительными являются метоксикарбонил и трет-бутоксикарбонил. Наиболее предпочтительным является метоксикарбонил.
- Термин "(Сх-Су)фторалкил" (х и у являются целыми числами) означает алкильную группу, определенную выше, содержащую от х до у атомов углерода, в которой один или большее количество (и, возможно, все) атомов водорода заменены фтором. Например, (С1-С2)фторалкильная группа содержит от 1 до 2 атомов углерода, где от 1 до 5 атомов водорода заменены фтором. Типичные примеры фторалкильных групп включают трифторметил, дифторметил и 2,2,2-трифторэтил. Предпочтительными являются трифторметил и 2,2,2-трифторэтил. Наиболее предпочтительным является трифторметил.
- Термин "(Сх-Су)фторалкоксигруппа" (х и у являются целыми числами) означает алкоксигруппу, определенную выше, содержащую от х до у атомов углерода, в которой один или большее количество (и, возможно, все) атомов водорода заменены фтором. Например, (С1-С2)фторалкоксигруппа содержит от 1 до 2 атомов углерода, где от 1 до 5 атомов водорода заменены фтором. Типичные примеры фторалкоксигрупп включают трифторметоксигруппу, дифторметоксигруппу и 2,2,2-трифторэтоксигруппу. Предпочтительными являются (С1)фторалкоксигруппы, такие как трифторметоксигруппа и дифторметоксигруппа. Наиболее предпочтительной является трифторметоксигруппа.
- Термин галоген означает фтор, хлор, бром или йод, предпочтительно фтор, хлор или бром и наиболее предпочтительно хлор или бром.
- Термин "арил" при использовании по отдельности или в любой комбинации означает фенильную или нафтильную группу. Предпочтительной является фенильная группа. Арильная группа может быть незамещенной или замещенной, как это явно определено.
В случае, если R1 обозначает "арил", термин означает указанные выше группы (предпочтительно фенил) и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными (предпочтительно незамещенными, моно- или дизамещенными и наиболее предпочтительно незамещенными или монозамещенными), где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, (C1-С4)алкоксигруппу, (С1-С2)алкилкарбонил, (С1-С2)фторалкил, (C1-С2)фторалкоксигруппу, нитрогруппу, цианогруппу и фенил, где фенил является незамещенным или монозамещенным галогеном. Предпочтительные заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, (С1-С4)алкоксигруппу, (C1-С2)алкилкарбонил, трифторметил и трифторметоксигруппу (и наиболее предпочтительно включающей фтор, бром, метоксигруппу и трифторметил). Примерами таких арильных групп являются фенил, 4-метилфенил, 2-метоксифенил, 4-метоксифенил, 4-ацетилфенил, 4-трифторметилфенил, 4-трифторметоксифенил, 3-бромфенил, 4-бромфенил, 4-бром-2-фторфенил и 4-йодфенил (и предпочтительно 4-метоксифенил, 4-трифторметилфенил, 4-бромфенил и 4-бром-2-фторфенил).
В случае, если R2 обозначает "арил", термин означает указанные выше группы (предпочтительно фенил) и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными (предпочтительно моно или дизамещенными и наиболее предпочтительно дизамещенными), где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил и фенил (и предпочтительно галоген). Примерами таких арильных групп являются 4-бромфенил и 2-хлор-3-фторфенил.
В случае, если R2 обозначает "(C1-C4)алкил, который является монозамещенным арильной группой" термин "арил" означает указанные выше группы (предпочтительно фенил) и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными (предпочтительно незамещенными или монозамещенными и наиболее предпочтительно монозамещенными), где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, -CH2NHR9, -SO2NH2 и фенил. Предпочтительные заместители независимо выбраны из группы, включающей галоген, -CH2NHR9 и -SO2NH2 (и наиболее предпочтительно -CH2NH2 и -SO2NH2). Примерами таких арильных групп являются 4-фторфенил, 2-хлорфенил, 3-аминометилфенил, 4-аминометилфенил, 3-(трет-бутоксикарбониламинометил)-фенил, 4-(трет-бутоксикарбониламинометил)-фенил и 4-сульфамоилфенил (и предпочтительно 3-аминометилфенил, 4-аминометилфенил и 4-сульфамоилфенил).
- Термин "арилоксигруппа" при использовании по отдельности или в комбинации означает группу арил-О-, где арильная группа является такой, как определено выше. Предпочтительным примером арилоксигруппы является феноксигруппа.
- Термин "гетероарил" при использовании по отдельности или в комбинации означает 5-10-членное моноциклическое или бициклическое ароматическое кольцо, содержащее 1, 2 или 3 гетероатома, независимо выбранных из группы, включающей кислород, азот и серу. Примерами таких гетероарильных групп являются фуранил, оксазолил, изоксазолил, оксадиазолил, тиенил, тиазолил, изотиазолил, тиадиазолил, пирролил, имидазолил, пиразолил, триазолил, пиридил, пиримидил, пиридазинил, пиразинил, индолил, изоиндолил, бензофуранил, изобензофуранил, бензотиофенил, индазолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензоизотиазолил, бензотриазолил, бензо[2,1,3]оксадиазолил, бензо[2,1,3]тиадиазолил, бензо[1,2,3]тиадиазолил, хинолинил, изохинолинил, нафтиридинил, циннолинил, хиназолинил, хиноксалинил и фталазинил. Гетероарильная группа может быть незамещенной или замещенной, как это явно определено.
В случае, если R1 обозначает "гетероарил", термин означает указанные выше группы. Предпочтительными гетероарильными группами, использующимися в R1, являются фуранил (предпочтительно фуран-2-ил), оксазолил (предпочтительно оксазол-5-ил), изоксазолил (предпочтительно изоксазол-3-ил), тиенил (предпочтительно тиофен-2-ил и тиофен-3-ил), тиазолил (предпочтительно тиазол-2-ил), тиадиазолил (предпочтительно [1,2,4]тиадиазол-5-ил), имидазолил (предпочтительно имидазол-1-ил и имидазол-2-ил), пиридил (предпочтительно пиридин-2-ил и пиридин-Зил), пиримидил (предпочтительно пиримидин-5-ил), индолил (предпочтительно индол-1-ил и индол-5-ил), бензимидазолил (предпочтительно бензимидазол-2-ил), бензотиазолил (предпочтительно бензотиазол-2-ил и бензотиазол-5-ил), бензоизотиазолил (предпочтительно бензоизотиазол-5-ил) и бензо[2,1,3]оксадиазолил (предпочтительно бензо[2,1,3]оксадиазол-4-ил). Наиболее предпочтительными гетероарильными группами являются фуранил (предпочтительно фуран-2-ил), тиазолил (предпочтительно тиазол-2-ил), пиридил (предпочтительно пиридин-2-ил и пиридин-3-ил) и бензотиазолил (предпочтительно бензотиазол-5-ил). Указанные выше гетероарильные группы, использующиеся в R1, являются незамещенными, моно-, ди- или тризамещенными (предпочтительно незамещенными или монозамещенными), где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, (С1-С4)алкоксигруппу, (C1-С2)алкилкарбонил, (С1-С2)фторалкил, (С1-С2)фторалкоксигруппу, нитрогруппу, цианогруппу и фенил, где фенил является незамещенным или монозамещенным галогеном. Предпочтительные заместители независимо выбраны из группы, включающей галоген, (C1-C4)алкил, (C1-С2)алкилкарбонил, нитрогруппу, цианогруппу и фенил, где фенил является незамещенным или монозамещенным галогеном. Наиболее предпочтительные заместители независимо выбраны из группы, включающей галоген, метил и ацетил. Примерами таких незамещенных, моно-, ди- или тризамещенных гетероарильных групп, использующихся в R1, являются фуран-2-ил, 5-ацетилфуран-2-ил (предпочтительный), 5-метилфуран-2-ил, 2-ацетилоксазол-5-ил, 5-изобутилизоксазол-3-ил, 5-трет-бутилизоксазол-3-ил, 5-ацетилтиофен-2-ил, 5-бромтиофен-3-ил, 5-хлортиазол-2-ил, 5-бромтиазол-2-ил (предпочтительный), 5-метилтиазол-2-ил, 4-трет-бутилтиазол-2-ил, 4-ацетилтиазол-2-ил, 5-нитротиазол-2-ил, 5-цианотиазол-2-ил, 4-(4-хлорфенил)-тиазол-2-ил, 3-фенил-[1,2,4]тиадиазол-5-ил, имидазол-1-ил, 4,5-диметилимидазол-2-ил (предпочтительный), 5-бромпиридин-2-ил (предпочтительный), 5-метилпиридин-2-ил (предпочтительный), 6-хлорпиридин-3-ил (предпочтительный), 6-бромпиридин-3-ил (предпочтительный), 2-хлорпиримидин-5-ил, индол-1-ил, 2-метилиндол-1-ил, индол-5-ил, 1-метилбензимидазол-2-ил, бензотиазол-2-ил, 6-фторбензотиазол-2-ил, 6-хлорбензотиазол-2-ил, бензотиазол-5-ил (предпочтительный), 2-метилбензотиазол-5-ил, 3-метилбензоизотиазол-5-ил и бензо[2,1,3]оксадиазол-4-ил.
В случае, если R обозначает "гетероарил", термин означает указанные выше группы. Предпочтительными гетероарильными группами, использующимися в R2, являются изоксазолил (предпочтительно изоксазол-4-ил), пиразолил (предпочтительно пиразол-3-ил, пиразол-4-ил и пиразол-5-ил) и пиридил (предпочтительно пиридин-3-ил). Указанные выше гетероарильные группы, использующиеся в R2, являются незамещенными, моно-, ди- или тризамещенными (предпочтительно монозамещенными), где заместители независимо выбраны из группы, включающей галоген, (C1-C4)алкил и фенил. Предпочтительные заместители независимо выбраны из группы, включающей метил и фенил. Примерами таких незамещенных, моно-, ди- или тризамещенных гетероарильных групп, использующихся в R2, являются 5-фенилизоксазол-4-ил (предпочтительный), 1,5-диметилпиразол-3-ил, 5-хлор-1,3-диметилпиразол-4-ил, 1-фенилпиразол-5-ил (предпочтительный) и 4-метилпиридин-3-ил.
В случае, если R2 обозначает "(С1-С4)алкил, который является монозамещенным гетероарильной группой, "термин "гетероарил" означает указанные выше группы. Предпочтительными гетероарильными группами являются фуранил (предпочтительно фуран-3-ил), изоксазолил (предпочтительно изоксазол-4-ил), тиазолил (предпочтительно тиазол-4-ил), имидазолил (предпочтительно имидазол-1-ил и имидазол-2-ил), пиразолил (предпочтительно пиразол-1-ил, пиразол-3-ил, пиразол-4-ил и пиразол-5-ил), триазолил (предпочтительно [1,2,4]триазол-1-ил), пиридил (предпочтительно пиридин-2-ил и пиридин-3-ил), индолил (предпочтительно индол-3-ил) и бензимидазолил (предпочтительно бензимидазол-2-ил). Указанные выше гетероарильные группы являются незамещенными, моно-, ди- или тризамещенными (предпочтительно незамещенными, моно- или дизамещенными), где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, -CH2NHR9, -SO2NH2 и фенил. Предпочтительные заместители независимо выбраны из группы, включающей (C1-C4)алкил и фенил. Примерами таких незамещенных, моно-, ди- или тризамещенных гетероарильных групп являются фуран-3-ил, 5-метил-3-фенилизоксазол-4-ил, 2-метилтиазол-4-ил, 2,5-диметилтиазол-4-ил, имидазол-1-ил (предпочтительный), 4,5-диметилимидазол-2-ил (предпочтительный), пиразол-1-ил (предпочтительный), 3,5-диметилпиразол-1-ил (предпочтительный), 1-этил-5-метилпиразол-3-ил (предпочтительный), 5-метилпиразол-4-ил, 1-этил-3-метилпиразол-5-ил, [1,2,4]триазол-1-ил (предпочтительный), пиридин-2-ил, пиридин-3-ил, индол-3-ил), бензимидазол-2-ил (предпочтительный) и 1-метилбензимидазол-2-ил.
- Термин "гетероциклил" при использовании по отдельности или в комбинации означает 4-6-членное насыщенное моноциклическое кольцо, содержащее 1 или 2 гетероатома, независимо выбранных из группы, включающей серу, кислород и азот (предпочтительно кислород и азот), где 1 или 2 метиленовые группы, соседние с атомом азота, необязательно замещены карбонильными группами. Примерами таких гетероциклильных групп являются азетидинил, оксетанил, пирролидинил, пирролидонил, тетрагидрофуранил, тетрагидротиофенил, имидазолидинонил, оксазолидинил, оксазолидинонил, тиазолидинил, тиазолидинонил, пиперидинил, пиперидонил, пиперазинил, пиперазинонил, пиперазиндионил, морфолинил, морфолинонил, тиоморфолинил, тиоморфолинонил и диоксанил. Предпочтительными примерами являются азетидинил, пирролидинил, пирролидонил, тетрагидрофуранил, имидазолидинонил, пиперидинил, пиперидонил, пиперазинил, морфолинил и диоксанил. Гетероциклильная группа может быть незамещенной или замещенной, как это явно определено.
В случае, если R2 обозначает "гетероциклил", термин означает указанные выше группы. Предпочтительными гетероциклильными группами, использующимися в R, являются азетидинил (предпочтительно азетидин-3-ил), пирролидинил (предпочтительно пирролидин-3-ил) и пиперидинил (предпочтительно пиперидин-3-ил и пиперидин-4-ил). Указанные выше гетероциклильные группы являются незамещенными или монозамещенными по атому азота (С1-С6)алкилом, бензилом или трет-бутоксикарбонилом. Примерами таких незамещенных или монозамещенных гетероциклильных групп являются 1-трет-бутоксикарбонилазетидин-3-ил, пирролидин-3-ил (предпочтительный), 1-трет-бутоксикарбонилпирролидин-3-ил, пиперидин-3-ил (предпочтительный), 1-трет-бутоксикарбонилпиперидин-3-ил, пиперидин-4-ил (предпочтительный), 1-метилпиперидин-4-ил, 1-этилпиперидин-4-ил, 1-(3-метилбутил)-пиперидин-4-ил, 1-бензилпиперидин-4-ил и 1-трет-бутоксикарбонилпиперидин-4-ил.
В случае, если R2 обозначает "(С1-С4)алкил, который является монозамещенным гетероциклилом" термин "гетероциклил" означает указанные выше группы. Предпочтительными гетероциклильными группами являются пирролидинил (предпочтительно пирролидин-1-ил и пирролидин-2-ил), пирролидонил (предпочтительно пирролидон-1-ил), тетрагидрофуранил (предпочтительно тетрагидрофуран-2-ил), имидазолидинонил (предпочтительно имидазолидин-2-он-1-ил), пиперидинил (предпочтительно пиперидин-3-ил и пиперидин-4-ил), пиперазинил (предпочтительно пиперазин-1-ил), морфолинил (предпочтительно морфолин-4-ил) и диоксанил (предпочтительно 1,4-диоксан-2-ил). Указанные выше гетероциклильные группы являются незамещенными или монозамещенными по атому азота (С1-С4)алкилом (предпочтительно) или трет-бутоксикарбонилом. Примерами таких незамещенных или монозамещенных гетероциклильных групп являются пирролидин-1-ил, пирролидин-2-ил, 1-метилпирролидин-2-ил, 1-этилпирролидин-2-ил, 1-трет-бутоксикарбонилпирролидин-2-ил, пирролидон-1-ил, тетрагидрофуран-2-ил, имидазолидин-2-он-1-ил, 1-трет-бутоксикарбонилпиперидин-3-ил, пиперидин-4-ил, 1-трет-бутоксикарбонилпиперидин-4-ил, 4-метилпиперазин-1-ил, морфолин-4-ил и 1,4-диоксан-2-ил. Предпочтительными Примерами таких незамещенных или монозамещенных гетероциклильных групп являются пирролидин-1-ил, пирролидин-2-ил, 1-метилпирролидин-2-ил, тетрагидрофуран-2-ил, имидазолидин-2-он-1-ил, пиперидин-4-ил, 4-метилпиперазин-1-ил и 1,4-диоксан-2-ил.
2) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим варианту осуществления 1), которые также являются соединениями формулы (IР)

в которой
W обозначает -СН2СН2- или -СН=СН-;
Y обозначает связь или (С1-С4)алкандиильную группу и R1 обозначает арильную или гетероарильную группу и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, (С1-С4)алкоксигруппу, (С1-С2)алкилкарбонил, (С1-С2)фторалкил, (С1-С2)фторалкоксигруппу, нитрогруппу, цианогруппу и фенил, где фенил является незамещенным или монозамещенным галогеном; или
арилоксигруппу; или
циклогексил, который является незамещенным или монозамещенным метилом; или
(С1-С2)алкилкарбонил; или
(С1-С4)алкоксикарбонил;
или Y вместе с R1 обозначает (С4-С6)алкильную группу;
Z обозначает -C(O)NR3-* или -CH2NR4C(O)-*,
где звездочки обозначают связь, соединяющую с R2;
R2 обозначает
(C3-C6)циклоалкил, который является незамещенным или монозамещенным гидроксигруппой или -CONH2; или
(С1-С6)алкил, который является незамещенным или монозамещенными фтором, трифторметилом, (C1-C4)алкоксигруппой, (С1-С4)алкилтиогруппой, (C1-С4)алкоксикарбонилом, гидроксигруппой, цианогруппой, -NR5R6 или -C(O)NR7R8; или
(С1-С4)алкил, который является монозамещенным (C3-C6)циклоалкилом; гетероциклилом, который является незамещенным или монозамещенным по атому азота (С1-С4)алкилом или трет-бутоксикарбонилом; или арильной или гетероарильной группой и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, -CH2NHR9, -SO2NH2 и фенил; или гетероциклил, который является незамещенным или монозамещенным по атому азота (С1-С6)алкилом, бензилом или трет-бутоксикарбонилом; или арильную или гетероарильную группу и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил и фенил; или группу, выбранную из группы, включающей 1-карбамоил-2-фенилэтил, 1-метоксиметил-2-фенилэтил, 2-морфолино-2-фенилэтил, 1-(1-пиперидинкарбонил)-этил, 2-фенилвинил, 2,2-дихлор-1-метилциклопропил; R3 обозначает водород, (С1-С3)алкил или 2-метоксиэтил; R4 обозначает водород или метил;
R5 обозначает водород, (С1-С3)алкил или трет-бутоксикарбонил; R6 обозначает водород или (С1-С3)алкил;
R7 и R8 независимо друг от друга обозначают водород или метил; и R9 обозначает водород или трет-бутоксикарбонил;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
3) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим варианту осуществления 1), в которых
W обозначает -СН2СН2- или -СН=СН-; Y обозначает связь или (С1-С4)алкандиильную группу;
R1 обозначает арильную или гетероарильную группу и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, (С1-С4)алкоксигруппу, (С1-С2)алкилкарбонил, (С1-С2)фторалкил, (C1-С2)фторалкоксигруппу, нитрогруппу, цианогруппу и фенил, где фенил является незамещенным или монозамещенным галогеном;
Z обозначает -C(O)NR3-* или -CH2NR4C(O)-*,
где звездочки обозначают связь, соединяющую с R2;
R2 обозначает
- (C3-C6)циклоалкил, который является незамещенным или монозамещенным гидроксигруппой, пирролидин-1-илметилом или -CONH2; или
- (С1-С6)алкил, который является незамещенным или монозамещенным фтором, трифторметилом, (C1-C4)алкилтиогруппой, (C1-C4)алкоксикарбонилом, гидроксигруппой, цианогруппой, -NR5R6, -C(O)NR7R8 или необязательно монозамещенным (С1-С4)алкоксигруппой, где заместитель выбран из группы, включающей гидроксигруппу и гетероциклил; или
- (С1-С5)алкил, который является монозамещенным
- гетероциклилом и этот гетероциклил является незамещенным или монозамещенными по атому азота (С1-С4)алкилом, или моно- или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил и (С1-С2)алкокси-(С1-С2)алкил; или
- арильной или гетероарильной группой и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, -CH2NH2 и -SO2NH2; или
- (С3-С5)фторалкил, который является монозамещенным гетероциклилом и этот гетероциклил является незамещенным (предпочтительный) или моно- или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей галоген и (C1-C4)алкил; или
- гетероциклил, который является незамещенным или монозамещенным по атому азота (С1-С6)алкилом, бензилом или трет-бутоксикарбонилом или монозамещенным по атому углерода пирролидин-1-илметилом; или
- арильную или гетероарильную группу, которые независимо являются незамещенными, моно-, или дизамещенными, где заместители независимо выбраны из группы, включающей галоген, (C1-C4)алкил и фенил;
R3 обозначает водород, (С1-С3)алкил или 2-метоксиэтил; или
R2 и R3 вместе со связанным с ними атомом азота образуют пиперидиновое кольцо и это кольцо замещено амино-(С1-С4)алкилом (предпочтительно аминометилом);
R4 обозначает водород или метил;
R5 обозначает водород, (С1-С3)алкил или трет-бутоксикарбонил; R6 обозначает водород или (С1-С3)алкил;
R7 и R8 независимо друг от друга обозначают водород или метил; или
R7 и R8 вместе со связанным с ними атомом азота образуют пирролидиновое кольцо;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
4) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-3), в которых
W обозначает -СН2СН2- или -СН=СН-;
Y обозначает связь или (С1-С4)алкандиильную группу;
R1 обозначает арильную или гетероарильную группу и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, (C1-С4)алкоксигруппу, (С1-С2)алкилкарбонил, (С1-С2)фторалкил, (С1-С2)фторалкоксигруппу, нитрогруппу, цианогруппу и фенил, где фенил является незамещенным или монозамещенным галогеном;
Z обозначает -C(O)NR3-* или -CH2NR4C(O)-*,
где звездочки обозначают связь, соединяющую с R2;
R2 обозначает
(C3-C6)циклоалкил, который является незамещенным или монозамещенным гидроксигруппой или -CONH2; или
(С1-С6)алкил, который является незамещенным или монозамещенными фтором, трифторметилом, (С1-С4)алкоксигруппой, (С1-С4)алкилтиогруппой, (С1-С4)алкоксикарбонилом, гидроксигруппой, цианогруппой, -NR5R6 или -C(O)NR7R8; или
(C1-C4)алкил, который является монозамещенным гетероциклилом, который является незамещенным или монозамещенным по атому азота (С1-С4)алкилом; или
(С1-С4)алкил, который является монозамещенным арильной или гетероарильной группой, и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (C1-C4)алкил, -CH2NH2 и -SO2NH2; или
гетероциклил, который является незамещенным или монозамещенным по атому азота (С1-С6)алкилом, бензилом или трет-бутоксикарбонилом; или арильную или гетероарильную группу, которые независимо являются незамещенными, моно- или дизамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил и фенил; R3 обозначает водород, (С1-С3)алкил или 2-метоксиэтил; R4 обозначает водород или метил;
R5 обозначает водород, (С1-С3)алкил или трет-бутоксикарбонил; R6 обозначает водород или (С1-С3)алкил; и
R7 и R8 независимо друг от друга обозначают водород или метил;
и к солям (предпочтительно фармацевтически приемлемым солям) таких
соединений.
5) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1) или 3), в которых
W обозначает -CH2CH2- или -СН=СН-;
Y обозначает связь;
R1 обозначает арильную или гетероарильную группу и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген (предпочтительно бром), (С1-С4)алкил (предпочтительно метил), (C1-C4)алкоксигруппу (предпочтительно метоксигруппу), (С1-С2)алкилкарбонил (предпочтительно ацетил), и (С1-С2)фторалкил (предпочтительно трифторметил);
Z обозначает -C(O)NR3-*,
где звездочка обозначает связь, соединяющую с R2;
R2 обозначает
- (C3-C6)циклоалкил, который является незамещенным или монозамещенным гидроксигруппой или пирролидин-1-илметилом; или
- (С1-С6)алкил, который является незамещенным или монозамещенным фтором, трифторметилом, (С1-С4)алкилтиогруппой (предпочтительно этилтиогруппой), гидроксигруппой, цианогруппой, -NR5R6, -C(O)NH2 или необязательно монозамещенным (C1-C4)алкоксигруппой (предпочтительно метоксигруппой или этоксигруппой), где заместитель выбран из группы, включающей гидроксигруппу и гетероциклил; или
- (С1-С5)алкил, который является монозамещенным
- гетероциклилом и этот гетероциклил является незамещенным или монозамещенным по атому азота метилом или этилом (предпочтительно метил), или моно- или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей фтор, метил и метоксиметил; или
- арильной или гетероарильной группой и эти группы независимо являются незамещенными, моно- или дизамещенными, где заместители независимо выбраны из группы, включающей (С1-С4)алкил (предпочтительно метил) и -CH2NH2; или
- (С3-С5)фторалкил, который является монозамещенным гетероциклилом (предпочтительно пирролидин-1-илом); или
- гетероциклил, который является незамещенным или монозамещенным по атому углерода пирролидин-1-илметилом;
R3 обозначает водород, (С1-С3)алкил (предпочтительно метил или этил) или 2-метоксиэтил;
R5 обозначает водород, (С1-С3)алкил (предпочтительно метил или этил) или трет-бутоксикарбонил; и
R6 обозначает водород или (С1-С3)алкил (предпочтительно метил или этил); и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
6) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-5), в которых
W обозначает -СН2СН2- или -СН=СН-;
Y обозначает связь;
R1 обозначает арильную или гетероарильную группу и эти группы независимо являются незамещенными или монозамещенными, где заместитель выбран из группы, включающей галоген (предпочтительно бром), (С1-С4)алкил (предпочтительно метил), (С1-С4)алкоксигруппу (предпочтительно метоксигруппу), (С1-С2)алкилкарбонил (предпочтительно ацетил) и (C1-С2)фторалкил (предпочтительно трифторметил);
Z обозначает -C(O)NR3-*,
где звездочка обозначает связь, соединяющую с R2;
R2 обозначает
(C3-C6)циклоалкил, который является незамещенным или монозамещенным гидроксигруппой; или
(С1-С6)алкил, который является незамещенным или монозамещенными фтором, трифторметилом, (С1-С4)алкоксигруппой (предпочтительно метоксигруппой или этоксигруппой), (С1-С4)алкилтиогруппой (предпочтительно этилтиогруппой), гидроксигруппой, цианогруппой, -NR5R6 или -C(O)NH2; или
(С1-С4)алкил, который является монозамещенным гетероциклилом, который является незамещенным или монозамещенным по атому азота метилом; или (С1-С4)алкил, который является монозамещенным арильной или гетероарильной группой, и эти группы независимо являются незамещенными, моно- или дизамещенными, где заместители независимо выбраны из группы, включающей (С1-С4)алкил (предпочтительно метил) и -CH2NH2; или
гетероциклил;
R3 обозначает водород, (С1-С3)алкил (предпочтительно метил или этил) или 2-метоксиэтил;
R5 обозначает водород, (С1-С3)алкил (предпочтительно метил или этил) или трет-бутоксикарбонил; и
R6 обозначает водород или (С1-С3)алкил (предпочтительно метил или этил); и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
7) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-6), в которых
W обозначает -СН2СН2-;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
8) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-6), в которых
W обозначает -СН=СН-;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
9) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-8), в которых
Y обозначает связь;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
10) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-4) или 7)-8), в которых
Y обозначает (С1-С4)алкандиильную группу (предпочтительно метандиил); и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
11) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-4) или 7)-10), в которых
R1 обозначает арильную или гетероарильную группу и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, (С1-С4)алкоксигруппу, (С1-С2)алкилкарбонил, (С1-С2)фторалкил, (С1-С2)фторалкоксигруппу, нитрогруппу, цианогруппу и фенил, где фенил является незамещенным или монозамещенным галогеном;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
12) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-11), в которых
R1 обозначает арильную или гетероарильную группу и эти группы независимо являются незамещенными или монозамещенными, где заместитель выбран из группы, включающей галоген (предпочтительно бром), (С1-С4)алкил (предпочтительно метил), (С1-С4)алкоксигруппу (предпочтительно метоксигруппу), (С1-С2)алкилкарбонил (предпочтительно ацетил) и (C1-С2)фторалкил (предпочтительно трифторметил);
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
13) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1), 2) или 7)-10), в которых
R1 обозначает арилоксигруппу (предпочтительно феноксигруппу), циклогексил,
4-метилциклогексил, (С1-С2)алкилкарбонил (предпочтительно ацетил) или (С1-С4)алкоксикарбонил (предпочтительно метоксикарбонил);
и к солям (предпочтительно фармацевтически приемлемым солям) таких
соединений.
14) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1), 7) или 8), в которых
Y вместе с R1 обозначает (С4-С6)алкильную группу или амино-(С4-С6)алкильную группу;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
15) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1), 2), 7) или 8), в которых
Y вместе с R1 обозначает (С4-С6)алкильную группу;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
16) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1), 7) или 8), в которых
Y вместе с R1 обозначает амино-(С4-С6)алкильную группу;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
17) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1), 7) или 8), в которых
Y обозначает (С1-С2)алкандиильную группу (предпочтительно этан-1,2-диил) и
R1 обозначает
- арильную группу, которая является незамещенной, моно-, ди- или тризамещенной, где заместители независимо выбраны из группы, включающей галоген (предпочтительно фтор, хлор и бром), (С1-С4)алкил (предпочтительно метил) и (С1-С4)алкоксигруппу (предпочтительно метоксигруппу); или
- бензо[d][1,3]диоксолил;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
18) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-17), в которых
Z обозначает -C(O)NR3-*, где звездочка обозначает связь, соединяющую с R2;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
19) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-4) или 7)-17), в которых
Z обозначает -CH2NR4C(O)-*, где звездочка обозначает связь, соединяющую с R2; и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
20) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1), 3) или 7)-19), в которых
R2 обозначает
(C3-C6)циклоалкил, который является незамещенным или монозамещенным гидроксигруппой, пирролидин-1-илметилом или -CONH2; или (С1-С6)алкил, который является незамещенным или монозамещенным фтором, трифторметилом, (С1-С4)алкилтиогруппой, (С1-С4)алкоксикарбонилом, гидроксигруппой, цианогруппой, -NR5R6, -C(O)NR7R8 или необязательно монозамещенным (С1-С4)алкоксигруппой, где заместитель выбран из группы, включающей гидроксигруппу и гетероциклил; или
(С1-С5)алкил, который является монозамещенным гетероциклилом, и этот гетероциклил является незамещенным или монозамещенными по атому азота (С1-С4)алкилом, или моно- или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил и (С1-С2)алкокси-(С1-С2)алкил; или
(С1-С5)алкил, который является монозамещенным арильной или гетероарильной группой, и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, -CH2NH2 и -SO2NH2; или
(С3-С5)фторалкил, который является монозамещенным гетероциклилом; или гетероциклил, который является незамещенным или монозамещенным по атому азота (С1-С6)алкилом, бензилом или трет-бутоксикарбонилом или монозамещенным по атому углерода пирролидин-1-илметилом; или
арильную или гетероарильную группу, которые независимо являются незамещенными, моно-, или дизамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил и фенил; и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
21) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-4) или 7)-19), в которых
R2 обозначает
(C3-C6)циклоалкил, который является незамещенным или монозамещенным гидроксигруппой или -CONH2; или
(С1-С6)алкил, который является незамещенным или монозамещенными фтором, трифторметилом, (С1-С4)алкоксигруппой, (С1-С4)алкилтиогруппой, (С1-С4)алкоксикарбонилом, гидроксигруппой, цианогруппой, -NR5R6 или -C(O)NR7R8; или
(С1-С4)алкил, который является монозамещенным гетероциклилом, который является незамещенным или монозамещенным по атому азота (С1-С4)алкилом;
или
(С1-С4)алкил, который является монозамещенным арильной или гетероарильной группой, и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (C1-C4)алкил, -CH2NH2 и -SO2NH2; или
гетероциклил, который является незамещенным или монозамещенным по атому азота (С1-С6)алкилом, бензилом или трет-бутоксикарбонилом; или арильную или гетероарильную группу, которые независимо являются незамещенными, моно- или дизамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил и фенил;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
22) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1), 3) или 7)-19), в которых
R2 обозначает
(C3-C6)циклоалкил, который является незамещенным или монозамещенным гидроксигруппой или пирролидин-1-илметилом; или
(С1-С6)алкил, который является незамещенным или монозамещенным фтором, трифторметилом, (C1-C4)алкилтиогруппой (предпочтительно этилтиогруппой), гидроксигруппой, цианогруппой, -NR5R6, -C(O)NH2 или необязательно монозамещенным (С1-С4)алкоксигруппой (предпочтительно метоксигруппой или этоксигруппой), где заместитель выбран из группы, включающей гидроксигруппу и гетероциклил; или
(С1-С5)алкил, который является монозамещенным гетероциклилом, и этот гетероциклил является незамещенным или монозамещенным по атому азота метилом или этилом (предпочтительно метилом), или моно- или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей фтор, метил и метоксиметил; или
(С1-С5)алкил, который является монозамещенным арильной или гетероарильной группой, и эти группы независимо являются незамещенными, моно- или дизамещенными, где заместители независимо выбраны из группы, включающей (C1-C4)алкил (предпочтительно метил) и -CH2NH2; или (С3-С5)фторалкил, который является монозамещенным гетероциклилом (предпочтительно пирролидин-1-илом); или
гетероциклил, который является незамещенным или монозамещенным по атому углерода пирролидин-1-илметилом;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
23) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-19), в которых R2 обозначает
(C3-C6)циклоалкил, который является незамещенным или монозамещенным гидроксигруппой; или
(С1-С6)алкил, который является незамещенным или монозамещенными фтором, трифторметилом, (С1-С4)алкоксигруппой (предпочтительно метоксигруппой или этоксигруппой), (С1-С4)алкилтиогруппой (предпочтительно этилтиогруппой), гидроксигруппой, цианогруппой, -NR5R6 или -C(O)NH2; или
(С1-С4)алкил, который является монозамещенным гетероциклилом, который является незамещенным или монозамещенным по атому азота метилом; или (С1-С4)алкил, который является монозамещенным арильной или гетероарильной группой, и эти группы независимо являются незамещенными, моно- или дизамещенными, где заместители независимо выбраны из группы, включающей (С1-С4)алкил (предпочтительно метил) и -CH2NH2; или гетероциклил;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
24) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1), 3), 5) или 7)-19), в которых
R2 обозначает (C3-C6)циклоалкил (предпочтительно циклопентил или циклогексил), который является незамещенным или монозамещенным гидроксигруппой, гидроксиметилом, аминометилом, пирролидин-1-илметилом или -CONH2 (и предпочтительно незамещенными или монозамещенными гидроксигруппой или пирролидин-1-илметилом);
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
25) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-19), в которых
R2 обозначает (C3-C6)циклоалкил (предпочтительно циклопентил или циклогексил), который является незамещенным или монозамещенным гидроксигруппой;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
26) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1), 3) или 7)-19), в которых
R2 обозначает (С1-С6)алкил, который является незамещенным или монозамещенными фтором, трифторметилом, (C1-C4)алкилтиогруппой, гидроксигруппой, цианогруппой, -NR5R6, -C(O)NR7R8 или необязательно монозамещенным (С1-С4)алкоксигруппой, где заместитель выбран из группы, включающей гидроксигруппу и гетероциклил;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
27) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-19), в которых
R2 обозначает (С1-С6)алкил, который является незамещенным или монозамещенными фтором, трифторметилом, (С1-С4)алкоксигруппой, (С1-С4)алкилтиогруппой, гидроксигруппой, цианогруппой, -NR5R6 или -C(O)NH2 (предпочтительно фтором, трифторметилм, метоксигруппой, этоксигруппой, гидроксигруппой, цианогруппой, или -C(O)NH2); и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
28) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1), 3), 5) или 7)-19), в которых R2 обозначает (С2-С5)алкил, который является незамещенным или монозамещенными фтором, трифторметилом, гидроксигруппой, -NR5R6, -C(O)NR7R8, метоксигруппой этоксигруппой или 2-(пирролидин-1-ил)-этоксигруппой;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
29) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1), 3) или 7)-19), в которых
R2 обозначает
(С1-С5)алкил, который является монозамещенным гетероциклилом, и этот гетероциклил является незамещенным или монозамещенными по атому азота (С1-С4)алкилом (предпочтительно метилом или этилом), или моно- или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей галоген, (C1-C4)алкил и (C1-С2)алкокси-(С1-С2)алкил (предпочтительно включающей фтор, метил и метоксиметил); или
(С1-С5)алкил, который является монозамещенным арильной или гетероарильной группой, и эти группы независимо являются незамещенными, моно- или дизамещенными, где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, -CH2NH2 и -SO2NH2 (и предпочтительно включающей метил и -CH2NH2);
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
30) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-19), в которых
R2 обозначает (C1-C4)алкил, который является монозамещенным гетероциклилом, который является незамещенным или монозамещенным по атому азота метилом; или
(С1-С4)алкил, который является монозамещенным арильной или гетероарильной группой, и эти группы независимо являются незамещенными, моно- или дизамещенными, где заместители независимо выбраны из группы, включающей (С1-С4)алкил (предпочтительно метил) и -CH2NH2;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
31) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1), 3), 5) или 7)-19), в которых
R2 обозначает (С1-С5)алкил, который является монозамещенным гетероциклилом, и этот гетероциклил является незамещенным или монозамещенным по атому азота метилом или этилом (предпочтительно метил), или моно- или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей фтор, метил и метоксиметил;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
32) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-19), в которых
R2 обозначает (C1-С4)алкил (предпочтительно метил или н-бутил и наиболее предпочтительно н-бутил), который является монозамещенным гетероциклилом, который является незамещенным (предпочтительный) или монозамещенными по атому азота метилом;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
33) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 29)-32), в которых
гетероциклил выбран из группы, включающей азетидинил (предпочтительно азетидин-1-ил), пирролидинил (предпочтительно пирролидин-1-ил и пирролидин-2-ил), тетрагидрофуранил (предпочтительно тетрагидрофуран-2-ил), имидазолидинонил (предпочтительно имидазолидин-2-он-1-ил), пиперидинил (предпочтительно пиперидин-1-ил, пиперидин-2-ил и пиперидин-4-ил), пиперазинил (предпочтительно пиперазин-1-ил), морфолинил (предпочтительно морфолин-4-ил) и 1,4-диазепанил (предпочтительно 1,4-диазепан-1-ил); и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
34) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-19), в которых
R2 обозначает (С1-С5)алкил (предпочтительно (С1-С3)алкил), который является монозамещенным арильной или гетероарильной группой, и эти группы независимо являются незамещенными, моно- или дизамещенными (предпочтительно незамещенными или монозамещенными), где заместители независимо выбраны из группы, включающей галоген, (С1-С4)алкил, -CH2NH2 и -SO2NH2 (и предпочтительно метил и -CH2NH2);
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
35) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-19), в которых
R2 обозначает (C1-C4)алкил (предпочтительно метил, этил или н-пропил), который является монозамещенным арильной или гетероарильной группой, и эти группы независимо являются незамещенными, моно- или дизамещенными (предпочтительно незамещенными или монозамещенными), где заместители независимо выбраны из группы, включающей (C1-C4)алкил (предпочтительно метил) и -CH2NH2;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
36) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-19), в которых
R2 обозначает (С1-С5)алкил (предпочтительно (С1-С3)алкил), который является монозамещенным гетероарильной группой, которая является незамещенной, моно- или дизамещенной (предпочтительно незамещенной или дизамещенной) (С1-С4)алкилом (предпочтительно метилом);
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
37) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1), 3), 5) или 7)-19), в которых
R2 обозначает (С3-С5)фторалкил, который является монозамещенным
гетероциклилом (предпочтительно пирролидин-1-илом);
и к солям (предпочтительно фармацевтически приемлемым солям) таких
соединений.
38) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим варианту осуществления 37), в которых
(С3-С5)фторалкил означает 3-фторбутил (предпочтительный) или 3,3-дифторбутил;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
39) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1), 3) или 7)-19), в которых
R2 обозначает гетероциклил, который является незамещенным или монозамещенным по атому азота (С1-С6)алкилом или монозамещенным по атому углерода пирролидин-1-илметилом;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
40) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-4) или 6-19), в которых
R2 обозначает гетероциклил, который является незамещенным (предпочтительный) или монозамещенными по атому азота (С1-С6)алкилом; и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
41) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-18) или 20)-40), в которых
R3 обозначает водород (предпочтительный), метил, этил или 2-метоксиэтил; и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
42) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1), 3) или 7)-19), в которых
R2 и R3 вместе со связанным с ними атомом азота образуют пиперидиновое кольцо и это кольцо замещено амино-(С1-С4)алкилом (предпочтительно аминометилом);
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
43) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-4), 7)-17) или 19)-40), в которых R4 обозначает водород;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
44) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-23), 26)-28), 41) или 43), в которых
R5 обозначает водород, метил или этил;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
45) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-23), 26)-28), 41), 43) или 44), в которых
R6 обозначает водород, метил или этил;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
46) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-4), 7)-21), 26), 28), 41) или 43), в которых
R7 и R8 обозначает водород;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
47) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1), 2), 7)-19), 41) или 43), в которых
R9 обозначает водород;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
48) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-47), в которых абсолютная конфигурация стереогенных центров является такой, как представленная выше в формуле ISt1;
и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
49) В другом варианте осуществления настоящее изобретение относится к мостиковым производным спиро[2.4]гептана, соответствующим любому из вариантов осуществления 1)-47), в которых абсолютная конфигурация стереогенных центров является такой, как представленная выше в формуле ISt2; и к солям (предпочтительно фармацевтически приемлемым солям) таких соединений.
50) Предпочтительные соединения формулы (I), определенные в варианте осуществления 1), выбраны из группы, включающей:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(5-аминопентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(пиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-изобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-аминобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(2-N,N-диметиламиноэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-аминометилфенил)-метил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-пиперидинилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(пирролидин-3-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2,2-диметил-3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-(N,N-диэтиламино)-бутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(3-гидроксипропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(2-карбамоилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-трет-бутоксикарбонилпирролидин-3-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(циклопентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-этоксипропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-пирролидинилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2,2,2-трифторэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-фторэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(N-метиламино)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-тетрагидрофуранилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-гидроксициклогексил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-этилсульфанилэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(5-(N,N-диэтиламино)-пент-2-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид; (5R*)-N5-(4-Бромфенил)-(6R*)-N6-(пиперидин-3-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-трет-бутоксикарбониламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(1-гидроксипроп-2-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-имидазолидин-2-он-1-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-пирролидин-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(2-метоксиэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(1H-бензимидазол-2-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(1-метилпирролидин-2-ил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N5-(2-гидроксиэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6,N6-бис-(2-метоксиэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(цианометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-1H-пиразол-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(4-аминометилфенил)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-этил-N6-(2-диэтиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-1H-имидазол-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-([1,4]-диоксан-2-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид; (5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-гидроксибутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(4-метилпиперазин-1-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-аминоэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-метил-N6-(2-Диметиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-трет-бутоксикарбониламинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(метил-трет-бутоксикарбониламино)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-пирролидин-1-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-1H-[1,2,4]-триазол-1-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(фуран-3-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(5-диметиламинопентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-диметиламинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-метоксипропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(1-этилпирролидин-2-ил)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-1H-[1,2,4]-триазол-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-трет-бутоксикарбонилпиперидин-3-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид; (5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(N-трет-бутоксикарбониламино)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-метилбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(2S)-1-гидрокси-4-метилпент-2-ил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(метоксикарбонил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(4-аминосульфонилфенил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(1-этил-5-метил-1H-пиразол-3-ил)-этил)-(4S,*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6,N6-бис-(2-метоксиэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(4,5-диметил-1H-имидазол-2-ил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(1S)-1-карбамоилэтил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-диэтиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(пентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N5-(5-трет-бутоксикарбониламинопентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N5-(N-(3-метилбутил)-пиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-пиридин-2-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2,2-диметил-3-N-трет-бутоксикарбониламинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(1-фенил-1H-пиразол-5-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(циклопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(бутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(гексил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(1-этил-3-метил-1H-пиразол-5-ил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-фенил-2-морфолиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-диэтиламинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-трет-бутоксикарбонилпирролидин-2-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-морфолиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-карбамоилциклогексил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(1-пиперидин-1-илпропан-1-он-2-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-бензилпиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-метил-N6-гексил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3,3-диметилбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-метилпиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-морфолинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(5-метил-1H-пиразол-4-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N5-(3-трет-бутоксикарбонилпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-{[(3-N-трет-бутоксикарбониламинометил)-фенил]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-пропил-N6-(циклопропилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-трет-бутоксикарбонилпиперидин-4-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(циклогексил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-трет-бутоксикарбонилпиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(1S)-1-карбамоил-2-фенилэтил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(2S)-3,3-диметил-1-(метиламино)-1-оксобутан-2-ил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(4-N-трет-бутоксикарбониламинометилфенил)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-трет-бутоксикарбонилазетидин-3-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(N-трет-бутоксикарбонилпиперидин-3-ил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(1S)-2-метокси-1-бензилэтил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(5-метил-3-фенилизоксазол-4-ил)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-карбамоилэтил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-метоксипропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(тетрагидрофуран-2-илметил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(2-имидазолидин-2-он-1-ил)-этил]-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(циклопропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-гидроксипропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(1H-имидазол-1-ил)-пропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(5-(диметиламино)-пентил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-пирролидин-1-илпропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(4-метилпиперазин-1-ил)-пропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(4,5-диметил-1H-имидазол-2-ил)-этил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Бромпиридин-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Метоксифенил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Хлорпиридин-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
{5R*)-N5-(Бензотиазол-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромпиридин-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Метилпиридин-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-Пентил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-[(4-Метилфенил)-метил]-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Метоксикарбонилэтил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(Циклогексилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Метилциклогекс-1-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Оксогексил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Нитротиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Хлортиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Цианотиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(Фуран-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(1-(4-Бромфенил)-этил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Трифторметоксифенил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Феноксиэтил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Метилбутил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-Бутил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Метилфуран-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Метилбензотиазол-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Фенилэтил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Оксопентил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-(1H-Имидазол-1-ил)-пропил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Хлорпиримидин-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Бромфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(Бензотиазол-2-ил)-(6R*)-N5-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-трет-Бутилизоксазол-3-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Метилбензо[d]изотиазол-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(1H-Индол-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(6-Фторбензотиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Этилбутил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-(4-Хлорфенил)-тиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(Бензо[2,1,3]оксадиазол-4-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-трет-Бутилтиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Фенил-[1,2,4]тиадиазол-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(6-Хлорбензотиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-(2-Метил-1H-индол-1-ил)-пропил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(1-Метил-1H-бензимидазол-2-ил)-этил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(1H-Индол-1-ил)-этил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(2-Метоксифенил)-этил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-(3,5-диметилпиразол-1-ил)-пропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(5-фенилизоксазол-4-карбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(4-(2-оксопирролидин-1-ил)-бутириламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(2-(2-хлорфенил)-ацетиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-метоксипропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-(N,N-диметиламинокарбонил)-пропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(2,2-дихлор-1-метилциклопропилкарбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(4-метоксикарбонилбутаноил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-(пентаноиламинометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(2-(2,5-диметилтиазол-4-ил)-ацетиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(1-фенил-1H-пиразол-5-карбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(3-аминокарбонилпропионил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(4-метилпиридин-3-карбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(изобутириламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(N-этилпиперидин-4-карбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-пиридин-3-илпропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[N-(3-метоксипропионил)-N-метиламино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(2-хлор-3-фторфенилкарбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(4-пирролидин-1-илбутаноиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(1,5-диметил-1H-пиразол-3-карбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(циклопентилкарбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(2-(2-метилтиазол-4-ил)-ацетиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(2-(N,N-диметиламино)-ацетиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[N-(2-(2-хлорфенил)-ацетил)-N-метиламино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[N-(1,5-диметил-1H-пиразол-3-карбонил)-N-метиламино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(2-циклопропилацетиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-(1-метил-1H-бензимидазол-2-ил)-пропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-1H-индол-3-илпропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(бутаноиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-(4-фторфенил)-пропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-фенил-акрилоиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(5-хлор-1,3-диметил-1H-пиразол-4-карбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилфенил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Метилтиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Ацетилтиофен-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Ацетилфуран-2-илметил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Ацетилфуран-2-илметил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Трифторметилфенил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Ацетилоксазол-5-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(4,5-Диметил-1H-имидазол-2-ил)-этил)-(6R*)-N6-(4-бромфенил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Йодфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-(изобутил)-изоксазол-3-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Бромтиофен-4-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид; и
(5R*)-N5-(2-Фтор-4-бромфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
или соли (предпочтительно фармацевтически приемлемые соли) таких
соединений;
следует понимать, что в любом из перечисленных выше соединений стереогенный центр, который специально не обозначен, может находиться в абсолютной (R)- или абсолютной (S)-конфигурации и следует понимать, что в любом из перечисленных выше соединений стереогенный центр, который специально не обозначен, может находиться в абсолютной (R)- или абсолютной (S)-конфигурации. В частности, для соединения, указанного в приведенном выше перечне как обладающего относительной (4S*,5R*,6R*,7R*)-конфигурацией, следует понимать, что также включается соответствующий энантиомер с абсолютной (4R,5S,6S,7s)-конфигурацией или соответствующий энантиомер с абсолютной (4S,5R,6R,7R?)-конфигурацией.
51) Другие предпочтительные соединения формулы (I), определенные в варианте осуществления 1), выбраны из группы, включающей: (5R*)-N5-(4-Бромфенил)-(6R*)-N5-(3-диметиламино-3-оксопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-амино-4-оксобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-пирролидино-3-оксопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-амино-2-оксоэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(4-этилпиперазин-1-ил)-бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-пиперидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(азетидин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-морфолинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(4-метил-1,4-диазепан-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(4-метилпиперазин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-пирролидино-4-оксобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(2-(2-(пирролидин-1-ил)этокси)этил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-((3R,6S)-6-(пирролидин-1-илметил)тетрагидро-2H-пиран-3-ил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(4-ацетилпиперазин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N5-(цис-4-(пирролидин-1-илметил)-циклогексил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-((3R)-фторпирролидино)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-((3S)-фторпирролидино)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(5-пирролидинопентил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(транс-4-(пирролидин-1-илметил)-циклогексил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-метиламино-3-оксопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Ацетилтиазол-5-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2,6-Дифтор-4-метоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2,3-Дифтор-4-метоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Фтор-4-метоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3,5-Дифтор-4-метоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Хлорфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Фторфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Трифторметоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Изопропоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромтиазол-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Ацетилоксазол-4-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-пирролидин-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(3-пирролидин-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6/г)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенилметил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Бромпирид-5-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилоксазол-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*5R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(изобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(изобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(изобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-(1H-бензимидазол-2-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(3-(1H-бензимидазол-2-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-(1H-бензимидазол-2-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Метоксипирид-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Бромпиразин-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Трифторметилпиридин-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Метилпиридин-5-ил)-(6R*)-N5-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(Бензо[d]оксазол-6-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Метилизоксазол-3-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Метилтиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Трифторметил-1,3,4-тиадиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Бромпиридин-5-ил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(2-фторэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-((2-имидазолидин-2-оп)-1-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-амино-3-оксопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(4-диэтиламинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-этоксипропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-пирролидинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(3-(4-метилпиперазин-1-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N5-(2-диметиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-диметиламинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-(4-метилпиперазин-1-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-((2-имидазолидин-2-оп)-1-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(4-диэтиламинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(2-фторэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(4-диэтиламинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-(4-метилпиперазин-1-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(2-диметиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-((2-имидазолидин-2-оп)-1-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(2-метоксиэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(3-Диметиламинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Бромпирид-5-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Бромпирид-5-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5r)-N5-(5-Бромпирид-2-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Хлорпирид-5-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Бромтиазол-5-илметил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Метоксифенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Метоксифенил)-(6R)-N6-(3-гидрокси-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-3-фторфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Хлорпиридин-5-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Метоксифенил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенилметил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Метоксифенил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромпиридин-2-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-фторфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-метилфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-3-хлорфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Хлорпиридин-5-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(пиперидин-4-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(2-метиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(5-аминопентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(4-(аминометил)фенилметил)-(4S*,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(2,2-диметил-3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(2-метиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(пиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-(аминометил)фенилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(4-(аминометил)фенилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(2,2-диметил-3-аминопропил)-(4S*,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(пиперидин-4-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Бромтиазол-5-илметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Метилпиридин-2-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2,5-дифторфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2,6-дифторфенил)-(6R)-N5-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2,3-дифторфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2,6-дифторфенилметил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид; (5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(5-аминопентил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(4-аминобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-3-фторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(5-аминопентил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пиперидин-4-ил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пиперидин-4-илметил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6,N6-(3-(аминометил)пентан-1,5-диил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(5-аминопентил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2,3-дифторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-3,5-дифторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2,5-дифторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пиперидин-4-ил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(изобутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-трет-бутоксикарбониламинобутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(5-трет-бутоксикарбониламинопентил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(5-аминопентил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-аминобутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6,N6-(3-(аминометил)пентан-1,5-диил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пиперидин-4-илметил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Бром-3-фторпиридин-5-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Аминобутил)-(6R*)-N6-(4-бромфенил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Аминопентил)-(6R*)-N6-(4-бромфенил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(Циклогексен-1 -ил)этил)-(6Д *)-Л^-(4-пирролидинобутил)-(45*,7Я *)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-трет-Бутилциклогексил)-(6Д *)-Л^-(4-пирролидинобутил)-(45,*,7/? *)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(Пиридин-2-ил)этил)-(6Д *)-Л^-(4-пирролидинобутил)-(45*,7Д *)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-ил)-(6Я *)-Л^-(4-пирролидинобутил)-(45*,7Д *)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Трифторметилтиазол-2-ил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2,4,6-Трифторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2,4-Диметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-[(2-Ацетилтиазол-4-ил)метил]-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Хлор-2-фторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Метилоксазол-2-ил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-[(5-Ацетилтиазол-2-ил)метил]-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Ацетилфенил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Бром-4-фторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Бром-4-фторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2,3,5-Трифторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-[(4-Метил-1,2,5-оксадиазол-3-ил)метил]-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Фтор-3-трифторметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3,5-Диметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Ацетилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Дифторметоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-[(2-Метоксипиридин-4-ил)метил]-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Фтор-5-трифторметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Хлор-5-трифторметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Фтор-5-трифторметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Фтор-3-трифторметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-[(2,6-Дихлорпиридин-4-ил)метил]-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2,5-Диметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4,5-Диметилтиазол-2-ил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Метокси-5-метилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Хлор-3,6-дифторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Изопропоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Хлор-6-фтор-3-метилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Хлор-4-метоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3,4-Диметоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2,4-Диметоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(3,4-Диметоксифенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(4-Метоксифенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*).
[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(4-Бромфенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(3,4-Диметилфенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(4-Метилфенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(4-Фторфенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(Бензо[d][1,3]диоксол-5-ил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(3-Бром-4-метоксифенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(2,4-Диметилфенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Этоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-(4-Хлорфенил)этил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-(4-Хлорфенил)этил)-(6R)-N6-(2-диметиламиноэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-(4-Хлорфенил)этил)-(6R)-N6-(2-(пиридин-2-ил)этил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-(4-Хлорфенил)этил)-(6R)-N6-(2-(4-аминосульфонилфенил)-этил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид; (5R)-N5-(2-(2,4-Дихлорфенил)этил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-(4-Хлорфенил)этил)-(6R)-N6-(N-из6пентилпиперидин-4-ил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-3,5-дифторфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромтиазол-2-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-3-трифторметилфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-[(4-Ацетилтиазол-2-ил)метил]-(6R*)-N6-(2-метиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(2,5-диметилпирролидин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(пирролидин-1-ил)пентил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(3-фтор-4-(пирролидин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(2-(метоксиметил)пирролидин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(3,3-дифторпирролидин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Бром-3-фторпиридин-5-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(2-гидроксиэтил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(3-гидроксипропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-гидроксибутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(2-метил-3-гидроксипроп-2-ил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(2-(2-гидроксиэтокси)этил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-гидроксициклогексил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-[(1-гидроксициклогексил)метил]-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(транс-4-(гидроксиметил)-циклогексил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(цис-4-(гидроксиметил)-циклогексил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пирролидин-3-ил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(2-(N-метиламино)-этил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(3-(N-метиламино)-пропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пиперидин-3-ил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-[(пирролидин-2-ил)-метил]-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-[(пиперидин-2-ил)-метил]-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-[(пиперидин-3-ил)-метил]-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(азетидин-3-ил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(Цис-4-(аминометил)-циклогексил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(транс-4-(аминометил)-циклогексил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид; и
(5R*)-N5-(2-Трифторметилпиридин-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
или соли (предпочтительно фармацевтически приемлемые соли) таких соединений;
следует понимать, что в любом из перечисленных выше соединений стереогенный центр, который специально не обозначен, может находиться в абсолютной (R)- или абсолютной (S)-конфигурации и что двойная связь, которая специально не обозначена, может находиться в (Е)- или (Z)-конфигурации. В частности, для соединения, указанного в приведенном выше перечне как обладающего относительной (4S*,5R*,6R*,7R*)-конфигурацией, следует понимать, что также включается соответствующий энантиомер с абсолютной (4R,5S,6S,7S)-конфигурацией или соответствующий энантиомер с абсолютной (4S,5R,6R,7R)-конфигурацией.
В объем настоящего изобретения также входят изотопно-меченые, предпочтительно меченые с помощью 2Н (дейтерий) соединения формулы (I), эти соединения идентичны соединениями формулы (I) с тем отличием, что один или большее количество заменены атомами, обладающими таким же атомным номером, но атомной массой или массовым числом, отличающимся от атомной массы или массового числа, обычно встречающихся в природе. Изотопно-меченые, предпочтительно меченые с помощью 2Н (дейтерий) соединения формулы (I) и их соли входят в объем настоящего изобретения. Замещение водорода более тяжелым изотопом 2Н (дейтерий) может привести к большей метаболической стабильности, приводящей, например, к увеличенному периоду полувыведения in vivo или возможности использования меньших доз, или может привести к уменьшению ингибирования ферментов цитохромов Р450, что приводит, например, к улучшенному профилю безопасности. В одном варианте осуществления настоящего изобретения соединения формулы (I) не являются изотопно-мечеными или они мечены только одним или большим количеством атомов дейтерия. В одном подварианте осуществления соединения формулы (I) совсем не являются изотопно-мечеными. Изотопно-меченые соединения формулы (I) можно получить по методикам, аналогичным описанным ниже в настоящем изобретении, но с использованием соответствующих изтопозамещенных вариантов подходящих реагентов или исходных веществ.
Термин "фармацевтически приемлемые соли" означает нетоксичные соли присоединения с неорганической или органической кислотой и/или основанием, см., например, "Salt selection for basic drugs", Int. J. Pharm. (1986), 33, 201-217.
Если для соединений, солей, фармацевтических препаратов, заболеваний и т.п.используется форма множественного числа, это также означает одно соединение, соль и т.п.
Соединения формулы (I), соответствующие любому из вариантов осуществления 1)-51), или их фармацевтически приемлемые соли являются подходящими для применения в качестве лекарственных средств. В частности, соединения формулы (I) модулируют рецептор ALX и/или FPRL2, т.е. они выступают в качестве агонистов рецептора ALX и/или в качестве агонистов FPRL2 и применимы для предупреждения или лечения заболеваний, которые отвечают на активацию рецептора ALX и/или FPRL2, таких как воспалительные заболевания, обструктивные заболевания дыхательных путей, аллергические патологические состояния, опосредуемые с помощью ВИЧ ретровирусные инфекции, сердечно-сосудистые нарушения, нейровоспаление, неврологические нарушения, боль, опосредуемые прионом заболевания и опосредуемые амилоидом нарушения (предпочтительно болезнь Альцгеймера); кроме того, они применимы для модулирования иммунных ответов (предпочтительно вызванных вакцинацией). В частности, соединения формулы (I) применимы для предупреждения или лечения заболеваний, таких как воспалительные заболевания, обструктивные заболевания дыхательных путей, аллергические патологические состояния, сердечно-сосудистые нарушения, нейровоспаление, неврологические нарушения, боль, опосредуемые прионом заболевания и опосредуемые амилоидом нарушения (предпочтительно болезнь Альцгеймера).
В частности, соединения формулы (I), соответствующие любому из вариантов осуществления 1)-51), или их фармацевтически приемлемые соли являются подходящими для предупреждения или лечения заболеваний, выбранных из группы, включающей воспалительные заболевания, обструктивные заболевания дыхательных путей и аллергические патологические состояния.
Воспалительные заболевания, обструктивные заболевания дыхательных путей и аллергические патологические состояния включают, но не ограничиваются только ими, одну, несколько или все указанные ниже группы заболеваний и нарушений:
1) Острое поражение легких (ОПЛ); острый респираторный дистресс синдром взрослых (ОРДВ); хроническое обструктивное заболевание легких, дыхательных путей или легочное заболевание (ХОЛЗ, ХОЗД или ХОЗЛ), включая хронический бронхит или связанную с ним одышку; эмфизему; а также обострение гиперреактивности дыхательных путей вследствие другой лекарственной терапии, в частности терапии другим вдыхаемым лекарственным средством. В частности, воспалительные заболевания, обструктивные заболевания дыхательных путей и аллергические патологические состояния включают ХОЛЗ, ХОЗД и ХОЗЛ.
2) Другие воспалительные заболевания, обструктивные заболевания дыхательных путей и аллергические патологические состояния включают бронхит любого типа или генеза.
3) Другие воспалительные заболевания, обструктивные заболевания дыхательных путей и аллергические патологические состояния включают бронхоэктаз и пневмокониоз любого типа или генеза.
4) Другие воспалительные заболевания, обструктивные заболевания дыхательных путей и аллергические патологические состояния включают астму любого типа или генеза, включая наследственную астму (неаллергическую) и приобретенную (аллергическую) астму, слабую астму, астму средней тяжести, тяжелую астму, бронхиальную астму, астму напряжения, профессиональную астму и астму, вызванную бактериальной инфекцией.
5) В другом варианте осуществления соединения формулы (I), соответствующие любому из вариантов осуществления 1)-51), или их фармацевтически приемлемые соли являются особенно подходящими для предупреждения или лечения воспалительных заболеваний. Воспалительные заболевания включают одну, несколько или все указанные ниже группы заболеваний и нарушений:
5а) В частности, воспалительные заболевания означают связанные с нейтрофилами нарушения, предпочтительно связанные с нейтрофилами нарушения дыхательных путей, включая гипернейтрофилию, поскольку она влияет на дыхательные пути и/или легкие. Другие связанные с нейтрофилами нарушения также включают периодонтит, гломерулонефрит и муковисцидоз.
5b) Другие воспалительные заболевания включают заболевания кожи, такие как псориаз, контактный дерматит, атопический дерматит, герпетнформный дерматит, склеродермию, аллергические васкулиты, уртикарию, красную волчанку и эпидермолиз.
5с) Другие воспалительные заболевания также означают заболевания или патологические состояния, содержащие воспалительный компонент. Заболевания или патологические состояния, содержащие воспалительный компонент, включают, но не ограничиваются только ими, заболевания и патологические состояния, влияющие на глаза, такие как увеит (передний, промежуточный и задний), увеит при синдроме Бехчета, конъюнктивит, сухой кератоконъюнктивит, сухой кератоконъюнктивит при синдроме Шегрена, и весенний конъюнктивит (и предпочтительно конъюнктивит, сухой кератоконъюнктивит и весенний конъюнктивит); заболевания, влияющие на нос, включая ринит и аллергический ринит (и предпочтительно аллергический ринит); и воспалительные заболевания, в которых участвуют аутоиммунные реакции или которые обладают аутоиммунным компонентом или этиологией, такие как системная красная волчанка, анкилозирующий спондилит, синдром Бехчета, синдром Шегрена, полихондрия, склеродермия, гранулематоз Вегенера, дерматомиозит, хронический активный гепатит, злокачественная миастения, синдром Стивенса - Джонсона, идиопатический спру, аутоиммунная воспалительная болезнь кишечника (например, язвенный колит и болезнь Крона), эндокринная офтальмопатия, хронический гиперчувствительный пневмонит, первичный биллиарный цирроз, сухой кератоконъюнктивит и весенний кератоконъюнктивит, интерстициальный фиброз легких, псориатический артрит и гломерулонефрит (и предпочтительно системная красная волчанка, полихондрия, склеродермию, гранулематоз Вегенера, дерматомиозит, хронический активный гепатит, злокачественная миастения, синдром Стивенса-Джонсона, идиопатический спру, аутоиммунная воспалительная болезнь кишечника (например, язвенный колит и болезнь Крона), эндокринная офтальмопатия, хронический гиперчувствительный пневмонит, первичный биллиарный цирроз, сухой кератоконъюнктивит и весенний кератоконъюнктивит, интерстициальный фиброз легких, псориатический артрит и гломерулонефрит).
5d) Другие воспалительные заболевания, в которых участвуют аутоиммунные реакции или которые обладают аутоиммунным компонентом или этиологией включают ревматоидный артрит, тиреоидит Хашимото и диабет типа I или II.
Кроме того, соединения формулы (I), соответствующие любому из вариантов осуществления 1)-51), или их фармацевтически приемлемые соли являются подходящими для предупреждения или лечения отторжения трансплантата органа или ткани, например, для лечения реципиентов трансплантата сердца, легких, объединенного сердца-легки, печени, почек, поджелудочной железы, кожи или роговицы и предупреждения реакции "трансплантат против хозяина", такой как иногда возникающая после трансплантации костного мозга, в особенности для лечения острого или хронического отторжения алло- и ксеротрансплантата или при трансплантации клеток, продуцирующих инсулин, например, клеток панкреатических островков.
Кроме того, соединения формулы (I), соответствующие любому из вариантов осуществления 1)-51), или их фармацевтически приемлемые соли являются подходящими для предупреждения или лечения опосредуемых с помощью ВИЧ ретровирусных инфекций.
Опосредуемые с помощью ВИЧ ретровирусные инфекции включают, но не ограничиваются только ими, одну, несколько или все группы заболеваний и нарушений, вызванных штаммами ВИЧ-1 и ВИЧ-2, такими как GUN-4v, GUN-7wt, AG204, AG206, AG208, НСМ305, НСМ308, НСМ342, mSTD104 и НСМ309.
Кроме того, соединения формулы (I), соответствующие любому из вариантов осуществления 1)-51), или их фармацевтически приемлемые соли являются подходящими для предупреждения или лечения сердечно-сосудистых нарушений.
Сердечно-сосудистые нарушения означают одно или большее количество патологических состояний сердечно-сосудистой системы (включая сердце) и заболевания зависимых органов. Патологические состояния сердечно-сосудистой системы и заболевания зависимых органов включают, но не ограничиваются только ими, нарушения сердечной мышцы (кардиомиопатия или миокардит), такие как идиопатическая кардиомиопатия, метаболическая кардиомиопатия, которая включает диабетическую кардиомиопатию, алкогольную кардиомиопатию, вызванную лекарственным средством кардиомиопатию, ишемическую кардиомиопатию и гипертензивную кардиомиопатию; атероматозные нарушения основных кровеносных сосудов (макрососудистое заболевание), таких как аорта, коронарные артерии, сонные артерии, цереброваскулярные артерии, почечные артерии, подвздошные артерии, бедренные артерии и подколенные артерии; токсические, вызванные лекарственным средством и метаболические (включая гипертензивные и/или диабетические) нарушения небольших кровеносных сосудов (микрососудистое заболевание), таких как сетчаточные артериолы, гломерулярные артериолы, нервные сосуды, артериолы сердца и связанные с ними капиллярные русла глаз, почек, сердца и центральной и периферической нервных систем; и разрыв бляшек атероматозных поражений главных кровеносных сосудов, таких как аорта, коронарные артерии, сонные артерии, цереброваскулярные артерии, почечные артерии, подвздошные артерии, бедренные артерии и подколенные артерии.
Кроме того, соединения формулы (I), соответствующие любому из вариантов осуществления 1)-51), или их фармацевтически приемлемые соли являются подходящими для предупреждения или лечения нейровоспаления. Нейровоспаление означает выработку в клетке сигнальных молекул, активацию глии или активацию путей и ответов глии, провоспалитальных цитокинов или хемокинов, активацию астроцитов или активацию путей и ответов астроцитов, активацию микроглии или активацию путей и ответов микроглии, окислительных связанных со стрессом ответов, таких как выработку синтазы оксида азота и накопление оксида азота, белков острой фазы, утрату синаптопсина и белка постсинаптического уплотнения-95 (PSD-95), компонентов комплементарного каскада, утрату или ослабление синаптической функции, активности протеинкиназы (например, смерть, связанная с активностью протеинкиназы), поведенческие дефициты, поражение клеток (например, поражение нейронных клеток), гибель клеток (например, гибель нейронных клеток) и/или осаждение амилоида β в амилоидных бляшках.
Кроме того, соединения формулы (I), соответствующие любому из вариантов осуществления 1)-51), или их фармацевтически приемлемые соли являются подходящими для предупреждения или лечения неврологических нарушений.
В частности, неврологические нарушения включают, но не ограничиваются только ими, эпилепсию, удар, ишемию головного мозга, паралич головного мозга, рецидивирующий-ремиссирующий рассеянный склероз, прогрессирующий рассеянный склероз, зрительный миелоневрит, клинически изолированный синдром, синдром Альперса, боковой амиотрофический склероз (БАС), старческое слабоумие, слабоумие с тельцами Леви, синдром Ретта, травму спинного мозга, травматическое поражение головного мозга, невралгию тройничного нерва, хроническую воспалительную демиелинизирующую полиневропатию, синдром Гийена-Барре, глоссофарингеальную невралгию, паралич Белла, злокачественную миастению, мышечную дистрофию, прогрессирующую мышечную атрофию, прогрессирующую врожденную бульбарную мышечную атрофию, синдромы грыжи, перелома или выпадения межпозвоночного диска, шейный спондилез, нарушения сплетения, компрессионный синдром разрушения верхней апертуры грудной клетки, периферические невропатии, слабое ухудшение познавательной способности, ухудшение познавательной способности, болезнь Альцгеймера, болезнь Паркинсона и хорею Гентингтона (и предпочтительно эпилепсию, удар, ишемию головного мозга, паралич головного мозга, рецидивирующий-ремиссирующий рассеянный склероз, прогрессирующий рассеянный склероз, синдром Альперса, боковой амиотрофический склероз (БАС), старческое слабоумие, слабоумие с тельцами Леви, синдром Ретта, травму спинного мозга, травматическое поражение головного мозга, невралгию тройничного нерва, глоссофарингеальную невралгию, паралич Белла, злокачественную миастению, мышечную дистрофию, прогрессирующую мышечную атрофию, прогрессирующую врожденную бульбарную мышечную атрофию, синдромы грыжи, перелома или выпадения межпозвоночного диска, шейный спондилез, нарушения сплетения, компрессионный синдром разрушения верхней апертуры грудной клетки, периферические невропатии, слабое ухудшение познавательной способности, ухудшение познавательной способности, болезнь Альцгеймера, болезнь Паркинсона и хорею Гентингтона).
Кроме того, соединения формулы (I), соответствующие любому из вариантов осуществления 1)-51), или их фармацевтически приемлемые соли являются подходящими для предупреждения или лечения боли. Боль включает, но не ограничивается только ими, невропатическую боль, примерами которой являются такие патологические состояния, как диабетическая невропатия, постгерпетическая невралгия, невралгия тройничного нерва, болезненная диабетическая полиневропатия, боль после удара, боль после ампутации, миелопатическая или радикулопатическая боль, атипическая лицевая боль и синдромы типа каузалгии.
Кроме того, соединения формулы (I), соответствующие любому из вариантов осуществления 1)-51), или их фармацевтически приемлемые соли являются подходящими для предупреждения или лечения опосредуемых прионом заболеваний. Опосредуемые прионом заболевания, также известные под названием трансмиссивные губчатые энцефалопатии (ТГЭ), включают, но не ограничиваются только ими, куру, синдром Герстманна-Стройсслера-Шейнкера (ГСШ), летальную семейную инсомнию (ЛСИ) и болезнь Крейтцфельда-Якоба (БКЯ).
Кроме того, соединения формулы (I), соответствующие любому из вариантов осуществления 1)-51), или их фармацевтически приемлемые соли являются подходящими для лечения опосредуемых амилоидом нарушений. Опосредуемые амилоидом нарушения определяются, как заболевания и нарушения, которые вызваны амилоидными или амилоидноподобными белками или связаны с ними. Заболевания и нарушения, вызванные амилоидными или амилоидноподобными белками или связанными с ними включают, но не ограничиваются только ими, болезнь Альцгеймера (БА), включая заболевания или патологические состояния, характеризующиеся уменьшением объема памяти познавательной способности, такие как, например, слабое ухудшение познавательной способности (СПС); слабоумие с тельцами Леви; синдром Дауна; внутримозговое кровоизлияние с амилоидозом. В другом варианте осуществления заболевания и нарушения, вызванные амилоидными или амилоидноподобными белками или связанными с ними включают прогрессирующий супрануклеарный паралич, амилоидный амилоидоз легких цепей, семейные амилоидные невропатии, рассеянный склероз, болезнь Крейтцфельда-Якоба, болезнь Паркинсона, связанное с ВИЧ слабоумие, боковой амиотрофический склероз (БАС), миозит с включенными тельцами (IBM), возникновение диабета у взрослых и старческий амилоидоз сердца (и предпочтительно прогрессирующий супрануклеарный паралич, рассеянный склероз, болезнь Крейтцфельда-Якоба, болезнь Паркинсона, связанное с ВИЧ слабоумие, боковой амиотрофический склероз (БАС), миозит с включенными тельцами (IBM), возникновение диабета у взрослых и старческий амилоидоз сердца).
Кроме того, соединения формулы (I), соответствующие любому из вариантов осуществления 1)-51), или их фармацевтически приемлемые соли являются подходящими для модулирования иммунных ответов.
Модулирование иммунных ответов включает, но не ограничивается только ими, способы, основанные на введении субъекту композиции по меньшей мере одного антигена и по меньшей мере одного соединения формулы (I), соответствующего любому из вариантов осуществления 1)-51), или его фармацевтически приемлемых солей. В некоторых случаях содержащую антиген композицию вводят первой, затем вводят композицию по меньшей мере одного соединения формулы (I), соответствующего любому из вариантов осуществления 1)-51), или его фармацевтически приемлемых солей. В других случаях содержащую антиген композицию вводят последней. Различные композиции можно вводить одновременно, вскоре одну после другой или раздельно во времени. Эти способы и композиции предназначены для терапевтический или профилактической иммунизации (т.е. преднамеренной провокации, усиления, интенсификации или модулирования адаптационного и/или врожденного иммунного ответа). Особые преимущества могут включать одно или большее количество из следующих:
1) Ускоренный и иммунный ответ после введения по меньшей мере одного соединения формулы (I), соответствующего любому из вариантов осуществления 1)-51), или его фармацевтически приемлемых солей и антигена, по сравнению с введением только антигена;
2) Более высокая чувствительность к небольшим количествам антигена (например, токсина или патогена) или антигенов, которые обычно не вызывают сильные иммунные ответы; и
3) Более эффективное противоопухолевое лечение.
Кроме того, соединения формулы (I), соответствующие любому из вариантов осуществления 1)-51), или их фармацевтически приемлемые соли являются подходящими для предупреждения или лечения муковисцидоза, фиброза легких, легочной гипертензии, заживления ран, диабетической нефропатии, уменьшения воспаления трансплантированной ткани, воспалительных заболеваний, вызванных патогенными организмами.
В частности, соединения формулы (I), соответствующие любому из вариантов осуществления 1)-51), или их фармацевтически приемлемые соли являются подходящими для предупреждения или лечения заболеваний, выбранных из одной, нескольких или всех указанных ниже групп заболеваний и нарушений:
1) Воспалительные заболевания, обструктивные заболевания дыхательных путей и аллергические патологические состояния, такие как острое поражение легких (ОПЛ); острый респираторный дистресс синдром взрослых (ОРДВ); хроническое обструктивное заболевание легких, дыхательных путей или легочное заболевание (ХОЛЗ, ХОЗД или ХОЗЛ), включая хронический бронхит или связанную с ним одышку; и астму любого типа или генеза, включая наследственную астму (неаллергическую) и приобретенную (аллергическую) астму, слабую астму, астму средней тяжести, тяжелую астму, бронхиальную астму, астму напряжения, профессиональную астму и астму, вызванную бактериальной инфекцией (и предпочтительно острое поражение легких (ОПЛ); острый респираторный дистресс синдром взрослых (ОРДВ); и астму любого типа или генеза, включая наследственную астму (неаллергическую) и приобретенную (аллергическую) астму, слабую астму, астму средней тяжести, тяжелую астму, бронхиальную астму, астму напряжения, профессиональную астму и астму, вызванную бактериальной инфекцией);
2) Воспалительные заболевания, такие как связанные с нейтрофилами нарушения, предпочтительно связанные с нейтрофилами нарушения дыхательных путей, включая гипернейтрофилию, поскольку она влияет на дыхательные пути и/или легкие; периодонтит; гломерулонефрит; муковисцидоз; и заболевания кожи, такие как псориаз, контактный дерматит, атопический дерматит, герпетиформный дерматит, склеродермию, аллергические васкулиты, уртикарию, красную волчанку, и эпидермолиз;
3) Заболевания, содержащие воспалительный компонент, такие как заболевания и патологические состояния, влияющие на глаза, такие как конъюнктивит, сухой кератоконъюнктивит и весенний конъюнктивит; воспалительное заболевание, в котором участвует аутоиммунные реакции или которое обладает аутоиммунным компонентом или этиологией; и аутоиммунная воспалительная болезнь кишечника (например, язвенный колит и болезнь Крона);
4) Опосредуемые с помощью ВИЧ ретровирусные инфекции, такие как заболевания и нарушения, вызванные штаммами ВИЧ-1 и ВИЧ-2, такими как GUN-4v, GUN-7wt, AG204, AG206, AG208, НСМ305, НСМ308, НСМ342, mSTD104 и НСМ309;
5) Нейровоспаление, которое означает выработку в клетке сигнальных молекул, активацию глии или активацию путей и ответов глии, провоспалитальных цитокинов или хемокинов, активацию астроцитов или активацию путей и ответов астроцитов, активацию микроглии или активацию путей и ответов микроглии, окислительных связанных со стрессом ответов, таких как осаждение амилоида (3 в амилоидных бляшках.
6) Неврологические нарушения, такие как удар, ишемия головного мозга, болезнь Альцгеймера и болезнь Паркинсона;
7) Опосредуемые прионом заболевания, также известные под названием трансмиссивные губчатые энцефалопатии (ТГЭ), такие как куру, синдром Герстманна-Стройсслера-Шейнкера (ГСШ), летальная семейная инсомния (ЛСИ) и болезнь Крейтцфельда-Якоба (БКЯ);
8) Опосредуемые амилоидом нарушения;
9) Муковисцидоз, заживление ран и воспалительные заболевания, вызванные патогенными организмами.
Настоящее изобретение также относится к применению соединения формулы (I), соответствующего любому из вариантов осуществления 1)-51), для приготовления фармацевтических композиций, предназначенных для лечения и/или профилактики указанных выше заболеваний.
Настоящее изобретение также относится к фармацевтически приемлемым солям и к фармацевтическим композициям и препаратам соединений формулы (I), соответствующих любому из вариантов осуществления 1)-51).
Фармацевтическая композиция, предлагаемая в настоящем изобретении, содержит по меньшей мере одно соединение формулы (I), соответствующее любому из вариантов осуществления 1)-51) (или его фармацевтически приемлемую соль) в качестве активного средства и необязательно носители и/или разбавители, и/или вспомогательные вещества.
Соединения формулы (I), соответствующие любому из вариантов осуществления 1)-51), и их фармацевтически приемлемые соли можно использовать в качестве лекарственных средств, например, в форме фармацевтических композиций для энтерального или парентерального введения.
Приготовление фармацевтических композиций можно провести по методикам, которые должны быть известны любому специалисту в данной области техники (см., например, Remington, The Science and Practice of Pharmacy, 21st Edition (2005), Part 5, "Pharmaceutical Manufacturing" [published by Lippincott Williams & Wilkins]), путем внесения описанных соединений формулы (I) или их фармацевтически приемлемых солей, необязательно в комбинации с другим терапевтически полезными веществами в галенову вводимую форму вместе с подходящими нетоксичными инертными терапевтически совместимыми твердыми или жидкими носителями и при необходимости с обычными фармацевтическими вспомогательными веществами.
Настоящее изобретение также относится к способу предупреждения или лечения заболевания или нарушения, указанноум в настоящем изобретении, включающему введение субъекту соединения формулы (I), соответствующего любому из вариантов осуществления 1)-51), или его фармацевтически приемлемой соли в фармацевтически активном количестве.
Любое указание на соединение формулы I, IP, IST1 или IST2 в этом тексте следует понимать, как указание и на соли (и предпочтительно фармацевтически приемлемые соли) таких соединений, если это является подходящим или целесообразным. Разумеется, предпочтения, указанные для соединений формулы I, с соответствующими изменениями применимы к соединениям формулы IР, к соединениям формулы IST1 и соединениям формулы IST2 а также к солям и фармацевтически приемлемым солям соединений формулы I, формулы IP, формулы IST1 или формулы IST2. Это относится и к этим соединениям в качестве лекарственных средств, к фармацевтическим композициям, содержащим эти соединения в качестве активных действующих средств, или применению этих соединений для приготовления лекарственного средства, предназначенного для лечения заболеваний, указанных в настоящем изобретении.
Кроме использования применительно к температурам, термин "примерно" (или, альтернативно, "около"), расположенный перед числовым значением "X" в настоящей заявке означает интервал, составляющий от X - 10% от X до X+10% от X, и предпочтительно интервал, составляющий от X - 5% от X до X+5% от X. В частном случае температур термин "примерно" (или, альтернативно, "около"), расположенный перед значением температуры "Y" в настоящей заявке означает интервал, составляющий от температуры Y - 10***С до Y+10***С, и предпочтительно интервал, составляющий от Y - 5***С до Y+5***С. Кроме того, термин "комнатная температура" (КТ) при использовании в настоящем изобретении означает температуру, равную примерно 25***С.
Соединения формулы (I) можно получить по методикам, приведенным ниже, по методикам, приведенным в примерах или по аналогичным методикам. Оптимальные условия проведения реакции могут меняться в зависимости от конкретных использующихся реагентов или растворителей, но такие условия специалист в данной области техники может определить с помощью стандартных процедур оптимизации.
Если не указано иное, то типичные группы R1, R2, R3, R4, R5, R6, R7, R8, R9, W, Y и Z являются такими, как определено для формулы (I). Другие использующиеся аббревиатуры определены в экспериментальном разделе.
Реакции спиртов с метансульфонилхлоридом могут привести к образованию соответствующего хлоридного или соответствующего мезилатного производного в зависимости от использующихся условий проведения реакции; в данной области техники хорошо известно, что даже небольшие изменения таких условий проведения реакции могут повлиять на выход указанных реакций; следует понимать, что оба реагента, хлорид и мезилат, можно использовать в качестве электрофильных реагентов в рассмотренных ниже реакциях.
В некоторых случаях типичные группы R1, R2, R3, R4, R5, R6, R7, R8, R9, W, Y и Z могут быть несовместимы с веществами, приведенными на представленных ниже схемах, и поэтому требуется использовать защитные группы (PG). Использование защитных групп хорошо известно в данной области техники (см., например, "Protective Groups in Organic Synthesis", T.W. Greene, P.G.M. Wuts, Wiley-Interscience, 1999). Для задач настоящего изобретения предполагается, что при необходимости содержатся такие защитные группы.
А. Синтез конечных продуктов
В приведенных ниже разделах А.а)-A.g) описаны общие методики получения соединений формулы (I).
А.а) Соединения формулы (I), в которой Z обозначает -C(O)NR3-*, можно получить из карбоновых кислот структуры 1 по реакции с подходящим амином R2R3NH с использованием стандартных условий сочетания с получением амида, таких как использование ЭДХ (этилендйхлорид)/HOBt/ДМАП или ДЦК/HOAt, или РуВОР, или HATU/ДМАП в присутствии основания, такого как ДИПЭА, при температуре, примерно равной КТ, в подходящем растворителе, таком как CH2Cl2. Альтернативно, соединения формулы (I) можно получить путем сочетания карбоновых кислот структуры 1 с подходящим амином R2R3NH с использованием РОСl3 в подходящем растворителе, таком как ДХЭ/пиридин (1:1). Альтернативно, соединения формулы (I) можно получить путем сочетания карбоновых кислот структуры 1 с промежуточным образованием ацилхлорида (с использованием стандартных условий, таких как оксалилхлорид и каталитическое количество ДМФ, в растворителе, таком как толуол). Альтернативно, соединения формулы (I) можно получить по реакции сложных эфиров структуры 2, в которой R10 обозначает (С1-С2)алкил, с подходящим амином R2R3NH с использованием АlМе3 в подходящем растворителе, таком как СН2Сl2.


A.b) Альтернативно, соединения формулы (I), в которой Z обозначает -C(O)NR3-*, можно получить по реакции карбоновых кислот структуры 3 с подходящим амином R1-Y-NH2 с использованием стандартных условий сочетания с получением амида, таких как использование ЭДХ/HOBt/ДМАП или ДЦК/HOAt в присутствии основания, такого как ДИПЭА при температуре около КТ в подходящем растворителе, таком как CH2Cl2. Альтернативно, соединения формулы (I) можно получить путем сочетания карбоновых кислот структуры 3 с подходящим амином R1-Y-NH2 с использованием РОСl3 в подходящем растворителе, таком как ДХЭ/пиридин (1:1).
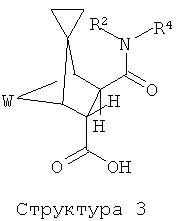
А.с) Альтернативно, соединения формулы (I), в которой Z обозначает -СН2-NR4C(O)-*, можно получить по реакции аминов структуры 4 с подходящей карбоновой кислотой R2СООН с использованием стандартных условий сочетания с получением амида, таких как использование ЭДХ/HOBt/ДМАП или ДЦК/HOAt в присутствии основания, такого как ДИПЭА при температуре около КТ в подходящем растворителе, таком как СН2Сl2.
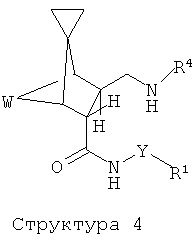
A.d) Альтернативно, соединения формулы (I), в которой R1 обозначает или содержит (С1-С2)алкилкарбонильную группу, можно получить путем удаления защитной группы кеталя структуры 5, в которой А обозначает связь (в случае, когда Y обозначает (C1-С4)алкандиильную группу) или арильную или гетероарильную группу, с использованием кислоты, такой как разбавленный водный раствор НСl в растворителе, таком как ТГФ (тетрагидрофуран), при температуре около КТ.

R11 обозначает (С1-С2)алкил и Rx обозначает (C1-С2)алкил или оба Rx вместе образуют этан-1,2-диильный мостик
А.е) Альтернативно, соединения формулы (I), в которой R1 обозначает или содержит (С1-С2)алкилкарбонильную группу, можно получить путем удаления защитной группы из защищенного силильной группой спирта структуры 6, в которой А обозначает связь (в случае, когда Y обозначает (С1-С4)алкандиильную группу) или арильную или гетероарильную группу, с использованием, например, ТБАФ в подходящем растворителе, таком как ТГФ, с последующим окислением с использованием, например, МnО2 в подходящем растворителе, таком как AcCN.

R11 обозначает (С1-С2)алкил и SiPG обозначает подходящую силильную защитную группу, такую как TMS, TIPS, TBDMS или TBDPS (предпочтительно TBDMS).
A.f) Альтернативно, соединения формулы (I), в которой R2 содержит первичную или вторичную аминогруппу, можно получить путем удаления защитной группы соответствующего защищенного амина, такой как N-трет-бутоксикарбонильная защитная группа аминогруппы с использованием кислоты, такой как НСl в смеси растворителей, такой как диоксан и CH2Cl2, при температуре около КТ.
A.g) Альтернативно, соединения формулы (I), в которой R2 содержит
амидную группу (-C(O)NR7R8), можно получить омылением соответствующего сложного эфира с последующей активацией полученной карбоновой кислоты путем образования смешанного ангидрида, например, с использованием этилхлорформиата и основания, такого как Et3N, в подходящем растворителе, таком как ТГФ, при температуре в диапазоне от 0°С до КТ и с последующей реакцией с подходящим амином R7R8NH.
В. Синтез промежуточных продуктов
В1. Синтез спиросоединений

R10 обозначает (C1-С2)алкил
Соединения структуры 1 можно получить омылением сложноэфирного фрагмента соединений структуры 2 с использованием основания, такого как LiOH, или NaOH, в растворителе, таком как смесь воды и органического растворителя, такого как ТГФ или EtOH.
Соединения структуры 2, в которой W обозначает -СН=СН-, можно получить по следующей последовательности реакций (см. схему 1): а) реакция Дильса-Альдера между спиро[2.4]гепта-4,6-диеном (получали в соответствии с J.W. Сое et al. Org. Letters 2004, 6, 1589) и имеющимся в продаже моноэтиловым эфиром (E)-бут-2-ендикарбоновой кислоты в подходящем растворителе, таком как МеОН, с получением смеси эндо- и экзо-продуктов; b) йодлактонизацией с использованием KI и I2 в присутствии основания, такого как NaHCO3, в растворителе, таком как CH2Cl2, при температуре около КТ с обеспечением разделения изомеров (йодлактона 1 (сложный эфир) и йодлактона 2 (карбоновая кислота)); с) ретро-йодлактонизация полученного йодлактона 1 с использованием избытка цинка в растворителе, таком как АсОН, при температуре примерно 65°С; и d) сочетание с образованием амида полученной карбоновой кислоты с подходящим амином R1-Y-NH2 с промежуточным образованием ацилхлорида (с использованием стандартных условий, таких как оксалилхлорид и каталитическое количество ДМФ, в растворителе, таком как толуол или CH2Cl2) в присутствии основания, такого как ДИПЭА, Et3N или пиридин, и в подходящем растворителе, таком как СН2Сl2, ТГФ или ацетон, или путем активации карбоновой кислоты с использованием стандартных условий сочетания с получением амида, таких как использование ЭДХ/HOBt/ДМАП в присутствии основания, такого как ДИПЭА, в подходящем растворителе, таком как СН2Сl2. Следует понимать, что в случае, когда заместитель R1 обозначает или содержит (С1-С2)алкилкарбонильную группу, соответствующую кетогруппу можно защитить в амине, использующемся на стадии d), путем образования кеталя или силилированного спирта; затем полученные промежуточные продукты можно превратить в соединения структуры 5 или 6 соответственно (см. ниже).
Соединения структуры 2, в которой W обозначает -СН2-СН2-, можно получить по следующей последовательности реакций (см. схему 1): а) реакция Дильса-Альдера между спиро[2.4]гепта-4,6-диеном и имеющимся в продаже моноэтиловым эфиром (Е)-бут-2-ендикарбоновой кислоты в подходящем растворителе, таком как МеОН, с получением смеси эндо- и экзо-продуктов; b) йодлактонизация с использованием KI и I2 в присутствии основания, такого как NaHCO3, в растворителе, таком как CH2Cl2, при температуре около КТ с обеспечением разделения изомеров (йодлактона 1 (сложный эфир) и йодлактона 2 (карбоновая кислота)); с) ретро-йодлактонизация полученного йодлактона 1 с использованием избытка цинка в растворителе, таком как АсОН, при температуре примерно 65°С; d) восстановление двойной связи с использованием циклогексена в присутствии Pd/C в подходящем растворителе, таком как ТГФ; и е) сочетание с образованием амида полученной карбоновой кислоты с подходящим амином R'-Y-NFb с промежуточным образованием ацилхлорида (с использованием стандартных условий, таких как оксалилхлорид и каталитическое количество ДМФ, в растворителе, таком как толуол или CH2Cl2) в присутствии основания, такого как ДИПЭА, Et3N или пиридин, и в подходящем растворителе, таком как CH2Cl2, ТГФ или ацетон, или путем активации карбоновой кислоты с использованием стандартных условий сочетания с получением амида, таких как использование ЭДХ/НОВх/ДМАП в присутствии основания, такого как ДИПЭА, в подходящем растворителе, таком как CH2Cl2. В случае, когда заместитель R1 обозначает или содержит (C1-С2)алкилкарбонильную группу, соответствующую кетогруппу можно защитить, как описано выше (соединения структуры 2, в которой W обозначает -СН=СН-).
Соединения структуры 3, в которой W обозначает -СН=СН-, можно получить по следующей последовательности реакций (см. схему 1): а) сочетание с образованием амида йодлактона 2 с подходящим амином R2R3NH, в котором R2, если он содержит первичную или вторичную аминогруппу, то может потребоваться введение защитной группы, например, N-трет-бутоксикарбонильной защитной группы аминогруппы с промежуточным образованием ацилхлорида (с использованием стандартных условий, таких как оксалилхлорид и каталитическое количество ДМФ, в растворителе, таком как толуол) в присутствии основания, такого как ДИПЭА, и в подходящем растворителе, таком как СН2Сl2, или путем активации карбоновой кислоты с использованием стандартных условий сочетания с получением амида, таких как использование ЭДХ/HOBt/ДМАП в присутствии основания, такого как ДИПЭА, в подходящем растворителе, таком как CH2Cl2; и b) ретро-йодлактонизация полученного йодлактона 3 с использованием избытка цинка в растворителе, таком как АсОН, при температуре примерно 65°С.
Соединения структуры 3, в которой W обозначает -СН2-СН2-, можно получить восстановлением двойной связи соединений структуры 3, в которой W обозначает -СН=СН- с использованием, например, водорода в присутствии Pd/C в подходящем растворителе, таком как EtOH или циклогексен, в присутствии Pd/C в подходящем растворителе, таком как ТГФ (см. схему 1).
Соединения структуры 4 можно получить восстановлением сложных эфиров соединений структуры 2 с использованием восстановительного реагента, такого как LiBH4, в подходящем растворителе, таком как ТГФ, при температуре примерно 65°С с последующим образованием соответствующего сульфоната (например, трифлата) по реакции спирта с производным сульфонилхлорида или ангидрида (например, трифторметансульфонового ангидрида) в подходящем растворителе, таком как CH2Cl2, в присутствии основания, такого как ДИПЭА, при температуре в диапазоне от -78 до 0°С и с последующей реакцией с R4NH2 в подходящем растворителе, таком как СН2Сl2, при температуре в диапазоне от -78°С до КТ. Альтернативно промежуточный сульфонат можно превратить в соответствующий азид с использованием азида натрия в подходящем растворителе, таком как ДМФ, при температуре примерно 80°С и с последующим восстановлением азида в амин с использованием Ph3P в подходящем растворителе, таком как ТГФ/Н2О.
Соединения структур 5 и 6 можно получить из эфиров карбоновых кислот структуры 2, в которой R1 обозначает или содержит замаскированную (C1-С2)алкилкарбонильную группу (например, силилированный спирт или защищенный путем образования ацеталя кетон) омылением сложноэфирного фрагмента с использованием основания, такого как LiOH, или NaOH, в растворителе, таком как смесь воды и органического растворителя, такого как ТГФ или EtOH, с последующей реакцией полученной карбоновой кислоты с
подходящим амином R2R3NH с использованием стандартных условий сочетания с получением амида, таких как использование ЭДХ/HOBt/ДМАП или ДЦК/HOAt в присутствии основания, такого как ДИПЭА при температуре около КТ в подходящем растворителе, таком как СН2Сl2. Альтернативно, соединения структур 5 и 6 можно получить по реакции сложных эфиров структуры 2, в которой R1 обозначает или содержит замаскированную (C1-С2)алкилкарбонильную группу, с подходящим амином R2R3NH с использованием АlМе3 в подходящем растворителе, таком как CH2Cl2. Соединения структуры 2, в которой R1 обозначает или содержит замаскированную (C1-С2)алкилкарбонильную группу можно получить в соответствии со схемой 1 с использованием соответствующего амина R1-Y-NH2, в котором R1 обозначает или содержит замаскированную (С1-С2)алкилкарбонильную группу (см. выше).
Альтернативно, соединения структур 5 и 6 можно получить из соединений структуры 3 по реакции с подходящим амином R1-Y-NH2, в котором R1 обозначает или содержит замаскированную (С1-С2)алкилкарбонильную группу, определенную выше, с использованием стандартных условий сочетания с получением амида, таких как использование ЭДХ/HOBt/ДМАП или ДЦК/HOAt в присутствии основания, такого как ДИПЭА при температуре около КТ в подходящем растворителе, таком как CH2Cl2.
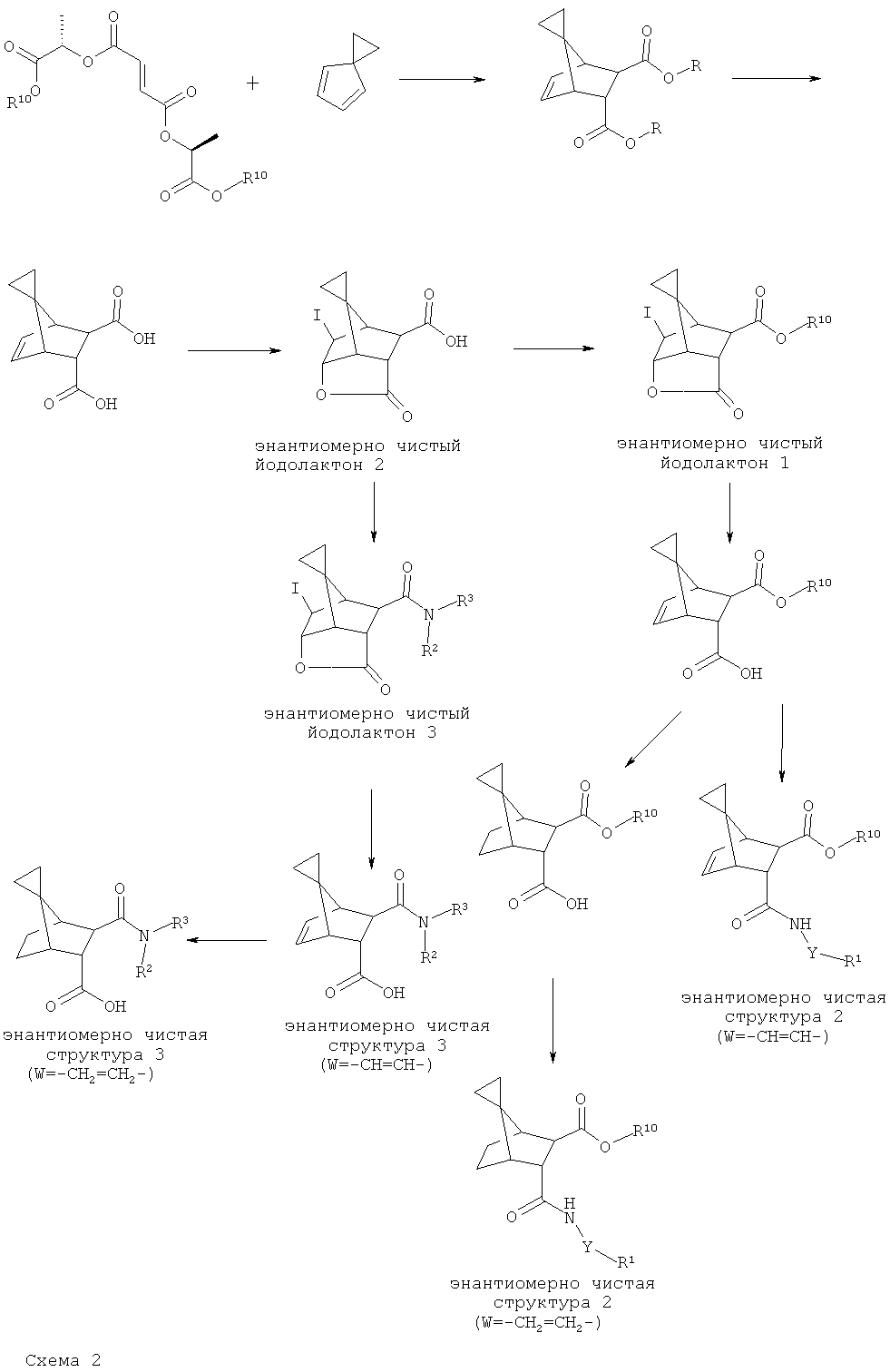
R10 обозначает (С1-С2)алкил и R обозначает (S)-CH(Me)COOR10 Энантиомерно чистые соединения структуры 1 можно получить омылением сложноэфирного фрагмента энантиомерно чистых соединений структуры 2 с использованием основания, такого как LiOH, или NaOH, в растворителе, таком как смесь воды и органического растворителя, такого как ТГФ или EtOH.
Энантиомерно чистые соединения структуры 2, в которой W обозначает -СН=СН-, можно получить по следующей последовательности реакций (см. схему 2): а) реакция Дильса-Альдера между спиро[2.4]гепта-4,6-диеном и имеющимся в продаже (E)-1,2-бис-[((1S)-1-этоксикарбонилэтокси)-карбонил]-этен в подходящем растворителе, таком как гексан; отнесение стереогенных центров полученных промежуточных продуктов проводили на основании литературных данных (G. Helmchen et al., Angew. Chem. Int. Ed. 1987, 26, 1143), где описана реакция Дильса-Альдера между циклопентадиеном и (E)-1,2-бис-[((1S)-1-этоксикарбонилэтокси)-карбонил]-этеном; b) омыление сложноэфирных фрагментов с использованием основания, такого как LiOH, в подходящем растворителе, таком как смесь ТГФ и воды; с) йодлактонизация с использованием KI и I2 в присутствии основания, такого как NaHCO3, в растворителе, таком как CH2Cl2, при температуре около КТ с получением энантиомерно чистого йодлактона 2; d) этерификация полученной карбоновой кислоты с использованием стандартных условий, таких как TMSCH2N2 в подходящем растворителе, таком как МеОН, или с промежуточным образованием ацилхлорида (с использованием стандартных условий, таких как оксалилхлорид и каталитическое количество ДМФ, в растворителе, таком как толуол или CH2Cl2) и с последующей реакцией с МеОН; е) ретро-йодлактонизация полученного сложного эфира йодлактона с использованием избытка цинка в растворителе, таком как АсОН, при температуре примерно 65°С; и f) сочетание с образованием амида полученной карбоновой кислоты с подходящим амином R1-Y-NH2 с промежуточным образованием ацилхлорида (с использованием стандартных условий, таких как оксалилхлорид и каталитическое количество ДМФ, в растворителе, таком как толуол или CH2Cl2) в присутствии основания, такого как ДИПЭА, Et3N или пиридин, и в подходящем растворителе, таком как СН2Сl2, ТГФ или ацетон, или путем активации карбоновой кислоты с использованием стандартных условий сочетания с получением амида, таких как использование ЭДХ/HOBt/ДМАП в присутствии основания, такого как ДИПЭА, в подходящем растворителе, таком как СН2Сl2. Следует понимать, что в случае, когда заместитель R1 обозначает или содержит (С1-С2)алкилкарбонильную группу, соответствующую кетогруппу можно защитить в амине, использующемся на стадии f), путем образования кеталя или силилированного спирта.
Энантиомерно чистые соединения структуры 2, в которой W обозначает -СН2-СН2-, можно получить по следующей последовательности реакций (см. схему 2): а) этерификация энантиомерно чистого йодлактона 2 с использованием стандартных условий, таких как TMSCH2N2 в подходящем растворителе, таком как МеОН, или с промежуточным образованием ацилхлорида (с использованием стандартных условий, таких как оксалилхлорид и каталитическое количество ДМФ, в растворителе, таком как толуол или CH2Cl2) и с последующей реакцией с МеОН с получением энантиомерно чистого йодлактона 1; b) ретро-йодлактонизация полученного сложного эфира йодлактона с использованием избытка цинка в растворителе, таком как АсОН, при температуре примерно 65°С; с) восстановление двойной связи с использованием циклогексена в присутствии Pd/C в подходящем растворителе, таком как ТГФ; и d) сочетание с образованием амида полученной карбоновой кислоты с подходящим амином R1-Y-NH2 с промежуточным образованием ацилхлорида (с использованием стандартных условий, таких как оксалилхлорид и каталитическое количество ДМФ, в растворителе, таком как толуол или CH2Cl2) в присутствии основания, такого как ДИПЭА, Et3N или пиридин, и в подходящем растворителе, таком как CH2Cl2, ТГФ или ацетон, или путем активации карбоновой кислоты с использованием стандартных условий сочетания с получением амида, таких как использование ЭДХ/HOBt/ДМАП в присутствии основания, такого как ДИПЭА, в подходящем растворителе, таком как CH2Cl2. Следует понимать, что в случае, когда заместитель R1 обозначает или содержит (С1-С2)алкилкарбонильную группу, соответствующую кетогруппу можно защитить в амине, использующемся на стадии d), путем образования кеталя или силилированного спирта.
Энантиомерно чистые соединения структуры 3, в которой W обозначает -СН=СН-, можно получить по следующей последовательности реакций (см. схему 2): а) сочетание с образованием амида энантиомерно чистого йодлактона 2 с подходящим амином R2R3NH, в котором R2, если он содержит первичную или вторичную аминогруппу, то может потребоваться введение защитной группы, например, N-трет-бутоксикарбонильной защитной группы аминогруппы с промежуточным образованием ацилхлорида (с использованием стандартных условий, таких как оксалилхлорид и каталитическое количество ДМФ, в растворителе, таком как толуол) в присутствии основания, такого как ДИПЭА, и в подходящем растворителе, таком как CH2Cl2, или путем активации карбоновой кислоты с использованием стандартных условий сочетания с получением амида, таких как использование ЭДХ/HOBt/ДМАП в присутствии основания, такого как ДИПЭА, в подходящем растворителе, таком как CH2Cl2; и b) ретро-йодлактонизация полученного энантиомерно чистого йодлактона 3 с использованием избытка цинка в растворителе, таком как АсОН, при температуре примерно 65°С.
Энантиомерно чистые соединения структуры 3, в которой W обозначает -СН2-СН2-, можно получить восстановлением двойной связи энантиомерно чистых соединений структуры 3, в которой W обозначает -СН=СН-, например, водородом в присутствии Pd/C в подходящем растворителе, таком как EtOH или циклогексен, в присутствии Pd/C в подходящем растворителе, таком как ТГФ (см. схему 2).
Энантиомерно чистые соединения структуры 4, в которой W обозначает -СН=СН- или -СН2-СН2-, можно получить из энантиомерно чистых соединений структуры 2 по аналогии с синтезом, описанным на схеме 1.
Энантиомерно чистые соединения структур 5 и 6, в которых W обозначает -СН=СН- или -СН2-СН2-, можно получить по аналогии со схемой 1.
Обычно энантиомерно чистые соединения структуры 1 можно получить или по аналогии с синтезом рацемических соединений структуры 1 с использованием в качестве исходного вещества энантиомерно чистого йодлактона 1 или 2, или путем проводимой с помощью хиральной ВЭЖХ очистки смеси энантиомеров.
В2. Синтез аминов R1-Y-NH2
Амины формулы R1-Y-NH2, если они не имеются в продаже, можно получить например по следующей последовательности реакций: а) превращение спирта R1-Y-OH в соответствующий мезилат или хлорид с использованием, например, MsCl, в присутствии основания, такого как Et3N и ДМАП, в подходящем растворителе, таком как СН2Сl2; b) превращение мезилата или хлорида в соответствующий азид с использованием, например, NaN3 в растворителе, таком как ДМФ, при температуре примерно 80°С; с) восстановление азидного фрагмента или с использованием Ph3Р и воды в растворителе, таком как ТГФ, при температуре примерно 60°С, или гидрированием с использованием содержащего металл катализатора, такого как Pd/C, в подходящем растворителе, таком как МеОН. В следующих абзацах описан синтез некоторых из этих аминов.
1-(5-Аминометилфуран-2-ил)-этанон можно получить с использованием следующей последовательности реакций: а) введение защитной группы в имеющийся в продаже 5-гидроксиметил-2-фурановый альдегид с использованием 3,4-дигидро-2H-пирана в присутствии пиридинийтолуол-4-сульфоната в растворителе, таком как СН2Сl2; b) метилирование альдегида с использованием, например, метилмагнийхлорида, в растворителе, таком как ТГФ, при температуре примерно 0°С; с) окисление полученного вторичного спирта с использованием окислительного реагента, такого как МnО2, в растворителе, таком как CH2Cl2, при температуре примерно 45°С; d) удаление защитной группы с использованием кислоты, такой как Amberlyst 15, в подходящем растворителе, таком как МеОН, при температуре примерно 35°С; е) хлорирование спирта с использованием, например, Ms-Cl в присутствии основания, такого как Et3N и ДМАП, в растворителе, таком как CH2Cl2, при температуре в диапазоне от 0°С до КТ; f) образование соответствующего азида с использованием NaN3 в растворителе, таком как ДМФ, при температуре примерно 80°С; и g) восстановление азидного фрагмента с использованием Ph3Р и воды в растворителе, таком как ТГФ, при температуре примерно 60°С.
3-(2-Метил-[1,3]диоксолан-2-ил)-пропиламин можно получить с использованием следующей последовательности реакций: а) конденсация имеющегося в продаже метилвинилкетона и нитрометана в присутствии катализатора, такого как активированный KF/Al2O3; b) введение защитной группы в полученный кетон с помощью этиленгликоля и катализатора, такого как p-TsOH, в растворителе, таком как толуол, при температуре примерно 120°С; и с) восстановление нитрогруппы с использованием содержащего металл катализатора, такого как Pd/C, в растворителе, таком как МеОН, в атмосфере Н2.
4-(2-Метил-[1,3]диоксолан-2-ил)-бутиламин можно получить с использованием следующей последовательности реакций: а) конденсация имеющегося в продаже этилацетоацетата и акрилонитрила в присутствии основания, такого как этилат натрия; b) декарбоксилирование с использованием основания, такого как Na2CO3, в растворителе, таком как вода, при температуре примерно 100°С; с) введение защитной группы в полученный кетон с помощью этиленгликоля и катализатора, такого как p-TsOH, в растворителе, таком как толуол, при температуре примерно 120°С; и d) восстановление нитрила с использованием восстановительного реагента, такого как LiAlH4, в растворителе, таком как Et2O, при температуре примерно 35°С.
[4-(2-Метил-[1,3]диоксолан-2-ил)-тиазол-2-ил]-метиламин можно получить с использованием следующей последовательности реакций: а) реакция имеющегося в продаже 2,4-дибромтиазол с литийорганическим реагентом, таким как н-бутиллитий, в растворителе, таком как эфир, при температуре примерно -78°С и последующее формилирование N,N-диметилформамидом при температуре в диапазоне от -78°С до КТ; b) восстановление восстановительным реагентом, таким как NaBH4, в растворителе, таком как МеОН, при температуре около КТ; с) введение в спирт защитной группы, такой как трет-бутилдиметилсилилхлоридная, в присутствии основания, такого как имидазол, в растворителе, таком как дихлорметан; d) реакция содержащего защитную группу спирта с литийорганическим реагентом, таким как н-бутиллитий, в растворителе, таком как эфир, при температуре примерно -78°С и последующее ацетилирование N,N-диметилацетамидом при температуре в диапазоне от -78°С до КТ; е) образование кеталя в присутствии триметилортоформиата и катализатора, такого как LiBF4, в растворителе, таком как этиленгликоль, при температуре примерно 95°С; f) удаление силильной защитной группы при стандартных условиях, таких как ТБАФ, в растворителе, таком как ТГФ, при температуре около КТ или 0°С; g) мезилирование с использованием такого реагента, как метансульфонилхлорид, в растворителе, таком как CH2Cl2, в присутствии основания, такого как Et3N и ДМАП, при температуре примерно 0°С; h) образование соответствующего азида с использованием NaN3 в растворителе, таком как ДМФ, при температуре примерно 80°С; и i) восстановление азидного фрагмента с использованием Ph3P и воды в растворителе, таком как ТГФ, при температуре примерно 60°С.
[5-(2-Метил-[1,3]Диоксолан-2-ил)-тиофен-2-ил]-метиламин можно получить с использованием следующей последовательности реакций: а) литиирование имеющегося в продаже 2-метил-2-тиофен-2-ил-[1,3]диоксолан с литийорганическим реагентом, таким как н-бутиллитий, в присутствии N,N,N',N'-тетраметилэтилендиамина в растворителе, таком как ТГФ, при температуре примерно -78°С и последующее добавление ДМФ; b) восстановление восстановительным реагентом, таким как NaBH4, в растворителе, таком как МеОН, при температуре примерно 0°С; с) хлорирование спирта с использованием, например, Ms-Cl в присутствии основания, такого как Et3N и ДМАП, в растворителе, таком как CH2Cl2, при температуре примерно 0°С; d) образование соответствующего азида с использованием NaN3 в растворителе, таком как ДМФ, при температуре примерно 80°С; и е) восстановление азидного фрагмента с использованием Ph3P и воды в растворителе, таком как ТГФ, при температуре примерно 60°С.
2-[1-(трет-Бутилдиметилсиланилокси)-этил]-оксазол-5-илметиламин можно получить с использованием следующей последовательности реакций: а) реакция имеющегося в продаже 1,3-оксазола с магнийорганическим реагентом, таким как изопропилмагнийхлорид, в растворителе, таком как ТГФ, при температуре примерно -10°С и последующее ацетилирование N-метокс-N-метилацетамидом при температуре в диапазоне от -10°С до КТ; b) восстановление кетона восстановительным реагентом, таким как NaBH4, в растворителе, таком как МеОН, при температуре в диапазоне от 0°С до КТ; с) введение в спирт защитной группы, такой как трет-бутилдиметилсилилхлоридная, в присутствии основания, такого как имидазол, в растворителе, таком как ТГФ; d) реакция содержащего защитную группу спирта с литийорганическим реагентом, таким как трет-бутиллитий, в растворителе, таком как ТГФ, при температуре в диапазоне от -78 до -40°С и последующее формилирование N,N-диметилформамидом при температуре в диапазоне от -78°С до КТ; е) восстановление альдегида восстановительным реагентом, таким как NaBH4, в растворителе, таком как МеОН, при температуре в диапазоне от 0°С до КТ; f) хлорирование с использованием такого реагента, как метансульфонилхлорид, в растворителе, таком как СН2Сl2, в присутствии основания, такого как Et3N и ДМАП, при температуре примерно 0°С; g) образование соответствующего азида с использованием NaN3 в растворителе, таком как ДМФ, при температуре примерно 80°С; и h) восстановление азидного фрагмента с использованием Ph3P и воды в растворителе, таком как ТГФ, при температуре примерно 60°С.
4-Бром-2,3-дифторбензиламин можно получить с использованием следующей последовательности реакций: а) реакция имеющегося в продаже 1,2-дифторбензола и триметилсилилхлорида в присутствии основания, такого как диизопропиламид лития, в подходящем растворителе, таком как ТГФ, при температуре примерно -78°С; b) превращение полученного (2,3-дифтор-1,4-фенилен)-бис(триметилсилана) в соответствующий 1,4-дибром-2,3-дифторбензол с использованием источника брома, такого как бром, при температуре в диапазоне от 0 до 58°С; с) реакция с литийорганическим реагентом, таким как н-бутиллитий, в растворителе, таком как ТГФ, при температуре около -78°С и последующее карбоксилирование твердым диоксидом углерода например, при температуре в диапазоне от -78°С до КТ; d) восстановление полученной карбоновой кислоты в соответствующий бенЗиловый спирт с использованием подходящего восстановительного реагента, такого как боран, в подходящем растворителе, таком как ТГФ, при температуре в диапазоне от 0 до 50°С; е) мезилирование с использованием такого реагента, как метансульфонилхлорид, в растворителе, таком как CH2Cl2, в присутствии основания, такого как Et3N и ДМАП, при температуре примерно 0°С; f) образование соответствующего азида с использованием NaN3 в растворителе, таком как ДМФ, при температуре примерно 80°С; и g) восстановление азидного фрагмента с использованием Ph3P и воды в растворителе, таком как ТГФ, при температуре примерно 60°С.
В3. Синтез аминов R2-NH2
Амины формулы R2-NH2, если они не имеются в продаже, можно получить например по следующей последовательности реакций: а) превращение спирта R2-ОН в соответствующий мезилат или хлорид с использованием, например, MsCl в присутствии основания, такого как Et3N и ДМАП в подходящем растворителе, таком как СН2Сl2, или превращение спирта R2-OH в соответствующий йодид с использованием, например, йода и Ph3P в присутствии основания, такого как имидазол, в подходящем растворителе, таком как СН2Сl2; b) превращение мезилата, хлорида или йодида в соответствующий азид с использованием, например, NaN3 в растворителе, таком как ДМФ, при температуре примерно 80°С; с) восстановление азидного фрагмента или с использованием Ph3P и воды в растворителе, таком как ТГФ, при температуре примерно 60°С, или гидрированием с использованием содержащего металл катализатора, такого как Pd/C, в подходящем растворителе, таком как МеОН.
Альтернативно, если они не имеются в продаже, амины формулы R2-NH2, которые также являются аминами формулы R2aCH2-NH2, можно получить восстановлением нитрилов R2a-CN с использованием восстановительного реагента, такого как LiAlH4, в подходящем растворителе, таком как ТГФ, при температуре в диапазоне от 0°С до КТ, или гидрированием с использованием содержащего металл катализатора, такого как Pd/C, в подходящем растворителе, таком как МеОН.
Если соединения формулы (I) получают в виде смесей энантиомеров, энантиомеры можно разделить по методикам, известным специалисту в данной области техники: например, путем образования и разделения диастереоизомерных солей или с помощью ВЭЖХ на хиральной стационарной фазе, например, с использованием колонки, такой как Regis Whelk-O1(R,R) (10 мкм), Daicel ChiralCel OD-H (5-10 мкм) или Daicel ChiralPak IA (10 мкм) или AD-H (5-10 мкм). Типичными условиями проведения хиральной ВЭЖХ является использование в изократическом режиме смеси элюента A (EtOH, в присутствии или при отсутствии амина, такого как Et3N или диэтиламин) и элюента В (гексан), при скорости потока, равной от 0,8 до 150 мл/мина.
Например, энантиомерно чистые соединения структуры 2 можно получить с помощью проводимого посредством хиральной ВЭЖХ разделения смеси энантиомеров; например, (5R)-N5-(4-бромфенил)-(6R)-6-этоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид можно получить с помощью проводимого посредством хиральной ВЭЖХ разделения (5R*)-N5-(4-бромфенил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида. Такое разделение предпочтительно проводят с использованием колонки Daicel ChiralPak AD-H и смеси EtOH и гексан (15/85) в качестве элюента.
Экспериментальная часть
Аббревиатуры (при использовании в настоящем изобретении и приведенном выше описании) Ас ацетил
I. Химические данные
Общие положения. Все температуры указаны в градусах Цельсия (°С). Если не указано иное, то реакции протекают при КТ.
В качестве СКО использовали материал SiliaBond® SCX, выпускающийся фирмой Silicycle.
В качестве ДЦК на полимерной подложке использовали PL-DCC, выпускающийся фирмой Polymer Laboratories.
В качестве SO2Cl, PL-SO2Cl на полимерной подложке использовали, выпускающийся фирмой Polymer Laboratories.
Аналитическую тонкослойную хроматографию (ТСХ) проводили с использованием пластин 0,2 мм: Merck, Силикагель 60 F254. Препаративную тонкослойную хроматографию (ТСХ) проводили с использованием пластин 0,2 или 0,5 мм: Merck, Силикагель 60 F254. Детектирование проводили с помощью УФ-излучения или с использованием раствора КМnO4 (3 г), K2CO3 (20 г), NaOH 5% (3 мл) и Н2O (300 мл) с последующим нагреванием.
Колоночную флэш-хроматографию (ФХ) и фильтрование проводили с использованием силикагеля 60 Merck (0,063-0,200 мм) или Macherey-Nagel силикагель (0,063-0,200 мм): для элюирования использовали ЭА, Et2O, гептан, гексан, СН2Сl2, CHCl3, МеОН, NH4OH или их смеси.
ЖХСД проводили с использованием колонок Isolute® SPE Flash SI II, выпускающиеся фирмой International sorbent technology, для элюирования использовали ЭА, Et2O, гептан, гексан, СН2Сl2, CHCl3, МеОН, NH4OH или их смеси.
Условия проведения ЖХ-МС 01 (если не указано иное): Прибор для анализа: Thermo Finnigan MSQ Surveyor MC с насосом для подачи двух компонентов Agilent 1100 и ДДМ. Колонка: Zorbax SB-AQ 5 мкм, 4,6×50 мм ВД (внутренний диаметр), выпускающаяся фирмой Agilent Technologies. Элюенты: А: Н2O+0,04% ТФК; В: AcCN; Градиентный режим: 5% В→95% В за 1 мин. Скорость потока: 4,50 мл/мин. Детектирование: УФ/Вид. и/или ИДСР, и MC, tR приведены в минутах.
Условия проведения ЖХ-МС 01b (если не указано иное): Прибор для анализа: Thermo Finnigan MSQ Surveyor MC с насосом для подачи двух компонентов Agilent 1100 и ДДМ. Колонка: Xbridge С18 5 мКМ, 4,6×50 мм ВД, выпускающаяся фирмой Waters. Элюенты: А: Н2O+0,04% ТФК; В: AcCN; Градиентный режим: 5% В→95% В за 1 мин. Скорость потока: 4,50 мл/мин. Детектирование: УФ/Вид. и/или ИДСР, и MC, tR приведены в минутах.
Условия проведения ЖХ-МС 02 (если не указано иное): Прибор для анализа: Thermo Finnigan MSQ Plus MC с насосом для подачи двух компонентов Agilent 1100 и ДДМ. Колонка: Zorbax SB-AQ 5 мкм, 4,6x50 мм ВД, выпускающаяся фирмой Agilent Technologies. Элюенты: А: Н2O+0,04% ТФК; В: AcCN; Градиентный режим: 5% В 95% В за 1 мин. Скорость потока: 4,50 мл/мин. Детектирование: УФ/Вид. и/или ИДСР, и MC, tR приведены в минутах.
Условия проведения ЖХ-МС 05 (если не указано иное): Прибор для анализа: Dionex GHP 3200 насос для подачи двух компонентов, MC: Thermo MSQ Plus, ДДМ: Dionex PDA 3000, ИДСР: Sedere Sedex 85, колонка: Xbridge C18 5 мКМ, 4,6×50 mm ВД, выпускающаяся фирмой Waters, термостатируемая в камере Dionex ТСС-3200. Элюенты: А: Н2O+0,04% ТФК; В: AcCN. Методика: Градиентный режим: 5% В →95% В за 1 мин. Скорость потока: 4,5 мл/мин. Детектирование: УФ/Вид. и/или ИДСР, и МС, tR приведены в минутах.
Условия проведения ЖХ-МС 05b (если не указано иное): Прибор для анализа: Dionex GHP 3200 насос для подачи двух компонентов, МС: Thermo MSQ Plus, ДДМ: Dionex PDA 3000, ИДСР: Sedere Sedex 85. Колонка: Zorbax Extend C18 1,8 мКМ, 4,6x20 мм, выпускающаяся фирмой Agilent Technologies, термостатируемая в камере Dionex ТСС-3200. Элюенты: А: Н2O+0,04% ТФК; В: AcCN. Методика: Градиентный режим: 2% В →95% В за 1,20 мин. Скорость потока: 4,5 мл/мин. Детектирование: УФ/Вид. и/или ИДСР, и МС, tR приведены в минутах.
Условия проведения ЖХ-МС 05 с (если не указано иное): Прибор для анализа: Dionex GHP 3200 насос для подачи двух компонентов, МС: Thermo MSQ Plus, ДДМ: Dionex PDA 3000, ИДСР: Sedere Sedex 85. Колонка: Zorbax SB-AQ 1,8 мкм, 4,6x20 мм ВД, выпускающаяся фирмой Agilent Technologies, термостатируемая в камере Dionex ТСС-3200. Элюенты: А: Н2O+0,04% ТФК; В: AcCN. Методика: Градиентный режим: 5% В →95% В за 1 мин. Скорость потока: 4,5 мл/мин. Детектирование: УФ/Вид. и/или ИДСР, и МС, tR приведены в минутах.
Условия проведения ЖХ-МС 06 (если не указано иное): Прибор для анализа: Dionex HPG-3000 насос для подачи двух компонентов, МС: Thermo MSQ МС, ДДМ: Dionex PDA 3000, ИДСР: PolymerLab ELS 2100. Колонка: Ascentis C18 2,7 мкм, 3x30 мм ВД, выпускающаяся фирмой Sigma-Aldrich, термостатируемая в камере Dionex ТСС-3000. Элюенты: А: Н2O+0,05% МК; В: AcCN. Методика: Градиентный режим: 5% В →95% В за 1,40 мин. Скорость потока: 3,0 мл/мин. Детектирование: УФ/Вид. и/или ИДСР, и МС, tR приведены в минутах.
Условия проведения ЖХ-МС 07 (если не указано иное): Аналитическая. Насос: Dionex HPG-3200RS, МС: Thermo MSQ Plus, ДДМ: Dionex ДДМ-3000RS, ИДСР: Sedere Sedex 85. Колонка: Xbridge C18 2,5 мКМ, 4,6×30 мм ВД, выпускающаяся фирмой Waters, термостатируемая в камере Dionex ТСС-3200. Элюенты: А: Н2O+0,04% ТФК; В: AcCN. Методика: Градиентный режим: 5% В →95% В за 1,00 мин. Скорость потока: 4,5 мл/мин. Детектирование: УФ/Вид. и/или ИДСР, и MC, tR приведены в минутах.
Условия проведения ЖХ-МС 07b (если не указано иное): Аналитическая. Насос: Dionex HPG-3200RS, MC: Thermo MSQ Plus, ДДМ: Dionex ДДМ-SOOORS, ИДСР: Sedere Sedex 85. Колонка: Zorbax SB-Aq 3,5 мКМ, 4,6x50 мм ВД, выпускающаяся фирмой Agilent Technologies, термостатируемая в камере Dionex ТСС-3200. Элюенты: А: Н2O+0,04% ТФК; В: AcCN. Методика: Градиентный режим: 5% В →95% В за 1,00 мин. Скорость потока: 4,5 мл/мин. Детектирование: УФ/Вид. и/или ИДСР, и MC, tR приведены в минутах.
Условия проведения ЖХ-МС 07 с (если не указано иное): Аналитическая. Насос: Dionex HPG-3200RS, MC: Thermo MSQ Plus, ДДМ: Dionex ДДМ-3000RS, ИДСР: Sedere Sedex 85. Колонка: Atlantis T3 5 мКМ, 4,6×30 мм ВД, выпускающаяся фирмой Waters, термостатируемая в камере Dionex ТСС-3200. Элюенты: А: Н2O+0,04% ТФК; В: AcCN. Методика: Градиентный режим: 5% В →95% В за 1,00 мин. Скорость потока: 4.5 мл/мин. Детектирование: УФ/Вид. и/или ИДСР, и MC, tR приведены в минутах.
Условия проведения ЖХ-МС 07d (если не указано иное): Аналитическая. Насос: Dionex HPG-3200RS, MC: Thermo MSQ Plus, ДДМ: Dionex ДДМ-3000RS, ИДСР: Sedere Sedex 85. Колонка: Ascentis Express CI8 2,7 мкм, 4,6×30 мм ВД, выпускающаяся фирмой Sigma-Aldrich, термостатируемая в камере Dionex ТСС-3200. Элюенты: А: Н2O+0,04% ТФК; В: AcCN. Методика: Градиентный режим: 2% В →95% В за 1,20 мин. Скорость потока: 4,5 мл/мин. Детектирование: УФ/Вид. и/или ИДСР, и MC, tR приведены в минутах.
Условия проведения ЖХ-МС 04 (если не указано иное): Аналитическая. Насос: Dionex HPG-3200RS, MC: Thermo MSQ Plus, ДДМ: Dionex ДДМ-3000RS, ИДСР: Sedere Sedex 85. Колонка: Xbridge C18 5 мКМ, 4,6×50 мм ВД, выпускающаяся фирмой Waters, термостатируемая в камере Dionex ТСС-3200. Элюенты: A: H2O/NH3 (c(NH3)=13 ммоль/л); В: AcCN. Методика: Градиентный режим: 2% В →95% В за 1,20 мин. Скорость потока: 4,5 мл/мин. Детектирование: УФ/Вид. и/или ИДСР, и MC, tR приведены в минутах.
Условия проведения ЖХ-МС МК (если не указано иное): Аналитическая. Насос: Waters Acquity Binary Solvent Manager, MC: Детектор Waters SQ, ДДМ: Детектор Acquity UPLC PDA, ИДСР: Acquity UPLC ИДСР. Колонка: Acquity UPLC ВЕН C18 1,7 мкм 2,1×50 мм ВД, выпускающаяся фирмой Waters, термостатируемая с помощью устройства для управления колонками Acquity UPLC. Элюенты: А: Н2O+0,05% МК; В: AcCN+0,05% МК. Методика: Градиентный режим: 2% В →98% В за 2,00 мин. Скорость потока: 1,2 мл/мин. Детектирование: УФ/Вид. и/или ИДСР, и МС, tR приведены в минутах.
Условия проведения ЖХ-МС ТФК (если не указано иное): Аналитическая. Насос: Waters Acquity Binary Solvent Manager, МС: Детектор Waters SQ, ДДМ: Детектор Acquity UPLC PDA, ИДСР: Acquity UPLC ИДСР. Колонка: Acquity UPLC ВЕН C18 1,7 мкм 2,1x50 мм ВД, выпускающаяся фирмой Waters, термостатируемая с помощью устройства для управления колонками Acquity UPLC. Элюенты: А: Н2O+0,05% ТФК; В: AcCN+0,05% ТФК. Методика: Градиентный режим: 2% В →98% В за 2,00 мин. Скорость потока: 1,2 мл/мин. Детектирование: УФ/Вид. и/или ИДСР, и МС, tR приведены в минутах.
Препаративная ВЭЖХ: X-Bridge С18 5 мкм, 50×19 мм ВД, выпускающаяся фирмой Waters. Элюенты: А: Н2O+0,5% NH4OH; В: AcCN; Градиентный режим: 10% В →90% В за 5 мин. Скорость потока: 40,0 мл/мин. Детектирование: УФ/Вид. и/или ИДСР, и МС, tR приведены в минутах.
Хиральная ВЭЖХ, прибор для анализа: а) колонка Regis Whelk, 4,6×250 мм, 10 мкм. Элюент A: EtOH+0,05% Et3N. Элюент В: гексан. Скорость потока: 1 мл/мин. b) ChiralPak AD, 4,6×250 мм, 5 мкм. Элюент A: EtOH+0,05% Et3N. Элюент В: гексан. Скорость потока: 1 мл/мин. с) ChiralCel OD, 4,6×250 мм, 10 мкм. Элюент A: EtOH+0,1%) Et3N. Элюент В: гексан. Скорость потока: 0,8 мл/мин. Детектирование: УФ/Вид., tR приведены в минутах.
Хиральная ВЭЖХ, препаративная: а) колонка Regis Whelk 01, 50×250 мм. Скорость потока: 100 мл/мин. b) ChiralPak AD, 20×250 мм. Скорость потока: 10 мл/мин. с) ChiralCel OD, 20 мкм, 50 мм ×250 мм. Скорость потока: 100 мл/мин. Детектирование: УФ/Вид., tR приведены в минутах.
Условия проведения ГХ-МС 01: Thermo Trace GC Ultra, Детектор Thermo DSQ II МС, автоматический пробоотборник Thermo TriPlus, Колонка: Zebron ZB-5 МС, 15 м х0,25 мм ВД, пленка 0,25 мкм, Скорость потока в колонке: 2,0 мл/мин, газ-носитель: гелий, коэффициент деления пробы: 20, SSL, температура на входе: 200°С, градиентный режим температуры: от 60 до 300°С от 0,0 мин до 4,0 мин, 300°С изотермический режим от 4,0 мин до 5,0 мин, ионизация: химическая ионизация с использованием СН4 в качестве газа-реагента.
ЯМР: Bruker Avance 400 (400 МГц); Varian Mercury 300 (300 МГц); химические сдвиги приведены в част./млн относительно использующегося растворителя; мультиплетности: s=синглет, d=дублет, t=триплет, q=квадруплет, р=пентиплет, hex=секстет, hept=гептет, m=мультиплет, br=широкий, константы спин-спинового взаимодействия приведены в герцах.
В качестве проточного реактора гидрирования использовали H-Cube®, выпускающийся фирмой ThalesNano.
Приведенные ниже примеры иллюстрируют настоящее изобретение, но не ограничивают его объем.
Общие методики
Общая методика А: Сочетание с образованием амида (1): В стеклянном сосуде в инертной атмосфере (N2) к амину (3,0 экв.) в CH2Cl2 (0,3 М) добавляли ДМАП (0,25 экв.), ЭДХ.НС1 (2,0 экв.) и ДИПЭА (1,0-3,0 экв., при необходимости). Раствор карбоновой кислоты (1,0 экв.) в CH2Cl2 (0,1 М) затем добавляли и реакционную смесь перемешивали при КТ в течение ночи. Реакционную смесь выливали в шприц, содержащий диатомитовую землю (Isolute® HM-N, выпускающуюся фирмой Separtis) обрабатывали с помощью 1М НС1 (1,0 мл/г Isolute®). Продукт элюировали с помощью CH2Cl2 (3×1 мл) и растворитель удаляли при пониженном давлении. Очистка остатка с помощью ФХ или ВЭЖХ давала искомое соединение.
Общая методика В: Сочетание с образованием амида (2): В стеклянном сосуде в инертной атмосфере (N2) смесь карбоновой кислоты (1,0 экв.), амина (3,0 экв.) и HOAt или HOBt (1,0 экв.) в СН2Сl2 (10 мл на 0,5 ммоля HOAt) добавляли к смоле ПЛ-ДЦК (4,0 экв.) в СН2Сl2 (0,2 М), при необходимости в присутствии ПС-ДИПЭА (ПС - полистирол). Реакционную смесь перемешивали при КТ в течение 2 дней. Реакционную смесь фильтровали через прибор для разделения фаз Isolute® и шприц промывали с помощью СН2Сl2 (3×1 мл) и растворитель удаляли при пониженном давлении. Очистка остатка с помощью ФХ или ВЭЖХ давала искомое соединение.
Общая методика С: Сочетание с образованием амида (3): В стеклянном сосуде в инертной атмосфере (N2) смесь карбоновой кислоты (1,0 экв.) и амина (1,0 экв.) в смеси ДХЭ/пиридин (1:1, 0,2 М) охлаждали до -10°С. РОСl3 (2,5 экв.) в смеси ДХЭ/пиридин (1:1, 1,2 М) добавляли и реакционную смесь перемешивали при -10°С в течение 1 ч. Реакционную смесь выливали в шприц, содержащий диатомитовую землю (Isolute® HM-N, выпускающуюся фирмой Separtis), обработанную с помощью Г М NaOH (1,0 мл/г Isolute). Продукт элюировали с помощью СН2Сl2 (3×2 мл) и растворитель удаляли при пониженном давлении. Очистка остатка с помощью ФХ или ВЭЖХ давала искомое соединение.
Общая методика D: Сочетание с образованием амида (4): В стеклянном сосуде в инертной атмосфере (N2) к смеси амина (1,0 экв.) и карбоновой кислоты (1,2 экв.) в СН2Сl2 (10 мл/ммоль кислоты) добавляли раствор HOBt (1,25 экв.), ДМАП (0,25 экв.), ЭДХНСl (1,5-2,0 экв.) и ДИПЭА (4,0-5,0 экв.) в СН2Сl2 (6 мл/ммоль HOBt). Реакционную смесь перемешивали при КТ в течение ночи. Реакционную смесь выливали в шприц, содержащий диатомитовую землю (Isolute® HM-N, выпускающуюся фирмой Separtis), обработанную с помощью 1М НСl (1,0 мл/г Isolute®). Продукт элюировали с помощью СН2Сl2 (3×1 мл) и растворитель удаляли при пониженном давлении. Очистка остатка с помощью ФХ или ВЭЖХ давала искомое соединение. Общая методика Е: Сочетание с образованием амида (5): В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору карбоновой кислоты (1,0 экв.) в СН2Сl2 (0,2 М) добавляли амина (1,0-2,0 экв.), ЭДХ НСl (2,0-3,0 экв.), ДИПЭА (3,0-6,0 экв., при необходимости) и ДМАП (0,25 экв.). Реакционную смесь перемешивали при КТ до завершения реакции. Затем добавляли воду, слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка остатка с помощью ФХ или ВЭЖХ давала искомое соединение.
Общая методика F: Амидирование по Вайнребу:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору амина (2,0 экв.) в СН2Сl2 (0,4 М) добавляли АlМе3 (1,0 М в гептане, 6,0 экв.). Реакционную смесь перемешивали при КТ в течение 1 ч и затем охлаждали до 0°С. Добавляли раствор сложного эфира (1,0 экв.) в СН2Сl2 (0,2 М) и реакционную смесь перемешивали при КТ до завершения реакции. Осторожно добавляли насыщенный водный раствор NaHCO3, слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка остатка с помощью ФХ или ВЭЖХ давала искомое соединение. Общая методика G: Удаление защитной группы диоксолана: В стеклянном сосуде в инертной атмосфере (N2) 0,06 М раствор диоксолан (1,0 экв.) в ТГФ обрабатывали с помощью 1 н. НСl (2,7 экв.) и реакционную смесь перемешивали при КТ до завершения реакции. Добавляли 1 н. водный раствор NaOH и продукт экстрагировали d помощью ЭА (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка остатка с помощью ФХ или ВЭЖХ давала искомое соединение.
Общая методика Н: Удаление защитной группы Воc:
В стеклянном сосуде в инертной атмосфере (N2) 0,06 М раствор защищенного группой Воc амина (1,0 экв.) в СН2Сl2 (+1 капля МеОН) обрабатывали с помощью 4 н. НСl в диоксане (15 мл/ммоля амин) и реакционную смесь перемешивали при КТ в течение 1 ч. Затем реакционную смесь концентрировали при пониженном давлении и остаток очищали с помощью ФХ или ВЭЖХ и получали искомое соединение. Общая методика I: Сочетание с образованием амида (6):
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору карбоновой кислоты (1,0 экв.) в СН2Сl2 (0,2 М) добавляли HOBt (1,2 экв.), ДМАП (0,25 экв.), ЭДХ НСl (2,5 экв.) и ДИПЭА (4,0 экв.). Реакционную смесь перемешивали при КТ в течение 30 мин. Затем добавляли раствор амина (1,0 экв.) в СН2Сl2 (0,2 М) и реакционную смесь перемешивали при КТ в течение ночи. Добавляли воду, слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка остатка с помощью ФХ или ВЭЖХ давала искомое соединение.
Общая методика J: Сочетание с образованием амида (7): В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору карбоновой кислоты (1,0 экв.) в СН2Сl2 (0,1 М) добавляли оксалилхлорид (1,1 экв.) и несколько капель ДМФ. Реакционную смесь перемешивали при КТ до завершения реакции. Раствор амина (2,2 экв.) в СН2Сl2 (0,4 М) затем добавляли и реакционную смесь перемешивали при КТ до завершения реакции, воду и СН2Сl2 затем добавляли, слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (2×). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Очистка остатка с помощью ФХ или ВЭЖХ давала искомое соединение.
Общая методика К: Сочетание с образованием амида (8):
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) смесь карбоновой кислоты (1,0 экв.), амина (1,0 экв.) и HOBt (1,2 экв.) в СН2Сl2 (1 мл на 0,3 ммоля HOBt) добавляли к смоле ПЛ-ДЦК (2,0 экв.) в СН2Сl2 (0,2 М). Реакционную смесь перемешивали при КТ в течение 1 дня. Реакционную смесь фильтровали и растворитель удаляли при пониженном давлении. Очистка остатка с помощью ФХ или ВЭЖХ давала искомое соединение.
Общая методика L: Сочетание с образованием амида (9):
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к смеси карбоновой кислоты (1,0 экв.), амина (1,1 экв.) и HATU (1,2 экз.) в ТГФ/ДМФ 4:1 (1 мл на 0,2 ммоля HATU) добавляли ДИПЭА (3,0 экв.). Реакционную смесь перемешивали при КТ в течение 1 дня. Затем добавляли воду и смесь экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка остатка с помощью ФХ или ВЭЖХ давала искомое соединение. Общая методика М: Получение карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) сложный эфир (1,0 экв.) растворяли в ТГФ (0,2 М) и обрабатывали 1 н. водным раствором NaOH (2,0 экв.) при КТ до завершения реакции. Реакционную смесь выливали в 1 н. водный раствор НСl и экстрагировали с помощью ЭА (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. К раствору неочищенной карбоновой кислоты (1,0 экв.) и Et3N (1,0 экв.) в сухом ТГФ (0,1 М) добавляли этилхлорформиат (1,0 экв.) при 0°С. Реакционную смесь перемешивали при 0°С в течение 15 мин и амин (водный раствор NH3 (избыток) или MeNH2 (1,0 экв.)) затем добавляли. Реакционную смесь перемешивали при 0°С до завершения реакции затем концентрировали при пониженном давлении. Остаток подвергали распределению между водой и CH2Cl2, слои разделяли и водный слой экстрагировали с помощью CH2Cl2 (2×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка остатка с помощью ФХ или ВЭЖХ давала искомое соединение.
Общая методика N: Сочетание с образованием амида (10):
В стеклянном сосуде в инертной атмосфере (N2) к раствору карбоновой кислоты (1,0 экв.) в СН2Сl2 (0,25 М) добавляли HOBt (1,20 экв.), ДМАП (0,25 экв.), ЭДХ НСl (2,5 экв.) и ДИПЭА (4,0 экв.). Реакционную смесь перемешивали при КТ в течение 30 мин. Затем добавляли амин (2,0 экв.) и реакционную смесь перемешивали при КТ до завершения реакции. Добавляли ДМФ (0,3 об. СН2Сl2) и ПЛ-SO2Сl2 (1,0 экв.) и после перемешивания при КТ в течение 1 ч смесь фильтровали (СН2Сl2) и концентрировали при пониженном давлении. Очистка остатка с помощью ФХ или ВЭЖХ давала искомое соединение.
Синтез промежуточных продуктов
Спиро[2.4]гепта-4,6-диен:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) смесь бензилтриэтилхлорида аммония (18,0 г, 78 ммоля) с 50% водным раствором NaOH (1,2 л) нагревали при 45°С. При перемешивании к раствору в NaOH добавляли охлажденный раствор циклопентадиена (полученного крекингом димера циклопентадиена при 180°С, 140 мл, 1,70 моля) в 1,2-дихлорэтане (122 мл, 1,55 моля), поддерживая внутреннюю температуру ниже 55°С. После завершения добавления (примерно 1,75 ч) реакционную смесь перемешивали при 50°С в течение 2 ч и давали охладиться до КТ. Слои разделяли, органический слой промывали с помощью 1М NaOH, сушили (Na2SO4) и фильтровали. Неочищенную коричневую жидкость перегоняли при пониженном давлении (85-95 мбар) и получали искомое соединение в виде бесцветной жидкости (т. кип.=45-50°С при 80 мбар).1Н ЯМР (400 МГц, CDCl3) δ 6,58 (m, 2Н), 6,19 (m, 2Н), 1,71 (s, 4Н).
Реакция Дильса-Альдера - получение (5R*)-5-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-(6R*)-6-карбоновой кислоты и (6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-(5R*)-5-карбоновой кислоты:

В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор моноэтилового эфира (E)-бут-2-ендикарбоновой кислоты (63,8 г, 0,44 моля) в МеОН (425 мл) при КТ обрабатывали спиро[2.4]гепта-4,6-диеном (57,6 мл, 0,57 моля). Реакционную смесь перемешивали при этой температуре в течение 11 дней. Смесь концентрировали при пониженном давлении и неочищенный остаток перекристаллизовывали из ЭА и пентана. (6R*)-6-Этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-(5R*)-5-карбоновую кислоту (экзо-продукт) получали в виде белого твердого вещества. Затем маточный раствор концентрировали при пониженном давлении, остаток очищали с помощью ФХ (гептан/ацетон, 2-5% ацетона) и получали продукт в виде смеси эндо/экзо-продуктов (желтое твердое вещество). ТСХ: rf (7:3 гептан-ацетон)=0,29. Условия проведения ЖХ-МС 02: tR=0,89 мин; [М+Н]+=373,99.1Н ЯМР (400 МГц, CDCl3) δ 6,42 (m, 1Н), 6,24 (dd, J=5,8, 2,5 Гц, 1Н), 4,20 (qd, J=7,3, 1,3 Гц, 2Н), 3,74 (t, J=4,0 Гц, 1Н), 2,82 (d, J=4,5 Гц, 1Н), 2,74 (br s, 1Н), 2,69 (br s, 1Н), 1,30 (t, J=7,0 Гц, 3Н), 0,50 (m, 4Н) для чистого изомера.1Н ЯМР (400 МГц, CDCl3) δ 6,40 (m, 1На+1Hb), 6,23 (dd, J=5,8, 2,8 Гц, 1Hа), 6,16 (dd, J=5,8, 2,8 Гц, 1Hb), 4,18 (qd, J=7,0, 1,3 Гц, 2Ha), 4,12 (qd, J=7,3, 2,0 Гц, 2Hb), 3,73 (t, J=4,3 Гц, 1Hа), 3,62 (t, J=4,3 Гц, 1Hb), 2,92 (d, J=4,5 Гц, 1Hb), 2,81 (d, J=4,5 Гц, 1Hа), 2,75 (br s, 1Hb), 2,72 (br s, 1Ha), 2,67 (br s, 1Ha+1Hb), 1,28 (t, J=7,3 Гц, 3На), 1,25 (t, J=7,0 Гц, 3Hb), 0,50 (m, 4Ha+4Hb) для смеси стереоизомеров.
Йодлактонизация - получение (±)-йодлактонов 1 (R10-Et) и 2:

К раствору 6-этоксикапбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоновой кислоты (15,00 г, 63,5 ммоля, смесь изомеров, полученная выше) в СН2Сl2 (95 мл) добавляли NaHCO3 (5,87 г, 69,8 ммоля), воду (286 мл), KI (39,00 г, 234,9 ммоля) и 12 (3,55 г, 11,0 ммоля). Реакционную смесь перемешивали при КТ в течение ночи. Реакцию останавливали путем добавления насыщенного водного раствора Na2S2O3. Слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты последовательно промывали насыщенным водным раствором NaHCO3 и рассолом, затем сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении и получали (±)-йодолактон 1 (R10=Et) (этиловый эфир) в виде бледно-желтого масла. ТСХ: rf (4:1 гептан-ацетон)=0,25. Условия проведения ЖХ-МС 02: tR=1,02 мин; [М+Н]+=363,53.

Затем водный слой подкисляли (pH=1) и экстрагировали с помощью ЭА. Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенное твердое вещество очищали с помощью ФХ и получали (±)-йодолактон 2 (карбоновая кислота) в виде белого твердого вещества. ТСХ: rf (70:30:1,1 гептан-ацетон-МеОН)=0,15. Условия проведения ЖХ-МС 02: tR=0,86 мин; [M+AcCN+H]+=376,49.
Ретро-йодлактонизация - получение (6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-(5R*)-5-карбоновой кислоты:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (±)-йодолактона 1 (R10=Et) (5,00 г, 13,8 ммоля) в уксусной кислоте (50 мл) добавляли порошкообразный цинк (13,54 г, 207,1 ммоля). Реакционную смесь перемешивали при 65°С в течение 2 ч, охлаждали до КТ, фильтровали и подвергали распределению между водой и ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 1:0→1:1) и получали искомое соединение в виде белого твердого вещества. ТСХ: rf (7:3 гептан-ЭА)=0,18. Условия проведения ЖХ-МС 02: tR=0,89 мин; [М+Н]+=237,30.
Сочетание с образованием амида (с 4-броманилином) - получение (5R*)-N5-(4-бромфенил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-(5R*)-5-карбоновой кислоты (17,9 г, 75,6 ммоля) в сухом толуоле (350 мл) добавляли несколько капель ДМФ и оксалилхлорид (10,1 мл, 113,5 ммоля). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 40 мин, охлаждали до КТ, концентрировали при пониженном давлении и остаток сушили в высоком вакууме.
К раствору этого ацилхлорида в сухом CH2Cl2 (350 мл) добавляли 4-броманилин (26,8 г, 151,3 ммоля) и ДИПЭА (38,8 мл, 151,3 ммоля). Реакционную смесь перемешивали при КТ в течение 2 ч. Добавляли 1 н. НС1, слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток растирали с МеОН и получали искомое соединение в виде бледно-коричневого твердого вещества. ТСХ: rf (7:3 гептан-ЭА)=0,46. Условия проведения ЖХ-МС 02: tR=1,09 мин; [М+Н]+=390,30.
Омыление - получение (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
Смесь (5R*)-N5-(4-бромфенил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (2,70 г, 6,92 ммоля) с EtOH (69 мл) и 1 н. NaOH (69 мл) перемешивали при 80°С в течение 1 ч. Затем реакционную смесь охлаждали до КТ и EtOH удаляли при пониженном давлении. Остаток подвергали распределению между 2 н. НСl и ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого твердого вещества. Условия проведения ЖХ-МС 02: tR=0,98 мин; [М+Н]+=362,20.
Сочетание с образованием амида (с гидрохлоридом метилового эфира бета-аланина) - получение (5R*)-N5-(4-бромфенил)-(6R*)-N6-(2-метоксикарбонилэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (200 мг, 0,55 ммоля) в сухом толуоле (1,7 мл) добавляли несколько капель ДМФ и оксалилхлорид (1,1 экв.). Реакционную смесь перемешивали при КТ в течение 90 мин, концентрировали при пониженном давлении и остаток выпаривали вместе с толуолом (2×). Затем остаток повторно растворяли в CH2Cl2 (0,7 мл) и к смеси добавляли гидрохлорид метилового эфира бета-аланина (85 мг, 0,61 ммоля) и ДИПЭА (0,28 мл, 3,0 экв.) при КТ. Реакционную смесь перемешивали при КТ в течение 20 мин, разбавляли с помощью CH2Cl2 и промывали 1 н. водным раствором НСl. Слои разделяли и водный слой подвергали обратной экстракции с помощью CH2Cl2 (2×). Объединенные органические экстракты промывали насыщенным водным раствором NaHCO3, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА) и получали искомое соединение в виде белого твердого вещества. ТСХ: rf (6:4 гептан-ЭА)=0,35. Условия проведения ЖХ-МС 02: tR=0,98 мин; [М+Н]+=446,90.
(5R*)-5-Гидроксикарбонил-(6R*)-N6-(4-бромфенил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамид:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (±)-йодолактон 2 (1,00 г, 2,99 ммоля) в сухом толуоле (17 мл) добавляли несколько капель ДМФ и оксалилхлорид (0,38 мл, 4,49 ммоля). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 20 мин, охлаждали до КТ, концентрировали при пониженном давлении и остаток сушили в высоком вакууме.
К раствору этого ацилхлорида в сухом CH2Cl2 (5 мл) добавляли 4-броманилин (730 мг, 4,24 ммоля) и ДИПЭА (1,5 мл, 8,98 ммоля). Реакционную смесь перемешивали при КТ в течение 20 мин. Добавляли 1 н. НСl, слои разделяли и водный слой экстрагировали с помощью CH2Cl2 (3×). Объединенные органические экстракты промывали рассолом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 7:3) и получали чистый амид в виде бледно-оранжевого вспененного вещества. ТСХ: rf (7:3 гептан-ЭА)=0,21. Условия проведения ЖХ-МС 02: tR=1,08 мин. В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору полученного выше йодолактона (1,29 г, 2,64 ммоля) в уксусной кислоте (10 мл) добавляли порошкообразный цинк (2,59 г, 39,64 ммоля). Реакционную смесь перемешивали при 65°С в течение 2 ч, охлаждали до КТ, фильтровали и подвергали распределению между водой и ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 4:6) и получали искомое соединение в виде белого вспененного вещества. ТСХ: rf (4:6 гептан-ЭА)=0,43. Условия проведения ЖХ-МС 02: tR=0,98 мин; [М+Н]+=362,31.
Восстановление двойной связи - получение (6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-(5R*)-5-карбоновой кислоты:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) деоксигенированную суспензию (6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-(5R*)-5-карбоновой кислоты (2,00 г, 8,46 ммоля), Pd/C 10% (339 мг) и циклогексена (1,72 мл, 7,93 ммоля) в сухом ТГФ (31 мл) перемешивали при кипячении с обратным холодильником в течение 4 ч. Реакционную смесь фильтровали через целит и осадок на фильтре промывали с помощью EtOH. Фильтрат концентрировали при пониженном давлении и получали искомое соединение в виде белого твердого вещества. ТСХ: rf (7:3 гептан-ЭА)=0,26. Условия проведения ЖХ-МС 02: tR=0,93 мин; [М+Н]+=239,34.
Сочетание с образованием амида (с 4-броманилином) - получение (5R*)-N5-(4-бромфенил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-(5R*)-5-карбоновой кислоты (2,00 г, 8,46 ммоля) в сухом толуоле (40 мл) добавляли несколько капель ДМФ и оксалилхлорид (1,13 мл, 12,70 ммоля). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 40 мин, охлаждали до КТ, концентрировали при1 пониженном давлении и остаток сушили в высоком вакууме.
К раствору этого ацилхлорида в сухом CH2Cl2 (40 мл) добавляли 4-броманилин (3,00 г, 16,93 ммоля) и ДИПЭА (4,35 мл, 25,40 ммоля). Реакционную смесь перемешивали при КТ в течение 1 ч. Добавляли 1 н. НСl, слои разделяли и водный слой экстрагировали с помощью CH2Cl2 (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 7:3) и получали искомое соединение в виде бледно-коричневого твердого вещества. ТСХ: rf (7:3 гептан-ЭА)=0,46. Условия проведения ЖХ-МС 02: tR=1,13 мин; [М+Н]+=392,30.
Омыление - получение (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида:
Смесь (5R*)-N5-(4-бромфенил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида (2,78 г, 7,09 ммоля) с EtOH (71 мл) и 1 н. NaOH (71 мл) перемешивали при 80°С в течение 1 ч. Затем реакционную смесь охлаждали до КТ и EtOH удаляли при пониженном давлении. Остаток подвергали распределению между 2 н. НСl и ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде оранжевого порошкообразного вещества. ТСХ: rf (7:3 гептан-ЭА)=0,18. Условия проведения ЖХ-МС 02: tR=1,01 мин; [М+Н]+=364,30.
Сочетание с образованием амида (с 4-пирролидин-1-илбутиламином) - получение (±)-йодолактона 3 (R2=4-пирролидин-1-илбутил и R3=Н):
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (±)-йодолактона 2 (6,92 г, 20,71 ммоля) в сухом СН2Сl2 (42 мл) добавляли несколько капель ДМФ и оксалилхлорид (1,96 мл, 22,78 ммоля). Реакционную смесь перемешивали при КТ в течение 30 мин, затем добавляли 4-(1-пирролидино)-бутиламин (3,00 г, 20,71 ммоля) и ДИПЭА (3,55 мл, 20,71 ммоля). Реакционную смесь перемешивали при КТ в течение 15 мин, разбавляли с помощью СН2Сl2 и промывали насыщенным водным раствором NH4Cl. Слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты промывали рассолом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (СН2Сl2/МеОН, 95:5) и получали искомое соединение в виде белого твердого вещества. ТСХ: rf (95:5 СН2Сl2/МеОН)=0,12. Условия проведения ЖХ-МС 02: tR=0,74 мин; [М+Н]+=459,30.
Ретро-йодлактонизация - получение (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (±)-йодолактона 3 (R2=4-пирролидин-1-илбутил и R3=Н) (7,11 г, 15,51 ммоля) в уксусной кислоте (100 мл) добавляли порошкообразный цинк (15,21 г, 232,70 ммоля). Реакционную смесь перемешивали при 65°С в течение 2 ч, охлаждали до КТ, фильтровали, промывали с помощью СН2Сl2 и фильтрат концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (С-18 обращенная фаза диоксида кремния, Н2O/МеОН, 1:0, затем 0:1) и получали искомое соединение в виде белого твердого вещества. Условия проведения ЖХ-МС 02: tR=0,64 мин; [М+Н]+=333,34.
Восстановление сложного эфира - получение (5R*)-N5-(4-бромфенил)-(6R*)-6-(гидроксиметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R*)-N5-(4-бромфенил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид (10,00 г, 25,62 ммоля) в сухом ТГФ (120 мл) добавляли UBH4 (2,55 г, 64,06 ммоля). Реакционную смесь перемешивали при 65°С в течение 2,5 ч и охлаждали до КТ. Добавляли насыщенный водный раствор NH4Cl и ЭА, слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлений. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 7:3) и получали искомое соединение в виде белого твердого вещества. ТСХ: rf (7:3 гептан-ЭА)=0,25. Условия проведения ЖХ-МС 02: tR=0,99 мин; [М+Н]+=348,30.
Образование амина через трифлат - получение (5R*)-N5-(4-бромфенил)-(6R*)-6-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R*)-N5-(4-бромфенил)-(6R*)-6-(гидроксиметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (1,00 г, 2,87 ммоля) в сухом СН2Сl2 (20 мл) добавляли ДИПЭА (1,23 мл, 7,18 ммоля). Реакционную смесь охлаждали до -78°С и по каплям добавляли трифторметансульфоновый ангидрид (0,55 мл, 3,33 ммоля). Реакционную смесь перемешивали при -78°С в течение 1 ч. Затем добавляли NH3 в диоксане (0,5 М, 15 мл, 7,50 ммоля) и реакционной смеси давали нагреться до КТ и перемешивали при этой температуре в течение ночи. Добавляли воду, слои разделяли и органический слой последовательно промывали насыщенным водным раствором NaHCO3 и рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Искомое соединение получали в виде оранжевого твердого вещества. ТСХ: rf (9:1:0,1 CH2Cl2-MeOH-NH4OH)=0,28. Условия проведения ЖХ-МС 02: tR=0,82 мин; [М+Н]+=347,24.
Образование амина через трифлат - получение (5R*)-N5-(4-бромфенил)-(6R*)-6-[(метиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R*)-N5-(4-бромфенил)-(6/?*)-6-(гидроксиметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (120 мг, 0,35 ммоля) в сухом СН2Сl2 (2,4 мл) добавляли ДИПЭА (0,15 мл, 0,86 ммоля). Реакционную смесь охлаждали до -78°С и по каплям добавляли трифторметансульфоновый ангидрид (0,09 мл, 0,57 ммоля). Реакционную смесь перемешивали при -78°С в течение 1 ч. Затем добавляли метиламин (2M в ТГФ, 1,73 мл, 3,46 ммоля) и реакционной смеси давали нагреться до КТ и перемешивали при этой температуре в течение 1 ч 30 мин. Добавляли воду и ЭА, слои разделяли и органический слой последовательно промывали насыщенным водным раствором NaHCO3 и рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Искомое соединение получали в виде оранжевого твердого вещества. Условия проведения ЖХ-МС 02: tR=0,82 мин; [М+Н]+=361,29.
1-(5-Гидроксиметилфуран-2-ил)-этанон:
В высушенной пламенем круглодонной колбе в инертной атмосфере (N2) к смеси 5-гидроксиметил-2-фуранового альдегида (100 г, 0,79 моля) и пиридинийтолуол-4-сульфоната (10 г, 0,04 моля) в СН2Сl2 (1 л) добавляли 3,4-дигидро-2H-пиран (150 мл, 1,62 моля), поддерживая внутреннюю температуру ниже 28°С (водяная баня). Реакционную смесь перемешивали при КТ в течение 5 ч. Добавляли воду (1 л), слои разделяли и органический слой промывали водой (500 мл) и выпаривали досуха и получали неочищенный 5-(тетрагидропиран-2-илоксиметил)-фуран-2-карбальдегид в виде желтого масла.
Неочищенный 5-(тетрагидропиран-2-илоксиметил)-фуран-2-карбальдегид (171 г) растворяли в ТГФ (1 л) и охлаждали до 1°С. Затем добавляли метилмагнийхлорид (3 М в ТГФ, 325 мл, 0,97 моля), поддерживая внутреннюю температуру ниже 5°С. После добавления реакционную смесь перемешивали при КТ в течение 1 ч. Добавляли воду (1 л), ТБМЭ (1 л) и 40% водный раствор лимонной кислоты (200 мл), слои разделяли и органический слой промывали водой (500 мл) и выпаривали досуха и получали неочищенный 1-[5-(тетрагидропиран-2-илоксиметил)-фуран-2-ил]-этанол. Часть неочищенного вещества (96 г, 0,43 моля) растворяли в СН2Сl2 (1 л) и обрабатывали с помощью Мп02 (371 г, 4,26 моля) при КТ. Реакционную смесь нагревали до 45°С и перемешивали при этой температуре в течение 24 ч. Затем смесь фильтровали через целит и осадок на фильтре промывали с помощью СН2Сl2. Фильтрат выпаривали досуха и получали неочищенный 1-[5-(тетрагидропиран-2-илоксиметил)-фуран-2-ил]-этанон в виде желтого масла.
Неочищенный 1-[5-(тетрагидропиран-2-илоксиметил)-фуран-2-ил]-этанон (89 г, 0,40 моля) растворяли в МеОН (500 мл) и обрабатывали с помощью Amberlyst 15 (15 г) при КТ. Реакционную смесь перемешивали при 35°С в течение 1 ч, охлаждали до КТ и фильтровали через целит. Добавляли Et3N (1 мл) и смесь выпаривали досуха. Остаток обрабатывали метилциклогексаном и получали 1-(5-гидроксиметилфуран-2-ил)-этанон в виде желтого масла, которое при выдерживании затвердевало.
1-(5-Аминометилфуран-2-ил)-этанон:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 1-(5-гидроксиметилфуран-2-ил)-этанона (2,00 г, 14,27 ммоля) в сухом СН2Сl2 (29 мл) обрабатывали при 0°С с помощью Et3N (2,58 мл, 18,55 ммоля), затем с помощью ДМАП (178 мг, 1,43 ммоля) и Ms-Cl (1,33 мл, 17,13 ммоля). После перемешивания при КТ в течение 3 ч реакцию останавливали водой. Слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный 1-(5-хлорметилфуран-2-ил)-этанон в виде коричневого масла. Часть этого неочищенного вещества (2,33 г, 14,72 ммоля) растворяли в сухом ДМФ (50 мл) и обрабатывали с помощью NaN3 (2,90 г, 44,16 ммоля) при 80°С в течение 24 ч. Затем реакционную смесь охлаждали до КТ и подвергали распределению между ЭА и водой. Слои разделяли и водный слой экстрагировали с помощью ЭА (1×). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении и получали неочищенный 1-(5-азидометилфуран-2-ил)-этанон в виде коричневого масла. Условия проведения ЖХ-МС 02: tR=0,81 мин; [M+AcCN+H]+=207,50.
К раствору неочищенного азида (500 мг, 3,03 ммоля) в ТГФ (15 мл) добавляли Ph3Р (на полимерной подложке; 3,0 ммоль/г, 1,5 экв.) и воду (5 мл). Реакционную смесь перемешивали при 60°С до завершения реакции, охлаждали до КТ и фильтровали. Затем добавляли насыщенный водный раствор NaHCO3 и ЭА, слои разделяли и водный слой экстрагировали с помощью ЭА (1×). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (9:1 СН2Сl2/МеОН) и получали искомое соединение в виде оранжевого масла. Условия проведения ЖХ-МС 02: tR=0,27 мин; [M+AcCN+H]+=181,61.
5-Нитропентан-2-он:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору метилвинилкетона (2,32 мл, 28,53 ммоля) в нитрометане (29,6 мл) при 0°С добавляли активированный KF/Аl2О3 (323 мг, получали путем смешивания KF и основного Аl2O3 в воде, последующего концентрирования и сушки). Затем реакционной смеси давали нагреться до КТ и перемешивали при этой температуре в течение 18 ч. Смесь фильтровали через нейтральней Аl2O3 и промывали с помощью СН2Сl2. Фильтрат концентрировали при пониженном давлении и получали искомое соединение в виде бесцветного масла.
2-Метил-2-(3-нитропропил)-[1,3]диоксолан:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки и аппаратом Дина-Штарка, и в инертной атмосфере (N2) неочищенный 5-нитропентан-2-он (28,53 ммоля) растворяли в сухом толуоле (28 мл). Добавляли этиленгликоль (10,2 мл, 183,02 ммоля) и p-TsOU (696 мг, 3,66 ммоля) и реакционную смесь перемешивали при 120°С в течение 5 ч. Затем реакционную смесь охлаждали до КТ и добавляли насыщенный водный раствор NaHCO3. Слои разделяли и органический слой промывали рассолом (2×), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 4:1) и получали искомое соединение в виде бледно-коричневого масла. ТСХ: rf (4:1 гептан-ЭА)=0,21.
3-(2-Метил-[1,3]диоксолан-2-ил)-пропиламин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, смесь 2-метил-2-(3-нитропропил)-[1,3]диоксолан (1,80 г, 10,27 ммоля) и Pd/C 10% (176 мг) в сухом МеОН (35 мл) перемешивали при КТ при атмосферном давлении Н2 в течение 11 ч. Затем реакционную смесь фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде бесцветного масла. Условия проведения ЖХ-МС 02: tR=0,25 мин; [М+Н]+=146,41.
2-Ацетил-4-цианомасляной кислоты этиловый эфир:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к этилату натрия (получали из 62 мг натрия в 8 мл EtOH) добавляли этилацетоацетат (9,7 мл, 76,1 ммоля). Затем при 40-45°С по каплям добавляли акрилонитрил (5 мл, 76,1 ммоля) и реакционную смесь перемешивали при этой температуре в течение ночи. Этанол удаляли и остаток промывали с помощью 65 мл воды, содержащей 3,5 мл уксусной кислоты, разбавляли с помощью СН2Сl2 и сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток перегоняли (т.кип.=95-105°С при 1 атм.) и получали искомое соединение. ТСХ: rf (7:3 гептан-ЭА)=0,29.
5-Оксогексаннитрил:
Смесь этилового эфира 2-ацетил-4-цианомасляной кислоты (5,70 г, 31,1 ммоля) и Na2СО3 (5,52 г, 52,1 ммоля) в воде (55 мл) перемешивали при кипячении с обратным холодильником в течение 4 ч. После охлаждения добавляли К2СО3 (1,9 г) и реакционную смесь экстрагировали с помощью Et2O (3×), затем с помощью СН2Сl2 (4х). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 65:35) и получали искомое соединение в виде бесцветного масла. ТСХ: rf (65:35 гептан-ЭА)=0,21.
4-(2-Метил-[1,3]диоксолан-2-ил)-бутиронитрил:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки и аппаратом Дина-Штарка, и в инертной атмосфере (N2) 5-оксогексаннитрил (1,69 г, 15,2 ммоля) растворяли в сухом толуоле (10 мл). Добавляли этиленгликоль (4,24 мл, 76,0 ммоля) и p-TsOH (289 мг, 1,5 ммоля) и реакционную смесь перемешивали при 120°С в течение 5 ч. Затем реакционную смесь охлаждали до КТ и добавляли насыщенный водный раствор NaHCO3. Слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (2×). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде бледно-желтого масла. Условия проведения ЖХ-МС 02: tR=0,94 мина. 4-(2-Метил-[1,3]диоксолан-2-ил)-бутиламин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 4-(2-метил-[1,3]диоксолан-2-ил)-бутиронитрил (2,23 г, 14,4 ммоля) в сухом Et2O (2,5 мл) добавляли к суспензии LiAlH4 (1,36 г, 35,9 ммоля) в сухом Et2O (50 мл). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 3 ч, охлаждали до КТ и обрабатывали водой (2 мл), 15% водным раствором NaOH (2 мл) и водой (4 мл). Осадок отфильтровывали и промывали с помощью Et2O. Фильтрат сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде светло-коричневого масла. Условия проведения ЖХ-МС 02: tR=0,32 мин; [М+Н]+=160,29.
4-Бромтиазол-2-карбальдегид:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор имеющегося в продаже 2,4-дибромтиазола (3,50 г, 14,41 ммоля) в сухом Et2O (120 мл) при -78°С обрабатывали с помощью n-BuLi (5,9 мл 2,5 М раствора в гексанах, 14,72 ммоля). Реакционную смесь перемешивали при этой температуре в течение 30 мин. Затем добавляли N,N-диметилформамид (1,35 мл, 14,47 ммоля) и смеси давали нагреваться до КТ в течение 1 ч. Реакцию останавливали путем добавления насыщенного водного раствора NH4Cl (50 мл). Слои разделяли и водный слой экстрагировали с помощью Et2O (3×50 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и растворители удаляли при пониженном давлении. Очистка остатка с помощью ФХ (10:1→3:1 гептан-ЭА) давала искомое соединение в виде бледно-желтого твердого вещества. ТСХ: rf (1:1 гептан-ЭА)=0,21. Условия проведения ЖХ-МС 02: tR=0,81 мина.
(4-Бромтиазол-2-ил)-метанол:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) 4-бромтиазол-2-карбальдегид (1,68 г, 8,75 ммоля), растворенный в МеОН (10 мл). При 0°С порциями добавляли NaBH4 (428 мг, 10,86 ммоля) и реакционную смесь перемешивали при КТ в течение 1 ч. Добавляли воду (10 мл) и смесь экстрагировали с помощью ЭА (3×20 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и растворители удаляли при пониженном давлении. Очистка остатка с помощью ФХ (6:1 →2:1 гептан-ЭА) давала искомое соединение в виде бледно-желтого твердого вещества. ТСХ: rf (1:1 гептан-ЭА)=0,31. Условия проведения ЖХ-МС 02: tR=0,62 мин [М+Н]+=194,31.
4-Бром-2-(трет-бутилдиметилсиланилоксиметил)-тиазол:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) (4-бромтиазол-2-ил)-метанол (1,37 г, 7,06 ммоля) растворяли в сухом СН2Сl2 (21 мл), трет-Бутилдиметилсилилхлорид (1,17 г, 7,77 ммоля) добавляли при 0°С, затем добавляли имидазол (985 мг, 14,47 ммоля). Реакционную смесь перемешивали при КТ в течение 2 ч. Добавляли 10% водный раствор К2СО3 (10 мл), слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (2×20 мл). Объединенные органические экстракты сушили над MgSO4, фильтровали и растворитель удаляли при пониженном давлении и получали искомое соединение в виде бесцветного масла. ТСХ: rf (1:1 гептан-ЭА) - 0,80.
1-[2-(трет-Бутилдиметилсиланилоксиметил)-тиазол-4-ил]-этанон:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору 4-бром-2-(трет-бутилдиметилсиланилоксиметил)-тиазола (1,94 г, 6,29 ммоля) в сухом Et2O (50 мл) при -78°С добавляли n-BuLi (2,76 мл 2,5 М раствора в гексанах, 6,92 ммоля). Затем реакционную смесь перемешивали в течение 30 мин при -78°С, затем по каплям добавляли N,N-диметилацетамид (1,17 мл, 12,58 ммоля). Реакционной смеси давали нагреваться до КТ в течение 1 ч и перемешивали при этой температуре в течение 20 мин. Добавляли насыщенный водный раствор NH4Cl (20 мл), слои разделяли и водный слой экстрагировали с помощью Et2O (3×30 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и растворитель удаляли при пониженном давлении. Очистка остатка с помощью ФХ (20:1→5:1 гептан-ЭА) давала искомое соединение в виде желтого твердого вещества. ТСХ: rf (1:1 гептан-ЭА)=0,51. Условия проведения ЖХ-МС 02: tR=1,11 мин; [М+Н]+=272,39.
2-(трет-Бутилдиметилсиланилоксиметил)-4-(2-метил-[1,3]диоксолан-2-ил)-тиазол:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 1-[2-(трет-бутилдиметилсиланилоксиметил)-тиазол-4-ил]-этанона (1,77 г, 6,52 ммоля) в этиленгликоле (7 мл) обрабатывали триметилортоформиатом (1,46 мл, 13,29 ммоля), затем с помощью LiBF4 (125 мг, 1,30 ммоля). Реакционную смесь нагревали при 95°С в течение 4 ч. Добавляли насыщенный водный раствор Na2CO3 (5 мл) и смесь экстрагировали с помощью Et2O (2×20 мл). Органические экстракты сушили над Na2SO4, фильтровали и растворитель удаляли при пониженном давлении. Очистка остатка с помощью ФХ (20:1→3:1 гептан-ЭА) давала искомое соединение в виде коричневого масла. ТСХ: rf (1:1 гептан-ЭА)=0,56. Условия проведения ЖХ-МС 02: tR=1,11 мин; [М+Н]+=316,36.
[4-(2-Метил-[1,3]диоксолан-2-ил)-тиазол-2-ил]-метанол: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 2-(трет-бутилдиметилсиланилоксиметил)-4-(2-метил-[1,3]диоксолан-2-ил)-тиазола (1,30 г, 4,12 ммоля) в сухом ТГФ (10 мл) при 0°С обрабатывали с помощью ТБАФ (6,2 мл 1 М раствора в ТГФ, 6,20 ммоля). Реакционную смесь перемешивали при 0°С в течение 5 мин и при КТ в течение 1 ч 30 мин. Затем смесь разбавляли с помощью ЭА (10 мл), промывали рассолом (3×10 мл), сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка остатка с помощью ФХ (5:1→1:3 гептан-ЭА) давала искомое соединение в виде желтого масла. ТСХ: rf (1:2 гептан-ЭА)=0,20. Условия проведения ЖХ-МС 02: tR=0,59 мин; [М+Н]+=202,48.
[4-(2-Метил-[1,3]диоксолан-2-ил)-тиазол-2-ил]-метиламин: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор [4-(2-метил-[1,3]диоксолан-2-ил)-тиазол-2-ил]-метанола (745 мг, 3,70 ммоля) в сухом СН2Сl2
(5 мл) при 0°С обрабатывали с помощью Et3N (0,67 мл, 4,79 ммоля), затем с помощью ДМАП (46 мг, 0,37 ммоля) и Ms-Cl (0,37 мл, 4,67 ммоля). После перемешивания при 0°С в течение 1 ч 30 мин реакцию останавливали водой (5 мл). Органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный 4-(2-метил-[1,3]диоксолан-2-ил)-тиазол-2-илметиловый эфир метансульфоновой кислоты в виде желтого масла. Часть этого неочищенного вещества (200 мг, 0,72 ммоля) растворяли в сухом ДМФ (2,5 мл) и обрабатывали с помощью NaN3 (50 мг, 0,76 ммоля) при 80°С в течение 24 ч. Затем реакционную смесь охлаждали до КТ и подвергали распределению между ЭА и водой. Слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали неочищенный 2-азидометил-4-(2-метил-[1,3]диоксолан-2-ил)-тиазол в виде желтого масла. Условия проведения ЖХ-МС 02: tR=0,82 мин; [М+Н]+=227,46.
К раствору неочищенного азида (160 мг, 0,71 ммоля) в ТГФ (4,5 мл) добавляли Ph3Р (371 мг, 1,41 ммоля) и воду (1 мл). Реакционную смесь перемешивали при 60°С в течение 4 ч и охлаждали до КТ. Затем добавляли насыщенный водный раствор NaHCO3 и ЭА, слои разделяли и водный слой экстрагировали с помощью ЭА (1×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (1:0→9:1 СН2Сl2-МеОН) и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 02: tR=0,37 мин; [М+Н]+=201,54.
[5-(2-Метил-[1,3]диоксолан-2-ил)-тиофен-2-ил]-метанол: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору имеющегося в продаже 2-метил-2-тиофен-2-ил-[1,3]диоксолана (5,00 г, 28,49 ммоля) в ТГФ (145,0 мл) при -78°С по каплям добавляли N,N,N',N'-тетраметилэтилендиамин (4,41 мл, 29,06 ммоля), затем n-BuLi (18,14 мл 1,6 М раствора в гексанах, 29,06 ммоля), поддерживая температуру равной -78°С. Затем реакционную смесь перемешивали в течение 2 ч при -78°С, затем по каплям добавляли ДМФ (6,74 мл, 87,22 ммоля). Охлаждающую баню удаляли и реакционную смесь перемешивали в течение 16 ч. Реакционную смесь выливали в насыщенный водный раствор NaH4Cl (200 мл) и экстрагировали с помощью ЭА (2×200 мл). Объединенные органические экстракты сушили над MgSO4, фильтровали и растворитель удаляли при пониженном давлении и получали неочищенный 5-(2-метил-[1,3]диоксолан-2-ил)-тиофен-2-карбальдегид в виде желтого масла. Условия проведения ЖХ-МС 02: tR=0,87 мин; [M+AcCN+H]+=240,32. Неочищенное вещество растворяли в инертной атмосфере (N2) в МеОН (51,2 мл) и при 0°С порциями в течение 20 мин обрабатывали с помощью NaBH4 (1,35 г, 34,19 ммоля пятью одинаковыми порциями). Реакционную смесь перемешивали при КТ в течение 45 мин. Реакционную смесь выливали в воду (90 мл) и водный слой экстрагировали с помощью ЭА (2×225 мл). Объединенные органические экстракты сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении. Очистка остатка с помощью ФХ (50:50 гептан-ЭА) давала искомое соединение. ТСХ: rf (50:50 гептан-ЭА)=0,40. Условия проведения ЖХ-МС 02: tR=0,72 мин; [М+Н]+=201,46.
[5-(2-Метил-[1,3]диоксолан-2-ил)-тиофен-2-ил]-метиламин: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор [5-(2-метил-[1,3]диоксолан-2-ил)-тиофен-2-ил]-метанола (5,00 г, 25,0 ммоля) в сухом СН2Сl2 (46 мл) при 0°С обрабатывали с помощью Et3N (4,5 мл, 32,5 ммоля), затем с помощью ДМАП (305 мг, 2,5 ммоля) и Ms-Cl (2,3 мл, 30,0 ммоля). После перемешивания при КТ в течение 2 ч реакцию останавливали водой (50 мл). Органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный 2-(5-хлорметилтиофен-2-ил)-2-метил-[1,3]диоксолан в виде желтого масла. Часть этого неочищенного вещества (953 мг, 4,36 ммоля) растворяли в сухом ДМФ (15 мл) и обрабатывали с помощью NaN3 (859 мг, 13,08 ммоля) при 80°С в течение 24 ч. Затем реакционную смесь охлаждали до КТ и подвергали распределению между ЭА и водой. Слои разделяли и органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении и получали неочищенный 2-азидометил-5-(2-метил-[1,3]диоксолан-2-ил)-тиофен в виде желтого масла. Условия проведения ЖХ-МС 02: tR=0,97 мин; [М+Н]+=226,50.
К раствору неочищенного азида (150 мг, 0,67 ммоля) в ТГФ (6 мл) добавляли Ph3P (на полимерной подложке, 1,6 ммоль/г, 2,0 экв.) и воду (2 мл).
Реакционную смесь перемешивали при 60°С до завершения реакции, охлаждали до КТ и фильтровали. Затем добавляли насыщенный водный раствор NaHCO3 и ЭА, слои разделяли и водный слой экстрагировали с помощью ЭА (1×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 01: tR=0,50 мин; [М+Н]+=199,99.
1-Оксазол-2-илэтанон:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор имеющегося в продаже 1,3-оксазол (3,25 мл, 48,49 ммоля) в сухом ТГФ (34,00 мл) обрабатывали изопропилмагнийхлоридом (24,00 мл 2,0 М раствора в ТГФ, 48,00 ммоля) при -15°С (поддерживая внутреннюю температуру ниже -10°С). Реакционную смесь перемешивали при этой температуре в течение 40 мин. Затем по каплям добавляли раствор N-метокси-N-метилацетамида (4,12 мл, 38,79 ммоля) в сухом ТГФ (10 мл), поддерживая внутреннюю температуру ниже -14°С. Реакционной смеси давали нагреться до КТ и перемешивали при этой температуре в течение ночи. Реакцию останавливали путем добавления 20% водного раствора NH4Cl (150 мл). Слои разделяли и водный слой экстрагировали с помощью Et2O (3×100 мл). Объединенные органические экстракты сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении. Очистка остатка с помощью ФХ (6:4 гексан-Et2О) давала искомое соединение в виде оранжевого масла. ТСХ: rf (6:4 гексан-Et2O)=0,27. Условия проведения ЖХ-МС 02: tR=0,47 мина. 1-Оксазол-2-илэтанол:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) 1-оксазол-2-илэтанон (1,76 г, 15,84 ммоля) растворяли в МеОН (30 мл). При 0°С порциями добавляли NaBH4 (811 мг, 20,59 ммоля) и реакционную смесь перемешивали при КТ в течение 1 ч 30 мин. Добавляли воду (30 мл) и МеОН удаляли при пониженном давлении. Затем смесь экстрагировали с помощью ЭА (7×50 мл). Объединенные органические экстракты сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении. Получали искомое соединение в виде бледно-желтого масла. Условия проведения ЖХ-МС 02: tR=0,33 мина.
2-[1-(трет-Бутилдиметилсиланилокси)-этил]-оксазол: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) 1-оксазол-2-илэтанол (1,21 г, 10,71 ммоля) растворяли в сухом ТГФ (50 мл). При КТ добавляли трет-бутилдиметилсилилхлорид (3,23 г, 21,43 ммоля), затем имидазол (1,46 г, 21,43 ммоля). Реакционную смесь перемешивали при КТ в течение 16 ч. Добавляли насыщенный водный раствор NH4Cl (100 мл) и ЭА (100 мл), слои разделяли и водный слой экстрагировали с помощью ЭА (1×100 мл). Объединенные органические экстракты сушили над MgSO4, фильтровали и растворитель удаляли при пониженном давлении. Очистка остатка с помощью ФХ (4:1 гексан-Et2O) давала искомое соединение в виде бесцветного масла. ТСХ: rf (4:1 гексан-Et2O)=0,39. Условия проведения ЖХ-МС 02: tR=1,08 мин; [М+Н]+=228,56. 2-[1-(трет-Бутилдиметилсиланилокси)-этил]-оксазол-5-карбальдегид: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору 2-[1-(трет-бутилдиметилсиланилокси)-этил]-оксазола (733 мг, 3,22 ммоля) в сухом ТГФ (16 мл) при -78°С добавляли трет-BuLi (2,62 мл 1,6 М раствора в пентане, 4,19 ммоля). Затем реакционную смесь перемешивали в течение 1 ч при -40°С и охлаждали до -78°С, затем по каплям добавляли N,N-диметилформамид (0,49 мл, 6,44 ммоля). Реакционной смеси давали нагреваться до КТ в течение 1 ч и перемешивали при этой температуре в течение 2 ч. Добавляли воду (30 мл) и насыщенный водный раствор NH4Cl (20 мл), слои разделяли и водный слой экстрагировали с помощью ЭА (2×30 мл). Объединенные органические экстракты сушили над MgSO4, фильтровали и растворитель удаляли при пониженном давлении. Очистка остатка с помощью ФХ (4:1 гептан-ЭА) давала искомое соединение в виде бесцветного масла. ТСХ: rf (4:1 гептан-ЭА)=0,33. Условия проведения ЖХ-МС 02: tR=1,08 мин; [М+Н]+=256,37.
2-[1-(трет-Бутилдиметилсиланилокси)-этил]-оксазол-5-илметанол: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) 2-[1-(трет-бутилдиметилсиланилокси)-этил]-оксазол-5-карбальдегид (457 мг, 1,79 ммоля) растворяли в МеОН (8 мл). При О°С порциями добавляли NaBH4 (92 мг, 2,33 ммоля) и реакционную смесь перемешивали при КТ в течение 20 мин. Добавляли воду (16 мл) и МеОН удаляли при пониженном давлении. Затем смесь экстрагировали с помощью ЭА (2×20 мл). Объединенные органические экстракты сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении. Искомое соединение получали в виде бесцветного масла. Условия проведения ЖХ-МС 02: tR=0,97 мин; [М+Н]+=258,37.
2-[1-(трет-Бутилдиметилсиланилокси)-этил]-оксазол-5-илметиламин: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 2-[1-(трет-бутилдиметилсиланилокси)-этил]-оксазол-5-илметанол (760 мг, 2,95 ммоля) в сухом CH2Cl2 (15 мл) обрабатывали при 0°С с помощью Et3N (0,53 мл, 3,82 ммоля), затем с помощью ДМАП (36 мг, 0,30 ммоля) и Ms-Cl (0,30 мл, 3,73 ммоля). После перемешивания при 0°С до завершения реакции реакцию останавливали водой (50 мл). Органический слой сушили над Na2SO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный 2-[1-(трет-бутилдиметилсиланилокси)-этил]-5-хлорметилоксазол в виде желтого масла. Неочищенное вещество (2,95 ммоля) растворяли в сухом ДМФ (15 мл) и обрабатывали с помощью NaN3 (205 мг, 3,01 ммоля) при 80°С в течение 40 ч. Затем реакционную смесь охлаждали до КТ и подвергали распределению между ЭА и водой. Слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали неочищенный 5-азидометил-2-[1-(трет-бутилдиметилсиланилокси)-этил]-оксазол в виде желтого масла. Условия проведения ЖХ-МС 02: tR=1,12 мин; [М+Н]+=283,55.
К раствору неочищенного азида (700 мг, 2,48 ммоля) в ТГФ (12 мл) добавляли Ph3P (на полимерной подложке, 1,6 ммоль/г, 3,0 экв.) и воду (4 мл). Реакционную смесь перемешивали при 60°С до завершения реакции, охлаждали до КТ и фильтровали. Затем добавляли насыщенный водный раствор NaHCO3 и ЭА, слои разделяли и водный слой экстрагировали с помощью ЭА (1×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (1:0→9:1 СН2Сl2-МеОН+2% Et3N) и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 01: tR=0,75 мин; [М+Н]+=257,08.
(2-Бромтиазол-5-ил)-метанол:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) 2-бромтиазол-5-карбальдегид (10,66 г, 55,51 ммоля) растворяли в МеОН (150 мл). При 0°С порциями добавляли NaBH4 (2,71 г, 68,91 ммоля) и реакционную смесь перемешивали при 0°С в течение 1 ч. Добавляли воду (10 мл) и смесь экстрагировали с помощью ЭА (3×70 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный (2-бромтиазол-5-ил)-метанол в виде оранжевого масла. ТСХ: rf (1:1 гептан-ЭА)=0,25. Условия проведения ЖХ-МС 01: tR=0,56 мин [М+Н]+=193,81.
2-Бром-5-(трет-бутилдиметилсиланилоксиметил)-тиазол: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) (2-бромтиазол-5-ил)-метанол (10,65 г, 54,88 ммоля) растворяли в сухом CH2Cl2 (150 мл), трет-Бутилдиметилсилилхлорид (9,58 г, 60,37 ммоля) добавляли при 0°С, затем имидазол (7,66 г, 112,51 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции, воду (100 мл) добавляли, слои разделяли и органический слой сушили над MgSO4, фильтровали и растворитель удаляли при пониженном давлении. Очистка остатка с помощью ФХ (от 1:0 до 30:1 гептан-ЭА) давала искомое соединение в виде желтого масла. ТСХ: rf (9:1 гептан-ЭА)=0,46. Условия проведения ЖХ-МС 01: tR=1,13 мин [М+Н]+=309,90.
1-[5-(трет-Бутилдиметилсиланилоксиметил)-тиазол-2-ил]-этанон: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору n-BuLi (4,3 мл 2,5 М раствора в гексанах, 10,75 ммоля) в сухом Et2O (15 мл) добавляли раствор 2-бром-5-(трет-бутилдиметилсиланилоксиметил)-тиазола (3,03 г, 9,83 ммоля) в сухом Et2O (10 мл) при -78°С. Затем реакционную смесь перемешивали в течение 30 мин при -78°С, затем N,N-диметилацетамид (1,9 мл, 20,43 ммоля) по каплям добавляли. Реакционную смесь перемешивали при -78°С в течение 1 ч. насыщенный водный раствор NH4Cl (20 мл) добавляли, слои разделяли и водный слой экстрагировали с помощью Et2O (2×30 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и растворитель удаляли при пониженном давлении и получали искомое соединение в виде оранжевого масла. ТСХ: rf (2:1 гептан-ЭА)=0,60. Условия проведения ЖХ-МС 02: tR=1,14 мин; [М+Н]+=272,32.
(2-(2-Метил-[1,3]диоксолан-2-ил)тиазол-5-ил)метанол: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 1-[5-(трет-бутилдиметилсиланилоксиметил)-тиазол-2-ил]-этанон (1,00 г, 3,68 ммоля) в этиленгликоле (4 мл) обрабатывали триметилортоформиатом (0,82 мл, 7,51 ммоля), затем с помощью LiBF4 (70 мг, 0,74 ммоля). Реакционную смесь нагревали при 95°С в течение 2 дней, насыщенный водный раствор Na2CO3 (5 мл) добавляли и смесь экстрагировали с помощью Et2O (3×20 мл). Органические экстракты сушили над Na2SO4, фильтровали и растворитель удаляли при пониженном давлении. Неочищенный остаток (смесь силилированных/десилилированных продуктов) в сухом ТГФ (10 мл) обрабатывали при КТ с помощью ТБАФ (1,1 мл 1 М раствора в ТГФ, 1,10 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь разбавляли с помощью ЭА, промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка остатка с помощью ФХ (4:1→1:2 гептан-ЭА) давала искомое соединение в виде бледно-желтого твердого вещества. ТСХ: rf (ЭА)=0,47. Условия проведения ЖХ-МС 02: tR=0,60 мин; [М+Н]+=202,46.
(2-(2-Метил-[1,3]диоксолан-2-ил)тиазол-5-ил)метанамин: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор (2-(2-метил-[1,3]диоксолан-2-ил)тиазол-5-ил)метанол (389 мг, 1,93 ммоля) в сухом СН2Сl2 (10 мл) обрабатывали при 0°С с помощью Et3N (0,35 мл, 2,50 ммоля), затем с помощью ДМАП (24 мг, 0,19 ммоля) и Ms-Cl (0,19 мл, 2,40 ммоля). После перемешивания при 0°С в течение 1 ч реакцию останавливали водой (10 мл). Органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении. Очистка с помощью ФХ (1:1→1:2 гептан-ЭА+1% Et3N) давала чистый (2-(2-метил-[1,3]диоксолан-2-ил)тиазол-5-ил)метилметансульфонат в виде бледно-желтого масла. Часть этого вещества (140 мг, 0,50 ммоля) растворяли в сухом ДМФ (1 мл) и обрабатывали с помощью NaN3 (35 мг, 0,53 ммоля) при 80°С в течение 1 ч 30 мин. Затем реакционную смесь охлаждали до КТ и подвергали распределению между ЭА и водой. Слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали неочищенный 5-(азидометил)-2-(2-метил-[1,3]диоксолан-2-ил)тиазол в виде коричневого масла. Условия проведения ЖХ-МС 01: tR=0,80 мин; [М+Н]+=226,96.
К раствору неочищенного азида (113 мг, 0,50 ммоля) в ТГФ (6 мл) добавляли Ph3P на полимерной подложке (262 мг, 1,00 ммоля) и воду (2 мл). Реакционную смесь перемешивали при 60°С в течение 1 ч, охлаждали до КТ, фильтровали и концентрировали при пониженном давлении. Остаток повторно растворяли в СН2Сl2/МеОН 9:1, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде оранжевого масла. Условия проведения ЖХ-МС 02: tR=0,48 мина. 1-(2-Бромтиазол-5-ил)-этанол:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор имеющегося в продаже 2-бромтиазол-5-карбальдегида (1,96 г, 10,00 ммоля) в CH2Cl2 (20 мл) обрабатывали при 0°С триметилалюминием (15 мл 2М раствора в толуоле, 30,00 ммоля). Затем реакционную смесь перемешивали при 0°С в течение 45 мин. Затем добавляли CH2Cl2 (100 мл), затем насыщенный водный раствор NH4Cl (100 мл). Затем смесь обрабатывали с помощью 1 н. НСl (50 мл) и водный слой экстрагировали с помощью CH2Cl2 (150 мл). Объединенные органические экстракты сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали искомое соединение в виде оранжевого масла. ТСХ: rf (1:1 гептан-ЭА)=0,38. Условия проведения ЖХ-МС 02: tR=0,70 мин; [М+Н]+=208,38.
1-(2-Бромтиазол-5-ил)-этанон:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 1-(2-бромтиазол-5-ил)-этанол (14,85 г, 71,37 ммоля) в CH3CN (160 мл) обрабатывали при КТ с помощью МnO2 (34,47 г, 356,84 ммоля) и реакционную смесь перемешивали в течение 20 ч при КТ, затем фильтровали через целит. Растворитель удаляли при пониженном давлении и получали искомое соединение в виде желтого твердого вещества. ТСХ: rf (1:1 гептан-ЭА)=0,54. Условия проведения ЖХ-МС 02: tR=0,79 мина.
2-Бром-5-(2-метил-[1,3]диоксолан-2-ил)-тиазол:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки и холодильником, в инертной атмосфере (N2) раствор 1-(2-бромтиазол-5-ил)-этанона (16,22 г, 78,71 ммоля) в этиленгликоле (85 мл) обрабатывали триметилортоформиатом (18 мл, 164,19 ммоля), затем с помощью LiBF4 (1,51 г, 15,74 ммоля). Реакционную смесь нагревали при 95°С в течение 2 дней. Добавляли насыщенный водный раствор NaHCO3 и смесь экстрагировали с помощью Et2О (3×). Органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и растворитель удаляли при пониженном давлении. Очистка остатка с помощью ФХ (от 20:1 До 3:1 гептан-ЭА) давала искомое соединение в виде желтого твердого вещества. ТСХ: rf (1:1 гептан-ЭА)=0,63. Условия проведения ЖХ-МС 02: tR=0,89 мин; [М+Н]+=250,24.
5-(2-Метил-[1,3]диоксолан-2-ил)-тиазол-2-карбальдегид:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 2-бром-5-(2-метил-[1,3]диоксолан-2-ил)-тиазола (5,00 г, 20,00 ммоля) в сухом Et2О (40 мл) при -78°С добавляли к n-BuLi (8,40 мл 2,5 М раствора в гексанах, 21,00 ммоля). Затем реакционную смесь перемешивали в течение 30 мин при -78°С, затем по каплям добавляли ДМФ (2,5 мл, 32,29 ммоля). Реакционную смесь перемешивали при -60°С в течение 1 ч. Добавляли насыщенный водный раствор NH4Cl (100 мл), затем 1 н. водный раствор НСl (50 мл). Слои разделяли и водный слой экстрагировали с помощью Et2O (5×). Объединенные органические экстракты сушили над Na2SO4, фильтровали и растворитель удаляли при пониженном давлении и получали искомое соединение в виде оранжевого масла. ТСХ: rf (1:1 гептан-ЭА)=0,50. Условия проведения ЖХ-МС 01: tR=0,78 мин; [М+Н]+=199,93.
[5-(2-Метил-[1,3]диоксолан-2-ил)-тиазол-2-ил]-метанол: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) 5-(2-метил-[1,3]диоксолан-2-ил)-тиазол-2-карбальдегид (5,12 г, 25,70 ммоля) растворяли в МеОН (60 мл). При 0°С порциями добавляли NaBH4 (1,26 г, 31,89 ммоля) и реакционную смесь перемешивали при 0°С в течение 1 ч. Добавляли воду и смесь экстрагировали с помощью ЭА (3×). Объединенные органические экстракты сушили над Na2SO4, фильтровали и растворители удаляли при пониженном давлении и получали искомое соединение в виде оранжевого масла. ТСХ: rf (1:1 гептан-ЭА)=0,31. Условия проведения ЖХ-МС 02: tR=0,64 мин; [М+Н]+=202,52. (5-(2-Метил-[1,3]диоксолан-2-ил)тиазол-2-ил)метанамин: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор [5-(2-метил-[1,3]диоксолан-2-ил)-тиазол-2-ил]-метанол (500 мг, 2,48 ммоля) в сухом CH2Cl2 (15 мл) обрабатывали при 0°С с помощью Et3N (0,45 мл, 3,21 ммоля), затем с помощью ДМАП (31 мг, 0,25 ммоля) и Ms-Cl (0,25 мл, 3,14 ммоля). После перемешивания при 0°С в течение 1 ч реакцию останавливали водой (10 мл). Органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный (5-(2-метил-[1,3]диоксолан-2-ил)-тиазол-2-ил)метилметансульфонат в виде коричневого масла. Это вещество растворяли в сухом ДМФ (10 мл) и обрабатывали с помощью NaN3 (175 мг, 2,66 ммоля) при 80°С до завершения реакции. Затем реакционную смесь охлаждали до КТ и подвергали распределению между ЭА и водой. Слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали неочищенный 2-(азидометил)-5-(2-метил-[1,3]диоксолан-2-ил)-тиазол в виде желтого масла. Условия проведения ЖХ-МС 02: tR=0,86 мин; [М+Н]+=227,47.
К раствору неочищенного азида (565 мг, 2,50 ммоля) в ТГФ (12 мл) добавляли Ph3P на полимерной подложке (2,0 экв.) и воду (4 мл). Реакционную смесь перемешивали при 60°С до завершения реакции, охлаждали до КТ, фильтровали и подвергали распределению между ЭА и насыщенным водным раствором NaHCO3. Слои разделяли и водный слой экстрагировали с помощью ЭА. Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде коричневого масла после очистки с помощью ФХ (СН2Сl2-МеOН от 1:0 до 9:1). Условия проведения ЖХ-МС 01: tR=0,38 мин; [М+Н]+=200,96.
(4-Бромтиазол-2-ил)метанамин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор (4-бромтиазол-2-ил)-метанола (695 мг, 3,58 ммоля) в сухом СН2Сl2 (10 мл) обрабатывали при 0°С с помощью Et3N (0,67 мл, 4,74 ммоля), затем с помощью ДМАП (44 мг, 0,36 ммоля) и Ms-Cl (0,36 мл, 4,65 ммоля). После перемешивания при 0°С в течение 1 ч реакцию останавливали водой (10 мл). Органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный (4-бромтиазол-2-ил)метилметансульфонат в виде коричневого масла. Неочищенное вещество растворяли в сухом ДМФ (6 мл) и обрабатывали с помощью NaN3 (257 мг, 3,91 ммоля) при 80°С до завершения реакции. Затем реакционную смесь охлаждали до КТ и подвергали распределению между ЭА и водой. Слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали неочищенный 2-(азидометил)-4-бромтиазол в виде желтого масла. Условия проведения ЖХ-МС 01: tR=0,83 мина.
К раствору неочищенного азида в ТГФ (12 мл) добавляли Ph3P на полимерной подложке (5,16 ммоля) и воду (4 мл). Реакционную смесь перемешивали при 60°С до завершения реакции, охлаждали до КТ и фильтровали. Фильтрат подвергали распределению между ЭА и насыщенным водным раствором NaHCO3, слои разделяли и водный слой экстрагировали с помощью ЭА. Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде оранжевого масла. Условия проведения ЖХ-МС 02: tR=0,24 мин; [М+Н]+=192,85.
(E)-2-Метил-3-фенилакриламид:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор альфа-метилкоричной кислоты (19,0 г, 116 ммоля) и Et3N (17,1 мл, 122 ммоля) в сухом ТГФ (500 мл) при 0°С обрабатывали этилхлорформиатом (11,4 мл, 117 ммоля). Реакционную смесь перемешивали при 0°С в течение 15 мин, затем добавляли водный раствор NH3 (250 мл) в ТГФ (150 мл). Реакционную смесь энергично перемешивали при 0°С в течение 30 мин и при КТ в течение 1 ч 30 мин. Затем слои разделяли, водный слой экстрагировали с помощью CH2Cl2 (2×) и объединенные органические экстракты концентрировали при пониженном давлении. Остаток подвергали распределению между водой и CH2Cl2, слои разделяли и водный слой экстрагировали с помощью CH2Cl2 (2×). Объединенные органические экстракты сушили (MgSO4), фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде белого твердого вещества. Условия проведения ЖХ-МС 01: tR=0,75 мин; [М+Н]+=162,07.
Этиловый эфир (Е)-2-(1-фенилпроп-1-ен-2-ил)оксазол-4-карбоновой кислоты:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) суспензию (E)-2-метил-3-фенилакриламид (29,4 г, 0,18 моля) и NaHCO3 (68,7 г, 0,82 моля) в ТГФ (500 мл) обрабатывали этиловым эфиром 3-бром-2-оксопропионовой кислоты (35,6 мл, 0,24 моля) и реакционную смесь кипятили с обратным холодильником в течение 20 ч. Повторно добавляли этиловый эфир 3-бром-2-оксопропионовой кислоты (10,0 мл, 0,68 моля) и реакционную смесь перемешивали при кипячении с обратным холодильником в течение 10 ч. Затем реакционную смесь фильтровали через целит и растворители выпаривали при пониженном давлении. Остаток растворяли в ТГФ (500 мл) и при 0°С по каплям обрабатывали трифторуксусным ангидридом (78,0 мл, 0,55 моля). Затем реакционную смесь перемешивали при КТ в течение ночи. Добавляли насыщенный водный раствор Na2СО3 и смесь экстрагировали с помощью ЭА (4×), сушили над MgSO4, фильтровали и растворитель удаляли при пониженном давлении. Очистка остатка с помощью ФХ (0:1→1:9 ЭА-гептан) давала искомое соединение в виде коричневого масла. ТСХ: rf (1:9 ЭА-гептан)=0,13. Условия проведения ЖХ-МС 01: tR=1,02 мин; [М+Н]+=257,97.
Этиловый эфир 2-ацетилоксазол-4-карбоновой кислоты:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор NaIO4 (23 г, 108 ммоля) в воде (150 мл) при энергичном перемешивании медленно добавляли к суспензии силикагеля (110 г) в ацетоне (500 мл). Затем смесь концентрировали при пониженном давлении и комкообразное твердое вещество диспергировали в СН2Сl2 и растворитель выпаривали при пониженном давлении. СН2Сl2 (500 мл) добавляли и реакционную смесь при КТ обрабатывали этиловым эфиром (Е)-2-(1-фенилпроп-1-ен-2-ил)оксазол-4-карбоновой кислоты (8,3 г, 32 ммоля) и гидратом RuCl3 (1,1 г, 2 ммоля). Реакционную смесь перемешивали при КТ в темноте в течение 60 мин, фильтровали и концентрировали при пониженном давлении. Очистка остатка с помощью ФХ (от 1:0 до 1:5 петролейный эфир-Et2O) давала искомое соединение в виде бледно-желтого твердого вещества. ТСХ: rf (1:1 ЭА-гептан)=0,52. Условия проведения ЖХ-МС 01: tR=0,70 мин; [М+Н]+=183,99.
2-(2-Метил-[1,3]диоксолан-2-ил)-оксазол-4-карбоновой кислоты этиловый эфир:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор этилового эфира 2-ацетилоксазол-4-карбоновой кислоты (7,0 г, 38,0 ммоля) в этиленгликоле (42,7 мл) обрабатывали триметилортоформиатом (10,5 мл, 96,0 ммоля), затем с помощью LiBF4 (0,73 г, 8,0 ммоля). Реакционную смесь нагревали при 95°С до завершения реакции. Добавляли 0,5 М водный раствор Na2СО3 и смесь экстрагировали с помощью Et2O. Органический слой промывали 0,5 М водным раствором Na2СО3 (2×), сушили над Na2SO4, фильтровали и растворитель удаляли при пониженном давлении и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 01: tR=0,76 мин; [М+Н]+=227,99.
(2-(2-Метил-[1,3]диоксолан-2-ил)оксазол-4-ил)метанол: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к охлажденному льдом раствору этилового эфира 2-(2-метил-[1,3]диоксолан-2-ил)-оксазол-4-карбоновой кислоты (5,05 г, 22,2 ммоля) в сухом ТГФ (80 мл) добавляли охлажденный льдом раствор LiAlH4 (1,0 М в ТГФ, 24,7 мл, 24,7 ммоля). Реакционную смесь перемешивали при 0°С до завершения реакции. При 0°С осторожно добавляли воду (2,0 мл), затем 1 М водный раствор NaOH (2,0 мл) и воду (2,0 мл). Полученную суспензию перемешивали при КТ в течение 1 ч, фильтровали (+ЭА) и фильтрат концентрировали при пониженном давлении и получали искомое соединение в виде желтого масла. ТСХ: rf (ЭА)=0,18. Условия проведения ЖХ-МС 05 с: tR=0,22 мин; [М+Н]+=186,30.
(2-(2-Метил-[1,3]диоксолан-2-ил)оксазол-4-ил)метанамин: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор (2-(2-метил-[1,3]диоксолан-2-ил)оксазол-4-ил)метанола (235 мг, 1,27 ммоля) в сухом СН2Сl2 (10 мл) при 0°С обрабатывали с помощью Et3N (0,24 мл, 1,68 ммоля), затем с помощью ДМАП (16 мг, 0,13 ммоля) и Ms-Cl (0,13 мл, 1,65 ммоля). После перемешивания при 0°С в течение 1 ч реакцию останавливали водой (10 мл). Органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный (2-(2-метил-[1,3]диоксолан-2-ил)оксазол-4-ил)метилметансульфонат в виде коричневого масла. Неочищенное вещество растворяли в сухом ДМФ (6 мл) и обрабатывали с помощью NaN3 (93 мг, 1,41 ммоля) при 80°С до завершения реакции. Затем реакционную смесь охлаждали до КТ и подвергали распределению между ЭА и водой. Слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали неочищенный 4-(азидометил)-2-(2-метил-1,3-диоксолан-2-ил)оксазол в виде коричневого масла. К раствору неочищенного азида в ТГФ (6 мл) добавляли Ph3P на полимерной подложке (1,2 экв.) и воду (2 мл). Реакционную смесь перемешивали при 60°С до завершения реакции, охлаждали до КТ и фильтровали. Фильтрат подвергали распределению между ЭА и насыщенным водным раствором NaHCO3 и слои разделяли. Водный слой концентрировали при пониженном давлении, остаток растирали с EtOH и твердое вещество отфильтровывали. Фильтрат сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде оранжевого масла. Условия проведения ЖХ-МС 01: tR=0,31 мин; [М+Н]+=185,01.
(2-Бромтиазол-5 -ил)метанамин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор (2-бромтиазол-5-ил)-метанола (621 мг, 3,20 ммоля) в сухом СН2Сl2 (10 мл) при 0°С обрабатывали с помощью Et3N (0,60 мл, 4,23 ммоля), затем с помощью ДМАП (39 мг, 0,32 ммоля) и Ms-Cl (0,33 мл, 4,15 ммоля). После перемешивания при 0°С в течение 1 ч реакцию останавливали водой (10 мл). Органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный (2-бромтиазол-5-ил)метилметансульфонат в виде бесцветного масла. Неочищенное вещество растворяли в сухом ДМФ (15 мл) и обрабатывали с помощью NaN3 (223 мг, 3,40 ммоля) при 80°С до завершения реакции. Затем реакционную смесь охлаждали до КТ и подвергали распределению между ЭА и водой. Слои разделяли и органический слой промывали водой (2×), сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали неочищенный 5-(азидометил)-2-бромтиазол в виде желтого масла. К раствору неочищенного азида в ТГФ (12 мл) добавляли Ph3P на полимерной подложке (1,2 экв.) и воду (4 мл). Реакционную смесь перемешивали при 55°С до завершения реакции, охлаждали до КТ и фильтровали. Фильтрат подвергали распределению между ЭА и смесью 1 н. водный раствор NaOH/насыщенный водный раствор NaHCO3 и слои разделяли. Водный слой экстрагировали с помощью ЭА и объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в зиде желтого масла. Условия проведения ЖХ-МС 01: tR=0,16 мин; [M+CH3CN+H]+=233,91.
(E)-2-Стирилоксазол-4-карбоновой кислоты этиловый эфир:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) суспензию 3-фенил-акриламида (10,31 г, 67,95 ммоля) и NaHCO3 (28,47 г, 339,73 ммоля) в ТГФ (260 мл) обрабатывали этиловым эфиром 3-бром-2-оксопропионовой кислоты (13,04 мл, 88,33 ммоля) и реакционную смесь кипятили с обратным холодильником в течение 15 ч. Повторно добавляли этиловый эфир 3-бром-2-оксопропионовой кислоты (13,04 мл, 88,33 ммоля) и реакционную смесь перемешивали при кипячении с обратным холодильником в течение 15 ч. Затем реакционную смесь фильтровали через целит и растворители выпаривали при пониженном давлении. Остаток растворяли в ТГФ (30 мл) и при 0°С по каплям обрабатывали трифторуксусным ангидридом (30,0 мл, 215,83 ммоля). Затем реакционную смесь перемешивали при КТ в течение ночи. Добавляли насыщенный водный раствор Na2CO3 и смесь экстрагировали с помощью ЭА (3×150 мл), сушили над MgSO4, фильтровали и растворитель удаляли при пониженном давлении. Очистка остатка с помощью ФХ (1:9 ЭА-гептан) давала искомое соединение в виде желтого твердого вещества. ТСХ: rf (1:9 ЭА-гептан)=0,1. Условия проведения ЖХ-МС 02: tR=1,01 мин; [М+Н]+=244,48.
Этиловый эфир 2-формилоксазол-4-карбоновой кислоты:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор NaIO4 (3,21 г, 15,00 ммоля) в воде (26,0) мл при энергичном перемешивании медленно добавляли к суспензии силикагеля (15,0 г) в ацетоне (60,0 мл). Затем смесь концентрировали при пониженном давлении и комкообразное твердое вещество диспергировали в CH2Cl2 и растворитель выпаривали при пониженном давлении. Добавляли CH2Cl2 (40,0 мл) добавляли и реакционную смесь при КТ обрабатывали этиловым эфиром (E)-2-стирилоксазол-4-карбоновой кислоты (1,22 г, 5,00 ммоля) и гидратом RuCl3 (82 мг, 0,15 ммоля). Реакционную смесь перемешивали при КТ в темноте в течение 30 мин, фильтровали и концентрировали при пониженном давлении. Очистка остатка с помощью ФХ (от 1:9 до 1:2 ЭА-гептан) давала искомое соединение в виде желтого твердого вещества. ТСХ: rf (3:2 ЭА-гептан)=0,21. Условия проведения ЖХ-МС 02: tR=0,51 мин; [М+Н2O+Н]+=188,50.
Этиловый эфир 2-гидроксиметилоксазол-4-карбоновой кислоты: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) этиловый эфир 2-формилоксазол-4-карбоновой кислоты (272 мг, 1,61 ммоля) растворяли в EtOH (5,0 мл). При 0°С порциями добавляли NaBH4 (112 мг, 2,84 ммоля) и реакционную смесь перемешивали при 0°С в течение 1 ч. Добавляли насыщенный водный раствор NH4Cl и смесь экстрагировали с помощью ЭА (5×10 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и растворители удаляли при пониженном давлении и получали искомое соединение в виде желтого масла. ТСХ: rf (ЭА)=0,50. Условия проведения ЖХ-МС 02: tR=0,58 мин; [М+Н]+=172,03.
Этиловый эфир 2-(трет-бутилдиметилсиланилоксиметил)-оксазол-4-карбоновой кислоты:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) этиловый эфир 2-гидроксиметилоксазол-4-карбоновой кислоты (275 мг, 1,61 ммоля) растворяли в сухом СН2Сl2 (5,0 мл). При КТ добавляли трет-бутилдиметилсилилхлорид (510 мг, 3,22 ммоля), затем имидазол (221 мг, 3,22 ммоля). Реакционную смесь перемешивали при КТ в течение 30 мин. Добавляли воду, слои разделяли и органический слой сушили над Na2SO4, фильтровали и растворитель удаляли при пониженном давлении. Очистка остатка с помощью ФХ (от Г.20 до 1:9 ЭА-гептан) давала искомое соединение в виде бесцветного масла. ТСХ: rf (9:1 гептан-ЭА)=0,15. Условия проведения ЖХ-МС 02: tR=1,10 мин; [М+Н]+=286,38.
2-(трет-Бутилдиметилсиланилоксиметил)-оксазол-4-карбальдегид:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор этилового эфира 2-(трет-бутилдиметилсиланилоксиметил)-оксазол-4-карбоновой кислоты (283 мг, 0,99 ммоля) в CH2Cl2 (5,0 мл) обрабатывали при -78°С с помощью DiBAL (1,85 мл 1М раствора в толуоле, 1,85 ммоля) и реакционную смесь перемешивали в течение 1 ч при -78°С. Добавляли МеОН (70 мкл) и Н2O (100 мкл) и реакционной смеси давали нагреться до КТ. Реакционную смесь фильтровали и растворитель удаляли при пониженном давлении и получали искомое соединение в виде бесцветного масла. ТСХ: rf (1:1 гептан-ЭА)=0,61. Условия проведения ЖХ-МС 02: tR=1,03 мин; [М+Н2O+Н]+=260,50.
1-[2-(трет-Бутилдиметилсиланилоксиметил)-оксазол-4-ил]-этанол: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 2-(трет-бутилдиметилсиланилоксиметил)-оксазол-4-карбальдегида (223 мг, 0,92 ммоля) в CH2Cl2 (8,0 мл) при 0°С обрабатывали триметилалюминием (2,50 мл 2М раствора в толуоле, 5,00 ммоля). Затем реакционную смесь перемешивали при 0°С в течение 45 мин. Затем добавляли насыщенный водный раствор NH4Cl и водный слой дважды экстрагировали с помощью СН2Сl2 и дважды с помощью ЭА. Объединенные органические экстракты сушили над Na2SO4, фильтровали и растворители удаляли при пониженном давлении и получали искомое соединение в виде бесцветного масла. ТСХ: rf (1:1 гептан-ЭА)=0,32. Условия проведения ЖХ-МС 02: tR=0,97 мин, [М+Н]+=258,30.
1-[2-(трет-Бутилдиметилсиланилоксиметил)-оксазол-4-ил]-этанон: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 1-[2-(трет-бутилдиметилсиланилоксиметил)-оксазол-4-ил]-этанола (193 мг, 0,75 ммоля) в AcCN (5,0 мл) при КТ обрабатывали с помощью МnО2 (362 мг, 3,75 ммоля). Реакционную смесь перемешивали в течение 16 ч при КТ, затем фильтровали через целит. Растворитель удаляли при пониженном давлении и получали искомое соединение в виде белого твердого вещества. ТСХ: rf (1:1 гептан-ЭА)=0,69. Условия проведения ЖХ-МС 02: tR=1,04 мин, [М+Н]+=255,84.
2-{[(трет-Бутилдиметилсилил)окси]метил}-4-(2-метил-[1,3]диоксолан-2-ил)оксазол: 4
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 1-[2-(трет-бутилдиметилсиланилоксиметил)-оксазол-4-ил]-этанона (3,82 г, 14,96 ммоля) в этиленгликоле (16 мл) обрабатывали триметилортоформиатом (3,35 мл, 30,51 ммоля), затем с помощью LiBF4 (0,29 г, 2,99 ммоля). Реакционную смесь нагревали при 95°С до завершения реакции. Добавляли 0,5 М водный раствор Na2СО3 и смесь экстрагировали с помощью Et2О. Органический слой промывали 0,5 М водным раствором Na2СО3 (2×), сушили над Na2SO4, фильтровали и растворитель удаляли при пониженном давлении и получали искомое соединение в виде коричневого масла. Условия проведения ЖХ-МС 01: tR=1,03 мин; [М+Н]+=300,08.
(4-(2-Метил-[1,3]диоксолан-2-ил)-оксазол-2-ил)-метанол: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 2-{[(трет-бутилдиметилсилил)окси]метил}-4-(2-метил-[1,3]диоксолан-2-ил)оксазола (3,50 г, 11,69 ммоля) в сухом ТГФ (70 мл) при 0°С обрабатывали с помощью ТБАФ (15,2 мл 1 М раствора в ТГФ, 15,20 ммоля). Реакционную смесь перемешивали при 0°С в течение 1 ч. Добавляли насыщенный водный раствор NH4C1, слои разделяли и водный слой экстрагировали с помощью ЭА. Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Очистка остатка с помощью ФХ (от 2:3 до 1:0 ЭА гептан) давала искомое соединение в виде бледно-желтого масла. ТСХ: rf (ЭА) - 0,20. Условия проведения ЖХ-МС 01: tR=0,45 мин, [М+Н]+=186,00. (4-(2-Метил-[1,3]диоксолан-2-ил)-оксазол-2-ил)метанамин: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор (4-(2-метил-[1,3]диоксолан-2-ил)-оксазол-2-ил)-метанола (230 мг, 1,24 ммоля) в сухом CH2Cl2 (10 мл) при 0°С обрабатывали с помощью Et3N (0,23 мл, 1,64 ммоля), затем с помощью ДМАП (15 мг, 0,12 ммоля) и Ms-Cl (0,13 мл, 1,61 ммоля). После перемешивания при 0°С в течение 1 ч реакцию останавливали водой (10 мл). Органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный (4-(2-метил-[1,3]диоксолан-2-ил)оксазол-2-ил)метилметансульфонат в виде бесцветного масла. Неочищенное вещество растворяли в сухом ДМФ (6 мл) и обрабатывали с помощью NaN3 (93 мг, 1,41 ммоля) при 80°С до завершения реакции. Затем реакционную смесь охлаждали до КТ и подвергали распределению между ЭА и водой. Слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали неочищенный 2-(азидометил)-4-(2-метил-[1,3]диоксолан-2-ил)оксазол в виде бесцветного масла. К раствору неочищенного азида в ТГФ (9 мл) добавляли Ph3P на полимерной подложке (1,4 экв.) и воду (3 мл). Реакционную смесь перемешивали при 55°С до завершения реакции, охлаждали до КТ и фильтровали. Фильтрат подвергали распределению между ЭА и насыщенным водным раствором NaHCO3 и слои разделяли. Водный слой концентрировали при пониженном давлении, остаток растирали с EtOH и твердое вещество отфильтровывали. Фильтрат сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде оранжевого масла. Условия проведения ЖХ-МС 01: tR=0,22 мин; [М+Н]+=185,00.
4-Хлорметилтиазол-2-карбоновой кислоты этиловый эфир: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор этилового эфира аминотиооксоуксусной кислоты (7,29 г, 54,74 ммоля) в толуоле (58 мл) обрабатывали 1,3-дихлорацетоном (8,41 г, 62,95 ммоля). Полученную смесь перемешивали при кипячении с обратным холодильником в течение 2 ч.
Добавляли ЭА (60 мл) и органический слой промывали насыщенным водным раствором NaHCO3, рассолом, сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении. Очистка остатка с помощью ФХ (70:30 гептан-ЭА) давала искомое соединение в виде оранжевого масла. ТСХ: rf (4:1 гептан-ЭА)=0,26. Условия проведения ЖХ-МС 02: tR=0,89 мин; [М+Н]+=206,45. 1
(4-Хлорметилтиазол-2-ил)-метанол:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор этилового эфира 4-хлорметилтиазол-2-карбоновой кислоты (8,51 г, 41,38 ммоля) в ТГФ (413 мл) при -78°С обрабатывали с помощью DiBAL (124 мл 1М раствора в ТГФ, 124 ммоля) и реакционную смесь перемешивали в течение 1 ч при -78°С. Затем смесь давали нагреться до КТ и выливали в раствор сегнетовой соли. После перемешивания в течение 1 ч слои разделяли и водный слой экстрагировали с помощью ЭА. Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка с помощью ФХ (гептан-ЭА) давала искомое соединение в виде желтого масла. ТСХ: rf (1:1 гептан-ЭА)=0,29. Условия проведения ЖХ-МС 02: tR=0,59 мин; [М+Н]+=164,08.
(4-Хлорметилтиазол-2-ил)-карбальдегид:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор (4-хлорметилтиазол-2-ил)-метанола (4,20 г, 25,67 ммоля) в CH3CN (257 мл) при КТ обрабатывали с помощью МnО2 (18,60 г, 192,55 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции, и затем фильтровали через целит. Растворитель удаляли при пониженном давлении и после очистки с помощью ФХ (гептан-ЭА 4:1) получали искомое соединение в виде бледно-желтого масла. ТСХ: rf (4:1 гептан-ЭА)=0,37. Условия проведения ЖХ-МС 02: tR=0,77 мин, [М+Н2O+Н]+=180,56.
1-(4-Хлорметилтиазол-2-ил)-этанол:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор (4-хлорметилтиазол-2-ил)-карбальдегида (2,00 г, 12,37 ммоля) в СН2Сl2 (124 мл) при 0°С обрабатывали триметилалюминием (62 мл 1 М раствора в гептане, 62,00 ммоля). Затем реакционную смесь перемешивали при 0°С в течение 45 мин. Затем добавляли насыщенный водный раствор NH4C1 и 1 н. водный раствор НСl и водный слой дважды экстрагировали с помощью СН2Сl2. Объединенные органические экстракты сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 02: tR=0,66 мин, [М+Н]+=178,54. 1-(4-Хлорметилтиазол-2-ил)-этанон:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 1-(4-хлорметилтиазол-2-ил)-этанола (2,19 г, 12,31 ммоля) в CF3CN (122 мл) при КТ обрабатывали с помощью МпОг (5,94 г, 61,52 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции и затем фильтровали через целит. Растворитель удаляли при пониженном давлении и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 02: tR=0,84 мина.
(2-Ацетилтиазол-4-ил)-метанамин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 1-(4-хлорметилтиазол-2-ил)-этанона (1,08 г, 6,13 ммоля) в сухом ДМФ (21 мл) и обрабатывали с помощью NaN3 (1,20 г, 18,39 ммоля) при 65°С до завершения реакции. Затем реакционную смесь охлаждали до КТ и подвергали распределению между ЭА и водой. Слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали неочищенный 1-(4-(азидометил)-тиазол-2-ил)-этанон в виде желтого масла. К раствору неочищенного азида (200 мг, 1,10 ммоля) в ТГФ (6 мл) добавляли Ph3P на полимерной подложке (2,0 экв.) и воду (2 мл). Реакционную смесь перемешивали при 60°С до завершения реакции, охлаждали до КТ и фильтровали. Фильтрат подвергали распределению между ЭА и насыщенным водным раствором NaHCO3 и слои разделяли. Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и после очистки с помощью ФХ (CH2Cl2-MeOH-Et3N) получали искомое соединение в виде коричневого масла. Условия проведения ЖХ-МС 01: tR=0,26 мин; [М+Н]+=157,04.
2-(3-Бромфенил)-2-метил-[1,3]диоксолан:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 3-бромацетофенона (2,11 г, 10,60 ммоля) в этиленгликоле (12 мл) обрабатывали триметилортоформиатом (2,3 мл, 21,02 ммоля), затем с помощью LiBF4 (204 мг, 2,13 ммоля). Реакционную смесь нагревали при 95°С в течение 18 ч. Добавляли насыщенный водный раствор Na2СО3 и смесь дважды экстрагировали эфиром и объединенные органические экстракты сушили над Na2SO4, фильтровали и растворитель удаляли при пониженном давлении. Очистка остатка с помощью ФХ (20:1 гептан-ЭА) давала искомое соединение в виде бледно-желтого масла. ТСХ: rf (9:1 гептан-ЭА)=0,41. Условия проведения ЖХ-МС 02: tR=1,01 мина.
3-(2-Метил-[1,3]диоксолан-2-ил)-бензальдегид:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору 2-(3-бромфенил)-2-метил-[1,3]диоксолана (2,37 г, 9,74 ммоля) в ТГФ (20,0 мл) при -78°С по каплям добавляли n-BuLi (4 мл 2,5 М раствора в гексане, 10,00 ммоля). Затем реакционную смесь перемешивали в течение 30 мин при -78°С, затем по каплям добавляли ДМФ (1,0 мл, 12,92 ммоля). Реакционной смеси давали нагреваться до КТ в течение 1 ч. Добавляли насыщенный водный раствор NH4Cl и смесь трижды экстрагировали с помощью Et2О. Объединенные органические экстракты сушили над NaSO4, фильтровали и растворитель удаляли при пониженном давлении и получали неочищенное искомое соединение в виде бледно-желтого масла. Условия проведения ЖХ-МС 02: tR=0,87 мина.
[3-(2-Метил-[1,3]диоксолан-2-ил)-фенил]-метанол:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к охлажденному льдом раствору 3-(2-метил-[1,3]диоксолан-2-ил)-бензальдегида (1,84 г, 9,59 ммоля) в МеОН (20 мл) добавляли NaBH4 (456 мг, 12,05 ммоля, четырьмя порциями). Затем реакционную смесь перемешивали в течение 1 ч при 0°С. Добавляли воду и смесь дважды экстрагировали с помощью ЭА. Объединенные органические экстракты промывали рассолом, сушили над Na2SO4, фильтровали и растворитель удаляли при пониженном давлении и получали искомое соединение в виде бледно-желтого масла. ТСХ: rf (4:1 гептан-ЭА)=0,12. Условия проведения ЖХ-МС 02: tR=0,74 мина.
(3-(2-Метил-[1,3]диоксолан-2-ил)-фенил)метанамин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор [3-(2-метил-[1,3]диоксолан-2-ил)-фенил]-метанола (1,68 г, 8,65 ммоля) в сухом СН2Сl2 (20 мл) при 0°С обрабатывали с помощью Et3N (1,60 мл, 11,38 ммоля), затем с помощью ДМАП (109 мг, 0,88 ммоля) и Ms-Cl (0,80 мл, 10,13 ммоля). После перемешивания при 0°С в течение 0,5 ч реакцию останавливали водой (10 мл). Органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА от 9:1 до 0:1) и получали чистый (3-(2-метил-[1,3]диоксолан-2-ил)-фенил)метилметансульфонат в виде белого твердого вещества. Часть этого вещества (300 мг, 1,10 ммоля) растворяли в сухом ДМФ (5 мл) и обрабатывали с помощью NaN3 (220 мг, 3,35 ммоля) при 80°С до завершения реакции. Затем реакционную смесь охлаждали до КТ и подвергали распределению между ЭА и водой. Слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали неочищенный 3-(азидометил)-(2-метил-[1,3]диоксолан-2-ил)-бензол в виде желтого масла. Условия проведения ЖХ-МС 02: tR=0,99 мина.
Смесь неочищенного азида (194 мг, 0,88 ммоля) в МеОН (5 мл) гидрировали в присутствии Pd/C (10%) при КТ до завершения реакции. Реакционную смесь фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде бледно-желтого твердого вещества. Условия проведения ЖХ-МС 02: tR=0,59 мин; [М+Н]+=194,64. (4-Бром-2,6-дифторфенил)-метанамин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 4-бром-2,6-дифторбензилового спирта (1,00 г, 4,48 ммоля) в сухом СН2Сl2 (20 мл) при 0°С обрабатывали с помощью Et3N (0,81 мл, 5,79 ммоля), затем с помощью ДМАП (55 мг, 0,45 ммоля) и Ms-Cl (0,37 мл, 4,71 ммоля). После перемешивания при 0°С в течение 0,5 ч и при КТ в течение 1 ч реакцию останавливали водой (10 мл). Органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный (4-бром-2,6-дифторфенил)метилметансульфонат в виде желтого масла. Это вещество растворяли в сухом ДМФ (6 мл) и обрабатывали с помощью NaN3 (93 мг, 1,41 ммоля) при 80°С до завершения реакции. Затем реакционную смесь охлаждали до КТ и подвергали распределению между ЭА и водой. Слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали неочищенный 1-(азидометил)-4-бром-2,6-дифторбензол в виде желтого масла. Условия проведения ЖХ-МС 01: tR=1,00 мина.
К смеси неочищенного азида (330 мг, 1,33 ммоля) в ТГФ (12 мл) добавляли Ph3P на полимерной подложке (2,0 экв.) и воду (2 мл). Реакционную смесь перемешивали при 55°С до завершения реакции, охлаждали до КТ и фильтровали. Фильтрат подвергали распределению между ЭА и насыщенным водным раствором NaHCO3 и слои разделяли. Водный слой экстрагировали с помощью ЭА и объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого твердого вещества. Условия проведения ЖХ-МС 02: tR=0,54 мин; [M+CH3CN+H]+=263,45.
4-Бром-3-фторбензиламин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 4-бром-3-фторбензойной кислоты (250 мг, 1,14 ммоля) в сухом ТГФ (5 мл) при 0°С обрабатывали с помощью Et3N (0,16 мл, 1,14 ммоля) и этилхлорформиатом (0,11 мл, 1,14 ммоля). Реакционную смесь перемешивали при 0°С в течение 15 мин, затем добавляли водный раствор NH3 (3 мл). Реакционную смесь энергично перемешивали при 0°С в течение 30 мин и при КТ в течение 2 ч и затем концентрировали при пониженном давлении. Остаток подвергали распределению между водой и СН2Сl2, слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (2×). Объединенные органические экстракты сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (ЭА-МеОН от 1:0 до 10:1) и соответствующий карбоксамид получали в виде белого твердого вещества. ТСХ: rf (9:1 ЭА-МеОН)=0,40. Условия проведения ЖХ-МС 01: tR=0,73 мин; [М+Н]=217,83.
Часть этого вещества (150 мг, 0,69 ммоля) растворяли в сухом ТГФ (5 мл) и при 0°С обрабатывали комплексом BH3.Me2S (1,0 М в ТГФ, 1,6 мл, 1,60 ммоля). Затем реакционную смесь нагревали при 50°С и перемешивали при этой температуре до завершения реакции. Смесь охлаждали до 0°С и добавляли воду, затем ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде белого твердого вещества. Условия проведения ЖХ-МС 07: tR=0,33 мин; [M+CH3CN+H]+=245,12.
1,4-Дибром-2,3-дифторбензол:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору диизопропиламида лития (11,25 ммоля) в сухом ТГФ (8 мл) при -78°С добавляли смесь 1,3-дифторбензола (600 мг, 5,26 ммоля) и Me3SiCl (1,48 мл, 11,57 ммоля). После перемешивания при -78°С в течение 75 мин реакцию останавливали путем добавления 1М водного раствора H2SO4. Смесь нагревали при КТ, разбавляли с помощью ТБМЭ и насыщали твердым NaCl. Слои разделяли и водный слой экстрагировали с помощью ТБМЭ. Объединенные органические экстракты сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный (2,3-дифтор-1,4-фенилен)-бис(триметилсилан) в виде белого твердого вещества. Это вещество (1,33 г, 5,15 ммоля) при 0°С обрабатывали бромом (1,06 мл, 20,58 ммоля). Затем реакционную смесь нагревали при 58°С и перемешивали при этой температуре до завершения реакции. Затем реакционную смесь охлаждали до 0°С и осторожно добавляли охлажденный льдом насыщенный раствор NaHCO3. Затем смесь экстрагировали с помощью ТБМЭ (2×) и объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и после перегонки получали 1,4-дибром-2,3-дифторбензол в виде бесцветного масла (0,05 мбар, 90°С). Условия проведения ЖХ-МС 07: tR=0,93 мина.
4-Бром-2,3-дифторбензиловый спирт:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 1,4-дибром-2,3-дифторбензола (490 мг, 1,80 ммоля) в сухом Et2О (6 мл) при -78°С добавляли к n-BuLi (0,72 мл 2,5 М раствора в гексанах, 1,80 ммоля). Реакционную смесь перемешивали при -78°С в течение 2 ч, затем добавляли твердый СО2. Реакционную смесь перемешивали при -78°С в течение 10 мин и затем ей давали нагреться до КТ. Затем смесь разбавляли с помощью ЭА и добавляли 1 н. водный раствор НСl. Слои разделяли и органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенную карбоновую кислоту в виде бледно-желтого твердого вещества. Неочищенное вещество (360 мг, 1,52 ммоля) растворяли в сухом ТГФ (7 мл) и при 0°С обрабатывали комплексом BH3.Me2S (1,0 М в ТГФ, 3,0 мл, 3,00 ммоля). Затем реакционную смесь нагревали при 50°С и перемешивали при этой температуре до завершения реакции. Смесь охлаждали до 0°С и добавляли воду, затем ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА от 9:1 до 2:1) и получали искомое соединение в виде бесцветного масла. ТСХ: rf (1:1 ЭА-гептан)=0,50.
4-Бром-2,3-дифторбензиламин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 4-бром-2,3-дифторбензилового спирта (175 мг, 0,70 ммоля) в сухом СН2Сl2 (2 мл) при 0°С обрабатывали с помощью Et3N (0,14 мл, 1,01 ммоля), затем с помощью ДМАП (10 мг, 0,08 ммоля) и Ms-Cl (0,06 мл, 0,82 ммоля). После перемешивания при 0°С в течение 0,5 ч и при КТ в течение 1 ч реакцию останавливали водой (2 мл). Органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный (4-бром-2,3-дифторфенил)метилметансульфонат в виде желтого масла. Это вещество растворяли в сухом ДМФ (3 мл) и обрабатывали с помощью NaN3 (46 мг, 0,71 ммоля) при 80°С до завершения реакции. Затем реакционную смесь охлаждали до КТ и подвергали распределению между ЭА и водой. Слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали неочищенный 1-(азидометил)-4-бром-2,3-дифторбензол в виде бесцветного масла. Условия проведения ЖХ-МС 07: tR=0,89 мина.
К смеси неочищенного азида (164 мг, 0,60 ммоля) в ТГФ (3 мл) добавляли Ph3P на полимерной подложке (2,0 экв.) и воду (1 мл). Реакционную смесь перемешивали при 55°С до завершения реакции, охлаждали до КТ и фильтровали. Фильтрат подвергали распределению между ЭА и насыщенным водным раствором NaHCO3 и слои разделяли. Водный слой экстрагировали с помощью ЭА и объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 07: tR=0,42 мин; [M+CH3CN+H]+=263,15.
4-Бром-3,5-дифторбензиловый спирт:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 4-бром-3,5-дифторйодбензола (790 мг, 2,48 ммоля) в сухом Et2O (12 мл) при -78°С добавляли к n-BuLi (0,98 мл 2,5 М раствора в гексанах, 2,45 ммоля). Реакционную смесь перемешивали при -78°С в течение 2 ч, затем добавляли твердый СO2. Реакционную смесь перемешивали при -78°С в течение 10 мин и затем давали нагреться до КТ. Затем смесь разбавляли с помощью ЭА и добавляли 1 н. водный раствор НСl. Слои разделяли и органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенную карбоновую кислоту в виде бледно-желтого твердого вещества. Неочищенное вещество (270 мг, 1,14 ммоля) растворяли в сухом ТГФ (6 мл) и при 0°С обрабатывали комплексом BH3.Me2S (1,0 М в ТГФ, 2,3 мл, 2,30 ммоля). Затем реакционную смесь нагревали до 50°С и перемешивали при этой температуре до завершения реакции. Смесь охлаждали до 0°С и добавляли воду, затем ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА от 9:1 до 2:1) и получали искомое соединение в виде белого твердого вещества. ТСХ: rf (1:1 ЭА-гептан)=0,53.
4-Бром-3,5-дифторбензиламин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 4-бром-3,5-дифторбензилового спирта (100 мг, 0,45 ммоля) в сухом CH2Cl2 (3 мл) при 0°С обрабатывали с помощью Et3N (0,081 мл, 0,58 ммоля), затем с помощью ДМАП (5 мг, 0,045 ммоля) и Ms-Cl (0,037 мл, 0,47 ммоля). После перемешивания при 0°С в течение 0,5 ч и при КТ в течение 0,5 ч реакцию останавливали водой (2 мл). Органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный (4-бром-3,5-дифторфенил)метилметансульфонат в виде желтого масла. Это вещество растворяли в сухом ДМФ (3 мл) и обрабатывали с помощью NaN3 (29 мг, 0,45 ммоля) при 80°С до завершения реакции. Затем реакционную смесь охлаждали до КТ и подвергали распределению между ЭА и водой. Слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали неочищенный 1-(азидометил)-4-бром-3,5-дифторбензол в виде желтого масла. Условия проведения ЖХ-МС 07: tR=0,90 мина.
К смеси неочищенного азида (70 мг, 0,28 ммоля) в ТГФ (4 мл) добавляли Ph3P на полимерной подложке (3,0 экв.) и воду (1 мл). Реакционную смесь перемешивали при 55°С до завершения реакции, охлаждали до КТ и фильтровали. Фильтрат подвергали распределению между ЭА и насыщенным водным раствором NaHCO3 и слои разделяли. Водный слой экстрагировали с помощью ЭА и объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 07: tR=0,37 мин; [M+CH3CN+H]+=263,15.
4-Бром-2,5-дифторбензиловый спирт:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 1,4-дибром-2,5-дифторбензола (600 мг, 2,21 ммоля) в сухом Et2O (8 мл) при -78°С добавляли к n-BuLi (0,88 мл 2,5 М раствора в гексанах, 2,20 ммоля). Реакционную смесь перемешивали при -78°С в течение 2 ч, затем добавляли твердый СО2. Реакционную смесь перемешивали при -78°С в течение 10 мин и затем давали нагреться до КТ. Затем смесь разбавляли с помощью ЭА и добавляли 1 н. водный раствор НСl. Слои разделяли и органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенную карбоновую кислоту в виде бледно-желтого твердого вещества. Неочищенное вещество (530 мг, 2,24 ммоля) растворяли в сухом ТГФ (20 мл) и при 0°С обрабатывали комплексом BH3.Me2S (1,0 М в ТГФ, 4,5 мл, 4,50 ммоля). Затем реакционную смесь нагревали до 50°С и перемешивали при этой температуре до завершения реакции. Смесь охлаждали до 0°С и добавляли воду, затем ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА от 3:1 до 1:1) и получали искомое соединение в виде белого твердого вещества. ТСХ: rf (1:1 ЭА-гептан)=0,53.
4-Бром-2,5-дифторбензиламин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 4-бром-2,5-дифторбензилового спирта (160 мг, 0,72 ммоля) в сухом CH2Cl2 (4 мл) при 0°С обрабатывали с помощью Et3N (0,13 мл, 0,93 ммоля), затем с помощью ДМАП (9 мг, 0,07 ммоля) и Ms-Cl (0,06 мл, 0,75 ммоля). После перемешивания при 0°С в течение 0,5 ч и при КТ в течение 1 ч реакцию останавливали водой (3 мл). Органический слой сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный (4-бром-2,5-дифторфенил)метилметансульфонат в виде желтого масла. Это вещество растворяли в сухом ДМФ (3 мл) и обрабатывали с помощью NaN3 (51 мг, 0,78 ммоля) при 80°С до завершения реакции. Затем реакционную смесь охлаждали до КТ и подвергали распределению между ЭА и водой. Слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали неочищенный 1-(азидометил)-4-бром-2,5-дифторбензол в виде желтого масла. Условия проведения ЖХ-МС 07: tR=0,89 мина.
К смеси неочищенного азида (110 мг, 0,44 ммоля) в ТГФ (3 мл) добавляли Ph3P на полимерной подложке (3,0 экв.) и воду (1,5 мл). Реакционную смесь перемешивали при 55°С до завершения реакции, охлаждали до КТ и фильтровали. Фильтрат подвергали распределению между ЭА и насыщенным водным раствором NaHCO3 и слои разделяли. Водный слой экстрагировали с помощью ЭА и объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 07: tR=0,40 мин; [M+CH3CN+H]+=263,14.
5-Амино-2-бром-3-фторпиридин: 1
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор 3-амино-5-фторпиридина (900 мг, 8,03 ммоля) в сухом ДМФ (13 мл) при 0°С обрабатывали N-бромсукцинимидом (1,43 г, 8,03 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь подвергали распределению между Et2O и водой. Слои разделяли и органический слой последовательно промывали водой, насыщенным водным раствором NaHCO3 и рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА от 9:1 до 1:1) и получали искомое соединение в виде оранжевого твердого вещества. Условия проведения ЖХ-МС 07: tR=0,52 мин; [М+Н]+=191,30.
4-(Азетидин-1-ил)бутан-1-амин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору триметиленимина (300 мг, 5,25 ммоля) и DBU (0,79 мл, 5,23 ммоля) в сухом Et2O (4 мл) при 0°С добавляли 4-бромбутиронитрил (0,54 мл, 5,27 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Смесь фильтровали и концентрировали при пониженном давлении. Неочищенный нитрил повторно растворяли в сухом ТГФ (4 мл) и при 0°С обрабатывали с помощью LiALH4 (230 мг, 6,06 ммоля). Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. Затем добавляли 1 н. водный раствор NaOH (2 мл), слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над Na2SO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный 4-(азетидин-1-ил)бутан-1-амин в виде бледно-желтого масла. Условия проведения ГХ-МС 01: tR=1,35 мин; [М+Н]+=129,00. 2-(2-(Пирролидин-1-ил)этокси)этанамингидрохлорида: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору 2-(2-аминоэтокси)этанола (536 мг, 5,00 ммоля) в ТГФ (3 мл) при 0°С добавляли 2М водный раствор NaOH (2,6 мл, 5,20 ммоля). Реакционную смесь перемешивали при 0°С в течение 10 мин и затем по каплям добавляли раствор ди-трет-бутилдикарбоната (1,16 г, 5,20 ммоля) в ТГФ (3 мл). Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. Смесь разбавляли с помощью CH2Cl2, фильтровали и слои разделяли. Органический слой сушили над Na2SO4, фильтровали и растворители удаляли при пониженном давлении. Неочищенный спирт повторно растворяли в сухом CH2Cl2 (20 мл) и обрабатывали трифенилфосфином на полистироле (5,63 ммоля) и имидазолом (190 мг, 2,76 ммоля). К этой смеси, охлажденной до 0°С, добавляли йод (808 мг, 3,15 ммоля). Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. Затем смесь фильтровали, CH2Cl2 удаляли при пониженном давлении. Остаток повторно растворяли в ЭА, последовательно промывали 10% водным раствором Na2SO3 и рассолом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный йодид повторно растворяли в CH3CN (15 мл) и обрабатывали пирролидином (0,17 мл, 1,99 ммоля) и К2СO3 (465 мг, 3,36 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции, фильтровали и концентрировали при пониженном давлении. Амин очищали с помощью ФХ (гептан-ЭА-ацетон, 1:0:0→0:0:1) и затем группу Вое удаляли путем обработки с помощью НСl (4,0 М в диоксане, 10 экв.) в сухом СН2Сl2 (3 мл). После растирания с горячей смесью ЭА/ацетон/МеОН получали искомое соединение в виде бежевого твердого вещества. Условия проведения ЖХ-МС 01: tR=0,13 мин; [М+Н]+=159,11.
(3R,6S)-6-(Пирролидин-1-илметил)тетрагидро-2H-пиран-3-амингидрохлорида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к охлажденному льдом раствору трет-бутилового эфира (3R,6S)-6-гидроксиметилтетрагидро-2H-пиран-3-илкарбаминовой кислоты (328 мг, 1,40 ммоля, Н.S.Overkleeft et al Eur. J. Org. Chem. 2003, 2418), трифенилфосфина на полистироле (6,16 ммоля) и имидазола (203 мг, 2,95 ммоля) в сухом СН2Сl2 (14 мл) добавляли йод (891 мг, 3,48 ммоля). Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. Затем смесь фильтровали, CH2Cl2 удаляли при пониженном давлении. Остаток повторно растворяли в ЭА, последовательно промывали 10% водным раствором Na2SO3 и рассолом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. После очистки с помощью ФХ йодид повторно растворяли в CH3CN (15 мл) и обрабатывали пирролидином (1,13 мл, 13,57 ммоля) и К2СО3 (750 мг, 5,43 ммоля). Реакционную смесь перемешивали при 85°С до завершения реакции, фильтровали и концентрировали при пониженном давлении. Амин очищали с помощью ФХ (гептан-ЭА-ацетон, 1:0:0→0:0:1) и затем группу Вос удаляли путем обработки с помощью НСl (4,0 М в диоксане, 9 экв.) в сухом CH2Cl2 (2 мл). После растирания с горячей смесью ЭА/ацетон/МеОН получали искомое соединение в виде почти белого твердого вещества. Условия проведения ЖХ-МС 01: tR=0,15 мин; [М+Н]+=185,06.
1-(4-(4-Аминобутил)пиперазин-1-ил)этанон:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору 1-ацетилпиперазина (256 мг, 2,00 ммоля) и DBU (0,30 мл, 2,00 ммоля) в сухом Et2O (2 мл) при 0°С добавляли 4-бромбутиронитрил (0,21 мл, 2,00 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Смесь фильтровали и концентрировали при пониженном давлении. Раствор неочищенного нитрила в EtOH (10 мл) концентрации 0,087 моль/л гидрировали при 50°С с использованием H-Cube® (1 мл/мин) и картриджа с никелем Ренея (30 мм) при давлении 50 бар до завершения реакции. Затем раствор концентрировали при пониженном давлении и получали неочищенный 1-(4-(4-аминобутил)пиперазин-1-ил)этанон в виде бесцветного масла. Условия проведения ГХ-МС 01: tR=2,94 мин; [М+Н]+=200,40.
цис-4-Бензилоксикарбониламиноциклогексанметанол: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору цис-4-бензилоксикарбониламиноциклогексанкарбоновой кислоты (417 мг, 1,50 ммоля) в ТГФ (15 мл) при 0°С добавляли комплекс BH3.Me2S (2,0 М в ТГФ, 1,5 мл, 3,00 ммоля). Реакционную смесь перемешивали при 0°С в течение 1 ч 30 мин. Дополнительно добавляли комплекс BH3.Me2S (2,0 М в ТГФ, 1,0 мл, 2,00 ммоля) при 0°С, затем NaBH4 (12 мг, 0,30 ммоля). Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. Для остановки реакции осторожно добавляли МеОН, летучие вещества удаляли при пониженном давлении и остаток выпаривали вместе с МеОН (2×). Очистка с помощью ФХ (гептан-ЭА, 1:0→3:2) давала чистый цис-4-бензилоксикарбониламиноциклогексанметанол в виде бесцветного масла. ТСХ: rf (1:2 гептан-ЭА)=0,45. Условия проведения ЖХ-МС 01: tR=0,82 мин; [М+Н]+=264,07.
цис-4-(Пирролидин-1-илметил)циклогексиламин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к охлажденному льдом раствору цис-4-бензилоксикарбониламиноциклогексанметанола (267 мг, 1,01 ммоля), трифенилфосфина на полистироле (3,20 ммоля) и имидазола (97 мг, 1,42 ммоля) в сухом СН2Сl2 (40 мл) добавляли йод (416 мг, 1,62 ммоля). Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. Затем смесь фильтровали, последовательно промывали 10% водным раствором Na2SO3 и рассолом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный йодид повторно растворяли в CH3CN (15 мл) и обрабатывали пирролидином (0,32 мл, 3,86 ммоля) и К2СO3 (533 мг, 3,86 ммоля). Реакционную смесь кипятили с обратным холодильником до завершения реакции, фильтровали и концентрировали при пониженном давлении. Амин очищали с помощью ФХ (гептан-ЭА, 1:0→1:1) и затем группу Cbz удаляли путем обработки с помощью 10% Pd/C (116 мг) в EtOH (20 мл) в атмосфере Н2. Искомое соединение получали в виде белого твердого вещества. Условия проведения ЖХ-МС 04: tR=0,99 мин; [М+Н]+=183,35.
транс-4-Бензилоксикарбониламиноциклогексанметанол: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору транс-4-бензилоксикарбониламиноциклогексанкарбоновой кислоты (417 мг, 1,50 ммоля) в ТГФ (15 мл) при 0°С добавляли комплекс BH3.Me2S (2,0 М в ТГФ, 1,5 мл, 3,00 ммоля). Реакционную смесь перемешивали при 0°С в течение 1 ч 30 мин. Дополнительно добавляли комплекс BH3.Me2S (2,0 М в ТГФ, 1,0 мл, 2,00 ммоля) при 0°С, затем NaBH4 (12 мг, 0,30 ммоля). Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. МеОН осторожно добавляли для остановки реакции, летучие вещества удаляли при пониженном давлении и остаток выпаривали вместе с МеОН (2×). Очистка с помощью ФХ (гептан-ЭА, 1:0 →3:2) давала чистый транс-4-
бензилоксикарбониламиноциклогексанметанол в виде белого твердого вещества. ТСХ: rf (1:2 гептан-ЭА)=0,35. Условия проведения ЖХ-МС 01: tR=0,82 мин; [М+Н]+=264,05.
транс-4-(Пирролидин-1-илметил)циклогексиламин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к охлажденному льдом раствору транс-4-бензилоксикарбониламиноциклогексанметанола (292 мг, 1,11 ммоля), трифенилфосфина на полистироле (3,52 ммоля) и имидазола (107 мг, 1,55 ммоля) в сухом СН2Сl2 (40 мл) добавляли йод (455 мг, 1,77 ммоля). Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. Затем смесь фильтровали, последовательно промывали 10% водным раствором Na2SO3 и рассолом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный йодид повторно растворяли в CH3CN (15 мл) и обрабатывали пирролидином (0,34 мл, 4,09 ммоля) и К2СO3 (566 мг, 4,09 ммоля). Реакционную смесь кипятили с обратным холодильником до завершения реакции, фильтровали и концентрировали при пониженном давлении. Амин очищали с помощью ФХ (гептан-ЭА, 1:0 →1:1) и затем группу Cbz удаляли путем обработки с помощью 10% Pd/C (147 мг) в МеОН (10 мл) в атмосфере Н2. Искомое соединение получали в виде бесцветного масла. Условия проведения ЖХ-МС 07d: tR=0,97 мин; [М+Н]+=183,37.
(R)-4-(3-Фторпирролидин-1-ил)бутан-1-амин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (R)-3-фторпирролидингидрохлорида (400 мг, 3,09 ммоля) и 4-бромбутиронитрила (0,32 мл, 3,09 ммоля) в сухом CH3CN (16 мл) при КТ добавляли К2СO3 (2,35 г, 16,99 ммоля), затем KI (51 мг, 0,31 ммоля). Реакционную смесь перемешивали при КТ в течение 15 ч. Смесь фильтровали и фильтрат подвергали распределению между водой и СН2Сl2. Слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный нитрил повторно растворяли в сухом ТГФ (23 мл) и обрабатывали при 0°С с помощью LiALH4 (214 мг, 5,47 ммоля). Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. Затем добавляли 1 н. водный раствор NaOH (7 мл), слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над Na2SO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный (R)-4-(3-фторпирролидин-1-ил)бутан-1-амин в виде бесцветного масла. Условия проведения ГХ-МС 01: tR=1,71 мин; [М+Н]+=161,10.
(S)-4-(3-Фторпирролидин-1 -ил)бутан-1-амин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (S)-3-фторпирролидингидрохлорида (200 мг, 1,54 ммоля) и 4-бромбутиронитрила (0,16 мл, 1,54 ммоля) в сухом CH3CN (8 мл) при КТ добавляли К2СO3 (1,17 г, 8,50 ммоля), затем KI (26 мг, 0,15 ммоля). Реакционную смесь перемешивали при КТ в течение 15 ч. Смесь фильтровали и фильтрат подвергали распределению между водой и СН2Сl2. Слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный нитрил повторно растворяли в сухом ТГФ (10 мл) и обрабатывали с помощью LiALH4 (92 мг, 2,35 ммоля) при 0°С. Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. Затем добавляли 1 н. водный раствор NaOH (3 мл), слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над Na2SO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный (S)-4-(3-фторпирролидин-1-ил)бутан-1-амин в виде желтого масла. Условия проведения ГХ-МС 01: tR=1,70 мин; [М+Н]+=161,10.
5-(Пирролидин-1-ил)пентан-1-амин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) смесь 5-бромвалеронитрила (0,21 мл, 1,80 ммоля), пирролидина (0,15 мл, 1,81 ммоля), К2СP3 (498 мг, 3,60 ммоля) и KI (60 мг, 0,36 ммоля) в сухом CH3CN (15 мл) кипятили с обратным холодильником в течение 1 ч. Смесь фильтровали и концентрировали при пониженном давлении. Раствор неочищенного нитрила (59 мг, 0,39 ммоля) в EtOH (8 мл) концентрации 0,05 моль/л гидрировали при КТ с использованием Н-Cube® (1 мл/мин) и картриджа с никелем Ренея (30 мм) при давлении 50 бар до завершения реакции. Затем раствор концентрировали при пониженном давлении и получали неочищенный 5-(пирролидин-1-ил)пентан-1-амин в виде бесцветного масла. Условия проведения ЖХ-МС 01: tR=0,16 мин; [М+Н]+=157,19.
4-(2,5-Диметилпирролидин-1-ил)бутан-1-амин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору 2,5-диметилпирролидина (250 мг, 2,34 ммоля) и 4-бромбутиронитрила (0,24 мл, 2,34 ммоля) в сухом CH3CN (12 мл) при КТ добавляли К2СO3 (1,78 г, 12,89 ммоля), затем KI (39 мг, 0,23 ммоля). Реакционную смесь перемешивали при КТ в течение 15 ч. Смесь фильтровали и фильтрат подвергали распределению между водой и СН2Сl2. Слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный нитрил повторно растворяли в сухом ТГФ (19 мл) и при 0°С обрабатывали с помощью LiALH4 (176 мг, 4,50 ммоля). Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. Затем добавляли 1 н. водный раствор NaOH (7 мл), слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный 4-(2,5-диметилпирролидин-1-ил)бутан-1-амин в виде желтого масла. Условия проведения ГХ-МС 01: tR=1,75 и 1,83 мин; [М+Н]+=171,30.
трет-Бутил-(4-оксопентил)карбамат:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору 4-(трет-бутоксикарбониламино)масляной кислоты (1,00 г, 4,77 ммоля) в сухом CH3CN (24 мл) при КТ добавляли N,O-диметилгидроксиламингидрохлорид (475 мг, 4,77 ммоля), ЭДХ.НСl (934 мг, 4,77 ммоля), HOBt (658 мг, 4,77 ммоля) и N-метилморфолин (2,68 мл, 23,86 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь концентрировали при пониженном давлении. Остаток повторно растворяли в ЭА, последовательно промывали водой, 10% водным раствором KHSO4, насыщенным водным раствором NaHCO3 и рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенное вещество растворяли в сухом ТГФ (20 мл) и при 0°С обрабатывали с помощью MeMgBr (3,0М раствор в Et2O, 3,25 мл, 9,75 ммоля). Реакционную смесь перемешивали при 0°С до завершения реакции. Затем осторожно добавляли 10% водный раствор KHSO4, слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты последовательно промывали насыщенным водным раствором NaHCO3 и рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА 3:2) и получали искомое соединение в виде бесцветного масла. ТСХ: rf (3:2 гептан-ЭА)=0,38.
4-(Пирролидин-1-ил)пентан-1-амингидрохлорида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору пирролидина (79 мг, 1,11 ммоля) в сухом CH3CN (6 мл) при КТ добавляли трет-бутил-(4-оксопентил)карбамат (291 мг, 1,44 ммоля), затем Na(OAc)3BH (680 мг, 2,88 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем добавляли насыщенный водный раствор NaHCO3 и смесь экстрагировали с помощью ЭА (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (CH2Cl2-MeOH-NH3) и получали чистый N-трет-бутоксикарбонил-4-(пирролидин-1-ил)пентан-1-амин в виде бесцветного масла. Условия проведения ЖХ-МС 05 с: tR=0,53 мин; [М+Н]+=257,41. После удаления защитной группы Вос с использованием 4 н. НСl в диоксане (10,0 экв.) в СН2Сl2 при КТ получали искомое соединение в виде бесцветного масла. трет-Бутил-(2-(оксиран-2-ил)этил)карбамат:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору 4-амино-1-бутена (2,00 г, 25,31 ммоля) в сухом СН2Сl2 (100 мл) при 0°С добавляли ди-трет-бутилдикарбонат (8,45 г, 37,96 ммоля) и ДИПЭА (8,66 мл, 50,62 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты промывали насыщенным водным раствором NaHCO3, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ(гептан-ЭА) и 4-(N-трет-бутоксикарбониламино)-1-бутен получали в виде бесцветного масла, которое повторно растворяли в сухом СН2Сl2 (175 мл) и при КТ обрабатывали м-хлорпербензойной кислотой (1,4 экв.). Реакционную смесь перемешивали при КТ до завершения реакции. Затем добавляли 1 н. водный раствор NaOH, слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА 3:2) и получали искомое соединение в виде бесцветного масла. ТСХ: rf (3:2 гептан-ЭА)=0,33.
3-Фтор-4-(пирролидин-1-ил)бутан-1 -амингидрохлорида: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор трет-бутил-(2-(оксиран-2-ил)этил)карбамата (1,50 г, 8,01 ммоля) в пирролидине (2 мл) нагревали при 85°С до завершения реакции. Реакционную смесь выпаривали досуха и получали желтое масло. Часть этого неочищенного вещества (300 мг, 1,16 ммоля) растворяли в сухом СН2Сl2 (34 мл) и при 0°С обрабатывали (диэтиламино)трифторидом серы (0,18 мл, 1,37 ммоля). Реакционную смесь перемешивали при 0°С до завершения реакции. Затем добавляли насыщенный водный раствор NaHCO3, слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Затем неочищенный остаток повторно растворяли в сухом CH2Cl2 (1 мл) и обрабатывали при КТ с помощью 4 н. НСl в диоксане (1 мл). Реакционную смесь перемешивали при КТ до завершения реакции, и растворители удаляли при пониженном давлении и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 07b: tR=0,14 мин; [М+Н]+=161,18.
4-(2-(Метоксиметил)пирролидин-1-ил)бутан-1-амин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору 2-(метоксиметил)пирролидина (300 мг, 2,61 ммоля) и 4-бромбутиронитрила (0,31 мл, 2,99 ммоля) в сухом CH3CN (13 мл) при КТ добавляли К2СО3 (1,51 г, 10,94 ммоля), затем KI (43 мг, 0,26 ммоля). Реакционную смесь перемешивали при КТ в течение 15 ч. Смесь фильтровали и фильтрат подвергали распределению между водой и CH2Cl2. Слои разделяли и водный слой экстрагировали с помощью CH2Cl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный нитрил повторно растворяли в сухом ТГФ (21 мл) и обрабатывали при 0°С с помощью LiALH4 (192 мг, 5,07 ммоля). Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. Затем добавляли насыщенный водный раствор сегнетовой соли и ЭА, слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный 4-(2-(метоксиметил)пирролидин-1-ил)бутан-1-амин в виде бледно-желтого масла. Условия проведения ГХ-МС 01: tR=2,1 мин; [М+Н]+=187,20.
4-(3,3-Дифторпирролидин-1-ил)бутан-1-амин:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору 3,3-дифторпирролидингидрохлорида (250 мг, 1,69 ммоля) и 4-бромбутиронитрила (0,17 мл, 1,69 ммоля) в сухом CH3CN (9 мл) при КТ добавляли К2СO3 (1,28 г, 9,29 ммоля), затем KI (28 мг, 0,17 ммоля). Реакционную смесь перемешивали при КТ в течение 15 ч. Смесь фильтровали и фильтрат подвергали распределению между водой и СН2Сl2. Слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный нитрил повторно растворяли в сухом ТГФ (8 мл) и при 0°С обрабатывали с помощью LiALH4 (75 мг, 1,92 ммоля). Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. Затем добавляли насыщенный водный раствор сегнетовой соли и ЭА, слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали неочищенный 4-(3,3-дифторпирролидин-1-ил)бутан-1-амин в виде бесцветного масла. Условия проведения ГХ-МС 01: tR=1,56 мин; [М+Н]+=179,10. (транс-4-Аминоциклогексил)метанол:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор транс-4-бензилоксикарбониламиноциклогексанметанола (110 мг, 0,42 ммоля) в МеОН (5 мл) гидрировали в присутствии Pd/C (10%) при КТ до завершения реакции. Затем смесь фильтровали и концентрировали при пониженном давлении. Искомое соединение получали в виде светло-коричневого твердого вещества. Условия проведения ЖХ-МС 07: tR=0,11 мин; [М+Н]+=130,24.
(цис-4-Аминоциклогексил)метанол:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) раствор цис-4-бензилоксикарбониламиноциклогексанметанола (235 мг, 0,89 ммоля) в МеОН (5 мл) гидрировали в присутствии Pd/C (10%) при КТ до завершения реакции. Затем смесь фильтровали и концентрировали при пониженном давлении. Искомое соединение получали в виде бесцветного масла. Условия проведения ЖХ-МС 07: tR=0,12 мин; [М+Н]+=130,26.
трет-Бутил-((цис-4-аминоциклогексил)метил)карбамат:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к охлажденному льдом раствору цис-4-бензилоксикарбониламиноциклогексанметанола (1,53 г, 5,81 ммоля), трифенилфосфина на полистироле (17,43 ммоля) и имидазола (559 мг, 8,13 ммоля) в сухом СН2Сl2 (150 мл) добавляли йод (2,38 г, 9,30 ммоля). Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. Затем смесь фильтровали, последовательно промывали 10% водным раствором Na2SO3 и рассолом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный йодид (1,94 г, 5,20 ммоля) повторно растворяли в ДМФ (15 мл) и обрабатывали азидом натрия (358 мг, 5,46 ммоля). Реакционную смесь нагревали при 80°С до завершения реакции. Затем смесь разбавляли с помощью ЭА, промывали рассолом (3×), сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. К смеси неочищенного азида (1,50 г, 5,20 ммоля) в ТГФ (27 мл) добавляли Ph3Р на полимерной подложке (2,0 экв.) и воду (9 мл). Реакционную смесь перемешивали при 55°С до завершения реакции, охлаждали до КТ и фильтровали. Фильтрат подвергали распределению между ЭА и водным раствором 0,5М Na2СО3 и слои разделяли. Водный слой экстрагировали с помощью ЭА (2×) и объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали бензил-(цис-4-(аминометил)циклогексил)карбамат в виде желтого масла. Условия проведения ЖХ-МС 07b: tR=0,57 мин; [М+Н]+=263,46.
К раствору неочищенного амина (467 мг, 1,78 ммоля) в ТГФ (4 мл) при 0°С добавляли 1М водный раствор NaOH (1,85 мл, 1,85 ммоля). Реакционную смесь перемешивали при 0°С в течение 10 мин и затем по каплям добавляли раствор ди-трет-бутилдикарбоната (412 мг, 1,85 ммоля) в ТГФ (3 мл). Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. Смесь разбавляли с помощью СН2Сl2, фильтровали и слои разделяли. Органический слой сушили над Na2SO4, фильтровали и растворители удаляли при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 1:0 →7:3) и затем группу Cbz удаляли путем обработки с помощью 10% Pd/C (150 мг) в смеси ЭА/МеОН 1:1 (10 мл) в атмосфере Н2. Искомое соединение получали в виде бесцветного масла. Условия проведения ЖХ-МС 07b: tR=0,52 мин; [М+Н]+=229,46.
трет-Бутил-((транс-4-аминоциклогексил)метил)карбамат: В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к охлажденному льдом раствору транс-4-бензилоксикарбониламиноциклогексанметанола (1,32 г, 5,01 ммоля), трифенилфосфина на полистироле (15,04 ммоля) и имидазола (483 мг, 7,02 ммоля) в сухом СН2Сl2 (150 мл) добавляли йод (2,06 г, 8,02 ммоля). Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. Затем смесь фильтровали, последовательно промывали 10% водным раствором Na2SO3 и рассолом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный йодид (1,64 г, 4,39 ммоля) повторно растворяли в ДМФ (15 мл) и обрабатывали азидом натрия (303 мг, 4,61 ммоля). Реакционную смесь нагревали при 80°С до завершения реакции. Затем смесь разбавляли с помощью ЭА, промывали рассолом (3×), сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. К смеси неочищенного азида (1,27 г, 4,40 ммоля) в ТГФ (21 мл) добавляли Ph3P на полимерной подложке (2,0 экв.) и воду (7 мл). Реакционную смесь перемешивали при 55°С до завершения реакции, охлаждали до КТ и фильтровали. Фильтрат подвергали распределению между ЭА и водным раствором 0,5М Na2CO3 и слои разделяли. Водный слой экстрагировали с помощью ЭА (2×) и объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали бензил-(транс-4-(аминометил)циклогексил)карбамат в виде белого твердого вещества. Условия проведения ЖХ-МС 07b: tR=0,57 мин; [М+Н]+=263,46.
К раствору неочищенного амина (466 мг, 1,78 ммоля) в ТГФ (4 мл) при 0°С добавляли 1М водный раствор NaOH (1,85 мл, 1,85 ммоля). Реакционную смесь перемешивали при 0°С в течение 10 мин и затем по каплям добавляли раствор ди-трет-бутилдикарбоната (412 мг, 1,85 ммоля) в ТГФ (3 мл). Реакционную смесь нагревали до КТ и перемешивали при этой температуре до завершения реакции. Смесь разбавляли с помощью СН2Сl2, фильтровали и слои разделяли. Органический слой сушили над Na2SO4, фильтровали и растворители удаляли при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 1:0 →7:3) и затем группу Cbz удаляли путем обработки с помощью 10% Pd/C (120 мг) в смеси ЭА/МеОН 1:1 (10 мл) в атмосфере Н2. Искомое соединение получали в виде белого твердого вещества. Условия проведения ЖХ-МС 07b: tR=0,51 мин; [М+Н]+=229,47.
Сочетание с образованием амида (с 2-[1-(трет-бутилдиметилсиланилокси)-этил]-оксазол-5-илметиламином) - получение (5R*)-N5-(2-[1-(трет-бутилдиметилсиланилокси)-этил]-оксазол-5-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида (150 мг, 0,45 ммоля) в сухом СН2Сl2 (5 мл) добавляли HOBt (73 мг, 0,54 ммоля), ЭДХ.НСl (216 мг, 1,13 ммоля), ДМАП (14 мг, 0,11 ммоля) и ДИПЭА (0,31 мл, 1,81 ммоля). Реакционную смесь перемешивали при КТ в течение 30 мин, затем добавляли раствор 2-[1-(трет-бутилдиметилсиланилокси)-этил]-оксазол-5-илметиламина (116 мг, 0,45 ммоля) в сухом СН2Сl2 (4 мл). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (9:1 СН2Сl2-МеОН+1% NH4OH) и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 01: tR=0,88 мин; [М+Н]+=571,24.
Сочетание с образованием амида (с 2-амино-5-метилтиазолом) - получение (5R*)-N5-(5-метилтиазол-2-ил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-(5R*)-5-карбоновой кислоты (400 мг, 1,69 ммоля) в сухом СН2Сl2 (9 мл) добавляли ЭДХ.НСl (828 мг, 4,23 ммоля), ДМАП (53 мг, 0,42 ммоля) и ДИПЭА (1,45 мл, 8,46 ммоля). Реакционную смесь перемешивали при КТ в течение 30 мин, затем добавляли 2-амино-5-метилтиазол (197 мг, 1,69 ммоля). Реакционную смесь перемешивали при КТ в течение 2 дней. Добавляли воду, слои разделяли и водный слой
экстрагировали с помощью CH2Cl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (1:1 гептан-ЭА) и получали искомое соединение в виде белого твердого вещества. ТСХ: rf (1:1 гептан-ЭА)=0,37. Условия проведения ЖХ-МС 02: tR=0,99 мин; [М+Н]+=333,41.
Сочетание с образованием амида (с 4-бромбензиламином) - получение (5R*)-N5-(4-бромфенилметил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-(5R*)-5-карбоновой кислоты (2,50 г, 10,58 ммоля) в сухом CH2Cl2 (53 мл) добавляли ЭДХ.НСl (5,17 г, 26,45 ммоля), ДМАП (330 мг, 2,64 ммоля) и ДИПЭА (9,1 мл, 52,91 ммоля). Реакционную смесь перемешивали при КТ в течение 30 мин, затем добавляли 4-бромбензиламингидрохлорид (2,40 г, 10,58 ммоля). Реакционную смесь перемешивали при КТ в течение 2 дней. Добавляли воду, слои разделяли и водный слой экстрагировали с помощью CH2Cl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (3:2 гептан-ЭА) и получали искомое соединение в виде желтого масла. ТСХ: rf (3:2 гептан-ЭА)=0,45. Условия проведения ЖХ-МС 02: tR=1,06 мин; [М+Н]+=404,00.
Омыление - получение (5R*)-N5-(4-бромфенилметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
Смесь (5R*)-N5-(4-бромфенилметил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (3,43 г, 8,48 ммоля) с EtOH (85 мл) и 1 н. NaOH (85 мл) перемешивали при КТ до завершения реакции. EtOH удаляли при пониженном давлении и остаток подвергали распределению между 1 н. НСl и ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 02: tR=0,94 мин; [М+Н]+=376,10.
Сочетание с образованием амида (с 2-амино-5-бромтиазолом) - получение (5R*)-N5-(5-бромтиазол-2-ил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-(5R*)-5-карбоновой кислоты (500 мг, 2,12 ммоля) в сухом СН2Сl2 (5 мл) добавляли несколько капель ДМФ и оксалилхлорид (0,20 мл, 2,33 ммоля). Реакционную смесь перемешивали при КТ в течение 30 мин. К раствору полученного ацилхлорида добавляли раствор 2-амино-5-бромтиазолгидробромида (851 мг, 3,17 ммоля) и ДИПЭА (1,45 мл, 8,47 ммоля) в сухом СН2Сl2 (2,5 мл). Реакционную смесь перемешивали при КТ в течение 2 ч. Добавляли 1 н. НСl, слои разделяли и водный слой экстрагировали с помощью ЭА (2×). Объединенные органические экстракты последовательно промывали насыщенным водным раствором Na2CO3, рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (7:3 гептан-ЭА) и получали искомое соединение в виде белого вспененного вещества. ТСХ: rf (7:3 гептан-ЭА)=0,30. Условия проведения ЖХ-МС 02: tR=1,05 мин; [М+Н]+=397,25.
Омыление - получение (5R*)-N5-(5-бромтиазол-2-ил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида: Смесь (5R*)-N5-(5-бромтиазол-2-ил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (1,13 г, 2,86 ммоля) с EtOH (29 мл) и 1 н. NaOH (29 мл) перемешивали при КТ до завершения реакции. EtOH удаляли при пониженном давлении и остаток подвергали распределению между 1 н. НСl и ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде бежевого твердого вещества. Условия проведения ЖХ-МС 02: tR=0,93 мин; [М+Н]+=369,21.
Сочетание с образованием амида (с (4-(2-метил-[1,3]диоксолан-2-ил)тиазол-2-ил)метанамином) - получение (5R*)-N5-(4-(2-метил-[1,3]диоксолан-2-ил)-тиазол-2-илметил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-(5R*)-5-карбоновой кислоты (970 мг, 4,11 ммоля) в сухом СН2Сl2 (15 мл) добавляли ЭДХ.НСl (1,97 г, 10,26 ммоля), ДМАП (125 мг, 1,02 ммоля) и ДИПЭА (2,81 мл, 16,42 ммоля). Реакционную смесь перемешивали при КТ в течение 30 мин, затем добавляли (4-(2-метил-[1,3]диоксолан-2-ил)тиазол-2-ил)метанамин (822 мг, 4,11 ммоля) в сухом CH2Cl2 (15 мл). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (5:1→1:4 гептан-ЭА) и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 02: tR=0,93 мин; [М+Н]+=419,02.
Омыление/удаление защитной группы ацеталя - получение (5R*)-N5-(4-ацетилтиазол-2-илметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
Смесь (5R*)-N5-(4-(2-метил-[1,3]диоксолан-2-ил)-тиазол-2-илметил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (1,50 г, 3,58 ммоля) с EtOH (35 мл) и 1 н. NaOH (35 мл) перемешивали при КТ до завершения реакции. EtOH удаляли при пониженном давлении и остаток подвергали распределению между 2 н. НСl и ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали неочищенную карбоновую кислоту в виде желтого твердого вещества. Часть этого неочищенного вещества (800 мг, 2,05 ммоля) растворяли в ТГФ (10 мл) и при КТ обрабатывали 1 н. водным раствором НСl (6 мл). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду и продукт экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого твердого вещества. Условия проведения ЖХ-МС 02: tR=0,77 мин; [М+Н]+=347,07.
Сочетание с образованием амида (с 2-амино-4-ацетилтиазолом) - получение (5R*)-#5-(4-ацетилтиазол-2-ил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-(5R*)-5-карбоновой кислоты (250 мг, 1,06 ммоля) в сухом СН2Сl2 (5 мл) добавляли ЭДХ.НСl (517 мг, 2,64 ммоля), ДМАП (33 мг, 0,26 ммоля) и ДИПЭА (0,91 мл, 5,29 ммоля). Реакционную смесь перемешивали при КТ в течение 30 мин, затем добавляли 2-амино-4-ацетилтиазолгидробромид (236 мг, 1,06 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА 1:1) и получали искомое соединение в виде бледно-розового твердого вещества. ТСХ: rf (1:1 гептан-ЭА)=0,41. Условия проведения ЖХ-МС 02: tR=0,97 мин; [М+Н]+=361,27.
Омыление - получение (5R*)-N5-(4-ацетилтиазол-2-ил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
Смесь (5R*)-N5-(4-ацетилтиазол-2-ил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид (80 мг, 0,22 ммоля) с EtOH (2,2 мл) и 1 н. NaOH (2,2 мл) перемешивали при КТ до завершения реакции. EtOH удаляли при пониженном давлении и остаток подвергали распределению между 2 н. НСl и ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде почти белого вспененного вещества. Условия проведения ЖХ-МС 02: tR=0,84 мин; [М+Н]+=333,29.
Сочетание с образованием амида (с 4-метил-1,3-оксазол-2-амином) - получение (5R*)-N5-(4-метилоксазол-2-ил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-(5R*)-5-карбоновой кислоты (300 мг, 1,27 ммоля) в сухом СН2Сl2 (6,5 мл) добавляли ЭДХ.НСl (621 мг, 3,17 ммоля), ДМАП (40 мг, 0,32 ммоля) и ДИПЭА (1,09 мл, 6,35 ммоля). Реакционную смесь перемешивали при КТ в течение 30 мин, затем добавляли 4-метил-1,3-оксазол-2-амин (138 мг, 1,27 ммоля). Реакционную смесь перемешивали при КТ в течение 36 ч. Добавляли воду, слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (1:4 гептан-ЭА) и получали искомое соединение в виде бесцветного масла. ТСХ: rf (1:4 гептан-ЭА)=0,53. Условия проведения ЖХ-МС 02: tR=0,88 мин; [М+Н]+=317,50.
Сочетание с образованием амида (с 2-амино-4,5-диметилтиазолом) -получение (5R*)-N5-(4,5-диметилтиазол-2-ил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-(5R*)-5-карбоновой кислоты (238 мг, 1,01 ммоля) в сухом СН2Сl2 (5 мл) добавляли ЭДХ.НСl (493 мг, 2,52 ммоля), ДМАП (31 мг, 0,25 ммоля) и ДИПЭА (0,86 мл, 5,04 ммоля). Реакционную смесь перемешивали при КТ в течение 30 мин, затем добавляли 2-амино-4,5-диметилтиазолгидрохлорид (169 мг, 1,01 ммоля). Реакционную смесь перемешивали при КТ в течение 36 ч. Добавляли воду, слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×) Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (3:2 гептан-ЭА) и получали искомое соединение в виде бесцветного масла. ТСХ: rf (3:2 гептан-ЭА)=0,25. Условия проведения ЖХ-МС 02: tR=1,00 мин; [М+Н]+=347,51.
Реакция Дильса-Альдера - получение (5R,6R)-5,6-бис-[(1-(15')-этоксикарбонил)-этоксикарбонил]-(4S,7R)-[4,7-этениленспиро[2.4]гептана]:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (E)-1,2-бис-[((15)-1-этоксикарбонил)-этоксикарбонил]-этена (7,40 г, 22,7 ммоля) в н-гексане (76 мл) добавляли спиро[2.4]гепта-4,6-диен (3,14 г, 34,0 ммоля) при КТ.
Реакционную смесь перемешивали при этой температуре в течение ночи. Смесь концентрировали при пониженном давлении и неочищенный остаток очищали с помощью ФХ (гептан/ЭА, 9:1). Искомое соединение получали в виде бледно-желтого масла. ТСХ: rf (9:1 гептан-ЭА)=0,25. Условия проведения ЖХ-МС 02: tR=1,12 мин; [М+Н]+=409,00.1Н ЯМР (400 МГц, CDCl3) δ 6,44 (dd, J=5,5, 3,0 Гц, 1Н), 6,32 (dd, J=5,5, 2,8 Гц, 1 Н), 5,12 (q, J=7,1 Гц, 1 Н), 5,06 (q,J=7,1 Гц, 1 Н), 4,28-4,14 (m, 4 Н), 3,76 (кажущийся t, J=4,0 Гц, 1 Н), 2,92 (d, J=4,8 Гц, 1 Н), 2,86 (m, 1 Н), 2,80 (m, 1 Н), 1,55-1,47 (m, 6Н), 1,29 (t, J=7,3 Гц, 3 Н), 1,29 (t, J=7,3 Гц, 3 Н), 0,70 (m, 1 Н), 0,56-0,44 (m, 3 Н).
Омыление - получение (4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R,6S)-5,6-бис-карбоновой кислоты:
К раствору (5R,6R)-5,6-бис-[(1-(1S)-этоксикарбонил)-этоксикарбонил]-(4S,7R)-[4,7-этениленспиро[2.4]гептан]а (9,51 г, 23,28 ммоля) в смеси ТГФ/H2О (1:1, 232 мл) добавляли LiOH (3,91 г, 93,13 ммоля). Реакционную смесь перемешивали при КТ в течение ночи. Добавляли 1 н. НСl для доведения значения pH реакционной смеси до pH=3, слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (СН2Сl2/МеОН, 9:1) и получали искомое соединение в виде бесцветного масла. ТСХ: rf (9:1 СН2Сl2/МеОН)=0,31. Условия проведения ЖХ-МС 02: tR=0,72 мин; [M+AcCN+H]+=250,18. Йодлактонизация - получение энантиомерно чистого йодолактона 2:

К раствору (4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R,6R)-5,6-бис-карбоновой кислоты (5,60 г, 22,32 ммоля) в CH2Cl2 (33 мл) добавляли NaHCO3 (2,06 г, 24,56 ммоля), воду (100 мл), KI (1,37 г, 82,60 ммоля) и 12 (6,80 г, 26,79 ммоля). Реакционную смесь перемешивали при КТ в течение 3 ч. Реакцию останавливали путем добавления насыщенного водного раствора Na2S2О3. Слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенное вспененное вещество очищали с помощью ФХ (ЭА) и получали энантиомерно чистый йодолактон 2 в виде белого твердого вещества. ТСХ: rf (ЭА)=0,33.
Этерификация - получение энантиомерно чистого йодолактона 1 (R10=Me):
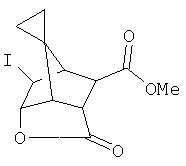
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору энантиомерно чистого йодолактон 2 (5,00 г, 14,96 ммоля) в сухом МеОН (75 мл) добавляли TMSCH2N2 (2,0 М в гексанах, 37,0 мл, 74,83 ммоля). Реакционную смесь перемешивали при КТ в течение ночи, концентрировали при пониженном давлении и очищали с помощью ФХ (гептан-ЭА, 4:1) и получали энантиомерно чистый йодолактон 1 (R10=Me) в виде белого твердого вещества. ТСХ: rf (4:1 гептан-ЭА)=0,18.
Ретро-йодлактонизация - получение (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору энантиомерно чистого йодолактона 1 (R10=Me) (2,86 г, 8,21 ммоля) в уксусной кислоте (29 мл) добавляли порошкообразный цинк (8,06 г, 123,23 ммоля). Реакционную смесь перемешивали при 65°С в течение 4 ч, охлаждали до КТ, фильтровали и подвергали распределению между водой и ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 1:1) и получали искомое соединение в виде бесцветного масла. ТСХ: rf (1:1 гептан-ЭА)=0,41.
Сочетание с образованием амида (с 4-броманилином) - получение (5R)-N5-(4-бромфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (80 мг, 0,36 ммоля) в сухом толуоле (2 мл) добавляли несколько капель ДМФ и оксалилхлорид (0,048 мл, 0,54 ммоля). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 40 мин, охлаждали до КТ, концентрировали при пониженном давлении и остаток сушили в высоком вакууме.
К раствору этого ацилхлорида в сухом CH2Cl2 (2 мл) добавляли 4-броманилин (96 мг, 0,54 ммоля) и ДИПЭА (0,18 мл, 1,08 ммоля). Реакционную смесь перемешивали при КТ в течение 1 ч. Добавляли 1 н. НСl, слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (3:2 гептан-ЭА) и получали искомое соединение в виде оранжевого твердого вещества. ТСХ: rf (3:2 гептан-ЭА)=0,50. Условия проведения ЖХ-МС 02: tR=1,06 мин; [М+Н]+=376,20.
Сочетание с образованием амида (с 1-(5-аминометилфуран-2-ил)-этаноном) - получение (5R)-N5-(5-ацетилфуран-2-илметил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (200 мг, 0,90 ммоля) в сухом СН2Сl2 (3 мл) добавляли ЭДХ.НСl (440 мг, 2,25 ммоля), ДМАП (28 мг, 0,22 ммоля) и ДИПЭА (0,46 мл, 2,70 ммоля). Реакционную смесь перемешивали при КТ в течение 30 мин, затем добавляли 1-(5-аминометилфуран-2-ил)-этанон (125 мг, 0,90 ммоля). Реакционную смесь перемешивали при КТ в течение 16 ч. Добавляли воду, слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (4:6 гептан-ЭА) и получали искомое соединение в виде бесцветного масла. ТСХ: rf (4:6 гептан-ЭА)=0,21. Условия проведения ЖХ-МС 02: tR=0,89 мин; [М+Н]+=344,49.
(5R)-N5-(5-Ацетилфуран-2-илметил)-(6/г)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(5-ацетилфуран-2-илметил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (210 мг, 0,61 ммоля) в EtOH (6,1 мл) добавляли 1 н. водный раствор NaOH (6,1 мл, 6,10 ммоля). Реакционную смесь перемешивали при КТ в течение ночи и концентрировали при пониженном давлении. Остаток подвергали распределению между 1 н. НСl и ЭА, слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и поручали искомое соединение в виде желтого вспененного вещества. ТСХ: rf (9:1 СН2Сl2/МеОН)=0,38. Условия проведения ЖХ-МС 02: tR=0,79 мин; [М+Н]+=329,94.
(5R)-N5-(4-Бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Смесь (5R)-N5-(4-бромфенил)-(6R)-6-этоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида (получали из рацемического соединения с помощью хиральной ВЭЖХ, 500 мг, 1,28 ммоля) и 1 н. водного раствора NaOH (13 мл) в EtOH (13 мл) перемешивали при КТ в течение ночи. Затем реакционную смесь концентрировали при пониженном давлении и подвергали распределению между 2М НСl и ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде белого твердого вещества. Условия проведения ЖХ-МС 02: tR=0,97 мин; [М+Н]+=362,20.
Восстановление двойной связи - получение (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) деоксигенированную суспензию (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (220 мг, 0,99 ммоля), Pd/C 10% (44 мг) и циклогексена (0,20 мл, 1,98 ммоля) в сухом ТГФ (2,5 мл) перемешивали при кипячении с обратным холодильником в течение 2 ч. Реакционную смесь фильтровали через целит и осадок на фильтре промывали с помощью ТГФ. Фильтрат концентрировали при пониженном давлении и получали искомое соединение в виде белого твердого вещества. ТСХ: rf (2:3 гептан-ЭА)=0,48.
Сочетание с образованием амида (с 4-броманилином) - получение (5R)-N5-(4-бромфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (220 мг, 0,98 ммоля) в сухом толуоле (5 мл) добавляли несколько капель ДМФ и оксалилхлорид (0,13 мл, 1,47 ммоля). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 40 мин, охлаждали до КТ, концентрировали при пониженном давлении и остаток сушили в высоком вакууме.
К раствору этого ацилхлорида в сухом CH2Cl2 (5 мл) добавляли 4-броманилин (261 мг, 1,47 ммоля) и ДИПЭА (0,50 мл, 2,94 ммоля). Реакционную смесь перемешивали при КТ в течение 1 ч. 1 н. НСl добавляли, слои разделяли и водный слой экстрагировали с помощью СН2Cl2 (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 4:1) и получали искомое соединение в виде белого вспененного вещества. ТСХ: rf (4:1 гептан-ЭА)=0,35. Условия проведения ЖХ-МС 02: tR=1,10 мин; [М+Н]+=378,22.
Сочетание с образованием амида (с 1-(5-аминометилфуран-2-ил)-этаноном) - получение (5R)-N5-(5-ацетилфуран-2-илметил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (200 мг, 0,89 ммоля) в сухом СН2Сl2 (3 мл) добавляли ЭДХ.НСl (436 мг, 2,23 ммоля), ДМАП (28 мг, 0,22 ммоля) и ДИПЭА (0,46 мл, 2,68 ммоля).
Реакционную смесь перемешивали при КТ в течение 30 мин, затем добавляли 1-(5-аминометилфуран-2-ил)-этанон (124 мг, 0,89 ммоля). Реакционную смесь перемешивали при КТ в течение 16 ч. Добавляли воду, слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (4:6 гептан-ЭА) и получали искомое соединение в виде бесцветного масла. ТСХ: rf (4:6 гептан-ЭА)=0,35. Условия проведения ЖХ-МС 01: tR=0,88 мин; [М+Н]+=346,05.
(5R)-N5-(5-Ацетилфуран-2-илметил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(5-ацетилфуран-2-илметил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида (110 мг, 0,32 ммоля) в EtOH (3,2 мл) добавляли 1 н. водный раствор NaOH (3,2 мл, 3,20 ммоля). Реакционную смесь перемешивали при КТ в течение ночи и концентрировали при пониженном давлении. Остаток подвергали распределению между 1 н. НСl и ЭА, слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого вспененного вещества. ТСХ: rf (9:1 СН2Сl2/МеОН)=0,38. Условия проведения ЖХ-МС 02: tR=0,82 мин; [М+Н]+=332,37.
Сочетание с образованием амида (с 2-амино-5-бромтиазолом) - получение (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (1,11 г, 5,00 ммоля) в сухом СН2Сl2 (20 мл) добавляли несколько капель ДМФ и оксалилхлорид (0,48 мл, 5,50 ммоля). Реакционную смесь перемешивали при КТ в течение 30 мин, концентрировали при пониженном давлении и остаток сушили в высоком вакууме.
К суспензии 2-амино-5-бромтиазолмоногидробромида (1,34 г, 5,00 ммоля) в сухом ТГФ (10 мл) добавляли раствор ацилхлорида в сухом ТГФ (10 мл), затем Et3N (1,4 мл, 10,0 ммоля). Реакционную смесь перемешивали при КТ в течение 1 ч, разбавляли с помощью ЭА и промывали рассолом. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 5:1) и получали искомое соединение в виде бледно-желтого масла. ТСХ: rf (1:1 гептан-ЭА)=0,60. Условия проведения ЖХ-МС 01: tR=0,98 мин; [М+Н]+=382,92.
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (2,14 г, 5,58 ммоля) в ТГФ (30 мл) добавляли 2 н. водный раствор NaOH (11 мл, 22,00 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь промывали с помощью Et2O, водный слой подкисляли и экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде бледно-желтого твердого вещества. Условия проведения ЖХ-МС 01: tR=0,88 мин; [М+Н]+=368,87.
Сочетание с образованием амида (с 5-амино-2-бромпиридином) - получение (5R)-N5-(2-бромпирид-5-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (222 мг, 1,00 ммоля) в сухом СН2Сl2 (4 мл) добавляли несколько капель ДМФ и оксалилхлорид (0,10 мл, 1,13 ммоля). Реакционную смесь перемешивали при КТ в течение 30 мин и добавляли раствор 5-амино-2-бромпиридина (265 мг, 1,50 ммоля) и ДИПЭА (0,70 мл, 4,00 ммоля) в сухом СН2Сl2 (2 мл). Реакционную смесь перемешивали при КТ в течение 20 мин, разбавляли с помощью ЭА и промывали 1 н. водным раствором НСl. Слои разделяли и водный слой экстрагировали с помощью ЭА (2×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 5:1 →3:1) и получали искомое соединение в виде бесцветного масла. Условия проведения ЖХ-МС 01: tR=0,95 мин; [М+Н]+=376,97.
(5R)-N5-(2-Бромпирид-5-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(2-бромпирид-5-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (323 мг, 0,86 ммоля) в ТГФ (4 мл) добавляли 2 н. водный раствор NaOH (1,7 мл, 3,40 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь выливали в 1 н. водный раствор НСl и экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде бледно-желтого вспененного вещества. Условия проведения ЖХ-МС 02: tR=0,87 мин; [М+Н]+=362,93.
Сочетание с образованием амида (с 4-бром-3-фторанилином) - получение (5R)-N5-(4-бром-3-фторфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (111 мг, 0,50 ммоля) в сухом CH2Cl2 (2 мл) добавляли ЭДХ.НСl (244 мг, 1,25 ммоля) и ДМАП (12 мг, 0,10 ммоля). Смесь охлаждали до 0°С и добавляли раствор 4-бром-3-фторанилина (95 мг, 0,50 ммоля) в сухом CH2Cl2 (1 мл), затем ДИПЭА (0,35 мл, 2,00 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой промывали 1 н. водным раствором НСl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, от 5:1 до 1:1) и получали искомое соединение в виде бесцветного твердого вещества. ТСХ: rf (1:1 гептан-ЭА)=0,55. Условия проведения ЖХ-МС 02: tR=1,07 мин; [М+Н]+=393,86.
Сочетание с образованием амида (с 4-бром-2-фторанилином) - получение (5R)-N5-(4-бром-2-фторфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (59 мг, 0,26 ммоля) в сухом СН2Сl2 (2 мл) добавляли ЭДХ.НСl (129 мг, 0,66 ммоля) и ДМАП (6 мг, 0,05 ммоля). Смесь охлаждали до 0°С и добавляли раствор 4-бром-2-фторанилина (50 мг, 0,26 ммоля) в сухом СН2Сl2 (1 мл), затем ДИПЭА (0,18 мл, 1,05 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой промывали 1 н. водным раствором НСl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, от 5:1 до 1:1) и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 02: tR=1,07 мин; [М+Н]+=393,65.
(5R)-N5-(4-Бром-2-фторфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(4-бром-2-фторфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (20 мг, 0,05 ммоля) в EtOH (1 мл) добавляли 1 н. водный раствор NaOH (0,5 мл, 0,50 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь концентрировали при пониженном давлении, остаток подвергали распределению между 2 н. НСl и ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 02: tR=0,97 мин; [М+Н]+=380,22.
Сочетание с образованием амида (с 4-бром-2-метиланилином) - получение (5R)-N5-(4-бром-2-метилфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (111 мг, 0,50 ммоля) в сухом СН2Сl2 (2 мл) добавляли ЭДХ.НСl (244 мг, 1,25 ммоля) и ДМАП (12 мг, 0,10 ммоля). Смесь охлаждали до 0°С и добавляли раствор 4-бром-2-метиланилина (93 мг, 0,50 ммоля) в сухом СН2Сl2 (1 мл), затем ДИПЭА (0,35 мл, 2,00 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой промывали 1 н. водным раствором НСl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, от 5:1 до 1:1) и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 02: tR=1,06 мин; [М+Н]+=389,98.
(5R)-N5-(4-Бром-2-метилфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(4-бром-2-метилфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (93 мг, 0,24 ммоля) в EtOH (2 мл) добавляли 1 н. водный раствор NaOH (1,0 мл, 1,00 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь концентрировали при пониженном давлении, остаток подвергали распределению между 2 н. НСl и ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде бледно-коричневого вспененного вещества. Условия проведения ЖХ-МС 02: tR=0,97 мин; [М+Н]+=376,26.
Сочетание с образованием амида (с 5-амино-2-хлорпиридином) - получение (5R)-N5-(2-хлорпиридин-5-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (111 мг, 0,50 ммоля) в сухом СН2Сl2 (2 мл) добавляли ЭДХ.НСl (244 мг, 1,25 ммоля) и ДМАП (12 мг, 0,10 ммоля). Смесь охлаждали до 0°С и добавляли раствор 4-бром-3-фторанилина (66 мг, 0,50 ммоля) в сухом СН2Сl2 (1 мл), затем ДИПЭА (0,35 мл, 2,00 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой промывали 1 н. водным раствором НСl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, от 5:1 до 1:1) и получали искомое соединение в виде белого вспененного вещества. Условия проведения ЖХ-МС 02: tR=0,96 мин; [М+Н]+=333,27.
Сочетание с образованием амида (с 2-амино-5-бромпиридином) - получение (5R)-N5-(5-бромпиридин-2-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (111 мг, 0,50 ммоля) в сухом CH2Cl2 (2 мл) добавляли ЭДХ.НСl (244 мг, 1,25 ммоля) и ДМАП (12 мг, 0,10 ммоля). Смесь охлаждали до 0°С и добавляли раствор 2-амино-5-бромпиридина (86 мг, 0,50 ммоля) в сухом CH2Cl2 (1 мл), затем ДИПЭА (0,35 мл, 2,00 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой промывали 1 н. водным раствором НСl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, от 5:1 до 1:1) и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 02: tR=1,03 мин; [М+Н]+=376,72.
(5R)-N5-(5-Бромпиридин-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(5-бромпиридин-2-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (29 мг, 0,08 ммоля) в EtOH (1 мл) добавляли 1 н. водный раствор NaOH (0,5 мл, 0,50 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь концентрировали при пониженном давлении, остаток подвергали распределению между 2 н. НСl и ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде бледно-желтого твердого вещества. Условия проведения ЖХ-МС 02: tR=0,94 мина.
Сочетание с образованием амида (с 2-амино-5-метилпиридином) - получение (5R)-N5-(5-метилпиридин-2-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (222 мг, 1,00 ммоля) в сухом СН2Сl2 (4 мл) добавляли 2-амино-5-метилпиридин (109 мг, 1,00 ммоля), ЭДХ.НСl (489 мг, 2,50 ммоля) и ДМАП (25 мг, 0,20 ммоля). Смесь охлаждали до 0°С и добавляли ДИПЭА (0,70 мл, 4,00 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой промывали 1 н. водным раствором НСl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, от 5:1 до 2:1) и получали искомое соединение в виде желтого масла. ТСХ: rf (2:1 гептан-ЭА)=0,43. Условия проведения ЖХ-МС 02: tR=0,79 мин; [М+Н]+=313,40.
(5R)-N5-(5-Метилпиридин-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(5-метилпиридин-2-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (56 мг, 0,18 ммоля) в ТГФ (1 мл) добавляли 2 н. водный раствор NaOH (0,4 мл, 0,80 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь выливали в 1 н. водный раствор НСl и экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде бледно-желтого твердого вещества. Условия проведения ЖХ-МС 02: tR=0,71 мин; [М+Н]+=298,61.
Сочетание с образованием амида (с 4-бром-2,5-дифторанилином) - получение (5R)-N5-(4-бром-2,5-дифторфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (111 мг, 0,50 ммоля) в сухом СН2Сl2 (2 мл) добавляли ЭДХ.НСl (244 мг, 1,25 ммоля) и ДМАП (12 мг, 0,10 ммоля). Смесь охлаждали до 0°С и добавляли раствор 4-бром-2,5-дифторанилина (104 мг, 0,50 ммоля) в сухом СН2Сl2 (1 мл), затем ДИПЭА (0,35 мл, 2,00 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой промывали 1 н. водным раствором НСl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, от 5:1 до 3:1) и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 02: tR=1,09 мин; [М+Н]+=412,39.
(5R)-N5-(4-Бром-2,5-дифторфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(4-бром-2,5-дифторфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (170 мг, 0,41 ммоля) в ТГФ (2 мл) добавляли 1 н. водный раствор NaOH (0,8 мл, 0,80 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь выливали в 1 н. водный раствор НСl и экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка с помощью ФХ (CH2Cl2-MeOH-NH4OH) давала искомое соединение в виде бледно-желтого масла. Условия проведения ЖХ-МС 02: tR=1,00 мин; [М+Н]+=398,40.
Сочетание с образованием амида (с 4-бром-2,6-дифторанилином) - получение (5R)-N5-(4-бром-2,6-дифторфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (200 мг, 0,90 ммоля) в сухом CH2Cl2 (4 мл) добавляли 3 капли ДМФ и оксалилхлорид (0,09 мл, 1,02 ммоля). Реакционную смесь перемешивали при КТ в течение 60 мин и концентрировали при пониженном давлении.
К суспензии 4-бром-2,6-дифторанилина (187 мг, 0,90 ммоля) в пиридине (1,1 мл) добавляли раствор ацилхлорида в ацетоне (5 мл). Реакционную смесь перемешивали при КТ в течение 2 ч, разбавляли с помощью ЭА и последовательно промывали 1 н. водным раствором НСl, насыщенным водным раствором NaHCO3 и рассолом. Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, от 5:1 до 3:1) и получали искомое соединение в виде бесцветного масла. ТСХ: rf (2:3 гептан-ЭА)=0,40. Условия проведения ЖХ-МС 02: tR=1,03 мин; [М+Н]+=411,86.
(5R)-N5-(4-Бром-2,6-дифторфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(4-бром-2,6-дифторфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (240 мг, 0,58 ммоля) в ТГФ (2 мл) добавляли 1 н. водный раствор NaOH (1,1 мл, 1,10 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь выливали в 1 н. водный раствор НСl и экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде белого вспененного вещества. Условия проведения ЖХ-МС 02: tR=0,94 мин; [М+Н]+=398,02.
Сочетание с образованием амида (с 4-бром-2,3-дифторанилином) - получение (5R)-N5-(4-бром-2,3-дифторфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (150 мг, 0,67 ммоля) в сухом CH2Cl2 (4 мл) добавляли 3 капли ДМФ и оксалилхлорид (0,07 мл, 0,77 ммоля). Реакционную смесь перемешивали при КТ в течение 60 мин и концентрировали при пониженном давлении.
К суспензии 4-бром-2,3-дифторанилина (140 мг, 0,67 ммоля) в пиридине (0,8 мл) добавляли раствор ацилхлорида в ацетоне (4 мл). Реакционную смесь перемешивали при КТ в течение 1 ч, разбавляли с помощью ЭА и последовательно промывали 1 н. водным раствором НСl, насыщенным водным раствором NaHCO3 и рассолом. Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого масла. ТСХ: rf (1:1 гептан-ЭА)=0,63. Условия проведения ЖХ-МС 02: tR=1,08 мин; [М+Н]+=411,93.
(5R)-N5-(4-Бром-2,3-дифторфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(4-бром-2,3-дифторфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (260 мг, 0,63 ммоля) в ТГФ (2,5 мл) добавляли 1 н. водный раствор NaOH (1,2 мл, 1,20 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь выливали в 1 н. водный раствор НСl и экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде белого вспененного вещества. Условия проведения ЖХ-МС 02: tR=0,99 мин; [М+Н]+=398,38.
Сочетание с образованием амида (с 4-бром-3,5-дифторанилином) - получение (5R)-N5-(4-бром-3,5-дифторфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (111 мг, 0,50 ммоля) в сухом CH2Cl2 (2 мл) добавляли ЭДХ.НСl (244 мг, 1,25 ммоля) и ДМАП (12 мг, 0,10 ммоля). Смесь охлаждали до 0°С и добавляли раствор 4-бром-3,5-дифторанилина (109 мг, 0,50 ммоля) в сухом СН2Сl2 (1 мл), затем ДИПЭА (0,35 мл, 2,00 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой промывали 1 н. водным раствором НСl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, от 5:1 до 1:1) и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 01: tR=1,06 мин; [М+Н]+=411,90.
Сочетание с образованием амида (с 4-бром-3-(трифторметил)анилином) - получение (5R)-N5-(4-бром-3-трифторметилфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (111 мг, 0,50 ммоля) в сухом СН2Сl2 (2 мл) добавляли ЭДХ.НСl (244 мг, 1,25 ммоля) и ДМАП (12 мг, 0,10 ммоля). Смесь охлаждали до 0°С и добавляли раствор 4-бром-3-(трифторметил)анилина (120 мг, 0,50 ммоля) в сухом СН2Сl2 (1 мл), затем ДИПЭА (0,35 мл, 2,00 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой промывали 1 н. водным раствором НСl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, от 5:1 до 1:1) и получали искомое соединение в виде бесцветного масла. Условия проведения ЖХ-МС 02: tR=1,11 мин; [М+Н]+=443,88.
Сочетание с образованием амида (с 4-бром-2-фторбензиламином) - получение (5R)-N5-(4-бром-2-фторфенилметил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (150 мг, 0,67 ммоля) в сухом CH2Cl2 (4 мл) добавляли 3 капли ДМФ и оксалилхлорид (0,07 мл, 0,77 ммоля). Реакционную смесь перемешивали при КТ в течение 60 мин и концентрировали при пониженном давлении.
К суспензии 4-бром-2-фторбензиламингидрохлорида (162 мг, 0,67 ммоля) в пиридине (0,80 мл) добавляли раствор ацилхлорида в ацетоне (4 мл). Реакционную смесь перемешивали при КТ в течение 1 ч, разбавляли с помощью ЭА и последовательно промывали 1 н. водным раствором НСl, насыщенным водным раствором NaHCO3 и рассолом. Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 01: tR=0,99 мин; [М+Н]+=407,94.
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(4-бром-2-фторфенилметил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (250 мг, 0,61 ммоля) в ТГФ (5 мл) добавляли 1 н. водный раствор NaOH (2,9 мл, 2,90 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь выливали в 1 н. водный раствор НСl и экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде белого вспененного вещества. Условия проведения ЖХ-МС 02: tR=0,94 мин; [М+Н]+=394,00.
Сочетание с образованием амида (с 4-бром-3-фторбензиламином) - получение (5R)-N5-(4-бром-3-фторфенилметил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (80 мг, 0,36 ммоля) в сухом CH2Cl2 (4 мл) добавляли 3 капли ДМФ и оксалилхлорид (0,04 мл, 0,41 ммоля). Реакционную смесь перемешивали при КТ в течение 60 мин и концентрировали при пониженном давлении.
К суспензии 4-бром-3-фторбензиламина (90 мг, 0,44 ммоля) в пиридине (0,43 мл) добавляли раствор ацилхлорида в ацетоне (4 мл). Реакционную смесь перемешивали при КТ в течение 1 ч, разбавляли с помощью ЭА и последовательно промывали 1 н. водным раствором НСl, насыщенным водным раствором NaHCO3 и рассолом. Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка с помощью ФХ (гептан-ЭА от 1:1 до 1:2) давала искомое соединение в виде бесцветного масла. Условия проведения ЖХ-МС 07: tR=0,84 мин; [М+Н]+=408,01.
Сочетание с образованием амида (с 4-бром-2,3-дифторбензиламином) -получение (5R)-N5-(4-бром-2,3-дифторфенилметил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (120 мг, 0,54 ммоля) в сухом СН2Сl2 (4 мл) добавляли 3 капли ДМФ и оксалилхлорид (0,05 мл, 0,62 ммоля). Реакционную смесь перемешивали при КТ в течение 60 мин и концентрировали при пониженном давлении.
К суспензии 4-бром-2,3-дифторбензиламина (120 мг, 0,54 ммоля) в пиридине (0,64 мл) добавляли раствор ацилхлорида в ацетоне (4 мл). Реакционную смесь перемешивали при КТ в течение 2 ч, разбавляли с помощью ЭА и последовательно промывали 1 н. водным раствором НСl, насыщенным водным раствором NaHCO3 и рассолом. Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка с помощью ФХ (гептан-ЭА от 9:1 до 1:1) давала искомое соединение в виде желтого масла. ТСХ: rf (1:1 гептан-ЭА)=0,65. Условия приведения ЖХ-МС 07: tR=0,86 мин; [М+Н]+=426,05.
(5R)-N5-(4-Бром-2,3-дифторфенилметил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(4-бром-2,3-дифторфенилметил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (120 мг, 0,28 ммоля) в ТГФ (4 мл) добавляли 1 н. водный раствор NaOH (1,3 мл, 1,30 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь выливали в 1 н. водный раствор НСl и экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде белого вспененного вещества. Условия проведения ЖХ-МС 07: tR=0,77 мин; [М+Н]+=411,93.
Сочетание с образованием амида (с 4-бром-3,5-дифторбензиламином) -получение (5R)-N5-(4-бром-3,5-дифторфенилметил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (55 мг, 0,25 ммоля) в сухом CH2Cl2 (4 мл) добавляли 2 капли ДМФ и оксалилхлорид (0,025 мл, 0,28 ммоля). Реакционную смесь перемешивали при КТ в течение 60 мин и концентрировали при пониженном давлении.
К суспензии 4-бром-3,5-дифторбензиламина (55 мг, 0,25 ммоля) в пиридине (0,24 мл) добавляли раствор ацилхлорида в ацетоне (4 мл). Реакционную смесь перемешивали при КТ в течение 2 ч, разбавляли с помощью ЭА и последовательно промывали 1 н. водным раствором НСl, насыщенным водным раствором NaHCO3 и рассолом. Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого масла. ТСХ: rf (1:1 гептан-ЭА)=0,65. Условия проведения ЖХ-МС 07: tR=0,85 мин; [М+Н]+=426,08.
(5R)-N5-(4-Бром-3,5-дифторфенилметил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(4-бром-3,5-дифторфенилметил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (80 мг, 0,19 ммоля) в ТГФ (2 мл) добавляли 1 н. водный раствор NaOH (1,5 мл, 1,50 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь выливали в 1 н. водный раствор НСl и экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде коричневого вспененного вещества. Условия проведения ЖХ-МС 07: tR=0,75 мин; [М+Н]+=412,08.
Сочетание с образованием амида (с 4-бром-2,5-дифторбензиламином) -получение (5R)-N5-(4-бром-2,5-дифторфенилметил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (90 мг, 0,40 ммоля) в сухом СН2Сl2 (4 мл) добавляли 2 капли ДМФ и оксалилхлорид (0,04 мл, 0,46 ммоля). Реакционную смесь перемешивали при КТ в течение 60 мин и концентрировали при пониженном давлении.
К суспензии 4-бром-2,5-дифторбензиламина (90 мг, 0,40 ммоля) в пиридине (0,39 мл) добавляли раствор ацилхлорида в ацетоне (4 мл). Реакционную смесь перемешивали при КТ в течение 2 ч, разбавляли с помощью ЭА и последовательно промывали 1 н. водным раствором НСl, насыщенным водным раствором NaHCO3 и рассолом. Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого масла. ТСХ: rf (1:1 гептан-ЭА)=0,65. Условия проведения ЖХ-МС 07: tR=0,86 мин; [М+Н]+=426,08.
(5R)-N5-(4-Бром-2,5-дифторфенилметил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(4-бром-2,5-дифторфенилметил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (170 мг, 0,40 ммоля) в ТГФ (4 мл) добавляли 1 н. водный раствор NaOH (1,6 мл, 1,60 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь выливали в 1 н. водный раствор НСl и экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде коричневого вспененного вещества. Условия проведения ЖХ-МС 07: tR=0,76 мин; [M+H]+=412,08.
Сочетание с образованием амида (с 5-амино-2-бром-3-фторпиридином) -получение (5R)-N5-(2-бром-3-фторпиридин-5-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (120 мг, 0,54 ммоля) в сухом CH2Cl2 (2 мл) добавляли 2 капли ДМФ и оксалилхлорид (0,054 мл, 0,61 ммоля). Реакционную смесь перемешивали при КТ в течение 60 мин и концентрировали при пониженном давлении.
К суспензии 5-амино-2-бром-3-фторпиридина (103 мг, 0,54 ммоля) в пиридине (0,64 мл) добавляли раствор ацилхлорида в ацетоне (3 мл). Реакционную смесь перемешивали при КТ в течение 1 ч, разбавляли с помощью ЭА и последовательно промывали 1 н. водным раствором НСl, насыщенным водным раствором NaHCO3 и рассолом. Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка с помощью ФХ (гептан-ЭА от 9:1 до 4:1) давала искомое соединение в виде белого вспененного вещества. ТСХ: rf (2:3 гептан-ЭА)=0,51. Условия проведения ЖХ-МС 07: tR=0,86 мин; [М+Н]+=395,30.
Сочетание с образованием амида (с 2-(4-хлорфенил)этиламином) -получение (5R)-N5-(2-(4-хлорфенил)этил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (800 мг, 3,60 ммоля) в сухом СН2Сl2 (10 мл) добавляли несколько капель ДМФ и оксалилхлорид (0,33 мл, 3,96 ммоля). Реакционную смесь перемешивали при КТ в течение 30 мин и добавляли раствор 2-(4-хлорфенил)этиламина (857 мг, 5,40 ммоля) и ДИПЭА (2,5 мл, 14,40 ммоля) в сухом СН2Сl2 (5 мл). Реакционную смесь перемешивали при КТ в течение 10 мин, разбавляли с помощью CH2Cl2 и промывали 1 н. водным раствором НСl. Слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (2×). Объединенные органические экстракты последовательно промывали водным раствором Nа2СО3 и рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, от 4:1 до 1:1) и получали искомое соединение в виде желтого масла. ТСХ: rf (1:1 гептан-ЭА)=0,55. Условия проведения ЖХ-МС 01: tR=1,00 мин; [М+Н]+=360,03.
(5R)-N5-(2-(4-Хлорфенил)этил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(2-(4-хлорфенил)этил)-(6r)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (550 мг, 1,53 ммоля) в EtOH (15 мл) добавляли 1 н. водный раствор NaOH (7,5 мл, 7,50 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь концентрировали при пониженном давлении и остаток подвергали распределению между ЭА и водным раствором 2 н. НСl. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде бледно-желтого твердого вещества. Условия проведения ЖХ-МС 01: tR=0,91 мин; [М+Н]+=346,00.
Сочетание с образованием амида (с 2-(2,4-дихлорфенил)этиламином) - получение (5R)-N5-(2-(2,4-дихлорфенил)этил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (110 мг, 0,50 ммоля) в сухом ДМФ (5 мл) добавляли HATU (188 мг, 0,50 ммоля) и ДИПЭА (0,13 мл, 0,75 ммоля) при КТ. Реакционную смесь перемешивали при КТ в течение 1 ч и добавляли раствор 2-(2,4-дихлорфенил)этиламина (94 мг, 0,50 ммоля) в сухом ДМФ (2,5 мл).
Реакционную смесь перемешивали при КТ в течение 30 мин, разбавляли с помощью ЭА и промывали водой. Слои разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, от 5:1 до 3:2) и получали искомое соединение в виде бесцветного масла. Условия проведения ЖХ-МС 01: tR=1,03 мин; [М+Н]+=394,02.
(5R)-N5-(2-(2,4-Дихлорфенил)этил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(2-(2,4-дихлорфенил)этил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (170 мг, 0,43 ммоля) в EtOH (4 мл) добавляли 1 н. водный раствор NaOH (2 мл, 2,00 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь концентрировали при пониженном давлении и остаток подвергали распределению между ЭА и водным раствором 2 н. НСl. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде белого вспененного вещества. Условия проведения ЖХ-МС 02: tR=0,97 мин; [М+Н]+=380,36.
Сочетание с образованием амида (с 4-бром-2-фторбензиламином) -получение (5R)-N5-(4-бром-2-фторфенилметил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (160 мг, 0,71 ммоля) в сухом СН2Сl2 (4 мл) добавляли 3 капли ДМФ и оксалилхлорид (0,07 мл, 0,81 ммоля). Реакционную смесь перемешивали при КТ в течение 60 мин и концентрировали при пониженном давлении.
К суспензии 4-бром-2-фторбензиламингидрохлорида (171 мг, 0,71 ммоля) в пиридине (0,84 мл) добавляли раствор ацилхлорида в ацетоне (4 мл). Реакционную смесь перемешивали при КТ в течение 1 ч, разбавляли с помощью ЭА и последовательно промывали 1 н. водным раствором НСl, насыщенным водным раствором NaHCO3 и рассолом. Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого масла. Условия проведения ЖХ-МС 02: tR=1,06 мин; [М+Н]+=410,67.
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(4-бром-2-фторфенилметил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида (290 мг, 0,71 ммоля) в ТГФ (5 мл) добавляли 1 н. водный раствор NaOH (2,8 мл, 2,80 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь выливали в 1 н. водный раствор НСl и экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде белого вспененного вещества. Условия проведения ЖХ-МС 01: tR=0,93 мин; [М+Н]+=395,95.
Сочетание с образованием амида (с 2-амино-5-бромтиазолом) - получение (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (4,70 г, 20,9 ммоля) в сухом CH2Cl2 (80 мл) добавляли 10 капель ДМФ и оксалилхлорид (2,2 мл, 25,1 ммоля). Реакционную смесь перемешивали при КТ в течение 60 мин и концентрировали при пониженном давлении.
К суспензии 2-амино-5-бромтиазолмоногидробромида (5,67 г, 21,1 ммоля) в пиридине (5 мл) добавляли раствор ацилхлорида в ацетоне (80 мл). Реакционную смесь перемешивали при КТ в течение 1 ч, разбавляли с помощью ЭА и последовательно промывали 1 н. водным раствором НСl, насыщенным водным раствором NaHCO3 и рассолом. Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 5:1) и получали искомое соединение в виде бледно-желтого твердого вещества. ТСХ: rf (2:1 гептан-ЭА)=0,38. Условия проведения ЖХ-МС 07 с: tR=0,98 мин; [М+Н]+=385,12.
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида (2,90 г, 7,53 ммоля) в ТГФ (60 мл) добавляли 2 н. водный раствор NaOH (15 мл, 30,00 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь промывали с помощью Et2O, водный слой подкисляли и экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде светло-коричневого твердого вещества. Условия проведения ЖХ-МС 07 с: tR=0,84 мин; [М+Н]+=371,11.
Сочетание с образованием амида (с 5-амино-2-бромпиридином) - получение (5R)-N5-(2-бромпирид-5-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (2,55 г, 11,37 ммоля) в сухом CH2Cl2 (60 мл) добавляли 10 капель ДМФ и оксалилхлорид (1,20 мл, 13,65 ммоля). Реакционную смесь перемешивали при КТ в течение 60 мин и концентрировали при пониженном давлении.
К суспензии 5-амино-2-бромпиридина (1,97 г, 11,37 ммоля) в пиридине (2,75 мл) добавляли раствор ацилхлорида в ацетоне (60 мл). Реакционную смесь перемешивали при КТ в течение 30 мин, разбавляли с помощью ЭА и последовательно промывали 1 н. водным раствором НСl, насыщенным водным раствором NaHCO3 и рассолом. Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 1:0→1:1) и получали искомое соединение в виде белого твердого вещества. ТСХ: rf (2:1 гептан-ЭА)=0,44. Условия проведения ЖХ-МС 07: tR=0,84 мин; [М+Н]+=379,04.
(5R)-N5-(2-Бромпирид-5-ил)-(6R)-6-гидроксикарбонил-(45',77 г)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамид:
К раствору (5R)-N5-(2-бромпирид-5-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида (3,81 г, 10,05 ммоля) в ТГФ (100 мл) добавляли 2 н. водный раствор NaOH (20 мл, 40,00 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Затем смесь выливали в 1 н. водный раствор НСl и экстрагировали с помощью ЭА (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении И получали искомое соединение в виде белого твердого вещества. Условия проведения ЖХ-МС 07: tR=0,72 мин; [М+Н]+=365,22.
Сочетание с образованием амида (с 5-амино-2-бром-3-фторпиридином) -получение (5R)-N5-(2-бром-3-фторпиридин-5-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-(5R)-5-карбоновой кислоты (121 мг, 0,54 ммоля) в сухом CH2Cl2 (2 мл) добавляли 2 капли ДМФ и оксалилхлорид (0,054 мл, 0,61 ммоля). Реакционную смесь перемешивали при КТ в течение 60 мин и концентрировали при пониженном давлении.
К суспензии 5-амино-2-бром-3-фторпиридина (103 мг, 0,54 ммоля) в пиридине (0,64 мл) добавляли раствор ацилхлорида в ацетоне (3 мл). Реакционную смесь перемешивали при КТ в течение 1 ч, разбавляли с помощью ЭА и последовательно промывали 1 н. водным раствором НСl, насыщенным водным раствором NaHCO3 и рассолом. Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка с помощью ФХ (гептан-ЭА от 9:1 до 4:1) давала искомое соединение в виде белого вспененного вещества. ТСХ: rf (2:3 гептан-ЭА)=0,52. Условия проведения ЖХ-МС 07: tR=0,91 мин; [М+Н]+=397,18.
Сочетание с образованием амида (с гидрохлоридом метилового эфира бета-аланина) - получение энантиомерно чистого йодолактона 3 (R2=2-метоксикарбонилэтил и R3=Н):
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору энантиомерно чистого йодолактона 2 (3,40 г, 10, 18 ммоля) в сухом толуоле (32 мл) добавляли несколько капель ДМФ и оксалилхлорид (1,11 мл, 12,58 ммоля). Реакционную смесь перемешивали при КТ в течение 60 мин, концентрировали при пониженном давлении и остаток выпаривали вместе с толуол (2×). Затем остаток повторно растворяли в CH2Cl2 (32 мл) и при КТ добавляли гидрохлорид метилового эфира бета-аланина (1,59 г, 11,19 ммоля) и ДИПЭА (5,37 мл, 30,53 ммоля). Реакционную смесь перемешивали при КТ в течение 25 мин, разбавляли с помощью CH2Cl2 и промывали насыщенным водным раствором NH4Cl. Слои разделяли и водный слой экстрагировали с помощью CH2Cl2 (3×). Объединенные органические экстракты промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 5:1→1:1) и получали искомое соединение в виде бледно-желтого вспененного вещества. ТСХ: rf (95:5 гептан-ЭА)=0,38. Условия проведения ЖХ-МС 02: tR=0,87 мин; [М+Н]+=420,00.
Ретро-йодлактонизация - получение (5R)-5-гидроксикарбонил-(6R)-N5-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору энантиомерно чистого йодолактона 3 (R2=2-метоксикарбантилэтил и R3=Н) (3,21 г, 7,66 ммоля) в уксусной кислоте (15 мл) добавляли порошкообразный цинк (0,60 г, 9,20 ммоля). Реакционную смесь перемешивали при 65°С в течение 2 ч, охлаждали до КТ, фильтровали и осадок на фильтре промывали с помощью ЭА. Фильтрат промывали водой, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (гептан-ЭА, 1:1→1:2) и получали искомое соединение в виде бесцветного масла. ТСХ: rf (ЭА)=0,27. Условия проведения ЖХ-МС 02: tR=0,71 мин; [М+Н]+=294,00.
Сочетание с образованием амида (с 4-пирролидин-1-илбутиламином) -получение энантиомерно чистого йодолактонд 3 (R2=4-пирролидин-1-илбутил и R3=Н):
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору энантиомерно чистого йодолактона 2 (1,59 г, 4,76 ммоля) в сухом СН2Сl2 (30 мл) добавляли несколько капель ДМФ и оксалилхлорид (0,45 мл, 5,23 ммоля). Реакционную смесь перемешивали при КТ в течение 2 ч, затем добавляли 4-(1-пирролидино)-бутиламин (0,69 г, 4,76 ммоля) и ДИПЭА (0,81 мл, 4,76 ммоля). Реакционную смесь перемешивали при КТ в течение 30 мин, разбавляли с помощью CH2Cl2 и промывали насыщенным водным раствором NH4Cl. Слои разделяли и водный слой экстрагировали с помощью СН2Сl2 (3×). Объединенные органические экстракты промывали рассолом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (СН2Сl2/МеОН, 9:1) и получали искомое соединение в виде бледно-желтого масла. ТСХ: rf (9:1 СН2Сl2/МеОН)=0,22. Условия проведения ЖХ-МС 01: tR=0,68 мин; [М+Н]+=458,65.
Ретро-йодлактонизация - получение (5R)-5-гидроксикарбонил-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору энантиомерно чистого йодолактона 3 (R2=4-пирролидин-1-илбутил и R3=Н) (1,29 г, 2,81 ммоля) в уксусной кислоте (5 мл) добавляли порошкообразный цинк (276 мг, 4,22 ммоля). Реакционную смесь перемешивали при 65°С в течение 0,5 ч, охлаждали до КТ, фильтровали, промывали с помощью ЭА и фильтрат концентрировали при пониженном давлении. Неочищенный остаток очищали с помощью ФХ (С-18 обращенная фаза диоксида кремния, Н2O/МеОН, 1:0, затем 0:1) и получали искомое соединение в виде белого вспененного вещества. Условия проведения ЖХ-МС 02: tR=0,64 мин; [М+Н]+=333,54.
Восстановление двойной связи - получение (5R)-5-гидроксикарбонил-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этнленспиро[2.4]гептан]-6-карбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) деоксигенированную суспензию (5R)-5-гидроксикарбонил-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида (500 мг, 1,70 ммоля), Pd/C 10% (181 мг) и циклогексена (0,80 мл, 7,80 ммоля) в сухом ТГФ (15 мл) перемешивали при кипячении с обратным холодильником в течение 16 ч. Реакционную смесь фильтровали через целит и осадок на фильтре промывали с помощью ТГФ. Фильтрат концентрировали при пониженном давлении и получали искомое соединение в виде бесцветного масла. ТСХ: rf (ЭА)=0,37. Условия проведения ЖХ-МС 02: tR=0,77 мин; [М+Н]+=296,26.
Сочетание с образованием амида (с 4-бромбензиламином) - получение (5R)-N5-(4-бромфенилметил)-(6R)-N5-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R)-5-гидроксикарбонил-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида (59 мг, 0,20 ммоля) в сухом CH2Cl2 (2 мл) добавляли 4-бромбензиламин (39 мг, 0,20 ммоля) в сухом CH2Cl2 (0,5 мл) при КТ, затем ЭДХ.НСl (98 мг, 0,50 ммоля) и ДМАП (5 мг, 0,04 ммоля). Затем при 0°С по каплям добавляли ДИПЭА (0,14 мл, 0,80 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой последовательно промывали 1 н. водным раствором НСl (2×), рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде бледно-коричневого масла. ТСХ: rf (1:2 гептан-ЭА)=0,31. Условия проведения ЖХ-МС 02: tR=0,92 мин; [М+Н]+=461,08.
Сочетание с образованием амида (с 2-амино-5-бромпиридином) -получение (5R)-N5-(5-бромпирид-2-ил)-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R)-5-гидроксикарбонил-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида (88 мг, 0,30 ммоля) в сухом CH2Cl2 (2 мл) при КТ добавляли 2-амино-5-бромпиридин (58 мг, 0,33 ммоля) в сухом СН2Сl2 (0,5 мл), затем ЭДХ.НСl (147 мг, 0,75 ммоля) и ДМАП (7 мг, 0,06 ммоля). Затем при 0°С по каплям добавляли ДИПЭА (0,21 мл, 1,20 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой последовательно промывали 1 н. водным раствором НСl (2×), рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого масла. ТСХ: rf (1:1 гептан-ЭА)=0,37. Условия проведения ЖХ-МС 02: tR=0,96 мин; [М+Н]+=448,40.
Сочетание с образованием амида (с 5-амино-2-хлорпиридином) - получение (5R)-N5-(2-хлорпирид-5-ил)-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R)-5-гидроксикарбонил-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида (88 мг, 0,30 ммоля) в сухом CH2Cl2 (2 мл) при КТ добавляли 5-амино-2-хлорпиридин (44 мг, 0,33 ммоля), затем ЭДХ.НСl (147 мг, 0,75 ммоля) и ДМАП (7 мг, 0,06 ммоля). Затем при 0°С по каплям добавляли ДИПЭА (0,21 мл, 1,20 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой последовательно промывали 1 н. водным раствором НСl (2×), рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого твердого вещества. ТСХ: rf (1:1 гептан-ЭА)=0,13. Условия проведения ЖХ-МС 02: tR=0,88 мин; [М+Н]+=404,06.
Сочетание с образованием амида (с 4-бром-2-фторбензиламингидрохлоридом) - получение (5R)-N5-(4-6ром-2-фторфенилметил)-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R)-5-гидроксикарбонил-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида (88 мг, 0,30 ммоля) в сухом СН2Сl2 (3 мл) при КТ добавляли 4-бром-2-фторбензиламингидрохлорид (72 мг, 0,30 ммоля), затем ЭДХ.НСl (147 мг, 0,75 ммоля) и ДМАП (7 мг, 0,06 ммоля). Затем при 0°С по каплям добавляли ДИПЭА (0,21 мл, 1,20 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой последовательно промывали 1 н. водным раствором НСl (2×), рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде бледно-желтого масла. ТСХ: rf (1:2 гептан-ЭА)=0,42. Условия проведения ЖХ-МС 02: tR=0,96 мин; [М+Н]+=479,10.
Сочетание с образованием амида (с (2-бромтиазол-5-ил)метиламином) - получение (5R)-N5-[(2-бромтиазол-5-ил)метил]-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R)-5-гидроксикарбонил-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида (88 мг, 0,30 ммоля) в сухом CH2Cl2 (2 мл) добавляли (2-бромтиазол-5-ил)метанамин (58 мг, 0,30 ммоля) в сухом СН2Сl2 (0,5 мл) при КТ, затем ЭДХ.НСl (147 мг, 0,75 ммоля) и ДМАП (7 мг, 0,06 ммоля). Затем при 0°С по каплям добавляли ДИПЭА (0,21 мл, 1,20 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой последовательно промывали 1 н. водным раствором НСl (2×), рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде коричневого масла. ТСХ: rf (1:2 гептан-ЭА)=0,21. Условия проведения ЖХ-МС 02: tR=0,85 мин; [М+Н]+=467,57.
Сочетание с образованием амида (с 4-метоксианилином) - получение (5R)-N5-(4-метоксифенил)-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R)-5-гидроксикарбонил-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида (88 мг, 0,30 ммоля) в сухом CH2Cl2 (2 мл) при КТ добавляли 4-метоксианилин (41 мг, 0,33 ммоля) в сухом СН2Сl2 (0,5 мл), затем ЭДХ.НСl (147 мг, 0,75 ммоля) и ДМАП (7 мг, 0,06 ммоля). Затем при 0°С по каплям добавляли ДИПЭА (0,21 мл, 1,20 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой последовательно промывали 1 н. водным раствором НСl (2×), рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде желтого масла. ТСХ: rf (1:2 гептан-ЭА)=0,37. Условия проведения ЖХ-МС 02: tR=0,90 мин; [М+Н]+=399,02.
Сочетание с образованием амида (с 4-бромбензиламином) - получение (5R)-N5-(4-бромфенилметил)-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R)-5-гидроксикарбонил-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-6-карбоксамиад (88 мг, 0,30 ммоля) в сухом CH2Cl2 (2 мл) добавляли 4-бромбензиламин (64 мг, 0,33 ммоля) в сухом CH2Cl2 (0,5 мл) при КТ, затем ЭДХ.НСl (147 мг, 0,75 ммоля) и ДМАП (7 мг, 0,06 ммоля). Затем при 0°С по каплям добавляли ДИПЭА (0,21 мл, 1,20 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой последовательно промывали 1 н. водным раствором НСl (2×), рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде бледно-желтого твердого вещества. ТСХ: rf (1:2 гептан-ЭА)=0,39. Условия проведения ЖХ-МС 02: tR=0,97 мин; [М+Н]+=462,80.
Сочетание с образованием амида (с 5-амино-2-хлорпиридином) - получение (5R)-N5-(2-хлорпирид-5-ил)-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R)-5-гидроксикарбонил-(6R)-N5-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-6-карбоксамида (88 мг, 0,30 ммоля) в сухом СН2Сl2 (2 мл) добавляли 5-амино-2-хлорпиридин (44 мг, 0,33 ммоля) в сухом СН2Сl2 (1 мл) при КТ, затем ЭДХ.НСl (147 мг, 0,75 ммоля) и ДМАП (7 мг, 0,06 ммоля). Затем при 0°С по каплям добавляли ДИПЭА (0,21 мл, 1,20 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой последовательно промывали 1 н. водным раствором НСl (2×), рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде светло-коричневого твердого вещества. Условия проведения ЖХ-МС 02: tR=0,92 мин; [М+Н]+=406,25.
Сочетание с образованием амида (с 4-бром-2-фторбензиламингидрохлоридом) - получение (5R)-N5-(4-бром-2-фторфенилметил)-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R)-5-гидроксикарбонил-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-6-карбоксамида (88 мг, 0,30 ммоля) в сухом CH2Cl2 (3 мл) при КТ добавляли 4-бром-2-фторбензиламингидрохлорид (80 мг, 0,33 ммоля), затем ЭДХ.НСl (147 мг, 0,75 ммоля) и ДМАП (7 мг, 0,06 ммоля). Затем при 0°С по каплям добавляли ДИПЭА (0,21 мл, 1,20 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой последовательно промывали 1 н. водным раствором НСl (2×), рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде белого твердого вещества. ТСХ: rf (1:2 гептан-ЭА)=0,45. Условия проведения ЖХ-МС 02: tR=0,98 мин; [М+Н]+=481,00.
Сочетание с образованием амида (с 4-метоксианилином) - получение (5R)-N5-(4-метоксифенил)-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамида:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R)-5-гидроксикарбонил-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-6-карбоксамида (88 мг, 0,30 ммоля) в сухом СН2Сl2 (3 мл) добавляли 4-метоксианилин (41 мг, 0,33 ммоля) при КТ, затем ЭДХ.НСl (147 мг, 0,75 ммоля) и ДМАП (7 мг, 0,06 ммоля). Затем при 0°С по каплям добавляли ДИПЭА (0,21 мл, 1,20 ммоля). Реакционную смесь перемешивали при КТ до завершения реакции. Добавляли воду, слои разделяли и органический слой последовательно промывали 1 н. водным раствором НСl (2×), рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении и получали искомое соединение в виде оранжевого масла. ТСХ: rf (1:2 гептан-ЭА)=0,45. Условия проведения ЖХ-МС 02: tR=0,93 мин; [М+Н]+=401,28.
Получение соединений примеров Пример 1:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(5-аминопентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам А, затем Н с использованием в качестве исходного вещества (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 5-(трет-бутоксикарбониламино)-пентиламина.
Условия проведения ЖХ-МС 05 с: tR=0,55 мин; [М+Н]+=446,12.
Пример 2:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике F с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(1-пирролидино)-бутиламина. Условия проведения ЖХ-МС 02: tR=0,85 мин; [М+Н]+=486,21.
Пример 3:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(пиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам А, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-(4-амино)-пиперидина.
Условия проведения ЖХ-МС 05 с: tR=0,54 мин; [М+Н]+=444,00.
Пример 4:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-изобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и изобутиламина. Условия проведения ЖХ-МС 05 с: tR=0,84 мин; [М+Н]+=417,18.
Пример 5:
(5R*)-N5-(4-Бромфенил)-(6R*)-N5-(4-аминобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам А, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(трет-бутоксикарбониламино)-бутиламина.
Условия проведения ЖХ-МС 05 с: tR=0,54 мин; [М+Н]+=432,05. Пример 6:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(2-N,N-диметиламиноэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-(диметиламино)-этиламина. Условия проведения ЖХ-МС 02: tR=0,82 мин; [М+Н]+=432,24.
Пример 7:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-((3-аминометилфенил)-метил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам А, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(трет-бутоксикарбониламинометил)-бензиламина.
Условия проведения ЖХ-МС 05 с: tR=0,58 мин; [М+Н]+=479,90.
Пример 8:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-пиперидинилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам А, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-4-(аминометил)-пиперидина.
Условия проведения ЖХ-МС 05 с: tR=0,55 мин; [М+Н]+=458,00.
Пример 9:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(пирролидин-3-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам А, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (±)-1-трет-бутоксикарбонил-3-аминопирролидина.
Условия проведения ЖХ-МС 05 с: tR=0,54 мин; [М+Н]+=429,97.
Пример 10:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2,2-диметил-3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам А, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-3-амино-2,2-диметилпропил амина.
Условия проведения ЖХ-МС 05 с: tR=0,57 мин; [М+Н]+=446,08.
Пример 11:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-(N,N-Диэтиламино)-бутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(диэтиламино)-бутиламина. Условия проведения ЖХ-МС 05b: tR=0,56 мин; [М+Н]+=488,28.
Пример 12:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(3-гидроксипропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-амино-1-пропанола. Условия проведения ЖХ-МС 02: tR=0,92 мин; [М+Н]+=418,92.
Пример 13:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(2-карбамоилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и бета-аланинамидгидрохлорида.
Условия проведения ЖХ-МС 02: tR=0,88 мин; [М+Н]+=432,20.
Пример 14:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-трет-бутоксикарбонилпирролидин-3-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (±)-3-амино-N-трет-бутоксикарбонилпирролидина.
Условия проведения ЖХ-МС 05 с: tR=0,78 мин; [М+Н]+=530,03. Пример 15:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(циклопентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и циклопентиламина. Условия проведения ЖХ-МС 05b: tR=0,85 мин; [М+Н]+=429,15.
Пример 16:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам А, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-3-аминопропиламина.
Условия проведения ЖХ-МС 05 с: tR=0,53 мин; [М+Н]+=417,99.
Пример 17:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-этоксипропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-этоксипропиламина. Условия проведения ЖХ-МС 05b: tR=0,79 мин; [М+Н]+=447,17.
Пример 18:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-пирролидинилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам А, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-трет-бутоксикарбонил-2-(аминометил)-пирролидина.
Условия проведения ЖХ-МС 05 с: tR=0,55 мин; [М+Н]+=444,06.
Пример 19:
(5R*)-N-(4-Бромфенил)-(6R*)-N6-(2,2,2-трифторэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2,2,2-трифторэтиламина. Условия проведения ЖХ-МС 05b: tR=0,80 мин; [М+Н]+=443,07.
Пример 20:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-фторэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-фторэтиламина. Условия проведения ЖХ-МС 05b: tR=0,73 мин; [М+Н]+=407,10.
Пример 21:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(N-метиламино)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам А, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6S*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-N-метил-2-аминоэтиламина.
Условия проведения ЖХ-МС 05 с: tR=0,54 мин; [М+Н]+=418,17. Пример 22:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-тетрагидрофуранилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-тетрагидрофуранилметиламина. Условия проведения ЖХ-МС 05b: tR=1,10 мин; [М+Н]+=445,31.
Пример 23:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-гидроксициклогексил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и транс-4-аминоциклогексанолгидрохлорида.
Условия проведения ЖХ-МС 05: tR=0,83 мин; [М+Н]+=459,20. Пример 24:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-этилсульфанилэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-этилсульфанилэтиламина. Условия проведения ЖХ-МС 05b: tR=0,83 мин; [М+Н]+=449,20.
Пример 25:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(5-(N,N-диэтиламино)-пент-2-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(N,N-диэтиламино)-1-метилбутиламина.
Условия проведения ЖХ-МС 05b: tR=0,92 мин; [М+Н]+=502,11. Пример 26:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(пиперидин-3-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам А, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (±)-N-трет-бутоксикарбонил-(3-амино)-пиперидина.
Условия проведения ЖХ-МС 05 с: tR=0,55 мин; [М+Н]+=444,01. Пример 27:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-трет-бутоксикарбониламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-трет-бутоксикарбониламиноэтиламина.
Условия проведения ЖХ-МС 05 с: tR=0,75 мин; [М+Н]+=504,02.
Пример 28:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(1-гидроксипроп-2-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и D,L-2-амино-1-пропанола.
Условия проведения ЖХ-МС 05: tR=0,81 мин; [М+Н]+=419,07.
Пример 29:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-имидазолидин-2-он-1-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-имидазолидин-2-он-1-илэтиламина.
Условия проведения ЖХ-МС 05b: tR=0,96 мин; [М+Н]+=472,98. Пример 30:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-пирролидин-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(1-пирролидино)-пропиламина. Условия проведения ЖХ-МС 05b: tR=0,86 мин; [М+Н]+=472,10.
Пример 31:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(2-метоксиэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-метоксиэтиламина.
Условия проведения ЖХ-МС 02: tR=0,98 мин; [М+Н]+=418,98.
Пример 32:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(1H-бензимидазол-2-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(1H-бензимидазол-2-ил)-пропиламина.
Условия проведения ЖХ-МС 05b: tR=0,59 мин; [М+Н]+=519,.
Пример 33:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(1-метилпирролидин-2-ил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-(1-метилпирролидин-2-ил)-этиламина.
Условия проведения ЖХ-МС 05b: tR=0,85 мин; [М+Н]+=472,17.
Пример 34:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-гидроксиэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-аминоэтанола. Условия проведения ЖХ-МС 02: tR=0,90 мин; [М+Н]+=405,26.
Пример 35:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6,N6-бис-(2-метоксиэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и бис-(2-метоксиэтил)-амина. Условия проведения ЖХ-МС 05b: tR=0,78 мин; [М+Н]+=477,20.
Пример 36:
(5R*)-N5-(4-Бромфенил)-(6R*)-N5-(цианометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и аминоацетонитрила. Условия проведения ЖХ-МС 05b: tR=0,70 мин; [М+Н]+=400,09.
Пример 37:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-1H-пиразол-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Условия проведения ЖХ-МС 05b: tR=0,54 мин; [М+Н]+=469,.
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-1H-пиразол-1-илпропиламина. Условия проведения ЖХ-МС 05b: tR=0,73 мин; [М+Н]+=469,15.
Пример 38:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(4-аминометилфенил)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам А, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(трет-бутоксикарбониламинометил)-бензиламина. Условия проведения ЖХ-МС 05 с: tR=0,57 мин; [М+Н]+=480,04.
Пример 39:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-этил-N6-(2-диэтиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарббксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-этил-2-(N,N-диэтиламино)-этиламина.
Условия проведения ЖХ-МС 05b: tR=0,60 мин; [М+Н]+=488,21.
Пример 40:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-1H-имидазол-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(1H-имидазол-1-ил)-пропиламина.
Пример 41:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-([1,4]-диоксан-2-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и [1,4]-диоксан-2-илметиламина. Условия проведения ЖХ-МС 05b: tR=1,06 мин; [М+Н]+=460,97.
Пример 42:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-гидроксибутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-аминобутанола. Условия проведения ЖХ-МС 05: tR=0,81 мин; [М+Н]+=433,21.
Пример 43:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(4 -метилпиперазин-1-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гндроксикарбонил-(4R*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(4-метилпиперазин-1-ил)-пропиламина.
Условия проведения ЖХ-МС 05b: tR=0,74 мин; [М+Н]+=501,10.
Пример 44:
(5R*)-N5-(4-Бромфенил)-(6R*)-N5-(2-аминоэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам А, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-2-аминоэтиламина.
Условия проведения ЖХ-МС 05 с: tR=0,53 мин; [М+Н]+=404,.
Пример 45:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-метил-N6-(2-диметиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-метил-2-(N,N-диметиламино)-этиламина.
Условия проведения ЖХ-МС 05b: tR=0,55 мин; [М+Н]+=446,17.
Пример 46:
(5R*)-N5-(4-Бромфенил)-(6R*)-N5-(4-трет-бутоксикарбониламинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-трет-бутоксикарбониламинобутиламина.
Условия проведения ЖХ-МС 05 с: tR=0,78 мин; [М+Н]+=532,07.
Пример 47:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(метил-трет-бутоксикарбониламино)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-N-метил-2-аминоэтиламина.
Условия проведения ЖХ-МС 05 с: tR=0,78 мин; [М+Н]+=517,63.
Пример 48:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-пирролидин-1-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-пирролидиноэтиламина. Условия проведения ЖХ-МС 05b: tR=0,54 мин; [М+Н]+=458,14.
Пример 49:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-1H-[1,2,4]-триазол-1-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидр6ксикарбонил-(4R*,7S*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-1H-[1,2,4]-триазол-1-илэтиламина.
Условия проведения ЖХ-МС 05: tR=0,78 мин; [М+Н]+=456,13.
Пример 50:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(фуран-3-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и фуран-3-илметиламина.
Условия проведения ЖХ-МС 05b: tR=0,79 мин; [М+Н]+=441,18.
Пример 51:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(5-диметиламинопентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид
Получали по общей методике Е с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 5-диметиламинопентиламина. Условия проведения ЖХ-МС 02: tR=0,84 мин; [М+Н]+=474,32.
Пример 52:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-димегиламинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-диметиламинопропиламина. Условия проведения ЖХ-МС 02: tR=0,82 мин; [М+Н]+=446,09.
Пример 53:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-метоксипропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-метоксипропиламина. Условия проведения ЖХ-МС 02: tR=1,00 мин; [М+Н]+=432,99.
Пример 54:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(1-этилпирролидин-2-ил)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (1-этилпирролидин-2-ил)-метиламина.
Условия проведения ЖХ-МС 05b: tR=0,88 мин; [М+H]+=472,12.
Пример 55:
(5R*)-N5-(4-Бромфенил)-(6R*)-N5-(3-1H-[1,2,4]-триазол-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дпкарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-1H-[1,2,4]-триазол-1-илпропиламина.
Условия проведения ЖХ-МС 05b: tR=0,63 мин; [М+Н]+=470,22.
Пример 56:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-трет-бутоксикарбонилпиперидин-3-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (±)-3-амино-N-трет-бутоксикарбонилпиперидина.
Условия проведения ЖХ-МС 05 с: tR=0,81 мин; [М+Н]+=544,06.
Пример 57:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(N-трет-бутоксикарбониламино)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-трет-бутоксикарбониламинопропиламина.
Условия проведения ЖХ-МС 05 с: tR=0,77 мин; [М+Н]+=517,58.
Пример 58:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-метилбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-метилбутиламина. Условия проведения ЖХ-МС 05b: tR=0,89 мин; [М+Н]+=431,13.
Пример 59:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(2S)-1-гидрокси-4-метилпент-2-ил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (2S)-2-амино-4-метилпентан-1-ола. Условия проведения ЖХ-МС 05: tR=0,93 мин; [М+Н]+=461,21.
Пример 60:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(метоксикарбонил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и гидрохлорида метилового эфира бета-аланина.
Условия проведения ЖХ-МС 02: tR=0,99 мин; [М+Н]+=446,94.
Пример 61:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(4-аминосульфонилфенил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Условия проведения ЖХ-МС 05b: tR=0,88 мин; [М+Н]+=483,.
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида й 2-(4-аминосульфонилфенил)-этиламина.
Условия проведения ЖХ-МС 05b: tR=1,06 мин; [М+Н]+=544,03.
Пример 62:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(1-этил-5-метил-1H-пиразол-3-ил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-(1-этил-5-метил-1H-пиразол-3-ил)-этиламина.
Условия проведения ЖХ-МС 05: tR=0,87 мин; [М+Н]+=497,14.
Пример 63:
(5R)-N5-(4-Бромфенил)-(6R)-N6,N6-бис-(2-метоксиэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и бис-(2-метоксиэтил)-амина. Условия проведения ЖХ-МС 02: tR=1,02 мин; [М+Н]+=477,24.
Пример 64:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(4,5-диметил-1H-имидазол-2-ил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5.6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-(4,5-диметил-1H-имидазол-2-ил)-этиламина.
Пример 65:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(1S)--карбамоилэтил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R*)-N-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (2S)-2-аминопропионамида. Условия проведения ЖХ-МС 02: tR=0,89 мин; [М+Н]+=431,92.
Пример 66:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-диэтиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-диэтиламиноэтиламина. Условия проведения ЖХ-МС 05b: tR=0,86 мин; [М+Н]+=460,09.
Пример 67:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(пентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и пентиламина. Условия проведения ЖХ-МС 05b: tR=0,89 мин; [М+Н]+=431,10.
Пример 68:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(5-трет-бутоксикарбониламинопентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 5-трет-бутоксикарбониламинопентиламина.
Условия проведения ЖХ-МС 05 с: tR=0,80 мин; [М+Н]+=546,04.
Пример 69:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-(3-метилбутил)-пиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-амино-1-изопентилпиперидина. Условия проведения ЖХ-МС 05b: tR=0,96 мин; [М+Н]+=514,10.
Пример 70:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-пиридин-2-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-пиридин-2-илэтиламина. Условия проведения ЖХ-МС 02: tR=0,83 мин; [М+Н]+=465,93.
Пример 71:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2,2-диметил-3-N-трет-бутоксикарбониламинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2,2-диметил-3-трет-бутоксикарбониламинопропиламина.
Условия проведения ЖХ-МС 05 с: tR=0,84 мин; [М+Н]+=546,02.
Пример 72:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(1-фенил-1H-пиразол-5-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-фенил-2H-пиразол-3-иламина. Условия проведения ЖХ-МС 05b: tR=1,15 мин; [М+Н]+=503,04.
Пример 73:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(циклопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида (1,0 экв.) в ДМФ (0,2 М) добавляли циклопропиламин (1,5 экв.), РуВОР (1,5 экв.) и ДИПЭА (3,0 экв.). Реакционную смесь перемешивали при КТ до завершения реакции. Затем реакционную смесь подвергали распределению между водой и ЭА. Слои разделяли и водный слой экстрагировали с помощью ЭА (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении. Очистка остатка с помощью ФХ или ВЭЖХ давала искомое соединение.
Условия проведения ЖХ-МС 02: tR=1,00 мин; [М+Н]+=401,13.
Пример 74:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(бутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и бутиламина. Условия проведения ЖХ-МС 02: tR=1,07 мин; [М+Н]+=416,25.
Пример 75:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(гексил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и гексиламина.
Условия проведения ЖХ-МС 05b: tR=1,25 мин; [М+Н]+=445,11.
Пример 76:
(5R*)-N5-(-Бромфенил)-(6R*)-N6-(2-(1-этил-3-метил-1H-пиразол-5-ил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-(1-этил-3-метил-1H-пиразол-5-ил)-этиламина.
Условия проведения ЖХ-МС 05b: tR=1,04 мин; [М+Н]+=497,09.
Пример 77:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-фенил-2-морфолиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-фенил-2-морфолиноэтиламина. Условия проведения ЖХ-МС 05b: tR=0,94 мин; [М+Н]+=550,09.
Пример 78:
(5Л*)-N5-(4-Бромфенил)-(6R*)-N6-(3-диэтиламинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамнд:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-диэтиламинопропиламина.
Условия проведения ЖХ-МС 05b: tR=0,88 мин; [М+Н]+=474,07.
Пример 79:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-трет-бутоксикарбонилпирролидин-2-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и TV-трет-бутоксикарбонилпирролидин-2-илметиламина. Условия проведения ЖХ-МС 05 с: tR=0,83 мин; [М+Н]+=544,06.
Пример 80:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-морфолиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-морфолиноэтиламина. Условия проведения ЖХ-МС 05b: tR=0,83 мин; [М+Н]+=474,05.
Пример 81:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-карбамоилциклогексил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и амида цис-2-аминоциклогексанкарбоновой кислоты.
Условия проведения ЖХ-МС 05b: tR=1,05 мин; [М+Н]+=486,06.
Пример 82:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(1-пиперидин-1-илпропан-1-он-2-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-амино-1-пиперидин-1-илпропан-1-она.
Условия проведения ЖХ-МС 05b: tR=1,13 мин; [М+Н]+=500,08.
Пример 83:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-бензилпиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-амино-Лг-бензилпиперидина. Условия проведения ЖХ-МС 05b: tR=0,60 мин; [М+Н]+=534,24.
Пример 84:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-метил-N6-гексил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и jV-метилгексиламина. Условия проведения ЖХ-МС 05b: tR=0,97 мин; [М+Н]+=459,15.
Пример 85:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3,3-диметилбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N6-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3,3-диметилбутиламина. Условия проведения ЖХ-МС 05b: tR=0,93 мин; [М+Н]+=445,13.
Пример 86:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-метилпиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-амино-N6-метилпиперидина. Условия проведения ЖХ-МС 05b: tR=0,83 мин; [М+Н]+=458,11.
Пример 87:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-морфолинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-морфолинопропиламина. Условия проведения ЖХ-МС 05b: tR=0,84 мин; [М+Н]+=488,15.
Пример 88:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(5-метил-1H-пиразол-4-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(5-метил-1H-пиразол-4-ил)-пропиламина.
Условия проведения ЖХ-МС 05b: tR=0,97 мин; [М+Н]+=483,05.
Пример 89:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-трет-бутоксикарбонилпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-трет-бутоксикарбонилпропиламина.
Условия проведения ЖХ-МС 05b: tR=1,21 мин; [М+Н]+=503,06. Пример 90:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-{[(3-N-трет-бутоксикарбониламинометил)-фенил]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(трет-бутоксикарбониламинометил)-бензиламина.
Условия проведения ЖХ-МС 05 с: tR=0,82 мин; [М+Н]+=580,00.
Пример 91:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-пропил-N6-(циклопропилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-(циклопропилметил)-пропиламина.
Условия проведения ЖХ-МС 05b: tR=0,93 мин; [М+Н]+=457,16.
Пример 92:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N6-трет-бутоксикарбонилпиперидин-4-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N6-трет-бутоксикарбонил-4-(аминометил)-пиперидина.
Условия проведения ЖХ-МС 05 с: tR=0,81 мин; [М+Н]+=558,03. Пример 93:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(циклогексил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и циклогексиламина. Условия проведения ЖХ-МС 05b: tR=1,22 мин; [М+Н]+=443,05.
Пример 94:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N6-трет-бутоксикарбонилпиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N6-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-амино-N6-трет-бутоксикарбонилпиперидина.
Условия проведения ЖХ-МС 05 с: tR=0,80 мин; [М+Н]+=544,04.
Пример 95:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(1S)-1-карбамоил-2-фенилэтил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (2S)-2-амино-3-фенилпропионамида.
Условия проведения ЖХ-МС 05b: tR=1,08 мин; [М+Н]+=508,04.
Пример 96:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(2S)-3,3-диметил-1-(метиламино)-1-оксобутан-2-ил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (2S)-2-амино-3,3,N-триметилбутирамида.
Условия проведения ЖХ-МС 05b: tR=1,11 мин; [М+Н]+=488,11.
Пример 97:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(4-N-трет-бутоксикарбониламинометилфенил)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ [5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(трет-бутоксикарбониламинометил)-бензиламина. Условия проведения ЖХ-МС 05 с: tR=0,82 мин; [М+Н]+=580,03.
Пример 98:
(5R*)-N6-(4-Бромфенил)-(6R*)-N6-(N6-трет-бутоксикарбонилазетидин-3-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-амино-N-трет-бутоксикарбонилазетидина.
Условия проведения ЖХ-МС 05 с: tR=0,77 мин; [М+Н]+=516,07.
Пример 99:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(N6-трет-бутоксикарбонилпиперидин-3-ил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N6-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-(N-трет-бутоксикарбонилпиперидин-3-ил)-этиламина. Условия проведения ЖХ-МС 05b: tR=1,25 мин; [М+Н]+=572,15.
Пример 100:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(1S)-2-метокси-1-бензилэтил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (1S)-1-бензил-2-метоксиэтиламина. Условия проведения ЖХ-МС 05b: tR=1,19 мин; [М+Н]+=509,01.
Пример 101:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(5-метил-3-фенилизоксазол-4-ил)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (5-метил-3-фенилизоксазол-4-ил)-метиламина.
Условия проведения ЖХ-МС 05b: tR=0,86 мин; [М+Н]+=531,77.
Пример 102:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-карбамоилэтил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 3-аминопропионамида. Условия проведения ЖХ-МС 05b: tR=0,63 мин; [М+Н]+=433,63.
Пример 103:
(5R*)-N5-(4-Бромфенил)-(6R*)-N5-(3-метоксипропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 3-метоксипропиламина.
Условия проведения ЖХ-МС 05b: tR=0,77 мин; [М+Н]+=435,12.
Пример 104:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(тетрагидрофуран-2-илметил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и тетрагидрофуран-2-илметиламина. Условия проведения ЖХ-МС 05b: tR=0,78 мин; [М+Н]+=447,12.
Пример 105:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(2-имидазолидин-2-он-1-ил)-этил]-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 2-имидазолидин-2-он-1-илэтиламина. Условия проведения ЖХ-МС 05b: tR=0,65 мин; [М+Н]+=475,14.
Пример 106:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(циклопропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида (1,0 экв.) в ДМФ (0,1 М) добавляли циклопропиламин (1,0 экв.), HATU (1,5 экв.), ДМАП (0,25 экв.) и ДИПЭА (5,0 экв.). Реакционную смесь перемешивали при КТ до завершения реакции. Затем реакционную смесь подвергали распределению между насыщенным водным раствором NH4Cl и CH2Cl2. Слои разделяли и водный слой экстрагировали с помощью CH2Cl2 (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении. Очистка остатка с помощью ФХ или ВЭЖХ давала искомое соединение.
Условия проведения ЖХ-МС 02: tR=1,03 мин; [М+Н]+=403,00.
Пример 107:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-гидроксипропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 3-аминопропанола. Условия проведения ЖХ-МС 05: tR=0,84 мин; [М+Н]+=421,07.
Пример 108:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(1H-имидазол-1-ил)-пропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 3-(1H-имидазол-1-ил)-пропиламина. Условия проведения ЖХ-МС 05b: tR=0,57 мин; [М+Н]+=471,18.
Пример 109:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(5-(диметиламино)-пентил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N6-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 5-диметиламинопентиламина. Условия проведения ЖХ-МС 05b: tR=0,58 мин; [М+Н]+=476,20.
Пример 110:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-пирролидин-1-илпропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 3-пирролидинопропиламина. Условия проведения ЖХ-МС 05b: tR=0,58 мин; [М+Н]+=474,20.
Пример 111:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(4-метилпиперазин-1-ил)-пропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 3-(4-метилпиперазин-1-ил)-пропиламина.
Условия проведения ЖХ-МС 05b: tR=0,50 мин; [М+Н]+=503,22.
Пример 112:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(4,5-диметил-1H-имидазол-2-ил)-этил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 2-(4,5-диметил-1H-имидазол-2-ил)-этиламина.
Условия проведения ЖХ-МС 05b: tR=0,59 мин; [М+Н]+=485,20.
Пример 113:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике F с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 4-(1-пирролидино)-бутиламина. Условия проведения ЖХ-МС 02: tR=0,87 мин; [М+Н]+=487,96.
Пример 114:
(5R*)-N5-(2-Бромпиридин-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 5-амино-2-бромпиридина.
Условия проведения ЖХ-МС 05: tR=0,68 мин; [М+Н]+=487,04.
Пример 115:
(5R*)-N5-(4-Метоксифенил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-метоксифениламина.
Условия проведения ЖХ-МС 05 с: tR=0,55 мин; [М+Н]+=438,29.
Пример 116:
(5R*)-N5-(2-Хлорпиридин-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 5-амино-2-хлорпиридина.
Условия проведения ЖХ-МС 05: tR=0,66 мин; [М+Н]+=443,15. Пример 117:
(5R*)-N5-(Бензотиазол-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 5-аминобензотиазола.
Условия проведения ЖХ-МС 05: tR=0,65 мин; [М+Н]+=465,18. Пример 118:
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептак]-6-карбоксамида и п-бромбензиламингидрохлорида.
Условия проведения ЖХ-МС 05: tR=0,72 мин; [М+Н]+=500,17.
Пример 119:
(5R*)-N5-(5-Бромпиридин-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-амино-5-бромпиридина.
Условия проведения ЖХ-МС 05: tR=0,69 мин; [М+Н]+=487,16.
Пример 120:
(5R*)-N6-(5-Бромтиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-амино-5-бромтиазола.
Условия проведения ЖХ-МС 05: tR=0,73 мин; [М+Н]+=493,03.
Пример 121:
(5R*)-N5-(5-Метилпиридин-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-амино-5-метилпиридина.
Условия проведения ЖХ-МС 05 с: tR=0,40 мин; [М+Н]+=423,32.
Пример 122:
(5R*)-N5-Пентил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и пентиламина. Условия проведения ЖХ-МС 05 с: tR=0,56 мин; [М+Н]+=401,96.
Пример 123:
(5R*)-N5-[(4-Метилфенил)-метил]-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-метилбензиламина.
Условия проведения ЖХ-МС 05: tR=0,72 мин; [М+Н]+=435,88.
Пример 124:
(5R*)-N5-(2-Метоксикарбонилэтил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-метоксикарбонилэтиламина.
Условия проведения ЖХ-МС 05 с: tR=0,45 мин; [М+Н]+=417,83.
Пример 125:
(5R*)-N5-(Циклогексилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и циклогексилметиламина.
Условия проведения ЖХ-МС 05 с: tR=0,56 мин; [М+Н]+=428,38.
Пример 126:
(5R*)-N5-(4-Метилциклогекс-1-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-метилциклогексиламина.
Условия проведения ЖХ-МС 05 с: tR=0,57 мин; [М+Н]+=428,39.
Пример 127:
(5R*)-N5-(5-Оксогексил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам Е, затем G с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-(2-метил-[1,3]диоксолан-2-ил)-бутиламина.
Условия проведения ЖХ-МС 02: tR=0,70 мин; [М+Н]+=430,02.
Пример 128:
(5R*)-N5-(5-Нитротиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике С с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-амино-5-нитротиазола.
Условия проведения ЖХ-МС 05: tR=0,66 мин; [М+Н]+=460,.
Пример 129:
(5R*)-N5-(5-Хлортиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике С с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-амино-5-
хлортиазола.
Условия проведения ЖХ-МС 05: tR=0,68 мин; [М+Н]+=449,13. Пример 130:
(5R*)-N5-(5-Цианотиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике С с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N61-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-харбоксамида и 2-амино-5-цианотиазола.
Условия проведения ЖХ-МС 05: tR=0,63 мин; [М+Н]+=440,23.
Пример 131:
(5R*)-N5-(Фуран-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и фуран-2-илметиламина.
Условия проведения ЖХ-МС 05 с: tR=0,47 мин; [М+Н]+=412,32.
Пример 132:
(5R*)-N5-(1-(4-Бромфенил)-этил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 1-(4-бромфенил)-этил амина.
Условия проведения ЖХ-МС 05: tR=0,77 мин; [М+Н]+=513,73.
Пример 133:
(5R*)-N5-(4-Трифторметоксифенил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-трифторметоксианилина.
Условия проведения ЖХ-МС 05: tR=0,81 мин; [М+Н]+=492,15. Пример 134:
(5R*)-N5-(2-Феноксиэтил)-(6R*)-N6-(4-пйрролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-феноксиэтиламина.
Условия проведения ЖХ-МС 05 с: tR=0,53 мин; [М+Н]+=452,30. Пример 135:
(5R*)-N5-(3-Метилбутил)-(6R*)-N6-(4-шфролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и изопентиламина. Условия проведения ЖХ-МС 05 с: tR=0,52 мин; [М+Н]+=401,97.
Пример 136:
(5R*)-N5-Бутил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и бутиламина. Условия проведения ЖХ-МС 05 с: tR=0,52 мин; [М+Н]+=388,38.
Пример 137:
(5R*)-N5-(5-Метилфуран-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (5-метилфуран-2-ил)-метиламина.
Условия проведения ЖХ-МС 05 с: tR=0,50 мин; [М+Н]+=426,33. Пример 138:
(5R*)-N5-(2-Метилбензотиазол-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 5-амино-2-метилбензотиазола.
Условия проведения ЖХ-МС 05: tR=0,68 мин; [М+Н]+=479,17.
Пример 139:
(5R*)-N5-(2-Фенилэтил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-фенилэтиламина. Условия проведения ЖХ-МС 05 с: tR=0,53 мин; [М+Н]+=436,32.
Пример 140:
(5R*)-N5-(4-Оксопентил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам Е, затем G с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3-(2-метил-[1,3]диоксолан-2-ил)-пропиламина.
Условия проведения ЖХ-МС 02: tR=0,68 мин; [М+Н]+=416,47.
Пример 141:
(5R*)-N5-(3-(1H-Имидазол-1-ил)-пропил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3-1H-имидазол-1-илпропиламина.
Условия проведения ЖХ-МС 05 с: tR=0,32 мин; [М+Н]+=440,36.
Пример 142:
(5R*)-N5-(2-Хлорпиримидин-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 5-амино-2-хлорпиримидина.
Условия проведения ЖХ-МС 05: tR=0,63 мин; [М+Н]+=444,13.
Пример 143:
(5R*)-N5-(3-Бромфенилметил)-(6R*)-N6-(4 -пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3-бромбензиламина. Условия проведения ЖХ-МС 05: tR=0,74 мин; [М+Н]+=499,62.
Пример 144:
(5R*)-N5-(Бензотиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-аминобензотиазола.
Условия проведения ЖХ-МС 05: tR=0,74 мин; [М+Н]+=465,18.
Пример 145:
(5R*)-N5-(5-трет-Бутилизоксазол-3-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3-амино-5-трет-бутилизоксазола.
Условия проведения ЖХ-МС 05: tR=0,76 мин; [М+Н]+=455,21.
Пример 146:
(5R*)-N6-(3-Метилбензо[d]изотиазол-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 5-амино-3-метилбензоизотиазола.
Условия проведения ЖХ-МС 05: tR=0,71 мин; [М+Н]+=479,19.
Пример 147:
(5R*)-N3-(1H-Индол-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 5-амино-1H-индола. Условия проведения ЖХ-МС 05: tR=0,65 мин; [М+Н]+=447,17.
Пример 148:
(5R*)-N5-(6-Фторбензотиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-амино-6-фторбензотиазола.
Условия проведения ЖХ-МС 05: tR=0,76 мин; [М+Н]+=483,10.
Пример 149:
(5R*)-N5-(2-Этилбутил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-этилбутиламина. Условия проведения ЖХ-МС 05: tR=0,75 мин; [М+Н]+=416,28.
Пример 150:
(5R*)-N5-(4-(4-Хлорфенил)-тиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-амино-4-(4-хлорфенил)-тиазола.
Условия проведения ЖХ-МС 05: tR=0,86 мин; [М+Н]+=525,10.
Пример 151:
(5R*)-N5-(Бензо[2,1,3]оксадиазол-4-ил)-(6R*)-N6-(4 -пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-аминобензо[2,1,3]оксадиазола.
Условия проведения ЖХ-МС 05: tR=0,73 мин; [М+Н]+=450,19.
Пример 152:
(5R*)-N6-(4-трет-Бутилтиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-амино-4-трет-бутилтиазола.
Условия проведения ЖХ-МС 05: tR=0,81 мин; [М+Н]+=471,19.
Пример 153:
(5R*)-N5-(3-Фенил-[1,2,4]тиадиазол-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 5-амино-3-фенил-[1,2,4]тиадиазола.
Условия проведения ЖХ-МС 05: tR=0,80 мин; [М+Н]+=492,17.
Пример 154:
(5R*)-N5-(6-Хлорбензотиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-амино-6-хлорбензотиазола.
Условия проведения ЖХ-МС 05: tR=0,82 мин; [М+Н]+=499,01.
Пример 155:
(5R*)-N5-(3-(2-Метил-1H-индол-1-ил)-пропил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6Л*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3-(2-метил-1H-индол-1-ил)-пропиламина.
Условия проведения ЖХ-МС 05: tR=0,79 мин; [М+Н]+=503,30.
Пример 156:
(5R*)-N5-(2-(1-Метил-1H-бензимидазол-2-ил)-этил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-(1-метил-1H-бензимидазол-2-ил)-этиламина.
Условия проведения ЖХ-МС 05: tR=0,48 мин; [М+Н]+=490,19.
Пример 157:
(5R*)-N5-(2-(1H-Индол-1-ил)-этил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-(1H-индол-1-ил)-этил амина.
Условия проведения ЖХ-МС 05: tR=0,70 мин; [М+Н]+=475,19.
Пример 158:
(5R*)-N5-(2-(2-Метоксифенил)-этил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-(2-метоксифенил)-этиламина.
Условия проведения ЖХ-МС 05: tR=0,72 мин; [М+Н]+=466,22.
Пример 159:
(5R*)-N6-(4-Бромфенил)-(6R*)-6-[(3-(3,5-диметилпиразол-1-ил)-пропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(3,5-диметилпиразол-1-ил)-пропионовой кислоты.
Условия проведения ЖХ-МС 05: tR=0,84 мин; [М+Н]+=497,18.
Пример 160:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(5-фенилизоксазол-4-карбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 5-фенилизоксазол-4-карбоновой кислоты.
Условия проведения ЖХ-МС 05: tR=1,09 мин; [М+Н]+=518,.
Пример 161:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(4-(2-оксопирролидин-1-ил)-бутириламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(2-оксопирролидин-1-ил)-масляной кислоты.
Условия проведения ЖХ-МС 05: tR=0,80 мин; [М+Н]+=499,65.
Пример 162:
(5R*)-N6-(4-Бромфенил)-(6R*)-6-[(2-(2-хлорфенил)-ацетиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (2-хлорфенил)-уксусной кислоты. Условия проведения ЖХ-МС 05: tR=1,00 мин; [М+Н]+=499,18.
Пример 163:
(5R*)-N6-(4-Бромфенил)-(6R*)-6-[(3-метоксипропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-метоксипропионовой кислоты. Условия проведения ЖХ-МС 05: tR=0,85 мин; [М+Н]+=433,13.
Пример 164:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-(N,N-диметиламинокарбонил)-пропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N,N-диметилсукцинамовой кислоты.
Условия проведения ЖХ-МС 05: tR=0,81 мин; [М+Н]+=474,17.
Пример 165:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(2,2-дихлор-1-метилциклопропилкарбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2,2-дихлор-1-метилциклопропанкарбоновой кислоты.
Условия проведения ЖХ-МС 05: tR=1,00 мин; [М+Н]+=497,04.
Пример 166:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(4-метоксикарбонилбутаноил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и монометилового эфира пентандикарбоновой кислоты.
Условия проведения ЖХ-МС 05: tR=0,88 мин; [М+Н]+=475,14.
Пример 167:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-(пентаноиламинометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и пентановой кислоты. Условия проведения ЖХ-МС 05: tR=0,96 мин; [М+Н]+=431,20.
Пример 168:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(2-(2,5-диметилтиазол-4-ил)-ацетиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных
веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-
этениленспиро[2.4]гептан]-5-карбоксамида и (2,5-диметилтиазол-4-ил)-уксусной кислоты.
Условия проведения ЖХ-МС 05: tR=0,89 мин; [М+Н]+=499,54.
Пример 169:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(1-фенил-1H-пиразол-5-карбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-фенил-2H-пиразол-3-карбоновой кислоты.
Условия проведения ЖХ-МС 05: tR=0,97 мин; [М+Н]+=517,14.
Пример 170:
(5R*)-N6-(4-Бромфенил)-(6R*)-6-{[(3-аминокарбонилпропионил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и сукцинамовой кислоты. Условия проведения ЖХ-МС 05: tR=0,75 мин; [М+Н]+=446,14.
Пример 171:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(4-метилпиридин-3-карбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-метилникотиновой кислоты. Условия проведения ЖХ-МС 05: tR=0,75 мин; [М+Н]+=466,20.
Пример 172:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(изобутириламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и изомасляной кислоты. Условия проведения ЖХ-МС 05: tR=0,92 мин; [М+Н]+=417,18.
Пример 173:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(N6-этилпиперидин-4-карбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-этилпиперидин-4-карбоновой кислоты.
Условия проведения ЖХ-МС 05: tR=0,72 мин; [М+Н]+=486,20.
Пример 174:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-пиридин-3-илпропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-пиридин-3-илпропионовой кислоты.
Условия проведения ЖХ-МС 05: tR=0,71 мин; [М+Н]+=480,16.
Пример 175:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[N6-(3-метоксипропионил)-N6-метиламино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-[(метиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-метоксипропионовой кислоты. Условия проведения ЖХ-МС 05: tR=0,90 мин; [М+Н]+=447,15.
Пример 176:
(5R*)-N6-(4-Бромфенил)-(6R*)-6-{[(2-хлор-3-фторфенилкарбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-хлор-3-фторбензойной кислоты. Условия проведения ЖХ-МС 05: tR=0,98 мин; [М+Н]+=503,04.
Пример 177:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(4-пирролидин-1-илбутаноиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-пирролидин-1-илмасляной кислоты.
Условия проведения ЖХ-МС 05: tR=0,73 мин; [М+Н]+=486,23.
Пример 178:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(1,5-диметил-1H-пиразол-3-карбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1,5-диметил-1H-пиразол-3-карбоновой кислоты.
Условия проведения ЖХ-МС 05: tR=0,93 мин; [М+Н]+=468,91.
Пример 179:
(5R*)-N6-(4-Бромфенил)-(6R*)-6-{[(циклопентилкарбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и циклопентанкарбоновой кислоты. Условия проведения ЖХ-МС 05: tR=0,97 мин; [М+Н]+=443,15.
Пример 180:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(2-(2-метилтиазол-4-ил)-ацетиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (2-метилтиазол-4-ил)-уксусной кислоты.
Условия проведения ЖХ-МС 05: tR=0,89 мин; [М+Н]+=485,96.
Пример 181:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(2-(N,N-диметиламино)-ацетиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и диметиламиноуксусной кислоты. Условия проведения ЖХ-МС 05: tR=0,75 мин; [М+Н]+=432,13.
Пример 182:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[N-(2-(2-хлорфенил)-ацетил)-N6-метиламино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-[(метиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (2-хлорфенил)-уксусной кислоты. Условия проведения ЖХ-МС 05: tR=1,06 мин; [М+Н]+=513,13.
Пример 183:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[N-(1,5-диметил-1H-пиразол-3-карбонил)-N6-метиламино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-[(метиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1,5-диметил-1H-пиразол-3-карбоновой кислоты.
Условия проведения ЖХ-МС 05: tR=0,91 мин; [М+Н]+=483,27.
Пример 184:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(2-циклопропилацетиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и циклопропилуксусной кислоты. Условия проведения ЖХ-МС 05: tR=0,92 мин; [М+Н]+=429,20.
Пример 185:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-(1-метил-1H-бензимидазол-2-ил)-пропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(1-метил-1H-бензимидазол-2-ил)-пропионовой кислоты.
Условия проведения ЖХ-МС 05: tR=0,78 мин; [М+Н]+=533,12.
Пример 186:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-1H-индол-3-илпропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6/?*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(1H-индол-3-ил)-пропионовой кислоты.
Условия проведения ЖХ-МС 05: tR=0,96 мин; [М+Н]+=518,20. Пример 187:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(бутаноиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и масляной кислоты. Условия проведения ЖХ-МС 02: tR=1,02 мин; [М+Н]+=417,45.
Пример 188:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-(4-фторфенил)-пропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(4-фторфенил)-пропионовой кислоты.
Условия проведения ЖХ-МС 05: tR=0,99 мин; [М+Н]+=497,16.
Пример 189:
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-фенил-акрилоиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-фенилакриловой кислоты. Условия проведения ЖХ-МС 05: tR=0,99 мин; [М+Н]+=477,13.
Пример 190:
(5R*)-N5-(4-Бромфенил)-(6/?*)-6-{[(5-хлор-1,3-диметил-1H-пиразол-4-карбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-6-(6R*)-(аминометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 5-хлор-1,3-диметил-1H-пиразол-4-карбоновой кислоты.
Условия проведения ЖХ-МС 05: tR=0,95 мин; [М+Н]+=502,99.
Пример 191:
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем G с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и [4-(2-метил-[1,3]диоксолан-2-ил)-тиазол-2-ил]-метиламина. Условия проведения ЖХ-МС 01: tR=0,66 мин; [М+Н]+=471,17.
Пример 192:
(5R*)-N5-(4-Ацетилфенил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-
(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 1-(4-аминофенил)-этанона.
Условия проведения ЖХ-МС 02: tR=0,78 мин; [М+Н]+=450,55.
Пример 193:
(5R*)-N5-(5-Метилтиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике F с использованием в качестве исходных веществ (5R*)-N5-(5-метилтиазол-2-ил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(1-пирролидино)-бутиламина. Условия проведения ЖХ-МС 02: tR=0,77 мин; [М+Н]+=429,17.
Пример 194:
(5R*)-N5-(5-Ацетилтиофен-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем G с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и [5-(2-метил-[1,3]диоксолан-2-ил)-тиофен-2-ил]-метиламина.
Условия проведения ЖХ-МС 02: tR=0,74 мин; [М+Н]+=470,48.
Пример 195:
(5R)-N5-(5-Ацетилфуран-2-илметил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике J с использованием в качестве исходных веществ (5R)-N5-(5-ацетилфуран-2-илметил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(1-пирролидино)-бутиламина.
Условия проведения ЖХ-МС 02: tR=0,71 мин; [М+Н]+=454,27.
Пример 196:
(5R)-N5-(5-Ацетилфуран-2-илметил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике J с использованием в качестве исходных веществ (5R)-N5-(5-ацетилфуран-2-илметил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 4-(1-пирролидино)-бутиламина. Условия проведения ЖХ-МС 02: tR=0,73 мин; [М+Н]+=456,18.
Пример 197:
(5R*)-N5-(4-Трифторметилфенил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-аминобензотрифторида.
Условия проведения ЖХ-МС 01: tR=0,85 мин; [М+Н]+=476,13.
Пример 198:
(5R*)-N5-(2-Ацетилоксазол-5-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к раствору (5R*)-N5-(2-[1-(трет-бутилдиметилсиланилокси)-этил]-оксазол-5-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид (1,0 экв.) в ТГФ (0,05 М) при 0°С добавляли 1 М раствор ТБАФ в ТГФ (1,5 экв.). Реакционную смесь перемешивали при КТ до завершения реакции. Реакционную смесь разбавляли с помощью ЭА, промывали рассолом (3×), сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали (5R*)-N5-(2-(1-гидроксиэтил)-оксазол-5-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид. Неочищенное вещество растворяли в AcCN (0,06 М) и обрабатывали с помощью МnO2 (5,5 экв.) при 50°С. После завершения реакции смесь фильтровали и концентрировали при пониженном давлении. Очистка с помощью ВЭЖХ давала искомое соединение.
Условия проведения ЖХ-МС 01: tR=0,66 мин; [М+Н]+=455,23.
Пример 199:
(5R*)-N5-(2-(4,5-Диметил-1H-имидазол-2-ил)-этил)-(6R*)-N6-(4-бромфенил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-бромфенил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-(4,5-диметил-1H-имидазол-2-ил)-этиламина.
Условия проведения ЖХ-МС 05 с: tR=0,59 мин; [М+Н]+=483,20.
Пример 200:
(5R*)-N6-(4-Йодфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-йодбензиламингидрохлорида.
Условия проведения ЖХ-МС 06: tR=0,68 мин; [М+Н]+=547,75.
Пример 201:
(5R*)-N5-(5-(изобутил)-изоксазол-3-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 1-(5-изобутилизоксазол-3-ил)-метиламина.
Условия проведения ЖХ-МС 06: tR=0,64 мин; [М+Н]+=468,89.
Пример 202:
(5R*)-N5-(2-Бромтиофен-4-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (2-бромтиофен-4-ил)-метиламина.
Условия проведения ЖХ-МС 06: tR=0,67 мин; [М+Н]+=506,49.
Пример 203:
(5R*)-N6-(2-Фтор-4-бромфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-бром-2-фторбензиламингидрохлорида.
Условия проведения ЖХ-МС 06: tR=0,69 мин; [М+Н]+=517,75.
Пример 204:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-диметиламино-3-оксопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике J с использованием в качестве исходных веществ
(5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-амино-N,N-диметилпропанамида. Условия проведения ЖХ-МС МК: tR=0,94 мин; [М+Н]+=460,11.
Пример 205:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-амино-4-оксобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике J с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-аминобутанамидгидрохлорида. Условия проведения ЖХ-МС МК: tR=0,87 мин; [М+Н]+=446,08.
Пример 206:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-пирролидино-3-оксопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике J с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-амино-1-(пирролидин-1-ил)пропан-1-онгидрохлорида.
Условия проведения ЖХ-МС МК: tR=0,98 мин; [М+Н]+=486,11.
Пример 207:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-амино-2-оксоэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике J с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-аминоацетамидгидрохлорида. Условия проведения ЖХ-МС МК: tR=0,84 мин; [М+Н]+=418,04.
Пример 208:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(4-этилпиперазин-1-ил)-бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(4-этилпиперазин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,57 мин; [М+Н]+=529,20.
Пример 209:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-пиперидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пиперидин-1-ил)бутан-1-амина. Условия проведения ЖХ-МС ТФК: tR=0,67 мин; [М+Н]+=500,14.
Пример 210:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(азетидин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбокс'амид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(азетидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,64 мин; [М+Н]+=472,12.
Пример 211:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-морфолинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-морфолинобутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,63 мин; [М+Н]+=502,19.
Пример 212:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(4-метил-1,4-диазепан-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике К с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(4-метил-1,4-диазепан-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,56 мин; [М+Н]+=529,19.
Пример 213:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(4-метилпиперазин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике К с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(4-метилпиперазин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,58 мин; [М+Н]+=515,17.
Пример 214:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-пирролидино-4-оксобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-амино-1-(пирролидин-1-ил)бутан-1-онгидрохлорида.
Условия проведения ЖХ-МС МК: tR=1,00 мин; [М+Н]+=500,13.
Пример 215:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(2-(2-(пирролидин-1-ил)этокси)этил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике К с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-(2-(пирролидин-1-ил)этокси)этанамингидрохлорида.
Условия проведения ЖХ-МС ТФК: tR=0,66 мин; [М+Н]+=502,15.
Пример 216:
(5R)-N5-(4-Бромфенил)-(6R)-N6-((3R,6S)-6-(пирролидин-1-илметил)тетрагидро-2H-пиран-3-ил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике К с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (3R,6S)-6-(пирролидин-1-илметил)тетрагидро-2H-пиран-3-амингидрохлорида.
Условия проведения ЖХ-МС ТФК: tR=0,68 мин; [М+Н]+=528,20.
Пример 217:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(4-ацетилпиперазин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-(4-(4-аминобутил)пиперазин-1-ил)этанона.
Условия проведения ЖХ-МС ТФК: tR=0,62 мин; [М+Н]+=543,15.
Пример 218:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(цис-4-(пирролидин-1-илметил)-циклогексил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике L с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и цис-4-(пирролидин-1-илметил)циклогексиламина.
Условия проведения ЖХ-МС ТФК: tR=0,68 мин; [М+Н]+=526,25.
Пример 219:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-((3R)-фторпирролидино)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (R)-4-(3-фторпирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,66 мин; [М+Н]+=504,18.
Пример 220:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-((3S)-фторпирролидино)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и (S)-4-(3-фторпирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,65 мин; [М+Н]+=504,.
Пример 221:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(5-пирролидинопентил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике К с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 5-(пирролидин-1-ил)пентан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,67 мин; [М+Н]+=500,14.
Пример 222:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(транс-4-(пирролидин-1-илметил)-циклогексил)-(4S,7R)-[4,7-этениленспиро[2.4]геПтан]-5,6-дикарбоксамид:
Получали по общей методике L с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гиДроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и транс-4-(пирролидин-1-илметил)циклогексиламина.
Условия проведения ЖХ-МС ТФК: tR=0,69 мин; [М+Н]+=526,19.
Пример 223:
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-метиламино-3-оксопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике N с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенил)-(6R*)-N6-(2-метоксикарбонилэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида и метиламина.
Условия проведения ЖХ-МС МК: tR=0,88 мин; [М+Н]+=446,10.
Пример 224:
(5R*)-N6-(2-Ацетилтиазол-5-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем G с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (2-(2-метил-[1,3]диоксолан-2-ил)тиазол-5-ил)метанамина.
Условия проведения ЖХ-МС ТФК: tR=0,48 мин; [М+Н]+=471,25.
Пример 225:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике К с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-пирролидин-1-илбутиламина. Условия проведения ЖХ-МС ТФК: tR=0,61 мин; [М+Н]+=493,09.
Пример 226:
(5R*)-N5-(2,6-Дифтор-4-метоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике I с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2,6-дифтор-4-метоксибензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,59 мин; [М+Н]+=488,26.
Пример 227:
(5R*)-N6-(2,3-Дифтор-4-метоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике I с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2,3-дифтор-4-метоксибензиламина.
Условия проведения ЖХ-МС МК: tR=0,73 мин; [М+Н]+=488,28.
Пример 228:
(5R*)-N6-(3-Фтор-4-метоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике I с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3-фтор-4-метоксибензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,56 мин; [М+Н]+=470,28.
Пример 229:
(5R*)-N5-(3,5-Дифтор-4-метоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике I с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3,5-дифтор-4-метоксибензиламина.
Условия проведения ЖХ-МС МК: tR=0,74 мин; [М+Н]+=488,29.
Пример 230:
(5R*)-N5-(4-Хлорфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике I с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-хлорбензиламина. Условия проведения ЖХ-МС МК: tR=0,77 мин; [М+Н]+=456,24.
Пример 231:
(5R*)-N6-(4-Фторфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике I с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-фторбензиламина. Условия проведения ЖХ-МС МК: tR=0,70 мин; [М+Н]+=440,27.
Пример 232:
(5R*)-N5-(4-Трифторметоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике I с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-трифторметоксибензиламина.
Условия проведения ЖХ-МС МК: tR=0,86 мин; [М+Н]+=506,26.
Пример 233:
(5R*)-N5-(4-Изопропоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике I с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-изопропоксибензиламина.
Условия проведения ЖХ-МС МК: tR=0,81 мин; [М+Н]+=480,33.
Пример 234:
(5R*)-N5-(4-Бромтиазол-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (4-бромтиазол-2-ил)метанамина.
Условия проведения ЖХ-МС ТФК: tR=0,52 мин; [М+Н]+=507,12.
Пример 235:
(5R*)-N3-(2-Ацетилоксазол-4-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем G с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (2-(2-метил-[1,3]диоксолан-2-ил)оксазол-4-ил)метанамина.
Условия проведения ЖХ-МС ТФК: tR=0,47 мин; [М+Н]+=455,33.
Пример 236:
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-пирролидин-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенилметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(пирролидин-1-ил)пропан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,62 мин; [М+Н]+=486,.
Пример 237:
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(3-пирролидин-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(5-бромтиазол-2-ил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(пирролидин-1-ил)пропан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,60 мин; [М+Н]+=479,09.
Пример 238:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике F с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина. Условия проведения ЖХ-МС ТФК: tR=0,65 мин; [М+Н]+=495,19.
Пример 239:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 3-аминопропанамидгидрохлорида. Условия проведения ЖХ-МС МК: tR=0,84 мин; [М+Н]+=441,06.
Пример 240:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-аминопропанамидгидрохлорида. Условия проведения ЖХ-МС МК: tR=0,79 мин; [М+Н]+=439,04.
Пример 241:
(5R)-N5-(4-Бромфенилметил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике М с использованием в качестве исходных веществ (5R)-N5-(4-бромфенилметил)-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида и NH4OH.
Условия проведения ЖХ-МС МК: tR=0,81 мин; [М+Н]+=446,11.
Пример 242:
(5R)-N5-(2-Бромпирид-5-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(2-бромпирид-5-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-аминопропанамидгидрохлорида. Условия проведения ЖХ-МС МК: tR=0,70 мин; [М+Н]+=433,07.
Пример 243:
(5R*)-N5-(4-Ацетилоксазол-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем G с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (4-(2-метил-[1,3]диоксолан-2-ил)-оксазол-2-ил)метанамина.
Условия проведения ЖХ-МС ТФК: tR=0,43 мин; [М+Н]+=455,23.
Пример 244:
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(изобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N6-(4-ацетилтиазол-2-илметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и изобутиламина. Условия проведения ЖХ-МС МК: tR=0,83 мин; [М+Н]+=402,18.
Пример 245:
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(изобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(5-бромтиазол-2-ил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и изобутиламина.
Условия проведения ЖХ-МС МК: tR=1,10 мин; [М+Н]+=424,06.
Пример 246:
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(изобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенилметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и изобутиламина.
Условия проведения ЖХ-МС МК: tR=1,10 мин; [М+Н]+=431,12.
Пример 247:
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-(1H-бензимидазол-2-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(4-ацетилтиазол-2-илметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(1H-бензо[d]имидазол-2-ил)пропан-1-амина.
Условия проведения ЖХ-МС МК: tR=0,63 мин; [М+Н]+=504,18.
Пример 248:
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(3-(1H-бензимидазол-2-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(5-бромтиазол-2-ил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(1H-бензо[d]имидазол-2-ил)пропан-1-амина.
Условия проведения ЖХ-МС МК: tR=0,83 мин; [М+Н]+=526,05.
Пример 249:
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-(1H-бензимидазол-2-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенилметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(1H-бензо[d]имидазол-2-ил)пропан-1-амина.
Условия проведения ЖХ-МС МК: tR=0,86 мин; [М+Н]+=533,15.
Пример 250:
(5R*)-N5-(2-Метоксипирид-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамидгидрохлорид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 6-метоксипиридин-3-амина.
Условия проведения ЖХ-МС ТФК: tR=0,48 мин; [М+Н]+=439,27.
Пример 251:
(5R*)-N5-(2-Бромпиразин-5-ил)-(6R*)-N6-(4 -пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамидгидрохлорид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 5-бромпиразин-2-амина.
Условия проведения ЖХ-МС ТФК: tR=0,58 мин; [М+Н]+=488,15.
Пример 252:
(5R*)-N5-(5-Трифторметилпиридин-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамидгидрохлорид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 5-(трифторметил)пиридин-2-амина.
Условия проведения ЖХ-МС ТФК: tR=0,66 мин; [М+Н]+=477,26.
Пример 253:
(5R*)-N5-(2-Метилпиридин-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамидгидрохлорид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 6-метилпиридин-3-амина.
Условия проведения ЖХ-МС ТФК: tR=0,40 мин; [М+Н]+=423,28.
Пример 254:
(5R*)-N5-(Бензо[d]оксазол-6-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамидгидрохлорид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и бензо[d]оксазол-6-амина.
Условия проведения ЖХ-МС ТФК: tR=0,51 мин; [М+Н]+=449,26.
Пример 255:
(5R*)-N5-(5-Метилизоксазол-3-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гелтан]-5,6-дикарбоксамидгидрохлорид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (5-метилизоксазол-3-ил)метанамина.
Условия проведения ЖХ-МС ТФК: tR=0,47 мин; [М+Н]+=427,25.
Пример 256:
(5R*)-N5-(4-Метилтиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамидгидрохлорид:
Получали по общей методике В с использованием в качестве исходных
веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-
(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-метилтиазол-2-амина.
Условия проведения ЖХ-МС ТФК: tR=0,52 мин; [М+Н]+=429,.
Пример 257:
(5R*)-N6-(5-Трифторметил-1,3,4-тиадиазол-2-ил)-(6R*)-N5-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамидгидрохлорид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 5-(трифторметил)-1,3,4-тиадиазол-2-амина.
Условия проведения ЖХ-МС ТФК: tR=0,62 мин; [М+Н]+=484,21.
Пример 258:
(5R)-N5-(2-Бромпиридин-5-ил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(2-бромпирид-5-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-пирролидинобутиламина. Условия проведения ЖХ-МС ТФК: tR=0,56 мин; [М+Н]+=487,20.
Пример 259:
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(2-фторэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N6-(5-бромтиазол-2-ил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-fluoroethanamine. Условия проведения ЖХ-МС МК: tR=0,94 мин; [М+Н]+=414,02.
Пример 260:
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-((2-имидазолидин-2-оп)-1-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(5-бромтиазол-2-ил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-(2-аминоэтил)имидазолидин-2-она.
Условия проведения ЖХ-МС МК: tR=0,82 мин; [М+Н]+=480,05.
Пример 261:
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-амино-3-оксопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N6-(4-ацетилтиазол-2-илметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-аминопропанамидгидрохлорида.
Условия проведения ЖХ-МС МК: tR=0,54 мин; [М+Н]+=417,14.
Пример 262:
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(4-диэтиламинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(4-ацетилтиазол-2-илметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(диэтиламино)бутиламина.
Условия проведения ЖХ-МС ТФК: tR=0,46 мин; [М+Н]+=473,30.
Пример 263:
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-этоксипропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N6-(4-бромфенилметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-этоксипропиламина.
Условия проведения ЖХ-МС МК: tR=1,03 мин; [М+Н]+=461,12.
Пример 264:
(5R*)-N6-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-пирролидинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(4-ацетилтиазол-2-илметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-(3-аминопропил)пирролидина.
Условия проведения ЖХ-МС ТФК: tR=0,44 мин; [М+Н]+=457,22.
Пример 265:
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(3-(4-метилпиперазин-1-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(5-бромтиазол-2-ил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-(3-аминопропил)-4-метилпиперазина.
Условия проведения ЖХ-МС ТФК: tR=0,53 мин; [М+Н]+=508,14.
Пример 266:
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6Л*)-N6-(2-диметиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(4-ацетилтиазол-2-илметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-диметиламиноэтиламина.
Условия проведения ЖХ-МС ТФК: tR=0,43 мин; [М+Н]+=417,18.
Пример 267:
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-диметиламинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N6-(4-ацетилтиазол-2-илметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-диметиламино-1-пропиламина.
Условия проведения ЖХ-МС ТФК: tR=0,43 мин; [М+Н]+=431,24.
Пример 268:
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-(4-метилпиперазин-1-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(4-ацетилтиазол-2-илметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-(3-аминопропил)-4-метилпиперазина.
Условия проведения ЖХ-МС ТФК: tR=0,40 мин; [М+Н]+=486,.
Пример 269:
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-((2-имидазолидин-2-оп)-1-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N6-(4-ацетилтиазол-2-илметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-(2-аминоэтил)имидазолидин-2-она.
Условия проведения ЖХ-МС МК: tR=0,58 мин; [М+Н]+=458,19.
Пример 270:
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(4-диэтиламинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N6-(5-бромтиазол-2-ил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(диэтиламино)бутиламина. Условия проведения ЖХ-МС ТФК: tR=0,62 мин; [М+Н]+=495,13.
Пример 271:
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(2-фторэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенилметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-фторэтиламингидрохлорида. Условия проведения ЖХ-МС МК: tR=0,95 мин; [М+Н]+=421,08.
Пример 272:
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(4-диэтиламинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенилметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(диэтиламино)бутиламина. Условия проведения ЖХ-МС ТФК: tR=0,64 мин; [М+Н]+=502,16.
Пример 273:
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-(4-метилпиперазин-1-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенилметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-(3-аминопропил)-4-метилпиперазина.
Условия проведения ЖХ-МС ТФК: tR=0,55 мин; [М+Н]+=515,21.
Пример 274:
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(2-диметиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенилметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-диметиламиноэтиламина. Условия проведения ЖХ-МС ТФК: tR=0,60 мин; [М+Н]+=446,16.
Пример 275:
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-((2-имидазолидин-2-оп)-1-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенилметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-(2-аминоэтил)имидазолидин-2-она.
Условия проведения ЖХ-МС МК: tR=0,84 мин; [М+Н]+=487,12.
Пример 276:
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(2-метоксиэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(5-бромтиазол-2-ил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-метоксиэтиламина. Условия проведения ЖХ-МС МК: tR=0,93 мин; [М+Н]+=426,04.
Пример 277:
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(3-диметиламинопропил)-(4S*,7R*) [4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-N5-(5-бромтиазол-2-ил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7 этениленспиро[2.4]гептан]-5-карбоксамида и 3-диметиламино-1-пропиламина. Условия проведения ЖХ-МС ТФК: tR=0,58 мин; [М+Н]+=453,10.
Пример 278:
(5R)-N5-(2-Бромпирид-5-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(2-бромпирид-5-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 3-аминопропанамидгидрохлорида. Условия проведения ЖХ-МС МК: tR=0,76 мин; [М+Н]+=435,10.
Пример 279:
(5R)-N5-(2-Бромпирид-5-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-зтиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(2-бромпирид-5-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 4-(1-пирролидино)бутиламина. Условия проведения ЖХ-МС ТФК: tR=0,60 мин; [М+Н]+=489,17.
Пример 280:
(5R)-N5-(5-Бромпирид-2-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике М с использованием в качестве исходных веществ (5R)-N5-(5-бромпирид-2-ил)-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида и NH4OH. Условия проведения ЖХ-МС МК: tR=0,79 мин; [М+Н]+=433,08.
Пример 281:
(5R)-N5-(2-Хлорпирид-5-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике М с использованием в качестве исходных веществ (5R)-N5-(2-хлорпирид-5-ил)-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида и NH4OH. Условия проведения ЖХ-МС МК: tR=0,68 мин; [М+Н]+=389,14.
Пример 282:
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике М с использованием в качестве исходных веществ (5R)-N5-(4-бром-2-фторфенилметил)-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида и NH4OH. Условия проведения ЖХ-МС МК: tR=0,83 мин; [М+Н]+=464,06.
Пример 283:
(5R?)-N5-(2-Бромтиазол-5-илметил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике М с использованием в качестве исходных веществ (5R)-N5-[(2-бромтиазол-5-ил)метил]-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида и NH4OH.
Условия проведения ЖХ-МС МК: tR=0,64 мин; [М+Н]+=453,01.
Пример 284:
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-5-гидроксикарбонил-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-бром-2-фторбензиламингидрохлорида.
Условия проведения ЖХ-МС ТФК: tR=0,64 мин; [М+Н]+=518,13.
Пример 285:
(5R)-N5-(4-Метоксифенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-5-гидроксикарбонил-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-аминоанизола. Условия проведения ЖХ-МС ТФК: tR=0,56 мин; [М+Н]+=438,25.
Пример 286:
(5R)-N5-(4-Бромфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-5-гидроксикарбонил-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-бромбензиламина. Условия проведения ЖХ-МС ТФК: tR=0,63 мин; [М+Н]+=500,10.
Пример 287:
(5R)-N5-(4-Метоксифенил)-(6R)-N6-(3-гидрокси-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Раствор (5R)-N5-(4-метоксифенил)-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида в ТГФ (0,09 М) при КТ обрабатывали 1 н. водным раствором NaOH (4,0 экв.) до завершения реакции. Реакционную смесь выливали в 2 н. водный раствор НСl и экстрагировали с помощью ЭА (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении и получали искомое соединение в виде коричневого масла. Условия проведения ЖХ-МС МК: tR=0,75 мин; [М+Н]+=385,15.
Пример 288:
(5R)-N5-(4-Бром-3-фторфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике F с использованием в качестве исходных веществ (5R)-N5-(4-бром-3-фторфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина. Условия проведения ЖХ-МС ТФК: tR=0,68 мин; [М+Н]+=504,13.
Пример 289:
(5R)-N5-(2-Хлорпиридин-5-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике F с использованием в качестве исходных веществ (5R)-N5-(2-хлорпиридин-5-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина. Условия проведения ЖХ-МС ТФК: tR=0,54 мин; [М+Н]+=443,21.
Пример 290:
(5R)-N5-(4-Метоксифенил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике М с использованием в качестве исходных веществ (5R)-N5-(4-метоксифенил)-(6R)-N5-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида и NH4OH. Условия проведения ЖХ-МС МК: tR=0,69 мин; [М+Н]+=384,19.
Пример 291:
(5R)-N5-(4-Бромфенилметил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике М с использованием в качестве исходных веществ (5R)-N5-(4-бромфенилметил)-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамида и NH4OH. Условия проведения ЖХ-МС МК: tR=0,86 мин; [М+Н]+=448,11.
Пример 292:
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике М с использованием в качестве исходных веществ (5R)-N5-(4-бром-2-фторфенилметил)-(6R)-N6-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамида и NH4OH. Условия проведения ЖХ-МС МК: tR=0,88 мин; [М+Н]+=466,10.
Пример 293:
(5R)-N5-(4-Метоксифенил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике М с использованием в качестве исходных веществ (5R)-N5-(4-метоксифенил)-(6R)-N5-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамида и NH4OH. Условия проведения ЖХ-МС МК: tR=0,76 мин; [М+Н]+=386,20.
Пример 294:
(5R)-N5-(5-Бромпиридин-2-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(5-бромпиридин-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина. Условия проведения ЖХ-МС ТФК: tR=0.63 мин; [М+Н]+=487,16.
Пример 295:
(5R)-N5-(4-Бром-2-фторфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(4-бром-2-фторфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина. Условия проведения ЖХ-МС ТФК: tR=0,67 мин; [М+Н]+=504,16.
Пример 296:
(5R)-N5-(4-Бром-2-метилфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бром-2-метилфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина. Условия проведения ЖХ-МС ТФК: tR=0,67 мин; [М+Н]+=500,14.
Пример 297:
(5R)-N5-(4-Бром-3-хлорфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике L с использованием в качестве исходных веществ (5R)-5-гидроксикарбонил-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-бром-3-хлоранилина. Условия проведения ЖХ-МС ТФК: tR=0,72 мин; [М+Н]+=520,16.
Пример 298:
(5R)-N5-(2-Хлорпиридин-5-ил)-(6R)-N5-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике М с использованием в качестве исходных веществ (5R)-N5-(2-хлорпирид-5-ил)-(6R)-N5-(2-метоксикарбонилэтил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамида и NH4OH. Условия проведения ЖХ-МС МК: tR=0,74 мин; [М+Н]+=391,15.
Пример 299:
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам В, затем Н с использованием в качестве исходных веществ (5R*)-N6-(4-ацетилтиазол-2-илметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-1,3-пропандиамина.
Условия проведения ЖХ-МС ТФК: tR=0,41 мин; [М+Н]+=403,18.
Пример 300:
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(пиперидин-4-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам В, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-ацетилтиазол-2-илметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-трет-бутоксикарбонил-4-(аминометил)пиперидина. Условия проведения ЖХ-МС ТФК: tR=0,45 мин; [М+Н]+=443,20.
Пример 301:
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(2-метиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам В, затем Н с использованием в качестве исходных веществ (5R*)-N5-(5-бромтиазол-2-ил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-N6-метилэтилендиамина.
Условия проведения ЖХ-МС ТФК: tR=0,56 мин; [М+Н]+=425,03.
Пример 302:
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(5-аминопентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-бром-2-фторбензиламингидрохлорида.
Условия проведения ЖХ-МС ТФК: tR=0,60 мин; [М+Н]+=453,04.
Пример 303:
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(4-(аминометил)фенилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам В, затем Н с использованием в качестве исходных веществ (5R*)-N6-(5-бромтиазол-2-ил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-(N-трет-бутоксикарбониламинометил)-4-(аминометил)бензола. Условия проведения ЖХ-МС ТФК: tR=0,61 мин; [М+Н]+=487,09.
Пример 304:
(5R*)-N5-5-(5-Бромтиазол-2-ил)-(6R*)-N6-(2,2-диметил-3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам В, затем Н с использованием в качестве исходных веществ (5R*)-N5-(5-бромтиазол-2-ил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(трет-бутоксикарбониламино)-2,2-диметилпропиламина. Условия проведения ЖХ-МС ТФК: tR=0,61 мин; [М+Н]+=453,09.
Пример 305:
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(2-метиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам В, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенилметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-N-метилэтилендиамина.
Условия проведения ЖХ-МС ТФК: tR=0,59 мин; [М+Н]+=432,18.
Пример 306:
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(пиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам В, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенилметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-трет-бутоксикарбонил-4-аминопиперидина.
Условия проведения ЖХ-МС ТФК: tR=0,60 мин; [М+Н]+=458,17.
Пример 307:
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам В, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенилметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-1,3-пропан диамина.
Условия проведения ЖХ-МС ТФК: tR=0,59 мин; [М+Н]+=432,06.
Пример 308:
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-(аминометил)фенилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам В, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенилметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-(N-трет-бутоксикарбониламинометил)-3-(аминометил)бензола.
Условия проведения ЖХ-МС ТФК: tR=0,64 мин; [М+Н]+=494,17.
Пример 309:
(5R*)-N6-(4-Бромфенилметил)-(6R*)-N6-(4-(аминометил)фенилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам В, затем Н с использованием в качестве исходных веществ (5R*)-N5-(4-бромфенилметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-(N6-трет-бутоксикарбониламинометил)-4-(аминометил)бензола. Условия проведения ЖХ-МС ТФК: tR=0,63 мин; [М+Н]+=494,12.
Пример 310:
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(2,2-диметил-3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам В, затем Н с использованием в качестве исходных веществ (5R*)-N6-(4-бромфенилметил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-(трет-бутоксикарбониламино)-2,2-диметилпропил амина. Условия проведения ЖХ-МС ТФК: tR=0,63 мин; [М+Н]+=460,13.
Пример 311:
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(пиперидин-4-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам В, затем Н с использованием в качестве исходных веществ (5R*)-N6-(4-бромфеншшетил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-трет-бутоксикарбонил-4-(аминометил)пиперидина. Условия проведения ЖХ-МС ТФК: tR=0,60 мин; [М+Н]+=472,16.
Пример 312:
(5R)-N5-(2-Бромтиазол-5-илметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-5-гидроксикарбонил-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (2-бромтиазол-5-ил)метанамина.
Условия проведения ЖХ-МС ТФК: tR=0,52 мин; [М+Н]+=507,13.
Пример 313:
(5R)-N5-(5-Метилпиридин-2-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(5-метилпиридин-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-аминопропанамидгидрохлорида. Условия проведения ЖХ-МС МК: tR=0,56 мин; [М+Н]+=369,19.
Пример 314:
(5R)-N5-(4-Бром-2,5-дифторфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бром-2,5-дифторфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,70 мин; [М+Н]+=522,17.
Пример 315:
(5R)-N5-(4-Бром-2,6-дифторфенил)-(6R)-N5-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бром-2,6-дифторфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,62 мин; [М+Н]+=522,17.
Пример 316:
(5R)-N5-(4-Бром-2,3-дифторфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бром-2,3-дифторфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,69 мин; [М+Н]+=522,14.
Пример 317:
(5R)-N5-(4-Бром-2,6-дифторфенилметил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-5-гидроксикарбонил-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (4-бром-2,6-дифторфенил)-метанамина.
Условия проведения ЖХ-МС ТФК: tR=0,64 мин; [М+Н]+=536,12.
Пример 318:
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(4-бром-2-фторфенилметил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,68 мин; [М+Н]+=520,20.
Пример 319:
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(5-аминопентил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(4-бром-2-фторфенилметил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-1,5-пентандиамина.
Условия проведения ЖХ-МС ТФК: tR=0,62 мин; [М+Н]+=478,13.
Пример 320:
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(4-аминобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве
исходных веществ (5R)-N5-(4-бром-2-фторфенилметил)-(6R)-6-
гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-1,4-бутандиамина.
Условия проведения ЖХ-МС ТФК: tR=0,61 мин; [М+Н]+=464,12.
Пример 321:
(5R)-N5-(4-Бром-3-фторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике F с использованием в качестве исходных веществ (5R)-N5-(4-бром-3-фторфенилметил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,65 мин; [М+Н]+=518,16.
Пример 322:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(5-аминопентил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-1,5-пентандиамина.
Условия проведения ЖХ-МС ТФК: tR=0,61 мин; [М+Н]+=453,05.
Пример 323:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пиперидин-4-ил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-амино-1-трет-бутоксикарбонилпиперидина.
Условия проведения ЖХ-МС ТФК: tR=0,57 мин; [М+Н]+=451,10.
Пример 324:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N5-(пиперидин-4-илметил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(аминометил)-1-трет-бутоксикарбонилпиперидина.
Условия проведения ЖХ-МС ТФК: tR=0,58 мин; [М+Н]+=465,16.
Пример 325:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6,N6-(3-(аминометил)пентан-1,5-диил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(трет-бутоксикарбониламинометил)пиперидина.
Условия проведения ЖХ-МС ТФК: tR=0,57 мин; [М+Н]+=465,07.
Пример 326:
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(5-аминопентил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамйд:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(4-бром-2-фторфенилметил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-1,5-пентандиамина.
Условия проведения ЖХ-МС ТФК: tR=0,64 мин; [М+Н]+=480,12.
Пример 327:
(5R)-N5-(4-Бром-2,3-дифторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N6-(4-бром-2,3-дифторфенилметил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,64 мин; [М+Н]+=536,17.
Пример 328:
(5R)-N5-(4-Бром-3,5-дифторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N6-(4-бром-3,5-дифторфенилметил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,64 мин; [М+Н]+=536,12.
Пример 329:
(5R)-N5-(4-Бром-2,5-дифторфенилметил)-(6R)-N5-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан}-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(4-бром-2,5-дифторфенилметил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,65 мин; [М+Н]+=536,22.
Пример 330:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пиперидин-4-ил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(5-бромтиаз6 л-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 4-амино-1-трет-бутоксикарбонилпиперидина.
Условия проведения ЖХ-МС ТФК: tR=0,60 мин; [М+Н]+=453,04.
Пример 331:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(изобутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и изобутиламина. Условия проведения ЖХ-МС МК: tR=1,15 мин; [М+Н]+=426,08.
Пример 332:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-трет-бутоксикарбониламинобутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-1,4-бутандиамина.
Условия проведения ЖХ-МС МК: tR=1,16 мин; [М+Н]+=541,09.
Пример 333:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(5-трет-бутоксикарбониламинопентил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-1,5-пентандиамина.
Условия проведения ЖХ-МС МК: tR=1,20 мин; [М+Н]+=555,12.
Пример 334:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(5-аминопентил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-1,5-пентандиамина.
Условия проведения ЖХ-МС ТФК: tR=0,63 мин; [М+Н]+=455,11.
Пример 335:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-аминобутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-1,4-бутандиамина.
Условия проведения ЖХ-МС ТФК: tR=0,61 мин; [М+Н]+=441,10.
Пример 336:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6,N6-(3-(аминометил)пентан-1,5-диил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 4-(трет-бутоксикарбониламинометил)пиперидина.
Условия проведения ЖХ-МС ТФК: tR=0,61 мин; [М+Н]+=467,15.
Пример 337:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пиперидин-4-илметил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 1-трет-бутоксикарбонил-4-(аминометил)пиперидина.
Условия проведения ЖХ-МС ТФК: tR=0,62 мин; [М+Н]+=467,12.
Пример 338:
(5R)-N5-(2-Бром-3-фторпиридин-5-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике F с использованием в качестве исходных веществ (5R)-N5-(2-бром-3-фторпиридин-5-ил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,61 мин; [М+Н]+=505,12.
Пример 339:
{5R*)-N5-(4-Аминобутил)-(6R*)-N6-(4-бромфенил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам А, затем Н с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-бромфенил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и N6-трет-бутоксикарбонил-1,4-бутандиамина.
Условия проведения ЖХ-МС ТФК: tR=0,63 мин; [М+Н]+=432,12.
Пример 340:
(5R*)-N5-(5-Аминопентил)-(6R*)-N6-(4-бромфенил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам А, затем Н с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-бромфенил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и N-трет-бутоксикарбонил-1,5-пентандиамина.
Условия проведения ЖХ-МС ТФК: tR=0,65 мин; [М+Н]+=446,14.
Пример 341:
(5R*)-N5-(2-(Циклогексен-1-ил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-(1-циклогексенил)этиламина.
Условия проведения ЖХ-МС ТФК: tR=0,66 мин; [М+Н]+=440,36.
Пример 342:
(5R*)-N5-(4-трет-Бутилциклогексил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-трет-бутилциклогексиламина.
Условия проведения ЖХ-МС ТФК: tR=0,78 мин; [М+Н]+=470,39.
Пример 343:
(5R*)-N6-(2-(Пиридин-2-ил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-(2-аминоэтил)пиридина.
Условия проведения ЖХ-МС ТФК: tR=0,35 мин; [М+Н]+=437,27.
Пример 344:
(5R*)-N6-(4-Ацетилтиазол-2-ил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R*)-N5-(4-ацетилтиазол-2-ил)-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,50 мин; [М+Н]+=457,26.
Пример 345:
(5R*)-N5-(4-Трифторметилтиазол-2-ил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике С с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-трифторметилтиазол-2-иламина.
Условия проведения ЖХ-МС ТФК: tR=0,64 мин; [М+Н]+=483,20.
Пример 346:
(5R*)-N5-(2,4,6-Трифторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2,4,6-трифторбензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,58 мин; [М+Н]+=476,24.
Пример 347:
(5R*)-N6-(2,4-Диметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2,4-диметилбензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,649 мин; [М+Н]+=450,31.
Пример 348:
(5R*)-N5-[(2-Ацетилтиазол-4-ил)метил]-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (2-ацетилтиазол-4-ил)-метанамина.
Условия проведения ЖХ-МС ТФК: tR=0,49 мин; [М+Н]+=471,23.
Пример 349:
(5R*)-N5-(3-Хлор-2-фторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3-хлор-2-фторбензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,62 мин; [М+Н]+=474,23.
Пример 350:
(5R*)-N5-(4-Метилоксазол-2-ил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике F с использованием в качестве исходных веществ (5R*)-N5-(4-метилоксазол-2-ил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина. Условия проведения ЖХ-МС ТФК: tR=0,46 мин; [М+Н]+=413,25.
Пример 351:
(5R*)-N5-[(5-Ацетилтиазол-2-ил)метил]-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем G с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (5-(2-метил-[1,3]диоксолан-2-ил)тиазол-2-ил)метанамина. Условия проведения ЖХ-МС ТФК: tR=0,46 мин; [М+Н]+=471,23.
Пример 352:
(5R*)-N5-(3-Ацетилфенил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 1-(3-аминофенил)этанона.
Условия проведения ЖХ-МС ТФК: tR=0,55 мин; [М+Н]+=450,28.
Пример 353:
(5R*)-N5-(2-Бром-4-фторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-бром-4-фторбензиламингидрохлорида.
Условия проведения ЖХ-МС ТФК: tR=0,63 мин; [М+Н]+=518,18.
Пример 354:
(5R*)-N5-(3-Бром-4-фторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3-бром-4-фторбензиламингидрохлорида.
Условия проведения ЖХ-МС ТФК: tR=0,63 мин; [М+Н]+=518,21.
Пример 355:
(5R*)-N5-(2,3,5-Трифторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2,3,5-трифторбензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,60 мин; [М+Н]+=476,26.
Пример 356:
(5R*)-N6-[(4-Метил-1,2,5-оксадиазол-3-ил)метил]-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (4-метил-1,2,5-оксадиазол-3-ил)метанамингидрохлорида.
Условия проведения ЖХ-МС ТФК: tR=0,48 мин; [М+Н]+=428,26.
Пример 357:
(5R*)-N5-(2-Фтор-3-трифторметилфенилметил)-(6R*)-N5-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-фтор-3-(трифторметил)бензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,65 мин; [М+Н]+=508,25.
Пример 358:
(5R*)-N5-(3,5-Диметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3,5-диметилбензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,66 мин; [М+Н]+=450,31.
Пример 359:
(5R*)-N5-(3-Ацетилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем G с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (3-(2-метил-[1,3]диоксолан-2-ил)-фенил)метанамина. Условия проведения ЖХ-МС ТФК: tR=0,52 мин; [М+Н]+=464,28.
Пример 360:
(5R*)-N6-(3-Дифторметоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3-(дифторметокси)бензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,60 мин; [М+Н]+=488,27.
Пример 361:
(5R*)-N5-[(2-Метоксипиридин-4-ил)метил]-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (2-метоксипиридин-4-ил)метанамина.
Условия проведения ЖХ-МС ТФК: tR=0,40 мин; [М+Н]+=453,25.
Пример 362:
(5R*)-N5-(3-Фтор-5-трифторметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3-фтор-5-(трифторметил)бензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,66 мин; [М+Н]+=508,27.
Пример 363:
(5R*)-N5-(4-Ацетилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 1-(4-(аминометил)фенил)этанона.
Условия проведения ЖХ-МС ТФК: tR=0,51 мин; [М+Н]+=464,24.
Пример 364:
(5R*)-N5-(2-Хлор-5-трифторметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-хлор-5-(трифторметил)бензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,68 мин; [М+Н]+=524,22.
Пример 365:
(5R*)-N5-(2-Фтор-5-трифторметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-фтор-5-(трифторметил)бензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,65 мин; [М+Н]+=508,24.
Пример 366:
(5R*)-N6-(4-Фтор-3-трифторметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-фтор-3-(трифторметил)бензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,66 мин; [М+Н]+=508,26.
Пример 367:
(5R*)-N5-[(2,6-Дихлорпиридин-4-ил)метил]-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (2,6-дихлорпиридин-4-ил)метанамина.
Условия проведения ЖХ-МС ТФК: tR=0,58 мин; [М+Н]+=491,18.
Пример 368:
(5R*)-N5-(2,5-Диметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2,5-диметилбензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,64 мин; [М+Н]+=450,30.
Пример 369:
(5R*)-N5-(4,5-Диметилтиазол-2-ил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике F с использованием в качестве исходных веществ (5R*)-N6-(4,5-диметилтиазол-2-ил)-(6R*)-6-этоксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,55 мин; [М+Н]+=443,25.
Пример 370:
(5R*)-N5-(2-Метокси-5-метилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (2-метокси-5-метилфенил)метанамингидрохлорида.
Условия проведения ЖХ-МС ТФК: tR=0,62 мин; [М+Н]+=466,32.
Пример 371:
(5R*)-N5-(2-Хлор-3,6-дифторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-хлор-3,6-дифторбензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,61 мин; [М+Н]+=492,20.
Пример 372:
(5R*)-N5-(2-Изопропоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и (2-изопропоксифенил)метанамина.
Условия проведения ЖХ-МС ТФК: tR=0,66 мин; [М+Н]+=480,31.
Пример 373:
(5R*)-N5-(2-Хлор-6-фтор-3-метилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике А с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-хлор-6-фтор-3-метилбензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,64 мин; [М+Н]+=488,27.
Пример 374:
(5R*)-N5-(3-Хлор-4-метоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике N с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3-хлор-4-метоксибензиламингидрохлорида.
Условия проведения ЖХ-МС МК: tR=0,75 мин; [М+Н]+=486,24.
Пример 375:
(5R*)-N5-(3,4-Диметоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике N с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3,4-диметоксибензиламина.
Условия проведения ЖХ-МС МК: tR=0,64 мин; [М+Н]+=482,32.
Пример 376:
(5R*)-N5-(2,4-Диметоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике N с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2,4-диметоксибензиламина.
Условия проведения ЖХ-МС МК: tR=0,73 мин; [М+Н]+=482,30.
Пример 377:
(5R*)-N5-(2-(3,4-Диметоксифенил)этил)-(6R*)-У5-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике N с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-(3,4-диметоксифенил)этиламина.
Условия проведения ЖХ-МС ТФК: tR=0,56 мин; [М+Н]+=496,30.
Пример 378:
(5R*)-N5-(2-(4-Метоксифенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике N с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-(4-метоксифенил)этиламина.
Условия проведения ЖХ-МС ТФК: tR=0,58 мин; [М+Н]+=466,32.
Пример 379:
(5R*)-N5-(2-(4-Бромфенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике N с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-bromophenethylamine.
Условия проведения ЖХ-МС ТФК: tR=0,65 мин; [М+Н]+=514,23.
Пример 380:
(5R*)-N5-(2-(3,4-Диметилфенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике N с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3,4-диметилфенетиламингидрохлорида.
Условия проведения ЖХ-МС ТФК: tR=0,67 мин; [М+Н]+=464,28.
Пример 381:
(5R*)-N5-(2-(4-Метилфенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике N с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2-(п-толил)этиламина.
Условия проведения ЖХ-МС ТФК: tR=0,63 мин; [М+Н]+=450,33.
Пример 382:
(5R*)-N5-(2-(4-Фторфенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике N с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-фторфенетиламина.
Условия проведения ЖХ-МС ТФК: tR=0,59 мин; [М+Н]+=454,29.
Пример 383:
(5R*)-N5-(2-(Бензо[d][1,3]диоксол-5-ил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике N с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3,4-метилендиоксифенетиламингидрохлорида.
Условия проведения ЖХ-МС ТФК: tR=0,57 мин; [М+Н]+=480,28.
Пример 384:
(5R*)-N5-(2-(3-Бром-4-метоксифенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике N с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 3-бром-4-метоксифенетиламина.
Условия проведения ЖХ-МС ТФК: tR=0,63 мин; [М+Н]+=544,22.
Пример 385:
(5R*)-N5-(2-(2,4-Диметилфенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике N с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 2,4-диметилфенетиламина.
Условия проведения ЖХ-МС ТФК: tR=0,67 мин; [М+Н]+=464,32.
Пример 386:
(5R*)-N5-(4-Этоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике N с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 4-этоксибензиламина.
Условия проведения ЖХ-МС ТФК: tR=0,60 мин; [М+Н]+=466,32.
Пример 387:
(5R)-N5-(2-(4-Хлорфенил)этил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(2-(4-хлорфенил)этил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина. Условия проведения ЖХ-МС ТФК: tR=0,64 мин; [М+Н]+=470,25.
Пример 388:
(5R)-N5-(2-(4-Хлорфенил)этил)-(6R)-N6-(2-диметиламиноэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R)-N5-(2-(4-хлорфенил)этил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-диметиламиноэтиламина. Условия проведения ЖХ-МС ТФК: tR=0,61 мин; [М+Н]+=416,21.
Пример 389:
(5R)-N5-(2-(4-Хлорфенил)этил)-(6R)-N6-(2-(пиридин-2-ил)этил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R)-N5-(2-(4-хлорфенил)этил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 2-(2-аминоэтил)пиридина. Условия проведения ЖХ-МС МК: tR=0,80 мин; [М+Н]+=450,21.
Пример 390:
(5R)-N5-(2-(4-Хлорфенил)этил)-(6R)-N6-(2-(4-аминосульфонилфенил)-этил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике D с использованием в качестве исходных веществ (5R)-N5-(2-(4-хлорфенил)этил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(2-аминоэтил)бензолсульфонамида.
Условия проведения ЖХ-МС МК: tR=0,95 мин; [М+Н]+=528,16.
Пример 391:
(5R)-N5-(2-(2,4-Дихлорфенил)этил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(2-(2,4-дихлорфенил)этил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,69 мин; [М+Н]+=504,22.
Пример 392:
(5R)-N5-(2-(4-Хлорфенил)этил)-(6R)-N6-(N6-изопентилпиперидин-4-ил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(2-(4-хлорфенил)этил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 1-(3-метилбутил)-пиперидин-4-иламингидрохлорида.
Условия проведения ЖХ-МС ТФК: tR=0,70 мин; [М+Н]+=498,30.
Пример 393:
(5R)-N5-(4-Бром-3,5-дифторфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике F с использованием в качестве исходных веществ (5R)-N5-(4-бром-3,5-дифторфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,71 мин; [М+Н]+=522,13.
Пример 394:
(5R)-N5-(4-Бромтиазол-2-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
В высушенной пламенем круглодонной колбе, снабженной стержнем для магнитной мешалки, и в инертной атмосфере (N2) к свежеприготовленному раствору диизопропиламида лития (3,4 экв.) в ТГФ (0,3 М) при 0°С добавляли 0,1 М раствор (5R)-N5-(5-бромтиазол-2-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамида. Реакционную смесь перемешивали при 0°С до завершения реакции. Добавляли воду (3,0 экв.) и смесь перемешивали при КТ в течение 15 ч, разбавляли с помощью ЭА, промывали рассолом, сушили над Na2SO4, фильтровали и растворители удаляли при пониженном давлении. Очистка с помощью ФХ давала искомое соединение.
Условия проведения ЖХ-МС ТФК: tR=0,59 мин; [М+Н]+=493,15.
Пример 395:
(5R)-N5-(4-Бром-3-трифторметилфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике F с использованием в качестве исходных веществ (5R)-N5-(4-бром-3-трифторметилфенил)-(6R)-6-метоксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,75 мин; [М+Н]+=554,16.
Пример 396:
(5R*)-N5-[(4-Ацетилтиазол-2-ил)метил]-(6R*)-N6-(2-метиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам В, затем Н с использованием в качестве исходных веществ (5R*)-N5-[(4-ацетилтиазол-2-ил)метил]-(6R*)-6-гидроксикарбонил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-N-метилэтилендиамина. Условия проведения ЖХ-МС ТФК: tR=0,42 мин; [М+Н]+=403,19.
Пример 397:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(2,5-диметилпирролидин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(2,5-диметилпирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,69 мин; [М+Н]+=514,19.
Пример 398:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(пирролидин-1-ил)пентил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)пентан-1-амингидрохлорида.
Условия проведения ЖХ-МС ТФК: tR=0,67 мин; [М+Н]+=500,16.
Пример 399:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(3-фтор-4-(пирролидин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 3-фтор-4-(пирролидин-1-ил)бутан-1-амингидрохлорида.
Условия проведения ЖХ-МС ТФК: tR=0,66 мин; [М+Н]+=504,.
Пример 400:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(2-(метоксиметил)пирролидин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(2-(метоксиметил)пирролидин-1 ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,68 мин; [М+Н]+=530,20.
Пример 401:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(3,3-дифторпирролидин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид, формиат:
Получали по общей методике Е с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и 4-(3,3-дифторпирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,67 мин; [М+Н]+=522,14.
Пример 402: '
(5R)-N5-(2-Бром-3-фторпиридин-5-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике F с использованием в качестве исходных веществ (5R)-N5-(2-бром-3-фторпиридин-5-ил)-(6R)-6-метоксикарбонил-(4S,7R) [4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 4-(пирролидин-1-ил)бутан-1-амина.
Условия проведения ЖХ-МС ТФК: tR=0,65 мин; [М+Н]+=507,17.
Пример 403:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(2-гидроксиэтил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и этаноламина. Условия проведения ЖХ-МС МК: tR=0,87 мин; [М+Н]+=414,03.
Пример 404:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(3-гидроксипропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 3-аминопропан-1-ола. Условия проведения ЖХ-МС МК: tR=0,90 мин; [М+Н]+=428,03.
Пример 405:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-гидроксибутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 4-аминобутан-1-ола. Условия проведения ЖХ-МС МК: tR=0,92 мин; [М+Н]+=442,06.
Пример 406:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(2-метил-3-гидроксипроп-2-ил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 2-амино-2-метилпропан-1-ола. Условия проведения ЖХ-МС МК: tR=1,00 мин; [М+Н]+=442,06.
Пример 407:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(2-(2-гидроксиэтокси)этил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 2-(2-аминоэтокси)этанола. Условия проведения ЖХ-МС МК: tR=0,88 мин; [М+Н]+=458,05.
Пример 408:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-гидроксициклогексил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и транс-4-аминоциклогексанолгидрохлорида.
Условия проведения ЖХ-МС МК: tR=0,96 мин; [М+Н]+=468,06.
Пример 409:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-[(1-гидроксициклогексил)метил]-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 1-аминометил-1-циклогексанолгидрохлорида.
Условия проведения ЖХ-МС МК: tR=1,08 мин; [М+Н]+=482,08.
Пример 410:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(транс-4-(гидроксиметил)-циклогексил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и (транс-4-аминоциклогексил)метанола.
Условия проведения ЖХ-МС МК: tR=1,01 мин; [М+Н]+=482,09.
Пример 411:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(цис-4-(гидроксиметил)-циклогексил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общей методике I с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и (цис-4-аминоциклогексил)метанола. Условия проведения ЖХ-МС МК: tR=0,99 мин; [М+Н]+=482,08.
Пример 412:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пирролидин-3-ил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 3-амино-1-трет-бутоксикарбонилпирролидингидрохлорида.
Условия проведения ЖХ-МС 07: tR=0,60 мин; [М+Н]+=439,41.
Пример 413:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(2-(N-метиламино)-этил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N6-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и N-трет-бутоксикарбонил-N-метилэтилендиамина.
Условия проведения ЖХ-МС 07: tR=0,60 мин; [М+Н]+=427,16.
Пример 414:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(3-(N6-метиламино)-пропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и трет-бутилового эфира N-(3-аминопропил)-N-метилкарбаминовой кислоты.
Условия проведения ЖХ-МС 07: tR=0,61 мин; [М+Н]+=441,16.
Пример 415:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пиперидин-3-ил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 3-амино-N-трет-бутоксикарбонилпиперидина.
Условия проведения ЖХ-МС 07: tR=0,61 min; [М+Н]+=453,20.
Пример 416:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-[(пирролидин-2-ил)-метил]-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 2-аминометил-N6-трет-бутоксикарбонилпирролидина.
Условия проведения ЖХ-МС 07: tR=0,62 мин; [М+Н]+=453,20.
Пример 417:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-[(пиперидин-2-ил)-метил]-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 2-аминометил-N-трет-бутоксикарбонилпиперидина.
Условия проведения ЖХ-МС 07: tR=0,63 мин; [М+Н]+=467,23.
Пример 418:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-[(пиперидин-3-ил)-метил]-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 3-аминометил-N6-трет-бутоксикарбонилпиперидина.
Условия проведения ЖХ-МС 07: tR=0,62 мин; [М+Н]+=467,22.
Пример 419:
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(азетидин-3-ил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам I, затем Н с использованием в качестве исходных веществ (5R)-N5-(5-бромтиазол-2-ил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5-карбоксамида и 3-амино-N6 трет-бутоксикарбонилазетидина.
Условия проведения ЖХ-МС 07: tR=0,60 мин; [М+Н]+=425,15.
Пример 420:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(цис-4-(аминометил)-циклогексил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам L, затем Н с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и трет-бутил-((цис-4-аминоциклогексил)метил)карбамата.
Условия проведения ЖХ-МС 07b: tR=0,69 мин; [М+Н]+=472,07.
Пример 421:
(5R)-N5-(4-Бромфенил)-(6R)-N6-(транс-4-(аминометил)-циклогексил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид:
Получали по общим методикам L, затем Н с использованием в качестве исходных веществ (5R)-N5-(4-бромфенил)-(6R)-6-гидроксикарбонил-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамида и трет-бутил-((транс-4-аминоциклогексил)метил)карбамата.
Условия проведения ЖХ-МС 07b: tR=0,70 мин; [М+Н]+=472,09.
Пример 422:
(5R*)-N6-(2-Трифторметилпиридин-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамидгидрохлорид:
Получали по общей методике В с использованием в качестве исходных веществ (5R*)-5-гидроксикарбонил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-6-карбоксамида и 5-амино-2-(трифторметил)пиридина.
Условия проведения ЖХ-МС ТФК: tR=0,60 мин; [М+Н]+=477,20.
II. Биологические исследования Исследование in vitro
Агонистическую активность соединений формулы (I) по отношению к рецептору ALX и FPRL2 определяют по описанной ниже экспериментальной методике.
Экспериментальная методика:
Определение содержания внутриклеточного кальция:
Клетки, экспрессирующие рекомбинантный рецептор ALX человека и белок G Gα16 (HEK293-hALXR-Gα16), выращивали до слияния 80% в среде для выращивания (СВ). Клетки отделяли от культуральных матрацев с помощью буфера для отделения клеток (Invitrogen, 13151-014) и собирали центрифугированием при 1000 об/мин при КТ в течение 5 мин в буфере для анализа (БА) (равные части сбалансированного солевого раствора Хенкса (Gibco, 14065-049) и МИСД без добавления фенолового красного (Gibco, 11880-028)). После инкубирования в течение 60 мин при 37°С и 5% CO2 в БА, к которому добавляли 1 мкМ Fluo-4 (AM) (Invitrogen, F14202) и 20 мМ HEPES (N-2-гидроксиэтилпиперазин-N-2-этансульфоновая кислота) (Gibco, 15630-056), клетки промывали и повторно суспендировали в БА. Затем их высевали в 384-луночные планшеты для анализа ФВСУП (Greiner, 781091) по 50000 клеток в 70 мкл на лунку и осаждали центрифугированием при 1000 об/мин в течение 1 мин. Исходные растворы исследуемых соединений готовили при концентрации, равной 10 мМ, в ДМСО и серийно разводили в БА до концентраций, необходимых для получения зависимостей доза - ответ. WKYMVm (Phoenix Peptides) использовали в качестве агониста сравнения. FLIPR384 или ФВСУП Tetra instruments (Molecular Devices) использовали в соответствии со стандартными инструкциями изготовителя, добавляя 4 мкл исследуемого соединения, растворенного в 10 мМ в ДМСО, и до проведения эксперимента разводили в буфере для анализа и получали необходимые конечные концентрации. Изменения интенсивности флуоресценции определяли до и после добавления исследуемых соединений при длине волны возбуждения=488 нм и длине волны испускания=540 нм. Интенсивности пиков испускания относительно базового уровня после добавления соединений использовали после вычитания значения для базовой линии. Значения нормировали на значение для контроля с высокой активностью (соединение WKYMVm, конечная концентрация 10 нМ) после вычитания значения для базовой линии (добавление БА).
Клетки, экспрессирующие рекомбинантный FPRL2 человека и белок G Gα16 (HEK293-hFPRL2-Gα16), выращивали до слияния 80% в среде для выращивания (СВ). Клетки отделяли от культуральных матрацев с помощью буфера для отделения клеток (Invitrogen, 13151-014) и собирали центрифугированием при 1000 об/мин при КТ в течение 5 мин в буфере для анализа (БА) (равные части сбалансированного солевого раствора Хенкса (Gibco, 14065-049) и МИСД без добавления фенолового красного (Gibco, 11880-028)). После инкубирования в течение 60 мин при 37°С и 5% CO2 в БА, к которому добавляли 1 мкМ Fluo-4 (AM) (Invitrogen, F14202) и 20 мМ HEPES (Gibco, 15630-056), клетки промывали и повторно суспендировали в БА. Затем их высевали в 384-луночные планшеты для анализа ФВСУП (Greiner, 781091) по 50000 клеток в 70 мкл на лунку и осаждали центрифугированием при 1000 об/мин в течение 1 мин. Исходные растворы исследуемых соединений готовили при концентрации, равной 10 мМ, в ДМСО и серийно разводили в БА до концентраций, необходимых для получения зависимостей доза - ответ. Gly 14-Гуманин (петид гуманин с заменой серина на глицин в положении 14, Phoenix Peptides) в качестве агониста сравнения. FLIPR384 или ФВСУП Tetra instruments (Molecular Devices) использовали в соответствии со стандартными инструкциями изготовителя, добавляя 4 мкл исследуемого Соединения, растворенного в 10 мМ в ДМСО, и до проведения эксперимента разводили в буфере для анализа и получали необходимые конечные концентрации. Изменения интенсивности флуоресценции определяли до и после добавления исследуемых соединений при длине волны возбуждения=488 нм и длине волны испускания=540 нм. Интенсивности пиков испускания относительно базового уровня после добавления соединений использовали после вычитания значения для базовой линии. Значения нормировали на значение для контроля с высокой активностью (соединение GLY14-гуманин, конечная концентрация 100 нМ) после вычитания значения для базовой линии (добавление БА).
Агонистическая активность приведенных в качестве примеров соединений представлена в таблице 1.
Реферат
Изобретение относится к мостиковым производным спиро[2.4]гептана формулы (I), в которой W обозначает -CHCH- или -СН=СН-; Z обозначает -C(O)NR-* или -CHNRC(O)-*, Y обозначает связь или (C-C)алкандиильную группу , R-Rявляются такими, как определено в описании, их получению и применению в качестве агонистов рецептора ALX и/или FPRL2 для лечения воспалительных и обструктивных заболеваний дыхательных путей. 3 н. и 11 з.п. ф-лы, 1 табл., 422 пр.
Формула
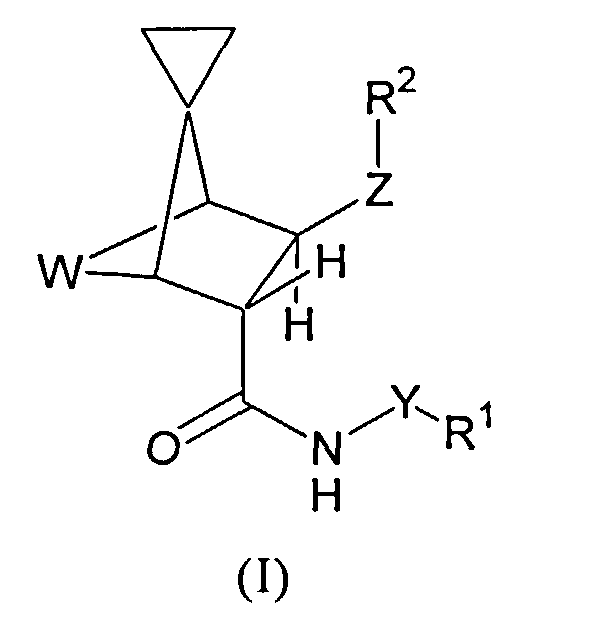
в которой
W обозначает -CH2CH2- или -СН=СН-;
Y обозначает связь или (C1-C4)алкандиильную группу и R1 обозначает
- арильную или гетероарильную группу и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (C1-C4)алкил, (C1-C4)алкоксигруппу, (C1-C2)алкилкарбонил, (C1-C2)фторалкил, (C1-C2)фторалкоксигруппу, нитрогруппу, цианогруппу и фенил, где фенил является незамещенным или монозамещенным галогеном; или
- бензо[d][1,3]диоксолил; или
- арилоксигруппу; или
- циклогексильную или циклогексенильную группу и эти группы независимо являются незамещенными или монозамещенными (C1-С4)алкилом; или
- (C1-C2)алкилкарбонил; или
- (C1-C4)алкоксикарбонил;
или Y вместе с R1 обозначает (C4-C6)алкильную группу или амино-(C4-C6)алкильную группу;
Z обозначает -C(O)NR3-* или -CH2NR4C(O)-*,
где звездочки обозначают связь, соединяющую с R2;
R2 обозначает
- (C3-C6)циклоалкил, который является незамещенным или монозамещенным гидроксигруппой, гидроксиметилом, R5R6N-CH2-, гетероциклилметилом или -CONH2; или
- (C1-C6)алкил, который является незамещенным или монозамещенным фтором, трифторметилом, (C1-C4)алкилтиогруппой, (C1-C4)алкоксикарбонилом, гидроксигруппой, цианогруппой, -NR5R6, -СООН, -C(O)NR7R8 или необязательно монозамещенным (C1-C4)алкоксигруппой, где заместитель выбран из группы, включающей гидроксигруппу и гетероциклил; или
- (C1-C6)алкил, который является монозамещенным
- (C3-C6)циклоалкилом и этот циклоалкил является незамещенным или монозамещенным группой -NR5R6 или гидроксигруппой;
- гетероциклилом и этот гетероциклил является незамещенным или монозамещенным по атому азота (C1-C4)алкилом, (C1-C2)алкилкарбонилом или трет-бутоксикарбонилом, и/или моно- или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей галоген, (C1-C4)алкил и (C1-C2)алкокси-(C1-C2)алкил; или
- арильной или гетероарильной группой и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (C1-C4)алкил, -CH2NHR9, -SO2NH2 и фенил; или
- (C3-C5)фторалкил, который является монозамещенным гетероциклилом, и этот гетероциклил является незамещенным или моно- или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей галоген и (C1-C4)алкил; или
- гетероциклил, который является незамещенным или монозамещенным по атому азота (C1-C6)алкилом, бензилом или трет-бутоксикарбонилом или монозамещенным по атому углерода пирролидин-1-илметилом; или
- арильную или гетероарильную группу и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (C1-C4)алкил и фенил; или
- группу, выбранную из группы, включающей 1-карбамоил-2-фенилэтил, 1-метоксиметил-2-фенилэтил, 2-морфолино-2-фенилэтил, 2-фенилвинил, 2,2-дихлор-1-метилциклопропил;
R3 обозначает водород, (C1-C3)алкил или 2-метоксиэтил; или
R2 и R3 вместе со связанным с ними атомом азота образуют 5-7-членное кольцо и это кольцо замещено амино-(C1-C4)алкилом;
R4 обозначает водород или метил;
R5 обозначает водород, (C1-C3)алкил или трет-бутоксикарбонил;
R6 обозначает водород или (C1-C3)алкил;
R7 и R8 независимо друг от друга обозначают водород или метил; или
R7 и R8 вместе со связанным с ними атомом азота образуют пирролидиновое или пиперидиновое кольцо; и
R9 обозначает водород или трет-бутоксикарбонил;
где
термин "арил" означает фенильную или нафтильную группу;
термин "арилоксигруппа" означает группу арил-О-, где арильная группа является такой, как определено выше;
термин "гетероарил" означает 5-10-членное моноциклическое или бициклическое ароматическое кольцо, содержащее 1, 2 или 3 гетероатома, независимо выбранных из группы, включающей кислород, азот и серу;
термин "гетероциклил" означает 4-7-членное насыщенное моноциклическое кольцо, содержащее 1 или 2 гетероатома, независимо выбранных из группы, включающей серу, кислород и азот, где 1 или 2 метиленовые группы, соседние с атомом азота, необязательно замещены карбонильными группами; или фармацевтически приемлемая соль такого соединения.
W обозначает -CH2-CH2- или -СН=СН-;
Y обозначает связь;
R1 обозначает арильную или гетероарильную группу и эти группы независимо являются незамещенными, моно-, ди- или тризамещенными, где заместители независимо выбраны из группы, включающей галоген, (C1-C4)алкил, (C1-C4)алкоксигруппу, (C1-C2)алкилкарбонил, и (C1-C2)фторалкил;
Z обозначает -C(O)NR3-*,
где звездочка обозначает связь, соединяющую с R2;
R2 обозначает
- (C3-C6)циклоалкил, который является незамещенным или монозамещенным гидроксигруппой или пирролидин-1-илметилом; или
- (C1-C6)алкил, который является незамещенным или монозамещенным фтором, трифторметилом, (C1-C4)алкилтиогруппой, гидроксигруппой, цианогруппой, -NR5R6, -C(O)NH2 или необязательно монозамещенным (C1-C4)алкоксигруппой, где заместитель выбран из группы, включающей гидроксигруппу и гетероциклил; или
- (C1-C5)алкил, который является монозамещенным
- гетероциклилом и этот гетероциклил является незамещенным или монозамещенным по атому азота метилом или этилом, или моно- или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей фтор, метил и метоксиметил; или
- арильной или гетероарильной группой и эти группы независимо являются незамещенными, моно- или дизамещенными, где заместители независимо выбраны из группы, включающей (C1-C4)алкил и -CH2NH2; или
- (C3-C5)фторалкил, который является монозамещенным гетероциклилом; или
- гетероциклил, который является незамещенным или монозамещенным по атому углерода пирролидин-1-илметилом;
R3 обозначает водород, (C1-C3)алкил или 2-метоксиэтил;
R5 обозначает водород, (C1-C3)алкил или трет-бутоксикарбонил; и
R6 обозначает водород или (C1-C3)алкил;
или фармацевтически приемлемая соль такого соединения.
Y обозначает связь;
или фармацевтически приемлемая соль такого соединения.
R1 обозначает арильную или гетероарильную группу и эти группы независимо являются незамещенными или монозамещенными, где заместитель выбран из группы, включающей галоген, (C1-C4)алкил, (C1-C4)алкоксигруппу, (C1-C2)алкилкарбонил и (C1-C2)фторалкил;
или фармацевтически приемлемая соль такого соединения.
Z обозначает -C(O)NR3-*, где звездочка обозначает связь, соединяющую с R2;
или фармацевтически приемлемая соль такого соединения.
(C3-C6)циклоалкил, который является незамещенным или монозамещенным гидроксигруппой или пирролидин-1-илметилом; или
(C1-C6)алкил, который является незамещенным или монозамещенным фтором, трифторметилом, (C1-C4)алкилтиогруппой, гидроксигруппой, цианогруппой, -NR5R6, -C(O)NH2 или необязательно монозамещенным (C1-C4)алкоксигруппой, где заместитель выбран из группы, включающей гидроксигруппу и гетероциклил; или
(C1-C5)алкил, который является монозамещенным гетероциклилом, и этот гетероциклил является незамещенным или монозамещенным по атому азота метилом или этилом, или моно- или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей фтор, метил и метоксиметил; или
(C1-C5)алкил, который является монозамещенным арильной или гетероарильной группой, и эти группы независимо являются незамещенными, моно- или дизамещенными, где заместители независимо выбраны из группы, включающей (C1-C4)алкил и -CH2NH2; или
(C3-C5)фторалкил, который является монозамещенным гетероциклилом; или гетероциклил, который является незамещенным или монозамещенным по атому углерода пирролидин-1-илметилом;
или фармацевтически приемлемая соль такого соединения.
R2 обозначает (С1-C6)алкил, который является незамещенным или монозамещенным фтором, трифторметилом, (C1-C4)алкилтиогруппой, гидроксигруппой, цианогруппой, -NR5R6, -C(O)NR7R8 или необязательно монозамещенным (C1-C4)алкоксигруппой, где заместитель выбран из группы, включающей гидроксигруппу и гетероциклил;
или фармацевтически приемлемая соль такого соединения.
R2 обозначает (C1-C5)алкил, который является монозамещенным гетероциклилом, и этот гетероциклил является незамещенным или монозамещенным по атому азота метилом или этилом, или моно- или дизамещенным по одному или двум из атомов углерода, где заместители независимо выбраны из группы, включающей фтор, метил и метоксиметил; или фармацевтически приемлемая соль такого соединения.
R2 обозначает (C1-C4)алкил, который является монозамещенным арильной или гетероарильной группой, и эти группы независимо являются незамещенными, моно- или дизамещенными, где заместители независимо выбраны из группы, включающей (C1-C4)алкил и -CH2NH2;
или фармацевтически приемлемая соль такого соединения.
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(5-аминопентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(пиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-изобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-аминобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R)-N6-(2-N,N-диметиламиноэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-((3-аминометилфенил)-метил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-пиперидинилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(пирролидин-3-ил)-(4S,*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2,2-диметил-3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-(N,N-диэтиламино)-бутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(3-гидроксипропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R*)-N6-(2-карбамоилэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-трет-бутоксикарбонилпирролидин-3-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(циклопентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-этоксипропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-пирролидинилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2,2,2-трифторэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-фторэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(N-метиламино)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-тетрагидрофуранилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-гидроксициклогексил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-этилсульфанилэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(5-(N,N-диэтиламино)-пент-2-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(пиперидин-3-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-трет-бутоксикарбониламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(1-гидроксипроп-2-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-имидазолидин-2-он-1-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-пирролидин-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(2-метоксиэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(1H-бензимидазол-2-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(1-метилпирролидин-2-ил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-гидроксиэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6,N6-бис-(2-метоксиэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(цианометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-1H-пиразол-1-илпропил)-(4S*,7R*)-[4,7-этсниленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(4-аминометилфенил)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-этил-N6-(2-диэтиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-1H-имидазол-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-([1,4]-диоксан-2-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-гидроксибутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(4-метилпиперазин-1-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-аминоэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-метил-N6-(2-диметиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-трет-бутоксикарбониламинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(метил-трет-бутоксикарбониламино)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-пирролидин-1-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-1H-[1,2,4]-триазол-1-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(фуран-3-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(5-диметиламинопентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-диметиламинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-метоксипропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(1-этилпирролидин-2-ил)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-1H-[1,2,4]-триазол-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-трет-бутоксикарбонилпиперидин-3-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(N-трет-бутоксикарбониламино)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-метилбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(2S)-1-гидрокси-4-метилпент-2-ил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(метоксикарбонил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(4-аминосульфонилфенил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(1-этил-5-метил-1H-пиразол-3-ил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6,N6-бис-(2-метоксиэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(4,5-диметил-1H-имидазол-2-ил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(1S)-1-карбамоилэтил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-диэтиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(пентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(5-трет-бутоксикарбониламинопентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-(3-метилбутил)-пиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-пиридин-2-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2,2-диметил-3-N-трет-бутоксикарбониламинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(1-фенил-1H-пиразол-5-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(циклопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(бутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(гексил)-(4S*,7R*)-[4,7-этениленсииро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(1-этил-3-метил-1H-пиразол-5-ил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-фенил-2-морфолиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-диэтиламинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-трет-бутоксикарбонилпирролидин-2-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-морфолиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-карбамоилциклогексил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(1-пиперидин-1-илпропан-1-он-2-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-бензилпиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-метил-N6-гексил-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3,3-диметилбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N6-метилпиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-морфолинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(5-метил-1H-пиразол-4-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-трет-бутоксикарбонилпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-{[(3-N-трет-бутоксикарбониламинометил)-фенил]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-пропил-N6-(циклопропилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-трет-бутоксикарбонилпиперидин-4-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(циклогексил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-трет-бутоксикарбонилпиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(1S)-1-карбамоил-2-фенилэтил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(2S)-3,3-диметил-1-(метиламино)-1-оксобутан-2-ил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(4-N-трет-бутоксикарбониламинометилфенил)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(N-трет-бутоксикарбонилазетидин-3-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(N-трет-бутоксикарбонилпиперидин-3-ил)-этил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-R6-[(1S)-2-метокси-1-бензилэтил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(5-метил-3-фенилизоксазол-4-ил)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-карбамоилэтил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-метоксипропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(тетрагидрофуран-2-илметил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-[(2-имидазолидин-2-он-1-ил)-этил]-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N6-(4-Бромфенил)-(6R*)-N6-(циклопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-гидроксипропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(1H-имидазол-1-ил)-пропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(5-(диметиламино)-пентил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-пирролидин-1-илпропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-(4-метилпиперазин-1-ил)-пропил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-(4,5-диметил-1H-имидазол-2-ил)-этил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Бромпиридин-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Метоксифенил)-(6R*)-N5-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Хлорпиридин-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(Бензотиазол-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромпиридин-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Метилпиридин-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-Пентил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-[(4-Метилфенил)-метил]-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Метоксикарбонилэтил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(Циклогексилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Метилциклогекс-1-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Оксогексил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Нитротиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Хлортиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Цианотиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(Фуран-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(1-(4-Бромфенил)-этил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Трифторметоксифенил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Феноксиэтил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Метилбутил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-Бутил-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Метилфуран-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Метилбензотиазол-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Фенилэтил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Оксопентил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-(1H-Имидазол-1-ил)-пропил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Хлорпиримидин-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Бромфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(Бензотиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-трет-Бутилизоксазол-3-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Метилбензо[d]изотиазол-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(1H-Индол-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(6-Фторбензотиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Этилбутил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-(4-Хлорфенил)-тиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(Бензо[2,1,3]оксадиазол-4-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-трет-Бутилтиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Фенил-[1,2,4]тиадиазол-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(6-Хлорбензотиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-(2-Метил-1H-индол-1-ил)-пропил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(1-Метил-1H-бензимидазол-2-ил)-этил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(1H-Индол-1-ил)-этил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(2-Метоксифенил)-этил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-(3,5-диметилпиразол-1-ил)-пропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(5-фенилизоксазол-4-карбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(4-(2-оксопирролидин-1-ил)-бутириламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(2-(2-хлорфенил)-ацетиламино)-метил]-(4S,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-метоксипропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-(N,N-диметиламинокарбонил)-проииониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(2,2-дихлор-1-метилциклопропилкарбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(4-метоксикарбонилбутаноил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-(пентаноиламинометил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(2-(2,5-диметилтиазол-4-ил)-ацетиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфепил)-(6R*)-6-{[(1-фенил-1H-пиразол-5-карбонил)-амино]-метил}-(4S,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(3-аминокарбонилпропионил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(4-метилпиридин-3-карбонил)-амино]-метил}-(4S,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(изобутириламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(N-этилпиперидин-4-карбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-пиридин-3-илпропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[N-(3-метоксипропионил)-N-метиламино]-метил}-(4S,*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(2-хлор-3-фторфенилкарбонил)-амино]-метил}-(4S,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(4-пирролидин-1-илбутаноиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(1,5-диметил-1H-пиразол-3-карбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(циклопентилкарбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(2-(2-метилтиазол-4-ил)-ацетиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(2-(N,N-диметиламино)-ацетиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[N-(2-(2-хлорфенил)-ацетил)-N-метиламино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[N-(1,5-диметил-1H-пиразол-3-карбонил)-N-метиламино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(2-циклопропилацетиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-(1-метил-1H-бензимидазол-2-ил)-пропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-1H-индол-3-илпропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(бутаноиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-(4-фторфенил)-пропиониламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-[(3-фенил-акрилоиламино)-метил]-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-6-{[(5-хлор-1,3-диметил-1H-пиразол-4-карбонил)-амино]-метил}-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5-карбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилфенил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Метилтиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Ацетилтиофен-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Ацетилфуран-2-илметил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Ацетилфуран-2-илметил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Трифторметилфенил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Ацетилоксазол-5-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(4,5-Диметил-1H-имидазол-2-ил)-этил)-(6R*)-N6-(4-бромфенил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Йодфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-(Изобутил)-изоксазол-3-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Бромтиофен-4-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид; и
(5R*)-N5-(2-Фтор-4-бромфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
или фармацевтически приемлемая соль такого соединения.
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-диметиламино-3-оксопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(4-амино-4-оксобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-пирролидино-3-оксопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(2-амино-2-оксоэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(4-этилпиперазин-1-ил)-бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-пиперидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(азетидин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-морфолинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(4-метил-1,4-диазепан-1-ил)бутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(4-метилпиперазин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-пирролидино-4-оксобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(2-(2-(пирролидин-1-ил)этокси)этил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-((3R,6S)-6-(пирролидин-1-илметил)тетрагидро-2H-пиран-3-ил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(4-ацетилпиперазин-1-ил)бутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(цис-4-(пирролидин-1-илметил)-циклогексил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-((3R)-фторпирролидино)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-((3S)-фторпирролидино)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(5-пирролидинопентил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(транс-4-(пирролидин-1-илметил)-циклогексил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенил)-(6R*)-N6-(3-метиламино-3-оксопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Ацетилтиазол-5-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2,6-Дифтор-4-метоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2,3-Дифтор-4-метоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Фтор-4-метоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3,5-Дифтор-4-метоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Хлорфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4.7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Фторфенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Трифторметоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4,S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Изопропоксифенилметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромтиазол-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Ацетилоксазол-4-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-пирролидин-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(3-пирролидин-1-илпропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенилметил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Бромпирид-5-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилоксазол-2-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(изобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(изобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(изобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-(1H-бензимидазол-2-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(3-(1H-бензимидазол-2-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-(1H-бензимидазол-2-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Метоксипирид-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Бромпиразин-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Трифторметилпиридин-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Метилпиридин-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(Бензо[d]оксазол-6-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Метилизоксазол-3-илметил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Метилтиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Трифторметил-1,3,4-тиадиазол-2-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Бромпиридин-5-ил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(2-фторэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-((2-имидазолидин-2-on)-1-илэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-амино-3-оксопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-R6-(4-диэтиламинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-этоксипропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-пирролидинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(3-(4-метилпиперазин-1-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(2-диметиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-диметиламинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-(4-метилпиперазин-1-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-((2-имидазолидин-2-on)-1-илэтил)-(4S,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(4-диэтиламинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(2-фторэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(4-диэтиламинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-(4-метилпиперазин-1-ил)-пропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(2-диметиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-((2-имидазолидин-2-on)-1-илэтил)-(4S,*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(2-метоксиэтил)-(4S*,7R*)-[4,7-этсниленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(3-диметиламинопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Бромпирид-5-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Бромпирид-5-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромпирид-2-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Хлорпирид-5-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Бромтиазол-5-илметил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Метоксифенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Метоксифенил)-(6R)-N6-(3-гидрокси-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-3-фторфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Хлорпиридин-5-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Метоксифенил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенилметил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Метоксифенил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромпиридин-2-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-фторфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-метилфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-3-хлорфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Хлорпиридин-5-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-илметил)-(6R*)-N6-(пиперидин-4-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(2-метиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(5-аминопентил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(4-(аминометил)фенилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Бромтиазол-2-ил)-(6R*)-N6-(2,2-диметил-3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(2-метиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-)N5-(4-Бромфенилметил)-(6R*)-N6-(пиперидин-4-ил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(3-(аминометил)фенилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(4-(аминометил)фенилметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(2,2-диметил-3-аминопропил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Бромфенилметил)-(6R*)-N6-(пиперидин-4-илметил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Бромтиазол-5-илметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Метилпиридин-2-ил)-(6R)-N6-(3-амино-3-оксопропил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2,5-дифторфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2,6-дифторфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2,3-дифторфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2,6-дифторфенилметил)-(6R)-N6-(4-пирролидин-1-илбутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(5-аминопентил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(4-аминобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-3-фторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(5-аминопентил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пиперидин-4-ил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пиперидин-4-илметил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6,N6-(3-(аминометил)пентан-1,5-диил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2-фторфенилметил)-(6R)-N6-(5-аминопентил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2,3-дифторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-3,5-дифторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-2,5-дифторфенилметил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пиперидин-4-ил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(изобутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-трет-бутоксикарбониламинобутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(5-трет-бутоксикарбониламинопентил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(5-аминопентил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-аминобутил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6,N6-(3-(аминометил)пентан-1,5-диил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пиперидин-4-илметил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-5-(2-Бром-3-фторпиридин-5-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Аминобутил)-(6R*)-N6-(4-бромфенил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(5-Аминопентил)-(6R*)-N6-(4-бромфенил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(Циклогексен-1-ил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-трет-Бутилциклогексил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(Пиридин-2-ил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилтиазол-2-ил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Трифторметилтиазол-2-ил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2,4,6-Трифторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2,4-Диметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-[(2-Ацетилтиазол-4-ил)метил]-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Хлор-2-фторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Метилоксазол-2-ил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-[(5-Ацетилтиазол-2-ил)метил]-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Ацетилфенил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Бром-4-фторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Бром-4-фторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2,3,5-Трифторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-[(4-Метил-1,2,5-оксадиазол-3-ил)метил]-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Фтор-3-трифторметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3,5-Диметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Ацетилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Дифторметоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-[(2-Метоксипиридин-4-ил)метил]-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Фтор-5-трифторметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Ацетилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Хлор-5-трифторметилфенилметил)-(6R*)-N5-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Фтор-5-трифторметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Фтор-3-трифторметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-[(2,6-Дихлорпиридин-4-ил)метил]-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2,5-Диметилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4,5-Диметилтиазол-2-ил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Метокси-5-метилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Хлор-3,6-дифторфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Изопропоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-Хлор-6-фтор-3-метилфенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3-Хлор-4-метоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(3,4-Диметоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2,4-Диметоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(3,4-Диметоксифенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(4-Метоксифенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(4-Бромфенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-5-(2-(3,4-Диметилфенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(4-Метилфенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(4-Фторфенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(Бензо[d][1,3]диоксол-5-ил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(57R*)-N5-(2-(3-Бром-4-метоксифенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(2-(2,4-Диметилфенил)этил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-(4-Этоксифенилметил)-(6R*)-N6-(4-пирролидинобутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-(4-Хлорфенил)этил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-(4-Хлорфенил)этил)-(6R)-N6-(2-диметиламиноэтил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-(4-Хлорфенил)этил)-(6R)-N6-(2-(пиридин-2-ил)этил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-(4-Хлорфенил)этил)-(6R)-N6-(2-(4-аминосульфонилфенил)-этил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-(2,4-Дихлорфенил)этил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-(4-Хлорфенил)этил)-(6R)-N6-(N-изопентилпиперидин-4-ил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-3,5-дифторфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромтиазол-2-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бром-3-трифторметилфенил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R*)-N5-[(4-Ацетилтиазол-2-ил)метил]-(6R*)-N6-(2-метиламиноэтил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(2,5-диметилпирролидин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(пирролидин-1-ил)пентил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(3-фтор-4-(пирролидин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(2-(метоксиметил)пирролидин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(4-(3,3-дифторпирролидин-1-ил)бутил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(2-Бром-3-фторпиридин-5-ил)-(6R)-N6-(4-пирролидинобутил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(2-гидроксиэтил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(3-гидроксипропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-гидроксибутил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(2-метил-3-гидроксипроп-2-ил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(2-(2-гидроксиэтокси)этил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(4-гидроксициклогексил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-[(1-гидроксициклогексил)метил]-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(транс-4-(гидроксиметил)-циклогексил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(цис-4-(гидроксиметил)-циклогексил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пирролидин-3-ил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(2-(N-метиламино)-этил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(3-(N-метиламино)-пропил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(пиперидин-3-ил)-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-[(пирролидин-2-ил)-метил]-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-[(пиперидин-2-ил)-метил]-(4S*,7R*)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-[(пиперидин-3-ил)-метил]-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(5-Бромтиазол-2-ил)-(6R)-N6-(азетидин-3-ил)-(4S,7R)-[4,7-этиленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(цис-4-(аминометил)-циклогексил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
(5R)-N5-(4-Бромфенил)-(6R)-N6-(транс-4-(аминометил)-циклогексил)-(4S,7R)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид; и
(5R*)-N5-(2-Трифторметилпиридин-5-ил)-(6R*)-N6-(4-пирролидин-1-илбутил)-(4S*,7R*)-[4,7-этениленспиро[2.4]гептан]-5,6-дикарбоксамид;
или фармацевтически приемлемая соль такого соединения.
Документы, цитированные в отчёте о поиске
Производные аминотриазола в качестве агонистов alх

Комментарии