Аспарагиназа, полученная из базидомицетов - RU2560597C2
Код документа: RU2560597C2
Чертежи









Описание
Область техники, к которой относится изобретение
Настоящее изобретение имеет отношение к ферменту аспарагиназе, получаемому из грибов класса базидиомицетов (Basidiomycetes), в частности Flammulina velutipes (опенок зимний). Кроме того, раскрываются способы гидролиза L-аспарагина и L-глутамина. Также раскрывается способ уменьшения образования акриламида в веществе, содержащем L-аспарагин.
Уровень техники
Применение фермента аспарагиназы в технологии пищевых продуктов берет начало от открытия того, что при температурной (тепловой) обработке пищи аспарагин в присутствии восстанавливающих углеводов частично превращается в акриламид. Поскольку углеводы, так же как и аминокислоты, повсеместно встречаются в пище, существует постоянный риск образования канцерогенного и генотоксичного акриламида во время тепловой обработки пищи. Температурной обработкой является, например, выпекание, жарение, обжаривание целиком или обжаривание во фритюре. Начало образования акриламида во время тепловой обработки пищи наблюдается при температурах, превышающих 120°С. Объединенный комитет экспертов ФАО/ВОЗ по пищевым добавкам и контаминантам (JECFA) констатировал, что воздействие акриламида из рациона питания может затрагивать здоровье человека, принимая во внимание его генотоксичность и канцерогенность.
(См. www.inchem.org/documents/jecfa/jeceval/jec_41.htm viewed on 1 July 2010.)
Особенно важное значение это имеет в пищевой промышленности в отношении многочисленного разнообразия продуктов, например, хлеба, булок, закусок, печенья, готовых завтраков (хлопьев), жареных зерен (таких как какао и кофе), экструдированных и резаных картофельных продуктов, которые объективно нуждаются в тепловой обработке.
Тепловая обработка пищи необходима для обеспечения качества пищи. Например, реакция потемнения (реакция Майларда) обеспечивает характерный аромат и цвет пищи. Более того, безопасность в отношении микробов и длительный срок хранения достигаются благодаря тепловой обработке пищи.
Было бы желательно обеспечить селективное удаление L-аспарагина до тепловой обработки пищи.
Как сообщалось, генетическая инженерия картофеля с использованием антисмыслового гена аспарагинсинтазы и клубень-специфических промоторов уменьшает, но не полностью устраняет аспарагин из клубней картофеля (Rommens 2007); по общему мнению, полное исключение аспарагина является летальным для растения.
Ферменты представляют собой идеальные селективные (избирательные) средства для того, чтобы модифицировать пищевые составляющие (компоненты пищи) без воздействия на другие составляющие пищи. Каталитическое действие ферментов на пищу отличается высокой субстратной специфичностью плюс специфичностью реакции и мягкими физическими условиями действия ферментов. Действие фермента на пищу является в большей мере экологически безопасным в связи с тем, что не задействованы органические растворители и тяжелые металлы ("зеленая химия"; "белая биотехнология"). Использование ферментов для модификации компонентов пищи позволяет изменить отдельный компонент пищи, в то же время избегая каких-либо побочных реакций, которые впоследствии могут приводить к образованию токсичных соединений в пище.
Однако в настоящее время отсутствует ферментативная технология, которая может рассматривать вопрос о селективном гидролизе белок-связанной аминокислоты, такой как аспарагин пищевого белка, даже без сохранения при этом обычных структурных и органолептических свойств соответствующего питательного вещества.
Например, было бы желательным гидролизовать свободный и мобильный аспарагин в пище до аспарагиновой кислоты. После этого аспарагин не может служить в качестве молекулы-предшественника для образования акриламида при термической обработке пищи.
Аспарагиназа (ЕС 3.5.1.1; L-аспарагин аминогидролаза) представляет собой фермент, катализирующий гидролиз L-аспарагина до аспарагиновой кислоты с выделением аммиака. По существу, фермент аспарагиназа действует на азот-углеродную связь в линейных амидах, а не на пептидные связи L-аспарагина.
L-аспарагин был первой открытой аминокислотой (в 1806 г.в соке спаржи лекарственной Asparagus officinalis), при этом L-аспарагин является универсальным для всех живых клеток. Соответственно, фермент аспарагиназа встречается в природе в большом количестве у животных от прокариотических микроорганизмов до позвоночных; см. Halpern, Y.S. and Grossowicz, N., Hydrolysis of amides by extracts from mycobacteria, Biochem. J. 65:716-720 (1957); Но, Р.Р.K., Frank, B.H. and Burck, P.J., Crystalline L-Asparaginase from Escherichia coli В., Science 165:510-512 (1969); Suld, H.M. and Herbut, P.A., Guinea pig serum and liver L-asparaginases - Comparison of serum and papain-digested liver L-asparaginase. J. Biol. Chem. 245:2797-2801 (1970). Первыми подробно исследованными аспарагиназами были тетрамерные аспарагиназы из E.coli, состоящие из 326 аминокислот (Jackson, R. Ch. and Handschumacher, R. E., Escherichia coli L-asparaginase. Catalytic activity and subunit nature, Biochemistry, 1970, 9 (18), pp 3585-3590).
До недавнего времени L-аспарагиназу использовали в качестве цитостатика для борьбы с клетками лейкоза и мастоцитомы (Herbert F. Oettgen, L-asparaginase: Ein neues Prinzip in der Chemotherapie maligner Neoplasien, Annals of Hematology, 1969, 19(6), 351-356).
Совсем недавно сообщалось о выделении фермента аспарагиназы из бактерий (Helicobacter pylori, Scotti et al. 2010; Pyrococcus furiosus, Greiner-Stoeffele and Struhalla, 2008) и плесневых грибов (Aspergillus niger. Van der Laan et al. 2008; Aspergillus oryzae, Matsui et al. 2008). Добавление двух и трехвалентных катионов и различных аминокислот и свободных тиолов (Elder et al. 2007), или альфа-амилазы (de Boer, 2006) или хлористого кальция в сочетании с фосфорной или лимонной кислотой (Elder et al. 2005) было заявлено для поддержки некоторой активности фермента аспарагиназы.
Глутаминаза является ферментом, родственным аспарагиназе. Глутаминазу выделяют из молочнокислых бактерий, поскольку они встречаются, например, в кишечной флоре кур (Thongsanit et al. 2008; Lactobacillus rhamnosus, Weingand-Ziade et al. 2003), из дрожжей (Zygosaccharomyces rouxii, Iyer and Singhal 2010), из морских грибков (Beauveria bassiana, Sabu et al. 2002) или опять же из плесневых грибов Aspergillus (Prasanth et al. 2009).
Применение фермента аспарагиназы в технологии пищевых продуктов является согласованным совсем недавно. В 2007 г. ферментный препарат превентаза (DSM) был введен на европейский рынок. Фермент превентаза (DSM) продуцируется рекомбинантным плесневым грибом, Aspergillus niger. Конкурирующий с аспарагиназой фермент, называемый Acrylaway (Novozymes), получают из родственных видов плесневых грибов Aspergillus oryzea с помощью погруженной периодической ферментации с подпиткой из генетически модифицированного штамма, несущего ген, кодирующий фермент аспарагиназу из Aspergillus oryzae. Оба штамма Aspergilli (Aspergillus niger и Aspergillus oryzae) описываются как имеющие продолжительный опыт безопасного промышленного использования, поскольку широко распространены в природе и обычно используются для производства ферментов пищевого качества.
При выпекании фермент аспарагиназу, как правило, смешивают с тестом перед тепловой обработкой пищи (например, выпеканием), чтобы устранить образование акриламида. При приготовлении картошки фри может применяться погружение кусочков картофеля в раствор или обрызгивание раствором аспарагиназы. Такая обработка может быть очень эффективной. Сообщалось о снижении уровней акриламида в готовом продукте при производстве картофельных чипсов от 1688 мкг/кг до 60 мкг/кг в сравнении с необработанными картофельными чипсами (Corrigan (2008)). Предполагается, что осуществимо уменьшение образования акриламида до >99,9% (Elder et al. 2004).
Безопасность изделия в отношении применения аспарагиназы в продуктах питания не является проблемой, так как фермент будет термоинактивироваться при тепловой обработке пищи перед стадией упаковки. Поэтому фермент аспарагиназа едва ли будет вступать в контакт с потребителем в своей активной форме.
Ферменты, полученные из базидомицетов
Большая часть из 1000 съедобных грибов относится к классу Basidiomycota (Базидиомицеты). Базидомицеты часто называются высшими грибами. Базидомицеты размножаются посредством образования булавовидных (столбчатых) клеток, несущих четыре мейоспоры. Своим названием базидомицеты обязаны своему строению (лат. Basidium = столб, базидий). Базидомицеты высоко ценятся во всем мире за их богатый вкус, высокое содержание белка и волокон и одновременно низкую калорийность. Кроме того, в Азии многим базидиальным грибам приписывают целебные для здоровья и заживляющие свойства.
Сапрофитные базидомицеты обычно заселяют древесные остатки в лесу, лесные почвы, лесную подстилку и упавшие деревья. Вегетативные клетки распространяются в подпочвенной области, образуя длинные нитевидные клетки (гифы). Для того чтобы выжить на в высшей степени стойком органическом веществе на земле, трехмерной сети лигнина, они обладают необыкновенно мощным набором оксидоредуктаз. К числу оксидоредуктаз относятся лигнинпероксидаза, марганцевая пероксидаза, универсальная пероксидаза, H2O2 продуцирующие оксидазы, такие как глюкозоксидаза и фенолоксидазы типа лакказы. Также обнаружены гликозидазы, такие как целлюлазы, которые помогают расщеплять целлюлозу древесины.
Поскольку в древесине лиственных и хвойных деревьев не содержится значительного количества белка и аминокислот, проявление активности аспарагиназы у грибов, растущих в этой отдельной природной среде обитания, не должно рассматриваться.
Культурные сорта Flammulina velutipes из базидомицетов также известны под названием «энокитаке», фламуллина бархатистоножковая или опенок зимний. Flammulina velutipes образует длинные, тонкие, белые плодовые тела, которые используются в Азиатской кухне как универсальные грибы. Грибы традиционно используются свежими, консервированными в герметичной упаковке для супов, салатов и других блюд. Грибы могут быть охлажденными примерно в течение одной недели.
Цель изобретения
Цель настоящего изобретения - предоставить фермент аспарагиназу с высокой активностью и высокой устойчивостью при работе (устойчивым рабочим состоянием).
Дополнительная цель изобретения - уменьшить образование акриламида в пищевом продукте путем применения фермента аспарагиназы.
Раскрытие изобретения
В одном аспекте настоящее изобретение имеет отношение к аспарагиназе, полученной из базидомицетов. В частности, базидомицетов Flammulina velutipes.
В дополнительном аспекте настоящее изобретение имеет отношение к способу гидролиза, по меньшей мере, одного из L-аспарагина или L-глутамина. Способ включает обработку вещества, содержащего, по меньшей мере, одно из числа L-аспарагина или L-глутамина, аспарагиназой, полученной из базидомицетов.
В следующем аспекте настоящее изобретение имеет отношение способу уменьшения образования акриламида в веществе, содержащем L-аспарагин. Способ включает применение к веществу, содержащему L-аспарагин, фермента аспарагиназы, полученной из базидомицетов. Далее способ включает нагревание вещества, содержащего L-аспарагин.
Вещество, содержащее, по меньшей мере, одну аминокислоту L-аспарагин или L-глутамин, может быть пищевым продуктом.
Кроме того, изобретение имеет отношение к продуктам, полученным способами настоящего изобретения.
Краткое описание фигур
Далее настоящее изобретение описывается со ссылкой на некоторые варианты осуществления, как показано на следующих фигурах:
фиг.1 показывает зависимость от времени внутриклеточного образования фермента аспарагиназы грибов Flammulina velutipes, выращенных в погруженной культуре;
фиг.2 показывает зависимость от времени внеклеточного образования фермента аспарагиназы грибов Flammulina velutipes, выращенных в погруженной культуре;
фиг.3 показывает геномную (А) и кодирующую (В) нуклеотидные последовательности и аминокислотную последовательность (С) фермента аспарагиназы грибов Flammulina velutipes. Первые 19 аминокислот называются сигнальной последовательностью;
фиг.4 показывает устойчивость к действию соли фермента аспарагиназы из Flammulina velutipes, экспрессированной в E.coli как в гетерологичном хозяине и использованной в виде неочищенного (сырого) фермента;
фиг.5 показывает устойчивость к рН фермента аспарагиназы из Flammulina velutipes, экспрессированной в E.coli как в гетерологичном хозяине и использованной в виде неочищенного фермента;
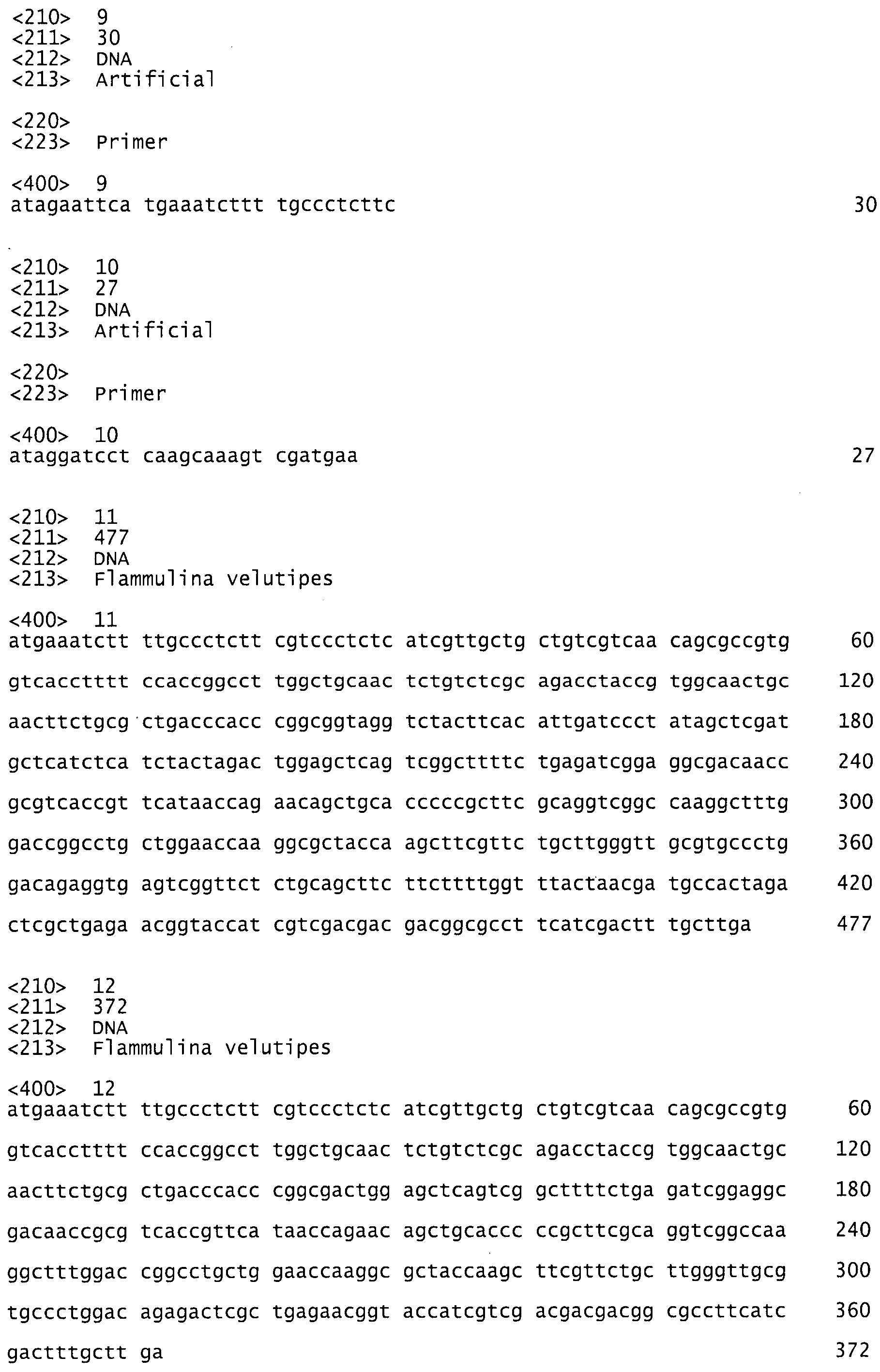
фиг.6 показывает оптимальное значение рН для аспарагиназы из Flammulina velutipes;
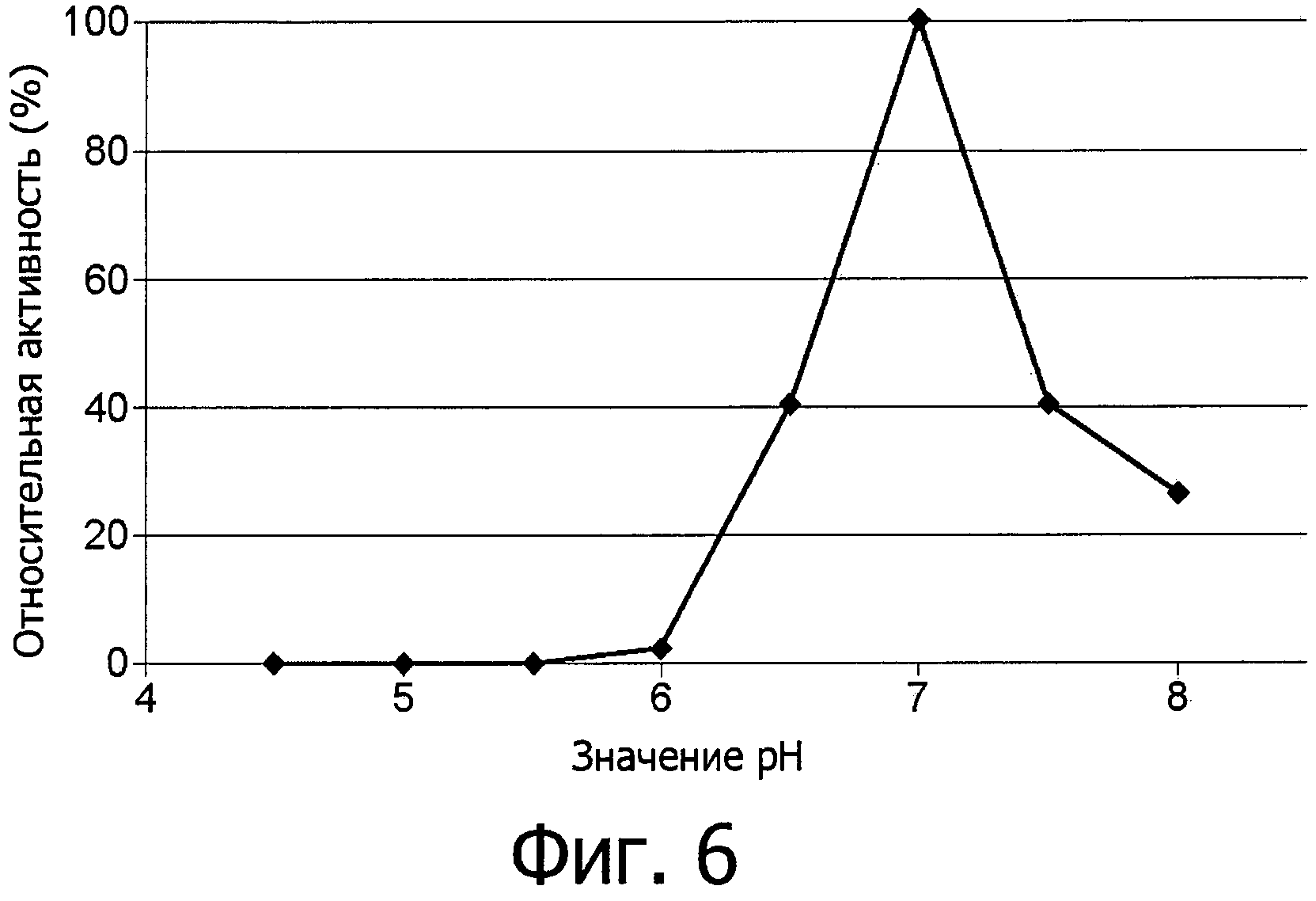
фиг.7 показывает устойчивость к температуре фермента аспарагиназы из Flammulina velutipes, экспрессированной в E.coli как в гетерологичном хозяине и использованной в виде неочищенного фермента;
фиг.8 показывает а) исследование активности с помощью нативного электрофореза в полиакриламидном геле (PAGE) и b) разделение фермента аспарагиназы Flammulina velutipes с помощью денатурирующего PAGE;
фиг.9 показывает температурный оптимум для аспарагиназы Flammulina velutipes.
Осуществление изобретения
С целью полного понимания настоящего изобретения и его преимуществ приводится подробное описание изобретения во взаимосвязи с фигурами.
Следует учесть, что различные аспекты настоящего изобретения только иллюстрируют конкретные способы употребления и использования изобретения и не ограничивают рамки изобретения, когда принимаются во внимание вместе с пунктами формулы изобретения и следующим подробным описанием.
В настоящем изобретении термин фермент аспарагиназа относится к ферменту, способному гидролизовать и L-аспарагин и L-глутамин.
Цель настоящего изобретения - значительно уменьшить образование канцерогенного акриламида в термически обработанной пище путем совмещенного ферментативного гидролиза предшественника акриламида L-аспарагина с помощью фермента аспарагиназы.
В одном варианте осуществления настоящего изобретения раскрывается способ производства фермента аспарагиназы. Аспарагиназу, обладающую высокой устойчивостью при работе, получают из мицелия базидомицетов Flammulina velutipes.
Штамм Flammulina velutipes является коммерчески доступным из коллекций культур, таких как DSMZ (Deutsche Sammlung fur Mikroorganismen und Zellkulturen GmbH, Braunschweig, Германия) или CBS (Centraalbureau voor Schimmelcultures, Utrecht, Нидерланды).
Использование мицелия базидомицетов Flammulina velutipes обеспечивает большие преимущества в отношении удобства производства и культивирования, поскольку не требуется собирать плодовые тела в диких местах. При широком использовании этого вида базидомицетов Flammulina velutipes в качестве продукта питания отсутствует очевидный риск для здоровья или безопасности.
Грибы базидомицеты вида Flammulina velutipes можно легко вырастить в погруженной культуре с минимальными требованиями в отношении добавок к среде. Должны присутствовать органический источник углерода, источник азота и источник фосфора; эти источники, как правило, обеспечиваются обычными смесями, такими как дрожжевой экстракт или смесь глюкозы с неорганическими аммониевыми и фосфатными солями. Также добавляют смеси второстепенных элементов и микроэлементов, рекомендованных для всех питательных сред микроорганизмов. Культивирование Basidiomycetes Flammulina velutipes предпочтительно осуществляют в погруженной культуре в течение от 3 до 20 дней, предпочтительно в течение от 6 до 15 дней. В большинстве случаев температура во время культивирования Basidiomycetes Flammulina velutipes находится в пределах от 10 до 35°С, предпочтительно от 20 до 30°С. Значение рН примерно от 4 до 8 является типичным, при этом предпочтительным является значение рН примерно от 5 до 7. Кроме того, типичными для этого метода являются условия слабого освещения.
Способ производства биомассы и фермента аспарагиназы работает при умеренных (нежестких) условиях и является экологически безвредным в противоположность методам предшествующего уровня техники.
Ферментативная активность аспарагиназы сначала определяется внутри клеток, как показано на фиг.1, и затем определяется и в питательной среде, как показано на фиг.2.
Использование питательной среды облегчает осуществление способа, также как выделение и накопление фермента аспарагиназы с помощью известных в данной области техники методов. Такими методами могут быть ультрафильтрация, осаждение или абсорбция. Благодаря этому можно получить и затем использовать для технического гидролиза не содержащий клетки концентрированный культуральный супернатант фермента аспарагиназы. Хотя фермент аспарагиназу можно выделить с помощью известных в данной области техники методов, нет необходимости это делать, так как полученный неочищенный препарат фермента аспарагиназы может использоваться далее в настоящем способе.
В процессе погруженного культивирования Flammulina velutipes был обнаружен пик (максимум) внутриклеточной активности фермента аспарагиназы приблизительно через одну неделю. Выделение во внеклеточное пространство начиналось через 12 дней и достигало пика приблизительно через 14 дней.
Активность окрашивания полиакриламидного геля, полученного при электрофорезе в нативных условиях, подтвердила каталитическую специфичность, на фиг.8 видны активные полосы очищенного фермента с массой 13 и 74 кДа, что указывает на присутствие не только мономерной, но и олигомерной формы.
В том случае, когда необходима максимальная чистота аспарагиназы, может использоваться рекомбинантный продукт из Bacillus subtilis. Для получения рекомбинантных штаммов необходимо знать полную аминокислотную последовательность фермента. Полная аминокислотная последовательность аспарагиназы показана на фиг.3, на которой представлена полная последовательность всех 123 аминокислотных остатков, полученная из полной последовательности структурного гена, состоящего из 372 пар оснований. Перед кодирующей областью находится сигнальная последовательность, состоящая из 18 пар оснований.
Апарагиназу добавляют к субстрату. Под добавлением аспарагиназы к субстрату имеется в виду, что аспарагиназа контактирует с субстратом. Это может включать, например, разбрызгивание, погружение или покрытие субстрата ферментом. Субстрат предпочтительно является пищевым веществом, которое содержит одно из числа L-аспарагина или L-глутамина. В большинстве случаев аспарагиназа наносится на субстрат в миллимолярных концентрациях приблизительно от 1 до 200, предпочтительно в миллимолярных концентрациях от 10 до 20 в зависимости от специфической активности. Фермент аспарагиназа может добавляться в виде чистого белка. Альтернативно фермент аспарагиназа может изготавливаться для специального применения в соответствии с предполагаемым использованием путем добавления к ферменту аспарагиназе таких ингредиентов, как лактоза, глицерин или альбумин с целью облегчить дозирование. Промышленно произведенный фермент аспарагиназа или изготовленный для специального применения фермент аспарагиназа может иметь форму таблеток, гранулята, стабилизированной жидкости или пастообразного препарата.
Для получения субстрата со значительно более низкими уровнями аспарагина или глутамина по сравнению с субстратом до обработки проводится гидролиз субстрата. Можно использовать стандартные условия проведения гидролиза, которые могут быть легко определены специалистом в данной области техники.
Поскольку на активность фермента аспарагиназы не оказывает действия химическая среда, в которой присутствует фермент, субстратом для обработки могут быть, например: напитки, бобы какао, сыр, кофейные зерна, кондитерские изделия, десерты, тесто, гарниры, картофель фри, фруктовые напитки, мясные продукты, продукты лечебного питания, питательные добавки, корм для домашних животных, картофельные чипсы, соусы, закуски, супы.
В частности, субстратом является любое изделие, предназначенное для потребления человеком или животным.
Степень гидролиза аспарагина в субстрате можно оценить или путем измерения уменьшения аспарагина, аспарагиновой кислоты или увеличения аммиака, или после обработки пищи путем измерения уровня остаточного акриламида.
Преимущество, предоставленное изобретением, состоит в том, что полученный в результате новый фермент аспарагиназа обладает явно выраженным сродством (высокой аффинностью) и демонстрирует улучшенную эффективность при гидролизе L-аспарагина.
Еще более неожиданными являются отличные технические свойства аспарагиназы в отношении функциональной устойчивости, что дает возможность ее использования в процессах при повышенной температуре и ионной силе и при разных условиях рН (фиг.4-7). Не требуется дополнительных ко-субстратов за исключением воды.
Новый фермент аспарагиназа обладает хорошей устойчивостью к рН и широким оптимумом рН в пределах между рН 5,5 и 9, смотри фиг.5 и 6. В этом интервале находится значение рН большинства продуктов питания.
Устойчивость при работе (функциональная устойчивость) фермента аспарагиназы не уменьшается даже при температурах вплоть до 55°С, см. фиг.7.
Изоэлектрическая точка мономера и олигомера аспарагиназы находится около 5,2, что было определено с помощью гель-электрофореза с изоэлектрическим фокусированием. Молекулярные массы мономера и олигомера аспарагиназы составляют 12,8, как установлено из полной последовательности, и около 74 для агрегированной формы, как установлено с помощью нативного электрофореза в полиакриламидном геле (PAGE), смотри фиг.8.
Уникальная последовательность фермента аспарагиназы, показанная на фиг.3, была определена с помощью ESI-MS анализа. Наиболее высокая степень гомологии первоначально полученных пептидов была обнаружена с карбоксилазой/металлопептидазой (Е-значение>30), липазой/эстеразой/деацетилазой (Е-значение>100) и пепсин-подобной аспарагиновой/гликозидгидролазой (Е-значение>14). В целом неоднородные результаты и низкие Е-значения показывают, что этот фермент аспарагиназа в действительности является новым и не имеет прецедента. Это объясняется уникальным источником, видом базидиомицетов.
Далее настоящее изобретение описывается путем пояснения в следующих неограничивающих примерах.
Примеры
В следующих примерах были использованы уже указанные материалы и методы.
Материалы и методы
Культивирование Flammulina velutipes
Все среды и оборудование перед применением подвергались автоклавированию, а на всем протяжении процедуры применяли стандартные методы стерилизации. Flammulina velutipes поддерживали на стандартных агаровых чашках (30,0 г л-1 глюкоза-моногидрат; 4,5 гл-1 аспарагин-моногидрат; 1,5 г л-1 KH2PO4; 0,5 г л-1 MgSO4; 3,0 г л-1дрожжевого экстракта; 15,0 г л-1 агар-агар; 1,0 млл-1 раствора микроэлементов, содержащего 0,005 г л-1 CuSO4·5H2O; 0,08 г л-1 FeCl3·6H2O; 0,09 г л-1 ZnSO4·7H2O; 0,03 г л-1MnSO4·H2O и 0,4 г л-1 EDTA (этилендиаминтетрауксусная кислота). Значение рН среды перед стерилизацией доводили до рН 6 с помощью 1 М NaOH.
Прекультуры готовили гомогенизацией 10×10 мм агаровой пробки (plug) с мицелием Flammulina velutipes в 100 мл стерильного стандартного питательного раствора при помощи Ultra Turrax (Miccra D-9, Art, Mullheim, Германия). Погруженные культуры поддерживали при 24°С и 150 об/мин. После культивирования в течение 5 дней, 50 мл прекультуры переносили в 250 мл основной культуральной среды, состоящей из минимальной среды (1,5 г л-1 KH2PO4; 0,5 г л-1 MgSO4; 1,0 мл л-1 раствора металлических микроэлементов) и 40 г л-1 глютена или 10 мМ глутамина, соответственно.
Получение фермента аспарагиназы из Flammulina velutipes
После 18 дней культивирования культура была профильтрована и супернатант, содержащий внеклеточный фермент аспарагиназу (200 мл) was reversed foamed [1]. Ретентат концентрировали ультрафильтрованием при помощи MWCO 10,000 кДа (Millipore, Bedford, MA) и разделяли с использованием эксклюзионной хроматографии на Сефарозе 6 с помощью 200 мМ Трис/HCl рН 7,5.
Определение активности
10 мМ L-глутамин или ЮмМ L-аспарагин в 0,1 М фосфате калия рН 7,0, соответственно, предварительно нагревали до 37°С. Итоговый анализ начинали добавлением 50 мкл нативного или 10 мкл рекомбинантного фермента в общий реакционный объем 150 мкл и останавливали через 10-20 минут добавлением 20 мкл 3% ТСА или нагреванием при 95°С в течение 10 мин. Контрольный эксперимент проводили без аминокислот. Образование продукта отслеживали с помощью HPLC. Одну единицу активности фермента вычисляли как количество фермента, необходимого для выработки 1 мкМ глутаминовой кислоты или аспарагиновой кислоты, соответственно, при 37°С за минуту.
ВЭЖХ осуществляли, используя С18 Nucleodur Pyramid, 5 мкм, 4 мм ID колонку, метанол в качестве элюента А, 0,1 М натрий ацетат плюс 0,044% триэтиламин (рН довели до значения 6,5 с помощью HCl) в качестве элюента В, о-фталдиальдегид в качестве агента для дериватизации, и флуоресцентный детектор.
Свободный белок
Концентрацию белка в супернатанте после гидролиза оценивали по методу Лоури, используя в качестве стандарта бычий сывороточный альбумин.
Оптимальная температура и значение рН
Определение оптимальной температуры и значения рН фермента аспарагиназы осуществляли с помощью растворов фермента, собранных во время культивирования или после того, как рекомбинантный белок был доступен в растворимой форме. Был проверен оптимум рН в пределах от рН 4 до 9 (0,1 М ацетат натрия рН 4, 5; 0,1 М фосфат калия рН 6, 7, 8; 0,1М карбонат натрия рН 9) при 37°С. Определение оптимальной температуры проводили в пределах от 20 до 70°С при оптимальном значении рН.
Устойчивость к температуре и рН
Для определения устойчивости к рН 10 мкл рекомбинантного фермента инкубировали в течение 16 час при 37°С в 40 мкл соответствующего вышеуказанного буфера. Добавили 100 мкл 10 мМ глутамина в 0,1 М фосфате калия (рН 7) и реакцию инкубировали в течение 20 минут при 37°С. Контрольный эксперимент проводили без субстрата. Реакцию останавливали при 95°С в течение 10 минут. Произведенную глутаминовую кислоту подсчитывали после ВЭЖХ-анализа, как описано выше.
Для исследования температурной устойчивости 10 мкл рекомбинантного фермента инкубировали в течение 1 часа при соответствующей °С в 40 мкл 0,1М калий-фосфатного буфера (рН 7). После этого добавили 100 мкл 10 мМ глутамина в 0,1М фосфате калия (рН 7) и смесь инкубировали в течение 20 мин при 37°С. Контрольный эксперимент проводили без субстрата. Реакцию останавливали при 95°С в течение 10 минут. Произведенную глутаминовую кислоту вычисляли после ВЭЖХ-анализа, как описано выше.
Тандемная масс-спектрометрия с ионизацией электрораспылением (ESI-MS) триптических пептидов.
Пептидазные полосы были вырезаны из SDS-полиакриламидных гелей, высушены и «переварены» (обработаны) трипсином. Полученные пептиды были экстрагированы и очищены в соответствии со стандартными протоколами. Масс-спектрометр Qtof II (Micromass, Великобритания), снабженный наноструйным источником ионов (nanospray ion source) и покрытыми золотом капиллярами был использован для ионизации распылением (ESI) MS пептидов. Для проведения экспериментов с индуцированной столкновениями диссоциацией множество заряженных родительских ионов выборочно пропускали из квадрупольного масс-анализатора в реакционную ячейку (25-30 eV). Полученные в результате дочерние ионы отделяли с помощью ортогонального времяпролетного масс-анализатора. Отпечатки пептидных масс (фингерпринтинг) полученные с помощью тандемного ESI-MS анализа использовали для идентификации межвидовых белков в публичных базах данных первичных последовательностей белков.
Нативная-PAGE и денатурирующая SDS-PAGE
SDS-PAGE-исследование проводили на 12% полиакриламидном разделяющем геле. Образцы готовили, смешивая 20 мкл раствора фермента аспарагиназы и 20 мкл загрузочного буфера [0,1 М Трис/HCl (рН 6.8); 0,2 М DTT, 4% SDS, 20% глицерин; 0,2% бромфеноловый синий], и кипятили в течение 15 минут. После электрофореза при 20 мА на гель, гели окрашивали серебром или кумасси бриллиантовым голубым. Для определения молекулярного веса использовали маркерные белки от 250 до 10 кДа (BioRad, Германия).
Нативный PAGE проводили в неденатурирующих условиях. Образцы готовили, смешивая 1:1 (об/об) с загрузочным буфером [0,05М Трис/HCL (рН 6,8); 2% SDS, 10% глицерин; 0,1% бромфеноловый синий]. После электрофореза при 10 мА на гель и при 8°С, гели 2 раза промыли в 2,5% Тритоне Х-100. Процедура окрашивания основывается на дезаминировании L-глутамина глутаминазой с получением L-глутамата. Окисление L-глутамата глутаматдегидрогеназой связано с восстановлением тетразолиевого красителя до окрашенного нерастворимого формазана. Раствор, окрашивающий глутаминазу, содержал 15 мМ L-глутамина, 0,5 г мл-1 глутаматдегидрогеназы из бычьей печени; 0,1 М фосфата калия рН 7; 2 мг мл-1 NAD; 0,04 мг мл-1 феназинметосульфата и 2 мг мл-1нитросинего тетразолия. Активность фермента выглядела после инкубации при 37°С как фиолетовые полосы.
Изоэлектрическое фокусирование
IEF полиакриламидный гель-электрофорез проводили на системе Multiphor II (Pharmacia LKB, Швеция) используя готовые гели Servalyt™ Precotes™ с фиксированным градиентом рН от 3 до 10 (Serva, Германия) при 3500 V час (2000 V, 6 mA, 12 W). Изоэлектрические точки аспарагиназы были вычислены как равные 5 при использовании испытуемой смеси белков отр1 3,5 до 10,7 (Serva, Германия). Гели окрашивали серебром, кумасси или на активность, как описано выше.
Подготовка РНК
РНК получали из 500 мг мицелия, хранящегося в RNALater® (Invitrogen) с использованием набора NucleoSpin® RNA Plant Kit (Macherey-Nagel, Duren, Германия).
Синтез кДНК
5 мкг общей РНК смешивали с 25 пмоль 3'ПЦР (ATTCTAGAGGCCGAGGCGGCCGACATG 30*Т VN) и доводили объем до 11 мкл DEPC-обработанной Н2О. Смесь инкубировали при 70°С в течение 5 мин и затем охлаждали на льду в течение 2 мин. Добавили 4 мкл 5х реакционного буферного раствора, 2 мкл dNTP смеси (10 мМ каждый); 0,5 мкл RiboLock™ и 20 пмоль SMART IIA (AAGCAGTGGTATCAACGCAGAGTACGCGGG), смешали и инкубировали при 37°С в течение 5 мин. После добавления 200 U RevertAid™ H Minus M-MuLV Reverse Transcriptase смесь инкубировали при 42°С в течение 60 мин. Реакцию останавливали нагреванием при 70°С в течение 5 мин.
Синтез комплементарной цепи проводили, смешивая 2,5 мкл 10х Long PCR buffer, 2 мкл dNTP смеси (2,5 мМ каждый); 25 пмоль 5'PCR (AAGCAGTGGTATCAACGCAGAGT), 25 пмоль 3'PCR, 1 мкл DMSO, 1 U Long PCR Enzyme Mix, 3 мкл ss cDNA и ddH2O до 25 мкл.
Реакционную смесь инкубировали при 94°С в течение 5 мин, а потом проводили 30 циклов амплификации при 94°С в течение 20 сек и 68°С в течение 6 мин, окончательную элонгацию проводили при 68°С в течение 20 минут.
Ферменты и реагенты были куплены у компании Fermentas, St. Leon-Rot, Германия. Олигонуклеотиды были синтезированы Eurofins MWG Operon, Ebersberg, Германия.
Поиск последовательности
Вырожденные праймеры были выведены из пептидных последовательностей. ПЦР-реакции проводили, смешав 2,5 мкл 10х TrueStart™ Taq-buffer, 2 мкл dNTP смеси (2,5 мМ каждый), 2 мкл 25 мМ MgCl2, 25 пмоль прямого праймера, 25 пмоль обратного праймера, 0,8 мкл DMSO, 0,625 U TrueStart™ Taq DNA Polymerase, 1 мкл ds кДНК и ddH2O до 25 мкл.
Touchdown ПЦР [2] проводили путем инкубирования реакционной смеси при 95°С в течение 5 минут, затем проводили 12 циклов при 95°С в течение 30 сек, (72°С - 1°С/цикл) в течение 60 сек и 72°С в течение 90 сек. Следующие 25 циклов проводили при температуре отжига 60°С. Окончательную элонгацию проводили при 72°С в течение 20 минут.
Результаты ПЦР-реакций анализировали с помощью гель-электрофореза (1% агароза (Serva, Heidelberg, Германия), растворенная в ТАЕ-буфере (40 мМ Трис, 20 мМ уксусная кислота, 1 мМ EDTA рН 8). Для обнаружения ДНК после охлаждения раствора агарозы примерно до 50°С к нему было добавлено 0,05%о SYBRSafe™ (Invitrogen).,
Выделение ДНК из агарозных гелей проводили с помощью набора NucleoSpin Extract II Kit (Macherey-Nagel).
Фрагменты ДНК дотировали в вектор pCR2.1® ТА-Vector (Invitrogen), смешивая 1 мкл вектора, 1 мкл 10х буферного раствора для Т4 ДНК-лигазы, 5 U T4 ДНК-лигазы, 0,5 мкл 5 мМ АТФ и 6,5 мкл ДНК-вставки. Реакционную смесь инкубировали при 25°С в течение двух часов.
Для трансформации 5 мкл лигазной смеси добавляли к 50 мкл химически компетентных клеток Е.coli TOP10 (Invitrogen), инкубировали на льду в течение 20 мин, проводили тепловой шок при 42°С в течение 45 сек и переносили обратно на лед. Сразу добавили 500 мкл среды SOC (Invitrogen). Клетки встряхивали при 200 об/мин и 37°С в течение 60 мин, а затем высевали на LB-агар, содержащий 50 мкг/мл ампициллина и 20 мкг/мл X-Gal (Roth). Засеянные чашки инкубировали при 37°С в течение ночи.
Отбор положительных клонов проводили при помощи скрининга рекомбинантов методом ПЦР. Реакционную смесь составляли, как указано выше, но использовали праймеры М13 uni (-21) (TGTAAAACGACGGCCAGT) и М13 rev (-29) (CAGGAAACAGCTATGACC). Матрицу вносили путем ресуспендирования материала колоний в реакционной смеси.
Реакционную смесь инкубировали при 95°С в течение 5 минут, а затем проводили 40 циклов амплификации при 95°С в течение 30 сек, 55°С в течение 1 мин и 72°С в течение 1 мин/kb. Окончательную элонгацию осуществляли при 72°С в течение 20 мин.
Плазмидную ДНК выделяли с помощью набора NucleoSpin Plasmid DNA Kit (Macherey-Nagel). Секвенирование проводили при помощи прибора Eurofins MWG Operon (Ebersberg, Германия).
Для получения полной последовательности из установленных фрагментов ДНК аспарагиназы были получены специфические праймеры и спарены с праймерами 5'PCR или 3'PCR, соответственно. Реакции ПЦР проводили, как указано выше, при температуре отжига 55°С и стадии элонгации 1 мин при 72°С.
Амплификация полной последовательности аспарагиназы достигалась с помощью праймеров FvNase_5' (ATGAAATCTTTTGCCCTCTTCG) и FvNase_3' (TCAAGCAAAGTGATGAAGG) при температуре отжига 55°С и стадии элонгации 1 мин при 72°С.
Для подтверждения последовательности геномную ДНК получали из мицелия, используя набор Genomic DNA Purification Kit (Fermentas). Полная последовательность аспарагиназы была амплифицирована и секвенирована.
Анализ ДНК и аминокислотной последовательности
Установление N-концевой сигнальной последовательности проводили путем анализа при помощи Signal P 3.0 [3]. Гомологию последовательности исследовали методом поиска в базе данных GenBank с помощью программы BLAST [4].
Гетерологичная экспрессия в Е.coli
Для клонирования аспарагиназы был амплифицирован ген из плазмидной ДНК с фланкирующими рестриктными сайтами EcoRI и BamHI с помощью ПЦР с использованием праймеров FvNase_EcoRI (ATAGAATTCATGAAATCTTTTGCCCTCTTC) и FvNase_BamHI (ATAGGATCCTCAAGCAAAGTCGATGAA). Была составлена генная кассета и лигирована в вектор экспрессии X-Zyme's pCTP2 с получением экспрессионного конструкта pCTP2-Aspa. Штаммы E.coli DH5alpha и JM105, трансформированные рСТР2-Aspa, выращивали в LB-среде при 37°С до OD600 нм 0,7, индуцировали (синтез белка) добавлением 0,5 мМ IPTG и дополнительно культивировали в течение ночи. Клетки ресуспендировали в Трис-буфере рН 7,5, лизировали обработкой ультразвуком, а клеточный дебрис (обломки) удаляли центрифугированием. Очистке аспарагиназы способствовала обработка сульфатом аммония.
Рекомбинантная аспарагиназа из Bacillus Subtilis
Секреция белков из бактерий является АТФ-зависимым процессом, который вовлекает перемещение пре-белка и последующее протеолитическое расщепление пре-белка на внешней поверхности мембраны до зрелого фермента. Сигнальная последовательность содержит всю информацию, необходимую для направления белка к мембране для транслокации.
Несмотря на то, что секреция в Bacillus subtilis изучена не так хорошо как секреция в Е.coli, в целом предполагается, что механизмы этих процессов аналогичны (Saier, М.Н., Jr., Wemer, Р.K. and Muller, М. 1989, Microbiol. Rev 53:333-366; Overhoff, В., Klein, М., Spies, М. and Freudi, R., 1991, Mol. Gen. Genet. 228:417-423). Одним из отличий между двумя наборами секретируемых белков является длина их сигнальных пептидов, которые обычно на 20 аминокислот длиннее в грамположительных, чем в их соответствующих грамотрицательных аналогах. Таким образом, общая стратегия экспрессии гетерологичных белков в грамположительных организмах, таких как Bacillus subtilis, подразумевает совмещение целевого белка с секреторным аппаратом хозяина (Mountain, А., 1989, Bacillus, С. Harwood, ed., Plenum Press, New York, 73-114). Стандартные протоколы, использующие вышеуказанные методы, известны в данной области техники и были использованы для сверх-экспрессии рекомбинантной аспарагиназы Bacillus subtilis.
Пример 1. Культивирование Flammulina velutipes
Все среды и оборудование перед применением подвергались автоклавированию, а на всем протяжении процедуры применяли стандартные методы стерилизации. Flammulina velutipes поддерживали на стандартных агаровых чашках (30,0 г л-1 глюкоза-моногидрат; 4,5 гл-1 аспарагин-моногидрат; 1,5 г л-1 KH2PO4; 0,5 г л-1 MgSO4; 3,0 г л-1дрожжевого экстракта; 15,0 г л-1 агар-агар; 1,0 млл-1 раствора микроэлементов, содержащего 0,005 г л-1 CuSO4·5H2O; 0,08 г л-1 FeCl3·6H2O; 0,09 г л-1 ZnSO4·7H2O; 0,03 г л-1MnSO4·H2O и 0,4 г л-1 EDTA (этилендиаминтетрауксусная кислота). Перед стерилизацией значение рН среды доводили до рН 6 с помощью 1 М NaOH.
Прекультуры готовили гомогенизацией 10×10 мм агаровой пробки с мицелием Flammulina velutipes в 100 мл стерильного стандартного питательного раствора при помощи Ultra Turrax (Miccra D-9, Art, Mullheim, Германия). Погруженные культуры поддерживали при 24°С и 150 об/мин. После культивирования в течение 5 дней, 50 мл прекультуры переносили в 250 мл основной культуральной среды, состоящей из минимальной среды (1,5 г л-1 KH2PO4; 0,5 г л-1 MgSO4; 1,0 мл л-1 раствора металлических микроэлементов) и 40 г л-1 глютена или 10 мМ глутамина, соответственно.
Пример 2. Получение фермента от Flammulina velutipes
После 18 дней культивирования культура была профильтрована и супернатант, содержащий внеклеточный фермент аспарагиназу (200 мл) was reversed foamed, при этом аспарагиназа и другой белок являются единственными белками, оставшимися в супернатанте. Остаток жидкости концентрировали с помощью ультрафильтрации (MWCO 10,000), а оба белка разделили с помощью эксклюзионной хроматографии на Сефарозе 6.
Большая часть исходно присутствующей гидролитической активности была извлечена, означая, что этот протокол дает пригодный концентрат ферментного препарата только в течение двух стадий.
Пример 3. Гидролиз L-аспарагина с использованием нативного фермента
100 мкл 10 мМ аспарагина в 0,1 М K2HPO4/KH2PO4 буфере (рН 7,0) предварительно нагревали при 37°С в течение 5 минут. Реакцию начинали добавлением 50 мкл раствора фермента. После инкубации в течение 20 мин при 37°С и 400 об/мин в термошейкере, реакцию останавливали добавлением 20 мкл ТСА. Контрольный эксперимент проводили без субстрата. Содержание аспарагиновой кислоты количественно определяли с помощью ВЭЖХ после ОРА-дериватизации, и различия между образцами и контролем использовали для подсчета активности фермента.
Данные расчетов указывают на быстрый ферментативный гидролиз субстрата L-аспарагина.
Пример 4. Гидролиз L-глутамина с использованием нативного фермента
100 мкл 10 мМ глутамина в 0,1 М K2HPO4/KH2PO4 буфере (рН 7,0) предварительно нагревали при 37°С в течение 5 минут. Реакцию начинали добавлением 50 мкл раствора фермента. После инкубации в течение 20 мин при 37°С и 400 об/мин в термошейкере, реакцию останавливали добавлением 20 мкл ТСА (трихлоруксусная кислота). Контрольный эксперимент проводили без субстрата. Содержание глутаминовой кислоты количественно определяли с помощью ВЭЖХ после ОРА-дериватизации, и различия между образцами и контролем использовали для подсчета активности фермента.
Эти расчетные данные указывают на полезную побочную активность аспарагиназы по отношению к субстрату L-глутамину.
Пример 5. Гидролиз L-аспарагина с использованием рекомбинантного фермента
140 мкл 10 мМ аспарагина в 0,1 М K2HPO4/KH2PO4 буфере (рН 7,0) предварительно нагревали при 37°С в течение 5 минут. Реакцию начинали добавлением 10 мкл раствора рекомбинантного фермента, разбавленного водой в 200 раз. После инкубации в течение 10 минут при 37°С и 400 об/мин в термошейкере, реакцию останавливали нагреванием до 95°С в течение 10 минут. Контрольный эксперимент проводили без субстрата. Содержание аспарагиновой кислоты количественно определяли с помощью ВЭЖХ после ОРА-дериватизации, и различие между образцом и контролем использовали для подсчета активности фермента. Активность фермента рекомбинантной аспарагиназы в отношении аспарагина составляла 43,3 kU л-1.
Пример 6. Гидролиз L-глутамина с использованием рекомбинантного фермента
140 мкл 10 мМ глутамина в 0,1 М K2HPO4/KH2PO4 буфере (рН 7,0) предварительно нагревали при 37°С в течение 5 мин. Реакцию начинали добавлением 10 мкл раствора рекомбинантного фермента, разбавленного водой в 200 раз. После инкубации в течение 10 мин при 37°С и 400 об/мин в термошейкере, реакцию останавливали нагреванием до 95°С в течение 10 мин. Образцы сравнения были приготовлены без субстрата. Содержание глутаминовой кислоты было количественно измерено с помощью ВЭЖХ после ОРА-дериватизации, и различие между образцом и образцом сравнения использовали для подсчета активности фермента. Активность рекомбинантной аспарагиназы в отношении глутамина составляла 4,3 kU л-1.
Таким образом, при наличии подробного описания настоящего изобретения следует понимать, что подробное описание не предназначается для ограничения рамок изобретения. То, что должно быть защищено патентом на изобретение, устанавливается в следующих пунктах формулы изобретения.
SEQUENCE LISTING
<110> Nestec SA
<120> Asparaginase from Basidiomycetes
<130> P39867/EP
<140> PCT/EP2011/055375
<141> 2011-04-06
<160> 12
<170> PatentIn version 3.3
<210> 1
<211> 123
<212> PRT
<213> Flammulina velutipes
<400> 1
Met Lys Ser Phe Ala Leu Phe Val Pro Leu Ile Val Ala Ala Val Val
1 5 10 15
Asn Ser Ala Val Val Thr Phe Ser Thr Gly Leu Gly Cys Asn Ser Val
20 25 30
Ser Gln Thr Tyr Arg Gly Asn Gly Asn Phe Cys Ala Asp Pro Pro Gly
35 40 45
Asp Trp Ser Ser Val Gly Phe Ser Glu Ile Gly Gly Asp Asn Arg Val
50 55 60
Thr Val His Asn Gln Asn Ser Cys Thr Pro Ala Ser Gln Val Gly Gln
65 70 75 80
Gly Phe Gly Pro Ala Cys Trp Asn Gln Gly Ala Thr Lys Leu Arg Ser
85 90 95
Ala Trp Val Ala Cys Pro Gly Gln Arg Leu Ala Glu Asn Gly Thr Ile
100 105 110
Val Asp Asp Asp Gly Ala Phe Ile Asp Phe Ala
115 120
<210> 2
<211> 27
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 2
attctagagg ccgaggcggc cgacatg 27
<210> 3
<211> 30
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 3
aagcagtggt atcaacgcag agtacgcggg 30
<210> 4
<211> 23
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 4
aagcagtggt atcaacgcag agt 23
<210> 5
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 5
tgtaaaacga cggccagt 18
<210> 6
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 6
caggaaacag ctatgacc 18
<210> 7
<211> 22
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 7
atgaaatctt ttgccctctt cg 22
<210> 8
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 8
tcaagcaaag tgatgaagg 19
<210> 9
<211> 30
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 9
atagaattca tgaaatcttt tgccctcttc 30
<210> 10
<211> 27
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 10
ataggatcct caagcaaagt cgatgaa 27
<210> 11
<211> 477
<212> DNA
<213> Flammulina velutipes
<400> 11
atgaaatctt ttgccctctt cgtccctctc atcgttgctg ctgtcgtcaa cagcgccgtg 60
gtcacctttt ccaccggcct tggctgcaac tctgtctcgc agacctaccg tggcaactgc 120
aacttctgcg ctgacccacc cggcggtagg tctacttcac attgatccct atagctcgat 180
gctcatctca tctactagac tggagctcag tcggcttttc tgagatcgga ggcgacaacc 240
gcgtcaccgt tcataaccag aacagctgca cccccgcttc gcaggtcggc caaggctttg 300
gaccggcctg ctggaaccaa ggcgctacca agcttcgttc tgcttgggtt gcgtgccctg 360
gacagaggtg agtcggttct ctgcagcttc ttcttttggt ttactaacga tgccactaga 420
ctcgctgaga acggtaccat cgtcgacgac gacggcgcct tcatcgactt tgcttga 477
<210> 12
<211> 372
<212> DNA
<213> Flammulina velutipes
<400> 12
atgaaatctt ttgccctctt cgtccctctc atcgttgctg ctgtcgtcaa cagcgccgtg 60
gtcacctttt ccaccggcct tggctgcaac tctgtctcgc agacctaccg tggcaactgc 120
aacttctgcg ctgacccacc cggcgactgg agctcagtcg gcttttctga gatcggaggc 180
gacaaccgcg tcaccgttca taaccagaac agctgcaccc ccgcttcgca ggtcggccaa 240
ggctttggac cggcctgctg gaaccaaggc gctaccaagc ttcgttctgc ttgggttgcg 300
tgccctggac agagactcgc tgagaacggt accatcgtcg acgacgacgg cgccttcatc 360
gactttgctt ga 372
Реферат
Изобретение относится к биотехнологии и представляет собой новый фермент аспарагиназу, полученную из Basidiomycete. Изобретение относится также к способу гидролиза одного из L-аспарагина или L-глутамина, включающего обработку субстрата, содержащего одно из L-аспарагина или L-глутамина, ферментом аспарагиназой. Изобретение относится также к способу уменьшения образования акриламида в пищевом веществе, содержащем L-аспарагин, включающему нанесение на пищевое вещество, содержащее L-аспарагин фермента аспарагиназы и нагревание вещества, содержащего L-аспарагин. Изобретение позволяет расширить арсенал ферментов, относящихся к аспарагиназам, а также уменьшить образование канцерогенного акриламида в термически обработанной пище. 3 н. и 6 з.п. ф-лы, 9 ил., 6 пр.
Формула

4 Способ гидролиза одного из L-аспарагина или L-глутамина, включающий:
- обработку субстрата, содержащего одно из L-аспарагина или L-глутамина, ферментом аспарагиназой по любому из пп. 1-3.
- нанесение на пищевое вещество, содержащее L-аспарагин фермента аспарагиназы по любому из пп. 1-3; и
- нагревание вещества, содержащего L-аспарагин.

Комментарии