Производные жирных кислот для перорального введения, обеспечивающие высокие вкусовые качества - RU2520070C2
Код документа: RU2520070C2
Чертежи


Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к вводимым перорально производным жирных кислот, в частности, производным масляной кислоты. Изобретение также относится к составам, содержащим их, и их клиническому применению. Более конкретно, изобретение относится к новым соединениям, получаемым из масляной кислоты, полезным в случае всех известных клинических применений последней и обеспечивающим физико-химические характеристики, подходящие для удобного перорального введения, поскольку они лишены неприятных органолептических свойств, характерных для бутирата. Новые соединения, кроме того, легко синтезируются и имеют хорошую растворимость и устойчивость при хранении.
Уровень техники
Известно, что жирные кислоты с короткой цепью (ЖККЦ) являются слабыми кислотами, содержащими от 2 до 5 атомов углерода (pK 4,8), и что их эндогенная продукция происходит в результате бактериальной ферментации олиго- и полисахаридов и в меньшей степени белков, пептидов и гликопротеинов нормальной кишечной сапрофитной флорой. С количественной точки зрения, основными ЖККЦ, получаемыми в результате ферментации углеводов, являются, в следующем порядке и с указанием соответствующих анионов, бутират, ацетат, пропионат, формиат, валерат и капронат, в то время как изобутират, 2-метилизобутират и изовалерат образуются в меньших количествах посредством катаболизма аминокислот с разветвленной цепью (валина, лейцина, изолейцина). С количественной точки зрения, ЖККЦ являются наиболее важными анионами, присутствующими в просвете толстого кишечника, где достигается их концентрация выше 100 мМ. Каждая ЖККЦ обладает специфическими характеристиками и характерными физиологическими эффектами. Ежедневно в кишечнике продуцируется приблизительно 5 г бутирата, который присутствует в просвете толстого кишечника в концентрации 10-30 мМ и является основным альтернативным глюкозе источником энергии для эпителиальных клеток толстого кишечника. Действительно, 60-70% энергии, потребляемой данными клетками, производится из бутирата. Также известно, что зависимость эпителиальных клеток толстого кишечника от бутирата как источника энергии увеличивается при продвижении от дистального отдела к проксимальному отделу толстого кишечника. ЖККЦ потенциально абсорбируются каждым пищеварительным отделом кишечника, что было показано на животных моделях и у людей-добровольцев. Энтероциты способны абсорбировать бутират, пропионат и ацетат главным образом посредством диффузии неионных соединений и параклеточным всасыванием. Всасывание данных жирных кислот обладает значительным влиянием на абсорбцию NaCl и в целом на водно-электролитный баланс. В частности, бутират способен вызывать сильный стимул в отношении абсорбции на уровне кишечника в случае электронейтрального транспорта NaCl и сильный ингибирующий эффект в отношении секреции Cl-. Данное стимулирующее абсорбцию/противосекреторное регуляторное действие в отношении трансэпителиального транспорта жидкостей осуществляется посредством ряда различных механизмов, таких как
- стимулирование абсорбции NaCl посредством совместного действия двух транспортных систем, представленных в щеточной кайме энтероцита, Cl-/HCO3- и Na+/H+ и Cl-/бутират и Na+/H+;
- ингибирование секреции Cl- посредством ингибирования активности котранспортера Na-K-2Cl (NKCC1), представленного на базолатеральной части энтероцита.
Исследования in vitro показали, что бутират обладает ингибирующим действием на секрецию Cl-, индуцируемую простагландином E2, фосфохолином и холерным токсином. Этот эффект является результатом снижения внутриклеточной продукции циклического АМФ на фоне регулирования аденилатциклазной экспрессии и активности. Сравнительные исследования демонстрируют, что стимулирующее абсорбцию действие бутирата в базальных состояниях и его ингибирующее действие на активные секреторные агенты является много больше в отношении как силы, так и продолжительности действия относительно других ЖККЦ.
Исследование in vivo на животных показали, что бутират обладает профилактическим действием в отношении возможного воспаления в кишечнике в результате диеты, богатой отрубями и волокнами, которые могут раздражающе действовать на слизистую оболочку кишечника. Подтверждение его эффективности обеспечивается тем фактом, что благодаря поддерживаемой абсорбции он дает возможность свиньям достичь оптимального веса за более короткий период времени (Mazzoni M. et al., J. Nutr., август 2008, 138(8):1426-31; Biagi G. et al., J. Anim. Sci., май 2007, 85(5):1184-91. Epub 12 февраля 2007). У человека бутират применяется в качестве диетической добавки при язвенном ректоколите благодаря его способности снижать частоту поноса и поддерживать функционирование толстого кишечника на хорошем уровне.
Помимо действия на кишечный трансэпителиальный транспорт жидкостей, бутират является сильным стимулятором трофики слизистой оболочки кишечника посредством сосудистых, гормональных и нейрональных механизмов. Понижение концентрации бутирата в кишечнике связано с увеличением воспаления слизистой оболочки и с изменениями моторики и различных функций, вовлеченных в механизм роста, дифференцировки и регенерации слизистой оболочки, в степени, приводящей к повышенному риску злокачественного новообразования. В то же время, бутират обладает способностью отрицательно регулировать рост кишечных опухолевых клеток.
В отношении конкретного примера из области гастроэнтерологии, клинические исследования, проводимые у детей с острой диареей, вызванной V. cholerae, демонстрировали уменьшение массы фекалий и более быстрое восстановление у пациентов, которым дополнительно к получению регидратирующей терапии вводили в диету резистентные амидные предшественники ЖККЦ (Ramakrishna B.S. et al., New. Engl. J. Med., 2000, 324:308-31316; Rabbani G.H., et al., Dig. Dis. Sci., 1999, 44:1547-1553). Данные результаты также были подтверждены в случае других форм инфекционной диареи у детей и в исследованиях на животных моделях (Rabbani B.S. et al., Gastroenterology, 2001, 121:554-56; Alam N.H. et al., Gastroenterology, 1997, 112:A; Alam N.H. et al., Pediatr. Лекарственные средства, 2003, 5:151-165). Механизмы данных терапевтических эффектов связаны со стимулирующим абсорбцию действием ЖККЦ, и в частности бутирата, на трансэпителиальный транспорт жидкостей в кишечнике, способный компенсировать потерю фекалий во время диареи, таким образом уменьшая продолжительность и тяжесть состояния (Sellin J.H. et al, Gastroenterology, 1998, 114:737-747; Mush M.W. et al., Am. J. Physiol. Gastrointest. Liver Physiol., 2001, 280:687-693). Благодаря его важному регуляторному действию на всасывание жидкостей в кишечнике, бутират успешно используется у пациентов с врожденной хлоридореей, тяжелым аутосомно-рецессивным генетическим заболеванием, характеризующимся тяжелой хронической диареей с неонатального возраста (Berni Canani R. et al., Gastroenterology, 2004, 127:630-63423). Данное исследование показывает, что пероральное введение бутирата, в дозе 100 мг/кг/день, способствует значительному снижению числа опорожнений/день и улучшению консистенции стула, до полной нормализации стула. Данный терапевтический эффект происходит как из-за стимуляции Cl-/бутират-котранспортера, так и регуляции механизмов синтеза и экспрессии в плазматической мембране энтероцитов молекул, ответственных за трансэпителиальный транспорт жидкостей в кишечнике. Данные свойства также делают вероятным терапевтическое применение бутирата при других заболеваниях желудочно-кишечного тракта, характеризующихся нарушениями в механизмах транспорта жидкостей и питательных веществ.
Бутират также играет центральную роль в поддержании целостности слизистой оболочки кишечника. Эксперименты in vivo на животных моделях показали, что бутират обладает трофическим действием на кишечник, обусловленным повышением уровня гастрина и зависящим от сохранности симпатической и парасимпатической нервных систем (Reilly K.J. et al., Gut., 1995, 37:81-86). Его действие на трансэпителиальный транспорт жидкостей и на трофику слизистой оболочки кишечника делает бутират потенциально идеальным терапевтическим инструментом для профилактики и лечения желудочно-кишечных расстройств в курсе лечения антибиотиками, и главным образом в случае антибиотик-ассоциированной диареи (ААД), которая поражает 15-40% субъектов, принимающих данный тип лекарственных средств (Mortensen P.B. et al., Scand. J. Gastroenterol. Suppl., 1996, 216:132-148; Krishnan S. et al., Scand. J. Gastroenterol., 1998, 33:242-246). Кроме того, действие на трансэпителиальный транспорт жидкостей и на моторику кишечника говорит в пользу терапевтического применения бутирата при лечении желудочно-кишечных функциональных расстройств, характеризующихся изменением моторики, таких как синдром раздраженного кишечника (Scarpellini E. et al., Dig. Liver Dis., 2007, Suppl. 1:19-22).
В литературе выдвигается предположение о возможном применении бутирата при лечении хронических воспалительных заболеваний кишечника. Бутират индуцирует клиническое и гистологическое заживление экспериментального колита, индуцированного посредством тринитробензолсульфоновой кислоты (Butzner J.D. et al., Gut., 1996, 38:568-573). При язвенном ректоколите (ЯРК) происходит изменение метаболизма ЖККЦ в эпителиальных клетках толстого кишечника (Roediger W.E.W., Lancet, 1980, 2:712-715), что вызывает понижение внутрипросветной концентрации данных жирных кислот. Было сделано предположение, что низкие концентрации ЖККЦ, обнаруженные у пациентов с тяжелым ЯРК, могут приводить к повреждению слизистой оболочки (Chapman M.A.S. et al., Gut., 1994, 35:73-76). В различных клинических исследованиях, бутират, вводимый местно (посредством клизмы) пациентам с ЯРК, давал положительные результаты, ускоряя клинический, эндоскопический и гистологический процесс заживления, когда вводился в комбинации с другими противовоспалительными лекарственными средствами, такими как месалазин (Scheppach et al., Dig. Dis. Sci., 1991, 36:185-187; Bruer R.I. et al., Gut., 1997, 40:485-491; Vernia P. et al., Dig. Dis. Sci., 1995, 40:305-307). Эффективность комбинации бутират/месалазин также была подтверждена в исследованиях с применением перорально вводимых составов (Vernia P. et al., Dig. Dis. Sci., 2000, 45:976-981).
В литературе существуют указания, что группы населения с низким числом случаев заболеваний толстого кишечника (также включая злокачественное новообразование толстого кишечника) имеют диету, богатую углеводами - основными предшественниками ЖККЦ. Защитное действие бутирата в отношении развития злокачественного новообразования толстого кишечника и полипоза достоверно подтверждено как in vitro, так и in vivo исследованиями: бутират в действительности способен in vitro ингибировать рост основной линии клеток опухоли толстого кишечника как путем снижения пролиферации, так и путем стимуляции дифференцировки и апоптоза. Доказано непосредственное противоопухолевое действие бутирата посредством регуляции транскрипции различных генов, вовлеченных в процесс онкогенеза (Boffa L. et al., J. Biol. Chem., 1981, 256:9612-9621; Avivi-Green C. et al., Oncol. Res., 2000, 12:83-95). Однако данное защитное действие бутирата определяется длительностью воздействия в отношении процесса онкогенеза (Basson M.D. et al., Proc. Soc. Exp. Biol. Med., 1998, 217:476-483; Hague A. et al., Int. J. Cancer, 1993, 55:498-505; Heerdt B.G. et al., Cancer Res., 1994, 54:3288-3294; Lupton J.R., Am. Soc. Nutr. Sci., 2004, 134:479-482).
Натрия 4-фенилбутират (4PBA) - аналог бутирата, вводимый перорально, рассматривается как потенциальное лекарственное средство для лечения муковисцидоза (у пациентов с мутацией ΔF 508). Действительно, 4PBA и позднее 2,2-диметилбутират (ST20) и альфа-метилгидрокоричная кислота (ST7) способны индуцировать повышенную экспрессию МВТР (трансмембранный регулятор муковисцидоза) в эпителии дыхательных путей как in vitro, так и in vivo (Rubenstein R.C. et al., J. Clin. Invest., 1997, 100:2457-2465; Nguyen T.D. et al., Biochem. Bioph. Res. Com., 2006, 342:245-252).
В гематологии бутират известен как индуктор продукции фетального гемоглобина (HbF) путем селективного стимулирования активности генов, кодирующих гамма-глобиновые цепи (Ikuta T. et al., Blood, 1998, 92:2924-2933). Данная активность привела к его применению у пациентов с промежуточной β-талассемией, у которых небольшое увеличение количества HbF индуцирует нормализацию внекостномозгового кроветворения со значительным снижением осложнений и улучшением качества жизни (Olivieri N.F. et al., Lancet, 1997, 350:491-492; Faller D.V. et al., Curr. Opin. Hematol., 1995, 2:109-117).
В первых исследованиях, проведенных у пациентов с талассемией, соответствие лечению было слабым, поскольку были необходимы внутривенные вливания в течение 4 дней с интервалами 3-4 недели. Позднее было показано, что перорально активные соединения масляной кислоты (фенилацетат натрия и 4-фенилбутират натрия) способны увеличивать продукцию HbF у субъектов с серповидно-клеточной анемией. Пероральное введение изобутирамида в дозе 350 мг/кг/день пациентам, страдающим β-талассемией, удлиняет интервал между переливаниями и уменьшает избыток железа. В настоящее время, однако, применение бутирата и его аналогов, по сравнению с контролируемыми клиническими испытаниями, не так широко распространено, вследствие плохого соблюдения режима терапии, демонстрируемого также для пероральных составов.
Что касается генетических метаболических заболеваний, 4-фенилбутират натрия одобрен Управлением по контролю качества продуктов и лекарств США (FDA) для применения у пациентов с дефицитом ферментов цикла мочевины, у которых он действует как акцептор аммиака. В действительности 4-фенилбутират натрия окисляется до фенилацетата, который связывается с глутамином и вызывает его выделение с мочой. У пациентов с дефицитом орнитин-транскарбамилазой применение 4-фенилбутирата натрия позволяет лучше контролировать метаболизм и лучше усваивать природные белки с пищей (Burlina A.B. et al., Molecular Genetics and Metabolism, 2001, 72:351-355). Также в стадии исследования является возможность применения 4-фенилбутирата натрия при лечении X-сцепленной адренолейкодистрофии (X-АЛД), пероксисомное заболевание, характеризующееся изменением метаболизма и накоплением жирных кислот с очень длинной цепью. Натрия 4-фенилбутират, применяемый либо in vitro на фибробластах пациентов с X-АЛД, либо in vivo у X-АЛД-нокаутированных морских свинок, приводит к увеличению бета-окисления жирных кислот с очень длинной цепью и индуцирует пролиферацию пероксисом (Kemp S. et al., Nat. Med., 1998, 4:1261-1268).
И, наконец, совсем недавно было показано, что пероральное введение бутирата может предотвращать и лечить инсулинорезистентность и увеличение веса в животной модели ожирения у крыс. Данные эффекты являются по меньшей мере частично связанными со стимуляцией расхода энергии и ряда митохондриальных функций и открывают новые интересные перспективы для применения в профилактике и лечении метаболических нарушений, связанных с ожирением.
Исходя из данных научных исследований в литературе и клинических исследований ряда исследовательских групп, появляется широкий спектр возможностей для терапевтического применения бутирата при пероральном введении и отсутствие серьезных нежелательных явлений.
Некоторое количество основанных на бутирате продуктов находится в продаже, но их применение все еще очень сильно ограничено и очень низко относительно широкого спектра возможных показаний, особенно при хронических заболеваниях, где предусмотрено длительное применение соединения. Основная проблема возникает вследствие трудностей, связанных с доступностью составов для бутирата, которые легко вводятся перорально, особенно пациентам детского возраста, главным образом в связи с чрезвычайно плохими вкусовыми качествами препаратов, существующих на рынке. Очень неприятный вкус и запах делают пероральное введение доступных в настоящее время препаратов на основе бутирата чрезвычайно трудным и данные затруднения еще более значительны в случае пациентов детского возраста, для которых введение таких препаратов оказывается действительно очень трудным. Проблемы, связанные с возможными фармацевтическими составами бутирата, возникают из-за того, что препарат имеет конкретные физико-химические характеристики. Масляная или н-бутановая кислота (C4H8O2) при комнатной температуре представляет собой густую жидкость, характеризующуюся очень неприятным, интенсивным запахом несвежего сыра и с течением времени подвергается деградации, что изменяет ее стабильность. В этом виде окислительные явления являются более явными, и обычные фармацевтические формы (сиропы, капсулы и таблетки) являются непригодными, за исключением, с определенными ограничениями, мягких желатиновых капсул, применение которых, однако, является невозможным у грудных детей и в раннем детстве. Большинство легко получаемых производных масляной кислоты представляют собой соли щелочных и щелочноземельных металлов, которые, в свою очередь, обладают далеко не незначительными недостатками. Соли натрия представляют собой твердые вещества с высокой степенью гигроскопичности и сильным запахом масляной кислоты. Соли кальция, несмотря на твердую форму, обладают очень плохой растворимостью в воде и соли магния, также твердые, являются растворяющимися. Соли кальция и магния, в любом случае, также сохраняют сильный характерный запах. В цитируемой выше литературе представлены многочисленные данные о недостатках, связанных с крайне неприятным вкусом и запахом и сопутствующими эпигастральными расстройствами вследствие перорального введения бутирата или его производных и его аналогов с нормальной или разветвленной цепью с вплоть до 6 атомами углерода. Это происходит, например, в случае введения фенилбутирата натрия или изобутирамида при клинических исследованиях с участием пациентов с талассемией (Collins A.F. et al., Blood, 1998, 85:43-49; Reich S. et al., Blood, 2000, 96:3357-3362). Основываясь на упомянутых выше факторах, существует очевидная необходимость в доступном соединении бутирата (или соединении жирных кислот с нормальной или разветвленной цепью с вплоть до 6 атомов углерода), которое сохраняет терапевтическую эффективность, но в то же время позволяет легко вводить препарат перорально, также благодаря улучшенным вкусовым качествам, кроме того, имеющее небольшую стоимость. Также препарат может быть пригоден для длительного лечения и также может быть полезен для медицины. Рассматривая возможные химические модификации масляной кислоты для получения производного, которое обладает хорошей стабильностью и растворимостью, отсутствием запаха и вкуса и приемлемыми вкусовыми качествами и которое не является гигроскопичным в твердом состоянии и легко синтезируется и очищается, может быть замечено, что хлорангидриды жирных кислот легко взаимодействуют в безводной среде как со спиртовыми, так и с аминогруппами, давая в качестве продуктов реакции сложные эфиры и ряд фармакологически активных молекул. Преимуществом сложных эфиров является приятный запах, до такой степени, что метиловые и этиловые эфиры масляной кислоты используются в качестве вкусовых и ароматизирующих агентов в пищевой промышленности, но они в основном являются маслами или поглощающими влагу твердыми веществами с низкой температурой плавления, и это не может решить проблемы из-за жидкого состояния, также не все из них являются стабильными на воздухе. Кроме того, сложноэфирная форма имеет низкую стабильность в кислой среде, и при pH желудка гидролиз приводит к формированию кислоты и спирта, из которых эти сложные эфиры получены, с последующим высвобождением масляной кислоты, снова приводя, хотя и в меньшей степени, к упомянутым выше проблемам со вкусовыми качествами. Сложноэфирные производные бутирата описаны, например, в патенте США 5763488, в котором предлагается пероральное введение пролекарств, состоящих из сложных эфиров масляной кислоты с треитолом, для клинического применения при заболеваниях, связанных с β-гемоглобином. Такие заболевания предлагаются с целью улучшения биодоступности бутирата, но в документе не принимаются во внимание аспекты, связанные со вкусовыми качествами пероральных лекарственных средств на основе данного активного компонента.
На конкретном примере желудочно-кишечных заболеваний, в международной патентной заявке WO 98/40064 предлагается применение, путем перорального введения, пролекарств бутирата с молочной кислотой. Целью является преодоление недостатков вследствие плохих фармакокинетических свойств бутирата и получение пероральных лекарственных средств, которые обеспечивают хорошую биодоступность и приемлемый период полувыведения, делая возможным эффективное высвобождение бутирата в плазму крови. Также, при этом, в документе не принимается во внимание особенность вкусовых качеств перорального лекарственного средства на основе бутирата. В настоящее время обнаружено, что некоторые амидные производные ЖККЦ, и в частности масляной кислоты, решают упомянутые выше проблемы.
Краткое описание рисунков
На фиг.1-5 демонстрируются изменения тока короткого замыкания (Iкз) в зависимости от времени (мин). Эффект был дозозависимым. В частности:
на фиг.1 показано действие добавления бутирата Na на Iкз в клетках Caco-2, помещенных в камеру Уссинга. Уменьшение Iкз, вызванное добавлением бутирата Na со стороны слизистой, указывает на абсорбцию ионов. Данные представлены в виде средних значений из трех экспериментов. Вещество добавляли в нулевой момент времени;
на фиг.2 показано действие добавления соединения 1 (пример 1) на Iкз в клетках Caco-2, помещенных в камеру Уссинга. Уменьшение Iкз, вызванное добавлением соединения 1 со стороны слизистой, указывает на абсорбцию ионов. Данные представлены в виде средних значений ± из трех экспериментов. Вещество добавляли в нулевой момент времени;
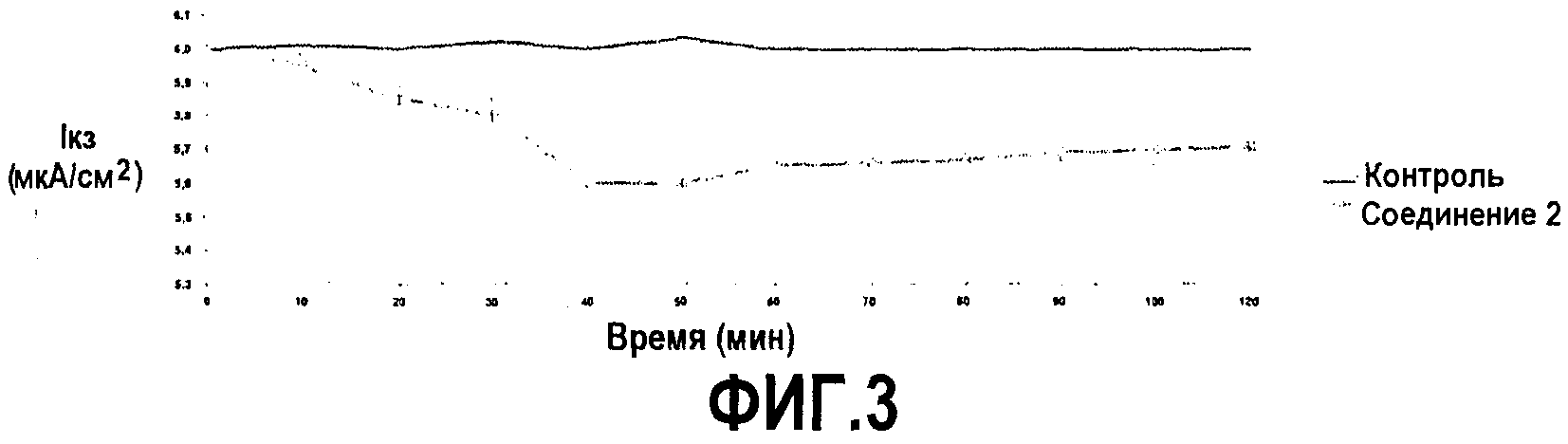
на фиг.3 показано действие добавления соединения 2 (пример 1) на Iкз в клетках Caco-2, помещенных в камеру Уссинга. Уменьшение Iкз, вызванное добавлением соединения 2 со стороны слизистой, указывает на абсорбцию ионов. Данные представлены в виде средних значений ± из трех экспериментов. Вещество добавляли в нулевой момент времени;
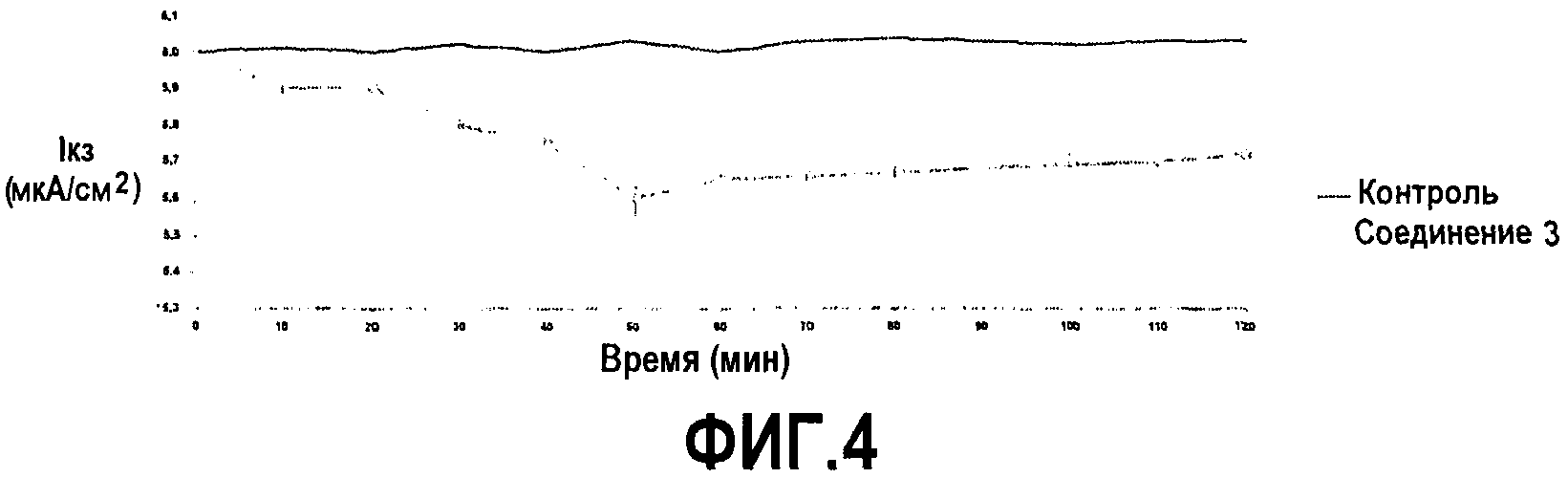
на фиг.4 показано действие добавления соединения 3 (пример 1) на Iкз в клетках Caco-2, помещенных в камеру Уссинга. Уменьшение Iкз, вызванное добавлением соединения 3 со стороны слизистой, указывает на абсорбцию ионов. Данные представлены в виде средних значений ± из трех экспериментов. Вещество добавляли в нулевой момент времени;
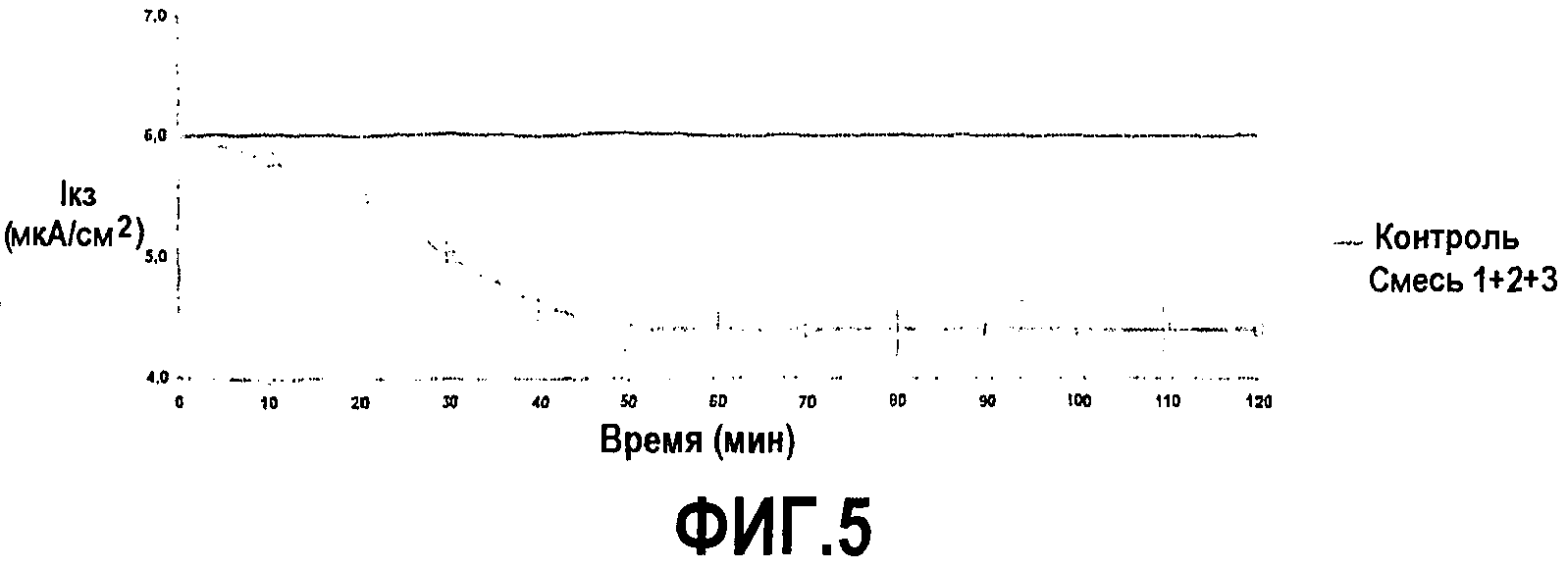
на фиг.5 показано действие добавления смеси соединений 1, 2 и 3 (пример 1) на Iкз в клетках Caco-2, помещенных в камеру Уссинга. Уменьшение Iкз, вызванное добавлением смеси соединений 1, 2 и 3 со стороны слизистой, указывает на абсорбцию ионов. Данные представлены в виде средних значений ± из трех экспериментов. Вещество добавляли в нулевой момент времени.
Подробное описание изобретения
В рамках исследований, которые привели к настоящему изобретению, рассматривалось, что амидные производные ЖККЦ, в частности масляной кислоты, обычно существующие в твердой, не имеющей запаха и вкуса форме, являются более стабильными, чем сложные эфиры, в условиях рН желудка и способны высвобождать соответствующую кислоту при щелочном гидролизе в тонком и толстом кишечнике. Данные фармакокинетические характеристики делают эти производные потенциальными пролекарствами с конкретными свойствами в отношении пролонгированного высвобождения в кишечнике, который составляет очень важную терапевтическую мишень, отвечающего в особенно эффективном способе необходимости в точном нацеливании лекарств.
Согласно изобретению было обнаружено, что синтез амидов ЖККЦ с нормальной или разветвленной цепью с применением нетоксичных, в высокой степени биосовместимых молекул, таких как аминокислоты, и в числе последних, в частности, фенилаланина, обеспечивает производные, наделенные всеми органолептическими и физико-химическими характеристиками, требуемыми для оптимального применения конечного продукта в виде перорального лекарственного средства, требуемого в медицине, также для длительной терапии или для лечения хронических заболеваний. Среди различных наиболее широко доступных природных аминокислот, фенилаланин обеспечивает самые лучшие амидные производные в отношении органолептических и физико-химических характеристик, давая не имеющие запаха и цвета твердые кристаллические продукты, и делает возможным чрезвычайно экономически выгодную очистку касательно отношения цена:выход. Наиболее предпочтительным, согласно изобретению, является кислотоустойчивый амид масляной кислоты с аминокислотой фенилаланин, фенилаланин-бутирамид (ФБА), который представляет собой твердое вещество, малогигроскопичное, удобное для взвешивания, устойчивое к действию кислот и щелочей и способное высвобождать масляную кислоту в тонком и толстом кишечнике непрерывно в течение длительного времени. Данный продукт, исследования токсичности для которого, описанные далее в данном документе, показали профиль токсичности, сравнимый с бутиратом, обладает физико-химическими свойствами, значительно более подходящими для широкого клинического применения по сравнению с последним. Отличительной чертой ФБА является то, что он не имеет неприятного запаха бутирата и практически безвкусный, таким образом, позволяя преодолеть основное ограничение для применения бутирата в терапии, а именно его очень плохие вкусовые качества. Более того, растворимость ФБА в воде является удовлетворительной, так как получаются прозрачные растворы вплоть до концентрации 0,1 M и суспензии при более высоких концентрациях.
Амидное производное масляной кислоты с фенилаланином или подходящими производными последнего получают путем взаимодействия соответствующего производного фенилаланина с бутирилхлоридом или эквивалентным производным масляной кислоты (простым или смешанным сложным эфиром или ангидридом) - см. Y в п.1, в полярном апротонном инертном органическом растворителе при комнатной температуре. В результате данной реакции образуется монобутирильное производное, которое является основным компонентом, в количественном выражении, сопровождаемым, в зависимости от структуры исходных реагентов, также дибутирильным производным исходного соединения фенилаланина и других производных, получаемым, например, в результате циклизации основного продукта в процессе реакции.
Хотя возможно выделение и очистка соединений, полученных известными способами, также было замечено, согласно изобретению, что реакционная смесь может успешно применяться без предварительного разделения на индивидуальные компоненты и что в данном состоянии также демонстрировались желаемые физико-химические, органолептические и фармакокинетические свойства.
Вследствие этого, конкретной целью настоящего изобретения является обеспечение амидного производного ЖККЦ, получаемого по реакции производного указанной жирной кислоты с производным фенилаланина в соответствии со следующей общей схемой:
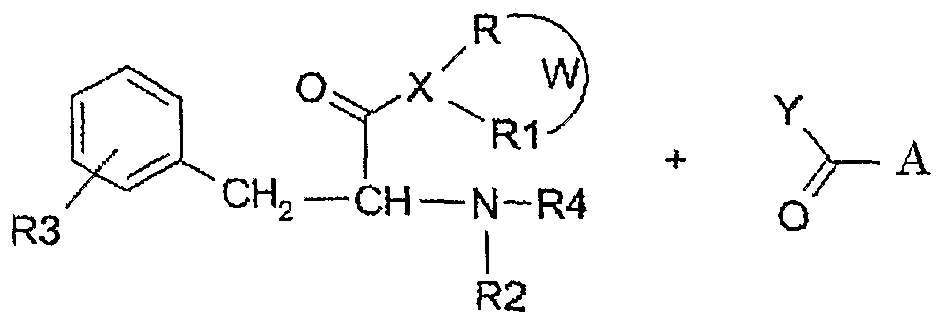
где
Y представляет собой атом галогена, алкоксил (2-6 атомов углерода), ацил (2-6 атомов углерода);
A представляет собой нормальную или разветвленную C(1-5) алкильную цепь, возможно замещенную фенилом;
X представляет собой кислород, азот или серу, при условии, что:
- когда X представляет собой кислород или серу, R представляет собой водород или (C1-6) алкильную группу и R1 и W отсутствуют;
- когда X представляет собой азот, R и R1 представлены независимо водородом или (C1-6) алкильной группой или (C1-6) ацильной группой и W отсутствует; или
W представляет собой 1,2-алкиленовую цепь с 2-6 атомами углерода, и R и R1 являются метиленовыми группами;
R2 и R4 представлены независимо водородом или (C1-6) алкильной группой или (C1-6) ацильной группой;
R3 выбирают из группы, состоящей из H, (C1-6)алкила, (C1-6)алкоксила, галогена, гидроксила, циано, нитро, амино, моно- или ди(C1-6)алкиламино, (C2-6)ациламино, формила, гидроксииминометила, (C1-6)алкоксииминометила и карбамоила;
при следующих условиях: полагая, что все описанное ранее понятно, производные по настоящему изобретению включают соли с фармацевтически приемлемыми основаниями и кислотами и возможные диастереомерные и энантиомерные формы.
C1-C6 алкильные группы, определенные для целей настоящего изобретения, могут быть нормальными или разветвленными и по существу представляют собой метил, этил, пропил, изопропил, бутил, изопентил, н-гексил и их аналоги, тогда как C1-C6 алкоксильные группы предпочтительно выбирают из группы, состоящей из метоксила, этоксила, пропоксила, изопропоксила, бутоксила, 2-метилпропоксила и трет-бутоксила.
Кроме того, для целей настоящего изобретения, алкиленовая цепь может быть нормальной или разветвленной, такой как, например, этилен, 1,3-пропилен, 2-метилэтилен, 1,4-бутилен, 2-метил-1,3-пропилен, 2-этилэтилен, 1,5-пентилен, 2-этил-1,3-пропилен, 2-метил-1,4-бутилен и тому подобное, тогда как под галогеном по существу подразумевается фтор, хлор, бром и йод. В соответствии с принятой в настоящее время химической номенклатурой C2-C6 ацильная группа по существу определяет ацетил, пропионил, бутирил, пентаноил, пивалоил, гексаноил и тому подобное. Термины алкоксил, алкиламино, ациламино, алкоксииминометил и карбамоил также имеют значения в соответствии с номенклатурой в данной области техники.
Соединения по настоящему изобретению получают путем взаимодействия двух соединений, указанных выше, предпочтительно в по существу эквимолярных количествах в полярном апротонном инертном растворителе, таком как, например, бензол, толуол или хлороформ, при комнатной температуре реакционной смеси, предпочтительно в течение периода времени от четырех до двадцати четырех часов, с последующими одной или несколькими стадиями разделения и очистки полученного продукта, предпочтительно путем перекристаллизации. В случае взаимодействия производного фенилаланина и бутирильного производного будет получена смесь бутирильных производных, где основной продукт будет состоять из монопроизводного с другими продуктами реакции, такими как дибутирильное производное и циклическое производное, указанное здесь далее.
В соответствии с некоторыми конкретными примерами осуществления, объектом изобретения является амидное производное жирной кислоты с короткой цепью, имеющее следующую общую формулу:
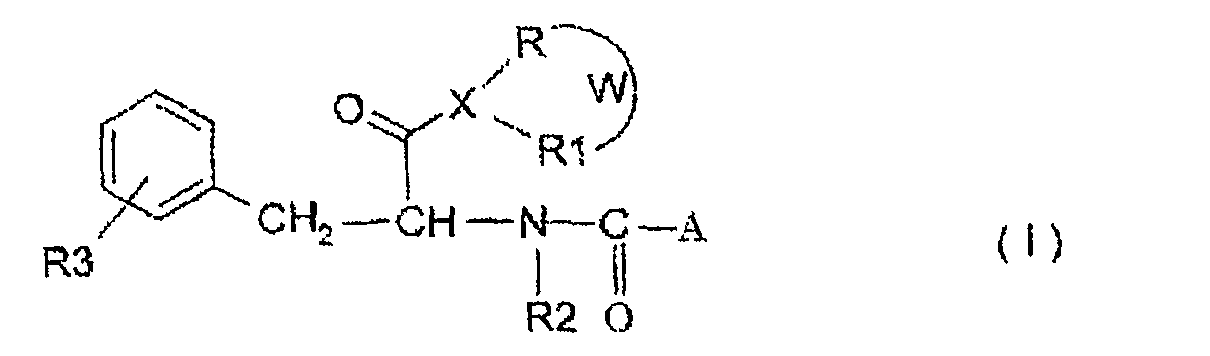
где A, X, W, R, R1, R2 и R3 определены ранее, и соответствующие соли с фармацевтически приемлемыми основаниями, а также возможные диастереомерные и энантиомерные формы.
Несколько предпочтительных форм соединения формулы (I), представленные также в следующих примерах синтеза, представляют собой соединение формулы (I), где A представляет собой -(CH2)2CH3, X представляет собой азот и R, R1, R2 и R3 представляет собой водород (N-(1-карбамоил-2-фенилэтил)бутирамид, и соединение, где A представляет собой -(CH2)2CH3, X представляет собой кислород, R представляет собой метоксильную группу и R2 и R3 представляют собой водород (метиловый эфир 2-бутириламино-3-фенилпропионовой кислоты).
В соответствие с другим конкретным примером осуществления изобретения, объектом настоящего изобретения является смесь амидных производных масляной кислоты, получаемая путем взаимодействия бутирилгалогенида с производным фенилаланина по схеме, представленной выше, и их соли с фармацевтически приемлемыми основаниями или кислотами, а также возможные диастереомеры и энантиомеры. Особенно выгодной для целей настоящего изобретения является смесь, полученная при проведении процесса, описанного в примере 1, и по существу содержащая следующие три соединения:
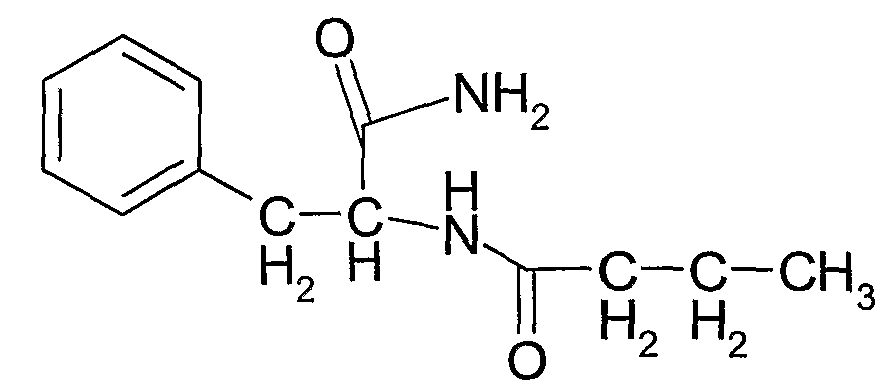
N-(1-карбамоил-2-фенилэтил)бутирамид (соединение 1) формулы:
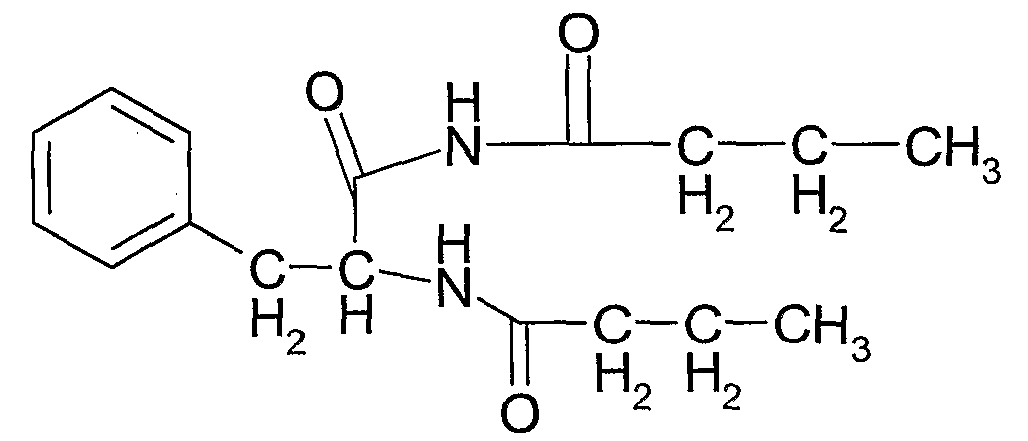
N-(1-бутирилкарбамоил-2-фенилэтил)бутирамид (соединение 2) формулы:
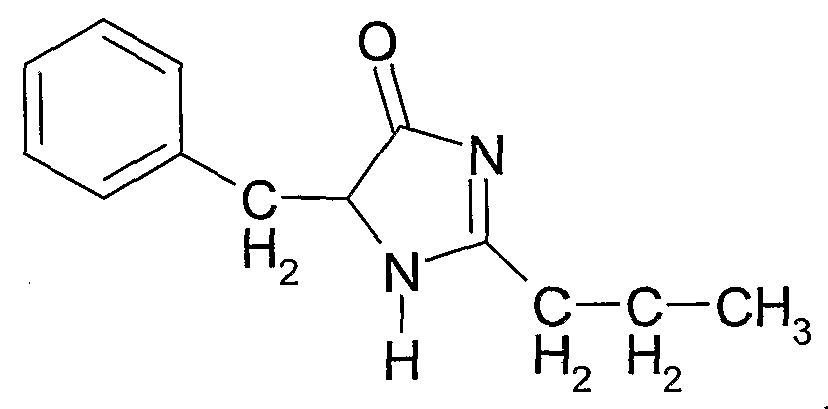
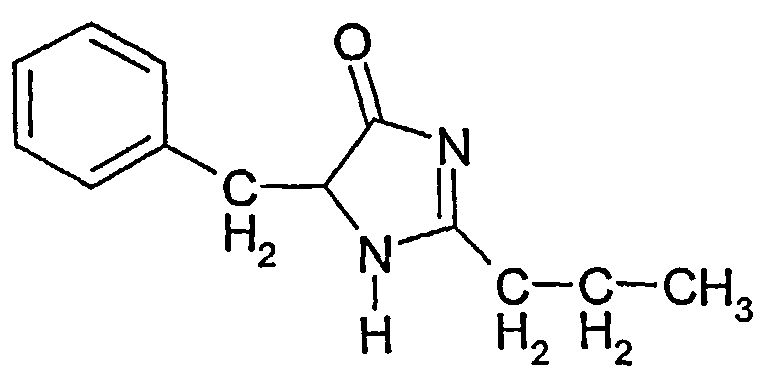
5-бензил-2-пропил-1H-имидазол-4(5H)-он (соединение 3) формулы:
Полученные таким образом соединения могут применяться в виде их смеси или могут быть выделены и очищены известными способами. Они могут быть выделены как в виде свободных форм, так и в виде соответствующих солей фармацевтически приемлемых оснований или кислот, при добавлении подходящего количества выбранного основания или кислоты к свободным формам или к реакционной смеси. Примерами таких солей являются фармацевтически приемлемые соли натрия или калия, соли аммония, с этилендиамином и алифатическими или ароматическими азотсодержащими основаниями, гидрохлориды, сульфаты, с алифатическими или ароматическими кислотами. Соединения по изобретению, принимая во внимание природу заместителей A, X, R, R1, R2 и R3, а также фенильную группу, имеют по меньшей мере один хиральный центр, поэтому они могут существовать в виде рацемических форм или в виде диастереоизомерных форм, которые могут быть получены способами, хорошо знакомыми квалифицированному химику. Например, один из них предполагает препаративную хроматографию на пластинах с хиральной подложкой с применением соответствующей системы элюента. Как указано выше, возможные диастереоизомеры соединений формулы (I) составляют дополнительный объект настоящего изобретения. Важно отметить, что указанные соединения, а также их соли с фармацевтически приемлемыми основаниями или кислотами, сохраняют действие в кишечнике, которое ранее было описано в отношении бутирата. Для проверки этого были получены экспериментальные данные на моделях in vitro эпителия кишечника человека. В другом аспекте, объектом изобретения является применение одного или более амидных производных жирных кислот с короткой цепью, в частности, производных масляной кислоты, получаемых путем взаимодействия, описанного выше, или их смесей для производства фармацевтического препарата, и более конкретно, препарата, полезного для лечения и профилактики заболеваний у человека или животного.
Возможные терапевтические применения соединений по изобретению суммированы в таблице далее.
В заключение, фармацевтические композиции по изобретению содержат в качестве активного компонента по меньшей мере одно соединение общей формулы (I) и его соответствующие производные, предпочтительно, по меньшей мере одно из амидных производных масляной кислоты, описанных выше, или более предпочтительно, смесь трех соединений 1, 2 и 3, вместе с одним или более фармацевтически приемлемыми адъювантами и/или носителями. Как указано во введении, тип композиции по изобретению, которая обеспечивает наибольшее преимущество для указанных терапевтических целей, является композицией, составленной для перорального введения, которая позволяет улучшить соблюдение режима терапии пациентом, особенно при продолжительной терапии и применении в педиатрии и ветеринарии. Фармацевтические препараты, подходящие для перорального введения, могут, например, быть в форме таблеток, капсул, сиропов, растворов и годных для питья суспензий, капель, гранул, препаратов для сублингвального введения или составов для местного, подкожного или желудочно-кишечного введения или препараты, вводимые парентерально, также в комбинации с другими активными компонентами, включая лекарственные средства, пищевые добавки, функциональные продукты питания, нутрицевтики и медицинские устройства.
Характерные черты изобретения, а также его преимущества и соответствующие способы химического синтеза будут более очевидны из подробного описания, представленного в виде ряда примеров ниже, вместе с результатами проведенных экспериментов и данными, сопоставляемыми с известным уровнем техники.
Пример 1
Способ синтеза
Растворяли 0,01 моль карбоксамида фенилаланина и 0,01 моль бутирилхлорида в 50 мл хлороформа и полученную смесь оставляли взаимодействовать при комнатной температуре в течение двадцати четырех часов. Упаренная в вакууме смесь давала твердый белого цвета остаток, который промывали 1% раствором бикарбоната натрия. Водный раствор бикарбоната дважды экстрагировали равным объемом этилацетата для извлечения дополнительной фракции смеси производных. Для выделения отдельных компонентов обработанную таким образом смесь подвергали хроматографии на колонке с силикагелем, используя дихлорметан в качестве элюента, с получением трех соединений, охарактеризованных ниже. Все три соединения перекристаллизовывали из смеси хлороформ/н-гексан 1:1 об:об, получая конечный выход соединения 1, равный или более 50% и аналогичное количество соединений 2 и 3.
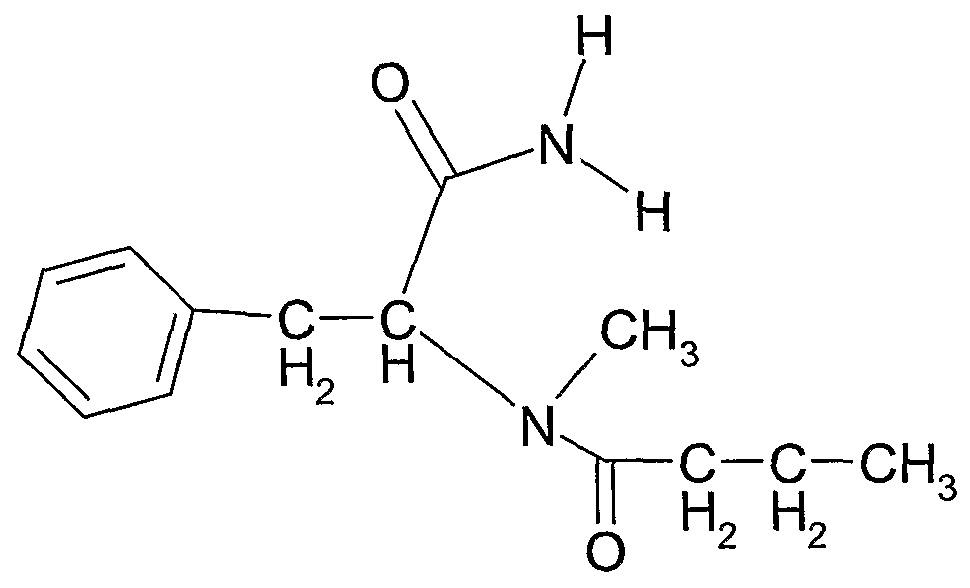
Соединение 1: N-(1-карбамоил-2-фенилэтил)бутирамид

1Н ЯМР: 7,34-7,22 (5H, м), 6,23 (1H, ушир.д), 5,99 (1H, NH2), 5,54 (1H, NH2), 4,71 (1H, дд), 3,06 (2H, дд), 2,11 (2H, т), 1,59 (2H, т), 0,87 (3H, кв).
Тпл.: 186-9°C. В.М.В. 234 (Вычисленный молекулярный вес);
Выход: >50% по весу от общего количества трех соединений.
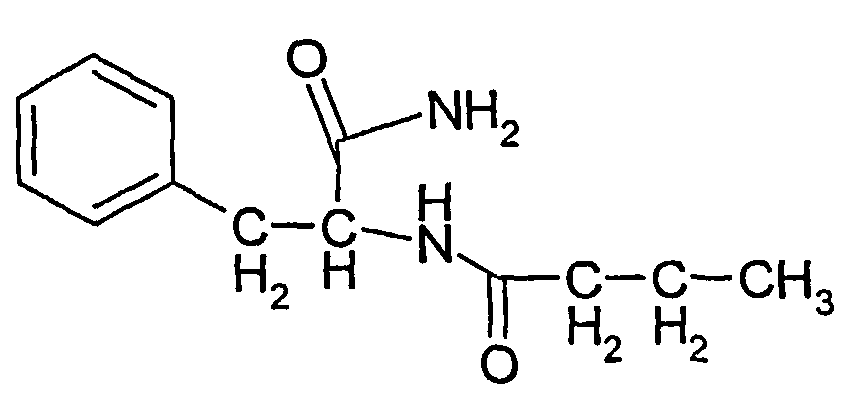
Соединение 2: N-(1-бутирил-карбамоил-2-фенилэтил)бутирамид

1Н ЯМР: 9,25 (1H, ушир.с), 7,25-7,18 (5H, м), 6,38 (1H, ушир.д), 4,97 (1H, м), 2,18 (1H, дд), 2,89 (1H, дд), 2,58 (2H, т), 2,15 (2H, т), 1,59 (4H, м), 0,92 (3H, т), 0,82 (3H, 7).
Тпл.: 198-9°C. В.М.В. 304;
Выход: ~20-30% по весу от общего количества трех соединений.
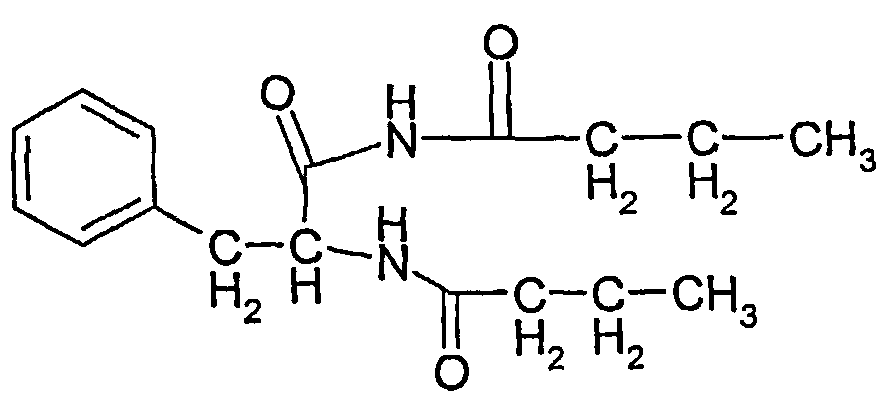
Соединение 3: 5-бензил-2-пропил-1H-имидазол-4(5H)-он

1Н ЯМР: 7,34-7,22 (5H, м), 5,88 (1H, ушир.д), 5,20 (1H, м), 3,08 (2H, дд), 2,18 (2H, т), 2,11 (2H, т), 1,61 (2H, м), 0,87 (3H, т).
Тпл.: 151-2°C. В.М.В. 216;
Выход: ~20-30% по весу от общего количества трех соединений.
Пример 2
Соединение 4: N-(1-карбамоил-п-толилметил)бутирамид
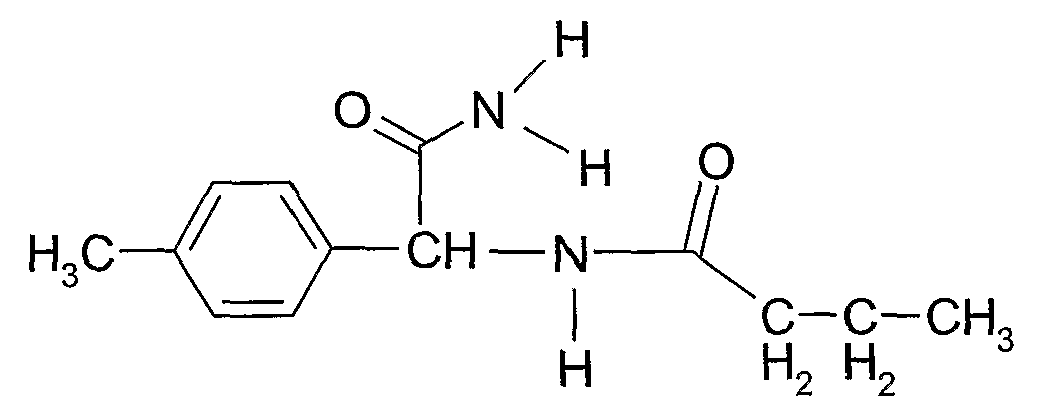
Растворяли 0,01 моль 2-амино-2-п-толилацетамида и 0,015 моль бутирилхлорида в 50 мл хлороформа с добавленными 0,02 моль триэтиламина и полученную смесь оставляли взаимодействовать при комнатной температуре в течение двадцати четырех часов. Упаренная в вакууме смесь давала твердый белого цвета остаток, который промывали 1% раствором бикарбоната натрия. Водный раствор бикарбоната дважды экстрагировали равным объемом этилацетата для извлечения дополнительной фракции соединения 4. Соединение 4 перекристаллизовывали из смеси хлороформ/н-гексан 1:1 об:об, получая конечный выход 90%
Примеры 3 и 4
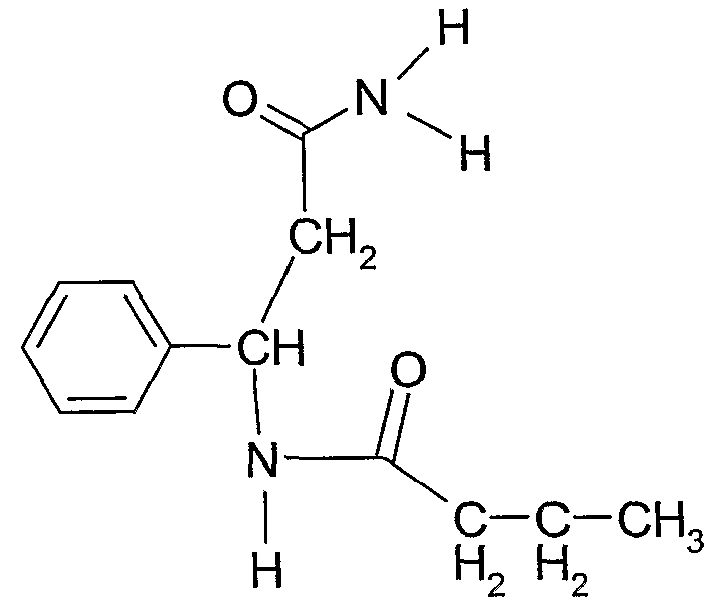
Соединение 5: N-(2-карбамоил-1-фенилэтил)бутирамид
Соединение 6: N-(4(2-карбамоилэтил)фенил)бутирамид
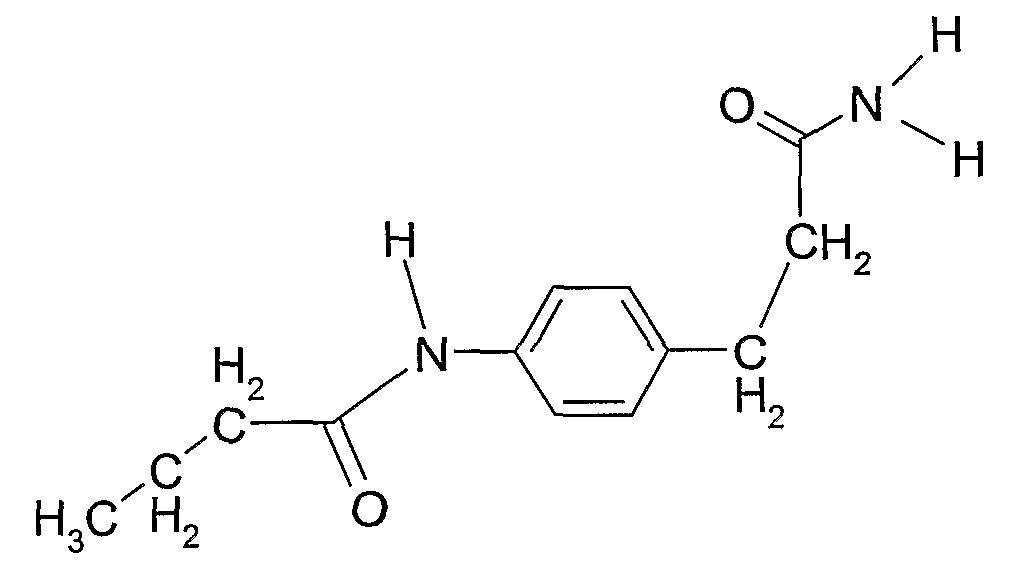
Соединения 5 и 6 получали тем же самым способом, что и соединение 4 в примере 2, используя 0,01 моль 3-амино-3-фенилпропанамида и 3-(4-аминофенил)пропанамида, соответственно, и получая конечный выход 90%.
Пример 5
Соединение 7: N-(1-оксо-3-фенил-1-(пиперидин-1-ил)пропан-2-ил)бутирамид
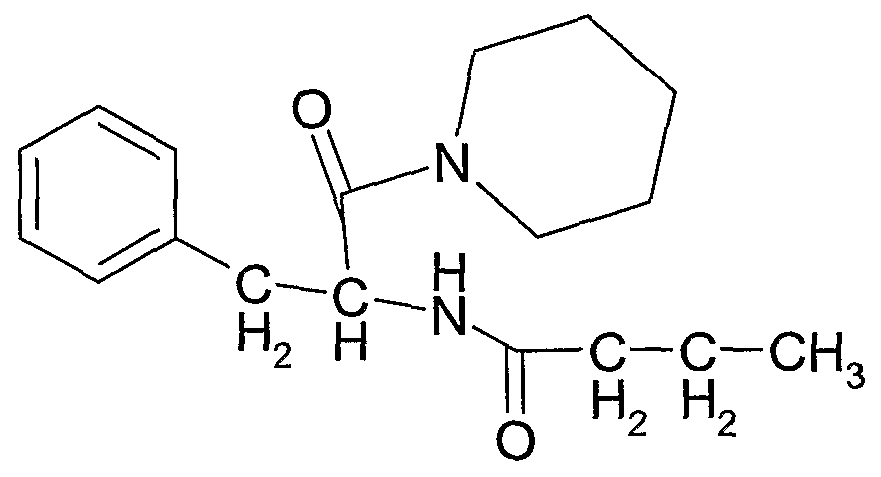
Соединение 7 получали тем же самым способом, что и соединение 4 в примере 2, используя 0,01 моль 2-амино-3-фенил-1-(пиперидин-1-ил)пропан-1-она, и перекристаллизовывали из смеси хлороформ/н-гексан 2:1 об:об. Получали с конечным выходом 90%.
Примеры 6-14
Соединение 8: N-(1-оксо-3-фенил-1-(пирролидин-1-ил)пропан-2-ил)бутирамид
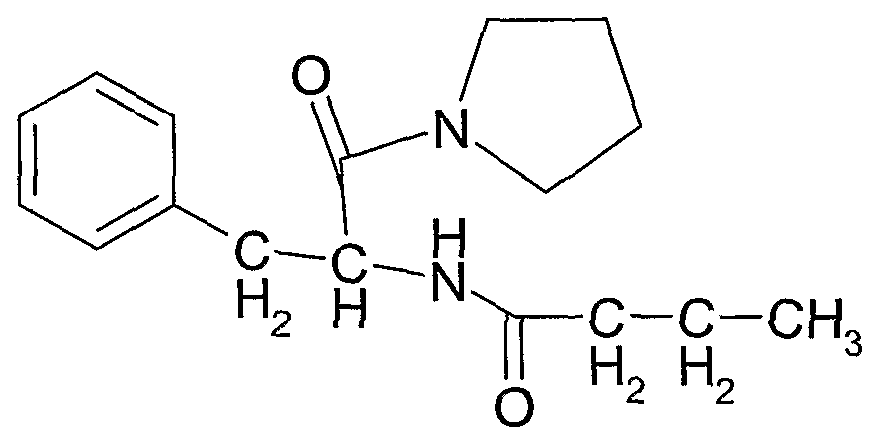
Соединение 9: N-(1-(метилкарбамоил)-2-фенилэтил)бутирамид
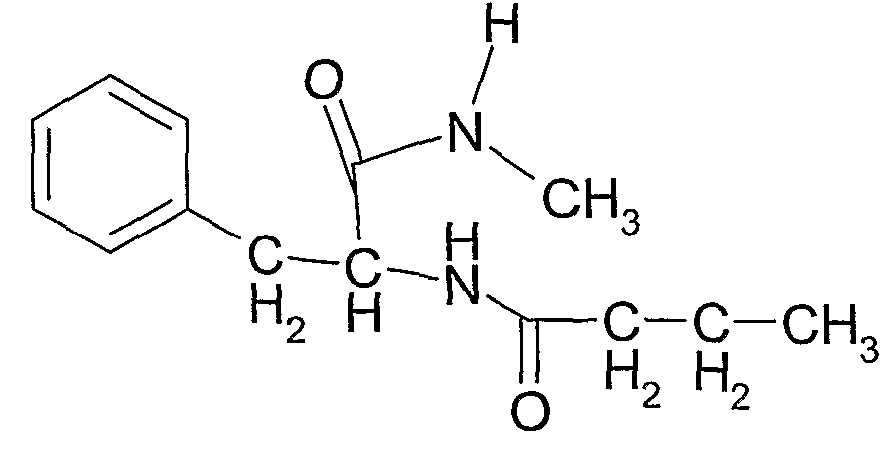
Соединение 10: N-(1-(этилкарбамоил)-2-фенилэтил)бутирамид

Соединение 11: N-(1-(пропилкарбамоил)-2-фенилэтил)бутирамид

Соединение 12: N-(1-(бутилкарбамоил)-2-фенилэтил)бутирамид
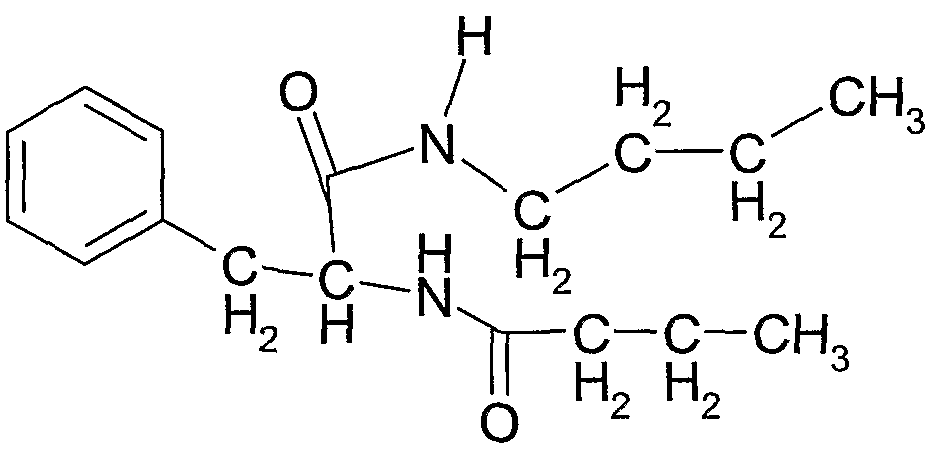
Соединение 13: N-(1-(пентилкарбамоил)-2-фенилэтил)бутирамид
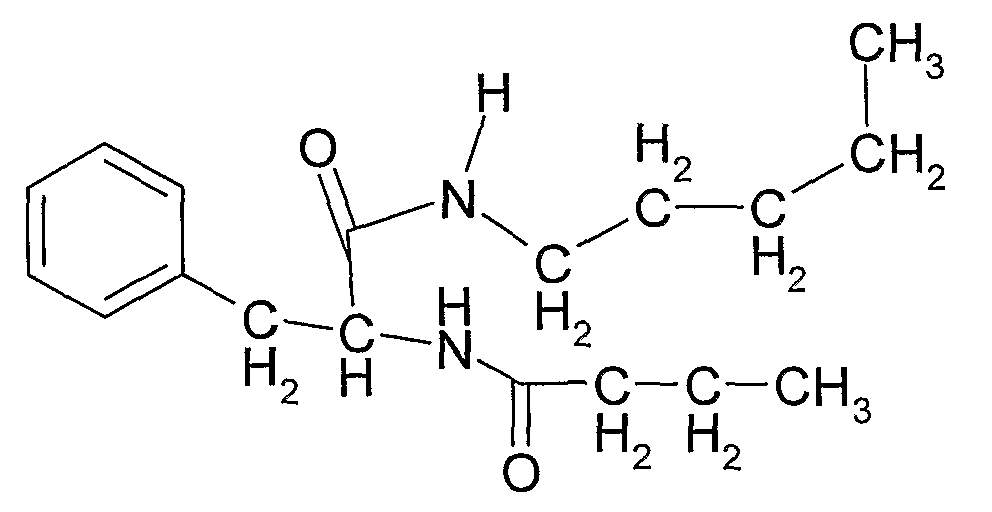
Соединение 14: N-(1-карбамоил-2-фенилэтил)-N-метилбутирамид
Соединение 15: N-(1-карбамоил-2-фенилэтил)-N-этилбутирамид

Соединение 16: N-(1-карбамоил-2-фенилэтил)-N-пропилбутирамид

Соединения 8-16 получали тем же самым способом, что и соединение 7 в примере 5, используя 0,01 моль:
2-амино-3-фенил-1-(пирролидин-1-ил)пропан-1-она в случае соединения 8;
2-амино-N-метил-3-фенилпропанамида в случае соединения 9;
2-амино-N-этил-3-фенилпропанамида в случае соединения 10;
2-амино-3-фенил-N-пропилпропанамида в случае соединения 11;
2-амино-N-бутил-3-фенилпропанамида в случае соединения 12;
2-амино-N-пентил-3-фенилпропанамида в случае соединения 13;
2-(метиламино)-3-фенилпропанамид в случае соединения 14;
2-(этиламино)-3-фенилпропанамида в случае соединения 15;
3-фенил-2-(пропиламино)пропанамида в случае соединения 16; и достигая конечного выхода 90% для каждого полученного соединения.
Аналогичным образом, как при получении продуктов, описанных в примерах 1-14, были получены амиды, используя изобутирил, валерил, изовалерил, фенилбутирил и фенилвалерилхлорид вместо бутирилхлорида.
Пример 15 (сравнительный)
Метиловый эфир 2-бутириламино-3-фенилпропионовой кислоты

Растворяли 0,01 моль метилового эфира фенилаланина и 0,01 моль бутирилхлорида в 50 мл безводного дихлорметана и полученную смесь оставляли взаимодействовать при комнатной температуре в течение четырех часов.
Упаренная в вакууме смесь давала маслянистый остаток, который промывали 1% раствором бикарбоната натрия. Полученное таким образом соединение очищали с помощью хроматографии, используя в качестве элюента хлороформ.
Выход: 85% титрованного продукта, масло.
1Н ЯМР: 7,25 (3H, т+т), 7,07 (2H, д), 6,09 (1H, ушир.д), 4,82 (1H, дд), 3,69 (3H, с), 3,08 (2H, дд), 2,12 (2H, т), 1,59 (2H, т), 0,87 (3H, кв).
Исследование токсичности соединений примера 1
Соединения реакционной смеси, полученные в соответствии с примером 1, исследовали на токсичность либо отдельно, либо в комбинации, после выделения из смеси и очистки. Полученные данные по токсичности сравнивали с данными в случае недериватизированной масляной кислоты.
LD50 для масляной кислоты, измеренная на Swiss мышах обоих полов весом 30 г, составляла 8,8 г/кг при пероральном введении.
Реакционная смесь примера 1 имела следующий процентный состав:
Соединение 1: 50%,
Соединение 2: 25%,
Соединение 3: 25%.
LD50 смеси составляла 19,93 г/кг при пероральном введении, эквивалентная 8,8 г масляной кислоты.
Соединения, тестируемые в виде отдельных соединений, показали следующие результаты:
Соединение 1 - LD50 23,78 г/кг, эквивалентная 8,8 г масляной кислоты,
Соединение 2 - LD50 16,29 г/кг, эквивалентная 8,8 г масляной кислоты,
Соединение 3 - LD50 21,62 г/кг, эквивалентная 8,8 г масляной кислоты.
В заключение необходимо отметить, что как смесь, так и отдельные соединения демонстрируют LD50, эквивалентную LD50масляной кислоты, указанной в Merck Index, 12-го издания.
Действие бутирата натрия и соединений 1, 2 и 3 на трансэпителиальный транспорт воды и электролитов
Культуры клеток
Эксперименты проводили с применением линии клеток кишечника человека, называемой Caco-2, полученной из Американской коллекции типовых культур (ATCC, Роквилл, США). Данные клетки через 15 дней после слияния образуют монослой энтероцитов с морфологией и функциональными характеристиками, идентичными для энтероцитов подвздошной кишки в верхушке ворсинки (Berni Canani R. et al., Gastroenterology, 2003, 124:368-76). Клетки растили в культуральной среде, состоящей из модифицированной по способу Дульбекко среде Игла (DMEM), содержащей глюкозу (4,5 г/л), 10% фетальной телячьей сыворотки (ФТС), 1% заменимых аминокислот, 1% L-глутамина, 1% пирувата натрия, стрептомицин (50 мг/мл), пенициллин (50 мЕд/мл), и инкубировали при 37°C в атмосфере 5% CO2 и 95% O2. Культуральную среду меняли ежедневно.
Эксперименты в камере Уссинга
Для всех экспериментов использовали клетки 30-40-ого пассажа, 2×106 клеток/фильтр, выращенные на поликарбонатной подложке (размер пор 0,4 мкм, диаметр 24,5 мм) в течение 15 дней после смыкания. Каждую подложку, содержащую клетки, закрепляли в камере Уссинга (World Precision Instruments, Сарасота, Флорида) в качестве монослоя клеток между люминальным и серозным отделениями (Berni Canani R. et al., J. Pediatr. Gastroenterol. Nutr., 28:315-320, 1999). Система камеры Уссинга позволяет посредством измерения определенных электрических параметров исследовать трансэпителиальный транспорт воды и электролитов. Данные параметры определяются: 1) трансэпителиальной разностью потенциалов (РП) и током короткого замыкания (Iкз), отражающими трансэпителиальный перенос ионов; 2) сопротивлением (RT) и ионной проводимостью (G) - определение целостности ткани. Сигнал, стимулирующий абсорбцию, при трансэпителиальном транспорте индуцирует уменьшение Iкз, в то время как сигнал, стимулирующий секрецию, индуцирует увеличение Iкз. Iкз выражают в микроамперах на квадратный сантиметр (мкА/см2), проводимость - в миллисименсах на квадратный сантиметр (мСм/см2) и трансэпителиальную разность потенциалов в милливольтах (мВ). Измерение данных электрических параметров возможно в присутствии серебряных электродов, помещенных вблизи обеих сторон (серозной и люминальной) клеточного монослоя и соединенных с автоматической системой регулирования напряжения, снабженной программным обеспечением для сбора и обработки данных (DVC 1000, World Precision Instruments, Сарасота, Флорида, США). Каждое отделение содержало 10 мл раствора Рингера следующего состава (в моль/л): 114 NaCl, 5 KCl, 0,3 NaH2PO4, 1,65 Na2HPO4, 1,25 CaCl2, 1,1 MgCl2, 25 NaHCO3, 10 глюкозы. Инкубационная жидкость циркулировала через камеру под действием тока газообразной смеси, состоящей из 95% O2 и 5% CO2 и ее температура поддерживалась при 37°C с помощью термостата (Berni Canani R. et al., J. Pediatr. Gastroenterol. Nutr., 1999, 28:315-320). Исследование изменений электрических параметров, отражающих изменения в трансэпителиальном транспорте воды и электролитов, проводили в фоновых (контрольных) условиях и после введения соединений на люминальную сторону монослоя клеток Caco-2.
Затем, чтобы исследовать действие соединений на трансэпителиальный транспорт воды и электролитов в условиях активной секреции, индуцированной повышающим секрецию агентом, проводили эксперименты с энтероцитами, которые инкубировались совместно с соединениями и холерным токсином (ХТ) в качестве агониста основного пути трансдукции сигнала, ответственного за секрецию жидкостей в кишечнике (Berni Canani R. et al., J. Infect. Dis., 2005, 191:1072-1077). В заключение, оценивали жизнеспособность клеток путем измерения электрического ответа на добавление теофиллина (5 мМ) на серозную сторону в конце каждого эксперимента (Berni Canani R. et al., WJG, 2006, 12:4710-4715).
Результаты
Добавление бутирата натрия с люминальной стороны энтероцитов человека индуцировало уменьшение тока короткого замыкания (ΔIкз = -0,8±0,2 мкА/см2) и разности потенциалов, но не изменяло проводимость ткани. Максимальное уменьшение Iкз наблюдали через 35 минут после добавления вещества. Данное колебание Iкз значительно отличалось от наблюдаемого в случае клеток контроля (p<0,001). Эффект был дозозависимым, с максимумом при конечной концентрации 10 мМ (фиг.1).
Аналогичные эксперименты проводили с применением других соединений (соединения 1, 2 и 3). Соединение 1 индуцировало дозозависимое уменьшение Iкз с максимальным эффектом при конечной концентрации 10 мМ (ΔIкз = -0,9±0,3 мкА/см2). Максимальное уменьшение Iкз наблюдали приблизительно через 40 минут после добавления со стороны слизистой энтероцитов, без влияния на стабильность проводимости ткани. Данное колебание Iкз значительно отличалось от наблюдаемого в случае клеток контроля (p<0,001) (фиг.2).
Добавление соединения 2 с люминальной стороны энтероцитов индуцировало дозозависимое уменьшение Iкз с максимальным эффектом при концентрации 10 мМ, равным -0,4±0,1 мкА/см2. Максимальное уменьшение Iкз наблюдали приблизительно через 40-45 минут после добавления со стороны слизистой энтероцитов, без влияния на стабильность проводимости ткани. Данное колебание Iкз значительно отличалось от наблюдаемого в случае клеток контроля (p<0,001) (фиг.3).
Добавление соединения 3 с люминальной стороны энтероцитов индуцировало дозозависимое уменьшение Iкз с максимальным эффектом при конечной концентрации 10 мМ, равным -1,1±0,1 мкА/см2, в отсутствие каких-либо значительных изменений в проводимости ткани. Максимальное значение эффекта наблюдали через значительно более продолжительное время по сравнению с другими двумя соединениями (40 мин vs 50 мин, p<0,001). Данное уменьшение Iкз было значительно больше, чем наблюдалось в случае клеток контроля (p<0,001) (фиг.4).
Добавление в культуру с люминальной стороны энтероцитов человека смеси 60/20/20% соединений 1, 2 и 3, эквивалентной 10 мМ бутирата натрия, индуцировало значительно более заметное уменьшение (p<0,001), по сравнению с наблюдаемым в случае 10 мМ одного бутирата натрия или в случае соединений 1, 2 и 3, с максимальным эффектом при конечной концентрации 10 мМ, равным -1,6±0,2 мкА/см2, без каких-либо воздействий на проводимость ткани (фиг.5).
Для исследования, обусловлены ли наблюдаемые электрические эффекты конечной абсорбцией хлорида (Cl-), проводили эксперименты в отсутствии в буфере Cl-. В данных экспериментальных условиях вместо Cl- использовали эквимолярные концентрации SO4-. В данных условиях, соединения, по отдельности или в смеси, не индуцировали какие-либо изменения в электрических параметрах, демонстрируя, что уменьшение Iкз происходило только благодаря активному транспорту Cl-. Введение ХТ (6×10-8 M) с люминальной стороны монослоя клеток, помещенного в камеру Уссинга, индуцировало увеличение Iкз. Данный секреторный эффект значительно уменьшался при предварительной инкубации клеток со смесью соединений, введенных с люминальной стороны, при конечной концентрации 10 мМ (+4,1±0,5 vs. +1,1±0,2 мкА/см2, p<0,001). Доступные в настоящее время данные in vitro показывают, что:
- соединения 1, 2 и 3, тестируемые поодиночке при непосредственном взаимодействии с энтероцитами человека в культуре в дозе 10 мМ, индуцируют конечный эффект стимулирования абсорбции в отношении транспорта жидкости в кишечнике. Эффект становится максимальным через приблизительно 25-55 минут без какого-либо воздействия в отношении целостности ткани. Данные эффекты аналогичны наблюдаемым эффектам в случае бутирата натрия. Смесь соединений 1, 2 и 3, в используемом в реакционной смеси соотношении (60/20/20%), эквивалентная 10 мМ бутирата натрия, индуцировала конечный эффект стимулирования абсорбции в отношении транспорта жидкости в кишечнике посредством прямого взаимодействия с энтероцитами человека в культуре. Эффект становился максимальным через 45 минут после добавления и был стабильным до конца эксперимента без какого-либо воздействия в отношении целостности ткани. Данный эффект является кинетически подобным эффекту, наблюдаемому в случае отдельных соединений, но является значительно более интенсивным и продолжительным во времени по сравнению с полученным в случае отдельных компонентов. Также было продемонстрировано сильное антисекреторное действие на холерный токсин - прототип секреторного агента в кишечнике.
Настоящее изобретение описано со ссылками на несколько конкретных примеров осуществления, но следует понимать, что специалисты в данной области техники могут осуществлять различные изменения или модификации, не выходящие, в связи с этим, за объем правовой охраны изобретения.
Реферат
Изобретение относится к новым производным жирных кислот с короткой цепью, в частности масляной кислоты, которые обладают физико-химическими характеристиками, подходящими для удобного перорального введения, поскольку они лишены неприятных органолептических свойств, характерных для бутирата. Новые соединения имеют удобную для взвешивания форму, устойчивы к действию кислот и щелочей и способны высвобождать кислоту в тонком и толстом кишечнике непрерывно в течение длительного времени. 4 н. и 3 з.п. ф-лы, 5 ил., 15 пр.
Формула
N-(1-карбамоил-2-фенилэтил) бутирамид,
N-(1-бутирилкарбамоил-2-фенилэтил)бутирамид,
5-бензил-2-пропил-1H-имидазол-4(5H)-он,
N-(1-карбамоил-п-толилметил)бутирамид,
N-(2-карбамоил-1-фенилэтил)бутирамид,
N-(4-(2-карбамоилэтил)фенил)бутирамид,
N-(1-оксо-3-фенил-1-(пиперидин-1-ил)пропан-2-ил)бутирамид,
N-(1-оксо-3-фенил-1-(пирролидин-1-ил)пропан-2-ил)бутирамид,
N-(1-(метилкарбамоил)-2-фенилэтил)бутирамид,
N-(1-(этилкарбамоил)-2-фенилэтил)бутирамид,
N-(1-(пропилкарбамоил)-2-фенилэтил)бутирамид,
N-(1-(бутилкарбамоил)-2-фенилэтил)бутирамид,
N-(1-(пентилкарбамоил)-2-фенилэтил)бутирамид,
N-(1-карбамоил-2-фенилэтил)-N-метилбутирамид,
N-(1-карбамоил-2-фенилэтил)-N-этилбутирамид,
N-(1-карбамоил-2-фенилэтил)-N-пропилбутирамид; и соли фармацевтически приемлемых оснований и кислот, диастереоизомерные формы и энантиомерные формы или их смеси.
N-(1-карбамоил-2-фенилэтил)бутирамида формулы
N-(1-бутирилкарбамоил-2-фенилэтил)бутирамида формулы
5-бензил-2-пропил-1H-имидазол-4(5H)-она формулы
обладающая стимулирующим абсорбцию действием на трансэпителиальный транспорт воды и электролитов в кишечнике.

Комментарии