Способ получения композиции, содержащей высушенные бактерии, и ее применение - RU2370525C2
Код документа: RU2370525C2
Чертежи


Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к улучшенному способу получения содержащей высушенные микроорганизмы композиции, который приводит к повышенной жизнеспособности микроорганизма, и к применению композиций высушенного микроорганизма, получаемых улучшенным способом.
УРОВЕНЬ ТЕХНИКИ
В сельском хозяйстве известно использование инокулятов, содержащих определенные типы микроорганизмов. Как правило, инокуляты наносят на семена или другой репродуктивный материал растения таким образом, что при посеве или посадке можно получать улучшенную окружающую среду, способствующую прорастанию семени, стимулированию роста растения или биологической защите семени и получающегося в результате растения.
Например, симбиотические бактерии, такие как бактерии родов Rhizobium и Bradyrhizobium, обеспечивающие фиксацию азота в бобовых растениях, можно использовать для инокуляции бобовых растений для способствования образованию клубеньков. Инокуляцию можно выполнять нанесением покрытия на семена, опылением в хозяйстве семян или сельскохозяйственных культур или помещением инокулята в борозды во время посадки.
Предыдущие способы получения инокулята предусматривали смешивание активной живой культуры микроорганизмов, такой как культура клубеньковых бактерий, с носителем, таким как гумус или торф. Влажный носитель поддерживает микроорганизм в активном состоянии. Однако срок хранения такой активной бактериальной культуры является коротким вследствие истощения в окружающей среде пищи и влаги.
Другой способ получения инокулятов представляет собой перевод бактерий в состояние покоя, например лиофилизацией бактерий. Этот процесс необходимо проводить быстро для предотвращения разрушения клетки.
Другой способ получения сухого инокулята в состоянии покоя описан в патенте США 5695541, где способ предусматривает культивирование различных видов микроорганизмов в среде для роста и смешивание культуры с носителем из глины с последующей медленной сушкой смеси воздухом в течение по крайней мере одних суток таким образом, что уровень влажности в микроорганизмах постепенно снижается, образуя высушенную композицию. Как указано, высушенные композиции обладают лучшей жизнеспособностью по сравнению с другими способами получения сухого инокулята в состоянии покоя.
Было описано, что импульсные электромагнитные поля (PEMF) стимулируют биологические ткани, в том числе микроорганизмы (см. патент США 6561968). В патенте США 6561968 было сделано предположение, что выживаемость микроорганизмов, таких как бактерии, в ходе сушки можно улучшать посредством обработки PEMF. Однако в патенте США 6561968 было сделано предположение, что обработка PEMF эффективна только в отношении частично высушенных микроорганизмов, т.е. микроорганизмов, которые частично высушены, но еще содержат в своем составе приблизительно 20% воды. Иначе говоря, в патенте США 6561968 описано использование обработки PEMF только для микроорганизмов, которые следует поддерживать в активном состоянии (например, при содержании воды, составляющем 20%, активность воды (Aw) еще находится на уровне (приблизительно от 1 до 0,95), при котором бактериальная популяция существует в активном состоянии в противоположность состоянию покоя). Кроме того, в патенте США 6561968 описана обработка PEMF, позволяющая бактериям лишь лучше выдерживать процедуру сушки (т.е. исходная выживаемость бактерий). Об эффекте на длительность срока хранения частично высушенных микроорганизмов не сообщено.
Сниженная выживаемость и, в особенности, сниженный срок хранения высушенных микроорганизмов, особенно при содержании воды в высушенном микроорганизме приблизительно от 1% до приблизительно 6% мас./мас., является важной проблемой.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на неожиданном открытии, что сочетание смешивания культуры микроорганизма с носителем и обработки импульсными электромагнитными полями (PEMF) значительно повышает срок хранения высушенных микроорганизмов. Иначе говоря, обрабатываемый по настоящему изобретению микроорганизм остается живым в высушенном состоянии в течение значительно более долгого периода времени по сравнению с микроорганизмами, просто высушенными на носителе, или по сравнению с микроорганизмами, обрабатываемыми только PEMF. Наблюдаемые различия являются синергичными.
Таким образом, в широком смысле настоящее изобретение относится к применению сочетания смешивания культуры микроорганизма с носителем и обработки импульсными электромагнитными полями (PEMF) в получении композиции, содержащей высушенные микроорганизмы. Получаемые в результате микроорганизмы имеют значительно увеличенный срок хранения.
ПОДРОБНОЕ ОПИСАНИЕ
В одном из аспектов настоящее изобретение относится к способу получения содержащей высушенные микроорганизмы композиции, предусматривающему культивирование одного или нескольких видов микроорганизмов; смешивание культивируемого микроорганизма с одним или несколькими носителями; обработку микроорганизма импульсными электромагнитными полями; инкубацию смеси культура:носитель в течение по крайней мере приблизительно 6 часов; и сушку микроорганизма таким образом, чтобы снизить уровень влажности до величины приблизительно от 1% мас. до приблизительно 6% мас.
В другом аспекте настоящее изобретение относится к содержащей высушенные микроорганизмы композиции, которую получают процессом по настоящему изобретению.
В еще одном аспекте настоящее изобретение относится к применению высушенного микроорганизма для получения семени растения или другого репродуктивного материала растения с нанесенным покрытием, где применение предусматривает нанесение на семя растения или другой репродуктивный материал растения композиции, содержащей высушенные микроорганизмы, которые получают процессом по настоящему изобретению.
В другом аспекте настоящее изобретение относится к применению высушенного микроорганизма для получения среды для роста, предусматривающему смешивание с почвой композиции, которая содержит высушенные микроорганизмы, получаемые процессом по настоящему изобретению.
В еще одном из аспектов настоящее изобретение относится к применению высушенного микроорганизма для очистки сточных вод, предусматривающему контакт со сточными водами композиции, которая содержит высушенные микроорганизмы, получаемые способом по настоящему изобретению, и отделение очищенной воды от композиции.
Получаемый способом по настоящему изобретению высушенный микроорганизм обладает одним или несколькими следующими свойствами: улучшенной исходной выживаемостью и повышенным сроком хранения по сравнению с микроорганизмом, получаемым только с носителем, и/или микроорганизмом, получаемым только обработкой PEMF.
В других вариантах осуществления настоящее изобретение относится к высушенному микроорганизму с улучшенной исходной выживаемостью и/или повышенным сроком хранения в сравнении с микроорганизмом, получаемым только с носителем, и/или микроорганизмом, получаемым только обработкой PEMF; к композициям, содержащим указанный высушенный микроорганизм; и к вариантам их применения, в том числе, например, в получении семян растения и/или другого репродуктивного материала с нанесенным покрытием, в получении среды для роста и в очистке сточных вод.
ПРЕДПОЧТИТЕЛЬНЫЕ АСПЕКТЫ
Таким образом, настоящее изобретение можно использовать для сушки любого микроорганизма, способного выживать в высушенном состоянии.
Предпочтительно, микроорганизм находится в фазе покоя. Соответственно, микроорганизм может находиться в высушенном или обезвоженном состоянии.
Предпочтительно, настоящее изобретение используют для сушки полезных микроорганизмов, для применения в сельскохозяйственной промышленности. Особый интерес представляют собой микроорганизмы, обладающие биоцидными свойствами, такими как противогрибковые или пестицидные и другие свойства, а также поддерживающие рост микроорганизмы, способные, например, жить в почве в присутствии растения, которое надлежит защищать.
Соответственно, микроорганизм по настоящему изобретению может представлять собой один или несколько грибов, в том числе дрожжей, бактерий, водорослей или простейших.
Соответственно, микроорганизм может представлять собой известный биоцидный микроорганизм, в том числе грибы Trichoderma и Gliocladium.
Предпочтительно, микроорганизм представляет собой бактерию, гриб или дрожжи.
Предпочтительно, в одном из аспектов микроорганизм представляет собой бактерию.
Предпочтительно, в одном из вариантов осуществления микроорганизм представляет собой дрожжи одного или нескольких следующих родов Candida, Cryptococcus, Cystofilobasidium, Hansenula, Kluyveromyces, Leucosporidium, Metschnikowia, Pichia, Rhodosporidium, Rodotorula, Saccharomyces, Sporobolomyces, Richosporon.
Предпочтительно, в другом варианте осуществления микроорганизм представляет собой гриб одного или нескольких следующих родов Acrophialospora, Ampelomyces, Aureobasidium, Bipolaris, Chaetomium, Cladorrhinum, Clonostachys, Coniothyrium, Epicoccum, Gliocladium, Glomus, Fusarium, Laetisaria, Microsphaeropsis, Mycothecium, Muscador, Mycoleptodiscus, Neocosmospora, Paecilomyces, Penicillium, Peniophora, Phlebiopsis, Phialophora, Pythium, Rhizoctonia, Rhizopus, Rhynchosporium, Sporidesmium, Stephanonectria, Talaromyces, Tilletiopsis, Trichoderma, Ulocladium, Verticillium, Hirsutella, Myrothecium, Nematophthora, Dactylella, Acremonium, Catenaria, Cylindrocarpon, Dactylella, Monacrosporium, Pochonia.
Соответственно, гриб может представлять собой один или несколько из следующих: Acremoniumstrictum, Caternariaauxiliaris, Cylindrocarpondestructans, Dactylellaoviparasitica, Hirsutellarhossiliensis, Monacrosporiumellipsosporum, Monacrosporiumcionopagum, Nematophthoragynophila, Paecilomycesmarquandii, Pochoniachlamydosporium, Clonostachysrosea, Coniothyriumminitans, Epicoccumnigrum, Eppicoccumpurpurascens, Fusariumculmorum, Fusariumoxysporum, Fusariumtabacinum, Fusariumsolani, Gliocladiumatrum, Gliocladium catenulatum, Gliocladium roseum, Gliocladium virens, Glomus claroideum, Glomus fasciculatum, Glomus intraradices, Glomus mossae, Laetisaria arvalis, Microsphaeropsis ochracea, Muscador albus, Mycoleptodiscus terrestris, Mycothecium verrucaria, Necosmospora vasinfecta, Paecilomyces fumosoroseus, Paecilomyces lilacinus, Penicillium frequentans, Penicillium godlewskii, Penicillium nigricans, Penicillium oxalicum, Peniophora gigantea, Phialophora sp. I-52, Phlebiopsis gigantea, Pythium acanthicum, Pythium acanthophoron, Pythium mycoparasiticum, Pythium nunn, Pythium oligandrum, Pythium periplocum, Rhizoctonia solani, Rhynchosporium alismatis, Rhizopus stolonifer, Sporidesmium sclerotivorum, Stephanonectria keitii, Talaromyces flavus, Tilletiopsis sp., Trichoderma asperellum, Trichoderma atroviride, Trichoderma hamatum, Trichoderma harzianum, Trichoderma inhatum, Trichoderma koningii, Trichoderma lignorum, Trichoderma longibrachiatum, Trichoderma stromaticum, Trichoderma viride, Ulocladium atrum, Verticilium chlamydosporium, Verticillium dahliae, Verticillium suchlasporium.
Предпочтительно, в еще одном варианте осуществления микроорганизм представляет собой бактерию одного или нескольких следующих родов: Actinoplanes, Agrobacterium, Arthrobacter, Bacillus, Bifidobacterium, Brevibacillus, Burkholderia, Chryseomonas, Comamonas, Enterobacter, Enterococcus, Erwinia, Flavobacterium, Lactobacillus, Lactococcus, Leuconostoc, Pantoea, Pasteuria, Paenibacillus, Pseudomonas, Rahnella, Raoultella, Serratia, Sporotrix, Stenotrophomonas, Streptococcus, Streptomyces, Rhizobium, Bradyrhizobium, Mezorhizobium, SinorhizobiumSeratia, Erwinia, Streptomycetes и Nocardia.
Предпочтительно, бактерия представляет собой неспорообразующую бактерию, выбранную из группы, которая состоит из Actinoplanes, Agrobacterium, Arthrobacter, Bifidobacterium, Brevibacillus, Burkholderia, Chryseomonas, Comamonas, Enterobacter, Enterococcus, Erwinia, Flavobacterium, Lactobacillus, Lactococcus, Leuconostoc, Pantoea, Pediococcus, Pseudomonas, Rahnella, Raoultella, Serratia, Sporotrix, Stenotrophomonas, Streptococcus, Streptomyces, Rhizobium, Bradyrhizobium, Mezorhizobium, Sinorhizobium Seratia, Erwinia, Streptomycetes и Nocardia.
Соответственно, бактерия может представлять собой одну или несколько из следующих: Agrobacterium radiobacter, Agrobacterium tumefaciens, Arthrobacter simplex, Bacillus chitinosporus, Bacillus licheniformis, Bacillus amylofaciens, Bacillus cereus, Bacillus lentimorbus, Bacillus megaterium, Bacillus mycoides, Bacillus popilliae, Bacillus pumilus, Bacillus subtilis, Bacillus thuringiensis, Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium lactis, Bifidobacterium longum, Bifidobacterium thermophilum, Brevibacillus brevis, Burkholderia cepacia, Chryseomonas luteola, Comamonas acidovorans, Enterobacter cloacae, Enterococcus faecium, Erwinia herbicola, Flavobacterium balustinum, Flavobacterium heparinum, Flavobacterium psycrophilium, Flavobacterium columnae, Lactobacillus acidophilus, Lactobacillus brevis, Lactobacillus bulgaricus, Lactobacillus casei, Lactobacillus coryniformis, Lactobacillus delbruekii, Lactobacillus fermentum, Lactobacillus grayii, Lactobacillus helveticus, Lactobacillus johnsonii, Lactobacillus plantarum, Lactobacillus reuteri, Lactobacillus rhamnosus, Lactobacillus salivarius, Lactococcus lactis, Lactobacillus pentosus, Lactobacillus sake, Pantoea agglomerans, Pantoea ananatis, Paenibacillus polymyxa, Pseudomonas aptata, Pseudomonas aureofaciens, Pseudomonas aeruginosa, Pseudomonas brassicacearum, Pseudomonas cepacia, Pseudomonas chlororaphis, Pseudomonas corrugata, Pseudomonas denitrificans, Pseudomonas fluorescens, Pseudomonas putida, Pseudomonas syringae, Pseudomonas tolaasii, Rahnella aqualis, Raoultella terrigena, Serratia marcescens, Serratia plymuthica, Sporotrix flocculosa, Stenotrophomonas malthophilia, Streptoccus lactis, Streptococcus salivarius, Streptococcus thermophilus, Streptomyces griseoviridis.
Соответственно, микроорганизм может представлять собой бактерию рода Pseudomonas. Соответственно, микроорганизм может представлять собой бактерию Pseudomonas fluorenscens. Соответственно, микроорганизм может представлять собой бактерию Pseudomonas fluorenscens, продуцирующую циклический липопептид.
Предпочтительно, микроорганизм культивируют в соответствующей культуральной среде. Соответственно, микроорганизм можно культивировать в среде для роста в общепринятом ферментере или флаконе. Соответственно, ферментер может представлять собой стационарный, полунепрерывный или непрерывный ферментер. Предпочтительно, микроорганизм культивируют, пока культура не достигнет стационарной фазы.
Соответственно, культуру и культуральную среду можно смешивать с носителем. Перед смешиванием с носителем культуру микроорганизма и/или культуральную среду можно разводить свежей или фильтрованной культуральной средой и/или дистиллированной водой. Предпочтительно, культуру микроорганизма разводят свежей или фильтрованной культуральной средой непосредственно перед смешиванием этой культуры с носителем.
Соответственно, смешивание можно выполнять непрерывным способом или отдельными порциями.
Предпочтительно, носитель находится в виде порошка или гранулята. Нахождение носителя в порошкообразном или гранулированном виде может зависеть от предполагаемого использования.
Соответственно, порошкообразный носитель может иметь средний диаметр частиц, например, приблизительно от 1 мкм до приблизительно 0,5 мм. Соответственно, гранулированный носитель может иметь средний диаметр частиц, например, приблизительно от 0,5 мм до приблизительно 3 мм.
В одном из вариантов осуществления предпочтительные носители представляют собой носители с большой площадью поверхности, предпочтительно, носители с площадью поверхности более чем 200 м2/грамм, предпочтительно, более чем 300 м2/грамм.
В другом варианте осуществления предпочтительные носители представляют собой носители с низким естественным содержанием воды (WC). Низкое естественное содержание воды является тем, что поддерживает бактерии в состоянии покоя. Предпочтительно, низкое естественное содержание воды представляет собой содержание воды 8,0% WC или ниже, предпочтительно, 7,5% WC или ниже, предпочтительно - приблизительно ниже 7% WC.
Соответственно, предпочтительные носители могут представлять собой носители с естественным содержанием воды в диапазоне от 3 до 7,5%. Это может быть особенно эффективно в вариантах применения, в которых смесь надлежит использовать, например, для нанесения покрытия на семена или другие репродуктивные материалы.
В одном из вариантов осуществления предпочтительный носитель представляет собой носитель, обладающий очень высоким естественным содержанием воды. Очень высокое естественное содержание воды является тем, что поддерживает бактерии в метаболическом состоянии. Как правило, очень высокое естественное содержание воды может составлять, например, >20%.
Естественное содержание воды в носителе представляет собой количество воды, которое связано с катионами или содержится в порах в природном цеолите или глине. Не желая ограничиваться теорией, цеолиты представляют собой гидратированные силикаты алюминия, что означает, что они содержат воду в своей основной структуре, т.е. структурная формула одного из клиноптилолитов представляет собой (Na,K,Ca)2-3A13(Al,Si)2Si13O36-12H2O, что является гидратированным силикатом натрия-калия-кальция-алюминия.
В рамках настоящей заявки “естественное содержание воды” означает количество воды, которое можно удалить из образца носителя в сушильном шкафу при 105°C в течение 4 часов. Во избежание недоразумений, в этом способе необязательно удаляют из носителя все молекулы воды.
Предпочтительно, носитель по настоящему изобретению имеет относительно постоянное содержание воды в течение времени. Постоянство содержания воды в носителе в течение времени определяет варианты применения, для которых носитель наиболее эффективен. Например, содержание влаги в клиноптилолите и бентоните относительно постоянно в течение времени. Таким образом, эти носители могут быть особенно эффективны для вариантов применения, где смесь культура:носитель можно повторно использовать после длительных периодов хранения, например такое содержание влаги может делать эти носители особенно эффективными для использования, например, в нанесении покрытия на семена или другие репродуктивные материалы. С другой стороны, некоторые носители могут иметь относительно менее постоянное содержание воды. Такое содержание воды может делать эти носители особенно эффективными для вариантов применения, в которых смесь культура:носитель используют только после короткого периода хранения в отсутствие продолжительного хранения.
Один из способов выявления относительного постоянства содержания влаги в носителе состоит в высушивании носителя до заданного % MC, а затем в измерении % MC в носителе через 30 суток после помещения носителя в контролируемую окружающую среду (т.е. при контролируемой температуре и/или относительной влажности). Потеря или прирост влажности указывает на неустойчивость носителя. Носитель, поддерживающий один и тот же % MC в течение периода 30 суток, считают очень устойчивым. Приобретаемое или теряемое носителем количество влаги, сравниваемое с количеством влаги, которое приобретает или теряет носитель в качестве положительного контроля (такой как бентонит или клиноптилолит), выявляет “относительную” устойчивость носителя. По настоящему изобретению бентонит и клиноптилолит рассматривают как устойчивые носители. Носитель, приобретающий больше влаги или теряющий больше влаги, чем бентонит или клиноптилолит, рассматривают как относительно менее устойчивый носитель.
Иначе говоря, носитель, имеющий содержание влаги, которое относительно постоянно в течение времени, можно рассматривать как носитель, способный к хорошей “буферизации” изменений влажности. Тогда как носитель, имеющий содержание влаги, которое относительно не постоянно в течение времени, можно рассматривать как носитель, не способный к буферизации изменений влажности. Соответственно, носитель по настоящему изобретению представляет собой носитель, способный к буферизации изменений влажности.
Соответственно, носитель может представлять собой один или несколько из следующих носителей: носитель из цеолита; носитель из глины; другие природные соединения кремния.
Цеолиты представляют собой микропористые кристаллические твердые вещества с четкими структурами. Как правило, они содержат в своем каркасе кремний, алюминий и кислород, а в своих порах содержат катионы, воду и/или другие молекулы (такие как, например, аммиак, ионы карбоната и ионы нитрата). Многие встречаются в природе в виде минералов. Другие являются синтетическими и их получают коммерческими. По настоящему изобретению можно использовать природные цеолиты и/или синтетические цеолиты.
Характерный признак цеолитов состоит в том, что они имеют структуры с трехмерным каркасом из связанных тетраэдров (Si,Al)O4, где (Si,Al) и O присутствуют в соотношении 1:2. Этой трехмерной структурой, в которой атом кислорода химически уравновешен катионом, обусловлено отличие цеолитов от глинистых минералов.
Соответственно, носитель из цеолита может представлять собой один или несколько из следующих цеолитов: анальцит, канкринит, шабазит, клиноптилолит, кордиерит, эдингтонит, эрионит, фожазит, феррьерит, гмелинит, гейландит, ломонтит, левинит, мезолит, морденит, натролит, оффретит, паулингит, филлипсит, птилолит, сколецит, томсонит, ZSM и ZK.
Предпочтительно, в некоторых аспектах носитель из цеолита представляет собой клиноптилолит. Соответственно, используемый здесь клиноптилолит может представлять собой клиноптилолит-K, клиноптилолит-Ca или клиноптилолит-Na. Предпочтительно, используемый здесь клиноптилолит представляет собой клиноптилолит-Na. Соответственно, используемый здесь клиноптилолит может иметь естественное содержание воды 4,7-5,4%, предпочтительно - приблизительно 5%. Предпочтительно, в одном из вариантов осуществления клиноптилолит представляет собой продукт клиноптилолит-Na под названием KlinominTM, доступный в NorNatur, Denmark. Соответственно, используемый по настоящему изобретению клиноптилолит состоит из более чем 80% клиноптилолита. Соответственно, носитель может обладать величиной pH 6,9-7,1 и/или площадью поверхности 260-290 м2/г.
Глина представляет собой природный, исходно получаемый из почвы гидратированный силикат алюминия, который обладает физическими свойствами, обусловленными, по крайней мере частично, размером и распределением коллоидных частиц, а также свойствами, включающими в себя пластичность. Как правило, 30% или более частиц в глине имеют диаметр меньше 0,002 мм.
Соответственно, носитель из глины может представлять собой одну или несколько из следующих глин: аттапульгит, бентонит, фуллерова земля, галлуазит, иллит, каолин, пирофиллит, вермикулит, сепиолит, монтмориллонит и мулит.
Предпочтительно, в одном из вариантов осуществления носитель может представлять собой бентонит. Бентонитом обозначают глины с хорошей способностью к увеличению в объеме и с различным содержанием монтмориллонита. Предпочтительно, главным компонентом бентонита является монтмориллонит, предпочтительно - монтмориллонит-Na. Один из приемлемых для использования по настоящему изобретению бентонитов содержит приблизительно 50% монтмориллонита, 10% каолинита, 10% иллита и 20% вермикулита. Такой бентонит доступен в виде OB-lergranulate из Tierra Products ApS, Denmark. Во избежание недоразумений, это бентонит, который указан в приведенном ниже экспериментальном разделе.
Предпочтительно, в другом варианте осуществления носитель представляет собой вермикулит.
Как понимает специалист в данной области, природная глина или вещества из цеолита необязательно являются чистыми. Поэтому в некоторых вариантах осуществления, когда авторы обозначают глину или цеолит таким названием, как например, клиноптилолит, это означает носитель, преимущественно состоящий из этой глины или цеолита (т.е. преимущественно состоящий, например, из клиноптилолита). Предпочтительно, глина или цеолит содержат более 50% указанной глины или цеолита (такого как, например, клиноптилолит), предпочтительно, более чем 60%, более предпочтительно, более чем 70%, более предпочтительно, более чем 80% указанной глины или цеолита. Соответственно, глина или цеолит могут содержать более чем 90% указанной глины или цеолита, или даже 100% указанной глины или цеолита.
Некоторые природные соединения кремния не относят к глинам или цеолитам. Такие природные соединения кремния включают в себя, например, одно или несколько из следующих: асбест, диаспор, диатомовая земля, диатомит, полевой шпат, трепел, кизельгур, слюда, кварц, песок и кремний.
Соответственно, в одном из аспектов носитель может представлять собой сочетание одного или нескольких носителей из глины с одним или несколькими носителями из цеолита.
Не желая ограничиваться теорией, предусматривают, что определенные виды микроорганизмов могут иметь предпочтительный носитель, т.е. могут лучше выживать в определенных носителях. После ознакомления специалиста в данной области с настоящим изобретением его обычные практические навыки легко позволят выявить предпочтительный носитель для любого предоставленного микроорганизма. Один из способов достижения этого состоит в проведении следующего анализа:
1. Определяют природное содержание воды в носителях посредством инкубирования носителей при 105°C в течение 4 часов.
2. Смешивают жидкую культуру микроорганизмов с различными носителями в соотношении 1:5.
3. Инкубируют в течение 1-2 суток для предоставления возможности роста бактерий.
4. Сушат смесь носителей до 1,5x, 1x, 0,75x (или большего количества величин) естественного содержания воды, определенного в (1), с последующим измельчением в тонкодисперсный порошок.
5. Инкубируют в течение >7 суток при комнатной температуре.
6. Подсчитывают CFU посредством посева на планшеты. Предпочтительные носители представляют собой носители, которые несут большие количества микроорганизмов в пределах заданного диапазона.
7. Необязательно, после определения набора предпочтительных носителей можно выявлять взаимосвязь WC и Aw. Предпочтительные носители представляют собой носители, у которых Aw не изменяется в течение времени в заданных условиях хранения (или изменяется лишь незначительно, т.е. изменения могут быть перенесены содержащимися микроорганизмами).
Следует отметить, что предпочтительные носители из глины/цеолита представляют собой носители с естественным содержанием воды, сходным с конечным содержанием влаги в смеси культура:носитель после сушки, как правило, в диапазоне от 3 до 7,5% (мас./мас.) в целях применения для семян, и/или представляют собой носители с относительно постоянным содержанием влаги в течение времени.
Предпочтительно, в другом варианте осуществления распределение микроорганизмов в носителе является равномерным. Равномерность распределения микроорганизмов в носителе можно определять посредством нанесения распылением носителя на поверхность и определения количества микроорганизмов на единицу площади.
Предпочтительно, культивируемый микроорганизм и носитель смешивают таким образом, что отношение культуры к носителю составляет приблизительно от 1:2 до приблизительно 1:6 (мас./мас.), предпочтительно - приблизительно от 1:3 до приблизительно 1:5 (мас./мас.), более предпочтительно, менее чем 1:4 (мас./мас.), такое как, например, 1:4,1, 1:4,2, 1:4,5, 1:4,75 или приблизительно 1:5.
Предпочтительно, в одном из вариантов осуществления культивируемый микроорганизм и носитель смешивают таким образом, что отношение культуры к носителю составляет менее чем 1:5 (мас./мас.).
Не желая ограничиваться теорией, было неожиданно открыто, что чем ниже соотношение культуры микроорганизма и носителя, тем выше количество жизнеспособных, пригодных к культивированию клеток (колониеобразующих единиц (CFU) в высушенном носителе). Было открыто, что культивируемый микроорганизм и носитель, предпочтительно, смешивают таким образом, что соотношение культуры и носителя составляет менее чем 1:4 (мас./мас.), соответственно, например, менее чем 1:4,1, 1:4,2, 1:4,5, 1:4,75 или 1:5.
Соответственно, для получения обычного препарата носителя можно проводить следующие стадии способа: клетки микроорганизмов можно смешивать с носителем в соотношении клетки микроорганизмов:носитель, составляющем менее чем 1:4 (мас./мас.), соответственно, например, менее чем 1:4,1, 1:4,2, 1:4,5, 1:4,75 или 1:5; смесь можно помещать на 7 суток на 10°C, а затем смесь можно сушить до содержания воды, составляющего 5% или менее, в течение периода от 3 до 4 суток в контролируемой атмосфере при влажности 32,5-35%.
Соответственно, концентрация микроорганизма (например, бактерий) в культуре микроорганизма непосредственно перед смешиванием с носителем составляет приблизительно 107-109 микроорганизмов/мл культуральной среды, предпочтительно, приблизительно 108 микроорганизмов/мл культуральной среды.
Соответственно, если носитель сухой (т.е. с содержанием воды 0%), например, после стерилизации в сушильном шкафу, то перед смешиванием культивируемого микроорганизма с носителем можно добавлять небольшую порцию воды и/или культуральной среды. Соответственно, воду и/или культуральную среду добавляют до тех пор, пока содержание влаги в носителе не станет таким, какое считают естественным для этого носителя. Добавление воды и/или культуральной среды предотвращает повреждение клетки вследствие выделения тепла в ходе смешивания. Если считают необходимым, то захваченный носителем воздух можно удалять под вакуумом.
Предпочтительно, после смешивания смеси культура:носитель смесь инкубируют в течение приблизительно более чем 6 часов, предпочтительно, приблизительно более чем 8 часов, предпочтительно, более чем 12 часов, предпочтительно, приблизительно более чем 18 часов, предпочтительно, от 0,5 до 14 суток. Наиболее предпочтительно, смесь культура:носитель инкубируют в течение приблизительно более чем 12 часов. Соответственно, смесь культура:носитель инкубируют в течение приблизительно от 12 часов до приблизительно 14 суток.
Соответственно, после смешивания смесь культура:носитель можно инкубировать при 5-30°C, предпочтительно, при 10-15°C, в течение приблизительно от 0 до приблизительно 14 суток, предпочтительно, при от 0,5 до приблизительно 14 суток. В ходе инкубации микроорганизмам позволяют расти и размножаться. Предпочтительно, если смесь культура:носитель инкубируют в течение более чем одних суток, то снижения влажности в ходе этого периода инкубации не происходит.
Соответственно, обработку импульсным электромагнитным полем (PEMF) можно проводить в ходе процесса в любое время. Например, обработку PEMF можно проводить на одной или нескольких следующих стадиях: в ходе культивирования микроорганизма; в ходе смешивания культивируемого микроорганизма с носителем; после смешивания культивируемого микроорганизма с носителем; в течение (необязательной) инкубации смеси культура:носитель; в течение высушивания смеси культура:носитель; в течение хранения высушенной смеси культура:носитель; после нанесения на семена или компоненты семян; в любое время после высушивания смеси культура:носитель; в любое время после повторной гидратации высушенной смеси культура:носитель.
Предпочтительно, в одном из вариантов осуществления обработку PEMF проводят в ходе культивирования микроорганизмов.
Соответственно, в другом варианте осуществления обработку PEMF проводят в ходе культивирования микроорганизмов и, необязательно, повторяют в ходе инкубации смеси культура:носитель.
Соответственно, можно проводить более чем одну обработку PEMF. В одном из вариантов осуществления можно проводить более чем две обработки PEMF.
В одном из вариантов осуществления микроорганизмы можно культивировать в непрерывном ферментере и можно подвергать обработке PEMF в одном участке ферментера перед дальнейшей обработкой всей или некоторой части культуры, необязательно, при повторном обороте части культуры в ферментере. Как правило, микроорганизмы можно подвергать воздействию PEMF во время прохождения через трубопровод (такой как труба, приемлемо, извитая труба) из ферментера.
Соответственно, каждую обработку PEMF можно проводить приблизительно от 0,5 часов до приблизительно 48 часов, предпочтительно, приблизительно от 4 часов до приблизительно 24 часов, предпочтительно, приблизительно от 8 часов до приблизительно 16 часов.
Предпочтительно, в одном из аспектов бактериальную культуру обрабатывают PEMF в течение 1-6 часов непосредственно перед смешиванием бактериальной культуры с носителем.
Однако предусматривают, что каждая обработка PEMF может состоять из нескольких обработок PEMF, где продолжительность каждой обработки составляет несколько минут (т.е. 1-20 минут, предпочтительно, 1-10 минут, более предпочтительно, 1-5 минут). Соответственно, микроорганизмы можно подвергать более чем одной обработке, предпочтительно, более чем двум, предпочтительно, более чем трем, предпочтительно, более чем четырем, предпочтительно, более чем пяти, предпочтительно, более чем шести, предпочтительно, более чем семи, предпочтительно, более чем восьми, предпочтительно, более чем девяти или предпочтительно, более чем десяти обработкам.
Как понимает специалист в данной области, в процессе по настоящему изобретению можно использовать любое устройство, служащее источником импульсных электромагнитных полей (PEMF).
Одно из таких устройств описано в США 6561968 (приведенном здесь полностью в качестве ссылки). Устройство в США 6561968 содержит множество электропроводящих витков, каждый с центральной осью, где каждая центральная ось направлена в микроорганизмы; и генератор импульсов, функционально связанный с каждым витком для обеспечения серий импульсов тока для проведения по каждому витку, где серии импульсов предназначены для возбуждения в каждом витке периодического переменного магнитного поля для индукции электрического поля. В устройстве из США 6561968 содержится несколько пар витков, где каждая пара витков включает в себя первый виток и прилегающий второй виток. В случае заданного импульса, обеспечиваемого генератором импульсов, магнитное поле в центре первого витка направлено к микроорганизмам, а магнитное поле в центре второго витка направлено от микроорганизмов.
Центральная ось витка представляет собой ось симметрии, обычно направленную вдоль центральной оси цилиндрического витка или перпендикулярно (при центральном расположении) плоскости плоского витка.
Поскольку устройство PEMF может выделять тепло, то предусматривают, что устройство может дополнительно содержать охлаждающее устройство.
Электромагнитные поля импульсного типа (PEMF) представляют собой наиболее часто используемый вид электромагнитной терапии, особенно для срастания костей, лечения артритов и при повреждениях в спорте и от повторяющихся нагрузок. Сообщали о множестве различных коммерческих видах устройства PEMF для использования в здравоохранении. Например, лишь одними из таких устройств PEMF являются устройства Curatron 2000-series; Wavetek; Bi Osteogen. Специалист в данной области легко узнает о других устройствах PEMF. Предусматривают, что по настоящему изобретению можно использовать любое из этих устройств.
Предпочтительно, микроорганизм сушат до содержания влаги, близкого к естественному содержанию влаги в носителе, которое, как правило, составляет приблизительно от 3 до приблизительно 6% (мас./мас.).
Предпочтительно, смесь культура микроорганизма:носитель сушат. Соответственно, смесь культура микроорганизма:носитель сушат до содержания влаги, близкого к естественному содержанию влаги в носителе, которое составляет приблизительно от 1% мас. до приблизительно 7% мас., предпочтительно, приблизительно от 3% мас. до приблизительно 6% мас.
Не желая ограничиваться теорией, было неожиданно открыто, что обработка PEMF клеток в носителе с менее чем 6% мас. воды, т.е. где Aw (активность воды) составляет приблизительно менее чем 0,7, приемлемо, приблизительно менее чем 0,5, значительно повышает срок хранения микроорганизма (особенно бактерий). Было открыто, что срок хранения можно увеличивать, например, до более чем, например, 1 года.
Активность воды (Aw) указывает на относительную доступность воды для бактерий в смеси. Активность воды, составляющая 1 или близкая к ней, указывает на то, что бактерии находятся в активном состоянии, а не в покое; тогда как активность воды менее чем 0,9, предпочтительно, приблизительно менее чем 0,7, означает, что микроорганизм находится в покое. Сходным образом, активность воды приблизительно от 0,4 до 0,6 означает, что бактерии находятся в покое. Предпочтительно, по настоящему изобретению активность воды в высушенной смеси культура:носитель составляет менее чем 0,9, предпочтительно, приблизительно менее чем 0,7, предпочтительно, приблизительно от 0,4 до 0,7, предпочтительно, приблизительно 0,6.
В настоящем изобретении было впервые показано, что обработку PEMF можно использовать для продления срока хранения высушенных микроорганизмов в состоянии покоя.
Предпочтительно, микроорганизм и/или смесь культура микроорганизма:носитель сушат воздухом. Соответственно, можно использовать сушку активным вентилированием. Например, смесь культура:носитель можно помещать на платформу с приграничным потоком воздуха над решетками с выходными отверстиями. В этом случае сушка может происходить в течение менее чем 1 суток, предпочтительно, в течение приблизительно 16 часов. Альтернативно, можно использовать обычную сушку комнатным воздухом в лотках или сходных контейнерах. Предпочтительно, сушку комнатным воздухом проводят при температуре приблизительно 10-30°C, как правило, приблизительно 20-24°C, и при относительной влажности менее чем 75%, предпочтительно, приблизительно 30-60%, более предпочтительно, приблизительно 32,5-35%. При сушке комнатным воздухом высушивание может занимать от 1 до 5 суток, предпочтительно, от 1 до 4 суток, приемлемо, 3-4 суток. Соответственно, в ходе сушки комнатным воздухом для выживания микроорганизма может быть полезно наличие в атмосфере ионов Ca2+. В качестве еще одной альтернативы сушку можно проводить помещением смеси культура:носитель в контейнер, например, контейнер Milli-WrapRTM, где контейнер допускает испарение влаги.
Уровень влаги постепенно снижают до величины приблизительно от 1% до приблизительно 6% (мас./мас.).
Стадию сушки можно проводить в нестерильных условиях.
Процесс по настоящему изобретению может содержать дополнительные стадии измельчения композиции смеси культура микроорганизма:носитель и/или нанесения композиции на семена или другой репродуктивный материал.
Например, высушенный продукт можно измельчать с использованием мельницы с воздушным сепаратором до конечного размера частиц приблизительно от 0,1 до приблизительно 150 микрон.
Соответственно, в одном из вариантов осуществления смесь культура:носитель можно инкубировать при приблизительно 10-15°C и при содержании влаги приблизительно 18-33% (масса во влажном состоянии) с последующей сушкой при 20°C над насыщенным хлоридом кальция в течение 3-4 суток при обеспечении относительной влажности приблизительно 32,5% или с последующей быстрой сушкой в течение менее чем 24 часов. Содержание влаги в смеси культура:носитель можно снижать до величины приблизительно от 4 до приблизительно 7%.
В одном из вариантов осуществления pH носителя или pH смеси культура микроорганизма:носитель составляет приблизительно от 6 до приблизительно 9, предпочтительно - приблизительно от 7 до приблизительно 9, более предпочтительно - приблизительно от 8 до приблизительно 9, более предпочтительно - приблизительно от 8,2 до приблизительно 8,8, более предпочтительно - приблизительно 8,6.
Предпочтительно, в одном из вариантов осуществления к носителю добавляют настолько мало жидкости, насколько возможно. В целом, в некоторых случаях слишком большое количество культуральной среды может означать снижение выживаемости бактерий в сухом носителе.
ПРЕИМУЩЕСТВА И НЕОЖИДАННЫЕ ОТКРЫТИЯ
Было обнаружено, что обработанные процессом по настоящему изобретению микроорганизмы выживают при сушке значительно лучше, т.е. имеют улучшенную исходную выживаемость, чем в случае использования только носителя и/или проведения только обработки PEMF. При этом, в частности, было открыто, что сочетание носителя вместе с обработкой PEMF приводит к выживанию микроорганизмов в течение значительно более долгого периода времени и улучшенному выживанию в высушенном состоянии, т.е. повышает срок хранения высушенного микроорганизма. Удивительно и неожиданно сочетанный эффект этих вариантов обработки, особенно на срок хранения высушенного микроорганизма, является синергичным в сравнении с каждой обработкой в отдельности.
В рамках настоящей заявки под термином “исходная выживаемость” авторы подразумевают способность микроорганизмов выдерживать существующий процесс сушки, где способность тестируют непосредственно после сушки, т.е. от 0 до приблизительно 14 суток, приемлемо, от 1 до приблизительно 5 суток, приемлемо, через 2 суток после сушки и независимо от того, наносили ли, например, высушенный микроорганизм или высушенную смесь культура:носитель на семя или другой репродуктивный материал.
В рамках настоящей заявки под термином “срок хранения” высушенного микроорганизма авторы подразумевают способность микроорганизмов расти и/или размножаться при повторной гидратации после хранения в течение продолжительных периодов времени, т.е. способность микроорганизмов выживать и возобновлять активность вследствие повторной гидратации, а также представлять собой жизнеспособные, пригодные к культивированию клетки после хранения в высушенном состоянии в течение продолжительного периода времени (например, в течение, по крайней мере, 24 часов, по крайней мере, 48 часов, по крайней мере, 6 месяцев или, по крайней мере, 12 месяцев).
Для еще большего повышения исходной выживаемости и/или срока хранения к культуре можно добавлять осмопротекторы или стабилизаторы клеток. Например, добавление к культуре 10-100 мМ сахарозы может увеличивать приблизительно в 10 раз количество выживающих микроорганизмов, например, Pseudomonas spp. Другие известные защитные средства и стабилизаторы клеток включают в себя аминокислоты и их производные, холин, эктоин, двухвалентные катионы, углеводы, глицерины, камеди, антиоксиданты, сухие обезжиренные молочные остатки, кристаллическую целлюлозу, карбоксиметилцеллюлозу (CMC) и производные CMC.
По настоящему изобретению заселяющие корни бактерии-антагонисты Pseudomonas, высушенные с использованием способа по настоящему изобретению и нанесенные на гранулированные семена сахарной свеклы, могут выживать на семенах в достаточно больших количествах в течение более чем 1,5 года и все же восстанавливать свой биологический антагонизм в отношении патогенных организмов и свои свойства в отношении заселения корней.
ВАРИАНТЫ ПРИМЕНЕНИЯ
Композицию, содержащую высушенные микроорганизмы, которые получают процессом по настоящему изобретению, можно применять для нанесения на семена или другой репродуктивный материал растения одного или нескольких из следующих: биоконтролирующие средства; стимулирующие рост средства; противогрибковые средства; пестициды.
Композицию, содержащую высушенные микроорганизмы, которые получают процессом по настоящему изобретению, можно вводить непосредственно в среду для роста в теплицах и в почве.
Кроме того, композицию, содержащую высушенные микроорганизмы, которые получают процессом по настоящему изобретению, можно применять для очистки сточных вод и/или очистки химических/биологических отходов, таких как, например, отходы на фермах.
Альтернативно, когда композиция содержит способные к биоочистке микроорганизмы, то композицию можно применять для очистки загрязненных почв, таких как, например, почвы, загрязненные PCB. Способные к биоочистке микроорганизмы хорошо известны и могут представлять собой любой микроорганизм, способный разрушать токсичные соединения, где микроорганизм включает в себя, но ими не ограничивается, генетически модифицированные микроорганизмы.
Альтернативно, композицию, содержащую высушенные микроорганизмы, которые получают процессом по настоящему изобретению, можно применять для введения микроорганизма в пищевые продукты и/или корма для животных. Приемлемые для применения в пищевой промышленности микроорганизмы хорошо известны и могут представлять собой, например, молочнокислые бактерии.
Кроме того, композицию, содержащую высушенные микроорганизмы, которые получают процессом по настоящему изобретению, можно применять в медицинских целях, например, в обеспечении, например, молочнокислыми бактериями.
СИНЕРГИЧНЫЙ ЭФФЕКТ
Сочетание смешивания культуры микроорганизма с носителем и обработки импульсными электромагнитными полями (PEMF) в получении композиции, содержащей высушенные микроорганизмы, приводит к синергичному эффекту на исходную выживаемость и/или срок хранения микроорганизмов.
Синергию можно выявлять посредством наблюдения за количеством жизнеспособных, пригодных к культивированию клеток микроорганизмов после следующих вариантов обработки: a) смешивания культуры микроорганизма с носителем; b) обработки PEMF; или c) сочетания a) и b). Синергию выявляют, когда сочетание (c) приводит к более хорошему эффекту (т.е. большему количеству жизнеспособных, пригодных к культивированию клеток при оценке исходной выживаемости и/или при оценке срока хранения микроорганизмов), чем варианты обработки (a) или (b) в отдельности. Предпочтительно, сочетанная обработка (c) приводит к большему количеству жизнеспособных, пригодных к культивированию клеток микроорганизмов при оценке исходной выживаемости и/или при оценке срока хранения микроорганизмов в сравнении с количеством жизнеспособных, пригодных к культивированию клеток микроорганизмов, получаемых обработкой (a), добавленным к количеству жизнеспособных, пригодных к культивированию клеток микроорганизмов, получаемых обработкой (b).
ПИЩЕВОЙ ПРОДУКТ
В рамках настоящей заявки термин “пищевой продукт” использован в широком смысле и включает в себя пищу для человека, а также пищу для животных (т.е. корм). В предпочтительном аспекте пищевой продукт предназначен для потребления человеком.
Пища может находиться в виде раствора или в виде твердого вещества в зависимости от использования и/или способа нанесения, и/или способа введения.
ПИЩЕВОЙ ИНГРЕДИЕНТ
Композицию по настоящему изобретению можно использовать в качестве пищевого ингредиента.
В рамках настоящей заявки термин “пищевой ингредиент” включает в себя препарат, который представляет собой функциональные продукты питания или пищевые продукты или который можно добавлять к ним, а также включает в себя препараты, которые можно использовать в небольших количествах в широком спектре продуктов, которым необходимо, например, подкисление или эмульгирование.
Пищевой ингредиент может находиться в виде раствора или в виде твердого вещества в зависимости от использования, и/или способа нанесения, и/или способа введения.
ПИЩЕВЫЕ ДОБАВКИ
Композиция по настоящему изобретению может представлять собой пищевые добавки или ее можно добавлять к ним.
ФУНКЦИОНАЛЬНЫЕ ПРОДУКТЫ ПИТАНИЯ
Композиция по настоящему изобретению может представлять собой функциональные продукты питания или ее можно добавлять к ним.
В рамках настоящей заявки термин “функциональный продукт питания” означает пищу, способную обеспечивать не только питательное действие и/или удовлетворение вкусом, но также способную обеспечивать дополнительное благоприятное воздействие на потребителя.
Хотя не существует утвержденного определения функционального продукта питания, большинство компаний, имеющих интерес в этой области, соглашаются, что функциональные продукты питания представляют собой продукты питания, которые продают в качестве обладающих конкретными эффектами на здоровье.
ПРОДУКТЫ ПИТАНИЯ
Композицию по настоящему изобретению можно использовать в получении продуктов питания, таких как один или несколько из: кондитерских изделий, молочных продуктов, мясных продуктов, продукции птицеводства, рыбопродуктов и хлебобулочных изделий.
Например, композицию по настоящему изобретению можно использовать в качестве ингредиентов безалкогольных напитков, фруктового сока или напитков, содержащих белок молочной сыворотки, лечебных чаев, напитков какао, молочных напитков и напитков с молочнокислыми бактериями, йогурта, йогурта для питья и вина.
Также настоящее изобретение относится к способу получения пищи или пищевого ингредиента, где способ предусматривает смешивание композиции, получаемой процессом по настоящему изобретению, или композиции по настоящему изобретению вместе с другим пищевым ингредиентом. В другом аспекте настоящее изобретение также относится к способу получения пищевого ингредиента.
ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ
Также композицию, получаемую процессом по настоящему изобретению, и/или композицию по настоящему изобретению можно использовать в качестве фармацевтического препарата или в его получении. В рамках настоящей заявки термин “фармацевтический препарат” использован в широком смысле и включает в себя фармацевтические препараты для человека, а также фармацевтические препараты для животных (т.е. ветеринарное применение). В предпочтительном аспекте фармацевтический препарат предназначен для использования человеком и/или для животноводства.
Фармацевтический препарат может быть предназначен для терапевтических целей, которые могут иметь лечебный, или паллиативный, или профилактический характер. Фармацевтический препарат может быть предназначен даже для диагностических целей.
При использовании в качестве фармацевтического препарата или в его получении композицию по настоящему изобретению можно применять в сочетании с одним или несколькими из: фармацевтически приемлемого носителя, фармацевтически приемлемого разбавителя, фармацевтически приемлемого эксципиента, фармацевтически приемлемого адъюванта, фармацевтически активного ингредиента.
Фармацевтический препарат может находиться в виде раствора или в виде твердого вещества в зависимости от использования, и/или способа нанесения, и/или способа введения.
ФАРМАЦЕВТИЧЕСКИЙ ИНГРЕДИЕНТ
Композицию, получаемую процессом по настоящему изобретению, и/или композицию по настоящему изобретению можно использовать в качестве фармацевтических ингредиентов. В рамках настоящей заявки продукт и/или композиция по настоящему изобретению могут представлять собой единственный активный компонент или они могут быть по крайней мере одним из нескольких (т.е. 2 или более) активных компонентов.
Фармацевтический ингредиент может находиться в виде раствора или в виде твердого вещества в зависимости от использования, и/или способа нанесения, и/или способа введения.
Фармацевтический ингредиент может находиться в виде шипучих продуктов для улучшения свойств растворения фармацевтического препарата.
ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ
Также композицию, получаемую процессом по настоящему изобретению, и/или композицию по настоящему изобретению можно использовать в качестве средства биоочистки, т.е. для поглощения и разрушения загрязняющих окружающую среду веществ.
ФОРМЫ
Композицию, получаемую процессом по настоящему изобретению, и/или композицию по настоящему изобретению можно использовать в любой приемлемой форме.
Приемлемые примеры форм включают в себя одну или несколько из: таблеток, драже, капсул, суппозиториев, растворов или суспензий, которые могут содержать ароматизаторы или красители, для применения с незамедлительным, отсроченным, модифицированным, длительным, прерывистым или контролируемым высвобождением.
Например, если продукт и/или композицию используют в форме таблетки, такой как для применения в качестве пищевого ингредиента, то таблетки могут также содержать одно или несколько из: эксципиентов, дезинтегрирующих веществ, связывающих грануляции веществ или смазывающих веществ.
Примеры приемлемых с точки зрения питания носителей для использования в получении форм включают в себя, например, воду, солевые растворы, спирт, силикон, воск, вазелин и т.п.
Предпочтительные эксципиенты для форм включают в себя лактозу, крахмал, целлюлозу, молочный сахар или полиэтиленгликоли с высокой молекулярной массой.
В случае водных суспензий и/или эликсиров получаемые процессом по настоящему изобретению композиции и/или композицию по настоящему изобретению можно сочетать с различными подсластителями или ароматизаторами, красящим веществом или красителями, с эмульгаторами и/или суспендирующими средствами, а также с разбавителями, такими как вода, этанол, пропиленгликоль и глицерин, и их сочетаниями.
Также формы могут включать в себя желатиновые капсулы; капсулы из клетчатки, таблетки из клетчатки и т.д.
ПРИМЕРЫ
Настоящее изобретение описано ниже только в целях примера, в котором могут ссылаться на следующие фигуры:
на фигуре 1 представлены исходная выживаемость и срок хранения высушенных Pseudomonasfluorescens (0-544 суток после обработки), нанесенных на гранулированное семя сахарной свеклы с последующей обработкой PEMF (55 В) в течение 0, 8, 16 или 48 часов и смешиванием с носителем из цеолита перед медленной сушкой в течение 4 суток;
на фигуре 2 представлены исходная выживаемость и срок хранения высушенных Pseudomonasfluorescens (0-544 суток после обработки), нанесенных на гранулированное семя сахарной свеклы с последующей обработкой PEMF (55 В) в течение 0, 8, 16, 24 или 48 часов и смешиванием с носителем из цеолита перед быстрой сушкой; и
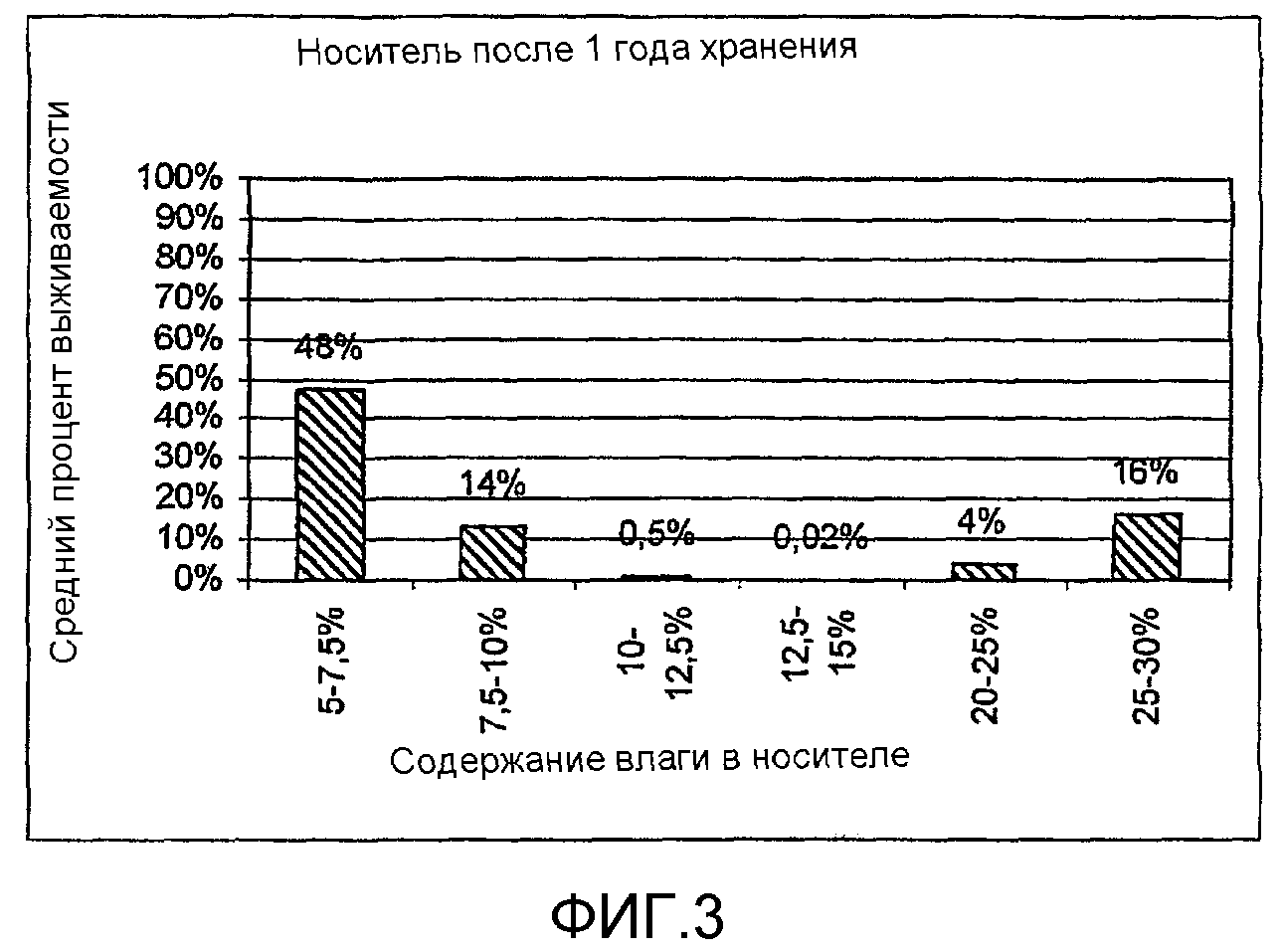
на фигуре 3 представлен средний процент выживаемости Pseudomonasfluorescens, сопоставленный с содержанием влаги в носителе.
ПРИМЕР 1 : эффект обработки PEMF в сочетании с носителями на исходную выживаемость и срок хранения высушенных микроорганизмов
Штамм Pseudomonasfluorescens DS96.578 культивировали в течение ночи в жидкой LB до близкой к стационарной фазы, 10x разводили свежей LB и смешивали с носителем из клиноптилолита (клиноптилолит-Na, доступный в виде KlinominTM в NorNatur, Denmark) в соотношении 1:2. Затем смесь сушили до содержания влаги приблизительно 22% посредством сушки воздухом на платформе с приграничным потоком воздуха, помещали в контейнер и инкубировали в течение 10 суток при 10°C на уровне влажности приблизительно 22% (мас./мас.). В конце периода носитель подвергали обработке импульсным электромагнитным полем (обработка PEMF - 2 мВ/см при 50 Гц) при 55 вольтах (55 В) в течение различных периодов времени (8, 16, 24 и 48 часов) или не подвергали обработке PEMF (0 часов). Устройство PEMF представляло собой устройство, описанное в США 6561968. В ходе периода инкубации популяции бактерий вырастали до величин, составляющих от 2×108 до 7,1×108 бактерий/грамм цеолита. Затем смесь культура:цеолит сушили до содержания влаги 3-6% (мас./мас.) перед нанесением на гранулированные семена сахарной свеклы. Сушку смесей культура:цеолит до 3-6% (мас./мас.) проводили в течение 16 часов сушкой активным вентилированием или медленным высушиванием посредством помещения смеси на 4 суток в камеру с относительной влажностью приблизительно 35%.
Выживаемость (в том числе исходную выживаемость и срок хранения) бактерии на семенах сахарной свеклы оценивали (на основе колониеобразующих единиц (CFU)/семя) через 2, 71 и 544 суток после обработки.
Результаты представлены в приведенной ниже таблице и в виде графика на фигуре 1 (медленная сушка) и фигуре 2 (быстрая сушка).
Как можно видеть из фигур, обработка PEMF (2 мВ/см при 50 Гц, 55 В) в сочетании с носителем повышает исходную выживаемость, а также срок хранения высушенных, нанесенных на семя бактерий в течение времени. В отличие от семян, покрытых обработанными PEMF носителями, из семян, которые покрыты необработанными PEMF смесями культура:носитель, по истечении 544 суток хранения нельзя выделить колониеобразующие бактерии.
ПРИМЕР 2: эффект обработки PEMF в сочетании с носителями на исходную выживаемость и срок хранения высушенных микроорганизмов
Штамм Pseudomonasfluorescens DS96.578 культивировали в течение ночи в жидкой LB. После культивирования в жидкой среде бактериальную культуру разводили в 10 раз свежей средой LB и смешивали со стерилизованным клиноптилолитом в соотношении 50 мл бактериальной культуры к 100 г клиноптилолита (1:2). После осторожного перемешивания смесь культура:клиноптилолит 1:2 медленно сушили воздухом до 123 г. Затем смесь бактериальная культура:клиноптилолит инкубировали в течение 10 суток при 10°C. В конце периода инкубации смесь культура:клиноптилолит разделяли на две равные порции, одну из которых подвергали обработке PEMF 50 В (2 мВ/см при 50 Гц, 55 В) в течение 16 часов, тогда как другую порцию обрабатывали таким же способом, за исключением отсутствия воздействия PEMF. После этой обработки смеси бактериальная культура:клиноптилолит сушили до содержания влаги 4-6% (мас./мас.) посредством помещения смесей на лотки в атмосфере с влажностью 35% на 4 суток. Высушенный носитель инкубировали при 10°C. Определяли количество бактерий, способных образовывать колонии на твердой среде LB, посредством растворения 1 г смеси в 10 мл 0,9% NaCl и посева 100 микролитров этого раствора на твердую LB.
Количество колониеобразующих бактерий в носителе через 0, 73, 121, 182 и 408 суток представлено в приведенной ниже таблице.
Как можно видеть из таблицы, бактерии хорошо выживали в высушенных носителях в течение многих месяцев. Через приблизительно полгода количество бактерий в носителе, не обработанном PEMF (2 мВ/см при 50 Гц, 55 В), начинает снижаться, тогда как количество колониеобразующих бактерий остается приблизительно на том же самом высоком уровне в течение более чем года. Очевидно, обработка PEMF смешанных с носителем бактерий c последующей сушкой смеси до уровня, при котором активность воды находится ниже уровня, который допускает активный рост бактерий, приводит к повышенной сохраняемости бактерий, способных образовывать колонии после повторной гидратации.
ПРИМЕР 3: сравнение двух носителей: клиноптилолита и сепиолита
Штамм Pseudomonasfluorescens DS96.578 (устойчивый к рифампицину) культивировали в течение ночи в жидкой среде Лурия-Бертани (LB), разводили в 10 раз свежей средой LB, и разведенную культуру смешивали со следующими носителями (клиноптилолит и сепиолит) до смеси культура:носитель приблизительно 1:1 (мас./мас.). Затем носители сушили для снижения содержания влаги до приблизительно 25% (мас./мас.) и инкубировали в течение 10 суток при 10°C. После этого носители сушили до различных уровней влажности от 10 до 25% и инкубировали при 10°C в течение дополнительных 23 суток. CFU/г носителя определяли посевами на застывший агар:
Как можно видеть из указанного выше примера, количество колониеобразующих бактерий на грамм носителя составляет относительно постоянную величину приблизительно 108 бактерий/г клиноптилолита при различных содержаниях влаги в носителе, тогда как количество колониеобразующих бактерий в носителе из сепиолита снижено в носителях с более низким содержанием влаги.
ПРИМЕР 4: выживаемость бактерий в различных носителях
Выживаемость бактерий как колониеобразующих единиц была исследована в трех различных носителях: вермикулите, бентоните и клиноптилолите. Бентонит и вермикулит представляют собой глины. Клиноптилолит (клиноптилолит-Na) представляет собой цеолит. Две культуры штамма Pseudomonasfluorescens DS96.578 выращивали в течение ночи в LB, дополненной 50 мМ сахарозы. Одну из культур подвергали обработке PEMF 50 В (2 мВ/см при 50 Гц, 55 В) в течение последних 8 часов культивирования. По окончании культивирования бактериальные культуры разводили в 10 раз свежей культуральной средой и смешивали 23 мл культуры с 100г предварительно стерилизованных носителей. Затем носители инкубировали в течение 6 суток при 10°C. На 6-е сутки носители с необработанными PEMF бактериями разделяли на две равные порции, одну из которых обрабатывали PEMF (16 часов, 50 В), а другую нет. На 7 сутки все носители снова разделяли на две части, одну из которых сушили воздухом в течение ночи в фильтровальных пакетах, тогда как другую часть носителей медленно сушили посредством их помещения на 4 суток в камеру с относительной влажностью приблизительно 35%. В результате процессов сушки получали носители с содержанием влаги, незначительно превосходящим их естественные содержания влаги. После сушки носители наносили на гранулированные семена сахарной свеклы: на 100000 семян использовали 60 г носителей. В приведенной ниже таблице представлено количество колониеобразующих единиц для отдельных стадий, определяемое дублирующими посевами на планшеты. Данные по CFU/семя получены для случая нанесения на семена медленно высушенных носителей.
CFU в бактериальной культуре на момент смешивания с носителем составляло 7,55x107 CFU/мл для необработанной культуры и 6,65x107 CFU/мл для обработанной PEMF культуры.
В вариантах обработки в отсутствие материала носителя в бактериальных культурах присутствовали те же самые концентрации бактерий. В этих вариантах обработки на семя наносили бактериальные культуры в отсутствие смешивания с носителем и через 2 суток после нанесения оценивали CFU/семя как остаток после вариантов обработки и, соответственно, вычисляли % выживаемости.

1. WC1: естественное содержание воды (WC) в используемом материале носителя.
2. % выживаемости: процент от ожидаемого количества колониеобразующих единиц, вычисляемый по формуле:
(CFU/семя) × 100000 семян/(CFU/г носителя × 60).
3. Aw измеряют посредством Testo 650, имеющего набор величин Aw 0628 0024.
4. % WC измеряют посредством сушки при 105°C в течение 4 часов.
N/A=не применимо к данному случаю
Для всех используемых материалов носителей количество колониеобразующих единиц (CFU) в высушенных носителях является высоким, независимо от используемого материала носителя и процедуры сушки, хотя во многих случаях количество CFU выше в медленно высушенном носителе. Процент колониеобразующих единиц, которые можно повторно выделить из семян с нанесенным покрытием, для обработанных PEMF бактерий последовательно более высок, чем для необработанных бактерий.
Если материал носителя не используют, то из семян с нанесенным покрытием нельзя выделить бактерии или можно выделить очень низкие количества (1-100) бактерий.
Таким образом, очевидно, что отдельно обработка PEMF не повышает выживаемость бактерий после нанесения на семена. С другой стороны, сочетание помещения бактериальной культуры в носитель (с низкой естественной способностью удерживать воду) и обработки PEMF (перед или после смешивания культуры с материалом носителя) повышает непосредственную выживаемость бактерий, которые можно повторно выделить из семян.
В рамках настоящей заявки авторы показывают, что после дегидратации до состояния, при котором активность воды находится ниже уровня, допускающего активный рост бактерий (состояния покоя), у обработанных PEMF клеток выявляют повышенную жизнеспособность, что можно видеть из улучшенной выживаемости колониеобразующих единиц после нанесения на семена.
Медленно высушенные носители хранили при 10°C в течение 322 суток и определяли количество способных образовывать колонии (CFU) бактерий на грамм носителя: результаты можно видеть в приведенной ниже таблице:
Как можно видеть из указанного выше, выживаемость бактерий, способных образовывать колонии после посева на планшеты, является высокой в клиноптилолите и бентоните, а особенно высока после обработки PEMF (2 мВ/см при 50 Гц, 55 В). Выживаемость в вермикулите снижена в сравнении с клиноптилолитом и бентонитом, но, тем не менее, улучшается при обработке PEMF в сравнении с необработанным контрольным образцом.
Семена сахарной свеклы с нанесенным покрытием хранили в течение 6 месяцев при 15°C. Количество бактерий на семя определяли, как описано ранее (CFU/семя). В приведенной ниже таблице представлены результаты для хранения в течение 2 суток, 28 суток и 182 суток после нанесения покрытия.
Как можно видеть из указанных выше фигур, у бактерий, обработанных PEMF (2 мВ/см при 50 Гц, 55 В) в ходе культивирования бактерий перед смешиванием с носителем или обработанных PEMF (2 мВ/см при 50 Гц, 55 В) после смешивания с носителем, выживаемость увеличивается в течение времени в сравнении с необработанными PEMF контрольными образцами. Для бактерий в клиноптилолите увеличение происходит более чем в 10 раз на 182 сутки после нанесения покрытия, а в вермикулите и бентоните происходит увеличение в 2-5 раз.
ПРИМЕР 5: эффект исходного соотношения бактериальная культура:носитель
Как правило, бактерии очень восприимчивы к кислотному стрессу. Измерение устойчивости бактериальной культуры к стрессу проводят воздействием на бактерии низким pH в течение определенного периода времени с последующим подсчетом на планшетах. Для исследования устойчивости к стрессу как функции исходного соотношения проводили эксперимент, в котором бактериальную культуру смешивали с материалом носителя.
Жидкие культуры штамма Pseudomonasfluorescens 96.578 выращивали в течение ночи при 20°C в LB и LB, дополненной 100 мМ сахарозы. Культуры смешивали со стерилизованными носителями из клиноптилолита в различных соотношениях бактериальной культуры и сухого носителя (приблизительно от 1:5 до приблизительно 1:2). После смешивания смеси культура:носитель, содержащие более чем 20,4% бактериальной суспензии, сушили воздухом на платформе с приграничным потоком воздуха до 20,4%. Носитель, содержащий 20,4% бактериальной культуры, дополнительно не сушили. После этого носители помещали в контейнер и инкубировали в течение 7 суток при 10°C. Затем носители сушили приблизительно до 5% влажности посредством инкубирования носителей в лотках в течение четырех суток при уровне относительной влажности 32,5%. После высушивания до уровня влажности 5% носители хранили в герметичных пластмассовых пакетах в течение 14 суток, после чего определяли количество колониеобразующих единиц на грамм носителя посредством смешивания 1 грамма носителя с 10 мл воды или 10 мл 100 мМ цитратного буфера, pH 4,5. Через 30 минут нахождения в этой среде бактерии высевали на планшеты LB и подсчитывали колониеобразующие единицы. Рассчитывали долю колониеобразующих бактерий после воздействия кислотного стресса относительно такой же культуры, на которую воздействовали чистой водой.
Бактерии DS96.578, культивируемые в среде LB или LB, дополненной 100 мМ сахарозы:
CFU/г носителя в высушенном носителе через 14 суток после высушивания до 5%:
Как можно видеть из указанной выше таблицы, абсолютное количество пригодных к культивированию бактерий в носителях, а также доля бактерий, способных выдерживать воздействие низкого pH в течение 30 минут, возрастают по мере снижения соотношения бактериальной суспензии и носителя из клиноптилолита во время смешивания. Повышенная устойчивость микроорганизмов к воздействию низкого pH указывает на то, что бактериальные популяции в смесях, где соотношение бактериальной культуры и носителя составляет приблизительно ниже 1:4, находятся в более хорошем состоянии для выдерживания стресса, такого как продолжительное хранение при низких уровнях влажности, или физического стресса, такого как перемещение носителей, т.е. нанесение носителей на семена.
ПРИМЕР 6: важность соотношения компонентов в смеси при исходном смешивании бактериальной культуры с носителем
7 штаммов Pseudomonas и 1 штамм Flavobacterium (DS00.135) культивировали в течение ночи в жидкой LB. После культивирования в жидкой среде бактерии разводили в 10 раз свежей средой LB и смешивали со стерилизованным клиноптилолитом в соотношении 50 мл бактериальной культуры к 100 г клиноптилолита (1:2) или 23 мл бактериальной культуры к 100 г клиноптилолита (1:4). После осторожного перемешивания смесь культура:клиноптилолит 1:2 медленно сушили воздухом до 123 г, тогда как смеси культура:клиноптилолит 1:4 сушке не подвергали. Таким образом, на этой стадии все носители содержали одинаковое количество влаги. Затем смеси бактериальные культуры:клиноптилолит инкубировали в течение 10 суток при 10°C. Обработку PEMF не проводили. После 10 суток инкубации смеси бактериальная культура:клиноптилолит сушили до содержания влаги 4-6% (мас./мас.) посредством помещения смесей на 4 суток на лотки в атмосфере с влажностью 35%. После сушки высушенные смеси культура:клиноптилолит наносили на гранулированные семена сахарной свеклы и определяли количество пригодных к культивированию бактерий на семя (CFU/семя) посредством подсчета колоний после дублирующих посевов растворенных гранул сахарной свеклы на твердую среду LB. Результаты можно видеть в приведенной ниже таблице. В ней четко показана важность использования не слишком большого количества бактериальных культур при смешивании с носителем.
ПРИМЕР 7: очень низкое соотношение компонентов в смеси при исходном смешивании бактериальной культуры с носителем
Приведенный ниже пример иллюстрирует то, что очень низкое соотношение компонентов в смеси при исходном смешивании бактериальной культуры с носителем также приводит к равномерному распределению больших количеств бактерий после нанесения на семена высушенной смеси бактериальная культура:носитель.
Штамм Pseudomonas DS00.103 культивировали в течение ночи в жидкой среде LB, дополненной 50 мМ сахарозы. Последние 8 часов культивирования культуру подвергали воздействию PEMF (2 мВ/см при 50 Гц, 55В). После обработки PEMF в жидкой культуре бактериальную культуру разводили в 10 раз свежей средой LB до 1,15x108 CFU/мл. Смешивали 7 мл, 8 мл, 9 мл или 10 мл разведенной бактериальной культуры с 50 г носителя из бентонита (что равно соотношению культура:носитель, составляющему 1:7,1, 1:6,25, 1:5,5 и 1:5 соответственно), помещали в контейнеры и инкубировали в течение 7 суток при 10°C. В ходе периода инкубации бактериальная популяция росла до величины от 5x108 до 1,3x109 бактерий/грамм носителя бактерий. После инкубации смеси культура:носитель сушили до содержания влаги приблизительно 5% посредством помещения смесей на 3 суток в камеру с относительной влажностью 35%. Высушенные таким образом смеси бактериальная культура:носитель измельчали в тонкодисперсные порошки и наносили смеси 8 мл/50 г и 10 мл/50 г на гранулированные семена сахарной свеклы (60 г смеси/100000 гранулированных семян). Среднее количество колониеобразующих единиц на семя определяли посредством растворения 25 гранулированных семян в растворе 0,9% NaCl в течение 30 минут с последующим посевом 100 микролитров этого раствора на твердую среду LB. Для определения количества колониеобразующих единиц на одно семя растворяли по одному гранулированному семени из каждого варианта обработки в растворах 0,9% NaCl и высевали на твердую среду LB.
В приведенной ниже таблице представлено количество колониеобразующих бактерий на грамм носителя, содержание влаги в высушенных носителях и среднее количество колониеобразующих бактерий на семя для каждого различного варианта исходного смешивания.
В приведенной ниже таблице представлены в порядке возрастания количества колониеобразующих бактерий на гранулированное семя для 20 выбранных случайным образом отдельных гранул.
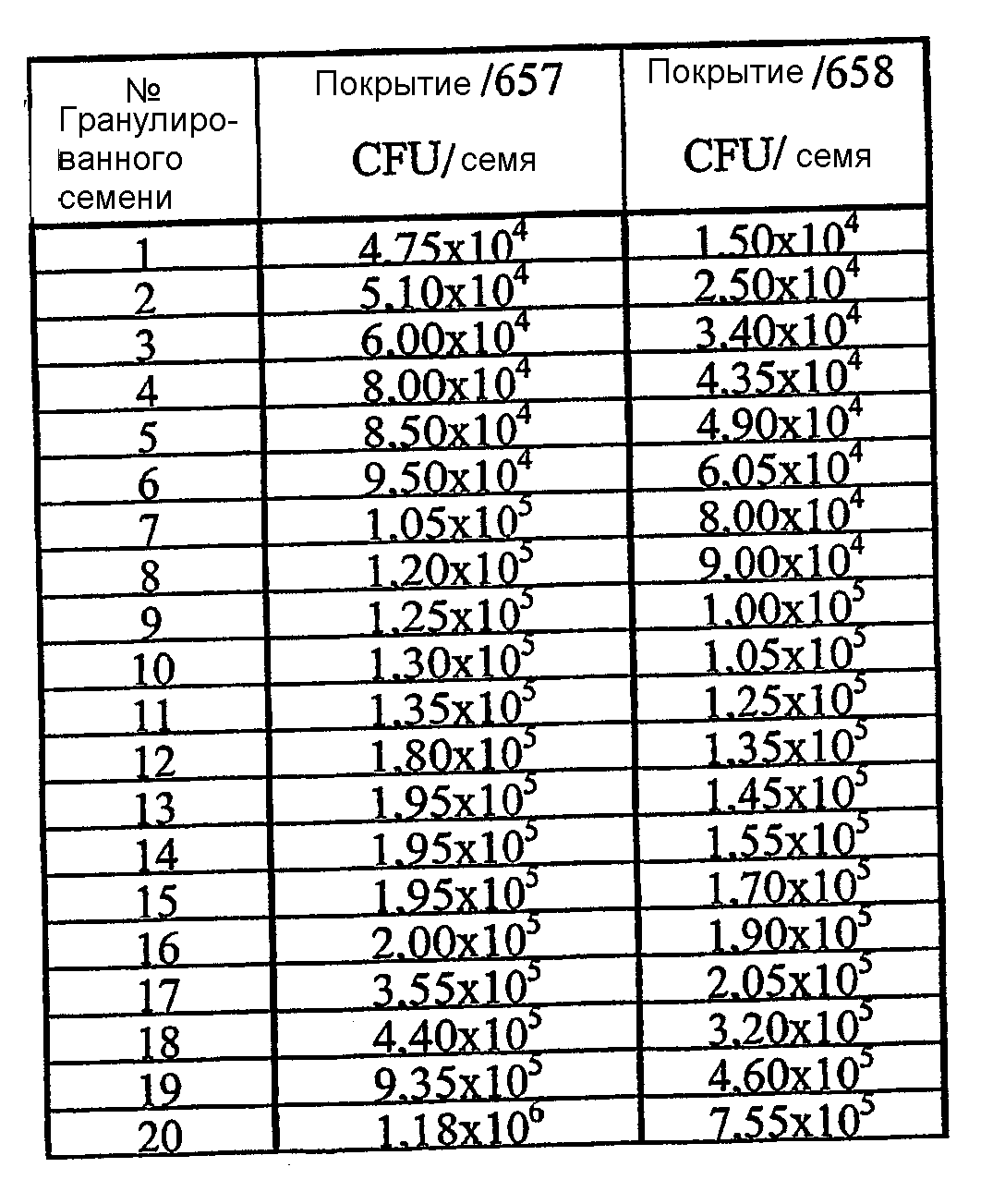
Как видно из двух указанных выше таблиц, количество бактерий на грамм носителя является высоким, даже когда соотношение бактериальной культуры и носителя ниже 1:5. Также видно, что в случае этих смесей с низким соотношением бактериальная культура:носитель точность нанесения на семя бактерий из носителей достаточно хороша для практического применения в нанесении бактерий на семена. Равномерное распределение по отдельному семени в этом эксперименте убедительно показывает, что бактерии равномерно распределяются в материале носителя при исходных соотношениях компонентов в смеси культура:носитель, составляющих 1:5 (мас./мас.) и ниже.
ПРИМЕР 8: высушенный до различных содержаний влаги носитель из клиноптилолита
Pseudomonasfluorescens культивировали в течение ночи в жидкой среде LB, дополненной 10 мМ трегалозы. После культивирования в жидкой среде бактериальную суспензию разводили в 10 раз свежей средой LB и смешивали 52 мл культуры с 100 г носителя из клиноптилолита с естественным содержанием воды 5,5%. Затем смесь сушили воздухом до содержания влаги приблизительно 22%, помещали в контейнер и инкубировали в течение 10 суток при 10°C. После периода инкубации смесь культура:носитель сушили до различных содержаний влаги посредством помещения смеси в условия с относительной влажностью 35% на различные периоды времени (до 4 суток). Фактическое содержание влаги в высушенных носителях определяли измерением потери массы после нагревания образца носителя в течение 4 часов до 105°C. Эксперимент повторяли три раза. Количества колониеобразующих бактерий на грамм носителя в сутки 0 определяли после посева на застывшую среду. Носители хранили в течение 365 суток в герметичных пластмассовых пакетах при 10°C и определяли количества колониеобразующих бактерий на грамм носителя. В приведенной ниже таблице представлены относящиеся к этому результаты:
Средний процент выживаемости Pseudomonasfluorescens, сопоставленный с содержанием влаги в носителе, представлен на фигуре 3.
Как можно видеть из результатов, хранение клеток в сухом носителе приводит к меньшей относительной гибели жизнеспособных (колониеобразующих единиц) бактерий. Хранение бактерий в таком же носителе при содержаниях влаги от 7,5 до 20% приводит к значительной относительной гибели жизнеспособных клеток.
Все указанные в приведенном выше описании публикации приведены здесь полностью в качестве ссылки. Специалистам в данной области очевидны различные модификации и изменения описанных способов и системы по настоящему изобретению без утраты объема и сущности настоящего изобретения. Хотя настоящее изобретение было описано в отношении конкретных предпочтительных вариантов осуществления, следует понимать, что заявленное изобретение не должно ненадлежащим образом ограничиваться такими конкретными вариантами осуществления. Действительно, подразумевают, что различные модификации описанных способов осуществления изобретения, которые очевидны специалистам в биохимии и биотехнологии, а также в связанных областях, входят в объем следующей формулы изобретения.
Реферат
Изобретение относится к биотехнологии. Способ получения композиции, содержащей высушенные бактерии, предусматривает культивирование одного или нескольких видов живых бактерий; смешивание культивируемой бактерии с одним или несколькими носителями; обработку бактерии импульсными электромагнитными полями 2 мВ/см при 50 Гц и 55 В; инкубирование смеси культура:носитель в течение по крайней мере приблизительно 6 часов; и сушку бактерии таким образом, чтобы снизить уровень влажности до величины приблизительно от 1% мас. до приблизительно 6% мас. Полученная композиция может быть использована для нанесения на семена или другой репродуктивный материал растения, для введения в среду для роста растений, для очистки сточных вод и/или очистки химических/биологических отходов, для очистки загрязненных почв, для введения приемлемого микроорганизма в пищевые продукты и/или корма для животных, для обеспечения молочнокислыми бактериями в медицинских целях. Сочетание смешивания культивируемой бактерии с одним или несколькими носителями и обработки микроорганизмов в композиции значительно повышает исходную выживаемость и срок хранения композиции. 6 н. и 16 з.п. ф-лы, 3 ил., 11 табл.
Формула
Документы, цитированные в отчёте о поиске
Способ очистки и обеззараживания жидких сред

Комментарии