Бактериоцин против листерий - RU2250267C2
Код документа: RU2250267C2
Чертежи


Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к области биотехнологии и, в частности, касается бактериоцина из Lactobacillus sakei, а именно, Lactobacillus sakei 2512, последовательности нуклеотидов, кодирующей этот бактериоцин, и промышленного применения этого бактериоцина в качестве активного средства против патогенной или нежелательной флоры при изготовлении продуктов питания.
Уровень техники
Молочнокислые бактерии широко применяются в пищевых ферментациях не только для улучшения вкуса и текстуры продуктов питания, но и для увеличения срока хранения полученного продукта. В самом деле, разнообразные молочнокислые бактерии обладают способностью подавлять рост некоторых грамположительных бактерий, включая такие источники патогенов, как Listeria monocytogenes, вследствие выделения молекул-антагонистов, в том числе пептидных соединений. Такие пептидные соединения, называемые бактериоцинами, представляют значительный интерес для сохранения качества и санитарной защиты продуктов питания, получаемых брожением.
В качестве примера таких бактериоцинов можно привести бактериоцины, относящиеся к подклассу полипептидов, именуемых бактериоцинами против листерий, бактериоцинами класса IIа (Ennahar S. et al., 2000, FEMS Microbiol. Rev., 24: 85-106) и цистибиотиками (Jack R. et al., 1995, Microbiol. Rev., 59(2): 171-200). Недавно сообщалось о возможном применении одного таких бактериоцинов из класса IIа, диверцина V41, для подавления роста Listeria monocytogenes в копченой семге (Duffes F. et al., 1999, J. Food Prot, 62(12): 1394-1403).
Последовательности этих полипептидов имеют большое сходство в N-концевой части, особенно наличие дисульфидного мостика. Гидрофобная С-концевая часть гораздо более вариабельна, хотя для некоторых из этих бактериоцинов, относящихся к типу педиоцинов (педиоцин РА-1, энтероцин А и диверцин V41), характерно наличие отрезка размером более 40 остатков и второго дисульфидного мостика на С-конце.
Авторы настоящего изобретения обнаружили новый бактериоцин класса IIа, получаемый из одного специфического штамма Lactobacillus sakei, который оказался особенно эффективным при подавлении роста Listeria, в частности Listeria monocytogenes.
В соответствии с Tagg J.R. et al., Bacteriol. Rev., 40; 722-756 (1976), термин "бактериоцин" в настоящем изобретении означает полипептид, вырабатываемый путем рибосомного синтеза микроорганизмами, способными специфически подавлять рост других бактерий.
Первым предметом настоящего изобретения является полипептид, происходящий из штамма Lactobacillus sakei 2512, обладающий активностью бактериоцина.
Штамм Lactobacillus sakei 2512 был депонирован 25 мая 2000 г. в Национальной Коллекции Культур Микроорганизмов, где он зарегистрирован под депозитным номером I-2479.
Бактериоцин настоящего изобретения получил наименование сакацин G (Sakacine G). Это полипептид с молекулярной массой порядка 3700-3900, предпочтительно 3834 Да, при определении методом масс-спектрометрии. Он обладает спектром ингибирования бактерий, очень близким спектру бактериоцинов класса IIа. Именно поэтому он оказался особенно эффективным против штаммов Lactobacillus sakei, отличных от Lactobacillus sakei 2512, против Pediococcus cerevisiae, всех штаммов Listeria, против Enterococcus faecalis и durans. И наоборот, он оказался неэффективным против других видов Lactobacillus, например, Lactobacillus delbrueckii, Lactobacillus plantarum, Lactobacillus brevis, Lactobacillus casei и одного штамма Enterococcus faecium.
Подобно бактериоцинам против листерий типа педиоцина, сакацин G имеет в своей пептидной структуре два дисульфидных мостика.
Анализ генетических детерминант у многих бактериоцинов класса IIа показал, что гены, ответственные за их продукцию, транспорт и иммунитет, организованы в виде одной или нескольких структур типа оперонов. Эти опероны зачастую локализованы в плазмидах и обычно включают как минимум два гена, кодирующих белки, гомолог АВС-переносчика и вспомогательный белок, который, по-видимому, участвует в выделении бактериоцина.
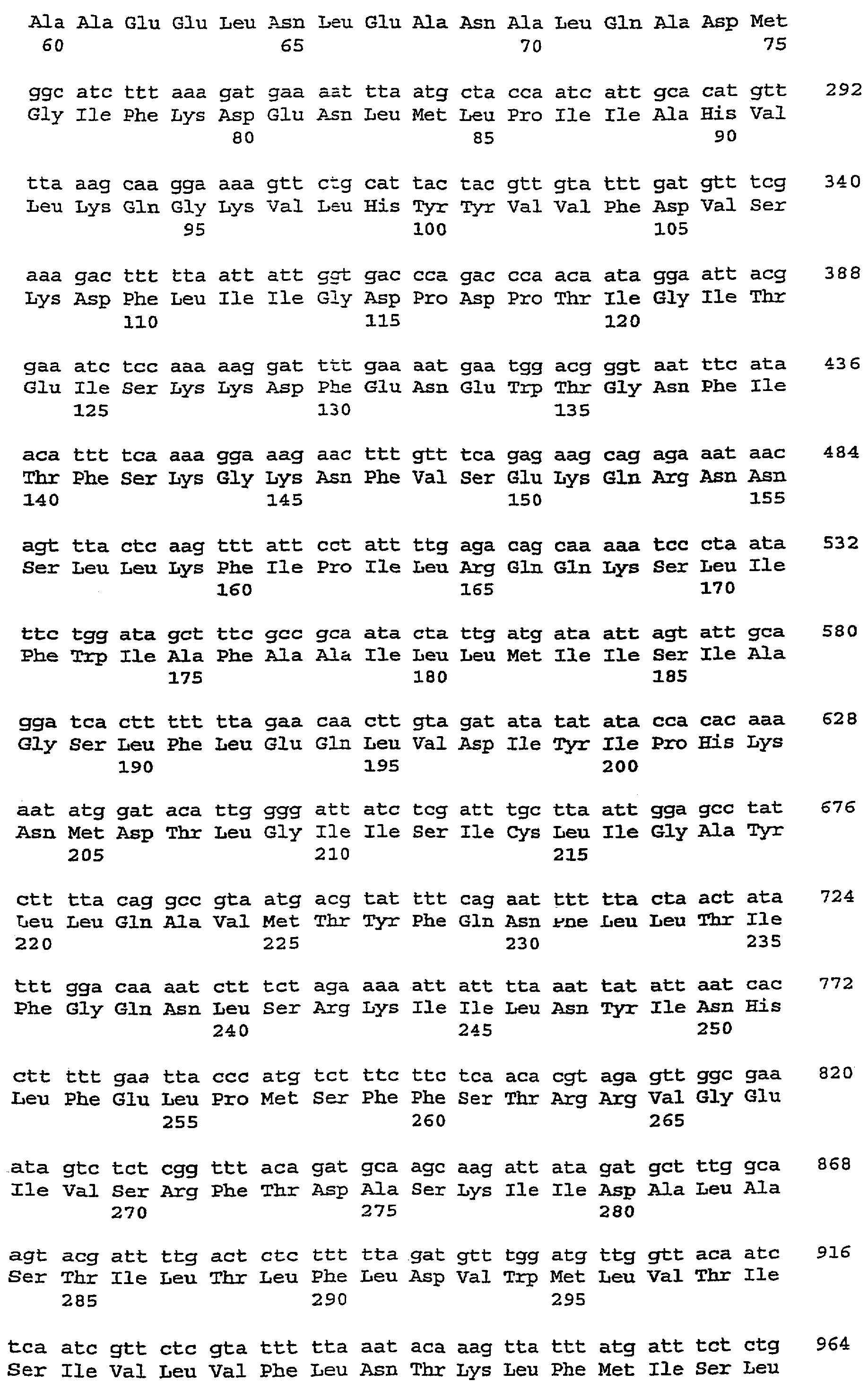
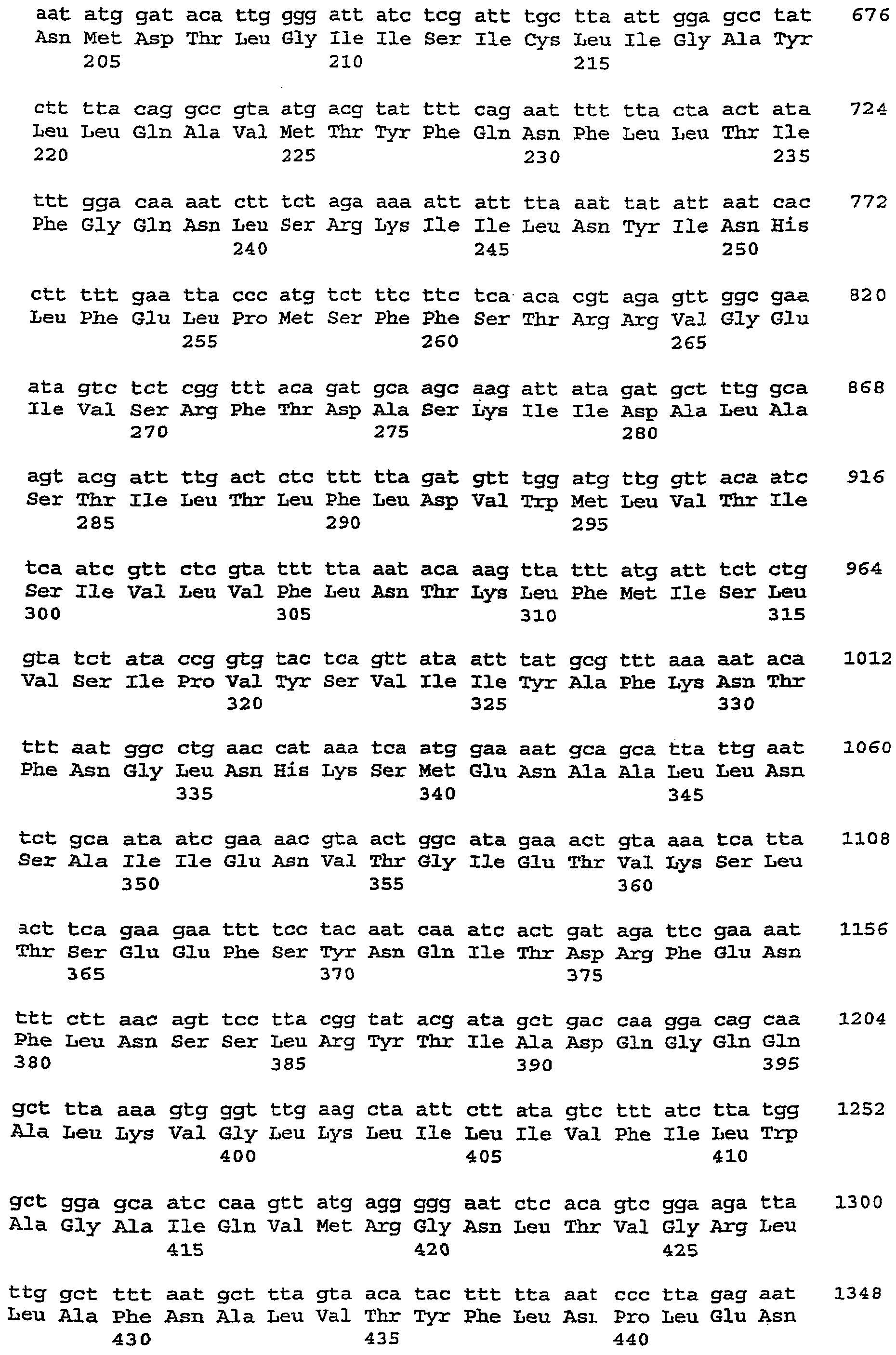
Клонирование нуклеотидного фрагмента, содержащего ген сакацина G, показало существование трех полных открытых рамок считывания skgA1 (SEQ ID № 1), skgA2 (SEQ ID № 3) и skgDc (SEQ ID № 13), включая укороченную рамку считывания skgD (SEQ ID № 7), а также укороченной рамки skgI (SEQ ID № 5), которые схематически представлены на фиг.1. Нуклеотидный фрагмент состоит из двух цепей, одна из которых - нить 5’-3’ приведена в последовательности ID № 15.
Продукты генов skgA1 и skgA2, называемые пребактериоцинами, подвергаются процессу созревания процессингу, при котором их соответствующие лидерные пептиды отщепляются между остатками 18 и 19, освобождая при этом активный сакацин G (остатки 19-55).
5’-3’ цепь нуклеотидного фрагмента, содержащего skgAl, skgA2, skgD и skgI, представлена в SEQ ID № 9.
Предметом настоящего изобретения также является изолированный (выделенный) полипептид, соответствующий бактериоцину, включающий последовательность SEQ ID № 2 и/или SEQ ID № 4. Последовательность зрелого бактериоцина соответствует SEQ ID № 12 и в нее входят последовательности SEQ ID № 2 и № 4.
Открытая рамка считывания skgI кодирует белок из 52 остатков. Сравнение этой последовательности с базами данных показывает большое сходство SkgI с белками иммунитета. Вероятно, она кодирует белок иммунитета, который защищает саму бактерию, продуцирующую сакацин G.
Настоящее изобретение также распространяется на изолированный полипептид, включающий последовательность SEQ ID № 6, соответствующую рамке считывания skgI.
Что касается последнего гена skgDc, то он кодирует белок, имеющий гомологию с белками семейства АВС-переносчиков, в частности, переносчиком педиоцина РА-1. Ген skgDc, вероятно, кодирует АВС-переносчик, специфичный к сакацину G.
Настоящее изобретение также распространяется на изолированный полипептид, включающий последовательность SEQ ID № 8, соответствующую гену skgDc, и на изолированный полипептид, содержащий последовательность SEQ ID № 14, соответствующую гену skgDc.
Предусматривается также, что охватываются и гомологичные последовательности, определяемые как:
i) последовательности, имеющие сходство на уровне не менее 70% с последовательностями SEQ ID № 2, № 4, № 6, № 8, № 12 или № 14,
ii) последовательности, кодируемые нуклеиновыми кислотами, гомологичными тем, которые определены ниже, то есть нуклеиновыми кислотами, гибридизирующимися с последовательностями SEQ ID № 1, № 3, № 5, № 7, № 9, № 13 или № 15, либо с комплементарными им последовательностями, в строгих условиях.
При этом термин "сходство" означает не только полное сходство или тождественность (идентичность) аминокислот сравниваемых гомологичных последовательностей, но и неполное сходство, определяемое как подобие. При установлении сходства между полипептидными последовательностями учитываются консервативные замены, представляющие собой замены аминокислот одного и того же класса: замены аминокислот с незаряженными боковыми цепями (аспарагина, глутамина, серина, треонина, тирозина), аминокислот с основными боковыми цепями (лизина, аргинина, гистидина), аминокислот с кислотньми боковыми цепями (аспарагиновой кислоты, глутаминовой кислоты), аминокислот с неполярными боковыми цепями (глицина, аланина, валина, лейцина, изолейцина, пролина, фенилаланина, метионина, триптофана, цистеина).
В частности, под "гомологичной аминокислотной последовательностью" имеются в виду все аминокислотные последовательности, отличающиеся от последовательности SEQ ID № 2, № 4, № 6, № 8, № 12 или № 14 заменой, делецией и/или вставкой одной аминокислоты или ограниченного числа аминокислот, особенно заменой природных аминокислот искусственными аминокислотами или псевдо-аминокислотами в тех положениях, модификация которых не наносит значительного ущерба биологической активности выделенного полипептида, предпочтительно сакацина G.
Предпочтительно, такая гомологичная аминокислотная последовательность имеет сходство на уровне по меньшей мере 85% с последовательностью SEQ ID № 2, № 4, № 6, № 8, № 12 или № 14, предпочтительно не менее 95%.
Гомологию обычно определяют с помощью программ анализа последовательностей, например, пакета программ для анализа последовательностей из Genetics Computer Group, University of Wisconsin Biotechnology Center, 1710 University Avenue, Madison, WI 53705. Сходные аминокислотные последовательности накладывают (сопоставляют) друг на друга так, чтобы получить максимальную степень гомологии (тождественности или подобия, как определено выше). Для этого может потребоваться введение искусственных пробелов в последовательность. После нахождения оптимального совмещения определяют степень гомологии путем вычисления суммы всех положений, по которым аминокислоты двух сравниваемых последовательностей идентичны, с последующим делением на общее число положений.
Биологическая активность изолированного полипептида, в частности, сакацина G, означает его способность к подавлению роста нежелательных штаммов бактерий и/или патогенов, предпочтительно, бактерий Listeria, более предпочтительно бактерий Listeria monocytogenes.
Предметом настоящего изобретения также является изолированная нуклеиновая кислота, кодирующая определенный выше полипептид.
Точнее, предметом настоящего изобретения является изолированная нуклеиновая кислота, включающая последовательность SEQ ID № 1 и/или SEQ ID № 3.
Была определена полная нуклеотидная последовательность области, участвующей в экспрессии сакацина G (3055 пар оснований, п.о.). Это двухцепочечная ДНК, 5’-3’ цепь которой представлена в SEQ ID № 15. Цепь 3’-5’ представлена на фиг.2. Предметом настоящего изобретения также является нуклеиновая кислота, включающая эту последовательность.
Как указано выше, эта последовательность имеет три полные открытые рамки считывания skgA1, skgA2, skgDc и одну укороченную – skgI. Предполагаемые гены skgA1 (SEQ ID № 1), skgA2 (SEQ ID № 3) и skgI (SEQ ID № 5) ориентированы в обратном направлении относительно skgDc (SEQ ID № 13).
Настоящее изобретение также охватывает нуклеиновую кислоту, включающую последовательность SEQ ID № 5, нуклеиновую кислоту, включающую последовательность SEQ ID № 13, и нуклеиновую кислоту, включающую последовательность SEQ ID № 7.
Предусматривается также, что охватываются и гомологичные последовательности, определяемые как:
i) последовательности, имеющие сходство на уровне не менее 70% с последовательностями SEQ ID № 1, № 3, № 5, № 7, № 9, № 13 или № 15,
ii) последовательности, гибридизирующиеся с последовательностями SEQ ID № 1, № 3, № 5, № 7, № 9, № 13 или № 15 либо с комплементарными им последовательностями, в строгих условиях,
iii) последовательности, кодирующие полипептид, именуемый сакацином G, который определен выше.
Предпочтительно гомологичная последовательность нуклеотидов, по изобретению, имеет сходство на уровне по меньшей мере 75% с последовательностью SEQ ID № 1, № 3, № 5, № 7, № 9, № 13 или № 15, более предпочтительно не менее 85% или не менее 90%.
Предпочтительно, такая гомологичная последовательность нуклеотидов гибридизируется специфически с последовательностями, комплементарными последовательности SEQ ID № 1, № 3, № 5, № 7, № 9, № 13 или № 15, в строгих условиях. Параметры, определяющие условия строгой гибридизации, зависят от температуры, при которой происходит разделение 50% двойных цепей (Тm).
Для последовательностей, содержащих более 30 оснований, Тm определяется по формуле (Sambrook et al., 1989, NY: Cold Spring Harbor Laboratory):
Tm = 81,5+0,41(%G+C)+16,6 log (концентрация катионов) - 0,63 (% формамида)
- (600/число оснований).
Для последовательностей, содержащих менее 30 оснований, Тm определяется по формуле: Тm = 4(G+C) + 2(А+Т).
В соответствующих условиях строгой гибридизации, при которых неспецифические последовательности не гибридизируются, температура гибридизации предпочтительно на 5-10°С ниже Тm, а в качестве буфера, предпочтительно, применяются растворы высокой ионной силы, например, раствор 6×SSC.
Термин "сходные последовательности", использовавшийся выше, означает не только полное сходство или тождественность (идентичность) сравниваемых нуклеотидов, но и неполное сходство, определяемое как подобие. При установлении сходства между полипептидными последовательностями учитываются, к примеру, пурины и пиримидины.
Гомологичные последовательности нуклеотидов с открытыми рамками считывания, приведенные в SEQ ID № 1, № 3, № 5, № 7, № 9, № 13 или № 15, также включают все последовательности нуклеотидов, отличающиеся от последовательности SEQ ID № 2, № 4, № 6, № 8, № 12 или № 14 мутацией, вставкой, делецией и/или заменой одного или нескольких оснований, либо вырожденностью генетического кода, если только они кодируют полипептид, обладающий биологической активностью сакацина G, как определено ниже.
К таким гомологичным последовательностям относятся и последовательности генов из других бактерий, чем Lactobacillus, кодирующие сакацин G.
Полипептиды настоящего изобретения могут быть синтезированы любыми методами, хорошо известными в этой области. Полипептиды, по изобретению, например, можно синтезировать методами химического синтеза, например, с помощью синтеза по Merrifield, который предпочтителен по причине чистоты, антигенной специфичности, отсутствия нежелательных вторичных продуктов, а также легкости получения целевого продукта.
Предметом настоящего изобретения также является способ получения рекомбинантного полипептида, в котором вектор, включающий нуклеиновую кислоту по настоящему изобретению, вводится в клетки хозяина, которые культивируют в условиях, обеспечивающих экспрессию полипептида по настоящему изобретению или полипептида, кодируемого нуклеиновой кислотой по настоящему изобретению.
Рекомбинантный бактериоцин также можно получить способом, в котором вектор, несущий нуклеиновую кислоту, включающую последовательность нуклеотидов, согласно изобретению, предпочтительно, последовательность SEQ ID № 1 и/или № 3, либо гомологичную последовательность, вводится в клетки хозяина, которые культивируют в условиях, обеспечивающих экспрессию соответствующего полипептида. Образовавшийся белок можно затем выделить и очистить. Применяются способы очистки, известные в этой области. Полученный рекомбинантный полипептид может быть очищен, исходя из лизатов и экстрактов клеток, из супернатанта культуральной жидкости, применяя такие методы или их комбинации, как фракционирование, хроматографические методы, иммуноаффинные методы с помощью специфических моно- или поликлональных антител и т.д.
Последовательность данной нуклеиновой кислоты, кодирующей сакацин G, можно встроить в экспрессирующий вектор, в котором она встраивается функциональным образом, вместе с элементами, позволяющими регулировать ее экспрессию, такими как промоторы, активаторы и/или терминаторы транскрипции. Элементы, контролирующие экспрессию последовательностей нуклеотидов (промоторы, активаторы, последовательности терминации...), выбирают в зависимости от клеток хозяина. Для этого последовательности нуклеотидов по изобретению можно встроить в вектор, реплицирующийся автономно в организме выбранного хозяина, или вектор, встраивающийся в геном хозяина. Такие векторы получают методами, применяемыми в настоящее время в этой области техники, и полученные при этом клоны вводят соответствующему хозяину стандартными методами, например, путем электропорации или осаждения фосфатом кальция.
Векторы для клонирования и/или экспрессии как те, что описаны выше, включающие последовательность нуклеотидов по настоящему изобретению, также являются составной частью настоящего изобретения.
Предметом изобретения также являются клетки хозяина, временно или стабильно трансформированные этими экспрессирующими векторами. Эти клетки можно получить путем введения в клетки хозяина, предпочтительно прокариотические, последовательности нуклеотидов, встроенной в вектор, описанный выше, и культивирования этих клеток в условиях, обеспечивающих репликацию и/или экспрессию введенной последовательности нуклеотидов.
Примеры клеток хозяина включают такие бактерии, как Lactococcus, Lactobacillus, Leuconostoc, Streptococcus, Pediococcus, Escherichia, а также дрожжи.
Последовательности нуклеотидов по изобретению могут быть как искусственного, так и не искусственного происхождения. Это последовательности ДНК или РНК, полученные при скринировании библиотек с помощью зондов, разработанных на основе последовательностей SEQ ID № 1, № 3, № 5, № 7, № 9, № 13 и/или № 15. Такие библиотеки можно получить классическими методами молекулярной биологии, известными в этой области.
Последовательности нуклеотидов по изобретению также можно получить путем химического синтеза или с применением смешанных методов, включающих химическую или энзиматическую модификацию последовательностей, полученных при скринировании библиотек.
Настоящее изобретение также предусматривает способ подавления роста Listeria, особенно Listeria monocytogenes, в условиях, связанных или не связанных с продуктами питания, которые могут быть заражены Listeria monocytogenes.
Listeria monocytogenes - это патогенный микроорганизм, который приводит к возникновению тяжелых заболеваний у человека и животных, которые могут легко распространяться через зараженные продукты, в частности, через мясо, мясопродукты, морские продукты, молоко и молочные продукты. Настоящее изобретение предусматривает способ подавления роста Listeria monocytogenes в продуктах питания, которые могут содержать Listeria monocytogenes в качестве загрязнения, при этом способ включает добавление полипептида по изобретению в данный продукт в количестве, достаточном для подавления роста Listeria monocytogenes.
Бактериоцины, согласно изобретению, применяются во всех пищевых системах предпочтительно в количестве от 1 до 100000 условных единиц (УЕ) бактериоцина на 1 г пищевого продукта.
Условная единица бактериоцина определяется как 5 мкл самого большого разведения супернатанта из культуральной жидкости, вызывающего образование определенной зоны подавления роста в отношении контрольного штамма одной из грамположительных бактерий на агаризованной среде.
Хотя продукты питания и наиболее подвержены заражению Listeria monocytogenes, однако ветеринарные и медицинские препараты тоже могут подвергаться заражению такими бактериями, равно как и косметические и родственные им изделия.
Бактериоцины по настоящему изобретению, в частности, сакацин G, также полезны для подавления роста таких патогенов в этих продуктах.
Таким образом, предметом настоящего изобретения является и применение бактериоцинов по настоящему изобретению в качестве активного средства против патогенной или нежелательной флоры, особенно при изготовлении продуктов питания, точнее, для подавления роста и размножения Listeria, особенно Listeria monocytogenes, в продуктах питания.
Полипептид может либо вводиться сам в продукты питания, либо вырабатываться в них штаммом Lactobacillus sakei 2512.
Таким образом, предметом настоящего изобретения является и применение штамма Lactobacillus sakei 2512 в продуктах питания для выработки в них полипептида бактериоцина, согласно изобретению.
Изобретение также касается композиции бактериоцина, включающей, по меньшей мере, один полипептид по настоящему изобретению, то есть, происходящий из штамма Lactobacillus sakei 2512 или включающий последовательность SEQ ID № 2, или № 4, или № 12, или № 14, либо штамм Lactobacillus sakei 2512.
Изобретение также распространяется на применение штамма Lactobacillus sakei 2512 в целях продукции полипептида, определенного выше, для подавления роста и размножения Listeria, особенно Listeria monocytogenes, в продуктах питания, а также композиций, содержащих этот штамм.
Нижеследующие примеры и фигуры приводятся в качестве иллюстрации, а не для ограничения предмета настоящего изобретения.
Перечень фигур
Фиг. 1. Схематическое представление генетического локуса, участвующего в продукции сакацина G.
Фиг. 2. Комплементарная нить 3’-5’, соответствующая полной нуклеотидной последовательности той области, что участвует в экспрессии сакацина G, у которой нить 5’-3’ представлена в SEQ ID № 15.
Сведения, подтверждающие возможность осуществления изобретения
Материалы и методы
- Бактериальные штаммы и культуральные среды. Lactobacillus sakei 2512 культивировали при 30°С в среде MRS (DIFCO Laboratories), стерилизованной 12 мин при 110°С. Индикаторные штаммы культивировали в среде BHI ("brain-heart infusion", DIFCO Laboratories) при 37°С.
- Измерение активности. В агаризованную (10 г/л) среду BHI инокулировали 1% стационарной культуры индикаторного штамма, а затем разливали в чашки Петри. В лунки, проделанные в застывающем агаре с помощью пробойника, вносили по 50 мкл раствора сакацина G. Активность бактериоцина выражалась в появлении зон подавления роста вокруг лунок после инкубации в течение ночи при 37°С.
- Анализ белка. Сакацин G анализировали методом масс-спектрометрии на приборе Sciex API 165 фирмы Perkin-Elmer, снабженном ионизатором типа lonspray. После лиофилизации активные фракции растворяли в смеси ацетонитрил/вода (1:1), содержащей 0,1% муравьиной кислоты, а затем вводили в прибор посредством инфузии со скоростью 5 мкл/мин.
Концентрацию белка определяли методом бицинхониновой кислоты с помощью набора ВСА (Sigma), согласно инструкциям производителя.
Сравнение белковых последовательностей осуществляли с помощью программы BLAST (1), полученной от ExPASY Швейцарского Института Биоинформатики.
- Молекулярное клонирование и трансформация. Плазмиды экстрагировали и выделяли из штаммов Escherichia coli и Lactobacillus sakei 2512 в соответствии с методами, описанными ранее Sambrook et al., 1989, NY: Cold Spring Harbor Laboratory, и Muriana et Klaenhammer, 1987, Appl. Environ. Microbiol, 53: 553-560, соответственно.
Рестрикционные ферменты и ферменты для модификации ДНК применяли согласно инструкциям поставщика (Gibco-BRL). Аналитический и препаративный гель-электрофорез в агарозе проводили в буфере трис/борат/ЭДТА (рН 8,3) согласно методам, описанным в Sambrook et al., 1989, NY: Cold Spring Harbor Laboratory. Расщепленные фрагменты ДНК выделяли из агарозных гелей с помощью набора "Prep-a-Gene" (Bio-Rad). Клонирование в плазмиды pGEM-T (Promega) и pZERO2 (Invitrogen) осуществляли в соответствии с рекомендациями поставщиков. Southern-гибридизацию проводили путем переноса на нейлоновую мембрану (Hybond-N+, Amersham), согласно Sambrook et al., 1989, NY: Cold Spring Harbor Laboratory. После переноса проводили гибридизацию с радиоактивным зондом, меченным32P с помощью набора "для мечения ДНК в системе из случайных праймеров" (Gibco-BRL). Компетентные клетки бактерий Е. coli получали и их трансформацию проводили методом Hanahan, 1983, J. Mol. Biol., 166, 557-80.
Taq-полимеразу (Gibco-BRL) использовали согласно рекомендациям поставщика.
Амплификацию фрагмента ДНК, кодирующего сакацин G, осуществляли с помощью прибора Geneamp 9700® (Perkin-Elmer) при следующих условиях: 35 циклов, состоящих из денатурации при 94°С в течение 30 сек, гибридизации при 45°С в течение 30 с и удлинения цепи при 72°С в течение 1 мин, после чего еще один цикл удлинения цепи при 72°С в течение 5 мин.
Фрагмент ДНК, несущий локус сакацина G, секвенировали с помощью автоматического секвенатора ABI Prism 310® (Perkin-Elmer) с применением набора для секвенирования "Big-dye terminator®" (Perkin-Elmer) и соответствующих праймеров.
Пример 1
Выделение и очистка сакацина G
16-часовую культуру Lactobacillus sakei 2512 (100 мл) центрифугировали 15 мин при 6000g. Отбирали супернатант и нагревали при 70°С в течение 20 мин. Супернатант охлаждали и разбавляли 1 объемом воды (после разбавления значение рН должно быть меньше 6, при необходимости следует добавить 1 М НСl), а затем пропускали через колонку (2,5×18 см), заполненную катионообменной смолой (карбоксиметилцеллюлозой: Cellufine C-200, Amicon), уравновешенной водой. После промывки сначала водой (100 мл), а затем 0,1 М раствором NaCl (150 мл), сакацин G элюировали 0,5 М раствором NaCI (200 мл). Значение рН всех растворов должно быть меньше 6. После этого активную фракцию наносили на картридж для твердофазной экстракции (Sep-pak plus C18, Waters), уравновешенный водой. После последовательной промывки 20 мМ растворами ацетата аммония (5 мл), содержащими 0, 10, 20 и 30% ацетонитрила, сакацин G элюировали 10 мл 20 мМ раствора ацетата аммония, содержащего 80% ацетонитрила. После лиофилизации экстракт растворяли в 1 мл 40% водного раствора ацетонитрила, а затем через инжектор наносили на аналитическую колонку С8 HPLC с обратной фазой (Kromasil, 5 μm, 100 Å, 4,6×250 мм, A.I.T.). HPLC проводили на установке, состоящей из насоса Perkin-Elmer серии 200 LC, подсоединенного к детектору Perkin-Elmer 785A. Регистрировали поглощение при 220 нм. Разделение проводили со скоростью 0,8 мл/мин, используя градиент из следующих растворителей: А = вода/0,1% трифторуксусной кислоты; В = ацетонитрил/вода/0,07% трифторуксусной кислоты. После промывки в течение 5 мин 20%-м раствором В проводили элюирование градиентом 20-40% раствора В за 10 мин и 40-55% раствора В за 20 мин.
Фракцию, соответствующую пику на 23 мин, которая оказалась активной против Listeria ivanovii BUG 496, анализировали методом масс-спектрометрии с ионизацией типа "ionspray". Выделенный продукт обладал чистотой не менее 95% и молекулярной массой 3834,32±0,31 Д. Количество очищенного сакацина G составляло в 120 мкг на 100 мл культуры. Выход при очистке составлял 55% от общей активности. Часть первичной последовательности сакацина G установили методом микросеквенирования, и на основе этой последовательности были разработаны два вырожденных олигонуклеотида.
Пример 2
Клонирование генетического локуса, участвующего в продукции сакацина G
На основе генетического кода были синтезированы два вырожденных олигонуклеотида: SakG01 (5’-AARTTATTATGGNAAYGGNGT-3’) (SEQ ID № 10) и SakG02S (5’-ACATGATGNCCNCCRTTNGC-3’ (SEQ ID № 11) для того, чтобы амплифицировать фрагмент ДНК, соответствующий структурному гену зрелого сакацина G (SEQ ID № 15) методом полимеризационной цепной реакции (ПЦР). Продукт амплификации размером около 100 п.о. клонировали в плазмиду pGEM-T, получая плазмиду pJMBYC01. Рестрикционный фрагмент PvuII длиной 560 п.о. из pJMBYC01, содержащий вставленный фрагмент, служил зондом при проведении Southern-гибридизации для локализации структурного гена в геноме Lactobacillus sakei 2512. В плазмидном экстракте из Lb. sakei 2512, обработанном рестрикционными ферментами HindIII и EcoRI, зонд обнаружил фрагменты размером около 2,1 и 9 т.п.о., соответственно. Фрагмент HindIII в 2,1 т.п.о. был очищен и встроен в вектор pZER02, полученную плазмиду назвали pJMBYC02. Присутствие структурного гена сакацина G в pJMBYC02 было подтверждено при ПЦР-амплификации с праймерами SakG01 и SakG02S, а также секвенировании ДНК фрагмента, встроенного в pJMBYC02. Такая же стратегия применялась и для определения полной последовательности гена skgD. Плазмидный экстракт Lb. sakei 2512 расщепляли Xbal. Продукт расщепления встраивали в плазмиду pBluescript SK+. Клоны, содержащие нужную последовательность, определяли с помощью радиоактивного зонда, полученного из плазмиды pJMBYC02 методом ПЦР с помощью олигонуклеотидов SakG03 (5’-CCTTGGTCAGGCTATCG-3’) (SEQ ID № 16) и SakG04 (5’-ATCACCTTTTTGAATTACCC-3’) (SEQ ID № 17).
Анализ полной нуклеотидной последовательности этой области (3051 п. о.) показал наличие трех полных открытых рамок считывания skgA1, skgA2, skgDc и одной укороченной, skgI. Предполагаемые гены skgA1, skgA2 и skgI ориентированы в обратном направлении относительно skgD.
Перед каждой из открытых рамок считывания находится потенциальный сайт связывания с рибосомами. Оба гена skgA1 и skgA2 кодируют белки из 55 аминокислотных остатков, из которых остатки 19-55 абсолютно идентичны. Отрезок 19-52 соответствует последовательности сакацина G, полученной при микросеквенировании. Следует отметить наличие 4 остатков цистеина в положениях 9, 14, 24 и на С-конце. Кроме того, расчетная молекулярная масса этого пептида равна 3838,2 Д и отличается от измеренной молекулярной массы (3834,32 Д) на 4 Д, что указывает на наличие двух дисульфидных мостиков в сакацине G, как это уже показано для других бактериоцинов против листерий.
Фрагмент 1-18 белков SkgA1 и SkgA2 отличаются только по 3 остаткам и имеют сильную гомологию с "лидерными" пептидами бактериоцинов класса II, которые участвуют в транспорте этих пептидов специфичными АВС-переносчиками. В частности, для этих "лидеров" характерны концевые мотивы GG, входящие в сайт созревания таких бактериоцинов. Сравнение нуклеотидных последовательностей генов skgA1 и skgA2 также показывает тождественность последовательностей на уровне более 95% в той части генов, которая кодирует зрелый бактериоцин.
Неполная открытая рамка считывания skgI кодирует белок из 52 остатков. Сравнение этой последовательности с различными базами данных показывает сильную гомологию SkgI с белками иммунитета Lcc и Mesl. Было показано участие MesI в защите от мезентерицина Y105. Можно полагать, что skgI кодирует белок иммунитета к сакацину G.
Последний ген skgDc кодирует белок из 727 аминокислот. Согласно базам данных, SkgDc обладает большой гомологией с белками семейства АВС-переносчиков, в частности, переносчиками педиоцина РА-1 PedD и PapD (Marugg et al., 1992, Appl. Environ. Microbiol. 58, 2360-7; Motlagh et al., 1994, Lett. Appl. Microbiol. 18, 305-12), сакацина Р-SppT (Huhne et al., 1996, Microbiology 142, 1437-48), сакацина А-SapT (Axelsson and Holck, 1995, J. Bacteriol. 177, 2125-37) и мезентерицина Y105-MesD (Fremaux et al., 1995, Microbiology 141,1637-45).
Пример 3
Спектр подавления роста
Тестировали чувствительность к сакацину G у 17 штаммов бактерий методом тестирования в лунках (см. Материалы и Методы). Результаты представлены ниже в таблице 1.
Спектр подавления роста у этого бактериоцина молочнокислых бактерий представляется достаточно узким и ограничивается штаммами Lactobacillus sakei и Pediococcus cerevisiae. Этот пептид, как и другие бактериоцины класса IIа, представляется активным против всех исследованных штаммов Listeria, а также против Enterococcus faecalis и durans, но не против Enterococcus faecium.












Реферат
Изобретение относится к биотехнологии и может быть использовано для сохранения пищевых продуктов. Бактериоцин сакацин G представляет собой полипептид, выделенный из lactobacillus sakei 2512, депонированный в Национальной коллекции клеточных культур под N I-2479, и способен подавлять рост и размножение листерий. Сакацин G имеет определенную аминокислотную последовательность, представленную в описании. Описана нуклеотидная последовательность, кодирующая полипептид сакацин G. Описан также вектор, включающий нуклеотидную последовательность, для клонирования и/или экспрессии полипептида, например, в трансформированных клетках, выбранных из Lactococcus, Lactobacillus и др. Разработан способ получения рекомбинантного полипептида. Бактериоцин сакацин G или штамм 2512 используют в составе бактерицидной композиции, обладающей способностью подавлять рост Гр+ патогенных бактерий, в частности, Listeria monocytogenes. Изобретение обеспечивает промышленное применение бактериоцина против патогенной или нежелательной флоры при изготовлении продуктов питания. 6 н. и 7 з.п. ф-лы, 2 ил., 1 табл.

Комментарии