Каскадные полимерные комплексы, исходные соединения и фармацевтическая композиция - RU2166501C2
Код документа: RU2166501C2
Чертежи


Описание
Изобретение относится к предмету, охарактеризованному в формуле изобретения, т. е. к каскадным полимерным комплексам, к средствам, содержащим эти соединения, применению комплексов в диагностике и терапии, а также получению этих соединений и средств.
Применяемые в медицине в настоящее время контрастные вещества для современных способов, формирующих изображение, ЯМР-томографии (MRI) и компьютерной томографии (CT) [Magnevist®, ProHance®, Ultravist® и

Внеклеточные MRI-контрастные вещества были впервые успешно применены при диагностике церебральных и спинномозговых заболеваний, так как при этом возникает совершенно особая ситуация в отношении регионального пространства распределения. В головном и спинном мозге внеклеточные контрастные вещества в здоровой ткани не могут покидать внутрисосудистое пространство вследствие гематоэнцефалического барьера. В случае болезненных процессов с нарушением гематоэнцефалического барьера (например, злокачественных опухолей, воспалений, демиелинизированных заболеваний и т.д.) внутри мозга возникают области с повышенной проницаемостью кровеносных сосудов для этих внеклеточных контрастных веществ (Schmiedl et al., MRI of blood-brain barrier permeability in astrocytic glomas: application of small and large molecular weight contrast media, Magn. Reson. Med. 22: 288, 1991). Это нарушение проницаемости сосудов позволяет отличать больную ткань с высокой контрастностью от здоровой ткани.
Однако вне головного и спинного мозга такой барьер проницаемости для вышеуказанных контрастных веществ отсутствует (Canty et al., First-pass entry of nonionic contrast agent into the myocarbial extravascular space. Effects on radiographic estimate of transit time and blood volume. Circulation 84: 2071, 1991). Вследствие этого накопление контрастного вещества зависит уже не от проницаемости сосуда, а лишь от величины внеклеточного пространства в соответствующей ткани. Отграничение сосудов от окружающего межуточного пространства при применении этих контрастных веществ невозможно.
Особенно для изображения сосудов было бы интересно контрастное вещество, которое распределяется исключительно в сосудистом пространстве. Такой агент кровяного депо должен позволить отграничивать с помощью ЯМР-томографии ткань, хорошо снабжаемую кровью, от ткани, плохо снабжаемой кровью, и тем самым диагностировать ишемию. При применении сосудистого контрастного вещества можно было бы отграничить также и инфарцированную ткань вследствие ее анемии от окружающей здоровой или ишемической ткани. Это имеет особое значение, если, например, нужно отличить инфаркт миокарда от ишемии.
До сих пор большинство пациентов с подозрением на сердечно-сосудистое заболевание (а это заболевание является наиболее частой причиной смерти в западных индустриальных странах) должны подвергаться инвазивным диагностическим исследованиям. В ангиографии в настоящее время применяется прежде всего рентгенодиагностика с помощью йодсодержащих контрастных веществ. Эти исследования обладают различными недостатками: они связаны с риском лучевой нагрузки, а также с неприятностями и нагрузками, которые прежде всего обусловлены тем, что йодсодержащие контрастные вещества в сравнении с ЯМР-контрастными веществами должны применяться в гораздо более высоких концентрациях.
Поэтому существует потребность в ЯМР-контрастных веществах, способных маркировать сосудистое пространство (агенты кровяного депо). Эти соединения должны отличаться хорошей переносимостью и высокой действенностью (сильное увеличение интенсивности сигнала при ЯМР-томографии).
Попытки по меньшей мере частичного решения этих проблем путем применения комплексообразователей, которые связывают макро- или биомолекулы, имели до сих пор лишь ограниченный успех.
Так, например, число парамагнитных центров в комплексах, описанных в заявках на европейский патент N 0088695 и N 0150844, недостаточно для удовлетворительного формирования изображения.
При увеличении числа необходимых ионов металла путем многократного введения комплексообразующих единиц в макробиомолекулу сродство и/или специфичность этой биомолекулы ухудшается до недопустимо низкого уровня [J. Nucl. Med. 24, 1158 (1983)].
В принципе макромолекулы могут быть пригодны в качестве контрастных веществ для ангиографии. Однако альбумин-GdDTPA (Radiology 1987; 162: 205), например, за 24 часа после внутривенной инъекции крысе накапливается в печеночной ткани в количестве, составляющем почти 30% дозы. Кроме того, за 24 часа выводится лишь 20% дозы.
Макромолекула полилизин-GdDTPA (заявка на европейский патент, N 0233610) оказалось также пригодной в качестве агента кровяного депо. Однако из-за условий получения это соединение состоит из смеси молекул различной величины. В опытах на крысе по выделению этого соединения из организма удалось показать, что эта макромолекула выводится в неизменном виде через почку в результате гломерулярной фильтрации. Но полилизин-GdDTPA также может содержать, из-за условий его синтеза, макромолекулы, которые настолько большие, что они при гломерулярной фильтрации не могут пройти через капилляры почки и поэтому остаются в организме.
Описаны также и макромолекулярные контрастные вещества на основе гидроокиси углеводов, например декстрана (заявка на европейский патент, публикация N 0326226). Недостаток этих соединений состоит в том, что они, как правило, содержат лишь около 5% парамагнитных катионов, усиливающих сигнал.
Описанные в заявке на европейский патент N 0430863, а также в выложенной заявке на германский патент DE 4344460 полимеры уже представляют собой шаг на пути к агентам кровяного депо, так как они не имеют характерной дня вышеупомянутых полимеров неоднородности в отношении размера и молекулярной массы. Тем не менее они, подобно описанным Винером и др. в одной публикации в "Magnetic Resonance in Medicine" от января 1994 года (стр. 1-8) соединениям, все еще оставляют желать лучшего относительно полного выделения, переносимости и/или действенности.
Поэтому задачей настоящего изобретения являются новые диагностические вещества прежде всего для распознавания и локализации болезней сосудов, не имеющие указанных недостатков. Поставленная задача решается с помощью настоящего изобретения.
Неожиданным образом было установлено, что комплексы, состоящие из азотсодержащих каскадных полимеров с комплексообразующими лигандами, по меньшей мере 16 ионов одного элемента порядковых номеров 20-29, 39, 42, 44 или 57-83, а также при необходимости катионов неорганических и/или органических оснований, аминокислот или амидов аминокислот и содержащие при необходимости ацилированные аминогруппы, пригодны для получения ЯМР- и рентгеновских диагностических средств, при этом они не имеют названных недостатков.
Комплексообразующие каскадные полимеры согласно изобретению могут быть описаны общей формулой I
A-{X-[Y-(Z-
в которой обозначают: A - азотсодержащее каскадное ядро основной мультиплетности a,
X и Y - независимо друг от друга простую связь или повторяющееся в
каскаде звено повторяющейся мультиплетности x или соответственно y,
Z и W - независимо друг от друга повторяющееся звено каскада повторяющейся мультиплетности z, соответственно w,
K
- остаток комплексообразователя,
a - цифры от 2 до 12,
x, y, z и w - независимо друг от друга цифры от 1 до 4,
при условии, что по меньшей мере два повторяющихся звена
различны и для произведения мультиплетностей справедливо 16 ≅ a•x•y•z•w ≅ 64.
В качестве каскадного ядра A пригодны:
атом азота,





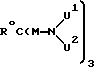


в которых обозначают: m и n - цифры от 1 до 10,
p - цифры от 0 до 10,
U1 обозначает Q1 или E,
U2 обозначает Q1 или E, причем E имеет значение группы

в которой обозначают: o - цифры от 1 до 6,
Q1 - атом водорода или Q2 и
Q2 - прямую связь,
M - C1-C10-алкиленовую цепь, при необходимости прерванную 1-3 атомами кислорода и/или при необходимости замещенную 1-2 оксигруппами,
R0 - разветвленный или линейный C1-C10-алкильный остаток, нитро- амино-, карбоксильную группу или

причем число Q2 соответствует основной мультиплетности a.
Простейший случай каскадного ядра представляет атом азота, три связи которого (основная мультиплетность a = 3) в первом "внутреннем слое (генерация) заняты тремя воспроизводимыми звеньями X, соответственно Y (если X обозначает прямую связь), соответственно Z (если X и Y каждый обозначает прямую связь); иными словами: три водородных атома аммиака, т.е. лежащего в основе инициирования каскада A(H)a = NH3, замещены тремя повторяющимися звеньями X, соответственно Y, соответственно Z. Содержащееся в каскадном ядре A число Q2 отражает при этом основную мультиплетность a.
Повторяющиеся звенья X, Y, Z и W содержат -NQ1Q2-группы, в которых Q1 обозначает атом водорода или Q1 и Q2 обозначают прямую связь. Содержащееся в соответствующем воспроизводимом звене (например, X) число Q2 соответствует воспроизводимой мультиплетности этого звена (например, x в случае X). Произведение a• x•y•z•w всех мультиплетностей указывает число связанных в каскадном полимере остатков K комплексообразователя. Полимеры согласно изобретению содержат минимально 16 и максимально 64 остатка K в молекуле, которые могут связывать соответственно от одного до максимально трех (в случае двухвалентных ионов), предпочтительно один ион элемента вышеназванных порядковых номеров.
Последняя генерация, т.е. связанная с остатками K комплексообразователя воспроизводимая единица W, связана с K через NH-группы (-NQ1Q2 с Q1 в значении атома водорода и Q2 в значении простой связи), в то время как предшествующие воспроизводимые звенья могут быть связаны друг с другом как через NHQ2-группы (например, в результате реакций ацилирования), так и через NQ2Q2-группы (например, в результате реакций алкилирования).
Каскадные полимерные комплексы согласно изобретению имеют максимально 10 генераций (т. е. молекула также может содержать более одной из соответствующих воспроизводимых звеньев X, Y и Z), предпочтительно, однако, от 2 до 4 генераций, причем по меньшей мере два воспроизводимых звена в молекуле являются различными.
Предпочтительными каскадными ядрами A являются такие, которые подпадают под вышеприведенные общие формулы, в которых
обозначают:
m - цифры 1-3, особо предпочтительно цифру 1,
n - цифры 1-3, особо предпочтительно цифру 1,
p - цифры 0-3, особо предпочтительно цифру 1,
o - цифру 1,
M - группу -CH2-, -CO- или -CH2CO- и
R0 - группу - CH2NU1U2-CH3- или NO2.
В
качестве других предпочтительных каскадных инициаторов A(H)a следует, например, назвать (в скобках указана основная мультиплетность "a" для случая последующего моно- и дизамещения,
служащего для построения очередной генерации):
трис(аминоэтил)амин (a = 6, соответственно 3);
трис(аминопропил)амин (a = 6, соответственно 3);
диэтилентриамин (a = 5,
соответственно 3);
триэтилентетрамин (a = 6, соответственно 4);
тетраэтиленпентамин (a = 7, соответственно 5);
1,3,5-трис(аминометил)бензол (a = 6, соответственно 3);
триамид тримезиновой кислоты (a = 6, соответственно 3);
1,4,7-триазациклононан (a = 3);
1,4,7,10-тетраазациклододекан (a = 4);
1,4,7,10,13-пентаазациклопентадекан (a =
5);
1,4,8,11-тетраазациклотетрадекан (a = 4);
1,4,7,10,13,16-гексаазациклооктадекан (a = 6);
1,4,7,10,13,16,19,22,25,28-декаазациклотриаконтан (a = 10);
тетеракис(аминометил)метан (a = 8, соответственно 4);
1,1,1-трис(аминометил)этан (a = 6, соответственно 3);
трис(аминопропил)нитрометан (a = 6, соответственно 3);
2,4,
6-триамино-1,3,5-триазин (a = 6, соответственно 3);
амид 1,3,5,7-адамантатантетракарбоновой кислоты (a = 8, соответственно 4);
амид 3,3',5,5'-дифенилового эфира тетракарбоновой
кислоты (a = 8, соответственно 4);
амид 1,2-бис[феноксиэтан]-3',3'',5',5''-тетракарбоновой кислоты (a = 8, соответственно 4);
1,4,7,10,13,16,21,24-октаазабицикло[8.8.8]гексакозан (a
= 6).
Следует указать на то, что определение A в качестве каскадного ядра и, следовательно, разделение каскадного ядра и первой воспроизводимой единицы может быть выбрано чисто
формально и тем самым независимо от действительной синтетической структуры желательных каскадных полимерных комплексов. Так, например, можно рассматривать применяемый в примере 4 трис(аминоэтил)амин
как каскадное ядро (сравни первую указанную для A общую формулу, в которой m = n = p = 1, U1 = E, где "o" имеет значение цифры 1 и U1 = U2 = Q2), но также и
как атом азота (=каскадное ядро A), который имеет в качестве первой генерации три воспроизводимые звенья:

(сравни определение E).
Каскадовоспроизводимые звенья X, Y, Z и W определяют независимо друг от друга через E



в которых обозначают U1 обозначает Q1 или E,
U2 обозначает Q2 или E, причем E имеет значение группы
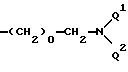
где обозначают: o - цифры от 1 до 6,
Q1 - атом водорода или Q2,
Q2 - прямую связь,
U3 - C1-C20-алкиленовую цепь, при необходимости прерванную 1-10 атомами кислорода и/или от 1 до 2 -N(CO)q-R2-, 1-2 фениленовыми и/или 1-2 фениленокси-остатками и/или при необходимости замещенную 1-2 оксо, тиоксо-, карбокси-, C1-C5-алкилкарбокси-, C1-C5-алкокси-, гидрокси-, C1-C5-алкильными группами
причем обозначают:
q - цифры 0 или 1 и
R2 - атом водорода, метиловый или этиловый остаток, при необходимости замещенный 1-2 гидроксигруппами или 1 карбоксигруппой,
L атом водорода или группу

V метиленовую группу

V группу
если U4 и U5 одновременно идентичны и обозначают прямую связь или группу M.
Предпочтительными повторяющимися в каскаде звеньями, X, Y, Z u W являются такие
звенья, у которых в вышеназванных общих формулах
остаток U3 обозначает
-CO-, -COCH2OCH2CO-, -COCH2-, -CH2CH2-,
-CONHC6H4-, -COCH2CH2CO-, -COCH2-CH2CH2CO-, -COCH2CH2CH2CH2CO-,
остаток U4 обозначает прямую связь, -CH2CO-,
остаток U5 обозначает прямую связь -(CH2)4-, -CH2CO-, -CH(COOH)-, CH2
OCH2CH2-, -CH2C6H4-, CH2-C6H4OCH2CH2-
остаток E обозначает группу

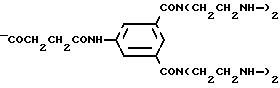
Примеры названных воспроизводимые звенья каскада X, Z и W включают:
-CH2CH2 NH-; -CH2CH2N<;
-COCH(NH-)(CH2)4NH-;
-COCH(N<)(CH2)4N<;
-COCH2OCH2CON(CH2CH2NH-)2;
-COCH2OCH2CON(CH2CH2N<)2,
-COCH2N(CH2 CH2NH-)2;
-COCH2N(CH2CH2N<)2;
-COCH2NH-; -COCH2N<;
-COCH2 CH2CON(CH2CH2NH-)2;
-COCH2CH2CON(CH2CH2N<)2;
-COCH2OCH2 CONH-C6H4- CH[CH2CON(CH2CH2NH-)2]2;
-COCH2OCH2CONH-C6H4- CH[CH2CON(CH2CH2N<)2]2;
-COCH2CH2CO-NH-C6H4- CH[CH2CON(CH2CH2 NH-)2]2;
-COCH2CH2CO-NH-C6H4- CH[CH2CON(CH2CH2N<)2]2;
-CONH-C6H4- CH[CH2CON(CH2CH2NH-)2]2;
-CONH-C6H4- CH[CH2CON(CH2CH2N<)2]2;
-COCH(NH-)CH(COOH)NH-;
-COCH(N<)CH(COOH)N<;




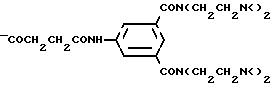






Остатки K комплексообразователя описываются общими формула IA и IB


в которых обозначают: R1 независимо друг от друга атом водорода или эквивалент иона металла порядковых номеров 20-29, 39, 42-44 или 57-83,
R2 - атом водорода, метиловый или этиловый остаток, при необходимости замещенный 1-2 гидроксигруппами или 1 карбоксигруппой,
R3 - группу

R4 - линейную, разветвленную, насыщенную или ненасыщенную C1-C30-алкильную цепь, при необходимости прерванную 1-10 атомами кислорода, 1 фениленовой, 1 фениленоксигруппой и/или при необходимости замещенную 1-5 гидрокси, 1-3 карбокси-, 1 фенильной группой (группами),
R5 - атом водорода или R4,
U6 - линейную, разветвленную, насыщенную или ненасыщенную C1-C20-алкиленовую группу, при необходимости содержащую 1-5 имино-, 1-3 фенилен-, 1-3 фениленокси-, 1-3 фениленимино-, 1-5 амидо, 1-2 гидразид-, 1-5 карбонил, 1-5 этиленокси-, 1 мочевинную, 1 тиомочевинную, 1-2 карбоксиалкилимино-, 1-2 сложноэфирные группы, 1-10 атомов кислорода, 1-5 атомов серы и/или 1-5 атомов азота и/или при необходимости замещенную 1-5 гидрокси-, 1-2 меркапто-, 1-5 оксо-, 1-5 тиоксо, 1-3 карбокси, 1-5 карбоксиалкильными, 1-5 сложноэфирными и/или 1-3 аминогруппами, причем содержащиеся при необходимости фениленовые группы могут быть замещены 1-2 карбокси-, 1-2 сульфоновыми или 1-2 гидроксигруппами,
T - группу -CO-α, -NHCO-α или -NHCS-α и
α - место присоединения к концевым атомам азота последней генерации воспроизводимого звена W.
Предпочтительными остатками комплексообразователя K являются такие, у которых в вышеназванной формуле (IA) C1-C20, предпочтительно C1-C12-алкиленовая цепь, указанная для U6, содержит группы -CH2-, -CH2NHCO-, -NHCOCH2O-, -NHCOCH2OC6H4-, - N(CH2CO2H)-, -NHCOCH2C6H4-. -NHCSNHC6H4, -CH2OC6H4-, -CH2CH2O-, и/или замещена группами -COOH, -CH2COOH.
В качестве примеров
для U6 необходимо назвать следующие группы:
-CH2-; -CH2CH2-, -CH2CH2CH2-,
-C6H4-,
-C6H10-, -CH2C6H5-,
-CH2NHCOCH2CH(CH2CO2H)- C6H4-,
-CH2NHCOCH2OCH2-,
-CH2NHCOCH2C6H4-,

-CH2NHCSNH-C6H4-CH(CH2COOH)CH2-,
-CH2OC6H4-N(CH2 COOH)CH2-,
-CH2NHCOCH2O(CH2CH2O)4- C6H4-,
-CH2O-C6H4-,
-CH2CH2-O-CH2CH2-, -CH2CH2-O-CH2CH2-O-CH2CH2-,


В качестве примеров для R4 необходимо назвать следующие группы:
-CH3, -C6H5, -CH2-COOH, -CH2-C6H5, -CH2-O-(CH2CH2-O-)6CH3-CH2-OH. Если заявляемое согласно изобретению средство предназначено для применения в ЯМР-диагностике, то центральный ион комплексной соли должен быть парамагнитным. Такими ионами являются, в частности, двух- и трехвалентные ионы элементов порядковых номеров 21-29, 42, 44 и 58-70. Подходящими являются, например, ионы хрома (III), железа (II), кобальта (II), никеля (II), меди (II), празеодима (III), неодима (III), самария (III) и иттербия (III). Благодаря очень сильному магнитному моменту особенно предпочтительны ионы гадолиния (III), тербия (III), диспрозия (III), гольмия (III), эрбия (III), марганца (II) и железа (III).
Если заявляемое согласно изобретению средство предназначено для рентгеновской диагностики, то центральный атом должен быть производным от элемента более высокого порядкового номера, чтобы обеспечить достаточное поглощение рентгеновских лучей. Было установлено, что для этой цели пригодны диагностические средства, содержащие физиологически приемлемую комплексную соль с центральными ионами, производными от элементов порядковых номеров 21-29, 39, 42, 44, 57-83. Таким ионом является, например, лантан (III) и вышеназванные ионы серии лантанидов.
Каскадные полимерные комплексы согласно изобретению содержат по меньшей мере 16 ионов элемента вышеназванного порядкового номера.
Остальные кислые атомы водорода, т.е. такие, которые не замещены центральным ионом, могут быть при необходимости полностью или частично заменены катионами неорганических и/или органических оснований, аминокислот или амидов аминокислот.
Пригодными неорганическими катионами являются, например, ионы лития, калия, кальция, магния и особенно натрия. Подходящими катионами органических оснований являются, между прочим, катионы первичных, вторичных или третичных аминов, таких как, например, этаноламин, диэтаноламин, морфолин, глюкамин, N,N-диметилглюкамин и особенно N-метилглюкамин. Приемлемыми катионами аминокислот являются, например, катионы лизина, аргинина и орнитина, а также амиды, как правило, кислых или нейтральных аминокислот.
Предлагаемые изобретением соединения, имеющие молекулярный вес от 10000 до 80000 D, предпочтительно от 15000 до 40000 D, обладают вышеуказанными полезными свойствами. Они содержат необходимое для их применения большое число ионов металла, устойчиво связанных в комплекс.
Они накапливаются в областях с повышенной проницаемостью сосудов, таких как опухоли, позволяют делать выводы о перфузии тканей, дают возможность определять объем крови в тканях, избирательно сокращать время релаксации, соответственно плотность крови и давать наглядное представление о проницаемости кровяных сосудов. Такая физиологическая информация не может быть получена путем применения внеклеточных контрастных веществ, как например Gd-DTPA [Magnevist®] . С этой точки зрения для предлагаемых соединений и в современных способах, формирующих изображение ЯМР-томографии и компьютерной томографии, открываются такие области применения, как: более специфический диагноз злокачественных опухолей, ранний терапевтический контроль при цитостатической, противовоспалительной или сосудорасширяющей терапии, раннее распознавание тканей с недостаточным кровоснабжением (например, в миокарде), ангиография при сосудистых заболеваниях и распознавание и диазноз (стерильных или инфекционных) воспалений.
Каскадные полимерные комплексы согласно изобретению с успехом могут быть применены также и для (интерстициальной и внутривенной) лимфографии.
Еще одним преимуществом каскадных полимерных комплексов согласно изобретению в сравнении с внеклеточными контрастными веществами, такими как Gd-DTPA [Magnevist®] , является их более высокая эффективность в качестве контрастных веществ для ЯМР-томографии (более высокая релаксация), что приводит к заметному уменьшению диагностически необходимой дозы. Одновременно контрастные вещества согласно изобретению могут быть приготовлены в виде растворов изоосмолярных по отношению к крови, благодаря чему они уменьшают осмотическую нагрузку организма, что находит свое отражение в пониженной токсичности вещества (более высокий токсический порог). Меньшие дозы и более высокий порог приводят к значительному повышению надежности применения контрастных веществ в современных способах формирования изображения.
В сравнении с макромолекулярными контрастными веществами на основе гидратов углеводов, например декстрана (заявка на европейский патент N 0326226), которые, как уже упоминалось, содержат, как правило, лишь около 5% сигналоусиливающих парамагнитных катионов, предлагаемые согласно изобретению полимерные комплексы содержат, как правило, около 20% парамагнитных катионов. Благодаря этому макромолекулы согласно изобретению вызывают намного большее усиление сигнала на молекулу, что одновременно приводит к значительному снижению необходимой для ЯМР-томографии дозы в сравнении с макромолекулярными контрастными веществами на основе гидратов углеводов.
С помощью полимерных комплексов согласно изобретению удалось сконструировать и получить макромолекулы таким образом, что они имеют единообразно определенный молекулярный вес. Тем самым оказалось возможным управлять величиной макромолекул таким образом, что макромолекулы получаются достаточно большими, чтобы они лишь медленно могли покидать полость сосуда, но одновременно и достаточно малыми, чтобы они еще могли проходить через капилляры почки, имеющие размер от 300 до 800

В сравнении с другими упомянутыми полимерными соединениями из уровня техники каскадные полимерные комплексы согласно изобретению отличаются улучшенной выводимостью из организма, более высокой эффективностью, большей стабильностью и/или лучшей переносимостью.
Еще одно преимущество настоящего изобретения состоит в том, что благодаря изобретению стали доступны комплексы с гидрофильными или липофильными, макроциклическими или открытоцепными, низкомолекулярными или высокомолекулярными лигандами. Это открывает возможность управления переносимостью и фармакокинетикой этих полимерных комплексов путем химического замещения.
Способ получения каскадных полимерных комплексов согласно изобретению осуществляют таким образом, что
соединения общей формулы I'
A-{X-[Y-(Z-(W-βw)z)y]x}a (I′)
в которой обозначают: A - азотсодержащее каскадное ядро
основной мультиплетности a,
X и Y - независимо друг от друга простую связь или воспроизводимое звено каскада воспроизводимой мультиплетности x, соответственно y,
Z и W - независимо
друг от друга воспроизводимое звено каскада воспроизводимой мультиплетности z, соответственно w,
a - цифры от 2 до 12,
x, y, z и w - независимо друг от друга цифры от 1 до 4 и
β - место присоединения концевых NH-групп последней генерации воспроизводимого звена W,
при условии, что по меньшей мере два воспроизводимых звена различны и что для произведения
мультиплетностей справедливо
16 ≅ a•x•y•z•w ≅ 64,
подвергают взаимодействию с комплексом или комплексообразователем K общей формулы I'A или
I'B


в которых обозначают:
R1′ - независимо друг от друга атом водорода или эквивалент иона металла порядковых номеров 20-29, 39, 42-44 или 57-83 или кислотозащитную группу,
R2 - атом водорода, метиловый или этиловый остаток, при необходимости замещенный 1-2 гидрокси- или 1 карбоксигруппой (группами),
R3′ - группу

R4 - линейную, разветвленную, насыщенную или ненасыщенную C1-C30 -алкильную цепь, при необходимости прерванную 1-10 атомами кислорода, 1 фениленовой, 1 фениленоксигруппой и/или при необходимости замещенную 1-5 гидрокси, 1-3 карбокси-, 1 фенильной группой (группами),
R5 - атом водорода или R4,
U6 - линейную, разветвленную, насыщенную или ненасыщеннную C1-C20-алкиленовую группу, при необходимости содержащую 1-5 имино- , 1-3 фениленовые, 1-3 фениленокси-, 1-3 фениленимино-, 1-5 амидные, 1-2 гидразидные, 1-5 карбонильные, 1-5 этиленокси-, 1 мочевинную, 1 тиомочевинную, 1-2 карбоксиалкиалкилимино-, 1-2 сложноэфирные группы, 1-10 атомов кислорода, 1-5 атомов серы и/или 1-5 атомов азота и/или при необходимости замещенную 1-5 гидрокси-, 1-2 меркапто-, 1-5 оксо-, 1-5 тиоксо-, 1-3 карбокси-, 1-5 карбоксиалкильными, 1-5 сложноэфирными и/или 1-3 аминогруппами, причем содержащиеся при необходимости фениленовые группы могут быть замещены 1-2 карбокси-, 1-2 сульфоновыми или 1-2 гидроксигруппами,
T' - группу -C*O-; -COOH-; -N=C=O- или -H=C=S- и
C*O - активированную карбоксильную группу,
при условии, что, поскольку K' обозначает комплекс, по меньшей мере два (в случае двухвалентных металлов) или три (в случае трехвалентных металлов) заместителя R1 обозначает один эквивалент иона металла вышеназванных элементов и что при необходимости могут присутствовать другие карбоксильные группы в форме их солей с неорганическими и/или органическими основаниями, аминокислотами или амидами аминокислот, в случае необходимости отщепляют имеющиеся защитные группы, если они имеются, полученные таким образом каскадные полимеры - поскольку K' обозначает комплексообразователь - подвергают взаимодействию известным образом с по меньшей мере одной окисью или солью металла элемента порядковых номеров 20-29, 39, 42, 44 или 57-83 и затем при необходимости полностью или частично замещают еще имеющиеся в полученных, таким образом, каскадных полимерных комплексах кислые атомы водорода катионами неорганических и/или органических оснований, аминокислот или амидов аминокислот и ацилируют в случае необходимости имеющиеся свободные концевые аминогруппы, если они еще имеются, при желании до или после комплексования металла.
Следующий аспект настоящего изобретения представляют новые соединения общей формулы I'A

в которой обозначают: R1′ - независимо друг от друга атом водорода или эквивалент иона металла порядковых номеров 20-29, 39, 42-44 или 57-83 или кислотозащитную группу,
R2 - атом водорода, метиловый или этиловый остаток, при необходимости замещенный 1-2 гидрокси- или 1 карбоксигруппой (группами),
R3′ - группу

R4 - линейную, разветвленную, насыщенную или ненасыщенную C1-C30-алкильную цепь, при необходимости, прерванную 1-10 атомами кислорода, 1 фениленовой, 1 фениленоксигруппой и/или при необходимости замещенную 1-5 гидрокси-, 1-3 карбокси-, 1 фенильной группой (группами),
U6 - линейную, разветвленную, насыщенную или ненасыщенную C1-C20 -алкиленовую группу, при необходимости содержащую 1-5 имино-, 1-3 фениленовые, 1-3 фениленокси-, 1-3 фениленимино-, 1-5 амидные, 1-2 гидразидные, 1-5 карбонильные, 1-5 этиленокси-, 1 мочевинную, 1 тиомочевинную, 1-2 карбоксиалкилимино-, 1-2 сложноэфирные группы, 1-10 атомов кислорода, 1-5 атомов серы, и/или 1-5 атомов азота, и/или при необходимости замещенную 1-5 гидрокси-, 1-2 меркапто-, 1-5 оксо-, 1-5 тиоксо-, 1-3 карбокси-, 1-5 карбоксиалкильными, 1-5 сложноэфирными и/или 1-3 аминогруппами, причем содержащиеся при необходимости фениленовые группы могут быть замещены 1-2 карбокси, 1-2 сульфоновыми или 1-2 гидроксигруппами,
T' - группу -C*O; -COOH-, -N=C=O- или -N=C=S и
C*O - активированную карбоксильную группу.
Они являются важными промежуточными продуктами при получении каскадных полимерных комплексов общей формулы I.
В качестве примера активированной карбонильной группы C*O в комплексах или соответственно в комплексообразователях K' необходимо назвать ангидрид, сложный п-нитрофениловый эфир, сложный эфир имида N-гидроксисукцинимида, сложный пентафторфениловый эфир и хлорангидрид кислоты.
Предпринимаемое для введения звеньев комплексообразователя присоединение или ацилирование проводят с субстратами, которые содержат желаемые заместители K (возможно, присоединенные к удаляемой группе) или из которых заданный заместитель образуется в результате реакции.
В качестве примера реакций присоединения следует назвать превращение изоцианатов и изотиоцианатов, причем превращение изоцианатов проводят предварительно в апротонных растворителях, таких как тетрагидрофуран (ТГФ), диоксан, диметилформамид (ДМФ), диметилсульфоксид (ДМСО), метиленхлорид, при температурах между 0 и 100oC, предпочтительно между 0 и 50oC, в случае необходимости при добавлении органического основания, такого как триэтиламин, пиридин, лутидин, N-этилдиизопропиламин, N-метилморфолин. Взаимодействие с изотиоцианатами проводят, как правило, в растворителях, как, например, вода или низшие спирты, такие как метанол, этанол, изопропанол или их смеси, ДМФ или смеси из ДМФ и воды, при температурах между 0 и 100oC, предпочтительно между 0 и 50oC, в случае необходимости при добавлении органического или неорганического основания, такого как триэтиламин, пиридин, лутидин, N-этилдиизопропиламин, N-метилморфолин, или гидроокисей щелочно-земельных, щелочных металлов, таких как гидроокиси лития, натрия, калия, кальция, или их карбонатов, как например карбонат магния.
В качестве примеров реакций ацилирования следует назвать превращение свободных карбоновых кислот по известным специалисту методам [например, J.P. Greenstein, M.Winitz, Chemistry of the Amino Acids, Jonn Wiley & Sons, N.Y. (1961), S. 943-945] . Однако оказалось целесообразным переводить карбоксильную группу перед реакцией ацилирования в активированную форму, такую как, например, ангидрид, активный сложный эфир или хлорангидрид [например, E.Gross, J.Meienhofer, The Peptides, Academic Press, N.Y. (1979), Vol. 1, S. 65-314; N.F. Albertson, Org. React. 12, 157(1962)].
В случае взаимодействия с активным сложным эфиром следует обратиться к известной специалисту литературе [например, Houben-Weyl, Methoden der organischen Chemie, Georg Thieme Verlag, Stuttgart, Band E 5 (1985), 633]. Это взаимодействие может проводиться при условиях, указанных выше для реакции ангидрида. Могут быть использованы также и апротонные растворители, такие как метиленхлорид, хлороформ.
В случае взаимодействий с хлорангидридом применяют только апротонные растворители, например метиленхлорид, хлороформ, толуол или ТГФ, при температурах между -20 и 50oC, предпочтительно между 0 и 30oC. Остальная информация в известной специалисту литературе [например, Houden-Weyl, Methoden der Organischen Chemie, Georg Thieme-Verlag, Stuttgart, (1974), Band 15/2, S. 355-364].
В случае, если R1' обозначает кислотозащитную группу, применяют низшие алкильные, арильные и аралкильные группы, например метил, этил, пропил, бутил, фенил, бензил, дифенилметил, трифенилметил, бис-(п-нитрофенил)-метил, а также триалкилсилильные группы.
Необходимое в некоторых случаях отщепление защитных групп проводят известными специалисту способами, например гидролизом, гидрогенолизом, щелочным омылением сложных эфиров щелочью в водно-щелочном растворе при температурах от 0oC до 50oC или в случае сложных трет-бутиловых эфиров с помощью трифторуксусной кислоты.
Концевые аминогруппы, в случае необходимости неполностью ацилированные лигандом или комплексом, могут быть переведены, если необходимо, в амиды или полуамиды. В качестве примера можно назвать взаимодействие с ацетангидридом, ангидридом янтарной кислоты или ангидридом дигликолевой кислоты.
Введение необходимых ионов металла проводят способом, раскрытым в германской выложенной заявке 3401052, путем растворения или суспендирования оксида или соли металла (например, нитрат, ацетат, карбонат, хлорид или сульфат) элемента порядковых номеров 20-29, 42, 44, 57-83 в воде и/или низшем спирте (таком как метанол, этанол или изопропанол) и путем взаимодействия с раствором или суспензией эквивалентного количества комплексообразующего лиганда и последующего при необходимости замещения существующих кислых атомов водорода кислотных групп катионами неорганических и/или органических оснований, аминокислот или амидов аминокислот.
Введение необходимых ионов металла может происходить как на стадии комплексообразователей I'A или I'B, т.е. перед связыванием с каскадными полимерами, так и после связывания неметаллизированных лигандов I'A или I'B.
Нейтрализацию при этом проводят с помощью неорганических оснований (например, гидроксидов, карбонатов или бикарбонатов, например натрия, калия, лития, магния или кальция) и/или органических оснований, например, в частности, первичных, вторичных и третичных аминов, например этаноламина, морфолина, глюкамина, N-метил- и N,N-диметилглюкамина, а также основных аминокислот, например лизина, аргинина и орнитина, или амидов первоначально нейтральных или кислых аминокислот, например гиппуровой кислоты, глицинацетамида.
Для получения нейтральных комплексных соединений можно, например, добавлять к кислым комплексным солям в водном растворе или суспензии соответствующие основания в количестве, достаточном для достижения нейтральной точки. Полученный раствор может быть затем сконцентрирован в вакууме досуха. Часто целесообразно осаждать образовавшиеся нейтральные соли путем добавления смешивающихся с водой растворителей, например низших спиртов (метанол, этанол, изопропанол и другие), низших кетонов (ацетон и другие), полярных эфиров (тетрагидрофуран, диоксан, 1,2-диметилоксиэтан и другие) и, таким образом, получать легко выделяемые и хорошо очищаемые катализаторы. Наиболее целесообразным оказалось добавление соответствующего основания уже во время комплексообразования реакционной смеси, что позволяет сократить процесс на одну стадию.
Если кислые комплексные соединения содержат несколько свободных кислых групп, то целесообразно получать нейтральные смешанные соли, которые содержат в качестве противоионов как неорганические, так и органические катионы.
Это может быть осуществлено, например, путем проведения взаимодействия между комплексообразующими лигандами в водной суспензии или растворе с оксидом или солью элемента, аналогичного центральному иону, и половиной необходимого для нейтрализации количества органического основания, выделения образовавшейся комплексной соли, при необходимости, ее очистки с последующим смешением, для полной нейтрализации, с необходимым количеством неорганического основания. Порядок добавления основания может быть также и обратным.
Очистка полученных таким образом каскадных полимерных комплексов производится в случае необходимости после доведения pH добавлением кислоты или основания до значения 6-8, предпочтительно 7, предпочтительно путем ультрафильтрации с помощью мембран с подходящей величиной пор (например, Amicon®XM30, Amicon®YM10, Amicon®YM3) или гель-фильтрации, например, на подходящих Sephadex®-гелях.
В случае нейтральных комплексных соединений часто бывает необходимым пропускать полимерные комплексы через анионообменную смолу, например IRA 67 (OH--форма), при необходимости, дополнительно через катионообменную смолу, например IRC 50 (H+-форма) для отделения ионных компонентов.
Содержащие концевые аминогруппы каскадные полимеры, необходимые для связывания с комплексообразователями K' (или также соответствующими металлсодержащими комплексами), получают в общем из азотсодержащих каскадных инициаторов A(H)a, которые могут быть приобретены коммерческим путем или же получены известными из литературы или аналогичными методами. Введение генераций X, Y, Z и W осуществляют по известным из литературы методами [например, J.March, Advanced Organic Chemistry, 3 rd ed.; John Wiley & Sons (1985), 354-381] реакцией ацилирования, соответственно алкилирования с имеющими нужные структуры защищенными аминами, содержащими способные присоединяться к каскадному ядру функциональные группы, такие как, например, карбоновые кислоты, изоцианаты, изотиоцианаты или активированные карбоновые кислоты (например, ангидриды, активные сложные эфиры, хлорангидриды кислот) или соответственно галогениды (например, хлориды, бромиды, йодиды), азиридин, медилаты, тозилаты или другие известные специалисту группы.
Здесь необходимо еще раз подчеркнуть, что различие между каскадным ядром A и воспроизводимыми звеньями является чисто формальным. С точки зрения синтеза может быть выгодно применять не формальный каскадный инициатор A(H)a, а вводить входящие по определению в каскадное ядро атомы азота лишь вместе с первой генерацией. Так, например, для синтеза описанного в примере 1б) соединения целесообразнее не алкилировать (шестикратно) формальное каскадное ядро триамид тримезиновой кислоты, например бензилоксикарбонила, зиридином, а (трижды) подвергать трихлорангидрид тримезиновой кислоты взаимодействию с бис[2-(бензилоксикарбониламино)-этил]-амином.
В качестве аминозащитных групп необходимо назвать известные специалисту бензилоксикарбонил, трет-бутоксикарбонил, трифторацетил, флуоренилметоксикарбонил, бензил и формил [Th.W.Greene, P.G.M. Wuts, Protective Groups in Organic Syntheses, 2nd ed., John Wiley and Sons (1991), S. 309-385]. После отщепления этих защитных групп, которое осуществляется также по известным из литературы методам, в молекулу может быть введена следующая генерация. Наряду с таким построением генерации путем двухстадийной реакции алкилирования, или соответственно ацилирования, и отщепление защитных групп возможно равным образом одновременное введение в две стадии двух, например X-[Y]x, или нескольких, например X-[Y(Z)y]x, генераций. Построение звеньев этой множественной генерации, осуществляют путем алкилирования, или соответственно ацилирования незащищенных аминов ("воспроизводимый амин"), имеющих структуры желательных воспроизводимых звеньев, с помощью второго воспроизводимого амина, аминогруппы которого находятся в защищенной форме.
Необходимые в качестве каскадного инициатора
соединения общей формулы A(H)a могут быть приобретены через торговлю или синтезированы известными из литературы или аналогичными методами [например, Houben-Weyl, Methoden der Org. Chemie,
Georg-Thieme-Verlag, Stuttgart (1957), Bd. 11/1; M.Micheloni et al., Inorg. Chem. (1985), 24, 3702; T.J. Atkins et al., Org. Synth., Vol. 58 (1978), 86-98; The Chemistry of Heterocyclic Compounds:
J.S.Bradshaw et al., Aza-Crown-Macrocycles, John Wiley & Sons, N.Y. (1993)]. В качестве примера следует назвать:
Трис(аминоэтил)амин [например, фирмы Fluka Chemie AG, Швейцария;
Aldrich-Chemie, Германия];
Трис(аминопропил)амин [например, C.Woerner et al., Angew. Chem. Int. Ed. Engl. (1993), 32, 1306];
Диэтилентриамин [например, Fluka; Aldrich];
Триэтилентетрамин [например, Fluka; Aldrich];
Тетраэтиленпентамин [например, Fluka; Aldrich];
1,3,5-Трис(аминометилбензол [например, T.M. Garrett et al., J. Am. Chem. Soc (1991), 113,
2965];
Триамид тримезиновой кислоты [например, H., Kurihara; Jpn. Kokai Tokkyo Koho JP 04077481; CA 117, 162453];
1,4,7-Триазациклононан [например, Fluka; Aldrich];
1,4,7,
10,13-Пентаазациклопентадекан [например, K. W. Aston, Eur. Pat. Appl. 0524161, CA 120, 44580];
1,4,7,10-Тетраазациклододекан [например, Aldrich];
1,4,8,11-Тетраазациклотетрадекан
[например, Fluka; Aldrich];
1,4,7,10,13,16,19,22,25,28-Декаазациклотриаконтан [например, A.Andres et al., J. Chem. Soc. Dalton Trans. (1993), 3507];
1,1,1-Трис(аминометил)этан
[например, R. J.Geue et al., Aust. J. Chem. (1983), 36, 927];
Трис(аминопропил)нитрометан [например, G.R.Newkome et al., Angew. Chem. 103, 1205 (1991) аналогично R.C. Larock, Comprehensive
Organic Transformations, VCH Publishers, N.Y. (1989), 419-420];
Амид 1,3,5,7-адамантантетракарбоновой кислоты [например, H.Stetter et al., Tetr. Lett. 1967, 1841];
Амид 1,
2-бис[феноксиэтан] -3', 3'', 5', 5''- тетракарбоновой кислоты [например, P. Collman et al.; J. Am. Chem. Soc. (1988), 110, 3477-86 аналогично примеру 1b];
1,4,7,10,13,16,21,
24-Октаазабицикло[8.8.8] гексакозан [например, P. H. Smith et al., J. Org. Chem. (1993), 58, 7939].
Необходимые для построения генераций повторяющиеся звенья, содержащие вышеназванные функциональные группы, получают согласно или аналогично описанным в экспериментальной части примерам, или по известным из литературы способам.
В качестве примера необходимо назвать:
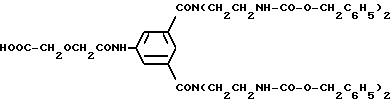
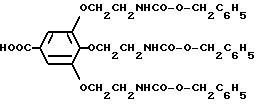
Сложный Nα,Nε-ди-бензилоксикарбонил-лизин-п-нитрофениловый эфир [см. пример 1в)]:
HOOC-CH2OCH2CO-N(CH2CH2
NH-CO-O- CH2C6H5)2;
HOOC-CH2N(CH2CH2NH-CO-O- CH2C6H5)2;
HOOC-CH2CH2CO-N(CH2CH2NH- COCF3)2 [может быть получена по примеру 3a), если использовать вместо бис(бензилоксикарбониламиноэтил)амина
бис(трифторацетиламиноэтил)амин и вместо ангидрида дигликолевой кислоты ангидрид янтарной кислоты];
HOOC-CH2OCH2CONH-C6H4- CH[CH2
CON(CH2CH2NH-CO-O- CH2C6H5)2]2; [может быть получена аналогично примеру 3a)];
O=C=N-C6H4
-CH[CH2CON(CH2CH2NH- CO-O-CH2C6H5)2]2;


N-Бензилоксикарбонил-азиридин [может быть получен по M.Zinic et al., J. Chem. Soc., Perkin Trans, 1, 21-26 (1993)];
N-Бензилоксикарбонил-глицин [может быть приобретен через торговую сеть, например, у фирмы Bachem California]
может быть получена по C.J.Cavallito et al., J. Amer. Chem. Soc. 1943, 65, 2140, если применять NCO-O-CH2C6H5-(2-бромметил)амин вместо бензилхлорида [A.R.Jacobson et al., J. Med. Chem. (1991), 34, 2816].
Комплексы и комплексообразователи общей формулы I'A и I'B получают согласно или аналогично описанным в экспериментальной части примерам или по известным из литературы способам (см. заявки на европейский патент NN 0512661, 0430863, 0255471 и 0565930).
Так, соединения общей формулы I'A и I'B получают способом, в котором предшественником функциональной группы T' служит группа T'', либо в значении защищенной кислотной функции, которая независимо от кислотозащитных групп R1′ может быть переведена вышеописанными способами в свободную кислотную функцию, либо в значении защищенной аминной функции, которая может быть деблокирована известными из литературы способами [Th.W.Greene, P.G.M. Wuts, Protective Groups in Organic Syntheses, 2nd edition, John Wiley and Sons (1991), S. 309-385] и затем переведена в изоцианаты или соответственно в изотиоцианаты [Methoden der Org. Chemie (Houben-Weyl), E4, S. 742-749, 837-843, Georg Thieme-Verlag, Stuttgart, New York (1983)]. Такие соединения могут быть получены согласно или аналогично описанным в экспериментальной части примерам путем моноалкилирования циклов подходящими амидами α-галогенкарбоновых кислот [в апротонных растворителях, таких как, например, хлороформ].
Соединения общей формулы I'B могут быть получены, например, способом,
в котором предшественником активированной карбоксильной C*O-группы служит защищенная кислотная функция, которая независимо от кислотозащитных групп R1′ может быть переведена с
помощью вышеуказанных известных из литературы способов в свободную кислотную функцию и активирована с помощью также описанных известных из литературы способов. Такие соединения могут быть получены
согласно или аналогично описанным в экспериментальной части прописям или, например, тем, что производное аминокислоты общей формулы II

где R5′ имеет указанное для R5 значение, причем в случае необходимости содержащиеся в R5 гидрокси- или карбоксигруппы присутствуют, в случае необходимости, в защищенной форме, и
V1 обозначает линейную или разветвленную C1-C6-алкильную группу, бензильную, триметилсилильную, триизопропилсилильную, 2,2,2-трифторэтоксигруппу, 2,2,2-трихлорэтоксигруппу, причем V1 отличен от R1″
подвергают взаимодействию с алкилирующим агентом общей формулы III

где R1″ обозначает защитную группу и
Hal обозначает атом галогена, такого как Cl, Br или I, предпочтительно, однако, Cl [см. также M.A. Wiliams, H. Rappoport, J. Org. Chem. 58, 1151 (1993)].
Предпочтительными производными аминокислот являются сложные эфиры встречающихся в природе α-аминокислот.
Реакция соединения (II) с соединением (III) предпочтительно проводится как реакция алкилирования в буфере, причем буфером служит водный раствор фосфата. Взаимодействие происходит при значениях pH 7-9, предпочтительно при pH 8. Концентрация буфера может составлять 0,1-2,5 М, предпочтительно, однако, применяется 2 М фосфатный буферный раствор. Температура реакции алкилирования может составлять от 0 до 50oC; предпочтительной является комнатная температура.
Реакцию проводят в полярном растворителе, например в ацетонитриле, тетрагидрофуране, 1,4-диоксане или 1,2-диметоксиэтане.
Предлагаемые изобретением фармацевтические средства также получают известным образом, суспендируя или растворяя комплексные соединения согласно изобретению, при необходимости, с введением известных в галеновой технике добавок - в водной среде и затем при необходимости стерилизуя суспензию или раствор. Подходящими добавками являются, например, физиологически приемлемые буферы (например, трометамин), добавки комплексообразователей или слабых комплексов (например, диэтилентриаминпентауксусной кислоты или соответствующие каскадные полимеры Ca-комплексы), или в случае необходимости электролиты, такие как, например, хлорид натрия, или в случае необходимости антиоксиданты, как например аскорбиновую кислоту.
Если для энтерального введения или других целей потребуются суспензии или растворы предлагаемых изобретением средств в воде или физиологическим солевом растворе, то их смешивают с одним или несколькими принятыми в галеновой практике веществами [например, метилцеллюлозой, лактозой, маннитом], и/или поверхностно-активными веществами [например, лецитином Tween®, Myrj®], и/или ароматическими веществами для коррекции вкусовых качеств [например, эфирными маслами].
Принципиально также возможно получать фармацевтические средства согласно изобретению и без выделения комплексных солей. В любом случае необходима особая тщательность в отношении того, чтобы хелатообразование шло таким образом, чтобы соли согласно изобретению и солевые растворы были практически свободны от обладающих токсическим действием нескомплексованных ионов металлов.
Это может быть обеспечено путем контрольных титрований во время процесса получения, например, с помощью цветных индикаторов, таких как ксиленоловый оранжевый. Поэтому изобретение относится также к способу получения комплексных соединений и их солей. В качестве последней меры безопасности остается очистка выделенной комплексной соли.
Предлагаемые
изобретением фармацевтические средства содержат предпочтительно от 1 мкмоль до 1,3 моль/л комплексной соли и применяются в дозировке, как правило, в количестве от 0,0001 до 5 ммоль/кг. Они
предназначены для энтерального и парентерального применения. Комплексные соединения применяются:
1. Для ЯМР- и рентгеновской диагностики в виде их комплексов и ионами элементов порядковых
номеров 21-29, 39, 42, 44 и 57-83.
2. Для радиодиагностики и радиотерапии в виде их комплексов с радиоизотопами элементов с порядковыми номерами 27, 29, 31, 32, 37-39, 43, 49, 62, 64, 70, 75 и 77.
Предлагаемые согласно изобретению средства удовлетворяют многообразным требованиям, предъявляемым к контрастным веществам для ЯМР-томографии. Они прекрасно годятся для того, чтобы после орального или парентерального приема благодаря усилению интенсивности сигнала улучшать информативность полученной с помощью ЯМР-томографа картины. Далее они обладают высокой эффективностью, необходимой для того, чтобы по возможности минимально нагружать организм посторонними веществами, и хорошей переносимостью, которая необходима для поддерживания неинвазивного характера исследований.
Хорошая растворимость в воде и незначительная осмоляльность предлагаемых изобретением средств позволяет получать высококонцентрированные растворы, позволяющие удерживать объемную нагрузку на кровообращение в приемлемых границах и компенсировать разбавление жидкостью организма, т.е. ЯМР-диагностические средства должны быть в 100-1000 раз более водорастворимы, чем для ЯМР-спектроскопии. Далее, предлагаемые изобретением средства имеют не только высокую стойкость in vitro, но и поразительно высокую стойкость in vivo, так что выделение в свободном виде или обмен ковалентно не связанных в комплексах - самих по себе ядовитых - ионов в течение времени, за которое новые контрастные вещества снова будут полностью выведены из организма, происходит лишь очень медленно.
В общем и целом предлагаемые изобретением средства для применения в качестве ЯМР-диагностиков дозируют в количестве от 0,0001 до 5 ммоль/кг, предпочтительно от 0,005 до 0,5 ммоль/кг. Детали применения обсуждаются, например, в работе H.-J. Weinmann et al., Am. J. of Roentgenology 142, 619 (1984).
Особенно низкие дозировки (ниже 1 мг/кг веса тела) органоспецифических ЯМР-диагностиков могут применяться, например, для обнаружения опухолей и инфаркта миокарда.
Далее, комплексные соединения согласно изобретению успешно могут применяться в качестве реагентов восприимчивости и реагентов сдвига для in vivo ЯМР-спектроскопии.
Предлагаемые изобретением средства благодаря их оптимальным радиоактивным свойствам и хорошей стабильности содержащихся в них комплексных соединений пригодны также в качестве радиодиагностиков. Детали применения описываются, например, в "Radiotracers for Medical Applications", CRC-Press, Boca Raton, Florida.
Другим методом формирования изображения с помощью радиоизопов является позитронно-эмиссионная томография, в которой применяются испускающие позитроны изотопы, такие как, например,43Sc,44Sc,52Fe,55Co и68Ga [Heiss, W. D. ; Phelps M.E.; Positron Emission Tomography of Brain, Springer Verlag Berlin, Heidelberg, New York, 1983].
Соединения согласно изобретению неожиданным образом пригодны также для дифференциации злокачественных и доброкачественных опухолей в областях без гематоэнцефалического барьера. Они характеризуются также тем, что они полностью удаляются из организма и тем самым хорошо переносимы.
Так как вещества согласно изобретению накапливаются в злокачественных опухолях (отсутствие диффузии в здоровые ткани, но высокая проницаемость опухолевых сосудов), то они могут поддерживать лучевую терапию злокачественных опухолей. Последняя отличается от соответствующей диагностики только количеством и видом применяемого изотопа. При этом целью является разрушение опухолевых клеток посредством богатого энергией коротковолнового излучения с по возможности минимальной дальностью действия. Для этого используются взаимодействия металлов, содержащихся в комплексах (например, железа или гадолиния) с ионизирующим излучением (например, рентгеновскими лучами) или с нейтронными лучами. Благодаря этому эффекту локальная эффективная лучевая доза в том месте, где находится металлический комплекс (например, в опухолях) значительно повышается. Чтобы создать такую же лучевую дозу в злокачественной ткани, лучевая нагрузка на здоровые ткани при применении таких металлических комплексов значительно уменьшается и тем самым исключаются для пациентов обременительные побочные действия. Поэтому металлокомплексные конъюгаты согласно изобретению пригодны также в качестве радиосенсибилизирующего вещества при лучевой терапии злокачественных опухолей (например, при использовании эффекта Мессбауэра или при терапии с нейтронным захватом). Подходящими β-испускающими ионами являются, например,46Sc,47Sc,48Sc,72Ga,73Ga и90Y. Подходящими α-испускающими ионами с небольшими периодами полураспада являются, например,211Bi,212Bi,213Bi и214Bi, причем212Bi предпочтителен. Пригодным протоно- и электроноиспускающим ионом является158Gd, который может быть получен из157Gd путем нейтронного захвата.
Если предлагаемое изобретением средство предназначено для применения в предложенном Р. Л. Миллсом и др. [Mills et al. Nature, Vol. 336 (1988), S. 787] варианте лучевой терапии то центральный ион должен быть производным от мессбауэровского изотопа, такого как, например,57Fe или151Eu.
При применении терапевтических средств согласно изобретению in vivo последние могут назначаться совместно с подходящим носителем, например с сывороткой или физиологическим раствором, и совместно с другим белком, например человеческим сывороточным альбумином. Дозировка при этом зависит от вида клеточного нарушения, используемого иона металла и метода получения изображения.
Предлагаемые согласно изобретению терапевтические средства вводятся парентерально, преимущественно внутривенно.
Детали применения радиотерапевтических средств обсуждаются, например, в: R.W.Kozak et al. TIBTEC, Oktober 1986, 262.
Предлагаемые изобретением средства очень хорошо годятся в качестве рентгеноконтрастных веществ, в частности для компьютерной томографии (CT), причем особенно необходимо подчеркнуть то, что при их использовании какие-либо признаки анафилаксиобразных реакций, известные по йодсодержащим контрастным веществам, не выявляются в биохимических и фармакологических исследованиях. Особенно ценны они вследствие благоприятных абсорбционных свойств в областях повышенных напряжений трубок в дигитальной субстрактивной технике.
В общем и целом предлагаемые изобретением средства для применения в качестве рентгеноконтрастных веществ дозируются по аналогии, например, с меглумин-диатриазоатом, в количествах от 0,1 до 5 ммоль/кг, предпочтительно от 0,25 до 1 ммоль/кг.
Детали применения рентгеноконтрастных веществ обсуждаются, например, в работах: Barke, Roentgenkontrastmittel, G. Thieme, Leipzig (1970) и P. Thurn, E. Bucheler "Einfuhrung in die Rontgendiagnostik", G. Thieme, Stuttgart, New York (1977).
Таким образом, синтезированы новые комплексообразователи, металлические комплексы и соли металлических комплексов, которые открывают новые возможности в диагностической и терапевтической медицине.
Нижеследующие примеры служат для более подробного пояснения предмета изобретения.
Пример 1
a) Бис[2-(бензилоксикарбониламино)-этил]-амин
51,5 г (500 ммоль) диэтилентриамина и 139 мл (1 моль) триэтиламина растворяют в дихлорметане и при
-20oC смешивают с 161 г бензилцианформиата (фирмы Fluka) и затем перемешивают в течение ночи при комнатной температуре. По окончании реакции упаривают под тягой, остаток растворяют в
диэтиловом эфире, органическую фазу промывают раствором карбоната натрия и сушат сульфатом натрия. Фильтрат смешивают с гексаном, осадок отфильтровывают и сушат.
Выход: 163,4 г (88% от теоретического).
Элементный анализ:
Рассчитано: C 64,67 H 6,78 N 11,31
Найдено: C 64,58 H 6,83 N 11,28
б) Триамид N,N,N',N',N'',
N''-гексакис[2-(бензилоксикарбониламино)- этил] -тримезиновой кислоты
13,27 г (50 ммоль) трихлорангидрида тримезиновой кислоты (фирмы Aldrich) и 34,7 мл (250 ммоль) триэтиламина растворяют в
диметилформамиде (ДМФ) и смешивают при 0oC с 65,0 г (175 ммоль) описанного в примере 1а) амина и затем перемешивают в течение ночи при комнатной температуре. Раствор упаривают под вакуумом
и остаток хроматографируют с этилацетатом на силикагеле.
Выход: 39,4 г (62% от теоретического).
Элементный анализ:
Рассчитано: C 65,24 H 5,95 N 9,92
Найдено: C 65,54 H 5,95 N 9,87
в) Nα,Nε- Бис(N, N'-дибензилоксикарбонил -лизил)-лизин, защищенный "три-лизин"
3,6 г (20 ммоль) лизин-гидрохлорида
и 6,95 мл (50 ммоль) триэтиламина растворяют в ДМФ, смешивают с 26,8 г (50 ммоль) п-нитрофенилового эфира Nα,Nε-дибензилоксикарбонил-лизина (фирмы Bachem) и
перемешивают два дня при комнатной температуре. По окончании реакции упаривают под вакуумом, остаток растворяют в этилацетате и встряхивают с разбавленной соляной кислотой. Органическую фазу сушат
сульфатом натрия, растворитель упаривают и остаток хроматографируют в системе этилацетат/этанол в ступенчатом градиенте.
Выход: 10,7 г (57% от теоретического).
Элементный анализ:
Рассчитано: C 63,95 H 6,65 N 8,95
Найдено: C 63,63 H 6,69 N 8,93
г) Полностью защищенный бензилоксикарбонил-24-полиамин на основе триамида N,N,N',N',N'',
N''-гексакис[2-(трилизиламино)-этил]-тримезиновой кислоты
1,27 г (1 ммоль) описанного в примере 1б) гексабензилоксикарбониламина растворяют в ледяной уксусной кислоте и при перемешивании
смешивают с 33%-ным бромистым водородом в ледяной уксусной кислоте. Через 60 минут с помощью диэтилового эфира усиливают начавшееся осаждение, образовавшийся гексаамингидробромид промывают эфиром,
сушат в вакууме и без дальнейшей очистки вводят в описываемую ниже реакцию.
Выход: 0,95 г (количественный).
7,0 г (7,5 ммоль) описанного в примере 1в) защищенного "трилизина", 1,2 г (7,5 ммоль) 1-гидроксибензотриазола и 2,4 г (7,5 ммоль) 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний-тетрафторбората (TBTU фирмы Peboc Limited, Англия) растворяют в ДМФ и перемешивают 15 минут. Этот раствор затем смешивают с 5,16 мл (30 ммоль) N-этилдиизопропиламина и 0,95 г (1 ммоль) вышеописанного гексаамингидробромида и перемешивают в течение ночи при комнатной температуре. По окончании реакции упаривают в вакууме и остаток хроматографируют в системе этилацетат/этанол (2:1) на силикагеле.
Выход: 4,55 г (76% от теоретического).
Элементный анализ:
Рассчитано: C 64,35 H 6,71 N 10,52
Найдено: C 64,08 H 6,57 N 10,29
д) Бензиловый эфир 2-бромпропионилглицина
К 100 г (296,4 ммоль)
глицинбензиловый сложный эфир соли п-толуолсульфокислоты и 33,0 г (326,1 ммоль) триэтиламина в 400 мл метиленхлорида добавляют по каплям при 0oC 55,9 г (326,1 ммоль) хлорангидрида
2-бромпропионовой кислоты. Температуре не дают подняться выше 5oC. По окончании добавления перемешивают в течение одного часа при 0oC, затем 2 часа при комнатной температуре.
Добавляют 500 мл ледяной воды и pH водной фазы с помощью 10%-ной водной соляной кислоты доводят до значения 2. Органическую фазу отделяют, промывают один раз 5%-ным водным раствором соды (300 мл) и
один раз водой (400 мл). Органическую фазу сушат над сульфатом магния и упаривают досуха в вакууме. Остаток перекристаллизовывают из диизопропилового эфира.
Выход: 68,51 г (75% от теоретического) бесцветного кристаллического порошка.
Точка плавления: 69-70oC.
Элементный анализ:
Рассчитано: C 46,76 H 7,19 N 4,54 Br 25,92
Найдено: C 46,91 H 7,28 N 4,45 Br 28,81
e) 1-[4-(Бензилоксикарбонил)-1-метил-2-оксо-3-азабутил] - 1,4,7,10-тетраазациклододекан
К 55,8 г (324,4 ммоль) 1,4,7,
10-тетраазациклододекана, растворенного в 600 мл хлороформа, прибавляют 50 г (162,2 ммоль) соединения, указанного в заголовке примера 1д), и перемешивают всю ночь при комнатной температуре. Добавляют
500 мл воды, отделяют органическую фазу и промывают ее еще 2 раза, каждый раз в 400 мл воды. Органическую фазу сушат над сульфатом магния и упаривают досуха в вакууме. Остаток хроматографируют на
силикагеле (растворитель: хлороформ/метанол/-25%-ный водный раствор аммиака = 10/5/1).
Выход: 40,0 г (63% от теоретического) слегка желтоватого вязкого масла.
Элементный анализ:
Рассчитано: C 61,36 H 8,50 N 17,89
Найдено: C 61,54 H 8,68 N 17,68
ж) 10-[4-(Бензилоксикарбонил)-1-метил-2-оксо-3-азабутил] -1,4,
7- трис(трет-бутоксикарбонилметил)-1,4,7,10-тетраазациклододекан (натрийбромидный комплекс)
К 20 г (51,08 ммоль) соединения, указанного в заголовке примера 1е) и 17,91 г (169 ммоль) карбоната
натрия в 300 мл ацетонитрила прибавляют 33 г (169 ммоль) трет-бутилового эфира бромуксусной кислоты и перемешивают 24 часа при 60oC. Охлаждают до 0oC, отфильтровывают от солей и
упаривают фильтрат досуха. Остаток хроматографируют на силикагеле (растворитель: этиловый эфир уксусной кислоты/этанол: 15/1). Фракции, содержащие продукт, упаривают и остаток перекристаллизовывают из
диизопропилового эфира.
Выход: 34,62 г (81% от теоретического) бесцветного кристаллического порошка.
Точка плавления: 116-117oC.
Элементный анализ:
Рассчитано: C 54,54 H 7,59 N 8,37 Na 2,74 Br 9,56
Найдено: C 54,70 H 7,65 N 8,24 Na 2,60 Br 9,37
з) 10-(4-Карбокси-1-метил-2-оксо -3-азабутил)-1,4,
7-трис(трет- бутоксикарбонилметил)-1,4,7,10-тетраазациклододекан (натрийбромидный комплекс)
30 г (35,85 ммоль) соединения, указанного в заголовке примера 1ж), растворяют в 500 мл изопропанола
и добавляют 3 г палладиевого катализатора (10% Pd/C). Гидрируют всю ночь при комнатной температуре. Отфильтровывают от катализатора, фильтрат упаривают в вакууме досуха и перекристаллизовывают из
ацетона.
Выход: 22,75 г (85% от теоретического) бесцветного кристаллического порошка.
Точка плавления: 225oC (разл.).
Элементный
анализ:
Рассчитано: C 49,86 H 7,69 N 9,38 Na 3,07 Br 10,71
Найдено: C 49,75 H 7,81 N 9,25 Na 2,94 Br 10,58
и) 24-мерный N-(5-ДОЗА-ил-4-оксо-3-азагексаноил)-каскадный
полиамид на основе триамида N,N,N',N',N'',N''-гексакис[2-трилизиламино)-этил]-тримезиновой кислоты
ДОЗА обозначает 1,4,7-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан] .
6,0 г (1 ммоль) описанного в примере 1г) полибензилоксикарбониламина растворяют в ледяной уксусной кислоте и при перемешивании смешивают с 33%-ным бромистым водородом в ледяной уксусной кислоте. Через 3 часа начавшееся осаждение усиливают с помощью диэтилового эфира, образовавшийся 24-амингидробромид промывают эфиром и сушат в вакууме.
35,84 г (48 ммоль) описанной в вышеприведенном примере 1з) кислоты растворяют в ДМФ, смешивают с 7,35 г (48 ммоль) 1-гидроксибензотриазола, с 15,41 г (48 ммоль) TBTU (фирмы Pedoc Limited, Англия) и с 49,3 мл (288 ммоль) N-этилдиизопропиламина и перемешивают 20 минут при комнатной температуре. Этот раствор затем смешивают с вышеописанным (1 ммоль) 24-амингидробромидом и перемешивают 4 дня при комнатной температуре. Раствор концентрируют в вакууме, остающееся масло охлаждают в ледяной бане и смешивают с трифторуксусной кислотой, перемешивают в течение ночи и затем осаждают диэтиловым эфиром. Осадок сушат в вакууме, растворяют в воде, доводят до pH 7, очищают от низкомолекулярных долей через ультрафильтрационную мембрану YM3 Amicon® и, наконец, фильтрат фильтруют посредством мембраны и сушат вымораживанием.
Выход: 13,5 г (83% от теоретического).
Содержание H2O (Карл-Фишер): 6,2%.
Элементный анализ (в пересчете на безводное вещество):
Рассчитано: C 45,82 H 6,09 N 15,07 Na 10,79
Найдено: C 45,56 H 6,15 N 14,80 Na 10,52
л) 24-мерный Gd-комплекс N-(5-ДОЗА-ил-4-оксо-3-азагексаноил)каскадного полиамида на основе
триамида N,N,N',N',N'',N''-гексакис[2-(трилизиламино)-этил]-тримезиновой кислоты
8,13 г (0,5 ммоль) описанной в предшествующем примере 1и) комплексообразующей кислоты доводят в воде
разбавленной соляной кислотой до pH 3, смешивают с 2,17 г (6 ммоль) Gd2O3, перемешивают 30 минут при 80oC, после остывания доводят до pH 7 и обессоливают через
ультрафильтрационную мембрану YM3 Amicon®. Наконец, фильтрат фильтруют через мембрану и сушат вымораживанием.
Выход: 8,89 г (92,1% от теоретического).
Содержание H2O (Карл-Фишер): 9,6%.
Определение Gd (AAS): 19,6%.
Элементный анализ (в пересчете на безводное вещество):
Рассчитано: C 40,
26 H 5,35 N 13,24 Gd 21,62
Найдено: C 39,98 H 5,51 N 13,42 Gd 21,37
Пример 2
а) Бензиловый эфир 2-бромпропионил-β-аланина
К 100 г (285 ммоль) β
-аланинбензилового эфира соли п-толуолсульфокислоты и 31,67 г (313 ммоль) триэтиламина в 400 мл метиленхлорида добавляют по каплям при 0oC 53,65 г (313 ммоль) хлорангидрида
2-бромпропионовой кислоты. Температуре не дают подняться выше 5oC. По окончании добавления перемешивают в течение одного часа при 0oC, затем 2 часа при комнатной температуре.
Добавляют 500 мл ледяной воды и pH водной фазы с помощью 10%-ной соляной кислоты доводят до значения 2. Органическую фазу отделяют, промывают один раз 5%-ной водной соляной кислотой (300 мл), один раз
5%-ным водным раствором соды (300 мл) и один раз водой (400 мл). Органическую фазу сушат над сульфатом магния и упаривают досуха в вакууме. Остаток перекристаллизовывают из диизопропилового эфира.
Выход: 71,36 г (78% от теоретического) бесцветного кристаллического порошка.
Элементный анализ:
Рассчитано: C 48,46 H 7,51 N 4,35 Br 24,80
Найдено: C
48,29 H 7,65 N 4,25 Br 24,61
б) 1-[5-(Бензилоксикарбонил)-1 -метил-2-оксо-3-азапентил]-1,4,7,10- тетраазациклододекан
К 53,32 г (310 ммоль) 1,4,7,10-тетраазациклододекана,
растворенного в 600 мл хлороформа, прибавляют 50 г (155,2 ммоль) соединения, указанного в заголовке примера 2а), и перемешивают всю ночь при комнатной температуре. Добавляют 500 мл воды, отделяют
органическую фазу и промывают ее еще 2 раза каждый раз в 400 мл воды. Органическую фазу сушат над сульфатом магния и упаривают досуха в вакууме. Остаток хроматографируют на силикагеле (растворитель:
хлороформ/метанол/25%-ный водный раствор аммиака = 10/5/1).
Выход: 38,39 г [61% от теоретического, в пересчете на примененный 2а)] слегка желтоватого вязкого масла.
Элементный анализ:
Рассчитано: C 62,20 H 8,70 N 17,27
Найдено: C 62,05 H 8,81 N 17,15
в) 10-[5-(Бензилоксикарбонил)-1-метил-2-оксо-3-азапентил] - 1,4,
7-трис(трет-бутоксикарбонилметил)-1,4,7,10-тетраазациклододекан (натрийбромидный комплекс)
К 20 г (49,32 ммоль) соединения, указанного в заголовке примера 2б), и 17,28 г (163 ммоль) карбоната
натрия в 300 мл ацетонитрила прибавляют 31,8 г (168 ммоль) трет-бутилового эфира бромуксусной кислоты и перемешивают 24 часа при 60oC. Охлаждают до 0oC, отфильтровывают от солей
и упаривают фильтрат досуха. Остаток хроматографируют на силикагеле (растворитель: этиловый эфир уксусной кислоты/этанол: 10/1). Фракции, содержащие продукт, упаривают и остаток перекристаллизовывают
из диизопропилового эфира.
Выход: 31,89 г (76% от теоретического) бесцветного кристаллического порошка.
Элементный анализ:
Рассчитано: C 55,05 H 7,70 N 8,23
Na 2,69 Br 9,40
Найдено: C 55,17 H 7,85 N 8,10 Na 2,51 Br 9,30
г) 10-[5-(Карбокси)-1-метил-2-оксо-3-азапентил)-1,4,7-трис(трет- бутоксикарбонилметил)-1,4,7,10-тетраазациклододекан
(натрийбромидный комплекс)
30 г (35,26 ммоль) соединения, указанного в заголовке примера 2в), растворяют в 500 мл изопропанола и добавляют 3 г палладиевого катализатора (10% Pd/C). Гидрируют
всю ночь при комнатной температуре. Отфильтровывают от катализатора, фильтрат упаривают в вакууме досуха и перекристаллизовывают из ацетона.
Выход: 24,41 г (91% от теоретического) бесцветного кристаллического порошка.
Элементный анализ:
Рассчитано: C 50,52 H 7,82 N 9,21 Na 3,01 Br 10,52
Найдено: C 50,41 H 7,95 N 9,10 Na 2,91 Br 10,37
д) 24-мерный N-(6-ДОЗА-ил-5-оксо-4-азагептаноил)-каскадный полиамид на основе триамида N, N,N',N',N'',N''-гексакис[2-(трилизиламино)-этил]-тримезиновой кислоты
6,0 г (1 ммоль) описанного в
примере 1г) полибензилоксикарбониламина растворяют в ледяной уксусной кислоте и при перемешивании смешивают с 33%-ным бромистым водородом в ледяной уксусной кислоте. Через 3 часа начавшееся осаждение
усиливают с помощью диэтилового эфира, образовавшийся 24-амингидробромид промывают эфиром и сушат в вакууме.
36,52 г (48 ммоль) описанной в вышеприведенном примере 2г) кислоты растворяют в ДМФ, смешивают с 7,35 г (48 ммоль) 1-гидроксибензотриазола, с 15,41 г (48 ммоль) TBTU (фирмы Pedoc Limited, Англия) и с 49,3 мл (288 ммоль) N-этилдиизопропиламина и перемешивают 20 минут при комнатной температуре. Этот раствор затем смешивают с вышеописанным (1 ммоль) 24-амингидробромидом и перемешивают 4 дня при комнатной температуре. Раствор концентрируют в вакууме, остающееся масло охлаждают в ледяной бане и смешивают с трифторуксусной кислотой, перемешивают в течение ночи и затем осаждают диэтиловым эфиром. Осадок сушат в вакууме, растворяют в воде, доводят до pH 7, очищают от низкомолекулярных долей через ультрафильтрационную мембрану YM3 Amicon® и, наконец, фильтрат фильтруют посредством мембраны и сушат вымораживанием.
Выход: 14,4 г (85% от теоретического).
Содержание H2O (Карл-Фишер): 8,7%.
Элементный анализ (в пересчете на безводное вещество):
Рассчитано: C 46,82 H 5,98 N 14,
79 Na 10,59
Найдено: C 47,04 H 6,23 N 14,96 Na 10,26
е) 24-мерный Gd-комплекс М-(6-ДОЗА-ил-5-оксо-4-азагептаноил)-каскадного полиамида на основе триамида N,N,N',N',N'',
N''-гексакис[2-трилизиламино)-этил]-тримезиновой кислоты
8,5 г (0,5 ммоль) описанной в предшествующем примере 2д) комплексообразующей кислоты доводят в воде до pH 3 разбавленной соляной
кислотой, смешивают с 2,17 г (6 ммоль) Gd2O3, перемешивают 30 минут при 80oC, после остывания доводят до pH 7 и обессоливают через ультрафильтрационную мембрану YM3
Amicon®. Наконец, фильтрат фильтруют через мембрану и сушат вымораживанием.
Выход: 8,50 г (88% от теоретического).
Содержание H2O (Карл-Фишер): 7,9%.
Определение Gd (AAS): 19,4%.
Элементный анализ (в пересчете на безводное вещество):
Рассчитано: C 41,12 H 5,52 N 12,99 Na 21,21
Найдено: C 40,86 H 5,34 N 13,25 Na 20,95
Пример 3
а) N, N'-Бис(бензилоксикарбонил)-3-[карбоксиметоксиацетил] -3- азапентан-1,5-диамин
37,14 г (100 ммоль) описанного в
примере 1а) бис(бензилоксикарбонил-аминоэтил)-амина растворяют в ДМФ, смешивают в ледяной бане с 17,4 г (150 ммоль) ангидрида дигликолевой кислоты (фирмы Janssen Chimica) и с 21 мл (150 ммоль)
триэтиламина и затем перемешивают в течение ночи при комнатной температуре. Раствор упаривают в вакууме, остаток растворяют в этилацетате и встряхивают с разбавленной соляной кислотой. Органическую
фазу сушат сульфатом натрия и после отфильтровывания от сушильного агента кристаллизуют добавлением гексана.
Выход: 41,4 г (85% от теоретического).
Элементный
анализ:
Рассчитано: C 59,13 H 6,00 N 8,62
Найдено: C 58,99 H 5,93 N 8,70
б) N,N',N'',
N'''-Тетракис{8-(бензилоксикарбониламино)- 6-[2-(бензилоксикарбониламино)-этил]-5-оксо-3-оксаоктаноил}циклен
345 мг (2 ммоль) 1,4,7,10-тетраазациклододекана (циклен фирмы Fluka) азеотропно
обезвоживают толуолом. К охлажденному раствору циклена в толуоле прибавляют при комнатной температуре раствор 4,88 г (10 ммоль) N,N'-бис(бензилоксикарбонил)-3-[карбоксиметоксиацетил] -3- азапентан-1,
5-диамина [пример 3а)] в тетрагидрофуране (ТГФ), а также 2,47 г (10 ммоль) 2-этокси-1-этоксикарбонил-1,2-дигидрохинолина (EEDQ фирмы Fluka) и перемешивают в течение ночи. По окончании реакции продукт
осаждают, добавляя гексан, освобождают от растворителя декантацией и еще раз переосаждают из системы ТГФ/гексан и затем из системы ТГФ/толуол. После сушки в вакууме получают 2,78 г (68% от
теоретического) бледно-желтого твердого вещества.
Элементный анализ:
Рассчитано: C 60,93 H 6,29 N 10,93
Найдено: C 60,68 H 6,40 N 10,97
в) Полностью
защищенный бензилоксикарбонил-32-полиамин на основе 32 аминов, конденсированных из N,N',N'',
N'''-тетракис{8- (бензилоксикарбониламино)-6-[2-(бензилоксикарбониламино)-этил]-5- оксо-3-оксаоктаноил}циклена и Nα,Nε-бис(лизил)-лизина ("трилизина")
2,05
г (1 ммоль) описанного в примере 3б) октабензилоксикарбониламина растворяют в ледяной уксусной кислоте и при перемешивании смешивают с 33%-ным бромистым водородом в ледяной уксусной кислоте. Через 90
минут с помощью диэтилового эфира усиливают начавшееся осаждение, образовавшийся окта-амин-гидробромид промывают эфиром, сушат в вакууме и без дальнейшей очистки вводят в описываемую ниже реакцию.
Выход: 1,6 г (количественный).
9,4 г (10 ммоль) описанного в примере 1в) защищенного "трилизина", 1,5 г (10 ммоль) 1-гидроксибензотриазола и 3,2 г (10 ммоль) 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний-тетрафторбората (TBTU фирмы Peboc Limited, Англия) растворяют в ДМФ и перемешивают 15 минут. Этот раствор затем смешивают с 5,16 мл (30 ммоль) N-этилдиизопропиламина и с 1,6 г (1 ммоль) вышеописанного окта-амин-гидробромида и перемешивают в течение ночи при комнатной температуре. По окончании реакции упаривают в вакууме и остаток хроматографируют в системе дихлорметан/метанол (10:1) на силикагеле.
Выход: 6,0 г (72% от теоретического).
Элементный анализ:
Рассчитано: C 63,32 H 6,76 N 10,
74
Найдено: C 62,98 H 6,91 N 10,43
г) 32-мерный N-(5-ДОЗА-ил-4-оксо-3-азагексаноил)-каскадный полиамид на основе описанного в вышеприведенном примере 3в) 32-мерного амина
8,
35 г (1 ммоль) описанного в примере 3в) 32-мерного бензилоксикарбониламина растворяют в ледяной уксусной кислоте и при перемешивании смешивают с 33%-ным бромистым водородом в ледяной уксусной кислоте.
Через 3 часа начавшееся осаждение усиливают с помощью диэтилового эфира, образовавшийся 32-амин-гидробромид промывают эфиром и сушат в вакууме.
47,8 г (64 ммоль) описанной в примере 1з) кислоты растворяют в ДМФ, смешивают с 9,8 г (64 ммоль) 1-гидроксибензотриазола с 20,5 г (64 ммоль) TBTU (фирмы Peboc Limited, Англия) и с 65,7 мл (384 ммоль) N-этилдиизопропиламина и перемешивают 20 минут при комнатной температуре. Этот раствор затем смешивают с вышеописанным (1 ммоль) 32-амингидробромидом и перемешивают 4 дня при комнатной температуре. Раствор концентрируют в вакууме, остающееся масло охлаждают в ледяной бане и смешивают с трифторуксусной кислотой, перемешивают в течение ночи при комнатной температуре и затем осаждают диэтиловым эфиром. Осадок сушат в вакууме, растворяют в воде, доводят до pH 7, очищают от низкомолекулярных долей через ультрафильтрационную мембрану YM3 Amicon® и, наконец, фильтрат фильтруют посредством мембраны и сушат вымораживанием.
Выход: 17,2 г (76,4% от теоретического).
Содержание H2O (Карл-Фишер): 7,6%.
Элементный анализ (в пересчете на безводное
вещество):
Рассчитано: C 45,73 H 6,12 N 15,08 Na 10,61
Найдено: C 45,89 H 6,30 N 14,84 Na 10,31
д) 32-мерный Gd-комплекс N-(5-ДОЗА-ил-4-оксо-3-азагексаноил)-каскадного
полиамида на основе описанного в примере 3в) 32-мерного амина
10,4 г (0,5 ммоль) описанной в предыдущем примере 3г) комплексообразующей кислоты доводят в воде до pH 3 разбавленной соляной
кислотой, смешивают с 2,89 г (8 ммоль) Gd2O3, перемешивают 30 минут при 80oC, после остывания доводят до pH 7 и обессоливают через ультрафильтрационную мембрану YM3
Amicon®. Наконец, фильтрат фильтруют через мембрану и сушат вымораживанием.
Выход: 12,1 г (91,1% от теоретического).
Содержание H2O (Карл-Фишер): 11,0%.
Определение Gd (AAS): 18,6%.
Элементный анализ (в пересчете на безводное вещество):
Рассчитано: C 40,26 H 5,39 N 13,28 Gd 21,30
Найдено: C 40,10 H 5,21 N 13,04 Gd 21,03
Аналогичным образом получают с Yb2(CO3)3 иттербиевый комплекс:
Элементный анализ (в пересчете на безводное
вещество):
Рассчитано: C 39,42 H 5,28 N 13,00 Yb 22,94
Найдено: C 39,29 H 5,40 N 12,81 Yb 22,65
Пример 4
а) Сложный эфир гексаэтиленгликольмонометилового эфира с
п-толуолсульфокислотой
К 20 г (67,49 ммоль) гексаэтиленгликольмонометилового эфира и 7,59 г (75 ммоль) триэтиламина в 200 мл хлороформа добавляют при 0oC порциями 14,3 г (75 ммоль)
хлорангидрида п-толуолсульфокислоты и перемешивают затем 4 часа при этой температуре. Упаривают в вакууме досуха и хроматографируют остаток на силикагеле (растворитель: хлороформ/метанол = 5/1).
Выход: 27,67 г (91% от теоретического) чешуйчатого, стеклообразного твердого вещества.
Элементный анализ:
Рассчитано: C 53,32 H 7,61 S 7,12
Найдено: C 53,
15 H 7,70 S 7,03
б) 1-Бензилокси-5-(бензилоксикарбонил)-2-хлоро-3-оксо-4-азапентан
К 100 г (296, 4 ммоль) сложного глицинбензилового эфира соли п-толуолсульфокислоты и 33,0 г (326,1
ммоль) триэтиламина в 400 мл метиленхлорида прибавляют по каплям при 0oC 76 г (326,1 ммоль) хлорангидрида 2-хлор-3-(бензилокси)-пропионовой кислоты (полученной согласно Inorg. Chem. Vol. 31;
2422, 1992) и перемешивают 2 часа при этой температуре. Добавляют 500 мл ледяной воды и устанавливают pH на значение 2 с помощью 10%-ной водной соляной кислоты. Органическую фазу отделяют и промывают
1 раз 5%-ной водной соляной кислотой (300 мл), 1 раз 5%-ным водным раствором соды (300 мл), 1 раз 5%-ным водным раствором соды (300 мл) и 1 раз водой (400 мл). Органическую фазу сушат над сульфатом
магния и упаривают досуха в вакууме. Остаток хроматографируют на силикагеле (растворитель: метиленхлорид/гексан/ацетон = 15/5/1).
Выход: 75,07 г (70% от теоретического) слегка желтоватого вязкого масла.
Элементный анализ:
Рассчитано: C 63,07 H 5,57 N 3,87 Cl 9,80
Найдено: C 63,17 H 5,65 N 3,75 Cl 9,63
в)
1-[4-(Бензилоксикарбонил)-1-(бензилоксиметил)-2-оксо-3- азабутил]-1,4,7,10-тетраазациклододекан
70 г (193,5 ммоль) соединения, указанного в заголовке примера 4б), и 11,1 г (64,5 ммоль) 1,4,7,
10-тетраазациклододекана растворяют в 70 мл диметилформамида и перемешивают 2 дня при 50oC. Упаривают в вакууме досуха, растворяют остаток в 700 мл воды и дважды экстрагируют хлороформом,
используя его каждый раз по 250 мл. Органическую фазу сушат над сульфатом магния и упаривают в вакууме досуха. Остаток хроматографируют на силикагеле (растворители: хлороформ/метанол/25%-ный водный
раствор аммиака = 10/5/1).
Выход: 13,16 г (41% от теоретического, в пересчете на циклен) вязкого бесцветного масла.
Элементный анализ:
Рассчитано: C 65,17 H
7,90 N 14,07
Найдено: C 65,24 H 7,77 N 14,18
г) 10-[4-(Бензилоксикарбонил)-1-(бензилоксиметил)-2-оксо-3- азабутил]-1,4,7-трис(трет-бутоксикарбонилметил)-1,4,7,10-тетраазациклододекан
(натрийбромидный комплекс)
К 13 г (26,12 ммоль) соединения, указанного в заголовке примера 4в), и 9,14 г (86,2 ммоль) карбоната натрия в 200 мл ацетонитрила прибавляют 16,81 г (86,2 ммоль)
трет-бутилового эфира бромуксусной кислоты и перемешивают 24 часа при 60oC. Охлаждают до 0oC, отфильтровывают от солей и упаривают фильтрат досуха. Остаток хроматографируют на
силикагеле (растворитель:
этиловый эфир уксусной кислоты/этанол = 15/1).
Выход: 19,46 г (79% от теоретического) воскообразного твердого вещества.
Элементный
анализ:
Рассчитано: C 57,32 H 7,38 N 7,43 Na 2,43 Br 8,47
Найдено: C 57,22 H 7,51 N 7,27 Na 2,33 Br 8,29
д) 10-[4-Карбокси-2-оксо-1-гидроксиметил-3-азабутил]-1,4,
7- трис(трет-бутоксикарбонилметил)-1,4,7,10-тетраазациклододекан (натрийбромидный комплекс)
К 19 г (20,15 ммоль) соединения, указанного в заголовке примера 4г), в 300 мл изопропанола
добавляют 3 г палладиевого катализатора (10% Pd/C) и гидрируют всю ночь при комнатной температуре. Отфильтровывают от катализатора, фильтрат упаривают в вакууме досуха и перекристаллизовывают из
ацетона.
Выход: 13,06 г (85% от теоретического) бесцветного кристаллического порошка.
Элементный анализ:
Рассчитано: C 48,82 H 7,53 N 9,18 Na 3,00 Br 10,
49
Найдено: C 48,71 H 7,68 N 9,03 Na 2,81 Br 10,23
е) 10-[4-(Бензилоксикарбонил)-1-(гидроксиметил)-2-оксо-3- азабутил] -1,4,7-трис(трет-бутоксикарбонилметил)-1,4,7,
10-тетраазациклододекан
К 13 г (17,04 ммоль) соединения, указанного в заголовке примера 4д), и 6,11 г (18,75 ммоль) безводного карбоната цезия в 70 мл диметилформамида добавляют 3,42 г (20
ммоль) бензилбромида и перемешивают всю ночь при 50oC. Охлаждают до 0oC и добавляют 700 мл воды. Затем дважды экстрагируют каждый раз с помощью 300 мл метиленхлорида.
Объединенные органические фазы промывают дважды водой, сушат над сульфатом магния и упаривают в вакууме досуха. Остаток хроматографируют на силикагеле (растворитель: этиловый эфир уксусной
кислоты/этанол).
Выход: 9,97 г (78% от теоретического) бесцветного вязкого масла.
Элементный анализ:
Рассчитано: C 60,86 H 8,47 N 9,34
Найдено: C 60,
95 H 8,61 N 9,21
ж) 10-[4-(Бензилоксикарбонил)-1-(2,5,8,11,14,17,20- гептаоксагенейкозаноил)-2-оксо-3-азабутил] -1,4,7-трис(трет- бутоксикарбонилметил)-1,4,7,10-тетраазациклододекан
9,7 г (12,93 ммоль) соединения, указанного в заголовке примера 4е), растворяют в 50 мл ТГФ и при -10oC добавляют 0,43 г (14,22 ммоль) гидрида натрия (80% в парафине). Перемешивают 30 минут
при 0oC. Затем добавляют 11,65 г (25,86 ммоль) соединения, указанного в заголовке примера 4а), и 3,46 г (25,86 ммоль) йодида лития. Перемешивают 24 часа при комнатной температуре. Осторожно
добавляют 3 мл воды и непосредственно за этим упаривают досуха. Остаток хроматографируют на силикагеле (растворитель: хлороформ/метанол = 10:1).
Выход: 12,1 г (91% от теоретического) стекловидного твердого вещества.
Элементный анализ:
Рассчитано: C 59,57 H 8,72 N 6,81
Найдено: C 59,65 H 8,91 N 6,62
з) 10-[1-(2,5,8,11,14,17,
20-гептаокса-генейкозаноил)-2-оксо-3- аза-4-(карбокси)-бутил] -1,4,7-трис(трет-бутоксикарбонилметил)-1,4,7,10- тетраазациклододекан
12 г (11,67 ммоль) соединения, указанного в заголовке
примера 4ж), растворяют в 300 мл изопропанола и добавляют 2 г палладиевого катализатора (10% Pd/C). Гидрируют всю ночь при комнатной температуре. Отфильтровывают от катализатора и фильтрат упаривают в
вакууме досуха. Остаток перекристаллизовывают из системы ацетон/диизопропиловый эфир.
Выход: 10,18 г (93% от теоретического) воскообразного твердого вещества.
Элементный анализ:
Рассчитано: C 56,33 H 8,92 N 7,46
Найдено: C 56,20 H 9,03 N 7,35
и) 24-мерный Gd-комплекс N-(5-ДОЗА-ил-4-оксо-3-аза- 7,10,13,16,19,22,
25-гептаокса-гексакозаноил)-каскадного полиамида на основе триамида N, N, N',N',N'',N''-гексакис[2-(трилизиламино)-этил]- тримезиновой кислоты
6,0 г (1 ммоль) описанного в примере 1г)
24-мерного бензилоксикарбониламина растворяют в ледяной уксусной кислоте и при перемешивании смешивают с 33%-ным бромистым водородом в ледяной уксусной кислоте. Через 3 часа начавшееся осаждение
усиливают с помощью диэтилового эфира, образовавшийся 24-амин-гидробромид промывают эфиром и сушат в вакууме.
45,03 г (48 ммоль) описанной в вышеприведенном примере 4з) кислоты растворяют в ДМФ, смешивают с 7,35 г (48 ммоль) 1-гидроксибензотриазола, с 15,41 г (48 ммоль) TBTU (фирмы Peboc Limited, Англия) и с 49,3 мл (288 ммоль) N-этилдиизопропиламина и перемешивают 20 минут при комнатной температуре. Этот раствор затем смешивают с вышеописанным (1 ммоль) 24-амингидробромидом и перемешивают 4 дня при комнатной температуре. Раствор концентрируют в вакууме, остающееся масло охлаждают в ледяной бане и смешивают с трифторуксусной кислотой, перемешивают в течение ночи и затем осаждают диэтиловым эфиром. Осадок сушат в вакууме, растворяют в воде, доводят разбавленной соляной кислотой до pH 3, смешивают с 8,70 г (24 ммоль) Gd2O3, перемешивают 4 часа при 80oC, после остывания доводят pH до значения 7 и очищают от низкомолекулярных долей через ультрафильтрационную мембрану YM3 Amicon® и, наконец, фильтрат фильтруют через мембрану и сушат вымораживанием.
Выход: 19,6 г (73,3% от теоретического).
Содержание H2O (Карл-Фишер): 8,3%.
Определение Gd (AAS): 14,0%.
Элементный анализ (в пересчете на безводное вещество):
Рассчитано: C 43,
94 H 6,38 N 9,43 Gd 15,39
Найдено: C 44,27 H 6,22 N 9,29 Gd 15,09
Пример 5
а) 1,7-Бис(трифторацетил)-1,4,7-триазагептан
В раствор 41,14 г (390 ммоль) 1,4,
7-триазагептана в 350 мл тетрагидрофурана добавляют по каплям при 80oC и в атмосфере азота 113,3 г (790 ммоль) этилового эфира трифторуксусной кислоты. Оставляют на ночь перемешиваться при
комнатной температуре, концентрируют в вакууме. Остающееся масло кристаллизуют из гексана.
Выход: 115 г (99,9% от теоретического).
Точка плавления: 68-70o C.
Элементный анализ:
Рассчитано: C 32,55 H 3,76 F 38,62 N 14,24
Найдено: C 32,63 H 3,75 F 38,38 N 14,19
б) 1,7-Бис(трифторацетил)-4-бензилоксикарбонил-1,4,
7-триазагептан
В 120 мл дихлорметана растворяют 14,75 г (50 ммоль) полученного в примере 5а) трифторацетильного соединения, а также 8,3 мл (60 ммоль) триэтиламина и охлаждают до 0o
C. Затем при перемешивании добавляют по каплям 7,5 мл (53 ммоль) бензилового эфира хлормуравьиной кислоты (97%), растворенного в 20 мл дихлорметана. Оставляют на ночь перемешиваться при комнатной
температуре, экстрагируют соли дистиллированной водой, сушат дихлорметановый раствор над сульфатом натрия, концентрируют в вакууме досуха и кристаллируют остаток из смеси эфир/гексан.
Выход: 18,40 г (85,7% от теоретического).
Точка плавления: 131-132oC.
Элементный анализ:
Рассчитано: C 44,76 H 3,99 F 26,55 N 9,79
Найдено: C 44,87 H 4,03 F 26,62 N 9,61
в) Ди-трет-бутиловый эфир 3,9-бис(трет-бутоксикарбонилметил)-6- бензилоксикарбонил-3,6,9-триазаундекандикарбоновой кислоты
В 30 мл этанола
растворяют 4,29 г (10 ммоль) полученного в примере 5б) трифторацетильного производного и смешивают с 800 мг (20 ммоль) едкого натрия в 10 мл дистиллированной воды. Перемешивают 3 часа при комнатной
температуре, концентрируют в вакууме на бане при температуре 40oC досуха, удаляют остатки воды азеотропной перегонкой с изопропанолом и растворяют в 30 мл диметилформамида. После этого
добавляют 6,9 г (50 ммоль) карбоната калия, а также 9,7 г (50 ммоль) третбутилового эфира бромуксусной кислоты и алкилируют 4-бензилоксикарбонил-1,4,7-триазагептан при комнатной температуре в течение
ночи. Диметилформамид отсасывают посредством масляного вакуумного насоса, остаток распределяют между водой и дихлорметаном, органический раствор сушат над сульфатом натрия, концентрируют в вакууме
досуха и очищают остаток хроматографически на силикагеле. Смесью уксусный эфир/гексан элюируют соединение, указанное в заголовке, получая его в виде пены.
Выход: 6,49 г (93,6% от теоретического).
Элементный анализ:
Рассчитано: C 62,32 H 8,57 N 6,06
Найдено: C 62,41 H 8,66 N 6,01
г) Ди-трет-бутиловый эфир 3,
9-бис(трет-бутоксикарбонилметил)-3,6,9-триазаундекандикарбоновой кислоты
В 100 мл этанола растворяют 3,5 г (5 ммоль) полученного в примере 5в) соединения, смешивают с 200 мг катализатора
Перльмана (Pd 20% на активированном угле) и гидрируют до поглощения рассчитанного количества водорода. Отсасывают от катализатора и концентрируют в вакууме досуха. Соединение, указанное в заголовке,
получают в виде белой пены.
Выход: 2,80 г (99,9% от теоретического).
Элементный анализ:
Рассчитано: C 60,08 H 9,54 N 7,51
Найдено: C 60,02 H 9,62 N
7,56
д) Ди-трет-бутиловый эфир 3,9-бис(трет-бутоксикарбонилметил)- 6-[1-(этоксикарбонил)-этил]-3,6,9-триазаундекандикислоты
В 30 мл диметилформамида растворяют 5,60 г (10 ммоль)
полученного в примере 5г) аминного соединения. Затем добавляют при комнатной температуре 1,66 г (12 ммоль) карбоната калия, а также 2,17 г (12 ммоль) этилового эфира 2-бромпропионовой кислоты и
перемешивают в течение ночи. Затем выливают на ледяную воду, экстрагируют уксусным эфиром, сушат органическую фазу над сульфатом натрия, концентрируют в вакууме досуха и посредством хроматографии на
силикагеле получают соединение, указанное в заголовке. Элюентом служит смесь уксусного эфира и гексана.
Выход: 4,18 г (63,4% от теоретического).
Элементный анализ:
Рассчитано: C 60,07 H 9,32 N 6,37
Найдено: C 60,18 H 9,40 N 6,31
е) Ди-трет-бутиловый эфир 3,9-бис(трет-бутоксикарбонилметил)- 6-[1-(карбокси)-этил]-3,6,
9-триазаундекандикислоты
В 50 мл этанола растворяют 6,60 г (10 ммоль) полученного в примере 5д) соединения. Затем добавляют раствор 400 мг (10 ммоль) гидроксида натрия в 5 мл дистиллированной
воды и перемешивают 3 часа при 50oC. Как показывает тонкослойная хроматограмма, омыление происходит количественно. Концентрируют в вакууме досуха, удаляют следы воды посредством совместной
перегонки с этанолом и сушат остаток при 40oC. Соединение, указанное в заголовке, получают в виде белого порошка. Оставшийся белый остаток растворяют в 80 мл влажного этанола (9:1) и при
перемешивании смешивают с раствором 535 мг (10 ммоль) хлористого аммония в 10 мл дистиллированной воды. Концентрируют в вакууме досуха, растворяют растворимую часть в бутаноле и еще раз концентрируют
в вакууме досуха. Остаток экстрагируют толуолом. Концентрируют органический раствор в вакууме досуха получают соединение, указанное в заголовке, в виде пены.
Выход: 5,35 г (84,7% от теоретического).
Элементный анализ:
Рассчитано: C 58,93 H 9,09 N 6,65
Найдено: C 59,01 H 9,16 N 6,60
ж) 24-мерный N-{N,N-бис[2-N,
N-бис(карбоксиметил)-аминоэтил]- аланил}-каскадный полиамид на основе триамида N, N, N', N',N'',N''-гексакис[2-(трилизиламино)-этил]-тримезиновой кислоты, натриевая соль
6,0 г (1 ммоль)
описанного в примере 1г) поли-бензилоксикарбониламина растворяют в ледяной уксусной кислоте и при перемешивании смешивают с 33%-ным бромистым водородом в ледяной уксусной кислоте. Через 3 часа
начавшееся осаждение усиливают с помощью диэтилового эфира, образовавшийся 24-амин-гидробромид промывают эфиром и сушат в вакууме.
30,33 г (48 ммоль) описанной в вышеприведенном примере 5е) кислоты растворяют в ДМФ, смешивают с 7,35 г (48 ммоль) 1-гидроксибензотриазола, с 15,41 г (49 ммоль) TBTU (фирмы Peboc Limited, Англия) и с 49,3 мл (288 ммоль) N-этилдиизопропиламина и перемешивают 20 минут при комнатной температуре. Этот раствор затем смешивают с вышеописанным (1 ммоль) 24-амин-гидробромидом и перемешивают 4 дня при комнатной температуре. Раствор концентрируют в вакууме, остающееся масло охлаждают в ледяной бане и смешивают с трифторуксусной кислотой, перемешивают в течение ночи при комнатной температуре и затем осаждают диэтиловым эфиром. Осадок сушат в вакууме, растворяют в воде, доводят до pH 7, очищают от низкомолекулярных долей через ультрафильтрационную мембрану YM3 Amicon® и, наконец, фильтрат фильтруют посредством мембраны и сушат вымораживанием.
Выход: 11,0 г (86,3% от теоретического).
Содержание H2O (Карл-Фишер): 8,2%.
Элементный анализ (в пересчете на
безводное вещество):
Рассчитано: C 42,87 H 5,41 N 11,96 Na 12,08
Найдено: C 42,78 H 5,66 N 12,11 Na 11,89
з) 24-мерный Gd-комплекс N-{N,N-бис[2-(N,
N-бис(карбоксиметил)-аминоэтил] -аланил} -каскадного полиамида на основе триамида N,N,N',N',N'',N''-гексакис[2-(трилизиламино)-этил]-тримезиновой кислоты, натриевая соль
8,13 г (0,5 ммоль)
описанной в предшествующем примере 5ж) комплексообразующей кислоты доводят до pH 3 в воде разбавленной соляной кислотой, смешивают с 2,17 г (6 ммоль) Gd2O3, перемешивают 30 минут
при 80oC, после остывания доводят до pH 7 и обессоливают через ультрафильтрационную мембрану YV3 Amicon®. Наконец, фильтрат фильтруют посредством мембраны и сушат
вымораживанием.
Выход: 8,0 г (90,5% от теоретического).
Содержание H2O (Карл-Фишер): 7,5%.
Определение Gd (AAS): 21,0%.
Элементный анализ (в пересчете на безводное вещество):
Рассчитано: C 35,93 H 4,38 N 10,03 Gd 23,09 Na 3,38
Найдено: C 35,71 H 4,65 N 9,88 Gd 22,84 Na 3,50
Пример 6
а) Ди-трет-бутиловый эфир 3,9-бис(трет-бутоксикарбонилметил)-6-бензилоксикарбонилметил-3,6,9- триазаундекандикислоты
В 30 мл диметилформамида растворяют 5,60 г (10 ммоль) полученного в
примере 5г) аминного соединения. Затем добавляют при комнатной температуре 1,66 г (12 ммоль) карбоната калия, а также 2,58 г (12 ммоль) бензилового эфира бромпропионовой кислоты и перемешивают в
течение ночи. Затем выливают на ледяную воду, экстрагируют уксусным эфиром, органическую фазу сушат над сульфатом натрия, концентрируют в вакууме досуха и хроматографически на силикагеле получают
соединение, указанное в заголовке. Элюентом служит смесь уксусного эфира и гексана.
Выход: 6,32 г (89,3% от теоретического).
Элементный анализ:
Рассчитано: C
64,65 H 9,00 N 5,95
Найдено: C 64,62 H 9,07 N 5,90
б) Ди-трет-бутиловый эфир 3,9-бис(трет-бутоксикарбонилметил)-6-карбоксиметил-3,6,9- триазаундекандикислоты
В 100 мл
этанола растворяют 7,08 г (10 ммоль) полученного в примере 6а) бензилового эфира и смешивают с 0,4 г катализатора Перльмана (Pd 20%, C). Гидрируют до поглощения 224 мл водорода, отсасывают от
катализатора, хорошо промывают этанолом и концентрируют раствор в вакууме досуха. Продукт получают в виде пены, которую кристаллизуют из смеси эфир/гексан.
Выход: 6,87 г (97,3% от теоретического).
Точка плавления: 73-75oC.
Элементный анализ:
Рассчитано: C 57,85 H 9,00 N 5,95
Найдено: C 57,91 H 9,11 N 6,01
в) 32-мерный N-{N,N-бис[2-(N,N-бис(карбоксиметил)-аминоэтил]- глицил}-каскадный полиамид на основе описанного в примере 3в) 32-мерного амина, натриевая соль
8,35 г (1 ммоль) описанного в
примере 3в) 32-мерного бензилоксикарбониламина растворяют в ледяной уксусной кислоте и при перемешивании смешивают с 33%-ным бромистым водородом в ледяной уксусной кислоте. Через 3 часа начавшееся
осаждение усиливают с помощью диэтилового эфира, образовавшийся 32-амин-гидробромид промывают эфиром и сушат в вакууме.
39,5 г (64 ммоль) описанной в вышеприведенном примере 6б) кислоты растворяют в ДМФ, смешивают с 9,8 г (64 ммоль) 1-гидроксибензотриазола, с 20,5 г (64 ммоль) TBTU (фирмы Peboc Limited, Англия) и с 65,7 мл (384 ммоль) N-этилдиизопропиламина и перемешивают 20 минут при комнатной температуре. Этот раствор затем смешивают с вышеописанным (1 ммоль) 32-амин-гидробромидом и перемешивают 4 дня при комнатной температуре. Раствор концентрируют в вакууме, остающееся масло охлаждают в ледяной бане и смешивают с трифторуксусной кислотой, перемешивают в течение ночи и затем осаждают диэтиловым эфиром. Осадок сушат в вакууме, растворяют в воде, доводят до pH 7, очищают от низкомолекулярных долей через ультрафильтрационную мембрану YM3 Amicon® и, наконец, фильтрат фильтруют через мембрану и сушат вымораживанием.
Выход: 15,7 г (78,6% от теоретического).
Содержание H2O (Карл-Фишер): 9,0%.
Элементный анализ (в пересчете на безводное вещество):
Рассчитано: C 41,77 H
5,24 N 12,33 Na 12,14
Найдено: C 41,49 H 5,36 N 12,49 Na 11,93
г) 32-мерный Gd-комплекс N-{N,N-бис[2-(N,N-бис(карбоксиметил))- аминоэтил]-глицил}-каскадного полиамида на основе
описанного в примере 3в) 32-мерного амина, натриевая соль
10,0 г (0,5 ммоль) описанной в предшествующем примере 6в) комплексообразующей кислоты доводят в воде до pH 3 разбавленной соляной
кислотой, смешивают с 2,89 г (8 ммоль) Gd2O3, перемешивают 30 минут при 80oC, после остывания доводят до pH 7 и обессоливают через ультрафильтрационную мембрану YM3
Amicon®. Наконец, фильтрат фильтруют через мембрану и сушат вымораживанием.
Выход: 10,9 г (90,9% от теоретического).
Содержание H2O (Карл-Фишер): 9,5%.
Определение Gd (AAS): 20,9%.
Элементный анализ (в пересчете на безводное вещество):
Рассчитано: C 34,98 H 4,24 N 10,33 Gd 23,19 Na 3,
39
Найдено: C 35,20 H 4,08 N 10,46 Gd 22,89 Na 3,60
Пример сравнения in-vivo с внеклеточными контрастными веществами
Следующий опыт показывает пригодность описанного в
примере 1л) соединения в качестве агента кровяного депо (blood-pool-agent).
Подопытными животными служат пять крыс-самцов (Schering-SPF) весом 300-350 г каждое. Перед опытом вскрывают брюшную полость, кишечник перемещают и затем через заднюю брюшину перевязывают хирургической иглой почечные (артериальные + венозные) сосуды обеих сторон. Сразу за этим брюшную полость снова закрывают. После этого каждому животному вводят внутривенно 0,3 мл (соответственно, 50 ммоль/л) следующего раствора контрастных веществ: смесь из 1 части соединения из примера 1л), ниже называемого соединением 1, и 1 части диспрозиевого комплекса 10-(1-гидроксиметил-2,3-дигидроксипропил)-1,4,7- трис(карбоксиметил)-1,4,7,10-тетраазациклододекана, полученного аналогично заявке на европейский патент EP 448191, далее называемого соединением 2. Катетером через сонную артерию отбирают пробы крови в следующие моменты времени: 15, 30, 45, 60, 90 сек, 3, 5, 10, 15 мин после инъекции (p. i). В отобранных пробах крови параллельно измеряются концентрации гадолиния (Gd) и диспрозия (Dy) посредством атомно-эмиссионной спектрометрии (ICP-AES). Оставшуюся в кровяном пространстве долю инъецированных контрастных веществ - соединения 1 (Gd) и соединения 2 (Dy, вещество сравнения) - можно сравнивать, благодаря различной маркировке в одном и том же животном. Так как почечное выделение невозможно, то падение концентрации этих веществ в крови может быть объяснено только распределением по кровяным пространствам и диффузией в межуточную ткань.
Результаты: Диффузия соединения 1 в промежуточное пространство в сравнении с внеклеточным контрастным веществом (соединение 2) заметно замедлена (см. фиг. 1).
Внеклеточное вещество (соединение 2) диффундирует так быстро в межуточные пространства тела, что уже через 3-5 минут после инъекции (p.i) достигается равновесие (на что указывает постоянный уровень этого вещества в крови). В противоположность этому, в случае каскадных полимеров (соединение 1), измерения показывают не только постоянно более высокие концентрации в крови (что указывает на меньший объем распределения), но также и то, что даже в течение всего периода исследования (15 минут) равновесие не наступает (что указывает на протекающую лишь очень медленно диффузию в межуточную ткань). Это означает, что соединение 1 ведет себя как контрастное вещество кровяного депо.
Пример МР-ангиографии на кролике
Указанное в примере 1л) соединение исследовалось на кролике (CH. R. Kisslegg,
вес тела = 4 кг) в эксперименте по МР-ангиографии (Магнитно-резонансная томография всего тела, система Сименс, 1,5 тесла, FISP 3D (трехмерная), TR: 400 миллисекунд; ТЕ: 15 миллисекунд; угол поворота:
45o; корональная).
На контрастном снимке (см. фиг. 2), сделанном до инъекции, видны лишь один-два крупных сосуда (например, брюшная аорта) при относительно слабом контрасте (интенсивность сигнала этих сосудов по отношению к сигналу фона). После внутривенного введения описанного в примере 1л) соединения в количестве, соответствующем 50 мкмоль Gd/кг веса тела, видно заметное усиление контраста (интенсивность сигнала/интенсивность фона) и большое число мелких и мельчайших кровяных сосудов (например, A. и V. femoralis, A. и V. mesenterica caudalis, A и V. renalis, A. и V. subrenalis и т.д.), которые до введения контрастных веществ нельзя было обнаружить.
Пример накопления контрастных веществ в лимфатических узлах морской свинки
Указанное в примере 1л) соединение согласно изобретению исследовалось на накопление его в лимфатических узлах трех последовательных (подколенной, паховой и подвздошной) областей в моменты времени от
30 мин до 24 часов после подкожного введения (10 мкмоль гадолиния на 1 кг веса тела, подкожно в заднюю лапу) на стимулированных морских свинках (полный адъювант Фройнда; соответственно по 0,1 мл
внутримышечно в правое и левое бедро и голень; за две недели до введения испытуемых веществ). При этом были получены результаты, приведенные в таблице (определение концентрации гадолиния производилось
посредством ICP-AES).
Реферат
Описываются новые каскадные
полимерные комплексы, содержащие а) комплексообразующие лиганды общей формулы I A-{X-[Y-(Z-
Формула
A-{X-[Y-(Z-
где А - атом азота, азотсодержащее каскадное ядро основной мультиплетности а:







или

где m и n = 1 - 10;
p = 0 - 10;
U1 обозначает Q1 или Е;
U2 обозначает Q2 или Е, причем Е имеет значение группы

где о = 1 - 6;
Q1 - атом водорода или Q2;
Q2 - прямая связь;
М - С1 - C10 - алкиленовая цепь, при необходимости прерванная 1 - 3 атомами кислорода и/или при необходимости замещенная 1 - 2 оксогруппами,
R0 - разветвленный или линейный C1 - C10 - алкильный остаток, нитро-, амино-, карбоксильная группа или M-N<(U1)U2, причем Q2 соответствует основной мультиплетности а;
X и Y независимо друг от друга - прямая связь или повторяющееся в каскаде звено повторяющейся мультиплетности x или соответственно у,
Z и W независимо друг от друга повторяющееся в каскаде звено повторяющейся мультиплетности z или соответственно w, при этом повторяющиеся звенья X, Y, Z и W - независимо друг от друга обозначают Е,

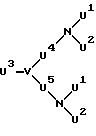

где U1 обозначает Q1 или Е; U2 обозначает Q2 или Е, причем Е имеет значение группы

где о = 1 - 6;
Q1 - атом водорода или Q2;
Q2 - прямая связь;
U3 - C1 - C20 - алкиленовая цепь, при необходимости прерванная от 1 до 10 атомами кислорода и/или от 1 до 2 остатками - N(CO)qR2 -, от 1 до 2 фенилен- и/или от 1 до 2 фениленоксиостатками и/или, при необходимости, замещенная от 1 до 2 алкилкарбокси-, C1 - C5-алкокси, гидрокси- или C1 - C5-алкильными группами, при этом q = 0 или 1 и R2 - атом водорода, метиловый или этиловый остаток, при необходимости, замещенный 1 - 2 гидроксигруппами или 1 карбоксигруппой,
L - атом водорода или группа

V - метиновая группа


если U4 и U5 одновременно идентичны и обозначают прямую связь или группу М;
К - остаток комплексообразователя, который присоединен к концевым атомам азота последней генерацией повторяющегося звена W, обозначает остаток общих формул IА или IВ


где R1 - независимо один от другого атом водорода или эквивалент иона металла порядковых номеров 57 - 83;
R2 - атом водорода, метиловый или этиловый остаток, при необходимости, замещенный 1 - 2 гидроксигруппами или 1 карбоксигруппой,
R3 - группа

R4 - линейная, разветвленная, насыщенная или ненасыщенная C1-C30-алкильная цепь, при необходимости, прерванная 1 - 10 атомами кислорода, 1 фенилен-, 1 фениленоксигруппой и/или, при необходимости, замещенная 1 - 5 гидрокси-, 1 - 3 карбокси-, 1 фенильной группой (группами);
R5 - атом водорода или R4;
U6 - линейная, разветвленная, насыщенная или ненасыщенная C1-C20-алкиленовая группа, при необходимости, содержащая 1 - 5 имино-, 1 - 3 фенилен-, 1 - 3 фениленокси-, 1 - 3 фениленимино-, 1 - 5 амидо-, 1 - 2 гидразидо-, 1 - 5 карбонил-, 1 - 5 этиленокси-, 1-мочевино-, 1 - 2 карбоксиалкилимино-, 1 - 2 сложноэфирные группы, 1 - 10 атомов кислорода, 1 - 5 атомов азота и/или при необходимости замещенная 1 - 5 гидрокси-, 1 - 5 оксо-, 1 - 3 карбокси-, 1 - 5 карбоксиалкил-, 1 - 5 сложноэфирными и/или 1 - 3 аминогруппами, при этом содержащиеся, при необходимости, фениленовые группы могут быть замещены 1 - 2 карбокси-, или 1 - 2 гидроксигруппами;
Т - группа -CO-α, -NHCS-α- или -NHCO-α, α - место присоединения к концевым атомам азота последней генерации повторяющегося звена W;
а = 2 - 12;
x, y, z и w - независимо друг от друга числа от 1 до 4, при условии, что по меньшей мере два повторяющихся звена различны и при этом произведение мультиплетностей
16 ≅ a•x•y•z•w ≅ 64,
б) по меньшей мере 16 ионов элемента порядковых номеров 57 - 83, в) при необходимости катионы неорганических и/или органических оснований, аминокислот или амидов аминокислот, а также г) при необходимости ацилированные концевые аминогруппы.
-CH2CH2O- и/или замещена группами -COOH, -CH2COOH.
-CH2NHCOCH2 CH(CH2CO2H)C6H4-, -CH2NHCOCH2 OCH2-, -CH2NHCOCH2C6H4-. 4. Каскадные полимерные комплексы по п.3, отличающиеся тем, что содержащиеся в повторяющихся звеньях каскада X, Y, Z и W остатки обозначают
U3 - -CO-, -COCH2 OCH2CO-, -COCH2-, -CH2CH2-, -CONHC6H4-, -COCH2CH2CO-, -COCH2-CH2CH2CO-, -COCH2CH2CH2CH2CO-,
U4 - прямую связь, -CH2CO-,
U5 - прямую связь, -(CH2)4-, -CH2CO-, -CH(COOH)-, CH2OCH2CH2-, -CH2C6H4-, -CH2C6H4OCH2CH2-,

5. Каскадные полимерные комплексы по п.3, отличающиеся тем, что каскадорепродукционные единицы X, Y, Z и W независимо одна от другой обозначают:
-CH2CH2NH-;
-CH2CH2-N<;
-COCH(NH-)(CH2)4NH-;
-COCH(N<)(-CH2)4N<;
-COCH2OCH2CON(CH2CH2NH-)2;
-COCH2OCH2CON(CH2CH2N<)2;
-COCH2N(CH2CH2NH-)2;
-COCH2N(CH2CH2N<)2;
-COCH2NH-;
-COCH2N<;
-COCH2CH2CON(CH2CH2 NH-)2;
-COCH2CH2CON(CH2CH2N<)2;
-COCH2OCH2CONH-C6H4-CH[CH2CON(CH2CH2NH-)2]2;
-COCH2OCH2CONH-C6H4-CH[CH2CON(CH2CH2N< )2]2;
-COCH2CH2CO-NH-C6H4-CH[CH2CON(CH2CH2NH-)2]2;
-COCH2CH2CO-NH-C6H4-CH[CH2CON(CH2CH2N<)2]2;
-CONH-C6H4-CH[CH2 CON(CH2CH2NH-)2]2;
-CONH-C6H4-CH[CH2CON(CH2CH2N<)2]2;
-COCH(NH-)CH(COOH)NH-;
-СOCH(N<)CH(COOH)N<;










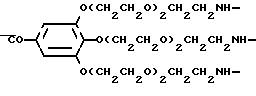
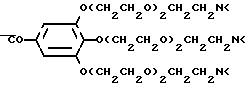
6. Каскадные полимерные комплексы по п.1, отличающиеся тем, что обозначают: m - число 1 - 3, n - число 1 - 3, о - число 1, р - число 0 - 3, M - -CH2-, -СО- или -CH2CO-группу и R0-CH2N U1U2-, CH3- или NO2-.

где R1′ - независимо друг от друга атом водорода, или эквивалент иона металла порядковых номеров 57 - 83 или кислотозащитная группа;
R2 - атом водорода, метиловый или этиловый остаток, при необходимости замещенный 1 - 2 гидрокси- или 1 карбоксигруппой;

R4 - линейная, разветвленная, насыщенная или ненасыщенная C1-C30-алкильная цепь, при необходимости, прерванная 1 - 10 атомами кислорода, 1 фенилен-, 1 фениленоксигруппами и/или, при необходимости, замещенная 1 - 5 гидрокси-, 1 - 3 карбокси-, 1 фенильной группой (группами);
U6 - линейная, разветвленная, насыщенная или ненасыщенная C1-C20-алкиленовая группа, при необходимости, содержащая 1 - 5 амино-, 1, 3 фенилен-, 1 - 3 фениленокси-, 1 - 3 фениленимино-, 1 - 5 амидо-, 1 - 2 гидразидо-, 1 - 5 карбонил-, 1 - 5 этиленокси, 1-мочевино, 1 - 2 карбоксиалкилимино-, 1 - 2 сложноэфирные группы, 1 - 10 атомов кислорода, 1 - 5 атомов азота и/или, при необходимости, замещенная 1 - 5 гидрокси, 1 - 5 оксо-, 1 - 3 карбокси-, 1 - 5 карбоксиалкил-, 1 - 5 сложноэфирными и/или 1 - 3 аминогруппами, при этом содержащиеся, при необходимости, фениленовые группы могут быть замещены 1 - 2 карбокси, или 1 - 2 гидроксигруппами;
T' - C* O-, -COOH, -N=C=S или -N=C=O группа и C*O - активированная карбоксильная группа.

Комментарии