Производные 2-(2,6-дигалофениламино)фенилуксусной кислоты и способ их получения - RU2109009C1
Код документа: RU2109009C1
Чертежи

Описание
Изобретение относится к сложным эфирам азотной кислоты производных 2-(2, 6-дигалофениламино)фенилуксусной кислоты, их использованию в фармацевтике и способу их получения.
Известен способ получения натриевой соли 2-(2,6- дихлорофениламино)фенилуксусной кислоты, которая уже в течение длительного времени используется в фармацевтике ввиду ее противовоспалительного действия и выпускается в продажу как товарный продукт во всем мире в течение многих лет [1 и 2].
Спектр фармакологического действия и эффективность натриевой соли 2-(2,6-дихлорофениламино)фенилуксусной кислоты описываются в Am. J.Med.80, Suppi. 4В, 1-87 (1986), в то время как другие данные, касающиеся фармакологического действия как противовоспалительного средства приводятся, например, в С.А.74, 86215 m (1971); Krupp et al. Experimentia 29, 450 (1973).
Использование 2-(2,6-дихлорофениламино)фенилуксусной кислоты как противовоспалительного препарата, как известно, вызывает очень сильные обратные реакции, например, нежелательные эффекты в кишечно-желудочном тракте, а также повреждения печени и почек. Проведено множество экспериментов (S.Moncada, R. M.J.Palmer, E.A.Higgs, Pharmacological Reviews, 43(2), 109-142 (1991); T. F. Lusher, C.M.Boulanger, Y.Dohi, Z.Yang, Hypertension, 19, 117-130 (1992)), на основании которых можно утверждать, что целостность сосудистого эндотелия действует как наиболее важный защитный барьер, позволяющий не допустить начала патологических реакций в различных органах и системах. Такой защитный барьер и, следовательно, целостность сосудистого эндотелия в физиологическом плане гарантируется присутствием азотной кислоты и простациклином.
Лечение лекарствами, обладающими противовоспалительным действием, такими как, например, натриевая соль 2-(2, 6-дихлорофениламино)фенилуксусной кислоты, вызывает ингибирование цикло-оксигеназы, фермента, который определяет синтез предшественника простациклина. Вследствие этого при ингибировании таким путем простациклина клеточный резерв его значительно истощается, что вызывает опасность для сосудистого эндотелия.
Как уже говорилось, ввиду указанного эндотелиального повреждения за счет истощения простациклина диффузионные патологические реакции проявляются с большой силой, что оказывает воздействие на желудочнокишечный тракт, печень и почки.
Объектом изобретения является продукт, который, обеспечивая неизменность характеристик фармакологического действия известных противовоспалительных препаратов, может устранять также нежелательные реакции, вызванные лечением данными препаратами.
Другим объектом изобретения является осуществление способа получения производных 2-(2,6-дигалофениламино)фенилуксусной кислоты, обладающих противовоспалительным действием и которые лишены тех нежелательных реакций, которые типичны для противовоспалительных лекарств.
Эти и другие объекты и преимущества, которые даны в
нижеследующем описании, достигаются благодаря производным 2-(2,б-ди-галофениламино) фенилуксусной кислоты, которые согласно изобретению имеют следующую общую формулу:
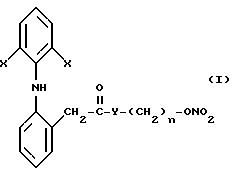
в которой
X представляет собой галоген, выбранный из числа хлора и брома;
Y выбран из числа кислорода, NH, NR1 где R1 представляет собой линейную или разветвленную группу алкила, и
n является числом от 1 до 10.
Фактически установлено, что ввод такой группы, как концевая группа сложного эфира азотной кислоты в производные 2-(2,6- дигалофениламино) фенилуксусной кислоты как в (1), позволяет сохранить фармакологическое действие противовоспалительных лекарств, с одновременным устранением нежелательных реакций, вызванных лечением указанными лекарственными препаратами.
Было отмечено, что соединения (1) могут найти полезное применение для лечения различных заболеваний, таких как ревматические заболевания, иммунологические нарушения, и могут также облегчить болевые ощущения низкой-средней силы любого типа.
Кроме того, соединения (1), составляющие объект изобретения, находят полезное применение для лечения заболеваний сердечно-сосудистой системы и мозговой ишемии, а также для лечения артериального тромбоза.
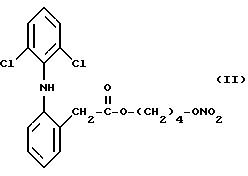
Согласно изобретению особенно большую ценность имеет сложный эфир азотной кислоты производного 2-(2,6-дигалофениламино) фенилуксусной кислоты (I), в котором X представляет
собой хлор, Y
представляет собой кислород и n равно 4, отвечающий следующей формуле:
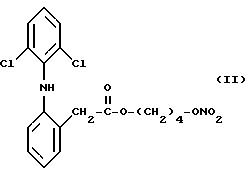
Кроме того,
особенно желательным соединением согласно изобретению является сложный эфир азотной кислоты производного 2-(2,6- дигалофениламино)фенилуксусной кислоты (I), в котором X представляет
собой хлор, Y
представляет собой кислород и n равно 2, который отвечает следующей формуле:
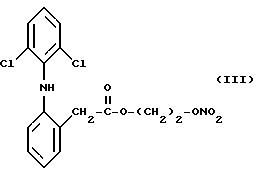
Для
получения производных (1) 2-(2,6- дигалофениламино)фенилуксусной кислоты, представляющей объект изобретения, наиболее предпочтителен первый способ, который согласно изобретению включает
следующие
фазы:
реакцию между натриевой солью 2-(2,6-дигалофениламино)фенилуксусной кислоты или 2-(2,6-дигалофениламино)фенилуксусной кислоты с функциональной группой карбоновой кислоты и
соединением,
имеющим следующую общую формулу:
R4-(CH2)n-R3, (IV)
в которой
R4 выбран из числа хлора, брома, NHR, где
R представляет
собой водород или линейную или разветвленную алкильную цепь;
R3 выбран из числа хлора, брома и иода, и n составляет от 1 до 10, карбоксильная группа 2-(2,
6-дигалофениламино)фенилуксусной кислоты функционализирована как ациловый хлорид, ангидрид и т.д., в результате чего получается соответствующий мономерный сложный эфир или соответствующий амид;
реакцию указанного мономерного сложного эфира или соответствующего амида с нитратирующим агентом, таким как AgNO3 или аналогичное соединение, в результате чего получаются сложные
эфиры азотной кислоты производных 2 - (2,6-дигалофениламино)фенилуксусной кислоты (1).
Второй способ, также наиболее желательный, отвечающий изобретению, включает следующие фазы:
реакцию между натриевой солью 2-(2,6-дигалофениламино)фенилуксусной кислоты или 2-(2,6-дигалофениламино)фенилуксусной кислоты, функционализированной карбоксильной группой, с соединением, имеющим
следующую общую формулу:
R4-(CH2)n-OH, (V)
в которой
R4 выбран из числа хлора, брома, NHR, где R представляет собой водород или
линейную или разветвленную алкильную цепь, и n составляет от 1 до 10, карбоксильная группа 2-(2,6-дигалофениламино) фенилуксусной кислоты функционализирована как акриловый хлорид, ангидрид и другие,
в
результате чего получается соответствующий мономерный сложный эфир соответствующего амида;
реакцию указанного мономерного сложного эфира или соответствующего амида с галогенирующим
соединением, таким как PBr3 или другие аналогичные соединения, в результате чего получается мономерный сложный эфир или амид, отличающийся присутствием концевой галогеновой группы;
реакцию указанного мономерного сложного эфира или амида, отличающегося присутствием концевой галогеновой группы, с нитратирующим агентом, таким как AgNO3 и другие аналогичные соединения,
в
результате чего получаются сложные эфиры азотной кислоты производных 2-(2,6- дигалофениламино) фенилуксусной кислоты (1).
Растворители, используемые при осуществлении способа изобретения, выбраны предпочтительно из числа хлороформа, метиленхлорида, ацетонитрила, диметилформамида, тетрагидрофурана, диоксана и т.д.
Такие способы получения производных 2-(2, 6-дигалофениламино) фенилуксусной кислоты (1), отвечающей изобретению, состоят из ограниченного числа фаз, позволяющих получить продукты при осуществлении такого процесса, с высокой скоростью, с удовлетворительными выходами и в больших количествах, даже в промышленных масштабах.
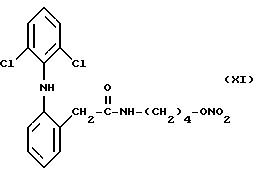
Согласно способу изобретения особенно успешно осуществляется получение сложных эфиров азотной
кислоты производных 2- (2,6-дихлорофениламино)фенилуксусной кислоты, имеющих следующие формулы:
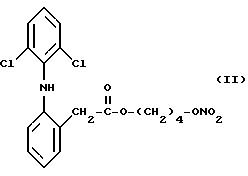
и
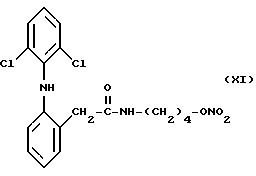
которые получаются как описано в нижеследующих примерах.
Пример 1.
а) 6 г 1-бром-4-хлор-бутана, разбавленного в 250 мл диметилформамида, вводили по каплям в раствор 10 г натриевой соли 2- (2,6-дихлорофениламино) фенилуксусной кислоты в 100 мл диметилформамида. Реакционная смесь перемешивалась в течение 12 ч. при комнатной температуре, затем разбавлялась водой и экстрагировалась метиленхлоридом. Экстрагированная таким образом органическая фаза обезвоживалась на сульфате натрия, и растворитель выпаривался при пониженном давлении до тех пор, пока не было получено 14 г остаточного продукта.
Этот остаточный продукт очищался методом хроматографии на силикагеле с использованием хлороформа в качестве элюента.
Затем головные фракции собирались, и выпаривание растворителя при пониженном давлении давало 11 г сухого остаточного продукта, который подвергался снова хроматографическому разделению на силикагеле с использованием в качестве элюента смеси, состоящей из гексана/простого эфира в соотношении 7/3 (об./об.).
Головные фракции собирались, растворитель выпаривался при пониженном давлении и получалось 3 г 2-(2,6- дихлорофениламино)фенилацетата-4 - хлоробутила (VIII).
ИК-спектр (см-1: C=0,1741; NH, 3340.
Спектр1Н-ЯМР (300 МГц) (CDCl3): 1,9 частей на миллион (м., 4H); 3,6 частей на миллион (м.,2H); 3,85 частей на миллион (с., 2H); 4,2 частей на миллион (м., 2H); 6,5-7,45 частей на миллион (м., ароматика).
Масс-спектрометрия (i.e): М+ 385.
б) 1, 2 г AgNO3, разбавленного в 11 мл ацетонитрила, вводили по каплям в 2 г (VIII), полученного как описано в а), разбавленного в 7 мл ацетонитрила. Реакционная смесь перемешивалась в течение 12 ч. при 85o C и затем фильтровалась.
Растворитель выпаривался при низком давлении из полученного раствора, и получался остаточный продукт, в который добавляли 30 мл метиленхлорида. Полученная таким путем смесь снова фильтровалась, органическая фаза промывалась водой и затем обезвоживалась над сульфатом натрия. Растворитель выпаривался при пониженном давлении и получалось 2,8 г сухого остаточного продукта, который затем очищался путем хроматография на силикагеле с использованием в качестве элюента смеси, состоящей из гексана/простого эфира в соотношении 7/3 (об. /об.). Фракции, содержащие продукт, собирались, растворитель выпаривался при пониженном давлении и получалось 2,5 г сложного эфира азотной кислоты производных 2-(2, 6- дихлорофениламино)фенилацетата 4-оксибутила (II).
ИК Спектр (см-1): C=0, 1729; NH, 3322; ONO2, 1637.
Спектр1Н-ЯМР (80 МГц) (CDCl3): 1,75 частей на миллион (м.,4H); 3,8 частей на миллион (с., 2H); 4,2 частей на миллион (м., 2H); 4,4 частей на миллион (м., 2H); 6,45-7,4 частей на миллион (м., ароматика).
Масс-спектрометрия (i.e) М+ 412.
Пример 2.
а) 0,5 г сложного этилового эфира 2-(2,6-дихлорофениламино)фенилуксусной кислоты вводили в 0,5 мл 4-аминобутанола, и полученная смесь перемешивалась при 100oC в течение 12 ч. Затем эта смесь снова доводилась до комнатной температуры, разбавлялась 5 мл воды и экстрагировалась 5 мл метиленхлорида. Экстрагированная таким путем органическая фаза обезвоживалась над сульфатом натрия, и растворитель выпаривался при пониженном давлении до тех пор, пока не получалось 0,19 г 2-(2, 6- дихлорофениламино) -4-оксибутилфенилацетамида (XII).
ИК Спектр (см-1)(нуйол): C=0, 1648; NH и OH, 3413.
Спектр1Н-ЯМР (80 МГц) (CDCl3 ): 1,65 частей на миллион (м., 4H); 3,3 частей на миллион (м., 2H); 3,6 частей на миллион (м., 2H); 6,08 частей на миллион (м., 1H); 6,5 частей на миллион (д.д., 1H); 6,85-7,5 частей на миллион (м., 6H).
Масс-спектрометрия: РМ 366.
б) 1,14 г PBr3 вводили в раствор 0,19 г 2-(2,6- дихлорофениламино)-4-оксибутил-фенилацетамида (XII) в 10 мл хлороформа; полученную таким путем смесь перемешивали в течение 30 мин и затем разбавляли 10 мл воды. Органическую фазу отделяли и обезвоживали над сульфатом натрия и затем растворитель выпаривали при пониженном давлении, и в результате получался сырой остаточный продукт, который очищали методом хроматографии с использованием в качестве элюента смеси, состоящей из метиленхлорида/этилацетата в соотношении 10/0,1 (об./об.).
Промежуточные фракции извлекались, растворитель подвергался выпариванию при пониженном давлении и получалось 50 мг 2-(2,6 - дихлорофениламино)-4-бромбутилфенилацетамида (XIII).
Спектр1Н-ЯМР (80 МГц) (CDCl3): 1,73 частей на миллион (м., 4H); 3,3 частей на миллион (м., 8H); 3,67 частей на миллион (с., 2H); 5,91 частей на миллион (шир.с., 1H); 6,5 частей на миллион (д.д., 1H); 6,92-7, 29 частей на миллион (м., 5H); 7,4 частей на миллион (д., 1H).
с) 1,5 г AgNO3 разбавленного в 10,7 мл ацетонитрила, вводили в раствор, состоящий из 2,8 г 2-(2, 6-дихлорофениламино)-4- бромбутил-фенилацетамида (XIII), разбавленного в 9 мл ацетонитрила. Реакционная смесь перемешивалась при 25oC в течение 3 дней и затем фильтровалась. Растворитель выпаривался при пониженном давлении из полученного раствора, и в результате получался остаточный продукт, который очищался методом хроматографии с использованием метиленхлорида в качестве элюента. Фракции, содержащие этот продукт, собирали, растворитель выпаривали при пониженном давлении, и получалось 0,5 г сложного эфира азотной кислоты производного 2-(2,6- дихлорофениламино) -4-оксибутилфенилацетамида (XI).
ИК Спектр (нуйол): C=0, 1650; NH, 3290; ONO2, 1630.
Спектр1Н-ЯМР (80 МГц) (CDCl3): 1,62 частей на миллион (м.,4H); 3,28 частей на миллион (м., 2H); 4,4 частей на миллион (т., 2H); 5,3 частей на миллион (шир.с., 1H); 6,49 частей на миллион (д.д., 1H); 6,85-7,36 частей на миллион (м., 5H); 7,4 частей на миллион (д., 1H).
Масс-спектрометрия: РМ 411.
Путем
биологических испытаний определяли противовоспалительное и обезболивающее действие, например, производных
2-(2,6-дигалофениламино) фенилуксусной кислоты (I), имеющей следующие формулы:
Противовоспалительное действие указанных производных 2-(2,6- дихлорофениламино) фенилуксусной кислоты определяли на крысах Wistar методом испытания на эдему каррагинан, как сообщалось в работе C.A.Winter, E.Risley, G.W. Nuss, Proc. Soc. Exp. Biol. Med. 111, 544- 547 (1962), в то время как обезболивающее действие указанных производных определяли на Швейцарских мышах, как сообщалось L. C. Hendershot, J.Forsaith, J. Pharmacol. Exp. Ter. 125, 237-249 (1959).
Противовоспалительное и обезболивающее действие указанных производных дается в табл. 1, и выражается как отношение силы их действия к силе действия 2-(2,6-дихлорофениламино)фенилуксусной кислоты, взятой для сравнения. Каждая величина представляет собой среднее значение величин, получаемых при обработке 10 животных.
Соединения (II) и (XI), используемые для указанных биологических испытаний, суспендировались в 0,5% карбоксиметилцеллюлозе до их ввода.
Затем определяли острое токсическое действие указанных производных (II) и (XI) путем орального ввода единичной дозы каждого из соединений (II) и (XI), с использованием для каждой группы соединений по 10 Швейцарских мышей. Частота смертельных случаев и начало токсических симптомов определяли за период, составляющий 14 дней.
Даже при вводе 250 мг/кг соединения (II) или соединения (XI) у исследуемых животных никаких симптомов токсичности обнаружено не было.
Дальнейшие биологические эксперименты, пригодные для определения фармакотоксикологического действия производных (II) проводились с исследованием соединения (II) в сопоставлении с 2-(2, 6- дихлорофениламино) фенилуксусной кислотой, взятой для сравнения.
А. Фармакодинамическое действие
Модели острого воздействия
Эдэма лапок крыс каррагенан: значения
ED 30 (мг/кг, внутриоральный ввод), полученные при данном испытании, равны соответственно 4,88 для соединения (II) и 4,21 для
2-(2,6- дихлорофениламино)фенилуксусной кислоты, что говорит о
сопоставимой эффективности этих двух соединений.
Воздействие на мышей фенилхинона: при дозах в пределах от 3 до 10 мг/кг (при оральном вводе) производное (II) показало полную эффективность, и сила его действия была почти сопоставима с силой действия 2-(2,6-дихлорофениламино)фенилуксусной кислоты и индометацина.
Модели подострого воздействия
Адъювантный артрит у крыс: животные, испытываемые в течение 19 последовательных дней (с 3-го по 21-й день после инъекции адъюванта) с использованием 3,
0 мг/кг (внутриорально) 2-(2,6-дихлорофениламино)
фенилуксусной кислоты или 1,5 или 3,0 мг/кг (внутриорально) соединения (III) обнаружили значительное снижение симптоматологии артрита.
Толерантность желудочно-кишечного тракта крыс
У всех животных, обработанных 15 мг/кг (внутриорально) 2- (2,6 дихлорофениламино) фенилуксусной кислоты были обнаружены сильно размытые язвы;
небольшие язвы были обнаружены также у животных,
обработанных данным соединением дозами 3,5 и 7,0 мг/кг (внутриорально).
Средняя доза ульцерогенности 2-(2, 6-дихлорофениламино)фенилуксусной кислоты согласно расчету равна 6,1 мг/кг при внутриоральном вводе.
Соединение (II) показывает хорошую толерантность даже при значительно более высоких дозах по сравнению с указанными; меньшего размера язвочки были обнаружены лишь у двух животных из десяти, обработанных дозой 100 мг/кг. В связи с этим невозможно определить среднюю дозу ульцерогенности соединения (II).
Общие, аспекты фармакологии
Проводили вторичные фармакологические оценки соединения (II) путем сопоставления его с 2-(2,
6-дихлорофениламино)фенилуксусной кислотой; никаких дополнительных эффектов не обнаружено, кроме первичного
фармакологического действия на центральную нервную систему, аутономную систему,
сердечно-сосудистую систему, систему дыхательных путей и желудочно-кишечный тракт.
Б. Токсикология
Острая токсичность при испытаниях на грызунах
Исследования
проводили на двух видах животных с осуществлением двух различных способов ввода.
Были получены указанные ниже
значения LD50 (мг/кг) и пределы фунгицидного действия 95%:
Крысы,
оральный ввод: 511 (356-732); мыши, оральный ввод: 497 (323-762); крысы, внутрибрюшинный ввод: 237 (156-369); мыши,
внутрибрюшинный ввод: 253 (171-374).
Максимальная переносимая доза у негрызунов.
Соединение (II) было хорошо переносимым у данных видов животных, которые, как известно, особенно чувствительны к данному классу соединений.
Животных обрабатывали дозами, увеличивающимися с 250 до 1000 мг/кг соединения (II): наименьшая доза не вызывала никаких симптомов, промежуточная доза вызывала лишь слабую обратимую диарею, в то время как наивысшая доза вызывала сильную, но обратимую диарею. В противоположность этому, ввод при тех же условиях 10 мг/кг 2-(2, 6- дихлорофениламино) фенилуксусной кислоты вызывал смертельный исход.
Подострая токсичность при испытании на грызунах
Животных обрабатывали дозами 5, 15 и 30 мг/кг соединения
(II) в течение четырех недель. Общие состояния и клиническое поведение,
привес, потребление воды и пищи, гематологический и химический клинический анализы показали, что две меньшие дозы хорошо
переносимы.
Подострая токсичность при испытании на собаках
Животных обрабатывали дозами 5, 15 и 30 мг/кг соединения (II) в течение 4 недель. Общие состояния и клиническое
поведение, привес, потребление пищи и воды, гематологический и химический
клинический анализы показали, что две меньшие дозы хорошо переносимы.
Реферат
Предметом изобретения являются сложные эфиры азотной
кислоты производных 2-(2,6-дигалофениламино) фенилуксусной кислоты, имеющие следующую общую формулу:
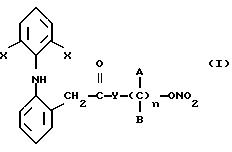
а также их фармацевтическое использование и способ их получения. 2 с. и 6 з.п. ф-лы, 1 табл.
Формула
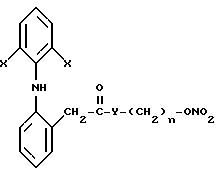
в которой Х - галоген, выбранный из хлора или брома;
Y выбран из кислорода, NH, NR1, где R1 - линейная или разветвленная алкильная группа:
n = 1 - 10.
R4 - (CH2 )n - R3,
где R4 - хлор, бром, NHR;
R - водород или линейный, или разветвленный С1 - С6-алкил;
R3 - хлор, бром, йод или ОН;
n = 1 - 10,
и полученный продукт обрабатывают нитрующим агентом, таким, как нитрат серебра, или в случае, когда R3 - ОН, его предварительно подвергают взаимодействию с галогенирующим соединением, таким, как трехбромистый фосфор, с последующей обработкой нитратом серебра.

Комментарии