Аминобензофеноны как ингибиторы il-1β и tnf-α - RU2239628C2
Код документа: RU2239628C2
Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к неизвестному до настоящего времени классу соединений, которые обладают противовоспалительным действием, к фармацевтическим препаратам, содержащим данные соединения, к дозированным лекарственным формам таких препаратов, а также к их применению для лечения и профилактики астмы, аллергии, артрита, включая ревматоидный артрит и спондилоартрит, подагры, атеросклероза, хронического воспалительного заболевания кишечника (болезнь Крона), пролиферативных и воспалительных заболеваний кожи, таких как псориаз и атопический дерматит, увеита, септического шока, СПИДа и угрей.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Ранее был описан ряд близкородственных аминобензофенонов (например, 4-(2-амино-4-нитро-фениламино)бензофенон) (Hussein, F.A. et а1., Iraqi J. Sci., 22, 54-66 (1981)). Однако не существует описания их применения. PCT/DK98/00008 раскрывает аминобензофеноновые ингибиторы секреции интерлейкина 1β (IL-1β) и фактора α некроза опухолей (TNF-α) in vitro, причем упомянутые соединения потенциально могут применяться для лечения воспалительных заболеваний, при которых в патогенез вовлечена выработка цитокинов, например, астмы, ревматоидного артрита, псориаза, контактного дерматита и атопического дерматита. Кроме того, соединения, описанные в PCT/DK98/00008, тестировали in vivo на противовоспалительную активность на мышиной модели хронического воспаления кожи, вызванного 12-О-тетрадеканоилфорбол-13-ацетатом (ТРА) (De Young, L.M. et al., Agents Actions, 26, 335-341 (1989); Carlson, R.P. et al., Agents Actions, 17, 197-204 (1985); Alford, J.G. et al., Agents Actions, 37, (1992); Stanley, P.L. et al., Skin Pharmacol., 262-271 (1991)). На данной модели хронического воспаления кожи активность указанных соединений была близка к активности контрольного соединения гидрокортизона.
Целью настоящего изобретения является предоставление аминобензофеноновых производных и родственных соединений, обладающих более высокой фармакологической активностью.
Указанная цель достигается при использовании новых аминобензофеноновых производных, соответствующих общей формуле (I), которые, как обнаружено, являются мощными ингибиторами секреции интерлейкина 1β (IL-1β) и фактора α некроза опухолей (TNF-α) in vitro. Многочисленные сведения имеющегося уровня техники (в частности, работы, список которых приведен в конце настоящего описания), позволяют с высокой степенью достоверности утверждать, что, обладая вышеуказанной фармакологической активностью, рассматриваемые новые соединения будут полезны для лечения воспалительных заболеваний, в том числе перечисленных во введении заболеваний, при которых в патогенез вовлечены секреция и регуляция цитокинов, или, более конкретно, интерлейкина 1β (IL-1β) и фактора α некроза опухолей (TNF-α). Ингибирование, или регуляция цитокинов по типу отрицательной обратной связи, возможно, имеет место благодаря ингибированию МАР-киназ.
КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
Соединения настоящего изобретения представлены общей формулой I

где R1, R2 и R3 обозначают один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из галогена, гидрокси, меркапто, трифторметила, амино, (C1 -С3)алкила, (С2-С3)олефиновой группы, (C1-С3)алкокси, (C1-С3)алкилтио, (C1-C6)алкиламино, (C1-С3)алкоксикарбонила, циано, -СОNН2, фенила или нитро; кроме того, R2 может обозначать водород, а R3 может обозначать карбокси и карбамоил;
R4 обозначает водород, (С1-С3)алкил или аллил;
Х обозначает кислород или серу;
Q обозначает -(СО)-, -(CS)- или связь;
Y обозначает (C5-C15)алкил; (С2-С5)олефиновую группу; (С3-С10)моноциклическую углеводородную группу; или фенил; причем любой из них может быть необязательно замещен одним или несколькими одинаковыми или различными заместителями, выбранными из группы, состоящей из соединений формулы R5, определенной ниже; (C1-C4)алкил, замещенный одним или несколькими заместителями, выбранными из группы R5; или группу формулы -(Z-O)n-Z, где Z представляет собой (C1-С3)алкил, n является целым числом >1; причем количество атомов в непрерывной линейной последовательности атомов в группе Y не превышает 15;
R5 обозначает галоген, гидрокси, меркапто, трифторметил, амино, (C1-С3)алкокси, (C1-С3)алкилтио, (C1-С6)алкиламино, (C1-С3 )алкоксикарбонил, циано, азидо, нитро, -СООН, -CONH2, -CONHR' или -COONR'R', где R' обозначает (C1-С3)алкил;
или их соли с фармацевтически приемлемыми кислотами, гидраты или сольваты.
В соединениях формулы I R1 предпочтительно обозначает один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из фтора, хлора, брома, гидрокси, трифторметила, амино, (C1-С2)алкила, (C2-С3)алкенила, (C1-С3)алкокси, (C1-С3)алкоксикарбонила, циано или -СОNН2;
R2 обозначает один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, фтора, хлора, брома, гидрокси, трифторметила, амино, (C1-С3)алкила, (C2-С3)алкенила, (C1-С3)алкокси.
R3 обозначает один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, галогена, гидрокси, трифторметила, (C1-С3)алкила, (C2 -С3)алкенила, (C1-С3)алкокси, (C1-С3)алкоксикарбонила, циано, карбокси или -СОNН2.
R4 обозначает водород, (C1-С2)алкил или аллил;
Х обозначает кислород или серу;
Q обозначает -(СО)- или связь.
Y обозначает (C5-С10 )алкил; (C2-С10)алкенил; (C3-С8)циклоалкил; (C5-С8)циклоалкеновую группу или фенил; причем любой из них может быть необязательно замещен одним или несколькими одинаковыми или разными заместителями, выбранными из группы, состоящей из соединений формулы R5, определенной ниже; (C1-С4)алкил, замещенный одним или несколькими заместителями, имеющими формулу R5; или группу формулы -(Z-O)n-Z, где Z представляет собой (C1-С3)алкил, n является целым числом >1; причем количество атомов в непрерывной линейной последовательности атомов в группе Y не превышает 9;
R5 обозначает галоген, гидрокси, амино, (C1 -С2)алкокси, (C1-С4)алкиламино, (C1-С3)алкоксикарбонил, циано, азидо, -СООН, -CONH2, -CONHR' или -COONR'R', где R' обозначает (C1-С2)алкил.
Более предпочтительно R1 обозначает один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из фтора, хлора, брома, гидрокси, метила или метокси; R2 обозначает один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, фтора, хлора, брома, гидрокси, метила или метокси; R3обозначает один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, фтора, хлора, брома, гидрокси, метила или метокси; R4 обозначает водород; Х обозначает кислород; Q обозначает -(СО)- или связь; Y обозначает (C5-С7)алкил; (C2-С4)алкенил; любой из них может быть необязательно замещен одним или несколькими одинаковыми или различными заместителями, выбранными из группы, состоящей из соединений формулы R5, (C1-С4)алкил, замещенный одним или несколькими заместителями, имеющими формулу R5; или группу формулы -СН2-O-СН2-СН2-O-СН3; R5предпочтительно обозначает фтор, хлор, бром, гидрокси, амино, (C1-С2)алкоксикарбонил, -СООН, -CONH2, -СООN(СН3)2.
Предпочтительно, если в соединениях формулы I, где Y представляет собой СF3, Q не обозначает -(СО)-.
Фенильная группа R1 и R2 может быть необязательно замещена, например, гидроксильной группой; аминогруппой; нитрогруппой; цианогруппой; галогеном, предпочтительно фтором, хлором или бромом; метилом; или метоксильной группой.
Характерными соединениями формулы I являются:
N-[2-[3-Хлор-4-(2-метилбензоил)фениламино]фенил]сукцинамовая кислота (соединение 101),
2'-[3-Хлор-4-(2-метилбензоил)фениламино]октананилид (соединение 102),
4-Бром-2'-[3-хлор-4-(2-метилбензоил)фениламино]бутананилид (соединение 103),
Этил-2'-[3-хлор-4-(2-метилбензоил)фениламино]сукцинанилат (соединение 104),
2-(2-Метоксиэтокси)-2'-[3-хлор-4-(2-метилбензоил)фениламино]-ацетанилид (соединение 105),
N,N-диметил-N'-2-[3-хлор-4-(2-метилбензоил)фениламино]-фенилсукцинамид (соединение 106),
2-Гидрокси-2'-[3-хлор-4-(2-метоксибензоил)фениламино]-ацетанилид (соединение 107),
2-Гидрокси-2'-[3-хлор-4-(2-метилбензоил)фениламино]ацетанилид (соединение 108),
2-Гидрокси-2'-[3-фтор-4-(2-метилбензоил)фениламино]ацетанилид (соединение 109),
2-Амино-2'-[3-хлор-4-(2-метилбензоил)фениламино]ацетанилид (соединение 110),
Этил-2-[2-[3-хлор-4-(2-метилбензоил)фениламино]анилин]ацетат (соединение 111),
2-Хлор-4-[2-(6-гидроксигексиламино)фениламино]-2'-метилбензофенон (соединение 112),
2-Хлор-4-[2-(3-гидроксипропиламино)фениламино]-2'-метилбензофенон (соединение 113),
5'-Бром-2'-[3-хлор-4-(2-метилбензоил)фениламино]гексананилид (соединение 114),
5'-Бром-2'-[3-хлор-4-(2-метилбензоил)фениламино]бут-3-енанилид (соединение 115),
5'-Бром-2'-[3-хлор-4-(2-метилбензоил)фениламино]-4-метилпентананилид (соединение 116),
2'-[3-Хлор-4-(2-метилбензоил)фениламино]-2-метилпентананилид (соединение 117),
N-[5-Бром-2-[3-хлор-4-(4-этокси-2-метилбензоил)фениламино]-фенил] сукцинамовая кислота (соединение 118),
N-[5-Бром-2-[3-этокси-4-(2-метилбензоил)фениламино]фенил] сукцинамовая кислота (соединение 119),
N-[5-Бром-2-[3-хлор-4-(2, 3-диметилбензоил)фениламино]фенил] сукцинамовая кислота (соединение 120),
N-[5-Бром-2-[3-хлор-4-(4-н-бутил-2-метилбензоил)фениламино]фенил] сукцинамовая кислота (соединение 121),
N-[5-Бром-2-[3-хлор-4-(4-хлор-2-метилбензоил)фениламино]фенил] сукцинамовая кислота (соединение 122),
N-[5-Бром-2-[3-фтор-4-(2-метилбензоил)фениламино]фенил] сукцинамовая кислота (соединение 123),
N-[5-Бром-2-[3-хлор-4-(2,4,5-триметилбензоил)фениламино]фенил] сукцинамовая кислота (соединение 124),
N-[5-Бром-2-[3-хлор-4-(4-фтор-2-метилбензоил)фениламино]фенил] сукцинамовая кислота (соединение 125),
N-[5-Бром-2-[3-хлор-4-(2,5-диметилбензоил)фениламино]фенил] сукцинамовая кислота (соединение 126),
N-[5-Бром-2-[3-фтор-4-(4-метокси-2-метилбензоил)фениламино]фенил] сукцинамовая кислота (соединение 127),
N-[5-Бром-2-[3-хлор-4-(3-хлор-2-метилбензоил)фениламино]фенил] сукцинамовая кислота (соединение 128),
а также их соли с фармацевтически приемлемыми кислотами, гидраты и сольваты.
Соединения формулы I, в которых Х=S в соответствии с формулой Iа, приведенной ниже, также в большинстве случаев являются предпочтительными
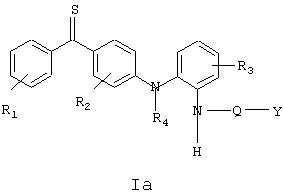
где R1, R2, R3, R4, Q и Y имеют вышеуказанные значения. Характерными соединениями формулы Iа являются:
N-[2-[3-Хлор-4-(2-метил(тиобензоил))фениламино]фенил] сукцинамовая кислота (соединение 129),
2'-[3-Хлор-4-(2-метил(тиобензоил))фениламино]октананилид (соединение 130),
4-Бром-2'-[3-хлор-4-(2-метил(тиобензоил))фениламино]бутананилид (соединение 131),
Этил-2'-[3-хлор-4-(2-метил(тиобензоил))фениламино]сукцинанилат (соединение 132),
2-(2-Метоксиэтокси)-2'-[3-хлор-4-(2-метил(тиобензоил))фениламино]ацетанилид (соединение 133),
N, N-диметил-N'-2- [3-хлор-4-(2-метил(тиобензоил))фениламино]фенилсукцинамид (соединение 134),
2-Гидрокси-2'-[3-хлор-4-(2-метокси(тиобензоил))фениламино]ацетанилид (соединение 135),
2-Гидрокси-2'-[3-хлор-4-(2-метил(тиобензоил))фениламино]ацетанилид (соединение 136),
2-Гидрокси-2'-[3-фтор-4-(2-метил(тиобензоил))фениламино]ацетанилид (соединение 137),
2-Амино-2'-[3-хлор-4-(2-метил(тиобензоил))фениламино]ацетанилид (соединение 138),
Этил-2-[2-[3-хлор-4-(2-метил(тиобензоил))фениламино]анилин]ацетат (соединение 139),
2-Хлор-4-[2-(6-гидроксигексиламино)фениламино]-2'-метил-(тиобензофенон) (соединение 140),
2-Хлор-4-[2-(3-гидроксипропиламино)фениламино]-2'-метил-(тиобензофенон) (соединение 141),
5'-Бром-2'-[3-хлор-4-(2-метил(тиобензоил))фениламино]гексананилид (соединение 142),
5'-Бром-2'-[3-хлор-4-(2-метил(тиобензоил))фениламино]бут-3-енанилид (соединение 143),
5'-Бром-2'-[3-хлор-4-(2-метил(тиобензоил))фениламино]-4-метилпентананилид (соединение 144),
2'-[3-Хлор-4-(2-метил(тиобензоил))фениламино]-2-метилпентананилид (соединение 145),
N-[5-Бром-2-[3-хлор-4-(4-этокси-2-метил(тиобензоил))фениламино]фенил] сукцинамовая кислота (соединение 146),
N-[5-Бром-2-[3-этокси-4-(2-метил(тиобензоил))фениламино]фенил] сукцинамовая кислота (соединение 147),
N-[5-Бром-2-[3-хлор-4-(2,3-диметил(тиобензоил))фениламино]-фенил] сукцинамовая кислота (соединение 148),
N-[5-Бром-2-[3-хлор-4-(4-н-бутил-2-метил(тиобензоил))фениламино]фенил]сукцинамовая кислота (соединение 149),
N-[5-Бром-2-[3-хлор-4-(4-хлор-2-метил(тиобензоил))фениламино]фенил] сукцинамовая кислота (соединение 150),
N-[5-Бром-2-[3-фтор-4-(2-метил(тиобензоил))фениламино]фенил] сукцинамовая кислота (соединение 151),
N-[5-Бром-2-[3-хлор-4-(2,4,5-триметил(тиобензоил))фениламино] фенил] сукцинамовая кислота (соединение 152),
N-[5-Бром-2-[3-хлор-4-(4-фтор-2-метил(тиобензоил))фениламино]фенил] сукцинамовая кислота (соединение 153),
N-[5-Бром-2-[3-хлор-4-(2,5-диметил(тиобензоил))фениламино]фенил] сукцинамовая кислота' (соединение 154),
N-[5-Бром-2-[3-фтор-4-(4-метокси-2-метил(тиобензоил))фениламино]фенил] сукцинамовая кислота (соединение 155),
N-[5-Бром-2-[3-хлор-4-(3-хлор-2-метил(тиобензоил))фениламино]фенил] сукцинамовая кислота (соединение 156),
а также их соли с фармацевтически приемлемыми кислотами, гидраты и сольваты.
Более предпочтительными соединениями общей формулы I являются соединения, в которых R1, R2 и R3 обозначают один заместитель. R1 и R2 предпочтительно находятся в орто-положении.
Соединения формул I и Iа могут применяться в виде солей, образованных фармацевтически приемлемыми неорганическими или органическими кислотами, такими как хлористоводородная, бромистоводородная и йодистоводородная кислота, фосфорная кислота, серная кислота, азотная кислота, п-толуолсульфоновая кислота, метансульфоновая кислота, муравьиная кислота, уксусная кислота, пропионовая кислота, лимонная кислота, виннокаменная кислота, янтарная кислота, бензойная кислота, малеиновая кислота, причем данные примеры не рассматриваются как ограничивающие настоящее изобретение.
В данном описании, если не оговорено иначе, приведенные ниже термины имеют указанные значения:
Алкил относится к одновалентной группе, полученной из алкана в результате удаления атома водорода, связанного с любым углеродным атомом, и включает подклассы нормальных алкилов (н-алкилов) и первичных, вторичных и третичных алькильных групп соответственно, которые имеют указанное число атомов углерода, включая, например, (C1-С5)алкил, (C1-C5)алкил, (С5)алкил, (С6-С10)алкил, (C6-C15)алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и т-бутил. Алкан относится к ациклическому разветвленному или неразветвленному углеводороду, имеющему общую формулу CnH2n+2 и, следовательно, состоящему только из атомов водорода и насыщенных атомов углерода.
Олефиновая группа относится к линейному или разветвленному ациклическому углеводороду, имеющему одну или несколько углерод-углеродных двойных связей в Е или Z конфигурации, если данная классификация применима, и имеющему указанное число атомов углерода. Данный термин включает, например, (C2-C15)oлефиновую группу, предпочтительно (C2-C15 )aлкенил; (С2-С3)олефиновую группу, предпочтительно (С2-С3)алкенил; винил; аллил; 1-бутенил; 2-бутенил; и 2-метил-2-пропенил. Предпочтительными являются олефиновые группы, имеющие только одну углерод-углеродную двойную связь, называемые здесь алкенильные.
Алкокси в широком смысле относится к радикалу формулы -OR, где R представляет собой алкил, как определено выше, например (C1-С3)алкокси, (C1-C2)алкокси, метокси, этокси, н-пропокси и т. п.
(C1-С3 )алкилтио в широком смысле относится к радикалу формулы -SR, где R представляет собой алкил, как определено выше, и включает метилтио, этилтио, н-пропилтио и 2-пропилтио.
(C1 -C3)алкиламино в широком смысле относится к радикалу формулы -NHR или -NR2, где R представляет собой алкил, как определено выше, имеющий 1-6 атомов углерода, и включает, например, метиламино, диметиламино, ди-(н-пропил)амино и н-бутил(этил)амино.
(C1-С3) алкоксикарбонил в широком смысле относится к радикалу формулы -COOR, где R представляет собой алкил, как определено выше, и включает метоксикарбонил, этоксикарбонил, н-пропоксикарбонил и изо-пропоксикарбонил.
(С3-С10)моноциклическая углеводородная группа включает насыщенные циклоалканы и ненасыщенные циклические олефины, такие как циклоалкены, имеющие одну эндоциклическую двойную связь и 3-10 атомов углерода, и включают, например, (С3 -C8)циклоалкил, циклопропил, циклопентил, циклогексил и циклоалкил, (С3-С10)циклоалкеновую группу и (С3-C8)циклоалкеновую группу. Конкретными примерами являются циклопроп-2-енил, циклобут-2-енил, циклопент-2-енил, циклогекс-3-енил и циклонон-4-енил.
Амино относится к группе -NH2.
Карбамоил относится к любой из групп -CONH2, -CONHR и CONRR', где R и R' представляют собой алкил, как описано выше.
Карбокси относится к радикалу формулы -СООН.
Галоген обозначает одинаковые или разные атомы, выбранные из фтора, хлора, брома и иода; фтор, хлор и бром являются предпочтительными.
ФАРМАКОЛОГИЧЕСКИЕ МЕТОДЫ
Для изучения действия соединения настоящего изобретения in vitro измеряют ингибирование секреции IL-1β и TNF-α с помощью следующей процедуры.
Выработку цитокина измеряют в среде со стимулированными липополисахаридом (LPS) мононуклеарными клетками периферической крови. Мононуклеарные клетки выделяют из периферической крови человека фракционированием с использованием Limphoprep® (Nycomed, Norway) и суспендируют в RPMI 1640 (среда для выращивания), содержащей фетальную телячью сыворотку (FCS, 2%), с получением концентрации 5×105 клеток/мл. Клетки инкубируют в 24-луночных планшетах для культивирования тканей в аликвотах объемом 1 мл. Тестируемые соединения растворяют в диметилсульфоксиде (DMSO, 10 мМ) и разбавляют средой. Соединения добавляют к клеткам и инкубируют в течение 30 минут, затем добавляют LPS (конечная концентрация 1 мг/мл). Планшеты инкубируют 18 часов и концентрацию IL-1β и TNF-α в среде определяют с помощью твердофазного иммуноферментного анализа. Рассчитывают средние ингибирующие концентрации (IС50) соединений. Результаты приведены в таблице 1.
Соединения настоящего изобретения также демонстрируют подобную активность в отношении способности ингибировать секрецию супероксида PMN (полиморфноядерными клетками), что также указывает на потенциальную возможность использования данных соединений в качестве противовоспалительных лекарственных препаратов. Соединения тестируют с помощью следующей методики. Человеческие полиморфноядерные (PMN) гранулоциты выделяют из крови человека путем осаждения декстраном, фракционирования с использованием Limphoprep® и гипотонического лизиса присутствующих в качестве примеси эритроцитов. Образование супероксид-аниона измеряют по уровню восстановления окисленной формы цитохрома С в системе с ингибируемым супероксиддисмутазой восстановлением (Madhu, S.B. et al. Inflammation, 16, 241 (1992)). Клетки суспендируют в сбалансированном солевом растворе Хэнкса и инкубируют с тестируемыми соединениями в течение 10 минут при 37°С. Клетки инициируют путем добавления TNF-α (конечная концентрация 3 нг/мл), через 10 минут добавляют окислительную форму цитохрома С (конечная концентрация 750 мкг/мл), бычий сывороточный альбумин (БСА, конечная концентрация 1 мг/мл) и формил-метионил-лейцил-фенилаланин (FMLP, конечная концентрация 10-7М) и инкубируют 3 минуты. Клетки охлаждают на льду и осаждают центрифугированием. Оптическую плотность не содержащего клеток супернатанта измеряют на спектрофотометре. Рассчитывают среднюю ингибирующую концентрацию (IС50) соединений. Результаты приведены в таблице 1.

Данные результаты показывают, что соединения настоящего изобретения способны ингибировать выработку IL-1β, TNF-α и PMN-супероксида и обладают фармакологической активностью, сравнимой с активностью стандартного соединения сравнения, что делает возможным применение данных соединений в лечении воспалительных заболеваний.
Для изучения активности соединений настоящего изобретения in vivo можно использовать мышиную модель хронического воспаления кожи, вызванного 12-O-тетрадеканоилфорбол-13-ацетатом (ТРА) (De Young, L.M. et al, Agents Action, 26, 335-341 (1989); Carlson, R.P. et al, Agents Action, 17, 197-204 (1985); Alford, J.G/ et al, Agents Action, 37 (1992); Stanley, P.L. et al, Skin Pharmacol, 4. 262-271 (1991)), и описание метода в PCT/DK98/00008, включенное в данное описание в качестве ссылки. Данные результаты демонстрируют, что активность соединения настоящего изобретения такая же, как и у известных стандартных соединений сравнения, например гидрокортизона, обладающего установленными побочными эффектами, тогда как соединения настоящего изобретения являются хорошо переносимыми и нетоксичными. Некоторые члены настоящего класса соединений демонстрируют очень низкую абсорбцию, что делает их особенно полезными при лечении различных дерматологических заболеваний. Как правило, они могут быть введены, например, пероральным, внутривенным, интраназальным, чрескожным способом или местно.
СПОСОБ ПОЛУЧЕНИЯ
Соединения настоящего изобретения могут быть получены с помощью ряда способов, хорошо известных специалистам в области органического синтеза. Соединения настоящего изобретения могут быть синтезированы с помощью способов, приведенных ниже, а также способов, известных в области синтетической органической химии, или их модификаций, которые могут быть сделаны специалистами в данной области. Предпочтительные способы включают, не ограничиваясь ими, описанные ниже.
Новые соединения формулы I и Iа могут быть получены с помощью реакций и методов, описанных в данном разделе. Реакции проводят в растворителях, подходящих для используемых реагентов и веществ и подходящих для осуществляемых превращений. Кроме того, следует понимать, что в описанных ниже способах синтеза все предлагаемые условия реакций, включая выбор растворителя, атмосферу реакции, температуру реакции, продолжительность эксперимента и методы обработки, выбраны как стандартные условия для данной реакции, хорошо известные специалисту в данной области. Специалисту в области органического синтеза должно быть понятно, что функциональные группы, присутствующие на различных фрагментах выбранной молекулы, должны быть совместимыми с предлагаемыми реагентами и реакциями. Не все соединения формулы I, относящиеся к данному классу, могут быть совместимыми с отдельными условиями реакций, необходимыми для некоторых описанных способов. Такие ограничения, применяемые к заместителям, совместимым с условиями реакции, будут очевидны для специалистов в данной области, причем можно также использовать альтернативные способы.

и R1, R2, R3, R4, Х и Y имеют указанные выше значения.
Схема 1
Соединения настоящего изобретения, в которых Q обозначает -(СО)-, могут быть получены по способу, включающему сочетание амина формулы II с кислотой формулы III или с ее активированным производным, как показано на схеме 1, где R1, R2, R3, R4, Х и Y такие, как определены в общей формуле I, за исключением того, что любой заместитель или функциональная группа, которые потенциально могут участвовать в реакции сочетания, могут быть защищены перед проведением реакции сочетания и затем удалены.
Реакцию сочетания или конденсацию проводят с помощью любого из многих способов образования амидных связей, известных специалисту в области органического синтеза. Данные способы включают, не ограничиваясь ими, применение стандартных методов сочетания, таких как метод с применением смешанных ангидридов угольной кислоты (изобутилхлорформиат), метод с применением карбодиимидов (N,N-диметиламинопропил-N'-этилкарбодиимид (EDC), дициклогексилкарбодиимид, диизопропилкарбодиимид), метод с применением активированных эфиров (пентафторфениловый сложный эфир, п-нитрофениловый сложный эфир, N-гидроксисукцинимидный эфир), карбонилдиимидазольный метод, азидный метод, фосфорные реагенты, такие как ВОР-Сl, превращение кислоты формулы III в хлорангидрид. Некоторые из данных методов (особенно карбодиимидный) могут быть усовершенствованы путем добавления 1-гидроксибензотриазола (HOBt).
Соединения настоящего изобретения, в которых С=Х и Q одновременно обозначают -(CS)-, могут быть получены из соединений данного изобретения, в которых С=Х или Q или они оба обозначают -(СО)-, с помощью способа, в котором используют соответствующий тиокарбонилирующий агент, такой как пентасульфид фосфора (Р4S10) или реагент Лавессона (2,4-бис(4-метоксифенил)-1,3,2,4-дитиафосфетан-2,4-дисульфид) и т.п. Альтернативно соединения настоящего изобретения, в которых Q обозначает -(CS)-, могут быть получены по способу, включающему сочетание амина формулы II с тиоацилирующим реагентом формулы IV, как показано на схеме 2, где R1, R2, R3, R1,, Х и Y такие, как определены в общей формуле I, за исключением того, что любой заместитель или функциональная группа, которые потенциально могут участвовать в реакции сочетания, могут быть защищены перед проведением реакции сочетания и затем удалены. Примерами таких тиоацилирующих реагентов являются, без ограничения, или сложные тионоэфиры, сложные дитиоэфиры и N-тиоацилазолы (полученные из имидазола, триазола, бензимидазола и бензотриазола).
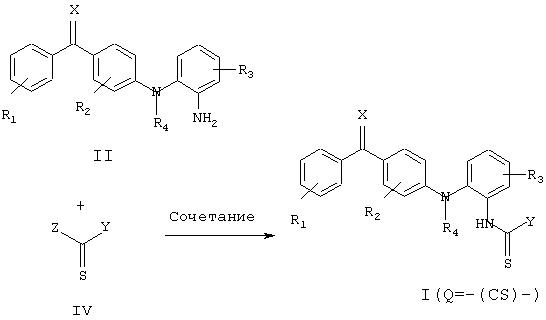
и R1, R2, R3, R4, Х и Y имеют указанные выше значения.
Схема 2
Соединения настоящего изобретения, в которых Q обозначает связь, могут быть получены по способу, включающему сочетание амина формулы II с алкилирующим реагентом формулы V, как показано на схеме 3, где R1, R2, R3, R4, Х и Y имеют значения, определенные в общей формуле I, за исключением того, что любой заместитель или функциональная группа, которые потенциально могут участвовать в реакции сочетания, могут быть защищены перед проведением реакции сочетания и затем удалены.
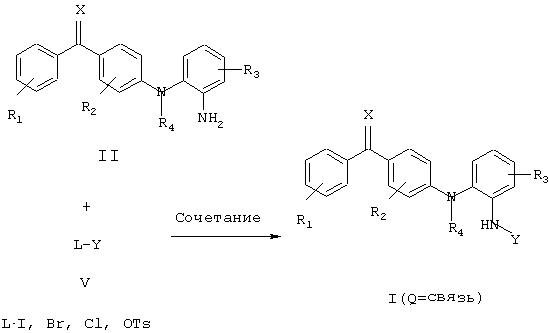
и R1, R2, R3, R4, Х и Y имеют указанные выше значения.
Схема 3
Обычно алкилирующие реагенты общей формулы V включают, не ограничиваясь ими, иодиды (L=I), бромиды (L=Br), хлориды (L=Cl) и сульфонаты (L=OSO2R, где R обозначает метил, трифторметил или 4-метилфенил).
Соединения настоящего изобретения общей формулы II (Х=O) могут быть получены с помощью нескольких способов, известных специалистам в области органического синтеза. Одна из использующихся последовательностей синтеза показана на схеме 4, где основной способ включает сочетание амина формулы VII с фторидом, хлоридом, бромидом, иодидом или трифлатом формулы VIII, как показано на схеме 4, где R1, R2, R3 и R4 такие, как определены в общей формуле I, с получением продукта сочетания общей формулы VI, за исключением того, что любой заместитель или функциональная группа, которые потенциально могут участвовать в реакции сочетания, могут быть защищены перед проведением реакции сочетания и затем удалены. Данное соединение VI затем может быть восстановлено до соответствующего амина с общей формулой II путем обработки стандартными восстанавливающими реагентами. Примеры таких восстанавливающих реагентов включают, не ограничиваясь ими, дигидрат хлорида олова (II), водород, формиат аммония или гидразингидрат, а также каталитическое количество палладия на угле.

L: Br, I, ОSО2СF3 или F и Сl
Y: Cl, Br, I, ОSО2 СF3, ОSО2СН3 или OTs
FGI: Взаимопревращение функциональных групп.
R1, R2, R3, R4 и Y имеют указанные выше значения.
Схема 4
Реакцию сочетания проводят с помощью любого из способов получения дифениламинов, известных специалисту в области органического синтеза. Предпочтительным способом является метод нуклеофильного ароматического замещения, который включает сочетание амина с арилфторидом или арилхлоридом в присутствии основания в подходящем растворителе. Установлено, что для данного процесса лучшими основаниями в особенности являются трет-бутоксид калия (KOt-Bu), трет-бутоксид натрия (NaOt-Bu), гидрид натрия (NaH) и гидрид калия (КН), однако другие основания также могут использоваться.
Реакцию обычно проводят при температуре окружающей среды (20-25°С) в биполярных апротонных растворителях, таких как диметилсульфоксид (DMSO), диметилформамид (DMF) или N-метилпирролидон (NMP), в инертной атмосфере, такой как атмосфера аргона или азота.
Альтернативно реакция сочетания может быть проведена по методу каталитического аминирования в присутствии палладия, который включает сочетание амина с арилгалогенидом (иодидом, бромидом, трифлатом или в некоторых случаях хлоридом) в присутствии основания, подходящего источника Pd и подходящего фосфинового лиганда в инертном растворителе.
Соединение палладия, использующееся в данном способе, специально не ограничивается, конкретными примерами являются ацетат палладия (II), хлорид палладия (II), бромид палладия (II), дихлорбис(трифенилфосфин)палладий(II), тетракис(трифенилфосфин)палладий(0), трис(дибензилиденацетон)-дипалладий(0). Предпочтительный лиганд включает, не ограничиваясь ими, рацемический или нерацемический 2,2'-бис(дифенилфосфин)-1,1'-бинафтил (далее упоминается как BINAP), три-о-толилфосфин, три-трет-бутилфосфин, 1, 1'-бис(дифенилфосфин)ферроцен, бис[(2-дифенилфосфин)фениловый] эфир (DPEphos), 2-дициклогексилфосфанил-2'-диметиламинобифенил, 2-(ди-трет-бутилфосфин)бифенил и 9,9-диметил-4, 6-бис(дифенилфосфин)ксантен (Xantphos). Количество палладия и лиганда, использующееся в данном способе, обычно составляет от 0,1 до 10 мол.% от количества используемого ароматического галогенида (или трифлата). Установлено, что для данного процесса лучшими основаниями в особенности являются трет-бутоксид натрия (NaOt-Bu) и карбонат цезия (Сs2СО3), однако другие основания также могут использоваться. Реакцию обычно проводят при повышенной температуре (80-120°С) в инертных растворителях, таких как 1,4-диоксан, толуол, бензол и тетрагидрофуран, в инертной атмосфере, такой как атмосфера аргона или азота.
Соединения настоящего изобретения, в которых R4 не является водородом, могут быть получены по способу, включающему сочетание амина формулы VI (R4=H) с алкилирующим реагентом, как показано на схеме 4, где R1, R2, R3 и R4 такие, как определены в общей формуле I, за исключением того, что любой заместитель или функциональная группа, которые потенциально могут участвовать в реакции сочетания, могут быть защищены перед проведением реакции сочетания и затем удалены.
Обычно алкилирующие реагенты общей формулы R-Y включают, не ограничиваясь ими, иодиды (Y=I), бромиды (Y=Br), хлориды (Y=Cl) и сульфонаты (Y=OSO2R', где R' обозначает метил, трифторметил или 4-метилфенил).
Соединения настоящего изобретения в отдельных случаях могут быть получены путем простого взаимопревращения функциональных групп (FGI), которое является стандартным процессом, известным специалистам в области органического синтеза, где функциональная группа в соединениях с общей формулой I (или в любых других промежуточных соединениях, описанных в данном документе) превращается в другую функциональную группу в процессе одной или нескольких стадий синтеза, приводя к образованию нового соединения с общей формулой I. Примерами таких способов являются, без ограничения, гидролиз сложного эфира в основных условиях с получением кислоты; удаление защитной группы метилового эфира обработкой, например, бортрибромидом (ВВr3) с получением фенола; каталитическое гидрирование олефина с получением насыщенного углеводорода.
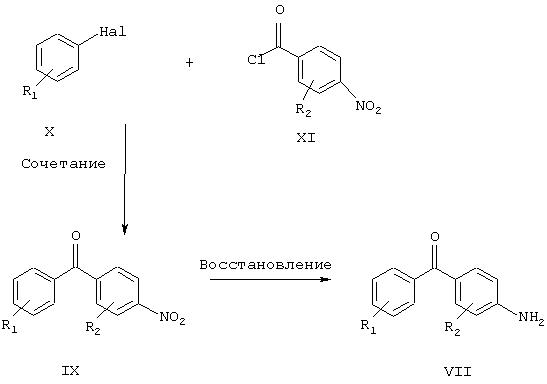
Hal: Br, I
R1 и R2 имеют указанные выше значения.
Схема 5
Соединения настоящего изобретения общей формулы VII могут быть получены с помощью нескольких способов, известных специалистам в области органического синтеза. Одна из использующихся последовательностей синтеза показана на схеме 5. Основная стадия включает сочетание бромида (или иодида) общей формулы Х с хлорангидридом кислоты общей формулы XI с получением бензофенона общей формулы IX. Данное соединение IX затем может быть восстановлено до соответствующего амина общей формулы VII путем обработки стандартными восстанавливающими реагентами. Примеры таких восстанавливающих реагентов включают, не ограничиваясь ими, дигидрат хлорида олова (II), водород, формиат аммония или гидразингидрат, а также каталитическое количество палладия на угле. Реакцию сочетания проводят путем превращения бромида (X) в реакционноспособное металлоорганическое промежуточное соединение, например, путем обработки бутиллитием с получением производного лития или путем обработки магнием с получением производного магния. Реакционноспособность данного промежуточного соединения затем модулируют путем трансметаллировния, например, с получением производного цинка путем обработки ZnCl2, ZnBr2 или ZnI2. Полученное цинкорганическое соединение затем подвергают реакции сочетания с хлорангидридом кислоты общей формулы XI в присутствии каталитического количества комплекса палладия(0). Примеры такого катализатора включают, в особенности не ограничиваясь ими, тетракис(трифенилфосфин)палладий(0), тетракис(трифениларсин)палладий(0), дихлорбис(трифенилфосфин)-палладий(II) или бензилхлорбис(трифенилфосфин)палладий(II).
В некоторых случаях может быть более выгодным изменить последовательность стадий описанных выше способов. Описанная последовательность способов не должна рассматриваться как ограничивающая получение соединений настоящего изобретения общей формулы I, и изменение последовательности реакций является альтернативой, очевидной для специалистов в области органического синтеза.
Полагают, что соединения настоящего изобретения могут использоваться для получения фармацевтических композиций, применяющихся для лечения вышеуказанных заболеваний.
Количество соединения формулы I и Iа (далее упоминается как активный ингредиент), необходимое для получения терапевтического эффекта, разумеется, будет изменяться в зависимости как от конкретного соединения, способа введения, так и от млекопитающего, подлежащего лечению. Подходящая доза соединения формулы I для системной обработки составляет от 0,1 до 200 мг/кг массы тела, наиболее предпочтительная доза, вводимая один или несколько раз в день, составляет от 0,2 до 50 мг/кг массы тела млекопитающего.
Хотя активный ингредиент может быть введен отдельно как необработанное химическое вещество, предпочтительно включать его в составе фармацевтической композиции. Подходящим является, если масса активного ингредиента составляет от 0,1 до 100% от массы композиции. В удобном случае дозированные формы композиции содержат от 0,07 мг до 1 г активного ингредиента. При местном введении масса активного ингредиента предпочтительно составляет от 1 до 20% от массы композиции, однако масса активного ингредиента может составлять до 50 мас.%.
Композиции, подходящие для назального или трансбуккального введения, могут включать от 0,1 до 20 мас.%, например приблизительно 2 мас.%, активного ингредиента.
Под термином дозированная форма подразумевают единичную, т.е. разовую дозу, которая может быть введена пациенту и которая может быть легко обработана и расфасована, оставаясь в виде физически и химически стабильной разовой дозы, включающей либо активное вещество как таковое, либо его смесь с твердыми или жидкими фармацевтическими разбавителями или носителями.
Композиции настоящего изобретения, предназначенные для применения как в ветеринарии, так и для лечения человека, содержат активный ингредиент в сочетании с фармацевтически приемлемым носителем и необязательно другой(ие) терапевтический(ие) ингредиент(ы). Носитель(и) должен быть приемлемым в том смысле, что он должен быть совместимым с другими ингредиентами композиции и не должен оказывать вредного влияния на реципиента.
Композиции включают формы, подходящие для перорального, глазного, ректального, парентерального (включая подкожное, внутримышечное и внутривенное), чрескожного, внутрисуставного, местного, назального или трансбуккального введения.
Обычно композиции могут быть представлены в дозированной лекарственной форме и могут быть получены с помощью любого метода, известного в области фармации. Все методы включают стадию объединения активного ингредиента с носителем, который включает один или несколько дополнительных ингредиентов. В основном композиции получают путем однородного и тщательного смешивания активного ингредиента с жидким носителем, или мелкоизмельченным твердым носителем, или с ними обоими и затем при необходимости формования продукта в целевую композицию.
Композиции настоящего изобретения, подходящие для перорального введения, могут находиться в виде дискретных единиц, таких как капсулы, саше, таблетки или лепешки, каждая из которых содержит предварительно определенное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной или неводной жидкости, или в виде эмульсии типа масло в воде, или вода в масле. Активный ингредиент может быть также введен в виде болюса, электуария или пасты.
Композиции для ректального введения могут находиться в виде свечей, включающих активный ингредиент и такой носитель, как кокосовое масло, или в виде клизмы.
Композиции, подходящие для парентерального введения, в удобном случае включают стерильный масляный или водный препарат активного ингредиента, который предпочтительно является изотоническим по отношению к крови реципиента.
Композиции, подходящие для внутрисуставного введения, могут находиться в виде стерильного водного препарата активного ингредиента, который может находиться в микрокристаллическом виде, например в виде водной микрокристаллической суспензии. В качестве формы представления активного ингредиента как для внутрисуставного, так и для глазного введения могут также использоваться липосомальные композиции или биоразлагаемые полимерные системы.
Композиции, подходящие для местного введения, включая обработку глаза, включают жидкие или полужидкие препараты, такие как линименты, лосьоны, гели, средства нанесения эмульсии типа масло в воде или вода в масле, такие как кремы, мази или пасты; или растворы или суспензии, такие как капли.
Композиции, подходящие для введения в нос или щечную полость, включают порошковые, самораспыляемые и распыляемые композиции, такие как аэрозоли и распылители.
В дополнение к вышеупомянутым ингредиентам композиции данного изобретения могут включать один или несколько добавочных ингредиентов.
Кроме того, композиции могут содержать другие терапевтически активные соединения, обычно применяющиеся при лечении упомянутых выше патологических состояний, например глюкокортикоиды, витамины D, антигистаминные средства, антагонисты фактора активации тромбоцитов (PAF), антихолинергические агенты, метилксантины, β-адренергические агенты, салицилаты, индометацин, флуфенамат, напроксен, тимегадин, соли золота, пенициламин, агенты, понижающие уровень сывороточного холестерина, ретиноиды, соли цинка и салицилазосульфапиридин (салазопирин).
Новые соединения данного изобретения являются полезными для ветеринарной и медицинской практики в качестве системных и местных терапевтических агентов, предназначенных для лечения и профилактики заболеваний. Новые соединения обладают противоугревой активностью и в числе прочего противовоспалительным и цитокин-регулирующим действием, возможно благодаря ингибированию МАР-киназы и могут применяться для лечения и профилактики астмы, аллергии, артрита, включая ревматоидный артрит и спондилоартрит, подагры, атеросклероза, хронического воспалительного заболевания кишечника (болезнь Крона), пролиферативных и воспалительных заболеваний кожи, таких как псориаз и атопический дерматит, увеита, септического шока, СПИДа и остеопороза.
Далее данное изобретение описывается с помощью нижеследующих не ограничивающих общих методик, способов получения и примеров.
ПРИМЕРЫ
Общие методики, способы получения и примеры
Конкретные примеры соединений формулы I перечислены в таблице 2.
Все точки плавления являются нескорректированными. Значения химических сдвигов (δ) (в м.д.) для спектров (300 МГц)1Н и13С ядерного магнитного резонанса (ЯМР) приведены, если не указано иначе, для растворов в дейтерохлороформе и гексадейтеродиметилсульфоксиде, по отношению к сигналам внутреннего стандарта тетраметилсилана (δ 0,00) или хлороформа (1Н ЯМР δ 7,25,13С ЯМР δ 76,81). Значение мультиплета (м), либо определенного (дублет (д), триплет (т), квартет (кв)), либо неопределенного, приведено приблизительно в средней точке, если не указан интервал (с синглет, шир. широкий). Используют безводные растворители. Термин "хроматография" относится к колоночной хроматографии, которую проводят на силикагеле с использованием флэш-методики.
В данном описании используют следующие аббревиатуры: СDСl3= дейтерохлороформ, DMF = N, N-диметилформамид, DMSO-d6гексадейтеродиметилсульфоксид, Et3N = триэтиламин, EtOAc = этилацетат, Et2O=диэтиловый эфир, НМРА = гексаметилтриамид фосфора, NMM=N-метилморфолин, THF = тетрагидрофуран, ВОР-Сl = бис(2-оксо-3-оксазолидинил)фосфиновой кислоты хлорангидрид, ТСХ=тонкослойная хроматография.
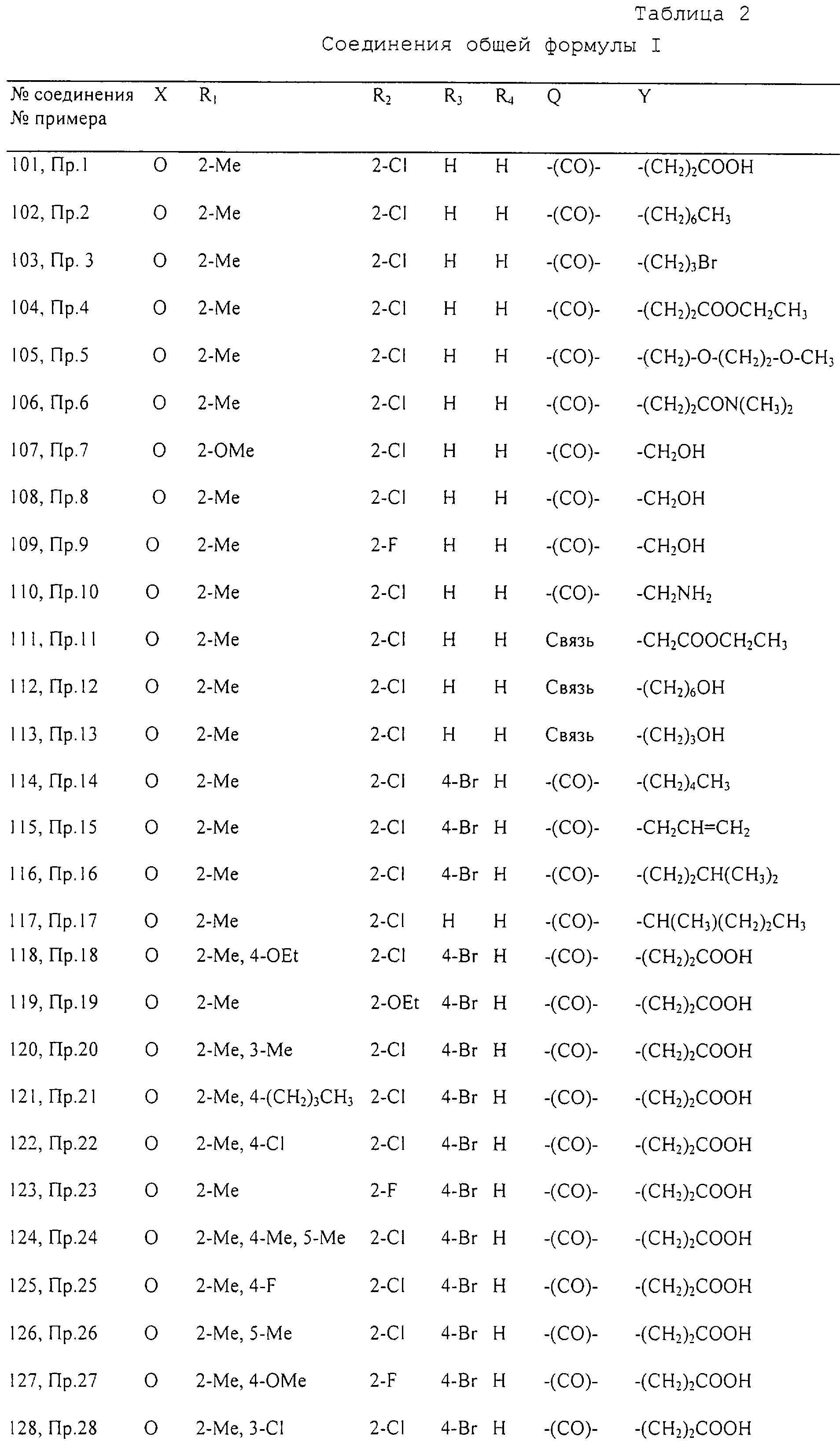
Нумерация в таблице 2 соответствует нумерации в приведенной ниже формуле
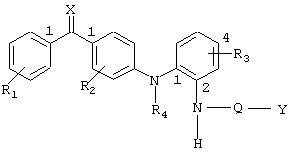
Общая методика
Сочетание соединений общей формулы II с соединениями общей формулы III (Z=Cl) с получением соединений общей формулы I (Q=О) или их защищенных производных.
К охлажденному (0°С) раствору амина (0,9 ммоль) общей формулы II и Et3N (2,7 ммоль) в СН2 Сl2 (5 мл) медленно добавляют раствор хлорангидрида кислоты (1,2 ммоль) общей формулы III в CH2Cl2 (1 мл). Смесь перемешивают 2 ч при 0°С и при КТ (комнатной температуре) в течение ночи. К реакционной смеси добавляют еще CH2Cl2 и раствор последовательно промывают 2М НСl, водой и насыщенным раствором соли, затем сушат (Nа2 SO4), фильтруют и концентрируют в вакууме. Остаток очищают либо кристаллизацией, либо хроматографией, получая анилид общей формулы I или его защищенное производное.
Общая методика 2
Сочетание соединений общей формулы II с соединениями общей формулы III (Z=OH) с получением соединений общей формулы I (Q=O) или их защищенных производных.
NMM (2,8 ммоль) добавляют к раствору кислоты (2,8 ммоль) общей формулы III (Z=O) в THF (10 мл) при -15°С, затем по каплям добавляют изобутилхлорформиат (2,8 ммоль). Смесь перемешивают 30 мин, добавляют раствор амина (2,0 ммоль) общей формулы II в THF (10 мл) и полученную взвесь перемешивают 1 ч при 0°С и при КТ в течение ночи. Реакционную смесь выливают в EtOAc и раствор последовательно промывают 1М НСl, 25% NаНСО3 и насыщенным раствором соли, затем сушат (МgSO4), фильтруют и концентрируют в вакууме. Остаток очищают или кристаллизацией, или хроматографией, получая анилид общей формулы I или его защищенное производное.
Общая методика 3
Алкилирование соединений общей формулы II соединениями общей формулы V с получением соединений общей формулы I (Q=связь), или их защищенных производных.
К взвеси амина (1,0 ммоль) общей формулы II, К2СО3 (2,0 ммоль) и KI (0,1 ммоль) в DMF (5 мл) добавляют алкилирующий реагент (1,0 ммоль) общей формулы V. Смесь перемешивают 24 ч при 25°С или до тех пор, пока исходное вещество не перестанет обнаруживаться с помощью ТСХ. Реакционную смесь выливают в воду (100 мл) и экстрагируют EtOAc (3×50 мл). Объединенные органические экстракты промывают насыщенным раствором соли, сушат (MgSO4), фильтруют и упаривают в вакууме. Остаток очищают хроматографией, получая алкилированный амин общей формулы I или его защищенное производное.
Общая методика 4
Сочетание соединений общей формулы II с соединениями общей формулы III (Z=YCOO) с получением соединений общей формулы I (Q=O) или их защищенных производных.
К раствору амина (2,9 ммоль) общей формулы II в уксусной кислоте (100%, 8 мл) медленно добавляют ангидрид кислоты (3,8 ммоль) общей формулы III. Смесь перемешивают 2 ч при КТ или до тех пор, пока исходное вещество не перестанет обнаруживаться с помощью ТСХ. К реакционной смеси добавляют воду, раствор перемешивают 30 мин и затем дважды экстрагируют EtOAc. Органические фазы сушат (MgSO4), фильтруют и концентрируют в вакууме. Остаток очищают либо кристаллизацией, либо хроматографией, получая анилид общей формулы I или его защищенное производное.
Пример 1.
N-[2-[3-Хлор-4-(2-метилбензоил)фениламино]фенил]сукцинамовая кислота (соединение 101)
Раствор 4-(2-аминофениламино)-2-хлор-2'-метилбензофенона (3,0 ммоль) в ледяной уксусной кислоте (5, 0 мл) при перемешивании нагревают до 70°С, затем добавляют ангидрид янтарной кислоты (4,0 ммоль). В течение 20 мин поддерживают температуру 100°С, после чего реакционную смесь концентрируют в вакууме, получая светло-коричневое сиропообразное вещество, которое кристаллизуется при стоянии. После растирания со смесью Et2O/CH2Cl2 3:1, сопровождающегося фильтрацией и промыванием, получают продукт в виде белых кристаллов.13С ЯМР (DMSO-d6): δ 195,3, 173,9, 170,6, 149,3, 142,4, 139,4, 136,5, 133,5, 132,4, 131,8, 131,1, 130,7, 128,8, 126,5, 125,7, 125,3, 125,1, 124,5, 123,7, 115,3, 112,2, 30,8, 29,1, 19,8.
Пример 2.
2'-[3-Хлор-4-(2-метилбензоил)фениламино]октананилид (соединение 102)
Общая методика: 1
Исходное соединение II: 4-(2-аминофениламино)-2-хлор-2'-метилбензофенон.
Исходное соединение III: октаноилхлорид.
Очистка: хроматография с использованием в качестве элюента смеси EtOAc/пентан 1:3.
13С ЯМР (СDСl3): δ 196,8, 172,8, 148,9, 139,2, 137, 6, 135,1, 133,7, 132,8, 131,8, 131,2, 130,8, 129,5, 128,3, 126,2, 125,6, 125,4, 124,8, 124,1, 116,0, 112,4, 37,2, 31,6, 29,1, 29,0, 25,7, 22,6, 20,3, 14,0.
Пример 3.
4-Бром-2'-[3-хлор-4-(2-метилбензоил)фениламино]бутананилид (соединение 103)
Общая методика: 1
Исходное соединение II: 4-(2-аминофениламино)-2-хлор-2'-метилбензофенон.
Исходное соединение III: 4-бромбутирилхлорид.
Очистка: хроматография с использованием в качестве элюента CH2 Cl2 и затем смеси EtOAc/CH2Cl2 1:20
13С ЯМР (СDСl3): δ 196,8, 171,1, 148,8, 139,1, 137,8, 135,1, 133,6, 132,5, 131, 8, 131,3, 130,9, 129,6, 128,7, 126,3, 125,9, 125,4, 125,0, 123,8, 116,1, 112,5, 44,3, 33,8, 27,9, 20,4.
Пример 4.
Этил-2'-[3-хлор-4-(2-метилбензоил)фениламино]сукцинанилат (соединение 104)
Общая методика: 2
Исходное соединение II: 4-(2-аминофениламино)-2-хлор-2'-метилбензофенон.
Исходное соединение III: моноэтилсукцинат.
Очистка: хроматография с использованием в качестве элюента смеси EtOAc/пентан 1:4 и 1:2.
13С ЯМР (СDСl3): δ 196,5, 173,4, 171,0, 148,5, 139,2, 137,9, 135,0, 133,5, 133,4, 131,3, 130,8, 129,6, 128,9, 126,5, 125,4, 125,2, 124,7, 123,8, 116,5, 112,6, 61,2, 29,7, 20,4, 14,2, 14, 2.
Пример 5.
2-(Метокиэтокси)-2'-[3-хлор-4-(2-метилбензоил)фениламино]-ацетанилид (соединение 105)
Общая методика: 2
Исходное соединение II: 4-(2-аминофениламино)-2-хлор-2'-метилбензофенон.
Исходное соединение III: 2-(2-метоксиэтокси)уксусная кислота.
Очистка: хроматография с использованием в качестве элюента смеси EtOAc/пентан 1:5.
13CNMR (СDСl3): δ 196,4, 169,1, 148,7, 139,3, 137,7, 135,0, 133,6, 133,1, 131,2, 130,8, 130,8, 129,5, 128,6, 126,5, 125,4, 125,3, 124,5, 124,0, 116,2, 112,5, 71,5, 71,3, 70,5, 59,1, 20,4.
Пример 6.
N,N-диметил-N'-2-[3-хлор-4-(2-метилбензоил)фениламино]фенилсукцинамид (соединение 106)
Общая методика: 2
Исходное соединение II: 4-(2-аминофениламино)-2-хлор-2'-метилбензофенон.
Исходное соединение III: N,N-диметилсукцинамовая кислота.
Очистка: хроматография с использованием в качестве элюента EtOAc
13С ЯМР (СDСl3): δ 196,5, 172,2, 148,5, 139,4, 137,8, 134, 9, 133,7, 133,5, 131,2, 130,7, 130,3, 129,6, 128,5, 126,2, 125,3, 125,3, 124,4, 122,5, 116,7, 112,5, 37,1, 35,8, 32,4, 29,6, 20,4.
Пример 7.
2-Гидрокси-2'-[3-хлор-4-(2-метоксибензоил)фениламино]-ацетанилид (соединение 107)
Общая методика: 1
Исходное соединение II: 4-(2-аминофениламино)-2-хлор-2'-метоксибензофенон.
Исходное соединение III: ацетоксиацетилхлорид.
Очистку O-ацетилированного производного (I) проводят методом хроматографии с использованием в качестве элюента смеси Et2O/пентан 1:4. Удаление защитных групп: защищенное производное (I) (0,38 ммоль) и К2СО3 (0,5 ммоль) перемешивают 1 ч в МеОН (5 мл) при температуре окружающей среды. Реакционную смесь выливают в EtOAc, раствор последовательно промывают водой и насыщенным раствором соли, затем сушат (Na2 SO4), фильтруют и концентрируют в вакууме, получая слабо окрашенный твердый продукт.
Т. пл.: 180,0-181,3°С.
13С ЯМР (DMSO-d6): δ 192,3, 170,5, 157,1, 149,7, 133,7, 133,4, 132,8, 132,4, 130,6, 129,4, 129,2, 126,8, 125,7, 125,4, 124,8, 122,2, 120,4, 114,7, 112,0, 111,7, 61,5, 55,6.
Пример 8
2-Гидрокси-2'-[3-хлор-4-(2-метилбензоил)-фениламино]ацетанилид (соединение 108)
Целевое соединение получают по способу примера 7, но вместо 4-(2-аминофениламино)-2-хлор-2'-метоксибензофенона используют 4-(2-аминофениламино)-2-хлор-2'-метилбензофенон. Соединение дополнительно очищают хроматографией, используя в качестве элюента смесь EtOAc/пентан 1:1.
Т. пл.: 127-129°С.
13С ЯМР (СDCl3): δ 197,4, 170,9, 149,0, 138,8, 138,0, 135,0, 133,5, 132,1, 131,4, 131,4, 131,2, 129,9, 128,6, 126,4, 126,2, 125,4, 125,3, 123,4, 116,1, 112,4, 62,4, 20,5.
Пример 9.
2-Гидрокси-2'-[3-фтор-4-(2-метилбензоил)фениламино]ацетанилид (соединение 109)
Целевое соединение получают по способу примера 7, но вместо 4-(2-аминофениламино)-2-хлор-2'-метоксибензофенона используют 4-(2-аминофениламино)-2-фтор-2'-метилбензофенон. Соединение дополнительно очищают кристаллизацией из CH2Cl2.
Т. пл.: 149-150°С.
13С ЯМР (DMSO-d6): δ 192,8, 170,5, 164,6, 161,2, 152,6, 152,4, 140,5, 134,9, 133,4, 132,9, 130,5, 130,3, 129,8, 127,3, 126,0, 125,7, 125,4, 124,8, 122,3, 115,7, 115,5, 109,8, 100,0, 99,7, 61,5, 19,2.
Пример 10.
2-Амино-2'-[3-хлор-4-(2-метилбензоил)-фениламино]ацетанилид (соединение 110)
Общая методика: 2
Исходное соединение II: 4-(2-аминофениламино)-2-хлор-2'-метилбензофенон.
Исходное соединение III: N-(9-флуоренилметоксикарбонил)глицин.
Очистку FMOC-защищенного производного (I) проводят методом хроматографии с использованием в качестве элюента смеси Еt2ОАс/пентан 1:4 и 1:2. Удаление защитных групп: Защищенное производное (I) (0,16 ммоль) и CsF (0,33 ммоль) перемешивают в смеси СН2Сl2 (6 мл) и СН3СN (2 мл) в течение 6 дней при температуре окружающей среды. Реакционную смесь выливают в воду и EtOAc и органическую фазу отделяют. Водную фазу экстрагируют дополнительным количеством EtOAc. Органическую фазу сушат (MgSO4), фильтруют и концентрируют в вакууме, получая неочищенный продукт, который очищают хроматографией, используя в качестве элюента смесь EtOAc/пентан 1:2.
13С ЯМР (СDСl3): δ 196,6, 171,8, 148,8, 139,3, 137,7, 135,0, 133,6, 132,6, 131,5, 131,2, 130, 8, 129,5, 128,5, 126,2, 125,7, 125,3, 124,8, 123,4, 116,1, 112,4, 44,9, 20,4.
Пример 11.
Этил-2-[2-[3-хлор-4-(2-метилбензоил)фениламино]анилин]ацетат (соединение 111)
Общая методика: 3
Исходное соединение II: 4-(2-аминофениламино)-2-хлор-2'-метил-бензофенон.
Исходное соединение V: этилбромацетат.
Очистка: хроматография с использованием в качестве элюента смеси EtOAc/пентан 1:2.
13С ЯМР (СDСl3): δ 196,5, 171,1, 149,9, 143,6, 139,4, 137,7, 135, 1, 133,6, 131,2, 130,6, 129,5, 128,2, 127,8, 126,9, 125,8, 125,3, 118,4, 115,6, 112,0, 111,8, 61,4, 45,7, 20,4, 14,2.
Пример 12.
2-Хлор-4-[2-(6-гидроксигексиламино)фениламино]-2'-метил-бензофенон (соединение 112).
К раствору 4-(2-аминофениламино)-2-хлор-2'-метилбензофенона (0,50 ммоль) в НМРА (5 мл) добавляют 6-бромгексанол (0,76 ммоль) и NаНСО3 (5,0 ммоль). Смесь перемешивают 24 ч при 60°С, добавляют дополнительное количество 6-бромгексанола (0,36 ммоль) и перемешивание продолжают в течение 6 ч. Реакционную смесь выливают в воду со льдом и экстрагируют EtOAc. Объединенные органические экстракты промывают насыщенным раствором соли, сушат (МgSO4), фильтруют и концентрируют в вакууме. Остаток дважды очищают хроматографией, используя в качестве элюента смесь EtOAc/гексан 1:2 и затем Et2O/гeкcaн 1:4, получая алкилированный анилин в виде масла.
1H ЯМР (СDСl3): δ 7,05-7,40 (м, 8Н), 6,60-6,80 (м, 3Н), 6,53 (дд, 1Н), 5,49 (с, 1Н), 3,97 (шир.с, 1Н), 3,60 (шир.т, 2Н), 3,13 (шир.т, 2Н), 2,47 (с, 3Н), 1,20-1,70 (м, 8Н).
Пример 13.
2-Хлор-4-[2-(3-гидроксипропиламино)фениламино]-2'-метилбензофенон (соединение 113)
К раствору 4-(2-аминофениламино)-2-хлор-2'-метилбензофенона (10,0 ммоль) в НМРА (50 мл) добавляют 3-бромпропанол (25,8 ммоль) и NаНСО3 (50 ммоль). Смесь перемешивают 72 ч при 60-70°С. Реакционную смесь выливают в воду со льдом и осажденный продукт отфильтровывают, промывают водой и сушат. Неочищенный продукт очищают хроматографией, используя в качестве элюента смесь EtOAc/Et2O 1:9, с получением алкилированного анилина в виде масла.
13С ЯМР (DMSO-d6): δ 195,0, 151,0, 144,2, 139,6, 136,1, 133,6, 130,9, 130,4, 128,5, 127,0, 126,1, 125,5, 125,2, 124,6, 115,6, 114,3, 111,2, 110,6, 58,6, 39,9, 31,7, 19,6.
Пример 14
5'-Бром-2'-[3-хлор-4-(2-метилбензоил)фениламино]гексананилид (соединение 114)
Общая методика: 1
Исходное соединение II: 4-(2-амино-4-бромфениламино)-2-хлор-2'-метилбензофенон.
Исходное соединение III: гексаноилхлорид.
Очистка: хроматография с использованием в качестве элюента смеси EtOAc/пентан 1:4.
13С ЯМР (СDСl3): δ 196,8, 172,5, 148,3, 138,9, 137,9, 135,0, 133,5, 133,5, 131,4, 131,3, 131,1, 129,7, 129,3, 129,0, 126,3, 125,4, 118,5, 116,2, 112,7, 37,3, 31,3, 25,2, 22,4, 20,5, 13,9.
Пример 15
5'-Бром-2'-[3-хлор-4-(2-метилбензоил)фениламино]бут-3-енанилид (соединение 115)
Общая методика: 2
Исходное соединение II: 4-(2-амино-4-бромфениламино)-2-хлор-2'-метилбензофенон.
Исходное соединение III: 3-бутеновая кислота.
Очистка: хроматография с использованием в качестве элюента дихлорметана.
13С ЯМР (CDCl3): δ 196,9, 169,8, 148,4, 138,8, 137,8, 135,0, 133,5, 131,4, 131,1, 130,8, 130,3, 129,7, 129,1, 128,9, 126,4, 125,9, 125,4, 120,8, 118,7, 116,2, 112,6, 42,1, 20,4.
Пример 16.
5'-Бром-2'-[3-хлор-4-(2-метилбензоил)фениламино]-4-метилпентананилид (соединение 116)
Общая методика: 1
Исходное соединение II: 4-(2-аминофениламино)-2-хлор-2'-метил-бензофенон.
Исходное соединение III: 4-метилпентаноилхлорид.
Очистка: хроматография с использованием в качестве элюента смеси EtOAc/пентан 1:6.
13С ЯМР (СDСl3): δ 196,7, 172,7, 148,3, 138,9, 138,0, 135,0, 133,5, 133,4, 131,4, 131,3, 131,1, 129,7, 129,4, 129,0, 126,3, 125,4, 118,5, 116,3, 112,7, 35,3, 34,3, 27,7, 22,3, 20,5.
Пример 17.
2'-[3-Хлор-4-(2-метилбензоил)фениламино]-2-метилпентананилид (соединение 117)
Общая методика: 1
Исходное соединение II: 4-(2-аминофениламино)-2-хлор-2'-метил-бензофенон.
Исходное соединение III: 2-метилпентаноилхлорид.
Очистка: хроматография с использованием в качестве элюента смеси EtOAc/пентан 1:4.
13С ЯМР (СdСl3): δ 196,6, 176,0, 148,9, 139,2, 137,8, 135,1, 133,6, 132,6, 132,1, 131,3, 130,8, 129,6, 128,8, 126,3, 126,1, 125,4, 123,8, 115,8, 112,3, 42,0, 36,6, 20,6, 20,4, 17,9, 14,0.
Пример 18.
N-[5-Бром-2-[3-хлор-4-(4-этокси-2-метилбензоил)фениламино]-фенил]сукцинамовая кислота (соединение 118)
Целевое соединение получают по способу примера 1, но вместо 4-(2-аминофениламино)-2-хлор-2'-метилбензофенона используют 4-(2-амино-4-бромфениламино)-2-хлор-4'-этокси-2'-метилбензофенон.
13С ЯМР (СDСl3): δ 198,3, 179,0, 170,9, 162,2, 146,7, 142,8, 135,0, 134,5, 133,1, 131,0, 130,1, 130,0, 129,8, 129,5, 128,3, 121,7, 118,0, 116,6, 114,9, 113,7, 111,1, 63,7, 30,4, 29,1, 21,9, 14,7.
Пример 19.
N-[5-Бром-2-[3-этокси-4-(2-метилбензоил)фениламино]фенил]сукцинамовая кислота (соединение 119)
Целевое соединение получают по способу примера 1, но вместо 4-(2-аминофениламино)-2-хлор-2'-метилбензофенона используют 4-(2-амино-4-бромфениламино)-2-этокси-2'-метилбензофенон. Соединение дополнительно очищают кристаллизацией из смесей дихлорметана и н-гексана.
13С ЯМР (): δ 195,3, 173,7, 170,8, 160,0, 150,1, 142,9, 134,3, 132,6, 132,2, 132,1, 129,9, 128,7, 127,5, 126,8, 126,5, 125,0, 124,5, 118,6, 114,7, 107,2, 98,1, 62,9, 30,7, 28,8, 19,2, 13,5.
Пример 20.
N-[5-Бром-2-[3-хлор-4-(2,3-диметилбензоил)фениламино]фенил]сукцинамовая кислота (соединение 120)
Целевое соединение получают по способу примера 1, но вместо 4-(2-аминофениламино)-2-хлор-2'-метилбензофенона используют 4-(2-амино-4-бромфениламино)-2-хлор-2',3'-диметилбензофенон. Соединение дополнительно очищают кристаллизацией из смесей дихлорметана и н-гексана.
13С ЯМР ():δ 195,6, 173,7, 170,7, 148,9, 140,3, 137,4, 134,2, 133,8, 133,6, 133,3, 131,6, 131,2, 127,5, 126,7, 126,6, 125,7, 125,3, 125,1, 115,7, 112,1, 30,7, 28,8, 19,6, 16,0.
Пример 21.
N-[5-Бром-2-[3-хлор-4-(4-н-бутил-2-метилбензоил)фениламино]-фенил]сукцинамовая кислота (соединение 121)
Целевое соединение получают по способу примера 1, но вместо 4-(2-аминофениламино)-2-хлор-2'-метилбензофенона используют 4-(2-амино-4-бромфениламино)-4'-н-бутил-2-хлор-2'-метилбензофенон.
13С ЯМР (СDСl3): δ 199,4, 178,9, 170,9, 147,9, 147,0, 139,4, 135,1, 134,4, 133,6, 132,0, 131,9, 131,5, 130,2, 129,5, 128,4, 125,7, 122,0, 116,6, 115,2, 113,6, 35,6, 33,2, 30,4, 29,1, 22,4, 21,2, 13,9.
Пример 22.
N-[5-Бром-2-[3-хлор-4-(4-хлор-2-метилбензоил)фениламино]фенил]сукцинамовая кислота (соединение 122)
Целевое соединение получают по способу примера 1, но вместо 4-(2-аминофениламино)-2-хлор-2'-метилбензофенона используют 4-(2-амино-4-бромфениламино)-2,4'-дихлор-2'-метил-бензофенон. Соединение дополнительно очищают кристаллизацией из смесей дихлорметана и н-гексана.
13С ЯМР (DMSO-d6): δ 194,1, 173,7, 170,7, 148,9, 139,1, 137,9, 135,1, 133,4, 133,3, 131,2, 130,7, 130,5, 127,5, 126,7, 126,4, 125,6, 125,3, 115,8, 115,5, 112,3, 30,7, 28,8, 19,4.
Пример 23.
N-[5-Бром-2-[3-фтор-4-(2-метилбензоил)фениламино]фенил]сукцинамовая кислота (соединение 123)
Целевое соединение получают по способу примера 1, но вместо 4-(2-аминофениламино)-2-хлор-2'-метилбензофенона используют 4-(2-амино-4-бромфениламино)-2-фтор-2'-метилбензофенон. Соединение дополнительно очищают кристаллизацией из смесей дихлорметана и н-гексана.
13С ЯМР (DMSO-d6): δ 192,8, 173,7, 170,8, 162,7, 151,3, 140,5, 134,9, 133,4, 133,1, 131, 1, 130,5, 129,8, 127,5, 127,3, 126,7, 125,6, 125,4, 116,0, 115,9, 110,3, 100,6, 30,7, 28,8, 19,2.
Пример 24.
N-[5-Бром-2-[3-хлор-4-(2,4, 5-триметилбензоил)фениламино]фенил]сукцинамовая кислота (соединение 124)
Целевое соединение получают по способу примера 1, но вместо 4-(2-аминофениламино)-2-хлор-2'-метилбензофенона используют 4'-(2-амино-4-бромфениламино)-2'-хлор-2,4,5-триметилбензофенон. Соединение дополнительно очищают кристаллизацией из смесей дихлорметана и н-гексана.
13С ЯМР (DMSO-d6): δ 195,2, 173,7, 170,7, 148,2, 139,7, 136,2, 134,3, 133,2, 133,1, 132,8, 132,8, 132,4, 131,5, 130,4, 127,8, 127,5, 126,7, 124,9, 115,5, 115,4, 112,3, 30,7, 28,8, 19,4, 19,2, 18,6.
Пример 25.
N-[5-Бром-2-[3-хлор-4-(4-фтор-2-метилбензоил)фениламино]фенил]сукцинамовая кислота (соединение 125)
Целевое соединение получают по способу примера 1, но вместо 4-(2-аминофениламино)-2-хлор-2'-метилбензофенона используют 4-(2-амино-4-бромфениламино)-2-хлор-4'-фтор-2'-метилбензофенон.
13С ЯМР (СDСl3): δ 197,7, 178,6, 170,9, 164,5, 147,6, 142,4, 134,3, 134,0, 133,6, 133,5, 132,0, 130,8, 129,6, 129,1, 128,0, 123,1, 118,6, 116,4, 116,1, 113,5, 112,7, 30,7, 29,1, 21,1.
Пример 26.
N-[5-Бром-2-[3-хлор-4-(2,5-диметилбензоил)фениламино]фенил]сукцинамовая кислота (соединение 126)
Целевое соединение получают по способу примера 1, но вместо 4-(2-аминофениламино)-2-хлор-2'-метилбензофенона используют 4-(2-амино-4-бромфениламино)-2-хлор-2',5'-диметилбензофенон. Соединение дополнительно очищают кристаллизацией из смесей дихлорметана и н-гексана.
13С ЯМР (DMSO-d6): δ 195,3, 173,7, 170,7, 148,6, 139,0, 134,6, 133,3, 133,2, 133,2, 131,3, 130,9, 129,1, 127,5, 127,0, 126,7, 125,1, 115,6, 112,3, 30,7, 28,8, 20,3, 19,3.
Пример 27.
N-[5-Бром-2-[3-фтор-4-(4-метокси-2-метилбензоил)фениламино]фенил]сукцинамовая кислота (соединение 127)
Целевое соединение получают по способу примера 1, но вместо 4-(2-аминофениламино)-2-хлор-2'-метилбензофенона используют 4-(2-амино-4-бромфениламино)-2-фтор-4'-метокси-2'-метилбензофенон. Соединение дополнительно очищают кристаллизацией из смесей дихлорметана и н-гексана.
13С ЯМР (DMSO-d6): δ 191,9, 173,7, 170,8, 162,0, 160,7, 150,4, 138,9, 133,2, 132,8, 132,1, 131,4, 131,1, 127,5, 126,7, 125,2, 117,0, 116,3, 115,6, 110,6, 110,4, 100,7, 55,2, 30,7, 28,8, 20,1.
Пример 28.
N-[5-Бром-2-[3-хлор-4-(3-хлор-2-метилбензоил)фениламино]фенил]сукцинамовая кислота (соединение 128)
Целевое соединение получают по способу примера 1, но вместо 4-(2-аминофениламино)-2-хлор-2'-метилбензофенона используют 4-(2-амино-4-бромфениламино)-2,3'-дихлор-2'-метилбензофенон. Соединение дополнительно очищают кристаллизацией из смесей дихлорметана и н-гексана.
13С ЯМР (DMSO-d6): δ 193,8, 173,7, 170,7, 149,4, 142,2, 134,5, 134,2, 134,0, 133,5, 133,2, 130,9, 130/7, 127,5, 127,2, 126,7, 126,6, 125, 6, 125,4, 116,0, 115,7, 112,2, 30,7, 28,8, 16,6.
Пример 29.
Таблетка, содержащая соединение 111, компоненты, мг:
Соединение 111 (активное вещество) 50
Лактоза 125
Крахмал 12
Метилцеллюлоза 2
Карбоксиметилцеллюлоза натрия 10
Стеарат магния 1
Активное вещество, лактозу и крахмал перешивают до гомогенного состояния в подходящем миксере и смачивают 5%-ным водным раствором метилцеллюлозы вязкость 15 сПз. Перемешивание продолжают до образования гранул. При необходимости влажные гранулы пропускают через подходящее сито и сушат, пока содержание воды не станет менее 1%, в подходящем сушильном аппарате, например в печи для обработки в кипящем слое или в сушильной печи. Высушенные гранулы пропускают через сито с диаметром отверстий 1 мм и перемешивают с карбоксиметилцеллюлозой натрия до гомогенного состояния. Добавляют стеарат магния и перемешивание продолжают в течение короткого периода времени. С помощью подходящего устройства для таблетирования из гранул получают таблетки весом 200 мг.
Пример 30
Композиция для инъекции, содержащая соединение 111, компоненты, %:
Соединение 111 (активное вещество) 1
Хлорид натрия q.s.
Этанол 10
Вода для инъекции до 100
Активное вещество растворяют в этаноле (10%), затем добавляют воду для инъекции до 100%, из которой предварительно приготовлен изотонический раствор с помощью хлорида натрия.
Ампулы заполняют полученной смесью и стерилизуют.
Пример 31
Композиция крема, содержащая соединение 101
Соединение 101 (10 г) растворяют в октилдодецилмиристате (250 г), получая часть А. Метилпарабен (1 г) и пропилпарабен (0,2 г) растворяют в феноксиэтаноле (6 г) и смешивают с 0,025 М фосфатным буфером рН 7,5 (632,8 г), получая часть В. Цетостеариловый спирт (50 г) и ARLACEL 165® (50 г) расплавляют в сосуде при 70-80°С. Добавляют часть А и нагревают до 60-70°С. Водную фазу тоже нагревают до 60-70°С и медленно добавляют к расплавленной масляной фазе при высокой скорости перемешивания. Гомогенизированные компоненты охлаждают до комнатной температуры.
Источники информации
Barnes, Peter J.; Cytokine-directed therapies for asthma, Journal of Allergy and Clinical Immunology (2001), 108 (2, Suppl.), S72-S76.
Rusznak, Csaba; New approaches for the treatment of allergic conditions, Current Medicinal Chemistry: Anti-Inflammatory & Anti-Allergy Agents (2003), 2 (2), 107-118.
Sieper, Joachim; Braun, Juergen; Anti-TNF agents for the treatment of spondyloarthropathies. Expert Opinion on Emerging Drugs (2002), 7 (2), 235-246.
Sebastiani, Silvia; Albanesi, Cristina; De Pita, Ornella; Puddu, Pietro; Cavani, Andrea; Girolomoni, Giampiero; The rote of chemokines in allergic contact dermatitis, Archives of Dermatological Research (2002), 293 (11), 552-559.
Nahar, Ibrahim К.; Shojania, Kam; Marra, Carlo A.; Alamgir, Abul H.; Anis, Aslam H.; Infliximab treatment of rheumatoid arthritis and Crohn's disease; Annals of Pharmacotherapy (2003), 37 (9), 1256-1265.
Taylor, Peter С.; Anti-TNF-α therapy for rheumatoid arthritis; an update; Internal Medicine (Tokyo, Japan) (2003), 42 (1), 15-20.
Sack, Michael N.; Tumor necrosis factor-α in cardiovascular biology and the potential role for anti-tumor necrosis factor-α therapy in heart disease; Pharmacology & Therapeutics (2002), 94 (1-2), 123-135.
Kam, Lori Y.; Targan, Stephan R.; TNF-α antagonists for the treatment of Crohn's disease; Expert Opinion on Pharmacotherapy (2000), 1 (4), 615-622.
LaDuca, Jeffrey R.; Gaspari, Anthony A.; Targeting tumor necrosis factor alpha: New drugs used to modulate inflammatory diseases; Dermatologic Clinics (2001), 19 (4), 617-635.
Girolomoni, Giampiero; Pastore, Saveria; Albanesi, Cristina; Cavani, Andrea; Targeting tumor necrosis factor- as a potential therapy in inflammatory skin diseases; Current Opinion in Investigational Drugs (PharmaPress Ltd.) (2002), 3 (11), 1590-1595.
Sebastiani, Silvia; Albanesi, Cristina; De Pita, Ornella; Puddu, Pietro; Cavani, Andrea; Girolomoni, Giampiero; The role of chemokines in allergic contact dermatitis; Archives of Dermatological Research (2002), 293 (11), 552-559.
Reimold, A.M.; TNF-α as therapeutic target: New drugs, more applications; Current Drug Targets: Inflammation & Allergy (2002), 1 (4), 377-392.
Rabinovici, Reuven; Yue, Tian Li; Vernick, Jerome; Feuerstein, Giora; PAF and TNF-α interactions in the pathophysiology of septic shock; Advances in Experimental Medicine and Biology (1991), 314 (Cell-Cell Interact. Release Inflammatory Mediators), 193-203.
Rifas, L; Bone and cytokines: beyond JL-1, IL-6 and TNF-α; Calcified Tissue International (1999), 64 (1), 1-7.
Gougeon, Marie-Lise; Ledru, Eric; IMaora, Honami; Bocchino, Marialuisa; Lecoeur, Herve; HIV, cytokines and programmed cell death (PCD): A subtle interplay; Annals of the New York Academy of Sciences (2000), 926 (Mechanisms of Cell Death II), 30-45.
Реферат
Изобретение относится к новым аминобензофенонам общей формулы (I)
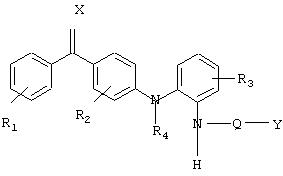
где R1 и R3 обозначают один или несколько одинаковых или различных заместителей, выбранных из группы, состоящей из галогена, (С1-С3)-алкила, (С1-С3)-алкокси; при условии, что, если R1 обозначает один заместитель, то он находится в орто-положении, а если R1обозначает несколько заместителей, то, по меньшей мере, один заместитель R1 находится в орто-положении; и R2 обозначает один заместитель в орто-положении, причем данный заместитель выбран из группы, состоящей из галогена, (С1-С3)-алкокси; а R3 дополнительно может обозначать водород; R4 обозначает водород; Х обозначает кислород; Q обозначает -(СО)- или связь; Y обозначает (С5-С15)алкил, (С2-С15)олефиновую группу; причем любая из указанных групп может быть необязательно замещена одним или несколькими одинаковыми или различными заместителями, выбранными из группы, состоящей из заместителей формулы R5, определенной ниже, за тем исключением, что, когда Q обозначает связь, тогда Y обозначает (С6-С15)алкил или (С5-С15)-алкил, замещенный группами R5; (С1-С4)алкил, замещенный одним или несколькими заместителями, выбранными из группы R5; или группу формулы - (Z -O)n- Z, где Z представляет собой (С1 -С3)алкил, n является целым числом >1, причем количество атомов в непрерывной линейной последовательности атомов в группе Y не превышает 15; R5 обозначает галоген, гидрокси, амино, (C1-C6)-алкиламино, (С1-С3)алкоксикарбонил, -СООН, -CONHR' или -COONR'R', где R' обозначает (С1-С3)алкил; или его фармацевтически приемлемая соль. Изобретение также относится к фармацевтической композиции для ингибирования секреции интерлейкина 1β (IL-1β) и фактора а некроза опухолей (TNF-α). Технический результат - получение новых соединений и фармацевтической композиции на их основе в целях использования их в медицинской и ветеринарной терапевтической практике. 2 с. и 4 з.п. ф-лы, 2 табл.
Формула


Комментарии