Производные циклоалкано-пиридина, фармацевтическая композиция на их основе и промежуточные соединения - RU2194698C2
Код документа: RU2194698C2
Чертежи
































































































Описание
Изобретение относится к новым химическим соединениям, обладающим активностью, тормозящей протеин переноса сложного эфира холестерина и стимулирующей обратный транспорт холестерина, конкретно к производным циклоалканопиридина, фармацевтической композиции на их основе и промежуточным соединениям.
Известны производные циклоалканоиндола и -азаиндола, обладающие антиатериосклеротической активностью (см. заявку DE 4435477, кл. С 07 D 471/04, А 61 К 31/645, опубл. 11.04.1996 г.).
Задачей изобретения является разработка биологически активных соединений, которые могут представлять собой активное вещество фармацевтической композиции, обладающей активностью, тормозящей протеин переноса сложного эфира холестерина и стимулирующей обратный транспорт холестерина.
Поставленная задача решается предлагаемыми циклоалканопиридина общей формулы (I)

где А - арил с 6-10 атомами углерода, незамещенный или монозамещенный галогеном;
D - арил с 6-10 атомами углерода, незамещенный или замещенный фенилом, нитро, галогеном, трифторметилом или трифторметокси, или остаток формулы
R3-L-

R7-T-O-X- ,
где R3, R4 и R7 независимо друг от друга означают циклоалкил с 3-6 атомами углерода или арил с 6-10 атомами углерода;
R3 и/или R4 означают остаток формулы
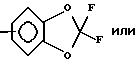

R5 - водород или галоген;
R6 - водород, галоген, азидо, трифторметил, гидроксил или остаток формулы -NR8R9,
где
R8 и R6 одинаковы или различны и означают водород или алкил с 1-6 атомами углерода;
или
R5 и R6 вместе образуют остаток формулы =NR10,
где
R10 означает водород или линейные или разветвленные алкил и ацил, каждый с 1-6 атомами углерода;
L - линейные или разветвленные алкиленовые и алкениленовые цепи, каждая с 1-8 атомами углерода, незамещенные или замещенные однократно гидроксилом;
Т и Х одинаковы или различны и означают линейную или разветвленную алкиленовую цепь с 1-8 атомами углерода; или
Т или Х означают связь;
Е - циклоалкил с 3-8 атомами углерода, линейный или разветвленный алкил с 1-8 атомами углерода или фенил, незамещенный или замещенный галогеном или трифторметилом;
R1 и R2 вместе образуют линейную или разветвленную алкиленовую цепь с 1-7 атомами углерода, которая замещена карбонильной группой и/или остатками формулы



-OR11 или

где а и b одинаковы или различны и означают число 1, 2 или 3,
R11 - водород, линейный или разветвленный силилалкил с 1-8 атомами углерода, линейный или разветвленный алкил с 1-8 атомами углерода, незамещенный или замещенный гидроксилом, линейным или разветвленным алкоксилом с 1-6 атомами углерода или фенилом, незамещенным или замещенным остатком из группы, включающей галоген, нитро, трифторметил, трифторметокси или алкил, незамещенный или замещенный группой формулы -OR12,
где
R12 - линейный или разветвленный ацил с 1-4 атомами углерода или бензил,
или
R11 - линейный или разветвленный ацил с 1-20 атомами углерода или бензоил, незамещенные или замещенные галогеном, трифторметилом, нитро или трифторметокси, или линейный или разветвленный фторацил с 1-8 атомами углерода и 1-9 атомами фтора;
при этом карбоциклы, в случае необходимости также в геминальном положении, могут быть замещены 1-6 одинаковыми или различными остатками из группы, включающей гидроксил, циклоалкил с 3-7 атомами углерода, алкоксил или алкилтио, каждый с 1-6 атомами углерода, и линейный или разветвленный алкил с 1-6 атомами углерода, замещенный одно- или двукратно гидроксилом, и/или фенил, который может быть замещен галогеном или трифторметилом;
и/или карбоциклы, также в геминальном положении, могут быть однократно замещены остатком из группы, включающей фенил, бензоил и тиофенил, незамещенные или замещенные галогеном или трифторметилом, или могут быть замещены остатком формулы
-SO2-C6H5, -(CO)d-NR13R14 или =O,
где d - число 0 или 1,
R13 и R14 одинаковы или различны и означают водород, циклоалкил с 3-6 атомами углерода, линейный или разветвленный алкил с 1-6 атомами углерода или фенил, незамещенный или однократно замещенный галогеном, трифторметилом или нитрогруппой,
и/или образовавшиеся карбоциклы могут быть замещены спиросвязанным остатком формулы




где Y и Y1 вместе образуют 2- до 6-членную линейную или разветвленную алкиленовую цепь;
е - число 1, 2, 3, 4, 6 или 7;
R16 и R16 вместе образуют 3- до 7-членный гетероцикл, содержащий атом кислорода;
смесью их изомеров или отдельными изомерами, их солями и N-окислами, за исключением 5(6Н)-хинолона, 3-бензоил-7,8-дигидро-2,7,7-триметил-4-фенила.
Предпочитаются производные циклоалкано-пиридина вышеприведенной формулы (I),
где А - нафтил или
фенил,
незамещенные или монозамещенные фтором, хлором, бромом;
D - фенил, незамещенный или замещенный нитро, фтором, хлором, бромом, фенилом, трифторметилом или трифторметокси, или остаток
формулы
R3-L-

R7-T-O-X- ,
где R3, R4 и R7 независимо друг от друга означают циклопропил, циклопентил или циклогексил, фенил, нафтил;
R3 и/или R4 означают остаток формулы


где R5 - водород, фтор, хлор или бром;
R6 - водород, фтор, хлор, бром, азидо, трифторметил, гидроксил или остаток формулы -NR8R9,
где
R8 и R9 одинаковы или различны и означают водород или алкил с 1-4 атомами углерода;
или
R5 и R6 вместе образуют остаток формулы =NR10,
где
R10 означает водород или линейные или разветвленные алкил и ацил, каждый с 1-4 атомами углерода;
L - линейные или разветвленные алкиленовая и алкениленовая цепи, каждая с 1-6 атомами углерода, незамещенные или замещенные однократно гидроксилом;
Т и Х одинаковы или различны и означают линейную или разветвленную алкиленовую цепь с 1-6 атомами углерода;
или
Т или Х означают связь;
Е - циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, линейный или разветвленный алкил с 1-6 атомами углерода или фенил, незамещенный или замещенный фтором, хлором или трифторметилом;
R1 и R2 вместе образуют линейную или разветвленную алкиленовую цепь с 1-6 атомами углерода, которая замещена карбонильной группой и/или остатком формулы


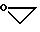
-OR11 или

где а и b одинаковы или различны и означают число 1, 2 или 3,
R11 - линейный или разветвленный силиалкил с 1-7 атомами углерода, линейный или разветвленный алкил с 1-6 атомами углерода, незамещенный или замещенный гидроксилом, линейным или разветвленным алкоксилом с 1-4 атомами углерода или фенилом, незамещенным или замещенным остатком из группы, включающей фтор, хлор, бром, нитро, трифторметил, трифторметокси, или алкил, незамещенный или замещенный группой формулы -OR12,
где
R12 - линейный или разветвленный ацил с 1-3 атомами углерода или бензил,
или
R11 - линейный или разветвленный ацил с 1-18 атомами углерода или бензоил, незамещенные или замещенные фтором, хлором, бромом, трифторметилом, нитро или трифторметоксилом, линейный или разветвленный фторацил с 1-6 атомами углерода;
при этом карбоциклы в случае необходимости также в геминальном положении, могут быть замещены одно- до пятикратно одинаковыми или различными остатками из группы, включающей гидроксил, циклопропил, циклобутил, циклопентил, циклогексил, алкоксил и алкилтио, каждый с 1-5 атомами углерода, или линейный или разветвленный алкил с 1-5 с атомами углерода, замещенный одно- или двукратно гидроксилом, и/или фенил, который может быть замещен фтором, хлором, бромом или трифторметилом;
и/или карбоциклы, также в геминальном положении, могут быть однократно замещены остатком из группы, включающей фенил, бензоил и тиофенил, незамещенные или замещенные фтором, хлором, бромом или трифторметилом, или могут быть замещены остатком формулы
-SO2 -C6H5 , -(CO)d-NR13R14 или =O.
где d - число 0 или 1,
R13 и R14 одинаковы или различны и означают
водород, циклопропил,
циклобутил, циклопентил, циклогексил, линейный или разветвленный алкил с 1-5 атомами углерода или фенил, незамещенный или однократно замещенный фтором, хлором, бромом или
трифторметилом;
и/или образовавшиеся карбоциклы могут быть замещены спиросвязанным остатком формулы


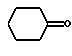
где Y и Y1 вместе образуют 2- до 5-членную линейную или разветвленную алкиленовую цепь,
е - число 1, 2, 3, 4, 5 или 6;
смесь их изомеров или отдельные изомеры, их соли и N-окислы, за исключением 5(6Н)-квинолона, 3-бензоил-7,8-дигидро-2,7,7-триметил-4-фенила.
В частности предпочитаются производные циклоалкано-пиридина вышеприведенной
формулы (I),
где А
- фенил, незамещенный или монозамещенный фтором, хлором, бромом,
D - фенил, незамещенный или замещенный нитро, трифторметилом, фенилом, фтором, хлором или бромом,
или остаток формулы
R3-L-

R7-T-O-X- ,
где R3, R4 и R7 независимо друг от друга означают циклопропил, циклопентил или циклогексил, фенил, нафтил,
R3 и/или R4 означают остаток формулы


где R5 - водород или фтор,
R6 - водород, фтор, хлор, бром, азидо, трифторметил, гидроксил, или остаток формулы -NR8R9,
где
R8 и R9 одинаковы или различны и означают водород или алкил с 1 - 3 атомами углерода,
или
R5 и R6 вместе образуют остаток формулы =NR10,
где
R10 означает водород или линейные или разветвленные алкил и ацил, каждый с 1-4 атомами углерода;
L - линейные или разветвленные алкиленовая и алкениленовая цепи, каждая с 1-5 атомами углерода, незамещенные или замещенные однократно гидроксилом;
Т и Х одинаковы или различны и означают линейную или разветвленную алкиленовую цепь с 1-3 атомами углерода;
или
Т или Х означают связь;
Е - циклопропил, циклопентил, циклогексил или фенил, незамещенный или замещенный фтором или трифторметилом, или линейный или разветвленный алкил с 1-4 атомами углерода;
R1 и R2 вместе образуют линейную или разветвленную алкиленовую цепь с 1-5 атомами углерода, которая замещена карбонильной группой и/или остатком формулы



-OR11 или

где а и b одинаковы или различны и означают число 1, 2 или 3,
R11 - линейный или разветвленный силилалкил с 1-6 атомами углерода, линейный или разветвленный алкил с 1-4 атомами углерода, незамещенный или замещенный гидроксилом, линейным или разветвленным алкоксилом с 1-3 атомами углерода или фенилом, незамещенным или замещенным остатком из группы, включающей фтор, хлор, бром, нитро, трифторметил, трифторметокси, или алкил, незамещенный или замещенный группой формулы -OR12,
где
R12 - линейный или разветвленный ацил с 1-3 атомами углерода или бензил,
или
R11 - линейный или разветвленный ацил с 1-15 атомами углерода и бензоил, незамещенные или замещенные фтором, хлором, бромом, трифторметилом, нитро или трифторметоксилом, или линейный или разветвленный фторацил с 1-4 атомами углерода,
при этом карбоциклы, в случае необходимости также в геминальном положении, могут быть замещены одно- до четырехкратно одинаковыми или различными остатками из группы, включающей гидроксил, циклопропил, циклобутил, циклопентил, циклогексил, алкоксил или алкилтио, каждый с 1-5 атомами углерода, и линейный или разветвленный алкил с 1-5 атомами углерода, замещенный одно- или двукратно гидроксилом, и фенил, который может быть замещен фтором, хлором, бромом или трифторметилом;
и/или карбоциклы, также в геминальном положении, могут быть однократно замещены остатком из группы, включающей фенил, бензоил и тиофенил,
или могут быть замещены остатком формулы
-SO2-C6H5, -(CО)d-NR13R14 или =O,
где d - число 0 или 1,
R13 и R14 одинаковы или различны и означают водород, циклопропил, циклопентил, линейный или разветвленный алкил с 1-4 атомами углерода или фенил, незамещенный или однократно замещенный фтором, хлором или бромом;
и/или образовавшиеся карбоциклы могут быть замещены спиросвязанным остатком формулы



где Y и Y1 вместе образуют 2- до 6-членную линейную или разветвленную алкиленовую цепь,
е - число 1, 2, 3, 4, 5 или 6;
смесь их изомеров или отдельные изомеры, их соли и N-окислы, за исключением 5(6Н)-квинолона, 3-бензоил-7,8-дигидро-2,7,7-триметил-4-фенила.
Предлагаемые соединения
общей формулы (I) можно получать за счет того, что
(А) в случае,
если D ≠ арил, соединение общей формулы (II)

где А, Е, R1 и R имеют вышеуказанное значение,
подвергают взаимодействию с металлоорганическим реагентом в среде инертного растворителя, направленному на введение заместителя D,
или в случае, если D означает остаток формулы R7-T-O-X,
(Б) соединение общей формулы (III)

где А, Е, X, R1 и R2 имеют вышеуказанное значение,
подвергают взаимодействию с соединением общей формулы (IV)
R7-T-Z (IV)
где R7 и Т имеют вышеуказанное значение и
Z означает галоген, предпочтительно хлор или бром,
в среде инертного растворителя, при необходимости в присутствии основания и/или вспомогательного вещества;
или
(В) соединение общей формулы (III) путем взаимодействия с соединением общей формулы (V)

где R17 - линейный алкил с 1-4 атомами углерода,
переводят в соединение общей формулы (VI)

где А, Е, X, R1, R2 и R17 имеют вышеуказанное значение,
а затем подвергают взаимодействию с соединением общей формулы (VII)
R7-T-O-H (VII),
где R7 и Т имеют вышеуказанное значение,
с последующим, в случае необходимости, снятием защитной группы,
или
(Г) для получения соединений общей формулы (Iа)
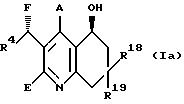
где А и R4 имеют вышеуказанное значение,
R18 и R16 одинаковы или различны и означают циклоалкил с 3-7 атомами углерода, алкоксил или алкилтио, каждый с 1-6 атомами углерода, линейный или разветвленный алкил с 1-6 атомами углерода, или фенил, бензоил, тиофенил, незамещенные или замещенные галогеном или трифторметилом,
или
R18 и R19 означают спиросвязанные остатки формулы

где W, Y, Y', R15 и R16 имеют вышеуказанное значение,
соединение общей формулы (VIII)
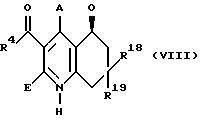
где R4, R18, R19, А и Е имеют вышеуказанное значение,
окисляют до соединения общей формулы (IX)

где R4, R18, R19, А и Е имеют вышеуказанное значение,
которое путем асимметрического восстановления превращают до соединения общей формулы (X)

где R4, R18, R19, А и Е имеют вышеуказанное значение,
которое путем введения защитной группы для гидроксила переводят в соединение общей формулы (XI)

где R4, R18, R19, А и Е имеют вышеуказанное значение, и
R20 - защитная группа для гидроксила, предпочтительно радикал формулы
-SiR21-R22R23,
где
R21, R22 и R23 одинаковы или различны и означают алкил с 1-4 атомами углерода,
из которого путем диастереомерного восстановления получают соединение общей формулы (XII),
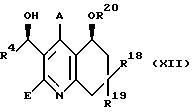
где R4, R18, R18, R20, А и Е имеют вышеуказанное значение,
которое подвергают взаимодействию с агентом фторирования, таким как, например, диэтиламинотрифторид серы и производные тиотетрафторида, с получением соединения общей формулы (XIII)

где R4, R18, R19, R20, А и Е имеют вышеуказанное значение,
в котором снимают защитную группу по обычным методам и при необходимости значения радикалов D, Е и/или R1 и R2 изменяют в рамках вышеприведенного определения по обычным методам.
Вышеприведенные способы поясняются схемами (А), (Б), (В), (Г), где используются нижеследующие условные сокращения:
DAST - трифторид
диэтиламиносеры
THF - тетрагидрофуран
Me
- метил
tBu - трет.бутил
МеОН - метанол
Ms - мелизат.
В качестве растворителей при осуществлении вышепредставленных способов пригодны простые эфиры, как диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир, или углеводороды, как бензол, толуол, ксилол, гексан, циклогексан или нефтяные фракции, или галогенсодержащие углеводороды, как дихлорметан, трихлорметан, тетрахлорметан, дихлорэтилен, трихлорэтилен или хлорбензол, или сложные эфиры уксусной кислоты, или триэтиламин, пиридин, диметилсульфоксид, диметилформамид, триамид гексаметилфосфорной кислоты, ацетонитрил, ацетон или нитрометан. Возможно также применение смесей указанных растворителей. Предпочитают дихлорметан.
В качестве оснований при осуществлении отдельных стадий пригодны стандартные сильные основные соединения. К ним относятся предпочтительно органические соединения лития, такие как, например, н.-бутиллитий, втор.бутиллитий или фениллитий, или амиды, такие как, например, диизопропиламид лития, амид натрия или амид калия, или гексаметилсилиламид лития, или гидриды щелочных металлов как гидрид натрия или гидрид калия. Особенно предпочитают н.-бутиллитий, гидрид натрия или диизопропиламид лития.
При осуществлении способов [Б] и [В], кроме того, пригодны стандартные неорганические основания. Предпочтительными являются гидроокиси щелочных металлов или щелочно-земельных металлов, как, например, гидроокись натрия или калия, или гидроокись бария, карбонаты щелочных металлов, как, например, карбонат натрия или калия, или бикарбонат натрия. Особенно предпочитают гидрид натрия или гидроокись калия.
В качестве металлоорганических реагентов пригодны системы, как, например, смесь магния и бромбензотрифторида, и н.-трифторметилфениллитий.
Как правило, реакции восстановления происходят предпочтительно с применением восстановителей, являющихся пригодными для восстановления кетонов до гидроксильных соединений. Особенно пригодным при этом является восстановление с применением гидридов металла или комплексных гидридов металла в среде инертных растворителей, при необходимости в присутствии триалкилборана. Реакции восстановления осуществляются предпочтительно с применением комплексных гидридов металла, таких как, например, боранат лития, боранат натрия, боранат калия, боранат олова, триалкилгидридобора-нат лития, диизобутилалюмогидрид или алюмогидрид лития. В частности, предпочитают в качестве восстановителя диизобутилалюмогидрид или боргидрид натрия.
Как правило, восстановитель используют в количестве 1-6 моль, предпочтительно 1-4 моль в пересчете на моль подвергаемых восстановлению соединений.
Реакция восстановления происходит, как правило, при температуре от -78oС до + 50oС, предпочтительно от -78oС до 0o С при применении в качестве восстановителя диизобутилалюмогидрида, от 0oС до комнатной температуры при применении в качестве восстановителя боргидрида натрия, в частности предпочтительно при -78oС, в зависимости от восстановителя и растворителя.
Как правило, реакцию восстановления осуществляют при атмосферном давлении, можно, однако, также работать при повышенном или сниженном давлении.
Гидрирование осуществляется по стандартным методам с применением водорода в присутствии катализатора на основе благородных металлов, такого как, например, палладий на угле, платина на угле или никель Ренея, в среде одного из вышеуказанных растворителей, предпочтительно в среде спирта, такого как, например, метанол, этанол или пропанол, при температуре от -20o С до +100oС, предпочтительно от 0oС до +50oС, при атмосферном или повышенном давлении.
Предпочтительно используют при осуществлении способа [А] сначала соединения общей формулы (II), где карбоцикл радикалов R1/R2 сперва замещен лишь группой -OSiR24R25R26, где R24, R25 и R26 одинаковы или различны и означают фенил или линейный или разветвленный алкил с 1-5 атомами углерода, а после снятия защитной группы вводят по стандартному методу указанный выше остаток, например R11.
Как правило, отщепление защитной группы осуществляется в одном из вышеуказанных спиртов и тетрагидрофуране, предпочтительно в смеси метанола и тетрагидрофурана в присутствии соляной кислоты при температуре от 0oС до 50oС, предпочтительно при комнатной температуре, и атмосферном давлении. В необычных случаях отщепление защитной группы происходит предпочтительно с использованием фторида тетрабутиламмония в тетрагидрофуране.
В рамках вышеуказанних значений защитная группа для гидроксила, как правило, означает защитную группу из группы: триметилсилил, триизопропилсилил, трет.-бутил-диметилсилил, бензил, бензилоксикарбонил, 2-нитробензил, 4-нитробензил, трет. бутилоксикарбонил, аллилоксикарбонил, 4-метоксибензил, 4-метоксибензилоксикарбонил, аллилоксикарбонил, 4-метоксибензил, 4-метоксибензилоксикарбонил, тетрогидропиранил, формил, ацетил, трихлорацетил, 2,2,2-трихлорэтоксикарбонил, метоксиэтоксикарбонил, [2-(триметилсилил)этокси]метил, бензоил, 4-метилбензоил, 4-нитробензоил, 4-фторбензоил, 4-хлорбензоил или 4-метоксибензоил. Предпочитают тетрогидропиранил, трет. бутилдиметилсилил и триизопропилсилил. Особенно предпочтительным является трет.бутилдиметилсилил.
В качестве растворителей при осуществлении отдельных стадий пригодны простые эфиры, как диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир, или углеводороды, как бензол, толуол, ксилол, гексан, циклогексан или нефтяные фракции, или галогенированные углеводороды, как дихлорметан, трихлорметан, тетрахлорметан, дихлорэтилен, трихлорэтилен или хлорбензол. Возможно также применение смесей указанных растворителей.
В качестве окислителя для получения соединений общей формулы (IX) пригодны, например, азотная кислота, аммонийнитрат церия(IV), 2,3-дихлор-5,6-дицианбензохинон, хлорхромат пиридиния, хлорхромат пиридиния на основной окиси алюминия, четырехокись осмия и двуокись марганца. Предпочитают двуокись марганца и азотную кислоту.
Окисление осуществляется в одном из вышеприведенных галогенированных углеводородов и воде. Предпочитаются дихлорметан и вода.
Окислитель используют в количестве 1-10 моль, предпочтительно 2-5 моль на моль соединений общих формул (VIII).
Окисление обычно осуществляют при температуре от -50oС до +100oС, предпочтительно от 0oС до комнатной температуры.
Как правило, окисление происходит при атмосферном давлении. Его можно, однако, также осуществлять при повышенном или сниженном давлении.
Реакция асимметрического восстановления до соединений общей формулы (X) обычно осуществляется в одном из вышеуказанных простых эфиров или толуоле, предпочтительно в тетрагидрофуране и толуоле.
Как правило, реакция восстановления осуществляется с использованием чистых энантиомерных 1R, 2S-аминоинданола и комплексов боранов, таких как, например, ВH3 х тетрагидрофуран, ВН3 х диметилсульфоксид и ВН3 х (С2Н5 )NС6Н5. Предпочитается система диэтиланилин борана/1R,2S-аминоинданол.
Как правило, восстановитель используют в количестве 1-6 моль, предпочтительно 1-4 моль в пересчете на моль подвергаемых восстановлению соединений.
Реакция восстановления происходит, как правило, при температуре от -78oС до +50oС, предпочтительно от -0oС до 30oС.
Как правило, реакцию восстановления осуществляют при атмосферном давлении, можно, однако, также работать при повышенном или сниженном давлении.
Как правило, введение защитной группы для гидроксила осуществляется в одном из вышеуказанных углеводоров, диметилформамиде или тетрагидрофуране, предпочтительно
в толуоле в присутствии
лутидина при температуре от
-20oС до +50oС, предпочтительно от -5oС до комнатной температуры, и при атмосферном давлении.
Реагентами для введения защитной группы для силила обычно являются трет. бутилдиметилсилилхлорид или трет. бутилдиметилсилилтрифторметансульфонат. Предпочитают трет.бутилдиметилсилилтрифторметансульфонат.
Реакция восстановления до соединений общей формулы (XI) происходит в одном из вышеназванных углеводоров, предпочтительно в толуоле.
Как правило, реакция восстановления до соединения общей формулы (XII) происходит с использованием стандартных восстановителей. Предпочтительными являются восстановители, пригодные для восстановления кетонов до гидроксильных соединений. Особенно пригодным при этом является восстановление с использованием гидридов металла или комплексных гидридов металла в среде инертных растворителей, при необходимости в присутствии триалкилборана. Реакцию восстановления осуществляют предпочтительно с использованием комплексных гидридов металла, таких как, например, боранат лития, боранат натрия, боранат калия, боранат олова, триалкилгидридоборанат лития, диизобутилалюмогидрид, бис-(2-метоксиэтокси)-дигидроалюминат натрия или алюмогидрид лития. В частности, предпочитают в качестве восстановителя бис-(2-метоксиэтокси)-дигидроалюминат натрия.
Как правило, восстановитель используют в количестве 1-6 моль, предпочтительно 1-3 моль в пересчете на моль подвергаемых восстановлению соединений.
Реакция восстановления происходит, как правило, при температуре от -20oС до +110oС, предпочтительно от 0oС до комнатной температуры.
Как правило, реакцию восстановления осуществляют при атмосферном давлении, можно, однако, также работать при повышенном или сниженном давлении.
При осуществлении реакции восстановления до соединений общей формулы (XII) в маточном растворе остаются небольшие остатки ненужного диастереомера. Для получения защищенного соединения (XI) эти остатки можно подвергать повторному окислению с использованием стандартных окислителей, таких как, например, хлорхромат пиридиния или активированный пиролюзит, в частности, с использованием активированного пиролюзита. Таким образом, их можно рециркулировать в процесс без уменьшения выхода.
Как правило, введение являющегося заместителем фтора осуществляется в одном из вышеприведенных углеводородов или метиленхлориде, предпочтительно в толуоле и в атмосфере аргона.
Среди производных тиотетрафторидов обычно применяют диэтиламинотрифторид серы или замещенные 2, 2'-бисфтором амины, как, например, диэтил-1,2,3,3,3-гексафторпропиламин.
Реакция происходит, как правило, при температуре от -78oС до 100oС, предпочтительно от -78oС до комнатной температуры в случае применения диэтиламинотрифторида серы, и от комнатной температуры до 80oС при получении диэтил-1,2,3,3,3-гексафторпропиламина.
Как правило, отщепление защитной группы осуществляется в одном из вышеуказанных спиртов и тетрагидрофуране, предпочтительно в смеси метанола и тетрагидрофурана в присутствии соляной кислоты при температуре от 0oС до 50oС, предпочтительно при комнатной температуре, и атмосферном давлении. В необычных случаях отщепление защитной группы происходит предпочтительно с использованием фторида тетрабутиламмония в тетрагидрофуране при комнатной температуре.
В качестве реакций по варьированию значений радикалов можно назвать, например, следующие типы
реакции:
окисление, восстановление, гидрирование, галогенирование, реакция Виттига/Гриньяра и амидирование/сульфоамидирование.
В качестве оснований при осуществлении отдельных стадий пригодны стандартные сильные основные соединения. К ним относятся предпочтительно органические соединения лития, такие как, например, н.-бутиллитий, втор.бутиллитий или фениллитий, или амиды, такие как, например, диизопропиламид лития, амид натрия или амид калия, или гексаметилсилиламид лития, или гидриды щелочных металлов, как гидрид натрия или гидрид калия. Особенно предпочитают н.-бутиллитий, гидрид натрия или диизопропиламид лития.
Кроме того, в качестве оснований пригодны стандартные неорганические основания. Предпочтительными являются гидроокиси щелочных металлов или щелочно-земельных металлов, как, например, гидроокись натрия или калия, или гидроокись бария, карбонаты щелочных металлов, как, например, карбонат натрия или калия, или бикарбонат натрия. Особенно предпочитают гидроокись натрия или гидроокись калия.
В качестве растворителя для отдельных стадий реакции пригодны также спирты, как метанол, этанол, пропанол, бутанол или трет.бутанол. Предпочитается трет.бутанол.
В случае необходимости требуется осуществлять реакционные стадии в атмосфере аргона.
Галогенирование обычно осуществляется в среде одного из вышеназванных хлорированных углеводородов. Предпочитается метиленхлорид.
В качестве агента галогенирования пригодны, например, трифторид диэтиламиносеры, морфолинотрифторид серы или сульфонилхлорид.
Галогенирование обычно осуществляют при температуре от -78oС до 0oС в зависимости от конкретного агента галогенирования и растворителя.
Как правило, галогенирование происходит при атмосферном давлении. Его можно, однако, также осуществлять при повышенном или сниженном давлении.
Соединения общих формул (II) и (III) новы, их можно получать путем взаимодействия соединения общей формулы (XIV)

где Е имеет вышеуказанное значение, и
R27-алкоксикарбонил с 1-4 атомами углерода или арил (D = арил) с альдегидом общей формулы (XV)
А-СНО (XV) ,
где А имеет вышеуказанное значение,
и соединением общей формулы (XVI)

где R28 и R29 вместе с карбонильной группой имеют указанное выше для радикалов R1 и R2 значение,
и получаемое соединение общей формулы (XVII)
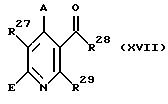
где A, E, R27, R28 и R29 имеют вышеуказанное значение,
подвергают восстановлению описанным выше образом до гидроксиметиловой функции (в случае получения соединения общей формулы (III)),
и затем алкоксикарбонильную группу (R27 ) можно переводить в альдегидную группу путем восстановительно-окислительной реакции.
В качестве растворителей при осуществлении окисления пригодны простые эфиры, как диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир, или углеводороды, как бензол, толуол, ксилол, гексан, циклогексан или нефтяные фракции, или галогенсодержащие углеводороды, как дихлорметан, трихлорметан, тетрахлорметан, дихлорэтилен, трихлорэтилен или хлорбензол, или этиловый эфир уксусной кислоты, или триэтиламин, пиридин, диметилсульфоксид, диметилформамид, триамид гексаметилфосфорной кислоты, ацетонитрил, ацетон или нитрометан. Возможно также применение смесей указанных растворителей. Предпочтительным является метиленхлорид.
В качеств окислителя пригодны, например, азотная кислота, аммонийнитрат церия(IV), 2,3-дихлор-5,6-дициан-бензохинон, хлорхромат пиридиния, хлорхромат пиридиния на основной окиси алюминия, четырехокись осмия и двуокись марганца. Предпочитают комплекс трехокиси серы и пиридина в смеси диметилсульфоксида и метиленхлорида и хлорхромат пиридиния на основной окиси алюминия.
Окисление осуществляется в одном из вышеприведенных хлорированных углеводородов и воде. Предпочитаются дихлорметан и вода.
Окислитель используют в количестве 1-10 моль, предпочтительно 2-5 моль на моль соединений общей формулы (XVII).
Окисление обычно осуществляют при температуре от -50oС до +100oС, предпочтительно от 0oС до комнатной температуры.
Как правило, окисление происходит при атмосферном давлении. Его можно, однако, также осуществлять при повышенном или сниженном давлении.
Соединения общих формул (VI), (V), (VII), (XIV), (XV) и (XVI) сами по себе известны, или их можно получать по стандартным способам.
Соединения общих формул (VI) и (XV) отчасти известны и могут получаться по вышеуказанным способам.
Соединения общих формул (VI) и (XV) новы и могут получаться по вышеуказанным способам.
Соединения общей формулы (VIII) и (XV) новы
и могут получаться за счет того, что
соединения общих формул (XVa), (XVIII) и (XIX)
A-CHO (XVa)

и

где А, Е, R4, R18 R19 имеют вышеуказанное значение,
подвергают взаимодействию с кислотой.
В качестве растворителя для получения соединений общей формулы (VIII) пригодны вышеуказанные простые эфиры или спирты. Предпочитается простой диизопропиловый эфир.
Как правило, в качестве кислот для получения соединений общей формулы (VIII) пригодны органические карбоновые кислоты и неорганические кислоты, такие как, например, щавелевая кислота, малеиновая кислота, фосфорная кислота, фумаровая кислота и трифторуксусная кислота. Предпочитается трифторуксусная кислота.
Как правило, кислоту используют в количестве 0,1-5 моль, предпочтительно 1 моль на моль соединений общей формулы (XIX).
Реакция обычно происходит при атмосферном давлении. Ее можно, однако, также осуществлять при повышенном или сниженном давлении.
Как правило, реакция осуществляется при температуре флегмы используемого растворителя.
Соединения общих формул (XV) и (XIX) сами по себе известны или могут получаться по известным способам.
Соединения общей формулы (XVIII) новы и могут получаться за счет того, что сначала путем
взаимодействия соединений общей формулы (XX)
Е-СО2-R30 (XX)
где Е имеет вышеуказанное значение, и
R30 - алкил с 1-4 атомами углерода,
с соединениями общей формулы (XXI)

где R4 имеет вышеуказанное значение,
в среде растворителя и в присутствии простого краунового эфира получают соединения общей формулы (XXII)
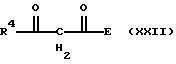
где R4 и Е имеют вышеуказанное значение,
которые затем подвергают взаимодействию с ацетатом аммония в среде инертных растворителей.
В качестве растворителя для осуществления первой стадии предыдущего способа пригодны вышеуказанные простые эфиры и углеводороды, причем предпочитают тетрагидрофуран.
В качестве растворителя для осуществления второй стадии предыдущего способа пригодны спирты, такие как, например, метанол, этанол, пропанол или изопропанол. Предпочтительным является этанол.
Обе стадии осуществляют при имеющейся в данном случае температуре флегмы соответствующего растворителя и атмосферном давлении.
Соединения общих формул (XX) и (XXI) отчасти новы или их можно получать по известным способам.
Соединения общей формулы (XXII) новы и могут получаться по вышеописанным способам.
Дополнительным объектом
изобретения являются промежуточные соединения, выбранные из группы,
включающей 3-амино-3-циклопентил-1-(4-трифторметилфенил)пропенон формулы

2-циклопентил-4-(4-фторфенил)-7,7-диметил-3-(4-трифторметилбензоил)-4,6,7,8-тетрагидро-1Н-хинолин-5-он формулы

2-циклопентил-4-(фторфенил)-4-(4-фторфенил)-7,7-диметил-3-(4-трифторметилбензоил)-7, 8-тетрагидро-6Н-хинолин-5-он формулы

[2-циклопентил-4-(4-фторфенил)-5-гидрокси-7,7-диметил-5, 6,7,8-тетрагидрохинолин-3-ил]-(4-трифторметилфенил)-метанон формулы

[5-(трет. бутилдиметилсиланилокси)-2-циклопентил-4-(4-фторфенил)-7,7-диметил-5,6,7, 8-тетрагидрохинолин-3-ил]-(4-трифторметилфенил)-метанон формулы

[5-(трет. бутилдиметилсиланилокси)-2-циклопентил-4-(4-фторфенил)-7,7-диметил-5,6,7,8-тетрагидрохинолин-3-ил]-(4-трифторметилфенил)-метанон формулы

[5-(трет. бутилдиметилсиланилокси)-2-циклопентил-4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил] 7,7-диметил-5,6,7,8-тетрагидрохинолин формулы

Предлагаемыми соединениями общей формулы (I) являются ингибиторы протеина переноса сложного эфира холестерина и стимулируют обратный транспорт холестерина. Они вызывают понижение уровня комплекса холестерина с липопротеином низкой плотности (далее "ЛПНП"=липопротеин низкой плотности) в крови при одновременном повышении уровня комплекса холестерина с липопротеином высокой плотности (далее "ЛПВП"=липопротеин высокой плотности). Поэтому их можно применять для лечения и профилактики гиполипопротеинемии, дислипидемии, гипертриглицеридемии, гиперлипидемии или артериосклероза.
Поэтому дальнейшим объектом изобретения является фармацевтическая композиция с активностью, тормозящей протеин переноса сложного эфира холестерина и стимулирующей обратный транспорт холестерина, содержащая по меньшей мере один фармацевтически приемлемый инертный носитель и по меньшей мере одно производное 2-арилзамещенного пиридина вышеприведенной общей формулы (I), смесь его изомеров или отдельный изомер или его физиологически приемлемый соль в эффективном количестве.
Фармакологическое действие предлагаемых веществ иллюстрируется следующими опытами.
Опыт ингибирования протеина переноса сложного эфира холестерина
Получение
протеина переноса сложного эфира
холестерина
Протеин переноса сложного эфира холестерина получают в частично очищенном виде из человеческой плазмы путем дифференциального центрифугирования и
колоночной хроматографии. Для
этого человеческую плазму доводят до плотности в 1,21 г/мл с применением бромида натрия и центрифугируют при 50000 оборотах в минуту при 4oС в течение 18
часов. Фракцию, отбираемую снизу
колонны, плотностью выше 1,21 г/мл подают в колонку типа Sephadex®Phenyl-Sepharose 4B фирмы Pharmacia, промывают буфером с рН 7,4, содержащим 0,15 м.
хлорида натрия и 0,001 м.
трис/HCl с последующим элюированием дистиллированной водой. Активные в отношении протеина переноса сложного эфира холестерина фракции собирают, диализируют с помощью 50 ммоль
ацетата натрия при
значении рН, равном 4,5, и подают в колонку типа CM-Sepharose® фирмы Pharmacia. Затем смесь элюируют с применением линейного градиента (0-1 м. хлорида натрия).
Собранные фракции
протеина переноса сложного эфира холестерина диализируют с помощью буфера 10 ммоль трис/HCl, имеющего значение рН, равное 7,4, и затем очищают хроматографией на колонке типа Mono
Q®
фирмы Pharmacia.
Получение радиоактивно меченого ЛПВП
50 мл свежей человеческой плазмы в среде этилендиаминотетрауксусной кислоты доводят до плотности в 1,
12 г/мл с
применением бромида натрия и центрифугируют в центрифуге типа Ту 65-Rotor при 50000 оборотах в минуту при 4oС в течение 18 часов. Верхнюю фазу применяют для получения холодных
ЛПНП. Нижнюю
фазу диализируют три раза с помощью PDB-буфера (10 ммоль трис/HCl, значение рН 7,4, 0,15 ммоль хлорида натрия, 1 ммоль этилендиаминотетрауксусной кислоты, 0,02% азида натрия), взятого в
количестве по
4 л. На каждые 10 мл объема ретентата подают 20 мкл3H-холестерина (продукт NET-725 фирмы Дюпонт; 1 мкКюри/мкл, в виде раствора в этаноле) и инкубируют при 37oС в
атмосфере
азота в течение 72 часов.
Затем смесь доводят до плотности в 1,21 г/мл с применением бромида натрия и центрифугируют в центрифуге типа Ту 65-Rotor при 50000 оборотах в минуту при 20oС в течение 18 часов. Верхнюю фазу отделяют и липопротеиновые фракции очищают градиентным центрифугированием. Для этого отделенную меченую фракцию липопротеина доводят до плотности в 1, 26 г/мл с применением бромида натрия. В пробирках для центрифуги типа SW 40-Rotor на каждые 4 мл этого раствора наливают 4 мл раствора плотностью в 1,21 г/мл, а также 4,5 мл раствора плотностью в 1, 063 г/мл, причем растворы состоят из PDB-буфера и бромида натрия. Затем смесь центрифугируют в центрифуге типа SW 40-Rotor при 38000 оборотах в минуту при 20oС в течение 24 часов. Промежуточный слой, содержащий меченый ЛПВП и имеющий плотность в диапазоне от 1,063 до 1,21 г/мл, диализируют три раза при 4oС с помощью PDB-буфера, взятого в количестве 100 объемов. Ретентат содержит радиоактивно меченый сложным эфиром3H-холестерола ЛПВП, который после доведения до приблизительно 5х106 отчетов в минуту/мл применяют в следующем опыте.
Проведение опыта
Для испытания активности протеина переноса сложного эфира холестерина определяют перенос сложного эфира3H-холестерола, находящегося в составе
человеческих ЛПВП, на биотинилированные ЛПНП. Реакцию прекращают подачей Streptavidin-SPA®beads фирмы Amersham и перенесенную радиоактивность определяют непосредственно в
сцинтилляционном счетчике.
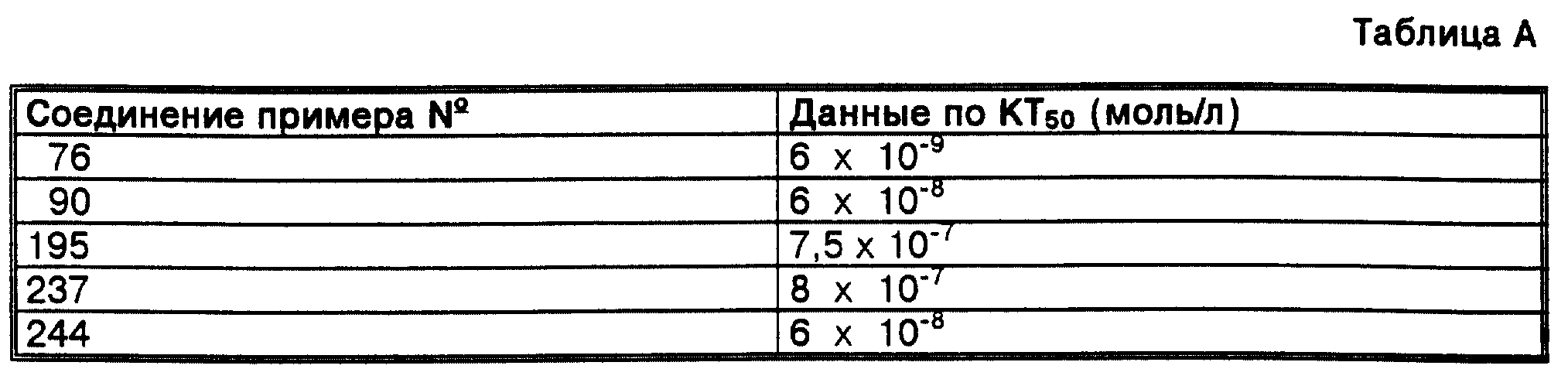
При 37oС в течение 18 часов инкубируют 10 мкл сложного эфира3H-холестерола в составе ЛПВП (~ 50000 отчетов в минуту) в смеси с 10 мкл биотинилированного ЛПНП (Biotin-LDL фирмы Amersham) в среде 50 ммоль буфера Hepes (0,15 м. хлорида натрия, 0,1% альбумина бычей сыворотки и 0,05% азида натрия), имеющего значение рН, равное 7,4, в присутствии 10 мкл протеина переноса сложного эфира холестерина (1 мг/мл) и 3 мкл раствора испытуемого вещества в 10% диметилсульфоксида и 1% альбумина бычьей сыворотки. Затем в смесь подают 200 мкл раствора SPA-Streptavidin-Bead фирмы Amersham (продукт TRKQ 7005). инкубируют в течение часа с одновременным встряхиванием и измеряют в сцинтилляционном счетчике. В качестве контрольных смесей применяют соответствующую смесь, содержащую 10 мкл протеина буфера и 10 мкл протеина переноса сложного эфира холестерина, инкубируемую при 4oС, а также смесь, содержащую 10 мкл протеина переноса сложного эфира холестерина, инкубируемую при 37oС. Измеряемую в контрольных смесях при 37oС активность протеина переноса сложного эфира холестерина берут за 100%. Концентрация вещества, при которой перенос снижается на половину, представляет собой концентрацию торможения (далее КТ50).
В таблице А приведены данные по КТ50 (моль/л) для ингибиторов протеина переноса сложного эфира холестерина.
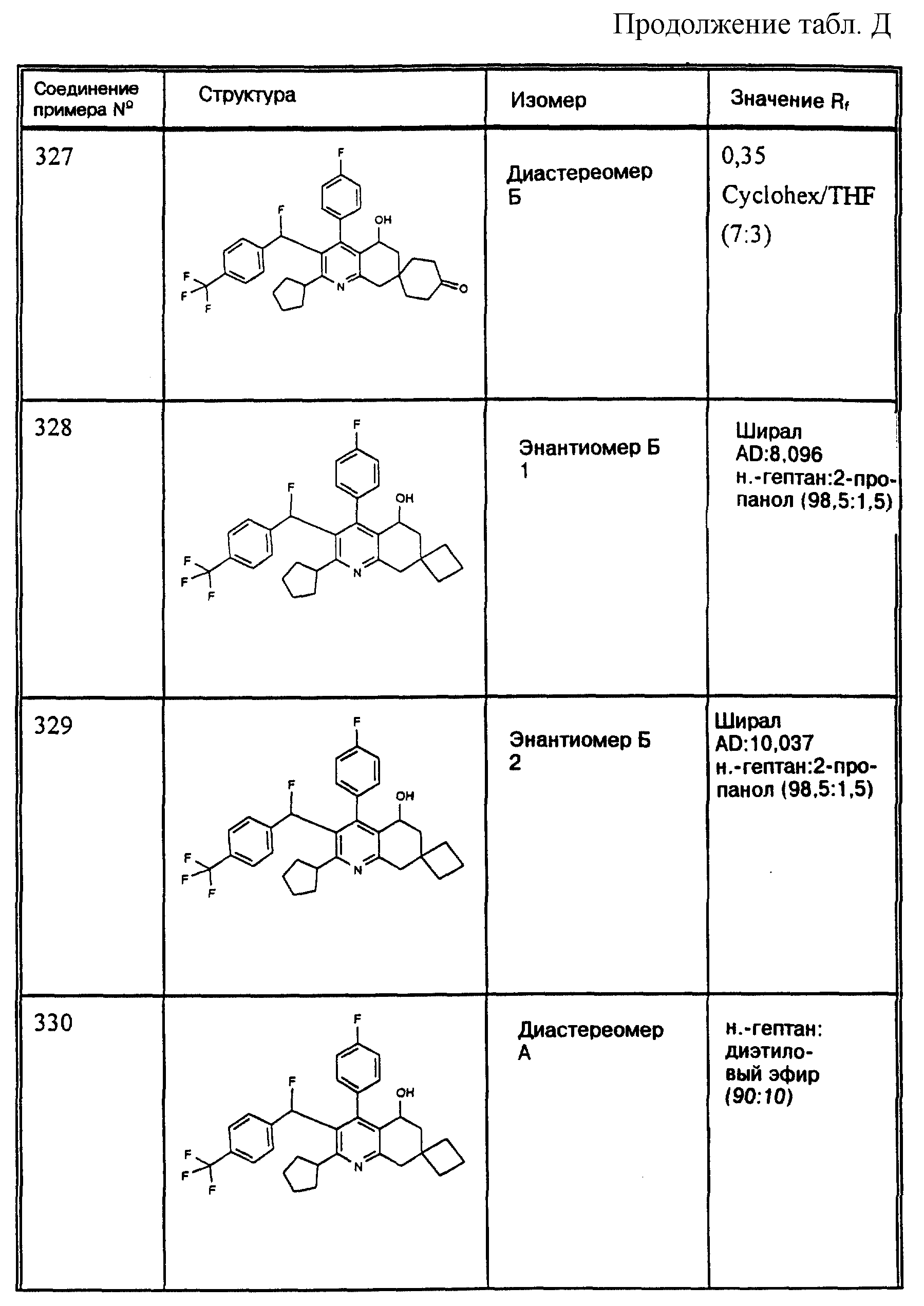
Активность ex vivo предлагаемых соединений
Сирийским хомякам не дают пищу в течение 24 часов и затем
наркотизируют, причем подкожно дают 0,80 мг/кг атропина, 0,80 мг/кг Ketavet® и через 30 минут внутрибрушинно дают 50 мг/кг нембутала. Затем яремную вену обнажают и вводят канюлю.
Испытуемое вещество растворяют в пригодном растворителе, как правило в растворе адалата (плацебо), состоящем из 60 г глицерина,. 100 мл воды и до 1000 мл ПЭГ с молярной массой 400, и дают хомякам с
помощью введенного в яремную вену полиэтиленового катетера. Контрольным животным дают тот же объем растворителя без испытуемого вещества. Затем вену перевязывают и рану закрывают.
Дачу испытуемого вещества можно также осуществлять перорально, при этом вещество растворяют в диметилсульфоксиде и суспендируют в 0,5% тилоза и затем дают хомякам перорально с помощью желудочного зонда. Контрольным животным дают тот же объем растворителя без испытуемого вещества.
Несколько раз в течение 24 часов после дачи испытуемого вещества берут кровь (приблизительно 250 мкл) путем пункции ретроорбитального венозного сплетения хомяков. Инкубацией при 4oС в течение ночи заканчивается свертывание, затем смесь центрифугируют в течение 10 минут при 6000 g. Активность протеина переноса сложного эфира холестерина в получаемой таким образом сыворотке определяют в модифицированном опыте, причем перенос сложного эфира3Н-холестерола, находящегося в составе ЛПВП, на биотинилированные ЛПНП измеряют таким же образом, как в вышеописанном опыте.
Реакцию прекращают подачей Streptavidin-SPA®beads фирмы Amersham и перенесенную радиоактивность определяют непосредственно в жидком сцинтилляционном счетчике.
Опыт проводят описанным выше в разделе "Проведение опыта" образом. При этом для испытания сыворотки 10 мкл протеина переноса сложного эфира холестерина заменяют 10 мкл соответствующих проб сыворотки. В качестве контрольных смесей применяют соответствующую инкубируемую смесь с сыворотками необработанных животных.
Перенесенную в контрольных смесях с применением контрольной сыворотки активность берут за 100%. Концентрация вещества, при которой перенос снижается на половину, представляет собой фактор ЕD50 (см. табл. Б).
Активность in vivo предлагаемых соединений
В опытах для определения орального действия на липопротеины и
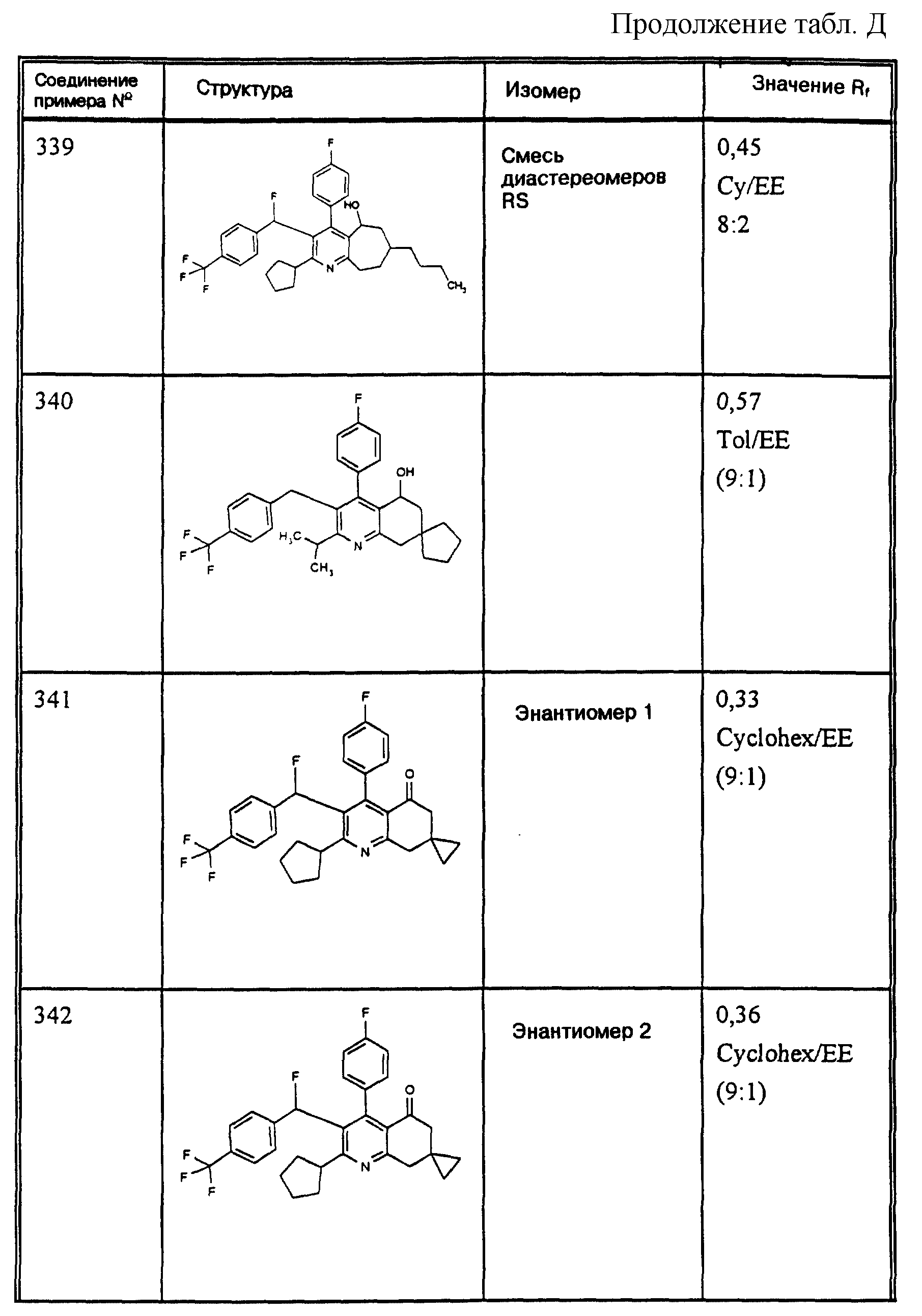
триглицериды испытуемое вещество, растворенное в диметилсульфоксиде и суспендированное в 0,5% тилоза, дают сирийским хомякам перорально с помощью желудочного зонда. Для определения активности
протеина
переноса сложного эфира холестерина берут кровь (приблизительно 250 мкл) путем ретроорбитальной пункции до начала опыта. Затем испытуемые вещества дают хомякам перорально с помощью
желудочного зонда.
Контрольным животным дают тот же объем растворителя без испытуемого вещества. Затем хомяков лишают корма и несколько раз в течение 24 часов после дачи испытуемого вещества берут
кровь путем пункции
ретроорбитального венозного сплетения хомяков.
Инкубацией при 4oС в течение ночи заканчивается свертывание, затем смесь центрифугируют в течение 10 минут при 6000 g. Содержание холестерина и триглицеридов в получаемой таким образом сыворотке определяют с помощью модифицированных ферментных проб, получаемых в торговле (холестерин определяют с помощью пробы 14366 фирмы Мерк, триглицериды - с помощью пробы 14364 фирмы Мерк). Сыворотку разбавляют соответствующим образом физиологическим раствором поваренной соли.
В микротитровальных пластинках с 96 чашками в 100 мкл разбавленной сыворотки подают 100 мкл испытуемого вещества и смесь инкубируют при комнатной температуре в течение 10 минут. Затем оптическую плотность определяют при длине волны в 492 нм с помощью автоматического считывающего устройства. Концентрацию смеси триглицеридов и холестерина определяют с помощью параллельно измеряющейся эталонной кривой.
Содержание ЛПВП определяют после осаждения содержащих апо В липопротеинов с помощью торгового реактива (Зигма 352-4) по инструкциям производителя.
Результаты опыта сведены в таблице В.
Активность in vivo человеческого протеина переноса сложного эфира холестерина на трансгенных мышах
Трансгенным мышам, разведенным по Динчуку, Харту,
Гонцалесу, Карману, Шмидту, Вираку (ВВА
(1995), 1295. 301), дают испытуемые вещества вместе с кормом. До начала опыта ретроорбитально берут кровь для определения содержания в сыворотке холестерина и
триглицеридов. Сыворотку получают
описанным выше в опыте с хомяками образом путем инкубации при 4oС в течение ночи и последующего центрифугирования при 6000 g. Через неделю снова берут
кровь для определения липопротеина и
триглицеридов. Изменение полученных данных пересчитают на процентное изменение по сравнению с исходными данными.
Результаты опыта сведены в таблице Г.
Новые активные вещества можно известным способом переводить в обычные лекарственные формы, такие как, например, таблетки, драже, пилюли, гранулы, аэрозоли, сиропы, эмульсии, суспензии и растворы, с применением инертных, нетоксичных, фармацевтически приемлемых носителей или растворителей. При этом терапевтически эффективное соединение может иметься в концентрациях от приблизительно 0,5 до 90% от веса смеси, т.е. в количествах, достаточных для достижения вышеуказанной дозировки.
Лекарственные формы получают, например, путем разбавления активных начал растворителями и/или носителями, при необходимости с применением эмульгаторов и/или диспергаторов, причем при использовании в качестве разбавителя воды можно применять при необходимости органические растворители в качестве вспомогательных растворителей.
Лекарственные средства дают обычным способом внутривенно, орально, парентерально или чрезъязычно, в частности орально.
При парентеральной даче можно использовать растворы активного начала с применением пригодных носителей.
Как правило, для достижения эффективных результатов при внутривенной даче выгодно применять активное начало в количествах от 0,001 до 1 мг/кг, предпочтительно 0,01 до 0,5 мг/кг от веса тела, а при оральной даче 0,01 до 20 мг/кг, предпочтительно 0,1 до 10 мг/кг от веса тела.
Тем не менее, в случае необходимости возможны отклонения от указанных количеств в зависимости от веса тела, способа введения лекарства, реакции пациента на лекарство, лекарственной формы и времени или периода, в который вводят лекарство. Так, в ряде случаев может быть достаточным принимать меньше указанного минимального количества, в то время как в других случаях следует принимать больше указанного количества. В случае дачи больших количеств активного начала рекомендуется разделять дозу на несколько разовых доз и применять их в течение дня.
Исходные
соединения
Пример I
Сложный метиловый эфир 4-(4-фторфенил)-2-изопропил-5-оксо-1,4,5,6,7,8-гекса-гидрохинолин-3-карбоновой кислоты

50,14 г (0,404 моль) п.-фторбензальдегида, 45,3 г (0,404 моль) 1,3-циклогександиона и 57,89 г (0,404 моль) сложного метилового эфира 3-амино-4-метил-пент-2-еновой кислоты в 1000 мл этанола нагревают с обратным холодильником в течение 60 часов. Смесь охлаждают до комнатной температуры и сгущают досуха. Остаток подвергают горячему растворению в 500 мл толуола, после чего при охлаждении добавляют 1 л петролейного эфира. Получаемый при этом кристаллический продукт отсасывают.
Выход:
100,8 г (72,6% теории)
Rf = 0,15 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 8:1)
Пример II
Сложный метиловый эфир
4-(4-фторфенил)-2-изопропил-5-оксо-5,6,7,
8-тетрагидрохинолин-3-карбоновой кислоты

К раствору 46,04 г (0,1341 моль) соединения примера I в 645 г дихлорметана прибавляют 30,44 мл (0,1341 моль) 2,3-дихлор-5,6-дициан-п.-бензохинона, затем перемешивают при комнатной температуре в течение ночи. После этого отсасывают на 500 мл силикагеля 60, дополнительно промывают 700 мл дихлорметана, и объединенные фильтраты сгущают досуха.
Выход: 24,2 г (52,87% теории)
Rf = 0,54 (смесь толуола и сложного
этилового эфира уксусной кислоты в соотношении 8:2)
Пример III
Сложный метиловый эфир 4-(4-фторфенил)-2-изопропил-5-гидрокси-5,6,7,
8-тетрагидрохинолин-3-карбоновой кислоты

70,64 г (0,207 моль) соединения примера II растворяют в атмосфере аргона в 706 г толуола и охлаждают до -78oС, затем прикапывают 228 мл (0,228 моль; 1,1 экв. ) диизобутилалюмогидрида (1,0-молярного в толуоле) в течение 20 минут. По истечении 5 минут перемешивания при -78oС еще раз прибавляют 35 мл (0,15 экв.) диизобутилалюмогидрида и перемешивают в течение 10 минут. Затем при -78oС дают прикапываться 500 мл 20%-ного раствора тартрата калия и натрия, при этом температура медленно повышается до 20oС. По истечении часа дополнительного перемешивания водную фазу отделяют и два раза экстрагируют сложным этиловым эфиром уксусной кислоты, объединенные органические фазы сушат над сульфатом натрия, фильтруют и сгущают. Остаток очищают путем хроматографии на 1000 мл силикагеля 60 с применением в качестве элюента толуола и смесей толуола и сложного этилового эфира уксусной кислоты в соотношениях 9: 1 и 8: 2. Содержащие желаемое соединение фракции собирают и сгущают до 100 мл, затем добавляют петролейный диэтиловый эфир. Выпавший кристаллизат отсасывают и сушат в высоком вакууме в течение ночи.
Выход: 1-ая фракция: 61,69 г (86,8% теории)
Выход: 2-ая фракция: 6,34
г (8,9% теории)
Rf = 0,14
(смесь толуола и этилового эфира уксусной кислоты в соотношении 9:1)
Пример IV
Сложный метиловый эфир
5-(трет.бутилдиметилсилилокси)-4-(4-фторфенил)-2-изопропил-5,6,7,
8-тетрагидрохинолин-3-карбоновой кислоты
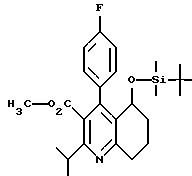
68,0 г (0,198 моль) соединения примера III растворяют в 340 г диметилформамида, и к получаемому раствору последовательно прибавляют 59,69 г (0,396 моль; 2 экв.) трет.бутилдиметилсилилхлорида, 48,54 г (0,713 моль; 3,6 экв. ) имидазола и 0,484 г (0,00396 моль; 0,02 экв.) N-диметиламинопиридина. Смесь перемешивают при комнатной температуре в течение ночи, распределяют в 800 мл раствора хлористого аммония и 400 мл сложного этилового эфира уксусной кислоты и с использованием 6 молярной соляной кислоты доводят до значения pH, равного 5 - 6. Органическую фазу отделяют, водную фазу два раза экстрагируют сложным этиловым эфиром уксусной кислоты, объединенные органические фазы сушат над сульфатом натрия, фильтруют и сгущают. Растворенный в толуоле остаток наносят на 1800 мл силикагеля и элюируют сначала толуолом, а затем смесью толуола и сложного этилового эфира уксусной кислоты в соотношении 9:1. После сгущения элюатов получают белый кристаллический продукт.
Выход: 87,5 г (96,7% теории)
Rf = 0,68 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 9:1)
Пример V
5-(трет. бутилдиметилсилилокси)-4-(4-фторфенил)-3-гидроксиметил-2-изопропил-5,6,
7,8-тетрагидрохинолин

87,4 г (0,191 моль) соединения примера IV растворяют в 500 г толуола и охлаждают в атмосфере аргона до -78oС. 690 мл (0,690 моль; 3,61 экв.) диизобутилалюмогидрида (1, 0-молярного в толуоле) прикалывают в течение часа, затем перемешивают еще при -78o С в течение 90 минут. К охлажденному до -78oC раствору осторожно добавляют 30 мл раствора тартрата калия и натрия и перемешивают при -78oС в течение 30 минут. После этого смеси дают нагреваться до комнатной температуры, доливают 400 мл мл раствора тартрата калия и натрия и разбавляют сложным этиловым эфиром уксусной кислоты. Наконец, добавляют еще 1,2 л раствора тартрата калия и натрия, при этом медленно образуются два почти прозрачных раствора. Органическую фазу отделяют, водную фазу два раза экстрагируют сложным этиловым эфиром уксусной кислоты. Объединенные органические фазы сушат над сульфатом натрия, фильтруют и сгущают. Полутвердый остаток растворяют в 400 мл толуола, наносят на 1100 мл силикагеля 60, предварительно обработанного толуолом, и элюируют сначала толуолом, а затем смесью толуола и сложного этилового эфира уксусной кислоты в соотношении 9:1.
Содержащие желаемое соединение фракции сгущают, к получаемому маслу прибавляют петролейный эфир, причем выпадает кристаллический продукт кашеобразной консистенции.
Выход: 72,52 г (92,0% теории)
Rf = 0,28 (смесь толуола и сложного этилового
эфира уксусной кислоты в соотношении 9:1)
Пример VI
5-(трет.
бутилдиметилсилилокси)-4-(4-фторфенил)-2-изопропил-5,6,7,8-тетрагидрохинолин-3-карбальдегид

К раствору 67,1 г (0,156 моль) соединения примера V в 671 г дихлорметана прибавляют 31,8 г (0,312 моль; 2 экв.) нейтральной окиси алюминия и 67,3 г (0,312 моль; 2 экв. ) хлорхромата пиридиния и перемешивают при комнатной температуре в течение 90 минут. Реакционный раствор наносят на 1100 мл силикагеля 60 (в сухом состоянии) и элюируют сначала толуолом, а затем смесью сложного этилового эфира уксусной кислоты и метанола в соотношении 9:1. Содержащие желаемое соединение фракции сгущают, выпавший продукт отсасывают и промывают небольшим количеством толуола. Затем продукт растворяют в 100 мл толуола,
наносят на 250 мл силикагеля 60 и элюируют сначала толуолом, а затем смесью толуола и сложного этилового эфира уксусной кислоты в соотношении 9: 1. Элюаты сгущают, получаемое масло выкристаллизовывают петролейным эфиром.
Выход: 1-ая фракция: 28,8 г (43,1% теории)
Выход: 2-ая фракция: 10,05 г (15,1% теории)
Rf = 0,72 (смесь
толуола и сложного этилового эфира уксусной кислоты в соотношении 9:1)
Пример VII
5-(трет.
бутилдиметилсилилокси)-4-(4-фторфенил)-3-[гидрокси-(4-трифторметилфенил)-метил]
-2-изопропил-5,6,7,8-тетрагидрохинолин (смесь диастереомера А и диастереомера Б)

341 мг (14, 03 ммоль; 6 экв.) магниевых стружек подают в 30 мл тетрагидрофурана и в атмосфере аргона нагревают с обратным холодильником, прикапывают с помощью шприца 1,052 г (4,676 ммоль; 2 экв.) 4-бромбензотрифторида в чистом виде. Кипятят с обратным холодильником в течение 45 минут, затем смеси дают охлаждаться до комнатной температуры. 1,0 г (2,338 ммоль) соединения примера VI растворяют в 20 мл тетрагидрофурана и охлаждают в атмосфере аргона приблизительно до -78oС, затем при перемешивании добавляют свежеприготовленный реактив Гриньяра. Холодильную ванну удаляют и реакционную смесь перемешивают в течение часа. Реакционный раствор распределяют при перемешивании в 200 мл концентрированного раствора хлористого аммония и 250 мл сложного этилового эфира уксусной кислоты. Органическую фазу отделяют, водную фазу два раза экстрагируют сложным этиловым эфиром уксусной кислоты, объединенные органические фазы сушат над сульфатом натрия, фильтруют, сгущают и сушат в высоком вакууме в течение ночи.
Выход: 1,18 г (97,5% теории; смесь диастереомеров А и
Б)
Разделение обеих пар диастереомеров (А и Б) осуществляется путем хроматографии на
100 мл силикагеля 60, обработанного циклогексаном. Растворенную в 4 мл циклогексана смесь диастереомеров
элюируют на силикагеле 60 сначала циклогексаном, а затем смесью циклогексана и
тетрагидрофурана в соотношении 9:1. После сгущения фракций получают обе пары диастереомеров.
Выход
диастереомера А: 789 мг (65,2% теории)
Rf = 0,42 (смесь
циклогексана и тетрагидрофурана в соотношении 9:1)
Выход диастереомера Б: 410 мг (33,9% теории)
Rf = 0,24 (смесь циклогексана и тетрагидрофурана в соотношении 9:1)
Пример VIII
5-(трет. бутилдиметилсилилокси)-4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил]
-2-изопропил-5,6,7,8-тетрагидрохинолин (смесь диастереомера А и диастереомера Б)

К раствору 876 мг (1,521 ммоль) смеси диастереомеров А и Б примера VII в 70 мл дихлорметана с помощью шприца добавляют при -78oС в атмосфере аргона 0,302 мл трифторида диэтиламиносеры, после этого удаляют холодильную ванну и дополнительно перемешивают в течение 30 минут. Затем реакционный раствор вмешивают в раствор сложного этилового эфира уксусной кислоты и хлористого аммония, органическую фазу отделяют, водную фазу три раза экстрагируют сложным этиловым эфиром уксусной кислоты, и весь органический экстракт сушат над сульфатом натрия, фильтруют, сгущают и сушат в высоком вакууме.
Выход: 690 мг (78,5% теории)
Rf = 0,57 (смесь
толуола и сложного этилового эфира уксусной кислоты в соотношении 9:1)
Пример IX
5-(трет.
бутилдиметилсилилокси)-4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил]-2-изопропил-5,6,
7,8-тетрагидрохинолин (диастереомер А)

Аналогично примеру VIII 250 мг (0,436 ммоль) диастереомера А примера VII в 10 мл дихлорметана подвергают взаимодействию с 0,086 мл (0,654 ммоль; 1,5 экв.) трифторида диэтиламиносеры при -78oС.
Выход: 233 мг (92,8%
теории)
Rf = 0,76 (смесь циклогексана и тетрагидрофурана в соотношении 9:1)
Пример
Х
5-(трет.
бутилдиметилсилилокси)-4-(4-фторфенил)-3-[фтор-(4-трифторметил-фенил)-метил]-2-изопропил-5,6,7,8-тетрагидрохинолин (диастереомер Б)

Аналогично примеру VIII 250 мг (0,436 ммоль) диастереомера Б примера VII в 10 мл дихлорметана подвергают взаимодействию с 0,086 мл (0,054 ммоль; 1,5 экв.) трифторида диэтиламиносеры при -78oС.
Выход: 246 мг (98,4% теории)
Rf = 0,76 (смесь циклогексана и тетрагидрофурана в соотношении
9:1)
Пример
XI
8-бром-5-(трет. бутилдиметилсилилокси)-4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил]-2-изопропил-5,6,7,8-тетрагидрохинолин

В раствор 18,7 г (32,5 ммоль) соединения примера Х в 500 мл четыреххлористого углерода подают в атмосфере аргона 9,3 г (52,5 ммоль) N-бромсукцимида и 500 мг нитрила азоизомасляной кислоты. Нагревают с обратным холодильником, причем через 10 минут происходит сильная реакция. По истечении двух с половиной часов охлаждают до комнатной температуры, отсасывают и сгущают. Сырой продукт элюируют на силикагеле 60 смесью циклогексана и сложного этилового эфира уксусной кислоты в соотношении 15:1, фракции сгущают и сушат в высоком вакууме.
Выход: 9,9 г (47% теории)
Rf = 0,58 (смесь циклогексана и сложного этилового эфира уксусной кислоты в соотношении 9:1)
Пример XII
8-бутил-5-(трет. бутилдиметилсилилокси)-4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил]-2-изопропил-5,6,7,8-тетрагидрохинолин

179 мг (2 ммоль) цианида меди (I) суспендируют в атмосфере аргона в 3 мл абсолютного толуола, который затем отгоняют в вакууме. После этого суспендируют в 2,6 мл абсолютного тетрагидрофурана и охлаждают до -65oС. При этой температуре прикапывают 2,5 мл 1,6-молярного раствора н-бутиллития (4 ммоль) и при временно повышающейся до -30oС температуре дополнительно перемешивают в течение часа. К получаемому раствору прикалывают при -65oС раствор 654 мг (1 ммоль) соединения примера XI в 2 мл абсолютного тетрагидрофурана и перемешивают в течение часа. Переработку реакционной смеси осуществляют следующим образом. Добавляют смесь 4,5 мл насыщенного раствора хлористого аммония и 0,5 мл концентрированного раствора аммиака, разбавляют 30 мл воды и три раза экстрагируют диэтиловым эфиром, взятым в количестве по 15 мл. Объединенные органические фазы сушат над сульфатом натрия, фильтруют и сгущают. Сырой продукт элюируют на силикагеле (0,04-0,0063 мм) смесью циклогексана и сложного этилового эфира уксусной кислоты в соотношении 98:2. Выход: 200 мг (32% теории)
Rf = 0,33 (смесь циклогексана и сложного этилового эфира уксусной кислоты в соотношении 98:2)
Пример XIII
4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил] -2-изопропил-5,6-дигидрохинолин-5-ол

К раствору 1,3 г (2 ммоль) 5-(трет.бутилдиметилсилилокси)-4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил] -2-изопропил-5,6,7,8-тетрагидрохинолина в 13 мл тетрагидрофурана прикапывают при комнатной температуре 10,9 мл 1, 1-молярного раствора фторида тетрабутиламмония. Через час вмешивают смесь 100 мл воды и 50 мл толуола. Фазы разделяют, и водную фазу дополнительно экстрагируют толуолом. Объединенные органические фазы промывают водой до нейтрального состояния, сушат над сульфатом натрия и сгущают. Сырой продукт элюируют на силикагеле (0,04-0,063) смесью циклогексана и сложного этилового эфира уксусной кислоты в соотношении 8:2, фракции сгущают, и продукт кристаллизуют.
Выход: 640 мг (70% теории)
Rf = 0,17 (смесь циклогексана и сложного этилового эфира уксусной кислоты
в
соотношении 8:2)
Пример XIV
1-циклопентил-3-(4-трифторметилфенил)-пропан-1,3-дион

1,97 кг трет. бутилата калия, 2,26 кг сложного метилового эфира циклопентанкарбоновой кислоты, 1,66 кг п.-трифторметилацетофенона и 36 г краунового эфира в 18 л тетрагидрофурана кипятят с обратным холодильником в течение 4 часов. Реакцию прекращают путем добавления 16 л 10%-ной соляной кислоты при комнатной температуре. Водную фазу экстрагируют сложным этиловым эфиром уксусной кислоты, и объединенные органические фазы промывают насыщенным раствором поваренной соли. После отгонки растворителя дистиллируют в вакууме 1,5 мбар, создаваемом при помощи масляного насоса. Получают 1,664 кг 1-циклопентил-3-(4-трифторметилфенил)-пропан-1,3-диона в качестве масла, которое при стоянии полностью кристаллизует.
Точка кипения: 138-145oС/1,5 мбар
Пример
XV
3-амино-3-циклопентил-1-(4-трифторметилфенил)-пропенон

1622,6 г 1-циклопентил-3-(4-трифторметилфенил)-пропан-1,3-диона и 730 г ацетата аммония в 4,9 л этанола кипятят с обратным холодильником в течение ночи. Этанол отгоняют в вакууме, и остаток подают в 4 л метиленхлорида. Раствор промывают раз водой и два раза насыщенным раствором бикарбоната натрия и сушат над сульфатом натрия. После отгонки метиленхлорида остаток перекристаллизовывают из 6 л горячего циклогексана. После сушки получают 1018 г бесцветных кристаллов, чистота которых составляет 98,6% по данным высокопроизводительной жидкостной хроматографии.
Точка плавления: 106oС
Тонкослойная хроматография: Rf = 0,2 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 4:1)
Пример XVI
2-циклопентил-4-(4-фторфенил)-7,7-диметил-3-(4-трифторметилбензоил)-4,6,7,8-тетрагидро-1Н-хинолин-5-он

984 г 3-амино-3-циклопентил-1-(4-трифторметилфенил)-пропенона, 714 г 5,5-диметил-1,3-циклогександиона, 647,8 г п. -фторбензальдегида и 139,3 г трифторуксусной кислоты в 15 л диизопропилового эфира кипятят с обратным холодильником в течение 5 часов. После охлаждения выпавшие кристаллы отсасывают, промывают диизопропиловым эфиром и сушат. Получают 1018 г бесцветных кристаллов, чистота которых составляет 98,6% по данным высокопроизводительной жидкостной хроматографии.
Точка плавления: 117oС
Тонкослойная хроматография: Rf = 0,2 (смесь
толуола и сложного этилового эфира уксусной кислоты в соотношении 4:1)
Примеры получения предлагаемых соединений
Пример 1
4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил] -2-изопропил-5,6,7,8-тетрагидрохинолин-5-ол (смесь диастереомеров А и Б)

К 680 мг (1,177 ммоль) соединения примера VIII, растворенного в 30 мл метанола и 15 мл тетрагидрофурана, добавляют 10 мл 3-молярной соляной кислоты и перемешивают при комнатной температуре в течение часа. Реакционный раствор вмешивают в 100 мл насыщенного раствора бикарбоната натрия, на котором находится слой из 100 мл сложного этилового эфира уксусной кислоты. Органическую фазу отделяют, водную фазу еще два раза экстрагируют сложным этиловым эфиром уксусной кислоты. Объединенные органические фазы промывают насыщенным раствором поваренной соли, сушат над сульфатом натрия, фильтруют и сгущают. Остаток подвергают хроматографии на 50 г силикагеля 60 с последующей элюацией сначала толуолом и затем смесью толуола и сложного этилового эфира уксусной кислоты в соотношении 8:2.
Выход: 240 мг (44,2% теории)
Rf = 0,19 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 9:1)
Пример 2
4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил] -2-изопропил-5,6,7,8-тетрагидрохинолин-5-ол (диастереомер А)

Аналогично примеру 1 223 мг (0,387 ммоль) соединения примера IX в 9 мл метанола и 9 мл тетрагидрофурана перемешивают с 3 мл 3-молярной соляной кислоты при комнатной температуре в течение ночи. Хроматографию сырого продукта осуществляют на 40 мл силикагеля 60, предварительно эксквилибрированного циклогексаном. Элюацию проводят циклогексаном с добавкой тетрагидрофурана, применяя градиент от 10 до 20%.
Выход: 167 мг (93,3% теории)
Rf = 0,43 (смесь циклогексана и тетрагидрофурана в соотношении 8:2)
Пример
3
4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил] -2-изопропил-5,6,7,8-тетрагидрохинолин-5-ол (диастереомер Б)

Аналогично примеру 1 236 мг (0,410 ммоль) соединения примера Х в 9 мл метанола и 9 мл тетрагидрофурана перемешивают с 3 мл 3-молярной соляной кислоты при комнатной температуре в течение ночи. Хроматографию сырого продукта осуществляют на 40 мл силикагеля 60, предварительно эксквилибрированного циклогексаном. Элюацию проводят циклогексаном с добавкой тетрагидрофурана, применяя градиент от 10 до 20%.
Выход: 182 мг (98,9% теории)
Rf = 0,41 (смесь циклогексана и тетрагидрофурана в соотношении 8:1)
Примеры
4 и 5
4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил] -2-изопропил-5,6,7,8-тетрагидрохинолин-5-ол (энантиомеры I и II)

82 мг диастереомера Б примера 3 растворяют в смеси 8 мл н.-гептана и 2-пропанола в соотношении 9: 1 и разделяют на препаративной колонке высокопроизводительной жидкостной хроматографии (250 х 20 мм; заполненной силикагелем марки Ширацел OD; 20 мкм). В качестве элюента используют смесь н. -гептана и 2-пропанола в соотношении 98:2. При температуре 40oС, 30 минутах времени движения и скорости подачи 7 мл/мин осуществляют всего 20 инъекций по 0,4 мл (детекция при 230 нм). Получают 9 фракций, которые после аналитического контроля путем высокопроизводительной жидкостной хроматографии различают, как в переднюю (энантиомер I; время удерживания: 6,13 мин) и заднюю (энантиомер II; время удерживания: 8,10 мин) фракции. Заднюю фракцию (время удерживания: 8,10 мин) подвергают повторной хроматографии на колонке, содержащей силикагель марки Ширацел OD, с использованием в качестве элюента смеси н.-гептана и 2-пропанола.
Выход энантиомера I: 37 мг (45,1% теории)
Выход энантиомера II: 32 мг (39,6% теории)
Аналитическая высокопроизводительная жидкостная хроматография:
колонка: 250 х 4,6 мм
(силикагель марки Ширацел OD-H; 5 мкм)
скорость подачи: 1,0 мл/мин
элюент: 98% н.-гептана и 2% 2-пропанола
температура: 40oС
объем подачи: 10 мкл
детекция: 220 нм
Пример 6
8-бутил-4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил] -2-изопропил-5,6,7,8-тетрагидрохинолин-5-ол

180 мг (0,28 ммоль) соединения примера XII в растворе 16,8 мл тетрагидрофурана и 2,8 мл 3-молярной соляной кислоты перемешивают при комнатной температуре в течение 16 часов. Затем вмешивают в 70 мл насыщенного раствора бикарбоната натрия и разбавляют 20 мл толуола. Органическую фазу отделяют, промывают водой, сушат над сульфатом натрия, фильтруют и сгущают. Сырой продукт элюируют на 25 г силикагеля 60 с использованием в качестве элюента смеси циклогексана и сложного этилового эфира уксусной кислоты в соотношении 9: 1.
Выход: 44 мг (30% теории)
Rf = 0,20 (смесь циклогексана и сложного этилового эфира уксусной кислоты в соотношении 9:1)
Пример 7
4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил] -2-изопропил-5,6,7,8-тетрагидрохинолин-5-он

В раствор 16 г (36,4 ммоль) соединения примера 2 в 655 мл дихлорметана при сильном перемешивании подают порциями 11,16 г (109,2 ммоль) нейтральной окиси алюминия и 23,54 г хлорхромата пиридиния. Через час прибавляют 140 г силикагеля 60 и отсасывают. Элюат сгущают и сушат.
Выход: 10,5 г (70% теории)
Rf = 0,55 (смесь циклогексана и сложного
этилового эфира
уксусной кислоты в соотношении 9:1)
Пример 8
4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил] -2-изопропил-6-(4-трифторметил-фенил)-метил-5,6,7,
8-тетрагидрохинолин-5-он

0,88 мл (1,4 ммоль) 1,6-молярного раствора н.-бутиллития в н.-гексане и 0,20 мл диизопропиламина вмешивают в атмосфере аргона при -70oС в 4 мл абсолютного тетрагидрофурана, после чего перемешивают при -50oС в течение часа. К этому раствору прикапывают при -50oС 460 мг (1 ммоль) раствора соединения примера 7 и перемешивают в течение дальнейшего часа. Затем прикапывают раствор 335 мг (1,4 ммоль) трифторметилбензилбромида в 1 мл абсолютного тетрагидрофурана и через час при -50oС гидролизуют водой. Переработку осуществляют следующим образом. Вмешивают смесь 5%-ного раствора поваренной соли и толуола, фазы разделяют, водную фазу дополнительно экстрагируют и объединенные органические фазы сушат над сульфатом натрия, фильтруют и сгущают. Сырой продукт элюируют на 90 г силикагеля 60 смесью циклогексана и сложного этилового эфира уксусной кислоты в соотношении 9:1.
Выход: 443 мг (72% теории)
Rf = 0,23 (смесь циклогексана и
сложного этилового эфира уксусной кислоты в соотношении 9:1)
Пример
9
4-(4-фторфенил)-3-фтор-(4-трифторметилфенил)-метил] -2-изопропил-6-(4-трифторметил-фенил)-метил-5,6,7,
8-тетрагидрохинолин-5-ол

К раствору 100 мг (0,32 ммоль) соединения примера 8 в 1,6 мл толуола прикапывают при -70oС 0,48 мл 1-молярного раствора диизобутилалюмогидрида в толуоле. Через 2 часа добавляют 5 мл 20%-ного раствора тартрата натрия и калия и перемешивают при комнатной температуре в течение 30 минут. Органическую фазу отделяют, сушат над сульфатом натрия, фильтруют и сгущают. Сырой продукт элюируют на силикагеле 60 смесью циклогексана и сложного этилового эфира уксусной кислоты в соотношении 85:15.
Выход: 58 мг
(59% теории)
Rf = 0,23 (смесь циклогексана и сложного этилового эфира уксусной кислоты в соотношении 85:15)
Аналогично вышеуказанным данным получают приведенные в таблице
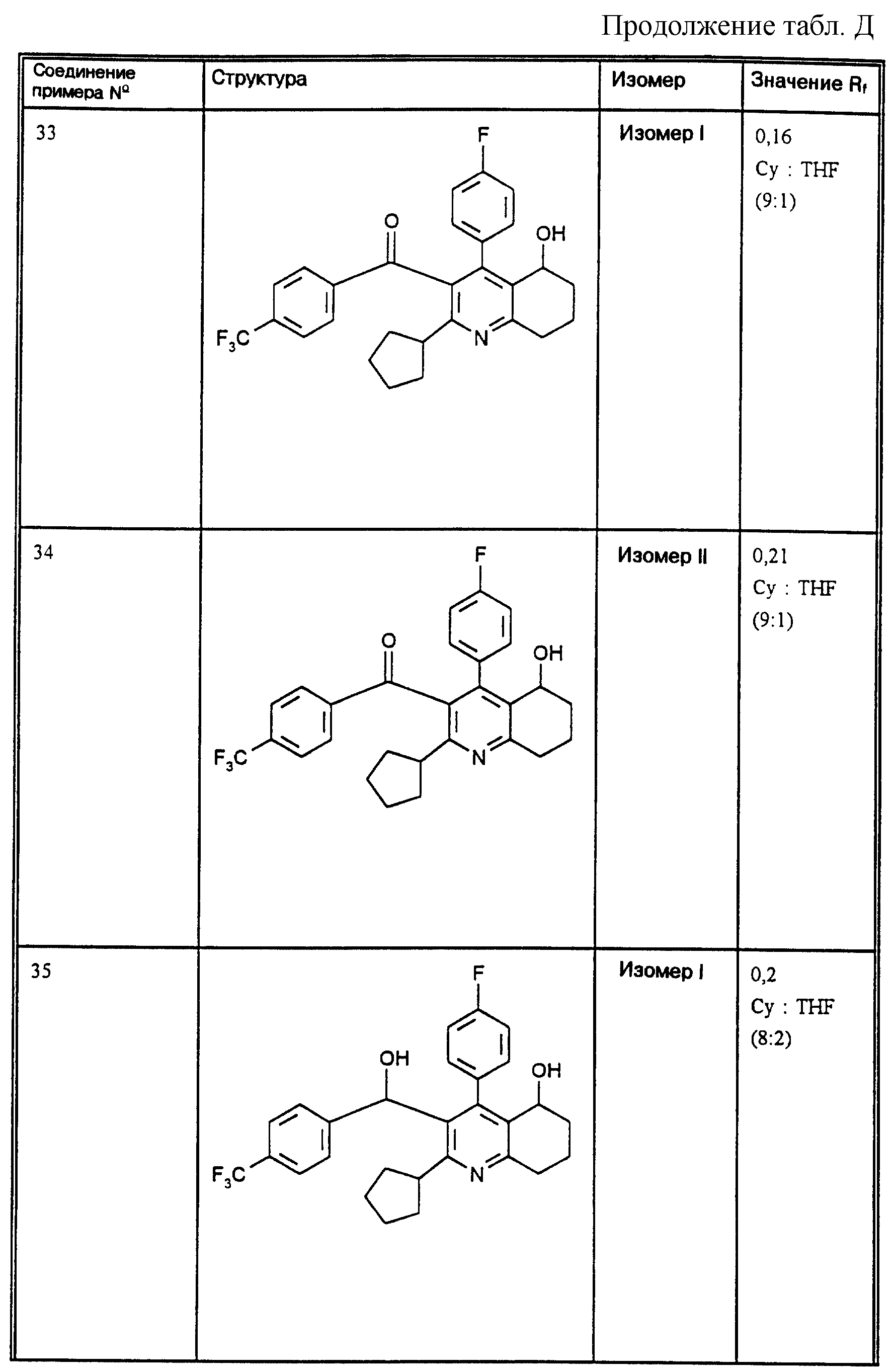
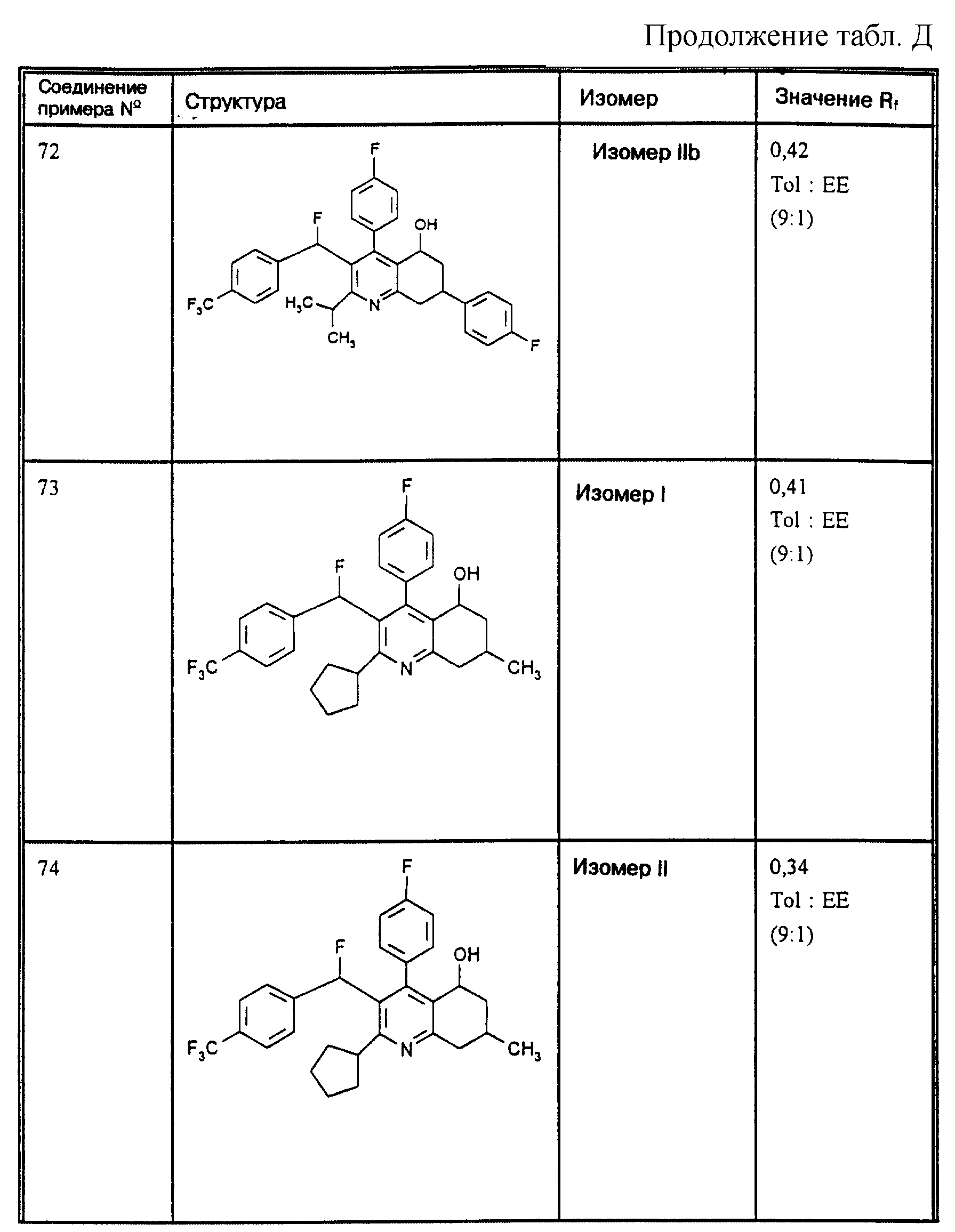
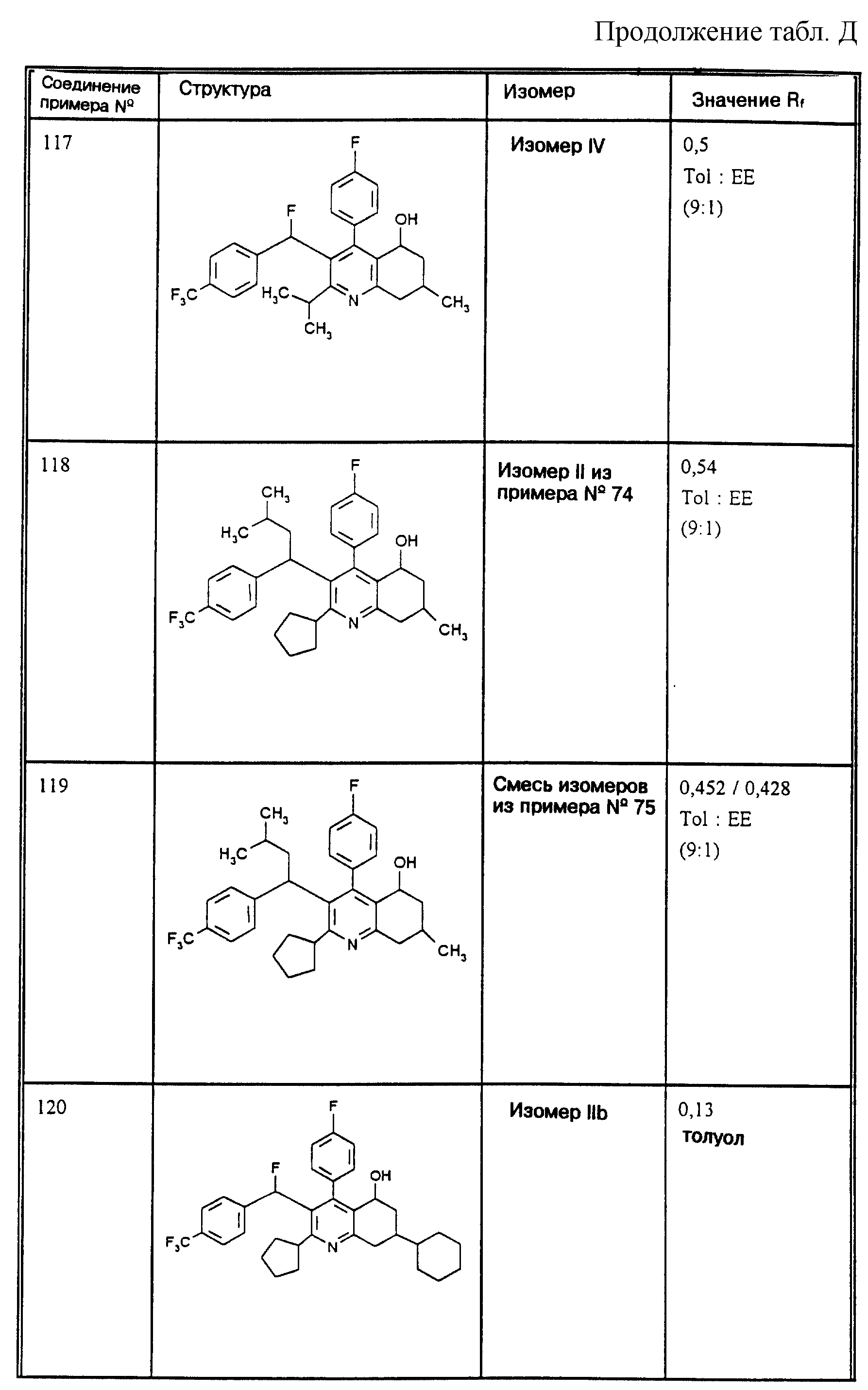
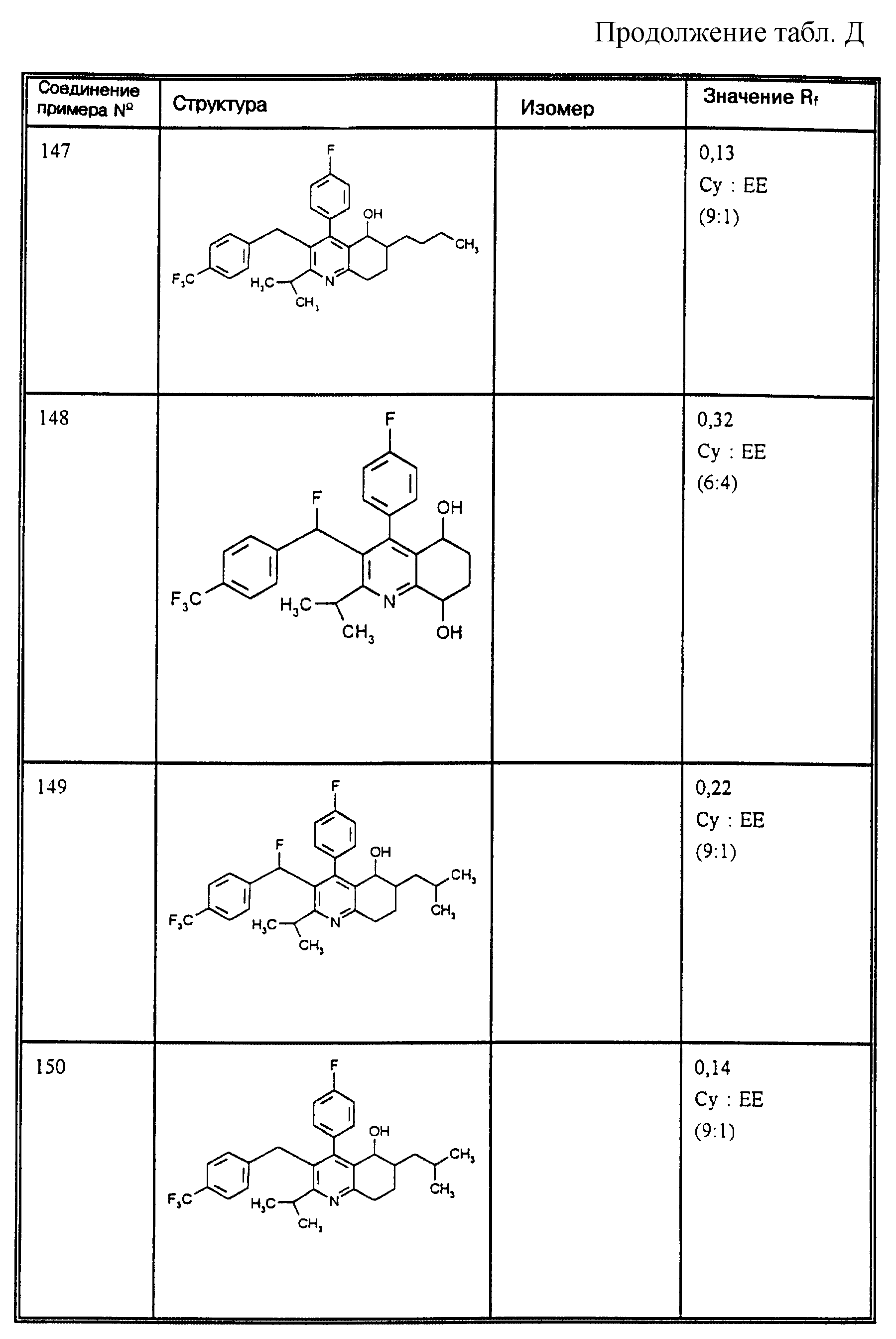
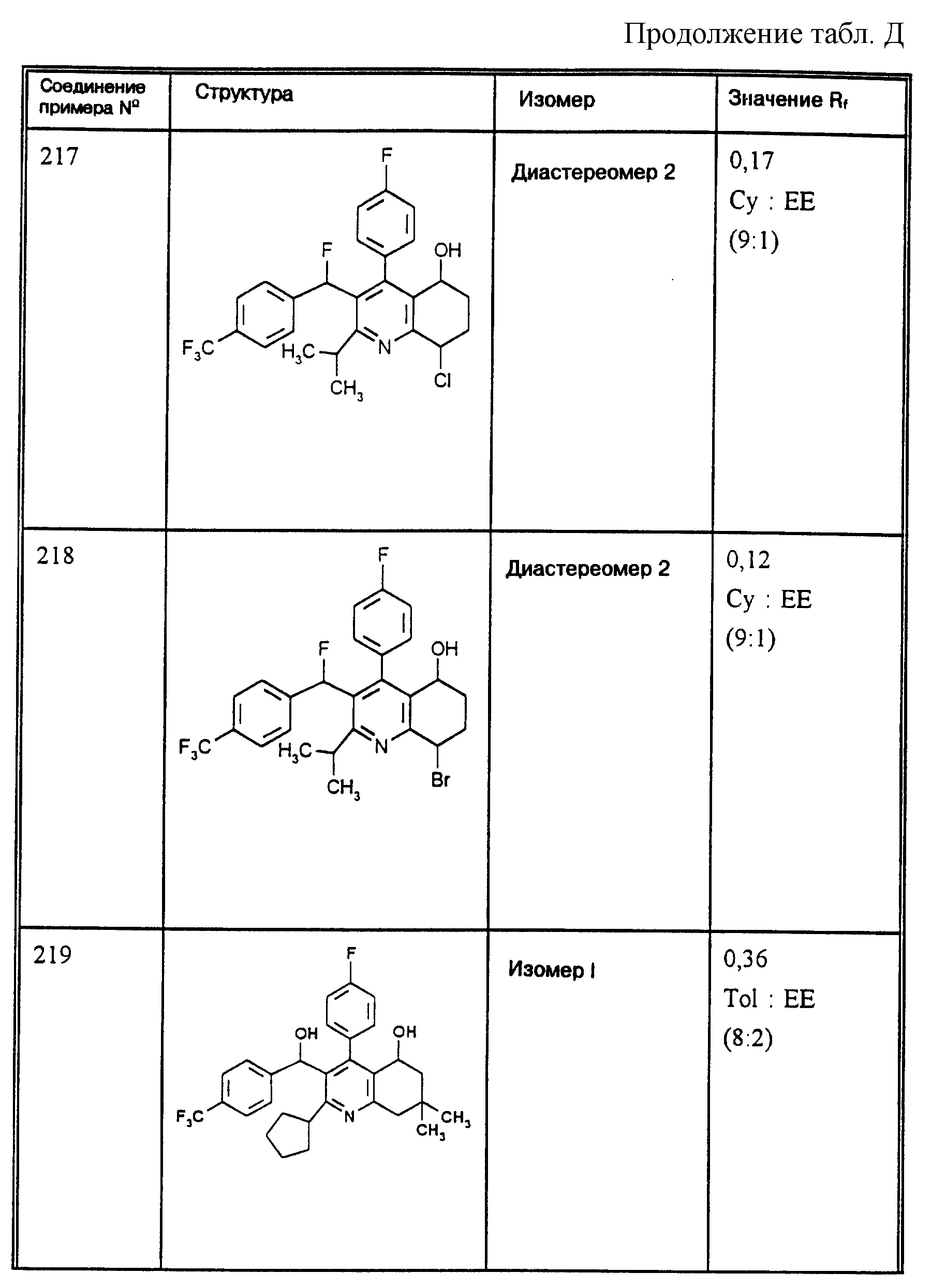
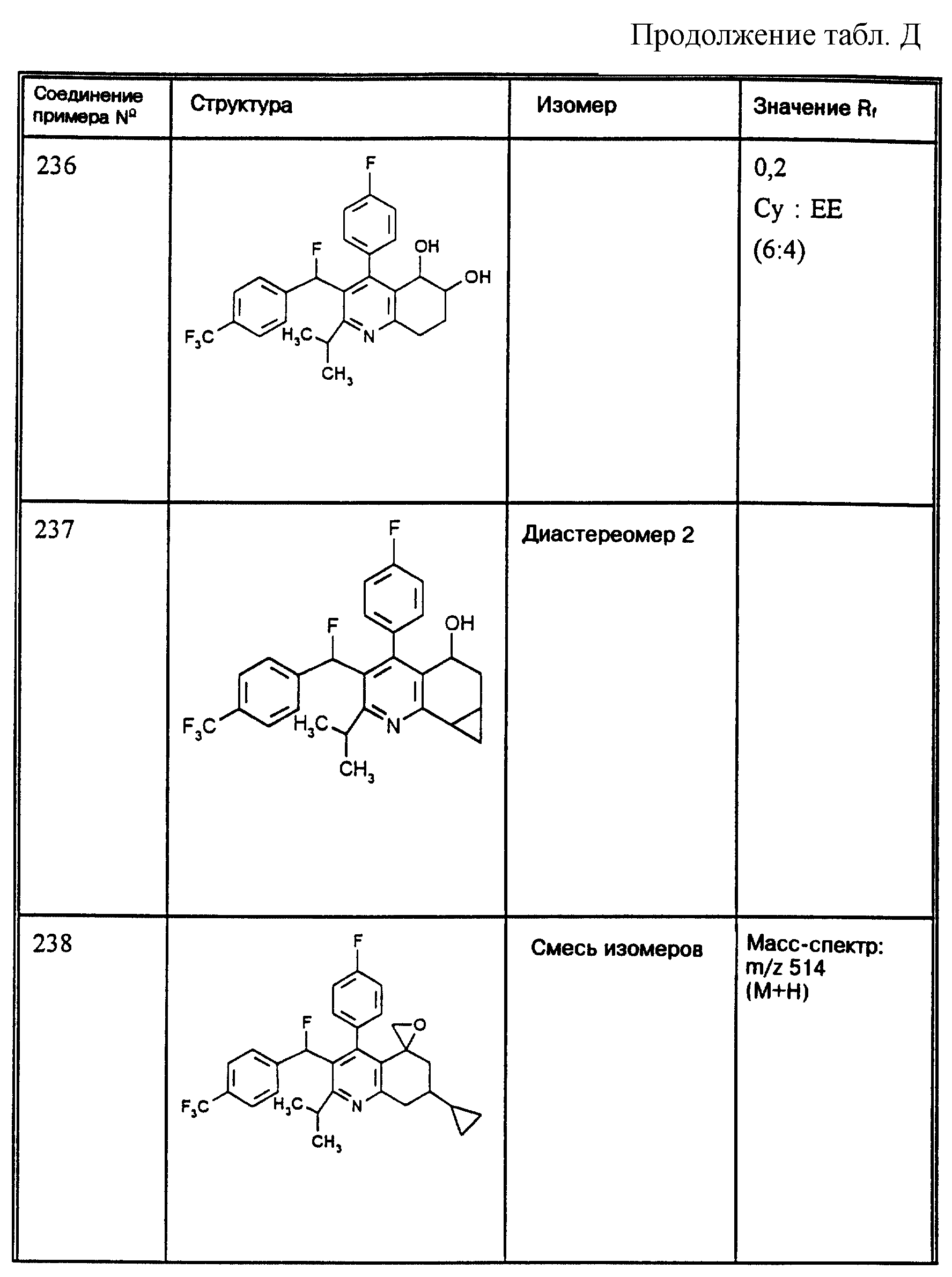
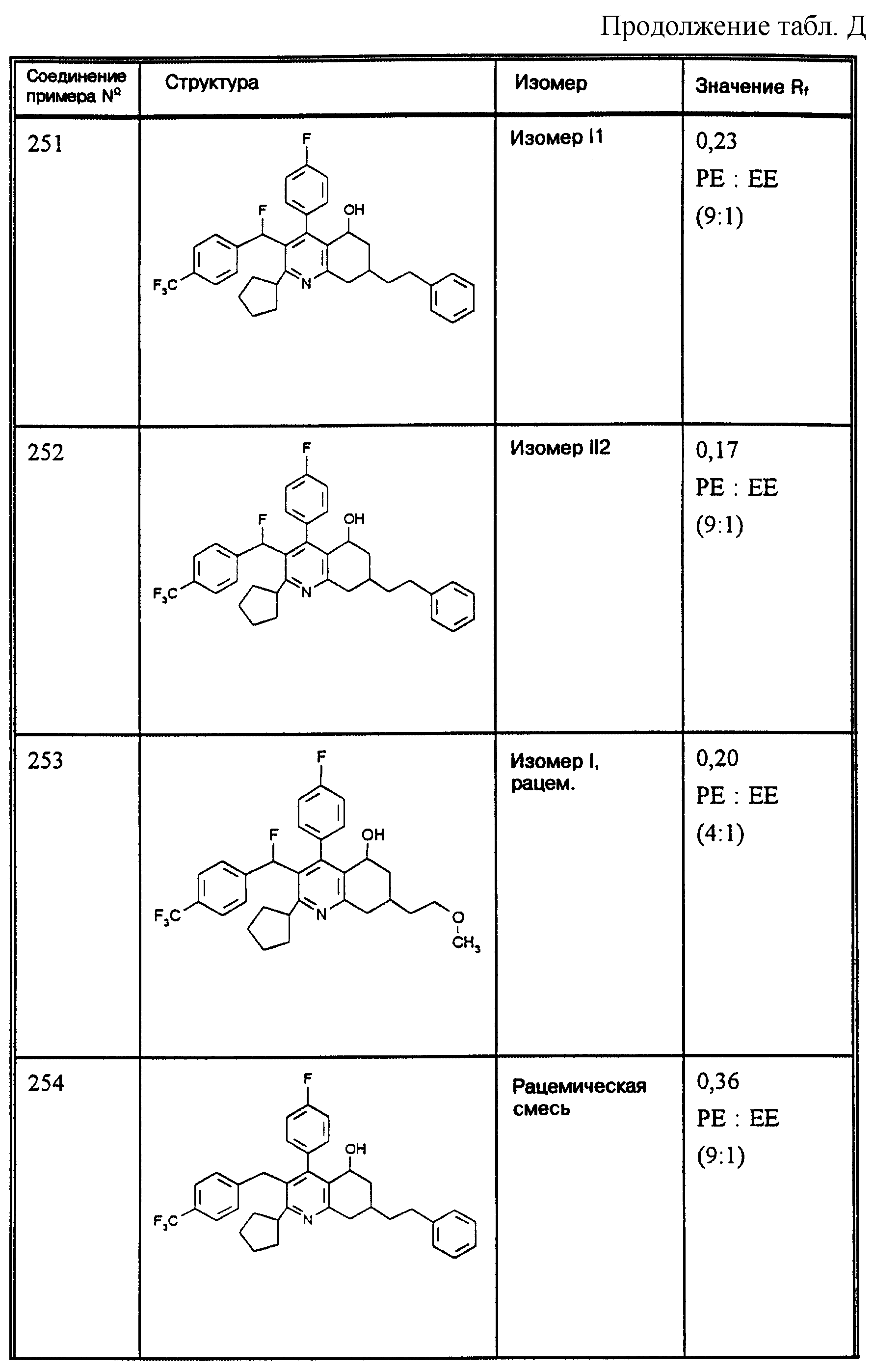
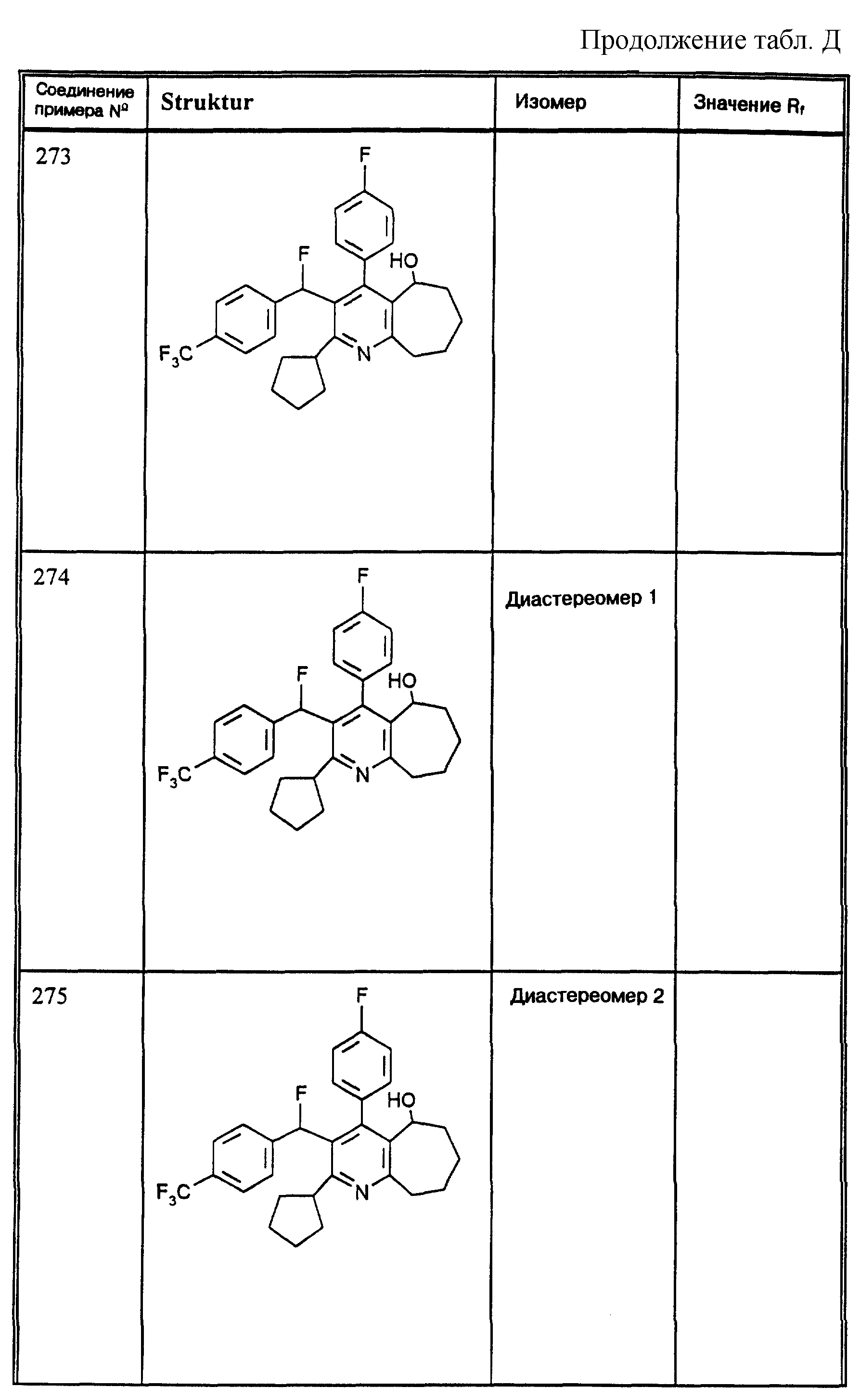
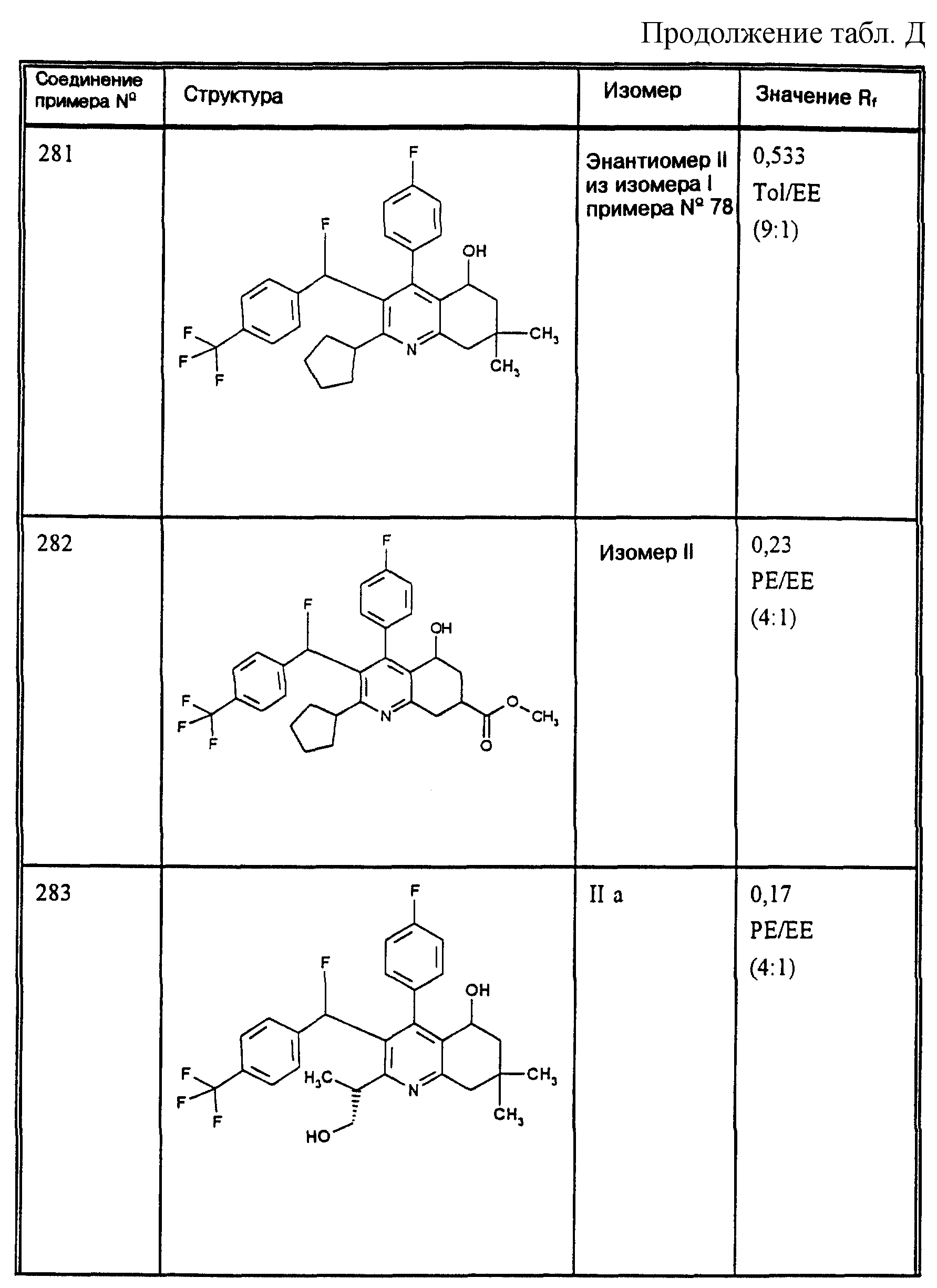
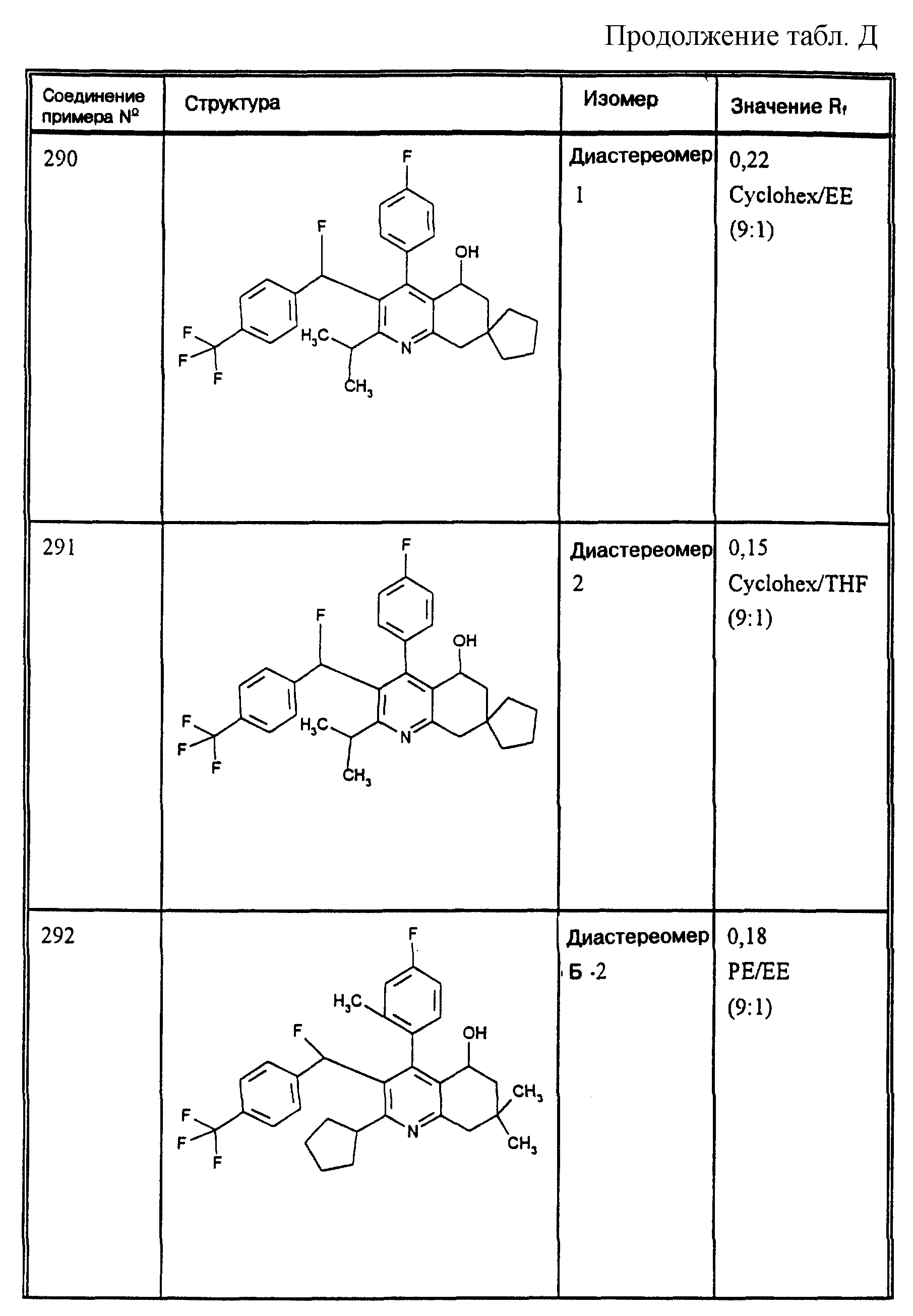
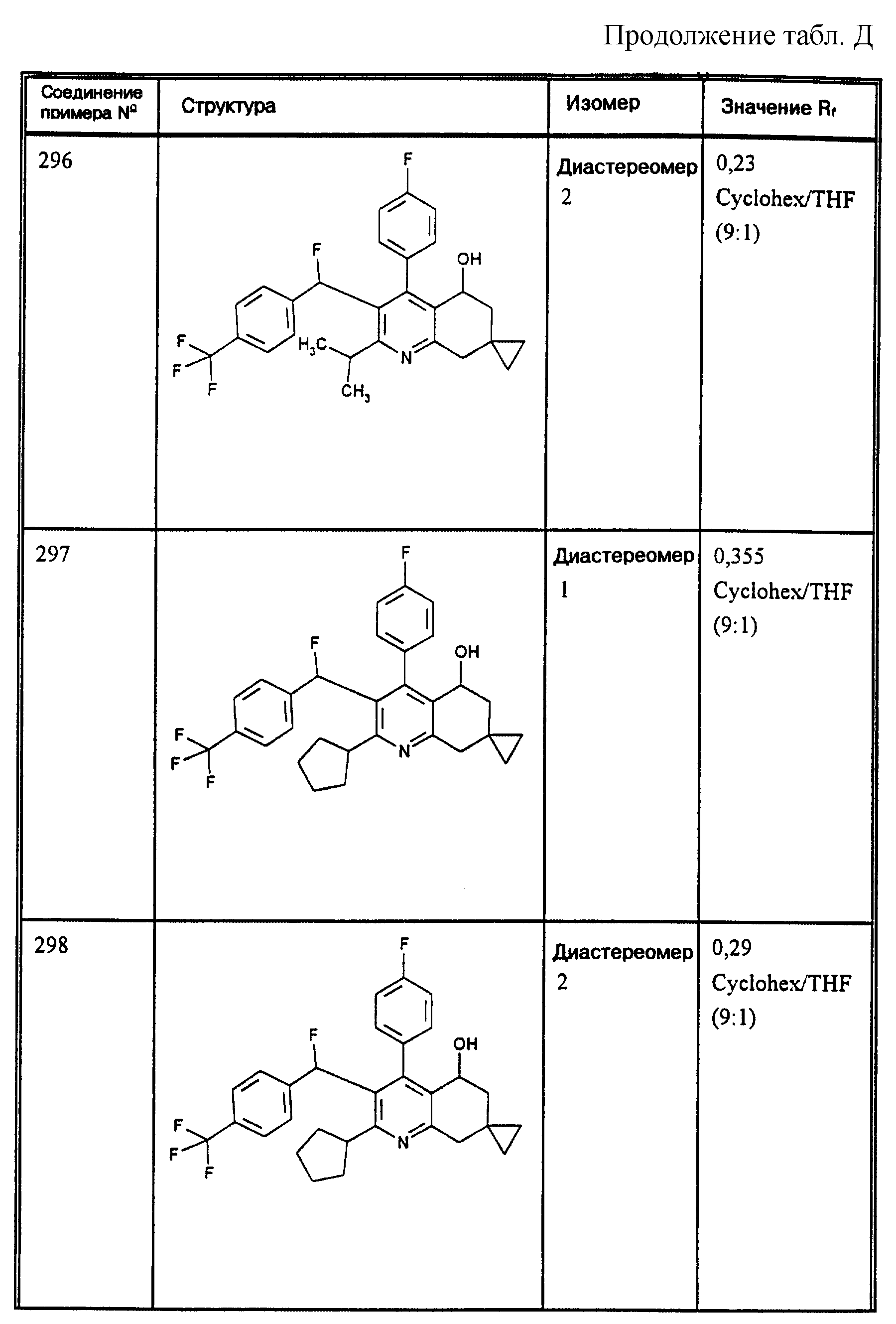
Д соединения, в которых используются следующие условные сокращения, означающие элюенты:
Cyclohex
Сус} =
циклогексан
Су
ЕЕ = сложный этиловый эфир уксусной
кислоты
РЕ = петролейный диэтиловый эфир
THF = тетрагидрофуран
Tol = толуол
МеОН = метанол
ЕtOН = этанол
Si 60 = силикагель марки 60
Si
100 = силикагель марки 100
Пример 367
2-циклопентил-4-(4-фторфенил)-7,7-диметил-3-(4-трифторметилбензоил)-7,
8-дигидро-6Н-хинолин-5-он

843 г 2-циклопентил-4-(4-фторфенил)-7, 7-диметил-3-(4-трифторметилбензоил)-4,6,7,8-тетрагидро-6Н-хинолин-5-она в 28 л метиленхлорида окисляют до пиридина с помощью 7021,3 г активированного пиролюзита при комнатной температуре в течение часа. После отделения пиролюзита и отгонки метиленхлорида перекристаллизовывают из петролейного эфира. Получают 618 г кристаллов, чистота которых составляет 99,3% по получаемым при высокопроизводительной жидкостной хроматографии данным. Из маточного раствора кристаллизации путем хроматографии на силикагеле с применением в качестве элюента смеси толуола и сложного этилового эфира уксусной кислоты в соотношении 4:1 получают дальнейших 4,1 г целевого продукта того же качества.
Точка плавления: 186oС
Тонкослойная хроматография: Rf = 0,8 (смесь толуола и сложного этилового эфира уксусной кислоты в соотношении 4:1)
Пример 368
[2-циклопентил-4-(4-фторфенил)-5-гидрокси-7,7-диметил-5,6,7,
8-тетрагидрохинолин-3-ил]-(4-трифторметилфенил)-метанон
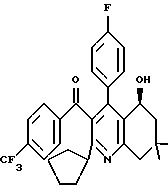
625,3 г 2-циклопентил-4-(4-фторфенил)-7,7-диметил-3-(4-трифторметилбензоил)-7,8-дигидро-6Н-хинолин-5-она в 6 л тетрагидрофурана подвергают восстановлению с помощью 56,4 г 1R,2S-аминоинданола и 800 г борандиэтиланилинового комплекса при температуре от 0 до -5oС. Прекращение реакции осуществляют приблизительно через 20 часов путем добавления 500 мл 1,2 этандиола. Тетрагидрофуран отгоняют, получающееся масло добавляют к сложному этиловому эфиру уксусной кислоты, и органическую фазу промывают 2 н. соляной кислотой и насыщенным раствором бикарбоната натрия, сушат и сгущают. Остаток перекристаллизовывают из горячего циклогексана. Получают всего 574 г бесцветных кристаллов, чистота которых составляет 99,4% по полученным при высокопроизводительной жидкостной хроматографии данным (чистота изомера 97,4%).
Точка плавления: 114oС
Тонкослойная хроматография: Rf = 0,2 (смесь
петролейного эфира и сложного этилового эфира
уксусной кислоты в соотношении 9:1)
Пример 369
[2-(трет. бутилдиметилсиланилокси)-2-циклопентил-4-(4-фторфенил)-7,7-диметил-5,6,7,
8-тетрагидрохинолин-3-ил]-(4-трифторметилфенил)-метанон

а) 574 г [2-циклопентил-4-(4-фторфенил)-5-гидрокси-7,7-диметил-5,6,7,8-тетрагидрохинолин-3-ил]-(4-трифторметилфенил)-метанона и 522 мл лутидина, растворенных в 5,4 л толуола, подвергают взаимодействию со смесью 593,2 г трет.бутилдиметилсилилтрифторметансульфоната и 1 л толуола в течение 150 минут при температуре от комнатной до -5oС. Реакцию прекращают добавлением 10%-ного водного раствора хлористого аммония, органическую фазу промывают 0,1 н. соляной кислотой и насыщенным водным раствором бикарбоната натрия и сушат. После отгонки растворителя в вакууме остаток перекристаллизовывают из этанола. Получают всего 633 г бесцветных кристаллов, чистота которых составляет 99,2% по полученным при высокопроизводительной жидкостной хроматографии данным (чистота изомера 98,7%).
Точка плавления: 108oС
Тонкослойная хроматография: Rf = 0,8 (смесь петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 9:1)
б) К 50
мг
син- и 50 мг анти-[5-(трет.бутилдиметилсиланилокси)-2-циклопентил-4-(4-фторфенил)-7,7-диметил-5,6,7,8-тетрагидрохинолин-3-ил]-(4-трифторметилфенил)-метанона, растворенного в 2 мл дихлорметана,
добавляют порциями 320 мг двуокиси марганца (фирмы Merck, зак. 805958, 90%, осажденной, активной) и перемешивают в течение 7 часов. Растворитель удаляют в вакууме, и остаток наносят непосредственно
на
колонку, содержащую силикагель. Путем хроматографии с применением в качестве элюента смеси петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 15:1 получают 93 мг
продукта.
Тонкослойная хроматография: Rf = 0,6 (смесь петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 9:1)
Пример 370
[5-(трет.
бутилдиметилсиланилокси)-2-циклопентил-4-(4-фторфенил)-7,7-диметил-5,6,7,8-тетрагидрохинолин-3-ил]-(4-трифторметилфенил)-метанол

К раствору 9 г [5-(трет.бутилдиметилсиланилокси)-2-циклопентил-4-(4-фторфенил)-7,7-диметил-5,6,7,8-тетрагидрохинолин-3-ил] -(4-трифторметилфенил)-метанола в 60 мл толуола прикапывают 16,5 мл 65%-ного раствора бис-(2-метокси-этокси)-дигидроалюмината натрия в толуоле. Через 3 с половиной часа реакцию прекращают добавлением метанола, экстрагируют сложным этиловым эфиром уксусной кислоты, и органическую фазу последовательно промывают раствором тартрата калия и натрия и насыщенным водным раствором бикарбоната натрия и сушат. После отгонки растворителя в вакууме остаток перекристаллизовывают из петролейного эфира. Получают всего 4,8 г бесцветных кристаллов, чистота которых составляет 99,4% по полученным при высокопроизводительной жидкостной хроматографии данным (чистота изомера 99,0%). Из маточного раствора кристаллизации получают дальнейших 1,8 г целевого продукта того же качества путем хроматографии на силикагеле с применением в качестве элюента смеси петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 9:1.
Точка плавления: 142oС
Тонкослойная хроматография: Rf = 0,5 (смесь петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 9:1)
Пример 371
5-(трет.
бутилдиметилсиланилокси)-2-циклопентил-4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил]-7,7-диметил-5,6,7,8-тетрагидрохинолин

К раствору 3,8 г [5-(трет.бутилдиметилсиланилокси)-2-циклопентил-4-(4-фторфенил)-7,7-диметил-5,6,7,8-тетрагидрохинолин-3-ил] -(4-трифторметилфенил)-метанола в 37,8 мл толуола прикапывают при -5oС раствор 1,46 г трифторида диэтиламиносеры в 10 мл толуола. Через 30 минут реакцию прекращают добавлением насыщенного водного раствора бикарбоната натрия, органическую фазу еще раз промывают насыщенным водным раствором бикарбоната натрия и сушат. После отгонки растворителя в вакууме остаток перекристаллизовывают из этанола. Получают всего 3,33 г бесцветных кристаллов, чистота которых составляет 99,4% по полученным при высокопроизводительной жидкостной хроматографии данным. Из маточного раствора кристаллизации получают дальнейших 0,26 г целевого продукта того же качества путем хроматографии на силикагеле с применением в качестве элюента смеси петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 10:1.
Точка плавления: 128oС
Тонкослойная хроматография: Rf = 0,8 (смесь петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 9:1)
Пример 372
5-(трет. бутилдиметилсиланилокси)-2-циклопентил-4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил]-7,7-диметил-5,6,7,8-тетрагидрохинолин

2 г [5-(трет. бутилдиметилсиланилокси)-2-циклопентил-4-(4-фторфенил)-7,7-диметил-5,6,7, 8-тетрагидрохинолин-3-ил]-(4-трифторметилфенил)-метанола и 2,14 мл N,N-диэтил-1,1,2,3,3,3-гексафторпропиламина в 25 мл толуола перемешивают в атмосфере аргона при 60oС в течение 18 часов. После этого смесь вливают в насыщенный раствор бикарбоната натрия, органическую фазу отделяют, снова экстрагируют насыщенным раствором бикарбоната натрия, сушат и сгущают в вакууме. Остаток перекристаллизовывают из горячего этанола, и после сушки получают 1,3 г бесцветных кристаллов, чистота которых составляет 99,4% по полученным при высокопроизводительной жидкостной хроматографии данным. Из маточного раствора кристаллизации получают дальнейших 0,3 г целевого продукта того же качества путем хроматографии на силикагеле с применением в качестве элюента смеси петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 10:1.
Пример 373
2-циклопентил-4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил] -7,7-диметил-5,6,7,
8-тетрагидрохинолин-5-ол

110 г 5-(трет.бутилдиметилсиланилокси)-2-циклопентил-4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил] -7,7-диметил-5,6,7,8-тетрагидрохинолина в смеси 913 мл 5 н. соляной кислоты, 1364 мл метанола и 902 мл тетрогидрофурана перемешивают при 40oС в течение 2 часов. Реакционную смесь вливают в насыщенный водный раствор бикарбоната натрия и экстрагируют сложным этиловым эфиром уксусной кислоты. После повторной промывки насыщенным водным раствором бикарбоната натрия органические фазы сушат. После отгонки растворителя в вакууме остаток перекристаллизовывают из циклогексана. После сушки в вакууме, создаваемом при помощи масляного насоса, получают всего 71,1 г бесцветных кристаллов, чистота которых составляет 99,4% по полученным при высокопроизводительной жидкостной хроматографии данным (чистота изомера 99,5%). Из маточного раствора кристаллизации получают дальнейших 10,8 г целевого продукта того же качества путем хроматографии на силикагеле с применением в качестве элюента смеси петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 7:1.
Точка плавления: 140oС
Тонкослойная хроматография:
Rf = 0,2 (смесь петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 9:1) Ти
Реферат
Изобретение относится к новым производным циклоалкано-пиридина общей формулы (I), где А-арил с 6-10 атомами углерода, незамещенный или монозамещенный галогеном, D-арил с 6-10 атомами углерода, незамещенный или замещенный фенилом, нитро, галогеном, трифторметилом или трифторметокси, или остаток формулы, представленной в формуле изобретения, Е-циклоалкил с 3-8 атомами углерода, линейный или разветвленный алкил с 1-8 атомами углерода или фенил, незамещенный или замещенный галогеном или трифторметилом, R1 и R2 вместе образуют линейную или разветвленную алкиленовую цепь с 1-7 атомами углерода, которая замещена карбонильной группой и/или остатком формулы, представленной в формуле изобретения, смеси их изомеров или отдельным изомерам, их солям и N-окислам, за исключением 5(6Н)-хинолона, 3-бензоил-7,8-дигидро-2,7,7-триметил-4-фенила. Также раскрыты промежуточные соединения для получения указанных производных циклоалкан-пиридина и фармацевтическая композиция на их основе. Изобретение может быть использовано в медицине для лечения и профилактики гиполипопротеинемии, дислипидемии, гипертриглицеридемии, гиперлипидемии или артериосклероза. 4 с. и 2 з.п.ф-лы, 5 табл.

Формула

где А-арил с 6-10 атомами углерода, незамещенный или монозамещенный галогеном;
D-арил с 6-10 атомами углерода, незамещенный или замещенный фенилом, нитро, галогеном, трифторметилом или трифторметокси, или остаток формулы
R3 -L-

R7-T-O-X-
где R3, R4 и R7 независимо друг от друга означают циклоалкил с 3-6 атомами углерода или арил с 6-10 атомами углерода; R3 и/или R4 означают остаток формулы


R5 - водород или галоген;
R6 - водород, галоген, азидо, трифторметил, гидроксил или остаток формулы-NR8R9, где R8 и R9 одинаковы или различны и означают водород или алкил с 1-6 атомами углерода;
или R5 и R6 вместе образуют остаток формулы= NR10, где R10 означает водород или линейные или разветвленные алкил и ацил, каждый с 1-6 атомами углерода:
L - линейные или разветвленные алкиленовые и алкениленовые цепи, каждая с 1-8 атомами углерода, незамещенные или замещенные однократно гидроксилом;
Т и Х одинаковы или различны и означают линейную или разветвленную алкиленовую цепь с 1-8 атомами углерода; или Т или Х означают связь;
Е - циклоалкил с 3-8 атомами углерода, линейный или разветвленный алкил с 1-8 атомами углерода или фенил, незамещенный или замещенный галогеном или трифторметилом;
R1 и R2 вместе образуют линейную или разветвленную алкиленовую цепь с 1-7 атомами углерода, которая замещена карбонильной группой и/или остатками формулы



-OR11 или

где а и b одинаковы или различны и означают число 1, 2 или 3;
R11 - водород, линейный или разветвленный силилалкил с 1-8 атомами углерода, линейный или разветвленный алкил с 1-8 атомами углерода, незамещенный или замещенный гидроксилом, линейным или разветвленным алкоксилом с 1-6 атомами углерода или фенилом, незамещенным или замещенным остатком из группы, включающей галоген, нитро, трифторметил, трифторметокси или алкил, незамещенный или замещенный группой формулы-OR12, где R12 - линейный или разветвленный ацил с 1-4 атомами углерода или бензил; или R11 - линейный или разветвленный ацил с 1-20 атомами углерода или бензоил, незамещенные или замещенные галогеном, трифторметилом, нитро или трифторметокси, или линейный или разветвленный фторацил с 1-8 атомами углерода и 1-9 атомами фтора,
при этом карбоциклы, в случае необходимости также в геминальном положении, могут быть замещены 1-6 одинаковыми или различными остатками из группы, включающей гидроксил, циклоалкил с 3-7 атомами углерода, алкоксил или алкилтио, каждый с 1-6 атомами углерода, и линейный или разветвленный алкил с 1-6 атомами углерода, замещенный одно- или двукратно гидроксилом, и/или фенил, который может быть замещен галогеном или трифторметилом; и/или карбоциклы, также в геминальном положении, могут быть однократно замещены остатком из группы, включающей фенил, бензоил и тиофекил, незамещенные или замещенные галогеном или трифторметилом, или могут быть замещены остатком формулы
-SO2-C6H5, -(CO)d-NR13R14 или = О,
где d = 0 или 1,
R13 и R14 одинаковыми различны и означают водород, циклоалкил с 3-6 атомами углерода, линейный или разветвленный алкил с 1-6 атомами углерода или фенил, незамещенный или однократно замещенный галогеном, трифторметилом или нитрогруппой,
и/или образовавшиеся карбоциклы могут быть замещены спиросвязанным остатком формулы




где Y и Y1 вместе образуют 2- до 6-членную линейную или разветвленную алкиленовую цепь;
е = 1,2,3,4,6 или 7;
R15 и R16 вместе образуют 3- до 7-членный гетероцикл, содержащий атом кислорода,
смесь их изомеров или отдельные изомеры, их соли и N-окислы, за исключением 5(6Н)-хинолона, 3-бензоил-7,8-дигидро-2,7,7-триметил-4-фенила.
R3 -L-

R7-T-O-X-
где R3, R4 и R7 независимо друг от друга означают циклопропил, циклопентил или циклогексил, фенил, нафтил; R3 и/или R4 означают остаток формулы


где R5 - водород, фтор, хлор или бром;
R6 - водород, фтор, хлор, бром, азидо, трифторметил. гидроксил или остаток формулы - NR8R9, где R8 и R9 одинаковы или различны и означают водород или алкил с 1-4 атомами углерода;
или R5 и R6 вместе образуют остаток формулы= NR10, где R10 означает водород или линейные или разветвленные алкил и ацил, каждый с 1-4 атомами углерода;
L - линейные или разветвленные алкиленовая и алкениленовая цепи, каждая с 1-6 атомами углерода, незамещенные или замещенные однократно гидроксилом;
Т и Х одинаковы или различны и означают линейную или разветвленную алкиленовую цепь с 1-6 атомами углерода; или Т или Х означают связь;
Е - циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, линейный или разветвленный алкил с 1-6 атомами углерода или фенил, незамещенный или замещенный фтором, хлором или трифторметилом; R1 и R2 вместе образуют линейную или разветвленную алкиленовую цепь с 1-6 атомами углерода, которая замещена карбонильной группой и/или остатком формулы



-OR11 или

где а и b одинаковы или различны и означают число 1, 2 или 3;
R11 - линейный или разветвленный силиалкил с 1-7 атомами углерода, линейный или разветвленный алкил с 1-6 атомами углерода, незамещенный или замещенный гидроксилом, линейным или разветвленным алкоксилом с 1-4 атомами углерода или фенилом, незамещенным или замещенным остатком из группы, включающей фтор, хлор, бром, нитро, трифторметил, трифторметокси, или алкил, незамещенный или замещенный группой формулы-OR12, где R12 - линейный или разветвленный ацил с 1-3 атомами углерода или бензил, или R11 - линейный или разветвленный ацил с 1-18 атомами углерода или бензоил, незамещенные или замещенные фтором, хлором, бромом, трифторметилом, нитро или трифторметоксилом, линейный или разветвленный фторацил с 1-6 атомами углерода;
при этом карбоциклы в случае необходимости также в геминальном положении, могут быть замещены одно- до пятикратно одинаковыми или различными остатками из группы, включающей гидроксил, циклопропил, циклобутил, циклопентил, циклогексил, алкоксил и алкилтио каждый с 1-5 атомами углерода, или линейный или разветвленный алкил с 1-5 с атомами углерода, замещенный одно- или двукратно гидроксилом, и/или фенил, который может быть замещен фтором, хлором, бромом или трифторметилом; и/или карбоциклы также в геминальном положении, могут быть однократно замещены остатком из группы, включающей фенил, бензоил и тиофенил, незамещенные или замещенные фтором, хлором, бромом или трифторметилом, или могут быть замещены остатком формулы
-SO2-C6H5, -(CO)d-NR13 R14 или = О,
где d = 0 или 1;
R13 и R14 одинаковы или различны и означают водород, циклопропил, циклобутил, циклопентил, циклогексил линейный или разветвленный алкил с 1-5 атомами углерода или фенил, незамещенный или однократно замещенный фтором, хлором, бромом или трифторметилом;
и/или образовавшиеся карбоциклы могут быть замещены спиросвязанным остатком формулы



где Y и Y1 вместе образуют 2- до 5-членную линейную или разветвленную алкиленовую цепь;
е = 1, 2, 3, 4, 5 или 6;
смесь их изомеров или отдельные изомеры, их соли и N-окислы, за исключением 5(6Н)-квинолона, 3-бензоил-7,8-дигидро-2,7, 7-триметил-4-фенила.
D - фенил, незамещенный или замещенный нитро, трифторметилом, фенилом, фтором, хлором или бромом, или остаток формулы
R3-L-

R7-T-O-X-
где R3, R4 и R7 независимо друг от друга означают циклопропил, циклопентил или циклогексил, фенил, нафтил; R3 и/или R4 означают остаток формулы


R5 - водород или фтор;
R6 - водород, фтор, хлор, бром, азидо, трифторметил, гидроксил, или остаток формулы - NR8R9, где R8 и R9 одинаковы или различны и означают водород или алкил с 1-3 атомами углерода,
или R5 и R6 вместе образуют остаток формулы = NR10, где R10 означает водород или линейные или разветвленные алкил и ацил, каждый с 1-4 атомами углерода;
L - линейные или разветвленные алкиленовая и алкениленовая цепи, каждая с 1-5 атомами углерода, незамещенные или замещенные однократно гидроксилом;
Т и Х одинаковы или различны и означают линейную или разветвленную алкиленовую цепь с 1-3 атомами углерода; или Т или Х означают связь;
Е - циклопропил, циклопентил, циклогексил или фенил, незамещенный или замещенный фтором или трифторметилом, или линейный или разветвленный алкил с 1-4 атомами углерода; R1 и R2 вместе образуют линейную или разветвленную алкиленовую цепь с 1-5 атомами углерода, которая замещена карбонильной группой и/или остатком формулы



-OR11 или

где а и b одинаковы или различны и означают число 1, 2 или 3;
R11 - линейный или разветвленный силилалкил с 1-6 атомами углерода, линейный или разветвленный алкил с 1-4 атомами углерода, незамещенный или замещенный гидроксилом, линейным или разветвленным алкоксилом с 1-3 атомами углерода или фенилом, незамещенным или замещенным остатком из группы, включающей фтор, хлор, бром, нитро, трифторметил, трифторметокси, или алкил, незамещенный или замещенный группой формулы -OR12, где R12 - линейный или разветвленный ацил с 1-3 атомами углерода или бензил; или R11 - линейный или разветвленный ацил с 1-15 атомами углерода и бензоил, незамещенные или замещенные фтором, хлором, бромом, трифторметилом, нитро или трифторметоксилом, или линейный или разветвленный фторацил с 1-4 атомами углерода,
при этом карбоциклы, в случае необходимости также в геминальном положении, могут быть замещены одно- до четырехкратно одинаковыми или различными остатками из группы, включающей гидроксил, циклопропил, циклобутил, циклопентил, циклогексил, алкоксил или алкилтио, каждый с 1-4 атомами углерода, и линейный или разветвленный алкил с 1-4 атомами углерода, замещенный одно- или двукратно гидроксилом, и фенил, который может быть замещен фтором, хлором, бромом или трифторметилом; и/или карбоциклы, также в геминальном положении, могут быть однократно замещены остатком из группы, включающей фенил, бензоил и тиофенил, или могут быть замещены остатком формулы
-SO2-C6H5, -(CО)d -NR13R14 или = O,
где d = 0 или 1,
R13 и R14 одинаковы или различны и означают водород, циклопропил, циклопентил, линейный или разветвленный алкил с 1-4 атомами углерода или фенил, незамещенный или однократно вмещенный фтором, хлором или бромом,
и/или карбоциклы могут быть замещены спиросвязанным остатком формулы


где Y и Y1 вместе образуют 2- до 6-членную линейную или разветвленную алкиленовую цепь;
е = 1, 2, 3, 4, 5 или 6;
смесь их изомеров или отдельные изомеры, их соли и N-окислы и N-окислы, за исключением 5(6Н)-квинолона, 3-бензоил-7,8-дигидро-2,7, 7-триметил-4-фенила.

представляющий собой промежуточный продукт для получения соединений формулы (I) по п. 1.
а) 2-циклопентил-4-(4-фторфенил)-7,7-диметил-3-(4-трифторметилбензоил)-4,6,7, 8-тетрагидро-1Н-хинолин-5-он формулы

б) 2-циклопентил-4-(фторфенил)-4-(4-фторфенил)-7, 7-диметил-3-(4-трифторметилбензоил)-7, 8-тетрагидро-6Н-хинолин-5-он формулы

в) [2-циклопентил-4-(4-фторфенил)-5-гидрокси-7, 7-диметил-5,6,7,8-тетрагидрохинолин-3-ил] -(4-трифторметилфенил)-метанон формулы

г) [5-(трет. бутилдиметилсиланилокси)-2-циклопентил-4-(4-фторфенил)-7,7-диметил-5,6,7,8-тетрагидрохинолин-3-ил] -(4-трифторметилфенил)-метанон формулы

д) [5-(трет. бутилдиметилсиланилокси)-2-циклопентил-4-(4-фторфенил)-7,7-диметил-5,6,7, 8-тетрагидрохинолин-3-ил] -(4-трифторметилфенил)-метанон формулы

е) [5-(трет. бутилдиметилсиланилокси)-2-циклопентил-4-(4-фторфенил)-3-[фтор-(4-трифторметилфенил)-метил] 7,7-диметил-5,6,7,8-тетрагидрохинолин формулы

6. Фармацевтическая композиция с активностью, тормозящей протеин переноса сложного эфира холестерина и стимулирующей обратный транспорт холестерина, содержащая по меньшей мере одно активное вещество и по меньшей мере один фармацевтически пригодный носитель, отличающаяся тем, что она в качестве активного начала содержит соединение общей формулы (I) по п. 1, его смесь изомеров или отдельный изомер, N-окись или его физиологически приемлемую соль в эффективном количестве.
08.07.1996 - значения радикалов A, D, Е, R1, R2, указанные в формуле изобретения, за исключением следующих значений: R1 и R2 вместе образуют линейную или разветвленную алкиленовую цепь с 1-7 атомами углерода, которая замещена остатком OR11, где R11 означает линейный или разветвленный фторацил с 4-8 атомами углерода и 8 или 9 атомами фтора; образовавшиеся карбоциклы могут быть замещены спиросвязанным остатком формулы

где R15 и R16 вместе образуют 3- до 7-членный гетероцикл, содержащий атом кислорода;
24.02.1997 - значения радикалов: R1 и R2 вместе образуют линейную или разветвленную алкиленовую цепь с 1-7 атомами углерода, которая замещена остатком OR11, где R11 означает линейный или разветвленный фторацил с 4-8 атомами углерода и 8 или 9 атомами фтора; образовавшиеся карбоциклы могут быть замещены спиросвязанным остатком формулы

где R15 и R16 вместе образуют 3- до 7-членный гетероцикл, содержащий атом кислорода по пп. 4-6;
08.07.1997 - значения радикалов: образовавшиеся карбоциклы могут быть замещены спиросвязанным остатком формулы

Документы, цитированные в отчёте о поиске
Замещенные производные миндальной кислоты и способ их получения
Патенты аналоги
Замещенные производные миндальной кислоты и способ их получения

Комментарии