Производные бицикло[2,2,1]гепт-7-иламина и их применения - RU2442771C2
Код документа: RU2442771C2
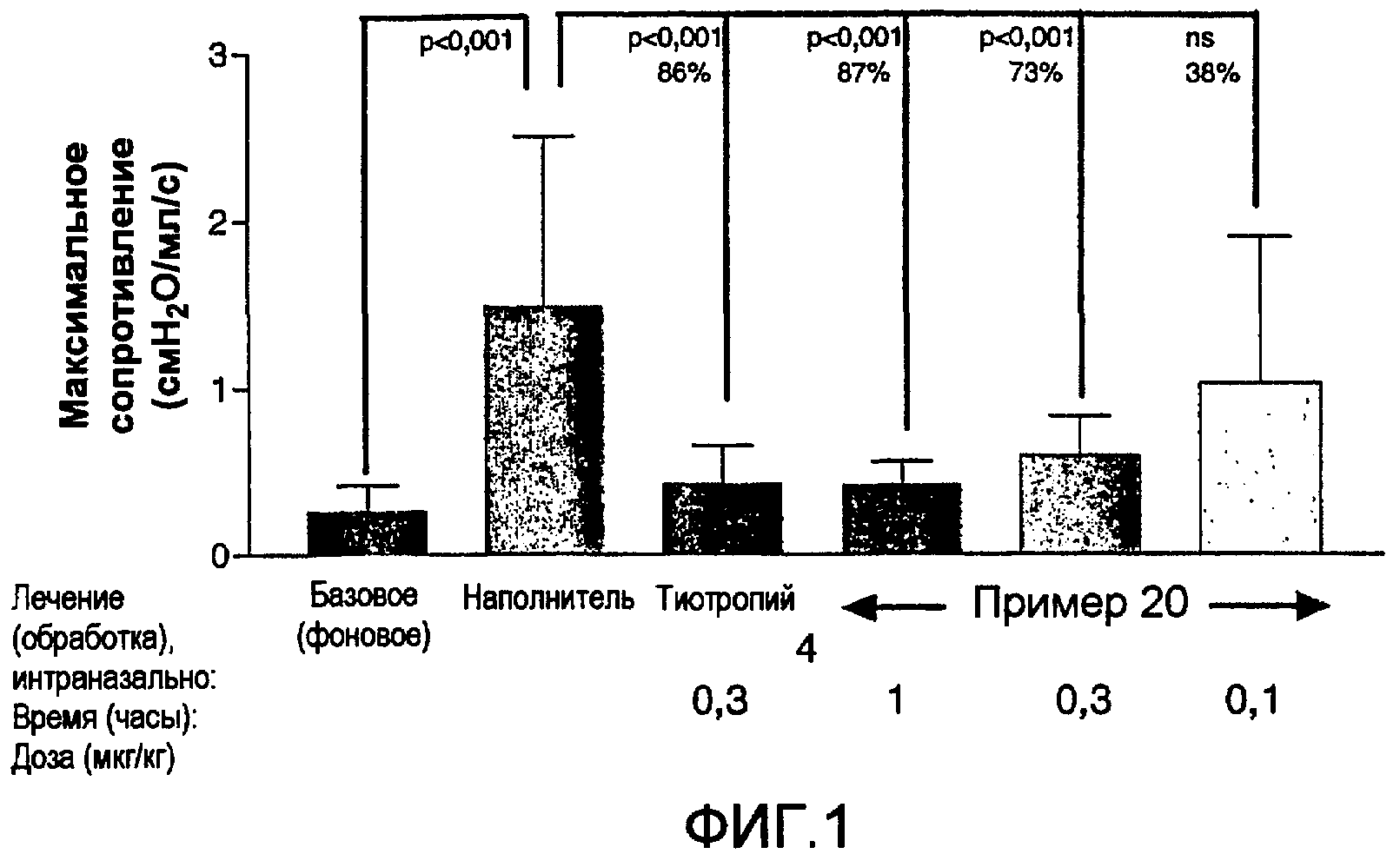
Чертежи
Описание
Область техники
Настоящее изобретение относится к производным бицикло[2.2.1]гепт-7-иламина, фармацевтическим композициям, их содержащим, способам их получения и применению для лечения заболеваний, опосредованных мускариновым рецептором М3, например, респираторных заболеваний.
Предшествующий уровень техники
Антихолинергические средства препятствуют прохождению или действиям, происходящим в результате прохождения, импульсов через парасимпатические нервы. Это является следствием способности указанных соединений тормозить действие ацетилхолина (Ach), блокируя его связывание с мускариновыми холинергическими рецепторами.
Существует пять подтипов мускариновых рецепторов ацетилхолина (mAChR), называемых M1-M5, и каждый (из них) является продуктом отдельного гена и каждый демонстрирует уникальные фармакологические свойства. mAChR широко распространены в органах позвоночных животных, и эти рецепторы могут опосредовать как тормозящие, так и возбуждающие действия. Например, в гладкой мышце, обнаруженной в дыхательных путях, мочевом пузыре и желудочно-кишечном тракте, mAChR М3 опосредуют сократительные реакции (рассматриваемые в Caulfield, 1993, Pharmac. Ther., 58, 319-379).
В легких мускариновые рецепторы M1, M2 и M3, как было показано, имеют (большое) значение и локализуются в трахее, бронхах, подслизистых (субмукоидных) железах и парасимпатических ганглиях (нервных узлах) (см. обзор Fryer и Jacoby, 1998, Am J Resp Crit Care Med., 158 (5 часть 3) стр.154-160). Рецепторы M3 на гладкой мускулатуре дыхательных путей опосредуют сокращение и, следовательно, бронхоспазм. Стимуляция рецепторов М3, локализованных в подслизистых железах, приводит к секреции слизи.
Повышенная передача сигнала через мускариновые рецепторы ацетилхолина отмечалась в целом ряде различных патофизиологических состояний, включая астму и COPD. При COPD тонус блуждающего нерва может либо повышаться (Gross et al. 1989, Chest; 96:984-987) и/или может провоцировать более высокую степень обструкции, по причине искаженной геометрии, при наложении поверх отечных или заполненных слизью стенок дыхательных путей (Gross et al. 1984, Am Rev Respir Dis; 129:856-870). Кроме того, воспалительные состояния могут привести к потере ингибирующей активности рецептора M2, что приводит к повышенным уровням высвобождения ацетилхолина после стимуляции блуждающего нерва (Fryer et al, 1999, Life Sci., 64, (6-7) 449-455). Полученная повышенная активация рецепторов M3 ведет к усилению обструкции дыхательных путей. Поэтому выявление сильнодействующих антагонистов мускариновых рецепторов может быть полезным для терапевтического лечения состояний заболевания, в которых задействована повышенная активность рецептора М3. В самом деле, современные стратегии лечения поддерживают регулярное использование бронходилятаторов антагониста М3 в качестве терапии первого выбора для пациентов с COPD (Pauwels et al. 2001, Am Rev Respir Crit Care Med; 163:1256-1276).
Неудерживание мочи вследствие гипертоничного [гиперрефлекторного] мочевого пузыря, как было показано, также опосредовано через повышенную стимуляцию mAChR М3. Поэтому антагонисты mAChR M3 могут быть полезными в качестве терапевтических средств для этих mAChR-опосредованных заболеваний.
Несмотря на массу данных, подтверждающих применение терапии, направленной против мускариновых рецепторов, для лечения состояний, связанных с заболеванием дыхательных путей, относительно небольшое число противомускариновых соединений находят применение в клинике больных с показаниями легочных заболеваний. Таким образом, остается потребность в новых соединениях, которые могли бы вызывать блокаду на мускариновых рецепторах М3, в особенности, в соединениях подобного типа с длительной продолжительностью действия, что делает возможным реализовать схему приема лекарственного средства один раз в сутки. Поскольку мускариновые рецепторы широко распространены по всему телу, возможность доставки антихолинергических средств непосредственно в дыхательные пути имеет преимущество, поскольку позволяет вводить более низкие дозы лекарственного средства. Конструкция и применение локально действующих активных лекарственных средств с длительной продолжительностью действия (пролонгированного действия) и которые способны удерживаться на рецепторах или в легком могли бы позволить снизить проявление нежелательных побочных действий, которые могут иметь место при системном введении тех же самых лекарственных средств.
Тиотропий (Spiriva™) представляет собой мускариновый антагонист длительного действия, в настоящее время поставляемый на рынок сбыта, для лечения хронической обструктивной болезни легких, предназначенный для введения ингаляционным путем.

Кроме того, ипратропий представляет собой мускариновый антагонист, имеющийся на рынке сбыта, для лечения COPD.

Имеются сообщения и о других модуляторах мускариновых рецепторов. Например, патент США 4353922 описывает мускариновые модуляторы на основе циклических систем [2.2.1]азабициклогептана. Европейский патент 418716 и US 005610163 описывают различные циклические системы на основе [3.2.1]азабициклооктана. В международной публикации WO 06/017768 описывают циклические системы [3.3.1]азабициклононана. Системы [2.2.2]азабициклооктана (хинуклидины) были ранее описаны, например, в US 2005/0209272 и международной публикации WO 06/048225. Системы [3.1.0]азабииклогексана были описаны, например, в международной публикации WO 06/035282. Системы [3.2.1]азабицилооктана были описаны, например, в международной публикации WO 06/035303.
Класс агонистов адренергических рецепторов β2 общеизвестен. Многие известные β2-агонисты, в частности, β2-агонисты длительного действия, такие как сальметерол и формотерол, играют (определенную) роль в лечении астмы и COPD. Кроме того, эти соединения обычно вводят ингаляционным путем. Соединения, в настоящее время оцениваемые как агонисты β2 суточного действия (вводимые один раз в день), описаны в Expert Opin. Investig. Drugs 14 (7), 775-783 (2005). Общеизвестный β2-агонист, фармакофор, имеет часть:

В данной области техники также известны фармацевтические композиции, которые содержат как мускариновый антагонист, так и β2-агонист, используемые для лечения респираторных заболеваний. Например, в US 2005/0025718 описан β2-агонист в комбинации с тиотропием, оксотропием, ипратропием и другими мускариновыми антагонистами; в международной публикации WO 02/060532 описана комбинация ипратропия с β2-агонистами, и в международной публикации WO 02/060533 описана комбинация оксотропия с β2-агонистами. Другие комбинации антагонист М3/β2-агонист описаны в международных публиациях WO 04/105759 и WO 03/087097.
В данной области техники известны также соединения, обладающие активностью как антагониста мускаринового рецептора, так и β2-агониста, представленной в одной и той же молекуле. Такие бифункциональные молекулы обеспечивают бронходилатацию, действуя двумя отдельными способами, при проявлении фармакокинетики, свойственной одной молекуле. Такую молекулу значительно легче ввести в состав лекарственного средства, предназначенного для терапевтического использования, по сравнению со случаем введения двух отдельных соединений, и ее существенно легче объединить в составе композиции, содержащей третий активный компонент, например, стероид. Такие молекулы описаны, например, в международных публикациях WO 04/074246, WO 04/089892, WO 05/111004, WO 06/023457 и WO 06/023460, в каждой из которых используют различный радикал-линкер для ковалентного связывания антагониста М3 с β2-агонистом, что указывает на то, что структура радикала-линкера не является решающей для сохранения проявления обеих активностей. Это не является неожиданностью, поскольку нет необходимости в том, чтобы молекула взаимодействовала с рецепторами М3 и β2 одновременно.
Краткое изложение сущности изобретения
В соответствии с изобретением предлагается соединение формулы (I):

где
A представляет собой атом кислорода или группу -N(R12)-;
(i) R1 представляет собой С1-С6-алкил или атом водорода и R2 представляет собой атом водорода или группу -R5, или группу -Z-Y-R5, или группу -Z-NR9R10; или группу -Z-CO-NR9R10; или группу -Z-NR9-CO-R5; или группу -Z-CO2-R5; или группу -Z-CO2H; и R3 представляет собой одиночную пару или С1-С6-алкил, и в этом случае атом азота, к которому он присоединен, представляет собой четвертичный азот и несет положительный заряд; или
(ii) R1 и R3 вместе с азотом, к которому они присоединены, образуют гетероциклоалкильное кольцо, и R2 представляет собой атом водорода; или группу -R5, или группу -Z-Y-R5, или группу -Z-NR9R10, или группу -Z-CO-NR9R10, или группу -Z-NR9-CO-R5, или группу -Z-CO2-R5, или группу -Z-CO2H; и в этих случаях атом азота, к которому он присоединен, представляет собой четвертичный азот и несет положительный заряд; или
(iii) R1 и R2 вместе с азотом, к которому они присоединены, образуют гетероциклоалкильное кольцо, при этом указанное кольцо замещено группой -Y-R5, или группой -Z-Y-R5, или группой -Z-NR9R10; или группой -Z-CO-NR9R10; или группой -Z-NR9-CO-R5; или группой -Z-CO2-R5; или группой -Z-CO2H; и R3 представляет собой одиночную пару или С1-С6-алкил, и в этом случае атом азота, к которому он присоединен, представляет собой четвертичный азот и несет положительный заряд;
R4 выбран из одной из групп формулы (а), (b), (с) или (d):

Z представляет собой С1-С16-алкиленовую, С2-С16-алкениленовую или С2-С16-алкиниленовую группу;
Y представляет собой связь или атом кислорода;
R5 представляет собой С1-С6-алкил, арил, арил, конденсированный с циклоалкилом, арил, конденсированный с гетероциклоалкилом, гетероарил, арил(С1-С8-алкил)-, гетероарил(С1-С8-алкил)-, циклоалкильную или гетероциклоалкильную группу;
R6 представляет собой С1-С6-алкил или атом водорода;
R7a и R7b представляют собой С1-С6-алкильную группу или галоген;
n и m равны независимо 0, 1, 2 или 3;
R8a и R8b независимо выбраны из группы, состоящей из арила, арила, конденсированного с гетероциклоалкилом, гетероарила, С1-С6-алкила, циклоалкила;
R8c представляет собой -ОН, С1-С6-алкил, гидрокси-С1-С6-алкил, нитрил, группу CONR8d2 или атом водорода;
R8d представляет собой С1-С6-алкил или атом водорода;
R9 и R10 представляют собой независимо атом водорода, С1-С6-алкил, арил, арил, конденсированный с гетероциклоалкилом, арил, конденсированный с циклоалкилом, гетероарил, арил(С1-С6-алкил)- или гетероарил(С1-С6-алкил)-группу; или R9 и R10 вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо из 4-8 атомов, необязательно содержащее дополнительный атом азота или кислорода;
R12 представляют собой С1-С6-алкил или атом водорода;
Ar1 представляет собой арил, гетероарил или циклоалкил;
Ar2 представляет собой независимо арил, гетероарил или циклоалкил; и
Q представляет собой атом кислорода, -СН2-, -СН2СН2- или связь;
или его фармацевтически приемлемая соль, сольват, N-оксид или пролекарство.
В одной подгруппе соединений по настоящему изобретению
A представляет собой атом кислорода или группу -N(R12)-;
R1 представляет собой C1-C6-алкил или атом водорода и R2 представляет собой C1-C6-алкил, атом водорода или группу -Z-Y-R5, или группу -Z-NR9R10; или R1 и R2 вместе с азотом, к которому они присоединены, образуют гетероциклоалкильное кольцо;
R3 представляет собой одиночную пару или C1-C6-алкил, и в этом случае атом азота, к которому он присоединен, представляет собой четвертичный азот и несет положительный заряд; или R1 и R3 вместе с азотом, к которому они присоединены, образуют гетероциклоалкильное кольцо и R2 представляет собой C1-C6-алкил, и в этом случае атом азота является кватернизованным и несет положительный заряд;
R4 выбран из одной из групп формулы (a) и (b):

Z представляет собой C1-C8-алкиленовую, C2-C8-алкениленовую или C2-C8-алкиниленовую группу;
Y представляет собой связь или атом кислорода;
R5 представляет собой арил, гетероарил, арил(C1-C8-алкил)- или гетероарил(C1-C8-алкил)-группу;
R6 представляет собой C1-C6-алкил или атом водорода;
R7a и R7b представляют собой независимо C1-C6-алкильную группу или галоген;
n и m равны независимо 0, 1, 2 или 3;
R8a и R8b независимо выбраны из группы, состоящей из арила, гетероарила, C1-C6-алкила, циклоалкила;
R8c представляет собой -OH, C1-C6-алкил, гидрокси-C1-C6-алкил или атом водорода;
R9 и R10 представляют собой независимо атом водорода, C1-C6-алкил, арил, гетероарил, арил(C1-C6-алкил)- или гетероарил(C1-C6-алкил)-группу; или R9 и R10 вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо из 4-8 атомов, необязательно содержащее дополнительный атом азота или кислорода; и
R12 представляет собой C1-C6-алкил или атом водорода.
Соединения по настоящему изобретению существуют либо в син-, либо в анти-формах;

Соединения по настоящему изобретению также существуют в отношении группы -AR4, либо в экзо-, либо в эндо-ориентации;

В настоящее время предпочтительно, чтобы соединения по настоящему изобретению находились преимущественно в анти-эндо-конфигурации.

Соединения по настоящему изобретению могут также существовать в виде оптических изомеров, так как замещенные бициклические структуры не могут иметь плоскость симметрии. Абсолютная конфигурация молекулы может быть определена в соответствии с правилами Канна-Ингольда-Прелога, присваивая обозначение (дескриптор) R или S каждому положению. Чтобы избежать путаницы, в настоящем описании используют нижеследующую нумерацию в циклической структуре.

Однако соединения по настоящему изобретению включают рацематы, отдельные энантиомеры и смеси энантиомеров в любом соотношении, поскольку все вышеуказанные формы обладают активностью, модулирующей мускариновый рецептор М3 в той или иной степени.
Предпочтительный класс соединений по настоящему изобретению состоит из солей четвертичного аммония формулы (I), где азот, показанный в формуле (I), представляет собой четвертичный азот, несущий положительный заряд.
Соединения по настоящему изобретению могут быть использованы для лечения или профилактики заболеваний, в патологию которых вовлечена активация мускариновых рецепторов, например, предлагаемые соединения используют для лечения ряда симптомов, включая, но не ограничиваясь ими, расстройства дыхательных путей, такие как хроническая обструктивная болезнь легких, хронический бронхит всех типов (включая одышку, связанную с ним), астма (аллергическая и неаллергическая; синдром стридорозного (свистящего) дыхания у ребенка), острый респираторный дистресс-синдром взрослых (ARDS), хроническая обструкция дыхательных путей, бронхиальная гиперактивность, пневмосклероз, эмфизема легких и аллергический ринит, обострение повышенной реактивности дыхательных путей вследствие лечения другими лекарственными средствами, в частности, ингаляционной терапии другими лекарственными средствами, пневмокониоз (например, алюминоз, антракоз, асбестоз, халикоз, птилоз, сидероз, силикоз, табакоз, биссиноз);
расстройства желудочно-кишечного тракта, такие как синдром раздраженной толстой кишки, гастродуоденальные язвы, желудочно-кишечные спазмы или гиперкинезия, дивертикулит; боль, сопровождающая спазмы гладкой мускулатуры желудочно-кишечного тракта; нарушения мочевыводящих путей, сопровождающие расстройства мочеиспускания, включая нейрогенную поллакиурию, нейрогенный мочевой пузырь, ночное недержание мочи, психосоматический мочевой пузырь, неудерживание мочи, связанное со спазмами мочевого пузыря или хроническим циститом, сильная потребность в мочеиспускании или поллакиурии; укачивание (болезнь движения); и
расстройства сердечно-сосудистой системы, такие как вагально (вагусно) индуцированная синусовая брадикардия.
Для лечения респираторных состояний введение ингаляцией зачастую является предпочтительным, и в таких случаях часто предпочтительно введение соединений (I), которые представляют собой соли четвертичного аммония. Во многих случаях продолжительность действия солей четвертичного аммония по настоящему изобретению, вводимых ингаляционным путем, может составлять больше 12 или больше 24 часов для типичной дозы. Для лечения расстройств желудочно-кишечного тракта и расстройств сердечно-сосудистой системы может быть предпочтительно введение парентеральным путем, как правило, пероральным путем.
Другой аспект настоящего изобретения представляет собой фармацевтическую композицию, содержащую соединение по настоящему изобретению и фармацевтически приемлемый носитель или наполнитель.
Другой аспект настоящего изобретения заключается в применении соединения по настоящему изобретению для получения лекарственного средства для лечения или профилактики заболевания или состояния, в патологию которого вовлечена активность мускаринового рецептора М3.
Терминология
Нижеследующие термины имеют указанные ниже значения, если в контексте, в котором их используют в описании, они не определены иначе.
“Ацил” означает -СО-алкильную группу, в которой алкильная группа такая, как указано в описании. Типичные ацильные группы включают -СОСН3 и -СОСН(СН3)2.
“Ациламино” означает -NR-ацильную группу, в которой R и ацил являются такими, как определено в описании. Типичные ациламиногруппы включают -NHCOCH3 и -N(CH3)COCH3.
“Алкокси” и “алкилокси” означают -О-алкильную группу, в которой алкил такой, как определен ниже. Типичные алкоксигруппы включают метокси (-ОСН3) и этокси (-ОС2Н5).
“Алкоксикарбонил” означает -СОО-алкильную группу, в которой алкил такой, как определен ниже. Типичные алкоксикарбонильные группы включают метоксикарбонил и этоксикарбонил.
“Алкил” в качестве группы или части группы относится к насыщенной углеводородной группе с прямой или разветвленной цепью, содержащей в цепи от 1 до 12, предпочтительно от 1 до 6 углеродных атомов. Типичные алкильные группы включают метил, этил, 1-пропил и 2-пропил.
“Алкенил” в качестве группы или части группы относится к углеводородной группе с прямой или разветвленной цепью, содержащей в цепи от 2 до 12, предпочтительно от 2 до 6 углеродных атомов и одну углерод-углеродную двойную связь. Типичные алкенильные группы включают этенил, 1-пропенил и 2-пропенил.
“Алкинил” в качестве группы или части группы относится к углеводородной группе с прямой или разветвленной цепью, содержащей в цепи от 2 до 12, предпочтительно от 2 до 6, углеродных атомов и одну углерод-углеродную тройную связь. Типичные алкинильные группы включают этинил, 1-пропинил и 2-пропинил.
“Алкиламино” означает -NH-алкильную группу, в которой алкил такой, как определен выше. Типичные алкиламиногруппы включают метиламино и этиламино.
“Алкилен” означает -алкилгруппу, в которой алкил такой, как определен ранее. Типичные алкиленовые группы включают -СН2-, -(СН2)2- и -С(СН3)НСН2-.
“Алкенилен” означает алкенилгруппу, в которой алкенил такой, как определен выше. Типичные алкениленовые группы включают -СН=СН-, -СН=СНСН2-
и -СН2СН=СН-.
“Алкинилен” означает алкинилгруппу, в которой алкинил такой, как определен ранее. Типичные алкиниленовые группы включают -СС-, -СССН2- и -СН2СС-.
“Алкилсульфинил” означает -SO-алкильную группу, в которой алкил такой, как определен выше. Типичные алкилсульфинильные группы включают метилсульфинил и этилсульфинил.
“Алкилсульфонил” означает -SO2-алкильную группу, в которой алкил такой, как определен выше. Типичные алкилсульфонильные группы включают метилсульфонил и этилсульфонил.
“Алкилтио” означает -S-алкильную группу, в которой алкил такой, как определен выше. Типичные алкилтиогруппы включают метилтио и этилтио.
“Аминоацил” означает -СО-NRR группу, в которой R такой, как указано в описании. Типичные аминоацильные группы включают -CONH2 и -CONHCH3.
“Аминоалкил” означает алкил-NH2 группу, в которой алкил такой, как описан ранее. Типичные аминоалкильные группы включают -CH2NH2.
“Аминосульфонил” означает -SO2-NRR группу, в которой R такой, как указано в описании. Типичные аминосульфонильные группы включают -SO2NH2 и -SO2NHCH3.
“Арил” в качестве группы или части группы означает необязательно замещенную моноциклическую или полициклическую ароматическую карбоциклическую часть, содержащую от 6 до 14 атомов углерода, предпочтительно от 6 до 10 атомов углерода, такую как фенил или нафтил. Арильная группа может быть замещена одной или несколькими группами-заместителями.
“Арилалкил” означает арилалкилгруппу, в которой арильные и алкильные части являются такими, как описаны ранее. Предпочтительные арилалкильные группы содержат С1-4-алкильную часть. Типичные арилалкильные группы включают бензил, фенэтил и нафталинметил. Их арильная часть может быть замещена одной или несколькими группами-заместителями.
“Арилалкилокси” означает арилалкилоксигруппу, в которой арильные и алкилокси части такие, как описаны ранее. Предпочтительные арилалкилоксигруппы содержат С1-4 алкильную часть. Типичные арилалкильные группы включают бензилокси. Их арильная часть может быть замещена одной или несколькими группами-заместителями.
“Арил, конденсированный с циклоалкилом” означает моноциклическое арильное кольцо, такое как фенил, конденсированное с циклоалкильной группой, и эти арил и циклоалкил имеют такие значения, как указано в описании. Типичные 'арил, конденсированный с циклоалкилом' группы включают тетрагидронафтил и инданил. Арильные и циклоалкильные кольца могут быть, каждое, замещенными одной или несколькими группами-заместителями. 'Арил, конденсированный с циклоалкилом' группа может быть присоединена к остатку соединения при помощи любого доступного атома углерода.
“Арил, конденсированный с гетероциклоалкилом” означает моноциклическое арильное кольцо, такое как фенил, конденсированное с гетероциклоалкильной группой, и эти арил и гетероциклоалкил имеют такие значения, как указано в описании. Типичные 'арил, конденсированный с гетероциклоалкилом' группы включают тетрагидрохинолинил, индолинил, бензодиоксинил, бензодиоксолил, дигидробензофуранил и изоиндолонил. Арильные и гетероциклоалкильные кольца могут быть, каждое, замещены одной или несколькими группами-заместителями. 'Арил, конденсированный с гетероциклоалкилом' группа может быть присоединена к остатку соединения при помощи любого доступного атома углерода или азота.
“Арилокси” означает -О-арильную группу, в которой арил такой, как описан выше. Типичные арилоксигруппы включают фенокси. Их арильная часть может быть замещена одной или несколькими группами-заместителями.
“Циклический амин” представляет собой особый случай “гетероциклоалкила” или “гетероцикла” и означает необязательно замещенную (3-8)-членную моноциклическую циклоалкильную структуру, где один из кольцевых атомов углерода замещен азотом и которая может необязательно содержать дополнительный гетероатом, выбранный из O, S или NR (где R такой, как указано в описании). Типичные циклические амины включают пирролидин, пиперидин, морфолин, пиперазин и N-метилпиперазин. Циклическая аминная группа может быть замещена одной или несколькими группами-заместителями.
“Циклоалкил” означает необязательно замещенную насыщенную моноциклическую или бициклическую структуру, содержащую от 3 до 12 атомов углерода, предпочтительно от 3 до 8 атомов углерода и более предпочтительно от 3 до 6 атомов углерода. Типичные моноциклические циклоалкильные структуры включают циклопропил, циклопентил, циклогексил и циклогептил. Циклоалкильная группа может быть замещена одной или несколькими группами-заместителями.
“Циклоалкилалкил” означает циклоалкилалкилгруппу, в которой циклоалкильные и алкильные части являются такими, как описаны ранее. Типичные моноциклические циклоалкилалкильные группы включают циклопропилметил, циклопентилметил, циклогексилметил и циклогептилметил. Их циклоалкильная часть может быть замещена одной или несколькими группами-заместителями.
“Диалкиламино” означает -N(алкил)2 группу, в которой алкил такой, как определен выше. Типичные диалкиламиногруппы включают диметиламино и диэтиламино.
“Гало” или “галоген” означает фтор, хлор, бром или йод. Предпочтительными являются фтор или хлор.
“Галогеналкокси” означает -О-алкильную группу, в которой алкил замещен одним или несколькими атомами галогена. Типичные галогеналкоксигруппы включают трифторметокси и дифторметокси.
“Галогеналкил” означает алкильную группу, которая замещена одним или несколькими атомами галогена. Типичные галогеналкильные группы включают трифторметил.
“Гетероарил” в качестве группы или части группы означает необязательно замещенную ароматическую моноциклическую или полициклическую органическую часть, содержащую от 5 до 14 атомов в циклической структуре, предпочтительно от 5 до 10 атомов в циклической структуре, в которой один или несколько из циклических атомов является(ются) другим(ими), чем углерод, например, атомом азота, кислорода или серы. Примеры таких групп включают бензимидазолил, бензоксазолил, бензотиазолил, бензофуранил, бензотиенил, фурил, имидазолил, индолил, индолизинил, изоксазолил, изохинолинил, изотиазолил, оксазолил, оксадиазолил, пиразинил, пиридазинил, пиразолил, пиридил, пиримидинил, пирролил, хиназолинил, хинолинил, тетразолил, 1,3,4-тиадиазолил, тиазолил, тиенильные и тиазолильные группы. Гетероарильная группа может быть замещена одной или несколькими группами-заместителями. Гетероарильная группа может быть присоединена к остатку соединения по настоящему изобретению посредством любого доступного атома углерода или азота.
“Гетероарилалкил” означает гетероарилалкилгруппу, в которой гетероарильные и алкильные части такие, как описано ранее. Предпочтительные гетероарилалкильные группы содержат низшую алкильную часть. Типичные гетероарилалкильные группы включают пиридилметил. Их гетероарильная часть может быть замещена одной или несколькими группами-заместителями.
“Гетероарилалкилокси” означает гетероарилалкилоксигруппу, в которой гетероарильные и алкилокси части такие, как описано ранее. Предпочтительные гетероарилалкилоксигруппы содержат низшую алкильную часть. Типичные гетероарилалкилоксигруппы включают пиридилметилокси. Их гетероарильная часть может быть замещена одной или несколькими группами-заместителями.
“Гетероарилокси” означает гетероарилоксигруппу, в которой гетероарил такой, как описано ранее. Типичные гетероарилоксигруппы включают пиридилокси. Их гетероарильная часть может быть замещена одной или несколькими группами-заместителями.
“Гетероарил, конденсированный с циклоалкилом” означает моноциклическую гетероарильную группу, такую как пиридил или фуранил, конденсированную с циклоалкильной группой, и эти гетероарил и циклоалкил имеют такие значения, как описано ранее. Типичные 'гетероарил, конденсированный с циклоалкилом' группы включают тетрагидрохинолинил и тетрагидробензофуранил. Гетероарильные и циклоалкильные кольца могут быть, каждое, замещены одной или несколькими группами-заместителями. 'Гетероарил, конденсированный с циклоалкилом' группа может быть присоединена к остатку соединения при помощи любого доступного атома углерода или азота.
“Гетероарил, конденсированный с гетероциклоалкилом” означает моноциклическую гетероарильную группу, такую как пиридил или фуранил, конденсированный с гетероциклоалкильной группой, и эти гетероарил и гетероциклоалкил являются такими, как описаны ранее. Типичные 'гетероарил, конденсированный с гетероциклоалкилом' группы включают дигидродиоксинопиридинил, дигидропирролопиридинил, дигидрофуранопиридинил и диоксолопиридинил. Гетероарильные и гетероциклоалкильные кольца могут быть, каждое, замещены одной или несколькими группами-заместителями. 'Гетероарил, конденсированный с гетероциклоалкилом' группы могут быть присоединены к остатку соединения посредством любого доступного атома углерода или азота.
“Гетероциклоалкил” или “гетероциклик” означает: (i) необязательно замещенную циклоалкильную группу, содержащую от 4 до 8 членов в цикле, которая содержит один или несколько гетероатомов, выбранных из O, S или NR; (ii) циклоалкильную группу, содержащую от 4 до 8 членов в цикле, которая содержит CONR и CONRCO (примеры таких групп включают сукцинимидил и 2-оксопирролидинил). Гетероциклоалкильная группа может быть замещена одной или несколькими группами-заместителями. Гетероциклоалкильная группа может быть присоединена к остатку соединения при помощи любого доступного атома углерода или азота.
“Гетероциклоалкилалкил” или “гетероциклоалкил” означает гетероциклоалкилалкилгруппу, в которой гетероциклоалкильные и алкильные части являются такими, как описано ранее.
“Низший алкил” в качестве группы означает, если не оговорено иначе, алифатическую углеводородную группу, которая может быть прямой или разветвленной, содержащую в цепи от 1 до 4 атомов углерода, т.е. метил, этил, пропил (пропил или изопропил) или бутил (бутил, изобутил или трет-бутил).
“Сульфонил” означает -SO2-алкильную группу, в которой алкил такой, как указано в описании. Типичные сульфонильные группы включают метансульфонил.
“Сульфониламино” означает -NR-сульфонильную группу, в которой R и сульфонил такие, как указано в описании. Типичные сульфониламиногруппы включают
-NHSO2CH3. R означает алкил, арил или гетероарил, указанные в описании.
“Фармацевтически приемлемая соль” означает физиологически или токсикологически допустимую соль и включает, когда целесообразно, фармацевтически приемлемые основно-аддитивные соли, фармацевтически приемлемые кислотно-аддитивные соли и фармацевтически приемлемые соли четвертичного аммония. Например, (i), в тех случаях, когда соединение по настоящему изобретению содержит одну или несколько кислотных групп, например, карбоксигруппы, фармацевтически приемлемые основно-аддитивные соли, которые можно получить, включают соли натрия, калия, кальция, магния и аммония, или соли с органическими аминами, такими как диэтиламин, N-метил-глюкамин, диэтаноламин или аминокислоты (например, лизин) и т.п.; (ii) в тех случаях, когда соединение по настоящему изобретению содержит основную группу, такую как аминогруппа, фармацевтически приемлемые кислотно-аддитивные соли, которые можно получить, включают гидрохлориды, гидробромиды, сульфаты, фосфаты, ацетаты, цитраты, лактаты, тартраты, мезилаты, малеаты, фумараты, сукцинаты и т.п.; (iii) в тех случаях, когда соединение содержит группу четвертичного аммония, приемлемые противоионы могут представлять собой, например, хлориды, бромиды, сульфаты, метансульфонаты, бензолсульфонаты, толуолсульфонаты (тозилаты), фосфаты, ацетаты, цитраты, лактаты, тартраты, мезилаты, малеаты, фумараты, сукцинаты и т.п.
Следует иметь в виду, что когда в настоящем описании ссылаются на соединения по настоящему изобретению, то подразумевается, что они включают и фармацевтически приемлемые соли.
“Пролекарство” относится к соединению, которое способно к in vivo превращению метаболитическим путем (например, путем гидролиза, восстановления или окисления) в соединение по настоящему изобретению. Например, пролекарство в виде сложного эфира соединения по настоящему изобретению, содержащего гидроксигруппу, может превратиться в результате гидролиза in vivo в родительскую (исходную) молекулу. Подходящие сложные эфиры соединений по настоящему изобретению, содержащих гидроксигруппу, представляют собой, например, ацетаты, цитраты, лактаты, тартраты, малонаты, оксалаты, салицилаты, пропионаты, сукцинаты, фумараты, малеаты, метилен-бис-β-гидроксинафтоаты, гентизаты, изотионаты, ди-п-толуоилтартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, п-толуолсульфонаты, циклогексилсульфаматы и хинаты. В качестве другого примера, сложноэфирное пролекарство соединения по настоящему изобретению, содержащего карбоксигруппу, может превратиться в результате гидролиза in vivo в родительскую молекулу. Примеры сложноэфирных пролекарств описаны F.J. Leinweber, Drug Metab. Res., 1987, 18, 379.
Следует иметь в виду, что когда в настоящем описании ссылаются на соединения по настоящему изобретению, то подразумевается, что они включают и формы пролекарств.
Термин “насыщенный” относится к соединениям и/или группам, которые не имеют (никаких) углерод-углеродных двойных связей или углерод-углеродных тройных связей.
“Необязательно замещенный” означает необязательно замещенные, вплоть до четырех, заместителями. Необязательные группы-заместители включают ацил (например, -СОСН3), алкокси (например, -ОСН3), алкоксикарбонил (например, -СООСН3), алкиламино (например, -NHCH3), алкилсульфинил (например, -SOCH3), алкилсульфонил (например, -SO2CH3), алкилтио (например, -SCH3), -NH2, аминоацил (например, -CON(CH3)2), аминоалкил (например, -CH2NH2), арилалкил (например, -CH2Ph или -CH2-CH2-Ph), циано, диалкиламино (например, -N(CH3)2), галоген, галогеналкокси (например, -OCF3 или -OCHF2), галогеналкил (например, -CF3), алкил (например, -СН3 или -СН2СН3), -ОН, -NO2, арил (необязательно замещенный алкокси, галогеналкокси, галогеном, алкилом или галогеналкилом), гетероарил (необязательно замещенный алкокси, галогеналкокси, галогеном, алкилом или галогеналкилом), гетероциклоалкил, аминоацил (например, -CONH2, -CONHCH3), аминосульфонил (например, -SO2NH2, -SO2NHCH3), ациламино (например, -NHCOCH3), сульфониламино (например, -NHSO2CH3), гетероарилалкил, циклический амин (например, морфолин), арилокси, гетероарилокси, арилалкилокси (например, бензилокси) и гетероарилалкилокси.
Алкиленовые, алкениленовые или алкиниленовые радикалы могут быть необязательно замещенными. Необязательные группы-заместители в вышеупомянутых радикалах включают алкокси (например, -ОСН3), алкиламино (например, -NHCH3), алкилсульфинил (например, -SOCH3), алкилсульфонил (например, -SO2CH3), алкилтио (например, -SCH3), -NH2, аминоалкил (например, -CH2NH2), арилалкил (например, -CH2Ph или -CH2-CH2-Ph), циано, диалкиламино (например, -N(CH3)2), галоген, галогеналкокси (например, -OCF3 или -OCHF2), галогеналкил (например, -CF3-), алкил (например, -СН3 или -СН2СН3), -ОН и -NO2.
Соединения по настоящему изобретению могут существовать в одной или нескольких геометрических, оптических, энантиомерных, диастереомерных и таутомерных формах, включая, но ими не ограничиваясь, цис- и транс-формы, Е- и Z-формы, R-, S- и мезо-формы, кето- и енольные формы. Если не оговорено особо, ссылка на конкретное соединение включает все указанные изомерные формы, включая рацемические смеси и другие их смеси. При необходимости, указанные изомеры могут быть выделены из их смесей известными методами (разделения) или методами, адаптированными к ним (например, хроматографические методы и рекристаллизационные методы). Если это целесообразно, то такие изомеры можно получить известными способами или способами, адаптированными к ним (например, асимметричный синтез).
Группы R1, R2 и R3
Существует три комбинации групп R1, R2 и R3.
В комбинации (i) R1 представляет собой С1-С6-алкил или атом водорода; и R2 представляет собой атом водорода или группу -R5, или группу -Z-Y-R5, или группу -Z-NR9R10, или группу -Z-CO-NR9R10, или группу -Z-NR9-CO-R5, или группу -Z-CO2-R5, или группу -Z-CO2H; и R3 представляет собой одиночную пару или С1-С6алкил, и в этом случае атом азота, к которому он присоедин, представляет собой четвертичный азот и несет положительный заряд.
В комбинации (ii) R1 и R3 вместе с азотом, к которому они присоединены, образуют гетероциклоалкильное кольцо, и R2 представляет собой атом водорода; или группу -R5, или группу -Z-Y-R5, или группу -Z-NR9R10, или группу -Z-CO-NR9R10, или группу -Z-NR9-CO-R5, или группу -Z-CO2-R5, или группу -Z-CO2H, и в этих случаях атом азота, к которому он присоединен, представляет собой четвертичный азот и несет положительный заряд. В частности, R1 и R3 вместе с азотом, к которому они присоединены, могут образовать моноциклическое кольцо, содержащее от 3 до 7 кольцевых атомов, в котором гетероатомы представляют собой атомы азота. Примеры таких колец включают азетидинил, пиперидинил, пиперазинил, N-замещенный пиперазинил, такой как метилпиперазинильные и пирролидинильные кольца.
В комбинации (iii) R1 и R2 вместе с азотом, к которому они присоединены, образуют гетероциклоалкильное кольцо, при этом указанное кольцо замещено группой -Y-R5, или группой -Z-Y-R5, или группой -Z-NR9R10 или группой -Z-CO-NR9R10, или группой -Z-NR9-CO-R5, или группой -Z-CO2-R5, или группой -Z-CO2H, и R3 представляет собой одиночную пару или С1-С6-алкил, и в этом случае атом азота, к которому он присоединен, представляет собой четвертичный азот и несет положительный заряд. В частности, R1 и R2 вместе с азотом, к которому они присоединены, могут образовать моноциклическое кольцо, содержащее от 3 до 7 атомов в кольце, в котором гетероатомы являются атомами азота. Примеры таких колец включают азетидинил, пиперидинил, пиперазинил, N-замещенный пиперазинил, такой как метилпиперазинильное и пирролидинильное кольца.
В тех случаях, когда группа -R5, или группа -Z-Y-R5, или группа -Z-NR9R10, или группа -Z-CO-NR9R10, или группа -Z-NR9-CO-R5, или группа -Z-CO2-R5, или группа -Z-CO2H присутствует в R2, или когда кольцо образовано R1, R2 и азотом, к которому они присоединены:
Z может представлять собой, например, -(СН2)1-16-, при этом последний необязательно замещен метилом на вплоть до трех углеродах в цепи;
Y представляет собой связь или -О-;
R5 может представлять собой
С1-С6-алкил, такой как метил, этил, н- или изопропил, н-, втор- или трет-бутил;
необязательно замещенный арил, такой как фенил или нафтил, или арил, конденсированный с гетероциклоалкилом, такой как 3,4-метилендиоксифенил, 3,4-этилендиоксифенил или дигидробензофуранил;
необязательно замещенный гетероарил, такой как пиридил, пирролил, пиримидинил, оксазолил, изоксазолил, бензизоксазолил, бензоксазолил, тиазолил, бензотиазолил, хинолил, тиенил, бензотиенил, фурил, бензофурил, имидазолил, бензимидазолил, изотиазолил, бензизотиазолил, пиразолил, изотиазолил, триазолил, бензотриазолил, тиадиазолил, оксадиазолил, пиридазинил, триазинил, индолил и индазолил;
необязательно замещенный арил(С1-С6-алкил)-, такой как арил(С1-С6-алкилы)-, где арильная часть представляет собой любую из ранее конкретно упомянутых арильных групп и часть -(С1-С6-алкил)- представляет собой -СН2- или -СН2СН2-;
необязательно замещенный арил, конденсированный с циклоалкилом, такой как инданил или 1,2,3,4-тетрагидронафталенил;
необязательно замещенный гетероарил(С1-С8-алкил)-, как, например, гетероарил(С1-С8-алкилы)-, в которых гетероарильная часть представляет собой любую из ранее конкретно упомянутых гетероарильных групп и часть -(С1-С6-алкил)- представляет собой -СН2- или -СН2СН2-;
необязательно замещенный циклоалкил, такой как циклопропил, циклобутил, циклопентил или циклогексил; или
необязательно замещенный гетероциклоалкил(С1-С8-алкил)-, как, например, гетероциклоалкил(С1-С8-алкилы)-, в которых гетероциклоалкильная часть представляет собой азетидинил, пиперидинил, пиперазинил, N-замещенный пиперазинил, такой как метилпиперазинил, или пирролидинил и часть -(С1-С6-алкил)- представляет собой -СН2- или -СН2СН2-.
R9 и R10 могут быть независимо выбраны из водорода; С1-С6-алкила, такого как метил, этил, или н- или изопропил; или любой из групп, конкретно указанных при обсуждении вышеупомянутого R5, замещенного арила, арила, конденсированного с гетероциклоалкилом, арила, конденсированного с циклоалкилом, гетероарила или арил(С1-С8-алкил)-; или
R9 и R10 вместе с атомом азота, к которому они присоединены, могут образовывать гетероциклическое кольцо из 4-8 кольцевых атомов, предпочтительно 4-6 кольцевых атомов, необязательно содержащее дополнительный атом азота или кислорода, такое как азетидинил, пиперидинил, пиперазинил, N-замещенный пиперазинил, такой как метилпиперазинил, пирролидинил, морфолинил и тиоморфолинил.
Предпочтительными (в настоящее время) являются соединения по настоящему изобретению, в которых в группе -NR1R2R3 R1 представляет собой метил или этил, R2 представляет собой группу -Z-Y-R5, обсужденную выше, в особенности, в которой R5 представляет собой циклическую липофильную группу, такую как фенил, бензил или фенилэтил, Y представляет собой связь или -О- и -Z- представляет собой прямой или разветвленный алкиленовый радикал, соединяющий азот и -YR5 цепью, содержащей вплоть до 12, например, вплоть до 9, углеродных атомов, и R3 представляет собой метил, так что азот является кватернизованным и несет положительный заряд.
Радикал А
А представляет собой атом кислорода или группу -N(R12)-, где R12 представляет собой С1-С6-алкил (такой как метил или этил) или R12 представляет собой атом водорода. В настоящее время предпочтителен случай, когда А представляет собой -О-.
Группа R4
R4 выбран из одной из групп формулы (а), (b), (c) или (d):

В группе (а) R6 может представлять собой С1-С6-алкил, такой как метил или этил, или атом водорода; Ar1 может представлять собой арильную группу, такую как фенильную, гетероарильную группу, такую как тиенил, в особенности, 2-тиенил, или циклоалкильную группу, такую как циклогексил, циклопентил, циклопропил или циклобутил; заместители кольца R7a и R7b могут представлять собой, независимо, С1-С6-алкильную группу, такую как метил, этил, н- или изопропил, н-, втор- или трет-бутил, или галоген, такой как фтор, хлор или бром; и m и n могут быть равны независимо 0, 1, 2 или 3.
В группах (b) и (d) R8a и R8b могут быть независимо выбраны из любой из групп арила, арила, конденсированного с гетероциклоалкилом, арил, конденсированный с циклоалкилом, гетероарилом, С1-С6-алкила или циклоалкила, конкретно упоминаемых при обсуждении вышеуказанного R5. R8c может представлять собой -ОН, атом водорода, С1-С6-алкил, такой как метил или этил, гидрокси-С1-С6-алкил, такой как гидроксиметил, нитрил или группу CONR8d2, где каждый R8d представляет собой независимо С1-С6-алкил, такой как метил или этил, или атом водорода. В настоящее время предпочтителен случай, когда R8c представляет собой -ОН. Предпочтительные комбинации R8a и R8b, в особенности, когда R8c представляет собой -ОН, включают комбинации, где (i) каждый из R8a и R8b представляет собой необязательно замещенный моноциклический гетероарил с 5 или 6 кольцевыми атомами, такой как пиридил, оксазолил, тиазолил, фурил и, в особенности, тиенил, такой как 2-тиенил; (ii) необязательно замещенный фенил; (iii) один из R8a и R8b представляет собой необязательно замещенный фенил и другой представляет собой циклоалкил, такой как циклопропил, циклобутил или, в особенности, циклопентил или циклогексил; и (iv) один из R8a и R8b представляет собой необязательно замещенный моноциклический гетероарил с 5 или 6 кольцевыми атомами, такой как пиридил, тиенил, оксазолил, тиазолил или фурил; и другой представляет собой циклоалкил, такой как циклопропил, циклобутил, циклопентил или циклогексил.
В группе (с) R8c может представлять собой -ОН, атом водорода, С1-С6-алкил, такой как метил или этил, гидрокси-С1-С6- алкил, такой как гидроксиметил, нитрил или группу CONR8d2, где каждый R8d представляет собой независимо С1-С6-алкил, такой как метил или этил, или атом водорода. В настоящее время предпочтителен случай, когда R8c представляет собой -ОН. Каждый Ar2 представляет собой арильное, гетероарильное или циклоалкильное кольцо и может представлять собой, например, любую из групп (колец), конкретно упоминаемых при обсуждении вышеупомянутого R5, арила, гетероарила, С1-С6-алкила или циклоалкила. Предпочтительные кольца Ar2 включают фенил. Мостиковая связь -Q между двумя кольцами Ar2 представляет собой -О-, -СН2- или -СН2СН2-.
Из вариантов R4 (a), (b), (c) и (d) (в настоящее время) предпочтительно, чтобы R4 представлял собой группу (b) или (c).
Предпочтительный подкласс соединений, который имеет отношение к настоящему изобретению, состоит из соединений формулы (IA)

где кольцо А представляет собой необязательно замещенное фенильное кольцо или моноциклическое гетероциклическое кольцо из 5 или 6 кольцевых атомов, или фенильное кольцо, конденсированное с гетероциклоалкилом, в которой гетероциклоалкильное кольцо представляет собой моноциклическое гетероциклическое кольцо из 5 или 6 кольцевых атомов; R8a представляет собой фенил, тиенил, циклопентил или циклогексил; R8b представляет собой фенил; тиенил, циклопентил или циклогексил; s равно 1, 2, 3, 4, 5, 6 или 7 и t равно 0, 1, 2, 3, 4, 5, 6 или 7 при условии, что s+t не больше 10; Y представляет собой связь или -О-, и X- представляет собой фармацевтически приемлемый анион. В соединениях (IA) (в настоящее время) предпочтительно, когда кольцо А представляет собой (i) необязательно замещенный фенил, в котором необязательные заместители выбраны из алкокси, галогена, в особенности, фтора или хлора, С1-С6-алкила, амино-С1-С3-ацила, амино-С1-С3-алкила и аминосульфонила, или (ii) фенильное кольцо, конденсированное с гетероциклоалкилом, где гетероциклоалкильное кольцо представляет собой моноциклическое гетероциклическое кольцо из 5 или 6 кольцевых атомов, такую как дигидробензофуранил.
Другой предпочтительный подкласс соединений, который имеет отношение к настоящему изобретению, состоит из соединений формулы (IB)

где кольцо В представляет собой необязательно замещенное фенильное кольцо или моноциклическое гетероциклическое кольцо из 5 или 6 кольцевых атомов или арильное кольцо, конденсированное с гетероциклоалкилом; s равно 1, 2, 3, 4, 5, 6 или 7 и t равно 0, 1, 2, 3, 4, 5, 6 или 7 при условии, что s+t не больше 10; Y представляет собой связь или -О-, и X- представляет собой фармацевтически приемлемый анион. В соединениях (IB) (в настоящее время) предпочтительно, когда кольцо В представляет собой (i) необязательно замещенный фенил, в котором необязательные заместители выбраны из алкокси, галогена, в особенности, фтора или хлора, С1-С6-алкила, амино-С1-С3-ацила, амино-С1-С3-алкила и аминосульфонила, или (ii) фенильное кольцо, конденсированное с гетероциклоалкилом, где гетероциклоалкильное кольцо представляет собой моноциклическое гетероциклическое кольцо из 5 или 6 кольцевых атомов, такую как дигидробензофуранил.
В обоих подклассах (IA) и (IB) (сумма) s+t может быть равна, например, 1, 2, 3, 4, 5, 6 или 7, или она может быть результатом подходящих комбинаций из t и s, таких как когда t равно 0, 1, 2, 3, 4, 5 или 6 и s равно 1, 2, 3, 4, 5, 6 или 7. В соединениях (IA) и (IB) (в настоящее время) предпочтительной комбинацией t, Y и s является комбинация, когда t равно 0, s равно 3 и Y представляет собой -О-. Другой предпочтительной комбинацией является комбинация, когда Y представляет собой связь и сумма s+t равна 2, 3 или 4.
В обоих подклассах (IA) и (IB), как и для соединений по настоящему изобретению, в целом, предпочтительны соединения, находящиеся преимущественно в анти-эндо-конфигурации.
Примеры соединений по настоящему изобретению включают соединения примеров, представленных в описании. Предпочтительные соединения по настоящему изобретению включают:
анти-2-(бифенил-2-илкарбамоилокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-феноксипропил)аммониевые соли,
анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-фенилпропил)аммониевые соли,
анти-(±)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-фенилпропил)аммониевые соли,
анти-(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-феноксипропил)аммониевые соли,
анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметилфенэтиламмониевые соли,
анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметил-(4-фенилбутил)аммониевые соли,
анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]триметиламмониевые соли,
(2-бензилоксиэтил)-анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметиламмониевые соли,
анти-(1S,2R)-2-(2-гидрокси-2,2-дифенилацетокси)бицикло[2.2.1]-гепт-7-ил]диметил-(3-феноксипропил)аммониевые соли,
анти-(1S,2R)-диметил-(3-феноксипропил)-[2-(9Н-ксантен-9-карбонилокси)бицикло[2.2.1]гепт-7-ил]аммониевые соли,
анти-(1S,2R)-2-(9-гидрокси-9Н-ксантен-9-карбонилокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-феноксипропил)аммониевые соли,
анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]индан-2-илдиметиламмониевые соли,
(бензилкарбамоилметил)-анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметиламмониевые соли,
[2-(2,3-дигидробензофуран-5-ил)этил]-анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметиламмониевые соли.
Как уже упоминалось выше в разделе “Предшествующий уровень техники”, соединения с двойной (двойственной) активностью антагониста рецептора М3 и агониста β2-адренорецептора известны, и лечение респираторного заболевания такими соединениями с двойной активностью является общепризнанной формой лечения. Известная стратегия обеспечения соединений такими механизмами двойственной активности заключается в образовании простой ковалентной связи между соединением с активностью антагониста рецептора М3 и соединением с активностью агониста β2-адренорецептора. Такие ковалентные конъюгаты соединения (I), агониста рецептора М3, определенного и обсужденного выше, и агониста β2-адренорецептора также составляют часть настоящего изобретения. Например, такие конъюгаты с двойственной активностью включают соединения формулы (I), определенные и обсужденные выше, модифицированные путем замены группы R2 группой -L-B, где L представляет собой радикал-линкер и В представляет собой часть, обладающую активностью агониста β2-адренорецептора. В конструктивном отношении такие конъюгаты с двойственной активностью могут быть представлены в виде формулы (III):

где R1, R2 и R4 такие, как определено и обсуждено выше в отношении соединений (I) по настоящему изобретению, L представляет собой дивалентный радикал-линкер и В представляет собой часть, обладающую активностью агониста β2-адренорецептора, как, например, фармакофор, β2-агонист, упоминаемый выше в разделе “Предшествующий уровень техники”. Такие соединения (III) составляют другой аспект настоящего изобретения. Примером такого соединения является соединение примера № 41 в настоящем описании.
Кроме того, настоящее изобретение касается фармацевтических композиций, содержащих, в качестве активного ингредиента, соединение по настоящему изобретению. Другие соединения могут быть объединены с соединениями по настоящему изобретению для предотвращения и лечения воспалительных заболеваний легких. Таким образом, настоящее изобретение также касается фармацевтических композиций для предотвращения и лечения расстройств дыхательных путей, таких как хроническая обструктивная болезнь легких, хронический бронхит, астма, хроническая обструкция дыхательных путей, пневмосклероз, эмфизема легких и аллергический ринит, содержащих терапевтически эффективное количество соединения по настоящему изобретению и один или несколько других терапевтических средств.
Другие соединения могут быть объединены с соединениями по настоящему изобретению для предотвращения и лечения воспалительных заболеваний легких. Соответственно, настоящее изобретение включает комбинацию средства по настоящему изобретению, описанного выше, с одним или несколькими противоспалительными средствами, бронходилататорами, антигистаминами, противозастойными или противокашлевыми средствами, при этом указанные средства по настоящему изобретению, описанные выше, и указанные комбинированные средства находятся в одной и той же композиции или различных композициях, вводимых раздельно или одновременно. Предпочтительные комбинации обычно имеют две или три различные фармацевтические композиции. Подходящие терапевтические средства для комбинированной терапии, наряду с соединениями по настоящему изобретению, включают:
один или несколько других бронходилататоров, таких как ингибиторы PDE3;
метилксантины, такие как теофиллин;
другие антагонисты мускаринового рецептора;
кортикостероид, например, флутиказон пропионат, циклезонид, мометазон фуроат или будезонид, или стероиды, описанные в WO 02/88167, WO 02/12266, WO 02/100879, WO 02/00679, WO 03/35668, WO 03/48181, WO 03/62259, WO 03/64445, WO 03/72592, WO 04/39827 и WO 04/66920;
нестероидный агонист рецептора глюкокортикоида;
агонист β2-адренорецептора, например, альбутерол (сальбутамол), сальметерол, метапротеренол, тербуталин, фенотерол, прокатерол, кармотерол, индакатерол, формотерол, арформотерол, пикуметерол, GSK-159797, GSK-597901, GSK-159802, GSK-64244, GSK-678007, TA-2005, а также соединения EP 1440966, JP 05025045, WO 93/18007, WO 99/64035, US 2002/0055651, US 2005/0133417, US 2005/5159448, WO 00/075114, WO 01/42193, WO 01/83462, WO 02/66422, WO 02/70490, WO 02/76933, WO 03/24439, WO 03/42160, WO 03/42164, WO 03/72539, WO 03/91204, WO 03/99764, WO 04/16578, WO 04/016601, WO 04/22547, WO 04/32921, WO 04/33412, WO 04/37768, WO 04/37773, WO 04/37807, WO 04/39762, WO 04/39766, WO 04/45618, WO 04/46083, WO 04/71388, WO 04/80964, EP 1460064, WO 04/087142, WO 04/89892, EP 01477167, US 2004/0242622, US 2004/0229904, WO 04/108675, WO 04/108676, WO 05/033121, WO 05/040103, WO 05/044787, WO 04/071388, WO 05/058299, WO 05/058867, WO 05/065650, WO 05/066140, WO 05/070908, WO 05/092840, WO 05/092841, WO 05/092860, WO 05/092887, WO 05/092861, WO 05/090288, WO 05/092087, WO 05/080324, WO 05/080313, US 20050182091, US 20050171147, WO 05/092870, WO 05/077361, DE 10258695, WO 05/111002, WO 05/111005, WO 05/110990, US 2005/0272769, WO 05/110359, WO 05/121065, US 2006/0019991, WO 06/016245, WO 06/014704, WO 06/031556, WO 06/032627, US 2006/0106075, US 2006/0106213, WO 06/051373, WO 06/056471;
модулятор лейкотриена, например, монтелукаст, зафирлукаст или пранлукаст; ингибиторы протеаз, такие как ингибиторы матриксной металлопротеазы, например, MMP12 и ингибиторы TACE, такие как маримастат, DPC-333, GW-3333;
ингибиторы человеческой эластазы нейтрофила, такие как сивелестат, и ингибиторы, описанные в WO 04/043942, WO 05/021509, WO 05/021512, WO 05/026123, WO 05/026124, WO 04/024700, WO 04/024701, WO 04/020410, WO 04/020412, WO 05/080372, WO 05/082863, WO 05/082864, WO 03/053930;
ингибиторы фосфодиэстеразы-4 (PDE4), например, рофлумиласт, арофиллин, циломиласт, ONO-6126 или IC-485;
ингибиторы фосфодиэстеразы-7;
противокашлевое средство, такое как кодеин или декстраморфан;
ингибиторы киназ, в частности, ингибиторы МАРКиназы Р38;
антагонисты Р2Х7;
ингибиторы INOS;
нестероидное противовоспалительное средство (NSAID), например, ибупрофен или кетопрофен;
антагонист рецептора допамина;
ингибиторы TNF-α, например, моноклональные антитела против-TNF, такие как Remicade и CDP-870, и иммуноглобулиновые молекулы рецептора TNF, такие как Enbrel;
агонисты А2а, такие как агонисты, описанные в ЕР 1052264 и ЕР 1241176;
антагонисты A2b, такие как антагонисты, описанные в WO 2002/42298;
модуляторы функции рецептора хемокина, например, антагонисты CCR1, CCR2, CCR3, CXCR2, CXCR3, CX3CR1 и CCR8, такие как SB-332235, SB-656933, SB-265610, SB-225002, MCP-1(9-76), RS-504393, MLN-1202, INCB-3284;
соединения, которые модулируют действие рецепторов простаноида, например, PGD2 (DP1 или CRTH2), или антагонист тромбоксана А2, например, раматробан;
соединения, которые модулируют функцию Th1 или Th2, например, агонисты PPAR;
антагонисты рецептора интерлейкина 1, такой как Kineret;
агонисты интерлейкина 10, такие как Ilodecakin;
ингибиторы редуктазы HMG-CoA (статины); например, розувастатин, мевастатин, ловастатин, симвастатин, правастатин и флувастатин;
регуляторы слизи, такие как INS-37217, диквафозол, зибенадет, CS-003, тальнетант, DNK-333, MSI-1956, гефитиниб;
антибактериальные средства (антибиотические и противовирусные) и противоаллергические лекарственные средства, включая, но не ограничиваясь ими, антигистаминные средства.
Массовое отношение первого и второго активных ингредиентов может варьироваться и обычно зависит от эффективной дозы каждого ингредиента. Как правило, обычно используют эффективную дозу каждого ингредиента.
Любой подходящий путь введения может быть использован для доставки млекопитающему, в частности, человеку, эффективной дозы соединения по настоящему изобретению. Для терапевтического применения активное соединение может вводиться любым удобным, подходящим или эффективным путем. Подходящие пути введения известны специалистам в данной области техники и включают пероральный, внутривенный, ректальный, парентеральный, местный, глазной, назальный, (транс)буккальный и легочный.
Величина профилактической или терапевтической дозы соединения по настоящему изобретению обычно, конечно, изменяется в зависимости от ряда факторов, включая активность конкретного соединения, подлежащео использованию, возраста, массы тела, диеты, общего состояния здоровья и пола пациента, времени введения, пути введения, скорости экскреции, применения любых других лекарственных средств и тяжести заболевания, подлежащего лечению. В общем, диапазон суточной дозы в случае введения ингаляцией обычно находится в пределах от около 0,1 мкг до около 10 мг на кг массы тела человека, предпочтительно от 0,1 мкг до около 0,5 мг на кг и более предпочтительно от 0,1 мкг до 50 мкг на кг, для однократных доз или небольших доз (вместе составляющих суточную дозу), повторяемых через определенные интервалы времени. С другой стороны, в некоторых случаях может возникнуть необходимость в применении доз, находящихся за пределами вышеуказанных значений. Композиции, подходящие для введения путем ингаляции, известны и могут включать носители и/или разбавители, которые известны для использования в таких композициях. Композиция может содержать 0,01-99 мас.% активного соединения. Предпочтительно, стандартная доза включает активное соединение в количестве от 1 мкг до 10 мг. Для перорального введения подходящие дозы составляют от 10 мкг на кг до 100 мг на кг, предпочтительно от 40 мкг на кг до 4 мг на кг.
Другой аспект настоящего изобретения предлагает фармацевтические композиции, которые содержат соединение по настоящему изобретению и фармацевтически приемлемый носитель. Термин “композиция”, как и в случае фармацевтической композиции, как подразумевается, охватывает продукт, содержащий активный ингредиент(ы) и инертный ингредиент(ы) (фармацевтически приемлемые наполнители), который составляет носитель, а также любой продукт, который является, непосредственно или косвенно, результатом комбинации, комплексообразования или агрегации любых двух или большего числа ингредиентов, или результатом диссоциации одного или нескольких ингредиентов, или следствием других типов реакций или взаимодействий одного или нескольких ингредиентов. Соответственно, фармацевтические композиции по настоящему изобретению включают в себя любую композицию, полученную смешением соединения по настоящему изобретению, дополнительного активного ингредиента(ов) и фармацевтически приемлемых наполнителей.
Фармацевтические композиции по настоящему изобретению включают в качестве активного ингредиента соединение по настоящему изобретению или его фармацевтически приемлемую соль и могут также содержать фармацевтически приемлемый носитель и необязательно другие терапевтические ингредиенты (средства). Термин “фармацевтически приемлемые соли” относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований или кислот, включая неорганические основания или кислоты и органические основания или кислоты, и солям соединений четвертичного аммония с фармацевтически приемлемыми противоионами.
В случае доставки путем ингаляции активное соединение находится предпочтительно в форме микрочастиц. Они могут быть получены различными методами, включая распылительную сушку, сублимационную сушку и превращение в микроскопический порошок.
В качестве примера, композицию по настоящему изобретению можно получить в виде суспензии для доставки из распылителя или в виде аэрозоля в жидком пропелленте, например, для использования в находящемся под давлением, способном осуществлять нормируемую дозоподачу, ингаляторе (PMDI). Пропелленты, подходящие для использования в PMDI, известны специалистам в данной области и включают CFC-12, HFA-134a, HFA-227, HCFC-22 (CCl2F2) и HFA-152 (C2H4F2) и изобутан.
В предпочтительном варианте (осуществления) изобретения композиция по изобретению находится в сухой порошкообразной форме, для доставки которой используют ингалятор сухого порошка (DPI). Известны различные типы DPI.
Микрочастицы для доставки путем введения могут быть введены в состав (лекарственного средства) вместе с наполнителями, которые способствуют их доставке и высвобождению. Например, в препарате в виде сухого порошка микрочастицы могут быть составлены вместе с несущими (высокого уровня) частицами носителя, которые содействуют движению потока из DPI в легкое. Подходящие несущие частицы известны и включают частицы лактозы; они могут иметь средневзвешенный аэродинамический диаметр больше 90 мкм.
В случае препарата на основе аэрозоля, например, он имеет состав:
Активные соединения могут дозироваться, как описано, в зависимости от используемой системы ингалятора. Помимо активных соединений (лекарственные) формы для введения могут дополнительно содержать наполнители, такие как, например, пропелленты (например, Frigen в случае дозированных аэрозолей), поверхностно-активные вещества, эмульгаторы, стабилизаторы, консерванты, ароматизаторы, наполнители (разбавители) (например, лактоза в случае ингаляторов сухого порошка) или, если это целесообразно, другие активные соединения.
Для ингаляции имеется в распоряжении большое число систем, с помощью которых могут генерироваться и вводиться аэрозоли с оптимальным размером частиц, используя тот способ ингаляции, который подходит пациенту. Помимо использования адаптеров (распорных деталей, расширяющих устройств) и грушевидных контейнеров (например, Nebulator®, Volumatic®,) и автоматических устройств, эмитирующих препарат в аэрозольной упаковке (Autohaler®), для дозированных (калиброванных) аэрозолей, в частности, в случае порошкообразных ингаляторов, в распоряжении имеется ряд технических решений (например, Diskhaler®, Rotadisk®, Turbohaler® или ингаляторы, например, описанные в EP-A-0505321). Кроме того, соединения по настоящему изобретению могут быть доставлены с помощью многокамерных устройств, предоставляя тем самым возможность доставки комбинированных лекарственных средств.
Способы синтеза
Соединения по настоящему изобретению могут быть получены согласно способам, представленным нижеследующими схемами и примерами, используя подходящие вещества, и в дальнейшем иллюстрируются нижеследующими конкретными примерами. Кроме того, используя способы, раскрытые в описании при раскрытии сущности изобретения, специалист в данной области может легко получить дополнительные соединения, заявляемые в настоящем изобретении. Однако не следует считать, что соединения, иллюстрируемые в примерах, образуют единственный класс соединений, который предлагается в виде изобретения. Кроме того, примеры иллюстрируют детали получения соединений по настоящему изобретению. Специалистам в данной области техники очевидно, что для получения этих соединений могут быть использованы известные вариации условий и способов осуществления нижеприведенных препаративных способов получения.
Соединения по настоящему изобретению могут быть выделены в форме их фармацевтически приемлемых солей, таких как соли, описанные в настоящем описании ранее.
Может возникнуть необходимость в защите реакционноспособных функциональных групп (например, гидрокси, амино, тио или карбокси) в промежуточных продуктах, используемых для получения соединений по настоящему изобретению, с целью избежать их нежелательного участия во взаимодействии, ведущем к образованию соединений. В связи с этим могут быть использованы обычные защитные группы, например, группы, описанные T.W. Greene and P.G.M. Wuts, “Protective groups in organic chemistry”, John Wiley and Sons, 1999.
Соединения по настоящему изобретению могут быть получены согласно путям, иллюстрированным на схеме 1.

Соединения формулы (I-a) и (I-b), где Ra, Rb и Rc и Rd являются такими, как определены для R1, R2, R3 и R4 в соединениях формулы (I), могут быть получены из соединений формулы (II-a) или (II-b):
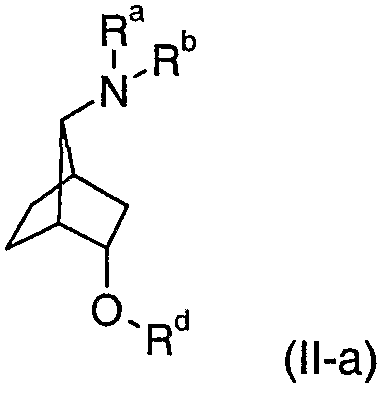
путем взаимодействия с соединением формулы (III-a):
Rc-X (III-a),
где Х представляет собой удаляемую группу, такую как галоген, тозилат, мезилат. Взаимодействие может быть осуществлено в ряде растворителей, таких как ацетонитрил, хлороформ, ДМФА или ДМСО, необязательно в присутствии основания третичного амина, такого как DIPEA, при температуре в диапазоне от 0°С до температуры кипения растворителя, предпочтительно от температуры окружающей среды до температуры кипения растворителя.
Соединения формулы (II-a) и (II-b), где Ra, Rb и Rd являются такими, как определены для R1, R2 и R4 в соединениях формулы (I), могут быть получены из соединений формулы (II-a) или (II-b), где Rb представляет собой Н, путем взаимодействия с соединением формулы (III-b):
Rb-CHO (III-b)
в присутствии подходящего восстановителя, такого как боргидрид металла, в особенности, триацетоксиборгидрид натрия. Взаимодействие может быть осуществлено в ряде растворителей, таких как 1,2-дихлорэтан, хлороформ, дихлорметан, спирты, необязательно в присутствии кислоты, такой как уксусная кислота, при температуре от 0°С до температуры кипения растворителя, предпочтительно от 0°С до температуры окружающей среды. Соединения формулы (III-a) и (III-b) общеизвестны в данной области и являются легко доступными, или их можно получить известными способами.
Подходящие способы получения соединений формулы (II-a) или (II-b), где Rb представляет собой Н, включают взаимодействие (II-a) или (II-b), где Rb представляет собой бензил, с водородом в присутствии палладия на углероде или гидроксида палладия на углероде в подходящих растворителях, таких как метанол, этанол, уксусная кислота, этилацетат и их смеси. Альтернативно, взаимодействие (II-a) или (II-b), где Rb представляет собой метил или бензил, с 1-хлорэтилхлорформиатом в подходящем растворителе, таком как 1,2-дихлорэтан, при температуре кипения растворителя, затем последующее взаимодействие с метанолом является предпочтительным способом получения соединений формулы (II-a) или (II-b), где Rb представляет собой Н.
Соединения формулы (II-a) и (II-b) существуют в двух энантиомерных формах, которые могут быть разделены хиральной препаративной ВЭЖХ, используя условия, известные специалистам в данной области техники и иллюстрируемые ниже. Альтернативно, так как абсолютная конфигурация соединений (II-a) и (II-b) диктуется абсолютной конфигурацией соединений (X) и (XV) соответственно, и соединения (X) и (XV) известны в литературе (смотрите EP0074856A2), то специалисту в данной области техники очевидно, что использование гомохирального исходного продукта может обеспечить получение гомохирального продукта определенной стереохимии.
Соединения формулы (II-a), где Rd представляет собой группу формулы (а) и R6 представляет собой Н, как определено выше для формулы (I), можно получить из соединений формулы (IV-a), где Ra и Rb являются такими, как определены выше, путем взаимодействия с соединением формулы (V):

где R7a, R7b, n и m такие, как определены для формулы (I), взаимодействие может проходить в ряде ненуклеофильных органических растворителей, таких как ДМФА или толуол, в диапазоне температур, предпочтительно от 0°С до температуры кипения растворителя.
Соединения формулы (V) известны в данной области техники и являются легко доступными, или их можно получить известными способами.
Соединения формулы (II-a), где Rd представляет собой группу формулы (b), определенную выше, можно получить из соединений формулы (IV-a) путем взаимодействия с соединением формулы (VI):

где R8a, R8b и R8c такие, как определены для формулы (I), и LG представляет собой удаляемую группу, например, О-алкил, галоген или 1-имидазолильную группу. Взаимодействие проводят в присутствии сильного основания, такого как NaH, в растворителе, таком как толуол, ТГФ или дихлорметан, в диапазоне температур, предпочтительно от 0°С до температуры кипения растворителя.
Соединения формулы (VI), где R8a, R8b и R8c такие, как определены для формулы (I), и LG представляет собой О-алкил, галоген или 1-имидазолильную группу, могут быть получены из соединений формулы (VII) известными способами.

Соединения формулы (VII) известны в данной области техники и легко доступны, или их можно получить известными способами, такими как способы, описанные в WO 01/04118.
Соединения формулы (II-a), где Rd представляет собой группу формулы (с), определенную выше, могут быть получены из соединений формулы (IV-a) путем взаимодействия с соединением формулы (VI-a):
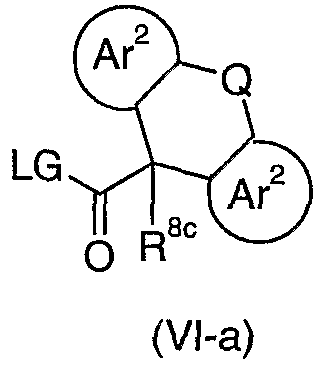
где Ar2 является таким, как определен для формулы (I), и LG представляет собой удаляемую группу, например, О-алкил, галоген или 1-имидазолильную группу. Взаимодействие проводят в присутствии сильного основания, такого как NaH, в растворителе, таком как толуол, ТГФ или дихлорметан, в диапазоне температур, предпочтительно от 0°С до температуры кипения растворителя.

Соединения формулы (VI-a), где R8d и R8c такие, как определены для формулы (I), и LG представляет собой О-алкил, галоген или 1-имидазолильную группу, могут быть получены из соединений формулы (VII-a) известными способами.
Соединения формулы (VII-a) известны в данной области техники и легко доступны, или их можно получить известными способами.
Соединения формулы (II-a), в которых Rd представляет собой группу формулы (d), определенную выше, можно получить из соединений формулы (IV-a) путем взаимодействия с соединением формулы (VI-b):

Взаимодействие проводят в присутствии сильного основания, такого как NaH, в растворителе, таком как толуол, ТГФ, предпочтительно ДМСО, в диапазоне температур предпочтительно от 0°С до температуры кипения растворителя.
Соединения формулы (VI-b) известны в данной области техники и легко доступны, или их можно получить известными способами.
Соединения формулы (IV-a) можно получить из соединений формулы (VIII-a) путем взаимодействия с подходящим восстановителем, предпочтительно восстановителем с объемной структурой, таким как LiAlH(OtBu)3. Взаимодействие проводят в полярном органическом растворителе, предпочтительно ТГФ, в диапазоне температур предпочтительно от -78°С до температуры кипения растворителя.
Соединения формулы (VIII-a) можно получить из соединений формулы (IX-a) путем взаимодействия с оловосодержащим реагентом, предпочтительно Bu3SnH, и радикальным инициатором, предпочтительно AIBN. Взаимодействие можно осуществить в ряде растворителей, предпочтительно толуоле, в диапазоне температур предпочтительно от температуры окружающей среды до температуры кипения растворителя.
Соединения формулы (IX-a) можно получить из соединений формулы (Х) путем взаимодействия с амином формулы (XI):
RaRbNH (XI).
Взаимодействие осуществляют в ряде растворителей, предпочтительно смеси ТГФ/ДХМ, в диапазоне температур предпочтительно от 0 до 100°С.
Соединения формулы (X) известны в данной области техники: J. Chem. Soc. Perkin Trans 1 (1975) 1767-1773; Synthesis (1997), 155-166.
Соединения формулы (XI) известны в данной области техники, и они могут быть получены известными способами или являются коммерчески доступными.
Соединения формулы (I-b) можно получить из соединений формулы (II-b) способом, аналогичным получению соединений формулы (I-a) из соединений вышеупомянутой формулы (II-a). Соединения формулы (II-b) можно получить из соединений формулы (XII-b) путем взаимодействия с оловосодержащим реагентом, предпочтительно Bu3SnH, и радикальным инициатором, предпочтительно AIBN. Взаимодействие можно осуществить в ряде растворителей, предпочтительно толуоле, в диапазоне температур предпочтительно от температуры окружающей среды до температуры кипения растворителя.
Соединения формулы (XII-b) могут быть получены из соединений формулы (IV-b) путем взаимодействия с бромирующим агентом, предпочтительно трифенилфосфином в тетрабромиде углерода в качестве растворителя.
Соединения формулы (IV-b) могут быть получены из соединений формулы (XIII-b) путем взаимодействия с подходящим восстановителем, предпочтительно боргидридом натрия. Взаимодействие проводят в полярном органическом растворителе, предпочтительно ТГФ, в диапазоне температур предпочтительно от -78°С до температуры кипения растворителя.
Соединения формулы (XIII-b) можно получить из соединений формулы (XIV-b) способами, аналогичными способам, используемым для получения соединений формулы (II-a) из соединений формулы (IV-a).
Соединения формулы (XIV-b) могут быть получены из соединений формулы (XV):
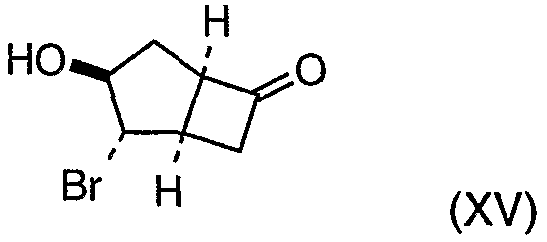
путем взаимодействия с амином формулы (XI). Взаимодействие осуществляют в ряде растворителей, предпочтительно смеси ТГФ/ДХМ, в диапазоне температур предпочтительно от 0 до 100°С.
Соединения формулы (XV) описаны в патенте Великобритании 2075503.

Получение соединений формулы (I), в которой А представляет собой группу -NR-, в общих чертах представлено на схеме 2.
Соединения формулы (XVI-a) могут быть получены из соединений формулы (XVII-a) способами, аналогичными тем, которые используют для получения соединений формулы (I-a) из соединений формулы (II-a).
Соединения формулы (XVII-a) можно получить из соединений формулы (XVIII-a) обработкой металлорганическим реагентом формулы (XXI-a):
R-M (XXI-a),
где М представляет собой разновидность металла, как, например, литий или Mg-галогенид, в особенности, реактив Гриньяра, в подходящем инертном растворителе, таком как ТГФ или диэтиловый эфир, при температуре в диапазоне от -78° до температуры кипения растворителя, предпочтительно от 0° до температуры окружающей среды. Соединения формулы (XXI-a) известны в данной области техники или могут быть получены согласно известным способам.
Соединения формулы (XVIII-a) могут быть получены из соединений формулы (XIX-a):

где Х представляет собой удаляемую группу, в особенности, группу галогена, необязательно в присутствии подходящего растворителя, такого как дихлорметан, в отсутствие или в присутствии основания, такого как диизопропилэтиламин. Соединения формулы (XIX-a) являются коммерчески доступными, или их легко получают в соответствии с литературой.
Соединения формулы (XIX-a) могут быть получены из соединений формулы (XX-a) путем восстановления оксима подходящим восстановителем, таким как боргидридный реагент, в частности, NaBH4/NiCl2, в подходящем растворителе, таком как метанол, при подходящей температуре, такой как 20°С.
Соединения формулы (XX-a) могут быть получены из соединений формулы (VIII-a) обработкой гидроксиламином или его солью в присутствии подходящего растворителя, такого как метанол, необязательно в присутствии основания, такого как ацетат натрия, при температуре в диапазоне от 0°С до температуры кипения растворителя, предпочтительно при температуре окружающей среды.
Нижеследующие неограничивающие примеры иллюстрируют настоящее изобретение.
Общие экспериментальные детали
Все взаимодействия проводят в атмосфере азота, если не оговорено иначе.
В тех случаях, когда продукты подвергали очистке с помощью колоночной хроматографии, 'флеш диоксид кремния' относится к силикагелю для хроматографии, размер частиц от 0,035 до 0,070 мм (от 220 до 440 меш) (например, силикагель 60 Fluka), прикладываемое давление азота вплоть до 10 p.s.i. (фунт/кв. дюйм) ускоряло элюирование колонки. В тех случаях, когда использовали тонкослойную хроматографию (ТСХ), это относится к использованию пластин, предназначенных для ТСХ, покрытых силикагелем, обычно 3×6 см силикагеля на пластинах из алюминиевой фольги с флуоресцентным индикатором (254 нм) (например, Fluka 60778). Все растворители и коммерческие реагенты использовали, как общепринято.
Все соединения, содержащие основной(ые) центр(ы), которые очищали методом ВЭЖХ, получали в виде соли ТФА, если не оговорено иначе.
Условия препаративной ВЭЖХ
Система ВЭЖХ 1
Колонка с обращенной фазой С18 (колонка Genesis 100×22,5 мм вн.д., размер частиц 7 мкм), элюирование градиентом А: вода + 0,1% ТФА; В: ацетонитрил + 0,1% ТФА со скоростью потока 5 мл/мин и градиент 1%/мин увеличение в В. УФ-детектирование при 230 нм.
Система ВЭЖХ 2
Колонка, наполненная фазой, содержащей привитые фенилгексильные группы (колонка Luna 250×21,20 мм с размером частиц 5 мкм), градиентное элюирование смесью растворителей А: вода + 0,1% ТФА; В: ацетонитрил + 0,1% ТФА со скоростью потока 5 мл/мин с УФ-детектированием при 254 нм.
Системы ЖХ/МС
Использовали комбинированные методы анализа, системы, сочетающие жидкостную хроматографию и масс-спектрометрию (ЖХ/МС).
Способ ЖХ-МС 1
Комбинация масс-спектрометра Micromass Platform LCT с колонкой с обращенной фазой С18 (Higgins Clipeus 100×3,0 мм, размер частиц 5 мкм), элюирование смесью растворителей А: вода + 0,1% муравьиной кислоты; В: ацетонитрил + 0,1% муравьиной кислоты. Градиент:
Способ ЖХ-МС 2
Комбинация масс-спектрометра Micromass Platform LCT с колонкой с обращенной фазой С18 (Phenomenex Luna 30×4,6 мм, размер частиц 3 мкм), элюирование смесью растворителей А: вода + 0,1% муравьиной кислоты; В: ацетонитрил + 0,1% муравьиной кислоты. Градиент:
Способ ЖХ-МС 3
Комбинация масс-спектрометра Waters Micromass ZQ с колонкой с обращенной фазой С18 (Phenomenex Luna 30×4,6 мм, размер частиц 3 мкм), элюирование смесью растворителей А: вода + 0,1% муравьиной кислоты; В: ацетонитрил + 0,1% муравьиной кислоты. Градиент:
Способ ЖХ-МС 4
Комбинация масс-спектрометра Waters Micromass ZQ с колонкой с обращенной фазой С18 (Higgins Clipeus С18 5 микрон, 100×3,0 мм или эквивалент), элюирование смесью растворителей А: вода + 0,1% муравьиной кислоты; В: ацетонитрил + 0,1% муравьиной кислоты. Градиент:
Аббревиатуры, используемые в экспериментальном разделе:
ДХМ = дихлорметан; ТГФ = тетрагидрофуран; MeOH = метанол; EtOH = этанол; ДМСО = диметилсульфоксид; EtOAc = этилацетат; DIPEA = диизопропилэтиламин; EDCl = 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид; DMAP = диметиламинопиридин; RT = температура окружающей среды; HATU = О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфат; ТФА = трифторуксусная кислота; Rt = время удерживания; насыщ. = насыщенный.
ПРИМЕР 1
7-диметиламинобицикло[2.2.1]гепт-2-иловый эфир (±)-анти-бифенил-2-илкарбаминовой кислоты (II-a): Ra, Rb = СН3, Rd = бифенил-2-илкарбамил

а. (±)-анти-5-бром-7-диметиламино-бицикло[2.2.1]гептан-2-он (IX-a): Ra, Rb = СН3
К охлажденному (-10°С) раствору (±)-2,3-дибромбицикло[3.2.0]гептан-6-она в ДХМ (20 мл) добавляют по каплям раствор диметиламина (2 М, 8,23 мл, 16,5 ммоль) в ТГФ. Реакционной смеси предоставляют возможность медленно нагреться до температуры окружающей среды на протяжении нескольких часов. Через 17 часов реакционную смесь концентрируют и остаток растворяют в Et2O и фильтруют. Фильтрат абсорбируют на диатомовой земле и хроматографируют на колонке с силикагелем, элюируя смесью 25% Et2O в пентане, получая 0,88 г (58%) указанного в заголовке продукта в виде оранжевого твердого вещества.1H-ЯМР (CDCl3, 400 МГц): δ 1,70 (1H, ддд, J=14,2 Гц, 4,4 Гц, 1,3 Гц), 2,18 (6H, с), 2,2 (1H, м), 2,47 (1H, д, J=1,2 Гц), 2,60 (1H, д, J=4,8 Гц), 2,80 (3H, м), 4,66 (1H, м).
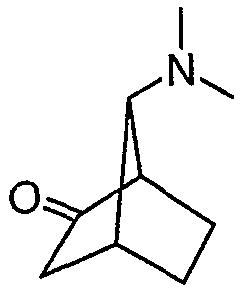
b. (±)-анти-7-диметиламинобицикло[2.2.1]гептан-2-он. (VIII-a): Ra, Rb = СН3
Толуол, перед взаимодействием, подвергают дегазации путем энергичного барботирования (инертным) газом-азотом в течение 30 минут. К (±)-5-бром-7-диметиламинобицикло[2.2.1]гептан-2-ону (200 мг, 0,75 ммоль) и азоизобутиронитрилу (12 мг, 0,07 ммоль) в атмосфере азота добавляют дегазированный толуол (8 мл). К раствору добавляют трибутилоловогидрид (221 мкл, 0,82 ммоль) и раствор перемешивают в атмосфере азота при 80°С в течение 1 часа. Добавляют раствор трибутилоловогидрида (30 мкл, 0,11 ммоль) в толуоле (300 мкл) и несколько хлопьев азоизобутиронитрила и реакционную смесь нагревают при 80°С в течение 1,5 часов. Реакционную смесь упаривают, получая 0,5 г желтой жидкости, которую хроматографируют на колонке с силикагелем, элюируя пентаном, затем смесью 20% Et2O в пентане вплоть до 100% Et2O, получая бесцветное масло, 214 мг (>100%, загрязнение остатками олова). ТСХ: Rf 0,25 (смесь 50% Et2O в пентане);1H-ЯМР (CDCl3, 400 МГц): включая сигналы для остатка олова. δ 0,90 (3H, т, J=7,4 Гц), 1,35 (6H, м), 1,61 (2H, м), 1,98 (2H, м), 2,09 (2H, м), 2,18 (6H, с), 2,25 (1H, с), 2,53 (1H, т, J=4,4 Гц), 2,58 (1H, д, J=4,8 Гц).
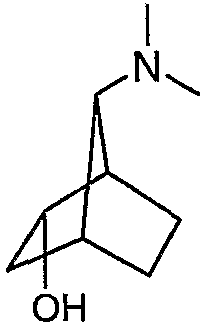
с. (±)-анти-7-диметиламино-бицикло[2.2.1]гептан-2-ол. (IV-a): Ra, Rb = СН3
К охлажденному (-10°С) раствору (±)-7-диметиламинобицикло[2.2.1]гептан-2-она (214 мг, ≤0,75 ммоль) в ТГФ (4 мл) добавляют три-трет-бутоксиалюминийгидрид лития (380 мг, 1,49 моль). Реакционную смесь перемешивают при 0°С в течение 1,5 часов и затем добавляют другую порцию три-трет-бутоксиалюминийгидрида лития (190 мг, 0,75 моль) и реакционную смесь перемешивают в течение еще 1,5 часов. Реакционную смесь разбавляют ДХМ и непосредственно упаривают (концентрируют) на диатомовой земле и хроматографируют на колонке с силикагелем, элюируя смесью 5% MeOH в ДХМ и далее в градиенте от 2,5% MeOH до 20% MeOH в ДХМ, получая 120 мг (100%) указанного в заголовке продукта в виде белого твердого вещества.1Н-ЯМР - спектроскопия указывает на то, что твердое вещество представляет собой смесь 93:7 указанного в заголовке продукта и его (±)-2-эпи-изомера. Изомеры не разделяют. ТСХ: Rf 0,1 (75% Et2O в пентане);1H-ЯМР (d4-MeOH, 400 МГц): δ 0,96 (1H, дд, J=4,0 Гц, 13,2 Гц), 1,31 (1H, м), 1,56 (1H, м), 1,80 (1H, м), 1,93 (1H, м), 2,01 (1H, м), 2,17 (1H, м), 2,28 (8H, с), 4,14 (1H, м).
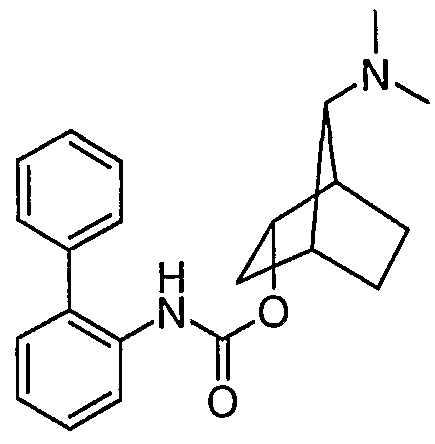
d. 7-диметиламинобицикло[2.2.1]гепт-2-иловый эфир (±)-анти-бифенил-2-илкарбаминовой кислоты
К раствору (±)-7-диметиламино-бицикло[2.2.1]гептан-2-ола (120 мг, 0,75 ммоль) в ДМФА (1,5 мл) и толуола (0,5 мл) добавляют некоторое количество порошкообразных молекулярных сит 3Å и 2-бифенилизоцианат (189 мг, 0,97 ммоль). Реакционную смесь перемешивают при 50°С в течение 15,5 часов и затем разбавляют EtOAc и промывают дважды водой, затем насыщенным раствором соли, сушат (Na2SO4), фильтруют и упаривают, получая 358 мг бесцветного сиропа. Полученный сироп очищают на колонке с силикагелем, элюируя смесью 2-4% MeOH в ДХМ, получая две фракции (143 мг) с различающейся чистотой. Собранную более чистую фракцию (91 мг) повторно хроматографируют на колонке с силикагелем, элюируя смесью 80% Et2O в пентане, получая три фракции, при этом наиболее чистая из них содержит указанное в заголовке соединение, практически не содержащее (±)-2-эпи-изомер, 42 мг (16%). ТСХ: Rf 0,2 (100% Et2O в пентане); ЖХ-МС (способ 1): Rt 6,99 мин, m/z 351 [MH]+;1H-ЯМР (CDCl3, 400 МГц): δ 1,11 (1H, дд, J=3,6 Гц, 13,6 Гц), 1,25 (1H, м), 1,62 (2H, м), 1,83 (1H, м), 2,05 (2H, м), 2,13 (1H, т, J=4,4 Гц), 2,18 (6H, с), 2,56 (1H, м), 4,95 (1H, м), 6,60 (1H, ушир.с), 7,13 (1H, дт, J=1,2 Гц, 7,4 Гц), 7,22 (1H, дд, J=1,6 Гц, 7,6 Гц), 7,33-7,44 (4H, м), 7,49 (2H, м), 8,09 (1H, д, J=8,0 Гц).
ПРИМЕР 2
7-диметиламинобицикло[2.2.1]гепт-2-иловый эфир (±)-анти-бифенил-2-илкарбаминовой кислоты (II-a): Ra, Rb = СН3, Rd = бифенил-2-илкарбамил (первый элюирующий энантиомер)

Указанное в заголовке соединение выделяют после препаративной хиральной ВЭЖХ примера 1 (Chiralpac IA, 250×20 мм вн.д.; смесь 12% трет-бутилметиловый эфир/гептан/0,25% диэтиламин; 14 мл/мин; Rt 20,6 минуты). ЖХ-МС (способ 1): Rt 7,03, m/z 351,2 [MH]+; ЯМР в том виде, как для примера 1.
ПРИМЕР 3
7-диметиламинобицикло[2.2.1]гепт-2-иловый эфир анти-бифенил-2-илкарбаминовой кислоты (II-a): Ra, Rb = СН3, Rd = бифенил-2-илкарбамил (второй элюирующий энантиомер)

Указанное в заголовке соединение выделяют после препаративной хиральной ВЭЖХ примера 1 (Chiralpac IA, 250×20 мм вн.д.; смесь 12% трет-бутилметиловый эфир/гептан/0,25% диэтиламин; 14 мл/мин; Rt 24 минуты). ЖХ-МС (способ 1): Rt 7,07, m/z 351,2 [MH]+; ЯМР в том виде, как для примера 1.
ПРИМЕР 4
(±)-анти-[2-(бифенил-2-илкарбамоилокси)бицикло[2.2.1]гепт-7-ил]триметиламмоний йодид (I-a): Ra, Rb, Rc = СН3, Rd = бифенил-2-илкарбамил

Раствор 7-диметиламинобицикло[2.2.1]гепт-2-илового эфира (±)-бифенил-2-илкарбаминовой кислоты в метилйодиде (2,5 мл) перемешивают при 40°С в течение 21 часа. Реакционную смесь упаривают и полученное твердое вещество хроматографируют на колонке с силикагелем, элюируя смесью 10% МеОН в ДХМ, получая 61 мг (41%) указанного в заголовке соединения в виде твердого вещества светло-желтого цвета. ЖХ-МС (способ 3): Rt 2,2 минуты, m/z 365 [M]+; ЖХ-МС (способ 1): Rt 7,16 минуты, m/z 365 [M]+;1H-ЯМР (CDCl3, 400 МГц): δ 1,13 (1H, дд, J=3,2 Гц, 13,6 Гц), 1,60 (1H, м), 1,81 (1H, м), 1,99 (2H, м), 2,06 (1H, с), 2,41 (1H, м), 2,78 (1H, с), 3,11 (1H, т, J=3,8 Гц), 3,52 (9H, с), 4,00 (1H, с), 5,02 (1H, м), 6,63 (1H, с), 7,13 (1H, дт, J=0,8 Гц, 7,2 Гц), 7,22 (1H, дд, J=1,6 Гц, 8,0 Гц), 7,31-7,51 (6H, м), 7,95 (1H, д, J=6,4 Гц).
ПРИМЕР 5
7-диметиламинобицикло[2.2.1]гепт-2-иловый эфир (±)-син-бифенил-2-илкарбаминовой кислоты (II-b): Ra, Rb = СН3, Rd = бифенил-2-илкарбамил

а.(±)-7-диметиламино-5-гидроксибицикло[2.2.1]гептан-2-он. (XIV-b): Ra, Rb = СН3
Раствор диметиламина (2,0 М, 24 мл, 48 ммоль) в ТГФ добавляют к раствору 2-бромбицикло[3.2.0]гептан-3-ола (4,00 г, 19,5 ммоль) в ацетоне (40 мл) при 0°С и смеси предоставляют возможность нагреться до температуры окружающей среды на протяжении 1 часа и перемешивают при температуре окружающей среды на протяжении ночи. Оранжевый раствор фильтруют и фильтрат упаривают досуха. Очистку осуществляют колоночной хроматографией на силикагеле, используя смесь 5% МеОН в ДХМ, получая 3,01 г (91%) продукта в виде желтовато-коричневого порошка. ЖХ-МС (способ 2): Rt 0,37 минуты, m/z 170,09 [MH]+.

b. 7-диметиламино-5-оксобицикло[2.2.1]гепт-2-иловый эфир (±)-син-бифенил-2-илкарбаминовой кислоты (XIII-b): Ra, Rb = СН3, Rd = бифенил-2-илкарбамил
2-бифенилизоцианат (90 мкл, 0,52 ммоль) добавляют к раствору 7-диметиламино-5-гидроксибицикло[2.2.1]гепт-2-она (90 мг, 0,53 ммоль) в толуоле (1 мл) и смесь нагревают при 70°С на протяжении ночи. Растворитель удаляют в вакууме и остаток очищают колоночной хроматографией, используя 100% ДХМ, а затем смесь 1% МеОН в ДХМ, получая продукт в виде белого порошка, 144 мг (75%). ЖХ-МС (способ 1): Rt 6,50 минуты, m/z 365,15 [MH]+.
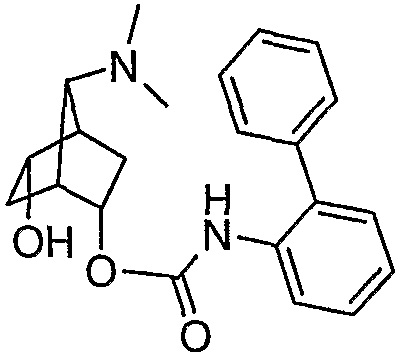
c. 7-диметиламино-5-гидроксибицикло[2.2.1]гепт-2-иловый эфир (±)-син-бифенил-2-илкарбаминовой кислоты (IV-b): Ra, Rb = СН3, Rd = бифенил-2-илкарбамил
Боргидрид натрия (25 мг, 0,68 ммоль) добавляют к раствору 7-диметиламино-5-оксобицикло[2.2.1]гепт-2-илового эфира бифенил-2-илкарбаминовой кислоты (200 мг, 0,55 ммоль) в безводном МеОН при 0°С и смеси предоставляют возможность нагреться до температуры окружающей среды в течение 1 часа. Растворитель удаляют в вакууме и остаток очищают колоночной хроматографией, используя 100% ДХМ, а затем смесь 2% МеОН в ДХМ, получая 194 мг (97%) продукта в виде белого порошка. ЖХ-МС (способ 1): Rt 6,31 минуты, m/z 367,16 [MH]+.
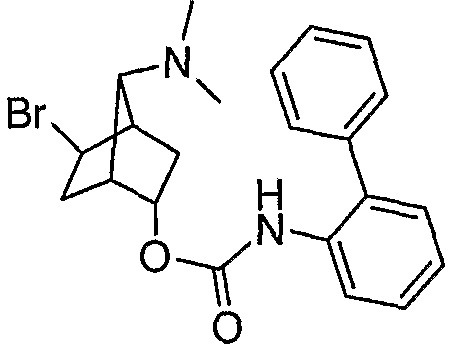
d. 5-бром-7-диметиламинобицикло[2.2.1]гепт-2-иловый эфир (±)-син-бифенил-2-ил-карбаминовой кислоты (XII-b): Ra, Rb = СН3, Rd = бифенил-2-илкарбамил
Суспензию 7-диметиламино-5-гидроксибицикло[2.2.1]гепт-2-илового эфира бифенил-2-илкарбаминовой кислоты (180 мг, 0,49 ммоль), нанесенного на полимер трифенилфосфина (2,18 ммоль/г, 0,90 г, 1,96 ммоль), тетрабромметана (1,56 г, 4,71 ммоль) и имидазола (130 мг, 1,91 ммоль) в ацетонитриле (4 мл) осторожно перемешивают при 50°С на протяжении ночи. Растворитель удаляют в вакууме и остаток очищают, используя ВЭЖХ (система 2: скорость потока 18 мл/мин, градиент увеличения в В 0,25%/мин). Полученную соль ТФА превращают в свободное основание, загружая в картридж SCX-2 с последующим элюированием смесью NH3/MeOH, получая 45 мг (21%) указанного в заголовке соединения. ЖХ-МС (способ 3): Rt 2,25 минуты, m/z 429,19/431,14 [MH]+.

е. 7-диметиламинобицикло[2.2.1]гепт-2-иловый эфир (±)-син-бифенил-2-илкарбаминовой кислоты
Раствор трибутилоловогидрида (40 мкл, 0,15 ммоль) в безводном толуоле (200 мкл) добавляют к раствору 5-бром-7-диметиламинобицикло[2.2.1]гепт-2-илового эфира бифенил-2-илкарбаминовой кислоты (45 мг, 0,10 ммоль) и 2,2'-азобис(2-метилпропионитрила) (10 мг, 0,06 ммоль) в безводном толуоле (0,8 мл) при 50°С до перемешивания при 80°С в течение 40 минут. Растворитель удаляют в вакууме и остаток очищают, используя ВЭЖХ (система 2: скорость потока 18 мл/мин, градиент увеличения в В 4%/мин. УФ-детектирование при 210 нм). Полученную соль ТФА превращают в свободное основание, пропуская через картридж SCX-2, с получением 28 мг (76%) указанного в заголовке соединения. ЖХ-МС (способ 1): Rt 7,18, m/z 351,19 [MH]+; (CDCl3) δ 1,09 (1H, м), 1,36 (2H, м), 1,66 (2H, м), 2,13 (1H, т, J=4,3 Гц), 2,24 (7H, с), 2,34 (1H, м), 2,54 (1H, т, J=4,0 Гц), 5,26 (1H, м), 6,58 (1H, с), 7,11 (1H, тд, J=7,5, 1,2 Гц), 7,21 (1H, дд, J=7,5, 1,6 Гц), 7,34 (1H, м), 7,38 (2H, м), 7,41 (1H, м), 7,49 (2H, м), 8,11 (1H, д, J=8,2 Гц).
ПРИМЕР 6
7-диметиламинобицикло[2.2.1]гепт-2-иловый эфир син-бифенил-2-илкарбаминовой кислоты (II-b): Ra, Rb = СН3, Rd = бифенил-2-илкарбамил (первый элюирующий энантиомер)

Указанное в заголовке соединение выделяют после препаративной хиральной ВЭЖХ примера 5 в условиях, приведенных для примера 2 (Rt 19 минут). ЖХ-МС (способ 1): Rt 7,16 мин, m/z 351 [MH]+; ЯМР в том виде, как для примера 5.
ПРИМЕР 7
7-диметиламинобицикло[2.2.1]гепт-2-иловый эфир син-бифенил-2-илкарбаминовой кислоты (II-b): Ra, Rb = СН3, Rd = бифенил-2-илкарбамил (второй элюирующий энантиомер)

Указанное в заголовке соединение выделяют после препаративной хиральной ВЭЖХ примера 5 в условиях, приведенных для примера 2 (Rt 20,4 минуты). ЖХ-МС (способ 1): Rt 7,14 мин, m/z 351 [MH]+; ЯМР в том виде, как для примера 5.
ПРИМЕР 8
(±)-син-[2-(бифенил-2-илкарбамоилокси)бицикло[2.2.1]гепт-7-ил]триметиламмоний йодид (I-b): Ra, Rb, Rc = СН3, Rd = бифенил-2-илкарбамил
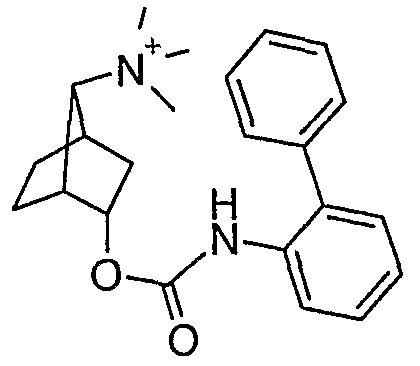
Указанное в заголовке соединение получают, используя условия, описанные для получения примера 4. ЖХ-МС (способ 1): Rt 7,02, m/z 365 [M]+; (CDCl3) δ 1,43 (1H, м), 1,50 (1H, дд, J=15,1, 3,8 Гц), 1,78 (1H, м), 1,88 (1H, м), 2,04 (1H, м), 2,51 (1H, м), 2,73 (1H, т, J=4,0 Гц), 2,96 (1H, т, J=3,9 Гц), 3,54 (9H, с), 4,31 (1H, с), 5,33 (1H, м), 6,65 (1H, с), 7,17 (1H, м), 7,25 (1H, м), 7,37 (3H, м), 7,43 (1H, м), 7,50 (2H, м), 7,99 (1H, д, ушир.).
Нижеследующие примеры получают способом, аналогичным способу, описанному для примера 1.

ПРИМЕР 13
Анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-феноксипропил)аммоний бромид (II-a): Ra, Rc = Ме, Rb = 3-фенилпропил, Rd = 2,2-дитиофен-2-илацетокси
а. Анти-(1S,2R)-7-(бензилметиламино)бицикло[2.2.1]гептан-2-ол
Указанное в заголовке соединение получают из (1S,2R,3R)-2,3-дибромбицикло[3.2.0]гептан-6-она и N-метилбензиламина, используя способы, аналогичные способам примера 1. ЖХ-МС (способ 2): Rt 0,76 минуты, m/z 232 [MH]+.

b. (1S,2R)-7-(бензилметиламино)бицикло[2.2.1]гепт-2-иловый эфир анти-гидроксидитиофен-2-илуксусной кислоты
К охлажденному (0°С) раствору анти-(1S,2R)-7-(бензилметиламино)бицикло[2.2.1]гептан-2-ола (1 г, 4,3 ммоль) добавляют по каплям гидрид натрия (432 мг 60% суспензии в минеральном масле, 10,8 ммоль). Смеси предоставляют возможность нагреться до температуры окружающей среды в течение 10 минут, затем вновь охлаждают до 0°С. Порциями добавляют этиловый эфир гидроксидитиофен-2-илуксусной кислоты (1,39 г, 5,2 ммоль) и затем смесь нагревают при 80°С в течение 2 часов. После предоставления возможности смеси охладиться до температуры окружающей среды реакционную смесь гасят, по каплям добавляя водный хлорид аммония (насыщ. 50 мл), затем экстрагируют этилацетатом (3×100 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют и упаривают до желтого масла. Очистка с помощью флеш-колонки с силикагелем, используя в качестве элюента смесь 5-10% этилацетата в гексане, затем другой флеш-колонки, используя в качестве элюента смесь 0-5% этилацетата в ДХМ, дает 1,12 г (57%) указанного в заголовке соединение в виде желтого масла: ЖХ-МС (способ 2): Rt 2,44 минуты, m/z 454 [MH]+.

с. (1S,2R)-7-метиламинобицикло[2.2.1]гепт-2-иловый эфир анти-гидроксидитиофен-2-илуксусной кислоты
К раствору (1S,2R)-7-(бензилметиламино)бицикло[2.2.1]гепт-2-илового эфира анти-гидроксидитиофен-2-илуксусной кислоты (400 мг, 0,88 ммоль) в 1,2-дихлорэтане (5 мл) добавляют 1-хлорэтилхлорформиат (0,57 мл, 5,3 ммоль) и смесь нагревают при 80°С в течение 8 часов. Растворитель и избыточный 1-хлорэтилхлорформиат удаляют при пониженном давлении, получая желтое/коричневое масло. Полученное масло вновь растворяют в метаноле (5 мл) и перемешивают при температуре окружающей среды в течение 1 часа, затем упаривают, получая желтую пену. Остаток суспендируют в воде (10 мл) и подщелачивают, используя гидроксид натрия (0,1 н.), затем экстрагируют этилацетатом (4×20 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют и упаривают досуха, получая коричневое твердое вещество. Очистка флеш-хроматографией на силикагеле, используя в качестве элюента смесь 5-10% метанола в ДХМ, дает 180 мг (56%) указанного в заголовке соединения в виде желтого твердого вещества: ЖХ-МС (способ 2): Rt 2,20 минуты, m/z 364 [MH]+.
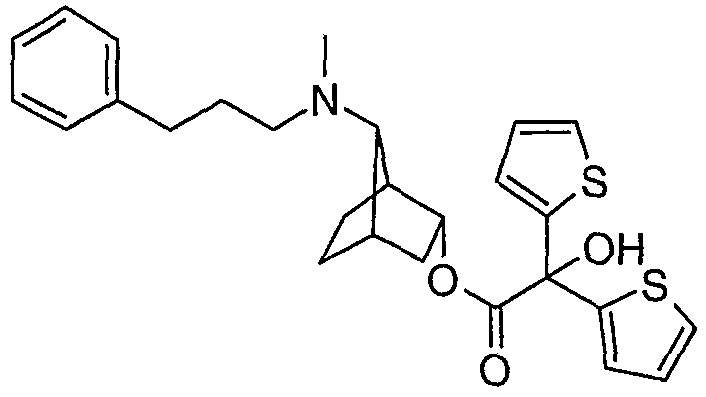
d. (1S,2R)-7-[метил-(3-фенилпропил)амино]бицикло[2.2.1]гепт-2-иловый эфир анти-гидроксидитиофен-2-илуксусной кислоты
К раствору (1S,2R)-7-метиламинобицикло[2.2.1]гепт-2-илового эфира анти-гидроксидитиофен-2-илуксусной кислоты (150 мг, 0,41 ммоль) в 1,2-дихлорэтане (10 мл) добавляют 3-фенилпропаналь (55 мкл, 0,41 ммоль). Смесь перемешивают при температуре окружающей среды в течение 10 минут, затем добавляют триацетоксиборгидрид натрия (174 мг, 0,82 ммоль) и смесь перемешивают при температуре окружающей среды в течение 2 часов. Добавляют водный гидрокарбонат натрия (насыщ. 10 мл) и смесь разделяют посредством картриджа фазового разделения, промывая водную фазу ДХМ. Объединенные органические слои упаривают, получая желтое масло. Очистка флеш-хроматографией на силикагеле, используя в качестве элюента смесь 0-10% этилацетата в ДХМ, дает 150 мг (76%) указанного в заголовке соединения: ЖХ-МС (способ 2): Rt 2,65 минуты, m/z 482 [MH]+.
e. Анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-фенилпропил)аммоний бромид
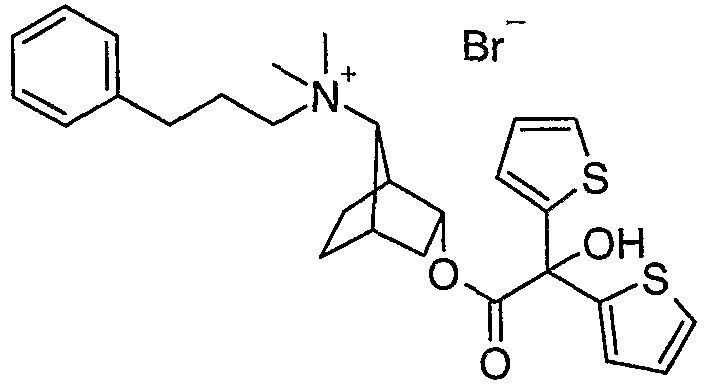
Раствор (1S,2R)-7-[метил-(3-фенилпропил)амино]бицикло[2.2.1]гепт-2-илового эфира анти-гидроксидитиофен-2-илуксусной кислоты (150 мг, моль) в 30% мас./мас. растворе метилбромида в ацетонитриле (5 мл) нагревают в герметизированной пробирке в течение 3 дней при 60°С. Растворитель удаляют и остаток очищают флеш-хроматографией на силикагеле, используя в качестве элюента смесь 5-10% метанола в ДХМ, получая 100 мг (65%) указанного в заголовке соединения в виде белого твердого вещества: ЖХ-МС (способ 1): Rt 8,43 минуты, m/z 496 [M]+;1H-ЯМР (ДМСО, 400 МГц) δ 1,01 (1H, дд, J=13,4 Гц, 3,1 Гц), 1,35 (1H, м), 1,69 (2H, м), 1,95 (1H, м), 2,04 (2H, м), 2,19 (1H, м), 2,61 (3H, м), 2,93 (1H, ушир.т, J=3,5 Гц), 3,07 (3H, с), 3,06 (3H, с), 3,39 (2H, м), 3,53 (1H, с), 5,0 (1H, м), 7,01 (2H, м), 7,10 (2H, м), 7,22 (1H, м), 7,27 (2H, м), 7,32 (2H, м), 7,39 (1H, с), 7,51 (2H, м).
ПРИМЕРЫ 14 и 15
Транс-1-анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]-1-метил-4-фенилпиперидиний бромид и цис-1-анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]-1-метил-4-фенилпиперидиний бромид (II-a): NRaRb = пиперидинил, Rc = Me, Rd = 2,2-дитиофен-2-илацетокси
а. (1S,2R)-7-(4-фенилпиперидин-1-ил)бицикло[2.2.1]гепт-2-иловый эфир анти-гидроксидитиофен-2-илуксусной кислоты
Указанное в заголовке соединение получают из (1S,2R,3R)-2,3-дибромбицикло[3.2.0]гептан-6-она и 4-фенилпиперидина, используя способы, аналогичные способам примеров 1 и 13. ЖХ-МС (способ 2): Rt 2,60 минуты, m/z 494 [MH]+.

b. Транс-1-анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]-1-метил-4-фенилпиперидиний бромид и цис-1-анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]-1-метил-4-фенилпиперидиний бромид
Указанные в заголовке соединения получают из (1S,2R)-7-(4-фенилпиперидин-1-ил)бицикло[2.2.1]гепт-2-илового эфира анти-гидроксидитиофен-2-илуксусной кислоты, используя способ, аналогичный примеру 13, затем разделяют, используя колоночную хроматографию на силикагеле, используя в качестве элюента смесь 5-15% метанола в ДХМ:
Транс-1-анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]-1-метил-4-фенилпиперидиний бромид: ЖХ-МС (способ 1): Rt 8,06 минуты, m/z 508 [M]+; (CDCl3) δ 1,27 (1H, м), 1,57 (1H, м), 1,77 (1H, м), 1,86 (1H, м), 2,06 (3H, м), 2,20 (2H, д, J=15,3 Гц), 2,40 (1H, м), 2,86 (1H, ушир.т, J=3,7 Гц), 3,03 (1H, ушир.т, J=3,7 Гц), 3,42 (1H, м), 3,61 (3H, с), 3,65 (1H, д, J=13,6 Гц), 3,69 (1H, с), 3,82 (1H, д, J=13,6 Гц), 4,50 (2H, м), 4,66 (1H, с), 5,16 (1H, м), 7,00 (2H, м), 7,17 (2H, м), 7,23 (2H, м), 7,26 (1H, м), 7,33 (4H, м).
Цис-1-анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]-1-метил-4-фенилпиперидиний бромид: ЖХ-МС (способ 1): Rt 8,10 минуты, m/z 508 [M]+; (CDCl3) δ 1,16 (1H, дд, J=13,8, 3,0 Гц), 1,52 (1H, м), 1,72 (2H, м), 2,08 (5H, м), 2,59 (1H, м), 2,86 (1H, ушир.т, J=4,0 Гц), 3,09 (1H, м), 3,20 (1H, ушир.с), 3,36 (3H, с), 3,82 (2H, д, J=12,2 Гц), 3,99 (2H, т, J=12,2 Гц), 4,63 (1H, с), 5,01 (1H, с), 5,32 (1H, м), 6,96 (2H, м), 7,16 (2H, м), 7,24 (5H, м), 7,31 (2H, м).
Нижеследующие примеры получают способом, аналогичным способу, описанному для примеров 13-14.
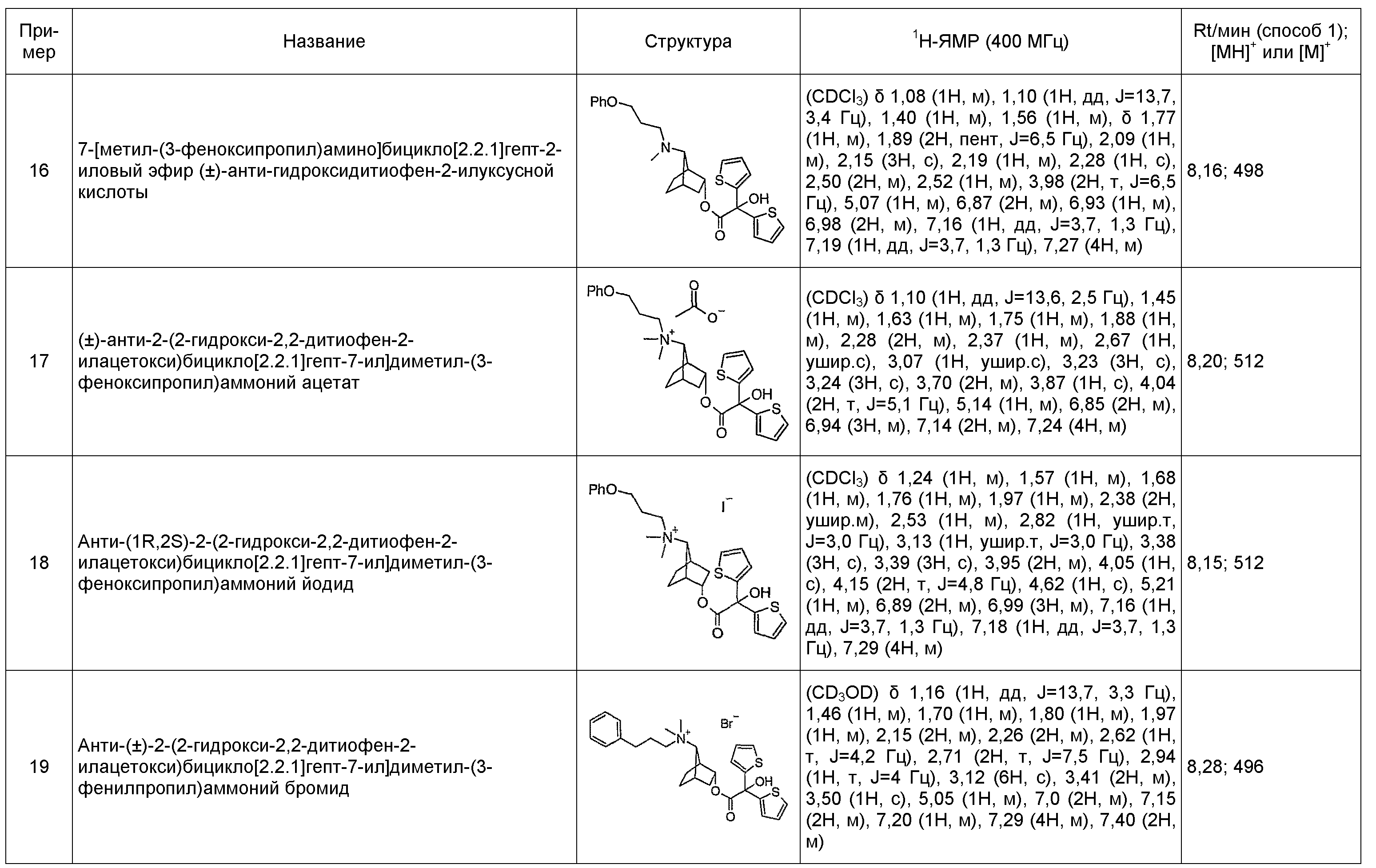



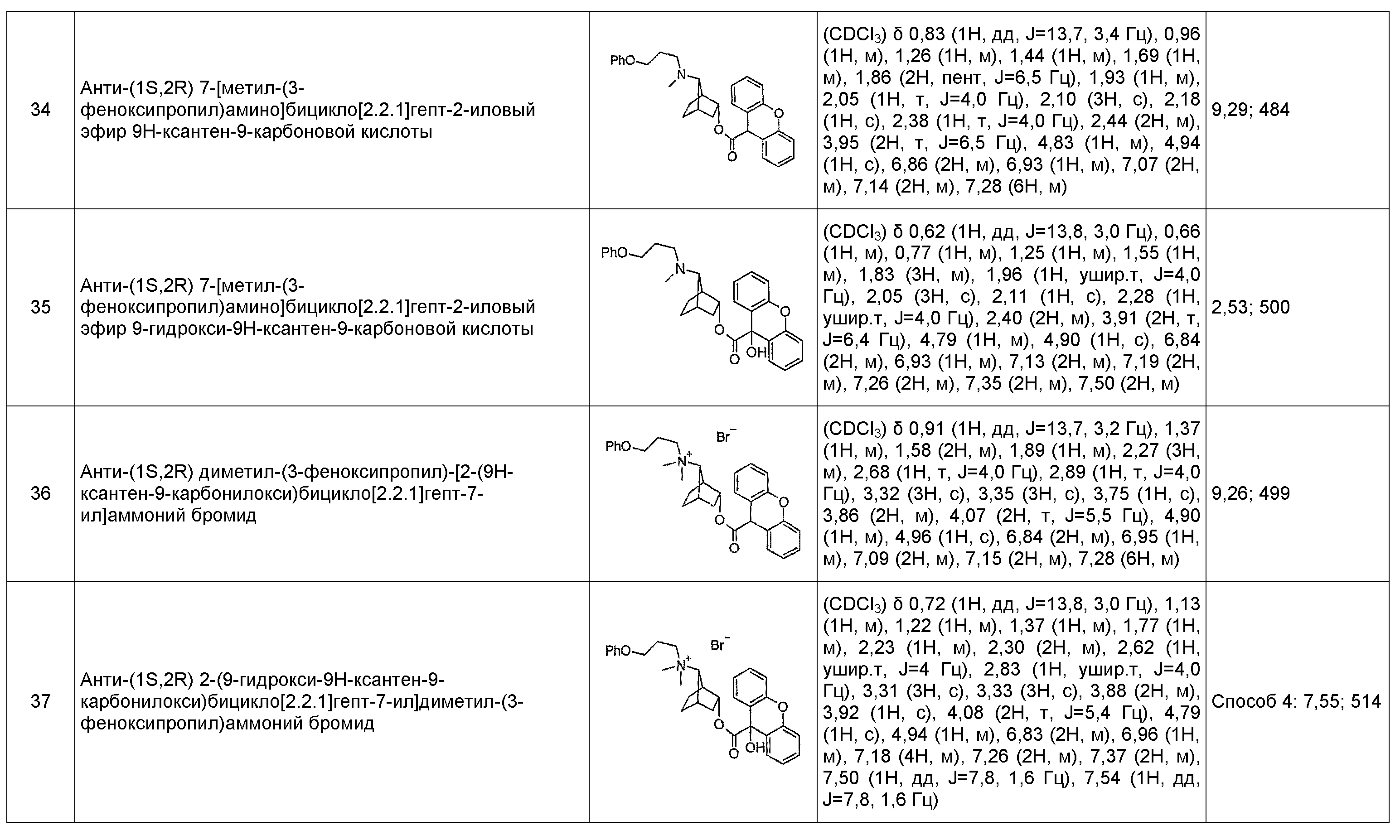
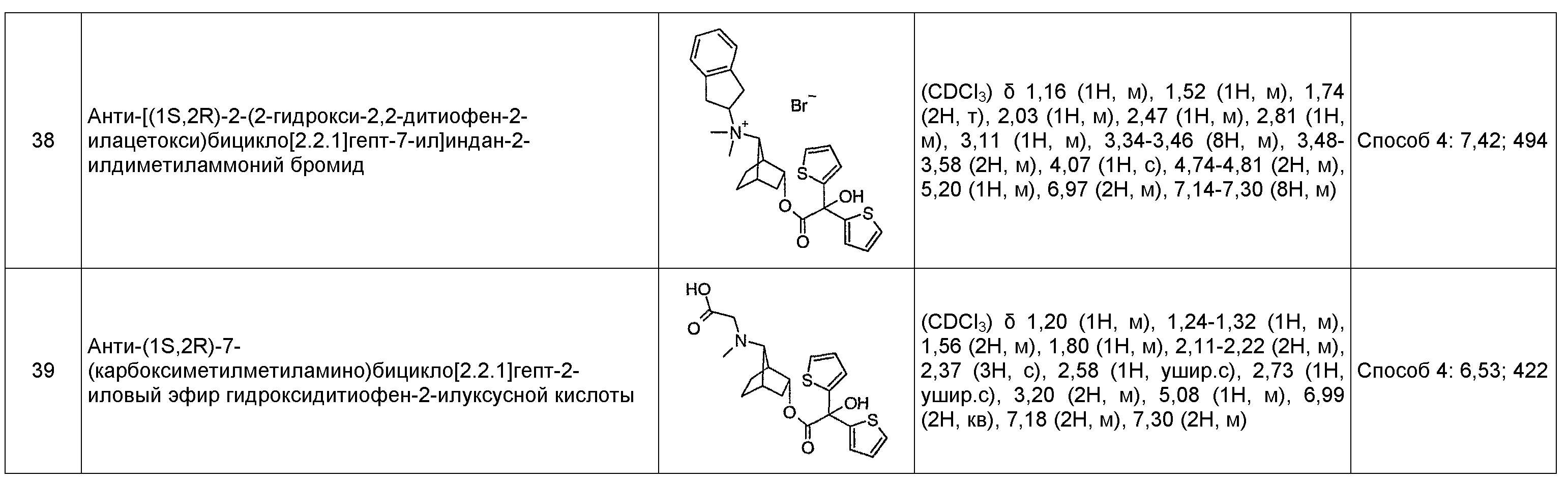
ПРИМЕР 40
Анти-(1S,2R) 2-(2-гидрокси-2,2-дифенилэтокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-феноксипропил)аммоний бромид

а. 2-{анти-(1S,2R)-7-[метил-(3-феноксипропил)амино]бицикло[2.2.1]гепт-2-илокси}-1,1-дифенилэтанол
Раствор анти-(1S,2R)-7-[метил-(3-феноксипропил)амино]бицикло[2.2.1]гептан-2-ола (177 мг, 0,64 ммоль) в 5 мл ДМСО перемешивают в атмосфере азота при температуре окружающей среды. Добавляют дисперсию гидрида натрия (45 мг, 60% дисперсия в масле) и реакционную смесь нагревают до 70°С в течение 60 минут, прежде чем ее охладить до 50°С. К аниону добавляют 1,1-дифенилэтиленоксид (256 мг, 1,31 ммоль) и продолжают нагревание в течение 60 минут. Реакционную смесь охлаждают до температуры окружающей среды, гасят добавлением воды, экстрагируют в EtOAc и объединенные органические экстракты промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют в вакууме. Реакционную смесь очищают хроматографией на силикагеле, используя в качестве элюента градиент 0-15% Et2O-циклогексан, получая продукт в виде прозрачного масла (22 мг). ЖХ-МС (способ 3): Rt 2,62 минуты, m/z 472 [MH]+.
b. Анти-(1S,2R) 2-(2-гидрокси-2,2-дифенилэтокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-феноксипропил)аммоний бромид
Указанное в заголовке соединение получают из 2-{анти-(1S,2R)-7-[метил-(3-феноксипропил)амино]бицикло[2.2.1]гепт-2-илокси}-1,1-дифенилэтанола, используя способы, аналогичные способам, описанным в примере 13. ЖХ-МС (способ 1): Rt 8,69 минуты, m/z 486 [M]+; (CDCl3) δ 1,07 (1Н, дд, J=13,3, 3,4 Гц), 1,60 (2Н, м), 1,89 (1Н, м), 2,09 (1Н, м), 2,30 (1Н, м), 2,37 (2Н, м), 2,66 (1Н, ушир.т, J=4,0 Гц), 2,93 (1Н, ушир.т, J=4,0 Гц), 3,22 (1Н, с), 3,37 (3Н, с), 3,38 (3Н, с), 3,09 (2Н, с), 3,97 (2Н, м), 4,07 (1Н, с), 4,14 (2Н, т, J=5,5 Гц), 4,17 (1Н, м), 6,86 (2Н, м), 6,96 (1Н, м), 7,26 (3Н, м), 7,31 (5Н, м), 7,40 (4Н, м).
ПРИМЕР 41
(1S,2R,4S,7S)-7-({9-[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]нонил}метиламино)бицикло[2.2.1]гепт-2-иловый эфир гидроксидитиофен-2-илуксусной кислоты
а. (9-бромнонилокси)-трет-бутилдиметилсилан
Трет-бутилдиметилсилилхлорид (28,16 г, 186,8 ммоль) добавляют порциями к раствору 9-бромнонан-1-ола (27,8 г, 124,6 ммоль) и имидазола (25,4 г, 373 ммоль) в сухом ДХМ (400 мл) при -10°С в атмосфере азота. Реакционной смеси дают возможность нагреться до температуры окружающей среды на протяжении ночи. Твердые вещества удаляют фильтрацией и фильтрат промывают 10% лимонной кислотой (водн.), затем насыщенным раствором соли, сушат (MgSO4), фильтруют и концентрируют досуха, получая указанное в заголовке соединение в виде желтого масла.
Выход: 41,4 г, 98%.
ТСХ: Rf 0,91 (смесь 50% диэтиловый эфир/циклогексан).

b. [9-(трет-бутилдиметилсиланилокси)нонил]метиламин
Раствор метиламина (120 мл, 2 М) добавляют к раствору (9-бромнонилокси)-трет-бутилдиметилсилана (41,4 г, 123 ммоль) в IMS (200 мл) при -10°С и затем смеси предоставляют возможность нагреться до температуры окружающей среды на протяжении ночи. После выпаривания растворителя остаток растирают в диэтиловом эфире и твердые вещества извлекают фильтрацией, получая указанное в заголовке соединение в виде соли HBr. Фильтрат концентрируют в вакууме, суспендируют в K2CO3 (водн.) и экстрагируют ДХМ. Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют, получая указанное в заголовке соединение в виде масла.
Выход: 24,1 г, 68% (11,1 г соли HBr, 24%).
ЖХ-МС (способ 2): Rt 2,80 минуты, m/z 288 [MH]+.

с. (1S,4S,7S)-5-бром-7-{[9-(трет-бутилдиметилсиланилокси)нонил]метиламино}бицикло[2.2.1]гептан-2-он
К раствору (1S)-2,3-дибромбицикло[3.2.0]гептан-6-она (2,15 г, 8,02 ммоль) в ацетоне (20 мл) добавляют [9-(трет-бутилдиметилсиланилокси)нонил]метиламин (5,77 г, 12,3 ммоль) и реакционную смесь перемешивают при температуре окружающей среды в течение 3 дней. После выпаривания растворителя остаток поглощают в смеси диэтиловый эфир/этилацетат и промывают смесью насыщ.NaHCO3(водн.)/насыщенный раствор соли. Водный слой экстрагируют диэтиловым эфиром. Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют досуха, получая темно-коричневое масло, которое очищают колоночной хроматографией на силикагеле, используя в качестве элюента градиент 5-15% диэтиловый эфир/пентан. После выпаривания летучих компонентов указанное в заголовке соединение получают в виде светло-желтого/коричневого масла.
Выход: 1,67 г, 44%.
ЖХ-МС (способ 3): Rt 4,83 минуты, m/z 474+476 [MH+].

d. (1S,4S,7S)-7-{[9-(трет-бутилдиметилсиланилокси)нонил]метиламино}бицикло[2.2.1]гептан-2-он
К раствору (1S,4S,7S)-5-бром-7-{[9-(трет-бутилдиметилсиланилокси)нонил]метиламино}бицикло[2.2.1]гептан-2-она (1,97 г, 4,2 ммоль) и AIBN (70 мг, 0,42 ммоль) в сухом дегазированном толуоле (40 мл) в атмосфере азота добавляют три-н-бутилоловогидрид (1,25 мл, 4,65 ммоль) и нагревают при 80°С на предварительно нагретой песочной бане. Через 2 часа при 80°С реакционную смесь концентрируют в вакууме и очищают колоночной хроматографией на силикагеле, используя в качестве элюента градиент 1-40% диэтиловый эфир/пентан. После выпаривания летучих компонентов получают указанное в заголовке соединение в виде светло-желтого/коричневого масла.
Выход: 2,41 г, количественный (содержит остатки бутилолова).
ЖХ-МС (способ 3): Rt 3,10 минуты, m/z 396 [MH+]

е. (1S,2R,4S,7S)-7-{[9-(трет-бутилдиметилсиланилокси)нонил]метиламино}бицикло[2.2.1]гептан-2-ол
К раствору (1S,4S,7S)-7-{[9-(трет-бутилдиметилсиланилокси)нонил]метиламино}бицикло[2.2.1]гептан-2-она (4,11 г, 10,4 ммоль макс) в сухом ТГФ (41 мл) при -5°С в атмосфере азота добавляют три-трет-бутоксиалюминийгидрид лития (3,44 г, 13,5 ммоль). Через 1,5 часа при -5°С добавляют еще три-трет-бутоксиалюминийгидрид лития (2,64 г, 10,4 ммоль). Через 1 час при -5°С реакцию гасят насыщ. раствором (водн.) хлорида аммония и распределяют между этилацетатом и водой. Твердые вещества удаляют фильтрацией и промывают этилацетатом. Фазы разделяют и водный слой экстрагируют этилацетатом. Объединенные органические слои промывают насыщ. NaHCO3 (водн.), насыщенным раствором соли, сушат (Na2SO4), фильтруют и концентрируют досуха, получая мутное желтое масло. Сырой продукт очищают колоночной хроматографией на силикагеле, используя в качестве элюента градиент 7,5-10% МеОН/ДХМ. После выпаривания летучих компонентов получают желтовато-коричневое вязкое масло.
Выход: 2,36 г, 57%.
ЖХ-МС (способ 2): Rt 2,95 минуты, m/z 398 [MH+].

f. (1S,2R,4S,7S)-7-{[9-(трет-бутилдиметилсиланилокси)нонил]метиламино}бицикло[2.2.1]гепт-2-иловый эфир гидроксидитиофен-2-илуксусной кислоты
Гидрид натрия (254 мг, 60% суспензия в минеральном масле, 6,35 ммоль) добавляют к раствору (1S,2R,4S,7S)-7-{[9-(трет-бутилдиметилсиланилокси)нонил]метиламино}бицикло[2.2.1]гептан-2-ола (1,01 г, 2,54 ммоль) в сухом толуоле (20 мл) при 0°С в атмосфере азота. Как только спадет выделение газа, порциями добавляют этиловый эфир гидроксидитиофен-2-илуксусной кислоты (817 мг, 3,04 ммоль), и после того как прекратится выделение газа, реакционную смесь нагревают при 80°С на предварительно нагретой песочной бане. Через 2,5 часа реакционную смесь выливают в смесь насыщенного хлорида аммония (водн.) и простого эфира. Слои разделяют, водный слой экстрагируют простым эфиром и объединенные органические слои промывают насыщенным раствором соли, сушат (Na2SO4), фильтруют и концентрируют досуха, получая светло-коричневое вязкое масло. Сырой продукт очищают колоночной хроматографией на силикагеле, используя в качестве элюента градиент 1-40% этилацетата в ДХМ, получая продукт в виде (очень) светло-коричневого вязкого масла.
Выход: 0,76 г, 48%.
ЖХ-МС (способ 3): Rt 3,44 минуты, m/z 620 [MH+].

g. (1S,2R,4S,7S)-7-[(9-гидроксинонил)метиламино]бицикло[2.2.1]гепт-2-иловый эфир гидроксидитиофен-2-илуксусной кислоты
Раствор (1S,2R,4S,7S)-7-{[9-(трет-бутилдиметилсиланилокси)нонил]метиламино}бицикло[2.2.1]гепт-2-иловый эфир гидроксидитиофен-2-илуксусной кислоты (0,51 г, 0,82 ммоль) в ТГФ (7 мл) обрабатывают 1 М HCl (3,5 мл) и перемешивают при температуре окружающей среды в течение 45 минут. Реакционную смесь нейтрализуют насыщ. NaHCO3 (водн.) и экстрагируют этилацетатом. Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют досуха, получая светло-коричневое масло, которое используют без дополнительной очистки.
Выход: 273 мг, 66%.
ЖХ-МС (способ 3): Rt 2,39 минуты, m/z 506 [MH+].

h. (1S,2R,4S,7S)-7-[метил-(9-оксононил)амино]бицикло[2.2.1]гепт-2-иловый эфир гидроксидитиофен-2-илуксусной кислоты
Периодинан Dess-Martin (450 мг, 1,06 ммоль) добавляют к раствору (1S,2R,4S,7S)-7-[(9-гидроксинонил)метиламино]бицикло[2.2.1]гепт-2-илового эфира гидроксидитиофен-2-илуксусной кислоты (370 мг, 0,732 ммоль) в сухом ДХМ (3 мл) при 0°С и реакционной смеси предоставляют возможность нагреться до температуры окружающей среды. Через 1 час при температуре окруающей среды реакционную смесь обрабатывают насыщ. NaHCO3 (водн.) и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат (Na2SO4), фильтруют и концентрируют досуха. Остаток растирают в простом эфире и твердые вещества удаляют фильтрацией. Фильтрат концентрируют, получая оранжево-коричневое вязкое масло, и используют непосредственно без дополнительной очистки.
Выход: 458 мг, 0,73 ммоль макс.

i. (1S,2R,4S,7S)-7-({9-[(R)-2-(трет-бутилдиметилсиланилокси)-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]нонил}метиламино)бицикло[2.2.1]гепт-2-иловый эфир гидроксидитиофен-2-илуксусной кислоты
Смесь (1S,2R,4S,7S)-7-[метил-(9-оксононил)амино]бицикло[2.2.1]гепт-2-илового эфира гидроксидитиофен-2-илуксусной кислоты (макс 0,73 ммоль), 5-[(R)-2-амино-1-(трет-бутилдиметилсиланилокси)этил]-8-гидрокси-1Н-хинолин-2-она (245 мг, 0,73 ммоль), триацетоксиборгидрида натрия (186 мг, 0,88 ммоль) и уксусной кислоты (2 капли) в сухом 1,2-дихлорэтане перемешивают при температуре окружающей среды на протяжении ночи. Реакционную смесь распределяют между ДХМ и насыщ. NaHCO3 (водн). Органический слой сушат (Na2SO4), фильтруют и концентрируют в вакууме, получая темно-зеленую/коричневую смолу, которая отверждается при стоянии и которую очищают препаративной ВЭЖХ (система 2, 2,35%В + 1%В/мин). Фракции, содержащие чистый продукт, концентрируют, нейтрализуют насыщ. NaHCO3 (водн.) и экстрагируют ДХМ. После концентрирования в вакууме получают зеленовато-коричневое масло.
Выход: 72 мг, 12%.
ЖХ-МС (способ 3): Rt 2,51 минуты, m/z 822 [MH+].

j. (1S,2R,4S,7S)-7-({9-[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]нонил}метиламино)бицикло[2.2.1]гепт-2-иловый эфир гидроксидитиофен-2-илуксусной кислоты
Раствор (1S,2R,4S,7S)-7-({9-[(R)-2-(трет-бутилдиметил-силанилокси)-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]нонил}метиламино)бицикло[2.2.1]-гепт-2-илового эфира гидрокси-дитиофен-2-илуксусной кислоты (72 мг, 0,087 ммоль) и тригидрофторида триэтиламина (60 мкл, 0,37 ммоль) перемешивают в смеси ТГФ/ДХМ (1:1, 2 мл) при температуре окружающей среды на протяжении ночи. Реакционную смесь нейтрализуют насыщ. NaHCO3 (водн.) и экстрагируют ДХМ. Органический слой концентрируют досуха, получая зеленое/коричневое масло, которое очищают препаративной ВЭЖХ (система 1, 15%В + 1%В/мин в течение 20 минут, затем 6%В/мин в течение 10 минут). Фракции, содержащие чистый продукт, концентрируют, нейтрализуют насыщ. NaHCO3 (водн.) и экстрагируют ТГФ. После концентрирования в вакууме получают светло-коричневое масло.
Выход: 50 мг, 81%.
ЖХ-МС (способ 3): Rt 2,04 минуты, m/z 708 [MH+].
ПРИМЕР 42
(Бензилкарбамоилметил)-анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметиламмоний бромид

а. Анти-(1S,2R)-7-[(бензилкарбамоилметил)метиламино]бицикло[2.2.1]гепт-2-иловый эфир гидроксидитиофен-2-илуксусной кислоты
Получают раствор (1S,2R)-7-метиламинобицикло[2.2.1]гепт-2-илового эфира анти-гидроксидитиофен-2-илуксусной кислоты (50 мг, 0,14 ммоль) в ацетонитриле (3 мл). Добавляют DIPEA (49 мкл, 0,28 ммоль) и N-бензил-2-бромацетамид (48 мг, 0,21 ммоль) и смесь перемешивают при 50°С в течение 2 часов. Растворитель выпаривают и очищают колоночной флеш-хроматографией на силикагеле, используя в качестве элюента градиент 0-10% этилацета в ДХМ, получая указанное в заголовке соединение в виде бледно-желтого масла (60 мг, 84%): ЖХ-МС (способ 2): Rt 2,83 минуты, m/z 511 [MH+].

b. (Бензилкарбамоилметил)-анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметиламмоний бромид
Указанное в заголовке соединение получают из анти-(1S,2R)-7-[(бензилкарбамоилметил)метиламино]бицикло[2.2.1]гепт-2-илового эфира гидроксидитиофен-2-илуксусной кислоты, используя способ, аналогичный способу, описанному в примере 13: ЖХ-МС (способ 4): Rt 7,53 минуты, m/z 525 [M+]; (CDCl3) δ 1,12 (1H, дд), 1,45-1,52 (1H, м), 1,63 (1H, м), 1,72-1,80 (1H, м), 1,88-1,97 (1H, м), 2,28 (1H, м), 2,74 (1H, ушир.т), 3,06 (1H, ушир.т), 3,34 (3H, с), 3,36 (3H, с), 4,17 (1H, с), 4,41 (2H, д), 4,68 (2H, дд), 4,79 (1H, с), 5,60 (1H, м), 6,98 (2H, м), 7,15 (2H, м), 7,19-7,23 (1H, м), 7,25-7,31 (4H, м), 7,36 (2H, д), 9,55 (1H, т).
Нижеследующий пример получают способом, аналогичным способу, описанному для примера 42.

ПРИМЕР 44
Анти-(1S,2R) [2-(2-циклогексил-2-гидрокси-2-фенилацетокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-феноксипропил)аммоний бромид

а. Анти-(1S,2R) 7-[метил-(3-феноксипропил)амино]бицикло[2.2.1]гепт-2-иловый эфир оксофенилуксусной кислоты
Раствор анти-(1S,2R) 7-[метил-(3-феноксипропил)амино]бицикло[2.2.1]гептан-2-ола (0,77 г, 2,8 ммоль) в безводном ТГФ (10 мл) перемешивают при температуре окружающей среды в атмосфере азота с гидридом натрия (145 мг 60% дисперсии в масле) в течение 3 часов. Добавляют оксофенилацетилхлорид (611 мг, 3,64 ммоль) и реакционной смеси предоставляют возможность стоять в течение 60 часов. Реакцию гасят добавлением насыщ. NH4Cl, экстрагируют в EtOAc и объединенные органические экстракты промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют в вакууме. Реакционную смесь очищают хроматографией на силикагеле, используя в качестве элюента градиент 0-5% Et2O-циклогексан, получая продукт в виде желтого масла (600 мг). (CDCl3) δ 1,20-1,30 (2H, м), 1,63-1,71 (2H, м), 1,78-1,88 (1H, м), 1,88-1,96 (2H, м), 2,14-2,25 (5H, м), 2,35-2,37 (1H, м), 2,50-2,58 (2H, м), 2,66-2,70 (1H, м), 3,97-4,03 (2H, м), 5,20-5,26 (1H, м), 6,85-6,95 (3H, м), 7,24-7,30 (2H, м), 7,48-7,54 (2H, м), 7,63-7,69 (2H, м), 7,95-8,00 (2H, м).

а. Анти-(1S,2R) 7-[метил-(3-феноксипропил)амино]бицикло[2.2.1]гепт-2-иловый эфир циклогексилгидроксифенилуксусной кислоты
К перемешиваемому раствору анти-(1S,2R) 7-[метил-(3-феноксипропил)амино]бицикло[2.2.1]гепт-2-илового эфира оксофенилуксусной кислоты (200 мг, 0,49 ммоль) в безводном ТГФ (5 мл) в атмосфере азота добавляют циклогексилмагнийхлорид (0,5 мл, 0,98 ммоль). Реакционную смесь нагревают при 50°С в течение 18 часов. Охлажденную смесь гасят добавлением насыщ. NH4Cl, экстрагируют в EtOAc и объединенные органические экстракты сушат над MgSO4 и концентрируют в вакууме. Реакционную смесь очищают хроматографией на силикагеле, используя в качестве элюента градиент 5-10% Et2O-циклогексан, получая продукт в виде прозрачного масла (123 мг). ЖХ-МС (способ 1): Rt 2,86 минуты, m/z 492 [MH+].

с. Анти-(1S,2R) [2-(2-циклогексил-2-гидрокси-2-фенилацетокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-феноксипропил)аммоний бромид
Указанное в заголовке соединение получают из анти-(1S,2R) 7-[метил-(3-феноксипропил)амино]бицикло[2.2.1]гепт-2-илового эфира циклогексилгидроксифенилуксусной кислоты, используя методики, описанные в общих чертах в примере 13. ЖХ-МС (способ 1): Rt 2,75 минуты, m/z 506 [M+].
ПРИМЕР 45
Анти-(1S,2R) 7-[метил-(3-феноксипропиламино]бицикло[2.2.1]гепт-2-иловый эфир 2-гидрокси-3,3-диметил-2-фенилмасляной кислоты

Указанное в заголовке соединение получают из анти-(1S,2R) 7-[метил-(3-феноксипропил)амино]бицикло[2.2.1]гепт-2-илового эфира оксофенилуксусной кислоты, используя методики, описанные в общих чертах в примере 44. (CDCl3) δ 0,97-1,05 (9H, с), 1,07-1,28 (2H, м), 1,68-1,79 (2H, м), 1,81-1,96 (3H, м), 2,1-2,24 (5H, м), 2,31 (1H, с), 2,49-2,61 (3H, м), 3,80 (1H, с), 3,97-4,03 (2H, м), 5,02-5,11 (1H, м), 6,86-6,95 (3H, м), 7,23-7,34 (5H, м), 7,69-7,74 (2H, м).
ЖХ-МС (способ 4): Rt 8,29 минуты, m/z 466 [MH+].
ПРИМЕР 46
Анти-(1S,2R) [2-(2-трет-бутил-2-гидрокси-2-фенилацетокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-феноксипропил)аммоний бромид
Указанное в заголовке соединение получают из анти-(1S,2R) 7-[метил-(3-феноксипропиламино]бицикло[2.2.1]гепт-2-илового эфира 2-гидрокси-3,3-диметил-2-фенилмасляной кислоты, используя методики, описанные в примере 13. ЖХ-МС (способ 2): Rt 2,82 минуты, m/z 480 [M+].
ПРИМЕР 47
[Анти-(1R,2R)-2-(2-гидрокси-2,2-дифенилацетиламино)бицикло[2.2.1]гепт-7-ил]диметил-(3-феноксипропил)аммоний бромид

а. (1R,7S)-N7-метил-N7-(3-феноксипропил)бицикло[2.2.1]гептан-2,7-диамин
Получают раствор (1S,7S)-7-[метил-(3-феноксипропил)амино]бицикло[2.2.1]гептан-2-она (1,35 г, 4,9 ммоль) в метаноле (90 мл). Добавляют ацетат натрия (648 мг, 7,9 ммоль), а затем гидрохлорид гидроксиламина (566 мг, 8,2 ммоль). Смесь перемешивают при комнатной температуре в течение 18 часов. Добавляют гексагидрат хлорида никеля(II) (2,11 г, 8,9 ммоль), а затем порциями добавляют боргидрид натрия (1,68 г, 44,5 ммоль). Смесь перемешивают при комнатной температуре в течение еще 18 часов. Растворитель удаляют при пониженном двлении и остаток распределяют между этилацетатом и водным гидроксидом натрия. Органическую фазу сушат над сульфатом натрия, фильтруют и упаривают до смолы. Последнюю загружают в картридж SCX, промывают метанолом и затем элюируют 4 М аммиаком в метаноле. Вещество далее очищают колоночной хроматографией на силикагеле, используя в качестве элюента градиент 0-10% метанола в ДХМ, получая указанное в заголовке соединение в виде коричневого масла (526 мг, 39%). ЖХ-МС (способ 2): Rt 0,34 минуты, m/z 275 [MH+].
b. N-{(1R,7S)-7-[метил-(3-феноксипропил)амино]бицикло[2.2.1]гепт-2-ил}-2-оксо-2-фенилацетамид
Получают раствор (1R,7S)-N7-метил-N7-(3-феноксипропил)бицикло[2.2.1]гептан-2,7-диамина (200 мг, 0,73 ммоль) в ДХМ (3 мл) с диизопропилэтиламином (0,25 мл, 1,46 ммоль). По каплям добавляют раствор оксофенилацетилхлорида (184 мг, 1,09 ммоль) в ДХМ (1 мл). Смесь перемешивают при комнатной температуре в течение 3 часов. Растворитель выпаривают и остаток очищают хроматографией на силикагеле, используя в качестве элюента градиент 0-20% этилацетата в ДХМ, получая указанное в заголовке соединение в виде безцветного масла (150 мг, 51%). ЖХ-МС (способ 2): Rt 2,28 минуты, m/z 407 [MH+].

с. 2-гидрокси-N-{анти-(1R,2R)-7-[метил-(3-феноксипропил)амино]бицикло[2.2.1]гепт-2-ил}-2,2-дифенилацетамид
Получают охлажденный (0°С) раствор N-{(1R,7S)-7-[метил-(3-феноксипропил)амино]бицикло[2.2.1]гепт-2-ил}-2-оксо-2-фенилацетамида (100 мг, 0,25 ммоль) в ТГФ (5 мл). Добавляют раствор фенилмагнийхлорида (0,26 мл, 2 М в ТГФ, 0,52 ммоль) и раствор перемешивают в течение 1 часа при 0°С, затем раствору предоставляют возможность нагреться до комнатной температуры в течение еще 1 часа. Реакцию гасят добавлением водного хлорида аммония (насыщ. 10 мл). Смесь экстрагируют этилацетатом, затем объединенные органические экстракты сушат над сульфатом натрия, фильтруют и упаривают. Очистка хроматографией на силикагеле, используя градиент 0-5% метанола в ДХМ, дает указанное в заголовке соединение в виде бесцветного масла (20 мг, 17%). ЖХ-МС (способ 2): Rt 2,55 минуты, m/z 485 [MH+].

d. [Анти-(1R,2R)-2-(2-гидрокси-2,2-дифенилацетиламино)бицикло[2.2.1]гепт-7-ил]диметил-(3-феноксипропил)аммоний бромид
Указанное в заголовке соединение получают из 2-гидрокси-N-{анти-(1R,2R)-7-[метил-(3-феноксипропил)амино]бицикло[2.2.1]гепт-2-ил}-2,2-дифенилацетамида, используя способ, аналогичный способу примера 13: ЖХ-МС (способ 1): Rt 7,88 минуты, m/z 499 [M+]; (CD3OD) δ 1,27 (1H, м), 1,66-1,75 (1H, м), 1,85 (2H, т), 2,05 (1H, м), 2,22-2,38 (3H, м), 2,73 (1H, м), 3,00 (1H, с), 3,20 (6H, с), 3,60-3,68 (3H, м), 4,11 (3H, м), 6,92-6,96 (3H, м), 7,25-7,34 (8H, м), 7,40-7,45 (4H, м).
ПРИМЕР 48
Анти-(1S,2R)-7-[(3-диметиламинопропил)метиламино]бицикло[2.2.1]гепт-2-иловый эфир гидроксидитиофен-2-илуксусной кислоты

Указанное в заголовке соединение получают из (1S,2R)-7-метиламинобицикло[2.2.1]гепт-2-илового эфира анти-гидроксидитиофен-2-илуксусной кислоты и хлорида (3-метансульфонилоксипропил)диметиламмония, используя способ, аналогичный способу примера 42: ЖХ-МС (способ 1): Rt 5,02 минуты, m/z 449 [MH+]; (CD3OD) δ 1,07-1,18 (2H, м), 1,50 (2H, м), 1,77 (3H, м), 2,10 (1H, м), 2,17 (3H, с), 2,32 (1H, с), 2,42 (2H, т), 2,54 (1H, с), 2,61 (6H, с), 2,79 (2H, м), 4,57 (1H, ушир.с), 5,02 (1H, м), 6,98 (2H, м), 7,14 (2H, м), 7,38 (2H, м).
ПРИМЕР 49
(3-диметиламинопропил)-[анти-(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметиламмоний бромид

а. Анти-(1S,2R)-7-{[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)этил]метиламино}бицикло[2.2.1]гепт-2-иловый эфир гидроксидитиофен-2-илуксусной кислоты
Указанное в заголовке соединение получают из (1S,2R)-7-метиламинобицикло[2.2.1]гепт-7-илового эфира анти-гидроксидитиофен-2-илуксусной кислоты и N-(2-бромэтил)фталимида, используя способ, аналогичный способу примера 42. ЖХ-МС (способ 2): Rt 2,70 минуты, m/z 537 [MH+].

b. Анти-(1S,2R)-7-[(2-аминоэтил)метиламино]бицикло[2.2.1]гепт-2-иловый эфир гидроксидитиофен-2-илуксусной кислоты
Получают раствор анти-(1S,2R)-7-{[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)этил]метиламино}бицикло[2.2.1]гепт-2-илового эфира гидроксидитиофен-2-илуксусной кислоты (80 мг, 0,15 ммоль) в этаноле (3 мл). Добавляют моногидрат гидразина (72 мкл, 1,49 ммоль) и смесь нагревают при 80°С в течение 1 часа, затем смеси дают возможность охладиться до комнатной температуры. Полученный белый осадок отфильтровывают и фильтрат промывают этанолом. Фильтрат упаривают, получая неочищенное указанное в заголовке соединение: ЖХ-МС (способ 3): Rt 2,03 минуты, m/z 407 [MH+].

с. Анти-(1S,2R)-7-[(2-бензоиламиноэтил)метиламино]бицикло[2.2.1]гепт-2-иловый эфир гидроксидитиофен-2-илуксусной кислоты
Неочищенный анти-(1S,2R)-7-[(2-аминоэтил)метиламино]бицикло[2.2.1]гепт-2-иловый эфир гидроксидитиофен-2-илуксусной кислоты (0,15 ммоль) растворяют в ДХМ (5 мл). Добавляют диизопропилэтиламин (31 мкл, 0,23 ммоль), а затем бензоилхлорид (17 мкл, 0,15 ммоль). Смесь перемешивают при комнатной температуре в течение 30 минут. Добавляют воду (5 мл) и органический слой отделяют с помощью картриджа фазового разделения и упаривают. Очистка хроматографией на силикагеле, используя в качестве элюента градиент 0-20% этилацетата в ДХМ, дает указанное в заголовке соединение в виде бесцветного масла (30 мг, 39%). ЖХ-МС (способ 3): Rt 2,47 минуты, m/z 511 [MH+].

d. (2-бензоиламиноэтил)-анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметиламмоний бромид
Указанное в заголовке соединение получают из анти-(1S,2R)-7-[(2-бензоиламиноэтил)метиламино]бицикло[2.2.1]гепт-2-илового эфира гидроксидитиофен-2-илуксусной кислоты, используя способ, аналогичный способу примера 13: ЖХ-МС (способ 1): Rt 7,25 минуты, m/z 525 [M+]; (CD3OD) δ 1,18 (1H, дд), 1,47-1,55 (1H, м), 1,74-1,90 (2H, м), 1,99-2,09 (1H, м), 2,31 (1H, м), 2,80 (1H, м), 3,12 (1H, м), 3,27 (3H, с), 3,27 (3H, с), 3,64-3,69 (3H, м), 3,89 (2H, т), 5,09 (1H, м), 7,00 (2H, м), 7,14 (2H, м), 7,40 (2H, м), 7,45-7,50 (2H, м), 7,54-7,58 (1H, м), 7,85-7,88 (2H, м).
БИОЛОГИЧЕСКИЕ ПРИМЕРЫ
Ингибирующие действия соединений по настоящему изобретению по отношению к мускариновому рецептору М3 и (в случае примера 41) адренергическому рецептору β2 определяют с помощью нижеследующих анализов связывания.
Анализы связывания радиолиганда с мускариновым рецептором
Для оценки сродства мускариновых антагонистов по отношению к мускариновым рецепторам М2 и М3 используют исследования связывания радиолиганда с использованием [3H]-N-метилскополамина ([3H]-NMS) и коммерчески доступных клеточных мембран, экспрессирующих человеческие мускариновые рецепторы (М2 и М3). Мембраны в трис-буфере инкубируют в 96-луночных планшетах с [3H]-NMS и антагонистом М3 при различных концентрациях в течение 3 часов. Затем мембраны и связанный радиолиганд собирают фильтрацией и оставляют сохнуть на протяжении ночи. Затем добавляют сцинтилляционную жидкость и связанный радиолиганд считывают, используя сцинтилляционный счетчик Canberra Packard Topcount.
Время полужизни антагонистов на каждом мускариновом рецепторе измеряют, используя альтернативный радиолиганд [3H]-QNB и адаптацию (модификацию) вышеизложенного анализа сродства. Антагонисты инкубируют в течение 3 часов при концентрации, в 10 раз превышающей их Ki, определенной с лигандом [3H]-QNB, с мембранами, экспрессирующими человеческие мускариновые рецепторы. По окончании этого времени [3H]-QNB добавляют до концентрации, в 25 раз превышающей его Kd, для рецептора, подлежащего исследованию, и инкубацию продолжают на протяжении различных периодов времени от 15 минут до 180 минут. Затем мембраны и связанный радиолиганд собирают фильтрацией и оставляют сохнуть на протяжении ночи. Затем добавляют сцинтилляционную жидкость и считывают связанный радиолиганд, используя сцинтилляционный счетчик Canberra Packard Topcount.
Скорость, при которой обнаруживается связывание [3H]-QNB с мускариновыми рецепторами, соотносят к скорости, с которой антагонист диссоциирует с рецептора, и принимают как время полужизни антагонистов на рецепторах.
Результаты:
В вышеприведенной таблице эффективности связывания М3 (значения Ki) указаны следующим образом: <1 нМ '+++'; 1-10 нМ '++'; >10 нМ '+'. Все испытуемые соединения демонстрируют значения Ki <5000 нМ. NT = не подвергались испытанию.
Анализ связывания радиолиганда с β-адренергическим рецептором
Для оценки сродства антагонистов по отношению к β-адренергическому рецептору используют исследования связывания радиолиганда с использованием [125I]-йодцианопиндолола и коммерчески доступных клеточных мембран, экспрессирующих человеческий β2-адренергический рецептор. Мембраны и SPA-шарики инкубируют с [125I]-йодцианопиндололом и антагонистом β2 при различных концентрациях в течение 3 часов при температуре окружающей среды в Трис-буфере. Анализ осуществляют в 96-луночных планшетах, которые считывают, используя счетчик Wallac Microbeta. В этом анализе пример 41 демонстрирует значение Ki <100 нМ.
Анализ ингибирования активации рецептора М3 посредством мобилизации кальция
В альтернативном анализе связывания рецептора М3 клетки СНО, экспрессирующие человеческий рецептор М3, высевают и инкубируют на протяжении ночи в 96-луночных планшетах с адсорбированным коллагеном (черная стенка, прозрачное дно) при плотности 50000/75 мкл среды в 3% сыворотке. На следующий день получают чувствительный к кальцию краситель (Molecular Devices, Cat # R8041) в буфере HBSS с добавлением 5 мМ пробенецида (рН 7,4). К клеткам добавляют равный объем раствора красителя (75 мкл) и инкубируют в течение 45 минут с последующим добавлением 50 мкл мускариновых антагонистов или наполнителя. Через еще 15 минут планшет считывают на FLEXstationTM (возбуждение 488 нм, испускание 525 нм) в течение 15 секунд, чтобы определить базовую флуоресценцию. Затем добавляют мускариновый агонист, Carbachol, при концентрации ЕС80 и измеряют флуоресценцию в течение еще 60 секунд. Сигнал рассчитывают вычитанием максимального отклика из среднего значения базовой флуоресценции в контрольных лунках в отсутствие антагониста. Затем вычисляют процент максимального ответа в присутствии антагониста, чтобы получить кривые IC50.
Ингибирующие действия соединений по настоящему изобретению на мускариновый рецептор М3 могут быть оценены в нижеследующих ex-viva и in vivo анализах.
Оценка эффективности и продолжительности действия в изолированной трахее морской свинки
Эксперименты осуществляют при 37°С в модифицированном растворе Кребса-Хенселейта (114 мМ NaCl, 15 мМ NaHCO3, 1 мМ MgSO4, 1,3 мМ CaCl2, 4,7 мМ KCl, 11,5 мМ глюкозы и 1,2 мМ KH2PO4, рН 7,4), насыщенном газовой смесью 95% О2/5% СО2. Индометацин добавляют до конечной концентрации 3 мкМ.
Трахеи извлекают у морских свинок Dunkin Hartley, взрослых самцов, и отделяют от сросшейся ткани прежде, чем вскрыть вдоль, в направлении, противоположном мышце. Отдельные полоски по ширине 2-3 хрящевых колец нарезают и подвешивают, используя хлопковую нить, в 10-мл ваннах для органов с водяной рубашкой и присоединяют к динамометрическому датчику так, чтобы обеспечить расположение ткани между двумя платиновыми электродами. Ответы регистрируют с помощью системы сбора данных MP100W/Ackowledge, соединенной с компьютером (РС). Ткани уравновешивают в течение одного часа в режиме покоящегося тонуса в 1g и затем подвергают стимуляции электрическим полем (EFS) при частоте 80 Гц с длительностью импульса 0,1 мс (миллисекунд), монополярный импульс, запускаемого каждые 2 минуты. Для каждой ткани строят кривую зависимости “напряжение-ответ” и затем прикладывают субмаксимальное напряжение к каждому кусочку ткани в соответствии с его собственной реакцией на напряжение. Ткани промывают раствором Кребса и оставляют стабилизироваться стимулированными до добавления испытуемого соединения. Кривые зависимости концентрация-ответ получают посредством кумулятивного добавления испытуемого соединения в полулогарифмических (half-log) приращениях. Как только ответ на каждое добавление достигнет плато, проводят следующее добавление. Процентное ингибирование EFS-стимулированного сокращения вычисляют для каждой концентрации каждого добавляемого соединения и, используя программное обеспечение Graphpad Prism, строят кривые зависимости доза-ответ и (по ним) вычисляют EC50 для каждого соединения.
Исследования, направленные на определение времени начала действия и продолжительности действия испытуемого соединения, осуществляют путем добавления предварительно определенной концентрации EC50 соединения к EFS сокращенным тканям и достижения (ими) реакции до выхода на плато. Время, требуемое для достижения 50% этого ответа, определяют как начальное время. Затем ткани отмывают от соединения путем промывания ванны для ткани свежеприготовленным раствором Кребса и измеряют время, требуемое для возврата до 50% состояния (ответа) сжатия в ответ на EFS в присутствии соединения. Этот период определяют как продолжительность действия. В качестве примера, в этом анализе соединение примера 20 имело EC50 0,8 нМ и продолжительность действия 540 минут.
Метахолин-индуцированный бронхостеноз in vivo
Морских свинок (Dunkin Hartley), мужской особи, весом 500-600 г, размещенных в клетках группами по 5 особей, идентифицируют индивидуально. Животным предоставляют возможность акклиматизироваться к окружающей среде в течение, по меньшей мере, 5 дней. На протяжении этого времени и времени изучения животным предоставляется свободный доступ к воде и пище.
Морских свинок подвергают анестезии ингаляцией анестезирующим средством, Halothane (5%). Испытуемое соединение или наполнитель (0,25-0,50 мл/кг) вводят интраназально. Животных помещают на обогреваемую мягкую подушечку и дают возможность восстановиться до возвращения их в клетки, где их содержат.
Через 24 часа после дозирования морских свинок окончательно подвергают анестезии уретаном (250 мкг/мл, 2 мл/кг). На хирургической (третьей) стадии наркоза яремную вену подвергают канюлированию, используя portex в.в. канюлю, заполненную гепаринизированным, забуференным фосфатом, физиологическим раствором (hPBS) (10 Е/мл), для в.в. введения метахолина. Трахею обнажают и подвергают канюлированию жесткой portex канюлей и пищевод подвергают катетеризации трансорально, используя гибкую детскую питательную трубку (для зондового питания).
Затем самопроизвольно дышащее животное присоединяют к легочной измерительной системе (EMMS, Hants, UK), состоящей из поточного пневмотахографа и датчика давления. Трахеальную канюлю присоединяют к пневмотахографу и канюлю пищевода присоединяют к датчику давления.
Пищеводную канюлю позиционируют таким образом, чтобы при этом базовое сопротивление (дыханию) составляло от 0,1 до 0,2 см Н2О/мл/с. 2-минутное базовое показание региструют до в.в. введения метахолина (вплоть до 30 мкг/кг, 0,5 мл/кг). 2-минутную регистрацию индуцированного сужения (просвета бронха) начинают с момента в.в. введения.
Программное обеспечение, которое используют для анализа бронхозащитных действий испытуемых соединений, позволяет вычислить максимальное сопротивление (дыханию) и площадь сопротивления под кривой (AUC) во время каждого 2-минутного периода регистрации. На фиг.1 представлены результаты, полученные в этом анализе, для соединения примера 20 (0,1, 0,3 и 1 мкг/кг, интраназально), введенного за 4 часа до Mch (10 мкг/кг в.в.)-индуцированного бронхоспазма, и соединения сравнения, тиотропия.
Реферат
Изобретение относится к новым соединениям формулы (I), обладающим свойствами антагониста мускаринового рецептора М3, пригодного для лечения или предотвращения заболевания или состояния, в (патологию) которого вовлечена активность мускаринового рецептора М3, таких как респираторные заболевания. В формуле (I) ! ! А представляет собой атом кислорода или группу -N(R)-; (i) R представляет собой C1-С6-алкил или атом водорода; и R представляет собой атом водорода или группу -R5, -Z-Y-R5, -Z-NR9R10, -Z-CO-NR9R10, -Z-NR9CO-R5 или -Z-CO2H; и R3 отсутствует или представляет собой С1-С6-алкил, и в этом случае атом азота, к которому он присоединен, представляет собой четвертичный азот и несет положительный заряд; или (ii) R1 и R2 вместе с азотом, к которому они присоединены, образуют гетероциклоалкильное кольцо, при этом указанное кольцо замещено группой -Y-R5 или -Z-Y-R5, и R3 отсутствует или представляет собой С1-С6-алкил, и в этом случае атом азота, к которому он присоединен, представляет собой четвертичный азот и несет положительный заряд; R4 представляет собой группу формулы (а), (b), (с) или (d); Z представляет собой С1-С16-алкиленовую группу; Y представляет собой связь или атом кислорода; R5 представляет собой С1-С6-алкил, арил, фенил, конденсированный с С3-С6циклоалкилом, фенил, конденсированный с гетероциклоалкилом, гетероарил, арил(С1-С8-алкил)-, гетероарил(С1-С8-алкил)-, С3-С6циклоалкильную или гетероС3-С6циклоалкильную группу; R6 представляет собой С1-С6-алкил или атом водорода; n и m равны 0; R8a R8b независимо выбраны из группы, состоящей из арила, фенила, конденсированного с гетероциклоалкилом, гетероарила, C1-С6-алкила, С3-С6циклоалкила; R8 с представляет собой -ОН или С1-С6-алкил; R9 и R10 предст
Формула

где А представляет собой атом кислорода или группу -N(R12)-;
(i) R1 представляет собой C1-С6-алкил или атом водорода; и R2 представляет собой атом водорода или группу -R5, -Z-Y-R5, -Z-NR9R10, -Z-CO-NR9R10, -Z-NR9CO-R5 или -Z-CO2H; и
R3 отсутствует или представляет собой C1-С6-алкил, и в этом случае атом азота, к которому он присоединен, представляет собой четвертичный азот и несет положительный заряд; или
(ii) R1 и R2 вместе с азотом, к которому они присоединены, образуют гетероциклоалкильное кольцо, при этом указанное кольцо замещено группой -Y-R5 или -Z-Y-R5, и
R3 отсутствует или представляет собой С1-С6-алкил, и в этом случае атом азота, к которому он присоединен, представляет собой четвертичный азот и несет положительный заряд;
R4 представляет собой группу формулы (а), (b), (с) или (d);

Z представляет собой С1-С16-алкиленовую группу;
Y представляет собой связь или атом кислорода;
R5 представляет собой С1-С6-алкил, арил, фенил, конденсированный с С3-С6циклоалкилом, фенил, конденсированный с гетероциклоалкилом, гетероарил, арил(С1-С8-алкил)-, гетероарил(С1-С8-алкил)-, С3-С6циклоалкильную или гетероС3-С6циклоалкильную группу;
R6 представляет собой С1-С6-алкил или атом водорода;
n и m равны 0;
R8a R8b независимо выбраны из группы, состоящей из арила, фенила, конденсированного с гетероциклоалкилом, гетероарила, C1-С6-алкила, С3-С6циклоалкила;
R8c представляет собой -ОН или С1-С6-алкил;
R9 и R10 представляют собой независимо атом водорода, С1-С6-алкил, арил, фенил, конденсированный с гетероциклоалкилом, фенил, конденсированный с С3-С6циклоалкилом, гетероарил, фенил(С1-С6-алкил)- или гетероарил (С1-С6-алкил)-группу;
R12 представляют собой С1-С6-алкил или атом водорода;
Ar1 представляет собой фенил;
Ar2 представляют собой независимо фенил; и
Q представляет собой атом кислорода;
когда соединение содержит группу четвертичного аммония, приемлемые противоионы выбирают из хлорида, бромида, иодида, сульфата, метансульфоната, бензолсульфоната, толуолсульфоната (тозилата), фосфата, ацетата, цитрата, лактата, тартрата, мезилата, малеата, фумарата и сукцината;
каждая гетероциклоалкильная группа представляет собой
(i) необязательно замещенную циклоалкильную группу, содержащую от 5 до 6 членов в цикле, которая содержит один гетероатом, выбранный из О или NR;
(ii) циклоалкильную группу, содержащую от 5 до 6 членов в цикле, которая содержит CONR и CONRCO; и где R представляет собой C1-С6алкил;
арил представляет собой моноциклическую или бициклическую ароматическую карбоциклическую часть, содержащую от 6 до 10 атомов углерода;
гетероарил представляет собой ароматическую моноциклическую или бициклическую органическую часть, содержащую от 5 до 10 атомов в циклической структуре, в которой один, два или три атомов в цикле выбраны из атомом азота, кислорода или серы, и если не указано иного циклические группы необязательно замещены до четырех заместителями, выбранными из -ОН или фенила; и если не указано иного
алкиленовые радикалы необязательно замещены C1-С6алкиламино, -NH2, аминоС1-С6алкилом, фенилом, диС1-С6алкиламино, C1-С6алкилом, или
-ОН,
или его фармацевтически приемлемая соль.
А представляет собой атом кислорода или группу -N(R12)-;
R1 представляет собой C1-С6-алкил или атом водорода, и
R2 представляет собой C1-С6-алкил, атом водорода или группу -Z-Y-R5 или группу -Z-NR9R10; или R1 и R2 вместе с азотом, к которому они присоединены, образуют гетероциклоалкильное кольцо, причем указанное кольцо замещено группой -Y-R5 или -Z-Y-R5;
R3 отсутствует или представляет собой C1-С6-алкил, и в этом случае атом азота, к которому он присоединен, представляет собой четвертичный азот и несет положительный заряд;
R4 представляет собой группу формулы (а) или (b):

Z представляет собой C1-С8алкиленовую группу;
Y представляет собой связь или атом кислорода;
R5 представляет собой фенил, фенил, конденсированный с С3-С6диклоалкилом, фенил, конденсированный с гетероциклоалкилом, гетероарил, фенил (C1-C8-алкил)-, гетероарил (C1-C8-алкил) - или гетероС3-С6циклоалкил-группу;
R6 представляет собой С1-С6-алкил или атом водорода;
n и m равны 0;
R8a и R8b независимо выбраны из группы, состоящей из фенила, гетероарилa, С1-С6-алкила, С3-С6циклоалкила;
R8c представляет собой -ОН или С1-С6-алкил;
R9 и R10 представляют собой независимо атом водорода, С1-С6-алкил, арил, гетероарил, арил(С1-С6-алкил) - или гетероарил(С1-С6-алкил)-группу; и R12 представляет собой C1-С6-алкил или атом водорода.
Z представляет собой - (СН2)1-16-алкилен, необязательно замещенный метилом на вплоть до трех атомов углерода в цепи;
Y представляет собой связь или -О-;
R5 представляет собой метил, этил, н- или изопропил, н-, втор- или трет-бутил; или
фенил, 3,4-метилендиоксифенил, 3,4-этилендиоксифенил, дигидробензофуранил, нафтил; или
пиридил, пирролил, пиримидинил, оксазолил, изоксазолил, бензизоксазолил, бензоксазолил, тиазолил, бензтиазолил, хинолил, тиенил, бензтиенил, фурил, бензфурил, имидазолил, бензимидазолил, изотиазолил, бензизотиазолил, пиразолил, изотиазолил, триазолил, бензтриазолил, тиадиазолил, оксадиазолил, пиридазинил, триазинил, индолил или индазолил; или
арилС1-С6алкил, где арильная часть представляет собой фенил, 3,4-метилендиоксифенил, 3,4-этилендиоксифенил, дигидробензо-фуранил или нафтил, и часть -(C1-С6-алкил)- представляет собой -СН2- или -СН2СН2-; или
гетероарилалкил, где гетероарильная часть представляет собой пиридил, пирролил, пиримидинил, оксазолил, изоксазолил, бензизоксазолил, бензоксазолил, тиазолил, бензтиазолил, хинолил, тиенил, бензтиенил, фурил, бензфурил, имидазолил, бензимидазолил, изотиазолил, бензизотиазолил, пиразолил, изотиазолил, триазолил, бензтриазолил, тиадиазолил, оксадиазолил, пиридазинил, триазинил, индолил или индазолил, и часть - (C1-С6-алкил) - представляет собой -СН2- или -СН2СН2-; или
инданил или 1,2,3,4-тетрагидронафталенил; или
гетероциклоалкил(С1-С6-алкил)-, где гетероциклоалкильная часть представляет собой азетидинил, пиперидинил, пиперазинил, N-замещенный пиперазинил, такой как метилпиперазинил, или тетрагидропирролил, и часть -(C1-С6-алкил)- представляет собой -СН2- или -СН2СН2-; или
циклопропил, циклобутил, циклопентил или циклогексил; и
R9 и R10 представляют собой независимо
водород; метил, этил или н- или изопропил;
фенил, 3,4-метилендиоксифенил, 3,4-этилендиоксифенил, дигидробензофуранил, нафтил;
пиридил, пирролил, пиримидинил, оксазолил, изоксазолил, бензизоксазолил, бензоксазолил, тиазолил, бензтиазолил, хинолил, тиенил, бензтиенил, фурил, бензфурил, имидазолил, бензимидазолил, изотиазолил, бензизотиазолил, пиразолил, изотиазолил, триазолил, бензтриазолил, тиадиазолил, оксадиазолил, пиридазинил, триазинил, индолил или индазолил; или
арилС1-С6алкил, где арильная часть представляет собой фенил, 3,4-метилендиоксифенил, 3,4-этилендиоксифенил, дигидробензо-фуранил, или нафтил, и часть -(C1-С6-алкил)- представляет собой -СН2- или -СН2СН2-.
m и n равны 0.
каждый Ar2, представляет собой фенил; и мостиковая связь -Q-между двумя кольцами Ar2 представляет собой -O-.

где кольцо А представляет собой необязательно замещенное фенильное кольцо или моноциклическую гетероциклическую структуру из 5 или 6 атомов в цикле, или фенил, конденсированный с гетероциклоалкилом, где гетероциклоалкильная структура представляет собой моноциклическую гетероциклическую структуру из 5 или 6 атомов в цикле; R8a представляет собой фенил, тиенил, циклопентил или циклогексил; R8b представляет собой фенил; тиенил, циклопентил или циклогексил; s равно 1, 2, 3, 4, 5, 6 или 7 и t равно 0, 1, 2, 3, 4, 5, 6 или 7 при условии, что сумма s+t составляет не больше 10; Y представляет собой связь или -О-, и X- представляет собой фармацевтически приемлемый анион, выбранный из хлорида, бромида, иодида, сульфата, метансульфоната, бензолсульфоната, толуолсульфоната, фосфата, ацетата, цитрата, лактата, тартрата, мезилата, малеата, фумарата и сукцината.

где кольцо В представляет собой необязательно замещенное фенильное кольцо или моноциклическую гетероциклическую структуру из 5 или 6 атомов в цикле, или фенил, конденсированный с гетероциклоалкилом, где гетероциклоалкильная структура представляет собой моноциклическую гетероциклическую структуру из 5 или 6 атомов в цикле; s равно 1, 2, 3, 4, 5, 6 или 7 и t равно 0, 1, 2, 3, 4, 5, 6 или 7 при условии, что сумма s+t составляет не больше 10; Y представляет собой связь или -О-, и X- представляет собой фармацевтически приемлемый анион, выбранный из хлорида, бромида, сульфата, метансульфоната, бензолсульфоната, толуолсульфоната, фосфата, ацетата, цитрата, лактата, тартрата, мезилата, малеата, фумарата и сукцината.
анти-[2-(бифенил-2-илкарбамоилокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-феноксипропил)аммониевых солей,
анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-фенилпропил)аммониевых солей,
анти-[(±)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-фенилпропил)аммониевых солей,
анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-феноксипропил)аммониевых солей,
анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметилфенэтиламмониевых солей,
анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметил-(4-фенилбутил)аммониевых солей,
анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]триметиламмониевых солей,
(2-бензилоксиэтил)-анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]диметиламмониевых солей,
анти-[(1S,2R)-2-(2-гидрокси-2,2-дифенилацетокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-феноксипропил)аммониевых солей,
анти-[(1S,2R)диметил-(3-феноксипропил)-[2-(9Н-ксантен-9-карбонилокси)бицикло[2.2.1]гепт-7-ил]аммониевых солей,
анти-[(1S,2R)2-(9-гидрокси-9Н-ксантен-9-карбонилокси)бицикло[2.2.1]гепт-7-ил]диметил-(3-феноксипропил)аммониевых солей и
анти-[(1S,2R)-2-(2-гидрокси-2,2-дитиофен-2-илацетокси)бицикло[2.2.1]гепт-7-ил]индан-2-илдиметиламмониевых солей.

Комментарии