Системы и методы оптимизации использования образца - RU2620922C2
Код документа: RU2620922C2
Чертежи
































































Описание
[0001] Настоящая заявка претендует на приоритет по заявке на изобретение США с серийным номером No. 61/435,250, поданным 21 января 2011 г, ссылка на которое используется в настоящем документе.
УРОВЕНЬ ТЕХНИКИ
[0002] Открытие большого количества биомаркеров заболеваний, новых видов лечения и появление миниатюризированных медицинских систем открыло новые пути прогнозирования, диагностики и мониторинга лечения заболеваний у постели больного и в других местах распределенного тестирования. Системы для лечения на месте оказания медицинской помощи в состоянии мгновенно выдавать результаты тестов медицинскому персоналу, другим медицинским работникам и пациентам. Ранняя диагностика заболевания или его прогрессирования и мониторинг лечения играют критически важную роль в лечении таких смертельных заболеваний как определенные типы онкологических и инфекционных заболеваний.
[0003] В процессе диагностики и лечения заболеваний могут оказаться полезными мультиплексные измерения с помощью биомаркеров, предоставляющие дополнительную информацию о заболевании пациента. Например, в процессе мониторинга действия медицинского препарата, величины трех или более биомаркеров могут быть получены параллельно. Как правило, для проведения мультиплексного анализа, основанного на расхождении, используются панели микротитратора и другие похожие приборы. Панель микротитратора (например, 384-луночная панель микротитратора) в состоянии параллельно анализировать большое количество элементов.
[0004] При использовании прибора для оказания услуг у постели больного (РОС), параллельный анализ элементов, как правило, ограничивается размером самого прибора и объемом анализируемой пробы. В большом количестве приборов РОС, соотношение количества элементов, которые можно анализировать, приблизительно, 1 к 10. Было бы полезно разработать прибор РОС, который бы был в состоянии проводить мультиплексный анализ маленьких проб.
[0005] Недостатком большинства мультиплексных приборов для анализа РОС является высокая стоимость производства компонентов. Если прибор предназначен для однократного использования, то себестоимость компонентов превращает производство такого прибора в невыгодный процесс. Кроме этого, если один из реагентов, используемых в мультиплексных приборах РОС, которые уже содержат все необходимые реагенты, проявляет нестабильность, тогда, возможно, придется забраковать всю партию изготовленных приборов, даже если остальные реагенты пригодны к употреблению.
[0006] Если клиент заинтересован в адаптации прибора РОС для выполнения определенных анализов, компании-изготовители мультиплексных приборов для анализа РОС зачастую сталкиваются с необходимостью комбинировать анализы и реагенты в приборе. Разработка мультиплексного прибора РОС для выполнения анализов, подходящего для каждого клиента, является очень дорогостоящим процессом, такой прибор трудно калибрировать и трудно проводить контроль качества.
[0007] Методы, используемые в приборах РОС, уже доказали свою важность в процессе мониторинга заболеваний и проведении лечения (например, системы проверки уровня сахара в крови при лечении диабета, измерение Протромбинового индекса при антикоагуляционной терапии с использованием Warfarin). Считается, что замирение многочисленных маркеров помогает лучше контролировать и проводить мониторинг серьезных заболеваний (таких как рак), при которых рекомендуется лечение несколькими препаратами.
[0008] Существует необходимость использования разнообразных источников информации при мониторинге состояния здоровья или прогрессирования заболеваний отдельных лиц, а также при лечении других разнообразных заболеваний. Это особенно важно при измерении уровня концентрации определенных специализированных аналитов (биомаркеров, антител, уровней экспрессии генов, метаболита, концентрации терапевтических препаратов и т.д.) на протяжении периода времени. Для того, чтобы сделать такой процесс более удобным и максимально эффективным, особенно важным считается использование таких технологий, которые дают возможность измерять необходимый уровень аналитов (любых типов), используя небольшое количество крови (проба крови, полученная проколом пальца) или другие пробы. В идеальном варианте такими технологиями будут пользоваться люди, не имеющие специальной подготовки, использующие их в таких местах для тестирования как дома, клиники, медицинские офисы, фармацевтические центры или магазины розничной торговли. Настоящее изобретение помогает решить эти проблемы и дает возможность регулярно выполнять подобные измерения дома у пациента или в других нелабораторных условиях.
[0009] Также существует необходимость максимально использовать полученные пробы, особенно в случаях, когда пробы (например, пробы крови) имеют ограниченный размер. Пробы крови, как правило, используются при проведении разнообразных медицинских, клинических тестов. До начала проведения большинства анализов клетки крови необходимо отделить от плазмы (или сыворотки) в связи с тем, что присутствие клеток может негативно повилять на химическую среду. Например, во время проведения анализа, уровень глюкозы и холестерина зачастую измеряются по изменению цвета химической среды, на что может повлиять присутствие образовавшихся элементов, особенно, эритроцитов или гемоглобина (из растворенных эритроцитов).
[0010] В идеальном варианте для использования распределенных систем тестирования понадобится небольшое количество крови, полученное методом прокола пальца. Такие пробы могут быть размером в 20 микролитов (мкл) (одна капля) или меньше. Пробы более крупного размера (например, до 200 мкл), как правило, нельзя получить простым проколом пальца без повторного вызывающего неудобство ("массирования") пальца. Альтернативные венозные пробы в несколько миллилитров (мкл) можно также брать, но для этого будет необходима помощь специально подготовленного флеботомиста.
[0011] Как правило, очень трудно проводить более одного анализа, используя маленький образец крови размером 20 мкл или меньше. Это особенно важно в случаях, когда образец крови необходимо отфильтровать для удаления клеток, и сбор годной к использованию плазмы из такого маленького количества малоэффективен. Как правило, удается собрать приблизительно 5 мкл или меньше. Образцы размером до 200 мкл можно эффективно отделять с помощью автоматизированных систем РОС (Abaxis, Biosite и т.д.), но это невозможно делать регулярно, так как необходима помощь специально подготовленного специалиста по сбору крови.
РАСКРЫТИЕ
[0012] Принимая во внимание несовершенство методов, используемых в настоящее время, существует необходимость разработки улучшенных методов автоматического отделения плазмы и (или) других материалов от клеток крови. Кроме этого, существует необходимость повышения точности таких измерений концентрации анализируемого вещества. В процессе измерения биомаркеров и других компонентов крови с целью мониторинга лечения и диагностики, важно использовать правильный объем пробы. В лабораторных условиях это достигается благодаря использованию разнообразных автоматизированных инструментов и специально подготовленных профессиональных работников. В отличие от предоставления услуг "у постели больного", например, дома, в розничных аптеках или в магазинах, предлагаемые методы и оборудование дадут возможность людям, не имеющим специальной подготовки, успешно получать и обрабатывать необходимые пробы.
[0013] Настоящее изобретение удовлетворяет вышеуказанным нуждам и имеет соответствующие преимущества.
[0014] В некоторых вариантах настоящее изобретение относится к лечению или к приборам, используемым у постели больного. В некоторых вариантах настоящее изобретение относится к системам, приборам, интерфейсам пользователя и методам для анализа проб с использованием лечения или приборов, предназначаемых для лечения у постели больного.
[0015] В одном варианте, приборы и методы, упомянутые здесь, предназначаются для идентификации типа пробы (кровь в отличие от плазмы и т.д.) или для измерения объема пробы на раннем этапе проведения анализа для того, чтобы удостовериться, что в определенном анализе используется соответствующая проба. В другом варианте настоящее изобретение также дает возможность корректировать большое количество ошибок, которые имеют место при проведении анализа.
[0016] Еще в одном варианте настоящее изобретение дает возможность одновременно измерять несколько аналитов различных типов с максимальной точностью.
[0017] Один аспект настоящего изобретения можно связать с автоматизированной системой для разделения одного или более компонентов биологических жидкостей. Такая автоматическая система может включать микродозатор или закрытую трубку, подогнанную для работы с аспиратором, где микродозатор или трубка имеют два направленных в разные стороны конца, один из которых закрыт или герметизируется; и центрифугу, переделанную для соединения с закупоренным микродозатором или с закрытой трубкой для того, чтобы влиять на разделение одного или более компонентов в биологической жидкости. В одном варианте один или более компонентов выбирается из группы, включающей плазму крови, кровяную сыворотку и взвешенные частицы. В другом варианте микродозатор соединяется с аспиратором для того, чтобы оказать влияние на забор биологической жидкости. В еще одном варианте один из открытых концов микродозатора герметически соединен с аспиратором. В другом варианте система состоит из изображающего устройства и, по крайней мере, еще одного микродозатора, предназначаемого для подачи жидкости в микродозатор или трубку (а) для аспирации жидкости из микродозатора или трубки (а). В еще одном варианте микродозатор или закрытая трубка расположены вертикально в момент остановки центрифуги. В другом варианте микродозатор или закрытая трубка расположены горизонтально в процессе вращения центрифуги с заданной скоростью.
[0018] Еще одним аспектом изобретения может быть метод изоляции компонентов в пробе, включающий один или более шагов: загрузка пробы в микродозатор или трубку, имеющую направленные в разные стороны концы, по крайней мере, один из которых герметизируется или герметически закрыт; герметизация микродозатора, по крайней мере, с одной стороны; центрифугирование закупоренного микродозатора, формируя, таким образом, межфазовую область, разделяющую пробу на надосадочную жидкость и осадок; получение изображения с помощью центрифугированного микродозатора для обнаружения местоположения межфазной области; и автоматическая аспирация надосадочной жидкости в месте межфазной области. В еще одном варианте метод также включает обнаружение местоположения надосадочной жидкости с помощью изображения и автоматической аспирации надосадочной жидкости на основе ее местоположения. В другом варианте детерминация происходит с помощью процессора, который дает инструкции аспирационному прибору, выполняющему автоматическую аспирацию. В другом варианте изображение регистрируется с помощью видеокамеры, разработанной для регистрации изображения боковой проекции микродозатора или трубки. В очередном варианте надосадочная жидкость включает одно или более из нижеследующего: плазма или сыворотка крови. В другом варианте осадок включает один или несколько следующих элементов: клетки крови или взвешенные частицы.
[0019] Компьютеризированный метод для характеристики аналита, который предположительно находится в пробе, может быть предоставлен как дополнительный аспект изобретения. Такой компьютеризированный метод может включать получение цифрового изображения пробы, где цифровое изображение состоит из двухмерного массива элементов изображения и каждый элемент состоит из множества величин интенсивности, каждая из которых соответствует ярко выраженной спектральной области детекции; сопоставляя, с помощью программируемого прибора, полученные величины интенсивности с заданным множеством величин, которое определяет динамический промежуток каждой спектральной области детекции, и, прогнозируя присутствие и (или) количество упомянутого аналита в пробе на основе вышеупомянутой корреляции полученных величин интенсивности с заданным множеством величин. В еще одном варианте множество величин интенсивности состоит из величин интенсивности для красных, зеленых и голубых спектральных областей детекции. В другом варианте такой метод включает выбор длины волны облучения пробы с помощью выбранной длины волны облучения до и (или) одновременно с полученным цифровым изображением. В другом варианте, такой метод включает одновременно с получением цифрового изображения (а) выбор еще одной длины волны облучения; (b) облучение пробы волной облучения новой длины; (с) получение другого цифрового изображения пробы, где цифровое изображение включает, по крайней мере, один двухмерный массив элементов изображения и где каждый элемент включает множество величин интенсивности, каждая из которых соответствует определенной спектральной области детекции; и (d) прогноз присутствия и (или) количества указанного аналита в пробе на основе полученных величин интенсивности, полученных от цифрового изображения или вышеуказанного другого цифрового изображения.
[0020] Кроме этого, один аспект такого изобретения связан с методом измерения концентрации аналита в пробе жидкости, включающим предоставление пробы, содержащейся в контейнере, рассчитанной по размеру на множество величин ширины, для предоставления возможности передачи света вдоль множества величин с меняющейся толщиной слоя, которая соответствует множеству величин определенной ширины; освещая контейнер вдоль, по меньшей мере, одного из множества величин толщины слоя; и получая изображения контейнера для первого измерения интенсивности света, переданного вдоль, по крайней мере, одного из множеств толщины слоя для определения концентрации аналита на основе первого измерения интенсивности света.
[0021] В соответствии с другим аспектом изобретения, метод обнаружения присутствия или концентрации аналита в пробе жидкости, содержащейся в контейнере (а именно, в кювете) может включать освещение контейнера вдоль первой области с толщиной слоя, измеренной в первый раз для получения первого измерения интенсивности освещения, переданной вдоль первой толщины слоя; перенос пробы жидкости в другую область контейнера с другой толщиной слоя, при условии, что первое измерение выходит за пределы предопределенного динамического промежутка переданной интенсивности света; освещая контейнер вдоль другой области для получения другого измерения интенсивности света, полученной вдоль другой толщины света; и необязательное повторение второго и третьего этапов до тех пор, пока измерения интенсивности света не попадут в предопределенный динамический промежуток, таким образом, обнаруживая присутствие или определяя концентрацию аналита. В еще одном варианте, метод также состоит из деконволюции линейного сканирования изображения, что позволяет обнаруживать присутствие или определять концентрацию аналита. В другом примере проба переходит из первой области контейнера с первой толщиной слоя в другую область контейнера с другой толщиной слоя с помощью аспирации пробы. В другом примере один конец контейнера соединен с дозатором, который сконфигурирован для аспирации пробы. В другом примере проба переносится вверх или вниз по контейнеру. Еще в одном примере контейнером является микродозатор. Еще в одном примере контейнер имеет форму конуса. В другом примере контейнер имеет два открытых конца. В другом примере диаметр одного открытого конца больше диаметра второго конца. Еще в одном примере контейнер отличается множеством величин определенной ширины для того, чтобы позволить передачу света вдоль множества разнообразных величин толщины слоя. В другом примере объем контейнера менее 100 микролитров. В другом примере множество определенных величин толщины слоя отображаются одновременно.
[0022] Дополнительный метод может стать частью предлагаемого изобретения. Такой метод может использоваться для определения аналита, который предположительно находится в пробе биологической жидкости, включая: предоставление пробы биологической жидкости; давая возможность такому аналиту вступать в реакцию с одним или несколькими реагентами, которые способны реагировать с аналитом для получения оптически различимого сигнала и измерение такого оптически различимого сигнала с множеством спектральных областей детекции, где присутствие такого оптически различимого сигнала в определенном пределе, по крайней мере, одной спектральной области детекции указывает на концентрацию аналита в указанной пробе биологической жидкости. В другой пробе измерение проводится изображающим устройством, сконфигурированным для измерения множества спектральных проб детекции. В другой пробе изображающее устройство сконфигурировано для измерения множества спектральных областей детекции одновременно. В другой пробе изображающее устройство сконфигурировано для измерения множества спектральных областей детекции последовательно.
[0023] Один из аспектов изобретения позволяет увеличить точность анализа методом изображения пробы на первом микродозаторе для обнаружения объема первой пробы; изображение одного или более реагентов во втором микродозаторе для определения объема одного или более реагентов, перемешивание пробы и одного или более реагентов во втором микродозаторе для определения объема одного и более реагентов; перемешивание пробы и одного или более реагентов для воспроизведения изображения реакционной смеси; воспроизведение изображения реакционной смеси; коррекция калибровки на основе определенных объемов пробы и одного или нескольких реагентов и расчет концентрации аналита с использованием правильной калибровки. Еще в одном варианте такой метод включает изображение реакционной смеси для определения объема реакционной смеси. В другом варианте изображение пробы в первом микродозаторе выполняется с помощью видеокамеры, сконфигурированной для получения боковой проекции первого микродозатора. В другом варианте изображение одного или более реагентов во втором конце выполняется с помощью видеокамеры, сконфигурированной для получения боковой проекции второго конца. В другом варианте высота пробы и одного или более реагентов вычисляется на основе полученных проекций. В другом варианте калибровка основана на определении объема реакционной смеси.
[0024] Очередной аспект изобретения представляет собой следующее устройство: сосуд, сконфигурированный для принятия и хранения пробы, таким образом, что сосуд включает внутреннюю поверхность, внешнюю поверхность, открытый конец, и противоположный закрытый конец; и микродозатор, сконфигурированный для проникновения в сосуд через открытый конец, таким образом микродозатор включает первый открытый конец и второй открытый концы; второй открытый конец введен в сосуд; b сосуд или микродозатор включает выступающий элемент на поверхности, предотвращающий контакт второго открытого конца микродозатора с дном внутренней поверхности закрытого конца сосуда. В еще одном варианте, характерная черта поверхности сформирована интегрально дну внутренней поверхности сосуда.
[0025] Еще одной составляющей изобретения является аппарат для обработки проб, включающий станцию подготовки проб, станцию для анализа и (или) станцию обнаружения; блок управления с командами, выполняемыми компьютером, для предоставления услуг в пункте обслуживания клиентов и в других местах с помощью, по крайней мере, одной из описанных выше станций подготовки проб, а также, по крайней мере, одной центрифуги, сконфигурированной для проведения центрифугирования пробы, полученной при проколе пальца. В одном варианте центрифуга, встроена в станцию подготовки проб и (или) в станцию для анализа. В другом варианте команды, выполняемые компьютерами, разработаны для предоставления услуг в пункте обслуживания клиентов или в месте, выбранном из группы мест, включающей розничные магазины, дом пациента или центр диспансеризации/лечения.
[0026] Другой аспект изобретения позволяет обеспечить динамическую ответную реакцию, которая включает: предварительное измерение пробы в контейнере с помощью механизма обнаружения; определение с помощью процессора на основе предварительных измерений того, находится ли концентрация пробы в определенных пределах, а также, определение с помощью процессора (а) какая степень разбавления необходима, если концентрация выше необходимого предела (b) какая степень повышения концентрации необходима, если концентрация пробы ниже необходимого предела, и регулирование концентрации пробы в соответствии с определенной степенью концентрации. В одном варианте метод включает последующие измерения пробы в контейнере. В другом варианте метод также включает, на основе последующих измерений с помощью процессора, принятие решения о том, находится ли концентрация пробы в определенных пределах. В другом варианте последующие измерения делаются с помощью механизма детекции. В еще одном варианте метод включает определение основных особенностей пробы на основе последующих измерений. В другом варианте основные характеристики выбираются из одной или нескольких следующих характеристик: присутствие или концентрация аналита, присутствие или концентрация клетки и морфология клетки. В другом варианте последующие измерения делаются с помощью отдельного механизма детекции на основе исходного механизма детекции. В очередном варианте первоначальное измерение предоставляет измерения концентрации необработанной клетки пробы. В еще одном варианте последующие измерения предоставляют собой измерения концентрации клеток пробы более высокого разрешения по сравнению с первоначальной концентрацией. В другом варианте первоначальные измерения получены благодаря воспроизведению изображения пробы. В другом варианте корректировка концентрации пробы позволяет выполнять детекцию аналита, который не попадает в желаемый диапазон.
[0027] Другой аспект изобретения представляет собой метод контроля качества, включающий воспроизведение изображения условий, при которых механизм детекции измеряет особенности пробы; и определение, с помощью процессора на основе воспроизведения, того, существуют ли неблагоприятные условия, при которых механизм детекции работает. В одном варианте неблагоприятные условия включают присутствие одного или нескольких нежелательных материалов. В другом варианте нежелательные материалы включают одно или несколько из следующих элементов: пузырьки, частицы, волокна, инородные вещества и выпавшая в осадок фаза, которые могут влиять на измерения особенностей пробы. В другом варианте механизм детекции отличается от механизма, который используется для получения изображения. В другом варианте изображение воспроизводится с помощью видеокамеры. В еще одном варианте метод включает дальнейшее уведомление при обнаружении нежелательных условий. В еще одном варианте метод включает дальнейшую корректировку пробы при обнаружении неблагоприятных условий. В другом варианте изображение включает изображение пробы. В другом варианте в качестве изображения выступает контейнер с пробой или механизм детекции.
[0028] Еще одним аспектом изобретения является автоматическая система для разделения одного или нескольких компонентов биологической жидкости, включающая центрифугу с одной или несколькими ковшами, сконфигурированными для получения контейнера с целью воздействия на разделение одного или нескольких компонентов пробы жидкости; и контейнер, который включает один или несколько предметов определенной формы, которые сочетаются с формой ковша. В одном варианте определенная форма ковша включает одну или несколько полок на которых предположительно должен находиться контейнер выпуклой формы. В другом варианте ковш сконфигурирован для принятия множества контейнеров с разными конфигурациями и где форма ковша включает множество полок, и где первый контейнер сконфигурирован таким образом, чтобы находиться в состоянии покоя на первой полке, а второй контейнер имеет вторую конфигурацию, предназначенную для того, чтобы находиться в состоянии покоя на второй полке.
[0029] Еще один аспект изобретения представляет собой аппарат для проведении анализа, состоящий из первого и второго концов; внешней поверхности; и внутренней поверхности, включающей один или несколько выбранных проб, каждая из которых связана одним или другим способом с реагентом, способным улавливать аналит, который предположительно находится в биологической пробе, и где первый и второй концы неодинаковы по размеру.
[0030] Еще один аспект изобретения предлагает аппарат для анализа, состоящий из опознавателя, который используется для определения (а) одного или нескольких улавливающих реагентов, закрепленного на внутренней поверхности и (b) источника биологической пробы, при условии, что аппарат для анализа содержит такую пробу.
[0031] Еще одним аспектом изобретения является аппарат для анализа, состоящий из множества отобранных проб, каждая из которых включает определенное улавливающее вещество.
[0032] Другие цели и преимущества изобретения можно будет лучше оценить при рассмотрении их вместе со следующим описанием и соответствующими чертежами. Хотя в следующем описании содержатся детали, описывающие определенный вариант изобретения, они должны рассматриваться не как ограничение области изобретения, а как воплощение предпочитаемых вариантов. Для каждого аспекта изобретения возможны разные варианты, которые уже упомянуты и хорошо знакомы даже специалистам среднего звена. Изменения и модификации можно внести в настоящее изобретение, не меняя его основной сути. Различные вещества и приборы, указанные здесь, можно использовать вместе и по отдельности в любых комбинациях с любым из указанных здесь методов или в любой из комбинаций.
ВКЛЮЧЕНИЕ В ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0033] Этим документом все издания, патенты и патентные заявки, упомянутые а настоящем перечне, включаются в описание изобретения и являются частью в такой же степени, как если бы каждое индивидуальное издание, патент или патентная заявка были индивидуально упомянуты для включения в описание изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0034] Новые элементы изобретения подробно излагаются в прилагаемой формуле изобретения.
Чтобы лучше понять качества и преимущества настоящего изобретения, необходимо ознакомиться со ссылкой на следующее подробное описание, в котором содержатся варианты реализации изобретения, в которых используются основные его принципы и прилагаются сопроводительный(е) чертеж(и):
[0035] Рисунок 1. Боковая проекция центрифуги.
[0036] Рисунок 2. Передняя сторона центрифуги.
[0037] Рисунок 3. Задняя сторона центрифуги.
[0038] Рисунок 4. Верхний вид микродозатора пробы.
[0039] Рисунок 5. Боковая проекция микродозатора пробы.
[0040] Рисунок 6. Поперечный разрез микродозатора пробы.
[0041] Рисунок 7. Чертеж микродозатора пробы, расположенной в пробе над поверхностью разделения плазмы и осажденных эритроцитов.
[0042] Рисунок 8. График времени центрифугирования в качестве функции оборотов в минуту.
[0043] Рисунок 9. График времени центрифугирования в качестве функции радиуса вентиля центрифуги.
[0044] Рисунок 10. Пустой закрытый микродозатор пробы.
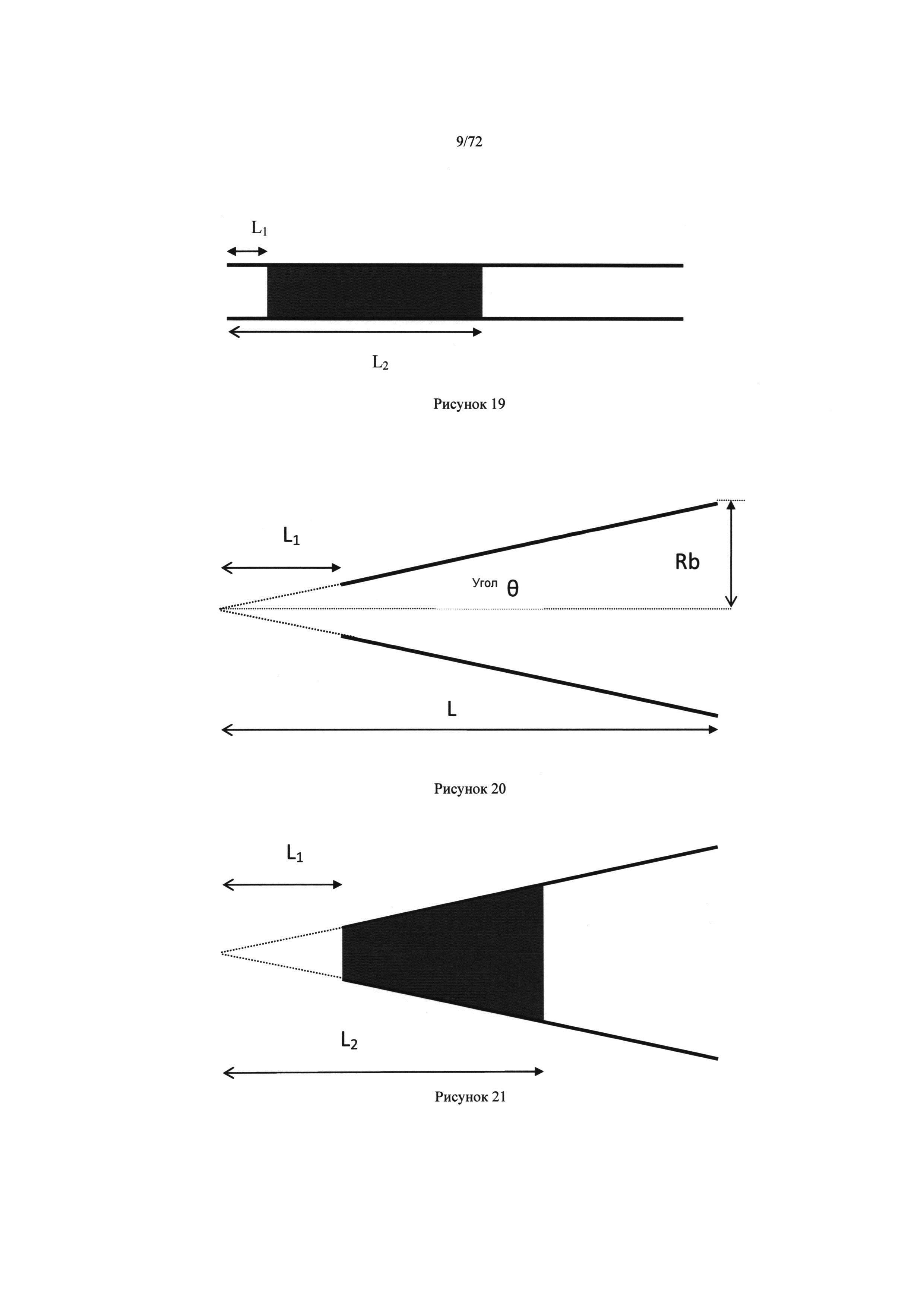
[0045] Рисунок 11. Закрытый микродозатор пробы, содержащий пробу биологической жидкости, т.е. крови.
[0046] Рисунок 12. Закрытый микродозатор пробы, содержащий пробу крови с 23% гематокрита после центрифугирования.
[0047] Рисунок 13. Закрытый микродозатор крови, содержащий пробу крови с 31% гематокрита после центрифугирования.
[0048] Рисунок 14. Закрытый микродозатор пробы, содержащий пробу крови с 40% гематокрита после центрифугирования.
[0049] Рисунок 15. Закрытый микродозатор пробу, содержащий пробу крови с 52% гематокрита после центрифугирования.
[0050] Рисунок 16. Закрытый микродозатор пробы, содержащий пробу крови с 68% гематокрита после центрифугирования.
[0051] Рисунок 17. Сопоставляет показатели гематокрита, измеренного с помощью цифрового отображения центрифугированной крови ("гематокрит, % подтвержденный") и гематокрит, измеренный стандартным гематокритным прибором ("гематокрит, % запланированный показатель").
[0052] Рисунок 18 Чертеж микродозатора, используемого во время химических реакций и микродозатора, используемого для крови/плазмы (размеры указаны в мм).
[0053] Рисунок 19. Цилиндрический капилляр с пробой.
[0054] Рисунок 20. Углы и размеры для вычисления объемов конусообразного контейнера, т.е. капилляра.
[0055] Рисунок 21. Углы и размеры для вычисления объемов конусообразный контейнера, т.е. капилляра.
[0056] Рисунок 22. Углы и размеры для вычисления объемов сферического сегмента.
[0057] Рисунок 23. Размеры для вычисления объема пробы, содержащейся в цилиндрическом микродозаторе, где у пробы один мениск.
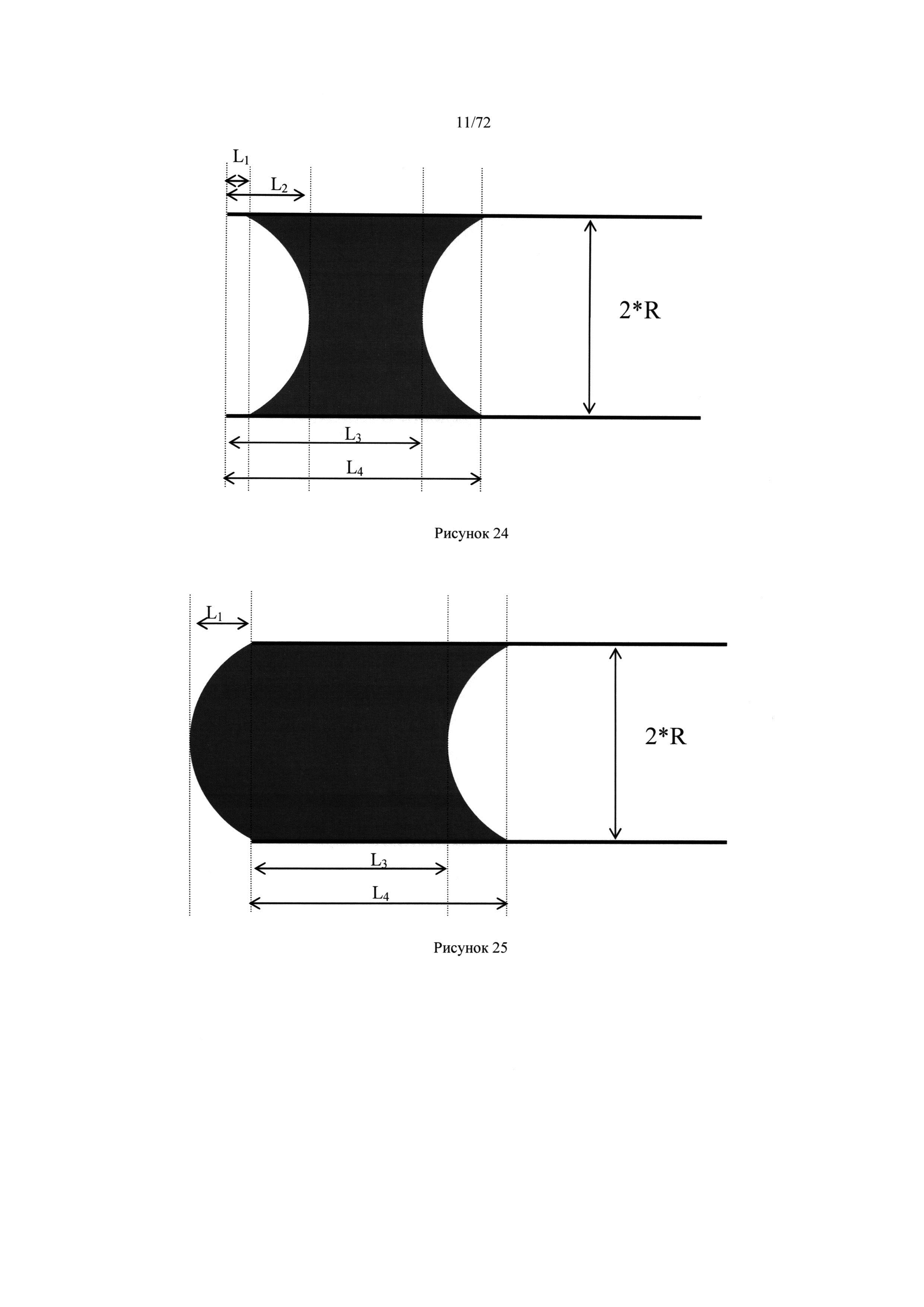
[0058] Рисунок 24. Размеры для вычисления объема пробы, содержащейся в цилиндрическом микродозаторе, в котором у пробы два мениска.
[0059] Рисунок 25. Размеры для вычисления объема пробы, содержащейся в цилиндрическом микродозаторе, в котором у пробы два мениска и один из которых находится за пределами цилиндрического микродозатора.
[0060] Рисунок 26. Размеры для вычисления объема пробы, содержащейся в цилиндрическом микродозаторе с пузырьком в пробе.
[0061] Рисунок 27. Размеры для вычисления объема пробы, содержащейся или связанной с цилиндрическим микродозатором и с пузырьком в пробе на всю ширину цилиндрического микродозатора.
[0062] Рисунок 28. Размеры для вычисления объема пробы, содержащейся или связанной с цилиндрическим микродозатором с пробой, включающей подвешенную каплю пробы за пределами цилиндрической верхушки.
[0063] Рисунок 29. Размеры для вычисления объема остаточной пробы, содержащейся в цилиндрическом микродозаторе.
[0064] Рисунок 30. Проба крови в микродозаторе до перемешивания с магнитным реагентом.
[0065] Рисунок 31. Проба крови, смешиваемая с магнитным реагентом.
[0066] Рисунок 32. Проба крови, смешанная с магнитным реагентом.
[0067] Рисунок 33. Проба крови, смешанная с магнитным реагентом, содержащимся в микродозаторе.
[0068] Рисунок 34. Проба крови, смешанная с магнитным реагентом, и помещенная в определенное место в микродозаторе.
[0069] Рисунок 35. Магнитная сила от магнита (М), которая была применена по отношению к пробе крови, перемешанной с магнитным реагентом.
[0070] Рисунок 36. Проба крови, разделенная на эритроциты и плазму с помощью магнитной силы.
[0071] Рисунок 37. Лунка, расположенная под микродозатором, содержащим пробу крови, разделенную на эритроциты и плазму.
[0072] Рисунок 38. Перенос плазмы крови из микродозатора в лунку.
[0073] Рисунок 39. Микродозатор после переноса пробы крови в лунку.
[0074] Рисунок 40. Высококонтрастное изображение цилиндрического микродозатора, содержащего раствор с низким уровнем поглощаемости.
[0075] Рисунок 41. Изображение конического микродозатора, содержащего раствор с высоким уровнем поглощаемости.
[0076] Рисунок 42. Микродозатор с раствором с высоким уровнем поглощаемости с двумя менисками в микродозаторе.
[0077] Рисунок 43. Микродозатор с пробой жидкости и крупными пузырьками по всему диаметру микродозатора.
[0078] Рисунок 44. Микродозатор, содержащий воду с прозрачным верхним мениском в прозрачном микродозаторе или капилляре.
[0079] Рисунок 45. Диаграмма рассчитанной концентрации протеина С как функции объема пробы.
[0080] Рисунок 46. Изображение прибора для переноса пробы с капилляром, корпусом, поршнем, углублением и выступом. Выступ может помочь найти поршень в корпусе.
[0081] Рисунок 47. Проба, расположенная в капилляре прибора для переноса пробы.
[0082] Рисунок 48. Прибор для переноса пробы после того, как проба была втолкнута поршнем.
[0083] Рисунок 49. Прибор для переноса пробы после того, как проба была вытолкнута неполностью.
[0084] Рисунок 50. Конический микродозатор, содержащий пробу, где положение L3 определяется стрелкой.
[0085] Рисунок 51. Диаграмма соотношения расстояния между L2 и L1 и расстояние между L3 и L1 как функция объема пробы.
[0086] Рисунок 52. Схема химической реакции, в результате которой появляется цветное вещество.
[0087] Рисунок 53. Схема химической реакции, в результате которой появляется цветное вещество из холестерина.
[0088] Рисунок 54. Схема химической реакции, в которой используются окисляющие эквиваленты для получения цветного вещества.
[0089] Рисунок 55. Пример вещества, которое меняет цвет в процессе образования комплекса с ионом металла.
[0090] Рисунок 56. Серия изображений микродозаторов при двукратном уменьшении концентрации альбумина справа налево, за исключением крайнего левого микродозатора, в котором отсутствует альбумин.
[0091] Рисунок 57. Серия изображений микродозаторов при двукратном уменьшении концентрации альбумина справа налево, за исключением крайнего левого микродозатора, в котором отсутствует холестерин.
[0092] Рисунок 58. Серия полукруглых лунок, сделанных в кусочке белого непрозрачного пластика, где в каждой из лунок имеет место двойное уменьшение концентрации аналита справа на лево, за исключением крайней левой лунки, в которой нет аналита. В некоторых вариантах аналитом может быть кальций.
[0093] Рисунок 59. Серия полукруглых лунок, сделанных в кусочке белого непрозрачного пластика, где в каждой из лунок имеет место двойное уменьшение концентрации аналита справа налево, за исключением крайней левой лунки в которой нет аналита. В некоторых вариантах аналитом может быть магнезии.
[0094] Рисунок 60. Серия полукруглых лунок, сделанных в кусочке белого непрозрачного пластика, где в каждой из лунок имеет место двойное уменьшение концентрации аналита справа налево, за исключением крайней левой лунки, в которой нет аналита. В некоторых вариантах аналитом может быть мочевина.
[0095] Рисунок 61. Серия кончиков с раствором бромфенолового синего.
[0096] Рисунок 62. Рисунок микродозатора с матрицей из явных оптических слоев разной толщины.
[0097] Рисунок 63. Толщина светопоглощающего слоя, проходящего через прямоугольную кювету.
[0098] Рисунок 64. Толщина светопоглощающего слоя, проходящего через лунку микротитровального планшета.
[0099] Рисунок 65. Толщина светопоглощающего слоя, проходящего через конусообразную кювету.
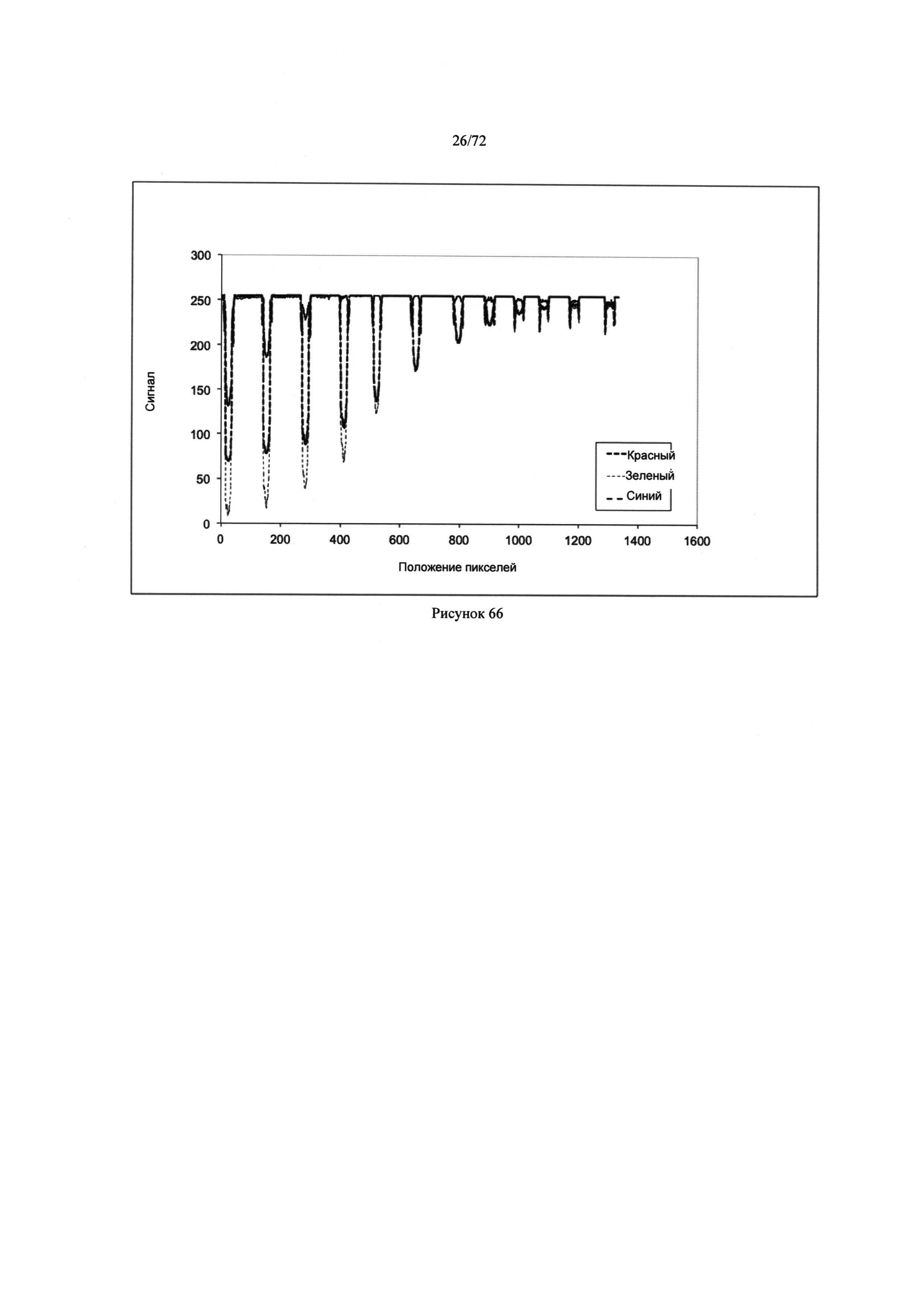
[00100] Рисунок 66. Диаграмма интенсивности света как функция местоположения на микродозаторах, содержащих пробы с разной концентрацией раствора бромофенолового голубого, для каналов красного, зеленого и голубого цвета.
[00101] Рисунок 67. Изображения микродозаторов, которые были проанализированы на Рисунке 66.
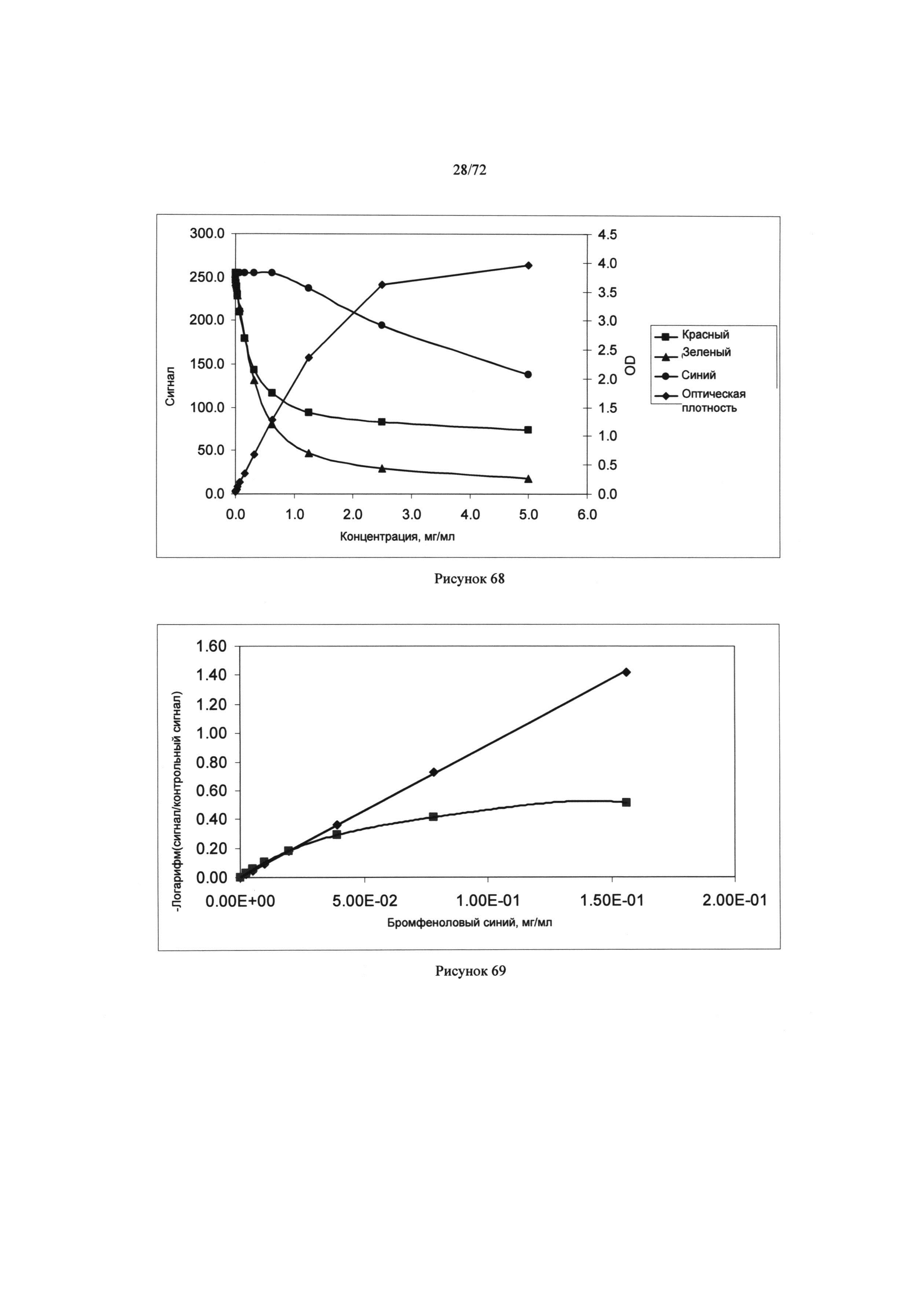
[00102] Рисунок 68. Диаграмма сигнала как функция концентрации бромофенольного голубого при измерении каналами красного, зеленого и голубого цвета. Оптическая плотность может измеряться при 589 нм.
[00103] Рисунок 69. Диаграмма логарифмической шкалы с ответным сигналом как функцией концентрации бромофенольного голубого, измеренного каналами голубого (ромбы) и красного (квадраты) цвета.
[00104] Рисунок 70. Диаграмма концентрации, полученной с помощью колориметрического анализа цифровых изображений, как функция действительной концентрации.
[00105] Рисунок 71. Диаграмма ответного сигнала, измеренная каналами красного (квадраты), зеленого (ромбы) и голубого (треугольники) цвета как функция концентрации альбумина.
[00106] Рисунок 72. Три диаграммы ответного сигнала, измеренного каналами зеленого, красного и голубого цвета для частиц полистирольной эмульсии.
[00107] Рисунок 73. Микродозатор, содержащий отдельные реагенты NADH, WST-1, PMS, и два микродозатора, содержащие смесь реагентов.
[00108] Рисунок 74. Дигитальное изображение микродозаторов, содержащих двойное уменьшение концентрации лактатдегидрогеназы (LDH) слева направо.
[00109] Рисунок 75. Диаграмма оптической плотности, измеренной при 450 нм, как функции LDH.
[00110] Рисунок 76. Добавление раствора хлорида калия к полоскам для анализа калия.
[00111] Рисунок 77. Микродозаторы, содержащие пробы крови, перемешанные с реагентами для определения группы крови для Anti-A, Anti-B, Anti-D и контроля (слева направо).
[00112] Рисунок 78. Измеренные сигналы как функции положения для красных (левая колонка), зеленых (средняя колонка) и голубых (правая колонка) каналов для проб, перемешанных с Anti-A, Anti В, Anti-D и контрольными реагентами.
[00113] Рисунок 79. Нормализованный сигнал как функция относительной концентрации, измеренной для узкой и широкой толщины слоя, использующий красный, зеленый и голубой каналы цвета.
[00114] Рисунок 80. Диаграмма величин умеренной концентрации как функция действительной концентрации, описывающей точность измерений алгоритма.
[00115] Рисунок 81. Флуоресцентное изображение анализируемых веществ в пробирках.
[00116] Рисунок 82. Изображение продуктов реакции в микродозаторах.
[00117] Рисунок 83. Изображение продуктов реакции в микродозаторах.
[00118] Рисунок 84. Изображение продуктов реакции в микродозаторах.
[00119] Рисунок 85. Изображение продуктов реакции в микродозаторах.
[00120] Рисунок 86. Изображение продуктов реакции в микродозаторах.
[00121] Рисунок 87. Изображение продуктов реакции в микродозаторах.
[00122] Рисунок 88. Изображение заднего фона, полученное для калибровки.
[00123] Рисунок 89. Флуоресцентное изображение продуктов реакции в микродозаторах.
[00124] Рисунок 90. Реагирование каналов красного и голубого цвета и флуоресцентное изображение как функция номера копии ДНК.
[00125] Рисунок 91. Диаграмма преобразованного 3-цветного сигнала как функция флуоресцентного сигнала.
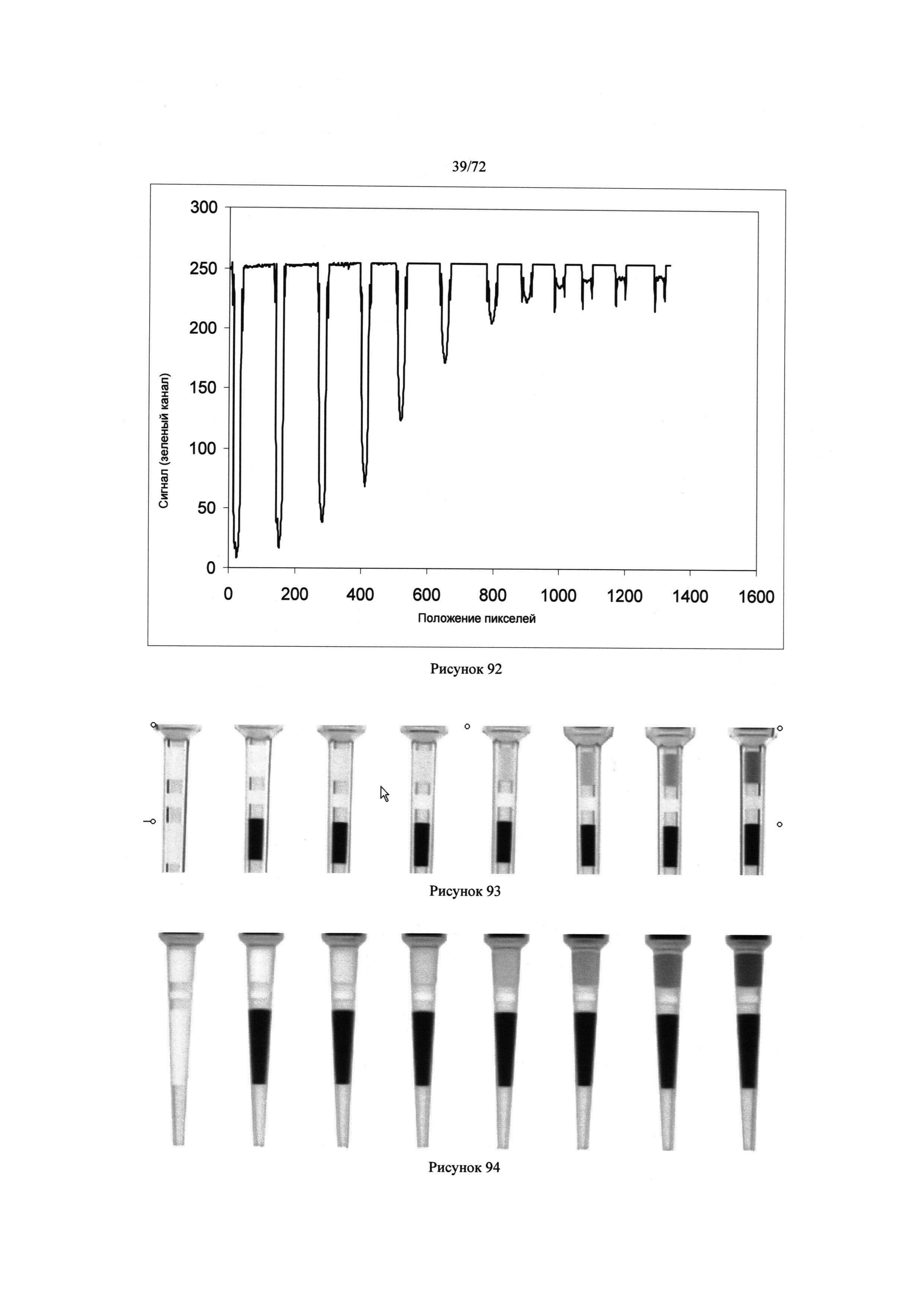
[00126] Рисунок 92. Диаграмма ответного сигнала зеленого канала как функция положения пикселей.
[00127] Рисунок 93. Изображение микродозаторов, содержащих раствор бромофенольного голубого и воды.
[00128] Рисунок 94. Изображение дополнительных микродозаторов, которые могут содержать растворы бромофенольного голубого и воды.
[00129] Рисунок 95. Схема микродозатора, содержащего реакционные смести для проведения нескольких анализов.
[00130] Рисунок 96. Изображение микродозаторов, содержащих растворы бромофенольного голубого и воды.
[00131] Рисунок 97. Диаграмма ответного сигнала для образца, воды и контрольного вещества при разных стандартах. Образцами могут быть калибровочные приборы на водной основе, содержащие известные концентрации аналита.
[00132] Рисунок 98. Микродозаторы с анализом для Са2+ (верхняя область микродозатора) и Mg2+ (нижняя область микродозатора).
[00133] Рисунок 99. Четыре микродозатора с разными типами проб сыворотки: гемолизированный (красноватого цвета), липемический (серые), иктерический (желтоватый), и нормальный (слева направо).
[00134] Рисунок 100. Схема видеокамеры и оптических компонентов.
[00135] Рисунок 101. Поперечное сечение видеокамеры и оптических компонентов, включая источник белого цвета, апертуру и сенсор.
[00136] Рисунок 102. Схема оптической установки для измерения светового сигнала с использованием (А) сенсора, который установлен для обнаружения света под перпендикулярным углом к возбуждающему пучку и (В) сенсор, расположенный в один ряд с возбуждающим пучком.
[00137] Рисунок 103. Изображения, полученные с помощью (А) возбуждающего пучка, перпендикулярного сенсору (В) возбуждающего пучка, расположенного в один ряд с сенсором.
[00138] Рисунок 104. Множество печатных красящих веществ, которые могут использоваться для калибровки оптической установки.
[00139] Рисунок 105. Диаграмма сигнала, как функция образца схемы. Серии 1-5 могут соответствовать различным концентрациям аналита, таким как 0, 20, 40, 60, и 80 соответственно.
[00140] Рисунок 106. Диаграмма сигнала как функция объема пробы. Серии 1-5 могут соответствовать различным концентрациям аналита. Таким как 0, 20, 40, 60, и 80 соответственно.
[00141] Рисунок 107. Диаграмма сигнала как функция объема пробы. Серии 1-5 могут соответствовать различным концентрациям аналита. Таким как 0, 20, 40, 60, и 80 соответственно.
[00142] Рисунок 108. Диаграмма концентрации измеренного аналита, как функция концентрации действительного аналита.
[00143] Рисунок 109. Диаграмма концентрации измеренного аналита как функция концентрации действительного аналита.
[00144] Рис. 110. Схематически иллюстрирует пример для анализа ELISA.
[00145] Рис. 111. Пример ротора в состоянии покоя с вертикально расположенными ковшами.
[00146] Рис. 112. Пример ротора в движении с ковшами под небольшим углом к горизонту.
[00147] Рис. 113. Пример конфигурации ковша.
[00148] Рис. 114. Пример сосуда для центрифугирования, соединенного с ковшом.
[00149] Рис. 115. Пример еще одного сосуда для центрифугирования, который можно соединить с ковшом.
[00150] Рис. 116. Пример сосуда для центрифугирования.
[00151] Рис. 117. Пример микродозатора для экстрагирования.
[00152] Рис. 118. Пример возможного соединения сосуда для центрифугирования и микродозатора экстрагирования.
[00153] Рис. 119. Изображение исходной смеси для реакции до центрифугирования.
[00154] Рис. 120. Очередное изображение реакционной смеси, сделанное до центрифугирования.
[00155] Рис. 121. Дополнительное изображение исходной реакционной смеси, сделанное до центрифугирования.
[00156] Рис. 122. Результаты как расстояние между областью взаимодействия и минискусом плазмы.
[00157] Рис. 123. Пример флуоресцентного микроснимка с помеченными лейкоцитами.
[00158] Рис. 124. Пример внутриклеточных проб на основе затемненных изображений.
[00159] Рис. 125. Пример получения многопараметрических данных из проб помеченных клеток.
[00160] Рис. 126. Пример высоко освещенных изображений цельной крови человека.
[00161] Рис. 127. Пример получения и анализа многопараметрических данных.
[00162] Рис. 128. Вариации в распределении света.
[00163] Рис. 129. Данные пяти анализов.
[00164] Рис. 130. Представленные графически параметры концентрации аналита, а также диаграммы точности, аккуратности и предполагаемой концентрации.
[00165] Рис. 131. Изображения, полученные с помощью дигитальной видеокамеры.
[00166] Рис. 132. Примеры изображений продукта реакции.
[00167] Рис. 133. Примеры изображений, анализированных до вращения и после вращения центрифуги.
[00168] Рис. 134. Примеры изображений продукта реакции.
[00169] Рис. 135. Спектральные функции нескольких проб сыворотки.
[00170] Рис. 136. Пример процесса детекции изобретения с помощью матрицы.
[00171] Рис. 137. Пример процесса детекции изобретения с помощью шариков.
[00172] Рис. 138. Пример процесса детекции изобретения с помощью помеченных аптамеров.
[00173] Рис. 139. Детекция аптамеров, связанных с дополнительной пробой.
[00174] Рис. 140. Отсутствие связывания между аптамером и некомплементарной пробой.
[00175] Рис. 141. Специфичность связывания аптамеров в матрице.
[00176] Рис. 142. Более детальный вид детекции аналита в матрице.
[00177] Рис. 143. Пример матрицы.
[00178] Рис. 144. График хемилюминесценции и концентрации анализа витамина Д.
[00179] Рис. 145. График хемилюминесценции и концентрации анализа эстрадиола.
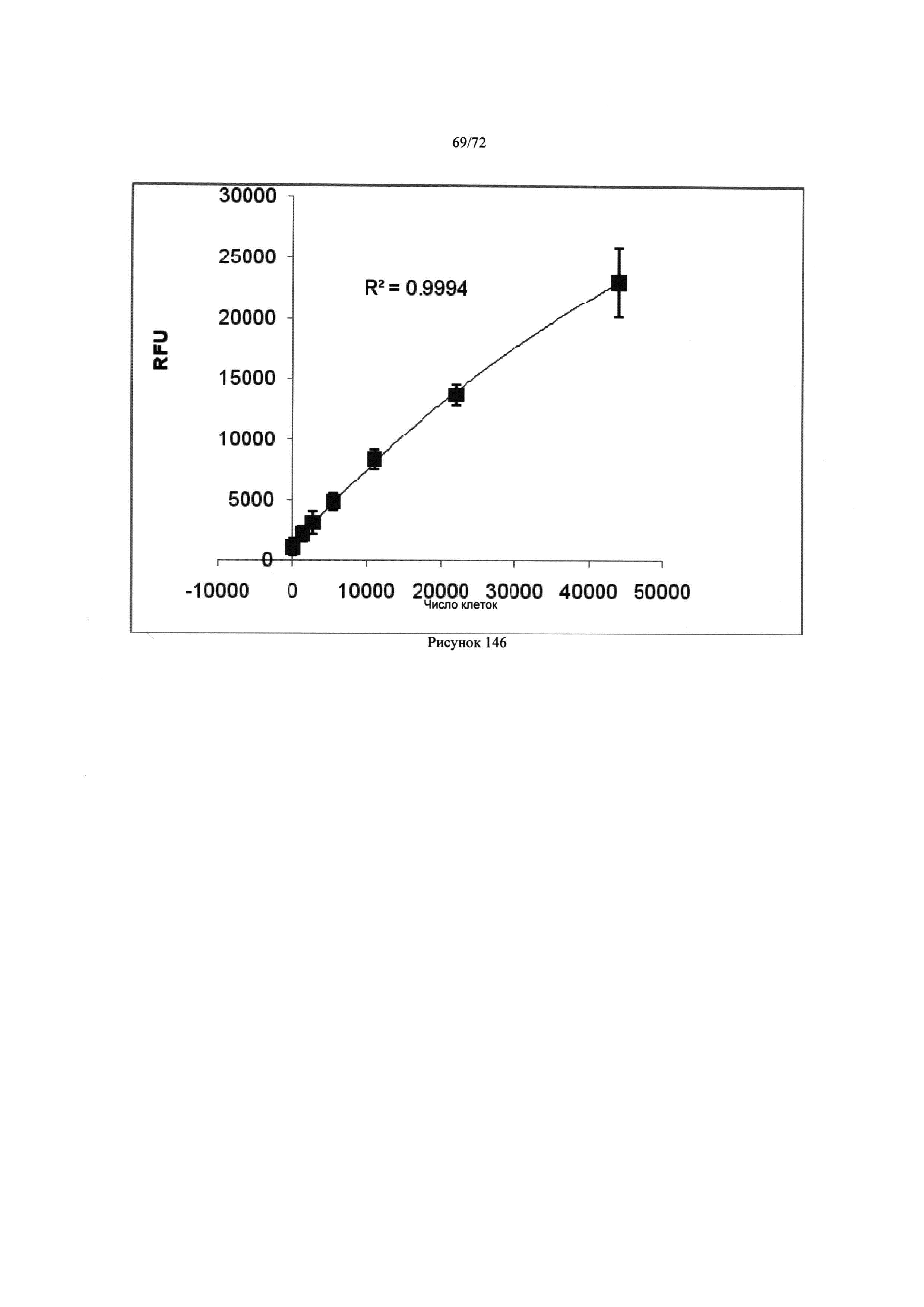
[00180] Рис. 146. Спектрофотометрические измерения концентрации "белых кровяных телец".
[00181] Рис. 147. График непрозрачности как функция времени.
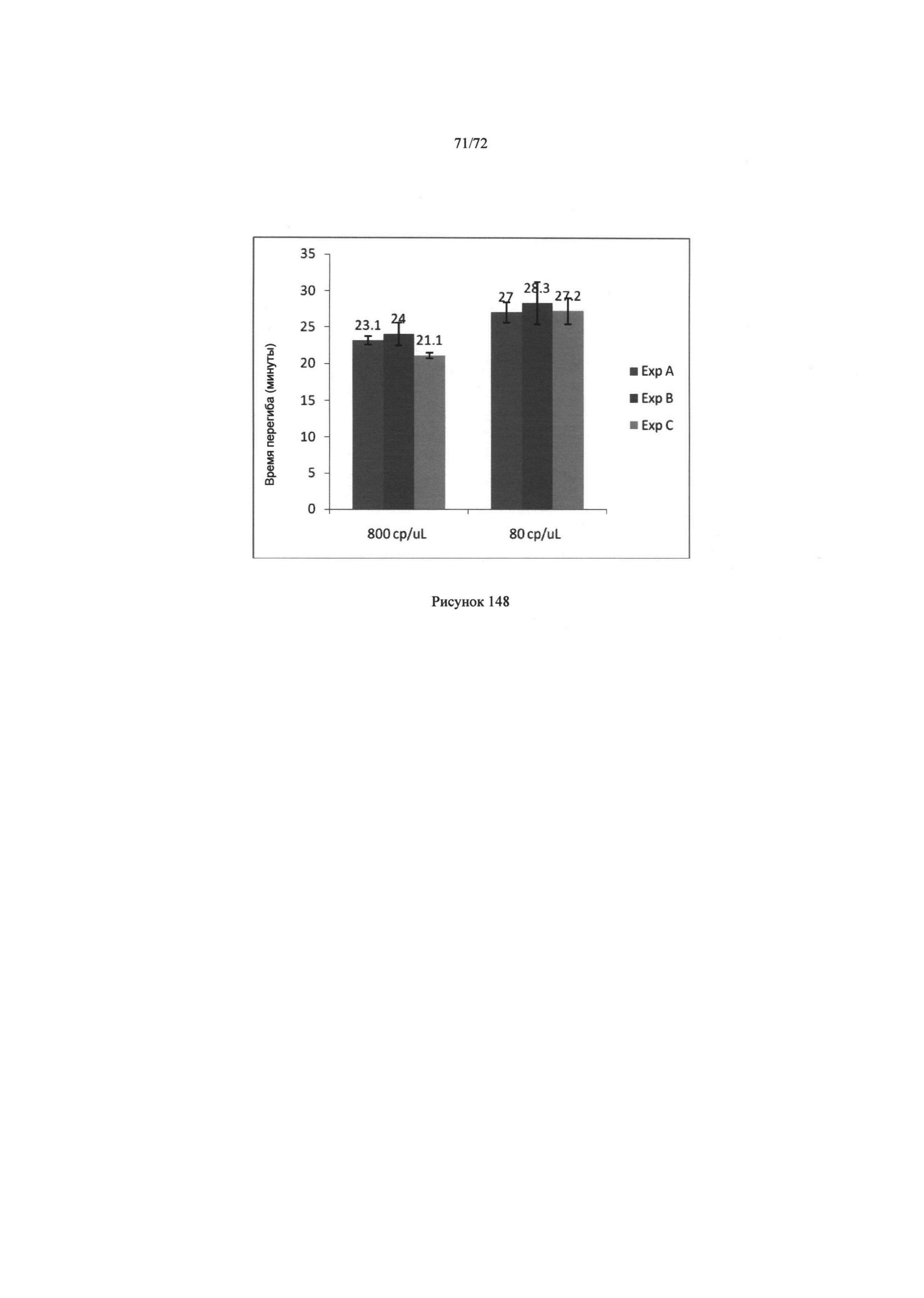
[00182] Рис. 148. График точек перегиба трех экспериментов с 800 копий/мкл и 80 копий/мкл.
[00183] Рис. 149. Графический пример, в котором используются магнитные капельки для анализа белков и маленьких молекул с помощью иммуносорбентного ферментного анализа (ELISA).
[00184] Рис. 150. Графический пример, в котором используются магнитные шарики для анализа белков и маленьких молекул с помощью иммуносорбентного ферментного анализа (ELISA).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00185] Хотя предпочтительные варианты осуществления и воплощения изобретения упомянуты и описаны выше, специалистам в данной области должно быть ясно, что они приводятся только в качестве примера. Разнообразные варианты, изменения и замещения могут быть сделаны специалистами в этой области без изменения сути изобретения. Должно быть ясно, что различные варианты настоящего изобретения, описанного здесь, можно использовать в процессе работы с изобретением.
[00186] Настоящее изобретение предлагает мобильные приложения для системы и методы для максимизации использования пробы. Различные аспекты изобретения, описанные здесь, можно использовать в различных приложениях, указанных ниже, или в любых других диагностических или терапевтических приложениях. Настоящее изобретение может использоваться как отдельная система или метод, или как часть интегрированного доклинического, клинического, лабораторного или медицинского приложения. Должно быть понятно, что различные аспекты изобретения могут использоваться по отдельности, все вместе или в различных комбинациях.
[00187] Упомянутые здесь приборы и системы могут послужить эффективным способом для детекции в реальном времени аналитов, присутствующих в биологической жидкости субъекта. Методы детекции можно использовать при разных условиях, включая идентификацию и квантификацию аналитов, связанных с определенными биологическими процессами, физиологическими условиями, расстройствами или этапами заболеваний. Такие системы обладают широким спектром применения, например, при проведении лекарственного скрининга, диагностики заболеваний, филогенетической классификации, родительской или судебной идентификации, начала или рецидива заболеваний, индивидуальной реакции на лечение по сравнению с группами населения и (или) мониторинг терапии. Приборы и системы, предназначенные для работы с субъектами, особенно важны для усовершенствования доклинического и клинического этапов лечения, улучшения соблюдения больным режимов и схем лечения, мониторинг МПД определенных, выписанных по рецепту врача препаратов, разработки индивидуализированной медицины, аутсорсинг тестирования крови из центральной лаборатории домой или по рецепту врача и (или) мониторинг терапевтических агентов после разрешения нормативных органов. Приборы и системы, предназначенные для работы с субъектами, могут использоваться плательщиками, которые занимаются аутсорсингом анализов крови из центральной лаборатории. Такие приборы и системы могут выступить в роли универсальной системы для индивидуализированной медицины. Использование той же системы допускает изменения или замену прибора вместе с протоколом или инструкциями к программируемому процессору систем для выполнения разнообразных анализов, как уже было описано выше. Системы и приборы, описанные здесь, хотя и отличаются меньшим размером и(или) являются портативными, включают новые характеристики и предлагают множество функций, присущих лабораторным инструментам.
[00188] В одном аспекте, изобретение состоит из прибора, включающего аппараты для анализа и реагентов, включающих реагенты, т.г, реагенты в жидкой и твердой фазах. В некоторых вариантах, один из целых приборов: аппарат для анализа, аппарат реагента или их комбинация являются аппаратами разового применения. В системе изобретения детекция аналита прибором для субъекта, как правило, автоматизирована. На такую автоматизацию влияет встроенный протокол или протокол, предоставленный с системой фирмой-изготовителем.
[00189] Описанные здесь приборы и системы предлагают большое количество характеристик, которыми не располагают существующие системы по услугам "у постели больного" или системы интегрированного анализа. Например, блоки многих систем обслуживания "у постели больного" работают на основе закрытой жидкостной системы или замкнутой системы для того, чтобы эффективно функционировать при наличии небольшого количества жидкости. В жидкостных приборах, вроде описанных выше блоков, допускается открытое движение жидкости между частями внутри определенного блока. Например, реагент может находиться в одно части, а проба может храниться в части, предназначенной для сбора пробы, при этом, растворитель может храниться в части для растворителя, а поверхность сбора данных может находиться в части для анализа, и ни одна из частей не находится в жидкостной связи с другими частями. Части могут двигаться по отношению к друг другу для того, чтобы соединить некоторые части жидкостной связью с помощью прибора для перевода жидкости системы. Например, прибор для перевода жидкости может включать головку, которая контактирует с аппаратом для анализа и помогает аппарату для анализа добиться жидкостной связи с аппаратом реагентов. В некоторых случаях головкой является микродозатор, который приводит в движение аппарат для анализа для установления жидкостной связи с аппаратом реагентов.
[00190] В одном варианте настоящее изобретение предоставляет метод обнаружения и измерения концентрации аналита в биологической жидкости или пробе ткани. Такой метод, как правило, включает шаги по предоставлению пробы (т.е. кровь, моча, слюна, ткань) для анализа каким-то прибором или системой изобретения, при этом, проба реагирует внутри, по крайней мере, одного аппарата для анализа, в результате чего поступает различаемый сигнал, образованный аналитом в пробе крови.
[00191] Еще один аспект изобретения дает возможность анализировать пробы с помощью прибора "у постели больного", сконфигурированного для максимального использования пробы. Например, более 15, 25, 50, 75, или 100 анализов может быть проведено на пробе с объемом менее 1, 20, 50, 100, или 500 т/л. Пробой может служить проба крови, полученная путем прокола пальца. Пробу можно получить в закрытом капилляре или микродозаторе. Пробу можно подготовить для одного или нескольких анализов путем разделения пробы (т.е., центрифугирования) и(или) процесса разбавления. Один или несколько анализов можно подготовить, соединив пробу, которая уже была разделена и разведена, с одним или несколькими реагентами в реакционной камере. Реакционной камерой может быть микродозатор, пробирка, аппарат для перевода пробы и (или) кюветка. Один или несколько анализов можно сконфигурировать таким образом, чтобы измерялся оптический сигнал, указывающий на концентрацию одного или нескольких аналитов в пробе. В реакционной камере может проводиться множество анализов, которые могут быть пространственно разделены. Множество оптических сигналов может возникать в одной реакционной камере при проведении одного анализа или при проведении множества пространственно разделенных анализов. Один или более оптических сигналов могут измеряться видеокамерой цифрового изображения, которая в состоянии измерять множество спектральных областей детекции или полосок обнаружения, т.е., красных, зеленых и голубых. Оптический сигнал может измеряться продуктом реакции анализа в реакционной камере, которой может служить микродозатор или другие контейнеры с пробой. Системы, приборы и методы могут быть полностью автоматизированы или полуавтоматизированы программируемыми логическими схемами.
[00192] Еще один аспект изобретения предлагает системы, приборы и методы подготовки проб для анализа. Пробы можно готовить для анализа с помощью одного или нескольких разделительных устройств. Например, пробу можно подготовить для анализа путем центрифугирования в центрифуге. Можно также делить на основе размера, заряда, гидрофобности/гидрофильности и(или) волатильности.
[00193] Одним аспектом изобретения является анализ пробы и продукта реакции с использованием анализа на основе изображения. Такая система может включать видеокамеру, которая в состоянии измерять оптический сигнал с использованием одной или нескольких областей спектра обнаружения. Например, видеокамера в состоянии измерять оптический сигнал с использованием красных, зеленых или голубых областей спектра обнаружения. Полученный сигнал может включать три измеренные величины, которые можно интерпретировать применяя один или нескольких алгоритмов, описанных здесь. Использование одной или нескольких областей спектра обнаружения может увеличить динамический диапазон проводимого анализа и может улучшить точность измерений по сравнению с измерениями, полученными на основе одной области спектра обнаружения.
[00194] Настоящее изобретение также описывает системы, приборы и методы снятия оптических измерений на пробах и реакционных продуктах анализа, содержащихся в реакционных камерах, каждый с множеством отдельных слоев разной толщины. Реакционная камера может иметь много слоев разной толщины, в которых наблюдается поглощение большего или меньшего количества света. Множество определенных слоев разной толщины (например, пробы или реакционной камеры) дают возможность увеличивать динамический диапазон протокола выбранного анализа. Изображение реакционной камеры можно анализировать описанным здесь методом для получения информации о пробе или проанализированных продуктах реакции. Комбинации использования множества существующих слоев разной толщины в одной реакционной камере и использование областей трехканального спектра обнаружения значительно улучшает динамический диапазон проводимого анализа.
[00195] Система для подготовки пробы и анализа может включать приборы, одноразовые компоненты и реагенты. Такая система может принимать пробы и автоматически выполнять множество анализов без вмешательства пользователя. При необходимости приборы могут включать графический интерфейс пользователя, механизм для ввода блоков, который может быть одноразовым, моторизированную платформу, которая может двигаться в трех измерениях, один или несколько одноаппартных приборов для обработки жидкости, один или много аппаратных приборов для обработки жидкости, один или несколько приборов для подготовки пробы, оптические сенсоры, каждый из которых включает РМТ и (или) устройство для обработки изображений, температурные регуляторы и коммуникационные устройства. Одноразовым компонентом может быть одноразовый блок, содержащий микродозаторы для проб, кольцевые уплотнения и реагенты. В некоторых вариантах одноразовые блоки могут также содержать нейтрализирующие установки, сконфигурированные для впитывания и нейтрализации жидких продуктов анализа.
[00196] Инструменты, одноразовые компоненты и реагенты могут быть помещены в закрывающееся пространство, например, корпус или панель шкафного типа. В некоторых вариантах в корпусе будет содержаться охватывающая разные слои область, размером 4 м2, 2 м2, 1 м2, 0,5 м2, 0,1 м2, 0,05 м2, или меньше. Изобретение предполагает предоставление системы тестирования, например, прибора предоставления услуг "у постели пациента", которая может включать один или более следующих этапов:
[00197] 1. Экономичное (с помощью центрифуги) разделение крови и сбор отделенной плазмы
[00198] 2. Разбавлении пробы плазмы на один или более уровней (например, 1:10, 1:100, 1:1000), чтобы каждый анализ проводился при оптимальном разбавлении
[00199] 3. Оптимизированное распределение пробы для нескольких анализов, которые могут включать несколько разных методов
[00200] 4. Оптимальные протоколы анализа
[00201] 5. Использование открытых полукруглых кювет для анализа проб, перемешивания с реагентами, инкубации и презентации в оптические системы
[00202] 6. Анализ проведенных процессов с помощью технологий отображения (сканирования и (или) фотографирования и(или) использование микроскопа)
[00203] В одном варианте прибор изобретения является автономным и включает все реагенты (твердой и жидкой фаз), для которых необходимо проведение множества анализов параллельно. При желании прибор можно сконфигурировать для проведения 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 100, 200, 500, 1000 или более анализов. Один или несколько из контрольных анализов можно добавить к функциям прибора для проведения параллельно при необходимости. Для анализа калибровки системы можно добавить калибраторы. Некоторые примеры сухих элементов управления и калибраторов, используемых для анализа калибровки системы, могут включать жидкие растворы аналитов или пробы плазмы, содержащие определенные уровни аналитов; определенное количество таких калибраторов и сухих элементов управления можно сушить с помощью лиофилизации, вакуумной сушки и других производственных процессов (и растворять во время анализа).
[00204] Используя такие компоненты в системе лечения "у постели больного" пациент или пользователь может количественно измерить много аналитов, например, более 10, 20, 30, 50, 75, 100, 150, или 200 аналитов, за менее чем 0.5, 1, 2, 3, 4, 5, 10, 20, 30, 60, 120, 180, 240, 480 или 600 минут.
[00205] Приборы субъектов и системы можно использовать для проведения количественного метода имуноанализа, который можно проводить за короткий период времени. Другие типы анализа можно проводить с помощью прибора изобретения, включающего, но не ограниченного, измерениями нуклеотидной последовательности и измерениями метаболита, например, холестерина или электолитов, таких как ионы магнезия или хлорида. В некоторых вариантах анализ выполняется менее чем за час, преимущественно менее чем за 120, 60, 30, 15, 10, 5, 4, 3, 2, или 1 минуты. В других вариантах анализ выполняется менее чем за 5 минут. Длительность детекции в анализе может меняться в зависимости от типа анализа, который предстоит выполнить прибором изобретения. Например, если необходима большая точность, анализ может длиться более одного часа или более одного дня. В некоторых примерах анализы, на проведение которых требуется длительный период времени, практичнее проводить в других вариантах системы "у постели больного": например, дома, а не в клинических условиях.
[00206] В других вариантах изобретения аппараты для реагента прибора субъекта можно сконфигурировать для включения компонентов, сформированных в группы по своему усмотрению. В аппаратах для реагента, как правило, находятся твердые или жидкие реагенты, необходимые для проведения анализа для обнаружения определенного аналита. Аппараты для анализа могут иногда (необязательно всегда) включать, по крайней мере, одну поверхность для сбора информации, способную на реакцию с аналитом из пробы биологической жидкости. Аппаратом для анализа может быть полый микродозатор с поверхностью для сбора данных, находящейся внутри микродозатора. Примеры таких микродозатора изобретения описываются ниже. Каждый аппарат для индивидуального анализа и реагента можно сконфигурировать для выполнения функции независимого анализа. При сборе прибора аппараты монтируются по мере надобности для использования в интегрированном приборе, который может приобрести форму блока.
[00207] Корпус прибора изобретения может быть изготовлен из полимерного, металлического или композитного материала, например, алюминия, полистирола или другого пластичного или поддающегося механической обработке пластика, и может включать специально отведенные места для установки аппаратов для анализа и реагентов. Корпус может включать метал или любой другой материал. Корпус может закрывать аппараты для анализа и(или) реагентов частично или полностью. Корпус может выдерживать вес аппарата для анализа и(или) реагентов. В одном варианте корпус в состоянии удалять влагу из кончиков или аппаратов для анализа с целью уменьшения количества лишней жидкости. Удаление влаги может проводиться с помощью пористой мембраны, например, из ацетата целлюлозы, или гигроскопичного материала, например, фильтровальной бумаги.
[00208] В некоторых вариантах, по крайней мере, один из компонентов прибора может быть сделан из полимерного материала. Одним из примеров полимерных материалов являются полистирол, поликарбонат, полипропилен, полидиметисилоксаны (PDMS), полиуретан, поливинилхлорид (PVC), полисульфон, полиметилметакрилат (РММА), акрилонитрил-бутадиен-стирол (ABS) и стекло.
[00209] Прибор и субкомпоненты могут быть изготовлены различными методами включая, но не ограничиваясь, холодную штамповку, литьевое прессование, рельефное тиснение, отливку, выдувное формование, станочную обработку, сварку, ультразвуковую сварку и термическую сварку. В одном варианте прибор изготавливается с помощью выдувного формования, термической сварки и ультразвуковой сварки. Субкомпоненты прибора можно соединить друг с другом термической сваркой, ультразвуковой сваркой, фрикционной посадкой (прессовой посадкой), клеящимися веществами, или, на примере определенных субстратов, например, стекла или полужесткого или нежесткого полимерного субстратов, естественной адгезией компонентов.
[00210] Описанная система в состоянии выполнять разнообразные анализы, независимо от типа аналита, идентифицированного в пробе биологической жидкости. В зависимости от типа прибора протокол можно перевести из внешнего прибора, где он может храниться в устройстве считывания, давая возможность устройству считывания выполнять определенный протокол прибора. В некоторых вариантах у прибора будет идентификатор (ID), который будет детектироваться или считываться прибором обнаружения идентификатора, описанным здесь. Идентификатор в состоянии выполнять двухстороннюю связь между прибором и сенсором или принимающей системой. Прибор обнаружения идентификатора в состоянии обмениваться информацией с установкой по обмену информацией с помощью оператора, который передает идентификатор внешнему прибору. При необходимости, внешний прибор в состоянии пересылать протокол, хранящийся во внешнем приборе в установку по обмену информацией на основе идентификатора. Протокол для системы может включать инструкции оператору системы для проведения протокола, включая, но не ограничиваясь, инструкциями по проведению определенного анализа и метода детекции. После проведения анализа, система генерирует сигнал, идентифицирующий аналит в пробе биологической жидкости, который принимается установкой детекции в системе. Обнаруженный сигнал затем передается в установку по обмену информацией, откуда он передается во внешний прибор для обработки, включая без ограничений, расчеты концентрации аналита пробы.
[00211] Системы, приборы и методы для выполнения анализа пробы с использованием приборов "у постели больного" и кончиков, которые могут выступать в качестве реакционных камер, описаны в Патентной заявке США No. 2009/0088336 и Предварительной заявке США No. 60/997,460, каждая из которых включена в настоящую заявку во всей полноте посредством ссылки.
[00212] Обработка проб и реакционные камеры
[00213] Пробы, реагенты, и собранные анализы, описанные здесь, могут обрабатываться и храниться в разнообразных реакционных камерах. Прибором для обработки пробы и реакционной камерой могут быть лунка, трубка или открытый микродозатор, который также может быть кюветой. Как уже было сказано, микродозатором может называться микродозатор пробы, микродозатор кюветы, реакционная камера, кювета, капилляр, прибор для обработки пробы, или прибор для передачи проб. Пробы собираются в микродозатор или трубку. Микродозаторы могут быть загерметизированы. Такая герметизация может быть постоянной или потенциально обратимой. Разведенные пробы можно комбинировать с одним или несколькими реагентами и перемешивать (как описано в предыдущих приложениях) в "элементах для проведения анализа" таких как кончики (открытые кюветы) или открытые или закрытые лунки. Когда анализ готов для считывания информации, элементы анализа могут быть пересланы в оптическую систему для анализа изображения или считывания другой информации. Кроме этого, реакционные смеси, полученные после анализа, могут пересылаться от одного элемента к другому. Например, анализы, выдержанные в микродозаторах, можно перенести на впитывающую или поглощающую среду; в то время как анализы, выдержанные в лунках, можно аспирировать в микродозаторы. Большое количество анализов можно проводить параллельно. Получение результатов анализов может проводиться последовательно или одновременно в зависимости от протокола анализа или времени выдержки. Для анализов, включающих измерения скорости изменений, элементы анализа могут быть отправлены в оптическую систему более одного раза в разное время.
[00214] Приборы для переноса жидкости и материалов
[00215] Приборы для переноса жидкости могут быть частью системы. Приборы для переноса жидкости могут включать множество головок. Прибор для переноса жидкости подразумевает любое количество головок, необходимых для детекции множества аналитов в пробе. В одном примере, прибор для переноса жидкости насчитывает примерно восемь головок, закрепленных на одной линии и на определенном расстоянии друг от друга. В одном варианте, головки имеют суженный носик, который приводится в движение с помощью прессованной посадки разными микродозаторами, например, аппарата для анализа или аппарата для сбора проб, как уже было описано выше. Микродозаторы могут обладать характеристиками, которые делают возможным автоматическое снятие с помощью специального инструмента и утилизацию в специальном месте определенного прибора как описано в инструкциях. В одном варианте, микродозаторы для анализа прозрачные и могут быть похожими на кювету в которой проводится анализ, обнаруживаемый оптическим детектором, например, электронным фотоумножителем или датчиком-видеокамерой.
[00216] В одном примере программируемый процессор (например, центральный процессор, CPU) системы может состоять из или сконфигурирован для приема (например, из памяти) инструкций или команд, и может контролировать прибор для переноса жидкости в соответствии с инструкциями для переноса пробы жидкости путем втягивания (для забора жидкости) или ввода (для вытеснения жидкости) пистона в закрытое воздушное пространство. Процессор может быть сконфигурирован для проведения аспирации и(или) распределения. Объем вытесняемого воздуха и скорость движения можно точно контролировать, например, с помощью программируемого процессора.
[00217] Смешивание проб (или реагентов) с растворителями (или другими реагентами) можно выполнить аспирацией компонентов для перемешивания в общей трубке, а затем провести систематическую аспирацию значительной части полученного объема вверх и вниз по микродозатору. Растворение засохших в трубке реагентов можно провести подобным образом. Инкубация пробы жидкости и реагентов с улавливающей поверхности, на которой находится улавливающий реагент, (например, антитело) достигается при помощи забора определенной жидкости в микродозатор и хранения ее там в течении неопределенного периода времени. Изъятие проб и реагентов производится вытеснением жидкости в резервуар или впитывающую салфетку в приборе. Еще один реагент может быть помещен в микродозатор в соответствии с инструкциями или протоколом для программируемого процессора.
[00218] Система может включать крепление или механизм инициации для переноски аппаратов для проб или микродозаторов. Механизм инициации может состоять из вакуумной установки или установки, предназначающейся для плотного контакта с выступом микродозатора аппарата для анализа. Например, средство для пересылки микродозаторов методом, похожим на движение головок прибора для переноса жидкости. Такой прибор можно также перенести на установку в соответствии с положением механизма инициации или крепления.
[00219] В одном варианте инструмент для передвижения микродозатора такой же как и инструмент для переноса пробы, например описанный здесь прибор для переноса жидкости. Микродозатор для сбора пробы можно прикрепить к головке дозатора с помощью выступа на микродозаторе коллектора. Микродозатор коллектора затем может использоваться для распространения жидкости по всему прибору и системе. После распределения жидкости микродозатор коллектора можно утилизировать, а микродозатор дозатора можно прикрепить к аппарату для анализа с помощью выступа на аппарате для анализа. Микродозатор аппарата для анализа затем можно переносить от одного аппарат для реагентов к другому и реагенты можно распределять в аппарат для анализа в соответствии с аспирацией или действиями дозатора, выполняемыми головкой дозатора. Головка дозатора может также выполнять перемешивание внутри микродозатор коллектора, аппарата для анализа или аппарата для реагента путем аспирации или с помощью действий вроде шприцевания.
[00220] В другом варианте микродозаторы, в которых содержится жидкость, включая реакционные смеси для анализа, можно разъединить с прибором дозирования и "припарковать" в определенных местах инструмента или внутри одноразового аппарата. При необходимости, микродозаторы можно закрыть с помощью уплотнителя (по примеру центрифуги) для предотвращения потери жидкости. В некоторых вариантах уплотнитель может быть сделан из винилопласта.
[00221] Типичные микродозаторы для пробы
[00222] Разнообразие контейнеров разных форм можно использовать в качестве микродозаторов для кончиков, реакционных камер и кювет. Например, кювета может быть круглой, цилиндрической, квадратной, прямоугольной, кубовидной, конусовидной, пирамидальной или другой формы, которая с состоянии удерживать пробу жидкости. Можно также использовать прямоугольные кюветы, в которых луч света падает под прямым углом к поверхности кюветы, как показано в одной плоскости и в разрезе на Рисунке 63. В таких прямоугольных кюветах проба жидкости, которая освещена, также прямоугольной формы и определена кюветой. Можно также использовать кюветы с круглым поперечным разрезом. Например, можно использовать некоторые виды пластин микротитратора, в которых объем освещенного пробы частично определяется мениском пробы, как показано внизу в одной плоскости и в разрезе на Рисунке 64.
[00223] Кюветы с разной длиной оптического пути можно использовать для оптимизации и расширения сигнала во время анализа и минимизации объема пробы, необходимой для измерения результатов анализа. Кюветы могут быть длиннее поперечного разреза, по крайней мере, в одной области. В некоторых ситуациях, длину оптического пути кюветы можно выбирать в зависимости от геометрической формы кюветы и (или) материала. Для разных анализов можно выбирать разные кюветы.
[00224] В настоящем изобретении предпочитаемая форма кюветы для анализа отличается круглым поперечным разрезом по направлению луча света, как показано на Рисунке 65. Использование кюветы с круглым поперечным разрезом имеет несколько преимуществ, включая, но не ограничиваясь, следующими:
[00225] 1. Длину оптического пути можно точно определить. Относящаяся к размерам погрешность инжекционно-формируемых деталей меньше на 1-2% CV. В обычных пластинах микротитратора мениски свободной жидкости могут вызывать неточности при измерении длины оптического пути.
[00226] 2. Открытые концы и округлая форма микродозаторов помогают с легкостью обрабатывать жидкость, что делает процесс аспирации жидкости более точным.
[00227] 3. Оптическое изображение микродозаторов дает возможность идентифицировать положение микродозаторов и границы колонны жидкости, а также точно определять центр микродозатора, где сигнал максимальный.
[00228] 4. В одном и том же микродозаторе можно выдерживать и анализировать более одной пробы жидкости. Это происходит потому, что в узкой части микродозатора происходит перенос незначительного количества материала (в осевом направлении) между граничащими "скоплениями" жидкости.
[00229] Микродозатор стандартного размера может иметь следующие характеристики:
[00230] Длина микродозатора: 0,5-4 см
[00231] OD микродозатора: 0,2-1,0 см
[00232] ID микродозатора: 0,1-0,5 см
[00233] Способность микродозатора вбирать жидкость: 5-50 мкл
[00234] Пространственная точность микродозатора: обычно выше чем 2% от +/- 0,001 см
[00235] Конфигурация микродозатора: микродозатор обычно отличается тем, что взаимодействует с дозатором (цилиндрическим) для того, чтобы формировать водонепроницаемое герметическое уплотнение. Существует цилиндрическая коническая область для получения изображения. Как правило, в оптической части микродозатора находятся, по крайней мере, две области с различной длиной оптического пути. Нижняя часть микродозатора, как правило, узкая, что способствует удержанию вертикальной жидкостной колонны под действием силы тяжести.
[00236] Материал микродозатора: Прозрачный или равномерно отражающая пластмасса (полистирол, полипропилен и т.д.) (пропускание света обозримого >80%).
[00237] Для получения изображения микродозатор обычно делают прозрачным или полупрозрачным, но это не является обязательным условием, если микродозаторы используются как кюветы для анализа в процессе выполнения трехцветного анализа. Микродозаторы кювет, которые кажутся "мутными", могут функционировать аналогично прозрачным микродозаторам. Мутные микродозаторы изготавливаются в пресс-формах с неотшлифованными или текстурированными поверхностями или с добавлением отражающего света материала в пластмассу, из которой изготавливаются микродозаторы. Можно сделать так, чтобы интенсивность рассеивания света таких мутных микродозаторов была незначительной, чтобы затемнять цветную жидкость, которая измеряется. В общем, можно выбрать чтобы влияние рассеивания света на проходящий свет было меньше чем 10, (20 и 30%) по отношению к влиянию цветного материала. Эффект рассеивания света можно выбрать таким образом, чтобы рассеивание цвета мутных микродозаторов было равномерным.
[00238] Микродозаторы и реакционные камеры, описанные здесь, могут включать цилиндрическую (или коническую) ось длиной в 2 см с внутренним диаметром приблизительно 1-5 мм, соответствующую объему приблизительно в 10-50 мкл.
[00239] В одном примере, в верхней части цилиндра находится усеченный цилиндрический "выступ", флюидно связанный с цилиндром и адаптированный для контакта с коническим элементом дозатора. Нижняя часть микродозатора может быть сужена для того, чтобы из микродозатора не выливалось содержимое в вертикальном положении и в положении, когда микродозатор не соединен с дозатором. Микродозатор может быть заостренным. Внешняя форма нижней части микродозатора, как правило, также в какой-то степени заостренная, диметр которой уменьшается от главной части цилиндрической оси в концу для того, чтобы дать возможность герметизации с помощью гибкого (винилового) колпачка, в который плотно вставляется конец микродозатора. Микродозаторы, как правило, изготавливаются из литьевого пластика (полистирола, полипропилена и т.д.). Микродозатор может быть прозрачным и полупрозрачным и тогда информация о пробе может быть получена при получении изображения.
[00240] На Рисунке 4, Рисунке 5 и Рисунке 6 показан пример микродозатора.
Микродозатор сконфигурирован с (1) верхней частью, которая может образовать герметичное уплотнение с головкой дозатора, (2) в общем цилиндрическую (в действительности коническую с наклоном под небольшим углом штамповочного уклона) ось и узкий заостренный нижний микродозатор. Микродозатор может образовать водонепроницаемое герметическое уплотнение с колпачком. Заостренная форма помогает добиться хорошего соответствия с колпачком при приложении среднего усилия. В качестве материала используется изготовленный литьем под давлением полистирол. Общие размеры: 32 мм длиной, максимальный внешний диаметр примерно 7.6 мм, практическая вместимость приблизительно 20 мкл. Размеры микродозатора можно изменить для большего объема. Например, для получения пробы в 50 мкл ID можно увеличить в 1.6 раз.
[00241] Герметизации можно добиться с помощью изготовленного из винилопласта или другого материала микродозатора, который с легкостью одевается на узкий конец контейнера с пробой, благодаря силе, которая возникает благодаря движению установки прибора в направлении по оси ζ. В микродозаторе может появиться пузырек воздуха после того, как на него одевается колпачок. Можно использовать центрифугирование для того, чтобы перегнать пузырек в верхнюю часть столба крови для того, чтобы избавиться от эффектов пузырька. Размеры микродозатора и(или) размеры держателя микродозатора в центрифуге можно привести в соответствие таким образом, чтобы микродозатор был закреплен для центрифугирования.
[00242] Подготовка пробы
[00243] Настоящее изобретение дает возможность получать системы, методы и приборы для обработки проб из разных источников. Например, пробы можно брать у пациентов, животных или в окружающей среде. Пробой может служить биологическая жидкость. Системы и приборы настоящего изобретения дадут вам возможность обработать любые биологически жидкости, в которых содержится интересующий вас аналит. Чаще всего используемые биологические жидкости включают, но не ограничиваются кровью, сывороткой, слюной, мочой, желудочным и пищеварительным соками, слезами, калом, спермой, влагалищной жидкостью, тканевой жидкостью, полученной из пораженной опухолью ткани и спинномозговой жидкостью.
[00244] В некоторых вариантах в роли биологической жидкости выступает проба крови живого пациента. Кровь собирают путем прокалывания пальца в объеме менее 0.5, 1, 5, 10, 20, 50, 100, 200, 300, 400, 500 или 1000 мкл.
[00245] Биологическую жидкость можно получать от пациента и помещать в прибор разными путями, включая, но не ограничиваясь с помощью ланцета, инъекции или с помощью пипетки.
[00246] Как указано здесь, термины "субъект" и "пациент" взаимозаменяемы и относятся к позвоночным, предпочтительно млекопитающим, и более предпочтительно к человеку. Группа млекопитающих включает, но не ограничивается мышами, обезьянами, сельскохозяйственными животными, людьми, животными для спорта и домашними животными.
[00247] В одном варианте надрез на коже делается с помощью ланцета и берется проба крови благодаря силе притяжения, капиллярному эффекту, аспирации или вакуумному давлению. Ланцет может быть частью прибора, частью системы или отдельным компонентом. При необходимости ланцет можно активировать разнообразными механическими, электрическими, электромеханическими или другими механизмами активации или в любом их сочетании. В еще одном варианте, при котором не требуется активный механизм, пациент может сам предоставить биологическую жидкость для прибора, например, пробу анализа слюны. Полученную жидкость можно поместить в устройство сбора проб прибора. Еще один вариант прибора включает, По-крайней мере, одну микроиглу для прокалывания кожи.
[00248] Объем биологической жидкости, который необходим для обработки прибором, может быть меньше 500 микролитров, как правило, от 1 до 100 микролитров. При желании, пробы объемом от 1 до 50 микролитров, от 1 до 40 микролитров, от 1 до 30 микролитров, от 1 до 10 микролитров или даже от 1 до 3 микролитров можно использовать для определения аналита с помощью прибора. В одном варианте объем биологической жидкости, используемой для определения аналита с помощью приборов или систем для субъекта, - одна капля жидкости. Например, одна капля крови из проколотого пальца может предоставить достаточное количество биологической жидкости для анализа прибором, системой или методом, описанным в настоящем документе.
[00249] Пробу биологической жидкости можно получить от субъекта прямо в микродозатор, описанный в настоящем документе, или его можно позднее перенести в микродозатор.
[00250] Разведение пробы
[00251] В некоторых случаях конфигурация процессора для переноса жидкости влияет на степень разведения пробы биологической жидкости множества анализируемых элементов и приводит к появлению сигналов, характерных для множества аналитов, которые обнаружены а анализируемом промежутке, таким образом, что такое множество аналитов обнаруживается в указанной системе. В одном примере проба биологической жидкости состоит из, по крайнем мере, двух аналитов, которые присутствуют в концентрациях, отличающихся, по меньшей мере, в 1, 2, 5, 10, 15, 50, 100, 500, 1000, 10,000, 105, 106, 107, 108, 109 или 1010 раз. В одном примере пробой биологической жидкости служит одна капля крови. В одном варианте концентрация, по крайней мере, двух аналитов, присутствующих в пробе, отличаются до 10 порядков возрастания (например, первый аналит присутствует в количестве 0.1 мкг/мл, а второй аналит присутствует в количестве 500 мкг/мл). В другом примере некоторые аналиты протеинов обнаружены в концентрациях более 100 мг/мл, при желании такой предел можно изменить на двенадцать порядков возрастания или убывания. При измерении аналитов нуклеиновой кислоты, например, ДНК или РНК с использованием методов экспоненциального роста, например, метода полимеразной цепной реакции, количество копий аналитов можно увеличить в миллиард раз до начала проведения измерений.
[00252] При желании степень разведения пробы биологической жидкости может помочь в получении сигналов, характерных для по меньшей мере двух аналитов в анализируемом промежутке.
[00253] Как описано в документе, предлагаемые системы и приборы в состоянии выполнять разнообразные функции, создавая универсальные лабораторные условия "у постели больного". Например, пробы можно собирать и манипулировать автоматически в настольной системе или в меньшем по размеру приборе. Обычно, проблема, характерная приборам "у постели больного", заключается в трудности достижения разных промежутков растворения при проведении множества анализов, при которых анализы отличаются разной чувствительностью или специфичностью. Например, в пробе может быть два налита, но один аналит отличается высокой концентрацией пробы, а второй очень низкой. Как описано, системы и приборы, предложенные в настоящем документе, в состоянии развести пробу до совершенно другого уровня с целью определения обоих аналитов. Кроме этого, пробу можно разделить на две или больше проб, что даст возможность обнаруживать индивидуальные аналиты на разных уровнях разведения.
[00254] Например, если аналит находится в пробе высокой концентрации, пробу можно последовательно развести до соответствующего промежутка детекции и перенести на поверхность улавливания для детекции. В подобной системе или приборе пробу с аналитом низкой концентрации, возможно, не нужно будет разбавлять. Таким образом, промежуток анализов, проводимых приборами и системами "у постели больного", описанных в настоящем документе, будет намного расширен по сравнению с уже существующими системами.
[00255] Системы для анализа РОС, использующие одноразовые блоки с разбавителем, как правило, ограничены в степени разбавления. Например, небольшое количество пробы крови, полученной проколом пальца (например, приблизительно 20 микролитов) можно разбавить разбавителем в максимальном объеме для того, чтобы поместить в 250-микролитровую пробирку, тогда практический предел разбавления всей пробы приблизительно 10 раз. В одном указанном примере система может аспирировать небольшое количество пробы (например, приблизительно 2 микролитра) и тогда максимальный фактор разбавления приблизительно 100 раз. В большом количестве анализов такие факторы разбавления приемлемы, но для анализа вроде С-реактивный белок (как описано в примерах в настоящих документах) появляется необходимость разбавить пробу намного больше. Анализы ELISA, основанные на разбавлении, отличаются характерным ограничением объема захватывающей поверхности, предназначенной для связывания с аналитом (например, для типичного аналита белка требуется несколько сотен мг/мл). Некоторые аналиты присутствуют в крови с сотнях микрограмм/мл. Даже при разбавлении в 100 раз, концентрация таких аналитов выходит за предел калибровки. В очередном примере системы, прибора или прибора для переноса жидкости, можно добиться большого количества разбавлений путем проведения большого количества переноса жидкости разбавителя в индивидуальном устройстве анализа или сбора пробы. Например, если присутствует высокая концентрация аналита в описанной выше пробе, пробу можно последовательно разводить до тех пор, пока концентрация не дойдет до соответствующего промежутка детекции. При помощи систем и методов, описанных здесь, можно проводить точные измерения или примерное определение степени разбавления для расчетов первоначальной концентрации аналита.
[00256] Разделение пробы
В некоторых вариантах изобретения пробу можно приготовить для анализа в процессе первого этапа разделения. Например, если пробирный анализ подразумевает анализ ДНК, можно использовать этап разделения ДНК для того, чтобы избавиться полностью или уменьшить количество примесей или нежелаемого исходного материала. В процессе выполнения этапа разделения можно использовать хроматографию, центрифугирование, твердую-жидкую экстракцию, связывающую способность или любые другие механизмы, известные специалистам в этой области.
[00258] В некоторых вариантах пробу крови, которую предстоит анализировать, сначала обрабатывают отделением компонента плазмы от пробы крови. Этот этап можно выполнять с помощью разнообразных подходов, таких как фильтрация, центрифугирование и связывающую способность. Центрифугирование может быть эффективным методом разделения компонентов в пробе крови и может использоваться с настоящим изобретением.
[00259] Отделение плазмы
[00260] Кровь можно поместить в открытый или герметизируемый микродозатор разными путями. Например, пробу можно собрать в пробирку, а в закрытый микродозатор пробу можно перевести из пробирки благодаря капиллярному эффекту или с помощью пневмонического воздействия. Предпочтительным методом введения является капиллярный эффект. Кроме этого, контейнер для хранения пробы можно оборудовать одним открытым концом, как в стандартной центрифуге.
[00261] После наполнения кровью микродозатор можно автоматически перенести в другое место в одноразовом блоке с герметизирующим элементом. Герметизирующим элементом может стать маленький "колпачок", изготовленный из поддающейся деформации (эластичного) материала (винила, силикона и т.д.), для соединения с нижним концом микродозатора для герметизации. Микродозатор герметизируется с помощью прибора, формируя водонепроницаемый барьер. Герметизированный микродозатор затем переводится в маленькую центрифугу (как правило, расположенную в и являющуюся частью прибора) и вдавливается в позиционный функцию в ротор центрифуги таким образом, что нижний (герметически закрытый) конец микродозатора установлен впритык к негибкой полке, на которой будет покоиться микродозатор во время центрифугирования.
[00262] Ротор центрифуги может быть круглым с диаметром приблизительно в 10 см.
Масса микродозатора, содержащего кровь, должна быть (1) маленькой по сравнению с ротором (2), при необходимости, уравновешенной с помощью противовеса, расположенного на противоположной части ротора для минимизации любой вибрации во время центрифугирования. Одно из направлений ротора центрифуги может быть вертикальным (ось вращения горизонтальная). Ротор устанавливается на вал трансмиссии, который приводится в движение электрическим мотором.
[00263] Центрифугирование можно выполнить вращением ротора со скоростью 15000 оборотов в минуту на протяжении 5 минут. Во время такого процесса определенные элементы крови (эритроциты и лейкоциты) опускаются в открытый конец микродозатора и формируют плотно упакованный столб, в котором плазма без клеток находится в части микродозатора, отдаленного от герметизирующей перегородки.
[00264] Микродозатор, в котором содержится разделенная проба, можно поместить вертикально в участок, доступный для прибора обработки жидкости, состоящего из узкого микродозатора ("микродозатор для сбора пробы") прикрепленного к прибору дозирования, который, в свою очередь, прикреплен к трехкоординатной установке.
[00265] Теперь плазму легко получить из центрифугированного пробы. Это достигается путем перевода микродозатора для получения пробы вертикально вдоль оси микродозатора центрифуги, таким образом, чтобы имел место жидкостный контакт с плазмой и чтобы плазма была вытолкнута вверх с помощью пневматической силы.
[00266] Дополнительно, этот процесс можно контролировать с помощью видеокамеры или другого прибора получения изображения, который можно использовать для измерения гематокрита в пробе и для предоставления информации о местоположении границы между плазмой и эритроцитами оператору установки/дозатора. С помощью полученного изображения разделенной крови, микродозатор узкой пипетки, установленный на пипетке, медленно опускается вертикально, таким образом, чтобы микродозатор оказался в осевом направлении со средством хранения пробы до тех пор, пока не образовался контакт с плазмой. Микродозатор затем опускается ниже до тех пор, пока не приблизится (на расстояние меньше чем 3, 2, 1, 0,5 или 0,1 мм) к области упакованной клетки. В то же время, плазма аспирируется в узкий микродозатор пипетки с помощью компьютера. Плазму можно аспирировать одновременно с движением узкого микродозатора пипетки в столб плазмы таким образом, чтобы плазма не вытеснялась в верхнюю часть прибора содержащего пробу. Аспирацию можно контролировать, чтобы избежать аспирации воздуха во время этапа удаления плазмы.
[00267] Как правило можно использовать микродозаторы пипетки с очень узким концом по примеру используемых в системе для электрофореза для аспирации плазмы из микродозатора центрифугированной пробы. Узкий микродозатор, как правило, конусообразный или зауженный с размерами в 1-3×0,1-0,5 см (длина × диаметр) может быть изготовлен из разнообразных материалов (полистирола, полипропилена и т.д.). Материал может быть прозрачным или полупрозрачным визуально. Один конец микродозатора контактирует с дозирующим прибором. Другой - очень сужен, (0,05-0,5 мм OD) настолько, чтобы войти в микродозатор с пробой, не касаясь внутренней поверхности микродозатора. Даже в случае контакта между микродозатором для аспирации плазмы и микродозатором для пробы, на аспирацию плазмы это не влияет.
[00268] Диаграмма процесса аспирации плазмы на этапе, на котором кончик для аспирации плазмы находится немного выше области взаимодействия клеток наполненных плазмой во время этапа аспирации, показанного на Рисунке 7.
[00269] Таким образом можно удалить всю плазму, оставив приблизительно 1 мкл в микродозаторе пробы для центрифугирования. Это соответствует приблизительно 11 мкл плазмы (90% восстановление) из 20 мкл крови с 40% гематокрита. Кроме этого, качество пробы (по отношению к гемолизу, липемии и иктерии) можно определить по изображению центрифугированной пробы.
[00270] Аспирированную плазму можно перевести в другие места для разведения и перемешивания с реагентами для проведения анализа по выявлению аналитов, не ограничивающегося метаболитами, электролитами, биомаркерами для белка, фармацевтическими препаратами и нуклеиновыми кислотами.
[00271] Отделение лейкоцитов
[00272] Еще одно применение изобретения - выделение белых кровяных телец из крови и их концентрация. Еще один аспект изобретения включает обработку пробы крови процессом лизирования эритроцитов (и дополнительно регулирует количество лейкоцитов) путем добавления реагентов (например, BD PharmlyseTM 555899 или BD FACS™ Lysing Solution 349202) в кровь и путем перемешивания. После короткого периода инкубации, лизируемая проба подвергается центрифугированию, как описано выше, так, что лейкоциты концентрируются в герметически закрытом конце микродозатора с кровью. Лизируемый раствор эритроцитов затем можно убрать с помощью аспирации. Восстановление лейкоцитов достигается либо (1) добавлением маленького количества буферного раствора и повторением аспирации в направлении "вверх и вниз" для повторного суспендирования клеток, после которой они вытесняются в специальный приемник или (2) удалением герметизирующего элемента и вытеснением упакованных клеток в приемник с помощью давления воздуха.
[00273] Альтернативный вариант дает возможность сбора лейкоцитов без лизирования эритроцитов. После центрифугирования крови (как уже известно) лейкоциты образуют слой над эритроцитной массой, который называется лейкоцитной пленкой. После удаления большей части плазмы (как описано выше) лейкоциты можно эффективно собрать, (1) добавляя небольшое количество (например, приблизительно 5 мкл) изотонического буферного раствора или (2) используя остаточное количества плазмы и повторно суспензируя лейкоциты повторной аспирацией или (или) путем механического перемешивания с помощью микродозатора для получения пробы. После суспензирования, получившуюся смесь лейкоцитов вместе с маленьким количеством эритроцитов суспензируют повторно для сбора аспирацией с целью анализа лейкоцитов. Таким образом, большинство лейкоцитов (как правило, все) можно собрать при небольшом (загрязняющем) количестве эритроцитов (как правило, меньше 5% оригинала).
[00274] Центрифуги
[00275] Рисунок 1, Рисунок 2, Рисунок 3. Показаны примеры уменьшенных в размере центрифуг (Рисунок 1 - боковая проекция, Рисунок 2 - передняя проекция, Рисунок 3 - задняя проекция), можно интегрировать в систему. В центрифуге может быть электрический мотор, способный вращать ротор со скоростью 15000 оборотов минуту. Один вид роторов центрифуги имеет форму лопастей вентилятора и устанавливается на ротор электродвигателя вертикально. К ротору прикрепляется элемент, который фиксирует приспособление для сбора пробы (микродозатор) и выступает в роли выемки или полки, на которой находится микродозатор, отдаленный от оси мотора, он также обеспечивает поддержку в процессе центрифугирования таким образом, чтобы не было утечки пробы. Микродозатор можно укрепить в ближнем конце с помощью механического стопора в роторе. Это можно выполнить для того, чтобы сила, которая возникает во время центрифугирования, не привела к прободению мягкого колпачка из ванили микродозатором. Микродозатор можно вводить и выводить с помощью стандартного механического робота, но предпочтительнее пипеткой. Ротором является предмет из акрилового волокна (или другого материала) определенной формы для минимизации вибрации и шума во время работы центрифуги. Ротор имеет определенную форму (необязательно) для того, чтобы, когда он находится под определенным вертикальным углом, другие подвижные компоненты инструмента могли двигаться, не касаясь центрифуги. Приспособления для фиксации пробы сбалансированы под действием центробежных сил с помощью противовеса, расположенного на противоположной стороне ротора, таким образом, чтобы центр инерции вращения находился в осевом положении по отношению к мотору. Мотор центрифуги может предоставлять данные для позиционирования в компьютер, который сможет контролировать положение ротора (как правило, вертикальное до и после центрифугирования).
[00276] Как можно видеть из двух графиков на рисунках 8 и 9, чтобы минимизировать время центрифугирования (без дополнительного механического стресса во время центрифугирования) в соответствии с опубликованными стандартами (DIN 58933-1; для США стандарт CLSI Н07-А3 "Процесс определения показателя гематокрита с помощью микрогематокритного метода"; Утвержденный стандарт - третье издание) приемлемые размеры для ротора находятся в пределах 5-10 см, он вращается со скоростью 10-20 тысяч оборотов в минуту, причем уплотнение эритроцитов занимает приблизительно 5 мин.
[00277] Ниже показано примерное уравнение для расчетов центробежной силы:
[00278]
[00279]
[00280] где:
[00281] g - гравитационное ускорение земли,
[00282] r - ротационный радиус,
[00283] N - скорость ротации, измеряющая количество оборотов за единицу времени,
[00284] где:
[00285] rcm - ротационный радиус, измеренный в сантиметрах (см),
[00286] NRPM - скорость ротации, измеряющая обороты в минуту (RPM).
[00287] RCF=1.118×10-6rcm.
[00288] В некоторых вариантах центрифуга может иметь горизонтальное положение с подвижным ковшом. В некоторых предпочитаемых вариантах центрифуга вращается по вертикальной оси. В дополнительных вариантах ось вращения может быть горизонтальной или под любым углом. Центрифуга может быть в состоянии вращать две или три емкости и может быть разработана с целью полной интеграции в автоматическую систему, использующую компьютеризованные микродозаторы. В некоторых вариантах емкости могут иметь закрытое дно. Подвижные ковши дадут возможность емкости центрифугирования занять пассивную ориентацию в вертикальном положении после остановки и вращаться под фиксированным углом во время вращения. В некоторых вариантах подвижные ковши дадут возможность емкостям центрифугирования принять горизонтальное положение во время вращения. Дополнительно, они могут вращаться под любым углом между горизонтальным и вертикальным положениями (например, приблизительно 15, 30, 45, 60 или 75 градусов вертикально. Центрифуга с подвижными ковшами будет соответствовать требованиям точности позиционирования и принципам воспроизводимости автоматической системы, использующей несколько систем позиционирования.
[00289] Компьютеризированная система контроля сможет использовать информацию позиционирования, получаемую от оптического датчика, для вращения ротора на контролируемых низких скоростях. Благодаря тому, что соответствующий мотор можно разработать для работы на высоких скоростях, нет необходимости придерживаться точных стационарных позиций, пользуясь обратной связью по позиционированию. В некоторых вариантах можно пользоваться видеокамерой в сочетании с рычагом, приводимым в движение соленоидом для гарантии точных остановок в фиксированном количестве положений. Используя отдельную систему контроля и сигналы обратной связи, получаемые от встроенных в мотор сенсоров, работающих по эффекту Холла, можно контролировать скорость вращения ротора на высокой скорости с максимальной точностью.
[00290] В связи с тем, что определенное количество чувствительных элементов должны функционировать одновременно в системе с инструментом для анализа, в идеальном варианте дизайн центрифуги понизит или сведет к минимуму вибрацию. Ротор можно сделать аэродинамическим с гладкой поверхностью, чтобы в горизонтальном положении ковши находились полностью внутри корпуса. Кроме этого можно использовать гашение вибрации в разнообразных положениях при разработке корпуса.
Ротор
[00291] Ротор центрифуги может быть компонентом системы, который будет поддерживать и вращать сосуд(ы) центрифугирования. Ось ротации может быть вертикальной и таким образом ротор может быть расположен горизонтально. Но, в дополнительных вариантах можно использовать разные оси ротации и положения ротора. Два компонента в форме ковша расположены симметрично на каждой стороне ротора, который поддерживает сосуды центрифугирования. Дополнительные конфигурации возможны при которых ковши находятся в положении радиальной симметрии, например, три ковша, расположенных под углом в 120 градусов. Может использоваться любое количество ковшов, включая, но не ограничиваясь 1, 2, 3, 4, 5, 6, 7, 8, или больше. Ковши можно расположить на одинаковом расстоянии друг от друга. Например, если используется n-количество Ковшов, где n-целое число, тогда ковши можно расположить на расстоянии 360/n градусов друг от друга. В других вариантах ковши не обязательно устанавливать на одинаковом расстоянии друг от друга или в положении радиальной симметрии.
[00292] Когда ротор находится в стационарном положении эти ковши под влиянием силы притяжения могут изменить положение и привести сосуд в вертикальное положение и сделать их доступным для микродозатора. На рисунке 111 можно увидеть пример ротора в положении покоя с вертикальным положением ковшей. В других вариантах ковши могут принимать положение под определенным углом, и такое положение не обязательно вертикально. Во время вращения ротора ковши принимают горизонтальное положение под определенным углом под влиянием силы притяжения. На рисунке 112 можно увидеть пример ротора в то время когда ковши находятся под небольшим углом к горизонту. Можно использовать остановки с резким торможением для вертикальных и горизонтальных положений, обеспечивающих точность и действующие для обеспечения соблюдения повторяемости позицирования и точности.
[00293] Ротор можно разработать аэродинамически в форме диска и имеет минимальное количество характеристик для снижения вибрации, вызываемой турбулентностью воздуха. Для этого необходимо, чтобы внешняя форма ковша совпадала с формой ротора таким образом, чтобы, когда вращается ротор и ковш принимает горизонтальное положение, ковш и ротор могли находиться на одной линии.
[00294] Для облегчения экстракции плазмы, ротор можно установить в положении под углом вниз по отношению к горизонту. Благодаря тому, что угол положения ковша можно прировнять к углу ротора, можно добиться вращения ковша под определенным фиксированным углом. Пеллет, полученный благодаря такой конфигурации, можно установить под углом к емкости, при установке вертикально. Узкий микродозатор для экстракции можно использовать для аспирации плазмы из верхушки емкости. Устанавливая микродозатор для экстракции возле нижней части наклонной поверхности, созданной угловым пеллетом, окончательный объем плазмы можно удалить более эффективно, не нарушая чувствительной лейкоцитной пленки.
[00295] Можно использовать пробирки разнообразной формы с ковшами прибора. В некоторых вариантах пробирки разнообразной формы могут иметь закрытые концы. Некоторые имеют формы стандартных пробирок для центрифугирования с конической нижней частью. Другие пробирки могут иметь цилиндрическую форму. Для обработки клеток предпочтительнее использовать пробирки с небольшим соотношением высоты к поперечному сечению. Пробирки с высоким соотношением (>10:1) можно использовать для точного измерения гематокрита и выполнения других требований, связанных с получением изображений. Однако, можно использовать любое соотношение высоты к поперечному сечению. Ковши можно изготавливать из любого из следующих видов пластмассы: полистирола, полипропилена или другого материала, указанного в настоящем документе. Размеры ковшей варьируют от нескольких микролитов до, приблизительно, миллилитра. Пробирки можно помещать в центрифугу и извлекать из нее с помощью "подъемно-транспортного" механизма.
Система контроля
[00296] Можно использовать систему двойного контроля для выполнения требований, связанных с вращением и позиционированием прибора центрифугирования. Чтобы придать ротору определенное положение для вращения, можно использовать систему контроля, основанную на позиционировании. В некоторых вариантах система контроля может основываться на системе контроля PID (Proportional Integral Derivative). Также, можно использовать другие системы контроля, используемые в отрасли. Передача информации в позиционирующее устройство может происходить с помощью оптического датчика. Для работы центрифуги на низкой или высокой скорости можно использовать датчики скорости, а систему контроля PID можно использовать для контроля скорости. Передачу информации в датчик скорости о скорости вращения можно выполнить с помощью простых сенсоров, работающих по принципу эффекта Холла, установленных на вале электродвигателя. Каждый сенсор может образовывать прямоугольную волну за один цикл вращения вала электродвигателя.
Стопорный механизм
[00297] Для позицирования ротора в определенной позиции, можно физически использовать стопорный механизм. В одном варианте стопорный механизм может работать на основе видеокамеры, соединенной с ротором и ручкой, приводимой в движение соленоидом. Видеокамера может иметь форму круглого диска с некоторым количеством зазубрин в форме "С", выгравированных по периметру. Для позиционирования ротора центрифуги, для начал ее ротационную скорость можно понизить до, максимум, 30 оборотов минуту. В других вариантах ротационная скорость может быть понижена до любой скорости, включая, но ограничиваясь 5 оборотами в минуту, 10 оборотами в минуту, 15 оборотами в минуту, 20 оборотами в минуту, 25 оборотами в минуту, 35 оборотами в минуту, 40 оборотами в минуту или 50 оборотами в минуту. Когда скорость достаточно замедлилась, можно привести в движение рычаг. В конце рычага можно установить опорный ролик для видеокамеры, который будет двигаться по периметру видеокамеры с минимальным трением. Когда опорный ролик видеокамеры доходит до определенной зазубрины в видеокамере, сила рычага, приводимого в движение соленоидом может оказаться больше силы мотора и мотор может остановиться. Тогда мотор можно остановить электронно и в комбинации со стопорным механизмом ротационное положение можно точно удерживать неопределенное количество времени.
Ковши центрифуги
[00298] Свободно вращающиеся ковши центрифуги можно сконфигурировать для работы с трубками центрифуги разных размеров. В некоторых вариантах на некоторых трубках имеются шейка или бортик на верхнем (открытом) конце. Шейка или воротничок может опираться на верхнюю часть ковша и поддерживать трубку во время центрифугирования. Как показано на рисунках 113, 114 и 115 можно использовать конические и цилиндрические пробирки различной длины и объема. На рисунках 113, 114 и 115 есть примеры ковшей другой формы, которые можно использовать. Например, на рисунке 113 можно увидеть пример конфигурации ковша. Ковш может быть укомплектован боковыми участками, которые состыковываются с центрифугой и дают возможность ковшам свободно двигаться. У ковша может быть закрытое дно и открытая верхняя часть. На рисунке 114 показан пример сосуда центрифугирования, состыкованного с ковшом. Как было упомянуто раньше, ковш может иметь специальную форму для состыковки с емкостями для центрифугирования разной конфигурации. У емкости для центрифугирования может быть один или несколько выступающих концов для того, чтобы опираться на ковш. Емкость для центрифугирования может отличаться одной или несколькими особенностями формы, способствующими состыковке с ковшом центрифуги. Такой характерной чертой может быть определенная форма емкости или один или несколько выступов. На рисунке 115 показан пример другой емкости центрифуги, состыкованной с ковшом. Как было описано ранее, ковш может отличаться одной или несколькими характерными чертами формы, которые дадут возможность емкостям центрифуги различной конфигурации состыковываться с ковшом.
Пробирки центрифуги и методы экстрагирования пробы:
[00299] Пробирка центрифуги и микродозатор для экстрагирования могут поставляться дополнительно и могут состыковываться для экстрагирования материала после центрифугирования. Пробирка центрифуги и микродозатор для экстрагирования могут иметь формы, позволяющие им выполнять сложные процессы автоматизированной системы. На рисунке 116 показан пример емкости центрифуги. На рисунке 117 показан пример микродозатора для экстрагирования. На рисунке 118 показан пример того, как емкость центрифуги и микродозатор для экстрагирования могут состыковываться. Все размеры приводятся только для примера и можно использовать другие размеры в тех же или в других пропорциональных отношениях.
[00300] Система дает возможность выполнить один или несколько из следующих процессов:
1. Быстрая обработка маленьких проб крови (как правило, 5-50 мкл)
2. Точное и быстрое измерение гематокрита
3. Эффективное удаление плазмы
4. Быстрая повторная суспензия образованных элементов (лейкоцитов и эритроцитов)
5. Концентрирование лейкоцитов (после маркировки флуоресцентных антител и фиксирование плюс лизирование красных кровяных телец)
6. Оптическое подтверждение процесса лизирования эритроцитов и сбор лейкоцитов
Краткое описание емкости центрифуги и микродозатора экстрагирования
[00301] Можно использовать специально разработанные емкость и микродозатор для работы центрифуги для удовлетворения специальных требований, установленных системой. Емкость центрифуги может быть пробиркой с закрытым дном, разработанной для вращения в центрифуге. В некоторых вариантах емкостью центрифуги может служить емкость на рисунке 116 или такая емкость может иметь отдельные детали емкости, показанной на рисунке 116. Она может отличаться рядом определенных деталей, которые дают возможность выполнять разнообразные анализы, включая измерения гематокрита, лизинг RBC, повторную суспензию осадка и рациональное экстрагирование плазмы. Микродозатор для экстрагирования можно разработать таким образом, чтобы его можно было вводить в емкость для центрифуги для точной экстракции жидкости и повторной суспензии осадка. В некоторых вариантах микродозатором для экстрагирования может быть микродозатор, показанный на рисунке 117, или в такой роли может выступать микродозатор, имеющий одну или несколько характеристик микродозатор, показанного на рисунке 117. Примерные спецификации каждого микродозатора можно найти в настоящем документе.
Емкость центрифуги
[00302] Емкость центрифуги можно разработать таким образом, чтобы работать с двумя возможными сценариями использования, каждый из которых связан с различным объемом антикоагулянтов и крови.
[00303] Первый сценарий использования может потребовать 40 мкл цельной крови с гепарином в качестве осадка, сбором максимального количества плазмы и измерения гематокрита с помощью компьютера. В случае, если гематокрит достигает уровня в 60% или ниже количества плазмы, необходимой или предпочитаемой, то ее уровень может быть приблизительно 40uL*40%=16uL.
[00304] В некоторых вариантах невозможно собрать 100% плазмы, потому что нельзя трогать верхний слой, поэтому необходимо соблюдать минимальное расстояние между дном микродозатора и верхом осадка. Такое минимальное расстояние можно определить экспериментально, а объем (V), который жертвуется как функция необходимого безопасного расстояния, (d) можно определить с помощью: V(d)=а*π1.25 мм2. Например, для достижения необходимого безопасного расстояния в 0,25 мм, необходимо будет пожертвовать 1,23 мкл объема 60% гематокрита. Объем может быть уменьшен за счет уменьшения внутреннего радиуса части гематокрита емкости центрифуги. Благодаря тому, что в некоторых вариантах узкая часть может соответствовать внешнему радиусу микродозатора экстрагирования и быть не менее 1,5 мм, соответствующие размеры емкости центрифуги могут быть минимальными.
[00305] Вместе с экстрагированием плазмы, в некоторых вариантах может понадобиться измерение гематокрита с помощью компьютера. Для ускорения такого процесса общую высоту массы гематокрита можно максимально увеличить, приведя к минимуму внутренний диаметр узкой части емкости. Максимально увеличивая высоту, можно оптимизировать отношение между изменением объема гематокрита и физическим изменением высоты столба, таким образом, увеличивая количество пикселей, которые можно использовать для выполнения измерений. Высота узкой части емкости может быть достаточной для разрешения ситуаций в наихудшем варианте с 80% гематокрита, в то же время, в верхней части столба может оставаться маленькое количество плазмы для проведения эффективного экстрагирования. Таким образом, 40 мкл*80%=32 мкл объема может понадобиться для точного измерения гематокрита. Объем узкой части микродозатора может быть приблизительно 35,3 мкл, что даст возможность оставить некоторое количество плазмы даже в худшем варианте.
[00306] Второй сценарий использования более сложный и может потребовать одно или несколько из следующего:
- осадок цельной крови;
- экстрагированная плазма;
- повторно суспензированный осадок в буферном растворе для лизирования и контрастном веществе;
- выпавшие в осадок оставшиеся лейкоциты (WBCs);
- удаление надосадочной жидкости;
- повторная суспензия лейкоцитов WBCs;
- полное экстрагирование суспензии лейкоцитов WBC.
[00307] Для того, чтобы провести повторную суспензию упакованного осадка, можно (как показали эксперименты) физически коснуться осадка микродозатором, достаточно длинным, чтобы достать до дна емкости, содержащей осадок. Предпочтительная форма дна емкости, которая используется для повторной суспензии, как правило, сферическая, похожая на стандартные коммерческие трубки PCR. В других вариантах можно использовать емкости с другой формой дна. Емкость центрифуги вместе с микродозатором для экстрагирования могут быть разработаны с целью ускорения процесса повторной суспензии благодаря выполнению таких требований к форме, в то же время, давая возможность кончику экстрагирования входить в контакт с дном.
[00308] Во время выполнения экспериментов повторной суспензии было замечено, что физический контакт между дном емкости и дном микродозатора могут создать герметическую перегородку, которая будет препятствовать движению жидкости. Можно использовать маленькое расстояние для того, чтобы полностью вывести осадок из состояния покоя, и в то же время, давая возможность жидкости циркулировать. Для того, чтобы ускорить такой процесс в автоматизированной системе, дну емкости центрифугирования можно придать еще одно качество. В некоторых вариантах такой характеристикой могут стать четыре маленькие полусферические выпуклости, расположенные по периметру дна емкости. Когда микродозатор для экстрагирования вводится в емкость полностью и происходит физический контакт, головка микродозатор может опираться на выпуклости и жидкость получает возможность свободно течь по выпуклостям. Это может привести к потере небольшого количества массы (~.25 мкл) в щелях.
[00309] Во время процесса лизирования в некоторых вариантах предполагаемое максимальное количество жидкости равняется 60 мкл, что, в сумме с 25 мкл, вытесненной микродозатором для экстрагирования, может потребовать общего объема в 85 мкл. Версия с максимальным объемом в 100 мкл может превысить такое требование. Второй сценарий использования требует похожих характеристик или характеристик, которые обсуждались ранее.
[00310] Геометрия верхней части емкости центрифуги может быть разработана для состыковки с носиком дозатора. Можно использовать любой носик дозатора, описанный здесь, или используемый в индустрии. Внешняя геометрия верхней части емкости может точно совпадать с формой микродозатора для реакции, под который разрабатываются микродозатор и блок, используемые в настоящий момент. В некоторых вариантах небольшая борозда может идти по краю внутренней поверхности верхней части. Такая борозда может выступать в роли зрительного маркера максимальной высоты жидкости, предназначенного для автоматической детекции ошибок с помощью компьютерной видеосистемы.
[00311] В некоторых вариантах расстояние между дном состыкованного носика и верхней линией жидкости - 2.5 мм. Расстояние в промежутке от 1,5 мм до 4 мм - рекомендуемое расстояние для микродозатора экстрагирования. Уменьшение расстояния может быть вызвано необходимостью снизить длину микродозатора экстрагирования, в то же время, выполняя требования о минимальном объеме. Необходимость уменьшения расстояния вызывается определенным использованием емкости. Потому что в некоторых вариантах обмена жидкостями в емкости может происходить только через верхнюю часть, то максимальное количество жидкости, которое будет находиться в емкости во время состыковки с носиком, будет максимальным количеством цельной крови в наличии на определенный момент (40 мкл). Уровень такой жидкости может быть намного ниже дна носика. Еще одним аспектом является то, что объем жидкости в емкости может быть больше этого и смачивать стенки до высоты носика. В некоторых вариантах специалисты, пользующиеся емкостью, должны будут удостовериться, что количество жидкости в емкости не превышает максимальную высоту жидкости даже, если общий объем меньше установленного максимума. В других вариантах в наличии могут иметься другие детали, которые помогут жидкости не покидать емкость.
[00312] Любые размеры, объемы и расстояния, используемые здесь, используются только в качестве примера. Можно использовать любые другие размеры, объемы и расстояния, которые являются пропорциональными или не пропорциональными числам, указанным выше.
[00313] Емкость центрифуги поддается воздействию разных сил в процессе обмена жидкостями и быстрого ввода и вывода микродозаторов. Если емкость не ограничена, возможно, что такие силы будут достаточно сильными, для того чтобы поднять или сместить сосуд из емкости центрифуги. Емкость необходимо закрепить для предотвращения ее смещения. Для этого, можно добавить небольшое кольцо по внешней окружности дна. Такое кольцо можно с легкостью состыковать с подвижной механической деталью на ковше. Пока удерживающая сила выпуклости больше сил, которые прилагаются во время манипуляции с жидкостью, но меньше силы трения при состыковке с носиком, то проблема решена.
Микродозатор для экстрагирования
[00314] Микродозатор для экстрагирования можно разработать для соединения с емкостью центрифуги, для эффективного экстрагирования плазмы и повторной суспензии клеток, выпавших в осадок. При желании общая длина (например, 34.5 мм) может в точности соответствовать другому микродозатору для крови, включая, но не ограничиваясь теми, которые описаны в США. Серийный номер: 12/244,723 (включенный в настоящий документ) может достаточно длинным для того, чтобы коснуться дна емкости центрифуги, в некоторых вариантах, достаточно длинным для того, чтобы касаться дна емкости и в процессе повторной суспензии и для полного сбора суспензии лейкоцитов.
[00315] Необходимый объем микродозатора экстрагирования можно определить с помощью максимального объема, который будет аспирирован из емкости центрифуги в любой период времени. В некоторых вариантах такой объем может быть 60 мкл, что, возможно, будет меньше максимального объема микродозатора, который составляет 85 мкл. В некоторых вариантах может предлагаться микродозатор большего объема, чем необходимо. Как с емкостью центрифуги, внутреннюю деталь по внутренней части верхней порции микродозатора можно использовать для маркировки высоты максимального объема. Расстояние между линий максимального объема и верхом состыкованного носика может быть 4.5 мм - достаточным расстоянием для предотвращения загрязнения носика. Любое достаточное расстояние доля предотвращения загрязнения носика.
[00316] Центрифугу можно использовать для седиментации выпавшего в осадок холестерина ЛПНП. Воспроизведение изображения можно использовать для подтверждения того, что надосадочная жидкость прозрачная, означая полное удаление осадка.
[00317] В одном примере плазму можно развести (например, 1:10), сделав смесью декстран сульфата натрия (25 мг/dL) и сульфата магния (100 ммоль), а затем провести инкубацию на протяжении 1 минуты выпадения в осадок холестерина ЛПНП. Продукт реакции затем можно аспирировать а трубку центрифуги, герметично закрыть и вращать со скоростью 3000 оборотов в минуту на протяжении трех минут. На рисунках 119, 120 и 121 можно увидеть изображения первоначальной реакционной смеси до начала центрифугирования (выпадает белый осадок), после центрифугирования (прозрачная осадочная жидкость) и выпавший в осадок холестерин ЛПНП (после снятия защитного колпачка).
[00318] В настоящем изобретении можно использовать другие примеры центрифуг, как описано в патентах США под номерами 5,693,233, 5,578,269, 6,599,476 и в публикациях патентов США 2004/0230400, 2009/0305392 и 2010/0047790, которые полностью включены посредством ссылки для разных целей.
[00319] Примеры протоколов
[00320] Различные вариации протокола можно использовать для центрифугирования и обработки. Например, типичный протокол для использования центрифуги для обработки и концентрации лейкоцитов для цитометрии может включать один или несколько шагов. Указанные ниже этапы можно использовать в любом порядке, а также одни этапы можно заменять другими:
1. Получение 10 uL крови антикоагуолированной ЭДТК (дозатор вводит кровь в нижний ковш центрифуги).
2. Седиментация лейкоцитов и эритроцитов с помощью центрифугирования (<5 мин × 10000 г).
3. Измерение гематокрита воспроизведением изображения.
4. Медленное удаление плазмы с помощью аспирации в дозатор (4 uL соответствующие в худшем варианте [60% гематокрита]), не нарушая клеток, выпавших в осадок.
5. Повторное суспендирование осадка после добавления 20 uL соответствующего коктейля из максимум пяти флюоресцентно-маркированных антител, растворенных в забуференном растворе + BSA (1 мг/мл) (общий объем реакционной смеси приблизительно 26 мкм).
6. Инкубация на протяжении 15 минут при 37С.
7. Подготовка фиксажного раствора для лизирования путем смешивания раствора для лизирования эритроцитов (хлорид аммония/бикарбонат калия) с фиксажным раствором с лейкоцитами (формальдегид).
8. Добавление 30 мкм фиксажного раствора для лизирования (общий объем реакционной смеси приблизительно 60 мкм).
9. Инкубация на протяжении 15 минут при 37С.
10. Седиментация лейкоцитов с помощью центрифугирования (5 мин, 10000 г).
11. Удаление гемолизата осадочной жидкости (приблизительно 57 мкм).
12. Повторное суспендирование лейкоцитов добавлением 8 мкм буферного раствора (изотонический забуференный раствор).
13. Точное измерение объема.
14. Подача пробы на (с 10 uL) цитометрию.
[00321] 3. Шаги могут включать получение пробы. В роли пробы может выступать биологическая жидкость, например кровь, или любые другие описанные здесь пробы. Объем пробы может быть маленьким, например, любой из объемов, указанных в настоящем документе. В некоторых примерах проба будет содержать антикоагулянт.
[00322] Может произойти этап разделения. Например, может иметь место разделение на основе плотности. Такое разделение может произойти с помощью центрифугирования, магнетического разделения, лизирования и других подходов к разделению, известных в отрасли. В некоторых вариантах, пробой может быть кровь, и может произойти разделение лейкоцитов и эритроцитов.
[00323] Можно снять измерения. В некоторых вариантах измерения можно делать с помощью изображения или с помощью другого механизма, описанного в настоящем документе. Например, гематокрит разделенной пробы крови можно получить с помощью изображения. Изображение можно получать с помощью цифровой видеокамеры или другого прибора для получения изображений, описанных в настоящем документе.
[00324] Можно убрать один или несколько компонентов пробы. Например, если проба разделена на твердые и жидкие компоненты, можно удалить жидкий компонент. Можно убрать плазму из пробы крови. В некоторых случаях жидкий компонент, например плазму, можно удалить с помощью дозатора. Жидкий компонент можно удалить, не касаясь твердого компонента. Получение изображения может помочь в удалении жидкого компонента, или любого другого компонента пробы. Например, можно использовать изображение для определения нахождения плазмы а также для определения точной позиции дозатора при удалении плазмы.
[00325] В некоторых вариантах в пробу можно добавить реагент или другой материал.
Например, можно провести повторное суспендирование твердой части пробы. Можно добавить маркированный материал. Может иметь место один или несколько инкубационных этапов. В некоторых вариантах можно добавить фиксажный раствор для лизирования. Могут иметь место дополнительные этапы разделения и (или) повторного суспендирования. При необходимости, этапы разведения и (или) концентрации могут иметь место.
[00326] Возможно измерении объема пробы. В некоторых ситуациях, объем пробы измеряется точно и аккуратно. Объем пробы можно измерять в системе с низким коэффициентом вариации, например, с таким коэффициентом вариации, который можно найти в настоящем документе. В некоторых ситуациях объем пробы можно измерять с помощью воспроизведения изображения. Можно получить изображение пробы, а потом на основе изображения можно рассчитать объем пробы.
[00327] Пробу можно добавить к необходимому процессу. Например, пробу можно добавить в цитометрию.
[00328] В другом примере типичный протокол может включать или не включать использование центрифуги для очищения нуклеиновой кислоты и может включать один или несколько шагов. Такая система может дать возможность экстрагирования ДНК/RHK для предоставления пробы нуклеиновой кислоты в реакции экспоненциального роста для детекции. Такой процесс может использоваться для экстрагирования нуклеиновых кислот из разных проб, включая, но не ограничиваясь, цельной кровью, сывороткой, вирусной передающей средой, образцами ткани, образцами пищи и культурой бактерий. Процесс может быть полностью автоматизирован и может экстрагировать ДНК/РНК последовательно и квантитивно. Указанные ниже этапы можно использовать в любом порядке, а также одни этапы можно заменять другими:
[00329] 1. Лизирование пробы. Лизирование клеток пробы можно выполнить, используя хаотропный-солевой буферный раствор. Хаотропный-солевой буферный раствор может включать одно из следующего: хаотропную соль, например, но не ограничиваясь, 3-6 Μ гуанида гидрохлорида или гуанидинтиоцианата; додецилсудьфат натрия (SDS) с типичной концентрацией в 0,1-5% v/v; этилендиаминтетрауксусную кислоту (EDTA) с типичной концентрацией в 1-5 мМ; лизозим с типичной концентрацией в 1 мг/мл; Протеиназу К с типичной концентрацией в 1 мг/мл; и pH может быть 7-7.5 с использованием HEPES в качестве буферного раствора. В некоторых вариантах инкубацию пробы можно выполнить в буферном растворе при нормальной температуре 20-95 LC на протяжении 0-30 минут. После лизирования в смесь можно добавить изопропанол (50%-100% v/v).
[00330] 2. Загрузка поверхности. Лизированную смесь можно подвергнуть воздействию функционализированной поверхности (часто в форме насадки из пузырьков) в форме, но не ограничиваясь, полимерного носителя, уплотненного в столбе по типу хромотографического анализа, магнитные шарики, перемешанные в столбе одной партией, пробу, закачанную через суспензированную смолу методом псевдоожиженного слоя и пробу, закачанную через закрытый канал тангенциальным потоком по поверхности. Поверхность может быть функционализирована таким образом, чтобы связывать нуклеиновые кислоты (например, ДНК, РНК, гибрид ДНК/РНК) в присутствии лизированного буферного раствора. Типы покрытия могут включать кремний, функциональные группы ионного обмена, такие как диэтиламиноэтанол (DEAE). Лизированные смеси можно подвергнуть воздействию поверхности и нуклеиновых кислот.
[00331] 3. Промывка. Твердая поверхность промывается солевым раствором по примеру 0-2 Μ хлорида натрия и этанола (20-80% в/в) при pH 7.0-7.5. Промывку можно делать так же как а и загрузку.
[00332] 4. Элюция. Нуклеиновые кислоты можно смывать с поверхности подвергая поверхность воздействию воды или буферного раствора при pH 7-9. Элюцию можно проводить таким же образом как и загрузку.
[00333] В этой системе можно использовать различные варианты этих или других протоколов. Такие протоколы можно использовать в сочетании или при замене любых протоколов или методов, описанных здесь.
[00334] В некоторых вариантах важно собрать клетки, уплотненные и концентрированные с помощью центрифугирования, для цитометрии. В некоторых вариантах, этого можно добиться с помощью дозатора. Жидкие растворы (как правило, изотонический забуференный раствор, дозирующий раствор, смесь лизирующего раствора и фиксатора или смесь маркированных антител в забуференном растворе) можно дозировать в ковше центрифуги и аспирировать и повторно аспирировать несколько раз. Микродозатор пипетки можно ввести с усилием в уплотненные клетки для начала процесса. Анализ изображения ускоряет процесс путем выполнения объективной проверки того, насколько все клетки были повторно суспензированы.
[00335] Использование пипетки и центрифуги для обработки проб до начала анализа:
[00336] В соответствии с одним из вариантов изобретения, такая система может отличаться наличием дозатора, "подъемно-транспортного" механизма и центрифуги. Такие функции дадут возможность выполнять практически любую обработку пробы и процедуры сложного анализа можно будет выполнить эффективно, используя маленькое количество пробы.
[00337] В частности, такая система даст возможность отделять сформированные элементы (красные и белые кровяные тельца) от плазмы. Такая система даст возможность повторного суспензирования сформированных элементов. В некоторых вариантах такая система даст возможность концентрации белых кровяных телец из фиксированной и гемолизированной крови. Такая система возможно также даст возможность лизирования клеток для выделения нуклеиновых кислот. В некоторых вариантах можно будет выполнить очищение и концентрирование нуклеиновых кислот в процессе фильтрации с помощью микродозатора, заполненного (как правило, в форме капель) реагентами твердой фазы (например, диоксид кремния). Система также сдаст возможность элюции очищенных нуклеиновых кислот после экстрагирования твердой фазы. Удаление и накопление осадка (например, выпавшего в осадок холестерина ЛПНП с помощью полиэтиленгликоля) также можно будет выполнить в системе.
[00338] В некоторых вариантах такая система даст возможность выполнить аффинную очистку. Маленькие молекулы, такие как витамин Д и сератонин могут впитываться на гранулированные (дисперсные) гидрофобные субстраты, а затем элюировать с помощью органических растворителей. Антигены можно перенести на субстраты, покрытые пленкой из антител и элюированные кислотой. Аналогичные методы можно использовать для концентрации аналитов, обнаруженных в низких концентрациях, таких как тромбоксан-В2 и 6-кето-простагландин Flα. Антигены можно перенести на субстраты, покрытые пленкой из антител или аптамера и элюированные.
[00339] В некоторых вариантах система может дать возможность химической модификации анализируемого вещества до начала анализа. Для анализа сератонина (5-окситриптамина) например, может потребоваться преобразование анализируемого вещества в производное соединение (например, ацетилированная форма) используя реагент (например, ангидрид). Это можно делать с целью получения формы анализируемого вещества, которое будет распознаваться антителом.
[00340] Жидкость можно перенести с помощью дозатора (вакуумное аспирирование и нагнетание). Дозатор может быть ограничен достаточно низкими результатами положительного и отрицательного давления (приблизительно 0,1-2,0 атмосфер). Можно использовать центрифугу для получения более высокого давления, когда появляется необходимость приложить усилие для проведения жидкости через гранулированную среду твердой фазы. Например, использование ротора с радиусом в 5 см при скорости в 10 тысяч оборотов в минуту приводит к возникновению силы в приблизительно 5 тысяч × г (примерно 7 атмосфер), достаточной для проталкивания жидкости по резистивной среде по типу уплотненного слоя. Можно использовать любые типы и конфигурации центрифуг, обсуждаемых здесь или известных в отрасли.
[00341] Можно выполнить измерения гематокрита, используя маленькое количество крови. Например, недорогие дигитальные фотоаппараты в состоянии получать изображения хорошего качества даже при плохом контрасте. Используя такую функцию, система настоящего изобретения в состоянии производить автоматические измерения гематокрита, используя маленькое количество крови.
[00342] Например, в стеклянный микрокапиляр можно собрать 1 мкл крови. Затем капилляр можно герметично закрыть с помощью отверждаемого адгезива и затем выполнить центрифугирование при 10000 × г на протяжении 5 минут. Можно с легкостью измерить объем упакованных клеток и можно также видеть мениск плазмы (отмеченный стрелкой), таким образом, чтобы можно было точно измерить гематокрит. Это поможет системе не тратить большое количество крови на проведение измерения. В некоторых вариантах видеокамеру можно использовать "как есть", не комбинируя с микроскопом для увеличения изображения. В других вариантах можно использовать микроскоп или другие оптические методы для увеличения изображения. В одном варианте гематокрит определялся с помощью дигитальной камеры без дополнительных оптических вмешательств, и полученный гематокрит был идентичным тому, которых измеряется стандартным лабораторным методом определения гематокрита, на проведение которого требуется много микролитров пробы. В некоторых вариантах длину столба пробы, а также длину столба эритроцитарной массы можно измерять довольно точно (+/- <0,05 мм). Предполагая, что столб пробы крови может быть приблизительно 10-20 мм, допустимое отклонение при получении результатов гематокрита может быть более 1%, что соответствует стандартным лабораторным методам.
[00343] Такая система позволяет выполнять измерения скорости оседания эритроцитов (ESR). Можно использовать способность дигитального фотоаппарата измерять маленькие расстояния и быстроту изменения расстояния для измерения ESR. В одном примере три пробы крови (15 мкл) были аспирированы в "реакционные микродозаторы". Изображения были получены на протяжении одного часа при интервале в две минуты. Анализ изображений использовался для измерения движения области взаимодействия между красными кровяными тельцами и плазмой. На рисунке 122 показаны результаты как расстояние области взаимодействия от мениска плазмы.
[00344] Точность измерений можно оценить, введя данные в полиномиальную функцию и рассчитывая допустимое отклонение и разницу между данными и эмпирической кривой (для всех проб). В настоящем примере это равняется 0,038 мм или <2% CV по отношению к расстоянию, которое преодолевается за один час. Соответственно, такой метод можно использовать для точного измерения ESR. Еще один метод определения ESR включает измерение максимального наклона, представляющего собой отношение расстояния ко времени.
[00345] Подготовка анализа
[00346] B некоторых вариантах микродозаторы можно разработать для выполнения множества реакций или анализов. Одновременное измерение нескольких различных анализируемых смесей и одного или нескольких контрольных веществ или одного или нескольких калибровочных стандартов можно делать в одном микродозаторе настоящего изобретения. Таким образом, мы используем способность брать пробы нескольких жидких источников путем последовательного аспирирования жидкостей в один и тот же микродозатор. Эффективная сегментация и разделение жидкостей намного улучшаешься, благодаря последовательной аспирации маленького количества воздуха и маленького количества промывной жидкости, которая промывает микродозаторы до начала аспирации следующей пробы жидкости.
[00347] Как описано выше микродозаторы могут иметь конусообразную форму. В некоторых вариантах для анализа может потребоваться кислород в качестве реагента. В таких реакциях увеличения кислорода в реакции можно добиться передвижением пробы и (или) анализируемой смеси в более широкую часть микродозатора для увеличения пропорции между площадью поверхности и объемом.
[00348]В Рисунке 93 и Рисунке 94, растворы бромфенолового синего были аспирированы в микродозаторы. Верхние сегменты (аспирированные первыми) 6 мкл были получены из серии двойного разбавления (максимальная концентрация (0,0781 мг/мл) справа от изображения, за исключением крайнего левого микродозатора, который является контрольным раствором). Затем воздух (2 мкл), промывная жидкость (2 мкл) в указанном порядке были аспирированы, после чего имела места аспирация контрольного раствора (0,625 мг/мл) фиксированной концентрации, объемом в 6 мкл.
[00349] На основе такого подхода можно добиться нескольких альтернативных конфигураций для анализа, например:
[00350] 1. Одновременное измерение реагента и (или) холостой пробы и анализа.
[00351] 2. Одновременное измерение пробы, холостой пробы и контрольного раствора.
[00352] 3. Калибровка анализа внутри микродозатора.
[00353] В нижеприведенной таблице можно увидеть некоторые "мультиплексные типы" предпочитаемых комбинаций анализируемых веществ, контрольных растворов и калибровочных стандартов в одном микродозаторе.
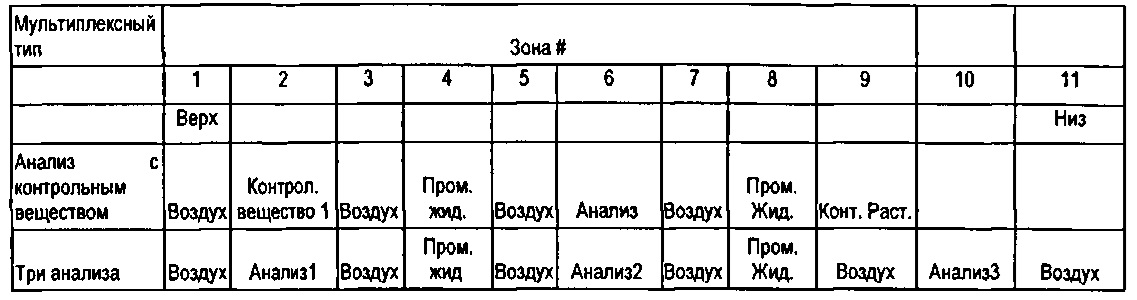

[00354] Случай 2 показан на Рисунке 95.
[00355] Серийные измерения холостых растворов, пробы, контрольных растворов и калибровочных стандартов можно также делать в одном микродозаторе. В такой ситуации, микродозатор наполняется первым раствором, считываются данные, а потом раствор выливается. Затем микродозатор можно наполнить повторно и получить данные о других пробах в указанном порядке. Влияние "переноса" цветного раствора от одной пробы к другой снижается одним или несколькими из следующего:
[00356] 1. Считывание результатов жидкого столба в средней части на расстоянии то части, которая контактировала с предыдущей пробой.
[00357] 2. Промывка микродозатора между пробами.
[00358] Для того, чтобы вычислить в какой степени имеет место 'перенос' одной жидкости в другую, выполнялась следующая процедура. Небольшое количество (например, 6 мкл) высококонцентрированного бромфенолового синего (например, 0,625 мг/мл) было аспирировано в микродозаторы, за чем последовало 2 мкл воздуха и 2 мкл промывной жидкости. Последней была произведена аспирация 6 мкл бромфенольного синего после двойного серийного разбавления, со следующими результатами (максимальная концентрация (0,0781 мг/мл) справа; крайний левый микродозатор наполнен контрольным раствором).
[00359] Как видно на изображениях в Рисунке 96 и по результатам 3-цветного анализа, показанного в Рисунке 97, измеримые количества высококонцентрированного раствора переносится в промывную жидкость.
[00360] Средний перенос (от высококонцентрированного контрольного вещества к промывной жидкости) равняется 1,4%. Хотя, по существу, ведущая зона (близкая к вышеуказанной массе) более поздней массы выступает в качестве второго промывочного этапа и информация о цвете считывается в месте, удаленном от такой ведущей зоны (как правило, в центральной зоне массы), эффективный перенос от одной массы к другой, как правило, меньше 1% и, поэтому, считается незначительным. Когда серии разбавления измерялись только с использованием проб серии разбавления для наполнения микродозаторов, полученные результаты идентичны результатам, полученным выше. Вышеуказанное представляет собой "стресс тест", предназначенный для оценки степени переноса.
[00361] На Рисунке 98 показан микродозатор с продуктами реакции двух коммерчески доступных анализов ионизированного кальция, Са2+ (верхний сегмент) и магнезия Mg2+ (нижний сегмент) которые были аспирированы в микродозаторы для измерений. Концентрации Са2+, используемые в настоящем эксперименте - 0, 2,5, 5, 10, 20 и 40 мг/децилитр; концентрации Mg2+ равняются 0, 1,25, 2.5, 5, 10, 20 мг/дЛ. Реакционные смеси для анализа (6 мкл [Са2+] и 4 мкл [Mg2+]) разделены 2 мкл воздуха, 3 мкл промывной жидкости и далее 4 мкл воздуха. Результаты каждого из анализов, полученные таким образом, идентичны тем, которые были измерены с одной реакционной смесью для анализа на один микродозатор.
[00362] Как показано выше, настоящее изобретение дает возможность одновременной оценки множества анализов. Можно делать много изображений кювет для анализа в одной области наблюдения. Как правило, можно выполнить одновременную оценку результатов анализов и контрольной жидкости в одной и той же кювете для анализа. Можно также выполнить одновременную оценку результатов нескольких анализов а одной и той не кювете для анализа.
[00363] Реакционная среда
[00364] Система может включать блок обогрева для нагревания анализа или устройства для анализа и (или) для контроля температуры анализа. Нагревание можно использовать на инкубационном этапе реакции анализа для поддержки реакции и для сокращения длительности, что необходимо для инкубационного этапа. Система может включать нагревательное устройство, сконфигурированное для получения устройства для анализа изобретения. Нагревательное устройство можно сконфигурировать для принятия множества устройств для анализа от прибора изобретения. Например, если возникает необходимость проведения 8 анализов в приборе, можно сконфигурировать нагревательное устройство для принятия 8 устройств для анализа. В некоторых вариантах устройства для анализа можно перенести для термического контакта с нагревательным устройством, используя средства для переноса устройств для анализа. Нагревание можно выполнить, используя применяемые в отрасли методы нагревания.
[00365] Оптимизация протокола
[00366] Протоколы анализа для анализирования проб можно оптимизировать разнообразными методами. Если необходимо выполнить несколько анализов пробы, все протоколы можно оптимизировать для удовлетворения наиболее строгих условий реакции или каждый из протоколов реакции можно оптимизировать на основе определенных требований определенного анализа.
[00367] В некоторых вариантах можно разработать один протокол для удовлетворения контрольных требований для всех возможных случаев. Например, для блока мультиплекс можно разработать один протокол на основе случая, когда необходимо выполнить все тесты определенного блока (т.е. пограничный случай). Такой протокол можно разработать для удовлетворения минимальных контрольных требований, таких как точность и динамический диапазон для каждого теста блока. Но, такой подход не является оптимальным для случаев необязательного использования, например, когда нужно выполнить тестирование только подгруппы тестов блока. В таких случаях, можно добиться большей эффективности с точки зрения чувствительности и показателей работы. Существует обратная зависимость между количеством пробы, используемой в анализе, и чувствительностью пробы. Например, в процессе анализа с чувствительностью 1 ед./мл при разведении пробы в соотношении 1:100 можно будет обнаружить 0,1 ед./мл при увеличении пропорции разведения до 1:10. Одним недостатком использования более низкой пропорции разведения в системе мультиплексного анализа с ограниченным объемом пробы может быть увеличение доли пробы, необходимой для проведения анализа в 10 раз даже при использовании минимального объема в процессе проведения анализа. Подобным образом можно улучшить точность выполнения анализа, используя более высокую концентрацию пробы. Например, анализ, в результате которого мы получаем сигнал в (например) 0,1 коэффициента поглощения +/-0,02 (20% неточность сигнала), при его ограниченности определения можно улучшить, увеличив концентрацию пробы в 10 раз, таким образом, чтобы полученный сигнал был в 10 сильнее, производя сигнал 0,1 +/1 0,02 OD при концентрации аналита в десять раз меньше, и при сигнале в 1,0, +/- 0,02 неточность теперь будет равняться 2%. Причина в том, что, как правило, сигнал анализа (в нижнем пределе концентраций аналита) прямо пропорционален концентрации аналита (и, соответственно, концентрации пробы); в то же время неточность сигнала может быть связана с квадратным корнем сигнала и увеличивается как квадратный корень концентрации аналита (и концентрация пробы). Таким образом, коэффициент вариации (CV) сигнала может быть обратно пропорционален квадратному корню сигнала; таким образом, что при 10-кратном увеличении сигнала имеет место приблизительно трехкратное уменьшение CV сигнала. В связи с тем, что CV концентрации, как правило, напрямую связан с CV сигналом, CV концентрации понизится с увеличением концентрации пробы (уменьшение разведения).
[00368] Протоколы можно оптимизировать для использования в определенных случаях, в отличие от стандартного подхода, описанного выше. Например, протокол можно оптимизировать для улучшения точности каждого из тестов, проводимых в мультиплексном приборе. Кроме этого, некоторые тесты можно приоритизировать по отношению к другим тестам для оптимизации. Оптимизацию протокола можно предварительно рассчитать для использования в случаях априори. Оптимизацию протокола можно также выполнить в реальном времени для новых случаев, не принадлежавших к категории априори. Можно выполнять валидацию системы для включения набора используемых случаев.
[00369] Ниже можно найти пример оптимизации протокола, где сравниваются два случая. В обоих случаях 8 мкл неразведенной пробы необходимо для выполнения необходимых тестов. В таком примере мультиплексный блок насчитывает 20 тестов, где для 5 тестов необходимо разведение 1:5 и для 15 тестов необходимо разведение 1:25.
[00370] В первом случае в пробе необходимо выполнить все тесты. Протокол в таком случае (случай использования В) следующий:
[00371] 1) Приготовить раствор в соотношении 1:5 (образец 8 мкл+32 мкл растворитель).
[00372] 2) Развести раствор в соотношении 1:25 (образец 15 мкл в соотношении 1:5+60 мкл разбавитель).
[00373] 3) Для проведения каждого теста (n=20), смешиваются 5 мкл специально разведенной пробы с 10 мкл реагента. Такой протокол приводит к неточности коэффициента вариации в 10% всех 20 тестов, удовлетворяя минимальные требования. Использование 1 мкл пробы для каждого разведения 1:5 анализа и 0,2 мкл для каждого разведения 1:25 пробы (что, в общем, составляет 5*1+15*0,2=8 мкл, используя всю пробу).
[00374] Во втором случае пользования (случай использования "В") на основе того же типа блока, необходимо выполнить только 10 тестов на пробе, не все 20. Кроме этого все эти тесты будут выполняться на уровне разведения 1:25 в случае использования А. В таком случае использования оптимизируется протокол для максимального улучшения точности, путем использования более низкой пропорции разведения (1:5). Оптимизированный протокол в таком случае использования представляет собой следующее:
[00375] 1) Приготовить раствор в соотношении 1:5 (проба 8 мкл + 32 мкл растворитель).
[00376] 2) Для проведения каждого теста (n=10), смешиваются 4 мкл специально разведенной пробы с 11 мкл реагента.
[00377] Использование пробы - 0,8 мкл неразведенной пробы за один анализ на общее количество 8 мкл. В связи с тем, что концентрация пробы при проведении анализа увеличивается в пять раз по сравнению с ос случаем использования А, чувствительность анализа улучшается в 5 раз и неточность анализа уменьшается в приблизительно 2,4 (5^0.5) раза до 4,5%.
[00378] Повторная оптимизация протокола в случае использования В требует в 5 раз больше пробы, использованной первоначально для каждого теста, таким образом, улучшая общий результат. Необходимо иметь в виду, что вышеуказанное обсуждение не учитывает неточности в связи с ошибками в измерении объемов, а только учитывает ошибки, связанные с неточностями при измерении оптического сигнала. Случай использования В отличается более низким показателем неточности в связи с неточностью при измерении объема, потому что используется меньше этапов дозирования. Например, если неточность измерения объема представляет собой 5% неточности в указанной концентрации аналита в обоих случаях использования, тогда общая неточность измерения аналита будет составлять 11,2% (10^2+5^2)^0,5 в случае использования А по сравнению с 6,5% (4,5^2+5^2)^0,5, в случае использования В (предполагая, что, как правило, факторы, вызывающие неточность анализа составляют в сумме квадратный корень сумм квадратов каждого из источников неточности).
[00379] Описанные выше эффекты легче наблюдать в случае анализа на основе люминесценции, когда анализ сигнала выражается как число фотонов, излучаемых за единицу времени. Также как и в случае радиоактивного излучения по примеру радиоиммуноанализа, неточность сигнала равняется квадратному корню сигнала и поэтому коэффициент вариации сигнала равен 100/ (квадратный корень сигнала). Например, коэффициент вариации сигнала в 10000 импульсов равен 1%. При проведении разных анализов, которые приводят к образованию фотонов (например, иммуноанализ хемилюминесценции, сигнал практически точно пропорционален концентрации аналита, по крайней мере, нижнему пределу концентрации). Таким образом, измеренный уровень погрешности аналита с 1/ (квадратный корень сигнала) для концентраций значительно выше уровня детекции. В анализах, использующих разведение пробы, погрешность измеренного аналита будет на уровне 1/ (разведение пробы). Например, анализ на основе пропорции разведения пробы 1:100 будет отличаться коэффициентом вариации сигнала и концентрации приблизительно 3,2 раза (10^0.5), что выше, чем в анализе со степенью разведения, равной 1:10 (и будет иметь чувствительность приблизительно в 10-раз выше).
[00380] Реакционные химические анализы
[00381] В соответствии с настоящим изобретением, возможно выполнять разнообразные анализы на флюидном устройстве для обнаружения присутствия интересующего аналита в пробе. В анализах на основе маркировочных знаков можно использовать разнообразные маркировочные знаки, используемые в отрасли, для использования их при анализе субъекта. В некоторых вариантах маркировочные знаки можно определять с помощью спектроскопических, фотохимических, биохимических, электрохимических, иммунохимических и других химических методов. Например, полезные маркировочные знаки нуклеиновой кислоты включают флуоресцентный краситель, электронно-плотные реагенты и ферменты. Известно большое количество маркировочных знаков для маркировки биологических компонентов; они широко применяются в научной и патентной литературе и также могут быть применимы в настоящем изобретении для индексирования биологических компонентов. Приемлемые маркировочные знаки включают ферменты, флуоресцентные вещества, хемилюминесцентные вещества, биолюминесцентные или цветные маркировочные знаки. Реагенты, определяющие специфичность анализа включают, например, моноклональные антитела, поликлональные антитела, аптамеры, белки, пробы нуклеиновых кислот или другие полимеры, такие как афинные матрицы, углеводы и липиды. Детекция может проводиться с помощью любых известных методов, включая спектрофотометрическое или оптическое отслеживание флуоресцентных или люминесцентных маркеров или другие методы, которые в состоянии отслеживать молекулу на основе размера, заряда или аффинности. Контрастное вещество может быть любым материалом с физическими или химическими характеристиками. Такие обнаруживаемые маркировочные знаки широко применимы в области электрофореза в геле, колоночной хроматографии, твердых носителей, спектроскопических подходов и тому подобное, и, в общем, маркировочные знаки, применимые для таких методов, можно использовать в настоящем изобретении. Таким образом, маркировочный знак включает без ограничений любой состав, выявляемый спектральным, фотохимическим, биохимическим, иммунохимическим, зондом для нуклеиновой кислоты, электрическим, оптическим тепловым или другими химическими методами.
[00382] В некоторых вариантах маркировочный знак (например, окрашенные смесь, фтор или ферменты) связывается прямо или косвенно с определяемой молекулой, в соответствии с методами, известными в отрасли. В других вариантах, маркировочный знак прикрепляется к рецептору для аналита (например, антитела, зонд нуклеиновой кислоты, аптамера и т.д.). Как указано выше, используется большое количество маркировочных знаков и выбор определенного маркировочного знака зависит от необходимой чувствительности, легкости слияния смесей, требований по отношению к стабильности инструментов, имеющихся в наличии и требований, связанных с утилизацией. Нерадиоактивные маркировочные знаки, как правило, присоединяются посредством косвенных методов. Как правило, рецептор, характерный определенному аналиту, связан с веществом, формирующим импульс. Иногда рецептор аналита связан с молекулой адаптера (например, биотин или авидин) и набор реагентов анализа включает связующее вещество (например, биотинилированный реагент или авидин) который связывает адаптер или аналит. Аналит связывается с определенным рецептором в реакционной зоне. Маркированный реагент в состоянии формировать многослойное комплексное соединение с аналитом, расположенным в центре. Реагент может также конкурировать с аналитом с целью получения рецепторов в реакционной зоне или связываться со свободными рецепторами в реакционной зоне, не занятой аналитом. Маркировочный знак по своей природе обнаруживаемый или связанный с системой импульсов, например, обнаруживаемыми ферментами, флуоресцентными веществами, хемилюминесцентным веществом, хемилюминогенетическими частицами, например, ферменты с люминогенным субстратом. Можно использовать разнообразные лиганды и антилиганды. В случаях, когда у лиганда имеется естественный антилиганд, например, биотин, тироксин дигоксигенин и кортизол, его можно использовать вместе с маркированными антителами. Альтернативно, в сочетании с антителами можно использовать любые гаптенные или антигенные вещества.
[00383] Интересующими нас ферментами, выступающими в качестве маркировочных знаков, могут быть гидролазы, в частности, фосфатазы, эстеразы, гликозидазы или оксиредуктазы, в частности, пероксидазы. Флуоресцентные вещества включают флюресцент и его производные, родамин и его производные, данзильные группы и умбелиферон. Хемилюминесцентные вещества включают диоксетан, эфир акридиния, люсиферин и 2,3-дигидрофталазиндион вроде луминола.
[00384] Методы детекции маркировочных знаков хорошо известны специалистам в отрасли. Так, например, если маркировочный знак флуоресцентный, его возможно определить возбуждая люминофор волной света определенной длины и определяя образующуюся флуоресценцию с помощью, например, микроскопии, визуальной инспекции, с помощью фотографии, благодаря использованию электронных детекторов типа дигитальных видеокамер, устройств с зарядовой связью (CCDs), умножителей, фотодиодов и других устройств обнаружения. Подобным образом ферментные маркировочные знаки обнаруживаются благодаря предоставлению соответствующих субстратов для фермента и обнаруживая полученный продукт реакции с помощью спектроскопа или дигитального изображения (тема настоящего изобретения). И последнее, простые колориметрические маркировочные знаки зачастую определяются просто с помощью определенного цвета маркировочного знака. Например, растворы коллоидного золота, как правило, розового цвета, в то время как разнообразные капли, опущенные в красящий раствор, приобретают определенный цвет.
[00385] В некоторых вариантах источники люминесценции испускают определяемый импульс. Люминесценция - это термин, который используется чаще всего по отношению к излучению света веществом, не связанным с повышением температуры. В общем, атомы или молекулы излучают фотоны электромагнитной энергии (т.е., света) в процессе перехода из возбужденного состояния в более низкое энергетическое состояние (как правило, основное состояние). Если возбуждающим агентом является фотон, то процесс люминесценции называется фотолюминесценцией или флуоресценцией. Если возбуждение вызывает электрон, то процесс люминесценции называется электролюминесценцией. Более конкретно, люминесценция возникает в результате прямого введения и удаления электронов в и из электронно-дырочной пары, и последующей рекомбинацией электронно-дырочной пары для выделения фотона. Люминесценция, возникающая в результате химической реакции, как правило, называется хемилюминесценцией. Люминесценция, возникающая от живого организма, как правило, называется биолюминесценцией. Если фотолюминесценция возникает в результате перехода, разрешенного по спину (т.е., один синглетный переход, триплет-триплетный переход), фотолюминесцентный процесс, как правило, называется флюоресценцией. Как правило, флуоресцентная эмиссия прекращается после удаления причины возбуждения в результате краткосрочных возбужденных состояний, Которые быстро исчезают благодаря переходам, разрешенным по спину. Если фотолюминесценция возникает в результате перехода, запрещенного по спину (т.е., один синглетный переход), фотолюминесцентный процесс, как правило, называется фосфоресценцией. Как правило, флуоресцентная эмиссия продолжается на протяжении длительного времени после удаления причины возбуждения в результате долгосрочных возбужденных состояний, Которые исчезают только в результате переходов, разрешенных по спину. Люминесцентный знак может иметь любую из вышеназванных характеристик.
[00386] Подходящие люминесцентные источники включают вещество, которое можно электронно возбудить химической реакцией и которое затем может излучать свет, выступающий в качестве определяемого импульса или отдавать энергию флуоресцентному рецептору. Было обнаружено, что разнообразные семьи веществ в состоянии излучать хемилюминесценцию в разных условиях. Одной такой семьей веществ является 2,3-дигидро-1,4-фталазинедион. Часто используемым веществом является луминол, который представляет собой 5-аминное вещество. Другими членами семейства являются 5-амино-6, 7, 8-триметокси- и аналог диметиламино[ка]бенза. Можно сделать так, чтобы эти вещества люминесцировали со щелочной перекисью водорода или гипохлорита кальция и основанием. Другим семейством веществ является 2,4,5-трифенилимидазол, где трифенилимидазол является общим названием для родительского продукта. Хемилюминесцентные аналоги включают пара-диметиламино и -метокси заместители. Хемилюминесценцию можно также получить с помощью оксалатов, как правило, сложные эфиры оксалила, например, n-нитрофенил и перекись по примеру перекиси водорода, при нормальных условиях. Другие широко известные полезные хемилюминесцентные вещества включают эфиры - Н-алкил акридинума и диоксетаны. Кроме этого, можно использовать люсиферины в сочетании с люсиферазой или люсигенином для обеспечения биолюминесценции. В качестве особо предпочитаемых хемилюминесцентных источников выступают субстраты "люминогенных" ферментов, таких как эфиры диоксетана-фосфата. Они сами не являются люминесцентными, но приводят к возникновению люминесцентных продуктов при реакции с фосфатазами, такими как щелочная фосфатаза. Использование люминогенных субстратов для ферментов предпочитается в связи с тем, что ферменты выступают в качестве усилителя, способного конвертировать в продукт тысячи молекул субстрата в секунду. Методы люминесценции также предпочитаются в связи с тем, что импульс (свет) можно распознавать с высокой чувствительностью и на большом динамическом промежутке с помощью РМТ.
[00387] Используемый в настоящем изобретении термин аналит включает без ограничений фармацевтические препараты, неактивные формы лекарства, фармацевтические агенты, лекарственные метаболиты, биомаркеры, такие как маркеры экпрессированных белков и клеток, антитела, белки сыворотки, холестерин и другие метаболиты, электролиты, ионы металлов, полисахариды, нуклеиновые кислоты, биологические аналиты, биомаркеры, гены, белки, Гормоны и их другие комбинации. Аналиты могут быть комбинациями полипептидов, гликопротеинов, полисахаридов, липидов и нуклеиновых кислот.
[00388] Настоящая система может использоваться для определения и (или) квантификации разнообразных аналитов. Например, аналиты, которые можно обнаружить и (или) квантифицировать включают альбумин, алкалин фосфатазу, ALT, AST, билирубин (прямой), билирубин (общий), остаточный азот мочевины (BUN), кальций, хлорид, холестерин, углекислый газ, креатинин, гаммаглутаминтранфераза (GGT), глобулин, глюкоза, холестерин ЛПВП, гемоглобин, гомоцистеин, железо, лактатдигидрогеназа, магний, фосфор, калий, натрий, общий белок, триглицериды и мочевая кислота. Обнаружение и квантификации таких аналитов может выполнятся с помощью оптических, электронных или измерений другого типа.
[00389] Особенный интерес представляют биомаркеры, связанные с определенным заболеванием или с определенным этапом заболевания. Такие аналиты включают, но не ограничиваются аналитами, связанными с автоиммунными заболеваниями, такими как лишний вес, гипертония, диабет, нейронные и дегенеративные заболевания, сердечные заболевания, эндокринные нарушения, метаболические нарушения, воспаления, сердечно-сосудистые заболевания, сепсис, регенерация тканей, раковые заболевания, болезнь Альцгеймера, осложнения после спортивных травм или другие комбинации.
[00390] Кроме того, интерес представляют биомаркеры, присутствующие в разном количестве в одной или нескольких тканях тела, включая сердце, печень, простату, легкие, почки, костный мозг, кровь, кожу, мочевой пузырь, головной мозг, мышцы, нервы и определенные тканы, измененные в результате разнообразных заболеваний, например, различные типы рака (злокачественные или без метастаз), автоиммунные заболевания, воспалительные или дегенеративные заболевания.
[00391] Кроме того, интерес представляют аналиты, указывающие на присутствие микроорганизмов, вирусов или хламидий. Одними из примеров таких микроорганизмов являются бактерии, вирусы и протозоа. Аналитами, которые можно обнаружить с помощью ключевого метода, являются переносимые с кровью патогены, выбранные из неограниченной группы, включающие Staphylococcus epidermidis, Escherichia coli, метициллин-резистентный Staphylococcus aureus (MSRA), Staphylococcus aureus, Staphylococcus hominis, Enterococcus faecalis, Pseudomonas aeruginosa, Staphylococcus capitis, Staphylococcus warneri, Klebsiella pneumoniae, Haemophilus influenzae, Staphylococcus simulans, Streptococcus pneumoniae и Candida albicans.
[00392] Аналиты, которые можно обнаружить с помощью ключевого метода, также включают разнообразные заболевания, предаваемые половым путем, которые модно выбрать из следующего списка: гонорея (Neisseria gonorrhoeae), сифилис (Treponena pallidum), хламидия (Clamyda tracomitis), негонококковый уретрит (Ureaplasm urealyticum), кандидоз (Candida albicans), шанкроид (Haemophilus ducreyi), трихомоноз (Trichomonas vaginalis), герпес половых органов (HSV тип I & II), ВИЧ, ВИЧ II и гепатит А, В, С, G, а также гепатит, вызванный TTV.
[00393] Дополнительные аналиты, которые можно обнаружить с помощью ключевого метода, включают разнообразие дыхательных патогенов, среди которых могут быть Pseudomonas aeruginosa, метициллин-резистентный Staphlococccus aureus (MSRA), Klebsiella pneumoniae, Haemophilis influenzae, Staphlococcus aureus, Stenotrophomonas maltophilia, Haemophilis parainfluenzae, Escherichia coli, Enterococcus faecalis, Serratia marcescens, Haemophilis parahaemolyticus, Enterococcus cloacae, Candida albicans, Moraxiella catarrhalis, Streptococcus pneumoniae, Citrobacter freundii, Enterococcus faecium, Klebsella oxytoca, Pseudomonas fluorscens, Neiseria meningitidis, Streptococcus pyogenes, Pneumocystis carinii, Klebsella pneumoniae Legionella pneumophila, Mycoplasma pneumoniae и Mycobacterium tuberculosis.
[00394] Ниже перечисляются дополнительные примеры маркеров в соответствии с настоящим изобретением: Аминофиллин, CRP, СКМВ, PSA, миоглобин, СА125, прогестерон, ТхВ2, 6-keto-PGF-1-alpha и аминофиллин. эстрадиол, лютеинизирующий гормон, триглицериды, триптаза, холестерин липопротеинов с низкой плотностью, холестерин липопротеинов с высокой плотностью, холестерин, IGFR.
[00395] Примеры маркеров печени включают без ограничений LDH, (LD5), аланинаминотрансфераза (ALT), аргиназа (для печени), альфа-фетопротеин (AFP), щелочная фосфатаза, лактатдегидрогеназа и билирубин.
[00396] Примеры маркеров почек включают без ограничений рецептор некроза опухоли - альфа, цистатин С, мочевой простангладин Д по типу лирокалина, синтатаза (LPGDS), рецептор роста гепатоцитов, поилцистин 2, полицистин 1, фиброцистин, уромодулин, аланин, аминопептидаза, Н-ацетил-Б-Д-глукосаминидаза, альбумин и ретинолсвязывающий белок (RBP). [00397] Примеры сердечных маркеров включают без ограничений тропонин I (TnI), тропонин Τ (TnT), креатининовая диназа (CK), СКМВ, миоглобин, связующие белки жирных кислот (FABP), С-реактивный белок (CRP), фибриноген Д-димер, S-100 белок, мозговой натрийуретический пептид (BNP), NT-proBNP, РАРР-А, миелопероксидаза (МРО), гликогенфосфорилаза изофермент ВВ (GPBB), тромбин активируемый ингибитор фибринолиза (TAFI), фибриноген, альбумин, Модифицированный ишемической болезнью (IMA), кардиотропин-1, и MLC-I (легкая цепь миозина).
[00398] Примеры панктреазных маркеров включают без ограничений амилазу, белки связанные с панкреатитом (РАР-1) и регенерированные белки (REG).
[00399] Примеры маркеров мышечной ткани включают без ограничений миостатин.
[00400] Примеры маркеров крови включают без ограничения эритропоэтин (ЕРО).
[00401] Примеры маркеров костного ремоделирования включают без ограничений: структурированный Ν-телопептид коллагена костного типа I (ΝΤx), карбокситерминальный перекрестно связывающий телопептид костного коллагена, лизил-пиридинолин (деоксипиридинолин), пиридинолин, устойчивая к тартрату кислая фосфатаза, Проколлаген I типа С пропептид, проколлаген I типа N пропептид, остеокалыдин (костный белок гамма-линоленовой кислоты), щелочная фосфотаза, катепсин K, СОМР (олигомерный матриксный белок хряща), остеокрин, остеопротегерин (OPG), RANKL, sRANK, TRAP 5 (TRACP 5), специфический фактор остеобластической клетки 1 (OSF-1, плеиотрофин), растворимые молекулы клеточной адгезии, sTfR, sCD4, sCD8, sCD44 и специфический фактор остеобласта 2 (OSF-2, Периостин).
[00402] В некоторых вариантах маркеры в соответствии с настоящим изобретением специфичны для определенных заболеваний. Примеры раковых маркеров включают без ограничений PSA (общий специфический антиген простаты), креатинин, простатическая кислая фосфатаза, комплексы PSA, специфический для простаты ген-1, СА 12-5, карциноэмбриональный антиген (СЕА), альфа-фетопротеин (AFP), hCG (человеческий хорионический гонадотропин), ингибин, САА овариальный С1824, СА 27.29, СА 15-3, САА грудная железа С1924, Her-2, панкреатический, СА 19-9,, САА панкреатический, нейрон-специфическая енолаза, ангиостатин DcR3 (растворимый рецептор-приманка 3), эндостатин, Ер-САМ (MK-1), свободный иммуноглобулин легкая цепь каппа частиц, свободный иммуноглобулин легкая цепь лямбда, герстатин, хромогранин А, адреномедуллин, итнегрин, рецептор роста эпидермиса, рецептор роста эпидермиса - тирозинкиназа, проадреномедуллин Ν-терминал 20 пептид, факты поста эндотелия сосудов, рецептор роста эндотелия сосудов, рецептор фактора стволовых клеток, c-kit/KDR, KDR и мидкин.
[00403] Примеры инфекционных заболеваний включают без ограничений: виремия, бактеремия, сепсис и маркеры: PMN эластаза, PMN эластаза/ α1-PI комплекс, поверхностно-активный белок D (SP-D), HBVc антиген, HBVs антиген, анти-HBVc, анти-ВИЧ, Т-подавитель лимфоцита антиген, соотношение антигена Т-лимфоцит, Т-помощник лимфоцит антигена, анти-HCV, пирогены, р24 антиген, мурамил-дипептид.
[00404] Примеры диабетических маркеров включают без ограничений С-пептид, гемоглобин А1с, гликозилированный альбумин, прогрессивные гликозилированные продукты минтеза (AGEs), 1,5-ангтдроглюцит, желудочный ингибиторный полипептид, глюкоза, гемоглобин A1c, ANGPTL3 и 4.
[00405] Примеры воспалительных маркеров включают без ограничений ревматоидный фактор (RF), антинуклеарное антитело (ANA), С-реактивный белок (CRP), белок клетки Клары (утероглобин).
[00406] Примеры аллергических маркеров включают без ограничений общий IgE и специфический IgE.
[00407] Примеры маркеров аутизма включают без ограничений серулоплазмин, металлотионеин, цинк, медь, В6, В12, глутутион, щелочная фосфатаза и активация апо-щелочной фосфотазы.
[00408] Примеры маркеров заболеваний коагуляции включают без ограничений b-тромбоглобулин, тромбоцитарный фактор 4, фактор фон Виллебранда.
[00409] В некоторых вариантах фактор зависит от типа лечения. Маркеры, указывающие на действие ингибиторов СОХ, включают, без ограничений ТхВ2 (Сох-1), 6-keto-PGF-1-alpha (Сох 2), 11-Dehydro-TxB-1a (Сох-1).
[00410] Другие маркеры настоящего изобретения включают без ограничений лептин, лептиновый рецептор и прокальцитонин, белок S100 головного мозга, вещество Р, 8-Iso-PGF-2a.
[00411] Примеры гериатрических маркеров включают без ограничений, специфическую для нейрона эндолазу, GFAP и S100B.
[00412] Примеры маркеров диетического статуса включают без ограничений преалбумин, албумин, ретинол-связующий белок (RBP), трансферрин, белок, стимулирующий ацилирование (ASP), адипонектин, белок, связанный с агути (AgRP), белок 4 по типу ангипоэтина (ANGPTL4, FIAF), С-пептид, AFABP (белки, связывающиеся с жирными кислотами адипоцита, FABP4), белок, стимулирующий ацилирование (ASP), EFABP (эпидермальные белки, связывающиеся с жирными кислотами, FABP5), глицентин, глукагон, пептид-1 по типу глукагона, пептид-2 по типу глукагона, грелин, инсулин, лептин, лептинный рецептор, PYY, RELMs, резимтин, amd sTfR (рецептор растворимого трансферрина).
[00413] Примеры маркеров липидного метаболизма включают без ограничений апо-липопротеины (несколько), Аро-А1, Аро-В, Apo-C-CII, Apo-D, Аро-Е.
[00414] Примеры маркеров статуса коагуляции включают без ограничений фактор I: фибриноген, фактор II: протромбин, фактор III: фактор ткани, фактор IV: кальций, фактор V: проакцерин, фактор VI, фактор VII: проконвертин, фактор VIII:, антигемолитический фактор, фактор IX: тромбопластин плазмы, фактор X: фактор Стюарта, фактор XI: плазменный предшественник тромбопластина плазмы, фактор XII: фактор Хагемана, фактор XIII: фактор Лаки-Лорана, прекалликреин, высокомолекулярный кининоген, белок С, белок S, D-димер, тканевой активатор плазминогена, плазминоген, а2-антиплазмин, ингибитор активатора плазминогена 1 (PAI1).
[00415] Примеры моноклональных антител включают антитела для EGFR, ErbB2 и IGF1R.
[00416] Примеры ингибиторов тирозинкиназы включают без ограничений Ab1, Kit, PDGFR, Src, ErbB2, ErbB 4, EGFR, EphB, VEGFR1-4, PDGFRb, FLt3, FGFR, PKC, Met, Tie2, RAF и TrkA.
[00417] Примеры ингибиторов серин/треонин киназы включают без ограничений АКТ, Aurora А/В/В, CDK, CDK (pan), CDK1-2, VEGFR2, PDGFRb, CDK4/6, МЕК1-2, mTOR и PKC-beta.
[00418] Величины рецептора GPCR включают без исключений хистаминовый рецептор, серотониновый рецептор, рецептор ангиотензиса, адренорецепторы, мускариновые ацетилхолиновые рецепторы, рецепторы GnRH, допаминовые рецепторы, простагландиновые рецепторы и рецепторы ADP.
[00419] Холестерин
[00420] Измерения метаболитов можно выполнять путем образования нового цветного продукта с помощью отксидаза (например, холестеролоксидаза) (для образования H2O2) и пероксидаза хрена, плюс хромоген (например, N-этил-N-(2-хидрокси-3-сульфопропил)-3,5-диметоксианилин, соль ["DAOS" плюс амино анти-пирин] для формирования цветного продукта вроде красителя Trinder). Один такой химический пример показан на Рисунке 52 и Рисунке 53.
[00421] NADH или NADPH
[00422] Образование или поглощение NADH или NADPH зачастую используются а клинических испытаниях. Это связано с тем, что такие соферменты выступают в качестве распространенных субстратов для ферментов. Например, измерения ферментов для клинических испытаний, таких как, лактатдегидрогеназа (LDH), можно измерять посредством скорости образования NADH. В связи с тем, что максимальное поглощение света NADH равняется 340 нм и (1) полистирол и другие пластические материалы плохо пропускают свет в промежутке UV, (2) источники белого света образуют маленькое количество света в промежутке UV и (3) сенсоры видеокамеры и сканнера проявляют низкую чувствительность в промежутке UV, не имеет смысла измерять NADH трехцветным анализом изображений. Для этого NADH можно превратить в цветной продукт с помощью тетразолиевые соли, такие как, водорастворимый тетразолий (e.g. WST-1 (Dojindo Molecular Technologies) плюс "электронный медиатор", например, 1-метоксифенозин метосульфат (PMS).
[00423] В некоторых вариантах анализы, которые приводят к появлению или поглощают NADH или NADPH можно сгруппировать с другими реакциями, при которых возможны колориметрические измерения. Например, NADH или NADPH можно использовать для превращения веществ, таких как 2-(4-лодофенил)-3-(4-нитрофенил)-5-(2,4-дисульфофенил)-2Н-тетразолиум, соль мононатрия (WST-1), в цветной формезанный краситель, как показано ниже, используя феназинметасульфат в качестве электронного медиатора, как показано на Рисунке 54.
[00424] Как показано на Рисунке 73, когда комбинируют NADH, WST-1 и PMS в миллимолярных концентрациях, формируется продукт желтого цвета (показано в микродозаторах, которые идут под названием Смесь).
[00425] На основе таких химических соотношений был разработан анализ для LDH. Лактат (мМ), NAD (мМ) и LDH были скомбинированы и инкубированы при температуре в 37С на протяжении 10 минут, после чего были добавлены WST-1 и PMS. Хороший эффект дозы на LDH был получен, как показано на Рисунке 74 при двойном серийном разведении LDH (1000 IU/L) (слава направо), соответствующим OD 450 нм, как показано на графике Рисунка 75.
[00426] Щелочная фосфатаза
[00427] В других вариантах, анализ на основе ферментов типа щелочной фосфатазы можно выполнить с помощью хромогенного субстрата типа п-нитрофенил фосфата. Ферментная реакция может привести к образованию п-нитрофенола, который имеет желтый цвет в щелочных условиях.
[00428] Ионы металлов
[00429] Измерения можно также выполнить на анализах, которые приводят к образованию комплексов, например между ионом металла и хелатирующим красителем, который меняет цвет при связывании. Например, о-Кресолфталеин Комплексон (показано на Рисунке 55) приводит к образованию комплекса с кальцием, который отличается по цвету от реагента. Общая структура такого анализа выглядит таким образом: Хелатирующий краситель (цвет 1) + ΜΝ+<-> Хелатирующий краситель: MN+:(цвет 2).
[00430] Оптический сигнал анализа иона металла также можно измерить, используя металло-зависимые ферменты. Например, ионы натрия можно определить ферментным путем, с помощью натрий-зависимой реакции β-галактозидазы с о-нитро-фенил галпрктозидом (ONPG), выступающим в качестве субстрата. Впитывание 405 нм продукта о-нитрофенола прямо пропорционально концентрации натрия.
[00431] ELISAs
[00432] Анализы аналитов также можно выполнять с помощью цвето-образующей ELISAs. Известно большое количество методов ELISA, которые приводят к образованию ферментов, использующих цвета, таких как пероксидаза хрена, щелочная фосфатаза и β-галактозадаза с хромогенным субстратом, по типу о-фенилендиамин, п-нитрофенил фосфата и о-нитрофенил галактозид соответственно. Такие анализы можно с легкостью выполнить и получить приемлемые результаты с помощью настоящего изобретения.
[00433] Люминогенные имуноанализы
[00434] Можно также выполнять люминогенные иммуноанализы. Для проведения анализов можно использовать хемилюминогенные вещества вроде ферментов с люминогенным субстратом. Например, хемилюминесцентные вещества включают диоксетан, Эфир акридиния, люсиферин и 2,3-дигидрофталазиндион вроде луминола.
[00435] Кроме этого, подходящие люминесцентные источники включают вещество, которое можно электронно возбудить химической реакцией и которое затем может излучать свет, выступающий в качестве определяемого импульса или отдавать энергию флуоресцентному рецептору. Было обнаружено, что разнообразные семьи веществ в состоянии излучать хемилюминесценцию в разных условиях. Одной такой семьей веществ является 2,3-дигидро-1,4-фталазинедион. Часто используемым веществом является луминол, который представляет собой 5-аминным веществом. Другими членами семейства являются 5-амино-6, 7, 8-триметокси- и аналог диметиламино[ка]бенза. Можно сделать так, чтобы эти вещества люминесцировали со щелочной перекисью водорода или гипохлорита кальция и основанием. Другим семейством веществ является 2,4,5-трифенилимидазол, где трифенилимидазол является общим названием для родительского продукта. Хемилюминесцентные аналоги включают пара-диметиламино и -метокси заместители. Хемилюминесценцию можно также получить с помощью оксалатов, как правило, сложные эфиры оксалила, например, п-нитрофенил и перекись по примеру перекиси водорода, при нормальных условиях. Другие широко известные полезные хемилюминесцентные вещества включают эфиры -Н-алкил акридинума и диоксетаны. Кроме этого, можно использовать люсиферины в сочетании с люсиферазой или люсигенином для обеспечения биолюминесценции.
[00436] Амплификация нуклеиновых кислот
[00437] Анализы, которые можно выполнять, также включают амплификацию нуклеиновых кислот. Такие анализы включают анализы изотермической амплификации и изотермической амплификацией с формированием петель. Амплификацию нуклеиновых кислот можно использовать для получения продуктов реакции анализа, которые визуально мутные, флуоресцентные или цветные, для аналитов, которые ставят своей целью получение величин нуклеиновых кислот (гены и т.д.). Технологию амплификации нуклеиновых кислот можно использовать для получения определенных величин ДНК и РНК. Дополнительную реакцию об изотермической амплификации нуклеиновых кислот можно найти в Goto et al., "Колориметрическая детекция изотермической амплификации с формированием петель на основе гидрокси мельдозы голубой", Биотехнологии, том 46, номер 3, март, 2009 г., стр. 167-172.
[00438] Технологию амплификации нуклеиновых кислот можно использовать для измерения ДНК, а также, при использовании с обратной транскриптазой, и с РНК. При проведении реакции продукт амплификации можно обнаружить оптически, используя внедренные красители или хромогенные реагенты, которые вступают в реакцию со свободным пирофосфатом, образованным как побочный продукт амплификации.
[00439] Такую реакцию можно визуализировать, изменяя (увеличивая) цвет, флуоресценцию и мутность. Очень маленькое число копий ДНК можно обнаружить меньше чем за час. Результаты такого анализа можно с легкостью обработать в настоящем изобретении с пользованием трехцветного анализа изображений. Как показано ниже, изображения продуктов реакции изотермической амплификации нуклеиновых кислот можно измерить с помощью (1) заднего освещения (оптика трансмиссии) измерение поглощения света, (2) изображения, полученные с помощью дигитального фотоаппарата света, который прошел через продукт реакции или (3) изображения флуоресцентного света, полученные с помощью освещения продуктов реакции с помощью источника ультрафиолетового света (или любого другого подходящего источника света), полученного дигитальным фотоаппаратом.
[00440] Анализ амплификации нуклеиновых кислот как правило проводиться в "единичном" смешивании в одной пробирке и инкубируют при повышении температуры. В некоторых форматах, реакцию можно контролировать а реальном времени изменением оптических свойств. В других форматах реакция превращается и проводится визуализация продуктов реакции, после добавления хромогенного или флуорогенного реагента. Настоящее изобретение дает возможность получения результатов анализа продуктов реакции нуклеиновых кислот прямо в реакционной пробирке или после аспирации в описанный выше микродозатор.
[00441] Мутность
[00442] Настоящее изобретение также дает возможность выполнения оптических турбометрических анализов. Например, иммунологические анализы можно выполнить путем измерения уровня агглютинации маленьких латексных частиц (50-300 нм). При выполнении таких анализов частицы можно покрыть слоем антигена и(или) антитела и агглютинация произойдет тогда, когда в пробу будет добавлен связующий элемент, типа антитела или антигена. Анализы можно проводить в прямом (т.е. антитело на частице вступает в реакцию с мультиэпитопным белком или биомаркером) или сопоставительном режиме (т.е. препарат хаптен на частице вступает в реакцию с антителами к препарату в сравнении с бесплатным препаратом в пробе). Рассеивание латекса становиться более мутным и мутность можно измерить уменьшением пропускания света с помощью 3-цветной оптики.
[00443] Кроме этого, можно выполнить анализы на основе крупных латексных частиц (диаметром приблизительно 1 мкм) или эритроцитов. Конфигурация анализа подобна турбидиметрическим анализам, как описано выше, но измерения можно выполнять с помощью анализа изображения (измерения с помощью сканнера или видеокамеры) с помощью программного средства для интерпретации количества и размера агглютинатов.
[00444] Реагенты для выполнения таких химических анализов можно включить в описанные выше блоки, например, микродозаторы пипеток. Реагенты можно хранить в виде жидкостей или в сухой лиофилизированной или стеклянной формах.
[00445] Локализированные реагенты
[00446] В некоторых вариантах местоположение и конфигурация места реакции является важным элементом прибора анализа. Большинство, если не все, одноразовые приборы для иммунологических анализов были сконфигурированы таким образом, чтобы захватывающая поверхность стала интегральной частью прибора.
[00447] В одном варианте, устройства для анализа из литьевого пластика можно приобретать в промышленных масштабах или изготавливать с помощью литьевого прессования с целью получения точных форм и размеров. Например, характерные размеры могут быть 0,05-3 мм в диаметре или иметь длину от 3 до 30 мм. Устройства могут быть покрыты захватывающими реагентами с помощью метода, похожего на методы, используемые для покрытия пластин микротитратора но преимущество в том, что их можно обрабатывать в большом количестве, поместив их в большую емкость, добавляя реагенты для покрытия и обрабатывая их с помощью просеивателей, держателей и похожие приборы, для сбора кусочков и их промывки при необходимости.
[00448] Устройство для анализа (сюда могут входить, например, микродозаторы, емкости или любые другие контейнеры) могут выступать в роли жесткой опоры, на которой может иметь место иммобилизация реагента. Устройство для анализа также выбирается таким образом, чтобы выполнять определенные функции при взаимодействии со светом. Например, устройство для анализа можно изготовить из материала типа функционализированного стекла, кремния, германия, фосфида галлия, диоксида кремния, нитрида кремния, модифицированного кремния или из любого другого геля или полимера типа (политетрафторэтилена, (поли)винилидендифторида, полистерол, поликарбонат, полипропилен, полиметилметакрилат (РММА), акрилонитрил бутадиен-стирол (ABS) или их комбинации. В одном варианте устройство для анализа включает полистирол. В других вариантах устройство для анализа может быть сделано из однородного материала, облицовочного материала, материалы с покрытием, обогащенный материал или/и залитые материалы. В настоящем изобретении можно использовать другие соответствующие материалы. Предпочтительно использовать прозрачное место реакции. Кроме этого, в случае, где присутствует оптически проводимое окно, которое пропускает свет для того, чтобы работал детектор оптического излучения, поверхность можно сделать непрозрачной и(или) предпочтительно рассеивающей свет. В некоторых вариантах устройство для анализа можно изготовить из прозрачного материала. В некоторых вариантах устройство для анализа можно изготовить из прозрачного материала.
[00449] Устройство для анализа может быть реагентом с покрытием и(или) обогащенным материалом. В некоторых вариантах реагентом может быть захватывающий реагент, способный иммобилизировать реагирующее вещество на захватывающей поверхности. Реагентом может быть клетка и(или) аналит или любые другие реагенты, описанные здесь. В некоторых вариантах, реагентом может быть молекула, которая выступает в роли агента захвата клеток. Агент захвата клеток может прикрепляться к поверхности определенных клеток во время переноса. В некоторых вариантах агентами захвата могут быть антитела, пептиды, органические молекулы (т.е., включающие липидную цепь, лиофильные молекулы), полимерные матрицы, белки, белковые композиты, гликопротеины, которые могут взаимодействовать с другими клеточными мембранами. Захватывающими реагентами могут быть молекулы, структурированные молекулы, наночастицы, наноструктуры и(или) клеточные каркасы. В некоторых вариантах можно получить микроструктуры, которые могут выступить в качестве механизма анализа в сосуде. Захватывающие реагенты (которые могут включать захватывающие структуры, сформированные из материала устройства анализа) могут дать возможность клеткам привязываться, связываться или быть захваченными.
[00450] Захватывающие реактивы в состоянии иммобилизировать реагенты, например, клетку, во время обработки. Методы захватывания могут быть химическими, физическими, электрическими, магнитными, механическими, связанными с размером, с плотностью, или любые их комбинации. В некоторых вариантах захватывающие реагенты можно использовать для концентрации реактивов, например, клеток, в определенном месте. Например, устройство для анализа может быть покрыто захватывающими реагентами, что может привести к тому, что клетки будут скапливаться на поверхности устройства для анализа, таким образом, концентрируя клетки на захватывающей поверхности. Захватывающие реагенты могут иммобилизировать захваченный реактив на поверхности клетки. Это может помочь фиксировать положение реагентов во время получения изображения (т.е., клетки, аналиты).
[00441] Иммобилизация реагентов может быть полезна в тех случаях, когда экспозиция реакций и (или) детекции длится очень долго. Например, ряд приложений визуализации требует продолжительного времени экспозиции (~1 мин.) или визуализации мелких объектов (<1 мкм), характеризующихся интенсивным броуновским движением.
[00452] В некоторых вариантах конструкции связывающие реагенты могут состоять из материалов, которые дают незначительный фон для визуализации или не дают фона вовсе. В некоторых случаях материал в блоке для анализа может давать незначительный фон для визуализации или не давать фона вовсе. Можно выбирать определенные связывающие реагенты, чтобы они не создавали помех, или создавали только незначительные помехи для визуализации и (или) детекции.
[00453] Иммобилизированный на связывающей поверхности реагент может быть полезен при обнаружении аналита в пробе биологической жидкости. В число таких реагентов входят, например, помимо прочего, зонды для нуклеиновой кислоты, антитела, рецепторы мембраны клетки, моноклональные антитела, антисыворотки и аптамеры, реагирующие на определенные целевые вещества. Можно использовать различные коммерческие реагенты, которые доступны в виде целого ряда поликлональных и моноклональных антител, специально разработанных для выявления конкретных веществ.
[00454] Специалисты в данной области, безусловно, оценят богатый выбор способов иммобилизации разных реагентов на подложке (основе), в которой происходит реакция. Иммобилизация может быть ковалентной и нековалентной, посредством связывающего агента, или связывать их с иммобилизированным агентом. В качестве примера агентов связывающих нуклеиновые кислоты или такие белковые молекулы, как антитела, с твердой подложкой можно привести соединения стрептавидина или авидина и (или) биотина, карбамитовые связи, эфирные связи, амидные связи, соединения, содержащие сложные тиоэфиры, (N)-замещенную тиомочевину, замещенный малеимид, аминовые, дисульфидные, амидные, гидразоновые связи и пр. Кроме того, силильный агент можно связать с нуклеиновой кислотой непосредственно на такой подложке, как стекло, принятым в отрасли методом. Поверхностной иммобилизации можно также добиться посредством поли-L лизиновой связи, которая обеспечивает зарядовую связь с поверхностью.
[00455] После заключительного этапа введения связывающей поверхности анализируемое вещество можно высушить. Например, обезвоживания можно добиться путем помещения вещества в сухую атмосферу или с использованием вакуумного коллектора и (или) путем нагнетания чистого сухого воздуха через коллектор или путем лиофилизации.
[00456] Связывающую поверхность можно нанести на блок для анализа любым из способов. Связывающая поверхность может быть нанесена на материал разными способами: путем окраски, печати, электрораспыления, заливания внутрь и пропитывания материала или любым иным способом. Связывающие реагенты могут быть нанесены на поверхность анализируемого материала, залиты в материал, введены в составе другого вещества или сделаны из самого материала. К примеру, реагент связывающего типа может быть внедрен в полимерную матрицу, которая может использоваться в качестве сенсора. В некоторых вариантах конструкции одну или несколько небольших частиц, напр., наночастицу, микрочастицу и (или) гранулу можно покрыть и (или) пропитать реагентами. В некоторых вариантах конструкции связывающие реагенты могут входить в состав самого анализируемого материала или добавляться к материалу отдельно.
[00457] Во многих вариантах конструкции блок для анализа позволяет подготавливать материал быстро и в больших объемах. Например, для анализа крупной партии может быть использована насадка для массового нанесения связывающей поверхности в насадку или на нее. Другой пример массовой обработки: насадка могут быть расположена на движущейся ленте или вращающейся платформе. Еще один способ упростить процесс обработки: большое количество насадок может быть подключено к вакуумному и (или) напорному коллектору.
[00458] Связывающий реагент может быть нанесен на блок для анализа на любом этапе процесса. К примеру, связывающий агент можно нанести на блок для анализа в процессе производства. Его можно нанести до отправки блока для анализа в место назначения. Другой вариант нанести связывающий реагент на блок для анализа - уже после доставки материала. В некоторых случаях связывающий реагент может быть нанесен на блок для анализа в месте его использования, например, в пункте обслуживания.
[00459] В некоторых вариантах конструкции связывающий реагент может покрывать всю поверхность или только часть блока для анализа. Связывающий реагент может находиться на внутренней поверхности блока для анализа. В некоторых вариантах конструкции связывающий реагент может покрывать поверхность блока для анализа только частично. Связывающий реагент может быть нанесен на поверхность с определенным рисунком. На поверхности блока могут быть участки, на которые нанесен связывающий реагент, и участки поверхности без реагента. К примеру, могут быть окрашенные и неокрашенные участки. Связывающий реагент может быть нанесен на поверхность в виде любого геометрического рисунка. К примеру, связывающий реагент может быть нанесен в виде точек, продольных или поперечных линий, решеток, полосок, кругов, колец или других фигур или узоров. Связывающие реагенты могут быть нанесены в любых произвольных местах на поверхности.
[00460] Несколько связывающих реагентов могут быть произвольно нанесены на блок для анализа. В некоторых вариантах конструкции несколько связывающих реагентов могут быть нанесены так, чтобы разные реагенты не смешивались (напр., разные связывающие реагенты не наносятся на одни и те же участки и места). В других случаях они могут смешиваться (напр., разные связывающие реагенты могут наноситься на одни и те же участки и места). Участки с разными связывающими реагентами могут чередоваться без пропусков или с пропусками. Разные связывающие реагенты могут использоваться для иммобилизации разных реактантов. К примеру, разные связывающие реагенты могут использоваться для иммобилизации разных клеток и (или) анализируемых веществ на связывающей поверхности. Применяя несколько связывающих реагентов, нанесенных в определенных участках, можно выявить несколько разных реактантов в одном анализируемом материале. В некоторых вариантах конструкции на поверхность аппарата для анализа можно наносить два или больше, три или больше, четыре или больше, пять или больше, семь или больше, десять или больше, пятнадцать или больше, двадцать или больше, тридцать или больше, сорок или больше, пятьдесят или больше, семьдесят или больше, 100 или больше, 150 или больше, 200 или больше или 300 или больше различных связывающих реагентов. Различные связывающие реагенты могут наноситься в виде любых узоров и форм. К примеру, различные связывающие реагенты могут наноситься в виде серии колец на внутреннюю поверхность блока для анализа. Например, различные связывающие реагенты могут наноситься на внутреннюю поверхность насадки, резервуара, контейнера, кюветы или другого сосуда, описанного в данном тексте.
[00461] Расположение различных связывающих реагентов на блоке для анализа может быть известно до выявления связанных реактантов. В некоторых вариантах конструкции блок для анализа содержит идентификатор, который определяет тип блока для анализируемого материала и (или) рисунок нанесенных на него связывающих реагентов. Возможен также вариант, когда расположение различных связывающих реагентов на блоке для анализа неизвестно до выявления связанных реактантов. Расположение различных связывающих реагентов может быть определено на основе положения выявленных связанных реактантов.
[00462] Связывающие реагенты могут быть нанесены любым способом из описанных в данном тексте. В некоторых случаях для нанесения различных связывающих реагентов может использоваться трафаретная методика и метод литографии.
[00463] Любое описание связывающих реагентов и (или) слоя, нанесенного на блок для анализа, применимо к любым другим аппаратам или сосудам, описанным в данном текста, включая помимо прочего насадки, резервуары, кюветы или блоки реагентов.
[00464] Блоки реагентов
[00465] Во многих вариантах конструкции изобретения наборы реагентов производятся блоками. Конструкция блока для реагентов может быть настроена таким образом, чтобы производить наборы быстро и большими партиями. Например, в процессе крупномасштабного производства можно одновременно наполнять и запечатывать много блоков реагентов. Блоки реагентов можно наполнять в соответствии с типом анализа или анализов, которые предстоит выполнять на приборе. Например, если разным пользователям нужно проводить разные анализы, блоки реагентов можно производить в соответствии с требованиями каждого пользователя, без необходимости создавать отдельно целые аппараты для разных случаев. Другой пример серийной обработки: блоки реагентов могут быть расположены на движущейся ленте или вращающейся платформе.
[00466] В другом варианте конструкции блоки регентов размещаются непосредственно в выемках в корпусе устройства. В этом варианте может быть предусмотрено изолирующее покрытие для участков на корпусе вокруг блоков реагентов.
[00467] В число реагентов, предназначенных для использования на данном изобретении, входят помимо прочего буферные растворы, ферментные субстраты, разбавляющие буферные растворы, конъюгаты, меченные ферментом конъюгаты, ДНК-синтезаторы, разбавители проб, отмывающие растворы, реагенты для предварительной обработки проб, включая такие вспомогательные вещества, как детергенты, полимеры, хелатные вещества, альбуминсвязывающие реагенты, ингибиторы ферментации, ферменты, антикоагулянты, вещества агглютинирующие красные кровяные тельца, антитела и другие вещества, необходимые для проведения анализа на приборе. Меченный ферментом конъюгат может быть либо поликлональным антителом, либо моноклональным антителом, помеченным ферментом, который создает обнаруживаемый сигнал при реакции с соответствующим субстратом. Примерами таких ферментов могут послужить среди прочего щелочная фосфотаза и пероксидаза хрена. В некоторых моделях реагенты содержат вещества для иммунологического анализа. Как правило, реагенты, особенно те, которые относительно нестабильны при смешивании с жидкостями, хранятся отдельно в определенных отделах (например, в блоках реагентов) в приборе.
[00468] В некоторых конструкциях блок реагентов содержит от около 5 микролитров до 1 миллилитра жидкости. В некоторых вариантах исполнения блок может содержать около 2-200 микролитров жидкости. В других вариантах конструкции блок реагентов содержит 100 микролитров жидкости. В одном из вариантах блок реагентов содержит около 40 микролитров жидкости. Объем жидкости в блоке реагентов может быть разным в зависимости от типа проводимого анализа или используемого образца биологической жидкости. В одной из конструкций объем реагентов не вычисляется заранее, но должен превышать известный минимум. В некоторых конструкциях реагенты первоначально хранятся в сухом виде и растворяются в начале проведения анализа на приборе.
[00469] В определенных вариантах конструкции блоки реагентов наполняются с помощью сифона, воронки, пипетки, шприца, иглы или сразу нескольких приспособлений. Блоки реагентов можно наполнять жидкостью путем вливания или вакуумного всасывания. Блоки реагентов можно заполнять по отдельности или в процессе серийного производства.
[00470] В определенных вариантах конструкции отдельный блок реагентов предназначен для хранения реагентов отдельно друг от друга. Блоки реагентов можно также использовать для хранения отмывающего раствора или подложки (субстрата). Кроме того, блоки реагентов могут содержать подложку с люминогеном. В определенных вариантах конструкции блок реагентов может содержать несколько различных реагентов.
[00471] В некоторых случаях устройство прибора позволяет осуществлять предварительную калибровку блоков для анализа и блоков реагентов до установки в прибор сменных одноразовых элементов.
[00472] Анализ связывания аптамеров
[00473] Данное изобретение предусматривает различные методы анализа на основе использования связывающих элементов, которые целенаправленно связывают одно или несколько анализируемых веществ в пробе. В общих чертах, связывающий элемент - это один из членов пары, который может конкретно и избирательно связываться с другим членом пары в среде с множеством разных молекул. В качестве примера связывающего элемента можно привести среди прочего антитела, антигены, металосвязывающие лиганды, зонды и праймеры для нуклеиновой кислоты, описанные в данном тесте рецепторы и реагенты, а также аптамеры. В некоторых вариантах конструкции в качестве связывающего элемента для обнаружения анализируемого вещества используется аптамер. Термин «аптамер» обозначает пептид, нуклеиновую кислоту или их сочетание, выбранные за их способность целенаправленно связывать одно или несколько анализируемых веществ. Пептидные аптамеры - это аффинные вещества, которые, как правило, состоят из одного или более доменов вариабельной петли, обнаруживаемых на поверхности каркасного белка. Аптамер, в основе которого нуклеиновая кислота - это специфический связывающий олигонуклеотид, который способен избирательно образовывать комплексы с нужными целевыми веществами. Это комплексообразование носит целевой характер в том смысле, что другие материалы, например другие вещества, находящиеся в соседстве с анализируемым веществом, не образуют комплекс с аптамером с такой аффинностью. Стоит заметить, что комплексообразование и аффинность - не абсолютные величины, и зависят от степени; однако в данном контексте определение «целевой» значит, что аптамер связывается с целью (мишенью) с гораздо большей степенью аффинности, чем с сопутствующими материалами. Таким образом, в данном контексте понятие «специфичность» значит избирательное воздействие и в этом смысле совпадает с понятием специфичности в применении, например, к антителам. Аптамер может быть подготовлен любым известным способом, включая синтетический, рекомбинантный метод и метод очистки. Кроме того, понятие «аптамер» включает в себя «вторичные аптамеры», которые содержат консенсусную (обобщающую типичную) последовательность, полученную при сравнении двух или более известных аптамеров с данной мишенью.
[00474] В общем, аптамеры на основе нуклеиновой кислоты состоят по длине от 9 до 35 нуклеотидов. В некоторых вариантах конструкции аптамер на основе нуклеиновой кислоты состоит, по меньшей мере, из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 80, 90, 100 или более остатков. Хотя олигонуклеотиды аптамеров, как правило, однонитевые или двухнитевые, наблюдались случаи, когда аптамеры имели трехнитевую или четырехнитевую структуру. В некоторых вариантах аптамер на основе нуклеиновой кислоты имеет кольцевую структуру, как в US 20050176940. Специфические связывающие олигонуклеотиды аптамеров должны содержать последовательность, которая обеспечивает специфичность, однако могут быть расширены за счет ограничивающих областей и других производных или модификаций. Аптамеры, которые способны связываться с веществом-мишенью, могут быть изолированы, секвенсированы и затем повторно синтезированы как стандартные фрагменты ДНК или РНК, или могут быть модифицированными олигомерами. Такие модификации могут среди прочего включать в состав: (1) модифицированные или аналогичные формы Сахаров (напр., рибоза и дезоксирибоза); (2) альтернативные связывающие группы; или (3) аналогичные формы пуриновых и пиримидиновых оснований.
[00475] Аптамеры на основе нуклеиновой кислоты могут содержать ДНК, РНК, функционализированные или модифицированные основания нуклеиновых кислот, аналоги нуклеиновой кислоты, модифицированные или альтернативные основные химические структуры или сочетания нескольких перечисленных элементов. Олигонуклеотиды аптамеров могут содержать стандартные основания аденина, гуанина, цитозина и тимина или уридина. В понятие «аптамеры» входят также синтетические аптамеры, которые содержат аналогичные формы пуринов и пиримидинов. «Аналогичные» формы пуринов и пиримидинов - это формы, общеизвестные среди специалистов, и многие из которых используются в качестве химиотерапевтических веществ. В качестве примеров аналогичных форм пуринов и пиримидинов (т.е. аналогов оснований) можно среди прочего привести азиридинилцитозин, 4-ацетилцитозин, 5-фторурацил, 5-бромурацил, 5-карбоксиметиламинометил-2-тиоуридин, 5-карбоксиметил-аминометилурацил, инозин, N6-изопентениладенин, 1-метиладенин, 1-метилпсевдоурацил, 1-метилгуанин, 1-метилинозин, 2,2-диметилгуанин, 2-метиладенин, 2-метилгуанин, 3-метилцитозин, 5-метилцитозин, Ν6-метиладенин, 7-метилгуанин, 5-метиламинометил-урацил, 5-метоксиаминометил-2-тиоурацил, бета-D-маннозилквеозин, 5-метоксиурацил, 2-метил-тио-N6-изопентиладенин, урацил-5-оксиуксусной кислоты метиловый эфир, псевдоурацил, квеуозин, 2-тиоцитозин, 5-метил-2-тиоурацил, 2-тиоурацил, 4-тиоурацил, 5-метилурацил, урацил-5-оксиуксусная кислота, 5-пентинил-урацил и 2,6-диаминопурин. Использование урацила в качестве заменяющей основы для тиамина в дезоксирибонуклеиновой кислоте (далее в тексте dU) считается «аналогичной» формой пириминида для данного изобретения.
[00476] Олигонуклеодтиды аптамеров могут содержать аналогичные формы сахара рибозы и дезоксирибозы, известные в среде специалистов, включая помимо прочего такие 2'-замещенные сахара, как 2'-O-метил-, 2-О-аллил, 2'-флуоро- или 2'-азидорибоза, карбоциклические аналоги сахара, альфа-аномерные сахара, такие эпимерные сахара, как арабиноза, ксилозы или ликсозы, сахара пиранозы, сахара фуранозы, седогептулезы, закрытые нуклеиновые кислоты (LNA), пептидная нуклеиновая кислота (PNA), ацикличные аналоги и абазические нуклеозидные аналоги, например, метил-рибозид.
[00477] В процесс синтеза аптамеров могут также быть промежуточные продукты. К примеру, любые из присутствующих в обычных условиях гидроксильных групп могут быть заменены фософоновыми группами, фосфатными группами, с защитой стандартной защитной группы или активированные для создания дополнительных связей с дополнительными нуклеотидами или субстратами. 5'-концевой ОН как правило не вступает в реакцию, но может быть фосфорилирован; замещающие группы ОН на 3'-конце могут тоже быть фосфорилированными. Гидроксильные группы могут также быть дериватизированны к стандартным защитным группам. Одна или несколько фосфодиэфирных связей может быть замещена альтернативными связывающими группами. Среди таких альтернативных связывающих групп помимо прочего такие варианты конструкции, в которых группа Р(O)O замещается на P(O)S («тиоат»), P(S)S «дитиоат»), P(O)NR 2 («амидат»), P(O)R, P(O)OR', СО или СН 2 («формацетал»), где каждая группа R или R' независимо является Η или замещенным или незамещенным алкилом (1-20С), в некоторых случаях содержащим эфирную (-О-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралкил.
[00478] В частности один из вариантов аптамеров, который используется в данном изобретении, основан на аптамерах РНК, как это описано в патентах, зарегистрированных в США под номерами 5,270,163 и 5,475,096, которые включены в данный текст настоящим упоминанием. Вышеупомянутые патенты описывают метод SELEX, который заключается в выборе олигонуклеотидов из ряда кандидатов и поэтапные циклы связывания, разделения и амплификации с использованием той же общей схемы отбора для создания практически любого нужного критерия связывающей способности и селективности. Начиная с группы нуклеиновых кислот, в которых желательно содержание сегмента случайных последовательностей, метод SELEX состоит из таких этапов: контакт смеси с мишенью, напр., с целевым веществом, при условиях благоприятных для образования связи, выделение свободных нуклеиновых кислот из нуклеиновых кислот, которые были связанны конкретно с молекулами-мишенями, разделение целевых комплексов с нуклеиновыми кислотами, амплификация нуклеиновых кислот, отделенных от целевых комплексов для получения обогащенной лигандами смеси нуклеиновых кислот, затем повторение стадий связывания, разделения, выделения и амплификации столько раз, сколько необходимо для получения необходимых высокоспецифичных лигандов нуклеиновой кислоты с высокой способностью связывания с молекулой-мишенью. В некоторых вариантах конструкции применяется негативный скрининг, в котором ряд аптамеров обрабатывают анализируемым веществом или другими веществами, которые могут быть обнаружены вместе с веществами-мишенями в анализируемом образце, и сохраняются только те аптамеры, которые не образовали связей.
[00479] Метод SELEX позволяет идентифицировать лиганды нуклеиновой кислоты с высокой степенью сродства, которые содержат модифицированные нуклеотиды, улучшающие такие характеристики лиганда, как стабильность in vivo или характеристики транспортировки. Примерами таких модификаций могут послужить химические замены в положении рибозы и (или) фосфата и (или) основания. В некоторых вариантах конструкции два или более аптамеров соединяются, образуя одну поливалентную молекулу аптамера. Поливалентная молекула аптамера может состоять из множества копий аптамера, каждая из которых будет нацелена на одно и то же вещество, или двух или больше аптамеров нацелены на разные вещества, или сочетание двух этих вариантов.
[00480] Аптамеры можно использовать в качестве диагностических и прогностических реагентов, в качестве реагентов для поиска новых лекарств, как средства контроля за реакцией отдельных пациентов на препарат и как реагенты для поиска новых мишеней для терапевтического воздействия. Аптамеры можно использовать для обнаружения, изменения функций или вмешательства или ингибирования функций одного или нескольких веществ-мишеней. Использованное здесь понятие «анализируемые вещества» (или аналита) включает помимо прочего препараты, пролекарства, фармацевтические вещества, метаболиты лекарств, а также такие биомаркеры, как экспрессированные белки и клеточные маркеры, антитела, плазменные белки, холестерин и другие метаболиты, электролиты, ионы металла, полисахариды, нуклеиновые кислоты, биологические аналиты, биомаркеры, гены, белки, гормоны или любое сочетание перечисленных видов. Аналиты могут быть сочетанием полипептидов, гликопротеинов, полисахаридов, липидов и нуклеиновых кислот. Аптамеры могут ингибировать деятельность продуктов генов про помощи, помимо прочего, следующих механизмов: (i) изменяя аффиность межбелкового взаимодействия; (ii) изменяя экспрессию белка на транскрипционном уровне; (iii) изменяя экспрессию белка на посттранскрипционном уровне; (iv) изменяя активность белка; и (v) изменяя положение белка. Конкретный механизм действия пептидного аптамера можно определить биохимическими и генетическими средствами, чтобы установить конкретную функцию в контексте взаимодействия с другими генами и продуктами генов.
[00481] Аптамеры можно использовать для выявления аналитов любым из описанных способов детекции. В одном из вариантов конструкции аптамеры образуют ковалентную и нековалентную связь с субстратом. В качестве примера субстрата, с которым могут образовывать связь аптамеры, можно помимо прочего привести твердые подложки, микрогранулы, микродозаторы, устройства для переноса образцов, кюветы, капиллярные и другие трубки, реакционные камеры или любые другие подходящие виды подложек, подходящие для системы детекции. В производстве биологических микрочипов используются разные методы изготовления полупроводников, напр., твердофазный синтез, комбинаторная химия, молекулярная биология и робототехника. Один из стандартных процессов в данном случае - метод фотолитографии для производства микрочипов с несколькими миллионами зондов на одном чипе. Другой вариант производства: если зонды не синтезированы предварительно, их можно закрепить на поверхности чипа с помощью такой технологии, как микроканальный транспорт, струйное точечное нанесение, трафаретная печать или фотосшивание. В качестве примере опишем процесс фотолитографии, который начинается с покрытия кварцевой пластины светочувствительным соединением, которое не даст кварцевой пластине вступать в связь с первым созданным нуклеотидом ДНК-зонда. Литографическая маска используется, чтобы предотвращать или пропускать свет на конкретные участки поверхности пластины. Затем поверхность приводится в контакт с раствором, который может содержать аденин, тимин, цитозин или гуанин, и связь происходит только на тех участках стекла, которые остались незащищенными от освещения. На связанные нуклеотиды нанесена светочувствительная защитная группа, что позволяет повторять весь цикл. Таким образом, микрочип создается так: при повторении циклов снятия защиты и образования связей синтезируются зонды. Процесс может повторяться до тех пор, пока зонды не достигнуть полной длины. Коммерческие микрочипы, как правило, создаются с плотностью свыше 1,3 млн. элементов на чипе. В зависимости от требований эксперимента и числа зондов, необходимых на одной чипе, каждую пластину можно разрезать на десятки или сотни отдельных чипов.
[00482] При производстве биочипа возможны и другие методики. Биочип может быть сделан из пленки Ленгмюра-Блоджетта, функционализированного стекла, германия, кремния, политетрафторэтилена, полистирола, арсенида галлия, золота, серебра, искусственной мембраны, нейлона, поливинилпиролидона или любого иного материала, используемого в отрасли и который может образовывать такие функциональные группы, как аминогруппы, карбоксилы, реагенты реакции Дильса-Адлера, тиоловые или гидроксильные группы, внедренные в его поверхность. Затем эти группы могут вступать в ковалентную связь со сшивающими агентами, образующими поперечные связи, и таким образом последующее присоединение лигандов нуклеиновой кислоты и их взаимодействие с молекулами-мишенями будет происходить в растворе, в котором биочип не будет создавать помех. Группы, образующие поперечные связи, - это, как правило, олигомер этиленгликоля, диамины и аминокислоты. Кроме того, аптамеры образовывать связь с чипом с помощью таких ферментных процессов, которые описаны в US 20100240544.
[00483] В некоторых вариантах исполнения аптамеры вступают в связь с поверхностью микрогранулы. В среде специалистов известны такие микрогранулы, используемые для соединения олигонуклеотидов, как магнитные, намагничиваемые и немагнитные гранулы. Микрогранулы могут быть помечены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или большим числом красителей, чтобы облегчить кодирование гранул и идентификацию аптамеров, присоединенных к ним. Кодирование микрогранул можно использовать для распознавания как минимум 10, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000, 5000 или большего числа разных микрогранул на одной плате, и при этом все микрогранулы будут соответствовать разным аптамерам с избирательным взаимодействием с определенным аналитом.
[00484] В некоторых вариантах конструкции реагенты образуют связи с поверхностью реакционной камеры, например насадки. К примеру, внутренняя поверхность насадки может быть покрыта аптамером, который взаимодействует с одним аналитом. В другом варианте внутренняя поверхность насадки может быть покрыта двумя и большим числом разных аптамеров, взаимодействующих с разными аналитами. Когда два или больше разных аптамера вступают в связь с внутренней поверхностью одной и той же насадки, каждый из этих аптамеров можно связать с разными известными участками, так что они будут образовывать четкие кольца или круги в разных местах вдоль оси насадки. В этом случае много различных веществ можно проанализировать в одной пробе, если провести пробу вдоль наконечника, позволяя аналитам, содержащимся в пробе, образовывать связи с аптамерами в покрытии на определенных участках насадки. Затем связи можно визуализировать, как описано в данном тексте, зная, какая из полосок в узоре на поверхности соответствует какому конкретному аналиту.
[00485] В некоторых вариантах конструкции связь одного или более аптамеров с одним или более веществом-мишенью выявляется с помощью оптических методов. В некоторых вариантах конструкции в качестве оптического метода использована флуоресценция. В некоторых вариантах проба, которая содержит подлежащие анализу вещества, обрабатывается метящим соединением, чтобы конъюгировать аналит с флуоресцентной меткой. Затем связь можно измерить с помощью флуоресценции, чтобы определить наличие и при необходимости количество одного или нескольких аналитов, как это показано на Рисунке 136 на примере аптамеров, связанных с чипом, и на Рисунке 137 на примере аптамеров, связанных с кодированными гранулами. В некоторых вариантах образец обрабатывается метящим соединением, чтобы конъюгировать аналиты со связывающими агентами (линкерами). После вступления в связь, линкер активируется флуоресцентной меткой, и наличие искомого вещества распознается с помощью флуоресценции. В некоторых вариантах конструкции домен связывания аналита в аптамере частично гибридизируется с дополнительным зондом, который помечен флуоресцентной меткой. При связывании с аналитом дополнительный зонд высвобождается, что приводит к оптически измеримому уменьшению флуоресцентного сигнала. В некоторых вариантах конструкции аптамер помечен флуоресцентной меткой и частично гибридизирован с дополнительным зондом, помеченным гасителем флуоресценции, который расположен поблизости от флуоресцентной метки. При образовании связи с аналитом дополнительный зонд высвобождается, что приводит в результате к измеримому увеличению флуоресцентного сигнала метки, конъюгированной в аптамере. В некоторых вариантах конструкции аптамер частично гибридизирован с дополнительным зондом, и эта гибридизация поглощает домен, содержащий вторичную структуру. При связывании с аналитом дополнительный зонд высвобождается, и вторичная структура позволяет вставочному красителю создать измеримый сигнал. В качестве примера меток, используемых при обнаружении связи между аптамером и аналитом, можно привести флюоресцеин, тетраметилродамин, техасский красный или любые другие красители на основе флюоресцирующих молекул, известные специалистам в отрасли. Уровень активации обнаруженной метки в каждом месте биочипа будет разным в зависимости от количества вещества-мишени в анализируемой смеси.
[00486] В некоторых вариантах смещенный дополнительный зонд сопрягается с одним из членов связанной пары, например, с биотином. Затем поддающаяся обнаружению молекула сопрягается с другим членом связанной пары, например, с авидином. После нанесения анализируемой смеси на биочип, добавляется сопряженная обнаруживаемая молекула. Количество обнаруживаемых молекул в каждой точке биочипа будет существенно отличаться в зависимости от количества молекул-мишеней, присутствующих в исследуемой смеси. В другом варианте конструкции смещенный дополнительный зонд будет помечен биотином, и его легко можно будет выявить путем добавления авидина с флуоресцентной меткой, тогда сам авидин свяжется с другим соединением, сопряженным с биотином и помеченным флуоресцирующей меткой. Группа биотинов на смещенном олигонуклиотиде может также быть использована для связывания соединенного с авидином фермента-репортера; затем фермент выступит катализатором в реакции выделения обнаруживаемого соединения в виде осадка. Другой вариант: фермент-репортер выступит катализатором реакции выделения нерастворимого вещества, которое локально погасит флуоресцентное свечение флуоресцентного биочипа. В другом варианте анализа с замещением, смещенный дополнительный зонд помечается иммунологически обнаруживаемым зондом, например, дигоксигенином. Затем смещенный дополнительный зонд будет связан первой серией антител, которые способны распознавать данный зонд. Эти первые антитела затем будут распознаны и связаны второй серией антител, помеченный флуоресцентной меткой или сопряженных с ферментом-репортером. Специалистам в данной отрасли известно много разновидностей этого примера, или им теперь придется столкнуться с ними. Также возможно проводить испытания, аналогичные иммуноферментному анализу ELISA типа "двойной сэндвич", используя сочетание антител и аптамеров в качестве рецепторов. К примеру, связывающая поверхность может быть функционализированна аптамером, а в качестве детекторного реагента можно использовать антитело с меткой фермента. Или наоборот, антитело может находиться на связывающей поверхности, а детекторный реагент будет помеченным меткой аптамером.
[00487] В некоторых вариантах исполнения проба, содержащая анализируемое вещество, рассеивается на трехмерную гидрогелевую матрицу. Гидрогелевая матрица при активации улавливает, устанавливая ковалентные связи, белки и малые молекулы. После смывания излишней и несвязанной части пробы, можно ввести аптамеры с флуоресцентными метками для выявления наличия конкретных веществ, как это показано на Рисунке 138. В некоторых вариантах трехмерная гидрогелевая матрица делится на небольшие разделы или микролунки, в которые можно добавить один аптамер для проведения конкретного анализа наличия аналита. В некоторых вариантах аптамеры помечаются набором кодированных квантовых точек или флуоресцентными метками, соответствующими уникальным сигнатурам. В некоторых вариантах аптамеры с метками добавляются в трехмерную матрицу одновременно с пробой.
[00488] В некоторых вариантах вместо антитела в иммуноферментном анализе (ELISA) используется аптамер. Как правило, проба соприкасается с поверхностью и образует с ней специфическую или неспецифическую связь. В иммуноферментном анализе типа «сэндвича» аналит образует специфическую связь с поверхностью, связываясь с первым антителом, которое соединено с поверхностью. В стандартном иммуноферментном анализе аналит, связанный специфическим или неспецифическим образом, затем обнаруживается путем связывания со вторым антителом, помеченным меткой. В иммуноферментном анализе с использованием аптамеров, первое антитело, второе антитело или оба замещаются аптамерами, конкретно реагирующими на анализируемое вещество.
[00489] Анализ изображений проб и продуктов реакции
[00490] В некоторых вариантах конструкции изобретения анализ проб и продуктов реакции можно проводить с помощью съемки цифровых изображений. Кюветы с анализируемым материалом могут быть выставлены так, чтобы их удобно было измерять и сканировать или фотографировать за один проход. В инструментальной системе изобретения это осуществляется автоматически с помощью механических компонентов. Кюветы с анализируемым материалом располагаются в определенных местах в отсеке и движутся при сканировании, сохраняя ориентацию и расположение. Диаграмма, изображенная на Рисунке 92, соответствует реакции канала сигнала зеленого по ширине кюветы. Как видно на рисунке, края кюветы четко очерчены, как и положение, соответствующее середине кюветы.
[00491] При сканировании или фотосъемке получают изображения в виде двухмерного набора пикселей, где каждый из пикселей содержит ряд параметров интенсивности, соответствующих четко выявленным участкам спектра (напр., красный, голубой, зеленый). Изображения могут быть анализированы с помощью линейного сканирования, которое может соответствовать горизонтальной части насадки. Если у насадки круглая форма, то коэффициент эффективного поглощения определяется с помощью деконволюции линейного сканирования на основе соответствующей функции. Примером функций такого рода могут послужить параболические функции и функции окружности. В некоторых вариантах конструкции могут быть получены усредненные данные на основе серии изображений насадки или пробы в разных положениях.
[00492] В одном из вариантов присутствует сенсор, который определяет расположение блока анализируемого материала относительно детектора, когда обнаружен материал.
[00493] Как показано на Рисунке 61 и Рисунке 62, бромфеноловый синий раствор был введен в ряд конических насадок и сфотографирован при фронтальном освещении (источник света и детектор находились с одной стороны от объекта). Использовались малые объемы (5 мкл) серийно разведенного раствора с концентрацией 0,78 мг/мл и самой высокой концентрацией в верхней части изображения. На Рисунке 61, на конических насадках слева проба расположена с самыми широкими промежутками, тогда как с правой стороны проба на насадках с самыми узкими промежутками. Изображение на Рисунке 61 было получено с помощью оптического сканирующего устройства.
[00494] На Рисунке 62 изображены насадки, съемка которых производилась с подсветкой сзади (источник света и детектор расположены с противоположных сторон снимаемого объекта). Съемка с подсветкой сзади более предпочтительна из-за более высокого качества изображения.
[00495] Как видно на Рисунке 61 и Рисунке 62, конкретная длина оптического канала цветного раствора может изменяться при смене формы насадки. В частности длина оптического пути может меняться и при использовании одной насадки с целью повышения чувствительности измерения светопоглощения (длинный оптический путь) или для расширения динамического диапазона измерения. Длину оптического пути можно изменить, изменив, к примеру, диаметр насадки.
[00496] Дополнительно в конструкции насадки может быть предусмотрена возможность анализировать материал на основе очень малого количества продуктов реакции, для которых нужно очень малое количество пробы. Как правило, реакционные смеси для анализа выдерживают в узкой части насадки, что дает высокое соотношение жидкой или воздушной поверхности к объему, снижая, таким образом, количество испарений. Небольшой объем можно затем снова переместить в широкую часть насадки для измерения окрашенного продукта, максимально увеличивая, таким образом, длину оптического пути (и соответственно повышая поглощение света) для данного объема реакционной смеси.
[00497] В качестве примера в нижеприведенной таблице мы сравниваем данные реакционной смеси объемом в 10 мкл, в которой 1 мкл пробы разведен в соотношении 1:10. В насадках данного изобретения анализируемая смесь выдерживается в 13-миллиметровом участке насадки диаметром в 1 мм, а затем перемещается в участок диаметром в 3 мм, где происходит измерение цвета. По сравнению с использованием титрационного микропланшета стандартных размеров (обычно состоящего из 384 лунок) для выдерживания и анализа такого же вещества, область жидкой поверхности вступающей в контакт с воздухом (причина испарения) в 5 раз меньше, а длина оптического канала в два раза больше.

[00498] Оптимизация длины оптического пути
[00499] Спектроскопические измерения окрашенных растворов осуществляются, как правило, посредством записи света, пропущенного через кювету, при максимальном поглощении длины волны. Затем данные преобразовываются для получения значений поглощения (А) или оптической плотности (OD). В соответствии с законом Бугера-Ламберта-Бера, А(λmax)=εМ*1*Концентрация, где εΜ - это продукт молярной экстинкции (L/моль⋅см), l - это длина оптического пути (см), а концентрация выражена в молях. OD=А для 1=1. Эта формула дает нам величину А, которая прямо пропорциональна концентрации раствора.
[00500] Есть два существенных ограничения измерения поглощения света при анализе концентраций раствора. При низких концентрациях, изменение светопропускаемости незначительное и, следовательно, неточное из-за колебаний фонового (или холостого) пропускания. При высоких концентрациях степень пропускания очень низка (например, при А=3, пропускаемый свет равен одной тысячной интенсивности света на входе. Любой посторонний свет или другие формы шума очень существенно влияют на измерения, и ответ на концентрацию становится нелинейным и неточным. Как правило, измерение поглощения света считается точным в диапазоне от 0,1 до 2,0 (20-кратный диапазон).
[00501] Метод, используемый в настоящем изобретении, помогает избавиться от большинства проблем, давая возможность с легкостью измерять цвет в широком динамическом промежутке (почти в 1000 раз):
[00502] 1. При разной длине оптического пути: низкую концентрацию можно измерять с помощью длинного оптического пути, а высокую концентрации можно измерять с помощью короткого оптического пути.
[00503] 2. При разном цвете каналов: низкую концентрацию можно измерять в наиболее подходящем по цвету канале, а высокую концентрацию можно измерять в канале, противоположном по цвету.
[00504] Это показано на Рисунке 79. Растворы бромфенольного синего серийно разведенного с 5 мг/мЛ были проанализированы с использованием трехцветного метода в кончиках в двух местах, один с максимальной длиной пути (также далее "длина пути") приблизительно 5 мм ("широкий"), и другой с длиной пути в 1 мм ("узкий"). Сигналы трехцветных каналов были нормализированы до самых высоких и низких уровней, как показано на диаграмме ниже. Был разработан алгоритм для оптимального экстрагирования концентрации аналита (бромфенольного синего):
[00505] 1. Для нормализованных сигналов в промежутке 10% максимум < сигнал < 90% максимум, расчет концентрации величин = а+b*Log(сигнал)+с*(Log(сигнал))^2 где a b и с независимые постоянные. Такая операция проводилась для каждого цвета для обеих длин оптического пути.
[00506] 2. Используя хорошо известный метод оптимизации (например, "Solver" в Microsoft Excel), необходимо рассчитать наиболее приемлемые величины для a, b и с для всех цветов и длин оптического пути.
[00507] 3. Затем необходимо найти усредненные величины для всех цветов и длин оптического пути.
[00508] Как показано на Рисунке 80, такой метод предоставляет точные результаты в диапазоне концентрации в 1000 раз. При использовании алгоритма для расчета величин концентрации с целью воспроизведения измерений (N=3), средний CV был равен 3.5%.
[00509] Измерения можно делать при разной длине оптического пути. В некоторых случаях, длина волны по крайней мере, частично зависит от геометрии (т.е., кювета, микродозатор, ампула) сосуда. Геометрия сосуда и другие свойства сосуда, например, способность рассеивания могут повлиять на оптический путь и длину оптического пути сосуда.
[00510] Многоцветный анализ
[00511] У сканнеров и видеокамер имеются детекторы, которые в состоянии измерить множество зон детекции разнообразных цветных каналов (т.е., красный, зеленый и голубой). Потому что все эти каналы имеют широкие спектры и химия красителей приводит к появлению цветных продуктов с широким диапазоном ширины, цветные продукты реакции можно обнаружить с помощью множества спектров детекции каналов. Например, Рисунок 71 показывает реакцию спектров детекции красных (квадраты), зеленых (ромбы) и голубых (треугольники) каналов как функцию концентрации аналита. Сигнал, который образует каждый из детекторов, соответствует интенсивности света в каждом из спектров, и, как правило, выражается в виде числа от 0 до 255. Когда белый свет проходит через квадратную часть кюветы, содержащей цветной раствор как показано выше, свет впитывается и интенсивность света уменьшается таким образом, что реакции детектора меняются.
[00512] Например, когда бромфенольный синий, растворенный в щелочном буферном растворе при концентрации в диапазоне от 0 до 5 мг/мл, сканируется в месте, обозначенном «С3» на Рисунке 62, сигналы, показанные на Рисунке 66, которые являются реакцией детектора, были распределены в участке, соответствующем семи пикселям по всей длине кюветы. Сигналы регистрировались сканером фирмы Epson с задним освещением. Рисунок 66 показывает три цветовые реакции на группу из 11 кюветок, содержащих 2-кратно серийно разбавленный раствор 5 мг/мЛ бромфенольного синего и "контрольного" раствора (расположенные слева направо на снимке). Изображение сосканированных кончиков показано на Рисунке 67. Сигнал каждого канала, соответствующий раствору, уменьшается настолько, чтобы соответствовать оптическому пути. Соответственно, максимальное изменение сигнала можно увидеть в центре кюветки. Когда были усреднены сигналы в центральной части кюветки (зона помечена маленькими прямоугольниками для четвертой кюветки слева) и отмечены на фоне концентрации бромфенольного синего, была зарегистрирована следующая реакция, как показано на Рисунке 68. В каждом из цветовых "каналов" сигнал уменьшается равномерно в соответствии с концентрацией. Зеленый сигнал изменяется больше всего, а голубой меньше всего. Соответствующие оптические плотности, измеренные с помощью М5 спектрометра (молекулярные приборы) при длине волны максимального впитывания (т.е.., 589 нм) тоже показаны. При максимальных концентрациях реакция спектрофотометра перестает быть прямой и меняется очень мало с концентрацией. Похожий эффект был замечен в реакциях зеленых и красных каналов сканирующего прибора. Реакция голубого канала очень незначительна пока не достигается максимальная концентрация.
[00513] По закону Беера, впитывание раствора равняется εМ*концетрация*длина оптического пути. Впитываемость определяется как Log10 (пропускание/контрольное пропускание), где контрольное пропускание соответствует пропусканию растворителя. Закон Беера касается параллельного луча монохроматического света (в действительности ширина полосы в несколько нм), который проходит нормальным путем через прямоугольную кюветку. Спектрофотометры реагируют линейно на величину концентрации, до тех пор, пока величина поглощения не равняется приблизительно 1,5. При более высокой величине поглощения реакция инструмента перестает быть линейной в связи с "рассеянным светом" и другими эффектами. Оптической плотностью считается поглощение на одном см оптического пути.
[00514] Когда информация о цветном сигнале, полученном в вышеуказанном эксперименте, была преобразована в соответствии с уравнением, которое линеаризирует оптическую трансмиссию, чтобы получить величину поглощения, пропорциональную концентрации в нормальной спектрофотометрии (-лог(сигнал/контрольный сигнал), диаграмма, показанная на Рисунке 69 была получена для зеленых (квадратов) и красных (ромбов) каналов.
[00515] Данные зеленого канала соответствуют закону Бера, но данные красного канала не подтверждают уровень плато для 2 мг/мЛ образца, подобно реакции OD спектрофотометра.
[00516] Улучшенная утилизация анализа благодаря трехцветному анализу и оптимизации длины оптической волны.
[00517] Результаты анализа, полученные в результате реакции, которые не поддавались интерпретации, можно спасти, благодаря настоящему изобретению. Настоящее изобретение дает возможность увеличить динамический диапазон и чувствительность анализов, благодаря комбинации оптимизации длины оптического пути и трехцветному анализу. Основной проблемой при контроле анализов является неспособность спасти данные, что вызвано уменьшением динамического диапазона, особенно в контексте проб, которые оцениваются для диагностики и контроля лечения, потому что у анализов ограничен динамический диапазон или ограничен диапазон величин аналита, которые можно охарактеризовать с уверенностью. Существуют две главные причины, по которым лабораторные системы анализа и тесты, проводимые на месте, не в состоянии предоставить результаты анализа. Прежде всего - величина аналита слишком большая или слишком маленькая для того, чтобы охарактеризовать. В некоторых случаях, это возможно поправить в лабораторных условиях путем выполнения повторного анализа полученной пробы с помощью иного разведения. При проведении теста на месте, как правило, нет другого выхода, кроме того, чтобы вновь связаться с пациентом, получить новую пробу и использовать иной (лабораторный) метод. Потому что системы анализа работают по определенному фиксированному протоколу и используют определенный фиксированный уровень разведения пробы. В любой из ситуации исправление ситуации требует затрат и вызывает неудобства. Кроме этого, может быть утеряна важная информация о правильном диагнозе и контроле лечения, что может навредить пациенту.
[00518] Система настоящего изобретения помогает избавиться от таких проблем, благодаря мониторингу анализов во время их проведения, распознавая любые проблемы и изменяя любую длину оптического пути, используемого для измерения продуктов анализа либо используя разные уровни чувствительности трехцветных каналов для анализа цвета и для анализа чувствительности.
[00519] В частности, когда измеряются продукты реакции анализа, и если измеренный сигнал либо слизком большой, либо слишком маленький, система может отреагировать:
[00520] 1. Получением измерений другой длины пути (перенос оптической кюветы по отношению к оптической системе таким образом, чтобы длина пути стала больше или меньше). Это можно выполнить благодаря (а) снятия измерений в стандартном, первоначальном местоположении, (b) пересылке результатов в программное средство, контролирующее анализ (в инструменте и (или) на отдаленной сервере), (с) распознаванию состояния проблемы и (d) модификации положения считывания результатов и снятию повторных измерений и (или)
[00521] 2. Акцентируя внимание на более или менее чувствительном цветовом канале в анализе сигналов. Это можно выполнить автоматически, благодаря соответствующим алгоритмам анализа.
[00522] Калибровка цвета
[00523] Реакцию сигналов можно откалибрировать для того, чтобы дать возможность рассчитать концентрацию цветных групп, полученных изображением. Для получения данных, которые бы предоставили предполагаемую концентрацию цветного раствора, можно использовать следующую процедуру. В других вариантах можно использовать другие методы.
[00524] 1. Для всех концентраций каждого канала трансформация - Log(signal/blank signal) была рассчитана и названа "А".
[00525] 2. Для всех концентраций, дальнейшая трансформация ("С") была рассчитана как а*А+b*А^2+с*А^3 (первоначально величины a, b и с были свободными величинами arbitrary values).
[00526] 3. Для всех концентраций величины С для трехцветных каналов были суммированы и получили название Cestimate.
[00527] 4. Сумма квадрата разницы между заданной (известной) концентрацией и Cestimate была рассчитана для всех концентраций.
[00528] 5. Величины параметров a, b и с для всех каналов были получены с помощью хорошо известного алгоритма, который минимизирует сумму квадрата разницы.
[00529] Результаты, показанные на Рисунке 70, демонстрируют точную калибровку реакции сканирующего устройства на всем концентрационном промежутке.
[00530] Были разработаны и другие алгоритмы автоматической калибровки, которые также считаются эффективными. Например, ниже приводится пример калибровки для анализа холестерина, проводимого в реакционном микродозаторе.
[00531] Измеренный сигнал разбивается на Красный (R), Зеленый (G) и Голубой (В) цветовые сигналы. Выводятся уравнения калибровки для оптимизации точности, аккуратности динамического диапазона в соответствии с требованиями формата анализа. В примере, взятом из настоящего анализа, используются только Красные и Зеленые каналы для вычисления концентрации. Эти два сигнала преобразовываться для расчетов промежуточной переменной (F) следующим образом:
[00532] F=р1+p2⋅G+р3⋅G2+р4⋅R+р5⋅R2,
[00533] где pi является параметром калибровки.
[00534] И последнее, сигнал F используется для расчетов концентрации (С) с помощью линейной транформации:
[00535] ,
[00536] где С - рассчитанная концентрация, а р6 и р7 - параметры калибровки, в нашем случае, представляющие собой параметры отрезка между двумя точками и наклона в линейной зависимости, соответственно.
[00537] Когда такой же подход использовался для большого набора анализов для разнообразных аналитов, которые привели к образования цветных продуктов, распределенных по всему спектру видимого излучения (Хмакс от 400-700 нм), были получены похожие результаты.
[00538] При пересылке обычных спектрофотометрических измерений, для нормализации измерения используется "контрольная величина." Метод (1) контрольные величины как правило, получаются измерением пробы, равносильного пробе, но не содержащего измеряемых компонентов. Измерения, как правило, делаются в той же кювете, которая используется для пробы или оптически равносильной кюветы. Таким образом, в спектрофотометрическом анализе все реагенты смешиваются в одинаковых концентрациях, используя один и тот же протокол, заменяя раствор с нулевым аналитом на пробу. Метод (2) использует двухэтапный процесс снятия измерений с помощью абсолютного эталона, например, воздуха (который никогда не меняется с точки зрения впитываемости) и сравнивая измерения пробу и контрольный раствор с абсолютным эталоном. Поглощаемость пробы затем рассчитывается вычитанием контрольной величины из величин пробы. Метод (3) заключается в измерении спектральной функции диапазона продуктов реакции анализа или пробы и сравнивает измеренную поглощаемость (или пересылку) на оптимальной длине волны (как правило, максимальная поглощаемость измеренных продуктов) с поглощаемостью при длине волны, при которой поглощаемость измеряемые продукты равна нулю. Поглощаемость представляет собой разницу между величинами, зарегистрированными при разной длине волны.
[00539] Можно использовать дигитальное изображение и трехцветных анализ, но в некоторых вариантах такие результаты можно менять в соответствии с дигитальными характеристиками сигнала анализа. А именно:
[00541] Для каждого пикселя и для каждого цвета сохраняется изображение белого эталона и интенсивность сигнала регулируется в соответствии с величиной, соответствующей отсутствию поглощения. Это можно сделать в соответствии со следующими процедурами, которые приводятся в качестве примера:
[00542] а. Регулировка интенсивности источника света,
[00543] b. Регулировка чувствительности детектора (предпочтительно), или
[00544] с. Регулировка программного средства (предпочтительно в комбинации).
[00545] Предпочтительно использовать комбинацию (b) и (с), указанную выше. Прежде всего, отрегулируйте детектор для работы в аналоговом режиме и затем более точно отрегулируйте результаты в дигитальном режиме.
[00546] Для регулировки аналогового режима увеличение и смещение усилителей между сенсорами света и зоной перехода аналогового на дигитальный регулируется для максимальной дигитализации. Нижний предел интересующего нас диапазона света нужно установить на ноль и верхний предел диапазона приравнять к величине, меньше уровня насыщаемости сенсора.
Соответственно изображения можно точнее отрегулировать в дигитальном режиме. В предпочитаемом подходе, в частности, можно использовать так называемую "двухобразную калибровку" для изображения m×n. Механизм заключается в получении черного изображения путем блокировки поступления света к детектору. Мы назовем такое изображение BLACK[m, n].
Регистрируется второе изображение калибровки, состоящее из света, полученного из максимального конца диапазона чувствительности. Мы назовем такое изображение WHITE[m, n].
Таким образом, можно создать откорректированное изображение [m, n] в пикселях:
[00548] .
[00549] Примечание: такая цифровая коррекция не изменяет динамического диапазона отцифрованных данных, но регулирует величины таким образом, чтобы черно-белые ссылки соответствовали друг другу.
[00550] 2. Изображение физического контрольного раствора в микродозаторе можно использовать в качестве контрольного пиксельного и цветного раствора. Контрольным раствором может быть:
[00551] а. Воздух;
[00552] b. Вода;
[00553] с. Контрольный продукт реакции анализа (без аналита);
[00554] d. Образец контрольного продукта (без реагентов анализа); или
[00555] е. Определенные комбинации вышеназванного.
[00556] 3. Сигнал из цветного канала со слабой или нулевой реакцией можно использовать для нормализации сигналов из других каналов.
[00557] Дополнительным методом контроля и нормализации оптических систем является получение изображения набора физических (стабильных) стандартов до или во время анализа. Например, множество печатных красителей (как показано на Рисунке 104) можно подготовить в соответствии с набором стандартных красок со стандартной интенсивностью подобно (подобно стандартной шкале для выбора цветов для калибровки видеокамер и сканирующих устройств).
[00558] Такие стандарты можно измерять с помощью отражения от непрозрачной поверхности или (предпочтительно) трансмиссией через прозрачную пленку.
[00559] В зависимости от стабильности оптических систем, калибровка и нормализация оптических систем может быть (1) одноразовым упражнением, (2) выполняемом на определенных интервалах или (3) выполняемых для каждого анализа.
[00560] Калибрование диапазона устройства дигитального изображения
[00561] В некоторых вариантах можно найти методы калибровки дигитального устройства отображения, используемого для получения изображения оптической плотности.
[00562] При тестировании оптической плотности аналита желательно использовать максимальную область диапазона устройства отображения. При нормальных условиях настройка может сказаться негативно на сравнительно однородном освещенный белом фоне, на устройстве получения изображения и аналите, который будет тестироваться в прозрачной кюветке между ними. В процессе работы на тесте может сказаться негативно кювета между устройством для получения изображения и источником фонового белого освещения и измерить количество света, поглощенного аналитом в кювете. Для максимизации полного динамического диапазона сенсора фона можно определить как максимально измеряемую интенсивность. Рекомендуется позаботиться о том, чтобы сенсор не пропитывался, потому что информация может быть утеряна, потому что пропитанный сенсор не всегда правильно регистрирует аттенюацию. Систему можно сконфигурировать таким образом, чтобы эффективно измерять величины максимально приемлемым путем фонового освещения и в то же время, минимизируя количество пропитанных пикселей.
[00563] Освещенный фон может излучать белый свет одинаковой интенсивности на всей поверхности. Выходящий свет может в некоторой степени варьироваться, создавая нормальную дистрибуцию интенсивностей пикселей, как обнаружено прибором отображения. Это иллюстрируют кривые на рисунке 128. Для этого примера сенсор может выдать величину от 0 до 256 для каждого пикселя, указывая на количество полученного света. Каждый пиксель может пропитываться при величине в 256. То есть, независимо от дальнейшего увеличения интенсивности света, регистрируется только величина 256. Серия 1 на рисунке 128, выраженная пунктирной линией, показывает, где свет слишком интенсивный, отсекая нормальную кривую. Серия 3, выраженная пунктирной линией, показывает, что все пиксели правильно отражают интенсивность, но чувствительность отражающего устройства ниже, чем должно быть в максимально динамическом промежутке. Величина большей части пикселей ниже. Серия 2 представляет собой желаемые параметры, где среднее значение дистрибуции максимально высокое, но в то же время достаточно маленькое количество пикселей пропитываются.
[00564] В одном варианте интенсивность фона может оставаться постоянной, в то время как параметры работы отображающего устройства можно регулировать. С целью контроля чувствительности отражающего устройства можно использовать два пульта управления: продолжительность воздействия и усиление. Продолжительность воздействия - это количество времени на протяжении которого пиксели сенсора собирают фотоны, прежде чем величина считывается. Для определенного количества света получаемая величина будет больше, если продолжительность воздействия дольше. Такая контрольная величина может служить "грубой" контрольной величиной для приложения. Усиление - это когда система контроля регулирует количество амплификации, прилагаемой к сигналу сенсора. Усиление амплитуд может увеличить величину сигнала, получаемого от сенсора. Усиление амплитуд может служить «точной» системой контроля.
[00565] Примером настройки параметров чувствительности отображающего устройства может быть один или несколько следующих этапов:
1. Время продолжительности воздействия приравнивается к величине ниже уровня насыщения. В качестве величины усиления амплитуд указывается максимально возможная величина.
2. Используя бинарный поиск по нарастанию необходимо отрегулировать время продолжительности воздействия, чтобы найти параметры, при которых не все пиксели интересующей нас зоны насыщены. Это можно обнаружить, дождавшись, пока средняя величина пикселя не стала меньше 256.
3. Постепенно регулируются величины усиления амплитуд, до тех пор, пока достаточное количество пикселей не достигает уровня насыщения. Количество пикселей на приемлемом уровне будет определено формой распределения. Широкое стандартное отклонение увеличит количество пикселей, которые могут быть насыщенными.
[00566] Дальше можно откорректировать баланс белого. В цифровом устройстве отображения есть три группы датчиков. Члены каждой из групп собирают свет на разной длине волны - красной, зеленой или голубой. При измерении белого света предпочтительно, чтобы датчики воспринимали одинаковые величины красного, зеленого и голубого каналов. Контрольная система баланса белого канала регулирует относительное увеличение амплитуд красного и голубого каналов. Потому что свет, который поступает сзади, считается белым, процедура будет заключаться в простой регулировке баланса белого до тех пор, пока на всех каналах не будут одинаковые величины. Как правило, зеленый канал не регулируют, а красный и голубой каналы меняются в противоположном направлении при изменении контрольных величин. Но в одном варианте другой канал, например красный или голубой канал, можно не регулировать, в то время как два другие канала меняются.
[00567] В заключение, изображения можно окончательно отрегулировать в дигитальном режиме. Предпочитаемым подходом, в частности, будет использование так называемой "двухобразной калибровки" для изображения m×n.
[00568] Настоящее изобретение использовалось для анализа различных окрашенных продуктов. Успешно измерялись цвета, начиная от максимального поглощения низкой длины волны (желтый) до максимально высокой длины (голубой). Максимальные значения длины волны для некоторых анализов таковы: 405, 450, 500, 510, 540, 570, 612 и 620 нм, что подтверждает способность считывать показатели цвета на всем спектре видимого излучения.
[00569] Цвета можно выразить количественно, усредняя данные о большом количестве пикселей (как правило, около 1000). Можно будет выбрать параметр (f), который лучше всего подходит (напр., максимальная R2) для информации о реакции на дозу. Сначала параметр можно подставить в формулу a1+b1*R+c1*R2+b2*G+c2*G2+b3*B+c2*B2, где а, b, с - постоянные величины, a R, G и В - величины интенсивности цвета красных, зеленых и голубых каналов. Затем можно получить параметр f, придав ему максимальную величину 1 и минимальную величину 0. Параметр f связан со светопропусканием через цветной продукт реакции. Как предполагается, f может быть связан с параметром оптической плотности (OD), используемой в спектрофотомерии для квантификации впитывающих продуктов. Когда 1 - f, измеренные 3-цветным отображением, вносятся в график вместе с параметром оптической плотности OD, измеренным при максимальном впитывании, для одинаковых продуктов реакции в микротитрационном планшете спектрофотометра можно заметить, что существует линейная зависимость между 1 - f и OD. На рисунке 129 представлены такие данные для пяти анализов. OD можно нормализовать как "относительное OD" = (OD - OD мин)/(ODмакс - OD мин). В некоторых случаях зависимость нелинейная, но коэффициент корреляции (R) как правило >0.99.
[00570] Параметр f можно использовать для калибровки анализов, измеренных с помощью 3-цветного изображения. При сопоставлении на графике с концентрацией аналита, можно показать ровную взаимосвязь калибровки при анализе холестерина, как показано на рисунке 130. Уравнение формы концентрации = а+b*f+c*f (где a, b и с - постоянные) связывает концентрацию с f, получено и приводиться на рисунке 130, рассчитанная концентрация, как правило, равна "номинальной" (предполагаемой, желаемой) величине (регрессия наклона близка к 1.0, отрезок между двумя точками близок к 0.0 и R2=0.998. Также на рисунке 130 показаны графики точности и аккуратности анализа. Точность близка к 100% (средняя величина - 100.2%) а неточность (представлена CV %) - низкая (меньше 10%, средняя величина CV - 3.9%).
[00571] Синхронное отображение анализов
[00572] Как показано на Рисунке 56, Рисунке 57, Рисунке 58, Рисунке 59, и Рисунке 60, можно получать параллельное изображение нескольких элементов анализа. Как правило, такие элементы можно поместить в хорошо знакомые места в блоки или в закрепленный на сабсистеме инструмент, таким образом, чтобы определенный элемент был взаимосвязан с определенным анализом. Даже если элементы не отличаются идеальной ориентацией, можно использовать анализ изображения для корректировки любых перебоев с помощью функций определенных элементов анализа.
[00573] Использовались серийно производимые анализы для альбумина (Рисунок 56) и холестерина (Рисунок 57) в соответствии с инструкциями завода-изготовителя. Была получена серия аналитов с определенной концентрацией в диапазоне, представляющем клинический интерес, используя серию калибраторов, в которых концентрация аналита была в два раза ниже максимальной концентрации. На Рисунке 56 и на Рисунке 57, концентрация аналита максимальная справа, а крайний левый микродозатор соответствует нулевому аналиту. Объем смеси реакции для анализа, аспирированного в микродозатор равен 20 мкм.
[00574] На Рисунках 58, 59 и 60 показано как можно получать параллельное изображение лунок и получено изображение продуктов реакции. Как указано выше углубления справа отличаются максимальной концентрацией аналитов и каждая смежная лунка имеет концентрацию в два раза ниже, за исключением левой крайней лунки с нулевой концентрацией аналита. В каждую из лунок поместили по семь мкл продукта реакции анализа.
[00575] Можно также получать изображение продуктов после промакивания продуктов реакции на пористые мембраны или бумагу и получением изображения после впитывания жидкости в поверхность. Можно также использовать разнообразие химических элементов для анализа, которыми пропитывают бумагу или мембраны и получить изображение полученных продуктов реакции после добавления пробы.
[00576] Анализ мутности
[00577] Нефелометрия выполняется измерением снижения интенсивности проходящего света после того, как он проходит через измеряемую пробу. Такой подход используется тогда, когда в результате анализа выпадает диспергированный осадок, который увеличивает мутность жидкости.
[00578] Нефелометрия можно измерять в латексных анализах агглютинации. В качестве модели реакций анализа латексной агглютинации частицы полистирольного латекса (диаметром 1 мкм) были введены в буферный раствор в определенной (w/v) концентрации, которые подверглись 3-цветному анализу изображения. Как видно на Рисунке 72, все три канала показали хорошую реакцию, которую можно использовать для измерения концентрации латексных частиц и латексной агглютинации.
[00579] Анализ агглютинации
[00580] Подобно анализу мутности, эту систему можно использовать для измерения агглютинации, гемагглютинации и ингибирования.
[00581] Эту систему можно использовать для определения группы крови посредством агглютинации эритроцитов. Кровь разводили и смешивали с реагентами для определения группы крови (анти-А, анти-В, анти-D), полученными из серийно производимого набора для определения группы крови. Как показано ниже для группы крови В+, соответствующую реакцию агглютинации можно легко увидеть во время получения изображения смесей. Кроме этого, когда изображения, показанные на Рисунке 77 были сосканнированы вместе с вертикальной осью микродозаторов, можно получить количественную величину агглютинации путем измерения изменений трехцветных сигналов как показано на Рисунке 78. Значительные изменения означают агглютинацию и могут обнаруживаться в каждом из цветовых каналов. Ясно, что этот метод можно использовать для измерения степени реакций агглютинации.
[00582] Распознавание формы
[00583] Изображения можно анализировать с точки зрения распознавания формы. Распознавание формы можно выполнять при нормальном увеличении и при очень большом увеличении. При большом увеличении можно использовать анализ изображения для распознавания размера аи формы клеток. Эти подходы очень часто используются при подсчете клеток для определения относительных концентраций эритроцитов, лейкоцитов и тромбоцитов. При нормальном увеличении распознавание формы используется для определения состояния пробы. Пузырьки и другие методы распознавания дефектов используются для гарантии того, что количество измеренной жидкости аспирируется и распределяется правильно.
[00584] Анализ проб на субстратах твердой фазы
[00585] Дигитальное изображение с фронтальным освещением можно также использовать для получения реакций анализа на субстратах с твердой поверхностью, как показано на Рисунке 76. Растворы хлорида калия (0, 2, 4 и 8 мМ) нанесли ан полоски для анализа калия ReflotronTM (Boehringer-Mannheim/Roche), разработанные для использования в системе анализа на отражательную способность.
[00586] Анализ качества пробы
[00587] Свойства определенных проб могут сделать результат анализа недействительными. Например, гемолиз приводит к тому, что ионы калия вытекают из кровяных телец в плазму, приводя к тому, что измеренные концентрации ионов калия в плазме или в сыворотке оказываются ложно высокими. Подобным образом, иктерия и липемия могут повлиять на цветообразующий химический состав, меняя измеренные коэффициенты поглощения. В настоящем изобретении можно обнаружить и квантифицировать такие мешающие вещества с помощью анализа изображений. Таким образом, анализы, приводящие к ошибочным результатам можно либо (1) удалить из списка результатов, полученных из аналитической системы либо (2) откорректировать оптические сигналы для учета измеренного уровня мешающих компонентов. Изображение с различными типами проб сыворотки показано на Рисунке 99 (слева направо: Гемолизированный, липемический, иктерический (желтый) и "нормальный").
[00588] Анализ цифровой информации
[005789] Традиционные методы сбора и калибровки информации в методах анализа, которые генерируют и меняют цвет, как правило, измеряют аналоговый сигнал, представляющий собой изменения свойств впитывания анализируемой смеси, генерируемой путем смешивания пробы с реагентом. Некоторые участки реакционной смеси освещаются и свет, пропускаемый через или отражаемый от такого участка, натыкается на детектор и оценивается как аналоговый сигнал. Качество анализа, определяемое объемом и качеством пробы, обработка пробы, соединение анализируемых элементов в анализируемое вещество и физический элемент, используемый для ввода смеси в оптическую систему полагаются на предполагаемое качество используемой физической системы.
[00591] В настоящем изобретении мы можем получить изображение (1) пробы, (2) процессов обработки пробы и (3) анализируемой смеси и получить информацию в виде одного или нескольких изображений. Каждый пиксель изображения анализируемой смеси является маленькой частью целого, но, получая средний результат 3-цветных сигналов от большого количества пикселей, мы получаем сигнал пикселя такого же качества, как и сигнал, полученный с использованием традиционных аналоговых методов. Но, там где традиционные методы теряют информацию в связи с усреднением, настоящее изобретение дает возможность накапливать информацию и хранить детали, не сохраняемые при использовании традиционных методов. В таком контексте, анализы, основанные на цвете, включают анализ: метаболитов, электролитов, ферментов, биомаркеров (используя иммуноанализ), препараты (используя иммуноанализ) и заданные параметры иммуноанализа (используя технологию "LAMP"). Те же принципы можно использовать при проведении анализов с флюоресценцией и люминесценцией.
[00591] Подтверждение и коррекция объема
[00592] Объем пробы или любого другого жидкого или твердого материала можно определить оптически. Это можно выполнить, получив изображение контейнера с измеренными внутренними размерами и рассчитав математически объем пробы на основе заполненной части сосуда. Пространственные измерения используются главным образом для измерения твердых растворов, которые были обезвожены. Наиболее распространенные случаи включают получение объема центрифугированных эритроцитов для определения уровня гематокрита. На примерах 6-11 и 16 описывается использование анализа на основе отображения для расчета объемов проб и снятия других измерений. Это позволяет улучшить результаты проводимых анализов. Например, если необходимо использовать объем в 10 мкм, а в соответствии с технологией изобретения было рассчитано, что в действительности объем - 8 мкм, система для проведения анализа в состоянии откорректировать результаты в соответствии с объемом (в нашем примере концентрация аналитов, рассчитанная в соответствии с пробой 10 мкм, будет умножаться на 10/8).
[00593] Действительные объемы проб и реагентов можно получить путем получения изображения проб и реагентов и можно использовать для корректировки расчетов, используемых для обнаружения, квантификации аналитов в пробе.
[00594] Как было показано на вышеуказанных примерах, использование получения изображения дает возможность делать оценку проб и анализируемых смесей с точки зрения качества и реакции. Кроме этого, получение изображения ‘микродозаторов”, используемых в качестве сосудов реакции и методы получения проб дают возможность (1) получать точные и аккуратные измерения объемов пробы и реагента и (2)использовать такую информацию для коррекции любых неточностей и отклонений в результате анализов по причине ошибок при расчете объема. Для того чтобы добиться этого, микродозаторы могут иметь точно и аккуратно рассчитанные геометрические формы (как в случае микродозаторов, изготовленных с помощью литьевого прессования). Повторные измерения микродозаторов с помощью получения изображения показали, что точность измерений равняется приблизительно 1%. Таким образом, возможно измерить объем жидких проб и реагентов в таких микродозаторах с соответствующей точностью. Если микродозирование проб и реагентов является менее аккуратным и точным, возможна коррекция результатов на основе действительных объемов (с помощью фотографических измерений).
[00595] Возьмите, к примеру, анализ, в котором реакция прямо пропорциональна концентрации аналита (что соответствует действительности во многих описанных в настоящем документе анализов). Ошибка в измерении объема пробы в 10% приведет к появлению ошибки в 10% величины, предоставленной аналитической системой. Если, например, измерить правильно объем неправильно дозированной пробы (например до 2% от действительной величины), реакцию системы можно откорректировать с целью снижения ошибки от 10% до 2%. Соответствующие коррекции можно сделать для ошибок объема реагентов. Алгоритм коррекции будет зависеть от реакции анализируемой системы на объем или знание каждого компонента анализа (проба, реагент), но такую информацию легко получить на этапах разработки и валидации анализа.
[00596] Таким образом, изобретение отличается разнообразными преимуществами по сравнению с традиционными методами. На этапе генерации "сигнала анализа", настоящее изобретение в состоянии обнаруживать физические дефекты кюветы анализа и дефекты в анализируемой смеси (пузырьки и тому подобное). После того, как эти дефекты были обнаружены (анализ изображения) результаты анализа можно отклонить для того, чтобы не было неправильных результатов или (предпочитается) можно избавиться от эффекта дефекта и рассчитать правильный сигнал анализа.
[00597] В процессе смешивания анализа, можно обнаружить все и любые дефекты, включая: неправильный тип пробы (т.е. кровь или плазма), неправильный объем пробы, неправильное отделение плазмы от сформированных элементов (эритроциты и лейкоциты), факторы пробы, которые могут скомпрометировать качество результатов анализа (т.е., липемия, иктерия, гемолиз, присутствие осадка или другие неопределенные несоответствия), дефекты при формировании анализируемой смеси (т.е., присутствие пузырьков, неправильное смешивание (неоднородность цвета)), механизмы оценки ретроспективного качества и сохранение подробной архивной информации, механизм измерения объема пробы и реагента (и корректировки неточностей и (или) несоответствий в таких объемах).
[00598] Опенка терапевтических агентов
[00599] В отдельном варианте приборы и методы мониторинга более одного фармакологического параметра, приемлемого для оценки эффективности и (или) терапевтического агента предлагаются. Например, терапевтический агент может включать любые вещества, которые имеют терапевтические свойства и (или) определенный потенциал. Такие вещества включают, но не ограничиваются биологическими и химическими соединениями, например, простые или сложные органические или неорганические молекулы, пептиды, белки (т.е. антитела) или полинуклеотиды (т.е. антисенс). Большое количество соединений можно синтезировать, например, полимеры, такие как полипептиды и полинуклеотиды и синтезированные органические соединения, на основе опорных структур, которые также могут быть включены в качестве терапевтических агентов. Кроме этого, разнообразные естественные источники могут предоставить соединения для скрининга, например растительные настойки или настойки животного происхождения и тому подобное. Необходимо понять, что не всегда ясно указывается, используется ли агент один или в комбинации с другим агентом, которому характерна похожая или отличающаяся биологическая активность как и агенту, идентифицированному с помощью разработанного скрининга. Предполагается, что такие агенты и методы будут пользоваться в комбинации с другими терапиями. Например, маленькие молекулы лекарственных препаратов зачастую измеряются с помощью масс-спектроскопии, результаты которой не всегда точны. Анализы ELISA (на основе антител) предоставляют более точные и аккуратные результаты.
[00600] В соответствии с настоящим изобретением, физиологические параметры включают без ограничений, такие параметры как температура, сердечный ритм/пульс, кровяное давление и дыхательный ритм. Фармакологические параметры включают концентрации биомаркеров, таких как белки, нуклеиновые кислоты и клеточные маркеры. Биомаркеры могут указывать на заболевание или могут появиться в результате действия препарата. Фармакокинетические (PK) параметры, в соответствии с настоящим изобретением, включают без ограничений препараты и метаболическую концентрацию препаратов. Идентификация и квантификация PK параметров в реальном времени из объема пробы считается наиболее приемлемой с точки зрения безопасности и эффективности препаратов. Если препарат и метаболические концентрации находятся за пределами желаемого промежутка и (или) в результате неожиданной реакции на препарат формируются непредвиденные метаболиты, возможно, будет необходимо предпринять срочные меры для гарантии безопасности пациента. Подобным образом, если какие-то из фармакодинамических (PD) параметров оказываются за пределами желаемого промежутка в процессе лечения, возможно, будет необходимо предпринять срочные меры.
[00601] Способность выполнять мониторинг скорости изменения концентрации аналита или PD или РК параметров на протяжении периода времени у одного субъекта или выполнение анализа тренда концентрации, PD, или РК параметров, независимо от того, являются ли они концентрациями препаратов или метаболитов, может предотвратить появление серьезных ситуаций. Например, если глюкоза выступает в роли интересующего нас аналита, концентрация глюкозы в пробе в определенный период времени, а также скорость измерения концентрации глюкозы в определенный период времени могут быть полезными при прогнозировании или предотвращении гипогликемических ситуаций. Такой анализ тренда характеризуется широкомасштабными полезными последствиями в разработке доз препаратов. При анализе разнообразных препаратов и их метаболитов считается, что способность распознать определенный тренд и предпринять соответствующие меры является желаемой характеристикой.
[00602] В некоторых вариантах настоящее изобретение представляет собой бизнес метод, используемый клиницистом при предоставлении индивидуального медицинского лечения. Бизнес метод может включать мониторинг лекарственной терапии после принятия препаратов по рецепту путем мониторинга трендов биомаркеров на протяжении периода времени. Такой бизнес метод может включать получение, по крайней мере, одного фармакологического параметра лица, получаемого лекарственный препарат, такое получение включает смешивание биологической жидкости и веществ, участвующих в реакции, содержащихся в приборе с жидкостью, который предоставляется вышеуказанному лицу для получения определенного сигнала, указывающего на присутствие, по крайней мере, одного фармакологического параметра, и поиск с помощью компьютера в медицинской карте вышеуказанного лица, по крайней мере, одного фармакологического параметра этого лица, таким образом, помогая клиницисту предоставить индивидуализированное медицинское лечение.
[00603] Указанные в настоящем документе приборы, системы и методы дают возможность автоматической квантификации фармакологических параметров пациента а также автоматического сравнения такого параметра с, например, медицинской картой пациента, что может включать историю параметра, мониторинг которого проводится, или медицинские истории другой группы субъектов. Соединение мониторинга аналита в реальном времени с внешним прибором, который в состоянии хранить, а также выполнять любой тип обработки информации или алгоритмов, например, прибор, который может помочь с обычном обслуживанием пациентов, включая, например, сравнение последней информации о пациенте с информацией о пациенте, полученной в прошлом. Поэтому, также предоставляется информация о бизнес методе, который помогает проводить, по крайней мере, частичный мониторинг пациента, который в настоящее время проводится медицинскими работниками.
[00604] Оптическая настройка для получения изображения продуктов реакции и пробы
[00605] Анализ пробы и продуктов реакции можно проводить с помощью оптической настройки. Оптическая настройка может включать источник света, апертуру и сенсор или детектор. Диаграмма оптической настройки показана на Рисунке 100 и Рисунке 101. В некоторых вариантах видеокамерой может быть Logitech С600 Webcamera, а сенсором видеокамеры может быть 1/3" 2.0 MP (1600×1200) CMOS: (MI-2010-SOC), в качестве линзы будет выступать линза вебкама со стандартными элементами (Lens-to-Object distance: 35 мм). В качестве источника света может выступать Moritex White Edge Illuminator MEBL-Cw25 (белый), работающий при 9,4 вольт. Получение изображения с помощью видеокамеры будет иметь место с последовательностью, где 1, 2, 3 4, или больше микродозаторов перемещаются установкой x-y-z в оптический путь.
[00606] В одном варианте детектор представляет собой корпус для блока считывающего устройства для детекции сигнала, издаваемого, по крайней мере, одним анализом прибора. Блок обнаружения может быть расположен над прибором или в другом направлении по отношению к прибору, на котором он находится, например, тип проводимого анализа и используемый механизм обнаружения. Можно соединить блок обнаружения с анализирующим устройством или анализирующее устройство с блоком обнаружения.
[00607] Сенсорами могут быть PMTs, разнообразные фотодиоды, лавинные фотодиоды, одночастотные фотодиоды, чипы CMOS и CCDs. Источниками освещения могут быть лазеры, одноцветные LEDs, широкочастотный свет флуоресцентных ламп или LEDs, множества LED, смеси красных, зеленых и голубых источников света, фосфоры, активированные LED, флуоресцентные трубки, лампы накалывания, и дуговые источники, например, импульсные лампы.
[00608] Во многих случаях предлагается оптический детектор, который используется в качестве прибора обнаружения. В качестве примеров можно среди прочего назвать фотодиод, фотоэлектронный умножитель (РМТ), детектор счета фотонов, лавинный фотодиод или приборы с зарядовой связью (CCD). В некоторых вариантах может использоваться точечный диод. В некоторых вариантах точечный диод можно комбинировать с усилителем для создания прибора обнаружения с чувствительностью, схожей с РМТ. Некоторые анализы приведут к возникновению люминесценции, как описано в настоящем документе. В некоторых вариантах обнаруживается хемилюминесценция. В некоторых вариантах блок обнаружения может включать множество волоконно-оптических кабелей, присоединенных пучком к детектору CCD или множеству РМТ. Волоконно-оптический пучок можно сделать из дискретных кабелей или множества маленьких кабелей, слитых вместе для формирования пучка. Такие литые пучки предлагаются в промышленных масштабах и легко интегрируются с детекторами CCD.
[00609] Детектор может также включать источник света, например лампочку или светоизлучающий диод (LED). Источник света может освещать анализ с целью детекции результатов. Например, анализ может быть флуоресцентным анализом или анализом поглощения, которые чаще всего используются с анализами нуклеиновых кислот. Детектор также может включать оптическую систему, которая доставляет источник света в анализ, например линза или волоконная оптика.
[00610] В некоторых вариантах система детекции может включать неоптические детекторы или сенсоры для обнаружения определенных параметров субъекта. Такие сенсоры могут включать температуру, проводимость, потенциометрические и амперометрические сигналы, для соединений, которые окисляются или восстанавливаются, например, O2, Н2О2 и I2, органические соединения, которые можно окислять или восстанавливать.
[00611] Освещение может быть фоновое, переднего плана или неясное (боковое). Боковое освещение можно использовать в общей химии с целью обнаружения либо светопоглощения (колориметрии) либо рассеивания (мутности). Такой метод имеет две формы, широкое, равномерно освещенное заднее поле и луч света определенной формы, который прерывается субъектом. Переднее освещение можно использовать для отражения и возбуждения флуоресценции. При отражении, субъект освещается спереди источником света, что измеряется светом, который отражается субъектом. Поглощение цветов производит такую же информацию, как и жидкость, освещаемая светом сзади. При отражении субъект также может быть освещен неясным светом. Использование неясного (сбоку) освещения превращает изображение в трехмерный объект и может выделить характеристики, которые ранее были незаметны. Более современный подход, основанный на таком методе, представляет собой модуляционный контраст Гоффманна, - систему, работающую на основе инвертированных микроскопов для использования при работе с клетками. Боковое освещение имеет те же ограничения что и светопольная микроскопия (низкий контраст многих биологических образцов; явно низкое разрешение в связи с несфокусированными объектами), но может выделить, структуры, ранее не видимые.
[00612] При возбуждении флюоресценцией, субъекты могут освещаться спереди с целью флуоресцентного освещения. Это, как правило, одноцветный свет, чаще всего лазер. В такой роли чаще всего выступает конфокальный лазерный сканирующий микроскоп. Боковое освещение может также использоваться при возбуждении флюоресценцией. В флуоресцентной цитометрии субъекты, как правило, возбуждаются под углом, как правило, 90 градусов, из которого появятся фотоны распада. Такая форма освещения дает возможность рассеивающей детекции прямо за субъектом (заднее освещение) а также флуоресцентной боковой эмиссии.
[00613] В некоторых вариантах изображение флуоресцентного света получают под углом в 90 градусов к углу возбуждения. В Рисунке 102А, источник фотонов (S), как правило, высокоинтенсивный LED, проходит через рассеивающий луч (D) и формирующую линзу (L1), приводя к появлению коллимируемого или медленного расходящегося возбуждающего луча. Возбуждающий луч проходит через полосовой фильтр (F1) и освещает пробу, состоящую из сосуда (пробирки, кюветы или микродозатора пипетки), содержащего раствор с флюоресцентно-помеченной пробой. Изотропически-испускаемая флюоресценция отделяется спектрально от света возбуждения с помощью длинного или полосатого фильтра (F2), подходящего для испускания Стокс-смещенной флюоресценции. Затем получают изображение света с использованием линзы (L2) цифровой видеокамеры (С) или другого детектора. Интенсивность флюоресценции определяется по полученным изображениям с помощью анализа изображений.
[00614] Изображения, полученные с помощью оптической настройки, показаны на Рисунке 102А показывают однопробирочные изображения (как показано на Рисунке 103А. Последовательные эксперименты показывают разницу в интенсивности флюоресценции от Отрицательного к Положительному экспериментам LAMP благодаря интеркалированным краскам.
[00615] В других вариантах изображение передаваемого света получено после оптической фильтрации для удаления света на возбужденной ширине волны. В Рисунке 103В, источник фотонов (S), как правило, высокоинтенсивный LED, проходит через рассеиватель луча (D) и формирующую линзу (L1), приводя к появлению коллимируемого или эллиптического луча возбуждения. Луч возбуждения проходит через полосовой фильтр (F1) и освещает пробы, предлагаемы в виде разнообразных сосудов (пробирка, кювета или микродозатор пипетки), каждый из которых содержит раствор с флюоресцентно-помеченной пробой. Изотропически-испускаемая флюоресценция отделяется спектрально от света возбуждения с помощью длинного или полосатого фильтра (F2), подходящего для испускания Стокс-смещенной флюоресценции. Затем получают изображение света с использованием линзы видеокамеры (L2) и цифровой видеокамеры (С). Интенсивность флюоресценции определяется по полученным изображениям с помощью анализа изображений. Оптическая настройка, показанная на Рисунке 103, может использоваться для получения разнообразия изображений одновременно нескольких пробирок (как показано на Рисунке 103В).
[00616] Для колориметрии предпочитаемый вариант определения чувствительности - освещение субъекта белым светом и получение результата сенсором изображения. В таком случае измеряется поглощение передаваемого цвета.
[00617] Для нефелометрии, предпочитаемый вариант определения чувствительности - освещение субъекта белым задним фоном и получение результата сенсором изображения. Для нефелометрии выполняется измерение снижения интенсивности проходящего света.
[00618] В люминометрии не используется освещение, потому что субъект испускает свои фотоны. Испускаемый свет может быть слабым и может быть обнаружен с помощью максимально чувствительного сенсора, например трубки фотоумножителя (РМТ).
[00619] В некоторых вариантах, получение изображения может быть сделано с помощью флюоресценции, освещения темных или светлых полей. Такое изображение можно использовать для цитометрии или других приложений. Эпи-флюоресцентого освещения можно добиться, используя три источника освещения с различной длиной волны. Далее, при необходимости можно использовать два разных источника одновременно. Одновременно платформа для изображения может использоваться для получения изображения разнообразных флуоресцентных красок. Сочетание источников освещения и оптической системы эмиссии можно сконфигурировать для достижения множества спектрально независимых каналов отображения.
[00620] Освещения темных полей можно добиться с помощью кольцевого светильника (расположенного или над или под пробой), темнополого конденсера Аббе, темнополого конденсера с тероидальным зеркалом, эпи-темнополого конденсора, установленного внутри рукава, окружающего линзу объектива, или сочетания кольцевого светильника с подвесным конденсором со стопором. Такие оптические компоненты создают световой конус числовой апертуры (ΝΑ) больше чем ΝΑ используемого параметра. Выбор диаграммы освещения зависит от разных факторов, таких как необходимость увеличения изображения, тип механической конструкции, размер датчика изображения и т.д. Схема освещения на основе кольцевого светильника, как правило, обеспечивает однотонное освещение темных полей большой территории, одновременно гарантируя достаточную приспособляемость механической конструкции к системе в общем.
[00621] Освещения светлых полей можно добиться, используя источник белого света вместе с конденсором для того, чтобы возникло освещение Койлера.
[00623] В некоторых вариантах можно использовать автоматический фильтр. Колесо автоматического фильтра дает возможность контролировать оптическую длину пути отображения, давая возможность получать изображение нескольких флюрофор одного поля.
[00624] В некоторых вариантах может использоваться автофокусирование на основе полученного отображения. Может использоваться алгоритм на основе изображения для контроля положения z (т.е., вертикального положения) объектива (т.е., расстояния от пробы) для того, чтобы добиться автоматического фокусирования. Кратко, маленькое изображение (например, 128×128 пикселей) может быть получено на быстрой скорости, с помощью освещения темных полей. Такое изображение можно проанализировать для достижения автофокусирования, что представляет собой мерой четкости изображения. Используя алгоритм быстрого поиска можно найти положение z объектива. Объектив можно перевести в новое положение z и получить очередное маленькое изображение. Для фокусирования системы замкнутого типа не требуется других аппаратов. Установку микроскопа можно присоединить к компьютеризированной шаговому двигателю чтобы позволить двигаться в направлениях X и Υ (т.е., горизонтальные направления). В любом положении можно получить желаемое количество изображений и установку можно перенести в новое положение ΧΥ.
[00624] Отображение или другие измерения можно выполнить с помощью датчика обнаружения. Датчик обнаружения может включать видеокамеру или другой прибор измерения, сконфигурированный для преобразования электромагнитного сигнала а электронный сигнал. В одном варианте, можно использовать видеокамеру с зарядовой связью (CCD) или электронно-умножающую CCD (EMCCD) видеокамеру. Датчиком обнаружения может быть сенсор, например, сенсор активных пикселей или сенсор CMOS. Датчик обнаружения может включать пробирку с фотоумножителем для обнаружения сигнала.
[00625] Датчик обнаружения может быть подключен к контейнеру с пробой (т.е., кювета, микродозадор, ампула). В некоторых случаях, датчик обнаружения связан напрямую с контейнером с пробой В других случаях, датчик обнаружения присоединен оптически к контейнеру с пробой с помощью одной или нескольких оптических систем, например линз, зеркал, коллиматоров или их комбинациям.
[00626] Подсчет клеток можно выполнить с помощью отображения и цитометрии. В ситуациях, где субъекты освещены светлым полем, предпочитаемый вариант - освещение субъекта спереди белым светом, а определение клеток с помощью сенсора отображения. Последующая цифровая обработка поможет подсчитать количество клеток. Если клеток не так много, или они маленькие по размеру предпочитаемый вариант - присоединить флуоресцентный маркер, а затем освещение поля субъекта с помощью лазера. Предпочитаемыми вариантом является получение изображения с помощью конфокального сканирования. При проточной цитометрии, субъекты получают пометки с помощью флуоресцентных маркеров, а затем плавно двигаются мимо определяющего прибора. Существует два типа сенсора - один в положении, освещающем субъект сзади, измеряя рассеивание луча для определения присутствующих клеток. Второй сенсор, расположенный таким образом, что освещение идет сбоку, измеряет флуоресцентный свет, излучаемый маркированными субъектами. Более подробное объяснение предлагается ниже, описывая методы отображения, используемые в цитометрии.
[00627] Системы конечного пользователя
[00626] После изготовления прибор и систему могут быть пересланы конечному пользователю вместе или индивидуально. Прибор или система изобретения можно упаковывать с руководством для пользователя или инструкциями по применению. В одном варианте система изобретения подходит для анализов, проводимых на разных приборах. Потому что компоненты прибора могут быть модулярными, пользователю необходима только одна система и разнообразные приборы или устройства анализов или реагенты для проведения большого количества анализов у постели больного или в других местах тестирования. В таком контексте систему можно использовать несколько раз с разными приборами и, возможно, понадобиться установить сенсоры и на приборе и в системе для определения изменений при пересылке. При пересылке, изменения давления и температуры могут оказать влияние на эксплутационные показатели разных компонентов настоящей системы и такой сенсор, расположенный на приборе или в системе, может передавать информацию о таких изменениях, например, во внешнее устройство, таким образом, чтобы выполнить настройку во время калибровки или во время обработки информации, получаемой от внешнего устройства. Например, если во время пересылки температура флюидного устройства достигла определенного уровня, сенсор, расположенный на устройстве, сможет обнаружить такое изменение и передать информацию в систему в момент введения устройства в систему пользователем. В системе может быть дополнительное устройство обнаружения для выполнения таких задач, или такое устройство может быть частью другого компонента системы. В некоторых вариантах информацию можно передавать беспроводным путем или в систему или во внешнее устройство, например, персональный компьютер или телевизор. Похожим образом, сенсор системы может определять подобные изменения. В некоторых вариантах предпочтительно включить сенсор в упаковку для пересылки, или вместо включения в компоненты системы, или в дополнение к этому. Например, обнаруживаемые неблагоприятные условия, которые могут привести к тому, что блок анализа или система будут считаться недействительными, могут включать подвергание воздействию температуры, превышающей максимально приносимую, или нарушение целостности блока, например, попадание влаги.
[00629] В одном варианте система состоит из установки для пересылки информации, которая в состоянии передавать и получать информацию беспроводным путем от внешнего устройства. Bluetooth или RTM technology могут выступить в качестве беспроводного метода передачи информации. Можно использовать различные методы передачи информации, например доступ по телефонной линии с помощью модема, прямая связь, например, T1, ISDN или кабельная линия. В некоторых вариантах беспроводная связь устанавливается с помощью типичной беспроводной сети, например, сотовой, спутниковой или сети для устройств персонального вызова, GPRS, или системы транспортировки внутренних данных, например, Ethernet или сети token ring в локальной сети. В некоторых вариантах, информация, закодированная ранее, передается по беспроводной сети. В некоторых вариантах, блок коммуникаций может включать беспроводной инфракрасный компонент коммуникаций для пересылки и получения информации. Такая система может включать интегрированные графические карты для упрощенного отображения информации.
[00630] В некоторых вариантах блоком коммуникаций может служить запоминающее или накопительное устройство, например, локализированный RAM, в котором будет храниться собранная информация. Накопительное устройство будет необходимо, если информацию нельзя передать в определенное время в связи с, например, временной проблемой с беспроводным подключением к сети. Информацию можно связать с идентификатором устройства в накопительном устройстве. В некоторых вариантах блок коммуникаций может повторить пересылку накопленной информации после определенного периода времени.
[00631] В некоторых вариантах внешнее устройство передает информацию в блок коммуникаций, расположенный в блоке устройства для считывания. Внешний прибор может предавать информацию в систему физически или беспроводным путем, но также может передавать информацию с помощью третьей стороны, включая, без ограничений, пациента, медицинских сотрудников, врачей, сотрудников лаборатории иди других представителей отрасли здравоохранения.
[00632] В некоторых вариантах система может включать внешнее устройство, например, систему компьютеров, сервер или другой электронный прибор, способный накапливать или обрабатывать информацию. В некоторых вариантах, внешний прибор включает одну или несколько компьютерных систем, серверов или других электронных приборов, способных накапливать или обрабатывать информацию. В некоторых вариантах прибор включает базу данных пациентов, например, но, не ограничиваясь, медицинскими карточками или историями болезни, протоколами клинических испытаний и протоколами доклинических испытаний. Во внешнем устройстве могут храниться протоколы для использования в системе, которые можно передавать с помощью блока коммуникаций системы после получения информации о том, какое устройство было введено в систему. В некоторых вариантах протокол будет зависеть от определителя устройства. В некоторых вариантах на внешнем устройстве будет храниться более одного протокола для каждого устройства. В других вариантах информация о пациенте на внешнем устройстве будет включать более одного протокола. В некоторых вариантах на внешнем сервере будут храниться математические алгоритмы для обработки количества фотонов, посланных из блока коммуникаций, а в некоторых вариантах, для подсчета концентрации аналита в образце биологической жидкости.
[00633] В некоторых вариантах внешнее устройство может включать один или несколько серверов, используемых в отрасли или коммерчески доступных. Такие серверы могут выполнять распределение нагрузки, управление задачами и резервную емкость в случае отказа одного или нескольких серверов или других компонентов внешнего устройства для улучшения доступности сервера. Сервер также можно внедрить в схему с распределенными параметрами накопления и процессорными модулями, также известными в отрасли, в то время как отработка информации в соответствии с настоящим изобретением будет иметь место на компьютерах, избавляя от необходимости использования сервера.
[00634] Сервер может включать базу данных и систему классификации. База данных может находиться на сервере или на другой серверной системе, к которой имеет доступ первый сервер. Потому что в базе данных может храниться конфиденциальная информация, можно внедрить систему безопасности для того, чтобы предотвратить доступ незаконных пользователей в базу данных.
[00635] Одним из преимуществ некоторых характеристик, описанных здесь, является то, что информация из внешнего устройства может передаваться не только назад в блок считывающего устройства, но и в другие части или внешние устройства, например, без ограничений, PDA или мобильный телефон. Такой передачи информации модно добиться с помощью беспроводной сети, описанной в настоящем документе. В некоторых вариантах, рассчитанная концентрация аналита или другая информация о пациенте может пересылаться, например, но, не ограничиваясь, медицинскому персоналу или пациенту.
[00636] Соответственно, информацию, полученную на основе использованных устройств и систем субъекта, можно использовать для проведения анализа тренда на концентрации аналита в субъекте, которая меняется со временем.
[00637] Еще одним преимуществом, как описано здесь, является то, что результаты анализа можно незамедлительно передать третьей стороне, которой результаты могут пойти на пользу. Например, уровень концентрации аналита, определенный внешним устройством, можно переслать пациенту или медицинскому работнику, кто, возможно, сможет предпринять дополнительные шаги. Этап обмена информацией с третьей стороной можно выполнять беспроводным путем, как описано здесь, и путем передачи информации в портативный прибор третьей стороны, и третья сторона может получать уведомления о результатах анализа в любое время и в любом месте. Таким образом, в чувствительных по времени условиях с пациентом можно связаться мгновенно для того, чтобы предпринять срочные медицинские меры при необходимости.
[00638] Как описано здесь, для детекции можно использовать отображение. Отображение можно использовать для выявления одной или нескольких характеристик пробы. Например, отображение можно использовать для детекции присутствия или отсутствия пробы. Отображение можно использовать для детекции местоположения, размещения объема или концентрации пробы. Отображение можно использовать для определения присутствия, отсутствия и (или) концентрации одного или нескольких аналитов в пробе.
[00639] В некоторых вариантах, можно использовать одно измерение для сбора различной информации о пробе и (или) аналитах. Например, одно измерение можно использовать для сбора информации об объеме пробы и концентрации аналита в пробе. Одно измерение можно использовать для сбора информации о присутствии и (или) концентрации множества аналитов и (или) типов аналита в пробе. Одно изображение можно использовать для сбора информации об одном, двух или нескольких типов информации, описанных здесь.
[00640] Такие методы отображения и детекции помогут в получении более точных результатов анализа, что помогает в ситуациях с маленьким объемом пробы, как описано здесь. Дополнительные примеры объема проб могут включать до 500 т/л, до 250 т/л, до 200 т/л, до 175 т/л, до 150 т/л, до 100 т/л, до 80 т/л, до 70 т/л, до 60 т/л, до 50 т/л, до 30 т/л, 20 т/л, до 15 т/л, до 10 т/л, до 8 т/л, до 5 л/т, до 1 т/л, до 500 нл, до 300 нл, до 100 нл, до 50 нл, до 10 нл, до 1 нл, до 500 pL, до 250 pL, до 100 pL, до 50 pL, до 10 pL, до 5 pL, или до 1 pL. В некоторых вариантах, объем пробы может включать меньше 3 капель из пальца, меньше 2 капель крови из пальца или меньше одной капли крови из пальца. Такие маленькие объемы приемлемы в приложениях, используемых у постели больного.
[00641] Такое отображение и(или) детекция может помочь добиться анализа с низким коэффициентом вариаций. Коэффициент вариаций может быть пропорцией между стандартным отклонением и абсолютной величиной среднего значения. В одном варианте, реакция и(или) анализ могут отличаться коэффициентом вариации (CV) (также "относительной стандартным отклонением" здесь) менее 20%, 15%, 12%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0.5%, 0.3% или 0.1%. Одна реакция и (или) анализ или процедура с множеством реакций и (или) анализов может иметь коэффициент вариации менее 20%, 15%, 12%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0.5%, 0.3% или 0.1%. Одна реакция и (или) анализ или процедура с множеством реакций и (или) анализов может иметь коэффициент вариации менее 20%, 15%, 12%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,3% или 0,1%.
[00642] В некоторых вариантах использование отображения с прибором, который можно поместить у постели больного, может улучшить общие показатели прибора. Точность и аккуратность можно улучшить и (или) уменьшить коэффициент вариации. Производительность устройства можно улучшить при обработке маленьких проб, по примеру проб, описанных здесь. Отображение можно использовать в сочетании с другими системами обнаружения в сочетании с другими процессами. Улучшение производительности может выражаться в уменьшении коэффициента вариации 15%, 12%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0.5%, 0.3% или 0.1%.
[00643] Отображение может использоваться для различных типов обнаружения одного или нескольких типов анализов или для порядка обработки проб. Примеры таких анализов или процедур обработки образцов включают центрифугирование, разделение, цитометрию, иммуноанализ, ELISA, анализ нуклеиновой кислоты, ферментный анализ, колориметрия и любые другие типы анализов или реакций, описанных здесь.
[00644] Системы отображения могут отличаться определенными преимуществами над другими методами для сбора и обработки информации и интерпретации результатов. Системы отображения могут максимизировать или улучшить эффективность при использовании маленьких проб и повышении производительности системного уровня. Системы отображения можно использовать для обнаружения по отдельности или можно использовать в комбинации с другими механизмами или системами обнаружения.
[00645] В некоторых системах можно использовать системы и сенсоры (например, фотодиоды или фотоэлектронные умножители и связанные оптические системы/приборы) которые, как правило, не предоставляют пространственной информации об исследуемой пробе. Скорее, такие системы в состоянии собирать информацию о пробе после интеграции пространственной информации, как правило, после того, как пространственная информация о пробе была утеряна. В процессе интеграции сигнала в пространстве от пробы могут исходить сигналы, уровни которых будут обнаружены сенсором, но развитие чувствительности оптических и других сенсоров может сказаться отрицательно на необходимость такой интеграции. Отображение для обнаружения можно использовать вместо таких сенсоров или можно использовать вместе с такими сенсорами.
[00646] Можно использовать системы отображения, которые могут отличаться одной или несколькими характеристиками. Датчики изображения могут отличаться чувствительностью или динамическим промежутком, которые удовлетворяют или превышают требования традиционных датчиков, не формирующих изображение. Устройства для получения изображения могут сохранять пространственные аспекты канализуемой пробы, давая возможность последующей обработки. Последующая обработка может включать QA/QC (т.е., контроль качества, например, автоматические определение ошибок и(или) анализ патолога) и(или) анализ изображения для получения определенных характеристик пробы. В устройстве изображения могут использоваться 3D, 2D, 1D (датчики с чувствительным элементом), и (или) точечные датчики с возможностью переводить пробу по отношению к собирающей оптике/датчикам, давая возможность пространственной реконструкции пробы. Информацию, получаемую от изображающего устройства, можно обработать для получения специфической информации, например морфологические свойства пробы (например, определение количества клеток), или информацию из определенных участков изображения (максимальная флюоресценция всей пробы или клетки изображения). Информацию, получаемую от устройства отображения, можно обрабатывать для улучшения чувствительности и разрешения измерений. Информация, получаемая от устройства изображения, дает возможность оценки вариации сигнала всего отображаемого образца. Информацию можно подвергнуть последующей обработке для расчета средней величины, стандартного отклонения, максимума, минимума и (или) другие приемлемые статистические данные образца или любого другого участка, определенного при получении изображения пробы. Приборы отображения дают возможность контролировать изменения на протяжении периода времени, благодаря получению изображений и сравнению изменений в изображениях со временем и в пространстве, которые заметны в процессах агрегации (например, анализ протромбинового индекса) или другие (т.е., химические, физические, биологические, электрические, морфологические) изменения в пробе на протяжении периода времени в пространстве. Устройства изображения могут ускорить получение информации о множествах, участках ткани и других конфигурациях анализа/пробы.
[00647] Применение цитометрии
[00648] В некоторых вариантах, любые из описанных здесь вариантов, можно адаптировать, давая возможность системе выполнять цитометрию. Цитометрия (т.е., подсчет и функциональный анализу клеток) в системе можно выполнить, используя анализ изображений. Кровь можно обрабатывать с помощью дозатора и центрифуги, как описано выше. Как правило, измеренный объем крови (1-50 uL) можно сначала процентрифугировать и убрать частицы плазмы. Затем кусочки клеток можно повторно ввести в буферный раствор, используя дозатор для дозирования и аспирации. Смесь флуоресцентных антител можно направить к отобранным клеточным маркерам клеточным маркерам (например, CD45, CD4 и т.д.). После короткого инкубационного периода можно добавить реагент, который может выступать в роли фиксатора лейкоцитов и лизирующим агентом эритроцитов. После очередной инкубации можно собрать лейкоциты с помощью центрифугирования, а надосадочную жидкость в форме лизата эритроцитов убрать путем аспирации. Помеченные лейкоциты можно повторно суспендировать в определенном объеме буферного раствора (как правило, меньше первоначально полученного объема крови (например, 1-20 мкл) и распределить в прозрачные капиллярные каналы для проведения анализа изображений. Как правило можно получить изображение трех или пяти типов клеток, с помощью антител с различными флуоресцентными метками и (или) антителами, помеченными разным соотношением фтора и белка. Когда необходимо проанализировать или подсчитать больше типов клеток, можно использовать больше одной реакционной смеси. В некоторых вариантах можно использовать реакционную смесь для подсчета ли анализа разных типов клеток.
[00649] В некоторых вариантах капиллярные каналы как правило 10-100 мкм глубиной, 0,5-2 мм шириной и 0,5-5 см длиной. Капиллярные каналы могут иметь другие размеры, включая, но, не ограничиваясь размерами, описанными в настоящем документе. Диспергирование помеченных клеток может заполнить канал, благодаря капиллярному действию и у клеток может появиться возможность осесть на поверхности нижнего канала. Каналы можно освещать с помощью одного или нескольких лазеров или других источников света (т.е., LED). Оптическая схема может включать один или несколько оптических элементов, таких как дихроические зеркала или линзы и может увеличивать или не увеличивать поле зрения. В некоторых вариантах поле зрения может увеличиваться от 2 до 100 раз. Можно получить группу изображений, которые, как правило, представляют собой поле зрения, приблизительно 1 мм × 0,5 мм, содержащее 1-10000 клеток (в идеальном варианте 300 интересующих нас клеток), отображенных с помощью датчика, площадью, приблизительно 1000×1000 пикселей (1 всего 1 миллион).
[00650] Можно получить серию изображений, отображающих прилегающие разделы каналов. Можно использовать механическую установку для перемещения каналов по направлению к источнику света. В некоторых ситуациях установку можно передвигать с помощью сервопривода в вертикальном направлении для фокусировки изображения. В некоторых вариантах источник света или один или несколько оптических элементов можно передвигать по направлению к установке для фокусировки изображения. Изображение, как правило, делают с помощью одной или нескольких комбинаций источника света и оптических фильтров. Источник света можно включать и выключать, а фильтры при необходимости переносить в оптический путь. Можно подсчитать до 1000 клеток любого типа. В других вариантах можно подсчитывать разное количество клеток, включая помимо прочего следующее количество: приблизительно 1 клетка, 5 клеток, 10 клеток, 30 клеток, 50 клеток, 100 клеток, 150 клеток, 200 клеток, 300 клеток, 500 клеток, 700 клеток, 1000 клеток, 1500 клеток, 2000 клеток, 3000 клеток, 5000 клеток. Клетки можно подсчитывать, используя известные алгоритмы подсчета. Клетки можно различать по характерной флюоресценции, размеру и форме. Алгоритм распознавания изображений можно использовать для исключения частиц помеченных клеток в большинстве случаев, когда можно найти сгруппированные клетки; такие клетки можно либо исключить из анализа, либо интерпретировать как агрегаты.
[00651] Платформой для цитометрии может быть интегрированное автоматическое устройство для микроскопического анализа, способное выполнять следующие задачи в полностью автоматической контролируемой среде. Одна или несколько из следующих задач могут осуществляться в приложениях для цитометрии. Следующие задачи могут осуществляться в порядке их появления или в другом порядке, или их можно заменять другими подходящими задачами.
1. Изоляция клеток крови определенного типа.
2. Маркировка клеток флуоресцентными и (или) цветными красящими веществами и (или) каплями.
3. Сбор взвеси клеток в оптически совместимой кювете.
4. Получение изображения клеток с помощью флуоресцентной микроскопии, темнопольного освещения и (или светлопольного освещения).
5. Автоматический анализ изображений для экстракции желаемых характеристик.
6. Автоматический анализ экстрагированной информации с использованием расширенных статистических методов классификации для получения клинической отчетной информации.
В следующих разделах каждая из таких задач обсуждается подробно, с изображениями и рисунками, где необходимо.
[00652] 1. Выделение клеток крови определенного типа. Клетки крови определенного типа можно выделить в соответствии с одним или несколькими из описанных в настоящем документе вариантов. Например, такого выделения можно добиться, как описано выше в применении к цитометрии или центрифуге.
[00653] 2. Маркировка клеток флуоресцентными и (или) цветными красителями и (или) шариками.
[00654] Можно использовать специфические флуоресцентные красители. Определенные клетки можно инкубировать с помощью предварительно поделенных на аликвоты растворов флуоресцентно маркированных связующих веществ (напр., антител, аптамеров, и т.д.), которые является специфическими для маркеров в этих клетках. Основным моментом является парование «ярких» флуоресцирующих агентов или агентов с высоким коэффициентом поглощения и высоким квантовым выходом с маркерами, по отношению к которым клетки выражают низкую связывающую способность и наоборот. Например, маркер CD22 можно выразить через В-лимфоциты приблизительно как одну десятую уровня CD45. Принимая во внимание относительное выражение, CD22 можно пометить «ярким» красящим веществом и CD45 можно пометить «более тусклым» красящим веществом. Маркеры, которые можно пометить таким методом, могут быть либо внутриклеточными, либо находится на поверхности клетки. Чувствительность детекции и квантификации можно повысить, используя вторичную систему маркировки для маркеров пониженной экспрессии. Коротко говоря, первичное вяжущее вещество может соединиться с другой молекулой, которая может конкретно распознаваться вторичным вяжущим веществом. Вторичное вяжущее вещество, помеченное большим количеством фторофоров, может затем связывать первичное вяжущее вещество in situ и улучшить сигнал флуоресценции. Одним из способов добиться этого может быть использование анти-CD22 антитела, связанного с биотином, которое затем может быть распознано антибиотиновым антителом, которое помечено флуоресцинизотиоцианатом (FITC). Такое использование может значительно улучшить флуоресцентный сигнал. На рисунке 123 показан пример флуоресцентного микрографа, отображающего помеченные лейкоциты. Данный пример иллюстрирует флуоресцентный микрограф Alexa-Fluor 647-анти-С045 маркированных лейкоцитов человека в фиксированной, лизированной пробе крови. Система псевдоцвета используется для улучшения восприятия клеток, расположенных между «яркими» клетками (с высокой экспрессией CD45) и «тусклыми» клетками (с низкой экспрессией CD45).
[00655] Изменение цвета клеточных отпечатков также можно использовать в системе. Например, ручную процедуру, описанную в StainRITE™ Wright-Giemsa Stain (Polysciences Inc.), можно автоматизировать и выполнить с помощью приборов в рассматриваемом изобретении.
[00656] В некоторых вариантах можно использовать неспецифические флуоресцентные красители.
С целью дифференциации субпопуляций лейкоцитов, в платформе могут использоваться флуоресцентные красители, которые могут связываться с нуклеиновыми кислотами (напр., SYTO, Hoechst) или липидными мембранами (напр., Dil, DiD, FM-4-64).
[00657] 3. Локализация взвеси отмытых клеток в оптически подходящей кювете.
[00658] В некоторых вариантах кюветы цитометрии можно разработать таким образом, чтобы локализовать взвесь отмытых клеток до маркировки определенного объема в «канале», созданном таким образом, чтобы над и под клетками находился оптически прозрачный регистрирующий материал. Пробу можно вводить в канал с помощью входного отверстия для проб. На определенном расстоянии от входного отверстия для проб можно добавить воздухоотвод для ослабления давления воздуха и передвижения проб в канал.
[00659] Можно использовать такие размеры канала, которые дадут возможность вместить определенный объем жидкости, независимо от объема, введенного во входное отверстие для проб. В каждой из кювет могут быть многочисленные каналы одинакового/разных объемов, каждый из которых имеет, по крайней мере, одно входное отверстие для проб и, по крайней мере, один воздухоотвод.
[00660] Концентрацию интересующих нас клеток в образце можно отрегулировать во время подготовки пробы таким образом, чтобы после локализации в кювете можно получить желаемое количество клеток в поле зрения в системе обработки изображений. Добиться этого можно, между прочим, таким методом: получение изображения контейнера диспергированием клеток и измерением мутности. Можно рассчитать плотность клеток, используя установленные отношения между мутностью и количеством клеток. Как правило, диспергирование клеток можно выполнить в буферном растворе с максимально низким количеством клеток и концентрация клеток будет выше оптимальной для подсчета клеток, основанного на анализе изображений. Затем можно добавить дополнительное количество буферного раствора, чтобы довести диспергирование до оптимального уровня.
[00661] Область получения изображений в кювете можно настроить таким образом, чтобы она давала достаточное количество клеток для нужной нам цели. Например, для подсчета большого количества RBC может потребоваться подсчет только 1000-2000 клеток, и поэтому, будет необходима маленькая область изображений в кювете. Тем не менее, для подсчета редких миелобласт может быть необходима в некоторых случаях возможность получить изображение более 100000 (всего) клеток. В таких условиях система может концентрировать суспензию клеток таким образом, чтобы получить изображение 100000 клеток с умеренным количеством полей зрения. Поэтому канал на кювете, предназначенной для получения изображения RBC, будет меньше того, который предназначен для получения изображения миелобласт.
[00662] Форма кюветы может быть приспособлена для автоматического поднятия стандартным пипеточным механизмом, чтобы можно было переносить кювету на платформу для получения изображения. Эжектор микродозатора пипеточного механизма выталкивает кювету из пипеточного механизма на платформу для получения изображения. Регистрация кюветы на платформе для получения изображения может произойти в два захода. При переводе кюветы на платформу изображения статическое фиксирование кюветы взаимодействует с соединительным механизмом платформы для получения изображения и размещает кювету параллельно оптической оси (фиксирование Χ,Υ) платформы для получения изображения. Затем фиксирование завершается с помощью механизма, расположенного на платформе для получения изображения. Механизм может наклонить кювету к плоской поверхности перпендикулярно оптической оси платформы для получения изображения (Ζ регистрация), таким образом удерживая пробу в пределе видимости платформы для получения изображения.
[00663] Получение изображения клеток с использованием флюоресценции, освещения темных полей и освещения светлых полей. Такой метод получения изображения клеток можно также использовать в других случаях применения настоящего изобретения, описанных в данном документе. Методы получения изображения, описанные выше, можно использовать и в других случаях.
[00664] Варианты подсветки: Конструкция платформы цитометрии может предполагать наличие трех типов диаграмм освещения: эпи-флуоресценция, темнопольное и светлопольное. Модульный характер установки также дает возможность интеграции фазового контраста и дифференциально-интерференциального контраста (DIC).
[00665] Эпи-флуоресцентного освещения можно добиться с помощью трех лазерных линий (напр., 488 нм, 532 нм и 640 нм), но модульных характер системы также дает возможность интеграции источников света, например, других лазерных источников, LED и стандартных дуговых ламп (напр., Xenon, Mercury и Halogen). Кроме этого, при необходимости можно одновременно использовать два различных источника. Поэтому, платформу для цитометрии можно использовать для получения изображения большого количества флуоресцентных красителей. Сочетание источников освещения и датчика эмиссии можно использовать и конфигурировать для достижения определенного количества (напр., 3-5) спектрально независимых каналов изображения.
[00666]Темнопольного освещения можно добиться с помощью кольцевого светильника (расположенного над или под пробой), темнопольного конденсора аббе, темнопольного конденсора и тороидального зеркала, эпи-темнопольного конденсора, встроенного в рукав вокруг линзы объектива или комбинации кольцевого светильника с конденсором установки, оборудованной с темным стопом. Такие оптические компоненты могут создать световой конус числовой апертуры (ΝΑ) больше ΝΑ используемого объектива. Выбор способа освещения зависит от разных переменных, например, от необходимой степени увеличения, особенностей механической конструкции, или размера сенсора изображения. Схема освещения с использованием кольцевого светильника, как правило, дает однородное темнопольное освещение широкой территории и, в то же время, гарантирует достаточную универсальность механической конструкции всей системы. На Рисунке 124 показан пример внутриклеточных проб на основе темпопольных изображений. В примере показаны разные внутриклеточные пробы темнопольных изображений лейкоцитов человека, (а) Хорошо заметная диаграмма рассеивания в связи с присутствием гранул эосинофилей, (b) полиморфоядерные нейтрофилы с нуклеолами, характерными для нуклеолярных долек и (с) клетки, которые не рассеивают свет в значительной степени (лимфоциты или базофилы)
[00667] Светлопольного освещения можно добиться с помощью источника белого света вместе с конденсором установки для создания эффекта освещения Колера. На рисунке 126 показан пример светлопольных изображений мазка крови человека. На примере показаны светлопольные изображения мазков цельной крови человека, нанесенных с помощью метода Райта-Гимза. Явно виден характерный рисунок нанесения мазков на лейкоциты человека. На таких изображениях также можно идентифицировать красные кровяные тельца определенной формы.
[00668] Сменный светофильтр: Сменный светофильтр позволяет контролировать оптический путь при получении изображения для того, чтобы добиваться изображения многочисленных флюорофор одного и того же поля зрения.
[00669] Автофокусирование на основе изображения: В платформе для цитометрии может использоваться алгоритм на основе изображения для контроля положения z (напр., вертикального положения) объектива (т.е., расстояния от пробы) с целью автофокусирования. Коротко говоря, небольшое изображение (например, 128×128 пикселей) можно получить на большой скорости с помощью темнопольного освещения. Такое изображение можно проанализировать для применения функции автофокусирования, которую можно использовать для измерения четкости изображения. На основе алгоритма быстрого поиска можно вычислить следующее положение z объектива. Пробу можно перенести в новое положение z, где можно получить еще одно изображение. В некоторых вариантах замкнутая система не требует использования других приспособлений для фокусирования.
[00670] Трансляция установки: Установку микроскопа можно подсоединить к шаговому двигателю, контролируемому компьютером, для трансляции в направлении X и Υ (напр., в горизонтальном направлении). В каждой точке можно получить необходимое количество изображений, а потом установку можно передвинуть в новое положение ΧΥ.
[00671] Датчик изображения: Для обнаружения сигнала можно использовать видеокамеру с CCD, EMCCD, CMOS или в некоторых трубку фотоувеличителя.
[00672] 5. Анализ изображений для экстрагирования необходимых клеточных характеристик.
[00673] В платформе для цитометрии можно использовать различные методы освещения для получения изображений, с разными характеристиками и свойствами. Маркировка с помощью специфических связующих клеточных маркеров может показать степень экспрессии определенного маркера на поверхности клетки или в клетке. Темнопольное изображение может помочь определить свойства рассеивания света клетки. Внутренние и внешние характеристики клетки, которые рассеивают больше света, выглядят более яркими, а характеристики, которые рассеивают меньшее количество света, выгладят более темными на темнопольном изображении. Клетки типа гранулоцитов содержат гранулы, размер которых находится в диапазоне (100-500 нм), и которые в состоянии рассеивать значительное количество света и, как правило, выглядят более яркими на темнопольных изображениях. Кроме этого, внешняя граница любой клетки может рассеивать свет и может выглядеть как кольцо яркого света. Диаметр такого кольца может непосредственно указывать на размер клетки. Светлопольные изображения клеток могут указывать на размер клетки, фазо-плотный материал клетки и цветные функции в клетке, если клетки были помечены до этого.
[00674] База данных для обработки изображений может извлекать, помимо прочего, следующую информацию о каждой клетке:
1. Размером клеток
2. Количественные измерения гранулярности клеток (также зачастую называемые боковым рассеиванием, на основе языка проточной цитометрии)
3. Количественные измерения флуоресценции каждого спектрального канала изображения после компенсации перекрестных искажений между спектральными каналами
4. Форма клетки, квантифицированная такими стандартными и специализированными качествами формы, как аспектовое отношение, диаметр Фере, эксцесс плотности, момент инерции, циркулярность, твердость и т.д.
5. Цвет, распределение цвета и форма клетки, в случаях, когда клетки были помечены красителями (не прикрепленными к антителам или другим типам рецептора).
6. Внутриклеточные рисунки маркировки и рассеивания цвета, определенные количественными показателями, например, плотностью гранул внутри клеток темнопольного изображения или количеством и размером нуклеолярных долек в окрашенном изображении Гимза-Райт полиморфноядерных нейтрофилов и т.д.
7. Колокализация свойств клетки, показанных на отдельных изображениях
[00675] Алгоритмы обработки изображений, используемые на этом этапе, могут включать комбинацию фильтрации изображения, распознавания контура, сравнения с эталоном, автоматического регулирования порога, морфологических операций и анализа формы объектов.
[00676] 6. Анализ экстрагированной информации с помощью усовершенствованных статистических методов классификации для получения клинической отчетной информации.
[00677] Любое количество измеренных характеристик можно экстрагировать из изображения клеток. Например, измеренные характеристики каждой из клеток, экстрагированные из изображений, находятся в диапазоне от 7 до 15, таким образом, создавая от 7 до 15 пространственных мест в каждой из клеток, что является точкой. Если n измеренных характеристик экстрагируется из изображений, и n-количество пространственных мест можно найти в каждой из клеток, тогда это точка.
[00678] На основе информации, полученной для большого количества клеток (напр., 100-100000 клеток) можно получить комплекс n-пространственно рассеянной информации.
[00679] Статистические методы можно использовать для группировки клеток в отдельные популяции в таком n-пространственном месте. Также эти методы могут использовать последние разработки из клеточной биологии и гематологии, чтобы способствовать группированию и идентификации популяций клеток.
[00680] На рисунке 125 показан пример многопараметрового получения информации из маркированных проб клеток. Лейкоциты человека были маркированы с помощью пан-лейкоцитного маркера анти-CD45-Alexa Fluor 700 (выделено здесь зеленым цветом) и В-клетка маркера анти-CD22-АРС (выделено красным цветом). На индивидуальных каналах показаны различные рисунки для CD45, CD22 выражения и бокового рассеивания. Клетки, имеющие CD22 и CD45 (В-лимфоциты) характеризуются низким боковым рассеиванием. С другой стороны, такие клетки как нейтрофилы и эзонофилы, отличающиеся высоким боковым рассеванием, не показывают маркировку CD22.
[00681] На рисунке 127 показан пример получения количественной многопараметровой информации и анализа. Например, можно создать гистограмму, на которой будет показано распределение интенсивности CD45 в лейкоцитах человека. Можно использовать любые другие методы распределения графической информации для отображения распределения. В некоторых вариантах можно создавать график рассеивания. Можно определить боковое рассеивание, сравнив анализ темнопольного изображения и интенсивность флуоресценции CD45 для пробы лейкоцитов человека. График бокового рассеивания может показать две основные популяции гранулоцитов (сверху в левой части) и лимфоцитов (снизу в правой части).
[00682] В следующих разделах описываются основные компоненты и свойства платформы для цитометрии и приложений. На основе этих свойств можно разработать широкий диапазон клеточных анализов для работы на такой платформе. Например, можно разработать 5-этапный анализ для определения 5-этапного лейкоцитного дифференциала. В таком случае, может быть зафиксировано количество клеток на микролитр крови для следующих типов лейкоцитов: моноциты, лимфоциты, нейтрофилы, базофилы и эзинофилы. Основная стратегия разработки такого анализа на платформе для цитометрии - это создание проблемы, в которой измеряются определенные свойства лейкоцитов, например, боковое рассеивание, интенсивность флуоресценции CD45 или CD20, таким образом, чтобы группировать лейкоциты в разные популяции (например, 5 популяций)в таком n-пространственном месте. Зоны, образованные вокруг группы клеток, можно позиционировать на графике рассеивания в 2-пространственном месте, и они называются «воротами» по примеру языка проточной цитометрии. Ниже приводится пример стратегии маркировки и «ворот»:


[00683] Платформа для проведения цитометрии и система для проведения анализа, описанные здесь, позволяют проводить автоматическую подготовку и получать пробы на основе упорядоченной пробы. Описанные системы и методы делают возможной специфическую идентификацию клеток по отношению к VCS (объем, проводимость и рассеивание), что может повысить точность идентификации и снизить случаи подтверждающего тестирования. Описанный здесь анализ изображения также позволяет при необходимости сохранять изображение клеток, для последующего подтверждения и анализа. Кроме этого могут быть доступны морфологические характеристики клетки. В некоторых вариантах возможна динамическая регулировка параметров подготовки и получения изображения пробы для работы с клеточными пробами широкого диапазона концентраций.
[00684] В некоторых вариантах можно использовать центрифугу для подготовки и концентрации популяций клеток. Метод может включать использование центрифуги для подготовки клеток и системы получения изображения и анализа, описанные в настоящем документе.
[00685] В некоторых вариантах, можно использовать комбинацию темнопольного изображения и изображения клеток, помеченных многочисленными флуоресцентными антителами. Такая комбинация позволяет проводить анализ по типу FACS в более простом и менее дорогостоящем приборе.
[00686] В соответствии с некоторыми вариантами настоящего изобретения, описанные здесь системы и методы открывают следующие функции. Такие функции могут быть полезны в различных способах применения. В некоторых вариантах возможна автоматическая проверка и обработка проб. Такая проверка и обработка проб может включать один или несколько следующих аспектов: качества пробы, измерения объема пробы, разведение (и измерение факторов разведения) и отделение красных или белых кровяных телец и плазмы.
[00687] Можно также использовать процесс, связанный с автоматическим химическим анализом. Он может включать осаждение, перемешивание и седиментацию.
[00688] В некоторых вариантах может иметь место автоматическое проведение всех анализов, которые, приводят к образованию люминесценции и меняют цвет (напр., химия красителей). Применяются следующие методы: спектрофотомерия, флуорометрия, люминометрия, турбидиметрия, нефелометрия, рефрактометрия, трехцветный анализ изображений, поляриметрия, измерение агглютинации, анализ изображения (с использованием следующих устройств: фотоаппарат, цифровой фотоаппарат, сканирующее устройство, безлинзовая фотография, 3х-мерная фотография, видео фотография) или микроскопия.
[00689] В описанных здесь системах и методах можно также осуществлять автоматический контроль качества и калибровку анализов.
[00690] В некоторых вариантах можно установить двухстороннюю связь. Такая связь помогает вести учет на всех этапах проведения анализа. Двухсторонняя связь позволяет вносить изменения в протокол анализа для оптимизации или увеличения числа нескольких проводимых анализов.
[00691] Контроль качества/Дополнительные способы применения
[00692] В некоторых вариантах изображение можно использовать в ходе одного или нескольких измерений или этапов диагностики. Получение изображения можно использовать в дополнение к другим методам, процедурам, реакциям и анализам. Например, изображения можно использовать для выполнения одного или нескольких этапов контроля качества или этапов любой другой процедуры, например, подготовка пробы, анализа или этапа диагностики. Изображения можно использовать для диагностики. Изображение можно использовать для повышения точности при сборе информации. Изображение может служить элементом контроля качества для проверки информации, результатов и (или) других измерений. Изображение может служить механизмом контроля и повышения качества. Изображение можно использовать для диагностики одного или нескольких условий, которые влияют на сбор информации и (или) точность полученной информации. Таким образом, изображение может улучшить подготовку пробы, анализа и (или) методику диагностики. Это особенно целесообразно в ситуациях, когда используются пробы небольшого объема, такие, как описываются выше.
[00693] В одном примере на этапе диагностики определяется наличие и концентрация аналита. Можно провести диагностику одного или нескольких сигналов, представляющих информацию, подходящую для последующей количественной или качественной оценки. Диагностика может включать или не включать диагностику видимого света. Диагностика может включать измерение энергии любого участка электромагнитного спектра (т.е., инфракрасный, микроволновый, ультрафиолетовый, гамма лучи, рентгеновские лучи, видимый свет). Диагностика может проходить с использованием любого типа датчика, в том числе оптический датчик, температурный датчик, датчики движения, датчик электричества, акустический датчик, химический датчик, спектрометр или любой другой датчик, описанный здесь или любое их сочетание. В некоторых вариантах диагностика может включать или не включать пространственное распределение света и энергии. В некоторых вариантах диагностика может включать или не включать распределение плотности энергии.
[00694] Изображение может позволить диагностировать одно или несколько условий, при которых происходит диагностика. Изображение может использоваться для диагностики условий образца, реагента, контейнера, части прибора, который может использоваться в диагностике. В некоторых вариантах изображением может быть видимое изображение. Например, изображение может включать получение кадра, снимка или (или) фотографии. Изображение может запечатлевать пространственное распределение энергии вдоль электромагнитного спектра. Энергия электромагнитного спектра может включать видимый свет или может включать другие диапазоны (напр., инфракрасный, ультрафиолетовый или любые другие, описанные выше). Например, пространственное распределение видимого света может включать двухмерное изображение. В некоторых вариантах получение изображения может включать использование прибора для получения изображения, как подробно описывается в настоящем документе. Среди примеров приборов для получения изображения можно привести фотоаппарат, например, безлинзовый (вычислительный) фотоаппарат (напр., фотоаппарат Франкен) или фотоаппарат с открытым исходным кодом. Прибор для получения изображения может регистрировать сигнал, способный создавать одномерную, двухмерную и трехмерную проекцию предмета, изображение которого получают. В некоторых вариантах прибором для получения изображения может быть устройство ввода регистрации движений, отрегулированное таким образом, чтобы предоставлять трехмерную или псевдо трехмерную проекцию предмета.
[00695] Метод получения изображения может быть таким же как используемый механизм диагностики, или отличаться от него. В некоторых вариантах используются разные механизмы диагностики на этапах диагностики и проверки контроля качества изображения. В некоторых вариантах диагностика может включать оценку полосы энергии или плотности распределения энергии, например, с помощью спектрометра, тогда как контроль качества изображения может включать пространственное распределение видимого света, например, с помощью видеокамеры.
[00696] Изображения используют при проведении светочувствительной диагностики. Например, с помощью прибора для получения изображения можно добиться изображения до 1 мм, 500 микрометров (мкм), 200 мкм, 100 мкм, 75 мкм, 50 мкм, 25 мкм, 15 мкм, 10 мкм, 7 мкм, 5 мкм, 1 мкм, 800 нанометров (нм), 700 нм, 500 нм, 300 нм, 100 нм, 50 нм, 30 нм, 10 нм, 5 нм, 1 нм, 500 пикометров (пм), 300 пм или 100 пм. В одном варианте изображение можно получить с помощью фотоаппарата с разрешением более 2 мегапикселей, 4 мегапикселей, 6 мегапикселей, 8 мегапикселей, 10 мегапикселей, 12 мегапикселей, 15 мегапикселей, 20 мегапикселей, 25 мегапикселей, 30 мегапикселей, 40 мегапикселей или 50 мегапикселей или больше.
[00697] Изображения можно использовать для диагностики ошибок или других проблемных состояний. Изображение можно использовать для определения состояния, которое повышает вероятность ошибки и (или) вызывает неточность. Например, изображение можно использовать для определения наличия или отсутствия одного или нескольких нежелательных веществ. В качестве примера нежелательных веществ можно привести пузырьки, частицы, волоски, взвешенные частицы, мусор, осадок или любое другое вещество, которое может повлиять на измерения. В другом примере изображение можно использовать для определения, попадает ли образец пробы, реагента, или любого другого материала в определенный диапазон, и находится ли проба, реагент или другой материал в определенном месте. Изображение можно использовать для определения концентрации пробы, реагента или материала или того, попадает ли проба, реагент или другой материал в определенный промежуток концентрации.
[00698] В одном примере анализ ферментов можно выполнить на пробе небольшого объема. Примеры величин, используемых при измерении объема, можно найти в настоящем документе. Можно использовать спектрометр или другой метод или механизм диагностики, описанный здесь, для этапа диагностики при анализе ферментов. Можно выполнить этап получения изображения для определения условий, при которых прошла диагностика. Например, этап изображения может помочь определить присутствуют ли нежелательные твердые частицы, например пузырьки, или другие неблагоприятные условия. С помощью этапа получения изображения можно проверить, идет ли анализ по плану. Этап получения изображения может также подтвердить, находятся ли производственные условия проведения анализа (или диагностики) в пределах допустимой погрешности или оптимизированных условий. В некоторых примерах изображение может включать снимок реакции, происходящей в контейнере. Полученное изображение можно проанализировать на выявление любых нежелательных и (или) желательных условий. В некоторых вариантах полученное изображение можно проанализировать автоматически, с помощью компьютеризированного метода. Один или несколько процессоров могут помочь при анализе полученного изображения, в некоторых случаях используя один или несколько методов на основе кода, хранящегося в памяти компьютера. Изображение может использоваться для контроля качества без вмешательства человека.
[00699] Изображение может выступать в качестве интеллекта системы. На этапе изображения может быть добыта информация об условиях, при которых проходит подготовка пробы, анализ и диагностика. Методы диагностики могут предоставить более надежные, точные и аккуратные измерения с помощью прибора «у постели пациента» или его компонента, использующего изображение в процессе контроля качества. Контроль качества полезен тогда, когда используются небольшие объемы.
[00700] Динамическая обратная связь
[00701] В некоторых вариантах можно наладить динамическую обратную связь во время этапа обработки пробы. Например, динамическая обратная связь может иметь место во время этапа подготовки пробы, этапа анализа и этапа диагностики. В некоторых вариантах динамическую обратную связь можно обеспечить с помощью изображения. Кроме этого, динамическая обратная связь может происходить посредством любого другого механизма диагностики, как описано в настоящем документе. В некоторых вариантах механизм динамической обратной связи может использовать оптическую диагностику, электромеханику, сопротивление, электрохимию, микрогидродинамику или любой другой механизм или их сочетание.
[00702] Динамическая обратная связь может функционировать на основе изображения или другого механизма диагностики. Динамическая обратная связь может быть задействована при автоматическом принятии решений системой. Например, можно получить изображение и можно получить данные, которые будут учитываться при принятии решения об определенном этапе. Датчик, например, датчик изображения, может фиксировать физическую информацию, которую можно использовать при решении о последующем этапе или процедуре. Такие последующие этапы или процедуры могут определяться автоматически на ходу.
[00703] В одном варианте может иметь место динамическое разведение. Контейнер, например, кювета или любой другой описанный здесь контейнер, может включать пробу. Механизм динамической обратной связи (т.е., изображение, спектрофотометр или другие механизмы диагностики) могут помочь определить концентрацию пробы. В некоторых вариантах определение может быть приблизительным или неточным. Первоначальное определение может быть неточным, потом информация предоставляется посредством обратной связи, которая поможет создать для пробы условия для более точной диагностики и (или) анализа. В одном примере механизмом динамической обратной связи может служить метод получения изображения, использующий первоначальную флуоресцентную диагностику для получения предварительной оценки концентрации.
[00704] Механизм динамической обратной связи может помочь определить, входит ли концентрация пробы в определенный диапазон. В одном примере концентрацией может быть концентрация клеток. Можно выполнить приблизительный подсчет клеток для определения концентрации клеток. Для подсчета клеток можно использовать один или несколько сигналов механизма динамической обратной связи. В некоторых вариантах можно использовать клетки с разнообразной концентрацией. В некоторых случаях концентрация может быть выше на 1, 2, 3, 4, 5, 6, 7 или больше порядков. В некоторых вариантах в зависимости от измеряемой и (или) анализируемой клетки или аналита, можно использовать разные концентрации в одной и той же пробе. В зависимости от определенной концентрации, пробу можно разбавить или концентрировать и (или) увеличить. Например, если концентрация выше установленного диапазона, пробу можно разбавить. Если концентрация ниже установленного диапазона, пробу можно концентрировать и (или) увеличить. Степень разведения и (или) концентрации и (или) амплификации можно определить на ходу на основе приблизительной концентрации.
[00705] Степень разведения и (или) концентрации и (или) увеличения можно определить автоматически. Динамическая обратная связь может быть автоматической. Механизм динамической обратной связи (т.е., изображение или другие механизмы диагностики) могут предоставлять информацию, которую можно анализировать для определения рабочих условий. Например, концентрацию пробы можно определить с помощью механизма динамической обратной связи. Может быть задействован процессор, который может получать (пересылать) один или несколько сигналов механизма динамической обратной связи. На основе полученных сигналов процессор сможет определить концентрацию и то, попадает ли концентрация в желаемый диапазон. Если концентрация попадает в определенный диапазон, процессор может принять решение, что нет необходимости разводить, концентрировать или увеличивать состав. Если концентрация окажется выше установленного диапазона, процессор может принять решение, что разведение необходимо. Процессор может определить степень разведения на основе того, насколько концентрация выходит за пределы требуемого диапазона. Если концентрация ниже установленного диапазона, процессор может решить, что концентрация (или амплификация) необходима. Процессор может определить степень увеличения на основе того, насколько концентрация ниже требуемого диапазона. Такое определение основывается на физических считываемых компьютерных носителях, включающих код, логику и инструкции для выполнения одного или более шагов. Такое определение может выполняться автоматически без вмешательства человека. Это может распространяться на любые производственные условия и не ограничиваться концентрацией пробы, например, концентрацией клетки.
[00706] В некоторых вариантах после измерения первоначальной обратной связи и этапа разведения концентрации/амплификации, возможно проведение более точных измерений. Например, можно осуществить более точный подсчет клеток после того, как принято решение, что проба попадает в определенный диапазон. В некоторых вариантах проба может попасть в определенный диапазон после одного разведения/и (или) концентрации и (или) амплификации. В других вариантах можно выполнить дополнительные этапы обратной связи и дополнительные этапы разведения и (или) концентрации. Например, если первоначальное определение подтверждает, что у пробы высокая концентрация, может иметь место этап разведения. После этапа разведения может иметь место дополнительный этап обратной связи. Если концентрация пробы не попадает в требуемый (или заранее установленный) диапазон, можно выполнить дополнительное разведение или концентрацию/амплификацию, в зависимости от того, выше или ниже установленного диапазона измеренная концентрация. Эту процедуру можно повторить столько раз, сколько нужно, чтобы проба попала в необходимый диапазон. Кроме этого, этап обратной связи можно повторять или не повторять, или можно повторить определенное количество раз. В некоторых вариантах каждый случай обратной связи будет происходить с большей точностью. На каждом из этапов обратной связи можно использовать одинаковую степень точности.
[00707] В некоторых вариантах, когда концентрация (например, концентрация клеток или аналита) попадает в установленный диапазон, пробу можно успешно проанализировать. Например, концентрация пробы клетки может иметь установленный диапазон, приемлемый для получения изображения. Можно получить определенное количество клеток для поля зрения.
[00708] Квантификацию и суммирование клеток с помощью изображения можно улучшить, контролируя плотность клеток во время получения изображения, ограничивая таким образом группирование клеток. Как правило, можно максимизировать или увеличить диапазон концентрации аналита, на протяжении которого анализ имеет линейную зависимость. Для того чтобы увеличить линейный диапазон анализа, динамическая система может выполнить предварительное не разрушающее измерение образца с помощью метода, отличающегося большим динамическим диапазоном для получения приблизительной концентрации клеток пробы. Потом с помощью алгоритма можно рассчитать соотношение концентрации клеток для разведения, необходимое для достижения приемлемого диапазона для выполнения основных измерений. Можно выполнить дальнейшее разведение и (или) концентрацию и (или) увеличение, таким образом осуществляя динамическое разведение и (или) концентрацию.
[00709] Такая динамическая ответная реакция, как, например, динамическое разведение, может быть приемлема в системах, использующих небольшие объемы. В некоторых вариантах общий объем пробы может включать любые описанные здесь объемы. В некоторых вариантах определенные порции пробы для анализа могут иметь любой из указанных здесь объемов. Динамическое разведение может помочь добиться низкого коэффициента вариации. Например, коэффициент вариации для подготовки пробы, анализа или этапа диагностики может быть одной из величин коэффициента вариации, описанных в настоящем документе. Этот метод подходит для применения в приборах «у постели больного», использующих маленькие объемы и (или) отличающиеся низким коэффициентом вариации.
[00710] Динамическая ответная реакция позволяет безопасно тестировать пробу. Такая процедура применима в системах, работающих с небольшими объемами. Один и тот же объем можно использовать для первоначальной диагностики ответной реакции и последующей диагностики. Одну и ту же пробу можно использовать для первоначальной диагностики ответной реакции и последующей диагностики в одном и том же контейнере (напр., кювета, пробирка, микродозатор). Может использоваться сосуд с пробой, расположенный за пределами установленного или требуемого диапазона на первоначальном этапе. Например, концентрация одного или нескольких аналитов и (или) клеток может находиться за пределами установленного и (или) требуемого первоначально диапазона. Одну и ту же пробу можно измерять в диапазоне в одном и том же сосуде. В некоторых вариантах концентрация одного или нескольких аналитов и (или) клеток может позднее попасть в установленный (требуемый) диапазон в одном и том же сосуде. В некоторых вариантах один или несколько промежуточных этапов, например, разведение и (или) концентрация/увеличение, можно провести на пробе для того, чтобы проба попала а установленный и (или) требуемый диапазон. Такие промежуточные шаги можно выполнить автоматически.
[00711] В некоторых вариантах разведение может выполняться автоматически. Например, разбавляющее вещество может находиться в контейнере с пробой и перемешиваться с пробой для того, чтобы воздействовать на новый объем пробы. В некоторых вариантах разбавляющее вещество может включать единичное разбавляющее вещество. В других случаях разбавляющее вещество может включать несколько разбавляющих агентов. Разбавляющее вещество можно ввести в контейнер с помощью насоса, клапанов и каналов подачи жидкости для облегчения подачи, например, посредством микрожидкостной системы с одним или несколькими микрожидкостными каналами и (или) одним или несколькими микрожидкостными насосами. Микрожидкостная система может включать один или несколько механических или электромеханических компонентов, например, систему механического перекачивания с одним или несколькими приводимыми в движение (например, пневматическое движение) клапанами для облегчения подачи жидкости. Система перекачивания в некоторых случаях будет включать механический нанос, отрегулированный для улучшения подачи жидкости. Система перекачивания может включать один или несколько сенсоров для измерения и передачи рабочих параметров, например, скорости потока жидкости, концентрации, температуры и (или) давления, в систему управления. В одном примере, разбавляющее вещество поступает в систему с помощью микорожидкостной системы с механическим насосом, соединенным с микрожидкостным каналом, устанавливая жидкостное соединение контейнера с резервуаром с разбавляющим веществом.
[00712] В некоторых вариантах используется перекачивающая система для внедрения разбавляющего вещества для разведения измеренной пробы. Разведение пробы можно измерить с помощью датчика, например, датчика освещения. В одном примере датчик освещения соединен с источником света для направления луча света сквозь пробу, и последующего измерения разведение пробы на основе рассеивания света пробой. Если измеренная концентрация (например, клетки, ткани) пробы находится над установленным уровнем (или порогом), в таком случае перекачивающая система направляет разбавляющее вещество (например, воду) из резервуара с разбавляющим веществом в контейнер с пробой.
[00713] В некоторых вариантах динамическое разбавление автоматизировано с помощью системы жидкого потока с насосом (например, микрофлуидный насос) и находится в жидкостной связи с каналом жидкого потока (например, микрофлуидный канал), и, кроме этого, включает один или несколько клапанов для регулирования потока жидкости. Автоматизацию разведения можно использовать для тестирования и регулировки параметров калибровки, например, при получении заранее установленных объемов разведения жидкости, используемой для изменения необходимой концентрации.
[00714] В некоторых ситуациях насос состоит из одного или нескольких клапанов, например, клапанов, приводимых в движение пневматически. Тогда насос, канал потока жидкости и один или несколько клапанов помогают установить жидкостную связь между резервуаром разбавляющего вещества и контейнером, приспособленным для хранения пробы. Один или несколько клапанов и (или) насос могут находиться в электрической связи с системой управления, имея в распоряжении процессор для контроля потока разбавляющего вещества из резервуара с разбавляющим веществом для контроля концентрации пробы.
[00715] Динамическая обратная связь дает возможность автоматически контролировать концентрацию пробы, снижая до минимума или устраняя полностью вмешательство пользователя. В некоторых случаях концентрация пробы контролируется автоматически (например, разводится или увеличивается) без участия пользователя. Такое минимальное участие пользователя может помочь добиться низкого коэффициента вариации при получении изображения или при использовании системы в целом, как описано в настоявшем документе.
[00716] В одном примере система динамической обратной связи используется для контроля концентрации клеток в жидкой пробе с использованием изображения. В пробе, полученной в контейнере с пробой, например, в кювете, изображение используется для того, чтобы измерить концентрацию клеток в жидкой пробе. Измеренная концентрация может быть приблизительным (или грубым) измерением концентрации. Система динамической обратной связи затем разбавляет жидкую пробу, направляя разбавляющее вещество в контейнер с пробой. Это помогает минимизировать или полностью устранить все нарушения (или разрушения) клеток в момент разведения. Затем можно выполнить необязательное измерение концентрации клеток жидкой пробы для измерения концентрации после разведения. В некоторых ситуациях реакция может произойти после разведения в том же контейнере пробы, который использовался для разведения пробы. В некоторых ситуациях реакция может происходить в случаях, когда разведение не было оптимальным.
[00717] В некоторых случаях во время динамической обратной связи можно добиться приблизительного измерения концентрации пробы с помощью спектрометра, а более точное измерение концентрации пробы можно получить с помощью прибора для получения изображения. Прибор для получения изображения может включать источник света (например, когерентный свет, например, лазерная установка, или некогерентный свет) и фотоаппарат, например, фотоаппараты с зарядовой связью (CCD). В одном примере после приблизительного измерения система динамической обратной связи регулирует концентрацию образца, предоставляя разбавляющее вещество и после этого снимает более точное измерение. Концентрацию пробы можно еще больше отрегулировать, используя небольшие объемы разбавляющего вещества (например, точная регулировка) по отношению к объему разбавляющего вещества, предоставленного во время приблизительной регулировки. Кроме этого, снимается приблизительная концентрация пробы с помощью прибора для получения изображения, а более точное измерение концентрации образца можно получить с помощью спектрометра. Приблизительное и точное регулирование
[00718] Системы динамической обратной связи, описанные здесь можно сконфигурировать для концентрирования/увеличения (т.е., увеличения концентрации) образца, например, клеток в жидкой пробе. В некоторых ситуациях этого можно добиться с помощью центрифугирования или индуцированного полем разделения (напр., разделение в электрическом поле, магнитное разделение).
[00719] В некоторых ситуациях концентрацию пробы можно получить с помощью прибора для получения изображения, когда местоположение прибора для изображения выбирается таким образом, чтобы получить определенную длину волны или точку фокусирования. В некоторых случаях положение одного или нескольких датчиков, связанных с прибором получения изображения, регулируется таким образом, чтобы получить определенную длину волны или точку фокусирования. В некоторых случаях безлинзовый фотоаппарат используется для получения изображения, выполняя численный анализ изображения и определяя различные точки фокусирования.
[00720] Динамическое разведение можно выполнять на пробах разных объемов. В некоторых случаях, когда объем пробы превышает установленный предел, пробу можно распределить по разным контейнерам для проб (напр., кюветы) для последовательной или параллельной обработки и получения изображений.
Самообучение
[00721] Динамический механизм получения обратной связи может способствовать самообучению системы. Например, можно получить первоначальное измерение обратной связи для динамической системы разведения/концентрации. На основе измерения обратной связи, пробу можно не обрабатывать, ее можно развести, или концентрировать/увеличить. Можно произвести последующие измерения и (или) диагностику. Последующие измерения и (или) диагностика могут стать или не стать дополнительными измерениями для обратной связи. На основе последующих измерений можно принять решение о том, была ли обработка (т.е., не обрабатывать, разводить, концентрировать/увеличивать) проведена правильно и(или) определить правильность степени обработки (т.е., достаточное разведение или концентрация/увеличение). Например, механизм первоначальной обратной связи может указать на то, что у пробы высокая концентрация и ее необходимо развести. Пробу можно развести определенным количеством. Можно получить последующие измерения (напр., можно получить изображение пробы). Если степень разведения не помещает пробу в определенный диапазон (т.е., развели слишком много или слишком мало), система может получить уведомление о том, что для последующего динамического разведения/концентрации с помощью похожего механизма первоначальной обратной связи можно использовать другую степень разведения. Если степень разведения помещает пробу в требуемый диапазон, система может получить подтверждение, что такая же степень разведения должна использоваться для последующего разведения при похожем или таком же измерении обратной связи.
[00722] Можно получить информацию на основе первоначальных условий и последующих действий, что поможет принять решение в последующих шагах в похожих ситуациях с динамической обратной связью. Это помогает системе самообучаться на протяжении периода времени и запоминать, какие шаги предпринимать в определенных динамических ситуациях. Такое самообучение может распространяться на определенные ситуации. Например, система самообучения может прийти к выводу, что одному лицу, у которого брали пробу, нужна степень разведения/концентрации, отличающаяся от другого лица. Такое самообучение может распространяться на группы людей с одной или несколькими характерными чертами. Например, система самообучения может решить, что пациенту, использующему определенный препарат, нужна будет степень концентрации/разведения, отличающаяся от другого пациента. Систему самообучения моно также обобщать. Например, система может прийти к выводу, что пациентам определенной демографической группы или имеющим общие характеристики могут потребовать или не потребовать разные степени разведения/концентрации. Система может использовать информацию, полученную в прошлом, личные карточки отдельных лиц, личные карточки других лиц, общую информацию о здоровье, общедоступную информацию, медицинскую информацию и статистические данные, информацию, которой располагает страховая компания, и другую информацию. Определенная информация может быть доступна в Интернете (т.е., веб-сайты, статьи, журналы, базы данных, медицинские статистические данные). Система может время от времени просматривать веб-сайты и базы данных для обновления информации. В некоторых вариантах будет иметь место самообучение прибора, облачной системы или внешнего устройства. При получении дополнительной информации ее можно загрузить на облако или внешнее устройство, и такая информация может стать доступной для самообучения системы.
Приборы для получения и обработки изображений
[00723] В некоторых вариантах подготовка пробы, обработка и анализ проводятся с помощью приборов для получения и обработки изображений, в том числе на основе поглощения электромагнитного излучения (или света) или приборов манипуляции, таких как приборы поучении изображения и спектрометры. В некоторых случаях прибор получения изображения можно использовать вместе со спектрометром. Спектрометр может использоваться для измерения свойств света на определенном участке электромагнитного спектра, который может использоваться для спектроскопического анализа, например, анализа материала. Прибор для получения изображения (или получении снимка) можно использовать для измерения концентрации пробы, состава, температуры, мутности, скорости течения и (или) вязкости.
[00724] В одном примере прибором для получения изображения может быть цифровой фотоаппарат. Приборы получения изображения могут включать устройства с зарядовой связью (CCDs) или фотоумножители или фототрубки или фотоопределители или другие приборы определения, например, сканирующий микроскоп, независимо от того, какой тип освещения используется - задний или лицевой. В некоторых случаях в фотоаппаратах могут использоваться CCDs, CMOS, фотоаппараты могут быть безлинзовыми (вычислительными) (т.е., фотоаппарат Франкен), фотоаппараты с открытым исходным кодом, или использовать другие технологии визуальной детекции, известные в отрасли. В некоторых ситуациях прибор получения изображения может включать оптический элемент, которым может быть линза. Например, оптическим элементом может быть линза, поглощающая свет из фокальной плоскости линзы детектора. Фотоаппараты могут включать один или несколько оптических элементов, которые будут фокусировать свет во время использования или смогут получать изображение, которое будет фокусироваться позднее. В некоторых вариантах приборы получения изображения могут работать на основе двухмерного изображения, трехмерного изображения и (или) четырехмерного изображения (использование изменений с ходом времени). Приборы получения изображений могут регистрировать статистические изображения или динамические изображения (т.е., видео). Статистические изображения могут регистрироваться в одной или в нескольких точках во времени. Приборы получения изображений могут также регистрировать видео и (или) динамические изображения. Видео-изображения могут регистрироваться постоянно на протяжении определенного или нескольких периодов времени.
[00725] В некоторых ситуациях в качестве прибора получения изображений можно использовать вычислительный фотоаппарат, используемый для измерения концентрации множества проб на протяжении короткого периода времени, например, мгновенно. В некоторых вариантах вычислительный фотоаппарат может иметь оптическое устройство, отличающееся от линзы. В одном примере вычислительным фотоаппаратом является безлинзовый фотоаппарат, получающий изображение множества проб в расположенных ступеньками контейнерах для проб (т.е., кюветах). Концентрацию пробы в определенном контейнере для проб затем можно рассчитать, например, математически переводя изображение в определенную фокальную точку в или рядом с частью изображения, имеющего определенный контейнер для пробы, и получая концентрацию пробы на основе полученного изображения. Такое математическое преобразование изображения, как, например, доступное с помощью безлинзового фотоаппарата, может предоставить другую информацию в разных точках в пространстве в поле зрения безлинзового фотоаппарата, что может включать точки в пространстве, полученном из рассеянного света. В некоторых вариантах последний сигнал можно проанализировать с помощью сложных алгоритмов. Одним из таких примеров является вычислительный фотоаппарат с оптическими элементами, которые могут создавать изображение, преобразованное по Фурье, на детекторе. Полученное «изображение» можно проанализировать для экстрагирования необходимой информации. Такой детектор даст возможность получить информацию от изображенного субъекта. Различных характеристик изображения, например, информации на определенной фокальной длине, можно добиться с помощью программного средства, используя боле простые приборы и ускоряя процесс получение информации.
[00726] Приборы поглощения электромагнитной радиации и манипуляции можно использовать в различных приложениях, описанных здесь, таких, например, которые измеряют концентрацию пробы, включая динамическое разведение. В одном примере прибор поглощения света и манипуляции включает источник света, например, источник когерентного света (т.е., лазерное излучение), в соединении с датчиком света, например, фотоаппаратом CCD, для поглощения рассеянного света, который может излучаться пробой после направления источника света на пробу. Этот метод можно использовать для измерения концентрации пробы. Датчик света можно сконфигурировать для получения (восприятия) света с разной длиной волны, например, красного, зеленого или голубого или других сочетаний, например, сочетание красного, оранжевого, желтого, зеленого, голубого, индиго и фиолетового. В некоторых ситуациях датчик света конфигурируется для восприятия света с длиной волны больше инфракрасного или близкой инфракрасному или меньше чем или равной ультрафиолетовому в добавок к видимому спектру света.
[00727] Приборы поглощения света и манипуляции можно использовать для сбора информации в определенные моменты времени или в разных точках во времени, что может использоваться для создания видео из множества обычных снимков и (или) звука (или другой информации, например, текстовой информации), связанных с изображением.
[00728] Приборы поглощения света и манипуляции, включая вычислительные (безлинзовые) фотоаппараты, можно использовать для получения двухмерных изображений или трехмерных изображений (или псевдо трехмерных) изображений и (или) видео.
[00729] В некоторых вариантах прибор поглощения изображения и манипуляции вносит помехи в объект и измеряет реакцию с точки зрения вызванных помех. Помехи могут быть в форме света (т.е., рентгеновское излучение, ультрафиолетовый свет), звук, электромагнитное поле, электростатическое поле или их комбинация. Например, звуковые помехи можно использовать при получении акустических изображений. Акустическое изображение может основываться на принципах, подобных тем, которые используются при диагностических ультразвуковых исследованиях, используемых в медицине. Акустическое изображение может работать подобно микроскопу, но с использованием акустических волн. Источник ультразвукового излучения может вызвать появление волн, которые проходят по пробе и отражаются/рассеиваются в связи с неоднородностью эластических свойств пробы. Датчик может получить «изображение» отраженных волн. Вариант такого метода может включать «получение фото акустического изображения», при котором акустические волны, идущие по пробе, могут привести к местной компрессии и расширению пробы. Такие компрессия/расширение могут вызвать изменение в рефракционном индексе материала пробы, что можно определить посредством измерения/изображения отражения лазерного луча пробой.
[00730] В некоторых ситуациях прибор получения изображения можно использовать для измерения объема клетки. В одном примере используется сочетание источника света и фотоаппарата CCD для получения снимка клетки. Компьютерная программа выполняет цифровую обработку снимка и проводит по середине клетки линию. Затем компьютерная система измеряет расстояние между точками, где линия пересекает границу клетки (или стенки клетки или мембраны) или дает приблизительное значение диаметра клетки, что можно использовать для определения объема клетки.
[00731] Прибор получения изображения может использовать микроскопию сканирования линий, что позволяет освещать пробы с тонкой линией или с когерентным лазерным светом, чтобы энергию источника можно было концентрировать на маленькой области, проявляющей высокую плотность мощности. Геометрию детектора можно сопоставить с линией или точкой. Затем линию/точку можно просканировать по пробе, чтобы получить изображение различных участков. Все отсканированные линии потом можно соединить для образования целого изображения (т.е., по примеру сканнера документов). Такой метод можно использовать как аналитический метод получения изображений по одной или нескольким причинам: (1) высокая плотность энергии освещения, (2) сравнительно высокая скорость сканирования строчек по сравнению со сканированием точек, (хотя обе могут быть медленнее полнокадрового или классического получения изображений), (3) точность аналитических измерений пробы, таких как, флуоресценция, абсорбция, люминесценция, (4) сочетание спектрального и гиперспектрального изображений, так, чтобы получить полный спектр пробы для каждого пикселя, (5) регулировка разрешения на ходу (т.е. не меняя элементов, пробу можно при необходимости сканировать при низком или высоком латеральном разрешении) или (6) предоставить глубину поля, что делает возможным получение изображений проб тканей.
[00732] В некоторых вариантах прибор получения изображений можно сконфигурировать для детекции света, излучаемого ионизацией (флуоресценцией или люминесценцией), например, с помощью мерцания. В одном примере, сцинтиллятор нанесен или встроен в материал, из которого изготовлен контейнер пробы. При соединении пробы (или при другом способе связи) с сцинтиллятором, он испускает свет (т.е., флуоресцентный свет), который обнаруживается детектором прибора изображения. Эту процедуру можно использовать для измерения радиоактивного разложения (т.е., альфа и (или) бета разложения) определенных проб.
[00733] В некоторых вариантах прибором получения изображений выступает полевой транзистор для определения заряженных частиц, например, ионов. Кроме этого, прибором для получения изображений может быть тепловой детектор для измерения изменения тепла, с помощью которого можно создавать тепловую карту.
[00734] В некоторых ситуациях контейнер для пробы включает одну или несколько лунок для иммобилизации пробы. Контейнер для пробы можно соединить с прибором получения изображений для получения изображений пробы, иммобилизованной в одной или нескольких лунках. Иммобилизацию пробы можно выполнить с помощью гранул с вяжущими поверхностными веществами (т.е., антителами) или с вяжущими поверхностными веществами, которые могут располагаться, к примеру, в нижней части лунок. Лунки могут иметь диаметр в диапазоне от нанометров до микрометров или больше.
[00735] В некоторых вариантах обнаружение проб и анализ проводится с помощью веществ, улучшающих изображение, например, красителей. Краситель может связываться с пробой, для обеспечения оптического, электрического или оптоэлектронного сигнала, который можно обнаружить с помощью детектора прибора для получения изображений. В одном примере краситель связывается с клеткой и флуоресцирует, что регистрируется детектором. Измеряя флуоресценцию, можно измерить пространственное распределение и (или) концентрацию клеток. С помощью веществ, улучшающих изображение, можно добиться улучшенного перехода от сигнала к шуму во время получения изображения (или снимка). Краситель может связаться с клеткой с помощью поверхностных рецепторов и (или) антител.
[00736] В некоторых случаях использование красителей может вызвать фоновую флуоресценцию, что может исказить изображение - пробу флуоресценции трудно удалить с флуоресцентного фона. В такой ситуации получение изображения можно улучшить, погрузив пробу в раствор с флуоресцентным красителем. Несвязанный краситель удаляется с помощью центрифуги (или магнитного или электрического разделения), отделяющей пробу от несвязанного красителя. Центрифугу можно внедрить в прибор «у постели больного», имеющий прибор для получения изображений. Пробу затем можно повторно ввести в раствор и получить изображение с помощью прибора для получения изображений.
[00737] В некоторых ситуациях получение изображения можно улучшить, используя динамическую ответную реакцию в дополнение к или вместо использования веществ, улучшающих изображение. В одном примере концентрации пробы можно оптимизировать с помощью разведения или увеличения до получения изображения.
[00738] Можно ускорить разделение пробы с помощью центрифуги. В качестве альтернативы можно выполнить разделение пробы с помощью магнитного или электрического поля. Например, магнитные частицы могут связываться клетками, и это можно использовать при наличии магнитного поля для привлечения клеток к источнику магнитного притяжения.
[00739] Описанные здесь системы и методы можно использовать в разных типах проб, например в клетках, полученных из тканей (т.е., кожа, кровь), слюна или моча. В одном примере, динамическая ответная реакция и (или) изображение могут использоваться с пробами тканей или пробами клеток, полученных из проб тканей.
Примеры
Пример 1: Амплификация нуклеиновых кислот с помощью изотермической амплификации сформированием петель (LAMP)
[00740] Следующие эксперименты проводились для оценки возможности проводить анализ LAMP методом трехцветного анализа изображений при флуоресценции и впитывания.
[00741] Условия реакции Lamp
[00742] Реакция LAMP проводилась в общем объеме 25 мкл в PCR трубках на 500 мкл (VWR, West Chester, РА). Реакционная смесь включала 0,8 г моль праймера 1 и праймера 2, 0,2 г моль праймера 3 и праймера 4, 400 г моль каждого dNTP (Invitrogen, Carlsbad, СА), 1 моль бетаина (Sigma, St. Louis, МО), 1X Thermopol буферного раствора (New England Biolabs, Ipswitch, MA), 2 м моль MgSO4 (Rockland Immunochemicals, Gilbertsville, PA), 8U Bst DNA большого фрагмента полимеразы (New England Biolabs, Ipswitch, MA) и определенное количество шаблона ДНК (варьировал от -10 и ~10^9 копий). В случае с негативным контрольным раствором, добавлялось приблизительно 10^9 копий не имеющего отношения ДНК.
[00743] Условия реакции
[00744] Реакция инкубировалась при 65°C на протяжении 1 часа в герметизированных пробирках. Полимераза затем инактивировалась нагреванием продуктов реакции при 80°C на протяжении 5 минут.
[00745] Детекция и визуализация продукта
[00746] SYBR Green I stain (Invitrogen, Carlsbad, СА) раствор разбавлялся в 100 раз, 5 мкл перемешивалось с 10 мкм перемешанных продуктов завершенной реакции LAMP и инкубировались на протяжении 5 минут при комнатной температуре. Затем результаты продуктов реакции были получены следующим образом:
[00747] Флуоресцентные данные: пробирки PCR или пипетки микродозаторов, содержащие смесь, освещались с помощью 302 нм ультрафиолетового света и флуоресцентного излучения (λmax ~ 524 нм), изображение которых было получено с помощью цифрового фотоаппарата (Canon EOS Tli, 18-55 мм, Canon, Lake Success, NY).
[00748] Цветовые данные: Продукты реакции аспирировались в микродозаторы, их изображение было получено с помощью цифрового фотоаппарата
[00749] Результаты:
[00750] Флуоресцентное изображение продуктов анализа в пробирках показано на Рисунке 81.
[00751] Флуоресцентное изображение продуктов анализа в микродозаторах показано на Рисунке 89.
[00752] Цветные изображения продуктов анализа в микродозаторах показаны на Рисунке 82, Рисунке 83, Рисунке 84, Рисунке 85, Рисунке 86 и Рисунке 87. На Рисунке 88 задний план цветного изображения, полученного для калибровки.
[00753] На Рисунке 90 показано сравнение реакций на дозу LAMP, полученное при измерении "объемной" флуоресценции (обычная флуометрия) и реакции для двух цветовых каналов, полученных с помощью фотоаппарата. Очевидно, что цветовой метод показывает реакцию, сравнимую с методом флуориметрии.
[00754] Когда цветные изображения анализировались и калибровались в соответствии с методами, описанными в этом документе с использованием всех цветовых каналов, было очевидно, что имеется близкое соответствие между калиброванным цветовым сигналом и флуоресцентным сигналом, как показано на Рисунке 91.
Пример 2: Система, максимально использующая пробы
[00755] Система, максимально использующая пробы, может обладать следующими характеристиками:
[00756] 1. Эффективное разделение крови на плазму и эффективное восстановление плазмы
[00757] а. Разделение достигается центрифугированием в капиллярной трубке
[00758] 2. Разбавление плазмы до нескольких заранее установленных уровней, которое подходит как для анализов с высокой, так и низкой чувствительностью
[00759] 3. Сведение к минимуму объема каждой реакционной смеси для анализов, требуемое для каждого анализа
[00760] а. Использование кюветы малого объема с открытым концом, пригодной для инкубации анализов, при которых исключается испарение
[00761] i. Длина кюветы намного больше ее ширины
[00762] b. Внутри упомянутых низкообъемных кювет имеется возможность увеличить чувствительность сигнала анализа за счет изменения оптической длины пути
[00763] i. Кювета является конической или широкой и мелкой
[00764] с. При необходимости достигается упомянутое увеличение чувствительности сигнала анализа перемещением продукта реакции (который не заполняет кювету) к выбранным местам, для которых больше длина пути во время оптического измерения
[00765] i. Внутренний объем кюветы гораздо больше объема анализируемой смеси
[00766] 4. Использование как одного, так и оба из нижеперечисленных условий - варьирующейся оптической длины пути и анализа 3-цветового канала - для увеличения полезного динамического диапазона анализов
Пример 3: Устройство для анализов в месте наблюдения
[00767] Устройство для анализов в месте наблюдения может включать прибор с одноразовыми картриджами, который обрабатывает пробы и выполняет анализы и сервер, удаленный от прибора, систему измерения и детекции, включающую:
[00768] - Одноразовый картридж, содержащий
[00769] - Приспособления для сбора и измерения проб (такие, как микродозаторы для проб)
[00770] - Приборный блок, содержащий
[00771] - Сенсор оптического изображения (такой, как фотоаппарат сотового телефона с источником света (например, со вспышкой) и устройство сбора изображений с приборов с зарядовой связью (ПЗС)
[00772] - Механизм для перемещения указанного микродозатора в такое место, где указанный сенсор оптического изображения сможет получать изображения
[00773] - Беспроводная загрузка указанных изображений (или другими методами) на сервер, который удален от прибора
[00774] - Программное обеспечение (ПО) для обработки изображений, способное:
[00775] - Измерять объемы по двухмерным изображениям
[00776] - Различать типы проб
[00777| - Использовать упомянутые типы проб и/или данные объема как часть операционного алгоритма для:
[00778] - Предоставления указаний пользователям системы касательно целостности пробы
[00779] - Предоставление всех необходимых указаний, чтобы увеличить или заменить пробу
[00780] - Толкование упомянутых данных с упомянутого прибора относительно результатов анализа, предположения о типе пробы и/или объеме пробы
[00781] По выбору система может включать дополнительные механизмы для обработки и/или отображения проб, собранных пользователями в "устройство сбора проб (капиллярное)", включающие:
[00782] - Механизмы для приемки капилляра в определенном месте и перемещения упомянутого капилляра в другое определенное место, где может быть получено изображение
[00783] - Механизмы для извлечения в значительной степени всей пробы в упомянутый картридж в определенном месте
Пример 4: Анализ капилляра, содержащего пробу крови
[00784] Отбор проб осуществляется пользователями прикосновением дальнего конца капилляра к капле крови (обычно из пальца). Капилляр обычно заполняется за счет капиллярного действия, если достаточно крови. В одном варианте изобретения пользователь помещает капилляр у защелки картриджа, а потом вставляет картридж в выдвижную деталь прибора, и затем приводит в действие анализ нажатием кнопки на дисплее графического интерфейса пользователя (ГИП) прибора. Все последующие шаги анализа автоматизированы. Прибор перемещает картридж внутри корпуса и закрывает дверцу, через которую был вставлен картридж. В этом варианте изобретения прибор перемещает деталь для захвата капилляра и передвигает его к положению перед цифровым фотоаппаратом, оборудованным источником вспышки с зарядовой связью. Изображение капилляра фотографируется со вспышкой и отправляется по беспроводной связи на сервер, который читает изображение с точки зрения типа, расположения и количества пробы. Если заранее установленные критерии отвечают инструкциям сервера, прибор продолжает анализ. Если проба является неудовлетворительной, капилляр возвращается в картридж, который извлекают, а сервер обращается к ГИПу для надлежащих указаний. Потом пользователь может (1) добавить еще пробы или (2) получить свежую пробу, и использовать новый капилляр. Как только пользователь сообщит ГИПу, что меры по устранению ошибки были приняты и капилляр/картридж снова вставили в прибор, сервер подает команду прибору на возобновление обработки анализа. Критерием для надлежащего объема пробы обычно является объем, превышающий минимально-необходимый для данного анализа. Для некоторых анализов таковым является, например 10 мкл как приемлемая для анализа проба, поэтому обычно проба считается удовлетворительной, если измеряемый объем > 12 мкл.
[00785] Во втором варианте изобретения, который можно внедрять отдельно или в сочетании с первым вариантом, получение изображения используется для измерения объема пробы, взятой из первоначальной пробы с помощью прибора. В последовательности шагов анализа проба извлекается из капилляра в ячейку для пробы в картридже либо (1) пользователем, либо (2) прибором. Затем из ячейки с пробами отбирается точный объем вторым микродозатором либо с помощью капиллярного действия, либо (предпочтительно) пневматическими методами. На этом этапе измеряется тип и объем подпробы (как наверху) получением изображения микродозатора. Если тип и объем пробы являются приемлемыми (целевое значение +/- <5%), процедура анализа продолжается. Если нет, анализ может быть прекращен, и пользователь получит команду принять меры для исправления. Распознаваемыми типами проб могут быть кровь и плазма или сыворотка и другие. Система обработки изображений различает, наблюдая очень большой контраст между кровью (непрозрачная) и микродозатором (прозрачный) по сравнению для случая с плазмой и сывороткой. Бывает, что объем пробы, хотя и не достигает целевого уровня, но все же остается достаточным для проведения анализа и получения удовлетворительных результатов (в примере наверху объем >5 мкл будет приемлемым, если целевой объем составляет 10 мкл). Алгоритм процедуры анализа, который рассчитывает концентрацию анализируемого вещества, потом использует корректировочную функцию: Конц. (верное значение) = Конц. (наблюдаемая при предположенном целевом объеме) * Целевой объем/Измеряемый объем.
[00786] Кровь можно распознавать легко, а ее объем, измеряется созданием карты массива элементов изображения микродозатора и расчетом темных элементов, а потом сравнением с заранее установленным числом для целевого объема. Несмотря на то, что типы проб сыворотки и плазмы (и других водных проб не из крови) прозрачны, система распознавания изображений может распознавать присутствие пробы благодаря изменению рефракции, которое наблюдается над мениском пробы, и различий в коэффициенте рефракции между материалом микродозатора и пробой. В другом варианте к пробе может быть добавлен краситель с помощью композиции высушенного красителя, нанесенной в виде покрытия внутри капилляра, которая растворяется в пробе.
[00787] Другие методы измерения объема пробы включают нахождение верха и низа каждого мениска и использование простых геометрических методик (как описано здесь). Пузырьки внутри столбика жидкости пробы могут распознаваться и измеряться методом, который обсуждался выше, и надлежащий объем вычитается из общего объема, абсорбированного пробой.
[00788] Методами, представленными выше, измеряются пробы внутри капилляра или свисающие с конца капилляра (как описано здесь). После того, как проба измерена и принята системой, она извлекается пипеткой/ пневматическими методами внутри прибора. Как только это происходит, можно снова получить изображение микродозатора и измерить все остаточные пробы. Действительный объем, который используется в анализе, представляет собой разницу между общим объемом и остаточным объемом.
[00798] Другой особой проблемой систем анализа по месту, особенно, когда они используются не обученным техническим персоналом, является присутствие пробы за пределами капилляра для проб.
[00790] Изображение такой пробы может быть получено и сделаны измерения с использованием данного изобретения, и пользователю будут даны команды для удаления избыточной крови.
[00791] Эффективность получения пробы и поставки в устройства для анализа зависит от используемой методики работы с жидкостью. В автоматических устройствах могут использоваться (1) пневматическое засасывание и извлечение (как во многих лабораториях, в которых используются одно- и многоканальные пипеточные устройства с одноразовыми микродозаторами; в пневматических устройствах может быть положительное или отрицательное давление (вакуум)), (2) прямое объемное вытеснение (как в шприце), технология струйной печати и подобные. Пробы и другие жидкости, такие, как реагенты, могут (3) выводиться из резервуаров капиллярным действием или (4) затеканием в пористую среду. Жидкости (пробы и/или реагенты) могут извлекаться с или без контакта с другими жидкостями. Например, если пробу нужно разбавить, микродозатор может погружаться в растворитель или вытесняться в воздух, чтобы капли попали в сухую ячейку или в ячейку, содержащую растворитель. Работа всех упомянутых выше систем и методов может быть выверена и/или измерена с использованием изобретения.
[00792] В других модификациях изображение капилляра может быть получено пользователем вне прибора с использованием внешнего фотоаппарата. Измерения объема могут быть прошкалированы в соответствии с размером капилляра. Такой фотоаппарат, ориентированный на фотографирование снаружи, может использоваться для распознавания пользователя/пациента для того, чтобы результаты можно было более надежно ассоциировать с соответствующим им пациентом. Этот метод может также применяться для проверки надлежащего лечения (изображение контейнера пилюли или пилюли или, в качестве варианта, для этой цели может быть использовано считывающее устройство для штриховых кодов в приборе).
[00793] Изобретение может также использоваться для измерения расположения и объемов реагента, набранного в микродозаторы для анализа. В некоторых случаях к реагентам могут добавляться красители, чтобы получить более ясные изображения (улучшенный контраст).
[00794] В анализах, где плазма отделяется от крови, данное изобретение можно использовать для проверки эффективности удаления красных кровяных телец и доступного объема плазмы. Альтернативным вариантом для перемещения микродозатора проб является перемещение фотоаппарата
[00795] Такая система может иметь следующие преимущества:
[00796] 1. Количественное измерение пробы.
[00797] 2. Способность распознавать тип пробы.
[00798] 3. Создание объективной, количественной записи объема пробы.
[00799] 4. Способствует получению результатов анализа при неправильном объеме пробы.
[00800] 5. Улучшает надежность системы анализа.
Пример 5: Микродозаторы
[00801] На Рисунке 18 показаны схемы микродозаторов, используемых для засасывания проб и реагентов (размеры в мм).
Пример 6: Геометрические измерения цилиндрического капилляра
[00802] На Рисунке 19 показаны размеры цилиндрического капилляра, содержащего пробу.
[00803] R = радиус
[00804] L1 = расстояние от нижнего конца цилиндра до нижнего мениска пробы
[00805] L2 = расстояние от нижнего конца до нижнего конца верхнего мениска
[00806] Вводимый объем = π*(R^2)*(L2 - L1)
Пример 7: Геометрические измерение конического капилляра
[00807] На Рисунке 20 и Рисунке 21 показаны размеры конического капилляра.
[00808] Rb = радиус основания конуса
[00809] L = длина
[00810] L1 = расстояние от (выступающей) верхней части конуса до нижнего мениска пробы
[00811] L2 = расстояние от (выступающей) верхней части конуса до нижней части верхнего мениска
[00812] Вводимый объем = π*(Rb/L)^2*[(L1)^3-(L2)^3]/3
[00813] Tg θ=Rb/L
Пример 8: Влияния менисков жидкости
[00814] Хорошо известно, что жидкости в капиллярах имеют изогнутый мениск. В зависимости от угла контакта мениски могут быть вогнутыми или выпуклыми по отношению к жидкости. Когда не прикладывается суммарное наружное давление, если поверхность капилляра гидрофильная (угол контакта < π/2), мениск будет вогнутым, или выпуклым, если поверхность гидрофобная (угол контакта > π/2). Когда к столбику жидкости прикладывается суммарное давление (капилляр ориентирован вертикально или пневматическое давление прикладывается прибором), нижний мениск может выступать ниже нижнего конца капилляра. В капиллярах малого диаметра силы поверхностного натяжения велики по отношению к небольшой силе притяжения поперек мениска. Давление поверхностного натяжения поперек мениска в вертикально-ориентированном круглом капилляре составляет 2π*R*γ*cosθ, где γ - это поверхностное натяжение, а θ - угол контакта. Давление поперек мениска, вызываемое силой притяжения равно pgAL/(π*R^2), где ρ - плотность жидкости, a ΔL - расстояние поперек мениска, a g - константа гравитации. Соответственно, поверхность мениска является сферической. Объем жидкости в сегменте (сегментах), занятых мениском (менисками) может быть рассчитан, как показано внизу, и использован для более точных расчетов объема.
[00815] Расстояния определяются от дна капилляра проб
[00816] L1 = расстояние от нижней части нижнего мениска
[00817] L2 = расстояние от верхней части нижнего мениска
[00818] L3 = расстояние от нижней части верхнего мениска
[00819] L4 = расстояние от верхней части верхнего мениска
[00820] Объем сферической верхушки
[00821] πh(3а2+h2)/6
[00822] Размеры сферической верхушки показаны на Рисунке 22.
[00823] Может возникнуть несколько разных ситуаций, определяемых числом и расположением менисков. Обратите внимание, что формулы, данные внизу, относятся как к вогнутым, так и выпуклым менискам.
[00824] Ситуация 1: Верхний мениск изогнут, нижний - горизонтальный (как показано на Рисунке 23)
[00825] Заменяем: а=R, h=L4-L3
[00826] Объем между L3 и L4=π*(L4-L3)*(3*(R)2+(L4-L3)2)/6
[00827] Общий объем = π*((R2)*L3+(L4-L3)*(3*(R)2+(L4-L3)2)/6)
[00828] Ситуация 2: Оба мениска находятся внутри капилляра и являются изогнутыми (как показано на Рисунке 24)
[00829] Общий объем=π*((R2)*L3-(L2-L1)*(3*(R)2+(L2-L1)2)/6+(L4-L3)*(3*(R)2+(L4-L3)2)/6
[00830] Ситуация 3: Имеются два изогнутых мениска. Нижний - изогнут и находится ниже нижнего конца капилляра (как показано на Рисунке 25)
[00831] Общий объем = π*((R2)*L3+(L1)*(3*(R)2+(L1)2)/6+(L4-L3)*(3*(R)2+(L4-L3)2)/6)
Пример 9: Пузырьки
[00832] Пузырьки в жидких пробах и реагентах приводят к колеблющимся уменьшениям объема измеряемой жидкости. В небольших капиллярах, когда пузырьки меньше поперечного сечения капилляра, они имеют сферическую форму. Когда они больше, то занимают цилиндрический объем (в цилиндрическом капилляре) и имеют полусферические концы.
[00833] Ситуация 1: Пузырек не настолько велик, чтобы распространиться на ширину капилляра (как показано на Рисунке 26)
[00834] Вычесть объем пузырька = (4/3)*π*r3
[00835] Ситуация 2: Пузырек занимает всю ширину капилляра (как показано на Рисунке 27)
[00836] Вычесть объем пузырька = 4π*R3+π*R2*L
Пример 10: Кровь висит снаружи конца капилляра
[00837] Ситуация 1: Кровь или реагенты, висящие снаружи вертикального капилляра, могут вызвать очень значительные проблемы в анализах, поскольку в этом случае анализ находится вне контроля. Как показано на Рисунке 28, система получения изображений может легко распознавать такую ситуацию.
[00838] Ситуация 2: Кровь снаружи капилляра, но не в висячем положении
[00839] Остаточная кровь за пределами капилляра также представляет собой проблематичную ситуацию, поскольку является возможным источником загрязнения реагентов и излишнего объема. И снова система получения изображений может распознавать такую ситуацию.
Пример 11: Остаточная кровь внутри капилляра после дозирования пробы
[00840] С этим можно справиться, подсчитав остаточный объем и вычтя его из общего объема пробы. На Рисунке 29 показан пример капилляра с остаточной кровью.
[00841] Остаточный объем = π*R2*L
Пример 12: Оценка отделения красных кровяных телец от проб крови
[00842] Для многих анализов желательно удалить красные кровяные тельца из крови и, таким образом, приготовить плазму. Когда это сделано, желательно, особенно для устройств анализа по месту, знать, насколько эффективным было это разделение, и чтобы определить, плазмы достаточно для выполнения анализа.
[00843] Рисунок 30 - На Рисунке 39 схематично показан один из предпочтительных вариантов удаления красных кровяных телец, который подходит для устройств анализа по месту настоящего изобретения. В ячейку, в которую будет добавлена проба крови, предварительно вводится сухая композиция намагничивающихся частиц с антителами для красных кровяных телец, смешанных со свободными для красных кровяных телец антителами, как показано на Рисунке 30. Когда в ячейку добавляется проба крови (показано на Рисунке 31) и смешивается с магнитным реагентом (показано на Рисунке 32, Рисунке 33 и Рисунке 34), красные кровяные тельца склеиваются с магнитными частицами и могут быть удалены, если поместить ячейку с кровью рядом с сильным магнитом (показано на Рисунке 35). Если надлежащим образом подвинуть ячейку к магниту, красные тельца будут отделяться от плазмы (показано на Рисунке 36), которую потом можно будет извлечь в приемную ячейку для анализа (показано на Рисунке 37, Рисунке 38 и Рисунке 39). Очевидно, что анализ изображений может определить, насколько эффективно прошло разделение, и подсчитать объем плазмы, имеющийся в наличии для анализа.
Пример 13: Изображения жидких проб в капиллярах
[00844] На Рисунке 40 показано высококонтрастное изображение цилиндрического микродозатора, содержащего жидкость с низкой абсорбирующей способностью.
[00845] На Рисунке 41 показано изображение конического микродозатора, содержащего жидкость с высокой абсорбирующей способностью.
[00846] На Рисунке 42 показан микродозатор с жидкостью с высокой абсорбирующей способностью, и показаны два мениска внутри микродозатора.
[00847] На Рисунке 43 показан микродозатор с жидкой пробой и большими пузырьками, которые распространяются по диаметру наконечника.
[00848] На Рисунке 44 показан микродозатор с водой и показан четкий верхний мениск в прозрачном микродозаторе или капилляре.
[00849] Рисунок 41 анализировался на длину столбика жидкости (соответствующего 5 мкл) и разрешающую способность верхнего мениска жидкости (Положение мениска определено с надежностью > 90%). Точность расположения мениска соответствовала < 1% длины столбика жидкости.


Пример 14: Влияние недостаточного объема пробы на результат анализа
[00850] Система использовалась для измерения содержания Белка-С в крови. Заданный объем пробы, который вводился в систему, составлял 20 мкл, когда устройство перекачки пробы использовалось надлежащим образом. Прибор был настроен на анализ 10 мкл крови из пробы. Концентрация анализируемого вещества, подсчитанная системой, показана на Рисунке 45 по мере того, как объем пробы специально уменьшался по отношению к целевому значению. Результат был фактически постоянный, пока объем пробы не стал меньше требуемого объема.
Пример 15: Устройство перекачки пробы
[00851] На Рисунке 46 показан пример устройства для перекачки пробы. Устройство состоит из (а) капилляра (сделанного из стекла или пластика), по выбору покрытого антикоагулянтом или другим реагентом, подходящим для обработки пробы перед анализом, (b) корпуса, удерживающего капилляр, оборудованного (с) плунжером (поршень), который может скользить внутри корпуса и у которого есть выступающая часть, скользящая внутри канавки в корпусе, (d) канавки в корпусе, которая принимает поршень и ограничивает осевое движение плунжера так, что его движение останавливается после вытеснения пробы, и (е) воздушного отверстия в корпусе, которое в нормальном состоянии открыто, но блокируется, когда плунжер приводится в движение (движется по направлению к дальнему концу устройства), чтобы вытеснить всю жидкость из капилляра.
[00852] На Рисунке 47 показано устройство перекачки пробы с капилляром, заполненным пробой. Указана "метка максимального заполнения".
[00853] На Рисунке 48 показано устройство перекачки пробы и вытеснение пробы при движении плунжера.
[00854] На Рисунке 49 показано устройство перекачки пробы после полного удаления пробы.
Пример 16: Измерение объема посредством анализа изображений
[00855] Известные объемы пробы жидкости были набраны в микродозаторы для проб с помощью пипеточного устройства. Изображения микродозаторов собирались коммерческим планшетным сканером (Dell), а расстояния (а) от дальнего конца микродозатора до мениска и (b) от дальнего конца микродозатора до детали, помеченной на изображении внизу, измерялись. Ориентация наконечника и его положение по отношению к оригиналодержателю сканера не контролировались, так, как изображение анализировалось путем измерения соотношения расстояния (а) к расстоянию (b) как меры объема пробы. Положения наконечника, мениска и помеченной детали измерялись с помощью коммерческого ПО для распознавания изображений (Jasc). Изображение было ориентировано горизонтально с помощью ПО перед тем, как производилась запись месторасположений, и информацию можно было читать напрямую на шкале, предоставляемой ПО. На Рисунке 50 показан пример изображения.
[00856] Расстоянием L1 было расположение микродозатора.
[00857] Расстоянием L2 было расположение мениска.
[00858] Расстоянием L3 было расположение стрелки, указанной на Рисунке 50.
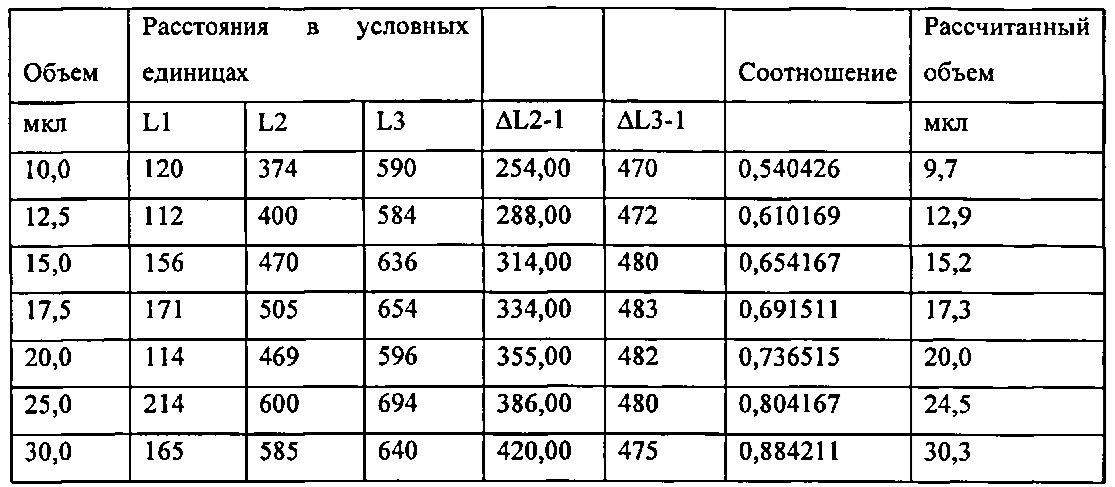
[00859] Как показано на Рисунке 51, объем был просто взят в зависимости от соотношения расстояний, и его можно было подсчитать. В среднем рассчитанный объем отличался от действительного менее, чем на 2%.
Пример 17: Изображения крови, отцентрифугированной в микродозатор
[00860] Гематокриты определялись по цифровым изображениям измерением соотношения длины столбика упакованных красных кровяных телец и общей длины столбика жидкости (от микродозатора до мениска). Это легко выполнялось с помощью ПО для распознавания меток, которое ориентировало микродозатор в известном направлении и считало пиксели между метками. Для вышеуказанных микродозаторов расстояния соответствовали нескольким сотням пикселей, что позволяло выполнять точные измерения.
[00862] На Рисунке 10 показан пустой микродозатор для проб с крышкой.
[00862] На Рисунке 11 показан микродозатор с крышкой и пробой крови.
[00863] На Рисунке 12 показан микродозатор с крышкой, содержащий 23% пробу гематокрита из крови после центрифугирования.
[00864] На Рисунке 13 показан микродозатор с крышкой, содержащий 31% пробу гематокрита из крови после центрифугирования.
[00865] На Рисунке 14 показан микродозатор с крышкой, содержащий 40% пробу гематокрита из крови после центрифугирования.
[00866] На Рисунке 15 показан микродозатор с крышкой, содержащий 52% пробу гематокрита из крови после центрифугирования.
[00867] На Рисунке 16 показан микродозатор с крышкой, содержащий 68% пробу гематокрита из крови после центрифугирования.
[00868] На Рисунке 17 показано сравнение измерений гематокрита с помощью системы цифровых изображений для отцентрифугированной пробы (гематокрит, % сообщенных значений) и гематокрита, измеренного по стандартным методикам (гематокрит, % целевых значений). Пример стандартной методики измерения гематокрита может включать измерение микрогематокрита в стеклянном капилляре с использованием стандартной лабораторной центрифуги и измерение длины слоя с упакованными красными кровяными тельцами и общей длины капилляра, заполненного пробой.
Пример 18: Система, включающая компоненты для разделения крови
[00869] Система, сконструированная для разделения крови, может включать следующие особенности:
[00870] 1. Конструкцию микродозатора.
[00871] а. Характеристическое соотношение около 20:1 длина: диаметр обеспечивает достаточно удобные длины для измерения пробы, упакованных телец и объемов плазмы.
[00872] b. Формы микродозаторов способствуют большей герметичности между дозатором и виниловой крышкой, и крышка легко удаляется при необходимости.
[00873] с. Небольшой угол линейного уклона конической формы основной детали микродозатора и более широкая коническая верхняя секция дозатора являются оптимальными для ввода средств для восстановления плазмы. Обратите внимание, что "противорадиальная" конструкция (дозатор уже в дальнем конце по отношению к оси вращения) является необычной.
[00874] d. Сконструирована более широкая верхняя секция микродозатора, чтобы можно было ее разместить на автоматическом пипеточном устройстве и перемещать по осям x-y-z. Обеспечивается соединение, при котором образуется регулируемая герметичная связь с жидкостью и которое можно легко удалить, когда потребуется.
[00875] 2. Использование очень точной и надежной системы координат x-y-z для перемещения микродозатора для восстановления плазмы.
[00876] 3. Использование автоматической технологии получения изображений для контроля выполнения операций центрифугирования и восстановления плазмы. Перемещение микродозатора восстановления плазмы в пределах расстояния менее одного миллиметра от интерфейса упакованных красных кровяных телец.
Пример 19: Использование измерения изображения объемов жидкости для улучшения калибровки анализа
[00877] Автоматические пипеточные устройства обычно имеют погрешность и точность до приблизительно 5% или менее в интервале (скажем) 5-50 мкл. Для многих анализов оба значения погрешности и точности определения объема должны быть очень хорошими (скажем < 2%), чтобы получить требуемую погрешность и точность измерений анализируемого вещества. Измерение и доставка (1) жидкостей с объемами менее 5 мкл (являются очень желательными, когда необходимо максимально использовать небольшой объем пробы), и (2) жидкостей с "проблематичными" физическими свойствами (такими, как вязкие растворы, растворы с детергентами и другие) часто могут иметь большие погрешности и малые значения точности, что ставит под угрозу точность результатов анализа. Одним из творческих решений таких проблем является использование анализа изображений жидкостей для измерения их объемов (проб, растворителей, реагентов, калибраторов и контрольных жидкостей), а потом корректировка функции калибровки анализа, чтобы сделать допуск на отклонения (до [скажем] 20%) от намечаемого объема. Мы показали, что с пипеточными микродозаторами, у которых очень точные размеры, могут быть выполнены измерения небольших объемов, вплоть до 5 мкл, с очень хорошей погрешностью и точностью (<2%). Внизу мы обосновываем (1) погрешность и точность измерения объемов и (2) использование известных соотношений между объемами растворов, применяемых в анализах (проб, реагентов и других), и ответную реакцию системы анализа, чтобы исправить калибровку анализов.
[00878] (1) Погрешность измерения объема методом анализа изображений:
[00879] В таблице внизу известные объемы раствора бромфенолового синего были набраны в конические наконечники.
[00880] Растворы поместили в среднюю часть микродозатора и получили их изображение с помощью сканера. Ориентация и положение микродозатора определялись стандартными методами. Ориентация микродозатора регулировалась алгоритмом, и измерялась длина столбика жидкости. Объем жидкости рассчитывался с использованием известных внутренних размеров микродозатора. Для четырех аликвот в четырех микродозаторах были получены четыре дублирующих изображения. Таким образом, ошибка, данная внизу, отражает воспроизводимость изображения и погрешность и точность размеров микродозатора.

[00881] Обратите внимание, что измерение объема не основывается на точности расположения жидкости в микродозаторе. Анализ изображения дает информацию касательно расположения жидкости в микродозаторе. Зная размеры микродозатора, всегда можно подсчитать объем по части дозатора, занятой жидкостью, независимо от того, где она располагается.
[00882] (2) Корректировка калибровки анализа при включении измеренного объема жидкости
[00883] Это достигается, как показано в следующем моделировании. Рассмотрим анализ, в котором проба соединена с двумя реагентами (названными 1 и 2). Целевой объем для пробы, реагента 1 и реагента 2 составляет 10 мкл. Результаты анализа рассчитываются по стандартной кривой, связывающей измеренный сигнал с концентрацией анализируемого вещества. Можно выполнить эксперименты как часть процесса калибровки, в которых объемы для пробы и реагентов меняются на 8 и 12 мкл в дополнение к 10 мкл, и результаты анализа рассчитываются, основываясь на калибровке, предназначенной для объемов 10 мкл. На Рисунке 105, Рисунке 106 и Рисунке 107 результаты были нанесены на график в зависимости от действительных объемов. Для объема пробы результат анализа фактически прямо пропорционален использованным объемам (показанным на Рисунке 105). Для реагентов были отмечены несколько непрямолинейные ответные реакции (показанные на Рисунке 106 и Рисунке 107). Эти ответные реакции основаны на "типовых" анализах, хорошо известных по полю, и величина изменений в зависимости от объема является репрезентативной.
[00884] Потом мы моделировали оценку, когда мы налагали степень случайной ошибки (приблизительно 5%, чтобы представить "ситуацию из реальной жизни") на результаты анализа в дополнение к воздействиям ненадлежащих объемов. Мы включили результаты, в которых объемы пробы, реагента 1 и реагента 2 настроены на 8, 10 и 12 мкл для всех комбинаций. Когда результаты этого упражнения были внесены в график, как показано на Рисунке 108 без корректирования ошибок объема, то следовало бы ожидать, что в сообщаемом результате есть значительная ошибка из-за игнорирования того факта, что использованные действительные объемы отличались от тех, которые использовались для калибровки анализа.
[00885] Когда мы допускаем колебания объема по отношению к целевым значениям, используя известную ответную реакцию анализа на объемы, и располагаем откорректированные значения для анализируемого вещества на графике, тем не менее, получаемый нами результат, показанный на Рисунке 109 оказывается гораздо лучше. Это достигалось множественным анализом регрессии данных.
[00886] Сводная статистика, в которой сравниваются результаты, рассчитанные с и без корректировки объема, дана в таблице внизу и отображает существенное улучшение всей системы показателей при использовании корректировки объема. "SEE" является стандартной ошибкой расчетов.

Пример 20: Чтение анализа ингибирования гемагглютинации с использованием микроскопии и анализа изображений:
[00887] Соляной раствор с фосфатным буфером (100 мкл), содержащий 0,3%-ный раствор красных кровяных телец индюшки, стабилизированный глутаральдегидом, без корректировки объема, и 0,5 мг/мл бычьего сывороточного альбумина, и, где указано, 2 гемагглютинированные единицы неактивированного вируса гриппа и 15 мкг поликлонированных антигриппозных козьих В-антител инкубировались в течение 15 минут в конической пробирке для полимеразной цепной реакции при комнатной температуре. Продукт реакции со дна пробирки был перенесен на прозрачную выдвижную деталь, просвечиваемую белым светом, и цифровым фотоаппаратом было снято изображение с 4-кратным увеличением. Как можно видеть на Рисунке 131, склеивание, вызванное красными кровяными тельцами, с гемагглютинином вируса (Рисунок 131 проба 3) легко наблюдается по сравнению с неагглютининованной контрольной пробой (Рисунок 131 проба 1). Когда в пробе были также избыточные антитела вируса, агглютинация полностью подавлялась. Следует отметить два воздействия реакции агглютинации: (1) в агглютинированных пробах наблюдается больше красных кровяных телец из-за более быстрого осаждения агглютинатов по сравнению с контрольной пробой и (2) каждое красное кровяное тельце в среднем больше сгруппировано с другими красными кровяными тельцами. С помощью ПО по распознаванию изображений можно выполнить количественные расчеты по реакции агглютинации, чтобы распознать, найти и подсчитать красные кровяные тельца и агглютинаты. В пробе 1 на Рисунке 131 показана неагглютинированная контрольная проба (без вирусов и антител). В пробе 2 на Рисунке 131 показана неагглютинированная проба (вирус плюс антитело).
[00888] В пробе 3 на Рисунке 131 показана агглютинированная проба (вирус, без антитела). Пример 21: Приготовление пробы, исследование качества надосадочной жидкости и подсчет качества липопротеинов низкой плотности (LDL) осадка
[00889] Плазма разбавлялась (1:10) до смеси декстран сульфата (25 мг/дл) и сульфата магния (100 ммоль), потом инкубировалась в течение 1 минуты для осаждения холестерина LDL. Продукт реакции набирался в пробирку для центрифугирования, потом закрывался крышкой и центрифугировался со скоростью 3000 оборотов в минуту в течение трех минут. Были сняты изображения первоначальной реакционной смеси до центрифугирования (где показан белый осадок), после центрифугирования (где показана чистая надосадочная жидкость) и крупинок LDL-холестерина (после удаления крышки). Например, на Рисунках 132, 134 показаны изображения продукта реакции.
[00890] Изображения продукта реакции осаждения LDL анализировались следующим образом. Цветовые уровни массива элементов изображения (пикселей) располагались на графике как функция их вертикального положения. Измерялись колебания значений, и суммировались значения для трех цветов. Из-за частиц осажденного LDL, которые сильно рассеивают свет, число для осадка (1154) было гораздо больше, чем (672) для чистой надосадочной жидкости. Сравнение числа для надосадочной жидкости с числом для контрольной пробы, которая не подвергалась воздействию реагента осаждения, дает возможность проанализировать качество центрифугирования (данные не показаны). На Рисунке 133 показаны примеры изображений, которые анализировались перед вращением центрифуги и после него.
[00891] После снятия черной виниловой крышки было сделано изображение осадка LDL. Его объем можно измерить с небольшой погрешностью, зная геометрию микродозатора и размер пикселя на изображении. В этом эксперименте объем осадка был рассчитан как равный 0,155+/-0,015 мкл.
Пример 22: Улучшение выполнения анализа для аминотрансферазы аланина (ALT) с помощью бланкирования оптических сигналов для 3-цветового изображения, обусловленного пробой
[00892] Аланинтрансферазу в сыворотке можно измерить в анализе, в котором энзим превращает аланин в пируват, который, в свою очередь, используется для получения пероксида водорода с кислородом и пирувата оксидазы. Потом пероксид используется для приготовления цветного продукта с помощью энзим пероксидазы из хрена, аминоантипирена и N-этил-N-(3-сульфопропил)анилина. Цветной продукт максимально абсорбируется при 560 нм.
[00893] Было найдено, что некоторые пробы сыворотки имеют значительную абсорбирующую способность при этой длине волны, как показано на Рисунке 135, и соответственно интерферировали с анализом. В частности, когда использовались относительно высокие концентрации проб (такие, как при заключительном разбавлении в анализе 1:10), анализ 3-цветного изображения анализа аланинтрансферазы давал неудовлетворительные результаты с клиническими пробами.
[00894] На Рисунке 135 показаны спектры нескольких проб сыворотки, разбавленных 1:10 в буферном растворе; оптическая плотность располагается на графике в зависимости от длины волны (нм). Большие колебания оптической плотности показаны на Рисунке 135.
[00895] В обычной спектроскопии этот вопрос решается снятием показания холостой пробы без добавленных ингредиентов анализа и вычитанием значения для холостой пробы из сигнала создаваемого анализом. В анализе 3-цветного изображения, как в данном изобретении, было найдено, что можно использовать аналогичный метод. Можно получить изображение разбавленной пробы и экстрагировать значения для трехцветного изображения. Потом можно изменить калибровочный алгоритм анализа, чтобы включить сигналы от непрореагировавшей пробы. Применительно к данному случаю, первоначальный алгоритм (без включения сигнала холостой пробы) был: Концентрация аланинтрансферазы = а+b*R+c*G+d*B+e*R2, где a, b, с, d и е являются эмпирически выводимыми константами, a R, G, В - это значения сигналов в красном, зеленом и синем каналах, соответственно. Улучшенный алгоритм был таким: Концентрация аланинтрансферазы = а+b*R+c*G+d*B+e*Rs,+f*Rs2, где Rs - это сигнал от холостой пробы в красном канале (обратите внимание, что эмпирически выводимые значения а, b, с, d и е отличались от тех же значений первоначального алгоритма).
[00896] Когда измерялись 21 проба сыворотки, в которых активность аланинтрансферазы варьировалась от 0 до 250 единиц/литр, с трехкратным копированием, и результаты анализа 3-цветного изображения сравнивались с результатами, полученными по методу клинической лаборатории (Тесо), была получена следующая статистика регрессии, показывающая существенно улучшенные результаты.

Пример 23: Ускорение и предоставление объективного анализа испытания на ингибирование гемагглютинации для антигриппозных антител
[00897] Реакционная смесь готовилась, как описано в Примере 20, инкубировалась только в течение одной минуты, затем вводилась в три разные микроканала (как описано выше в примерах для цитометрии) и снималось изображение. Было сделано около 5-10 изображений для каждой пробы, чтобы получить адекватную статистику. В среднем, каждое изображение состоит приблизительно из 800-900 телец. Процесс агглютинации можно объективно оценить, измерив радиальное распределение телец вокруг репрезентативно выбранных отдельных телец с использованием функции.
[00898] Изображения обрабатывались для получения центроидных положений отдельных телец в 2D -формате. Положения 2D использовались для расчета функции радиального распределения (RDF), известной также как функция парных корреляций. Функция радиального распределения, g(r) количественно определяет вероятность нахождения тельца на расстоянии от выбранного тельца. Математически,
g(r)=ρ(r)/ρo,
где p(r)2πrdr - это количество телец, найденных на расстоянии r от конкретного тельца, а ρo - это средняя плотность телец по всему окну изображения. Значение g(r) рассчитывается как среднее для всех частиц в изображении и по многим изображениям, чтобы гарантировать статистически значимый результат.
[00899] Результаты
[00900] Значение первого пика g(r) количественно определяет число дубликатов пробы. Следовательно, g(r) для агглютинированных проб должна быть больше по величине по сравнению с другими двумя пробами. Значение g растет быстро от 0 до максимума на протяжении расстояния приблизительно в 20 пикселей (соответствующего приблизительно 12 микрон, что приблизительно в два раза больше диаметра красного кровяного тельца), потом уменьшается приблизительно до 1,0. Как показано внизу, агглютинация из-за вируса отличалась от отсутствия агглютинации, когда вируса не было, или антитело ингибировало вызванную вирусом агглютинацию.

Пример 24: Приготовление систем распознавания анализируемого вещества с использованием аптамеров
[00901] Два олиго-ДНК-аптамера были созданы для того, чтобы избирательно улавливать белки (тромбин и инсулин). Олиго-ДНК-аптамер состоял из связывающего участка, имеющего последовательность, выбранную из опубликованных данных, инертную часть для увеличения связывающего участка с поверхности шарика или микроанализа, и реакционной группы, чтобы химически привязать аптамер к поверхности. Аптамер 1 (специфический для тромбина) имел следующую последовательность: 5'-Am-(T)45GGTTGGTGTGGTTGG-3'. У Аптамера 2 (специфического для инсулина) последовательность была следующая: 5'-Am-(T)32ACAGGGGTGTGGGGACAGGGGTGTGGGG-3'. Обозначение "Am" в начале каждой последовательности означает "аминогруппа".
[00902] Два аптамера были привязаны к шарикам полистирола (5 микрон), функционализированных карбоксильными группами. Потом шарики промывались, и избыток реагента удалялся. Затем шарики смешивались с образцами олиго-ДНК, флуоресцентно помечались и становились взаимодополняющими для связывающих участков аптамеров. Гибридизация образцов с аптамерами фиксировалась с помощью флуоресцентной эмиссии. Только взаимодополняющие образцы показали процесс положительной гибридизации, согласно измерениям, сделанным с помощью флуоресцентной эмиссии. Специфичность гибридизации иллюстрируется сравнением Рисунка 139, где показаны шарики после гибридизации с взаимодополняющим образцом, с Рисунком 140, где показаны шарики после гибридизации с невзаимодополняющим образцом. Распознавание выполнялось с помощью лазерного излучения при 635 нм, а эмиссия фильтровалась при 650 нм (±10 нм) на фотоаппарате с ПЗС, после размещения шариков на аналитическом субстрате. Аналогичная процедура использовалась на стеклянной поверхности, покрытой эпоксисиланом для привязывания Аптамеров 1 и 2. Анализ гибридизировался с флуоресцентным образцом, и специфичное распознавание места связывания аптамера измерялось распознаванием флуоресцентной эмиссии установленным фотоаппаратом с ПЗС и сканером анализа (Inopsys). На рисунке 141 показана связывающая специфичность аптамеров в анализе, подробности показаны на Рисунке 142. На Рисунке 143 показан пример просканированного анализа.
Пример 25: Распознавание анализируемого вещества с использованием аптамеров
[00903] Анализ, включающий Аптамер 1, гибридизированный с флуоресцентно помеченным, взаимодополняющим образцом; взаимодополняющий образец был приготовлен, как в Примере 24. Тромбин вводился в анализ при концентрации около 100 наномолярного раствора, позволяющей реагировать с комплексом образца Аптамера 1. Сигнал флуоресцентной эмиссии от Аптамера 1 в анализе уменьшался в 2,5 раза, что указывало на смещение образца при связывании Аптамера 1 и тромбина.
Пример 26: Связующие
[00904] Использовались два типа связующих, которые биотинилировались и применялись для создания улавливающих поверхностей на твердой фазе единицы анализа, покрытой авидином. Выработка реагента анализа и считываемые результаты анализа, основанного на люминесценции, получены с использованием (1) аптамеров и (2) одноцепочечных фрагментов Fv антител (SCFVs - одноцепочечный вариабельный фрагмент) на пластинах микротитратора. Аптамер и SCFV как связующие для анализов на люминесцентной основе можно приспособить к микродозаторам, системам получения изображений и к устройствам, предоставляемым в этой работе. Анализируемые вещества могут подвергаться анализу, а результаты прочитываться с использованием фотоаппаратов для измерения цвета при смене создающего сигнал реагента, от щелочной фосфатазы до, например, пероксидазы хрена с хромогенным субстратом, или с использованием щелочной фосфатазы с хромогенным субстратом. Микродозаторы в пластине микротитратора (или других форматах) могут прочитываться в любом картриджном (единица анализа) формате.
Пример 27: Анализ витамина D с использованием аптамеров ДНК на пластине микротитратора
[00905] В этом примере анализ витамина D выполнялся с использованием аптамеров ДНК с одной нитью. На биотинилированные аптамеры ДНК наносилось покрытие на покрытой ультравидином полистирольной поверхности пластины микротитратора с множеством ячеек. Перед нанесением покрытия аптамеры быстро денатурировались и ренатурировались при нагревании до приблизительно 95 градусов Цельсия, потом сразу охлаждались льдом. Потом добавляли приблизительно 15 микролитров заново свернутых биотинилированных аптамеров ДНК витамина D в 25 ммоль трис-соляного буферного раствора, содержащего NaCl, MgCl2, 10% этанола, pH 7,5, в каждую ячейку для образования поверхностей захвата. После нанесения покрытий ячейки промывали и блокировали приблизительно 100 мкл блокирующего реагента для снижения не относящегося к эксперименту связывания.
[00906] Анализируемое вещество для анализа (витамин D) разбавляли в трис-соляном растворе, NaCl, MgCl2, 10% этанола, pH 7,5; и смешивали с раствором витамина D-конъюгата щелочной фосфатазы при различных концентрациях в требуемом для анализа диапазоне, и предоставляли в аналитическую установку для 10-минутной инкубации при комнатной температуре. Аналитическая установка потом промывалась три раза 100 мкл промывочного буферного раствора. В каждую ячейку для анализа добавлялось приблизительно 40 мкл субстрата для щелочной фосфатазы, и спустя 10 минут, собирались данные по хемилюминесценции (таблица внизу). На Рисунке 144 показан график зависимости хемилюминесценции от концентрации (нанограмм/мл) витамина D.


Пример 28: Анализ эстрадиола на пластине микротитратора
[00907] В этом примере выполнялся анализ для стероидного гормона (эстрадиола) с использованием одноцепочечных вариабельных фрагментов (scfv). В этом анализе внутренняя поверхность аналитической установки покрывалась биотинилированным SCFV на покрытой ультравидином полистирольной поверхности пластины микротитратора с множественными ячейками. В каждую аналитическую установку добавлялось около 15 микролитров 1 мкл/мл биотинилированного SCFV в трис-соляном буферном растворе с pH 8; 0,03% BSA, 0,05% тимеразола. После промывки каждая аналитическая установка закреплялась 100 мкл закрепляющего реагента с последующей сушкой сухим воздухом в течение ночи и хранением с влагопоглотителем.
[00908] Анализируемое вещество (свободный эстрадиол) разбавлялось в трис-соляном буферном растворе (БСР), pH 8, БСР, тимеразол, смешивалось с эстрадиолом-конъюгатом щелочной фосфатазы в стабилизаторе от Biostab и поставлялось в аналитическую установку с покрытием из SCFV в течение приблизительно 10 минут при комнатной температуре.
[00909] Потом аналитические ячейки промывались 5 раз 100 мкл промывного буферного раствора. После промывки в каждую установку для анализа добавлялось 40 мкл люминесцирующего субстрата для щелочной фосфатазы (KPL PhosphaGlo), и данные хемилюминесценции собирались в течение 10 минут (таблица внизу). На Рисунке 145 показан график зависимости хемилюминесценции от концентрации (пикограмм/мл) эстрадиола.

Пример 29: Подсчет белых кровяных телец и дифференциальный анализ
[00910] Концентрация белых кровяных телец (WBC) в периферической крови человека может варьироваться от приблизительно 1000 телец/мкл до 100,000 телец/мкл. Однако, в некоторых случаях диапазон системы получения изображений является более ограниченным, таким, как от приблизительно 4000 телец/мкл до 7000 телец/мкл. Если концентрация телец меньше 4000 телец/мкл, система может быть не в состоянии подсчитать целевое значение 10000 телец, что может быть необходимо для анализа. Если концентрация телец в пробе составляет более 7000 телец/мкл, то каждое поле зрения может быть слишком загромождено, чтобы выполнить точную сегментацию изображения и подсчет телец. Типовой подход для получения изображений белых кровяных телец дан внизу.
[00911] В одном примере предоставляется система получения изображений (например, цитометр), сконфигурированная для флуоресцентной спектрофотомерии. В системе используется флуоресцентная спектрофотомерия для измерения концентрации телец в пробе. Проба помечается флуоресцентно-конъюгированными антителами для получения изображений (например, AF647-CD45) и также флуоресцентным маркером нуклеиновой кислоты (например, DRAQ5). Считывание количественных данных флуоресценции на модуле спектрометра обеспечивает измерение концентрации белых кровяных телец при низкой чувствительности (LLOQ (нижний предел количественной оценки) приблизительно составляет 5000 телец/мкл), но высоком динамическом диапазоне (например, 5000-100000 телец/мкл). Концентрация, измеренная на спектрофотометре, дает возможность подсчитать оптимальное отношение разбавления, такое, что окончательная концентрация взвеси отмытых клеток находится между 4000-7000 телец/мкл.
[00912] На Рисунке 146 показан высокий динамический диапазон флуоресценции при спектрофотометрическом измерения концентрации белых кровяных телец. Белые кровяные тельца помечались флуоресцентным веществом анти-CD45, а другие антитела возбуждались красным светом с длиной волны около 640 нм, и собирался эмиссионный спектр количественной флуоресценции. Интегрированная флуоресценция размещена на оси у.
Пример 30: Распознавание стрептококков группы А с помощью изотермического увеличения
[00913] Изотермическое увеличение отдельных геномных проб может распознаваться по мутности. В этом примере геномная проба, экстрагированная из клеток стрептококков группы А (StrepA) (концентрация исходного раствора = 2×108 орг/мл из My biosource) увеличивалась с помощью изотермического увеличения, и протекание реакции измерялось по мутности. Приблизительно 5 мкл исходного раствора клеток бактерий и 45 мкл воды качества RT PCR (полимеразная цепная реакция с обратной транскрипцией) (10Х разбавление исходного раствора) нагревались при приблизительно 95 градусах Цельсия в течение 8-10 минут (происходит разрыв клеток и освобождение ДНК). Геномная проба разбавлялась и вводилась в пробу объемом приблизительно 25 мкл в пробирке для полимеразной цепной реакции, содержащей реагенты для увеличения (например, ДНК-полимеразу, праймеры, буферный раствор). Пробирка для полимеразной цепной реакции инкубировалась при приблизительно 61 градусе Цельсия в течение приблизительно 60 минут, пока протекание реакции фиксировалось по мутности. Результаты даны внизу, а на Рисунке 147 показаны графики мутности в зависимости от времени:

[00914] Проводились три отдельных эксперимента при 800 копиях/мкл и 80 копиях/мкл. Эксперимент А проводился со Стреп А, имеющем синтетический геномный шаблон ДНК (от Genescript). Эксперимент В проводился разбавлением исходного Стреп А в 10 раз с последующей дезактивацией под действием тепла при 95 градусах Цельсия в течение приблизительно 8-10 минут, и с последующим серийным разбавлением дезактивированного теплом разбавленного в 10 раз исходного Стреп А. Эксперимент С проводился с использованием варьирующей концентрации исходного Стреп А (дезактивированных клеток бактерий) с последующей дезактивацией теплом при 95 градусах Цельсия в течение приблизительно 10 минут. Точки перегиба кривой для каждого эксперимента показаны на Рисунке 148. Для каждой из 800 копий/мкл и 80 копий/мкл три сгруппированных графика включают Эксперимент А слева, Эксперимент В в середине и Эксперимент С справа. Средние точки перегиба даны в следующей таблице:

Пример 31: использование магнитных шариков
[00915] В этом примере используются магнитные шарики для анализа белков и небольших молекул в иммуноферментных анализах (ИФА). На Рисунке 110 схематично показан типовой метод для ИФА. Анализы включают два белка, Белок 1 и Белок 2. Проба Белка1 разбавляется примерно в 150 раз (протокол для микродозатора = в 30 раз), объем пробы примерно 0,007 мкл, объем разбавленной пробы примерно 1 мкл, объем реакционной смеси примерно 3 мкл и время реакции - примерно 10 минут (мин) (инкубация пробы и инкубация субстрата). Результаты для Белка 1 показаны в следующей таблице. Результаты Испытания 2 для Белка 1 показаны на Рисунке 149.


[00916] Проба Белка 2 разбавлялась примерно в 667 раз, объем пробы был примерно 0,0015 мкл, объем разбавленной пробы - примерно 1 мкл, объем реакционной смеси - примерно 3 мкл, и время реакции - примерно 10 мин (инкубация пробы и инкубация субстрата). Результаты для Белка 2 показаны в следующей таблице. Результаты Испытания 1 для Белка 2 показаны на Рисунке 150.

[00917] Из вышеупомянутого следует заключить, что в то время, как конкретные воплощения были проиллюстрированы и описаны, для них могут быть сделаны различные модификации, и в настоящей работе это рассматривается. Также не предполагается, что изобретение будет ограничено конкретными примерами, предоставленными в пределах описания патента. В то время, как изобретение было описано со ссылкой на упомянутое выше описание патента, описания и иллюстрирование предпочтительных воплощений в настоящей работе не рассматриваются как истолкованные в ограничивающем смысле.
[00918] Кроме того, следует понимать, что все аспекты изобретения не ограничиваются конкретными описаниями, конфигурациями или относительными пропорциями, изложенными здесь, которые зависят от разнообразных условий и переменных. Конструктивно выполненные модификации изобретения, различные по форме и деталям, будут очевидны для специалиста. Таким образом, предполагается, что изобретение также охватывает и все такие модификации, разновидности и аналоги.
Реферат
Способ определения присутствия или концентрации анализируемого вещества в пробе текучей среды, находящейся в контейнере, включает: (a) просвечивание контейнера вдоль первого участка, имеющего первую длину пути, для получения первого измерения интенсивности света, переданного вдоль первой длины пути, (b) определение того, что первое измерение оказалось за пределами заранее определенного динамического диапазона переданной интенсивности света, (c) перемещение пробы жидкости в указанном контейнере на другой участок с другой длиной пути, и (d) просвечивание указанного контейнера вдоль другого участка для получения другого измерения интенсивности света, переданного через другую длину пути. При этом по выбору повторяют шаги (с) и (d) в указанном контейнере, пока измерение интенсивности света не будет находиться в пределах заранее определенного динамического диапазона, определяя, таким образом, присутствие или концентрацию анализируемого вещества. Технический результат – повышение надежности распознавания анализируемого вещества. 2 н. и 17 з.п. ф-лы, 150 ил., 16 табл.

Комментарии