Производные 1-амино-2-замещенного фенилэтанола, способ их получения (варианты) - RU2095344C1
Код документа: RU2095344C1
Чертежи













Описание
Изобретение относится к ряду соединений, которые характеризуются 2-[2-/замешенный фенилокси-, -тио- или -метил-/-1-метил-этил]-аминоэтанольной структурой и которые обладают ценными антидиабетическими свойствами и являются средствами борьбы с полнотой. Кроме того, они являются средствами лечения и профилактики гиперлипемии и гипергликемии, а благодаря ингибированию действия альдозоредуктазы они оказываются также эффективными при лечении и профилактике осложнений диабетов. Помимо этого, они эффективны при лечении и профилактике связанных с полнотой гипертонии, остеопороза. В соответствии с изобретением предлагаются также способы получения соединений изобретения и способы применения и их содержащие композиции.
Известен ряд соединений этого общего типа, причем известны сведения о том, что некоторые из них обладают
антидиабетическим
действием и/или действием против полноты. Известные соединения, которые структурно относятся к соединениям настоящего изобретения, могут быть представлены нижеследующей общей
структурной формулой
(А):

Так, например, Д. Т. Коллин и др. (J. Med. Chem. 13, 674-680, 1970 г.) описывают соединения, у которых символом Q, помимо прочего, обозначена изопропильная группа, трет-бутильная группа или 2-фенил-1-метил-этильная группа и по меньшей мере один из символов


В описании к пат. Великобритании N 15551260 также сказано, что то же действие проявляют соединения, отвечающие общей формуле (А), но у которых символом Q обозначена фениламиноэтильная группа.
В описании к пат. Великобритании N 1200886 также предлагаются соединения, отвечающие общей формуле (А), но у которых символом Q обозначена оксибензиловая, алкоксибензиловая или 2-фенокси-1-метил-этиловая группа, и утверждается, что они проявляют бета-адренергетическое стимулирующее действие и блокирующее действие.
В описании к Европейской патентной публикации
N 6735 предлагается ряд соединений
формулы (А), у которых Q обозначает группу формулы (В):

где RA4 обозначает карбоксильную группу или остаток ее соли, алкоксикарбонильную группу, содержащую от 2 до 5 углеродных атомов, или алкилкарбамоильную группу, содержащую от 2 до 5 углеродных атомов, RA5 обозначает атом водорода, хлора или фтора, метильную группу, метоксигруппу, гидроксильную группу, карбоксильную группу или остаток ее соли, алкилоксикарбонильную группу, содержащую от 2 до 5 углеродных атомов, или алкилкарбамоильную группу, содержащую от 2 до 5 углеродных атомов; RA6 обозначает водородный атом или метильную, этильную или пропильную группу; RA7 обозначает водородный атом или метильную, этильную или пропильную группу; XA обозначает кислородный атом или одинарную связь; а YA обозначает алкиленовую группу, содержащую от 1 до 6 углеродных атомов, или одинарную связь, и говорится о том, что они обладают антигипергликемическим действием и действием против полноты.
В описании к Европейской патентной публикации N 21636, которая в настоящий момент рассматривается заявителем как ближайшая по техническому решению к настоящему изобретению, предлагаются соединения, отвечающие общей формуле (A), у которой символом Q обозначена группа формулы (B) и у которой каждый из символов RA1 и RA2 обозначает водородный атом, атом галогена, гидроксильную группу, оксиметильную группу или трифторметильную группу, причем значения символов RA1 и RA2 могут быть как идентичными, так и различными; RA3 обозначает атом водорода; RA4 обозначает гидроксильную группу или низшую алкильную группу, замещенную низшей алкоксигруппой или низшей ацилоксигруппой; RA5 обозначает водородный атом; каждый из RA6 и RA7 обозначает водородный атом или метильную группу, причем значения символов RA6 и RA7 могут быть как идентичными, так и различными; XA обозначает кислородный атом или одинарную связь; а УA обозначает метиленовую или этиленовую группу. Сообщается также, что они обладают антигипергликемийным действием и действием против полноты. Некоторые из соединений настоящего изобретения выбраны из соединений, описанных в вышеуказанной ссылке, а их достоинство состоит в том, что они оказывают слабое действие на рецепторы центральной нервной системы, в частности, на мускарин, N-метил-D-аспартат и серотонин (5-HT1, 5-HT2 и 5-HT3). Они не оказывают также никакого воздействия на сердечно-сосудистую систему, поскольку не проявляют никакого инотропного действия (правое предсердие) или хронотропного действия (правое предсердие). Таким образом, соединения настоящего изобретения оказывают значительно меньше побочных эффектов и, следовательно, могут найти более широкий диапазон практического применения.
В описании к Европейской патентной публикации N 25331 предлагаются
соединения, отвечающие общей формуле (A),
где Q обозначает группу формулы (C):

каждый из RA1, RA2 и RA3, которые могут быть как идентичными, так и различными, представляет собой атом водорода, фтора, хлора или брома или трифторметильную группу; каждый из RB1, RB2, RB3 и RB4 представляет собой водородный атом или низшую алкильную группу, причем значения символов RB1, RB2, RB3 и RB4 могут быть как идентичными, так и различными; RB5 обозначает карбоксильную группу, остаток ее низшего алкильного эфира или группу формулы -CONHRB6 (где RB6 обозначает водородный атом или низшую алкильную группу); а УB обозначает алкиленовую группу, содержащую 1 или 2 углеродных атома. Сообщается, что они обладают антигипергликемическим действием и действием против избыточной полноты.
В описании к американскому патенту N 4338333 говорится, что соединения, отвечающие общей формуле (A), у которой символом Q обозначена группа формулы (B), а RA1 обозначает атом водорода или галогена, гидроксильную, оксиметильную или трифторметильную группу; каждый из RA2 и RA3, которые могут быть как идентичными, так и различными, обозначает атом водорода или галогена или гидроксильную группу; каждый из RA6 и RA7, которые могут быть как идентичными, так и различными, обозначает водородный атом или метильную группу; RA6 обозначает водородный атом; XA обозначает кислородный атом или одинарную связь; YA обозначает метиленовую или этиленовую группу; а RA5 обозначает группу формулы -O-ZA-COOH, где ZA обозначает алкиленовую группу, содержащую менее 3 углеродных атомов, или алкениленовую группу, содержащую менее 3 углеродных атомов, а также их соли, сложные эфиры и амиды обладают действием против гипергликемии и ожирения.
Более того, в описании к Европейской патентной публикации N 262785 говорится, что из соединений, отвечающих данной формуле, 2-[2-/4-карбоксиметоксифенил/-1/R/-1-метилэтил]-амино-1/R/-/3-хлорфенил/-этанол, его метиловый сложный эфир и фармацевтически приемлемые соли (называемые RR-изомером), которые могут включать в себя некоторое количество 2-[2-/4-карбоксиметоксифенил/-1-/S/-1-метил-этил] -амино-1-/S/-/3-хлорфенил/-этанола, его метилового сложного эфира и фармацевтически приемлемых солей /SS-изомера/ при условии, что содержание SS-изомера не превышает 50 масс. от смеси RR- и SS-изомеров, особенно эффективны как антигипергликемические лекарства или лекарства против ожирения.
Авторами настоящего изобретения был открыт ограниченный ряд новых 2-[2-/замещенный фенилокси, -тио или -метил/-1-метил- этил]-аминоэтанольных производных, которые обладают ценным антидиабетическим действием и действием против ожирения в сочетании с низкой токсичностью и значительно уменьшенными побочными эффектами. Более того, соединения изобретения обладают способностью ингибировать действие альдозоредуктазы, благодаря чему они могут оказаться также эффективными при лечении и профилактике осложнений диабетов. Они эффективны также при лечении и профилактике связанных с ожирением гипертонии и остеопороза.
Таким образом, целью настоящего изобретения является ряд соединений данного типа.
Дополнительной и более специфической целью изобретения является создание таких соединений, которые обладают антидиабетическим действием и действием против ожирения, предпочтительнее в сочетании с низкой токсичностью и значительно более слабыми побочными эффектами.
Тем не менее еще одной целью изобретения является разработка способов применения и создание композиций, включающих в себя такие соединения.
Другие цели и достоинства изобретения очевидны из нижеследующего описания.
Соединения изобретения
представляют собой соединения общей формулы (I):

где R0 водородный атом, метильная группа или гидроксиметильная группа;
R1 замещенная алкильная группа, содержащая от 1 до 12 углеродных атомов, которая замещена по меньшей мере одним из заместителей А, определенных ниже;
R2 и R3, которые могут быть как идентичными, так и различными, и каждый обозначает водородный атом, атом галогена, гидроксильную группу, алкильную группу, содержащую от 1 до б углеродных атомов, замещенную гидроксилом;
X атом кислорода; Ar группу формулы (II) или (III):

где R4, R5 и R6 являются одинаковыми или различными и каждый обозначает водородный атом, атом галогена, алкоксигруппу, содержащую от 1 до 5 углеродных атомов, алкильную группу, содержащую от 1 до 5 углеродных атомов, или галоидалкильную группу, содержащую от 1 до 4 углеродных атомов; вышеуказанные заместители А выбирают из карбоксильных групп, алкоксикарбонильных групп, содержащих от 2 до 7 углеродных атомов, карбамоильных групп, гидроксикарбамоильных групп, гидроксильных групп, ацилоксигрупп, содержащих от 1 до 6 углеродных атомов, и 2,4-диоксотиазолидин-5-ильных групп; и их фармацевтически приемлемые соли.
В соответствии с изобретением предлагается также фармацевтически приемлемая композиция для лечения или профилактики диабетов, ожирения, гиперлипемии, гипергликемии, осложнений диабетов, связанных с ожирением гипертонии и остеопороза, которая включает в себя эффективное количество активно-действующего соединения в смеси с фармацевтически приемлемым носителем или разбавителем, где активно-действующее соединение выбирают из класса, который охватывает соединения формулы (I) и их фармацевтически приемлемых солей.
В соответствии с изобретением предлагается также способ лечения или профилактики диабетов, ожирения, гиперлипемии и гипергликемии, осложнений диабетов, связанных с ожирением гипертонии и остеопороза у млекопитающих, в особенности, человека, причем при осуществлении указанного способа предусмотрено введение в организм упомянутого млекопитающего эффективного количества активно-действующего соединения, где такое активно-действующее соединение выбирают из класса, который охватывает соединения формулы (I) и их фармацевтически приемлемые соли.
В соответствии с изобретением предлагаются также способы получения соединений изобретения, которые более подробно описаны ниже.
В формуле соединений изобретения R1 обозначает незамещенную алкильную группу, содержащую от 1 до 12 углеродных атомов, которая замещена по меньшей мере одним заместителем, выбираемым из класса, который охватывает заместители A, определенные выше и подтвержденные примерами, приведенными ниже. Указанная группа может представлять алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 12 углеродных атомов, примерами которой являются метильная, этильная, пропильная, бутильная, пентильная, гексильная, гептильная, октильная, нонильная, децильная, ундецильная, додецильная, изопропильная, изобутильная, втор.бутильная, трет.бутильная, 1-метилбутильная, 2-метил-бутильная, З-метилбутильная, 1-этилпропильная, 1,1-диметилпропильная, 1,2-диметилпропильная, 2,2-диметилпропильная, 3-гексильная, 1-метилпентильная, 2-метилпентильная, З-метилпентильная, 4-метилпентильная, 1,1-диметилбутильная, 1,2-диметилбутильная, 1,3-диметилбутильная, 2,2-диметилбутильная, 2,3-диметилбутильная, 3,3-диметилбутильная, 1,1,2- триметилпропильная, 1,2, 2-триметилпропильная, 1-метилгексильная, 1-этилпентильная и 1-пропилбутильная группы. Из них авторами настоящего изобретения предпочтение отдается алкильным группам с прямой или разветвленной цепью, содержащим от 1 до б углеродных атомов, а наибольшее предпочтение отдается алкильным группам с прямой или разветвленной цепью, которые содержат по 1-3 углеродных атома.
Эта алкильная группа, обозначенная символом R1, замещена по меньшей мере одним из заместителей А. Число таких заместителей практически не ограничено, за исключением того ограничения, которое обусловлено числом замещаемых углеродных атомов или, возможно, пространственными затруднениями. Однако обычно авторы изобретения предпочитают, чтобы число заместителей находилось в интервале от 1 до n, где n число водородных атомов в незамещенной алкильной группе или 8, смотря что меньше. Таким образом, в случае метильной группы число заместителей составляет от 1 до 3; в случае этильной группы оно находится в интервале от 1 до 5; в случае пропильной и изопропильных групп оно находится в пределах от 1 до 7, в случае бутильной и высших алкильных групп оно равно от 1 до 8. Во всех случаях предполагаемый максимум может быть обусловлен стерическими эффектами, как это хорошо известно в данной области техники. Примерами таких заместителей А являются нижеследующие радикалы.
Заместитель А представляет собой карбоксильную, карбамоильную, гидроксильную, 2,4-диоксотиазолидин-5-ильную группу, алкоксикарбонильную группу С2-С7, гидроксикарбамоильную группу, С1-С6-ацилоксигруппу.
Когда заместитель А представляет собой алкоксикарбонильную группу, она может оказаться алкоксикарбонильной группой с прямой или разветвленной цепью, содержащей от 2 до 7 углеродных атомов, примеры которой охватывают метоксикарбонильную, этоксикарбонильную, пропоксикарбонильную, изопропоксикарбонильную, бутоксикарбонильную, изобутоксикарбонильную, втор. бутоксикарбонильную, трет. бутоксикарбонильную, пентилоксикарбонильную и 2,2-диметилпропоксикарбонильную группы, из которых заявитель предпочитает алкоксикарбонильные группы с прямой или разветвленной цепью, содержащие от 2 до 5 углеродных атомов, а наиболее предпочтительными являются алкоксикарбонильные группы с прямыми цепями, каждая из которых содержит 2 или 3 углеродных атомов.
В том случае, когда заместитель А представляет собой ацилоксигруппу, она представляет собой алифатическую карбоксильную ацилоксигруппу, которая является группой с прямой или разветвленной цепью, содержащей от 1 до б углеродных атомов. К ее примерам относятся формилокси-, ацетокси, пропионилокси-, бутирилокси-, изобутирилокси-, валерилокси-, изовалерилокси-, пивалоилокси-, и гексаноилоксигруппы. Из них заявителем предпочтительными считаются ацилоксигруппы с прямыми или разветвленными цепями, которые содержат по 1-5 углеродных атомов, а наиболее предпочтительными из них являются те ацилоксигруппы, которые содержат по 1-3 углеродных атома.
Группы R2 и R3 могут быть идентичными между собой или же различными. В том случае, когда R2 или R3 означает атом галогена, он может представлять собой, например, атом фтора, хлора, брома или иода, предпочтительнее атом фтора, хлора или брома, более предпочтительно атом фтора или хлора.
В том случае, когда R2 или R3 обозначает алкильную группу, содержащую от 1 до 6 углеродных атомов, она может представлять собой группу с прямой или разветвленной цепью, примеры которой охватывают метильную, этильную, пропильную, бутильную, пентильную, изопропильную, изобутильную, втор-бутильную, трет.бутильную, 2-пентильную, 3-пентильную, 2-метилбутильную, 3-метилбутильную, 1,1-диметилпропильную, 1,2-диметилпропильную и 2,2-диметилпропильную группы. Из них заявитель предпочитает те алкильные группы с прямыми и разветвленными цепями, каждая из которых содержит от 1 до 4 углеродных атомов, причем более предпочтительными являются алкильные группы с прямыми или разветвленными цепями, каждая из которых содержит от 1 до 3 углеродных атомов.
В том случае, когда R4, R5 или R6 обозначает алкоксигруппу, содержащую от 1 до 5 углеродных атомов, она может представлять собой алкоксигруппу с прямой или разветвленной цепью, содержащую от 1 до 5, предпочтительнее от 1 до 3 углеродных атомов, к примерам которой относятся метокси-, этокси-, пропокси-, изопропокси-, бутокси-, изобутокси- и пентилоксигруппы. Из них заявитель предпочтение отдает тем алкоксигруппам, каждая из которых содержит от 1 до 3 углеродных атомов, причем более предпочтительными являются метокси- и этоксигруппы.
В том случае, когда R4, R5 или R6 обозначает алкильную группу, содержащую от 1 до 5 углеродных атомов, она может представлять собой группу с прямой или разветвленной цепью, а ее примеры включают в себя метильную, этильную, пропильную, бутильную, пентильную, изопропильную, изобутильную, втор. бутильную, трет.бутильную, 2-пентильную, З-пентильную, 2-метилбутильную, 3-метилбутильную, 1,1-диметилпропильную, 1,2-диметилпропильную и 2,2-диметилпропильную группы. Из них заявителем предпочтение отдается алкильным группам с прямыми или разветвленными цепями, каждая из которых содержит от 1 до 4 углеродных атомов, причем более предпочтительными являются такие алкильные группы с прямыми или разветвленными цепями, каждая из которых содержит от 1 до 3 углеродных атомов.
К предпочтительным соединениям относятся соединения общей формулы 1, в которых R0 обозначает водородный атом, метильную группу или гидроксиметильную группу; R1 обозначает замещенную алкильную группу, содержащую от 1 до 12 углеродных атомов и замещенную по меньшей мере 1, но не более, чем 8 заместителями, выбираемыми из заместителей A1, которые определены ниже; каждый из R2 и R3, которые идентичны или различны, обозначает водородный атом, атом фтора, атом хлора, атом брома, гидроксильную группу, или замещенную гидроксилом алкильную группу, содержащую от 1 до 6 углеродных атомов; X обозначает атом кислорода, Ar обозначает группу формулы (II) или (III), определенную по п.1; R4 обозначает водородный атом, атом фтора, атом хлора, атом брома, метоксигруппу, этоксигруппу, алкильную группу, содержащую от 1 до 5 углеродных атомов, трифторметильную группу; R5 обозначает водородный атом, атом фтора, атом хлора, атом брома, метоксигруппу, алкильную группу, содержащую от 1 до 5 углеродных атомов, а R6 обозначает водородный атом, атом фтора, атом хлора, метоксигруппу или метильную группу; причем указанные заместители А1 выбирают из карбоксильных групп, алкоксикарбонильных групп, содержащих от 2 до 7 углеродных атомов, карбамоильных групп, гидроксикарбамоильных групп, гидроксильных групп, алифатических ацилоксигрупп, содержащих от 1 до 6 углеродных атомов, и 2, 4-диоксотиазолидин-5-ильных групп.
Наиболее предпочтительными являются соединения, в которых R0 обозначает водородный атом; R1 обозначает метоксикарбонилметильную, этоксикарбонилметильную, 2-метоксикарбонилэтильную, бис-/метоксикарбонил/-метильную, гидроксиметильную, 2-гидроксиэтильную, 1,2-дигидроксиэтильную, 1, 3-дигидрокси-2-пропильную, 1-метоксикарбонил-1-гидроксиметильную, 2-метоксикарбонил-2-гидроксиэтильную, 2-ацетоксиэтильную или 2,4-диоксотиазолидин-5-илметильную группу; R2 обозначает водородный атом, атом хлора или гидроксиметильную группу; R3 обозначает водородный атом; а Ar обозначает фенильную, 2-хлорфенильную, З-хлорфенильную, 4-хлорфенильную, З-бромфенильную, З-фторфенильную, З-метилфенильную, З-метоксифенильную, З-трифторметилфенильную, 3-хлор-4-фторфенильную или 2-нафтильную группу.
Предпочтительными соединениями являются следующие соединения: 2-[2-/4-метоксикарбонилметилфенокси-/1-метилэтил]-амино-1 -/3-хлорфенил/-этанол; 2-{ 2-[4-/2-метоксикарбонилэтил/-фенокси] -1-метилэтил} - амино-1-фенилэтавол; 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэтил] -амино-1-/3-бромфенил/-этанол; 2-[2-/4-мето-ксикарбонилметилфенокси/-1-метилэтил] -амино-1-/3,5/дихлорфенил/-этанол; 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэтил] -амино-1- фенилэтанол; 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэтил]-амино-1-/3-хлор-4-фторфенил/-этанол; 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэтил]- амино-1-/3-метоксифенил/-этанол; 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэтил]-амино -1-/3-трифтор-метилфенил/-этанол; и их соли.
Соединения настоящего изобретения способны существовать в форме различных стереоизомеров, как это очевидно из формулы (IV):

где значения символов R0, R1, R2, R3, X и Ar определены выше, в том случае, когда R0 обозначает водородный атом, существуют по меньшей мере два асимметричных углеродных атома (обозначены символами*1 и*3), а в случае, если R0 обозначает метильную или оксиметильную группу, существуют по меньшей мере три асимметричных углеродных атома (обозначены символами*1,*2 и*3). Хотя все они представлены в данном случае одной общей формулой, рамками настоящего изобретения охватываются как индивидуальные, изолированные изомеры, так и смеси (в которых содержание изомеров может быть одинаковым или различным), включающие в себя их рацематы. В тех случаях, когда в качестве исходных материалов используют оптически активные соединения или применяют технологию стереоспецифического синтеза, индивидуальные изомеры могут быть получены непосредственно. С другой же стороны, при получении смесей изомеров индивидуальные изомеры могут быть выделены с применением соответствующей техники растворения.
Из соединений изобретения заявитель предпочитает те изомеры, у которых асимметричные углеродные атомы, обозначенные символами*1 и*3 образуют R-конфигурацию.
Примерами
конкретных соединений изобретения являются такие соединения формулы (1-1), у которых имеются различные замещающие группы (см. приложение) и формулы (1-2), у которых имеются
различные замещающие группы,


Соединения изобретения могут быть получены в соответствии с самыми различными хорошо известными способами. Так, например, их в общем можно получить реакцией соединения формулы (Y):

(где значения символов Ar и R0 определены выше; Z обозначает водородный атом или гидроксизащитную группу) с соединением формулы (VI):

где значения символов X, R1, R2 и R3 определены выше с последующим, если необходимо, восстановлением соединения; а также, если необходимо, удалением всех блокирующих групп и, возможно, реакцией солеобразования со всеми образующими соединениями.
Как более подробно описано ниже, продукт реакции соединений формул (V) и (VI) содержит двойную связь, его восстанавливают с получением соединения формулы I.
Конкретные примеры процессов, которые можно проводить для получения соединений изобретения, описаны в методах 1 и 2.
Метод 1.
При осуществлении этого метода проводят реакцию аминоспирта формулы (V'):

(где значения символов R0 и Ar определены выше) (см. например, работу Д. Т. Коллинса в "J. Med. Chem. 13, 674-680, 1970) с кето-соединением формулы VI):

(где значения символов R1, R2, R3 и X определены выше) с получением соединения формулы (IX):

(где значения символов R0, R1, R2, R3, x и Ar определены выше (стадия А), после чего полученное соединение восстанавливают (стадия В).
Соединение формулы (VI) можно получить с использованием обычных средств, например, реакцией галоидацетона с фенольным или тиофенольным соединением в соответствии с методами, которые хорошо известны в технике.
На стадии А этой реакции соединение формулы (IX) получают реакцией аминоспирта формулы (V) с кетосоединением формулы (VI). Эту реакцию можно проводить в присутствии или без использования обезвоживающего агента, в частности, безводного карбоната натрия, безводного карбоната калия, безводного сульфата натрия, безводного хлорида кальция, безводного сульфата магния или обезвоживающего молекулярного сита.
Обычно реакцию предпочтительнее проводить в среде растворителя, природа которого не имеет решающего значения при условии, что он не оказывает нежелательного воздействия на ход реакции и что он способен растворять реагенты, по меньшей мере в некоторой степени. Примеры приемлемых растворителей охватывают углеводороды, которые могут быть алифатическими или ароматическими, в частности, бензол, ксилол, гексан и гептан; галоидированные углеводороды, в особенности, галоидированные алифатические углеводороды, в частности, хлороформ, хлористый метилен и четыреххлористый углерод; простые эфиры, в частности, диэтиловый эфир, тетрагидрофуран и диоксан; амиды, в частности, диметилформамид, диметилацетамид, гексаметилфосфортриамид; спирты, в частности, метанол и этанол; сульфоксиды, в частности, диметилсульфоксид; сульфолан; а также смеси любых двух или большего числа растворителей, которые перечислены выше.
Такую реакцию проводят в широком интервале температур, а конкретно выбираемая реакционная температура для осуществления изобретения решающего значения не имеет. Обычно заявитель находит удобным проводить эту реакцию при температуре в пределах от достигаемой при охлаждении льдом до точки кипения используемого растворителя. Подобным же образом в широком диапазоне можно варьировать продолжительность времени, которое требуется для протекания реакции, в зависимости от многих факторов, прежде всего, от реакционной температуры и природы используемых реагентов. Однако в большинстве случаев, когда реакцию проводят в предпочтительных условиях, указанных выше, достаточной является продолжительность от 0, 5 до 10 ч.
Эту реакцию предпочтительнее проводить в среде растворителя, в частности, углеводорода или спирта, в течение промежутка времени от 1 до 5 ч при температуре от достигаемой охлаждением льдом до температуры кипения (с обратным холодильником). Еще предпочтительнее проводить реакцию с бензоле путем выдержки при температуре кипения с обратным холодильником в течение периода времени от 1 до 3 ч с одновременным удалением образующейся воды.
На стадии В соединение формулы (I) получают восстановлением соединения формулы (IX), которое может быть получено согласно вышеизложенному при описании стадии A. Эту реакцию обычно проводят с использованием восстановительного агента или путем гидрогенизации в присутствии катализатора. В том случае, когда восстановление проводят с использованием восстановительного агента, для осуществления изобретения природа восстановительного агента не имеет значения, поэтому в ходе этой реакции можно с равным успехом использовать любой из тех восстановительных агентов, которые обычно применяют в ходе проведения реакций такого типа. Примеры подходящих восстановительных агентов включают в себя гидриды металлов, в частности, литийборгидрид, натрийборгидрид, натрийцианоборгидрид, литийалюминийгидрид и диизобутилалюминийгидрид. Обычно такую реакцию предпочтительнее проводить в среде растворителя, природа которого значения не имеет при условии, что он не оказывает никакого нежелательного воздействия на ход реакции и что он способен растворять реагенты, по меньшей мере, в некоторой степени. Примеры приемлемых растворителей охватывают углеводороды, которые могут быть как алифатическими, так и ароматическими, в частности, бензол, толуол, ксилол, гексан или гептан; простые эфиры, в частности, диэтиловый эфир, тетрагидрофуран или диоксан; амиды, в частности, диметилформамид, диметилацетамид или гексаметилфосфортриамид; спирты, в частности, метанол, этанол или изопропанол; а также смеси любых двух или большего числа растворителей, перечисленных выше.
Эта реакция протекает в широком диапазоне температур, причем конкретно выбираемая реакционная температура решающего значения для осуществления изобретения не имеет. Обычно заявитель считает удобным проводить реакцию при любой температуре от достигаемой охлаждением льдом до повышенных, составляющих, например, 50oC или больше. Промежуток времени, который необходим для проведения реакции, также варьируется в широком диапазоне в зависимости от многих факторов, в особенности, от реакционной температуры и природы реагентов. Однако в большинстве случаев промежуток времени в пределах от 0,5 до нескольких дней, как правило, считается достаточным.
Такую реакцию предпочтительнее проводить с использованием натрийборгидрида или натрийцианоборгидрида в присутствии спиртового растворителя и при температуре от достигаемой охлаждением льдом до 50oC в течение промежутка времени от 1 до 24 ч.
В том случае, когда реакцию восстановления проводят путем гидрогенизации в присутствии катализатора, в качестве этого последнего можно использовать любой из катализаторов, которые обычно применяют при каталитическом восстановлении, а природа катализатора при осуществлении изобретения значения не имеет. Примеры предпочтительных катализаторов охватывают палладий на древесном угле или окись платины. Обычно такую реакцию предпочтительнее проводить в среде растворителя, природа которого не имеет решающего значения при условии, что он не оказывает нежелательного воздействия на ход реакции и что он способен растворять реагенты, по меньшей мере в некоторой степени. К примерам приемлемых растворителей относятся простые эфиры, в частности, диэтиловый эфир, тетрагидрофуран и диоксан; амиды, в частности, диметилформамид и диметилацетамид; спирты, в частности, метанол, этанол или изопропанол; сложные эфиры, в частности, метилацетат и этилацетат, а также смеси любых двух или большего числа растворителей, перечисленных выше. В случае использования палладиевого катализатора каталитическую гидрогенизацию предпочтительнее проводить под давлением от среднего до высокого, предпочтительнее от 1 до 5 кг/кв. см. При использовании платинового катализатора гидрогенизацию предпочтительнее проводить под атмосферным давлением. Такую реакцию проводят в широком диапазоне температур, причем конкретно выбранная температура для осуществления изобретения решающего значения не имеет. Обычно заявитель считает удобным проводить реакцию при температуре в интервале от комнатной до 50oC. Предпочтительнее также проводить реакцию в среде спиртового растворителя, в частности, метанола или этанола.
В том случае, когда соединение формулы (V) является оптически активным благодаря наличию асимметричных углеродных атомов в положениях, которые обозначены символом*1 и/или*2, стереохимическая целостность у соединения формулы (IХ) может быть сохранена, в результате чего образуется соединение формулы (I). Более того, в случае, когда на стадии В может быть проведена обычная реакция асимметричной гидрогенизации, соединения формулы (I) могут быть получены в форме стереоизомеров, в молекулах которых в положении, обозначенном символом*3, имеются асимметричные углеродные атомы.
Метод 2.
Соединение формулы (I) можно получать (стадия А1) реакцией карбонильного
соединения формулы (XIII):

(где значения символов R0 и Ar определены выше, а Z обозначает водородный атом или гидроксиблокирующую группу) с аминосоединением формулы (XI):

с получением соединения формулы (XIV):
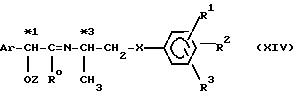
(где значения символов R0, R1, R2, R3, X, Ar и Z определены выше), после чего (стадия В1) полученное соединение формулы (XIV) восстанавливают с получением соединения формулы (XV):

(где значения символов R0, R1, R2, R3, X, Ar и Z определены выше), а затем, если необходимо, удаляют защитную группу из молекулы соединения, у которого Z обозначает гидроксиблокирующую группу, в результате чего получают соединение формулы (I).
Стадии A1 и B1 по существу идентичны вышеописанным стадиям A и B метода 1, поэтому их можно осуществлять в аналогичных условиях.
Природа гидроксиблокирующей группы, которая обозначена символом Z, для осуществления изобретения решающего значения не имеет, поэтому любая такая группа, которую обычно применяют в качестве оксиблокирующей группы, в равной степени приемлема для использования при проведении данной реакции. Примеры таких групп включают в себя тетрагидропираниловую, метоксиметиловую, дифенилметиловую, тритиловую, триметилсилиловую, трет.бутилдиметилсилиловую и трет. бутилдифенилсилиловую группы. В том случае, если по завершении стадий А1 и В1 необходимо удалять блокирующие группы, тип реакции их удаления зависит от природы блокирующей группы, что хорошо известно в данной области техники. Также хорошо известны и проводимые с этой целью реакции. Примеры таких реакций удаления приведены Т.У.Грином в работе "Protective Groups in Organic Synthesis", издание "Джон уили энд санс" и в работе дж.Ф.Макони "Protective Groups in Organic Chemistry", издательство "Пленум пресс", которые упомянуты в данном описании в качестве ссылок.
Те
соединения формулы (XIII), у которых R0 обозначает
водородный атом, то есть соединения формулы (XVI):

могут быть получены в соответствии с процедурой, которая суммарно проиллюстрирована с помощью нижеследующей схемы реакций В:

В вышеприведенных формулах значения символов Ar и Z определены выше, а символом В обозначена низшая алкильная группа, предпочтительнее группа, содержащая от 1 до 4 углеродных атомов, в частности, такая, примеры которой приведены в связи с вышеупомянутыми заместителями В.
На стадии 1 этой схемы реакций соединение формулы (f) обрабатывают обычными средствами, например, согласно изложенному в работе Organic Synthesis 1, стр. 336, которая в данном описании упомянута в качестве ссылки, с получением соединения формулы (g).
Этот процесс обычно проводят посредством реакции соединения формулы (f) с цианистым водородом или триметилсилилцианидом в присутствии иодистого цинка и в среде растворителя или без него, в результате чего получают циангидриновое производное, после чего полученное циангидриновое производное подвергают гидролизу, который катализируют кислотой. Реакцию получения циангидринового соединения обычно проводят в широком диапазоне температур, например, от достигаемой охлаждением льдом до повышенной, предпочтительнее при температуре от комнатной до 100oC. Гидролиз, катализируемый кислотой, как правило, проводят с использованием обычной кислоты, например, минеральной кислоты, в частности, соляной кислоты или серной кислоты, или органической кислоты, в частности n-толуолсульфокислоты сульфокислоты или уксусной кислоты, в присутствии избытка воды и при температуре от комнатной до точки кипения реакционной смеси (с обратным холодильником) в течение промежутка времени от нескольких десятков минут до нескольких десятков часов. Такую реакцию предпочтительнее проводить при температуре кипения с обратным холодильником в присутствии соляной кислоты или серной кислоты в течение промежутка времени от 30 мин до 10 ч.
После этого полученное таким образом соединение формулы (g) можно подвергать этерификации путем реакции катализируемой кислотой этерификации или обработкой этерифицирующим агентом, в частности, диазоалканом или алкилгалогенидом совместно со щелочью, в результате чего образуется соединение формулы (h).
Катализируемую кислотой этерификацию можно проводить, например, реакцией соединения формулы (g) с избытком спирта в среде растворителя или без него, предпочтительнее в присутствии минеральной кислоты, в частности, соляной кислоты или серной кислоты, или органической кислоты, в частности, n-толуолсульфокислоты при приемлемой температуре, например, от комнатной температуры до повышенной в течение приемлемого промежутка времени, например, от нескольких часов до нескольких дней.
Этерификацию с использованием диазоалкана предпочтительнее проводить в среде растворителя, например, спирта, в частности, метанола или этанола; углеводорода, который может быть алифатическим или ароматическим, в частности, бензола, толуола, ксилола, гексана или гептана; простого эфира, в частности, диэтилового эфира, тетрагидрофурана или диоксана, или смеси любых двух или большего числа растворителей, перечисленных выше. Эту реакцию проводят в широком диапазоне температур, причем точная величина температуры для осуществления изобретения значения не имеет. Обычно заявитель считает удобным проводить такую реакцию при температуре от достигаемой охлаждением льдом до повышенной, предпочтительнее при температуре при от достигаемой охлаждением льдом до 60oC. Промежуток времени, необходимый для завершения реакции, также можно варьировать в широком интервале в зависимости от многих факторов, в особенности от реакционной температуры и природы используемых реагентов и растворителя.
В ходе проведения реакции этерификации с использованием щелочи и алкилгалогенида применяют такие щелочи, примерами которых могут служить карбонаты щелочных металлов, в частности, карбонат калия и карбонат натрия. Такую реакцию, как правило, предпочтительнее проводить в среде растворителя. В отношении природы используемого растворителя отсутствуют какие-либо конкретные ограничения при условии, что он не оказывает никакого нежелательного воздействия на ход реакции или на участвующие в ней реагенты и что он способен растворять реагенты, по меньшей мере в некоторой степени. Примеры приемлемых растворителей включают в себя спирты, в частности, метанол и этанол; простые эфиры, в частности, диэтиловый эфир, тетрагидрофуран и диоксан; углеводороды, в частности, бензол, толуол, ксилол, гексан или гептан; амиды, в частности, диметилформамид, диметилацетамид или гексаметилфосфортриамид; а также смеси любых двух или большего числа растворителей, перечисленных выше. Такую реакцию можно проводить в широком интервале температур, а точная реакционная температура при осуществлении изобретения решающего значения не имеет. Обычно заявитель предпочитает проводить эту реакцию при температуре приблизительно от комнатной до повышенной. Промежуток времени для завершения этой реакции также можно варьировать в широком диапазоне в зависимости от многих факторов, в особенности от реакционной температуры и природы используемых реагентов и растворителя. Однако при условии, что эту реакцию проводят в предпочтительных условиях, которые указаны выше, период времени от нескольких часов до нескольких дней обычно оказывается достаточным.
На стадии 3 полученное таким образом соединение формулы (h) блокируют с использованием обычных оксиблокирующих групп, получая соединение формулы (i). К примерам пригодных для использования оксиблокирующих групп относятся тетрагидропиранильная, метоксиметильная, дифенилметильная, тритильная, триметилсилильная, трет.бутилдиметилсилильная и трет.бутилдифенилсилильная группы, как это изложено, например, в работе Т.У.Грина "Protective Groups in Organic Synhesis ", издательство "Джон Уили энд санс" и работе Дж.Ф. Макоми "Protective Groups in Organic Chemistry", издательство "Пленум пресс".
Затем на стадии 4 соединение формулы (XVI) можно получить с помощью обычных средств из соединения формулы (i), например, путем реакции соединения формулы (i) с диизо бутилалюминийгидридом в углеводородном растворителе, в частности, в гексане, гептане, бензоле, толуоле или ксилоле, который предварительно охлажден в ацетоновой бане с сухим льдом.
Соединение формулы (ХVI) можно также получать в соответствии с процедурой,
которая суммирована в нижеследующей схеме реакций
C:

(где значения символов Ar, Z и R определены выше).
На стадии 1 данной схемы реакций с использованием обычных средств проводят, например, реакцию соединения формулы (i) с гидридом металла, в частности, с литийалюминийгидридом или диизобутилалюминийгидридом, в результате чего получают соединение формулы (j).
Такую реакцию, как правило, предпочтительнее проводить в среде растворителя. Не существует каких-либо особых ограничений в отношении природы используемого растворителя при условии, что он не оказывает нежелательного воздействия на ход реакции или на используемые реагенты и что он способен растворять эти реагенты, по меньшей мере в некоторой степени. Примеры приемлемых растворителей охватывают простые эфиры, в частности, диэтиловый эфир, тетрагидрофуран и диоксан.
Затем с помощью обычных средств полученное таким образом соединение формулы (j) окисляют на стадии 2, например, с использованием комплекса трехокиси серы и пиридина, хромового окислительного агента или путем проведения окислительной реакции Шверка, в результате чего получают соединение формулы (XVI).
В том случае, когда соединение формулы (XVI) является оптически активным,
существует возможность получения стереоизомеров
соединения формулы (IV), в молекуле которого в положении, обозначенном символом*1, имеется симметричный углеродный атом. То есть в случае,
если аминосоединение формулы (XVI) оказывается
оптически активным, а R0 обозначает водородный атом, возникает возможность раздельного получения соединений формулы (IV), характеризующихся
стереохимизмом, который обусловлен любым
желаемым сочетанием: (*1R,*3R), (*1R,*3S), (*1S,*3R) или (*1S,*
3S)
Более того, соединение формулы
(g) можно разделять на соединения (R) и (S) с помощью любого оптически активного амина, который приемлем для использования при обычном оптическом разделении,
например (+)- или (-)-эфедрина или
(d)- или (е)-1-фенилэтиламина.
Желаемые соединения, получаемые в соответствии с любым из методов 1 или 2, можно выделить из реакционной смеси после завершения реакции с использованием обычных средств. При желании полученные таким образом соединения можно подвергать дополнительной очистке согласно стандартным технологиям, например, в соответствии с различными процедурами хроматографической обработки, в особенности в хроматографической колонке, и/или перекристаллизации, осаждения, или тому подобного. В соответствии с одной из приемлемых процедур выделения и очистки предусмотрены добавление в реакционную смесь подходящего растворителя; экстрагирование растворителем продукта; удаление растворителя из экстракта отгонкой и очистка остатка хроматографической обработкой в колонке с силикагелем или тому подобным, в результате чего целевое соединение выделяют в чистом состоянии.
Биологическая активность.
Соединения формулы (I) и их фармацевтически приемлемые соли характеризуются различным физиологическим действием, которое сообщает им значительный потенциал при лечении и профилактике различных физиологических расстройств. Так, например, они улучшают состояние пациента при гипергликемии, повышают переносимость в отношении глюкозы, которая может быть улучшена при ожирении, ингибируют действие альдозоредуктазы и улучшают состояние при гипатитном глюкогенезе и гипергликемии; они полезны в качестве профилактики и/или терапевтических агентов при гипергликемии, ожирении, гиперлипемии и таких диабетических осложнений, как ретинопатия, нефропатия, нейропатия, катаракты, коронарные сердечные расстройства и атеросклероз; их можно также использовать для лечения и профилактики связанных с ожирением гипертонии и остеопороза. Кроме того, поскольку соединения изобретения характеризуются низкой токсичностью, их можно использовать в качестве профилактических и/или терапевтических агентов в случаях вышеуказанных болезней и расстройств.
Биологическая активность соединений изобретения проиллюстрирована в ходе нижеследующих экспериментов, в которых соединения изобретения идентифицированы посредством номера одного из нижеприведенных примеров, где описано их получение.
Эксперимент 1. Гипогликемическое действие при глюкозной нагрузке. Гипогликемическое действие соединений изобретения при глюкозной нагрузке у мышей определяли следующим образом.
Трехмесячным самкам мышей КК, вес каждой из которых составлял от 28 до 30 г, которым не давали еды в течение ночи, перорально ввели в организм по 1 мг/кг испытываемого соединения или карбоксиметилцеллюлозы (КМЦ) в контрольных случаях. По истечении 60 мин им подкожно ввели по 1,2 г/кг D-глюкозы. Далее по истечении 60 и 120 мин с момента подкожной инъекции глюкозы у животных брали кровь и с помощью анализатора глюкозы (GL-101, продукция фирмы "Мицубиши Касеи, Ко. ") определяли содержание в ней глюкозы. Гипогликемическое действие (R) испытываемого соединения при глюкозной нагрузке рассчитывали в соответствии с нижеследующим уравнением: R [1 (В/А)] • 100, где А - содержание глюкозы в крови животных той группы, которым вводили КМЦ, В - содержание глюкозы в крови животных той группы, которым вводили образцы испытываемого соединения.
Полученные результаты сведены в табл. 1.
Из данных табл. 1 видно, что все испытанные соединения проявили превосходное гипогликемическое действие.
Эксперимент 2. Ингибирование альдозоредуктазы. Альдозоредуктазу хрусталиков глаз коровы выделили и частично очистили по методу С.Хаймана и Дж.Х.Киношиты (J. Biol. Chem. 240, 877, 1965 г.) и К.Инагаки, И.Мавы и Дз.Окуды (Arch. Biochem. Biophys. 316, 337, 1982 г.), после чего фотометрическим путем по методу Вармы и др. (Biochem. Pharmac. 25, 2505, 1976 г.) определили ее активность. Ингибирование анзимной активности для соединений изобретения определяли при концентрации 5 мкг/мл. Полученные результаты сведены в табл. 2.
Эксперимент 3. Токсичность. Подопытными животными были самки мышей линии ddY. Этих животных разбили на группы по 3 особи в каждой. Испытываемое соединение вводили в организм перорально при дозировке 300 мг/кг веса тела каждого животного. В качестве испытываемых соединений использовали те, которые были получены согласно изложенному в примерах 1, 3, 8, 24, 47 и 48. Затем за животными наблюдали в течение 1 недели после введения в их организм соединения, причем в течение всего периода наблюдений животные не проявляли никаких признаков ненормального самочувствия, которые могли бы быть вызваны испытываемыми соединениями. Все животные выжили к концу периода наблюдения.
Учитывая значительность дозы соединения, введенного в организм каждого животного, нулевая смертность среди них указывает на то, что соединения изобретения характеризуются низкой токсичностью.
В зависимости от конкретного пациента и желаемого пути введения в его организм соединения изобретения можно вводить в различных формах. Приемлемые препаративные формы для перорального введения в организм включают в себя таблетки, капсулы, гранулы, порошки или сиропы, а приемлемые композиции для парентерального введения в организм охватывают препараты для инъекций (которые могут быть для внутривенных, внутримышечных и подкожных инъекций), капли или суппозитории. Эти различные препараты могут быть приготовлены обычными средствами, когда активнодействующее соединение смешивают с любыми известными добавками, которые обычно используют в области производства фармацевтических препаратов, в частности, основы для приготовления лекарств, связующие вещества, агенты, придающие рассыпчатость, смазочные добавки, корригенты, агенты, придающие растворимость, суспендирующие агенты и вещества, наносимые в качестве покрытия. Дозировку можно варьировать в зависимости от симптомов, возраста и веса тела пациента, пути введения в организм и препаративной формы. Однако ежедневная доза от 0,01 до 2000 мг, которую можно вводить в организм в виде одной порции или порции, разделенной на несколько частей, обычно оказывается достаточной для взрослого человека.
Процесс получения соединений изобретения далее проиллюстрирован с помощью нижеследующих неограничивающих его рамок примеров, а процессы получения некоторых из исходных материалов проиллюстрированы в последующих примерах получения.
Пример 1. 2-[2-/4-гидроксиметилфенокси/-1-метилати] - амино-1-/3-хлорфенил/-этанол, 1/6-этилацетат (соединение N 7-21). 0,83 мг литийалюминийгидрида осторожно добавили с перемешиванием в раствор 1,95 г 2-[2-/4-метоксикарбонилфенокси/-1-метилэтил] -амино-1-/3-хлорфенил/-этанола (полученного согласно нижеизложенному в примере получения 1), растворенного в 70 мл тетрагидрофурана и в образовавшейся смеси при комнатной температуре в течение 2 ч провели реакцию. По истечении указанного времени в реакционную смесь добавили 0,9 мл воды, 0,9 мл 15-ного (вес на объем) водного раствора гидрата окиси натрия и 3 мг воды в указанном порядке, после чего смесь перемешивали при комнатной температуре. Затем реакционную смесь профильтровали с использованием продукта "Celite" (торговое наименование), служащего в качестве вспомогательного агента при фильтровании, и отгонкой под пониженным давлением освободили фильтрат от растворителя. Полученный остаток очистили хроматографической обработкой в колонке с силикагелем с использованием в качестве элюента смеси этилацетата и этанола в объемном соотношении 10:1, в результате чего в виде стеклоподобного материала получили 1,5 г соединения, указанного в заголовке примера, величина Rf которого была равна 0,55 (тонкослойная хроматографическая обработка на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с этанолом в объемном соотношении 4:1). Полученный продукт содержит некоторое количество этилацетата, но как полагают, это не является комплексом.
Пример 2. 5-[4-(2-[2-/3-хлорфенил/-2-гидроксиэтиламино]- пропокси)-бензил] -тиазолидин-2,4-дион, 1/2 этилацетат (соединение N 5-1). Раствор 2,5 г 2-амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в примере получения 8) и 3,58 г 5-[4-/2-оксопропокси/-бензил]-диазолидин-2,4-диона в 50 мл бензола выдержали при температуре кипения с обратным холодильником в течение 1,5 ч с постоянным удалением воды, образовавшейся в ходе протекания реакции. По истечении этого времени использованный бензол удаляли отгонкой под пониженным давлением. Полученный остаток растворяли в 100 мл абсолютного метанола, а затем в образовавшийся раствор добавили 3 г боргидрида натрия. Далее реакционной смеси позволили отстояться в течение ночи при комнатной температуре, после чего ее сконцентрировали выпариванием при пониженном давлении и концентрат смешали с водой. Образовавшуюся водную смесь подвергли экстракционной обработке этилацетатом и экстракт высушили над безводным сульфатом натрия. Растворитель удалили отгонкой под пониженным давлением и полученный остаток очистили хроматографической обработкой путем пропускания через колонку с силикагелем, используя этилацетат, а затем смесь этилацетата с этанолом в объемном соотношении 10:1 в качестве элюента. Продукт перекристаллизовали из этилацетата, получив 0,74 г соединения, указанного в заголовке примера, в виде кристаллов с температурой плавления от 100 до 125oC.
Пример 3. 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэтил] -амино-1-/3-хлорфенил/-этанол (соединение N 3-1). Раствор 2,2 г 2-амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в примере получения 8) и 2,6 г метил-4-/2-оксо-пропокси/-фенилацетата (полученного согласно изложенному ниже в примере получения 3) в 200 мл бензола выдержали при температуре кипения с обратным холодильником в течение приблизительно 2 ч, непрерывно удаляя воду, которая образовалась по ходу реакции. По истечение указанного промежутка времени отгонкой под пониженным давлением реакционную смесь освободили от бензола, который использовали в качестве растворителя, а полученный остаток растворили в 150 мл абсолютного метанола. В этот раствор добавили 1 г боргидрида натрия при одновременном охлаждении льдом и образовавшуюся смесь перемешивали при комнатной температуре в течение 5 ч. Затем реакционную смесь смешивали с этилацетатом и с насыщенным водным раствором хлорида натрия. Органический слой отделили и высушили над безводным сульфатом магния, а затем под пониженным давлением отогнали растворитель. Полученный остаток очистили пропусканием через хроматографическую колонку с силикагелем, используя смесь этилацетата с этанолом и триэтиламином в объемном соотношении 40: 1: 1 в качестве элюента, в результате чего получили 2,3 г соединения, указанного в заголовке примера, с Rf 0,44 (тонкослойная хроматографическая обработка на силикагеле с использованием в качестве проявляющего растворителя смеси зтилацетата с этанолом и триэтиламином в объемном соотношении 40:1:1).
Пример 4. 2-(2-[4-/3-гидроксипропил/-фенокси]-1-метилэтил)-амино-1-/3-хлорфенил/-этанол (соединение N 7-4). Процедуру, аналогичную вышеизложенной в примере 2, повторили полностью, за исключением того, что в данном случае использовали 4,3 г 2-амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в примере получения 8), 3,5 г метил-3-[4-/2-оксопропокси/-фенил] -пропионата (полученного согласно изложенному в примере получения 5), 150 мл бензола, 150 мл абсолютного метанола и 6,12 г боргидрида натрия. Получили сырой продукт, который очистили пропусканием через хроматографическую колонку с силикагелем, используя в качестве элюента смесь этилацетата с этанолом в объемном соотношении 10:1, в результате чего получили 2,9 г соединения, указанного в заголовке примера, с Rf 0,4 (тонкослойная хроматографическая обработка на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с этанолом в объемном соотношении 10:1).
Пример 5. 2-(2-[4-/2-метоксикарбонилэтил/-фенокси]-1-метил- этил)-амино-1-фенилэтанол (соединение N 3-5). 2,2 г 2-(2-[4-метоксикарбонилэтенил)-фенокси] -1-метилэтил)-амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в примере получения 53) растворили в 200 мл метанола и гидрогенизовали путем пропускания пузырьков водорода через раствор под атмосферным давлением и при комнатной температуре в присутствии 0,5 г 10-ного по весу палладия на древесном угле в течение 3 ч. Катализатор удалили фильтрованием и фильтрат сконцентрировали выпариванием под пониженным давлением. Далее концентрат растворили в этилацетате и приготовленный раствор промыли водным раствором карбоната калия и водой в указанном порядке, после чего высушили над безводным сульфатом натрия. Далее отгонкой под пониженным давлением удалили растворитель, а остаток очистили пропусканием через хроматографическую колонку с силикагелем, используя в качестве элюента этилацетат. Полученный таким образом продукт перекристаллизовали из смеси этилацетата с гексаном, в результате чего в виде кристаллов получили 1,2 г соединения, указанного в заголовке примера, с температурой плавления 103-104oC.
Пример 6. 2-(2-[4-/2-метоксикарбонил-2-гидроксиэтил/-фенокси]-1-метилэтил)-амино-1-/3-хлорфенил/-этанола (соединение N 6-2). Смесь 1,16 г 2-амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в примере получения 8), 1,71 г метил-3-[4-/2-оксопропокси/-фенил]-лактата (полученного согласно изложенному в примере получения 6) и 40 мл бензола выдержали при температуре кипения с обратным холодильником в течение 3,5 ч, одновременно непрерывно удаляя воду, которая образовалась по ходу реакции. После завершения реакции бензол, который использовали в качестве растворителя, удалили отгонкой под пониженным давлением и остаток растворили в 50 мл абсолютного метанола. Затем добавили 2,04 г цианоборгидрида натрия при одновременном охлаждении раствора и в образовавшейся смеси в течение ночи при комнатной температуре провели реакцию. По завершении этого периода времени под пониженным давлением удалили отгонкой метанол и полученный остаток смешали с этилацетатом и водным раствором хлорида натрия. Этилацетатный слой отделили, промыли водным раствором хлорида натрия, а затем высушили над безводным сульфатом натрия. Далее под пониженным давлением отгонкой удалили растворитель и остаток очистили пропусканием через хроматографическую колонку с силикагелем, используя в качестве элюента этилацетат, в результате чего получали 1,9 г соединения, указанного в заголовке примера, с Rf 0,30 (тонкослойная хроматографическая обработка на силикагеле с использованием этилацетата в качестве проявляющего растворителя).
Пример 7. 2-(2-[4-/2-метоксикарбонилэтил/-фенокси]-1-метил-этил)-амино-1-/3-хлорфенил/-этанол (соединение N 3-4). В соответствии с процедурой, аналогичной вышеизложенной в примере 6, но с использованием в данном случае 4,5 г 2-амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в примере получения 8), 3,5 г метил-3-[4-/2-оксопропокси/-фенил]-пропионата (полученного согласно изложенному в примере получения 5), 100 мл бензола, 100 мл абсолютного метанола и 2,6 г цианоборгидрида натрия, в виде кристаллов получили 2,8 г соединения, указанного в заголовке примера, с температурой плавления 65-73oС.
Пример 8. 2-(2-[4-/2-гидроксиэтил/-фенокси]-1-метилэтил)-амино-1-/3-хлорфенил/-этанол (соединение N 7-3). В соответствии с процедурой, аналогичной вышеизложенной в примере 2, но с использованием 2,0 г 2-амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в примере получения 8), 2,13 г 2-[4-/2-оксопропокси/-фенил]-этанола (полученного согласно изложенному в примере получения 7), 100 мл бензола, 100 мл абсолютного метанола и 0,95 г боргидрида натрия, получили сырой продукт. Этот продукт очистили вначале пропусканием через хроматографическую колонку с силикагелем, используя в качестве элюента смесь этилацетата с зтанолом в объемном соотношении 20: 1, а затем перекристаллизацией из этилацетата, получив в виде кристаллов двух отдельных типов 1,18 г и 1,02 г продуктов, которые представляли собой диастереоизомеры соединения, указанного в заголовке примера, с температурой плавления соответственно 108-111oC и 78-80oC.
Пример 9. 2-[1-/4-метоксикарбонилметилфенокси/-1-метилэтил]-амино-2-/S/-гидроксиметил-1-/S/-фенилэтанол (соединение N 3-6). В соответствии с процедурой, аналогичной вышеизложенной в примере 6, но с использованием в данном случае 5,7 г (1S, 2S)-/+/- 2-амино-1-фенил-1,3-пропандиола, 5 г метил-4-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 3), 250 мл бензола, 250 мл абсолютного метанола и 4,34 г цианоборгидрида натрия, получили 1,54 г соединения, указанного в заголовке примера, с Rf 0,27 (тонкослойная хроматографическая обработка на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с гексаном в объемном соотношении 2:1).
Пример 10. 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэтил]-амино-1-/2-нафтил/-этанол (соединение N 3-7). В соответствии с процедурой, аналогичной той, что изложена в вышеприведенном примере 6, но с использованием в данном случае 3 г 2-амино-1-/2-нафтил/-этанола (полученного согласно изложенному в примере получения 9), 3,87 г метил-4-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 3), 60 мл бензола. 50 мл абсолютного метанола и 2,49 г цианоборгидрида натрия получили 3,23 г соединения, указанного в заголовке примера, с Rf 0,15 (в результате тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Пример 11. 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэти]- амино-1-/1-нафтил/-этанол (соединение N 3-8). В соответствии с процедурой, аналогичной вышеизложенной в примере 6, но с использованием при этом 3 г 2-амино-1-/1-нафтил/-этанола (полученного согласно изложенному в примере получения 10), 3,87 г метил-4-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 3), 60 мл бензола, 50 мл абсолютного метанола и 3 г цианоборгидрида натрия получили 1,9 г соединения, указанного в заголовке примера, с Rf 0,35 (после тонкослойной хроматографической обработки на силикагеле с использованием этилацетата в качестве проявляющего растворителя).
Пример 12. 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэти]-амино-2-метил-1-фенилэтанол (соединение N 3-9). В соответствии с процедурой, аналогичной вышеизложенной в примере 6, но с использованием при этом 3 г (1R, 2S)-/-/норэфедрина, 4,36 г метил-4-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 3), 60 мл бензола, 50 мл абсолютного метанола и 3,41 г цианоборгидрида натрия в форме кристаллов получили 2,65 г соединения, указанного в заголовке примера, с температурой плавления 124oC (после перекристаллизации из смеси этилацетата с гексаном).
Пример 13. 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэтил]- амино-2-метил-1-фенилэтанол (соединение N 3-9). В соответствии с процедурой, аналогичной вышеизложенной в примере 12, но с использованием при этом 3 г /1S, 22/-/+/-1-норэфедрина, 4,36 г метил-4-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 3), 60 мл бензола, 50 мл абсолютного метанола и 3,57 г цианоборгидрида натрия, получили 2,41 г соединения, указанного в заголовке примера, в виде кристаллов с температурой плавления 122oC.
Пример 14. 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэти]-амино-1-/2-хлорфенил/-этанол (соединение N 3-11). В соответствии с процедурой, аналогичной той, что изложена в вышеприведенном примере 6, но с использованием при этом 2 г 2-амино-1-/2-хлорфенил/-этанола (полученного согласно изложенному в примере получения 11), 3,11 г метил-4-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 3), 60 мл бензола, 50 мл абсолютного метанола и 2,3 г цианоборгидрида натрия получили 3,25 г соединения, указанного в заголовке примера, с Rf 0,39 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Пример 15. 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэтил]-амино-1-/4-хлорфенил/-этанол (соединение N 3-12). В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 12, но с использованием при этом 2 г 2-амино-1-/4-хлорфенил/-этанола (полученного согласно изложенному в примере получения 12), 3,11 г метил-4-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 3), 60 мл бензола, 50 мл абсолютного метанола и 2,7 г цианоборгидрида натрия получили в форме кристаллов 1,54 г соединения, указанного в заголовке примера, с температурой плавления 78-79oС.
Пример 16. 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэтил]-амино-1-/3-фторфенил/-этанол (соединение N 3-13). В соответствии с процедурой, аналогичной той, что описана в примере 6, но с использованием в данном случае 2 г 2-амино-1-/3-фторфенил/-этанола (полученного согласно изложенному в примере получения 13), 3,44 г метил-4-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 3), 60 мл бензола, 60 мл абсолютного метанола и 3,6 г цианоборгидрида натрия в форме кристаллов получили 1,18 г соединения, указанного в заголовке примера, с температурой плавления 52oС.
Пример 17. 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэтил]-амино-1-/3,4,5-триметоксифенил/-этил (соединение N 3-16). В соответствии с процедурой, аналогичной вышеизложенной в примере 6, но с использованием при этом 2 г 2-амино-1-/3,4,5-триметоксифенил/-этанола (полученного согласно изложенному в примере получения 14), 2,35 г метил-4-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 3), 70 мл бензола, 60 мл абсолютного метанола и 4,8 г цианоборгидрида натрия получили 3,14 г соединения, указанного в заголовке данного примера, с Rf 0,21 (после тонкослойной хроматографической обработки на силикагеле с использованием этилацетата в качестве проявляющего растворителя).
Пример 18. 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэтил]-амино-1-/3-феноксифенил/-этанол (соединение N 3-26). В соответствии с процедурой, аналогичной той, что изложена в вышеприведенном примере 6, но с использованием при этом 2 г 2-амино-1-/3-феноксифенил/-этанола (полученного согласно изложенному в примере получения 15), 3,4 г метил-4-/2-оксопропокси/-фенилацетата (полученного согласно нижеизложенному в примере получения 3), 70 мл бензола, 60 мл абсолютного метанола и 3,7 г цианоборгидрида натрия получили 1,27 г соединения, указанного в заголовке примера, с Rf 0,26 (после тонкослойной хроматографической обработки на силикагеле с использованием этилацетата в качестве проявляющего растворителя).
Пример 19. 2-(2-[4-/2-оксоэтил/-фенокси]-1-метилэтил)-амино-1/S/-фенилэтанол (соединение N 7-1). Повторили процедуру, аналогичную вышеизложенной в примере 3, за исключением того, что при этом использовали 1,4 г 2-амино-1/S/-фенилэтанола (полученного согласно изложенному в примере получения 16), 2,4 г 2-[4-/2-оксопропокси/-фенил]-этанола (полученного согласно изложенному в примере получения 7), 100 мл бензола, 100 мл абсолютного метанола и 0,95 г цианоборгидрида натрия и после завершения реакции реакционную смесь разбавляли водой и подвергали экстракционной обработке этилацетатом. Затем экстракт сконцентрировали и концентрат очистили пропусканием через хроматографическую колонку с силикагелем, используя в качестве элюента смесь этилацетата с этанолом в объемном соотношении 30:1. В результате в виде кристаллов получили 0,53 г соединения, указанного в заголовке примера, с температурой плавления 93-96oC (после перекристаллизации из этилацетата).
Пример 20. 2-[2-/3-метоксикарбонилметилфенокси/-1-метилэти]-амино-1-/3-хлорфенил/-этанол, 1/4 гидрат (соединение N 3-2). В соответствии с процедурой, аналогичной той, что описана в примере 6, но с использованием при этом 2 г 2-амино-1-/3-хлор-фенил/-этанола (полученного согласно изложенному в примере получения 8), 3,11 г метил-3-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 17), 70 мл бензола, 60 мл абсолютного метанола и 2,45 г цианоборгидрида натрия получили 2,57 г соединения, указанного в заголовке примера, с Rf 0,38 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Пример 21. 2-[2-/2-метоксикарбонилметилфенокси/-1-метилэти]-амино-1 -/3-хлорфенил/-этанол (соединение N 3-3).
В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 6, но с использованием в данном случае 2 г 2-амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в примере получения 8), 3,11 г метил-2-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 18), 70 мл бензола, 60 мл абсолютного метанола и 2,5 г цианоборгидрида натрия, получили 3,1 г соединения, указанного в заголовке примера, с Rf 0,30 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Пример 22. 2-[2-/4-метоксикарбонилметил-2-хлорфенокси/-1-метилэти]-амино-1-/3-хлорфенил/-этанол (соединение N 3-28). В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 6, но с использованием при этом 5,15 г 2-амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в примере получения 8), 10, 3 метил-3-хлор-4-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 19), 200 мл бензола, 200 мл абсолютного метанола и 6 г цианоборгидрида натрия в форме кристаллов получили 1,2 г соединения, указанного в заголовке примера, с температурой плавления 83-103oС (после перекристаллизации из смеси этилацетата с гексаном).
Пример 23. 2-[2-/4-карбамоилметил-2-хлорфенокси/-1-метил-этил]-амино-1-/3-хлорфенил/-этанол, 1/8 гидрат (соединение N 4-6). Раствор 2 г 2-[2-/4-метоксикарбонилметил-2-хлорфенокси/-метилэтил]-амино-1-/3-хлорфенил/-этанола (полученного согласно вышеизложенному в примере 22) в 50 мл метанола в реакционном сосуде подвергли насыщению газообразным аммиаком с одновременным охлаждением раствора, после чего реакционный сосуд плотно закрыли и оставили стоять при комнатной температуре в течение 1 недели. По завершении указанного промежутка времени под пониженным давлением отгонкой удаляли растворитель, а остаток перекристаллизовали из этилацетата, в результате чего в форме кристаллов получили 0,55 г соединения, указанного в заголовке примера, с температурой плавления 99-101oC.
Пример 24. 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэтил]-амино-1-/3-хлорфенил/-этанолфумарат (фумарат соединения N 3-1). Смесь 10,0 г 2-[2-/4-метоксикарбонилметилфенокси/-1-метил- этил]-амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в вышеприведенном примере 3) с 2,8 г фумаровой кислоты растворяли в метаноле, а затем под пониженным давлением отгонкой удаляли метанол. Остаток перекристаллизовали из этилацетата, получив в виде кристаллов 11,5 г соединения, указанного в заголовке примера, с температурой плавления 130-146oC.
Пример 25. 2-(2-[3,4-бис-/гидроксиметил/-фенокси] -1-метил-этил]- амино-1-/3-хлорфенил/-этанол (соединение N 7-7). В соответствии с процедурой, аналогичной вышеизложенной в примере 1, но с использованием при этом 2,53 г 2-(2-13,4-бис-/метоксикарбонил/-фенокси/-2-метилэтил)-амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в примере получения 20), 0,81 г литийалюминийгидрида и 100 мл сухого тетрагидрофурана и с последующей очисткой реакционного продукта пропусканием через хроматографическую колонку с силикагелем, где в качестве элюента использовали смесь этилацетата с этанолом в объемном соотношении 5:1, получили 1,04 г соединения, указанного в заголовке примера, с Rf 0,37 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с этанолом в объемном соотношении 5:1).
Пример 26. 2-(2-[4-/1,1,2, 2-тетракис-/этоксикарбонил/-этил]-фенокси/-1-метилэтил)-амино-1-/3-хлорфенил/-этанол (соединение N 3-22) В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 6, но с использованием при этом 1 г 2-амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в примере получения 8), 3 г 4-[1,1,2,2-тетракис-/этоксикарбонил/-этил] -феноксиацетона (полученного согласно изложенному в примере получения 22), 100 мл сухого бензола, 50 мл абсолютного метанола и 920 мг цианоборгидрида натрия и последующей очисткой реакционного продукта пропусканием через хроматографическую колонку с силикагелем, где в качестве элюента использовали смесь этилацетата с гексаном в объемном соотношении 10: 1, получили 0,4 г соединения, указанного в заголовке примера, с Rf 0,35 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Пример 27. 2[2-/4-метоксикарбонилметилфенокси/-1/К/-метил-этил]-амино-1-/R/-фенилэтанол (соединение N 3-29). 870 мг тетрабутиламмонийфторида добавили в раствор 510 мг N-[2-/4-метоксикарбонилметилфенокси/-1/R/-метил-этил] -2-/R/-трет. бутилдиметилсилилокси-2-фенилэтанамина (полученного согласно изложенному в примере получения 29) в 15 мл тетрагидрофурана, после чего образовавшуюся смесь перемешивали при комнатной температуре в течение 2 ч. По истечении этого промежутка времени реакционную смесь разбавили водой и водную смесь подвергли экстракционной обработке этилацетатом. Экстракт высушили над безводным сульфатом натрия, а затем под пониженным давлением отгонкой удалили растворитель. Полученный остаток очистили пропусканием через хроматографическую колонку с силикагелем, используя в качестве элюента этилацетат, в результате чего в форме кристаллов получили 0,23 г соединения, указанного в заголовке данного примера, с температурой плавления 69-70oC.
[α] - 20,0o (c-1,
000, хлороформ).
Пример 28. 2-[2-/4-метоксикарбонилметилфенокси/-1/S/-метил-этил]-амино-1-/S/-фенилэтанол (соединение N 3-29). В соответствии с процедурой, аналогичной той, что описана в
вышеприведенном примере 27, но
с использованием при этом 970 мг N-[2-/4-метоксикарбонилметилфенокси/-1-/S/-метилэтил] -2/S/-трет. бутилдиметилсилилокси-2-фенилэтанамина (полученного согласно
изложенному в примере получения 30), 20
мл тетрагидрофурана и 1,7 г тетрабутиламмонийфторида в форме кристаллов получили 0,58 г соединения, указанного в заголовке примера, с температурой плавления
70-71oС.
[α]
Пример 29.
2-[2-/4-метоксикарбонилметилфенокси/-1/S/-метилэтил] - амино-1/R/-фенилэтанол (соединение N 3-29). В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 27,
но с
использованием при этом 460 мг N-[2-/4-метоксикарбонилметилфенокси/-1-/S/-метилэтил]-2-/R/- трет. бутилдиметилсилилокси-2-фенилэтанамина (полученного согласно изложенному в примере получения 31),
15
мл тетрагидрофурана и 780 мг тетрабутиламмонийфторида в форме кристаллов получили 0,23 г соединения, указанного в заголовке примера, с температурой плавления 89-90oC
[α
]
Пример 30.
2-[2-/4-метоксикарбонилметилфенокси/-1-/R/-метил-этил]-амино-1-/S/-фенилэтанол (соединение N 3-29). В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 27, но с
использованием в данном случае 880 мг N-[2-/4-метоксикарбонилметилфенокси/-1/R/-метилэтил]-2/S/- трет. бутилдиметилсилилокси-2-фенилэтанамина (полученного согласно изложенному в примере получения 32),
20 мл тетрагидрофурана и 1,5 г тетрабутиламмонийфторида в форме кристаллов получили 0,5 г соединения, указанного в заголовке примера, с температурой плавления 90-91oС.
[α]
Пример 31.
2-[2-/3-метоксикарбонилметил-4-гидроксифенокси/-1-метилэти] -амино-1-фенилэтанол, 1/4 гидрат (соединение N 3-60) В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 6,
но с использованием при этом 0,72 г 2-амино-1-фенилэтанола, 1,5 г метил-2-окси-5-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 21) 60 мл бензола, 50 мл
абсолютного метанола и 1,9 г цианоборгидрида натрия и последующей очисткой реакционного продукта пропусканием через хроматографическую колонку с силикагелем, где в качестве элюента использовали смесь
этилацетата с этанолом в объемном соотношении 10:1, получили 0,07 г соединения, указанного в заголовке примера, с Rf 0,40 (после тонкослойной хроматографической обработки на силикагеле с
использованием в качестве проявляющего растворителя смеси этилацетата с этанолом в объемном соотношении 10:1).
Пример 32. 2-(2-[2, 4-бис/-гидроксиметил/-фенокси]-1-метил-этил)-амино-1-/3-хлорфенил/-этанол, 1/4 гидрат (соединение N 7-8) В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 1, но с использованием при этом 1,28 г 2-(2-[,4-бис-/метоксикарбонил/-фенокси]-1-метилэтил)-амино-1- /3-хлорфенил)-этанола (полученного согласно изложенному в примере получения 33), 0,463 г литийалюминийгидрида и 70 мл сухого тетрагидрофурана и последующей очисткой реакционного продукта пропусканием через хроматографическую колонку с силикагелем, где в качестве элюента использовали смесь этилацетата с этанолом в объемном соотношении 4:1, получили 0,78 г соединения, указанного в заголовке примера, с Rf 0,34 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с этанолом в объемном соотношении 4:1).
Пример 33. 2-[2-/4-метоксикарбонилметил-2-гидроксифенокси/-1-метилэтил] -амино-1-/3-хлорфенил/-этанол (соединение N 3-23). В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 6, но с использованием в данном случае 2 г 2-амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в примере получения 8), 3,07 г метил-3-окси-4-/2-оксо-пропокси/-фенилацетата (полученного согласно изложенному в примере получения 34), 70 мл сухого бензола, 60 мл абсолютного метанола и 1,7 г цианоборгидрида натрия и последующей очисткой реакционного продукта пропусканием через хроматографическую колонку с силикагелем, где в качестве элюента использовали этилацетат, в форме кристаллов получили 2,62 г соединения, указанного в заголовке примера, с температурой плавления 68oC.
Пример 34. 2-(2-[2-хлор-4-/N-гидроксикарбамоилметил/-фенокси]-1-метилэтил)-амино-1-/3-хлорфенил/-этанол (соединение N 4-15). Смесь, которая включала в себя 2,0 г 2-[2-/4-метоксикарбонилметил-2-хлорфенокси/-1-метилэтид]- амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в вышеприведенном примере 22), 6,25 г гидроксиламингидрохлорида, 50 мл метанола и 11 г триэтиламина, оставили стоять при комнатной температуре в течение 8 дней, а затем под пониженным давлением удалили отгонкой растворитель (метанол). Полученный остаток смешали с этилацетатом и водным раствором хлорида натрия. Далее этилацетатный слой отделили и промыли водным раствором хлорида натрия, после чего его высушили над безводным сульфатом натрия. Под пониженным давлением удалили отгонкой растворитель, а остаток очистили хроматографической обработкой в колонке с силикагелем, используя в качестве элюента смесь этилацетата с этанолом в объемном соотношении 5:2, в результате чего в форме стеклоподобного твердого продукта получили 1,1 г соединения, указанного в заголовке примера, с температурой плавления 65-75oC.
Пример 35. 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэтил]-амино-1-/3,5-дитрет. бутил-4-гидроксифенил/-этанол, 1/2 фумарат (1/2 фумарат соединения N 3-27). Процедуру, аналогичную той, что описана в вышеприведенном примере 6, повторили, за исключением того, что в данном случае использовали 3 г 2-амино-1-/3,5-дитрет.бутил-4-гидроксифенил/- этанола (полученного согласно изложенному в примере получения 35), 2,2 г метил-4-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 3), 100 мл бензола, 60 мл абсолютного метанола и 4 г цианоборгидрида натрия и что продукт очистили повторным пропусканием через хроматографическую колонку с силикагелем с использованием в качестве элюента вначале этилацетата, а затем смеси бензола с этилацетатом в объемном соотношении 1:1. В результате получили 2,1 г 2-[2-/4-метоксикар- бонилметилфенокси/-1-метилэтил]-амино-1-/3,5-дитрет. бутил-4-оксифенил/-этанола. Далее этот продукт смешали с 246 мг фумаровой кислоты и образовавшуюся смесь перекристаллизовали из этилацетата, получив в форме кристаллов 1,5 г соединения, указанного в заголовке примера, с температурой плавления 171-174oC.
Пример 36. 2-[2-/4-карбоксиметил-2-хлорфенокси/-1-метилэти]-амино-1-/3-хлорфенил/-этанола, 1/4 гидрата (соединение N 2-12). Раствор 6,0 г гидрата окиси калия в 10 мл воды добавляли в раствор 2,3 г 2-[2-/4-метоксикарбонилметил-2-хлорфенокси/-1-метилэтил] -амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в вышеприведенном примере 22) в 90 мл метанола и образовавшуюся смесь оставили стоять в течение ночи. По истечение этого периода времени реакционную смесь вылили в смесь воды со льдом и добавлением 1 н водного раствора соляной кислоты, величину pH довели до 7, после чего смесь обработали ультразвуковыми волнами. Выпавшие в осадок кристаллы собрали фильтрованием и перекристаллизовали из метанола, в результате чего в форме кристаллов получили 0,97 г соединения, указанного в заголовке примера, с температурой плавления 188-192oC.
Пример 37. 2-{2-[4-/альфа-метоксикарбонил-альфа-гидроксиметил/-фенокси] -1-метилэтил}-амино-1-/3-хлорфенил/-этанол (соединение N 6-1). В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 6, но с использованием в данном случае 5,2 г метил-4-/2-оксопропокси/-манделата (полученного согласно изложенному в примере получения З6), 3,12 г 2-амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в примере получения 8), 80 мл сухого бензола, 80 мл абсолютного метанола и 4,2 г цианоборгидрида и последующей очисткой реакционного продукта пропусканием через хроматографическую колонку с силикагелем с использованием в качестве элюента этилацетата, получили 3,87 г соединения, указанного в заголовке примера: с Rf 0,27 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Пример 38. 2-(2-[4-/2-ацетоксиэтил/-фенокс]-1-метилэтил)-амино-1-/3-хлорфенил/-этанол (соединение N 8-1). В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 6, но с использованием в данном случае 2 г 2-[4-/2-оксопропокси/-фенил]-ацилацетата (полученного согласно изложенному в примере получения 37), 1,45 г 2-амино-1-/3- хлорфенил/-этанола (полученного согласно изложенному в примере получения 8), 60 мл сухого бензола, 50 мл абсолютного изопропанола и 2,06 г цианоборгидрида натрия и последующей очисткой реакционного продукта пропусканием через хроматографическую колонку с силикагелем с использованием в качестве элюента смеси этилацетат с гексаном в объемном соотношении 1:1, получили 0,49 г соединения, указанного в заголовке данного примера, с Rf 0,34 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с гексаном в объемном соотношении 1:1).
Пример 39. 2-{2-[4-бис/метоксикарбонил/метилфенокси]-1-метилэтил}-амино-1-/3-хлорфенил/-этанол (соединение N 3-18). В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 6, но с использованием в данном случае 0,42 г диметил-4-/2-оксопропокси/-фенилмалоната (полученного согласно изложенному в примере получения 38), 0,26 г 2-амино-1-/3- хлорфенил/-этанола (полученного согласно изложенному в примере получения 8), 50 мл сухого бензола, 50 мл абсолютного метанола и 0,9 г цианоборгидрида натрия и последующей очисткой реакционного продукта пропусканием через хроматографическую колонку с силикагелем, где в качестве элюента использовали этилацетат, получили 0,4 г соединения, указанного в заголовке примера, с Rf 0,28 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Пример 40. 2-[2-/4-метоксикарбонилметилфенокси/-1-метил-этил]-амино-1-/3, 5-дихлорфенил/-этанол (соединение N 3-15). В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 3, но с использованием в данном случае 2-амино-1-/3, 5-дихлорфенил/-этанола, полученного согласно изложенному в примере получения 39), 3,87 г метил-4-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 3), 80 мл бензола, 60 мл абсолютного метанола и 2,9 г цианоборгидрида натрия и последующей очисткой продукта реакции пропусканием через хроматографическую колонку с силикагелем, где в качестве элюента использовали этилацетат, получили 3,6 г соединения, указанного в заголовке примера, с Rf 0,51 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Пример 41. 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэтил]-амино-1-/3-хлор-4-фторфенил/-этанол (соединение N 3-41). В соответствии с процедурой, аналогичной той, что была описана в вышеприведенном примере 3, но с использованием в данном случае 3,0 г 2-амино-1-/3-хлор-4-фторфенил/-этанола (полученного согласно изложенному ниже в примере получения 40), 4,22 г метил-4-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 3), 80 мл бензола, 60 мл абсолютного метанола и 3, 5 г цианоборгидрида натрия и последующей очисткой реакционного продукта его пропусканием через хроматографическую колонку с силикагелем, где в качестве элюента использовали этилацетат, получили 3,31 г соединения, указанного в заголовке примера, с Rf 0,22 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Пример 42. 2-[2-/4-метоксикарбонилметилфенокси/-1-метил-этил]-амино-1-/3-бромфенил/-этанол (соединение N 14). В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 3, но с использованием при этом 3,0 г 2-амино-1-/3-бромфенил/-этанола (полученного согласно изложенному в примере получения 41), 3,67 г метил-4-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 3), 80 мл бензола, 60 мл абсолютного метанола и 3,1 г цианоборгидрида натрия и последующей очисткой реакционного продукта его пропусканием через хроматографическую колонку с силикагелем, где в качестве элюента использовали этилацетат, получили 3,33 г соединения, указанного в заголовке примера, с Rf 0,25 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Пример 43. 2-[2-/4-метоксикарбонилметилфенокси/-1-метилэтил]-амино-1-/3-трифторметилфенил/-этанол (соединение N 3-66). В соответствии с процедурой, аналогичной той, что изложена в вышеприведенном примере 3, но с использованием в данном случае 3,0 г 2-амино-1-/3-трифторметилфенил/-этанола (полученного согласно изложенному в примере получения 42), 3,89 г метил-4-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 3), 80 мл бензола, 60 мл абсолютного метанола и 4,0 г цианоборгидрида натрия и последующей очистки реакционного продукта его пропусканием через хроматографическую колонку с силикагелем, где в качестве элюента использовали этилацетат, получили 2,2 г соединения, указанного в заголовке примера, с Rf 0,32 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Пример 44. 2-[2-/4-метоксикарбонилметилфенокси/-1-метил- эти]-амино-1-/3-метоксифенил/-этанол (соединение N 3-62). В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 3, но с использованием при этом 2,5 г 2-амино-1-/3-метоксифенил/-этанола (полученного согласно изложенному в примере получения 43), 4,0 г метил-4-/2-оксопропокси/-фенилацетата (полученного согласно изложенному в примере получения 3), 80 мл бензола, 60 мл абсолютного метанола и 2,75 г цианоборгидрида натрия и последующей очистки реакционного продукта путем его пропускания через хроматографическую колонку с силикагелем, где в качестве элюента использовали этилацетат, получили 3,11 г соединения, указанного в заголовке примера, с Rf 0,21 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Пример 45. 2-[2-/4-метоксикарбонилметилфенокси/-1-метил-этил]-амино-1-/3-метилфенил/-этанол (соединение N 3-61). В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 3, но с использованием при этом 2,5 г 2-амино-1-/3-метилфенил/-этанола (полученного согласно изложенному в примере получения 44), 4,4 г метил-4-/2-оксопропокси/-фенилацетата (полученного по изложенному в примере получения 3), 80 мл бензола, 60 мл абсолютного метанола и 4,5 г цианоборгидрида натрия и последующей очисткой реакционного продукта пропусканием его через хроматографическую колонку с силикагелем, где в качестве элюента использовали этилацетат, получили 3,2 г соединения, указанного в заголовке примера, с Rf 0,24 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Пример 46. 2-[2-/4-метоксикарбонилметилфенокси/-1/R/-метилэтил] - амино-1/R/-3-/3-хлорфенил/-этанол (соединение N 3-1). В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 27, но с использованием в данном случае 3,02 г N-[2-/4-метоксикарбонилметилфенокси/-1/R/-метилэтил] - 2/R/-трет.бутилдиметилсилилокси-2-/3-хлорфенил/-этаноамина (полученного согласно изложенному в примере получения 50), 4,81 г тетрабутиламмонийфторида и 100 мл тетрагидрофурана, получили 1,7 г соединения, указанного в заголовке примера, с Rf 0,39 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
[α]
Пример 47.
2-[2-/4-метоксикарбонилметилфенокси/-1/R/-метилэтил] - амино-1/R/-3-хлорфенил/-этанолфумарат (фумарат соединения N 3-1). 30 мл гексана
осторожно добавили в раствор 1,6 г
2-[2-/4-метоксикарбонилметилфенокси/-1/R/-метилэтил] -амино-1/R/-/3-хлорфенил/-этанола (полученного согласно вышеизложенному в примере 46) и 491 мг фумаровой кислоты
в 5 мл этилацетата, одновременно
обрабатывая реакционную смесь ультразвуковыми волнами. Выпавшие в осадок кристаллы собрали фильтрованием и высушили, в результате чего в форме кристаллов получили 1,95
г соединения, указанного в
заголовке, с температурой плавления 73-78oC.
[α]
Пример 48. 5-[4-{ 2/R/-[2/R/-/3-хлорфенил/-2-гидроксиэтил-амино]-пропокси}-бензол]-тиазолидин-2,4-дион (соединение N 5-1). 88 г
тетрабутиламмонийфторида с
одновременным охлаждением льдом добавили в раствор 46,2 г 5-[4-2/R/-[2/R/-/3-хлорфенил/-2-трет. бутилдиметилсилилоксиэтиламино] -пропоксибензил] -тиазолдин-2,4-диона
(полученного согласно изложенному
в примере получения 52) в 500 мл тетрагидрофурана и образовавшуюся смесь перемешивали при комнатной температуре в течение 15 ч. По истечении этого промежутка времени
отгонкой под пониженным давлением
удалили тетрагидрофурановый растворитель, а остаток смешали с водой, а затем подвергли экстракционной обработке этилацетатом. Затем экстракт промыли водным раствором
хлорида натрия и высушили над
безводным сульфатом натрия. Под пониженным давлением отгонкой удалили этилацетатный растворитель и остаток очистили его пропусканием через хроматографическую колонку с
силикагелем, используя в
качестве элюента смесь этилацетата с этанолом в объемном соотношении 5:1. Полученные таким образом сырые кристаллы перекристаллизовали из смеси этилацетата с этанолом, в
результате чего в форме
кристаллов получили 27,1 г соединения, указанного в заголовке примера, с температурой плавления 100-112oC.
[α]
Пример 49. 5-[4-(2-[2-/2-нафтил/-2-гидроксиэтиламино]- пропокси)-бензил]
-тиазолидин-2,4-дион
(соединение N 5-2). В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 2, но с использованием в данном случает 520 мг 2-амино-1-/2-нафтил/-этанола
(полученного
согласно изложенному в примере получения 9), 650 мг 5-[4-/2-оксопропокси/-бензил]-тиазолидин-2,4-диона (полученного согласно изложенному в примере получения 2), 150 мл бензола, 100 мл
абсолютного
метанола и 1,25 г боргидрида натрия и последующей очисткой реакционного продукта его пропусканием через хроматографическую колонку с силикагелем, где использовали в качестве элюента смесь
этилацетата
с этанолом в объемном соотношении 5:1, в
форме кристаллов получили 0,49 г соединения, указанного в заголовке примера, с температурой плавления 115-145oC.
Пример 50. 5-[/4-(2-[2-/3-трифторметилфенил/-2-гидрокси- этиламино]-пропокси)-бензил] -тиазолидин-2,4-дион (соединение N 5-3). В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 2, но с использованием при этом 5,88 г 2-амино-1-/3-трифторметилфенил/-этанола (полученного согласно изложенному в примере получения 42), 8 г 5- [4-/2-оксопропокси/-бензил/-тиазолидин-2,4-диона (полученного согласно изложенному в примере получения 2), 200 мл бензола, 150 мл абсолютного метанола и 5,4 г цианоборгидрида натрия и последующей очисткой реакционного продукта путем его пропускания через хроматографическую колонку с силикагелем, где в качестве элюента использовали этилацетат, в форме кристаллов получили 4,8 г соединения, указанного в заголовке примера, с температурой плавления 100-105oC.
Пример получения 1. 2-[2-/4-метоксикарбонилфенокси/-1-метилэтил]-амино-1-/3-хлорфенил/-этанол. Процедуру, аналогичную той, что описана в примере 12, повторили, за исключением того, что в данном случае использовали 3,43 г 2-амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному в примере получения 8), 4,5 г метил-4-/2-оксопропокси/-бензоата (полученного согласно изложенному в описании к европейской патентной публикации N 6735), 100 мл бензола, 100 мл абсолютного метанола и 2,7 г боргидрида натрия, в результате чего в форме кристаллов получали соединение, указанное в заголовке примера, с температурой плавления 99-101oC.
Пример получения 2. 5-[4-/2-оксопропокси/-бензил]-тиазо- лидин-2,4-дион.
2(а) 1-/4-аминофенокси/-пропан-2-онгидрохлорид. При комнатной температуре в течение 5 ч через смесь, которая включала в себя 19,6 г 1-/4-нитрофенокси/-пропан-2-она, 300 мл метанола, 30 мл концентрированного водного раствора соляной кислоты и 4 г 10-ного (вес/объем) палладия на древесном угле, пропускали поток водорода. По истечении указанного периода времени катализатор отфильтровывали и фильтрат сконцентрировали выпариванием под пониженным давлением, получив 20 г соединения, указанного в заголовке примера.
2(в) Этил-2-хлор-3-[4-/2-оксопропокси/-фенил] -пропионат. В смесь 20 г 1-/4-аминофенокси/-пропан-2-онгидрохлорида (полученного согласно изложенному на стадии (а), описанной выше) с 400 мл ацетона добавили 50 мл 35-ного (вес/объем) водного раствора соляной кислоты, а затем по каплям в образовавшуюся смесь добавили раствор 12 г нитрита натрия в 20 мл воды при одновременном охлаждении льдом, после чего смесь перемешивали при той же самой температуре в течение 20 мин. По истечении указанного промежутка времени в смесь в виде отдельных порций добавили 130 г этилакрилата, а затем 3,2 г закиси меди и образовавшуюся смесь перемешивали при комнатной температуре в течение 1 часа. Далее реакционную смесь сконцентрировали выпариванием под пониженным давлением и концентрат смешали с водой и этилацетатом. Этилацетатный слой отделили, промыли водой и высушили над безводным сульфатом натрия, а растворитель затем удалили отгонкой под пониженным давлением. Полученный остаток очистили его пропусканием через хроматографическую колонку с силикагелем, используя в качестве элюента смесь гексана с этилацетатом в объемном соотношении 5: 1, получив 11,3 г соединения, указанного в заголовке примера, с Rf 0,31 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси гексана с этилацетатом в объемном соотношении 5:1).
2(с) 5-[4-/2-оксопропокси/-бензи] -тиазолидин-2,4-дион. Смесь, которая включала в себя 12 г этил-2-хлор-3-[4-/2-оксопропокси/-фенил]-пропионата (полученного согласно вышеизложенному на стадии (в)), 5 г тиомочевины и 30 мл сульфолана, выдержали в течение 3 ч при температуре 90oC, а затем в эту смесь добавили 100 мл метоксиэтанола, после чего ее выдержали при повышенной температуре в течение дополнительных 4 ч. По завершении этого периода времени в реакционную смесь добавили 40 мл воды и 20 мл концентрированного водного раствора соляной кислоты и образовавшуюся смесь выдержали в течение 4,5 ч на масляной бане при температуре 100oC. После этого реакционную смесь смешали с водой и этилацетатом с последующим отделением этилацетатного слоя, его промывкой водой и сушкой над безводным сульфатом натрия; далее под пониженным давлением отгонкой удалили растворитель. Полученный остаток очистили его пропусканием через хроматографическую колонку с силикагелем, используя метод градиентного элюирования с помощью смесей гексана с этилацетатом в интервале соотношений от 3:2 до 2:3 (по объему) в качестве элюента, с последующей кристаллизацией из смеси этилацетата с гексаном, в результате чего в форме кристаллов получили соединение, указанное в заголовке примера, с температурой плавления 158-159oC.
Пример получения 3. Метил-4-/2-оксопропокси/-фенилацетат. Смесь, которая содержала 74,6 г метил-4-оксифенилацетата, 92,2 г бромацетона, 125 г карбоната калия и 750 мл диметилформамида, перемешивали при комнатной температуре в течение 1 дня. По завершении этого периода времени реакционную смесь сконцентрировали выпариванием под пониженным давлением. Полученный концентрат смешали с водой, а затем подвергли экстракционной обработке этилацетатом. Экстракт промыли водным раствором хлорида натрия и высушили над безводным сульфатом натрия, а растворитель после этого удалили отгонкой под пониженным давлением. Остаток очистили пропусканием его через хроматографическую колонку с силикагелем, используя в качестве элюента смесь этилацетата с бензолом в объемном соотношении 1:8, в результате чего получили соединение, указанное в заголовке примера, с Rf 0,43 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с бензолом в объемном соотношении 1:7).
Пример получения 4. Метил-4-/2-оксопропокси/-циннамат. В соответствии с процедурой, аналогичной той, что изложена в примере получения 3, но с использованием в данном случае 16 г метил-4-оксициннамата, 14,9 г бромацетона, 20 г карбоната калия и 150 мл диметилформамида в форме кристаллов получили соединение, указанное в заголовке примера, с температурой плавления 117-118oС (после перекристаллизации из этилацетата).
Пример получения 5. Метил-3-[4-/2-оксопропокси/-фенил]-пропионат. Через раствор 4 г метил-4-/2-оксопропокси/-цианамата (полученного согласно изложенному в примере получения 4) в смеси 200 мл метанола со 100 мл тетрагидрофурана в присутствии 2 г 10-ного по весу палладия на древесном угле при комнатной температуре в течение 2 ч пропускали поток водорода. По завершении этого промежутка времени катализатор отфильтровали и фильтрат сконцентрировали выпариванием под пониженным давлением. Полученный концентрат очистили его пропусканием через хроматографическую колонку с силикагелем, используя в качестве элюента этилацетат, в результате чего получили соединение, указанное в заголовке примера, с Rf 0,54 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси гексана с этилацетатом в объемном соотношении 2:1).
Пример получения 6. Метил-3-[4-/2-оксопропокси/-фенил]-лактат. В соответствии с процедурой, аналогичной той, что описана в примере получения 3, но с использованием в данном случае 1,8 г метил-4-оксифениллактата, 1,63 г бромацетона, 1,65 г карбоната калия и 150 мл диметилформамида получили соединение, указанное в заголовке примера, с Rf 0,32 (после тонкослойной хроматографической обработки на силикагеле с использованием смеси гексана с зтилацетатом в объемном соотношении 1:1 в качестве проявляющего растворителя).
Пример получения 7. 2-[4-/2-оксопропокси/-фенил]-этанол. В соответствии с процедурой, аналогичной той, что изложена в вышеприведенном примере получения 3, но с использованием в данном случае 10 г 2-/4-оксифенил/-этанола, 21,6 г бромацетона, 30 г карбоната калия и 100 мл диметилформамида получили соединение, указанное в заголовке примера, с Rf 0,31 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси гексана с этилацетатом в объемном соотношении 1:1).
Пример получения 8. 2-амино-1-/3-хлорфенил/-этанол. В смесь 112 г триметилсилилнитрила с 0,1 г иодистого цинка добавили по каплям 140 г 3-хлорбензальдегида и образовавшуюся смесь выдержали при повышенной температуре на масляной бане, температуру которой поддерживали на уровне 90oC в течение 2,5 ч. По завершении этого промежутка времени реакционную смесь по каплям добавили в смесь 50 г тилийалюминийгидрида с 1200 мл тетрагидрофурана, после чего смесь выдержали при температуре кипения с обратным холодильником в течение 40 мин. Затем смесь охладили льдом, после чего добавили 50 мл воды, 50 мл 15-ного (вес/объем) водного раствора гидрата окиси натрия и 50 мл воды в указанном порядке. Нерастворившиеся материалы отфильтровали и фильтрат сконцентрировали выпариванием под пониженным давлением. Концентрат очистили пропусканием через хроматографическую колонку с силикагелем, используя в качестве элюента смесь этилацетата с этанолом и триэтиламином в объемном соотношении 10: 4: 1 с последующей перегонкой в вакууме, в результате чего соединение, указанное в заголовке примера, получили в виде жидкости с температурой кипения 140-141oC при остаточном давлении 2,5 мм рт.ст. (383 Па).
Пример получения 9. 2-амино-1-/2-нафтил/-этанол. Смесь 7,4 г 2-нафтальдегида с 9,93 г триметилсилилнитрила и каталитическим количеством иодистого цинка выдержали на масляной бане при температуре 90oC в течение 2 ч. По завершении этого периода времени реакционную смесь по каплям добавили в смесь 5,7 г литийалюминийгидрида и 500 мл тетрагидрофурана с одновременным охлаждением льдом, после чего образовавшуюся смесь выдержали при температуре кипения с обратным холодильником в течение 3 ч, а затем в нее по каплям добавили 5,7 мл воды, 5,7 мл 15-ного (вес/объем) водного раствора гидрата окиси натрия и 17,1 мл воды в указанном порядке. Нерастворившиеся материалы отфильтровали и фильтрат выпаривали под пониженным давлением. Кристаллы, полученные из этого концентрата, перекристаллизовали из смеси этилацетата с гексаном, получив в форме кристаллов соединение, указанное в заголовке примера, с температурой плавления 113-116oC.
Пример получения 10. 2-амино-1-/1-нафтил/-этанол. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 9, но с использованием при этом 7,4 г 1-нафтальдегида, 9,93 г триметилсилилнитрила, каталитического количества иодистого цинка и 500 мл тетрагидрофурана в форме кристаллов получили соединение, указанное в заголовке примера, с температурой плавления 124-126,5oC.
Пример получения 11. 2-амино-1-/2-хлорфенил/-этанол. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 8, но с использованием в данном случае 6,75 г 2-хлорбензальдегида, 9,93 г триметилсилилнитрила, каталитического количества иодистого цинка, 5,7 г литийалюминийгидрида и 500 мл тетрагидрофурана в форме жидкости с температурой кипения 132oC при остаточном давлении 2 мм рт.ст. (266 Па) получили соединение, указанное в заголовке примера.
Пример получения 12. 2-амино-1-/4-хлорфенил/-этанол. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 8, но с использованием в данном случае 6,75 г 4-хлорбензальдегида, 9,93 г триметилсилилнитрила, каталитического количества иодистого цинка, 5,7 г литийалюминийгидрида и 500 мл тетрагидрофурана в форме жидкости с температурой кипения 141oC при остаточном давлении 2 мм рт.ст. (266 Па) получили соединение, указанное в заголовке примера.
Пример получения 13. 2-амино-1-/3-фторфенил/-этанол. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 8, но с использованием при этом 6 г З-фторбензальдегида, 12,5 мл триметилсилилнитрила, каталитического количества иодистого цинка, 5,7 г литийалюминийгидрида и 500 мл тетрагидрофурана в форме жидкости с температурой кипения 117oC при остаточном давлении 1,5 мм рт.ст. (200 Па) получили соединение, указанное в заголовке примера.
Пример получения 14. 2-амино-1-/3,4,5-триметоксифенил/-этанол. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 9, но с использованием в данном случае 9,42 г 3,4, 5-триметоксибензальдегида, 12,5 мл триметилсилилнитрила, каталитического количества иодистого цинка, 5,7 г литийалюминийгидрида и 500 мл тетрагидрофурана в форме кристаллов с температурой плавления 141oC (после перекристаллизации из этилацетата) получили соединение, указанное в заголовке примера.
Пример получения 15. 2-амино-1-/3-феноксифенил/-этанол. 10 г 3-феноксибензальдегидцианогидрина по каплям добавили в смесь 5,1 г литийалюминийгидрида и 500 мл тетрагидрофурана с одновременным охлаждением льдом и образовавшуюся смесь выдержали при температуре кипения с обратным холодильником в течение 4 ч. По завершении этого промежутка времени в реакционную смесь при одновременном охлаждении льдом добавили 5 мл воды, 6 мл 15-ного (вес/объем) водного раствора гидрата окиси натрия и 18 мл воды в указанном порядке. Нерастворившиеся материалы отфильтровали, а фильтрат сконцентрировали выпариванием под пониженным давлением. Концентрат очистили пропусканием через хроматографическую колонку с силикагелем, используя в качестве элюента смесь этилацетата с этанолом в объемном соотношении 3:1, в результате чего получили соединение, указанное в заголовке примера, с Rf - 0,32 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с этанолом и триэтиламином в объемном соотношении 5:5:1).
Пример получения 16. 2-амино-1/S/-фенилэтанол.
16(а) Этил-/S/альфа-трет. бутилдиметилсилилокси-альфа фенилацетат. Раствор 31,4 г трет.бутилдиметилсилилхлорида в 200 мл диметилформамида по каплям добавили в раствор 25 г этил-/S/-/+/- манделата и 28,4 г имидазола в 800 мл диметилформамида и образовавшуюся смесь перемешивали в течение ночи при температуре 40oC. По завершении этого промежутка времени под пониженным давлением отгонкой удалили диметилформамидный растворитель и полученный остаток очистили пропусканием через хроматографическую колонну с силикагелем, используя в качестве элюента смесь гексана с этилацетатом в объемном соотношении 10:1, в результате чего получили соединение, указанное в заголовке примера, с Rf 0,84 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси гексана с этилацетатом в оббемном соотношении 10:1).
16 (b) 2/S/-трет.бутилдиметилсилилокси-2-фенилэтанол. 15,5 г боргидрида натрия отдельными порциями с одновременным охлаждением льдом добавили в раствор 20 г этил-/S/-альфа-трет.-бутилдиметилсилилокси-альфа-фенилацетата (полученного согласно вышеизложенному на стадии (а)) в 500 мл абсолютного метанола и образовавшуюся смесь перемешивали в течение ночи при комнатной температуре. По завершении этого периода отдельными порциями в нее добавили 10 г боргидрида натрия при одновременном охлаждении льдом. Затем реакционную смесь перемешивали при комнатной температуре в течение 5 ч, после чего ее сконцентрировали выпариванием под пониженным давлением и концентрат смешали с водой и этилацетатом. Этилацетатный слой отделили, промыли водой и высушили над безводным сульфатом натрия, а затем отгонкой под пониженным давлением удалили растворитель, получив в виде сырого продукта соединение, указанное в заголовке примера.
16(с) 2/S/-трет. бутилдиметилсилилокси-2-фенилэтилазид. Раствор 13,36 г сырого 2-/S/-трет.бутилдиметилсилилокси-2-фенилэтанола (полученного согласно вышеизложенному на стадии (в)) и 5,36 г триэтиламина в 450 мл тетрагидрофурана охладили в бане из ацетона со льдом. Далее в этот раствор по каплям добавили раствор 6,68 г метансульфонилхлорида в 50 мл тетрагидрофурана и образовавшуюся смесь перемешивали в течение 1 ч при одновременном охлаждении льдом. Затем под пониженным давлением отгонкой удалили тетрагидрофурановый растворитель и остаток смешали с водой, этилацетатом и водным раствором хлористого натрия. Этилацетатный слой отделили, промыли водным раствором хлористого натрия и высушили над безводным раствором сульфата натрия с последующим удалением отгонкой под пониженным давлением растворителя. Полученный остаток растворили в 300 мл диметилформамида и в приготовленный таким образом раствор добавили 10,48 г азида натрия, после чего смесь перемешивали в течение ночи при температуре 80oC. По завершении этого периода отгонкой под пониженным давлением из реакционной смеси удалили диметилформамидный растворитель. Полученный остаток смешали с этилацетатом и водным раствором хлористого натрия. Этилацетатный слой отделили, промыли водным раствором хлористого натрия и высушили над безводным сульфатом натрия. Отгонкой под пониженным давлением удалили этилацетатный растворитель, а полученный остаток очистили его пропусканием через хроматографическую колонну с силикагелем, используя в качестве элюента смесь этилацетата с гексаном в объемном соотношении 1: 50, в результате чего получили соединение, указанное в заголовке примера.
16(d) 2-амино-1/S/-фенилэтанол. Смесь 2,6 г литийалюминийгидрида в 400 мл тетрагидрофурана охладили в бане из ацетона со льдом и по каплям в охлажденную смесь добавили раствор 9,4 г 2/S/-трет.бутилдиметилсилилокси-2- фенилэтилазида (полученного согласно вышеизложенному на стадии (с)) в 100 мл тетрагидрофурана. Смесь перемешивали в течение 1 ч с охлаждением льдом, после чего по каплям в эту реакционную смесь добавили 2,6 мл воды, 2,6 мл 15 -ного (вес/объем) водного раствора гидрата окиси натрия и 7,8 мл воды в указанном порядке. Нерастворившиеся материалы отфильтровали и выпариванием под пониженным давлением сконцентрировали фильтрат. Полученный остаток очистили его пропусканием через хроматографическую колонну с силикагелем, используя в качестве элюента смесь этилацетата с этанолом в объемном соотношении 1: 2, в результате чего в форме кристаллов получили соединение, указанное в заголовке примера, с температурой плавления 69-70oC.
Пример получения 17. Метил-3-/2-оксопропокси/-фенилацетат. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 3, но с использованием в данном случае 2,8 г метил-3-оксифенилацетата, 3,5 г бромацетона, 4 г карбоната калия и 30 мл диметилформамида получили соединение, указанное в заголовке примера, с Rf 0,41 (тонкослойная хроматографическая обработка на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с гексаном в объемном соотношении 2:5).
Пример получения 18. Метил-2-/2-оксопропокси/-фенилацетат. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 3, но с использованием при этом 15,6 г метил-2-оксифенилацетата, 34 г бромацетона, 25 г карбоната калия и 170 мл диметилформамида получили соединение, указанное в заголовке примера, с Rf 0,39 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси гексана с этилацетатом в объемном соотношении 3: 1).
Пример получения 19. Метил-3-хлор-4-/2-оксопропокси/-фенилацетат. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 3, но с использованием при этом 20 г метил-З-хлор-4-оксифенилацетата, 27 г бромацетона, 28 г карбоната калия и 300 мл диметилформамида получили соединение, указанное в заголовке примера, с Rf - 0,33 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси гексана с этилацетатом в объемном соотношении 3:1).
Пример получения 20. 2-(2-[3, 4-бис/метоксикарбонил-/фенокси]-1-метилэтил)-амино-1 -/3-хлорфенил/-этанол. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере 6, но с использованием в данном случае 2 г 2-амино-/3-хлорфенил/-этанола (полученного согласно вышеизложенному в примере получения 8), 3,73 г диметил-4-/2-оксопропокси/-фталата (полученного согласно изложенному в примере получения 54), 70 мл бензола, 60 мл абсолютного метанола и 1,32 г боргидрида натрия, получили соединение, указанное в заголовке примера, с Rf 0,29 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Пример получения 21. Метил-2-гидрокси-5-/2-оксопропокси/-фенилацетат. Смесь 5 г 2,5-диоксифенилуксусной кислоты, 15 мл абсолютного метанола и 15 мл 4 н раствора хлористого водорода в диоксане оставили стоять в течение ночи, после чего отгонкой под пониженным давлением удалили растворитель. Остаток растворили в этилацетате и образовавшийся раствор дважды промыли водой, а затем высушили над безводным сульфатом натрия. Этилацетатный растворитель удалили отгонкой под пониженным давлением, после чего 4 г остатка смешали с 70 мл безводного диметилформамида, 3,32 г бромацетона и 3,04 г карбоната калия, а образовавшуюся смесь перемешивали в течение ночи при комнатной температуре. По завершении этого периода времени реакционную смесь вылили в воду, нейтрализовали водным раствором соляной кислоты и подвергли экстракционной обработке этилацетатом. Экстракт промыли водой и высушили над безводным сульфатом натрия. Затем растворитель удалили отгонкой под пониженным давлением. Полученный остаток очистили пропусканием через хроматографическую колонну с силикагелем, используя в качестве элюента смесь этилацетата с гексаном в объемном соотношении вначале 1:2, а затем 3:4. в результате чего получили соединение, указанное в заголовке примера, с Rf 0,43 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с гексаном в объемном соотношении 1:2).
Пример получения 22. n[1,1,2,
2-тетракис-/этоксикарбонил/-этил]-феноксиацетон. В соответствии с процедурой,
аналогичной той, что описана в вышеприведенном примере получения 3, но с использованием в данном случае 11,7 г n-[1,1,2,
2-тетракис-/этоксикарбонил/-этил]-фенола, 7,9 г бромацетона, 7,9 г карбоната
калия и 100 мл диметилформамида и последующей очисткой реакционного продукта его пропусканием через хроматографическую
колонку с силикагелем, где в качестве элюента использовали смесь этилацетата с
гексаном в объемном соотношении 1: 2, получили соединение, указанное в заголовке примера, с Rf 0,21 (после тонкослойной
хроматографической обработки на силикагеле с использованием в качестве
проявляющего растворителя смеси этилацетата с гексаном в объемном соотношении 1:2)
Пример получения 23.
Этил-/R/-альфа-/трет. бутилдиметилсилилокси/-альфа-фенилацетат. Раствор 31,4 г
трет.бутилдиметилсилилхлорида в 200 мл диметилформамида по каплям добавили в раствор 25 г этил-/R/-/-/-манделата и 28,4 г
имидазола в 600 мл безводного диметилформамида и образовавшуюся смесь
перемешивали в течение ночи при температуре 40oC. Затем отгонкой под пониженным давлением удалили диметилформамидный
растворитель и остаток смешали с водой, после чего подвергли
экстракционной обработке этилацетатом. Экстракт высушили над безводным сульфатом натрия с последующим удалением отгонкой под пониженным
давлением растворителя. Полученный остаток очистили его
пропусканием через хроматографическую колонну с силикагелем, используя в качестве элюента смесь этилацетата с гексаном в объемном соотношении
1:10. В форме жидкости с температурой кипения 129oC при остаточном давлении 3,5 мм рт.ст. (466 Па) путем вакуумной перегонки получили соединение, указанное в заголовке примера.
[α]
Пример получения 24.
Этил-/S/-альфа-/трет.
бутилдиметилсилилокси/-альфа-фенилацетат. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 23, но с использованием в данном случае 23,
8 г имидазола, 400
мл диметилформамида, 30,1 г трет.бутилдиметилсилилхлорида и 100 мл диметилформамида в форме жидкости с температурой кипения 125,5oC, при остаточном давлении 3,0 мм
рт.ст. (400 Па)
получили соединение, указанное в заголовке примера.
[α]
Пример получения 25. /R/-альфа-/трет.бутилдиметилсилилокси/-альфа-фенилацетальдегид. При температуре -65oC в атмосфере азота в раствор 5,9 г
этил-/R/-альфа-/трет. бутилдиметилсилилокси/-альфа-фенилацетата (полученного согласно вышеизложенному в примере получения 23) в 300 мл сухого гексана по каплям добавили 20 мл 1М раствора гексанового
раствора диизобутилалюминийгидрида и образовавшуюся смесь перемешивали при температуре -40oC в течение 4 ч. По завершении этого периода времени в реакционную смесь при температуре -40oC по каплям добавили 10 мл тетрагидрофуранового раствора, содержащего 1 мл воды, после чего реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч. Далее реакционную
смесь
профильтровали с использованием продукта "Целит" (торговое наименование, вспомогательный агент при фильтровании) и фильтрат сконцентрировали под пониженным давлением. Полученный остаток
очистили его
пропусканием через хроматографическую колонну с силикагелем, используя в качестве элюента смесь этилацетата с гексаном в объемном соотношении 1: 60, в результате чего получили соединение,
указанное в
заголовке примера, с Rf 0,64 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с гексаном в объемном
соотношении
1:50).
Пример получения 26. /S/-альфа-/трет.бутилдиметилсилилокси/-альфа-фенилацетальдегид. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 25, но с использованием в данном случае 8,8 г этил-/S/-альфа-/трет. бутилдиметилсилилокси/-альфа-фенилацетата (полученного согласно вышеизложенному в примере получения 24), 300 мл сухого гексана и 30 мл 1М раствора диизобутилалюминийгидрида в гексане и с последующей очисткой реакционного продукта его пропусканием через хроматографическую колонну с силикагелем, где использовали в качестве элюента смесь этилацетата с гексаном, получили соединение, указанное в заголовке примера, с Rf 0,29 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с гексаном в объемном соотношении 1:80).
Пример получения 27. Метил-4-[2/R/-амино-1-пропокс]-фенилацетат. 16,6 г диэтилазодикарбоксилата при охлаждении льдом добавили в раствор 16,8 г /R/-2-трет.бутоксикарбониламино-1-пропанола, 10,0 г метил-4-оксифенилацетата и 24,0 г трифенилфосфина в 50 мл сухого бензола и образовавшуюся смесь перемешивали при комнатной температуре в течение 2 дней. По завершении этого периода времени отгонкой под пониженным давлением удалили бензольный растворитель. Полученный осадок растворили в 100 мл метанола и в приготовленный таким образом раствор добавили 200 мл 4 н раствора хлористого водорода в диоксане при одновременном охлаждении льдом, после чего смеси дали постоять при комнатной температуре в течение 3 ч. Затем реакционную смесь вылили в воду и добавлением водного раствора карбоната калия величину pH этой водной смеси довели до 8-9 с последующей экстракционной обработкой смеси этилацетатом. Экстракт высушили над безводным сульфатом натрия и под пониженным давлением отгонкой отогнали из него этилацетатный растворитель. Полученный остаток очистили его пропусканием через хроматографическую колонку с силикагелем, используя в качестве элюента смесь этилацетата с этанолом в объемном соотношении 3:1, в результате чего получили соединение, указанное в заголовке примера.
[α]
Пример получения 28. Метил-4-/2/S/-амино-1-пропокси/-фенилацетат. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 27, но с использованием в данном случае 15,8 г /S/-2-трет. бутоксикарбониламино-1-пропанола, 10,0 г метил-4-оксифенилацетата, 24 г трифенилфосфина, 70 мл сухого бензола, 15,7 г диэтилазодикарбоксилата, 50 мл метанола и 70 мл 4 н раствора хлористого водорода в диоксане получили соединение, указанное в заголовке примера.
[α]
Пример получения 29. N-[2-/4-метоксикарбонилфенокси/-1/R/- метилэтил]-2/R/-трет.
бутилдиметилсилилокси-2-фенилэтанамин. При
одновременном охлаждении льдом в раствор 1,01 г /R/-альфа-/трет.бутилдиметилсилилокси/-альфа-фенилацетальдегида (полученного согласно изложенному выше в
примере получения 25) и 570 мг
метил-4-[/R/-амино-1-пропокс]-фенилацетата (полученного согласно изложенному выше в примере получения 27) в 10 мл абсолютного метанола добавили 630 мг цианоборгидрида
натрия и образовавшейся смеси
дали постоять в течение ночи при комнатной температуре. По завершении этого периода времени реакционную смесь смешали с этилацетатом и водой. Органический слой отделили,
промыли водой и высушили над
безводным сульфатом натрия, после чего отгонкой под пониженным давлением удалили растворитель. Полученный остаток очистили пропусканием через хроматографическую колонну с
силикагелем, используя в
качестве элюента смесь этилацетата с гексаном в объемном соотношении 1:4, в результате чего получили соединение, указанное в заголовке примера.
[α
]
Пример получения 30.
N-[2-/4-метоксикарбонилметилфенокси/-1/S/-метилэтил]
-2/S/ -трет. бутилдиметилсилилокси-2-фенилэтанамин. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения
29, но с использованием в данном случае 1,5 г
/S/-альфа-/трет.бутилдиметилсилилокси/-альфа- фенилацетальдегида (полученного согласно изложенному выше в примере получения 26), 1,1 г
метил-4-[2/S/-амино-1-пропокси]-фенилацетата (полученного
согласно изложенному выше в примере получения 28), 10 мл абсолютного метанола и 950 мг цианоборгидрида получили соединение, указанное в
заголовке примера.
[α]
Пример получения 31.
N-[2-/4-метоксикарбонилметилфенокси/-1/S/-метилэтил] -2/R/-трет. бутилдиметилсилилокси-2-фенилэтанамин. В соответствии с процедурой, аналогичной той, что описана в примере
получения 29, но с
использованием при этом 750 мг /R/-альфа-/трет.бутилдиметилсилилокси/-альфа-фенилацетальдегида (полученного согласно изложенному выше в примере получения 25), 920 мг
метил-4-[2/R/-амино-1-пропокси]-фенилацетата (полученного согласно изложенному в примере получения 28), 10 мл абсолютного метанола и 500 мг цианоборгидрида натрия получили соединение, указанное в
заголовке примера.
[α]
Пример получения 32. N-[2-/4-метоксикарбонилметилфенокси/-1/R/-метилэти] -2/S/ -трет.бутилдиметилсилилокси-2-фенилэтатамин. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 29, но с использованием в данном случае 1,5 г /S/-альфа/трет.бутилдиметилсилилокси/-альфа- фенилацетальдегида (полученного согласно изложенному выше в примере получения 26), 1,1 г метил-4-[2/R/-амино-1-пропокси]-фенилацетата (полученного согласно изложенному выше в примере получения 27), 10 мл абсолютного метанола и 950 мг цианоборгидрида натрия получили соединение, указанное в заголовке примера.
[α]
Пример получения 33. 2-(2-[2,4-бис-/метоксикарбонил/-фенокси]-1-метилэтил)-амино-1-/3-хлорфенил/-этанол. В соответствии с процедурой, аналогичной той, что описана в примере
получения 8, но с использованием при этом 1,3 г 2-амино-1-/3-хлорфенил/-этанола (полученного согласно изложенному выше в примере
получения 8), 2,31 г диметил-4-/2-оксопропокси/-изофталата
(полученного согласно изложенному в примере получения 55), 60 мл бензола, 50 мл абсолютного метанола и 0,73 г боргидрида натрия и последующей очисткой реакционного продукта его пропусканием через
хроматографическую колонку с силикагелем, где в качестве элюента использовали смесь этилацетата с этанолом в объемном соотношении 10:1, в форме кристаллов с температурой плавления 112oC
получили соединение, указанное в заголовке примера.
Пример получения 34. Метил-3-окси-4-/2-оксопропокси/-фенилацетат. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 21, но с использованием в данном случае 10 г 3,4-диоксифенилуксусной кислоты, 30 мл абсолютного метанола, 20 мл 4 н раствора хлористого водорода в диоксане, 200 мл безводного диметилформамида, 8,74 г бромацетона и 8,02 г карбоната калия получили соединение, указанное в заголовке примера, с Rf 0,37 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с гексаном в объемном соотношении 1:2).
Пример получения 35. 2-амино-1-/3,5-дитрет.бутил-4-оксифенил/-этанол. Смесь, которая включала в себя 44 г 3,5-дитрет.бутил-4-окси-бензальдегида, 25 мл триметилсилилнитрила и каталитическое количество иодистого цинка, выдержали с перемешиванием в течение 1 ч при температуре 90oC. Затем реакционную смесь по каплям добавили в смесь 16 г литийалюминийгидрида с 600 мл тетрагидрофурана при одновременном охлаждении льдом и образовавшуюся смесь перемешивали в течение 2 ч при одновременном охлаждении льдом. По завершении этого промежутка времени в смесь добавили 16 мл воды, 16 мл 15-ного (вес/объем) водного раствора гидрата окиси натрия и 50 мл воды в указанном порядке. Нерастворившиеся материалы отфильтровали и фильтрат сконцентрировали выпариванием под пониженным давлением. Полученный остаток очистили его пропусканием через хроматографическую колонку с силикагелем, используя в качестве элюента смесь этилацетата с этанолом и триэтиламином в объемном соотношении 20: 20:1, и перекристаллизацией из этилацетата, в результате чего в форме кристаллов получили соединение, указанное в заголовке примера, с температурой плавления 137-140oC.
Пример получения 36. Метил-4-/2-оксопропокси/-манделат. 100 мл 10-ного (по весу) раствора триметилсилилдиазометана в гексане добавили по каплям при одновременном охлаждении льдом в раствор 12,38 г 4-оксиминдальной кислоты в смеси 150 мл тетрагидрофурана с 30 мл метанола и образовавшуюся смесь перемешивали при комнатной температуре в течение 1 ч, после чего отгонкой под пониженным давлением удалили растворитель, а полученный остаток смешали с 250 мл диметилформамида, 25 г бромацетона и 25,4 г карбоната калия. Далее реакционную смесь обработали аналогично вышеизложенному в примере получения 3, в результате чего получили соединение, указанное в заголовке примера, с Rf 0,39 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси гексана с этилацетатом в объемном соотношении 1:1).
Пример получения 37. 2-[4-/2-оксопропокси/-фенил] -этилацетат. 1,96 г уксусного ангидрида добавили при одновременном охлаждении льдом в смесь 3,1 г 2-[4-/2-оксопропокси/-фенил]-этанола (полученного согласно вышеизложенному в примере получения 7), 50 мл безводного тетрагидрофурана и 2,53 г пиридина и образовавшуюся смесь перемешивали при комнатной температуре в течение 3,5 ч. По завершении этого промежутка времени добавили 12,5 г пиридина и 9,8 г уксусного ангидрида при одновременном охлаждении льдом и смеси дали постоять при комнатной температуре в течение 1 дня, после чего отгонкой под пониженным давлением удалили растворитель и остаток смешали с водой с последующей его экстракционной обработкой этилацетатом. Экстракт высушили над безводным сульфатом натрия и под пониженным давлением отгонкой удалили растворитель, в результате чего получили соединение, указанное в заголовке примера, с Rf - 0,71 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с гексаном в объемном соотношении 1:1).
Пример получения 38. Диметил-4-/2-оксопропокси/-фенилмалонат. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 3, но с использованием при этом 0,5 г диметил-4-оксифеналмалоната, 0,612 г бромацетона, 0,616 г карбоната калия и 90 мл диметилформамида и последующей очисткой реакционного продукта его пропусканием через хроматографическую колонну с силикагелем, где в качестве элюента использовали смесь этилацетата с гексаном в объемном соотношении 2:3, получили соединение, указанное в заголовке примера, с Rf 0,37 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с гексаном в объемном соотношении 2:3).
Пример получения 39. 2-амино-1-/3,5-дихлорфенил/-этанол. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 8, но с использованием 10 г 3,5-дихлорбензальдегида, 6,23 г триметилсилилнитрила, каталитического количества иодистого цинка, 5,4 г литийалюминийгидрида и 200 мл тетрагидрофурана и последующей очисткой реакционного продукта его пропусканием через хроматографическую колонку с силикагелем, используя в качестве элюента смесь этилацетата с этанолом в объемном соотношении 2: 1, получили соединение, указанное в заголовке примера, с Rf 0,19 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с этанолом и триэтиламином в объемном соотношении 10:3:1) и температурой плавления 66oC.
Пример получения 40. 2-амино-1-/3-хлор-4-фторфенил/-этанол. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 8, но с использованием в данном случае 10 г З-хлор-4-фторбензальдегида, 6,89 г триметилсилилнитрила, каталитического количества иодистого цинка, 5,99 г литийалюминийгидрида и 200 мл тетрагидрофурана и последующей очисткой реакционного продукта его пропусканием через хроматографическую колонну с силикагелем, где использовали в качестве элюента смесь этилацетата с этанолом в объемном соотношении 2:1, получили соединение, указанное в заголовке примера, с Rf 0,21 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с этанолом и триэтиламином в объемном соотношении 10:3:1).
Пример получения 41. 2-амино-1-/3-бромфенил/-этанол. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 8, но с использованием при этом 25 г 3-бромбензальдегида, 14,78 г триметилсилилнитрила, каталитического количества иодистого цинка, 13, 2 г литийалюминийгидрида и 400 мл тетрагидрофурана и последующей очисткой реакционного продукта пропусканием через хроматографическую колонку с силикагелем, где в качестве элюента использовали смесь этилацетата с этанолом в объемном соотношении 2: 1, получили соединение, указанное в заголовке примера, с Rf 0,22 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с этанолом и триэтиламином в объемном соотношении 10:3:1).
Пример получения 42. 2-амино-1-/3-трифторметилфенил/-этанол. В
соответствии с процедурой, аналогичной той, что описана в вышеприведенном
примере получения 8, но с использованием в данном случае 25 г 3-трифторметилбензальдегида, 15,71 г триметилсилилнитрила,
каталитического количества иодистого цинка, 12,8 г литийалюминийгидрида и 400
мл тетрагидрофурана и последующей очисткой реакционного продукта его пропусканием через хроматографическую колонку с
силикагелем с использованием в качестве элюента смеси этилацетата с этанолом в
объемном соотношении 2:1 получили в форме кристаллов с температурой плавления 72oC соединение, указанное в
заголовке примера, с Rf 0,25 (после тонкослойной хроматографической обработки на
силикагеле с использованием смеси этилацетата с этанолом и триэтиламином в качестве проявляющего растворителя в
объемном соотношении 10:3:1),
Пример получения 43.
2-амино-1-/3-метоксифенил/-этанол. В соответствии с процедурой, аналогичной той, что описана в примере получения 8, но с использованием в
данном случае 28 г 3-метоксибензальдегида, 22,92 г
триметилсилилнитрила, каталитического количества иодистого цинка, 19,92 г литийалюминийгидрида и 400 мл тетрагидрофурана и последующей очисткой
реакционного продукта его пропусканием через
хроматографическую колонку с силикагелем, где использовали в качестве элюента смесь этилацетата с этанолом в объемном соотношении 2:1, получили соединение,
указанное в заголовке примера, с Rf 0,18
(после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с этанолом и
триэтиламином в объемном соотношении 10:3:1).
Пример получения 44. 2-амино-1-/3-метилфенил/-этанол. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 8, но с использованием при этом 25,75 г 3-метилбензальдегида, 23,35 г триметилсилилнитрила, каталитического количества иодистого цинка, 20,3 г литийалюминийгидрида и 400 мл тетрагидрофурана и последующей очисткой реакционного продукта его пропусканием через хроматографическую колонку с силикагелем, где в качестве элюента использовали смеси этилацетата с этанолом в объемном соотношении 2: 1, получили соединение, указанное в заголовке примера, с Rf 0,22 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с этанолом и триэтиламином в объемном соотношении 10:3:1).
Пример получения 45. 3-хлорминдальная кислота. Смесь 158 г 3-хлорбензальдегида, 111,8 г триметилсилилнитрила и каталитическое количество иодистого цинка с перемешиванием выдержали при температуре 90oC в течение 2 ч. Затем реакционную смесь охладили льдом и добавили в нее 360 мл концентрированного водного раствора соляной кислоты. Далее образовавшуюся смесь выдержали при температуре кипения с обратным холодильником в течение 1 ч, после чего ее смешали с водой и этилацетатом. Этилацетатный слой отделили и смешали с 30-ным (вес/объем) водным раствором гидрата окиси натрия. Водный слой отделили, промыли трижды этилацетатом, а затем подкислили концентрированным водным раствором соляной кислоты с последующей экстракционной обработкой этилацетатом. Экстракт промыли водой и высушили над безводным сульфатом натрия. Далее отгонкой под пониженным давлением удалили растворитель, получив в форме кристаллов соединение, указанное в заголовке примера, с температурой плавления 110-114oC.
Пример получения 46. /R/-3-хлорминдальная кислота и /S/-3-хлорминдальная кислота. Смесь 100 г 3-хлорминдальной кислоты (полученной согласно вышеизложенному в примере получения 45), и 32,7 г /R/-/+/-1-фенетиламина растворили в смеси метанола с диэтиловым эфиром и перекристаллизовали из этой смеси. Полученные кристаллы собрали фильтрованием, трижды перекристаллизовали из смеси метанола с диэтиловым эфиром и смешали с водным раствором соляной кислоты. Далее эту смесь подвергли экстракционной обработке этилацетатом. Экстракт высушили над безводным сульфатом натрия и под пониженным давлением отгонкой удалили растворитель, получив /R/-3-хлорминдальную кислоту в форме кристаллов с температурой плавления 102-105oC.
[α]
К фильтрату, полученному согласно вышеизложенному, добавили соляной кислоты и смесь подвергли экстракционной обработке этилацетатом. Экстракт
высушили над безводным сульфатом
натрия и отгонкой под пониженным давлением удалили растворитель. Полученный остаток смешали с 32,7 г /S/-/-/-1-фенетиламина и трижды перекристаллизовали из смеси
метанола с диэтиловым эфиром, получив
в форме кристаллов /S/-3-хлорминдальную кислоту с температурой плавления 101-104oC.
[α]
Пример получения 47. Метил-/R/-3-хлорманделат. 18,3 г 10-ного (вес/объем)
раствора триметилсилилдиазометана в
гексане по каплям добавили в раствор 28 г /R/-3-хлорминдальной кислоты (полученной согласно вышеизложенному в примере 46) в смеси 300 мл метанола с 700 мл бензола
и образовавшуюся смесь перемешивали в
течение 1 ч. По завершении этого периода времени отгонкой под пониженным давлением удалили растворитель, получив в виде сырого продукта соединение, указанное в
заголовке примера, с [α]
Пример получения 48. Метил-/R/-альфа-трет. бутилдиметилсилилокси-3-хлорфенилацетат. Раствор 31,6 г трет.бутилдиметилсилилхлорида в 200 мл диметилформамида по каплям с одновременным охлаждением льдом добавили в раствор 28 г метил-/R/-3-хлорманделата (полученного согласно вышеизложенному в примере 47) и 28,5 г имидазола в 300 мл диметилформамида и образовавшуюся смесь перемешивали при той же самой температуре в течение 30 мин, после чего оставили стоять на ночь при температуре 40oC. По завершении этого периода времени реакционную смесь сконцентрировали выпариванием под пониженным давлением и остаток смешали с водой и этилацетатом. Этилацетатный слой отделили и высушили над безводным сульфатом натрия, а затем под пониженным давлением отгонкой удалили растворитель. Полученный остаток очистили его пропусканием через хроматографическую колонну с силикагелем, используя в качестве элюента смесь этилацетата с гексаном в объемном соотношении 1:15, в результате чего в форме кристаллов получили соединение, указанное в заголовке примера, с температурой плавления 36-38oC.
[α]
Пример получения 49. /R/-альфа-трет.бутилдиметилсилилокси- альфа/3-хлорфенил/-ацетальдегид. Раствор 26 г
метил-/R/-альфа-трет.бутилдиметилсилилокси-З- хлорфенилацетата (полученного согласно вышеизложенному в примере получения 48) в смеси с 1000 мл безводного гексана и 500 мл сухого толуола охладили до
температуры -60oC, а затем в этот охлажденный раствор по каплям добавили 124 мл 1М раствора диизобутилалюминийгидрида в гексане. Образовавшуюся смесь перемешивали при той же самой
температуре в течение 3 ч, после чего в нее добавили 100 мл воды и температуре смеси дали постепенно повыситься до комнатной. Затем реакционную смесь смешали с водой и этилацетатом с последующим ее
перемешиванием в течение 30 мин. Нерастворившиеся материалы отфильтровали с использованием продукта "Целит" (торговое наименование) в качестве ускорителя фильтрования, а этилацетатный слой отделили
от
фильтрата и высушили над безводным сульфатом натрия. Отгонкой под пониженным давлением удалили этилацетатный растворитель и остаток очистили пропусканием через хроматографическую колонку с
силикагелем,
используя в качестве элюента смесь этилацетата с гексаном в объемном соотношении 1:60, в результате чего получили соединение, указанное в заголовке примера, с Rf 0,36 (после тонкослойной
хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с гексаном в объемном соотношении 1:60).
Пример получения 50. N-[2-/4-метоксикарбонилметилфенокси/-1/R/-метилэтил]-3/R/-трет.бутилдиметилсилилокси. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 29, но с использованием при этом 5,2 г /R/-альфа-трет.бутилдиметилсилилокси-альфа-/3-хлор-фенил/-ацетальдегида (полученного согласно изложенному выше в примере получения 49), 4,24 г метил-4-[2/R/-амино-1-пропокси]-фенилацетата (полученного согласно изложенному выше в примере получения 27), 50 мл абсолютного метанола и 3,4 цианоборгидрида натрия, получили соединение, указанное в заголовке примера, с Rf 0,20 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата с гексаном в объемном соотношении 1:4).
[α]
Пример
получения 51. 5-(4-[2/R/-амино-1-пропокси]-бензил)-тиазолидин-2,4-дионтрифторацетат.
51(а) 5-/4-ацетоксибензилиден/-тиазолидин-2,4-дион. Смесь, которая включала в себя 200 г n-оксибензальдегида, 229 г тиазолидин-2,4-диона, 280 г ацетата натрия и 660 мл диметилацетамида, перемешивали при температуре 150oC в течение 1 ч. Затем ее охладили и добавили в эту реакционную смесь 540 мл диметилацетамида и 370 мл уксусного ангидрида. Далее образовавшуюся смесь перемешивали при температуре 50oC в течение 1,5 ч, после чего ее вылили в воду. Твердый материал, который выпал в осадок, собрали фильтрованием: промыли водой и высушили на безводным сульфатом натрия, получив соединение, указанное в заголовке примера.
51 (b) 5-/4-ацетоксибензил/-тиазолидин-2,4-дион. 2,0 г 5-/4-ацетоксибензилидин/-тиазолидин-2,4-диона (полученного согласно изложенному выше на стадии (а)) растворили в 80 мл уксусной кислоты и подвергли гидрогенизации пропусканием водорода под атмосферным давлением через этот раствор при температуре 90oС в течение 5 ч в присутствии 2,0 г 10-ного (по весу) палладия на древесном угле. По завершении этого промежутка времени катализатор отфильтровали и фильтрат разбавили толуолом. Затем отгонкой в виде толуольного азеотропа удалили служившую растворителем уксусную кислоту. Кристаллы, которые выделились при добавлении к концентрату толуола и гексана, собрали и высушили, получив соединение, указанное в заголовке примера.
51(с) 5-/4-ацетоксибензил/-3-трифенилметилтиазолидин-2,4-дион. 3,43 г триметиламина добавили в раствор 9,0 г 5-/4-ацетокси-бензил/-тиазолидин-3,4-диона (полученного согласно вышеприведенному на стадии (b)) в 70 мл хлористого метилена и в образовавшуюся смесь по каплям добавили раствор 9,45 г трифенилметилхлорида в 30 мл хлористого метилена. Затем эту смесь перемешивали при комнатной температуре в течение 1 ч, после чего ее оставили стоять в течение ночи при той же самой температуре. По истечении указанного периода времени реакционную смесь смешали с водой и этилацетатом и органический слой отделили, промыли насыщенным водным раствором хлористого натрия и высушили над безводным сульфатом натрия. Кристаллы, которые выпали в осадок при отгонке растворителя под пониженным давлением, промыли смесью гексана с этилацетатом и высушили, получив соединение, указанное в заголовке примера.
51 (d) 5-/4-оксибензил/-3-трифенилметилтиазолидин-2,4-дион. Раствор 2,99 г 28 -ного (вес/объем) метанольного раствора гидрата окиси натрия в 10 мл метанола по каплям при охлаждении льдом добавили в раствор 7,86 г 5-/4-ацетоксибензил/-3-трифенил-метилтиазолидин-2,4-диона (полученного согласно вышеизложенному на стадии (с)) в 70 мл толуола и образовавшуюся смесь перемешивали при комнатной температуре в течение 1 ч, после чего ее оставили стоять в течение ночи при той же самой температуре. Величину pH реакционной смеси добавлением 1 н водного раствора соляной кислоты довели до 4 н и смесь подвергли экстракционной обработке этилацетатом. Экстракт промыли водой и высушили над безводным сульфатом натрия. Затем под пониженным давлением отгонкой удалили растворитель, а кристаллы, которые выпали в осадок, собрали, промыли гексаном и высушили, получив соединение, указанное в заголовке примера.
51(е) 5-(4-[2/R/-трет. бутоксикарбониламинопропокси] -бензил)-3-трифенилметилтиазолидин-2,4-дион. 13,2 г диэтилазодикарбоксилата по каплям добавили в раствор 20,7 г трифенилфосфина в 300 мл бензола и смесь перемешивали при комнатной температуре в течение 30 мин. По завершении этого промежутка времени в смесь добавили 35,0 г 5-/4-оксибензил/-3-трифенилметилтиазолидин-2,4-диона (полученного согласно вышеизложенному на стадии (d)) и образовавшуюся смесь перемешивали при комнатной температуре в течение 1 ч. В эту смесь затем добавили 13,2 г /R/-трет.бутоксикарбониламино-1-пропанола, после чего ее оставили стоять на ночь. По завершении этого периода в реакционную смесь добавили 40,9 г трифенилфосфина, 23,68 мл диэтилазодикарбоксилата и 33 г /R/-2-трет. бутоксикарбониламино-1-пропанола в указанном порядке в виде 3 или 4 отдельных порций и смесь перемешивали затем в течение 2 дней. По истечении этого периода отгонкой под пониженным давлением из реакционной смеси бензоловый растворитель удалили, а остаток очистили его пропусканием через хроматографическую колонну с силикагелем, используя в качестве элюента смесь этилацетата с гексаном в объемном соотношении 1:3, в результате чего в виде кристаллов получили 30 г соединения, указанного в заголовке примера, с температурой плавления 153-157o C.
[α]
51 (f)
5-(4-[2/R/-аминопропокси]-бензил)-тиазолидин-2,4-дионтриацетат. 500 мл трифторуксуной кислоты по каплям с одновременным охлаждением добавили в раствор 85,5 г
5-(4-[2/R/-трет.бутоксикарбониламинопропокси]-бензил)-3-трифенилметилтиазолидин-2,4-диона (полученного согласно вышеизложенному на стадии (е)) в 700 мл хлористого метилена и образовавшуюся смесь
перемешивали при комнатной температуре в течение 4 ч. По завершении этого промежутка времени реакционную смесь освободили от растворителя (хлористого метилена) и трифторуксусной кислоты за счет
отгонки под пониженным давлением и к остатку добавили смесь бензола с небольшим количеством этилацетата. Выпавшие при этом в осадок кристаллы собрали фильтрованием и перекристаллизовали из смеси
метанола с этилацетатом, получив в форме кристаллов соединение, указанное в заголовке примера, с температурой плавления 162-166oC.
[α]
Пример получения 52. 5-[4-(2-/R/-[2/R/-/3-хлорфенил/-2-трет.
бутилдиметилсилилокси]этиламино]-пропокси] бензилтиазолидин-2,4-дион. Смесь, включающую в себя 36,5 г 5-(4-[2/R/-аминопропокси]-бензил)-тиазолидин-2,4-дионтрифторацетата (полученного согласно
вышеизложенному в примере получения 51), 98,4 г /R/-альфа-/трет.бутилдиметилсилилокси/-альфа-фенилацетальдегида (полученного согласно изложенному в примере получения 25) и 400 мл абсолютного метанола
перемешивали при комнатной температуре в течение 2,5 ч, а затем в эту смесь отдельными порциями добавили 29,0 г цианоборгидрида с одновременным охлаждением на бане с хлористым натрием. Далее
реакционную смесь оставили стоять на ночь при комнатной температуре, после чего отгонкой под пониженным давлением из нее удалили метанольный растворитель. Полученный остаток смешали с водой и
этилацетатом. Этилацетатный слой отделили, промыли водным раствором хлористого натрия и высушили над безводным сульфатом натрия. Затем отгонкой под пониженным давлением удалили этилацетатный
растворитель и полученный остаток очистили его пропусканием через хроматографическую колонну с силикагелем, где в качестве элюента использовали смесь этилацетата с гексаном в объемном соотношении 2:1,
получив соединение, указанное в заголовке примера.
[α]
Пример получения 53. 2-(2-[4-/2-метоксикарбонилэтенил/-фенокси]-1-метилэтил-амино-1-/3-хлорфенил/-этанол. Раствор 6,07 г 2-амино-1-/3-хлорфенил/-этанола
(полученного
согласно вышеизложенному в примере получения 8) и 6,5 г метил-4-/2-оксопропокси/-циннамата (полученного согласно вышеизложенному в примере получения 4) в 100 мл бензола выдержали при
температуре
кипения в течение 3,5 ч, непрерывно удаляя воду, которая образовывалась по ходу реакции. По завершении указанного промежутка времени отгонкой под пониженным давлением из реакционной смеси
удалили
бензол, который был использован в качестве растворителя, и полученный остаток растворили в 100 мл абсолютного метанола. В этот раствор с охлаждением льдом добавили 3 г боргидрида натрия и
образовавшуюся смесь перемешивали при комнатной температуре в течение ночи, а затем в течение 5 ч при температуре 60oC. Затем реакционную смесь сконцентрировали ее выпариванием под
пониженным давлением и концентрат подвергли экстракционной обработке этилацетатом. Экстракт промыли водой и высушили над безводным сульфатом натрия. Растворитель удалили отгонкой под пониженным
давлением и полученный остаток очистили его пропусканием через хроматографическую колонну с силикагелем, используя в качестве элюента смесь этилацетата с этанолом в объемном соотношении 10:1, в
результате чего получили две фракции. Полученный таким образом продукт перекристаллизовали из смеси этилацетата с гексаном, получив соединение, указанное в заголовке примера, с температурой плавления
97-103oC.
Пример получения 54. Диметил-4-/2-оксопропокси/-фталат. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 3, но с использованием 10,5 г диметил-4-оксифталата, 13,7 г бромацетона, 14 г карбоната калия и 150 мл диметилформамида в виде маслоподобного продукта получили соединение, указанное в заголовке примера, с Rf 0,48 (после тонкослойной хроматографической обработки на силикагеле с использованием в качестве проявляющего растворителя смеси гексана с этилацетатом в объемном соотношении 1:1).
Пример получения 55. Диметил-4-/2-оксопропокси/-изофталат. В соответствии с процедурой, аналогичной той, что описана в вышеприведенном примере получения 3, но с использованием в данном случае 10,5 г диметил-4-оксиизофталата, 15 г бромацетона, 17 г карбоната калия и 100 мл диметилформамида и последующей очисткой реакционного продукта его пропусканием через хроматографическую колонну с силикагелем с использованием в качестве элюента смеси гексана с этилацетатом в объемном соотношении 2:1 получили соединение, указанное в заголовке примера с температурой плавления 115-116oC.
В таблицах использованы нижеследующие аббревиатуры: Ac ацетил; Boc - бутоксикарбонил; iBoc -изобутоксикарбонил; gBo втор.бутоксикарбонил; tBoc - трет. бутоксикарбонил; Bu бутил; TBu -трет.бутил; Byr бутирил; iByr - изобутирил; Bzc бензилоксикарбонил; Et этил; Etc этоксикарбонил; Me - метил; Mec -метоксикарбонил; Np нафтил; Ph -фенил; Piv пивалоил; Pr - пропил; iPr изопропил; iPrc изопропоксикарбонил; Prn пропионил; Tfm - трифтометил; Thix тиазолидин-5-ил; Val валерил; iVal изовалерил.
Реферат
Соединения формулы I

[где R0 - водородный атом, метил или гидроксиметил; R1 -замещенный алкил; каждый из R2 и R3 - атом водорода или галогена, гидрокси, алкокси-, карбоксигруппа, алкоксикарбонил, алкил, нитрогруппа, галоидалкил или замещенный алкил; X - атом кислорода или серы; а Ar - возможно замещенный фенил или нафтил] и их фармацевтически приемлемые соли обладают различными ценными фармацевтическими активностями, включая сюда антидиабетическую активность и активность против ожирения; кроме того, они пригодны для лечения или профилактики гиперлипемии и гипергликемии, а благодаря ингибированию действия альдозоредуктазы они также могут быть эффективными при лечении и профилактике осложнений диабетом. 3 с. и 42 з.п. ф-лы, 11 табл.
Формула

где
R0 водородный атом, метильная или гидроксиметильная группа;
R1 замещенная алкильная группа, содержащая 1 12 углеродных атома, которая замещена по меньшей мере одним из заместителей A, определенных ниже;
R2 и R3, одинаковые или различные, каждый водород, галоген, гидроксильная группа, алкильная группа, содержащая 1 6 углеродных атома, замещенная гидроксилом;
Х кислород;
Ar группа формулы II

или формулы III

где R4 R6, одинаковые или различные и каждый водород, галоген, алкоксигруппа, содержащая 1 5 углеродных атома, алкильная группа, содержащая 1 5 углеродных атома, или галоидалкильная группа, содержащая 1 - 4 углеродных атома;
заместители A выбирают из карбоксильных групп, алкоксикарбонильных групп, содержащих 2 7 углеродных атома, карбамоильных групп, гидроксикарбамоильных групп, гидроксильных групп, ацилоксигрупп, содержащих 1 6 углеродных атома, и 2, 4-диоксотиазолидин-5-ильных групп,
и их фармацевтически приемлемые соли.

где Ar, R0 R3 и Х имеют значения, определенные в п.1, отличающийся тем, что осуществляют реакцию соединения формулы V

где Ar и R0 имеют значения, указанные в п.1;
Z водород или гидроксизащитная группа,
с соединением формулы VI

где R1 R3 и Х имеют указанные в п.1 значения,
с последующим восстановлением полученного соединения и, если необходимо, удаляют защитную группу и, при необходимости, превращают в соль.

где Ar, R0 R3 и Х указаны в п.1,
отличающийся тем, что осуществляют реакцию соединения формулы XIII

где Ar и R0 имеют значения, определенные в п.1;
Z гидроксизащитная группа или водород,
с соединением формулы XI

где R1 R3 и Х определены в п.1,
с последующим восстановлением полученного соединения формулы XIV
где R0 R3, X, Ar и Z имеют значения, определенные в п.1,
в результате чего получают соединение формулы XV

где R0 R3, X, Ar и Z имеют значения, указанные выше,
и, если необходимо, удаляют любую защитную группу и, необязательно, образуют соль полученного соединения.

Комментарии