Способ получения 3,3-диарилпропиламинов (варианты) и соединения (варианты) - RU2270188C2
Код документа: RU2270188C2
Описание
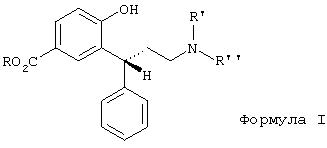
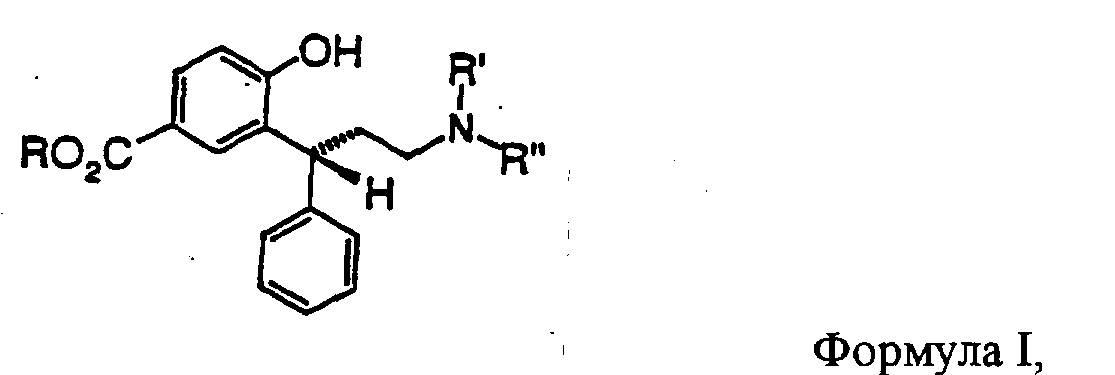
Данное изобретение относится к способу получения производных 3,3-диарилпропиламинов общей формулы I и стерически высокочистых устойчивых интермедиатов и к их применению для получения фармацевтических композиций.
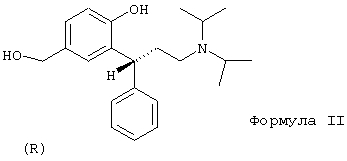
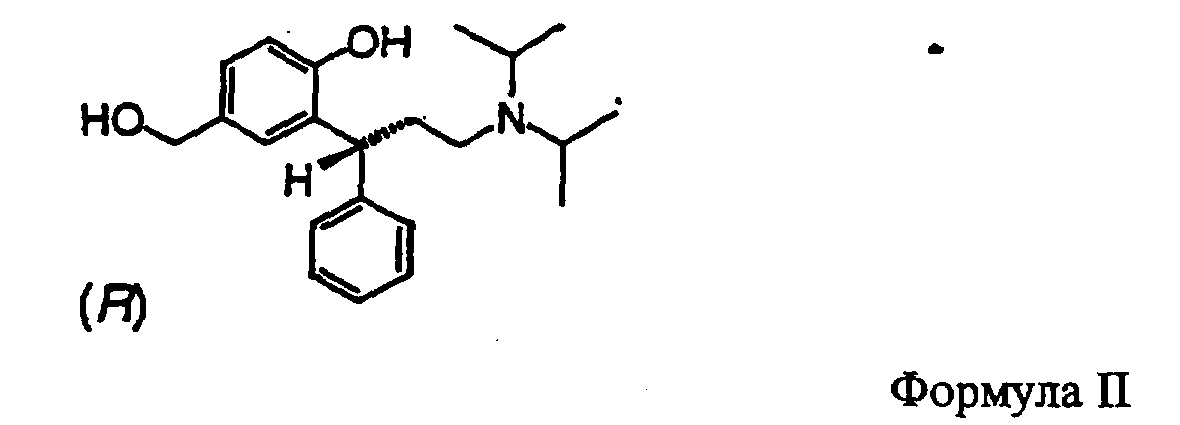
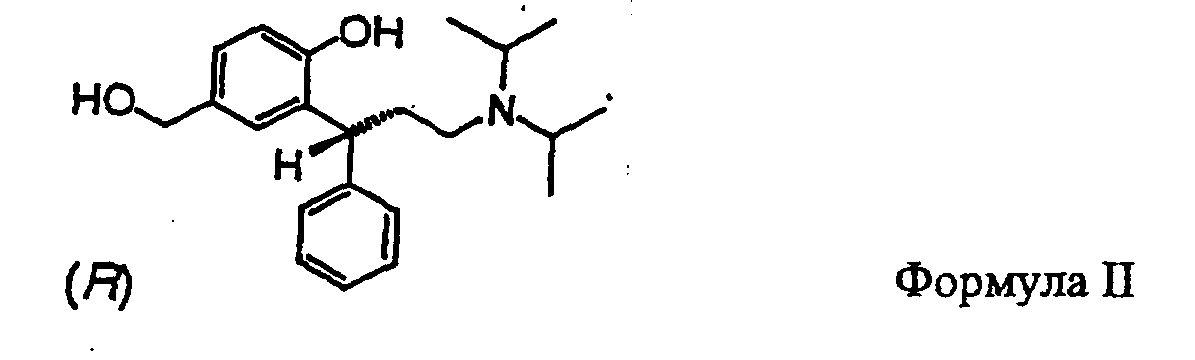
В частности, изобретение относится к получению соединения формулы II
и фармацевтически ценных интермедиатов.
Из патента США 5559269 известен способ получения соединения формулы II. Этот способ включает 11 стадий. Энантиомер R получают в этом процессе разделением рацематов с помощью хиральной кислоты на стадии 5.
Из патентной заявки РСТ/ЕР 99/03212, идентичной WO 99/58478, известен способ получения соединения формулы II, включающий 12 стадий. Согласно ей разделение рацематов осуществляют с помощью хирального основания на стадии 2.
Оба способа имеют недостатки, так как вследствие большого числа стадий они очень сложны и дают неудовлетворительный выход.
Следовательно, цель настоящего изобретения - избежать вышеописанных недостатков.
Неожиданно эта цель была достигнута с помощью способа, включающего только 6 стадий, в котором необходимое разделение рацематов осуществляют уже на первой стадии и который имеет особенности, указанные в формуле изобретения.
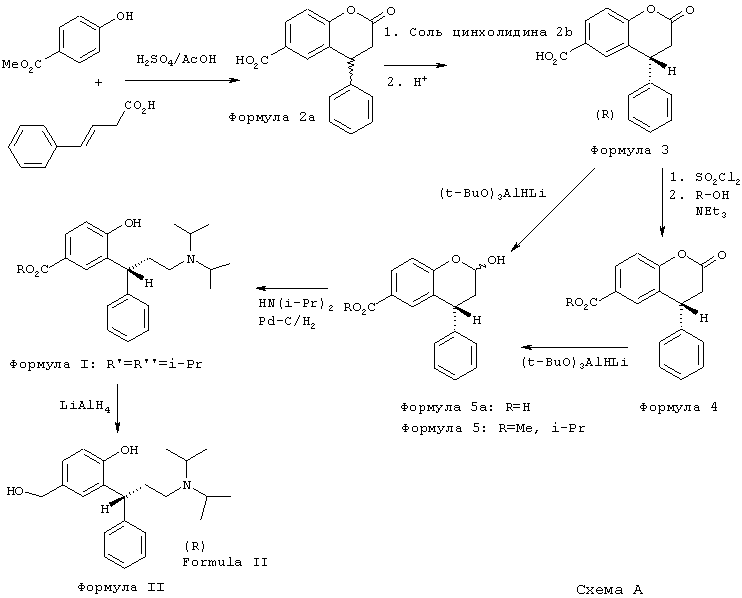
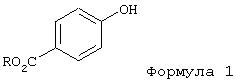
В качестве исходных соединений для получения 3,3-диарилпропиламинов общей формулы I, представленной выше, применяют 4-гидроксибензойную кислоту или ее низшие алкиловые эфиры (РНВ-эфиры; пара-гидроксибензоаты), предпочтительно ее метиловые эфиры формулы 1

которые реагируют с коричной кислотой с образованием соединения общей формулы 2

где R обозначает водород, линейный или разветвленный C1-C6-алкил, предпочтительно метил или изопропил.
При проведении реакции, в частности, исходя из 4-гидроксибензоатов можно в качестве непосредственного продукта реакции получать свободную кристаллическую кислоту формулы 2а.
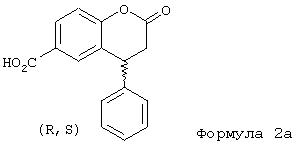
Реакция проходит при повышенных температурах в присутствии катализатора. Предпочтительным растворителем является уксусная кислота. Протонные кислоты, такие как серная, оказались подходящими в качестве катализаторов, а оптимальные температуры находятся в интервале 50-117°C, предпочтительно 100°С. Соединения формулы 2а получают в этих вышеуказанных условиях реакции в виде кристаллических твердых веществ с выходом около 70-78% и с высокой степенью чистоты (>90%). Чистота дополнительно повышается при перекристаллизации, например, из 2-бутанона, уксусной кислоты или N-метилпирролидин-2-она.
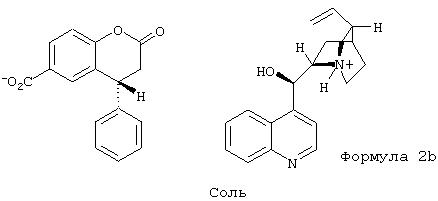
Кристаллические соли получают с неорганическими или органическими основаниями. Хиральные органические основания дают соли в виде смеси диастереомеров, в которых один энантиомер заметно преобладает. Если используют третичный хиральный амин цинхонидин, получают кристаллическую соль формулы 2b 90%-ной чистоты, в которой кислотная компонента более чем на 95% представляет собой R-энантиомер. Последующей перекристаллизацией можно добиться оптической чистоты 99% е.е.

С другой стороны, в солях, в которых основная компонента образована из других хиральных аминов, нет какого-либо заметного преобладания одного из оптических изомеров.
Свободную кислоту формулы 3 выделяют подкислением водных растворов или суспензий и экстракцией подходящим растворителем. Согласно данному изобретению предпочтительно применяют этилацетат.

Чистое соединение формулы 3 представляет собой устойчивый кристаллический продукт. Дальнейшей перекристаллизацией достигают более чем 99%-ной химической и оптической чистоты.
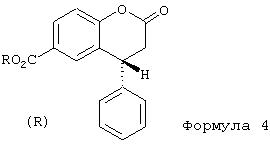
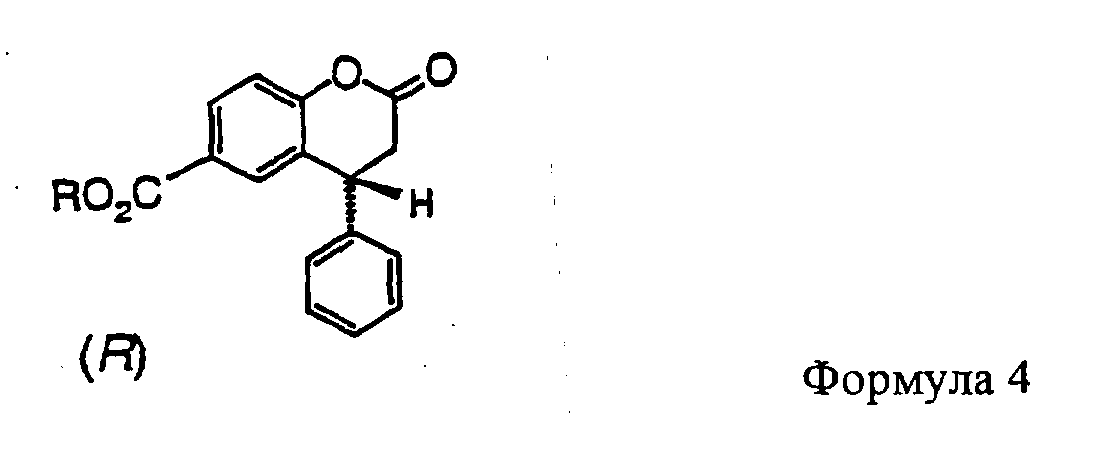
Правовращающий изомер соединения формулы 3 превращается, после активации, в сложные эфиры общей формулы 4, в которой R обозначает линейный или разветвленный C1-C6-алкил, предпочтительно метил или изопропил.

Согласно изобретению реакция идет в присутствии хлористого тионила или оксалилхлорида через промежуточную стадию образования хлорангидрида с последующей этерификацией под действием спиртов R-OH, где R обозначает линейный или разветвленный C1-C6-алкил, предпочтительно метил или изопропил, в присутствии соответствующих оснований.
Полученные сложные эфиры лактонного типа представляют собой устойчивые бесцветные кристаллические вещества.
В другом аспекте изобретение нацелено на использование различной реакционной способности карбоксильных групп лактонного цикла и ароматического сложного эфира по отношению к гидридным реагентам.
Так, когда эти реагенты, предпочтительно диизобутилалюминийгидрид или литий-три-трет-бутоксиалюминийгидрид, действуют на соединения формулы 4, почти исключительно идет восстановление лактона в лактол формулы 5 (например, R обозначает метил или изопропил).
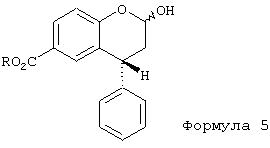
Вторым аспектом данного изобретения является то, что при подходящих условиях из соединения формулы 3 образуется лактол кислоты формулы 5а, когда восстановление проводят с эквивалентным избытком гидрида.

Эти лактолы формул 5 и 5а являются подходящими субстратами для восстановительного аминирования первичными, вторичными или третичными аминами, приводящего к соединениям общей формулы I. В формуле I R' и R'' являются одинаковыми или различными и обозначают водород, линейный или разветвленный C1-С6-алкил, предпочтительно метил или изопропил. R имеет указанное выше значение. Подходящей оказалась система газообразный водород/драгоценный металл, предпочтительно палладий. Также можно использовать перенос водорода (формиат аммония/драгоценный металл) или восстановление гидридами (например, цианоборгидридом).
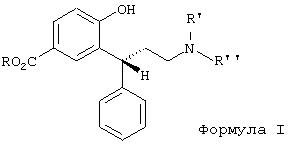
Амины формулы I можно получать как в виде нейтральных соединений, так и в виде солей, предпочтительно гидрохлоридов, в кристаллической форме.
Другим аспектом данного изобретения является восстановление карбоксильной группы соединений формулы I до гидроксибензиловых спиртов формулы II. В качестве восстановителей подходящими являются диборан, боргидрид, алюминийгидрид, диизобутилалюминийгидрид или предпочтительно алюмогидрид лития. Получают соединение формулы II, когда каждый из R' и R'' в формуле I обозначает изопропил.
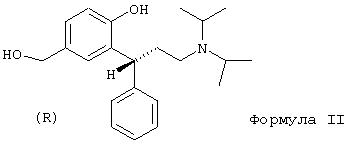
По аналогии с процессом получения, указанным в документе РСТ/ЕР 99/03212 = WO 99/58478, адаптированным к решению задачи по данному изобретению, правовращаюпщй энантиомер соединения формулы II получают в виде свободного основания. Правовращающий энантиомер получают в соответствии с процессом получения соединения формулы II, описанным с помощью нижеследующих примеров. Этот энантиомер имеет R-конфигурацию. Гидроксибензиловый спирт формулы II образует ряд устойчивых кристаллических солей, причем специального упоминания заслуживают гидрохлориды, формиаты и монофумараты.
Кислые соли фумаровой кислоты, в частности, в высшей степени пригодны для химически элегантной очистки гидроксибензилового спирта.
В частности, следующие соединения получены способом по данному изобретению:
(R,S)-4-фенил-2-хроманон-6-карбоновая кислота
цинхонидиновая соль (R)-4-фенил-2-хроманон-6-карбоновой кислоты
(R)-4-фенил-2-хроманон-6-карбоновая кислота
(R,S)-4-фенил-2-хроманон-6-карбонилхлорид
(R)-4-фенил-2-хроманон-6-карбонилхлорид
метиловый эфир (R, S)-2-оксо-4-фенилхроман-2-карбоновой кислоты
метиловый эфир (R)-2-оксо-4-фенилхроман-2-карбоновой кислоты
изопропиловый эфир (R,S)-2-оксо-4-фенилхроман-2-карбоновой кислоты
изопропиловый эфир (R)-2-оксо-4-фенилхроман-2-карбоновой кислоты
метиловый эфир (4R,4S)-2-(R,S)-гидрокси-4-фенилхроман-6-карбоновой кислоты
метиловый эфир (4R)-2-(R,S)-гидрокси-4-фенилхроман-6-карбоновой кислоты
изопропиловый эфир (4R,4S)-2-(R,S)-гидрокси-4-фенилхроман-6-карбоновой кислоты
изопропиловый эфир (4R)-2-(R,S)-гидрокси-4-фенилхроман-6-карбоновой кислоты
(4R,4S)-2-(R,S)-гидрокси-4-фенилхроман-6-карбоновая кислота
(4R)-2-(R,S)-гидрокси-4-фенилхроман-6-карбоновая кислота
метиловый эфир (R,S)-3-(3-диизопропиламино-1-фенилпропил)-4-гидроксибензойной кислоты - основание и гидрохлорид
метиловый эфир (R)-(-)-3-(3-диизопропиламино-1-фенилпропил)-4-гидроксибензойной кислоты - основание и гидрохлорид
(R)-(-)-3-(3-диизопропиламино-1-фенилпропил)-4-гидроксибензойная кислота - основание и гидрохлорид
(R,S)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенол
(R)-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенол - основание, формиат и кислая соль фумаровой кислоты
Получение вышеперечисленных соединений показано на приведенной ниже схеме А.
Более подробно данное изобретение поясняется с помощью нижеследующих физических методов исследования и с помощью примеров.
Физические методы исследования
Все описанные соединения полностью охарактеризованы1Н и/или13С ЯМР-спектроскопией (прибор Brucker DPX 2000). Химсдвиги в спектрах13С ЯМР (50 мГц, м.д.) определяются относительно растворителей CDCl3 (77,10 м.д.), CD3OD (49,00 м. д.) или гексадейтерийдиметилсульфоксида(DMSO-d6, 39,70 м.д.). Химсдвиги в спектрах1H ЯМР (200 мГц, м.д.) определяют относительно внутреннего стандарта тетраметилсилана (0,00 м.д.).
Определение энантиомерной чистоты
а) Методом ВЭЖХ
Разделение осуществляют на колонке фирмы Daicel (Chiralpack AD, 250×4,6 мм), элюент - н-гептан/этанол/трифторуксусная кислота (92,5/7,5/0,1 об.%), скорость потока 1 мл/мин, детектирование осуществляют в УФ-свете (250 нм). Типичное время удерживания, например, для энантиомеров (R,S)-1 составляет 18,0 и 19,5 мин.
б) Методом капиллярного электрофореза (СЕ, КЭ):
Разделение осуществляют на приборе Beckman-Coulter модели VDQ в капиллярах размером 60 см (ID, внутренний диаметр 75 мкм), в поле 500 В/см в буфере 100 мМ/100 нМ трис-буфер/борная кислота, рН 8,5, в присутствии 3% (об/вес) модификатора - гидроксипропил-β-циклодекстрина. Детектирование осуществляют с.помощью УФ при 200 нм. Типичное время удерживания энантиомеров, например, дикарбоновой кислоты, образующейся при щелочном гидролизе (R,S)-1, составляет 6,6 и 6,8 мин.
Оптическое вращение определяют при 589,3 нм при комнатной температуре на поляриметре Perkin-Elmer 241.
Даны некорректированные температуры плавления (т.пл.), определяемые на приборе Mettler FP 1, а в отдельных случаях также методом дифференциального термоанализа (DSC).
ИК-спектры регистрируют на спектрометре Perkin-Elmer FTIR 1610 с разрешением 4 см-1.
Газовая хроматография - масс-спектроскопия (GC-MS): спектры (отношение заряд/масса и относительная интенсивность (%)) регистрируют на масс-спектрометре с трехмерной ловушкой Finnigan TSQ 700 методом положительной (Р-Cl) или отрицательной (N-Cl) химической ионизации, используя в качестве газа-реагента метан или аммиак. Гидроксильные соединения анализируют в виде их триметилсилиловых эфиров. Комбинированная жидкостная хроматография - масс-спектрометрия (LC-MS): Waters Integrity System, Thermabeam Mass Detector (ЭУ, 70 эВ), указаны соотношения масса/заряд и относительная интенсивность.
Элементные анализы сделаны Pascher.
Примеры
1. (R,S)-4-Фенил-2-хроманон-6-карбоновая кислота (формула 2а).
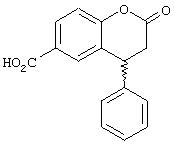
Смесь коричной кислоты (100 г, 0,68 моль), метилового эфира 4-гидроксибензойной кислоты (108 г, 0,71 моль) и уксусной кислоты (80 мл) нагревают до 100°С. К образовавшемуся прозрачному раствору при перемешивании прибавляют 80 мл 96% серной кислоты. Через 2 часа начинают образовываться кристаллы. Продолжают перемешивание при той же температуре еще 16 часов, смесь охлаждают до комнатной температуры и разбавляют 500 мл воды. Выпавшие кристаллы отфильтровывают, промывают диэтиловым эфиром и сушат в вакууме.
Выход сырого продукта 142 г (78% от теоретического), кристаллы светло-бежевого цвета. Т.пл. 246°С.
1Н ЯМР (ДМСО-d6): 3,18 (д, 2Н, J=6,6 Гц, CH2), 4,62 (т, 1Н,1=6,6 Гц, СН), 7,14-7,43 (м, 6Н), 7,62 (с, 1Н), 7,90 (д, 1Н, J=8,6 Гц).
13С ЯМР (ДМСО-d6): 35,93; 39,26; 117,20; 126,81; 127,13; 127,65; 127,65; 127,70; 129, 24; 129,95; 130,25; 140,91; 154,80; 166,66; 167,30.
Доказательство строения
Титрование водным 0,1N раствором NaOH в смеси диоксан/вода по фенолфталеину показывает наличие одного эквивалента карбоновой кислоты/моль. При капиллярном электрофорезе электроферограмма дает один главный пик (>90%) однозарядного иона. После щелочного гидролиза этот пик исчезает и появляется новый пик со временем удерживания, соответствующим дианиону. К метанольному раствору кислоты добавляют избыток триэтиламина и оставляют этот раствор при комнатной температуре на несколько дней. Тонкослойная хроматография показывает, что выделенный продукт превращается в новый продукт. ЯМР-спектр этого продукта соответствует метиловому эфиру.
Таким образом, (R,S)-la представляет собой лактон моноосновной кислоты, а не фенолдикарбоновую кислоту с открытой цепью.
2. Цинхонидиновая соль (R)-4-фенил-2-хроманон-6-карбоновой кислоты
(формула 2b).

1. (R,S)-4-Фенил-2-хроманон-6-карбоновую кислоту (2,28 г, 8,5 ммоль) и цинхонидин. (2,36 г, 8 ммоль) растворяют в 40 мл кипящего 2-бутанона. Перемешивают 18 час при комнатной температуре, выпавшие кристаллы отфильтровывают и сушат в вакууме.
Выход 2,13 г светло-желтых кристаллов цинхонидиновой соли (R)-4-фенил-2-хроманон-6-карбоновой кислоты (90% от теоретического, е.е. 90% (ВЭЖХ)). Перекристаллизацией из того же растворителя получают кристаллическую соль с 99,3% е.е., т.пл. 197,5°С.
13С ЯМР (CDCl3/CD3OD): 18,17; 24,39; 26,90; 36,86; 37,21; 40,53; 43,32; 54,12; 60,03; 66,23, 116,51, 118,60; 122,70; 124,73; 127,41; 128,07; 129,01; 129,31; 129,78; 130,09; 133,02; 137,70; 140,35; 147,20; 149,57; 153,37; 167,37; 167,64; 172,87.
[α]D20=-38,7 (с=1,0, MeOH).
3. (R)-4-Фенил-2-хроманон-6-карбоновая кислота

Избыток водного раствора соляной кислоты прибавляют к перемешиваемой суспензии соли 2 в этилацетате при комнатной температуре. Через один час органическую фазу отделяют и сушат сульфатом натрия. После фильтрования упаривают досуха и кристаллический остаток перекристаллизовывают из смеси 2-бутанон/циклогексан. Получают бесцветные кристаллы с почти количественным выходом (е.е. 99,2%). Т.пл. 224,9°С
13С ЯМР (CDCl3/CD3OD): 36,43; 40,19; 116,92; 125,54; 126,96; 127,10; 127,57; 128,98; 130,29; 130,59; 139,64; 154,71; 167,27; 167,50.
[α]D20=+45,7 (с=1,0 МеОН).
4. Карбонилхлориды.
а) (R,S)-4-Фенил-2-хроманон-6-карбонилхлорид
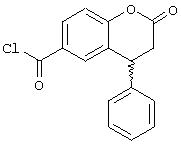
К смеси (R,S)-4-фенил-2-хроманон-6-карбоновых кислот (21,5 г, 0,08 моль) в 80 мл толуола добавляют четыре капли пиридина, а затем 17,7 мл (0,24 моль) тионилхлорида. После перемешивания в течение 30 мин при комнатной температуре смесь нагревают 2 часа при 90-100°С, охлаждают и упаривают досуха на роторном испарителе. Остаток в виде масла растворяют в толуоле и снова упаривают досуха в вакууме. (R,S)-4-Фенил-2-хроманон-6-карбонилхлорид с количественным выходом остается в виде бледно-желтого масла.
1Н ЯМР (CDCL3): 3,07 (м, 2Н, СН2), 4,41 (т, 1Н, J=6,7 Гц, СН), 7,11-7,40 (м, 6Н, арил Н), 7,59 (д,1Н, J=2 Гц, арил Н), 8,08 (дд,1Н, J=2/6,5 Гц, арил Н).
13С ЯМР (CDCl3): 36,43; 40,51; 118,00; 127,34; 128,23; 129,05; 129,49; 129,56; 132,10; 132,12; 165,88; 167,03.
b) (R)-4-Фенил-2-хроманон-6-карбонилхлорид
Таким же способом (R)-4-фенил-2-хроманон-6-карбоновую кислоту превращают в соединение, названное в заглавии, бледно-желтое масло.
5. Эфиры карбоновых кислот.
а) Метиловый эфир (R,S)-2-оксо-4-фенилхроман-2-карбоновой кислоты
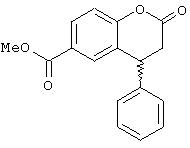
К раствору хлорангидрида (R,S)-4-фенил-2-хроманон-6-карбоновой кислоты (22,9 г, 0,08 моль) в абсолютном тетрагидрофуране (100 мл) при 0°С при перемешивании прибавляют 3 г (0,094 моль) метанола и 16 мл (0,12 моль) триэтиламина в 20 мл ТГФ. После перемешивания а течение 18 часов при комнатной температуре реакционную смесь отфильтровывают и фильтрат упаривают досуха. После перекристаллизации из кипящего диэтилового эфира остается 13,7 г (65% от теоретического) метилового эфира (R,S)-2-оксо-4-фенилхроман-2-карбоновой кислоты в виде бесцветных кристаллов. Т.пл.97-99°С.
13С ЯМР (CDCl3): 36,70; 40,55; 52,19; 117,29; 125,78; 126,67; 127,35; 127,88; 129,29; 130,23; 130,54; 139,79; 155,03; 166,00; 166,60.
b) Метиловый эфир (R)-2-оксо-4-фенилхроман-2-карбоновой кислоты
Реакция хлорангидрида (R)-4-фенил-2-хроманон-6-карбоновой кислоты, описанная для рацемата, дает кристаллический метиловый эфир (R)-2-оксо-4-фенилхроман-2-карбоновой кислоты.
c) Изопропиловый эфир (R,S)-2-оксо-4-фенилхроман-2-карбоновой кислоты
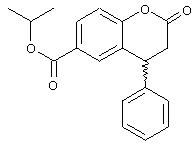
Изопропиловый эфир (R,S)-2-оксо-4-фенилхроман-2-карбоновой кислоты получают в виде кристаллов светло-бежевого цвета с т.пл. 85,9°С таким же способом, как и метиловый эфир.
13С ЯМР (CDCl3): 21,93; 36,88; 40,65; 68,72; 117,25; 125,58; 127,35; 127,53; 127,91; 129,32; 130,30; 130,51; 139,94; 154,95; 165,09; 166,72.
d) Изопропиловый эфир (R)-2-оксо-4-фенилхроман-2-карбоновой кислоты
Хлорангидрид (R)-4-фенил-2-хроманон-6-карбоновой кислоты тем же способом превращают в соединения формулы 4.
6. Эфиры 2-гидрокси-4-фенилхроман-6-карбоновой кислоты.
а) Метиловый эфир (4R,4S)-2-(R,S)-гидрокси-4-фенилхроман-6-карбоновой кислоты

К раствору 11,7 г (0,042 моль) метилового эфира (R,S)-2-оксо-4-фенилхроман-2-карбоновой кислоты в 60 мл абсолютного ТГФ при 0°С при перемешивании по каплям прибавляют литий-ди-трет-бутоксиалюминийгидрид (11,6 г, 0,046 моль) в 40 мл ТГФ. Через 2 часа смесь выливают в 100 мл воды. Водную фазу несколько раз экстрагируют этилацетатом и объединенные органические вытяжки промывают водой, сушат сульфатом натрия и упаривают в вакууме досуха. В остатке получают 11,1 г (95% от теории) метилового эфира (4R,4S)-2-(R,S)-гидрокси-4-фенилхроман-6-карбоновой кислоты в виде бесцветного масла.
13С ЯМР (CDCl3) (смесь диастереомеров, примерно 1: 5): 36,15; 36,94; 38,36; 41,05, 51,91; 91,75; 94,81, 117,13; 122,88; 124,95; 125,27; 127,03; 127,24; 128.39; 128,72; 128,88; 129,00; 129,73; 129,93; 131,59; 131,77; 143,13; 143,63; 156,33; 166,98.
b) Метиловый эфир (4R)-2-(R,S)-гидрокси-4-фенилхроман-6-карбоновой кислоты
Метиловый эфир (R)-4-фенил-2-хроманон-6-карбоновой кислоты тем же способом превращают в заглавное соединение.
c) Изопропиловый эфир (4R,4S)-2-(R,S)-гидрокси-4-фенилхроман-6-карбоновой кислоты
Изопропиловый эфир (R,S)-4-фенил-2-хроманон-6-карбоновой кислоты тем же способом превращают в заглавное соединение.
d) Изопропиловый эфир (4R)-2-(R, S)-гидрокси-4-фенилхроман-6-карбоновой кислоты
Изопропиловый эфир (R)-4-фенил-2-хроманон-6-карбоновой кислоты тем же способом превращают в заглавное соединение.
7. 2-Гидрокси-4-фенилхроман-6-карбоновые кислоты.
а) (4R,4S)-2-(R,S)-Гидрокси-4-фенилхроман-6-карбоновая кислота

(R,S)-4-Фенил-2-хроманон-6-карбоновую кислоту тем же способом превращают в заглавное соединение.
b) (4R)-2-(R, S)-Гидрокси-4-фенилхроман-6-карбоновая кислота
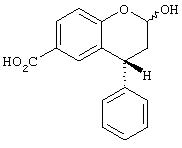
(R)-4-Фенил-2-хроманон-6-карбоновую кислоту тем же способом превращают в заглавное соединение.
8. Метиловый эфир 3-(3-диизопропиламино-1-фенилпропил)-4-гидроксибензойной кислоты.
а) Метиловый эфир (R,S)-3-(3-диизопропиламино-1-фенилпропил)-4-гидроксибензойной кислоты - основание и гидрохлорид
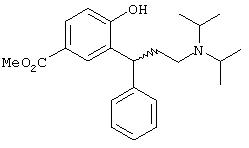
К раствору 11,1 г (0,039 моль) метилового эфира (4R,4S)-2-(R,S)-гидрокси-4-фенилхроман-6-карбоновой кислоты и 21 мл (0,15 моль) диизопропиламина в 100 мл метанола прибавляют 0,4 г палладия на угле (10% Pd; катализатор) и гидрируют при комнатной температуре при давлении 4 бар (4·105 Па). После продувания аппарата газообразным азотом смесь фильтруют, фильтрат упаривают досуха и растворяют в диэтиловом эфире. Прозрачный бесцветный раствор охлаждают до 5°С и через него пропускают слабый ток газообразного хлористого водорода. Выпавшие бесцветные кристаллы гидрохлорида метилового эфира (R,S)-3-(3-диизопропиламино-1-фенилпропил)-4-гидроксибензойной кислоты отфильтровывают и сушат в вакууме (10,9 г, 69% от теории).
13С ЯМР (ДМСО-d6): 16,51; 18,11; 18,78; 31,53; 41,30; 45,81; 51,83; 54,14; 115,60; 120,43, 126,62; 128,01; 128,61; 129,25; 129,53; 130,01; 143,04; 159,77; 166,30.
Свободное основание получают при перемешивании суспензии гидрохлорида в этилацетате с избытком водного раствора карбоната натрия. Органическую фазу промывают водой, сушат сульфатом натрия, фильтруют и упаривают досуха (количественный выход).
b) Метиловый эфир (R)-(-)-3-(3-диизопропиламино-1-фенилпропил)-4-гидроксибензойной кислоты

Таким же способом, который описан для рацемата, из метилового эфира (4R)-2-(R,S)-гидрокси-4-фенилхроман-6-карбоновой кислоты получают оптически активный метиловый эфир (R)-(-)-3-(3-диизопропиламино-1-фенилпропил)-4-гидроксибензойной кислоты 99,6%-ной чистоты (ВЭЖХ). Т.пл. 143,7°С (DSC: 144,7°С).
[α]D20=-26,6 (с=0,93, EtOH).
13С ЯМР (CDCl3): 18,74; 19,62; 33,12; 39,68; 42,36; 48,64; 51,42; 117,99; 120,32; 126, 23; 128,30; 128,85; 129,39; 130,26; 132,21; 144,06; 162,43; 167,35.
Macc-спектрометрия (ЭУ, 70 эВ): 369 (M+, 3%), 354 (13%), 265 (3%), 237 (5%), 209 (5%), 181 (5%), 152 (4%), 126 (8%), 114 (100%).
9. (R)-(-)-3-(3-Диизопропиламино-1-фенилпропил)-4-гидроксибензойная кислота

Получают из (4R)-2-(R,S)-гидрокси-4-фенилхроман-6-карбоновой кислоты, как описано выше.
Гидрохлорид:
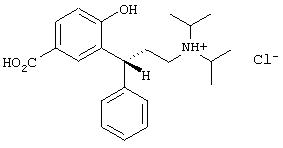
Получают из основания (R)-(-)-3-(3-диизопропиламино-1-фенилпропил)-4-гидроксибензойной кислоты и газообразного HCl в этилацетате, перекристаллизация из кипящей воды. Т.пл. 260,7°С.
[α]D20=-28,8 (c=1, MeOh).
13С ЯМР (ДМСО-d6): 16,57; 18,12; 31,68; 41,26; 45,89; 54,19; 115,43; 121,59; 124,99; 126,63; 128,09; 128,65; 129,47; 129,83; 143,17; 159,41; 167,44.
Вычислено для С22Н30 ClNO3(М.в. 391,94): С 67,42%; H 7,72%; Cl 9,05%; N 3,57%; О 12,25%; Найдено: С 65,63%; Н 7,68%; Cl 8,54%; N 3,68%; О 12,05%.
10. (R, S)-2-(3-Диизопропиламино-1-фенилпропил)-4-гидроксиметилфенол

К суспензии алюмогидрида лития (0,94 г, 24,7 ммоль) при перемешивании при 0°С медленно по каплям прибавляют раствор метилового эфира (R,S)-3-(3-диизопропиламино-1-фенилпропил)-4-гидроксибензойной кислоты (9,1 г, 24,6 ммоль) в 50 мл ТГФ. После перемешивания в течение двух часов раствор доводят до комнатной температуры и перемешивают еще в течение двух часов. Смесь охлаждают (0°С) и по каплям последовательно добавляют 1 мл воды и 1 мл 10% водного раствора бикарбоната натрия. Смесь фильтруют и остаток после фильтрования промывают ТГФ, объединенные органические вытяжки упаривают досуха. Остаток в виде вязкого светло-желтого масла растворяют в этилацетате, раствор промывают 10%-ным водным раствором бикарбоната натрия. После сушки (сульфат натрия), фильтрования и упаривания остаток кристаллизуют из малого количества этилацетата. После высушивания в вакууме получают 5 г (59% от теории) (R,S)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенола в виде кристаллов светло-бежевого цвета. Т.пл. 112,2°С.
13С ЯМР (CDCl3): 19,57; 19,95; 33,34; 39,55; 42,13; 48,01; 65,34; 118,50; 126,27; 126,54; 127,50; 128,37; 128,54; 132, 61; 132,77; 144,56; 155,46.
11. (R)-(+)-2-(3-Диизопропиламино-1-фенилпропил)-4-гидроксиметилфенол (формула II)

Получают из метилового эфира (R)-(-)-3-(3-диизопропиламино-1-фенилпропил)-4-гидроксибензойной кислоты, как описано выше. Бесцветные кристаллы, т.пл. 102,3°С (из этилацетата).
[α]D20=+21,3 (с=1,0, EtOH).
12. Соль муравьиной кислоты (формиат).
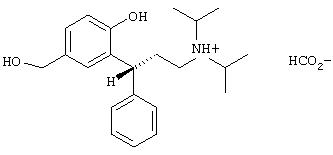
К раствору (R)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенола (1,02 г, 3, 00 моль) в 7,5 г ацетонитрила при комнатной температуре прибавляют 138,1 мг (3 ммоль) муравьиной кислоты. Выпавшее при этом масло при нагревании переходит в раствор. При стоянии в течение ночи выпадают крупные кристаллы, которые отфильтровывают и сушат (выход почти количественный), чистота (ВЭЖХ) 97,7%. Т.пл. 151,8°С.
[α]D20=-7,3 (с=1, вода).
13С ЯМР (ДМСО-d6): 19,16; 19,27; 34,21; 41,06; 44,46; 50,78; 63,16; 114,96; 125,72; 126,00; 126,31; 128,08; 128,30; 130,14; 132,96; 144,73; 153,74; 164,98.
13. Кислая соль фумаровой кислоты.

К раствору (R)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенола (2,94 г, 8,61 ммоль) в 25 мл ацетона при комнатной температуре прибавляют 1,0 г (8,61 ммоль) фумаровой кислоты. Сразу выпадает соль в виде бесцветных кристаллов, перемешивают еще 30 мин при комнатной температуре, отфильтровывают и сушат в вакууме. Выход 3,94 г (100% от теории). Т.пл.216,1°С.
Растворимость при комнатной температуре (мг/мл): <0,2 в этилацетате, 2-бутаноне, хлористом метилене; >50 в метаноле; примерно 10 в воде.
[α]D20=+9,6 (с=1, этанол).
[α]D20=-5,7 (с=1, ацетонитрил/вода=90/10).
13С ЯМР (CD3OD): 17,97; 33,68; 43,19; 47,72; 56,31; 65,05; 116,29; 127,58; 128,04; 128,46; 129,13; 129,53; 130,55; 130,55; 133,73; 136,29; 144,37; 155,41; 171,38.
Исходя из диола формулы II, имеющего чистоту 99%, методом солеобразования с увеличением чистоты до 100% были синтезированы следующие соли:
1. Гидрофумарат (соль фумаровой кислоты, образец MS 17002, химический выход 95,4%).
2. (S)- (+)- манделат (соль миндальной кислоты, образец MS 17003, химический выход 84,5%).
3. Формиат (соль муравьиной кислоты, образец MS 17004, химический выход 87%).
Из прилагаемой таблицы видно, что синтезированные соли являются аналитически чистыми. Однако соль гидрофумарат получается с самым высоким химическим выходом, имеет самую высокую точку плавления и самую высокую стабильность после термического напряжения (30 минут при 130°С). Кроме того, гидрофумарат проявляет наиболее сильное стремление к кристаллизации, тогда как манделат часто получают в виде масла, которое можно перевести в кристаллическую форму, только действуя на чистый пересыщенный раствора соли ультразвуком или помещая затравку кристалла в такой раствор (инокуляция).
Кроме того, формиат проявляет очень слабую устойчивость после термического напряжения по сравнению с соответствующим гидрофумаратом.
Таким образом, гидрофумарат гидроксибензилового спирта формулы II особенно пригоден для очистки этого гидроксибензилового спирта.
Исследование проводят при условиях: начальная температура 25°С, скорость нагрева 10°С/мин, конечная температура 130°С, выдержка 30 мин.
Пропускаемый газ: азот; охлаждение не контролировалось.
Реферат
Изобретение относится к новому улучшенному способу получения производных 3,3-диарилпропиламинов общей формулы (I) и стерически высокочистым устойчивым интермедиатам и их применению для получения фармацевтических композиций. Способ получения 3,3-диарилпропиламинов общей формулы I

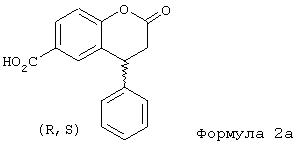
которое затем реагирует с хиральным третичным амином - цинхонидином, образуя соответствующую соль соединения общей формулы 2b
из которой далее, при окислении, выделяется в кристаллической форме соединение формулы 3

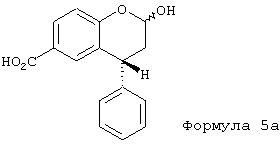
которое либо непосредственно восстанавливается эквивалентным избытком гидрида с получением лактола формулы 5а, либо через промежуточную стадию образования соответствующего хлорангидрида кислоты с образованием сложного эфира со спиртами типа R-OH, где R указано выше, превращается в соединение формулы 4

и затем гидрируется диизобутилалюминийгидридом или три-трет-бутоксиалюминийгидридом с образованием лактола формулы 5. Полученный лактол формулы 5а или 5 в результате восстановительного аминирования вторичным амином образует соединения формулы I. 6 н. и 4 з.п. ф-лы, 1 табл.
Формула






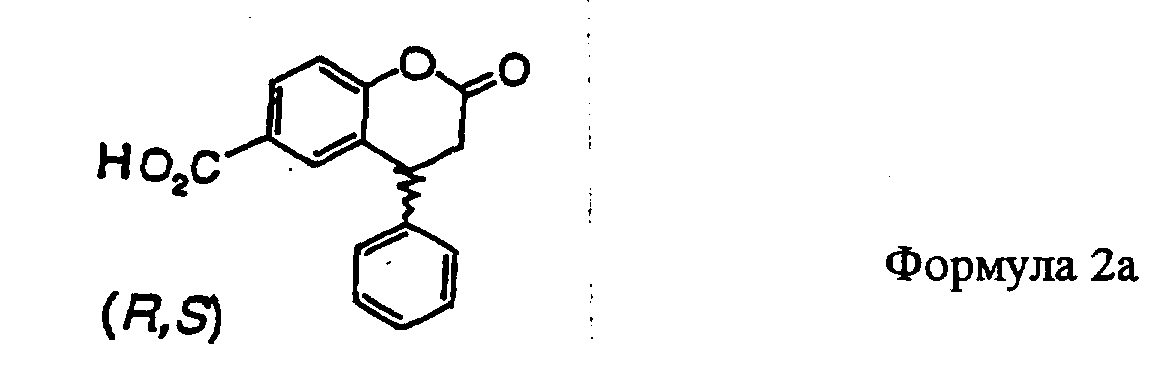




Комментарии