Напиток, способ его получения, способ получения пива и пенообразующая добавка в напиток - RU2145974C1
Код документа: RU2145974C1
Чертежи























Описание
Область техники
Настоящее изобретение относится к
пенистому напитку, такому как пиво, способу приготовления
пенистого напитка и использованию пенообразующей добавки.
Предшествующий уровень техники
Напитки играют важную роль в
нашей повседневной жизни не только как источники
необходимой жидкости и питания, но и в качестве стимулятора. Для напитков высокого качества, кроме вкуса, важными являются и такие свойства, как
вязкость и пенообразующая способность.
В настоящее время в продаже имеется целый ряд пенистых напитков, таких как, например, пиво, молочный коктейль и некоторые безалкогольные напитки. Однако ощущается потребность в новых пенистых напитках, также как и необходимость улучшить качество уже известных пенистых напитков.
Было сделано множество усилий для исследования и выделения веществ, образующих пену в пиве, и для улучшения способности пива образовывать пену.
Уже в течение более 50 лет известно, что способность пива образовывать пену определяется содержанием в нем белка, который в обычном пиве составляет около 3-4 мг/мл, а также то, что свободные липиды и остатки моющих средств пагубно влияют на стабильность пены пива.
Множество проведенных исследований (Ссылки 1, 2, 4, 17) были связаны с выяснением, какие пивные белковые компоненты участвуют в стабилизации пены, но все они не дали четкого ответа на этот вопрос. Было выдвинуто предположение, что для пены важны несколько классов белков в зависимости от их молекулярного веса (Ссылки 2, 11, 20).
Профиль молекулярной массы пивных белков находится в пределах от массы малых полипептидов до примерно 150000 Да и выше. Было установлено, что все вместе белки, содержащиеся в пиве и имеющие молекулярные массы до примерно 100000 Да, оказывают положительное влияние на стабилизацию пивной пены, тогда как малые полипептиды, особенно полипептиды, имеющие молекулярную массу меньше 5000 Да, считаются причиной отрицательного воздействия на пену (Ссылки 6, 19). Более того, исследования проведенные Шарпом и другими (Ссылка 15), привели к предположению, что стабильность пены пива связана с соотношением полипептидов, имеющих высокую и низкую молекулярную массу. Рассматривая важность специфических белков, Екой и другие (Ссылка 20) утверждают, что белок Z, ячменный альбумин с 40000 Да, играет наиболее важную роль в стабильности пены. Это находится в противоречии с результатами, полученными Холлемансом и Тонизом (Ссылка 11), которые выявили, что полное или избирательное удаление упомянутого белка из пива при помощи специфических иммобилизованных антител оказывало лишь незначительное влияние на стабильность пены.
Было также установлено, что в пивной пене концентрируются высокомолекулярные компоненты дрожжей, которые в основном имеют углеводную природу (Ссылки 10, 12).
Большинство из упомянутых выше заключений было получено в результате фракционирования пивных белков и установления способности различных фракций образовывать устойчивую пену. Ни одно из этих исследований не предпринимало никаких шагов по улучшению качества пивной пены.
При обсуждении качества пены следует иметь в виду два важных параметра, а именно способность образовать пену и способность стабилизировать эту пену.
В настоящее время неожиданно было установлено, что существует особая группа белков, обозначаемая как БПЛ злаковых (злаковые БПЛ), способная образовывать пену в напитках.
Поэтому настоящее изобретение касается такого напитка, содержащего белок и/или пептиды, который характеризуется признаками пункта 1 формулы изобретения.
"Злаковый БПЛ" означает белки или пептиды из класса злаковых, называемые как белки переноса (липидов БПЛ). В таблице I показана последовательность ряда таких БПЛ (злаковых) и БПЛ других растений. Эти белки более подробно описаны у Молина и других (Ссылка 13).
Гомологи обозначают белки, имеющие 50-110 аминокислот и особенно 80-100 аминокислот, у которых по меньшей мере 60%, предпочтительнее 80% или больше последовательности оснований гомологична последовательности злаковых БПЛ.
Особенно важны структурные взаимоотношения. Поэтому гомологичные белки предпочтительно содержат по меньшей мере шесть цистеиновых групп, предпочтительно восемь цистеиновых групп для создания трех или четырех дисульфидных мостиков.
Предпочтительными гомологичными белками являются TLTP, SLTP, CLTP, CB-A, CB-B и CB-C.
В настоящем изобретении предпочтение отдано БПЛ семян злаковых.
Особенно предпочтительным БПЛ злаковых является БПЛ из семян ячменя, который в таблице I обозначен как BLTP, а в примерах обозначен как БПЛ1 (LTP1).
BLTP является основным белком, который в изобилии находится в слое алейронов семян ячменя (Ссылка 14, 16). Его молекулярная масса составляет 9694 Да, он содержит 91 аминокислотных остатков, 8 цистеинов (Ссылка 18). Его аминокислотная последовательность была установлена (Ссылка 18). Она была клонирована, и была установлена нуклеотидная последовательность комплектарной ДНК (Ссылка 14).
В следующем ниже описании изобретения термин "Злаковый БПЛ" или подгруппы его, например ячменный БПЛ, также обозначает гомологи, как они определены выше с последовательностью, гомологичной упомянутой группе БПЛ. Далее, термин "Злаковый БПЛ" или его подгруппы, например ячменный БПЛ, обозначает модифицированную фракцию зернового БПЛ, полученную из упомянутого БПЛ или из их гомологов при помощи нагревания, кипячения и/или затирания БПЛ. Предпочтительно, когда зерновой БПЛ не полностью денатурирован, то есть некоторые структуры остаются в наличии благодаря способности цистеинов образовывать дисульфидные мостики.
Когда зерновой БПЛ подвергают стадии нагревания, кипячения и/или затирания, как будет описано в последующем, то есть тому, что является нормальным в процессе пивоварения, он в основном сохраняет всю свою первичную последовательность, тогда как вторичные и третичные структуры в разной степени изменяются, и некоторые или все дисульфидные мостики могут перегруппироваться. В процессе пивоварения упомянутая аминокислота ячменного БПЛ часто окисляется. Авторы настоящего изобретения также наблюдали образование БПЛ-димеров или БПЛ-олигомеров, вероятно за счет группировки одного или нескольких дисульфидных мостиков, имеющихся в БПЛ. Как будет в дальнейшем описано, БПЛ может также соединяться с другими имеющимися в наличии компонентами, присутствующими на стадии кипячения, например, с гордеиновыми фрагментами, хмелями и липидами.
Модифицированный зерновой БПЛ можно предпочтительно получить путем нагревания обычного зернового БПЛ в водном растворе в течение периода времени до 3 часов при температуре от 50 до 95oC или путем кипячения при атмосферном давлении в течение до 2 часов и/или затиранием, как при обычной стадии затирания во время производства пива.
В описании термин "Злаковый БПЛ" (Cereal LTP) обозначает также его гомологи или модифицированный злаковый БПЛ и модифицированные гомологи, если только не будет иначе оговорено.
Напиток может представлять собой любую жидкость, которую можно пить, например, это могут быть такие напитки, которые основаны на молоке и фруктах, и пиво.
Когда небольшое количество, т.е. около 50 мг/л, имеется в известных сортах пива, то эта известная технология отрицается в пункте 1.
Производство пива или пивоваренный процесс в том виде, как он известен из предыдущего уровня техники, подробно описывается в литературе, например в "Учении об Осолаживании и Пивоварении", том I, Д.Е.Бриггс, Дж.С.Хау, Р.Стивенс и Т. У.Янг. Чепман енд Холл, Лондон (1981 г.) и том II, Дж.С.Хау, Д.Е. Бриггс, Р. Стивенс и Т.У.Янг. Чепман енд Холл (1982 г.) описывает множество сырьевых материалов и способов. Обычно способы содержат стадии от (А) до (Г).
(А) Подбор сырьевых материалов и приготовление.
Сырьевые
материалы включают в себя
воду, углеводы и белки (которые имеются в злаках, таких как
ячмень, пшеница, рис, кукуруза, сорго); сахар; сиропы; экстракты солода; ферменты, образующиеся в
процессе осолаживания злаков (например, ячменя и пшеницы) или микробиологического производства;
придающие привкус или запах компоненты (обжаренный солод, хмели и другие материалы или соли
растений).
Злаковые сырьевые материалы могут быть в следующем виде:
осолаженном;
измельченном; отделенном (для того, чтобы получить компоненты со специфическим привкусом или
запахом и ферментативной активностью).
(Б) Затирание и производство сусла.
Включает в себя:
Экстрагирование при помощи регулируемого (по температуре и
времени) процесса замачивания подготовленных сырьевых материалов; кипячение и отделение сусла от нерастворимых
материалов.
(В) Ферментация сусла.
Ферментация происходит после добавления дрожжевой взвеси в холодное насыщенное воздухом сусло. В условиях управляемого температурного режима за счет обмена веществ в дрожжах (ферментации) сусло превращается в пиво, содержащее некоторые продуцированные дрожжами компоненты, такие как алкоголь и придающие вкус и аромат компоненты. Эту стадию можно контролировать параметрами процесса: температурой и количеством дрожжей, а также селекцией дрожжей.
(Г) Осветление и завершающая обработка.
После хранения и созревания осадок оставшихся дрожжей и белка/таннина фильтруют и вводят углекислоту, красящие вещества и другие корректирующие добавки, подобные стабилизирующим и придающим вкус и аромат компонентам.
Для пивоваров общеизвестным является тот факт, что пиво, изготовленное только из осолаженного ячменя или осолаженной пшеницы, образует пену с большим потенциалом (способностью образовывать пену) и лучшей стабильностью, чем пиво, сваренное с добавками.
Анализы содержания злакового БПЛ в известных сортах пива с наиболее высоким известным потенциалом пенообразования показали, что концентрация злакового БПЛ составляет значительно меньше 300 мг/л.
Качество пивной пены зависит как от процесса пивоварения, так и от используемого сырьевого материала. Поскольку настоящее изобретение в основном связано с сырьевыми материалами, содержание злакового БПЛ в пиве, вслед за начальной плотностью, больше всего связано со злаковым БПЛ в сусле, приготовленном согласно EBC (Европейская конвенция по пивоварению) стандартному способу затирания, которое также обозначается как сусло конгресса. Для неосолаженных злаковых можно применять аналогичную процедуру экстрагирования, при необходимости включающую дополнительное установление нормальных уровней активности ферментов пивоварения.
Злаковый БПЛ, который присутствует в известном сладком солоде, предназначенном для производства пива, это прежде всего БПЛ1 или несколько модифицированный БПЛ1. Степень модификации зависит от способа, используемого при его приготовлении. Когда готовится солод конгресса в соответствии со стандартным способом затирания ЕВС, около 90% злакового БПЛ, имеющегося в солоде конгресса, замеряют при помощи анализа ELISA с использованием антител, против немодифицированного БПЛ1, при условии, что анализ ELISA осуществляют согласно стандартным методикам, которые будут описаны ниже.
Концентрация злакового БПЛ в известном пиве меньше X и значительно меньше X1, где X и X1 обозначают уровни, которые можно получить в пиве, приготовленном из сырьевых материалов, которые при использовании стандартного затировочного способа ЕВС обеспечивают получение солода конгресса, имеющего концентрацию злакового БПЛ, соответствующую 125 μг/мл и 150 μг/мл, соответственно злакового БПЛ, измеренного при помощи ELIZA с использованием антител против немодифицированного БПЛ1.
Термин "первый солод" обозначает солод, полученный на стадии первого фильтрования после стадии затирания. Первая стадия фильтрования представляет собой обычную стадию фильтрования перед промыванием фильтровальной лепешки.
Термин "сладкий солод" обозначает солод, полученный после стадии завершающего фильтрования, то есть после того, как остаток на фильтре был промыт водой. Поэтому сладкий солод представляет собой смесь первого солода с промывкой водой.
Термин "солод конгресса" обозначает солод, приготовленный в соответствии со стандартным способом затирания ЕВС.
Термин "солод" означает конечный солод после затирания, фильтрования и кипячения.
Весь злаковый БПЛ, имеющийся в солоде, можно обнаружить главным образом в пиве, приготовленном из этого солода. 1 мл солода в нормальных условиях дает примерно от 1 до 2 мл пива.
Это значит, что солод с концентрацией злакового
БПЛ 125 μг/мл может обеспечить получение пива с концентрацией злакового БПЛ до 125 μг/мл.
Стандартный способ затирания
ЕВС подробно описан в книге "АНАЛИТИКА-ЕБС", Четвертое
издание, 1987, стр. Е59, опубликованной издательством Брауерай унд Рундшау, СН-8047, Цюрих, Швейцария.
Напиток настоящего
изобретения содержит предпочтительно по меньшей мере 25
μг/мл злакового БПЛ, тогда как необязательная концентрация злакового БПЛ и особенно БПЛ семян злаков составляет 100 и больше μ
г/мл.
Злаковый БПЛ можно узнавать по его структуре
последовательности.
Концентрация злакового БПЛ может быть измерена путем применения твердофазного иммуноферментного анализа
(ELISA) для злакового БПЛ. Такой анализ для злакового БПЛ
(Cereal-LTP ELISA) отсутствует на рынке, но его можно получить, если использовать стандартные методики, содержащие стадии:
(а)
получение антител на злаковый БПЛ путем иммунизации животного,
получение сыворотки и очистку антител,
(б) биотинилирование антител, и
(в) построение стандартной кривой БПЛ при помощи
конкурирующей методики ELISA, включающей компонент, который
может быть измерен, например, при помощи спектрофотометра.
Способы ELISA как таковые обычно известны специалистам, в настоящее время они являются наиболее распространенными способами измерения биоактивных компонентов.
Общие сведения о способах ELISA можно найти в Ссылке 23.
Предпочтительно напиток согласно изобретению содержит также гордеин, глютелин, другие альбумины, такие как белок Z, получаемый из компонентов пива и/или хмеля, такие как изокислоты и другие горькие смолы хмеля. Эти компоненты оказывают стабилизирующее действие на пену и проявляют синергически пенообразующий эффект вместе со злаковым БПЛ.
Напиток может также включать в себя углевод, липиды и/или жирные кислоты. Эти компоненты улучшают вкус и "тело" напитка.
Некоторые из названных выше компонентов, например гордеин, хмель и липиды, могут соединяться с БПЛ, если их кипятить вместе. Свойства пенообразования злакового БПЛ, модифицированного при помощи кипячения вместе с компонентами хмеля и/или триглицеридом, улучшаются.
Напиток может также содержать другие компоненты в небольших количествах, такие как стабилизаторы (альгиновые кислоты, альгинат, каррагинан, глицериды, аравийскую камедь, пектин), синтетические подслащивающие вещества, ароматизирующие вещества, красящие вещества, витамины, минералы, консерванты, вещества, вызывающие выделение пузырьков газа, антиокислители и ферменты, особенно ферменты, расщепляющие белок, и ферменты, расщепляющие углеводы.
В том случае, когда напиток по изобретению представляет собой пиво, содержание злакового БПЛ предпочтительно превышает 5 мас.%, конкретно больше 10 мас.% и предпочтительно больше 15 мас.% от общего содержания белка. Массу модифицированного злакового БПЛ рассчитывают как массу соответствующего количества немодифицированного злакового БПЛ, то есть массу других компонентов, связанных со злаковым БПЛ, не включают.
Настоящее изобретение также включает способ приготовления напитка, содержащего белок и/или пептид. Этот способ характеризуется признаком пункта 11.
Злаковый БПЛ может добавляться в любом виде, при условии, что он по крайней мере частично растворим.
На практике он может быть добавлен в виде размолотого или измельченного злакового материала или же в виде экстракта из злаковых материалов.
Такой экстракт можно получить любым способом, например путем кипячения и/или растирания злаков или злакового материала в жидкости и, при желании, очищения при помощи фильтрации и необязательного фракционирования фильтрата. Жидкость может предпочтительно также включать в себя хмель и/или липиды, особенно триглицериды. Экстракт можно также высушить, например, при помощи лиофилизации или сушки распылением.
Злаковый БПЛ может быть, например, получен в видоизмененной форме из пива, как это описано в последующих примерах.
Злаковый БПЛ может быть также получен из микроорганизма, например из дрожжей, грибков или бактерий, содержащих ДНК-последовательность, кодирующую злаковый БПЛ в геноме. Поскольку число ДНК-последовательностей, кодирующих злаковый БПЛ, известно, специалист в этой области будет в состоянии включить такую ДНК-последовательность в геном бактерий, дрожжей или грибков, используя известные способы. Дрожжи могут представлять собой, например, Saccharomyces carlsberqensis или cerevisiae.
Злаковый БПЛ может быть продуцирован, например, микроорганизмом, продуцирующим злаковый БПЛ, в напитке на стадии ферментации.
Если напиток не ферментирован, злаковый БПЛ предпочтительно добавляется в форме очищенного растворимого экстракта.
Злаковый БПЛ может быть естественно введен в ферментированный напиток в виде очищенного растворимого экстракта, но поскольку производство ферментированных напитков в нормальных условиях включает в себя стадию фильтрации, необходимости в очищении экстракта злакового БПЛ может и не быть.
Злаковый БПЛ может вводиться на любой стадии производства, сразу весь целиком или небольшими порциями, непрерывно или периодически.
В тех случаях, когда напитком является пиво, злаковый БПЛ можно добавлять, например, на стадии приготовления солода или экстракта солода, путем приготовления солода из злаковых зерен, которые рафинируют, для получения высокого содержания БПЛ, например, путем использования генетического переноса.
Злаковый БПЛ можно также добавлять во время приготовления сусла, например, в виде размолотого или измельченного злакового материала, особенно в виде измельченных зерен, которые добавляют перед стадией затирания.
Настоящее изобретение также включает использование злакового БПЛ в качестве пенообразующей добавки к напитку. Такое использование заявлено в пунктах 21 - 23.
Когда злаковый БПЛ используют согласно настоящему изобретению, он предпочтителен в сочетании с другими компонентами, включая белки, но предпочтительно, чтобы злаковый БПЛ составлял не менее 15%, более предпочтительно 25 мас. % от общего содержания белка. Массу модифицированного злакового БПЛ рассчитывают как массу соответствующего количества немодифицированного злакового БПЛ, то есть масса других компонентов, связанных со злаковым БПЛ, не включается.
Краткое описание чертежей
В дальнейшем изобретение
будет описано в виде следующих ниже примеров.
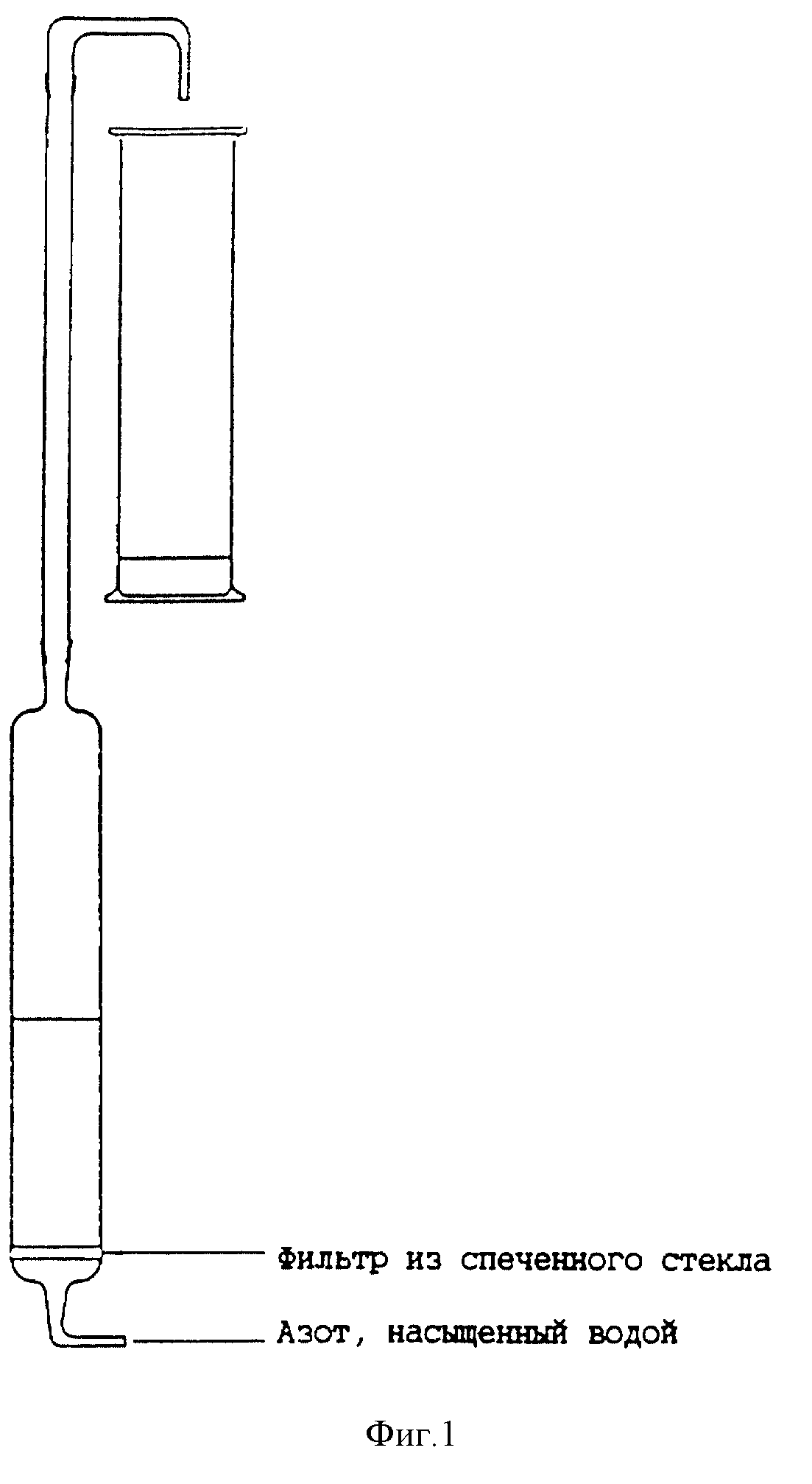
Фиг. 1. Пенная колонка на 1,65 л пива, изготовленная из боросиликатного стекла.
Фиг. 2. График гель-фильтрации осевшей пены после третьей флотации легкого пива на Сефадексе G-75 (5 см х 87 см, 1700 мл), уравновешенном 50 мМ ацетата аммония, pH 4,5.
Фиг. 3. График зависимости потенциала пены от концентрации низкомолекулярных (LMW) компонентов в образцах для испытания пены.
Фиг. 4. График зависимости периода полуоседания пены от концентрации высокомолекулярных (HMW) компонентов воде, содержащей 0,3 мг/мл низкомолекулярных компонентов (LMW).
Фиг. 5. (А) Электрофорез высокомолекулярных компонентов, низкомолекулярных компонентов и ячменного БПЛ1 в SDS (додецилсульфат натрия)-полиакриламидном геле. (20% однородного геля. Фаст-система. Окрашивание Кумасси Блю R 350). Метчики молекулярной массы M1 и M2.
(Б) Вестерн-блоттинг HMW, LMW и яичного БПЛ1 с использованием специфических антител на ячменный БПЛ1.
Фиг. 6. График ионнообменной хроматографии низкомолекулярных компонентов на C-Сефарозе Фаст Флоу (5х7 см, 135 мл), уравновешенной 20 мМ ацетата Na, pH 4,9, NaCl-графидиент---; оптическая плотность при 280 нм.
Фиг. 7. График потенциалов пенообразования, полученных анализами, выполненными с дистиллированной водой, содержащей увеличивающиеся концентрации Пула 1, Пула III или БПЛ1. Концентрация растворенного белка была рассчитана по данным анализов аминокислот.
Фиг. 8. График потенциалов пенообразования, полученных анализами, выполненными на пиве, содержащем увеличивающиеся концентрации Пула I, Пула III или БПЛ1. Концентрация растворенного белка была рассчитана по данным анализов аминокислот.
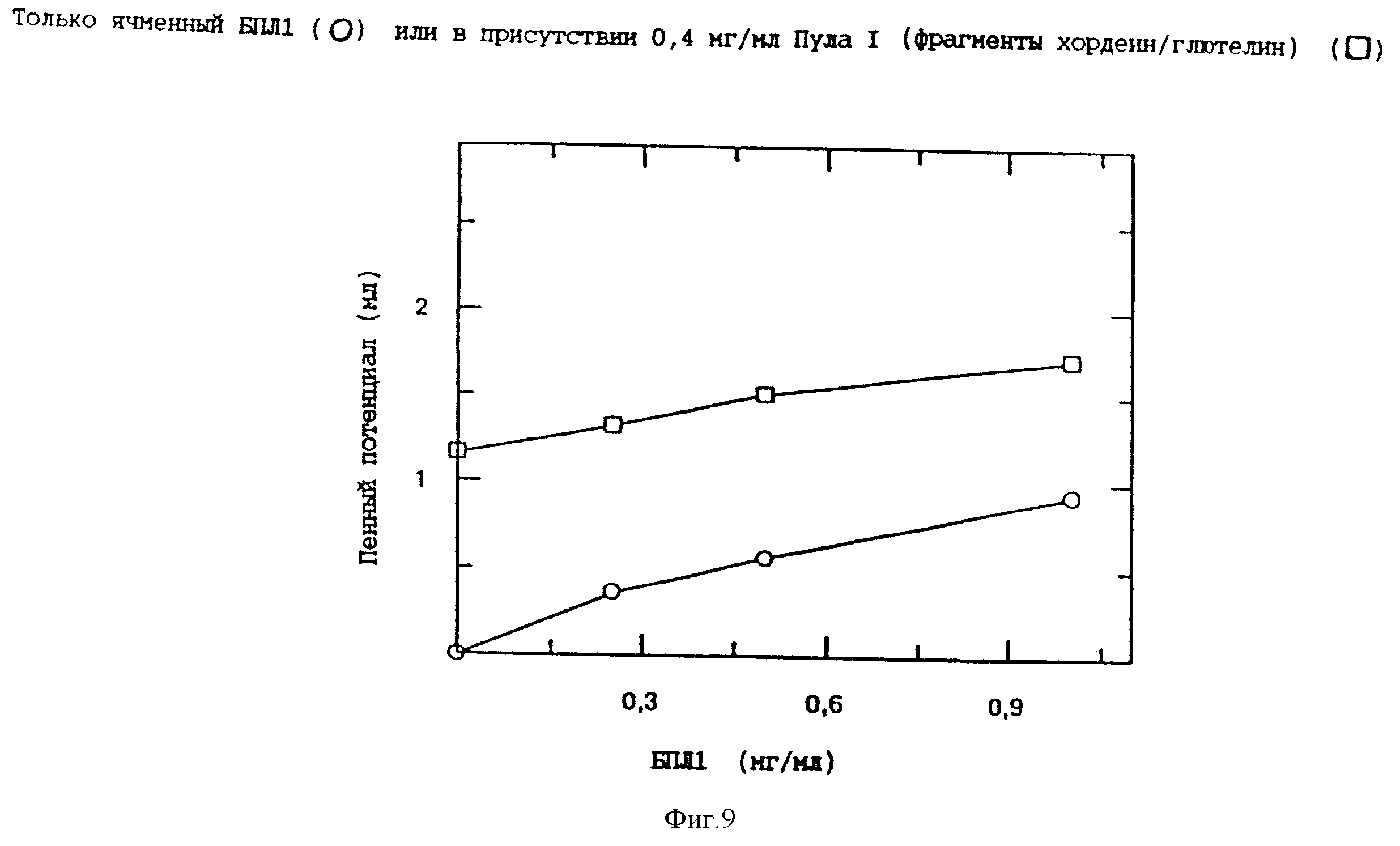
Фиг. 9. График потенциалов пенообразования, полученных анализами, выполненными на водных растворах, содержащих увеличивающиеся концентрации только ячменного БПЛ1 или в присутствии 0,4 мг/мл из Пула I. Концентрация растворенного белка была рассчитана по данным анализов аминокислот.
Фиг. 10. График потенциалов пенообразования, полученных анализами, выполненными с водными растворами, содержащими увеличивающиеся концентрации только Пула III или Пула III в присутствии 0,4 мг/мл Пула I. Концентрация растворенного белка была рассчитана по данным анализов аминокислот.
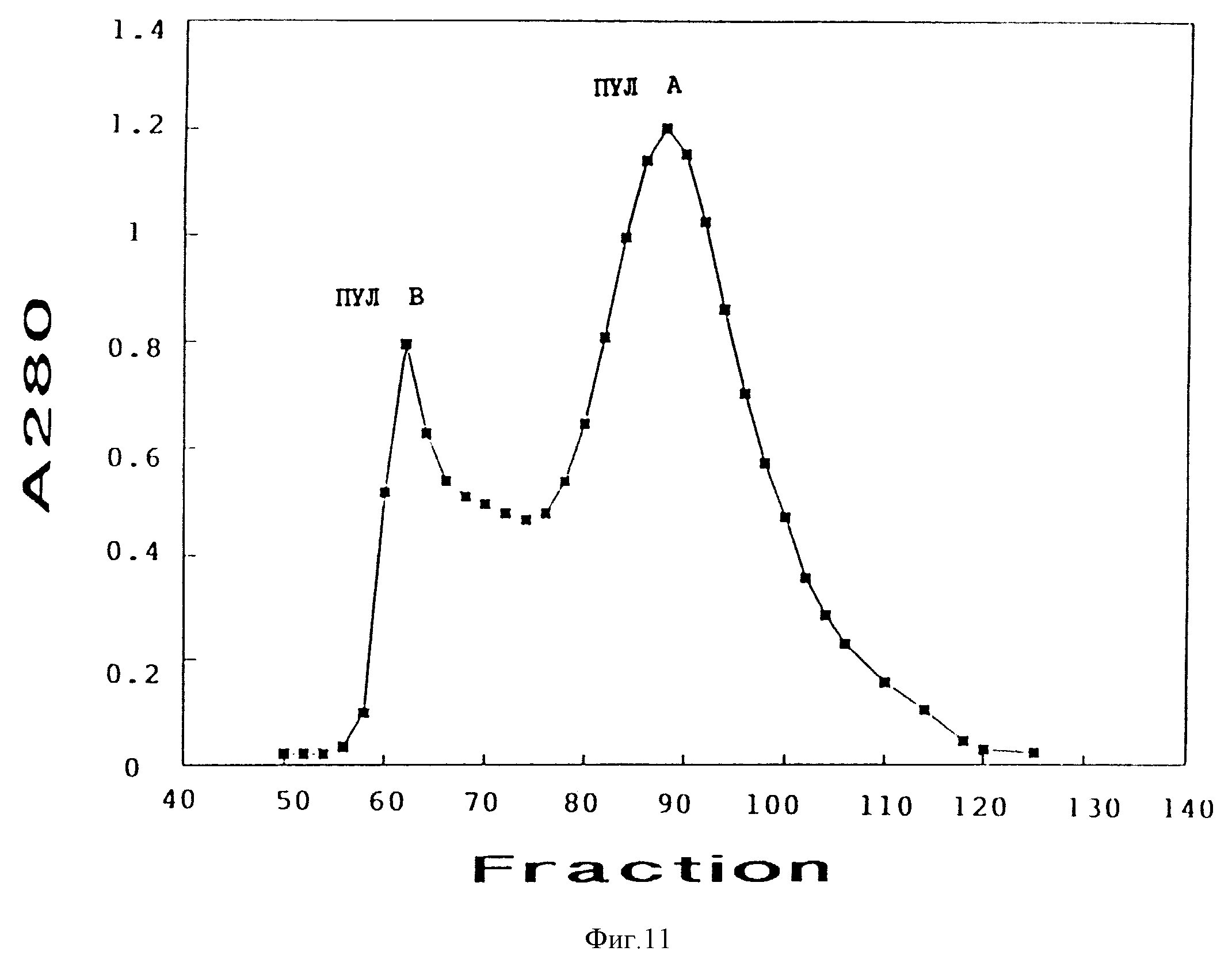
Фиг. 11. График гель-фильтрации Пула III, выделенного после третьей флотации легкого пива на Сефадексе G-50, уравновешенном 20 мМ NaAc, 0,1 M NaCl, pH 4,9.
Фиг. 12А и 12Б показывают 'H NMR-спектры БПЛ1 семян ячменя и БПЛ1 пивной пены соответственно.
Изготовление солода
Солод, применяемый в следующих
примерах, был изготовлен в виде легкого солода (лагерный
солод).
Изготовление сусла конгресса с использованием стандартного метода затирки EBC
Размалывание
55 г
солода были измельчены путем размывания и 50 г муки были
помещены в стакан для затора.
Размалывание выполняли в дисковой мельнице Бюлер-Миаг, у которой зазор между дисками составляет 0, 2 мм.
Затирание
Затирочная
ванна была отрегулирована на температуру примерно в 45oC.
В стакан было влито 200 мг дистиллированной воды при температуре примерно в 46oC при одновременном помешивании стеклянной палочкой, избегая при этом комкования. Было обеспечено поддерживание температуры в заторе точно 45oC.
Стакан был немедленно установлен в затирочную баню и приведена в действие мешалка. Температуру 45oC сохраняли в заторе точно в течение 30 мин. После этого температуру в заторе повышали в течение 25 мин на 1oC в минуту.
При достижении температуры в 70oC дополнительно вливали 100 мл дистиллированной воды с температурой 70oC. Температуру 70oC поддерживали в течение 1 часа. Затор охлаждали до комнатной температуры в течение 10-15 мин. Мешалку промывали небольшим количеством дистиллированной воды, с наружной стороны стакан высушили и путем добавления дистиллированной воды массу содержимого стакана доводили до 450,0 г.
Фильтрация
Содержимое стакана было тщательно размешено
стеклянной палочкой и немедленно и полностью вылито на бумажный
фильтр.
Первые 100 мл фильтрата были возвращены в воронку.
Фильтрацию прекращали, когда фильтровальная лепешка оказывалась сухой, или в том случае, когда после 2 часов процесс фильтрации становился медленным.
Аналитические методики
Идентификация ячменного БПЛ1
(вестерн-блоттинг)
Электрофорез в SDS-полиакриламидном геле был выполнен
после кипячения в течение 15 мин с 10 мМ дитиотреитом с использованием системы Фармация Фаст-Систем и 20% однородных
гелей. Затем выполнялось блоттирование на нитроцеллюлозе в аппарате Фаст-Систем
при 70oC в течение 30 мин. После промывания водой нитроцеллюлозу инкубировли с телячьей сывороткой для
бокирования неспецифического связывания и затем термостатировали в течение ночи со
специфическими антителами на БПЛ1 (приготовленными так, как это описано в примере 8). После этого применяли систему
АР вестерн-блоттинга Promega (Каталог N W3930) для обнаружения связывания
специфических антител. Использовали смесь нитро блю тетразолий и 5-бромо-4-хлоро-3-индолил фосфата в качестве цвет
проявляющего субстрата для щелочной фосфатазы.
(Определение
N-концевой аминокислотной последовательности)
Определение N-концевой аминокислотной последовательности выполняли
секвенатором в газовой фазе модели 470А Эпплайд Биосистемз, с использованием
программ, представленных компанией.
Аминокислотный состав определяли аминокислотным анализатором LKB model Alpha Plus после гидролиза в 6 M HCl при 110oC в течение 24 часов в трубках с откаченным воздухом (вакуумных).
Определение содержания углевода
Содержание углевода
определялось с использованием системы фенол/серная кислота (Ссылка 7).
Определение содержания белка
Содержание протеина (белка) определяли при помощи аминокислотных анализов
или метода связывания красителя Бредфорда (Ссылка 5).
Испытания пенообразования
Была применена оптоэлектрическая система испытания пены (Ссылки 8, 9) с использованием
цифрового анализа видеоизображения для измерения потенциала пены и периода
полуоседания пены в образце 10 мл. Потенциал пены (p) является количеством пены в мл, образуемой первоначально мл образца.
Временем полуоседания пены (F) является время, выраженное в секундах,
которое требуется колонке пены для того, чтобы осесть до половины первоначального объема. Содержание пены представляет собой
потенциал пены, умноженный на объем в мл. Фракции или пулы фракций,
полученные после хроматографии диализовали против дистиллированной воды при помощи диализных фильтров Spectra/por®
(отсечение 3500 Да) до проведения испытания пены или
лиофилизовали для удаления ацетата аммония. Испытания пены проводились в квадрупликатах.
Использовали анализатор стабильности пены пива системы Карлсберга (Ссылка 21) для испытания пены бутылочного пива, содержащего CO2. Период полуоседания пены, определенный по этому методу, составляет половину периода полуоседания пены с превращением в пиво (в секундах), после полного превращения 150 г пива в пену. Это оседание после первоначальной задержки в течение примерно 30 секунд является процессом первого порядка (Ссылка 22).
Пример 1
Выделение и очистка злакового БПЛ из семян ячменя (БПЛ1)
Методика (a)
Чистый ячменный БПЛ1 был выделен из 25 кг ячменной муки
(сорт Алексис, собран в Дании в 1992 г.) путем
экстрагирования при помощи 250 л воды при pH 6,5 в течение 2 часов. Смесь была оставлена на ночь при температуре 2oC для того, чтобы
нерастворимый материал мог выпасть в осадок.
Надосадочная жидкость была сконцентрирована при помощи ультрафильтрации до 7 л, и в нее был добавлен сульфат аммония до насыщения на 40%. Через 2-3 часа
при температуре в 2oC осадок был
удален центрифугированием, а в надосадочную жидкость был добавлен сульфат аммония до ее насыщения на 75%. После выдерживания в течение 16 часов при 2oC полученная суспензия была
центрифугирована для получения осадка, который может храниться при 2oC в течение нескольких недель. Четверть осадка была растворена в 500 мл воды, нагрета
до 100oC и немедленно
охлаждена на льду. Раствор был центрифугирован для удаления любого выпадающего в осадок вещества и диализирован в диализном фильтре Spectra/por®
(отсечение 3500 Да) против воды
После центрифугирования диализированный продукт, pH которого установили 7,0 при помощи добавления NaOH, был подвергнут ионообменной хроматографии на колонке с
CM-целлюлозой (5 см х 25 см, 500 мл),
уравновешенной 20 мМ фосфата Na, pH 7,0. Вестерн-блоттинг показал, что ячменный БПЛ1 элюируется при градиенте NaCl от 0 до 0,1 М. Фракции, содержащие БПЛ1, были
объединены, диализированы в фильтре
Спектра/пор® против воды и введены в колонку с C-Сефарозой Фаст Флоу (5 см х 15 см, 300 мл), уравновешенной 20 мМ Хепесе, pH 7,0. Ячменный БПЛ1
был элюирован при градиенте NaCl от
0 до 0,3 М NaCl в том же буферном растворе. Фракции, содержащие ячменный БПЛ1, обнаруженные вестерн-блоттингом, были сгруппированы диализированы против
дистиллированной воды в диализной мембране
Spectra/por® и лиофилизированы. N-концевое аминокислотное секвенирование, выявившее последовательность
Leu-Asn-*-Gly-Gin-Val-Asp-Ser-,
где звездочка обозначает
положение, соответствующее цистеину, обнаруженному в этом положении в БПЛ1, показало, что выделенный БПЛ1 является чистым.
Методика (б)
Аналогична методике (а), за
исключением того, что стадия нагревания была пропущена.
Никакие различия в способностях пенообразования или иммунореактивности не наблюдались у БПЛ, приготовленных согласно методикам (а) и (б).
Пример 2
Очистка БПЛ1 из пивной пены
Была изготовлена колонка для непрерывного
образования пены из боросиликатного стекла, как показано на фиг. 1. Пену
получали из 15 л (или из 1,65 л, но в этом случае все качества упоминаемых химических веществ были уменьшены на коэффициент 9)
легкого пива барботированием через него 450 мл/мин газообразного азота в
течение ночи. Азот был предварительно насыщен водяным паром перед впуском в колонку для пены. Пену, собранную на
выходе,
осаждали и разбавляли до первоначального объема пива при помощи
дистиллированной воды и вновь вводили в колонку. Вторая и третья флотации были выполнены, как это описано выше, и было найдено, что пена,
собранная при третьей флотации легкого пива, содержала 35%
общего содержания пены в первоначальном пиве.
Компоненты, имеющиеся в осевшей пене из последней флотации, разделяли по молекулярной массе при помощи гель-фильтрации на Сефадексе G-75 в колонке (5 см х 87 см, 1700 мл), уравновешенной 50 мМ ацетата аммония, pH 4,5. Гель-фильтрация осевшей пены из третьей флотации на Сефадексе G-75 привела к образованию трех пиков, поглощающих у 280 нм (фиг. 2). Два из пиков были названы HMW и LMW соответственно, как показано на фиг. 2. Высокомолекулярная фракция HMW состояла примерно на 90% из углерода и на 10% из белка, тогда как низкомолекулярная фракция LMW состояла на 90% из белка и на 10% из углевода. Было установлено, что третий пик содержит низкомолекулярные соединения, такие как аминокислоты, изогумулоны и углеводы.
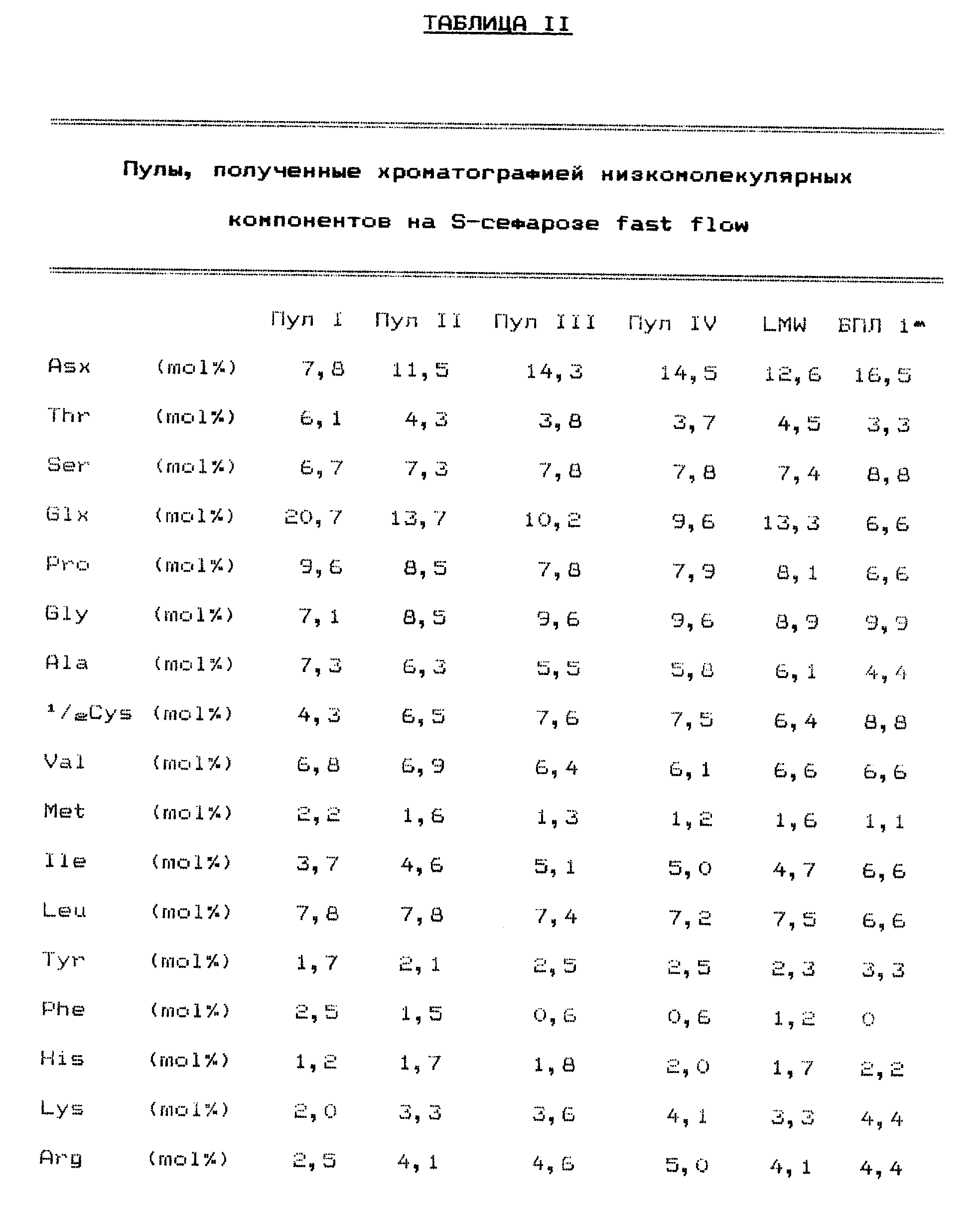
Аминокислотный состав низкомолекулярной фракции и сгруппированных фракций напоминали аминокислотный состав хорошо известного белка переноса липид ячменя (БПЛ1) (Ссылка 18) (табл. II). Электрофорез LMW в SDS-полиакриламидном геле выявил размытое пятно (путем окрашивания Кумасси Блю К 350) в районе молекулярных масс от 6000 до 18000 Да (фиг. 5). Однако вестерн-блоттинг с использованием специфических антител на ячменный БПЛ1 показал, что ячменный БПЛ1 (молекулярный вес в 9700 Да) является основным компонентом LMW (фиг. 5). Это было подтверждено N-концевым аминокислотным секвенированием.
Аминокислотный состав LMW показал слишком большие величины Pro и Glx при сравнении с составом ячменного БПЛ1 (Ссылка 18) (Табл. II) вероятно из за присутствия фрагментов гордеина и глютелина; пятно, найденное окрашиванием серебром после электрофореза в SDS-полиакриламидном геле, могло быть образовано такими фрагментами.
Низкомолекулярную фракцию пены лиофилизировали для удаления ацетат аммония. БПЛ1 очищали от низкомолекулярной фракции пены, полученной из 15 л легкого пива, при помощи ионоообменной хроматографии на S-Сефарозе Фаст Флоу (фиг. 6). Низкомолекулярную фракцию вводили в колонку (5 см х 7 см, 135 мл), уравновешенную 20 мМ ацетата Na, pH 4,9, и после промывки БПЛ1 был элюирован в виде широкого пика (Пулы II-IV, фиг. 6) путем применения линейного градиента NaCl (0-0,3 М) в том же буферном растворе. Проходящая (неотсорбированная) фракция и три пула фракций, содержащих БПЛ1, определенных вестерн-блоттингом, диализировали против дистиллированной воды в диализном фильтре Spectra/por® (отсечение 3500 Да) и лиофилизовали.
Ультрафильтр: DDS-GR81PP, Доу Фильтрейшн, Дания.
Spectra/por® : Спектрум Медикал Индастриз, Инк., США.
СМ-целлюлоза: Уотман Биосинтемз Лимитед, Швеция.
C-Сефароза Фаст Флору: Фармасиа, Швеция.
Сефадекс G-75; Фармасиа, Швеция.
Аминокислотные анализы после кислотного гидролиза (табл. II), проходящей фракции и трех пулов, содержащих широкий пик, выявили, что проходящие фракции имели аминокислотные составы, напоминающие гордеины и глютелины, имеющие высокое содержание Glx и Pro, тогда как широкий пик, элюированный при применении градиента NaCl, был оценен как довольно чистый БПЛ1, исходя из аминокислотных анализов (табл. II) и N-концевого аминокислотного секвенирования, хотя электрофорез в SDS-полиакриламидном геле все еще выявлял следы окрашиваемых Кумасси соединений, имеющих молекулярные массы в диапазоне 6000-18000 Да, в трех пулах, содержащих широкий элюатный пик. Как проходящая фракция (Пул I), содержащая гордеин/глютелин, так и фракции БПЛ1 (Пулы II-IV) образуют пену с хорошим потенциалом в воде (табл. II), но период полуоседания пены у фракции БПЛ1 был довольно низким в отличие от фракции гордеин/глютелин, обеспечивающей высокие значения периода полуоседания пены (табл. II). Расчет содержания пены в четырех пулах показал, что 95% пены, обнаруженной в низкомолекулярных компонентах, находилось в четырех пулах (табл. II).
Пример 2A
Фракционирование Пула III
Пул III, полученный из легкого пива, как это описано в
примере 2, был разделен на фракции по молекулярной массе при помощи гель-фильтрации на Сефадексе G-50 в колонке (2,6 см х 67 см, 330 мл), уравновешенной 20 мМ NaAc, 0,1 M NaCl, pH 4,9. Это разделение
привело к образованию двух пиков, поглощающих при 280 нм, пула A и пула B (фиг.11). SDS-PAGE в невосстанавливающих условиях и вестерн-блоттинг с использованием специфических антител на ячменный БПЛ1,
выявили, что пул A состоял в основном из димерных форм БПЛ, но были также найдены более многомерные формы. В противоположность этому в пуле B были найдены только мономерные БПЛ1.
Пример 2B
Были зарегистрированы 'H ЯМР-спектры БПЛ1, полученного из ячменя (Пример 1в), и БПЛ1, полученного из пивной пены, соответственно. Спектры регистрировали при 310 K (37oC)
и pH 4,0.
Полученные спектры показаны на фиг. 12А и 12В.
На фиг. 12А показан1H ЯМР-спектр БПЛ1 семян ячменя, который типичен для глобулярного белка, где большую часть вторичной структуры составляет α -спираль.
Это показано в большом ядре Hα, имеющем химический сдвиг ниже 4,8 млн.д. Кроме того, рассеивание ЯМР-сигналов является явным указанием на то, что значительная часть белка сложена и что он имеет хорошо определенную вторичную структуру.
Детальный анализ спектров корреляционной спектроскопии (CDSY), общей корреляционной спектроскопии (TOCSY) и ядерной спектроскопии Оверхаузера (NOESY) подтвердил, что БПЛ1 семян ячменя является глобулярным белком с хорошо определенной структурой.
Спектр (фиг. 12B) БПЛ пивной пены типичен для белков, которые в значительной степени или частично развернуты, т.е. практически не имеется вторичных и третичных структур. Мы можем прийти к заключению, что БПЛ1, выделенный из пива, в большей или меньшей степени денатурирован.
Пример 3
Очистка БПЛ1 из первого сусла
Первое сусло было
получено во время производства легкого пива на пивзаводе Карлсберга. Сусло было центрифугировано в центрифуге Сорвалл RC3 в течение 30 мин при скорости 4000 об/мин для того, чтобы удалить
нерастворимый материал. Был добавлен сульфат аммония до конечной концентрации 85% и через 16 ч при 4oC полученная суспензия была центрифугирована в течение 30 мин при 4000 об/мин. Осадок
был растворен в 300 мл воды и 2 х 60 мл были подвергнуты гель-фильтрации с использованием Сефадекс G-75 в колонке (5 см х 87 см, 1700 мл), уравновешенной 50 мМ ацетат аммония, pH 4,5. Картина
элюирования была аналогична тому, которая была получена после гель-фильтрации осевшей пены (фиг.2). Объединенные низкомолекулярные фракции были леофилизованы (для удаления ацетата аммония),
растворены
в воде, диализованы и подвергнуты ионообменной хроматографии на S-Сефарозе Фаст Флоу (5 х 7 см), уравновешенной 20 мМ ацетата Na, pH 4,9. БПЛ1 был элюирован путем линейного градиента NaCl
(0-0,3 М) в
том же буферном растворе. Профиль элюирования был аналогичен тому, который показан на фиг. 6 для разделения на фракции низкомолекулярной фракции, выделенной из пены. Фракции, составляющие
Пул III,
были сгруппированы и диализованы против дистиллированной воды в диализном фильтре Spectra/por® (отсечение 3500 Да) и лиофилизированы. Концентрация БПЛ1 (модифицированного
и
немодифицированного) была определена аминокислотным анализом.
Пример 4
Низкомолекулярные и высокомолекулярные фракции, полученные из легкого пива, как описано в примере 2,
были испытаны на их способность образовывать пену в воде. Результаты приведены в табл. III.
Этот результат показал, что концентрация фракции низкомолекулярных компонентов имеет большее влияние на потенциал пены независимо от концентрации высокомолекулярных компонентов. Этот факт далее показан на фиг. 3 и 4 с использованием величины, данных в табл. III.
Пример 5
БПЛ1 был выделен из пяти различных сортов пива легкого типа, которые имели различные потенциалы пенообразования. БПЛ был получен из 1,65 л пива в основном таким же способом, который
был описан в примере 2, только в этом случае вместо S-Сефарозы Фаст Флоу использовали оборудование Mono S.
Легкое пиво было сварено из различных, указанных ниже, сортов ячменя:
А: Бленхайм,
Б: Карузо,
В: Грит,
Г: Эминант,
Смесь: смесь из неизвестных сортов ячменя.
Результаты показаны в табл. IV.
Пример 6
Испытания пены были проведены на БПЛ1, выделенном из ячменной муки так, как это описано в примере 1, методика (б), и на Пуле I и на Пуле III, полученном из легкого пива так, как
описано в примере 2.
Использовали в качестве воды дистиллированную воду.
Использовали пиво, которое было легким пивом Карлсбергера.
Во время каждого испытания применяли 10 мл воды или пива, и немедленно добавляли пулы или БПЛ прежде, чем происходило образование пены, как это описывалось раньше.
Когда в воде или пиве растворяли повышенные концентрации выделенного БПЛ1, Пула I или Пула III соответственно, растворы показывали увеличение потенциала пены в ходе испытаний на пену (фиг. 7 и 8), хотя увеличения в потенциале пены были менее заметными у растворов пива (фиг. 8), чем у водных растворов (фиг. 7), возможно благодаря уже имеющимся положительным компонентам пены в пиве. При низкой концентрации белка эффект добавления пивной фракции БПЛ1 (Пул III) был большим, чем у фракции, содержащей фрагменты гордеина/глютелина (Пул I). Добавление БПЛ1, выделенного из ячменной муки, в пиво приводило к небольшому повышению как потенциала пены (фиг.8), так и периода полуразрушения пены. Более того, влияние увеличения концентрации БПЛ1 на потенциал пены (пример 5) гораздо лучше выражен у БПЛ1, выделенного из пива (Пул III), чем у БПЛ1, который был выделен из ячменя (фиг.8). Рекомбинированные эксперименты, то есть испытания пены, выполненные с растворами 0,4 мг/мл Пула I в дистиллированной воде с повышающейся концентрацией БПЛ1, выделенного из ячменя или из пива (Пул III), подтверждают это наблюдение (фиг. 9 и 10). Влияние ячменного БПЛ1 на потенциал пены в присутствии Пула I оказывалось меньшим, чем влияние аналогичной концентрации Пула III.
Пример 7
Анализ ELISA (для определения концентрации БПЛ1)
Получение на ячменный БПЛ1
Двух кроликов
иммунизировали
100 μг ячменного БПЛ1 (полученного из ячменной муки сорта Алексис, как это было описано в примере 1, методика (а), при каждой иммунизации, согласно стандартной иммунизационной
схеме, которая
применяется в Дако, Глоструп, Дания.
От каждого животного было получено 20 мл сыворотки через 54 дня после первой инъекции и затем с интервалами в один месяц.
Сыворотку, полученную при первом взятии крови животного, использовали в течение всех экспериментов, которые описаны ниже.
Очистка антител
Антитела класса
иммуноглобулина G
(IgG) были очищены от других сывороточных компонентов при помощи афинной хроматографии на белок A-сефарозе (Pharmacia, Uppsala, Sweden) в соответствии с инструкцией изготовителя. Z
антитела,
распознающие БПЛ1, отделяли от антител с другой специфичностью афинной хроматографией на небольшой колонке, полученной путем ковалентного присоединения БПЛ1 из ячменя к Сефарозе. 64 мг
ячменного БПЛ1
растворяли в 10 мл 0,1 М NaHCO3, 0,5 М NaCl при pH 8,3 и соединяли с 2 г активированной CNBr Сефарозы 4B (Фармасиа, Швеция) согласно инструкциям изготовителя. Затем в
небольшую колонну
помещали 1 мл этого иммуноадсорбента и уравновешивали его 10 мМ фосфорнокислого натрия, 150 мМ NaCl фосфорнокислого натрия, pH 7,3 (PBS10). Фракция IgG, которого очищали
при помощи
хроматографии на конъюгате белок A-Сефароза, вносили в колонку, которая была покрыта уравновешивающим буферным раствором до тех пор, пока A280 не стал 0,002. Связанный IgG
элюировали при
помощи 0,5 М муравьиной кислоты, pH 2,0, разбавляли 4 объемами 10 х PBS10, и pH при помощи NaOH устанавливали 4,0. Наконец, образец был диализован против PBS10 в
фильтре
Spectra/por® (отсечение 3500 Да) и биотинилирован, как это описано ниже.
Биотинилирование антител
10 мг антител в 1 мл PBS10 были
смешаны с 0,1
мл 1 М буферного раствора углекислого натрия с pH 9,5. Затем антитела биотинилировали путем добавления 57 μл 0,1 М BXNHS (биотинамодокапроатный эфир N-гидроксисукцинилида от
Сигмы, США,
Каталожный номер N 2643) в DMSO (диметилсульфоксид). Смесь выдерживали в течение 1 часа при комнатной температуре. После этого непрореагировавший BXNHS удаляли и буферный раствор заменяли
на PBS10 путем гель-фильтрации, выполненной согласно инструкции производителя на небольшой одноразовой колонке с Сефрадексом G-25 (PD-10, Фармасиа, Уппсапа, Швеция), уравновешенной PBS10.
Концентрацию антител в реагенте устанавливали 1 мг/мл путем добавления PBS10 до общего объема в 10 мл. После добавления 100 мг BSA (альбумин бычьей сыворотки), реагент был
оставлен на
хранение в аликвотах при температуре в -20oC.
Твердофазный иммуноферментный анализ (ELISA) БПЛ
БПЛ определяли при помощи конкурирующей методики
ELISA.
Первоначально очищенный ячменный БПЛ абсорбировали на внутренней поверхности лунок из полистирола. Лунки были расположены по 12 штук на полосках и полоски были помещены в рамки, в каждой из них было по 8 полосок (Нанк Иммуно Модуле C12 Максисорб от Нанка, Дания). 200 μл раствора, разбавленного БПЛ1, полученного как описано в примере 1, методика (a) (100 нг/мл PBS10), добавляли в каждую лунку и инкубировали при температуре 4oC в течение 16-20 часов. После этого инкубирования оставшиеся сайты связывания на поверхности полистирола блокировали путем инкубирования 225 μл BSA/PBST (1 мг BSA/мл PBST, где PBST является PBS10 c добавлением 0,05% Твина 20) в каждую лунку при 37oC в течение 1 часа. Затем лунки опорожняли и шесть раз промывали PBST при помощи ручного моющего устройства, соответствующего полоскам полистирола (Нанк Иммуно Уош 12 от Нанка, Дания), и хранили при температуре -20oC до использования.
Перед анализом образцы, содержащие БПЛ1, разбавляли соответствующим образом при помощи DSA/PBST, и стандартные растворы БПЛ1, полученные, как описано в примере 1, методика (a), приготовляли в том же буферном растворе. Биотинилированные антитела, распознающие ячменный БПЛ1, добавляли до конечной концентрации 100 нг/мл. 200 μг аликвотных смесей затем инкубировали в лунках в течение одного часа при температуре 37oC. Каждый образец или стандарт анализировали трижды. После инкубирования лунки опорожняли и промывали, как было описано раньше.
На следующем этапе 200 μл аликвоты конъюгата стрептавидина и пероксидазы хрена (Сигма, США, Каталожный N S 5512), разбавленные до 250 нг/мл в BSA/PBST, инкубировали в лунках в течение 10 мин при температуре 20-22oC. После этого лунки вновь опорожняли и промывали.
Наконец, 200 μл раствора субстрата, содержащего 3,3',5, 5'-тетраметилбензидин (TMB, 100 μг/мл) и 0,015% H2O2 в буфере цитрата и фосфата, pH 5,0, добавляли в каждую лунку и инкубировали в течение 10 мин при температуре 20-22oC. Ферментативную реакцию затем прекращали путем добавления 125 μл 4 N HCl в каждую лунку и оптическую плотность лунок у 450 нм измеряли спектрофотометром, соответствующим рамкам, включающими по 96 лунок (Перкин-Елмер Ламбда Ридер).
Каждая из серии анализов включала стандарты в диапазоне 8000-62,5 нг ячменного БПЛ1/мл. Стандартную кривую строили путем нанесения оптической плотности в зависимости от log концентрации БПЛ1, и все концентрации БПЛ1 в образцах рассчитывали относительно данной кривой.
Специфичность антител
Антитела,
полученные на ячменный БПЛ1 и очищенные по афинности, как описано ранее, применяли в вестерн-блоттинге на реакцию с ячменными и солодовыми экстрактами, суслом и пивом. Не наблюдались
никакие реакции с
другими компонентами, кроме как с БПЛ1 или с модифицированным БПЛ1.
При анализе методом ELISA антитела распознавали БПЛ1 из первого сусла и пены, но в меньшей степени, чем БПЛ1 из ячменя. Более низкая реакционная способность обусловлена модификациями, которые происходили в процессе затирания, кипячения сусла, ферментации и пенообразующих процессов. При сравнении с концентрациями, определенными аминокислотными анализами (пример 3), реакция с БПЛ1 или с модифицированным БПЛ1 из первого сусла составляла примерно 65% реакции с БПЛ1, полученным из ячменной муки, как описано в примере 1, методика (a). Реакция с БПЛ1 или с модифицированным БПЛ1 из сусла конгресса, как было определено, составляла примерно 90% реакции с БПЛ1, полученным из ячменной муки. Поскольку стандартная кривая была построена на основе ячменного БПЛ (полученного, как это описано в примере 1, методика (a), фактическое количество БПЛ1 или модифицированного БПЛ1 в сусле конгресса можно определить путем умножения величины, полученной по стандартной кривой ячменной БПЛ1, на коэффициент 10/9.
Пример 8
Добавление БПЛ во время
приготовления сусла.
Для изучения влияния добавления БПЛ на этапе сусловарения была установлена модельная система. Сладкое сусло варили в круглодонном сосуде, соединенном с обратным
холодильником, в течение 90
минут, используя согревающий кожух. Проводили два типа экспериментов:
(а) чистый ячменный БПЛ1 из сорта Алексис (Дания, 1992 г.), полученный, как это описано в
примере 1, методика (a) (0,5
мг/мл), и/или экстракт хмеля (61 мг α-кислоты/л) добавляли в начале процесса варки, и
(б) чистый ячменный БПЛ1 добавляли в сусло (сваренное или
несваренное, с добавлением или без
добавления экстракта хмеля (61 мг α-кислоты/л)), но не подвергали варке.
Пример 9
Пиво с высокой концентрацией БПЛ1 изготовляли на
пивоваренном заводе в Карлсберге на
50-литровой пилотной установке с использованием 60% легкого солода и 40% добавок (кукурузной крупы). Кукурузная крупа соответствовала спецификациям Карлсбергского
пивоваренного завода, т. е. имела
следующий состав:
вода, % - <12,5
экстракт, сухой вес, % p - >89
жир, сухой вес, % - <1,0
сортировка на сите
Пфургштедтера
>2
мм - 0%
>1,27 мм - 3,5%
< 0,25 мм - 5,05%
Метод пивоваренного цеха предусматривал декоктовое растирание и варку солода в
течение 90 мин с выпариванием 10%.
Через 15 мин после начала варки солода в чан сусла добавляли неочищенный препарат БПЛ1. Этот препарат экстрагировали из 6 х 25 кг ячменной муки сорта Алексис,
урожая Дании 1992 г. , концентрировали
при помощи ультрафильтрования и осаждали при помощи сернокислого аммония, как это было описано ранее. Осадок растворяли в 5 л H2O, диафильтровали до
850 мл, нагревали до 100oC и
немедленно охлаждали на льду. Раствор центрифугировали в центрифуге Сорвалл RC3 в течение 30 мин и при 4000 об/мин. Концентрация БПЛ1 в надосадочной жидкости,
как было определено при помощи анализа по
методике ELISA, составила 60 мг/мл, и в чан сусла было добавлено 800 мл. Конечное сусло имело 14,8% Плато. Сваренный продукт ферментировали Карлсбергскими
дрожжами (Saccharomyces carlsbergensis) в
цилиндрических конических чанах. Первоначальную ферментацию проводили в течение 9 суток, созревание и стабилизация продолжались 10 дней. Наконец, пиво
фильтровали и доваривали 10,6% Плато.
Способность образовывать пену данного сваренного напитка и напитка, изготовленного из тех же сырьевых материалов при аналогичных условиях, но без добавления БПЛ1, измеряли с применением анализатора стабильности пены системы Карлсберга. Время полуразрушения (полуоседания) пены пива с высоким БПЛ 1 было увеличено до 113 сек по сравнению с 93 сек для пива без добавления БПЛ1.
Пример 10
Содержание БПЛ1 (сумма модифицированного и немодифицированного БПЛ1) в сусле конгресса
Солод был приготовлен из ряда сортов
ячменя, обычно применяемых для
пивоварения. Сорта ячменя были выращены в различных районах и урожай был убран в разные годы.
Солод был приготовлен для производства легкого пива.
Сусло конгресса было изготовлено из образцов солода с использованием стандартного способа затирания EBC, как это было описано ранее.
Содержание БПЛ1 (сумма модифицированного и немодифицированного БПЛ1) в образцах сусла конгресса было установлено при помощи метода ELISA, который был описан ранее. Общее число анализированных проб сусла составило 82, соответствующих 41 образцу солода.
Метод ELISA применяли так, как это описано в примере 7, и концентрацию БПЛ1 определяли с использованием стандартной кривой как эквивалентной ячменному БПЛ1, то есть без умножения на корректирующий коэффициент.
Результаты представлены в табл. VI. Каждая величина представляет среднее значение для двух отдельных сусел конгресса.
Пример 11
Выделение и очистка злакового БПЛ из пшеничной муки
Чистый пшеничный БПЛ1 выделяли из 30 кг пшеничной муки при помощи экстракции 270 л воды при
pH 7,8 в течение 4 ч. Смесь выдерживали ночью
при температуре в 4oC для того, чтобы нерастворимый материал выпал в осадок. 195 л надосадочной жидкости концентрировали при помощи
ультрафильтрации до 6,9 л и оставшуюся муку удаляли при
помощи центрифугирования. Добавляли сульфат аммония до 80%-ного насыщения и через 16 часов при температуре 4oC полученную суспензию
центрифугировали. Одну четверть выпавшего осадка t
растворяли в 400 мл воды и диализовали в диализном фильтре Spectra/por® (отсечение 3500 Да) против воды. Диализат (1 л)
центрифугировали, устанавливали pH 6,5 и подвергали
ионообменной хроматографии, используя колонку S-Сефарозы Фаст Флоу (5 см х 15 см, 300 мл), уравновешенной 20 мМ Mes при pH 6,5. Пшеничный БПЛ1
элюировали путем применения в том же буферном растворе
градиента NaCl (от 0 до 0,1 М). Фракции, содержащие компонент с 10 кДа, идентифицировали при помощи SDS-PAGE с использованием Фаст системы от
Фармасиа, группировали и концентрировали в вакууме при
35oC при помощи роторного испарителя. Компоненты в концентрированном образце разделяли при помощи гель-фильтрации на Сефадексе G-50 в
колонне (2,5 см х 67 см, 330 л), уравновешенной 20 мМ
NaCl при pH 4,9. Пик, содержащий белок с 10 кДа, идентифицировали при помощи SDS-PAGE и N-концевого аминокислотного секвенирования, установив
последовательность Ilt-Asp-*-Gly-His-Val-Asp-Ser-Leu-Val-,
где звездочка обозначает положение, соответствующее Cys, найденному в этом положении в ячменном БПЛ1, подтверждающую, что этот компонент
является чистым ячменным БПЛ1. Препарат был диализован в
диализном фильтре Spectra/por® (отсечение 3500 Да) и лиофилизирован.
Пример 12
Добавление
пшеничного БПЛ1 во время приготовления сусла
Было
проведено исследование влияния добавления пшеничного БПЛ1 во время этапа варки сусла при использовании модели системы, описанной в примере
8. Чистый пшеничный БПЛ (полученный, как было описано в
примере 11) (0,5 мг/мл) и/или экстракт хмеля (61 мг α-кислоты) добавляли в начале процесса варки. Полученные потенциалы пены
представлены в табл. VII.
Пример 13
Влияние варки на пенообразующий потенциал ячменного или пшеничного БПЛ1
Ячменный или пшеничный БПЛ1 (0,5 мг/мл), полученный, как
это описано в примерах 1(б) и 11 соответственно, растворяли в
20 мМ Mes (2-(N-формалино)-этансульфокислота), pH 3,5. Добавляли 2% этилового спирта (вместе или без 2,5 мг//мл трилинолеина) при
обработке ультразвуком. Экстракт хмеля добавляли до достижения
окончательной концентрации 61 мг α-кислоты/л, как указано в табл. VIII, и смесь варили в течение 90 минут, как было описано в
примере 8. Замеры пены делали после добавления высокомолекулярной
фракции (2,5 г/мл), полученной, как было описано в примере 2.
Ссылки
Литература
1. Андерсон Ф.Б. и
Харрис Г. Азотные составляющие элементы пивоваренных материалов.
XII. Вещества, стабилизирующие пену в пиве. Дж. Инст. Брю. 69: 383-388 (1963 г.).
2. Асано К. и Хашимото Н. Выделение и характеризация пенообразующих белков пива. Дж. Ам. Сос. Брю. Чем. 38:129-137 (1980 г.).
3. Бернхард У.Р. и Соммервилл С.Р. Общая идентичность мнимых амилазных замедлителей из ячменя и пальчатого проса с белками, передающими фосфолипиды, выведенными из аминокислотной последовательной гомологии. Арч. Биочем. Биофиз. 269:695-697 (1989 г.).
4. Бишоп Л.Р. Вещества, образующие дымку и пену в пиве. Дж. Инст. Брю. 81:440-449 (1975 г.).
5. Бредфорд М.М. Быстрый и чувствительный способ для определения количества микрограммных количеств белка, использующего принцип связывания белковых красителей. Анал. Биочем. 72:248-254 (1976 г.).
6. Дейл С.Дж. и Янг Т.У. Низкомолекулярные азотные компоненты и их влияние на стабильность пивной пены. Дж. Инст. Брю. 98:123-127 (1976 г.).
7. Дюбуа М., Джиллес К.А., Гамильтон Дж.К., Реберс Р.А. и Смит Ф. Цветометрический способ для определения сахаров и связанных с ними веществ. Анал. Чем. 28, 350-356 (1956 г.).
8. Хаугстед С. и Эрдал К. Поиски головы. Прок. Юр. Брю. Конв., 23-й Конгресс, Лиссабон, 1991, стр. 449-456.
9. Хаугстед С., Педерсен М.Б. и Эрдал К. Оптоэлектрическая система испытания пены. Монатшр. Браувиззеншафт 43:336-339 (1990 г.).
10. Хейгаард Дж. и Соренсен С.Б. Характеризация богатой белком фракции пива при помощи двухмерной иммуноэлектрофоретической техники. Компт. Ренд. Трэв. Лаб. Карлсберг 40:187-203 (1975 г.).
11. Холлеманз М. и Тониз А.К.Дж.М. Роль специфических белков в пивной пене. Прок. Юр. Брю. Конв. 22-й Конгресс, Цюрих, 1989, стр. 561-568.
12. Мохан С.Б., Смит Л., Кемп У. и Лиддиатт А. Иммунохимический анализ пивной пены. Дж. Инст. Брю. 98:187-192 (1992 г.).
13. Молина А. , Сегура А. и Гарсиа-Олмедо Ф. Белки, передающие липиды (nsLTPs) из ячменного и маисового листа, являются мощными замедлителями бактериальных и грибковых растительных болезнетворных организмов. Письма FEBS. 316:119-122 (1993 г.).
14. Манди Дж. и Роджерс Дж.С. Выборное выражение возможного амилазного/протеазного замедлителя в ячменных ялейроновых клетках. Сравнение с ячменным амилазным/самтилизиновым замедлителем. Планта 169:51-63 (1986 г.).
15. Шарп Ф.Р., Жаке Д., Роуселл А.Г. и Уайтиар А.Л. Быстрые методы измерения пенообразующей активности азотных компонентов сусел и пивных сортов. Прок. Юр. Брю. Конв. 18-й Конгресс, Копенгаген, 1981, стр. 607-614 (1981 г. ).
16. Скривер К., Ли Р., Мюллер-Ури Ф., Олсен Ф.-Л. и Манди Дж. Структура и выражение гена Ltp1 ячменного белка, передающего липиды. Плант. Мол. Биол. 18:585-589 (1992 г.).
17. Слэкк П.Т. и Бамфорт С.У. Фракционирование полипептидов из ячменя и пива при помощи гидрофобной хроматографии взаимодействия. Влияние их гидрофобности на стабильность пены. Дж. Инст. Брю. 89:397-401 (1983 г.).
18. Свенссон Б. , Асано К. , Джонассен И., Пулсен Ф.М., Манди Дж. и Свендсен И. : 10kD гомолог белка ячменного зерна с α-замедлителем от заостренного проса. Карлсберг Рез. Коммюн. 51:493-500 (1986 г.).
19. Уитиар А.Л. Основные факторы, которые определяют стабильность пены. Институт пивоварения. Австралийская и Новозеландская секция. Прос. 15-ая Конвенция. Новая Зеландия, 1978, стр. 67-75.
20. Йокой С., Маеда К., Ксиао Р., Камада К. и Камимура М. Характеризация пивных белков, влияющих на пену пива. Прок. Юр. Брю. Конв. 22-й Конгресс. Цюрих, 1989, стр. 503-512 (1989 г.).
21. Халлгрен Л. , Розендал И. и Расмуссен Дж.Н. Опыты с новым анализатором стабильности пены. Система Карслберга Дж. Ам. Сос. Брю. Чем. 49:78-86 (1991 г.).
22. Расмуссен Дж.Н. Автоматизированный анализ стабильности пены. Карлсберг Рез. Коммюн. 46:25-36, (1981 г.).
23. Вааг П. Связанное с ферментами иммуносорбентное испытание (ELISA) в пивоваренной промышленности. Принципы и практика. В ходе анализа неалкогольных напитков. Современные способы анализа растений, том 8 (Редакторы Линскенс Х.Ф. и Джексон Дж.Ф.) Шпрингер Ферлаг, Берлин, 1988.
Реферат
Изобретение относится к пищевой промышленности и касается напитков, содержащих белки и/или пептиды. Напиток содержит злаковый БПЛ и/или его гомологи, и/или модифицированную фракцию злакового БПЛ. Последнюю можно получить из злакового БПЛ и/или его гомологов нагреванием, кипячением и/или затиранием злакового БПЛ и/или гомологов в воде при рН в диапазоне от 3 до 7. Это позволит получить напитки со стабильной пеной. 4 с. и 19 з.п. ф-лы, 12 ил., 8 табл.
Формула
5. Напиток по любому из пп.1 - 4, отличающийся тем, что он, кроме того, содержит злаковые запасные белки, такие как гордеин и/или глютелин, или их фрагменты.
17. Способ получения пива, предусматривающий стадии приготовления солода или экстракта солода, приготовления сусла, сбраживания сусла, осветления и завершающей обработки пива, отличающийся тем, что на одной или нескольких указанных стадиях добавляют злаковый БПЛ и/или его гомологи, и/или модифицированную фракцию злакового БПЛ.

Комментарии