Композиции и способы для лечения иммунодефицита - RU2724058C2
Код документа: RU2724058C2
Чертежи





Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композициям и способам для лечения иммунодефицита (например, первичного иммунодефицитного заболевания). В частности, согласно настоящему изобретению предложены композиции иммуноглобулина плазмы человека, содержащие титры выбранных антител, специфичных к множеству респираторных патогенов, способы идентификации людей-доноров и образцов от доноров для применения в композициях, способы изготовления композиций и способы применения композиций (например, для профилактического введения и/или терапевтического лечения (например, пассивной иммунизации (например, иммунопрофилактики))).
УРОВЕНЬ ТЕХНИКИ
В то время как большинство людей обладают интактной иммунной системой, которая служит для защиты от широкого спектра инфекционных организмов, которые обычно инфицируют людей, включая вирусы, бактерии и грибки, многие индивидуумы демонстрируют нарушенный или ослабленный иммунитет. Существует множество компонентов иммунной системы, все из которых способствуют отторжению чужеродных инвазивных патогенов. Гуморальная иммунная система, которая вырабатывает циркулирующие антитела, является одним из главных компонентов, который, как часто обнаруживается, отсутствует у индивидуумов с ослабленным иммунитетом либо при рождении, либо может быть приобретенным дефектом. Иммунодефицит может быть классифицирован как первичный или вторичный.
Первичные иммунодефицитные заболевания (PIDD) представляют собой группу из более чем 150 заболеваний, при которых часть иммунной системы субъекта отсутствует или не функционирует нормально. Для того чтобы считаться первичным иммунодефицитом, причина иммунодефицита не должна быть вторичной по своей природе (например, причиной является другое заболевание, лечение лекарственными средствами или воздействие токсинов на окружающую среду). Большинство первичных иммунодефицитов представляют собой генетические нарушения и диагностируются у детей, хотя менее тяжелые формы могут не быть распознаны до зрелого возраста. Примерно 1 из 500 человек рождается с первичным иммунодефицитом.
Большинство иммунодефицитов (например, первичные и вторичные) приводят к дефектному гуморальному или клеточно-опосредованному иммунному ответу на инфекционные патогены. Отсутствие здоровой, правильно функционирующей гуморальной иммунной системы (той части иммунной системы, которая необходима для выработки антител, которые, в конечном счете, ответственны за устранение инфекции) делает человека восприимчивым ко многим инфекциям. Было показано, что инфузия иммуноглобулина восстанавливает способность таких индивидуумов с дефектным иммунитетом защищать себя от инфекции.
Коммерчески доступные иммуноглобулины производитель продуктов из крови и плазмы получает из объединенной сыворотки человека, собирает, обрабатывает и распределяет на продажу. Первый препарат очищенного иммуноглобулина G (IgG) человека, применяемый клинически, представлял собой сывороточный иммуноглобулин, который был получен в 1940-х годах (Cohn, E.J., et al "J. Am Chem. Soc., 68: 459-475 (1946) и Oncely, J.L. et al., J. Am Chem Soc. 71: 541-550 (1949)). Иммуноглобулин, получаемый данным способом, демонстрировал высокое молекулярно-массовое распределение при анализе путем эксклюзионной хроматографии с высоким разрешением. Ранее иммуноглобулин применяли главным образом для предотвращения инфекций у пациентов с дефицитом иммунитета. Иммуноглобулин, получаемый из плазмы тысяч разных доноров, включает антитела ко многим патогенам, с которыми доноры-индивидуумы «сталкивались» на протяжении жизни, и именно эти антитела при введении пациентам с PIDD путем инфузии защищают их от серьезных инфекций.
Однако у доступных в настоящее время продуктов иммуноглобулина существуют значительные ограничения. Поскольку объединяют иммуноглобулин от тысяч случайных доноров, титры антител ко многим инфекционным организмам (например, патогенам), от которых требуется защита, сильно варьируются и очень часто недостаточны для удовлетворения потребностей в иммунитете у индивидуума с супрессией иммунитета (например, в случае серьезного инфицирования патогеном).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композициям и способам для Лечения иммунодефицита (например, первичного иммунодефицитного заболевания). В частности, согласно настоящему изобретению предложены композиции объединенного иммуноглобулина плазмы человека, способы идентификации плазмы человека для применения в композициях, способы изготовления композиций и способы применения композиций (например, для профилактического введения и/или терапевтического лечения (например, пассивной иммунизации (например, иммунопрофилактики))).
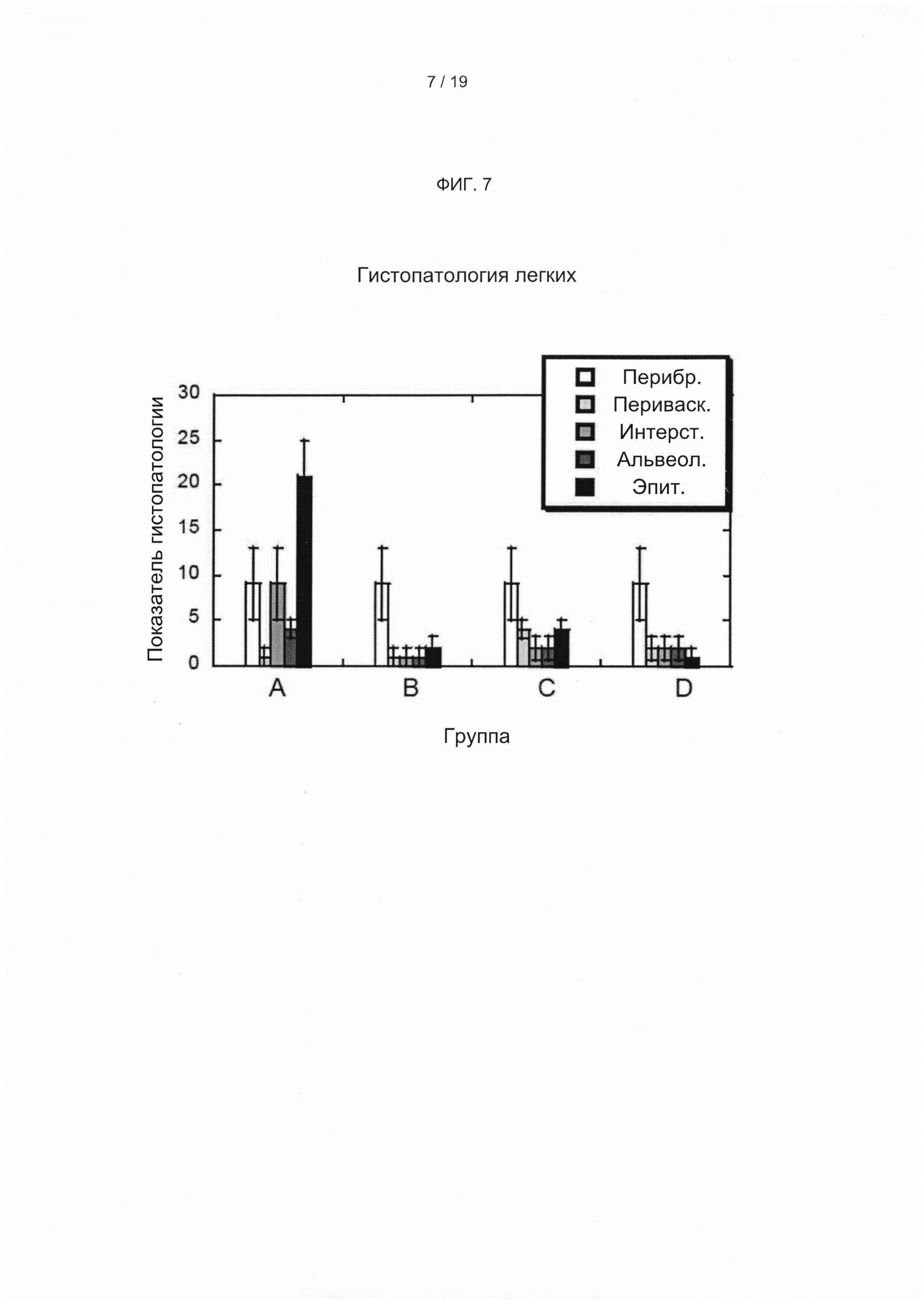
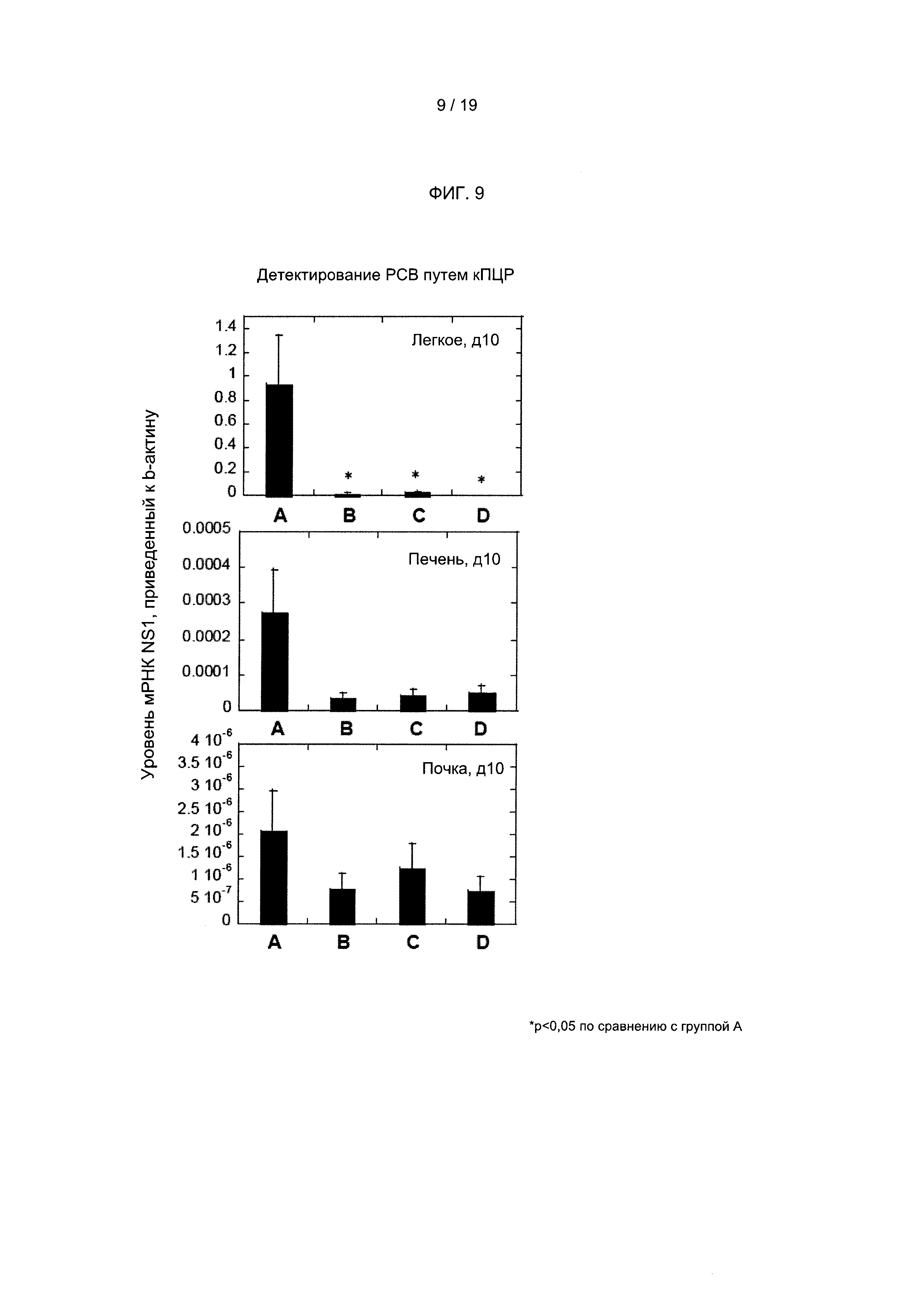
Соответственно, в одном из вариантов реализации настоящего изобретения предложена композиция, содержащая объединенные образцы плазмы, полученные от 1000 или более отобранных субъектов, представляющих собой людей (например, людей-доноров плазмы), при этом указанная объединенная плазма содержит повышенные уровни (например, выбранные, согласующиеся и/или стандартизированные уровни) титров патогенспецифических антител к одному или более (например, двум, трем, четырем или более) респираторным патогенам по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей (например, людей-доноров плазмы). Настоящее изобретение не ограничивается типом респираторных патогенов, к которым объединенная плазма содержит повышенные уровни титров патогенспецифических антител. Композиция объединенной плазмы может содержать повышенные уровни титров патогенспецифических антител к одному или более из: респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса, коронавируса, S. pneumonia, H. influenza, L. pneumophila, Streptococcus группы А, или любому другому респираторному патогену, известному в данной области техники или описанному в настоящем документе. В другом варианте реализации объединенная плазма от отобранных доноров плазмы содержит повышенные уровни титров патогенспецифических антител к двум или более респираторным патогенам, описанным в настоящем документе, по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В другом варианте реализации объединенная плазма содержит повышенные уровни титров патогенспецифических антител к трем или более респираторным патогенам, описанным в настоящем документе, по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В одном из вариантов реализации объединенная плазма содержит титр антител, специфичных к респираторно-синцитиальному вирусу, который по меньшей мере в 2 раза (например, в 2 раза, в 3 раза, в 4 раза, в 5 раз, в 6 раз, в 7 раз, в 8 раз, в 9 раз, в 10 или более раз) больше титра антител, специфичных к респираторно-синцитиальному вирусу, обнаруживаемого в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В другом варианте реализации объединенная плазма содержит титры патогенспецифических антител по меньшей мере к двум или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса, коронавируса, S. pneumonia, H. influenza, L. Pneumophila и Streptococcus группы А, каждый из которых значительно повышен (например, по меньшей мере в 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 4,0, 5,0, 6,0, 7,0, 8,0 или более раз) по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В другом варианте реализации объединенная плазма содержит титры патогенспецифических антител по меньшей мере к трем или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса, коронавируса, S. pneumonia, H. influenza, L. Pneumophila и Streptococcus группы А, каждый из которых повышен по меньшей мере в 1,5 раза по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В другом варианте реализации объединенная плазма содержит титры патогенспецифических антител по меньшей мере к четырем или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса, коронавируса, S. pneumonia, H. influenza, L. Pneumophila и Streptococcus группы А, каждый из которых повышен по меньшей мере в 1,5 раза по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В одном из вариантов реализации объединенная плазма содержит образцы плазмы, полученные от 1000-3000 или более (например, более 1000, 1250, 1500, 1750, 2000, 2500, 3000, 3500, 4000 или более) субъектов, представляющих собой людей. В одном из предпочтительных вариантов реализации объединенная плазма содержит образцы плазмы, полученные от 1000-1100 субъектов, представляющих собой людей. В одном из вариантов реализации композиция, содержащая объединенные образцы плазмы, дополнительно содержит фармацевтически приемлемый носитель (например, природные и/или не встречающиеся в природе носители). В одном из вариантов реализации композицию объединенной плазмы применяют для получения иммуноглобулина (например, для внутривенного введения субъекту). В одном из вариантов реализации композиция и/или иммуноглобулин объединенной плазмы обеспечивает полезный терапевтический эффект для субъекта, которому вводят указанную композицию, которого нельзя достичь путем введения смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей, и/или иммуноглобулина, полученного из указанной смеси. Настоящее изобретение не ограничивается типом обеспечиваемого полезного терапевтического эффекта. Действительно, могут быть достигнуты различные полезные терапевтические эффекты, включая те, которые описаны в настоящем документе. В одном из вариантов реализации объединенная плазма и/или иммуноглобулин обладает улучшенными свойствами нейтрализации вирусов по сравнению со смесью образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей, или иммуноглобулином, полученным из указанной смеси. Например, в одном из вариантов реализации объединенная плазма обладает улучшенными свойствами нейтрализации вирусов в отношении одного или более (например, двух, трех, четырех, пяти или более) респираторных патогенов (например, описанных в настоящем документе). В другом варианте реализации указанные улучшенные свойства нейтрализации вирусов позволяют уменьшить и/или предотвратить инфекцию у субъекта, которому вводят композицию, на период времени, продолжительность которого больше и недостижима у субъекта, которому вводят смесь образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. Например, в одном из вариантов реализации иммуноглобулин, полученный из объединенной плазмы согласно настоящему изобретению (например, охарактеризованный, выбранный и смешанный согласно настоящему изобретению), который вводят субъекту, обуславливает значительную зависимую от концентрации нейтрализующую активность в отношении респираторно-синцитиального вируса (РСВ) и/или нейтрализующую активность, специфичную в отношении другого респираторного патогена (например, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса, коронавируса, S. pneumonia, H. influenza, L. Pneumophila и Streptococcus группы А), которую не достигают или которую нельзя достичь с применением иммуноглобулина, полученного из объединенных случайным образом образцов плазмы (например, в течение периода, составляющего часы, дни, недели или дольше). В одном из вариантов реализации полезный терапевтический эффект объединенной плазмы и/или иммуноглобулина согласно настоящему изобретению представляет собой улучшенные свойства нейтрализации вирусов, которые позволяют уменьшить или предотвратить инфекцию у субъекта, которому вводят указанную объединенную плазму и/или иммуноглобулин, на период времени, продолжительность которого больше и недостижима у субъекта, которому вводят смесь объединенной плазмы и/или полученный из нее иммуноглобулин, полученные от 1000 или более случайных субъектов, представляющих собой людей. В другом варианте реализации полезный терапевтический эффект объединенной плазмы и/или иммуноглобулина согласно настоящему изобретению представляет собой терапевтический и/или защитный уровень титров антител против кори, полиомиелита и/или дифтерии. В одном из вариантов реализации полезный терапевтический эффект представляет собой значительное снижение вирусной нагрузки в легких и/или носу у субъекта с ослабленным иммунитетом, которому вводят объединенную плазму и/или иммуноглобулин, по сравнению с контрольным субъектом, их не получающим. В другом варианте реализации объединенная плазма и/или иммуноглобулин значительно уменьшает гистопатологию легких у субъекта с ослабленным иммунитетом, которому вводят объединенную плазму и/или иммуноглобулин, по сравнению с контрольным субъектом, их не получающим. В другом варианте реализации объединенная плазма и/или иммуноглобулин значительно снижает уровень патогенной вирусной РНК в ткани, выбранной из легкого, печени и почки, у субъекта с ослабленным иммунитетом, которому вводят объединенную плазму и/или иммуноглобулин, по сравнению с контрольным субъектом. В одном из вариантов реализации субъект, которому вводят иммуноглобулин, полученный из объединенной плазмы согласно настоящему изобретению, демонстрирует среднее кратное повышение титра нейтрализующих антител анти-РСВ по меньшей мере в 3 раза, по меньшей мере в 3,5 раза, по меньшей мере в 4 раза, по меньшей мере в 4,5 раза, по меньшей мере в 5 раз, по меньшей мере в 5,5 раза, по меньшей мере в 6 раз, по меньшей мере в 6,5 раза, по меньшей мере в 7 раз, по меньшей мере в 7,5 раза, по меньшей мере в 8 раз, по меньшей мере в 8,5 раза, по меньшей мере в 9 раз, по меньшей мере в 9,5 раза или более, в момент времени, составляющий по меньшей мере 1-14 дней (например, 14 дней, 15 дней, 16 дней, 17 дней, 18 дней, 19 дней или более) после введения иммуноглобулина. Настоящее изобретение не ограничивается количеством иммуноглобулина, вводимым субъекту. В одном из вариантов реализации субъекту вводят 250-2500 мг/кг иммуноглобулина однократно или ежедневно в течение двух или более дней (например, 2, 3, 4 или более последовательных дней). В одном из вариантов реализации субъекту вводят 1500 мг/кг иммуноглобулина в первый день и 750 мг/кг иммуноглобулина во 2 день. В другом варианте реализации субъекту вводят 750 мг/кг иммуноглобулина в первый день и 750 мг/кг иммуноглобулина во 2 день. В другом варианте реализации внутривенную инфузию используют для введения иммуноглобулина пациенту один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в семь недель или один раз в восемь недель. В другом варианте реализации внутривенную инфузию используют для введения 200-1500 мг/кг (например, 200-1000 мг/кг или 300-800 мг/кг) иммуноглобулина один раз в три или четыре недели в течение установленного периода времени (например, в течение нескольких месяцев, 6, 7, 8, 9, 10, 11, 12 или более месяцев, 1 года, 2 лет, 3 лет, 4 лет, 5 лет или дольше). В другом варианте реализации дозу для внутривенной инфузии иммуноглобулина корректируют для поддержания минимального уровня концентрации иммуноглобулина (например, более 200, 250, 300, 350, 400, 450, 500, 550, 600, 650 или выше) мг/дл. В предпочтительном варианте реализации дозу для внутривенной инфузии иммуноглобулина корректируют для поддержания минимального уровня концентрации иммуноглобулина, составляющего более 500 мг/дл. В одном из вариантов реализации внутривенную инфузию используют для введения иммуноглобулина пациенту в количестве, достаточном для обеспечения минимального уровня IgG у указанного пациента, составляющего по меньшей мере 700, 750, 800, 850, 900, 950, 1000, 1050, 1100, 1150, 1200, 1250 или более мг/дл (например, для пациентов при либо трехнедельном, либо четырехнедельном режиме дозирования).
В некоторых вариантах реализации пациент, которому вводят (например, путем внутривенной инфузии) РСВ-внутривенный иммуноглобулин (IVIG) согласно настоящему изобретению, демонстрирует уровни нейтрализующих антител, специфичных к респираторным патогенам и вирусу кори, Corynebacterium diphtheriae, вирусу полиомиелита, Clostridium tetani, haemophilus influenzae типа В, streptococcus pneumonia, цитомегаловирусу (ЦМВ) и/или вирусу ветряной оспы, которые примерно в 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7 или более раз выше по сравнению с уровнем нейтрализующих антител до инфузии. Например, в некоторых вариантах реализации пациент, которому вводят (например, путем внутривенной инфузии) PCB-IVIG согласно настоящему изобретению, демонстрирует 4-7-кратное повышение титра антител, специфичных к РСВ, и 2-6-кратное повышение титра антител к одному или более из: вируса кори, Corynebacterium diphtheriae, вируса полиомиелита, Clostridium tetani, haemophilus influenzae типа В, streptococcus pneumonia и/или ЦМВ. В некоторых вариантах реализации пациент, которому вводят (например, путем внутривенной инфузии) PCB-IVIG согласно настоящему изобретению, демонстрирует 3-8-кратное повышение титра антител, специфичных к РСВ, и 2-6-кратное повышение титра антител к каждому из: вируса кори, Clostridium tetani, haemophilus influenzae типа В, streptococcus pneumonia и ЦМВ. В некоторых вариантах реализации пациент, которому вводят (например, путем внутривенной инфузии) дозу PCB-IVIG согласно настоящему изобретению, составляющую <500 мг/кг, демонстрирует 3,5-5-кратное (например, 3,5-, 3,6-, 3,7-, 3,8-, 3,9-, 4,0-, 4,1-, 4,2-, 4,3-, 4,4-, 4,5-, 4,6-, 4,7-, 4,8-, 4,9- или 5,0-кратное) повышение титра антител, специфичных к РСВ, 3,0-5,0-кратное (например, 3,0-, 3,1-, 3,2-, 3,3-, 3,4-, 3,5-, 3,6- 3,7-, 3,8-, 3,9-, 4,0-, 4,1-, 4,2-, 4,3-, 4,4-, 4,5-, 4,6-, 4,7-, 4,8-, 4,9- или 5,0-кратное) повышение титра антител, специфичных к Clostridium tetani, 2-4-кратное (например, 2,0-, 2,1-, 2,2-, 2,3-, 2,4-, 2,5-, 2,6-, 2,7-, 2,8-, 2,9-, 3,0-, 3,1-, 3,2-, 3,3-, 3,4-, 3,5-, 3,6-, 3,7-, 3,8-, 3,9- или 4,0-кратное) повышение титра антител, специфичных к haemophilus influenzae типа В, 1,5-4-кратное (например, 1,5-, 1,6-, 1,7-, 1,8-, 1,9-, 2,0-, 2,1-, 2,2-, 2,3-, 2,4-, 2,5-, 2,6-2,7-, 2,8-, 2,9-, 3,0-, 3,1-, 3,2-, 3,3-, 3,4-, 3,5-, 3,6-, 3,7-, 3,8-, 3,9- или 4,0-кратное) повышение титра антител, специфичных к streptococcus pneumonia, 2-3-кратное (например, 2,0-, 2,1-, 2,2-, 2,3-, 2,4-, 2,5-, 2,6-, 2,7-, 2,8-, 2,9- или 3,0-кратное) повышение титра антител, специфичных к вирусу кори, и/или 2-3-кратное (например, 2,0-, 2,1-, 2,2-, 2,3-, 2,4-, 2,5-, 2,6-, 2,7-, 2,8-, 2,9- или 3,0-кратное) повышение титра антител, специфичных к ЦМВ. В некоторых вариантах реализации пациент, которому вводят (например, путем внутривенной инфузии) дозу PCB-IVIG согласно настоящему изобретению, составляющую ≥500 мг/кг, демонстрирует 6-8-кратное (например, 6,0-, 6,1-, 6,2-, 6,3-, 6,4-, 6,5-, 6,6-, 6,7-, 6,8-, 6,9-, 7,0-, 7,1-, 7,2-, 7,3-, 7,4-, 7,5-, 7,6-, 7,7-, 7,8-, 7,9- или 8,0-кратное) повышение титра антител, специфичных к РСВ, 4-5-кратное (например, 4,0-, 4,1-, 4,2-, 4,3-, 4,4-, 4,5-, 4,6-, 4,7-, 4,8-, 4,9- или 5,0-кратное) повышение титра антител, специфичных к Clostridium tetani, 3-4-кратное (например, 3,0-, 3,1-, 3,2-, 3,3-, 3,4-, 3,5-, 3,6-, 3,7-, 3,8-, 3,9- или 4,0-кратное) повышение титра антител, специфичных к haemophilus influenzae типа В, 2-5-кратное (например, 2,0-, 2,1-, 2,2-, 2,3-, 2,4-, 2,5-, 2,6-, 2,7-, 2,8-, 2,9-, 3,0-, 3,1-, 3,2-, 3,3-, 3,4-, 3,5-, 3,6-, 3,7-, 3,8-, 3,9-, 4,0-, 4,1-, 4,2-, 4,3-, 4,4-, 4,5-, 4,6-, 4,7-, 4,8-, 4,9- или 5,0-кратное) повышение титра антител, специфичных к streptococcus pneumonia, 2,5-5-кратное (например, 2,5-, 2,6-, 2,7-, 2,8-, 2,9-, 3,0-, 3,1-, 3,2-, 3,3-, 3,4-, 3,5-, 3,6-, 3,7-, 3,8-, 3,9-, 4,0-, 4,1-, 4,2-, 4,3-, 4,4-, 4,5-, 4,6-, 4,7-, 4,8-, 4,9- или 5,0-кратное) повышение титра антител, специфичных к вирусу кори, и/или 3-5-кратное (например, 3,0-, 3,1-, 3,2-, 3,3-, 3,4-, 3,5-, 3,6-, 3,7-, 3,8-, 3,9-, 4,0-, 4,1-, 4,2-, 4,3-, 4,4-, 4,5-, 4,6-, 4,7-, 4,8-, 4,9- или 5,0-кратное) повышение титра антител, специфичных к ЦМВ.
В одном из вариантов реализации объединенная плазма и/или полученный из нее иммуноглобулин уменьшает число случаев инфекции у субъекта, которому вводят композицию. В другом варианте реализации объединенная плазма и/или полученный из нее иммуноглобулин уменьшает количество дней, необходимое для введения антибиотиков (например, для лечения инфекции) субъекту, которому вводят указанную объединенную плазму и/или иммуноглобулин. В другом варианте реализации объединенная плазма и/или полученный из нее иммуноглобулин повышает минимальный уровень циркулирующих антител, специфичных к респираторным патогенам, у субъекта (например, повышает уровень титров нейтрализующих антител, специфичных к респираторным патогенам (например, обеспечивая тем самым защитные уровни антител, специфичных к респираторным патогенам, между запланированными датами введения указанной объединенной плазмы и/или полученного из нее иммуноглобулина, не поддерживаемые у субъекта, которому вводят смесь образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей, или иммуноглобулин, полученный из указанной смеси)).
В другом варианте реализации настоящего изобретения предложена иммунотерапевтическая композиция, содержащая объединенные образцы плазмы, полученные от 1000 или более отобранных субъектов, представляющих собой людей, при этом указанная объединенная плазма содержит повышенные уровни титров патогенспецифических антител к двум или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса, коронавируса, S. pneumonia, H. influenza, L. Pneumophila и Streptococcus группы А, по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей; и фармацевтически приемлемый носитель. В одном из вариантов реализации иммунотерапевтическая композиция, предложенная согласно настоящему изобретению, дополнительно содержит один или более биологически активных агентов. Настоящее изобретение не ограничивается типом биологически активного агента/вещества. Действительно, могут быть использованы различные биологически активные агенты/вещества, включая, но не ограничиваясь указанными, антитела, антитоксинное вещество, противовоспалительный агент, противораковый агент, противомикробный агент, терапевтический агент, антигистаминное средство, цитокин, хемокин, витамин, минерал и т.п. В одном из вариантов реализации биологически активный агент представляет собой антитоксинный агент. В одном из вариантов реализации указанный антитоксинный агент представляет собой моноспецифическое, биспецифическое или полиспецифическое антитело, обладающее специфичностью в отношении вирусного, бактериального или грибкового токсина. В другом варианте реализации бактериальный или грибковый токсин выбран из нейротоксина Botulinum, столбнячного токсина, токсина E.coli, токсина Clostridium difficile, RTX-токсина Vibrio, стафилококковых токсинов, токсина цианобактерий и микотоксинов. В другом варианте реализации иммунотерапевтическая композиция дополнительно содержит аликвоту одного или нескольких моноклональных антител, обладающих одиночной или множественной специфичностью (например, иммуногенная композиция может быть с добавлением одного или более антител, или биологически активного вещества (например, моноклонального антитела любой специфичности, антитоксинного агента и т.д.)). Настоящее изобретение не ограничивается типом одного или более антител, добавляемых (например, вносимых) в иммуногенную композицию. Действительно, может быть использовано любое одно или более антител (например, специфичных к патогену или патогенному продукту), включая, но не ограничиваясь указанными, стандартные антитела, биспецифические антитела, полиспецифические антитела и т.п., известные в данной области техники (например, специфичные к одному или множеству антигенов).
В другом варианте реализации настоящего изобретения предложен способ обеспечения иммунотерапии для субъекта (например, нуждающегося в ней субъекта (например, субъекта с заболеванием или с риском заболевания)), включающий введение указанному субъекту терапевтически эффективного количества композиции, содержащей объединенные образцы плазмы, полученные от 1000 или более отобранных субъектов, представляющих собой людей, при этом указанная объединенная плазма содержит повышенные уровни титров патогенспецифических антител к одному или более (например, двум, трем, четырем, пяти или более) респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса, коронавируса, S. pneumonia, H. influenza, L. Pneumophila и Streptococcus группы А, по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В одном из вариантов реализации иммунотерапию применяют для профилактического лечения инфекции, связанной с микробным патогеном. В другом варианте реализации иммунотерапию применяют для терапевтического лечения инфекции, связанной с микробным патогеном. В одном из вариантов реализации субъект страдает иммунодефицитом. Настоящее изобретение не ограничивается типом иммунодефицита. Действительно, настоящее изобретение можно применять для обеспечения композиций и способов иммунотерапии для пациента с ослабленным иммунитетом, субъекта с повышенным риском инфицирования (например, подвергающегося длительному пребыванию в больнице и/или ожидающего прямого воздействия нескольких конкретных патогенов) и/или индивидуума, чей иммунный ответ был приведен в состояние дефицита (например, в результате заболевания иммунной системы, в результате заболевания, подавляющего иммунные функции (например, СПИД, идиопатическая тромбоцитопеническая пурпура (ИТП) и т.д.), в результате терапии (например, химиотерапии), приводящей к супрессии иммунной системы). В одном из вариантов реализации способы иммунотерапии, предложенные согласно настоящему изобретению, останавливают прогрессирование иммунодефицита и позволяют по меньшей мере частично оправиться от иммунодефицита. Преимуществом композиций и способов, описанных в настоящем документе, является то, что многие варианты реализации не требуют введения субъекту дополнительных лекарственных средств для устранения риска инфицирования и, следовательно, они избавлены от нежелательных побочных эффектов или взаимодействий с другими видами терапии. Другим преимуществом композиций и способов, описанных в настоящем документе, является то, что указанные композиции и способы можно применять для лечения или предотвращения заболевания, при этом для лечения или предотвращения указанного заболевания не существует лекарственных средств или других традиционных способов лечения (например, композиции и способы согласно настоящему изобретению можно применять для лечения и/или предотвращения инфекции, вызываемой респираторно-синцитиальным вирусом). Еще одним преимуществом композиций и способов согласно настоящему изобретению является то, что композиции и способы согласно настоящему изобретению можно применять для лечения инфекции, когда неизвестен лежащий в основе инфекционный агент. Более того, в одном из вариантов реализации композиции и способы согласно настоящему изобретению применяют для профилактического и/или терапевтического лечения инфекции, для которой не существует известного лечения (например, различные вирусные заболевания). В некоторых вариантах реализации композиции и способы согласно настоящему изобретению применяют для профилактического и/или терапевтического лечения инфекций (например, устойчивых к существующему лечению (например, устойчивого к антибиотикам заболевания/инфекции (например, ванкомицин-резистентные стафилококки))). В некоторых вариантах реализации композиции и способы согласно настоящему изобретению применяют для профилактического и/или терапевтического лечения субъекта, имеющего некомпетентную иммунную систему (например, у которого лечение с помощью антибиотикотерапии или другой традиционной противомикробной терапии принесет мало пользы - не принесет пользы).
В других вариантах реализации композиции и способы согласно настоящему изобретению применяют для снижения риска развития у субъекта респираторной инфекции. Настоящее изобретение не ограничивается типом субъекта, которого лечат композициями и способами согласно настоящему изобретению. Действительно, так можно лечить различных субъектов, включая, но не ограничиваясь указанными, субъекта с риском развития инфекции (например, респираторной или другого типа инфекции (например, снижая тем самым риск развития инфекции у субъекта с повышенным риском инфицирования)). В одном из вариантов реализации субъект, которого лечат композицией согласно настоящему изобретению, страдает или у него диагностировано первичное иммунодефицитное заболевание (PIDD). В другом варианте реализации субъект представляет собой пациента с терминальной стадией почечной недостаточности (ESRD); страдающего раком пациента, получающего иммуносупрессивную терапию, пациента со СПИДом, страдающего диабетом пациента, новорожденного, пациента, которому проведена трансплантация, пациента, получающего иммуносупрессивную терапию, пациента с PIDD и другими иммунодефицитами, пациента с нарушением нормального функционирования иммунной системы, пациента с аутоиммунным заболеванием, пожилого человека в лечебном учреждении санаторного типа для пациентов, нуждающихся в постоянном уходе, пациента с аутоиммунным заболеванием, получающего иммуносупрессивную терапию, пациента, которому проведена трансплантация, пациента с инвазивным оперативным вмешательством, ожогового пациента или другого пациента в отделении неотложной помощи. В одном из вариантов реализации иммунотерапия обеспечивает субъекта профилактическим иммунитетом к двум или более патогенам, выбранным из Clostridium botulinum, цитомегаловируса (ЦМВ), Corynebacterium diphtheriae, вируса гепатита А, вируса кори, вируса гепатита В, вируса гепатита С, вируса иммунодефицита человека (ВИЧ), вируса бешенства, столбняка, вируса осповакцины, Pseudomonas aeruginosa, вируса ветряной оспы, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса, коронавируса и респираторно-синцитиального вируса (РСВ). Однако настоящее изобретение этим не ограничивается. Действительно, иммунотерапия композициями и способами согласно настоящему изобретению может обеспечить субъекта профилактическим иммунитетом к любому из микробных патогенов, описанных в настоящем документе. В другом варианте реализации иммунотерапию применяют для лечения инфекции у субъекта, вызванной Clostridium botulinum, цитомегаловирусом (ЦМВ), Corynebacterium diphtheriae, вирусом гепатита А, вирусом кори, вирусом гепатита В, вирусом гепатита С, вирусом иммунодефицита человека (ВИЧ), вирусом бешенства, столбняком, вирусом осповакцины, Pseudomonas aeruginosa, вирусом ветряной оспы, вирусом гриппа А, вирусом гриппа В, вирусом парагриппа типа 1, вирусом парагриппа типа 2, метапневмовирусом, коронавирусом и/или респираторно-синцитиальным вирусом (РСВ), или любым микробным патогеном, описанным в настоящем документе.
В другом варианте реализации настоящего изобретения предложен способ получения композиции объединенной плазмы, включающий получение образцов плазмы от субъектов, представляющих собой людей; получение характеристик титра патогенспецифических антител в подгруппе указанных образцов плазмы к одному или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса; отбор на основе охарактеризованных титров антител образцов плазмы, содержащих повышенные уровни титров патогенспецифических антител к одному или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса, по сравнению с контрольным значением (например, титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей); объединение отобранных образцов плазмы с другими образцами плазмы с получением композиции объединенной плазмы, при этом указанная композиция объединенной плазмы содержит титры патогенспецифических антител к одному или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса, из которых один или более титров повышены по меньшей мере в 1,5 раза по сравнению с контрольным значением (например, титрами патогенспецифических антител в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей). В одном из вариантов реализации указанный способ включает отбор на основе охарактеризованных титров антител образцов плазмы, содержащих повышенные уровни титров патогенспецифических антител к двум или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса, по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В другом варианте реализации указанный способ включает отбор на основе охарактеризованных титров антител образцов плазмы, содержащих повышенные уровни титров патогенспецифических антител к трем, четырем или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса, по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В одном из вариантов реализации композиция объединенной плазмы содержит титры патогенспецифических антител по меньшей мере к двум или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса, каждый из которых повышен по меньшей мере в 1,5 раза по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В одном из вариантов реализации композиция объединенной плазмы содержит титры патогенспецифических антител по меньшей мере к трем или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса, каждый из которых повышен по меньшей мере в 1,5 раза по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В другом варианте реализации композиция объединенной плазмы содержит титр антител, специфичных к респираторно-синцитиальному вирусу, который по меньшей мере в 2 раза (например, в 2, 2,5, 3, 3,5, 4,5, 5, 6, 7, 8, 9, 10 или более раз) больше титра антител, специфичных к респираторно-синцитиальному вирусу, обнаруживаемого в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. Например, в одном из вариантов реализации настоящего изобретения предложен способ получения композиции объединенной плазмы, содержащей конкретный повышенный титр антител к респираторно-синцитиальному вирусу (РСВ) и конкретный повышенный титр антител к одному или более другим респираторным патогенам, от по меньшей мере 1000 людей-доноров плазмы, включающий получение образцов плазмы от отобранных людей-доноров плазмы и неотобранных людей-доноров плазмы, при этом указанные отобранные люди-доноры плазмы включают отобранных людей-доноров с высоким титром и отобранных людей-доноров с не высоким титром, при этом отобранные люди-доноры идентифицированы путем получения характеристик конкретного титра антител к респираторно-синцитиальному вирусу в образце плазмы от человека-донора, при этом получение характеристик конкретного титра антител к респираторно-синцитиальному вирусу включает первый скрининговый анализ плазмы, используемый для оценки нейтрализующей активности в образце плазмы; и второй скрининговый анализ, характеризующий конкретный титр антител очищенной фракции иммуноглобулинов в каждом образце плазмы, идентифицированном как демонстрирующий верхние 20% нейтрализующей активности с использованием первого скринингового анализа плазмы, при этом очищенную фракцию иммуноглобулинов, демонстрирующую титр РСВ-нейтрализующих антител 1800 или выше, используют для идентификации образца плазмы, содержащего повышенный титр антител к одному или более респираторных патогенов, выбранных из вируса парагриппа 1, вируса парагриппа 2, коронавируса ОС43, коронавируса 229Е, вируса гриппа А, вируса гриппа В и метапневмовируса, и используют для отнесения человека-донора к категории отобранного человека-донора с высоким титром; и объединение 1000 или более образцов плазмы от отобранных людей-доноров с высоким титром, отобранных людей-доноров с не высоким титром и неотобранных людей-доноров для получения композиции объединенной плазмы, при этом 10-65%, 20-55%, 30-50%, 40-50% (например, в предпочтительном варианте реализации менее 50% (например, примерно 30-45%, 35-45%, 40-45%)) от 1000 или более образцов плазмы получены от отобранных людей-доноров с высоким титром; и при этом композиция объединенной плазмы содержит титр РСВ-специфичных антител, который по меньшей мере в 3 раза больше титра РСВ-специфичных антител в контрольном образце, и титр антител к одному или более респираторным патогенам, выбранным из вируса парагриппа 1, вируса парагриппа 2, коронавируса ОС43 и коронавируса 229Е, который по меньшей мере в 1,5 раза (например, примерно в 1,25, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,5, 3,0 или более раз) больше титра антител в контрольном образце, при этом указанный контрольный образец представляет собой смесь образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. Также предложены композиции объединенной плазмы, полученные в соответствии со способами, описанными в настоящем документе. В одном из вариантов реализации менее 50% от общего объема композиции объединенной плазмы (например, в предпочтительных вариантах реализации примерно 30-45%, 35-45%, 35-40%) составляют плазму, полученную от отобранных людей-доноров с высоким титром; примерно 55-70% (например, в предпочтительном варианте реализации примерно 55-75%, 55-65%) от общего объема композиции объединенной плазмы составляют плазму, полученную от отобранных людей-доноров с не высоким титром, и примерно 3-20% от общего объема композиции объединенной плазмы составляют плазму от неотобранных людей-доноров. В одном из вариантов реализации композиция объединенной плазмы обеспечивает полезный терапевтический эффект для субъекта, которому вводят указанную композицию, которого нельзя достичь путем введения смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. Настоящее изобретение не ограничивается типом обеспечиваемого полезного терапевтического эффекта. Действительно, могут быть достигнуты различные полезные терапевтические эффекты, включая те, которые описаны в настоящем документе. В одном из вариантов реализации композиция объединенной плазмы обладает улучшенными свойствами нейтрализации вирусов по сравнению со смесью образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В другом варианте реализации указанные улучшенные свойства нейтрализации вирусов позволяют уменьшить и/или предотвратить инфекцию у субъекта, которому вводят композицию, на период времени, продолжительность которого больше и недостижима у субъекта, которому вводят смесь образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей.
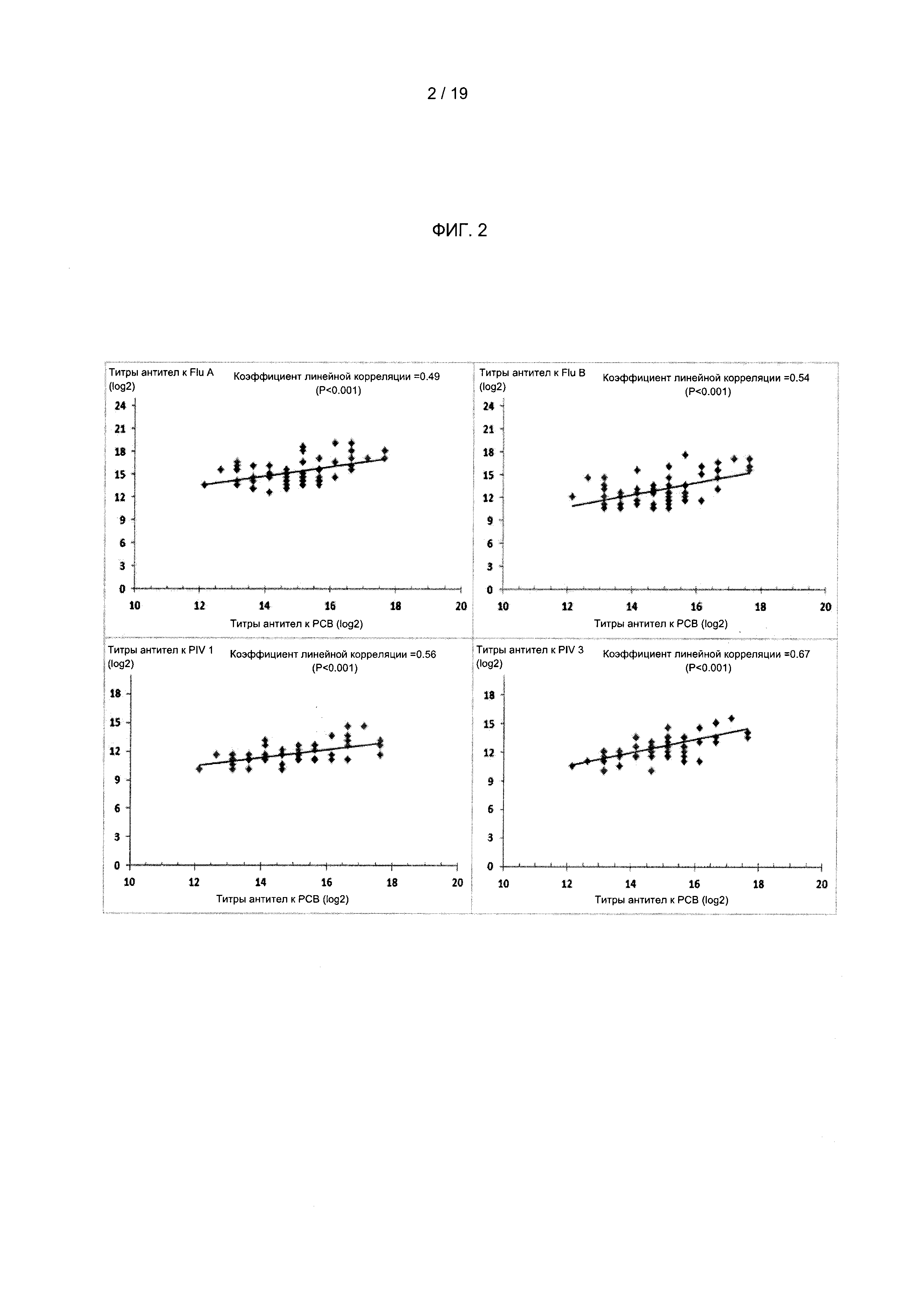
В одном из вариантов реализации настоящего изобретения предложено применение титра нейтрализующих антител к РСВ (или другому респираторному патогену) в качестве биомаркера для идентификации доноров плазмы, которые демонстрируют высокий/сильный ответ в общем на другие респираторные патогены (например, вирус гриппа А, вирус гриппа В, вирус парагриппа типа 1, вирус парагриппа типа 2, метапневмовирус, коронавирус, S. pneumonia, H. influenza, L. Pneumophila и Streptococcus группы А). В другом варианте реализации настоящего изобретения предложен способ применения уровня титра нейтрализующих антител, специфичных к респираторным патогенам (например, титра РСВ-нейтрализующих антител), детектированного в образце плазмы от донора, в качестве биомаркера, который показывает и/или предоставляет информацию относительно уровня титров нейтрализующих антител, специфичных к респираторным патогенам, в указанном образце к одному или более из: вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса. Применение такого биомаркера делает возможной идентификацию доноров и плазмы (например, отобранного донора и/или образца от донора с высоким титром), которая может быть смешана с плазмой от отобранного донора с не высоким титром или плазмой от неотобранного донора с получением композиции объединенной плазмы согласно настоящему изобретению. В одном из вариантов реализации образец плазмы, идентифицированный как содержащий конкретный титр антител к респираторно-синцитиальному вирусу (например, путем первого скринингового анализа плазмы, используемого для оценки нейтрализующей активности в образце плазмы; и второго скринингового анализа, характеризующего конкретный титр антител очищенной фракции иммуноглобулинов в каждом образце плазмы, идентифицированном как демонстрирующий верхние 20% нейтрализующей активности с использованием первого скринингового анализа плазмы), составляющий примерно 1800 или выше (например, примерно 1800, 1850, 1900, 1950, 2000, 2050, 2100 или более), используют для идентификации образца плазмы, содержащего повышенный титр антител (например, указанный повышенный титр представляет собой титр, который по меньшей мере примерно в 1,5 раза (например, примерно в 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,5, 3,0 или более раз) больше титра антител в контрольном образце, при этом указанный контрольный образец представляет собой смесь образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей) к одному или более респираторным патогенам, выбранным из вируса парагриппа 1, вируса парагриппа 2, коронавируса ОС43, коронавируса 229Е, вируса гриппа А, вируса гриппа В и метапневмовируса.
В другом варианте реализации настоящего изобретения предложены композиции гипериммунных глобулинов (например, композиции аденовирусных гипериммунных глобулинов, композиции гипериммунных глобулинов РСВ, композиции пневмококковых гипериммунных глобулинов и т.д.) и способы их получения, и применения (например, для пассивной иммунизации пациентов, восприимчивых или страдающих инфекцией (например, бактериальной инфекцией (например, связанной со Streptococcus pneumonia, Haemophilus influenza и т.д.), вирусной инфекцией (например, связанной с аденовирусом, вирусом герпеса, вирусом гриппа, риновирусом и т.д.), грибковой инфекцией (например, связанной с Aspergillus fumigatus, Cladosporium или другими грибками) и/или воздействием микробных токсинов и/или вредных веществ (например, яда животных))). В одном из вариантов реализации объединенные образцы плазмы человека (например, с повышенным титром желаемых антител (например, прицельно воздействующих на конкретные патогены и/или идентифицированных как обладающие конкретным желаемым свойством (например, улучшенным противовоспалительным свойством))) комбинируют с получением специально созданных пулов иммуноглобулинов (например, обладающих желаемой характеристикой, недостижимой при отсутствии комбинирования пулов (например, более высоким уровнем защиты от инфекции, воспаления или токсинов)) с повышенным титром антител к нескольким конкретным патогенам или патогенным продуктам (например, токсинам).
В одном из вариантов реализации настоящего изобретения предложены композиции и способы для получения композиции, содержащей объединенные образцы плазмы (например, плазму от множества доноров (например, которая содержит повышенные титры антител, специфичных к микробам (например, высокий титр иммуноглобулина, специфичного к вирусным, бактериальным и/или грибковым патогенам))). Как описано в настоящем документе, пул плазмы можно применять в качестве или в терапевтической композиции (например, для лечения и/или предотвращения вирусной, бактериальной и/или грибковой инфекции). В одном из вариантов реализации настоящего изобретения предложена композиция, содержащая объединенные образцы плазмы (например, терапевтическая композиция), содержащие плазму от множества доноров (например, 1000 или более людей-доноров), при этом все или подгруппа из указанного множества доноров демонстрируют высокий титр специфичных к микробным патогенам антител к одному или множеству микробных патогенов в результате введения одной или множества иммуногенных композиций, содержащих микробные антигены, указанному множеству доноров. Настоящее изобретение не ограничивается способом получения пула антител. Действительно, могут быть использованы различные способы, включая, но не ограничиваясь указанными, введение одного или более микробных (например, вирусных, бактериальных и/или грибковых) антигенов субъекту-хозяину для вызова усиленной экспрессии антител, специфичных к микробным (например, вирусным, бактериальным и/или грибковым) патогенам, и получение сыворотки или плазмы, содержащей пулы с повышенными титрами антител, специфичных к микробным (например, вирусным, бактериальным и/или грибковым) патогенам, от донора или множества доноров. В некоторых вариантах реализации плазму/сыворотку очищают и/или концентрируют (например, для концентрирования присутствующего в ней иммуноглобулина, специфичного к микробным (например, вирусным, бактериальным и/или грибковым) патогенам (например, перед предоставлением (например, введением) субъекту)). Настоящее изобретение не ограничивается одним или более микробными (например, вирусными, бактериальными и/или грибковыми) антигенами, используемыми для вызова усиленной экспрессии антител, специфичных к микробным (например, вирусным, бактериальным и/или грибковым) патогенам. Действительно, можно использовать различные микробные (например, вирусные, бактериальные и/или грибковые) антигены, включая, но не ограничиваясь указанными, конъюгированные и неконъюгированные микробные антигенные белки или пептиды, сахара (полисахариды), компоненты клеточной стенки, вирусные антигены и т.п. В некоторых вариантах реализации используемые вирусные, бактериальные и/или грибковые антигены представляют собой или имеют форму коммерчески доступной вакцины. Коммерчески доступные вакцины хорошо известны специалисту в данной области. В качестве примера, не ограничивающие примеры коммерчески доступных вакцин, которые находят применение в настоящем изобретении, включают, но не ограничиваются указанными, вакцину против аденовирусов типа 4 и типа 7, вакцину против сибирской язвы, вакцину БЦЖ, дифтерийный и столбнячный анатоксины, вакцину на основе дифтерийного и столбнячного анатоксинов и бесклеточного коклюшного компонента, вакцину на основе дифтерийного и столбнячного анатоксинов и бесклеточного коклюшного компонента, против гепатита В (рекомбинантную) и инактивированную вакцину против вируса полиомиелита, конъюгированную (конъюгат столбнячного анатоксина) вакцину на основе дифтерийного и столбнячного анатоксинов и бесклеточного коклюшного компонента, инактивированного вируса полиомиелита и Haemophilus b, конъюгированную вакцину Haemophilus b (например, конъюгат менингококкового белка, конъюгат столбнячного анатоксина), рекомбинантную вакцину против гепатита В, вакцину против гепатита А, против гепатита А инактивированную и гепатита В (рекомбинантную (например, РЕКОМБИВАКС НВ, ЭНДЖЕРИКС-В) вакцину, вакцину против вируса папилломы человека (например, поливалентную, двухвалентную, четырехвалентную (типы 6, 11, 16, 18) вакцину), вакцину против вируса гриппа (например, вакцину против гриппа A (H1N1), моновалентную вакцину, трехвалентную (например, типы А и В) вакцину, вакцину против H5N1, ФЛУМИСТ, ФЛУАРИКС, ФЛУВИРИН, АГРИФЛУ, ФЛУЗОН, ФЛУКСЕЛЬВАКС (FLUXELVAX), ФЛУМИСТ четырехвалентную), вакцину против японского вируса энцефалита, вакцину против вируса кори, вакцину против вируса кори и вируса эпидемического паротита, вакцину против вируса кори, эпидемического паротита и краснухи, вакцину против вируса кори, эпидемического паротита, краснухи и ветряной оспы, менингококковую вакцину (например, против групп А, С, Y и W-135 олигосахаридную конъюгированную с дифтерийным CRM197 вакцину), менингококковую против групп С и Y и против Haemophilus b вакцину, конъюгированную со столбнячным анатоксином, менингококковую полисахаридную (серогруппы А, С, Y и W-135) вакцину, конъюгированную с дифтерийным анатоксином, менингококковую полисахаридную вакцину (например, комбинированную вакцину против групп А, С, Y и W-135), вакцину против эпидемического паротита, противочумную вакцину, пневмококковую вакцину (например, ПНЕВМОВАКС23, пневмококковую 7-валентную конъюгированную вакцину, ПРЕВНАР, пневмококковую 13-валентную конъюгированную вакцину), вакцину против вируса полиомиелита, вакцину против бешенства, противоротавирусную вакцину, вакцину против вируса краснухи, противооспенную (осповакцина) вакцину, столбнячный и дифтерийный анатоксины (например, ДЕКАВАК, ТЕНИВАК), вакцину на основе столбнячного анатоксина, уменьшенного содержания дифтерийного анатоксина и бесклеточного коклюшного компонента, брюшнотифозную вакцину, Ви-полисахаридную брюшнотифозную вакцину, вакцину против ветряной оспы, вакцину против желтой лихорадки и/или вакцину против опоясывающего лишая. В некоторых вариантах реализации микробный антиген представляет собой вирусный антиген (например, антиген респираторно-синцитиального вируса), бактериальный антиген (например, антиген S. pneumoniae) и/или грибковый антиген. В некоторых вариантах реализации антиген S. pneumoniae представляет собой сахар (например, полисахарид) клеточной мембраны S. pneumoniae. В некоторых вариантах реализации антиген S. pneumoniae представляет собой конъюгированную вакцину (например, конъюгированную с носителем и/или адъювантом (например, молекулой белка или другого носителя)). В некоторых вариантах реализации антиген S. pneumoniae представляет собой неконъюгированную вакцину. В некоторых вариантах реализации конъюгированная вакцина или неконъюгированная вакцина содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или более различных антигенов (например, из равного количества различных серотипов S. pneumonia). В некоторых вариантах реализации один или более различных серотипов S. pneumoniae включают, но не ограничиваются указанными, серотипы 1, 2, 3, 4, 5, 6А, 6В, 7А, 7В, 7С, 7D, 7Е, 7F, 8, 9A-9V, 12, 14, 18С, 19A-19F, 23A-23F и 25. В некоторых вариантах реализации один или более различных серотипов S. pneumoniae выбраны из любого из более чем 90 различных идентифицированных серотипов S. pneumoniae. В некоторых вариантах реализации один или более различных серотипов S. pneumoniae являются недавно идентифицированными.
В одном из вариантов реализации предложены композиции, которые содержат множество различных типов антител (например, направлены на различные патогены (например, вирусные патогены, бактериальные патогены, эукариотические патогены и т.д.), распознают различные антигены, распознают различные эпитопы и т.д.) и обогащены (например, повышенный титр) по меньшей мере двумя различными антителами или наборами антител (например, направлены на различные патогены, распознают различные антигены, распознают различные эпитопы и т.д.). В конкретных вариантах реализации композиции содержат специально созданные пулы антител. В некоторых вариантах реализации по меньшей мере от примерно 0,01% до примерно 70% от всего иммуноглобулина, присутствующего в композиции, направлены на один или более целевых патогенов, хотя настоящее изобретение этим не ограничивается (например, композиция может содержать менее 0,01% или более 70% иммуноглобулина, направленного на целевые патогены). Иммуноглобулин, направленный на целевые патогены, может составлять >0,1% >2%, >5%, >10%, >20%, >30%, >40%, >50%, >60%, >70%, >80% или >90% от всего иммуноглобулина, присутствующего в композиции. В некоторых вариантах реализации композиция содержит два или более иммуноглобулинов к целевым патогенам, каждый из которых присутствует в количестве более 1% от всего иммуноглобулина, присутствующего в указанной композиции (например, два или более иммуноглобулинов к целевым патогенам присутствуют в количестве более 1,5%, 2,0%, 3,0%, 4,0%, 5,0% или больше от всего иммуноглобулина, два или более иммуноглобулинов к целевым патогенам присутствуют в количестве более 10% от всего иммуноглобулина, два или более иммуноглобулинов к целевым патогенам присутствуют в количестве более 15% от всего иммуноглобулина, два или более иммуноглобулинов к целевым патогенам присутствуют в количестве более 20% от всего иммуноглобулина, два или более иммуноглобулинов к целевым патогенам присутствуют в количестве более 25% от всего иммуноглобулина и т.д.).
Любой подходящий способ получения плазмы, образцов с антителами, композиций объединенной плазмы и/или иммуноглобулина из них включен в объем настоящего изобретения. Более того, любой подходящий способ получения, изготовления, очистки, фракционирования, обогащения и т.д. образцов с антителами и/или пулов плазмы входит в объем настоящего изобретения. Типичные техники и процедуры получения образцов с антителами и получения пулов плазмы приведены, например, в: патенте США №4174388; патенте США №4346073; патенте США №4482483; патенте США №4587121; патенте США №4617379; патенте США №4659563; патенте США №4665159; патенте США №4717564; патенте США №4717766; патенте США №4801450; патенте США №4863730; патенте США №5505945; патенте США №5582827; патенте США №6692739; патенте США №6962700; патенте США №6984492; патенте США №7045131; патенте США №7488486; патенте США №7597891; патенте США №6372216; заявке на патент США №2003/0118591; заявке на патент США №2003/0133929; заявке на патент США №2005/0053605; заявке на патент США №2005/0287146; заявке на патент США №2006/0110407; заявке на патент США №2006/0198848; заявке на патент США №2006/0222651; заявке на патент США №2007/0037170; заявке на патент США №2007/0249550; заявке на патент США №2009/0232798; заявке на патент США №2009/0269359; заявке на патент США №2010/0040601; заявке на патент США №2011/0059085; и заявке на патент США №2012/0121578; полное содержание которых включено в настоящее описание посредством ссылки. В вариантах реализации настоящего изобретения можно использовать любую подходящую комбинацию техник, способов или композиций из перечисленных выше источников.
В некоторых вариантах реализации образцы плазмы и/или образцы с антителами получают от субъектов-доноров в форме безвозмездно предоставляемого или приобретаемого биологического материала (например, кровь или плазма). В некоторых вариантах реализации образцы плазмы и/или образцы с антителами (например, кровь, плазма, выделенные антитела и т.д.) получают из коммерческого источника. В некоторых вариантах реализации образец плазмы и/или образец с антителами, донорскую кровь или донорскую плазму подвергают скринингу на предмет патогенов и либо очищают, либо отбрасывают, если присутствуют конкретные патогены. В одном из вариантов реализации скрининг проводят до объединения образца от донора с другими образцами от доноров. В других вариантах реализации скрининг проводят после объединения образцов. Антитела, кровь и/или плазма могут быть получены от любых подходящих субъектов. В некоторых вариантах реализации антитела, кровь и/или плазму получают от субъекта, который недавно (например, в течение 1 года, в течение 6 месяцев, в течение 2 месяцев, в течение 1 месяца, в течение 2 недель, в течение 1 недели, в течение 3 дней, в течение 2 дней, в течение 1 дня) был вакцинирован или был подвергнут воздействию одного или более конкретных патогенов. В некоторых вариантах реализации субъекту с положительным результатом на антитела к представляющему интерес патогену вводят антигены к данному патогену для повышения титра желаемых антител. В некоторых вариантах реализации субъект демонстрирует выработанные антитела и/или имеет повышенный титр антител к одному или более конкретным патогенам. В некоторых вариантах реализации субъекту, независимо от того демонстрирует он отрицательный или положительный результат на антитела к конкретному микробному патогену, вводят один или более различных вирусных, бактериальных и/или грибковых антигенов/вакцин для повышения титра конкретных желаемых антител (например, антител, специфичных к вирусным, бактериальным и/или грибковым патогенам). Патогены, к которым донор может иметь повышенный титр антител, включают, но не ограничиваются указанными: Clostridium botulinum, цитомегаловирус (ЦМВ), Corynebacterium diphtheriae, вирус гепатита А, вирус кори, вирус гепатита В, вирус гепатита С, вирус иммунодефицита человека (ВИЧ), вирус бешенства, вирус столбняка, вирус осповакцины, Pseudomonas aeruginosa, вирус ветряной оспы и респираторно-синцитиальный вирус (РСВ), вирус иммунодефицита человека, вирус гепатита С, вирус папилломы человека, вирус гепатита В или другие вирусные или бактериальные патогены для человека.
В некоторых вариантах реализации образцы плазмы, известные, идентифицированные и/или отобранные (например, в соответствии со способами, описанными в настоящем документе), и содержащие повышенный титр конкретного антитела (например, антитела, направленные на РСВ), или набор образцов плазмы комбинируют (например, объединяют) с получением композиции, содержащей объединенные образцы плазмы (например, с повышенным титром антител, направленных на конкретный патоген или группу патогенов (например, РСВ и один или более других респираторных патогенов)). Например, композицию, содержащую объединенные образцы плазмы, получают путем объединения образцов плазмы, полученных от отобранных субъектов, представляющих собой людей, и неотобранных субъектов, представляющих собой людей, при этом указанная объединенная плазма содержит повышенные уровни (например, повышенные примерно на 20%, 30%, 40%, 50%, 60%, 70%, 85%, 90%, 100%, 125%, 150%, 160%, 170%, 175%, 180%, 200%, 225%, 250%, 275%, 300%, 350%, 400%, 450%, 500%, 550%, 600%, 650%, 700%, 750%, 800%, 850%, 900%, 950%, 1000% или более) титров патогенспецифических (например, специфичных к РСВ, специфичных к вирусу гриппа А, специфичных к вирусу гриппа В, специфичных к вирусу парагриппа типа 1, специфичных к вирусу парагриппа типа 2, специфичных к метапневмовирусу и/или специфичных к коронавирусу) антител по сравнению с контрольным значением (например, титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей). В другом варианте реализации иммуноглобулин получают из объединенной плазмы (например, в соответствии с методами и способами, описанными в настоящем документе). В некоторых вариантах реализации композицию, содержащую объединенные образцы плазмы, получают путем объединения образцов плазмы, полученных от отобранных людей-доноров и неотобранных людей-доноров, при этом указанная объединенная плазма содержит повышенные уровни титров РСВ-специфичных антител (например, индивидуумы, недавно подвергнутые воздействию РСВ, индивидуумы, недавно вакцинированные против РСВ и т.д.) и титров антител, специфичных к другим респираторным патогенам, по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В одном из вариантов реализации композиция, содержащая объединенные образцы плазмы и/или полученный из них иммуноглобулин согласно настоящему изобретению, представляет собой стерильный раствор с рН, равным примерно 4,0-8,0 (например, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0-5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8 или выше). В другом варианте реализации композицию, содержащую объединенные образцы плазмы, и/или полученный из них иммуноглобулин согласно настоящему изобретению, получают в соответствии со стандартами Управления США по контролю за качеством пищевых продуктов и лекарственных средств (FDA) для получения иммуноглобулина (например, Свод федеральных нормативных актов (CFR) 37 §§640.100; 640.101; 640.102; 640.103; 640.104, 1 апреля 2013 года). В одном из вариантов реализации композиция, содержащая объединенные образцы плазмы и/или полученный из них иммуноглобулин согласно настоящему изобретению (например, PCB-IVIG, описанный в настоящем документе, в частности, в разделе «Примеры»), содержит по меньшей мере минимальный уровень титров антител к Corynebacterium diphtheria, вирусу кори и вирусу полиомиелита, рекомендованный FDA (например, см. 37 CFR §640.104).
В одном из вариантов реализации композиция, содержащая объединенные образцы плазмы и/или полученный из них иммуноглобулин согласно настоящему изобретению, содержит повышенные уровни титров патогенспецифических антител к респираторно-синцитиальному вирусу и одному или более респираторным патогенам, выбранным из вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса, по сравнению с контрольным значением титра антител (например, титром патогенспецифических антител, обнаруживаемым в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей), при этом указанные повышенные уровни специфичных к РСВ, специфичных к вирусу гриппа А, специфичных к вирусу гриппа В, специфичных к вирусу парагриппа типа 1, специфичных к вирусу парагриппа типа 2, специфичных к метапневмовирусу и/или специфичных к коронавирусу антител повышены по меньшей мере на 20%, 30%, 40%, 50%, 60%, 70%, 85%, 90%, 100%, 125%, 150%, 175%, 200%, 225%, 250%, 275%, 300%, 350%, 400%, 450%, 500%, 550%, 600%, 650%, 700%, 750%, 800%, 850%, 900%, 950%, 1000% или более по сравнению с контрольным значением (например, уровнем титров патогенспецифических антител, обнаруживаемым в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей). В одном из вариантов реализации настоящего изобретения предложен способ получения описанной выше композиции, включающий получение образцов плазмы от отобранных людей-доноров и неотобранных людей-доноров; объединение 1000 или более образцов плазмы как от отобранных доноров, так и от неотобранных доноров с получением композиции объединенной плазмы. В одном из вариантов реализации образцы плазмы от отобранных людей-доноров и неотобранных людей-доноров подвергают скринингу для подтверждения отсутствия передающихся с кровью патогенов (например, до или после объединения). В другом варианте реализации отбираемых людей-доноров идентифицируют путем идентификации конкретного титра антител к одному или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса. В предпочтительном варианте реализации отбираемых людей-доноров идентифицируют путем идентификации конкретного титра антител к респираторно-синцитиальному вирусу. В другом варианте реализации отобранные люди-доноры включают доноров с высоким титром и доноров со средним титром, при этом доноры с высоким титром имеют титр патогенспецифических антител, который в 2-5 раз, 5-8 раз, 8-10 раз, 10-14 раз, 14 раз или более больше стандартного значения (титра патогенспецифических антител, присутствующих в пуле образцов плазмы от 1000 или более случайных субъектов, представляющих собой людей), и при этом доноры со средним титром имеют титр патогенспецифических антител, который представляет собой титр патогенспецифических антител, присутствующих в пуле образцов плазмы от 1000 или более случайных субъектов, представляющих собой людей, или который лишь незначительно выше (например, на 5-20% выше) или незначительно ниже (например, на 5-20% ниже) данного значения. В другом варианте реализации отобранные люди-доноры включают доноров с высоким титром, доноров со средним титром и доноров с низким титром, при этом доноры с высоким титром имеют титр патогенспецифических антител, который в 2-5 раз, 5-8 раз, 8-10 раз, 10-14 раз, 14 раз или более больше стандартного значения (титра патогенспецифических антител, присутствующих в пуле образцов плазмы от 1000 или более случайных субъектов, представляющих собой людей), при этом доноры со средним титром имеют титр патогенспецифических антител, который представляет собой титр патогенспецифических антител, присутствующих в пуле образцов плазмы от 1000 или более случайных субъектов, представляющих собой людей, или который лишь незначительно выше (например, на 5-20% выше) или незначительно ниже (например, на 5-20% ниже) данного значения, и при этом доноры с низким титром имеют титр патогенспецифических антител, который составляет примерно 20-50 процентов от титра патогенспецифических антител, присутствующих в пуле образцов плазмы от 1000 или более случайных субъектов, представляющих собой людей.
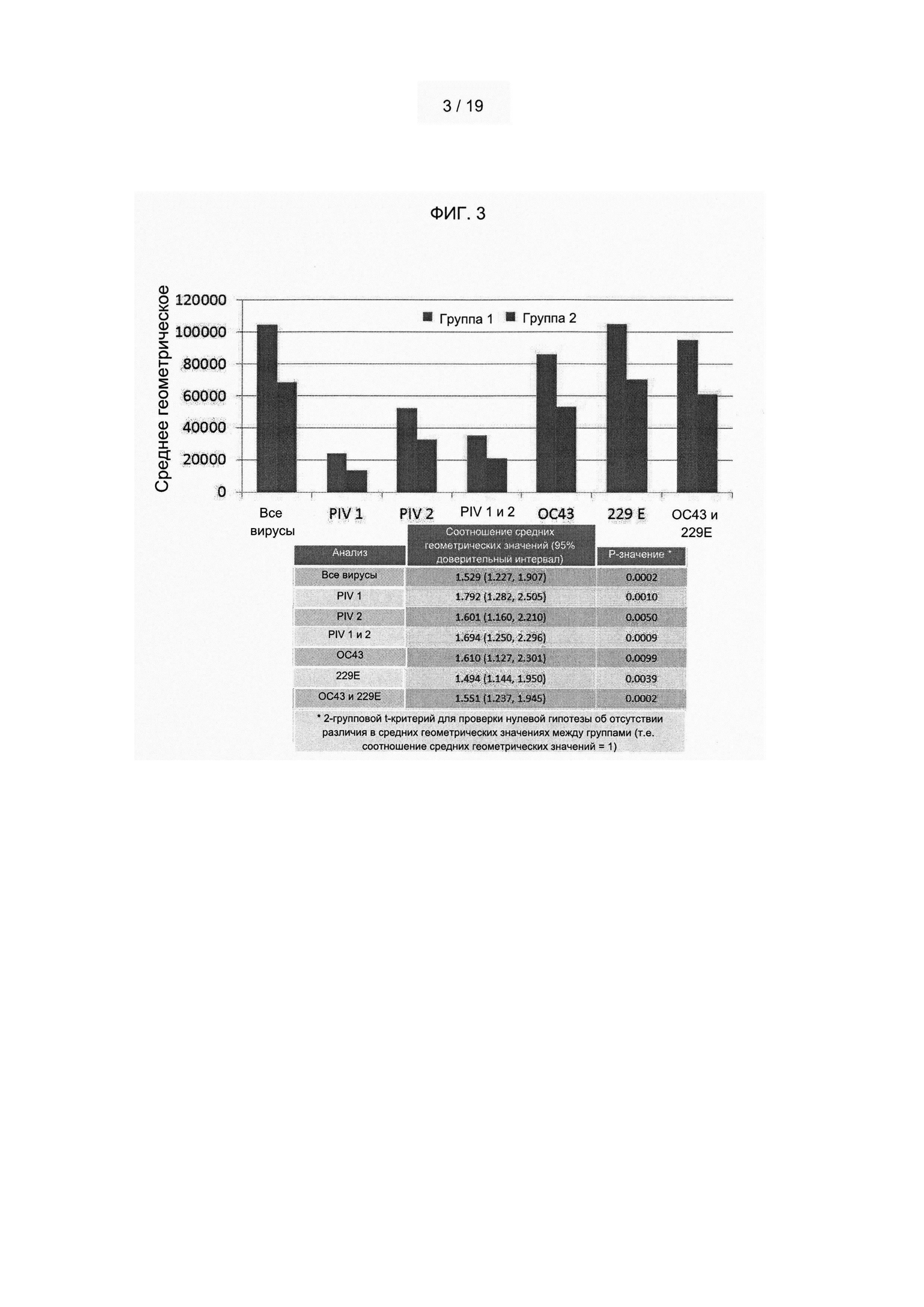
В одном из вариантов реализации идентификация титра антител включает первый скрининговый анализ плазмы, позволяющий оценить нейтрализующую активность в образце плазмы, и второй скрининговый анализ, позволяющий оценить титр антител в очищенной фракции иммуноглобулинов образца плазмы. В одном из вариантов реализации нейтрализующую активность в плазме измеряют по отсутствию инфицирования гепатоцитов вирусом РСВ. В другом варианте реализации первый скрининговый анализ плазмы, оценивающий нейтрализующую активность, позволяет подразделить образцы плазмы на образцы с высоким титром, средним титром или низким титром РСВ-специфичных антител, при этом донор/образец от донора с высоким титром к РСВ является таким, который содержит титр РСВ-нейтрализующих антител, составляющий примерно 7800 или более, донор/образец от донора со средним титром к РСВ является таким, который содержит титр анти-РСВ, составляющий примерно 3300-7799, и донор/образец от донора с низким титром к РСВ является таким, который содержит титр анти-РСВ, составляющий примерно 1800-3299 (например, титр рассчитывают и присваивают донору/образцу от донора как разведение, дающее 50% ингибирование роста вируса (та точка, которая составляет 50% двух крайних точек (физиологический раствор плюс вирус представляет собой 100 рост, и без добавленного вируса представляет собой 0 рост) в соответствии со способами, описанными в настоящем документе (см., например, примеры 1 и 2)). В другом варианте реализации только образцы плазмы, идентифицированные как демонстрирующие верхние 20%-30% нейтрализующей активности всех доноров, обрабатывают с получением очищенного иммуноглобулина, а затем подвергают скринингу с использованием второго скринингового анализа. В предпочтительном варианте реализации только образцы плазмы, идентифицированные как демонстрирующие верхние 20% нейтрализующей активности всех доноров, обрабатывают с получением очищенного иммуноглобулина, а затем подвергают скринингу с использованием второго скринингового анализа. В одном из вариантов реализации второй скрининговый анализ характеризует титр РСВ-специфичных антител очищенной фракции иммуноглобулинов образца плазмы. В предпочтительном варианте реализации донор/образец от донора, который содержит титр РСВ-нейтрализующих антител, составляющий по меньшей мере 1800, в очищенной фракции иммуноглобулинов образца плазмы, оценивают как донора с высоким титром. В предпочтительном варианте реализации титр РСВ-нейтрализующих антител, составляющий по меньшей мере 1800, используют для идентификации донора/образца от донора (например, образца плазмы), содержащего повышенные уровни одного или более респираторных патогенов, выбранных из вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса. В другом варианте реализации композиция объединенной плазмы содержит титр РСВ-нейтрализующих антител, составляющий 1800 или более. В одном из вариантов реализации меньше половины (например, примерно 10-20%, 20-30%, 30-40%, 40-50%) из 1000 или более доноров представляют собой доноров с высоким титром. В предпочтительном варианте реализации примерно 30-45%, 35-45% или 35-40% от 1000 или более доноров представляют собой доноров с высоким титром. В другом варианте реализации настоящего изобретения предложена композиция объединенной плазмы и/или полученный из нее иммуноглобулин, полученные в соответствии с описанными выше способами. В одном из вариантов реализации композиция объединенной плазмы содержит примерно 1800-2500 литров (например, примерно 1800, примерно 1900, примерно 2000, примерно 2100 примерно 2200, примерно 2300, примерно 2400 или примерно 2500 литров) плазмы от 1000 доноров с титром РСВ-нейтрализующих антител, составляющим 1800 или более. В одном из вариантов реализации композиция объединенной плазмы согласно настоящему изобретению содержит примерно 2200 литров плазмы от 1000 доноров с титром РСВ-нейтрализующих антител, составляющим 1800 или более, при этом менее 50% от общего объема композиции объединенной плазмы (например, в предпочтительных вариантах реализации примерно 30-45%, 35-45%, 35-40%) составляют плазму, полученную от отобранных людей-доноров с высоким титром; примерно 55-70% (например, в предпочтительном варианте реализации примерно 55-75%, 55-65%) от общего объема композиции объединенной плазмы составляют плазму, полученную от отобранных людей-доноров с не высоким титром, и примерно 3-20% от общего объема композиции объединенной плазмы составляют плазму от неотобранных людей-доноров. В другом варианте реализации композиция объединенной плазмы содержит титры патогенспецифических антител по меньшей мере к двум или более респираторным патогенам, выбранным из вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса, каждый из которых повышен по меньшей мере примерно в 1,5 раза (например, примерно в 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,5, 3,0 или более раз) по сравнению с контрольным значением (например, титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей, или титрами патогенспецифических антител, обнаруживаемыми в традиционном гипериммунном иммуноглобулине (например, гипериммунном иммуноглобулине против бешенства (ГИПЕРРАБ (HYPERRAB), Grifols, Клейтон, Северная Каролина), гипериммунном иммуноглобулине против гепатита (например, ГИПЕРГЕП В, Talecris Biotherapeutics, Research Triangle Park, Северная Каролина), гипериммунном глобулине против РСВ (например, РЕСПИГАМ (RESPIGAM), MEDIMMUNE, Inc.)). В одном из вариантов реализации композиция объединенной плазмы содержит по меньшей мере минимальный титр антител к Corynebacterium diphtheria, вирусу кори и вирусу полиомиелита, рекомендованный FDA (например, см. 37 CFR §640.104). В одном из вариантов реализации композиция объединенной плазмы содержит титр антител, специфичных к респираторно-синцитиальному вирусу, который по меньшей мере в 3 раза (например, в 3, 4, 5, 6, 7, 8, 9, 10 или более раз) больше титра антител, специфичных к респираторно-синцитиальному вирусу, обнаруживаемого в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В одном из вариантов реализации композиция объединенной плазмы обеспечивает полезный терапевтический эффект для субъекта, которому вводят указанную композицию, которого нельзя достичь путем введения смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. Могут быть обеспечены несколько типов полезных терапевтических эффектов, включая, но не ограничиваясь указанными, ингибирование инфекции, вызванной РСВ, вирусом гриппа А, вирусом гриппа В, вирусом парагриппа типа 1, вирусом парагриппа типа 2, метапневмовирусом и/или коронавирусом, у субъекта, которому вводят композицию, на период времени, продолжительность которого больше и недостижима у субъекта, которому вводят смесь образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей; значительное снижение вирусной нагрузки в легких и/или носу (например, у субъекта с ослабленным иммунитетом, которому вводят композицию, по сравнению с контрольным субъектом, не получающим композицию); значительное уменьшение гистопатологии легких (например, у субъекта с ослабленным иммунитетом, которому вводят композицию, по сравнению с контрольным субъектом, не получающим композицию); и/или значительное снижение уровня патогенной вирусной РНК в ткани легкого, печени, почки и/или другой ткани (например, у субъекта с ослабленным иммунитетом, которому вводят композицию, по сравнению с контрольным субъектом, не получающим композицию). В одном из вариантов реализации в композиции объединенной плазмы отсутствуют детектируемые уровни (например, детектируемые с использованием любого способа, известного в данной области техники (например, рекомендованного Управлением США по контролю за качеством пищевых продуктов и лекарственных средств)) вируса иммунодефицита человека (ВИЧ) 1 (ВИЧ-1), ВИЧ-2, Treponema pallidum, Plasmodium falciparum, Plasmodium malariae, Plasmodium ovale, Plasmodium vivax, Plasmodium knowlesi, вируса гепатита В (HBV), вируса гепатита С (HCV), прионов, вируса Западного Нила, парвовируса, Typanosoma cruzi, коронавируса, вызывающего тяжелый острый респираторный синдром (ТОРС), и/или вируса осповакцины. В одном из вариантов реализации каждый индивидуальный образец плазмы, используемый в способе или композиции согласно настоящему изобретению, получают только в одобренных FDA учреждениях по сбору крови и тестируют путем проведения серологических тестов (например, серологических тестов, одобренных FDA) на предмет вируса иммунодефицита человека (ВИЧ) 1 (ВИЧ-1), ВИЧ-2, Treponema pallidum, Plasmodium falciparum, Plasmodium malariae, Plasmodium ovale, Plasmodium vivax, Plasmodium knowlesi, вируса гепатита В (HBV), вируса гепатита С (HCV), прионов, вируса Западного Нила, парвовируса, Typanosoma cruzi, коронавируса, вызывающего ТОРС, и/или вируса осповакцины. В другом варианте реализации индивидуальный образец плазмы и/или композицию объединенной плазмы согласно настоящему изобретению тестируют на присутствие ВИЧ-1, ВИЧ-2, HBV, HCV или другого инфекционного агента (например, патогена) с использованием тестирования методом амплификации нуклеиновых кислот (NAT) и применяют в способе или композиции согласно настоящему изобретению только при подтверждении отсутствия патогенов.
Настоящее изобретение не ограничивается типом субъекта (например, млекопитающее, нечеловекообразный примат, человек и т.д.), которому вводят или которого лечат композицией согласно настоящему изобретению (например, объединенные образцы плазмы и/или их содержащая иммунотерапевтическая композиция). Действительно, субъект может представлять собой любого субъекта, нуждающегося в лечении композицией согласно настоящему изобретению (например, субъекта, инфицированного или восприимчивого к инфицированию (например, вследствие иммунодефицита) инфекционным агентом (например, любым одним или более инфекционными агентами, описанными в настоящем документе (например, респираторными патогенами))). В некоторых вариантах реализации субъект подвергается повышенному риску инфицирования (например, одним или несколькими конкретными патогенами (например, респираторными патогенами)). Субъект может представлять собой новорожденного. В некоторых вариантах реализации субъект страдает иммунодефицитом (например, субъект, получающий иммуносупрессивные лекарственные средства (например, пациент, которому проведена трансплантация), страдающий заболеванием иммунной системы, страдающий заболеванием, которое подавляет иммунные функции, проходящий терапию (например, химиотерапию), которая приводит к супрессии иммунной системы, подвергающийся длительному пребыванию в больнице и/или субъект, ожидающий прямого воздействия патогена или патогенов. Например, в некоторых вариантах реализации субъект с ослабленным иммунитетом представляет собой пациента с терминальной стадией почечной недостаточности (ESRD); страдающего раком пациента, получающего иммуносупрессивную терапию (например, химиотерапию, облучение), пациента со СПИДом, страдающего диабетом пациента, новорожденного, пациента, которому проведена трансплантация (например, пациента, которому проведена трансплантация гематопоэтических стволовых клеток (ГСК), костного мозга (КМ), пуповинной крови, гаплоидентичная трансплантация и/или трансплантация паренхиматозного органа), пациента, получающего иммуносупрессивную терапию (например, терапевтическая иммуносупрессия, стероиды), пациента с PIDD и другими иммунодефицитами, пациента с нарушением нормального функционирования иммунной системы, пациента с аутоиммунным заболеванием, пожилого человека в лечебном учреждении санаторного типа для пациентов, нуждающихся в постоянном уходе, пациента с аутоиммунным заболеванием, получающего иммуносупрессивную терапию, пациента, которому проведена трансплантация, пациента с инвазивным оперативным вмешательством, ожогового пациента или другого пациента в отделении неотложной помощи. В некоторых вариантах реализации субъект, которого лечат композициями и/или способами согласно настоящему изобретению, включает субъектов со здоровой или нормальной иммунной системой (например, с бактериальной, вирусной и/или грибковой инфекцией). В некоторых вариантах реализации субъект, которого лечат, представляет собой субъекта, подвергающегося риску воздействия агента или вещества (например, токсина или токсинов), который выше обычного. В некоторых вариантах реализации субъект представляет собой военнослужащего, человека из аварийной бригады или другого субъекта, подвергающегося риску воздействия токсина (например, биологического токсина), который выше обычного, при этом лечение композициями и/или способами согласно настоящему изобретению обеспечивает для субъекта один или более полезных эффектов в отношении иммунного ответа (например, введение иммунотерапевтической композиции военнослужащему предотвращает проявление у указанного военнослужащего признаков или симптомов заболевания, или заболеваемость, обычно связанную с воздействием токсина).
Таким образом, согласно настоящему изобретению предложены способы и композиции для предотвращения и/или лечения инфекций, связанных с бактериальными, вирусными, грибковыми и дрожжевыми микроорганизмами. В некоторых вариантах реализации настоящего изобретения предложены композиции (например, наборы) и способы для идентификации субъектов (например, субъектов, вакцинированных одним или более бактериальными, вирусными и/или грибковыми микробными антигенами/вакцинами), подходящих для получения донорской плазмы/сыворотки (например, с высокими титрами антител, специфичных к бактериальным, вирусным и/или грибковым патогенам). В некоторых вариантах реализации настоящего изобретения предложены новые терапевтические композиции для активной и пассивной иммунизации против инфекций, вызываемых и/или связанных с микробными (например, бактериальными, вирусными, грибковыми и т.д.) патогенами. В некоторых вариантах реализации настоящего изобретения предложены новые терапевтические композиции для активной и пассивной иммунизации против инфекций, вызываемых и/или связанных с конкретным вирусом (например, респираторно-синцитиальным вирусом), бактериями (например, S. pneumonia), грибком или дрожжами. Настоящее изобретение не ограничивается типом инфекции, вызываемой и/или связанной с S. pneumoniae. Действительно, композиции и способы согласно настоящему изобретению подходят для всех инфекций, связанных с присутствием S. pneumonia (например, включая, но не ограничиваясь указанными, пневмонию, бактериемию, менингит, средний отит и т.д.). Например, в некоторых вариантах реализации композиции и способы согласно настоящему изобретению применяют для (например, вводят) субъектов с иммунодефицитом. Как подробно описано в настоящем документе, настоящее изобретение не ограничивается каким-либо конкретным иммунодефицитом. Иммунодефицит может быть врожденным, приобретенным или являться следствием иммуносупрессивной терапии. В некоторых вариантах реализации настоящего изобретения предложена терапевтическая композиция, которая обеспечивает антитела к микробной инфекции (например, вызываемой S. pneumonia), повышает скорость опсонизации и фагоцитоза микробных патогенов (например, S. pneumonia), и/или индуцирует усиленное внутриклеточное уничтожение микробных патогенов (например, S. pneumonia) (например, тем самым предотвращая или устраняя микробную инфекцию (например, инфекцию S. pneumoniae)). В некоторых вариантах реализации настоящего изобретения предложена иммунологическая сыворотка против бактерий, вирусов, дрожжей и/или грибков (например, S. pneumonia). В некоторых вариантах реализации настоящего изобретения предложена плазма/сыворотка, обеспечивающая гуморальный и/или клеточный иммунитет к бактериям, вирусам, дрожжам и/или грибкам (например, S. pneumonia). В некоторых вариантах реализации указанный гуморальный и/или клеточный иммунитет является непродолжительным (например, 5 недель, 4 недели, 3 недели, 2 недели или меньше). В некоторых вариантах реализации гуморальный и/или клеточный иммунитет сохраняется 5, 6, 7, 8, 9, 10, 11, 12, 13 14, 15, 16 или более недель.
В некоторых вариантах реализации получают или отбирают плазму (например, пул плазмы (например, полученный от донора или множества доноров (например, одного или более доноров, вакцинированных одинаковым или разным микробным антигеном (например, вирусом, бактерией и/или грибком)))), которая содержит высокий титр антител к конкретному микроорганизму (например, вирусу, бактерии и/или грибку). В некоторых вариантах реализации получают или отбирают плазму (например, пул плазмы (например, полученный от донора или множества доноров (например, одного или более доноров, вакцинированных одинаковым или разным микробным антигеном (например, антигеном, представляющим собой вирус, бактерию и/или грибок)))), которая содержит высокий титр антител к двум или более микроорганизмам (например, двум или более конкретным вирусам, бактериям и/или грибкам). В некоторых вариантах реализации получают или отбирают плазму (например, пул плазмы (например, полученный от донора или множества доноров (например, одного или более доноров, вакцинированных одинаковым или разным микробным антигеном (например, антигеном, представляющим собой вирус, бактерию и/или грибок)))), которая содержит высокий титр антител, специфичных к 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или более различным микробным антигенам (например, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или более различным конкретным вирусам, бактериям и/или грибкам (например, серотипам S. pneumonia)).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 представлены диаграммы рассеяния для титров антител к РСВ и титров антител к гриппу A (Flu А), гриппу В (Flu В), вирусу парагриппа 1 (PIV 1) и вирусу парагриппа 3 (PIV 3) в линейном масштабе.
На фиг. 2 представлены диаграммы рассеяния для титров антител к РСВ и титров антител к гриппу А, гриппу В, PIV 1 и PIV 3 в масштабе Log2.
На фиг. 3 изображены графики, показывающие уровень титров нейтрализующих антител к респираторным патогенам, присутствующих в композициях IVIG, полученных с применением композиций и способов согласно настоящему изобретению.
На фиг. 4 представлено схематическое изображение модели у хлопкового хомяка, используемой для исследования терапевтического действия иммуноглобулина, полученного, как описано в примере 2.
На фиг. 5 представлено схематическое изображение модели у хлопкового хомяка, используемой для исследования профилактического действия иммуноглобулина, полученного, как описано в примере 2.
На фиг. 6 показано уменьшение общего количества лейкоцитов и общего количества лимфоцитов у всех животных, которых лечили циклофосфамидом (группы А, В, С и G), по сравнению со здоровыми хлопковыми хомяками, не подвергнутыми манипуляциям (группы D, Е и F).
На фиг. 7 показано, что легкие животных с супрессией иммунитета, инфицированных РСВ, демонстрировали увеличенное повреждение эпителия по сравнению с легкими РСВ-инфицированных здоровых хлопковых хомяков (группа А по сравнению с группой D), и что лечение животных IVIG согласно настоящему изобретению (группы В и С) приводило к уменьшению повреждения эпителия.
На фиг. 8 показаны титры вируса в общих гомогенатах легких и носа, измеренные в 4 и 10 дни после интраназального заражения приблизительно 5,0 Log10 PCB/A/Long, у хлопкового хомяка с супрессией иммунитета в случае лечения и отсутствия лечения с применением IVIG согласно настоящему изобретению.
На фиг. 9 показана экспрессия генов РСВ (NS1 мРНК), определенная количественно путем анализа методом количественной ПЦР, в образцах легких, печени и почек, полученных от животных группы А, В, С и D в 10 день после инфицирования. Уровень транскрипта РСВ был самым низким в образцах группы D и самым высоким в образцах группы А. Лечение животных с супрессией иммунитета IVIG согласно настоящему изобретению приводило к статистически значимому снижению уровня мРНК NS1 РСВ в легких (группы В и С по сравнению с группой А).
На фиг. 10 показано уменьшение общего количества лейкоцитов и общего количества лимфоцитов у всех животных, которых лечили циклофосфамидом, по сравнению со здоровыми хлопковыми хомяками, не подвергнутыми манипуляциям.
На фиг. 11 показано снижение уровня общего IgG в сыворотке хлопковых хомяков, которых лечили циклофосфамидом, по сравнению с сывороткой контрольных животных.
На фиг. 12 показаны титры вируса в общих гомогенатах легких, измеренные в 4 и 10 дни после интраназального заражения приблизительно 5,0 Log10 PCB/A/Long.
На фиг. 13 показана экспрессия генов РСВ (NS1 мРНК), определенная количественно путем анализа методом количественной ПЦР, в легком, почке и печени одного из животных группы А (животное # 96998) и одного из животных группы В (животное # 97009). Экспрессию NS1 мРНК детектировали во всех трех органах, полученных от животного в группе А, и в легком и печени животного в группе В.
На фиг. 14 показано, что хлопковых хомяков, инфицированных (А) паливизумаб-резистентным мутантом РСВ/А/Tracy или (В) РСВ/В/18537, можно было с таким же успехом сравнить с исходным вирусом, и что мутантный вирус был устойчив к иммунопрофилактическому действию паливизумаба.
На фиг. 15 показано влияние PCB-IVIG согласно настоящему изобретению на титры вируса в жидкости легочного лаважа.
На фиг. 16 показано влияние PCB-IVIG согласно настоящему изобретению (А) на титры нейтрализующих РСВ/А/Tracy антител в сыворотке и (В) на титры нейтрализующих РСВ/В/18537 антител в сыворотке.
ОПРЕДЕЛЕНИЯ
В настоящем описании термин «субъект» относится к любому человеку или животному (например, нечеловекообразный примат, грызун, животное из семейства кошачьих, животное, относящееся к семейству псовых, бык, свинья, лошадь и т.д.).
В настоящем описании термин «образец» употребляется в самом широком смысле и включает материалы, полученные из любого источника. В настоящем описании термин «образец» относится к материалам, полученным из биологического источника, например, полученным от животных (включая людей), и включает любые жидкости, твердые вещества и ткани. В конкретных вариантах реализации настоящего изобретения биологические образцы включают кровь и продукты крови, такие как плазма, сыворотка и т.п. Однако данные примеры не ограничивают типы образцов, которые, находят применение в настоящем изобретении.
В настоящем описании термин «антитело» относится к молекуле иммуноглобулина, которая, как правило, состоит из двух идентичных пар полипептидных цепей, при этом каждая пара включает одну «легкую» (L) цепь и одну «тяжелую» (Н) цепь. Легкие цепи человека подразделяются на каппа- и лямбда-легкие цепи. Тяжелые цепи подразделяются на мю, дельта, гамма, альфа или эпсилон и определяют изотип антитела как IgM, IgD, IgG, IgA и IgE соответственно. В легких и тяжелых цепях вариабельные и константные области соединены областью «J», состоящей примерно из 12 или более аминокислот, при этом тяжелая цепь также включает область «D», состоящую примерно из 3 или более аминокислот. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно обозначаемой в настоящем документе HCVR или VL) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначаемой в настоящем документе LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплемента. Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, называемые определяющими комплементарность областями (complementarity determining region, CDR), перемежающиеся с областями, которые являются более консервативными и называются каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от аминоконца к карбоксиконцу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области каждой пары тяжелой/легкой цепи (VH и VL) соответственно образуют центр связывания антитела. Термин «антитело» включает антитело, которое представляет собой часть мультимера антитела (мультимерная форма антител), такого как димеры, тримеры или мультимеры мономерных антител более высокого порядка. Данный термин также включает антитело, связанное или присоединенное, или иным образом физически или функционально ассоциированное с молекулой, не представляющей собой антитело. Кроме того, термин «антитело» не ограничивается каким-либо конкретным способом получения антитела. Например, он включает, в том числе рекомбинантные антитела, синтетические антитела, моноклональные антитела, поликлональные антитела, биспецифические антитела и полиспецифические антитела.
В настоящем описании термин «производное антитела» относится к молекуле, которая способна связываться с тем же антигеном, с которым связывается антитело, из которого она получена, и содержит аминокислотную последовательность, которая является такой же или схожей с антителом, связанную с дополнительной молекулой. Аминокислотная последовательность антитела, содержащаяся в производном антитела, может представлять собой полноразмерное антитело или может представлять собой какую-либо часть или части полноразмерного антитела. Указанная дополнительная молекула может представлять собой химическую или биологическую молекулу. Примеры дополнительных молекул включают химические группы, аминокислоты, пептиды, белки (такие как ферменты, антитела) и химические соединения. Дополнительная молекула может быть полезна, например, для применения в качестве детектирующего агента, метки, маркера, фармацевтического или терапевтического агента. Аминокислотная последовательность антитела может быть присоединена или связана с дополнительной молекулой путем химического сочетания, генетического слияния, нековалентной ассоциации или иным образом. Термин «производное антитела» также включает химерные антитела, гуманизированные антитела и молекулы, полученные в результате модификаций аминокислотных последовательностей антитела, таких как консервативные замены, присоединения и встраивания аминокислот.
В настоящем описании термин «антиген» относится к любому веществу, которое способно индуцировать адаптивный иммунный ответ. Антиген может представлять собой целую клетку (например, бактериальную клетку), вирус, грибок или их антигенную часть, или компонент. Примеры антигенов включают, но не ограничиваются указанными, микробные патогены, бактерии, вирусы, белки, гликопротеины, липопротеины, пептиды, гликопептиды, липопептиды, анатоксины, углеводы, опухолеспецифические антигены и их антигенные части или компоненты.
В настоящем описании термин «антигенсвязывающий фрагмент» антитела относится к одной или более частям полноразмерного антитела, которые сохраняют способность связываться с тем же антигеном, с которым связывается указанное антитело.
В настоящем описании термины «иммуноглобулин», «молекула иммуноглобулина» и «IG» включают (1) антитела, (2) антигенсвязывающие фрагменты антитела и (3) производные антитела, каждый из которых определен в настоящем документе. Как описано в настоящем документе, иммуноглобулин может быть получен из (например, фракционирован из, выделен из, очищен от, концентрирован из и т.д.) композиций объединенной плазмы (например, для введения субъекту). В настоящем описании термин «внутривенный иммуноглобулин (IVIG)» относится к традиционному иммуноглобулину, полученному из плазмы от более чем одной тысячи случайных людей-доноров, тогда как термин «IVIG согласно настоящему изобретению», например, PCB-IVIG, описанный в настоящем документе и, в частности, в разделе «Примеры», относится к иммуноглобулину, полученному от одной тысячи или более людей-доноров в соответствии со способами согласно настоящему изобретению, который содержит повышенный титр РСВ-специфичных антител и повышенный титр антител к одному или более другим респираторным патогенам (например, вирусу парагриппа 1, вирусу парагриппа 2, коронавирусу ОС43 и/или коронавирусу 229Е) по сравнению с контрольным образцом (например, традиционным IVIG, полученным из смеси образцов плазмы, полученных от 1000 или более случайных людей-доноров плазмы). В настоящем описании термины «гипериммунный глобулин», «гипериммунный сывороточный глобулин» и «гипериммунный иммуноглобулин» относятся к глобулину иммунной сыворотки, имеющему высокий титр антител, специфичных к одному организму или антигену (например, специфичных к гепатиту, специфичных к столбняку, специфичных к бешенству или специфичных к ветряной оспе), полученному из плазмы или сыворотки, полученной от донора (доноров), содержащей повышенный титр антител к одному конкретному организму или антигену. Например, иммуноглобулин против ветряной оспы (ВЗИГ (VZIG), Massachusetts Public Health Biologic Laboratories, Бостон, Массачусетс; или ВАРИЗИГ, Cangene Corporation, Виннипег, Канада) представляет собой очищенный иммуноглобулин человека, который имеет высокий титр антител, специфичных к ветряной оспе, полученный от нескольких сотен доноров плазмы, и не имеет значительных титров антител или имеет пониженные титры антител к другим организмам или антигенам (например, кори). Другие продукты гипериммунного глобулина, как правило, получают от доноров, которые были иммунизированы от конкретного патогена или антигена (например, иммуноглобулин против бешенства, ГИПЕРРАБ, Grifols, Клейтон, Северная Каролина, полученный от нескольких сотен или менее доноров, иммунизированных вакциной против бешенства). Коммерчески доступные продукты гипериммунного глобулина не удовлетворяют спецификациям FDA для инфузии у некоторых популяций пациентов (например, пациентов с иммунодефицитом).
В настоящем описании термин «образец с антителами» относится к композиции, содержащей антитела (например, жидкость (например, плазма, кровь, очищенные антитела, фракции крови или плазмы, компоненты крови или плазмы и т.д.)), полученной от донора или предоставленной донором (например, природный источник), или полученной из синтетического, рекомбинантного источника, другого источника in vitro или из коммерческого источника. Образец с антителами может демонстрировать повышенный титр конкретного антитела или набора антител на основе воздействия патогенов/антигенов (например, естественное воздействие или посредством вакцинации) на донора, или антител, разработанных для выработки в синтетических, рекомбинантных условиях или условиях in vitro. В настоящем описании образец с антителами, содержащий повышенный титр антител к X, называется «образцом с повышенными антителами к X». Например, образец с антителами, содержащий повышенный титр антител к цитомегаловирусу, называется «образцом с повышенными антителами к цитомегаловирусу».
В настоящем описании термин «выделенное антитело» или «выделенная связывающая молекула» относится к антителу или связывающей молекуле, идентифицированной и отделенной по меньшей мере от одной примеси, с которой она обычно связана в источнике. Примеры выделенного антитела включают: антитело, которое: (1) не связано с одним или более естественным образом связанными компонентами, которые сопровождают его в природном состоянии; (2) по существу свободно от других белков из источника происхождения; или (3) экспрессировано рекомбинантным способом, in vitro, или в бесклеточной системе, или получено путем синтеза и извлечено из среды, в которой оно было получено.
В настоящем описании термины «объединенная плазма», «объединенные образцы плазмы» и «композиция объединенной плазмы» относятся к смеси двух или более образцов плазмы и/или полученной из нее композиции (например, иммуноглобулин). Повышенный титр конкретного антитела или набора антител в объединенной плазме отражает повышенные титры в образцах с антителами, которые составляют указанную объединенную плазму. Например, образцы плазмы могут быть получены от субъектов, которые были вакцинированы (например, вакциной), или которые демонстрируют от природы высокие титры антител к одному или более патогенам по сравнению с уровнем (уровнями) антител, обнаруживаемыми у популяции в целом. После объединения образцов плазмы получают композицию объединенной плазмы (например, содержащую повышенный титр антител, специфичных к конкретному патогену). В настоящем описании объединенная плазма с повышенным титром антител к Х (например, где «X» представляет собой микробный патоген) называется «пулом, содержащим повышенные антитела к X». Например, объединенная плазма с повышенным титром антител к цитомегаловирусу называется «пулом, содержащим повышенные антитела к цитомегаловирусу». Также в настоящем описании употребляется термин «первичный пул антител», который относится к смеси двух или более образцов плазмы. Повышенный титр конкретного антитела или набора антител в первичном пуле антител отражает повышенные титры в образцах с антителами, которые составляют указанный первичный пул антител. Например, многие порции донорской плазмы могут быть получены от субъектов, которые были вакцинированы (например, поливалентной вакциной Pseudomonas aeruginosa). После объединения образцов плазмы получают первичный пул антител, содержащий повышенный титр антител к Pseudomonas aeruginosa. В настоящем описании первичный пул антител с повышенным титром антител к Х (например, где «X» представляет собой микробный патоген) называется «пулом, содержащим повышенные антитела к X». Например, первичный пул антител с повышенным титром антител к цитомегаловирусу называется «пулом, содержащим повышенные антитела к цитомегаловирусу». Композиции объединенной плазмы можно применять для получения иммуноглобулина (например, который затем вводят субъекту) способами, известными в данной области техники (например, фракционирование, очистка, выделение и т.д.). Настоящее изобретение предусматривает введение как композиций объединенной плазмы, так и полученного из них иммуноглобулина субъекту для обеспечения полезного профилактического и/или терапевтического эффекта для указанного субъекта. Соответственно, термин «композиция объединенной плазмы» может относиться к иммуноглобулину, полученному из объединенной плазмы/объединенных образцов плазмы.
В настоящем описании термин «вторичный пул антител» или «специально созданный пул антител» относится к смеси двух или более первичных пулов антител. Такой пул, например, может быть специально создан таким образом, чтобы демонстрировать повышенный титр конкретных антител или наборов антител путем комбинирования первичных пулов, демонстрирующих такие повышенные титры. Например, первичный пул с повышенным титром антител к Pseudomonas aeruginosa можно комбинировать с первичным пулом с повышенным титром антител к вирусу ветряной оспы с получением специально созданного пула антител с повышенным титром антител к Pseudomonas aeruginosa и вирусу ветряной оспы.
В настоящем описании термин «пул с добавлением антител» относится к объединенному образцу плазмы (например, первичный или специально созданный пул антител), который содержит антитела по меньшей мере из одного природного источника с добавлением или в комбинации с антителами или другим иммуноглобулином, полученным путем синтеза, рекомбинантными способами или другими способами in vitro. В настоящем описании термин «выделенное антитело» или «выделенная связывающая молекула» относится к антителу или связывающей молекуле, идентифицированной и отделенной по меньшей мере от одной примеси, с которой она обычно связана в источнике. Примеры выделенного антитела включают: антитело, которое: (1) не связано с одним или более естественным образом связанными компонентами, которые сопровождают его в природном состоянии; (2) по существу свободно от других белков из источника происхождения; или (3) экспрессировано рекомбинантным способом, in vitro, или в бесклеточной системе, или получено путем синтеза и извлечено из среды, в которой оно было получено.
В настоящем описании термин «очищенный» или «очищать» означает результат любого процесса, позволяющего удалить некоторые примеси из представляющего интерес компонента, такого как белок (например, антитело) или нуклеиновая кислота. Таким образом повышают процент очищенного компонента в образце.
В настоящем описании термин «иммунотерапевтические агенты» относится к химическому или биологическому веществу, которое может усиливать иммунный ответ (например, специфический или общий) у млекопитающего. Примеры иммунотерапевтических агентов включают: пассивно вводимые первичные пулы антител; специально созданные пулы антител (например, пассивно вводимые специально созданные пулы антител); вакцины, хемокины, антитела, фрагменты антител, бациллу Кальметта-Герена (БЦЖ); цитокины, такие как интерфероны; вакцины, такие как персонализированная иммунотерапия МиВакс (MyVax personalized immunotherapy), Онивакс-Р (Onyvax-P), Онкофаг, GRNVAC1, ФавИд (FavId), Провендж, ГВАКС (GVAX), Ловаксин-Ц (Lovaxin С), БиоваксИД (BiovaxID), GMXX и НеуВакс (NeuVax); и антитела, такие как алемтузумаб (КЭМПАС), бевацизумаб (АВАСТИН), цетуксимаб (ЭРБИТУКС), гемтузумаб озогамицин (МИЛОТАРГ), ибритумомаб тиуксетан (ЗЕВАЛИН), панитумумаб (ВЕКТИБИКС), ритуксимаб (РИТУКСАН, МАБТЕРА), трастузумаб (ГЕРЦЕПТИН), тозитумомаб (БЕКСАР), тремелимумаб, CAT-3888, агонистические антитела к рецептору CD40, описанные в WO2003/040170, и любое иммуномодулирующее вещество.
В настоящем описании термин «донор» относится к субъекту, предоставляющему биологический образец (например, кровь, плазму и т.д.). Донор/образец от донора может быть подвергнут скринингу на присутствие или отсутствие конкретных патогенов (например, с использованием руководства Управления США по контролю за качеством пищевых продуктов и лекарственных средств (FDA) для оценки стандартов безопасности для продуктов крови (например, изданного Консультативным комитетом FDA по продуктам крови)). Например, донор/образец от донора может быть подвергнут скринингу в соответствии с руководством FDA для подтверждения отсутствия одного или более передающихся с кровью патогенов (например, вирус иммунодефицита человека (ВИЧ) 1 (ВИЧ-1), ВИЧ-2; Treponema pallidum (сифилис); Plasmodium falciparum, P. malariae, P. ovale, P. vivax или Р. knowlesi (малярия); вирус гепатита В (HBV), вирус гепатита С (HCV); прионы (болезнь Крейтцфельдта-Якоба); вирус Западного Нила; парвовирус; Typanosoma cruzi; коронавирус, вызывающий ТОРС, вирус осповакцины или другой патоген, на предмет которого обычно проводят скрининг или рекомендуется проводить скрининг таким регулирующим органом, как FDA). В настоящем описании термины «отобранный донор», «отобранный субъект, представляющий собой человека» и т.п. относятся к субъекту, выбранному и/или идентифицированному для предоставления биологического образца (например, крови, плазмы и т.д.) на основе наличия желаемой характеристики у данного биологического образца (например, конкретного титра (например, высокого, среднего или низкого титра) антител (например, определенного с использованием одного или более методов скрининга (например, анализа нейтрализации или другого анализа, описанного в настоящем документе), специфичных к одному или более патогенам (например, одному или более респираторным патогенам (например, респираторно-синцитиальному вирусу))). Например, в одном из вариантов реализации, описанных в настоящем документе, отобранный донор с высоким титром (например, идентифицированный путем получения характеристик конкретного титра антител к респираторно-синцитиальному вирусу путем первого скринингового анализа плазмы, используемого для оценки РСВ-нейтрализующей активности в образце плазмы от донора; и второго скринингового анализа, характеризующего конкретный титр антител очищенной фракции иммуноглобулинов в каждом образце плазмы от донора, идентифицированном как демонстрирующий верхние 20% нейтрализующей активности с использованием первого скринингового анализа плазмы, при этом очищенную фракцию иммуноглобулинов, демонстрирующую титр РСВ-нейтрализующих антител 1800 или выше, используют для отнесения образца плазмы к категории отобранного донора с высоким титром) имеет титр патогенспецифических антител, который примерно в 1,5-2,0 раза, в 2-5 раз, в 5-8 раз, в 8-10 раз, в 10-14 раз, в 14 или более раз больше стандартного значения (титра патогенспецифических антител, присутствующих в пуле образцов плазмы от 1000 или более случайных субъектов, представляющих собой людей), при этом доноры со средним титром имеют титр патогенспецифических антител, который представляет собой титр патогенспецифических антител, присутствующих в пуле образцов плазмы от 1000 или более случайных субъектов, представляющих собой людей, или который лишь незначительно выше (например, на 5-20% выше) или незначительно ниже (например, на 5-20% ниже) данного значения, и при этом доноры с низким титром имеют титр патогенспецифических антител, который составляет примерно 20-50 процентов от титра патогенспецифических антител, присутствующих в пуле образцов плазмы от 1000 или более случайных субъектов, представляющих собой людей. В настоящем описании термины «неотобранный донор», «случайный донор», «случайный субъект, представляющий собой человека» и т.п. при употреблении к образцу от донора (например, крови, плазмы и т.д.), используемому для получения пула образцов от доноров, относятся к субъекту, предоставляющему биологический образец (например, кровь, плазму и т.д.) без конкретных сведений о характеристиках (например, титре антител в одному или более патогенам) данного образца. Таким образом, случайный донор/образец от случайного донора может представлять собой субъекта/образец, удовлетворяющий требованиям FDA для скрининга на предмет передающихся с кровью патогенов и неотобранный на основе титров антител (например, титров антител, специфичных к респираторным патогенам). В одном из вариантов реализации, описанных в настоящем документе, титр для донора/образца от донора из не тестированного/неотобранного источника устанавливают равным нулю. Если объединяют биологические образцы от группы отобранных доноров, отобранных на основании одной и той же характеристики, получаемый таким образом пул (например, первичный пул) будут усиливать в отношении выбранной характеристики. С другой стороны, если объединяют биологические образцы от группы неотобранных случайных доноров, случайные различия между биологическими образцами будут усреднены, и получаемый таким образом пул (например, первичный пул) не будут усиливать в отношении какой-либо конкретной характеристики. Предпочтительным является проведение скрининга как случайных доноров/образцов от случайных доноров, так и отобранных доноров/образцов от отобранных доноров (например, с использованием требований FDA для скрининга) для подтверждения отсутствия передающихся с кровью патогенов (например, до и/или после объединения). Кроме того, в соответствии с одним из вариантов реализации настоящего изобретения и как подробно описано в настоящем документе, биологические образцы (например, образцы плазмы) от одного или более отобранных доноров могут быть смешаны с биологическими образцами (например, образцами плазмы) от одного или более других отобранных доноров (например, отобранных на основании одинаковой или разной характеристики (например, одинаковый или разный титр (например, высокий, средний или низкий титр) антител к конкретному патогену) и/или смешаны с биологическими образцами (например, образцами плазмы) от одного или более неотобранных доноров для получения композиции объединенной плазмы (например, содержащей желаемый стандартизированный уровень антител к одному или более конкретным патогенам (например, одному или более респираторным патогенам)).
В настоящем описании термин «иммуностимулирующее количество» относится к такому количеству вакцины (например, противовирусной, антибактериальной и/или противогрибковой вакцины), которое способно стимулировать иммунный ответ. Иммунный ответ включает набор биологических эффектов, приводящих к выработке организмом иммуноглобулинов или антител в ответ на чужеродный элемент. Соответственно, термин «иммунный ответ» относится к активации В-клеток, in vivo или в культуре, путем стимуляции рецепторных молекул Ig поверхности В-клеток. Измерение иммунного ответа находится в рамках компетенции специалиста в данной области техники и включает определение уровней антител с использованием способов, описанных в серии Р. Tijssen, Laboratory Techniques in Biochemistry and Molecular Biology: Practice and Theory of Enzyme Immunoassays, (Burdon & van Knippenberg eds., 3rd ed., 1985) Elsevier, New York; и Antibodies: A Laboratory Manual, (Harlow & Lane eds., 1988), Cold Spring Harbor Laboratory Press; а также процедур, таких как противоточный иммуноэлектрофорез (GIEP), радиоиммуноанализ, радиоиммунопреципитация, твердофазный иммуноферментный анализ (ELISA), дот-блот-анализы и анализы «сэндвич»-типа, см. патенты США №№4376110 и 4486530, содержание всех из которых включено посредством ссылки. Измерение иммунного ответа также включает детектирование или определение явлений активации В-клеток, которые могут предшествовать выработке антител или сигнализировать о повышении выработки антител. Такие измерения включают анализы пролиферации В-клеток, анализы фосфорилирования, анализы внутрицитоплазматической концентрации свободного кальция и другие способы определения активации В-клеток, известные в данной области техники. Типичные анализы приведены в Mongini et al., J. Immunol. 159: 3782-91 (1997); Frade, et al., BBRC 188: 833-842 (1992); Tsokos et al., J. Immunol. 144: 1640-1645 (1990); Delcayre et al., BBRC 159: 1213-1220 (1989); и Nemerow et al., J. Immunol. 135: 3068-73 (1985), содержание каждого из которых включено посредством ссылки. В предпочтительных вариантах реализации практическое применение настоящего изобретения включает способствование, усиление или стимуляцию иммунного ответа. Данные действия относятся к формированию иммунного ответа, которого ранее не было; к оптимизации или повышению желаемого иммунного ответа; к формированию или повышению вторичного ответа, характеризующегося повышенным переключением изотипа, анамнестической реакцией или тем и другим; к обеспечению статистически повышенного иммунозащитного эффекта в отношении патогена; к вызову эквивалентного или более сильного гуморального иммунного ответа или другой меры активации В-клеток при пониженной или ограничивающей дозе антигена; к вызову повышенного гуморального иммунного ответа или другой меры активации В-клеток в ответ на эквивалентную дозу антигена; или к снижению порога аффинности для активации В-клеток in vivo или in vitro. Предпочтительно, термин «иммуностимулирующее количество» относится к такому количеству вакцины, которое способно стимулировать иммунный ответ у субъекта (например, донора) и на основе которого плазму, сыворотку или другой компонент крови субъекта забирают для применения в композициях и способах согласно настоящему изобретению (например, для терапевтического и/или профилактического лечения микробной (например, вирусной, бактериальной и/или грибковой) инфекции у субъекта, которого лечат композициями и способами, описанными в настоящем документе).
Термины «буфер» или «буферные агенты» относятся к веществам, которые при добавлении к раствору делают указанный раствор устойчивым к изменениям pH.
Термины «восстановитель» и «донор электронов» относятся к веществу, которое отдает электроны второму веществу с уменьшением степени окисления одного или более атомов второго вещества.
Термин «соль одновалентного металла» относится к любой соли, в которой металл (например, Na, K или Li) имеет суммарный заряд 1+ в растворе (т.е. число протонов на единицу больше числа электронов).
Термин «соль двухвалентного металла» относится к любой соли, в которой металл (например, Mg, Ca или Sr) имеет суммарный заряд 2+ в растворе.
Термины «хелатор» или «хелатообразующий агент» относятся к любым веществам, содержащим более одного атома с неподеленной парой электронов, которые доступны для образования связи с ионом металла.
Термин «раствор» относится к водной или неводной смеси.
В настоящем описании термин «адъювант» относится к любому веществу, которое может стимулировать иммунный ответ (например, иммунный ответ слизистой оболочки). Некоторые адъюванты могут вызывать активацию клетки иммунной системы (например, адъювант может вызывать выработку и секрецию цитокина иммунной клеткой). Примеры адъювантов, которые могут вызывать активацию клетки иммунной системы, включают, но не ограничиваются указанными, составы в виде наноэмульсий, описанные в настоящем документе, сапонины, выделенные из коры дерева Q. saponaria, такие как QS21 (гликолипид, который элюируется в 21 пике при фракционировании ВЭЖХ; Aquila Biopharmaceuticals, Inc., Вустер, Массачусетс); поли(ди(карбоксилатофенокси)фосфазен (полимер РСРР; Научно-исследовательский институт вирусов (Virus Research Institute), США); производные липополисахаридов, такие как монофосфориллипид A (MPL; Ribi ImmunoChem Research, Inc., Гамильтон, Монтана), мурамилдипептид (MDP; Ribi) и треонилмурамилдипептид (t-MDP; Ribi); ОМ-174 (глюкозамина дисахарид, связанный с липидом А; ОМ Pharma SA, Мерен, Швейцария); холерный токсин (СТ) и фактор элонгации Leishmania (очищенный белок Leishmania; Corixa Corporation, Сиэтл, Вашингтон). Традиционные адъюванты хорошо известны в данной области техники и включают, например, фосфатные или гидроксосоли алюминия («квасцы»). В некоторых вариантах реализации композиции согласно настоящему изобретению вводят совместно с одним или более адъювантами (например, для «сдвига» иммунного ответа в направлении ответа Th1- и/или Th2-типа). В некоторых вариантах реализации используют адъюванты, описанные в US 2005158329; US 2009010964; US 2004047882; или US 6262029 (полное содержание каждого из которых включено в настоящее описание посредством ссылки).
В настоящем описании термин «количество, эффективное для индукции иммунного ответа» (например, композиции для индукции иммунного ответа) относится к уровню дозы, необходимому (например, при введении субъекту) для стимуляции, формирования и/или вызова иммунного ответа у указанного субъекта. Эффективное количество может быть введено в одном или более введениях (например, одинаковым или разными путями), применениях или дозировках, и не ограничивается конкретным составом или путем введения.
В настоящем описании термин «в таких условиях, при которых у указанного субъекта формируется иммунный ответ» относится к любой качественной или количественной индукции, формированию и/или стимуляции иммунного ответа (например, врожденного или приобретенного).
В настоящем описании термин «иммунный ответ» относится к ответу со стороны иммунной системы субъекта. Например, иммунные ответы включают, но не ограничиваются указанными, детектируемое изменение (например, увеличение) активации Toll-подобного рецептора (TLR), экспрессии и/или секреции лимфокинов (например, цитокинов (например, цитокинов Th1- или Th2-типа) или хемокинов), активации макрофагов, активации дендритных клеток, активации Т-клеток (например, CD4+ или CD8+ Т-клеток), активации природных клеток-киллеров (NK) и/или активации В-клеток (например, выработки и/или секреции антител). Дополнительные примеры иммунных ответов включают связывание иммуногена (например, антигена (например, иммуногенного полипептида)) с молекулой главного комплекса гистосовместимости (МНС) и индукцию ответа цитотоксических Т-лимфоцитов («CTL»), индукцию ответа В-клеток (например, выработки антител) и/или ответа хелперных Т-лимфоцитов, и/или реакции гиперчувствительности замедленного типа (DTH) на антиген, из которого происходит указанный иммуногенный полипептид, рост (например, рост популяции клеток) клеток иммунной системы (например, Т-клеток, В-клеток (например, на любой стадии развития (например, плазматических клеток)) и увеличение процессирования и представления антигена антигенпредставляющими клетками. Иммунный ответ может быть на иммуногены, которые иммунная система субъекта признает чужеродными (например, экзоантигены микроорганизмов (например, патогенов) или аутоантигены, распознаваемые как чужеродные). Таким образом, следует понимать, что в настоящем описании термин «иммунный ответ» относится к любому типу иммунного ответа, включая, но не ограничиваясь указанными, врожденный иммунный ответ (например, активация сигнального каскада рецепторов Toll), клеточно-опосредованные иммунные ответы (например, ответы, опосредуемые Т-клетками (например, антигенспецифическими Т-клетками) и неспецифическими клетками иммунной системы) и гуморальные иммунные ответы (например, ответы, опосредуемые В-клетками (например, через выработку и секрецию антител в плазму, лимфу и/или тканевые жидкости)). Термин «иммунный ответ» включает все аспекты способности иммунной системы субъекта отвечать на антигены и/или иммуногены (например, как первоначальный ответ на иммуноген (например, патоген), так и приобретенные (например, анамнестические) ответы, которые являются результатом адаптивного иммунного ответа).
В настоящем описании термины «иммуноген» и «антиген» относятся к агенту (например, микроорганизму (например, бактерии, вирусу или грибку) и/или его части, или компоненту (например, белковому антигену или полисахариду)), который способен вызывать иммунный ответ у субъекта.
В настоящем описании термин «антиген Streptococcus» (например, S. pneumoniae) относится к компоненту или продукту бактерий рода Streptococcus, который вызывает иммунный ответ при введении субъекту.
В настоящем описании термин «патогенный продукт» относится к любому компоненту или продукту, полученному из патогена, включая, но не ограничиваясь указанными, полипептиды, пептиды, белки, нуклеиновые кислоты, мембранные фракций и полисахариды.
В настоящем описании термины «фармацевтически приемлемый» или «фармакологически приемлемый» относятся к композициям, которые по существу не вызывают нежелательных реакций (например, токсических, аллергических или иммунологических реакций) при введении субъекту.
В настоящем описании термин «фармацевтически приемлемый носитель» относится к любому из стандартных фармацевтических носителей, включая, но не ограничиваясь указанными, фосфатный буферный раствор, воду и различные типы смачивающих агентов (например, лаурилсульфат натрия), все растворители, дисперсионные среды, покрытия, лаурилсульфат натрия, изотонические и замедляющие абсорбцию агенты, разрыхлители (например, картофельный крахмал или крахмалгликолят натрия), полиэтилгликоль, другие природные и не встречающиеся в природе носители, и т.п. Композиции также могут содержать стабилизаторы и консерванты. Примеры носителей, стабилизаторов и адъювантов описаны и хорошо известны в данной области техники (см., например, Martin, Remington's Pharmaceutical Sciences, 15th Ed., Mack Publ. Co., Easton, Pa. (1975), содержание которого включено в настоящее описание посредством ссылки).
В настоящем описании термин «фармацевтически приемлемая соль» относится к любой соли (например, полученной путем реакции с кислотой или основанием) композиции согласно настоящему изобретению, которая физиологически переносится у целевого субъекта. «Соли» композиций согласно настоящему изобретению могут быть получены из неорганических или органических кислот и оснований. Примеры кислот включают, но не ограничиваются указанными, хлористоводородную, бромистоводородную, серную, азотную, хлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную, п-толуолсульфоновую, винную, уксусную, лимонную, метансульфоновую, этансульфоновую, муравьиную, бензойную, малоновую, сульфоновую, нафталин-2-сульфоновую, бензолсульфоновую кислоту и т.п. Другие кислоты, такие как щавелевая кислота, хотя и не являются сами по себе фармацевтически приемлемыми, могут быть использованы для получения солей, подходящих в качестве промежуточных соединений при получении композиций согласно настоящему изобретению и их фармацевтически приемлемых солей присоединения кислоты. Примеры оснований включают, но не ограничиваются указанными, гидроксиды щелочных металлов (например, натрия), гидроксиды щелочноземельных металлов (например, магния), аммиак и соединения формулы NW4+ где W представляет собой С1-4 алкил, и т.п.
Примеры солей включают, но не ограничиваются указанными: ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, хлорид, бромид, иодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, пальмоат, пектинат, персульфат, фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат, ундеканоат и т.п. Другие примеры солей включают анионы соединений согласно настоящему изобретению в сочетании с подходящим катионом, таким как Na+, NR4+ и NW4+ (где W представляет собой C1-4 алкильную группу) и т.п. Предполагается, что для терапевтического применения соли соединений согласно настоящему изобретению являются фармацевтически приемлемыми. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, могут также найти применение, например, для получения или очистки фармацевтически приемлемого соединения.
Предполагается, что для терапевтического применения соли композиций согласно настоящему изобретению являются фармацевтически приемлемыми. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, могут также найти применение, например, для получения или очистки фармацевтически приемлемой композиции.
В настоящем описании термины «с риском инфицирования» и «с риском заболевания» относятся к субъекту, предрасположенному к конкретной инфекции или заболеванию (например, респираторной инфекции или заболеванию). Данная предрасположенность может быть генетической (например, конкретная генетическая склонность к заболеванию, такая как наследственные нарушения) или обусловленной другими факторами (например, иммуносупрессией, ослабленной иммунной системой, иммунодефицитом, условиями окружающей среды, воздействием вредных соединений, присутствующих в окружающей среде, и т.д.). Таким образом, настоящее изобретение не ограничивается каким-либо конкретным риском (например, субъект может подвергаться «риску заболевания» если просто он подвергается воздействию и взаимодействует с другими людьми), и настоящее изобретение также не ограничивается каким-либо конкретным заболеванием.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композициям и способам для лечения иммунодефицита (например, первичного иммунодефицитного заболевания). В частности, согласно настоящему изобретению предложены композиции объединенной плазмы человека и/или полученный из них иммуноглобулин, способы идентификации плазмы человека для применения в композициях, способы изготовления (например, с использованием способов объединения и смешивания, описанных в настоящем документе) композиций и способы применения композиций (например, для профилактического введения и/или терапевтического лечения (например, пассивной иммунизации (например, иммунопрофилактики))).
Иммуноглобулин, получаемый из плазмы тысяч разных доноров, включает антитела ко многим патогенам, с которыми данные индивидуумы «сталкивались» на протяжении жизни. Однако существует значительное ограничение. Поскольку объединяют иммуноглобулин от тысяч доноров, титры антител ко многим инфекционным организмам (например, микробным патогенам), от которых требуется защита, сильно варьируются и очень часто недостаточны для удовлетворения потребностей в иммунитете в случае инфицирования (например, патогеном) у индивидуума с супрессией иммунитета.
Гипериммунные сывороточные глобулины (сывороточный иммуноглобулин с высокими титрами конкретного антитела) в отличие от нормального иммуноглобулина подходили для терапевтического лечения пациентов, которым требуется немедленная инфузия высоких титров антител. Например, противостолбнячный гипериммунный глобулин подходит для лечения пациентов, у которых могут подозревать столбняк, и гипериммунный глобулин против бешенства - для лечения пациентов с подозрением на бешенство. Гипериммунные сывороточные глобулины могут быть получены из плазмы или сыворотки, полученной от отобранного донора (доноров) с повышенными титрами конкретного антитела по сравнению с обычно обнаруживаемыми у популяции в среднем (т.е. не обнаруживается в высоком титре у популяции в среднем). Данные доноры либо были недавно иммунизированы конкретной вакциной (см., например, патент США №4174388), либо же они недавно оправились от инфекции или заболевания (см., например, Stiehm, Pediatrics, Vol. 63, No. 1, 301-319 (1979); полное содержание которого включено в настоящее описание посредством ссылки). Данные сыворотки или плазму с высоким титром объединяют и подвергают процедурам фракционирования (Cohn et al, J. Am. Chem. Soc., 68, 459 (1946); Oncley, et al, J. Am. Chem. Soc., 71, 541 (1949); полное содержание которых включено в настоящее описание посредством ссылки). Такие процедуры требовали специального отбора донора или ограниченного числа доноров для получения гипериммунного глобулина с повышенными концентрациями желаемых антител.
В системе верхних дыхательных путей человека обычно встречается множество различных микроорганизмов. S. pneumonias является одним из таких примеров. Тогда как S. pneumoniae является частью нормальной флоры верхних дыхательных путей, как и во многих случаях естественной флоры, она может стать патогенной в определенных условиях (например, если иммунная система хозяина подавлена). Это также имеет место и в случае других инфекций, которые становятся вирулентными у хозяев с супрессией иммунитета.
Цитомегаловирус (ЦМВ) представляет собой род вирусов, некоторые из которых могут инфицировать людей и вызывать заболевание. Тогда как инфекция не распространена среди населения в целом, она очень часто встречается у некоторых восприимчивых групп пациентов. Пациенты, которым проведена трансплантация органа, и страдающие раком пациенты с супрессией иммунитета были идентифицированы как подвергающиеся необычайно высокому риску заражения тяжелой и иногда смертельной ЦМВ-инфекцией.
Респираторно-синцитиальный вирус (РСВ) считается самой важной причиной тяжелого респираторного заболевания у младенцев и детей младшего возраста. Он может также являться важной причиной заболевания нижних дыхательных путей у пациентов пожилого возраста, пациентов, которым проведена трансплантация гематопоэтических стволовых клеток, и пациентов, которым проведена трансплантация органа. Существуют данные о том, что в одних лишь Соединенных Штатах данный вирус вызывает пневмонию, бронхит и круп у приблизительно 4 миллионов детей каждый год, приводящие к смерти примерно 4500 человек. В западном мире он является основной причиной госпитализации детей (National Research Council News Report, 35, 9 (1985); Stott, E.J. et al. Archives of Virology, 84: 1-52 (1985); и W.H.O. Scientific Group, World Health Organization Technical Report Series 642 (1980); полное содержание которых включено в настоящее описание посредством ссылки).
Вирус ветряной оспы (VZV) является причиной клинического заболевания, которое хотя и не распространено среди населения в целом, часто встречается у некоторых восприимчивых групп пациентов. Пациенты, которым проведена трансплантация органа, и страдающие раком пациенты с супрессией иммунитета были идентифицированы как подвергающиеся необычайно высокому риску заражения тяжелой и иногда смертельной VZV-инфекцией. Zaia et al. в The Journal of Infectious Diseases, Vol. 137, No. 5, 601-604 (1978) описали практический способ получения иммуноглобулина VZV для внутримышечного введения. Устаревшую кровь подвергали скринингу на предмет комплементсвязывающего антитела к VZV. Примерно 15% единиц плазмы содержали титр комплементсвязывающих антител, равный или больше 1:16, и примерно 7,5% - больше или равный 1:32.
Pseudomonas aeruginosa (P. aeruginosa) представляет собой распространенную бактерию, которая может вызывать заболевание у животных, включая людей. Хотя инфицирование Р. aeruginosa не распространено среди населения в целом, инфекция, вызываемая Р. aeruginosa, очень часто встречается у некоторых восприимчивых групп пациентов. Жертвы ожогов, страдающие раком пациенты с супрессией иммунитета и индивидуумы с длительным пребыванием в больнице были идентифицированы как подвергающиеся необычайно высокому риску тяжелого и иногда смертельного заболевания, вызываемого Р. aeruginosa. James et al. в The Lancet, 13 December 1980, 1263-1265 (полное содержание которого включено в настоящее описание посредством ссылки) описали пассивную иммунизацию ожоговых пациентов с риском сепсиса. Иммунизацию проводили иммуноглобулином, полученным из плазмы здоровых добровольцев, представляющих собой людей, вакцинированных поливалентной вакциной Pseudomonas.
Настоящее изобретение относится к композициям и способам для лечения иммунодефицита (например, первичного иммунодефицитного заболевания). В частности, согласно настоящему изобретению предложены композиции объединенного иммуноглобулина плазмы человека, способы идентификации плазмы человека для применения в композициях, способы изготовления композиций и способы применения композиций (например, для профилактического введения и/или терапевтического лечения (например, пассивной иммунизации (например, иммунопрофилактики))). В одном из вариантов реализации настоящего изобретения предложена композиция, содержащая объединенные образцы плазмы, полученные от 1000 или более субъектов, представляющих собой людей, при этом указанная объединенная плазма содержит повышенные уровни титров патогенспецифических антител к одному или более респираторным патогенам по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. Настоящее изобретение не ограничивается типом респираторных патогенов, к которым объединенная плазма содержит повышенные уровни титров патогенспецифических антител. Композиция объединенной плазмы может содержать повышенные уровни титров патогенспецифических антител к одному или более из: респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса, коронавируса, S. pneumonia, H. influenza, L. pneumophila. Streptococcus группы А, или любому другому респираторному патогену, известному специалисту в данной области техники или описанному в настоящем документе. В некоторых вариантах реализации настоящего изобретения предложена композиция, содержащая объединенные образцы плазмы, для пассивной иммунизации пациентов, восприимчивых или страдающих инфекцией (например, бактериальной инфекцией (например, связанной со Streptococcus pneumonia, Haemophilus influenza и т.д.), вирусной инфекцией (например, связанной с аденовирусом, вирусом герпеса, вирусом гриппа, риновирусом и т.д.), грибковой инфекцией (например, связанной с Aspergillus fumigatus, Cladosporium или другими грибками) и/или воздействием микробных токсинов и/или вредных веществ (например, яда животных))).
Соответственно, в настоящем документе описаны способы и композиции для пассивной иммунизации субъектов, инфицированных или восприимчивых к инфекции, заболеванию или вреду от различных патогенов (например, патогенных бактерий (например, S. aureus, P. aeruginosa и т.д.), патогенных вирусов (например, РСВ, ЦМВ и т.д.), патогенных эукариот, токсинов (например, бактериальных токсинов (например, нейротоксина Botulinum, столбнячного токсина, токсина Clostridium difficile, токсина E.coli, RTX-токсина Vibrio, стафилококковых токсинов, токсина цианобактерий), грибковых токсинов, например, микотоксинов)) и т.д. Способы включают, например, смешивание и/или объединение образцов плазмы с получением композиции, содержащей объединенные образцы плазмы (например, от 1000 или более субъектов-доноров), содержащие конкретные повышенные уровни титров патогенспецифических антител, и/или полученный из них иммуноглобулин (например, для лечения инфекции, когда введение (например, инфузия) традиционного IVIG не обеспечивает достаточные уровни антител, необходимые для лечения конкретной инфекции). Композиция объединенной плазмы может содержать повышенные уровни титров патогенспецифических антител к одному или более из: респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса, коронавируса, S. pneumonia, H. influenza, L. pneumophila. Streptococcus группы А, или любому другому респираторному патогену или другому типу патогена, известному специалисту в данной области техники или описанному в настоящем документе, по сравнению с контрольным значением (например, уровнями титров патогенспецифических антител в образцах плазмы от 1000 или более случайных доноров). В одном из вариантов реализации образцы плазмы от доноров, содержащие высокие титры антител к конкретному респираторному патогену (например, РСВ), идентифицируют, отбирают и смешивают с другими образцами плазмы от доноров, не содержащими высокие титры антител к конкретному респираторному патогену (например, РСВ), для получения пула образцов плазмы от по меньшей мере 1000 доноров, при этом указанный пул содержит желаемый (например, стандартизированный, повышенный) титр антител к одному или более конкретным респираторным патогенам (например, РСВ) при отсутствии необходимости в использовании 1000 доноров с высоким титром. Например, в некоторых вариантах реализации способы идентификации, отбора и смешивания согласно настоящему изобретению позволяют получить объединенные образцы плазмы от по меньшей мере 1000 доноров, при этом указанная объединенная плазма содержит желаемый (например, стандартизированный, повышенный) титр антител к одному или более конкретным респираторным патогенам (например, РСВ), при этом меньше примерно 50% (например, 50-45%, 45-40%, 40-35%, 35-30%, 30-25%, 25-20% или меньше) доноров идентифицированы как имеющие высокий титр антител к РСВ и/или антител, специфичных к другим респираторным патогенам. В одном из вариантов реализации предложена композиция объединенной плазмы (например, объединенные образцы плазмы или полученный из них иммуноглобулин), при этом указанная композиция объединенной плазмы содержит плазму от 1000 или более доноров, при этом примерно 40-50% образцов плазмы от доноров содержат высокий титр антител к РСВ и/или антител, специфичных к другим респираторным патогенам, 20-30% образцов плазмы от доноров содержат средний титр антител к РСВ и/или антител, специфичных к другим респираторным патогенам, и 20-40% образцов плазмы от доноров содержат низкий титр антител к РСВ и/или антител, специфичных к другим респираторным патогенам. В другом варианте реализации образцы плазмы от 1000 или более (например, 1000, 1000-1500, 1500-2000, 2000-3000, 3000-4000, 4000-6000, 6000-8000 или более) субъектов, представляющих собой людей, характеризуют на предмет титров антител (например, с использованием одного или более анализов, описанных в настоящем документе (например, с использованием первого анализа нейтрализации или другого типа анализа, описанного в настоящем документе, и/или второго анализа нейтрализации или другого типа анализа, описанного в настоящем документе)) к одному или более респираторным вирусам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса, коронавируса, S. pneumonia, H. influenza, L. Pneumophila и Streptococcus группы А; субъектов относят к категориям субъектов с высоким, средним или низким титром к одному или более респираторным вирусам; образцы плазмы получают от подгруппы субъектов, идентифицированных как субъекты с высоким, средним или низким титром; и образцы плазмы от по меньшей мере 500 (например, по меньшей мере 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1050, 1100, 1150, 1200 или более) идентифицированных таким образом субъектов смешивают друг с другом для получения композиции объединенной плазмы (например, содержащей желаемый повышенный титр антител к одному или более респираторным вирусам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса, коронавируса, S. pneumonia, H. influenza, L. Pneumophila и Streptococcus группы А).
В одном из вариантов реализации идентификация титра антител включает первый скрининговый анализ плазмы, позволяющий оценить нейтрализующую активность/титр (например, РСВ-нейтрализующую активность) в образце плазмы, и второй скрининговый анализ, позволяющий оценить титр антител в очищенной фракции иммуноглобулинов образца плазмы (например, конкретный титр антител к РСВ в очищенной фракции иммуноглобулинов). В одном из вариантов реализации нейтрализующую активность в плазме измеряют по отсутствию инфицирования гепатоцитов. В другом варианте реализации первый скрининговый анализ плазмы, оценивающий нейтрализующую активность, позволяет подразделить образцы плазмы на образцы с высоким титром, средним титром или низким титром РСВ-специфичных антител, при этом донор/образец от донора с высоким титром к РСВ является таким, который содержит титр анти-РСВ, составляющий примерно 7800 или более, донор/образец от донора со средним титром к РСВ является таким, который содержит титр анти-РСВ, составляющий примерно 3300-7799, и донор/образец от донора с низким титром к РСВ является таким, который содержит титр анти-РСВ, составляющий примерно 1800-3299 (например, титр рассчитывают и присваивают донору/образцу от донора как разведение, дающее 50% ингибирование роста вируса/инфекции гепатоцитов (та точка, которая составляет 50% двух крайних точек (физиологический раствор плюс вирус представляет собой 100 рост, и без добавленного вируса представляет собой 0 рост)) в соответствии со способами, описанными в настоящем документе). В другом варианте реализации только образцы плазмы, идентифицированные как демонстрирующие верхние 20% нейтрализующей активности, обрабатывают с получением очищенного иммуноглобулина, а затем подвергают скринингу с использованием второго скринингового анализа. В одном из вариантов реализации второй скрининговый анализ характеризует титр РСВ-специфичных антител очищенной фракции иммуноглобулинов образца плазмы. В предпочтительном варианте реализации донор/образец от донора, который содержит титр РСВ-нейтрализующих антител, составляющий 1800, в очищенной фракции иммуноглобулинов образца плазмы, оценивают как донора с высоким титром. В предпочтительном варианте реализации титр РСВ-нейтрализующих антител, составляющий 1800, используют для идентификации донора/образца от донора (например, образца плазмы), содержащего повышенные титры антител к одному или более респираторным патогенам, выбранным из вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса, по сравнению с титром антител в контрольном образце (например, титром антител, специфичных к респираторным патогенам, присутствующим в пуле образцов плазмы от 1000 или более случайных субъектов, представляющих собой людей). В другом варианте реализации композиция объединенной плазмы содержит титр РСВ-нейтрализующих антител, составляющий 1800 или более.
В одном из вариантов реализации, когда смешивают образцы плазмы от 1000 или более субъектов, меньше половины (например, примерно 10-20%, 20-30%, 30-40%, 40-50%) из 1000 или более доноров получены от субъектов, отнесенных к категории субъектов с высоким титром (например, с использованием описанных выше первого и второго скрининговых анализов) к одному или более респираторным вирусам (например, РСВ). Например, в предпочтительном варианте реализации, когда смешивают образцы плазмы от 1000 или более субъектов, только примерно 40-50% (например, 400-500) образцов плазмы получены от субъектов, отнесенных к категории субъектов с высоким титром (например, с использованием описанных выше первого и второго скрининговых анализов) к одному или более респираторным вирусам (например, РСВ), а остальные характеризуются как не содержащие высокий титр (например, к одному или более респираторным вирусам (например, РСВ)). В другом предпочтительном варианте реализации, когда смешивают образцы плазмы от 1000 или более субъектов, только примерно 40-45% (например, 400-450) образцов плазмы получены от субъектов, отнесенных к категории субъектов с высоким титром к одному или более респираторным вирусам. В предпочтительных вариантах реализации 30-45%, 35-45%, 40-45% от 1000 или более образцов плазмы получены от отобранных людей-доноров с высоким титром.
В одном из вариантов реализации, когда смешивают образцы плазмы от 1000 или более субъектов, только примерно 30-45%, 35-45% или 30-40% образцов плазмы получены от субъектов, отнесенных к категории субъектов с высоким титром (например, с использованием последовательных первого и второго скрининговых анализов, описанных в настоящем документе) антител к РСВ, примерно 55-75% или примерно 55-65% получены от отобранных доноров с не высоким титром и примерно 3-30% или примерно 3-20% получены от неотобранных доноров.
В одном из вариантов реализации менее 50% от общего объема композиции объединенной плазмы (например, в предпочтительных вариантах реализации примерно 30-45%, 35-45%, 35-40%) составляют плазму, полученную от отобранных людей-доноров с высоким титром; примерно 55-70% (например, в предпочтительном варианте реализации примерно 55-75%, 55-65%) от общего объема композиции объединенной плазмы составляют плазму, полученную от отобранных людей-доноров с не высоким титром, и примерно 3-20% от общего объема композиции объединенной плазмы составляют плазму от неотобранных людей-доноров.
В одном из вариантов реализации, когда смешивают образцы плазмы от 1000 или более субъектов, смешанная плазма или полученный (например, фракционированный) из нее иммуноглобулин содержит серопротективные титры антител к кори, дифтерии и полиомиелиту (например, содержат титры антител к кори, дифтерии и полиомиелиту, которые обеспечивают субъекту, которому вводят указанную композицию смешанной плазмы или полученный из нее иммуноглобулин, уровни антител в сыворотке, специфичных к кори, дифтерии и полиомиелиту, для предотвращения или защиты от инфекции, вызываемой указанными вирусами). В другом варианте реализации, когда смешивают образцы плазмы от 1000 или более субъектов, смешанная плазма или полученный (например, фракционированный) из нее иммуноглобулин содержит серопротективные титры антител к кори, дифтерии, полиомиелиту, столбняку и/или ветряной оспе (например, содержат титры антител к кори, дифтерии, полиомиелиту, столбняку и/или ветряной оспе, которые обеспечивают субъекту, которому вводят указанную композицию смешанной плазмы или полученный из нее иммуноглобулин, уровни антител в сыворотке, специфичных к кори, дифтерии, полиомиелиту, столбняку и/или ветряной оспе, для предотвращения или защиты от инфекции, вызываемой указанными вирусами (например, соответствуют уровням титров антител, рекомендованным Управлением США по контролю за качеством пищевых продуктов и лекарственных средств (например, для лечения иммунодефицитного заболевания и/или лечения или предотвращения инфекции у субъекта с иммунодефицитом))). В другом варианте реализации объединенная плазма содержит повышенные уровни титров патогенспецифических антител к двум, трем, четырем или более респираторным патогенам, описанным в настоящем документе, по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В одном из вариантов реализации объединенная плазма содержит титр антител, специфичных к респираторно-синцитиальному вирусу, который по меньшей мере в 2 раза (например, в 2 раза, в 3 раза, в 4 раза, в 5 раз, в 6 раз, в 7 раз, в 8 раз, в 9 раз, в 10 раз, в 12 раз, в 15 или более раз) больше титра антител, специфичных к респираторно-синцитиальному вирусу, обнаруживаемого в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В другом варианте реализации объединенная плазма содержит титры патогенспецифических антител по меньшей мере к двум или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса, коронавируса, S. pneumonia, H. influenza, L. pneumophila. Streptococcus группы А, каждый из которых повышен по меньшей мере в 1,5 раза по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В другом варианте реализации объединенная плазма содержит титры патогенспецифических антител по меньшей мере к трем или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса, коронавируса, S. pneumonia, H. influenza, L. Pneumophila и Streptococcus группы А, каждый из которых повышен по меньшей мере в 1,5 раза по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В другом варианте реализации объединенная плазма содержит титры патогенспецифических антител по меньшей мере к четырем или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса, коронавируса, S. pneumonia, H. influenza, L. Pneumophila и Streptococcus группы А, каждый из которых повышен по меньшей мере в 1,5 раза по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В одном из вариантов реализации объединенная плазма содержит образцы плазмы, полученные от 1000-3000 или более (например, более 1000, 1250, 1500, 1750, 2000, 2500, 3000, 3500, 4000 или более) субъектов, представляющих собой людей. В одном из вариантов реализации объединенную плазму применяют для получения иммуноглобулина (например, для внутривенного введения субъекту). В одном из вариантов реализации объединенная плазма и/или иммуноглобулин обеспечивает полезный терапевтический эффект для субъекта, которому вводят указанную объединенную плазму и/или иммуноглобулин, которого нельзя достичь путем введения смеси образцов плазмы (или полученного из нее иммуноглобулина), полученных от 1000 или более случайных субъектов, представляющих собой людей. Настоящее изобретение не ограничивается типом обеспечиваемого полезного терапевтического эффекта. Действительно, могут быть достигнуты различные полезные терапевтические эффекты, включая те, которые описаны в настоящем документе. В одном из вариантов реализации объединенная плазма и/или иммуноглобулин обладает улучшенными свойствами нейтрализации вирусов по сравнению со смесью образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей, или иммуноглобулином, полученным из указанной смеси. Например, в одном из вариантов реализации объединенная плазма обладает улучшенными свойствами нейтрализации вирусов в отношении одного или более (например, двух, трех, четырех, пяти или более) респираторных патогенов (например, описанных в настоящем документе). В другом варианте реализации указанные улучшенные свойства нейтрализации вирусов позволяют уменьшить и/или предотвратить инфекцию у субъекта, которому вводят композицию, на период времени, продолжительность которого больше и недостижима у субъекта, которому вводят смесь образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В одном из вариантов реализации объединенная плазма и/или полученный из нее иммуноглобулин уменьшает число случаев инфекции у субъекта, которому вводят композицию. В другом варианте реализации объединенная плазма и/или полученный из нее иммуноглобулин уменьшает количество дней, необходимое для введения антибиотиков (например, для лечения инфекции) субъекту, которому вводят указанную объединенную плазму и/или иммуноглобулин. В другом варианте реализации объединенная плазма и/или полученный из нее иммуноглобулин повышает минимальный уровень циркулирующих антител, специфичных к респираторным патогенам, у субъекта (например, повышает уровень титров нейтрализующих антител, специфичных к респираторным патогенам (например, обеспечивая тем самым защитные уровни антител, специфичных к респираторным патогенам, между запланированными датами введения указанной объединенной плазмы и/или полученного из нее иммуноглобулина, не поддерживаемые у субъекта, которому вводят смесь образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей, или иммуноглобулин, полученный из указанной смеси)). В одном из вариантов реализации композиция, содержащая объединенные образцы плазмы, дополнительно содержит фармацевтически приемлемый носитель (например, любой природный или не встречающийся в природе носитель (носители), известный в данной области техники). В одном из вариантов реализации субъект, которому вводят иммуноглобулин, полученный из объединенной плазмы согласно настоящему изобретению, демонстрирует среднее кратное повышение титра нейтрализующих антител анти-РСВ по меньшей мере в 4 раза, по меньшей мере в 5 раз, по меньшей мере в 6 раз, по меньшей мере в 7 раз, по меньшей мере в 8 раз, по меньшей мере в 9 раз или более, в момент времени, составляющий по меньшей мере от 1 до 14 дней (например, 14 дней, 15 дней, 16 дней, 17 дней, 18 дней, 19 дней или более) после введения иммуноглобулина. Настоящее изобретение не ограничивается количеством иммуноглобулина, вводимым субъекту. В одном из вариантов реализации субъекту вводят 100-5000 мг/кг иммуноглобулина однократно или ежедневно в течение двух или более дней (например, 2, 3, 4 или более последовательных дней). В другом варианте реализации такие дозы вводят с перерывами, например, каждую неделю, каждые две недели, каждые три недели, каждые четыре недели и т.п. В одном из вариантов реализации субъекту вводят 750-1500 мг/кг иммуноглобулина в первый день и 750-1500 мг/кг иммуноглобулина во 2 день. В одном из вариантов реализации субъекту вводят 1500 мг/кг иммуноглобулина в первый день и 750 мг/кг иммуноглобулина во 2 день. В другом варианте реализации субъекту вводят 750 мг/кг иммуноглобулина в первый день и 750 мг/кг иммуноглобулина во 2 день. В одном из вариантов реализации субъекту вводят иммуноглобулин в первый день, возможно вводят иммуноглобулин во 2 день, а затем повторно вводят иммуноглобулин каждый 21 день. В одном из вариантов реализации субъекту вводят иммуноглобулин в первый день, возможно вводят иммуноглобулин во 2 день, а затем повторно вводят иммуноглобулин каждые 28 дней. В одном из вариантов реализации объединенная плазма и/или полученный из нее иммуноглобулин уменьшает число случаев инфекции у субъекта, которому вводят композицию. В другом варианте реализации объединенная плазма и/или полученный из нее иммуноглобулин уменьшает количество дней, необходимое для введения антибиотиков (например, для лечения инфекции) субъекту, которому вводят указанную объединенную плазму и/или иммуноглобулин. В другом варианте реализации объединенная плазма и/или полученный из нее иммуноглобулин повышает минимальный уровень циркулирующих антител, специфичных к респираторным патогенам, и повышает минимальный уровень циркулирующих антител, специфичных к вирусу кори, Corynebacterium diphtheriae, вирусу полиомиелита, Clostridium tetani, haemophilus influenzae типа В, streptococcus pneumonia, ЦМВ и/или вирусу ветряной оспы, у субъекта (например, повышает уровень титров нейтрализующих антител, специфичных к респираторным патогенам и вирусу кори, Corynebacterium diphtheriae, вирусу полиомиелита, Clostridium tetani, haemophilus influenzae типа В, streptococcus pneumonia, ЦМВ и/или вирусу ветряной оспы (например, обеспечивая тем самым защитные уровни антител, специфичных к респираторным патогенам, и антител к вирусу кори, Corynebacterium diphtheriae, вирусу полиомиелита, Clostridium tetani, haemophilus influenzae типа В, streptococcus pneumonia, ЦМВ и/или вирусу ветряной оспы между запланированными датами введения указанной объединенной плазмы и/или полученного из нее иммуноглобулина, не поддерживаемые у субъекта, которому вводят смесь образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей, или иммуноглобулин, полученный из указанной смеси)).
Один из вариантов реализации настоящего изобретения предусматривает применение детектирования высокого титра антител в образце плазмы от донора к одному или более респираторным патогенам (например, РСВ) для идентификации (например, в качестве биомаркера) донора плазмы, демонстрирующего высокий/сильный ответ на антигенную стимуляцию (например, имеющего высокие титры антител (например, к множеству респираторных патогенов)) через выработку повышенных уровней антител, по сравнению с донорами, не демонстрирующими сильный ответ/не вырабатывающими повышенные уровни антител (например, имеющими титры антител от средних до низких) (см., например, пример 1). Таким образом, в одном из вариантов реализации настоящего изобретения предложен способ идентификации донора плазмы, демонстрирующего высокий/сильный ответ на антигенную стимуляцию, включающий получение образца плазмы от субъекта, получение характеристик титра патогенспецифических антител в плазме к одному или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса; и идентификацию субъекта, демонстрирующего высокий/сильный ответ на антигенную стимуляцию, в случае, если плазма содержит повышенные уровни (например, по меньшей мере в 1,5 раза (например, в 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более раз)) титров патогенспецифических антител к одному или более респираторным патогенам по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В одном из вариантов реализации плазма содержит повышенные уровни титров патогенспецифических нейтрализующих антител по меньшей мере к двум или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса, каждый из которых повышен по меньшей мере в 1,5 раза (например, в 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более раз) по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В другом варианте реализации настоящего изобретения предложен способ применения уровня титра нейтрализующих антител, специфичных к респираторным патогенам (например, титра РСВ-нейтрализующих антител), детектированного в образце плазмы от донора, в качестве биомаркера, который показывает уровень титров нейтрализующих антител, специфичных к респираторным патогенам, в указанном образце к одному или более из: вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса (например, для идентификации, отбора и смешивания образцов плазмы).
Плазму, полученную от одного или множества доноров, идентифицированных как демонстрирующие высокий/сильный ответ (например, имеющих высокие титры нейтрализующих антител), можно использовать совместно с плазмой от одного или множества доноров, идентифицированных как не демонстрирующие высокий/сильный ответ (например, не имеющих высоких титров нейтрализующих антител), для получения смеси образцов плазмы, обладающей желаемой характеристикой. Например, в одном из вариантов реализации настоящего изобретения предложен способ получения композиции объединенной плазмы, включающий получение образцов плазмы от субъектов, представляющих собой людей; получение характеристик титра патогенспецифических антител в подгруппе указанных образцов плазмы к одному или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса; отбор на основе охарактеризованных титров антител образцов плазмы, содержащих повышенные уровни титров патогенспецифических антител к одному или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса, по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей; объединение отобранных образцов плазмы с другими образцами плазмы с получением композиции объединенной плазмы, при этом указанная композиция объединенной плазмы содержит титры патогенспецифических антител по меньшей мере к двум или более респираторным патогенам, выбранным из респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса и коронавируса, каждый из которых повышен по меньшей мере в 1,5 раза по сравнению с титрами патогенспецифических антител, обнаруживаемыми в смеси образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей. В предпочтительном варианте реализации объединяют 1000 или более образцов плазмы, отнесенных к определенной категории в соответствии со способами, описанными в настоящем документе, для получения композиции объединенной плазмы (см., например, пример 2).
Как описано в примерах 3 и 4, применение композиции согласно настоящему изобретению (например, иммуноглобулина, полученного из плазмы, объединенной с применением способов отбора согласно настоящему изобретению) обеспечивает клиническую эффективность и улучшенные результаты у субъектов.
Иммунотерапевтические композиции согласно настоящему изобретению тестировали в модели иммунодефицита человека у хлопковых хомяков. Оценивали терапевтическое, а также профилактическое действие. Для анализа терапевтического действия иммуноглобулин, полученный, как описано в примере 2, вводили в терапевтических целях хлопковым хомякам с супрессией иммунитета (которых лечили циклофосфамидом) и здоровым хлопковым хомякам, зараженным PCB/A/Long (см. пример 3).
Иммуносупрессию в группах, получавших лечение циклофосфамидом (А, В, С и G), подтверждали по значительному уменьшению количеств клеток цельной крови и лимфоцитов по сравнению со здоровыми хлопковыми хомяками (группы D, Е и F). Животные с супрессией иммунитета, которых лечили IVIG согласно настоящему изобретению, группы В и С, демонстрировали значительное снижение вирусной нагрузки в легких и носу в день 4 после инфицирования (p.i.) и 10 день после инфицирования по сравнению с РСВ-инфицированными животными с супрессией иммунитета, которых лечили физиологическим раствором (группа А) (см. пример 3). Данное снижение сопровождалось уменьшением гистопатологии легких и уменьшением детектирования вирусной РНК в образцах легких, печени и почек животных группы В и С в 10 день после инфицирования. Лечение здоровых хлопковых хомяков IVIG согласно настоящему изобретению также приводило к значительному снижению нагрузки РСВ в легких и носу животных, которых лечили IVIG (группы Е и F), по сравнению с животными, которых лечили физиологическим раствором (группа D), в 4 день после инфицирования (см. пример 3).
Иммунотерапевтические композиции согласно настоящему изобретению также тестировали в модели иммунодефицита человека у хлопковых хомяков на предмет профилактического действия (см. пример 4). Иммуносупрессию подтверждали по значительному уменьшению количеств клеток цельной крови и лимфоцитов, и уменьшению общего количества IgG в сыворотке. Животные с супрессией иммунитета, которых лечили IVIG согласно настоящему изобретению, демонстрировали недетектируемую репликацию вируса в легких в 4 день после инфицирования и почти полное снижение длительной репликации вируса, вызываемой иммуносупрессией, измеренной в 10 день (только два из 5 животных в группе демонстрировали минимальную репликацию вируса (см. пример 4)). Данное снижение сопровождалось уменьшением гистопатологии легких и уменьшением детектирования вирусной РНК в образцах легких, почек и печени у выбранных животных с супрессией иммунитета.
В отличие от традиционных продуктов IVIG, доступных на рынке, в некоторых вариантах реализации настоящего изобретения предложен иммуноглобулин от доноров, идентифицированных и отобранных как имеющие высокие титры нейтрализующих антител к РСВ, и также имеющих в значительной степени повышенные титры антител к другими респираторным вирусам (например, парагриппу типа 1 и типа 3, гриппу, коронавирусу и метапневмовирусу) (например, по сравнению с контрольным образцом или по сравнению с другим коммерчески доступным IVIG) (см., например, примеры 1, 2 и 5). Соответственно, иммунотерапевтическая композиция согласно настоящему изобретению, содержащая IVIG согласно настоящему изобретению, имеет уникальный профиль антител для множества респираторных вирусов (например, который отличает ее от других коммерчески доступных IVIG). IVIG согласно настоящему изобретению не только физически отличается от традиционного коммерчески доступного IVIG, он также отличается активностью и клинической эффективностью. Например, в некоторых вариантах реализации IVIG согласно настоящему изобретению применяют (например, в или в виде иммунотерапевтической композиции для лечения пациентов (например, пациентов с ослабленным иммунитетом)) для уменьшения присутствия и/или тяжести инфекций верхних дыхательных путей, опосредуемых вирусами (например, см. пример 5). В некоторых вариантах реализации настоящего изобретения предложен способ лечения (например, профилактического или терапевтического) пациента (например, пациента с ослабленным иммунитетом (например, пациента с PIDD)), включающий введение (например, терапевтически эффективного количества) иммунотерапевтической композиции, содержащей IVIG согласно настоящему изобретению, субъекту для предотвращения и/или лечения инфекции у указанного субъекта (например, инфекции верхних дыхательных путей) (см., например, пример 5).
Как описано в примере 5, пациенты с ослабленным иммунитетом, которым вводили иммунотерапевтическую композицию согласно настоящему изобретению, демонстрировали нулевые серьезные бактериальные инфекции. Кроме того, вторичные конечные точки, которые измеряли (включая незапланированные визиты к врачу, незапланированные визиты в отделение скорой помощи, пропущенные дни на работе по причине инфекции, общее количество дней в больнице по причине инфекции), были меньше достигаемых в случае традиционных коммерчески доступных продуктов IVIG (например, клинические результаты, достигаемые с использованием PCB-IVIG согласно настоящему изобретению, указывают на клиническую эффективность и преимущество иммунотерапевтических композиций согласно настоящему изобретению по сравнению с традиционными продуктами).
Например, при рассмотрении вторичных конечных точек, получаемых с применением IVIG согласно настоящему изобретению, и тех, которые достигаются в случае традиционных продуктов IVIG, доступных на рынке, IVIG согласно настоящему изобретению обеспечивал в значительной степени лучшие (более низкие) показатели для каждого из следующих: количество дней, пропущенных на работе/школе/детском саду (1,66 на пациента в год), дни госпитализации по причине инфекции (.089 на пациента в год) и незапланированные визиты к врачу или в отделение скорой помощи (.72 на пациента в год).
Тогда как для реализации настоящего изобретения понимание механизма не является необходимым, и тогда как настоящее изобретение не ограничивается каким-либо конкретным механизмом, в одном из вариантов реализации способы идентификации и отбора высоких титров антител к респираторным патогенам (например, специфичных к РСВ) в плазме субъекта согласно настоящему изобретению позволяют идентифицировать и/или отобрать субъектов, которые в целом обладают системой иммунного ответа, вырабатывающей высокие уровни антител, специфичных к респираторным патогенам, по сравнению с другими субъектами, которые не демонстрируют высокие титры антител к респираторным патогенам (например, к РСВ) и не вырабатывают высокие уровни антител, специфичных к респираторным патогенам. Ген иммунного ответа, который кодирует интенсивность гуморальных ответов антител на микробные антигены, находится под контролем главного комплекса гистосовместимости (HLA). В данном контексте доноры, отобранные на основе сильных ответов на РСВ, в некоторых вариантах реализации демонстрируют сильный ответ на другие респираторные вирусы. Тогда как для реализации настоящего изобретения понимание механизма не является необходимым, и тогда как настоящее изобретение не ограничивается каким-либо конкретным механизмом, в одном из вариантов реализации сильный ответ на респираторные патогены обусловлен воздействием на доноров в силу их рода занятий или других демографических факторов (например, таких, что субъект не только повторно подвергается РСВ-инфекции, но также воздействию или инфицированию другими распространенными респираторными вирусами). Таким образом, в некоторых вариантах реализации иммунологический анамнез субъекта объясняет тот факт, что указанный субъект имеет повышенные титры антител к нескольким распространенным респираторным вирусам.
В некоторых вариантах реализации образцы плазмы и/или образцы с антителами включают безвозмездно предоставляемые и/или приобретаемые образцы жидкостей организма, например, индивидуальные образцы крови или компонентов крови (например, плазму). Данные образцы могут быть очищены и/или подвергнуты скринингу на присутствие патогенов или других примесей (например, до или после объединения). Несколько образцов с антителами от доноров (например, образцы плазмы от доноров или другие образцы, содержащие антитела) могут быть объединены с созданием пула объединенных образцов плазмы/первичного пула антител (например, после идентификации или скрининга на предмет желаемого титра антител в образцах с антителами). Путем комбинирования индивидуальных образцов с антителами (например, образцов крови или компонентов крови (например, плазмы)), содержащих титры антител к одному или более выбранным антигенам, эпитопам, внеклеточным белкам, белкам вирусной поверхности, которые выше нормальных титров, с плазмой, взятой от доноров, неотобранных по высоким титрам, получают пул объединенных образцов плазмы/первичный пул антител, демонстрирующий повышенный титр таких антител. В некоторых вариантах реализации выбранные антигены, эпитопы, внеклеточные белки, белки вирусной поверхности и т.д. вводят субъектам для индукции экспрессии желаемых антител (например, у которых могут быть взяты образцы с антителами). Полученный образец с повышенным титром антител (например, кровь, сыворотка, плазма, очищенные антитела (например, содержащие более высокий титр антител по сравнению с контрольным уровнем (например, титром антител в объединенных образцах плазмы от 1000 или более случайных субъектов, представляющих собой людей)) восстанавливают и объединяют с образцами с антителами от других субъектов, которые демонстрируют или, как ожидается, демонстрируют повышенный титр тех же антител (или антител, направленных на те же антигены, внеклеточные белки, белки вирусной поверхности и т.д.), или с образцами с антителами от субъекта, которые не были подвергнуты скринингу на предмет титра антител или которые содержат низкий или отсутствующий титр антител к конкретному патогену. В некоторых вариантах реализации объединенные образцы с антителами очищают, подвергают скринингу и/или концентрируют. В одном из вариантов реализации объединение образцов (например, 1000 или более образцов) происходит таким образом, что используют наименьшее возможное количество образцов от доноров с высоким титром (например, идентифицированных с помощью композиций и способов, описанных в настоящем документе), но по-прежнему сохраняется желаемый стандартизированный и повышенный титр антител к одному или более (например, двум, трем, четырем или более) респираторным патогенам, описанным в настоящем документе.
В некоторых вариантах реализации настоящего изобретения используют плазму от субъектов, которым были введены иммуногенные вещества (например, вакцины, антигены, эпитопы, внеклеточные белки, белки вирусной поверхности и т.д.) для выработки повышенных уровней конкретных нейтрализующих антител у субъекта. Настоящее изобретение не ограничивается типом антигена (например, антигеном S. pneumonias), используемого для введения субъекту (например, донору) для индукции экспрессии конкретных антител. В некоторых вариантах реализации антиген представляет собой антиген S. pneumoniae или его фрагмент, или компонент.В некоторых вариантах реализации антиген представляет собой полисахарид (например, неконъюгированный или конъюгированный с носителем или белком) или его множество. В некоторых вариантах реализации антиген (например, антиген S. pneumoniae) представляет собой вакцину S, содержащую компоненты, способные индуцировать конкретные антитела (например, антитела, специфичные к нескольким различным серотипам S. pneumonia). В некоторых вариантах реализации вакцина представляет собой коммерчески доступную вакцину. Настоящее изобретение не ограничивается указанной вакциной. Действительно, могут быть использованы различные вакцины (например, вакцины против S. pneumoniae), включая, но не ограничиваясь указанными, ПРЕВНАР, СИНФЛОРИКС, ПНЕВМОВАКС, а также другие, известные в данной области техники. Подобным образом, настоящее изобретение не ограничивается типом или путем введения/иммунизации. Действительно, может быть использован любой путь/тип иммунизации, включая, но не ограничиваясь указанными, способы, описанные в публикациях патентов США №№ US 2008026002, US 2007009542; US 2002094338; US 2005070876; US 2002010428; US 2009047353; US 2008066739; и US 2002038111, полное содержание каждой из которых включено в настоящее описание посредством ссылки. Подобным образом, настоящее изобретение не ограничивается составом вакцины (например, вакцины против S. pneumoniae). Действительно, может быть использован любой состав, включая, но не ограничиваясь указанными, те, которые описаны в US 2002107265, полное содержание которого включено в настоящее описание посредством ссылки. В некоторых вариантах реализации вакцина представляет собой поливалентную вакцину, в которой добавлены дополнительные антигены (см., например US 2007161088; US 2006121059, полное содержание каждого из которых включено в настоящее описание посредством ссылки). В некоторых вариантах реализации микробные антигены очищают перед применением в вакцине (например, конъюгированной вакцине) (см., например, US 2008286838, полное содержание которого включено в настоящее описание посредством ссылки). Способы культивирования микроорганизмов, подходящих для способа получения пневмококковых конъюгированных вакцин, описаны в US2010290996, полное содержание которого включено в настоящее описание посредством ссылки. В качестве альтернативы, в некоторых вариантах реализации используют антигены (например, антигены S. pneumonia), которые не конъюгированы с белком-носителем (см., например, US 2009136547, полное содержание которого включено в настоящее описание посредством ссылки). В некоторых вариантах реализации используют иммуномодуляторы (см., например, US 2004156857; US 5985264; и WO 11041691, полное содержание каждого из которых включено в настоящее описание посредством ссылки). В некоторых вариантах реализации терапевтические антитела вырабатываются у донора, которому вводят антиген (например, антиген S. pneumoniae) и/или вакцину в соответствии со способами, описанными в WO 05070458; US 2009191217; и WO 10094720, полное содержание каждого из которых включено в настоящее описание посредством ссылки. В некоторых вариантах реализации антигены (например, вакцины (например, конъюгированные или неконъюгированные вакцины)) используют для получения антител (например, присутствующих в сыворотке и/или плазме), которые полезны против организмов, вызывающих инфекционные заболевания (например, описанных в US 2003099672; WO 0062802, полное содержание каждого из которых включено в настоящее описание посредством ссылки).
В некоторых вариантах реализации используют полисахаридную вакцину (например, содержащую несколько серотипов S. pneumoniae (например, содержащую очищенные полисахариды 1, 2, 3, 4 или более, или всех 23 следующих серотипов S. pneumoniae: 1, 2, 3, 4, 5, 6b, 7F, 8,9N, 9V, 10A, НА, 12F, 14, 15В, 17F, 18С, 19F, 19А, 20, 22F, 23F и 33F)). Тогда как для реализации настоящего изобретения понимание механизма не является необходимым, и тогда как настоящее изобретение не ограничивается каким-либо конкретным механизмом действия, в некоторых вариантах реализации антиген (например, антиген S. pneumoniae) или вакцина, которая стимулирует выработку и секрецию В-клетками (например, плазматическими клетками) специфического (например, специфичного к S. pneumonia) иммуноглобулина (например, IgM, специфичного к S. pneumonia) без помощи Т-клеток, находит применение в настоящем изобретении.
В некоторых вариантах реализации используют конъюгированную вакцину, которая содержит капсульные полисахариды (например, множества серотипов S. pneumoniae), ковалентно связанные с носителем и/или адъювантом (например, дифтерийным анатоксином CRM197). Тогда как для реализации настоящего изобретения понимание механизма не является необходимым, и тогда как настоящее изобретение не ограничивается каким-либо конкретным механизмом действия, в некоторых вариантах реализации любой антиген (например, антиген S. pneumoniae) или вакцина, которая стимулирует выработку и секрецию В-клетками (например, плазматическими клетками) специфического (например, специфичного к S. pneumonia) иммуноглобулина (например, IgM и/или IgG, специфичного к S. pneumonia) через взаимодействие с конкретными хелперными Т-клетками 2 типа и/или выработку В-клеток памяти (например, В-клеток памяти, специфичных к S. pneumonia), находит применение в настоящем изобретении.
Таким образом, в некоторых вариантах реализации настоящего изобретения предложены способы стимуляции высоких уровней антител у донора, включающие введение животному, например, человеку фармацевтически приемлемой композиции, содержащей иммунологически эффективное количество композиции антигена (например, композиции антигена S. pneumoniae). Указанная композиция может содержать частично или в значительной степени очищенные антигены (например, антигены S. pneumoniae (например, полисахаридные, белковые и/или пептидные эпитопы, полученные из природных или рекомбинантных источников, которые могут быть получены естественным путем или либо химически синтезированы, либо получены альтернативным способом in vitro из рекомбинантных клеток-хозяев, экспрессирующих сегменты ДНК, кодирующие такие эпитопы)).
Способы определения эффективности иммунизации (например, определения уровня титров антител, специфичных к S. pneumonia) известны в данной области техники и для оценки эффективности иммунизации можно использовать любой известный способ. В некоторых вариантах реализации способы детектирования для оценки эффективности вакцины (например, пневмококковой конъюгированной вакцины) используют, как описано, например, в US 2005260694; US 4308026; US 4185084; или US 2005208608, полное содержание каждого из которых включено в настоящее описание посредством ссылки.
В некоторых вариантах реализации предложены наборы и способы, позволяющие идентифицировать образцы и/или пулы с конкретными титрами антител (например, титрами антител, которые повышены). В одном из вариантов реализации подходящее количество детектирующего реагента (например, антитело, специфичное в отношении антител, антиген или другой реагент, известный в данной области техники) иммобилизуют на твердой подложке и помечают детектируемым агентом. Антитела могут быть иммобилизованы на различных твердых субстратах известными способами. Подходящие твердые субстраты включают материалы, имеющие мембрану или покрытие, нанесенное или прикрепленное к палочкам (stick), гранулам, чашкам, плоским корпусам или другому твердому субстрату. Другие твердые субстраты включают планшеты для культур клеток, планшеты для ELISA, пробирки и полимерные мембраны. Антитела могут быть помечены детектируемым агентом, таким как флуорохром, радиоактивной меткой, биотином или другим ферментом, таким как пероксидаза хрена, щелочная фосфатаза и 2-галактозидаза. Если детектирующий реагент представляет собой фермент, средство для детектирования детектирующего реагента может поставляться с набором. В подходящих средствах для детектирования детектируемого реагента используют фермент в качестве детектируемого агента и субстрат фермента, который меняет цвет при контакте с указанным ферментом. Набор может также содержать средство для оценки продукта анализа, например, цветовую шкалу или справочную числовую шкалу. Некоторые подходящие способы характеристики образцов и пулов приведены в источниках, содержание которых включено в настоящее описание посредством ссылки. Настоящее изобретение не ограничивается способом, используемым для характеристики образцов и пулов, содержащих повышенный титр.
В некоторых вариантах реализации предложены композиции (например, образцы с антителами, объединенные образцы плазмы, иммуноглобулины и т.д.), в которых антитела были очищены и/или отделены от одной или более примесей. Иммуноглобулины человека были впервые выделены в большом масштабе F.J. Cohn в 1940-х годах. В некоторых вариантах реализации методы, предложенные Cohn (Cohn et al., J. Am. Chem. Soc. 1946; 68: 459-475; полное содержание которого включено в настоящее описание посредством ссылки), или модифицированные методы Cohn используют для получения иммуноглобулинов в настоящем изобретении. В некоторых вариантах реализации используют различные способы очистки и выделения для получения по существу немодифицированных, неизмененных, неденатурированных и/или нативных молекул иммуноглобулинов высокой степени чистоты. Типичные методы предложены, например, в патенте США №4482483, полное содержание которого включено в настоящее описание посредством ссылки. В некоторых вариантах реализации композиции (например, пулы антител) содержат >50% иммуноглобулина (например, >60%, >70%, >80%, >90%, >95%, >99%). Для получения таких композиций могут быть использованы различные способы, включая, например, стандартные способы очистки и выделения белков, а также фракционирование биологических жидкостей (например, плазмы). Описание фракционирования антител для применения в иммунотерапевтических средствах можно найти, например, в патенте США №4346073 и других источниках, приведенных в настоящем описании, полное содержание каждого из которых включено в настоящее описание посредством ссылки. В некоторых вариантах реализации иммуноглобулины очищают способом фракционного осаждения, путем ионообменной хроматографии, эксклюзионной хроматографии, ультрафильтрации, аффинной хроматографии или их любых подходящих комбинаций (см., например, патент США №7597891; патент США №4256631; патент США №4305870; Lullau et al., J. Biol. Chem. 1996; 271: 16300-16309; Corthesy, Biochem. Soc. Trans. 1997; 25: 471-475; и Crottet et al., Biochem. J. 1999; 341: 299-306; полное содержание которых включено в настоящее описание посредством ссылки).
В некоторых вариантах реализации образцы плазмы объединяют с получением большого объема антител/иммуноглобулинов (например, для коммерческого, клинического, терапевтического применения и/или применения для исследовательских целей). В конкретных вариантах реализации образцы с антителами (например, образцы плазмы), демонстрирующие определенную желаемую характеристику или характеристики, объединяют с получением первичного пула антител (например, объединенных образцов плазмы), усиленного, демонстрирующего и/или обогащенного данной желаемой характеристикой. В некоторых вариантах реализации объединяют образцы с антителами (например, плазму), полученные от нескольких субъектов (например, >2 субъектов, >5, >10 субъектов, >20 субъектов, >100 субъектов, >200 субъектов, >500 субъектов, >1000 субъектов, >2000 субъектов, >5000 субъектов, >10000 или более субъектов). Субъекты, от которых могут быть получены образцы с антителами (например, кровь, плазма и т.д.), могли быть недавно подвергнуты воздействию патогена, антигена или эпитопа, недавно вакцинированы патогеном, антигеном или эпитопом, или специально подвергнуты воздействию патогена, антигена или эпитопа с целью выработки конкретных антител.
В некоторых вариантах реализации предложены способы объединения/комбинирования первичных пулов антител (например, объединенных образцов плазмы) для получения вторичных пулов антител или специально созданных пулов антител. Два или более первичных пулов антител, каждый из которых демонстрирует желаемую характеристику (например, антитела к РСВ, антитела к гриппу и т.д.), комбинируют в желаемом соотношении с получением специально созданного пула антител. В некоторых вариантах реализации специально созданный пул антител демонстрирует относительную сумму характеристик первичных пулов антител, из которых он получен (например, специально созданный пул придает иммунитет к конкретным патогенам в такой степени, которая согласуется с относительным количеством первичных пулов, из которых он получен). В других вариантах реализации специально созданный пул антител демонстрирует характеристики, отличные от первичных пулов антител, из которых он получен (например, специально созданный пул придает иммунитет к конкретному патогену в большей степени, чем используемые по отдельности первичные пулы, из которых он получен, обеспечивает повышенный общий иммунитет по сравнению с применением отдельных первичных пулов, обеспечивает повышенный полезный противовоспалительный эффект по сравнению с применением отдельных первичных пулов).
Композицию согласно настоящему изобретению (например, объединенную плазму и/или полученный из нее иммуноглобулин) можно вводить любыми подходящими способами, включая парентеральное, подкожное, интраперитонеальное, внутрилегочное и, при необходимости в местном лечении, внутриочаговое введение. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, интраперитонеальное или подкожное введение. Кроме того, композиции согласно настоящему изобретению можно вводить путем пульс-инфузии, в частности, со снижением доз. Введение доз можно осуществлять любым подходящим путем, например, путем инъекций, таких как внутривенные или подкожные инъекции, в зависимости отчасти от того, является ли введение однократным или постоянным.
Композиция согласно настоящему изобретению может быть получена, дозирована и/или введена в соответствии с надлежащей медицинской практикой. Рассматриваемые в данном контексте факторы включают конкретное вылечиваемое нарушение, клиническое состояние отдельного пациента, причину нарушения, участок доставки агента, способ введения, схему введения и другие факторы, известные врачу. Композиции согласно настоящему изобретению не обязательно, но возможно получают совместно с одним или более агентами, применяемыми в настоящее время для предотвращения или лечения рассматриваемого нарушения. Эффективное количество таких других агентов зависит от количества антитела, присутствующего в составе, типа нарушения или лечения и других факторов, рассмотренных выше. Данные агенты, как правило, используют в тех же дозах и с путями введения, описанными в настоящем документе, или в дозах от примерно 1 до 99% доз, описанных в настоящем документе, или в любой дозе и любым путем, который эмпирически/клинически определен как подходящий.
Для предотвращения или лечения заболевания подходящая доза композиции согласно настоящему изобретению (при применении отдельно или в комбинации с одним или более другими дополнительными терапевтическими агентами) может зависеть от ряда факторов, включая тип заболевания, которое лечат, тип антитела, габариты, площадь поверхности тела, возраст пациента, конкретное вводимое соединение, пол, время и путь введения, общее состояние здоровья, взаимодействие с другими лекарственными средствами, вводимыми одновременно, тяжесть и течение заболевания, то, вводят ли антитело в профилактических или терапевтических целях, предшествующую терапию и историю болезни пациента.
Точная доза может быть определена лечащим врачом с учетом состояния пациента, которого лечат. Дозу и введение корректируют для обеспечения достаточных уровней активного вещества (например, пула плазмы) или для поддержания желаемого эффекта. Дополнительные факторы, которые можно учитывать, включают тяжесть болезненного состояния; возраст, массу тела и пол субъекта; питание, время и частоту введения, комбинацию (комбинации) лекарственных средств, чувствительность реакции и переносимость/ответ на терапию. Длительно действующие фармацевтические композиции можно вводить каждые 3-4 дня, каждую неделю или один раз в две недели, четыре недели, шесть недель, восемь недель или больше в зависимости от периода полувыведения и скорости клиренса конкретного состава.
Композиция согласно настоящему изобретению может быть введена пациенту за одни раз или за серию введений. В зависимости от типа и тяжести заболевания примерно от 1 мкг/кг до 5000 мг/кг (например, 0,5 мг/кг - 1500 мг/кг) композиции согласно настоящему изобретению могут составлять начальную потенциальную дозу для введения пациенту, как, например, путем одного или более отдельных введений, так и путем непрерывной инфузии. Как описано в настоящем документе, дополнительные лекарственные средства или агенты (например, антибиотики, противовирусные средства, противовоспалительные и/или заживляющие соединения) можно вводить одновременно с композицией объединенной плазмы согласно настоящему изобретению. Типичная суточная доза такого агента может находиться в диапазоне от примерно 1 мкг/кг до 100 мг/кг или более. В случае повторных введений в течение нескольких дней или дольше в зависимости от состояния, лечение, как правило, можно продолжать до желаемого подавления симптомов заболевания. Одна из типичных доз композиции согласно настоящему изобретению будет находиться в диапазоне от примерно 0,05 мг/кг до примерно 10 мг/кг. Таким образом, пациенту можно вводить одну или более доз, составляющих примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или их любую комбинацию). Такие дозы можно вводить с перерывами, например, каждую неделю или каждые две или три недели. Врач легко может контролировать терапевтическое введение композиции согласно настоящему изобретению и может, в свою очередь, определить необходимость введения более высоких или более низких доз указанной композиции.
Композиции согласно настоящему изобретению могут быть введены (например, внутривенно, перорально, внутримышечно, подкожно и т.д.) пациенту в фармацевтически приемлемом носителе, таком как физиологический раствор. Такие способы хорошо известны специалисту в данной области техники.
Соответственно, в некоторых вариантах реализации настоящего изобретения композиция согласно настоящему изобретению может быть введена пациенту отдельно или в комбинации с другими лекарственными средствами, или в фармацевтических композициях, в которых она смешана со вспомогательным веществом (веществами) или другими фармацевтически приемлемыми носителями. В одном из вариантов реализации настоящего изобретения фармацевтически приемлемый носитель является фармацевтически инертным. В зависимости от вылечиваемого состояния фармацевтические композиции могут быть получены и введены системно или местно. Способы получения и введения можно найти в последнем издании "Remington's Pharmaceutical Sciences" (Mack Publishing Co, Easton Pa.). Подходящие пути могут, например, включать пероральное или трансмукозальное введение; а также парентеральную доставку, включая внутримышечное, подкожное, интрамедуллярное, интратекальное, внутрижелудочковое, внутривенное, интраперитонеальное или интраназальное введение.
Для инъекции композиция согласно настоящему изобретению может быть получена в водных растворах, предпочтительно физиологически совместимых буферах, таких как раствор Хэнкса, раствор Рингера или буферный физиологический раствор. Для введения в ткани и клетки в составе используют проникающие вещества, необходимые для прохождения через конкретный барьер. Такие проникающие вещества, в целом, известны в данной области техники.
В других вариантах реализации композиции согласно настоящему изобретению (например, фармацевтические композиции) могут быть получены с использованием фармацевтически приемлемых носителей, хорошо известных в данной области техники, в дозах, подходящих для перорального введения. Такие носители позволяют представить фармацевтические композиции в виде таблеток, пилюль, капсул, жидкостей, гелей, сиропов, растворов, суспензий и т.п. для перорального приема или интраназального введения пациентом, которого лечат.
Фармацевтические композиции, подходящие для применения в настоящем изобретении, включают композиции, в которых активные ингредиенты содержатся в эффективном количестве для достижения намеченной цели. Например, эффективное количество композиции согласно настоящему изобретению может представлять собой такое количество, которое приводит к ингибированию роста и/или уничтожению бактерий или вирусов у субъекта. Специалист в данной области техники может легко определить эффективные количества, особенно в свете описания, представленного в настоящем документе.
В дополнение к активным ингредиентам фармацевтические композиции могут содержать подходящие фармацевтически приемлемые носители, включающие вспомогательные вещества и дополнительные вещества, которые облегчают переработку композиций согласно настоящему изобретению в препараты, подходящие для фармацевтического применения.
Фармацевтические композиции согласно настоящему изобретению могут быть получены способом, который сам по себе известен (например, с помощью традиционных способов смешивания, растворения, гранулирования, изготовления драже, растирания в порошок, эмульгирования, инкапсулирования, захвата или лиофилизации).
Фармацевтические составы для парентерального введения включают водные растворы композиций в водорастворимой форме. Кроме того, могут быть получены суспензии композиций в виде соответствующих масляных суспензий для инъекций. Подходящие липофильные растворители или носители включают жирные масла, такие как кунжутное масло, или синтетические эфиры жирных кислот, такие как этилолеат или триглицериды, или липосомы. Водные суспензии для инъекций могут содержать вещества, повышающие вязкость суспензии, такие как натрийкарбоксиметилцеллюлоза, сорбитол или декстран. Суспензия может также содержать подходящие стабилизаторы или агенты, повышающие растворимость композиций, что позволяет получать высококонцентрированные растворы.
Композиции согласно настоящему изобретению в составе с фармацевтически приемлемым носителем могут быть получены, помещены в соответствующую емкость и снабжены этикеткой для лечения указанного состояния. Состояния, указанные на этикетке, могут включать лечение или предотвращение вирусной или бактериальной инфекции.
Фармацевтическая композиция может быть представлена в виде соли и может быть получена с помощью множества кислот, включая, но не ограничиваясь указанными, хлористоводородную, серную, уксусную, молочную, винную, яблочную, янтарную и т.д. Соли, как правило, более растворимы в водных или других протонных растворителях, чем соответствующие формы свободного основания. В других случаях предпочтительный препарат может представлять собой лиофилизированный порошок в 1 мМ-50 мМ гистидине, 0,1%-2% сахарозе, 2%-% маннитоле в диапазоне pH от 4,0 до 5,5, который комбинируют с буфером перед применением.
Таким образом, в некоторых вариантах реализации настоящего изобретения предложены фармацевтические составы, содержащие IVIG (например, PCB-IVIG) согласно настоящему изобретению. Для получения фармацевтических или стерильных композиций IVIG может быть смешан с фармацевтически приемлемым носителем или вспомогательным веществом (см., например. Remington's Pharmaceutical Sciences и U.S. Pharmacopeia: National Formulary, Mack Publishing Company, Easton, Pa. (1984)). Составы терапевтических агентов (например, иммунотерапевтическая композиция) могут быть получены путем смешивания с физиологически приемлемыми носителями, вспомогательными веществами или стабилизаторами в форме, например, лиофилизированных порошков, взвесей, водных растворов или суспензий (см., например, Hardman, et al. (2001) Goodman and Oilman's The Pharmacological Basis of Therapeutics, McGraw-Hill, New York, N.Y.; Gennaro (2000) Remington: The Science and Practice of Pharmacy, Lippincott, Williams, and Wilkins, New York, N.Y.; Avis, et al. (eds.) (1993) Pharmaceutical Dosage Forms: Parenteral Medications, Marcel Dekker, NY; Lieberman, et al. (eds.) (1990) Pharmaceutical Dosage Forms: Tablets, Marcel Dekker, NY; Lieberman, et al. (eds.) (1990) Pharmaceutical Dosage Forms: Disperse Systems, Marcel Dekker, NY; Weiner and Kotkoskie (2000) Excipient Toxicity and Safety, Marcel Dekker, Inc., New York, N.Y.).
Таким образом, в некоторых вариантах реализации способы, предложенные согласно настоящему изобретению, дополнительно включают этап приготовления состава, представляющий собой добавление одного или более вспомогательных веществ к композиции иммуноглобулина (например, IVIG). Не ограничивающие примеры вспомогательных веществ, которые могут быть включены в составы, предложенные согласно настоящему изобретению, включают неионные поверхностно-активные вещества, наполнители (например, сахара и сахарные спирты), антиоксиданты, полисахариды и фармацевтически приемлемые водорастворимые полимеры (например, поли(акриловая кислота), поли(этиленоксид), поли(этиленгликоль), поли(винилпирролидон), гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и крахмал).
В одном из вариантов реализации вспомогательное вещество представляет собой агент, регулирующий осмолярность композиции. Не ограничивающие примеры агентов, регулирующих осмолярность, включают маннитол, сорбитол, глицерин, сахарозу, глюкозу, декстрозу, левулезу, фруктозу, лактозу, полиэтиленгликоли, фосфаты, хлорид кальция, глюконоглюкогептонат кальция, диметилсульфон и т.п.
В одном из вариантов реализации настоящего изобретения предложен способ стабилизации водной композиции иммуноглобулина, при этом указанный способ включает получение композиции иммуноглобулина с: 75 мМ-175 мМ галогенида металла (например, 100-150 мМ хлорид натрия); 150-350 мМ аминокислоты (например, 200-290 мМ глицин) и 0,01-0,1% неионного поверхностно-активного вещества (например, поверхностно-активное вещество, представляющее собой полисорбат (например, 0,1-0,3% полисорбат 80)); и pH от 3,5 до 7,0 (например, pH от 4,0 до 5,0). В одном из вариантов реализации состав содержит 120±20 мМ хлорид натрия. В другом варианте реализации состав содержит 245±45 мМ глицин. В другом варианте реализации состав содержит 0,2±0,05% поверхностно-активного вещества, представляющего собой полисорбат (например, полисорбат 20 или полисорбат 80). В другом варианте реализации состав имеет pH 4,3±0,3. В другом варианте реализации указанный способ дополнительно включает хранение композиции иммуноглобулина в воздухонепроницаемом герметичном сосуде в атмосфере инертного газа. В другом варианте реализации инертный газ представляет собой азот. В другом конкретном варианте реализации инертный газ представляет собой аргон. В другом конкретном варианте реализации инертный газ представляет собой диоксид углерода. В одном из вариантов реализации конечный состав не содержит поверхностно-активное вещество или сахар.
Композиции согласно настоящему изобретению (например, объединенные образцы плазмы) можно комбинировать с дополнительными агентами (например, антителами, фрагментами антител, антителоподобными молекулами, моноклональными антителами или другими белками, или малыми молекулами) для усиления иммунотерапевтического и/или противовоспалительного действия. Такие дополнительные агенты могут быть получены рекомбинантным способом, путем синтеза, in vitro и т.д. Настоящее изобретение не ограничивается типами дополнительных агентов, с которыми комбинируют объединенный образец с антителами или другой образец. В некоторых вариантах реализации добавляют рекомбинантные или синтетические антитела (например, гуманизированные моноклональные антитела), или фрагменты антител (например, направленные на конкретный патоген или антиген). Кроме того, в композиции могут быть добавлены антитела (например, моноклональные, поликлональные и т.д.) к указанным бактериям и вирусам. В некоторых вариантах реализации в пулы образцов с антителами добавляют различные терапевтические средства (например, противовоспалительные агенты, химиотерапевтические агенты), стабилизаторы, буферы и т.д., например, для дополнительного повышения эффективности, стабильности, вводимости, длительности действия, области применения и т.д.
Композиции могут содержать носители, такие как консерванты, смачивающие агенты, эмульгирующие и диспергирующие агенты. Предотвращение действия микроорганизмов может быть обеспечено различными антибактериальными и противогрибковыми агентами, например, парабенами, хлорбутанолом, фенолом, сорбиновой кислотой и т.п. Может быть также желательным включение изотонических агентов, например, сахаров, хлорида натрия и т.п. Пролонгированную абсорбцию иммуноглобулинов можно обеспечить путем использования агентов, отсрочивающих абсорбцию, например, моностеарата алюминия и желатина.
В некоторых вариантах реализации композицию согласно настоящему изобретению вводят субъекту для обеспечения терапевтических, превентивных, профилактических и/или других полезных эффектов.
В некоторых вариантах реализации иммунотерапевтическая композиция согласно настоящему изобретению (например, с повышенными антителами к двум или более патогенам, антигенам или эпитопам и т.д.) эффективно лечит (например, терапевтически, превентивно, профилактически и т.д.), связывает антигены и/или направлена на патогенные бактерии, включая, но не ограничиваясь указанными: Bacillus anthracis, Bordetella pertussis, Borrelia burgdorferi, Brucella abortus, Brucella canis, Brucella melitensis, Brucella suis, Campylobacter jejuni, Chlamydia pneumonia, Chlamydia trachomatis, Chlamydophila psittaci, Clostridium botulinum, Clostridium difficile, Clostridium perfringens, Clostridium tetani, Corynebacterium diphtheria, Enterococcus faecalis, Enterococcus faecium, Escherichia coli, Francisella tularensis, Haemophilus influenza, Helicobacter pylori, Legionella pneumophila, Leptospira interrogans, Listeria monocytogenes, Mycobacterium leprae, Mycobacterium tuberculosis, Mycoplasma pneumonia, Neisseria gonorrhoeae, Neisseria meningitides, Pseudomonas aeruginosa, Rickettsia rickettsia, Salmonella typhi, Salmonella typhimurium, Shigella sonnei, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus saprophyticus, Streptococcus agalactiae, Streptococcus pneumonia, Streptococcus pyogenes, Treponema pallidum, Vibrio cholera и Yersinia pestis.
В некоторых вариантах реализации иммунотерапевтическая композиция согласно настоящему изобретению (например, с повышенными антителами к двум или более патогенам, антигенам или эпитопам и т.д.) эффективно лечит (например, терапевтически, превентивно, профилактически и т.д.), связывает антигены и/или направлена на патогенные вирусы, включая, но не ограничиваясь указанными: аденовирус, вирус коксаки, вирус Эпштейна-Барр, вирус ВК, вирус гепатита А, вирус гепатита В, вирус гепатита С, вирус простого герпеса (тип 1), вирус простого герпеса (тип 2), цитомегаловирус, вирус герпеса человека (тип 8), вирус иммунодефицита человека (ВИЧ), вирус гриппа, вирус кори, вирус эпидемического паротита, вирус папилломы человека, вирус парагриппа, вирус полиомиелита, вирус бешенства, респираторно-синцитиальный вирус, вирус краснухи и вирус ветряной оспы.
Заболевания и состояния, при которых введение композиций согласно настоящему изобретению следует применять в терапевтических или профилактических целях, включают, но не ограничиваются указанными: вариабельный неклассифицируемый иммунодефицит, дефицит IgA, инфекцию, вызываемую вирусом иммунодефицита человека (ВИЧ), бактериальные и вирусные инфекции, такие как инфекция дыхательных путей, вызываемая гриппом, инфекция дыхательных путей, вызываемая респираторно-синцитиальным вирусом, инфекция дыхательных путей, вызываемая риновирусом, инфекция дыхательных путей, вызываемая аденовирусом: протозойные инфекции, такие как лямблиоз, дрожжевые инфекции; хронический лимфоцитарный лейкоз; множественную миелому; макроглобулинемию; хронический бронхит; бронхоэктазию; астму; иммуносупрессию, связанную с трансплантацией костного мозга; иммуносупрессию, связанную с введением циклофосфамида; иммуносупрессию, связанную с введением азатиаприна; иммуносупрессию, связанную с введением метотрексата; иммуносупрессию, связанную с введением хлорамбуцила; иммуносупрессию, связанную с введением азотистого иприта; иммуносупрессию, связанную с введением 6-меркаптопурина; иммуносупрессию, связанную с введением тиогуанина; тяжелый комбинированный иммунодефицит; дефицит аденозиндезаминазы; дефицит молекул I класса главного комплекса гистосовместимости (синдром «голых» лимфоцитов) и дефицит молекул II класса главного комплекса гистосовместимости; дефицит пуриннуклеозидфосфорилазы; синдром ДиДжорджи; транзиторную младенческую гипогаммаглобулинемию; сцепленную с Х-хромосомой агаммаглобулинемию; сцепленную с Х-хромосомой агаммаглобулинемию с дефицитом гормона роста; дефицит транскобаламина II; иммунодефицит с тимомой; иммунодефицит с наследственным дефектом ответа на вирус Эпштейна-Барр; дефицит иммуноглобулина с повышенным IgM; дефицит Р-цепей; атаксию-телеангиэктазию; иммунодефицит с частичным альбинизмом; последствия селективного дефицита IgA, такие как те, которые являются следствием ревматоидного артрита; ювенильный ревматоидный артрит; системную красную волчанку; тиреоидит; злокачественную анемию; дерматомиозит; гемолитическую анемию с положительным тестом Кумбса; идиопатическую болезнь Аддисона; церебральный васкулит и идиопатическую тромбоцитопеническую пурпуру.
Применение конкретных композиций и способов согласно настоящему изобретению для лечения патогенов или лечения/предотвращения инфекции может варьироваться в зависимости от места инфекции. Например, иммунотерапевтические композиции, применяемые для лечения и/или предотвращения респираторных инфекций, могут содержать иммуноглобулины, при этом антитела и/или моноклональные антитела специфичны в отношении по меньшей мере двух из следующих патогенов: респираторно-синцитиального вируса, вируса гриппа А, вируса гриппа В, вируса гриппа С, вируса парагриппа типа 1, вируса парагриппа типа 2, риновируса, метапневмовируса, коронавируса, S. pneumonia, H. influenza, L. pneumophila. Streptococcus группы А, Streptococcus mutans, В. gingivalis, S. pyogenes (группа А), S. pneumoniae, K. pneumoniae, P. aeruginosa, S. aureus, M. pneumoniae или любого другого респираторного патогена или другого типа патогена, известного специалисту в данной области техники или описанного в настоящем документе.
Различные заболевания (например, рак, СПИД и т.д.), инфекции и способы лечения (например, противовирусные средства, лекарственные средства против отторжения, виды химиотерапии и т.д.) могут вызывать локализованное или общее воспаление у субъекта, которое может приводить к дискомфорту, последующим проблемам со здоровьем, заболеваемости и/или смерти. В некоторых вариантах реализации композиции и способы согласно настоящему изобретению обеспечивают полезные противовоспалительные эффекты при введении субъекту. Было показано, что объединенные иммуноглобулины оказывают противовоспалительное действие при пассивном введении (см., например, Nimmerjahn and Ravetch, Annu. Rev. Immunol. 2008, 26: 513-33.; Ramakrishna et al. Plos Pathogens. 2011. 7:6:e1002071.; полное содержание которых включено в настоящее описание посредством ссылки). В некоторых вариантах реализации композиция согласно настоящему изобретению оказывает усиленное противовоспалительное действие (например, 10% усиление, 20% усиление, 50% усиление, 2-кратное усиление, 3-кратное усиление, 5-кратное усиление, 10-кратное усиление или более) по сравнению с противовоспалительным действием смеси образцов плазмы, полученных от случайных субъектов, представляющих собой людей (например, 1000 или более случайных субъектов, представляющих собой людей). Хотя для реализации настоящего изобретения понимание механизма не является необходимым, и тогда как настоящее изобретение не ограничивается каким-либо конкретным механизмом, в одном из вариантов реализации композиция объединенной плазмы согласно настоящему изобретению демонстрирует в значительной степени усиленное противовоспалительное действие по сравнению с традиционным IVIG, поскольку указанная композиция объединенной плазмы согласно настоящему изобретению содержит плазму по меньшей мере от 1000 доноров (например, по сравнению с традиционным гипериммунным глобулином, полученным от ограниченного числа доноров (например, в одном из вариантов реализации чем больше количество различных объединяемых образцов плазмы, тем благоприятнее противовоспалительное действие (например, тем значительнее полезный эффект в отношении гистопатологии (например, уменьшение гибели эпителиальных клеток)) наблюдают)).
В некоторых вариантах реализации композиции согласно настоящему изобретению обеспечивают лечение и профилактику ран, ожогов, внутрибольничных инфекций и инфекций ротовой полости, и респираторных инфекций. В некоторых вариантах реализации иммунотерапевтические композиции согласно настоящему изобретению содержат конкретные титры антител к конкретным патогенам. Например, титры антител к конкретным патогенам в композициях согласно настоящему изобретению могут составлять от 1 до 1000 мкг/мл (например, 1 мкг/мл… 2 мкг/мл… 5 мкг/мл… 10 мкг/мл… 20 мкг/мл… 50 мкг/мл… 100 мкг/мл… 200 мкг/мл… 500 мкг/мл… 1000 мкг/мл), хотя предусмотрены и более высокие и более низкие титры.
В некоторых вариантах реализации защитная активность иммунотерапевтической композиции, содержащей специально созданный пул антител, усилена за счет дополнительного содержания одного или более дополнительных агентов, включая, но не ограничиваясь указанными: антибиотики, противовирусные средства, противовоспалительные и/или заживляющие соединения. Например, биоциды, поверхностно-активные вещества, аналоги блокаторов рецепторных участков адгезии бактерий, цитокины, факторы роста, макрофагальные хемотаксические агенты, цефалоспорины, аминогликозиды, фторхинолоны и т.д. могут быть представлены на терапевтически приемлемых уровнях в композициях согласно настоящему изобретению.
В некоторых вариантах реализации настоящего изобретения композиции согласно настоящему изобретению вводят отдельно, тогда как в других вариантах реализации композиции предпочтительно присутствуют в фармацевтическом составе, содержащем по меньшей мере один активный ингредиент/агент, определенный выше, совместно с твердой подложкой или, в качестве альтернативы, совместно с одним или более фармацевтически приемлемыми носителями и возможно другими терапевтическими агентами. Каждый носитель должен быть «приемлемым» в том смысле, что он должен быть совместимым с другими ингредиентами состава и безвредным для субъекта.
Композиции согласно настоящему изобретению могут быть введены любым подходящим путем введения (например, энтеральным путем, парентеральным путем и т.д.). Термин «энтеральный путь» введения относится к введению через любую часть желудочно-кишечного тракта. Примеры энтеральных путей включают пероральный, трансмукозальный, трансбуккальный и ректальный путь или внутрижелудочный путь. Термин «парентеральный путь» введения относится к пути введения, отличному от энтерального пути. Примеры парентеральных путей введения включают внутривенное, внутримышечное, внутрикожное, интраперитонеальное, внутриопухолевое, интравезикальное, внутриартериальное, интратекальное, внутрикапсулярное, интраорбитальное, интракардиальное, транстрахеальное, внутрисуставное, субкапсулярное, субарахноидальное, интраспинальное, эпидуральное и интрастернальное, подкожное или топическое введение. В типичных вариантах реализации композиции вводят субъекту так, что они поступают в кровоток (например, внутривенное введение). В некоторых вариантах реализации композиции вводят в устройства или инструменты, которые будут соприкасаться с телом субъекта (например, медицинские устройства, бинты и т.д.). Антитела и композиции согласно настоящему изобретению могут быть введены с использованием любого подходящего способа, например, путем перорального приема (например, пилюля, таблетка, сироп, жидкость, эликсир и т.д.), введения через назогастральный зонд, гастростомическую трубку, инъекции (например, внутривенной), инфузии, с помощью имплантируемого инфузионного насоса и осмотического насоса. Подходящий путь и способ введения могут варьироваться в зависимости от ряда факторов, таких как конкретное используемое антитело или антитела, желаемая скорость абсорбции, конкретный используемый состав или лекарственная форма, тип или тяжесть вылечиваемого нарушения, конкретное место действия и состояния пациента, и могут быть легко выбраны специалистом в данной области техники.
Термин «терапевтически эффективное количество» относится к количеству, которое является эффективным для намеченной терапевтической цели. Например, в контексте усиления иммунного ответа «терапевтически эффективное количество» представляет собой любое количество, эффективно стимулирующее, вызывающее, повышающее, улучшающее или усиливающее любой ответ иммунной системы млекопитающего. В контексте оказания противовоспалительного действия «терапевтически эффективное количество» представляет собой любое количество, которое является достаточным для того, чтобы вызвать любое желаемое или полезное уменьшение воспаления или предотвратить возникновение воспаления. Терапевтически эффективное количество антитела обычно находится в диапазоне от примерно 0,001 до примерно 5000 мг/кг и чаще от примерно 0,05 до примерно 100 мг/кг массы тела млекопитающего. Например, указанное количество может составлять примерно 0,3 мг/кг, 1 мг/кг, 3 мг/кг, 5 мг/кг, 10 мг/кг, 50 мг/кг или 100 мг/кг массы тела млекопитающего. Точный уровень доз для введения может быть легко определен специалистом в данной области техники и будет зависеть от ряда факторов, таких как тип и тяжесть нарушения, которое лечат, конкретная используемая связывающая молекула, путь введения, время введения, продолжительность лечения, конкретная используемая дополнительная терапия, возраст, пол, масса тела, состояние, общее состояние здоровья и анамнез вылечиваемого пациента, и подобные факторы, хорошо известные в области медицины.
Иммунотерапевтическую композицию, специально созданный пул антител или другую композицию согласно настоящему изобретению часто вводят несколько раз. Интервалы между однократными дозами могут составлять, например, часы, дни, недели, месяцы или годы. Типичная схема лечения включает введение один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в месяц, один раз в 3 месяца или один раз в 3-6 месяцев. Примеры режимов дозирования для иммунотерапевтической композиции, содержащей специально созданный пул антител, включают 1 мг/кг массы тела или 3 мг/кг массы тела путем внутривенного введения с использованием одной из следующих схем дозирования: (i) каждые четыре недели для шести доз, затем каждые три месяца; (ii) каждые три недели; (iii) 3 мг/кг массы тела однократно с последующим 1 мг/кг массы тела каждые три недели. Другие дозы и режимы могут быть определены клиницистами, исследователями или другими практикующими врачами согласно настоящему изобретению.
Следует понимать, что иммунотерапевтические композиции, описанные в настоящем документе, находят применение в ветеринарии, а также эффективны в сфере здравоохранения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Следующие примеры приведены для демонстрации и дополнительной иллюстрации некоторых предпочтительных вариантов реализации и аспектов настоящего изобретения, и не ограничивают объем настоящего изобретения.
Пример 1
Исследования показали, что способность людей отвечать на чужеродные антигены (например, микробные патогены (например, встречающиеся в природе или в форме вакцины)) контролируется главным комплексом гистосовместимости (тип лейкоцитарный антиген человека «HLA» у людей, главный комплекс гистосовместимости у мыши, Н-2, гомологичен HLA у людей). Дополнительные исследования показали, что комплекс гистосовместимости контролирует гуморальные ответы антител, формируемые у субъекта на микробные патогены. На протяжении некоторого времени существовали различные программы HLA-типирования, и они позволяли исследовать тип HLA относительно различных иммунологических ответов у людей (например, трансплантация и/или отторжение костного мозга, трансплантация органа, аутоиммунитет, рак и сила иммунного ответа (например, гуморального иммунного ответа), формируемого субъектом). Несмотря на то, что HLA-типирование может быть полезным в данных ограниченных случаях, стоимость, медицинская документация и другие проблемы делают невозможным проведение HLA-типирования у индивидуумов в других случаях.
При разработке вариантов реализации настоящего изобретения проводили эксперименты для определения того, можно ли идентифицировать подгруппу доноров плазмы как демонстрирующую сильный (например, высокий) гуморальный иммунный ответ при отсутствии HLA-типирования. Например, идентификация отельных субъектов или популяции индивидуумов, демонстрирующих сильный гуморальный иммунный ответ, может быть сама по себе полезной для идентификации индивидуумов как потенциальных доноров плазмы (например, для получения иммуноглобулина). Кроме того, проводили эксперименты для определения того, можно ли идентифицировать индивидуумов, демонстрирующих сильный ответ не только на один микробный патоген, но и на множество микробных патогенов (например, такой индивидуум или популяция индивидуумов могут демонстрировать высокие титры благодаря силе гуморального иммунного ответа у субъекта не только на один микробный патоген/антиген, но и множество микробных патогенов/антигенов (например, любой или все микробные патогены/антигены, воздействию которых указанный индивидуум или популяция индивидуумов подвергалась на протяжении жизни)). Таким образом, проводили эксперименты с целью идентифицировать доноров плазмы как, в целом, демонстрирующих сильный ответ, при отсутствии необходимости в типировании тканей (например, HLA-типировании) доноров на предмет конкретного комплекса генов гистосовместимости. С этой целью исследовали и характеризовали образцы плазмы от доноров на предмет титров антител к одному или множеству респираторных патогенов для получения характеристик доноров (например, как демонстрирующих высокий/сильный ответ на антигенную стимуляцию через выработку повышенных уровней антител по сравнению с донорами, не демонстрирующими сильный ответ/не вырабатывающими повышенные уровни антител (например, путем определения титров антител к одному или более респираторным патогенам у субъектов)).
Респираторные патогены были выбраны, поскольку индивидуумы повсеместно подвергаются воздействию множества респираторных патогенов. То есть почти все популяции людей, представляющих собой взрослых и детей, подвергались воздействию множества респираторных патогенов и, следовательно, в определенный момент их жизни у них вырабатывался гуморальный ответ антител, который можно измерить. Проводили эксперименты для определения того, можно ли идентифицировать индивидуумов, демонстрирующих высокий/сильный ответ, с использованием титров антител к одному или множеству респираторных патогенов. В одном из не ограничивающих примеров, описанных ниже, проводили эксперименты для определения того, можно ли использовать титр антител к респираторно-синцитиальному вирусу (РСВ) в образце плазмы от донора для предсказания титра антител к другим респираторным патогенам в указанном образце плазмы от донора. Например, проводили эксперименты для определения того, можно ли использовать высокий титр антител к респираторному патогену (например, РСВ) в качестве биомаркера для идентификации донора как, в целом, демонстрирующего высокий/сильный ответ на антигенную стимуляцию (например, на множество респираторных или других патогенов) через выработку повышенных уровней антител, по сравнению с донорами, не демонстрирующими сильный ответ/не вырабатывающими повышенные уровни антител.
Получали двадцать образцов плазмы от случайных доноров и определяли титры антител к множеству респираторных вирусов. В частности, образцы плазмы от доноров исследовали и характеризовали на предмет титров антител к различным респираторным патогенам, включая респираторно-синцитиальный вирус (РСВ), грипп A (Flu А), грипп В (Flu В), парагрипп типа 1 (PIV1), типа 2 (PIV2) и типа 3 (PIV3), метапневмовирус (HMPV) и/или коронавирус ОС43 (штаммы ОС43 и 229Е). Для определения титров антител каждый образец плазмы очищали; очищенную фракцию Ig анализировали либо путем анализа нейтрализации (например, на предмет РСВ), либо путем твердофазного иммуноферментного анализа (ELISA) (например, грипп А и В, парагрипп, метапневмовирус и коронавирус). Как описано ниже, титры к каждому респираторному вирусу получали в результате каждой из трех отдельных серий/анализов (обозначаемых СЕРИЯ 1, СЕРИЯ 2 и СЕРИЯ 3), и титр РСВ-нейтрализующих антител для каждого образца сравнивали с титрами антител к респираторным вирусам, не представляющим собой РСВ.
Для количественного измерения уровня титра присутствующих нейтрализующих антител анти-РСВ (например, в образцах сыворотки, плазмы человека или полученных из них продуктах (также называемых аналитом)), разрабатывали анализ микронейтрализации РСВ. Вкратце, одно или более разведении аналита (50 мкл) инкубировали совместно с исходным инфекционным раствором РСВ (РСВ-А2, 50-100 БОЕ, 50 мкл) в 96-луночных планшетах для тканевой культуры в течение 30 минут при комнатной температуре. Раствор для разведения был таким же, как и питательные среды, минимальная поддерживающая среда Игла с глутамином, 2% FBS и пенициллином-стрептомицином (далее ЕМЕМ). В зависимости от относительного титра нейтрализующего антитела в анализируемом образце указанное антитело будет нейтрализовать некоторую часть или весь РСВ. К смеси аналит/вирус добавляли равный объем (100 мкл) приблизительно 1,5×105 клеток НЕр-2 (CCL-23 АТСС) в ЕМЕМ и образцы инкубировали при 36-38°С, 4,5-5,5% CO2 в течение 3 дней, за это время только не нейтрализованный вирус будет распространяться в клетки НЕр-2. Следовательно, количество реплицирующегося вируса было обратно пропорционально количеству нейтрализующего антитела, присутствующего в аналите. После инкубации вирус фиксировали в лунках планшета для тканевой культуры 80% ацетоном в ФБР. Затем планшеты проявляли путем анализа иммуноферментного типа (EIA). В EIA использовали моноклональное антитело мыши к F-белку РСВ с последующим антителом, конъюгированным с ферментом пероксидазой хрена, которое позволяло детектировать указанное моноклональное антитело мыши к F-белку РСВ. Наконец, добавляли хромогенный субстрат и анализировали путем EIA с использованием стандартных спектрофотометрических методов. Полученные относительные значения поглощения были прямо пропорциональны количеству вируса РСВ в лунках и, таким образом, обратно пропорциональны количеству нейтрализующего антитела в аналите.
Для определения титров в плазме и сыворотке образцы и контроли подвергали 2-кратному разведению в двух повторностях от 1:100 до 1:25600 в 96-луночном планшете для тканевой культуры и инкубировали совместно с вирусом и клетками НЕр-2, как описано выше. Кроме того, каждый планшет содержал лунки без вируса (100% ингибирование) и с вирусом без антитела (0% ингибирования). Данные значения поглощения использовали для расчета точки 50% ингибирования.
Титры определяли как минимальное разведение аналита, преодолевшее точку 50% ингибирования. Все титры корректировали относительно значения титра стандартного контроля с малым количеством (MQC).
Для идентификации и отнесения образцов к категории образцов с высоким, средним или низким титром РСВ-нейтрализующих антител получали контроли для анализа с использованием трех отдельных и отличных образцов, а также контроль, представляющий собой эталонный продукт. Контроли/стандарты для анализа разрабатывали на основе анализа тысяч доноров, проанализированных в ходе экспериментов, проводимых при разработке настоящего изобретения. Идентифицировали и использовали контроль с малым количеством (LQC), который содержал титры РСВ-нейтрализующих антител ниже среднего наблюдаемого диапазона титров, идентифицировали и использовали контроль со средним количеством (MQC), который содержал титры РСВ-нейтрализующих антител, попадающие в средний наблюдаемый диапазон, и идентифицировали и использовали контроль с высоким количеством (HQC), который содержал титры РСВ-нейтрализующих антител в верхнем пределе анализов (соответственно, контроли LQC, MQC и HQC идентифицировали и использовали на основе наблюдений тысяч образцов). Для того чтобы анализ считался валидным, данные, полученные для контролей, должны были отвечать предварительно определенным критериям для титра и/или поглощения. Относительные диапазоны титров к РСВ для контролей для анализа с низким, средним и высоким значением были следующими: 1800-3299; 3300-7799; и 7800 или выше соответственно.
Для скрининга плазмы и сыворотки образцы и контрольные сыворотки инактивировали путем нагревания и разводили 1:200 в ЕМЕМ. Разведение 1:200 добавляли в дубликаты лунок и проводили анализ нейтрализации РСВ, как описано выше. Определяли диапазоны поглощения для контролей LQC, MQC и HQC. Регистрировали среднее значение для значений поглощения дубликатов лунок для каждого образца. Снова поглощение было обратно пропорционально количеству нейтрализующего антитела в образце. Следовательно, чем ниже поглощение, тем больше присутствует нейтрализующего антитела.
В постановку анализа для каждого планшета включали LQC, MQC и HQC, размещаемые в соответствии с принципом ограничивающих стандартов. Для того чтобы анализ считался валидным, титры должны были отвечать предварительно определенным критериям. В случае, когда титр в плазме или сыворотке был <100, ее можно было разводить до 12,5 раза и тестировать 2-кратные разведения от 12,5 до 3200. Таким образом, когда клинический образец подвергали предварительному скринингу и титр в указанном образце был таким низким, что разведение 1:100 было бы слишком большим разведением для того, чтобы можно было детектировать какой-либо сигнал, разведение начинали с 1:12,5 с последующими двукратными разведениями от данной точки. Данный предварительный скрининг клинических образцов приводил к тому результату, что если титр донора был таким низким, что был необходим данный тип разведения, их относили к категории образцов с низким титром. Все планшеты анализировали с использованием контрольного антитела в качестве ограничивающего стандарта для планшетов.
Проводили иммуноферментный анализ (EIA) для детектирования сывороточного IgG, специфичного к вирусу, для девяти респираторных вирусов: гриппа А и В, PCB, серотипов 1, 2 и 3 вируса парагриппа (PIV), метапневмовируса человека (hMPV) и коронавируса 229Е (CoV 229E), и коронавируса ОС43 в соответствии с опубликованными способами (см., например, Falsey et al., J Am Geriatr Soc. 1992; 40: 115-119; Falsey et al., J Am Geriatr Soc. 1995; 43: 30-36; Falsey et al., J Am Geriatr Soc. 1997; 45: 706-711; Falsey et al., J Infect Dis. 2003; 187: 785-790). Вкратце, антигены получали из лизатов цельных клеток, инфицированных вирусом, для всех вирусов, кроме РСВ. Очищенные гликопротеины вирусной поверхности использовали в качестве антигена для EIA РСВ в соответствии с опубликованными способами (см., например, Falsey et al., J Am Geriatr Soc. 1992; 40: 115-119). Серийные двукратные разведения каждого образца тестировали в двух повторностях.
Анализ данных проводили с помощью подхода парных данных. Пары данных создавали путем сопоставления с ID донора в каждой серии анализа ELISA.
В частности, для оценки коррекции между титрами антител к РСВ и титрами антител к респираторному вирусу, не представляющему собой РСВ, на уровне донора получали пары данных антител путем сопоставления с ID донора в рамках одной и той же серии анализа ELISA (обозначаемой серия №1, серия №2 и серия №3). Получали пары титров антител к РСВ донора и титров антител к другому вирусу, не представляющему собой РСВ, этого же донора. Следовательно, создавали всего 20 пар в рамках серии и всего 60 пар создавали в рамках сравнения. Оценивали линейную корреляцию между титрами антител к РСВ и титрами антител к другому вирусу, не представляющему собой РСВ, с использованием коэффициента корреляции Пирсона в линейном масштабе и в масштабе log2. Весь анализ проводили с использованием SAS, версия 9.3.
Как показано в таблице 1, обнаруживали положительную линейную корреляцию между наблюдаемыми титрами антител к РСВ и наблюдаемыми титрами антител к другим респираторным патогенам, не представляющим собой РСВ. Данное наблюдение показывало, что образцы плазмы, идентифицированные как имеющие высокое значение титра антител к РСВ, также содержали более высокий/больший титр к другим патогенам, не представляющим собой РСВ. Все коэффициенты корреляции были статистически значимыми (p<0,05), при этом расчетные коэффициенты корреляции находились в диапазоне от 0,29 (ОС43) до 0,67 (PIV 3) в масштабе log2. Диаграмма рассеяния, демонстрирующая титр РСВ-нейтрализующих антител по сравнению с титрами антител к гриппу А, гриппу В, PIV 1 и PIV 3 в линейном масштабе, представлена на фиг.1. Диаграмма рассеяния, демонстрирующая титр РСВ-нейтрализующих антител по сравнению с титрами антител к гриппу А, гриппу В, PIV 1 и PIV 3 в масштабе log2, представлена на фиг.2.
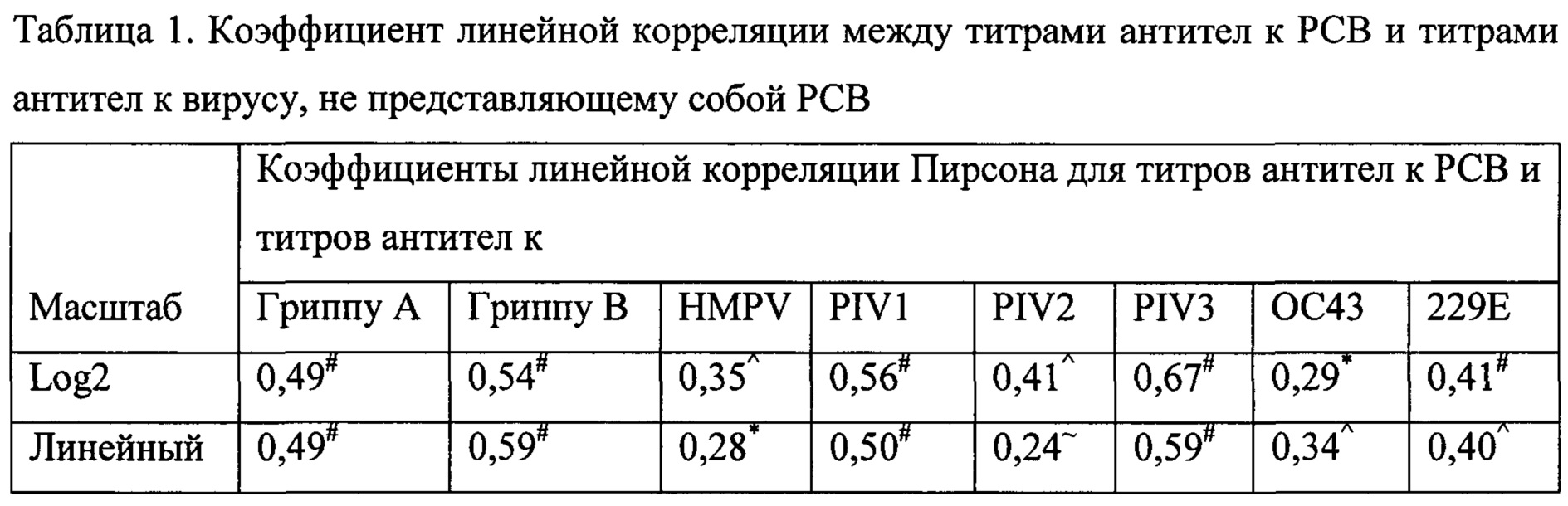
При разработке вариантов реализации настоящего изобретения проводили дополнительные эксперименты для определения того, можно ли обнаруживаемую положительную линейную корреляцию между наблюдаемыми титрами антител к РСВ и титрами антител к другим респираторным патогенам, не представляющим собой РСВ, отнести к общему повышению всех титров.
Для данного эксперимента получали характеристики титра нейтрализующих корь антител и определяли, можно или его использовать для идентификации образцов как обладающих желаемой характеристикой (например, повышенными уровнями титров антител к другому патогену, не представляющему собой корь). Получали характеристики для двух отдельных образцов. Партия 1 демонстрировала титр нейтрализующих корь антител, составляющий 2,34, и титр РСВ-нейтрализующих антител, составляющий 17,275. Партия 2 демонстрировала значительно более низкий титр нейтрализующих корь антител, составляющий 0,73, и титр РСВ-нейтрализующих антител, составляющий 20,375. Таким образом, даже несмотря на то, что титр антител к кори в одном случае составлял лишь приблизительно 30% от значения для другой партии, обе партии коррелировали с/были отобраны по высокому титру антител к РСВ. Соответственно, определяли, что вирус кори не подходит в качестве отличительного маркера для отбора образцов плазмы, содержащих высокий титр к другим вирусам, не представляющим собой корь.
Таким образом, для каждого из 20 случайных анализируемых образцов наблюдали значительную корреляцию между титром нейтрализующих антител, специфичных к РСВ, и титром антител, специфичных к одному или более другим респираторным патогенам - высокий титр антител к РСВ напрямую и в значительной степени коррелировал с высоким титром (титрами) антител, специфичных к другим респираторным патогенам.
Пример 2
Проводили дополнительные эксперименты для определения того, можно ли образцы плазмы, идентифицированные как демонстрирующие высокий/сильный ответ (содержащие высокий титр) в примере 1, комбинировать с другими образцами с не высоким титром для получения пула из 1000 или более образцов, при этом содержащего желаемый повышенный титр антител к РСВ и желаемый повышенный титр антител к одному или более другим респираторным патогенам.
Образцы плазмы от доноров подвергали первоначальному скринингу (предварительному скринингу, описанному в примере 1) с использованием оптической плотности для определения титра РСВ-нейтрализующих антител. Вкратце, донорскую плазму, разведенную 1:400, смешивали с РСВ, а затем наносили на клетки Нер 2. Нейтрализующую активность в плазме измеряли по отсутствию инфицирования гепатоцитов. После инкубации для обеспечения экспрессии вируса планшет фиксировали, а затем окрашивали моноклональным антителом анти-РСВ с последующим контрантителом, конъюгированным с пероксидазой хрена. Чем ниже наблюдаемая оптическая плотность (OD), тем выше нейтрализующая способность плазмы (тем меньше остается вирусов, инфицирующих клетки).
Получали дополнительные характеристики верхних 20% образцов от доноров, идентифицированных при предварительном скрининге как имеющие самую низкую OD. То есть после идентификации клинических образцов, подвергнутых предварительному скринингу путем определения одной точки титрования путем анализа нейтрализации, попадающих в верхние 20% образцов от доноров с точки зрения титра нейтрализующих антител, получали дополнительную плазму от идентифицированных таким образом доноров для дальнейшего анализа. Дополнительные образцы плазмы от доноров очищали, очищали/получали фракцию иммуноглобулинов и указанную фракцию анализировали путем анализа нейтрализации с использованием кривой полного титрования для получения титра РСВ-нейтрализующих антител. Донорскую плазму, подвергаемую дальнейшему тестированию, подвергали серийному разведению (например, 1:100 1:200 1:400 и т.д.) в анализе полного титрования и титр присваивали образцу (т.е. донору плазмы) как разведение, дающее 50% ингибирование роста вируса (50% ингибирование представляет собой ту точку, которая составляет 50% двух крайних точек (физиологический раствор плюс вирус представляет собой 100 рост, и без добавленного вируса представляет собой 0 рост)).
Иммуноглобулин, полученный из дополнительных образцов плазмы, в которых регистрировали титр РСВ-нейтрализующих антител, составляющий 1800 и выше, приводил к оценке донора как демонстрирующего высокий/сильный ответ. Конкретный титр РСВ-нейтрализующих антител для каждого образца плазмы от каждого донора регистрировали и использовали в последующем процессе смешивания. В результате экспериментов, проводимых при разработке вариантов реализации настоящего изобретения, определяли, что только примерно 25-50% тех, кто попадал в группу верхних 20% путем первоначального/предварительного скрининга, классифицировали с использованием второго анализа нейтрализации РСВ как доноров с высоким/сильным ответом на основе титра 1800 или выше (только 5-10% от общей исходной популяции, подвергнутой скринингу).
Плазму получали на постоянной основе от доноров, классифицированных как демонстрирующие высокий/сильный ответ, и периодически (ежемесячно) тестировали. Если во время данного процесса определяли, что титр РСВ-нейтрализующих антител донора, демонстрирующего высокий/сильный ответ, падал ниже 1700, указанного донора больше не классифицировали как демонстрирующего высокий/сильный ответ. Доноров, идентифицированных как демонстрирующие высокий/сильный ответ с титром РСВ-нейтрализующих антител 1800 или выше, относили к категории с высоким титром (отобранные доноры с высоким титром). Плазму от оставшихся 50% доноров плазмы, идентифицированных как попадающие в верхние 20% всех доноров, но не имеющих титр РСВ-нейтрализующих антител 1800 или выше, относили к категории со средним титром. Третью группу доноров плазмы относили к категории доноров из не тестированного/неотобранного источника.
Комбинировали плазму от отобранных доноров с высоким титром, отобранных доноров с не высоким титром и доноров из неотобранного источника. Титр РСВ-нейтрализующих антител в смешанных образцах плазмы рассчитывали арифметически следующим образом: умножали титр в плазме на ее объем с получением общего титра, а затем делили на общий объем всех образцов плазмы. Например, если один литр плазмы с титром 100 добавляли к одному литру плазмы с титром 200, общий титр составлял 100×1+200×1, что равнялось 300, и делили на 2 литра с получением конечного титра, равного 150. Тестировали, можно ли получить смешанную плазму от 1000 различных доноров с общим объемом 2500 литров и титром РСВ-нейтрализующих антител, составляющим 1800 или больше (и/или титром антител к РСВ, составляющим 1800 или больше, и повышенным титром антител к одному или более другим респираторным вирусам). Поскольку целевой титр РСВ-нейтрализующих антител составлял 1800, если смесь при арифметическом расчете давала более высокое значение, то в смесь вводили плазму из обычного источника. Титр для плазмы от донора из не тестированного/неотобранного источника устанавливали равным нулю. Следовательно, при добавлении плазмы из обычного источника не наблюдали повышения значения титра, только увеличение объема (знаменатель), которое, как описано выше, приводило к более низкому конечному титру РСВ-нейтрализующих антител. Смешивание продолжали путем добавления либо материала с высоким титром, либо плазмы из обычного источника до достижения целевого титра. Предпринимали попытки получить композицию объединенной плазмы, содержащую примерно 2500 литров (л) от по меньшей мере 1000 людей-доноров плазмы, с конечным титром антител к РСВ, составляющим 1800, но с использованием в пуле значительно меньшего количества чем все отобранные доноры с высоким титром (например, из-за к ограниченной доступности доноров с высоким титром). Удивительно, в результате экспериментов, проводимых при разработке вариантов реализации настоящего изобретения, определяли, что образцы плазмы можно было подразделять и смешивать для получения 2500 литров объединенной плазмы от по меньшей мере 1000 доноров с конечным титром РСВ-нейтрализующих антител, составляющим 1800, при этом менее половины доноров, используемых для объединения, представляли собой отобранных доноров с высоким титром (например, идентифицированные способами двухэтапного скрининга, описанными выше (см. таблицу 2 ниже)), и при этом указанная композиция объединенной плазмы содержала значительные уровни титров антител, специфичных к кори, дифтерии и/или полиомиелиту.
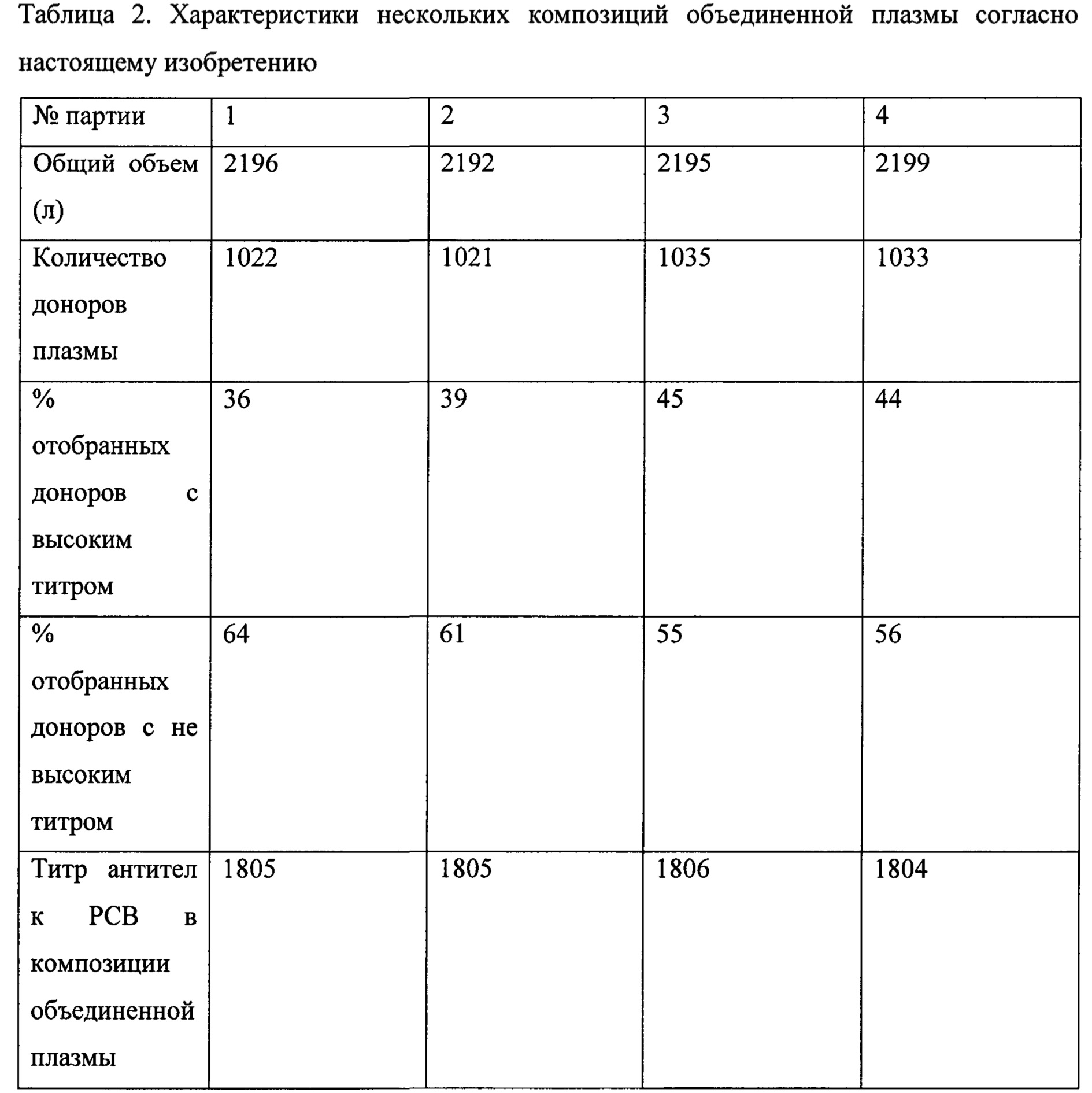
Соответственно, согласно настоящему изобретению предложен способ смешивания/объединения, позволяющий получить композицию объединенной плазмы или полученный из нее иммуноглобулин, содержащий стандартизированный и воспроизводимый уровень антител, специфичных к респираторным патогенам (например, РСВ), обеспечивающий тем самым ранее недоступный, согласующийся и воспроизводимый продукт иммуноглобулина (например, для применения в качестве IVIG). Эксперименты подтвердили, что композиция объединенной плазмы или полученный из нее иммуноглобулин согласно настоящему изобретению (например, 2500 литров объединенной плазмы от 1000 доноров с конечным титром РСВ-нейтрализующих антител, составляющим 1800) могут быть согласованно получены от различных групп из 1000 доноров. Дополнительные эксперименты подтвердили, что композиция объединенной плазмы согласно настоящему изобретению (например, 2500 литров объединенной плазмы от 1000 доноров с конечным титром РСВ-нейтрализующих антител, составляющим 1800) содержала уровни антител к столбняку, кори и полиомиелиту, которые предотвращают или защищают от инфицирования указанными вирусами, а также содержала повышенный титр (титры) антител, специфичных к респираторным патогенам, описанным в примере 1.
По окончании смешивания образцов повторяли арифметический расчет (с отдельными объемами для каждого донора, содержащими соответствующие титры) для подтверждения того, что исходное уравнение смешивания было правильным. Таким образом, хотя каждая партия, полученная в соответствии с данным способом, имеет разное соотношение отобранных доноров с высоким титром и отобранных доноров с не высоким титром, способы скрининга и смешивания, идентифицированные и описанные в настоящем документе, позволяют получить продукт смешанной плазмы, содержащий стандартизированный повышенный титр РСВ-нейтрализующих антител, а также повышенные уровни титров антител, специфичных к респираторным патогенам. После получения различные смеси образцов плазмы от 1000 доноров использовали для получения IVIG.
Весь технологический процесс по получению IVIG осуществляли в соответствии с надлежащей производственной практикой (GMP) для минимизации загрязнения и обеспечения чистоты, идентичности и эффективности лекарственного вещества. Производственный процесс осуществляли после модифицированного процесса фракционирования холодным спиртом Cohn-Oncley, позволяющего выделить фракцию иммуноглобулинов в виде раствора (см., например, Cohn e al., J Am Chem Soc, 62, 459-475 (1946); и Teschner et al., Vox Sang. 2007 Jan; 92 (1): 42-55, полное содержание каждого из которых включено в настоящее описание посредством ссылки). Способ Cohn-Oncley представляет собой многоэтапный способ выделения иммуноглобулинов из плазмы с использованием разных концентраций спирта в конкретных условиях температуры, pH, концентрации белка и ионной силы на каждом этапе. После фракционирования промежуточное лекарственное вещество подвергали этапам инактивации/удаления вирусов, дополнительной очистке и включению в состав нерасфасованного лекарственного вещества.
Модифицированное фракционирование холодным спиртом Cohn-Oncley начинали с объединения достаточного количества единиц плазмы для получения 1800-2000 л плазмы (~2500 единиц, представляющих по меньшей мере 1000 отдельных доноров). Подтверждали, что указанные единицы плазмы удовлетворяли всем регулятивным требованиям и стандартам Ассоциации производителей терапевтических препаратов на основе белков плазмы (Plasma Protein Therapeutics Association) для плазмы из источника, представляющего собой человека.
Криопреципитат удаляли путем центрифугирования при <5°С до начала фракционирования. Криопреципитат-обедненную плазму доводили до pH 7,3±0,1 и 8±3 масс. % этанола SDA-3A, и выдерживали при -2±1°С пока фракция I выпадала в осадок. Фракцию I удаляли путем центрифугирования и надосадочную жидкость дополнительно обрабатывали.
Надосадочную жидкость фракции I доводили до pH 7,9±0,1 и 25±3 масс. % этанола SDA-3A, и выдерживали при -5±1°С пока фракция II+III выпадала в осадок. Фракцию II+III удаляли путем центрифугирования, ресуспендировали в натрий-фосфатном буфере при pH 7,2±0,1. Этанол SDA-3A добавляли до 20±3%, и фракция II+IIIw образовывалась при выдерживании смеси при -5±1°С.
Фракцию II+IIIw ресуспендировали и фракцию III удаляли при pH 5,2±0,05, 17±3% этанола SDA-3A и температуре -5±1°С. Фракцию III отделяли путем центрифугирования и надосадочную жидкость дополнительно обрабатывали.
К надосадочной жидкости фракции III добавляли промытый кислотой Целит, а затем удаляли путем глубинной фильтрации. Фильтрованную надосадочную жидкость доводили до концентрации, составляющей <70 г белка/л, pH 4,2±0,25 и проводимости <5 мСм до инактивации вирусов 0,3±0,1% TnBP и 1,0±0,2% Тритон-Х 100 при 28±2°С. TnBP и Тритон-Х-100 удаляли путем хроматографии С-18. Элюат С-18 дополнительно очищали с использованием колонки с Q-сефарозой.
Дополнительное удаление вирусов осуществляли с использованием 35 нм нанофильтрации элюата с Q-сефарозы. После нанофильтрации продукт получали с использованием ультрафильтрации/диафильтрации.
Изготавливали три отдельных партии IVIG с высоким титром РСВ-нейтрализующих антител (PCB-IVIG) (из объединенных образцов плазмы от 1000 или более субъектов и содержащих стандартизированный повышенный титр антител к РСВ с использованием композиций и способов для предварительного скрининга и скрининга согласно настоящему изобретению). Три указанных PCB-IVIG сравнивали с 7 разными партиями коммерчески доступного традиционного IVIG (4 разных производителя/торговых марки). Проводили анализы ELISA для количественного определения титра антител к РСВ, PIV1, PIV2, ОС43, 229Е, гриппу А и гриппу В. Анализы ELISA проводили в три разных дня.
Тестирование IVIG путем ELISA осуществляли слепым методом по отношению к типу образца. Все образцы разводили буфером для разведения образцов (ФБР с 0,3% Твином 20 и 0,1 М EDTA) до стандартной концентрации, составляющей 50 мг IgG на мл. Каждый вирусный антиген разводили в предварительно определенной концентрации в бикарбонатном буфере и наносили по отдельности на микротитрационные планшеты для иммуноферментного анализа, и хранили в течение ночи в увлаженных камерах при 4°С. На следующий день планшеты промывали и восемь серийных 2-кратных разведении неизвестного продукта в двух повторностях инкубировали на планшетах с антигеном при комнатной температуре в увлаженных камерах в течение 3 часов. Исходное разведение раствора IVIG, помещаемого на планшеты с антигеном, составляло 1:1600. Затем планшеты промывали и связанный IgG детектировали с помощью антитела козы к IgG человека, конъюгированного со щелочной фосфатазой, с последующим субстратом. В каждый планшет вносили стандартную сыворотку и определяли титр IgG к конкретному вирусу как наибольшее разведение с оптической плотностью (OD) 0,20.
Статистический анализ. Данные титра сводили в таблицу с описательной статистикой N (объем выборки, среднее значение, среднее геометрическое, стандартное отклонение, минимальное значение, срединное значение и максимальное значение). Различия между PCB-IVIG и коммерческим IVIG (т.е. группой 1 и группой 2) представляли в виде соотношения средних геометрических значений (RGM), а также приводили 95% доверительные интервалы для RGM. Р-значение для проверки нулевой гипотезы, что RGM было равно 1, получали на основе двухвыборочного t-критерия при уровне значимости, равном 0,05.
На фиг. 3 показано, что среднее геометрическое титра антител PCB-IVIG было значительно больше для других респираторных вирусов по сравнению со средним геометрическим титра антител коммерческих партий IVIG. В частности, титр антител PCB-IVIG (группа 1) к другим респираторным вирусам был в 1,5-1,8 раза больше по сравнению с коммерческим IVIG (группа 2).
Свойства IVIG из 1000 или более образцов, содержащих повышенные уровни титров нейтрализующих антител к одному или более респираторным патогенам, полученного с применением композиций и способов согласно настоящему изобретению, являются значительным достижением и улучшением по сравнению с другим IVIG, доступным в данной области техники. В частности, композиции IVIG согласно настоящему изобретению не демонстрируют или не содержат титр нейтрализующих антител только к одному патогену (например, преобладание в отношении только одного из типов респираторных патогенов), а скорее с помощью способов идентификации доноров и способов смешивания, разработанных и описанных в настоящем документе, получают IVIG, который содержит в значительной степени повышенные титры нейтрализующих антител к множеству респираторных патогенов и других патогенов (например, полиомиелиту, дифтерии и т.д.) по сравнению с титрами в 1000 смешанных случайным образом образцов плазмы. Обнаружение того, что титр нейтрализующих антител к РСВ (или другому респираторному патогену) можно применять в качестве биомаркера для идентификации доноров плазмы, представляющих собой отобранных доноров с высоким титром (демонстрирующих высокий/сильный ответ, в целом, на респираторные патогены (например, вирус гриппа А, вирус гриппа В, вирус парагриппа типа 1, вирус парагриппа типа 2, метапневмовирус, коронавирус, S. pneumonia, Н. influenza, L. pneumophila и Streptococcus группы А)), делает возможной идентификацию доноров и плазмы, которая может быть смешана с плазмой от отобранного донора с не высоким титром и плазмой от неотобранного донора с получением полезного продукта объединенной плазмы. Таким образом, тогда как для реализации настоящего изобретения понимание механизма не является необходимым, и тогда как настоящее изобретение не ограничивается каким-либо конкретным механизмом действия, в некоторых вариантах реализации настоящего изобретения предложена ранее недоступная композиция объединенной плазмы (например, полученная в соответствии со способами, описанными выше), содержащая значительное количество (например, более 50%) плазмы от отобранного донора с не высоким титром (например, плазмы с не высоким титром антител к РСВ), которая обеспечивает полезный терапевтический эффект, которого нельзя достичь с помощью стандартного гипериммунного иммуноглобулина (например, полученного от ограниченного числа (например, 100-300) доноров плазмы). В другом варианте реализации благодаря повышенным уровням титров нейтрализующих антител к одному или множеству из: РСВ, вируса гриппа А, вируса гриппа В, вируса парагриппа типа 1, вируса парагриппа типа 2, метапневмовируса, коронавируса, S. pneumonia, Н. influenza, L. pneumophila и Streptococcus группы А, такие композиции объединенной плазмы обеспечивают в значительной степени повышенный полезный терапевтический эффект для субъекта, которому вводят указанную композицию. Например, объединенная композиция согласно настоящему изобретению по сравнению с объединенными образцами плазмы, полученными от 1000 или более случайных субъектов, представляющих собой людей, обеспечивает свойства нейтрализации вирусов в отношении одного или множества респираторных патогенов или других патогенов, которые не обеспечивают объединенные случайным образом образцы (например, обеспечивает субъекту профилактические и/или терапевтические уровни антител к полиомиелиту, дифтерии и/или кори). Таким образом, субъект, которому вводят композицию согласно настоящему изобретению, может побороть или вылечиться от инфекций, которые не поддаются лечению композицией объединенных образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей, или которые не поддаются лечению традиционным гипериммунным иммуноглобулином. Например, композиция объединенной плазмы согласно настоящему изобретению (например, из 1000 или более образцов, при этом указанная композиция объединенной плазмы содержит титр РСВ-нейтрализующих антител 1800 или выше и повышенные уровни антител к одному или более респираторным патогенам) при введении субъекту дает указанному субъекту возможность побороть или вылечиться от инфекций, которые не поддаются лечению композицией объединенных образцов плазмы, полученных от 1000 или более случайных субъектов, представляющих собой людей, и/или которые не поддаются лечению традиционным гипериммунным иммуноглобулином, полученным от ограниченного числа доноров (например, такой гипериммунный иммуноглобулин требует вакцинации субъекта против дифтерии, полиомиелита и/или кори в дополнение к получению гипериммунного иммуноглобулина).
Например, IVIG, полученный в соответствии со способами, описанными выше, сравнивали с традиционным РСВ-специфичным иммуноглобулином, доступным в данной области техники, РЕСПИГАМОМ (MEDIMMUNE, Inc., гипериммунный иммуноглобулин, полученный от нескольких сотен (100-300) здоровых людей-доноров плазмы, имеющий концентрацию антител, специфичных к РСВ, которая выше обычной). Тогда как иммуноглобулин согласно настоящему изобретению демонстрировал уровень РСВ-нейтрализующей активности, схожий с уровнем РЕСПИГАМА, титры нейтрализующих антител к другим респираторным вирусам были значительно выше в IVIG согласно настоящему изобретению (таблица 3, IVIG-1000 доноров) по сравнению с уровнями, обнаруживаемыми в РЕСПИГАМЕ (см. таблицу 3).
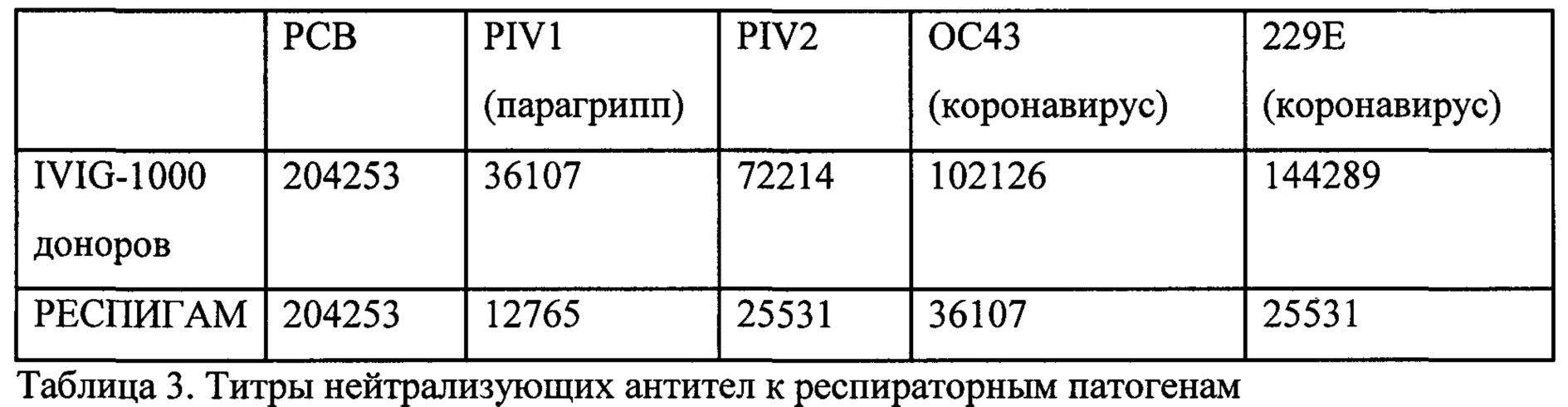
IVIG, полученный в соответствии со способами, описанными выше (PCB-IVIG), вводили в рандомизированном двойном слепом исследовании с диапазоном доз пациентам с ослабленным иммунитетом, инфицированным РСВ (многоцентровое исследование II фазы, проводимое в центрах в США, Канаде, Австралии и Новой Зеландии). Пациенты с ослабленным иммунитетом представляли собой пациентов, которым проведена либо трансплантация костного мозга, либо паренхиматозного органа, которые одновременно получали иммуносупрессивную терапию, в возрасте 2-65 лет (средний возраст 38 лет). В момент включения в исследование у каждого пациента подтверждали РСВ-инфекцию верхних дыхательных путей с использованием ОТ-ПЦР. Пациенты попадали в одну из трех групп. Первая группа получала 1500 мг/кг PCB-IVIG в первый день с последующими 750 мг/кг PCB-IVIG во второй день. Вторая группа получала 750 мг/кг PCB-IVIG в первый день с последующими 750 мг/кг PCB-IVIG во второй день. Третья группа получала плацебо, представляющее собой физиологический раствор, в оба дня. В 18 день пациенты в группе 1 демонстрировали среднее кратное повышение относительно исходного уровня титров нейтрализующих антител анти-РСВ, составляющее 9,24 (p-значение относительно плацебо = 0,0043; при этом 85,7% пациентов демонстрировали повышение более чем в 4 раза). В 18 день пациенты в группе 2 демонстрировали среднее кратное повышение относительно исходного уровня титров нейтрализующих антител анти-РСВ, составляющее 4,85 (p-значение относительно плацебо = 0,0268; при этом 42,9% пациентов демонстрировали повышение более чем в 4 раза). Также оценивали титры антител к streptococcus pneumonia до и после введения IVIG пациентам. В целом, не наблюдали значительного повышения или понижения титров антител, специфичных к streptococcus pneumonia, у пациентов после введения IVIG.
Пример 3
Терапевтическое действие IVIG
Иммунотерапевтические композиции согласно настоящему изобретению тестировали в модели иммунодефицита человека у хлопкового хомяка. Оценивали терапевтическое, а также профилактическое действие. Для анализа терапевтического действия PCB-IVIG, полученный, как описано в примерах 1 и 2 выше, вводили в терапевтических целях хлопковым хомякам с супрессией иммунитета (которых лечили циклофосфамидом) и здоровым хлопковым хомякам, зараженным PCB/A/Long.
Животные: пятьдесят три (53) инбредных самца и самки хлопковых хомяков Sigmodon hispidus в возрасте от 6 до 8 недель (источник: Sigmovir Biosystems, Inc., Роквилл, Мэриленд) содержали и ухаживали за ними под наблюдением ветеринаров в соответствии с руководством Национального института здравоохранения и протоколом исследования у животных, утвержденным Институциональным комитетом по содержанию и использованию животных Sigmovir (Протокол IACUC №2). Хлопковых хомяков содержали в прозрачных клетках из поликарбоната по отдельности и обеспечивали стандартным кормом для грызунов (Harlan #7004) и водопроводной водой без ограничения.
Вирус для заражения: прототипный Long-штамм РСВ (АТСС, Манассас, Вирджиния) репродуцировали в клетках НЕр-2 после последовательного клонирования с помощью метода бляшкообразования для уменьшения дефектных интерферирующих частиц. Пул вируса, обозначаемый hRSV/A/Long партия # 041513, содержащий приблизительно 5,0×107 БОЕ/мл в сахарозных стабилизирующих средах, использовали для экспериментов in vivo. Данный исходный вирус хранили в условиях -80°С и характеризовали in vivo с использованием модели у хлопкового хомяка, и валидизировали для репликации в верхних и нижних дыхательных путях.
Тестируемый препарат (препараты): иммуноглобулин (100 мг/мл) для внутривенного введения (IVIG) получали, как описано в примерах 1 и 2 выше, и хранили при 4°С до начала применения in vivo. Вкратце, получали объединенные образцы плазмы от 1000 или более субъектов с общим объемом 2500 литров, содержащие стандартизированный повышенный титр антител к РСВ (титр нейтрализующих антител 1800), с использованием композиций и способов для предварительного скрининга и скрининга согласно настоящему изобретению, из которых получали иммуноглобулин, как описано в примере 2.
Методы
Идентификацию животных осуществляли с использованием ушных бирок. Забор крови осуществляли с использованием кровопускания из ретроорбитального синуса. Забор в пробирки с EDTA для анализа цельной крови (-3 день), забор сыворотки (до иммунизации, 4 день после инфицирования, 10 день после инфицирования). Путь инфицирования представлял собой интраназальную (и/н) инокуляцию. Путь лечения IVIG представлял собой интраперитонеальную (и/п) инъекцию. Эвтаназию проводили с использованием асфиксии СO2. Ткань легких, ткань печени и ткань почек брали после эвтаназии для анализов бляшкообразования для РСВ, количественной ПЦР (кПЦР) и гистопатологии.
В таблице 4 представлен экспериментальный дизайн исследования для данных экспериментов.
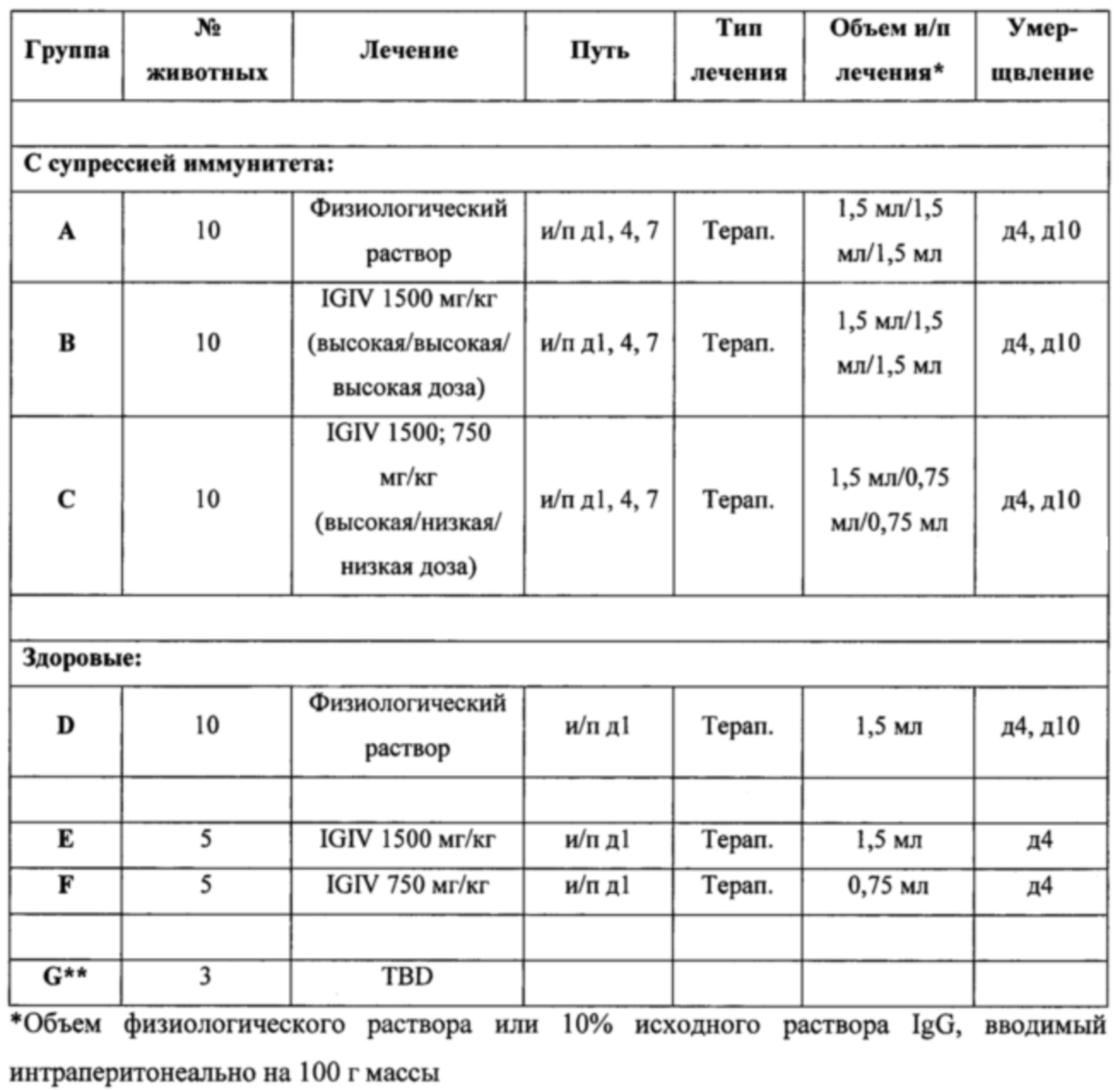

Схематическое изображение модели у хлопкового хомяка, используемой для исследования терапевтического действия PCB-IVIG, полученного, как описано в примере 2, представлено на фиг.4.
Анализ цельной крови. Автоматизированный анализ цельной крови проводили на образцах крови, собранных в EDTA-содержащие пробирки. Анализировали общее количество лейкоцитов и лимфоцитов.
Анализ бляшкообразования для РСВ. Гомогенаты легких осветляли путем центрифугирования и разводили 1:10 и 1:100 в ЕМЕМ. Конфлюэнтные монослои НЕр-2 в 24-луночных планшетах инфицировали в двух повторностях 50 мкл образца на лунку, начиная с неразведенных (исходных) образцов с последующими разведенными гомогенатами. После одного часа инкубации при 37°С в инкубаторе с 5% CO2 лунки покрывали 0,75% метилцеллюлозной средой и планшеты возвращали в 37°С инкубатор. После 4 дней инкубации верхний слой удаляли и клетки фиксировали 0,1% красителем кристаллическим фиолетовым в течение одного часа, затем промывали и сушили на воздухе. Подсчитывали бляшки и выражали титры вируса в виде бляшкообразующих единиц на грамм ткани. Титр вируса для группы рассчитывали как среднее геометрическое + стандартная ошибка для всех животных в данной группе в конкретный момент времени. Использовали t-критерий Стьюдента для определения значимости изменения репликации вируса между группами, получавшими лечение носителем, и тестируемыми группами, при этом p<0,05 указывает на статистически значимое различие.
ПЦР в режиме реального времени. Тотальную РНК экстрагировали из гомогенизированной ткани легких, почек или печени с использованием набора для очистки RNeasy (QIAGEN). Один мкг тотальной РНК использовали для получения кДНК с использованием набора для обратной транскрипции QuantiTect (Qiagen). Для ПНР-реакций в режиме реального времени набор QuantiFast SYBR Green PCR Kit (Qiagen) использовали в конечном объеме 25 мкл с конечными концентрациями праймеров 0,5 мкМ. Реакции проводили в 96-луночных планшетах. Амплификацию осуществляли на iCycler Bio-Rad в 1 цикле 95°С в течение 3 минут, с последующими 40 циклами 95°С в течение 10 секунд, 60°С в течение 10 секунд и 72°С в течение 15 секунд. Исходные циклы и пороговый цикл (Ct) рассчитывали с помощью программного обеспечения iQ5 в режиме PCR Base Line Subtracted Curve Fit. Относительное количественное определение ДНК использовали для всех образцов. Стандартные кривые получали с использованием серийно разведенного образца кДНК, наиболее обогащенного представляющим интерес транскриптом (например, легкие с 4 дня после первичного инфицирования РСВ). Значения Ct наносили на график в зависимости от log10 фактора разведения кДНК. Данные кривые использовали для преобразования значений Ct, полученных для разных образцов, в относительные единицы экспрессии. Затем данные относительные единицы экспрессии приводили к уровню мРНК β-актина («ген домашнего хозяйства»), экспрессируемой в соответствующем образце. Для исследований у животных уровни мРНК выражали в виде среднего геометрического ±SEM для всех животных в группе в конкретный момент времени.
Результаты
Анализ цельной крови. Общее количество лейкоцитов и общее количество лимфоцитов было снижено у всех животных, которых лечили циклофосфамидом (группы А, В, С и G), по сравнению со здоровыми хлопковыми хомяками, не подвергнутыми манипуляциям (группы D, Е и F). Данное отличие наблюдали в образцах, полученных через 18 дней после начала лечения циклофосфамидом (-3 день относительно заражения РСВ) (см. фиг. 6).
Гистопатология легких. Гистопатологию легких оценивали у РСВ-инфицированных животных с ослабленным иммунитетом из групп А, В и С, и у здоровых получавших лечение физиологическим раствором и РСВ-инфицированных животных (группа D) в 10 день после инфицирования. Легкие РСВ-инфицированных животных с супрессией иммунитета демонстрировали увеличенное повреждение эпителия по сравнению с легкими РСВ-инфицированных здоровых хлопковых хомяков (группа А по сравнению с группой D) (фиг. 7). Лечение животных IGIV (группы В и С) приводило к уменьшению повреждения эпителия. Не отмечали значительных отличий для двух различных режимов лечения IVIG, используемых в группах В и С.
Титры РСВ в легких. Титры вируса в общих гомогенатах легких и носа измеряли в 4 и 10 дни после интраназального заражения приблизительно 5,0 Log10 PCB/A/Long. В 4 день после инфицирования вирусная нагрузка у РСВ-инфицированных здоровых и с супрессией иммунитета хлопковых хомяков, которых лечили физиологическим раствором (группы D и А соответственно), была сопоставима между указанными группами как для легких, так и для носа. Терапевтическое лечение IVIG либо здоровых животных (группы Е и F), либо животных с супрессией иммунитета (группы В и С) приводило к статистически значимому (р<0,05) снижению титра вируса в легких и носу. В 10 день после инфицирования РСВ не детектировали в легких здоровых инфицированных животных, которых лечили физиологическим раствором (группа D), и вирус был едва детектируемым в носу двух из пяти животных группы D. В отличие от этого, более 6 Log10 БОЕ/грамм выделяли из легких и носа животных с супрессией иммунитета, инфицированных РСВ, которых лечили физиологическим раствором (группа А). Лечение IVIG вызывало статистически значимое снижение вирусной нагрузки как в легких, так и в носу инфицированных животных (группы В и С). Наблюдали умеренную зависимость от дозы с на 0,5 Log10 БОЕ/грамм большим снижением, наблюдаемым в образцах легких, полученных от группы животных, которых лечили более высокой дозой IVIG (группа В по сравнению с группой С) (см. фиг. 8).
Детектирование РСВ путем кПЦР. Экспрессию генов РСВ (NS1 мРНК) количественно определяли путем анализа методом кПЦР в образцах легких, печени и почек, полученных от животных группы А, В, С и D в 10 день после инфицирования. Уровень транскрипта РСВ был самым низким в образцах группы D и самым высоким в образцах группы А. Лечение животных с супрессией иммунитета IVIG приводило к статистически значимому снижению уровня мРНК NS1 РСВ в легких (группы В и С по сравнению с группой А) (фиг. 9). Транскрипт NS1 также снижался в печени и почке РСВ-инфицированных животных с супрессией иммунитета при лечении IVIG.
Иммуносупрессию в группах А, В, С, G, получавших лечение циклофосфамидом, подтверждали по значительному уменьшению количеств клеток цельной крови и лимфоцитов по сравнению со здоровыми хлопковыми хомяками (группы D, Е и F). Животные с супрессией иммунитета, которых лечили IVIG согласно настоящему изобретению, группы В и С, демонстрировали значительное снижение вирусной нагрузки в легких и носу в день 4 после инфицирования и 10 день после инфицирования по сравнению с РСВ-инфицированными животными с супрессией иммунитета, которых лечили физиологическим раствором (группа А). Данное снижение сопровождалось уменьшением гистопатологии легких и уменьшением детектирования вирусной РНК в образцах легких, печени и почек животных группы В и С в 10 день после инфицирования. Лечение хлопковых хомяков IVIG согласно настоящему изобретению приводило к значительному снижению нагрузки РСВ в легких и носу животных, которых лечили IVIG (группы Е и F), по сравнению с животными, которых лечили физиологическим раствором (группа D), в 4 день после инфицирования.
Пример 4
Профилактическое действие IVIG
Иммунотерапевтические композиции согласно настоящему изобретению тестировали в модели иммунодефицита человека у хлопкового хомяка. Оценивали терапевтическое, а также профилактическое действие. Для анализа профилактического действия иммуноглобулин, полученный, как описано в примере 2 выше, применяли в профилактических целях у хлопковых хомяков с супрессией иммунитета (которых лечили циклофосфамидом), зараженных PCB/A/Long.
Животные: тридцать (30) инбредных самцов и самок хлопковых хомяков Sigmodon hispidus в возрасте от 6 до 8 недель (источник: Sigmovir Biosystems, Inc., Роквилл, Мэриленд) содержали и ухаживали за ними под наблюдением ветеринаров в соответствии с руководством Национального института здравоохранения и протоколом исследования у животных, утвержденным Институциональным комитетом по содержанию и использованию животных Sigmovir (Протокол IACUC №2). Хлопковых хомяков содержали в прозрачных клетках из поликарбоната по отдельности и обеспечивали стандартным кормом для грызунов (Harlan # 7004) и водопроводной водой без ограничения.
Вирус для заражения: прототипный Long-штамм РСВ (АТСС, Манассас, Вирджиния) репродуцировали в клетках НЕр-2 после последовательного клонирования с помощью метода бляшкообразования для уменьшения дефектных интерферирующих частиц. Пул вируса, обозначаемый hRSV/A/Long партия # 041513, содержащий приблизительно 5,0×107 БОЕ/мл в сахарозных стабилизирующих средах, использовали для экспериментов in vivo. Данный исходный вирус хранили в условиях -80°С и характеризовали in vivo с использованием модели у хлопкового хомяка, и валидизировали для репликации в верхних и нижних дыхательных путях.
Методы
Идентификацию животных осуществляли с использованием ушных бирок. Забор крови осуществляли с использованием кровопускания из ретроорбитального синуса. Забор в пробирки с EDTA для анализа цельной крови (-3 день), забор сыворотки (до иммунизации, 4 день после инфицирования, 10 день после инфицирования). Путь инфицирования представлял собой интраназальную (и/н) инокуляцию. Путь лечения IVIG представлял собой интраперитонеальную (и/п) инъекцию. Эвтаназию проводили с использованием асфиксии CO2. Ткань легких, ткань печени и ткань почек брали после эвтаназии для анализов бляшкообразования для РСВ, количественной ПЦР (кПЦР) и гистопатологии.
В таблице 5 представлен экспериментальный дизайн исследования для данных экспериментов.
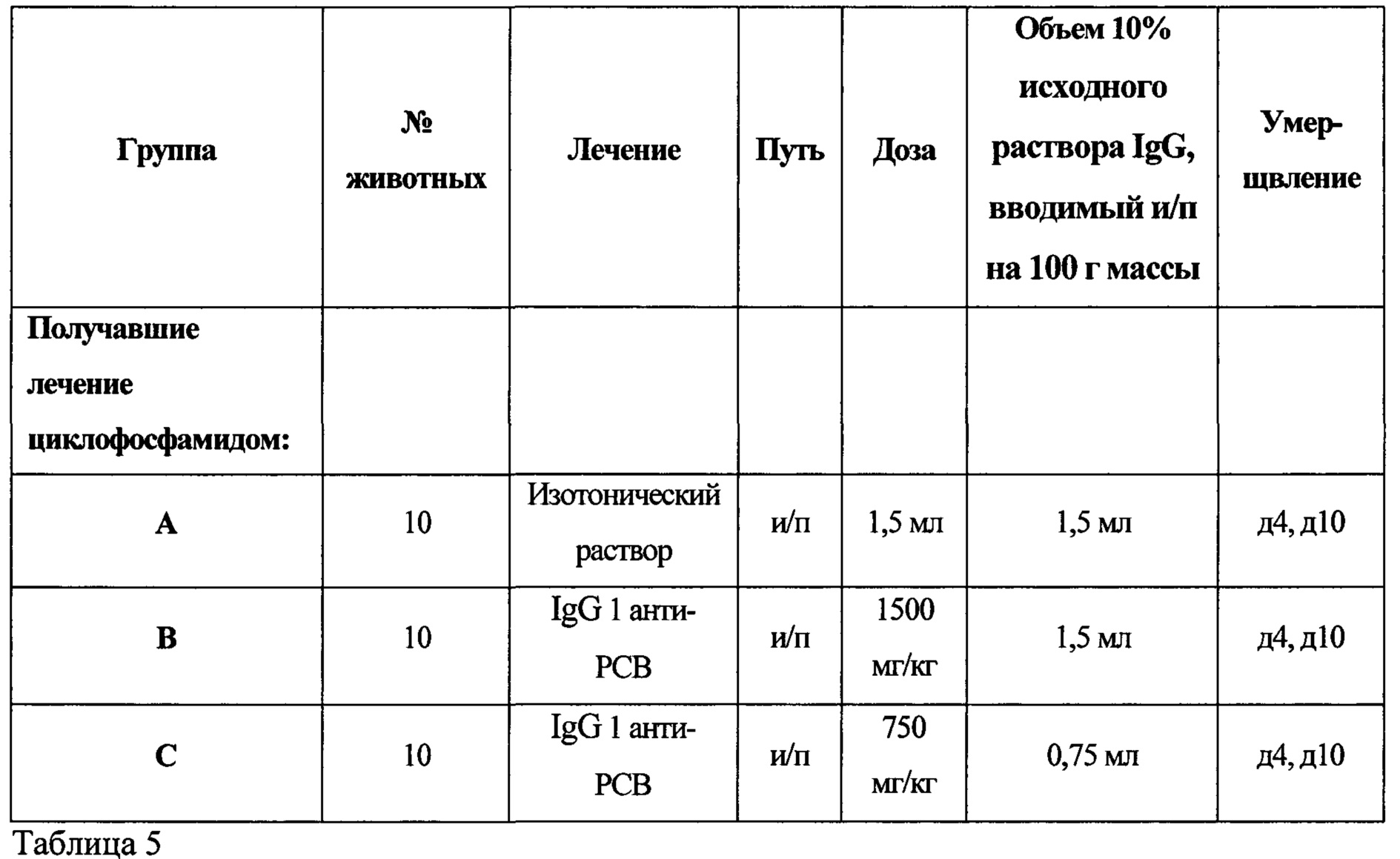
На фиг. 5 представлено схематическое изображение модели у хлопкового хомяка, используемой для исследования профилактического действия иммуноглобулина, полученного, как описано в примере 2.
Анализ цельной крови. Автоматизированный анализ цельной крови проводили на образцах крови, собранных в EDTA-содержащие пробирки. Анализировали общее количество лейкоцитов и лимфоцитов, и представляли в сравнении с ранее полученными показателями крови здоровых соответствующих по возрасту хлопковых хомяков, не подвергнутых манипуляциям.
ELISA для определения общего IgG в сыворотке. На 96-луночные планшеты наносили антитело кролика к IgG хлопкового хомяка 1:1000 в растворе для нанесения (KPL 50-84-00). Затем лунки блокировали (KPL 50-61-00) и загружали образцы сыворотки, разведенные 1:50000. Связанный IgG хлопкового хомяка детектировали антителом курицы к IgG хлопкового хомяка (1:15000; Immunology Consultants Laboratory CCOT-25A), а затем HRP-меченым антителом козы к IgG курицы (1:10000; KPL). Определяли количество IgG в каждом образце сыворотки относительно стандартной кривой, построенной для 10-кратного разведения сыворотки от здорового хлопкового хомяка, при этом принимали, что разведение сыворотки 1:100 содержало 10000 единиц IgG.
Анализ бляшкообразования для РСВ. Гомогенаты легких осветляли путем центрифугирования и разводили 1:10 и 1:100 в ЕМЕМ. Конфлюэнтные монослои НЕр-2 в 24-луночных планшетах инфицировали в двух повторностях 50 мкл образца на лунку, начиная с неразведенных (исходных) образцов с последующими разведенными гомогенатами. После одного часа инкубации при 37°С в инкубаторе с 5% CO2, лунки покрывали 0,75% метилцеллюлозной средой и планшеты возвращали в 37°С инкубатор. После 4 дней инкубации верхний слой удаляли и клетки фиксировали 0,1% красителем кристаллическим фиолетовым в течение одного часа, затем промывали и сушили на воздухе. Подсчитывали бляшки и выражали титры вируса в виде бляшкообразующих единиц на грамм ткани. Титр вируса для группы рассчитывали как среднее геометрическое + стандартная ошибка для всех животных в данной группе в конкретный момент времени. Использовали t-критерий Стьюдента для определения значимости изменения репликации вируса между группами, получавшими лечение носителем, и тестируемыми группами, при этом p<0,05 указывает на статистически значимое различие.
ПЦР в режиме реального времени. Тотальную РНК экстрагировали из гомогенизированной ткани легких, почек или печени с использованием набора для очистки RNeasy (QIAGEN). Один мкг тотальной РНК использовали для получения кДНК с использованием набора для обратной транскрипции QuantiTect (Qiagen). Для ПЦР-реакций в режиме реального времени набор QuantiFast SYBR Green PCR Kit (Qiagen) использовали в конечном объеме 25 мкл с конечными концентрациями праймеров 0,5 мкМ. Реакции проводили в 96-луночных планшетах. Амплификацию осуществляли на iCycler Bio-Rad в 1 цикле 95°С в течение 3 минут, с последующими 40 циклами 95°С в течение 10 секунд, 60°С в течение 10 секунд и 72°С в течение 15 секунд. Исходные циклы и пороговый цикл (Ct) рассчитывали с помощью программного обеспечения iQ5 в режиме PCR Base Line Subtracted Curve Fit. Относительное количественное определение ДНК использовали для всех образцов. Стандартные кривые получали с использованием серийно разведенного образца кДНК, наиболее обогащенного представляющим интерес транскриптом (например, легкие с 4 дня после первичного инфицирования РСВ). Значения Ct наносили на график в зависимости от log10 фактора разведения кДНК. Данные кривые использовали для преобразования значений Ct, полученных для разных образцов, в относительные единицы экспрессии. Затем данные относительные единицы экспрессии приводили к уровню мРНК β-актина («ген домашнего хозяйства»), экспрессируемой в соответствующем образце. Для исследований у животных уровни мРНК выражали в виде среднего геометрического ±SEM для всех животных в группе в конкретный момент времени.
Результаты
Анализ цельной крови. Общее количество лейкоцитов и общее количество лимфоцитов было снижено у всех животных, которых лечили циклофосфамидом, по сравнению со здоровыми хлопковыми хомяками, не подвергнутыми манипуляциям (для сравнения использовали ранее полученные показатели количества лейкоцитов и лимфоцитов для 6-8-недельных S. hispidus). Данное отличие наблюдали в образцах, полученных через 18 дней после начала лечения циклофосфамидом (-3 день относительно заражения РСВ, фиг. 10А), а также в образцах, полученных от животных, которых умерщвляли в 4 день и 10 день после заражения РСВ (фиг. 10В).
ELISA для определения общего IgG в сыворотке. Уровень общего IgG в сыворотке хлопковых хомяков, которых лечили циклофосфамидом, был снижен по сравнению с сывороткой контрольных животных (фиг. 11). Данное снижение наблюдали для сыворотки, полученной в оба дня анализа: 3 дня до и 10 дней после инфицирования, что соответствует 18 и 31 дням после начала лечения циклофосфамидом.
Титры РСВ в легких. Титры вируса в общих гомогенатах легких измеряли в 4 и 10 дни после интраназального заражения приблизительно 5,0 Log10 PCB/A/Long. В 4 день после инфицирования 4,98 Log10 БОЕ/г РСВ детектировали в легких животных группы А (фиг. 12). Вирус не выделяли из легких животных в группах В и С. В 10 день после инфицирования детектировали 6,14 Log10 БОЕ/г РСВ в легких животных группы А. Вирус не выделяли из легких животных в группе В и у 3 из 5 животных в группе С.
Титры РСВ в почках и печени. Количественно определяли инфекционные РСВ-вирусные частицы путем анализа бляшкообразования в почках и печени одного из животных группы А (животное # 96998) и одного из животных группы В (животное # 97009). Ни в одном из органов ни у одного из животных не детектировали вирус.
Детектирование РСВ путем кПЦР. Экспрессию генов РСВ (NS1 мРНК) количественно определяли путем анализа методом кПЦР в легком, почке и печени одного из животных группы А (животное # 96998) и одного из животных группы В (животное # 97009). Экспрессию NS1 мРНК детектировали во всех трех органах, полученных от животного в группе А, и в легком и печени животного в группе В (фиг. 13). Для всех трех анализируемых органов экспрессии генов РСВ была выше у животного в группе А по сравнению с животным в группе В.
Гистопатология. Гистопатологию анализировали в образцах легких, почек и печени одного из животных группы А (животное # 96998) и одного из животных группы В (животное # 97009). Не отмечали значительных различий между анализируемыми образцами почек группы А и В, и между образцами печени группы А и В. Патология легких у животного группы А была более сильной, чем у животного группы В и характеризовалась утолщением и дегенерацией бронхиолярного эпителия, интерстициальной пневмонией и слабым альвеолитом.
Иммуносупрессию подтверждали по значительному уменьшению количеств клеток цельной крови и лимфоцитов, и уменьшению общего IgG в сыворотке. Животные с супрессией иммунитета, которых лечили IVIG, демонстрировали недетектируемую репликацию вируса в легких в 4 день после инфицирования и почти полное снижение длительной репликации вируса, вызываемой иммуносупрессией, измеренной в 10 день (только два из 5 животных в группе демонстрировали минимальную репликацию вируса). Данное снижение сопровождалось уменьшением гистопатологии легких и уменьшением детектирования вирусной РНК в образцах легких, почек и печени у выбранных животных с супрессией иммунитета.
Пример 5
Эффективность и фармакокинетика IVIG in vivo у пациентов с первичным иммунодефицитом
Иммуноглобулин (PCB-IVIG) получали, как описано в примерах 1 и 2 выше, и представляли в форме для внутривенной инфузии. Указанный PCB-IVIG содержал 10% белок человека, из которого по меньшей мере 96% представляли собой иммуноглобулин G (IgG; 100 мг IgG/мл), включенный в состав с 120±20 мМ хлоридом натрия, 245±45 мМ глицином и 0,2±0,05% полисорбатом 80 при pH 4,3±0,3.
Пациенты исследования. Всего 59 пациентов с первичным иммунодефицитом включали в исследование и лечили в 9 центрах проведения исследования по всем США. Включенные в исследование пациенты включали мужчин и женщин в возрасте ≥3 и ≤74 лет с подтвержденным диагнозом первичного иммунодефицита. Перед включением в исследование пациенты должны были получить инфузии IVIG каждые 3 или 4 недели в дозе, которая не менялась на >50% от средней дозы на основе мг/кг, в течение ≥3 месяцев. Пациентов исключали, если у них в анамнезе были нежелательные реакций на кровь или продукты, получаемые из крови, избирательный дефицит IgA и аллергическая реакция в анамнезе на продукты, содержащие IgA или антитела к IgA, нарушение функции печени, тромбоз глубоких вен, гемолиз или положительный тест Кумбса, или если они были беременными или кормящими.
Дизайн исследования. Данное исследование представляло собой исследование для оценки фармакокинетики, эффективности и безопасности у пациентов с точно установленным PIDD. Внутривенные инфузии осуществляли в дозах 300-800 мг/кг каждые 3 или 4 недели в течение приблизительно 1 года. Интервал между введением доз определяли в соответствии со схемой инфузии до исследования для каждого пациента. Скорость инфузии поступательно повышали каждые 15 минут до достижения максимума, составляющего 8 мг/кг/мин. Дозы PCB-IVIG корректировали во время исследования для поддержания минимальных концентраций IgG>500 мг/дл.
Подгруппу пациентов приглашали участвовать фармакокинетической (ФК) части исследования. Всего 32 пациента участвовали в ФК части исследования. Выполняли следующие связанные с иммуноглобулином лабораторные тесты: общие уровни IgG и конкретные антитела: Streptococcus pneumonias (включая серотипы), Haemophilus influenzae типа В, ЦМВ, корь, РСВ и столбняк.
Оценка безопасности. Осуществляли мониторинг пациентов на предмет нежелательных явлений (НЯ) и серьезных нежелательных явлений (СНЯ) во время каждой инфузии и после каждого визита с помощью дневников пациентов. НЯ определяли как любое нежелательное медицинское явление независимо от того, было ли определено, что указанное НЯ связано с продуктом, или нет. Пациенты регулярно заполняли дневник пациента для фиксации данных между инфузиями в рамках исследования. Дневник пациента использовали для фиксации числа случаев и длительности серьезной бактериальной инфекции (SBI) и других инфекций, применения антибиотиков, дней пропуска по болезни (пропуск работы или школы), незапланированных визитов к врачу или в больницу по причине инфекции и числа случаев нежелательных явлений. Эти данные рассматривали с персоналом исследования во время каждого визита в рамках исследования для подтверждения их точности и полноты, и выдавали новый дневник пациента. Временно связанные НЯ (ВСНЯ) представляли собой нежелательные явления, возникающие в течение 72 часов после инфузии PCB-IVIG. Конечные точки безопасности включали: число случаев ВСНЯ, СНЯ и связанных СНЯ, прекращение лечения в рамках исследования, смертность по любой причине и смерть, связанную с PIDD, реакции в месте инфузии, изменение основных жизненных показателей до или после инфузии, долю инфузии с одним или более ВСНЯ и изменения лабораторных показателей.
Оценка эффективности. Первичная конечная точка эффективности представляла собой демонстрацию частоты SBI менее 1,0 на человеко-год во время 12-месячного лечения IVIG. Вторичные конечные точки эффективности включали число случаев всех инфекций любого вида, количество дней, пропущенных на работе/школе/занятии по причине инфекции и ее лечения, количество незапланированных визитов к врачу/отделение скорой помощи по причине инфекций, время до разрешения инфекций, число госпитализаций и дней госпитализации по причине инфекций, количество дней антибиотикотерапии (профилактика и лечение), связь между дозой, минимальным уровнем и риском серьезных и несерьезных инфекций, и минимальное общее количество IgG и уровни конкретных антител.
Фармакокинетическая оценка. Образцы крови для анализа ФК получали, начиная с момента после инфузии 7 или инфузии 9, для обеспечения вымывания предыдущего продукта IVIG. Запланированное время для забора образцов было следующим: до инфузии, конец инфузии, 60 минут, 2 часа, 24 часа, 48 часов, 4 дня, 7 дней, 14 дней и 21 день после инфузии. Все ФК параметры рассчитывали с использованием анализа без учета компартментов. В анализе использовали только те концентрации в плазме, которые равны или больше валидизированного нижнего предела количественного определения для анализов отдельных антител. Во всех фармакокинетических анализах использовали фактическое время забора образцов. Время по протоколу использовали для расчета средних концентраций в плазме для графического представления. Рассчитываемые ФК параметры включали: константу элиминации (K), период полуэлиминации (t1/2), площадь под кривой (AUC(0-t)) за 21- или 28-дневный интервал между введением доз, общий клиренс плазмы (CL) и объем распределения (Vz).
Статистический анализ. Популяция «пациенты, которым назначено лечение» (ITT) включала всех подвергнутых скринингу пациентов, которые соответствовали критериям для лечения PCB-IVIG. Все пациенты ITT, получившие по меньшей мере одну инфузию PCB-IVIG в исследовании (обозначаемые mITT), представляли собой основную популяцию для анализов эффективности и безопасности. Популяция для ФК включала всех пациентов mITT, включенных в ФК часть исследования и с достаточными образцами плазмы для получения ФК параметров.
Описательную статистику представляли для всего лечения и по схеме лечения (n, среднее значение, SD, минимальное, срединное и максимальное значение для непрерывных переменных и количества, и проценты для категориальных переменных). Инфекции идентифицировали на основе сообщаемых возникших после начала лечения нежелательных явлений, отмеченных в системно-органном классе «Инфекционные и паразитарные заболевания» в Медицинском словаре регулятивной деятельности (MedDRA). Сопутствующие лекарственные препараты использовали для идентификации всех антибиотиков на основе кодирования уровня, пути и показания для лекарственных средств в Анатомо-терапевтическо-химической классификации (АТС) Всемирной организации здравоохранения (ВОЗ). Частоту в годовом исчислении (на человека в год) рассчитывали по всем эпизодам (например, все явления инфекции) или всем дням (например, дни, пропущенные по причине инфекции), деленным на все человеко-годы. 1-стороннюю 95% верхнюю границу для частоты в годовом исчислении определяли из общей линейной модели для распределения Пуассона только с параметром интерсепта. Квартили и среднее количество дней до разрешения инфекций оценивали с использованием оценок Каплана-Мейера. 2-сторонние 90% доверительные интервалы рассчитывали с использованием нормальной аппроксимации с поправкой на непрерывность для доли инфузий с≥1 ВСНЯ.
Демографические данные пациентов. Пятьдесят девять пациентов, 28 мужчин и 31 женщина получали лечение PCB-IVIG. Большинство пациентов исследования были белокожими (98,3%) и в возрасте в диапазоне от 3 до 74 лет, средний возраст составлял 41,8 лет. Исследование включало 48 взрослых пациентов (>16 лет) и 11 пациентов детского возраста. Популяция для оценки безопасности включала всех пациентов, получивших по меньшей мере одну инфузию исследуемого лекарственного средства (популяция mITT), она представляла собой основную популяцию для оценки эффективности и безопасности. Наиболее распространенным типом PIDD был вариабельный неклассифицируемый иммунодефицит (CVID) у 45 пациентов (76,3% пациентов). Среднее время от постановки диагноза до включения в исследование составляло 8,66 лет (в диапазоне от 0,3 до 32,9 лет). Демографические характеристики были схожи для 2 режимов.
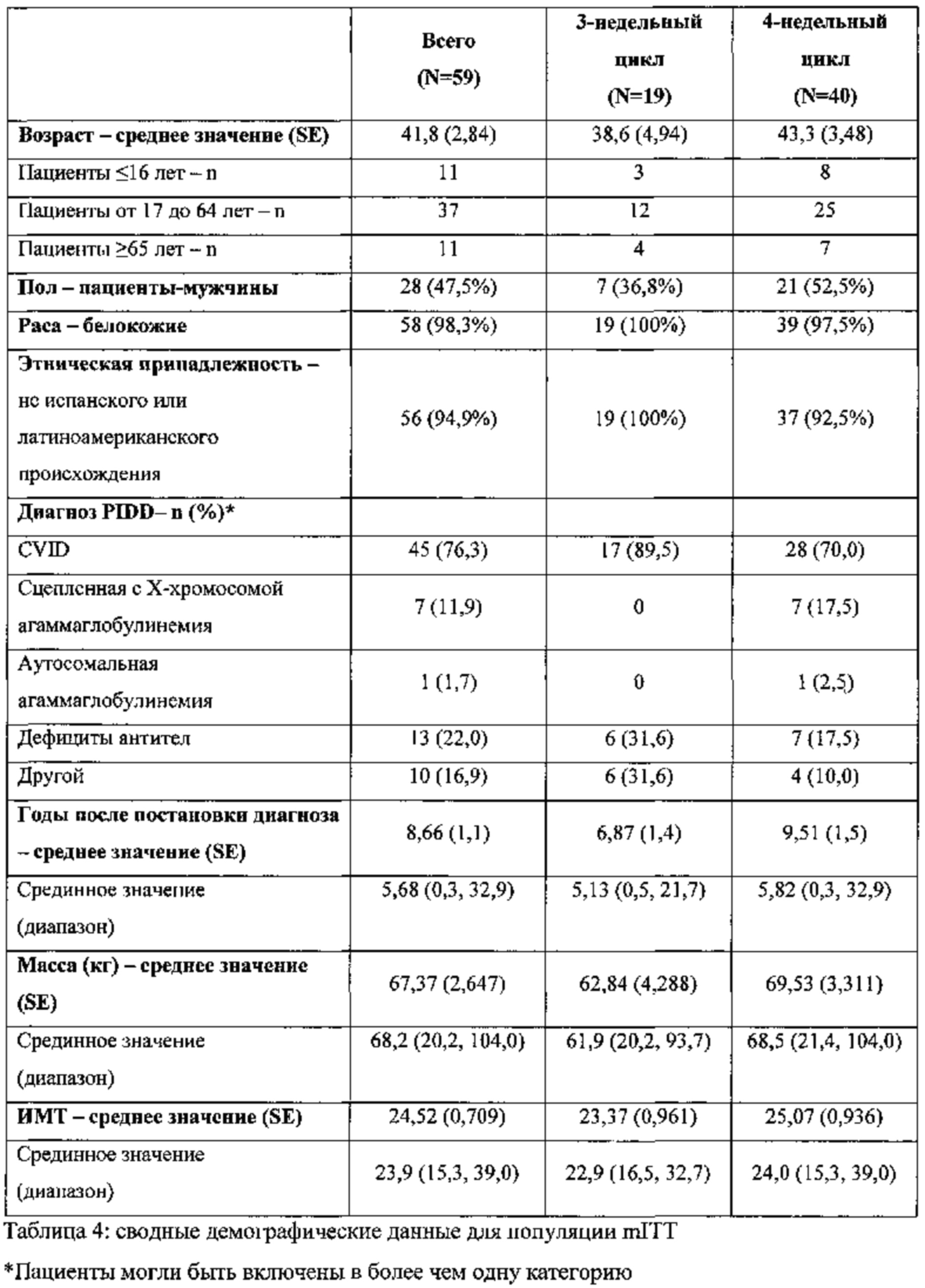
Безопасность. На протяжении всего исследования осуществляли 793 инфузии, в среднем 13,4 инфузии на пациента. Из 793 инфузии в рамках исследования одна не была завершена, как планировали, и две инфузии (у 2 разных пациентов) прерывали из-за НЯ и завершали на следующий день. Средняя (SE) планируемая скорректированная по массе тела доза PCB-IVIG, вводимая во время исследования, составляла 505,2 (4,84) мг/кг с диапазоном от 284 до 1008 мг/кг.Инфузии в рамках исследования, в целом, хорошо переносились, при этом 95,8% инфузии осуществляли с максимальной переносимой скоростью инфузии 8 мг/кг/мин или выше, и премедикацию использовали в случае менее 1% инфузии. Во время исследования скорость инфузии PCB-IVIG находилась в диапазоне от 0,5 до 13,3 мг/кг/мин.
В исследовании не сообщали о серьезных бактериальных инфекциях. В ходе данного исследования 58 пациентов (98,3%) испытали всего 618 возникших после начала лечения НЯ (ВПНЛНЯ). Наиболее часто сообщаемые ВПНЛНЯ, независимо от связи с исследуемым лекарственным средством, включали: головную боль, синусит, диарею, вирусный гастроэнтерит, назофарингит и инфекцию верхних дыхательных путей. Определяли, что всего 55 ВПНЛНЯ были связаны с исследуемым лекарственным средством у 26 (44,1%) пациентов исследования. Наиболее часто сообщаемые связанные с исследуемым лекарственным средством ВПНЛНЯ включали: головную боль, нежелательную лекарственную реакцию, диарею, усталость, мигрень, миалгию и зуд. Во время исследования 43 (72,9%) пациента испытали по меньшей мере одно ВСНЯ, и ВСНЯ испытывали в 113 случаях (14,2%) инфузии в рамках исследования.
Сообщали о двух серьезных нежелательных явлениях (СНЯ), ни одно из них не было связано с исследуемым лекарственным средством; каждое явление испытывалось как единичный случай у одного пациента. Испытываемые в исследовании СНЯ включали один случай каждого из: послеоперационной раневой инфекции и мигрени.
Наблюдали малое число случаев нежелательных инфузионных реакций, всего 31 явление, испытываемое 18 пациентами (30,5%) во время 29 инфузии (3,7%). Наиболее часто сообщаемые явления включали головную боль и миалгию. В данном исследовании сообщали всего о четырех реакциях в месте инфузии у двух пациентов. Сообщаемые реакции в месте инфузии включали экстравазацию в месте инфузии и боль в месте инфузии. Средние лабораторные показатели не подтверждали тенденцию к значительным изменениям лабораторных оценок во время лечения исследуемым лекарственным средством. Итоговые лабораторные оценки в рамках исследования были, в целом, схожи с оценками скрининга, и тенденций не отмечали. Результаты исследования не демонстрировали подтверждение каких-либо случаев тромбоза, острой почечной недостаточности, явлений гемолиза, трансмиссии вируса, асептического менингита или связанного с трансфузией острого повреждения легких.
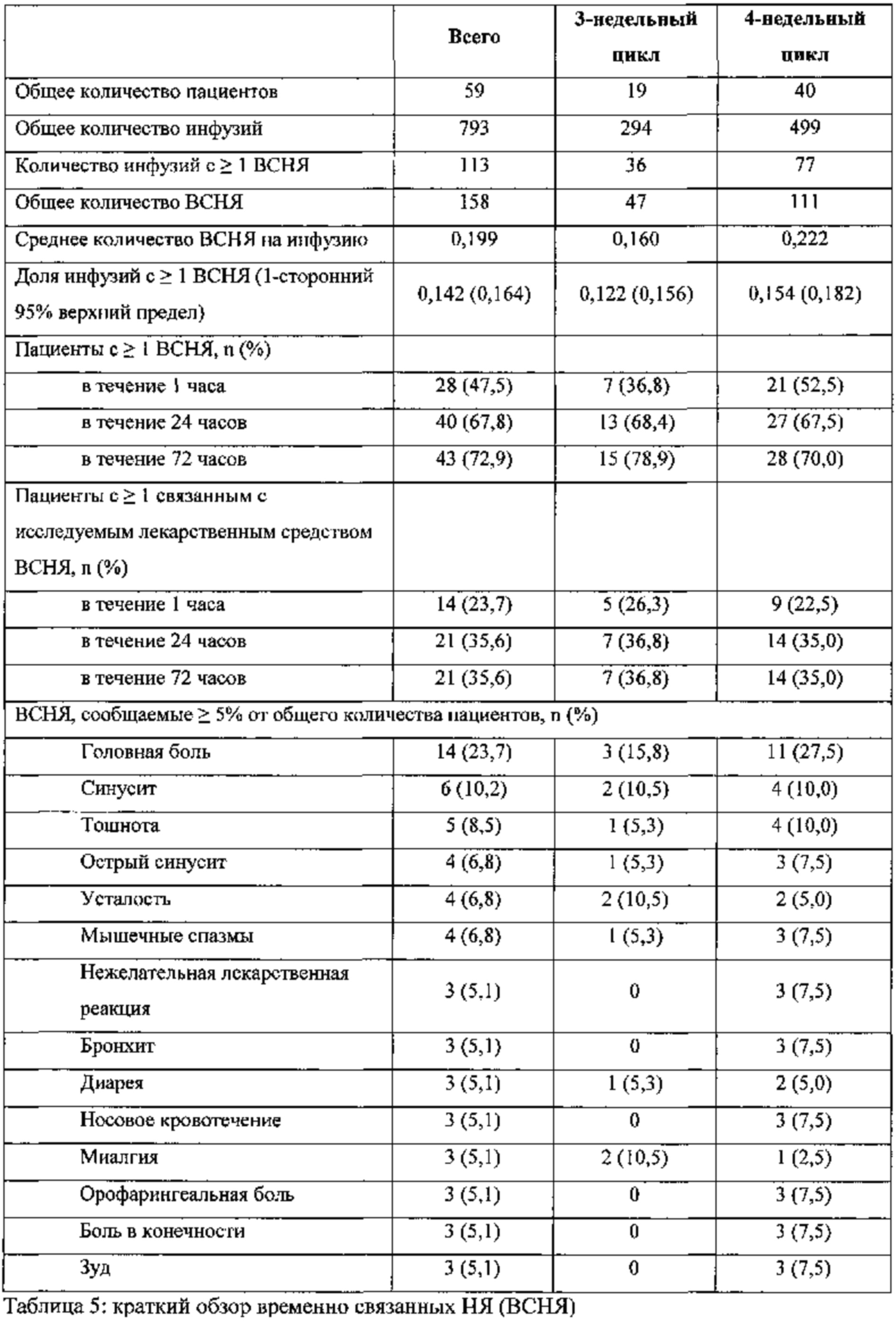
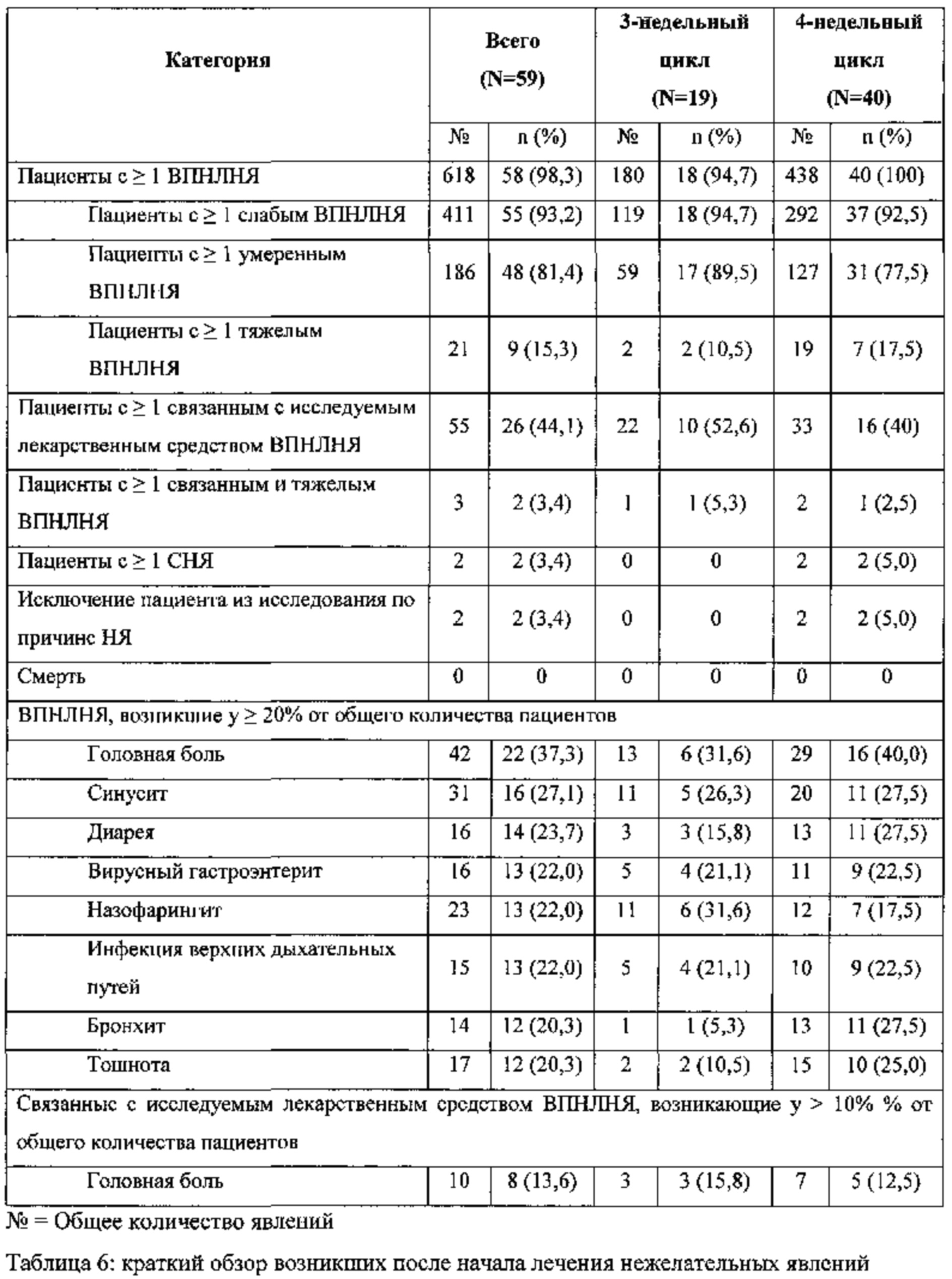
Эффективность. Исследование успешно продемонстрировало эффективность и безопасность лечения PCB-IVIG у пациентов с PIDD в возрасте от 3 до 74 лет за период, составляющий один год. Эффективность PCB-IVIG демонстрировало уменьшение возникновения SBI в популяции исследования. Наблюдаемое число случаев нулевых (0) SBI у 55,88 пациенто-лет лечения приводило к частоте SBI ниже критериев <1,0 SBI на пациента в год, установленных FDA. Безопасность PCB-IVIG демонстрировала доля инфузий, связанных с ВСНЯ. Доля инфузий в рамках исследования с ВСНЯ составляла 0,142 с верхним 1-сторонним пределом 95% доверительного интервала 0,164, что указывает на то, что исследование достигло цели (0,40) для данной конечной точки безопасности.
Другие ключевые вторичные конечные точки эффективности включали число случаев инфекций (3,436 инфекции на пациента в год), дни, пропущенные на работе/школе/детском саду по причине инфекции (1,66 дня на пациента в год), незапланированные визиты к врачу по причине инфекции (0,966 визита на пациента в год) и госпитализации по причине инфекции (0,018 госпитализации на пациента в год). Тогда как между PCB-IVIG и плацебо или любым другим продуктом IGIV не проводили прямых сравнений, при рассмотрении в сравнении с опубликованными данными исследований со схожим дизайном результаты для PCB-IVIG были, в целом, сопоставимыми или более благоприятными по сравнению с результатами для разрешенных коммерчески доступных продуктов.
Анализ минимальных концентраций IgG и конкретных антител показал, что введение PCB-IVIG в дозах 284-1008 мг/кг каждые 3 или 4 недели, в целом, поддерживало концентрации, схожие с присутствующими в начале исследования. Единственное исключение из этого наблюдения было в случае минимальных титров к РСВ, когда уровни, повышенные после начала лечения PCB-IVIG, затем сохранялись на повышенном уровне на протяжении оставшейся части исследования. При анализе исследуемой дозой PCB-IVIG (<500 или ≥500 мг/кг PCB-IVIG) наблюдали подтверждение более высоких уровней конкретных антител ко всем исследуемым патогенам у пациентов, получавших дозы PCB-IVIG ≥500 мг/кг, по сравнению с теми, кто получал дозы <500 мг/кг (например, уровней антител, специфичных к РСВ, haemophilus influenzae типа В, Clostridium tetani, streptococcus pneumonia, вирусу кори и ЦМВ).
При поддержании минимальных уровней IgG и конкретных антител на протяжении всего исследования для пациентов обеспечивали полезное защитное действие IGIV, о чем свидетельствует малое число случаев серьезных и других представляющих интерес инфекций, и дней, пропущенных на работе, в школе или детском саду, и малое число внеплановых визитов к врачу и госпитализаций по причине инфекции. Тогда как пациенты, которым вводили дозы PCB-IVIG 3-недельным циклом, имели тенденцию к более высоким минимальным концентрациям IgG по сравнению с пациентами с 4-недельным циклом, не было подтверждения, позволяющего предположить различие в результатах эффективности или безопасности на основе продолжительности цикла лечения. Оба цикла лечения успешно поддерживали минимальные концентрации IgG значительно выше целевого порога в 500 мг/дл, со средними минимальными уровнями IgG в диапазоне от 1051,6 до 1194,9 мг/дл для пациентов 3-недельного цикла, и от 913,3 до 978,5 мг/дл для пациентов 4-недельного цикла.
Большинство пациентов в данном исследовании не испытывали каких-либо связанных с инфузией проблем или осложнений. Использование премедикации ограничивалось семью инфузиями в рамках исследования (0,4%), и 95,8% инфузий хорошо переносились с максимальной скоростью инфузий 8 мг/кг/мин или выше, что подтверждало малое число случаев нежелательных инфузионных реакций или реакций в месте инфузий, и отсутствие клинически значимых наблюдений нарушения основных жизненных показателей во время инфузий в рамках исследования.
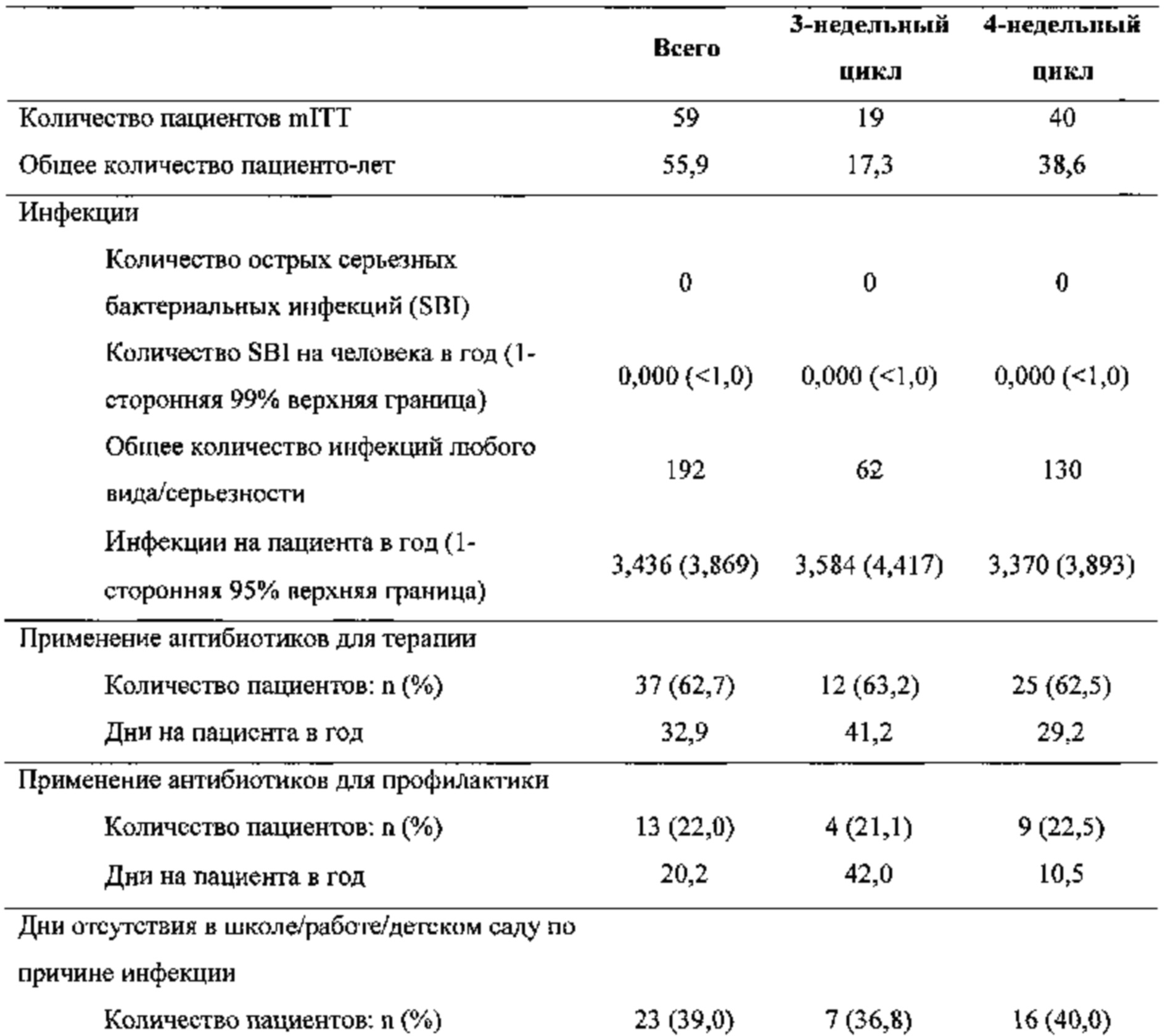
ФК эффективность. Тридцать пациентов, 20 пациентов 4-недельного цикла инфузий и 10 пациентов 3-недельного цикла инфузий, участвовали в ФК части исследования. Введение PCB-IVIG при любом режиме приводило к повышению IgG и антител к Hib, ЦМВ, РСВ, столбняку и серотипам Streptococcus pneumoniae с наибольшим повышением Cmax, наблюдаемым в случае антител к РСВ. Не наблюдали очевидного различия между группами в средних концентрациях IgG в плазме и средних значениях Сmax с немного большей AUC за интервал между введением доз из-за на семь дней более длительного периода. Хотя средние значения
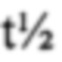
Хотя в каждой группе был диапазон доз PCB-IVIG, не наблюдали очевидной связи между AUC за интервал между введением доз и либо общей дозой, либо скорректированной по массе тела дозой для каждой когорты. В целом, на повышение антител к Hib, ЦМВ, РСВ, столбняку и серотипам Streptococcus pneumoniae не влияли интервалы лечения, используемые в данном исследовании. Средние значения для всех антител, измеренные в начале исследования, были сопоставимы с титрами до инфузии для обеих когорт, и максимальные титры были выше, чем исходные титры и титры до инфузии. По-видимому, не было различия в воздействии IgG в зависимости от пола или возрастной группы. Анализ концентраций IgG в плазме, скорректированных относительно исходных, позволил провести сравнения между когортами 3- и 4-недельного цикла которые были сопоставимы с теми с использованием концентраций в плазме без коррекции относительно исходных.
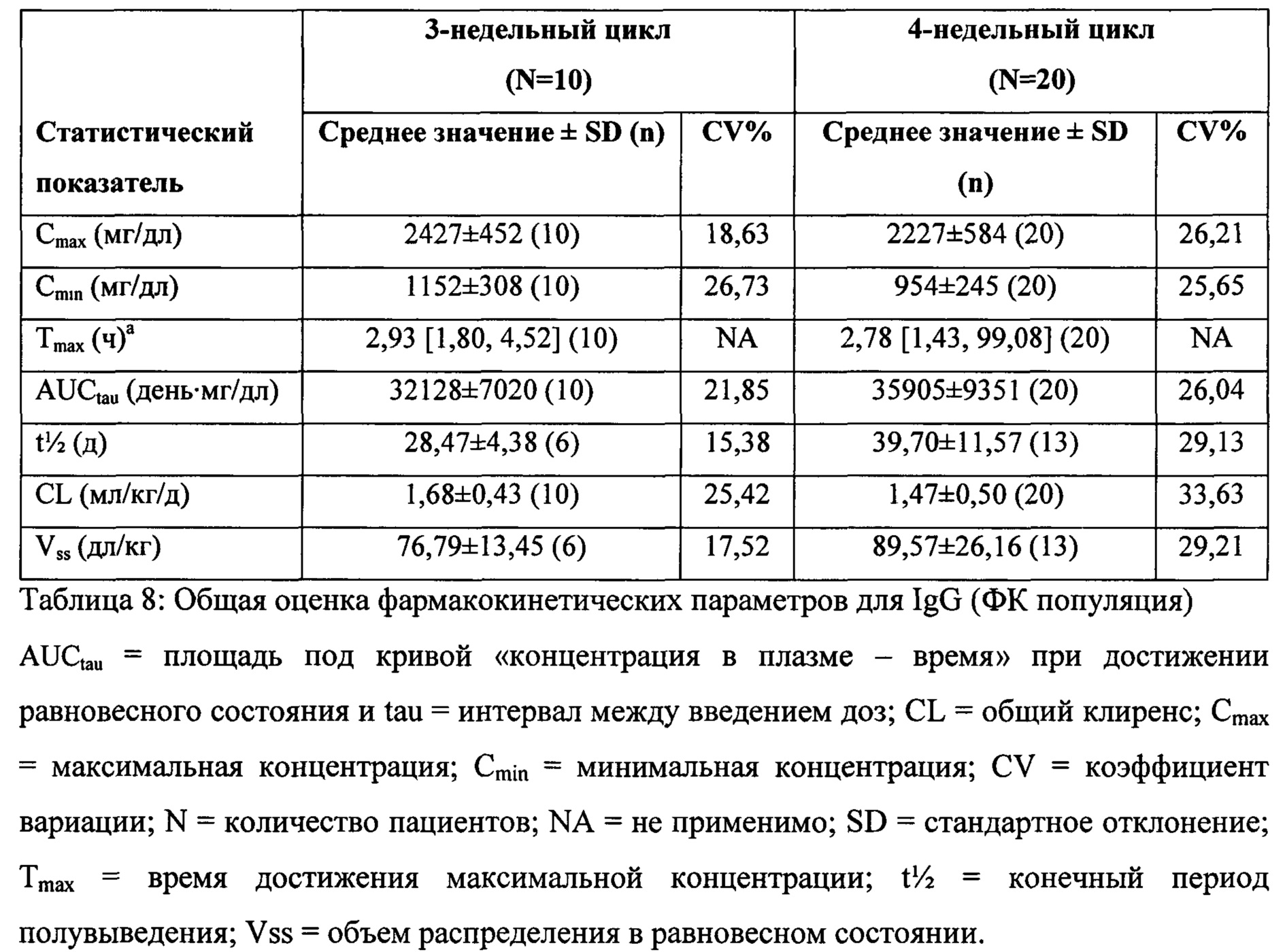
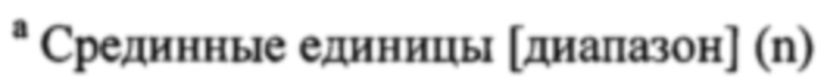
Пример 6
Противовирусная активность PCB-IVIG в модели у хлопковых хомяков, инфицированных паливизумаб-резистентным (ПР) РСВ/А/Тracy
Проводили эксперименты для получения характеристик терапевтического и профилактического действия PCB-IVIG, вводимого в профилактических целях путем интраперитонеальной инъекции в количестве 1500 мг/кг хлопковым хомякам (XX), инфицированным респираторно-синцитиальным вирусом (РСВ). Эксперименты позволяли сравнить эффективность PCB-IVIG согласно настоящему изобретению с эффективностью паливизумаба (торговое название СИНАГИС, изготавливаемый MedImmune, Гейтерсберг, Мэриленд, США) (15 мг/кг) в отношении РСВ дикого типа (wt)/A/Tracy (wt-PCB/A/Tracy) и паливизумаб-резистентного РСВ/А/Tracy (ПР-РСВ/А/Tracy).
Выделяли паливизумаб-резистентные мутанты РСВ/А/Tracy и РСВ/В/18537. Вкратце, их получали после серийного пересева вирусов в возрастающих концентрациях (40, 80, 160 и 320 мкг/мл) паливизумаба (Pmab). Оба паливизумаб-резистентных мутантных вируса содержали одну мутацию аминокислоты (АК) в положении 262. Оба родительских штамма содержали аспарагин (амид, нейтральная полярная АК) в ак262, и оба паливизумаб-резистентных мутанта содержали тирозин (ароматическая нейтральная полярная АК). Замена N262Y происходила в предполагаемом антигенном домене II и в определенном для паливизумаба эпитопе (АК262-276). Большинство опубликованных паливизумаб-резистентных мутантов содержат замены в АК 272, 268, 275 и 276. Как показано на фиг. 14, хлопковых хомяков, инфицированных (А) паливизумаб-резистентным мутантом РСВ/А/Tracy или (В) РСВ/В/18537, можно было с таким же успехом сравнить с исходным вирусом, однако мутантный вирус был устойчив к иммунопрофилактическому действию паливизумаба.
Анализируемые конечные титры вируса в жидкостях легочного лаважа (3 мл) и промывочных жидкостях носа (2 мл) у инфицированных хлопковых хомяков (массой 125-150 г) сравнивали с хлопковыми хомяками, не получавшими лечение. Количественное определение вируса осуществляли путем полуколичественного анализа бляшкообразования. Уровни РСВ-специфичных нейтрализующих антител для PCB-IVIG в жидкостях легочного лаважа и в сыворотках определяли путем анализа микронейтрализации в 0 и +4 дни с использованием wt-PCB/A/Tracy.
Для получения характеристик потенциальной профилактической эффективности в модели РСВ-ХХ использовали следующий дизайн исследования: всех хлопковых хомяков инфицировали интраназально в 0 день (хлопковые хомяки (масса тела ~130 г)):
Для заражения wt-PCB/A/Tracy
Группа 1: 5 хлопковых хомяков лечили ФБР путем интраперитонеальной инъекции (и/п) в -24 ч (положительный контроль инфицирования wt-PCB/A/Tracy);
Группа 2: 5 хлопковых хомяков лечили RI-002 в количестве 1500 мг/кг и/п в -24 ч; и
Группа 3: 5 хлопковых хомяков лечили паливизумабом в количестве 15 мг/кг внутримышечно в -24 ч.
Для заражения ПР-РСВ/А/Tracy
Группа 4: 5 хлопковых хомяков лечили ФБР путем интраперитонеальной инъекции (и/п) в -24 ч (положительный контроль инфицирования ПР-РСВ/А/Tracy);
Группа 5: 5 хлопковых хомяков лечили RI-002 в количестве 1500 мг/кг и/п в -24 ч; и
Группа 6: 5 хлопковых хомяков лечили паливизумабом в количестве 15 мг/кг внутримышечно в -24 ч.
Хлопковые хомяки (XX): масса тела хлопковых хомяков составляла ~130 г (определяли по возрасту в начале). Значения массы тела регистрировали в конце эксперимента. Значения массы тела животных и распределение по полу были максимально схожими во всех группах в начале. Всех животных заражали живым wt-РСВ/А или ПР-РСВ/А в 0 день.
Заражение вирусом:
a) РСВ дикого типа/А/Tracy (Р3 w.p. 9/26/2013, выращенный в клетках НЕр-2), 1,35×105 БОЕ интраназально (100 мкл) хлопковым хомякам, слегка анестезированным изофлураном. Исходный: 1,35×106 БОЕ/мл.
b) Паливизумаб-резистентный РСВ/А/Tracy (ПР-РСВ/А/Tracy (Р8 w.p. 11/22/2013), 2,04×105 БОЕ интраназально (100 мкл) хлопковым хомякам, слегка анестезированным изофлураном. Исходный: 2,04×106 БОЕ/мл.
Процедуры и анализы: забор органов и образцов. После эвтаназии с помощью СO2 определяли массу тела каждого хлопкового хомяка и регистрировали пол и возраст. Левую и одну из больших правых долей легких извлекали, промывали в стерильной воде с удалением внешнего загрязнения кровью и взвешивали. Левую долю подвергали трансплевральному лаважу с использованием 3 мл среды Искова с 15% глицерином, смешанной с 2% FBS-MEM (1:1, об./об.), в 3 мл шприце с иглой 26G3/8, и вводили путем инъекции в нескольких местах, чтобы полностью раздуть долю. Жидкость лаважа извлекали путем легкого нажима на плоскость раздутой доли и использовали для трансплеврального лаважа правой доли в соответствии с той же методикой. Жидкость лаважа собирали и хранили на льду до титрования. Для назального промывания верхних дыхательных путей челюсти разъединяли. Затем отделяли голову и 1 мл среды Искова с 15% глицерином, смешанной с 2% FBS-MEM (1:1, об./об.), проталкивали через каждую ноздрю (всего 2 мл). Выходящую жидкость собирали из заднего отверстия неба и хранили на льду до титрования. Образцы не замораживали перед титрованием, которое проводили по окончании сбора образцов.
Титры РСВ Tracy в жидкости легочного лаважа (БОЕ/г легкого) и титры в назальной промывочной жидкости (общее количество БОЕ). Анализы бляшкообразования проводили с использованием 24-луночных планшетов для тканевой культуры, содержащих почти конфлюэнтные монослои (от 20 до 40×104 клеток/лунка) клеток НЕр-2, полученные в 10% FBS за 24 часа до начала анализа. В начале каждого анализа осуществляли разведения (как правило, серийные log10) тестируемых образцов. 0,2 мл каждого образца добавляли в лунки в двух повторностях и оставляли для адсорбции в течение 90 минут при периодическом осторожном встряхивании. После удаления инокулята монослои покрывали 0,75% метилцеллюлозой в 2% FBS-MEM, содержащей антибиотики, витамины и другие питательные вещества. В каждый анализ включали тканевую культуру и положительные контроли вируса. Планшеты помещали в инкубатор при 36°С, с 5% СO2. В 6 день +1 день спустя планшеты окрашивали 0,01% кристаллическим фиолетовым/10% раствором формалина (1,5 мл/лунка) и оставляли на 24-48 часов при комнатной температуре. Лунки промывали водой. Когда бляшки присутствовали, их можно было легко видеть (светлые круги на очень темном синем фоне). Все бляшки в лунках, содержащих от 20 до 100 бляшек, подсчитывали, вычисляли среднее и рассчитывали титры вируса как log10 общего количества БОЕ для назальной промывочной жидкости или log10 БОЕ/г ткани для легких или других органов. Нижний предел детектирования данным способом составлял 0,70 log10 общего количества БОЕ или приблизительно 1,4 log10 БОЕ/г легкого соответственно.
Определение присутствия нейтрализующих антител PCB-IVIG и антител паливизумаба в 0 и 4 дни путем анализа микронейтрализации: тесты для определения нейтрализующих антител PCB-IVIG и антител паливизумаба в сыворотке к РСВ/А/Tracy (РСВ/А) проводили в 96-луночных микротитрационных планшетах с клетками НЕр-2. Клонированный с помощью метода бляшкообразования РСВ/А представлял собой вирус, используемый в анализе микронейтрализации (Nt). Образцы сыворотки инактивировали путем нагревания при 56°С в течение 30 минут. Выполняли серийные двукратные разведения в двух повторностях, начиная с 3 log2, для определения титра нейтрализующих антител (Ab) для каждого образца. Титр нейтрализующих антител определяли как разведение сыворотки, при котором наблюдали >50% уменьшение цитопатического действия вируса (СРЕ). СРВ определяли как разрушение ткани и определяли визуально после фиксации лунок 10% нейтральным буферным формалином и окрашивания кристаллическим фиолетовым. Титры нейтрализующих антител представляли собой категориальные log показатели, а не непрерывные значения. Самый низкий детектируемый титр Nt Ab составлял 2,5 log2. Образцам с недетектируемыми титрами Nt Ab присваивали значение 2 log2. Титры Nt Ab регистрировали кратно 0,5 log2 (например, 2,5, 3,0, 3,5, 4,0 и т.д.). Если образец содержал титр Nt Ab, который был равен или превышал верхний предел теста (>14 log2), данный образец повторно тестировали, так чтобы титр Nt Ab мог быть определен путем расширения разведении до 26 log2. Внутренние стандарты и контроли представляли собой диапазон низких, средних и высоких титров РСВ-специфичных нейтрализующих антител. Кроме того, паливизумаб включали в количестве 40 и 320 мкг/мл, которое давало титры Nt Ab в низких-средних и средних диапазонах.
В таблицах 9 и 10 ниже представлены схемы для различных групп лечения и параметры исследования. Сокращения: и/п, интраперитонеальный; в/м, внутримышечный; NtAb, нейтрализующее антитело, БОЕ, бляшкообразующие единицы, ПР, паливизумаб-резистентный. Всех животных заражали интраназально (100 мкл) wt-PCB/A/Tracy (1,35×105 БОЕ) или ПР-РСВ/А/Tracy (2,04×105 БОЕ) в 0 день.
2N=5 животных/группа; всего 30 животных. Концентрация лекарственного средства будет зависеть от определенной массы тела хлопкового хомяка на момент инокуляции.4Фактическая рассчитанная суточная доза, определенная по массе тела в +4 день.
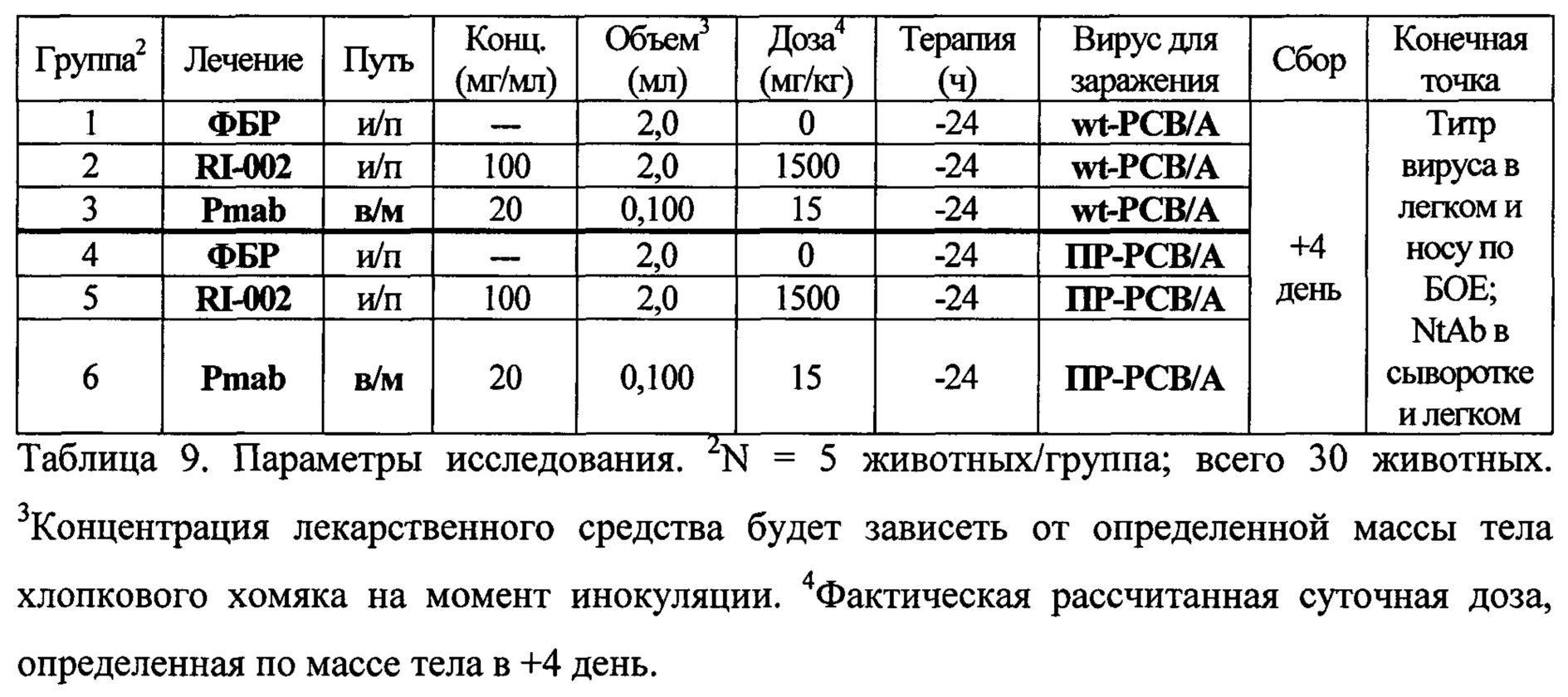
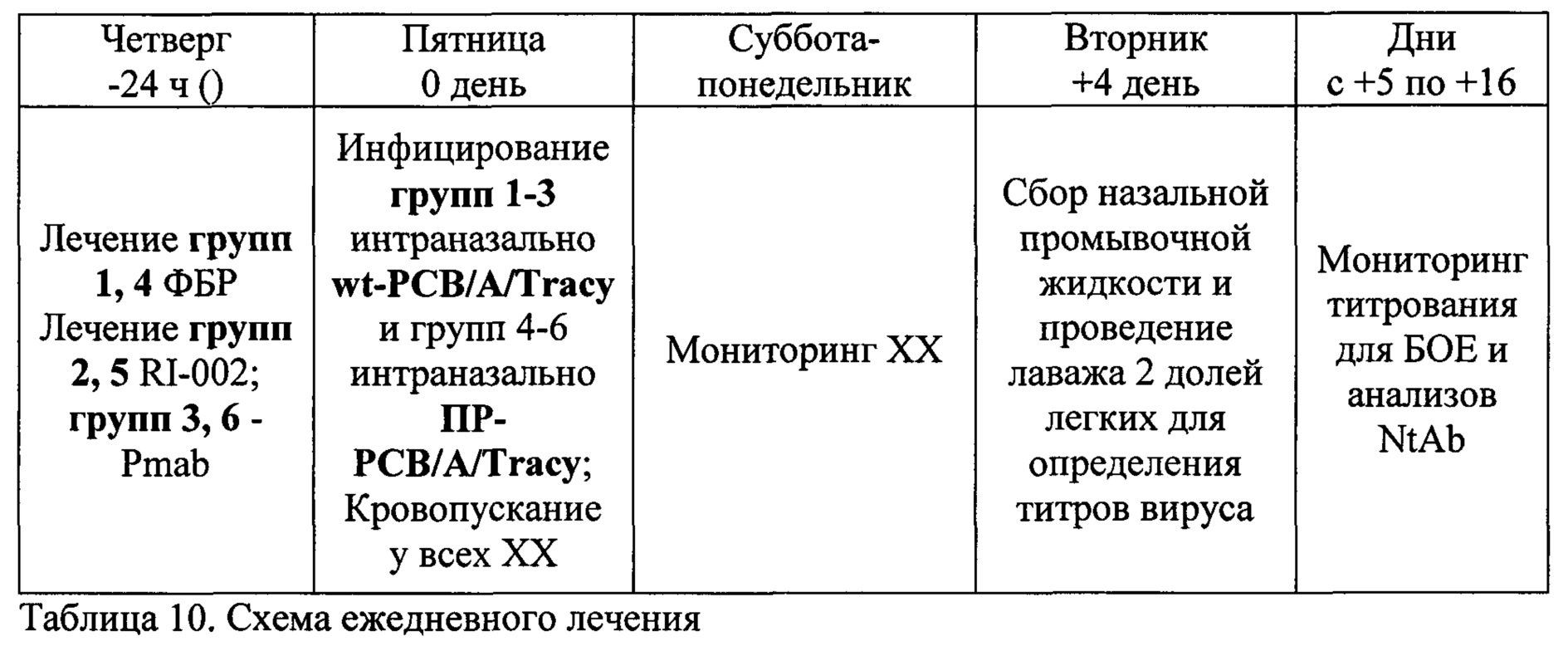
Результаты представлены в таблицах 11-18 ниже и на фиг. 15.
В таблице 11 представлена доза, масса образца легкого и значения массы тела в+4 день.
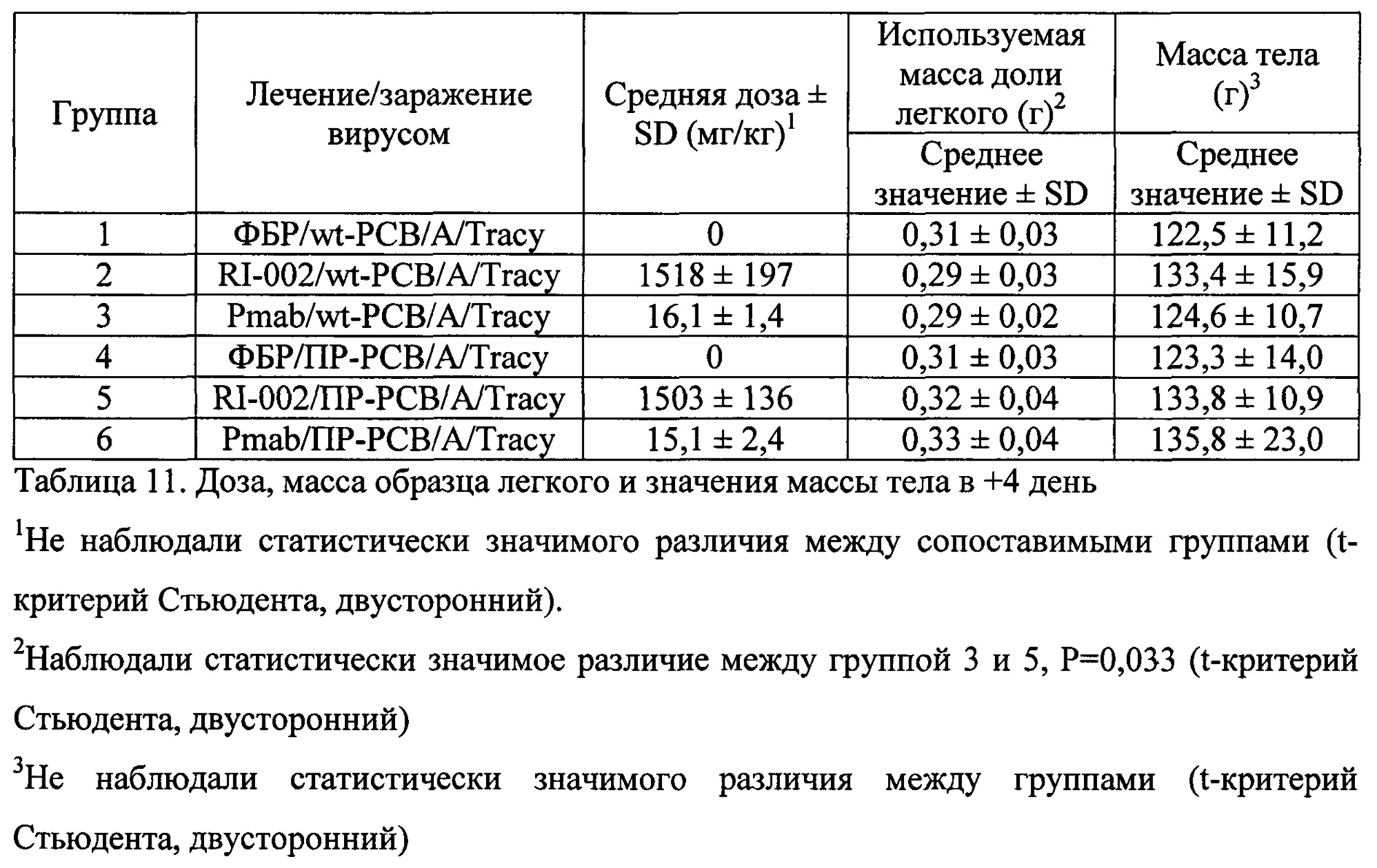
В таблице 12 представлены титры в жидкостях легочного лаважа в +4 день.
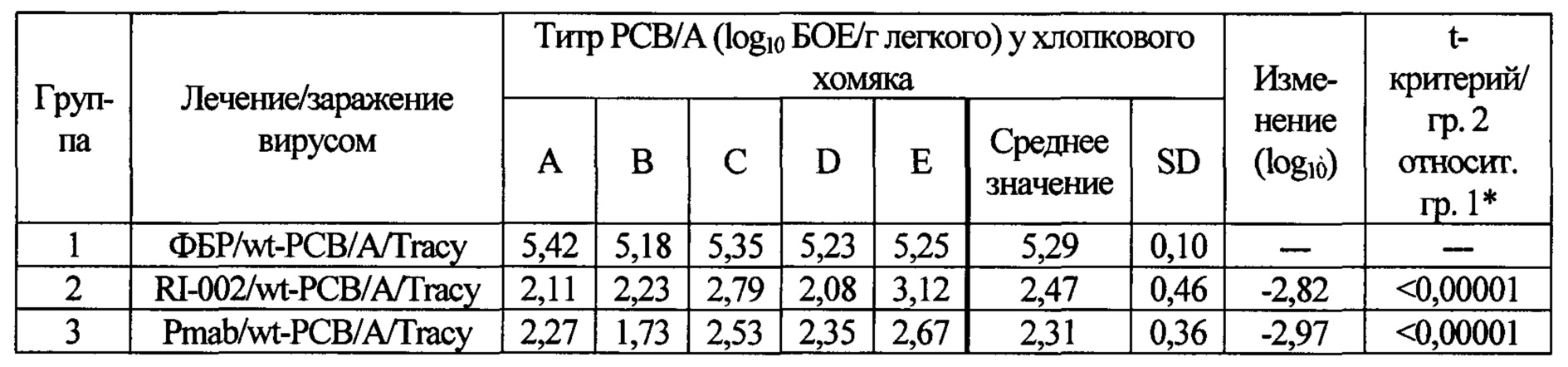

Влияние РСВ-IVIG на титры вируса в жидкости легочного лаважа показано на фиг. 15.
В таблицах 13 и 14 представлен титр РСВ/А/Tracy-нейтрализующих антител в сыворотке в 0 день и +4 день соответственно.
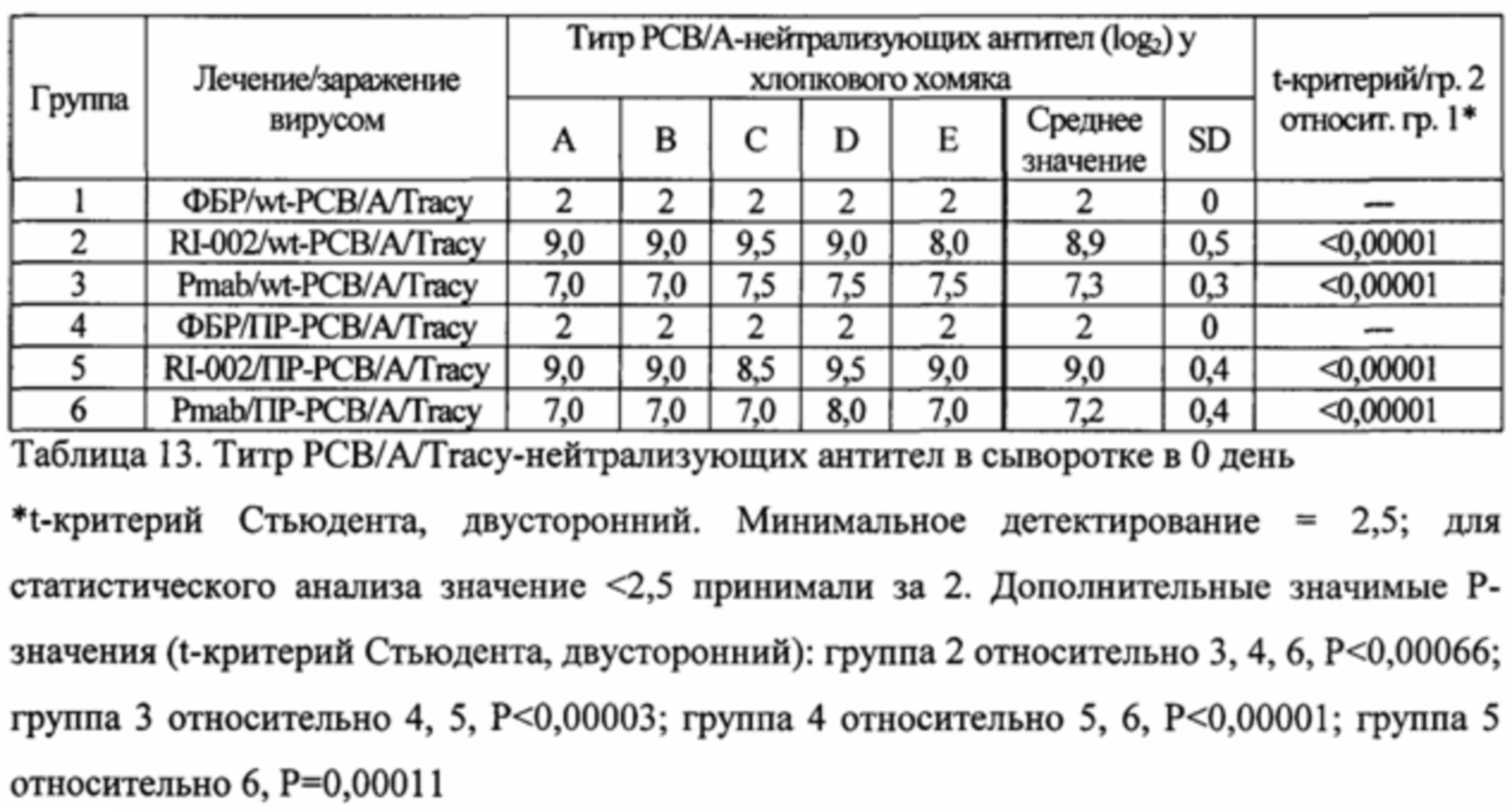
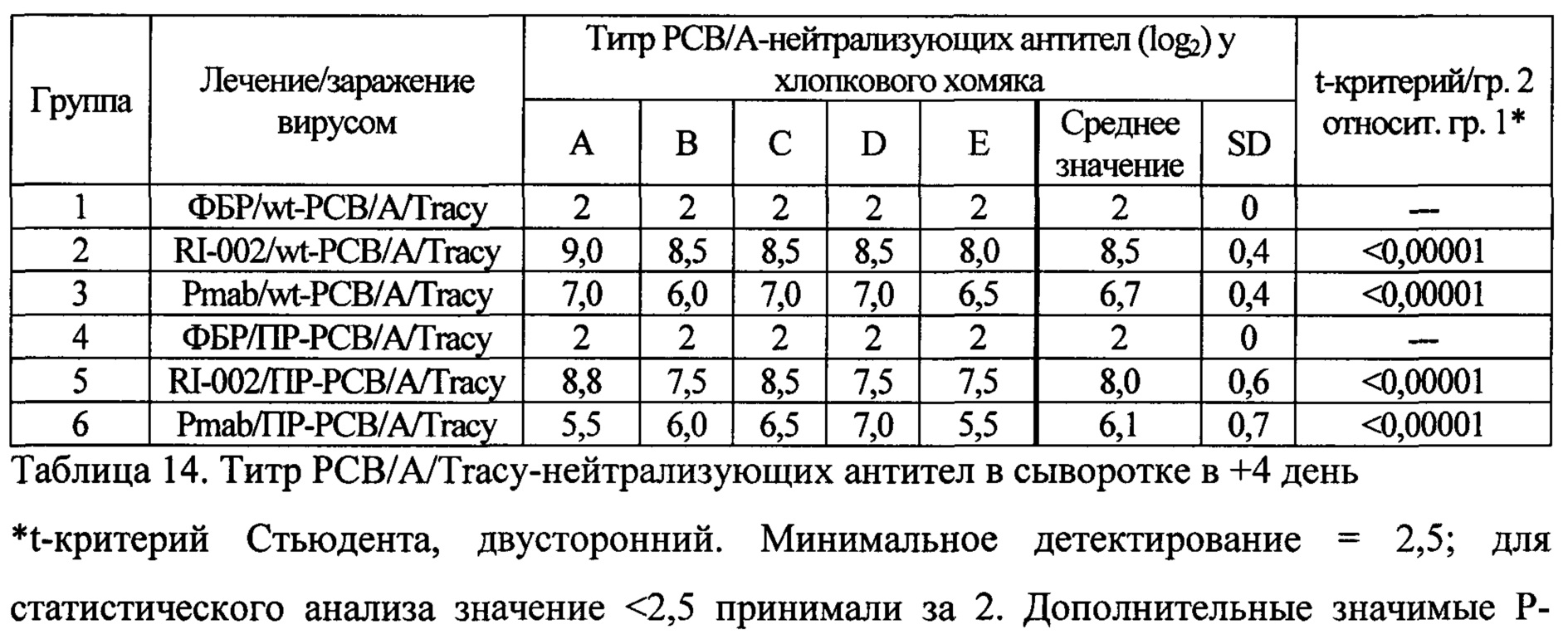

В таблицах 15 и 16 представлен титр РСВ/В/18537-нейтрализующих антител в сыворотке в 0 день и +4 день соответственно.
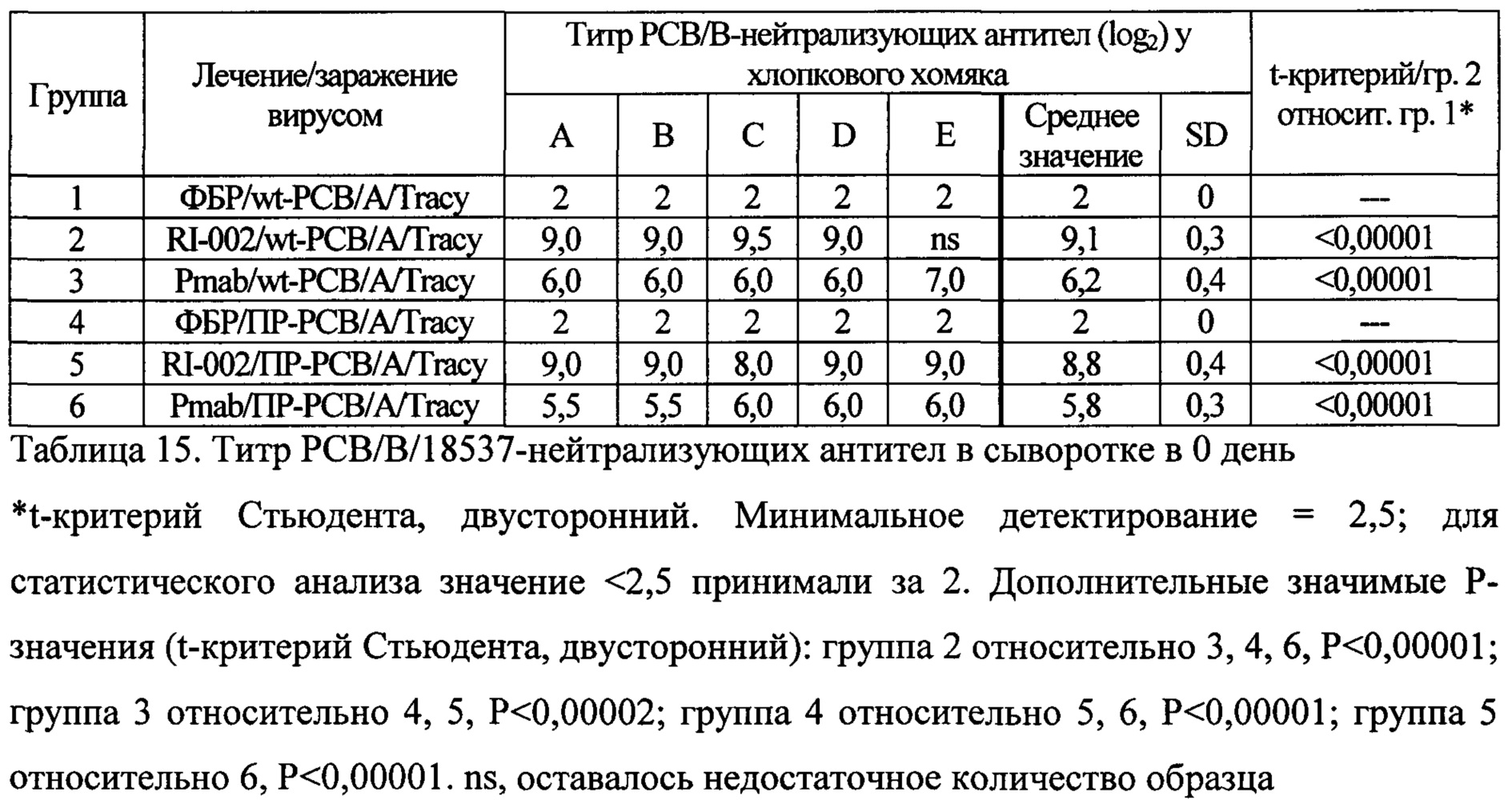
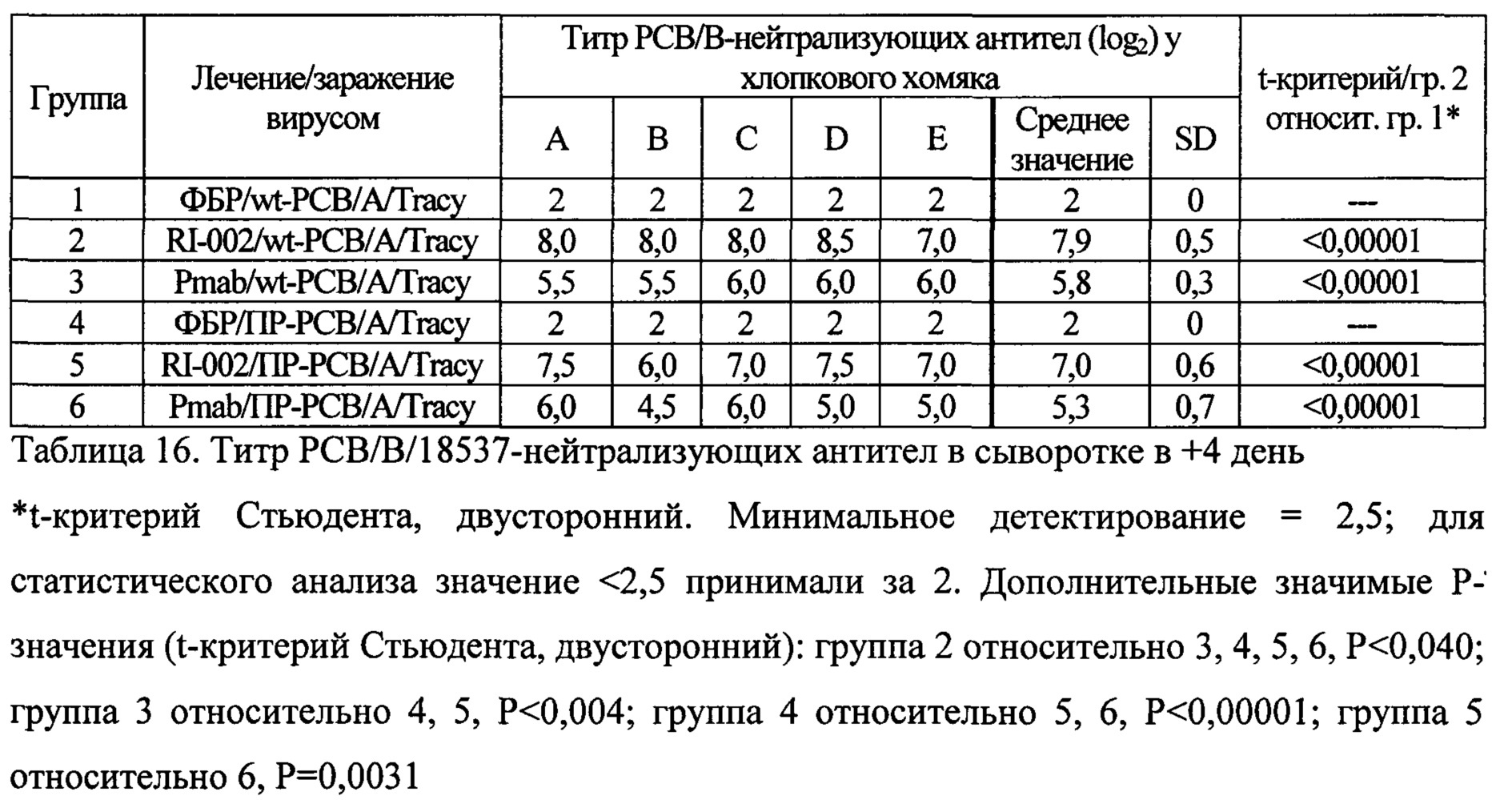
Влияние РСВ-IVIG на титры РСВ/А/Tracy-нейтрализующих антител в сыворотке и на титры РСВ/В/18537-нейтрализующих антител в сыворотке показано на фиг. 16А и 16В соответственно.
В таблице 17 показано сравнение концентрации антител в сыворотке для PCB-IVIG и паливизумаба после внутримышечного введения, измеренной путем анализа микронейтрализации.
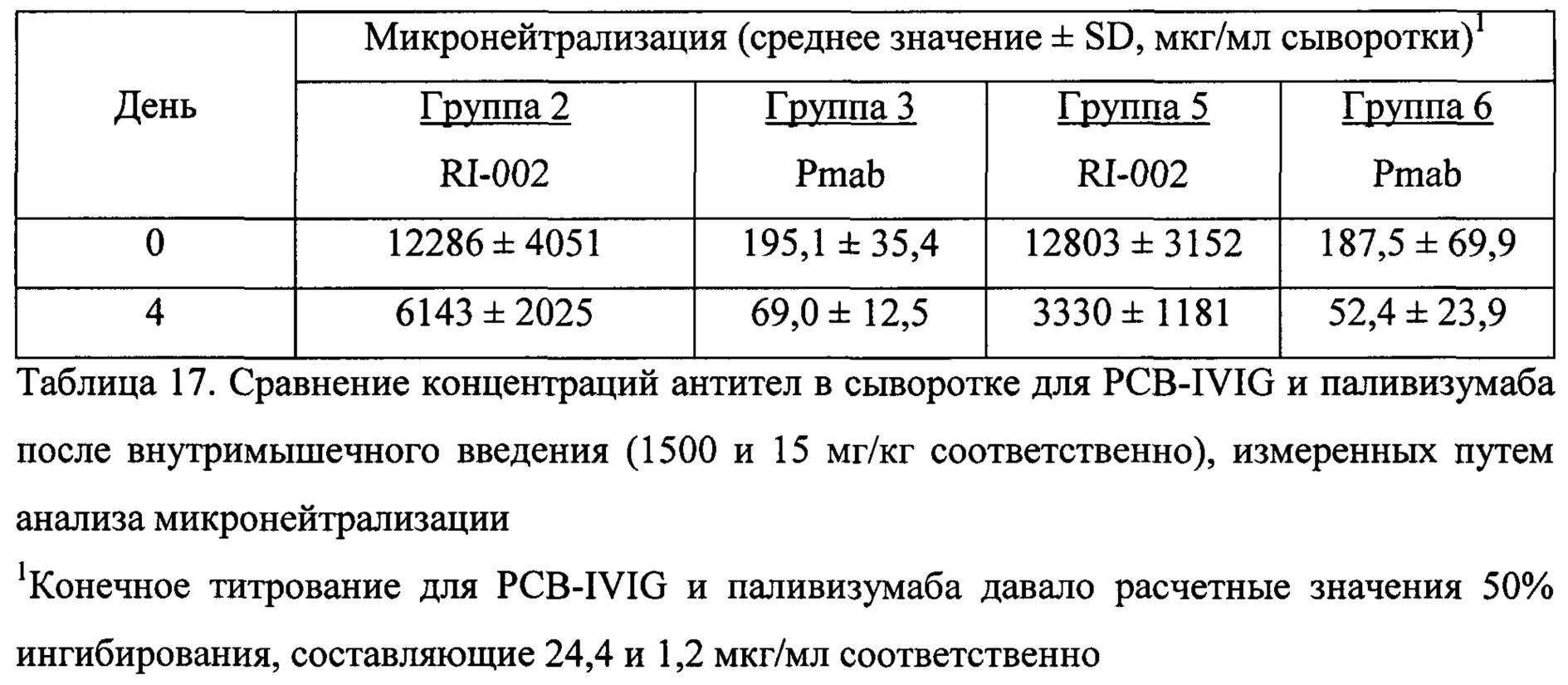
Как описано выше, действие PCB-IVIG, вводимого путем интраперитонеальной инъекции за 24 часа до заражения РСВ/А/Tracy, было минимальным в отношении как wt-, так и ПР-РСВ/А/Tracy (общее уменьшение БОЕ на 0,76 и 0,28 log10 соответственно) (если одно из животных в таблице 12, группа 2 (2С заштриховано) исключали из анализа, поскольку значение составляло почти 2 стандартных отклонения от среднего значения (остальные 4 XX, среднее значение ± sd = 4,31±0,14)). Действие PCB-IVIG, вводимого путем интраперитонеальной инъекции за 24 часа до заражения РСВ/А/Tracy, было превосходным в отношении как wt-, так и ПР-РСВ/А/Tracy (уменьшение БОЕ/г ткани легкого на 2,82 и 2,45 log10 соответственно), и в случае wt-PCB/A/Tracy было схожим с паливизумабом (Pmab). Кроме того, PCB-IVIG ингибировал репликацию вируса ПР-РСВ/А/Tracy, тогда как Pmab - нет. PCB-IVIG вызывал сопоставимое и значительное уменьшение вируса в легких, когда хлопковых хомяков заражали либо wt-PCB/A/Tracy, либо ПР-РСВ/А/Tracy. На момент заражения РСВ/А/Tracy (0 день) титры нейтрализующего антитела в сыворотках были выше для PCB-IVIG, вводимого в количестве 1500 мг белка/кг, по сравнению с паливизумабом, вводимым в количестве 15 мг белка/кг (Р<0,0039; t-критерий Стьюдента, двусторонний). Wt- и ПР-РСВ/А/Tracy одинаково ингибировались PCB-IVIG, но не паливизумабом, в концентрациях, используемых в модели профилактики РСВ/А/Tracy у хлопкового хомяка. Титры РСВ/В/18537-нейтрализующих антител в сыворотке были схожи по величине с титрами, наблюдаемыми в отношении РСВ/А/Tracy. В целом, PCB-IVIG, вводимый в количестве 1500 мг/кг, влиял на титры wt-PCB/A/Tracy в носу и легких подобно паливизумабу, вводимому в количестве 15 мг/кг. PCB-IVIG более эффективно уменьшал репликацию РСВ в легких по сравнению с носом. В отличие от паливизумаба, PCB-IVIG эффективно уменьшал репликацию вируса в легких в модели паливизумаб-резистентного РСВ/А/Tracy у хлопкового хомяка.
Для специалиста в данной области техники будут очевидны различные модификации, рекомбинации и вариации описанных признаков и вариантов реализации в пределах объема и сущности настоящего изобретения. Хотя были описаны конкретные варианты реализации, следует понимать, что заявленное изобретение не должно ограничиваться такими конкретными вариантами реализации. Действительно, различные модификации описанных способов и вариантов реализации, которые очевидны специалисту в соответствующей области техники, входят в объем приведенной ниже формулы изобретения. Полное содержание всех публикаций и патентов, упомянутых в настоящей заявке и/или перечисленных ниже, включено в настоящее описание посредством ссылки.
Реферат
Группа изобретений относится к лечению иммунодефицита. Иммунотерапевтическая композиция содержит объединенные образцы плазмы, полученные от 1000 или более людей-доноров плазмы, при этом указанная композиция характеризуется конечным титром РСВ-нейтрализующих антител, составляющим по меньшей мере 1800, и титром антител к одному или более респираторным патогенам, выбранным из вируса парагриппа 1, вируса парагриппа 2, коронавируса OC43, коронавируса 229Е, вируса гриппа А, вируса гриппа B и метапневмовируса, который по меньшей мере в 1,5 раза больше титра указанных антител в контрольном образце, при этом указанный контрольный образец представляет собой смесь образцов плазмы, полученных от 1000 или более случайных людей-доноров плазмы, и при этом менее чем 50% объединенных образцов плазмы в указанной иммунотерапевтической композиции получены от людей-доноров плазмы с конечным титром РСВ-нейтрализующих антител, составляющим по меньшей мере 1800. Также раскрыты способ обеспечения иммунотерапии для субъекта для лечения или предотвращения респираторной инфекции и способ получения композиции. Группа изобретений обеспечивает эффективную иммунотерапию. 5 н. и 16 з.п. ф-лы, 16 ил., 19 табл., 6 пр.

Комментарии