Способ получения арилалкилгидропероксидов, комплекс переходного металла - RU2142954C1
Код документа: RU2142954C1
Чертежи
Описание
Это изобретение имеет отношение к способу получения арилалкилгидропероксидов селективным окислением арилалкилуглеводородов в соответствующие им арилалкилгидропероксиды в высокой концентрации кислородсодержащими газами в присутствии комплексов переходных металлов в качестве катализатора, которые содержат как лиганд циклическую или открытую цепь полифункционального органического аминосоединения, имеющего по крайней мере три атома азота в молекуле. Это изобретение в дальнейшем относится к таким переходным металлическим комплексам.
Арилалкилгидропероксиды используются как исходные материалы для производства ряда коммерческих химикатов, например, для производства фенола и ацетона из моногидропероксида кумола.
Описание предшествующего уровня
Уже известен ряд способов для производства арилалкилгидропероксидов окислением арилалкилуглеводородов в
соответствующие им арилалкилгидропероксиды в кислородсодержащих газах в присутствии катализатора.
Например, способ, описанный в публикации японского патента N 50-50020, в котором алкилбензолы, имеющие вторичные алкильные группы, такие как 3,5-диметилкумол, окислялись в присутствии воды кислородсодержащим газом, используя водорастворимый комплекс или хелатное соединение кобальта, никеля, марганца, меди или железа, имеющие полиаминокарбоксильные кислоты, такие как этилендиаминтетрауксусная кислота (ЭДТА) в качестве лиганда, давая соответствующие им арилалкилгидропероксиды.
В соответствии с этим способом необходимо, чтобы щелочь была добавлена последовательно в водный раствор, в котором проводится реакция в присутствии катализатора для установления в растворе слегка кислой pH с тем, чтобы предотвратить побочное получение щавелевой кислоты или уксусной кислоты, которые дезактивируют катализатор. Более того, способ имеет дополнительное неудобство из-за того, что реакция окисления не происходит с практически целесообразной скоростью при такой относительно низкой температуре примерно 80oC, при которой термальным разложением конечных органических гидропероксидов можно пренебречь.
Краткое изложение сущности изобретения
Объектом изобретения является способ для производства
арилалкилгидропероксидов селективным окислением арилалкилуглеводородов в соответствующие арилалкилгидропероксиды в высокой концентрации и при ограничении термического разложения получающихся
гидропероксидов кислородсодержащими газами, используя определенный комплекс переходного металла как катализатор.
Изобретение представляет способ для получения арилалкилгидропероксидов,
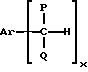
который включает селективное окисление арилалкилуглеводородов, имеющих формулу (I):
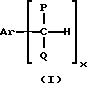
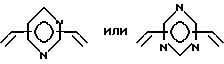
где P и Q являются алкилом и могут быть одинаковы или отличны друг от друга; X является целым числом от 1 до 3: и Ar является ароматической углеводородной группой, имеющей валентность X, кислородсодержащим газом в присутствии комплекса переходного металла как катализатора, который содержит в качестве лиганда циклическое полифункциональное аминосоединение, имеющее по крайней мере три атома азота в кольце, образующем молекулярную цепь, или с открытой цепью полифункциональное аминосоединение, имеющее по крайней мере три атома азота в главной цепи молекулы, при условии, что комплекс переходного металла не является комплексом порфирина или фталоцианина.
Описание предпочтительных воплощений
1. Исходные арилалкилуглеводороды.
Арилалкилуглеводород (I),
использованный как исходный материал в способе изобретения, имеет формулу (I):
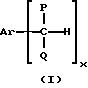
где P и Q являются алкилом и могут быть одинаковы или отличны друг от друга; X является целым числом от 1 до 3; и Ar является ароматической углеводородной группой, имеющей валентность X.
Необходимо, чтобы арилалкилуглеводород имел по крайней мере один альфа-водород в молекуле, и в особенности предпочтительно, чтобы арилалкилуглеводород имел водород, связанный с третичным атомом углерода. Алкил предпочтительно является метилом. В свою очередь, ароматическая группа, имеющая валентность X, такая, что ее выбирают из бензола, нафталина, бифенила или дифенилэфира, предпочитая первые два.
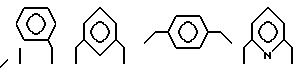
Предпочтительные примеры арилалкилуглеводородов включают, например, диизопропилбензолы, такие как кумол, цимол, m-диизопропилбензол или p-диизопропилбензол, триизопропилбензолы, такие как 1,3,5-триизопропилбензол, этилбензол, вторичный бутилбензол, вторичный бутилэтилбензол, изопропилнафталины, диизопропилнафталины, такие как 2,6-диизопропилнафталины, изопропилбифенилы, диизопропилбифенилы, такие как 4,4'-диизопропилбифенилы. Эти арилалкилуглеводороды только иллюстративны, и изобретение необязательно ограничивается этими примерами арилалкилуглеводородов.
В соответствии с изобретением, арилалкилуглеводород селективно окисляется в соответствующий арилалкилгидропероксид кислородсодержащим газом в присутствии катализатора на основе переходного металла, который содержит в качестве лиганда циклическое полифункциональное аминосоединение, имеющее по крайней мере три атома азота в кольце, образующем молекулярную цепь, или открытую цепь полифункционального аминосоединения, имеющего по крайней мере три атома азота в главной цепи молекулы.
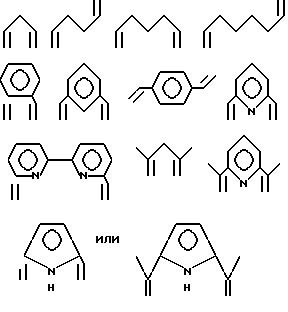
В нижеследующих формулах, которые показывают предпочтительные примеры комплексов переходных металлов, использованных в настоящем изобретении, формулы в скобках означают полифункциональные аминосоединения, т.е. лиганды.
2. Комплексные катализаторы, содержащие циклические полифункциональные аминосоединения в качестве лигандов.
Сначала, катализатор на основе комплекса переходного металла, включающий в качестве лиганда циклическое полифункциональное аминосоединение, будет описан.
Первый катализатор на основе комплекса переходного металла, использованный в изобретении, является
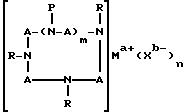
электрически нейтральным комплексом и имеет формулу (II):
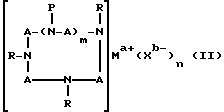
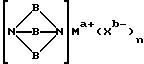
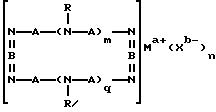
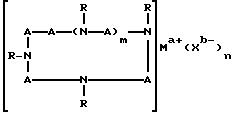
где A означает независимо алкилен, имеющий 1-6 углеродов в главной цепи группы, фенилен, нафтилен (нафталиндиил), фенантрилен (фенантрендиил), пиридиндиил, пирролдиил, пиразиндиил, пиримидиндиил или 1,3,5-триазиндиил и может содержать неактивные заместители; R означает независимо водород, алкил, арил, алкиларил или арилалкил, и алкил, арил, алкиларил или арилалкил могут содержать неактивные заместители; M означает центральный ион переходного металла, имеющий валентность +а; X является противоионом, имеющим валентность -b, которая устойчива при окислении; а означает целое число 1-4, b означает положительное целое число, n означает 1 - 4, n равно a/b и m означает 0 или положительное целое число 1 или больше.
Вообще катализатор на основе комплекса переходного металла может изменять степень окисления центрального иона металла в течение окисления арилалкилуглеводорода. Например, степень окисления центрального иона металла может увеличиваться. В таком случае анион, присутствующий в реакционной среде, будет образовывать противоион, соответствующий увеличению степени окисления центрального иона металла.
В вышеупомянутой формуле (II), A независимо является алкиленом, имеющим 1-6 углеродов в главной цепи группы, фениленом, нафтиленом, фенантриленом, пиридиндиилом, пирролдиилом, пиразиндиилом, пиримидиндиилом или 1,3,5-триазиндиилом. Примером алкилена может быть этилен, триметилен, тетраметилен, пентаметилен или гексаметилен, причем этилен наиболее предпочителен.
Группы, представленные A, могут содержать неактивные заместители, такие как алкил, алкоксил, арил, алкиларил, арилалкил, этинилен, эфирную группу, циано, амино, амидо, сульфамид, карбоксил, карбоксилат, гидроксил или сложноэфирную группу.
R независимо означает водород, алкил, арил, алкиларил или арилалкил, а алкил, арил, алкиларил или арилалкил могут при этом содержать неактивные заместители, как упомянутые здесь раньше.
Алкил предпочтительно имеет 1-25 углеродов, и может быть, например, метилом, этилом, пропилом, бутилом, пентилом, гексилом, октилом, децилом, ундецилом, додецилом или тридецилом. Примерами арила могут быть фенил или нафтил. Алкиларил может быть представлен, например, толилом, тогда как арилалкил, например, бензилом.
Неактивные заместители, которые R может содержать, представляют, в частности, гидроксилалкил, такой как гидроксиэтил, гидроксипропил или гидроксибутил, алкоксиалкил, такой как метоксиэтил, метоксипропил, метоксибутил или метоксипентил, сложноэфирную группу, содержащую алкил, такую как карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, ацетат, пропионат или бутират, цианоалкил, такой как цианометил, цианоэтил, цианопропил или цианобутил, аминоалкил такой как аминоэтил, аминопропил, аминобутил или аминопентил, амидогруппу, содержащую алкил, такую как ацетиламинометил, ацетиламиноэтил, ацетиламинопропил, бензоиламинометил или бензоиламинопропил, или сульфамидную группу, содержащую алкил, такую как метилсульфаминоэтил, метилсульфаминопропил, метилсульфаминобутил, фенилсульфаминоэтил, фенилсульфаминобутил, толилсульфаминоэтил или толилсульфаминопропил.
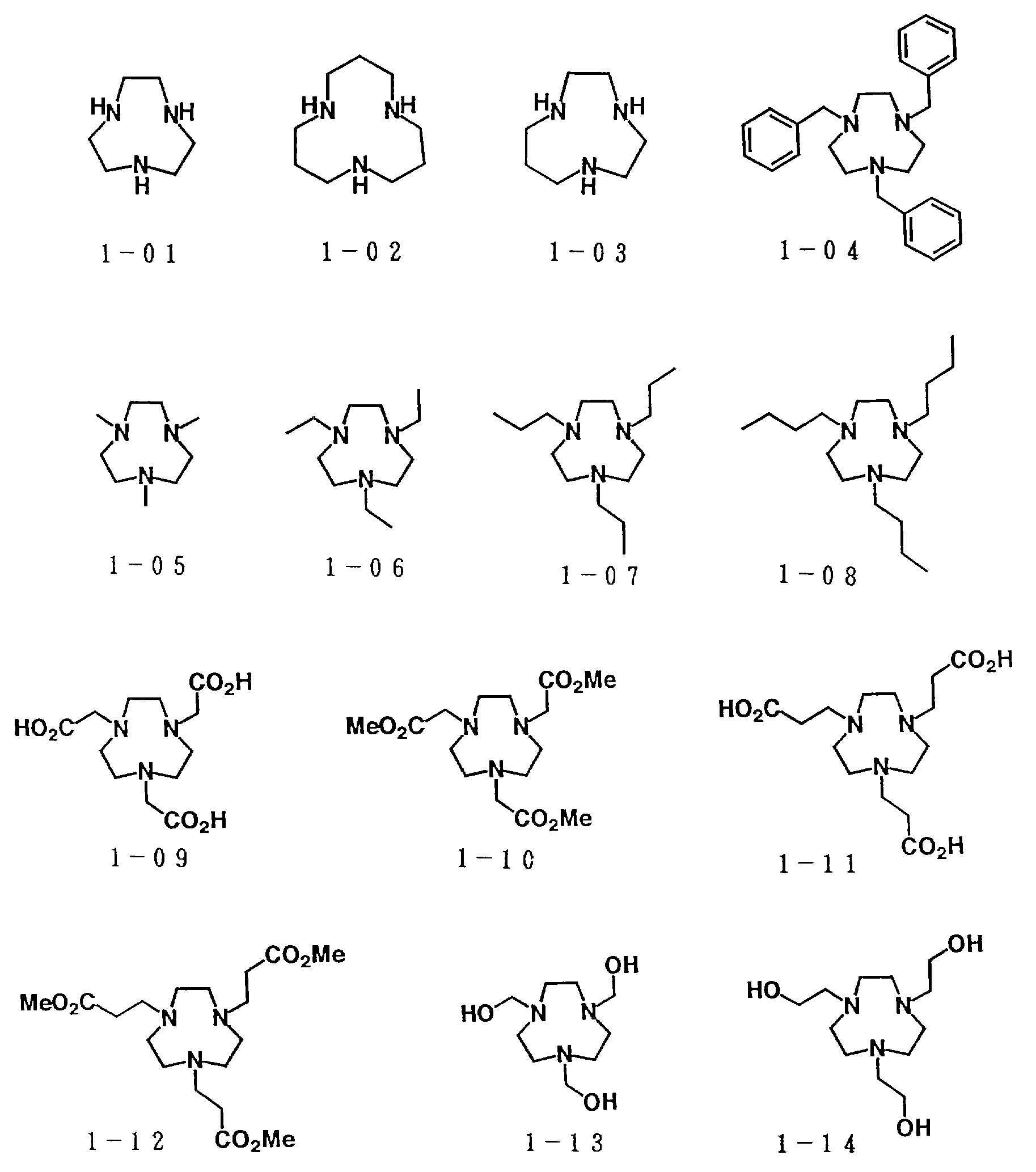
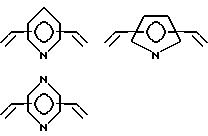
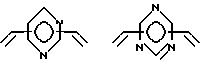
Особенно предпочтительно, чтобы циклическое полифункциональное аминосоединение, которое имеет три атома азота в кольце, образующем молекулярную цепь (триазакраун), и которое образует лиганд в первом комплексе переходного металла, имело формулу (II), в которой A является этиленовой группой.
Предпочтительными примерами таких триазакраунов являются соединения от 1-01 до 1-18. (см. соединения от 1 - 01 до 1 - 18 в конце описания).
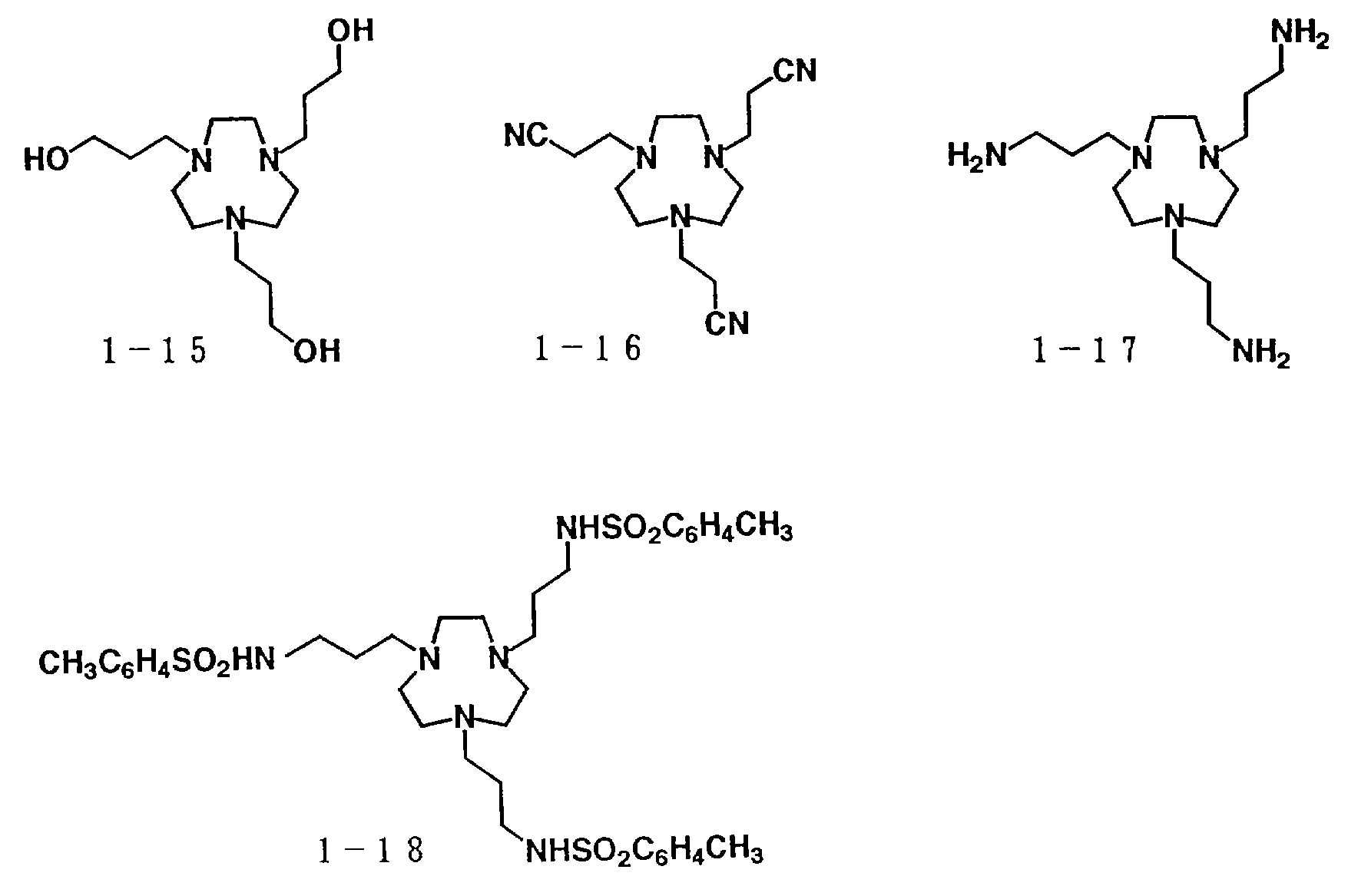
В свою очередь, наиболее предпочтительно, чтобы циклическое полифункциональное аминосоединение, которое имеет четыре атома азота или более в кольце, образующем молекулярную цепь, и которое образует лиганд в первом комплексе переходного металла, имело формулу (II), в которой A является этиленом, триметиленом, 2,6- пиридиндиильной, 2,5-пирролдиильной или 2,2'-бипиридил-6,6'- диильной группой, и m является целым числом 1-4.
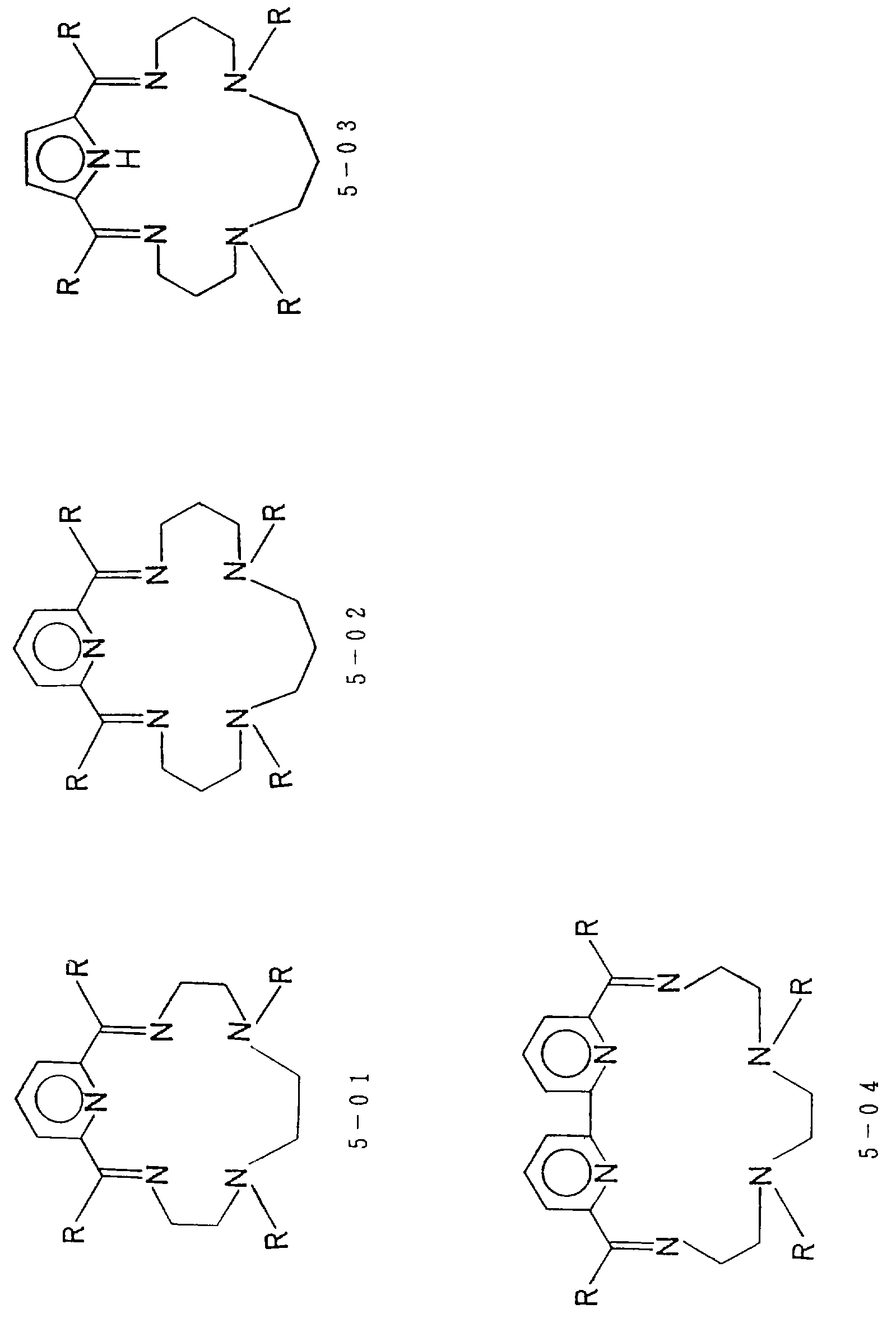
Предпочтительными примерами таких циклических полифункциональных аминосоединений являются от 2-01 до 2-16, (см. соединения от 2 - 01 до 2 - 16 в конце описания), где R является алкилом с 1-8 углеродами, арилом с 6-14 углеродами, таким как фенил, арилалкилом с 7-14 углеродами, таким как бензил, или алкиларилом с 7-14 углеродами, таким как толил.
Второй катализатор на основе комплекса переходного
металла, использованный в настоящем изобретении, имеет формулу (III):
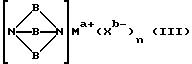
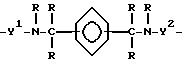
где B является дивалентной органической группой, имеющей формулу (IV):
или
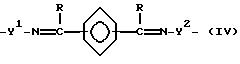
где Y1 и Y2 независимо являются алкиленом, имеющим 1-6 углеродов в главной цепи группы, или фениленом, и могут содержать неактивные заместители, R независимо означает водород, алкил, арил, алкиларил или арилалкил, и алкил, арил, алкиларил или арилалкил могут содержать неактивные заместители,
M означает центральный ион переходного металла, имеющий валентность +а; X является противоионом, имеющим валентность -b, которая устойчива при окислении; а означает целое число 1-4, b означает положительное целое число, n означает 1-4, n равно a/b.
Особенно предпочтительно, чтобы Y1 и Y2 являлись этиленом или триметиленом, и R - водородом.
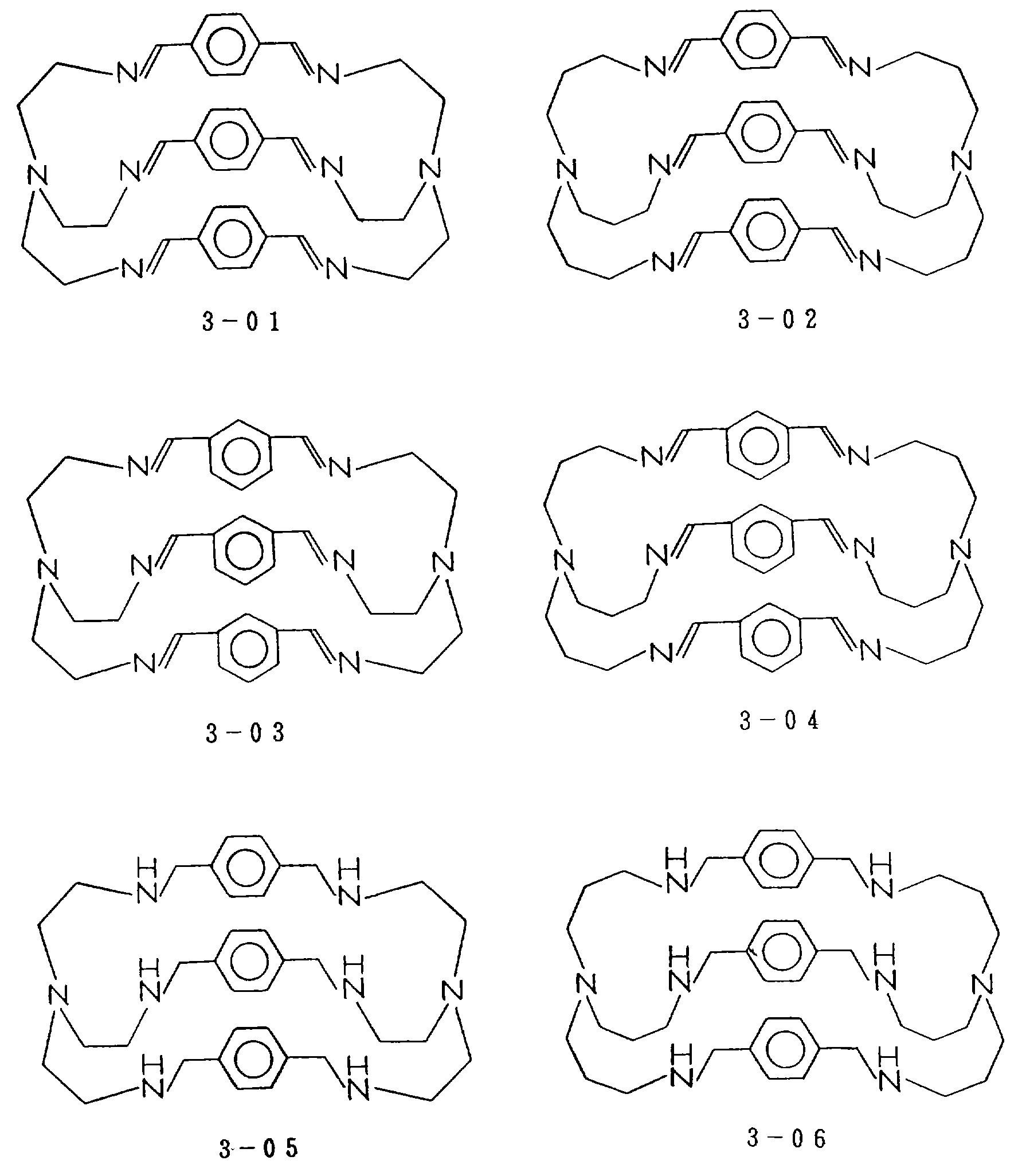
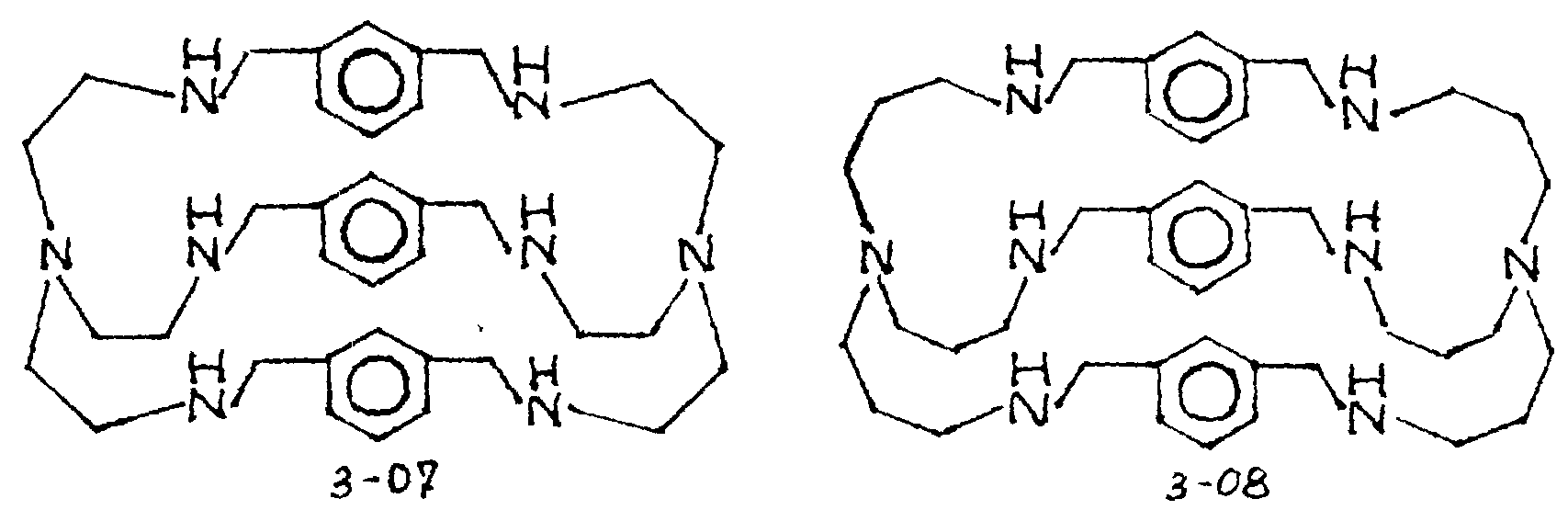
Соответственно, предпочтительными примерами циклических полифункциональных аминосоединений, которые образуют лиганд во втором комплексе переходного металла (III) являются соединения от 3-01 до 3-08 (см. соединения от 3-01 до 3-08 в конце описания).
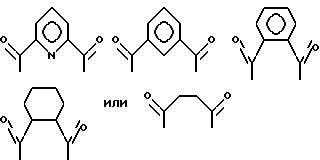
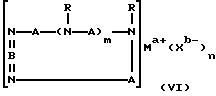
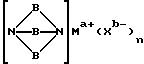
Третий катализатор на основе комплекса переходного металла, использованный в изобретении, имеет формулу (VI):
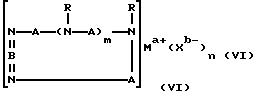
где A независимо является алкиленом, имеющим 1-6 углеродов в главной цепи группы, фениленом, нафтиленом, фенантриленом, пиридиндиилом, пирролдиилом, пиразиндиилом, пиримидиндиилом или 1,3,5-триазиндиилом, и может содержать неактивные заместители; B является бис(алкилиденом), имеющим 2-10 углеродов в главной цепи группы,
и может содержать неактивные заместители; R является независимо водородом, алкилом, арилом, алкиларилом или арилалкилом, и алкил, арил, алкиларил или арилалкил могут содержать неактивные заместители; M означает центральный ион переходного металла, имеющий валентность +a; X является противоионом, имеющим валентность -b, которая устойчива при окислении; а означает целое число 1-4, b означает положительное целое число, n означает 1-4, n равно a/b и m означает 0 или положительное целое число 1 или больше.
Предпочтительные примеры бис(алкилиденовой) группы следующие:
Предпочтительные примеры, кроме того, бис(алкилиденовых)групп, которые содержат в себе гетероароматические кольца, являются следующие:
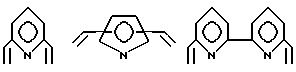
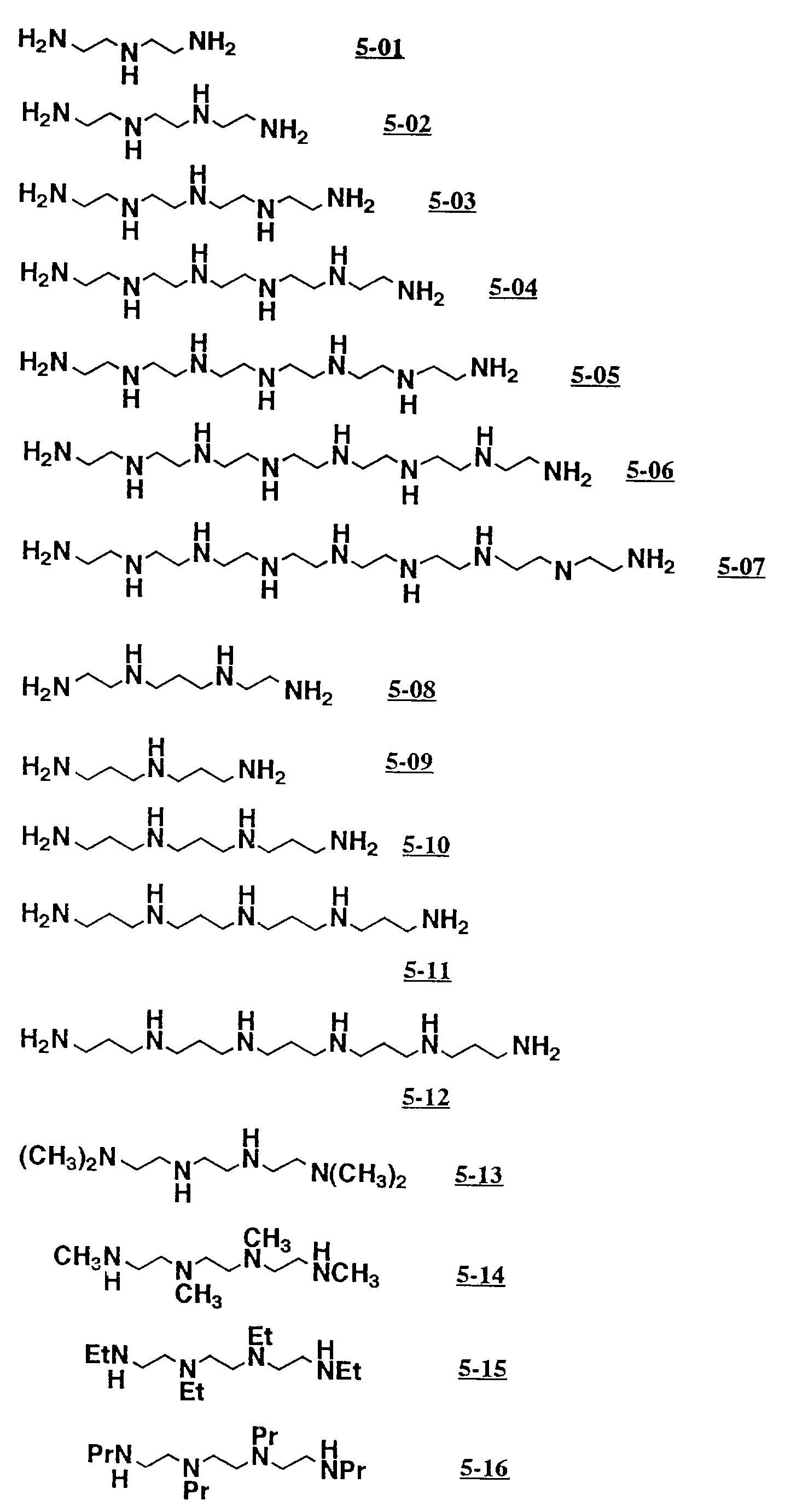
Соответственно, предпочтительные примеры циклических полифункциональных аминосоединений представлены соединениями от 5-01 до 5-04 (см. соединение от 5-01 до 5-04 в конце описания), где R является алкилом с 1-8 углеродами, арилом с 6-14 углеродами, таким как фенил, арилалкилом с 7-14 углеродами, таким как бензил, или алкиларилом с 7-14 углеродами, таким как толил.
Четвертый катализатор на основе комплекса переходного металла, используемый в изобретении, имеет формулу (VII):
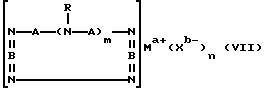
где A независимо является алкиленом, имеющим 1-6 углеродов в главной цепи группы, фениленом, нафтиленом, фенантриленом, пиридиндиилом, пирролдиилом, пиразиндиилом, пиримидиндиилом; B является бис(алкилиденом), имеющим 2-10 углеродов в главной цепи группы,
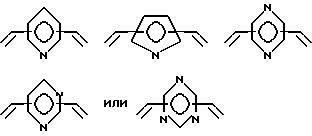
и может содержать неактивные заместители; R независимо означает водород, алкил, арил, алкиларил или арилалкил, и алкил, арил, алкиларил или арилалкил могут содержать неактивные заместители, M означает центральный ион переходного металла, имеющий валентность +a; X является противоионом, имеющим валентность -b, которая устойчива при окислении; а означает целое число 1-4, b означает положительное целое число, n означает 1 - 4, n равно a/b и m означает 0 или положительное целое число 1 или больше.
Предпочтительные примеры бис(алкилиденовой) группы могут быть такими же, как вышеупомянутые здесь в связи с четвертым комплексом переходного металла.
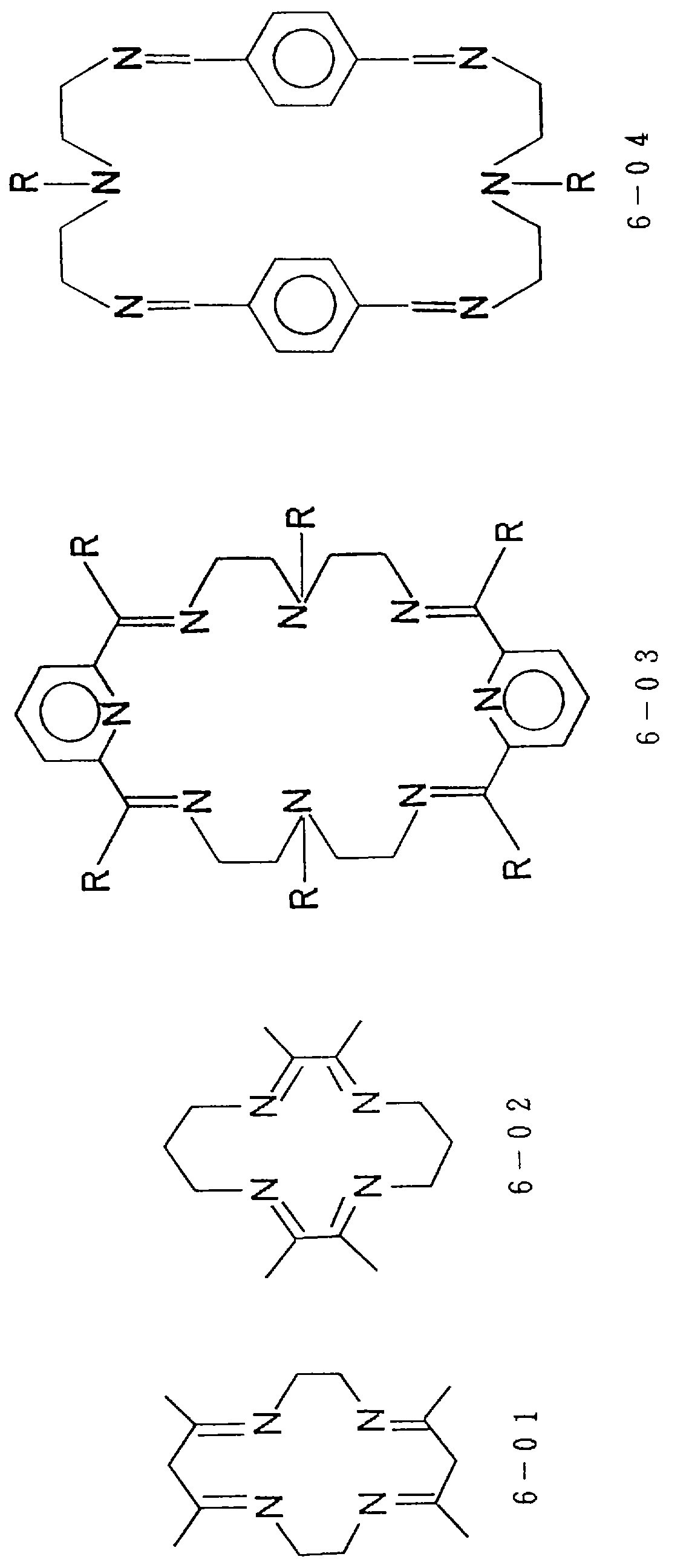
Предпочтительные примеры циклических полифункциональных аминосоединений представлены соединениями от 6-01 до 6-04 (см. соединения от 6-01 до 6-04 в конце описания), где R является алкилом с 1-8 углеродами, арилом с 6-14 углеродами, таким как фенил, арилалкилом с 7-14 углеродами, таким как бензил, или алкиларилом с 7-14 углеродами, таким как толил.
В любой из формул комплексов переходных металлов, которые содержат как лиганд циклическое полифункциональное аминосоединение, как указано выше, M является центральным ионом переходного металла, имеющим валентность +a, где а является целым числом 1-4. Предпочтительные примеры переходного металла - железо, никель, марганец, кобальт, медь, рутений, родий, среди которых железо, никель, марганец, кобальт, медь или рутений особенно предпочтительны.
X является противоионом, имеющим валентность -b, которая стабильна при окислении, где b является положительным целым числом.
Предпочтительными примерами противоиона являются, например, галогенидионы, такие как хлорид-ион или бромид-ион, SO4- (сульфат ион), NO3-, BF4

В формулах а является целым числом 1-4, b является положительным целым числом, n является целым числом 1-4, n равно a/b, и m и q, если есть, являются 0 или положительным целым числом 1 или больше, предпочтительно 0, 1, 2 или 3.
Согласно изобретению первый комплекс переходного металла особенно предпочтителен. Здесь могут быть упомянуты как предпочтительные примеры, в которых лиганд или циклическое соединение полифункциональное аминосоединение являются триазакрауном, например, (1,4, 7-триазанонан)марганец (II) сульфат, (N, N', N''- трибутил-1,4,7-триазанонан)марганец (II) сульфат, (N,N',N''- трибензил-1,4,7-триазанонан)марганец (II) сульфат, (N,N',N''- трис(3-гидроксипропил)-1,4, 7-триазанонан)марганец (II) сульфат или (N, N', N''-трис(калия пропионат)-1,4,7-триазанонан)марганец (II) сульфат.
Здесь могут быть упомянуты как предпочтительные примеры, в которых
лиганд или циклическое полифункциональное аминосоединение имеет четыре атома азота или более в кольце, образующем молекулярную цепь, например,
(1,4,8,11-тетраазациклотетрадекан)марганец (II)
сульфат,
(1,4,8,11-тетраазациклотетрадекан)кобальт (III) хлорид,
(1,4,8,11-тетраазациклотетрадекан)медь (II) сульфат,
(1,4,8,11-тетраазациклотетрадекан)рутений (II) хлорид,
(1,4,8,11-тетраазациклотетрадекан)никель (II) сульфат,
(1,4,8,11-тетраазациклотетрадекан)марганец (II) бензоат,
(1,4,8,11-тетраазациклотетрадекан)кобальт (II) бензоат,
(1,4,8,12-тетраазациклопентадекан)марганец (II) сульфат,
[N, N', N'', N'''-тетракис(2-этоксикарбонилэтил)-(1,4,8,11- тетраазациклотетрадекан)]кобальт (II) сульфат,
(1,4,8,
11-тетраазациклотетрадекан)марганец (II) стеарат,
(1,4,8,11-тетраазациклотетрадекан)кобальт (II) стеарат,
[N, N',N'',N'''-тетра-n бутил - (1,4,8,11-тетраазациклотетрадекан)] марганец
(II) сульфат.
Кроме того, примерами являются комплексы сульфата меди, комплексы бензоата меди, комплексы сульфата кобальта, комплексы ацетата кобальта или комплексы хлорида рутения с одним из циклических полифункциональных аминосоединений 3-01, 3-08, от 4-01 до 4-09, от 5-01 до 5-04 и от 6-01 до 6-03.
3. Комплексные катализаторы, содержащие полифункциональные аминосоединения с открытой цепью как лиганды.
Сейчас будут описаны катализаторы на основе комплексов переходных металлов, которые содержат в качестве лиганда полифункциональные аминосоединения с открытой цепью.
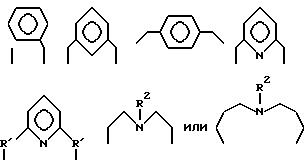
Первый катализатор на основе комплекса переходного металла имеет формулу (II):
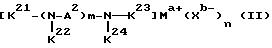
где A независимо является алкиленом, имеющим 1-6 углеродов в главной цепи группы, o-фениленом, m-фениленом, p-фениленом, 1,8-нафтиленом, 9,10-фенантриленом, 2, 6-пиридиндиилом, 3,6- акридиндиилом, 2,2'-бипиридил - 6,6'-диилом, 1,10- фенантролин-2,9-диилом, 2,6-пиримидиндиилом, 4,5- пиримидиндиилом, 2,6-пиразиндиилом, 2-фенил-1,3,5-триазин -2,6-диилом.
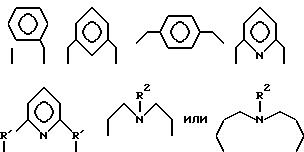
где R1 является алкиленом с 1-8 углеродами, и R2 является алкилом с 1-8 углеродами, арилом с 1-8 углеродами, арилалкилом с 7-14 углеродами или алкиларилом с 7-14 углеродами, и R1 и R2 могут содержать неактивные заместители; K21, K22, K23 и K24 независимо являются водородом, алкилом, арилом, алкиларилом, арилалкилом, пиридилом, пиридилалкилом или хинолилом, где алкил, арил, алкиларил, арилалкил, пиридил, пиридилалкил или хинолил могут содержать неактивные заместители; M означает центральный ион переходного металла, имеющий валентность +a; X является противоионом, имеющим валентность -b, которая устойчива при окислении; a означает целое число 1-4, b означает положительное целое число, n означает 1-4, n равно a/b и m является положительным целым числом 2 или больше.
В вышеупомянутой формуле (II) K21, K22, K23 и K24 независимо являются водородом, алкилом, арилом, арилалкилом, пиридилом, пиридилалкилом или хинолилом.
Алкил предпочтительно имеет 1-25 углеродов и может быть представлен метилом, этилом, пропилом, бутилом, пентилом, гексилом, октилом, децилом, ундецилом, додецилом или тридецилом. Арил может быть представлен фенилом иди нафтилом. Алкиларил может быть представлен, например, толилом, тогда как арилалкил, например, бензилом.
Пиридил может быть представлен, например, 2 - пиридилом, 3-пиридилом или 6-метил 2-пиридилом.
Пиридилалкил может быть представлен, например, 2 - пиридилметилом, 3-пиридилметилом, 2 - пиридилэтилом или 3- пиридилэтилом. Хинолил может быть 8-хинолилом.
Алкил, арил, алкиларил, арилалкил, пиридил, пиридилалкил или хинолил могут содержать неактивные заместители; такие как гидроксил, эфирная группа, сложноэфирная группа, циано, амино, амидо, сульфамид, карбоксил, или карбоксилат.
A2 является вышеупомянутой группой, и когда она означает алкилен из 1-6 углеродов, это может быть этилен, триметилен, тетраметилен, пентаметилен или гексаметилен.
A2 может также содержать неактивные заместители; такие как гидроксил, эфирная группа, сложноэфирная группа, циано, амино, амидо, сульфамид, карбоксил или карбоксилат.
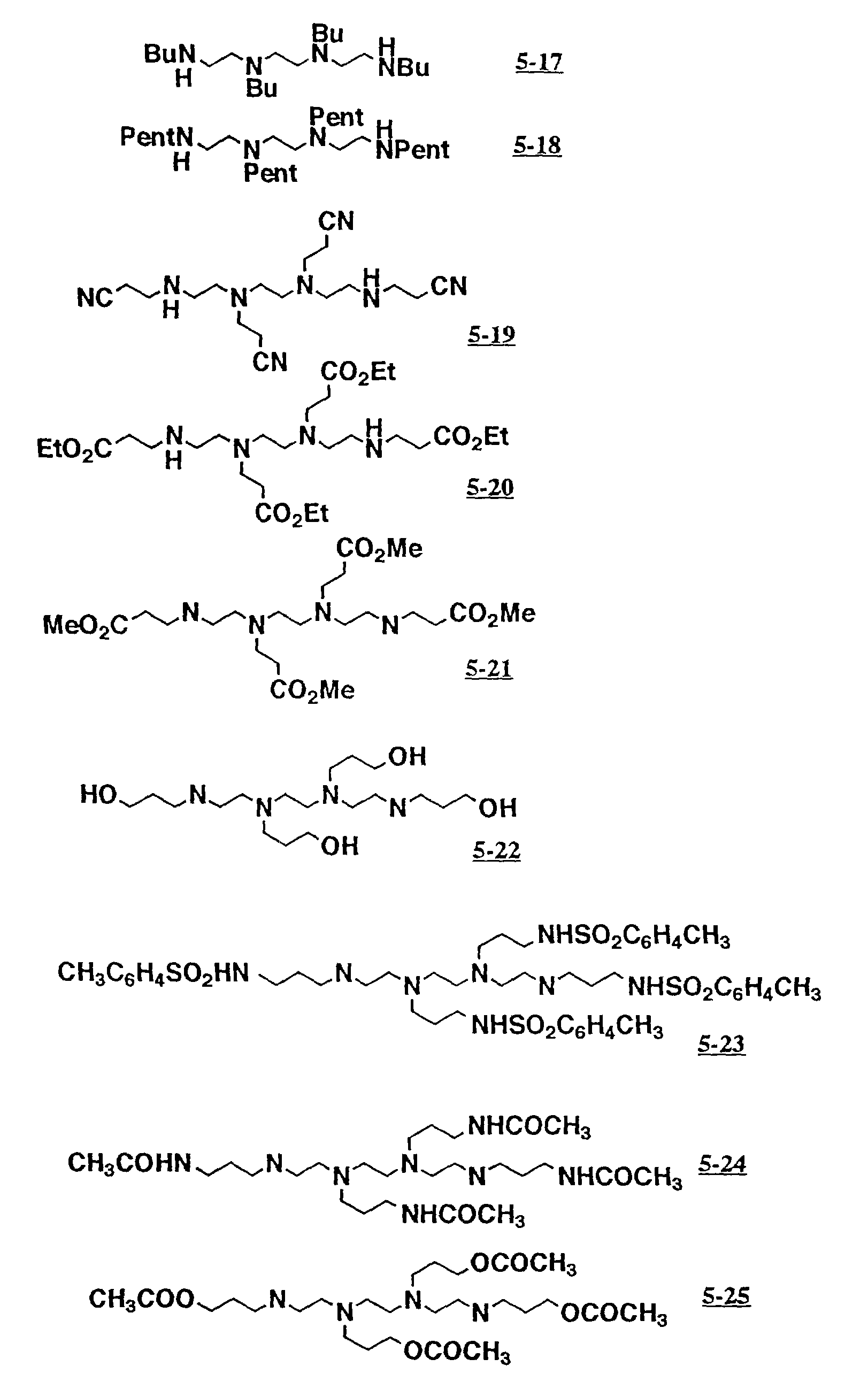
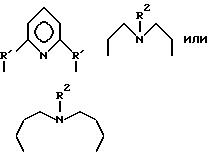
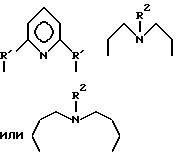
Предпочитаемыми примерами полифункциональных аминосоединений с открытой цепью, которые образуют лиганд в первом комплексе переходного металла (II) являются следующими соединениями от 5-01 до 5-25.
5-01:диэтилентриамин
5-02:триэтилентетрамин
5-03:тетраэтиленпентамин
5-04:гексаэтиленгептамин
5-05:гептаэтиленоктамин
5-07:октаэтиленнонамин
5-08:N,N'-бис(2-аминоэтил)-1,3-пропандиамин
5-09:N-(3-аминопропил)-1,3-пропандиамин
5-10:N,N'-бис(2-аминопропил)-1,3-пропандиамин
5-11:1,5,9,13,17-пентаазагептадекан
5-12:1,5,9,13,17,21-гексаазагенэйкозан
5-13:N,N,N',N'-тетраметилтриэтилентетрамин
5-14:N,N,N'',N''-тетраметилтриэтилентетрамин
5-15:N,N,N'',N''-тетраэтилтриэтилентетрамин
5-16:N,N,N'',N''-тетрапропилтриэтилентетрамин
5-17:N,N,N'',
N''-тетрабутилтриэтилентетрамин
5-18:N,N,N'',N''-тетрапентилтриэтилентетрамин
5-19:N,N,N'',N''-тетракис(2-цианоэтил)триэтилентетрамин
5-20:N,N,N'',
N''-тетракис(2-этоксикарбонилэтил)триэтилентетрамин
5-21:N,N',N'',N'''-тетракис(2-метоксикарбонилэтил)триэтилентетрамин
5-22:N,N',N'',
N'''-тетракис(3-гидроксипропил)триэтилентетрамин
5-23:N,N',N'',N'''-тетракис(3-тозиламиноэтил)триэтилентетрамин
5-24:N,N',N'',N'''-тетракис(3-ацетиламинопропил)-триэтилентетрамин
5-25:N,N',N'',N'''-тетракис(3-ацетоксипропил)триэтилентетрамин
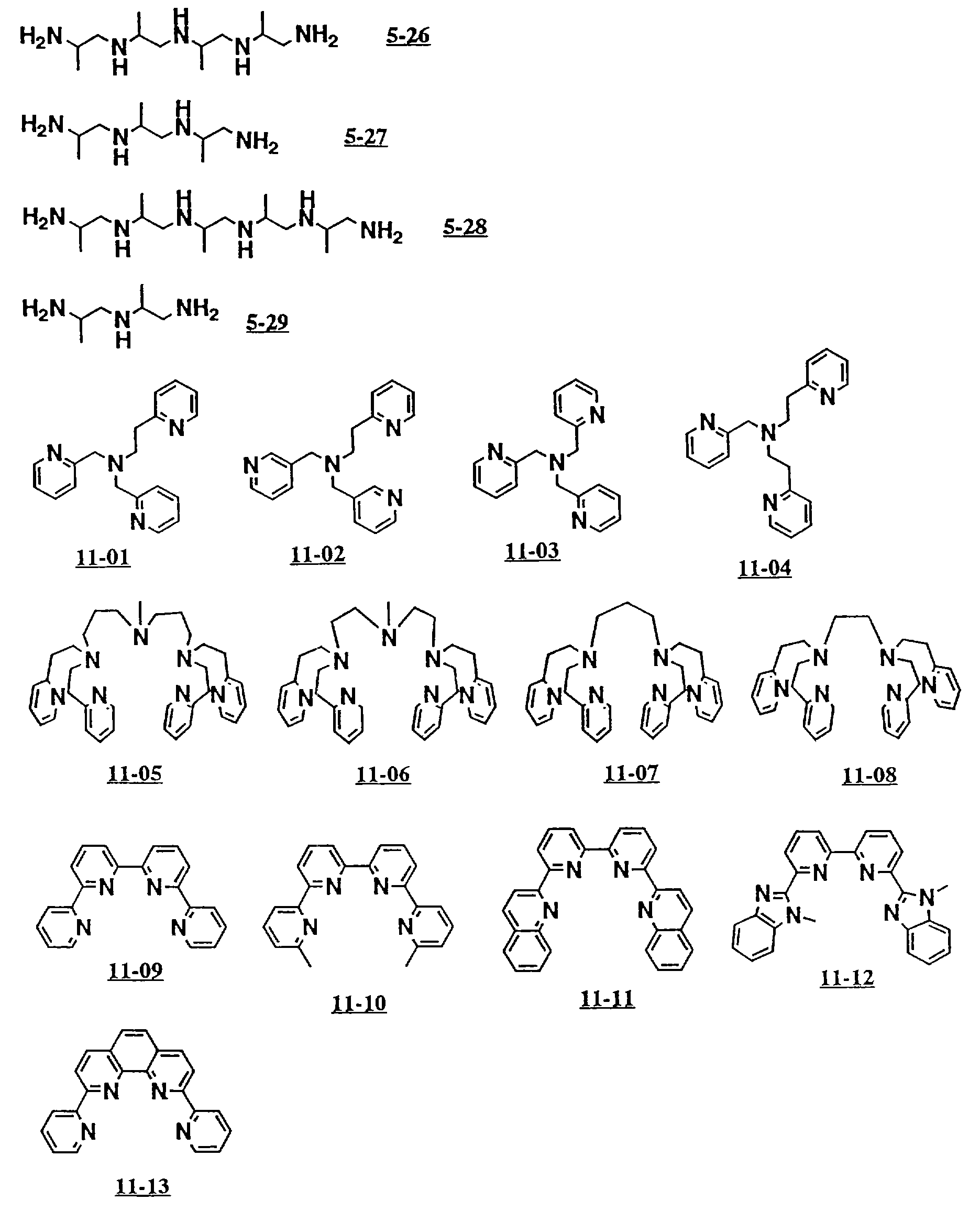
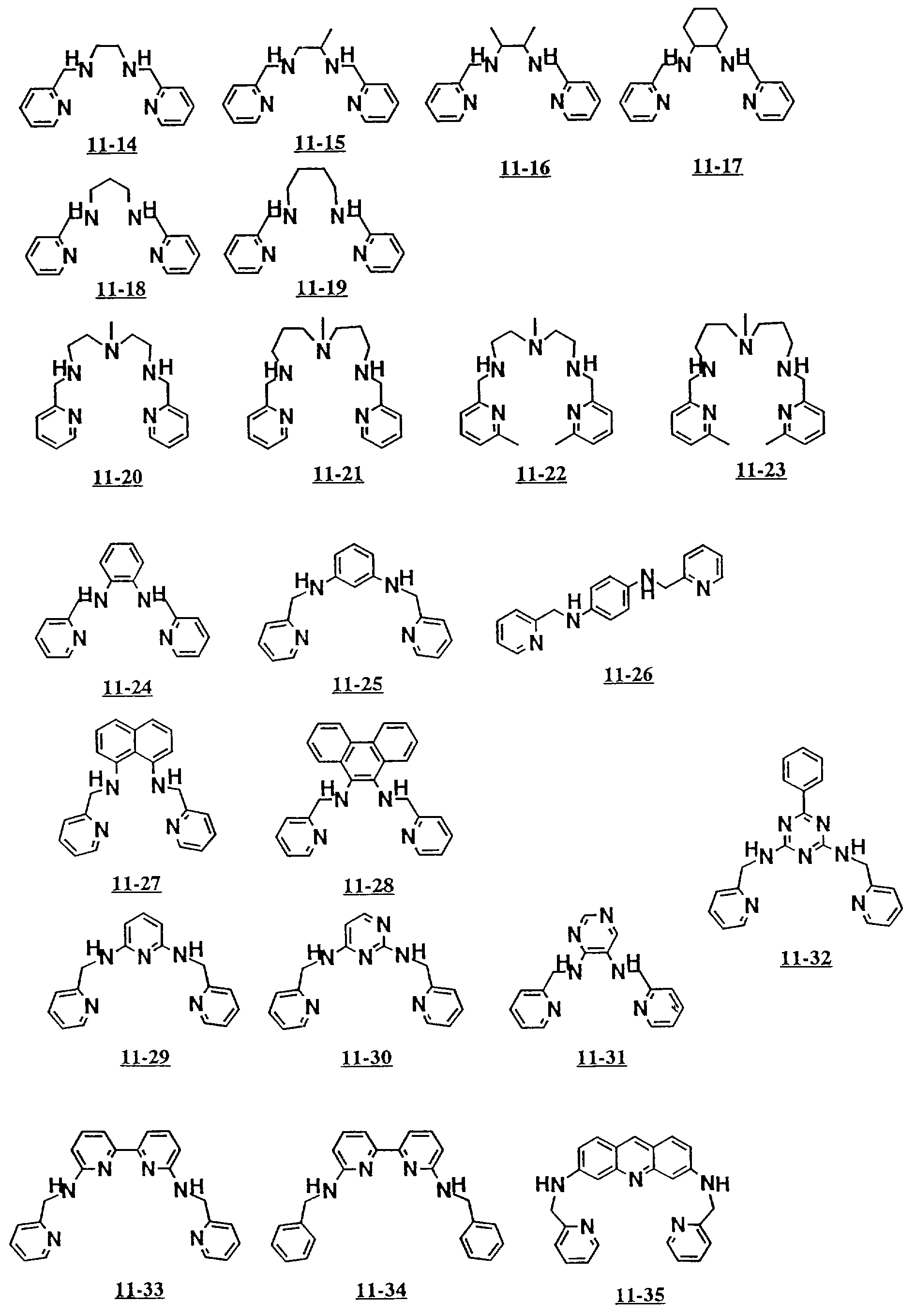
В дополнение к вышеуказанным соединениям от 5-01 до 5-25 здесь могут быть упомянуты примеры полифункциональных
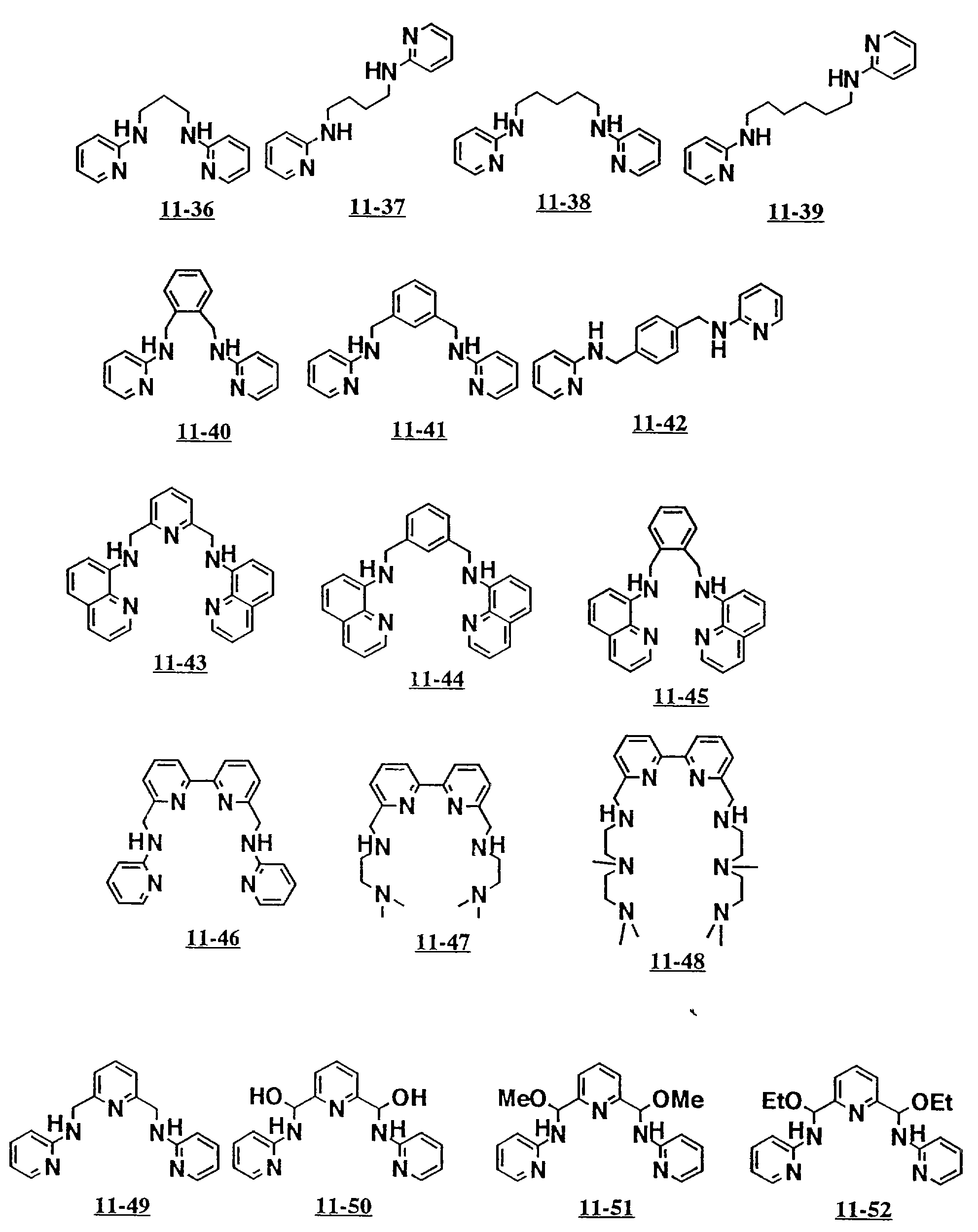
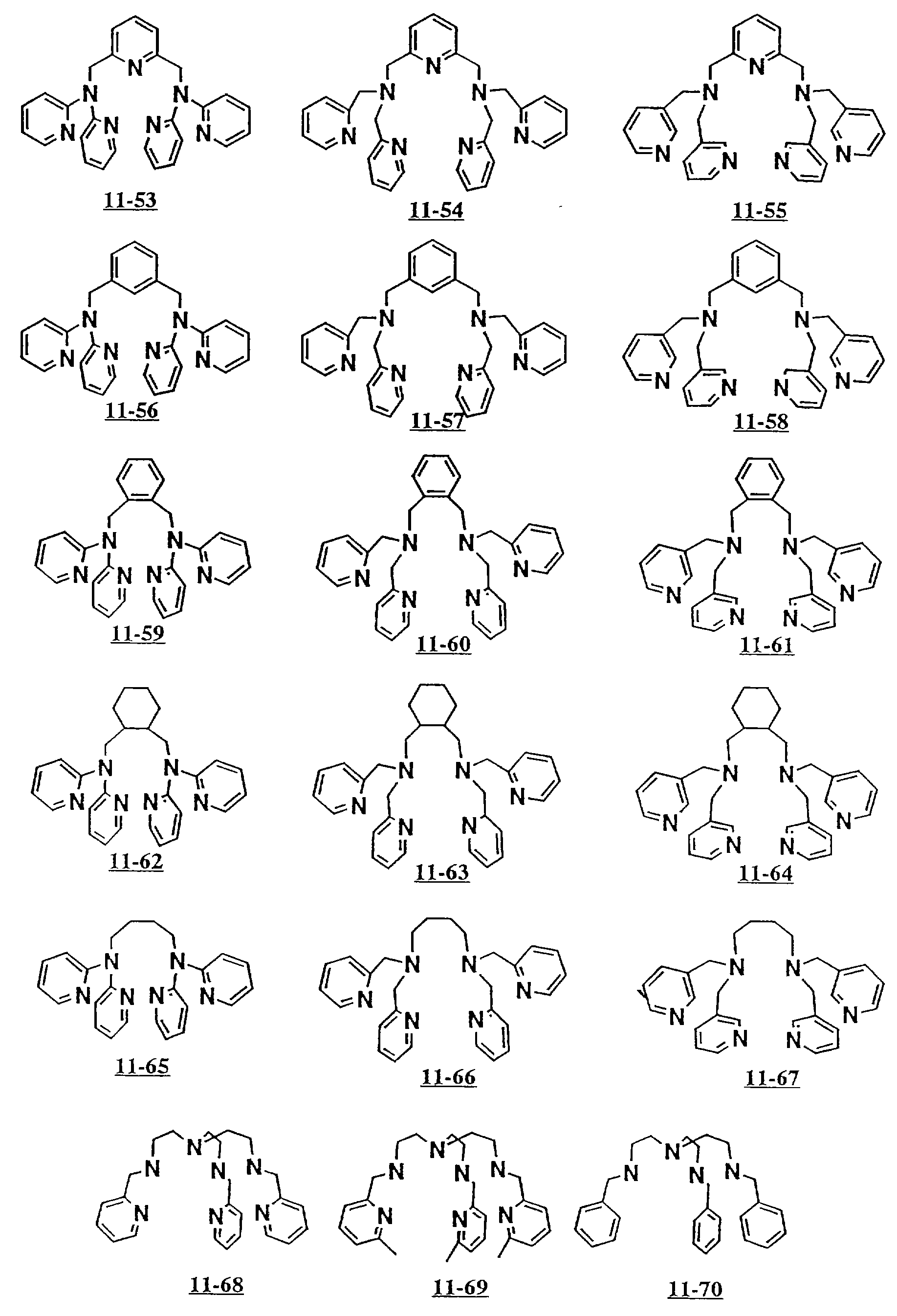
аминосоединений с открытой цепью от 5-26 до 5-29 и от 11-01 до 11- 70 (см. соединения от 5-26 до 5-29 и от 11-01 до 11-70 в конце описания).
Среди них наиболее предпочтительны аминосоединения, которые имеют формулу (II), где A2 является этиленом или триметиленом, и m 2 или 3.
Второй использованный катализатор на основе комплекса переходного
металла имеет формулу (III):
[K31=N-A3-N-K32]Ma+(Xb-)n
где A3 независимо является алкиленом, имеющим 1-6
углеродов в главной цепи группы, о-фениленом, т-фениленом, р-фениленом, 1,8-нафтиленом, 9,10-фенантриленом, 2,6- пиридиндиилом, 3,6-акридиндиилом, 2,2'-бипиридил-6,6'-диилом, 1,10-фенантролин-2,
9-диилом, 2,6-пиримидиндиилом, 4,5- пиримидиндиилом, 2,6-пиразиндиилом, 2-фенил-1,3,5-триазин-2,6- диилом,
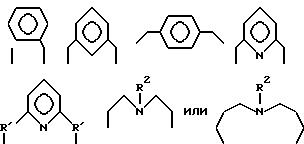
где R1 является алкиленом с 1-8 углеродами, и R2 является алкилом с 1-8 углеродами, арилом с 1-8 углеродами, арилалкилом с 7-14 углеродами или алкиларилом с 7-14 углеродами, и может содержать неактивные заместители; K31 и K32 являются 2-аминобензилиденом и могут содержать неактивные заместители; M означает центральный ион переходного металла, имеющий валентность +a; X является противоионом, имеющим валентность -b, которая устойчива при окислении; a означает целое число 1-4, b означает положительное целое число, n означает 1-4, n равно a/b.
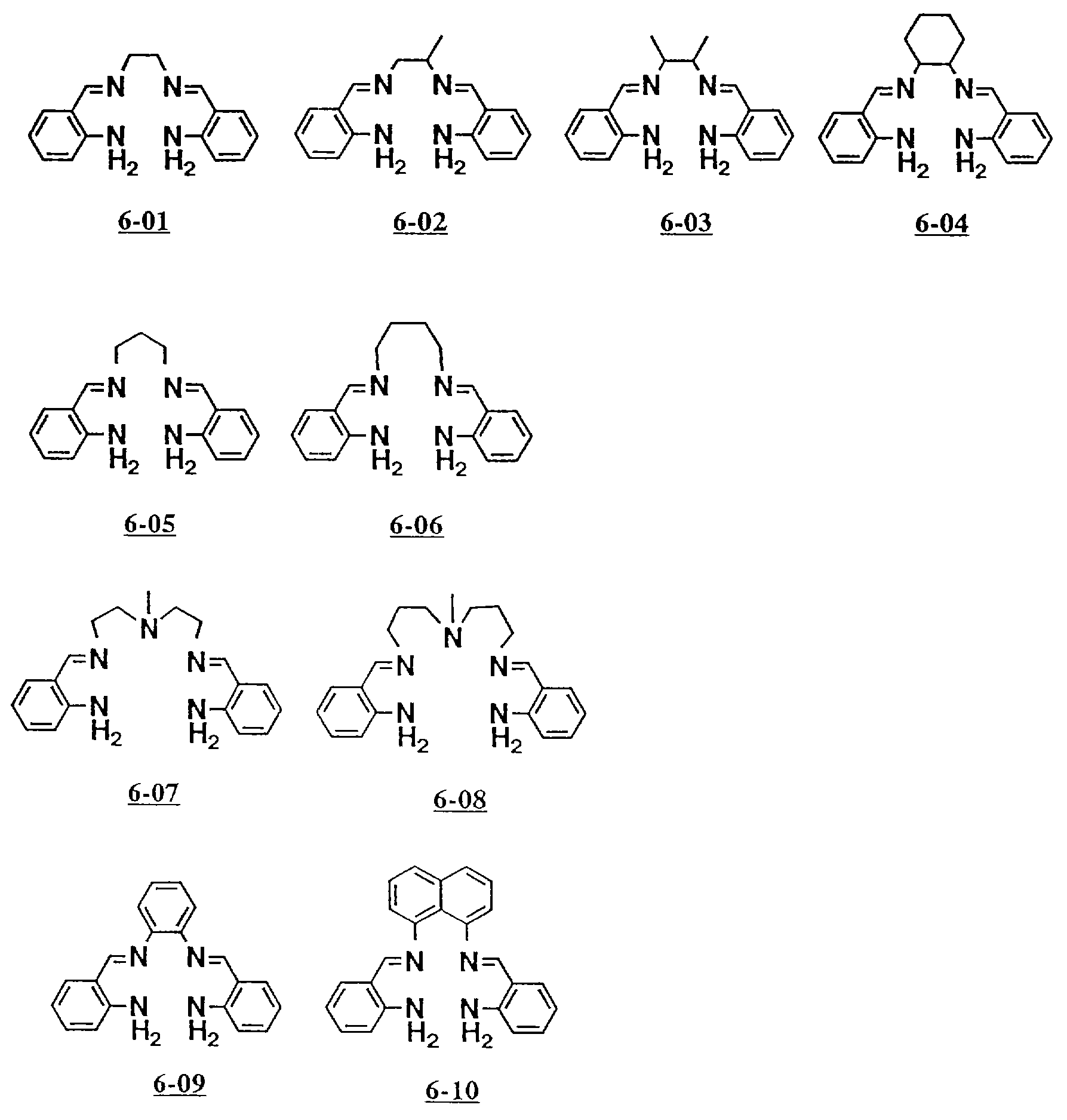
Предпочтительными примерами полифункционального аминосоединения с открытой цепью, который образует лиганд во втором комплексе переходного металла (III) являются соединения от 6-01 до 6-10 (см. соединения от 6-01 до 6-10 в конце описания).
Третий использованный катализатор на основе комплекса переходного металла имеет формулу (V):
[K41
=N-A4-N=K42]>Ma+(Xb-)n
где A4 независимо является алкиленом, имеющим 1-6 углеродов в главной цепи группы, о-фениленом,
т-фениленом, р-фениленом, 1,8-нафтиленом, 9,10-фенантриленом, 2,6-пиридиндиилом, 3,6-акридиндиилом, 2,2'-бипиpидил-6,6'-диилoм, 1,10-фенантролин- 2,9-диилом, 2,6-пиримидиндиилом, 4,5-пиpимидиндиидoм,
2,6- пиразиндиилом, 2-фeнил-1,3,5-тpиaзин-2,6-диилoм,
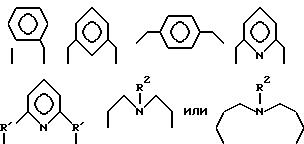
где R1 является алкиленом с 1-8 углеродами, R2 является алкилом с 1-8 углеродами, арилом с 1-8 углеродами, арилалкилом с 7-14 углеродами или алкиларилом с 7-14 углеродами, и может содержать неактивные заместители; K41 и K42 являются 2-пиридилметиленом или 6-метил-2-пиридилметиленом и могут содержать неактивные заместители; M означает центральный ион переходного металла, имеющий валентность +a; X является противоионом, имеющим валентность -b, которая устойчива при окислении; а означает целое число 1-4, b означает положительное целое число, n означает 1-4, n равно a/b.
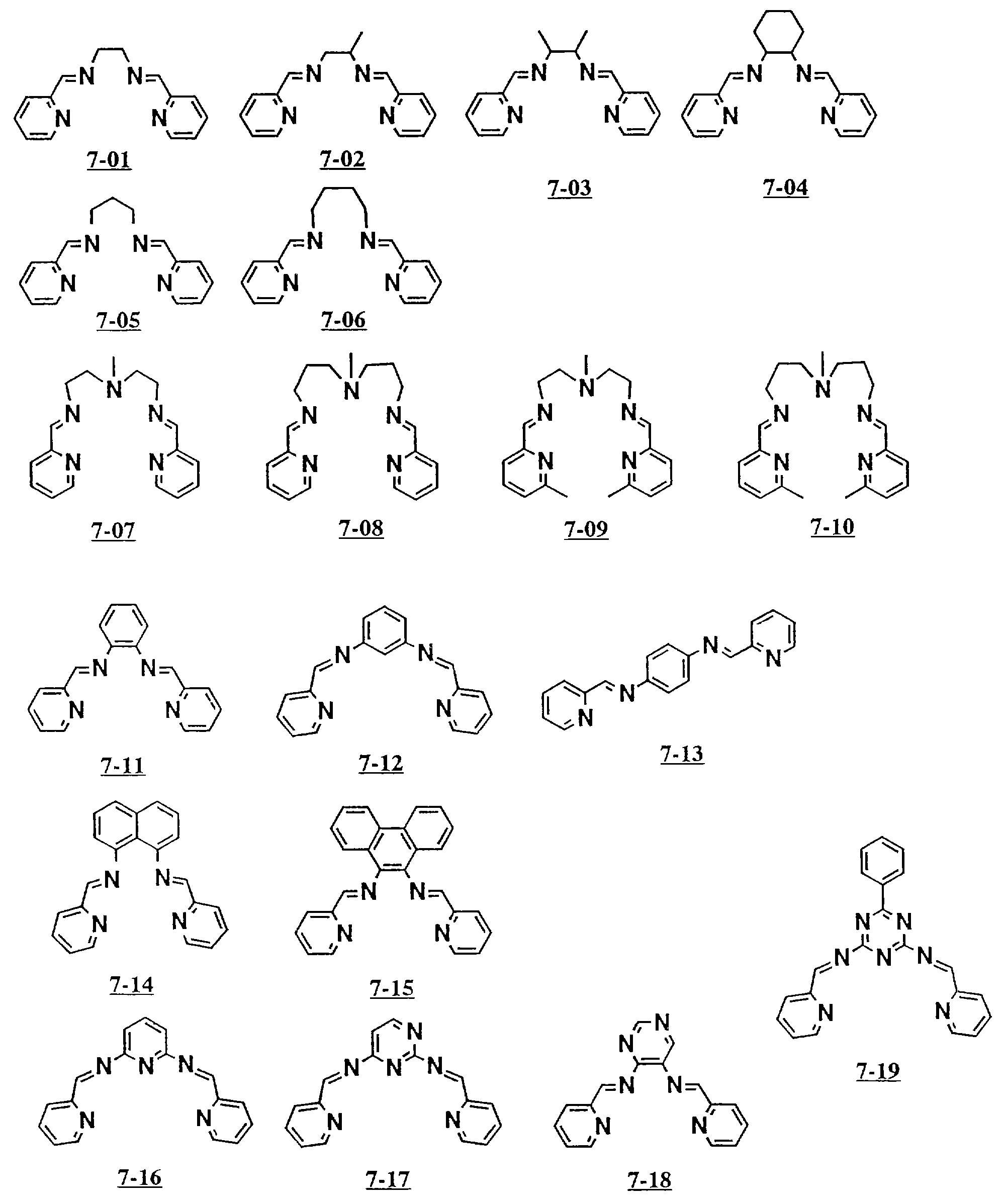
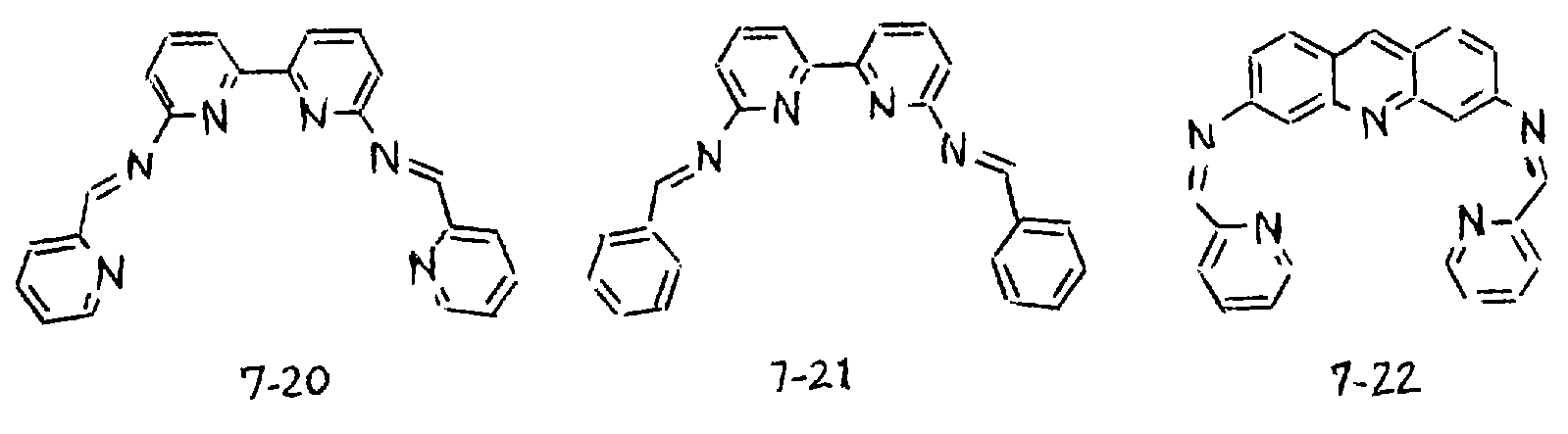
Предпочтительными примерами полифункционального аминосоединения с открытой цепью: который образует лиганд в третьем комплексе переходного металла (IV), являются соединения от 7-01 до 7-22 (см. соединения от 7-01 до 7-22 в конце описания).
Четвертый использованный катализатор на основе комплекса переходного металла имеет формулу (V):
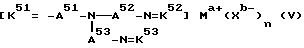
где с A51 по A53 являются независимо алкиленом, имеющим 1-6 углеродов в главной цепи группы и могут содержать неактивные заместители; с K51 по K53 являются бензилиденом, 2-пиридилметиленом или 6-метил-2-пиридилметиленом и могут содержать неактивные заместители; M означает центральный ион переходного металла, имеющий валентность +a; X является противоионом, имеющим валентность -b, которая устойчива при окислении; a означает целое число 1-4, b означает положительное целое число, n означает целое число 1-4, n равно a/b.
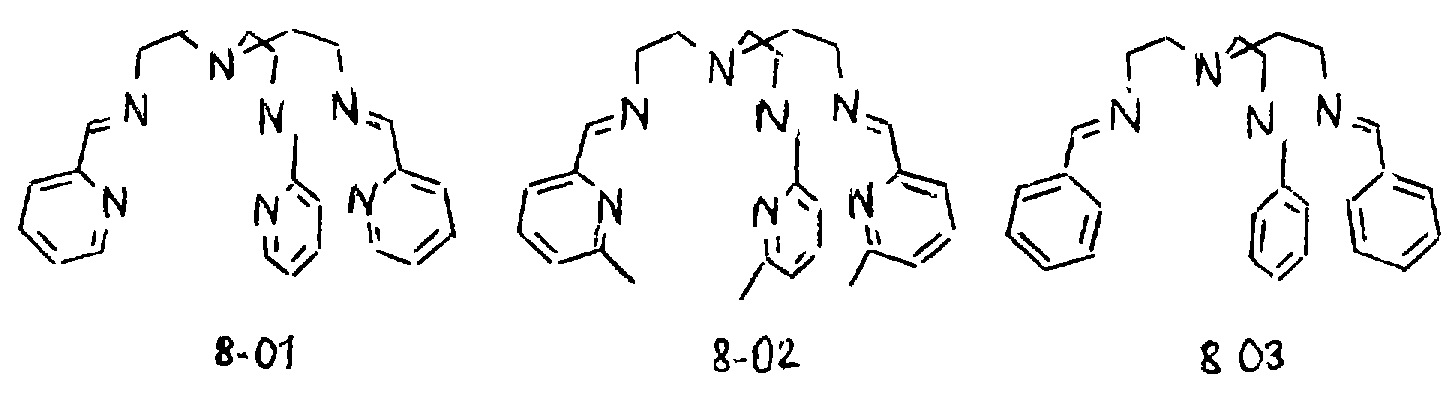
Предпочтительными примерами полифункционального аминосоединения с открытой цепью, которое образует лиганд в четвертом комплексе переходного металла (V), являются соединения от 8-01 до 8-03 (см. соединения от 8-01 до 8-03 в конце описания).
Пятый использованный катализатор на основе комплекса переходного металла имеет
формулу (VI):
[K61-N=A6=N-K62]Ma+(Xb-)n
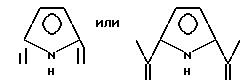
где A6 означает
и может содержать неактивные заместители; K61 и K62 являются 2-пиридилом, 3-пиридилом, 8-хинолилом или аминоалкилом, причем алкил имеет 2-4 углерода и может содержать неактивные заместители; M означает центральный ион переходного металла, имеющий валентность +a; X является противоионом, имеющим валентность -b, которая устойчива при окислении; a означает целое число 1-4, b означает положительное целое число, n означает целое число 1-4, n равно a/b.
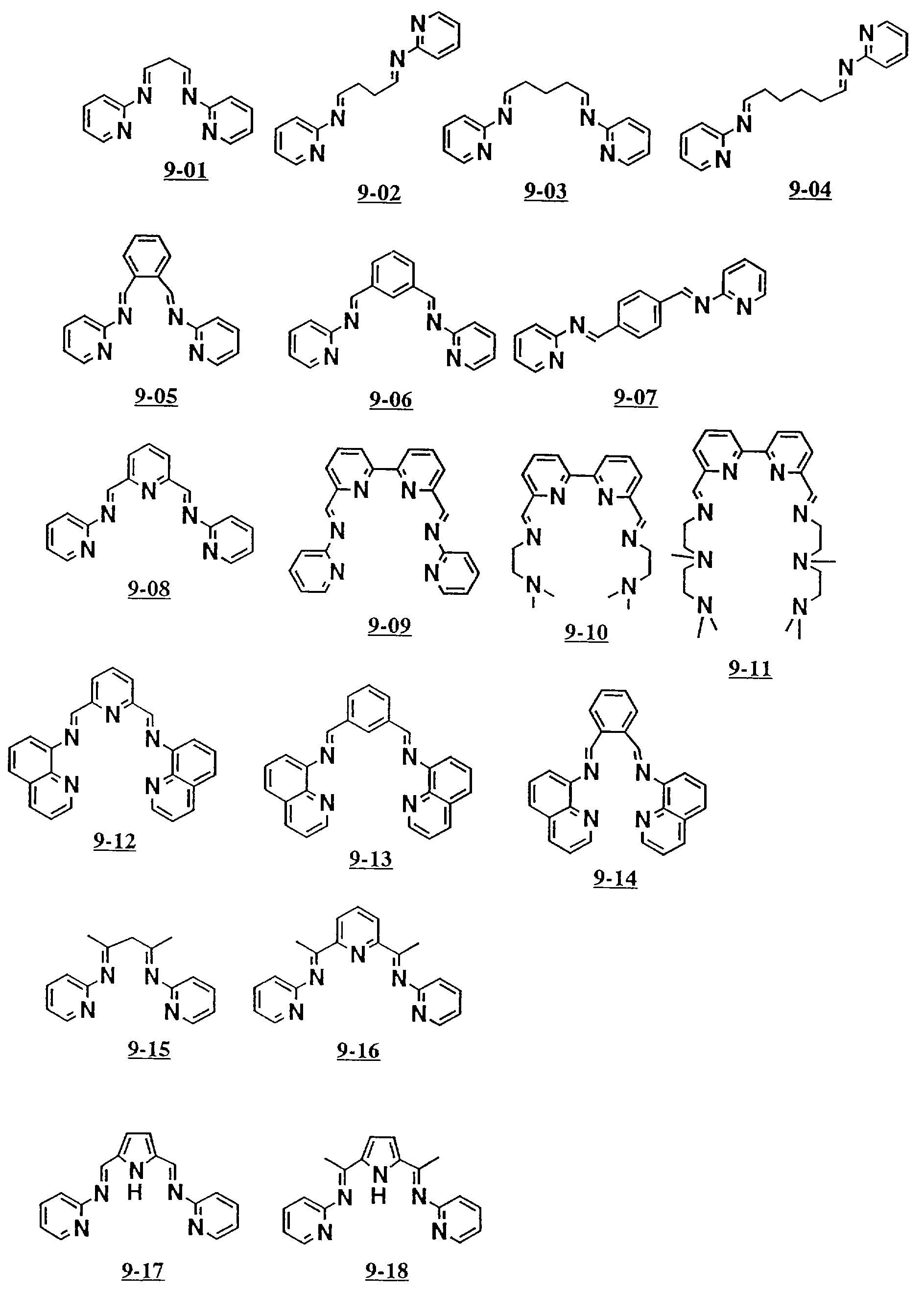
Предпочтительными примерами полифункционального аминосоединения с открытой цепью, которое образует лиганд в пятом комплексе переходного металла (VI), являются соединения с 9-01 по 9-18 (см. соединения с 9-01 по 9-18 в конце описания).
Шестой использованный катализатор на основе комплекса переходного металла имеет формулу (VII):
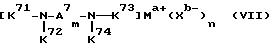
где A7 означает
и может содержать неактивные заместители; K71-K74 являются 2-пиридилом, 3-пиридилом, 2-пиpидилмeтилoм или 3-пиридилметилом и могут содержать неактивные заместители; M означает центральный ион переходного металла, имеющий валентность +a; X является противоионом, имеющим валентность -b, которая устойчива при окислении; a означает целое число 1-4, b означает положительное целое число, n означает целое число 1-4, n равно a/b.
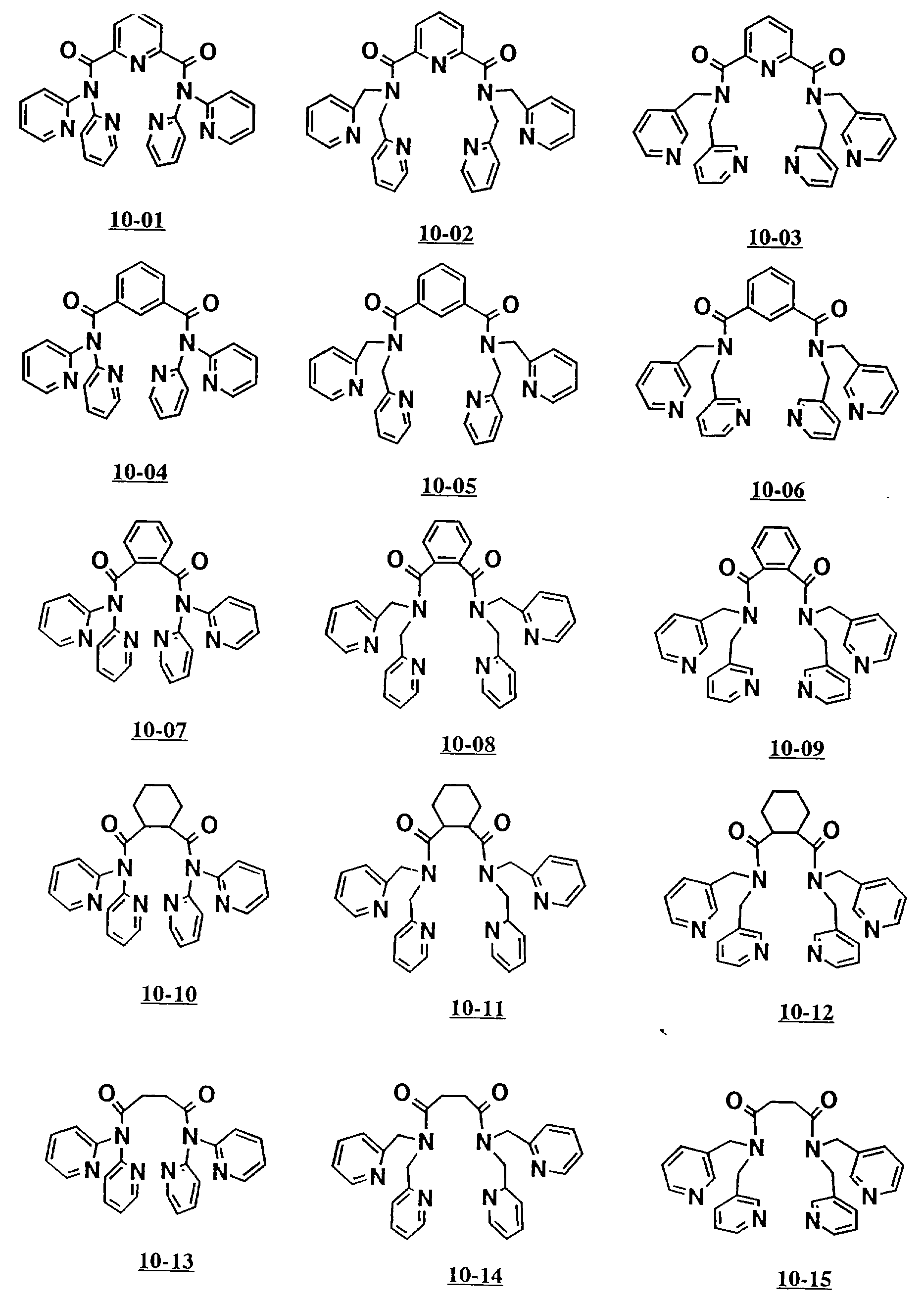
Предпочтительными примерами полифункционального аминосоединения с открытой цепью, которое образует лиганд в шестом комплексе переходного металла (VII), являются соединения с 10-01 по 10-15 (см. соединения с 10-01 по 10-15 в конце описания).
Седьмой использованный катализатор на основе комплекса переходного металла имеет формулу
(VIII):
[K81=N-A8-N=K82]Ma+(Xb-)n
где A8 независимо является алкиленом, имеющим 1-6 углеродов в главной
цепи группы, o-фениленом, m-фениленом, p-фениленом, 1,8-нафтиленом, 9,10-фенантриленом, 2,6- пиридиндиилом, 3,6-акридиндиилом, 2,2'-бипиридил-6,6'-диилом, 1,10-фенантролин-2,9-диилом, 2,
6-пиримидиндиилом, 4,5- пиримидиндиилом, 2,6-пиразиндиилом, 2-фенил-1,3,5-триазин-2,6- диилом,
где R1 является алкиленом из 1-8 углеродов, и R является алкилом из 1-8 углеродов, арилом из 1-8 углеродов, арилалкилом из 7-14 углеродов или алкиларилом из 7-14 углеродов, и может содержать неактивные заместители; K81 и K82 являются группой формулы:
-T-N=CR81-CR82=
где T является гидроксилом, амино или общей формулой:
-NR4R5
где R4 и R5 независимо являются алкилом с 1-6 углеродами и могут содержать неактивные заместители; R81 и R82 независимо являются водородом, алкилом с 1-6 углеродами или фенилом, причем алкил или фенил могут содержать неактивные заместители; M означает центральный ион переходного металла, имеющий валентность +a; X является противоионом, имеющим валентность -b, которая устойчива при окислении; а означает целое число 1-4, b означает положительное целое число, n означает целое число 1-4, n равно a/b.
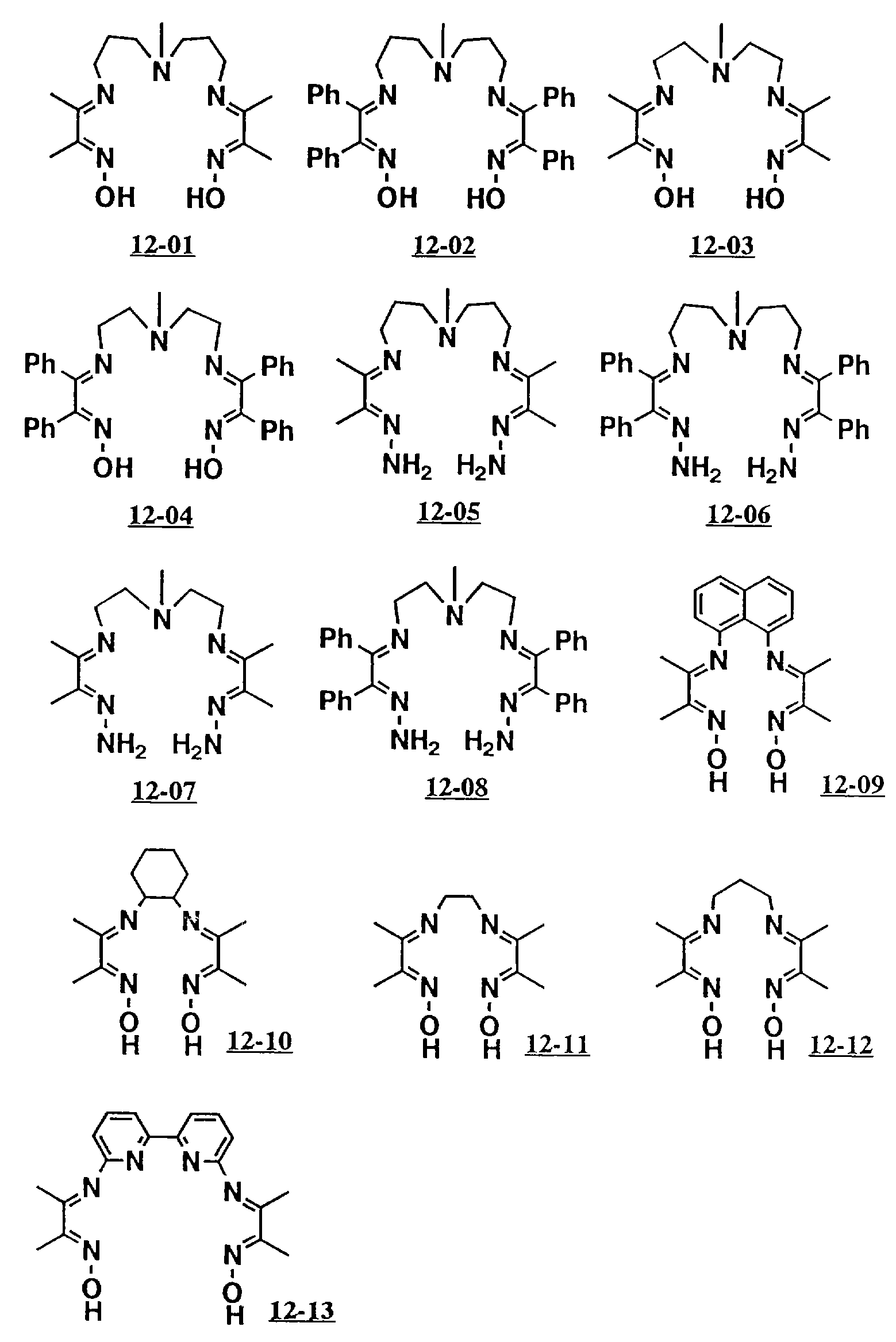
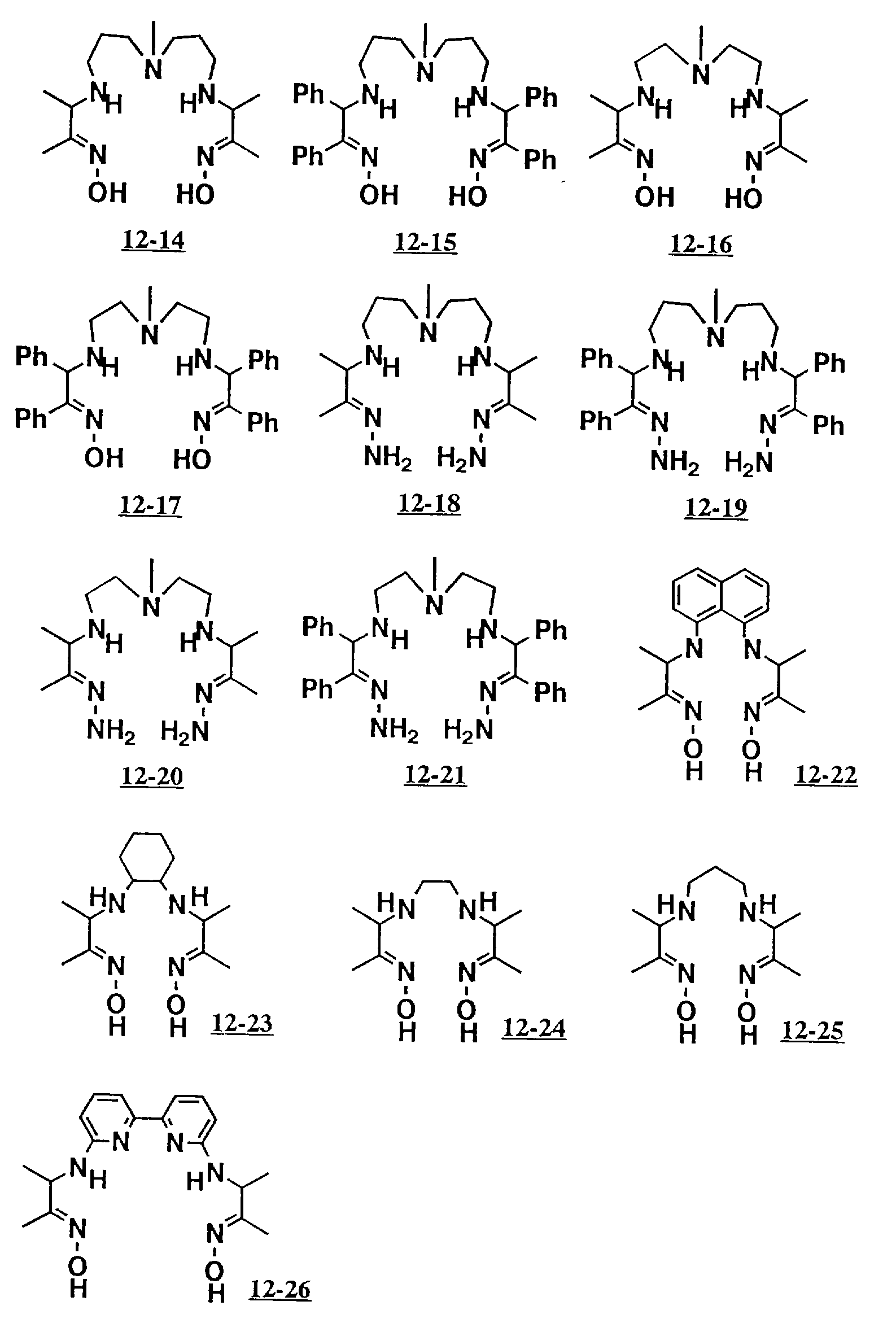
Предпочтительными вариантами полифункционального аминосоединения с открытой цепью, которое образует лиганд в седьмом комплексе переходного металла (VIII), являются соединения с 12-01 по 12-26 (см. соединения с 12-01 по 12-26 в конце описания).
В любой из формул комплексов переходных металлов, которые содержат как лиганд полифункциональное аминосоединение с открытой цепью, как указано выше, M является центральным ионом переходного металла, имеющим валентность +a, где a является целым числом 1-4. Предпочтительными примерами переходного металла являются железо, никель, марганец, кобальт, медь, рутений, родий, среди которых железо, никель, марганец, кобальт, медь или рутений особенно предпочтительны.
X является противоионом, имеющим валентность -b, которая стабильна при окислении, где b является положительным целым числом. Предпочтительными примерами противоиона являются, например, галогенидионы, такие как хлорид-ион или бромид-ион, SO4- (сульфат ион), NO3-, BF4-, PF6-, ClO4-, CO3-, P2O74-, S2O62-, анионы органических карбоксильных кислот, такие как оксалат ион, ацетат ион, нафтенат ион, бензоат ион, нафтоат ион, анионы органических сульфокислот, такие как метансульфонат ион, трифторметансульфонат ион, бензолсульфонат ион или p-толуолсульфонат ион, или пероксиданионы, такие как кумилпероксид анион. Кроме того, примеры включают ацетилацетонат или скварат ион.
В формулах a является целым числом 1-4, b является положительным целым числом, n является целым числом 1-4, n равно a/b и m является положительным целым числом 2 или больше, предпочтительно 2 или 3.
4. Реакция, использующая катализаторы на основе комплекса переходного металла.
Согласно изобретению, использование комплекса переходного металла в окислительной реакции арилалкилуглеводородов как катализатора, который содержит в качестве лиганда полифункциональное аминосоединение с циклической или открытой цепью, которое имеет HOMO энергию от -10 эВ до -3 эВ, как посчитано посредством MOPAC VERSION 6.0 РМ3 метода, дает указанные арилалкилгидропероксиды селективно в высокой концентрации при высокой реакционной скорости без заметного разложения получающегося органического гидропероксида. Хорошо известно, что HOMO энергия - это энергия, которую имеют высшие занимаемые молекулярные орбитали молекулы, и чем меньше HOMO энергия у молекулы, тем менее электронодонорная молекула.
Катализаторы на основе комплекса переходного металла, используемые в изобретении, можно легко приготовить при обработке неорганической солью, карбоксилатом или сульфонатом переходного металла циклического или с открытой цепью полифункционального аминосоединения таким образом, чтобы аминосоединение было координировано переходным металлом. Более специфична, например, обработка неорганической соли, карбоксилата или сульфоната переходного металла с аминосоединением соответствующим растворителем, дающая переходный металлический комплекс. Получающийся комплекс переходного металла может быть очищен, если необходимо, например, перекристаллизацией, экстракцией или хроматографическим разделением.
Катализатор на основе комплекса переходного металла может быть использован в твердой форме, или может быть растворен в реагирующем веществе или в реакционном растворителе. Следует указать, что катализатор на основе комплекса переходного металла может быть использован и в гетерогенной и в гомогенной реакциях.
Катализатор на основе комплекса переходного металла, который содержит циклическое полифункциональное аминосоединение как лиганд, используется в количестве 0.000001-10 частей по весу, предпочтительно в количестве 0.00001-1 частей по весу, на 100 частей по весу исходного арилалкилуглеводорода.
В частности, когда лигандом является полифункциональное аминосоединение, которое имеет три атома азота в кольце, образующем молекулярную цепь, катализатор на основе комплекса переходного металла используется предпочтительно в количестве 0.00001-5 частей по весу, более предпочтительно в количестве 0.0001-0.1 частей по весу, на 100 частей по весу исходного арилалкилуглеводорода. В случае, когда лиганд является циклическим полифункциональным аминосоединением, которое имеет четыре атома азота или больше в кольце, образующем молекулярную цепь, катализатор используют предпочтительно в количестве 0.000001-5 частей по весу, более предпочтительно 0.0001-0.1 частей по весу, на 100 частей по весу исходного арилалкилуглеводорода.
В то же время, катализатор на основе комплекса переходного металла, содержащий полифункциональное аминосоединение с открытой цепью в качестве лиганда, используется предпочтительно в количестве 0.00001-5 частей по весу, более предпочтительно в количестве 0.0001-0.1 частей по весу, на 100 частей по весу исходного арилалкилуглеводорода.
Окисление исходного арилалкилуглеводорода происходит в кислородсодержащем газе. Обычно используют воздух как кислородсодержащий газ, однако, кислород, диоксид углерода, монооксид углерода или смесь кислорода и азота могут быть использованы, если необходимо. Реакция протекает обычно при нормальном давлении, однако, реакция может быть проведена при увеличенном давлении, если необходимо. Реакционная температура может колебаться в пределах от 40oC до 130oC, предпочтительно от 50oC до 110oC.
Реакция может быть проведена в присутствии твердого щелочного соединения или водного раствора щелочного соединения, такого как карбонат натрия, бикарбонат натрия, гидроксид натрия, карбонат калия, гидроксид калия, гидроксид бария или оксид магния. Щелочное соединение может быть использовано в количестве 0.0001-10 частей по весу, предпочтительно в количестве 0.001-5 частей по весу на 100 частей по весу исходного арилалкилуглеводорода.
Реакция может начаться при использовании маленького количества инициатора, обычно конечного арилалкилгидропероксида, если необходимо. Например, моногидропероксид кумола может быть использован как инициатор в окислении кумола.
Реакция может проводиться или периодическим или непрерывным способом. Когда реакция проводится периодическим способом, катализатор добавлен к арилалкилуглеводороду, если он жидкий, при температуре, при которой происходит реакция окисления, и воздух продувают через смесь при перемешивании при повышенной температуре.
Реакция может протекать при пропускании исходного арилалкилуглеводорода или его раствора вместе с воздухом над неподвижным слоем катализатора.
Конечный арилалкилгидропероксид легко выделяется из реакционной смеси стандартными методами, например, дистилляцией.
В соответствии с изобретением, использование комплекса переходного металла как катализатора, который содержит как лиганд циклическое полифункциональное органическое аминосоединение, имеющее по крайней мере три атома азота в молекуле, при окислении арилалкилуглеводородов кислородсодержащим газом, таким как воздух, позволяет селективно окислять исходные арилалкилуглеводороды в соответствующие им арилалкилгидропероксиды в высокой концентрации при высокой скорости реакции без заметного разложения конечных органических пероксидов.
5. Примеры.
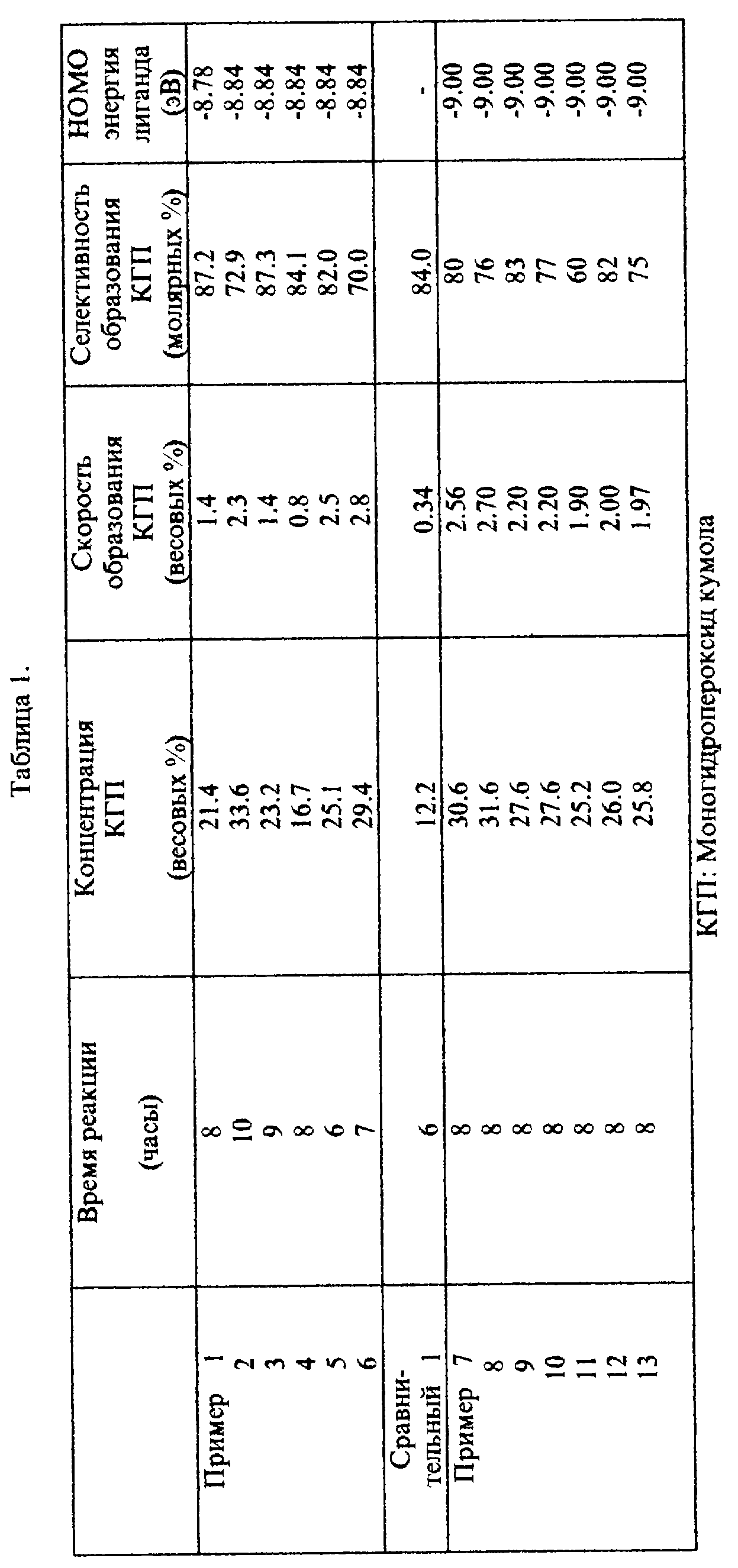
Изобретение детально описано в следующих примерах. Однако изобретение не ограничено этими примерами. Как ниже следует, концентрация моногидропероксида кумола в реакционной смеси после реакции была измерена посредством иодометрии и газовой хроматографии, тогда как селективность гидропероксида кумола была измерена посредством газовой хроматографии.
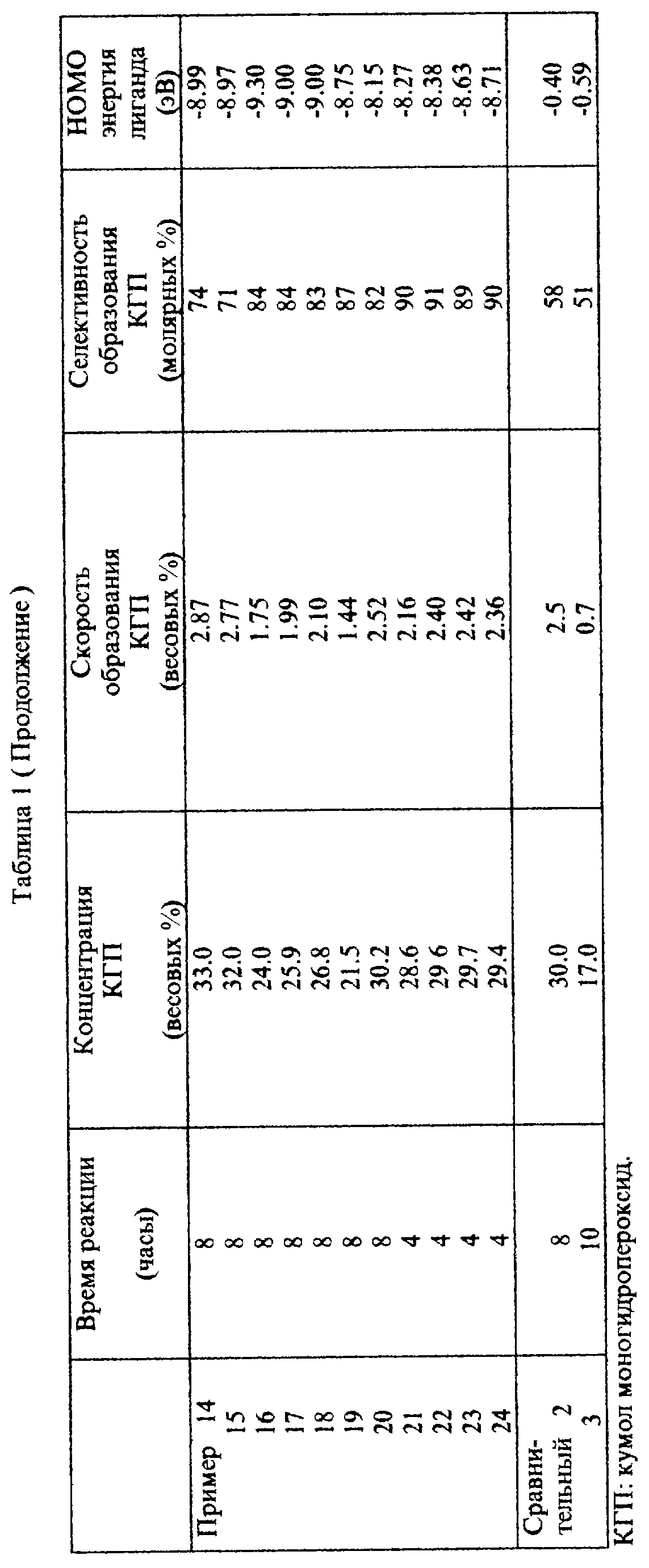
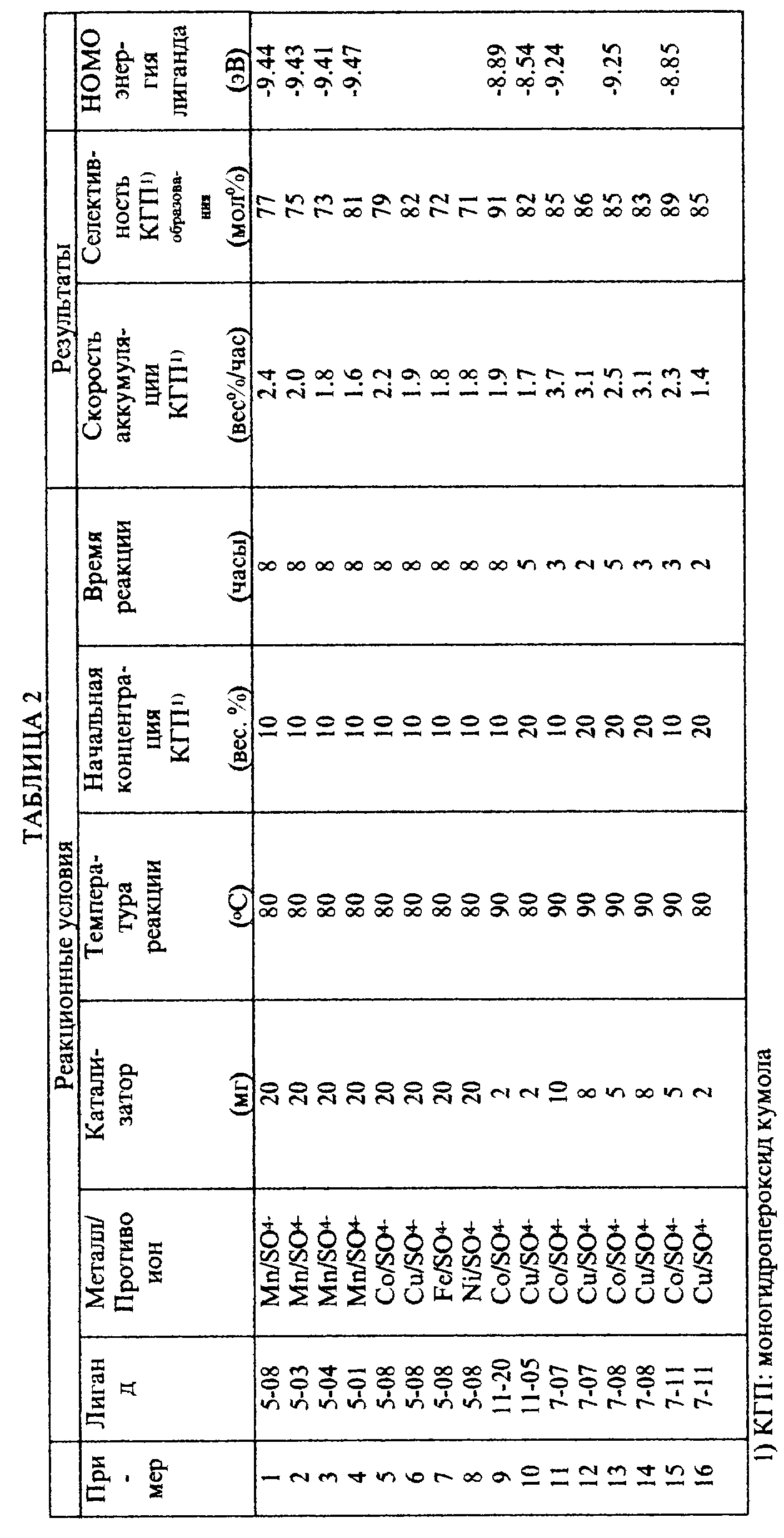
Результаты реакций в следующих примерах и сравнительных примерах, а именно, концентрация конечного моногидропероксида кумола в реакционной смеси после реакции, скорость образования моногидропероксида кумола в течение реакции и селективность моногидропероксида кумола показаны в табл. 1 и 2.
HOMO энергия циклических полифункциональных аминов, использованных как лиганды в приготовлении катализаторов на основе комплекса переходного металла, также показана в табл. 1 и 2, которая была посчитана при использовании MOPAC VERSION 6.0 РМЗ метода.
Пример I
Использование катализаторов на основе
комплекса переходного металла, содержащих циклические полифункциональные амины как лиганды
Получение арилалкилгидропероксидов при использовании первого катализатора на основе комплекса
переходного металла, где циклическими полифункциональными аминолигандами являются триазакраун соединения.
Пример 1.
20 мг [1,4,7-триазациклононан] марганец (II) сульфата было добавлено к смеси 90 г кумола и 10 г монопероксида кумола. Полученная смесь была нагрета до 80oC, и кумол окислялся в течение 8 часов при перемешивании, в то время как воздух подавался в смесь со скоростью 60 мл в минуту.
Пример 2.
Окисление воздухом кумола проводили тем же способом, как в примере 1, в течение 10 часов при использовании 20 мг [N,N',N''- трис(3-гидроксипропил)-1,4,7-триазациклононан] марганец (II) сульфата вместо [1,4,7-триазациклононан]марганец (II) сульфата.
Пример 3.
Окисление воздухом кумола проводили тем же способом, как в примере 1, в течение 9 часов при использовании 2 мг (N,N',N''- трис(3-гидроксипропил)-1,4,7-триазациклононан] марганец (II) сульфата вместо [1,4, 7-триазациклононан]марганец (II) сульфата.
Пример 4.
Окисление воздухом кумола проводили тем же способом, как в примере 2, за исключением того, что 10 мл дистиллированной воды было добавлено в смесь в начале реакции.
Пример 5.
Окисление воздухом кумола проводили под давлением 6 кг/см2 воздуха в автоклаве в течение 6 часов и далее тем же способом, как в примере 3.
Пример 6.
Окисление воздухом кумола проводили в течение 7 часов таким же способом, как в примере 5, при использовании 5 мг комплексного катализатора.
Сравнительный пример 1.
10 мл водного раствора, содержащего 20 мг сульфата марганца, было добавлено к смеси 90 г кумола и 10 г моногидропероксида кумола. Полученную смесь нагрели до 80oC, и кумол окисляли в течение 6 часов при перемешивании, причем воздух подавали в смесь со скоростью 60 мл в минуту.
Получение арилгидропероксида при использовании первого катализатора на основе комплекса переходного металла, в котором циклическими полифункциональными аминолигандами являются амины, имеющие четыре или более атомов азота в молекуле.
Пример 7.
10 мг [1,4,8,11-тетраазациклотетрадекан]марганца (II) сульфата было добавлено к смеси 90 г кумола и 10 г монопероксида кумола. Полученная смесь была нагрета до 80oC, и кумол окисляли в течение 8 часов при перемешивании, причем воздух подавали в смесь со скоростью 60 мл в минуту.
Пример 8.
Реакцию проводили при использовании 20 мг [1,4,8,11- тетраазациклотетрадекан)кобальта (III) хлорида вместо (1,4,8,11- тетраазациклотетрадекан] марганец (II) сульфата, а далее таким же способом, как в примере 7.
Пример 9.
Реакцию проводили при использовании 20 мг [1,4,8,11- тетраазациклотетрадекан]меди (II) сульфата вместо (1,4,8,11- тетраазациклотетрадекан]марганец (II) сульфата, а далее таким же способом, как в примере 7.
Пример 10.
Реакцию проводили при использовании 2 мг (1,4,8, 11-тетраазациклотетрадекан] рутения (II) сульфата вместо [1,4,8,11-тетраазациклотетрадекан]марганец (II) сульфата, а далее таким же способом, как в примере 7.
Пример 11.
Реакцию проводили при использовании 20 мг [1,4,8,11- тетраазациклотетрадекан] никеля (II) сульфата вместо [1,4,8,11- тетраазациклотетрадекан]марганец (II) сульфата, а далее таким же способом, как в примере 7.
Пример 12.
Реакцию проводили при использовании 2 мг [1,4,8,11- тетраазациклотетрадекан] марганца (II) бензоата вместо [1,4,8, 11- тетраазациклотетрадекан)марганец (II) сульфата, а далее таким же способом, как в примере 7.
Пример 13.
Реакцию проводили при использовании 20 мг [1,4,8, 11- тетраазациклотетрадекан)кобальта (II) бензоата вместо [1,4,8,11- тетраазациклотетрадекан] марганец (II) сульфата, а далее таким же способом, как в примере 7.
Пример 14.
Реакцию проводили при использовании 20 мг [1,4,8,12- тетраазациклопентадекан)марганца (II) сульфата вместо (1,4,8,11- тетраазациклотетрадекан] марганец (II) сульфата, а далее таким же способом, как в примере 7.
Пример 15.
Реакцию проводили при использовании 20 мг [1,4,7,10,13,16- гексаазациклооктадекан] марганца (II) сульфата вместо [1,4,8, 11- тетраазациклотетрадекан]марганец (II) сульфата, а далее таким же способом, как в примере 7.
Пример 16.
Реакцию проводили при использовании 20 мг [N,N'N'', N'''- тетракис(2-этоксикарбонилэтил)-1,4,8,11- тетраазациклотетрадекан] кобальта (II) сульфата вместо (1,4,8,11- тетраазациклотетрадекан] марганец (II) сульфата, а далее таким же способом, как в примере 7.
Пример 17.
Реакцию проводили при использовании 2 мг [1,4,8,11- тетраазациклотетрадекан] марганца (II) стеарата вместо [1,4,8,11- тетраазациклотетрадекан] марганец (II) сульфата, а далее таким же способом, как в примере 7.
Пример 18.
Реакцию проводили при использовании 2 мг (1,4,8,11- тетраазациклотетрадекан] кобальта (II) стеарата вместо (1,4,8,11- тетраазациклотетрадекан)марганец (II) сульфата, а далее таким же способом, как в примере 7.
Пример 19.
Реакцию проводили при использовании 2 мг (N,N',N'',N'''-тетра-n-бутил-1,4,8,11-тетраазациклотетрадекан)марганца (II) сульфата вместо [1,4,8,11-тетраазациклотетрадекан)марганец (II) сульфата, а далее таким же способом, как в примере 7.
Использование пятого катализатора на основе комплекса переходного металла.
Пример 20.
Реакцию проводили в присутствии 2 мг комплекса переходного металла, полученного при использовании бромида кобальта (III) и соединения (6-02) вместо (1,4,8,11-тетраазациклотетрадекан]марганца (II) сульфата, а далее таким же способом, как в примере 7.
Использование третьего катализатора на основе комплекса переходного металла.
Пример 21.
К смеси 80 г кумола, 20 г моногидропероксида кумола и 50 г 0,02% по весу водного раствора карбоната натрия было добавлено 2 мг комплекса переходного металла, полученного при использовании гептагидрата сульфата кобальта и соединения (4-02). Полученную смесь нагрели до 90oC, а кумол окисляли в течение 4 часов при перемешивании, причем воздух подавали в смесь со скоростью 180 мл в минуту.
Использование четвертого катализатора на основе переходного металла.
Пример 22.
Реакцию проводили в присутствии 2 мг комплекса переходного металла, полученного при использовании пентагидрата сульфата меди (II) и соединения (5-02, где R, связанный с азотом, является водородом, и R, связанный с углеродом, является метилом) вместо комплекса, полученного при использовании гептагидрата сульфата кобальта и соединения (4-02), а далее таким же способом, как в примере 21.
Использование второго катализатора на основе комплекса переходного металла.
Пример 23.
Реакцию проводили в присутствии 2 мг комплекса переходного металла, полученного при использовании пентагидрата сульфата меди (II) и соединения (3-01) вместо комплекса, полученного при использовании гептагидрата сульфата кобальта и соединения (4-02), а далее таким же способом, как в примере 21.
Использование пятого катализатора на основе комплекса переходного металла.
Пример 24.
Реакцию проводили в присутствии 2 мг комплекса переходного металла, полученного при использовании пентагидрата сульфата меди (II) и соединения (6-03) вместо комплекса, полученного при использовании гептагидрата сульфата кобальта и соединения (4-02), а далее таким же способом, как в примере 21.
Сравнительный пример 2.
Реакцию проводили в присутствии 2 мг (фталоцианина)кобальта (II) вместо [1,4,8,11-тетраазациклотетрадекан] марганец (II) сульфата, а далее таким же способом, как в примере 7.
Сравнительный пример 3.
Окисление воздухом кумола проводили таким же способом, как в примере 7, в течение 10 часов при использовании 2 мг (тетрафенилпорфирин)кобальт (II) вместо [1,4, 8,11- тетраазациклотетрадекан]марганец (II) сульфата.
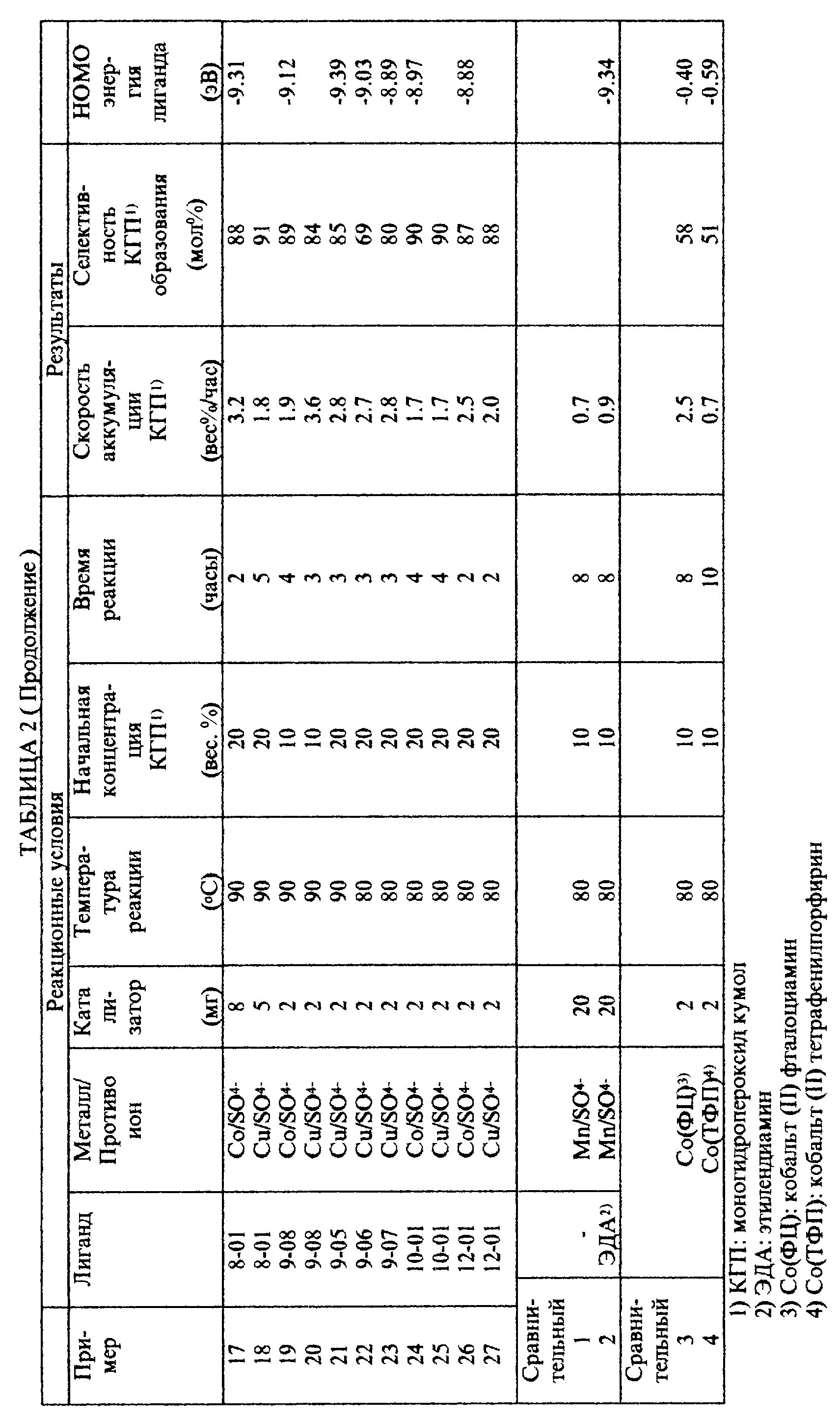
Пример II
Использование катализаторов на основе комплекса переходного металла, содержащего полифункциональные амины с
открытой цепью в качестве лигандов
Использование первых катализаторов на основе комплекса переходного металла.
Пример 1.
20 мг [N,N'-бис(2-аминоэтил)-1, 3-пропандиамин)марганца (II) сульфата добавили к смеси 90 г кумола и 10 г моногидропероксида кумола. Полученную смесь нагрели до 80oC, и кумол окисляли в течение 8 часов при перемешивании, причем воздух подавали в смесь со скоростью 60 мл в минуту.
После реакции концентрация полученного моногидропероксида кумола составляла 29,6% по весу. Соответственно скорость аккумуляции моногидропероксида кумола, как было найдено, составляет 2,42% по весу в час. Селективность получаемого моногидропероксида кумола, как было найдено, составляет 77% несмотря на факт, что моногидропероксид кумола аккумулировался в реакционной смеси в количестве 29,6% по весу.
Сравнительный пример 1.
20 мг пентагидрата сульфата марганца (II) было добавлено в смесь 90 г кумола и 10 г моногидропероксида кумола. Полученную смесь нагревали до 80oC и кумол окисляли в течение 8 часов при перемешивании, причем воду подавали в смесь со скоростью 60 мл в минуту.
После реакции концентрация конечного моногидропероксида кумола составляла 15.8% по весу. Соответственно скорость аккумуляции моногидропероксида кумола, как было найдено, составляет лишь 0.72% по весу в час.
Сравнительный пример 2.
20 мг (этилендиамин)кобальта (II) сульфата было добавлено в смесь 90 г кумола и 10 г моногидропероксида кумола. Полученную смесь нагревали до 80oC и кумол окисляли в течение 8 часов при перемешивании, причем воду подавали в смесь со скоростью 60 мл в минуту.
После реакции концентрация конечного моногидропероксида кумола составляла 17.3% по весу. Соответственно скорость аккумуляции моногидропероксида кумола, как было найдено, составляет лишь 0.91% по весу в час.
Исследование первых катализаторов на основе комплексов переходных металлов.
Пример 2.
Реакция проводилась при использовании 20 мг (тетраэтиленпентамин)марганца (II) сульфата вместо [N, N'-бис(2- аминоэтил)-1,3-пропандиамин]марганца (II) сульфата, а далее таким же способом, как в примере 1. Скорость аккумуляции моногидропероксида кумола, как было найдено, составляет 1.96% по весу в час, и селективность моногидропероксида кумола, как было найдено, составляет 75%.
Пример 3.
Реакция проводилась при использовании 20 мг (пентаэтиленгексамин)марганца (II) сульфата вместо [N, N'-бис(2- аминоэтил)-1,3-пропандиамин]марганца (II) сульфата, а далее таким же способом, как в примере 1.
Скорость аккумуляции моногидропероксида кумола, как было найдено, составляет 1.81% по весу в час, и селективность моногидропероксида кумола, как было найдено, составляет 73%.
Пример 4.
Реакцию проводили при использовании 20 мг (диэтилентриамин)марганца (II) сульфата вместо [N,N'-бис(2- аминоэтил)-1,3-пропандиамин]марганца (II) сульфата, а далее таким же способом, как в примере 1.
Скорость аккумуляции моногидропероксида кумола, как было найдено, составляет 1.64% по весу в час, и селективность моногидропероксида кумола, как было найдено, составляет 81%.
Пример 5.
Реакцию проводили при использовании 20 мг [N,N'-бис(2-аминоэтил)-1,3-пропандиамин] кобальта (II) сульфата вместо [N,N'- бис(2-аминоэтил)-1, 3-пропандиамин)марганца (II) сульфата, а далее таким же способом, как в примере 1.
Скорость аккумуляции моногидропероксида кумола, как было найдено, составляет 2.19% по весу в час, и селективность моногидропероксида кумола, как было найдено, составляет 79%.
Пример 6.
Реакцию проводили при использовании 20 мг [N,N'-бис(2- аминоэтил)-1, 3-пропандиамин] меди (II) сульфата вместо [N,N'- бис(2-аминоэтил)-1,3-пропандиамин]марганца (II) сульфата, а далее таким же способом, как в примере 1.
Скорость аккумуляции моногидропероксида кумола, как было найдено, составляет 1.86% по весу в час, и селективность моногидропероксида кумола, как было найдено, составляет 82%.
Пример 7.
Реакцию проводили при использовании 20 мг [N,N'-бис(2- аминоэтил)-1,3-пропандиамин] железа (II) сульфата вместо [N,N'- бис(2-аминоэтил)-1,3-пропандиамин] марганца (II) сульфата, а далее таким же способом, как в примере 1.
Скорость аккумуляции моногидропероксида кумола, как было найдено, составляет 1.79% по весу в час, и селективность моногидропероксида кумола, как было найдено, составляет 72%.
Пример 8.
Реакцию проводили при использовании 20 мг [N,N'-бис(2-аминоэтил)-1,3-пропандиамин] никеля (II) сульфата вместо [N, N'- бис(2-аминоэтил)-1,3-пропандиамин] марганца (II) сульфата, а далее таким же способом, как в примере 1.
Скорость аккумуляции моногидропероксида кумола, как было найдено, составляет 1.80% по весу в час, и селективность моногидропероксида кумола, как было найдено, составляет 71%.
Пример 9.
К смеси 90 г кумола и 10 г моногидропероксида кумола было добавлено 2 мг комплекса переходного металла, полученного при обработке соединения (11-20) сульфатом кобальта, и затем добавили в смесь 50 г 0.02% по весу водного раствора карбоната натрия.
Полученную смесь нагрели до 90oC, и кумол окисляли в течение 8 часов при перемешивании, причем воздух подавали в смесь со скоростью 180 мл в минуту. Результаты представлены в табл. 2.
В дальнейшем в примере 10 использовали первый катализатор на основе комплекса переходного металла; в примерах с 11 по 16 использовали третий катализатор на основе комплекса переходного металла; в примерах 17 и 18 использовали четвертый катализатор на основе комплекса переходного металла; в примерах с 19 по 23 использовали пятый катализатор на основе комплекса переходного металла; и в примерах с 24 по 27 использовали шестой катализатор на основе комплекса переходного металла.
Примеры 10-27.
Окисление воздухом кумола проводили таким же способом, как в примере 9 при использовании 100 г смеси кумола и моногидропероксида, имевшей различные соотношения моногидропероксида кумола и кумола в смеси, в присутствии катализатора при температуре в течение периода времени, как показано в табл. 2.
Сравнительный пример 3.
Реакцию проводили при использовании 2 мг (фталоциан)кобальта (II) вместо (этилендиамин)кобальта (II) сульфата, а далее таким же способом, как в сравнительном примере 2. Результаты представлены в табл. 2.
Сравнительный пример 4.
Реакцию проводили при использовании 2 мг (тетрафенилпорфирин)кобальта (II) вместо (этилендиамин)кобальта (II) сульфата, а далее таким же способом, как в сравнительном примере 2. Результаты представлены в табл. 2.
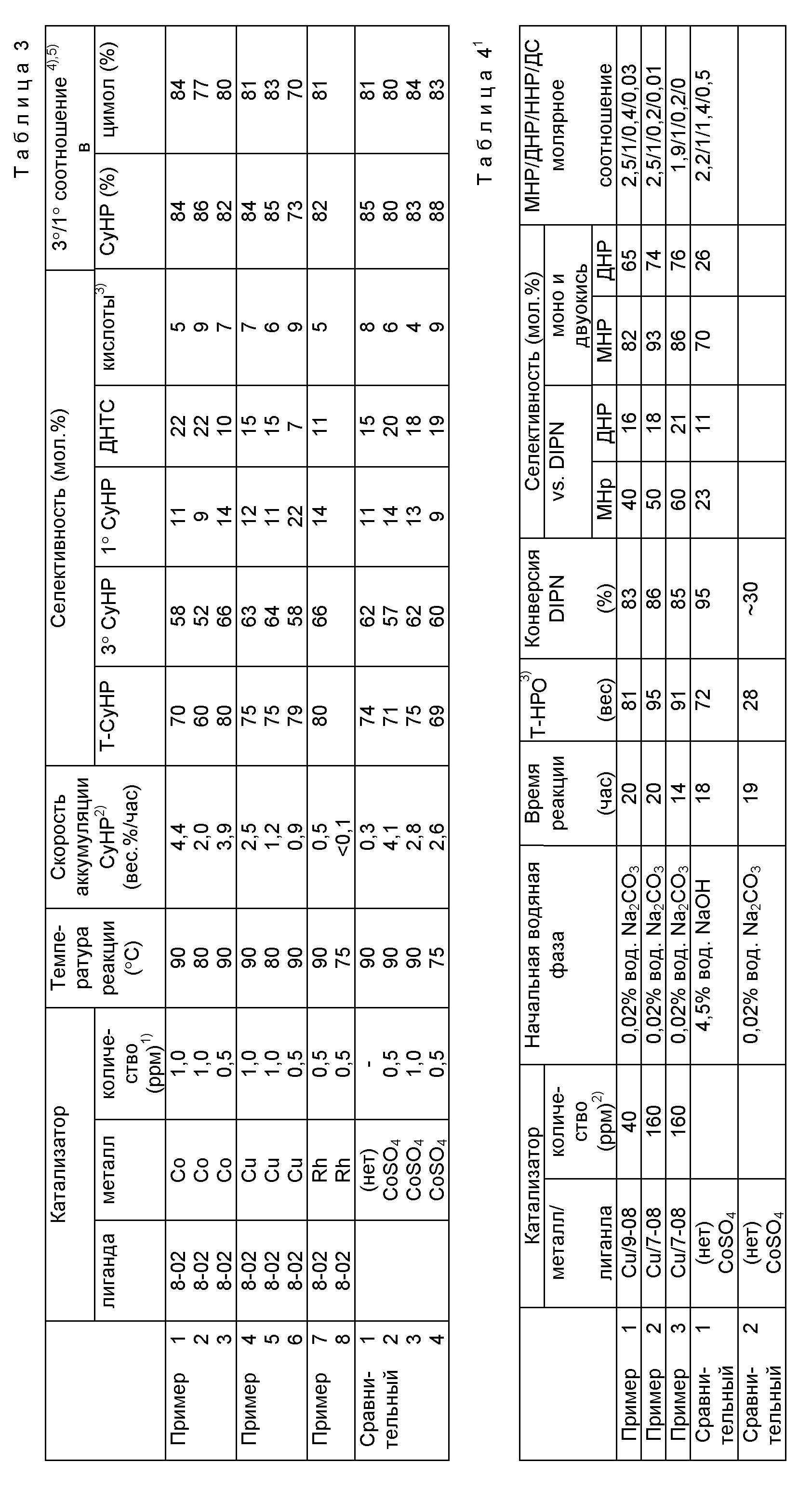
Приложение A
Окисление смеси м- и р-цимолов
100 г раствора смеси м- и р-цимола, содержащего заданное количество цимолгидропероксида, 50 г 0,02% водного
раствора соли углекислого натрия и катализатор (комплекс переходного металла) помещали в отдельную колбу объемом 200 мл, снабженную конденсатором Димрота, входным газовым патрубком, тепловым
отстойником и мешалкой. Колбу нагревали в масляной ванне при одновременной подаче воздуха в колбу при атмосферном давлении в количестве 210 мл/мин через счетчик подаваемого потока, так что реакция
проводилась при заданной температуре. Во время реакции бралась проба водной фазы, чтобы проверить величину pH водной фазы, является ли она щелочной, и добавлялся 1% водный раствор соли углекислого
натрия, когда необходимо было сохранить водную фазу щелочной. Во время второй части реакции водная фаза образовывала буферную зону, так что величина pH водной фазы устанавливалась на значении 7,5.
Через полчаса и через час после начала реакции, соответственно, анализировалась фаза реакционной смеси посредством йодометрии и 0,5 г органической фазы анализировались посредством жидкой хроматографии с точными характеристиками.
Небольшое количество гидроокиси натрия добавлялось к водной фазе, чтобы сделать эту фазу щелочной, и анализировалась посредством жидкой хроматографии с точными характеристиками, предусмотренной с колонкой с реверсивной фазой. Реакционная смесь подвергалась обработке в центрифуге, чтобы удалить водную фазу и концентрация цимолгидропероксида (CyHP) в органической фазе определялась йодометрией путем использования потенциометра. Концентрация цимолгидропероксида (CyHP) может быть рассчитана с помощью следующего уравнения, если вес пробы - x(г) и ее объем - y(мл).
CyHP (% по весу) + [y(мл)•(1/200)•166.2]x(г). Затем примерно 0,5 г органической фазы также анализировались посредством жидкой хроматографии с точными характеристиками. Результаты анализа приведены в таблице 3.
Использованные в табл. 3 сокращения обозначают следующее:
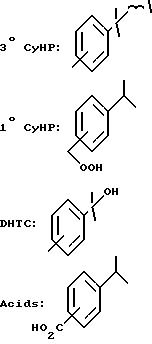
Примечания к табл. 3:
1) рассчитано как металл по отношению к органической фазе.
2) рассчитано путем вычитания начальной концентрации из Т- CyHP(3oCyHP+1oCyHP) через час после начала реакции.
3) определено как куминовая кислота посредством анализа водной фазы путем использования реверсивной колонки (Zorbax-DDS, aq/H3PO4/CH3CN=1/1).
4) 3o/1o соотношение в CyHP = (3o CyHP/Т-CyHP)• 100(%).
5) 3o/1o соотношение в цимоле = [продукт окисления третичного водорода/(продукт окисления третичного водорода + продукт окисления первичного водорода)]•100(%).
Окисление диизопропилнафталина (DIPN)
50 г 2,6-диизопропилнафталина, 100 г 0,02% водного раствора соли углекислого натрия и катализатор
(комплекс переходного металла) помещали в отдельную колбу объемом 200 мл, снабженную конденсатором Димрота, входным газовым патрубком, тепловым отстойником и мешалкой. Колбу нагревали в масляной ванне
при одновременной подаче в колбу газа, содержащего 80% кислорода, при атмосферном давлении в количестве 210 мл/мин через счетчик подаваемого потока, так что реакция проводилась при заданной
температуре. Во время реакции бралась проба водной фазы, чтобы проверить величину pH водной фазы, является ли она щелочной и добавлялся, 1% водный раствор соли углекислого натрия, когда необходимо
было сохранить водную фазу щелочной. В течение всего периода проведения реакции, продолжавшегося почти 20 часов, было добавлено общее количество 40 мл.
Поскольку исходные соединение и продукт, т.е. диизопропилнафталиндигидропероксид были в твердом состоянии при комнатной температуре, то органическая фаза медленно нагревалась нагревательным пистолетом, чтобы расплавить органическую фазу до проведения анализа реакционной смеси. Проба органической фазы реакционной смеси анализировалась посредством йодометрии и 0,5 г органической фазы посредством жидкой хроматографии с точными характеристиками.
Концентрация гидропероксида в органической фазе анализировалась посредством йодометрии путем использования потенциометра. Концентрация суммарного гидропероксида
(Т-HPO) может быть рассчитана с помощью следующего уравнения, если вес пробы - x(г) и объем титрования - y(мл):
Т-HPO (% по весу) = [y(мл)•(1/200)•244,3]/х(г).
Затем примерно 0,5 г органической фазы было точно взвешено и нагревалось и плавилось. Добавлялось 50 мг 4,4'- дигидроксидифенилэфира к органической фазе как обычная норма и смесь растворялась в 10 мл метанола и анализировалась посредством жидкой хроматографии с точными характеристиками. Результаты приведены в табл. 4.
Использованные в табл. 2 сокращения обозначают следующее:
Т-HPO: концентрация суммарного гидропероксида
DIPN: 2,6-диизопропилнафталин
MHP: 2-изопропил-6-(2-гидроперокси-2-пропил)нафталин
ДHP: 2,6-диизопропилнафталин
дигидропероксид
HHP: 2-(2-гидрокси-2-пропил)-6-(2-гидроперокси-2-пропил)- нафталин
ДC: 2,6-бис(2-гидрокси-2-пропил)нафталин
Примечания к табл. 4:
1) реакция
проводилась при температуре 90oC в органической/водяной фазе с соотношением 1/2 (W/W), используя подачу газа, содержащего 80% кислорода со скоростью 210 мл/мин при атмосферном давлении;
2) рассчитано как металл;
3) общее количество гидропероксида при условии MHP.
Приложение B
Приготовление комплексов переходного металла
1. Марганцевый
комплекс соединения циклического полифункционального амина 2-03 (1,4,8,11-тетра-n-бутил- тетраазациклотетрадекан)
(приготовление 2-03).
В атмосфере азота помещали 2,00 г (50 ммол) 60% дисперсии гидрида натрия в колбе с объемом 300 мл и промывали гексаном посредством сцеживания. После просушивания в вакууме добавлялся гидрид натрия к 10 мл N-метилпирролидона, чтобы получить шлам гидрида натрия в N-метилпирролидоне.
Раствор охлаждался на льду и 40 мл раствора 2,04 г (10 ммол) 1,4,8,11-тетраазациклотетрадекана в N-метилпирролидоне добавлялись каплями к раствору гидрида натрия, после чего образовывался водород и смесь образовывала суспензию. Суспензия нагревалась до комнатной температуры и затем 6,85 г (50 ммол) n-бутил бромида добавлялось каплями к суспензии с последующим перемешиванием при комнатной температуре в течение 5 дней.
Нерастворимые вещества фильтровались, окончательный фильтрат концентрировался посредством дистилляции раствора. Окончательный концентрат фракционировался посредством хроматографии в нейтральной колонке окиси алюминия, используя хлорид метилена в качестве элюента. Полученные фракции испарялись до сухости и просушивались в вакууме, чтобы получить 1,25 г (30% выхода) 1,4,8,11-тетра-n-бутил- тетраазациклотетрадекана в виде белой твердой массы.
FD-MS: 424
1H-NMR(CDCl3):1,00(t; 12H,CH3), 1,2-1,9
(m; 16H+4H),2,3-3,0(m; 16H+8H).
(приготовление комплекса)
К раствору 0,71 г (1,7 моли) 1,4,8,
11-тетра-n-бутил- тетраазациклотетрадекана в 20 мл безводного метанола добавляли 0,34 г (1,4 ммол) порошка MnSO4•5H2O при комнатной температуре. Смесь затем перемешивали
при температуре 60oC в течение двух часов. Твердая масса фильтровалась и просушивалась, чтобы получить 0,29 г (36% выхода) необходимого комплекса металла в виде молочно-белой твердой
массы.
Элементарный анализ: Mn; 9,5(8,7), C; 50,2(49,6), H; 9,6(9,9), N; 8,9(8,9). Величины в скобках являются рассчитанными величинами тригидрата.
Благодаря использованию соединения циклического полифункционального амина, имеющего различные размеры колец вместо 1,4,8,11-тетра-n-бутил-тетраазациклотетрадекана можно было получить циклические соединения 2-01 до 2-15 таким же способом. Благодаря использованию алкилбромида вместо n-бутилбромида могли быть получены циклические соединения 2-01 до 2-15, имеющие алкил вместо бутила, таким же способом.
2. Соединение комплекса меди полифункционального амина с открытой цепью 7-08.
(приготовление 7-08).
Раствор 6,1 г (42 ммол) 3, 3'-диамино-N-метилдипропиламина в 10 мл этанола добавляли каплями к раствору 9,0 г (84 ммол) 2- пиридинкарбоксальдегида в 15 мл безводного этанола при перемешивании при комнатной температуре и смесь перемешивали еще в течение четырех часов. Смесь концентрировалась посредством дистилляции раствора и осадок экстрагировался с теплым гексаном.
Экстракт концентрировался до объема 400 мл и затем охлаждался в рефрижераторе в течение ночи, после чего в экстракте выделялось красновато-оранжевое масло. Масло выделялось и просушивалось в вакууме, чтобы получить 8,5 г (71% выхода) желаемое соединение амина 7-08.
FD-MS: 286
1H-NMR(CDCl3):1,8-2,4(m; 4H, CH2), 2,45 (S: 3H, CH3), 2,90 (t; 4H), 3,85 (t; 4H), 7,1-7,4 (m; 2H),
7,5-7,9 (m; 2H), 7,9-8,05 (m; 2H), 8,4 (s; 2H), 8,6-8,7(m; 2H).
(приготовление комплекса).
1,0 г (3,5 ммол) соединения амина растворялись в 15 мл безводного метанола в атмосфере азота, чтобы получить красновато- оранжевый раствор. 0,75 г (3.0 ммолл) CuSO4•5H2O засыпали в известковый раствор в ступе и добавлялся в таком виде в раствор при комнатной температуре, чтобы получить черновато-голубой раствор. Раствор перемешивался в течение одного часа при комнатной температуре и нагревался до температуры 60oC с последующим перемешиванием в течение последующих трех часов. Раствор затем охлаждался до комнатной температуры и экстрагировался трижды с 30 мл гексана. Метанол удалялся из экстракта посредством дистилляции. Осадок растворялся в 5 мл метиленхлорида и затем добавлялось 20 мл гексана к раствору осажденной вязкой черной твердой массы. Раствор затем удалялся посредством сцеживания. Осадок промывался небольшим количеством ацетонитрила и просушивался в вакууме, чтобы получить черную твердую массу. Твердая масса перемешивалась в гексане при комнатной температуре, фильтровалась и просушивалась в вакууме, чтобы получить 1,0 г (62% выхода) желаемого соединения амина в виде черно-коричневого порошка.
Элементарный анализ: Cu; 11,3(11,8), C: 42,3(42,5), H; 6,1(5,8), N; 13,1(13,0), S; 6,3(6,0). Значения величин в скобках являются рассчитанными величинами тригидрата.
В результате использования соответственно селектированных диалдегидов и ди- или триаминов могут быть получены полифункциональные соединения с открытой цепью 7-01 до 7-22 таким же способом.
3. Соединение комплекса меди полифункционального амина с открытой цепью 9-08.
1,35 г (10 ммол) 2,6-пиридиндикарбоксальдегида и 1,88 г (20 ммол) 2-аминопиридина растворялись в 100 мл этанола в атмосфере азота. 2,50 г (10 ммол) CuSO4•5H2O засыпали в известковый раствор в ступе и добавлялись маленькими порциями к раствору при комнатной температуре при перемешивании, чтобы получить голубой раствор. Раствор далее перемешивался в течение пяти часов при комнатной температуре, после чего бело-голубая твердая масса осаждалась в форме шлама. После этого шлам перемешивался при температуре 50oC в течение шести часов, затем фильтровался. Твердая масса преобразовывалась в шлам в ацетоне, промывалась ацетоном и затем просушивалась в вакууме, чтобы получить 4.3 г (80% выхода) желаемого комплекса в виде бело-голубого порошка. Элементарный анализ: Cu; 11,9(14,2), C; 42,5(45,7), H; 4,3(2,9), N; 13,2(15,7), S, 6,0(7,2). Значения величин в скобках являются рассчитанными величинами моногидрата.
IR(KBr): 3000-3500, 1620, 1540, 1480, 1420, 1335, 1120, 1070, 1040, 770 см-1.
UV-vis: 670 пм (смещенные к 750 пм после выдерживания в воде в течение трех часов).
Благодаря использованию соответственно селектированных диальдегидов и аминов могли быть получены полифункциональные соединения с открытой цепью 9-01 до 9-18 таким же способом.
4. Соединение комплекса меди полифункционального амина с открытой цепью 8-02.
(приготовление 8-02).
Раствор 1,41 г (7,5 ммол) трис(2-аминоэтил)-амина в 20 мл этинола добавлялся каплями к охлажденному на льду раствору 3,09 г (25 ммол) 6-метил-2-пиридин-карбоксальдегида в 10 мл безводного этанола при перемешивании и смесь перемешивалась при комнатной температуре в течение восьми часов. Смесь концентрировалась посредством дистилляции раствора и осадок экстрагировался с 500 мл теплого гексана. Экстракт охлаждался в рефрижераторе в течение ночи, после чего выделялось красновато-коричневое масло в виде экстракта. Масло выделялось и просушивалось в вакууме, чтобы получить 3,1 г (82% выхода) желаемого соединения амина 8-02.
FD-MS:497.
(приготовление комплекса).
3,64 г (8 ммол) соединения амина растворялись в 20 мл безводного метанола в атмосфере азота, чтобы получить красно- оранжевый раствор. 1,9 г (7,6 ммол) CuSO4•5H2O засыпались в известковый раствор в ступе и добавлялись к раствору при комнатной температуре, чтобы получить черно-голубой раствор. После перемешивания раствора в течение 12 часов при комнатной температуре он экстрагировался трижды с 20 мл гексана. Метанол удалялся посредством дистилляции из экстракта. Осадок перемешивался в 10 мл ацетонитрила при температуре 160oC и затем фильтровался. Твердая масса в виде шлама сливалась в 10 мл метиленхлорида при комнатой температуре и фильтровалась. Твердая масса промывалась гексаном и просушивалась в вакууме, чтобы получить 2,85 г (53% выхода) желаемого комплекса в виде красновато-коричневого порошка.
Элементарный анализ: Cu; 11,3(9,0), C; 40,0(46,0), H; 6,0(6,1), N; 13,1(13,9), S; 4,8(4,5). Значения величин в скобках являются рассчитанными величинами пентагидрата.
В результате использования соответственно селектированных альдегидов и аминов можно было получить полифункциональные соединения с открытой цепью 8-01 до 8-03 таким же способом.
5. Соединение комплекса меди полифункционального амина с открытой цепью 12-02.
(приготовление 12-02).
Раствор 4,10 г (40 ммол) 2,3-бутандионион-оксима в 20 мл этанола добавлялся постепенно каплями к раствору 5,8 г (40 ммол) 3,31 -диамино-n-метилдипропил-амина в 20 мл этанола при комнатной температуре при перемешивании. Смесь орошалась при нагревании в течение шести часов. После охлаждения смесь концентрировалась посредством дистилляции раствора, чтобы выделить масло, и добавлялось 6 мл метиленхлорида к маслу, чтобы растворить в нем масло. Смесь перемешивали с 6 мл гексана с последующим разделением раствора на две фазы. Таким образом, раствор экстрагировался трижды. Выделялась незначительная фаза и концентрировалась посредством дистилляции раствора, чтобы получить 6,67 (количественно) желаемого соединения амина в виде темно-красного масла - сиропа.
FM-DS:311.
(приготовление комплекса).
0,9 г (2,9 ммол) соединения амина растворялись в 20 мл безводного метанола в атмосфере азота, чтобы получить желтый раствор. 0,62 г (2,5 ммол) CuSO4•5H2O засыпались в известковый раствор в ступе и добавлялись к раствору при комнатной температуре при перемешивании, чтобы получить зеленовато-черный раствор. Раствор перемешивался в течение 12 часов при комнатной температуре и затем нагревался до температуры 60oC в течение четырех часов. Раствор затем охлаждался до комнатной температуры и экстрагировался с 20 мл гексана трижды. Раствор концентрировался посредством дистилляции метанола. Осадок растворялся в 3 мл метанола, и 20 мл ацетонитрила добавлялись к раствору, чтобы получить в осадке твердую массу. Твердая масса сливалась в виде шлама в 10 мл ацетонитрила и затем промывалась гексаном с последующим просушиванием в вакууме, чтобы получить 0,9 г (64% выхода) желаемого комплекса в виде зеленовато-черного порошка.
Элементарный анализ: Cu; 13,0(12,5), C; 30,5(32,1), H; 6,7(7,0) N; 12,3(12,5) S; 7, 8(5,7). Значения величин в скобках являются рассчитанными величинами пентагидрата.
Благодаря использованию соответственно селектированных оксимов и диаминов могут быть получены полифункциональные соединения с открытой цепью 12-01 до 12-13 таким же образом.
Реферат
Изложен способ получения арилалкилгидропероксидов, который заключается в селективном окислении арилалкилуглеводородов, имеющих формулу I
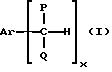
Формула
где P и Q являются алкильными группами и могут быть одинаковы или отличны друг от друга;
x является целым числом от 1 до 3;
Ar является ароматической углеводородной группой, имеющей валентность X,
кислородсодержащим газом в присутствии катализатора на основе комплекса переходного металла, отличающийся тем, что комплекс переходного металла содержит в качестве лиганда циклическое полифункциональное аминосоединение, имеющее по крайней мере три атома азота в кольце, образующем молекулярную цепь, или полифункциональное аминосоединение с открытой цепью, имеющее по крайней мере три атома в главной цепи молекулы, при условии, что комплекс переходного металла не является комплексом порфирина или комплексом фталоцианина.
где A означает независимо алкилен, имеющий 1 - 6-углеродов в главной цепи группы, фенилен, нафтилен (нафталиндиил), фенантрилен (фенантрендиил), пиридиндиил, пирролдиил, пиразиндиил, пиримидиндиил или 1,3,5-триазиндиил и может содержать неактивные заместители;
R означает независимо водород, алкил, арил, алкиларил или арилалкил, и алкил, арил, алкиларил или арилалкил могут содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b;
m означает 0 или положительное целое 1 или больше.
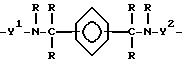
где B является дивалентной органической группой, имеющей формулу IV
или
где Y1 и Y2 независимо являются алкиленом, имеющим 1 - 6 углеродов в главной цепи группы, или фениленом, и может содержать неактивные заместители;
R независимо означает водород, алкил, арил, алкиларил или арилалкил, и алкил, арил, алкиларил или арилалкил могут содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b.
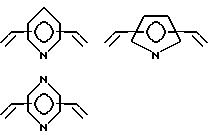
где A независимо является алкиленом, имеющим 1 - 6 углеродов в главной цепи группы, фениленом, нафтиленом, фенантриленом, пиридиндиилом, пирролдиилом, пиразиндиилом, пиримидиндиилом или 1,3,5-триазиндиилом, и может содержать неактивные заместители;
B является бис(алкилиденом), имеющим 2 - 10 углеродов в главной цепи группы
и может содержать неактивные заместители;
R является независимо водородом, алкилом, арилом, алкиларилом или арилалкилом, и алкил, арил, алкиларил или арилалкил могут содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b;
m означает 0 или положительное целое число 1 или более.
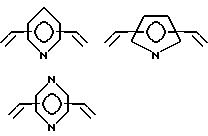
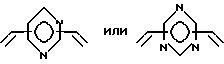
где A независимо является алкиленом, имеющим 1 - 6 углеродов в главной цепи группы, фениленом, нафтиленом, фенантриленом, пиридиндиилом, пирролдиилом, пиразиндиилом, пиримидиндиилом или 1,3, 5-триазиндиилом, и может содержать неактивные заместители;
B является бис(алкилиденом), имеющим 2 - 10 углеродов в главной цепи группы
и может содержать неактивные заместители;
R независимо означает водород, алкил, арил, алкиларил или арилалкил, и алкил, арил, алкиларил или арилалкил могут содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b;
m означает 0 или положительное целое число 1 или более.
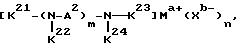
где A2 независимо является алкиленом, имеющим 1 - 6 углеродов в главной цепи группы, o-фениленом, m-фениленом, p-фениленом, 1,8-нафтиленом, 9,10-фенантриленом, 2,6-пиридиндиилом, 3,6-акридиндиилом, 2,2'-бипиридил - 6,6'-диилом, 1,10-фенантролин - 2,9-диилом, 2,6-пиримидиндиилом, 4,5-пиримидиндиилом, 2,6-пиразиндиилом, 2-фенил -1,3,5- триазин-2,6-диилом,
где R1 является алкиленом с 1 - 8 углеродами, и R2 является алкилом с 1 - 8 углеродами, арилом с 1 - 8 углеродами, арилалкилом с 7 - 14 углеродами или алкиларилом с 7 - 14 углеродами, и R1 и R2 могут содержать неактивные заместители;
K21, K22, K23 и K24 независимо являются водородом, алкилом, арилом, алкиларилом, арилалкилом, пиридилом, пиридилалкилом или хинолилом, где алкил, арил, алкиларил, арилалкил, пиридил, пиридилалкил или хинолил могут содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b;
m является положительным целым числом 2 или более.
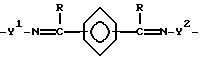
[K31 = N - A3 - N = K32] Ma+(Xb-)n,
где A3 независимо является алкиленом, имеющим 1 - 6 углеродов в главной цепи группы, o-фениленом, m-фениленом, p-фениленом, 1,8-нафтиленом, 9,10-фенантриленом, 2,6-пиридиндиилом, 3,6-акридиндиилом, 2,2'-бипиридил-6,6'-диилом, 1,10-фенантролин-2,9-диилом, 2, 6-пиримидиндиилом, 4,5-пиримидиндиилом, 2,6-пиразиндиилом, 2-фенил-1,3,5-триазин-2,6-диилом,
где R является алкиленом с 1 - 8 углеродами, и R является алкилом с 1 - 8 углеродами, арилом с 1 - 8 углеродами, арилалкилом с 7 - 14 углеродами или алкиларилом с 7 - 14 углеродами, и может содержать неактивные заместители;
K31 и K32 являются 2-аминобензилиденом и могут содержать неактивные заместители; M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b.
[K41 = N - A4 - N = K42]Ma+(Xb-)n,
где A4 независимо является алкиленом, имеющим 1 - 6 углеродов в главной цепи группы, o-фениленом, m-фениленом, p-фениленом, 1,8-нафтиленом, 9,10-фенантриленом, 2,6-пиридиндиилом, 3,6-акридиндиилом, 2,2'-бипиридил - 6, 6'-диилом, 1,10-фенантролин-2,9-диилом, 2,6-пиримидиндиилом, 4,5-пиримидиндиилом, 2,6-пиразиндиилом, 2-фенил-1,3,5-триазин-2,6-диилом,
где R1 является алкиленом с 1 - 8 углеродами, и R является алкилом с 1 - 8 углеродами, арилом с 1 - 8 углеродами, арилалкилом с 7 - 14 углеродами или алкиларилом с 7 - 14 углеродами и может содержать неактивные заместители;
K41 и K42 являются 2-пиридилметиленом или 6-метил-2-пиридилметиленом и могут содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоином, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b.
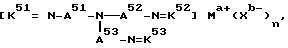
где с A51 по A53 являются независимо алкиленом, имеющим 1 - 6 углеродов в главной цепи группы и могут содержать неактивные заместители;
с K51 по K53 являются бензилиденом, 2-пиридилметиленом или 6-метил-2-пиридилметиленом и могут содержать неактивные заместители; M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b.
[K61 - N = A6 = N - K62]Ma+(Xb-)n,
где A6 означает
и может содержать неактивные заместители;
K61 и K62 являются 2-пиридилом, 3-пиридилом, 8-хинолилом или аминоалкилом, причем алкил имеет 2 - 4 углерода и может содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b.
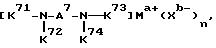
где A7 означает
и может содержать неактивные заместители;
K71 - K74 являются 2-пиридилом, 3-пиридилом, 2-пиридилметилом или 3-пиридилметилом и могут содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b.
[K81 = N - A8 - N = K82]Ma+(Xb-)n,
где A8 независимо является алкиленом, имеюшим 1 - 6 углеродов в главной цепи группы, o-фениленом, m-фениленом, p-фениленом, 1,8-нафтиленом, 9,10-фенинтриленом, 2,6-пиридиндиилом, 3,6-акридиндиилом, 2,2'-бипиридил - 6,6'-диилом, 1,10-фенантролин-2,9-диилом, 2,6-пиримидиндиилом, 4, 5-пиримидиндиилом, 2,6-пиразиндиилом, 2-фенил-1,3,5-триазин-2,6-диилом,
где R1 является алкиленом из 1 - 8 углеродов, и R2 является алкилом из 1 - 8 углеродов, арилом из 1 - 8 углеродов, арилалкилом из 7 - 14 углеродов или алкиларилом из 7 - 14 углеродов, и может содержать неактивные заместители;
K81 и K82 являются группой формулы
-T - N = CR81 - CR82 =,
где T является гидроксилом, амино или общей формулой
-NR4R5,
где R4 и R5 независимо являются алкилом с 1 - 6 углеродами и могут содержать неактивные заместители;
R81 и R82 независимо являются водородом, алкилом с 1 - 6 углеродами или фенилом, причем алкил или фенил могут содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b.
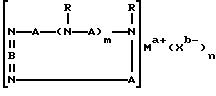
где A означает независимо алкилен, имеющий 1 - 6 углеродов в главной цепи группы, фенилен, нафтилен (нафталиндиил), фенантрилен (фенантрендиил), пиридиндиил, пирролдиил, пиразиндиил, пиримидиндиил или 1,3,5-триазиндиил и может содержать неактивные заместители;
R означает независимо водород, алкил, арил, алкиларил или арилалкил, и алкил, арил, алкиларил или арилалкил могут содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b;
m означает 0 или положительное целое число 1 или больше.
где B является дивалентной органической группой, имеющей формулу IV
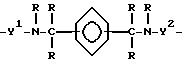
или
где Y1 и Y2 независимо являются алкиленом, имеющим 1 - 6 углеродов в главной цепи группы, или фениленом, и может содержать неактивные заместители, R независимо означает водород, алкил, арил, алкиларил или арилалкил, и алкил, арил, алкиларил или арилалкил могут содержать неактивные заместители, M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b.
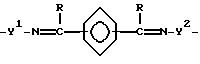
где A независимо является алкиленом, имеющим 1 - 6 углеродов в главной цепи группы, фениленом, нафтиленом, фенантриленом, пиридиндиилом, пирролдиилом, пиразиндиилом, пиримидиндиилом или 1,3,5-триазиндиилом, и может содержать неактивные заместители;
B является бис(алкилиденом), имеющим 2 - 10 углеродов в главной цепи группы
и может содержать неактивные заместители;
R является независимо водородом, алкилом, арилом, алкиларилом или арилалкилом, и алкил, арил, алкиларил или арилалкил могут содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b;
m означает 0 или положительное целое число 1 или более.
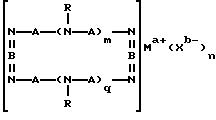
где A независимо является алкиленом, имеющим 1 - 6 углеродов в главной цепи группы, фениленом, нафтиленом, фенантриленом, пиридиндиилом, пирролдиилом, пиразиндиилом, пиримидиндиилом или 1,3,5-триазиндиилом, и может содержать неактивные заместители;
B является бис(алкилиденом), имеющим 2 - 10 углеродов в главной цепи группы
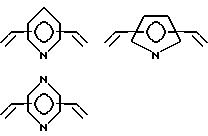
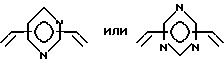
и может содержать неактивные заместители;
R независимо означает водород, алкил, арил, алкиларил или арилалкил, и алкил, арил, алкиларил или арилалкил могут содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b; m означает 0 или положительное целое число 1 или более.
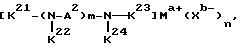
где A2 независимо является алкиленом, имеющим 1 - 6 углеродов в главной цепи группы, o-фениленом, m-фениленом, p-фениленом, 1,8-нафтиленом, 9,10-фенантриленом, 2,6-пиридиндиилом, 3, 6-акридиндиилом, 2,2'-бипиридил-6,6'-диилом, 1,10-фенантролин-2,9-диилом, 2,6-пиримидиндиилом, 4,5-пиримидиндиилом, 2,6-пиразиндиилом, 2-фенил-1,3,5-триазин-2,6-диилом.
где R1 является алкиленом с 1 - 8 углеродами, и R2 является алкилом с 1 - 8 углеродами, арилом с 1 - 8 углеродами, арилалкилом с 7 - 14 углеродами или алкиларилом с 7 - 14 углеродами, и R1 и R2 могут содержать неактивные заместители;
K21, K22, K23 и K24 независимо являются водородом, алкилом, арилом, алкиларилом, арилалкилом, пиридилом, пиридилалкилом или хинолилом, где алкил, арил, алкиларил, арилалкил, пиридил, пиридилалкил или хинолил могут содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b;
m является положительным целым числом 2 или более.
[K31 = N - A3 - N = K32] Ma+(Xb-)n,
где A3 независимо является алкиленом, имеющим 1 - 6 углеродов в главной цепи группы, o-фениленом, m-фениленом, p-фениленом, 1,8-нафтиленом, 9,10-фенантриленом, 2,6-пиридиндиилом, 3,6-акридиндиилом, 2,2'-бипиридил - 6,6'-диилом, 1,10-фенантролин-2,9-диилом, 2,6-пиримидиндиилом, 4,5-пиримидиндиилом, 2,6-пиразиндиилом, 2-фенил-1,3,5-триазин-2,6-диилом,
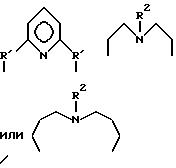
где R1 является алкиленом с 1 - 8 углеродами, и R2 является алкилом с 1 - 8 углеродами, арилом с 1 - 8 углеродами, арилалкилом с 7 - 14 углеродами или алкиларилом с 7 - 14 углеродами, и может содержать неактивные заместители;
K31 и K32 являются 2-аминобензилиденом и могут содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b.
[K41 = N - A4 - N = K42]Ma+(Xb-)n,
где A4 независимо является алкиленом, имеющим 1 - 6 углеродов в главной цепи группы, o-фениленом, m-фениленом, p-фениленом, 1,8-нафтиленом, 9, 10-фенантриленом, 2,6-пиридиндиилом, 3,6-акридиндиилом, 2,2'-бипиридил-6,6'-диилом, 1,10-фенантролин-2,9-диилом, 2,6-пиримидиндиилом, 4,5-пиримидиндиилом, 2,6-пиразиндиилом, 2-фенил-1,3,5-триазин-2, 6-диилом,
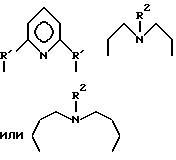
где R1 является алкиленом с 1 - 8 углеродами, и R2 является алкилом с 1 - 8 углеродами, арилом с 1 - 8 углеродами, арилалкилом с 7 - 14 углеродами или алкиларилом с 7 - 14 углеродами и может содержать неактивные заместители;
K41 и K42 являются 2-пиридилметиленом или 6-метил-2-пиридилметиленом и могут содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b.
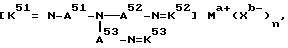
где с A51 по A53 являются независимо алкиленом, имеющим 1 - 6 углеродов в главной цепи группы и могут содержать неактивные заместители;
K51 по K53 являются бензилиденом, 2-пиридилметиленом или 6-метил-2-пиридилметиленом и могут содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b.
[K61 - N = A6 = N - K62]Ma+(Xb-)n,
где A6 означает
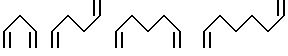
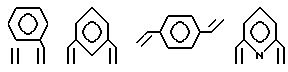
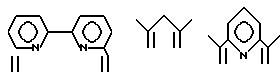
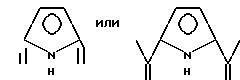
и может содержать неактивные заместители;
K61 и K62 являются 2-пиридилом, 3-пиридилом, 8-хинолилом или аминоалкилом, причем алкил имеет 2 - 4 углерода и может содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b.
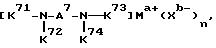
где A означает
и может содержать неактивные заместители;
K71 - K74 являются 2-пиридилом, 3-пиридилом, 2-пиридилметилом или 3-пиридилметилом и могут содержать неактивные заместители;
M означает центральный ион переходного металла, имеющий валентность +a;
X является противоионом, имеющим валентность -b, которая устойчива при окислении;
a означает целое число 1 - 4;
b означает положительное целое число;
n означает целое число 1 - 4, n равно a/b.
14.03.95 по п. 1, где комплекс переходного металла содержит в качестве лиганда циклическое аминосоединение, имеющие 3 атома азота в кольце и по п. 2, где m = 0;
28.02.95 по п. 1, где комплекс переходного металла содержит в качестве лиганда циклическое полифункциональное аминосоединение, имеющее четыре или более атомов азота в молекуле; по п.2, где m > 1 и по п.15;
24.05.95 по п. 1, где комплекс переходного металла содержит в качестве лиганда полифункциональное аминосоединение с открытой цепью, имеющее три или более атомов азота в молекуле; частично по п.8.

Комментарии