Модулирование хемосенсорных рецепторов и связанных с ними лигандов - RU2586282C2
Код документа: RU2586282C2
Чертежи










Описание
Данная заявка устанавливает приоритет заявки США № 11/760592, озаглавленной "Modulation of Chemosensory Receptors and Ligands Associated Therewith", поданной 8 июня 2007; заявки США № 11/836074, озаглавленной "Modulation of Chemosensory Receptors and Ligands Associated Therewith", поданной 8 августа 2007; и заявки США № 61/027410, озаглавленной "Modulation of Chemosensory Receptors and Ligands Associated Therewith", поданной 8 февраля 2008. Содержание этих заявок включено полностью в качестве ссылок.
УРОВЕНЬ ТЕХНИКИ
Вкусовая система обеспечивает сенсорную информацию о химическом составе внешнего мира. Трансдукция вкуса является одной из наиболее комплексных форм химически-инициированных ощущений у животных. Сигнализацию вкуса находят во всем животном царстве, начиная с простейших многоклеточных до наиболее сложных позвоночных. Считается, что ощущения, связанные со вкусом, включают отдельные сигнальные пути, медиированные рецепторами, например, метаботропическими или ионотропическими рецепторами. Клетки, которые экспрессируют рецепторы при обработке определенными химическими стимулами активируют вкусовое ощущение через деполяризацию с образованием потенциала действия, который, как полагают, инициирует чувство. Полагают, что это событие инициирует выделение нейтротрансмиттеров в синапсах вкусовых афферентных нейронов, тем самым, инициируя подачу сигнала вдоль нейронных путей, которые медиируют вкусовые ощущения.
Как таковые, вкусовые рецепторы специфически распознают молекулы, которые активируют определенные вкусовые ощущения. Эти молекулы также называют здесь «тестанты». Множество вкусовых рецепторов принадлежат к суперсемейству 7-трансмембранных рецепторов, которые также известны как рецепторы, сопряженные с G-белком (GPCR). Полагают, что другие вкусы медиируются канальными белками Рецепторы, сопряженные с G-белком, контролируют множество физиологических функций, таких как эндокринная функция, экзокринная функция, частота сердечных сокращений, липолиз, метаболизм углеводов и подача трансмембранных сигналов.
Например, семейство C рецепторов, сопряженных с G-белком (GPCR) человека включает восемь рецепторов метаботропического глутамата (mGlu(l-8)), два рецептора гетеродимерной гамма-аминомасляной кислоты(B) (GABA(B)), кальций-чувствительный рецептор (CaR), три вкусовых рецептора (T1R), рецептор смешанной L-альфа-аминокислоты (GPRC6A) и пять рецепторов-сирот. Семейство C GPCR характеризуется большим амино-концевым доменом, который связывает эндогенные ортостерические агонисты. Кроме того, были описаны аллостерические модуляторы, которые связываются с семью трансмембранными доменами рецепторов.
В общем, при связывании лиганда с GPCR, рецептор предположительно претерпевает конформационное изменение, ведущее к активации G-белка. G-белки состоят из трех подъединиц: гуанилнуклеотид-связывающей α-подъединицы, β-подъединицы и γ-подъедницы. G-белки циклируют между двумя формами, в зависимости от того, GDP или GTP привязан к α-подъединице. Если привязан GDP, G-белок существует в виде гетеротримера: Gαβγ комплекс. Если привязан GTP, α-подъедница отделяется от гетеротримера, что дает Gβγ комплекс. Если Gαβγ комплекс оперативно связывается с активированным рецептором, сопряженным с G-белком в мембране клетки, скорость обмена GTP на связанный GDP повышается, и скорость отделения связанной Gα подъединицы от Gαβγ комплекса возрастает. Свободная Gα подъединица и Gβγ комплекс, таким образом, способны передавать сигнал в расположенные ниже элементы множества путей сигнальной трансдукции. Эти события образуют основу для множества различных сигнальных явлений в клетках, включая, например, сигнальное явление, которое идентифицируется как нейрологические сенсорные ощущения, такие как вкус и/или запах.
Полагают, что млекопитающие различают пять основных вкусовых ощущений: сладкое, горькое, кислое, соленое и вкус белковых веществ (вкус глутамата натрия). Множественные физиологические исследования на животных показали, что клетки вкусовых рецепторов могут селективно реагировать на различные химические стимулы. У млекопитающих клетки вкусовых рецепторов собраны во вкусовых сосочках, которые распределены в различных бугорках эпителия языка. Окруженные бугорки, найденные в задней части языка, содержат от сотен до тысяч вкусовых сосочков. Наоборот, листовидные сосочки, расположенные на заднем боковом крае языка, содержат от дюжин до сотен вкусовых сосочков. Далее, грибовидные сосочки, расположенные в передней части языка, содержат только один или несколько вкусовых сосочков.
Каждый вкусовой сосочек, в зависимости от вида, содержит 50-150 клеток, включая клетки-предшественники, поддерживающие клетки и клетки вкусовых рецепторов. Клетки рецепторов иннервированы в основании афферентными нервными окончаниями, которые передают информацию во вкусовые центры коры головного мозга через синапсы в стволе мозга и таламусе. Объяснение механизмов подачи сигналов вкусовыми клетками и обработки информации важно для понимания функции, регулирования и восприятия вкусового ощущения.
Вкусовая система была выбрана в процессе эволюции так, чтобы определять питательные и полезные соединение, а также вредные или токсические вещества. Вне языка экспрессия Gαgust также происходит в клетках желудка и поджелудочной железы, что позволяет предположить существование механизма ощущения вкуса в желудочно-кишечном (ЖК) тракте. Экспрессия вкусовых рецепторов также была найдена в выстилке желудка и кишечника, что позволяет предположить участие вкусовых рецепторов в молекулярном восприятии терапевтических объектов и токсинов.
Полные или частичные последовательности множественных человеческих и других эукариотических хемосенсорных рецепторов известны в настоящее время. В течение нескольких последних лет множество групп, включая заявителя Senomyx, Inc., описали идентификацию и клонирование генов двух семейств GPCR, которые вовлечены в моделирование вкуса, и получили экспериментальные результаты, относящиеся к пониманию биологии вкуса. Эти результаты показывают, что горький, сладкий и вкус белковых веществ, также называемый вкус белковых веществ, инициируется активацией двух типов специфических рецепторов, расположенных на поверхности клеток вкусовых рецепторов (TRC) на языке, т.е. T2R и T1R. В настоящее время полагают, что, по крайней мере, от 26 до 33 генов кодируют функциональные рецепторы (T2R) для веществ с горьким вкусом у человека и грызунов, соответственно.
По контрасту, существует только 3 T1R, T1R1, T1R2 и T1R3, которые вовлечены во вкус белковых веществ и сладкий вкус. Структурно, T1R и T2R рецепторы обладают отличительными признаками рецепторов, сопряженных с G-белком (GPCR), т.е. 7-трансмембранных доменов, имеющих на концах небольшие экстрацеллюлярные и интрацеллюлярные амино и карбоксильные окончания, соответственно.
T2Rs был клонирован из различных млекопитающих, включая крыс, мышей и человека. T2R включают новое семейство человеческих и крысиных рецепторов, сопряженных с G-белком, которые экспрессируются в подклассе клеток вкусовых рецепторов языка и небного эпителия. Эти вкусовые рецепторы организованы в кластерах во вкусовых клетках и генетически связаны с локусами, которые влияют на горький вкус. Тот факт, что T2R модулирует горький вкус, был продемонстрирован в клеточных анализах. Например, было показано, что mT2R-5, hT2R-4 и mT2R-8 активируются горькими молекулами в in vitro анализе густицидина, что дает экспериментальное подтверждение тому, что T2R действуют как рецепторы горького вкуса. См. также T2R, описанные в патенте США № 7105650.
Члены семейства T1R в общем включают T1R1, T1R2 и T1R3, например, rT1R3, mT1R3, hT1R3, rT1R2, mT1R2, hT1R2 и rT1R1, mT1R1 и hT1R1. Известно, что три члена гена T1R, T1R1, T1R2 и T1R3 образуют функциональные гетеродимеры, которые специфически распознают сладости и аминокислоты. Обычно полагают, что сочетание T1R2/T1R3 распознает природные и искусственные сладости, тогда как сочетание T1R1/T1R3 распознает несколько L-аминокислот и глутамат натрия (MSG), соответственно. Например, со-экспрессия T1R1 и T1R3 в рекомбинантных клетках хозяина дает гетеро-олигомерный вкусовой рецептор, который отвечает стимуляторам вкуса белковых веществ. Стимуляторы вкуса белковых веществ включают, глутамат натрия и другие молекулы, которые обладают «острым» вкусом. Наоборот, со-экспрессия T1R2 и T1R3 в рекомбинантных клетках хозяина дает гетеро-олигомерный рецептор сладкого вкуса, который реагирует на природные и искусственные сладости.
Существует необходимость в данной области техники в разработке различных путей идентификации соединений или других веществ, подходящих для модификации рецепторов и их лигандов, связанных с хемосенсорным или родственным хемосенсорному ощущением или реакцией. Кроме того, существует необходимость в соединениях или других веществах с такими характеристиками.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение основано, по крайней мере, частично, на открытии, что экстраклеточный домен, например, домен венериной мухоловки хемосенсорного рецептора, особенно одно или более взаимодействующих сайтов домена венериной мухоловки, является подходящей целью для соединений или других веществ для модулирования хемосенсорного рецептора и/или его лигандов. Следовательно, данное изобретение относится к способам скрининга для идентификации модификаторов хемосенсорных рецепторов и их лигандов, а также модификаторам, способным модулировать хемосенсорные рецепторы и их лиганды.
В одном варианте, в данном изобретении представлен способ скрининга варианта модификатора лиганда хемосенсорного рецептора. Способ включает определение того, подходит ли тестируемое вещество для взаимодействия с хемосенсорным рецептором через место взаимодействия в домене венериной мухоловки хемосенсорного рецептора.
В другом варианте, в данном изобретении представлен способ скрининга варианта модификатора лиганда хемосенсорного рецептора. Способ включает определение того, подходят ли тестируемое вещество для взаимодействия с хемосенсорным рецептором через первое место взаимодействия в домене венериной мухоловки хемосенсорного рецептора, где первое место взаимодействия идентифицируется в свете второго места взаимодействия, идентифицированного на основе взаимодействия между лигандом хемосенсорного рецептора и хемосенсорным рецептором.
В еще одном варианте, в данном изобретении представлен способ скрининга варианта модификатора хемосенсорного рецептора. Способ включает определение того, подходит ли тестируемое вещество для взаимодействия с хемосенсорным рецептором через место взаимодействия в домене венериной мухоловки хемосенсорного рецептора, где место взаимодействия включает взаимодействующий остаток, выбранный из группы, включающей N143, S144, I167, S40, S144, S165, Y103, D142, P277, K65, R383, D307, E302, D278, P185, T184, T326, E302, V384, A305, I325, I306, D307, E382, I279, I67, V66, V309, S303, T242, F103, Q328 и S168 T1R2 и их сочетание, где тестируемое вещество, подходящее для взаимодействия с местом взаимодействия хемосенсорного рецептора, является характерным кандидатом модификатора хемосенсорного рецептора.
В еще одном варианте, в данном изобретении представлен способ модулирования активности лиганда хемосенсорного рецептора. Способ включает контакт модификатора лиганда хемосенсорного рецептора с клетками, содержащими T1R2 домен венериной мухоловки в присутствии лиганда хемосенсорного рецептора, где модификатор лиганда хемосенсорного рецептора взаимодействует с местом взаимодействия хемосенсорного рецептора.
В еще одном варианте, в данном изобретении представлен модификатор лиганда хемосенсорного рецептора, где в присутствии лиганда хемосенсорного рецептора он взаимодействует с T1R2 доменом венериной мухоловки через, по крайней мере, три взаимодействующих остатка, выбранных из группы, включающей N143, S144, I167, S40, S144, S165, Y103, D142, P277, K65, R383, D307, E302, D278, P185, T184, T326, E302, V384, A305, I325, I306, E382, I279, I67, V66, V309, S303, T242, F103, Q328 и S168 T1R2.
В еще одном варианте, в данном изобретении представлен модификатор лиганда хемосенсорного рецептора, имеющий структуру формулы (I):

или его таутомер, соль, сольват и/или его сложный эфир, где:
G образует одинарную связь с либо D, либо E и двойную связь с другим D или E;
R1 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -CN, -NO2, -OR3, -S(O)aR3, -NR3R4, -CONR3R4, -CO2R3, -NR3CO2R4, -NR3CONR4R5, -NR3CSNR4R5, -NR3C(=NH)NR4R5, -SO2NR3R4, -NR4SO2R3, -NR3SO2NR4R5, -B(OR3)(OR4), -P(O)(OR3)(OR4) или -P(O)(R3)(OR4);
R2 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -CN, -NO2, -OR6, -S(O)bR6, -NR6R7, -CONR6R7, -CO2R6, -NR6CO2R7, -NR6CONR7R8, -NR6CSNR7R8, -NR6C(=NH)NR7R8, -SO2NR5R6, -NR5SO2R6, -NR5SO2NR6R7, -B(OR5)(OR6), -P(O)(OR5)(OR6) или -P(O)(R5)(OR6); или, альтернативно, R1 и R2, вместе с атомами, к которым они присоединены, образуют арильное, замещенное арильное, гетероарильное, замещенное гетероарильное, циклоалкильное, замещенное циклоалкильное, циклогетероалкильное и замещенное циклогетероалкильное кольцо, где кольцо необязательно конденсировано с другим арильным, замещенным арильным, гетероарильным, замещенным гетероарильным, циклоалкильным, замещенным циклоалкильным, циклогетероалкильным или замещенным циклогетероалкильным кольцом;
при условии, что R1 и R2 оба не являются водородом;
A является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, галогеном, -CN, -NO2, -OR9, -S(O)CR9, -NR9COR10, -NHOR9, -NR9R10, -NOR9, -CONR9R10, -CO2R9, -NR9CO2R10, -NR9CONR10R11, -NR9CSNR10R11, -NR9C(=NH)NR10R11, -B(OR10)(OR11), -P(O)(OR10)(OR11) или -P(O)(R10)(OR11);
B является -N- или -C(R12)-;
R12 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -NR13R14, -CN, -OR13, -S(O)dR13, -CO2R13 или -CONR13R14;
G является -C- или -S(O)2-;
при условии, что если G является -S(O)2-, то G образует одинарную связь с E;
если связь между D и G является одинарной связью, то D является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, галогеном, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -OR15, -NH-OR15, -S(O)eR15, -NR15R16, -NH-NHR15, -CO2R15 или -CONR15R16;
если G образует двойную связь с D, то D является =O, =S, =N-OR15 или =N-NHR15;
n равно 0 если G является -S(O)2-, и n равно 1, если G является -C-;
E является -NR17-, -N- или -C(R18)-;
при условии, что E является -NR17- только если G формирует одинарную связь с E;
R17 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом или -CO2R19;
R18 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -NR20R21, -CN, -OR20, -S(O)fR20, -CO2R20 или -CONR20R21;
a, b, c, d, e и f независимо равны 0, 1 или 2; и
R3, R4, R5, R6, R7, R8, R9, R10, R11, R13, R14, R15, R16, R18, R20 и R21 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом; или альтернативно, R3 и R4, R4 и R5, R6 и R7, R7 и R8, R9 и R10, R10 и R11, R13 и R14, R15 и R16, или R20 и R21, вместе с атомами, к которым они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо.
В одном варианте формулы (I), соединение в соответствии с данным изобретением имеет структурную формулу (II):

где:
Y образует одинарную связь либо с W либо с Z, и двойную связь с другим из W или Z;
W является -C(R24)-, -S-, -N-, -N(R25)- или -O-;
Y является -C(R26)- или -N-;
Z является -C(R27)-, -S-, -N-, -N(R28)- или -O-;
R24 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -CN, -NO2, -OR29, -S(O)gR29, -NR29R30, -CONR29R30, -CO2R29, -SO2NR29R30, -NR29SO2R30, -B(OR29)(OR30), -P(O)(OR29)(OR30) или -P(O)(R29)(OR30);
R26 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, галогеном, -CN, -NO2, -OR31, -S(O)hR31, -OCOR31, -NR31R32, -CONR31R32, -CO2R31, -SO2NR31R32, -NR31SO2R32, -B(OR31)(OR32), -P(O)(OR31)(OR32) или -P(O)(R31)(OR32);
R27 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, галогеном, -CN, -NO2, -OR33, -S(O)iR33, -OCOR33, -NR33R34, -CONR33R34, -COR33, -CO2R33, -SO2NR33R34, -NR33SO2R34, -B(OR33)(OR34), -P(O)(OR33)(OR34) или -P(O)(R33)(OR34) или альтернативно, R24 и R26 или R26 и R27 вместе с атомами, к которым они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо;
g, h и i независимо равны 0 или 1;
R25 и R28 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом; и
R29, R30, R31, R32, R33 и R34 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом; или альтернативно, R29 и R30, R31 и R32 или R33 и R34, вместе с атомами, к которым они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо; и
при следующих условиях:
(a) если W является -O- или -S- или -NR25, тогда Z является -C(R27) или -N-; и
(b) если Z является -O- или -S- или -NR28, тогда W является -C(R24) или -N-.
В одном варианте формулы (I), соединение в соответствии с данным изобретением имеет структурную формулу (III):

где:
H является -C(R35)- или -N-;
I является -C(R36) или -N-;
J является -C(R37)- или -N-;
K является -C(R38)- или -N-;
R35 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, галогеном, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -CN, -NO2, -OR39, -S(O)jR39, -OCOR39, -NR39R40, -CONR39R40, -CO2R39, -SO2NR39R40, -NR39SO2R40, -B(OR39)(OR40), -P(O)(OR39)(OR40) или -P(O)(R39)(OR40);
R36 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, галогеном, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -CN, -NO2, -OR41, -S(O)kR41, -OCOR41, -NR41R42, -CONR41R42, -CO2R41, -SO2NR41R42, -NR41SO2R42, -B(OR41)(OR42), -P(O)(OR41)(OR42) или -P(O)(R41)(OR42);
R37 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, галогеном, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом ,-CN, -NO2, -OR43, -S(O)lR43, -OCOR43, -NR43R44, -CONR43R44, -CO2R43, -SO2NR43R44, -NR43SO2R44, -B(OR43)(OR44), -P(O)(OR43)(OR44) или -P(O)(R43)(OR44);
R38 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, галогеном, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -CN, -NO2, -OR45, -S(O)mR45, -OCOR45, -NR45R46, -CONR45R46, -COR45, -CO2R45, -SO2NR45R46, -NR45SO2R46, -B(OR45)(OR46), -P(O)(OR45)(OR46) или -P(O)(R45)(OR46); или альтернативно R36 и R37 или R37 и R38, вместе с атомами, к которым они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо;
j, k, l и m независимо равны 0, 1 или 2; и
R39, R40, R41, R42, R43, R44, R45 и R46 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом или альтернативно R39 и R40, R41 и R42, R43 и R44 или R45 и R46 вместе с атомами, к которым они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо;
при условии, что, не более двух из H, I, J и K являются -N-.
В одном варианте, в данном изобретении представлена принимаемая внутрь композиция, содержащая модификатор лиганда хемосенсорного рецептора, где в присутствии лиганда хемосенсорного рецептора он взаимодействует с T1R2 доменом венериной мухоловки через, по крайней мере, три взаимодействующих остатка, выбранных из группы, включающей N143, S144, I167, S40, S144, S165, Y103, D142, P277, K65, R383, D307, E302, D278, P185, T184, T326, E302, V384, A305, I325, I306, E382, I279, I67, V66, V309, S303, T242, F103, Q328 и S168 человеческого T1R2. В одном варианте, модификатором лиганда хемосенсорного рецептора является соединение, имеющее структурную формулу (I), (II) или (III), или его таутомер, соль, сольват и/или сложный эфир. В другом варианте, принимаемая внутрь композиция также содержит один или более подсластителей.
В одном варианте, в данном изобретении представлен способ улучшения сладкого вкуса принимаемой вовнутрь композиции, включающий взаимодействие принимаемой вовнутрь композиции или ее предшественников с модификатором лиганда хемосенсорного рецептора с получением модифицированной принимаемой вовнутрь композиции. в одном варианте, модификатором лиганда хемосенсорного рецептора является соединение, имеющее структурную формулу (I), (II) или (III), или его таутомер, соль, сольват и/или сложный эфир.
В одном варианте, в данном изобретении представлен способ лечения состояния, связанного с хемосенсорным рецептором, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества вещества, выбранного из группы, включающей модификатор хемосенсорного рецептора, модификатор лиганда хемосенсорного рецептора или их сочетание, где вещество взаимодействует с местом взаимодействия хемосенсорного рецептора. В одном варианте, модификатором лиганда хемосенсорного рецептора является соединение, имеющее структурную формулу (I), (II) или (III), или его таутомер, соль, сольват и/или сложный эфир.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фигуре 1 изображены примерные полиморфные варианты человеческого T1R1.
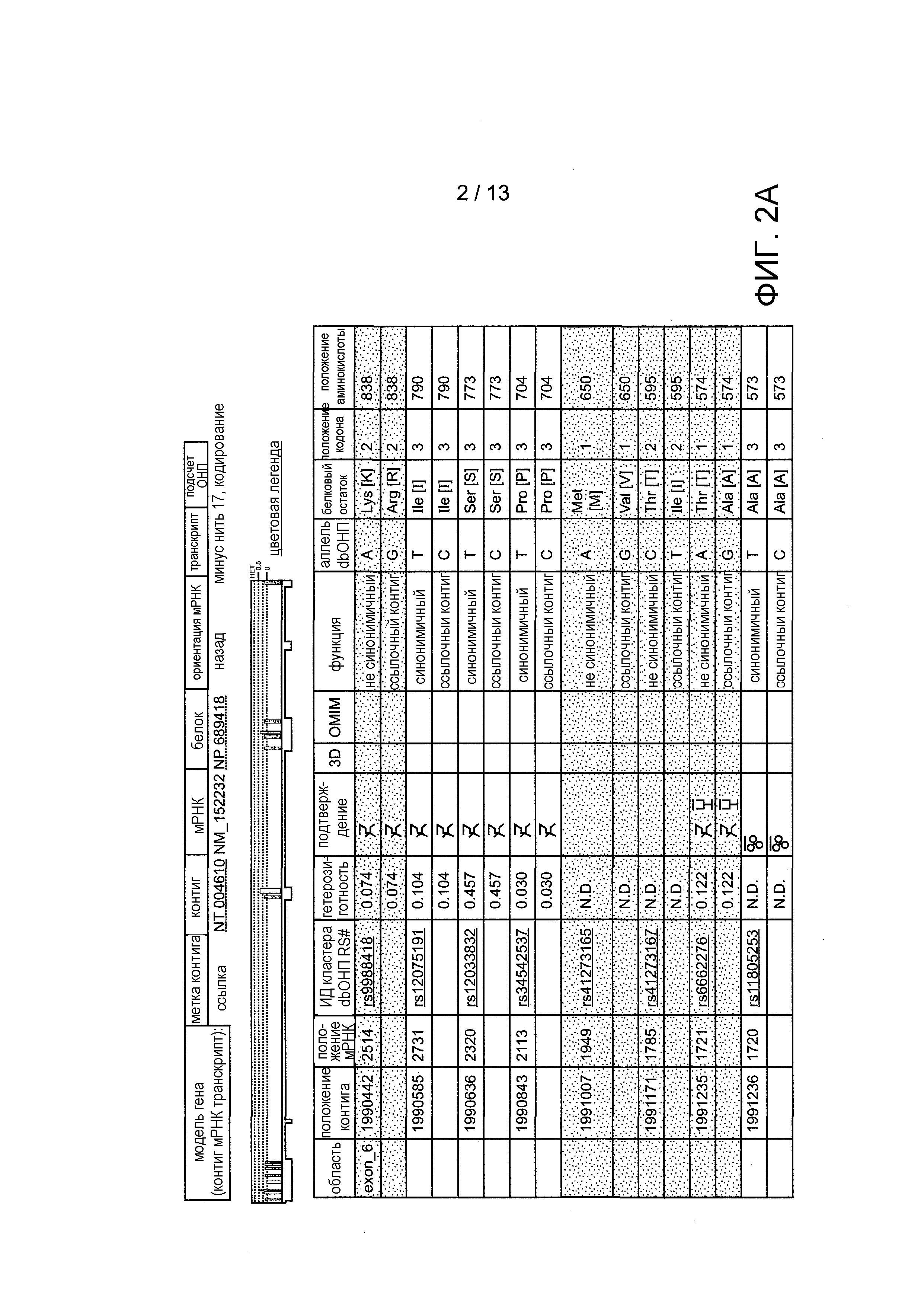
На фигуре 2 изображены примерные полиморфные варианты человеческого T1R2.
На фигуре 3 показаны дендрограммы расположения последовательностей T1R1.
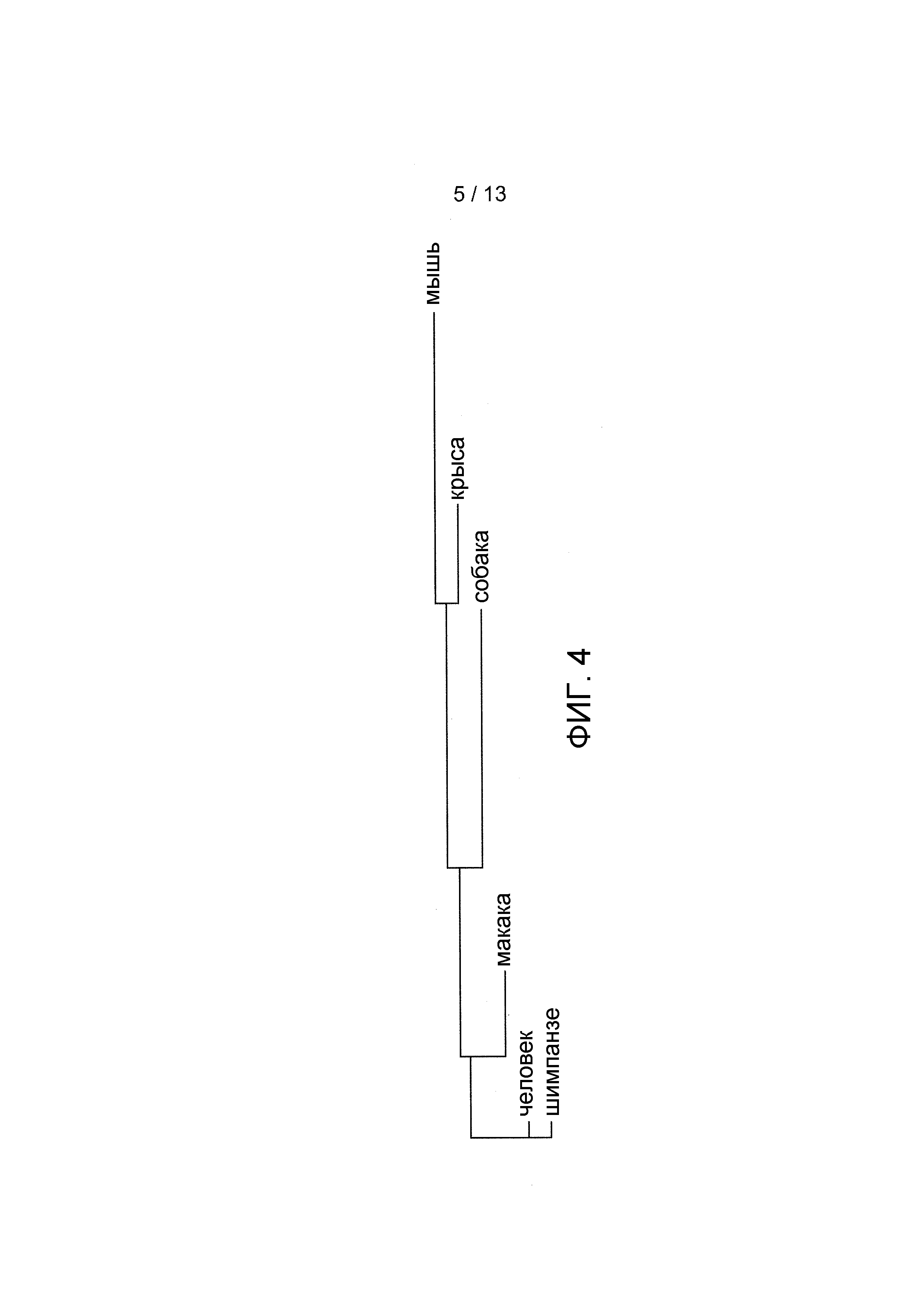
На фигуре 4 показаны дендрограммы расположения последовательностей T1R2.
На фигуре 5 показаны примеры взаимодействующего пространства для сукралозы и одного из соединений в соответствии с данным изобретением. Белок представлен как ленточная диаграмма.
На фигуре 6 показаны примеры взаимодействующего пространства и остатки для сукралозы и одного из соединений в соответствии с данным изобретением. Белок представлен как ленточная диаграмма.
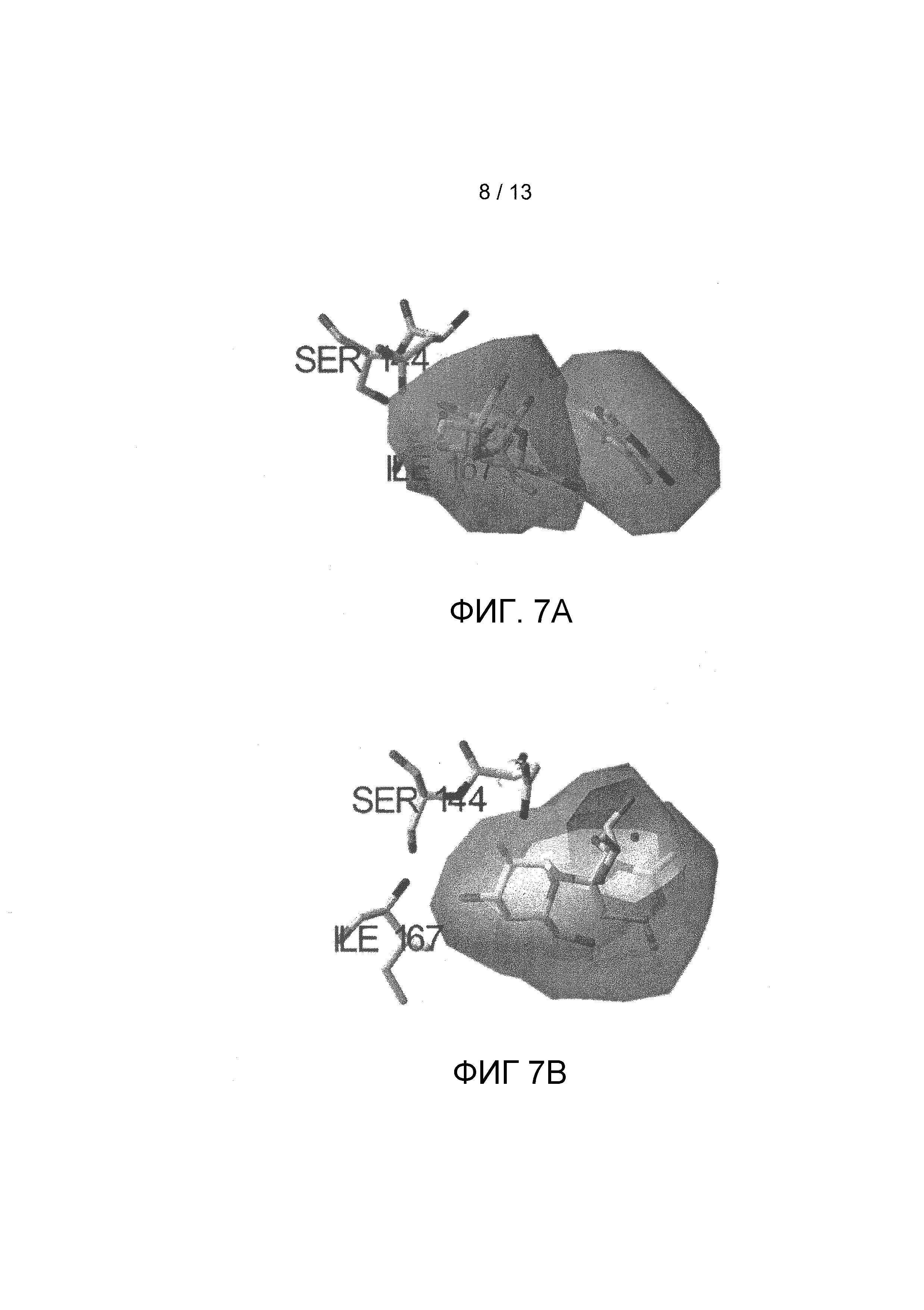
На фигуре 7 показаны примеры взаимодействующего пространства и остатки, связанных с шарниром для сукралозы и одного из соединений в соответствии с данным изобретением.
На фигуре 8 показаны примеры частичных взаимодействующих поверхностей и взаимодействующих остатков, близких к шарниру для сахарозы и сукралозы.
На фигуре 9 показаны примеры взаимодействующего пространства и остатков, связанных с долями для сукралозы и одного из соединений в соответствии с данным изобретением.
На фигуре 10 показаны примеры взаимодействующего пространства и остатков, связанных с местом взаимодействия для сукралозы и одного из соединений в соответствии с данным изобретением.
На фигуре 11 показаны примеры результатов для исследований картирования генов с применением человеческо-крысиных химерных рецепторов.
На фигуре 12 показаны результаты примерных результатов мутагенеза.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Перед подробным описание изобретения даны следующие определения.
Термин "T1R" семейство включает полиморфные варианты, аллели, мутанты и гомологи, которые: (1) имеют около 30-40% идентичной последовательности аминокислот, более конкретно, около 40, 50, 60, 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентичной последовательности аминокислоты к T1R, известным или описанным, например, в заявках на патент США № 10/179373, поданной 26 июня 2002, № 09/799629, поданной 5 апреля 2001 и № 10/035045, поданной 3 января 2002, в промежутке около 25 аминокислот, оптимально, 50-100 аминокислот; (2) специфически связаны с антителами, выработанными против иммуногена, содержащего последовательность аминокислот, выбранную из группы, включающей последовательности T1R, описанные ниже, и их консервативно модифицированные варианты; (3) специфически гибридизируются (с размером, по крайней мере, около 100, необязательно, по крайней мере, около 500-1000 нуклеотидов) в условиях ограничивающей гибридизации до последовательности, выбранной из группы, включающей последовательности ДНК T1R, описанные ниже, и их консервативно модифицированные варианты; (4) включают последовательность, по крайней мере, на около 40% идентичную к группе, включающей последовательность аминокислот T1R, описанную ниже или (5) амплифицированы праймерами, которые специфически гибридизируются в условиях ограниченной гибридизации до описанных последовательностей T1R.
В частности, эти "T1R" включают вкусовые рецепторы GPCR, обозначенные как hT1R1, hT1R2, hT1R3, rT1R1, rT1R2, rT1R3, mT1R1, mT1R2 и mT1R3, имеющие последовательности нуклеиновых кислот и последовательности аминокислот, известные или описанные, например, в заявках на патент США № 10/179373, поданной 26 июня 2002, № 09/799629, поданной 5 апреля 2001 и № 10/035045, поданной 3 января 2002, и их варианты, аллели, мутанты, ортологи и химеры, которые специфически связываются и/или реагируют на сладкие, белковые вещества и любые другие родственные хемосенсорным лиганды, включая активаторы, ингибиторы и улучшители. Также T1R включают вкусовые рецепторы GPCR, экспрессирующиеся у человека или других млекопитающих, например, клетки, связанные со вкусом и/или частью желудочно-кишечной системы, включающей, без ограничений, пищевод, желудок, кишечник (тонкий и толстый), прямую кишку, печень, желчные протоки, поджелудочную железу, желчный пузырь и т.д. Также T1R полипептиды включают химерные последовательности, полученные из частей конкретного полипептида T1R, такого как T1R1, T1R2 или T1R3 различных видов, или объединением частей различных T1R, где такие химерные T1R последовательности объединены с получением функционального рецептора сладкого вкуса или вкуса белковых веществ. Например, химерные T1R могут содержать внеклеточную область T1R, т.е. T1R1 или T1R2, и трансмембранную область другого T1R, либо T1R1 или T1R2.
Топологически, определенные хемосенсорные GPCR имеют "N-концевой домен"; "внеклеточные домены", "трансмембранный домен", содержащий семь трансмембранных областей, и соответствующие цитоплазматические и внеклеточные петли, "цитоплазматические области" и "C-концевую область" (см., например, Hoon et al., Cell 96:541-51 (1999); Bucket et al., Cell 65: 175-87 (1991)). Эти области могут быть структурно идентифицированы с применением методов, известных специалисту в данной области техники, таких как программы анализа последовательности, которые идентифицируют гидрофобные и гидрофильные домены (см., например, Stryer, Biochemistry, (3rd ed. 1988); см. также множество существующих в Интернете программ анализа последовательностей, таких как находятся на dot.imgen.bcm.tmc.edu). Эти области применяют для получения химерных белков и для in vitro исследований в соответствии с данным изобретением, например, анализа связывания лигандов.
"Внеклеточные домены" относятся к доменам хемосенсорных рецепторов, например, T1R полипептидов, которые выделяются из клеточной мембраны и обрабатываются на внеклеточной поверхности клетки. Такие области включают "N-концевой домен" который обрабатывается на внеклеточных поверхностях клетки, а также внеклеточные петли трансмембранного домена, которые обрабатываются на внеклеточной поверхности клетки, т.е. внеклеточные петли между трансмембранными областями 2 и 3, трансмембранными областями 4 и 5, и трансмембранными областями 6 и 7. "N-концевой домен" начинается с N-окончания и длится до области, близкой к началу трансмембранной области. Такие внеклеточные области применяют для in vitro анализов связывания лигандов, в растворимой и твердой фазе. Кроме того, трансмембранные области, описанные ниже, также могут быть вовлечены в связывание лигандов, либо в сочетании с внеклеточными областями, либо отдельно, и поэтому также применяются в in vitro анализах связывания лигандов.
"Трансмембранный домен", который включает семь трансмембранных "областей", относится к доменам хемосенсорных рецепторов, например, T1R полипептидов, которые лежат в мембране плазмы, и могут также включать соответствующие цитоплазматические (внутриклеточные) и внеклеточные петли, также называемые трансмембранными "областями." Семь трансмембранных областей и внеклеточные и цитоплазматические петли могут быть идентифицированы стандартными методами, описанными у Kyte et al., J. Mol. Biol. 157:105-32 (1982)), или у Stryer, выше.
"Цитоплазматические домены" относятся к доменам хемосенсорных рецепторов, например, T1R белкам, которые обращены к внутренней стороне клетки, например, "C-концевой домен" и внутриклеточным петлям трансмембранного домена, например, внутриклеточные петли между трансмембранными областями 1 и 2, трансмембранными областями 3 и 4, и трансмембранными областями 5 и 6. "C-концевые домены" относятся к области, которая простирается от конца последней трансмембранной области до C-окончания белка, и которая обычно расположена в цитоплазме.
Термин "7-трансмембранный рецептор" означает полипептид, принадлежащий к надсемейству трансмембранных белков, которые имеют семь областей, которые охватывают мембрану плазмы семь раз (таким образом, семь областей называются "трансмембранными" или "TM" доменами TM I - TM VII).
Фраза "функциональное действие" или "активность" в контексте описанных анализов для тестируемых соединений, которые модулируют хемосенсорный рецептор, например, улучшают трансдукцию сигнала, медиированного членом семейства T1R, такие как функциональное действие или активность сладкого рецептора или рецептора белковых веществ, включают определение любого параметра, который косвенно или прямо находится под влиянием конкретного хемосенсорного рецептора, например, функционального, физического или химического действий. Они включают, без ограничений, связывание лигандов, изменения ионного потока, мембранный потенциал, ток, транскрипцию, связывание G-белка, фосфорилирование или дефосфорилирование GPCR, трансдукцию сигнала, взаимодействия рецептор-лиганд, концентрации второго мессенджера (например, cAMP, cGMP, IP3 или внутриклеточного Ca2+), in vitro, in vivo и ex vivo, а также включают другие физиологические эффекты, которые повышают или понижают выделение нейротрансмиттера или гормона.
Термин "определение функционального действия" или "активности" рецептора означает исследования соединения, которое повышает или понижает параметр, который косвенно или прямо попадает под влияние хемосенсорного рецептора, например, функциональные, физические или химические эффекты. Такие функциональные эффекты могут быть измерены любыми средствами, известными специалистам в данной области техники, например, изменениями спектроскопических характеристик (например, флуоресценции, абсорбции, коэффициента преломления), гидродинамических (например, формы), хроматографических или свойств растворимости, фиксации потенциала, потенциалочувствительных красителей, цельноклеточных токов, радиоизотопного оттока, индуцируемых маркеров, хемосенсорных рецепторов ооцитов, например, экспрессии T1R гена; хемосенсорного рецептора клеток культуры ткани, например, экспрессии T1R; транскрипционной активацией хемосенсорного рецептора, например, T1R генов; анализами связывания лиганда; изменениями напряжения, мембранного потенциала и проводимости; анализами ионного потока; изменениями во внутриклеточных вторичных мессенджерах, таких как cAMP, cGMP, и трифосфата инозита (IP3); изменениями во внутриклеточных уровнях кальция; выделением нейротрансмиттера и подобными.
"Ингибиторы", "активаторы" и "модификаторы" хемосенсорнго рецептора, например, T1R белков, применяют взаимозаменяемо для обозначения ингибирующих, активирующих или модулирующих молекул, идентифицированных с применением in vitro и in vivo анализов трансдукции хемосенсорного сигнала, например, лигандов, агонистов, антагонистов и их гомологов и миметиков. Ингибиторы включают соединения, которые, например, связываются с, частично или полностью блокируют стимулирование, снижают, предотвращают, задерживают действие, инактивируют, десенсибилизируют или подавляют трансдукцию вкуса, например, антагонисты. Активаторы являются соединениями, которые, например, связываются, стимулируют, увеличивают, открывают, сенсибилизируют или активируют трансдукцию хемосенсорного сигнала, например, агонисты. Модификаторы включают соединения, которые, например, изменяют, прямо или косвенно, активность рецептора или взаимодействие рецептора с его лигандами, например, лигандами рецептора, и необязательно связываются с или взаимодействуют с активаторами или ингибиторами; G-белками; киназами (например, гомологами родопсинкиназы и киназами бета-адренергического рецептора, которые включены в деактивацию и десенсибилизацию рецептора); и аррестинами, которые также деактивируют и десенсибилизируют рецепторы. Модификаторы включают генетически модифицированные версии хемосенсорных рецепторов, например, членов семейства T1R, например, с измененной активностью, а также природных и синтетических лигандов, антагонистов, агонстов, маленьких химических молекул и подобных. Термин "модификатор лиганда хемосенсорного рецептора" в данном описании включает улучшитель хемосенсорного рецептора. В данном изобретении он включает, без ограничений, сладкие лиганды (агонисты или антагонисты), лиганды вкуса белковых веществ (агонисты или антагонисты), сладкие улучшители и улучшители вкуса белковых веществ, и ингибиторы сладкого вкуса или вкуса белковых веществ.
"Улучшитель" относится к соединению, которое модулирует (повышает) активацию конкретного рецептора, предпочтительно, хемосенсорного, например, T1R2/T1R3 рецептора или T1R1/T1R3 рецептора, но которое само по себе не вызывает значительную активацию конкретного рецептора. В данном описании такие улучшители улучшают активацию хемосенсорного рецептора его лигандом. Обычно "улучшитель" является специфическим к конкретному лиганду, т.е. он не улучшает активацию хемосенсорного рецептора хемосенсорными лигандами, отличными от конкретного хемосенсорного лиганда или лигандов, близко родственных ему.
"Предполагаемый улучшитель" относится к соединению, идентифицированному, например, in silico или нет, как потенциальный улучшитель, с применением анализов, описанных здесь, но улучшающее действие которого еще не подтверждено in vivo, например, в подходящих вкусовых тестах.
Термины "полипептид", "пептид" и "белок" применят взаимозаменяемо для обозначения полимера аминокислотных остатков. Термины применяют к аминокислотным полимерам, в которых один или более аминокислотных остатков является искусственным химическим миметиком соответствующей природной аминокислоты, а также к природным аминокислотным полимерам и не природным аминокислотным полимерам.
"Внеклеточный домен" и хемосенсорный рецептор, например, области T1R рецептора и описанные здесь композиции также включают "аналоги" или "консервативные варианты" и "миметики" ("пептидомиметики") со структурами и активностью, которая по существу соответствует примерной последовательности. Таким образом, термины "консервативный вариант" или "аналог" или "миметик" относится к полипептиду, который модифицирует последовательность аминокислоты, так, что изменения не сильно изменяют структуру (консервативный вариант) и/или активность полипептида, как определено здесь. Они включают консервативно модифицированные варианты последовательности аминокислоты, т.е. аминокислотные замещения, добавления или делеции тех остатков, которые не являются критическими для активности белка, или замещение аминокислот с остатками, имеющими похожие свойства (например, кислотные, щелочные, положительно или отрицательно заряженные, полярные или не полярные, и т.д.) так, что замещения даже критических аминокислот не сильно изменяют структуру и/или активность.
Более конкретно, "консервативно модифицированные варианты" применяется для последовательностей аминокислоты и нуклеиновой кислоты. Что касается последовательностей конкретных аминокислот, консервативно модифицированные варианты относятся к тем нуклеиновым кислотам, которые кодируют идентичные или практически идентичны последовательностям аминокислот, или где нуклеиновая кислота не кодирует практически идентичные последовательности аминокислоты. Из-за дегенерации генетического кода, большое количество функционально идентичных нуклеиновых кислот кодирует любой данный белок.
Например, кодоны GCA, GCC, GCG и GCU все кодируют аминокислоту аланин. Таким образом, в каждом положении, где аланин характеризуется кодоном, кодон может быть изменен до любого из описанных соответствующих кодонов без изменения кодированного полипептида.
Такие вариации нуклеиновых кислот являются "молчащими вариантами", которые являются одним из видов консервативно модифицированных вариаций. Каждая последовательность нуклеиновой кислоты, которая кодирует полипептид, также описывает каждый возможный молчащий вариант нуклеиновой кислоты. Специалист в данной области техники поймет, что каждый кодон в нуклеиновой кислоте (за исключением AUG, который, как правило, является единственным кодоном для метионина, и TGG, который, как правило, является единственным кодоном для триптофана) может быть модифицирован с получением функционально идентичной молекулы. Следовательно, каждый молчащий вариант нуклеиновой кислоты, который кодирует полипептид, подразумевается в каждой описанной последовательности.
Таблицы консервативного замещения, в которых представлены функционально похожие аминокислоты, хорошо известны в данной области техники. Например, один экземпляр руководства по выбору консервативных замещений, включает (оригинальный остаток с примером замещения): ala/gly или ser; arg/lys; asn/gln или his; asp/glu; cys/ser; gln/asn; gly/asp; gly/ala или pro; his/asn или gln; ile/leu или val; leu/ile или val; lys/arg или gln или glu; met/leu или tyr или ile; phe/met или leu или tyr; ser/thr; thr/ser; trp/tyr; tyr/trp или phe; val/ile или leu. В альтернативном примере руководства применяются следующие шесть групп, каждая из которых содержит аминокислоты, которые являются консервативными заместителями друг для друга: 1) Аланин (A), Серин (S), Треонин (T); 2) Аспаргиновая кислота (D), Глутаминовая кислота (E); 3) Аспарагин (N), Глутамин (Q); 4) Аргинин (R), Лизин (I); 5) Изолейцин (I), Лейцин (L), Метионин (M), Валин (V); и 6) Фенилаланин (F), Тирозин (Y), Триптофан (W); (см. также, например, Creighton, Proteins, W. H. Freeman and Company (1984); Schultz and Schimer, Principles of Protein Structure, Springer-Verlag (1979)). Специалист в данной области техники поймет, что указанные выше замещения не являются единственно возможными консервативными замещениями. Например, для некоторых целей, можно считать все заряженные аминокислоты консервативными замещениями друг для друга, независимо от того, являются ли они отрицательными или положительными. Кроме того, отдельные замещения, делеции или добавления, которые изменяют, добавляют или уменьшают отдельные аминокислоты в кодированной последовательности, также могут считаться "консервативно модифицированными вариантами".
Термины "миметик" и "пептидомиметик" относится к синтетическому химическому соединению, которое имеет практически такие же структурные и/или функциональные характеристики полипептидов, например, внеклеточный домен или любая область T1R2 или T1R1. Миметик может либо полностью состоять из синтетических, не природных аналогов аминокислот, либо может быть химерной молекулой из частично природных пептидных аминокислот и частично не природных аналогов аминокислот. Миметик также может включать любое количество консервативных замещений природных аминокислот, при условии, что такие замещения также значительно не меняют структуру и/или активность миметика.
Как и с полипептидами в соответствии с данным изобретением, которые являются консервативными вариантами, обычные эксперименты помогут определить, попадает ли миметик в объем данного изобретения, т.е. его структура и/или функция практически не изменены. Полипептидные миметические композиции могут содержать любое сочетание не природных структурных компонентов, которые обычно выбирают из трех структурных групп: a) группы сцепления остатков, отличные от природной амидной связи ("пептидная связь"); b) не природные остатки на месте природных аминокислотных остатков; или c) остатки, которые включают вторичную структурную мимикрию, т.е. вызывают или стабилизируют вторичную структуру, например, бета-виток, гамма-виток, бета-пласт, альфа-спиральная структура, и подобные. Полипептид может быть охарактеризован как миметический, если все или некоторые из его остатков соединены химическими средствами, отличными от природных пептидных связей. Отдельные петидомиметические остатки могут быть соединены пептидными связями, другими химическими связями или средствами сопряжения, такими как, например, глутаральдегид, сложные эфиры N-гидроксисукцинимида, бифункциональные малеимиды, N,N′-дициклогексилкарбодиимид (ДЦК) или N,N′-диизопропилкарбодиимид (ДИК). Связующие группы, которые могут быть альтернативой традиционной амидной связи ("пептидная связь") включают, например, кетометилен (например, -C(O)-CH2- для -C(O)-NH-), аминометилен -CH2(NH)-, этилен, олефин -CH=CH-, простой эфир -CH2O-, тиоэфир -CH2S-, тетразол (CN4), тиазол, ретроамид, тиоамид или сложный эфир (см., например, Spatola, Chemistry and Biochemistry of Амино Acids, Peptides and Proteins, Vol. 7, 267-357, Marcell Dekker, Peptide Backbone Modifications, NY (1983)). Полипептид также может быть охарактеризован как миметик, если содержит все или некоторые остатки вместо природных аминокислотных остатков; не природные остатки подробно описаны в научной и патентной литературе.
"Алкил" сам по себе или как часть другого заместителя, относится к насыщенному или ненасыщенному, разветвленному, прямому или циклическому одновалентному радикалу, полученному удалением одного атома водорода от одинарного атома углерода исходного алкана, алкена или алкина. Термин "алкил" включает "циклоалкил", такой как определен ниже. Типовые алкильные группы включают, но не ограничены ими, метил; этилы, такие как этанил, этенил, этинил; пропилы, такие как пропан-1-ил, пропан-2-ил, циклопропан-1-ил, проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил), циклопроп-1-ен-1-ил; циклопроп-2-ен-1-ил, проп-1-ин-1-ил, проп-2-ин-1-ил, и т.д.; бутилы, такие как бутан-1-ил, бутан-2-ил, 2-метилпропан-1-ил, 2-метилпропан-2-ил, циклобутан-1-ил, бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метилпроп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, циклобут-1-ен-1-ил, циклобут-1-ен-3-ил, циклобута-1,3-диен-1-ил, бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил, и т.д.; и подобные. Термин "алкил" конкретно включает группы, имеющие любую степень или уровень насыщения, т.е. группы, имеющие исключительно одинарные связи углерод-углерод, группы, имеющие одну или более двойных связей углерод-углерод, группы, имеющие одну или более тройных связей углерод-углерод, и группы, имеющие смесь одинарных, двойных и тройных связей углерод-углерод. Если подразумевается определенный уровень насыщения, применяются выражения "алканил", "алкенил" и "алкинил". В некоторых вариантах, алкильная группа содержит от 1 до 20 атомов углерода (C1-C20 алкил). В других вариантах, алкильная группа содержит от 1 до 10 атомов углерода (C1-C10 алкил). В еще одном варианте, алкильная группа содержит от 1 до 6 атомов углерода (C1-C6 алкил). Необходимо отметить, что если алкильная группа далее связана с другим атомом, она становится "алкиленовой" группой. Другими словами, термин "алкилен" относится к двухвалентному алкилу. Например, -CH2CH3 является этилом, а -CH2CH2- является этиленом. То есть, "алкилен" сам по себе или как часть другого заместителя, относится к насыщенному или ненасыщенному, разветвленному, прямому или циклическому двухвалентному радикалу, полученному удалением двух атомов водорода из одинарного атома углерода или двух разных атомов углерода исходного алкана, алкена или алкина. Термин "алкилен" включает "циклоалкилен", такой как определен ниже. Термин "алкилен" конкретно включает группы, имеющие любую степень или уровень насыщения, т.е. группы, имеющие исключительно одинарные связи углерод-углерод, группы, имеющие одну или более двойных связей углерод-углерод, группы, имеющие одну или более тройных связей углерод-углерод, и группы, имеющие смесь одинарных, двойных и тройных связей углерод-углерод. Если подразумевается определенный уровень насыщения, применяются выражения "алканилен", "алкенилен" и "алкинилен". В некоторых вариантах алкиленовая группа содержит от 1 до 20 атомов углерода (C1-C20 алкилен). В других вариантах, алкиленовая группа содержит от 1 до 10 атомов углерода (C1-C10 алкилен). В других вариантах, алкиленовая группа содержит от 1 до 6 атомов углерода (C1-C6 алкилен).
"Алканил" сам по себе или как часть другого заместителя, относится к насыщенному, разветвленному, прямому или циклическому алкильному радикалу, полученному удалением одного атома водорода от одинарного атома углерода исходного алкана. Термин "алканил" включает "циклоалканил", такой как определен ниже. Типовые алканильные группы включают, но не ограничены ими, метанил; этанил; пропанилы, такие как пропан-1-ил, пропан-2-ил (изопропил), циклопропан-1-ил, и т.д.; бутанилы, такие как бутан-1-ил, бутан-2-ил (втор-бутил), 2-метилпропан-1-ил (изобутил), 2-метилпропан-2-ил (трет-бутил), циклобутан-1-ил, и т.д.; и подобные.
"Алкенил" сам по себе или как часть другого заместителя, относится к ненасыщенному, разветвленному, прямому или циклическому алкильному радикалу, имеющему, по крайней мере, одну двойную связь углерод-углерод, полученному удалением одного атома водорода от одинарного атома углерода исходного алкена. Термин "алкенил" включает "циклоалкенил", такой как определен ниже. Группа может иметь цис или транс структуру вокруг двойной связи. Типовые алкенильные группы включают, но не ограничены ими, этенил; пропенилы, такие как проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил), проп-2-ен-2-ил, циклопроп-1-ен-1-ил; циклопроп-2-ен-1-ил; бутенилы, такие как бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метил-проп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, циклобут-1-ен-1-ил, циклобут-1-ен-3-ил, циклобута-1,3-диен-1-ил, и т.д.; и подобные.
"Алкинил" сам по себе или как часть другого заместителя, относится к ненасыщенному, разветвленному, прямому или циклическому алкильному радикалу, имеющему, по крайней мере, одну тройную связь углерод-углерод, полученному удалением одного атома водорода от одинарного атома углерода исходного алкина. Типовые алкинильные группы включают, но не ограничены ими, этинил; пропинилы, такие как проп-1-ин-1-ил, проп-2-ин-1-ил, и т.д.; бутинилы, такие как бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил и т.д.; и подобные.
"Алкокси" сам по себе или как часть другого заместителя, относится к радикалу формулы -O-R199, где R199 является алкилом или замещенным алкилом, как определено в данном описании.
"Ацил" сам по себе или как часть другого заместителя относится к радикалу -C(O)R200, где R200 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, гетероалкилом, замещенным гетероалкилом, гетероарилалкилом или замещенным гетероарилалкилом, как определено в данном описании. Типовые примеры включают, но не ограничены ими формил, ацетил, циклогексилкарбонил, циклогексилметилкарбонил, бензоил, бензилкарбонил и подобные.
"Арил", сам по себе или как часть другого заместителя, относится к одновалентной ароматической углеводородной группе, полученной удалением одного атома водорода из одинарного атома углерода исходной ароматической системы колец, как определено в данном описании. Типовые арильные группы включают, но не ограничены ими, группы, полученные из ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, флорантрена, флуорена, гексацена, гексафена, гексалена, as-индацена, s-индацена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плеядена, пирена, пирантрена, рубицена, трифенилена, тринафталина и подобных. В некоторых вариантах, арильная группа содержит от 6 до 20 атомов углерода (C6-C20 арил). В других вариантах, арильная группа содержит от 6 до 15 атомов углерода (C6-C15 арил). В других вариантах, арильная группа содержит от 6 до 10 атомов углерода (C6-C10 арил).
"Арилалкил", сам по себе или как часть другого заместителя, относится к ациклической алкильной группе, в которой один из атомов водорода, связанный с атомом углерода, обычно концевым или sp3 атомом углерода, замещен арильной группой, как определено в данном описании. Типовые арилалкильные группы включают, но не ограничены ими, бензил, 2-фенилэтан-1-ил, 2-фенилэтен-1-ил, нафтилметил, 2-нафтилэтан-1-ил, 2-нафтилэтен-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил и подобные. Если рассматриваются конкретные алкильные группы, применяется номенклатура арилалканил, арилалкенил и/или арилалкинил. В некоторых вариантах, арилалкильная группа является (C6-C30)арилалкилом, например, алканильная, алкенильная или алкинильная группа арилалкильной группы является (C1-C10)алкилом и арильная группа является (C6-C20)арилом. В других вариантах, арилалкильная группа является (C6-C20)арилалкилом, например, алканильная, алкенильная или алкинильная группа арилалкильной группы является (C1-C8) алкилом и арильная группа является (C6-C12) арилом. В другом варианте арилалкильная группа является (С6-С15) арилалкилом, например, алканильная, алкенильная или алкинильная группа арилалкильной группы является (C1-C5)алкилом, и арильная группа является (C6-C10)арилом.
"Циклоалкил", сам по себе или как часть другого заместителя, относится к насыщенному или ненасыщенному циклическому алкильному радикалу, как определено в данном описании. Также, "циклоалкилен", сам по себе или как часть другого заместителя, относится к насыщенному или ненасыщенному циклическому алкиленовому радикалу, как определено в данном описании. Если подразумевается определенный уровень насыщения, применяется номенклатура "циклоалканил", "циклоалкенил" или "циклоалкинил". Типовые циклоалкильные группы включают, но не ограничены ими, группы, полученные из циклопропана, циклобутана, циклопентана, циклогексана, и подобные. В некоторых вариантах циклоалкильная группа содержит от 3 до 10 атомов в кольце (C3-C10 циклоалкил). В других вариантах циклоалкильная группа содержит от 3 до 7 атомов в кольце (C3-C7 циклоалкил). Циклоалкил может быть далее замещен одним или более гетероатомами, включающими, но не ограниченными ими, N, P, O, S и Si, которые присоединены к атомам углерода циклоалкила через одновалентную или многовалентную связь.
"Гетероалкил", "гетероалканил", "гетероалкенил" и "гетероалкинил", сами по себе или как часть другого заместителя, относятся к алкильным, алканильным, алкенильным и алкинильным группам, соответственно, в которых один или более атомов углерода (и, необязательно, любые связанные с ними атомы водорода) каждый, независимо друг от друга, замещен одинаковыми или разными гетероатомами или гетероатомными группами. Также "гетероалкилен", "гетероалканилен", "гетероалкенилен" и "гетероалкинилен", сами по себе или как часть другого заместителя, относятся к алкиленовым, алканиленовым, алкениленовым и алкиниленовым группам, соответственно, в которых один или более атомов углерода (и, необязательно, любые связанные с ними атомы водорода) каждый, независимо друг от друга, заменен одинаковыми или разными гетероатомами или гетероатомными группами. Типовые гетероатомы или гетероатомные группы, которые могут заменять атомы углерода, включают, но не ограничены ими, -O-, -S-, -N-, -Si-, -NH-, -S(O)-, -S(O)2-, -S(O)NH-, -S(O)2NH- и подобные и их сочетания. Гетероатомы или гетероатомные группы могут быть помещены в любое внутреннее положение алкильных, алкенильных или алкинильных групп. Типовые гетероатомные группы, которые могут быть включены в такие группы, включают, но не ограничены ими, -O-, -S-, -O-O-, -S-S-, -O-S-, -NR2O1R2O2-, =N-N=, -N=N-, -N=N-NR2O3R2O4, -PR2O5-, -P(O)2-, -POR2O6-, -O-P(O)2-, -SO-, -SO2-, -SnR207R208- и подобные, где R201, R202, R203, R204, R205, R206, R207 и R208 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, циклоалкилом, замещенным циклоалкилом, циклогетероалкилом, замещенным циклогетероалкилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом.
"Циклогетероалкил" или "гетероциклил", сам по себе или как часть другого заместителя, относится к насыщенному или ненасыщенному циклическому алкильному радикалу, в котором один или более атомов углерода (и, необязательно, любые связанные с ними атомы водорода) независимо замещены одинаковыми или разными гетероатомами. Также, "циклогетероалкилен", сам по себе или как часть другого заместителя, относится к насыщенному или ненасыщенному циклическому алкиленовому радикалу, в котором один или более атомов углерода (и, необязательно, любые связанные с ними атомы водорода) независимо замещены одинаковыми или разными гетероатомами. Циклогетероалкил может быть далее замещен одним или более гетероатомами, выбранными из, но не ограниченными ими, N, P, O, S и Si, которые присоединены к атомам углерода циклогетероалкила через одновалентную или многовалентную связь. Типовые гетероатомы для замещения атома углерода включают, но не ограничены ими, N, P, O, S, Si и т.д. Если подразумевается определенный уровень замещения, применяют номенклатуру "циклогетероалканил" или "циклогетероалкенил". Типовые циклогетероалкильные группы включают, но не ограничены ими, группы, полученные из эпоксидов, азиринов, тииранов, имидазолидина, морфолина, пиперазина, пиперидина, пиразолидина, пирролидона, хинуклидина и подобных. В некоторых вариантах, циклогетероалкильная группа содержит от 3 до 10 атомов в кольце (3-10-членный циклогетероалкил). В других вариантах, циклоалкильная группа содержит от 5 до 7 атомов в кольце (5-7-членный циклогетероалкил). Циклогетероалкильная группа может быть замещена на гетероатоме, например, атоме азота, (C1-C6) алкильной группой. Конкретные примеры включают N-метилимидазолидинил, N-метилморфолинил, N-метилпиперазинил, N-метилпиперидинил, N-метилпиразолидинил и N-метилпирролидинил, включенные в определение "циклогетероалкила." Цциклогетероалкильная группа может быть присоединена к остатку молекулы через атом углерода кольца или гетероатом кольца.
"Соединения" относится к соединениям, охватываемым структурной формулой, описанной здесь, и включает любые конкретные соединения, соответствующие этой формуле, структура которых описана здесь. Соединения могут быть идентифицированы по их химической структуре и/или химическому наименованию. Если химическая структура и химическое наименование противоречат друг другу, химическая структура является определяющей для идентификации соединения. Описанные здесь соединения могут содержать один или более хиральных центров и/или двойных связей, и поэтому могут существовать в виде стереоизомеров, таких как изомеры с двойной связью (т.е. геометрические изомеры), энантиомеры или диастереомеры. Следовательно, изображенные здесь химические структуры охватывают все возможные энантиомеры и стереоизомеры иллюстрированных соединений, включая стереоизохимически чистые формы (например, геометрически чистые, энантиомерно чистые или диастереомерно чистые) и энантиомерные и стереоизомерные смеси. Энантиомерные и стерелизомерные смеси могут быть разделены на составляющие их энантиомеры или стереоизомеры с применением методик разделения или методик хирального синтеза, хорошо известных специалистам в данной области техники. Соединения также могут существовать в нескольких таутомерных формах, включая енольную форму, кето форму и их смеси. Следовательно, изображенные здесь химические структуры охватывают все возможные таутомерные формы иллюстрированных соединений. Описанные соединения также включают изотопно-меченые соединения, где один или более атом имеет атомную массу, отличную от атомной массы, существующей в природе. Примеры изотопов, которые могут быть введены в соединения в соответствии с данным изобретением, включают, но не ограничены ими,2H,3H,13C,14C,15N,18O,17O и т.д. Соединения могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы, и в виде N-оксидов. Определенные соединения могут существовать во множественных кристаллических или аморфных формах. В общем, все физические формы эквивалентны завяленным здесь областям применения и включены в объем данного изобретения. Далее, должно быть понятно, что если показаны частичные структуры соединений, то скобки указывают на место присоединения частичной структуры к оставшейся молекуле. Термин "таутомер" в данном описании относится к изомерам, которые очень легко превращаются друг в друга так, что они могут существовать в равновесии. Например, следующие соединения A и B являются таутомерами друг друга:

"Галоген" сам по себе или как часть другого заместителя относится к радикалу -F, -Cl, -Br или -I.
"Гетероарил", сам по себе или как часть другого заместителя, относится к одновалентному гетероароматическому радикалу, полученному удалением одного атома водорода из одинарного атома исходных гетероароматических кольцевых систем, как определено в данном описании. Типовые гетероарильные группы включают, но не ограничены ими, группы, полученные из акридина, β-карболина, хромана, хромена, циннолина, фурана, имидазола, индазола, индола, индолина, индолизина, изобензофурана, изохромена, изоиндола, изоиндолина, изохинолина, изотазола, изоксазола, нафтиридина, оксадиазола, оксазола, пиримидина, фенантридина, фенантролина, феназина, фталазина, птеридина, пурина, пирана, пиразина, пиразола, пиридазина, пиридина, пиримидина, пиррола, пирролизина, хиназолина, хинолина, хинолизина, хиноксалина, тетразола, тиадиазола, тиазола, тиофена, триазола, ксантена и подобных. В некоторых вариантах, гетероарильная группа содержит от 5 до 20 атомов в кольце (5-20-членный гетероарил). В других вариантах, гетероарильная группа содержит от 5 до 10 атомов в кольце (5-10-членный гетероарил). Примеры гетероарильных групп включают группы, полученные из фурана, тиофена, пиррола, бензотиофена, бензофурана, бензимидазола, индола, пиридина, пиразола, хинолина, имидазола, оксазола, изоксазола и пиразина.
"Гетероарилалкил", сам по себе или как часть другого заместителя, относится к ациклической алкильной группе, в которой один из атомов водорода, связанный обычно с концевым или sp3 атомом углерода, замещен гетероарильной группой. Если подразумеваются конкретные алкильные группы, применяют номенклатуру гетероарилалканил, гетероарилалкенил и/или гетероарилалкинил. В некоторых вариантах, гетероарилалкильная группа содержит 6-21-членный гетероарилалкил, например, алканильной, алкенильной или алкинильной группой гетероарилалкила является (C1-C6) алкил, и гетероарильной группой является 5-15-членный гетероарил. В других вариантах, гетероарилалкил является 6-13-членным гетероарилалкилом, например, алканильной, алкенильной или алкинильной группой является (C1-C3) алкил, и гетероарильной группой является 5-10-членный гетероарил.
"Исходная ароматическая система колец" относится к ненасыщенной циклической или полициклической системе колец, имеющей систему конъюгированных π электронов. Отдельно включены в определение "исходная ароматическая система колец" конденсированные системы колец, в которых одно или более из колец является ароматическим, и одно или более из колец является насыщенным или ненасыщенным, такие как, например, флуорен, индан, инден, фенален и т.д. Типовые исходные ароматические системы колец включают, но не ограничены ими, ацеантрилен, аценафтилен, ацефенантрилен, антрацен, азулен, бензол, кризен, коронен, фторантрен, флуорен, гексацен, гексафен, гексален, as-индацен, s-индацен, индан, инден, нафталин, октацен, октафен, октален, овален, пента-2,4-диен, пентацен, пентален, пентафен, перилен, фенален, фенантрен, пицен, плеяден, пирен, пирантрен, рубицен, трифенилен, тринафталин и подобные.
"Исходная гетероароматическая система колец" относится к исходной ароматической системе колец, в которой один или более атомов углерода (и необязательно любые связанные с ним атомы водорода) каждый независимо замещен одинаковыми или разными гетероатомами. Типовые гетероатомы для замены атома углерода включают, но не ограничены ими, N, P, O, S, Si, и т.д. Отдельно включены в определение "исходная гетероароматическая система колец" конденсированные системы колец, в которых одно или более колец являются ароматическими, и одно или более колец являются насыщенными или ненасыщенными, такие как, например, бензодиоксан, бензофуран, хроман, хромен, индол, индолин, ксантен и т.д. Типовые исходные гетероароматические системы колец включают, но не ограничены ими, арсиндол, карбазол, β-карболин, хроман, хромен, циннолин, фуран, имидазол, индазол, индол, индолин, индолизин, изобензофуран, изохромен, изоиндол, изоиндолин, изохинолин, изотиазол, изоксазол, нафтиридин, оксадиазол, оксазол, пиримидин, фенантридин, фенантролин, феназин, фталазин, птеридин, пурин, пиран, пиразин, пиразол, пиридазин, пиридин, пиримидин, пиррол, пирролизин, хиназолин, хинолин, хинолизин, хиноксалин, тетразол, тиадиазол, тиазол, тиофен, триазол, ксантен и подобные.
"Пациент" включает человека. Термины "человек" и "пациент" применяют взаимозаменяемо.
"Фармацевтически приемлемый" означает подходящий для применения в контакте с тканями человека и животных, не вызывая токсичности, раздражения, аллергической реакции и подобных, соизмеримый с разумным соотношением польза/риск и эффективный для предполагаемого применения с медицинской точки зрения.
"Предотвращение" или "профилактика" относится к снижению риска возникновения заболевания или расстройства (например, остановка развития, по крайней мере, одного из клинических симптомов заболевания у пациента, который может быть в группе риска или предрасположен к заболеванию, но еще не ощущает и не демонстрирует симптомы заболевания).
"Защитная группа" относится к группе атомов, которые, при присоединении к реакционноспособной функциональной группе в масках молекулы, снижает или предотвращает реакционноспособность функциональной группы. Примеры защитных групп могут быть найдены в Green et al., "Protective Groups in Organic Chemistry", (Wiley, 2n ed. 1991) и Harrison et al., "Compendium of Synthetic Organic Methods", VoIs. 1-8 (John Wiley and Sons, 1971-1996). Типовые аминозащитные группы включают, но не ограничены ими, формил, ацетил, трифторацетил, бензил, бензилоксикарбонил ("CBZ"), трет-бутоксикарбонил ("Boc"), триметилсилил ("TMS"), 2-триметилсилилэтансульфонил ("SES"), тритил и замещенные тритильные группы, аллилоксикарбонил, 9-флуоренилметилоксикарбонил ("FMOC"), нитровератрилоксикарбонил ("NVOC") и подобные. Типовые гидроксизащитные группы включают, но не ограничены ими, такие, где гидроксигруппа либо ацилирована, либо алкилирована, такие как бензил, и простые эфиры тритила, а также простые эфиры алкила, простые эфиры тетрагидропиранила, простые эфиры триалкилсилила и простые эфиры аллила.
"Сахаридное кольцо" также известно как сахарное кольцо и включает моносахаридное, дисахаридное и полисахаридное кольцо. Предпочтительно, сахаридным кольцом является моносахаридное кольцо. Примеры моносахаридов включают глюкозу (декстрозу), фруктозу, галактозу, ксилозу и рибозу. Под "производным сахаридного кольца" понимают не природное или искусственное сахаридное кольцо, где стереохимические центры частично или полностью отличаются от сахаридного кольца.
"Соль" относится к соли соединения, которая обладает желаемым фармакологическим действием исходного соединения. Такие соли включают: (1) кислотно-аддитивные соли, полученные с неорганическими кислотами, такие как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные; или полученные с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислоты, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, третичная бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и подобные; или (2) соли, полученные при замещении кислотного протона, присутствующего в исходном соединении, ионом металла, например, ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; или взаимодействием с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин и подобные.
"Сольват" означает соединение, полученное сольватированием (объединением молекул растворителя с молекулами или ионами раствора), или соединение, которое состоит из иона или молекулы раствора, т.е. соединения в соответствии с данным изобретением, с одной или более молекулами растворителя. Если растворителем является вода, соответствующим сольватом является "гидрат".
"N-оксид", также известный как аминоксид или амин-N-оксид, означает соединение, которое получают из соединения в соответствии с данным изобретением окислением аминовой группы соединения в соответствии с данным изобретением. N-оксид обычно содержит функциональную группу R3N+-O- (иногда пишут как R3N=O или R3N→O).
"Замещенный", при применении к определенной группе или радикалу, означает, что один или более атомов водорода определенной группы или радикала замещены, каждый независимо от других, одинаковыми или разными заместителями. Группы заместителей, применяемые для замещения атомов углерода в указанной группе или радикале, включают, но не ограничены ими -Ra, галоген, -O-, =O, -ORb, -SRb, -S-, =S, -NRCRC, =NRb, =N-ORb, тригалогенметил, -CF3, -CN, -OCN, -SCN, -NO, -NO2, =N2, -N3, -S(O)2Rb, -S(O)2NRb, -S(O)2O-, -S(O)2ORb, -OS(O)2Rb, -OS(O)2O-, -OS(O)2ORb, -P(O)(O-)2, -P(O)(ORb)(O-), -P(O)(ORb)(ORb), -C(O)Rb, -C(S)Rb, -C(NRb)Rb, -C(O)O-, -C(O)ORb, -C(S)ORb, -C(O)NRCRC, -C(NRb)NRcRc, -OC(O)Rb, -OC(S)Rb, -OC(O)O-, -OC(O)ORb, -OC(S)ORb, -NRbC(O)Rb, -NRbC(S)Rb, -NRbC(O)O-, -NRbC(O)ORb, -NRbC(S)ORb, -NRbC(O)NRcRc, -NRbC(NRb)Rb и -NRbC(NRb)NRcRc, где Ra выбирают из группы, включающей алкил, циклоалкил, гетероалкил, циклогетероалкил, арил, арилалкил, гетероарил и гетероарилалкил; каждый Rb независимо является водородом или Ra; и каждый Rc независимо является Rb или, альтернативно, два Rc могут быть взяты вместе с атомом азота, к которому они присоединены, с получением 4-, 5-, 6- или 7-членного циклогетероалкила, который необязательно может включать от 1 до 4 одинаковых или разных дополнительных гетероатомов, выбранных из группы, включающей O, N и S. В качестве конкретных примеров, -NRCRC включает -NH2, -NH-алкил, N-пирролидинил и N-морфолинил. В качестве другого конкретного примера, замещенный алкил включает -алкилен-O-алкил, -алкиленгетероарил, -алкиленциклогетероалкил, -алкилен-C(O)ORb, -алкилен-C(O)NRbRb и -CH2-CH2-C(O)-CH3. Один или более заместителей, вместе с атомами, к которым они присоединены, могут образовывать циклическое кольцо, включающее циклоалкил и циклогетероалкил.
Также, группы заместителей, применяемые для замещения ненасыщенных атомов углерода в определенной группе или радикале, включают, но не ограничены ими, -Ra, галоген, -O-, -ORb, -SRb, -S-, -NRCRC, тригалогенметил, -CF3, -CN, -OCN, -SCN, -NO, -NO2, -N3, -S(O)2Rb, -S(O)2O-, -S(O)2ORb, -OS(O)2Rb, -OS(O)2O-, -OS(O)2ORb, -P(O)(O-)2, -P(O)(ORb)(O-), -P(O)(ORb)(ORb), -C(O)Rb, -C(S)Rb, -C(NRb)Rb, -C(O)O-, -C(O)ORb, -C(S)ORb, -C(O)NRCRC, -C(NRb)NRCRC, -OC(O)Rb, -OC(S)Rb, -OC(O)O-, -OC(O)ORb, -OC(S)ORb, -NRbC(O)Rb, -NRbC(S)Rb, -NRbC(O)O-, -NRbC(O)ORb, -NRbC(S)ORb, -NRbC(O)NRCRC, -NRbC(NRb)Rb и -NRbC(NRb)NRCRC, где Ra, Rb и RC такие, как определены выше.
Группы заместителей, применяемые для замещения атома азота в гетероалкильной и циклогетероалкильной группах, включают, но не ограничены ими, -Ra, -O-, -ORb, -SRb, -S-, -NRCRC, тригалогенметил, -CF3, -CN, -NO, -NO2, -S(O)2Rb, -S(O)2O-, -S(O)2ORb, -OS(O)2Rb, -OS(O)2O-, -OS(O)2ORb, -P(O)(O-)2, -P(O)(ORb)(O-), -P(O)(ORb)(ORb), -C(O)Rb, -C(S)Rb, -C(NRb)Rb, -C(O)ORb, -C(S)ORb, -C(O)NRCRC, -C(NRb)NRCRC, -OC(O)Rb, -OC(S)Rb, -OC(O)ORb, -OC(S)ORb, -NRbC(O)Rb, -NRbC(S)Rb, -NRbC(O)ORb, -NRbC(S)ORb, -NRbC(O)NRCRC, -NRbC(NRb)Rb и -NRbC(NRb)NRCRC, где Ra, Rb и RC такие, как описаны выше.
Группы заместителей из представленного выше списка, применимые для замещения других определенных групп или атомов, будут очевидны специалисту в данной области техники.
Заместители, применяемые для замещения определенной группы, также могут быть замещены, обычно одной или более их тех же или других групп, выбранных из различных групп, указанных выше.
"Лечить" или "лечение" любого заболевания или расстройства относится, в некоторых вариантах, к облегчению заболевания или расстройства (т.е. остановке или снижению развития заболевания или, по крайней мере, одного из его клинических симптомов). В других вариантах "лечить" или "лечение" относится к облегчению, по крайней мере, одного физического параметра, который может быть не заметен пациенту. В еще одних вариантах, "лечить" или "лечение" относится к ингибированию заболевания или расстройства, либо физически, (например, стабилизации не заметного симптома), психологически (например, стабилизации психического параметра) или обоих. В еще одном варианте, "лечить" или "лечение" относится к задержке наступления заболевания или расстройства.
"Терапевтически эффективное количество" означает соединение, которое при введении пациенту для лечения заболевания, является достаточным для эффективности такого лечения для заболевания. "Терапевтически эффективное количество" варьируется в зависимости от соединения, заболевания и его тяжести, и возраста, массы тела и т.д., лечимого пациента.
"Носитель" относится к разбавителю, адъюванту, наполнителю или носителю, с которым вводят соединение.
Данное изобретение основано, по крайней мере, частично, на открытии, что внеклеточный домен, например, домен венериной мухоловки хемосенсорного рецептора, особенно один или более взаимодействующих сайтов в домене венериной мухоловки, является подходящей целью для соединений или других веществ для модулирования хемосенсорного рецептора и/или его лигандов. Следовательно, в данном изобретении представлены способы скриннинга для идентификации модификаторов хемосенсорного рецептора, а также модификаторов лигандов хемосенсорного рецептора. Кроме того, в данном изобретении представлены соединения и композиции, способные модулировать хемосенсорные рецепторы, а также лиганды хемосенсорного рецептора.
Согласно одному аспекту данного изобретения, в нем представлены способы скриннинга модификаторов хемосенсорного рецептора путем определения того, подходит ли тестируемое вещество для взаимодействия с хемосенсорным рецептором через одно или более мест взаимодействия во внеклеточном домене хемосенсорного рецептора, например, домене венериной мухоловки хемосенсорного рецептора. Согласно другому аспекту данного изобретения, в нем представлены способы скриннинга модификаторов лигандов хемосенсорного рецептора путем определения того, подходит ли тестируемое вещество для взаимодействия с хемосенсорным рецептором и, необязательно, его лигандом через одно или более мест взаимодействия во внеклеточном домене хемосенсорного рецептора, например, домене венериной мухоловки хемосенсорного рецептора, необязательно в присутствии лиганда хемосенсорного рецептора.
В общем, внеклеточный домен хемосенсорного рецептора относится к внеклеточному амино-окончанию хемосенсорного рецептора и обычно включает домен связывания с лигандом и домен с цистеин-богатым линкером, который связывает домен, связывающийся с лигандом и оставшийся белок. В классе C GPCR, домен, связывающийся с лигандом, обычно обозначается как домен венериной мухоловки, структура которого была выяснена, например, с применением рентгеновской кристаллографии.
Домен венериной мухоловки обычно состоит из двух относительно жестких долей, связанных тремя нитями, образующими гибкую "шарнирную" область. При отсутствии лиганда домен венериной мухоловки имеет тенденцию принимать открытые конформации с хорошо разделенными долями, а также закрытые конформации с расположенными близко долями. В одном примере, домен венериной мухоловки включает область от аминокислоты 36 до аминокислоты 509 человеческого T1R1, от аминокислоты 31 до аминокислоты 507 человеческого T1R2, и/или от аминокислоты 35 до аминокислоты 511 человеческого T1R3.
Домен венериной мухоловки в соответствии с данным изобретением включает любой домен связывания с лигандом, или домен, взаимодействующий с лигандом, во внеклеточном домене хемосенсорного рецептора. В одном варианте, домен венериной мухоловки в соответствии с данным изобретением включает любой домен связывания с лигандом члена семейства T1R. В другом варианте, домен венериной мухоловки в соответствии с данным изобретением включает любой внеклеточный домен хемосенсорного рецептора со структурой, содержащей две доли, связанные шарнирной областью. В еще одном варианте, домен венериной мухоловки в соответствии с данным изобретением включает любой домен, соответствующий структуре и/или функции области, включающей от аминокислоты 36 до аминокислоты 509 человеческого T1R1, от аминокислоты 31 до аминокислоты 507 человеческого T1R2, и/или от аминокислоты 35 до аминокислоты 511 человеческого T1R3. В еще одном варианте, домен венериной мухоловки в соответствии с данным изобретением включает любой домен связывания с лигандом T1R1, T1R2 и/или T1R3, а также любой его полиморфный вариант, аллель или мутацию. Примеры иллюстраций полиморфных вариантов T1R1 и T1R2 показаны на фигурах 1-4.
В соответствии с данным изобретением, хемосенсорным рецептором может быть любой рецептор, связанный с хемосенсорным ощущением или трансдукцией сигнала, выпущенного хемосенсорным лигандом, например, через вкусовые рецепторы или связанные с вкусовыми рецепторы, экпрессрующиеся во вкусовых сосочках, в желудочно-кишечном тракте и т.д. В одном варианте, хемосенсорным рецептором является рецептор, который принадлежит к 7-транмембранному рецептору или рецепторам, сопряженным с G-белком (GPCR). В другом варианте, хемосенсорным рецептором является рецептор, проводящий трансдукцию сигнала через один или более G-белков. В еще одном варианте, хемосенсорным рецептором является рецептор, который принадлежит к семейству C или классу C GPCR. В еще одном варианте, хемосенсорным рецептором является рецептор, который принадлежит к семейству T1R. В еще одном варианте, хемосенсорными рецепторами являются рецепторы T1R1, T1R2, T1R3 или их эквиваленты или варианты, или их сочетания. В еще одном варианте, хемосенсорными рецепторами являются гетеро-димер T1R2 и T1R3, или их эквиваленты или варианты.
В соответствии с данным изобретением, местом взаимодействия в домене венериной мухоловки хемосенсорного рецептора может быть один или более взаимодействующих остатков или трехмерное взаимодействующее пространство, или их сочетание. В одном варианте, место взаимодействия в соответствии с данным изобретением находится в домене венериной мухоловки T1R2. В другом варианте, место взаимодействия в соответствии с данным изобретением находится в домене венериной мухоловки T1R3. В еще одном варианте, место взаимодействия в соответствии с данным изобретением находится в домене венериной мухоловки обоих T1R2 и T1R3.
Обычно такое место взаимодействия может быть определено любыми подходящими методами, известными или открытыми позднее в данной области техники. Например, такое место взаимодействия может быть определено на основе компьютерного моделирования, например, с применением программного обеспечения, такого как Homology или Modeller (от Accelrys Corporation) для построения трехмерных гомологических моделей домена венериной мухоловки хемосенсорного рецептора, например, доменов венериной мухоловки T1R2 и/или T1R3, на основе кристаллических структур гомологов доменов венериной мухоловки.
Такое место взаимодействия также может быть определено, например, на основе рентгеновской кристаллографии и трехмерной структуры определенного хемосенсорного рецептора, например, гетеродимера T1R2, T1R3 или T1R2/T1R3. Альтернативно, например, такое место взаимодействия может быть определено на основе молекулярных механических методик, например, анализа нормальных колебаний, методик образования петли, Monte Carlo и/или молекулярно-механического моделирования для изучения движений и альтернативных конформаций доменов венериной мухоловки, моделированием стыковки лигандов предполагаемого к стыковке рецептора и модификаторов лиганда выбранного рецептора в такие модели или в определенные экспериментально структуры хемосенсорных рецепторов, например, T1R1 и T1R2.
Кроме того, например, такое место взаимодействия может быть определено на основе мутагенеза, например, направленного мутагенеза или сочетания двух или более подходящих способов, известных или открытых позднее, например, описанных здесь способов.
В одном примере такое место взаимодействия расположено в части хемосенсорного рецептора, например, T1R2, и может быть определено в присутствии или отсутствии другой части хемосенсорного рецептора, например, T1R3. В другом примере такое место взаимодействия может быть определено в присутствии или отсутствии модификатора хемосенсорного рецептора и/или модификатора лиганда хемосенсорного рецептора.
В одном варианте, место взаимодействия в домене венериной мухоловки хемосенсорного рецептора включает один или более взаимодействующих остатков домена венериной мухоловки хемосенсорного рецептора. В соответствии с данным изобретением, взаимодействующий остаток домена венериной мухоловки хемосенсорного рецептора представляет собой остаток, связанный с любым прямым или косвенным взаимодействием между хемосенсорным рецептором и модификатором хемосенсорного рецептора или модификатора лиганда хемосенсорного рецептора, или обоих.
В одном примере взаимодействующий остаток в соответствии с данным изобретением включает любой остаток хемосенсорного рецептора, связанный с взаимодействием между модификатором хемосенсорного рецептора и хемосенсорным рецептором. В другом примере, взаимодействующий остаток в соответствии с данным изобретением включает любой остаток хемосенсорного рецептора, связанный с взаимодействием между модификатором лиганда хемосенсорного рецептора и хемосенсорным рецептором. В еще одном примере, взаимодействующий остаток в соответствии с данным изобретением включает любой остаток хемосенсорного рецептора, связанный с взаимодействием между хемосенсорным рецептором, модификатором хемосенсорного рецептора и модификатором лиганда хемосенсорного рецептора.
В еще одном примере, взаимодействующий остаток в соответствии с данным изобретением включает любой остаток хемосенсорного рецептора, связанный с взаимодействием между хемосенсорным рецептором и веществом со сладким вкусом, например любым природным или синтезированным соединением со сладким вкусом, включающим, без ограничений, некалорийные соединения со сладким вкусом, соединения со сладким вкусом пониженной калорийности и соединением со сладким вкусом ложной калорийности, и т.д. Примеры соединений со сладким вкусом включают, без ограничений, цикламиновую кислоту, могросид, тагатозу, мальтозу, галактозу, маннозу, сахарозу, фруктозу, лактозу, аспартам, неотам и другие производные аспартама, сахарин, сукралозу, ацесульфам K, глюкозу, эритритол, D-триптофан, глицин, маннит, сорбит, мальтит, лактит, изомальт, гидрированный сироп глюкозы (HGS), гидрированный гидролизат крахмала (HSH), стевиозид, ребаудиозид A и другие сладкие гликозиды на основе стевии, алитам, каррелам и другие подсластители на основе гуанидина, тагатозу, ксилит, кукурузный сироп с высоким содержанием фруктозы и т.д.
В еще одном примере, взаимодействующий остаток в соответствии с данным изобретением включает любой остаток хемосенсорного рецептора, связанный с взаимодействием между хемосенсорным рецептором и улучшителем вещества со сладким вкусом. В еще одном примере, взаимодействующий остаток в соответствии с данным изобретением включает любой остаток хемосенсорного рецептора, связанный с взаимодействием между хемосенсорным рецептором, веществом со сладким вкусом и улучшителем вещества со сладким вкусом.
В другом варианте, взаимодействующим остатком в соответствии с данным изобретением является остаток в домене венериной мухоловки хемосенсорного рецептора, где любая мутация которого может вызвать изменения активности хемосенсорного рецептора или столкнуть лиганд хемосенсорного рецептора с хемосенсорным рецептором, или оба. Например, взаимодействующий остаток в соответствии с данным изобретением может включать любой остаток в домене венериной мухоловки хемосенсорного рецептора, где любая мутация которого может вызвать определяемые изменения, например, количественное или качественное изменение активности хемосенсорного рецептора в ответ на модификатор хемосенсорного рецептора и/или модификатор лиганда хемосенсорного рецептора.
В еще одном варианте взаимодействующим остатком в соответствии с данным изобретением является остаток в домене венериной мухоловки хемосенсорного рецептора, который взаимодействует или образует продуктивные взаимодействия, например, вандерваальсовы, запасы гидрофобных атомов или атомных групп, водородные связи, стэкинг-взаимодействия кольца или электростатические взаимодействия с соляным мостиком с модификатором хемосенсорного рецептора или модификатором лиганда хемосенсорного рецептора, или обоими.
В другом варианте, взаимодействующим остатком домена венериной мухоловки хемосенсорного рецептора может быть любой остаток, составляющий один или более взаимодействующих структурных компонентов домена венериной мухоловки, который связан, прямо или косвенно, с взаимодействием между хемосенсорным рецептором и модификатором хемосенсорного рецептора или модификатором лиганда хемосенсорного рецептора, или обоими. Например, структура домена венериной мухоловки хемосенсорного рецептора обычно включает две доли, соединенных шарнирной областью. Остатками, составляющими взаимодействующий структурный компонент домена венериной мухоловки, могут быть, например, остатки, составляющие шарнирную область, внутреннюю часть каждой доли или остатки каждой доли, которые находятся в непосредственной близости во время активации или конформационного изменения домена венериной мухоловки, включая, без ограничений, остатки на внутренних поверхностях долей, направленные друг на друга, или на концах долей, где остатки особенно испытывают воздействие растворителя, но все еще близки к остаткам на противоположной доле, и т.д.
Примеры взаимодействующих остатков домена венериной мухоловки хемосенсорного рецептора включают один или более остатков из 1) N143, S144 и I167 человеческого T1R2, 2) S40, S144, S165, Y103, D142 и P277 человеческого T1R2, 3) K65, R383, D307, E302 и D278 человеческого T1R2, 4) I167, P185, T184, T326, E302, V384, A305, I325, I306, R383, D307, E382, D278, I279, I67, V66, V309, D142, S165, S40, S303, T242, F103, Q328 и S168 человеческого T1R2, 5) N143, S144, I167, K65, R383, D307, E302, D278, P185, T184, T326, E302, V384, A305, I325, I306, D307, E382, I279, I67, V66, V309, D142, S165, S40, S303, T242, F103, Q328 и S168 человеческого T1R2, и 6) N143, I167, K65, R383, D307, E302, D278, P185, T184, T326, V384, A305, I325, I306, D307, E382, I279, I67, V66, V309, D142, S165, S40, S303, T242, F103, Q328 и S168 человеческого T1R2.
Примеры взаимодействующих остатков домена венериной мухоловки хемосенсорного рецептора по отношению к модификатору хемосенсорного рецептора включают один или более остатков из 1) N143, S144 и I167 человеческого T1R2, 2) S40, S144, S165, Y103, D142 и P277 человеческого T1R2, 3) I167, P185, T184, T326, E302, V384, A305, I325, I306, R383, D307, E382, D278, I279, I67, V66, V309, D142, S165, S40, S303, T242, F103, Q328 и S168 человеческого T1R2, 4) N143 и I167 человеческого T1R2, 5) S40, S165, Y103, D142 и P277 человеческого T1R2, и 6) I167, P185, T184, T326, V384, A305, I325, I306, R383, D307, E382, D278, I279, I67, V66, V309, D142, S165, S40, S303, T242, F103, Q328 и S168 человеческого T1R2.
Примеры взаимодействующих остатков домена венериной мухоловки хемосенсорного рецептора по отношению к веществу со сладким вкусом, такому как сахароза и сукралоза, включают один или более из S40, S144, Y103, D142, P277 человеческого T1R2. Примеры взаимодействующих остатков домена венериной мухоловки хемосенсорного рецептора по отношению к веществу со сладким вкусом, такому как сахарин или ацесульфам K, включают один или более из K65, R383, D307, E302 и D278 человеческого T1R2.
Примеры взаимодействующих остатков домена венериной мухоловки хемосенсорного рецептора по отношению к модификатору лиганда хемосенсорного рецептора, например, улучшителю лиганда хемосенсорного рецептора, включает один или более из 1) K65, R383, D307, E302 и D278 человеческого T1R2, 2) S40, S144, S165, Y103, D142 и P277 человеческого T1R2, и 3) I167, P185, T184, T326, E302, V384, A305, I325, I306, R383, D307, E382, D278, I279, I67, V66, V309, D142, S165, S40, S303, T242, F103, Q328 и S168 человеческого T1R2.
В контексте данного изобретения, любая ссылка на конкретный взаимодействующий остаток, например, N143 человеческого T1R2 рецептора, включает все его соответствующие остатки, например, 1) любой остаток человеческого или не человеческого T1R2, который соответствует тому же положению при любом методе расположения последовательности, 2) любой остаток человеческого или не человеческого T1R2, который соответствует тому же положению при любом способе компьютерного моделирования в присутствии или отсутствии лиганда или модификатора лиганда, 3) любой остаток человеческого или не человеческого T1R2, который соответствует структурной или функциональной роли конкретного взаимодействующего остатка, 4) любой остаток человеческого или не человеческого T1R2, который является полиморфным вариантом, аллелем, мутацией и т.д. конкретного остатка, 5) любой остаток человеческого или не человеческого T1R2, который является консервативным замещением или консервативно модифицированным вариантом конкретного остатка, и 6) любой соответствующий остаток человеческого или не человеческого T1R2 в модифицированной форме, например, искусственный химический миметик конкретного взаимодействующего остатка или в не модифицированной форме, например, природной форме.
В другом варианте, место взаимодействия в домене венериной мухоловки хемосенсорного рецептора представляет собой трехмерное место взаимодействия в домене венериной мухоловки, отмеченном или определенном, частично или полностью, взаимодействующими остатками или одной или более границами, например, точками, линиями или поверхностями взаимодействия между хемосенсорным рецептором и одним или более модификаторами хемосенсорного рецептора или модификаторами лиганда хемосенсорного рецептора, или их сочетанием. В соответствии с данным изобретением, остаток очерчивает или ограничивает пространство, включающее любой остаток, имеющий один или более атомов скелета и/или боковой цепи, которые расположены так, что они могут потенциально взаимодействовать с атомами лиганда хемосенсорного рецептора или модификатора лиганда хемосенсорного рецептора, или обоими.
Например, место взаимодействия в соответствии с данным изобретением может быть любым частичным или целым пространством в домене венериной мухоловки, которое обычно занимается одним или более модификаторами хемосенсорного рецептора или модификаторами лиганда хемосенсорного рецептора, когда они взаимодействуют с хемосенсорным рецептором по отдельности или вместе. В одном примере, местом взаимодействия в соответствии с данным изобретением является пространство в домене венериной мухоловки, обычно занимаемое модификатором хемосенсорного рецептора, например, веществом со сладким вкусом. В другом примере, местом взаимодействия в соответствии с данным изобретением является пространство в домене венериной мухоловки, обычно занимаемое модификатором лиганда хемосенсорного рецептора, например, улучшителем вещества со сладким вкусом, в присутствии лиганда хемосенсорного рецептора. В еще одном примере, местом взаимодействия в соответствии с данным изобретением является пространство в домене венериной мухоловки, обычно занимаемое модификатором хемосенсорного рецептора, например, веществом со сладким вкусом, и модификатором лиганда хемосенсорного рецептора, например, улучшителем вещества со сладким вкусом. В еще одном примере, местом взаимодействия в соответствии с данным изобретением является пространство в домене венериной мухоловки, которое определено, сформовано или трансформировано на основе взаимодействия между хемосенсорным рецептором и его лигандом или модификатором его лиганда, существующее, частично или полностью, вне пространства.
В соответствии с данным изобретением, домен венериной мухоловки хемосенсорного рецептора может быть обычно виден как две доли, объединенные шарнирной областью. Примеры взаимодействующего пространства в домене венериной мухоловки хемсенсорного рецептора включают любое пространство, связанное с шарнирной областью, внутренней стороной одной или двух долей, концом одной или двух долей или их сочетанием, хемосенсорного рецептора.
Примеры взаимодействующего пространства в домене венериной мухоловки хемосенсорного рецептора по отношению к модификатору хемосенсорного рецептора включают любое пространство в домене венериной мухоловки, определенное или, по крайней мере, частично определенное шарнирной областью. В соответствии с данным изобретением, шарнирная область обычно содержит остатки, которые близки к трем нитям, соединяющим две доли. В одном примере, шарнирная область содержит остатки, которые являются гомологами рассматриваемым остаткам, координирующим агонисты и антагонисты в кристаллических структурах одного или более доменов венериной мухоловки, таких как mGluR рецептор. В другом примере, шарнирная область T1R2 включает остатки N143, S144 и I167 T1R2.
Примеры мест взаимодействия в домене венериной мухоловки хемосенсорного рецептора по отношению к модификатору лиганда хемосенсорного рецептора включают любое пространство, определенное или, по крайней мере, частично определенное внутренней стороной одной или двух долей в направлении от шарнирной область, а также остатки на концах долей, которые находятся в непосредственной близости с остатками другой доли.
В еще одном варианте, местом взаимодействия в домене венериной мухоловки хемосенсорного рецептора является сочетание одного или более взаимодействующих остатков во взаимодействующем пространстве хемосенсорного рецептора. Например, местом взаимодействия хемосенсорного рецептора могут быть взаимодействующие остатки, связанные с одним взаимодействующим структурным компонентом хемосенсорного рецептора в сочетании с трехмерным пространством, находящимся рядом, например, не ближе чем на 1 Ангстрем и не больше чем на 30 Ангстремов, к этому взаимодействующему структурному компоненту. Другим примером места взаимодействия хемосенсорного рецептора является взаимодействующие остатки, связанные с одним взаимодействующим структурным компонентом хемосенсорного рецептора в сочетании с трехмерным пространством, кроме взаимодействующего структурного компонента.
В общем, способы скриннинга, представленные в соответствии с данным изобретением, могут проводиться любыми подходящими способами, известными или открытыми позднее. В одном варианте, способы скриннинга, представленные в соответствии с данным изобретением, проводят с применением компьютерного моделирования, например, через "эффективный скрининг" с применением любой подходящей системы компьютерного моделирования или через специфический или детальный проект соединения с применением любой подходящей системы компьютерного дизайна.
В другом варианте, способы скриннинга, представленные в соответствии с данным изобретением, проводят с применением биологических анализов, например, высокопроизводительным скринингом взаимодействий между соединениями и хемосенсорным рецептором или его фрагментами, например, генетически модифицированными хемосенсорными рецепторами или их фрагментами, такими как мутированные домены венериной мухоловки хемосенсорных рецепторов.
В еще одном варианте, способы скриннинга, представленные в соответствии с данным изобретением, проводят с применением сочетания биологического анализа и компьютерного моделирования и/или дизайна. Например, способы скриннинга, представленные в соответствии с данным изобретением, могут представлять собой сочетание высокопроизводительного скриннинга взаимодействий между созданными на компьютере или предварительно отсортированных соединений и мутированными доменами венериной мухоловки хемосенсорных рецепторов.
В одном примере способ скриннинга, представленный в соответствии с данным изобретением для модификаторов хемосенсорного рецептора, включает определение места взаимодействия с применением известного модификатора хемосенсорного рецептора, например, структурно похожего с исследуемым модификатором хемосенсорного рецептора, с последующим определением того, способно ли тестируемое вещество взаимодействовать с хемосенсорным рецептором через определенное место взаимодействия.
В другом примере, способ скриннинга, представленный в соответствии с данным изобретением для модификаторов хемосенсорного рецептора, включает определение того, способно ли тестируемое вещество взаимодействовать с хемосенсорным рецептором через предварительно определенное место взаимодействия, например, место взаимодействия, выбранное или определенное до скриннинга, включая, без ограничений, выбранное или определенное на основе известных модификаторов хемосенсорного рецептора или желаемых характеристик модификаторов хемосенсорного рецептора.
В еще одном варианте, способ скриннинга, представленный в соответствии с данным изобретением для модификаторов лиганда хемосенсорного рецептора, включает определение места стыковки лиганда хемосенсорного рецептора с последующим определением, подходят ли тестируемое вещество для взаимодействия с лигандом хемосенсорного рецептора через место взаимодействия, выбранное с учетом стыковки лиганда хемосенсорного рецептора. В соответствии с данным изобретением, процесс стыковки может включать любые известные или открытые позднее способы. Например, стыковкой может быть процесс, в котором центр массы, ориентации и внутренняя степень свободы молекулы модифицированы так, чтобы соответствовать им в предопределенном пространстве в структурной модели. В одном примере, стыковкой может быть процесс, который включает преобразование и вращение лиганда хемосенсорного рецептора по отношению к структурной модели хемосенсорного рецептора, например, модели домена венериной мухоловки хемосенсорного рецептора при одновременной корректировке внутренних углов закручивания лиганда хемосенсорного рецептора для соответствия месту взаимодействия хемосенсорного рецептора. Примером широко применяемой программы стыковки является GLIDE от Schroedinger, Inc.
В еще одном примере, способ скриннинга, представленный в соответствии с данным изобретением для модификаторов лиганда хемосенсорного рецептора, включает определение места стыковки для лиганда хемосенсорного рецептора с последующим определением места взаимодействия с применением известного модификатора лиганда хемосенсорного рецептора, и с последующим определением того, подходит ли тестируемое вещество для взаимодействия с лигандом хемосенсорного рецептора через определенное место взаимодействия.
В еще одном варианте, способ скриннинга, представленный в соответствии с данным изобретением для модификаторов лиганда хемосенсорного рецептора, включает определение того, подходит ли тестируемое вещество для взаимодействия с хемосенсорным рецептором через предварительно определенное место взаимодействия для модификаторов лиганда хемосенсорного рецептора.
В еще одном примере, способ скриннинга, представленный в соответствии с данным изобретением для модификаторов лиганда хемосенсорного рецептора, включает определение того, подходит ли тестируемое вещество для взаимодействия с хемосенсорным рецептором, через, например, одновременное определение того, подходят ли лиганд хемосенсорного рецептора и тестируемое вещество для взаимодействия хемосенсорным рецептором в предварительно определенном месте взаимодействия хемосенсорного рецептора или месте взаимодействия определенного с применением известного лиганда хемосенсорного рецептора и его целевого рецептора.
В еще одном примере, способ скриннинга, представленный в соответствии с данным изобретением для модификаторов лиганда хемосенсорного рецептора, включает определение того, подходит ли тестируемое вещество для взаимодействия с хемосенсорным рецептором через место взаимодействия, определенное предварительно или нет, а также того, подходит ли тестируемое вещество для взаимодействия с лигандом хемосенсорного рецептора.
В еще одном примере, способ скриннинга, представленный в соответствии с данным изобретением для модификаторов лиганда хемосенсорного рецептора, включает определение того, подходит ли тестируемое вещество для взаимодействия с хемосенсорным рецептором через место взаимодействия, определенное предварительно или нет, а также того, может ли такое взаимодействие стабилизировать конформацию, например, полузакрытую или закрытую коформацию в домене венериной мухоловки, образованную взаимодействием между лигандом хемосенсорного рецептора и хемосенсорным рецептором, например, путем образования продуктивных дополнительных взаимодействий в шарнирной области, долях домена венериной мухоловки или концах домена венериной мухоловки через вандерваальсовы связи, запасы гидрофобных атомов или атомных групп, водородные связи, стэкинг-взаимодействия кольца или электростатические взаимодействия с соляным мостиком и т.д.
В общем, любые подходящие средства, известные или открытые позднее, могут применяться для определения того, подходит ли тестируемое вещество для взаимодействия с местом взаимодействия в соответствии с данным изобретением. Например, можно определить применимость тестируемого соединения на основе того, соответствует ли часть или все тестируемое вещество определенному пространству, определенному местом взаимодействия, например, соответствует ли тестируемое вещество конкретному пространству, определенному местом взаимодействия, практически таким же образом, как и известный модификатор хемосенсорного рецептора или модификатор лиганда хемосенсорного рецептора.
Альтернативно, можно определить применимость тестируемого вещества по отношению к месту взаимодействия, основываясь на том, взаимодействует ли оно с хемосенсорным рецептором таким же образом, каким взаимодействует с известными модификаторами хемосенсорного рецептора или модификатором лиганда хемосенсорного рецептора, когда они взаимодействуют с местом взаимодействия.
Кроме того, можно определить применимость тестируемого вещества на основе того, образует ли оно продуктивные взаимосвязи с местом взаимодействия, например, вандерваальсовы связи, запасы гидрофобных атомов или атомных групп, водородные связи, стэкинг-взаимодействия кольца или электростатические взаимодействия с соляным мостиком и т.д. В одном варианте, можно определить применимость тестируемого вещества на основе того, образует ли оно продуктивные взаимосвязи с местом взаимодействия без образования вандерваальсового совмещения с одним или более атомами хемосенсорного рецептора или лиганда хемосенсорного рецептора, например, в контексте одной или более конформаций домена венериной мухоловки в свете возможной гибкости домена венериной мухоловки.
В соответствии с данным изобретением, тестируемое вещество, подходящее для взаимодействия с одним или более местами взаимодействия в домене венериной мухоловки хемосенсорного рецептора, является характерным для кандидата в модификаторы хемосенсорного рецептора или модификатора лиганда хемосенсорного рецептора. В одном варианте, тестируемое вещество, подходящее для взаимодействия с одним или более местами взаимодействия в домене венериной мухоловки T1R2, является характерным для кандидата в модификаторы рецептора T1R2 или модификатора лиганда рецептора T1R2. В другом варианте, тестируемое вещество, подходящее для взаимодействия с одним или более местами взаимодействия в домене венериной мухоловки T1R2, является характерным для кандидата в модификаторы рецептора T1R или модификатора лиганда рецептора T1R. В еще одном варианте, тестируемое вещество, подходящее для взаимодействия с одним или более местами взаимодействия в домене венериной мухоловки T1R2, является характерным для кандидата в модификаторы рецептора или модификатора лиганда рецептора семейства GPCR. В еще одном варианте, тестируемое вещество, подходящее для взаимодействия с одним или более местами взаимодействия в домене венериной мухоловки хемосенсорного рецептора, является характерным для кандидата в модификаторы хемосенсорного рецептора или модификатора лиганда хемосенсорного рецептора, который соответствует хемосенсорному рецептору или принадлежит к тому же семейству или классу хемосенсорного рецептора.
В соответствии с данным изобретением, тестируемое вещество, подходящее для взаимодействия с одним или более местами взаимодействия в домене венериной мухоловки хемосенсорного рецептора, является характерным для кандидата в модификаторы хемосенсорного рецептора или модификатора лиганда хемосенсорного рецептора. В одном варианте, тестируемое вещество, подходящее для взаимодействия с одним или более местами взаимодействия в домене венериной мухоловки T1R2, является характерным для кандидата в модификаторы рецептора T1R2 или модификатора лиганда рецептора T1R2.
В одном примере, тестируемое вещество, подходящее для взаимодействия с одним или более местами взаимодействия, содержащий один или более взаимодействующих остатков K65, D278, L279, D307, R383 и V384 человеческого T1R2 является характерным для кандидата в улучшители лиганда рецептора T1R2.
В другом примере, тестируемое вещество, подходящее для взаимодействия с одним или более местами взаимодействия, содержащий один или более взаимодействующих остатков S40, S144, Y103, D142 и P277 человеческого T1R2 является характерным для кандидата в улучшители лиганда рецептора T1R2 по отношению к сахарозе или сукралозе или любому лиганду со структурой, похожей на сахарозу или сукралозу, или любому лиганду, взаимодействующему с T1R2 так же, как сахароза или сукралоза, например, через одно или более взаимодействующих пространств и/или остатков, применяемых сахарозой или сукралозой.
В контексте данной заявки, любая ссылка на модификатор, например улучшитель или ингибитор T1R2 рецептора или лиганда T1R2 рецептора включает модификатор для любого T1R рецептора, любого рецептора надсемейства GPCR или любого рецептора, соответствующего рецептору T1R2, например, любого рецептора со структурой, функцией или схемой экспрессии, перекрывающейся или сходной с T1R2. В данном изобретении тестируемым веществом может быть любое соединение или молекула, например, любое соединение или вещество, которое потенциально может быть источником желаемого модификатора хемосенсорного рецептора или модификатором лиганда хемосенсорного рецептора. Например, тестируемым веществом может быть член комбинаторной библиотеки, "специфически созданное" соединение, которое создано на основе различных желаемых характеристик или обоснований и т.д.
В общем, модификатор хемосенсорного рецептора или лиганда включает любое соединение или вещество, способное взаимодействовать с, например, связыванием с хемосенсорным рецептором или модулированием структуры или функции хемосенсорного рецептора, например, активировать, деактивировать, повышать или снижать активность трансдукции сигнала хемосенсорного рецептора, особенно через путь трансдукции сигнала G-белка.
В одном варианте, модификатором хемосенсорного рецептора или лиганда является соединение или вещество со сладким вкусом, включающее, без ограничений, любое нейтральное или синтезированное вещество со сладким вкусом, например, некалорийные соединения со сладким вкусом, соединения со сладким вкусом пониженной калорийности и соединением со сладким вкусом ложной калорийности, и т.д. Примеры соединений со сладким вкусом включают, без ограничений, цикламиновую кислоту, могрозид, тагатозу, мальтозу, галактозу, маннозу, сахарозу, фруктозу, лактозу, аспартам, неотам и другие производные аспартама, сахарин, сукралозу, ацесульфам K, глюкозу, эритритол, D-триптофан, глицин, маннит, сорбит, мальтит, лактит, изомальт, гидрированный сироп глюкозы (HGS), гидрированный гидролизат крахмала (HSH), стевиозид, ребаудиозид A и другие сладкие гликозиды на основе стевии, алитам, каррелам и другие подсластители на основе гуанидина, тагатозу, ксилит, кукурузный сироп с высоким содержанием фруктозы и т.д.
В другом варианте, модификатором хемосенсорного рецептора или лиганда (применяется взаимозаменяемо в соответствии с данным изобретением) является соединение или вещество, способное активировать хемосенсорный рецептор, например, активировать путь трансдукции сигнала G-белка, связанный с хемосенсорным рецептором. В еще одном варианте, модификатором хемосенсорного рецептора или лиганда является соединение или вещество, способное блокировать или снижать активацию хемосенсорного рецептора. В еще одном варианте, модификатором хемосенсорного рецептора или лиганда является соединение или вещество, способное модулировать активность хемосенсорного рецептора и вызывать терапевтически желательную реакцию или трансдукцию сигнала. В еще одном варианте, модификатором хемосенсорного рецептора или лиганда является модификатор лиганда хемосенсорного рецептора.
В соответствии с данным изобретением, модификатор лиганда хемосенсорного рецептора включает любое соединение или вещество, способное взаимодействовать или модулировать активность модификатора хемосенсорного рецептора или активность хемосенсорного рецептора в присутствии модификатора хемосенсорного рецептора. В одном варианте, модификатором лиганда хемосенсорного рецептора является улучшитель модификатора хемосенсорного рецептора. В другом варианте, модификатором лиганда хемосенсорного рецептора является антагонист модификатора хемосенсорного рецептора. В еще одном варианте, модификатором лиганда хемосенсорного рецептора является улучшитель модификатора хемосенсорного рецептора, не обладающей существенной активностью модификатора хемосенсорного рецептора. В еще одном варианте модификатором лиганда хемосенсорного рецептора является улучшитель соединения со сладким вкусом, сам не обладающий существенным сладким вкусом, например, что определяется животными или человеком из основной части панели, по крайней мере, восьми человеческих тестеров вкусов, с применением методик, известных в данной области техники. В еще одном варианте, модификатором лиганда хемосенсорного рецептора является улучшитель или ингибитор модификатора хемосенсорного рецептора способный вызывать желаемую терапевтическую реакцию или трансдукцию сигнала.
Согласно другому аспекту данного изобретения, в нем представлены модификаторы лиганда хемосенсорного рецептора. В одном варианте, в нем представлены модификаторы лиганда хемосенсорного рецептора, идентифицированные способами скриннинга в соответствии с данным изобретением. В другом варианте, в нем представлены модификаторы лиганда хемосенсорного рецептора, способные взаимодействовать с хемосенсорным рецептором через место взаимодействия в соответствии с данным изобретением. В еще одном варианте, в нем представлены модификаторы лиганда хемосенсорного рецептора, способные взаимодействовать с хемосенсорным рецептором через один или более взаимодействующих остатков хемосенсорного рецептора. В еще одном варианте, в нем представлены модификаторы лиганда хемосенсорного рецептора, способные взаимодействовать с хемосенсорным рецептором через взаимодействующее пространство в домене венериной мухоловки, который ограничен, определен и сформован, частично или полностью, взаимодействующими остатками хемосенсорного рецептора. В еще одном варианте, в нем представлены модификаторы лиганда хемосенсорного рецептора, исключающие, например, природные или синтезированные улучшители сладкого вкуса, известные до данного изобретения.
В контексте данного изобретения, "способные взаимодействовать с" или "взаимодействующие с" означает, что соединение или молекула связывается с или образует одну или более молекулярных взаимосвязей, например, продуктивных взаимосвязей, с другой молекулой, например, хемосенсорным рецептором. Примеры молекулярных взаимосвязей, например продуктивных взаимосвязей, включают вандерваальсовы связи, запасы гидрофобных атомов или атомных групп, водородные связи, стэкинг-взаимодействия кольца или электростатические взаимодействия с соляным мостиком с модификатором хемосенсорного рецептора или модификатором лиганда хемосенсорного рецептора или их сочетания.
В одном варианте, в данном изобретении представлены модификаторы лиганда хемосенсорного рецептора, способные взаимодействовать с хемосенсорным рецептором через группу взаимодействующих остатков или пространство в домене венериной мухоловки, которое ограничено, сформовано или определено, частично или полностью, группой или любой подгруппой взаимодействующих остатков, необязательно в присутствии лиганда хемосенсорного рецептора, например, 1) S40, S144, S165, Y103, D142, P277 человеческого T1R2, 2) K65, R383, D307, E302 и D278 человеческого T1R2, 3) I167, P185, T184, T326, E302, V384, A305, I325, I306, R383, D307, E382, D278, I279, I67, V66, V309, D142, S165, S40, S303, T242, F103, Q328 и S168 человеческого T1R2, 4) S40, S144, S165, Y103, D142, P277, K65, R383, D307, E302 и D278 человеческого T1R2, 5) S40, S144, S165, Y103, D142, P277, I167, P185, T184, T326, E302, V384, A305, I325, I306, R383, D307, E382, D278, I279, I67, V66, V309, S303, T242, F103, Q328 и S168 человеческого T1R2, 6) K65, R383, D307, E302, D278, I167, P185, T184, T326, E302, V384, A305, I325, I306, E382, I279, I67, V66, V309, D142, S165, S40, S303, T242, F103, Q328 и S168 человеческого T1R2, 7) S40, S144, S165, Y103, D142, P277, K65, R383, D307, E302, D278, I167, P185, T184, T326, E302, V384, A305, I325, I306, E382, I279, I67, V66, V309, S303, T242, F103, Q328 и S168 человеческого T1R2, 8) N143, S144 и I167 человеческого T1R2, или 9) N143, S40, S144, S165, Y103, D142, P277, K65, R383, D307, E302, D278, I167, P185, T184, T326, E302, V384, A305, I325, I306, E382, I279, I67, V66, V309, S303, T242, F103, Q328 и S168 человеческого T1R2.
В другом варианте, в данном изобретении представлены улучшители лиганда хемосенсорного рецептора, способные взаимодействовать с хемосенсорным рецептором в присутствии лиганда хемосенсорного рецептора через один или более взаимодействующих остатков K65, D278, L279, D307, R383, V384 человеческого T1R2.
В еще одном варианте в данном изобретении представлены улучшители сахарозы или сукралозы, способные взаимодействовать с хемосенсорным рецептором в присутствии сахарозы или сукралозы через один или более взаимодействующих остатков S40, S144, Y103, D142, P277 человеческого T1R2.
В еще одном варианте, в данном изобретении представлены улучшители лиганда хемосенсорного рецептора, способные взаимодействовать с хемосенсорным рецептором, необязательно, в присутствии лиганда хемосенсорного рецептора через, по крайней мере, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 взаимодействующих остатков, выбранных из N143, S40, S144, S165, Y103, D142, P277, K65, R383, D307, E302, D278, I167, P185, T184, T326, E302, V384, A305, I325, I306, E382, I279, I67, V66, V309, S303, T242, F103, Q328 и S168 человеческого T1R2.
В еще одном варианте, в данном изобретении представлены модификаторы лиганда хемосенсорного рецептора, способные взаимодействовать с хемосенсорным рецептором для стабилизации конформации, например, полузакрытой или закрытой конформации, образованной взаимодействием между хемосенсорным рецептором и лигандом хемосенсорного рецептора.
В еще одном варианте, в данном изобретении представлены модификаторы лиганда хемосенсорного рецептора, например, сахарин, аналоги сахарина, ацесульфам K, аналоги ацесульфама K или любое соединение, способное взаимодействовать с хемосенсорным рецептором через место взаимодействия, которое похоже или перекрывается с местом взаимодействия, применяемым сахарином или ацесульфамом K. В одном примере, в данном изобретении представлены улучшители лиганда хемосенсорного рецептора, например, сахарин, аналоги сахарина, ацесульфам K или аналоги ацесульфама K, которые взаимодействуют с хемосенсорным рецептором через место взаимодействия, включающее один или более взаимодействующих остатков K65, R383, D307, E302 и D278 человеческого T1R2.
Согласно еще одному аспекту данного изобретения, в нем представлены модификаторы хемосенсорного рецептора. В одном варианте, в нем представлены модификаторы хемосенсорного рецептора, идентифицированные способами скриннинга в соответствии с данным изобретением. В другом варианте, в нем представлены модификаторы хемосенсорного рецептора, способные взаимодействовать с хемосенсорным рецептором через место взаимодействия в соответствии с данным изобретением. В еще одном варианте, в нем представлены модификаторы хемосенсорного рецептора, способные взаимодействовать с хемосенсорным рецептором через один или более фармацевтические остатки хемосенсорного рецептора. В еще одном варианте, в нем представлены модификаторы хемосенсорного рецептора, способные взаимодействовать с хемосенсорным рецептором через взаимодействующее пространство в домене венериной мухоловки, которое ограничено, сформовано или определено, частично или полностью, взаимодействующими остатками хемосенсорного рецептора. В еще одном варианте, в нем представлены модификаторы хемосенсорного рецептора, исключающие, например, природные или синтезированные улучшители сладкого вкуса, известные до данного изобретения.
В еще одном варианте, в данном изобретении представлены модификаторы хемосенсорного рецептора, способные взаимодействовать с хемосенсорным рецептором через группу взаимодействующих остатков или пространство в домене венериной мухоловки, которое ограничено, сформовано или определено, частично или полностью, группой или любой подгруппой взаимодействующих остатков, например, 1) S40, S144, S165, Y103, D142, P277 человеческого T1R2, 2) K65, R383, D307, E302 и D278 человеческого T1R2, 3) I167, P185, T184, T326, E302, V384, A305, I325, I306, R383, D307, E382, D278, I279, I67, V66, V309, D142, S165, S40, S303, T242, F103, Q328 и S168 человеческого T1R2, 4) S40, S144, S165, Y103, D142, P277, K65, R383, D307, E302 и D278 человеческого T1R2, 5) S40, S144, S165, Y103, D142, P277, I167, P185, T184, T326, E302, V384, A305, I325, I306, R383, D307, E382, D278, I279, I67, V66, V309, S303, T242, F103, Q328 и S168 человеческого T1R2, 6) K65, R383, D307, E302, D278, I167, P185, T184, T326, E302, V384, A305, I325, I306, E382, I279, I67, V66, V309, D142, S165, S40, S303, T242, F103, Q328 и S168 человеческого T1R2, 7) S40, S144, S165, Y103, D142, P277, K65, R383, D307, E302, D278, I167, P185, T184, T326, E302, V384, A305, I325, I306, E382, I279, I67, V66, V309, S303, T242, F103, Q328 и S168 человеческого T1R2, 8) N143, S144 и I167 человеческого T1R2, или 9) N143, S40, S144, S165, Y103, D142, P277, K65, R383, D307, E302, D278, I167, P185, T184, T326, E302, V384, A305, I325, I306, E382, I279, I67, V66, V309, S303, T242, F103, Q328 и S168 человеческого T1R2.
В еще одном варианте, в данном изобретении представлены модификаторы хемосенсорного рецептора, способные взаимодействовать с хемосенсорным рецептором через, по крайней мере, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 взаимодействующих остатков, выбранных из группы N143, S40, S144, S165, Y103, D142, P277, K65, R383, D307, E302, D278, I167, P185, T184, T326, E302, V384, A305, I325, I306, E382, I279, I67, V66, V309, S303, T242, F103, Q328 и S168 человеческого T1R2.
Согласно еще одному аспекту данного изобретения, в нем представлены способы модулирования хемосенсорного рецептора и/или его лиганда через модулирование одного или более мест взаимодействия хемосенсорного рецептора. Например, можно модулировать хемосенсорный рецептор через контакт, in vivo или in vitro, модификатора хемосенсорного рецептора или модификатора лиганда хемосенсорного рецептора или обоих, (например, необязательно исключая природные вещества со сладким вкусом или улучшители сладкого вкуса, известные до данного изобретения) с клетками, содержащими хемосенсорный рецептор, где модификатор хемосенсорного рецептора или лиганд хемосенсорного рецептора способен взаимодействовать с или конъюгироваться с одним или более местами взаимодействия хемосенсорного рецептора.
В одном варианте, способ модулирования хемосенсорного рецептора и/или его лиганда включает модулирование одного или более взаимодействующих остатков или взаимодействующих пространств или их сочетания. В другом варианте, способ модулирования хемосенсорного рецептора и/или его лиганда путем взаимодействия с одним или более взаимодействующих остатков в присутствии лиганда хемосенсорного рецептора. В еще одном варианте, способ модулирования хемосенсорного рецептора или его лиганда включает модулирование воздействия лиганда хемосенсорного рецептора на хемосенсорный рецептор путем взаимодействия с хемосенсорным рецептором через один или более взаимодействующих остатков в присутствии лиганда хемосенсорного рецептора.
В еще одном варианте, способ модулирования хемосенсорного рецептора и/или его лиганда включает взаимодействие с хемосенсорным рецептором через группу взаимодействующих остатков или пространства, которое ограничено, сформовано или определено, частично или полностью, группой или любой подгруппой взаимодействующих остатков, необязательно в присутствии лиганда хемосенсорного рецептора, например, 1) S40, S144, S165, Y103, D142, P277 человеческого T1R2, 2) K65, R383, D307, E302 и D278 человеческого T1R2, 3) I167, P185, T184, T326, E302, V384, A305, I325, I306, R383, D307, E382, D278, I279, I67, V66, V309, D142, S165, S40, S303, T242, F103, Q328 и S168 человеческого T1R2, 4) S40, S144, S165, Y103, D142, P277, K65, R383, D307, E302 и D278 человеческого T1R2, 5) S40, S144, S165, Y103, D142, P277, I167, P185, T184, T326, E302, V384, A305, I325, I306, R383, D307, E382, D278, I279, I67, V66, V309, S303, T242, F103, Q328 и S168 человеческого T1R2, 6) K65, R383, D307, E302, D278, I167, P185, T184, T326, E302, V384, A305, I325, I306, E382, I279, I67, V66, V309, D142, S165, S40, S303, T242, F103, Q328 и S168 человеческого T1R2, 7) S40, S144, S165, Y103, D142, P277, K65, R383, D307, E302, D278, I167, P185, T184, T326, E302, V384, A305, I325, I306, E382, I279, I67, V66, V309, S303, T242, F103, Q328 и S168 человеческого T1R2, 8) N143, S144 и I167 человеческого T1R2, или 9) N143, S40, S144, S165, Y103, D142, P277, K65, R383, D307, E302, D278, I167, P185, T184, T326, E302, V384, A305, I325, I306, E382, I279, I67, V66, V309, S303, T242, F103, Q328 и S168 человеческого T1R2.
В еще одном варианте, способ модулирования хемосенсорного рецептора и/или его лиганда включает взаимодействие с хемосенсорным рецептором через один или более взаимодействующих остатков N143, S144 и I167 человеческого T1R2.
В еще одном варианте, способ модулирования хемосенсорного рецептора и/или его лиганда включает взаимодействие с хемосенсорным рецептором, необязательно в присутствии лиганда хемосенсорного рецептора через один или более взаимодействующих остатков K65, D278, L279, D307, R383, V384 человеческого T1R2.
В еще одном варианте, способ модулирования хемосенсорного рецептора и/или его лиганда включает взаимодействие с хемосенсорным рецептором, необязательно в присутствии сахарозы или сукралозы, через один или более взаимодействующих остатков S40, S144, Y103, D142, P277 человеческого T1R2.
В еще одном варианте, способ улучшения хемосенсорного рецептора и/или его лиганда включает взаимодействие с хемосенсорным рецептором, необязательно в присутствии лиганда хемосенсорного рецептора, через один или более взаимодействующих остатков K65, D278, L279, D307, R383, V384, S40, S144, Y103, D142, P277 человеческого T1R2.
В еще одном варианте, способ модулирования хемосенсорного рецептора и/или его лиганда включает взаимодействие с хемосенсорным рецептором, необязательно в присутствии лиганда хемосенсорного рецептора, через, по крайней мере, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 взаимодействующих остатков, выбранных из группы N143, S40, S144, S165, Y103, D142, P277, K65, R383, D307, E302, D278, I167, P185, T184, T326, E302, V384, A305, I325, I306, E382, I279, I67, V66, V309, S303, T242, F103, Q328 и S168 человеческого T1R2.
В еще одном варианте, способ модулирования хемосенсорного рецептора и/или его лиганда включает взаимодействие с хемосенсорным рецептором, необязательно в присутствии лиганда хемосенсорного рецептора, через, по крайней мере, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 взаимодействующих остатков, выбранных из группы N143, S40, S144, S165, Y103, D142, P277, K65, R383, D307, E302, D278, I167, P185, T184, T326, E302, V384, A305, I325, I306, E382, I279, I67, V66, V309, S303, T242, F103, Q328 и S168 человеческого T1R2.
В соответствии с данным изобретением, способ модулирования хемосенсорного рецептора и/или его лиганда включает модулирование активности, структуры, функции, экспрессии и/или модификацию хемосенсорного рецептора, а также модулирование, лечение или профилактику состояния, например, физиологического или патологического состояния, связанного с хемосенсорным рецептором.
В общем, физиологическое или патологическое состояние, связанное с хемосенсорным рецептором, включает состояние, связанное со вкусом, например, сладким вкусом, вкусом белковых веществ, горьким, кислым, соленым вкусом или их сочетанием, или состояние, связанное с, например, желудочно-кишечной системой, метаболическими расстройствами, функциональными желудочно-кишечными расстройствами, и т.д.
В одном варианте, способ в соответствии с данным изобретением, например, модулирование хемосенсорного рецептора и/или его лиганда, включает усиление или ослабление сладкого вкуса или вкуса белковых веществ или реакции пациента, физиологической или иной, на сладкий вкус или вкус белковых веществ. В другом варианте, способ в соответствии с данным изобретением, например, модулирование хемосенсорного рецептора и/или его лиганда включает улучшение сладкого вкуса или вкуса белковых веществ или реакции пациента, физиологической или иной, на сладкий вкус или вкус белковых веществ.
В еще одном варианте, способ в соответствии с данным изобретением, например, модулирование хемосенсорного рецептора и/или его лиганда, включает модулирование, лечение и/или профилактику состояния, связанного с желудочно-кишечной системой, включая, без ограничений, состояния, связанные с подвижностью пищевода (например, крикофарингеальная ахалазия, истерический комок, ахалазия, диффузный спазм пищевода и связанные с ним расстройства моторики, склеродермия, охватывающая пищевод, и т.д.), воспалительные расстройства (например, гастроэзофагеальный рефлюкс и эзофагит, инфекционный эзофагит и т.д.), пептическая язва, язва двенадцатиперстной кишки, язва желудка, гастринома, стрессовая язва и эрозии, гастрит, рак пищевода, опухоли желудка, расстройства абсорбции (например, абсорбции определенных питательных веществ, таких как углевод, белок, аминокислота, жир, холестерин и жирорастворимые витамины, вода и натрий, кальций, железо, водорастворимые витамины, и т.д.), расстройства малабсорбции, дефекты слизистой функции (например, воспалительные или инфильтрационные расстройства, биохимические или генетические аномалии, эндокринные и метаболические расстройства, энтеропатия с потерей белка и т.д.), аутоиммунные заболевания пищеварительного тракта (например, целиакия, болезнь Крона, язвенный колит и т.д.), синдром раздраженного кишечника, воспалительная болезнь кишечника, осложнения воспалительной болезни кишечника, внекишечные проявления воспалительной болезни кишечника, расстройства подвижности кишечника, сосудистые расстройства в кишечнике, аноректальные расстройства (например, геморрой, воспаление ануса и т.д.), рак ободочной и прямой кишки, опухоли тонкого кишечника, рак ануса, нарушения печеночного метаболизма, гипербилирубинемия, гепатит, алкогольная болезнь печения и цирроз, билиарный цирроз, новообразования в печени, инфильтрационные и метаболические заболевания, поражающие печень (например, жировая инфильтрация печени, синдром Рейе, диабетический гликогеноз, гликогеноз, болезнь Вильсона, гемохроматоз), заболевания желчного пузыря и желчных протоков, расстройства поджелудочной железы (например, панкреатит, панкреатическая эндокринная недостаточность, рак поджелудочной железы и т.д.), эндокринные опухоли желудочно-кишечного тракта и поджелудочной железы и т.д.
В еще одном варианте, способ в соответствии с данным изобретением, например, модулирование хемосенсорного рецептора и/или его лиганда, включает модулирование, лечение и/или профилактику состояния, связанного с метаболическими расстройствами, например, аппетита, массы тела, поглощения пищи или жидкости или реакции пациента на поглощение пищи или жидкости, или состояния насыщения или ощущения пациентом чувства сытости, поглощения и регулирования поглощения питательных веществ (например, белково-энергетическая недостаточность, физиологические ухудшения, связанные с белково-энергетической недостаточностью, и т.д.), ожирения, вторичного ожирения (например, гипотиреоз, болезнь Кушинга, инсулинома, гипоталамические расстройства и т.д.), расстройств питания (например, нервная анорексия, булимия и т.д.), дефицита и избытка витаминов, метаболизма инсулина, диабетов (I и II типа) и их осложнений (например, аномалии кровообращения, ретинопатия, диабетическая нефропатия, диабетическая невропатия, диабетические язвы ног и т.д.), метаболизма глюкозы, метаболизма жиров, гипогликемии, гипергликемии, гиперлипопротеинемии, и т.д.
В еще одном варианте, способ в соответствии с данным изобретением, например, модулирование хемосенсорного рецептора и/или его лиганда, включает модулирование, лечение и/или профилактику состояния, связанного с функциональными желудочно-кишечными расстройствами, например, когда при отсутствии какого-либо конкретного патологического состояния, такого как пептическая язва и рак, пациент имеет расстройство пищеварения, например, чувство вздутого живота, тошноту, рвоту, боль в области живота, анорексию, рефлюкс желудочной кислоты или аномальные движения кишечника (запор, диарея и подобные), необязательно, основанные на удержании содержимого желудочно-кишечного тракта, особенно в желудке. В одном примере, функциональные желудочно-кишечные расстройства включают состояние без заболевания органов желудочно-кишечного тракта, но с одним или более воспроизводимых желудочно-кишечных симптомов, которые ухудшают качество жизни пациента, например, человека.
Примеры функциональных желудочно-кишечных расстройств включают, без ограничений, функциональную диспепсию, гастроэзофагеальный рефлюкс, диабетический гастропарез, рефлюкс-эзофагит, постоперационная желудочно-кишечная дисфункция и подобные, тошнота, рвота, болезненное состояние, изжога, чувство вздутия живота, тяжесть в желудке, отрыжка, грудные корчи, боль в груди, дискомфорт в желудке, анорексию, дисфагию, рефлюкс желудочной кислоты, боль в животе, запор, диарею, одышку, удушье, низкий уровень побудительной мотивации и энергии, глоточное затруднение, ощущение чужеродного тела, быструю утомляемость, кривошею, тиотонию, сухость во рту (сухой рот, жажда и т.д.), тахипноэ, чувство изжоги в желудочно-кишечном тракте, чувство холода в конечностях, трудность концентрации, нетерпеливость, расстройства сна, головную боль, общее недомогание, учащенное сердцебиение, ночной пот, тревогу, головокружение, вертиго, приливы, избыточное потение, депрессию и т.д.
В еще одном варианте, способ в соответствии с данным изобретением, например, модулирование хемосенсорного рецептора и/или его лиганда, включает повышение или содействие пищеварения, абсорбции, уровня питательных веществ в крови и/или подвижности желудочно-кишечного тракта у пациента, например, содействие опорожнению желудка (например, очистке содержимого желудка), снижение вздутия живота сразу после приема пищи, улучшение анорексии и т.д. В общем, такое содействие может быть достигнуто либо напрямую, либо через повышение секреции регулирующего вещества, например, гормонов и т.д.
В еще одном варианте, способ в соответствии с данным изобретением, например, модулирование хемосенсорного рецептора и/или его лиганда, включает повышение одной или более желудочно-кишечных функций для улучшения качества жизни или состояния здоровья пациента.
В еще одном варианте, способ в соответствии с данным изобретением, например, модулирование хемосенсорного рецептора и/или его лиганда, включает активности клеток, экпрессирующих T1R (например, T1R1, T1R2 или T1R3), например, клеток печени (например, гепатоцитов, эндотелиальных клеток, купферовских клеток печени, звездчатых клеток, эпителиальных клеток желчных проходов и т.д.), клеток сердца (например, эндотелиальных, сердечных и клеток гладкой мускулатуры и т.д.), клеток поджелудочной железы (например, альфа-клеток, бета-клеток, дельта-клеток, нейросекреторных PP клеток, D1 клеток и т.д.), клеток соска (например, протоковых эпителиальных клеток и т.д.), клеток желудка (например, мукоцитов, пристеночных клеток, главных клеток, G клеток, P/D1 клеток), клеток кишечника (например, энтероэндокринных клеток, щеточных клеток и т.д.), клеток слюнных желез (например, серологических мукоцитов, мукоцитов, микоэпителиальных клеток, клеток вставочных протоков, клеток исчерченных протоков и т.д.), L клеток (например, экпрессирующих GLP-1 и т.д.), энтерохромаффиноцитов (например, экспрессирующих серотонин), энтерохромаффиноцитоподобных клеток, G клеток {например, экспрессирующих гастрин), D клеток (дельта клеток, например, экспрессирующих соматостатин), I клеток (например, экспрессирующих холесцистокинин (ХЦК)), K клеток {например, экспрессирующих желудочной ингибиторный полипептид), P/D1 клеток (например, экспрессирующих грелин), главных клеток (например, экспрессирующих пепсин) и S клеток (например, экспрессирующих секретин). В одном примере, способ в соответствии с данным изобретением включает повышение уровня экспрессии T1R в клетках, экспрессирующих T1R. В другом примере, способ в соответствии с данным изобретением включает повышение уровня секреции клеток, экспрессирующих T1R.
В еще одном варианте, способ в соответствии с данным изобретением, например, модулирование хемосенсорного рецептора и/или его лиганда, включает модулирование экспрессии, секреции и/или функционального уровня клеток, экспрессирующих T1R, связанных с производством гормонов, пептидов, ферментов. В одном примере, способ в соответствии с данным изобретением включает модулирование уровня глюкозы, например, ингибиторы хемосенсорного рецептора, такого как T1R2, могут применяться для снижения уровня глюкозы (например, абсорбции глюкозы) у пациента. В другом примере, способ в соответствии с данным изобретением включает модулирование уровня инкретинов, например, агонист хемосенсорного рецептора, такого как T1R2, может применяться для повышения глюкагоноподбного пептида 1 (GLP-I) и, таким образом, повышения выработки инсулина. В еще одном примере, способ в соответствии с данным изобретением включает модулирование экспрессии, секреции и/или уровня активности гормонов или пептидов, вырабатываемых клетками, производящими T1R клетками, производящими желудочно-кишечный гормон, например, лиганды для рецепторов 5HT (например, серотонина), инкретины (например, GLP-1 и глюкозо-зависимый инсулинотропический полипептид (GIP)), гастрин, секретин, пепсин, холецистокинин, амилазу, грелин, лептин, соматостатин и т.д. В еще одном примере, способ в соответствии с данным изобретением включает модулирование путей, связанных с гормонами, пептидами и/или ферментами, секретируемыми клетками, экспрессирующими T1R.
Примеры модификаторов лиганда хемосенсорного рецептора, представленного в соответствии с данным изобретением и/или подходящего для применения в способах в соответствии с данным изобретением, включают соединения со следующими формулами.
В одном варианте данного изобретения, модификатором лиганда хемосенсорного рецептора является соединение, имеющее структурную формулу (I):

или его таутомер, соль, сольват и/или сложный эфир, где:
G образует одинарную связь с D или E, и двойную связь с другим из D или E;
R1 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -CN, -NO2, -OR3, -S(O)aR3, -NR3R4, -CONR3R4, -CO2R3, -NR3CO2R4, -NR3CONR4R5, -NR3CSNR4R5, -NR3C(=NH)NR4R5, -SO2NR3R4, -NR4SO2R3, -NR3SO2NR4R5, -B(OR3)(OR4), -P(O)(OR3)(OR4) или -P(O)(R3)(OR4);
R2 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -CN, -NO2, -OR6, -S(O)bR6, -NR6R7, -CONR6R7, -CO2R6, -NR6CO2R7, -NR6CONR7R8, -NR6CSNR7R8, -NR6C(=NH)NR7R8, -SO2NR5R6, -NR5SO2R6, -NR5SO2NR6R7, -B(OR5)(OR6), -P(O)(OR5)(OR6) или -P(O)(R5)(OR6); или, альтернативно, R1 и R2, вместе с атомами, к которым они присоединены, образуют арильное, замещенное арильное, гетероарильное, замещенное гетероарильное, циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо, где кольцо необязательно конденсировано с другим арильным, замещенным арильным, гетероарильным, замещенным гетероарильным, циклоалкильным, замещенным циклоалкильным, циклогетероалкильным или замещенным циклогетероалкильным кольцом;
при условии, что R1 и R2 оба не являются водородом;
A является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, галогеном, -CN, -NO2, -OR9, -S(O)CR9, -NR9COR10, -NHOR9, -NR9R10, -NOR9, -CONR9R10, -CO2R9, -NR9CO2R10, -NR9CONR10R11, -NR9CSNR10R11, -NR9C(=NH)NR10R11, -B(OR10)(OR11), -P(O)(OR10)(OR11) или -P(O)(R10)(OR11);
B является -N- или -C(R12)-;
R12 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -NR13R14, -CN, -OR13, -S(O)dR13, -CO2R13 или -CONR13R14;
G является -C- или -S(O)2-;
при условии, что если G является -S(O)2-, то G образует одинарную связь с E;
если связь между D и G является одинарной связью, тогда D является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, галогеном, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -OR15, -NH-OR15, -S(O)eR15, -NR15R16, -NH-NHR15, -CO2R15 или -CONR15R16;
если G образует двойную связь с D, тогда D является =O, =S, =N-OR15 или =N-NHR15;
n равно 0 если G является -S(O)2-, и n равно 1, если G является -C-;
E является -NR17-, -N- или -C(R18)-;
при условии, что E является -NR17- только если G образует одинарную связь с E;
R17 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом или -CO2R19;
R18 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -NR20R21, -CN, -OR20, -S(O)fR20, -CO2R20 или -CONR20R21;
a, b, c, d, e и f независимо равны 0, 1 или 2; и
R3, R4, R5, R6, R7, R8, R9, R10, R11, R13, R14, R15, R16, R18, R20 и R21 независимо является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом; или, альтернативно, R3 и R4, R4 и R5, R6 и R7, R7 и R8, R9 и R10, R10 и R11, R13 и R14, R15 и R16, или R20 и R21, вместе с атомами, к которым они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо.
В одном варианте формулы (I), R1 и R2, вместе с атомами, к которым они присоединены, образуют арильное, замещенное арильное, гетероарильное, замещенное гетероарильное, циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо, где кольцо необязательно конденсировано с другим арильным, замещенным арильным, гетероарильным, замещенным гетероарильным, циклоалкильным, замещенным циклоалкильным, циклогетероалкильным или замещенным циклогетероалкильным кольцом.
В одном варианте формулы (I), модификатором лиганда хемосенсорного рецептора является соединение, имеющее структурную формулу (II),

где:
Y образует одинарную связь с W или Z, и двойную связь с другим из W или Z;
W является -C(R24)-, -S-, -N-, -N(R25)- или -O-;
Y является -C(R26)- или -N-;
Z является -C(R27)-, -S-, -N-, -N(R28)- или -O-;
R24 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом -CN, -NO2, -OR29, -S(O)gR29, -NR29R30, -CONR29R30, -CO2R29, -SO2NR29R30, -NR29SO2R30, -B(OR29)(OR30), -P(O)(OR29)(OR30) или -P(O)(R29)(OR30);
R26 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом -CN, -NO2, -OR31, -S(O)hR31, -NR31R32, -CONR31R32, -CO2R31, -OCOR31, -SO2NR31R32, -NR31SO2R32, -B(OR31)(OR32), -P(O)(OR31)(OR32) или -P(O)(R31)(OR32);
R27 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом -CN, -NO2, -OR33, -S(O)iR33, -NR33R34, -CONR33R34, -COR33, -CO2R33, -OCOR33, -SO2NR33R34, -NR33SO2R34, -B(OR33)(OR34), -P(O)(OR33)(OR34) или -P(O)(R33)(OR34); или, альтернативно, R24 и R26 или R26 и R27 вместе с атомами, к которым они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо;
g, h и i независимо равны 0 или 1;
R25 и R28 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом; и
R29, R30, R31, R32, R33 и R34 независимо является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом; или, альтернативно, R29 и R30, R31 и R32 или R33 и R34 вместе с атомами, к которым они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо; и
при следующих условиях:
(a) если W является -O- или -S- или -NR25, тогда Z является -C(R27) или -N-; и
(b) если Z является -O- или -S- или -NR28, тогда W является -C(R24) или -N-.
В одном варианте формулы (II), (D)n-G является

В одном варианте формулы (II), соединение в соответствии с данным изобретением имеет структурную формулу (IIa):
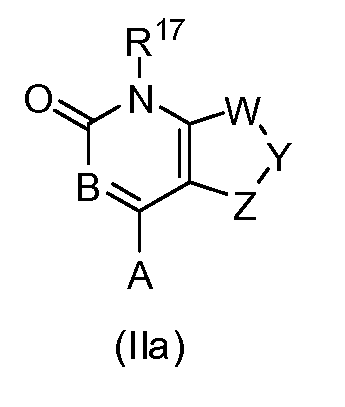
при следующих условиях:
(a) если W является -O- или -S- или -NR25, тогда Z является -C(R27) или -N-;
(b) если Z является -O- или -S- или -NR28, тогда W является -C(R24) или -N-; и
(c) если B является -N-, тогда A не является галогеном.
В одном варианте формулы (IIa), соединение в соответствии с данным изобретением имеет структурную формулу (IIb):
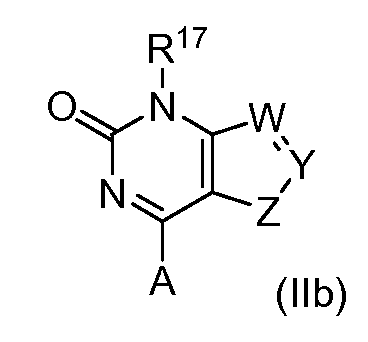
где, W является -C(R24)- или -N-; Y является -C(R26)- или -N-; и Z является -S-, -N(R28)- или -O-.
В одном варианте формулы (IIb), W является -C(R24)-, и Y является -C(R26)-.
В одном варианте формулы (IIb), W является -C(R24)-; Y является -C(R26)-; R24 является водородом, алкилом, замещенным алкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, -CN, -NO2, -OR29, -S(O)gR29, -OCOR29, -NR29R30, -CONR29R30 или -CO2R29; и R26 является водородом, алкилом, замещенным алкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, -CN, -NO2, -OR31, -OCOR31, -S(O)nR31, -NR31R32, -CONR31R32 или -CO2R31. В предпочтительном варианте, R24 является водородом, -CF3, алкилом или замещенным алкилом; и R26 является водородом, -CF3, алкилом или замещенным алкилом.
В одном варианте формулы (IIb), W является -C(R24)-; и Y является -C(R26)-; A является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, -CN, -NO2, -S(O)CR9, -NR9R10, -CONR9R10, -CO2R9 или -NR9CO2R10; R17 является водородом, алкилом, замещенным алкилом, арилалкилом, или замещенным арилалкилом; R24 является водородом, алкилом, замещенным алкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, -CN, -NO2, -OR29, -S(O)gR29, -OCOR29, -NR29R30, -CONR29R30 или -CO2R29; и R26 является водородом, алкилом, замещенным алкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, -CN, -NO2, -OR31, -S(O)hR31, -OCOR31, -NR31R32, -CONR31R32 или -CO2R31.
В одном варианте формулы (IIb), W является -C(R24)-; и Y является -C(R26)-; A является -NR9COR10, -NHOR9, -NR9R10, -NOR9, -CONR9R10, -CO2R9, -NR9CO2R10, -OR9, -NR9CONR10R11, -NR9CSNR10R11 или -NR9C(=NH)NR10R11; R17 является водородом, алкилом, замещенным алкилом, арилалкилом, или замещенным арилалкилом; R24 является водородом, алкилом, замещенным алкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, -CN, -NO2, -OR29, -S(O)gR29, -OCOR29, -NR29R30, -CONR29R30 или -CO2R29; и R26 является водородом, алкилом, замещенным алкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, -CN, -NO2, -OR31, -S(O)hR31, -OCOR31, -NR31R32, -CONR31R32 или -CO2R31. В предпочтительном варианте, A является -OH, -NH2, -NHCH3, -N(CH3)2, -NHOCH3, -NOCH3, -NHC(O)CH3, -NHC(O)OCH3, -NHC(O)NH2, -NHC(S)NH2, -NHC(NH)NH2, -CN, -CH2OH, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2, -CO2H, -CONH2, -CONHCH3 или -CH2NHC(O)CH3; R17 является водородом, метилом, этилом, пропилом, изопропилом, н-бутилом, изобутилом, втор-бутилом, трет-бутилом, фенилом или бензилом; и R24 является водородом, -CF3, метилом, этилом, пропилом, изопропилом, н-бутилом, изобутилом, втор-бутилом или трет-бутилом; и R26 является водородом, -CF3, метилом, этилом, пропилом, изопропилом, н-бутилом, изобутилом, втор-бутилом или трет-бутилом. В более предпочтительном варианте, A является -NH2, R17 является водородом или метилом, R24 является водородом, -CF3, метилом или этилом и R26 является водородом, -CF3, метилом или этилом.
В некоторых вариантах формулы (IIb), R28 является водородом, алкилом или арилалкилом.
В некоторых вариантах формулы (IIb), R28 является водородом, метилом или бензилом.
В некоторых конкретных вариантах формулы (IIb), соединения имеют структурную формулу, выбранную из группы, включающей:
или их таутомер, соль, сольват и/или сложный эфир.
В некоторых предпочтительных вариантах солью этих соединений является гидрохлорид или трифторацетат.
В одном варианте формулы (IIa), соединение в соответствии с данным изобретением имеет структурную формулу (IIc):

где, W является -S-, -N(R25)- или -O-; Y является -C(R26)- или -N-; и Z является -C(R27)- или -N-. В предпочтительном варианте, Y является -C(R26)- и Z является -C(R27)-.
В одном варианте формулы (IIa), W является -S-, -N(R25)- или -O-; Y является -C(R26)- или -N-; Z является -C(R27)- или -N-; R27 является водородом, алкилом, замещенным алкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, -CN, -NO2, -OR33, -S(O)iR33, -OCOR33, -NR33R34, -CONR33R34 или -CO2R33; и R26 является водородом, алкилом, замещенным алкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, -CN, -NO2, -OR31, -S(O)hR31′ -OCOR31, -NR31R32, -CONR31R32 или -CO2R31.
В одном варианте формулы (IIa), W является -S-, -N(R25)- или -O-; Y является -C(R26)- или -N-; Z является -C(R27)- или -N-; R26 и R27 вместе с атомом, к которому они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо.
В одном варианте формулы (IIa), W является -S-, -N(R25)- или -O-; Y является -C(R26)- или -N-; Z является -C(R27)- или -N-; A является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, -NR9COR10, -NHOR9, -NOR9, -OR9, -NR9CONR10R11, -NR9CSNR10R11 или -NR9C(=NH)NR10R11, -CN, -NO2, -S(O)CR9, -NR9R10, -C(O)NR9R10, -CO2R9 или -NR9CO2R10; и R17 является водородом, алкилом, замещенным алкилом, арилалкилом, или замещенным арилалкилом.
В одном варианте формулы (IIa), W является -S-, -N(R25)- или -O-; Y является -C(R26)- или -N-; Z является -C(R27)- или -N-; A является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, -NR9COR10, -NHOR9, -NOR9, -OR9, -NR9CONR10R11, -NR9CSNR10R11 или -NR9C(=NH)NR10R11, -CN, -NO2, -S(O)CR9, -NR9R10, -NR9C(O)R10, -C(O)NR9R10, -CO2R9 или -NR9CO2R10; R17 является водородом, алкилом, замещенным алкилом, арилалкилом или замещенным арилалкилом; R27 является водородом, алкилом, замещенным алкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, -CN, -NO2, -OR33, -S(O)iR33, -OCOR33, -NR33R34, -C(O)NR33R34 или -CO2R33; и R26 является водородом, алкилом, замещенным алкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, -CN, -NO2, -OR31, -S(O)hR31, -OC(O)R31, -NR31R32, -C(O)NR31R32 или -CO2R31, или, альтернативно, R26 и R27 вместе с атомом(ами), к которым они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо. В более предпочтительном варианте, A является -NH2; R17 является водородом, метилом, этилом, пропилом, изопропилом, н-бутилом, изобутилом, втор-бутилом, трет-бутилом, фенилом или бензилом; R26 и R27 независимо являются водородом, алканилом, замещенным алканилом, алкокси, карбоновой кислотой, амидом карбоновой кислоты или сложным эфиром карбоновой кислоты; или, альтернативно, R26 и R27 вместе с атомом(ами), к которым они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо.
В некоторых конкретных вариантах формулы (IIa)), соединения имеют структурную формулу, выбранную из группы, включающей:


или их таутомера, соли, сольвата и/или сложного эфира. В некоторых предпочтительных вариантах солью этих соединений является гидрохлорид или трифторацетат.
В одном варианте формулы (II), соединение в соответствии с данным изобретением имеет структурную формулу (IIe):
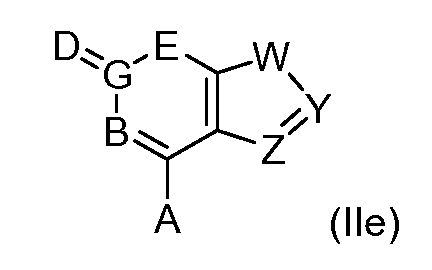
где, G образует одинарную связь с E и двойную связь с D; B является -N-; E является -NR17-; D является =S, =N-OR15 или =N-NHR15; W является -S-, -N(R25)- или -O-; Y является -C(R26)-; и Z является -C(R27)-.
В одном варианте формулы (II), соединение в соответствии с данным изобретением имеет структурную формулу (IIf):
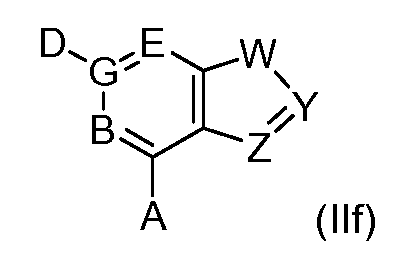
где,
G образует двойную связь с E и одинарную связь с D;
B является -N-;
E является -N-;
D является -OR15, -NH-OR15, -NH-NHR15, -S(O)eR15 или -NR15R16;
W является -S-, -N(R25)- или -O-;
Y является -C(R26)-; и
Z является -C(R27)-.
В одном варианте формулы (IIe) или (IIf), A является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, -OR9, -SR9, -CN, -NR9R10, -CONR9R10, -CO2R9, -NR9CO2R10, -NR9CONR10R11, -NR9CSNR10R11 или -NR9C(=NH)NR10R11. Более предпочтительно, R17 является водородом, алкилом, замещенным алкилом, арилалкилом или замещенным арилалкилом; R26 и R27 независимо являются водородом, алканилом, замещенным алканилом, алкокси; или, альтернативно, R26 и R27 вместе с атомом(ами), к которым они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо.
В некоторых конкретных вариантах формулы (IIe) или (IIf), соединение в соответствии с данным изобретением имеет структурную формулу, выбранную из группы, включающей:

или их таутомер, солМ, сольват и/или сложный эфир. В некоторых предпочтительных вариантах солью этих соединений является гидрохлорид или трифторацетат.
В одном варианте формулы (II), соединение в соответствии с данным изобретением имеет структурную формулу (IId):

при следующих условиях:
(a) если W является -O- или -S- или -NR25, тогда Z является -C(R27) или -N-; и
(b) если Z является -O- или -S- или -NR28, тогда W является -C(R24) или -N-.
В варианте формулы (IId), W является -S-, NR25, -O-; Y является -CR26-; Z является -C(R27)-; и W и Y образуют одинарную связь, и Y и Z образуют двойную связь.
В варианте формулы (IId), W является -C(R24)-; Y является -CR26-; Z является -S-, -NR28-, -O; и W и Y образуют двойную связь, и Y и Z образуют одинарную связь.
В варианте формулы (IId), W является -S-, NR25, -O-; Y является -N-; Z является -C(R27)-; и W и Y образуют одинарную связь, и Y и Z образуют двойную связь.
В варианте формулы (IId), W является -NR25; Y является -N-; и Z является -C(R27)-; и Y образует одинарную связь с каждым W и двойную связь с Z.
В некоторых вариантах формулы (IId), A является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, -OR9, -SR9, -CN, -NR9R10, -CONR9R10, -CO2R9, -NR9CO2R10, -NR9CONR10R11, -NR9CSNR10R11 или -NR9C(=NH)NR10R11. Предпочтительно, R17 является водородом. Более предпочтительно, R26 и R27 независимо являются водородом, алканилом, замещенным алканилом, алкокси, карбоновой кислотой, сложным эфиром карбоновой кислоты; или, альтернативно, R26 и R27 вместе с атомом(ами), к которым они присоединены, образуют циклоалкильное или замещенное циклоалкильное кольцо.
В некоторых вариантах формулы (IId), соединение в соответствии с данным изобретением имеет структурную формулу, выбранную из группы, включающей:
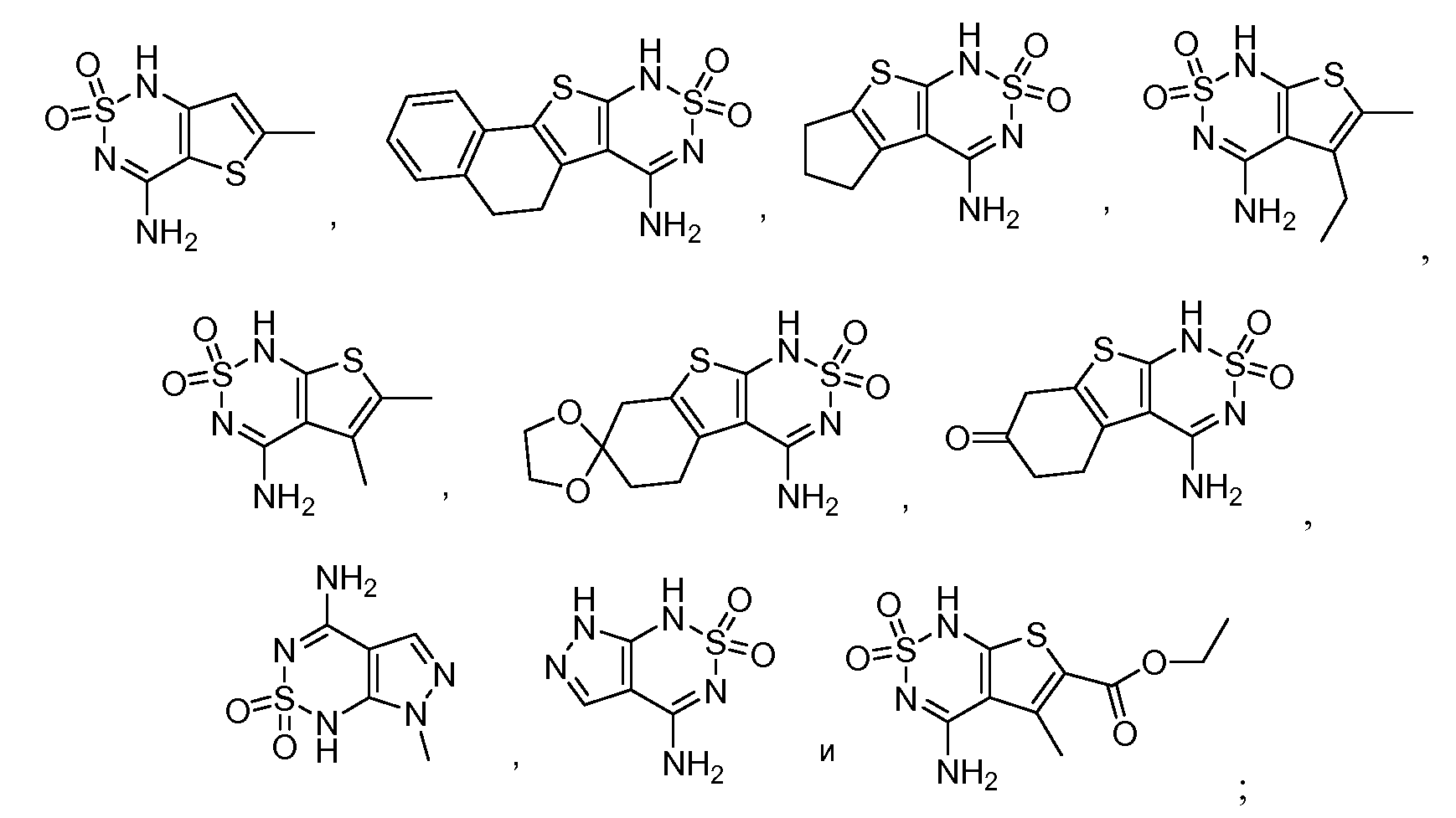
или их таутомера, соли, сольвата и/или сложного эфира. В некоторых предпочтительных вариантах солью этих соединений является гидрохлорид или трифторацетат.
В одном варианте формулы (I), модификатор лиганда хемосенсорного рецептора имеет структурную формулу (III):

где:
H является -C(R35)- или -N-;
I является -C(R36) или -N-;
J является -C(R37)- или -N-;
K является -C(R38)- или -N-;
R35 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, галогеном, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом, -CN, -NO2, -OR39, -S(O)jR39, -NR39R40, -CONR39R40, -CO2R39, -SO2NR39R40, -NR39SO2R40, -B(OR39)(OR40), -P(O)(OR39)(OR40) или -P(O)(R39)(OR40);
R36 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, галогеном, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом, -CN, -NO2, -OR41, -S(O)kR41, -NR41R42, -CONR41R42, -CO2R41, -OCOR41, -SO2NR41R42, -NR41SO2R42, -B(OR41)(OR42), -P(O)(OR41)(OR42) или -P(O)(R41)(OR42);
R37 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, галогеном, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом ,-CN, -NO2, -OR43, -S(O)lR43, -NR43R44, -CONR43R44, -CO2R43, -OCOR43, -SO2NR43R44, -NR43SO2R44, -B(OR43)(OR44), -P(O)(OR43)(OR44) или -P(O)(R43)(OR44); или, альтернативно, R36 и R37, вместе с атомом, к которому они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо;
R38 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, галогеном, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом, -CN, -NO2, -OR45, -S(O)mR45, -NR45R46, -CONR45R46, -COR45, -CO2R45, -OCOR45, -SO2NR45R46, -NR45SO2R46, -B(OR45)(OR46), -P(O)(OR45)(OR46) или -P(O)(R45)(OR46);
j, k, l и m независимо равны 0, 1 или 2; и
R39, R40, R41, R42, R43, R44, R45 и R46 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом или, альтернативно, R39 и R40, R41 и R42, R43 и R44, или R45 и R46 вместе с атомами, к которым они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо;
при условии, что, не более двух из H, I, J и K являются -N-. Под «не более двух из H, I, J и K являются -N-", подразумевают, что среди H, I, J и K имеется ноль атомов азота, один атом азота или два атома азота.
В одном варианте формулы (III), (D)n-G является

В одном варианте формулы (III), соединение в соответствии с данным изобретением имеет структурную формулу (IIIa):

В одном варианте формулы (IIIa), A является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -CN, -OR9, -NO2, -S(O)CR9, -NHOR9, -NR9COR10, -NR9R10, -CONR9R10, -CO2R9, -NR9CO2R10, -NR9CONR10R11, -NR9CSNR10R11 или -NR9C(=NH)NR10R11. Предпочтительно, A является -OH, -NH2, -NHCH3, -N(CH3)2, -NHOCH3, -NOCH3, -NHC(O)CH3, -NHC(O)OCH3, -NHC(O)NH2, -NHC(S)NH2, -NHC(NH)NH2, -CN, -CH2OH, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2, -CO2H, -CONH2, -CONHCH3 или -CH2NHC(O)CH3.
В одном варианте формулы (IIIa), R17 является водородом, алкилом, замещенным алкилом, арилалкилом, или замещенным арилалкилом. Предпочтительно, R17 является водородом, метилом, этилом, пропилом, изопропилом, н-бутилом, изобутилом, втор-бутилом, трет-бутилом, фенилом или бензилом.
В одном варианте формулы (IIIa), H является -C(R35)-; I является -C(R36); J является -C(R37)-; и K является -C(R38)-.
В одном варианте формулы (IIIa), A является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, -CN, -OR9, -NO2, -S(O)CR9, -NHOR9, -NR9COR10, -NR9R10, -CONR9R10, -CO2R9 или -NR9CO2R10; и R17 является водородом, алкилом, замещенным алкилом, арилалкилом или замещенным арилалкилом.
В одном варианте формулы (IIIa), A является -OH, -NH2, -NHCH3, -N(CH3)2, -NHOCH3, -NOCH3, -NHC(O)CH3, -NHC(O)OCH3, -NHC(O)NH2, -NHC(S)NH2, -NHC(NH)NH2, -CN, -CH2OH, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2, -CO2H, -CONH2, -CONHCH3 или -CH2NHC(O)CH3; и R17 является водородом, метилом, этилом, пропилом, изопропилом, н-бутилом, изобутилом, втор-бутилом, трет-бутилом, фенилом или бензилом.
В одном варианте формулы (IIIa), R35 является водородом, алкилом, замещенным алкилом, галогеном, гетероалкилом, замещенным гетероалкилом, -CN, -NO2, -OR39, -S(O)jR39, -OCOR39, -NR39COR40, -CONR39R40, -CO2R39, NR39R40, -SO2NR39R40 или -NR39SO2R40; R36 является водородом, алкилом, замещенным алкилом, галогеном, гетероалкилом, замещенным гетероалкилом, -CN, -NO2, -OR41, -S(O)jR41, -OCOR41, NR41R42, -NR41COR42, -CONR41R42, -CO2R41, -SO2NR41R42 или -NR41SO2R42; R37 является водородом, алкилом, замещенным алкилом, галогеном, гетероалкилом, замещенным гетероалкилом, -CN, -NO2, -OR43, -S(O)jR43, -OCOR43, NR43R44, -NR43COR44, -CONR43R44, -CO2R43, -SO2NR43R44 или -NR43SO2R44; или, альтернативно, R36 и R37, вместе с атомами, к которым они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо; и R38 является водородом, алкилом, замещенным алкилом, галогеном, гетероалкилом, замещенным гетероалкилом, -CN, -NO2, -OR45, -S(O)jR45, -OCOR45, NR45R46, -NR45COR46, -CONR45R46, -CO2R45, -SO2NR45R46, -NR45SO2R46. Также предпочтительно, чтобы R38 являлся водородом, алканилом, замещенным алканилом, алкенилом, замещенным алкенилом, циклоалканилом, замещенным циклоалканилом, циклоалкенилом, замещенным циклоалкенилом, галогеном, гетероалкилом, замещенным гетероалкилом, -CN, -NO2, -OR45, -S(O)jR45, -OCOR45, NR45R46, -NR45COR46, -CONR45R46, -CO2R45, -SO2NR45R46, -NR45SO2R46. Также предпочтительно, чтобы A являлся -NH2, R17 являлся водородом, метилом, этилом или бензилом; и R35, R36, R37 и R38 независимо являлись водородом, фтором, хлором, бромом, метилом, трифторметилом, этилом, изопропилом, циклопропилом, пропенилом, метилпропенилом, бутенилом, метилбутенилом, замещенным пропенилом, замещенным метилпропенилом, замещенным бутенилом, замещенным метилбутенилом, -NH-алканилом, -NH-(замещенным алканилом), -OH, -OCH3, -O-циклоалканилом, -O-бензилом, -CO2H.
В некоторых вариантах формулы (IIIa), соединение имеет структурную формулу, выбранную из группы, включающей:
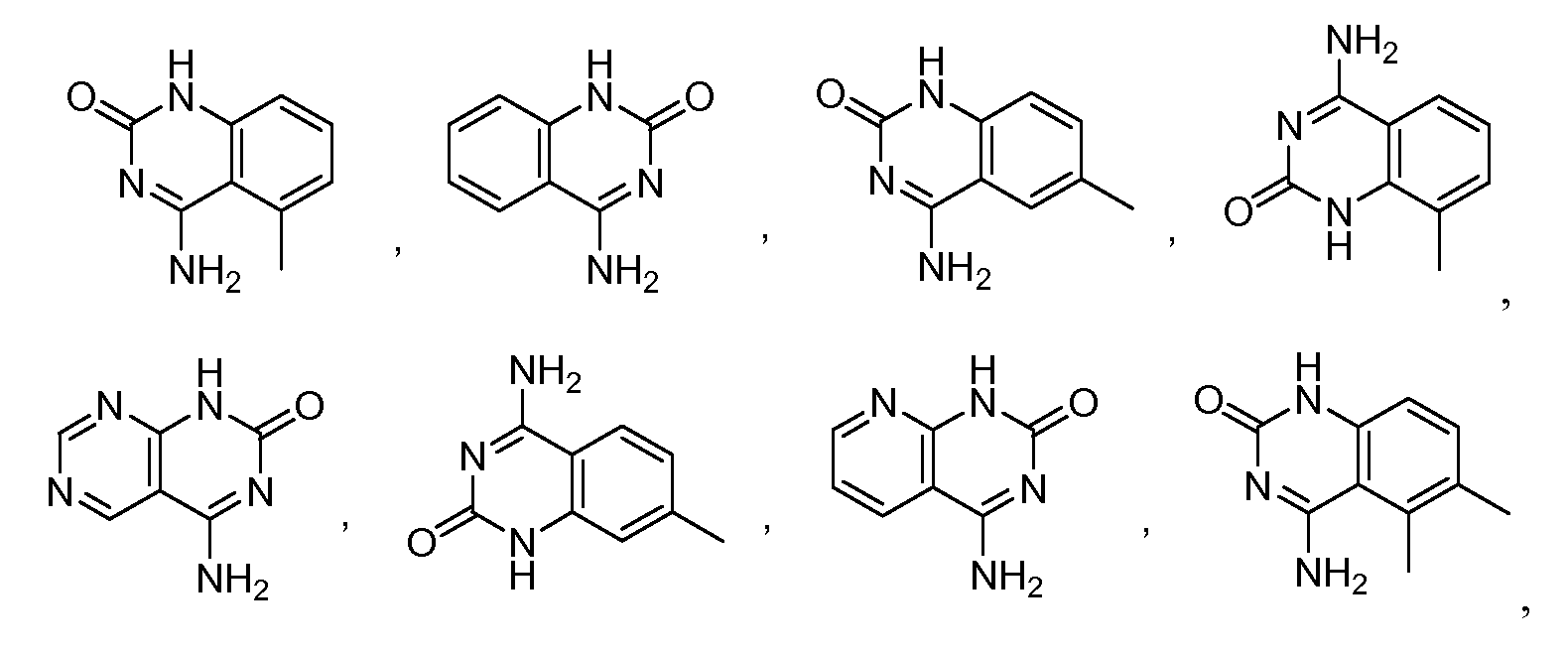







или их таутомера, соли, сольвата и/или сложного эфира. В некоторых предпочтительных вариантах солью этих соединений является гидрохлорид или трифторацетат.
В одном варианте формулы (IIIa), соединение в соответствии с данным изобретением имеет структурную формулу (IIIa1):
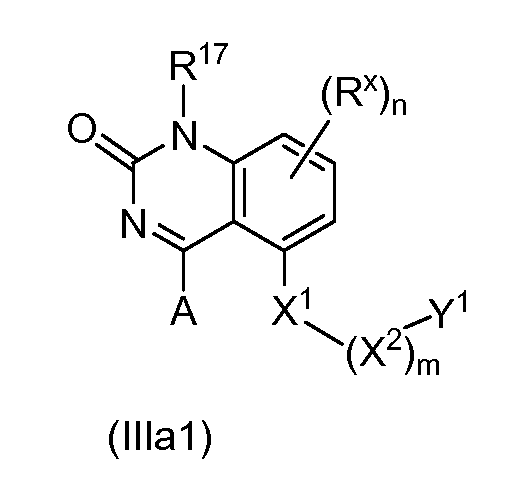
где,
A является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -CN, -OR9, -NO2, -S(O)CR9, -NOR9, -NHOR9, -NR9COR10, -NR9R10, -CONR9R10, -CO2R9 или -NR9CO2R10;
R17 является водородом, алкилом, замещенным алкилом, арилалкилом или замещенным арилалкилом;
X1 является -CH2-, -O-, -NR9-, -S-, -S(O)- или -S(O)2-;
X2 является алкиленом, замещенным алкиленом, гетероалкиленом или замещенным гетероалкиленом;
m равно 0 или 1;
Y1 является циклогетероалкилом, замещенным циклогетероалкилом или

X3 и X5 независимо являются ковалентной связью, -O- или -NR9-;
X4 является O, NR9, N-OR9 или S;
Rx является галогеном, -NO2, -CN, -OH, -NH2, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом;
n равно 0, 1, 2 или 3;
Ry является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом, -NR9R10;
и каждый R9 и R10 независимо является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом;
при условии, что если X1 является -O- или -S-, и m равно нулю; тогда X3 не является -O-.
В одном варианте формулы (IIIa1), X1 является -CH2-; и Y1 является

В одном варианте формулы (IIIa1), X1 является -O-, -NR9- или -S-; m равно O или 1, и Y1 является циклогетероалкилом или замещенным циклогетероалкилом.
В одном варианте формулы (IIIa1), X1 является -O-, -NR9- или -S-; m равно 1, и Y1 является
В некоторых вариантах формулы (IIIa1), X2 является метиленом, этиленом, пропиленом, диметилэтиленом, метилциклопропиленом или циклопропилметиленом.
В некоторых вариантах формулы (IIIa1), A является водородом, алкилом, замещенным алкилом, -CN, -OR9, -NO2, -S(O)CR9, -NOR9, -NHOR9, -NR9COR10, -NR9R10, -CONR9R10, -CO2R9 или -NR9CO2R10.
В некоторых вариантах формулы (IIIa1), R17 является водородом, алкилом, замещенным алкилом.
В некоторых вариантах формулы (IIIa1), Y1 является циклогетероалкилом или замещенным циклогетероалкилом. Предпочтительно, Y1 является пиперидинилом, замещенным пиперидинилом, тетрагидрофуранилом, замещенным тетрагидрофуранилом, тетрагидропиранилом, замещенным тетрагидропиранилом, дигидрофуранилом, замещенным дигидрофуранилом, пирролидинилом, замещенным пирролидинилом, оксетанилом, или замещенным оксетанилом. Также предпочтительно, что замещенный циклогетероалкил содержит один или более заместителей, выбранных из группы, включающей алкил, замещенный алкил, арил, замещенный арил, арилалкил, замещенный арилалкил, ацил, замещенный ацил, гетероалкил, замещенный гетероалкил, гетероарил, замещенный гетероарил, гетероарилалкил, замещенный гетероарилалкил, -CN, -OR9, -NO2, -S(O)CR9, -NOR9, -NHOR9, -NR9COR10, -NR9R10, -CONR9R10, -CO2R9 и -NR9CO2R10.
В некоторых вариантах формулы (IIIa1), X4 является O.
В некоторых вариантах формулы (IIIa1), -X3-C(X4)-X5- является -C(O)-, -C(O)-NH-, - NH-C(O)-, -NH-C(O)-NH-, -C(O)-O-, -O-C(O)-, -O-C(O)-O-, -NH-C(O)-O-, -O-C(O)-NH-, -C(NH)-, -C(NH)-NH-, -NH-C(NH)-, -NH-C(NH)-NH-, -C(NH)-O-, -O-C(NH)-, -O-C(NH)-O-, - NH-C(NH)-O-, -O-C(NH)-NH-, -C(N-OH)- или -C(S)-.
В некоторых вариантах формулы (IIIa1), A является водородом, алкилом, замещенным алкилом или -NR9R10; R17 является водородом; и Y1 является пиперидинилом, замещенным пиперидинилом, тетрагидрофуранилом, замещенным тетрагидрофуранилом, тетрагидропиранилом, замещенным тетрагидропиранилом, дигидрофуранилом, замещенным дигидрофуранилом, пирролидинилом, замещенным пирролидинилом, оксетанилом или замещенным оксетанилом.
В некоторых вариантах формулы (IIIa1), A является водородом, алкилом, замещенным алкилом или -NR9R10; R17 является водородом; Y1 является -X3-C(X4)-X5-; и -X3-C(X4)-X5- является -C(O)-, -C(O)-NH-, -NH-C(O)-, -NH-C(O)-NH-, -C(O)-O-, -O-C(O)-, -O-C(O)-O-, -NH-C(O)-O-, -O-C(O)-NH-, -C(NH)-, -C(NH)-NH-, -NH-C(NH)-, -NH-C(NH)-NH-, -C(NH)-O-, -O-C(NH)-, -O-C(NH)-O-, NH-C(NH)-O-, -O-C(NH)-NH-, -C(N-OH)- или -C(S)-.
В некоторых вариантах формулы (IIIa1), соединение имеет структурную формулу, выбранную из группы, включающей:

или их таутомера, соли, сольвата и/или сложного эфира. В некоторых предпочтительных вариантах солью этих соединений является гидрохлорид или трифторацетат.
В одном варианте формулы (III), соединение в соответствии с данным изобретением имеет структурную формулу (IIIb):

В одном варианте формулы (IIIb), A является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, -CN, -NO2, -OR9, -S(O)CR9, -NR9COR10, -NHOR9, -NR9R10, -NOR9, -CONR9R10, -CO2R9, -NR9CO2R10, -NR9CONR10R11, -NR9CSNR10R11 или -NR9C(=NH)NR10R11.
В одном варианте формулы (IIIb), R17 является водородом, алкилом или замещенным алкилом.
В одном варианте формулы (IIIb), A является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, -OR1, -SR1, -CN, -NR9R10, -CONR9R10, -CO2R9, -NR9CO2R10, -NR9CONR10R11, -NR9CSNR10R11 или -NR9C(=NH)NR10R11; и R17 является водородом, алкилом или замещенным алкилом.
В одном варианте формулы (IIIb), H является -C(R35)- или -N-; I является -C(R36)-; J является -C(R37)-; и K является -C(R38)- или -N-.
В одном варианте формулы (IIIb), H является -C(R35)-; I является -C(R36)-; J является -C(R37)-; и K является -C(R38)-.
В одном варианте формулы (IIIb), R35 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, галогеном, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом, -CN, -NO2, -OR39, -S(O)jR39, -OCOR39, -NR39R40, -CONR39R40, -CO2R39, -SO2NR39R40, -NR39SO2R40; R36 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, галогеном, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом, -CN, -NO2, -OR41, -S(O)kR41, -OCOR41, -NR41R42, -CONR41R42, -CO2R41, -SO2NR41R42, -NR41SO2R42; R37 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, галогеном, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом ,-CN, -NO2, -OR43, -S(O)lR43, -OCOR43, -NR43R44, -CONR43R44, -CO2R43, -SO2NR43R44, -NR43SO2R44; R38 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, галогеном, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом, -CN, -NO2, -OR45, -S(O)mR45, -OCOR45, -NR45R46, -CONR45R46, -COR45, -CO2R45, -SO2NR45R46, -NR45SO2R46.
В одном варианте формулы (IIIb), A является -NH2, R17 является водородом, метилом, этилом или бензилом; и R35, R36, R37 и R38 независимо являются водородом, фтором, хлором, бромом, -CN, алканилом, замещенным алканилом, алкенилом, замещенным алкенилом, алкинилом, замещенным алкинилом, циклоалканилом, замещенным циклоалканилом, циклоалкенилом, замещенным циклоалкенилом, гетероалканилом, замещенным гетероалканилом, циклогетероалкиломом, замещенным циклогетероалкиломом, -O-алканилом, -O-(замещенным алканилом), -O-алкенилом, -O-(замещенным алкенилом), -NH-алканилом, -NH-(замещенным алканилом), -NH-алкенилом, -NH-(замещенным алкенилом), -S-алканилом, -S-(замещенным алканилом), -S-алкенилом, или -S-(замещенным алкенилом).
В некоторых вариантах формулы (IIIb), соединение имеет структурную формулу, выбранную из группы, включающей:

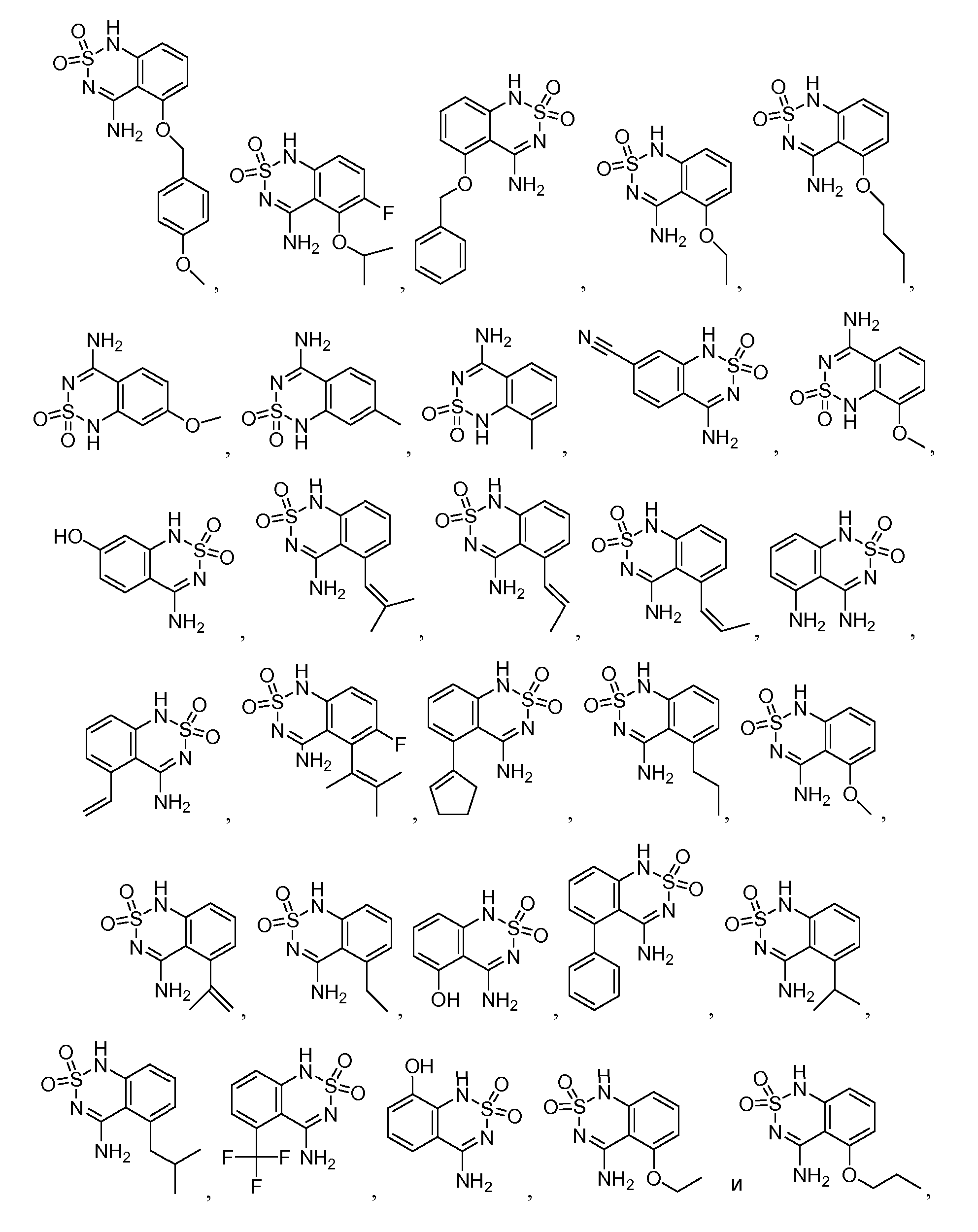
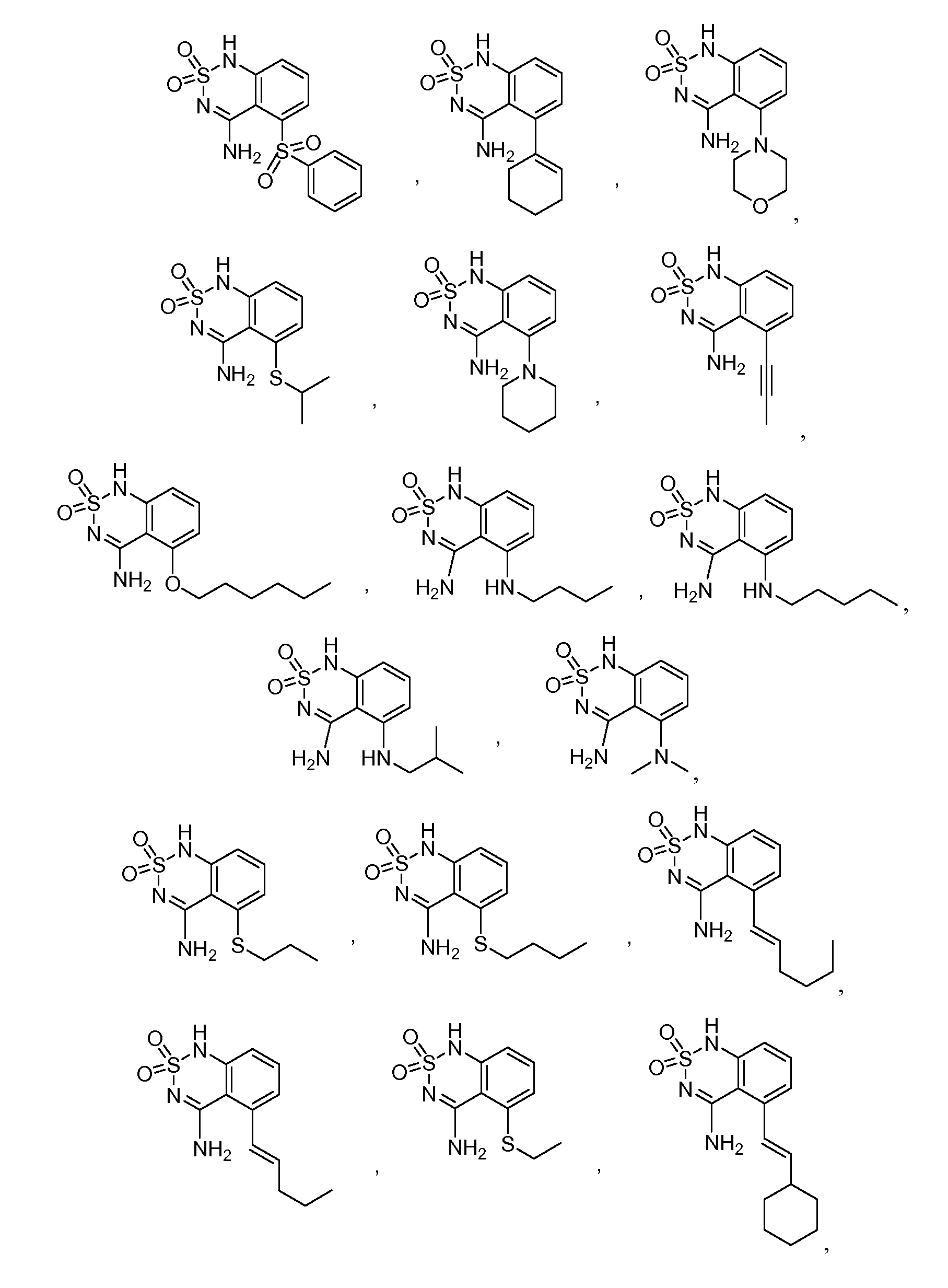
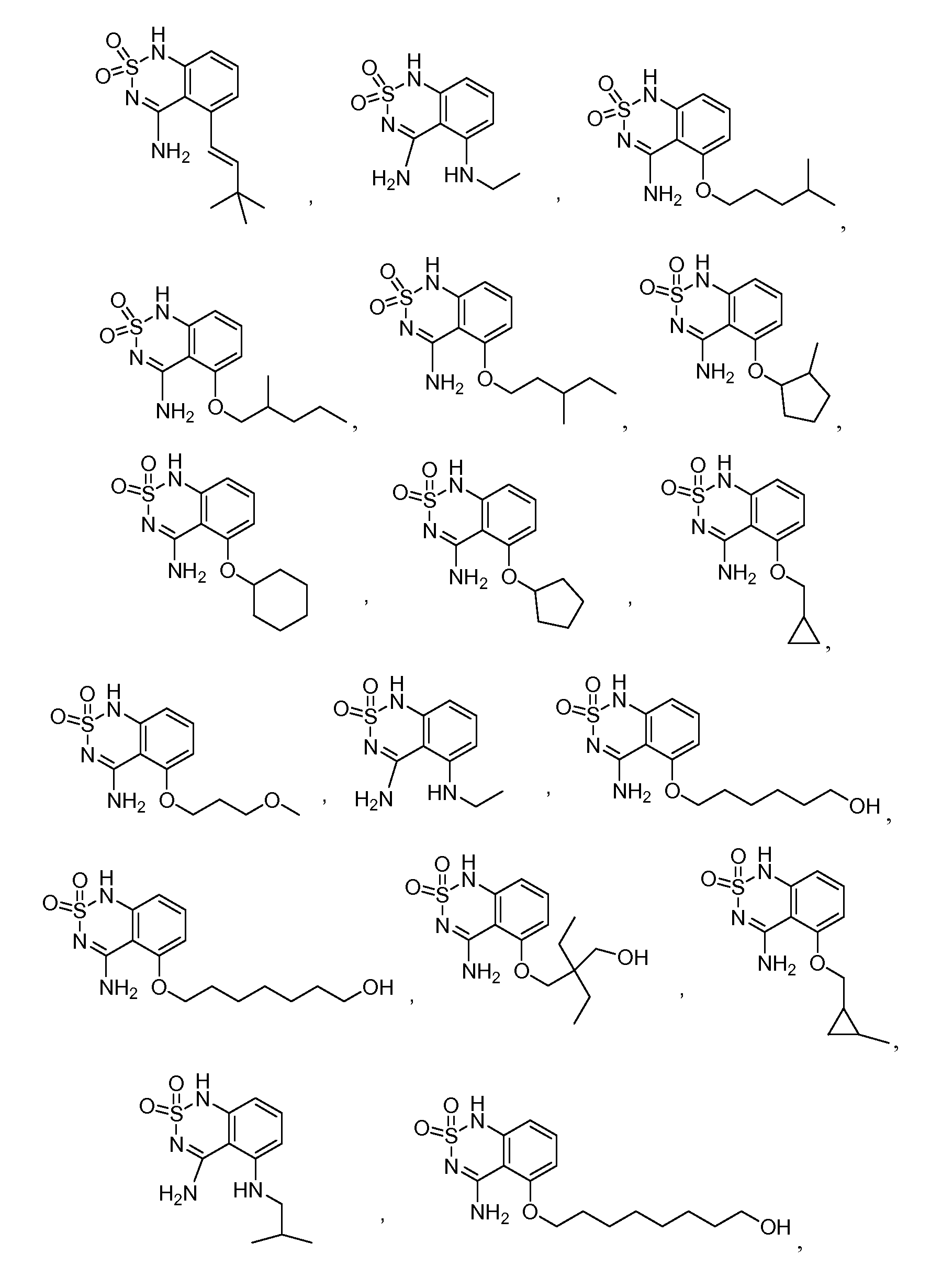
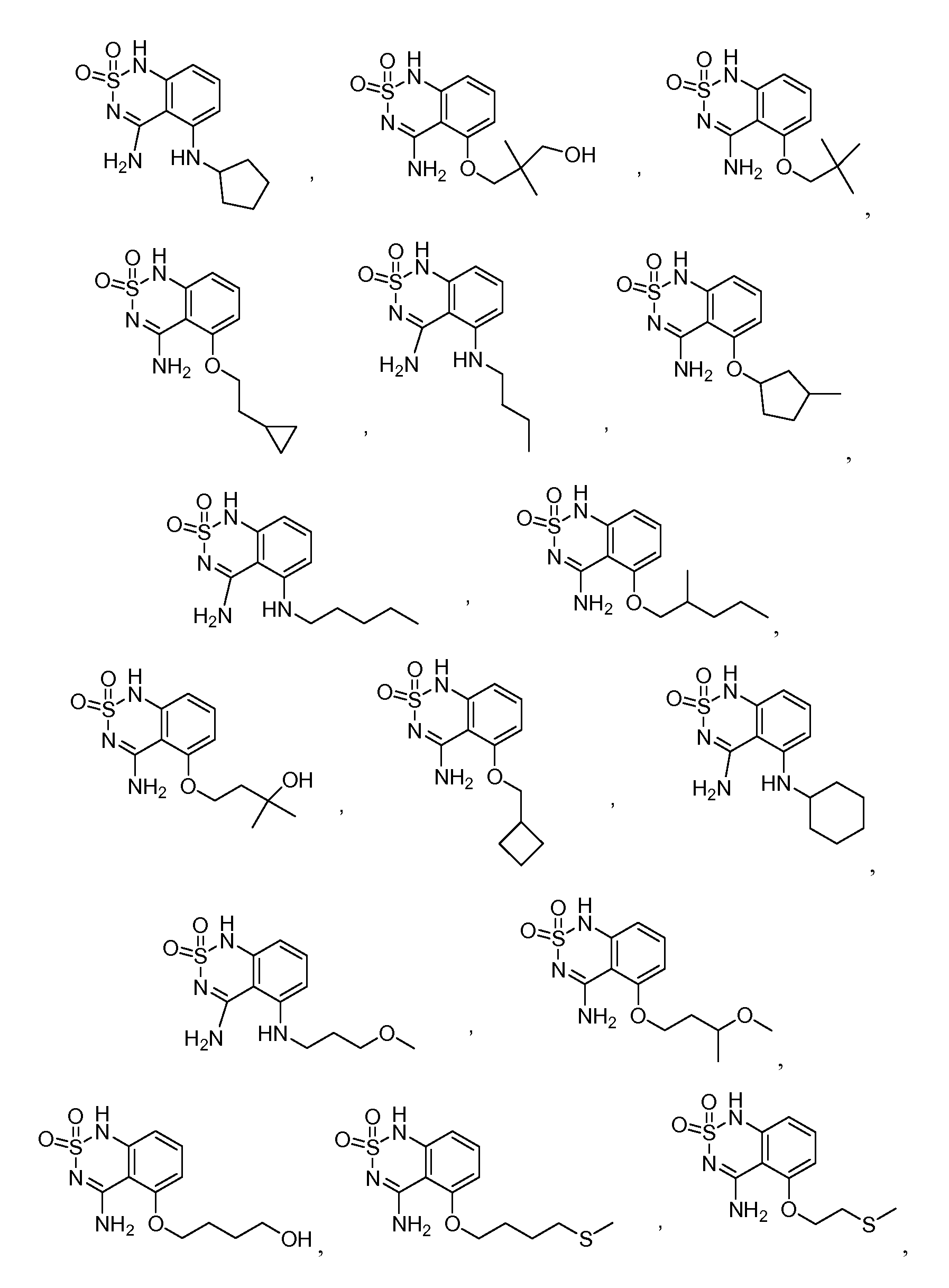
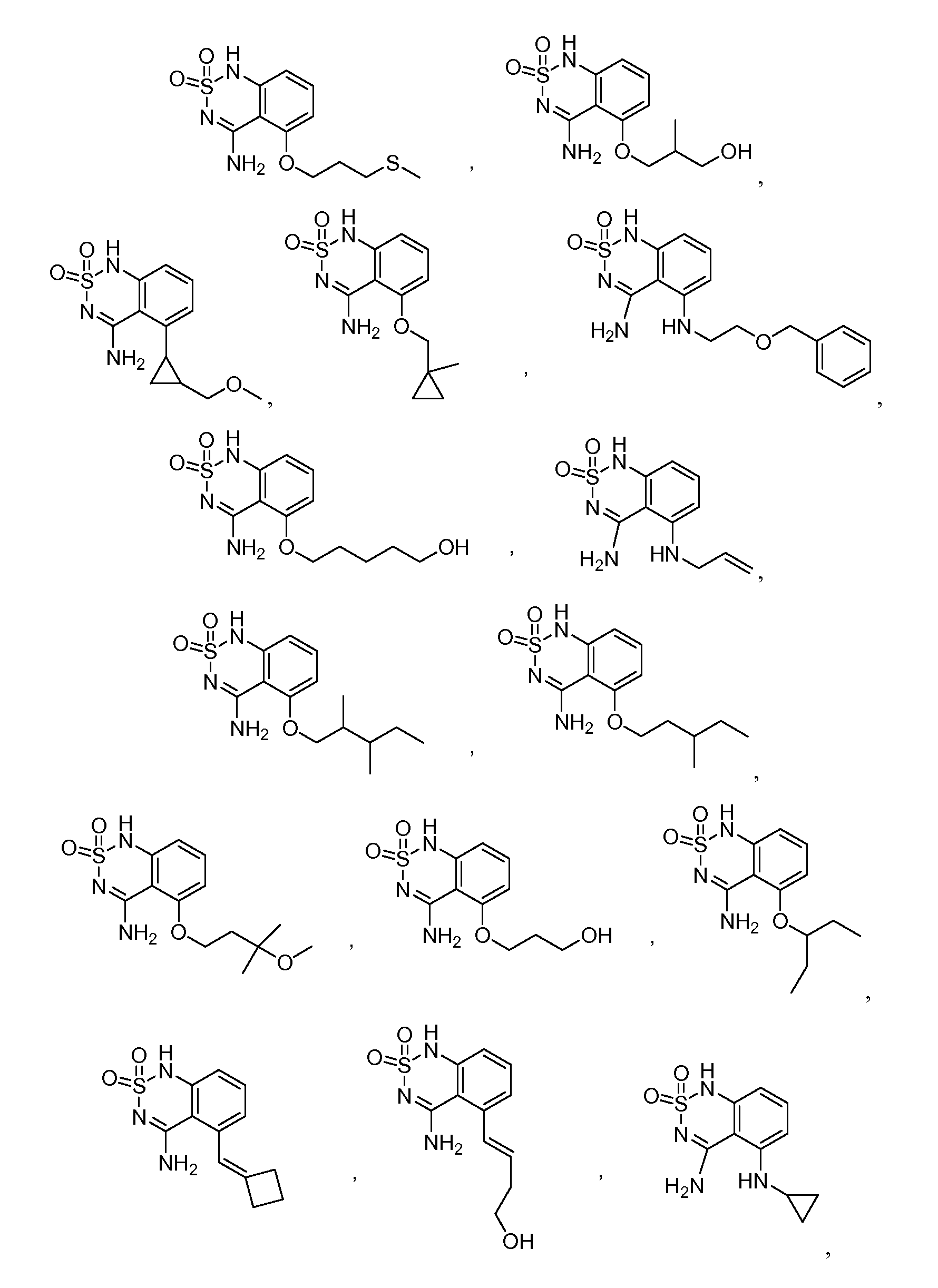




или их таутомера, соли, сольвата и/или сложного эфира. В некоторых предпочтительных вариантах солью этих соединений является гидрохлорид или трифторацетат.
В одном варианте формулы (IIIb), соединение в соответствии с данным изобретением имеет структурную формулу (IIIb1):

где,
A является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -CN, -OR9, -NO2, -S(O)CR9, -NOR9, -NHOR9, -NR9COR10, -NR9R10, -CONR9R10, -CO2R9 или -NR9CO2R10;
R17 является водородом, алкилом, замещенным алкилом, арилалкилом, или замещенным арилалкилом;
X1 является -CH2-, -O-, -NR9-, -S-, -S(O)- или -S(O)2-;
X2 является алкиленом, замещенным алкиленом, гетероалкиленом или замещенным гетероалкиленом;
m равно 0 или 1;
Y1 является гетероарилом, замещенным гетероарилом, циклогетероалкилом, замещенным циклогетероалкилом или

X3 и X5 независимо являются ковалентной связью, -O- или -NR9-;
X4 является O, NR9, N-OR9 или S;
Rx является галогеном, -NO2, -CN, -OH, -NH2, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом;
n равно 0, 1, 2 или 3;
RY является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом, -NR9R10; и
каждый R9 и R10 независимо является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом;
при условии, что если X1 является -O- или -S-, и m равно нулю; тогда X3 не является -O-.
В одном варианте формулы (IIIb1), X1 является -CH2-; и Y1 является
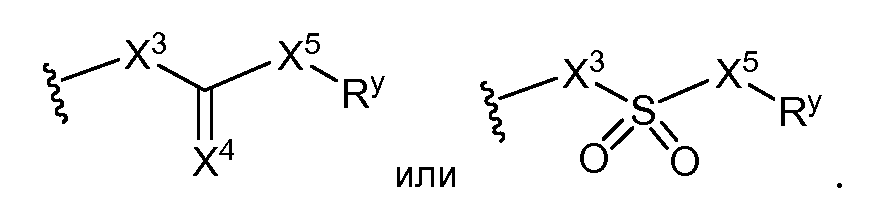
В одном варианте формулы (IIIb1), X1 является -O-, -NR9- или -S-; m равно 0 или 1, и Y1 является циклогетероалкилом или замещенным циклогетероалкилом.
В одном варианте формулы (IIIb1), X1 является -O-, -NR9- или -S-; m равно 1, и Y1 является

В некоторых вариантах формулы (IIIb1), X является алканиленом, замещенным алканиленом, гетероалканиленом, замещенным гетероалканиленом, алкениленом, замещенным алкениленом, гетероалкениленом, или замещенным гетероалкениленом.
В некоторых вариантах формулы (IIIb1), X является метиленом, этиленом, пропиленом, изо-пропиленом, бутиленом, изо-бутиленом, втор-бутиленом, пентиленом, гексиленом, гептиленом, диметилэтиленом, метилциклопропиленом, циклопропилметиленом, этениленом, пропениленом или бутениленом.
В одном варианте формулы (IIIb1), A является водородом, алкилом, замещенным алкилом, -CN, -NO2, -OR9, -S(O)CR9, -NR9COR10, -NHOR9, -NR9R10, -NOR9, -CONR9R10, -CO2R9, -NR9CO2R10, -NR9CONR10R11, -NR9CSNR10R11, -NR9C(=NH)NR10R11.
В одном варианте формулы (IIIb1), R17 является водородом, алкилом или замещенным алкилом.
В одном варианте формулы (IIIb1), Y1 является циклогетероалканилом, замещенным циклогетероалканилом, циклогетероалкенилом или замещенным циклогетероалкенилом. Предпочтительно, Y1 является пиперидинилом, замещенным пиперидинилом, тетрагидрофуранилом, замещенным тетрагидрофуранилом, тетрагидропиранилом, замещенным тетрагидропиранилом, дигидрофуранилом, замещенным дигидрофуранилом, пирролидинилом, замещенным пирролидинилом, оксетанилом, замещенным оксетанилом, сахаридным кольцом или его производным, замещенным сахаридным кольцом или его производным.
В одном варианте формулы (IIIb1), Y1 является гетероарилом или замещенным гетероарилом. Предпочтительно, Y1 является пиридинилом, замещенным пиридинилом, пирролилом, замещенным пирролилом, фуранилом, замещенным фуранилом, пиразолилом, замещенным пиразолилом, изоксазолилом, замещенным изоксазолилом, оксазолилом и замещенным оксазолилом. Также предпочтительно, чтобы замещенный циклогетероалканил или замещенный циклогетероалкенил содержал один или более заместителей, выбранных из группы, включающей алкил, замещенный алкил, арил, замещенный арил, арилалкил, замещенный арилалкил, ацил, замещенный ацил, гетероалкил, замещенный гетероалкил, гетероарил, замещенный гетероарил, гетероарилалкил, замещенный гетероарилалкил, -CN, -OR9, -NO2, -S(O)CR9, -NOR9, -NHOR9, -NR9COR10, -NR9R10, -CONR9R10, -CO2R9 и -NR9CO2R10.
В одном варианте формулы (IIIb1), Y является
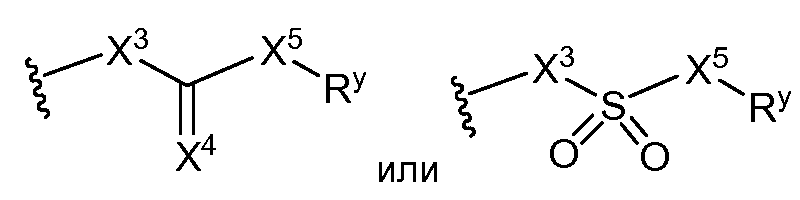
В одном варианте формулы (IIIb1), -X3-C(X4)-X5- является -C(O)-, -C(O)-NH-, -NH-C(O)-, -NH-C(O)-NH-, -C(O)-O-, -O-C(O)-, -O-C(O)-O-, -NH-C(O)-O-, -O-C(O)-NH-, -C(NH)-, -C(NH)-NH-, -NH-C(NH)-, -NH-C(NH)-NH-, -C(NH)-O-, -O-C(NH)-, -O-C(NH)-O-, -NH-C(NH)-O-, -O-C(NH)-NH-, -C(N-OH)- или -C(S)-.
В одном варианте формулы (IIIb1), A является водородом, алкилом, замещенным алкилом или -NR9R10; R17 является водородом; и Y1 является пиперидинилом, замещенным пиперидинилом, тетрагидрофуранилом, замещенным тетрагидрофуранилом, тетрагидропиранилом, замещенным тетрагидропиранилом, дигидрофуранилом, замещенным дигидрофуранилом, пирролидинилом, замещенным пирролидинилом, оксетанилом, замещенным оксетанилом, моносахаридным кольцом, замещенным моносахаридным кольцом, пиридинилом, замещенным пиридинилом, пирролилом, замещенным пирролилом, фуранилом, замещенным фуранилом, пиразолилом, замещенным пиразолилом, изоксазолилом, замещенным изоксазолилом, оксазолилом или замещенным оксазолилом.
В одном варианте формулы (IIIb1), A является водородом, алкилом, замещенным алкилом или -NR9R10; R17 является водородом; Y1 является -X3-C(X4)-X5-; и -X3-C(X4)-X5- является -C(O)-, -C(O)-NH-, -NH-C(O)-, -NH-C(O)-NH-, -C(O)-O-, -O-C(O)-, -O-C(O)-O-, -NH-C(O)-O-, -O-C(O)-NH-, - C(NH)-, -C(NH)-NH-, -NH-C(NH)-, -NH-C(NH)-NH-, -C(NH)-O-, -O-C(NH)-, -O-C(NH)-O-, -NH-C(NH)-O-, -O-C(NH)-NH-, -S(O)2-, -NH-S(O)2-, -S(O)2-NH-, -O-S(O)2-, -S(O)2-O-, -C(N-OH)- или -C(S)-.
В некоторых вариантах формулы (IIIb1), соединение имеет структурную формулу, выбранную из группы, включающей:
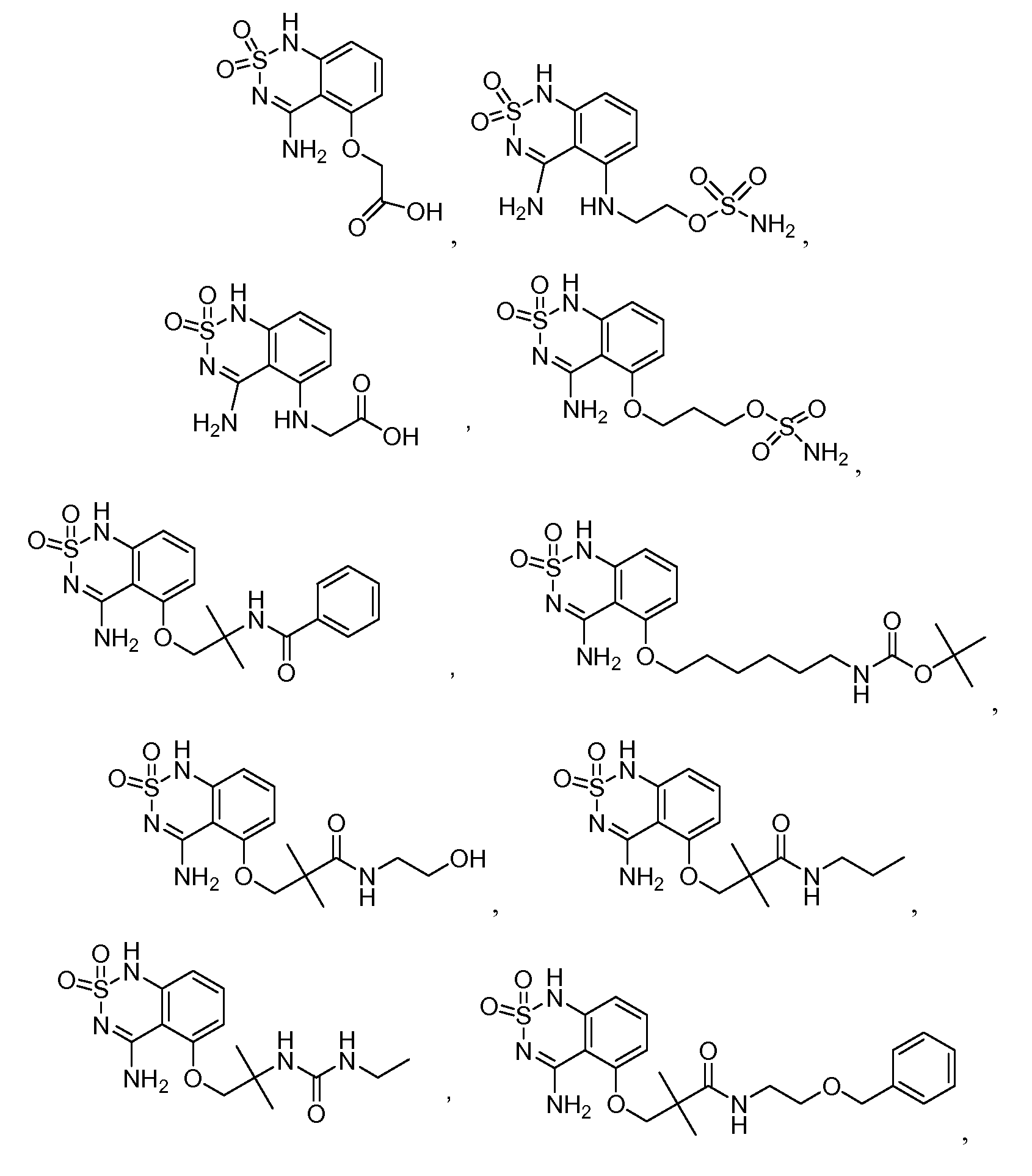



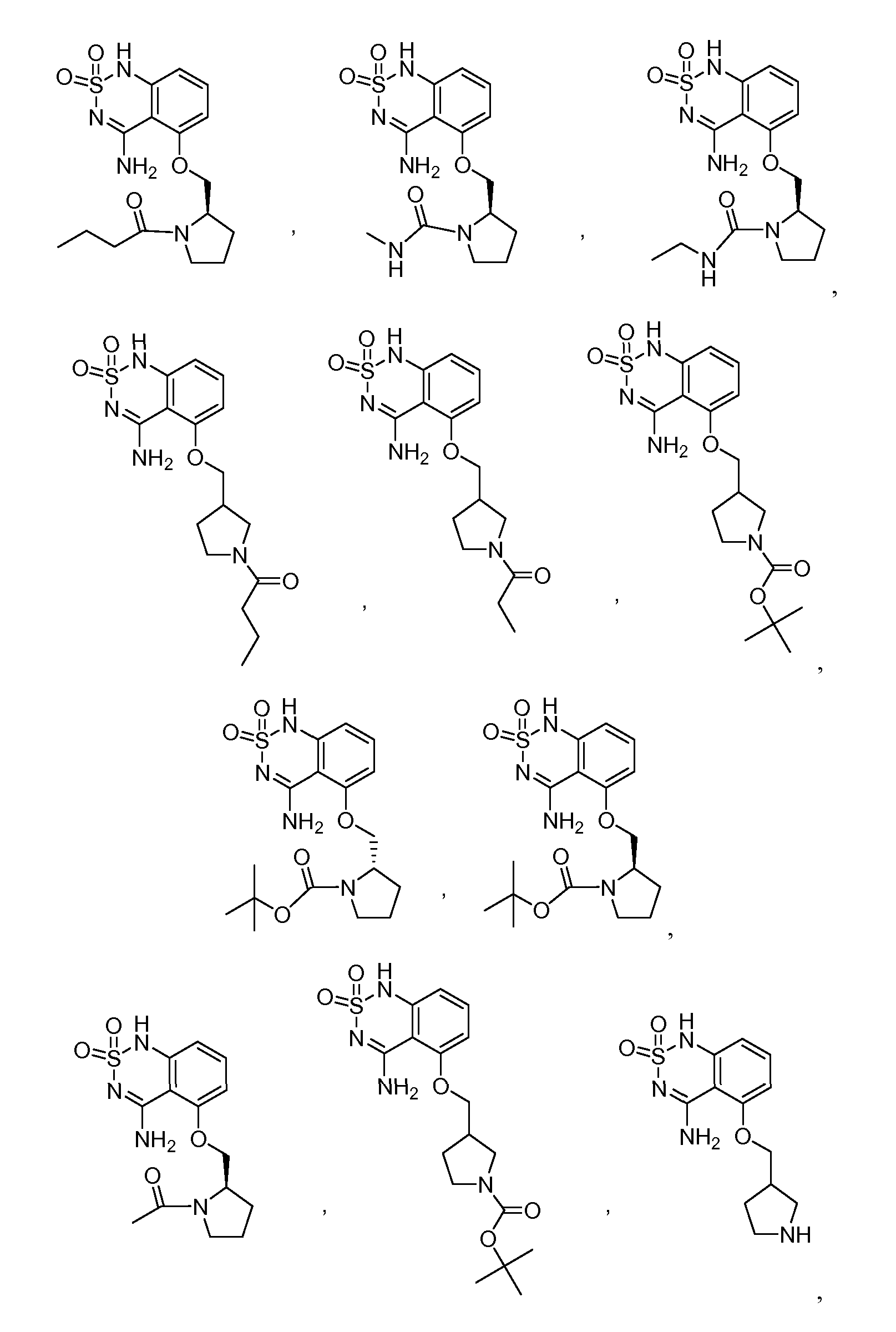
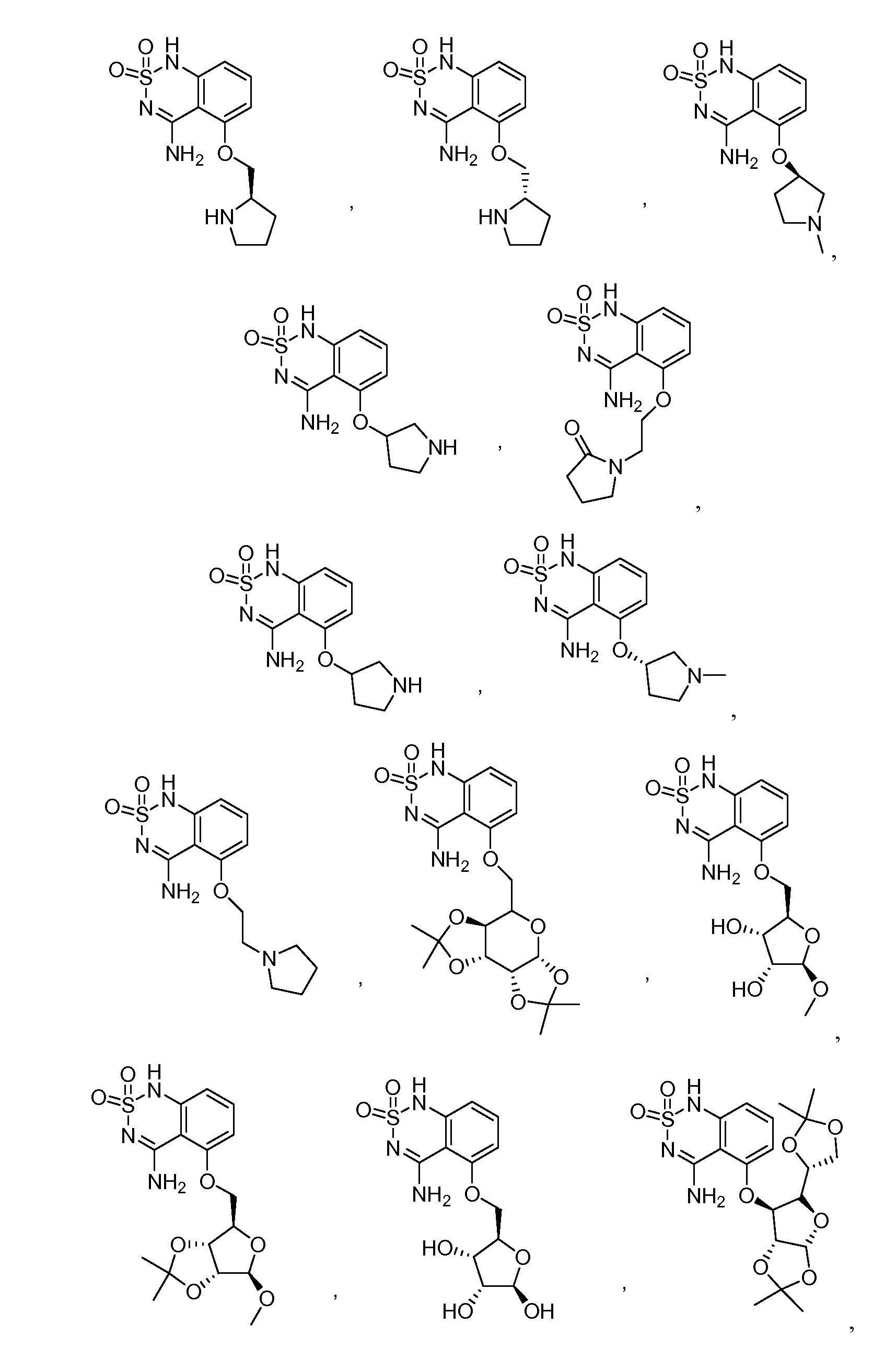

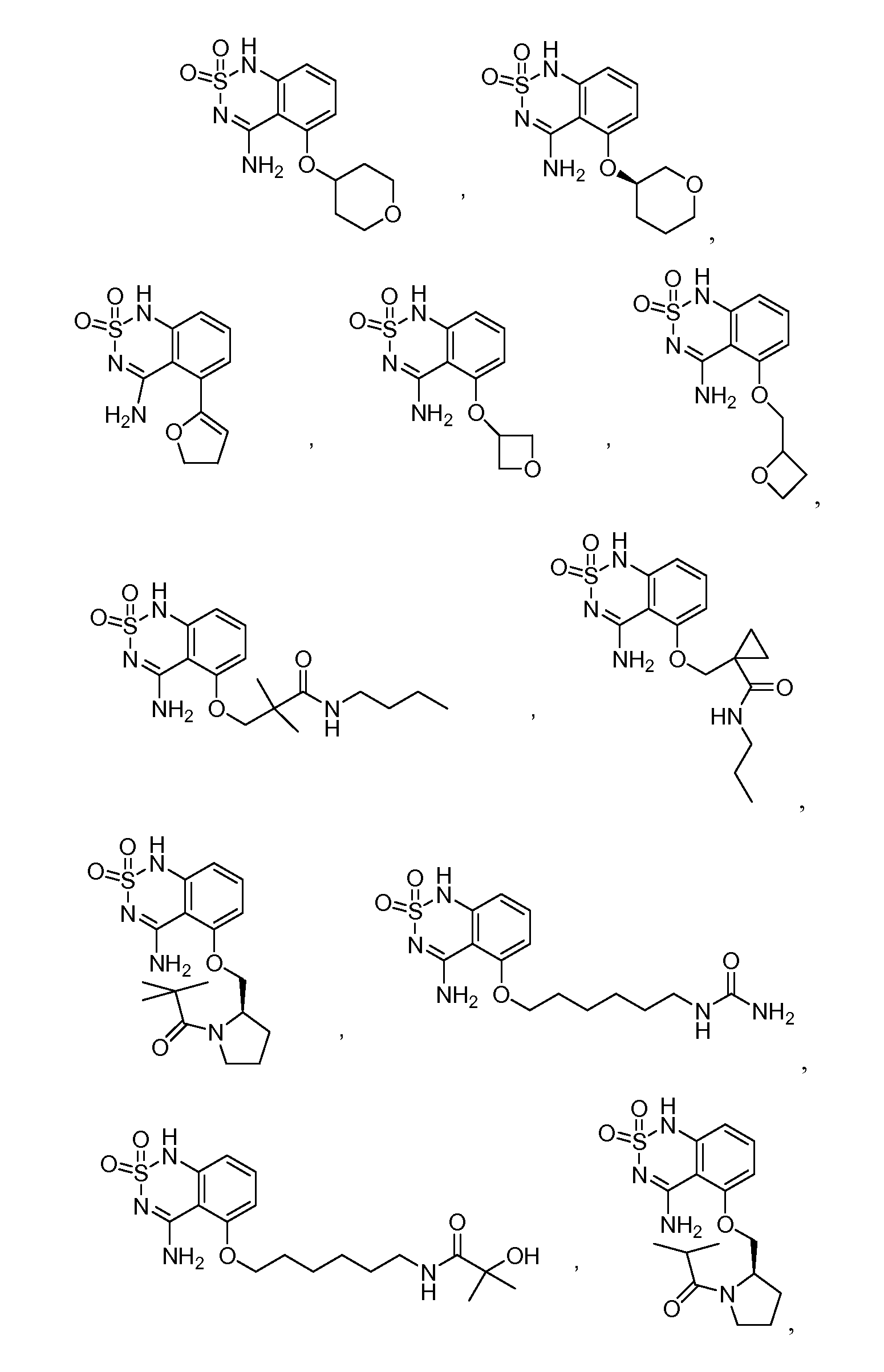


или их таутомера, соли, сольвата и/или сложного эфира. В некоторых предпочтительных вариантах солью этих соединений является гидрохлорид или трифторацетат.
В одном варианте формулы (III), соединение в соответствии с данным изобретением имеет структурную формулу (IIIc):
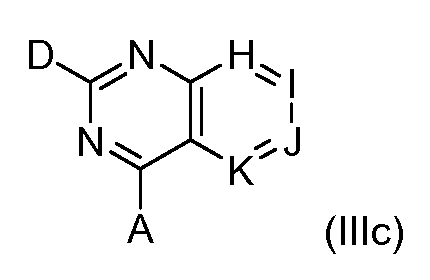
где
D является галогеном, -OR15, -NH-OR15, -NH-NHR15, -S(O)eR15 или -NR15R16.
В одном варианте формулы (IIIc), R35, R36, R37 и R38 независимо являются водородом, алкилом или замещенным алкилом. Предпочтительно, H является -C(R35)-; I является -C(R36); J является -C(R37)-; и K является -C(R38)-.
В некоторых вариантах формулы (IIIc), соединение имеет структурную формулу, выбранную из группы, включающей:
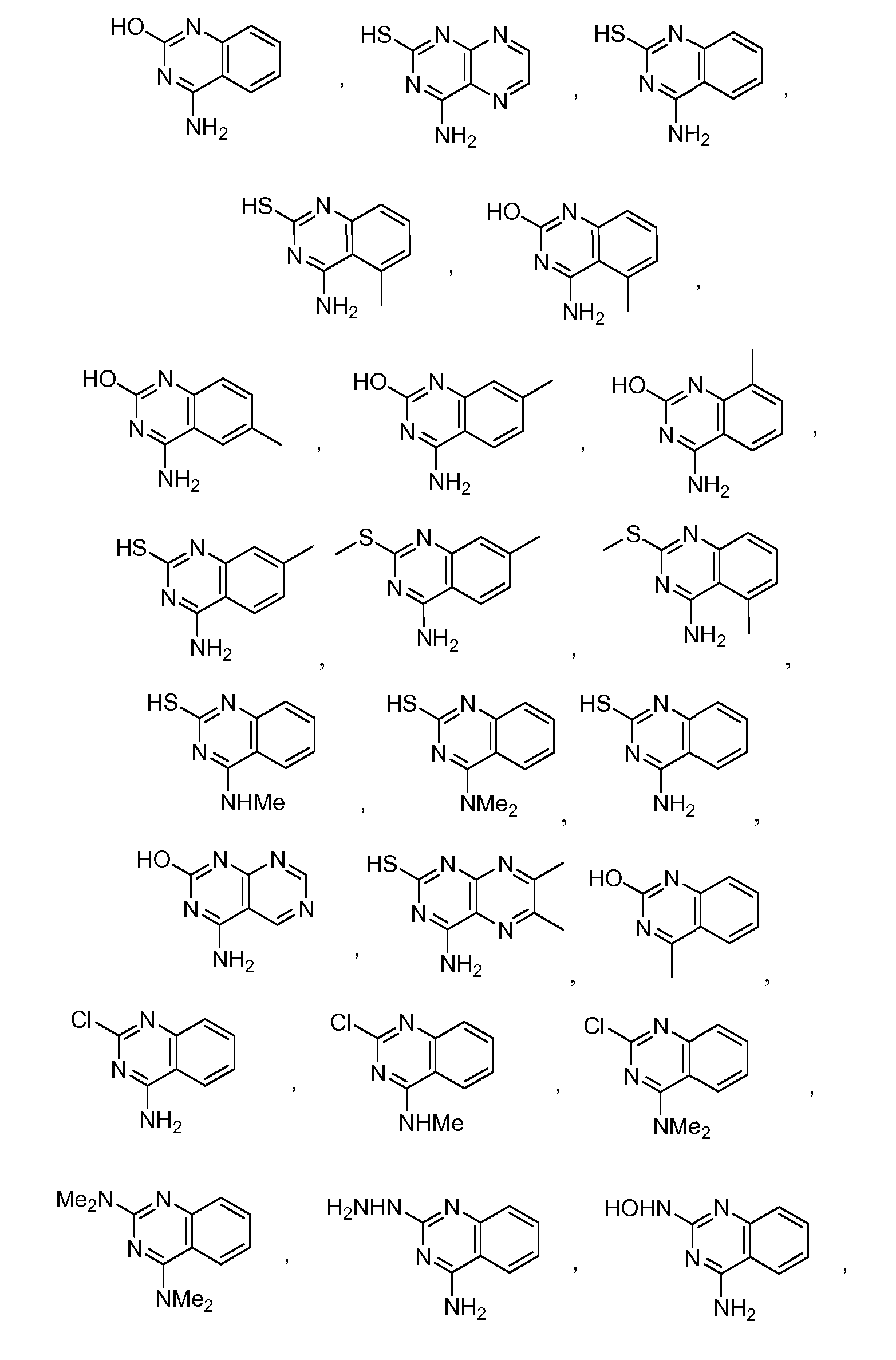

или их таутомера, соли, сольвата и/или сложного эфира. В некоторых предпочтительных вариантах солью этих соединений является гидрохлорид или трифторацетат.
В одном варианте формулы (III), соединение в соответствии с данным изобретением имеет структурную формулу (XI):

где,
R12 является водородом, -OH, -SH, -CN, -CH2OH или -CO2H;
D является -OH или -SH; и
A является -OH, -NH2, -NHCH3, -N(CH3)2, -NHC(O)CH3, -NHC(O)OCH3, -NHC(O)NH2, -NHC(S)NH2, -NHC(NH)NH2, -CN, -CH2OH, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2, -CO2H, -CONH2, -CONHCH3 или -CH2NHC(O)CH3;
при условии, что если R12 является водородом, тогда R35, R36, R37 и R38 не является водородом.
В одном варианте формулы (XI), R12 является -OH, -SH, -CN, -CH2OH или -CO2H; и A является -NH2, -NHCH3, -N(CH3)2, -NHC(O)CH3, -NHC(O)OCH3, -NHC(O)NH2, -NHC(S)NH2, -NHC(NH)NH2, -CN, -CH2OH, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2, -CO2H, -CONH2, -CONHCH3 или -CH2NHC(O)CH3.
В некоторых вариантах формулы (XI),
если R36, R37, R38 и R35 является водородом, D является -OH и A является -CO2H; тогда R12 не является -CO2H или -OH;
если R36, R37, R38 и R35 являются водородом, D является -OH и A является -NH2; тогда R12 не является -CO2H или CN;
если R36, R38 и R35 является водородом, R37 является -OMe, D является -OH и A является -CH2OH; тогда R12 не является -CH2OH; и
если R36, R38 и R35 являются водородом, R37 является водородом или метилом, D является -OH и A является -CO2H; тогда R12 не является -SH.
В одном варианте формулы (III), соединение в соответствии с данным изобретением имеет структурную формулу (XII):
где
R12 является водородом, -OH, -SH, -CN, -CH2OH или -CO2H;
D является -SH или -OH;
A является -OH, -NH2, -NHCH3, -N(CH3)2, -NHC(O)CH3, -NHC(O)OCH3, -NHC(O)NH2, -NHC(S)NH2, -NHC(NH)NH2, -CN, -CH2OH, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2, -CO2H, -CONH2, -CONHCH3 или -CH2NHC(O)CH3;
R36 является водородом, -OCH3, -OC2H5, -OC3H7, -CH3, -C2H5, -CH(CH3)2, -CH2OH, -CH2OCH3, -CN, -C(O)NR41R42, -CO2R41, -SO2NR39R40, -NR39SO2R40, -B(OR39)(OR40), -P(O)(OR39)(OR40) или -P(O)(R39)(OR40); и
R37 является водородом, -OCH3, -OC2H5, -OC3H7, -CH3, -C2H5, -CH(CH3)2, -CH2OH, -CH2OCH3, -CN, -C(O)NR43R44, -CO2R43, -SO2NR43R44, -NR43SO2R44, -B(OR43)(OR44), -P(O)(OR43)(OR44) или -P(O)(R43)(OR44).
В одном варианте формулы (XII), R12 является -OH, -SH, -CN, -CH2OH или -CO2H.
В одном варианте формулы (III), соединение в соответствии с данным изобретением имеет структурную формулу (XIII):
D является =O или =S;
A является -OH, NH2, -NHCH3, -N(CH3)2, -NHC(O)CH3, -NHC(O)OCH3, -NHC(O)NH2, -NHC(S)NH2, -NHC(NH)NH2, -CN, -CH2OH, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2, -CO2H, -CONH2, -CONHCH3 или -CH2NHC(O)CH3;
R17 является водородом, алкилом, арилом, арилалкилом.
В одном варианте формулы (XIII), если A является -NH2 и R35, R36, R37 и R38 являются водородом; тогда R17 не является метилом, этилом или фенилом.
В некоторых вариантах формулы (XIII), соединение имеет структурную формулу, выбранную из группы, включающей:


или их таутомера, соли, сольвата и/или сложного эфира. В некоторых предпочтительных вариантах солью этих соединений является гидрохлорид или трифторацетат.
В одном варианте формулы (III), соединение в соответствии с данным изобретением имеет структурную формулу (XIV):

где A является -OH, -NH2, -NHCH3, -N(CH3)2, -NHC(O)CH3, -NHC(O)OCH3, -NHC(O)NH2, -NHC(S)NH2, -NHC(NH)NH2, -CN, -CH2OH, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2, -CO2H, -CONH2, -CONHCH3 или -CH2NHC(O)CH3; и R17 является алкилом, арилом или арилалкилом.
В одном варианте формулы (I), модификатором лиганда хемосенсорного рецептора является соединение, имеющее структурную формулу (IV):

где:
L является -CHR60-, -NR47, -O- или -S-;
M является -CHR61-, -NR48, -O- или -S-;
R является -CHR62-, -NR49, -O- или -S-;
T является -CHR63-, -NR50, -O- или -S-;
o и p независимо равны 0, 1 или 2;
R60 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом ,-CN, -NO2, -OR64, -S(O)tR64, -OCOR64, -NR64COR65, -NR64R65, -CONR64R65, -CO2R64, -SO2NR64R65, -NR64SO2R65, -B(OR64)(OR65), -P(O)(OR64)(OR65) или -P(O)(R64)(OR65);
R61 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом ,-CN, -NO2, -OR66, -S(O)uR66, -OCOR66, -NR66COR67, -NR66R67, -CONR66R67, -CO2R66, -SO2NR66R67, -NR66SO2R67, -B(OR66)(OR67), -P(O)(OR66)(OR67) или -P(O)(R66)(OR67);
R62 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом ,-CN, -NO2, -OR68, -S(O)VR68, -OCOR68, -NR68COR69, -NR68R69, -CONR68R69, -CO2R68, -SO2NR68R69, -NR68SO2R69, -B(OR68)(OR69), -P(O)(OR68)(OR69) или -P(O)(R68)(OR69);
R63 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом ,-CN, -NO2, -OR70, -S(O)xR70, -OCOR70, -NR70COR71, -NR70R71, -CONR70R71, -CO2R70, -SO2NR70R71, -NR70SO2R71, -B(OR70)(OR71), -P(O)(OR70)(OR71) или -P(O)(R70)(OR71); или альтернативно R60 и R61, R61 и R62, или R62 и R63 вместе с атомами, к которым они присоединены, образуют арильное, замещенное арильное, гетероарильное, замещенное гетероарильное, циклоалкильное, замещенное циклоалкильное, циклогетероалкильное и замещенное циклогетероалкильное кольцо;
t, u, v и x независимо равны 0, 1 или 2;
R64 - R71 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом или, альтернативно, R64 и R65, R66 и R67, R68 и R69, или R70 и R71 вместе с атомами, к которым они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо; и
R47 - R50 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом;
при условии, что не более одного из L, M, R и T является гетероатомом.
В одном варианте формулы (IV), B является -N- и E является -NR17- или -N-. Предпочтительно, G является -C-.
В одном варианте формулы (IV), соединение в соответствии с данным изобретением имеет структурную формулу (XV):

где D является -SH или -OH; и A является -OH, -NH2, -NHCH3, -N(CH3)2, -NHC(O)CH3, -NHC(O)OCH3, -NHC(O)NH2, -NHC(S)NH2, -NHC(NH)NH2, -CN, -CH2OH, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2, -CO2H, -CONH2, -CONHCH3 или -CH2NHC(O)CH3.
В некоторых конкретных вариантах формулы (XV), соединение имеет структурную формулу, выбранную из группы, включающей:

или их таутомера, соли, сольвата и/или сложного эфира. В некоторых предпочтительных вариантах солью этих соединений является гидрохлорид или трифторацетат.
В одном варианте формулы (IV), B является -N-; E является -NR17- или -N-; A является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, -OR9, -SR9, -CN, -NR9R10, -CONR9R10, -CO2R9, -NR9CO2R10, -NR9CONR10R11, -NR9CSNR10R11 или -NR9C(=NH)NR10R11; и D является =O, =S , =N-OR15.
В одном варианте формулы (IV), соединение в соответствии с данным изобретением имеет структурную формулу (IVb):

где L является -CHR60-; M является -CHR61-; R является -CHR62-; T является -CHR63-.
В некоторых конкретных вариантах формулы (IV), соединение имеет структурную формулу, выбранную из группы, включающей:

или их таутомера, соли, сольвата и/или сложного эфира. В некоторых предпочтительных вариантах солью этих соединений является гидрохлорид или трифторацетат.
В одном варианте формулы (IV), соединение в соответствии с данным изобретением имеет структурную формулу (IVa):
В одном варианте формулы (IVa), L является -CHR60-; M является -CHR61-; R является -CHR62-; и Т является -CHR63-. Предпочтительно, A является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, -OR9, -SR9, -CN, -NR9R10, -CONR9R10, -CO2R9, -NR9CO2R10, -NR9CONR10R11, -NR9CSNR10R11 или -NR9C(=NH)NR10R11.
В некоторых конкретных вариантах формулы (IVa), соединение имеет структурную формулу, выбранную из группы, включающей:

или их таутомера, соли, сольвата и/или сложного эфира. В некоторых предпочтительных вариантах солью этих соединений является гидрохлорид или трифторацетат.
В одном варианте формулы (II), соединение в соответствии с данным изобретением имеет формулу (Va):

где D является водородом, алкилом, арилом, галогеном, -OH, -NH2, -SR15, -CH3, -CO2H или -CONH2; A является -NH2, -NHCH3, -N(CH3)2, -NHC(O)CH3, -NHC(O)OCH3, -NHC(O)NH2, -NHC(S)NH2, -NHC(NH)NH2, -CN, -CH2OH, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2, -CO2H, -CONH2, -CONHCH3 или -CH2NHC(O)CH3; и R15 является водородом, алкилом, замещенным алкилом, арилалкилом.
В одном варианте формулы (Va), Y образует одинарную связь с W и двойную связь с Z; W является -C(R24)- или -N-; Y является -C(R26)- или -N-; и Z является -S-, -N(R28) или -O-.
В одном варианте формулы (Va), Y образует двойную связь с W и одинарную связь с Z; W является -S-, -N(R25) или -O-; Y является -C(R26)- или -N-; и Z является -C(R27)- или -N-.
В некоторых вариантах формулы (Va), где B является -C(R12)-.
В одном варианте формулы (Va), соединение в соответствии с данным изобретением имеет структурную формулу (V):
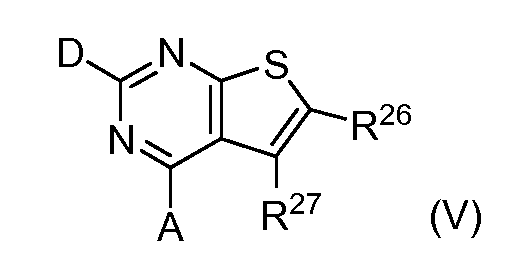
где:
R26 является водородом, алкилом, галогеном, -CO2R54, -CONR54R55, -SO2NR54R55, -NR54SO2R55, -B(OR54)(OR55), -P(O)(OR54)(OR55) или -P(O)(R54)(OR55);
R27 является водородом, алкокси, алкилом, замещенным алкилом, галогеном, -CN, -C(O)NR56R57, -CO2R56, -SO2NR56R57, -NR56SO2R57, -B(OR56)(OR57), -P(O)(OR56)(OR57) или -P(O)(R56)(OR57); или, альтернативно, R52 и R53 вместе с атомами, к которым они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо, и
R54, R55, R56 и R57 независимо является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом; или альтернативно R54 и R55 или R56 и R57 вместе с атомами, к которым они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо;
при условии, что если R26 и R27 являются водородом и D является -SH; тогда A является -NH2.
В одном варианте формулы (V),
если D является метилом, A является диметиламино, и R53 является водородом; тогда R52 не является метилом, этилом или карбоксилом;
если D является метилом, A является диметиламино, и R53 является метилом; тогда R52 не является метилом;
если D является -SCH3, A является диметиламино, и R53 является водородом; тогда R52 не является карбоэтокси;
если D является водородом, A является диметиламино, и R53 является водородом; тогда R52 не является карбоксилом или карбоэтокси;
если D является водородом, A является диметиламино, и R53 является метилом; тогда R52 не является метилом;
если D является водородом, A является метиламино, и R53 является водородом; тогда R52 не является метилом, этилом или карбоэтокси;
если D является водородом, A является метиламино, и R53 является метилом; тогда R52 не является метилом или карбоэтокси;
если D является водородом, A является метиламино, и R53 является -CH2NMe; тогда R52 не является метилом или карбоэтокси;
если D является фенилом, A является метиламино, и R53 является водородом; тогда R52 не является метилом; и
если D является фенилом, A является -NH(CO)CH3, и R53 является метилом; тогда R52 не является карбометокси.
В одном варианте формулы (V), соединение в соответствии с данным изобретением имеет структурную формулу (VI):

где D является водородом, -CH3, -C2H5, фенилом или бензилом.
В одном варианте формулы (V), соединение в соответствии с данным изобретением имеет структурную формулу (VII):

где A является водородом, -CH3, -C2H5, фенилом или бензилом.
В одном варианте формулы (V), соединение в соответствии с данным изобретением имеет структурную формулу (VIII):

где
R9 и R10 независимо являются водородом, -CH3, -C2H5, фенилом или бензилом; и
при условии, что оба R9 и R10 не являются водородом.
В одном варианте формулы (V), соединение в соответствии с данным изобретением имеет структурную формулу (IX):

где
R52 является алкилом, замещенным алкилом, -CN, -C(O)NR54R55, -CO2R54, -SO2NR54R55, -NR54SO2R55, -B(OR54)(OR55), -P(O)(OR54)(OR55) или -P(O)(R54)(OR55);
R53 является алкилом, CO2R56 или -CONR56R57, -SO2NR56R57, -NR56SO2R57, -B(OR56)(OR57), -P(O)(OR56)(OR57) или -P(O)(R56)(OR57); и
R54 - R57 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом; или альтернативно R52 и R53 вместе с атомами, к которым они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо.
В одном варианте формулы (V), соединение в соответствии с данным изобретением имеет структурную формулу (X):

где,
D является -OH, -SH или -NH2,
R52 является алкилом, замещенным алкилом, алкокси, -CN, -C(O)NR54R55, -CO2R54, -SO2NR54R55, -NR54SO2R55, -B(OR54)(OR55), -P(O)(OR54)(OR55), -P(O)(R54)(OR55),
R54 и R55 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом; или альтернативно R54 и R55 вместе с атомами, к которым они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо.
В некоторых вариантах формулы (Va), соединение имеет структурную формулу, выбранную из группы, включающей:



где,
R12 является -OH, -SH, -CN, -CH2OH или -CO2H; и
R51 является -CH3, -CH2CH3, бензилом или -CH2CO2CH2CH3;
или их таутомера, соли, сольвата и/или сложного эфира. В некоторых предпочтительных вариантах солью этих соединений является гидрохлорид или трифторацетат.
В другом варианте данного изобретения, модификатор лиганда хемосенсорного рецептора является соединением, имеющим структурную формулу (XVI):

или его таутомер, соль, сольват и/или сложный эфир, где:
n равно 1, 2 или 3;
каждый G независимо является -C(R77)(R79)-, -C(O)-, -NR77- или -S(O)2-;
при условии, что если n больше одного, тогда только один G является -C(O)-, -C(S), -S(O)2- или -NR77-;
Y является -C(O)-, -C(S) или -S(O)2-;
R7 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -CN, -NO2, -OR72, -S(O)aR72, -NR72R73, -CONR72R73, -CO2R72, -NR72CO2R73, -NR72CONR73R74, -NR72CSNR73R74 или -NR72C(=NH)NR73R74, -SO2NR72R73, -NR72SO2R73, -NR72SO2NR73R74, -B(OR72)(OR73), -P(O)(OR72)(OR73) или -P(O)(R72)(OR73);
a и b независимо равны 0, 1 или 2;
R71 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -CN, -NO2, -OR74, -S(O)bR74, -NR74R75, -CONR74R75, -CO2R74, -NR74CO2R75, -NR74CONR75R76, -NR74CSNR75R76 или -NR74C(=NH)NR75R76, -SO2NR74R75, -NR74SO2R75, -NR74SO2NR75R76, -B(OR74)(OR75), -P(O)(OR74)(OR75), -P(O)(R74)(OR75) или альтернативно, R71 и R72 вместе с атомами, к которым они присоединены, образуют арильное, замещенное арильное, гетероарильное, замещенное гетероарильное, циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо, где кольцо необязательно конденсировано с другим арильным, замещенным арильным, гетероарильным, замещенным гетероарильным, циклоалкильным, замещенным циклоалкильным, циклогетероалкильным или замещенным циклогетероалкильным кольцом;
R72 - R76 независимо является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом или, альтернативно, R72 и R73, R73 и R74, R74 и R75 и R75 и R76 вместе с атомами, к которым они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо; и
R77 - R79 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом или, альтернативно, R77 и R79, вместе с атомами, к которым они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо.
В некоторых вариантах формулы (XVI), если G является -C(O)- и R78 является водородом, R71 и R72 не образуют фенильное кольцо. В других вариантах, R70 и R71 вместе с атомами, к которым они присоединены, образуют арильное, замещенное арильное, гетероарильное, замещенное гетероарильное, циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо, где кольцо необязательно конденсировано с другим арильным, замещенным арильным, гетероарильным, замещенным гетероарильным, циклоалкильным, замещенным циклоалкильным, циклогетероалкильным или замещенным циклогетероалкильным кольцом.
В других вариантах формулы (XVI), представлено соединение структурной формулы (XVII), (XVIII), (XIX) или (XX):

где o равно 1 или 2.
В некоторых вариантах, R70 и R71 вместе с атомами, к которым они присоединены, образуют арильное, замещенное арильное, гетероарильное, замещенное гетероарильное, циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо, где кольцо необязательно конденсировано с другим арильным, замещенным арильным, гетероарильным, замещенным гетероарильным, циклоалкильным, замещенным циклоалкильным, циклогетероалкильным или замещенным циклогетероалкильным кольцом.
В другом варианте формулы (XVI), модификатором лиганда хемосенсорного рецептора является соединение, имеющее структурную формулу (XXI):

где:
X является O или S;
H является -N- или -CR81-;
I является -N- или -CR82-;
J является -N- или -CR83-;
K является -N- или -CR84-;
при условии, что не более 2 из H, I ,J или K являются -N-;
R81 является водородом, алкокси, -OCH3, -OC2H5, -OC3H7, алкилом, -CH3, -C2H5, -CH(CH3)2, -CH2OH, галогеном, хлором, фтором, -CH2OCH3, -CN, -C(O)NR85R86, -CO2R85, -SO2NR85R86, -NR85SO2R86, -B(OR85)(OR86), -P(O)(OR85)(OR86) или -P(O)(R85)(OR86);
R82 является водородом, алкокси, -OCH3, -OC2H5, -OC3H7, алкилом, -CH3, -C2H5, -CH(CH3)2, -CH2OH, галогеном, хлором, фтором, -CH2OCH3, -CN, -C(O)NR88R87, -CO2R88, -SO2NR88R87, -NR88SO2R87, -B(OR88)(OR87), -P(O)(OR88)(OR87) или -P(O)(R88)(OR87);
R83 является водородом, алкокси, -OCH3, -OC2H5, -OC3H7, алкилом, -CH3, -C2H5, -CH(CH3)2, -CH2OH, галогеном, хлором, фтором, -CH2OCH3, -CN, -C(O)NR90R89, -CO2R90, -SO2NR90R89, -NR90SO2R89, -B(OR90)(OR89), -P(O)(OR90)(OR89) или -P(O)(R90)(OR89);
R84 является водородом, алкокси, -OCH3, -OC2H5, -OC3H7, алкилом, -CH3, -C2H5, -CH(CH3)2, -CH2OH, галогеном, хлором, фтором, -CH2OCH3, -CN, -C(O)NR92R91, -CO2R90, -SO2NR92R91, -NR92SO2R91, -B(OR92)(OR91), -P(O)(OR92)(OR91) или -P(O)(R92)(OR91); и
R85 - R91 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом или, альтернативно, R85 и R86, R87 и R88, R89 и R90, или R91 и R92 вместе с атомами, к которым они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо;
при условии, что R81, R82, R83 и R84 все не являются водородом.
В некоторых вариантах формулы (XXII), R81, R82, R83 и R84 независимо являются водородом, алкокси, -OCH3, -OC2H5, -OC3H7, алкилом, -CH3, -C2H5, -CH(CH3)2, -CH2OH, галогеном, хлором, фтором, -CH2OCH3, -CN, -C(O)NHMe, -CO2H, -CO2CH3, -SO2N(CH3)2, -NHSO2CH3, -B(OH)2 или -P(O)(OH)2.
В других вариантах формулы (XXII) представлены соединения, имеющие представленные ниже структуры:

В другом варианте данного изобретения, модификатором лиганда хемосенсорного рецептора является соединение, имеющее структурную формулу (XXII):

или его таутомер, соль, сольват и/или сложный эфир, где:
каждый G независимо является -C(R94)(R95)-, -C(O)-, -NR94- или -S(O)2-;
n равно 1, 2 или 3;
при условии, что если n больше одного, тогда только один G является -C(O)-, -S(O)2- или -NR94-;
Y является -C(O)-, -C(S)- или -S(O)2-;
L является -C(R104)(R105)-, -O-, или -NR94-;
R92 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -CN, -NO2, -OR98, -S(O)yR98, -NR98R99, -CONR98R99, -CO2R98, -NR98CO2R99, -NR98CONR99R100, -NR98CSNR99R100 или -NR98C(=NH)NR99R100, -SO2NR98R99, -NR98SO2R99, -NR98SO2NR99R100, -B(OR98)(OR99), -P(O)(OR98)(OR99) или -P(O)(R98)(OR99);
R93 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -CN, -NO2, -OR100, -S(O)2R101, -NR101R102, -CONR101R102, -CO2R101, -NR101CO2R102, -NR101CONR102R103, -NR101CSNR102R103 или -NR101C(=NH)NR102R103, -SO2NR101R102, -NR101SO2R102, -NR101SO2NR102R103, -B(OR101)(OR102), -P(O)(OR101)(OR102), -P(O)(R101)(OR102) или, альтернативно, R92 и R93 вместе с атомами, к которым они присоединены, образуют арильное, замещенное арильное, гетероарильное, замещенное гетероарильное, циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо, где кольцо необязательно конденсировано с другим арильным, замещенным арильным, гетероарильным, замещенным гетероарильным, циклоалкильным, замещенным циклоалкильным, циклогетероалкильным или замещенным циклогетероалкильным кольцом;
y и z независимо равны 0, 1 или 2;
R98 - R103 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом или, альтернативно, R98 и R99, R99 и R100, R101 и R102, или R102 и R103 вместе с атомами, к которым они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо;
R94 - R95 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом или, альтернативно, R94 и R95, вместе с атомами, к которым они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо;
R96 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом; и
R104 - R105 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом или, альтернативно, R104 и R105, вместе с атомами, к которым они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо.
В некоторых вариантах, если L является O, R95 является водородом, R92 является метилом и связь, соединяющая атомы углерода, присоединенные к R92 и R93 является двойной связью, тогда R93 не является водородом.
В некоторых вариантах формулы (XXII) представлено соединение структурной формулы (XXIII):
где если R92 является -CH3, тогда R93 не является водородом, и оба R92 и R93 не являются водородом.
В некоторых вариантах формулы (XXII), R92 и R93 независимо являются водородом, -OCH3, -OC2H5, -OC3H7, алкилом, -CH3, -C2H5, -CH(CH3)2, -CH2OH, галогеном, хлором, фтором, -CH2OCH3, -CN, -SCH3, -C(O)NHMe, -CO2H, -CO2CH3, -SO2N(CH3)2, -NHSO2CH3, -B(OH)2 или -P(O)(OH)2. В других вариантах, R92 и R93 вместе с атомами, к которым они присоединены, образуют циклоалкильное, циклогетероалкильное, арильное или гетероарильное кольцо.
В других вариантах формулы (XXII), соединения имеют представленные структуры:

Определения и заместители для различных видов и подвидов данных соединений описаны подробно выше. Специалисту в данной области техники должно быть понятно, что любое сочетание определений и заместителей, представленных выше, не должно давать неэффективные виды и соединение. Под "неэффективным видом или соединением" понимают, что структура соединения, которое нарушает соответствующие научные принципы (такое как, например, атом углерода, соединенный более четырех ковалентных связей) или является таким нестабильным, что выделение соединения из реакционной смеси является невозможным (такое как, например, более трех карбонильных групп, непрерывно соединенных друг с другом).
В одном варианте, в данном изобретении представлен способ получения соединения, имеющего структурную формулу (a):

включающий взаимодействие соединения, имеющего структурную формулу (b)

с основанием, где D является кислородом или серой; A является -NH2 или -ORb; R17 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, или замещенным арилалкилом; R26 и R27 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, -CN, -NO2, -OR31, -S(O)hR31, -NR31R32, -CONR31R32, -CO2R31, -SO2NR31R32 или -NR31SO2R32; или, альтернативно, R26 и R27, вместе с атомами, к которым они присоединены, образуют циклоалкильное, замещенное циклоалкильное, гетероциклоалкильное или замещенное гетероциклоалкильное кольцо; Ar является арилом или замещенным арилом; и Ra является -CN, -C(O)Rb, -C(O)ORb, -C(O)N(Rb)2; каждый Rb независимо является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, или замещенным гетероарилалкилом; h равно 0, 1 или 2; и R31 и R32 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом; или, альтернативно, R31 и R32, вместе с атомами, к которым они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо. Предпочтительно, чтобы основанием было неорганическое основание, такое как NaOH.
В одном варианте, соединение, имеющее структурную формулу (b), получают взаимодействием соединения, имеющего структурную формулу (c):

В другом варианте, в данном изобретении представлен способ получения соединения, имеющего структурную формулу (e):

включающий взаимодействие соединения, имеющего структурную формулу (f)

с основанием, где A является -NH2 или -ORb; R17 является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, или замещенным арилалкилом; R35, R36, R37 и R38 каждый независимо является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, галогеном, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом, -CN, -NO2, -OR41, -S(O)kR41, -NR41R42, -CONR41R42, -CO2R41, -SO2NR41R42 и -NR41SO2R42; или альтернативно, R35 и R36, R36 и R37, или R37 и R38, вместе с атомами, к которым они присоединены, образуют циклоалкильное, замещенное циклоалкильное, гетероциклоалкильное или замещенное гетероциклоалкильное кольцо; Ra является -CN, -C(O)Rb, -C(O)ORb, -C(O)N(Rb)2; каждый Rb независимо является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом; и R41 и R42 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, ацилом, замещенным ацилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом; или, альтернативно, R41 и R42, вместе с атомами, к которым они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо. Предпочтительно, чтобы основанием являлось неорганическое основание, такое как NaOH.
В другом варианте, в данном изобретении представлен способ получения соединения, имеющего структурную формулу (e):
включающий взаимодействие соединения, имеющего структурную формулу (g)

с NH2S(O)2NH2 или Cl-S(O)2-NH2 в присутствии основания для получения непосредственно соединения, имеющего структурную формулу (e); или, альтернативно, с получением соединения, имеющего структурную формулу (f) по пункту 221, которое далее подвергается взаимодействию с основанием с получением соединения, имеющего структурную формулу (e). Предпочтительно, чтобы основанием являлось органическое основание, такое как DBU.
В общем, соединения в соответствии с настоящим изобретением, например, соединения, имеющие представленные здесь формулы, могут быть синтезированы способом, описанным выше и в представленных ниже типовых методиках и/или схемах.
Как описано выше, соль соединения в соответствии с данным изобретением обычно может быть получена взаимодействием соединения с кислотой или основанием. В одном варианте, данное изобретение представляет способ синтеза для получения соли соединения, имеющего любую из представленных выше структурных формул, в промышленных масштабах. Способ синтеза позволяет получить большое количество соли соединения в соответствии с данным изобретением, быстро и экономично. Способ синтеза может применяться в лабораторной установке или в промышленной установке. Один пример метода синтеза описан подробно в примере 165 ниже.
В общем, соединения в соответствии с данным изобретением, например, соединения с представленными здесь формулами, могут быть синтезированы в соответствии с представленными ниже методиками и/или схемами.
Пиримидины B, включающие конденсированные производные пиримидина, такие как хиназолины и пиридо[2,3-d]пиримидины, синтезируют из 2-аминонитрилов, 2-аминокетонов или 2-аминокарбоксильных производных A взаимодействием с соответствующими карбоксильными производными, как показано на схеме 1 (Rad-Moghadam et al, J. of Heterocyclic Chem. 2006, 43, 913; Roy et al, J. Org. Chem. 2006, 71, 382; Jung et al, J. Med. Chem. 2006, 49, 955; Khabnadideh et al., Bioorg. Med. Chem. 2005, 13, 2637). Аминогруппа в исходном материале A может быть далее функционализирована алкилированием (Brown et al., J. Med. Chem. 1990, 33, 1771) или восстановительным аминированием (Uehling et al., J. Med. Chem. 2006, 49, 2758, и т.д.) с получением соответствующих N-монозамещенных 2-аминонитрилов, 2-аминокетонов или 2-аминокарбоксильных производных C. Реакция сочетания A или C с изо(тио)цианатами, такими как, например, бензоилизо(тио)цианатами, и последующая циклизация обработкой с NaOH дает производные пиримидин-2(1H)-(ти)она E, включая, но не ограничиваясь ими, конденсированные пиримидин-2(1H)-(ти)оны, такие как производные хиназолин-2(1H)-(ти)она и пиридо[2,3-d]пиримидин-2(1H)-(ти)она (El-Sherbeny et al., Med. Chem. Rev. 2000, 10, 122 и представленные там ссылки; Reddy et al., Synthetic Commun. 1988, 18, 525; Wilson, Org. Lett. 2001, 3, 585, и представленные там ссылки). Прямая циклизация A или C с (тио)мочевинами в присутствии NaOH также дает образование производных пиримидин-2(1H)-(ти)она E (схема 1) (Naganawa et al., Bioorg. Med. Chem. 2006, 14, 7121 и представленные там ссылки).
Схема 1

Пиримидины B и пиримидин-2(1H)-(ти)оны E также могут быть получены из соответствующих производных 1,3-дикарбонила и производных α,β-ненасыщенного карбонила конденсацией с гуанидинами, амидинами или производными (тио)мочевины, как показано на схеме 2 (Sharma et al., Eur. J. Med. Chem. 2006, 41, 83, и представленные там ссылки; Bellur et al., Tetrahedron 2006, 62, 5426 и представленные там ссылки; Hauser et al., J. Org. Chem. 1953, 18, 588).
Схема 2

Различные пиримидины и пиримидин-2(1H)-(ти)оны, а также их конденсированные производные пиримидина и пиримидин-2(1H)-(ти)она, такие как хиназолины и хиназолин-2(1H)-оны могут быть синтезированы из производных пиримидин-2,4(1H,3H)-диона, а также конденсированных производных пиримидин-2,4(1H,3H)-дионов, таких как хиназолин-2,4(1H,3H)-дион и пиридо[2,3-d]пиримидин-2,4(1H,3H)-дион (схема 3). Взаимодействие производных пиримидин-2,4(1H,3H)-диона с фосгеном или POCl3 дает соответствующие 2,4-дихлорпиримидины (Lee et al., Synlett. 2006, 65 и представленные там ссылки). Дальнейшие замещения двух хлоридов различными нуклеофилами дает пиримидины и пиримидин-2(1H)-(ти)оны, а также конденсированные производные пиримидина и пиримидин-2(1H)-(ти)она (Kanuma et al., Bioorg. & Med. Chem. Lett. 2005, 15, 3853 и представленные там ссылки; Liu et al., Bioorg. & Med. Chem. Lett. 2007, 17, 668; Wilson et al., Bioorg. & Med. Chem. 2007, 15, 77; Boarland et al., J. Chem. Soc. 1951, 1218).
Схема 3

Также, [1,2,6]тиадиазин-2,2-диоксиды и конденсированные производные [1,2,6]тиадиазин-2,2-диоксида, такие как, например, 1H-бензо[c][1,2,6]тиадиазин-2,2-диоксиды также синтезируют из 2-аминонитрилов, 2-аминокетонов или 2-аминокарбоксильных производных A или C (схема 4), взаимодействием с NH2SO2Cl (Hirayama et al., Bioorg. & Med. Chem. 2002, 10, 1509; Kanbe et al., Bioorg. & Med. Chem. Lett. 2006, 16, 4090 и представленные там ссылки) или NH2SO2NH2 (Maryanoff et al., J. Med. Chem. 2006, 49, 3496, и представленные там ссылки) с последующей циклизацией в присутствии NaOH (Goya et al., Heterocycles, 1986, 24, 3451 ; Albrecht et al., J. Org. Chem. 1979, 44, 4191; Goya et al., Arch. Pharm. (Weinheim) 1984, 317, 777). Конденсация соответствующих 1,3-дикарбонильных производных, α,β-ненасыщенных карбонильных производных с производными сульфамида (схема 4) также дает производные [1,2,6]тиадиазин-2,2-диоксида (Wright, J. Org. Chem. 1964, 29, 1905).
Схема 4

Способы синтеза производных тиено[2,3-d]пиримидина описаны на схеме 5. Производные 2-аминотиофена 303 синтезируют с применением реакции Гевальда (Chen et al., Synthetic Communication 2004, 34, 3801 и представленные там ссылки; Elmegeed et al., Eur. J. Med. Chem. 2005, 40, 1283 и представленные там ссылки). Соединение 303 может быть циклизовано с соответствующими карбоксильными производными с получением производных тиено[2,3-d]пиримидина 304 (Rad-Moghadam, J. Heterocyclic Chem. 2006, 43, 913; Seijas et al., Tetrahedron Lett. 2000, 41, 2215, и представленные там ссылки; Jung et al., J. Med. Chem. 2006, 49, 955.).
Схема 5
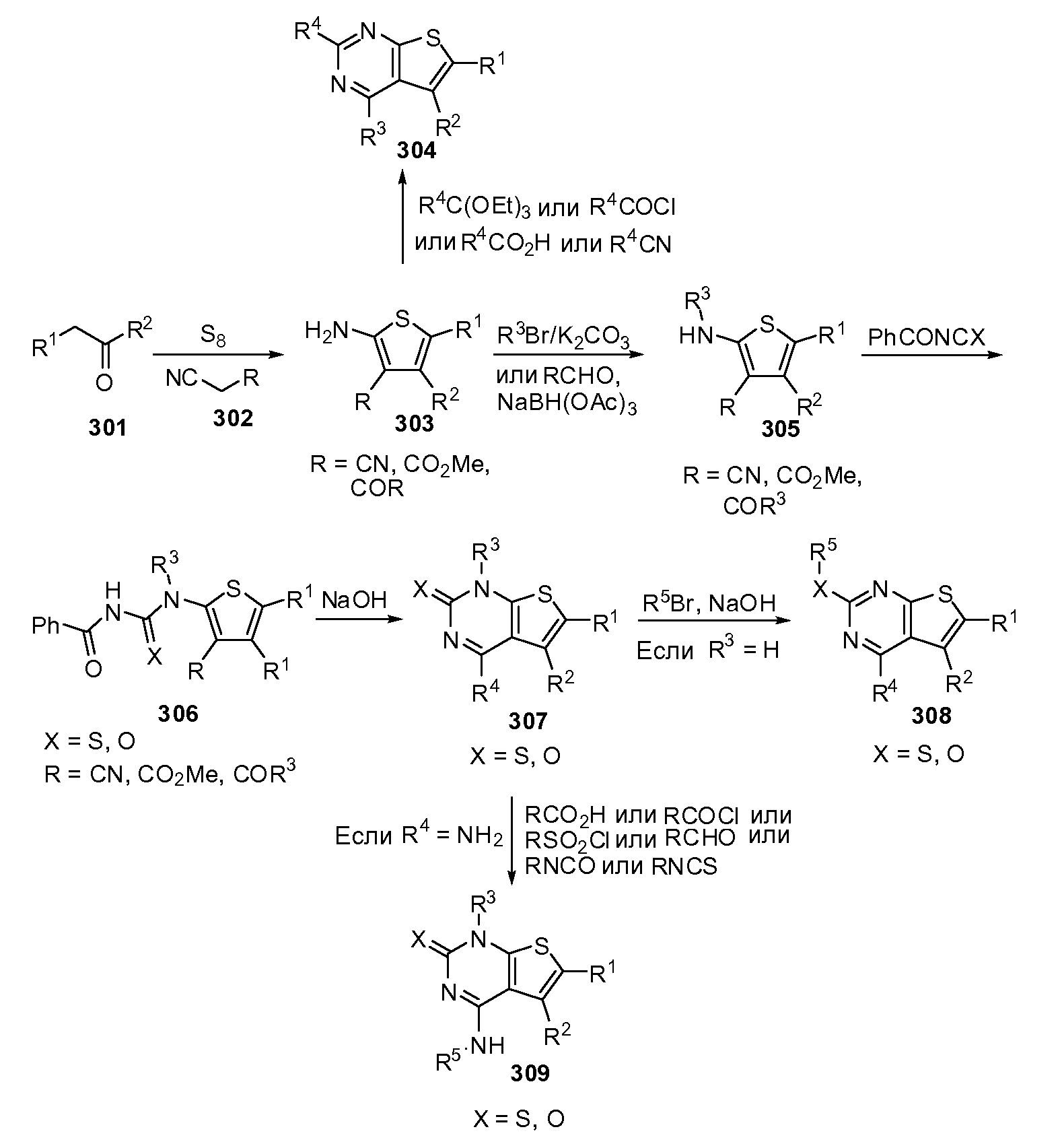
Производные 2-аминотиофена 303 могут быть также алкилированы либо обработкой R3Br/K2CO3, либо RCHO/NaBH(OAc)3 с получением N-алкилированных производных 2-аминотиофена 305 (Brown et al., J. Med. Chem. 1990, 33, 1771; Uehling et al., J. Med. Chem. 2006, 49, 2758 и представленные там ссылки), который затем подвергают взаимодействию с, например, с бензоилизо(тио)цианатом с получением соответствующих производных бензоил(тио)мочевины 306. Соединения 306 может быть циклизованы обработкой NaOH с получением производных тиено[2,3-d]пиримидина 7 (El-Sherbeny et al., Med. Chem. Rev. 2000, 10, 122, и представленные там ссылки; Reddy et al., Synthetic Commun. 1988, 18, 525; Wilson, Org. Lett. 2001, 3, 585 и представленные там ссылки). Если R3 = H, соединения 307 могут взаимодействовать с R5Br/NaOH с получением алкилированных продуктов 8 (Hirota et al., Bioorg. Med. Chem. 2003, 11, 2715.). Если R4 = NH2, аминогруппа может быть далее функционализирована с получением продуктов 309.
Также, хиназолин-2(1H)-он и производные хиназолин-2(1H)-тиона 402 синтезируют из различных производных 2-аминобензойной кислоты, производных 2-аминобензонитрила, производных 2-аминоацетофенона и производных 2-аминобензамида 400 как показано на схеме 6. Реакция сочетания соединений 400 с бензоилизо(тио)цианатами дает соответствующие производные бензоил(тио)мочевины 401. Их циклизация в присутствии NaOH дает производные хиназолин-2(1H)-(ти)она 402 (El-Sherbeny, Med. Chem. Rev. 2000, 10, 122 и представленные там ссылки; Reddy et al., Synthetic Commun. 1988, 18, 525; Wilson, Org. Lett. 2001, 3, 585 и представленные там ссылки).
Схема 6

Производные 1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида 404 синтезируют из тех же исходных материалов 400 (схема 7) через их реакции с сульфамидом или сульфамоилхлоридом с последующей циклизацией с NaOH. Прямая реакция соединений 400 с сульфамидом в присутствии DBU при повышенной температуре также дает производные 1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида 404 (Maryanoff et al., J. Med. Chem. 2006, 49, 3496, и представленные там ссылки).
Схема 7

Производные хиназолина также синтезируют из хиназолин-2,4(1H,3H)-дионов (схема 8). Реакция хиназолин-2,4(1H,3H)-дионов с POCl3 дает соответствующие дихлорхиназолины (Zunszain et al., Bioorg. & Med. Chem. 2005, 13, 3681 и представленные там ссылки). Дальнейшие замещения двух хлоридов различными нуклеофилами дает производные хиназолина (схема 8) (Kanuma et al., Bioorg. & Med. Chem. Lett. 2005, 15, 3853 и представленные там ссылки; Blackburn, Bioorg. & Med. Chem. Lett. 2006, 16, 2621).
Схема 8

Производные 4-амино-5,6,7,8-тетрагидрохиназолин-2(1H)-(ти)онов и производные 4-амино-5,6,7,8-тетрагидро-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида, а также структурные аналоги с разными размерами кольца, как показано на схеме 9, обычно синтезируют методами, описанными здесь. Циклизация Торпе-Циглера динитрилов в присутствии основания дает β-амино-α,β-ненасыщенные производные нитрила (Winkler et al., Tetrahedron 2005, 61, 4249; Yoshizawa et al., Green Chem. 2002, 4, 68, и представленные там ссылки; Rodriguez-Hahn et al., Synthetic Commun. 1984, 14, 967, и представленные там ссылки; Francis et al., J. Med. Chem. 1991, 34, 2899). β-Амино-α,β-ненасыщенные нитрилы могут взаимодействовать, например, с бензоилизо(тио)цианатом и далее быть циклизованы обработкой NaOH с получением производных 4-амино-5,6,7,8-тетрагидрохиназолин-2(1H)-(ти)она (El-Sherbeny et al., Med. Chem. Rev. 2000, 10, 122, и представленные там ссылки; Reddy et al., Synthetic Commun. 1988, 18, 525) а также их структурных аналогов с различными размерами кольца (схема 9). Подобная реакция β-амино-α,β-ненасыщенных производных нитрила с сульфамоилхлоридом с последующей обработкой NaOH дает производные 4-амино-5,6,7,8-тетрагидро-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида, а также структурные аналоги с различными размерами кольца (схема 9) (Hirayama et al., Bioorg. & Med. Chem. 2002, 10, 1509; Kanbe et al., Bioorg. & Med. Chem. Lett. 2006, 16, 4090 и представленные там ссылки).
Схема 9

Ацесульфам и конденсированные производные ацесульфама C, такие как бензо[e][1,2,3]оксатиазин-4(3H)-он-2,2-диоксиды могут быть синтезированы через взаимодействие производных 1,3-дикарбонила A или производных 2-гидроксикарбоксила B и D с SO3 или ClSO2NH2, как описано на схеме 10 (Linkies et al., Synthesis 1990, 405 и представленные там ссылки; Ahmed et al., J. Org. Chem. 1988, 53, 4112; Ahmed et al., Heterocycles 1989, 29, 1391).
Схема 10

Производные ацесульфама C также могут быть синтезированы циклизацией алкинов или енолов с FSO2NCO (Clauss et al., Tetrahedron Lett. 1970, 2, 119) или ClSO2NCO (Rasmussen et al., J. Org. Chem. 1973, 35, 2114; Etter et al., J. Org. Chem. 1986, 51, 5405; Tripathi et al., Indian J. Chem. Sect. B 1987, 26B, 1082.) как показано на схеме 11.
Схема 11

Производные сахарина могут быть синтезированы прямой окислительной циклизацией N-алкил-o-метиларенсульфонамидов, как показано на схеме 12 (Xu et al., Tetrahedron 2006, 62, 7902 и представленные там ссылки; Pal et al., Letters in Drug Design & Discovery 2005, 2, 329). Циклизация производных o-карбоксиларенсульфонилхлорида с первичными аминами также дает производные сахарина (Robinson et al., Eur. J. Org. Chem. 2006, 19, 4483 и представленные там ссылки; Yamada et al., J. Med. Chem. 2005, 48, 7457 и представленные там ссылки; Da Settimo et al., J. Med. Chem. 2005, 48, 6897). Другие гетероароматические конденсированные производные изотиазол-3(2H)-он-1,1-диоксида могут быть синтезированы так же.
Схема 12
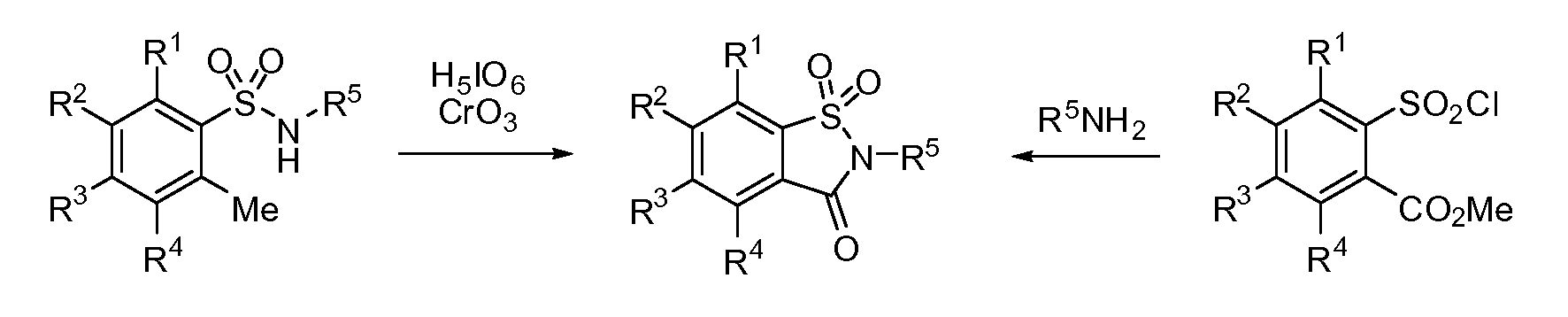
В соответствии с данным изобретением, модификаторы хемосенсорного рецептора или модификаторы лиганда хемосенсорного рецептора в соответствии с данным изобретением могут применяться в одном или более способах в соответствии с данным изобретением, например, модулировании хемосенсорного рецептора и/или его лигандов. В общем, модификаторы хемосенсорного рецептора или модификаторы лиганда хемосенсорного рецептора в соответствии с данным изобретением представлены в композиции, такой как, например, проглатываемая композиция. В данном описании "проглатываемая композиция" включает любое вещество, предназначенное для перорального применения, либо в чистом виде, либо вместе с другим веществом. Проглатываемая композиция включает "пищевые продукты или напитки" и "не пищевые продукты". Под "пищевыми продуктами или напитками" подразумевают любой съедобный продукт, предназначенный для потребления человеком или животным, включая твердые вещества, полутвердые вещества или жидкости (например, напитки). Термин "не пищевые продукты" или "не пищевая композиция" включает пищевые добавки, нутрицевтики, функциональные пищевые продукты (например, любая свежая или обработанная пища, заявленная как способствующая укреплению здоровья и/или предупреждающая болезнь кроме основных питающих функций питательных веществ), фармацевтические и безрецептурные лекарственные средства, продукты по уходу за полостью рта, такие как средства для чистки зубов и ополаскиватели для полости рта, косметические продукты, такие как подслащенные бальзамы для губ и другие продукты личной гигиены, в которых применяется сукралоза или другие подсластители.
Проглатываемая композиция также включает фармацевтическую, медицинскую или косметическую композицию, или альтернативно, входит в рецептуру, например, фармацевтической или медицинской композиции или пищевого продукта или напитка или композиции.
В одном варианте, модификаторы хемосенсорного рецептора или модификаторы лиганда хемосенсорного рецептора, представленные в соответствии с данным изобретением, могут применяться в очень низких концентрациях, порядка нескольких частей на миллион, в сочетании с одни или более известными подсластителями, натуральными или искусственными, для того, чтобы снизить концентрацию известного подсластителя, требуемого для получения проглатываемой композиции, имеющей желаемую степень сладости.
Широко применяемые известные или искусственные подсластители для применения в соответствии с данным изобретением включают, но не ограничены ими, обычные сахаридные подсластители, например, сахарозу, фруктозу, глюкозу и композиции подсластителей, включающие природные сахара, такие как кукурузный сироп (включая кукурузный сироп с высоким содержанием глюкозы) или другие сиропы или концентраты подсластителей, полученные из натуральных фруктов и овощей, полусинтетические подсластители на основе "сахарного спирта", такие как эритритол, изомальт, лактит, маннит, сорбит, ксилит, мальтодекстрин и подобные, и искусственные подсластители, такие как аспартам, сахарин, ацесульфам-K, цикламат, сукралоза и алитам. Подсластители также включают цикламинокую кислоту, могрозид, тагатозу, мальтозу, галактозу, маннозу, сахарозу, фруктозу, лактозу, неотам и другие производные аспартама, глюкозу, D-триптофан, глицин, мальтит, лактит, изомальт, гидрированный сироп глюкозы (HGS), гидрированный гидролизат крахмала (HSH), стевиозид, ребаудиозид A и другие сладкие гликозиды на основе стевии, карелам и другие подсластители на основе гуанидина, и т.д. Термин "подсластители" также включает сочетания описанных здесь подсластителей.
Модификаторы хемосенсорного рецептора или модификаторы лиганда хемосенсорного рецептора в соответствии с данным изобретением также могут быть представлены, отдельно или в сочетании, с любой проглатываемой композицией, известной или открытой в будущем. Например, проглатываемая композиция может быть съедобной композицией или не съедобной композицией. Под "съедобной композицией" понимают любую композицию, которая может потребляться как пища человеком или животными, включая твердые вещества, гель, пасту, пенный материал, полутвердые вещества, жидкости или их смеси. Под "не съедобной композицией" понимают, что композиция предназначена для потребления человеком или животным не в качестве пищи, включая твердые вещества, гель, пасту, пенный материал, полутвердые вещества, жидкости или их смеси. Не съедобные композиции включают, но не ограничены ими, медицинские композиции, которые относятся к не съедобным композициям, предназначенным для потребления человеком или животным для терапевтических целей. Под «животным» понимают любое не относящееся к человеку животное, такое как, например, домашний скот и домашние животные.
В одном варианте, модификаторы хемосенсорного рецептора или модификаторы лиганда хемосенсорного рецептора добавляют в не съедобную композицию или не съедобный продукт, такой как пищевая добавка, нутрицевтик, функциональные пищевые продукты (например, любая свежая или обработанная пища, заявленная как способствующая укреплению здоровья и/или предупреждающая болезнь кроме основных питающих функций питательных веществ), фармацевтические и безрецептурные лекарственные средства, продукты по уходу за полостью рта, такие как средства для чистки зубов и ополаскиватели для полости рта, косметические продукты, такие как подслащенные бальзамы для губ и другие продукты личной гигиены, в которых применяется сукралоза или другие подсластители.
В общем, безрецептурные (OTC) продукты и продукты для ухода за полостью рта обычно относятся к продуктам для дома и/или личного пользования, которые могут продаваться без рецепта и/или без визита к профессиональному медику. Примеры OTC продуктов включают, но не ограничены ими, витамины и пищевые добавки; местные обезболивающие средства и/или анестетики; средства для лечения кашля, простуды и аллергии; антигистаминные и/или противоаллергические средства; и их сочетания. Витамины и пищевые добавки включают, но не ограничены ими, витамины, пищевые добавки, тонизирующие/бутилированные питательные напитки, детские витамины, пищевые добавки, любые другие продукты, являющиеся или относящиеся к питанию, и их сочетания. Местные обезболивающие и/или анестезирующие средства включают любые местные кремы/мази/гели, применяемые для облегчения поверхностных или глубоких болей и раздражения, например, мышечной боли; гели при прорезывании зубов; пластыри с обезболивающим ингредиентом; и их сочетания. Средства для облегчения кашля, простуды и аллергии включают, но не ограничены ими, противозастойные средства, средства от кашля, фарингеальные препараты, конфеты, содержащие лекарственное средство, антигистаминные препараты и детские противокашлевые, противопростудные и противоаллергические средства; и комбинированные продукты. Антигистамины и/или противоаллергические средства включают, но не ограничены ими, любые системные препараты для лечения сенной лихорадки, аллергического ринита, укусов насекомых и ужаления насекомыми. Примеры продуктов по уходу за полостью рта включают, но не ограничены ими, полоски для очистки рта, зубную пасту, зубные щетки, ополаскивания для рта/зубов, средства по уходу за зубными протезами, освежители для рта, не профессиональные отбеливатели зубов и зубную нить.
В другом варианте, модификаторы хемосенсорного рецептора и модификаторы лиганда хемосенсорного рецептора добавляют в пищевые продукты или напитки или композиции. Примеры пищевых продуктов и напитков или композиций включают, но не ограничены ими, сладкие оболочки, глазировку или глазурь для съедобных продуктов или любого вещества, включенного в категорию супов, категорию высушенных бакалейных товаров, категорию напитков и категорию готовых блюд, категорию консервированных продуктов, категорию замороженных бакалейных товаров, категорию охлажденных бакалейных товаров, категорию закусок, категорию хлебобулочных изделий, категорию кондитерских изделий, категорию молочных продуктов, категорию мороженого, категорию заменителей пищи, категорию макарон и лапши, и категорию соусов, заправок, приправ, категорию детского питания и/или категорию спредов.
В общем, категория супов относится к баночным/консервированным, дегидратированным, быстрорастворимым, охлажденным, УВТ и замороженным супам. Для целей данного определения, суп(ы) подразумевают пищу, приготовленную из мяса, птицы, рыбы, овощей, зерновых, фруктов и других ингредиентов, сваренную в жидкости, которая может включать видимые куски некоторых или всех этих ингредиентов. Он может быть прозрачным (в виде бульона) или густым (в виде похлебки), однородным, пюреобразным или содержать кусочки, быть готовым к употреблению, полусгущенным или сгущенным, и может подаваться горячим или холодным, в качестве первого блюда или в качестве основного блюда, или в качестве закуски между блюдами (пьется как напиток). Суп может применяться в качестве ингредиента для приготовления других компонентов пищи, и может варьироваться от бульонов (консоме) до соусов (супы на основе сливок или сыра).
"Категория дегидратированной и кулинарной пищи" обычно означает: (i) вспомогательные продукты для приготовления пищи, такие как: порошки, гранулы, пасты, концентрированные жидкие продукты, включая концентрированный бульон, бульон и бульоноподобные продукты в прессованных кубиках, таблетках, порошках или гранулированной форме, которые продают отдельно в качестве готового продукта, или как ингредиент продукта, соусов и рецептурных смесей (независимо от технологии); (ii) пищевые продукты в растворах, такие как: дегидрированные и сублимированные супы, включая дегидрированные суповые смеси, дегидрированные быстрорастворимые супы, дегидрированные готовые супы, дегидрированные или обычные композиции готовых блюд, пищевые продуктов и отдельных закусок, включая блюда из макарон, картофеля и риса; и (iii) продукты для украшения пищи, такие как: приправы, маринады, заправки для салатов, приправы для салатов, соусы для макания, панировка, взбитые белковые смеси для панировки, спреды длительного хранения, соусы барбекю, жидкие рецептурные смеси, концентраты, соусы или соусные смеси, включая рецептурные смеси для салата, продаваемые как готовые продукты или как ингредиенты продукта, дегидрированного, жидкого или замороженного.
Категория напитков обычно включает напитки, смеси для напитков и концентраты, включая, но не ограничиваясь ими, газированные и не газированные напитки, алкогольные и не алкогольные напитки, готовые к употреблению напитки, жидкие концентрированные композиции для приготовления напитков, таких как газированная вода, и сухие порошковые смеси для приготовления напитков. Категория напитков также включает алкогольные напитки, безалкогольные напитки, спортивные напитки, изотонические напитки и горячие напитки. Алкогольные напитки включают, но не ограничены ими, пиво, сидр/пери, FAB, вино и спирты. Безалкогольные напитки включают, но не ограничены ими, газированную воду, такую как газированная вода на основе колы и не на основе колы; фруктовые соки, такие как соки, нектары, сокосодержащие напитки и напитки с фруктовым вкусом; бутилированная вода, включая газированную воду, родниковую воду и очищенную/столовую воду; функциональные напитки, которые могут быть газированы или не газированы, и включают спортивные, энергетические напитки или эликсиры; концентраты, такие как жидкие и порошковые концентраты в готовой к применению дозе. Горячие напитки включают, но не ограничены ими, кофе, такой как свежий, быстрорастворимый и комбинированный кофе; чай, такой как черный, зеленый, белый, оолонг и чай с добавками; и другие горячие напитки, включающие порошки, гранулы, блоки или таблетки на основе вкусовых добавок, солода или растительной основе, смешиваемые с молоком или водой.
Категория закусок обычно включает любой продукт, который может считаться легкой необязательной пищей, включающей, но не ограниченной ими, сладкие и пикантные закуски и батончики. Примеры закусок включают, но не ограничены ими, фруктовые закуски, чипсы/криспы, прессованные закуски, тортильи/кукурузные чипсы, попкорн, крендельки, орехи и другие сладкие и пикантные закуски. Примеры закусочных батончиков включают, но не ограничены ими, зерновые/мюсли батончики, хлебцы для завтрака, энергетические батончики, фруктовые батончики и другие закусочные батончики.
Категория хлебобулочных изделий обычно включает любой съедобный продукт, процесс приготовления которого включает обработку теплом или избыточным солнечным светом. Примеры хлебобулочных изделий включают, но не ограничены ими, хлеб, сдобу, печенье, булочки, изделия из хлебных злаков, хлеб для тостов, кондитерские изделия, вафли, тортильи, бисквиты, пироги, бублики, пирожные, изделия с заварным кремом, торты, любые печенные продукты и любые их сочетания.
Категория мороженого включает замороженные десерты, содержащие сливки, сахар и вкусовую добавку. Примеры мороженого включают, но не ограничены ими: мороженое для потребления на месте; мороженое для потребления дома; замороженный йогурт и мороженое домашнего приготовления; мороженое на основе сои, овса, фасоли (например, красной фасоли и золотистой фасоли) и риса.
Категория кондитерских изделий обычно включает съедобный продукт, который имеет сладкий вкус. Примеры кондитерских изделий включают, но не ограничены ими, карамель, желе, шоколадные конфеты, кондитерские изделия из сахара, жевательную резинку и подобные, и любые комбинированные продукты.
Категория заменителей пищи обычно включает любые продукты питания, предназначенные для замены обычной пищи, особенно для людей, имеющих проблемы со здоровьем или фитнессом. Примеры пищевых заменителей включают, но не ограничены ими, продукты для похудания и продукты, принимаемые в период выздоровления.
Категория готовой пищи включает любые продукты питания, которые могут быть поданы в качестве пищи без значительного приготовления или обработки. Готовая пища включает продукты, которые имеют рецептурную "квалификацию", приданную им производителем, что дает высокую степень готовности, завершенности и удобства. Примеры готовой пищи включают, но не ограничены ими, баночные/консервированные, замороженные, высушенные, охлажденные готовые блюда; обеденные смеси; замороженную пиццу; охлажденную пиццу; и готовые салаты.
Категория макарон или лапши включает любые макароны и/или лапшу включая, но не ограничиваясь ими, баночные, высушенные и охлажденные/свежие макароны; и простую, быстрорастворимую, охлажденную, замороженную и закусочную лапшу.
Категория баночных/консервированных продуктов включает, но не ограничена ими, баночное/консервированное мясо и мясные продукты, рыбу/морепродукты, овощи, томаты, фасоль, фрукты, готовые блюда, суп, пасту и другие баночные/консервированные продукты.
Категория замороженных обработанных продуктов включает, но не ограничена ими, замороженное обработанное красное мясо, обработанную птицу, обработанную рыбу/морепродукты, обработанные овощи, заменители мяса, обработанный картофель, хлебобулочные продукты, десерты, готовые блюда, пиццу, суп, лапшу и другие замороженные продукты.
Категория высушенных обработанных продуктов включает, но не ограничена ими, рис, десертные смеси, высушенные готовые блюда, дегидрированный суп, быстрорастворимый суп, высушенные макароны, обычную лапшу и быстрорастворимую лапшу.
Категория охлажденных обработанных продуктов включает, но не ограничена ими, охлажденное обработанное мясо, обработанные продукты из рыбы/морепродуктов, ланчи, свежие резанные фрукты, готовые блюда, пиццу, готовые салаты, суп, свежие макароны и лапшу.
Категория соусов, заправок и приправ включает, но не ограничена ими, томатные пасты и пюре, бульонные кубики, травы и специи, глутамат натрия (MSG), столовые соусы, соусы на основе сои, соусы к макаронам, соусы для влажного жарения, сухие порошковые смеси для соусов, кетчуп, майонез, горчицу, заправки для салата, винегрета, смеси для макания, соленья и другие соусы, заправки и специи.
Категория детского питания включает, но не ограничена ими, композиции на основе молока или сои; и приготовленное, высушенное и другое детское питание.
Категория спредов включает, но не ограничена ими, джемы и пресервы, мед, шоколадные спреды, спреды на основе орехов и спреды на основе дрожжей.
Категория молочных продуктов обычно относится к съедобным продуктам, полученным из молока млекопитающего. Примеры молочных продуктов включают, но не ограничены ими, продукты из питьевого молока, сыр, йогурт и кисломолочные напитки, и другие молочные продукты.
Дополнительные примеры для съедобных композиций, особенно пищевых продуктов или напитков, или композиций представлены далее. Примеры съедобных композиций включают одну или более из кондитерских изделий, шоколадных кондитерских изделий, таблеток, плиток, конфет, упакованных в пакеты небольшого объема, ассорти в коробках, стандартные ассорти в коробках, миниатюры, завернутые вперекрутку, сезонный шоколад, шоколад с игрушками, сладкие пирожки, другие шоколадные конфеты, леденцы, стандартные леденцы, энергетические леденцы, леденцовую карамель, пастилу, жевательную резинку, мармелад и жевательный мармелад, ирис, карамель и нугу, лекарственные конфеты, леденцы на палочке, лакричные конфеты, другие конфеты на основе сахара, жевательную резинку, жевательную резинку с сахаром, жевательную резинку без сахара, функциональную жевательную резинку, надувную жевательную резинку, хлеб, упакованный промышленный хлеб, неупакованный хлеб домашней выпечки, мучные кондитерские изделия, упакованные промышленные торты, неупакованные домашние торты, печенье, печенье в шоколадной глазури, слоеное печенье, острые печенья и крекеры, заменители хлеба, печенье с начинкой, хлопья для завтрака, готовые хлопья, семейные хлопья для завтрака, хлопья, мюсли, детские хлопья для завтрака, горячие хлопья, мороженое, развесное мороженое, порционное молочное мороженое, порционной водное мороженое, мультипорционное молочное мороженое, мультипорционное водное мороженое, упакованное мороженое, упакованное молочное мороженое, десерты на основе мороженого, мороженое на дом, молочное мороженое на дом, десерты из мороженого, мягкое мороженое, водное мороженое на дом, замороженный йогурт, мороженое домашнего приготовления, молочные продукты, молоко, свежее/пастеризованное молоко, цельное свежее/пастеризованное молоко, полуснятое свежее/пастеризованное молоко, молоко длительного хранения/УВТ, цельное молоко длительного хранения/УВТ, полуснятое молоко длительного хранения/УВТ, обезжиренное молоко длительного хранения/УВТ, козье молоко, сгущенное/выпаренное молоко, обычное сгущенное/выпаренное молоко, ароматизированное, функциональное и другое сгущенное молоко, ароматизированные молочные напитки, ароматизированные молочные напитки на чистом молоке, ароматизированные молочные напитки с фруктовым соком, соевое молоко, кисломолочные напитки, ферментированные молочные напитки, сливки для кофе, порошковое молоко, ароматизированные напитки из порошкового молока, сливки, сыр, плавленый сыр, пастообразный плавленый сыр, не пастообразный плавленый сыр, не плавленый сыр, пастообразный не плавленый сыр, твердый сыр, упакованный твердый сыр, неупакованный твердый сыр, йогурт, обычный/натуральный йогурт, ароматизированный йогурт, фруктовый йогурт, йогурт с пробиотиком, питьевой йогурт, обычный питьевой йогурт, питьевой йогурт с пробиотиком, охлажденные десерты длительного хранения, десерты на основе молока, десерты на основе сои, охлажденные закуски, мягкий сыр низкой жирности и творог, обычный мягкий сыр низкой жирности и творог, ароматизированный мягкий сыр низкой жирности и творог, острый мягкий сыр низкой жирности и творог, сладкие и острые закуски, фруктовые закуски, чипсы/криспы, прессованные закуски, тортилья/кукурузные чипсы, попкорн, крендельки, орехи, другие сладкие и острые закуски, батончики, мюсли батончики, батончики для завтрака, энергетические батончики, фруктовые батончики, другие батончики, продукты, заменяющие пищу, продукты для похудения, напитки, применяемые во время выздоровления, готовые блюда, баночные готовые блюда, замороженные готовые блюда, высушенные готовые блюда, охлажденные готовые блюда, обеденные смеси, замороженная пицца, охлажденная пицца, суп, баночный суп, дегидрированный суп, быстрорастворимый суп, охлажденный суп, горячий суп, замороженный суп, макароны, баночные макароны, высушенные макароны, охлажденные/свежие макароны, лапша, обычная лапша, быстрорастворимая лапша, быстрорастворимая лапша в стаканчиках, быстрорастворимая лапша в пакетах, охлажденная лапша, закусочная лапша, баночная лапша, баночная пища, баночное мясо и мясные продукты, баночная рыба/морепродукты, баночные овощи, баночные томаты, баночная фасоль, баночные фрукты, баночные готовые блюда, баночный суп, баночные макароны, другие баночные продукты, замороженные продукты, замороженное обработанное красное мясо, замороженная обработанная птица, замороженная обработанная рыба/морепродукты, замороженные обработанные овощи, замороженные заменители мяса, замороженный картофель, печеные картофельные чипсы, отличные от печеных картофельные продукты, не печеный замороженный картофель, замороженные хлебобулочные изделия, замороженные десерты, замороженные готовые блюда, замороженная пицца, замороженный суп, замороженная лапша, другая замороженная пища, высушенная пища, десертные смеси, высушенные готовые блюда, дегидрированный суп, быстрорастворимый суп, высушенные макароны, обычная лапша, быстрорастворимая лапша в стаканах, быстрорастворимая лапша в пакетах, охлажденная пища, охлажденное обработанное мясо, охлажденная рыба/морепродукты, охлажденная обработанная рыба, охлажденная рыба в оболочке, замороженная копченая рыба, охлажденный набор для ланча, охлажденные готовые блюда, охлажденная пицца, охлажденный суп, охлажденные/свежие макароны, охлажденная лапша, масла и жиры, оливковое масло, растительное масло и масло из семян, кулинарные жиры, масло, маргарин, мягкие масла и жиры, функциональные мягкие масла и жиры, соусы, заправки и приправы, томатные пасты и пюре, бульонные кубики, гранулированные соусы, жидкие продукты и запасы, травы и специи, ферментированные соусы, соусы на основе сои, соусы к макаронам, влажные соусы, сухие порошковые смеси для соусов, кетчуп, майонез, обычный майонез, горчица, заправки для салата, обычные заправки для салата, заправки для салата с низким содержанием жира, винегрета, соус для обмакивания, засола, другие соусы, заправки и приправы, детское питание, молочная смесь, стандартная молочная смесь, улучшенная молочная смесь, молочная смесь, для детей ясельного возраста, гипоаллергенная молочная смесь, готовое детское питание, высушенное детское питание, другое детское питание, спреды, джемы и пресервы, мед, шоколадные спреды, ореховые спреды и спреды на основе дрожжей. Примеры съедобных композиций также включают кондитерские изделия, хлебобулочные продукты, мороженое, молочные продукты, сладкие и острые закуски, закусочные батончики, заменяющие мясо продукты, готовые блюда, супы, макароны, лапшу, баночные продукты, замороженные продукты, высушенные продукты, охлажденные продукты, масла и жиры, детское питание или спреды и их смеси. Примеры съедобных композиций также включают хлопья для завтрака, сладкие напитки или твердые или жидкие концентраты для получения напитков, в идеале такие, чтобы было возможно снизить концентрацию известных ранее сахаридных подсластителей или искусственных подсластителей.
Обычно, по крайней мере, количество, модулирующее хемосенсорный рецептор, количество, модулирующее лиганд хемосенсорного рецептора, количество, модулирующее сладкий вкус, количество ароматизирующего сладкого агента или количество, улучшающее сладкий вкус одного или более модификаторов хемосенсорного рецептора или модификаторов лиганда хемосенсорного рецептора в соответствии с данным изобретением добавляют в съедобную или медицинскую композицию, необязательно в присутствии известных подсластителей, например, так, чтобы съедобный или медицинский продукт с модифицированным сладким вкусом имел усиленный сладкий вкус по сравнению со съедобным или медицинским продуктом, полученным без модификаторов в соответствии с данным изобретением, по определению человеком или животными в целом, или в случае тестирования композиций, по определению основной частью панели из, по крайней мере, восьми человек, производящих тестирование вкуса, с применением методик, хорошо известных в данной области техники.
Концентрация сладкой вкусовой добавки, необходимой для модулирования или улучшения вкуса съедобного или медицинского продукта, или композиции зависит от множества факторов, включая тип съедобной композиции и ее различные другие ингредиенты, особенно присутствие других известных сладких вкусовых добавок и их концентраций, природную генетическую изменчивость и индивидуальные предпочтения и состояние здоровья разных людей, тестирующих композиции, и субъективное действие конкретного соединения на вкус таких хемосенсорных соединений.
Одна из областей применения модификаторов хемосенсорного рецептора и/или модификаторов лиганда хемосенсорного рецептора включает модулирование (включая улучшение или ингибирование) сладкого вкуса или других вкусовых свойств других природных или синтетических сладких кристаллов Tastant, и полученных из них съедобных композиций. Обычно требуется широкий, но также низкий спектр концентраций соединений или веществ в соответствии с данным изобретением, например, от около 0,001 ч./млн до 100 ч./млн, или более узкие альтернативные интервалы от около 0,1 ч./млн до около 10 ч./млн, от около 0,01 ч./млн до около 30 ч./млн, от около 0,05 ч./млн до около 10 ч./млн, от около 0,01 ч./млн до около 5 ч./млн, или от около 0,02 ч./млн до около 2 ч./млн или от около 0,01 ч./млн до около 1 ч./млн.
В еще одном варианте, модификатор хемосенсорного рецептора и модификатор лиганда хемосенсорного рецептора в соответствии с данным изобретением может содержаться в фармацевтических композициях, содержащих терапевтически эффективное количество одного или более соединений в соответствии с данным изобретением, предпочтительно в очищенной форме, вместе с подходящим количеством фармацевтически приемлемого носителя, так, чтобы получить форму для подходящего введения пациенту.
При введении пациенту, соединения в соответствии с данным изобретением и фармацевтически приемлемые носители, предпочтительно, являются стерильными. Вода является предпочтительным носителем, если соединение в соответствии с данным изобретением вводиться внутривенно. Физиологические растворы и водные растворы декстрозы и глицерина также могут применяться в качестве жидких носителей, особенно для растворов для инъекций. Подходящие фармацевтические носители также включают наполнители, такие как крахмал, глюкоза, лактоза, сахароза, желатин, солод, рис, мука, мел, силикагель, стеарат натрия, глицеринмоностеарат, тальк, хлорид натрия, сухое снятое молоко, глицерин, пропилен, гликоль, вода, этанол и подобные. Фармацевтические композиции в соответствии с данным изобретением, при желании, также могут содержать незначительное количество смачивающего или эмульгирующего агентов, или pH буферных агентов. Кроме того, могут применяться вспомогательные, стабилизирующие, загущающие, смазывающие и красящие агенты.
Фармацевтические композиции, содержащие соединение в соответствии с данным изобретением, могут быть произведены с применением обычных методов смешивания, растворения, гранулирования, дражирования, отмучивания, эмульгирования, инкапсулирования, захвата или лиофилизации. Фармацевтические композиции могут быть составлены обычным методом, с применением одного или более физиологически приемлемых носителей, разбавителей, наполнителей или вспомогательных агентов, которые способствуют обработке соединений в соответствии с данным изобретением в препараты, которые могут применяться фармацевтически. Подходящая композиция зависит от выбранного способа введения.
Фармацевтические композиции в соответствии с данным изобретением могут принимать форму растворов, суспензий, эмульсии, таблеток, пилюль, гранул, капсул, капсул заполненных жидкостью, порошков, композиций отложенного выделения, суппозиториев, эмульсий, аэрозолей, спреев, суспензий, или любых других форм, подходящих для применения. В некоторых вариантах, фармацевтические приемлемым носителем является капсула (см. например, Grosswald et al., патент США № 5698155). Другие примеры подходящих фармацевтических носителей описаны в данной области техники (см. Remington: The Science and Practice of Pharmacy, Philadelphia College of Pharmacy and Science, 20th Edition, 2000).
Для местного введения соединение в соответствии с данным изобретением может быть составлено в виде растворов, гелей, мазей, кремов, суспензий и т.д., которые также хорошо известны в данной области техники.
Системные композиции включают такие, которые разработаны для введения инъекцией, например, подкожно, внутривенно, внутримышечно, интратекально или внутрибрюшинно, а также такие, которые предназначены для введения чрезкожно, через слизистую, перорально или в легкие. Системные композиции могут быть получены в сочетании с другим активным ингредиентом, который улучшает очищение реснитчатого эпителия слизистой дыхательных путей или снижает вязкость слизи. Эти активные ингредиенты включают, но не ограничены ими, блокаторы натриевых каналов, антибиотики, N-ацетилцистеин, гомоцистеин и фосфолипиды.
В некоторых вариантах соединения в соответствии с данным изобретением составлены в соответствии с рутинными методиками в виде фармацевтических композиций, адаптированных для внутривенного введения человеку. Обычно соединения в соответствии с данным изобретением для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. Для инъекций, соединение в соответствии с данным изобретением может быть составлено в водных растворах, предпочтительно, в физиологически совместимых буферах, таких как раствор Хэнка, раствор Рингера или физиологический раствор. Раствор может содержать композиционные агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. При необходимости, фармацевтические композиции могут включать солюбилизирующий агент.
Фармацевтические композиции для внутривенного введения могут необязательно содержать местные анестетики, такие как лигнокаин, для облегчения боли в месте инъекции. Обычно, ингредиенты вводят либо отдельно, либо смешанными вместе в стандартной лекарственной форме, например, в виде лиофилизированного порошка или безводного концентрата в герметично закрытом контейнере, таком как ампула или саше, показывающем количество активного агента. Если соединение в соответствии с данным изобретением вводят в виде вливания, оно может быть диспергировано, например, в бутыли для вливания, содержащей стерильную фармацевтическую воду или физиологический раствор. Если соединение в соответствии с данным изобретением вводят инъекцией, ампула со стерильной водой для инъекций или физиологическим раствором может поставляться так, чтобы ингредиенты могли быть смешаны до введения.
Для введения через слизистую в композиции применяют пенетранты, подходящие для преодоления барьера, такие пенетранты обычно известны в данной области техники.
Фармацевтические композиции для перорального введения могут быть в виде таблеток, пастилок, водных или масляных суспензий, гранул, порошков, эмульсий, капсул, сиропов или эликсиров, например. Пероральные фармацевтические композиции могут содержать один или более дополнительные агенты, например, подсластители, такие как фруктоза, аспартам или сахарин; ароматизаторы, такие как перечная мята, масло зимолюбки или красители типа «вишня» и консерванты, для получения фармацевтически приятных композиций.
Более того, если они имеют форму таблетки или пилюли, фармацевтические композиции могут иметь оболочки для задерживания разложения и абсорбции в желудочно-кишечном тракте, тем самым замедленное действие в течение длительного периода времени. Селективно проницаемые мембраны, окружающие осмотически активное ведущее соединение, также подходят для перорально вводимых соединений в соответствии с данным изобретением. В таких последних платформах, жидкость из среды, окружающей капсулу, впитывается ведущим соединением, которое разбухает до выдавлиания агента или композиции агента через отверстие. Такие ведущие платформы могут обеспечивать профиль доставки практически нулевого порядка, в отличие от пиковых профилей композиций с немедленным выделением. Также может применяться замедляющий материал, такой как глицеринмоностеарат или глицеринстеарат. Пероральные композиции могут включать стандартные носители, такие как маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлозу, карбонат магния и т.д. Такие носители предпочтительно имеют фармацевтическую степень чистоты.
Для пероральных жидких композиций, таких как, например, суспензии, эликсиры и растворы, подходящие носители, наполнители или разбавители включают воду, физиологический раствор, алкиленгликоли (например, пропиленгликоль), полиалкиленгликоли (например, полиэтиленгликоль), масла, спирты, слегка кислые буферы с pH 4 и pH 6 (например, ацетат, цитрат, аскорбат при от около 5,0 мМ до около 50,0 мМ) и т.д. Дополнительно, могут быть добавлены ароматизаторы, консерванты, красители, соли желчных кислот, ацилкарнитины и подобные.
Для буккального введения фармацевтические композиции могут иметь форму таблеток, пастилок и т.д., составленных обычными методами.
Жидкие лекарственные композиции, подходящие для применения с небулайзерами и устройствами для распыления жидкостей и EHD аэрозольными устройствами обычно включают соединение в соответствии с данным изобретением с фармацевтически приемлемым носителем. Предпочтительно, фармацевтически приемлемым носителем является жидкость, такая как спирт, вода, полиэтиленгликоль или перфторуглерод. Необязательно, другой материал может быть добавлен для изменения аэрозольных свойств раствора или суспензии соединений в соответствии с данным изобретением. Предпочтительно, этот материал является жидкостью, такой как спирт, гликоль, полигликоль или жирная кислота. Другие методы получения жидких лекарственных растворов или суспензий, подходящих для применения в аэрозольных устройствах, известны специалистам в данной области техники (см., например, Biesalski, патент США № 5112598; Biesalski, патенте США № 5556611).
Соединение в соответствии с данным изобретением также может быть составлено в виде ректальной или вагинальной фармацевтической композиции, такой как суппозитории или удерживающие клизмы, например, содержащие обычные основы для суппозиториев, такие как масло какао или другие глицериды.
В дополнение к композициям, описанным ранее, соединение в соответствии с данным изобретением также может быть составлено в виде депо препаратов. Такие долгодействующие композиции могут вводиться имплантацией (например, подкожно или внутримышечно) или внутримышечной инъекцией. Таким образом, соединение в соответствии с данным изобретением может быть составлено с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами, или в виде умеренно растворимых производных, например, в виде умеренно растворимой соли.
Если соединение в соответствии с данным изобретением является кислым, оно может быть включено в любую из описанных выше композиций в виде свободной кислоты, фармацевтически приемлемое соли, сольвата или гидрата. Фармацевтически приемлемые соли, практически сохраняющие активность свободной кислоты, могут быть получены взаимодействием с основаниями и являются более растворимыми в водным и других протонных растворителях, чем соответствующие свободные кислоты.
Соединение в соответствии с данным изобретением и/или содержащая его фармацевтическая композиция обычно применяется в количестве, эффективном для достижения поставленной цели. При применении для лечения или профилактики соединений в соответствии с данным изобретением и/или содержащих их фармацевтических композиций вводят или наносят в терапевтически эффективном количестве.
Количество соединения в соответствии с данным изобретением, которое будет эффективно для лечения конкретного расстройства или состояния, описанного здесь, зависит от природы расстройства или состояния и может быть определено стандартными клиническими методами, известными в данной области техники. В дополнение, in vitro или in vivo анализы могут необязательно применяться для того, чтобы идентифицировать оптимальную дозировку. Вводимое количество соединения в соответствии с данным изобретением, конечно, зависит от, среди прочего, лечимого пациента, массы тела пациента, тяжести состояния, способа введения и мнения прописывающего терапевта.
Например, доза может быть введена в фармацевтической композиции за один раз, за несколько раз или с контролируемым выделением. В одном варианте, соединения в соответствии с данным изобретением вводят перорально в форме с замедленным выделением. Дозирование может повторяться периодически, может проводиться в чистом виде ли в сочетании с другими лекарственными средствами и может продолжаться настолько долго, сколько требуется для эффективного лечения болезненного состояния или расстройства.
Подходящие дозировки для перорального введения зависит от мощности, но обычно составляет от около 0,001 мг до около 200 мг соединения в соответствии с данным изобретением на килограмм массы тела. Дозировка может быть легко определена методами, известными специалисту в данной области техники.
Подходящие дозы для внутривенного (в.в.) введения составляют от около 0,01 мг до около 100 мг на килограмм массы тела. Подходящая дозировка для интраназального введения составляет обычно от около 0,01 мг/кг массы тела до около 1 мг/кг массы тела. Суппозитории обычно содержат от около 0,01 миллиграмма до около 50 миллиграммов соединения в соответствии с данным изобретением на килограмм массы тела, и содержат активный ингредиент в количестве от около 0,5% до около 10% массовых. Рекомендованные дозы для чрезкожных, внутримышечных, внутрибрюшинных, подкожных, эпидуральных, подъязычных или интрацеребральных введений составляют от около 0,001 мг до около 200 мг на килограмм массы тела. Эффективная доза может быть экстраполирована из кривых «доза-эффект», полученных на системах тестирования in vitro или на животных моделях. Такие животные модели и системы хорошо известны в данной области техники.
Предпочтительно, терапевтически эффективная доза соединения в соответствии с данным изобретением, описанного здесь, оказывает терапевтическую пользу без значительной токсичности. Токсичность соединений в соответствии с данным изобретением может быть определена с применением стандартных фармацевтических методов и может быть легко оценена специалистом в данной области техники. Доза между токсическим и терапевтическим эффектом называется терапевтический индекс. Соединение в соответствии с данным изобретением предпочтительно демонстрируют особенно высокие терапевтические индексы при лечении заболеваний и расстройств. Доза соединения в соответствии с данным изобретением, описанная здесь, предпочтительно попадает в интервал распространенных концентраций, которые включают эффективную дозу с незначительной токсичностью или отсутствием токсичности.
В определенных вариантах данного изобретения соединения в соответствии с данным изобретением и/или их фармацевтические композиции могут применяться в комбинированной терапии с, по крайней мере, одним другим агентом. Соединение в соответствии с данным изобретением и/или его фармацевтическая композиция может действовать аддитивно или, более предпочтительно, синергетически. В некоторых вариантах соединение в соответствии с данным изобретением и/или его фармацевтическую композицию вводят одновременно с введением другого агента, который может быть частью той же фармацевтической композиции, которая содержит соединение в соответствии с данным изобретением, или может быть в другой фармацевтической композиции. В других вариантах, фармацевтическую композицию в соответствии с данным изобретением вводят до или после введения другого агента.
В еще одном варианте, модификаторы хемосенсорного рецептора и модификаторы лиганда хемосенсорного рецептора в соответствии с данным изобретением и/или содержащие их фармацевтические композиции преимущественно могут применяться в медицине.
При применении для лечения и/или профилактики заболеваний или расстройств, описанные здесь соединения и/или фармацевтические композиции могут вводиться или наноситься отдельно или в сочетании с другими агентами. Соединения и/или содержащие их фармацевтические композиции также могут вводиться или наноситься отдельно, в сочетании с другими активными агентами.
Способы лечения или профилактики введением пациенту терапевтически эффективного количества описанного здесь соединения и/или содержащей его фармацевтической композиции представлены здесь. Пациентом может быть животное, более предпочтительно, млекопитающее, и наиболее предпочтительно, человек.
В одном примере, описанные здесь соединения и/или содержащие их фармацевтические композиции вводят перорально. Соединения и/или содержащие их фармацевтические композиции также могут вводиться любым другим удобным путем, например, инфузией или инъекцией болюса, абсорбцией через эпителиальные или кожно-слизистые выстилки (например, слизистую ротовой полости, слизистую прямой кишки и кишечника, и т.д.). Введение может быть системным или местным. Известны различные системы доставки (например, инкапсулирование в липосомы, микрочастицы, капсулы, и т.д.), которые могут применяться для введения соединения, описанного здесь, и/или содержащей его фармацевтической композиции. Способы введения включают, но не ограничены ими, внутрикожное, внутримышечное, внутрибрюшинное, внутривенное, подкожное, интраназальное, эпидуральное, пероральное, подъязычное, интраназальное, интрацеребральное, интравагинальное, чрезкожное, ректальное, через игаляции или местное, особенно в уши, нос, глаза и на кожу. Предпочтительный способ введения остается в компетенции практикующего врача и зависит, частично, от места возникновения медицинского состояния. В большинстве случаев, введенные вызывает выделение соединений и/или содержащих их фармацевтических композиций в кровоток.
В другом примере, может быть желательно, вводить одно или более соединений в соответствии с данным изобретением и/или их фармацевтической композиции местно в область, нуждающуюся в лечении. Это может быть достигнуто, например, и без ограничений, местным вливанием во время хирургического вмешательства, местным нанесением, например, в сочетании с повязкой на рану после хирургического вмешательства, инъекцией с применением катетера, с помощью суппозитория, или с помощью импланта, где такой имплант является пористым, не пористым или гелеобразным материалом, включая мембраны, такие как сиаластовые мембраны или волокна. В одном варианте, введение может осуществляться прямой инъекцией в место (или бывшее место) состояния.
В еще одном примере, может быть желательно, вводить одно или более соединений в соответствии с данным изобретением и/или содержащих их фармацевтических композиций в центральную нервную систему любым подходящим путем, включая интравентрикулярные, интратекальные и эпидуральные инъекции. Интравентрикулярная инъекция может быть проведена с помощью интравентрикулярного катетера, например, присоединенного к резервуару, такому как резервуар Оммайя.
Соединения в соответствии с данным изобретением и/или содержащие их фармацевтические композиции также могут вводиться непосредственно в легкие ингаляцией. Для введения ингаляцией соединения в соответствии с данным изобретением и/или содержащие их фармацевтические композиции могут быть удобным образом доставляться в легкие с применением множества различных устройств. Например, дозирующий ингалятор ("MDI"), в котором применяются канистры, содержащие подходящий низкокипящий газ-вытеснитель (например, дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, двуокись углерода или любой другой подходящий газ) может применяться для введения соединений в соответствии с данным изобретением и/или содержащих их фармацевтических композиций непосредственно в легкие.
Альтернативно, порошковый ингалятор ("DPI") может применяться для введения соединений в соответствии с данным изобретением и/или содержащих их фармацевтических композиций в легкие. В DPI обычно применяется механизм, такой как выброс газа для получения облака сухого порошка в контейнере, который затем может вдыхаться пациентом. DPI также хорошо известны в данной области техники. Популярным вариантом является многодозный DPI ("MDDPI"), который позволяет вводить более одной терапевтической дозы. Например, капсулы и картриджи из желатина, которые могут применяться в ингаляторе или инсуффляторе, могут быть составлены с порошковой смесью соединения в соответствии с данным изобретением и подходящей порошковой базой, такой как лактоза или крахмал для подобных систем.
Другим устройством, которое может применяться для доставки соединений в соответствии с данным изобретением и/или содержащих их фармацевтических композиций в легкие является устройство для распыления жидкости, поставляемое, например, Aradigm Corporation, Hayward, CA. В системах для распыления жидкостей применяют очень маленькие отверстия для аэрозолизации жидких лекарственных композиций, которые затем могут быть ингалированы непосредственно в легкие.
В еще одном примере небулайзер применяют для доставки соединений в соответствии с данным изобретением и/или содержащих их фармацевтических композиций в легкие. Небулайзеры могут создавать аэрозоли из жидких лекарственных композиций с помощью, например, ультразвуковой энергии, с получением тонких частиц, которые могут легко ингалированы (см. например, Verschoyle et al., British J. Cancer, 1999, 80, Suppl. 2, 96). Примеры небулайзеров включают устройства, поставляемые Sheffield Pharmaceuticals, Inc (см., Armer et al., патент США № 5954047; van der Linden et al., патент США № 5950619; van der Linden et al., патент США № 5970974) и Batelle Pulmonary Therapeutics, Columbus, OH.
В еще одном примере, электродинамическое ("EHD") аэрозольное устройство применяют для доставки соединений в соответствии с данным изобретением и/или содержащих их фармацевтических композиций в легкие. В EHD аэрозольных устройствах применяют электрическую энергию для аэрозолизации жидких лекарственных растворов или суспензий (см. например, Noakes et al., патент США № 4765539). Электрохимические свойства композиции могут быть важными параметрами для оптимизации доставки соединений в соответствии с данным изобретением и/или содержащих их фармацевтических композиций в легкие с помощью EHD аэрозольного устройства, и такая оптимизация обычно проводится специалистом в данной области техники. EHD аэрозольные устройства могут более успешно доставлять соединения в легкие, по сравнению с другими методами доставки в легкие.
В еще одном варианте соединения в соответствии с данным изобретением и/или содержащие их фармацевтические композиции могут доставляться в везикуле, в частности, липосоме (Langer, 1990, Science 249:1527-1533; Treat et al., в "Liposomes in the Therapy of Infectious Disease and Cancer," Lopez-Berestein and Fidler (eds.), Liss, New York, pp. 353-365 (1989); см. в основном, "Liposomes in the Therapy of Infectious Disease and Cancer," Lopez-Berestein and Fidler (eds.), Liss, New York, pp.353-365 (1989)).
В еще одном варианте, соединения в соответствии с данным изобретением и/или содержащие их фармацевтические композиции могут доставляться через системы замедленной доставки, предпочтительно, пероральные системы замедленной доставки. В одном из вариантов настоящего изобретения может использоваться насос. (См., Langer, supra, Sefton, 1987, CRC Crit. Ref. BiomedEng. 14:201; Saudek et al., 1989, N. Engl. J Med. 321:574).
В еще одном примере, может применяться полимерный материал (см. "Medical Applications of Controlled Release," Langer and Wise (eds.), CRC Pres., Boca Raton, Florida (1974); "Controlled Drug Bioavailability," Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Langer et al., 1983, J Macromol. ScL Rev. Macromol Chem. 23:61; см. также Levy et al., 1985, Science 228: 190; During et al., 1989, Ann. Neurol. 25:351; Howard et al., 1989, J. Neurosurg. 71:105).
В других вариантах, полимерные материалы применяют для пероральных форм с замедленным выделением. Предпочтительные полимеры включают карбоксиметилцеллюлозу натрия, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и гидроксиэтилцеллюлозу (наиболее предпочтительно, гидроксипропилметилцеллюлозу). Другие предпочтительные простые эфиры целлюлозы описаны у (Alderman, Int. J. Pharm. Tech. & Prod. Mfr., 1984, 5(3) 1-9). Факторы, влияющие на выделения лекарства, известны специалистам в данной области техники и описаны в известном уровне техники (Bamba et al., Int. J. Pharm., 1979, 2, 307).
В еще одном примере, покрытые энтеросолюбильной оболочкой могут применяться для пероральных композиций с замедленным выделением. Предпочтительные покрытия включают полимеры с pH-зависимой растворимостью (т.е. pH-контрольное выделение), полимеры с небольшой или рН-зависимой скоростью набухания, растворения или эрозии (например, контролируемое по времени выделение) полимеры, которые разлагаются под действием ферментов (т.е. выделение, контролируемое ферментами), и полимеры, которые образуют тонкий слой при повышении давления (т.е. выделение, контролируемое давлением).
В еще одном примере, осмотические системы доставки применяют для введения пероральных форм с замедленным выделением (Verma et al., Drug Dev. Ind. Pharm., 2000, 26:695-708). В еще одном варианте, OROS™ осмотические устройство применяют в качестве устройства для введения пероральных устройств с замедленным выделением (Theeuwes et al., патент США № 3845770; Theeuwes et al., патент США № 3916899).
В еще одном примере, система с контролируемым выделением может быть помещена рядом с целью соединений и/или содержащих их фармацевтических композиций в соответствии с данным изобретением, что дает возможность применять только часть системной дозы (См., например, Goodson, in "Medical Applications of Controlled Release," supra, vol. 2, pp. 115-138 (1984). Другие системы с контролируемым выделением обсуждаются в Langer, 1990, Science 249:1527-1533 могут также применяться.
Выше представлено общее описание изобретения, оно же будет легко понятно с учетом представленных ниже примеров, которые представлены только для иллюстрации и не являются ограничивающими. Понятно, что различные модификации и изменения могут быть сделаны с представленными здесь примерными вариантами, не выходя за суть и объем данного изобретения.
ПРИМЕРЫ
ЭКСПЕРИМЕНТ 1: Моделирование и идентификация потенциального улучшителя лиганда хемосенсорного рецептора
Общая методика
Общие методики идентификации потенциального улучшителя лиганда хемосенсорного рецептора суммированы далее.
1. Конструирование модели структуры домена венериной мухоловки T1R2
2. Стыковка лиганда хемосенсорного рецептора, например, подсластителя, с активным сайтом структуры домена венериной мухоловки T1R2, с или без присутствия T1R3
3. Стыковка улучшителя лиганда хемосенсорного рецептора, например, сладкого улучшителя, с активным сайтом в присутствии лиганда хемосенсорного рецептора, например, подсластителя.
4. Выбор улучшителя лиганда хемосенсорного рецептора, например, кандидата на сладкие улучшители, на основе двух критериев: a) он подходит к активному сайту модели и b) он образует продуктивные взаимодействия с доменом венериной мухоловки T1R2 и с лигандом хемосенсорного рецептора, например, подсластителем. Взаимодействия могут быть вандерваальсовы, запасы гидрофобных атомов или атомных групп, водородные связи, стэкинг-взаимодействия кольца или электростатические взаимодействия с соляным мостиком. Ключевые остатки для таких взаимодействий включают шарнирные остатки, ближайший активный сайт, клешнеобразные остатки, например, взаимодействующие остатки, описанные в данном изобретении. Кандидаты не ограничены полным соответствием с активным сайтом, так как они открыты и улучшитель лиганда хемосенсорного рецептора может выходить за активный сайт настолько, насколько они частично проникают в него.
Модель структуры
Модель структуры домена венериной мухоловки T1R2 может быть взята из кристаллической структуры T1R2 или T1R2 в комплексе с T1R3. Домены могут быть в открытой или закрытой форме, и могут быть или не быть APO или содержать лиганд. Альтернативно, модель структуры домена венериной мухоловки T1R2 может быть построена с применением стандартных методов гомологичного моделирования с применением структур доступных доменов венериной мухоловки, таких как домены венериной мухоловки рецептора mGluR, в качестве шаблонов для построения модели.
Примером методики для построения такой модели является применение коммерческого программного обеспечения Homology или Modeller от Accelrys Corporation, которые хорошо описаны в литературе и коммерчески доступны. Альтернативные конформации модели также могут быть исследованы с применением дополнительных молекулярных механических методик, которые могут включать, но не ограничены ими, анализ нормальных колебаний для исследования относительного движения долей модели, методики создания петли для получения альтернативных конформаций петель в модели, или моделирование методом Монте Карло и/или молекулярно-динамическое моделирование.
Стыковка
Лиганд хемосенсорного рецептора, например, подсластитель, сначала стыкуют с активным сайтом T1R2. Его смоделированное положение в активном сайте выбирают по способности формировать вандерваальсовы связи, стэкинг-взаимодействия кольца, водородные связи и/или взаимодействия с соляным мостиком с взаимодействующими остатками в активном сайте домена венериной мухоловки T1R2.
Кандидат в модификаторы хемосенсорного рецептора, например, улучшитель сладкого затем может быть состыкован с активным сайтом в присутствии лиганда, например, подсластителя, описанного в предыдущем параграфе. Его активное положение и его кандидатство в качестве потенциального модификатора лиганда хемосенсорного рецептора, например сладкого улучшителя, основано на его способности образовывать продуктивные взаимодействия в виде вандерваальсовы связи, стэкинг-взаимодействия кольца, водородные связи и/или взаимодействия с соляным мостиком с взаимодействующими остатками, описанными в соответствии с данным изобретением, с дополнительными остатками домена T1R2, и, необязательно, с лигандом хемосенсорного рецептора, например, подсластителем в активном сайте, как описано выше.
Кандидат в модификаторы лиганда хемосенсорного рецептора
Молекула считается кандидатом, если она может быть состыкована с активным сайтом в присутствии лиганда хемосенсорного рецептора, например, подсластителя, с получением продуктивных взаимодействий с взаимодействующими остатками, описанными в соответствии с данным изобретением. Определены два пространства в активном сайте: первое пространство, занятое лигандом хемосенсорного рецептора, например, подсластителем, и второе пространство, занятое модификатором лиганда хемосенсорного рецептора, например, улучшителем. Результаты моделирования и мутагенеза дает установленные ключевые остатки, которые, вероятно, выстраивают эти пространства для лиганда хемосенсорного рецептора, например, подсластителей и модификатора лиганда хемосенсорного рецептора, например, сладких улучшителей. В контексте нашего исследования, «остаток, выравнивающий пространство» означает, что остаток имеет атомы основной цепи и/или боковой цепи, которые расположены так, что они потенциально могут взаимодействовать с атомами лиганда хемосенсорного рецептора, например, подсластителя (пространство #1) и/или модификатора лиганда хемосенсорного рецептора, например, сладкого улучшителя (пространство #2). Хотя сам лиганд хемосенсорного рецептора, например, подсластитель и модификатор лиганда хемосенсорного рецептора, например, сладкий улучшитель не могут занимать одно и тоже пространство, их соответствующие пространства могут накладываться друг на друга благодаря способности остатков контактировать с обоими, лигандом хемосенсорного рецептора, например, подсластителем и модификатором лиганда хемосенсорного рецептора, например, сладким улучшителем, благодаря гибкости белка, и благодаря потенциалу к множественному связыванию с лигандом хемосенсорного рецептора, например, подсластителем или модификатором лиганда хемосенсорного рецептора, например, сладким улучшителем. Информация по выравниванию важных остатков пространства #1 и пространства #2 идет из моделирования и стыковки и из сайтнаправленного мутагенеза.
Считается, что шарнирные остатки связаны с первым пространством (пространство #1). Было обнаружено, что одно из пространств, занятых лигандом хемосенсорного рецептора, например, подсластителем, частично выровнено остатками, называемым здесь шарнирными остатками. Множество доменов венериной мухоловки кристаллизовано с агонистами, включающими mGluR1, mGluR2 и mGluR3, которые демонстрируют образующее агонисты взаимодействие с гомологичными остатками тех, которые идентифицированы здесь для T1R2. Множество лигандов хемосенсорного рецептора, например, подсластителей, стыкованных с моделью T1R2, могут быть стыкованы с этой областью. Сайтнаправленный мутагенез также является значительным подтверждением открытия, что шарнирные остатки, или остатки, пространственно близкие к ним, являются ключевыми остатками для активации хемосенсорного рецептора, например, T1R2 родственного рецептора. Так как лиганды хемосенсорного рецептора, например, подсластители, могут варьироваться в размере, существуют дополнительные остатки, выравнивающие это первое пространство для больших остатков, где список таких дополнительных остатков зависит, частично, от размера лиганда хемосенсорного рецептора, например, подсластителя.
Считается, что пинцетные остатки связаны со вторым пространством (пространство #2). Известно, что домены венериной мухоловки переходят из «открытого» состояния в «закрытое» состояние при связывании с лигандом. Домен венериной мухоловки состоит из двух долей, обычно называемых в литературе как верхняя доля и нижняя доля. В «открытом» состоянии доли скорее разделены, а в закрытом состоянии доли относительно двигаются и это движение сближает верхнюю и нижнюю доли. Кроме прямой стабилизации закрытого состояния T1R2 агонистом, моделирование демонстрирует, что существует дополнительная стабилизация закрытого состояния через взаимодействия остатков верхней доли с соответствующими остатками нижней доли, которые здесь названы «пинцетными остатками». Было обнаружено, что место взаимодействия, т.е. взаимодействующее пространство для модификатора лиганда хемосенсорного рецептора, например сладкого улучшителя, является пространством, которое частично выровнено этими пинцетными остатками, так как дополнительные взаимодействия в этой области могут еще больше стабилизировать закрытую агонизированную форму домена венериной мухоловки. Исследование сайтнаправленного мутагенеза также является доказательством открытия, что пинцетные остатки и остатки, пространственно близкие к ним, являются ключевыми остатками, связанными с модулированием лиганда хемосенсорного рецептора, например, улучшением активности лиганда.
Первое пространство и второе пространство могут меняться местами. В представленном выше описании модификатор хемосенсорного рецептора, например, подсластитель, связывается с шарнирной областью, а модификатор лиганда хемосенсорного рецептора, например, сладкий улучшитель, связывается с пинцетной областью. Это только один пример и он не должен рассматриваться как ограничивающий. Например, анализ моделирования и стыковки продемонстрировал, что подобный способ связывания для сахарина в качестве агониста (подсластителя) включает связывание с пинцетной областью. Этот результат также подтверждается сайтнаправленным мутагенезом. Если модификатор хемосенсорного рецептора, например, подсластитель связан с пинцетной областью, существует возможность для дальнейшей стабилизации закрытой формы домена венериной мухоловки через связывание модификатора лиганда хемосенсорного рецептора, например, сладкого улучшителя с шарнирной областью.
Определения в методиках
1. Стыковка.
Стыковкой обычно считается процесс преобразования и вращения молекулы-кандидата по отношению к хемосенсорному рецептору, например, структурной модели T1R2, при одновременной корректировке внутренних углов закручивания молекулы-кандидата для того, чтобы вписать молекулу-кандидата в активный сайт хемосенсорного рецептора, например, структурную модель T1R2. Положения молекулы-кандидата (положения, относительные ориентации и внутренние закручивания) выбирают на основе того, соответствует ли молекула активному сайту, и может ли молекула образовывать вандерваальсовы взаимодействия, водородные связи, стэкинг-взаимодействия кольца и взаимодействия с соляным мостиком с остатками активного сайта и с лигандом хемосенсорного рецептора, например, подсластителем. Ключевые остатки могут быть идентифицированы. Кандидат является таковым с наибольшей вероятностью, если он взаимодействует с остатками в активном сайте в форме шарнирной области, соседним активным сайтом, пинцетными остатками и всей совокупностью активного сайта. Также считается, что он наиболее вероятно образует прямые взаимодействия с лигандом хемосенсорного рецептора, например, подсластителем.
2. Гомологичное моделирование
Под гомологичным моделированием обычно понимается процесс построения модели домена венериной мухоловки хемосенсорного рецептора, например, T1R2, от его последовательности аминокислот и от трехмерных координат одного или более гомологичных белков домена венериной мухоловки. Гомологичное моделирование может осуществляться с применением стандартных методов, подробно описанных в литературе и доступных в коммерческих программных продуктах, таких как Homology program или Modeler от Accelrys Corporation. Модели основаны на экспериментально определенных структурах открытых и закрытых форм, а также на анимации моделей с применением анализа нормальных колебаний, если его применяют для определения пинцетных остатков, описанных выше.
Примерные иллюстрации анализа моделирования
На фигурах 5-10 показаны взаимодействующие пространства и остатки, связанные с одним из представленных анализов молекулярного моделирования.
ЭКСПЕРИМЕНТ 2: Анализ мутагенеза для идентификации модификатора лиганда хемосенсорного рецептора: улучшитель
В наших предыдущих заявках на патенты (международная публикация № WO07047988 и международная публикация № WO070104709) описан способ с применением человеческо-крисиных химерных сладких - химерных белковых рецепторов для составления схемы мест связывания сладких и белковых тастантов. Данные демонстрируют, что множество подсластителей, включая сахарозу, фруктозу, аспартам, неотам, D-триптофан (D-Trp), ацесульфам K, сахарин и дульцин, все взаимодействуют с доменом венериной мухоловки T1R2 (VFT), а белковые тастанты, включая L-глутамат, инозин-5′-монофосфат (IMP) и гуанозин-5′-монофосфат (GMP) взаимодействуют с доменом венериной мухоловки T1R1.
Основываясь на правилах молекулярного моделирования был проведен сайтнаправленный мутагенез человеческого T1R2 VFT. Мутагенез был проведен с применением обычного метода на основе ПЦР. Мутанты человеческого T1R2 временно трансфицируют в клетки HEK293 вместе с дикой кДНК человеческого T1R3, и трансфицированные клетки характеризуют с применением автоматизированной машины FLIPR или кальциевой системы визуализации, как описано в наших предыдущих заявках на патенты. Для контроля экспрессии мембран плазмы, укладки белка и других факторов, которые могут внести свой вклад в изменение активности рецептора, мы применяем 2 подсластителя, которые взаимодействуют с другими доменами человеческого сладкого рецептора в качестве положительного контроля. 2 контрольных подсластителя включают цикламат и соединение X (Senomyx). Из полученных ранее данных известно, что цикламат взаимодействует с человеческим трансмембранным доменом T1R3, а соединение X взаимодействует с человеческим трансмембранным доменом T1R2.
Данные мутагенеза для нескольких подсластителей суммированы в представленных ниже таблицах. На основе этих данных был сделан вывод, что 6 остатков (S40, S144, S165, Y103, D142, P277) являются критическими для взаимодействия с этими подсластителями.
Данные мутагенеза на FLIPR
Данные мутагенеза на кальциевой визуализации
Дополнительные мутации R383
Сладкий улучшитель, соединение A, является селективным для человеческого сладкого рецептора, и не активным для крысиного сладкого рецептора. Применяя описанные ранее человечески-крысиные рецепторы, была построена карта места связывания соединения A с hT1R2 VFT. Как показано на фигуре 11, соединение A улучшает активность сукралозы к человеческому сладкому рецептору (h2/h3), но не к крысиному сладкому рецептору (r2/r3). Когда заменили крысиный рецептор T1R2 VFT его человеческим дубликатом (h2-r2/r3), рецептор был улучшен соединением A. С другой стороны, когда заменили человеческий рецептор T1R2 VFT его крысиным дубликатом (r2-h2/h3), рецептор не может быть далее улучшен соединением A. Был сделан вывод, что соединение A взаимодействует с человеческим T1R2 VFT. Из-за различной чувствительности человеческого и крысиного рецепторов к сукралозе, различные концентрации сукралозы применяют для получения ~EC20 различных рецепторов.
После соединения A, еще 8 аналогов были идентифицированы как улучшающие активность сукралозы к человеческому сладкому рецептору. Для этих 8 аналогов проводили те же эксперименты с проецированием, и наблюдали ту же схему активности, как и для соединения A, что суммировано в представленной ниже таблице. Было сделано заключение, что все 8 аналогов соединения A взаимодействуют с человеческим T1R2 VFT.
После проецирования улучшителей на человеческий T1R2 VFT, был проведен анализ мутагенеза для дальнейшего определения места взаимодействия. Как показано в представленной ниже таблице, шесть остатков (K65, D278, L279, D307, R383, V384) были идентифицированы как критические для активности соединения А и аналогов. Эти соединения, а именно, соединения А и А1 - 8, являются типовыми соединениями в соответствии с данным изобретением структурной формулы (I) и субродовых формул. Интересно, что V384 также является важным для активности 2 структурно родственных подсластителей (как показано на фигуре 12), сахарина и ацесульфама K (AceK), что показывает, что эти подсластители могут занимать такое же пространство в человеческим T1R2 VFT. Концентрация подсластителей включает: аспартам (15 мМ), D-Trp (20 мМ), сахарозу (200 мМ), сукралозу (3,2 мМ), AceK (8 мМ), сахарин (3,2 мМ), цикламат (80 мМ), S3819 (25 μM).
ЭКСЕРИМЕНТ 3: Химический синтез соединений в соответствии с данным изобретением
Пример 1: 4-Амино-5,6-диметилтиено[2,3-d]пиримидин-2(1H)-тион

Раствор N-(3-циано-4,5-диметилтиофен-2-илкарбамотиоил)бензамида (пример 1a) (1,90, 6,03 ммоль) и NaOH (2н, 8,3 мл) в EtOH (25 мл) перемешивают при 100°С в атмосфере азота в течение получаса. После охлаждения до комнатной температуры прозрачный реакционный раствор фильтруют, и фильтрат осторожно нейтрализуют 10% AcOH при энергичном перемешивании при 0°С. Полученный осадок собирают фильтрацией, промывают теплой водой и затем 20% EtOH в воде с получением конечного продукта, 4-амино-5,6-диметилтиено[2,3-d]пиримидин-2(1H)-тиона (1,11 г, 87%) в виде твердого вещества беловатого цвета. т. пл.: > 260°С.1H ЯМР (400 МГц, ДМСО-d6) δ 2,25 (с, 3H), 2,26 (с, 3H). МС 212 (MH+).
Пример 1a: N-(3-Циано-4,5-диметилтиофен-2-илкарбамотиоил)бензамид
К раствору 2-амино-4,5-диметилтиофен-3-карбонитрила (1,52 г, 10,0 ммоль) в 1,4-диоксане (20 мл) добавляют бензоилизотиоцианат (1,63 г, 10,0 ммоль). Затем реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение ночи. Осадок собирают фильтрацией, промывают EtOAc/гексаном (1:4), и сушат в вакууме в течение ночи с получением N-(3-циано-4,5-диметилтиофен-2-илкарбамотиоил)бензамида в виде твердого вещества белого цвета.1H ЯМР (400 МГц, CDCl3) δ 2,23 (с, 3H), 2,31 (с, 3H), 7,58-7,54 (м, 2H), 7,68-7,66 (м, 1H), 7,94 (д, J=7,2 Гц, 2H), 9,13 (ушир.с, 1H). МС 316 (MH+).
Пример 2: 4-Аминохиназолин-2(1H)-тион
Получают по методике примера 1 из N-(2-цианофенилкарбамотиоил)бензамида (Пример 2a).1H ЯМР (400 МГц, ДМСО-d6) δ 7,25 (дт, J=1,0, 8,2 Гц, 1H), 7,35 (д, J=8,2 Гц, 1H), 7,65 (дт, J=1,0, 8,2 Гц, 1H), 8,05 (дд, J=1,0, 8,1 Гц, 1H), 8,30 (с, 1H), 8,35 (с, 1H), 12,34 (с, 1H). МС 178 (MH+).
Пример 2a: N-(2-цианофенилкарбамоилтиоил)бензамид:
Получают по методике примера 1a из 2-аминобензонитрила и бензоилизотиоцианата в виде твердого вещества бледно-желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,35-7,56 (м, 3H), 7,67 (т, 1H), 7,75-7,76 (д, J=5,2 Гц, 2H), 7,89-7,91 (д, J=7,2 Гц, 2H), 7,98-8,01 (дд, J1= 1,6 Гц, J2= 8,2 Гц, 2H), 11,90 (с, 1H), 12,54 (с, 1H). МС 282 (MH+).
Пример 3: 4-Амино-5-метилхиназолин-2(1H)-тион
Получают по методике примера 1 из N-(2-циано-3-метилфенилкарбамотиоил)бензамида (Пример 3a) в виде твердого вещества беловатого цвета. Т. пл.: > 250°С.1H ЯМР (400 МГц, ДМСО-d6) δ 2,68 (с, 3H), 7,03 (д, J=6,8 Гц, 1H), 7,13 (ушир., 1H), 7,22 (д, J=6,8 Гц, 1H), 7,48 (т, J=6,8 Гц, 1H), 8,50 (ушир., 1H), 12,26 (с, 1H).13C ЯМР (ДМСО-d6) δ 23,26, 109,86, 114,37, 127,16, 134,31, 136,97, 143,57, 160,58, 179,67. МС 192 (MH+).
Пример 3a: N-(2-Цианофенилкарбамотиоил)бензамид
Получают по методике примера 1a из 2-амино-6-метилбензонитрила и бензоилизотиоцианата в виде твердого вещества бледно-желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,40 (м, 1H), 7,52-7,69 (м, 5H), 7,98-8,01 (м, 2H), 11,99 (с, 1H), 12,54 (с, 1H). МС 296 (MH+).
Пример 4: 4-амино-5,6-диметилтиено[2,3-d]пиримидин-2(1H)-он

Раствор N-(3-циано-4,5-диметилтиофен-2-илкарбамоил)бензамид (пример 4a) (44,35 г, 148,1 ммоль) и NaOH (2н, 204 мл) в EtOH (400 мл) перемешивают при 100°С в атмосфере азота в течение четырех часов. Прозрачный реакционный раствор фильтруют, и фильтрат охлаждают до комнатной температуры, и затем осторожно нейтрализуют 10% AcOH (~120 мл) при энергичном перемешивании при 0°С. После перемешивания в течение ночи от 0°С до комнатной температуры, полученный осадок собирают фильтрацией, промывают теплой водой (60-70°С, 150 мл × 4) и 20% EtOH в воде (200 мл × 2), и затем сушат при 50°С в вакууме в течение ночи с получением конечного продукта 4-амино-5,6-диметилтиено[2,3-d]пиримидин-2(1H)-она (27,7 г, 96%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,98 (ушир.с, 1H), 2,24 (с, 3H), 2,19 (с, 3H). МС 196 (MH+).
Пример 4a: N-(3-циано-4,5-диметилтиофен-2-илкарбамоил)бензамид
К раствору 2-амино-4,5-диметилтиофен-3-карбонитрила (пример 4b) (25 г, 164,5 ммоль) в 1,4-диоксане (600 мл) добавляют бензоилизоцианат (24,2 г, 164,5 ммоль). Затем реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение ночи. Осадок собирают фильтрацией, промывают 1,4-диоксаном (20 мл × 3) и сушат в вакууме при 40°С в течение 3 часов с получением N-(3-циано-4,5-диметилтиофен-2-илкарбамоил)бензамида (44,35 г, 90%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,10 (с, 3H), 2,24 (с, 3H), 7,52-7,56 (м, 2H), 7,64-7,69 (м, 1H), 8,01-8,03 (м, 2H), 11,57 (ушир.с, 1H), 12,05 (ушир.с, 1H). МС 300 (MH+).
Пример 4b: 2-амино-4,5-диметилтиофен-3-карбонитрил
К раствору бутанона (162,0 мл, 1,8 моль), серы (57,99 г, 1,8 моль) и малононитрила (119,49 г, 1,8 моль) в безводном этаноле (1,2 л) добавляют при 0°С триэтиламин (251,4 мл, 1,8 моль). Реакционную смесь перемешивают при 0°С в течение 15 минут, затем нагревают при 80°С в течение 70 минут. После охлаждения до комнатной температуры, этанол (920 мл) удаляют при пониженном давлении и добавляют водный NaCl (30%, 750 мл). Полученную смесь перемешивают в течение 10 минут и экстрагируют диэтиловым (1л). Водный слой далее экстрагируют диэтиловым эфиром (500 мл), и нерастворимые твердые вещества удаляют фильтрацией, после чего органический слой отделяют и объединяют с первым экстрактом диэтилового эфира. Объединенный органический экстракт сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Остаток перемешивают в течение 2 часов в дихлорметане (300 мл), и твердое вещество собирают. Больше твердого вещества выделяют из раствора дихлорметана, охлажденного до -78°С. Объединенный твердый продукт кипятят с обратным холодильником в дихлорметане (600 мл) в течение 10 минут, затем перемешивают при комнатной температуре в течение 30 минут и охлаждают до -78°С. Полученный осадок собирают фильтрацией с получением неочищенного продукта (115 г). Фильтрат концентрируют, и остаток подвергают хроматографии на силикагеле (элюент: дихлорметан) с получением твердого вещества, которое объединяют с предыдущим неочищенным продуктом. Полученный остаток очищают флэш-хроматографией на силикагеле (дихлорметан) с получением 2-амино-4,5-диметилтиофен-3-карбонитрила (105 г, 38%) в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,93 (д, J=1,2 Гц, 3H), 2,07 (д, J=1,2 Гц, 3H), 3,33 (с, 2H). МС 153 (MH+).
Пример 5: 4-Амино-5,6-бутилентиено[2,3-d]пиримидин-2(1H)-тион

Получают по методике примера 1 из N-(3-циано-4,5,6,7-тетрагидробензо[b]тиофен-2-илкарбамотиоил)бензамида (Пример 5a).1H ЯМР (400 МГц, ДМСО-d6) δ 175 (м, 4H), 2,62 (м, 2H), 2,74 (м, 2H). МС 238 (MH+).
Пример 5a: N-(3-Циано-4,5,6,7-тетрагидробензо[b]тиофен-2-илкарбамотиоил)бензамид.
Получают по методике примера 1a из 2-амино-4,5,6,7-тетрагидробензо[b]тиофен-3-карбонитрила (пример 5b) и бензоилизотиоцианата в виде твердого вещества бледно-желтого цвета. МС 342 (MH+).
Пример 5b: 2-Амино-4,5,6,7-тетрагидробензо[b]тиофен-3-карбонитрил
Раствор циклогексана (1,96 г, 20,0 ммоль), малононитрила (1,32 г, 20,0 ммоль), серы (640 мг, 20,0 ммоль) и триэтиламина (2,03 г, 20 ммоль) в EtOH (50 мл) кипятят с обратным холодильником в течение 6 ч в атмосфере азота. Растворитель удаляют при пониженном давлении, и остаток разделяют между EtOAc и водой. Органический слой отделяют, промывают насыщенным раствором соли и сушат над Na2SO4. После выпаривания растворителя, остаток очищают хроматографией на силикагеле с EtOAc/гексаном (2:3) с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, CDCl3) δ 1,79 (м, 4H), 2,50 (м, 4H), 4,59 (с, 2H). МС 179 (MH+).
Пример 6: 4-Амино-5-метилхиназолин-2(1H)-он
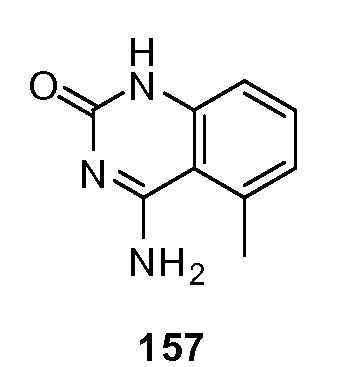
Получают по методике примера 1 из N-(2-циано-3-метилфенилкарбамоил)бензамида (пример 6a).1H ЯМР (400 МГц, ДМСО-d6) δ 3,04 (с, 3H), 7,43 (д, J=7,2 Гц, 1H), 7,51 (д, J=7,2 Гц, 1H), 7,97 (т, J=7,2 Гц, 1H). МС 176 (MH+).
Пример 6a: N-(2-Циано-3-метилфенилкарбамоил)бензамид
Получают по методике примера 1a из 2-амино-6-метилбензонитрила и бензоилизоцианата в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,19 (д, J=7,6 Гц, 1H), 7,52-7,68 (м, 5H), 8,02-8,08 (м, 2H), 11,32 (с, 1H), 11,46 (с, 1H). МС 280 (MH+).
Пример 7: 4-Амино-6-этил-5-метилтиено[2,3-d]пиримидин-2(1H)-он

Получают по методике примера 1 из N-(3-циано-5-этил-4-метилтиофен-2-илкарбамоил)бензамида (Пример 7a).1H ЯМР (400 МГц, ДМСО-d6) δ 1,11 (т, J=7,6 Гц, 3H), 2,26 (с, 3H), 2,60-2,67 (кв., J=7,6 Гц, 2H). МС 210 (MH+).
Пример 7a: N-(3-Циано-5-этил-4-метилтиофен-2-илкарбамоил)бензамид
Получают по методике примера 1a из 2-амино-5-этил-4-метилтиофен-3-карбонитрила (пример 7b) и бензоилизоцианата в виде твердого вещества бледно-желтого цвета. МС 314 (MH+).
Пример 7b: 2-Амино-5-этил-4-метилтиофен-3-карбонитрил
Получают по методике примера 5b из 2-пентанона, малононитрила и серы в виде твердого вещества желтого цвета. МС 167 (MH+).
Пример 8: 4-Амино-6-метилтиено[2,3-d]пиримидин-2(1H)-он

Получают по методике примера 1 из N-(3-циано-5-метилтиофен-2-илкарбамоил)бензамида (Пример 8a).1H ЯМР (400 МГц, ДМСО-d6) δ 2,34 (с, 3H), 6,97 (с, 1H), 7,50 (с, 1H). МС 182 (MH+).
Пример 8a: N-(3-Циано-5-метилтиофен-2-илкарбамоил)бензамид
Получают по методике примера 1a из 2-амино-5-метилтиофен-3-карбонитрила и бензоилизоцианата в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,36 (д, J=1,2 Гц, 3H), 6,89 (д, J=1,2 Гц, 1H), 7,55 (т, J=8,0 Гц, 2H), 7,66 (д, J=7,2 Гц, 1H), 8,03-8,01 (м, 2H), 11,60 (ушир.с, 1H), 12,08 (ушир.с, 1H). МС 286 (MH+).
Пример 9: 4-Амино-6-(гидроксиметил)-5-метилтиено[2,3-d]пиримидин-2(1H)-тион

Получают по методике примера 1 из N-(3-циано-5-(гидроксиметил)-4-метилтиофен-2-илкарбамотиоил)бензамида (Пример 9a).1H ЯМР (400 МГц, ДМСО-d6) δ 2,30 (с, 3H), 4,54-4,55 (д, J=5,2 Гц, 2H), 5,54 (т, 1H). МС 228 (MH+).
Пример 9a: N-(3-Циано-5-(гидроксиметил)-4-метилтиофен-2-илкарбамотиоил)-бензамид
Получают по методике примера 1a из 2-амино-5-(гидроксиметил)-4-метилтиофен-3-карбонитрила (Пример 9b) и бензоилизотиоцианата в виде твердого вещества желтого цвета. МС 332 (MH+).
Пример 9b: 2-Амино-5-(гидроксиметил)-4-метилтиофен-3-карбонитрил
Получают по методике примера 5b из 4-гидроксибутан-2-она, малононитрила и серы в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,97 (с, 3H), 4,30-4,31 (д, J=5,6 Гц, 2H), 5,10 (т, 1H), 7,00 (с, 2H).
Пример 10: 4-Амино-5,6,7,8-тетрагидрохиназолин-2(1H)-тион
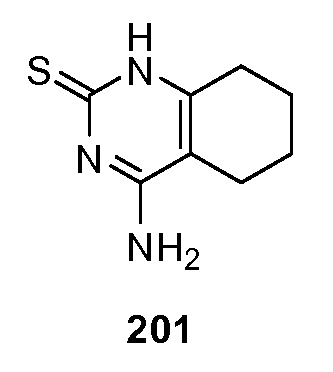
Получают по методике примера 1 из N-(2-цианоциклогекс-1-енилкарбамотиоил)бензамида (Пример 10a) в виде твердого вещества белого цвета. H ЯМР (400 МГц, ДМСО-d6) δ 1,60-1,65 (м, 4H), 2,13 (м, 2H), 2,38 (м, 2H), 6,93 (с, 1H), 7,56 (с, 1H), 11,84 (с, 1H). МС 182 (MH+).
Пример 10a: N-(2-Цианоциклогекс-1-енилкарбамотиоил)бензамид
Получают по методике примера 1a из 2-аминоциклогекс-1-енкарбонитрила (Пример 10b) и бензоилизотиоцианата в виде твердого вещества белого цвета. МС 286 (MH+).
Пример 10b: 2-Аминоциклогекс-1-енкарбонитрил
Перемешиваемую смесь 1,7-гептандинитрила (24,44 г, 0,2 моль) и трет-BuOK (22,44 г, 0,2 моль) нагревают при 80°С в течение 3 ч в атмосфере азота. Затем смесь охлаждают до комнатной температуры и хранят при комнатной температуре в течение ночи. Остаток обрабатывают водой и экстрагируют простым эфиром (2X). Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают перекристаллизацией из MeOH с получением указанного в заголовке соединения в виде твердого вещества белого цвета (18,2 г, 75%).1H ЯМР (400 МГц, CDCl3) δ 1,58-1,71 (м, 4H), 2,12-2,20 (м, 4H), 4,23 (ушир.с, 2H). МС 123 (MH+).
Пример 11: 4-Амино-6-метилтиено[2,3-d]пиримидин-2(1H)-он

Получают по методике примера 1 из N-(3-цианотиофен-2-илкарбамоил)бензамида (Пример 11a).1H ЯМР (400 МГц, ДМСО-d6) δ 6,97 (с, J=5,2 Гц, 1H), 7,31 (д, J=6,0 Гц, 1H), 7,60 (с, 2H), 11,38 (ушир.с, 1H). МС 168 (MH+).
Пример 11a: N-(3-Цианотиофен-2-илкарбамоил)бензамид
Получают по методике примера 1a из 2-аминотиофен-3-карбонитрила и бензоилизоцианата в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,23-7,19 (м, 2H), 7,55 (т, J=8,0 Гц, 2H), 7,70-7,66 (м, 1H), 8,04-8,02 (м, 2H), 11,62 (ушир.с, 1H), 12,18 (ушир.с, 1H). МС 272 (MH+).
Пример 12: 4-Аминохиназолин-2(1H)-он
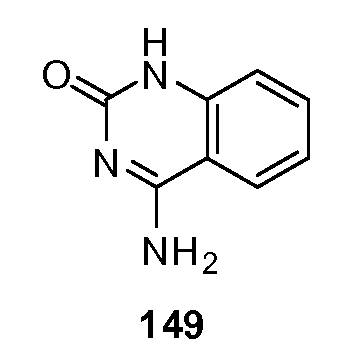
Получают по методике примера 1 из N-(2-цианофенилкарбамоил)бензамида (Пример 12a) в виде твердого вещества белого цвета (156 мг, 41%).1H ЯМР (400 МГц, ДМСО-d6) δ 7,12-7,20 (м, 2H), 7,59-7,63 (м, 1H), 8,08-8,10 (д, 1H), 8,60 (ушир., 2H), 11,2 (ушир., 1H).13C ЯМР (ДМСО-d6) δ 108,72, 115,98, 122,32, 125,51, 135,38, 142,96, 154,96, 163,51. МС 162 (MH+).
Пример 12a: N-(2-Цианофенилкарбамоил)бензамид
Получают по методике примера 1a из 2-аминобензонитрила и бензоилизоцианата в виде порошка белого цвета (661 мг, 59%).1H ЯМР (400 МГц, ДМСО-d6) δ 7,27-7,29 (т, 1H), 7,52-7,56 (т, 1H), 7,64-7,74 (м, 2H), 7,82-7,85 (дд, 1H), 8,02-8,04 (м, 2H), 8,22-8,24 (д, 1H). МС 266 (MH+).
Пример 13: 4-Амино-6-метокси-5-метилтиено[2,3-d]пиримидин-2(1H)-он
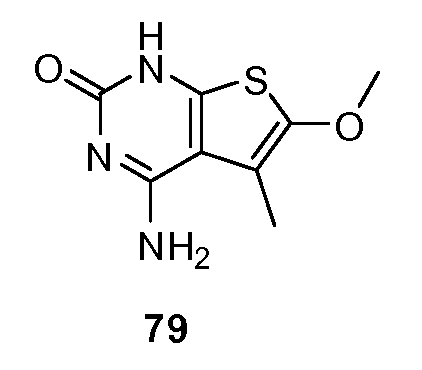
Получают по методике примера 1 из N-(3-циано-5-метокси-4-метилтиофен-2-илкарбамоил)бензамида (Пример 13a).1H ЯМР (400 МГц, ДМСО-d6) δ 2,19 (с, 3H), 3,78 (с, 3H), 2,74 (с, 2H). МС 212 (MH+).
Пример 13a: N-(3-Циано-5-метокси-4-метилтиофен-2-илкарбамоил)бензамид.
Получают по методике примера 1a из 2-амино-5-метокси-4-метилтиофен-3-карбонитрила (пример 13b) и бензоилизоцианата в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,03 (с, 3H), 3,86 (с, 3H), 7,54 (т, J=7,2 Гц, 2H), 7,67 (т, J=7,6 Гц, 1H), 8,01-8,03 (д, J=8,4 Гц, 2H), 11,60 (с, 1H), 12,03 (с, 1H). МС 316 (MH+).
Пример 13b: 2-Амино-5-метокси-4-метилтиофен-3-карбонитрил
Получают по методике примера 5b из 1-метоксипропан-2-она, малононитрила и серы в виде твердого вещества коричневого цвета. МС 169 (MH+).
Пример 14: 4-Амино-6-метилхиназолин-2(1H)-он

Получают по методике примера 1 из N-(2-циано-4-метилфенилкарбамоил)бензамида (Пример 14a) в виде твердого вещества белого цвета (259 мг, 57%).1H ЯМР (400 МГц, ДМСО-d6) δ 2,29 (с, 3H), 6,99-7,05 (м, 1H), 7,35-7,37 (д, 1H), 7,72 (ушир., 2H), 7,79 (с, 1H) 10,55 (ушир.с, 1H). МС 176 (MH+).
Пример 14a: N-(2-Циано-4-метилфенилкарбамоил)бензамид
Получают по методике примера 1a из 2-амино-5-метилбензонитрила (Пример 14b) в виде порошка белого цвета (724 мг, 46%). МС 280 (MH+).
Пример 14b: 2-Амино-5-метилбензонитрил
5-Метил-2-нитробензонитрил (1,92 г, 11,84 ммоль) добавляют порциями к перемешиваемому раствору SnCl2 (11,22 г, 59,2 ммоль) в конц. HCl (12 мл) и EtOH (12 мл). Температуру реакции поддерживают при 20-30°С с применением ледяной бани. Реакционную смесь затем перемешивают при комнатной температуре в течение 1 ч и выливают в ледяной водный раствор NaOH (6н, около 30 мл) для нейтрализации до pH7. Продукт экстрагируют в EtOAc, промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют с получением указанного в заголовке соединения (1,56 г, 99%) в виде твердого вещества желто-коричневого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,21 (с, 3H), 5,79 (ушир.с, 2H), 6,68-6,71 (д, 1H), 7,10-7,13 (дд, 1H), 7,15 (с, 1H).13C ЯМР (ДМСО-d6) δ 20,13, 93,99, 116,12, 118,94, 125,38, 132,32, 135,76, 150,21. МС 133 (MH+).
Пример 15: 4-Амино-8-метилхиназолин-2(1H)-он
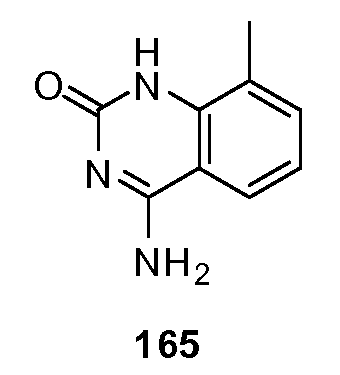
Получают по методике примера 1 из N-(2-циано-6-метилфенилкарбамоил)бензамида (Пример 15a) в виде твердого вещества белого цвета (60 мг, 56%).1H ЯМР (400 МГц, ДМСО-d6) δ 2,29 (с, 3H), 6,96-7,00 (т, 1H), 7,37-7,38 (д, 1H), 7,70-7,72 (ушир., 2H), 7,80-7,82 (д, 1H), 9,87 (ушир.с, 1H). МС 176 (MH+).
Пример 15a: N-(2-Циано-6-метилфенилкарбамоил)бензамид
Получают по методике примера 1a из 2-амино-3-метилбензонитрила (Пример 15b) и бензоилизоцианата в виде порошка белого цвета (186 мг, 67%). МС 280 (MH+).
Пример 15b: 2-Амино-3-метилбензонитрил
К раствору 2-бром-6-метиланилина (126 мкл, 1 ммоль) в сухом NMP (3 мл) добавляют CuCN (197 мг, 2,2 ммоль). Смесь облучают микроволнами при 200°С в течение 40 минут, охлаждают до комнатной температуры и выливают в смесь аммиака (50% масс./об., 10 мл) и льда. Смесь перемешивают в течение 30 мин, и продукт экстрагируют дихлорметаном (3×20 мл). Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный материал очищают на силикагеле (50% EtOAc/гексан) с получением масла коричневого цвета, которое кристаллизуется при выстаивании (128 мг, 96%).1H ЯМР (400 МГц, ДМСО-d6) δ 2,08 (с, 3H), 5,68 (ушир.с, 2H), 6,51-6,55 (т, 1H), 7,17-7,19 (д, 1H), 7,22-7,24 (дд, 1H). МС 133 (MH+).
Пример 16: 4-Аминопиримидо[4,5-d]пиримидин-2(1H)-он

Получают по методике примера 1 из N-(2-циано-4,5-диметилфуран-3-илкарбамоил)бензамида (Пример 16a).1H ЯМР (400 МГц, ДМСО-d6) δ 8,91 (с, 1H), 8,92 (с, 1H), 9,24 (с, 2H), 11,50 (ушир., 1H). МС 164 (MH+).
Пример 16a: N-(2-Циано-4,5-диметилфуран-3-илкарбамоил)бензамид
Получают по методике примера 1a из 4-аминопиримидин-5-карбонитрила и бензоилизоцианата в виде беловатого порошка. МС 268 (MH+).
Пример 17: 4-Амино-7-метилхиназолин-2(1H)-тион
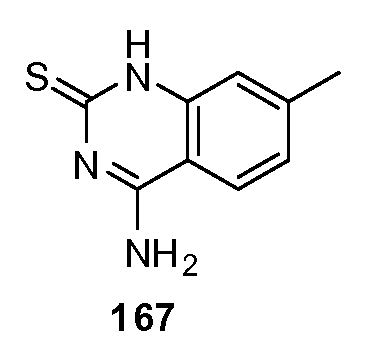
Получают по методике примера 1 из N-(2-циано-5-метилфенилкарбамотиоил)бензамида (Пример 17a).1H ЯМР (400 МГц, ДМСО-d6) δ 2,35 (с, 3H), 7,08 (д, J=8,0 Гц, 1H), 7,13 (с, 1H), 7,93 (д, J=8,0 Гц, 1H), 8,21 (с, 1H), 8,24 (с, 1H), 12,26 (с, 1H). МС 192 (MH+).
Пример 17a: N-(2-Циано-5-метилфенилкарбамотиоил)бензамид
Получают по методике примера 1a из 2-амино-4-метилбензонитрила и бензоилизотиоцианата в виде порошка бледно-желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,32 (д, J=8,0 Гц, 1H), 7,51-7,58 (м, 3H), 7,67 (т, J=7,8 Гц, 1H), 7,78 (д, J=8,0 Гц, 1H), 7,98-8,01 (м, 2H), 11,88 (с, 1H), 12,49 (с, 1H). МС 296 (MH+).
Пример 18: 4-Амино-5,6-диметилфуро[2,3-d]пиримидин-2(1H)-он
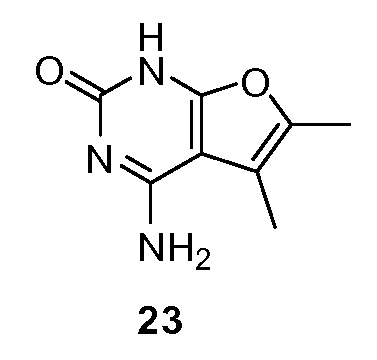
Получают по методике примера 1 из N-(2-циано-4,5-диметилфуран-3-илкарбамоил)бензамида (Пример 18a).1H ЯМР (400 МГц, ДМСО-d6) δ 2,11 (с, 3H), 2,20 (с, 3H). МС 180 (MH+).
Пример 18a: N-(2-Циано-4,5-диметилфуран-3-илкарбамоил)бензамид
Получают по методике примера 1a из 2-амино-4,5-диметилфуран-3-карбонитрила и бензоилизоцианата в виде твердого вещества беловатого цвета. МС 284 (MH+).
Пример 19: 4-Амино-7-метилхиназолин-2(1H)-он
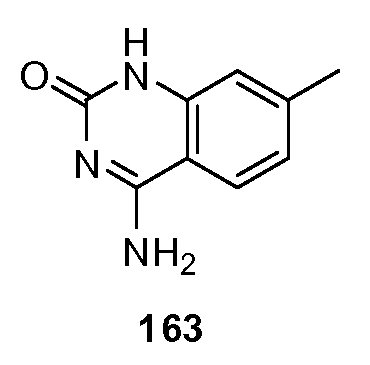
Получают по методике примера 1 из N-(2-циано-5-метилфенилкарбамоил)бензамида (Пример 19a).1H ЯМР (400 МГц, ДМСО-d6) δ 2,59 (с, 3H), 7,37 (с, 1H), 7,49 (д, J=7,2 Гц, 1H), 8,21 (д, J=7,2 Гц, 1H). МС 176 (MH+).
Пример 19a: N-(2-Циано-5-метилфенилкарбамоил)бензамид
Получают по методике примера 1a из 2-амино-4-метилбензонитрила и бензоилизоцианата в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,10-7,13 (м, 1H), 7,54 (т, J=7,8 Гц, 2H), 7,66 (т, J=7,8 Гц, 1H), 7,71 (д, J=8,0 Гц, 1H), 8,02-8,04 (м, 2H), 8,07 (с, 1H), 11,32 (с, 1H), 11,44 (с, 1H). МС 280 (MH+).
Пример 20: 4-Амино-1-бензил-5,6-диметилтиено[2,3-d]пиримидин-2(1H)-тион

Получают по методике примера 1 из N-(бензил(3-циано-4,5-диметилтиофен-2-ил)карбамотиоил)бензамида (Пример 20a). МС 302 (MH+).
Пример 20a: N-(Бензил(3-циано-4,5-диметилтиофен-2-ил)карбамотиоил)-бензамид.
Получают по методике примера 1a из 2-(бензиламино)-4,5-диметилтиофен-3-карбонитрила (Пример 20b) и бензоилизотиоцианата. МС 406 (MH+).
Пример 20b: 2-(Бензиламино)-4,5-диметилтиофен-3-карбонитрил
К раствору 2-амино-4,5-диметилтиофен-3-карбонитрил (151 мг, 1,0 ммоль) и бензальдегида (106 мг, 1 ммоль) в 15 мл 4% уксусной кислоты в дихлорэтане добавляют цианоборгидрид на подложке из двуокиси кремния (2,0 г, 2,0 ммоль). Реакционную смесь помещают в микроволновый реактор на 5 минут при 135°С. Цианоборгидрид на подложке из двуокиси кремния удаляют фильтрацией, и продукт очищают препаративной ВЭЖХ с применением ацетонитрила/воды в качестве растворителя. МС 243 (MH+).
Пример 21: 4-Амино-1-этил-5,6-диметилтиено[2,3-d]пиримидин-2(1H)-он

Получают по методике примера 1 из N-((3-циано-4,5-диметилтиофен-2-ил)(этил)карбамоил)бензамида (Пример 21a). МС 224 (MH+).
Пример 21a: N-((3-Циано-4,5-диметилтиофен-2-ил)(этил)карбамоил)бензамид.
Получают по методике примера 1a из 2-(этиламино)-4,5-диметилтиофен-3-карбонитрила (Пример 21b) и бензоилизоцианата. МС 328 (MH+).
Пример 21b: 2-(Этиламино)-4,5-диметилтиофен-3-карбонитрил
К смеси 2-(бензиламино)-4,5-диметилтиофен-3-карбонитрила (302 мг, 2,0 ммоль), карбоната калия (276 мг, 2,0 ммоль) и каталитического количества йодида калия в ацетонитриле (1 мл) в 20 мл колбе для микроволнового реактора добавляют этилйодид (310 мг, 2,0 ммоль). Реакционную колбу помещают в микроволновой реактор на 15 минут при 165°С. Реакционную смесь растворяют в этилацетате и промывают водой и насыщенным раствором соли. Этилацетатную фазу сушат над сульфатом натрия, и растворитель выпаривают при пониженном давлении, и продукт очищают препаративной ВЭЖХ с применением ацетонитрила/воды в качестве растворителя. МС 181 (MH+).
Пример 22: 4-Амино-1,5,6-триметилтиено[2,3-d]пиримидин-2(1H)-он

Получают по методике примера 1 из N-((3-циано-4,5-диметилтиофен-2-ил)(метил)карбамоил)бензамида (Пример 22a). МС 210 (MH+).
Пример 22a: N-((3-Циано-4,5-диметилтиофен-2-ил)(метил)карбамоил)-бензамид.
Получают по методике примера 1a из 4,5-диметил-2-(метиламино)тиофен-3-карбонитрила (Пример 22b) и бензоилизоцианата. МС 314 (MH+).
Пример 22b: 4,5-Диметил-2-(метиламино)тиофен-3-карбонитрил
Получают по методике примера 21b из 2-амино-4,5-диметилтиофен-3-карбонитрила и метилйодида.
Пример 23: 1H-Бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Перемешиваемую смесь 2-цианоанилина (236 мг, 2,0 ммоль), сульфамида (192 мг, 2,0 ммоль) и DBU (304 мг, 2,0 ммоль) нагревают при 160°С в атмосфере азота в течение 3 дней. После охлаждения до комнатной температуры реакционную смесь разбавляют водой и три раза экстрагируют EtOAc. Водный слой удаляют в вакууме, и остаток очищают хроматографией на силикагеле, элюируя 10% MeOH в дихлорметане с получением указанного в заголовке соединения в виде твердого вещества бледно-желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,03 (дд, J=0,8, 8,0 Гц, 1H), 7,12 (дт, J=0,8, 8,0 Гц, 1H), 7,56 (дт, J=0,8, 8,0 Гц, 1H), 7,85 (дд, J=0,8, 8,0 Гц, 1H). МС 198 (MH+).
Пример 24: 5-Метил-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Раствор N-(2-циано-3-метилфенил)сульфамида (Пример 24a) (211 мг, 1,0 ммоль) в EtOH обрабатывают NaOH (2,0н, 1,0 мл, 2,0 ммоль), и полученный раствор нагревают до 100°С и перемешивают при этой температуре в течение 0,5 часа. После охлаждения до комнатной температуры прозрачный реакционный раствор фильтруют, и фильтрат осторожно нейтрализуют 10% AcOH при энергичном перемешивании при 0°С. Полученный осадок собирают фильтрацией, промывают теплой водой и 20% EtOH в воде с получением указанного в заголовке соединения 5-метил-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксида в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,59 (с, 3H), 6,85-6,87 (д, J=8,4 Гц, 1H), 6,92-6,94 (д, J=7,2 Гц, 1H), 7,24 (с, 1H), 7,37 (т, J=7,6 Гц, 1H), 8,24 (с, 1H), 10,76 (с, 1H). МС 212 (MH+).
Пример 24a: N-(2-Циано-3-метилфенил)сульфамид
Раствор 2-амино-6-метилбензонитрила (1,32 г, 10 ммоль) и сульфамида (4,81 г, 50 ммоль) в сухом 1,4-диоксане (50 мл) кипятят с обратным холодильником в атмосфере азота в течение 3 дней. После охлаждения реакционной смеси до комнатной температуры, осадок фильтруют и промывают диоксаном. Фильтрат концентрируют при пониженном давлении, и остаток очищают хроматографией на силикагеле, элюируя EtOAc/гексаном (3:7) с получением указанного в заголовке соединения в виде твердого вещества бледно-белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,44 (с, 3H), 7,19-7,21 (м, 3H), 7,39-7,41 (д, J=8,4 Гц, 1H), 7,53 (т, J=8,0 Гц, 1H), 9,41 (с, 1H).
Пример 25: 5,6-Диметил-2-(метилтио)тиено[2,3-d]пиримидин-4-амин

К суспензии N-(3-циано-4,5-диметилтиофен-2-илкарбамотиоил)-бензамида (Пример 1a) (1,33 г, 4,22 ммоль) в этаноле (25 мл) добавляют NaOH (2,0н, 5,8 мл) при комнатной температуре в атмосфере азота. После перемешивания при 100°С в атмосфере азота в течение 0,5 ч, реакционную смесь охлаждают на ледяной бане и по каплям добавляют MeI (0,8 мл). После перемешивания в течение еще 0,5 ч полученный осадок собирают фильтрацией, промывают водой, 20% EtOH/H2O и сушат в вакууме с получением указанного в заголовке соединения (840 мг, 89%).1H ЯМР (400 МГц, ДМСО-d6) δ 2,32 (с, 3H), 2,34 (с, 3H), 2,42 (с, 3H), 6,93 (ушир.с, 2H). МС 226 (MH+).
Пример 26: 2-Метокси-5,6-диметилтиено[2,3-d]пиримидин-4-амин

Получают по методике примера 25 из N-(3-циано-4,5-диметилтиофен-2-илкарбамоил)бензамида (Пример 4a) и метилйодида с 86% выходом.1H ЯМР (400 МГц, CDCl3) δ 2,35 (с, 3H), 2,36 (с, 3H), 3,53 (с, 3H), 6,0 (ушир.с, 2H). МС 210 (MH+).
Пример 27: 5,6-Диметил-2-(метилтио)фуро[2,3-d]пиримидин-4-амин

Получают по методике примера 25 из N-(2-циано-4,5-диметилфуран-3-илкарбамотиоил)бензамида (Пример 27a).1H ЯМР (400 МГц, ДМСО-d6) δ 2,16 (с, 3H), 2,23 (с, 3H), 2,41 (с, 3H), 6,92 (с, 2H). МС 210 (MH+).
Пример 27a: N-(2-Циано-4,5-диметилфуран-3-илкарбамотиоил)бензамид
Получают по методике примера 1a из 2-амино-4,5-диметилфуран-3-карбонитрила и бензоилизотиоцианата. МС 300 (MH+).
Пример 28: 7-Метил-2-(метилтио)хиназолин-4-амин

Получают по методике примера 25 из N-(2-циано-5-метилфенилкарбамотиоил)бензамида (Пример 17a).1H ЯМР (400 МГц, ДМСО-d6) δ 2,40 (с, 3H), 2,45 (с, 3H), 7,17 (дд, J=2,0, 8,8 Гц, 1H), 7,32 (с, 1H), 7,71 (ушир., 2H), 8,01 (д, J=8,4 Гц, 1H). МС 206 (MH+).
Пример 29: 5-Метил-2-(метилтио)хиназолин-4-амин

Получают по методике примера 25 из N-(2-циано-3-метилфенилкарбамотиоил)бензамида (Пример 3a).1H ЯМР (400 МГц, ДМСО-d6) δ 2,46 (с, 3H), 2,75 (с, 3H), 7,11 (д, J=7,2 Гц, 1H), 7,33 (д, J=7,2 Гц, 1H), 7,51 (дд, J=0,8, 7,2 Гц, 1H). МС 206 (MH+).
Пример 30: 5,6-Диметилтиено[2,3-d]пиримидин-2,4-диамин

Смесь 2-амино-4,5-диметилтиофен-3-карбонитрила (500 мг, 3,29 ммоль), цианогуанидина (276,6 мг, 3,29 ммоль) и HCl (2н, 1,5 мл) в воде (10 мл) кипятят с обратным холодильником в атмосфере азота в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры и подщелачивают разбавленным водным раствором NaOH до pH 7~8. После выпаривания воды остаток очищают препаративной ВЭЖХ, элюируя ацетонитрилом и водой с получением указанного в заголовке соединения (33 мг, 5%).1H ЯМР (400 МГц, ДМСО-d6) δ 2,22 (с, 3H), 2,27 (с, 3H), 5,85 (ушир.с, 2H), 6,29 (ушир.с, 2H). МС 195 (MH+).
Пример 31: 2,5,6-Триметилтиено[2,3-d]пиримидин-4-амин
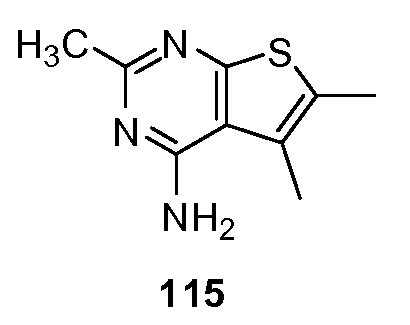
Смесь 2-амино-4,5-диметилтиофен-3-карбонитрила (200 мг, 1,32 ммоль), ацетата аммония (204 мг, 2,64 ммоль) и триэтилортоацетата (2,0 мл) перемешивают в герметично закрытой колбе при 120°С в течение ночи. После охлаждения реакционной смеси до комнатной температуры, осадок собирают фильтрацией, промывают EtOAc и сушат на воздухе с получением указанного в заголовке соединения (52 мг, 60%) в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, CDCl3) δ 2,41 (с, 3H), 2,45 (с, 3H), 2,56 (с, 3H), 5,28 (ушир.с, 2H). МС 194 (MH+).
Пример 32: 5,6-Диметилтиено[2,3-d]пиримидин-4-амин

Получают по методике примера 31 из 2-амино-4,5-диметилтиофен-3-карбонитрила и триэтилортоформиата.1H ЯМР (400 МГц, ДМСО-d6) δ 2,36 (с, 3H), 2,39 (с, 3H), 6,85 (ушир.с, 2H), 8,14 (с, 1H). МС 180 (MH+).
Пример 33: 2-Этил-5,6-диметилтиено[2,3-d]пиримидин-4-амин

Получают по методике примера 31 из 2-амино-4,5-диметилтиофен-3-карбонитрила и триэтилортопропаната.1H ЯМР (400 МГц, ДМСО-d6) δ 1,19 (т, J=7,6 Гц, 3H), 2,33(с, 3H), 2,36 (с, 3H), 2,61 (кв., J=7,6 Гц, 2H), 6,74 (ушир.с, 2H). МС 208 (MH+).
Пример 34: 5,6-Диметил-2-фенилтиено[2,3-d]пиримидин-4-амин

Смесь 2-амино-4,5-диметилтиофен-3-карбонитрила (152 мг, 1,0 ммоль), ацетата аммония (308,3 мг, 4,0 ммоль) и триэтилортобензоата (2,0 мл) в герметично закрытой колбе помещают в микроволновый реактор при 200°С на 20 мин. После охлаждения реакционной смеси до комнатной температуры, ее разбавляют EtOAc, промывают насыщенным NaHCO3 и H2O. Растворитель удаляют в вакууме, и остаток очищают препаративной ВЭЖХ, элюируя ацетонитрилом и водой с получением указанного в заголовке соединения (80 мг, 31%).1H ЯМР (400 МГц, CDCl3) δ 2,45 (с, 3H), 2,48 (с, 3H), 5,34 (ушир.с, 2H), 7,46-7,43 (м, 3H), 8,4-8,38 (м, 2H). МС 256 (MH+).
Пример 35: 5,6-Диметил-2-пропилтиено[2,3-d]пиримидин-4-амин

Получают по методике примера 34 из 2-амино-4,5-диметилтиофен-3-карбонитрила и триэтилортобутаната.1H ЯМР (400 МГц, ДМСО-d6) δ 0,87 (т, J=7,6 Гц, 3H), 1,72-1,67 (м, 2H), 2,33(с, 3H), 2,36 (с, 3H), 2,57 (т, J=7,2 Гц, 2H), 6,73 (ушир.с, 2H). МС 222 (MH+).
Пример 36: 5,6-Диметил-2-(метилсульфонил)тиено[2,3-d]пиримидин-4-амин

К суспензии 5,6-диметил-2-(метилтио)тиено[2,3-d]пиримидин-4-амин (Пример 1) (200 мг, 0,89 ммоль) в ДХМ (25 мл) добавляют м-хлорпероксибензойную кислоту (767 мг, 4,44 ммоль). После перемешивания при комнатной температуре в течение ночи, реакционную смесь разбавляют EtOAc, промывают водой и насыщенным раствором соли, сушат над Na2SO4, фильтруют и выпаривают. Остаток очищают препаративной ВЭЖХ, элюируя ацетонитрилом и водой, с получением указанного в заголовке соединения (45 мг, 20%).1H ЯМР (400 МГц, ДМСО-d6) δ 2,42 (с, 6H), 3,27 (с, 3H). МС 258 (MH+).
Пример 37: Этил 5,6-диметил-2-тиоксо-1,2-дигидротиено[2,3-d]пиримидин-4-илкарбамат

К суспензии 4-амино-5,6-диметилтиено[2,3-d]пиримидин-2(1H)-тиона (211 мг, 1 ммоль) в ДМФ (5 мл) добавляют Et3N (0,21 мл, 1,5 ммоль) и этилхлорформиат (0,143 мл, 1,5 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, затем разбавляют EtOAc, промывают водой и насыщенным раствором соли, сушат над Na2SO4, фильтруют и выпаривают. Остаток очищают на Biotage SP-1, элюируя EtOAc/гексаном с получением указанного в заголовке соединения (154 мг, 54%).1H ЯМР (400 МГц, ДМСО-d6) δ 1,22 (т, J=7,2 Гц, 3H), 2,38 (с, 3H), 2,39 (с, 3H), 4,25 (кв., J=7,2 Гц, 2H), 7,25-7,21 (м, 2H). МС 284 (MH+).
Пример 38: 2-Хлорхиназолин-4-амин

К раствору 2,4-дихлорхиназолина (2,0 г, 10 ммоль) в ТГФ (10 мл) добавляют аммиак (28-30% в воде, 18 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляют EtOAc, промывают насыщенным NaHCO3, водой и насыщенным раствором соли, сушат над Na2SO4, фильтруют и выпаривают. Полученное твердое вещество промывают EtOAc с получением указанного в заголовке соединения (1,3 г, 72%).1H ЯМР (400 МГц, ДМСО-d6) δ 7,52-7,48 (м, 1H), 7,6-7,58 (м, 1H), 7,8-7,76 (м, 1H), 8,22-8,20 (м, 1H), 8,32 (ушир.с, 2H).
Пример 39: 2-Хлор-N-метилхиназолин-4-амин
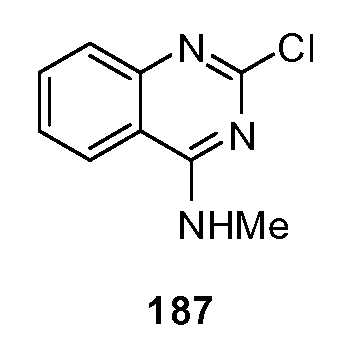
Получают по методике примера 38 из 2,4-дихлорхиназолина и метиламина.1H ЯМР (400 МГц, ДМСО-d6) δ 2,98 (д, J=4,4 Гц, 3H), 7,53-7,49 (м, 1H), 7,61-7,58 (м, 1H), 7,79-7,75 (м, 1H), 88,19-8,17 (м, 1H),,78 (ушир.с, 1H).
Пример 40: 2-Хлор-N,N-диметилхиназолин-4-амин
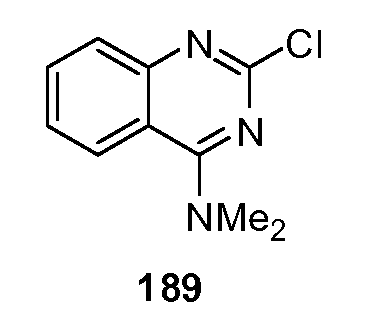
Получают по методике примера 38 из 2,4-дихлорхиназолина и диметиламина.1H ЯМР (400 МГц, CDCl3) δ 3,42 (с, 6H), 7,42-7,39 (м, 1H), 7,72-7,70 (м, 1H), 7,79-7,77 (м, 1H), 8,03-8,01 (м, 1H). МС 208 (MH+).
Пример 41: N2,N2,N4,N4-тетраметилхиназолин-2,4-диамин

Получают по методике примера 38 из 2,4-дихлорхиназолина и диметиламина.1H ЯМР (400 МГц, CDCl3) δ 3,27-3,23 (м, 12H), 7,01-6,97 (м, 1H), 7,51-7,47 (м, 2H), 7,80-7,78 (м, 1H). МС 217 (MH+).
Пример 42: 2-Гидразинилхиназолин-4-амин

Смесь 2-хлорхиназолин-4-амина (Пример 38) (100 мг, 0,56 ммоль) и гидразина (0,09 мл, 2,79 ммоль) в этаноле (5 мл) нагревают в герметично закрытой колбе при 80°С в течение ночи. После охлаждения реакционной смеси полученный осадок собирают фильтрацией, промывают этанолом и сушат на воздухе с получением указанного в заголовке соединения (84 мг, 86%).1H ЯМР (400 МГц, ДМСО-d6) δ 4,2 (ушир.с, 2H), 4,6 (ушир.с, 2H), 7,0 (т, J=7,2 Гц, 1H), 7,27 (д, J=8,0 Гц, 1H), 7,43 (с, 1H), 7,61 (с, 1H), 7,87 (д, J=7,6 Гц, 1H).
Пример 43: 2-(Гидроксиамино)хиназолин-4-амин
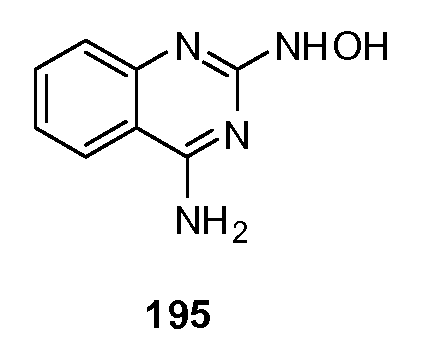
Получают по методике примера 42 из 2-хлорхиназолин-4-амина (Пример 38) и гидроксиламина.1H ЯМР (400 МГц, ДМСО-d6) δ 7,44-7,35 (м, 2H), 7,78-7,74 (м, 2H), 8,24-8,22 (м, 1H), 8,95-8,76 (м, 2H). МС 177 (MH+).
Пример 44: 2-(Метоксиамино)хиназолин-4-амин

Получают по методике примера 42 из 2-хлорхиназолин-4-амина (Пример 38) и метоксиламина.1H ЯМР (400 МГц, ДМСО-d6) δ 3,79 (с, 3H), 7,48-7,44 (м, 1H), 7,86-7,80 (м, 2H), 8,27 (д, J=8,0 Гц, 1H), 8,99 (с, 1H), 9,16 (с, 1H), 12,39-12,08 (м, 1H). МС 191 (MH+).
Пример 45: N′-(4-Аминохиназолин-2-ил)ацетогидразид

Получают по методике примера 42 из 2-хлорхиназолин-4-амина (Пример 38) и метоксиламина.1H ЯМР (400 МГц, ДМСО-d6) δ 1,86 (с, 3H), 7,09 (т, J=7,2 Гц, 1H), 7,27 (д, J=8,4 Гц, 1H), 7,54-7,44 (м, 3H), 8,04-7,99 (м, 2H), 9,63 (с, 1H). МС 218 (MH+).
Пример 46: 4-(Метиламино)хиназолин-2(1H)-тион

Смесь 2-хлор-N-метилхиназолин-4-амина (Пример 39) (100 мг, 0,52 ммоль), тиомочевины (47,5 мг, 0,62 ммоль) и муравьиной кислоты (0,02 мл, 0,52 ммоль) в этаноле (5 мл) кипятят с обратным холодильником в течение 1,5 ч. После охлаждения до комнатной температуре, реакционную смесь нейтрализуют разбавленным водным раствором NaOH. Растворитель удаляют в вакууме, и остаток очищают препаративной ВЭЖХ, элюируя ацетонитрилом и водой с получением указанного в заголовке соединения (18 мг, 18%).1H ЯМР (400 МГц, ДМСО-d6) δ 2,99 (д, J=4,8 Гц, 3H), 7,25 (т, J=7,6 Гц, 1H), 7,35 (д, J=8,0 Гц, 1H), 7,65-7,61 (м, 1H), 8,0 (д, J=8,0 Гц, 1H), 8,70 (д, J=4,4 Гц, 1H), 12,32 (с, 1H). МС 192 (MH+).
Пример 47: 4-(Диметиламино)хиназолин-2(1H)-тион

Получают по методике примера 46 из 2-хлор-N,N-диметилхиназолин-4-амина (Пример 40) и тиомочевины.1H ЯМР (400 МГц, ДМСО-d6) δ 3,31 (с, 6H), 7,24-7,19 (м, 1H), 7,40-7,38 (м, 1H), 7,65-7,61 (м, 1H), 8,00 (д, J=8,0 Гц, 1H), 12,35(с, 1H). МС 206 (MH+).
Пример 48: 5,6,7,8-Тетрагидрохиназолин-2,4(1H,3H)-дион

Раствор 2-оксоциклогексанкарбонитрила (615 мг, 5,0 ммоль) и мочевины (600 мг, 10,0 ммоль) в 1,25н HCl в EtOH (20 мл) кипятят с обратным холодильником в течение ночи. Затем ее охлаждают до 0°С, осадок собирают фильтрацией, промывают EtOH/H2O и сушат в вакууме в течение ночи с получением продукта в виде твердого вещества белого цвета.1H ЯМР (400 МГц, CD3OD) δ 1,67-1,80 (м, 4H), 2,25-2,29 (м, 2H), 2,38-2,42 (м, 2H). МС 167 (MH+).
Пример 49: 5,7-Дигидротиено[3,4-d]пиримидин-2,4(1H,3H)-дион

Получают по методике примера 48 из 4-оксотетрагидротиофен-3-карбонитрила в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 3,74 (т, J=3,6 Гц, 2H), 3,96 (т, J=3,6 Гц, 2H), 11,06 (с, 1H), 11,21 (с, 1H). МС 171 (MH+).
Пример 50: 5,6-Диметил-2-тиоксо-2,3-дигидротиено[2,3-d]пиримидин-4(1H)-он
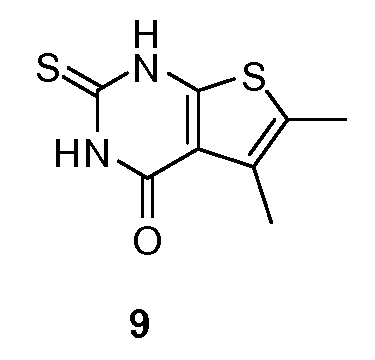
К суспензии этил 4,5-диметил-2-тиоуреидотиофен-3-карбоксилата (Пример 50a) (37 мг, 0,17 ммоль) в сухом EtOH (10 мл) добавляют гидроксид натрия (21 мг, 0,52 ммоль). Реакционную смесь затем перемешивают при комнатной температуре в течение 5 минут, и кипятят с обратным холодильником в течение 10 минут. Реакционную смесь охлаждают до комнатной температуре, нейтрализуют 10% AcOH и затем концентрируют досуха. Остаток очищают хроматографией на силикагеле (градиент 0-50% EtOAc в гексане) с получением указанного в заголовке соединения (8 мг) с 24% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 2,25 (с, 6H), 12,24 (с, 1H), 13,27 (с, 1H). МС 202 (MH+).
Пример 50a: Этил 4,5-диметил-2-тиоуреидотиофен-3-карбоксилат
К раствору этил 2-изотиоцианато-4,5-диметилтиофен-3-карбоксилата (Пример 50b) (1,21 г, 5,27 ммоль) в дихлорметане (10 мл) добавляют аммиак (7M в MeOH, 1,12 мл, 7,91 ммоль) при 0°С. Затем реакционную смесь перемешивают при комнатной температуре в течение 3 ч, гасят водой и экстрагируют дихлорметаном (3X). Объединенные органические слои промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Остаток темно-оранжевого цвета очищают хроматографией на силикагеле (градиент 0-50% EtOAc в гексане) с получением указанного в заголовке соединения (37,1 мг, 3%).1H ЯМР (400 МГц, ДМСО-d6) δ 1,32 (т, 3H, J=7,1 Гц), 2,18 (с, 3H), 2,19 (с, 3H), 4,30 (кв., 2H, J=7,1 Гц), 8,43 (с, 2H), 11,38 (с, 1H). МС 259 (MH+).
Пример 50b: Этил 2-изотиоцианато-4,5-диметилтиофен-3-карбоксилат
К смеси тиофосгена (5,10 мл, 7,64 ммоль) и карбоната кальция (1,05 г, 10,54 ммоль) в CHCl3/H2O (1/2 объема, 6 мл) по каплям добавляют раствор этил 2-амино-4,5-диметилтиофен-3-карбоксилата (1,05 г, 5,27 ммоль) в CHCl3 (7 мл) при 0°С в течение 1 ч. Реакционную смесь перемешивают в течение 2,5 ч при 0°С, промывают водой (3X). Органический слой сушат над MgSO4, фильтруют и концентрируют с получением указанного в заголовке соединения (1,21 г, 100%).1H ЯМР (400 МГц, ДМСО-d6) δ 1,32 (т, 3H, J=7,1 Гц), 2,19 (с, 3H), 2,30 (с, 3H), 4,28 (кв., 2H, J=7,1 Гц).
Пример 51: 4-Этил-5,6-диметилтиено[2,3-d]пиримидин-2(1H)-он

К раствору 1-(4,5-диметил-3-пропионилтиофен-2-ил)мочевины (Пример 51a) (15,4 мг, 0,068 ммоль) в сухом EtOH (10 мл) добавляют гидроксид натрия (8,4 мг, 0,20 ммоль). Реакционную смесь затем перемешивают при КТ в течение 30 минут в атмосфере азота. Реакционную смесь нейтрализуют 10% AcOH и затем концентрируют досуха. Остаток очищают хроматографией на силикагеле (градиент 0-10% MeOH в дихлорметане) с получением указанного в заголовке соединения (2,7 мг, 19%).1H ЯМР (400 МГц, CDCl3) δ 1,42 (т, J=7,6 Гц, 3H), 2,31 (с, 3H), 2,33 (с, 3H), 3,06 (кв., J=7,6 Гц, 2H). МС 209 (MH+).
Пример 51a: 1-(4,5-Диметил-3-пропионилтиофен-2-ил)мочевина
К раствору трифосгена (68 мг, 0,224 ммоль) в сухом дихлорметане (2 мл) добавляют по каплям смесь 1-(2-амино-4,5-диметилтиофен-3-ил)пропан-1-она (Пример 51b) (111 мг, 0,605 ммоль) и ДИЭА (0,24 мл, 1,344 ммоль) в сухом дихлорметане (3,5 мл) в течение периода 20 минут. После перемешивания реакционной смеси в течение 5 минут добавляют смесь аммиака (7M в MeOH, 0,086 мл, 0,605 ммоль) и ДИЭА (0,24 мл, 1,344 ммоль) в сухом дихлорметане (2 мл) одной порцией. Затем реакционную смесь перемешивают при комнатной температуре в течение 1 ч в атмосфере азота. Реакционную смесь концентрируют досуха. Остаток растворяют в EtOAc (50 мл) и затем промывают 10% NaHSO4, 5% NaHCO3 и насыщенным раствором соли. Органический слой сушат над MgSO4, фильтруют и концентрируют. Желтый остаток очищают хроматографией на силикагеле (градиент 0-50% EtOAc в гексане) с получением указанного в заголовке соединения (15,4 мг, 30%).1H ЯМР (400 МГц, CDCl3) δ 1,18 (т, 3H, J=7,2 Гц), 2,25 (с, 3H), 2,30 (с, 3H), 2,87 (кв., 2H, J=7,2 Гц), 4,77 (с, 2H), 11,99 (с, 1H). МС 227 (MH+).
Пример 51b: 1-(2-Амино-4,5-диметилтиофен-3-ил)пропан-1-он
К раствору 3-оксопентеннитрила (971 мг, 10 ммоль) в сухом EtOH (100 мл) добавляют серу (2,57 г, 10 ммоль), бутанон (0,91 мл, 10 ммоль) и морфолин (0,88 мл, 10 ммоль) при комнатной температуре в атмосфере азота. Затем реакционную смесь кипятят с об при 90°С в течение 6 ч и затем перемешивают в течение ночи при комнатной температуре в атмосфере азота. Оранжево-коричневую реакционную смесь концентрируют. Остаток разбавляют водой и экстрагируют EtOAc (2 X). Объединенные органические слои промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают дважды: сначала хроматографией на силикагеле (градиент 0-25% EtOAc в гексане) и затем препаративной ВЭЖХ (0-90% ацетонитрил в воде) с получением указанного в заголовке соединения (123 мг, 7%).1H ЯМР (400 МГц, CDCl3) δ 1,17 (т, 3H, J=7,2 Гц), 2,17 (с, 3H), 2,24 (с, 3H), 2,78 (кв., 2H, J=7,2 Гц), 6,81 (с, 2H). МС 184 (MH+).
Пример 52: 4-Этил-5,6-диметилтиено[2,3-d]пиримидин-2(1H)-он

К раствору бромида метилмагния (3,0 M в эфире, 4,0 мл, 12,0 ммоль) в сухом эфире (5 мл) по каплям добавляют к раствору 2-аминобензонитрила (723 мг, 6,0 ммоль) в сухом эфире (5 мл) при КТ в атмосфере азота. После кипячения смеси с обратным холодильником в течение 2 ч в атмосфере азота, реакционную смесь охлаждают до 0°С и по каплям добавляют метилхлорформиат (0,7 мл, 9,0 ммоль). Добавляют сухой ТГФ (5 мл) для растворения полученного осадка. Затем реакционную смесь кипятят с обратным холодильником в течение ночи в атмосфере азота. Реакционную смесь подкисляют 1н HCl и затем нейтрализуют 5% водным раствором NaHCO3. Водную смесь промывают EtOAc, и водный слой концентрируют. Остаток очищают препаративной ВЭЖХ (0-90% ацетонитрил в воде) с получением указанного в заголовке соединения (15,2 мг).1H ЯМР (400 МГц, CD3OD) δ 2,79 (с, 3H), 7,33 (д, J=7,1 Гц, 1H), 7,34 (т, J=7,1 Гц, 1H), 7,75 (тд, J=1,2, 7,8 Гц, 1H), 8,03 (дд, J=1,2 8,4 Гц, 1H). МС 161 (MH+).
Пример 53: 4-аминопиридо[2,3-d]пиримидин-2(1H)-он

Раствор N-(3-цианопиридин-2-илкарбамоил)бензамид (пример 53a) (360 мг, 1,35 ммоль) и NaOH (2н, 1,85 мл) в EtOH (5мл) перемешивают при 100°С в атмосфере азота в течение получаса. После охлаждения до комнатной температуры прозрачный реакционный раствор фильтруют, и фильтрат осторожно нейтрализуют с 10% AcOH при энергичном перемешивании при 0°С. Полученный осадок собирают фильтрацией и промывают теплым 20% EtOH в воде с получением конечного продукта 4-аминопиридо[2,3-d]пиримидин-2(1H)-она (120 мг, 55%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,22 (дд, J=4,4 Гц, 4,8 Гц, 1H), 7,29 (дд, J=4,8 Гц, 1H), 8,24 (дд, J=2 Гц, 1,6 Гц, 1H), 8,59 (дд, J=2 Гц, 1,6 Гц, 1H), 8,66-8,71 (м, 2H), 8,70 (д, J=1,2 Гц, 1H). МС 162 (MH+).
Пример 53a: N-(3-цианопиридин-2-илкарбамоил)бензамид
К раствору 2-амино-3-цианопиридина (300 мг, 2,5 ммоль) в 1,4-диоксане (5 мл) добавляют бензоилизоцианат (370 мг, 2,5 ммоль). Затем реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение ночи. Осадок собирают фильтрацией, промывают EtOAc/гексаном (1:4) и сушат в вакууме с получением N-(3-цианопиридин-2-илкарбамоил)бензамида в виде твердого вещества белого цвета (360 мг, 54%). МС 266 (MH+).
Пример 54: 5,6-диметилхиназолин-2,4(1H,3H)-дион

Получают по методике примера 53 из N-(2-циано-3,4-диметилфенилкарбамоил)бензамида (Пример 54a) в виде твердого вещества белого цвета (90 мг, 66%).1H ЯМР (400 МГц, ДМСО-d6) δ 2,24 (с, 3H), 2,54 (с, 3H), 6,87 (д, J=8,4 Гц, 1H), 7,32 (д, J=8,4 Гц, 1H), 10,51 (с, 1H). МС 189 (MH+).
Пример 54a: N-(2-циано-3,4-диметилфенилкарбамоил)бензамид
Получают по методике примера 53a из 6-амино-2,3-диметилбензонитрила и бензоилизоцианата в виде твердого вещества беловатого цвета (210 мг, 72%).1H ЯМР (400 МГц, ДМСО-d6) δ 2,27 (с, 3H), 2,43 (с, 3H), 7,48 (д, J=6,4 Гц, 2H), 7,53 (т, J=8 Гц, 7,6 Гц, 2H), 7,65 (т, J=7,2 Гц, 1H), 7,94 (д, J=8 Гц, 1H), 8,03 (д, J=7,6 Гц, 2H), 11,29 (с, 1H), 11,37 (с, 1H). МС 293 (MH+).
Пример 55: 4-амино-7-метоксихиназолин-2(1H)-он

Получают по методике примера 53 из N-(2-циано-5-метоксифенилкарбамоил)бензамида (Пример 55a) в виде твердого вещества белого цвета (24 мг, 37%).1H ЯМР (400 МГц, ДМСО-d6) δ 3,79 (с, 3H), 6,63 (д, J=4 Гц, 1H), 6,67 (дд, J=2,4 Гц, 2,8 Гц, 1H), 7,67 (ушир., 2H), 7,89 (д, J=8,8 Гц, 1H), 10,61 (с, 1H). МС 191 (MH+).
Пример 55a: N-(2-циано-5-метоксифенилкарбамоил)бензамид
Получают по методике примера 53a из 2-амино-4-метоксибензонитрила и бензоилизоцианата в виде твердого вещества белого цвета (99 мг, 45%).1H ЯМР (400 МГц, ДМСО-d6) δ 3,86 (с, 3H), 6,87 (дд, J=2,5 Гц, 2,4 Гц, 1H), 7,54 (т, J=8 Гц, 2H), 7,66 (т, J=1,2 Гц, 1H), 7,77 (д, J=7,2 Гц, 1H), 7,89 (д, J=8,4 Гц, 1H), 8,03 (д, J=2,8 Гц, 2H), 11,35 (с, 1H), 11,52 (с, 1H). МС 295 (MH+).
Пример 56: 4-амино-5-метоксихиназолин-2(1H)-он

Получают по методике примера 53 из N-(2-циано-3-метоксифенилкарбамоил)бензамида (Пример 56a) в виде твердого вещества светло-желтого цвета (35 мг, 51%).1H ЯМР (400 МГц, ДМСО-d6) δ 3,93 (с, 3H), 6,67 (дд, J=7,6 Гц, 8,4 Гц, 2H), 7,45 (т, J=8 Гц, 1H), 7,75 (с, 1H), 7,93-7,97 (ушир., 1H), 10,69 (с, 1H). МС 191 (MH+).
Пример 56a: N-(2-циано-3-метоксифенилкарбамоил)бензамид
Получают по методике примера 53a из 2-амино-6-метоксибензонитрила и бензоилизоцианата в виде твердого вещества светло-оранжевого цвета (118 мг, 41%).1H ЯМР (400 МГц, ДМСО-d6) δ 3,94 (с, 3H), 6,98 (д, J=8 Гц, 1H), 7,54 (т, J=8 Гц, 2H), 7,64 (т, J=8,4 Гц, 2H), 7,88 (д, J=8,4 Гц, 1H), 8,04 (д, J=5,6 Гц, 2H), 11,35 (с, 1H), 11,51 (с, 1H). МС 295 (MH+).
Пример 57: 4-амино-5-гидроксихиназолин-2(1H)-он

Получают по методике примера 53 из N-(2-циано-3-гидроксифенилкарбамоил)бензамида (Пример 57a) в виде твердого вещества зеленого цвета (50 мг, 53%).1H ЯМР (400 МГц, ДМСО-d6) δ 6,66 (д, J=8,4 Гц, 1H), 6,73 (д, J=7,6 Гц, 1H), 7,57 (т, J=8,8 Гц, 1H), 9,47 (с, 1H), 9,68 (с, 1H), 11,84 (с, 1H). МС 177 (MH+).
Пример 57a: N-(2-циано-3-гидроксифенилкарбамоил)бензамид
Получают по методике примера 53a из 2-амино-6-гидроксибензонитрила и бензоилизоцианата в виде твердого вещества беловатого цвета (166 мг, 46%).1H ЯМР (400 МГц, ДМСО-d6) δ 6,76 (д, J=8,4 Гц, 1H), 7,46 (т, J=8 Гц, 1H), 7,54 (т, J=8 Гц, 2H), 7,66-7,73 (м, 2H), 8,04-8,06 (д, J=8 Гц, 2H), 11,24 (с, 1H), 11,30 (с, 1H), 11,42 (с, 1H). МС 281 (MH+).
Пример 58: 4-амино-7-гидроксихиназолин-2(1H)-он
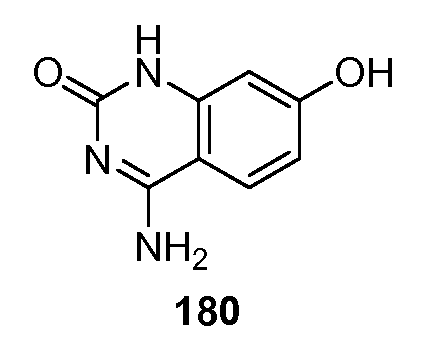
Получают по методике примера 53 из N-(2-циано-5-гидроксифенилкарбамоил)бензамида (Пример 58a) в виде твердого вещества светло-серого цвета (104 мг, 41%).1H ЯМР (400 МГц, ДМСО-d6) δ 6,51 (с, 2H), 6,52 (д, J=2,4 Гц, 1H), 7,69-7,72 (ушир., 1H), 7,82 (д, J=9,2 Гц, 2H), 10,57 (ушир., 1H). МС 177 (MH+).
Пример 58a: N-(2-циано-5-гидроксифенилкарбамоил)бензамид:
Получают по методике примера 53a, но кипятят с обратным холодильником в ацетоне вместо 1,4-диоксана, из 2-амино-4-гидроксибензонитрила и бензоилизоцианата в виде твердого вещества желтого цвета (399 мг, 94%). МС 281 (MH+).
Пример 59: 4-амино-8-метоксихиназолин-2(1H)-он
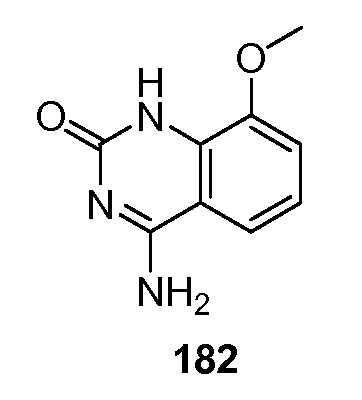
Получают по методике примера 53 из N-(2-циано-6-метоксифенилкарбамоил)бензамида (Пример 59a) в виде твердого вещества темно-белого цвета (75 мг, 39%).1H ЯМР (400 МГц, ДМСО-d6) δ 3,86 (с, 3H), 7,02 (т, J=8,4 Гц, 1H), 7,17 (д, J=7,2 Гц, 1H), 7,56 (д, J=7,6 Гц, 1H), 7,85 (ушир., 2H), 9,73(с, 1H). МС 191 (MH+).
Пример 59a: N-(2-циано-6-метоксифенилкарбамоил)бензамид:
Получают по методике примера 53a из 2-амино-3-метоксибензонитрила и бензоилизоцианата в виде твердого вещества светло-оранжевого цвета (280 мг, 95%).1H ЯМР (400 МГц, ДМСО-d6) δ 3,89 (с, 3H), 7,42 (т, J=3,2 Гц, 2H), 7,46 (д, J=3,6 Гц, 1H), 7,54 (т, J=8 Гц, 2H), 7,66 (т, J=7,6 Гц, 1H), 8,05 (д, J=8,6 Гц, 2H), 10,55 (с, 1H), 11,32 (с, 1H). МС 295 (MH+).
Пример 60: 8-амино-[1,3]диоксоло[4,5-g]хиназолин-6(5H)-он
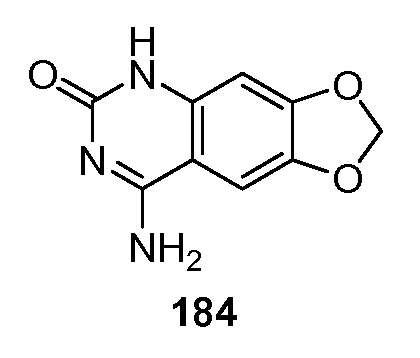
Получают по методике примера 53 из N-(6-цианобензо[d][1,3]диоксол-5-илкарбамоил)бензамида (Пример 60a) в виде твердого вещества светло-желтого цвета (80 мг, 77%).1H ЯМР (400 МГц, ДМСО-d6) δ 6,24 (с, 2H), 6,74 (с, 1H), 7,75 (с, 1H), 9,36 (д, J=10,4 Гц, 1H), 9,80 (д, J=7,2 Гц, 1H), 12,01 (с, 1H). МС 205 (MH+).
Пример 60a: N-(6-цианобензо[d][1,3]диоксол-5-илкарбамоил)бензамид:
Получают по методике примера 53a из 6-аминобензо[d][1,3]диоксол-5-карбонитрила и бензоилизоцианата в виде твердого вещества желтого цвета (157 мг, 82%).1H ЯМР (400 МГц, ДМСО-d6) δ 6,19 (с, 2H), 7,42 (с, 1H), 7,54 (т, J=8 Гц, 2H), 7,66 (т, J=7,6 Гц, 1H), 7,74 (с, 1H), 8,03 (д, J=9,2 Гц, 2H), 11,32 (д, J=12,8 Гц, 2H). МС 309 (MH+).
Пример 61: 4-(Метоксиамино)хиназолин-2(1H)-он

К суспензии 2,4-дихлорхиназолина (995 мг, 5,0 ммоль) в сухом EtOH (100 мл), добавляют гидрохлорид метоксиамина (569 мг, 5,5 ммоль) и NaOH (227 мг, 5,5 ммоль) одной порцией при 0°С. Реакционную смесь перемешивают при 0°С в течение 1 часа, затем помещают в холодильник при 4°С на 72 ч. После завершения, реакционную смесь концентрируют, и остаток растворяют в EtOAc и промывают насыщенным NaHCO3 (1 x) и насыщенным раствором соли (1 x). Органическую фазу сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают препаративной ВЭЖХ (10-90% CH3CN в H2O) с получением 4-(метоксиамино)хиназолин-2(1H)-он (556 мг, 36%) в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 3,68 (с, 3H), 7,02 (т, J=7,4 Гц, 1H), 7,35 (д, J=7,9 Гц, 1H), 7,52 (ддд, J=8,1, 7,0, 1,5 Гц, 1H), 7,77 (дд, J=7,8, 1,4 Гц, 1H), 10,13 (ушир.с, 1H), 10,89 (ушир.с, 1H). МС 192,2 (MH+).
Пример 62: 4-Этоксихиназолин-2(1H)-он

Очистка препаративной ВЭЖХ (10-90% CH3CN в H2O) неочищенного продукта из примера 61 также дает 4-этоксихиназолин-2(1H)-он (90 мг, 9%) в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,35 (т, J=7,0 Гц, 3H), 4,44 (кв., J=7,0 Гц, 2H), 7,34 (ддд, J=8,1, 7,0, 1,2 Гц, 1H), 7,46 (дд, J=8,2, 1,0 Гц, 1H), 7,71 (ддд, J=8,5, 7,0, 1,2 Гц, 1H), 8,01 (дд, J=8,2, 1,5 Гц, 1H), 12,25 (ушир.с, 1H). МС 191,1 (MH+).
Пример 63: 4-Амино-5-метил-2-оксо-1,2-дигидротиено[2,3-d]пиримидин-6-карбоновая кислота

К раствору трет-бутил 4-амино-5-метил-2-оксо-1,2-дигидротиено[2,3-d]пиримидин-6-карбоксилата (пример 64a) (10,7 г, 38,03 ммоль) в CH2Cl2 (25 мл), добавляют трифторуксусную кислоту (25 мл, 324,5 ммоль). Реакционную смесь перемешивают при КТ в течение ночи. Выпавшее в осадок твердое вещество собирают фильтрацией и промывают CH2Cl2 с получением 4-амино-5-метил-2-оксо-1,2-дигидротиено[2,3-d]пиримидин-6-карбоновой кислоты (6,98 г, 82%) в виде твердого вещества светло-коричневого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,78 (с, 3H). МС 226,0 (MH+).
Пример 64: трет-Бутил 4-амино-5-метил-2-оксо-1,2-дигидротиено[2,3-d]пиримидин-6-карбоксилат
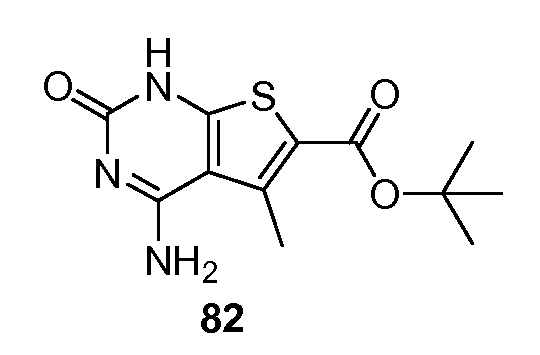
К суспензии трет-бутил 5-(3-бензоилуреидо)-4-циано-3-метилтиофен-2-карбоксилата (пример 64a) (18 г, 60,52 ммоль) в EtOH (200 мл) добавляют NaOH (75 мл, 2н). Суспензия становится прозрачной, и смесь нагревают до температуры кипения с обратным холодильником в течение 30 мин. После охлаждения до КТ реакционную смесь фильтруют, и фильтрат охлаждают до 0°С в ледяной/водной бане. Раствор нейтрализуют 10% уксусной кислотой. Твердый осадок собирают фильтрацией и нагревают в EtOH при 80°С в N2 в течение 20 мин. После охлаждения до КТ продукт собирают фильтрацией и промывают 10% EtOH в H2O с получением трет-бутил 4-амино-5-метил-2-оксо-1,2-дигидротиено[2,3-d]пиримидин-6-карбоксилата (10,73 г, 63%) в виде твердого вещества коричневого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,51 (с, 9H), 2,73 (с, 3H), 3,18 (с, 2H). МС 282,2 (MH+).
Пример 64a: трет-бутил 5-(3-бензоилуреидо)-4-циано-3-метилтиофен-2-карбоксилат
К раствору трет-бутил 5-амино-4-циано-3-метилтиофен-2-карбоксилата (пример 64b) (16 г, 67,14 ммоль) в диоксане (200 мл), добавляют бензоилизоцианат (10 г, 67,14 ммоль). Реакционную смесь перемешивают при КТ в течение ночи, и после завершения разбавляют EtOAc, промывают NaHCO3, водой, насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют с получением трет-бутил 5-(3-бензоилуреидо)-4-циано-3-метилтиофен-2-карбоксилат (21,78 г, 84%) в виде твердого вещества коричневого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,54 (с, 9H), 3,58 (с, 3H), 7,58 (т, J=7,5 Гц, 2H), 7,71 (т, J=7,5 Гц, 1H), 7,88 (д, J=7,5 Гц, 1H), 8,05 (д, J=7,5 Гц, 2H), 12,25 (ушир.с, 1H).
Пример 64b: трет-бутил 5-амино-4-циано-3-метилтиофен-2-карбоксилат
К раствору трет-бутил 3-оксобутаноата (30 мл, 183,94 ммоль) в сухом EtOH (360 мл), добавляют элементарную серу (5,90 г, 183,94 ммоль), малононитрил (12,16 г, 183,94 ммоль) и триэтиламин (25,6 мл, 183,94 ммоль). Реакционную смесь нагревают до 80°С и перемешивают в течение 2 ч. После охлаждения до КТ смесь концентрируют при пониженном давлении. Полученный остаток растворяют в EtOAc, промывают NaHCO3, водой, насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Неочищенный остаток очищают флэш-хроматографией на силикагеле (20% EtOAc в гексане) с получением трет-бутил 5-амино-4-циано-3-метилтиофен-2-карбоксиалата (31,2 г, 73%) в виде твердого вещества коричневого цвета.
Пример 65: 4-Аминохинолин-2(1H)-он
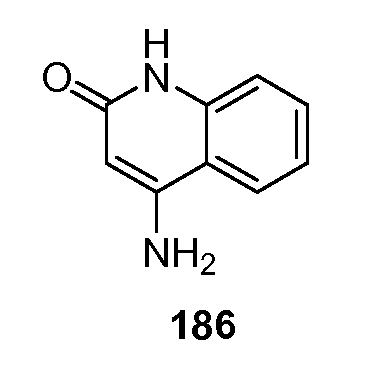
4-Амино-2-оксо-1,2-дигидрохинолин-3-карбоновую кислоту (Пример 64) (0,030 г, 0,15 ммоль) нагревают в чистом виде при 295°C в течение 10 минут, затем охлаждают до комнатной температуры с получением 4-аминохинолин-2(1H)-он (0,023 г, 99%) в виде твердого вещества светло-желтого цвета. Т. пл.: > 250°С.1H ЯМР (400 МГц, ДМСО-d6) δ 5,42 (с, 1H), 6,55 (с, 2H), 7,07 (т, J=7,6 Гц, 1H), 7,19 (д, J=8,0 Гц, 1H), 7,42 (т, J=7,2 Гц, 1H), 7,86 (д, J=7,6 Гц, 1H), 10,71 (с, 1H). МС 161 (MH+).
Пример 66: 4-Амино-2-оксо-1,2-дигидрохинолин-3-карбоновая кислота

Бензил 4-амино-2-оксо-1,2-дигидрохинолин-3-карбоксилат (Пример 66a) (0,6 г, 2,04 ммоль) растворяют в ДМФ (8 мл) и нагревают при 70°С в водородном баллоне в присутствии 10% Pd/C (0,15 г) в течение 1 часа. Pd/C отфильтровывают и промывают дихлорметаном, и растворители удаляют в вакууме. Остаток растворяют/суспендируют в NaOH (2M, 40 мл), перемешивают при комнатной температуре в течение 30 минут и раствор промывают дихлорметаном. Водный слой охлаждают до 0°С и подкисляют до pH 1 добавлением 2M HCl. Полученный осадок собирают и промывают дихлорметаном с получением 4-амино-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты (0,050 г, 12%) в виде твердого вещества светло-желтого цвета. Т. пл.: > 250°С.1H ЯМР (400 МГц, ДМСО-d6) δ 7,32 (м, 1H), 7,39 (д, J=7,6 Гц, 1H), 7,69 (м, 1H), 8,27 (д, J=8,4 Гц, 1H), 8,86 (с, 1H), 9,87 (с, 1H), 11,95 (с, 1H). МС 205 (MH+).
Пример 66a: Бензил 4-амино-2-оксо-1,2-дигидрохинолин-3-карбоксилат
Бензил 4-хлор-2-оксо-1,2-дигидрохинолин-3-карбоксилат (Пример 66b) (0,55 г, 1,75 ммоль) растворяют в ДМФ (8 мл) и добавляют 4-метоксибензиламин (0,56 мл, 4,31 ммоль). Реакционную смесь нагревают при 115°C в течение 30 минут, затем охлаждают до комнатной температуры и выливают в ледяную воду. Полученный осадок растворяют в 10 мл ТФК и перемешивают при комнатной температуре в течение 15 минут, затем смесь выливают в ледяную воду. Полученный осадок собирают, растворяют в дихлорметане, сушат над MgSO4, фильтруют и выпаривают с получением неочищенного бензил 4-амино-2-оксо-1,2-дигидрохинолин-3-карбоксилата (600 мг), который применяют без дальнейшей очистки. МС 295 (MH+).
Пример 66b: Бензил 4-хлор-2-оксо-1,2-дигидрохинолин-3-карбоксилат
Дибензилмалонат (7,75 мл, 31,6 ммоль) медленно добавляют к суспензии 60% гидрида натрия в минеральном масле (1,41 г, 35,3 ммоль) в безводном ДМФ (100 мл) при -20°С в атмосфере азота. После перемешивания при комнатной температуре в течение 30 минут добавляют N-карбоксиантраниловый ангидрид (5,0 г, 30,7 ммоль), и реакционную смесь нагревают при 120°С в течение 1 часа. Реакционную смесь охлаждают до -50°С и медленно добавляют оксалилхлорид (10,7, 123 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 часов, затем выливают в водный NaCl (10%, 750 мл) при 0°С, и полученный осадок отфильтровывают. Осадок растворяют в дихлорметане, сушат над MgSO4, фильтруют и выпаривают при пониженном давлении. К остатку добавляют диэтиловый эфир, и полученное твердое вещество собирают с получением бензил 4-хлор-2-оксо-1,2-дигидрохинолин-3-карбоксилата (3,56 г, 37% выход), который применяют без дальнейшей очистки. МС 314 (MH+).
Пример 67: Этил 4-гидрокси-2-оксо-1,2-дигидрохинолин-3-карбоксилат

Диэтилмалонат (11,4 мл, 75,1 ммоль) медленно добавляют к суспензии 60% гидрида натрия в минеральном масле (3,09 г, 77,3 ммоль) в безводном ДМФ (100 мл) при -10°С в атмосфере азота. После перемешивания при комнатной температуре в течение 30 минут, добавляют N-карбоксиантраниловый ангидрид (12,0 г, 73,6 ммоль), и реакционную смесь нагревают при 115°C в течение 2,5 часов. Реакционную смесь охлаждают до комнатной температуры, затем выливают в ледяную воду (1,4 л) и подкисляют до pH 4 добавлением 2M HCl. Полученный осадок собирают, затем растворяют/суспендируют в дихлорметане (450 мл). Раствор дихлорметана отфильтровывают и затем выпаривают с получением остатка, который энергично растирают с диэтиловым эфиром (150 мл) в течение 1 часа. Твердое вещество собирают с получением этил 4-гидрокси-2-оксо-1,2-дигидрохинолин-3-карбоксилата (3,63 г, 21%) в виде твердого вещества белого цвета. т. пл.: 190°С.1H ЯМР (400 МГц, ДМСО-d6) δ 1,31 (т, J=7,2 Гц, 3H), 4,35 (кв., J=7,2 Гц, 2H), 7,21 (м, 1H), 7,27 (д, J=8,0 Гц, 1H), 7,63 (м, 1H), 7,93 (дд, J=0,8, 8,4 Гц, 1H), 11,51 (с, 1H), 13,40 (с, 1H). МС 234 (MH+).
Пример 68: Метил 4-амино-2-оксо-1,2-дигидрохинолин-3-карбоксилат

Метил 4-(4-метоксибензиламино)-2-оксо-1,2-дигидрохинолин-3-карбоксилат (Пример 68a) (0,841 г, 2,49 ммоль) растворяют в ТФК (5 мл) и перемешивают при комнатной температуре в течение 30 минут. ТФК удаляют при пониженном давлении, и остаток растворяют в дихлорметане, затем осаждают добавлением избытка диэтилового эфира. Полученное твердое вещество собирают фильтрацией, суспендируют в дихлорметане и промывают концентрированным бикарбонатом натрия. Твердое вещество собирают с получением метил 4-амино-2-оксо-1,2-дигидрохинолин-3-карбоксилата (0,230 г, 42%) в виде твердого вещества белого цвета. т. пл.: 236°C.1H ЯМР (400 МГц, ДМСО-d6) δ 3,73 (с, 3H), 7,12 (т, J=8,0 Гц, 1H), 7,17 (д, J=8,0 Гц, 1H), 7,52 (т, J=8,0 Гц, 1H), 8,08 (д, J=8,0 Гц, 1H), 8,38 (ушир.с, 2H), 10,88 (ушир.с, 1H). МС 219 (MH+).
Пример 68a: метил 4-(4-метоксибензиламино)-2-оксо-1,2-дигидрохинолин-3-карбоксилат
Метил 4-хлор-2-оксо-1,2-дигидрохинолин-3-карбоксилат (Пример 69) (0,928 г, 3,91 ммоль) растворяют в ДМФ (6 мл) и добавляют 4-метоксибензиламин (1,14 мл, 8,78 ммоль). Реакционную смесь нагревают при 90°С в течение 30 минут, затем охлаждают до комнатной температуры и выливают в перемешиваемую смесь 50 мл гексана и 100 мл ледяной воды. Полученный осадок собирают фильтрацией и далее подвергают хроматографии на силикагеле (0% до 20% MeOH в дихлорметане) с получением метил 4-(4-метоксибензиламино)-2-оксо-1,2-дигидрохинолин-3-карбоксилата в виде твердого вещества беловатого цвета (0,841 г, 64%). МС 339 (MH+).
Пример 69: Метил 4-хлор-2-оксо-1,2-дигидрохинолин-3-карбоксилат

Диметилмалонат (2,2 мл, 19,2 ммоль) медленно добавляют к суспензии 60% гидрида натрия в минеральном масле (0,81 г, 20,3 ммоль) в безводном ДМФ (100 мл) при -10°С в атмосфере азота. После перемешивания при комнатной температуре в течение 30 минут добавляют N-карбоксиантраниловый ангидрид (3,0 г, 18,4 ммоль), и реакционную смесь нагревают при 115°С в течение 2,5 часов. Затем реакционную смесь охлаждают до -40°С и медленно добавляют оксалилхлорид (6 мл, 68,8 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 20 минут и затем выливают в 1200 мл 10% NaCl при 0°С. Полученный осадок собирают фильтрацией с получением неочищенного метил 4-хлор-2-оксо-1,2-дигидрохинолин-3-карбоксилата (1,40 г, 32%), который применяют без дальнейшей очистки.1H ЯМР (400 МГц, ДМСО-d6) δ 3,87 (с, 3H), 7,39 (м, 2H), 7,70 (м, 1H), 7,92 (д, J=8,4 Гц, 1H), 12,49 (с, 1H). МС 238 (MH+).
Пример 70: Метил 4-гидрокси-2-оксо-1,2-дигидрохинолин-3-карбоксилат

Диметилмалонат (2,2 мл, 19,2 ммоль) медленно добавляют к суспензии 60% гидрида натрия в минеральном масле (0,81 г, 20,3 ммоль) в безводном ДМФ (50 мл) при -10°С в атмосфере азота. После перемешивания при комнатной температуре в течение 20 минут, добавляют N-карбоксиантраниловый ангидрид (3,0 г, 18,4 ммоль), и реакционную смесь нагревают при 115°C в течение 2,5 часов. Реакционную смесь охлаждают до комнатной температуры, затем выливают в ледяную воду (500 мл) и подкисляют до pH 2 добавлением 2M HCl. Полученный осадок собирают фильтрацией с получением неочищенного метил 4-гидрокси-2-оксо-1,2-дигидрохинолин-3-карбоксилата (2,89 г, 72%), который применяют без дальнейшей очистки.1H ЯМР (400 МГц, ДМСО-d6) δ 3,86 (с, 3H), 7,23 (м, 2H), 7,63 (м, 1H), 7,94 (дд, J=0,8, 8,0 Гц, 1H), 11,55 (с, 1H), 13,33 (с, 1H). МС 220 (MH+).
Пример 71: 4-Амино-2-оксо-1,2-дигидрохинолин-3-карбонитрил

4-хлор-2-оксо-1,2-дигидрохинолин-3-карбонитрил (пример 72) (0,66 г, 3,23 ммоль) суспендируют в ДМФ (7 мл) и добавляют 4-метоксибензиламин (0,94 мл, 7,26 ммоль). Реакционную смесь нагревают при 100°С в течение 1 часа и ДМФ удаляют в вакууме. Остаток растворяют в TFA (6 мл) и перемешивают при комнатной температуре в течение 30 минут и добавляют дихлорметан (10 мл). Образовавшийся твердый продукт собирают, суспендируют в воде, и раствор перемешивают в течение ночи. Твердое вещество собирают фильтрацией с получением 4-амино-2-оксо-1,2-дигидрохинолин-3-карбонитрил (0,150 г, 25%) в виде твердого вещества белого цвета. т. пл.: > 250°С.1H ЯМР (400 МГц, ДМСО-d6) δ 7,19 (м, 2H), 7,57 (м, 1H), 7,88 (ушир.с, 2H), 8,12 (д, J=7,6 Гц, 1H), 11,23 (с, 1H). МС 186 (MH+).
Пример 72: 4-хлор-2-оксо-1,2-дигидрохинолин-3-карбонитрил

2,4-Дихлорхинолин-3-карбонитрил (Пример 72a) (0,95 г, 4,26 ммоль) и ацетат аммония (0,36 г, 467 ммоль) нагревают в уксусной кислоте (20 мл) при 140°С в течение 4 часов, затем охлаждают до комнатной температуры. Реакционную смесь выливают в ледяную воду (400 мл), и полученный осадок собирают фильтрацией с получением 4-хлор-2-оксо-1,2-дигидрохинолин-3-карбонитрил (0,668 г, 77%) в виде твердого вещества светло-желтого цвета. т. пл.: > 250°С.1H ЯМР (400 МГц, ДМСО-d6) δ 7,42 (м, 2H), 7,79 (м, 1H), 7,96 (д, J=8,4 Гц, 1H), 12,72 (с, 1H). МС 205 (MH+).
Пример 72a: 2,4-дихлорхинолин-3-карбонитрил
N-циклогексил-4-гидрокси-2-оксо-1,2-дигидрохинолин-3-карбоксамид (Пример 73) (1,18 г, 4,12 ммоль) растворяют в оксихлориде фосфора (15 мл) и медленно добавляют триэтиламин (1,72 мл, 12,4 ммоль). Реакционную смесь нагревают при 120°С в течение 7 часов, затем охлаждают до комнатной температуры и осторожно выливают в ледяную воду (300 мл). Полученный осадок собирают фильтрацией с получением 2,4-дихлорхинолин-3-карбонитрила (0,848 г, 92%), который применяют без дальнейшей очистки. МС 223 (MH+).
Пример 73: N-циклогексил-4-гидрокси-2-оксо-1,2-дигидрохинолин-3-карбоксамид

Метил 4-гидрокси-2-оксо-1,2-дигидрохинолин-3-карбоксилат (Пример 70) (2,70 г, 12,3 ммоль) суспендируют в толуоле (27 мл) и добавляют циклогексиламин (1,40 г, 14,1 ммоль). Реакционную смесь нагревают при 115°C в течение 5 часов, затем охлаждают до комнатной температуры. Добавляют диэтиловый эфир (50 мл), и полученный осадок собирают фильтрацией с получением N-циклогексил-4-гидрокси-2-оксо-1,2-дигидрохинолин-3-карбоксамида (1,22 г, 35%) в виде твердого вещества беловатого цвета. т. пл.: 221°C.1H ЯМР (400 МГц, ДМСО-d6) δ 1,37 (м, 4H), 1,55 (м, 1H), 1,68 (м, 2H), 1,88 (м, 2H), 3,86 (м, 1H), 7,28 (т, J=8,0 Гц, 1H), 7,36 (д, J=8,0 Гц, 1H), 7,68 (т, J=7,6 Гц, 1H), 7,95 (д, J=8,0 Гц, 1H), 10,35 (д, J=7,6 Гц, 1H), 11,83 (ушир.с, 1H). МС 287 (MH+).
Пример 74: 4-амино-2-оксо-1,2-дигидрохинолин-3-карбоксамид
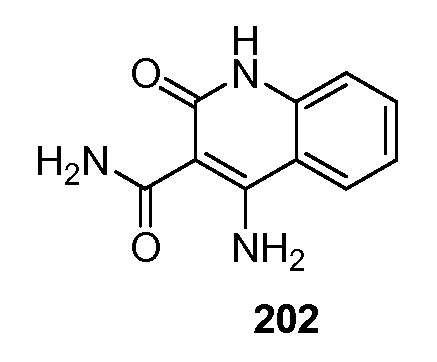
N,N-бис(4-метоксибензил)-4-(4-метоксибензиламино)-2-оксо-1,2-дигидрохинолин-3-карбоксамид (Пример 74a) (2,0 г, 3,55 ммоль) растворяют в ТФК (15 мл), и раствор перемешивают при комнатной температуре в течение 6 часов. ТФК удаляют в вакууме, и полученное твердое вещество перемешивают в воде в течение ночи, затем собирают фильтрацией с получением 1,8 граммов неочищенного конечного продукта.1H ЯМР (400 МГц, ДМСО-d6) δ 7,18 (м, 2H), 7,25 (д, J=7,2 Гц, 1H), 7,56 (т, J=8,0 Гц, 1H), 8,09 (д, J=7,6 Гц, 2H), 9,83 (д, J=4,8 Гц, 1H), 10,85 (ушир.с, 1H), 11,12 (с, 1H). МС 204 (MH+).
Пример 74a: N,N-бис(4-метоксибензил)-4-(4-метоксибензиламино)-2-оксо-1,2-дигидрохинолин-3-карбоксамид
4-хлор-N,N-бис(4-метоксибензил)-2-оксо-1,2-дигидрохинолин-3-карбоксамид (Пример 74b) (4,25 г, 9,18 ммоль) растворяют в ДМФ (20 мл) и добавляют 4-метоксибензиламин (2,68 мл, 20,6 ммоль). Реакционную смесь нагревают при 100°С в течение 1,5 часа, затем охлаждают до комнатной температуры и выливают в ледяную воду (300 мл). Полученный осадок собирают фильтрацией и далее подвергают хроматографии на силикагеле (0% - 20% MeOH в дихлорметане) с получением неочищенного N,N-бис(4-метоксибензил)-4-(4-метоксибензиламино)-2-оксо-1,2-дигидрохинолин-3-карбоксамида (3,65 г, 71%), который применяют без дальнейшей очистки. МС 564 (MH+).
Пример 74b: 4-хлор-N,N-бис(4-метоксибензил)-2-оксо-1,2-дигидрохинолин-3-карбоксамид
Триэтиламин (5,73 мл, 41,2 ммоль) добавляют к оксихлориду фосфора (60 мл), с последующим добавлением 4-гидрокси-N,N-бис(4-метоксибензил)-2-оксо-1,2-дигидрохинолин-3-карбоксамид (Пример 74c) (6,11 г, 13,7 ммоль). Реакционную смесь нагревают при 65°C в течение 4 часов, затем охлаждают до комнатной температуры и осторожно выливают в ледяную воду (1200 мл). Раствор экстрагируют дихлорметаном (2×200 мл). Органические слои объединяют и промывают водой, сушат над MgSO4, фильтруют и выпаривают. Остаток растворяют в дихлорметане (18 мл) и выливают в 200 мл 30% гексана в диэтиловом эфире. Полученный осадок собирают фильтрацией с получением неочищенного 4-хлор-N,N-бис(4-метоксибензил)-2-оксо-1,2-дигидрохинолин-3-карбоксамида (4,25 г, 67%), который применяют без дальнейшей очистки. МС 463 (MH+).
Пример 74c: 4-Гидрокси-N,N-бис(4-метоксибензил)-2-оксо-1,2-дигидрохинолин-3-карбоксамид
Этил 4-гидрокси-2-оксо-1,2-дигидрохинолин-3-карбоксилат (Пример 67) (3,58 г, 15,4 ммоль) и бис(4-метоксибензил)амин (4,54 г, 17,6 ммоль) суспендируют в толуоле (36 мл) и нагревают при 115°C в течение 5 часов, затем охлаждают до комнатной температуры. Добавляют диэтиловый эфир (50 мл), и полученный осадок собирают фильтрацией с получением неочищенного 4-гидрокси-N,N-бис(4-метоксибензил)-2-оксо-1,2-дигидрохинолин-3-карбоксамида (6,45 г, 95%) который применяют без дальнейшей очистки.
Пример 75: 4-Амино-6,7-дигидро-1H-циклопента[d]пиримидин-2(5H)-он

Раствор N-(2-цианоциклопент-1-енилкарбамоил)бензамида (пример 75a) (500 мг, 1,96 ммоль) и NaOH (2н, 2,7 мл) в EtOH (20 мл) перемешивают при 100°С в атмосфере азота в течение 2 часов. После охлаждения до комнатной температуры прозрачный реакционный раствор фильтруют, и фильтрат осторожно нейтрализуют 10% AcOH при энергичном перемешивании при 0°С. Полученный осадок собирают фильтрацией, промывают теплой водой и затем 20% EtOH в воде с получением конечного продукта 4-амино-6,7-дигидро-1H-циклопента[d]пиримидин-2(5H)-он (200 мг, 68%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 10,57 (ушир.с, 1H), 6,93 (ушир.с, 1H), 6,65 (ушир.с, 1H), 2,56 (т, J=7,2 Гц, 2H), 2,43 (т, J=7,6 Гц, 2H) 1,96-1,89 (м, 2H). МС 152 (MH+).
Пример 75a: N-(2-цианоциклопент-1-енилкарбамоил)бензамид
К раствору 2-аминоциклопент-1-енкарбонитрила (400 мг, 3,7 ммоль) в 1,4-диоксане (20 мл) добавляют бензоилизоцианат (545 г, 3,7 ммоль). Реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение ночи. Осадок собирают фильтрацией, промывают 1,4-диоксаном и сушат с получением N-(2-цианоциклопент-1-енилкарбамоил)бензамида (720 мг, 76%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, CDCl3) δ 11,33 (с, 1H), 11,22 (ушир.с, 1H), 7,99-7,97 (м, 2H), 7,67-7,63 (м, 1H), 7,54-7,51 (м, 2H), 3,04-3,0 (м, 2H), 2,51-2,47 (м, 2H) 1,95-1,90 (м, 2H). МС 256 (MH+).
Пример 76: 4-амино-6,7,8,9-тетрагидро-1H-циклогепта[d]пиримидин-2(5H)-он
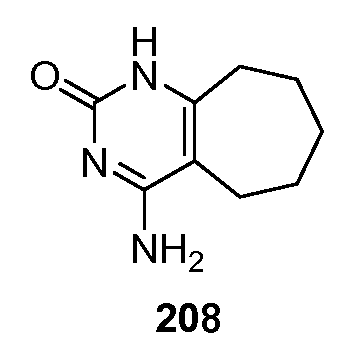
Получают по методике примера 75 из (Z)-N-(2-цианоциклогепт-1-енилкарбамоил)бензамида (Пример 76a).1H ЯМР (400 МГц, ДМСО-d6) δ 10,29 (ушир.с, 1H), 6,72 (ушир.с, 2H), 2,49-2,46 (м, 2H), 2,38-2,36 (м, 2H) 1,72-1,66 (м, 2H), 1,52-1,48 (м, 2H) 1,41-1,36 (м, 2H). МС 180 (MH+).
Пример 76a: (Z)-N-(2-цианоциклогепт-1-енилкарбамоил)бензамид:
Получают по методике примера 75a из (Z)-2-аминоциклогепт-1-енкарбонитрила и бензоилизоцианата в виде твердого вещества белого цвета. МС 284 (MH+).
Пример 77: 6-Фтор-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Раствор N-(2-циано-4-фторфенил)сульфамида (Пример 77a) (211 мг, 1,0 ммоль) в EtOH (1 мл) обрабатывают NaOH (2,0н, 1,0 мл, 2,0 ммоль), и полученный раствор нагревают до 100°С в течение 0,5 ч. После охлаждения до комнатной температуры раствор нейтрализуют 10% AcOH. Полученный осадок собирают фильтрацией, промывают водой с получением 6-фтор-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксида в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,01-7,05 (дд, J=8,8 Гц, 5,2 Гц, 1H), 7,45-7,5 (м, 1H), 7,80-7,83 (дд, J=9,6 Гц, 2,4 Гц, 1H), 8,24 (с, 1H), 11,03 (с, 1H).
Пример 77a: N-(2-Циано-4-фторфенил)сульфамид
Раствор 2-амино-5-фторбензонитрила (136 мг, 1 ммоль) и сульфамоилхлорида (114 мг, 1 ммоль) в ДМА (2 мл) перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь очищают на Varian ВЭЖХ (10% ацетонитрил/вода) с получением N-(2-циано-4-фторфенил)сульфамида в виде твердого вещества бледно-белого цвета.1H ЯМР (400 МГц, ДМСО-d6) 7,18 (м, 2H), 7,56-7,60 (дд, J=8,8 Гц, 2,8 Гц 2H), 9,44 (с, 1H).
Пример 78: 6-Хлор-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 77 из N-(2-циано-4-хлорфенил)сульфамида (Пример 78a).1H ЯМР (400 МГц, ДМСО-d6) δ 7,00-7,03 (д, J=8,8 Гц, 1H), 7,59-7,62 (дд, J=8,8 Гц, 4 Гц, 1H), 8,05-8,06 (д, J=2,4 Гц, 1H), 8,27-8,33 (д, J=25 Гц, 1H), 11,19 (с, 1H).
Пример 78a: N-(2-циано-4-хлорфенил)сульфамид
Получают по методике примера 77a из 2-амино-5-хлорбензонитрила и сульфамоилхлорида.1H ЯМР (400 МГц, ДМСО-d6) 7,3 (с, 2H), 7,54-7,56 (д, J=9,2 Гц, 1H), 7,74-7,77 (дд, J=8,4 Гц, 2 Гц, 1H), 9,67 (с, 1H).
Пример 79: 5-Хлор-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 77 из 5-хлор-(2-циано-3-хлорфенил)сульфамида (Пример 79a).1H ЯМР (400 МГц, ДМСО-d6) δ 7,00-7,03 (м, 1H), 7,20-7,23 (дд, J=8,4 Гц, 1,2 Гц, 1H), 7,48-7,52 (м, 1H), 7,75 (с, 1H), 8,61 (с, 1H), 11,22 (с, 1H).
Пример 79a: N-(2-Циано-3-хлорфенил)сульфамид
Получают по методике примера 77a из 2-амино-6-хлорбензонитрила и сульфамоилхлорида.
Пример 80: 5-Фтор-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 77 из N-(2-циано-3-фторфенил)сульфамида (Пример 80a).1H ЯМР (400 МГц, ДМСО-d6) δ 6,84-6,97 (м, 2H), 7,53-7,57 (м, 1H), 7,59 (с, 1H), 8,42 (с, 1H), 11,29 (с, 1H).
Пример 80a: N-(2-Циано-3-фторфенил)сульфамид
Получают по методике примера 77a из 2-амино-6-фторбензонитрила и сульфамоилхлорида.
Пример 81: 6,7-Диметокси-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 77 из N-(2-циано-4,5-диметоксифенил)сульфамида (Пример 81a).1H ЯМР (400 МГц, ДМСО-d6) δ 3,75-3,79 (д, J=14,4, 6H), 6,48 (с, 1H), 7,38 (с, 1H), 7,89 (ушир., 1H), 8,04 (ушир., 1H), 0,64 (с, 1H).
Пример 81a: N-(2-Циано-4,5-диметоксифенил)сульфамид
Получают по методике примера 77a из 2-амино-4,5-диметоксибензонитрила и сульфамоилхлорида.1H ЯМР (400 МГц, ДМСО-d6) δ 3,77-3,80 (д, J=14,8, 6H), 7,05 (с, 1H), 7,06 (с, 1H), 7,29 (с, 1H), 9,15 (с, 1H).
Пример 82: 7-Трифторметил-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 77 из N-(2-циано-5-трифторметилфенил)сульфамида (Пример 82a).1H ЯМР (400 МГц, ДМСО-d6) δ 7,28 (с, 1H), 7,43-7,45 (дд, J=8,8 Гц, 1,6 Гц, 1H), 8,14-8,16 (д, J=7,6 Гц, 1H), 8,41-8,52 (ушир., 2H), 11,40 (с, 1H).
Пример 82a: N-(2-Циано-5-трифторметилфенил)сульфамид
Получают по методике примера 77a из 2-амино-4-трифторметилбензонитрила и сульфамоилхлорида.1H ЯМР (400 МГц, ДМСО-d6) δ 7,53(с, 1H), 7,74-7,76 (д, J=8,4 Гц, 1H), 8,01-8,03 (дд, J=8,4 Гц, 1,6 Гц, 1H), 8,23 (с, 1H), 10,16 (ушир., 1H).
Пример 83: 6-Фенил-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид
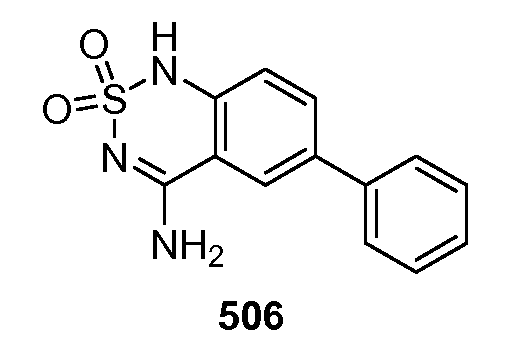
Получают по методике примера 77 из N-(2-циано-4-фенилфенил)сульфамида (Пример 83a).1H ЯМР (400 МГц, ДМСО-d6) δ 6,72-6,70 (д, J=8 Гц, 1H), 6,97-7,0 (м, 1H), 7,08-7,12 (м, 2H), 7,34-7,36 (м, 2H), 7,50-7,53 (дд, J=8,4 Гц, 1,6 Гц, 1H), 7,83 (ушир., 1H), 7,87 (с, 1H), 8,07 (ушир., 1H) 10,75 (с, 1H).
Пример 83a: N-(2-Циано-4-фенилфенил)сульфамид
В 2 мл колбе для микроволнового реактора, фенилбороновую кислоту (75 мг, 0,6 ммоль), N-(2-циано-4-бромфенил)сульфамид (Пример 83b) (137 мг, 0,5 ммоль) и карбонат калия (400 мг, 1,5 ммоль) растворяют в смеси ДМЭ/воды (1,5 мл, ДМЭ/вода 4:1). Раствор дегазируют барботированием N2 в реакционный раствор в течение 5 минут и добавляют тетракистрифенилфосфин палладия (25 мг, 0,025 ммоль). Реакционную смесь помещают в микроволновый реактор на 5 минут при 150°С. Неочищенную реакционную смесь растворяют в воде и промывают этилацетатом. Водный раствор выпаривают в вакууме с получением N-(2-циано-4-фенилфенил)сульфамида.
Пример 83b: N-(2-циано-4-бромфенил)сульфамид
Получают по методике примера 77a из 2-амино-5-бромбензонитрил и сульфамоилхлорида.1H ЯМР (400 МГц, ДМСО-d6) δ 7,31(с, 2H), 7,48-7,50 (д, J=8 Гц, 1H), 7,85-7,88 (дд, J=9,3 Гц, 1,2 Гц, 1H), 8,05-8,06 (д, J=2,4 Гц, 1H), 9,67 (с, 1H).
Пример 84: 6-(E)-проп-1-енил-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 77 из N-(2-циано-4-(E)-проп-1-енилфенил)сульфамида (Пример 84a).1H ЯМР (400 МГц, ДМСО-d6) δ 1,83-1,82 (д, J=5,6 Гц 3H), 6,29-6,25 (м, 2H), 6,85-6,87 (д, J=8,4 Гц, 1H), 7,5-7,53 (дд, J=8,4 Гц, 1,6 Гц, 1H), 7,86 (с, 1H), 7,96 (ушир., 2H), 10,95 (ушир., 1H).
Пример 84a: N-(2-Циано-4-(E)-проп-1-енилфенил)сульфамид
Получают по методике примера 77a из N-(2-циано-4-бромфенил)сульфамид (Пример 83b) и (E)-проп-1-енилбороновой кислоты.
Пример 85: 6-(2-метилпроп-1-енил)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид
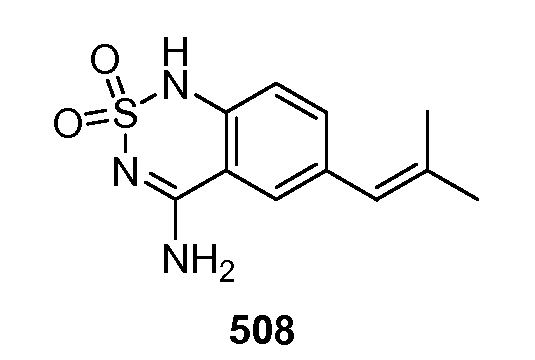
Получают по методике примера 77 из N-(2-циано-4-(2-метилпроп-1-енил)фенил)сульфамида (Пример 85a).1H ЯМР (400 МГц, ДМСО-d6) δ 1,8-1,85(дд, J=22,4 Гц, 1,2 Гц, 6H), 6,18 (с, 1H), 6,84-6,86 (д, J=8,4 Гц, 1H), 7,31-7,33 (д, J=8,4 Гц, 1H), 7,66 (с, 1H), 7,78 (ушир., 2H), 10,91 (ушир., 1H).
Пример 85a: N-(2-Циано-4-(2-метилпроп-1-енил)фенил)сульфамид
Получают по методике примера 77a из N-(2-циано-4-бромфенил)сульфамида (Пример 83b) и 2-метилпроп-1-енилбороновой кислоты.
Пример 86: 6-Трифторметил-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид
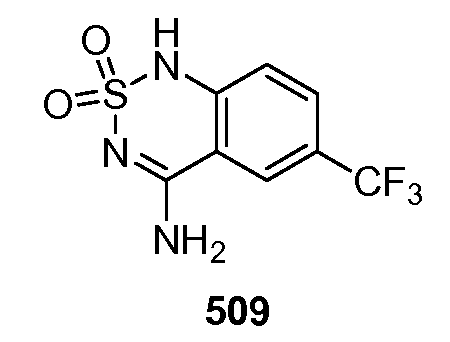
Получают по методике примера 77 из N-(2-циано-4-трифторфенил)сульфамида (Пример 86a).1H ЯМР (400 МГц, ДМСО-d6) δ 7,14-7,16 (д, J=8,8 Гц, 1H), 7,85-7,88 (дд, J=8,8 Гц, 1,6 Гц, 1H), 8,37-8,39 (д, J=9,6 Гц, 1H), 8,52 (ушир., 2H), 11,56 (с, 1H).
Пример 86a: N-(2-Циано-4-трифторметилфенил)сульфамид
Получают по методике примера 77a из 2-амино-5-(трифторметил)бензонитрила (Пример 86b) и сульфамоилхлорида.1H ЯМР (400 МГц, ДМСО-d6) δ 7,53 (с, 2H), 7,74-7,76 (д, J=8,4 Гц, 1H), 8,01-8,03 (дд, J=8,4 Гц, 1,6 Гц, 1H), 8,23-8,233 (д, J=1,2 Гц, 1H), 10,16 (ушир., 1H).
Пример 86b: 2-Амино-5-(трифторметил)бензонитрил
В 20 мл колбе для микроволнового реактора 2-бром-4-(трифторметил)анилин (238 мг, 1 ммоль) и цианид меди (90 мг, 1 ммоль) растворяют в N-метилпирролидоне (NMP) (10 мл). Реакционную смесь помещают в микроволновый реактор в течение 5 минут при 200°С. Неочищенный остаток растворяют в этилацетате и осадок удаляют фильтрацией. Прозрачный раствор промывают водой. Органический слой собирают, сушат над сульфатом натрия и выпаривают в вакууме. Остаток очищают на Varia ВЭЖХ (10% ацетонитрил/вода) с получением указанного в заголовке соединения.
Пример 87: 6-Изопропил-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 77 из N-(2-циано-4-изопропилфенил)сульфамида (Пример 87a).1H ЯМР (400 МГц, ДМСО-d6) δ 1,18-1,2(д, J=6,4 Гц, 6H), 2,85 (м, 1H), 6,91-6,93 (д, J=8,8 Гц, 1H), 7,42-7,45 (дд, J=8,8 Гц, 2 Гц 1H), 7,768-7,773 (д, J=2 Гц, 1H), 8,13 (ушир., 2H), 10,8 (с, 1H).
Пример 87a: N-(2-Циано-4-изопропилфенил)сульфамид
Получают по методике примера 77a из 2-амино-5-изопропилбензонитрила (Пример 87b) и сульфамоилхлорида.
Пример 87b: 2-Амино-5-изопропилбензонитрил
Получают по методике примера 86b из 2-бром-4-изопропиланилина.
Пример 88: 6-Изобутил-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид
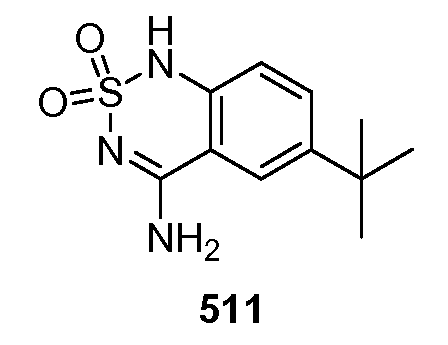
Получают по методике примера 77 из N-(2-циано-4-изобутилфенил)сульфамида (Пример 88a).1H ЯМР (400 МГц, ДМСО-d6) δ 1,27(с, 9H), 6,92-6,94 (д, J=8,4 Гц, 1H), 7,58-7,61 (дд, J=8,8 Гц, 2,4 Гц 1H), 7,84-7,85 (д, J=2,4 Гц, 1H), 8,06 (ушир., 1H), 8,33 (ушир., 1H), 10,8 (с, 1H).
Пример 88a: N-(2-Циано-4-изобутилфенил)сульфамид
Получают по методике примера 77a из 2-амино-5-изобутилбензонитрила (Пример 88b) и сульфамоилхлорида.
Пример 88b: 2-Амино-5-изобутилбензонитрил
Получают по методике примера 86b из 2-бром-4-изобутиланилин.
Пример 89: 6-Метил-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 77 из N-(2-циано-4-метилфенил)сульфамида (Пример 89a). МС 212 (MH+).
Пример 89a: N-(2-циано-4-метилфенил)сульфамид
Получают по методике примера 77a из 2-амино-5-метилбензонитрила (Пример 14b) и сульфамоилхлорида.
Пример 90: N5-изопропил-1H-бензо[c][1,2,6]тиадиазин-4,5-диамин-2,2-диоксид
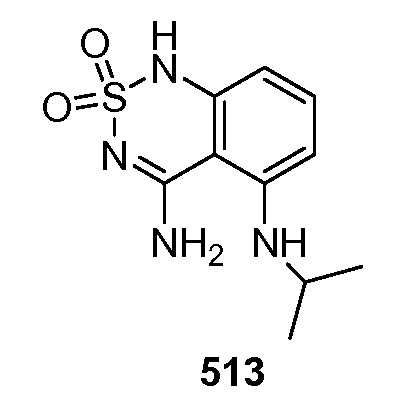
Раствор сульфамида 2-амино-6-(изопропиламино)бензонитрила (Пример 90a) (0,14 г, 0,54 ммоль) и NaOH (2н, 0,54 мл) в EtOH (3 мл) перемешивают при 90°С в атмосфере азота в течение 0,5 часа. Реакционную смесь охлаждают до комнатной температуры и концентрируют в вакууме. Добавляют H2O (1 мл), и реакционную смесь нейтрализуют до pH ~ 3 добавлением 10% AcOH. Полученный осадок экстрагируют EtOAc, и после выпаривания растворителей остаток очищают препаративной тонкослойной хроматографией с применением раствора ДХМ/EtOAc (4:1) в качестве элюента, с получением N5-изопропил-1H-бензо[c][1,2,6]тиадиазин-4,5-диамин-2,2-диоксида (0,02 г).1H ЯМР (400 МГц, ДМСО-d6) δ 1,11 (д, J=6,4 Гц, 6H), 1,84 (ушир.с, 1H), 5,24 (ушир.с, NH), 6,22-6,19 (м, 2H, NH), 7,09 (т, J=8,0 Гц, 1H), 7,48 (ушир.с, 2H). МС 255 (MH+).
Пример 90a: сульфамид 2-амино-6-(изопропиламино)бензонитрила
К раствору 2-амино-6-(изопропиламино)бензонитрил (Пример 90b) (0,09 г, 0,54 ммоль) в ДМА (3 мл) добавляют сульфамоилхлорид (0,19 г, 1,62 ммоль). Реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 2 часов, разбавляют H2O (5 мл) и экстрагируют EtOAc. Растворители из объединенных органических фаз выпаривают, и остаток очищают препаративной тонкослойной хроматографией с применением раствора гексан/EtOAc (3:2) в качестве элюента с получением сульфамида 2-амино-6-(изопропиламино)бензонитрила (0,14 г). МС 255 (MH+).
Пример 90b: 2-амино-6-(изопропиламино)бензонитрил
К раствору 2-(изопропиламино)-6-нитробензонитрила (Пример 90c) (0,21 г, 1,02 ммоль) в MeOH (9 мл) добавляют концентрированную HCl (2 мл). Затем порциями добавляют Fe (0,17 г, 3,07 ммоль), и реакционную смесь кипятят с обратным холодильником при 90°С в течение 15 минут. После охлаждения до комнатной температуры, разбавления H2O (50 мл) и экстрагирования ДХМ (3×50 мл), объединенные органические фазы промывают насыщенным раствором соли, сушат над MgSO4 и растворители выпаривают с получением 2-амино-6-(изопропиламино)бензонитрила (0,19 г, 100%) в виде масла коричневого цвета, которое применяют на следующей стадии без дальнейшей очистки. МС 176 (MH+).
Пример 90c: 2-(изопропиламино)-6-нитробензонитрил
К раствору 2,6-динитробензонитрила (0,58 г, 3,00 ммоль) в ДМФ (6 мл) добавляют изопропиламин (0,71 г, 12,00 ммоль), и реакционную смесь перемешивают при 50°С в атмосфере азота в течение десяти минут. После охлаждения до комнатной температуры, разбавления H2O и экстрагирования EtOAc, растворители объединенных органических фаз выпаривают, и остаток очищают флэш-хроматографией (система Biotage, колонка 80 г силикагеля) с применением раствора гексан/EtOAc (3:2) в качестве элюента, с получением 2-(изопропиламино)-6-нитробензонитрила (0,22 г, 35%)1H ЯМР (400 МГц, ДМСО-d6) δ 1,20 (д, J=6,4 Гц, 6H), 3,85-3,80 (м, 1H), 5,94 (д, J=8,0 Гц, NH), 7,26 (д, J=9,0 Гц, 1H), 7,42 (д, J=9,0 Гц, 1H), 7,60 (т, J=8,8 Гц, 1H).
Пример 91: 6-метил-1H-тиено[3,2-c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Раствор 3-амино-5-метилтиофен-2-карбонитрила (250 мг, 1,0 экв., 1,81 ммоль) и сульфамоилхлорида (2,71 ммоль, 1.5 экв., 314 мг) в ДМА (5 мл) перемешивают при комнатной температуре в течение ночи. Добавляют воду (30 мл) и NaOH (1,5 экв., 10н, 2,71 ммоль, 271 мкл), и смесь замораживают на бане сухой лед/ацетон, и летучие вещества удаляют на лиофилизаторе. Полученное твердое вещество промывают водой и затем суспендируют в EtOH (25 мл, 200 крепость). К этой суспензии добавляют NaOH (1н, 2,5 экв., 4,52 ммоль, 4,52 мл) и смесь нагревают до кипения с обратным холодильником в течение 45 минут. Реакционную смесь охлаждают до комнатной температуры и гасят HCl (1н, 2,5 экв., 4,52 ммоль, 4,52 мл). pH доводят до ~ 1-2 добавлением 1н HCl, и летучие вещества удаляют на роторном испарителе. Полученное твердое вещество суспендируют в воде (10 мл), перемешивают, отфильтровывают и промывают водой. Неочищенный продукт сушат в вакуумной печи с получением 6-метил-1H-тиено[3,2-c][1,2,6]тиадиазин-4-амин-2,2-диоксида (257 мг) в виде порошка беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,46 (д, J=0,8 Гц, 3H), 6,53 (кв., J=0,8 Гц, 1H), 7,75 (ушир.с, 2H), 11,34 (с, 1H),1H ЯМР (400 МГц, CD3OD) δ 2,52 (д, J=0,8 Гц, 3H), 6,55 (кв., J=0,8 Гц, 1H). МС 218 (MH+).
Пример 92: 5-циклопропил-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Раствор 2-амино-6-циклопропилбензонитрила (Пример 92a) (1,0 экв., 626 мкмоль, 99 мг) и сульфамоилхлорида (1,5 экв., 939 мкмоль, 109 мг) в ДМА (1 мл) перемешивают в сцинтилляционной колбе при комнатной температуре. Через 2 часа добавляют NaOH (1,5 экв., 939 мкмоль, 1н, 939 мкл) и воду (18 мл), и полученный выпавший в осадок продукт перемешивают в течение ночи при комнатной температуре. Осадок отфильтровывают и промывают водой (3×5 мл). Влажный осадок растворяют в EtOH (5 мл, 200 крепость) и добавляют NaOH (2,5 экв., 1565 мкмоль, 1н, 1565 мкл). Реакционную смесь нагревают до 80°С при перемешивании в течение ночи. Реакционную смесь охлаждают до комнатной температуры и в реакционную колбу добавляют HCl (2,5 экв., 1565 мкмоль, 1н, 1565 мкл). Этанол и большую часть воды удаляют на роторном испарителе. Полученный осадок суспендируют в воде (5 мл), перемешивают, фильтруют и промывают водой (20 мл). Продукт сушат в вакуумной печи с получением 5-циклопропил-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксида (41 мг, 28%) в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,71 (м, 2H), 1,04 (м, 2H), 2,401 (м, 1H), 6,85 (д, J=8 Гц, 2H), 7,37 (т + ушир.с, J=8 Гц, 2H), 8,40 (ушир.с, 1H), 10,80 (с, 1H),1H ЯМР (400 МГц, CD3OD) δ 0,89 (м, 2H), 1,15 (м, 2H), 2,36 (м, 1H), 6,90 (д, J=8 Гц, 1H), 6,97 (д, J=8 Гц, 1H), 7,41 (т, J=8 Гц, 1H). МС 238 (MH+).
Пример 92a: 2-амино-6-циклопропилбензонитрил
2-5 мл колбу для микроволнового реактора, содержащую 2-амино-6-бромбензонитрил (1,0 экв., 1,0 ммоль, 197 мг), циклопропилбороновую кислоту (1,3 экв., 1,3 ммоль, 112 мг) и K3PO4 (3,5 экв., 3,5 ммоль, 743 мг) промывают азотом. В эту колбу добавляют толуол (4 мл, Sure-Seal), воду (200 мкл), трициклогексилфосфин (0,018 экв., 18,1 мкмоль, 88% чистота, 20% в гексане, 32 мкл), и ацетат палладия (II) (0,05 экв. "Pd," тример, 0,0167 ммоль, 12 мг), все в атмосфере азота. Реакционную колбу промывают азотом, закрывают гофрированной мембраной и облучают микроволнами в течение 30 минут при 130°С. Реакционную смесь охлаждают до комнатной температуры, разделяют между EtOAc (3 мл) и водой (1 мл). Слои разделяют, водный слой экстрагируют EtOAc (2×3 мл), объединенные органические слои сушат над сульфатом натрия. EtOAc фильтруют через 0,45 мкм ПТФЭ фритту для удаления тонкоизмельченных твердых веществ, и концентрируют на роторном испарителе. Неочищенный продукт очищают на силикагеле (SiliaPrep 80 г картридж, градиентное элюирование от 10% EtOAc/гексан до 40% EtOAc/гексан, загружают в растворе в 1:1 гексан:ДХМ). Фракции, содержащие продукт, концентрируют на роторном испарителе с получением 2-амино-6-циклопропилбензонитрила (99 мг, 62,7%) в виде воскообразного твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,668 (м, 2H), 0,979 (м, 2H), 1,978 (м, 1H), 5,882 (ушир.с, 2H), 6,128 (д, J=8 Гц, 1H), 6,546 (д, J=8 Гц, 1H), 7,129 (т, J=8 Гц, 1H).
Пример 93: 5,6-[4′,5′-дигидронафто[1′,2′-b]]-1H-тиено[2,3-c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Раствор 2-сульфамоиламино-4,5-дигидронафто[1,2-b]тиофен-3-карбонитрила (Пример 93a) (336 мг, 1,11 ммоль) в EtOH (5 мл) обрабатывают NaOH (2,0н, 1,1 мл, 2,22 ммоль), и полученный раствор нагревают до 100°С и перемешивают при этой температуре в течение 1,5 ч. После охлаждения до комнатной температуры, прозрачный раствор фильтруют, и фильтрат осторожно нейтрализуют 10% AcOH при энергичном перемешивании при 0°С. Полученный осадок собирают фильтрацией, промывают теплой водой и 20% EtOH в воде с получением 105 мг указанного в заголовке соединения в виде твердого вещества беловатого цвета с 31% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 2,48 (м, 4H), 5,70 (с, 2H), 6,87-6,89 (д, J=7,6 Гц, 1H), 6,96 (т, 1H), 7,06-7,10 (м, 2H). МС 306 (MH+).
Пример 93a: 2-сульфамоиламино-4,5-дигидронафто[1,2-b]тиофен-3-карбонитрил
К раствору 2-амино-4,5-дигидронафто[1,2-b]тиофен-3-карбонитрила (Пример 93b) (250 мг, 1,11 ммоль) в диметилацетамиде (5 мл) добавляют сульфамоилхлорид (385 мг, 3,33 ммоль). Реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение около 1 ч, затем ее разбавляют водой и экстрагируют EtOAc, органический слой промывают насыщенным раствором соли, сушат над Na2SO4 фильтруют и выпаривают с получением неочищенного продукта, который применяют на следующей стадии.
Пример 93b: 2-амино-4,5-дигидронафто[1,2-b]тиофен-3-карбонитрил
Раствор 3,4-дигидронафталин-2(1H)-она (2,2 г, 15,05 ммоль), малононитрила (994 мг, 15,05 ммоль), серы (482 мг, 15,05 ммоль) и триэтиламина (1,52 г, 15,05 ммоль) в EtOH (100 мл) кипятят с обратным холодильником в течение 2 ч в атмосфере азота. Растворитель удаляют при пониженном давлении, и остаток кристаллизуют из EtOAc/гексана с получением 2,91 г указанного в заголовке соединения в виде твердого вещества коричневого цвета с 86% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 2,59 (т, 2H), 2,86 (т, 2H), 6,94 (д, 1H), 7,03 (т, 1H), 7,11-7,16 (м, 2H), 7,48 (с, 2H).
Пример 94: 5,6-(дигидро-4′H-циклопента-1′H)тиено[2,3-c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 93 из 2-сульфамоиламино-5,6-дигидро-4H-циклопента[b]тиофен-3-карбонитрила (Пример 94a).1H ЯМР (400 МГц, ДМСО-d6) δ 2,15 (м, 2H), 2,53 (м, 2H), 2,68 (м, 2H), 5,39 (с, 2H). МС 244 (MH+).
Пример 94a: 2-сульфамоиламино-5,6-дигидро-4H-циклопента[b]тиофен-3-карбонитрил
Получают по методике примера 93a из 2-амино-5,6-дигидро-4H-циклопента[b]тиофен-3-карбонитрила (Пример 94b).1H ЯМР (400 МГц, CDCl3) δ 2,41 (м, 2H), 2,82 (м, 2H), 2,89 (м, 2H), 5,46 (с, 1H).
Пример 94b: 2-амино-5,6-дигидро-4H-циклопента[b]тиофен-3-карбонитрил
Получают по методике примера 93b из циклопентанона.1H ЯМР (400 МГц, ДМСО-d6) δ 2,23 (м, 2H), 2,53 (м, 2H), 2,63 (м, 2H), 7,00 (с, 2H).
Пример 95: 5-этил-6-метил-1H-тиено[2,3-c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 93 из 2-сульфамоиламино-4-этил-5-метилтиофен-3-карбонитрила (Пример 95a).1H ЯМР (400 МГц, ДМСО-d6) δ 1,01 (т, 3H), 2,06 (с, 3H), 2,53 (кв., 2H), 5,50 (с, 2H). МС 246 (MH+).
Пример 95a: 2-сульфамоиламино-4-этил-5-метилтиофен-3-карбонитрил
Получают по методике примера 93a из 2-амино-4-этил-5-метилтиофен-3-карбонитрила (Пример 95b).1H ЯМР (400 МГц, CDCl3) δ 1,17 (т, 3H), 2,31 (с, 3H), 2,59 (кв., 2H), 5,45 (с, 2H).
Пример 95b: 2-амино-4-этил-5-метилтиофен-3-карбонитрил
Получают по методике примера 93b из пентан-3-она.1H ЯМР (400 МГц, ДМСО-d6) δ 1,01 (т, 3H), 2,06 (с, 3H), 2,33 (кв., 2H), 6,84 (с, 2H). МС 167 (MH+).
Пример 96: 5,6-диметил-1H-тиено[2,3-c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 93 из 2-сульфамоиламино-4,5-диметилтиофен-3-карбонитрила (Пример 96a).1H ЯМР (400 МГц, ДМСО-d6) δ 2,04 (с, 3H), 2,10 (с, 3H), 5,48 (с, 2H). МС 232 (MH+).
Пример 96a: 2-сульфамоиламино-4,5-диметилтиофен-3-карбонитрил
К раствору 2-амино-4,5-диметилтиофен-3-карбонитрила (Пример 4b) (1,0 г, 6,57 ммоль) в 1,4-диоксане (50 мл) добавляют сульфамид (3,87 г, 40,30 ммоль). Реакционную смесь нагревают до кипения с обратным холодильником в течение 24 ч, затем охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении, и остаток очищают хроматографией на силикагеле, элюируя EtOAc/гексаном (2:3) с получением 300 мг продукта в виде масла темно-красного цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,09 (3, 3H), 2,26 (с, 3H), 7,32 (с, 2H), 10,17 (с, 1H).
Пример 97: (E)-5-(3-метоксипроп-1-енил)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Раствор (E)-2-сульфамоиламино-6-(3-метоксипроп-1-енил)бензонитрила (Пример 97a) (139 мг, 0,5 ммоль) в EtOH обрабатывают NaOH (2,0н, 0,5 мл, 1,0 ммоль), и полученный раствор нагревают до 100°С и перемешивают при этой температуре в течение 4 ч. После охлаждения до комнатной температуры, прозрачный реакционный раствор фильтруют, и фильтрат осторожно нейтрализуют 10% AcOH при энергичном перемешивании при 0°С. Полученный осадок собирают фильтрацией, промывают теплой водой и 20% EtOH в воде с получением указанного в заголовке соединения (Е)-5-(3-метоксипроп-1-енил)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксида (108 мг, 78%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 3,29 (с, 3H), 4,06 (дд, J=4,8, 1,2 Гц, 2H), 6,26 (дт, J=16,2, 5,0 Гц, 1H), 6,91-6,95 (м, 2H), 6,97 (ушир.с, 1H), 7,16 (д, J=7,2 Гц, 1H), 7,46 (т, J=8,0 Гц, 1H), 8,31 (с, 1H), 10,93 (с, 1H).13C ЯМР (ДМСО-d6) δ 58,4, 72,5, 111,6, 117,0, 122,4, 129,0, 132,5, 134,0, 138,1, 143,7, 162,9. МС 268 (MH+).
Пример 97a: (Е)-2-сульфамоиламино-6-(3-метоксипроп-1-енил)бензонитрил
К раствору (Е)-2-амино-6-(3-метоксипроп-1-енил)бензонитрила (Пример 97b) (188 мг, 1,0 ммоль) в ДМА добавляют NH2SO2Cl (347 мг, 3,0 ммоль) при 0°С в атмосфере азота. Затем реакционную смесь перемешивают при комнатной температуре в течение 6 ч, разбавляют EtOAc, промывают насыщенным раствором соли (5X) и сушат над Na2SO4. Растворитель выпаривают при пониженном давлении с получением (Е)-2-сульфамоиламино-6-(3-метоксипроп-1-енил)бензонитрила в виде твердого вещества бледно-желтого цвета, которое применяют на следующей стадии без дальнейшей очистки.
Пример 97b: (Е)-2-амино-6-(3-метоксипроп-1-енил)бензонитрил
К раствору 2-амино-6-бромбензонитрила (1,0 г, 5,0 ммоль), (E)-2-(3-метоксипропенил)-4,4,5,5-тетраметил-(1,3,2)-диоксаборолана (1,2 г, 6,0 ммоль) и K2CO3 (1,38 г, 10,0 ммоль) в ДМЭ/H2O (4:1, 20 мл) добавляют Pd(PPh3)4 (289 мг) при комнатной температуре в атмосфере азота. Реакционную смесь нагревают до 85°С и перемешивают при этой температуре в атмосфере азота в течение ночи. После охлаждения до комнатной температуры, реакционный раствор разбавляют EtOAc, промывают насыщенным раствором соли (2X) и сушат над Na2SO4. После удаления растворителя остаток очищают хроматографией на силикагеле, элюируя 30% EtOAc в гексане с получением указанного в заголовке соединения в виде твердого вещества бледно-желтого цвета.1H ЯМР (400 МГц, CDCl3) δ 3,40 (с, 3H), 4,12 (дд, J=6,0, 1,8 Гц, 2H), 4,42 (с, 2H), 6,42 (дт, J=16,0, 5,8 Гц, 1H), 6,63 (д, J=8,0 Гц, 1H), 6,85 (д, J=16,0 Гц, 1H), 6,93 (д, J=8,0 Гц, 1H), 7,26 (т, J=8,0 Гц, 1H).13C ЯМР (CDCl3) δ 58,2, 72,7, 95,4, 113,6, 115,0, 116,6, 128,5, 130,9, 133,4, 140,3, 150,1. МС 189 (MH+).
Пример 98: 5-(3-Метилбут-2-ен-2-ил)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 97 из 2-амино-6-(3-метилбут-2-ен-2-ил)бензонитрила (Пример 98a) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, CDCl3) δ 1,53 (с, 3H), 1,80 (с, 3H), 1,86 (с, 3H), 6,70 (дд, J=7,2, 1,0 Гц, 1H), 6,82 (с, 1H), 6,93 (дд, J=7,2, 1,0 Гц, 1H), 7,46 (т, J=7,2 Гц, 1H), 8,28 (с, 1H), 10,98 (с, 1H).13C ЯМР (ДМСО-d6) δ 20,8, 21,4, 22,6, 109,4, 116,8, 124,4, 129,7, 132,0, 134,3, 144,1, 144,6, 162,1. МС 266 (MH+).
Пример 98a: 2-Амино-6-(3-метилбут-2-ен-2-ил)бензонитрил
Получают по методике примера 1a из 2-амино-6-бромбензонитрила и 3-метил-2-бутен-2-илбороновой кислоты в виде оранжевого масла. МС 187 (MH+).
Пример 99: 5-Бром-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид
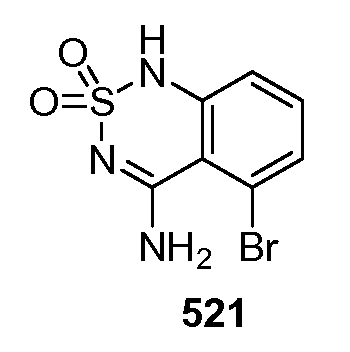
Получают по методике примера 97 из 2-амино-6-бромбензонитрила в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,03-7,07 (м, 1H), 7,37-7,42 (м, 2H), 7,65 (с, 1H), 8,60 (с, 1H), 11,19 (с, 1H).13C ЯМР (ДМСО-d6) δ 113,3, 118,0, 121,0, 129,0, 135,0, 145,5, 161,3. МС 275, 277 (MH+).
Пример 100: 4H-Нафто[2,1-c][1,2,6]тиадиазин-1-амин-2,2-диоксид

Получают по методике примера 97 из 2-амино-1-нафтонитрила в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,17 (д, J=8,0 Гц, 1H), 7,48 (дт, J=1,2, 8,0 Гц, 1H), 7,63 (дт, J=1,2, 8,0 Гц, 1H), 7,90 (с, 1H), 7,93 (дд, J=1,2, 8,0 Гц, 1H), 8,24 (с, 1H), 8,39 (д, J=8,0 Гц, 1H), 11,42 (с, 1H).13C ЯМР (ДМСО-d6) δ 106,3, 118,2, 124,9, 125,4, 129,2, 129,8, 130,0, 130,2, 135,9, 143,7, 163,2. МС 248 (MH+).
Пример 101: 5,6,7,8-Тетрагидро-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 97 из 2-аминоциклогекс-1-енкарбонитрила (Пример 10b) в виде твердого вещества бледно-желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,54-1,62 (м, 4H), 2,08 (т, J=5,4 Гц, 2H), 2,20 (т, J=5,4 Гц, 2H), 6,94 (с, 1H), 7,41 (с, 1H), 10,53 (с, 1H).13C ЯМР (ДМСО-d6) δ 21,6, 22,5, 28,3, 97,6, 150,3, 163,4. МС 202 (MH+).
Пример 102: 1H-пиридо[2,3-c][1,2,6]тиадиазин-4-амин-2,2-диоксид
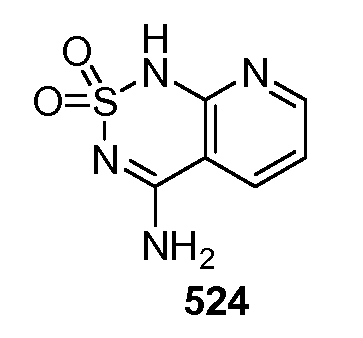
Перемешиваемую смесь 2-аминоникотинонитрила (238 мг, 2,0 ммоль), сульфамида (192 мг, 2,0 ммоль) и 1 мл ДБУ нагревают при 160°С в атмосфере азота в течение ночи. Затем ее охлаждают до комнатной температуры, реакционную смесь разбавляют водой и три раза экстрагируют EtOAc. Водный слой сушат в вакууме, и остаток очищают хроматографией на силикагеле, элюируя 15% MeOH в дихлорметане с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 6,87 (т, J=5,6 Гц, 1H), 7,95 (ушир.с, 2H), 8,22 (д, J=5,2 Гц, 1H), 8,39-8,37 (м, 1H), 12,58 (ушир.с, 1H). МС 199 (MH+).
Пример 103: 6-Бром-1H-бензо[c][1,2,6]тиадиазин-4-амин

Получают по методике примера 97 из 2-амино-5-бромбензонитрила.1H ЯМР (400 МГц, ДМСО-d6) δ 6,95 (д, J=8,8 Гц, 1H), 7,73-7,70 (м, 1H), 8,17 (д, J=1,6 Гц, 1H), 8,28 (ушир.с, 2H), 11,9 (с, 1H). МС 275, 277 (MH+).
Пример 104: 5-(Метилтио)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 97 из 2-сульфамоиламино-6-(метилтио)бензонитрила (Пример 104a).1H ЯМР (400 МГц, ДМСО-d6) δ 2,39 (с, 3H), 6,38-6,36 (м, 1H), 6,47-6,45 (м, 1H), 6,59 (ушир.с, 2H), 6,97-6,93 (м, 1H). МС 244 (MH+).
Пример 104a: 2-сульфамоиламино-6-(метилтио)бензонитрил
Получают по методике примера 1 из 2-амино-6-(метилтио)бензонитрила (Пример 8b) и сульфамоилхлорида.1H ЯМР (400 МГц, ДМСО-d6) δ 2,56 (с, 3H), 7,18 (д, J=8,4 Гц, 1H), 7,26 (с, 2H), 7,33 (д, J=8,0 Гц, 1H), 7,59 (т, J=8,40 Гц, 1H), 9,51 (с, 1H).
Пример 104b: 2-амино-6-(метилтио)бензонитрил
К раствору 2-(метилтио)-6-нитробензонитрила (Пример 104c) (1,5 г, 7,73 ммоль) в EtOH (150 мл)/ТГФ (50 мл)/EtOAc (50 мл) добавляют 200 мг 10% Pd/C. Реакционную смесь гидрируют на фракционном шейкере в течение ночи. После фильтрации фильтрованный раствор сушат в вакууме, и остаток очищают хроматографией на силикагеле, элюируя EtOAc/гексаном с получением указанного в заголовке соединения (79%).1H ЯМР (400 МГц, CDCl3) δ 2,51 (с, 3H), 4,47 (с, 2H), 6,53-6,51 (м, 1H), 6,58 (д, J=8,0 Гц, 1H), 7,27-7,21 (м, 1H).
Пример 104c: 2-(метилтио)-6-нитробензонитрил
К суспензии 2,6-динитробензонитрила (5,0 г, 25,89 ммоль) в 100 мл безводного MeOH добавляют NaSMe (2,0 г в 100 мл MeOH) по каплям через добавочную воронку в атмосфере азота при 0°С. После завершения добавления реакционную смесь перемешивают при 0°С в течение 1 ч. Затем 250 мл воды добавляют к реакционной смеси, полученный осадок собирают фильтрацией и сушат на воздухе с получением указанного в заголовке соединения в виде твердого вещества желтого цвета (93%).1H ЯМР (400 МГц, CDCl3) δ 2,64 (с, 3H), 7,60-7,57 (м, 1H), 7,70 (т, J=8,4 Гц, 1H), 8,01-7,99 (м, 1H).
Пример 105: 5,6-(1′,2′,3′,4′-тетрагидро-2′,2′-этиленедиоксидбензо)-1H-тиено[2,3-c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 97 из 2-амино-5,7-дигидро-4H-спиро[бензо[b]тиофен-6,2′-[1,3]диоксолан]-3-карбонитрила (Пример 105a).1H ЯМР (400 МГц, ДМСО-d6) δ 1,80 (т, J=6,0 Гц, 2H), 2,65 (с, 2H), 2,79 (т, J=6,0 Гц, 2H), 3,94-3,91 (м, 4H), 5,99 (ушир.с, 2H). МС 316 (MH+).
Пример 105a: 2-амино-5,7-дигидро-4H-спиро[бензо[b]тиофен-6,2′-[1,3]диоксолан]-3-карбонитрил
Раствор 1,4-диоксаспиро[4.5]декан-8-она (5,0 г, 32,0 ммоль), малононитрила (2,11 г, 32,01 ммоль), серы (1,03 г, 32,0 ммоль) и триэтиламина (4,5 мл, 32,0 ммоль) в EtOH (100 мл) перемешивают при комнатной температуре в течение 1 ч в атмосфере азота. Затем растворитель удаляют при пониженном давлении, и остаток обрабатывают EtOAc. Полученный осадок собирают фильтрацией и сушат на воздухе с получением указанного в заголовке соединения в виде твердого вещества светло-зеленого цвета (44%).1H ЯМР (400 МГц, ДМСО-d6) δ 1,77 (т, J=6,8 Гц, 2H), 2,43 ((т, J=6,4 Гц, 2H), 2,57 (с, 2H), 3,88 (с, 4H), 6,99 (с, 2H). МС 237 (MH+).
Пример 106: 5,6-(1′,2′,3′,4′-тетрагидро-2′-оксидбензо)-1H-тиено[2,3-c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Перемешиваемую смесь 5,6-(1′,2′,3′,4′-тетрагидро-2′,2′-этилендиоксидбензо)-1H-тиено[2,3-c][1,2,6]тиадиазин-4-амин-2,2-диоксида (Пример 105) (130 мг, 0,41 ммоль), 5 мл ТГФ и 1 мл 2н HCl кипятят с обратным холодильником в атмосфере азота в течение 2 ч. После охлаждения до комнатной температуры полученный осадок собирают фильтрацией и сушат на воздухе с получением указанного в заголовке соединения в виде розового твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 2,57 (т, J=6,8 Гц, 2H), 3,10 (т, J=6,4 Гц, 2H), 3,50 (с, 2H), 6,91 (ушир.с, 1H), 7,88 (ушир.с, 1H), 11,81 (ушир.с, 1H). МС 272 (MH+).
Пример 107: 1,5,6,7-тетрагидроциклопента[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Раствор 2-сульфамоиламиноциклопент-1-енкарбонитрила (Пример 107a) (108 мг, 0,57 ммоль) в EtOH обрабатывают NaOH (2,0н, 0,5 мл), и полученный раствор нагревают до 100°С и перемешивают при этой температуре в течение 4 ч. После охлаждения до комнатной температуры реакционный раствор осторожно нейтрализуют 2н HCl при энергичном перемешивании при 0°С. Реакционный раствор сушат в вакууме, и остаток очищают хроматографией на силикагеле, элюируя 10% MeOH в дихлорметане с получением указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ 1,69-1,63 (м, 2H), 2,2 (т, J=7,6 Гц, 2H), 2,3 (т, J=6,8 Гц, 2H), 5,12 (с, 2H). МС 188 (MH+).
Пример 107a: 2-сульфамоиламиноциклопент-1-енкарбонитрил
К раствору 2-аминоциклопент-1-енкарбонитрила (440 мг, 4,07 ммоль) в 10 мл ДМА добавляют сульфамоилхлорид (941,3 мг, 8,15 ммоль), и полученную смесь перемешивают при комнатной температуре в атмосфере азота в течение 2 ч. Затем ее разбавляют EtOAc, органический слой промывают насыщенным раствором соли и сушат в вакууме, и остаток очищают хроматографией на силикагеле, элюируя EtOAc/гексаном с получением указанного в заголовке соединения.1H ЯМР (400 МГц, CDCl3) δ 2,04-1,97 (м, 2H), 2,61-2,57(м, 2H), 2,9-2,86 (м, 2H), 5,66 (с, 2H), 8,04 (с, 1H).
Пример 108: 5-(фенилтио)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид
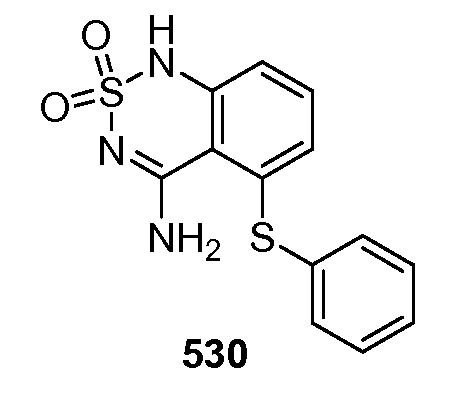
Получают по методике примера 97 из 2-сульфамоиламино-6-(фенилтио)бензонитрила (Пример 108a)1H ЯМР (400 МГц, ДМСО-d6) δ 6,43-6,40 (м, 1H), 6,64-6,62 (м, 1H), 6,75 (ушир.с, 2H), 7,01-6,97 (м, 1H), 7,22-7,15 (м, 3H), 7,3-7,26 (м, 2H). МС 306 (MH+).
Пример 108a: 2-сульфамоиламино-6-(фенилтио)бензонитрил
Получают по методике примера 104a из 2-амино-6-(фенилтио)бензонитрила (Пример 108b).1H ЯМР (400 МГц, ДМСО-d6) δ 6,85-6,82 (м, 1H), 7,32 (с, 2H), 7,47-7,42 (м, 6H), 7,53 (т, J=8,0 Гц, 1H), 9,63 (с, 1H).
Пример 108b: 2-амино-6-(фенилтио)бензонитрил
Получают по методике примера 104b из 2-нитро-6-(фенилтио)бензонитрила (Пример 108c),1H ЯМР (400 МГц, ДМСО-d6) δ 6,20 (ушир.с, 2H), 6,32-6,30 (м, 1H), 6,69-6,67 (м, 1H), 7,19 (т, J=8,0 Гц, 1H), 7,4-7,34 (м, 5H).
Пример 108c: 2-нитро-6-(фенилтио)бензонитрил
К смеси 2,6-динитробензонитрила (2,0 г, 10,36 ммоль) и K2CO3 (1,43 г, 10,36 ммоль) в 5 мл безводного ДМФ добавляют PhSH (1,14 мл в 5 мл ДМФ) по каплям в атмосфере азота при 0°С. После завершения добавления реакционную смесь перемешивают при 0°С в течение 0,5 ч. Затем реакционную смесь выливают в 50 мл воды, полученный осадок собирают фильтрацией, промывают водой и сушат на воздухе с получением указанного в заголовке соединения.
Пример 109: 5-(Метилсульфанил)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 107 из 2-сульфамоиламино-6-(метилсульфинил)бензонитрила (Пример 109a)1H ЯМР (400 МГц, ДМСО-d6) δ 2,58 (с, 3H), 6,51 (ушир.с, 2H), 6,78-6,76 (м, 1H), 6,94-6,92 (м, 1H), 7,23-7,19 (м, 1H). МС 260 (MH+).
Пример 109a: 2-сульфамоиламино-6-(метилсульфинил)бензонитрил
Смесь 2-сульфамоиламино-6-(метилтио)бензонитрила (Пример 104a) (48 мг, 0,2 ммоль) и MCPBA (69 мг, 0,4 ммоль) в дихлорметане (16 мл) кипятят с обратным холодильником в течение ночи. После охлаждения осадок собирают фильтрацией, промывают дихлорметаном, сушат на воздухе с получением указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ 2,83 (с, 3H), 7,35 (ушир.с, 2H), 7,72-6,69 (м, 2H), 7,92 (т, J=8,0 Гц, 1H), 9,87 (ушир.с, 1H).
Пример 110: 5-(Метилсульфонил)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 107 из 2-сульфамоиламино-6-(метилсульфонил)бензонитрила (Пример 110a).1H ЯМР (400 МГц, ДМСО-d6) δ 3,30 (с, 3H), 6,95-6,93 (м, 1H), 7,01 (ушир.с, 2H), 7,17-7,17 (м, 1H), 7,24-7,21 (м, 1H).МС 276 (MH+).
Пример 110a: 2-сульфамоиламино-6-(метилсульфонил)бензонитрил
Получают по методике примера 107a из 2-амино-6-(метилсульфонил)бензонитрила (Пример 109b)1H ЯМР (400 МГц, ДМСО-d6) δ 3,37 (с, 3H), 7,46 (с, 2H), 7,85-7,83 (м, 1H), 7,93-7,91 (м, 2H), 9,92 (с, 1H).
Пример 110b: 2-амино-6-(метилсульфонил)бензонитрил
Получают по методике примера 107b из 2-(метилсульфонил)-6-нитробензонитрила (Пример 110c).1H ЯМР (400 МГц, ДМСО-d6) δ 3,26 (с, 3H), 6,63 (ушир.с, 2H), 7,15-7,09 (м, 2H), 7,51-7,47 (м, 1H).
Пример 110c: 2-(метилсульфонил)-6-нитробензонитрил
Получают по методике примера 109a из 2-(метилтио)-6-нитробензонитрила (Пример 104c)1H ЯМР (400 МГц, ДМСО-d6) δ 3,48 (с, 3H), 8,21 (д, J=7,6 Гц, 1H), 8,49-8,47 (м, 1H), 8,66-8,64 (м, 1H).
Пример 111: 4-Амино-5-(пропилокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

К суспензии 2-сульфамоиламино-6-пропоксибензонитрила (Пример 111a) (4,73 г, 18,53 ммоль) в этаноле (65 мл) добавляют водный NaOH (2н, 18,6 мл, 37,06 ммоль). Полученный прозрачный раствор кипятят с обратным холодильником в течение 3 часов в атмосфере азота. После охлаждения до комнатной температуры полученный раствор фильтруют, фильтрат охлаждают до 0°С и нейтрализуют 10% уксусной кислотой. Полученный осадок фильтрацией, суспендируют в 50 мл этанола/воды (1:1) и нагревают до 40°С в течение 20 мин. Твердое вещество собирают фильтрацией с получением 4-амино-5-(пропилокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (4 г, 85%) в виде порошка бледно-желтого цвета. т. пл.: 229-230°С.1H ЯМР (400 МГц, ДМСО-d6) δ 0,96 (т, J=7,3 Гц, 3H), 1,81 (секст, J=7,3 Гц, 2H), 4,10 (т, J=6,7 Гц, 2H), 6,60 (д, J=8,6 Гц, 1H), 6,73 (д, J=8,6 Гц, 1H), 7,44 (т, J=8,6 Гц, 1H), 7,81 (ушир.с, 1H), 8,35 (ушир.с, 1H), 10,93 (ушир.с, 1H).13C ЯМР (400 МГц, ДМСО-d6) δ 11,07, 22,18, 71,41, 100,93, 105,64, 110,21, 135,53, 145,16, 158,47, 161,10. МС 256 (MH+).
Пример 111a: 2-Сульфамоиламино-6-пропоксибензонитрил
К раствору 2-амино-6-пропоксибензонитрила (Пример 111b) (4,23 г, 24,01 ммоль) в диметилацетамиде (20 мл) под N2 добавляют сульфамоилхлорид (5,56 г, 48,02 ммоль). Затем реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 4 часов. После завершения реакционную смесь гасят добавлением льда/воды (250 мл). Полученный осадок собирают фильтрацией, промывают водой и сушат с получением 2-сульфамоиламино-6-пропоксибензонитрила (4,73 г, 77%) в виде твердого вещества бледно-желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,01 (д, J=7,2 Гц, 3H), 1,76 (секст, J=7,2 Гц, 2H), 4,08 (т, J=6,8 Гц, 2H), 6,96 (д, J=8,5 Гц, 1H), 7,15 (т, J=8,5 Гц, 1H), 7,28 (ушир.с, 2H), 7,57 (д, J=8,5 Гц, 1H), 9,46 (с, 1H). МС 256 (MH+).
Пример 111b: 2-Амино-6-пропоксибензонитрил
2-Нитро-6-пропоксибензонитрил (Пример 111c) (4,95 г, 24,01 ммоль) растворяют в EtOH (50 мл) и ТГФ (15 мл). Добавляют 10% Pd/C (255 мг, 2,4 ммоль), и реакционную смесь гидрируют с применением аппарата Пара в течение 12 часов при 40 psi(фунт/дюйм2). После завершения реакционную смесь фильтруют через целит, и фильтрат концентрируют с получением 2-нитро-6-пропоксибензонитрила (4,3 г, 100%) в виде геля светло-коричневого цвета.1H ЯМР (400 МГц, CDCl3) δ 1,05 (д, J=7,4 Гц, 3H), 1,83 (секст, J=7,0 Гц, 2H), 3,96 (т, J=7,0 Гц, 2H), 4,38 (ушир.с, 2 H), 6,20 (д, J=8,5 Гц, 1H), 6,28 (т, J=8,5 Гц, 1H), 7,19 (д, J=8,5 Гц, 1H).
Пример 111c: 2-Нитро-6-пропоксибензонитрил
К раствору 2,6-динитробензонитрила (6 г, 31,07 ммоль) в сухом ДМФ (45 мл) при 0°С добавляют раствор натрия (815 мг, 35,42 ммоль) в н-пропаноле (23,5 мл) по каплям в течение 30 минут. После завершения добавления реакционную смесь нагревают до комнатной температуры и перемешивают в течение 2,5 часов. Реакционную смесь выливают в смесь лед/вода (250 мл), и осадок собирают фильтрацией и сушат с получением 2-нитро-6-пропоксибензонитрила (4,95 г, 77%) в виде твердого вещества светло-коричневого цвета.1H ЯМР (400 МГц, CDCl3) δ 1,11 (д, J=7,5 Гц, 3H), 1,93 (секст, J=7,5 Гц, 2H), 4,14 (т, J=7,0 Гц, 2H), 7,31 (д, J=8,6 Гц, 1H), 7,69 (т, J=8,6 Гц, 1H), 7,82 (д, J=8,6 Гц, 1H).
Пример 112: 4-Амино-5-(пентокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид
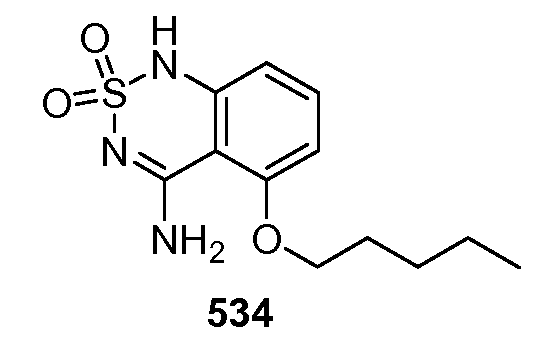
Получают по методике примера 111 из 2-сульфамоиламино-6-пентоксибензонитрила (Пример 112a) с получением 4-амино-5-(пентокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (59 мг, 43%).1H ЯМР (400 МГц, ДМСО-d6) δ 0,88 (т, J=7,3 Гц, 3H), 1,35 (м, 4H), 1,80 (квинт, J=6,8 Гц, 2H), 4,14 (т, J=6,4 Гц, 2H), 6,59 (д, J=8,2 Гц, 1H), 6,73 (д, J=8,56 Гц, 1H), 7,44 (т, J=8,5 Гц, 1H), 7,81 (ушир.с, 1H), 8,34 (ушир.с, 1H), 10,92 (ушир.с, 1H). МС 284 (MH+).
Пример 112a: 2-Сульфамоиламино-6-пентоксибензонитрила
Получают по методике примера 1a из 2-амино-6-пентоксибензонитрила с получением 2-сульфамоиламино-6-пентоксибензонитрила.
Пример 112b: 2-Амино-6-(пентилокси)бензонитрил
Получают по методике примера 111b из 2-нитро-6-(пентилокси)бензонитрила с получением 2-амино-6-(пентилокси)бензонитрила. МС 205 (MH+).
Пример 112c: 2-Нитро-6-(пентилокси)бензонитрил
Получают по методике примера 111c из 2,6-динитробензонитрила и пентанола с получением 2-нитро-6-(пентилокси)бензонитрила.
Пример 113: 4-Амино-5-(фенокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид
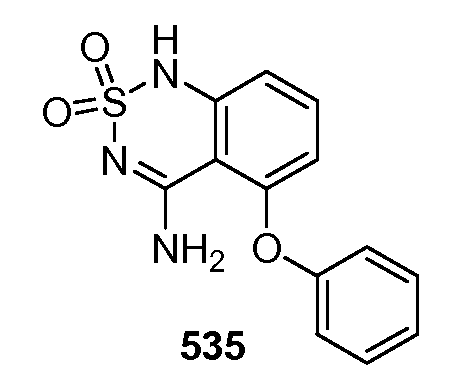
Получают по методике примера 111 из 2-сульфамоиламино-6-феноксибензонитрила (Пример 113a) с получением 4-амино-5-(фенокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (29 мг, 50%).1H ЯМР (400 МГц, MeOD) δ 6,39 (дд, J=8,3, 0,8 Гц, 1H), 6,75 (дд, J=8,2, 1,1 Гц, 1H), 7,18 (м, 2H), 7,30 (м, 1H), 7,40 (т, J=8,5 Гц, 1H), 7,48 (м, 2H). МС 290 (MH+).
Пример 113a: 2-Сульфамоиламино-6-феноксибензонитрил
Получают по методике примера 111a из 2-амино-6-феноксибензонитрила (Пример 113b) с получением 2-сульфамоиламино-6-феноксибензонитрила (250 мг, 100%).1H ЯМР (400 МГц, MeOD) δ 6,60 (д, J=8,6 Гц, 1H), 7,11 (д, J=8,0 Гц, 1H), 7,26 (т, J=7,5 Гц, 1H), 7,39 (д, J=8,3 Гц, 1H), 7,45 (м, 2H), 7,50 (т, J=8,6 Гц, 1H). МС 290 (MH+).
Пример 113b: 2-Амино-6-феноксибензонитрил
К раствору 2-нитро-6-(фенокси)бензонитрила (Пример 113c) (1,94 г, 8,08 ммоль) в MeOH (164 мл) медленно добавляют концентрированную HCl (7,23 мл) с последующим добавлением железного порошка (1,58 г, 28,3 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 30 мин и концентрируют в вакууме. Остаток растворяют в EtOAc и промывают 1н NaOH, водой и насыщенным раствором соли. Органический слой сушат над MgSO4, фильтруют, концентрируют и очищают флэш-хроматографией 1:1 гексан:EtOAc с получением 2-амино-6-феноксибензонитрила (384 мг, 22,6%).1H ЯМР (400 МГц, MeOD) δ 5,97 (д, J=8,3 Гц, 1H), 6,50 (д, J=8,6 Гц, 1H), 7,06 (м, 2H), 7,18 (м, 2H), 7,40 (м, 2H). МС 210 (MH+).
Пример 113c: 2-Нитро-6-феноксибензонитрил
Раствор 2,6-динитробензонитрила (2,0 г, 10,5 ммоль), фенола (1,42 г, 15,1 ммоль) и K2CO3 (1,45 г, 10,5 ммоль) в ДМФ (20 мл) перемешивают при КТ под N2 в течение 4,5 часов. После завершения реакционную смесь разбавляют EtOAc (100 мл), промывают H2O, сушат над MgSO4, фильтруют и концентрируют. Остаток перекристаллизовывают из гексана/EtOAc с получением 2-нитро-6-феноксибензонитрила (1,94 г, 77%).1H ЯМР (400 МГц, MeOD) δ 7,20 (м, 2H), 7,28 (дд, J=8,6, 1,1 Гц, 1H), 7,34 (м, 1H), 7,51 (м, 2H), 7,78 (т, J=8,7 Гц, 1H), 8,05 (дд, J=8,2, 0,8 Гц, 1H).
Пример 114: 4-Амино-5-(4-метоксибензилокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(4-метоксибензилокси)бензонитрила (Пример 114a) с получением 4-амино-5-(4-метоксибензилокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (12 мг, 10%).1H ЯМР (400 МГц, ДМСО-d6) δ 3,76 (с, 3H), 6,72 (д, J=8,4, 1H), 6,80 (д, J=8,1, 1H), 6,95 (м, 2H), 7,48 (м, 3H), 10,89 (ушир.с, 1H), 11,0 (ушир.с, 1H). МС 334 (MH+).
Пример 114a: 2-Сульфамоиламино-6-(4-метоксибензилокси)бензонитрил
К раствору хлорсульфонилизоцианата (212 мг, 1,50 ммоль) в CH2Cl2 (0,55 мл) при 0°С добавляют муравьиную кислоту (0,575 мл) под N2. Реакционную смесь перемешивают в течение 30 мин, и добавляют раствор 2-амино-6-(4-метоксибензилокси)бензонитрила (Пример 114b) (191 мг, 0,75 ммоль) в CH2Cl2 (4 мл) при 0°С с последующим добавлением Et3N (0,627 мл, 4,50 ммоль). Через 30 мин реакционную смесь концентрируют в вакууме и разбавляют водой. pH доводят до 7 концентрированной HCl, и очищают ВЭЖХ с обращенной фазой (10-90% ацетонитрил в воде) с получением 2-сульфамоиламино-6-(4-метоксибензилокси)бензонитрила (130 мг, 52%).1H ЯМР (400 МГц, MeOD) δ 3,80 (с, 3H), 5,15 (с, 2H), 6,88 (д, J=8,1 Гц 1H), 6,94 (м, 2H), 7,40 (м, 2H), 7,48 (т, J=8,7 Гц, 1H), 7,75 (дд, J=8,6, 0,8 Гц, 1H).
Пример 114b: 2-Амино-6-(4-метоксибензилокси)бензонитрил
Получают по методике примера 113b из 2-нитро-6-(4-метоксибензилокси)бензонитрила (Пример 114c) с получением 2-амино-6-(4-метоксибензилокси)бензонитрила (451 мг, 22%).1H ЯМР (400 МГц, MeOD) δ 3,80 (с, 3H), 5,06 (с, 2H), 6,33 (дд, J=8,3, 0,8 Гц, 1H), 6,38 (м, 1H), 6,93 (м, 2H), 7,19 (т, J=8,2 Гц, 1H), 7,38 (м, 2H).
Пример 114c: 2-Нитро-6-(4-метоксибензилокси)бензонитрил
Получают по методике примера 112c из 2,6-динитробензонитрила и 4-метоксибензилового спирта с получением 2-нитро-6-(4-метоксибензилокси)бензонитрила (2,40 г, 81%).1H ЯМР (400 МГц, CDCl3) δ 3,82 (с, 3H), 5,26 (с, 2H), 6,93 (м, 2H), 7,35 (дд, J=8,6, 0,7 Гц, 1H), 7,38 (м, 2H), 7,65 (т, J=8,6 Гц, 1H), 7,83 (дд, J=8,2, 0,8 Гц, 1H).
Пример 115: 4-Амино-5-оксиуксусная кислота-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид

Получают по методике примера 111 из этил 2-(2-циано-3-(сульфамоиламино)фенокси)ацетата (Пример 115a) с получением 4-амино-5-оксиуксусной кислоты-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксида (74,9 мг, 15%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 4,88 (с, 2H), 6,65 (дд, J=8,3, 0,8 Гц, 1H), 6,69 (дд, J=8,5, 0,7 Гц, 1H), 7,46 (т, J=8,3 Гц, 1H), 8,42 (ушир.с, 1H), 8,53 (ушир.с, 1H) 11,02 (ушир.с, 1H), 13,49 (ушир.с, 1H). МС 272 (MH+).
Пример 115a: Этил 2-(2-циано-3-(сульфамоиламино)фенокси)ацетат
Получают по методике примера 111a из этил 2-(3-амино-2-цианофенокси)ацетата (Пример 5b) с получением этил 2-(2-циано-3-(сульфамоиламино)фенокси)ацетата (567 мг, 79%) в виде твердого вещества светло-желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,22 (т, J=7,0 Гц, 3H), 4,19 (кв., J=7,0 Гц, 2H), 5,01 (с, 2H), 6,87 (д, J=8,6 Гц, 1H), 7,20 (д, J=8,3 Гц, 1H), 7,32 (с, 2H), 7,56 (т, J=8,6 Гц, 1H), 9,53 (ушир.с, 1H).
Пример 115b: Этил 2-(3-амино-2-цианофенокси)ацетат
Получают по методике примера 111b из этил 2-(3-амино-2-нитрофенокси)ацетата (Пример 115c) с получением этил 2-(3-амино-2-цианофенокси)ацетата (539 мг, 56%) в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,21 (т, J=7,6 Гц, 3H), 4,17 (кв., J=7,6 Гц, 2H), 4,85 (с, 2H), 6,06 (ушир.с, 2H), 6,10 (д, J=8,0 Гц, 1H), 6,38 (дд, J=8,6, 0,8 Гц, 1H), 7,17 (т, J=8,4 Гц, 1H).
Пример 115c: Этил 2-(3-амино-2-нитрофенокси)ацетат
К раствору 2-гидрокси-6-нитробензонитрила (Пример 115d) (616 мг, 4,33 ммоль) и K2CO3 (718 мг, 5,20 ммоль) в ацетоне (8 мл), добавляют этилбромацетат (0,576 мл, 5,20 ммоль). Реакционную смесь кипятят с обратным холодильником под N2 в течение 4,5 часов. После завершения реакционную смесь фильтруют, и фильтрат концентрируют и сушат с получением этил 2-(3-амино-2-нитрофенокси).1H ЯМР (400 МГц, ДМСО-d6) δ 1,23 (т, J=7,0 Гц, 3H), 4,20 (кв., J=7,1 Гц, 2H), 5,19 (с, 2H), 7,69 (дд, J=8,6, 0,8 Гц, 1H), 7,89 (т, J=8,4 Гц, 1H), 7,97 (дд, J=8,3, 0,8 Гц, 1H).
Пример 115d: 2-Гидрокси-6-нитробензонитрил
К раствору 2,6-динитробензонитрила (10,0 г, 52,3 ммоль) в MeOH (215 мл) добавляют раствор Na (1,32 г, 57,5 ммоль) в MeOH (23,3 мл). Реакционную смесь кипятят с обратным холодильником под N2 в течение 2,5 часов, охлаждают до КТ и осадок собирают фильтрацией. Полученный осадок объединяют с пиридингидрохлоридом (15,1 г, 130 ммоль), и твердые вещества плавят при 200°С в течение 18 часов. После завершения реакционную смесь охлаждают до КТ, промывают насыщенным раствором соли (1×300 мл) и экстрагируют EtOAc (2×500 мл). Органические слои объединяют, сушат над MgSO4, фильтруют и концентрируют с получением 2-гидрокси-6-нитробензонитрила (6,70 г, 87%).1H ЯМР (400 МГц, MeOD) δ 7,35 (дд, J=8,3, 0,8 Гц, 1H), 7,67 (т, J=8,2 Гц, 1H), 7,77 (дд, J=8,2, 1,1 Гц, 1H).
Пример 116: 4-Амино-5-(изопропокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-изопропоксибензонитрила (Пример 116a) с получением 4-амино-5-(изопропокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (50 мг, 171%).1H ЯМР (400 МГц, ДМСО-d6) δ 1,38 (д, J=5,8 Гц, 6H), 4,84 (септ, J=5,9 Гц, 1H), 6,59 (д, J=8,7 Гц, 1H), 6,77 (д, J=8,7 Гц, 1H), 7,45 (д, J=8,7 Гц, 1H), 7,81 (ушир.с, 1H), 8,32 (ушир.с, 1H), 10,94 (ушир.с, 1H). МС 256 (MH+).
Пример 116a: 2-Сульфамоиламино-6-изопропоксибензонитрил
Получают по методике примера 111a из 2-амино-6-изопропоксибензонитрила (Пример 6b) с получением 2-сульфамоиламино-6-изопропоксибензонитрила (21 мг, 8%).1H ЯМР (400 МГц, MeOD) δ 1,37 (д, J=5,6 Гц, 6H), 4,67 (септ, J=6,0 Гц, 1H), 6,29 (д, J=8,2 Гц, 1H), 6,36 (дд, J=8,1, 0,8 Гц, 1H), 7,07 (т, J=8,2 Гц, 1H).
Пример 116b: 2-Амино-6-изопропоксибензонитрил
Получают по методике примера 113b из 2-нитро-6-изопропоксибензонитрила (Пример 116c) с получением 2-амино-6-изопропоксибензонитрила (201 мг, 76%) в виде масла желтого цвета.1H ЯМР (400 МГц, MeOD) δ 1,34 (д, J=6,0 Гц, 6H), 4,64 (септ, J=6,1 Гц, 1H), 6,25 (д, J=8,1 Гц, 1H), 6,34 (дд, J=8,2, 0,8 Гц, 1H), 7,18 (т, J=8,3 Гц, 1H).
Пример 116c: 2-Нитро-6-изопропоксибензонитрил
Получают по методике примера 115c из 2-гидрокси-6-нитробензонитрила (Пример 115d) и изопропилбромида с получением 2-нитро-6-изопропоксибензонитрила (324 мг, 64%).1H ЯМР (400 МГц, MeOD) δ 1,43 (д, J=6,2 Гц, 6H), 4,89 (септ, J=6,2 Гц, 1H), 7,61 (дд, J=8,0, 1,0 Гц, 1H), 7,80 (т, J=8,2 Гц, 1H), 7,85 (дд, J=8,2, 1,2 Гц, 1H).
Пример 117: 4-Амино-5-(бензилокси)-1H-бензо[c] [1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(бензилокси)бензонитрила (Пример 117a) с получением 4-амино-5-(бензилокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (42 мг, 61%).1H ЯМР (400 МГц, MeOD) δ 5,32 (с, 2H), 6,65 (дд, J=8,3, 1,2 Гц, 1H), 6,85 (дд, J=8,6, 1,0 Гц, 1H), 7,36-7,52 (м, 6H). МС 304 (MH+).
Пример 117a: 2-Сульфамоиламино-6-(бензилокси)бензонитрил
Получают по методике примера 111a из 2-амино-6-(бензилокси)бензонитрила (Пример 117b) с получением 2-сульфамоиламино-6-(бензилокси)бензонитрила (74 мг, 30%).1H ЯМР (400 МГц, MeOD) δ 5,22 (с, 2H), 6,94 (д, J=8,5 Гц, 1H), 7,26 (д, J=8,2 Гц, 1H), 7,32 (м, 1H), 7,38 (т, J=7,2 Гц, 2H), 7,47 (д, J=7,4 Гц, 2H), 7,51 (т, J=8,2 Гц, 1H).
Пример 117b: 2-Амино-6-(бензилокси)бензонитрил
Получают по методике примера 113b из 2-нитро-6-(бензилокси)бензонитрила (Пример 117c) с получением 2-амино-6-(бензилокси)бензонитрила (215 мг, 63%).1H ЯМР (400 МГц, MeOD) δ 5,15 (с, 2H), 6,32 (д, J=8,2 Гц, 1H), 6,39 (д, J=8,2 Гц, 1H), 7,20 (т, J=8,4 Гц, 1H), 7,38 (т, J=7,6 Гц, 2H), 7,46 (д, J=7,4 Гц, 2H). МС 225 (MH+).
Пример 117c: 2-Нитро-6-(бензилокси)бензонитрил
К раствору 2-гидрокси-6-нитробензонитрила (пример 115) (1,0 г, 6,09 ммоль) и Cs2CO3 (2,16 г, 6,64 ммоль) в ацетоне (14 мл) добавляют бензилбромид (1,16 г, 6,76 ммоль). Реакционную смесь кипятят с обратным холодильником под N2 в течение 1,5 часов, затем фильтруют, и фильтрат концентрируют. Остаток очищают флэш-хроматографией 3:2 гексан:EtOAc с получением 2-нитро-6-(бензилокси)бензонитрила (500 мг, 32%).1H ЯМР (400 МГц, MeOD) δ 5,40 (с, 2H), 7,34-7,45 (м, 3H), 7,53 (м, 2H), 7,69 (дд, J=8,6, 0,8 Гц, 1H), 7,82 (т, J=8,4 Гц, 1H), 7,91 (т, J=8,2, 0,8 Гц, 1H).
Пример 118: 4-Амино-5-(этокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-этоксибензонитрила (Пример 118a) с получением 4-амино-5-этокси-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (120 мг, 50%).1H ЯМР (400 МГц, ДМСО-d6) δ 1,37 (т, J=6,9 Гц, 3H), 4,18 (кв., J=6,9 Гц, 2H), 6,96 (д, J=8,8 Гц, 1H), 7,16 (д, J=8,8 Гц, 1H), 7,27 (ушир.с, 2H), 7,57 (т, J=8,4 Гц, 1H), 9,44 (ушир.с, 1H). МС 242 (MH+).
Пример 118a: 2-Сульфамоиламино-6-этоксибензонитрил
Получают по методике примера 111a из 2-амино-6-этоксибензонитрила (Пример 8b) с получением 2-сульфамоиламино-6-этоксибензонитрила (161 мг, 67%). МС 242 (MH+).
Пример 118b: 2-Амино-6-этоксибензонитрил
Получают по методике примера 111b из 2-нитро-6-этоксибензонитрила (Пример 8c) с получением 2-амино-6-этоксибензонитрила (162 мг, 100%). МС 163 (MH+).
Пример 118c: 2-Нитро-6-этоксибензонитрил
Получают по методике примера 115c из 2-гидрокси-6-нитробензонитрила (Пример 115d) и этилбромида с получением 2-нитро-6-этоксибензонитрила (192 мг, 50%).
Пример 119: 4-Амино-5-(бутокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-бутоксибензонитрила (Пример 119a) с получением 4-амино-5-бутокси-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (67 мг, 50%).1H ЯМР (400 МГц, ДМСО-d6) δ 0,95 (т, J=7,4 Гц, 3H), 1,44 (секст, J=7,4 Гц, 2H), 1,81 (квинт, J=7,9 Гц, 2H), 4,17 (т, J=6,7 Гц, 2H), 6,61 (д, J=8,2 Гц, 1H), 6,76 (д, J=8,2 Гц, 1H), 7,46 (т, J=8,2 Гц, 1H), 7,82 (ушир.с, 1H), 8,35 (ушир.с, 1H), 10,96 (ушир.с, 1H). МС 270 (MH+).
Пример 119a: 2-Сульфамоиламино-6-бутоксибензонитрил
Получают по методике примера 111a из 2-амино-6-бутоксибензонитрила (Пример 9b) с получением 2-сульфамоиламино-6-бутоксибензонитрила. МС 270 (MH+).
Пример 119b: 2-Амино-6-бутоксибензонитрил
Получают по методике примера 111b из 2-нитро-6-бутоксибензонитрила (Пример 9c) с получением 2-амино-6-бутоксибензонитрила (190 мг, 71%). МС 191 (MH+).
Пример 119c: 2-нитро-6-бутоксибензонитрил
Получают по методике примера 115c из 2-гидрокси-6-нитробензонитрила (Пример 115d) и бутилбромида с получением 2-нитро-6-бутоксибензонитрила.
Пример 120: 4-Амино-1-метил-1H-пиразоло[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 5-сульфамоиламино-1-метил-1H-пиразол-4-карбонитрила (Пример 120a) с получением 4-амино-1-метил-1H-пиразоло[c][1,2,6]тиадиазин-2,2-диоксида (100 мг, 50%).1H ЯМР (400 МГц, ДМСО-d6) δ 3,76 (с, 3H), 7,43 (с, 2H), 7,98 (с, 1H), 9,84 (с, 1H).
Пример 120a: 5-сульфамоиламино-1-метил-1H-пиразол-4-карбонитрил
Получают по методике примера 111a из 5-амино-1-метил-1H-пиразол-4-карбонитрила с получением 5-сульфамоиламино-1-метил-1H-пиразол-4-карбонитрила.
Пример 121: 4-Амино-2H-пиразоло[c][1,2,6]тиадиазин-2,2-диоксид
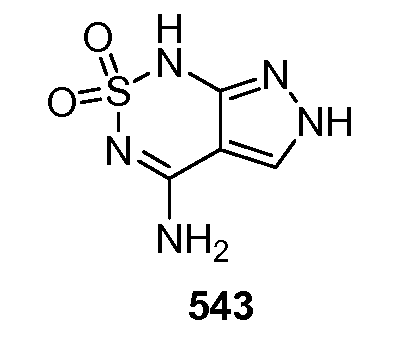
Получают по методике примера 111 из 3-сульфамоиламино-1H-пиразол-4-карбонитрила (Пример 11a) с получением 4-амино-2H-пиразоло[c][1,2,6]тиадиазин-2,2-диоксид (90 мг, 48%).1H ЯМР (400 МГц, ДМСО-d6) δ 6,97 (с, 2H), 8,47 (с, 1H), 9,71 (с, 1H), 13,36 (с, 1H).
Пример 121a: 3-сульфамоиламино-1H-пиразол-4-карбонитрил
Получают по методике примера 111a из 3-амино-1H-пиразол-4-карбонитрила с получением 3-сульфамоиламино-1H-пиразол-4-карбонитрила.
Пример 122: 4-Амино-7-метокси-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-4-метоксибензонитрила (Пример 122a) с получением 4-амино-7-метокси-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (49 мг, 65%).1H ЯМР (400 МГц, ДМСО-d6) δ 3,81 (с, 3H), 6,58 (д, J=2,3 Гц, 1H), 6,75 (дд, J=9,1, 2,7 Гц, 1H), 7,82 (д, J=8,8 Гц, 1H), 10,85 (ушир.с, 1H), 10,99 (ушир.с, 1H). МС 228 (MH+).
Пример 122a: 2-Сульфамоиламино-4-метоксибензонитрил
Получают по методике примера 114a из 2-амино-4-метоксибензонитрила (Пример 122b) с получением 2-сульфамоиламино-4-метоксибензонитрила в виде белых кристаллов (111 мг, 44%).1H ЯМР (400 МГц, MeOD) δ 3,85 (с, 3H), 6,73 (дд, J=9,0, 2,8 Гц, 1H), 7,54 (д, J=9,0 Гц, 1H), 7,84 (д, J=2,4 Гц, 1H). МС 228 (MH+).
Пример 122b: 2-Амино-4-метоксибензонитрил
Получают по методике примера 111b из 2-нитро-4-метоксибензонитрила с получением 2-амино-4-метоксибензонитрила (910 мг, 78%).1H ЯМР (400 МГц, CDCl3) δ 3,79 (с, 3H), 4,73 (ушир.с, 2H), 6,20 (м, 1H), 6,31 (м, 1H), 7,30 (д, J=8,7 Гц, 1H).
Пример 123: Этил 4-амино-5-метил-2-оксо-1,2-дигидротиено[c][1,3,6]тиадиазин-2,2-диоксид-6-карбоксилат
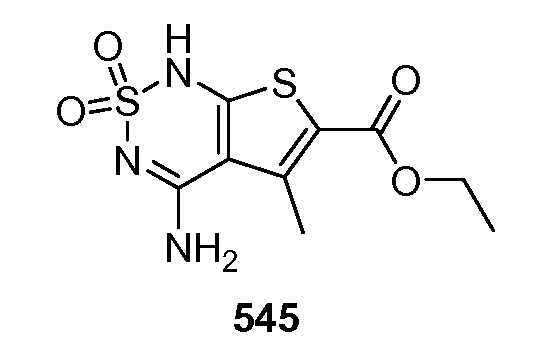
Получают по методике примера 111 из этил 5-сульфамоиламино-4-циано-3-метилтиофен-2-карбоксилата (Пример 123a) с получением этил 4-амино-5-метил-2-оксо-1,2-дигидротиено[c][1,3,6]тиадиазин-2,2-диоксид-6-карбоксилата (1,22 г, 72%).1H ЯМР (400 МГц, ДМСО-d6) δ 1,26 (т, J=6,9 Гц, 3H), 2,73 (с, 3H), 4,17 (кв., J=7,0 Гц, 2H). МС 290 (MH+).
Пример 123a: Этил 5-сульфамоиламино-4-циано-3-метилтиофен-2-карбоксилат
Получают по методике примера 114a из этил 5-амино-4-циано-3-метилтиофен-2-карбоксилата (Пример 123b) с получением этил 5-сульфамоиламино-4-циано-3-метилтиофен-2-карбоксилата (1,73 г, 80%).1H ЯМР (400 МГц, ДМСО-d6) δ 1,28 (т, J=7,0 Гц, 3H), 2,36 (с, 3H), 4,24 (кв., J=7,1 Гц, 2H).
Пример 123b: Этил 5-амино-4-циано-3-метилтиофен-2-карбоксилат
К раствору этил 3-оксобутаноата (3,0 мл, 23,5 ммоль), малононитрила (1,55 г, 23,5 ммоль) и серы (753 мг, 23,5 ммоль) в EtOH (39 мл), добавляют Et3N (3,28 мл, 23,5 ммоль). Реакционную смесь кипятят с обратным холодильником под N2 в течение 3 часов, затем сразу очищают флэш-хроматографией (99:1 CH2Cl2:EtOAc) с получением этил 5-амино-4-циано-3-метилтиофен-2-карбоксилат (2,18 г, 44%).1H ЯМР (400 МГц, ДМСО-d6) δ 1,21 (т, J=7,0 Гц, 3H), 2,36 (с, 3H), 4,15 (кв., J=7,2 Гц, 2H).
Пример 124: 4-Амино-7-метил-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-4-метилбензонитрила (Пример 124a) с получением 4-амино-7-метил-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (50 мг, 50%).1H ЯМР (400 МГц, MeOD) δ 2,40 (с, 3H), 6,92 (с, 1H), 7,03 (м, 1H), 7,70 (д, J=8,2 Гц, 1H). МС 212 (MH+).
Пример 124a: 2-Сульфамоиламино-4-метилбензонитрил
Получают по методике примера 114a из 2-амино-4-метилбензонитрила (Пример 14b) с получением 2-сульфамоиламино-4-метилбензонитрила (205 мг, 82%).1H ЯМР (400 МГц, CDCl3) δ 2,35 (с, 3H), 6,88 (м, 1H), 7,38 (д, J=7,7 Гц, 1H), 7,72 (ушир.с, 1H), 7,97 (с, 1H), 9,37 (с, 1H). МС 212 (MH+).
Пример 124b: 2-Амино-4-метилбензонитрил
Раствор 2-бром-4-метилбензонитрила (2,0 г, 10,7 ммоль) и CuCN (1,92 г, 21,4 ммоль) в NMP (10 мл) подвергают взаимодействию с микроволновом реакторе в течение 20 мин при 200°С. После завершения реакционную смесь охлаждают до 0°С и медленно добавляют 15% водный NH4OH (215 мл). Смесь перемешивают при КТ в течение 30 мин, затем экстрагируют CH2Cl2. Органический слой промывают H2O, насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают флэш-хроматографией (3:1 гексан:EtOAc) с получением 2-амино-4-метилбензонитрила (1,24 г, 88%).1H ЯМР (400 МГц, CDCl3) δ 1,45 (с, 3H), 5,70 (м, 1H), 5,84 (м, 1H), 6,41 (д, J=8,0 Гц, 1H).
Пример 125: 4-Амино-8-метил-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-3-метилбензонитрила (Пример 125a) с получением 4-амино-8-метил-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (9 мг, 8%).1H ЯМР (400 МГц, MeOD) δ 2,37 (с, 3H), 7,09 (т, J=7,7 Гц, 1H), 7,45 (д, J=7,3 Гц, 1H), 8,04 (д, J=7,7 Гц, 1H). МС 212 (MH+).
Пример 125a: 2-Сульфамоиламино-3-метилбензонитрил
Получают по методике примера 114a из 2-амино-3-метилбензонитрила (Пример 15b) с получением 2-сульфамоиламино-3-метилбензонитрила (115 мг, 46%).1H ЯМР (400 МГц, MeOD) δ 2,34 (с, 3H), 7,31 (т, J=7,5 Гц, 1H), 7,57 (м, 2H). МС 212 (MH+).
Пример 126: 4-Амино-7-циано-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 114a из 2-аминотерефталонитрила (Пример 126a) с получением 4-амино-7-циано-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (40 мг, 16%).1H ЯМР (400 МГц, ДМСО-d6) δ 7,37 (д, J=1,5 Гц, 1H), 7,57 (дд, J=8,2, 1,6 Гц, 1H), 8,12 (д, J=8,5 Гц, 1H), 8,51 (ушир.с, 2H), 11,51 (с, 1H). МС 223 (MH+).
Пример 126a: 2-Аминотерефталонитрил
Получают по методике примера 124b из 2,5-диброманилина с получением 2-аминотерефталонитрила (1,14 г, 100%).1H ЯМР (400 МГц, MeOD) δ 6,91 (дд, J=8,2, 1,6 Гц, 1H), 7,12 (д, J=1,6 Гц, 1H), 7,51 (д, J=8,0 Гц, 1H).
Пример 127: 4-Амино-8-метокси-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-3-метоксибензонитрила (Пример 127a) с получением 4-амино-8-метокси-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (11 мг, 15%).1H ЯМР (400 МГц, MeOD) δ 3,97 (с, 3H), 7,14 (т, J=7,9 Гц, 1H), 7,22 (дд, J=7,8, 1,2 Гц, 1H), 7,72 (д, J=8,2, 1,2 Гц, 1H). МС 228 (MH+).
Пример 127a: 2-Сульфамоиламино-3-метоксибензонитрил
Получают по методике примера 114a из 2-амино-3-метоксибензонитрила (Пример 127b) с получением 2-сульфамоиламино-3-метоксибензонитрила (113 мг, 45%).1H ЯМР (400 МГц, ДМСО-d6) δ 3,85 (с, 3H), 7,27 (м, 1H), 7,30 (дд, J=7,7, 1,7 Гц, 1H), 7,35 (дд, J=7,9, 1,7 Гц, 1H), 8,87 (с, 1H), 9,09 (ушир.с, 1H). МС 228 (MH+).
Пример 127b: 2-Амино-3-метоксибензонитрил
Получают по методике примера 111b из 3-метокси-2-нитробензонитрила с получением 2-амино-3-метоксибензонитрила (346 мг, 60%).1H ЯМР (400 МГц, MeOD) δ 3,87 (с, 3H), 6,65 (т, J=7,7 Гц, 1H), 6,95 (дд, J=7,7, 1,2 Гц, 1H), 7,00 (дд, J=8,2, 1,2 Гц, 1H). МС 149 (MH+).
Пример 128: 4-Амино-7-гидрокси-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-4-гидроксибензонитрила (Пример 128a) с получением 4-амино-7-гидрокси-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (7 мг, 14%).1H ЯМР (400 МГц, MeOD) δ 6,50 (д, J=2,0 Гц, 1H), 6,65 (дд, J=9,0, 2,4 Гц, 1H), 7,82 (д, J=8,8 Гц, 1H). МС 214 (MH+).
Пример 128a: 2-Сульфамоиламино-4-гидроксибензонитрил
Получают по методике примера 114a из 2-амино-4-гидроксибензонитрила (Пример 18b) с получением 2-сульфамоиламино-4-гидроксибензонитрила (51 мг, 22%).1H ЯМР (400 МГц, MeOD) δ 6,56 (дд, J=8,6, 2,4 Гц, 1H), 7,43 (д, J=8,6 Гц, 1H), 7,68 (д, J=2,2 Гц, 1H). МС 214 (MH+).
Пример 128b: 2-Амино-4-гидроксибензонитрил
Получают по методике примера 111b из 4-гидрокси-2-нитробензонитрила (Пример 128c) с получением 2-амино-4-гидроксибензонитрила (286 мг, 100%).1H ЯМР (400 МГц, MeOD) δ 6,15 (дд, J=8,5, 2,3 Гц, 1H), 6,20 (д, J=1,9 Гц, 1H), 7,18 (д, J=8,6 Гц, 1H).
Пример 128c: 4-Гидрокси-2-нитробензонитрил
Смесь 4-метокси-2-нитробензонитрила (820 мг, 4,6 ммоль) и пиридингидрохлорида (755 мг, 4,6 ммоль) нагревают при 200°С под N2 в течение 18 часов. После завершения реакционную смесь охлаждают до комнатной температуры, промывают насыщенным раствором соли и экстрагируют EtOAc (2×100 мл). Органические слои объединяют, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают флэш-хроматографией (1:1 гексан:EtOAc) с получением 4-гидрокси-2-нитробензонитрила (200 мг, 26%).1H ЯМР (400 МГц, MeOD) δ 7,24 (дд, J=8,6, 2,4 Гц, 1H), 7,70 (д, J=2,4 Гц, 1H), 7,83 (д, J=8,6 Гц, 1H).
Пример 129: 4-Амино-5-(2-метилпроп-1-енил)-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид

К перемешиваемому раствору 2-сульфамоиламино-6-(2-метилпроп-1-енил)бензонитрила (Пример 129a) (1,69 г, 6,73 ммоль) в EtOH (29,0 мл), в атмосфере азота добавляют водный раствор NaOH (2,0M, 6,73 мл, 13,45 ммоль) при комнатной температуре. Полученную смесь нагревают при кипении с обратным холодильником в течение 4 ч, охлаждают до комнатной температуры и нейтрализуют 10% AcOH (pH ~ 6). Нейтрализованную смесь выдерживают на ледяной бане в течение 30 мин. Полученный осадок фильтруют, промывают холодной водой и сушат с получением 1,49 г (88%) указанного в заголовке соединения в виде твердого вещества белого цвета. Продукт очищают кристаллизацией из этанола. т.пл.: > 260°С.1H-ЯМР (400 МГц, ДМСО-d6) δ 10,91 (ушир.с, 1H), 8,30 (ушир.с, 1H), 7,46 (т, J=8,00 Гц, 1H), 6,96 (ушир.с, 1H), 6,92 (д, J=8,4 Гц, 1H), 6,83 (д, J=7,2 Гц, 1H), 6,46 (ушир.с, 1H), 1,89-1,87 (м, 3H), 1,65-1,63 (м, 3H).13C-ЯМР (100 МГц, ДМСО-d6) δ 162,1, 143,1, 138,8, 137,6, 132,9, 124,4, 123,3, 115,7, 110,7, 25,8 и 19,2. МС 252 (MH+).
Пример 129a: 2-Сульфамоиламино-6-(2-метилпроп-1-енил)бензонитрил
Раствор 2-амино-6-(2-метилпроп-1-енил)бензонитрила (Пример 129b) (1,24 г; 7,23 ммоль) в N,N-диметилацетамиде (ДМА) (20,0 мл) в атмосфере азота обрабатывают сульфамоилхлоридом (1,67 г; 14,45 ммоль) при комнатной температуре. Полученную смесь перемешивают при комнатной температуре в течение 2 ч, и реакцию гасят водой (40 мл). Смесь экстрагируют EtOAc (4×80 мл), объединенный экстракт промывают водой (2×20 мл) и насыщенным раствором соли, сушат с MgSO4. Фильтрат выпаривают, и остаток очищают хроматографией на силикагеле с применением градиента (гексан/EtOAc 1:0 до 1:1), с получением 1,69 г (93%) указанного в заголовке соединения в виде твердого вещества белого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 9,42 (ушир.с, 1H), 7,61 (т, J=8,0 Гц, 1H), 7,44 (д, J=8,0 Гц, 1H), 7,24 (ушир.с, 2H), 7,19 (д, J=8,0 Гц, 1H), 6,35 (ушир.с, 1H), 1,92-1,95 (м, 3H), 1,76-1,79 (м, 3H).
Пример 129b: 2-Амино-6-(2-метилпроп-1-енил)бензонитрил
Концентрированную HCl (65,5 мл) медленно добавляют к раствору 2-нитро-6-(2-метилпроп-1-енил)бензонитрила (Пример 129c) (2,00 г; 9,89 ммоль) в EtOH (120,2 мл) при комнатной температуре. Затем полученную смесь обрабатывают порошком железа (5,52 г; 98,91 ммоль), добавляемого небольшими порциями при той же температуре. Смесь перемешивают при комнатной температуре в течение 15 мин и затем нагревают при кипении с обратным холодильником в течение 30 мин. Смесь охлаждают до комнатной температуры, EtOH выпаривают, и pH доводят до pH~10 водным NaOH (2,0M). Подщелоченную смесь экстрагируют EtOAc (4×100 мл) и объединенный экстракт сушат с безводным MgSO4. Фильтрат выпаривают, и остаток очищают хроматографией на силикагеле с применением градиента от гексана до гексан/EtOAc (8:2) с получением 1,32 г (77%) указанного в заголовке соединения в виде масла желтого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 7,19-7,25 (м, 1H), 6,62 (д, J=8,4 Гц, 1H), 6,46 (д, J=7,2 Гц, 1H), 6,23 (ушир.с, 1H), 5,91 (ушир.с, 2H), 1,86- 1,88 (м, 3H), 1,72-1,74 (м, 3H).
Пример 129c: 2-Нитро-6-(2-метилпроп-1-енил)бензонитрил
Суспензию трифторметансульфоната 2-циано-3-нитрофенила (Пример 129d) (4,80 г; 16,21 ммоль), 2-метил-1-пропенилбороновой кислоты (2,43 г; 24,32 ммоль), тетракис(трифенилфосфин)палладия(0) (1,87 г; 1,62 ммоль), карбоната натрия (1,89 г; 17,83 ммоль) и воды (33,0 мл) в диметоксиэтане (ДМЭ) (132,0 мл) нагревают при кипении с обратным холодильником в течение 4 ч в атмосфере азота. Реакционную смесь охлаждают до комнатной температуре и разбавляют водой (100 мл) и EtOAc (250 мл). Органическую фазу отделяют, и водную фазу экстрагируют EtOAc (3×100 мл). Объединенный экстракт промывают насыщенным раствором соли и сушат с безводным MgSO4. Фильтрат выпаривают, и остаток очищают хроматографией на силикагеле с применением градиента от гексана до гексан/EtOAc (7:3), с получением 2,01 г (61%) указанного в заголовке соединения в виде твердого вещества желтого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 8,19-8,23 (м, 1H), 7,83-7,93 (м, 2H), 6,45 (ушир.с, 1H), 1,95-1,98 (м, 3H), 1,75-1,79 (м, 3H).
Пример 129d: Трифторметансульфонат 2-циано-3-нитрофенила
К раствору 2-гидрокси-6-нитробензонитрила (Пример 129e) (2,90 г, 17,67 ммоль) в CH2Cl2 (90,0 мл) при 0°С в атмосфере азота добавляют триэтиламин (3,58 г, 4,93 мл, 35,34 ммоль) с последующим добавлением по каплям трифторметансульфонового ангидрида (7,48 г, 4,46 мл, 26,51 ммоль). Реакционную смесь перемешивают при 0°С в течение 30 мин и реакцию гасят насыщенным водным раствором Na2CO3 (100 мл). Органический слой отделяют, и водную фазу экстрагируют CH2Cl2 (3×100 мл). Объединенный экстракт сушат с безводным MgSO4, фильтруют и выпаривают. Остаток очищают хроматографией на силикагеле с применением градиента от гексана до гексан/EtOAc (6:4) с получением 5,23 г (100%) указанного в заголовке соединения в виде твердого вещества коричневого цвета.1H-ЯМР (400 МГц, ДМСОd6) δ 8,49-8,53 (м, 1H), 8,23-8,27 (м, 1H), 8,13-8,19 (м, 1H).
Пример 129e: 2-Гидрокси-6-нитробензонитрил
2-Метокси-6-нитробензонитрил (Пример 129f) (10,73 г, 60,2 ммоль) и пиридингидрохлорид (16,0 г, 138 ммоль) смешивают вместе в виде твердых веществ в атмосфере азота, затем нагревают на предварительно разогретой масляной бане при 200°С в течение 40 мин. После охлаждения до комнатной температуры добавляют воду (200 мл) и CH2Cl2 (200 мл) и энергично перемешивают в течение 1 часа. Затем выпавший в осадок продукт собирают фильтрацией и перекристаллизовывают из воды с получением 8,2 г, (83%) 2-гидрокси-6-нитробензонитрила в виде твердого вещества коричневого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 12,13 (ушир.с, 1H), 7,68-7,79 (м, 2H), 7,39-7,44 (м, 1H).
Пример 129f: 2-Метокси-6-нитробензонитрил
Раствор метоксида натрия, полученный добавлением натрия (1,68 г, 73,1 ммоль) к безводному MeOH (73 мл), добавляют к 2,6-динитробензонитрилу (13,20 г, 68,4 ммоль) в сухом MeOH (284 мл) в атмосфере азота при комнатной температуре в течение 10 мин. Реакционную смесь кипятят с обратным холодильником в течение 1 часа и затем MeOH удаляют в вакууме. Добавляют дихлорметан (400 мл), и нерастворимые твердые вещества отфильтровывают. Органический слой промывают насыщенным раствором соли (100 мл), сушат с MgSO4 и удаляют в вакууме с получением 11,45 г (94%) 2-метокси-6-нитробензонитрила, который применяют без дальнейшей очистки.1H-ЯМР (400 МГц, ДМСО-d6) δ 7,87-7,94 (м, 2H), 7,68-7,75 (м, 1H), 4,01 (с, 3H).
Пример 130: 4-Амино-5-((E)-проп-1-енил)-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид

К перемешиваемому раствору (Е)-2-сульфамоиламино-6-(проп-1-енил)бензонитрила (Пример 130a) (0,82 г, 3,45 ммоль) в EtOH (15,0 мл), в атмосфере азота, в водном растворе NaOH (2,0 M, 3,45 мл, 6,90 ммоль) добавляют при комнатной температуре. Полученную смесь нагревают при кипении с обратным холодильником в течение 4 ч. Смесь охлаждают до комнатной температуры и нейтрализуют (pH ~6) 10% AcOH. Нейтрализованную смесь хранят на ледяной бане в течение 30 мин. Полученный осадок фильтруют, промывают водой и сушат с получением 0,70 г (86%) указанного в заголовке соединения. Продукт очищают кристаллизацией из этанола. т. пл.: > 260°С.1H-ЯМР (400 МГц, ДМСО-d6) δ 10,90 (ушир.с, 1H), 8,32 (ушир.с, 1H), 7,45 (т, J=7,6 Гц, 1H), 7,11 (д, J=7,6 Гц, 1H), 6,95 (ушир.с, 1H), 6,91 (д, J=7,2 Гц, 1H), 6,75 (дд, J=15,6 Гц, J=1,2 Гц, 1H), 6,23 (дкв., J=15,6 Гц, J=6,8 Гц, 1H), 1,88 (дд, J=6,8 Гц, J=1,6 Гц, 3H).13C-ЯМР (100 МГц, ДМСО-d6) δ 162,2, 142,9, 138,3, 133,2, 131,2, 128,8, 121,7, 115,8, 110,4 и 18,7. МС 238 (MH+).
Пример 130a: (Е)-2-Сульфамоиламино-6-(проп-1-енил)бензонитрил
Раствор (Е)-2-амино-6-(проп-1-енил)бензонитрила (пример 130b) (0,60 г, 3,82 ммоль) в N,N-диметилацетамиде (ДМА) (15,5 мл), в атмосфере азота, обрабатывают сульфамоилхлоридом (0,88 г, 7,63 ммоль) при комнатной температуре. Полученную смесь перемешивают при комнатной температуре в течение 2 ч, и реакцию гасят водой (20 мл). Смесь экстрагируют EtOAc (4×80 мл), объединенный экстракт промывают водой (2×20 мл) и насыщенным раствором соли, сушат с MgSO4. Фильтрат выпаривают, и остаток очищают хроматографией на силикагеле с применением градиента от гексана до гексан/EtOAc (1:1) с получением 0,83 г (92%) указанного в заголовке соединения в виде твердого вещества белого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 9,39 (ушир.с, 1H), 7,48-7,60 (м, 2H), 7,38-7,43 (м, 1H), 7,21 (ушир.с, 2H), 6,51-6,65 (м, 2H), 1,88- 1,94 (м, 3H).
Пример 130b: (Е)-2-Амино-6-(проп-1-енил)бензонитрил
Концентрированную HCl (34,5 мл) медленно добавляют к раствору (Е)-2-нитро-6-(проп-1-енил)бензонитрила (Пример 2c) (0,98 г, 5,21 ммоль) в EtOH (63,5 мл) при комнатной температуре. Затем полученную смесь обрабатывают порошком железа (2,91 г, 52,08 ммоль), который добавляют маленькими порциями при той же температуре. Смесь перемешивают при комнатной температуре в течение 15 мин, и затем нагревают при кипении с обратным холодильником в течение 30 мин. Смесь охлаждают до комнатной температуры, EtOH выпаривают и pH доводят до pH~10 водным раствором NaOH (2,0M). Подщелоченную смесь экстрагируют EtOAc (4×100 мл) и объединенный экстракт сушат с безводным MgSO4. Фильтрат выпаривают, и остаток очищают хроматографией на силикагеле с применением градиента от гексана до гексан/EtOAc (8:2) с получением 0,67 г (81%) указанного в заголовке соединения в виде твердого вещества белого цвета.1H-ЯМР (400 МГц, DMCO-d6) δ 7,16-7,23 (м, 1H), 6,78 (д, J=7,2 Гц, 1H), 6,59-6,64 (м, 1H), 6,35-6,53 (м, 2H), 5,92 (ушир.с, 2H), 1,83-1,89 (м, 3H).
Пример 130c: (Е)-2-Нитро-6-(проп-1-енил)бензонитрил
Суспензию 2-йод-6-нитробензонитрила (Пример 130d) (1,52 г, 5,53 ммоль), тетракис(трифенилфосфин)палладия(0) (0,64 г, 0,55 ммоль), транс-1-пропен-1-илбороновой кислоты (0,95 г, 11,06 ммоль), карбонат натрия (0,65 г, 6,08 ммоль) и воды (10,0 мл) в диметоксиэтане (ДМЭ) (40,0 мл) нагревают при кипении с обратным холодильником в течение 15 ч, в атмосфере азота. Реакционную смесь охлаждают до комнатной температуры и разбавляют водой (20 мл) и EtOAc (100 мл). Органическую фазу отделяют, и водную фазу экстрагируют с EtOAc (3×50 мл). Объединенный экстракт промывают насыщенным раствором соли и сушат с безводным MgSO4. Фильтрат выпаривают, и остаток очищают хроматографией на силикагеле с применением градиента от гексана до гексан/EtOAc (7:3) с получением 0,98 г (94%) указанного в заголовке соединения в виде твердого вещества белого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 8,16-8,24 (м, 2H), 7,83-7,89 (м, 1H), 6,71- 6,84 (м, 2H), 1,90-2,02 (м, 3H).
Пример 130d: 2-Йод-6-нитробензонитрил
2-Амино-6-нитробензонитрил (Пример 130e) (4,32 г, 26,5 ммоль) добавляют небольшими порциями к суспензии нитрита натрия (2,19 г, 31,7 ммоль) в концентрированной H2SO4 (43 мл) и уксусной кислоте (43 мл) при 45°C. Реакционную смесь нагревают при 45°C в течение 1 ч и затем добавляют небольшими порциями к раствору йодида калия (7,47 г, 45,0 ммоль) в H2SO4 (1M, 43 мл). После перемешивания при комнатной температуре в течение 1,5 ч к реакционной смеси добавляют ледяную воду, и выпавший в осадок продукт собирают фильтрацией. Продукт очищают хроматографией на силикагеле, элюируя CH2Cl2 с получением 2-йод-6-нитробензонитрила (3,86 г, 53%) в виде твердого вещества желтого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 8,46-8,52 (м, 1H), 8,34-8,38 (м, 1H), 7,66-7,71 (м, 1H).
Пример 130e: 2-Амино-6-нитробензонитрил
Концентрированную HCl (39 мл) добавляют к раствору 2,6-динитробензонитрила (11,3 г, 58,5 ммоль) в MeOH (235 мл) и 1,4-диоксана (145 мл) при 70°С. Внешний нагрев удаляют, и порошок железа (11,44 г, 205 ммоль) медленно добавляют порциями с такой скоростью, чтобы сохранять температуру 70°С. После добавления железа реакционную смесь нагревают до кипения с обратным холодильником в течение еще 30 мин, затем охлаждают до комнатной температуры и выливают в EtOAc (400 мл) и воду (400 мл). Твердые вещества отфильтровывают и дважды экстрагируют кипящим EtOAc (300 мл). Объединенный органический экстракт сушат с MgSO4, фильтруют и выпаривают с получением 2-амино-6-нитробензонитрила (6,5 г, 68%) в виде твердого вещества красного цвета, которое применяют без дальнейшей очистки.1H-ЯМР (400 МГц, ДМСО-d6) δ 7,48-7,54 (м, 1H), 7,41-7,45 (м, 1H), 7,18-7,22 (м, 1H), 6,74 (ушир.с, 2H).
Пример 131: 4-Амино-5-((Z)-проп-1-енил)-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид

Получают по методике примера 129 из (Z)-2-сульфамоиламино-6-(проп-1-енил)бензонитрила (Пример 131a) с получением 4-амино-5-((Z)-проп-1-енил)-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксида (28,2 мг, 91%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 10,92 (ушир.с, 1H), 8,30 (ушир.с, 1H), 7,44-7,51 (м, 1H), 6,90-7,00 (м, 2H), 6,83-6,89 (м, 1H), 6,65-6,73 (м, 1H), 5,88-5,99 (м, 1H), 1,60-1,66 (м, 3H).
Пример 131a: (Z)-2-Сульфамоиламино-6-(проп-1-енил)бензонитрил
Получают по методике примера 129a из (Z)-2-амино-6-(проп-1-енил)бензонитрил (Пример 3b) в количестве 32,7 мг (92%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 9,45 (ушир.с, 1H), 7,59-7,65 (м, 1H), 7,47 (д, J=7,6 Гц, 1H), 7,18-7,28 (м, 3H), 6,50-6,57 (м, 1H), 5,99-6,09 (м, 1H), 1,74-1,79 (м, 3H).
Пример 131b: (Z)-2-Амино-6-(проп-1-енил)бензонитрил
Концентрированную HCl (1,54 мл) добавляют к суспензии (Z)-2-нитро-6-(проп-1-енил)бензонитрила (Пример 3c) (0,35 г, 1,86 ммоль) в MeOH (30 мл) и 1,4-диоксане (15 мл) при комнатной температуре с последующим добавлением порциями порошка железа (0,73 г, 13,0 ммоль). Полученную смесь нагревают до кипения с обратным холодильником в течение 2,5 ч, охлаждают до 0°С и pH доводят до pH~10 50% водным раствором NaOH. Смесь экстрагируют EtOAc (3×50 мл), объединенный экстракт сушат с MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле элюируя градиентом от 0% до 100% ДХМ в гексане с получением 0,24 г (80%) (Z)-2-амино-6-(проп-1-енил)бензонитрила в виде масла желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,24-7,30 (м, 1H), 6,68 (д, J=8,4 Гц, 1H), 6,55 (д, J=7,2 Гц, 1H), 6,42-6,48 (м, 1H), 5,98 (ушир.с, 2H), 5,89-5,97 (м, 1H), 1,74-1,78 (м, 3H). МС 159 (MH+).
Пример 131c: (Z)-2-Нитро-6-(проп-1-енил)бензонитрил
Получают по методике примера 129c из трифторметансульфоната 2-циано-3-нитрофенил (Пример 129d) и цис-1-пропен-1-илбороновой кислотой Неочищенный продукт очищают хроматографией на силикагеле элюируя градиентом растворителей от 0% до 100% ДХМ в гексане, с получением 0,80 г (97%) (Z)-2-нитро-6-(проп-1-енил)бензонитрила (97%) в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 8,25-8,30 (м, 1H), 7,90-7,98 (м, 2H), 6,25-6,70 (м, 1H), 6,17-6,28 (м, 1H), 1,78-1,82 (м, 3H).
Пример 132: 4,5-Диамино-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид
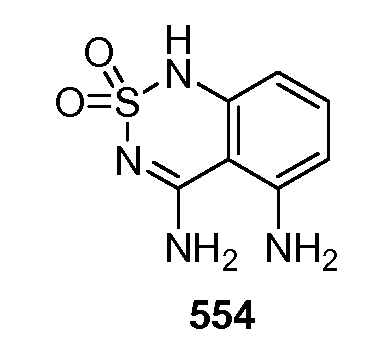
Получают по методике примера 129 из 2-сульфамоиламино-6-аминобензонитрила (Пример 132a) в количестве 95,3 мг (84%) в виде твердого вещества коричневого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 10,55 (ушир.с, 1H), 7,80 (ушир.с, 2H), 7,09-7,16 (т, J=8,0 Гц, 1H), 6,42 (д, J=8,4 Гц, 1H), 6,22 (д, J=8,4 Гц, 1H), 5,79 (ушир.с, 2H).
Пример 132a: 2-Сульфамоиламино-6-аминобензонитрил
Получают по методике примера 129a из 2,6-диаминобензонитрила (Пример 132b) в количестве 129,4 мг (60%) в виде твердого вещества коричневого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 9,00 (ушир.с, 1H), 7,18 (т, J=8,0 Гц, 1H), 7,08 (ушир.с, 2H), 6,62-6,67 (м, 1H), 6,49-6,54 (м, 1H), 5,95 (ушир.с, 2H).
Пример 132b: 2,6-Диаминобензонитрил
Концентрированную HCl (44,3 мл) добавляют к раствору 2,6-динитробензонитрила (12,9 г, 67,1 ммоль) в MeOH (269 мл) и 1,4-диоксане (166 мл) при 70°С. Внешнее нагревание удаляют, и порошок железа (13,1 г, 235 ммоль) медленно добавляют порциями со скоростью, позволяющей сохранить температуру 70°С. После завершения добавления железа реакционную смесь нагревают до кипения с обратным холодильником в течение еще 30 мин, затем охлаждают до комнатной температуры и выливают в EtOAc (400 мл) и воду (400 мл). Твердые вещества отфильтровывают и экстрагируют дважды кипящим EtOAc (300 мл). Органические слои объединяют, сушат с MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают хроматографией с обращенной фазой (0-100% CH3CN в H2O) с получением указанного в заголовке соединения (1,0 г, 11%), которое применяют без дальнейшей очистки. МС 134 (MH+).
Пример 133: 4-Амино-5-винил-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид

Получают по методике примера 129 из 2-сульфамоиламино-6-винилбензонитрила (Пример 133a) в количестве 30,0 мг (48%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 10,95 (ушир.с, 1H), 8,33 (ушир.с, 1H), 7,48 (т, J=8,0 Гц, 1H), 7,18 (д, J=7,6 Гц, 1H), 7,09 (дд, J=17,6, 10,8 Гц, 1H), 6,90-6,99 (м, 2H), 5,78 (дд, J=17,6, 1,6 Гц, 1H), 5,47 (дд, J=11,2, 1,2 Гц, 1H).
Пример 133a: 2-Сульфамоиламино-6-винилбензонитрил
Получают по методике примера 129a из 2-амино-6-винилбензонитрила (Пример 133b) в количестве 63,0 мг (81%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 9,46 (ушир.с, 1H), 7,59-7,67 (м, 2H), 7,46-7,52 (м, 1H), 7,23 (ушир.с, 2H), 6,93 (дд, J=17,2, 10,8 Гц, 1H), 6,08 (д, J=17,2 Гц, 1H), 5,59 (д, J=11,2 Гц, 1H).
Пример 133b: 2-Амино-6-винилбензонитрил
Получают по методике примера 129b из 2-нитро-6-винилбензонитрила (Пример 133c) в количестве 123,9 мг (71%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,25 (т, J=8,0 Гц, 1H), 6,87 (д, J=7,2 Гц, 1H), 6,80 (дд, J=17,2, 11,6 Гц, 1H), 6,69 (д, J=8,4 Гц, 1H), 6,00 (ушир.с, 2H), 5,92 (д, J=17,2 Гц, 1H), 5,44 (д, J=10,8 Гц, 1H).
Пример 133c: 2-Нитро-6-винилбензонитрил
Получают по методике примера 129c из трифторметансульфоната 2-циано-3-нитрофенила (Пример 129d) в количестве 0,61 г (86%) в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 8,26-8,34 (м, 2H), 7,90-7,98 (м, 1H), 7,09 (дд, J=17,6, 11,2 Гц, 1H), 6,26 (д, J=17,6 Гц, 1H), 5,80 (д, J=11,6 Гц, 1H).
Пример 134: 4-Амино-6-фтор-5-(2-метилпроп-1-енил)-1H-бензо[c][1,2,3]тиадиазине-2,2-диоксид

Получают по методике примера 129 из 3-фтор-2-(2-метилпроп-1-енил)-6-сульфамоиламинобензонитрила (Пример 134a) в количестве 125,0 мг (86%) в виде твердого вещества белого цвета. т. пл.: > 250°C.1H ЯМР (400 МГц, ДМСО-d6) δ 1,51 (с, 3H), 1,90 (с, 3H), 6,27 (с, 1H), 7,00 (м, 1H), 7,10 (ушир.с, 1H), 7,45 (м, 1H), 8,35 (ушир.с, 1H), 10,95 (ушир.с, 1H). МС 270 (MH+).
Пример 134a: 3-Фтор-2-(2-метилпроп-1-енил)-6-сульфамоиламинобензонитрил
Получают по методике примера 129a из 6-амино-3-фтор-2-(2-метилпроп-1-енил)бензонитрила (Пример 134b) в количестве 156,0 мг (88%), в виде твердого вещества белого цвета. МС 270 (MH+).
Пример 134b: 6-Амино-3-фтор-2-(2-метилпроп-1-енил)бензонитрил
Получают по методике примера 129b из 3-фтор-2-(2-метилпроп-1-енил)-6-нитробензонитрила (Пример 134c) в количестве 0,38 г, (84%) в виде твердого вещества белого цвета. МС 191 (MH+).
Пример 134c: 3-Фтор-2-(2-метилпроп-1-енил)-6-нитробензонитрил
2-Бром-3-фтор-6-нитробензонитрил (Пример 134d) (0,62 г, 2,53 ммоль), 2-метилпроп-1-енилбороновую кислоту (0,50 г, 5,05 ммоль), ацетат палладия(II) (0,023 г, 0,102 ммоль), K3PO4 (1,61 г, 7,58 ммоль) и дициклогексил(2′,6′-диметоксибифенил-2-ил)фосфин (0,083 г, 0,202 ммоль) суспендируют в безводном ТГФ (16 мл) в атмосфере азота и нагревают при 70°С в течение 4,5 ч. Растворитель удаляют в вакууме, и продукт очищают хроматографией на силикагеле элюируя градиентом от 0% до 100% этилацетат в гексане, с получением 3-фтор-2-(2-метилпроп-1-енил)-6-нитробензонитрила 0,44 г (78%) в виде твердого вещества желтого цвета. МС 221 (MH+).
Пример 134d: 2-Бром-3-фтор-6-нитробензонитрил
Триэтиламин (2,53 мл, 18,2 ммоль) добавляют к суспензии 2-бром-3-фтор-6-нитробензамида (Пример 6e) (1,60 г, 6,08 ммоль) в POCl3 (32 мл), и смесь нагревают при 75°C в течение 1,5 ч. Смесь осторожно выливают в смесь льда и воды (400 мл) и дважды экстрагируют CH2Cl2. Объединенный экстракт сушат MgSO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле, элюируя градиентом растворителя от 0% до 100% EtOAc в гексане, с получением 2-бром-3-фтор-6-нитробензонитрила 0,95 г, (64%) в виде твердого вещества желтого цвета.
Пример 134e: 2-Бром-3-фтор-6-нитробензамид
2-Бром-3-фтор-6-нитробензойную кислоту (Пример 134f) (24,83 г, 94,0 ммоль, смесь двух региоизомеров) растворяют в безводном ТГФ (200 мл) в атмосфере азота при комнатной температуре. Добавляют безводный ДМФ (0,75 мл), и полученную смесь охлаждают до 0°С. Медленно добавляют оксалилхлорид (12,3 мл, 141 ммоль), и реакционную смесь перемешивают при 0°С в течение 10 мин, и при комнатной температуре в течение еще 2 ч. Реакционную смесь выпаривают досуха, суспендируют в безводном ТГФ (100 мл) и добавляют медленно к концентрированному гидроксиду аммония (350 мл) при 0°С. После перемешивания в течение 45 минут при 0°С смесь экстрагируют CH2Cl2 (5×100 мл), и органические экстракты отбрасывают. На этом этапе желаемый региоизомер присутствует в виде нерастворимого осадка в водном слое, который собирают фильтрацией с получением 10,3 г (42%) 2-бром-3-фтор-6-нитробензамида, который применяют без дальнейшей очистки.1H ЯМР (400 МГц, ДМСО-d6) δ 8,27 (дд, J=8,8, 4,4 Гц, 1H), 8,10 (ушир.с, 1H), 7,95 (ушир.с, 1H), 7,66 (дд, J=9,6, 7,6 Гц, 1H).
Пример 134f: 2-Бром-3-фтор-6-нитробензойная кислота
В 1 л трехгорлую колбу, оборудованную капельной воронкой и термометром, загружают 2-бром-3-фторбензойную кислоту (Пример 134g) (28,23 г, 0,13 моль) и концентрированную H2SO4 (200 мл). После охлаждения до 0°С по каплям добавляют HNO3 (70%, 16,0 мл) в течение более 30 мин, сохраняя температуру от 0 до 10°С. Через 1 ч реакционную смесь выливают в измельченный лед, сохраняя температуру ниже 20°С. Смесь экстрагируют EtOAc (2×200 мл), объединенный экстракт промывают насыщенным раствором соли и сушат с MgSO4. Фильтрат выпаривают с получением 27,27 г (77%) смеси 2-бром-3-фтор-6-нитробензойной кислоты и 2-бром-3-фтор-5-нитробензойной кислоты (1:0,4) в виде твердого вещества коричневого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 8,33 (дд, J=9,6, 4,8 Гц, 1H), 7,21 (дд, J=10,0, 8,0 Гц, 1H).
Пример 134g: 2-Бром-3-фторбензойная кислота
В 1 л трехгорлую колбу, оборудованную капельной воронкой и термометром, загружают 2-амино-3-фторбензойную кислоту (20,0 г, 0,13 моль) и ацетонитрил (160 мл). После охлаждения до 0°С по каплям добавляют, HBr (47%, 160 мл) в течение более 10 мин. К полученному раствору по каплям добавляют раствор NaNO2 (10,0 г, 0,14 моль) в воде (20,0 мл) в течение 1 ч. После добавления реакционную смесь перемешивают при 0°С в течение 5 мин и порциями добавляют бромид меди(I) (22,0 г, 0,15 моль) в течение 30 мин. Перемешивание продолжают при 70°С на масляной бане в течение 1 ч. После охлаждения до 0°С добавляют 700 мл воды, и осадок фильтруют, промывают холодной водой и сушат в вакууме с получением 28,23 г (100%) указанного в заголовке соединения в виде твердого вещества белого цвета. Неочищенный продукт применяют на следующей стадии без очистки.
Пример 135: 4-Амино-5-(циклопентен-1-ил)-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид

Получают по методике примера 129 из 2-сульфамоиламино-6-(циклопентен-1-ил)бензонитрила (Пример 135a) в количестве 36,0 мг (33%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,97 (м, 2H), 2,48 (м, 2H), 2,58 (м, 2H), 5,94 (м, 1H), 6,83 (ушир.с, 1H), 6,92 (м, 2H), 7,46 (м, 1H), 8,25 (ушир.с, 1H), 11,02 (ушир.с, 1H), МС 264 (MH+).
Пример 135a: 2-Сульфамоиламино-6-(циклопентен-1-ил)бензонитрил
Получают по методике примера 129a из 2-амино-6-(циклопентен-1-ил)бензонитрила (Пример 135b) в количестве 156,0 мг (88%), в виде твердого вещества белого цвета.
Пример 135b: 2-Амино-6-(циклопентен-1-ил)бензонитрил
Получают по методике примера 129b из 2-(циклопентен-1-ил)-6-нитробензонитрила (Пример 135c) в количестве 0,44 г, (84%) в виде твердого вещества белого цвета. МС 185 (MH+).
Пример 135c: 2-(Циклопентен-1-ил)-6-нитробензонитрил
Получают по методике примера 129c из трифторметансульфоната 2-циано-3-нитрофенила (Пример 129d) в количестве 0,62 г (84%) в виде твердого вещества белого цвета.
Пример 136: 4-Амино-5-н-пропил-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид

Получают по методике примера 129 из 2-сульфамоиламино-6-н-пропилбензонитрила (Пример 136a) в количестве 144,3 мг (66%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 10,73 (ушир.с, 1H), 8,14 (ушир.с, 1H), 7,44 (ушир.с, 1H), 7,38 (т, J=8,0 Гц, 1H), 6,97 (д, J=6,8 Гц, 1H), 6,86 (д, J=8,0 Гц, 1H), 2,97 (т, J=7,6 Гц, 2H), 1,51 (гекс, J=7,6 Гц, 2H), 0,81 (т, J=7,6 Гц, 3H).
Пример 136a: 2-сульфамоиламино-6-н-пропилбензонитрил
Получают по методике примера 129a из 2-амино-6-н-пропилбензонитрила (Пример 136b) в количестве 238,4 мг (91%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 9,37 (ушир.с, 1H), 7,55 (т, J=8,4 Гц, 1H), 7,39-7,44 (м, 1H), 7,17-7,23 (м, 3H), 2,71 (т, J=8,0 Гц, 2H), 1,60 (гекс, J=7,6 Гц, 2H), 0,90 (т, J=7,6 Гц, 3H).
Пример 136b: 2-Амино-6-н-пропилбензонитрил
(Z)-2-Амино-6-(проп-1-енил)бензонитрил (Пример 131b) (0,45 г, 2,82 ммоль) и 10% Pd/C (0,17 г) перемешивают в EtOH (15 мл) в атмосфере водорода в течение 4 ч. Катализатор отфильтровывают, и органический слой концентрируют в вакууме с получением 0,43 г (96%) 2-амино-6-н-пропилбензонитрила в виде масла желтого цвета, которое применяют без дальнейшей очистки. МС 161 (MH+).
Пример 137: 4-Амино-5-метокси-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид

Получают по методике примера 129 из 2-сульфамоиламино-6-метоксибензонитрила (Пример 137a) в количестве 138,9 мг (93%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 10,09 (ушир.с, 1H), 8,28 (ушир.с, 1H), 8,03 (ушир.с, 1H), 7,44 (т, J=8,0 Гц, 1H), 6,70 (д, J=8,4 Гц, 1H), 6,58 (д, J=8,0 Гц, 1H), 3,89 (с, 3H).
Пример 137a: 2-сульфамоиламино-6-метоксибензонитрил
Получают по методике примера 129a из 2-амино-6-метоксибензонитрила (Пример 137b) в количестве 175,9 мг (84%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 9,44 (ушир.с, 1H), 7,56 (т, J=8,4 Гц, 1H), 7,25 (ушир.с, 2H), 7,14 (д, J=8,0 Гц, 1H), 6,93 (д, J=8,8 Гц, 1H), 3,87 (с, 3H).
Пример 137b: 2-Амино-6-метоксибензонитрил
Раствор 2-метокси-6-нитробензонитрила (1,01 г, 5,69 ммоль), циклогексена (2,84 г, 3,51 мл, 34,58 ммоль) и 10% Pd/C (0,58 г) в EtOH (25 мл) кипятят с обратным холодильником в течение 1,5 ч. Смесь охлаждают до комнатной температуры, фильтруют и выпаривают, с получением указанного в заголовке соединения 0,83 г (98%). Неочищенный продукт применяют на следующей стадии без дальнейшей очистки.1H ЯМР (400 МГц, ДМСО-d6) δ 7,17 (т, J=8,0 Гц, 1H), 6,31- 6,35 (м, 1H), 6,17-6,21 (м, 1H), 5,97 (ушир.с, 2H), 3,76 (с, 3H).
Пример 138: 4-Амино-5-(проп-1-ен-2-ил)-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид
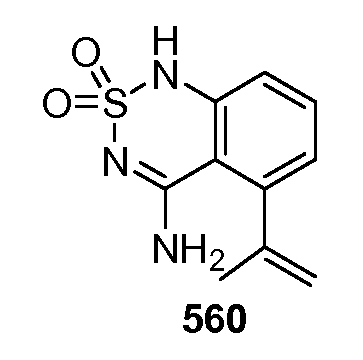
Получают по методике примера 129 из 2-сульфамоиламино-6-(проп-1-ен-2-ил)бензонитрила (Пример 138a) в количестве 63,8 мг (82%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 11,05 (ушир.с, 1H), 8,32 (ушир.с, 1H), 7,44-7,52 (м, 1H), 6,94-7,00 (м, 1H), 6,84-6,89 (м, 1H), 6,82 (ушир.с, 1H), 5,16-5,19 (м, 1H), 5,31-5,35 (м, 1H), 2,00 (с, 3H).
Пример 138a: 2-Сульфамоиламино-6-(проп-1-ен-2-ил)бензонитрил
Получают по методике примера 129a из 2-амино-6-(проп-1-ен-2-ил)бензонитрила (Пример 138b) в количестве 80,5 мг (100%), в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 9,40 (ушир.с, 1H), 7,58-7,64 (м, 1H), 7,48-7,52 (м, 1H), 7,25 (ушир.с, 2H), 7,18-7,24 (м, 1H), 5,34-5,40 (м, 1H), 5,10-5,14 (м, 1H), 2,10 (с, 3H).
Пример 138b: 2-Амино-6-(проп-1-ен-2-ил)бензонитрил
Получают по методике примера 129b из 2-нитро-6-(проп-1-ен-2-ил)бензонитрила (Пример 138c) в количестве 303,4 мг (83%), в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,18-7,25 (м, 1H), 6,67-6,72 (м, 1H), 6,47-6,51 (м, 1H), 5,97 (ушир.с, 2H), 5,24-5,27 (м, 1H), 5,07-5,10 (м, 1H), 2,03-2,06 (м, 3H)
Пример 138c: 2-Нитро-6-(проп-1-ен-2-ил)бензонитрил
Суспензию трифторметансульфонат 2-циано-3-нитрофенила (Пример 129d) (0,93 г, 3,15 ммоль), трифтор(проп-1-ен-2-ил)бората калия (0,70 г, 4,73 ммоль), дихлор 1,1′-бис(дифенилфосфино)ферроцен палладия(II) (0,26 г, 0,32 ммоль), карбоната цезия (3,08 г, 9,45 ммоль) и воды (5,6 мл) в ТГФ (56 мл) нагревают до кипения с обратным холодильником в течение 25 мин в атмосфере азота. Реакционную смесь охлаждают до комнатной температуры и разбавляют водой (100 мл) и EtOAc (100 мл). Органическую фазу отделяют, и водную фазу экстрагируют EtOAc (3×100 мл). Объединенный экстракт промывают разбавленной HCl (1,5M), насыщенным раствором соли сушат с безводным MgSO4, фильтрат выпаривают и остаток очищают хроматографией на силикагеле с применением градиента от гексана до гексан/EtOAc (7:3), с получением 0,30 г (49%) указанного в заголовке соединения в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 8,24-8,29 (м, 1H), 7,86-7,95 (м, 2H), 5,47-5,52 (м, 1H), 5,20-5,23 (м, 1H), 2,12-2,15 (м, 3H).
Пример 139: 4-Амино-5-этил-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид
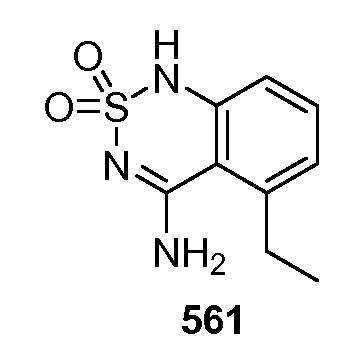
Получают по методике примера 129 из 2-сульфамоиламино-6-винилбензонитрила (Пример 139a) в количестве 84,2 мг (80%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 10,74 (ушир.с, 1H), 8,16 (ушир.с, 1H), 7,24-7,52 (м, 2H), 6,99 (д, J=7,2 Гц, 1H), 6,84-6,88 (м, 1H), 3,00 (кв., J=7,6 Гц, 2H), 1,12 (т, J=7,6 Гц, 3H).
Пример 139a: 2-сульфамоиламино-6-винилбензонитрил
Получают по методике примера 129a из 2-амино-6-этилбензонитрила (Пример 139b) в количестве 280,3 мг (98%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 9,36 (ушир.с, 1H), 7,52-7,60 (т, J=8,4 Гц, 1H), 7,38-7,43 (м, 1H), 7,19 7,24 (м, 1H), 7,19 (ушир.с, 2H), 2,75 (кв., J=8,0, 2H), 1,18 (т, J=7,6 Гц, 3H).
Пример 139b: 2-Амино-6-этилбензонитрил
Получают по методике примера 129b из 2-этил-6-нитробензонитрила (Пример 139c) в количестве 0,46 г (74%), в виде твердого вещества оранжевого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,18 (т, J=8,0 Гц, 1H), 6,59 (д, J=8,0 Гц, 1H), 6,47 (д, J=7,2 Гц, 1H), 5,89 (ушир.с, 2H), 2,60 (кв., J=7,6 Гц, 2H), 1,15 (т, J=7,6 Гц, 3H).
Пример 139c: 2-Этил-6-нитробензонитрил
Суспензию 2 этил-6-нитроанилина (Пример 139d) (1,96 г, 11,80 ммоль) в растворе HCl (3,0M, 24,5 мл) перемешивают при комнатной температуре в течение 20 мин. После охлаждения до 0-5°С добавляют раствор NaNO2 (1,63 г, 23,6 ммоль) в воде (12,25 мл) в течение 10 мин. Полученную смесь перемешивают при 0-5°С в течение 30 мин, и полученный гомогенный раствор переносят в раствор CuCN (2,63 г, 29,5 ммоль) и KCN (5,06 г, 77,8 ммоль) в воде (60 мл) и EtOH (31,0 мл). Полученную смесь энергично перемешивают при комнатной температуре в течение 30 мин и затем нагревают до 70°С в течение еще 30 мин для завершения реакции. Холодную смесь фильтруют и экстрагируют EtOAc (3×100 мл). Объединенный экстракт промывают NaOH (0,5M) и насыщенным раствором соли и сушат с безводным MgSO4. Фильтрат выпаривают и остаток очищают хроматографией на силикагеле, элюируя 30% EtOAc в гексане, с получением 0,66 г (33%) указанного в заголовке соединения в виде твердого вещества оранжевого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 8,18-8,24 (м, 1H), 7,85-7,97 (м, 2H), 2,93 (кв., J=7,2 Гц, 2H), 1,24 (т, J=7,2 Гц, 3H).
Пример 139d: 2 Этил-6-нитроанилин
Раствор N-(2-этил-6-нитрофенил)актамида (Пример 139e) (0,62 г, 2,98 ммоль) в EtOH (21 мл) и концентрированной HCl (13 мл) кипятят с обратным холодильником в течение 24 ч. EtOH выпаривают, остаток разбавляют водой (10 мл) и pH доводят до pH~8 добавлением NaOH (2,0M водный раствор). Нейтрализованный раствор экстрагируют EtOAc (3×50 мл), объединенный экстракт промывают водой и насыщенным раствором соли и сушат с безводным MgSO4. Фильтрат выпаривают, и остаток очищают на ВЭЖХ с получением 0,32 г (64%) 2-этил-6-нитроанилина в виде твердого вещества оранжевого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,82-7,87 (м, 1H), 7,27-7,32 (м, 1H), 7,16 (ушир.с, 2H), 6,55-6,62 (м, 1H), 2,55 (кв., J=7,2 Гц, 2H), 1,13 (т, J=7,2 Гц, 3H).
Пример 139e: N-(2-этил-6-нитрофенил)ацетамид
Раствор азотной кислоты (4,2 мл) в ледяной уксусной кислоте (5,2 мл) по каплям добавляют к раствору N-(2-этилфенил)ацетамида (Пример 139f) (1,00 г, 6,13 ммоль) в AcOH (22 мл) и уксусного ангидрида (18 мл) при 0°С. Реакционную смесь перемешивают при 0°С в течение 1 ч, разбавляют водой (50 мл) и нейтрализуют Na2CO3 (pH~8). Нейтрализованную смесь экстрагируют EtOAc (3×50 мл), объединенный экстракт промывают водой и насыщенным раствором соли и сушат с безводным MgSO4. Фильтрат выпаривают и остаток очищают на ВЭЖХ с получением 0,62 г (48%) указанного в заголовке соединения в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 9,81 (ушир.с, 1H), 7,68-7,73 (м, 1H), 7,57-7,62 (м, 1H), 7,39 (т, J=8,0 Гц, 1H), 2,64 (кв., J=8,0 Гц, 2H), 2,00 (с, 3H), 1,10 (т, J=8,0 Гц, 3H).
Пример 139f: N-(2-этилфенил)ацетамид
2-Этиланилин (9,70 г, 80,0 ммоль) добавляют к смеси ледяной AcOH (30 мл) и уксусного ангидрида (20 мл), и полученную смесь кипятят с обратным холодильником при 120°С в течение 3ч. Затем реакционную смесь охлаждают до комнатной температуры и выливают в кипящую смесь воды и EtOH (20 мл каждого). Смесь перемешивают при КТ в течение 1 ч и затем охлаждают (0-5°С) в течение ночи. EtOH выпаривают, и остаток смеси разбавляют водой (100 мл). Полученную смесь нейтрализуют Na2CO3 и экстрагируют EtOAc. Объединенный экстракт промывают насыщенным раствором соли, сушат с безводным MgSO4, фильтруют и выпаривают. Остаток очищают хроматографией на силикагеле, элюируя 5% MeOH в CH2Cl2, с получением 5,50 г (42%) указанного в заголовке соединения в виде твердого вещества розового цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 9,25 (ушир.с, 1H), 7,05-7,40 (м, 4H), 2,55 (кв., J=7,6 Гц, 2H), 2,02 (с, 3H), 1,09 (т, J=7,6 Гц, 3H).
Пример 140: 4-Амино-5-гидрокси-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид
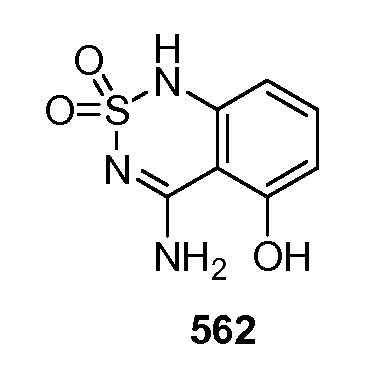
Получают по методике примера 129 из 2-сульфамоиламино-6-гидроксибензонитрила (Пример 140a) в количестве 50,6 мг (20%) в виде твердого вещества коричневого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 11,00 (ушир.с, 1H), 9,24 (ушир.с, 1H), 7,37 (т, J=8,0 Гц, 1H), 7,18 (ушир.с, 2H), 6,97 (д, J=8,4 Гц, 1H), 6,71 (д, J=8,4 Гц, 1H).
Пример 140a: 2-сульфамоиламино-6-гидроксибензонитрил
Получают по методике примера 129a из 2-амино-6-гидроксибензонитрила (Пример 140b) в количестве 0,25 г (99%), в виде твердого вещества коричневого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 11,01 (ушир.с, 1H), 9,25 (ушир.с, 1H), 7,37 (т, J=8,0 Гц, 1H), 7,18 (ушир.с, 2H), 6,95-6,99 (м, 1H), 6,69-6,74 (м, 1H).
Пример 140b: 2-Амино-6-гидроксибензонитрил
Раствор 2-метокси-6-нитробензонитрила (Пример 129f) (1,11 г, 6,76 ммоль) в EtOH (120 мл) гидрируют над каталитическим количеством 10% Pd/C (0,15 г) при комнатной температуре в атмосфере водорода (1 атм.). Через 2 ч смесь фильтруют, и катализатор промывают EtOAc (150 мл). Объединенный экстракт выпаривают с получением 1,11 г (100%) указанного в заголовке соединения в виде твердого вещества коричневого цвета. Неочищенный продукт применяют на следующей стадии без дальнейшей очистки.1H ЯМР (400 МГц, ДМСО-d6) δ 10,39 (ушир.с, 1H), 7,00 (т, J=8,0 Гц, 1H), 6,12-6,17 (м, 1H), 6,01-6,05 (м, 1H), 5,77 (ушир.с, 2H).
Пример 141: 4-Амино-5-фенил-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид
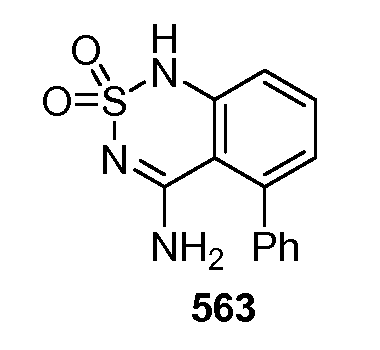
Получают по методике примера 129 из 2-сульфамоиламино-6-фенилбензонитрила (Пример 141a) в количестве 114,7 мг (90%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,12 (ушир.с, 1H), 8,04 (ушир.с, 1H), 7,52-7,58 (м, 1H), 7,39-7,50 (м, 3H), 7,32-7,38 (м, 2H), 7,02-7,07 (м, 1H), 6,97-7,01 (м, 1H), 5,61 (ушир.с, 1H).
Пример 141a: 2-Сульфамоиламино-6-фенилбензонитрил
Получают по методике примера 129a из 3-аминобифенил-2-карбонитрила (Пример 141b) в количестве 142,3 мг (94%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 9,49 (ушир.с, 1H), 7,68-7,74 (м, 1H), 7,58-7,62 (м, 1H), 7,44-7,53 (м, 5H), 7,30-7,34 (м, 1H), 7,29 (ушир.с, 2H).
Пример 141b: 3-Аминобифенил-2-карбонитрил
Получают по методике примера 129b из 3-нитробифенил-2-карбонитрила (Пример 141c) в количестве 117,0 мг (80%), в виде твердого вещества белого цвета. МС 195 (MH+).
Пример 141c: 3-Нитробифенил-2-карбонитрил
Получают по методике примера 129c из трифторметансульфонат 2-циано-3-нитрофенила (Пример 129d) и фенилбороновой кислоты.
Пример 142: 4-Амино-5-изопропил-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид

Получают по методике примера 129 из 2-сульфамоиламино-6-изопропилбензонитрила (Пример 142a) в количестве 53,7 мг (49%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 10,74 (ушир.с, 1H), 8,19 (ушир.с, 1H), 7,42 (т, J=8,0 Гц, 1H), 7,15 (ушир.с, 1H), 7,07-7,13 (м, 1H), 6,83-6,88 (м, 1H), 3,71 (гепт, J=6,4 Гц, 1H), 1,18 (д, J=6,8 Гц, 6H).
Пример 142a: 2-сульфамоиламино-6-изопропилбензонитрил
Получают по методике примера 129a из 2-амино-6-изопропилбензонитрила (Пример 142b) в количестве 112,0 мг (97%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 9,35 (ушир.с, 1H), 7,60 (т, J=8,4 Гц, 1H), 7,41 (д, J=8,0 Гц, 1H), 7,27 (д, J=7,6 Гц, 1H), 7,20 (ушир.с, 2H), 3,20 (гепт, J=6,8 Гц, 1H), 1,23 (д, J=6,8 Гц, 6H).
Пример 142b: 2-Амино-6-изопропилбензонитрил
Получают по методике примера 136b из 2-амино-6-(проп-1-ен-2-ил)бензонитрила (Пример 138b) в количестве 112,0 мг (97%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,21 (т, J=8,0 Гц, 1H), 6,60 (д, J=8,4 Гц, 1H), 6,52 (д, J=7,2 Гц, 1H), 5,87 (ушир.с, 2H), 3,03 (гепт, J=6,8 Гц, 1H), 1,18 (д, J=6,8 Гц, 6H).
Пример 143: 4-Амино-5-изобутил-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид
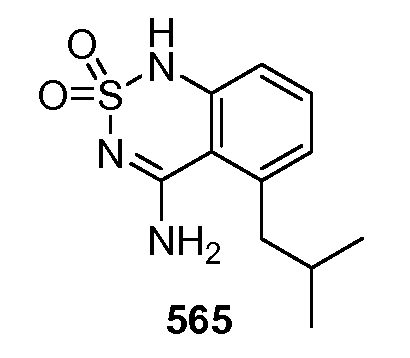
Получают по методике примера 129 из 2-сульфамоиламино-6-изобутилбензонитрила (Пример 143a) в количестве 32,5 мг (63%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 10,70 (ушир.с, 1H), 8,08 (ушир.с, 1H), 7,55 (ушир.с, 1H), 7,36 (т, J=8,0 Гц, 1H), 6,89-6,94 (м, 1H), 6,84-6,88 (м, 1H), 2,87 (д, J=6,8 Гц, 2H), 1,69-1,81 (м, 1H), 0,72 (д, J=6,8 Гц, 6H).
Пример 143a: 2-сульфамоиламино-6-изобутилбензонитрил
Получают по методике примера 129a из 2-амино-6-изобутилбензонитрила (Пример 143b) в количестве 52,0 мг (91%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 9,36 (ушир.с, 1H), 7,55 (т, J=8,0 Гц, 1H), 7,41 (д, J=8,0 Гц, 1H), 7,21 (ушир.с, 2H), 7,16 (д, J=6,8 Гц, 1H), 2,62 (д, J=7,6 Гц, 2H), 1,82-1,96 (м, 1H), 0,88 (д, J=6,4 Гц, 6H).
Пример 143b: 2-Амино-6-изобутилбензонитрил
Получают по методике примера 136b из 2-амино-6-(2-метилпроп-1-енил)бензонитрила (Пример 129b) в количестве 76,4 мг (98%) в виде масла желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,17 (т, J=8,0 Гц, 1H), 6,60 (д, J=8,4 Гц, 1H), 6,42 (д, J=7,6 Гц, 1H), 5,88 (ушир.с, 2H), 2,47 (д, J=7,6 Гц, 2H), 1,78-1,92 (м, 1H), 0,86 (д, J=6,4 Гц, 6H).
Пример 144: 4-Амино-5-трифторметил-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид

Получают по методике примера 129 из 2-сульфамоиламино-6-трифторметилбензонитрил (Пример 144a) в количестве 114,8 мг (96%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 11,41 (ушир.с, 1H), 7,64-7,72 (м, 1H), 7,50 (д, J=7,2 Гц, 1H), 7,38-7,68 (ушир.с, 1H), 7,31 (д, J=8,4 Гц, 1H), 3,10-3,60 (ушир.с, 1H).
Пример 144a: 2-сульфамоиламино-6-трифторметилбензонитрил
Получают по методике примера 129a из 2-амино-6-трифторметилбензонитрил (Пример 144b) в количестве 138,5 мг (82%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 9,91 (ушир.с, 1H), 7,84-7,92 (м, 2H), 7,69-7,76 (м, 1H), 7,42 (ушир.с, 2H).
Пример 144b: 2-Амино-6-трифторбензонитрил
2-(4-Метоксибензиламино)-6-(трифторметил)бензонитрил (Пример 144c) (3,49 г, 11,4 ммоль) обрабатывают трифторуксусной кислотой (ТФК) (35 мл) при 0°С, и затем перемешивают при комнатной температуре в течение 20 мин. ТФК удаляют вакууме, и остаток растворяют в CH2Cl2 (150 мл) и промывают 1M NaOH. Органический слой сушат с MgSO4, фильтруют и удаляют в вакууме. Неочищенный продукт очищают хроматографией на силикагеле, элюируя CH2Cl2 с получением 2,12 г (99%) 2-амино-6-(трифторметил)бензонитрила в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,45 (м, 1H), 7,07 (м, 1H), 6,96 (м, 1H), 6,60 (ушир.с, 2H).
Пример 144c: 2-(4-Метоксибензиламино)-6-(трифторметил)бензонитрил
2-Фтор-6-(трифторметил)бензонитрил (2,44 г, 12,9 ммоль) и 4-метоксибензиламин (7,09 г, 51,7 ммоль) суспендируют в 1,4-диоксане (10 мл) и нагревают в микроволновой печи при 180°С в течение 30 мин. 1,4-Диоксан удаляют в вакууме, и неочищенный материал очищают хроматографией на силикагеле, элюируя CH2Cl2 с получением 3,71 г 2-(4-метоксибензиламино)-6-(трифторметил)бензонитрила (94%) в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 3,71 (с, 3H), 4,42 (д, J=5,6 Гц, 2H), 6,89 (м, 2H), 6,97 (м, 2H), 7,29 (м, 3H), 7,48 (м, 1H).
Пример 145: 4-Амино-8-гидрокси-1H-бензо[c][1,2,3]тиадиазин-2,2-диоксид

Получают по методике примера 129 из 2-сульфамоиламино-3-гидроксибензонитрила (Пример 145a) в количестве 53,9 мг (66%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 10,14 (ушир.с, 2H), 8,04 (ушир.с, 2H), 7,31-7,39 (м, 1H), 6,97-7,03 (м, 1H), 6,88 (т, J=7,6 Гц, 1H).
Пример 145a: 2-Сульфамоиламино-3-гидроксибензонитрил
Получают по методике примера 129a из 2-амино-3-гидроксибензонитрила (Пример 145b) в количестве 83,5 мг (39%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 10,23 (ушир.с, 1H), 8,66 (ушир.с, 1H), 7,14-7,27 (м, 3H), 6,71 (ушир.с, 2H).
Пример 145b: 2-Амино-3-гидроксибензонитрил
К раствору 2-амино-3-метоксибензонитрила (Пример 127b) (0,98 г, 6,59 ммоль) в CH2Cl2 (25,0 мл) по каплям добавляют раствор BBr3 в CH2Cl2 (1,0M, 19,8 мл, 19,77 ммоль) при -78°С в атмосфере азота. Полученную смесь перемешивают при -78°С в течение 30 мин, и затем при комнатной температуре в течение ночи. Реакционную смесь гасят водой, подщелачивают насыщенным водным NaHCO3 (pH~8) и экстрагируют CH2Cl2. Объединенный экстракт сушат с MgSO4, фильтруют и выпаривают. Указанное в заголовке соединение получают в количестве 0,80 г (91%) в виде твердого вещества оранжевого цвета, и применяют на следующей стадии без дальнейшей очистки.1H ЯМР (400 МГц, ДМСО-d6) δ 9,86 (ушир.с, 1H), 6,82-6,87 (м, 2H), 6,46 (т, J=8,0 Гц, 1H), 5,34 (ушир.с, 2H).
Пример 146: 4-Амино-5,6-(5′,7′-дигидро-4′H-[2′,3′-c]пирано)тиено[2,3-d]-пиримидин-2(1H)-он

Раствор N-(3-циано-5,7-дигидро-4H-тиено[2,3-c]пиран-2-илкарбамоил)бензамида (Пример 146a) (500 мг, 1,53 ммоль) и NaOH (2н, 2,1 мл) в EtOH (40 мл) перемешивают при 100°С в атмосфере азота в течение ночи. После охлаждения до комнатной температуры прозрачный реакционный раствор фильтруют, и фильтрат осторожно нейтрализуют 10% AcOH при энергичном перемешивании при 0°С. Полученный осадок собирают фильтрацией, промывают водой и затем 20% EtOH в воде с получением конечного продукта (280 мг, 82%) в виде твердого вещества беловатого цвета, которое сушат в вакууме в течение ночи. Т. пл.: > 260°С.1H ЯМР (400 МГц, ДМСО-d6) δ 2,83 (т, J=5,6 Гц, 2H), 3,86 (т, J=5,6 Гц, 2H), 4,58 (с, 2H), 7,23 (ушир.с, 2H), 11,56 (ушир.с, 1H). МС 224 (MH+).
Пример 146a: N-(3-циано-5,7-дигидро-4H-тиено[2,3-c]пиран-2-илкарбамоил)бензамид
К раствору 2-амино-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбонитрила (Пример 146b) (400 мг, 2,22 ммоль) в 1,4-диоксане (30 мл) добавляют бензоилизоцианат (327 мг, 2,22 ммоль). Реакционную смесь затем перемешивают при комнатной температуре в атмосфере азота в течение ночи. Осадок собирают фильтрацией, промывают 1,4-диоксаном и сушат на воздухе с получением указанного в заголовке соединения (577 мг, 80%) в виде твердого вещества светло-желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,62 (т, J=5,2 Гц, 2H), 3,87 (т, J=5,2 Гц, 2H), 4,62 (с, 2H), 7,56-7,53 (м, 2H), 7,67-7,65 (м, 1H), 8,04-8,01 (м, 2H), 11,60 (ушир.с, 1H), 12,13 (ушир.с, 1H).
Пример 146b: 2-амино-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбонитрил
К смеси дигидро-2H-пиран-4(3H)-она (820 мг, 8,19 ммоль), малононитрила (541 мг, 8,19 ммоль) и серы (263 мг, 8,19 ммоль) в этаноле (50 мл) добавляют триэтиламин (1,14 мл, 8,19 ммоль). Реакционную смесь затем кипятят с обратным холодильником в атмосфере азота в течение ночи. После охлаждения до комнатной температуры осадок собирают фильтрацией, промывают этанолом и сушат на воздухе с получением указанного в заголовке соединения (1,15 г, 78%) в виде твердого вещества светло-коричневого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,43-2,40 (м, 2H), 3,80 (т, J=5,6 Гц, 2H), 4,40 (т, J=2,0 Гц, 2H), 7,09 (с, 2H), МС 181 (MH+).
Пример 147: (E)-4-амино-5-(3-метоксипроп-1-енил)хиназолин-2(1H)-он

Получают по методике примера 146 из (Е)-2-амино-6-(3-метоксипроп-1-енил)бензонитрила (Пример 97a) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 3,28 (с, 3H), 4,02 (дд, J=6,0, 1,2 Гц, 2H), 6,13 (дт, J=16,0, 3,8 Гц, 1H), 7,06 (д, J=8,0 Гц, 1H), 7,23 (д, J=8,0 Гц, 1H), 7,52 (т, J=8,0 Гц, 1H), 7,80 (д, J=16,0 Гц, 1H), 11,07 (с, 1H), 11,13 (с, 1H).13C ЯМР (ДМСО-d6) δ 58,0, 72,9, 111,4, 115,5, 121,9, 129,9, 131,2, 134,7, 140,2, 142,7, 150,6, 164,1.
Пример 148: 4-Амино-5,6-(2′,3′-дигидро-1′H-циклопента[b])-тиено[2,3-d]пиримидин-2(1H)-он-2,2-диоксид

Получают по методике примера 4 из N-(3-циано-5,6-дигидро-4H-циклопента[b]тиофен-2-илкарбамоил)бензамида (Пример 148a).1H ЯМР (400 МГц, ДМСО-d6) δ 2,33 (м, 2H), 2,76 (т, 2H), 2,87 (т, 2H), 7,51 (ушир.с, 2H), 11,56 (ушир.с, 1H). МС 208 (MH+).
Пример 148a: N-(3-циано-5,6-дигидро-4H-циклопента[b]тиофен-2-илкарбамоил)бензамид
Получают по методике примера 4a из 2-амино-5,6-дигидро-4H-циклопента[b]тиофен-3-карбонитрила (Пример 148b).1H ЯМР (400 МГц, ДМСО-d6) δ 2,34 (м, 2H), 2,72 (т, 2H), 2,82 (т, 2H), 7,52 (т, 2H), 7,65 (т, 1H), 8,01 (д, 2H), 11,56 (с, 1H), 12,06 (с, 1H)
Пример 148b: 2-амино-5,6-дигидро-4H-циклопента[b]тиофен-3-карбонитрил
Получают по методике примера 5b из циклопентанона.1H ЯМР (400 МГц, ДМСО-d6) δ 2,23 (м, 2H), 2,53 (м, 2H), 2,63 (м, 2H), 7,00 (с, 2H)1H ЯМР (400 МГц, ДМСО-d6) δ 2,23 (м, 2H), 2,53 (т, 2H), 2,62 (т, 2H), 7,00 (с, 2H).
Пример 149: 4-амино-5,6-(1′,2′,3′,4′-тетрагидробензо[b])-тиено[2,3-d]пиримидин-2(1H)-он-2,2-диоксид

Получают по методике примера 4 из N-(3-циано-4,5,6,7-тетрагидробензо[b]тиофен-2-илкарбамоил)бензамида (Пример 149a).1H ЯМР (400 МГц, ДМСО-d6) δ 1,73 (м, 4H), 2,57 (т, 2H), 2,72 (т, 2H). МС 222 (MH+).
Пример 149a: N-(3-циано-4,5,6,7-тетрагидробензо[b]тиофен-2-илкарбамоил)бензамид
Получают по методике примера 4a из 2-амино-4,5,6,7-тетрагидробензо[b]тиофен-3-карбонитрил (Пример 5b).1H ЯМР (400 МГц, ДМСО-d6) δ 1,75 (м, 4H), 2,51 (т, 2H), 2,60 (т, 2H), 7,54 (т, 2H), 7,66 (т, 1H), 8,02 (д, 2H), 11,57 (с, 1H), 12,06 (с, 1H).
Пример 150: 4-Амино-5-(2-метилпроп-1-енил)хиназолин-2(1H)-он
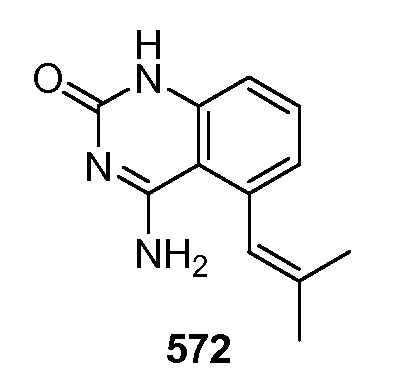
Суспензию N-(2-циано-3-(2-метилпроп-1-енил)фенилкарбамоил)бензамида (Пример 150a) (0,133 г, 0,416 ммоль) в EtOH (3 мл) обрабатывают раствором NaOH (2 M, 0,416 мл, 0,832 ммоль) при комнатной температуре. Полученную смесь нагревают при 90°С в течение 30 мин, охлаждают до комнатной температуры и нейтрализуют 10% AcOH. Осажденный продукт собирают фильтрацией с получением 69,0 мг (77%) 4-амино-5-(2-метилпроп-1-енил)хиназолин-2(1H)-она в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,60 (д, J=1,2 Гц, 3H), 1,93 (д, J=1,2 Гц, 3H), 6,58 (с, 1H), 6,67 (ушир.с, 1H), 6,73 (м, 1H), 7,05 (м, 1H), 7,48 (м, 1H), 7,93 (ушир.с, 1H), 10,72 (ушир.с, 1H). МС 216 (MH+).
Пример 150a: N-(2-циано-3-(2-метилпроп-1-енил)фенилкарбамоил)бензамид
Бензоилизоцианат (88,1 мг, 0,60 ммоль) добавляют к раствору 2-амино-6-(2-метилпроп-1-енил)бензонитрила (Пример 129b) (75,2 мг, 0,44 ммоль) в безводном 1,4-диоксане в атмосфере азота, и перемешивают при комнатной температуре в течение 12 ч. Смесь концентрируют в вакууме и очищают хроматографией на силикагеле, элюируя градиентом растворителей от 0% до 15% MeOH в CH2Cl2, с получением 125,0 мг (86%) N-(2-циано-3-(2-метилпроп-1-енил)фенилкарбамоил)бензамида в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,80 (д, J=1,2 Гц, 3H), 1,95 (д, J=1,2 Гц, 3H), 6,40 (с, 1H), 7,19 (м, 1H), 7,55 (м, 2H), 7,67 (м, 2H), 8,03 (м, 2H), 8,13 (м, 1H), 11,33 (с, 1H), 11,48 (с, 1H).
Пример 151: 4-Амино-5-винилхиназолин-2(1H)-он

Получают по методике примера 150 из N-(2-циано-3-винилфенилкарбамоил)бензамида (Пример 151a) в количестве 20,0 мг (33%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 5,53 (м, 1H), 5,64 (м, 1H), 6,50 (ушир.с, 1H), 6,98 (м, 1H), 7,08 (м, 1H), 7,37 (м, 1H), 7,50 (м, 1H), 8,0 (ушир.с, 1H), 10,75 (ушир.с, 1H). МС 188 (MH+).
Пример 151a: N-(2-циано-3-внилфенилкарбамоил)бензамид
Получают по методике примера 150a из 2-амино-6-винилбензонитрила (Пример 133b) в количестве 99,3 мг (83%), в виде твердого вещества белого цвета.
Пример 152: 4-Амино-5-(проп-1-ен-2-ил)хиназолин-2(1H)-он

Получают по методике примера 150 из N-(2-циано-3-(проп-1-ен-2-ил)фенилкарбамоил)бензамида (Пример 152a) в количестве 30,0 мг (47%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,07 (с, 3H), 5,14 (м, 1H), 5,43 (м, 1H), 6,67 (ушир.с, 1H), 6,80 (м, 1H), 7,11 (м, 1H), 7,50 (м, 1H), 7,99 (ушир.с, 1H), 10,81 (ушир.с, 1H). МС 202 (MH+).
Пример 152a: N-(2-Циано-3-(проп-1-ен-2-ил)фенилкарбамоил)бензамид
Получают по методике примера 150a из 2-амино-6-(проп-1-ен-2-ил)бензонитрила (Пример 138b) в количестве 96,0 мг (72%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,15 (с, 3H), 5,23 (м, 1H), 5,43 (м, 1H), 7,25 (м, 1H), 7,55 (м, 2H), 7,68 (м, 2H), 8,04 (м, 2H), 8,19 (м, 1H), 11,35 (с, 1H), 11,54 (с, 1H).
Пример 153: 4-Амино-5-циклопентенилхиназолин-2(1H)-он

Получают по методике примера 150 из N-(циано-3-циклопентенилфенилкарбамоил)бензамида (Пример 153a) в количестве 60,0 мг (75%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,01 (м, 2H), 2,55 (м, 2H), 2,61 (м, 2H), 5,91 (с, 1H), 6,49 (ушир.с, 1H), 6,81 (м, 1H), 7,08 (м, 1H), 7,48 (м, 1H), 7,88 (ушир.с, 1H), 10,76 (с, 1H). МС 228 (MH+).
Пример 153a: N-(Циано-3-циклопентенилфенилкарбамоил)бензамид
Получают по методике примера 150a из 2-амино-6-(циклопентен-1-ил)бензонитрила (Пример 135b) в количестве 117,0 мг (93%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,99 (м, 2H), 2,57 (м, 2H), 2,78 (м, 2H), 6,45 (м, 1H), 7,26 (м, 1H), 7,57 (м, 2H), 7,68 (м, 2H), 8,06 (м, 2H), 8,15 (м, 1H), 11,34 (ушир.с, 1H), 11,51 (с, 1H).
Пример 154: (E)-4-Амино-5-(проп-1-енил)хиназолин-2(1H)-он

Получают по методике примера 150 из (Е)-N-(2-циано-3-(проп-1-енил)фенилкарбамоил)бензамида (Пример 154a) в количестве 13,0 мг (8%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,91 (м, 3H), 6,09 (м, 1H), 6,40 (ушир.с, 1H), 6,91 (м, 2H), 7,03 (м, 1H), 7,45 (м, 1H), 7,9 (ушир.с, 1H), 10,70 (с, 1H). МС 202 (MH+).
Пример 154a: (Е)-N-(2-Циано-3-(проп-1-енил)фенилкарбамоил)бензамид
Получают по методике примера 150a из (Е)-2-амино-6-(проп-1-енил)бензонитрила (Пример 130b) в количестве 0,22 г (88%), в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 11,50 (ушир.с, 1H), 11,34 (ушир.с, 1H), 8,13 (д, J=8,4 Гц, 1H), 8,02-8,08 (м, 2H), 7,64-7,70 (м, 2H), 7,52-7,59 (м, 2H), 7,20 (д, J=8,0 Гц, 1H), 5,50-5,18 (м, 2H), 3,55-3,59 (м, 3H).
Пример 155: 4-амино-5-циклопропилхиназолин-2(1H)-он

Раствор 2-амино-6-циклопропилбензонитрила (Пример 92a) (1,0 экв., 1,0 ммоль, 158 мг) и бензоилизоцианата (90% чистота, 1,0 экв., 1,0 ммоль, 1,171 г/мл, 140 мкл) в диоксане (15 мл) перемешивают при комнатной температуре. Через 2 часа летучие вещества удаляют на роторном испарителе. Полученную неочищенную N-бензоилмочевину суспендируют в EtOH (10 мл, 200 крепость) и добавляют NaOH (2,5 экв., 2,5 ммоль, 1н, 2,50 мл). Реакционную смесь нагревают до 75°С при перемешивании в течение 7 часов. Растворитель выпаривают, и остаток разбавляют водой (10 мл). Реакционную смесь подкисляют 10% раствором лимонной кислоты/воды и осторожно титруют до pH 7-8 с насыщенным раствором NaHCO3. Выпавший в осадок продукт собирают вакуумной фильтрацией, промывают водой. Остаток суспендируют в EtOH (3 мл, 200 крепость) и добавляют HCl (12,1н, 3 мл). Смесь нагревают до 90°С в течение 1 часа. Реакционную смесь охлаждают до комнатной температуры и разбавляют водой (20 мл), фильтруют (0,45 мкм ПТФЭ фритта) и фильтрат концентрируют на роторном испарителе. Остаток далее очищают препаративной ТСХ (1000 мкм, 10/90 MeOH/ДХМ) и растиранием с метанолом при комнатной температуре. Реакция дает 25 мг (12,4%) указанного в заголовке соединения в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,802 (м, 2H), 1,086 (м, 2H), 2,345 (м, 1H), 6,922 (д, J=8 Гц, 1H), 7,000 (д, J=8 Гц, 1H), 7,253 (ушир.с, 1H), 7,397 (т, J=8 Гц, 1H), 8,022 (ушир.с, 1H), 10,644 (с, 1H). МС 202 (MH+).
Пример 156: N5-метил-1H-бензо[c][1,2,6]тиадиазин-4,5-диамин-2,2-диоксид

Получают по методике примера 90 из 2-амино-6-(метиламино)бензонитрилсульфамида (Пример 156a) с получением N5-метил-1H-бензо[c][1,2,6]тиадиазин-4,5-диамин-2,2-диоксида (27,7 мг, 45%).1H ЯМР (400МГц, ДМСО-d6) δ 2,67 (д, J=2 Гц, 3H), 5,91 (ушир.с, NH), 6,21-6,17 (м, 2H), 7,17 (т, J=8 Гц, 1H), 7,51 (ушир.с, 2H), 10,6 (ушир.с, NH). МС 227 (MH+).
Пример 156a: 2-амино-6-(метиламино)бензонитрилсульфамид
Получают по методике примера 90a из 2-амино-6-(метиламино)бензонитрила (Пример 156b) с получением 2-амино-6-(метиламино)бензонитрилсульфамида (65 мг, 30%).1H ЯМР (400МГц, CDCl3) δ 2,88 (д, J=5,2 Гц, 3H), 4,23 (ушир.с, NH), 4,66 (ушир.с, NH), 4,87 (ушир.с, 2H), 6,44 (д, J=8 Гц, 1H), 6,90 (д, J=8 Гц, 1H), 7,39 (т, J=8 Гц, 1H), МС 227 (MH+).
Пример 156b: 2-амино-6-(метиламино)бензонитрил
Получают по методике примера 90b из 2-метиламино-6-нитробензонитрила (пример 156b) с получением 2-амино-6-(метиламино)бензонитрила (0,30 г, 85%) в виде масла коричневого цвета, которое применяют на следующей стадии без дальнейшей очистки.1H ЯМР (400МГц, CDCl3) δ 2,87 (д, J=5,2 Гц, 3H), 4,25 (ушир.с, 2H), 4,47 (ушир.с, NH), 5,96 (д, J=8,8 Гц, 1H), 6,02 (д, J=8,4 Гц, 1H), 7,13 (т, J=8 Гц, 1H). МС 148 (MH+).
Пример 156c: 2-метиламино-6-нитробензонитрил
Получают по методике примера 90c из 2,6-динитробензонитрила и метиламина с получением 2-метиламино-6-нитробензонитрила (0,42 г, 79%).1H ЯМР (400МГц, ДМСО-d6) δ 2,85 (д, J=5,2 Гц, 3H), 6,75 (д, J=4,8 Гц, NH), 7,16 (д, J=8,4 Гц, 1H), 7,45 (д, J=7,6 Гц, 1H), 7,64 (т, J=8,4 Гц, 1H).
Пример 157: 4-амино-5-(метиламино)хиназолин-2(1H)-он

Раствор N-(2-циано-3-(метиламино)фенилкарбамоил)бензамида (Пример 157a) (0,05 г, 0,17 ммоль) и NaOH (2н, 0,17 мл) в EtOH (6 мл) перемешивают при 90°С в атмосфере азота в течение получаса. Реакционную смесь охлаждают до комнатной температуры и концентрируют в вакууме. Добавляют H2O (1 мл) и реакционную смесь нейтрализуют до pH ~ 4 добавлением 10% AcOH. Полученный осадок фильтруют и сушат в вакууме. Неочищенный продукт очищают препаративной тонкослойной хроматографией с применением раствора ДХМ/MeOH (9:1) в качестве элюента, с получением 4-амино-5-(метиламино)хиназолин-2(1H)-она (18,2 мг, 56%).1H ЯМР (400МГц, ДМСО-d6) δ 2,76 (с, 3H), 6,10 (д, J=7,6 Гц, 1H), 6,12 (д, J=8 Гц, 1H), 7,13 (т, J=8 Гц, 1H), 7,25 (ушир.с, NH), 9,66 (ушир.с, NH,) 10,13 (ушир.с, 2H). МС 191 (MH+).
Пример 157a: N-(2-циано-3-(метиламино)фенилкарбамоил)бензамид
К раствору 2-амино-6-(метиламино)бензонитрила (пример 156b) (0,14 г, 0,97 ммоль) в 1,4-диоксане (3 мл) добавляют бензоилизоцианат (0,17 г, 1,17 ммоль). Реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение ночи. Полученный осадок фильтруют и сушат в вакууме с получением N-(2-циано-3-(метиламино)фенилкарбамоил)бензамида (57 мг, 20%).1H ЯМР (400 МГц, ДМСО-d6) δ 2,75 (д, J=4,4 Гц, 3H), 6,26 (д, J=4,8 Гц, NH), 6,43 (д, J=9,6 Гц, 1H), 7,40-7,43 (м, 2H), 7,51-7,55 (м, 2H), 7,63-7,65 (м, 1H), 8,01 (д, J=8,4 Гц, 2H), 11,23 (с, NH), 11,30 (с, NH). МС 295 (MH+).
Пример 158: N5-пропил-1H-бензо[c][1,2,6]тиадиазин-4,5-диамин-2,2-диоксид
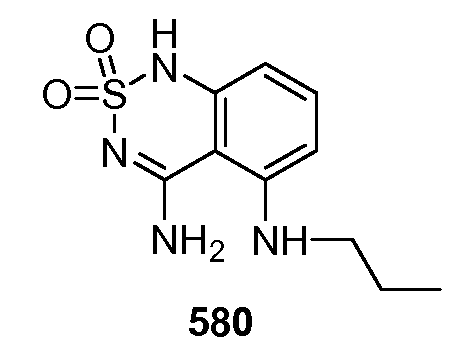
Получают по методике примера 90 из 2-амино-6-(пропиламино)бензонитрилсульфамида (Пример 158a) с получением N5-пропил-1H-бензо[c][1,2,6]тиадиазин-4,5-диамин-2,2-диоксида (183 мг, 74%).1H ЯМР (400МГц, ДМСО-d6) δ 0,91 (т, J=7,2 Гц, 3H), 1,57-1,63 (м, 2H), 2,48 (кв., J=7,2, 2H), 5,85-5,88 (м, NH), 6,27 (д, J=8 Гц, 1H), 6,37 (д, J=8,4 Гц, 1H), 7,24 (т, J=8 Гц, 1H), 7,87 (ушир.с, 2H), 10,65 (ушир.с, NH). МС 255 (MH+).
Пример 158a: 2-амино-6-(пропиламино)бензонитрилсульфамид
Получают по методике примера 90a из 2-амино-6-(пропиламино)бензонитрила (Пример 158b) с получением 2-амино-6-(пропиламино)бензонитрилсульфамида (254 мг, 43%).1H ЯМР (400МГц, CDCl3) δ 0,87 (т, J=7,2 Гц, 3H), 1,48-1,57 (м, 2H), 3,10 (кв., J=6, J=5,6, 2H), 5,86-5,89 (м, NH), 6,49 (д, J=8,4 Гц, 1H), 6,69 (д, J=7,6 Гц, 1H), 7,13 (с, 2H), 7,29 (т, J=8 Гц, 1H), 9,06 (с, NH), МС 255 (MH+).
Пример 158b: 2-амино-6-(пропиламино)бензонитрил
Получают по методике примера 90b из 2-пропиламино-6-нитробензонитрила (пример 158c) с получением 2-амино-6-(пропиламино)бензонитрила (0,41 г, 91%) в виде масла коричневого цвета, которое применяют на следующей стадии без дальнейшей очистки. МС 175 (MH+).
Пример 158c: 2-пропиламино-6-нитробензонитрил
Получают по методике примера 90c из 2,6-динитробензонитрила и пропиламин 2-пропиламино-6-нитробензонитрила (0,53 г, 86%).1H ЯМР (400МГц, ДМСО-d6) δ 0,88 (т, J=7,2 Гц, 3H), 1,51-1,57 (м, 2H), 3,22 (кв., J=5,6, J=6,4, 2H), 6,60-6,63 (м, NH), 7,22 (д, J=8,8 Гц, 1H), 7,40 (д, J=7,6 Гц, 1H), 7,58 (т, J=8,4 Гц, 1H).
Пример 159: 5-(пирролидин-1-ил)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 90 из 2-амино-6-(пирролидин-1-ил)бензонитрилсульфамида (пример 159a) с получением 5-(пирролидин-1-ил)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксида (14,2 мг, 11%).1H ЯМР (400 МГц, ДМСО-d6) δ 1,88-1,86 (м, 4H), 3,16-3,10 (ушир.м, 4H), 6,45 (д, J=7,6 Гц, 1H), 6,64 (д, J=8,4 Гц, 1H), 7,30 (т, J=8,0 Гц, 1H), 7,83 (с, 1H, NH2), 8,14 (с, 1H, NH2), 10,79 (с, INH). МС 267 (MH+).
Пример 159a: 2-амино-6-(пирролидин-1-ил)бензонитрилсульфамид
Получают по методике примера 90a из 2-амино-6-(пирролидин-1-ил)бензонитрила (Пример 159b) с получением 2-амино-6-(пирролидин-1-ил)бензонитрилсульфамида (0,34 г, 100%).1H ЯМР (400 МГц, ДМСО-d6) δ 1,94-1,91 (м, 4H), 3,48-3,45 (м, 4H), 6,55 (д, J=7,6 Гц, 1H), 6,81 (д, J=8,0 Гц, 1H), 7,15 (с, 2H, NH2), 7,32 (т, J=8,0 Гц, 1H), 8,9 (с, INH). МС 267 (MH+).
Пример 159b: 2-амино-6-(пирролидин-1-ил)бензонитрил
Получают по методике примера 90b из 2-нитро-6-(пирролидин-1-ил)бензонитрила (пример 159c) с получением 2-амино-6-(пирролидин-1-ил)бензонитрил (0,48 г, 85%) в виде масла коричневого цвета, которое применяют на следующей стадии без дальнейшей очистки.1H ЯМР (400 МГц, ДМСО-d6) δ 1,91- 1,88 (м, 4H), 3,43-3,40 (м, 4H), 5,61 (с, 2H, NH2), 5,86 (д, J=8,8 Гц, 1H), 6,06 (д, J=8,0 Гц, 1H), 6,99 (т, J=8,0 Гц, 1H). МС 188 (MH+).
Пример 159c: 2-нитро-6-(пирролидин-1-ил)бензонитрил
Получают по методике примера 90c из 2,6-динитробензонитрила и пирролидина с получением 2-нитро-6-(пирролидин-1-ил)бензонитрила, который применяют на следующей стадии без дальнейшей очистки.1H ЯМР (400 МГц, ДМСО-d6) δ 1,97-1,94 (м, 4H), 3,60-3,57 (м, 4H), 7,22 (д, J=8,0 Гц, 1H), 7,41 (д, J=6,8 Гц, 1H), 7,58 (т, J=8,0 Гц, 1H), МС 218 (MH+).
Пример 160: 4-Амино-5-изобутокси-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-изобутоксибензонитрила (пример 160a) с получением 4-амино-5-изобутокси-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (65 мг, 50%).1H ЯМР (400 МГц, ДМСО-d6) δ 1,01 (д, J=6,7 Гц, 6H), 2,06 (септ, J=6,6 Гц, 1H), 3,90 (д, J=6,2 Гц, 2H), 6,96 (д, J=8,3 Гц, 1H), 7,15 (д, J=8,0 Гц, 1H), 7,27 (ушир.с, 2H), 7,56 (т, J=8,7 Гц, 1H), 9,46 (с, 1H). МС 270 (MH+).
Пример 160a: 2-Сульфамоиламино-6-изобутоксибензонитрил
Получают по методике примера 111a из 2-амино-6-изобутоксибензонитрила (пример 160b) с получением 2-сульфамоиламино-6-изобутоксибензонитрила (130 мг, 50%). МС 191 (MH+-NH2SO2).
Пример 160b: 2-Амино-6-изобутоксибензонитрил
Получают по методике примера 111b из 2-изобутокси-6-нитробензонитрила (пример 160c) с получением 2-амино-6-изобутоксибензонитрила. МС 191 (MH+).
Пример 160c: 2-изобутокси-6-нитробензонитрил
Получают по методике примера 160c из 2,6-динитробензонитрила и изобутанола с получением 2-изобутокси-6-нитробензонитрила.1H ЯМР (400 МГц, ДМСО-d6) δ 1,05 (д, J=6,4 Гц, 6H), 2,11 (септ, J=6,6 Гц, 1H), 4,07 (д, J=6,5 Гц, 2H), 7,75 (дд, J=8,0, 1,9 Гц, 1H), 7,91 (т, J=8,2 Гц, 1H), 7,94 (дд, J=8,2, 1,9 Гц, 1H).
Пример 161: 4-Амино-5-втор-бутокси-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-втор-бутоксибензонитрила (пример 161a) с получением 4-амино-5-втор-бутокси-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (57 мг, 44%).1H ЯМР (400 МГц, ДМСО-d6) δ 0,95 (т, J=7,9 Гц, 3H), 1,28 (д, J=5,9 Гц, 3H), 1,67 (м, J=7,4 Гц, 2H), 4,57 (секст, J=5,9 Гц, 1H), 6,98 (д, J=8,7 Гц, 1H), 7,13 (д, J=8,3 Гц, 1H), 7,27 (ушир.с, 2H), 7,55 (т, J=8,3 Гц, 1H), 9,41 (с, 1H). МС 270 (MH+).
Пример 161a: 2-Сульфамоиламино-6-втор-бутоксибензонитрил
Получают по методике пример 1a из 2-амино-6-втор-бутоксибензонитрила (пример 20b) с получением 2-сульфамоиламино-6-втор-бутоксибензонитрила. МС 191 (MH+-NH2SO2).
Пример 161b: 2-Амино-6-втор-бутоксибензонитрил
Получают по методике примера 111b из 2-втор-бутокси-6-нитробензонитрила (пример 161c) с получением 2-амино-6-втор-бутоксибензонитрила. МС 191 (MH+).
Пример 161c: 2-втор-Бутокси-6-нитробензонитрил
Получают по методике примера 161c из 2,6-динитробензонитрила и втор-бутанола с получением 2-втор-бутокси-6-нитробензонитрила.1H ЯМР (400 МГц, ДМСО-d6) δ 0,98 (т, J=7,5 Гц, 3H), 1,33 (д, J=5,9 Гц, 3H), 1,73 (м, 2H), 4,76 (секст, J=5,9 Гц, 1H), 7,78 (дд, J=6,8, 2,8 Гц, 1H), 7,90 (м, 2H).
Пример 162: 4-Амино-циклобутокси-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-циклобутоксибензонитрила (пример 162a) с получением 4-амино-циклобутокси-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид (19,4 мг, 10%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,65 (м, 1H), 1,79 (м, 1H), 2,19 (м, 2H), 2,43 (м, 2H), 4,82 (м, 1H), 6,52 (д, J=7,9 Гц, 1H), 6,58 (д, J=8,2 Гц, 1H), 7,40 (т, J=8,1 Гц, 1H), 7,78 (ушир.с, 1H), 8,31 (ушир.с, 1H), 10,92 (ушир.с). МС 268 (MH+).
Пример 162a: 2-Сульфамоиламино-6-циклобутоксибензонитрил
Получают по методике примера 111a из 2-амино-6-циклобутоксибензонитрила (пример 162b) с получением 2-сульфамоиламино-6-циклобутоксибензонитрила (231 мг, 100%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,67 (м, 1H), 1,82 (м, 1H), 2,08 (м, 2H), 2,47 (м, 2H), 4,83 (пент, J=7,2 Гц, 1H), 6,79 (д, J=8,2 Гц, 1H), 7,15 (д, J=8,2 Гц, 1H), 7,28 (ушир.с, 1H), 7,54 (т, J=8,2 Гц, 1H), 9,46 (ушир.с, 1H). МС 268 (MH+).
Пример 162b: 2-Амино-6-циклобутоксибензонитрил
Получают по методике примера 111b из 2-циклобутокси-6-нитробензонитрила (пример 162c) с получением 2-амино-6-циклобутоксибензонитрила (174 мг, 70%) в виде белых игольчатых кристаллов.1H ЯМР (400 МГц, ДМСО-d6) δ 1,65 (м, 1H), 1,81 (м, 1H), 2,06 (м, 2H), 2,44 (м, 2H), 4,72 (пент, J=7,3 Гц, 1H), 6,00 (ушир.с, 2H), 6,07 (д, J=7,8 Гц, 1H), 6,34 (дд, J=8,2, 0,8 Гц, 1H), 7,17 (т, J=8,1 Гц, 1H), МС 189 (MH+).
Пример 162c: 2-Циклобутокси-6-нитробензонитрил
Получают по методике примера 111c из 2,6-динитробензонитрила и циклобутанола с получением 2-амино-6-циклобутоксибензонитрила (298 мг, 34%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,69 (м, 1H), 1,85 (м, 1H), 2,14 (м, 2H), 2,52 (м, 2H), 4,98 (пент, J=7,3 Гц, 1H), 7,55 (дд, J=8,2, 1,1 Гц, 1H), 7,87 (т, J=8,2 Гц, 1H), 7,92 (дд, J=8,4, 1,3 Гц, 1H).
Пример 163: 4-Амино-5-циклобутоксихиназолин-2(1H)-он

Получают по методике примера 111 из N-(2-циано-3-циклобутоксифенилкарбамоил)бензамида (пример 163a) с получением 4-амино-5-циклобутоксихиназолин-2(1H)-она (19,4 мг, 76%) в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,68 (м, 1H), 1,84 (м, 1H), 2,20 (м, 2H), 2,49 (м, 2H), 4,87 (пент, J=7,2 Гц, 1H), 7,52 (д, J=8,2 Гц, 1H), 6,71 (д, J=8,2 Гц, 1H), 7,92 (т, J=8,2 Гц, 1H), 7,48 (ушир.с, 1H), 7,88 (ушир.с, 1H), 10,65 (ушир.с, 1H). МС 232 (MH+).
Пример 163a: N-(2-Циано-3-циклобутоксифенилкарбамоил)бензамид
К раствору 2-амино-6-циклобутоксибензонитрила (пример 162b) (30 мг, 0,16 ммоль) в 1,4-диоксане (2 мл) добавляют бензоилизоцианат (23 мг, 0,16 ммоль). Реакционную смесь перемешивают при КТ под N2 в течение 19 часов. После завершения реакционную смесь разбавляют EtOAc, промывают насыщенным NaHCO3 (2x), водой, насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют с получением N-(2-циано-3-циклобутоксифенилкарбамоил)бензамида (38 мг, 71%).1H ЯМР (400 МГц, ДМСО-d6) δ 1,64 (м, 1H), 1,81 (м, 2H), 2,05 (м, 1H), 2,42 (м, 2H), 4,71 (пент, J=7,1 Гц, 1H), 6,05 (д, J=8,2 Гц, 1H), 6,33 (д, J=8,3 Гц, 1H), 7,15 (т, J=8,5 Гц, 1H), 7,45 (м, 1H), 7,56 (м, 2H), 7,87 (м, 1H), 8,05 (м, 1H), 11,35 (с, 1H).
Пример 164: 4-Амино-5-(3-метилбут-2-ен-2-ил)хиназолин-2(1H)-он
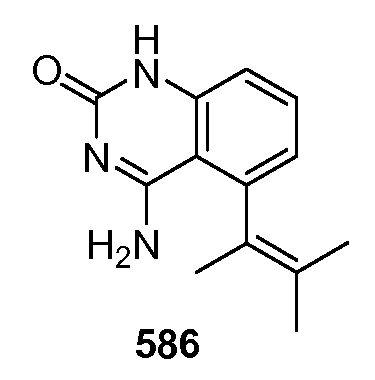
Получают по методике примера 146 из 1N-(2-циано-3-(3-метилбут-2-ен-2-ил)фенилкарбамоил)бензамида (пример 164a) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, CDCl3) δ 1,44 (с, 3H), 1,83 (с, 3H), 1,89 (с, 3H), 6,65 (дд, J=7,2, 1,0 Гц, 1H), 6,69 (ушир.с, 2H), 7,04 (дд, J=7,2, 1,0 Гц, 1H), 7,48 (т, J=7,2 Гц, 1H), 10,74 (с, 1H). МС 230 (MH+).
Пример 164a: N-(2-циано-3-(3-метилбут-2-ен-2-ил)фенилкарбамоил)бензамид
Получают по методике примера 146a из 2-амино-6-(3-метилбут-2-ен-2-ил)бензонитрила (Пример 98a) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,47 (с, 3H), 1,81 (с, 3H), 1,92 (с, 3H), 7,01-7,04 (м, 1H), 7,51-7,56 (м, 1H), 7,62-7,69 (м, 3H), 8,01-8,04 (м, 2H), 8,12-8,15 (м, 1H), 11,32 (с, 1H), 11,49 (с, 1H). МС 334 (MH+).
Пример 165: Улучшенный синтез гидрохлорида 4-амино-5,6-диметилтиено[2,3-d]пиримидин-2(1H)-она

В этом примере описан улучшенный способ получения соли HCl соединения 1. Более конкретно, улучшенный способ включает определенный протокол промывания и получения соли HCl на конечной стадии. По сравнению с общим способом получения соли HCl, этот способ дает значительно более чистый продукт с улучшенной растворимостью и простотой обращения.
К раствору 4-амино-5,6-диметилтиено[2,3-d]пиримидин-2(1H)-она (Пример 165a) (1082 г, 5,54 молей) в воде (8,1 л) добавляют этанольный раствор HCl (1,25н в 200 градусном этаноле). Полученную суспензию нагревают до кипения с обратным холодильником в течение 15 минут с получением прозрачного раствора. (В некоторых случаях дополнительная 1:1 H20:1,25н HCl в этаноле должна быть добавлена для получения прозрачного раствора). Раствор фильтруют в горячем состоянии, и фильтрат охлаждают до 0°С при перемешивании. Полученный осадок собирают фильтрацией, и промывают ацетоном (3×5,4 л) и гептаном (3×5,4 л). Твердые вещества помещают в сушильные лотки и сушат в вакууме в течение ночи с получением гидрохлорида 4-амино-5,6-диметилтиено[2,3-d]пиримидин-2(1H)-она в виде порошка беловатого цвета (1176 г, 92% выход). > 99% чистота по определению ВЭЖХ. т. пл.: > 260°С.1H ЯМР (400 МГц, ДМСО-d6) δ 2,30 (с, 6H), 8,56 (ушир.с, 1H), 9,54 (ушир.с, 1H), 12,92 (ушир.с, 2H).13C ЯМР (400 МГц, ДМСО-d6) δ 12,2, 13,3, 106,5, 125,5, 125,7, 146,1, 154,9, 155,3, МС 196,2 (MH+). Чистота по определению ВЭЖХ 99,64%.
Пример 165a: 4-амино-5,6-диметилтиено[2,3-d]пиримидин-2(1H)-он.
Этанол добавляют в 50 л трехгорлую колбу (30,8 л) и начинают перемешивание. Добавляют N-(3-циано-4,5-диметилтиофен-2-илкарбамоил)бензамид (Пример 165b) (933 г, 3,12 моль) с последующим добавлением NaOH (2н, 4,5 л). Реакционную смесь нагревают до кипения с обратным холодильником (-77°С) и перемешивают в атмосфере азота в течение 2,5 часов. Затем раствор охлаждают до 65°С и обрабатывают древесным углем (233 г). После перемешивания в течение 30 минут горячий раствор фильтруют, и фильтрат медленно охлаждают до комнатной температуры. Фильтрат осторожно нейтрализуют 4н HCl при энергичном перемешивании, затем далее охлаждают до от -5°С до 5°С. Полученный осадок собирают фильтрацией, промывают водой (3×14 л), ДМФ (1×18,7 л), ацетоном (3×14 л) и водой (3×14 л). Твердое вещество помещают в сушильные поддоны и сушат в вакууме в течение ночи с получением 4-амино-5,6-диметилтиено[2,3-d]пиримидин-2(1H)-тиона (573 г, 87%) в виде твердого вещества беловатого цвета. т. пл.: > 260°С.1H ЯМР (400 МГц, ДМСО-d6) δ 7,95 (ушир.с, 1H), 2,25 (с, 3H), 2,16 (с, 3H). МС 196(MH+). Чистота по определению ВЭЖХ 99,64%.
Пример 165b: N-(3-Цино-4,5-диметилтиофен-2-илкарбамоил)бензамид
К раствору 2-амино-4,5-диметилтиофен-3-карбонитрила (1680 г, 11,04 моль) в 1,4-диоксане (42 л) добавляют бензоилизоцианат (1624 г, 11,04 моль). Реакционную смесь затем перемешивают при комнатной температуре в атмосфере азота в течение ночи. Полученный осадок собирают фильтрацией, промывают 1,4-диоксаном (3×1,7 л) и гептаном (3×1,7 л), и сушат в вакууме в течение ночи с получением N-(3-циано-4,5-диметилтиофен-2-илкарбамоил)бензамида в виде твердого вещества белого цвета (2800 г, 84,7% выход).1H ЯМР (400 МГц, ДМСО-d6) δ 2,10 (с, 3H), 2,24 (с, 3H), 7,52-7,56 (м, 2H), 7,64-7,69 (м, 1H), 8,01-8,03 (м, 2H), 11,57 (ушир.с, 1H), 12,05 (ушир.с, 1H). МС 300 (MH+).
Пример 166: Хлорид 4-(2-(4-амино-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид-5-илокси)этил)пиперидиния

Трет-бутил-4-(2-(4-амино-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид-5-илокси)этил)пиперидин-1-карбоксилат (Пример 166a) (20 мг, 0,047 ммоль) растворяют в растворе HCl в EtOH (1 мл, 1,25 M). Реакционную смесь перемешивают при кипении с обратным холодильником в атмосфере N2. После завершения осадок собирают вакуумной фильтрацией с получением желаемого продукта (17 мг, 100%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,38 (м, 2H), 1,73 (м, 1H), 1,81 (м, 2H), 1,87 (м, 2H), 2,84 (м, 2H), 3,24 (м, 2H), 4,21 (т, J=6,4 Гц, 2H), 6,64 (д, J=8,1 Гц, 1H), 6,78 (д, J=8,3 Гц, 1H), 7,47 (т, J=8,3 Гц, 1H), 7,81 (ушир.с, 1H), 8,35 (ушир.с, 1H), 8,59 (м, 1H), 8,85 (м, 1H), 10,99 (ушир.с, 1H). МС 325 (MH+).
Пример 166a: трет-Бутил 4-(2-(4-амино-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид-5-илокси)этил)пиперидин-1-карбоксилат
Получают по методике примера 111 из трет-бутил 4-(2-(2-циано-3-(сульфамоиламино)фенокси)этил)пиперидин-1-карбоксилата (Пример 166b) в 15% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,07 (квд, J=12,8, 4,6 Гц, 2H), 1,40 (с, 9H), 1,60 (м, 1H), 1,70 (м, 2H), 1,79 (кв., J=6,7 Гц, 2H), 2,70 (м, 2H), 3,93 (м, 2H), 4,21 (т, J=6,7 Гц, 2H), 6,62 (д, J=8,1 Гц, 1H), 6,78 (д, J=8,3 Гц, 1H), 7,46 (т, J=8,3 Гц, 1H), 7,82 (ушир.с, 1H), 8,34 (ушир.с, 1H), 10,96 (ушир.с, 1H).
Пример 166b: трет-Бутил-4-(2-(2-циано-3-(сульфамоиламино)фенокси)этил)пиперидин-1-карбоксилат
Получают по методике примера 111a из трет-бутил 4-(2-(3-амино-2-цианофенокси)этил)пиперидин-1-карбоксилата (Пример 166c) с 72% выходом в виде прозрачного сиропа.1H ЯМР (400 МГц, ДМСО-d6) δ 1,08 (м, 2H), 1,40 (с, 9H), 1,71 (м, 5H), 2,70 (м, 2H), 3,93 (м, 2H), 4,17 (т, J=6,3 Гц, 2H), 6,98 (д, J=8,6 Гц, 1H), 7,16 (д, J=8,3 Гц, 1H), 7,28 (ушир.с, 2H), 7,57 (т, J=8,3 Гц, 1H), 9,45 (ушир.с, 1H).
Пример 166c: трет-Бутил 4-(2-(3-амино-2-цианофенокси)этил)пиперидин-1-карбоксилат:
Получают по методике примера 111b из трет-бутил 4-(2-(2-циано-3-нитрофенокси)этил)пиперидин-1-карбоксилата (Пример 166d) в 36% в виде белой пены.1H ЯМР (400 МГц, CDCl3) δ 1,06 (м, 2H), 1,40 (с, 9H), 1,68 (м, 5H), 2,70 (м, 2H), 3,93 (м, 2H), 4,05 (т, J=6,0 Гц, 2H), 5,98 (ушир.с, 2H), 6,23 (д, J=8,4 Гц, 1H), 6,34 (д, J=8,4 Гц, 1H), 7,18 (т, J=8,2 Гц, 1H).
Пример 166d: трет-Бутил-4-(2-(2-циано-3-нитрофенокси)этил)пиперидин-1-карбоксилат:
К суспензии трет-бутил-4-(2-гидроксиэтил)пиперидин-1-карбоксилата (769 мкл, 3,50 ммоль) и NaH (118 мг, 3,50 ммоль, 60% дисперсия в минеральном масле) в сухом ДМФ (5 мл) при 0°С добавляют раствор 2,6-динитробензонитрила (614 мг, 3,18 ммоль) в сухом ДМФ (4 мл). Реакционную смесь перемешивают под N2, нагревая до КТ. После завершения реакцию гасят H2O (50 мл), и осадок собирают вакуумной фильтрацией с получением трет-бутил-4-(2-(2-циано-3-нитрофенокси)этил)пиперидин-1-карбоксилата (955 мг, 80%) в виде твердого вещества рыжевато-коричневого цвета.1H ЯМР (400 МГц, CDCl3) δ 1,09 (м, 2H), 1,40 (с, 9H), 1,73 (м, 5H), 2,70 (м, 2H), 3,94 (м, 2H), 4,32 (т, J=6,8 Гц, 2H), 7,75 (м, 1H), 7,92 (м, 2H).
Пример 167: хлорид 4-(2-(4-амино-2-оксо-1,2-дигидрохиназолин-5-илокси)этил)пиперидиния

Получают по методике примера 166 из трет-бутил 4-(2-(4-амино-2-оксо-1,2-дигидрохиназолин-5-илокси)этил)пиперидин-1-карбоксилата (Пример 167a) с 92% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,36 (м, 2H), 1,70 (м, 1H), 1,83 (кв., J=6,5 Гц, 2H), 1,88 (м, 2H), 2,84 (м, 2H), 3,26 (м, 2H), 4,36 (т, J=6,4 Гц, 2H), 6,86 (д, J=8,3 Гц, 1H), 6,99 (д, J=8,3 Гц, 1H), 7,76 (т, J=8,3 Гц, 1H), 8,50 (ушир.с, 1H), 8,74 (ушир.с, 1H), 8,98 (ушир.с, 1H), 9,46 (ушир.с, 1H), 11,99 (ушир.с, 1H). МС 289 (MH+).
Пример 167a: трет-бутил 4-(2-(4-амино-2-оксо-1,2-дигидрохиназолин-5-илокси)этил)пиперидин-1-карбоксилат
Получают по методике примера 111 из трет-бутил 4-(2-(3-(3-бензоилуреидо)-2-цианофенокси)этил)пиперидин-1-карбоксилат (Пример 167b) с 31% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,08 (квд, J=12,8, 4,6 Гц, 2H), 1,40 (с, 9H), 1,60 (м, 1H), 1,70 (м, 2H), 1,79 (кв., J=6,4 Гц, 2H), 2,69 (м, 2H), 3,93 (м, 2H), 4,23 (т, J=6,9 Гц, 2H), 6,73 (м, 2H), 7,47 (т, J=8,2 Гц, 1H), 7,57 (ушир.с, 1H), 7,93 (ушир.с, 1H), 10,73 (ушир.с, 1H).
Пример 167b: трет-бутил 4-(2-(3-(3-бензоилуреидо)-2-цианофенокси)этил)пиперидин-1-карбоксилат
Получают по методике примера 146a из трет-бутил 4-(2-(3-амино-2-цианофенокси)этил)пиперидин-1-карбоксилата (Пример 167c) со 100% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,09 (м, 2H), 1,40 (с, 9H), 1,60 (м, 1H), 1,71 (м, 5H), 2,71 (м, 2H), 3,94 (м, 2H), 4,21 (т, J=6,5 Гц, 2H), 7,01 (д, J=8,5 Гц, 1H), 7,56 (т, J=7,4 Гц, 2H), 7,47 (т, J=8,2 Гц, 1H), 7,64 (т, J=8,5 Гц, 1H), 7,68 (тт, J=7,3, 1,5 Гц, 1H), 7,87 (д, J=8,3 Гц, 1H), 8,05 (м, 2H), 11,35 (ушир.с, 1H), 11,49 (ушир.с, 1H) .
Пример 168: 4-Амино-5-(циклогексилокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-гексилоксибензонитрила (Пример 168a) с 63% выходом в виде кристаллического вещества белого цвета. Т. пл.: 215-216°С.1H ЯМР (400 МГц, ДМСО-d6) δ 1,30-1,71 (м, 8H), 1,99 (м, 2H), 4,63 (м, 1H), 6,60 (дд, J=8,2, 0,8 Гц, 1H), 6,82 (д, J=8,2 Гц, 1H), 7,45 (т, J=8,3 Гц, 1H), 7,83 (ушир.д, J=2,0 Гц, 1H), 8,40 (ушир.д, J=2,4 Гц, 1H), 10,95 (ушир.с, 1H). МС 296 (MH+).
Пример 168a: 2-Сульфамоиламино-6-циклогексилбензонитрил
Получают по методике примера 111a из 2-амино-6-циклогексилоксибензонитрил (Пример 168b) с 91% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,37 (м, 3H), 1,51 (м, 3H), 1,70 (м, 2H), 1,85 (м, 2H), 4,55 (м, 1H), 6,98 (д, J=8,1 Гц, 1H), 7,10 (д, J=8,5 Гц, 1H), 7,24 (ушир.с, 2H), 7,51 (т, J=8,5 Гц, 1H), 9,39 (с, 1H).
Пример 168b: 2-Амино-6-циклогексилоксибензонитрил:
Получают по методике примера 111b из 2-нитро-6-циклогексилоксибензонитрила с получением 2-амино-6-циклогексилоксибензонитрила (420 мг, 27%) в виде сиропа зеленого цвета.1H ЯМР (400 МГц, CDCl3) δ 1,37 (м, 3H), 1,50 (м, 3H), 1,71 (м, 2H), 1,85 (м, 2H), 4,43 (м, 1 H), 5,94 (ушир.с, 2H), 6,26 (д, J=8,6 Гц, 1H), 6,31 (д, J=8,1 Гц, 1H), 7,16 (т, J=8,1 Гц, 1H). МС 215 (MH+).
Пример 168c: 2-Нитро-6-циклогексилоксибензонитрил:
Получают по методике примера 166d из 2-нитро-6-циклогексилоксибензонитрила и циклогексанола с 100% выходом с виде светло-рыжевато-твердого вещества коричневого цвета.1H ЯМР (400 МГц, CDCl3) δ 1,45 (м, 4H), 1,60 (м, 2H), 1,74 (м, 2H), 1,90 (м, 2H), 4,76 (м, 1H), 7,79 (м, 1H), 7,89 (м, 2H).
Пример 169: 4-Амино-5-(циклопентокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-пентоксибензонитрила (Пример 169a) с 38% выходом в виде беловатых игл. т. пл.: >260°С.1H ЯМР (400 МГц, ДМСО-d6) δ 1,67 (м, 4H), 1,85 (м, 2H), 1,98 (м, 2H), 5,05 (м, 1H), 6,61 (д, J=7,8 Гц, 1H), 6,76 (д, J=7,8 Гц, 1H), 7,46 (т, J=7,8 Гц, 1H), 7,72 (ушир.с, 1H), 8,35 (ушир.с, 1H), 10,96 (ушир.с, 1H). МС 282 (MH+).
Пример 169a: 2-Сульфамоиламино-6-циклопентоксибензонитрил:
Получают по методике примера 111a из 2-амино-6-циклопентоксибензонитрила (Пример 169b) с 100% выходом в виде сиропа светло-коричневого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,61 (м, 2H), 1,74 (м, 4H), 1,93 (м, 2H), 4,98 (м, 1H), 6,96 (д, J=9,0 Гц, 1H), 7,14 (д, J=8,2 Гц, 1H), 7,28 (ушир.с, 2H), 7,55 (т, J=8,2 Гц, 1H), 9,43 (с, 1H).
Пример 169b: 2-Амино-6-циклопентоксибензонитрил:
Получают по методике примера 111b из 2-нитро-6-циклопентоксибензонитрила (Пример 169c) с 84% выходом в виде сиропа зеленого цвета.1H ЯМР (400 МГц, CDCl3) δ 1,58 (м, 2H), 1,71 (м, 4H), 1,89 (м, 2H), 4,84 (м, 1 H), 5,94 (ушир.с, 2H), 6,20 (д, J=8,0 Гц, 1H), 6,31 (д, J=8,3 Гц, 1H), 7,17 (т, J=8,3 Гц, 1H).
Пример 169c: 2-Нитро-6-циклопентоксибензонитрил:
Получают по методике примера 166d из 2,6-динитробензонитрила и циклопентанола с 78% выходом в виде твердого вещества светло-рыжевато-коричневого цвета.1H ЯМР (400 МГц, CDCl3) δ 1,64 (м, 2H), 1,77 (м, 4H), 1,97 (м, 2H), 5,14 (м, 1H), 7,73 (м, 1H), 7,88 (м, 2H).
Пример 170: Хлорид 4-(2-(4-амино-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид-5-илокси)метил)пиперидиния

Получают по методике примера 166 из трет-бутил 4-(2-(4-амино-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид-5-илокси)метил)пиперидин-1-карбоксилат (Пример 170a) с 89% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,49 (м, 2H), 1,90 (д, J=13,1 Гц, 2H), 2,23 (м, 1H), 2,89 (кв., J=11,6 Гц, 2H), 3,30 (д, J=12,3 Гц, 2H), 4,09 (ушир.с, J=6,6 Гц, 2H), 6,65 (д, J=8,2 Гц, 1H), 6,82 (д, J=8,2 Гц, 1H), 7,48 (т, J=8,2 Гц, 1H), 7,74 (ушир.с, 1H), 8,33 (ушир.с, 1H), 8,69 (м, 1H), 8,92 (м, 1H), 11,01 (с, 1H). МС 272 (MH+).
Пример 170a: Трет-бутил 4-(2-(4-амино-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид-5-илокси)метил)пиперидин-1-карбоксилат
Получают по методике примера 111 из трет-бутил 4-((2-циано-3-(сульфамоиламино)фенокси)метил)пиперидин-1-карбоксилата (Пример 170b) с 91% в виде твердого вещества белого цвета. МС 355 (MH+ - C(CH3)3).
Пример 170b: Трет-бутил 4-((2-циано-3-(сульфамоиламино)фенокси)метил)пиперидин-1-карбоксилат
Получают по методике примера 111a из трет-бутил 4-((3-амино-2-цианофенокси)метил)пиперидин-1-карбоксилата (Пример 170c) с 56% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ1H ЯМР (400 МГц, ДМСО-d6) δ 1,20 (м, 2H), 1,41 (с, 9H), 1,76 (д, J=13,2 Гц, 2H), 1,97 (м, 2H), 4,00 (м, 4H), 6,96 (д, J=8,6 Гц, 1H), 7,16 (д, J=8,3 Гц, 1H), 7,28 (с, 2H), 7,57 (т, J=8,3 Гц, 1H), 9,47 (с, 1H).
Пример 170c: Трет-бутил 4-((3-амино-2-цианофенокси)метил)пиперидин-1-карбоксилат
Получают по методике примера 111b из трет-бутил 4-((2-циано-3-нитрофенокси)метил)пиперидин-1-карбоксилата (Пример 170d) с 74% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,18 (квд, J=12,6, 3,8 Гц, 2H), 1,41 (с, 9H), 1,74 (д, J=12,6 Гц, 2H), 1,93 (м, 2H), 2,75 (м, 2H), 3,88 (д, J=6,6 Гц, 2H), 3,99 (ушир.д, J=12,1 Гц, 2H), 6,00 (ушир.с, 2H), 6,21 (д, J=8,2 Гц, 1H), 6,34 (д, J=8,3 Гц, 1H), 7,18 (т, J=8,2 Гц, 1H).
Пример 170d: Трет-бутил 4-((2-циано-3-нитрофенокси)метил)пиперидин-1-карбоксилат
Получают по методике примера 111c из 2,6-динитробензонитрила и трет-бутил 4-(гидроксиметил)пиперидин-1-карбоксилата с 73% в виде твердого вещества рыжевато-коричневого цвета.1H ЯМР (400 МГц, MeOD) δ 1,24 (квд, J=12,8, 4,4 Гц, 2H), 1,41 (с, 9H), 1,78 (ушир.д, J=12,1 Гц, 2H), 2,02 (м, 2H), 2,77 (м, 2H), 4,00 (ушир.д, J=13,1 Гц, 2H), 4,15 (д, J=6,3 Гц, 2H), 7,74 (дд, J=7,5, 1,5 Гц, 1H), 7,91 (м, 2H).
Пример 171: 4-Амино-5-(циклобутилметокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-циклобутилметоксибензонитрила (Пример 171a) с 21% выходом в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,88 (м, 4H), 2,08 (м, 2H), 2,86 (септ, J=7,9 Гц, 1H), 4,16 (д, J=6,9 Гц, 2H), 6,62 (дд, J=8,2, 1,2 Гц, 1H), 6,77 (дд, J=8,6, 0,7 Гц, 1H), 7,47 (т, J=8,2 Гц, 1H), 7,76 (ушир.с, 1H), 8,39 (ушир.с, 1H), 10,98 (ушир.с, 1H). МС 282 (MH+).
Пример 171a: 2-Сульфамоиламино-6-циклобутилметоксибензонитрил
Получают по методике примера 111a из 2-амино-6-циклобутилметоксибензонитрила (Пример 171b) с 94% выходом в виде твердого вещества светло-желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,94 (м, 4H), 2,12 (м, 2H), 2,86 (септ, J=7,5 Гц, 1H), 4,13 (д, J=6,3 Гц, 2H), 7,00 (д, J=8,4 Гц, 1H), 7,19 (д, J=8,2 Гц, 1H), 7,31, (ушир.с, 2H), 7,60 (т, J=8,4 Гц, 1H), 9,48 (ушир.с, 1H).
Пример 171b: 2-Амино-6-циклобутилметоксибензонитрил
Получают по методике примера 111b из 2-нитро-6-циклобутилметоксибензонитрила (Пример 171c) с 41% выходом в виде масла желтого цвета. МС 203 (MH+).
Пример 171c: 2-Нитро-6-циклобутилметоксибензонитрил
Получают по методике примера 166d из 2,6-динитробензонитрила и циклобутилметанола с 68% в виде твердого вещества рыжевато-коричневого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,93 (м, 4H), 2,10 (м, 2H), 2,79 (м, 1H), 4,25 (д, J=6,3 Гц, 2H), 7,74 (дд, J=8,5, 2,2 Гц, 1H), 7,91 (м, 2H).
Пример 172: 4-Амино-5-(тетрагидро-2H-пиран-4-илокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(тетрагидро-2H-пиран-4-илокси)бензонитрила (Пример 172a) с 69% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,77 (м, 2H), 2,05 (м, 2H), 3,51 (тд, J=11,6, 2,1 Гц, 2H), 3,85 (дт, J=11,4, 3,9 Гц, 2H), 4,83 (септ, J=4,1 Гц, 1H), 6,62 (д, J=8,0 Гц, 1H), 6,88 (д, J=8,4 Гц, 1H), 7,46 (т, J=8,2 Гц, 1H), 7,78 (ушир.с, 1H), 8,39 (ушир.с, 1H), 10,96 (ушир.с, 1H). МС 298 (MH+).
Пример 172a: 2-Сульфамоиламино-6-(тетрагидро-2H-пиран-4-илокси)бензонитрил
Получают по методике примера 111a из 2-амино-6-(тетрагидро-2H-пиран-4-илокси)бензонитрила (Пример 172b) с 58% в виде твердого вещества светло-оранжевого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,64 (м, 2H), 1,99 (м, 2H), 3,53 (ддд, J=11,6, 8,3, 3,1 Гц, 2H), 3,85 (м, 2H), 4,80 (септ, J=4,0 Гц, 1H), 7,07 (д, J=8,3 Гц, 1H), 7,16 (д, J=8,1 Гц, 1H), 7,28 (ушир.с, 2H), 7,56 (т, J=8,5 Гц, 1H), 9,47 (ушир.с, 1H).
Пример 172b: 2-Амино-6-(тетрагидро-2H-пиран-4-илокси)бензонитрил
Получают по методике примера 111b из 2-нитро-6-(тетрагидро-2H-пиран-4-илокси)бензонитрила (Пример 172c) с 49% в виде оранжевого сиропа. МС 219 (MH+).
Пример 172c: 2-Нитро-6-(тетрагидро-2H-пиран-4-илокси)бензонитрил
Получают по методике примера 166d из 2,6-динитробензонитрила и тетрагидро-2H-пиран-4-ола с 100% выходом в виде твердого вещества рыжевато-коричневого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,69 (м, 2H), 2,03 (м, 2H), 3,56 (м, 2H), 3,87 (м, 2H), 4,98 (септ, J=3,8 Гц, 1H), 7,90 (м, 3H).
Пример 173: 4-Амино-5-(циклопентилокси)хиназолин-2(1H)-он

Получают по методике примера 111 из N-(2-циано-3-(циклопентилокси)фенилкарбамоил)бензамида (Пример 173a) с 45% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,68 (м, 4H), 1,84 (м, 2H), 1,99 (м, 2H), 5,06 (м, 1H), 6,70 (д, J=8,3 Гц, 2H), 7,43 (с, 1H), 7,45 (т, J=8,2 Гц, 1H), 7,85 (ушир.с, 1H), 10,65 (ушир.с, 1H).
Пример 173a: N-(2-циано-3-(циклопентилокси)фенилкарбамоил)бензамид
Получают по методике примера 146a из 2-амино-6-циклопентоксибензонитрила (Пример 173b) с 70% выходом в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,63 (м, 2H), 1,77 (м, 4H), 1,98 (м, 2H), 5,03 (м, 1H), 6,98 (д, J=8,6 Гц, 1H), 7,55 (т, J=7,6 Гц, 2H), 7,62 (т, J=8,6 Гц, 1H), 7,67 (тт, J=7,4, 1,2 Гц, 1H), 7,87 (д, J=8,0 Гц, 1H), 8,06 (м, 2H), 11,37 (ушир.с, 1H), 11,54 (ушир.с, 1H).
Пример 174: 4-Амино-5-(тетрагидрофуран-3-илокси)-1H-бензо[c][1,2,6] тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(тетрагидрофуран-3-илокси)бензонитрила (Пример 174a) с 33% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,07 (м, 1H), 2,26 (м, 1H), 3,74 (тд, J=8,4, 4,7 Гц, 1H), 3,84 (м, 2H), 3,95 (д, J=10,4 Гц, 1H), 5,23 (м, 1H), 6,61 (д, J=8,1 Гц, 1H), 6,73 (д, J=8,4 Гц, 1H), 7,45 (т, J=8,1 Гц, 1H), 7,64 (ушир.с, 1H), 8,33 (ушир.с, 1H), 10,97 (ушир.с, 1H). МС 284 (MH+).
Пример 174a: 2-Сульфамоиламино-6-(тетрагидрофуран-3-илокси)бензонитрил
Получают по методике примера 111a из 2-амино-6-(тетрагидрофуран-3-илокси)бензонитрила (Пример 174b) с 40% выходом в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,99 (м, 1H), 2,28 (м, 1H), 3,77 (тд, J=8,3, 4,7 Гц, 1H), 3,83 (м, 1H), 3,87 (д, J=7,3 Гц, 1H), 3,92 (дд, J=10,2, 4,4 Гц, 1H), 5,19 (м, 1H), 6,96 (д, J=8,3 Гц, 1H), 7,18 (д, J=8,3 Гц, 1H), 7,29 (с, 2H), 7,58 (т, J=8,3 Гц, 1H), 9,49 (ушир.с, 1H).
Пример 174b: 2-Амино-6-(тетрагидрофуран-3-илокси)бензонитрил
Получают по методике примера 111b из 2-нитро-6-(тетрагидрофуран-3-илокси)бензонитрила (Пример 174c) с 97% выходом в виде сиропа светло-коричневого цвета. МС 205 (MH+).
Пример 174c: 2-Нитро-6-(тетрагидрофуран-3-илокси)бензонитрил
Получают по методике примера 166d из 2,6-динитробензонитрила и тетрагидрофуран-3-ола с 50% выходом в виде твердого вещества светло-желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,04 (м, 1H), 2,32 (м, 1H), 3,81 (тд, J=8,3, 4,6 Гц, 1H), 3,89 (м, 2H), 3,98 (дд, J=10,8, 4,5 Гц, 1H), 5,36 (м, 1H), 7,75 (дд, J=8,1, 1,5 Гц, 1H), 7,91 (т, J=8,2 Гц, 1H), 7,95 (дд, J=8,2, 1,6 Гц, 1H).
Пример 175: 4-Амино-5-(1-изопропилпиперидин-4-илокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(1-изопропилпиперидин-4-илокси)бензонитрила (Пример 175b) с 12% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,24 (д, J=6,7 Гц, 6H), 2,11 (м, 2H), 2,28 (м, 2H), 3,13 (м, 4H), 4,87 (м, 1H), 6,67 (д, J=8,0 Гц, 1H), 6,87 (д, J=8,6 Гц, 1H), 7,49 (т, J=8,3 Гц, 1H), 7,67 (ушир.с, 1H), 8,43 (ушир.с, 1H), 10,79 (ушир.с, 1H). МС 339 (MH+).
Пример 175a: 2-Сульфамоиламино-6-(1-изопропилпиперидин-4-илокси)бензонитрил
Получают по методике примера 111a из 2-амино-6-(1-изопропилпиперидин-4-илокси)бензонитрила (Пример 175b). Продукт применяют на следующей стадии без дальнейшей очистки.
Пример 175b: 2-Амино-6-(1-изопропилпиперидин-4-илокси)бензонитрил
Получают по методике примера 111b из 2-нитро-6-(1-изопропилпиперидин-4-илокси)бензонитрила (Пример 175c) с 80% выходом в виде сиропа коричневого цвета. МС 260 (MH+).
Пример 175c: 2-Нитро-(1-изопропилпиперидин-4-илокси)-6-бензонитрил
Получают по методике примера 166d из 2,6-динитробензонитрила и 1-изопропилпиперидин-4-ола с 90% выходом в виде твердого вещества рыжевато-коричневого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,99 (д, J=6,8 Гц, 6H), 1,72 (м, 2H), 1,95 (м, 2H), 2,41 (м, 2H), 2,71 (м, 3H), 4,80 (м, 1H), 7,81 (дд, J=8,2, 1,3 Гц, 1H), 7,89 (м, 2H).
Пример 176: (R)-4-Амино-5-((1-бутирилпирролидин-2-ил)метокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

К раствору (R)-2-амино-6-((1-бутирилпирролидин-2-ил)метокси)бензонитрила (84 мг, 0,29 ммоль) (Пример 176a) в ацетонитриле (9 мл) добавляют сульфамоилхлорид (70 мг, 0,60 ммоль). Реакционную смесь перемешивают при КТ в течение 20 ч и после завершения концентрируют в вакууме. Полученный остаток растворяют в EtOH (1 мл), и добавляют 2н водный NaOH (4 мл). Смесь кипятят с обратным холодильником в течение 2 ч и после завершения охлаждают до КТ, нейтрализуют 1н HCl и перемешивают при 0°С. Полученный осадок собирают вакуумной фильтрацией с получением желаемого продукта (38 мг, 35%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,89 (т, J=7,3 Гц, 3H), 1,54 (секст, J=7,3 Гц, 2H), 1,94 (м, 4H), 2,26 (т, J=7,3 Гц, 2H), 3,49 (м, 2H), 4,10 (м, 1H), 4,25 (м, 1H), 4,43 (м, 1H), 6,62 (д, J=8,2 Гц, 1H), 6,90 (д, J=8,2 Гц, 1H), 7,45 (т, J=8,2 Гц, 1H), 8,08 (ушир.с, 1H), 8,34 (ушир.с, 1H), 10,93 (ушир.с, 1H). МС 367 (MH+).
Пример 176a: (R)-2-Амино-6-((1-бутирилпирролидин-2-ил)метокси)бензонитрил
Получают по методике примера 111b из (R)-2-((1-бутирилпирролидин-2-ил)метокси)-6-нитробензонитрила (Пример 176b) с 77% выходом. МС 274 (MH+).
Пример 176b: (R)-2-((1-Бутирилпирролидин-2-ил)метокси)-6-нитробензонитрил
К суспензии хлорида (R)-2-((2-циано-3-нитрофенокси)метил)пирролидиния (140 мг, 0,49 ммоль) (Пример 176c) в ТГФ (3 мл) добавляют Et3N (143 мкл, 1,03 ммоль) и бутирилхлорид (56 мкл, 0,54 ммоль). Реакционную смесь перемешиваю в течение 72 ч при КТ под N2. После завершения реакционную смесь фильтруют, и фильтрат концентрируют с получением (R)-2-((1-бутирилпирролидин-2-ил)метокси)-6-нитробензонитрила (127 мг, 82%) в виде сиропа желтого цвета. МС 318 (MH+).
Пример 176c: Хлорид (R)-2-((2-Циано-3-нитрофенокси)метил)пирролидиния
Получают по методике примера 166 из (R)-трет-бутил 2-((2-циано-3-нитрофенокси)метил)пирролидин-1-карбоксилата (Пример 176d) с 71% выходом в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,92 (м, 2H), 2,14 (м, 2H), 3,28 (м, 2H), 4,07 (м, 2H), 4,50 (дд, J=710,6, 6,4 Гц, 1H), 4,57 (дд, J=10,9, 3,5 Гц, 1H), 7,77 (д, J=8,0 Гц, 1H), 7,98 (м, 2H), 9,36 (ушир.с, 1H), 9,74 (ушир.с, 1H).
Пример 176d: (R)-трет-Бутил 2-((2-циано-3-нитрофенокси)метил)пирролидин-1-карбоксилат
Получают по методике примера 166d из 2,6-динитробензонитрила и (R)-трет-бутил 2-(гидроксиметил)пирролидин-1-карбоксилата с 87% выходом в виде твердого вещества рыжевато-коричневого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,39 (с, 9H), 1,82 (м, 1H), 2,02 (м, 3H), 3,32 (м, 2H), 4,08 (м, 1H), 4,32 (м, 2H), 7,79 (д, J=8,0 Гц, 1H), 7,91 (м, 2H).
Пример 177: (R)-2-((4-Амино-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид-5-илокси)метил)-N-пропилпирролидин-1-карбоксамид
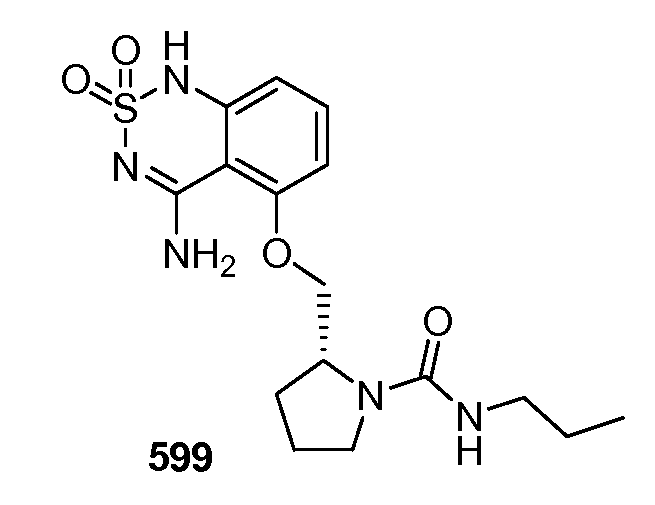
Получают по методике примера 176 из (R)-2-((3-амино-2-цианофенокси)метил)-N-пропилпирролидин-1-карбоксамида (Пример 177a) с 57% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,83 (т, J=7,6 Гц, 3H), 1,42 (секст, J=7,3 Гц, 2H), 1,90 (м, 4H), 3,00 (м, 2H), 3,20 (м, 1H), 3,43 (м, 2H), 4,01 (м, 1H), 4,16 (м, 1H), 4,33 (м, 1H), 6,27 (м, 1H), 6,61 (д, J=8,4 Гц, 1H), 6,89 (д, J=8,3 Гц, 1H), 7,45 (т, J=8,2 Гц, 1H), 8,19 (ушир.с, 1H), 8,27 (ушир.с, 1H), 10,91 (с, 1H). МС 382 (MH+).
Пример 177a: (R)-2-((3-Амино-2-цианофенокси)метил)-N-пропилпирролидин-1-карбоксамид
Получают по методике примера 111b из (R)-2-((2-циано-3-нитрофенокси)метил)-N-пропилпирролидин-1-карбоксамид (Пример 177b) с 14% выходом. МС 303 (MH+).
Пример 177b: (R)-2-((2-Циано-3-нитрофенокси)метил)-N-пропилпирролидин-1-карбоксамид
Получают по методике примера 176b из хлорида (R)-2-((2-циано-3-нитрофенокси)метил)пирролидиния (Пример 176c) и пропилизоцианата с 100% выходом в виде твердого вещества светло-желтого цвета. МС 333 (MH+).
Пример 178: (R)-2-((4-Амино-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид-5-илокси)метил)-N-этилпирролидин-1-карбоксамид

Получают по методике примера 176 из (R)-2-((3-амино-2-цианофенокси)метил)-N-этилпирролидин-1-карбоксамида (Пример 178a) с 60% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,02 (т, J=6,8 Гц, 3H), 1,90 (м, 4H), 3,08 (квинт, J=6,8 Гц, 2H), 3,20 (м, 2H), 4,01 (м, 1H), 4,16 (м, 1H), 4,33 (м, 1H), 6,27 (м, 1H), 6,62 (д, J=8,4 Гц, 1H), 6,89 (д, J=8,4 Гц, 1H), 7,46 (т, J=8,4 Гц, 1H), 8,20 (ушир.с, 1H), 8,27 (ушир.с, 1H), 10,91 (с, 1H). МС 368 (MH+).
Пример 178a: (R)-2-((3-Амино-2-цианофенокси)метил)-N-этилпирролидин-1-карбоксамид
Получают по методике примера 111b из (R)-2-((2-циано-3-нитрофенокси)метил)-N-этилпирролидин-1-карбоксамида (Пример 178b) с 62% выходом. МС 289 (MH+).
Пример 178b: (R)-2-((2-Циано-3-нитрофенокси)метил)-N-этилпирролидин-1-карбоксамид
Получают по методике примера 176b из хлорида (R)-2-((2-циано-3-нитрофенокси)метил)пирролидиния (Пример 176c) и этилизоцианата с 95% выходом в виде твердого вещества светло-желтого цвета. МС 319 (MH+).
Пример 179: (R)-4-Амино-5-((1-изобутирилпирролидин-2-ил)метокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид
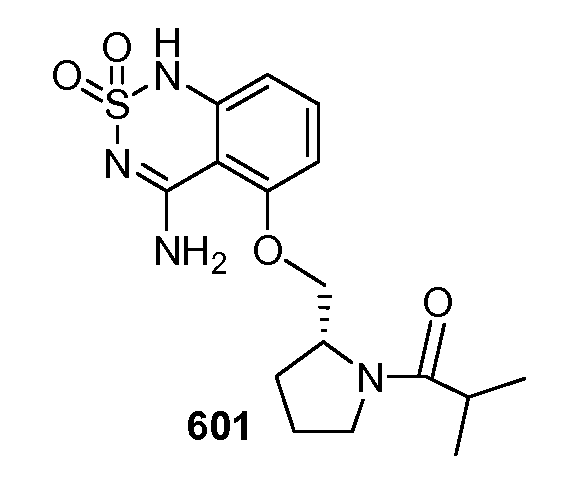
Получают по методике примера 176 из (R)-2-амино-6-((1-изобутирилпирролидин-2-ил)метокси)бензонитрила (Пример 179b) с 100% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,02 (д, J=6,3 Гц, 6H), 1,94 (м, 4H), 2,70 (м, 1H), 3,55 (м, 2H), 4,12 (м, 1H), 4,24 (м, 1H), 4,43 (м, 1H), 6,62 (д, J=7,9 Гц, 1H), 6,91 (д, J=8,1 Гц, 1H), 7,47 (т, J=8,1 Гц, 1H), 8,04 (ушир.с, 1H), 8,34 (ушир.с, 1H), 10,93 (ушир.с, 1H). МС 367 (MH+).
Пример 179a: (R)-2-Амино-6-((1-изобутирилпирролидин-2-ил)метокси)бензонитрил
Получают по методике примера 111b из (R)-2-((1-изобутирилпирролидин-2-ил)метокси)-6-нитробензонитрила (Пример 179b) с 80% выходом в виде прозрачного сиропа. МС 288 (MH+).
Пример 179b: (R)-2-((1-изобутирилпирролидин-2-ил)метокси)-6-нитробензонитрил
Получают по методике примера 176b из хлорида (R)-2-((2-циано-3-нитрофенокси)метил)пирролидиния и изобутирил хлорида со 100% выходом в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,96 (дд, J=6,6, 3,5 Гц, 6H), 1,93 (м, 4H), 2,14 (м, 1H), 2,66 (септ, J=6,6 Гц, 1H), 3,55 (м, 1H), 4,28 (м, 3H), 7,79 (дд, J=7,6, 1,8 Гц, 1H), 7,89 (м, 2H).
Пример 180: (R)-4-Амино-5-((1-пивалоилпирролидин-2-ил)метокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 176 из (R)-2-амино-6-((1-пивалоилпирролидин-2-ил)метокси)бензонитрила (Пример 180a) с 64% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,18 (с, 9H), 1,92 (м, 4H), 3,55 (м, 1H), 3,73 (м, 1H), 4,13 (м, 1H), 4,27 (м, 1H), 4,48 (м, 1H), 6,62 (д, J=8,2 Гц, 1H), 6,92 (д, J=8,2 Гц, 1H), 7,47 (т, J=8,2 Гц, 1H), 7,95 (ушир.с, 1H), 8,37 (ушир.с, 1H), 10,95 (ушир.с, 1H). МС 381 (MH+).
Пример 180a: (R)-2-Амино-6-((1-пивалоилпирролидин-2-ил)метокси)бензонитрил
Получают по методике примера 111b из (R)-2-((1-пивалоилпирролидин-2-ил)метокси)-6-нитробензонитрила (Пример 180b) с 91% выходом в виде прозрачного сиропа. МС 302 (MH+).
Пример 180b: (R)-2-((1-пивалоилпирролидин-2-ил)метокси)-6-нитробензонитрил
Получают по методике примера 176b из хлорида (R)-2-((2-циано-3-нитрофенокси)метил)пирролидиния и пивалоилхлорида с 99% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,16 (с, 9H), 1,91 (м, 3H), 2,13 (м, 1H), 3,70 (м, 2H), 4,35 (м, 3H), 7,81 (дд, J=7,5, 2,1 Гц, 1H), 7,92 (м, 2H).
Пример 181: (R)-2-((4-Амино-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид-5-илокси)метил)-N-изопропилпирролидин-1-карбоксамид

Получают по методике примера 176 из (R)-2-((3-амино-2-цианофенокси)метил)-N-изопропилпирролидин-1-карбоксамида (Пример 181a) с 23% выходом в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,05 (д, J=6,4 Гц, 6H), 1,87 (м, 4H), 3,17 (м, 1H), 3,79 (м, 1H), 3,98 (м, 1H), 4,15 (м, 1H), 4,31 (м, 1H), 5,88 (д, J=7,4 Гц, 1H), 6,59 (д, J=8,2 Гц, 1H), 6,86 (д, J=8,5 Гц, 1H), 7,43 (т, J=8,2 Гц, 1H), 8,18 (ушир.с, 1H), 8,23 (ушир.с, 1H), 10,88 (с, 1H). МС 382 (MH+).
Пример 181a: (R)-2-((3-Амино-2-цианофенокси)метил)-N-изопропилпирролидин-1-карбоксамид
Получают по методике примера 111b из (R)-2-((2-циано-3-нитрофенокси)метил)-N-изопропилпирролидин-1-карбоксамид (Пример 181b) с 86% выходом в виде прозрачного сиропа.1H ЯМР (400 МГц, ДМСО-d6) δ 1,07 (д, J=5,9 Гц, 6H), 1,89 (м, 3H), 2,10 (м, 1H), 3,16 (м, 1H), 3,45 (м, 1H), 3,78 (м, 1H), 3,91 (м, 1H), 4,06 (м, 1H), 4,12 (м, 1H), 5,85 (д, J=7,7 Гц, 1H), 6,00 (ушир.с, 2H), 6,31 (д, J=8,4 Гц, 1H), 6,34 (д, J=8,4 Гц, 1H), 7,18 (т, J=8,4 Гц, 1H).
Пример 181b: (R)-2-((2-Циано-3-нитрофенокси)метил)-N-изопропилпирролидин-1-карбоксамид
Получают по методике примера 176b из хлорида (R)-2-((2-циано-3-нитрофенокси)метил)пирролидиния (Пример 176c) и изопропилизоцианата со 100% выходом в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,07 (д, J=6,5 Гц, 6H), 1,91 (м, 3H), 2,13 (м, 1H), 3,17 (м, 1H), 3,79 (м, 1H), 4,19 (м, 2H), 4,32 (д, J=8,8 Гц, 1H), 5,91 (д, J=8,1 Гц, 1H), 7,89 (м, 3H).
Пример 182: (R)-2-((4-Амино-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид-5-илокси)метил)-N-трет-бутилпирролидин-1-карбоксамид
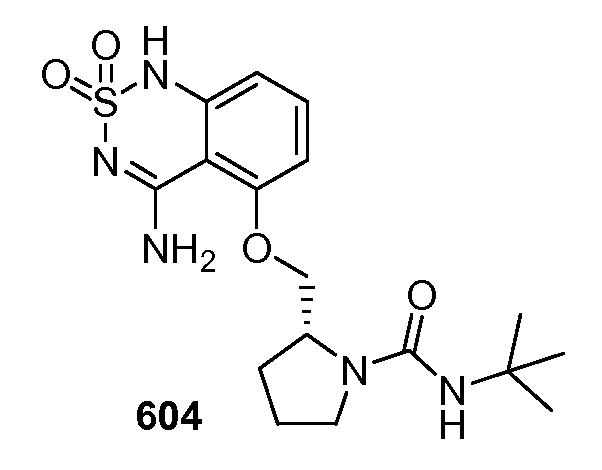
Получают по методике примера 176 из (R)-2-((3-амино-2-цианофенокси)метил)-N-трет-бутилпирролидин-1-карбоксамида (Пример 182a) с 56% выходом в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,27 (с, 9H), 1,89 (м, 4H), 3,21 (м, 1H), 4,02 (м, 1H), 4,19 (м, 1H), 4,34 (м, 1H), 5,35 (с, 1H), 6,62 (м, 1H), 6,86 (м, 1H), 7,46 (м, 1H), 8,23 (ушир.с, 1H), 8,25 (ушир.с, 1H), 10,91 (с, 1H). МС 396 (MH+).
Пример 182a: (R)-2-((3-Амино-2-цианофенокси)метил)-N-трет-бутилпирролидин-1-карбоксамид
Получают по методике примера 111b из (R)-2-((2-циано-3-нитрофенокси)метил)-N-трет-бутилпирролидин-1-карбоксамида (Пример 182b) с 96% выходом в виде твердого вещества белого цвета. МС 317 (MH+).
Пример 182b: (R)-2-((2-Циано-3-нитрофенокси)метил)-N-трет-бутилпирролидин-1-карбоксамид
Получают по методике примера 176b из хлорида (R)-2-((2-циано-3-нитрофенокси)метил)пирролидиния (Пример 176c) и трет-бутилизоцианата со 100% выходом в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,27 (с, 9H), 1,86 (м, 1H), 1,95 (м, 2H), 2,12 (м, 1H), 3,18 (м, 1H), 3,37 (м, 1H), 4,20 (м, 1H), 4,23 (дд, J=16,0, 6,3 Гц, 1H), 4,31 (дд, J=9,7, 2,7 Гц, 1H), 5,36 (с, 1H), 7,84 (дд, J=7,4, 0,9 Гц, 1H), 7,91 (м, 2H).
Пример 183: 4-Амино-5-(пентан-3-илокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(пентан-3-илокси)бензонитрила (Пример 183a) с 48,7% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,91 (т, J=7,6 Гц, 6H), 1,73 (м, 4H), 4,54 (м, 1H), 6,59 (дд, J=8,4, 1,2 Гц, 1H), 6,79 (д, J=8,0 Гц, 1H), 7,45 (т, J=8,4 Гц, 1H), 7,84 (ушир.д, J=2,8 Гц, 1H), 8,38 (ушир.д, J=1,6 Гц, 1H), 10,96 (с, 1H). МС 284 (MH+).
Пример 183a: 2-Сульфамоиламино-6-(пентан-3-илокси)бензонитрил:
Получают по методике примера 111a из 2-амино-6-(пентан-3-илокси)бензонитрила (Пример 183b) с 68,1% выходом. МС 284 (MH+).
Пример 183b: 2-Амино-6-(пентан-3-илокси)бензонитрил:
Получают по методике примера 111b из 2-нитро-6-(пентан-3-илокси)бензонитрила (Пример 183c) со 100% выходом. МС 205 (MH+).
Пример 183c: 2-Нитро-6-(пентан-3-илокси)бензонитрил:
Получают по методике примера 111c из пентан-3-ола и 2,6-динитробензонитрила с 86,5% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,94 (т, J=7,6 Гц, 6H), 1,70 (м, 4H), 4,62 (м, 1H), 7,78 (дд, J=7,2, 2,4 Гц, 1H), 7,88 (м, 2H).
Пример 184: (S)-4-Амино-5-(втор-бутокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из (S)-2-сульфамоиламино-6-втор-бутоксибензонитрила (Пример 184a) с 43,2% выходом.1H ЯМР (400 МГц, ДМСО-d6) 0,94 (т, J=7,6 Гц, 3H), 1,29 (д, J=6,4 Гц, 1H), 1,69 (м, 2H), 4,72 (м, 1H), 6,59 (дд, J=8,4, 1,2 Гц, 1H), 6,79 (д, J=8,0 Гц, 1H), 7,45 (т, J=8,4 Гц, 1H), 7,84 (ушир.д, J=2,8 Гц, 1H), 8,38 (ушир.д, J=1,6 Гц, 1H), 10,96 (с, 1H). МС 270 (MH+).
Пример 184a: (S)-2-Сульфамоиламино-6-втор-бутоксибензонитрил:
Получают по методике примера 111a из (S)-2-амино-6-втор-бутоксибензонитрила (Пример 184b) с 69,1% выходом. МС 270 (MH+).
Пример 184b: (S)-2-Амино-6-втор-бутоксибензонитрил:
Получают по методике примера 111b из (S)-2-втор-бутокси-6-нитробензонитрила (Пример 184c) со 100% выходом. МС 191(MH+).
Пример 184c: (S)-2-втор-Бутокси-6-нитробензонитрил:
Получают по методике примера 111c из (S)-бутан-2-ола и 2,6-динитробензонитрила с 85,2% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,94 (т, J=7,6 Гц, 3H), 1,29 (д, J=6,4 Гц, 1H), 1,69 (м, 2H), 4,72 (м, 1H), 7,74 (дд, J=6,8, 2,4 Гц, 1H), 7,86 (м, 1H).
Пример 185: (S)-4-Амино-5-(метоксипропокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид
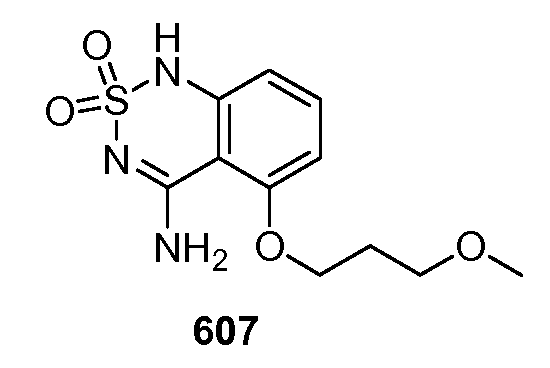
Получают по методике примера 111 из 2-сульфамоиламино-6-(3-метоксипропокси)бензонитрила (Пример 185a) с 69,3% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 2,03 (м, 2H), 3,23 (с, 3H), 3,50 (т, J=5,4 Гц, 2H), 4,18 (т, J=5,6 Гц, 2H), 6,58 (дд, J=8,0, 0,8 Гц, 1H), 6,70 (дд, J=8,4, 0,8 Гц, 1H), 7,43 (т, J=8,0 Гц, 1H), 78,22 (ушир.с, 1H), 8,31 (ушир.с, 1H), 10,90 (с, 1H). МС 286 (MH+).
Пример 185a: 2-Сульфамоиламино-6-(3-метоксипропокси)бензонитрил:
Получают по методике примера 111a из 2-амино-6-(3-метоксипропокси)бензонитрила (Пример 185b) с 69,7% выходом. МС 286 (MH+).
Пример 185b: 2-Амино-6-(3-метоксипропокси)бензонитрил:
Получают по методике примера 111b из 2-(3-метоксипропокси)-6-нитробензонитрила (Пример 185c) со 100% выходом. МС 207 (MH+).
Пример 185c: 2-(3-Метоксипропокси)-6-нитробензонитрил:
Получают по методике примера 111c из 3-метоксипропан-1-ола и 2,6-динитробензонитрила с 63,6% выходом.1H ЯМР (400 МГц, CDC13) δ 2,16 (м, 2H), 3,36 (с, 3H), 3,63 (т, J=5,6 Гц, 2H), 4,29 (т, J=6,4 Гц, 2H), 7,35 (дд, J=8,8, 0,8 Гц, 1H), 7,69 (т, J=8,8 Гц, 1H), (дд, J=8,4, 0,8 Гц, 1H).
Пример 186: (S)-4-Амино-5-(циклопропилметокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(циклопропилметокси)бензонитрила (Пример 186a) с 49,4% выходом. Т. пл.: 246-247°С.1H ЯМР (400 МГц, ДМСО-d6) δ 0,39 (м, 2H), 1,60 (м, 2H), 1,36 (м, 1H), 4,02 (д, J=7,2 Гц, 2H), 6,60 (дд, J=8,4, 0,8 Гц, 1H), 6,73 (д, J=8,4 Гц, 1H), 7,45 (т, J=8,8 Гц, 1H), 7,99 (ушир.д, J=1,6 Гц, 1H), 8,41 (ушир.д, J=1,6 Гц, 1H), 10,96 (ушир.с, 1H). МС 268 (MH+).
Пример 186a: 2-Сульфамоиламино-6-(циклопропилметокси)бензонитрил:
Получают по методике примера 111a из 2-амино-6-(циклопропилметокси)бензонитрила (Пример 186b) с 87,5% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,18 (м, 2H), 0,41 (м, 2H), 1,07 (м, 1H), 3,80 (д, J=7,2 Гц, 2H), 6,76 (д, J=8,0 Гц, 1H), 6,96 (д, J=7,6 Гц, 1H), 7,09 (ушир.с, 2H), 7,37 (т, 8,0 Гц, 1H). МС 268 (MH+).
Пример 186b: 2-Амино-6-(циклопропилметокси)бензонитрил:
Получают по методике примера 111b из 2-(циклопропилметокси)-6-бензонитрила (Пример 186c) со 100% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,35 (м, 2H), 0,58 (м, 2H), 1,23 (м, 1H), 3,86 (д, J=7,6 Гц, 2H), 5,98 (ушир.с, 2H), 6,20 (д, J=8,0 Гц, 1H), 6,32 (дд, J=8,8, 0,8 Гц, 1H), 7,17 (т, 8,8 Гц, 1H) МС 189 (MH+).
Пример 186c: 2-(Циклопропилметокси)-6-бензонитрил:
Получают по методике примера 111c из 2,6-динитробензонитрила и циклопропилметанола с 90% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,40 (м, 2H), 0,62 (м, 2H), 1,29 (м, 1H), 4,14 (д, J=7,2 Гц, 2H), 7,71 (дд, J=7,2, 1,2 Гц, 1H), 7,9 (м, 2H).
Пример 187: 4-Амино-5-(метокситетрагидро-2H-пиран-4-ил)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(тетрагидро-2H-пиран-4-ил)бензонитрила (Пример 187a) с 92% выходом в виде твердого вещества кремового цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,31 (м, 4H), 1,63 (ушир.м, 4H), 3,31 (ушир.м, 2H), 3,86 (ушир.м, 2H), 4,01 (д, J=6,8 Гц, 2H), 6,57 (д, J=8,4 Гц, 1H), 6,71 (д, J=8,0 Гц, 1H), 7,41 (т, J=8,0 Гц, 1H), 7,68 (ушир., 1H), 8,24 (с, 1H), 10,90 (ушир., 1H). МС 312 (MH+).
Пример 187a: 2-Сульфамоиламино-6-(тетрагидро-2H-пиран-4-ил)бензонитрил
Получают по методике примера 111a из 2-амино-6-((тетрагидро-2H-пиран-4-ил)метокси)бензонитрила (Пример 187b) с 51% выходом в виде твердого вещества оранжевого цвета.1Η ЯМР (400 МГц, ДМСО-d6) δ 1,35 (м, 2H), 1,66 (ушир., 2H), 2,01 (ушир., 1H), 3,32 (ушир., 2H), 3,87 (ушир.м, 2H), 3,96 (д, J=6,4 Гц, 2H), 6,92 (д, J=8,4 Гц, 1H), 7,12 (д, J=8,4 Гц, 1H), 7,19 (ушир.с, 2H), 7,52 (т, J=8,4 Гц, 1H), 9,44 (ушир.с, 1H).
Пример 187b: 2-Амино-6-((тетрагидро-2H-пиран-4-ил)метокси)бензонитрил
Получают по методике примера 111b из 2-нитро-6-((тетрагидро-2H-пиран-4-ил)метокси)бензонитрила (Пример 187c) с 80% выходом в виде твердого вещества желтого цвета.1H ЯМР (400МГц, ДМСО-d6) δ 1,32 (м, 2H), 1,64 (м, 2H), 1,97 (ушир., 1H), 3,31 (м, 2H), 3,86 (м, 4H), 5,97 (с, 2H), 6,19 (д, J=8,4 Гц, 1H), 6,31 (д, 1H), 7,15 (т, J=8,4 Гц, 1H).
Пример 187c: 2-Нитро-6-((тетрагидро-2H-пиран-4-ил)метокси)бензонитрил:
К раствору тетрагидропиран-4-метанола (782 мг, 6,73 ммоль) в ТГФ (25 мл) медленно добавляют 1,38 M nBuLi (4,13 мл, 5,70 ммоль) в гексане при -78°С в атмосфере азота. Через один час добавляют раствор 2,6-динитробензонитрила (1,00 г, 5,18 ммоль) в ТГФ (25 мл). Реакционную смесь перемешивают под N2 в течение ночи при КТ, затем гасят водой (100 мл). Осадок собирают фильтрацией с получением 2-нитро-6-((тетрагидро-2H-пиран-4-ил)метокси)бензонитрила (1,13 г, 83%) в виде твердого вещества светло-коричневого цвета.1H ЯМР (400МГц, ДМСО-d6) δ 1,68 (м, 2H), 2,06 (ушир., 1H), 3,33 (м, 2H), 3,88 (м, 2H), 4,11 (д, J=6,0 Гц, 2H), 7,72 (д, J=6,0 Гц, 1H), 7,89-7,85 (м, 2H).
Пример 188: 4-Амино-5-(метокситетрагидрофуран-3-ил)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид
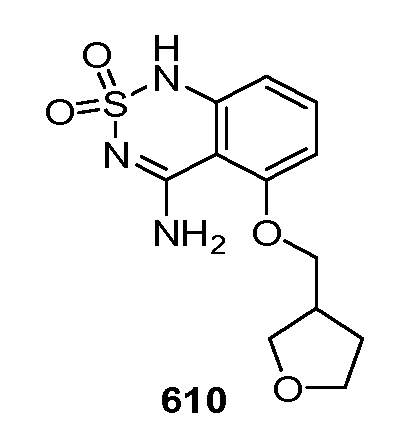
Получают по методике примера 111 из 2-сульфамоиламино-6-(метокситетрагидрофуран-3-ил)бензонитрила (Пример 188a) с 26% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,64 (м, 1H), 1,99 (м, 1H), 2,73 (м, 1H), 3,56 (м, 2H), 3,67 (м, 1H), 3,75 (м, 1H), 4,04 (м, 2H), 6,51 (д, J=8,4 Гц, 1H), 6,62 (д, J=8,4 Гц, 1H), 7,34 (т, J=8,0 Гц, 1H), 7,70 (ушир.с, 1H), 8,09 (ушир.с, 1H), 10,92 (ушир.с, 1H), МС 298 (M H+).
Пример 188a: 2-Сульфамоиламино-6-(метокситетрагидрофуран-3-ил)бензонитрил
Получают по методике примера 111a из 2-амино-6-((тетрагидрофуран-3-ил)метокси)бензонитрила (Пример 188b) с 14% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,62 (м, 1H), 1,96 (м, 1H), 2,43 (м, 1H), 2,61 (м, 1H), 3,48 (м, 1H), 3,60 (м, 1H), 3,71 (м, 2H), 3,99 (м, 2H), 6,90 (д, J=8,8 Гц, 1H), 7,09 (д, J=8,0 Гц, 1H), 7,19 (с, 1H), 7,49 (т, J=8,4 Гц, 1H), 9,42 (с, 1H).
Пример 188b: 2-Амино-6-((тетрагидрофуран-3-ил)метокси)бензонитрил:
Получают по методике примера 111b из 2-нитро-6-((тетрагидрофуран-3-ил)метокси)бензонитрила (Пример 188c) с 99% выходом в виде золотисто-коричневого масла. МС 219 (MH+).
Пример 188c: 2-Нитро-6-((тетрагидрофуран-3-ил)метокси)бензонитрил:
Получают по методике примера 166d из 2,6-динитробензонитрила и 3-гидроксиметилтетрагидрофурана с 48% выходом в виде твердого вещества оранжево-красного цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,68 (м, 1H), 2,00 (м, 1H), 2,70 (м, 1H), 3,54 (м, 1H), 3,66 (м, 1H), 3,76 (м, 2H), 4,03 (м, 1H), 4,19 (м, 1H), 7,73 (д, J=7,6 Гц, 1H), 7,90-7,95 (м, 2H).
Пример 189: 4-Амино-5-((тетрагидрофуран-2-ил)метокси)хиназолин-2(1H)-он

Получают по методике примера 111 из N-(2-циано-3-((тетрагидрофуран-2-ил)метокси)фенилкарбамоил)бензамида (Пример 189a) с 39% выходом.1H ЯМР (400 МГц, d-ДМСО) δ 1,65 (ушир.м, 1H), 1,85 (ушир.м, 2H), 1,99 (ушир.м, 1H), 3,71 (м, 2H), 3,78 (м, 1H), 3,98 (м, 1H), 6,70-6,67 (м, 2H), 7,42 (т, J=8,0 Гц, 1H), 7,62 (с, 1H), 7,88 (с, 1H), 10,62 (с, 1H).
Пример 189a: N-(2-Циано-3-((тетрагидрофуран-2-ил)метокси)фенилкарбамоил)бензамид
Получают по методике примера 146a из 2-амино-6-((тетрагидрофуран-2-ил)метокси)бензонитрила (Пример 189b) с 45% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, d-ДМСО) δ 1,98-1,74 (м, 4H), 3,54 (м, 1H), 3,69 (м, 1H), 4,20-4,07 (м, 3H), 6,97 (д, J=8,8 Гц, 1H), 7,67-7,51 (м, 4H).
Пример 189b: 2-Амино-6-((тетрагидрофуран-2-ил)метокси)бензонитрил
Получают по методике примера 111b из 2-нитро-6-((тетрагидрофуран-2-ил)метокси)бензонитрила (Пример 189c) с 92% выходом в виде прозрачного масла светло-голубого цвета.1H ЯМР (400 МГц, MeOD) δ 1,97-1,68 (м, 4H), 3,75-3,64 (м, 1H), 3,80-3,75 (м, 1H), 3,98-3,90 (м, 2H), 4,15-4,12 (м, 1H), 5,96 (с, 1H), 6,18 (д, J=8,0 Гц, 1H), 6,31 (д, J=8,0 Гц, 1H), 7,14 (т, J=8,4 Гц, 1H).
Пример 189c: 2-Нитро-6-((тетрагидрофуран-2-ил)метокси)бензонитрил:
Получают по методике примера 166d из 2,6-динитробензонитрила и тетрафурфурилового спирта с 68% выходом.1H ЯМР (400 МГц, MeOD) δ 2,10-1,70 (м, 7H), 3,68-3,66 (м, 1H), 3,80-3,78 (м, 1H), 4,29-4,20 (м, 3H), 7,72 (д, J=6,0 Гц, 1H), 7,90-7,84 (м, 2H).
Пример 190: 4-Амино-5-(2-метоксибензилокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(4-метоксибензилокси)бензонитрила (Пример 190a) с 85% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 3,81 (с, 3H), 5,25 (с, 2H), 6,59 (д, J=8,4 Гц, 1H), 6,86 (д, J=8,0 Гц, 1H), 6,96 (т, J=7,2 Гц, 1H), 7,09 (д, J=8,0 Гц, 1H), 7,37 (т, J=8,0 Гц, 1H), 7,46-7,42 (м, 2H), 7,91 (с, 1H), 8,31 (с, 1H), 10,96 (с, 1H). МС 334 (MH+).
Пример 190a: 2-Сульфамоиламино-6-(2-метоксибензилокси)бензонитрил
Получают по методике примера 111a из 2-амино-6-((тетрагидрофуран-2-ил)метокси)бензонитрила (Пример 190b) с 23% выходом.1H ЯМР (400 МГц, d-ДМСО) δ 3,80 (с, 3H), 6,88 (д, J=8,4 Гц, 1H), 6,88 (д, J=8,1 Гц 1H), 6,96 (т, J=7,6 Гц, 1H), 7,06 (д, J=8,0 Гц, 2H), 7,16 (д, J=8,4 Гц, 1H), 7,39-7,33 (м, 5H), 7,45 (д, J=7,2 Гц, 1H), 11,20 (с, 1H).
Пример 190b: 2-Амино-6-(2-метоксибензилокси)бензонитрил
Получают по методике примера 111b из 2-нитро-6-(2-метоксибензилокси)бензонитрила (пример 190c) с 56% выходом.1H ЯМР (400 МГц, MeOD) δ 3,79 (с, 3H), 5,04 (с, 2H), 6,30-6,26 (м, 2H), 7,06-6,94 (м, 3H), 7,33-7,28 (м, 3H), 7,54 (с, 1H).
Пример 190c: 2-Нитро-6-(2-метоксибензилокси)бензонитрил
Получают по методике примера 111c из 2,6-динитробензонитрила и 2-метоксибензилового спирта с 58% выходом.1H ЯМР (400 МГц, ДМСО) δ 3,82 (с, 3H), 5,34 (с, 2H), 6,99 (т, J=7,6 Гц, 1H), 7,08 (д, J=8,4 Гц, 1H), 7,37 (т, J=8,4 Гц, 1H), 7,46 (д, J=6,0 Гц, 1H), 7,81 (д, J=7,6 Гц, 1H), 7,93-7,87 (м, 2H).
Пример 191: 4-Амино-5-(метокситетрагидрофуран-2-ил)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид
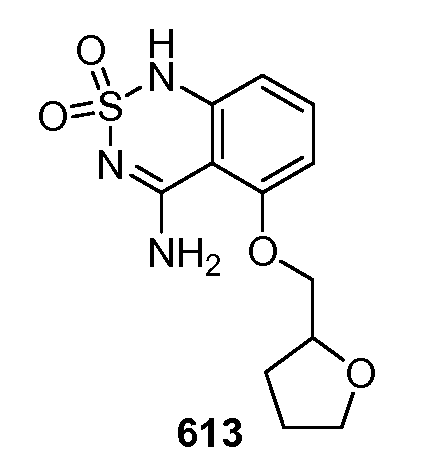
Получают по методике примера 111 из 2-сульфамоиламино-6-(метокситетрагидрофуран-2-ил)бензонитрила (Пример 191a) со 100% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,65 (м, 1H), 1,86 (м, 1H), 1,98 (м, 1H), 3,69 (м, 1H), 3,78 (м, 1H), 3,98 (м, 1H) 4,25 (м, 1H), 6,61 (д, J=7,2 Гц, 1H), 6,74 (д, J=8,0 Гц, 1H).
Пример 191a: 2-Сульфамоиламино-6-(метокситетрагидрофуран-2-ил)бензонитрил
Получают по методике примера 111a из 2-амино-6-((тетрагидрофуран-2-ил)метокси)бензонитрила (Пример 189b) с 79% выходом в виде твердого вещества светло-желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,02-1,68 (м, 2H), 3,66 (м, 1H), 3,81-3,76 (м, 1H), 4,20-4,03 (м, 3H), 6,93 (д, J=8,4 Гц, 1H), 7,12 (д, J=8,4 Гц, 1H), 7,23 (с, 1H), 7,53 (т, J=8,4 Гц, 1H), 9,34 (ушир.с, 1H).
Пример 192: 4-Амино-5-(фуран-3-илметокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(фуран-3-илметокси)бензонитрила (Пример 192a) с 45% выходом в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 5,11 (с, 2H), 6,54 (д, J=0,4 Гц, 1H), 6,56 (с, 1H), 6,80 (д, J=8,8 Гц, 1H), 7,39 (т, J=8,4 Гц, 1H), 7,64 (с, 1H), 7,74 (с, 1H), 7,81 (с, 1H), 8,23 (с, 1H), 10,90 (с, 1H). МС 294 (MH+).
Пример 192a: 2-Сульфамоиламино-6-(фуран-3-илметокси)бензонитрил
Получают по методике примера 111a из 2-амино-6-(фуран-3-илметокси)бензонитрила (Пример 192b) с 57% выходом в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, d-ДМСО) δ 5,04 (с, 2H), 6,62 (с, 1H), 6,88 (д, J=8,8 Гц, 1H), 7,15 (д, J=8,1, 0,8 Гц, 1H), 7,35 (д, J=8,8 Гц, 1H), 7,39-7,32 (м, 2H), 7,67 (с, 1H), 7,79 (с, 1H), 7,86 (с, 1H), 7,93 (с, 1H), 10,91 (с, 1H).
Пример 192b: 2-Амино-6-(фуран-3-илметокси)бензонитрил
Получают по методике примера 111b из 2-нитро-6-(фуран-3-илметокси)бензонитрила (Пример 192c) с 21% выходом в виде масла светло-желтого цвета.1H ЯМР (400 МГц, d-ДМСО) δ 4,92 (с, 2H), 6,31-6,26 (м, 2H), 6,59 (с, 1H), 6,99 (т, J=8,4 Гц, 1H), 7,27 (с, 1H), 7,45 (с, 1H), 7,66 (с, 1H), 7,76 (с, 1H).
Пример 192c: 2-Нитро-6-(фуран-3-илметокси)бензонитрил
Получают по методике примера 111c из 2,6-динитробензонитрила и 3-фуранметанола со 100% выходом.1H ЯМР (400 МГц, d-ДМСО) δ 5,27 (с, 2H), 6,59 (с, 1H), 7,69 (с, 1H), 7,91-7,84 (м, 4H).
Пример 193: 4-Амино-5-(3-метоксибензилокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(3-метоксибензилокси)бензонитрил (Пример 193a) с 54% выходом.1H ЯМР (400 МГц, d-ДМСО) δ 3,74 (с, 3H), 5,27 (с, 2H), 6,59 (д, J=8,0 Гц, 1H), 6,79 (д, J=8,0 Гц, 1H), 6,90 (д, J=8,0 Гц, 1H), 7,04 (д, J=7,2 Гц, 1H), 7,08 (с, 1H), 7,31 (т, J=8,4 Гц, 1H), 7,42 (т, J=8,0 Гц, 1H), 7,89 (ушир.с, 1H), 8,32 (ушир.с, 1H), 10,96 (ушир.с, 1H). МС 334 (MH+).
Пример 193a: 2-Сульфамоиламино-6-(3-метоксибензилокси)бензонитрил
Получают по методике примера 111a из 2-амино-6-(3-метоксибензилокси)бензонитрила (Пример 193b) с 17% выходом в виде твердого вещества белого цвета. МС 334 (MH+).
Пример 193b: 2-Амино-6-(3-метоксибензилокси)бензонитрил
К смеси 2-нитро-6-(3-метоксибензилокси)бензонитрила (Пример 193c) (480 мг, 1,69 ммоль) с 5:1 ацетоном:водой (9 мл) добавляют цинк (552 мг, 8,44 ммоль) и хлорид аммония (911 мг, 16,9 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут, затем фильтруют и концентрируют. Остаток очищают флэш-хроматографией (55:45 EtOAc:гексан) с получением 2-амино-6-(бензилокси)бензонитрила (337 мг, 78%).1H ЯМР (400 МГц, d-ДМСО) δ 3,73 (с, 3H), 5,04 (с, 1H), 6,27 (д, J=8,0 Гц, 1H), 6,31 (д, J=8,4 Гц, 1H), 7,06-6,97 (м, 3H), 7,27 (т, J=8,0 Гц, 1H), 7,36 (с, 1H), 7,55 (с, 1H).
Пример 193c: 2-(3-Метоксибензилокси)-6-нитробензонитрил
Получают по методике примера 111c из 2,6-динитробензонитрила и 3-метоксибензилового спирта с 83% выходом.1H ЯМР (400 МГц, d-ДМСО) δ 3,75 (с, 3H), 5,38 (с, 2H), 6,91 (д, J=8,0 Гц, 1H), 7,04 (д, J=7,6 Гц, 1H), 7,07 (с, 1H), 7,33 (т, J=8,0 Гц, 1H), 7,78 (д, J=8,8 Гц, 4H), 7,93-7,87 (м, 2H).
Пример 194: Хлорид 4-(2-(4-амино-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид-5-илокси)метил)пирролидиния
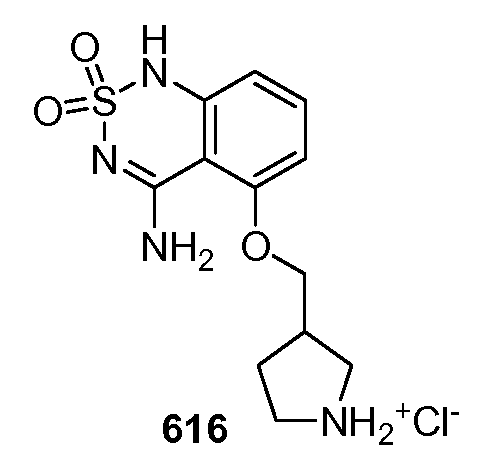
Получают по методике примера 166 из трет-бутил 3-(2-(4-амино-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид-5-илокси)метил)пирролидин-1-карбоксилата (Пример 194a) с 27% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,72 (м, 1H), 2,07 (м, 1H), 2,52 (м, 1H), 2,64 (м, 1H), 2,94-2,74 (м, 3H), 3,79 (м, 2H), 6,26 (д, J=8,0 Гц, 1H), 6,37 (д, J=8,8 Гц, 1H), 7,09 (т, J=8,0 Гц, 1H), 7,31 (ушир.с, 1H), 7,96 (ушир.с, 1H), 9,03 (ушир.с, 1H).
Пример 194a: трет-Бутил 3-(2-(4-амино-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид-5-илокси)метил)пирролидин-1-карбоксилат
Получают по методике примера 111 из трет-бутил-3-((2-циано-3-(сульфамоилметил)фенокси)метил)пирролидин-1-карбоксилата (Пример 194b) с 94% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,37 (с, 9H), 1,66 (ушир.м, 1H), 1,97 (ушир.м, 1H), 2,78 (ушир.м, 1H), 3,48-3,20 (ушир.м, 4H), 4,12 (ушир.м, 2H), 6,60 (д, J=8,0 Гц, 1H), 6,74 (д, J=8,4 Гц, 1H), 7,44 (т, J=8,4 Гц, 1H), 7,70 (с, 1H), 8,33 (с, 1H), 10,95 (с, 1H).
Пример 194b: трет-Бутил 3-((2-циано-3-(сульфамоиламино)фенокси)метил)пирролидин-1-карбоксилат
Получают по методике примера 111a из трет-бутил 3-((3-амино-2-цианофенокси)метил)пирролидин-1-карбоксилата (Пример 194c) с 47% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,37 (с, 9H), 1,70 (ушир., 1H), 1,97 (ушир., 1H), 2,63 (ушир., 1H), 3,47- 2,98 (ушир.м, 4H), 4,08 (ушир.м, 2H), 6,94 (д, J=8,8 Гц, 1H), 7,14 (д, J=8,4 Гц, 1H), 7,24 (с, 1H), 7,48 (с, 1H), 7,54 (т, J=8,0, 1H), 9,48 (ушир.с, 1H).
Пример 194c: трет-Бутил 3-((3-амино-2-цианофенокси)метил)пирролидин-1-карбоксилат
Получают по методике примера 111b из трет-бутил-((2-циано-3-нитрофенокси)метил)пирролидин-1-карбоксилата (Пример 194d) со 100% выходом в виде прозрачного масла.1H ЯМР (400МГц, ДМСО-d6) δ 1,37 (с, 9H), 1,69 (ушир., 1H), 1,96 (ушир., 1H), 2,59 (ушир., 1H), 3,07 (ушир., 1H), 3,23 (ушир., 1H), 3,35 (ушир., 1H), 3,40 (ушир., 1H), 3,96 (м, 2H), 5,98 (с, 2H), 6,20 (д, J=8,0 Гц, 1H), 6,32 (д, J=8,0 Гц, 1H), 7,15 (т, J=8,4 Гц, 1H).
Пример 194d: трет-Бутил-((2-циано-3-нитрофенокси)метил)пирролидин-1-карбоксилат
Получают по методике примера 166d из 2,6-динитробензонитрила и трет-бутил 3-(гидроксиметил)пирролидин-1-карбоксилата с 69% выходом в виде твердого вещества желтого цвета. МС 347 (MH+).
Пример 195: (R)-4-Амино-5-((1-ацетилпирролидин-2-ил)метокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид
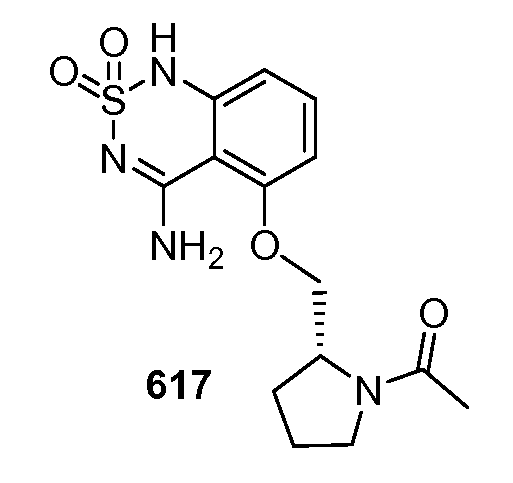
Получают по методике примера 176 из (R)-2-амино-6-((1-ацетилпирролидин-2-ил)метокси)бензонитрила (Пример 195a) с 31% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,90 (м, 4H), 2,00 (с, 3H), 3,49 (м, 2H), 4,09 (дд, J=9,7, 6,1 Гц, 1H), 4,24 (дд, J=9,8, 5,7 Гц, 1H), 4,41 (м, 1H), 6,62 (д, J=8,2 Гц, 1H), 6,87 (д, J=8,5 Гц, 1H), 7,46 (т, J=8,3 Гц, 1H), 8,12 (ушир.с, 1H), 8,33 (ушир.с, 1H), 10,93 (ушир.с, 1H). МС 339 (MH+).
Пример 195a: (R)-2-Амино-6-((1-ацетилпирролидин-2-ил)метокси)бензонитрил
Получают по методике примера 111b из (R)-2-((1-ацетилпирролидин-2-ил)метокси)-6-нитробензонитрила (Пример 195b) с 77% выходом в виде прозрачного сиропа. МС 260 (MH+).
Пример 195b: (R)-2-((1-Ацетилпирролидин-2-ил)метокси)-6-нитробензонитрил
Получают по методике примера 176b из хлорида (R)-2-((2-циано-3-нитрофенокси)метил)пирролидиния и ацетилхлорида со 100% выходом в виде сиропа желтого цвета. МС 290 (MH+).
Пример 196: 4-Амино-5-(метокси-3-пирролидин-1-пропионил)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-((1-пропионилпирролидин-3-ил)метоксибензонитрил (Пример 196a) с 29% выходом в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,95 (т, J=7,6 Гц, 3H), 1,66 (м, 1H), 1,77 (м, 1H), 1,97 (м, 1H), 2,05 (м, 1H), 2,21 (кв., J=8,0 Гц, 2H), 2,74 (м, 1H), 2,86 (м, 1H), 3,63-3,23 (м, 4H), 4,13 (м, 2H), 6,60 (д, J=8,0 Гц, 1H), 6,75 (д, J=8,4 Гц, 1H), 7,44 (т, J=8,0 Гц, 1H), 7,72 (с, 1H), 8,37-8,32 (м, 1H), 10,94 (с, 1H).
Пример 196a: 2-Сульфамоиламино-6-((1-пропионилпирролидин-3-ил)метоксибензонитрил
Получают по методике примера 111a из 2-амино-6-((1-пропионилпирролидин-3-ил)метокси)бензонитрила (Пример 196b) с 27% выходом в виде твердого вещества белого цвета. МС 353 (MH+).
Пример 196b: 2-Амино-6-((1-пропионилпирролидин-3-ил)метокси)бензонитрил:
Получают по методике примера 111b из 2-нитро-6-((1-пропионилпирролидин-3-ил)метокси)бензонитрила (Пример 196c) со 100% выходом в виде прозрачного масла. МС 274 (MH+).
Пример 196c: 2-Нитро-6-((1-пропионилпирролидин-3-ил)метокси)бензонитрил:
Получают по методике примера 176b из гидрохлорида 2-нитро-6-(пирролидин-3-илметокси)бензонитрила (Пример 196d) и пропионилхлорида с 51% выходом в виде твердого вещества желтого цвета. МС 304 (MH+).
Пример 196d: Гидрохлорид 2-нитро-6-(пирролидин-3-илметокси)бензонитрил:
Получают по методике примера 166 из трет-бутил-((2-циано-3-нитрофенокси)метил)пирролидин-1-карбоксилата (Пример 194d) со 100% выходом в виде твердого вещества желтого цвета. МС 248 (MH+).
Пример 197: 4-Амино-5-(метокси-3-пирролидин-1-бутирил)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-((1-бутирилпирролидин-3-ил)метоксибензонитрила (Пример 197a) с 73% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,86 (т, J=7,6 Гц, 3H), 1,48 (кв., J=7,6 Гц, 2H), 1,65 (м, 1H), 1,76 (м, 1H), 1,97 (м, 1H), 2,05 (м, 1H), 2,17 (т, J=7,2 Гц, 2H), 2,74 (м, 1H), 2,85 (м, 1H), 3,10 (м, 1H), 3,64- 3,23 (м, 4H), 4,12 (м, 1H), 6,60 (д, J=8,0 Гц, 1H), 6,75 (д, J=8,8 Гц, 1H), 7,44 (т, J=8,4 Гц, 1H), 7,71 (с, 1H), 8,35-8,32 (м, 1H), 10,94 (с, 1H).
Пример 197a: 2-Сульфамоиламино-6-((1-бутирилпирролидин-3-ил)метоксибензонитрил:
Получают по методике примера 111a из 2-амино-6-((1-бутирилпирролидин-3-ил)метокси)бензонитрила (Пример 197b) с 19% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,85 (т, J=7,6 Гц, 3H), 1,48 (кв., J=7,6 Гц, 2H), 2,13-1,64 (м, 2H), 2,17 (м, 2H), 2,75-2,53 (м, 2H), 3,65-3,18 (м, 4H), 4,09 (м, 2H), 6,94 (м, 1H), 7,13 (м, 1H), 7,25 (с, 1H), 7,54 (м, 1H), 9,45 (м, 1H).
Пример 197b: 2-Амино-6-((1-бутирилпирролидин-3-ил)метокси)бензонитрил:
Получают по методике примера 111b из 2-нитро-6-((1-бутирилпирролидин-3-ил)метокси)бензонитрила (Пример 197c) со 100% выходом в виде масла коричневого цвета. МС 288 (MH+).
Пример 197c: 2-Нитро-6-((1-бутирилпирролидин-3-ил)метокси)бензонитрил:
Получают по методике примера 176b из гидрохлорида 2-нитро-6-(пирролидин-3-илметокси)бензонитрила (Пример 196d) и бутирилхлорида со 100% выходом в виде твердого вещества оранжевого цвета. МС 318 (MH+).
Пример 198: (E)-4-Амино-5-(1-(пропилкарбамоил)циклопропилметокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 1-((2-циано-3-(сульфамоиламино)фенокси)метил)-N-пропилциклопропанкарбоксамида (Пример 198a) с 94% выходом в виде твердого вещества белого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 10,95 (ушир.с, 1H), 8,35 (ушир.с, 1H), 7,95 (ушир.с, 1H), 7,76 (т, J=5,2 Гц, 1H), 7,45 (т, J=8,0 Гц, 1H), 6,69 (д, J=8,8 Гц, 1H), 6,61 (д, J=7,6 Гц, 1H), 4,22 (с, 2H), 3,01 (кв., J=6,4 Гц, 2H), 1,40 (гекс, J=6,8 Гц, 2H), 1,12-1,18 (м, 2H), 0,88-0,95 (м, 2H), 0,80 (т, J=7,6 Гц, 3H). МС 353 (MH+).
Пример 198a: 1-((2-Циано-3-(сульфамоиламино)фенокси)метил)-N-пропилциклопропанкарбоксамид
Получают по методике примера 111a из 1-((3-амино-2-цианофенокси)метил)-N-пропилциклопропанкарбоксамида (Пример 198b) и сульфамоилхлорида с 78% выходом в виде твердого вещества белого цвета.1H-ЯМР (400 МГц, DMCO-d6) δ 9,45 (ушир.с, 1H), 7,51-7,61 (м, 2H), 7,26 (ушир.с, 2H), 7,16 (д, J=8,0 Гц, 1H), 6,91 (д, J=8,4 Гц, 1H), 4,24 (с, 2H), 3,04 (кв., J=6,4 Гц, 2H), 1,43 (гекс, J=7,6 Гц, 2H), 1,08-1,14 (м, 2H), 0,83-0,88 (м, 2H), 0,82 (т, J=7,2 Гц, 3H).
Пример 198b: 1-((3-Амино-2-цианофенокси)метил)-N-пропилциклопропанкарбоксамид
Раствор 1-(гидроксиметил)-N-пропилциклопропанкарбоксамида (Пример 198c) (0,67 г, 4,25 ммоль) в безводном ТГФ (10 мл) обрабатывают NaH (0,17 г, 4,25 ммоль, 60% суспензия в минеральном масле) при 0°С в атмосфере азота. Полученную смесь перемешивают при 0°С в течение 10 мин и при КТ в течение 30 мин. Затем добавляют раствор 2-амино-6-фторбензонитрила (0,53 г, 3,86 ммоль) в ТГФ (5,0 мл), и полученную смесь нагревают до кипения с обратным холодильником в течение ночи. Холодную смесь гасят насыщенным водным раствором NH4Cl (20 мл) и экстрагируют EtOAc (3×50 мл). Объединенный экстракт промывают насыщенным раствором соли, сушат над безводным MgSO4, фильтруют и выпаривают. Остаток очищают хроматографией на силикагеле с применением градиента гексан → гексан/EtOAc (4:6), с получением 0,75 г (71%) указанного в заголовке соединения в виде твердого вещества желтого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 7,51 (т, J=6,0 Гц, 1H), 7,17 (т, J=8,0 Гц, 1H), 6,34 (д, J=8,4 Гц, 1H), 6,19 (д, J=8,4 Гц, 1H), 5,97 (ушир.с, 2H), 4,13 (с, 2H), 3,04 (кв., J=6,4 Гц, 2H), 1,43 (гекс, J=6,8 Гц, 2H), 1,05-1,11 (м, 2H), 0,78-0,86 (м, 5H).
Пример 198c: 1-(гидроксиметил)-N-пропилциклопропанкарбоксамид
К раствору этил 1-(пропилкарбамоил)циклопропанкарбоксилата (Пример 198d) (1,65 г, 8,27 ммоль) в EtOH (70 мл) добавляют NaBH4 (0,97 г, 25,64 ммоль) при КТ. Полученную смесь перемешивают при КТ в течение 2 дней, гасят 1,5M HCl и концентрируют при пониженном давлении. Концентрированную смесь экстрагируют EtOAc (4×70 мл), объединенный экстракт промывают насыщенным NaHCO3 и насыщенным раствором соли, и сушат над MgSO4. Фильтрат выпаривают и остаток очищают хроматографией на силикагеле с применением градиента растворителя гексан → гексан/EtOAc (1:9) с получением 1,14 г (88%) продукта в виде твердого вещества белого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 7,49 (ушир.с, 1H), 5,09 (ушир.с, 1H), 3,49 (с, 2H), 3,05 (кв., J=6,4 Гц, 2H), 1,41 (гекс, J=7,6 Гц, 2H), 0,86-0,91 (м, 2H), 0,83 (т, J=7,2 Гц, 3H), 0,55-0,60 (м, 2H).
Пример 198d: Этил 1-(пропилкарбамоил)циклопропанкарбоксилат
К раствору 1-(этоксикарбонил)циклопропанкарбоновой кислоты (Wheeler, T. N.; Ray, J. A. Synthetic Communications 1988, 18(2), 141) (1,52 г, 9,62 ммоль) и н-пропиламина (0,63 г, 10,58 ммоль) в безводном ДМФ (65 мл) при КТ добавляют NaHCO3 (4,04 г, 48,11 ммоль), гидрохлорид N-(3-диметиламинопропил)-N′-этилкарбодиимида (2,21 г, 11,54 ммоль) и гидрат 1-гидроксибензотриазола (1,77 г, 11,54 ммоль) в атмосфере азота. После перемешивания при КТ в течение ночи смесь разделяют между водой (100 мл) и EtOAc (300 мл). Органическую фазу отделяют, промывают водой и насыщенным раствором соли, и сушат над безводным MgSO4. Фильтрат выпаривают с получением 1,65 г (86%) неочищенного продукта, который применяют на следующей стадии без очистки.1H-ЯМР (400 МГц, ДМСО-d6) δ 8,33 (ушир.с, 1H), 4,08 (кв., J=6,8 Гц, 2H), 3,07 (кв., J=6,4 Гц, 2H), 1,43 (гекс, J=6,4 Гц, 2H), 1,31 (с, 4H), 1,17 (т, J=6,4 Гц, 3H), 0,85 (т, J=7,2 Гц, 3H).
Пример 199: (Е)-4-Амино-5-(4-метоксибут-2-енилокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(4-метоксибут-2-енилокси)бензонитрила (Пример 199a) с 91% выходом в виде твердого вещества белого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 10,94 (ушир.с, 1H), 8,34 (ушир.с, 1H), 7,90 (ушир.с, 1H), 7,45 (т, J=8,4 Гц, 1H), 6,75 (д, J=7,6 Гц, 1H), 6,61 (д, J=8,0 Гц, 1H), 5,88-6,02 (м, 2H), 4,75-4,81 (м, 2H), 3,88-3,93 (м, 2H), 3,22 (с, 3H). МС 298 (MH+).
Пример 199a: 2-Сульфамоиламино-6-(4-метоксибут-2-енилокси)бензонитрил
Получают по методике примера 111a из (Е)-2-амино-6-(4-метоксибут-2-енилокси)бензонитрила (Пример 199b) с 93% выходом в виде твердого вещества белого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 9,46 (ушир.с, 1H), 7,56 (т, J=8,4 Гц, 1H), 7,26 (ушир.с, 2H), 7,15 (д, J=8,0 Гц, 1H), 6,96 (д, J=8,8 Гц, 1H), 5,84-6,00 (м, 2H), 4,68-4,76 (м, 2H), 3,89-3,95 (м, 2H), 3,23 (с, 3H).
Пример 199b: (Е)-2-Амино-6-(4-метоксибут-2-енилокси)бензонитрил
К раствору (Е)-2-(4-метоксибут-2-енилокси)-6-нитробензонитрила (Пример 199c) (0,25 г, 1,00 ммоль) в смеси AcOH, EtOH и воды (33 мл, 1:1:1) добавляют порошок железа (0,56 г, 10,00 ммоль) при КТ. Полученную смесь перемешивают при КТ в течение 20 мин, затем нагревают до 50°С в течение еще 15 мин и охлаждают. Суспензию концентрируют при пониженном давлении; остаток обрабатывают водой (50 мл) и экстрагируют EtOAc (4×50 мл). Объединенный экстракт промывают насыщенным водным NaHCO3 и насыщенным раствором соли и сушат над безводным MgSO4. Фильтрат выпаривают и остаток очищают флэш-хроматографией на силикагеле с применением градиента гексан → гексан/EtOAc (1:1), с получением 0,19 г (86%) указанного в заголовке соединения в виде твердого вещества белого цвета.1H-ЯМР (400 МГц, ДМСО-d6) 7,17 (т, J=8,4 Гц, 1H), 6,34 (д, J=8,8 Гц, 1H), 6,22 (д, J=8,4 Гц, 1H), 6,00 (ушир.с, 2H), 5,82-5,96 (м, 2H), 4,56-4,62 (м, 2H), 3,88-3,93 (м, 2H), 3,23 (с, 3H).
Пример 199c: (Е)-2-(4-Метоксибут-2-енилокси)-6-нитробензонитрил
К раствору (Е)-2-(4-гидроксибут-2-енилокси)-6-нитробензонитрила (Пример 199d) (0,50 г, 2,13 ммоль) и 2,6-ди-трет-бутил-4-метилпиридина (2,18 г, 10,65 ммоль) в CH2Cl2 (15,0 мл) при КТ добавляют тетрафторборат триметилоксония (1,58 г, 10,65 ммоль) в атмосфере азота. Через 1 ч при КТ реакция гасят водой (50 мл) и экстрагируют EtOAc (4×50 мл). Объединенный экстракт промывают водой, 1,5M HCl, насыщенным водным NaHCO3 и насыщенным раствором соли и сушат над безводным MgSO4. Фильтрат выпаривают и остаток очищают хроматографией на силикагеле с применением градиента растворителя гексан → гексан/EtOAc (3:7), с получением 0,25 г (72%) указанного в заголовке соединения в виде твердого вещества желтого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 7,84-7,92 (м, 2H), 7,68-7,73 (м, 1H), 5,82-6,03 (м, 2H), 4,82-4,88 (м, 2H), 3,87-3,93 (м, 2H), 3,21 (с, 3H).
Пример 199d: (Е)-2-(4-Гидроксибут-2-енилокси)-6-нитробензонитрил
Получают по методике примера 166d из (Е)-бут-2-ен-1,4-диола (Miller, A. E. G.; Biss, J. W.; Schwartzman, L. H. J. Org. Chem. 1959, 24, 627 с 30% выходом в виде твердого вещества желтого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 7,83-7,94 (м, 2H), 7,67-7,74 (м, 1H), 5,97-6,07 (м, 1H), 5,78-5,89 (м, 1H), 4,80-89 (м, 3H), 3,94-4,02 (м, 2H).
Пример 200: 4-Амино-5-(2-(гидроксиметил)аллилокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из ацетата 2-((2-циано-3-(сульфамоиламино)фенокси)метил)аллила (Пример 200a) с 44% выходом в виде твердого вещества белого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 10,95 (ушир.с, 1H), 8,34 (ушир.с, 1H), 8,01 (ушир.с, 1H), 7,45 (т, J=8,0 Гц, 1H), 6,76 (д, J=8,4 Гц, 1H), 6,61 (д, J=8,0 Гц, 1H), 5,26 (с, 1H), 5,20 (с, 1H), 5,14 (т, J=5,2 Гц, 1H), 4,78 (с, 2H), 4,03 (д, J=5,2 Гц, 2H). МС 284 (MH+).
Пример 200a: ацетат 2-((2-Циано-3-(сульфамоиламино)фенокси)метил)аллила
Получают по методике примера 111a из ацетата 2-((3-амино-2-цианофенокси)метил)аллила (Пример 200b) с 87% выходом в виде твердого вещества белого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 9,50 (ушир.с, 1H), 7,57 (т, J=8,4 Гц, 1H), 7,28 (ушир.с, 2H), 7,17 (д, J=8,0 Гц, 1H), 6,97 (д, J=8,4 Гц, 1H), 5,39 (ушир.с, 1H), 5,33 (ушир.с, 1H), 4,74 (с, 2H), 4,63 (с, 2H), 2,05 (с, 3H).
Пример 200b: ацетат 2-((3-Амино-2-цианофенокси)метил)аллила
Получают по методике примера 199b из ацетата 2-((2-циано-3-нитрофенокси)метил)аллила (Пример 200c) с 76% выходом в виде масла желтого цвета.1H-ЯМР (400 МГц, DMCO-d6) δ 7,18 (т, J=8,4 Гц, 1H), 6,35 (д, J=8,8 Гц, 1H), 6,23 (д, J=8,0 Гц, 1H), 6,03 (ушир.с, 2H), 5,34-5,38 (м, 1H), 5,28-5,31 (м, 1H), 4,61 (с, 4H), 2,05 (с, 3H).
Пример 200c: ацетат 2-((2-Циано-3-нитрофенокси)метил)аллила
К раствору 2-(2-(гидроксиметил)аллилокси)-6-нитробензонитрила (Пример 200d) (0,40 г, 1,73 ммоль), 4-диметиламинопиридина (0,21 г, 1,73 ммоль) и пиридина (0,68 г, 8,64 ммоль) в CH2Cl2 (10,0 мл) при 0°С, добавляют Ac2O (0,53 г, 5,19 ммоль) в атмосфере азота. После перемешивания при 0°С в течение 10 мин смесь перемешивают при КТ в течение ночи. Реакционную смесь разбавляют EtOAc (100 мл), промывают 1,5M HCl, насыщенным водным NaHCO3 и насыщенным раствором соли и сушат над MgSO4. Фильтрат выпаривают и остаток очищают хроматографией на силикагеле с применением градиента растворителя гексан → гексан/EtOAc (3:7), с получением 0,40 г (84%) указанного в заголовке соединения в виде твердого вещества желтого цвета.1H-ЯМР (400 МГц, ДМСО-d6) δ 7,95 (дд, J=8,4 Гц, J=1,2 Гц, 1H), 7,91 (т, J=8,4 Гц, 1H), 7,74 (дд, J=8,4 Гц, J=1,2 Гц, 1H), 5,43-5,46 (м, 1H), 5,36-5,40 (м, 1H), 4,90 (с, 2H), 4,66 (с, 2H), 2,05 (с, 3H).
Пример 200d: 2-(2-(Гидроксиметил)аллилокси)-6-нитробензонитрил
Получают по методике примера 166d из 2,6-динитробензонитрила и 2-метиленпропан-1,3-диола с 55% выходом в виде твердого вещества белого цвета.1H-ЯМР (400 МГц, ДМСО-d5) δ 7,93 (дд, J=8,4 Гц, J=0,8 Гц, 1H), 7,89 (т, J=8,0 Гц, 1H), 7,73 (дд, J=7,6 Гц, J=0,8 Гц, 1H), 5,23-5,29 (м, 2H), 5,03 (т, J=5,6 Гц, 1H), 4,85 (с, 2H), 4,06 (д, J=5,2 Гц, 2H). |ΠατΑππ1009_Λ1|ΖΖΜΠΤΑΓ|
Пример 201: 4-Амино-5-(4,5-дигидрофуран-2-ил)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид
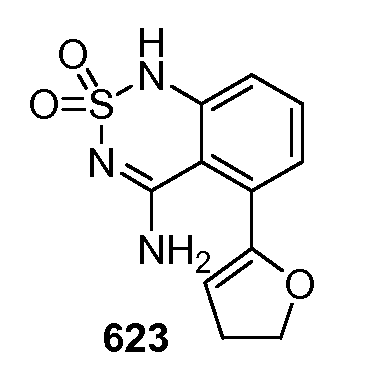
Получают по методике примера 111 из 2-сульфамоиламино-6-(4,5-дигидрофуран-2-ил)бензонитрила (Пример 201a) с 31% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,75-2,81 (м, 2H), 4,43 (т, J=9,2 Гц, 2H), 5,35-5,36 (м, 1H), 7,07 (дд, J=1,2, 8,0 Гц, 1H), 7,12 (дд, J=1,2, 7,2 Гц, 1H), 7,50-7,54 (м, 1H), 8,2-8,4 (ушир.с, 1H), 11,09 (с, 1H). МС 266 (MH+).
Пример 201a: 2-сульфамоиламино-6-(4,5-дигидрофуран-2-ил)бензонитрил
Получают по методике примера 111a из 2-амино-6-(4,5-дигидрофуран-2-ил)бензонитрила (Пример 201b) с 19% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,82-2,88 (м, 2H), 4,45 (т, J=9,6 Гц, 2H), 5,89 (т, J=3,2 Гц, 1H), 7,29 (с, 2H), 7,47 (д, J=7,2 Гц, 1H), 7,56 (д, J=7,6 Гц, 1H), 7,67 (т, J=8,0 Гц, 1H), 9,42 (с, 1H). МС 266 (MH+).
Пример 201b: 2-амино-6-(4,5-дигидрофуран-2-ил)бензонитрил
2-Амино-6-бромбензонитрил (0,75 г, 3,81 ммоль), (4,5-дигидрофуран-2-ил)тирметилстаннан (Menez, P.; Fargeas, V.; Poisson, J.; Ardisson, J.; Lallemand, J.-Y.; Pancrazi, A. Тетраhedron Letters 1994, 35(42), 7767) (1,02 г, 4,38 ммоль), и тетракис(трифенилфосфин) палладий (0,33 г, 0,28 ммоль) кипятят с обратным холодильником в толуоле (10,0 мл) в атмосфере азота в течение 1,5 ч. Добавляют насыщенный хлорид аммония (12 мл) и гидроксид аммония (4 мл), и смесь экстрагируют EtOAc. Органический слой концентрируют в вакууме и остаток очищают хроматографией на силикагеле с применением 35% EtOAc/гексана с получением 0,48 г (68%) указанного в заголовке соединения в виде масла желтого цвета.1H ЯМР (400 МГц, ацетон-d6) δ 2,78-2,83 (м, 2H), 4,40 (т, J=9,2 Гц, 2H), 5,76 (т, J=12 Гц, 1H), 6,04 (с, 2H), 6,77-6,80 (м, 2H), 7,28 (т, J=8,0 Гц, 1H). МС 187 (MH+).
Пример 202: 4-Амино-5-(тетрагидрофуран-2-ил)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(тетрагидрофуран-2-ил)бензонитрила (Пример 202a) с 52% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,94-2,05 (м, 3H), 2,21-2,28 (м, 1H), 3,81-3,87 (м, 1H), 3,92-3,97 (м, 1H), 5,23-5,27 (м, 1H), 7,02 (д, J=8,0 Гц, 1H), 7,30 (д, J=7,6 Гц, 1H), 7,51 (т, J=7,6 Гц, 1H), 7,9-8,5 (ушир., 2H), 10,94 (с, 1H). МС 268 (MH+).
Пример 202a: 2-Сульфамоиламино-6-(тетрагидрофуран-2-ил)бензонитрил
2-Амино-6-(4,5-дигидрофуран-2-ил)бензонитрил (Пример 202b) (0,24 г, 1,28 ммоль), 10% Pd/C (0,24 г) и формиат аммония (2,40 г, 38,1 ммоль) кипятят с обратным холодильником в MeOH (25 мл) в атмосфере азота в течение 1,5 ч. Нерастворимые твердые вещества отфильтровывают и отбрасывают, и растворитель удаляют в вакууме. Полученный остаток растворяют в EtOAc, промывают насыщенным Na2CO3 и насыщенным раствором соли, сушат над MgSO4 и концентрируют в вакууме. Остаток растворяют в безводном ДМА (2,0 мл) и обрабатывают сульфамоилхлоридом (0,11 г, 0,97 ммоль). Реакционную смесь перемешивают в атмосфере азота в течение 30 минут, гасят водой (5,0 мл) и экстрагируют EtOAc (3×50 мл). Объединенный экстракт сушат над MgSO4, фильтруют и концентрируют в вакууме. Неочищенный продукт очищают преп-ТСХ на силикагеле с применением 65% EtOAc/гексана с получением 45,0 мг (13%) указанного в заголовке соединения в виде твердого вещества белого цвета.1H ЯМР (400 МГц, Ацетон-d6) δ 1,71-1,78 (м, 1H), 2,02-2,07 (м, 2H), 2,45-2,52 (м, 1H), 3,90-3,95 (м, 1H), 4,10-4,15 (м, 1H), 5,08 (т, J=6,8 Гц, 1H), 6,6-6,8 (ушир., 2H), 7,36-7,39 (м, 1H), 7,62-7,63 (м, 2H), 8,22 (ушир.с, 1H). МС 268 (MH+).
Пример 203: 4-Амино-5-(3-(пиридин-2-ил)пропокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид
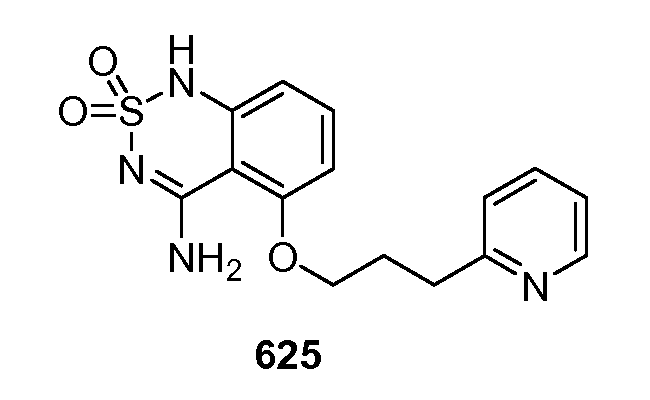
Получают по методике примера 111 из 2-сульфамоиламино-6-(3-(пиридин-2-ил)пропокси)бензонитрила (Пример 203a) с 58% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,37 (квинт, J=6,8 Гц, 2H), 2,89 (т, J=7,2 Гц, 2H), 4,19 (т, J=6,0 Гц, 2H), 6,60 (д, J=8,4 Гц, 1H), 6,73 (д, J=8,8 Гц, 1H), 7,19-7,22 (м, 1H), 7,29 (д, J=8,0 Гц, 1H), 7,44 (т, J=8,4 Гц, 1H), 7,68-7,72 (м, 1H), 7,92 (с, 1H), 8,36 (с, 1H), 8,49 (д, J=4,0 Гц, 1H), 10,94 (ушир.с, 1H). МС 333 (MH+).
Пример 203a: 2-Сульфамоиламино-6-(3-(пиридин-2-ил)пропокси)бензонитрил
Получают по методике примера 111a из 2-амино-6-(3-(пиридин-2-ил)пропокси)бензонитрила (Пример 203b) с 97% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,15 (квинт, J=6,4 Гц, 2H), 2,92 (т, J=7,6 Гц, 2H), 4,15 (т, J=6,0 Гц, 2H), 6,93 (д, J=8,4 Гц, 1H), 7,14 (д, J=8,4 Гц, 1H), 7,20-7,29 (м, 4H), 7,55 (т, J=8,4 Гц, 1H), 7,68-7,72 (м, 1H), 8,48 (д, J=4,8 Гц, 1H), 9,49 (ушир.с, 1H). МС 333 (MH+).
Пример 203b: 2-Амино-6-(3-(пиридин-2-ил)пропокси)бензонитрил
Получают по методике примера 199b из 2-нитро-6-(3-(пиридин-2-ил)пропокси)бензонитрил (Пример 203c) с 85% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,12 (квинт, J=6,8 Гц, 2H), 2,90 (т, J=7,2 Гц, 2H), 4,02 (т, J=6,4 Гц, 2H), 5,99 (с, 2H), 6,18 (д, J=8,0 Гц, 1H), 6,33 (д, J=8,8 Гц, 1H), 7,14-7,22 (м, 2H), 7,26 (д, J=8,0 Гц, 1H), 7,67-7,71 (м, 1H), 8,49 (д, J=3,6 Гц, 1H). МС 254 (MH+).
Пример 203c: 2-Нитро-6-(3-(пиридин-2-ил)пропокси)бензонитрил
Получают по методике примера 187c из 3-(пиридин-2-ил)пропан-1-ол 2,6-динитробензонитрила с 86% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,21 (квинт, J=6,4 Гц, 2H), 2,95 (т, J=7,2 Гц, 2H), 4,31 (т, J=6,4 Гц, 2H), 7,19-7,22 (м, 1H), 7,28 (д, J=7,6 Гц, 1H), 7,67-7,74 (м, 2H), 7,86-7,92 (м, 2H), 8,48 (д, J=4,8 Гц, 1H). МС 284 (MH+).
Пример 204: 4-Амино-5-(2-(пиридин-2-ил)этокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(2-(пиридин-2-ил)этокси)бензонитрила (Пример 204a) с 22% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 3,29 (т, J=5,6 Гц, 2H), 4,46 (т, J=5,6 Гц, 2H), 6,59 (д, J=8,0 Гц, 1H), 6,75 (д, J=8,8 Гц, 1H), 7,28-7,31 (м, 1H), 7,40-7,46 (м, 2H), 7,75-7,80 (м, 1H), 8,33-8,52 (м, 3H), 10,91 (с, 1H). МС 319 (MH+).
Пример 204a: 2-Сульфамоиламино-6-(2-(пиридин-2-ил)этокси)бензонитрил
Получают по методике примера 111a из 2-амино-6-(2-(пиридин-2-ил)этокси)бензонитрила (Пример 204b) с 67% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 3,22 (т, J=6,4 Гц, 2H), 4,48 (т, J=6,4 Гц, 2H), 7,00 (д, J=8,8 Гц, 1H), 7,14 (д, J=8,4 Гц, 1H), 7,23-7,26 (м, 3H), 7,39 (д, J=7,6 Гц, 1H), 7,55 (т, J=8,4 Гц, 1H), 7,73 (т, J=7,2 Гц, 1H), 8,51 (д, J=4,4 Гц, 1H), 9,42 (с, 1H). МС 319 (MH+).
Пример 204b: 2-Амино-6-(2-(пиридин-2-ил)этокси)бензонитрил
Получают по методике примера 2b из 2-нитро-6-(2-(пиридин-2-ил)пропокси)бензонитрила (Пример 221c) с 60% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 3,18 (т, J=6,8 Гц, 2H), 4,36 (т, J=6,8 Гц, 2H), 5,97 (с, 2H), 6,25 (д, J=8,4 Гц, 1H), 6,32 (д, J=8,4 Гц, 1H), 7,17 (т, J=8,0 Гц, 1H), 7,22-7,26 (м, 1H), 7,37 (д, J=8,0 Гц, 1H), 7,70-7,75 (м, 1H), 8,51 (д, J=4,4 Гц, 1H). МС 240 (MH+).
Пример 204c: 2-Нитро-6-(2-(пиридин-2-ил)этокси)бензонитрил
Получают по методике примера 187c из 2-(пиридин-2-ил)этанола и 2,6-динитробензонитрила с 82% выходом в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 3,27 (т, J=6,4 Гц, 2H), 4,64 (т, J=6,4 Гц, 2H), 7,23-7,27 (м, 1H), 7,41 (д, J=8,0 Гц, 1H), 7,71-7,79 (м, 2H), 7,86-7,91 (м, 2H), 8,50-8,52 (м, 1H). МС 270 (MH+).
Пример 205: 4-Амино-5-((5-метилизоксазол-3-ил)метокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид
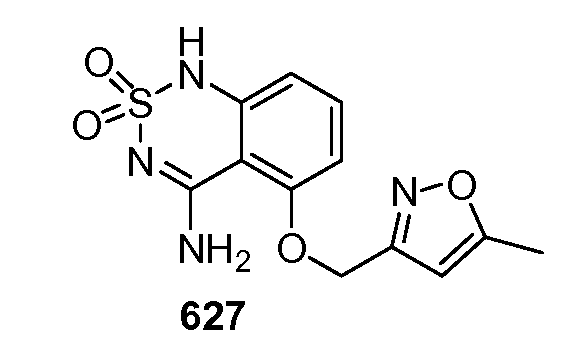
Получают по методике примера 111 из 2-сульфамоиламино-6-((5-метилизоксазол-3-ил)метокси)бензонитрила (Пример 205a) с 83% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,42 (с, 3H), 5,40 (с, 2H), 6,36 (с, 1H), 6,65 (д, J=8,4 Гц, 1H), 6,81 (д, J=8,4 Гц, 1H), 7,48 (т, J=8,4 Гц, 1H), 8,06 (с, 1H), 8,40 (с, 1H), 11,02 (с, 1H). МС 309 (MH+).
Пример 205a: 2-Сульфамоиламино-6-((5-метилизоксазол-3-ил)метокси)бензонитрил
Получают по методике примера 111a из 2-амино-6-((5-метилизоксазол-3-ил)метокси)бензонитрила (Пример 222b) с 85% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,42 (с, 3H), 5,32 (с, 2H), 6,34 (с, 1H), 7,07 (д, J=8,0 Гц, 1H), 7,19 (д, J=8,0 Гц, 1H), 7,30 (с, 2H), 7,59 (т, J=8,8 Гц, 1H), 9,53 (с, 1H). МС 309 (MH+).
Пример 205b: 2-Амино-6-((5-метилизоксазол-3-ил)метокси)бензонитрил
Получают по методике примера 199b из 2-((5-метилизоксазол-3-ил)метокси)-6-нитробензонитрила (Пример 205c) с 52% выходом в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,42 (с, 3H), 5,19 (с, 2H), 6,07 (с, 2H), 6,31-6,33 (м, 2H), 6,37 (д, J=8,4 Гц, 1H), 7,20 (т, J=8,4 Гц, 1H). МС 230 (MH+).
Пример 205c: 2-((5-Метилизоксазол-3-ил)метокси)-6-нитробензонитрил
Получают по методике примера 187c из (5-метилизоксазол-3-ил)метанола и 2,6-динитробензонитрила с 86% выходом в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,43 (д, J=0,8 Гц, 3H), 5,50 (с, 2H), 6,38 (д, J=0,4 Гц, 1H), 7,83 (дд, J=1,2, 8,4 Гц, 1H), 7,91-7,98 (м, 2H). МС 260 (MH+).
Пример 206: 4-Амино-5-(2-циклопропилэтокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(2-циклопропилэтокси)бензонитрила (Пример 206a) с 94% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,11-0,15 (м, 2H), 0,43-0,48 (м, 2H), 0,77-0,81 (м, 1H), 1,73 (кв., J=6,8 Гц, 2H), 4,21 (т, J=6,8 Гц, 2H), 6,61 (д, J=8,0 Гц, 1H), 6,77 (д, J=8,4 Гц, 1H), 7,46 (т, J=8,4 Гц, 1H), 7,87 (с, 1H), 8,39 (с, 1H), 10,96 (с, 1H). МС 282 (MH+).
Пример 206a: 2-Сульфамоиламино-6-(2-циклопропилэтокси)бензонитрил
Получают по методике примера 111a из 2-амино-6-(2-циклопропилэтокси)бензонитрила (Пример 206b) с 80% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,13-0,17 (м, 2H), 0,41-0,46 (м, 2H), 0,82-0,87 (м, 1H), 1,64 (кв., J=6,4 Гц, 2H), 4,16 (т, J=6,4 Гц, 2H), 6,96 (д, J=8,0 Гц, 1H), 7,14 (д, J=8,8 Гц, 1H), 7,27 (с, 2H), 7,56 (т, J=8,8 Гц, 1H), 9,44 (с, 1H). МС 282 (MH+).
Пример 206b: 2-Амино-6-(2-циклопропилэтокси)бензонитрил
Получают по методике примера 199b из 2-(2-циклопропилэтокси)-6-нитробензонитрила (Пример 206c) с 90% выходом в виде масла желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,13-0,16 (м, 2H), 0,40-0,45 (м, 2H), 0,81-0,85 (м, 1H), 1,61 (кв., J=6,8 Гц, 2H), 4,04 (т, J=6,4 Гц, 2H), 5,97 (с, 2H), 6,21 (д, J=8,0 Гц, 1H), 6,32 (д, J=8,8 Гц, 1H), 7,17 (т, J=8,4 Гц, 1H). МС 203 (MH+).
Пример 206c: 2-(2-Циклопропилэтокси)-6-нитробензонитрил
Получают по методике примера 187c из 2-циклопропилэтанола и 2,6-динитробензонитрила с 85% выходом в виде масла желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,15-0,20 (м, 2H), 0,43-0,47 (м, 2H), 0,84-0,89 (м, 1H), 1,69 (кв., J=6,8 Гц, 2H), 4,31 (т, J=6,4 Гц, 2H), 7,73-7,76 (м, 1H), 7,86-7,93 (м, 2H). МС 233 (MH+).
Пример 207: 4-Амино-5-(гидроксиметил)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-циано-3-(сульфамоиламино)бензилацетата (Пример 207a) с 53% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 4,60 (с, 2H), 6,62-6,63 (м, 1H), 7,04 (д, J=8,0 Гц, 1H), 7,09 (д, J=7,2 Гц, 1H), 7,51 (т, J=7,6 Гц, 1H), 8,33 (ушир.с, 1H), 8,86 (ушир.с, 1H), 10,92 (с, 1H). МС 228 (MH+).
Пример 207a: 2-Циано-3-(сульфамоиламино)бензилацетат
Получают по методике примера 111a из 3-амино-2-цианобензилацетата (Пример 207b) с 90% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, Ацетон-d6) δ 2,09 (с, 3H), 5,24 (с, 2H), 6,76 (ушир.с, 2H), 7,38 (дд, J=0,8, 7,2 Гц, 1H), 7,66-7,75 (м, 2H), 8,40 (ушир.с, 1H). МС 270 (MH+).
Пример 207b: 3-Амино-2-цианобензилацетат
Получают по методике примера 199b из 2-циано-3-нитробензилацетата (Пример 207c) с 84% выходом в виде масла желтого цвета.1H ЯМР (400 МГц, метанол-d6) δ 2,10 (с, 3H), 5,11 (с, 2H), 6,70 (д, J=7,2 Гц, 1H), 6,78 (д, J=8,8 Гц, 1H), 7,28 (т, J=8,4 Гц, 1H). МС 191 (MH+).
Пример 207c: 2-Циано-3-нитробензилацетат
Уксусный ангидрид (0,84 мл, 8,87 ммоль) добавляют к раствору 2-(гидроксиметил)-6-нитробензонитрила (Пример 207d) (0,31 г, 1,77 ммоль), пиридина (0,86 мл, 10,6 ммоль) и ДМАП (0,22 г, 1,77 ммоль) с CH2Cl2 (10 мл) и перемешивают в течение 24 ч при КТ. Смесь промывают один раз AcOH (1 M, 20 мл), сушат с MgSO4, концентрируют и очищают хроматографией на двуокиси кремния с применением CH2Cl2, с получением указанного в заголовке соединения в количестве 0,36 г (92%) в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,12 (с, 3H), 5,35 (с, 2H), 7,99 (т, J=8,0 Гц, 1H), 8,06 (дд, J=0,8, 8,0 Гц, 1H), 8,37 (дд, J=0,8, 8,0 Гц, 1H).
Пример 207d: 2-(Гидроксиметил)-6-нитробензонитрил
Боргидрид натрия (92,0 мг, 2,43 ммоль) добавляют к раствору 2-формил-6-нитробензонитрила (Пример 207e) (0,86 г, 4,88 ммоль) в MeOH (38 мл) и ТГФ (38 мл) при -8°С и перемешивают при этой температуре в течение не более 30 мин. Реакционную смесь гасят HCl (6 M, 4,88 мл), затем добавляют воду (50 мл) и насыщенным раствором соли (50 мл). Смесь экстрагируют EtOAc, объединенный экстракт сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают хроматографией на двуокиси кремния с применением градиента растворителя CH2Cl2→CH2Cl2/MeOH (8:2) с получением указанного в заголовке соединения в количестве 0,32 г, (37%), которое применяют немедленно на следующей стадии.1H ЯМР (400 МГц, ДМСО-d6) δ 4,77 (д, J=5,6 Гц, 2H), 5,87 (т, J=5,6 Гц, 1H), 7,97 (т, J=8,0 Гц, 1H), 8,07 (дд, J=0,4, 8,0 Гц, 1H), 8,28 (дд, J=0,8, 8,0 Гц, 1H).
Пример 207e: 2-Формил-6-нитробензонитрил
1,1-Диметокси-N,N-диметилметанамин (13,56 мл, 102 ммоль) добавляют к раствору 2-метил-6-нитробензонитрила (15,0 г, 92,5 ммоль) в безводном ДМФ (60 мл) в атмосфере азота и нагревают при 130°С в течение 15 ч. Добавляют ледяную воду, и полученный темный осадок собирают фильтрацией и сушат в вакууме. Фосфатный буфер (pH 7, 350 мл) и затем NaIO4 (40 г, 187 ммоль) добавляют к раствору темного осадка в ТГФ (350 мл) и перемешивают при КТ в течение 3 ч. Смесь экстрагируют EtOAc, объединенный экстракт промывают насыщенным раствором соли и сушат с MgSO4. Фильтрат концентрируют и остаток очищают хроматографией на двуокиси кремния с применением градиента растворителя гексан → EtOAc, с получением 3,07 г (19%) указанного в заголовке соединения в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 8,15 (т, J=8,4 Гц, 1H), 8,41 (дд, J=1,2, 7,6 Гц, 1H), 8,62 (дд, J=1,2, 8,4 Гц, 1H), 10,25 (с, 1H).
Пример 208: (Е)-4-Амино-5-(4-оксо-4-(пропиламино)бут-2-енилокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из (Е)-4-(2-циано-3-(сульфамоиламино)фенокси)-N-пропилбут-2-енамида (Пример 208a) с 19% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, Ацетон-d6) δ 0,87 (т, J=7,2 Гц, 3H), 1,47 (гекс, J=7,6 Гц, 2H), 3,11-3,17 (м, 4H), 5,35 (кв., J=7,2 Гц, 1H), 6,70 (д, J=6,0 Гц, 1H), 6,77 (д, J=8,0 Гц, 1H), 6,87 (д, J=8,0 Гц, 1H), 7,2- 7,5 (ушир.с, 2H), 7,51 (т, J=8,0 Гц, 1H), 8,19 (ушир.с, 1H), 9,5-10,5 (ушир.с, 1H). МС 339 (MH+).
Пример 208a: (Е)-4-(2-Циано-3-(сульфамоиламино)фенокси)-N-пропилбут-2-енамид
Получают по методике примера 111a из (Е)-4-(3-амино-2-цианофенокси)-N-пропилбут-2-енамида (Пример 208b) в 87% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,84 (т, J=7,2 Гц, 3H), 1,43 (гекс, J=6,8 Гц, 2H), 3,06 (кв., J=6,8 Гц, 2H), 4,90 (д, J=2,8 Гц, 2H), 6,15 (д, J=15,6 Гц, 1H), 6,70-6,77 (м, 1H), 6,91 (д, J=8,8 Гц, 1H), 7,17 (д, J=8,4 Гц, 1H), 7,27 (ушир.с, 2H), 7,57 (т, J=8,8 Гц, 1H), 8,13-8,16 (м, 1H), 9,52 (ушир.с, 1H). МС 339 (MH+).
Пример 208b: (Е)-4-(3-Амино-2-цианофенокси)-N-пропилбут-2-енамид
Получают по методике примера 199b из (Е)-4-(2-циано-3-нитрофенокси)-N-пропилбут-2-енамида (Пример 208c) с 73% выходом в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,84 (т, J=7,2 Гц, 3H), 1,42 (гекс, J=7,2 Гц, 2H), 3,06 (кв., J=6,8 Гц, 2H), 4,77-4,79 (м, 2H), 6,04 (с, 2H), 6,11-6,20 (м, 2H), 6,35 (д, J=8,4 Гц, 1H), 6,67-6,74 (м, 1H), 7,18 (т, J=8,0 Гц, 1H), 8,11-8,14 (м, 1H). МС 260 (MH+).
Пример 208c: (Е)-4-(2-Циано-3-нитрофенокси)-N-пропилбут-2-енамид
(Е)-4-Бром-N-пропилбут-2-енамид (Elliott, M.; Farnham, A. W.; Janes, N. F.; Johnson, D. M.; Pulman, D. A. Pesticide Science 1987 18(4) 229) (0,14 г, 0,70 ммоль), 2-гидрокси-6-нитробензонитрил (0,14 г, 0,88 ммоль), карбонат калия (0,39 г, 2,81 ммоль) и 18-краун-6 (0,11 г, 0,42 ммоль) кипятят с обратным холодильником в ацетоне (6 мл) в течение 2 ч, и затем выливают в ледяную воду (45 мл). Полученный осадок собирают фильтрацией с получением 0,16 г (79%) указанного в заголовке соединения в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,84 (т, J=12 Гц, 3H), 1,42 (гекс, J=7,2 Гц, 2H), 3,06 (кв., J=6,8 Гц, 2H), 5,07 (д, J=2,8 Гц, 2H), 6,16 (д, J=16,0 Гц, 1H), 6,71-6,78 (м, 1H), 7,69 (д, J=8,0 Гц, 1H), 7,88-7,96 (м, 2H), 8,11-8,14 (м, 1H).
Пример 209: (S)-4-Амино-5-((1-ацетилпирролидин-2-ил)метокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 176 из (S)-2-амино-6-((1-ацетилпирролидин-2-ил)метокси)бензонитрила (Пример 209a) с 10% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,93 (м, 4H), 2,00 (с, 3H), 3,50 (м, 2H), 4,09 (дд, J=10,0, 6,2 Гц, 1H), 4,24 (дд, J=10,0, 5,6 Гц, 1H), 4,41 (м, 1H), 6,62 (д, J=8,2 Гц, 1H), 6,87 (д, J=8,5 Гц, 1H), 7,46 (т, J=8,5 Гц, 1H), 8,12 (ушир.с, 1H), 8,33 (ушир.с, 1H), 10,93 (ушир.с, 1H). МС 339 (MH+).
Пример 209a: (S)-2-Амино-6-((1-ацетилпирролидин-2-ил)метокси)бензонитрил
К суспензии хлорида (S)-2-((2-циано-3-нитрофенокси)метил)пирролидиния (130 мг, 0,46 ммоль) (Пример 209b) в ТГФ (5 мл) добавляют Et3N (135 мкл, 0,97 ммоль) и ацетилхлорида (36 мкл, 0,50 ммоль). Реакционную смесь перемешивают при КТ в течение 18 ч, фильтруют и разбавляют EtOH (20 мл). Полученный раствор гидрируют (20 Бар) с применением 10% Pd/C в качестве катализатора. После завершения реакционную смесь концентрируют с получением указанного в заголовке соединения (61 мг, 51%) в виде прозрачного сиропа. МС 260 (MH+).
Пример 209b: Хлорид (S)-2-((2-Циано-3-нитрофенокси)метил)пирролидиния
Получают по методике примера 166 из (S)-трет-бутил-2-((2-циано-3-нитрофенокси)метил)пирролидин-1-карбоксилата (Пример 209c) с 81% выходом в виде твердого вещества беловатого цвета. МС 248 (MH+-HCl).
Пример 209c: (S)-трет-Бутил 2-((2-циано-3-нитрофенокси)метил)пирролидин-1-карбоксилат
Получают по методике примера 166d из 2,6-динитробензонитрила и (S)-трет-бутил 2-(гидроксиметил)пирролидин-1-карбоксилата с 89% выходом в виде твердого вещества рыжевато-коричневого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,40 (с, 9H), 1,81 (м, 1H), 2,03 (м, 3H), 3,32 (м, 2H), 4,08 (м, 1H), 4,33 (м, 2H), 7,79 (д, J=7,8 Гц, 1H), 7,93 (м, 2H).
Пример 210: (S)-4-Амино-5-((1-пропионилпирролидин-2-ил)метокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 176 из (S)-2-амино-6-((1-пропионилпирролидин-2-ил)метокси)бензонитрила (Пример 210a) с 17% выходом в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,01 (т, J=7,8 Гц, 3H), 1,95 (м, 4H), 2,31 (м, 2H), 3,48 (м, 2H), 4,11 (дд, J=10,0, 6,4 Гц, 1H), 4,27 (дд, J=9,8, 5,0 Гц, 1H), 4,43 (м, 1H), 6,64 (д, J=7,9 Гц, 1H), 6,92 (д, J=8,4 Гц, 1H), 7,48 (т, J=8,2 Гц, 1H), 8,09 (ушир.с, 1H), 8,34 (ушир.с, 1H), 10,95 (ушир.с, 1H). МС 353 (MH+).
Пример 210a: (S)-2-Амино-6-((1-пропионилпирролидин-2-ил)метокси)бензонитрил
Получают по методике примера 209a из хлорида (S)-2-((2-циано-3-нитрофенокси)метил)пирролидиния (Пример 210b) и пропионилхлорида с 90% выходом в виде прозрачного сиропа. МС 274 (MH+).
Пример 211: (S)-4-Амино-5-((1-бутирилпирролидин-2-ил)метокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 176 из (S)-2-амино-6-((1-бутирилпирролидин-2-ил)метокси)бензонитрила (Пример 211a) с 78% выходом в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,88 (т, J=7,5 Гц, 3H), 1,54 (кв., J=7,5 Гц), 1,94 (м, 4H), 2,26 (т, J=7,5 Гц, 2H), 3,48 (м, 2H), 4,10 (м, 1H), 4,25 (м, 1H), 4,43 (м, 1H), 6,62 (д, J=8,1 Гц, 1H), 6,89 (д, J=8,6 Гц, 1H), 7,47 (т, J=8,3 Гц, 1H), 8,08 (ушир.с, 1H), 8,32 (ушир.с, 1H), 10,93 (ушир.с, 1H). МС 367 (MH+).
Пример 211a: (S)-2-Амино-6-((1-бутирилпирролидин-2-ил)метокси)бензонитрил
Получают по методике примера 209a из хлорида (S)-2-((2-циано-3-нитрофенокси)метил)пирролидиния (Пример 209b) и бутирилхлорида с 90% выходом в виде твердого вещества белого цвета. МС 288 (MH+).
Пример 212: (S)-2-((4-Амино-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид-5-илокси)метил)-N-метилпирролидин-1-карбоксамид

Получают по методике примера 176 из (S)-2-((3-амино-2-цианофенокси)метил)-N-метилпирролидин-1-карбоксамид (Пример 212a) с 30% выходом в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,89 (м, 4H), 2,60 (д, J=3,9 Гц, 3H), 3,20 (м, 2H), 4,01 (м, 1H), 4,16 (м, 1H), 4,32 (м, 1H), 6,23 (м, 1H), 6,62 (д, J=8,2 Гц, 1H), 6,89 (д, J=8,5 Гц, 1H), 7,46 (т, J=8,2 Гц, 1H), 8,19 (ушир.с, 1H), 8,27 (ушир.с, 1H), 10,92 (с, 1H). МС 354 (MH+).
Пример 212a: (S)-2-((3-Амино-2-цианофенокси)метил)-N-метилпирролидин-1-карбоксамид
Получают по методике примера 209a из хлорида (S)-2-((2-циано-3-нитрофенокси)метил)пирролидиния (Пример 209b) и метилизоцианата с 53% выходом в виде твердого вещества белого цвета. МС 275 (MH+).
Пример 213: (S)-2-((4-Амино-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид-5-илокси)метил)-N-этилпирролидин-1-карбоксамид

Получают по методике примера 276 из (S)-2-((3-амино-2-цианофенокси)метил)-N-этилпирролидин-1-карбоксамида (Пример 213a) с 68% выходом в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,03 (т, J=6,9 Гц, 6H), 1,90 (м, 4H), 3,08 (квинт, J=6,6 Гц, 2H), 3,20 (м, 1H), 3,31 (м, 1H), 4,00 (дд, J=9,7, 6,7 Гц, 1H), 4,17 (дд, J=9,7, 6,0 Гц, 1H), 4,33 (м, 1H), 6,27 (д, J=5,7 Гц, 1H), 6,62 (д, J=8,2 Гц, 1H), 6,89 (д, J=8,3 Гц, 1H), 7,46 (т, J=8,2 Гц, 1H), 8,20 (ушир.с, 1H), 8,26 (ушир.с, 1H), 10,91 (с, 1H). МС 368 (MH+).
Пример 213a: (S)-2-((3-Амино-2-цианофенокси)метил)-N-этилпирролидин-1-карбоксамид
Получают по методике примера 209a из хлорида (S)-2-((2-циано-3-нитрофенокси)метил)пирролидиния (Пример 209b) и этилизоцианата со 100% выходом в виде твердого вещества белого цвета. МС 289 (MH+).
Пример 214: (S)-2-((4-Амино-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид-5-илокси)метил)-N-пропилпирролидин-1-карбоксамид

Получают по методике примера 276 из (S)-2-((3-амино-2-цианофенокси)метил)-N-пропилпирролидин-1-карбоксамид (Пример 214a) с 37% выходом в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,84 (т, J=7,6 Гц, 6H), 1,43 (секст, J=7,4 Гц, 2H), 1,92 (м, 4H), 3,01 (м, 2H), 3,21 (м, 1H), 3,33 (м, 1H), 4,02 (дд, J=9,7, 6,4 Гц, 1H), 4,18 (дд, J=9,7, 5,9 Гц, 1H), 4,34 (м, 1H), 6,27 (д, J=5,6 Гц, 1H), 6,62 (д, J=8,4 Гц, 1H), 6,89 (д, J=8,6 Гц, 1H), 7,46 (т, J=8,3 Гц, 1H), 8,20 (ушир.с, 1H), 8,27 (ушир.с, 1H), 10,91 (с, 1H). МС 382 (MH+).
Пример 214a: (S)-2-((3-Амино-2-цианофенокси)метил)-N-пропилпирролидин-1-карбоксамид
Получают по методике примера 209a из хлорида (S)-2-((2-циано-3-нитрофенокси)метил)пирролидиния (Пример 209b) и пропилизоцианата со 100% выходом в виде твердого вещества белого цвета. МС 303 (MH+).
Пример 215: 3-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-2′,2′-диметил-N-пропилпропанамид
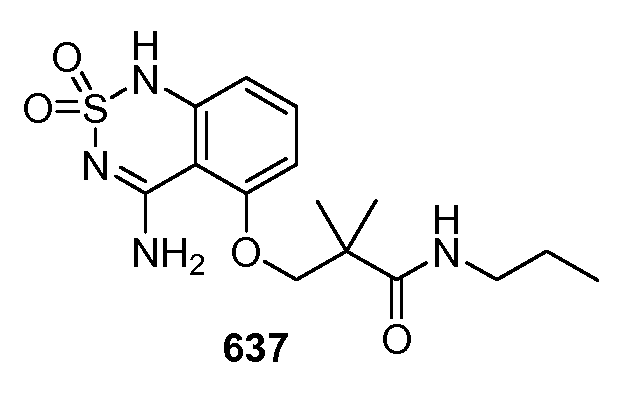
К перемешиваемому раствору 3-(3-сульфамоиламино-2-цианофенокси)-2,2-диметил-N-пропилпропанамида (18,52 г, 52,55 ммоль) (Пример 215a) в EtOH (150 мл) добавляют раствор NaOH (2,0н, 52,3 мл) при комнатной температуре. Реакционную смесь затем кипятят с обратным холодильником в течение 2 ч до завершения реакции по ТСХ. Раствор охлаждают до 0°С и осторожно нейтрализуют 10% уксусной кислотой и осадок собирают фильтрацией и промывают водой. Продукт далее очищают перекристаллизацией из EtOH/H2O (1:4), сушат в вакууме с получением указанного в заголовке соединения в виде твердого вещества белого цвета (13,5 г, 73%). т. пл.: 225-226°С.1H ЯМР (400 МГц, ДМСО-d6) δ 0,75 (т, J=7,4 Гц, 3H), 1,22 (с, 6H), 1,38 (м, 2H), 3,01 (кв., J=6,5 Гц, 2H), 4,07 (с, 2H), 6,59 (д, J=8,0 Гц, 1H), 6,71 (д, J=8,0 Гц, 1H), 7,44 (т, J=8,0 Гц, 1H), 7,82 (т, J=5,6 Гц, 1H), 7,92 (с, 1H), 8,33 (с, 1H), 10,93 (с, 1H). МС 355 (MH+).
Пример 215a: 3-(3-Сульфамоиламино-2-цианофенокси)-2,2-диметил-N-пропилпропанамид
К раствору 3-(3-амино-2-цианофенокси)-2,2-диметил-N-пропилпропанамид (16,5 г, 59,92 ммоль) (Пример 215b) в ДМА (50 мл) добавляют сульфамоилхлорид (13,85 г, 119,84 ммоль) при 0°С в атмосфере азота. Затем реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 3 ч, затем разбавляют EtOAc, последовательно промывают NaHCO3, насыщенным раствором соли, сушат над Na2SO4, фильтруют и выпаривают с получением указанного в заголовке соединения в виде твердого вещества беловатого цвета (18,52 г, 87%).1H ЯМР (400 МГц, ДМСО-d6) δ 0,79 (т, J=7,6 Гц, 3H), 1,20 (с, 6H), 1,38 (м, 2H), 3,01 (кв., J=6,5 Гц, 2H), 4,05 (с, 2H), 6,92 (д, J=8,4 Гц, 1H), 7,13 (д, J=8,4 Гц, 1H), 7,24 (с, 2H), 7,53 (т, J=8,4 Гц, 1H), 7,55 (т, J=5,6 Гц, 1H), 9,42 (с, 1H). МС 355 (MH+).
Пример 215b: 3-(3-Амино-2-цианофенокси)-2,2-диметил-N-пропилпропанамид
Способ A: К раствору 3-(2-циано-3-нитрофенокси)-2,2-диметил-N-пропилпропанамида (305 мг, 1,0 ммоль) (Пример 215c) в EtOAc (20,0 мл) добавляют 10% Pd/C (50 мг). Суспензию перемешивают в атмосфере H2 при комнатной температуре в течение ночи. Pd/C отфильтровывают и промывают EtOAc. Фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на силикагеле, элюируя 50% EtOAc в гексане с получением указанного в заголовке соединения (267 мг, 97%) в виде твердого вещества белого цвета. МС 276 (MH+).
Способ B: К раствору 3-гидрокси-2,2-диметил-N-пропилпропанамида (20,2 г, 0,127 моль) (Пример 215d) в сухом ТГФ (500 мл) осторожно добавляют NaH (60% в минеральном масле, 7,64 г, 0,191 моль) небольшими порциями при 0°С в атмосфере азота. Реакционную смесь затем нагревают до комнатной температуры и перемешивают в атмосфере азота в течение 1 ч. К этому раствору медленно добавляют при комнатной температуре 2-амино-6-фторбензонитрил (17,3 г, 0,127 моль) в ТГФ (100 мл), и реакционную смесь кипятят с обратным холодильником в течение ночи в атмосфере азота, затем охлаждают до комнатной температуры, гасят насыщенным раствором соли и экстрагируют EtOAc (3X). Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4, выпаривают и остаток кристаллизуют из EtOAc/гексана с получением соединения в виде твердого вещества белого цвета (16,5 г, 48%). МС 276 (MH+).
Пример 215c: 3-(2-Циано-3-нитрофенокси)-2,2-диметил-N-пропилпропанамид
К раствору 3-гидрокси-2,2-диметил-N-пропилпропанамида (1,59 г, 10,0 ммоль) (Пример 215d) в сухом ТГФ (30 мл) осторожно добавляют NaH (60% в минеральном масле, 400 мг, 10,0 ммоль) небольшими порциями при 0°С в атмосфере азота. Реакционную смесь перемешивают при 0°С в атмосфере азота в течение 2 ч. К этому раствору добавляют 2,6-динитробензонитрил (1,93, 10,0 ммоль), и реакционный раствор перемешивают при 0°С - КТ в атмосфере азота в течение ночи. Реакционную смесь гасят насыщенным раствором соли и экстрагируют EtOAc (3X). Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4. После выпаривания растворителей остаток очищают хроматографией на силикагеле, элюируя 60% EtOAc в гексане с получением указанного в заголовке соединения в виде твердого вещества бледно-желтого цвета (2,21 г, 72%). МС 306 (MH+).
Пример 215d: 3-Гидрокси-2,2-диметил-N-пропилпропанамид
Способ A: Раствор метил 3-гидрокси-2,2-диметилпропаноата (2,64 г, 20 ммоль) и н-пропиламина (1,81 г, 30 ммоль) нагревают при 190°С с применением микроволн в течение 10 часов. Избыточный амин удаляют в вакууме с получением указанного в заголовке соединения в виде бесцветного масла (3,18 г, 100%). МС 160 (MH+).
Способ B: К раствору 3-гидрокси-2,2-диметилпропановой кислоты (20,0 г, 0,169 моль), пропиламина (15,3 мл, 0,186 моль) и HOBt (25,1 г, 0,186 моль) в сухом дихлорметане (500 мл) добавляют EDCl (35,6 г, 0,186 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь затем перемешивают при комнатной температуре в атмосфере азота в течение ночи. Реакционную смесь гасят насыщенным раствором соли и экстрагируют EtOAc (8X). Объединенные органические слои промывают насыщенным раствором NaHCO3, разбавленной HCl, насыщенным раствором соли и сушат над Na2SO4. Выпаривание растворителя при пониженном давлении дает указанное в заголовке соединение в виде бесцветного масла (19,2 г, 71%). МС 160 (MH+).
Пример 216: N-(1-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-2′-метилпропан-2′-ил)бензамид

Получают по методике примера 215 из N-(1-(3-сульфамоиламино-2-цианофенокси)-2-метилпропан-2-ил)бензамида (Пример 216a) с 93% выходом в виде твердого вещества белого цвета. Т. пл.: 235-236°С.1H ЯМР (400 МГц, ДМСО-d6) δ 1,47 (с, 6H), 4,38 (с, 2H), 6,61 (д, J=8,4 Гц, 1H), 6,77 (д, J=8,0 Гц, 1H), 7,39-7,51 (м, 4H), 7,75 (д, J=7,6 Гц, 2H), 7,90 (с, 1H), 8,17 (с, 1H), 8,47 (с, 1H), 10,97 (с, 1H). МС 389 (MH+).
Пример 216a: N-(1-(3-Сульфамоиламино-2-цианофенокси)-2-метилпропан-2-ил)бензамид
Получают по методике примера 215a из N-(1-(3-амино-2-цианофенокси)-2-метилпропан-2-ил)бензамида (Пример 216b) с 98% выходом в виде твердого вещества белого цвета. МС 389 (MH+).
Пример 216b: N-(1-(3-Амино-2-цианофенокси)-2-метилпропан-2-ил)бензамид
Получают по методике примера 215b (Способ A) из N-(1-(2-циано-3-нитрофенокси)-2-метилпропан-2-ил)бензамида (Пример 216c) с 96% выходом в виде твердого вещества белого цвета. МС 310 (MH+).
Пример 216c: N-(1-(2-циано-3-нитрофенокси)-2-метилпропан-2-ил)бензамид
Получают по методике примера 215c из N-(1-гидрокси-2-метилпропан-2-ил)бензамида (Boyd, R.N.; Hansen, R.H. J. Am. Chem. Soc. 1953, 75, 5896) и 2,6-динитробензонитрила с 91% выходом в виде твердого вещества бледно-желтого цвета. МС 340 (MH+).
Пример 217: 5-(Неопентилокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 215 из 2-сульфамоиламино-6-(неопентилокси)бензонитрила (Пример 217a) с 73% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,01 (с, 9H), 3,86 (с, 2H), 6,61 (д, J=8,0 Гц, 1H), 6,77 (д, J=8,0 Гц, 1H), 7,45 (т, J=8,0 Гц, 1H), 7,66 (с, 1H), 8,49 (с, 1H), 10,99 (с, 1H). МС 284 (MH+).
Пример 217a: 2-Сульфамоиламино-6-(неопентилокси)бензонитрил
Получают по методике примера 215a из 2-амино-6-(неопентилокси)бензонитрила (Пример 217b) с 92% выходом. МС 284 (MH+).
Пример 217b: 2-Амино-6-(неопентилокси)бензонитрил
Получают по методике примера 215b (Способ A) из 2-(неопентилокси)-6-нитробензонитрил (Пример 217c) с 96% выходом. МС 205 (MH+).
Пример 217c: 2-(Неопентилокси)-6-нитробензонитрил
Получают по методике примера 215c из 2,2-диметилпропан-1-ола и 2,6-динитробензонитрила с 80% выходом. МС 235 (MH+).
Пример 218: 3-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-N-(2"-(бензилокси)этил)-2′,2′-диметилпропанамид

Получают по методике примера 215 из 3-(3-сульфамоиламино-2-цианофенокси)-N-(2-(бензилокси)этил)-2,2-диметилпропанамида (Пример 218a) с 92% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,22 (с, 6H), 3,26 (кв., J=5,8 Гц, 2H), 3,41 (т, J=5,8 Гц, 2H), 4,07 (с, 2H), 4,36 (с, 2H), 6,60 (д, J=7,6 Гц, 1H), 6,71 (д, J=7,6 Гц, 1H), 7,19-7,28 (м, 4H), 7,43 (т, J=8,0 Гц, 2H), 7,91 (с, 1H), 7,97 (т, J=5,8 Гц, 1H), 8,34 (с, 1H), 10,93 (с, 1H). МС 447 (MH+).
Пример 218a: 3-(3-Сульфамоиламино-2-цианофенокси)-N-(2-(бензилокси)этил)-2,2-диметилпропанамид
Получают по методике примера 215a из 3-(3-амино-2-цианофенокси)-N-(2-(бензилокси)этил)-2,2-диметилпропанамида (Пример 218b) с 100% выходом. МС 447 (MH+).
Пример 218b: 3-(3-Амино-2-цианофенокси)-N-(2-(бензилокси)этил)-2,2-диметилпропанамид
Получают по методике примера 215b (Способ B) из N-(2-(бензилокси)этил)-3-гидрокси-2,2-диметилпропанамида (Пример 218c) и 2-амино-6-фторбензонитрила с 82% выходом. МС 368 (MH+).
Пример 218c: N-(2-(бензилокси)этил)-3-гидрокси-2,2-диметилпропанамид
К раствору 3-гидрокси-2,2-диметилпропановой кислоты (2,36 г, 20 ммоль), 2-(бензилокси)этанамина (3,02 г, 20 ммоль) и HOBt (2,71 г, 20 ммоль) в сухом дихлорметане (100 мл) добавляют EDCl (3,82 г, 20 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь затем перемешивают при комнатной температуре в атмосфере азота в течение ночи. Реакционную смесь гасят насыщенным раствором соли и экстрагируют EtOAc (3X). Объединенные органические слои промывают насыщенным раствором NaHCO3, разбавленной HCl, насыщенным раствором соли и сушат над Na2SO4. После выпаривания растворителя остаток очищают хроматографией на силикагеле, элюируя 40% EtOAc в гексане с получением указанного в заголовке соединения в виде бесцветного масла (4,89 г) с 97% выходом. МС 252 (MH+).
Пример 219: 3-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-N-(2"-гидроксиэтил)-2′,2′-диметилпропанамид

К раствору 3-(4-амино-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-2,2-диоксид-N-(2′-(бензилокси)этил)-2′,2′-диметилпропанамида (Пример 218, 112 мг, 0,25 ммоль) в EtOAc/EtOH/ТГФ (1:1:1, 20,0 мл) добавляют 10% Pd/C (50 мг). И суспензию перемешивают в атмосфере H2 при комнатной температуре в течение 2 ч. Pd/C отфильтровывают и промывают MeOH. Фильтрат концентрируют при пониженном давлении и остаток очищают перекристаллизацией из EtOH с получением указанного в заголовке соединения в виде твердого вещества белого цвета (81 мг) с 90% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,22 (с, 6H), 3,11 (кв., J=6,0 Гц, 2H), 3,35 (кв., J=6,0 Гц, 2H), 4,05 (с, 2H), 4,61 (т, J=6,0 Гц, 1H), 6,59 (д, J=8,0 Гц, 1H), 6,70 (д, J=8,0 Гц, 1H), 7,43 (т, J=8,0 Гц, 1H), 7,78 (т, J=6,0 Гц, 1H), 7,93 (с, 1H), 8,29 (с, 1H), 10,93 (с, 1H). МС 357 (MH+).
Пример 220: 3-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-N-(4"-метоксибензил)-2′,2′-диметилпропанамид
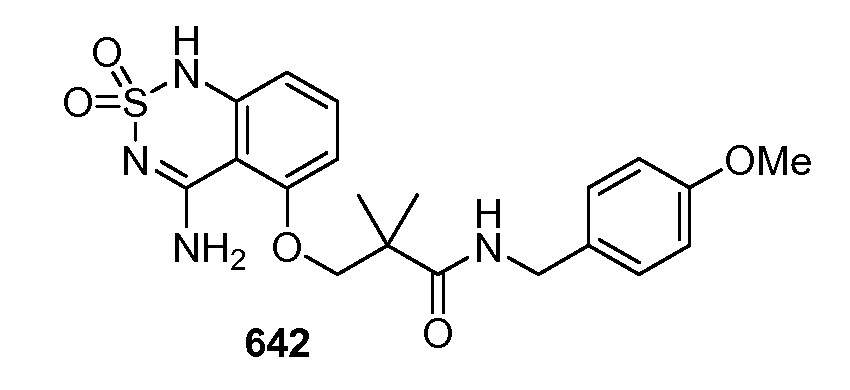
Получают по методике примера 215 из 3-(3-сульфамоиламино-2-цианофенокси)-N-(4-метоксибензил)-2,2-диметилпропанамида (Пример 220a) с 92% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,25 (с, 6H), 3,66 (с, 3H), 4,12 (с, 2H), 4,21 (д, J=5,6 Гц, 2H), 6,61 (д, J=8,4 Гц, 1H), 6,71 (д, J=8,4 Гц, 1H), 6,73 (д, J=8,0 Гц, 2H), 7,06 (д, J=8,0 Гц, 2H), 7,44 (т, J=8,4 Гц, 1H), 7,87 (с, 1H), 8,31 (с, 1H), 8,35 (т, J=5,6 Гц, 1H), 10,95 (с, 1H). МС 433 (MH+).
Пример 220a: 3-(3-Сульфамоиламино-2-цианофенокси)-N-(4-метоксибензил)-2,2-диметилпропанамид
Получают по методике примера 215a из 3-(3-амино-2-цианофенокси)-N-(4-метоксибензил)-2,2-диметилпропанамида (Пример 220b) со 100% выходом. МС 433 (MH+).
Пример 220b: 3-(3-Амино-2-цианофенокси)-N-(4-метоксибензил)-2,2-диметилпропанамид
К раствору 3-(2-циано-3-нитрофенокси)-N-(4-метоксибензил)-2,2-диметилпропанамида (1,15 г, 3,0 ммоль) (Пример 220c) в простом диметиловом эфире диэтиленгликоля (30 мл) добавляют по каплям раствор SnCl2·2H2O (2,03 г, 9,0 ммоль) в концентрированной HCl (15 мл) при 0°С. Реакционную смесь затем перемешивают при 0°С в течение еще 1 ч. Реакционный раствор нейтрализуют 2н NaOH при 0°С и экстрагируют EtOAc (2X). Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4. После выпаривания растворителя остаток очищают хроматографией на силикагеле, элюируя 50% EtOAc в гексане с получением указанного в заголовке соединения в виде твердого вещества белого цвета (0,91 г) с 86% выходом. МС 354 (MH+).
Пример 220c: 3-(2-Циано-3-нитрофенокси)-N-(4-метоксибензил)-2,2-диметилпропанамид
Получают по методике примера 215c из 3-гидрокси-N-(4-метоксибензил)-2,2-диметилпропанамида (Пример 220d) и 2,6-динитробензонитрила с 95% выходом в виде твердого вещества бледно-желтого цвета. МС 384 (MH+).
Пример 220d: 3-Гидрокси-N-(4-метоксибензил)-2,2-диметилпропанамид
Получают по методике примера 4c из 3-гидрокси-2,2-диметилпропановой кислоты и 4-метоксибензиламина с 97% выходом в виде твердого вещества белого цвета. МС 238 (MH+).
Пример 221: 3-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-N,2′,2′-триметилпропанамид

Получают по методике примера 215 из 3-(3-сульфамоиламино-2-цианофенокси)-N,2,2-триметилпропанамида (Пример 221a) с 62% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,21 (с, 6H), 2,58 (д, J=1,2 Гц, 3H), 4,05 (с, 2H), 6,60 (д, J=8,0 Гц, 1H), 6,72 (д, J=8,0 Гц, 1H), 7,44 (т, J=8,0 Гц, 1H), 7,80 (кв., J=1,2 Гц, 1H), 7,96 (с, 1H), 8,33 (с, 1H), 10,93 (с, 1H). МС 327 (MH+).
Пример 221a: 3-(3-Сульфамоиламино-2-цианофенокси)-N,2,2-триметилпропанамид
Получают по методике примера 215a из 3-(3-амино-2-цианофенокси)-N,2,2-триметилпропанамида (Пример 221b) с 69% выходом. МС 327 (MH+).
Пример 221b: 3-(3-Амино-2-цианофенокси)-N,2,2-триметилпропанамид
Получают по методике примера 215b (Способ A) из 3-(2-циано-3-нитрофенокси)-N,2,2-триметилпропанамида (Пример 221c) с 95% выходом в виде твердого вещества белого цвета. МС 248 (MH+).
Пример 221c: 3-(2-Циано-3-нитрофенокси)-N,2,2-триметилпропанамид
Получают по методике примера 215c из 3-гидрокси-N,2,2-триметилпропанамида (Пример 221d) и 2,6-динитробензонитрила с 77% выходом в виде твердого вещества бледно-желтого цвета. МС 378 (MH+).
Пример 221d: 3-Гидрокси-N,2,2-триметилпропанамид
Получают по методике примера 215d из метил 3-гидрокси-2,2-диметилпропаноата и метиламина с 51% выходом. МС 132 (MH+).
Пример 222: 3-(4-Амино-2-оксо-1,2-дигидрохиназолин-5-илокси)-2,2-диметил-N-пропилпропанамид

Раствор N-(2-циано-3-(2,2-диметил-3-оксо-3-(пропиламино)пропокси)фенилкарбамоил)бензамида (пример 222a) (141 мг, 0,3 ммоль) и NaOH (2н, 0,3 мл) в EtOH (5 мл) перемешивают при 100°С в атмосфере азота в течение 2 ч. После охлаждения до комнатной температуры прозрачный реакционный раствор фильтруют, и фильтрат осторожно нейтрализуют 10% AcOH при энергичном перемешивании при 0°С. Полученный осадок собирают фильтрацией, промывают водой и затем 20% EtOH в воде с получением конечного продукта (81 мг) с 76% выходом в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,73 (т, J=7,4 Гц, 3H), 1,21 (с, 6H), 1,33-1,41 (м, 2H), 3,01 (кв., J=7,4 Гц, 2H), 4,08 (с, 2H), 6,64 (д, J=8,0 Гц, 1H), 6,69 (д, J=8,0 Гц, 1H), 7,42 (т, J=8,0 Гц, 1H), 7,47 (с, 1H), 7,79 (т, J=7,4 Гц, 1H), 7,84 (с, 1H), 10,60 (с, 1H). МС 319 (MH+).
Пример 222a: N-(2-Циано-3-(2,2-диметил-3-оксо-3-(пропиламино)пропокси)фенилкарбамоил)бензамид
Получают по методике примера 146a из 3-(3-амино-2-цианофенокси)-2,2-диметил-N-пропилпропанамида (Пример 215b, Способ A) и бензоилизоцианата с 85% выходом в виде твердого вещества белого цвета. МС 423 (MH+).
Пример 223: 4-Амино-5-(неопентилокси)хиназолин-2(1H)-он
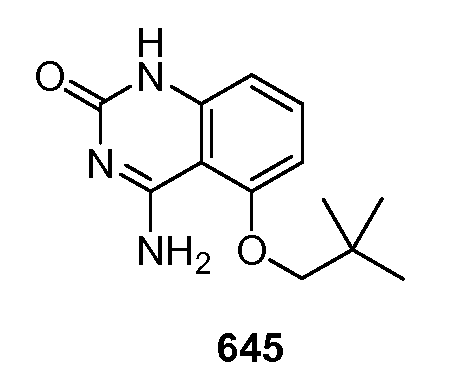
Получают по методике примера 222 из N-(2-циано-3-(неопентилокси)фенилкарбамоил)бензамида (Пример 223a) с 90% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,03 (с, 9H), 3,90 (с, 2H), 5,96 (с, 2H), 6,15 (д, J=7,6 Гц, 1H), 6,30 (д, J=7,6 Гц, 1H), 7,14 (т, J=7,6 Гц, 1H), 11,22 (с, 1H). МС 248 (MH+).
Пример 223a: N-(2-Циано-3-(неопентилокси)фенилкарбамоил)бензамид
Получают по методике примера 146a из 2-амино-6-(неопентилокси)бензонитрила (Пример 217b) и бензоилизоцианата с 96% выходом в виде твердого вещества белого цвета. МС 352 (MH+).
Пример 224: 5-(3-Метокси-3-метилбутокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 215 из 2-сульфамоиламино-6-(3-метокси-3-метилбутокси)бензонитрила (Пример 224a) с 52% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,16 (с, 6H), 1,98 (т, J=6,2 Гц, 2H), 3,09 (с, 3H), 4,18 (т, J=6,2 Гц, 2H), 8,57 (д, J=8,0 Гц, 1H), 6,73 (д, J=8,0 Гц, 1H), 7,43 (т, J=8,0 Гц, 1H), 8,25 (с, 1H), 8,30 (с, 1H), 10,89 (с, 1H). МС 314 (MH+).
Пример 224a: 2-Сульфамоиламино-6-(3-метокси-3-метилбутокси)бензонитрил
Получают по методике примера 215a из 2-амино-6-(3-метокси-3-метилбутокси)бензонитрила (Пример 224b) с 95% выходом. МС 314 (MH+).
Пример 224b: 2-Амино-6-(3-метокси-3-метилбутокси)бензонитрил
Получают по методике примера 215b (Способ A) из 2-(3-метокси-3-метилбутокси)-6-нитробензонитрила (Пример 224c) с 62% выходом. МС 235 (MH+).
Пример 224c: 2-(3-Метокси-3-метилбутокси)-6-нитробензонитрил
Получают по методике примера 215c из 3-метокси-3-метилбутан-1-ола и 2,6-динитробензонитрила с 52% выходом. МС 265 (MH+).
Пример 225: 3-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-N-(2"-метоксиэтил)-2′,2′-диметилпропанамид

Получают по методике примера 215 из 3-(3-сульфамоиламино-2-цианофенокси)-N-(2-метоксиэтил)-2,2-диметилпропанамид (Пример 225a) с 12% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,21 (с, 6H), 3,13 (с, 3H), 3,17-3,22 (м, 2H), 3,28 (т, J=6,0 Гц, 2H), 4,07 (с, 2H), 6,59 (д, J=8,0 Гц, 1H), 6,71 (д, J=8,0 Гц, 1H), 7,43 (т, J=8,0 Гц, 1H), 7,87 (с, 1H), 7,91 (т, J=5,6 Гц, 1H), 8,33 (с, 1H), 10,92 (с, 1H). МС 371 (MH+).
Пример 225a: 3-(3-Сульфамоиламино-2-цианофенокси)-N-(2-метоксиэтил)-2,2-диметилпропанамид
Получают по методике примера 215a из 3-(3-амино-2-цианофенокси)-N-(2-метоксиэтил)-2,2-диметилпропанамида (Пример 225b) с 41% выходом. МС 371 (MH+).
Пример 225b: 3-(3-Амино-2-цианофенокси)-N-(2-метоксиэтил)-2,2-диметилпропанамид
Получают по методике примера 215b (Способ A) из 3-(2-циано-3-нитрофенокси)-N-(2-метоксиэтил)-2,2-диметилпропанамида (Пример 225c) с 91% выходом. МС 292 (MH+).
Пример 225c: 3-(2-Циано-3-нитрофенокси)-N-(2-метоксиэтил)-2,2-диметилпропанамид
Получают по методике примера 215c из 3-гидрокси-N-(2-метоксиэтил)-2,2-диметилпропанамида (Пример 225d) и 2,6-динитробензонитрила с 55% выходом. МС 322 (MH+).
Пример 225d: 3-Гидрокси-N-(2-метоксиэтил)-2,2-диметилпропанамид
Получают по методике примера 215d (Способ A) из метил 3-гидрокси-2,2-диметилпропаноата и 2-метоксиэтанамина со 100% выходом. МС 176 (MH+).
Пример 226: N-(3-(4-Амино)-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси-2′,2′-диметилпропил)пропионамид

Получают по методике примера 215a из N-(3-(3-амино-2-цианофенокси)-2,2-диметилпропил)пропионамида (Пример 226a) и сульфамоилхлорид с 17% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,93-0,96 (м, 9H), 2,06-2,11 (м, 2H), 3,07 (д, J=6,0 Гц, 2H), 3,74 (с, 2H), 6,58 (т, J=8,4 Гц, 1H), 6,69 (д, J=8,8 Гц, 1H), 7,41 (т, J=8,4 Гц, 1H), 7,93-7,98 (м, 2H), 8,35 (ушир.с, 1H), 10,91 (ушир.с, 1H). МС 355 (MH+).
Пример 226a: N-(3-(3-Амино-2-цианофенокси)-2,2-диметилпропил)пропионамид
Получают по методике примера 215b (Способ A) из N-(3-(2-циано-3-нитрофенокси)-2,2-диметилпропил)пропионамида (Пример 226b) с 100% выходом. МС 276 (MH+).
Пример 226b: N-(3-(2-Циано-3-нитрофенокси)-2,2-диметилпропил)пропионамид
Получают по методике примера 215c из N-(3-гидрокси-2,2-диметилпропил)пропионамида (Пример 226c) и 2,6-динитробензонитрила с 68% выходом. МС 306 (MH+).
Пример 226c: N-(3-Гидрокси-2,2-диметилпропил)пропионамид
Получают по методике, описанной в литературе (Boyd, R.N.; Hansen, R.H. J. Am. Chem. Soc. 1953, 75, 5896) из 2-амино-2-метилпропан-1-ола и бензоилхлорида с 84% выходом в виде твердого вещества белого цвета. МС 160 (MH+).
Пример 227: 1-(3-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-2′,2′-диметилпропил)-3′-этилмочвина

Получают по методике примера 215 из 1-(3-(3-сульфамоиламино-2-цианофенокси)-2,2-диметилпропил)-3-этилмочевина (Пример 227a) с 55% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,88-0,96 (м, 9H), 2,90-2,97 (м, 2H), 3,01 (д, J=6,4 Гц, 2H), 3,72 (с, 2H), 5,75 (т, J=5,6 Гц, 1H), 6,07 (т, J=6,4 Гц, 1H), 6,56 (д, J=8,4 Гц, 1H), 6,67 (д, J=8,8 Гц, 1H), 7,39 (т, J=8,4 Гц, 1H), 8,05 (ушир.с, 1H), 8,25 (ушир.с, 1H), 10,89 (с, 1H). МС 370 (MH+).
Пример 227a: 1-(3-(3-Сульфамоиламино-2-цианофенокси)-2,2-диметилпропил)-3-этилмочевина
Получают по методике примера 215a из 1-(3-(3-амино-2-цианофенокси)-2,2-диметилпропил)-3-этилмочевины (Пример 227b) со 100% выходом. МС 370 (MH+).
Пример 227b: 1-(3-(3-Амино-2-цианофенокси)-2,2-диметилпропил)-3-этилмочевина
Получают по методике примера 215b (Способ A) из 1-(3-(2-циано-3-нитрофенокси)-2,2-диметилпропил)-3-этилмочевины (Пример 227c) с 90% выходом. МС 291 (MH+).
Пример 227c: 1-(3-(2-Циано-3-нитрофенокси)-2,2-диметилпропил)-3-этилмочевина
Получают по методике примера 215c из 1-этил-3-(3-гидрокси-2,2-диметилпропил)мочевины (Пример 227d) и 2,6-динитробензонитрила с 47% выходом. МС 321 (MH+).
Пример 227d: 1-Этил-3-(3-гидрокси-2,2-диметилпропил)мочевина
К раствору 3-амино-2,2-диметилпропан-1-ола (1,03 г, 10 ммоль) в сухом 1,4-диоксан (20 мл) добавляют по каплям этилизоцианат (0,71 г, 10 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь затем перемешивают при комнатной температуре в атмосфере азота в течение ночи. Растворитель удаляют при пониженном давлении с получением указанного в заголовке соединения в виде бесцветного масла (1,74 г, 100%). МС 175 (MH+).
Пример 228: 3-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-N-бутил-2′,2′-диметилпропанамид

Получают по методике примера 215 и 1a из 3-(3-амино-2-цианофенокси)-N-бутил-2,2-диметилпропанамида (Пример 228a) и сульфамоилхлорида с 14% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,78 (т, J=7,2 Гц, 3H), 1,14-1,22 (м, 8H), 1,33-1,37 (м, 2H), 3,02-3,07 (м, 2H), 4,07 (с, 2H), 6,60 (д, J=8,0 Гц, 1H), 6,71 (д, J=8,8 Гц, 1H), 7,44 (т, J=8,4 Гц, 1H), 7,80 (т, J=5,6 Гц, 1H), 7,91 (с, 1H), 8,33 (с, 1H), 10,92 (с, 1H). МС 369 (MH+).
Пример 228a: 3-(3-Амино-2-цианофенокси)-N-бутил-2,2-диметилпропанамид
Получают по методике примера 215b (Способ A) из N-бутил-3-(2-циано-3-нитрофенокси)-2,2-диметилпропанамида (Пример 228b) с 89% выходом. МС 290 (MH+).
Пример 228b: N-Бутил-3-(2-циано-3-нитрофенокси)-2,2-диметилпропанамид
Получают по методике примера 215c из N-бутил-3-гидрокси-2,2-диметилпропанамида (Пример 228c) и 2,6-динитробензонитрила с 66% выходом. МС 320 (MH+).
Пример 228c: N-Бутил-3-гидрокси-2,2-диметилпропанамид
Получают по методике примера 215d (Способ A) из метил 3-гидрокси-2,2-диметилпропаноата и н-бутиламина со 100% выходом. МС 174 (MH+).
Пример 229: N-(1-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-2′-метилпропан-2′-ил)бутирамид
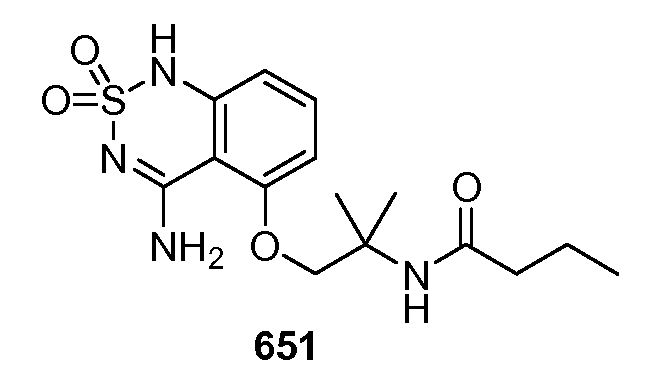
Получают по методике примера 215 из N-(1-(3-сульфамоиламино-2-цианофенокси)-2-метилпропан-2-ил)бутирамида (Пример 229a) и гидроксида натрия с 54% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,78 (т, J=7,2 Гц, 3H), 1,32 (с, 6H), 1,43-1,44 (м, 2H), 2,00 (т, J=7,2 Гц, 2H), 4,24 (с, 2H), 6,60 (д, J=8,0 Гц, 1H), 6,73 (д, J=8,4 Гц, 1H), 7,44 (т, J=8,4 Гц, 1H), 7,77 (с, 1H), 7,82 (с, 1H), 8,42 (с, 1H), 10,97 (с, 1H). МС 355 (MH+).
Пример 229a: N-(1-(3-Сульфамоиламино-2-цианофенокси)-2-метилпропан-2-ил)бутирамид
Получают по методике примера 215a из N-(1-(3-амино-2-цианофенокси)-2-метилпропан-2-ил)бутирамида (Пример 229b) и сульфамоилхлорида со 100% выходом. МС 355 (MH+).
Пример 229b: N-(1-(3-Амино-2-цианофенокси)-2-метилпропан-2-ил)бутирамид
Получают по методике примера 215b (Способ A) из N-(1-(2-циано-3-нитрофенокси)-2-метилпропан-2-ил)бутирамида (Пример 229c) со 100% выходом. МС 276 (MH+).
Пример 229c: N-(1-(2-Циано-3-нитрофенокси)-2-метилпропан-2-ил)бутирамид
Получают по методике примера 215c из N-(1-гидрокси-2-метилпропан-2-ил)бутирамида (Пример 229d) и 2,6-динитробензонитрила с 72% выходом. МС 306 (MH+).
Пример 229d: N-(1-Гидрокси-2-метилпропан-2-ил)бутирамид
Получают по методике, описанной в литературе (Boyd, R.N.; Hansen, R.H. J Am. Chem. Soc. 1953, 75, 5896) из 2-амино-2-метилпропан-1-ола и бутирилхлорида с 32% выходом. МС 160 (MH+).
Пример 230: 1-(1-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-2′-метилпропан-2′-ил)-3′-этилмочевина

Получают по методике примера 215 из 1-(1-(3-сульфамоиламино-2-цианофенокси)-2-метилпропан-2-ил)-3-этилмочевины (Пример 230a) с 37% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,92 (т, J=7,2 Гц, 3H), 1,27 (с, 6H), 2,90-2,93 (м, 2H), 4,21 (с, 2H), 5,63 (т, J=5,2 Гц, 1H), 5,95 (с, 1H), 6,59 (д, J=8,0 Гц, 1H), 6,72 (д, J=8,4 Гц, 1H), 7,42 (т, J=8,4 Гц, 1H), 7,94 (с, 1H), 8,34 (с, 1H), 10,94 (с, 1H). МС 356 (MH+).
Пример 230a: 1-(1-(3-Сульфамоиламино-2-цианофенокси)-2-метилпропан-2-ил)-3-этилмочевина
Получают по методике примера 215a из 1-(1-(3-амино-2-цианофенокси)-2-метилпропан-2-ил)-3-этилмочевины (Пример 230b) и сульфамоилхлорида со 100% выходом. МС 356 (MH+).
Пример 230b: 1-(1-(3-Амино-2-цианофенокси)-2-метилпропан-2-ил)-3-этилмочевина
Получают по методике примера 215b (Способ A) из 1-(1-(2-циано-3-нитрофенокси)-2-метилпропан-2-ил)-3-этилмочевины (Пример 230c) с 86% выходом. МС 277 (MH+).
Пример 230c: 1-(1-(2-Циано-3-нитрофенокси)-2-метилпропан-2-ил)-3-этилмочевина
Получают по методике примера 215c из 1-этил-3-(1-гидрокси-2-метилпропан-2-ил)мочевины (Пример 230d) и 2,6-динитробензонитрила с 65% выходом. МС 307 (MH+).
Пример 230d: 1-Этил-3-(1-гидрокси-2-метилпропан-2-ил)мочевина
Получают по методике примера 227d из 2-амино-2-метилпропан-1-ола и этилизоцианата с 94% выходом. МС 161 (MH+).
Пример 231: 4-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-2′-метилбутан-2′-ола
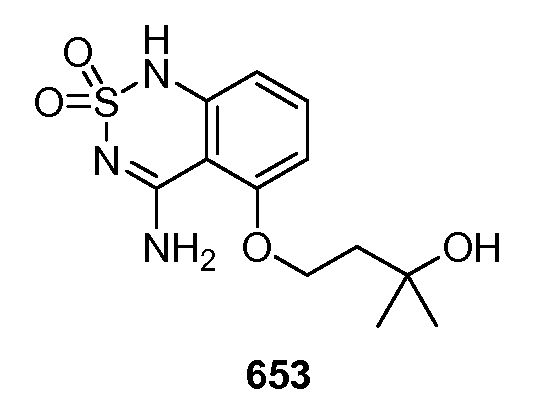
Получают по методике примера 215 из 4-(2-циано-3-(сульфамоиламино)фенокси)-2-метилбутан-2-илацетата (Пример 231a) с 20% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,15 (с, 6H), 1,89 (т, J=6,4 Гц, 2H), 4,22 (т, J=6,4 Гц, 2H), 4,62 (с, 1H), 6,57 (д, J=8,0 Гц, 1H), 6,73 (д, J=8,4 Гц, 1H), 7,43 (т, J=8,4 Гц, 1H), 8,22 (с, 1H), 8,30 (с, 1H), 10,87 (с, 1H). МС 300 (MH+).
Пример 231a: 4-(2-Циано-3-(сульфамоиламино)фенокси)-2-метилбутан-2-илацетат
Получают по методике примера 215a из 4-(3-амино-2-цианофенокси)-2-метилбутан-2-илацетата (Пример 231b) и сульфамоилхлорида со 100% выходом. МС 342 (MH+).
Пример 231b: 4-(3-Амино-2-цианофенокси)-2-метилбутан-2-илацетат
Получают по методике примера 215b (Способ A) из 4-(2-циано-3-нитрофенокси)-2-метилбутан-2-илацетата (Пример 231c). МС 263 (MH+).
Пример 231c: 4-(2-Циано-3-нитрофенокси)-2-метилбутан-2-илацетат
К раствору 2-(3-гидрокси-3-метилбутокси)-6-нитробензонитрила (Пример 231d) (250 мг, 1 ммоль), триэтиламина (3 экв.) и ДМАП (0,1 экв.) в сухом дихлорметане (20 мл) по каплям добавляют ацетилхлорид (1,5 экв.) при 0°С в атмосфере азота. Реакционную смесь затем перемешивают при 0°С - комнатной температуре в течение ночи. Реакционную смесь разбавляют EtOAc, промывают насыщенным раствором соли и сушат над Na2SO4. После выпаривания растворителя остаток очищают хроматографией на силикагеле, элюируя 20% EtOAc в гексане с получением указанного в заголовке соединения (137 мг, 47%). МС 293 (MH+).
Пример 231d: 2-(3-Гидрокси-3-метилбутокси)-6-нитробензонитрил
Получают по методике примера 215c из 3-метилбутан-1,3-диола и 2,6-динитробензонитрила с 81% выходом. МС 251 (MH+).
Пример 232: 2-((4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)метил)-2′-этилбутан-1′-ол

Получают по методике примера 215 из 2-этил-2-((2-метил-3-(сульфамоиламино)фенокси)метил)бутилацетата (Пример 232a) с 20% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,73-0,80 (м, 6H), 1,21-1,37 (м, 4H), 3,31-3,33 (м, 2H), 3,89 (с, 2H), 4,92 (ушир.с, 1H), 6,56 (д, J=8,0 Гц, 1H), 6,73 (д, J=8,4 Гц, 1H), 7,40 (т, J=8,4 Гц, 1H), 8,16 (ушир.с, 2H), 10,91 (ушир.с, 1H). МС 328 (MH+).
Пример 232a: 2-((2-Циано-3-(сульфамоиламино)фенокси)метил)-2-этилбутилацетат
Получают по методике примера 215a из 2-((3-амино-2-цианофенокси)метил)-2-этилбутилацетата (Пример 232b) и сульфамоилхлорида с 90% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,80 (т, J=7,6 Гц, 6H), 1,37-1,43 (м, 4H), 1,98 (с, 3H), 3,87 (с, 2H), 3,96 (с, 2H), 6,98 (д, J=8,8 Гц, 1H), 7,13 (д, J=8,4 Гц, 1H), 7,25 (с, 2H), 7,54 (т, J=8,4 Гц, 1H), 9,46 (с, 1H).
Пример 232b: 2-((3-Амино-2-цианофенокси)метил)-2-этилбутилацетат
Получают по методике примера 215b (Способ A) из 2-((2-циано-3-нитрофенокси)метил)-2-этилбутилацетата (Пример 232c) с 91% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,79 (т, J=7,6 Гц, 6H), 1,34-1,41 (м, 4H), 1,97 (с, 3H), 3,76 (с, 2H), 3,94 (с, 2H), 5,97 (с, 2H), 6,21 (д, J=8,0 Гц, 1H), 6,31 (д, J=8,4 Гц, 1H), 7,15 (т, J=8,0 Гц, 1H). МС 291 (MH+).
Пример 232c: 2-((2-Циано-3-нитрофенокси)метил)-2-этилбутилацетат
Получают по методике примера 231c из 2-(2-этил-2-(гидроксиметил)бутокси)-6-нитробензонитрила (Пример 232d) и ацетилхлорида с 82% выходом. МС 321 (MH+).
Пример 232d: 2-(2-Этил-2-(гидроксиметил)бутокси)-6-нитробензонитрил
Получают по методике примера 215c из 2,2-диэтилпропан-1,3-диола и 2,6-динитробензонитрила с 86% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,80 (т, J=7,6 Гц, 6H), 1,34 (кв., J=7,6 Гц, 4H), 3,33 (д, J=5,6 Гц, 2H), 3,96 (с, 2H), 4,57 (т, J=5,2 Гц, 1H), 7,74-7,76 (м, 1H), 7,84-7,90 (м, 2H).
Пример 233: 3-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-2′,2′-диметилпропан-1′-ол

Получают по методике примера 215 из 3-(2-циано-3-(сульфамоиламино)фенокси)-2,2-диметилпропилацетата (Пример 233a) с 30% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,94 (с, 6H), 3,29-3,31 (м, 2H), 3,88 (с, 2H), 5,01 (т, J=4,4 Гц, 1H), 6,58 (д, J=8,4 Гц, 1H), 6,71 (д, J=8,4 Гц, 1H), 7,42 (т, J=8,0 Гц, 1H), 8,14 (с, 1H), 8,32 (с, 1H), 10,92 (с, 1H). МС 300 (MH+).
Пример 233a: 3-(2-Циано-3-(сульфамоиламино)фенокси)-2,2-диметилпропилацетат
Получают по методике примера 215a из 3-(3-амино-2-цианофенокси)-2,2-диметилпропилацетата (Пример 233b) и сульфамоилхлорид с 60% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,99 (с, 6H), 1,98 (с, 3H), 3,85 (с, 2H), 3,91 (с, 2H), 6,91 (д, J=8,4 Гц, 1H), 7,12 (д, J=8,0 Гц, 1H), 7,23 (с, 2H), 7,52 (т, J=8,0 Гц, 1H), 9,45 (с, 1H).
Пример 233b: 3-(3-Амино-2-цианофенокси)-2,2-диметилпропилацетат
Получают по методике примера 215b (Способ A) из 3-(2-циано-3-нитрофенокси)-2,2-диметилпропилацетата (Пример 233c) с 77% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,98 (с, 6H), 2,00 (с, 3H), 3,75 (с, 2H), 3,90 (с, 2H), 5,99 (с, 2H), 6,17 (д, J=8,4 Гц, 1H), 6,31 (д, J=8,4 Гц, 1H), 7,15 (т, J=8,0 Гц, 1H).
Пример 233c: 3-(2-Циано-3-нитрофенокси)-2,2-диметилпропилацетат
Получают по методике примера 231c из 2-(3-гидрокси-2,2-диметилпропокси)-6-нитробензонитрил (Пример 233d) и ацетилхлорида с 66% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,04 (с, 6H), 2,00 (с, 3H), 3,95 (с, 2H), 4,02 (с, 2H), 7,70-7,72 (м, 1H), 7,85-7,92 (м, 2H).
Пример 233d: 2-(3-Гидрокси-2,2-диметилпропокси)-6-нитробензонитрил
Получают по методике примера 215c из 2,2-диметилпропан-1,3-диола и 2,6-динитробензонитрила с 73% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,94 (с, 6H), 3,29-3,31 (м, 2H), 3,95 (с, 2H), 4,69 (т, J=5,6 Гц, 1H), 7,69-7,71 (м, 1H), 7,84-7,90 (м, 2H).
Пример 234: N-(4-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)бутил)ацетамид

Получают по методике примера 215 из N-(4-(2-циано-3-(сульфамоиламино)фенокси)бутил)ацетамида (Пример 234a) с 30% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,48-1,51 (м, 2H), 1,77-1,81 (м, 5H), 3,03-3,08 (м, 2H), 4,14 (т, J=6,0 Гц, 2H), 6,59 (д, J=8,0 Гц, 1H), 6,73 (д, J=8,4 Гц, 1H), 7,43 (т, J=8,4 Гц, 1H), 7,78 (с, 1H), 7,84 (ушир.с, 1H), 8,32 (с, 1H), 10,93 (с, 1H). МС 327 (MH+).
Пример 234a: N-(4-(2-Циано-3-(сульфамоиламино)фенокси)бутил)ацетамид
Получают по методике примера 215a из N-(4-(3-амино-2-цианофенокси)бутил)ацетамида (Пример 234b) и сульфамоилхлорида со 100% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,51-1,54 (м, 2H), 1,70-1,73 (м, 2H), 1,77 (с, 3H), 3,04-3,09 (м, 2H), 4,09 (т, J=6,4 Гц, 2H), 6,93 (д, J=8,4 Гц, 1H), 7,13 (д, J=8,0 Гц, 1H), 7,25 (с, 2H), 7,54 (т, J=8,0 Гц, 1H), 7,85 (ушир.с, 1H), 9,42 (с, 1H).
Пример 234b: N-(4-(3-Амино-2-цианофенокси)бутил)ацетамид
Получают по методике примера 215b (Способ A) из N-(4-(2-циано-3-нитрофенокси)бутил)ацетамида (Пример 234c) с 85% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,49-1,54 (м, 2H), 1,66-1,70 (м, 2H), 1,77 (с, 3H), 3,03-3,08 (м, 2H), 3,97 (т, J=6,8 Гц, 2H), 5,95 (с, 2H), 6,18 (д, J=8,0 Гц, 1H), 6,31 (д, J=7,6 Гц, 1H), 7,15 (т, J=8,4 Гц, 1H), 7,83 (ушир.с, 1H).
Пример 234c: N-(4-(2-Циано-3-нитрофенокси)бутил)ацетамид
К раствору 2-(4-аминобутокси)-6-нитробензонитрила (Пример 234d) (235 мг, 1,0 ммоль), триэтиламина (3 экв.) и ДМАП (0,1 экв.) в сухом дихлорметане (20 мл) по каплям добавляют ацетилхлорид (1,5 экв.) при 0°С в атмосфере азота. Реакционную смесь затем перемешивают при 0°С - КТ в течение ночи. Реакционную смесь разбавляют EtOAc, промывают насыщенным раствором соли и сушат над Na2SO4. После выпаривания растворителя остаток очищают хроматографией на силикагеле, элюируя 50% EtOAc в гексане с получением указанного в заголовке соединения (158 мг, 57%). МС 278 (MH+).
Пример 234d: 2-(4-Аминобутокси)-6-нитробензонитрил
Раствор трет-бутил 4-(2-циано-3-нитрофенокси)бутилкарбамата (Пример 234e) (671 мг, 2 ммоль) в ДХМ/ТФК (1:1, 20 мл) перемешивают при комнатной температуре в течение 2 ч. Растворитель удаляют в вакууме с получением указанного в заголовке соединения (698 мг, 100%). МС 236 (MH+).
Пример 234e: трет-Бутил 4-(2-циано-3-нитрофенокси)бутилкарбамат
Получают по методике примера 215c из трет-бутил 4-гидроксибутилкарбамата и 2,6-динитробензонитрила с 7% выходом в виде твердого вещества бледно-желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,35 (с, 9H), 1,52-1,55 (м, 2H), 1,72-1,76 (м, 2H), 2,94-2,99 (м, 2H), 4,24 (т, J=6,8 Гц, 2H), 6,86 (ушир.с, 1H), 7,69-7,72 (м, 1H), 7,85-7,90 (м, 2H).
Пример 235: 4-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)бутилсульфамат

Получают по методике примера 215 из 4-(2-циано-3-(сульфамоиламино)фенокси)бутилсульфамат (Пример 235a) с 31% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,74-1,79 (м, 2H), 1,85-1,91 (м, 2H), 4,07 (т, J=6,4 Гц, 2H), 4,18 (т, J=6,8 Гц, 2H), 6,58-6,60 (м, 1H), 6,74 (д, J=8,4 Гц, 1H), 7,42-7,46 (м, 3H), 7,79 (с, 1H), 8,32 (с, 1H), 10,93 (с, 1H). МС 365 (MH+).
Пример 235a: 4-(2-Циано-3-(сульфамоиламино)фенокси)бутилсульфамат
Получают по методике примера 215a из 2-амино-6-(4-(трет-бутилдиметилсилилокси)бутокси)бензонитрила (Пример 235b) и сульфамоилхлорида с 63% выходом. МС 382 (M++H20).
Пример 235b: 2-Амино-6-(4-(трет-бутилдиметилсилилокси)бутокси)бензонитрил
Получают по методике примера 215b (Способ A) из 2-(4-(трет-бутилдиметилсилилокси)бутокси)-6-нитробензонитрила (Пример 235c) с 76% выходом. МС 321 (MH+).
Пример 235c: 2-(4-(трет-Бутилдиметилсилилокси)бутокси)-6-нитробензонитрила
Получают по методике примера 215c из 4-(трет-бутилдиметилсилилокси)бутан-1-ола и 2,6-динитробензонитрила с 25% выходом в виде твердого вещества бледно-желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,01 (с, 6H), 0,81-0,83 (м, 9H), 1,61-1,66 (м, 2H), 1,76-1,81 (м, 2H), 3,63 (т, J=6,8 Гц, 2H), 4,26 (т, J=6,4 Гц, 2H), 7,68-7,70 (м, 1H), 7,84-7,89 (м, 2H).
Пример 236: 4-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-бутан-1′-ол
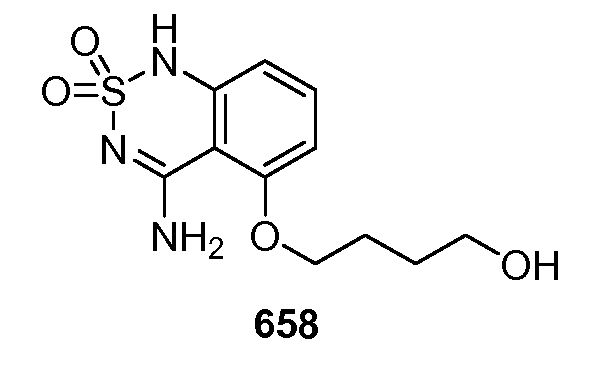
Получают по методике примера 215 из 4-(2-циано-3-(сульфамоиламино)фенокси)бутилсульфамата (Пример 235a) с 2% выходом.1H ЯМР (400 МГц, CD3OD) δ 1,69-1,73 (м, 2H), 1,95-1,99 (м, 2H), 3,63 (т, J=6,4 Гц, 2H), 4,24 (т, J=6,4 Гц, 2H), 6,61-6,63 (м, 1H), 6,75-6,77 (м, 1H), 7,45 (м, J=8,0 Гц, 1H). МС 286 (MH+).
Пример 237: 3-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-2′-метилпропан-1′-ол

Получают по методике примера 215 из 3-(2-циано-3-(сульфамоиламино)фенокси)-2-метилпропилацетата (Пример 237a) с 41% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,94 (д, J=6,4 Гц, 3H), 2,09-2,13 (м, 1H), 3,36-3,42 (м, 1H), 3,46-3,50 (м, 1H), 4,05 (д, J=6,4 Гц, 2H), 4,84 (т, J=5,6 Гц, 1H), 6,57 (д, J=7,6 Гц, 1H), 6,70 (д, J=8,4 Гц, 1H), 7,42 (т, J=8,4 Гц, 1H), 8,05 (ушир.с, 1H), 8,24 (ушир.с, 1H), 10,91 (с, 1H). МС 286 (MH+).
Пример 237a: 3-(2-Циано-3-(сульфамоиламино)фенокси)-2-метилпропилацетат
Получают по методике примера 215a из 3-(3-амино-2-цианофенокси)-2-метилпропилацетата (Пример 237b) и сульфамоилхлорида с 78% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,02 (д, J=6,8 Гц, 3H), 2,01 (с, 3H), 2,23-2,27 (м, 1H), 3,99-4,07 (м, 4H), 6,94 (д, J=8,8 Гц, 1H), 7,14 (д, J=8,0 Гц, 1H), 7,26 (с, 2H), 7,55 (т, J=8,0 Гц, 1H), 9,47 (с, 1H).
Пример 237b: 3-(3-Амино-2-цианофенокси)-2-метилпропилацетат
Получают по методике примера 215b (Способ A) из 3-(2-циано-3-нитрофенокси)-2-метилпропилацетата (Пример 237c) с 73% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,99 (д, J=7,2 Гц, 3H), 2,00 (с, 3H), 2,19-2,24 (м, 1H), 3,91 (д, J=5,2 Гц, 2H), 3,97-4,06 (м, 2H), 5,98 (с, 2H), 6,19 (д, J=8,0 Гц, 1H), 6,32 (д, J=8,4 Гц, 1H), 7,16 (т, J=8,0 Гц, 1H).
Пример 237c: 3-(2-Циано-3-нитрофенокси)-2-метилпропилацетат
Получают по методике примера 231c из 2-(3-гидрокси-2-метилпропокси)-6-нитробензонитрила (Пример 237d) и ацетилхлорида с 41% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,04 (д, J=6,8 Гц, 3H), 2,00 (с, 3H), 2,28-2,33 (м, 1H), 4,05-4,08 (м, 2H), 4,18 (д, J=6,0 Гц, 2H), 7,71-7,73 (м, 1H), 7,86-7,92 (м, 2H).
Пример 237d: 2-(3-Гидрокси-2-метилпропокси)-6-нитробензонитрил
Получают по методике примера 215c их 2-метилпропан-1,3-диола и 2,6-динитробензонитрила с 37% выходом. МС 237 (MH+).
Пример 238: 3-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)пропан-1′-ол

Получают по методике примера 215 из 3-(2-циано-3-(сульфамоиламино)фенокси)пропилсульфамата (Пример 238a) с 6% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,92-1,97 (м, 2H), 3,55-3,59 (м, 2H), 4,20 (т, J=6,4 Гц, 2H), 4,79 (т, J=4,8 Гц, 1H), 6,57-6,59 (м, 1H), 6,71- 6,73 (м, 1H), 7,43 (т, J=8,4 Гц, 1H), 8,12 (ушир.с, 1H), 8,28 (ушир.с, 1H), 10,90 (с, 1H). МС 272 (MH+).
Пример 238a: 3-(2-Циано-3-(сульфамоиламино)фенокси)пропилсульфамат
Получают по методике примера 215a из 2-амино-6-(3-гидроксипропокси)бензонитрила (Пример 238b) и сульфамоилхлорида с 30% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 2,11- 2,14 (м, 2H), 4,16-4,21 (м, 4H), 6,96 (д, J=8,0 Гц, 1H), 7,15 (д, J=7,6 Гц, 1H), 7,26 (с, 2H), 7,49 (с, 2H), 7,56 (т, J=8,4 Гц, 1H), 9,46 (с, 1H).
Пример 238b: 2-Амино-6-(3-гидроксипропокси)бензонитрил
Получают по методике примера 215b (Способ A) из 2-(3-гидроксипропокси)-6-нитробензонитрила (Пример 238c) со 100% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,79-1,85 (м, 2H), 3,52-3,56 (м, 2H), 4,04 (т, J=6,4 Гц, 2H), 4,54 (т, J=5,2 Гц, 1H), 5,93 (с, 2H), 6,19 (д, J=8,0 Гц, 1H), 6,30 (д, J=8,4 Гц, 1H), 7,15 (т, J=8,0 Гц, 1H).
Пример 238c: 2-(3-Гидроксипропокси)-6-нитробензонитрил
Получают по методике примера 215c из пропан-1,3-диола и 2,6-динитробензонитрила с 61% выходом в виде твердого вещества бледно-желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,89-1,93 (м, 2H), 3,56-3,61 (м, 2H), 4,30 (т, J=6,4 Гц, 2H), 4,61 (т, J=5,2 Гц, 1H), 7,71-7,74 (м, 1H), 7,85-7,91 (м, 2H).
Пример 239: 5-(Бутилтио)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 215 из 2-сульфамоиламино-6-(бутилтио)бензонитрила (Пример 239a) с 12% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,85 (т, J=7,6 Гц, 3H), 1,34-1,41 (м, 2H), 1,49-1,56 (м, 2H), 2,97 (т, J=7,2 Гц, 2H), 6,87 (д, J=8,4 Гц, 1H), 7,12 (д, J=7,6 Гц, 1H), 7,41 (т, J=7,6 Гц, 1H), 8,12 (ушир.с, 2H), 11,02 (ушир.с, 1H). МС 286 (MH+).
Пример 239a: 2-Сульфамоиламино-6-(бутилтио)бензонитрил
Получают по методике примера 215a из 2-амино-6-(бутилтио)бензонитрила (Пример 239b) с 76% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,88 (т, J=7,2 Гц, 3H), 1,36-1,45 (м, 2H), 1,54-1,61 (м, 2H), 3,07 (т, J=7,6 Гц, 2H), 7,25-7,27 (м, 3H), 7,33-7,36 (м, 1H), 7,57 (т, J=8,4 Гц, 1H), 9,50 (с, 1H).
Пример 239b: 2-Амино-6-(бутилтио)бензонитрил
Получают по методике примера 215b (Способ A) из 2-нитро-6-(бутилтио)бензонитрила (Пример 239c) с 87% выходом.1H ЯМР (400 МГц, CDCl3) δ 0,93 (т, J=7,2 Гц, 3H), 1,42-1,52 (м, 2H), 1,63-1,70 (м, 2H), 2,97 (т, J=6,8 Гц, 2H), 4,43 (ушир.с, 2H), 6,52-6,54 (м, 1H), 6,67-6,69 (м, 1H), 7,21 (т, J=8,0 Гц, 1H).
Пример 239c: 2-Нитро-6-(бутилтио)бензонитрил
Получают по методике примера 215c из бутан-1-тиола и 2,6-динитробензонитрила с 90% выходом.1H ЯМР (400 МГц, CDCl3) δ 0,97 (т, J=7,2 Гц, 3H), 1,42-1,55 (м, 2H), 1,70-1,77 (м, 2H), 3,09 (т, J=7,2 Гц, 2H), 7,63-7,69 (м, 2H), 7,99-8,01 (м, 1H).
Пример 240: 6-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)гексилсульфамат

Получают по методике примера 215 из 6-(2-циано-3-(сульфамоиламино)фенокси)гексилсульфамата (Пример 240a) с 46% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,03-1,05 (м, 4H), 1,28 (м, 2H), 1,45 (м, 2H), 3,64 (т, J=6,4 Гц, 2H), 3,78 (т, J=6,4 Гц, 2H), 6,22 (д, J=7,6 Гц, 1H), 6,37 (д, J=7,6 Гц, 1H), 7,02 (с, 2H), 7,07 (т, J=7,6 Гц, 1H), 7,44 (с, 1H), 7,96 (с, 1H), 10,56 (с, 1H). МС 393 (MH+).
Пример 240a: 6-(2-Циано-3-(сульфамоиламино)фенокси)гексилсульфамат
Получают по методике примера 215a из 2-амино-6-(6-гидроксигексилокси)бензонитрила (Пример 240b) и сульфамоилхлорида с 20% выходом. МС 393 (MH+).
Пример 240b: 2-Амино-6-(6-гидроксигексилокси)бензонитрил
Получают по методике примера 215b (Способ A) из 2-(6-гидроксигексилокси)-6-нитробензонитрила (Пример 240c) с 99% выходом. МС 235 (MH+).
Пример 240c: 2-(6-Гидроксигексилокси)-6-нитробензонитрил
Получают по методике примера 215c из гексан-1,6-диола и 2,6-динитробензонитрила с 88% выходом в виде твердого вещества бледно-желтого цвета. МС 265 (MH+).
Пример 241: 5-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)пентилсульфамат

Получают по методике примера 215 из 5-(2-циано-3-(сульфамоиламино)-фенокси)пентилсульфамат (Пример 241a) с 44% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,09 (м, 2H), 1,33 (м, 2H), 1,47 (м, 2H), 3,66 (т, J=6,6 Гц, 2H), 3,79 (т, J=6,6 Гц, 2H), 6,22 (д, J=8,0 Гц, 1H), 6,37 (д, J=8,0 Гц, 1H), 7,03 (с, 2H), 7,07 (т, J=8,0 Гц, 1H), 7,43 (с, 1H), 7,95 (с, 1H), 10,57 (с, 1H). МС 379 (MH+).
Пример 241a: 5-(2-Циано-3-(сульфамоиламино)фенокси)пентилсульфамат
Получают по методике примера 215a из 2-амино-6-(5-(трет-бутилдиметилсилилокси)пентилокси)бензонитрила (Пример 241b) и сульфамоилхлорида с 26% выходом. МС 379 (MH+).
Пример 241b: 2-Амино-6-(5-(трет-бутилдиметилсилилокси)пентилокси)бензонитрил
Получают по методике примера 215b (Способ А) из 2-(5-(трет-бутилдиметилсилилокси)пентилокси)-6-нитробензонитрила (Пример 241c) с 93% выходом. МС 335 (MH+).
Пример 241c: 2-(5-(трет-Бутилдиметилсилилокси)пентилокси)-6-нитробензонитрил
Получают по методике примера 215c из 5-(трет-бутилдиметилсилилокси)пентан-1-ола и 2,6-динитробензонитрила в виде твердого вещества бледно-желтого цвета с 46% выходом. МС 365 (MH+).
Пример 242: 5-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)пентан-1′-ол

Получают по методике примера 215 из 2-сульфамоиламино-6-(5-гидроксипентилокси)бензонитрила (Пример 242a) с 32% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,39-1,49 (м, 4H), 1,77-1,84 (м, 2H), 3,31-3,44 (м, 2H), 4,14 (т, J=6,4 Гц, 2H), 4,35 (м, 1H), 6,59 (д, J=8,0 Гц, 1H), 6,74 (д, J=8,0 Гц, 1H), 7,44 (т, J=8,0 Гц, 1H), 7,81 (с, 1H), 8,34 (с, 1H), 10,93 (с, 1H). МС 300 (MH+).
Пример 242a: 2-Сульфамоиламино-6-(5-гидроксипентилокси)бензонитрил
Получают по методике примера 215a из 2-амино-6-(5-(трет-бутилдиметилсилилокси)пентилокси)бензонитрила (Пример 241b) и сульфамоилхлорид с 4% выходом. МС 300 (MH+).
Пример 243: 1-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-2′,2′,4′-триметилпентан-3′-ол

Получают по методике примера 215 из 1-(2-циано-3-(сульфамоиламино)-фенокси)-2,2,4-триметилпентан-3-илацетата (Пример 243a) с 35% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,76-0,78 (д, 3H), 0,93 (с, 6H), 1,05 (с, 3H), 1,86-1,89 (м, 1H), 3,18-3,19 (д, 1H), 3,73-3,75 (д, 1H), 3,99-4,02 (д, 1H), 4,98-4,99 (д, 1H), 6,57-6,59 (д, J=8 Гц, 1H), 6,70-6,72 (д, J=8 Гц, 1H), 7,43 (т, J=8 Гц, 1H), 8,29 (с, 1H), 8,43 (с, 1H), 10,88 (с, 1H). МС 342 (MH+).
Пример 243a: 1-(2-Циано-3-(сульфамоиламино)фенокси)-2,2,4-триметилпентан-3-илацетат
Получают по методике примера 215a из 1-(3-амино-2-цианофенокси)-2,2,4-триметилпентан-3-илацетата (Пример 243b) и сульфамоилхлорида с 90% выходом. МС 384 (MH+).
Пример 243b: 1-(3-Амино-2-цианофенокси)-2,2,4-триметилпентан-3-илацетат
Получают по методике примера 215b (Способ A) из 1-(2-циано-3-нитрофенокси)-2,2,4-триметилпентан-3-илацетат (Пример 243c) с 83% выходом. МС 305 (MH+).
Пример 243c: 1-(2-Циано-3-нитрофенокси)-2,2,4-триметилпентан-3-илацетат
Получают по методике примера 231c из 2-(3-гидрокси-2,2,4-триметилпентилокси)-6-нитробензонитрила (Пример 243d) и ацетилхлорида с 50% выходом. МС 335 (MH+).
Пример 243d: 2-(3-Гидрокси-2,2,4-триметилпентилокси)-6-нитробензонитрил
Получают по методике примера 215c из 2,2,4-триметилпентан-1,3-диола и 2,6-динитробензонитрила с 90% выходом. МС 293 (MH+).
Пример 244: 5-(4-(Метилтио)бутокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 215 из 2-сульфамоиламино-6-(4-(метилтио)бутокси)бензонитрила (Пример 244a) с 79% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,63-1,67 (м, 2H), 1,86-1,90 (м, 2H), 2,02 (с, 3H), 2,48-2,53 (м, 2H), 4,16 (т, 2H), 6,57-6,60 (д, J=8,4 Гц, 1H), 6,72-6,74 (д, J=8,4 Гц, 1H), 7,43 (т, J=8 Гц, 1H), 7,80 (с, 1H), 8,35 (с, 1H), 10,92 (с, 1H). МС 316 (MH+).
Пример 244a: 2-Сульфамоиламино-6-(4-(метилтио)бутокси)бензонитрил
Получают по методике примера 215a из 2-амино-6-(4-(метилтио)бутокси)бензонитрила (Пример 244b) и сульфамоилхлорида с 66% выходом. МС 316 (MH+).
Пример 244b: 2-Амино-6-(4-(метилтио)бутокси)бензонитрил
Получают по методике примера 215b (Способ A) из 2-(4-(метилтио)бутокси)-6-нитробензонитрила (Пример 244c) с 95% выходом. МС 237 (MH+).
Пример 244c: 2-(4-(Метилтио)бутокси)-6-нитробензонитрил
Получают по методике примера 215c из 4-(метилтио)бутан-1-ола и 2,6-динитробензонитрила с 89% выходом. МС 267 (MH+).
Пример 245: 5-(4-(Метилсульфинил)бутокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид
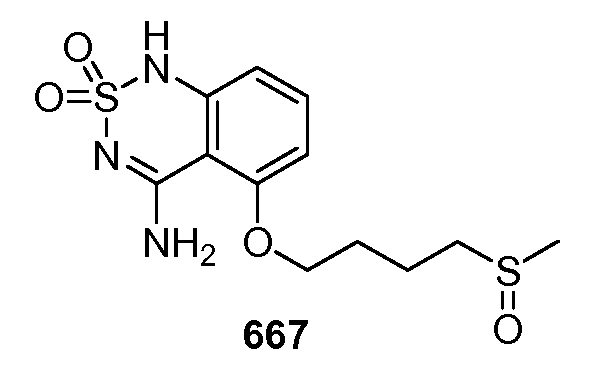
К раствору 5-(4-(метилтио)бутокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксида (Пример 244) (79 мг, 0,25 ммоль) в ДХМ/CH3CO2H (20:1, 20 мл) добавляют MCPBA (1,0 экв.) при комнатной температуре. Реакционную смесь затем перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают при пониженном давлении и остаток очищают хроматографией на силикагеле, элюируя с 15% MeOH в дихлорметан с получением указанного в заголовке соединения (74 мг, 90%) в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,74-1,77 (м, 2H), 1,88-1,95 (м, 2H), 2,50 (с, 3H), 2,68-2,73 (м, 1H), 2,77-2,83 (м, 1H), 4,19 (т, 2H), 6,58-6,60 (д, J=8,4 Гц, 1H), 6,73-6,75 (д, J=8,0 Гц, 1H), 7,44 (т, J=8,0 Гц, 1H), 7,79 (с, 1H), 8,33 (с, 1H), 10,92 (с, 1H). МС 332 (MH+).
Пример 246: 5-(4-(Метилсульфонил)бутокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид
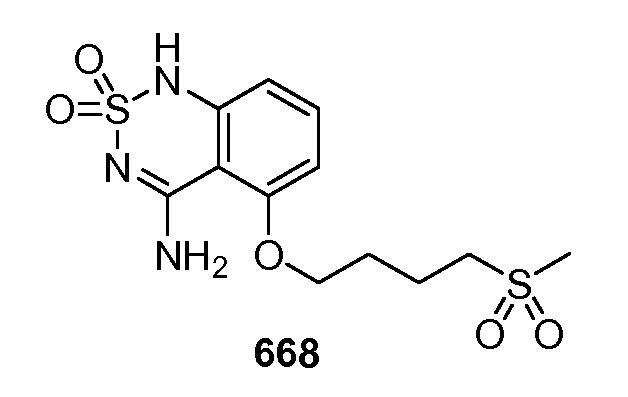
Получают по методике примера 245 из 5-(4-(метилтио)бутокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксида (Пример 244) взаимодействием с 3 эквивалентами MCPBA в виде твердого вещества белого цвета с 88% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,80-1,82 (м, 2H), 1,91-1,95 (м, 2H), 2,93 (с, 3H), 3,18 (т, 2H), 4,18 (т, 2H), 6,58-6,60 (д, J=8,4 Гц, 1H), 6,73-6,75 (д, J=8,0 Гц, 1H), 7,44 (т, J=8,0 Гц, 1H), 7,79 (с, 1H), 8,34 (с, 1H), 10,92 (с, 1H). МС 348 (MH+).
Пример 247: 5-(3-(Метилтио)пропокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 215 из 2-сульфамоиламино-6-(3-(метилтио)пропокси)бензонитрила (Пример 247a) с 69% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 2,05 (с, 3H), 2,08 (м, 2H), 2,59 (т, J=7,2 Гц, 2H), 4,21 (т, J=6,4 Гц, 2H), 6,59-6,61 (д, J=8,0 Гц, 1H), 673-6,75 (д, J=8,8 Гц, 1H), 7,44 (т, J=8,0 Гц, 1H), 7,79 (с, 1H), 8,33 (с, 1H), 10,93 (с, 1H). МС 302 (MH+).
Пример 247a: 2-Сульфамоиламино-6-(3-(метилтио)пропокси)бензонитрил
Получают по методике примера 215a из 2-амино-6-(3-(метилтио)пропокси)бензонитрила (Пример 247b) и сульфамоилхлорида с 69% выходом. МС 302 (MH+).
Пример 247b: 2-Амино-6-(3-(метилтио)пропокси)бензонитрил
Получают по методике примера 215b (Способ A) из 2-(3-(метилтио)пропокси)-6-нитробензонитрила (Пример 247c) с 98% выходом. МС 223 (MH+).
Пример 247c: 2-(3-(Метилтио)пропокси)-6-нитробензонитрил
Получают по методике примера 215c из 4-(метилтио)бутан-1-ола и 2,6-динитробензонитрила с 89% выходом. МС 253 (MH+).
Пример 248: 5-(3-(Метилсульфинил)пропокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 245 из 5-(3-(метилтио)пропокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксида (Пример 247) взаимодействием с 1,0 эквивалентом MCPBA в виде твердого вещества белого цвета с 90% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 2,18-2,22 (м, 2H), 2,54 (с, 3H), 2,75-2,78 (м, 1H), 2,89-2,93 (м, 1H), 4,26 (т, J=6,4 Гц, 2H), 6,60-6,61 (д, J=8,4 Гц, 1H), 6,73-6,75 (д, J=8,0 Гц, 1H), 7,44 (т, J=8,0 Гц, 1H), 7,83 (с, 1H), 8,30 (с, 1H), 10,92 (с, 1H). МС 318 (MH+).
Пример 249: 5-(3-(Метилсульфонил)пропокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 245 из 5-(3-(метилтио)пропокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксида (Пример 247) взаимодействием с 3,0 эквивалентами MCPBA с 87% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,24-2,27 (м, 2H), 3,00 (с, 3H), 3,26 (т, J=7,6 Гц, 2H), 4,24 (т, J=6,4 Гц, 2H), 6,60-6,62 (д, J=8,0 Гц, 1H), 6,72-6,74 (д, J=8,0 Гц, 1H), 7,45 (т, J=8,0 Гц, 1H), 7,79 (с, 1H), 8,31 (с, 1H), 10,93 (с, 1H). МС 334 (MH+).
Пример 250: 5-(2-(2-Этоксиэтокси)этокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 215 из 2-сульфамоиламино-6-(2-(2-этоксиэтокси)этокси)бензонитрила (Пример 250a) с 52% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,05 (т, J=7,2 Гц, 3H), 3,37-3,43 (м, 2H), 3,47 (т, 2H), 3,58 (т, 2H), 3,81 (т, 2H), 4,26 (т, 2H), 6,60-6,62 (д, J=8,0 Гц, 1H), 6,73-6,75 (д, J=8,0 Гц, 1H), 7,45 (т, J=8,4 Гц, 1H), 7,99 (с, 1H), 8,32 (с, 1H), 10,97 (с, 1H). МС 330 (MH+).
Пример 250a: 2-Сульфамоиламино-6-(2-(2-этоксиэтокси)этокси)бензонитрил
Получают по методике примера 215a из 2-амино-6-(2-(2-этоксиэтокси)этокси)бензонитрила (Пример 250b) и сульфамоилхлорида с 69% выходом. МС 330 (MH+).
Пример 250b: 2-Амино-6-(2-(2-этоксиэтокси)этокси)бензонитрил
Получают по методике примера 215b (Способ A) из 2-(2-(2-этоксиэтокси)этокси)-6-нитробензонитрила (Пример 250c) с 98% выходом. МС 251 (MH+).
Пример 250c: 2-(2-(2-Этоксиэтокси)этокси)-6-нитробензонитрил
Получают по методике примера 215c из 2-(2-этоксиэтокси)этанола и 2,6-динитробензонитрила с 66% выходом. МС 281 (MH+).
Пример 251: 5-(3-Метилциклопентилокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 215 из 2-сульфамоиламино-6-(3-метилциклопентилокси)бензонитрила (Пример 251a) с 45% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,97-1,04 (м, 3H), 1,28-1,37 (м, 2H), 1,75-2,03 (м, 4H), 2,31-2,38 (м, 1H), 4,95-5,02 (м, 1H), 6,56-6,58 (д, J=7,6 Гц, 1H), 6,67-6,69 (д, J=8,4 Гц, 1H), 7,42 (т, J=8,4 Гц, 1H), 7,69-7,72 (м, 1H), 8,30-8,36 (м, 1H), 10,92 (с, 1H). МС 296 (MH+).
Пример 251a: 2-Сульфамоиламино-6-(3-метилциклопентилокси)бензонитрил
Получают по методике примера 215a из 2-амино-6-(3-метилциклопентилокси)бензонитрила (Пример 251b) и сульфамоилхлорида с 52% выходом. МС 296 (MH+).
Пример 251b: 2-Амино-6-(3-метилциклопентилокси)бензонитрил
Получают по методике примера 215b (Способ A) из 2-(3-метилциклопентилокси)-6-нитробензонитрила (Пример 251c) с 98% выходом. МС 217 (MH+).
Пример 251c: 2-(3-Метилциклопентилокси)-6-нитробензонитрил
Получают по методике примера 215c из 3-метилциклопентанола и 2,6-динитробензонитрила с 70% выходом. МС 247 (MH+).
Пример 252: 1-(3-(4-Амино-2,2-диоксид-1H-бензо[c][1,2,6]тиадиазин-5-илокси)-2′,2′-диметилпропил)-3′-(4"-метоксибензил)мочевина

Получают по методике примера 215 из 1-(3-(3-сульфамоиламино-2-цианофенокси)-2,2-диметилпропил)-3-(4-метоксибензил)мочевины (Пример 252a) с 77% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,92 (с, 6H), 3,06 (д, J=6,4 Гц, 2H), 3,32 (с, 2H), 3,67 (с, 3H), 4,06 (д, J=6,0 Гц, 2H), 6,29 (т, J=6,0 Гц, 2H), 6,61 (д, J=8,0 Гц, 1H), 6,71 (д, J=8,0 Гц, 1H), 6,74 (д, J=8,8 Гц, 2H), 7,06 (д, J=8,8 Гц, 2H), 7,44 (т, J=8,0 Гц, 1H), 8,12 (с, 1H), 8,34 (с, 1H), 10,90 (с, 1H). МС 462 (MH+).
Пример 252a: 1-(3-(3-Сульфамоиламино-2-цианофенокси)-2,2-диметилпропил)-3-(4-метоксибензил)мочевина
Получают по методике примера 215a из 1-(3-(3-амино-2-цианофенокси)-2,2-диметилпропил)-3-(4-метоксибензил)мочевины (Пример 252b) и сульфамоилхлорида с 100% выходом. МС 462 (MH+).
Пример 252b: 1-(3-(3-Амино-2-цианофенокси)-2,2-диметилпропил)-3-(4-метоксибензил)мочевина
Получают по методике примера 215b (Способ B) из 1-(3-гидрокси-2,2-диметилпропил)-3-(4-метоксибензил)мочевины (Пример 252c) и 2-амино-6-фторбензонитрила с 60% выходом. МС 383 (MH+).
Пример 252c: 1-(3-Гидрокси-2,2-диметилпропил)-3-(4-метоксибензил)мочевина
Получают по методике примера 227d из 3-амино-2,2-диметилпропан-1-ола и 4-метоксибензилизоцианата со 100% выходом. МС 267 (MH+).
Пример 253: 5-(проп-1-инил)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 215 из 2-сульфамоиламино-6-(3-(триметилсилил)проп-1-инил)бензонитрила (Пример 253a) с 10% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,28 (с, 2H), 2,16 (с, 3H), 6,99-7,01 (д, J=8,4 Гц, 1H), 7,21-7,23 (д, J=7,8 Гц, 1H), 7,45 (т, J=7,8 Гц, 1H). МС 236 (MH+).
Пример 253a: 2-Сульфамоиламино-6-(3-(триметилсилил)проп-1-инил)бензонитрил
Раствор 2-амино-6-(3-(триметилсилил)проп-1-инил)бензонитрила (Пример 253b) (557 мг, 2,0 ммоль) и NH2SO2NH2 (0,96 г, 10 ммоль) в сухом 1,4-диоксане (50 мл) кипятят с обратным холодильником в атмосфере азота в течение 2 дней. Растворитель выпаривают при пониженном давлении и остаток очищают хроматографией на силикагеле, элюируя 70% EtOAc в гексане с получением указанного в заголовке соединения (31 мг, 5%) в виде твердого вещества белого цвета. МС 308 (MH+).
Пример 253b: 2-Амино-6-(3-(триметилсилил)проп-1-инил)бензонитрил
К перемешиваемому раствору триметил(проп-2-инил)силана (1,12 г, 10 ммоль), 2-амино-6-бромбензонитрила (Klaubert, D. H.; Sellstedt, J. H.; Guinosso, C. J.; Capetola, R. J.; Bell, S. C. J. Med. Chem. 1981, 24, 742) (1,0 г, 5 ммоль), CuI (0,01 экв.) в триэтиламине (50 мл) добавляют Pd(PPh3)4 (0,1 экв.) при комнатной температуре в атмосфере азота. Реакционную смесь затем кипятят с обратным холодильником в атмосфере азота в течение ночи. Растворитель выпаривают и остаток титруют с EtOAc/водой. Органический слой отделяют, промывают насыщенным раствором соли и сушат над Na2SO4. После выпаривания растворителя остаток очищают хроматографией на силикагеле, элюируя 15% EtOAc в гексане с получением указанного в заголовке соединения (1,43 г, 63%) в виде жидкости. МС 229 (MH+).
Пример 254: 5-((2-Метилциклопропил)метокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид
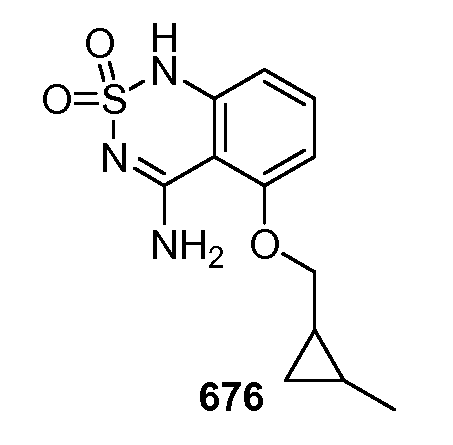
Получают по методике примера 111 из сульфамида 2-амино-6-((2-метилциклопропил)метокси)бензонитрила (пример 254a) с 68% выходом (смесь диастереоизомеров).1H ЯМР (400 МГц, ДМСО-d6) δ 0,17-0,40 (м, 1H), 0,54-0,58 (м, 1H), 0,76-0,85 (м, 1H), 0,99-1,12 (м, 4H), 3,96-4,33 (м, 2H), 6,58-6,61 (м, 1H), 6,67-6,77 (м, 1H), 7,41-7,47 (м, 1H), 7,97 (с, NH), 8,38 (с, NH), 10,97 (с, NH). МС 282 (MH+).
Пример 254a: Сульфамид 2-амино-6-((2-метилциклопропил)метокси)бензонитрила
Получают по методике примера 90a из 2-амино-6-((2-метилциклопропил)метокси)бензонитрила (Пример 254b) со 100% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,34-0,36 (м, 1H), 0,51-0,53 (м, 1H), 0,77-0,79 (м, 1H), 0,95-0,97 (м, 1H), 1,04-1,09 (м, 3H), 3,92-4,03 (м, 2H), 6,86-6,88 (ушир.м, 1H), 7,11-7,18 (ушир.м, 3H), 7,48-7,52 (ушир.м, 1H), 9,53 (ушир.с, NH). МС 282 (MH+).
Пример 254b: 2-Амино-6-((2-метилциклопропил)метокси)бензонитрил
Раствор 2-((2-метилциклопропил)метокси)-6-нитробензонитрила (пример 254c) (0,29 г, 1,25 ммоль) в EtOAc/EtOH 1:1 (30 мл) гидрируют в аппарате H-куб с применением 10% Pd/C в качестве катализатора. Раствор выпаривают с получением 2-амино-6-((2-метилциклопропил)метокси)бензонитрила (0,20 г, 79%) в виде масла желтого цвета. МС 203 (MH+).
Пример 254c: 2-((2-Метилциклопропил)метокси)-6-нитробензонитрил
Получают по методике примера 166d из (2-метилциклопропил)метанола и 2,6-динитробензонитрила с 81% выходом. МС 233 (MH+).
Пример 255: N5-Изобутил-1H-бензо[c][1,2,6]тиадиазин-4,5-диамин-2,2-диоксид

Получают по методике примера 111 из сульфамида 2-амино-6-(изобутиламино)бензонитрила (Пример 255a) с 23% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,95 (д, J=6,8 Гц, 6H), 1,88-1,95 (м, 1H), 2,84 (т, J=6,8 Гц, 2H), 5,87 (т, J=6,4 Гц, NH), 6,31 (дд, J=0,8 Гц, J=8,0 Гц, 1H), 6,40 (д, J=8,0 Гц, 1H), 7,26 (т, J=8,4 Гц, 1H), 7,88 (с, NH2), 10,70 (с, NH). МС 269 (MH+).
Пример 255a: Сульфамид 2-амино-6-(изобутиламино)бензонитрила
Получают по методике примера 90a из 2-амино-6-(изобутиламино)бензонитрила (Пример 255b) и применяют на следующей стадии без дальнейшей очистки. МС 269 (MH+).
Пример 255b: 2-Амино-6-(изобутиламино)бензонитрил
Получают по методике примера 90b из 2-(изобутиламино)-6-нитробензонитрила (Пример 255с) с 66% выходом. МС 190 (MH+).
Пример 255c: 2-(Изобутиламино)-6-нитробензонитрил
Получают по методике примера 90c из 2,6-динитробензонитрила и метиламина с 92% выходом. МС 220 (MH+).
Пример 256: 5-((1-Метилциклопропил)метокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 111 из сульфамида 2-амино-6-((1-метилциклопропил)метокси)бензонитрила (Пример 256a) с 39% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,44-0,46 (м, 2H), 0,59-0,62 (м, 2H), 1,2 (с, 3H), 3,96 (с, 2H), 6,59 (д, J=8,4 Гц, 1H), 6,66 (д, J=8,0 Гц, 1H), 7,43 (т, J=8,0 Гц, 1H), 7,83 (ушир.с, NH), 8,40 (ушир.с, NH), 9,45 (ушир.с, NH). МС 282 (MH+).
Пример 256a: Сульфамид 2-амино-6-((1-метилциклопропил)метокси)бензонитрила
Получают по методике примера 90a из 2-амино-6-((1-метилциклопропил)метокси)бензонитрила (Пример 256b) со 100% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,40-0,43 (м, 2H), 0,53-0,56 (м, 2H), 1,20 (с, 3H), 3,89 (с, 2H), 6,85 (д, J=8,0 Гц, 1H), 7,11-7,23 (ушир.с, NH2), 7,12 (д, J=8,0 Гц, 1H), 7,51 (т, J=8,4 Гц, 1H), 9,45 (ушир.с, NH). МС 282 (MH+).
Пример 256b: 2-Амино-6-((1-метилциклопропил)метокси)бензонитрил
Получают по методике примера 254b из 2-((1-метилциклопропил)метокси)-6-нитробензонитрила (Пример 256c) с 88% выходом в виде масла желтого цвета. МС 203 (MH+).
Пример 256c: 2-((1-Метилциклопропил)метокси)-6-нитробензонитрил
Получают по методике примера 166d из (1-метилциклопропил)метанола и 2,6-динитробензонитрила с 65% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,44-0,46 (м, 2H), 0,57-0,59 (м, 2H), 1,22 (с, 3H), 4,06 (с, 2H), 7,67 (дд, J=1,6 Гц, J=8,0 Гц, 1H), 7,85-7,92 (м, 2H).
Пример 257: 1-(2-(4-Амино-1H-бензо[c][1,2,6]тиадиазин-5-илокси)этил)пирролидин-2-он-2,2-диоксид

Получают по методике примера 111 из сульфамида 2-амино-6-(2-(2-оксопирролидин-1-ил)этокси)бензонитрила (Пример 257a) с 45% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,94 (кв., J=7,2 Гц, 2H), 2,26 (т, J=7,6 Гц, 2H), 3,43 (т, J=7,2 Гц, 2H), 3,68 (т, J=4,4 Гц, 2H), 4,23 (т, J=4,4 Гц, 2H), 6,59 (д, J=7,6 Гц, 1H), 6,70 (д, J=8,8 Гц, 1H), 7,43 (т, J=8,4 Гц, 1H), 7,82 (ушир.с, NH), 8,21 (ушир.с, NH), 10,98 (ушир.с, NH). МС 325 (MH+).
Пример 257a: Сульфамид 2-амино-6-(2-(2-оксопирролидин-1-ил)этокси)бензонитрила
Получают по методике примера 90a из 2-амино-6-(2-(2-оксопирролидин-1-ил)этокси)бензонитрила (Пример 257b) со 100% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,94 (кв., J=8,4 Гц, 2H), 2,22 (т, J=8,4 Гц, 2H), 3,50-3,58 (м, 4H), 4,21 (т, J=4,8 Гц, 2H), 6,94 (ушир.с, 1H), 7,17 (д, J=7,6 Гц, 1H), 7,24 (ушир.с, NH2), 7,54 (т, J=7,2 Гц, 1H), 9,49 (ушир.с, NH). МС 325 (MH+).
Пример 257b: 2-Амино-6-(2-(2-оксопирролидин-1-ил)этокси)бензонитрил
Получают по методике примера 254b из 2-нитро-6-(2-(2-оксопирролидин-1-ил)этокси)бензонитрила (Пример 257c) с применением трифторэтанола/гексафторизопропанола (1:1) в качестве растворителя со 100% выходом МС 246 (MH+).
Пример 257c: 2-Нитро-6-(2-(2-оксопирролидин-1-ил)этокси)бензонитрил
Получают по методике примера 166d из 1-(2-гидроксиэтил)пирролидин-2-она и 2,6-динитробензонитрила с 74% выходом. МС 276 (MH+).
Пример 258: N5-(3-Метоксипропил)-1H-бензо[c][1,2,6]тиадиазин-4,5-диамин-2,2-диоксид

Получают по методике примера 90 из сульфамида 2-амино-6-(3-метоксипропиламино)бензонитрила (Пример 258a) с 69% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,79-1,85 (м, 2H), 3,06 (кв., J=6,8 Гц, J=6,8 Гц, 2H), 3,22 (с, 3H), 3,42 (т, J=6,0 Гц, 2H), 5,94 (т, J=5,0 Гц, NH), 6,26 (д, J=8,4 Гц, 1H), 6,34 (д, J=8,0 Гц, 1H), 7,23 (т, J=8,0 Гц, 1H), 7,88 (с, NH2), 10,64 (с, NH). МС 285 (MH+).
Пример 258a: Сульфамид 2-амино-6-(3-метоксипропиламино)бензонитрила
Получают по методике примера 90a из 2-амино-6-(3-метоксипропиламино)бензонитрила с 65% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,74-1,79 (м, 2H), 3,19 (кв., J=6,8 Гц, J=7,2 Гц, 2H), 3,22 (с, 3H), 3,39 (т, J=6,2 Гц, 2H), 5,96 (т, J=5,6 Гц, NH), 6,47 (д, J=8,8 Гц, 1H), 6,70 (д, J=8,0 Гц, 1H), 7,09 (с, NH2), 7,31 (т, J=8,0 Гц, 1H), 9,09 (с, NH). МС 285 (MH+).
Пример 258b: 2-Амино-6-(3-метоксипропиламино)бензонитрил
К раствору 2-(3-метоксипропиламино)-6-нитробензонитрила (Пример 258c) (0,58 г, 2,48 ммоль) в EtOH (20 мл) добавляют циклогексен (1,26 мл, 12,4 ммоль). Затем добавляют 10% Pd/C (1,32 г), и реакционную смесь кипятят с обратным холодильником при 100°С в течение 20 минут, охлаждают до комнатной температуры, фильтруют через Целит, затем промывают EtOH (3×20 мл) и выпаривают с получением 2-амино-6-(3-метоксипропиламино)бензонитрила (0,43 г, 84%) в виде бесцветного масла.1H ЯМР (400 МГц, ДМСО-d6) δ 1,71-1,77 (м, 2H), 3,10 (кв., J=6,8 Гц, J=6,8 Гц, 2H), 3,22 (с, 3H), 3,37 (т, , J=3,2 Гц, 2H), 5,55 (т, J=5,2 Гц, NH), 5,63 (с, NH2), 5,79 (д, J=7,6 Гц, 1H), 5,93 (д, J=8,0 Гц, 1H), 6,98 (т, J=8,0 Гц, 1H). МС 206 (MH+).
Пример 258c: 2-(3-Метоксипропиламино)-6-нитробензонитрил
Получают по методике примера 90c из 2,6-динитробензонитрила и 3-метоксипропиламина с 83% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,76-1,81 (м, 2H), 3,23 (с, 3H), 3,28-3,33 (м, 2H), 3,40 (т, J=5,6 Гц, 2H), 6,66 (т, J=4,8 Гц, NH), 7,30 (д, J=8,8 Гц, 1H), 7,42 (д, J=8,0 Гц, 1H), 7,60 (т, J=8,0 Гц, 1H).
Пример 259: N5-Этил-1H-бензо[c][1,2,6]тиадиазин-4,5-диамин-2,2-диоксид
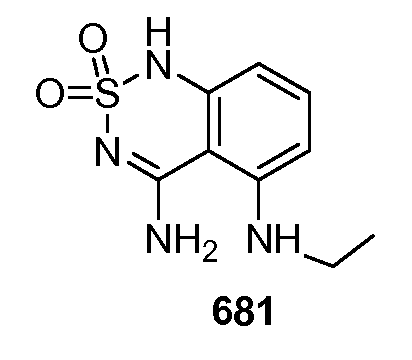
Получают по методике примера 111 из сульфамида 2-амино-6-(этиламино)бензонитрила (Пример 259a) с 57% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,18 (т, J=6,8 Гц, 3H), 2,99-3,06 (м, 2H), 5,87 (т, J=5,2 Гц, NH), 6,30 (д, J=7,6 Гц, 1H), 6,38 (д, J=7,6 Гц, 1H), 7,26 (т, J=8,0 Гц, 1H), 7,90 (с, NH2), 10,68 (с, NH). МС 241 (MH+).
Пример 259a: Сульфамид 2-амино-6-(этиламино)бензонитрила
Получают по методике примера 90a из 2-амино-6-(этиламино)бензонитрила (Пример 259b) с 47% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,14 (т, J=7,2 Гц, 3H), 3,15-3,22 (м, 2H), 5,84 (ушир.с, NH), 6,48 (д, J=8,8 Гц, 1H), 6,72 (д, J=8,0 Гц, 1H), 7,02 (ушир.с, NH2), 7,31 (т, J=8,0 Гц, 1H), 9,14 (ушир.с, NH). МС 241 (MH+).
Пример 259b: 2-Амино-6-(этиламино)бензонитрил
Получают по методике примера 254b из 2-(этиламино)-6-нитробензонитрила (Пример 259c) с применением трифторэтанола/гексафторизопропанола (2:1) в качестве растворителя с 81% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,14 (т, J=7,2 Гц, 3H), 3,15-3,22 (м, 2H), 5,41 (ушир.т, J=5,2 Гц, NH), 5,64 (с, NH2), 5,82 (д, J=8,0 Гц, 1H), 5,96 (д, J=8,0 Гц, 1H), 7,00 (т, J=8,4 Гц, 1H). МС 162 (MH+).
Пример 259c: 2-(Этиламино)-6-нитробензонитрил
Получают по методике примера 90c из 2,6-динитробензонитрила и 2M раствора этиламина в ТГФ с 88% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,13 (т, J=7,6 Гц, 3H), 3,26-3,33 (м, 2H), 6,59 (ушир.т, J=5,2 Гц, NH), 7,22 (д, J=9,2 Гц, 1H), 7,42 (д, J=8,0 Гц, 1H), 7,60 (т, J=8,4 Гц, 1H). МС 162 (M-Et).
Пример 260: N5-(2-(Бензилокси)этил)-1H-бензо[c][1,2,6]тиадиазин-4,5-диамин-2,2-диоксид

Получают по методике примера 90 из сульфамида 2-амино-6-(2-(бензилокси)этиламино)бензонитрила (Пример 260a) с 68% выходом.1H ЯМР (400МГц, ДМСО-d6) δ 3,25 (кв., J=5,2 Гц, J=6,4 Гц, 2H), 3,64 (т, J=5,6 Гц, 2H), 4,49 (с, 2H), 5,91 (т, J=5,2 Гц, NH), 6,28 (д, J=8,4 Гц, 1H), 6,40 (д, J=8,4 Гц, 1H), 7,23 (т, J=8,0 Гц, 1H), 7,25-7,35 (м, 5H), 7,90 (с, NH2), 10,68 (с, NH). МС 347 (MH+).
Пример 260a: Сульфамид 2-амино-6-(2-(бензилокси)этиламино)бензонитрила
Получают по методике примера 90a из 2-амино-6-(2-(бензилокси)этиламино)бензонитрила (Пример 260b) с 45% выходом.1H ЯМР (400 МГц, CDCl3) δ 3,36 (кв., J=5,2 Гц, J=5,6 Гц, 2H), 3,57 (т, J=5,6 Гц, 2H), 4,49 (с, 2H), 5,76 (т, J=5,6 Гц, NH), 6,55 (д, J=8,4 Гц, 1H), 6,72 (д, J=8,0 Гц, 1H), 7,12 (с, NH2), 7,25-7,32 (м, 6H), 9,12 (с, NH). МС 347 (MH+).
Пример 260b: 2-Амино-6-(2-(бензилокси)этиламино)бензонитрил
Получают по методике примера 90b из 2-(2-(бензилокси)этиламино)-6-нитробензонитрила (Пример 260c) со 100% выходом в виде масла коричневого цвета.1H ЯМР (400МГц, CDCl3) δ 3,27 (кв., J=5,2 Гц, J=6,0 Гц, 2H), 3,56 (т, J=5,6 Гц, 2H), 4,49 (с, 2H), 5,34 (т, J=5,6 Гц, NH), 5,67 (с, NH2), 5,84 (д, J=8,0 Гц, 1H), 5,95 (д, J=8,4 Гц, 1H), 6,98 (т, J=8,2 Гц, 1H), 7,30-7,34 (м, 5H). МС 268 (MH+).
Пример 260c: 2-(2-(Бензилокси)этиламино)-6-нитробензонитрил
Получают по методике примера 90c из 2-(бензилокси)этанамина и 2,6-динитробензонитрила с 77% выходом.1H ЯМР (400МГц, ДМСО-d6) δ 3,49 (кв., J=5,2 Гц, J=5,6 Гц, 2H), 3,59 (т, J=5,6 Гц, 2H), 4,49 (с, 2H), 6,47 (т, J=5,8 Гц, NH), 7,23-7,31 (м, 6H), 7,43 (д, J=8,0 Гц, 1H), 7,58 (т, J=8,4 Гц, 1H).
Пример 261: 2-(4-Амино-1H-бензо[c][1,2,6]тиадиазин-5-иламино)этанол-2,2-диоксид

В раствор N5-(2-(бензилокси)этиламино)-1H-бензо[c][1,2,6]тиадиазин-4,5-диамин-2,2-диоксида (Пример 260) (0,10 г, 0,29 ммоль) в EtOH (20 мл) загружают 30 мг 10% Pd/C и баллон H2 и перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь фильтруют через Целит, который промывают EtOH, объединенные органические фазы выпаривают и остаток очищают флэш-хроматографией с применением ДХМ/MeOH (9:1) раствора в качестве элюента, с получением 2-(4-амино-1H-бензо[c][1,2,6]тиадиазин-5-иламино)этанол-2,2-диоксида (64,8 мг, 87%).1H ЯМР (400МГц, ДМСО-d6) δ 3,11 (кв., J=5,6 Гц, J=5,6 Гц, 2H), 3,58-3,59 (м, 2H), 4,84 (ушир.с, 1H), 5,84 (т, J=5,2 Гц, NH), 6,26 (д, J=8,0 Гц, 1H), 6,37 (д, J=8,4 Гц, 1H), 7,22 (т, J=8,0 Гц, 1H), 7,86 (с, NH2), 10,65 (ушир.с, NH). МС 257 (MH+).
Пример 262: 3-((4-Амино-1H-бензо[c][1,2,6]тиадиазин-5-илокси)метил)-N-пропилпиперидин-1-карбоксамид-2,2-диоксид

Получают по методике примера 111 из сульфамида 3-((3-амино-2-цианофенокси)метил)-N-пропилпиперидин-1-карбоксамида (Пример 262a) с 88% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,81 (т, J=6,8 Гц, 3H), 1,23-1,43 (м, 4H), 1,60-1,63 (ушир.м, 1H), 1,81-1,84 (ушир.м, 1H), 1,99-2,05 (ушир.м, 1H), 2,67-2,75 (м, 1H), 2,80-2,85 (м, 1H), 2,93-2,98 (м, 2H), 3,71 (ушир.д, J=12,8, 1H), 3,90 (ушир.д, J=10,8, 1H), 3,98-4,08 (м, 2H), 6,44 (д, J=6,0 Гц, NH), 6,62 (д, J=8,0 Гц, 1H), 6,76 (д, J=8,4 Гц, 1H), 7,46 (т, J=8,4 Гц, 1H), 7,80 (с, NH), 8,37 (с, NH), 10,95 (с, NH). МС 396 (MH+).
Пример 262a: Сульфамид 3-((3-амино-2-цианофенокси)метил)-N-пропилпиперидин-1-карбоксамида
Получают по методике примера 90a из 3-((3-амино-2-цианофенокси)метил)-N-пропилпиперидин-1-карбоксамида (Пример 262b) со 100% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,81 (т, J=7,2 Гц, 3H), 1,31-1,44 (м, 4H), 1,61-1,64 (ушир.м, 1H), 1,85-1,87 (ушир.м, 2H), 2,60-2,75 (м, 2H), 2,94-2,98 (м, 2H), 3,78 (ушир.д, J=12,8 Гц, 1H), 3,93-3,97 (м, 1H), 4,01-4,10 (м, 2H), 6,38 (д, J=6,0 Гц, NH), 6,96 (д, J=8,8 Гц, 1H), 7,16 (д, J=8,4 Гц, 1H), 7,27 (с, NH), 7,41 (с, NH), 7,57 (т, J=8,4 Гц, 1H), 9,48 (с, NH). МС 396 (MH+).
Пример 262b: 3-((3-Амино-2-цианофенокси)метил)-N-пропилпиперидин-1-карбоксамид
Получают по методике примера 254b из 3-((2-циано-3-нитрофенокси)метил)-N-пропилпиперидин-1-карбоксамида (Пример 262c) с 94% выходом. МС 317 (MH+).
Пример 262c: 3-((2-Циано-3-нитрофенокси)метил)-N-пропилпиперидин-1-карбоксамид
К раствору гидрохлорида 2-нитро-6-(пиперидин-3-илметокси)бензонитрила (Пример 262d) (0,10 г, 0,34 ммоль) в ТГФ (6 мл) добавляют триэтиламин (0,10 мл, 0,76 ммоль) и пропилизоцианат (0,05 мл, 0,52 ммоль), и реакционную смесь перемешивают при КТ в атмосфере азота в течение 3 часов, затем фильтруют и выпаривают с получением 3-((2-циано-3-нитрофенокси)метил)-N-пропилпиперидин-1-карбоксамида (0,13 г, 100%).1H ЯМР (400 МГц, ДМСО-d6) δ 0,81 (т, J=7,2 Гц, 3H), 1,34-1,41 (м, 4H), 1,62-1,64 (ушир.м, 1H), 1,87-1,95 (ушир.м, 2H), 2,64-2,77 (м, 2H), 2,93-2,98 (м, 2H), 3,77 (ушир.д, J=12,8 Гц, 1H), 3,98 (ушир.д, J=12,8 Гц, 1H), 4,09-4,13 (м, 1H), 4,17-4,20 (м, 1H), 6,38 (д, J=5,6 Гц, NH), 7,74 (ушир.дд, J=1,6 Гц, J=8,0 Гц, 1H), 7,88-7,94 (м, 2H). МС 347 (MH+).
Пример 262d: Гидрохлорид 2-нитро-6-(пиперидин-3-илметокси)бензонитрила
Получают по методике примера 166 из трет-бутил 3-((2-циано-3-нитрофенокси)метил)пиперидин-1-карбоксилата (Пример 262e) с 98% выходом. МС 262 (MH+).
Пример 262e: трет-Бутил 3-((2-циано-3-нитрофенокси)метил)пиперидин-1-карбоксилат
Получают по методике примера 215c из трет-бутил 3-(гидроксиметил)пиперидин-1-карбоксилата и 2,6-динитробензонитрила с 58% выходом. МС 263 [M+H-Boc]+.
Пример 263: трет-Бутил 3-((4-амино-1H-бензо[c][1,2,6]тиадиазин-5-илокси)метил)пиперидин-1-карбоксилат-2,2-диоксид

Получают по методике примера 111 из сульфамида трет-бутил 3-((3-амино-2-цианофенокси)метил)пиперидин-1-карбоксилата (Пример 263a), сохраняя pH выше 3 при подкислении, с получением трет-бутил 3-((4-амино-1H-бензо[c][1,2,6]тиадиазин-5-илокси)метил)пиперидин-1-карбоксилат-2,2-диоксида (33 мг, 23%).1H ЯМР (400 МГц, ДМСО-d6) δ 1,27-1,40 (ушир.с, 11H), 1,62-1,66 (ушир.м, 1H), 1,78-1,83 (ушир.м, 1H), 2,05-2,12 (ушир.м, 1H), 2,87-2,94 (м, 2H), 3,64-3,71 (ушир.м, 1H), 3,83-3,86 (ушир.м, 1H), 4,04 (ушир.д, J=7,2 Гц, 2H), 6,62 (д, J=8,0 Гц, 1H), 6,77 (д, J=8,4 Гц, 1H), 7,46 (т, J=8,4 Гц, 1H), 7,76 (ушир.с, NH), 8,37 (ушир.с, NH), 10,95 (с, NH). МС 311 [M+H-Boc]+.
Пример 263a: Сульфамид трет-бутил 3-((3-амино-2-цианофенокси)метил)пиперидин-1-карбоксилата
Получают по методике примера 90a из трет-бутил 3-((3-амино-2-цианофенокси)метил)пиперидин-1-карбоксилата (Пример 263b). После экстрагирования добавляют NaOH 1M (1,56 мл, 1,56 ммоль) к охлажденной на льду реакционной смеси, что ускоряет образование липкого оранжевого продукта. Воду выливают, и остаток разбавляют в EtOAc и экстрагируют с получением сульфамида трет-бутил 3-((3-амино-2-цианофенокси)метил)пиперидин-1-карбоксилата (0,15 г, 84%).1H ЯМР (400 МГц, ДМСО-d6) δ 1,35-1,40 (ушир.с, 11H), 1,63-1,66 (ушир.м, 1H), 1,79-1,83 (ушир.м, 1H), 1,88-1,93 (ушир.м, 1H), 2,78-2,85 (м, 2H), 3,74-3,78 (ушир.м, 1H), 3,92-4,04 (м, 3H), 6,96 (д, J=8,4 Гц, 1H), 7,15 (д, J=8,4 Гц, 1H), 7,27 (с, NH2), 7,56 (т, J=8,8 Гц, 1H), 9,47 (с, NH). МС 311 [M+H-Boc]+.
Пример 263b: трет-Бутил 3-((3-амино-2-цианофенокси)метил)пиперидин-1-карбоксилат
Получают по методике примера 254b из трет-бутил 3-((2-циано-3-нитрофенокси)метил)пиперидин-1-карбоксилата (Пример 262e) со 100% выходом в виде масла. МС 232 [M+H-Boc]+.
Пример 264: 4-Амино-5-(транс-2-метилциклопентилокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

К раствору 2-амино-6-(транс-2-метилциклопентилокси)бензонитрила (Пример 264a) (150 мг, 0,694 ммоль) в диметилацетамиде (3 мл) под N2 добавляют сульфамоилхлорид (3 экв.). Реакционную смесь перемешивают при комнатной температуре под N2 в течение 2 часов, разбавляют этилацетатом (50 мл) и гасят водой (20 мл). Слои разделяют. Органический экстракт выпаривают. К остатку последовательно добавляют этанол (3 мл) и водный NaOH (2н, 2,5 экв.). Полученную смесь нагревают до 90°С в течение 16 часов. Обработку проводят по методике примера 111 с получением желаемого продукта (160 мг, 78%) в виде порошка белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,02 (д, J=6,4 Гц, 3H), 1,26 (м, 1H), 1,71 (ушир.с, 3H), 1,89 (м, 1H), 2,12 (м, 1H), 2,24 (м, 1H), 4,55 (ушир.с, 1H), 6,60 (д, J=8,0 Гц, 1H), 6,71 (д, J=8,0 Гц, 1H), 7,45 (т, J=8,0 Гц, 1H), 7,73 (ушир.с, 1H), 8,35 (ушир.с, 1H), 10,96 (ушир.с, 1H). МС 296 (MH+).
Пример 264a: 2-Амино-6-(транс-2-метилциклопентилокси)бензонитрил
Получают по методике примера 111b из 2-(транс-2-метилциклопентилокси)-6-нитробензонитрила (Пример 264b) с получением указананного соединения с количественным выходом в виде бесцветного масла.1H ЯМР (400 МГц, CDCl3) δ 1,04 (д, J=7,2 Гц, 3H), 1,23 (м, 1H), 1,72 (м, 1H), 1,81 (м, 2 H), 1,99 (м, 2H), 2,26 (м, 1H), 4,28 (м, 1H), 4,36 (ушир.с, 2H), 6,18 (д, J=8,4 Гц, 1H), 6,18 (д, J=8,4 Гц, 1H), 7,18 (т, J=8,4 Гц, 1H). МС 296 (MH+)
Пример 264b: 2-(Транс-2-метилциклопентилокси)-6-нитробензонитрил
Получают по методике примера 111c из 2,6-динитробензонитрила и транс-2-метилциклопентанола с 65% в виде твердого вещества желтого цвета. МС 247 (MH+).
Пример 265: 4-Амино-5-(((2R,3S,4R)-3,4-дигидрокси-5-метокситетрагидрофуран-2-ил)метокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

К раствору 4-амино-5-(((2R,3S,4R)-3,4,5-тригидрокситетрагидрофуран-2-ил)метокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (Пример 265a) (7 мг, 0,020 ммоль) в сухом метаноле (1 мл) добавляют трифторуксусную кислоту (0,2 мл), и смесь кипятя с обратным холодильником в течение ночи. Полученный раствор выпаривают досуха с получением указанного в заголовке соединения в виде порошка белого цвета (7,28 мг, 100%, смесь диастереомеров ~ 4/1).1H ЯМР (400 МГц, ДМСО-d6): δ [3,17 (с, ¾H)], 3,22 (с, 3H), 3,81 (д, J=4,0 Гц, 1H), [3,93 (м, ½H)], 4,12 (м, 3H), 4,39 (м, 1H), 4,71 (с, 1H), [4,85 (д, J=4,0 Гц, V4H)], 5,44 (ушир.с, 2H), 6,65 (д, J=8,0 Гц, 1H), 6,81 (д, J=8,0 Гц, 1H), 7,48 (т, J=8,0 Гц, 1H), 7,95 (с, 1H), 8,41 (с, 1H), 11,00 (с, 1H), [11,01 (с, ¼H)].
Пример 265a: 4-Амино-5-(((2R,3S,4R)-3,4,5-тригидрокситетрагидрофуран-2-ил)метокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид
К суспензии 4-амино-5-(((3aR,4R,6R,6aR)-6-метокси-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксида (Пример 265b) (15 мг, 0,038 ммоль) в воде (1 мл) добавляют трифторуксусную кислоту (0,2 мл) и смесь нагревают в течение ночи при 80°С. Реакционную смесь выпаривают досуха с получением указанного в заголовке соединения в виде твердого вещества белого цвета с количественным выходом (смесь диастереомеров ~ 10/1).1H ЯМР (400 МГц, ДМСО-d6): δ 3,71 (м, 4H), 4,12 (м, 3H), 4,35 (м, 1H), 5,02 (с, 1H), 6,63 (д, J=8,0 Гц, 1H), 6,79 (д, J=8,0 Гц, 1H), 7,47 (т, J=8,0 Гц, 1H), 8,03 (ушир.с, 1H), 8,31 (ушир.с, 1H), 10,96 (ушир.с, 1H), [11,00 (ушир.с, 0,1H)].
Пример 265b: 4-Амино-5-(((3aR,4R,6R,6aR)-6-метокси-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид
Получают по методике примера 111 из 2-сульфамоиламино-6-(((3aR,4R,6R,6aR)-6-метокси-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метокси)бензонитрила (Пример 265c) с 78% выходом в виде твердого вещества бежевого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,28 (с, 3H), 1,41 (с, 3H), 3,18 (с, 3H), 4,00 (т, J=9,2 Гц, 1H), 4,32 (дд, J=5,2, 10,0 Гц, 1H), 4,59 (дд, J=5,2, 8,8 Гц, 1H), 4,63 (д, J=6,0 Гц, 1H), 4,82 (д, J=6,0 Гц, 1H), 5,02 (с, 1H), 6,64 (д, J=8,4 Гц, 1H), 6,70 (д, J=8,4 Гц, 1H), 7,48 (т, J=8,4 Гц, 1H), 7,98 (ушир.с, 1H), 8,43 (ушир.с, 1H), 11,02 (ушир.с, 1H).
Пример 265c: 2-Сульфамоиламино-6-(((3aR,4R,6R,6aR)-6-метокси-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метокси)бензонитрил
Получают по методике примера 111a из 2-амино-6-(((3aR,4R,6R,6aR)-6-метокси-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метокси)бензонитрила (Пример 265d) с 77% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, CDCl3) δ 1,34 (с, 3H), 1,50 (с, 3H), 3,33 (с, 3H), 4,08 (м, 2H), 4,51 (дд, J=6,4, 7,6 Гц, 1H), 4,65 (д, J=6,0 Гц, 1H), 4,79 (д, J=6,0 Гц, 1H), 5,01 (с, 1H), 5,25 (ушир.с, 2H), 6,70 (д, J=8,4 Гц, 1H), 7,28 (ушир.с, 1H), 7,30 (д, J=8,0 Гц, 1H), 7,51 (т, J=8,4 Гц, 1H).
Пример 265d: 2-Амино-6-(((3aR,4R,6R,6aR)-6-метокси-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метокси)бензонитрил
Получают по методике примера 111b из 2-(((3aR,4R,6R,6aR)-6-метокси-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метокси)-6-нитробензонитрила (Пример 252e) с 40% выходом в виде бесцветного липкого материала.1H ЯМР (400 МГц, CDCl3) δ 1,33 (с, 3H), 1,49 (с, 3H), 3,33 (с, 3H), 4,05 (м, 2H), 4,45 (ушир.с, 2H), 4,56 (дд, J=6,0, 8,0 Гц, 1H), 4,65 (д, J=6,0 Гц, 1H), 4,82 (ушир.д, J=6,0 Гц, 1H), 5,00 (с, 1H), 6,21 (дд, J=0,8, 8,4 Гц, 1H), 6,33 (дд, J=0,8, 8,4 Гц, 1H), 7,20 (т, J=8,4 Гц, 1H).
Пример 265e: 2-(((3aR,4R,6R,6aR)-6-Метокси-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метокси)-6-нитробензонитрил
Получают по методике примера 111c из 2,6-динитробензонитрила и ((3aR,4R,6R,6aR)-6-метокси-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метанола с 70% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, CDCl3) δ 1,33 (с, 3H), 1,49 (с, 3H), 3,32 (с, 3H), 4,23 (д, J=2,0 Гц, 1H), 4,24 (с, 1H), 4,60 (ушир.т, J=6,0 Гц, 1H), 4,67 (д, J=6,0 Гц, 1H), 4,86 (ушир.д, J=6,0 Гц, 1H), 5,01 (с, 1H), 7,35 (д, J=8,4 Гц, 1H), 7,72 (т, J=8,4 Гц, 1H), 7,87 (дд, J=0,8, 8,4 Гц, 1H).
Пример 266: 4-Амино-5-(((3aR,5aS,8aS,8bS)-2,2,7,7-тетраметилтетрагидро-3aH-бис[1,3]диоксоло[4,5-b:4′,5′-d]пиран-5-ил)метокси)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 264 из 2-амино-6-(((3aR,5aS,8aS,8bS)-2,2,7,7-тетраметилтетрагидро-3aH-бис[1,3]диоксоло[4,5-b:4′,5′-d]пиран-5-ил)метокси)бензонитрила (Пример 266a) с 72% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,29 (с, 3H), 1,31 (с, 3H), 1,38 (с, 3H), 1,43 (с, 3H), 4,07 (м, 2H), 4,19 (ушир.д, J=8,4 Гц, 1H), 4,36 (дд, J=1,2, 8,0 Гц, 1H), 4,41 (дд, J=2,4, 5,2 Гц, 1H), 4,44 (дд, J=2,4, 10,0 Гц, 1H), 4,67 (дд, J=2,4, 8,0 Гц, 1H), 5,51 (д, J=4,8 Гц, 1H), 6,63 (д, J=8,0 Гц, 1H), 6,77 (д, J=8,4 Гц, 1H), 7,45 (т, J=8,4 Гц, 1H), 7,86 (ушир.с, 1H), 8,41 (ушир.с, 1H), 10,98 (ушир.с, 1H). МС 456 (MH+).
Пример 266a: 2-Амино-6-(((3aR,5aS,8aS,8bS)-2,2,7,7-тетраметилтетрагидро-3aH-бис[1,3]диоксоло[4,5-b:4′,5′-d]пиран-5-ил)метокси)бензонитрил
Получают по методике примера 111b из 2-нитро-6-(((3aR,5aS,8aS,8bS)-2,2,7,7-тетраметилтетрагидро-3aH-бис[1,3]диоксоло[4,5-b:4′,5′-d]пиран-5-ил)метокси)бензонитрила (Пример 266b) с количественным выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,28 (с, 3H), 1,31 (с, 3H), 1,37 (с, 3H), 1,39 (с, 3H), 4,05 (м, 2H), 4,16 (дд, J=4,0, 8,8 Гц, 1H), 4,37 (м, 2H), 4,67 (дд, J=2,4, 8,0 Гц, 1H), 5,47 (д, J=4,8 Гц, 1H), 6,01 (ушир.с, 2H), 6,23 (д, J=8,0 Гц, 1H), 6,35 (д, J=8,4 Гц, 1H), 7,17 (т, J=8,4 Гц, 1H).
Пример 266b: 2-Нитро-6-(((3aR,5aS,8aS,8bS)-2,2,7,7-тетраметилтетрагидро-3aH-бис[1,3]диоксоло[4,5-b:4′,5′-d]пиран-5-ил)метокси)бензонитрил
Получают по методике примера 111c из 2,6-динитробензонитрила и ((3aR,5aS,8aS,8bS)-2,2,7,7-тетраметилтетрагидро-3aH-бис[1,3]диоксоло[4,5-b:4′,5′-d]пиран-5-ил)метанола с 59% выходом в виде липкого продукта белого цвета. МС 408 (MH+), 424 (MH2O+).
Пример 267: 4-Амино-5-(1-(2-метоксиэтил)-1H-1,2,3-триазол-4-ил)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(1-(2-метоксиэтил)-1H-1,2,3-триазол-4-ил)бензонитрила (Пример 267a) с 78% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 3,27 (с, 3H), 3,78 (т, J=5,2 Гц, 2H), 4,59 (т, J=5,2 Гц, 2H), 6,90 (ушир.с, 1H), 7,09 (дд, J=0,8, 8,0 Гц, 1H), 7,20 (дд, J=0,8, 7,6 Гц, 1H), 7,58 (т, J=7,6 Гц, 1H), 8,15 (ушир.с, 1H), 8,32 (с, 1H), 11,09 (ушир.с, 1H). МС 323 (MH+).
Пример 267a: 2-Сульфамоиламино-6-(1-(2-метоксиэтил)-1H-1,2,3-триазол-4-ил)бензонитрил
Получают по методике примера 111a из 2-амино-6-(1-(2-метоксиэтил)-1H-1,2,3-триазол-4-ил)бензонитрила (Пример 267b) с 90% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 3,28 (с, 3H), 3,79 (т, J=5,2 Гц, 2H), 4,66 (т, J=5,2 Гц, 2H), 7,32 (ушир.с, 2H), 7,60 (дд, J=1,2, 8,0 Гц, 1H), 7,76 (т, J=8,0 Гц, 1H), 7,82 (дд, J=1,2, 8,0 Гц, 1H), 8,64 (с, 1H), 9,52 (ушир.с, 1H).
Пример 267b: 2-Амино-6-(1-(2-метоксиэтил)-1H-1,2,3-триазол-4-ил)бензонитрил
К раствору 1-бром-2-метоксиэтана (5,00 г, 35,97 ммоль) в ДМФ (25 мл) добавляют азид натрия (3 экв.), и смесь нагревают при 50°С в течение 48 часов. Реакционную смесь разбавляют водой (75 мл) и экстрагируют диэтиловым эфиром. Органический экстракт сушат над MgSO4 и концентрируют с получением 1-азидо-2-метоксиэтана в виде жидкости желтого цвета. Этот азид (200 мг, 1,94 ммоль) добавляют к раствору 2-амино-6-этинилбензонитрила (250 мг, 1,76 ммоль) (Пример 267c) в Η2O/трет-BuOΗ = 1:2 (15 мл) и раствор обрабатывают последовательно аскорбатом натрия (0,264 ммоль) и CuSO4 (0,035 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 48 часов, разбавляют водой и экстрагируют этилацетатом. Органический экстракт сушат над MgSO4 и очищают над силикагелем (этилацетат/гексан 6:4) с получением указанного в заголовке соединения в виде твердого вещества белого цвета с 88% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 3,26 (с, 3H), 3,78 (т, J=5,2 Гц, 2H), 4,23 (т, J=5,2 Гц, 2H), 6,13 (ушир.с, 2H), 6,80 (дд, J=1,2, 8,4 Гц, 1H), 7,09 (дд, J=1,2, 7,6 Гц, 1H), 7,36 (т, J=8,4 Гц, 1H), 8,52 (с, 1H). МС 244 (MH+).
Пример 267c: 2-Амино-6-этинилбензонитрил
К раствору 2-амино-6-бромбензонитрила (1,25 г, 6,34 ммоль) и этинилтриметилсилана (2,42 г, 12,7 ммоль) в сухом Et3N (15 мл) добавляют под N2 Cu(I) (60 мг), Pd(PPh3)4(360 мг), и смесь перемешивают при 80°С в течение 20 часов. Реакционную смесь охлаждают до комнатной температуры, разбавляют этилацетатом и промывают насыщенным раствором соли. Органический слой выпаривают, и остаток растворяют в метаноле (20 мл), обрабатывают 1M водным раствором NaOH (1,05 экв.) и перемешивают при комнатной температуре в течение 1 часа. Метанол выпаривают, и водный остаток экстрагируют CH2Cl2, сушат над MgSO4 и очищают на силикагеле (этилацетат/гексан 75/25) с получением желаемого продукта с 93% выходом в виде твердого вещества светло-желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 4,54 (с, 1H), 6,24 (ушир.с, 2H), 6,76 (дд, J=0,8, 7,6 Гц, 1H), 6,82 (дд, J=0,8, 8,4 Гц, 1H), 7,28 (дд, J=7,6, 8,4 Гц, 1H). МС 143 (MH+).
Пример 268: 4-Амино-5-(фуран-3-ил)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(фуран-3-ил)бензонитрила (Пример 268a) с 47% выходом в виде твердого вещества бежевого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 6,34 (ушир.с, 1H), 6,51 (дд, J=0,8, 2,0 Гц, 1H), 7,03 (м, 2H), 7,52 (дд, J=7,6, 8,0 Гц, 1H), 7,79 (т, J=1,6 Гц, 1H), 7,93 (дд, J=0,8, 1,6 Гц, 1H), 8,23 (ушир.с, 1H), 11,09 (с, 1H). МС 264 (MH+).
Пример 268a: 2-Сульфамоиламино-6-(фуран-3-ил)бензонитрил
Получают по методике примера 111a из 2-амино-6-(фуран-3-ил)бензонитрила (Пример 268b) с 63% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 6,97 (дд, J=0,8, 2,0 Гц, 1H), 7,29 (ушир.с, 2H), 7,46 (дд, J=0,8, 7,6 Гц, 1H), 7,54 (дд, J=0,8, 8,0 Гц, 1H), 7,69 (т, J=8,0 Гц, 1H), 7,85 (т, J=1,6 Гц, 1H), 8,21 (дд, J=0,8, 1,6 Гц, 1H), 9,48 (ушир.с, 1H).
Пример 268b: 2-Амино-6-(фуран-3-ил)бензонитрил
Получают по методике примера 129c из фуран-3-илбороновой кислоты и 2-амино-6-бромбензонитрила с 74% выходом в виде твердого вещества желтого цвета.1H ЯМР (400 МГц, CDCl3) δ 4,51 (ушир.с, 2H), 6,66 (дд, J=1,2, 8,4 Гц, 1H), 6,78 (дд, J=1,2, 2,0 Гц, 1H), 6,82 (дд, J=1,2, 8,0 Гц, 1H), 7,31 (т, J=8,0 Гц, 1H), 7,50 (т, J=1,6 Гц, 1H), 7,95 (дд, J=1,2, 1,6 Гц, 1H).
Пример 269: 4-Амино-5-(тиофен-3-ил)-1H-бензо[c][1,2,6]тиадиазин-2,2-диоксид

Получают по методике примера 111 из 2-сульфамоиламино-6-(тиофен-3-ил)бензонитрила (Пример 269a) с 52% выходом в виде твердого вещества бежевого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 5,82 (ушир.с, 1H), 7,05 (м, 3H), 7,54 (т, J=8,0 Гц, 1H), 7,67 (м, 1H), 8,15 (ушир.с, 1H), 11,13 (с, 1H). МС 280 (MH+).
Пример 269a: 2-Сульфамоиламино-6-(тиофен-3-ил)бензонитрил
Получают по методике примера 111a из 2-амино-6-(тиофен-3-ил)бензонитрила (Пример 269b) с 60% выходом в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 7,31 (ушир.с, 2H), 7,42 (дд, J=1,2, 2,8 Гц, 1H), 7,43 (д, J=1,6 Гц, 1H), 7,57 (дд, J=0,8, 8,0 Гц, 1H), 7,70 (т, J=8,0 Гц, 1H), 7,73 (дд, J=2,8, 4,8 Гц, 1H), 7,88 (дд, J=1,2, 2,8 Гц, 1H), 9,48 (ушир.с, 1H).
Пример 269b: 2-Амино-6-(тиофен-3-ил)бензонитрил
Получают по методике примера 129c из тиофен-3-илбороновой кислоты и 2-амино-6-бромбензонитрила с 94% выходом в виде твердого вещества бежевого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 6,08 (ушир.с, 2H), 6,70 (дд, J=1,2, 7,6 Гц, 1H), 6,77 (дд, J=1,2, 8,4 Гц, 1H), 7,31 (дд, J=7,6, 8,4 Гц, 1H), 7,38 (дд, J=1,2, 4,8 Гц, 1H), 7,66 (дд, J=2,8, 4,8 Гц, 1H), 7,78 (дд, J=1,2, 2,8 Гц, 1H).
Пример 270: 5-(2,2-Диметилциклопропил)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Раствор 2-амино-6-(2,2-диметилциклопропил)бензонитрила (381 мкмоль, 71 мг) (Пример 270a) и сульфамоилхлорида (572 мкмоль, 66 мг) в ДМА (1 мл) перемешивают при комнатной температуре. Через 1 час реакционную смесь разбавляют NaOH (1н, 572 мкмоль, 572 мкл) и водой (~30 мл). Осадок отфильтровывают, промывают водой (3×5 мл), затем растворяют в EtOH (10 мл) и добавляют NaOH (1н, 953 мкл). Реакционную смесь нагревают до 80°С при перемешивании. После завершения растворитель выпаривают, и остаток разделяют между водой (20 мл) и простым эфиром (5 мл). Водный слой экстрагируют простым эфиром (2×5 мл), затем подкисляют до pH ~3 добавлением 1н HCl. Осадок собирают, промывают водой, сушат в вакууме с получением желаемого продукта (59 мг, 58%) в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,610 (м, 1H), 0,63 (с, 3H), 0,89 (м, 1H), 1,20 (с, 3H), 2,48 (м, 1H), 6,88 (д, J=8 Гц, 1H), 6,92 (д, J=8 Гц, 1H), 7,21 (ушир.с, 1H), 7,39 (т, J=8 Гц, 1H), 8,42 (ушир.с, 1H), 10,74 (с, 1H). МС 266 (MH+).
Пример 270a: 2-амино-6-циклопропилбензонитрил
К дегазированному раствору 2-амино-6-бромбензонитрила (851 мкмоль, 168 мг), 2,2-диметилциклопропилбороновой кислоты (1,106 мкмоль, 126 мг) (Пример 270b) и Cs2CO3 (2,979 ммоль, 970 мг) в ДМЭ (3,4 мл) и воде (850 мкл) добавляют тетракис(трифенилфосфино)палладий(0) (43 мкмоль, 50 мг) в атмосфере азота, и реакционную смесь обрабатывают микроволнами в течение 2 часов при 160°C. Реакционную смесь охлаждают до комнатной температуры и экстрагируют EtOAc (3×5 мл). Объединенные органические слои промывают один раз насыщенным раствором соли (5 мл), сушат над сульфатом натрия, фильтруют и выпаривают. Неочищенный продукт очищают на силикагеле (EtOAc/гексан 10%-40%) с получением желаемого продукта (71 мг, 45%) в виде парафинообразного твердого вещества желтого цвета.1H ЯМР (400 МГц, CDCl3) δ 0,82 (м, 1H), 0,82 (с, 3H), 0,85 (м, 1H), 1,33 (с, 3H), 1,92 (м, 1H), 4,36 (ушир.с, 2H), 6,47 (д, J=8 Гц, 1H), 6,56 (д, J=8 Гц, 1H), 7,20 (т, J=8 Гц, 1H).
Пример 270b: 2,2-Диметилциклопропилбороновая кислота
К раствору 1-бром-2,2-диметилциклопропана (7,48 ммоль, 1,115 г) (Пример 270c) в безводном ТГФ (20 мл) добавляют тBuLi (8,23 ммоль, 1,7M в пентане, 4,85 мл) по каплям при -78°C в атмосфере азота. Через 1 час при -78°C, добавляют триметилборат (8,23 ммоль, 920 мкл), и реакционную смесь перемешивают в течение 2 часов при -78°С, нагревают до комнатной температуры, перемешивают в течение 1 часа и гасят насыщ. раствором NH4Cl (20 мл). Реакционную смесь разбавляют до общего объема 100 мл ДХМ и обрабатывают HCl (6н в воде, 22,45 ммоль, 3,74 мл). Слои разделяют, водный слой экстрагируют дихлорметаном (2×50 мл), объединенные органические слои промывают насыщенным раствором соли (25 мл), сушат над сульфатом натрия, фильтруют и выпаривают. Остаток разбавляют ацетоном (50 мл) и несколькими каплями воды, затем осторожно концентрируют в вакууме с получением 214 мг (25,1%) продукта в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ацетон-d6) δ 0,00 (м, 1H), 0,13 (м, 1H), 0,755 (дд, J=4 Гц, 8 Гц, 1H), 0,865 (дд, J=4 Гц, 8 Гц, 1H), 1,39 (с, 3H), 1,46 (с, 3H), 6,81 (с, 2H).
Пример 270c: 1-Бром-2,2-диметилциклопропан
К суспензии цинка (тонкоизмельченный порошок, 319,4 ммоль, 20,88 г) в EtOH (20 мл) добавляют HCl (12н, 5 мл) при 0°C. К смеси добавляют раствор 1,1-дибром-2,2-диметилциклопропана (18,2 г) (пример 270d) в EtOH (20 мл) в течение 5 минут при перемешивании. Реакционную смесь медленно нагревают до комнатной температуры в течение ночи. Соли цинка отфильтровывают через слой Целита, Целит промывают EtOH (50 мл), и полученный раствор разделяют между водой (200 мл) и пентаном (200 мл). Водный слой далее экстрагируют пентаном (2×100 мл), и объединенные органические экстракты последовательно промывают водой (4×75 мл), насыщенным раствором соли (25 мл), сушат над сульфатом натрия, фильтруют и выпаривают с получением продукта (1,115 г, 9,4%) в виде летучей бесцветной жидкости.1H ЯМР (400 МГц, ацетон-d6) δ 0,602 (дд, J=4 Гц, 6 Гц, 1H), 1,025 (дд, J=6 Гц, 8 Гц, 1H), 1,116 (с, 3H), 1,233 (с, 3H), 2,963 (дд, J=4 Гц, 8 Гц, 1H).
Пример 270d: 1,1-Дибром-2,2-диметилциклопропан
К раствору пентана (200 мл), охлажденному до -5°C, добавляют изобутилен (457,7 ммоль, 25,68 г), затем трет-бутоксид калия (549,2 ммоль, 61,63 г). Затем добавляют бромоформ (457,7 ммоль, 40,0 мл) по каплям при энергичном перемешивании в течение около 1 часа при -5°C. Реакционную смесь медленно нагревают до комнатной температуры и затем разделяют между пентаном (100 мл) и водой (200 мл). Водный слой экстрагируют пентаном (2×50 мл), и объединенные органические слои промывают водой (4×75 мл), насыщенным раствором соли (50 мл), сушат над сульфатом натрия, фильтруют и выпаривают. Оранжевый остаток пропускают через слой двуокиси кремния, элюируя пентаном. Растворитель выпаривают с получением желаемого продукта (65,70 г, 57,3%) в виде бесцветного масла.1H ЯМР (400 МГц, ацетон-d6) δ 1,392 (с, 6H), 1,505 (с, 2H).
Пример 271: (±)-Транс-5-(2-(метоксиметил)циклопропил)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 270 из (±)-транс-2-амино-6-(2-(метоксиметил)циклопропил)бензонитрила (пример 271a) и сульфамоилхлорида с 34% в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,976 (м, 1H), 1,172 (м, 1H), 1,340 (м, 1H), 2,282 (м, 1H), 3,175 (дд, J=8 Гц, 10 Гц, 1H), 3,252 (с, 3H), 3,576 (дд, J=5 Гц, 10 Гц, 1H), 6,802 (д, J=8 Гц, 1H), 6,855 (д, J=8 Гц, 1H), 7,376 (т, J=8 Гц, 1H), 8,396 (ушир.с, 1H), 8,473 (ушир.с, 1H), 10,823 (с, 1H). МС 282 (MH+).
Пример 271a: (±)-Транс-2-амино-6-(2-(метоксиметил)циклопропил)бензонитрил
Получают по методике примера 270a из (±)-транс-2-(метоксиметил)циклопропилбороновой кислоты (пример 271b) и 2-амино-6-бромбензонитрил с 64% выходом в виде желтовато-коричневого парафинообразного твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 0,932 (м, 2H), 1,341 (м, 1H), 1,879 (м, 1H), 2,324 (с, 3H), 3,351 (д, J=6 Гц, 2H), 5,896 (ушир.с, 2H), 6,148 (д, J=8 Гц, 1H), 6,550 (д, J=8 Гц, 1H), 7,130 (т, J=8 Гц, 1H).
Пример 271b: (±)-Транс-2-(метоксиметил)циклопропилбороновая кислота
К раствору (±)-транс-2-(метоксиметил)циклопропил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (10,0 ммоль, 2,121 г) (пример 271c), растворенному в ТГФ (64 мл) добавляют NaIO4 (30,0 ммоль, 6,417 г) и воду (16 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 минут, затем обрабатывают водной HCl (2н, 3,33 мл). Реакционную смесь перемешивают в течение одного часа при комнатной температуре, разделяют между EtOAc (100 мл), водный слой экстрагируют EtOAC (2×50 мл), объединенные органические слои промывают насыщенным раствором соли (25 мл), сушат над сульфатом натрия, фильтруют и выпаривают. Смесь помещают в ацетон, обрабатывают несколькими каплями воды и осторожно выпаривают до вязкого масла, которое медленно отверждается при комнатной температуре с получением желаемого продукта с количественным выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 0,467 (м, 1H), 0,324 (м, 1H), 0,532 (м, 1H), 1,055 (м, 1H), 3,099 (дд, J=7 Гц, 10 Гц, 1H), 3,186 (дд, J=7 Гц, 10 Гц, 1H), 3,206 (с, 3H), 7,344 (с, 2H).
Пример 271c: (±)-Транс-2-(метоксиметил)циклопропил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
К раствору (E)-2-(3-метоксипроп-1-енил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (32,2 ммоль, 6,3710 г) в безводном толуоле (50 мл) в атмосфере азота добавляют диэтилцинк (0,59 M в гексане, 32,2 ммоль, 54,6 мл), с последующим добавлением CH2I2 (45,08 ммоль, 3,63 мл). Колбу нагревают до 50°C в атмосфере азота. Через 4 часа добавляют другую порцию диэтилцинка (54,6 мл) и CH2I2 (3,63 мл) и нагревают в течение ночи в атмосфере азота. Реакционную смесь охлаждают до комнатной температуры и гасят насыщенным водным NH4Cl (50 мл). Реакционную смесь разделяют между простым эфиром (200 мл), слои отделяют, органический слой промывают насыщенным раствором соли (25 мл), сушат над сульфатом натрия, фильтруют и выпаривают. Остаток очищают на силикагеле (EtOAc/гексан 1% - 15%) с получением желаемого продукта (5,552 г, 81,3%) в виде масла светло-желтого цвета.1H ЯМР (400 МГц, ацетон) δ 0,012 (м, 1H), 0,804 (м, 1H), 0,944 (м, 1H), 1,172 (м, 1H), 3,484 (дд, J=6 Гц, 10 Гц, 1H), 3,553 (дд, J=6 Гц, 10 Гц, 1H), 3,570 (с, 3H).
Пример 272: (E)-4-(4-Амино-2,2-диоксо-1H-бензо[c][1,2,6]тиадиазин-5-ил)бут-3-ен-1-ол
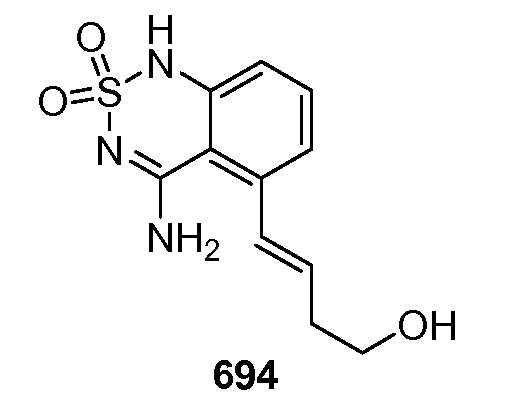
К раствору (E)-5-(4-(тетрагидро-2H-пиран-2-илокси)бут-1-енил)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксида (322 мкмоль, 43 мг) (Пример 273) в ТГФ (860 мкл) добавляют AcOH (1,7 мл) и воду (430 мкл), и раствор нагревают в течение ночи при 45°C. Раствор охлаждают до комнатной температуры и растворитель выпаривают. Остаток растирают с кипящей водой, затем охлаждают до комнатной температуры. Полученное твердое вещество собирают и промывают водой с получением желаемого продукта (69 мг, 80%) в виде твердого вещества светло-желтого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 2,365 (кв., J=6 Гц, 2H), 3,568 (кв., J=6 Гц, 2H), 4,681 (т, J=6 Гц, 1H), 6,186 (дт, J=7 Гц, 16 Гц, 1H), 6,786 (д, J=16 Гц, 1H), 6,922 (д, J=8 Гц, 1H), 7,022 (ушир.с, 1H), 7,088 (д, J=8 Гц, 1H), 7,468 (т, J=8 Гц, 1H), 8,388 (ушир.с, 1H), 10,935 (с, 1H). МС 268 (MH+).
Пример 273: (E)-5-(4-(Тетрагидро-2H-пиран-2-илокси)бут-1-енил)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 270 из (E)-2-амино-6-(4-(тетрагидро-2H-пиран-2-илокси)бут-1-енил)бензонитрила (пример 273a) и сульфамоилхлорида с 61% выходом в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 0,459 (м, 4H), 1,610 (м, 2H), 1,700 (м, 2H), 2,479 (кв., J=6 Гц, 2H), 3,428 (м, 1H), 3,528 (м, 1H), 3,765 (м, 2H), 4,579 (м, 1H), 6,200 (дт, J=7 Гц, 16 Гц, 1H), 6,823 (д, J=16 Гц, 1H), 6,867 (ушир.с, 1H), 6,931 (д, J=8 Гц, 1H), 7,087 (д, J=8 Гц, 1H), 7,472 (т, J=8 Гц, 1H), 8,401 (ушир.с, 1H), 10,945 (с, 1H). МС 352 (MH+).
Пример 273a: (E)-2-Амино-6-(4-(тетрагидро-2H-пиран-2-илокси)бут-1-енил)бензонитрил
Получают по методике примера 270a из (E)-4,4,5,5-тетраметил-2-(4-(тетрагидро-2H-пиран-2-илокси)бут-1-енил)-1,3,2-диоксаборолана (Пример 273b) и 2-амино-6-бромбензонитрила с 47% выходом в виде желтой смолы.1H ЯМР (400 МГц, CDCl3) δ 1,570 (м, 4H), 1,727 (м, 2H), 1,837 (м, 2H), 2,565 (кв., J=6 Гц, 2H), 3,541 (м, 2H), 3,879 (м, 2H), 4,387 (ушир.с, 2H), 4,635 (м, 1H), 6,423 (дт, J=7 Гц, 16 Гц, 1H), 6,586 (д, J=8 Гц, 1H), 6,710 (д, J=16 Гц, 1H), 6,905 (д, J=8 Гц, 1H), 7,237 (т, J=8 Гц, 1H).
Пример 273b: (E)-4,4,5,5-Тетраметил-2-(4-(тетрагидро-2H-пиран-2-илокси)бут-1-енил)-1,3,2-диоксаборолан
Чистый 2-(бут-3-инилокси)тетрагидро-2H-пиран (12,8 ммоль, 2,0 мл) обрабатывают пинаколбораном (19,1 ммоль, 2,78 мл) при 60°C в атмосфере азота. Через 2 часа добавляют другую порцию пинаколборана (12,8 ммоль, 1,86 мл) и продолжают нагревание при 60°C. Через 8 часов реакционную смесь разбавляют гексаном (30 мл) и обрабатывают по каплям водой (1 мл), перемешивая до тех пор, пока не прекратится выделение газа. Слои разделяют, водный слой экстрагируют гексаном (2×5 мл), объединенные органические слои промывают насыщенным раствором соли (5 мл), сушат над сульфатом магния, фильтруют и выпаривают. Неочищенный продукт очищают на силикагеле (EtOAc/гексан 10% - 30%) с получением продукта (1,73 г, 48% выход) в виде масла.1H ЯМР (400 МГц, CDCl3) δ 1,262 (с, 3H), 1,531 (м, 2H), 1,699 (м, 1H), 1,812 (м, 1H), 2,469 (дкв., J=2 Гц, 7 Гц, 2H), 3,495 (м, 1H), 3,832 (м, 2H), 4,593 (дд, J=3 Гц, 4 Гц, 1H), 5,523 (дт, J=2 Гц, 18 Гц, 1H), 6,634 (дт, J=7 Гц, 18 Гц, 1H).
Пример 274: 8-(4-Амино-2,2-диоксо-1H-бензо[c][1,2,6]тиадиазин-5-илокси)октан-1-ол

К раствору 8-(3-амино-2-цианофенокси)октилацетата (746 мкмоль, 227 мг) в ДМА (3 мл) добавляют сульфамоилхлорид (1,492 ммоль, 172 мг) и пиридин (4,476 ммоль, 362 мкл). Реакционную смесь перемешивают при комнатной температуре до завершения, затем гасят насыщ. NaHCO3 (15 мл) и добавляют твердый NaCl. Осадок собирают и промывают водой. Влажный осадок суспендируют в EtOH (15 мл) и обрабатывают NaOH (8,952 ммоль, 1н, 8,95 мл). Реакционную смесь кипятят с обратным холодильником до завершения, затем охлаждают до комнатной температуры. Большую часть EtOH и воды удаляют в вакууме, затем реакционную смесь растворяют в воде (15 мл), экстрагируют простым эфиром (3×5 мл), фильтруют через 0,45 мкм ПТФЭ фритту, затем подкисляют 10% раствором лимонной кислоты/воды до pH 4-5. Осадок отфильтровывают, промывают водой и сушат с получением желаемого продукта 146 мг (57,3%) в виде твердого вещества беловатого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ 1,265 (м, 6H), 1,380 (м, 4H), 1,785 (пентет, J=7 Гц, 2H), 3,348 (кв., J=6 Гц, 2H), 4,303 (т, J=5 Гц, 2H), 6,580 (д, J=8 Гц, 1H), 6,724 (д, J=8 Гц, 1H), 7,428 (т, J=8 Гц, 1H), 7,796 (ушир.с, 1H), 8,329 (ушир.с, 1H), 10,922 (с, 1H). МС 342 (MH+).
Пример 274a: 8-(3-Амино-2-цианофенокси)октилацетат
Раствор 8-(2-циано-3-нитрофенокси)октилацетата (802 мкмоль, 268 мг) (Пример 274c) в EtOH (15 мл) гидрируют в аппарате H-куб с применением 10% Pd/C в качестве катализатора. Раствор выпаривают с получением 8-(3-амино-2-цианофенокси)октилацетата (244 мг, 244 мг). МС 305 (MH+).
Пример 274b: 8-(2-Циано-3-нитрофенокси)октилацетат
2-(8-гидроксиоктилокси)-6-нитробензонитрил (804 мкмоль, 235 мг) (Пример 274c) растворяют в сухом ДХМ (10 мл), охлаждают до 0°C, и обрабатывают последовательно пиридином (3,216 ммоль, 260 мкл) и ацетилхлоридом (1,608 ммоль, 114 мкл). Реакционную смесь перемешивают и медленно нагревают до комнатной температуры. После завершения реакции летучие соединения удаляют в вакууме, и неочищенный продукт очищают на силикагеле (10% - 50% EtOAc в гексане) с получением желаемого продукта (268 мг, 100%). МС 335 (MH+).
Пример 274c: 2-(8-Гидроксиоктилокси)-6-нитробензонитрил
К раствору 1,8-октандиола (3,87 ммоль, 566 мг) в ТГФ (сухой, 10 мл) добавляют 2,6-динитробензонитрил (1,29 ммоль, 250 мг) и ДБУ (1,30 ммоль, 194 мкл). Реакционную смесь перемешивают в течение 24 часов при комнатной температуре и выпаривают. Маслянистый остаток растирают с 10% лимонной кислотой/водой и добавляют твердый NaCl. Осадок собирают, промывают водой, сушат в вакууме и очищают на силикагеле (40% - 100% EtOAc в гексане) с получением желаемого продукта (235 мг, 62,3%) в виде розоватого твердого вещества. МС 293 (MH+).
Пример 275: 7-(4-Амино-2,2-диоксо-1H-бензо[c][1,2,6]тиадиазин-5-илокси)гептан-1-ол

Получают по методике примера 274 из 7-(3-амино-2-цианофенокси)гептилацетата (Пример 275a) и сульфамоилхлорида с 79,4% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,320 (м, 4H), 1,405 (м, 4H), 1,811 (пентет, J=7 Гц, 2H), 3,378 (кв., J=6 Гц, 2H), 4,154 (т, J=6 Гц, 2H), 4,331 (т, J=5 Гц, 1H), 6,605 (д, J=8 Гц, 1H), 6,752 (д, J=8 Гц, 1H), 7,454 (т, J=8 Гц, 1H), 7,823 (ушир.с, 1H), 8,358 (ушир.с, 1H), 10,946 (с, 1H). МС 328 (MH+).
Пример 275a: 7-(3-Амино-2-цианофенокси)гептилацетат
Получают по методике примера 274a из 7-(2-циано-3-нитрофенокси)гептилацетата (Пример 275b) с 89% выходом. МС 291 (MH+)
Пример 275b: 7-(2-Циано-3-нитрофенокси)гептилацетат
Получают по методике примера 274b из 2-(7-гидроксигептилокси)-6-нитробензонитрила (Пример 275c) со 100% выходом. МС 321 (MH+).
Пример 275c: 2-(7-Гидроксигептилокси)-6-нитробензонитрил
Получают по методике примера 274c (за исключением того, что ДБУ заменяют KOtBu) из 1,7-гептандиола с 65% выходом. МС 279 (MH+).
Пример 276: 9-(4-Амино-2,2-диоксо-1H-бензо[c][1,2,6]тиадиазин-5-илокси)нонан-1-ол

Получают по методике примера 274 из 9-(3-амино-2-цианофенокси)нонилацетата (Пример 276a) и сульфамоилхлорида с 62,3% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,250 (м, 8H), 1,381 (м, 4H), 1,791 (пентет, J=7 Гц, 2H), 3,349 (кв., J=6 Гц, 2H), 4,135 (т, J=6 Гц, 2H), 4,301 (т, J=5 Гц, 1H), 6,585 (д, J=8 Гц, 1H), 6,728 (д, J=8 Гц, 1H), 7,434 (т, J=8 Гц, 1H), 7,798 (ушир.с, 1H), 8,329 (ушир.с, 1H), 10,924 (с, 1H). МС 356 (MH+).
Пример 276a: 9-(3-Амино-2-цианофенокси)нонилацетат
Получают по методике примера 274a из 9-(2-циано-3-нитрофенокси)нонилацетата (Пример 276b) с 99,3% выходом. МС 319 (MH+)
Пример 276b: 9-(2-Циано-3-нитрофенокси)нонилацетат
Получают по методике примера 274b из 2-(9-гидроксинонилокси)-6-нитробензонитрила (Пример 276c) со 100% выходом. МС 349 (MH+).
Пример 276c: 2-(9-Гидроксинонилокси)-6-нитробензонитрил
Получают по методике примера 274c (за исключением того, что ДБУ заменяют 1,1,3,3-тетраметилгуанидином) из 1,9-нонандиола и 2,6-динитробензонитрила с 30,7% выходом. МС 307 (MH+).
Пример 277: N-(6-(4-Амино-2,2-диоксо-1H-бензо[c][1,2,6]тиадиазин-5-илокси)гексил)-2-гидрокси-2-метилпропанамид

Получают по методике примера 274 из 1-(6-(3-амино-2-цианофенокси)гексиламино)-2-метил-1-оксопропан-2-илацетата (Пример 277a) с 65,5% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,201 (с, 6H), 1,289 (м, 2H), 1,399 (м, 4H), 1,790 (пентет, J=7 Гц, 2H), 3,036 (кв., J=6 Гц, 2H), 4,130 (т, J=6 Гц, 2H), 5,272 (с, 1H), 6,587 (д, J=8 Гц, 1H), 6,728 (д, J=8 Гц, 1H), 7,436 (т, J=8 Гц, 1H), 7,594 (ушир.т, 1H), 7,804 (ушир.с, 1H), 8,326 (ушир.с, 1H), 10,924 (с, 1H). МС 399 (MH+).
Пример 277a: 1-(6-(3-Амино-2-цианофенокси)гексиламино)-2-метил-1-оксопропан-2-илацетат
Получают по методике примера 274a из 1-(6-(2-циано-3-нитрофенокси)гексиламино)-2-метил-1-оксопропан-2-илацетата (Пример 274b) с 94,4% выходом. МС 362 (MH+)
Пример 277b: 1-(6-(2-Циано-3-нитрофенокси)гексиламино)-2-метил-1-оксопропан-2-илацетат
К раствору трет-бутил 6-(2-циано-3-нитрофенокси)гексилкарбамата (333 мкмоль, 121 мг) (Пример 277c) в диоксане (2 мл) добавляют конц. HCl (1 мл). Через 15 минут раствор концентрируют в вакууме и сушат в высоком вакууме. Неочищенную соль HCl суспендируют в ДХМ (сухой, 10 мл) и обрабатывают пиридином (2,664 ммоль, 215 мкл) и 1-хлор-2-метил-1-оксопропан-2-илацетатом (1,332 ммоль, 193 мкл). Реакционную смесь кипятят с обратным холодильником в атмосфере азота до прозрачности (6 ч), затем охлаждают до комнатной температуры и летучие вещества удаляют в вакууме. Остаток очищают на силикагеле (40% - 100% EtOAc в гексане) с получением продукта (117 мг, 90%) в виде густого масла светло-желтого цвета. МС 392 (MH+).
Пример 277c: трет-Бутил 6-(2-циано-3-нитрофенокси)гексилкарбамат
Получают по методике примера 215c из трет-бутил 6-гидроксигексилкарбамата с 53,8% выходом в виде твердого вещества светло-желтого цвета. МС 364 (MH+).
Пример 278: 1-(6-(4-Амино-2,2-диоксо-1H-бензо[c][1,2,6]тиадиазин-5-илокси)гексил)мочевина
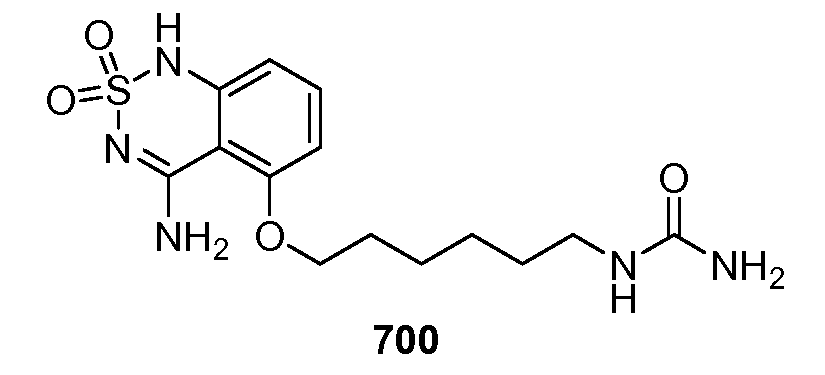
Раствор 1-(6-(4-амино-2,2-диоксо-1H-бензо[c][1,2,6]тиадиазин-5-илокси)гексил)-3-(4-метоксибензил)мочевины (122 мкмоль, 58 мг) (Пример 279) в ДХМ (2,5 мл) обрабатывают ТФК (2,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 4 часов, затем летучие вещества удаляют в потоке азота. Маслянистый остаток растирают с простым эфиром, осадок собирают, промывают простым эфиром, затем растворяют в MeOH и выпаривают с получением желаемого продукта (44 мг,100% выход).1H ЯМР (400 МГц, ДМСО-d6) δ 1,364 (м, 6H), 1,812 (пентет, J=7 Гц, 2H), 2,943 (ушир.т, 2H), 4,154 (д, J=7 Гц, 2H), 4,131 (т, J=7 Гц, 2H), 5,349 (ушир.с, 2H), 5,894 (ушир.с, 1H), 6,607 (д, J=8 Гц, 1H), 6,752 (д, J=8 Гц, 1H), 7,456 (т, J=8 Гц, 1H), 7,824 (ушир.с, 1H), 8,351 (ушир.с, 1H), 10,945 (с, 1H). МС 356 (MH+).
Пример 279: 1-(6-(4-Амино-2,2-диоксо-1H-бензо[c][1,2,6]тиадиазин-5-илокси)гексил)-3-(4-метоксибензил)мочевина

К суспензии хлорида 6-(4-амино-2,2-диоксо-1H-бензо[c][1,2,6]тиадиазин-5-илокси)гексан-1-аминия (166 мкмоль, 52 мг) (Пример 280) в сухом ДХМ (6 мл) последовательно добавляют Et3N (332 мкмоль, 46 мкл) и 1-(изоцианатметил)-4-метоксибензол (183 мкмоль, 26 мкл). Реакционную смесь перемешивают в течение 48 часов при комнатной температуре, затем концентрируют в вакууме. Остаток промывают водой, сушат, затем очищают на силикагеле (20% - 100% EtOAc в гексане) с получением желаемого продукта (64 мг, 81,0% выход).1H ЯМР (400 МГц, ДМСО-d6) δ 1,296 (м, 2H), 1,371 (м, 4H), 1,791 (пентет, J=8 Гц, 2H), 2,980 (кв., J=6 Гц, 2H), 3,695 (с, 3H), 4,086 (д, J=6 Гц, 2H), 4,131 (т, J=6 Гц, 2H), 5,836 (ушир.т, J=5 Гц, 1H), 6,141 (ушир.т, J=6 Гц, 1H), 6,585 (д, J=8 Гц, 1H), 6,727 (д, J=8 Гц, 1H), 6,840 (д, J=9 Гц, 2H), 7,137 (д, J=9 Гц, 2H), 7,433 (т, J=8 Гц, 1H), 7,803 (ушир.с, 1H), 8,321 (ушир.с, 1H), 10,926 (с, 1H). МС 476 (MH+).
Пример 280: Хлорид 6-(4-амино-2,2-диоксо-1H-бензо[c][1,2,6]тиадиазин-5-илокси)гексан-1-аминия

К раствору трет-бутил 6-(4-амино-2,2-диоксо-1H-бензо[c][1,2,6]тиадиазин-5-илокси)гексилкарбамата (118 мг, 286 мкмоль) (Пример 281) в диоксане (2 мл) добавляют конц. HCl (1 мл) и раствор перемешивают при комнатной температуре в течение 15 минут. Растворители удаляют в вакууме, и остаток растирают с горячим этанолом. После охлаждения до комнатной температуры осадок собирают, промывают горячим этанолом и сушат в вакууме с получением желаемого продукта 56 мг (62,9%) в виде беловатого порошка.1H ЯМР (400 МГц, ДМСО-d6) δ 1,367 (м, 4H), 1,529 (пентет, J=7 Гц, 2H), 1,795 (пентет, J=7 Гц, 2H), 2,741 (ушир.м, 2H), 4,144 (т, J=7 Гц, 2H), 6,596 (д, J=8 Гц, 1H), 6,733 (д, J=8 Гц, 1H), 7,440 (т, J=8 Гц, 1H), 7,725 (ушир.с, 3H), 7,795 (ушир.с, 1H), 8,350 (ушир.с, 1H), 10,954 (с, 1H). МС 313 (MH+).
Пример 281: трет-Бутил 6-(4-амино-2,2-диоксо-1H-бензо[c][1,2,6]тиадиазин-5-илокси)гексилкарбамат
Получают по методике примера 274 из трет-бутил 6-(3-амино-2-цианофенокси)гексилкарбамата (Пример 281a) и сульфамоилхлорида с 59,5% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 1,274 (м, 2H), 1,339 (с, 9H), 1,361 (м, 4H), 1,779 (пентет, J=7 Гц, 2H), 2,878 (кв., J=6 Гц, 2H), 4,122 (т, J=6 Гц, 2H), 6,580 (д, J=8 Гц, 1H), 6,722 (д, J=8 Гц, 1H), 6,75 (ушир.т, J=6 Гц, 1H), 7,428 (т, J=8 Гц, 1H), 7,798 (ушир.с, 1H), 8,323 (ушир.с, 1H), 10,921 (с, 1H). МС 413 (MH+).
Пример 281a: трет-Бутил 6-(3-амино-2-цианофенокси)гексилкарбамат
Получают по методике примера 274a из трет-бутил 6-(2-циано-3-нитрофенокси)гексилкарбамата (пример 277c) с количественным выходом. МС 334 (MH+).
Пример 282: 5-(2-(1H-Пиррол-1-ил)этокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 274 из 2-(2-(1H-пиррол-1-ил)этокси)-6-аминобензонитрила (Пример 282a) и сульфамоилхлорида с 66,6% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 4,392 (м, 4H), 5,992 (т, J=2 Гц, 2H), 6,595 (д, J=8 Гц, 1H), 6,693 (д, J=8 Гц, 1H), 6,816 (т, J=2 Гц, 2H), 7,428 (т, J=8 Гц, 1H), 7,482 (ушир.с, 1H), 8,288 (ушир.с, 1H), 10,930 (с, 1H). МС 307 (MH+).
Пример 282a: 2-(2-(1H-Пиррол-1-ил)этокси)-6-аминобензонитрил
Получают по методике примера 274a из 2-(2-(1H-пиррол-1-ил)этокси)-6-нитробензонитрила (Пример 282b) с 85,2% выходом. МС 228 (MH+).
Пример 282b: 2-(2-(1H-Пиррол-1-ил)этокси)-6-нитробензонитрил
Получают по методике примера 166d из 2-(1H-пиррол-1-ил)этанола и 2,6-динитробензонитрила с 42,5% выходом. МС 258 (MH+).
Пример 283: 5-(2-(1H-Пиразол-1-ил)этокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 274 из 2-(2-(1H-пиразол-1-ил)этокси)-6-аминобензонитрила (Пример 283a) и сульфамоилхлорида с 54,5% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 4,406 (т, J=5 Гц, 2H), 4,630 (т, J=5 Гц, 2H), 6,266 (т, J=2 Гц, 1H), 6,593 (д, J=8 Гц, 1H), 6,689 (д, J=8 Гц, 1H), 7,445 (ушир.с, 1H), 7,425 (т, J=8 Гц, 1H), 7,805 (д, J=2 Гц, 1H), 8,224 (ушир.с, 1H), 8,301 (ушир.с, 1H), 10,904 (с, 1H). МС 308 (MH+).
Пример 283a: 2-(2-(1H-Пиразол-1-ил)этокси)-6-аминобензонитрил
Получают по методике примера 274a из 2-(2-(1H-пиразол-1-ил)этокси)-6-нитробензонитрила (Пример 283b) с 46,2% выходом. МС 229 (MH+).
Пример 283b: 2-(2-(1H-Пиразол-1-ил)этокси)-6-нитробензонитрил
Получают по методике примера 215c из 2-(1H-пиразол-1-ил)этанола и 2,6-динитробензонитрила с 89,2% выходом. МС 259 (MH+).
Пример 284: 5-(2-(3,5-Диметил-1H-пиразол-1-ил)этокси)-1H-бензо[c][1,2,6]тиадиазин-4-амин-2,2-диоксид

Получают по методике примера 274 из 2-(2-(3,5-диметил-1H-пиразол-1-ил)этокси)-6-аминобензонитрила (Пример 284a) и сульфамоилхлорида с 18,2% выходом.1H ЯМР (400 МГц, ДМСО-d6) δ 2,066 (с, 3H), 2,215 (с, 3H), 4,313 (т, J=4 Гц, 2H), 4,397 (т, J=4 Гц, 2H), 5,801 (с, 1H), 6,584 (д, J=8 Гц, 1H), 6,645 (д, J=8 Гц, 1H), 7,418 (т, J=8 Гц, 1H), 8,395 (ушир.с, 1H), 8,677 (ушир.с, 1H), 10,885 (с, 1H). МС 336 (MH+).
Пример 284a: 2-(2-(3,5-Диметил-1H-пиразол-1-ил)этокси)-6-аминобензонитрил
Получают по методике примера 274a из 2-(2-(3,5-диметил-1H-пиразол-1-ил)этокси)-6-нитробензонитрила (пример 284b) с 69,3% выходом. МС 257 (MH+).
Пример 284b: 2-(2-(3,5-Диметил-1H-пиразол-1-ил)этокси)-6-нитробензонитрил
Получают по методике примера 215c из 2-(3,5-диметил-1H-пиразол-1-ил)этанола и 2,6-динитробензонитрила с 90,7% выходом. МС 287 (MH+).
ЭКСПЕРИМЕНТ 4: Биологический анализ
Производное колонии клеток HEK293 (Chandrashekar et al., Cell 100, 703-711, 2000), которое стабильно экспрессирует Gαl5 и hT1R2/hT1R3 (Li et al., Proc Natl Acad Sci USA 99, 4692-4696, 2002) (см. также, международную публикацию № WO 03/001876) применяют в биологических анализах в сочетании с идентифицирующими соединениями, обладающими свойствами улучшения сладкого вкуса.
Соединения изначально выбирают на основе их активности к hT1R2/hT1R3-HEK293-Gαl5 колонии клеток Li et al., supra. Активность определяют с применением автоматизированного флуорометрического визуализирующего анализа на инструменте FLIPR (Fluorometric Intensity Plate Reader, Molecular Devices, Sunnyvale, CA) (обозначенного анализ FLIPR). Клетки от одного клона (обозначенного клон S-9) засевают в 384-луночные планшеты (при приблизительно 50000 клеток на лунку) в среде, содержащей DMEM Low Glucose (Invitrogen, Carlsbad, CA), 10% диализированную фетальную телячью сыворотку (Invitrogen, Carlsbad, CA), 100 единиц/мл Пенициллина G и 100 мкг/мл Стрептомицина (Invitrogen, Carlsbad, CA) (Li et al., 2002) (см. также, международную публикацию № WO 03/001876).
Клетки S-9 выращивают в течение 24 часов при 37°С. Клетки S-9 затем насыщают кальциевым красителем Fluo-3AM (Molecular Probes, Eugene, OR), 4 мкМ в физиологическом растворе с фосфатным буфером (D-PBS) (Invitrogen, Carlsbad, CA), в течение 1 часа при комнатной температуре. После замены 25 мкл D-PBS, проводят стимулирование в инструменте FLIPR и при комнатной температуре добавлением 25 мкл D-PBS с добавлением соединений в концентрациях, соответствующих трехкратному желаемому конечному уровню (Стимулирование 1).
Клетки инкубируют с соединениями в течение 7,5 минут и затем проводят другое стимулирование в инструменте FLIPR добавлением 25 мкл of D-PBS с добавлением суб-оптимальной концентрации подсластителей (с получением от около 5% до 20% активности рецептора) (Стимулирование 2).
Альтернативно, после замены 25 мкл D-PBS на лунку, стимулирование проводят на инструменте FLIPR при комнатной температуре добавлением 25 мкл D-PBS с добавлением различных стимуляторов.
Типовые подсластители включают, но не ограничены ими D-Глюкозу, D-Фруктозу, Сукралозу, Аспартам и Сахарозу. Затем активность рецептора количественно оценивают через определение увеличения максимальной флуоресценции (с применением 480 нм возбуждения и 535 нм эмиссии) после нормализации до основной интенсивности флуоресценции, измеренной до стимулирования. Соединения, вызывающие повышение медиированной подсластителем активности рецептора, выбирают для дальнейшей характеризации и количественной оценки свойств потенциального улучшения.
В представленном ниже анализе фиксированную концентрацию соединений добавляют в двух повторностях в 10 последовательных столбцов (20 лунок всего) во время стимулирования 1. Типовые тестируемые концентрации соединения включают 300 мкМ, 100 мкМ, 50 мкМ, 30 мкМ, 10 мкМ, 3 мкМ и 1 мкМ, 0,3 мкМ, 0,1 мкМ или 0,03 мкМ. Через 7,5 минут инкубационного периода, повышение концентраций подсластителя (для построения кривой «доза-реакция») проводят в тех же лунках, в двух повторностях, во время стимулирования 2. Относительную эффективность соединений при улучшении рецептора определяют расчетом величины сдвига в EC50 для подсластителя. Улучшение определяют как соотношение (EC50R), соответствующее EC50 подсластителей, определенному при отсутствии тестируемого соединения, деленному на EC50 подсластителя, определенному в присутствии тестируемого соединения. В некоторых вариантах соединения имеют EC50R от около 1 (например, >1) до около 1000. В других вариантах соединения имеют EC50R от около 1,25 до около 500. В других вариантах, соединения имеют EC50R от около 1,50 до около 100. В других вариантах, соединения имеют EC50R от около 1 (например, >1) до около 50.
В еще одном варианте соединения в дозе около 50 мкМ имеют EC50R от около 1 (например, >1) до около 1000, от около 1,25 до около 500, от около 1,50 до около 100, или от около 1 (например, >1) до около 50. Результаты анализа соединений показаны в таблице А ниже.
В одном иллюстративном примере, EC50R прединкубированной сукралозы при 50 мкМ для одной группы определенных соединений в соответствии с данным изобретением обычно составляют от 0,73 до 5,20, EC50R со-стимулированной сукралозы при 50 мкМ для той же группы соединений обычно составляют от 0,72 до 4,46. В другом иллюстративном примере, EC50R со-стимулированной сахарозы при 50 мкМ для одной группы определенных соединений в соответствии с данным изобретением обычно составляют от 1,30 до 4,35, EC50R со-стимулированной сукралозы при 50 мкМ для той же группы соединений обычно составляют от 1,73 до 24,09, и EC50R со-стимулированной фруктозы при 50 мкМ для той же группы соединений обычно составляют от 0,81 до 4,46. В другом иллюстративном примере, EC50R со-стимулированной сахарозы при 50 мкМ для одной группы определенных соединений в соответствии с данным изобретением обычно составляют от 1,05 до 2,44, EC50R со-стимулированной сукралозы при 50 мкМ для той же группы соединений обычно составляют от 1,57 до 11,63, и EC50R со-стимулированной фруктозы при 50 мкМ для той же группы соединений обычно составляют от 0,99 до 1,78. В другом иллюстративном примере, EC50R со-стимулированной сахарозы при 50 мкМ для одной группы определенных соединений в соответствии с данным изобретением обычно составляют от 1,27 до 116,56, EC50R со-стимулированной сукралозы при 50 мкМ для той же группы соединений обычно составляют от 1,48 до 157,63, и EC50R со-стимулированной фруктозы при 50 мкМ для той же группы соединений обычно составляют от 0,68 до 9,56. В другом иллюстративном примере, EC50R со-стимулированной сахарозы при 50 мкМ для одной группы определенных соединений в соответствии с данным изобретением обычно составляют от 0,88 до 36,66, EC50R со-стимулированной сукралозы при 50 мкМ для той же группы соединений обычно составляют от 1,07 до 101,15, и EC50R со-стимулированной фруктозы при 50 мкМ для той же группы соединений обычно составляют от 0,71 до 7,09. В другом иллюстративном примере, EC50R со-стимулированной сахарозы при 50 мкМ для одной группы определенных соединений в соответствии с данным изобретением обычно составляют от 1,39 до 17,17, EC50R со-стимулированной сукралозы при 50 мкМ для той же группы соединений обычно составляют от 3,80 до 49,89, и EC50R со-стимулированной фруктозы при 50 мкМ для той же группы соединений обычно составляют от 0,92 до 6,07. В другом иллюстративном примере, EC50R со-стимулированной сахарозы при 50 мкМ для одной группы определенных соединений в соответствии с данным изобретением обычно составляют от 1,30 до 56,27, EC50R со-стимулированной сукралозы при 50 мкМ для той же группы соединений обычно составляют от 1,26 до 204,98, и EC50R со-стимулированной фруктозы при 50 мкМ для той же группы соединений обычно составляют от 1,14 до 8,37.
ЭКСПЕРИМЕНТ 5: Измерение сладкого привкуса и улучшения сладкого привкуса человеческими дегустаторами при проведении градационного теста
Тестируемые образцы, содержащие экспериментальные соединения, сравнивают с кривой «доза-реакция» для выявленной интенсивности подслащивания для концентраций подсластителей (таких как, например, сукралоза, сахароза, фруктоза и другие подсластители) для определения эквивалентной интенсивности подслащивания.
Группа из восьми или более дегустаторов тестируют растворы, включающие подсластители в различных концентрациях, а также экспериментальное соединение с или без добавления подсластителя. Дегустаторы затем ранжируют интенсивность подслащивания образцов на структурированной горизонтальной линейной шкале, разлинованной от 0 до 15, где 0 означает отсутствие подслащивания, и 15 означает подслащивание, эквивалентное образцу с 15% сахарозы. Баллы, выдаваемые интенсивности подслащивания, усредняют для всех дегустаторов. Затем, применяя средние баллы и/или уравнение линии для кривой «доза-реакция» подсластителя, определяют концентрации с эквивалентным подслащиванием для образцов, содержащих экспериментальные соединения.
Дегустаторов предварительно знакомят с основным свойством вкуса и обучают применять шкалу с баллами от 0 до 15. Дегустаторов просят воздерживаться от еды или питья (за исключением воды) в течение, по крайней мере, 1 часа до проведения теста. Дегустаторы едят крекер и несколько раз промывают рот водой для его очистки.
Растворы подсластителя представлены с большим спектром концентраций, например, 100 ч./млн, 200 ч./млн, 300 ч./млн, 400 ч./млн и 500 ч./млн для сукралозы или от 0% до 12% для сахарозы или фруктозы, для получения кривой «доза-реакция». Образцы, содержащие экспериментальное соединение, получают отдельно и в 100 ч./млн растворе сукралозы, или 6% растворе сахарозы или фруктозы. Все образцы получают в гипонатриевом буфере pH 7,1. Для того, чтобы облегчить дисперсию, растворы могут быть получены в 0,1% этаноле.
Растворы диспергируют в объеме 20 мл в 1 унц. стаканчиках, подаваемых дегустаторам при комнатной температуре. Все образцы представлены в произвольном уравновешенном порядке для снижения систематической ошибки. Далее, две сессии тестирования могут применяться для проверки точности панели.
Дегустаторы тестируют каждый образец отдельно и оценивают интенсивность сладости по линейной шкале до тестирования следующего образца. Все образцы выплевывают. Дегустаторы могут повторно попробовать образцы, но могут использовать только предложенный объем образца. Дегустаторы должны ополаскивать рот водой между образцами. Поедание не соленых крекеров между образцами может потребоваться в зависимости от тестируемого образца.
Баллы для каждого образца усредняют по дегустаторам и рассчитывают стандартную ошибку. Кривую «доза-реакция» наносят графически, и ее применяют для обеспечения аккуратного ранжирования панели; т.е. повышение концентрации сукралозы должно соответствовать увеличенным средним баллам для сладости. 2-факторный ANOVA (факторами являются образцы и дегустаторы) и множество сравнительных тестов (таких как тест Tukey′s Honestly Significant Difference) могут применяться для различий между образцами и/или дегустаторами. 3-факторный ANOVA, где третьим фактором являются сеансы, может применяться для определения того, существуют ли различия в баллах между сеансами.
Соединения, тестируемые в данном эксперименте, а именно, соединения C1 - C21, являются типовыми соединениями в соответствии с данным изобретением, включая соединения структурной формулы (I) и ее субгенерических формул.
Результаты тестирования вкусовых ощущений человека для соединения C1 представлены ниже. В таблице 1 показано, что 100 мкМ соединения C1 в 100 ч./млн сукралозе дает сладость, эквивалентную 200 ч./млн сукралозы. В таблице 2 показано, что 100 мкМ соединения C1 само по себе не обладает сладостью и поэтому может быть определено как настоящий улучшитель сладкого вкуса.
Результаты тестирования вкусовых ощущений человека для соединения C2, представленны ниже. В таблице 3, показано, что 100 мкМ соединения в 100 ч./млн сукралозы эквивалентны сладости до около 600 ч./млн сукралозы. В таблице 4 показана кривая «доза-реакция» для соединения C2 с 100 ч./млн сукралозы, что показывает значительное улучшение сладкого вкуса сукралозы при добавлении повышенных количеств соединения C2. В таблице 5 показано, что 100 мкМ соединения C2 в чистом виде обладает незначительным или не обладает сладким вкусом и поэтому может быть определено как настоящий улучшитель сладости.
Результаты тестирования вкусовых ощущений человека для соединения C3 показаны ниже. В таблице 6 показано, что 100 мкМ соединения в 100 ч./млн сукралозы эквивалентно сладости около 200 - 300 ч./млн сукралозы. В таблице 7 показано, что 100 мкМ соединения C3 в чистом виде не обладает сладким вкусом, и поэтому может быть определено как настоящий улучшитель сладости.
Результаты тестирования вкусовых ощущений человека для соединения C4 показаны ниже. В таблице 8 показано, что 100 мкМ соединения C4 в 6% сахарозе эквивалентно сладости 8% сахарозы. В таблице 9 показано, что 100 мкМ соединения C4 в чистом виде не обладает сладостью, и поэтому может быть определено как настоящий улучшитель сладости.
Результаты тестирования вкусовых ощущений человека для соединения C5 показаны ниже. В таблице 10 показано, что 100 мкМ соединения C5 в 6% сахарозы обладает сладостью, эквивалентной 9% сахарозе. В таблице 11 показано, что 100 мкМ соединения C5 в чистом виде не обладает сладостью, и поэтому может быть определено как настоящий улучшитель сладости.
Результаты тестирования вкусовых ощущений человека для соединения C6 показаны ниже. В таблице 12 показано, что 100 мкМ соединения C6 в 6% сахарозы обладает сладостью, эквивалентной 10% сахарозе. В таблице 13 показано, что 100 мкМ соединения C6 в чистом виде не обладает сладостью, и поэтому может быть определено как настоящий улучшитель сладости.
Результаты тестирования вкусовых ощущений человека для соединения C7 показаны ниже. В таблице 14 показано, что 50 мкМ соединения C7 в 6% сахарозы обладает сладостью, эквивалентной 9% сахарозе.
Результаты тестирования вкусовых ощущений человека для соединения C8 показаны ниже. В таблице 15 показано, что 100 мкМ соединения C8 в 6% сахарозы обладает сладостью, эквивалентной 8% сахарозе. В таблице 16 показано, что 100 мкМ соединения C8 в чистом виде не обладает сладостью, и поэтому может быть определено как настоящий улучшитель сладости.
Результаты тестирования вкусовых ощущений человека для соединения C9 показаны ниже. В таблице 17 показано, что от около 40 до около 55 мкМ соединения C9 в 100 ч./млн сукралозы обладает сладостью, эквивалентной 400 ч./млн сукралозы. В таблице 18 показано, что от около 40 до около 55 мкМ соединения C9 в чистом виде не обладает сладостью, и поэтому может быть определено как настоящий улучшитель сладости.
Результаты тестирования вкусовых ощущений человека для соединения C10 показаны ниже. В таблице 19 показано, что 25 мкМ соединения C10 в 6% сахарозы обладает сладостью, эквивалентной 8% сахарозе.
В таблице 20 показано, что 25 мкМ соединения C10 в чистом виде не обладает сладостью, и поэтому может быть определено как настоящий улучшитель сладости.
Результаты тестирования вкусовых ощущений человека для соединения C11 показаны ниже. В таблице 21 показано, что 50 мкМ соединения C11 в 6% сахарозы обладает сладостью, эквивалентной 8% сахарозе.
Результаты тестирования вкусовых ощущений человека для соединения C12 показаны ниже. В таблице 22 показано, что 50 мкМ соединения C12 в 6% сахарозы обладает сладостью, эквивалентной 9% - 10% сахарозе.
Результаты тестирования вкусовых ощущений человека для соединения C13 показаны ниже. В таблице 23 показано, что 25 мкМ соединения C13 в 6% сахарозы обладает сладостью, эквивалентной 8% сахарозе.
Результаты тестирования вкусовых ощущений человека для соединения C14 показаны ниже. В таблице 24 показано, что 50 мкМ соединения C14 в 6% сахарозы обладает сладостью, эквивалентной 8% - 9% сахарозе.
Результаты тестирования вкусовых ощущений человека для соединения C15 показаны ниже. В таблице 25 показано, что 50 мкМ соединения C15 в 6% сахарозы обладает сладостью, эквивалентной около 9% - 10% сахарозе.
Результаты тестирования вкусовых ощущений человека для соединения C16 показаны ниже. В таблице 26 показано, что 25 мкМ соединения C16 в 6% сахарозы обладает сладостью, эквивалентной около 10% - 12% сахарозе. В таблице 27 показана кривая «доза - реакция» для соединения C16 с 6% сахарозой, которая показывает, что сладость сахарозы значительно улучшается при добавлении повышенных количеств соединения C16. В таблице 28 показано, что 14,11 мкМ соединения C16 в 50 ч./млн сукралозы обладает сладостью, эквивалентной около 200 ч./млн - 300 ч./млн сукралозы. В таблице 29 показано, что 25 мкМ соединения C16 в 6% фруктозе обладает сладостью, эквивалентной от 6% до 8% фруктозы. В таблице 29 показано, что соединение C16 в чистом виде не обладает сладостью, и поэтому может быть определено как настоящий улучшитель сладости.
Результаты тестирования вкусовых ощущений человека для соединения C17 показаны ниже. В таблице 31 показано, что от около 8 мкМ соединения C17 в 6% сахарозе обладает сладостью, эквивалентной около 9% - 10% сахарозе. В таблице 32 показано, что 8 мкМ соединения C17 в чистом виде не обладает сладостью, и поэтому может быть определено как настоящий улучшитель сладости.
ЭКСПЕРИМЕНТ 6: Измерение сладкого привкуса и улучшения сладкого привкуса дегустаторами людьми при проведении спаренной пробы
Тестируемые образцы, содержащие экспериментальные соединения, представляют парами дегустаторам, и их просят определить, какой из образцов слаще. Группа дегустаторов, включающая 10-16 или более человек, участвует в каждом тесте. Дегустаторы воздерживаются от еды или питья (за исключением воды) в течение, по крайней мере, 1 часа до тестирования. Дегустаторы очищают рот полосканием несколько раз за тестирование.
Все образцы получают с этанолом для обеспечивания дисперсии соединения в растворе. Также включены образцы без соединения; все растворы сбалансированы для 0,1% этанола.
Образцы также получают с гипонатриевым буфером (pH 7,1) вместо воды. Буфер содержит 0,952 г KCl, 5,444 г Na2HPO4 и 0,952 г KH2PO4 в 40 л DIUF воды. объем образца обычно составляет 20 мл.
В одной спаренной пробе дегустатору предоставляют два различных образца и просят определить, какой образец слаще. Образцы при проведении спаренной пробы представлены в произвольном уравновешенном порядке. Дегустаторы делают 1 минутный перерыв между тестированием вкусов для очистки рта от каких-либо вкусов.
Таблицы вероятности биноминального распределения применяют для определения вероятности корректного количества реакций, возникающих в каждом тесте при альфа = 0,05.
Результаты тестирования вкусовых ощущений человека для соединения C18 показаны ниже. В таблице 33 показано, что дегустаторы определили, что 6% фруктоза + 100 мкМ соединения C18 гораздо слаще, чем раствор 6% фруктозы (р<0,05).
Результаты тестирования вкусовых ощущений человека для соединения C19 показаны ниже. В таблице 34 показано, что дегустаторы определили, что 6% фруктоза + 100 мкМ соединения C19 гораздо слаще, чем раствор 6% фруктозы (р<0,05).
Результаты тестирования вкусовых ощущений человека для соединения C20 показаны ниже. В таблице 35 показано, что дегустаторы определили, что 6% фруктоза + 100 мкМ соединения C20 гораздо слаще, чем раствор 6% фруктозы (р<0,05). В таблице 36 показано, что 100 мкМ соединения С20 в чистом виде обладает незначительным или не обладают сладким вкусом сами по себе (Эксперимент 5).
Результаты тестирования вкусовых ощущений человека для соединения C21 показаны ниже. В таблице 37 показано, что дегустаторы определили, что 6% фруктоза + 25 мкМ соединения C21 гораздо слаще, чем раствор 6% фруктозы (р<0,05). В таблице 38 показано, что дегустаторы определили, что 6% фруктоза + 25 мкМ соединения C21 имеют такую же сладость, что и раствор 7% фруктозы.
ЭКСПЕРИМЕНТ 7. Определение растворимости соединений в соответствии с данным изобретением и их солей HCl в пропиленгликоле
Растворимость соединений в соответствии с данным изобретением и их солей HCl в пропиленгликоле определяют методом встряхиваемой колбы. Приблизительно 50 мг тестируемого соединения взвешивают и добавляют в 4-мл стеклянную колбу, затем в колбу добавляют 1 мл пропиленгликоля. Колбу обрабатывают ультразвуком в течение 10 минут и затем встряхивают в течение 24 ч на орбитальном встряхивателе при 300 об./мин. Аликвоту 200 мкл раствора переносят из колбы в 1,5 мл центрифужную колбу и центрифугируют при 12500 об./мин. в течение 10 мин. Аликвоту 50 мкл надосадочной жидкости разводят в 100 крат пропиленгликолем. Затем 50 мкл этого раствора далее разводят в 100 крат водой и анализируют масс спектрометрией и жидкостной хроматографией (колонка C18 с градиентным элюированием со скоростью потока 2,0 мл/мин, водой с 01% трифторуксусной кислоты в качестве подвижной фазы A и метанолом с 0,1% трифторуксусной кислоты в качестве подвижной фазы B, % промывания подвижной фазы В от 5% до 05% за 0,6 мин и затем выстаивание при 95% в течение 1,4 мин). Результат одного типового тестирования растворимости показан в таблице А.
Все публикации и заявки на патент в данном описании включены сюда в качестве ссылок в том же объеме, в котором каждая отдельная публикация или заявка на патент конкретно и отдельно могут быть включены в качестве ссылки.
Представленное выше подробное описание дано только для ясности и понимания, и не должно рассматриваться как ограничения, так как его модификации очевидны специалистам в данной области техники. Не является признанием то, что любая представленная здесь информация относится к известному уровню техники или относится к представленной здесь формуле изобретения, или что любая публикация, специально или косвенно упомянутая, является известным уровнем техники.
Если не указано иначе, все технические и научные термины, применяемые здесь, имеют то же значение, которое повсеместно принято в данной области техники, к которой принадлежит изобретение.
Здесь представлены варианты данного изобретения, включая наилучший способ осуществления данного изобретения. Варианты предпочтительных вариантов очевидны специалистам в данной области техники при прочтении представленного выше описания. Авторы данного изобретения ожидают, что специалисты в данной области техники будут применять такие варианты подобающим образом, и авторы данного изобретения полагают, что изобретение может быть использовано на практике отличным от описанного способом. Следовательно, данное изобретение включает все модификации и эквиваленты объекта, описанного в формуле изобретения, насколько это допускается действующим законодательством. Более того, любое сочетание описанных выше элементов во всех возможных вариантах включено в объем данного изобретения, если не указано иначе, или если ясно не противоречит контексту.
Реферат
Группа изобретений раскрывает съедобные композиции, содержащие модификаторы хемосенсорных рецепторов и их лигандов. Конкретнее группа изобретений включает проглатываемые композиции, содержащие соединение структурной формулы (IIc)Композиции заявленной группы изобретений обеспечивают возможность получения и улучшения сладкого вкуса. 2 н. и 25 з.п. ф-лы, 13 ил., 39 табл., 284 пр.
Формула

или его таутомер, соль, сольват и/или его сложный эфир,
где:
A является -NR9R10;
R17 является водородом или алкилом;
R9 и R10 являются водородом;
W является -S-;
Y является -C(R26)-;
Z является -C(R27)-;
R26 является водородом, алкилом, замещенным алкилом, гетероалкилом, замещенным гетероалкилом, -CONR31R32 или -CO2R31;
R27 является водородом, алкилом, замещенным алкилом, гетероалкилом, замещенным гетероалкилом, -CONR33R34 или -CO2R33; или альтернативно R26 и R27, вместе с атомами, к которым они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо;
и
R31, R32, R33 и R34 независимо являются водородом, алкилом или замещенным алкилом; или альтернативно R31 и R32 или R33 и R34,
вместе с атомами, к которым они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо;
причем количество, обеспечивающее улучшение сладкого вкуса, находится в пределах от около 0,0001 до около 100000 ч/млн соединения структурной формулы (IIc).







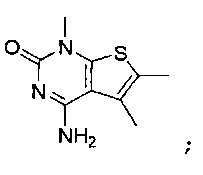
или его таутомер, соль, сольват и/или его сложный эфир.
а) от около 0,0001 ч/млн до около 10 ч/млн соединения, имеющего структурную формулу (IIc) или его таутомера, соли, сольвата и/или сложного эфира; или
б) от около 0,01 ч/млн до около 100 ч/млн соединения, имеющего структурную формулу (IIc) или его таутомера, соли, сольвата и/или сложного эфира; или
в) от около 10 ч/млн до около 100000 ч/млн соединения, имеющего структурную формулу (IIc) или его таутомера, соли, сольвата и/или сложного эфира.
по крайней мере, один натуральный подсластитель; и
по крайней мере, один искусственный или синтезированный подсластитель.
R27 является водородом, алкилом или замещенным алкилом,; и
R26 является водородом, гетероалкилом, замещенным гетероалкилом, -OR31, -CONR31R32 или -CO2R31.
R26 и R27 вместе с атомом, к которому они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо.
R17 является водородом.
R17 является водородом;
R27 является водородом, алкилом или замещенным алкилом; и
R26 является водородом, гетероалкилом, замещенным гетероалкилом, -C(O)NR31R32 или -CO2R31, или альтернативно R26 и R27вместе с атомом(ами), к которым они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо.
A является -NH2;
R17 является метилом, этилом, пропилом, изопропилом, н-бутилом, изобутилом, втор-бутилом или трет-бутилом;
R26 и R27 независимо являются водородом, алканилом, замещенным алканилом или алкокси;
или альтернативно R26 и R27 вместе с атомом(ами), к которым они присоединены, образуют циклоалкильное, замещенное циклоалкильное, циклогетероалкильное или замещенное циклогетероалкильное кольцо.

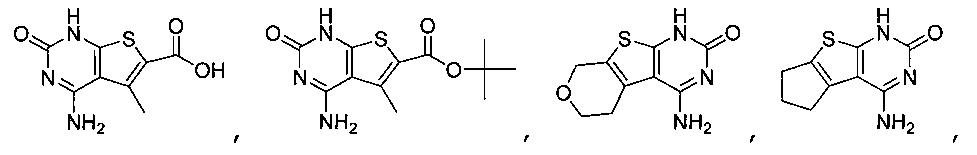

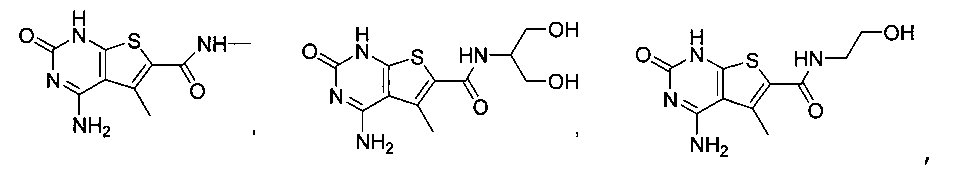






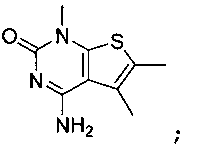
или его таутомер, соль или сольват, причем количество, обеспечивающее улучшение сладкого вкуса, находится в пределах от около 0,001 до около 100 ч/млн соединения структурной формулы (IIc).
сорбит, ксилит, мальтодекстрин, мальтит, изомальт, гидрированный сироп глюкозы (HGS), гидрированный гидролизат крахмала (HSH), стевиозид, ребаудиозид A и другие сладкие гликозиды на основе стевии, карелам, другие подсластители на основе гуанидина, сахарин, ацесульфам K, цикламат, сукралозу, алитам, могрозид, неотам, аспартам, другие производные аспартама и их сочетания.
по крайней мере, один натуральный подсластитель; и
по крайней мере, один искусственный или синтезированный подсластитель.

Комментарии