Новые ароматизирующие вещества, модификаторы вкуса, соединения, придающие вкус, усилители вкуса, соединения, придающие вкус "умами" или сладкий вкус, и/или усилители и их применение - RU2419602C2
Код документа: RU2419602C2
Описание
По данной заявке испрашивается приоритет в соответствии с предварительной патентной заявкой США № 60/494071, поданной 6 августа 2003 г, и также испрашивается приоритет в соответствии с предварительной патентной заявкой США № 60/552064, поданной 9 марта 2004 г, полное описание которых включено в данное описание в качестве ссылки.
Область изобретения
Настоящее изобретение относится к разработке модификаторов аромата или вкуса, таких как ароматизатор или ароматизирующие вещества и усилители аромата или вкуса, более конкретно модификаторы острого («умами») или сладкого вкуса, ароматизирующие вещества, придающие острый или сладкий вкус, и усилители острого или сладкого вкуса для пищевых продуктов, напитков и других продуктов питания или лекарственных продуктов, предназначенных для перорального применения, или композиций.
Предпосылки изобретения
На протяжении столетий для улучшения вкуса к напиткам и/или продуктам питания, лекарственным композициям, предназначенным для перорального введения, добавляли разнообразные природные и неприродные композиции и/или соединения. Хотя давно известно, что существует только несколько основных типов «вкусов», биологическая и биохимическая основа вкусового восприятия была плохо понятна, и большинство улучшающих вкус или модифицирующих вкус веществ были открыты в основном с помощью метода проб и ошибок.
Недавно были достигнуты значительные успехи в идентификации эффективных природных ароматизирующих веществ, таких как, например, подсластители, такие как сахароза, фруктоза, глюкоза, эритрит, изомалт, лактитол, маннит, сорбит, ксилит, некоторые известные натуральные терпеноиды, флавоноиды или белковые подсластители. См., например, недавно опубликованную статью Kinghorn et al «Noncariogenic Intense Natural Sweeteners» (Med Res Rev 18(5) 347-360, 1998), в которой обсуждены недавно открытые природные материалы, обладающие значительно большей сладостью по сравнению с природными подсластителями, такими как сахароза, фруктоза и тому подобное. Аналогично, недавно были достигнуты успехи в идентификации и коммерциализации новых синтетических подсластителей, таких как аспартам, сахарин, ацесульфам-K, цикламат, сахароза и алитам и тому подобное, см. недавно опубликованную статью Ager et al. (Angew Chem Int. Ed. 1998, 37, 1802-1817). Полное описание двух указанных выше ссылок включено в данное описание посредством ссылки для представления по крайней мере части того знания, которое имеется у специалистов в данной области относительно известных подсластителей.
Однако в данной области сохраняется необходимость создания новых и усовершенствованных ароматизирующих веществ. Например, одним из пяти известных основных вкусов является острый вкус или вкус «умами» мононатрий глутамата («MSG»). Как известно, у некоторых людей MSG вызывает побочное действие, однако был достигнут незначительный прогресс в идентификации природных заменителей MSG. Известно, что некоторые природные вещества могут повышать или усиливать эффект MSG в качестве ароматизирующего вещества, придающего острый вкус, и, таким образом, может потребоваться меньшее количество MSG для придания вкуса. Например, известно, что природные нуклеотидные соединения инозинмонофосфат (IMP) или гуанозинмонофосфат (GMP) обладают множественным эффектом в отношении острого вкуса MSG, но выделение и очистка IMP и GMP из природных источников или их синтез являются очень сложными и дорогостоящими, и поэтому имеют только ограниченное практическое применение для большинства коммерческих нужд в пищевых и лекарственных композициях. Менее дорогостоящие соединения, которые могут обеспечить вкус самого MSG или усилить эффективность какого-либо имеющегося MSG, представляют очень большую ценность. Аналогично, разработка соединений, которые будут являться либо новыми «высокоинтенсивными» подсластителями (т.е. во много раз превышающими сладость сахарозы), или какими-либо соединениями, которые значительно повышают сладость известных природных или искусственных подсластителей, таким образом, уменьшая потребность в калорийных или некалорийных посластителях, будет иметь очень большую полезность и ценность.
В последние годы был достигнут существенный прогресс в биотехнологии в целом и в лучшем понимании основ биологического и биохимического феномена вкусового рецептора. Например, недавно были идентифицированы белки вкусовых рецепторов у млекопитающих, которые вовлечены во вкусовое восприятие. В частности, было идентифицировано два различных семейства рецепторов, сопряженных с G белками, которые, как полагают, вовлечены в рецепторное восприятие, T2R и T1R (см., например, Nelson, et al., Cell (2001) 106(3):381-390; Adler, et al., Cell (2000) 100(6): 693-702; Chandrashekar, et al., Cell (2000) 100:703-711; Matsunami, et al., Number (2000) 404:601-604; Li, et al., Proc. Natl. Acad. Sci. USA (2002) 99:4962-4966; Montmayeur, et al., Nature Neuroscience (2001) 4(S):492-498: патент США № 6462148 и PCT публикации WO 02/06254, WO 00/63166 art, WO 02/064631 и WO 03/001876, и патентная публикация США 2003-0232407 A1). Полное описание указанных выше статей, патентных заявок и опубликованных патентов включены в данное описание в качестве ссылки для всех целей, включая описание их идентичности и структуры белков вкусовых рецепторов млекопитающих T2R и T1R и способы искусственной экспрессии этих рецепторов в клеточных линиях, и применение полученных клеточных линий для скрининга соединений в качестве возможных ароматизирующих веществ, придающих «острый» или «сладкий» вкус.
Тогда как T2R представляет собой семейство свыше 25 генов, которые входят в состав рецептора горького вкуса, T1R состоит только из трех членов, T1R1, T1R2 и T1R3 (см. Li, et al., Proc. Natl. Acad. Sci. USA (2002) 99:4962-4966). Недавно в WO 02/064631 и/или WO 03/001876 было описано, что некоторые члены T1R, при одновременной экспрессии в подходящих клеточных линиях млекопитающих, объединяются с образованием функциональных вкусовых рецепторов. В частности, было обнаружено, что одновременная экспрессия T1R1 и T1R3 в подходящей клеточной линии приводит к образованию функционального рецептора острого («умами») вкуса T1R1/T1R3, который реагирует на острый вкусовой раздражитель, включая мононатрий глутамат. Аналогично, было обнаружено, что одновременная экспрессия T1R2 и T1R3 в подходящей клеточной линии приводит к образованию функционального рецептора сладкого вкуса T1R2/T1R3, который реагирует на различные вкусовые раздражители, включая природные и искусственные подсластители (см. Li, et al. (Id.)). В ссылках, приведенных выше, также описаны методы анализа и/или высокоэффективного скрининга, с помощью которых можно измерить рецепторную активность T1R1/T1R3 или T1R2/T1R3 путем флуорометрической визуализации в присутствии заданного соединения. Авторы изобретения использовали вышеописанные методы анализа и/или высокоэффективного скрининга для идентификации исходного «лидирующего» соединения, которое модулирует активность T1R1/T1R3 рецепторов острого вкуса или T1R2/T1R3 рецепторов сладкого вкуса, затем подвергали долгому, сложному и циклическому процессу исследования, оценки и оптимизации, что привело к созданию различных изобретений, описанных далее.
Краткое описание изобретения
Изобретение имеет много аспектов, каждый из которых в некоторой степени относится к некоторым неприродным амидным соединениям и/или соединениям амидных производных, имеющих общую представленную ниже структурную формулу(I):

где R1, R2 и R3 могут быть независимо далее определены различными способами, как более подробно описано ниже. Во всех вариантах осуществления амидных соединений формулы (I) группа R1 представляет собой органический остаток, содержащий по меньшей мере три атома углерода, с различными альтернативными ограничениями размера и/или химических характеристик группы R1, как более подробно описано ниже. Во многих, но не во всех вариантах осуществления амидные соединения формулы (I) являются «первичными» амидами, то есть один из R2 и R3 представляет собой органическую группу, содержащую по меньшей мере три атома углерода, а другой из R2 и R3 представляет собой водород.
Амидные соединения формулы (I) также включают некоторые подклассы амидных производных или классы производных, относящихся к амидам, такие как, например, мочевины, уретаны, оксаламиды, акриламиды и тому подобное, как более подробно описано ниже.
Многие из подгрупп и примеров «амидных» соединений формулы (I), как показано ниже, способны связываться и/или активировать in vitro оба или один из рецепторов «острого» («умами») вкуса T1R1/T1R3 или сладкого вкуса T1R2/T1R3 при относительно низких концентрациях микромолярного порядка или при более низких концентрациях. Также полагают, что амидные соединения аналогично взаимодействуют с рецепторами острого или сладкого вкуса животных или человека in vivo, что было подтверждено для некоторых соединений формулы (I) в представленных в данном описании вкусовых тестах у человека.
Соответственно, многие подгруппы и примеры «амидных» соединений формулы (I), которые более подробно описаны ниже, в неожиданно низких концентрациях могут быть использованы в качестве ароматизирующих агентов, придающих острый или сладкий вкус, или в качестве усилителей острого или сладкого вкуса. Таким образом, в некоторых вариантах осуществления, изобретение относится к способам модулирования острого вкуса пищевого или лекарственного продукта, предусматривающим:
а) получение по меньшей мере пищевого или лекарственного продукта или их предшественника, и
b) объединение пищевого или лекарственного продукта или их предшественника по меньшей мере с некоторым количеством модулятора острого вкуса или некоторым количеством модулятора сладкого вкуса по меньшей мере одного неприродного амидного соединения или с их пригодной в пищу солью с получением, таким образом, модифицированного пищевого или лекарственного продукта,
где амидное соединение имеет формулу:

где R1 содержит органический или углеводородный остаток, содержащий по меньшей мере три атома углерода и необязательно один или несколько гетероатомов, независимо выбранных из кислорода, азота, серы, галогена или фосфора, и
где необязательно один из R2 и R3 представляет собой H, и где по меньшей мере другой из R2 и R3 содержит органический или углеводородный остаток, содержащий по меньшей мере три атома углерода и необязательно один или несколько гетероатомов, независимо выбранных из кислорода, азота, серы, галогенов или фосфора.
Дополнительные необязательные ограничения химических и физических характеристик групп R1, R2 и R3 будут описаны ниже. Некоторые из амидных соединений формулы (I) были синтезированы способами, известными в данной области для различных целей, но, насколько известно авторам изобретения, ранее не было известно, что такие амиды могут использоваться в качестве ароматизирующих агентов, придающих острый или сладкий вкус, или усилителей острого или сладкого вкуса в очень низких концентрациях. Более того, многие амидные соединения формулы (I), описанные в данном описании, являются новыми соединениями, которые ранее вообще не были синтезированы и являются эффективными ароматизирующими агентами, придающими острый или сладкий вкус, или усилителями острого или сладкого вкуса.
Изобретение также относится к пищевым или лекарственным продуктам, получаемым способом, указанным выше, и к пищевым или лекарственным продуктам или композициям или их предшественникам, которые содержат амидные соединения формулы (I), включая, но этим не ограничиваясь, пищевые продукты, напитки, лекарственные продукты и композиции, предназначенные для перорального введения, и их предшественники.
Во многих вариантах осуществления одно или несколько амидных соединений формулы (I), далее определенных, описанных и/или заявленных в данной заявке, или их пригодные в пищу соли могут быть использованы в виде смесей или в сочетании с другими известными придающими острый или сладкий вкус соединениями, или использованы в качестве усилителей вкуса в пищевых продуктах, напитках и лекарственных композициях, для приема человеком или животными.
В некоторых вариантах осуществления амидные соединения формулы (I), по отдельности обладающие незначительным или возможно даже вообще не обладающие ни сладким, ни острым вкусом, могут быть использованы в очень низких концентрациях для очень значительного усиления эффективности других придающих острый или сладкий вкус ароматизирующих агентов в пищевой или лекарственной композиции или ее предшественнике. Изобретение, описываемое в данном описании, также относится к модифицирующим вкус пищевым или лекарственным продуктам, которые содержат модифицирующие вкус количества одного или нескольких амидных соединений, описанных в данном описании.
Многие из амидных соединений формулы (I) и/или различные подклассы этих амидных соединений при использовании или вместе с MSG, или отдельно повышают или моделируют чувствительность in vitro и острый вкус у человека при неожиданно низких концентрациях. В некоторых вариантах осуществления амидные соединения по изобретению являются агонистами рецепторов T1R1/T1R3 и, следовательно, могут индуцировать или усиливать у человека острый вкус. Эти соединения могут улучшать, усиливать, модулировать или индуцировать действие других природных и синтетических ароматизирующих агентов, придающих острый вкус.
В близких вариантах осуществления многие амидные соединения, охватываемые формулой (I), являются агонистами рецепторов T1R2/T1R3 и, следовательно, могут индуцировать ощущение сладкого вкуса у человека при неожиданно низких концентрациях. Эти соединения могут повышать, усиливать, модулировать или индуцировать действие других природных, частично синтетических или синтетических сладких вкусовых добавок, таких как, например сахароза, фруктоза, глюкоза, эритрит, изомалт, лактинол, маннит, сорбит, ксилит, некоторые известные природные терпеноиды, флавоноиды или белковые подсластители, аспартам, сахарин, ацесульфам-K, цикламат, сукразоз и алитам и тому подобное, или их смесь.
Неожиданно было обнаружено, что многие варианты осуществления соединений формулы (I) имеют значительное структурное сходство и/или частичное совпадение между амидными соединениями, которые могут продуцировать или усиливать сладкий и острый вкус пищевого продукта или лекарственной композиции, даже несмотря на то, что соответствующие белки биологических вкусовых рецепторов, вероятно, существенно различаются. Еще более неожиданно было обнаружено, что по меньшей мере некоторые описываемые в данном описании амидные соединения формулы (I) могут индуцировать или усиливать как сладкий, так и острый вкус пищевого или лекарственного продукта. Следовательно, в некоторых аспектах изобретение относится к соединениям формулы (I) или различным подклассам и группам соединений, которые модулируют (например, индуцируют, повышают или усиливают действие) вкус известных природных или синтетических подсластителей.
В некоторых вариантах осуществления изобретение относится к новым соединениям, вкусовым добавкам, усилителям вкуса, модификаторам вкуса и/или композициям, содержащим соединения формулы (I) и их различные подклассы и группы соединений.
В других вариантах осуществления изобретение относится к соединениям формулы (I) или их различным подклассам и группам соединений, которые модулируют (например, индуцируют, повышают или усиливают действие) вкус мононатрий глутамата (MSG) или синтетических вкусовых добавок, придающих острый вкус.
В некоторых вариантах осуществления изобретение относится к пищевым продуктам или лекарственным композициям, подходящим для приема человеком или животным, или к их предшественникам, содержащим по меньшей мере одно соединение формулы (I) или его пригодную в пищу или фармацевтически приемлемую соль. Эти композиции, предпочтительно, включают пищевые продукты, такие как продукты питания или напитки, лекарственные продукты или композиции, предназначенные для перорального введения, и гигиенические продукты для полости рта, и добавки, которые при добавлении к этим продуктам модулируют их вкус или запах, в частности, усиливая (повышая) их острый и/или сладкий вкус.
Настоящее изобретение также относится к новым подклассам и группам амидных соединений, охватываемым соединениями общей формулы (I), и к производным, ароматизирующим веществам, пищевым или лекарственным продуктам или композициям, включающим ароматизирующие вещества, придающие острый или сладкий вкус, и усилителям вкуса, содержащим их.
Вышеприведенное описание только резюмирует некоторые аспекты настоящих изобретений и в любом случае не предназначено или не должно интерпретироваться как ограничивающее настоящее изобретение.
Подробное описание изобретения
Настоящее изобретение более легко может быть понято с помощью ссылок на нижеследующее подробное описание различных вариантов осуществления изобретения и примеров, приведенных ниже, и химических рисунков и таблиц и их предварительного и последующего описания. Перед описанием и раскрытием соединений, композиций и/или способов по настоящему изобретению следует иметь в виду, что если не указано иного в пунктах формулы изобретения, то изобретение не ограничивается конкретными пищевыми продуктами или способами получения пищевых продуктов, конкретными пищевыми или фармацевтическими носителями или композициями, или конкретными способами введения соединений по изобретению в пищевые или лекарственные продукты или композиции, предназначенные для перорального введения, поскольку если специалисту в соответствующей области они хорошо знакомы, то они могут, безусловно, варьировать. Также должно быть ясно, что терминология, используемая в данном описании, предназначена только для целей описания конкретных вариантов осуществления и не предназначена для ограничения.
Определения
Используемый в данном описании термин «лекарственный продукт» включает как твердые, так и жидкие композиции, которые являются нетоксическими материалами и могут проглатываться, имеют лекарственное значение или содержат лечебные активные агенты, такие как сироп от кашля, капли от кашля, аспирин и жевательные лекарственные таблетки.
Гигиенические продукты для полости рта включают твердые и жидкие продукты, такие как зубная паста или полоскание для рта.
«Пригодный в пищу, биологически приемлемый или приемлемый с медицинской точки зрения носитель или эксципиент» представляет собой твердую или жидкую среду и/или композицию, которая используется для получения желаемой лекарственной формы соединения по настоящему изобретению, для того чтобы вводить соединение по изобретению в диспергируемой/разбавленной форме для максимального усиления биологической эффективности соединения по изобретению. Пригодный в пищу, биологически приемлемый или приемлемый с медицинской точки зрения носитель включает обычные пищевые ингредиенты, такие как вода с нейтральным, кислым или щелочным рН, фруктовый или овощной соки, уксус, маринады, пиво, вино, природные эмульсии вода/жир, такие как молоко или сгущенное молоко, пищевые масла и шортенинги, жирные кислоты, низкомолекулярные олигомеры пропиленгликоля, глицериновые эфиры жирных кислот и дисперсии или эмульсии таких гидрофобных веществ в водной среде, соли, такие как хлорид натрия, пшеничная мука, растворители, такие как этанол, твердые пищевые разбавители, такие как овощные порошки или мука, или другие жидкие носители; дисперсионные или суспензионные добавки; поверхностно-активные вещества; изотонические вещества; загустители или эмульгаторы, консерванты; твердые связующие вещества; смазки и тому подобное.
Используемый термин “аромат” относится к вкусовому восприятию и/или восприятию запаха индивидуумом, включающему сладкий, кислый, соленый, горький, «умами» вкус и другие. Индивидуумом может быть человек или животное.
Используемый термин “ароматизирующее вещество” относится к соединению или его биологически приемлемой соли, которое вызывает запах или вкус у животного или человека.
Используемый термин “модификатор вкуса и аромата” относится к соединению или его биологически приемлемой соли, которое модулирует, в том числе повышает или усиливает, и вызывает вкус и/или запах природного или синтетического ароматизирующего вещества у животного или человека.
Используемый термин “усилитель вкуса и аромата” относится к соединению или его биологически приемлемой соли, которое усиливает вкус или запах природного или синтетического ароматизирующего вещества.
Используемый термин “острый вкус” относится к острому «умами» вкусу, обычно к вкусу, вызываемому MSG (мононатрий глутамат) у животного или человека.
Используемый термин “ароматизирующее вещество, придающее острый вкус”, “соединение, придающее острый вкус” или “соединение, активирующее рецептор острого вкуса” относится к соединению или его биологически приемлемой соли, которое вызывает различимый острый вкус у индивидуума, например к MSG (мононатрий глутамат), или соединению, которое активирует рецептор T1R1/T1R3 in vitro. Индивидуумом может быть человек или животное.
Используемый термин “ароматизирующее вещество, придающее сладкой вкус”, “соединение, вызывающее сладкий вкус” или “соединение, активирующее рецептор сладкого вкуса” относится к соединению или его биологически приемлемой соли, которое вызывает различимый сладкий вкус у индивидуума, например к сахарозе, фруктозе, глюкозе и другим известным природным подсластителям на основе сахарида, или известным искусственным подсластителям, таким как сахарин, цикламат, аспартам и тому подобное, как более подробно обсуждено ниже, или к соединению, которое активирует рецептор T1R2/T1R3 in vitro. Индивидуумом может быть человек или животное.
Используемый термин “модификатор острого вкуса” относится к соединению или его биологически приемлемой соли, которое модулирует, в том числе повышает или усиливает, вызывает и блокирует острый вкус природных или синтетических ароматизирующих веществ, вызывающих острый вкус, например к мононатрий глутамату (MSG), у животного или человека.
Используемый термин “модификатор сладкого вкуса” относится к соединению или его биологически приемлемой соли, которое модулирует, в том числе повышает или усиливает, вызывает и блокирует сладкий вкус природных или синтетических ароматизирующих веществ, вызывающих сладкий вкус, например к сахарозе, фруктозе, глюкозе и другим известным природным подластителям на основе сахаридов, или к известным искусственным подсластителям, таким как сахарин, цикламат, аспартам и тому подобное, у животного или человека.
Используемый термин “усилитель острого вкуса” относится к соединению или его биологически приемлемой соли, которое повышает или усиливает острый вкус природных или синтетических ароматизирующих веществ, вызывающих острый вкус, например к мононатрию глутамата (MSG), у животного или человека.
Используемый термин “усилитель сладкого вкуса” относится к соединению или его биологически приемлемой соли, которое повышает или усиливает сладкий вкус природных или синтетических ароматизирующих веществ, вызывающих сладкий вкус, например к сахарозе, фруктозе, глюкозе и другим известным природным подсластителям на основе сахаридов, или к известным искусственным подсластителям, таким как сахарин, цикламат, аспартам и тому подобное, как подробно обсуждено ниже, у животного или человека.
Используемый термин «соединение, активирующее рецептор «умами» вкуса» относится к соединению, которое активирует рецептор «умами» вкуса, такой как рецептор T1R1/T1R3.
Используемый термин «соединение, активирующее рецептор сладкого вкуса» относится к соединению, которое активирует рецептор сладкого вкуса, такой как рецептор T1R2/T1R3.
Используемый термин «соединение, модулирующее рецептор «умами» вкуса» относится к соединению, которое модулирует (активирует, усиливает или блокирует) рецептор «умами» вкуса.
Используемый термин «соединение, модулирующее рецептор сладкого вкуса» относится к соединению, которое модулирует (активирует, усиливает или блокирует) рецептор сладкого вкуса.
Используемый термин «соединение, усиливающее рецептор «умами» вкуса» относится к соединению, которое повышает или усиливает действие природного или синтетического соединения, активирующего рецептор «умами» вкуса, например мононатрий глутамата (MSG).
Используемый термин «соединение, усиливающее рецептор сладкого вкуса» относится к соединению, которое повышает или усиливает действие природного или синтетического соединения, активирующего рецептор сладкого вкуса, например сахарозы, фруктозы, глюкозы и других известных природных подсластителей на основе сахаридов, или известные искусственные подсластители, такие как сахарин, цикламат, аспартам и тому подобное, как подробно обсуждено ниже.
Используемый термин «количество ароматизирующего вещества, вызывающего острый вкус» относится к количеству соединения, достаточному для того, чтобы вызывать острый вкус пищевого или лекарственного продукта или композиции, или его предшественника. Максимальный интервал количества ароматизирующего вещества, вызывающего острый вкус, может составлять от около 0,001 частей на миллион до 100 частей на миллион, или узкий интервал может составлять от около 0,1 частей на миллион до около 10 частей на миллион. Альтернативные интервалы количества ароматизирующего вещества, вызывающего острый вкус, могут составлять от около 0,01 частей на миллион до около 30 частей на миллион, от около 0,05 частей на миллион до около 15 частей на миллион, от около 0,1 частей на миллион до около 5 частей на миллион или от около 0,1 частей на миллион до около 3 частей на миллион.
Используемый термин «количество ароматизирующего вещества, вызывающего сладкий вкус» относится к количеству соединения, достаточному для того, чтобы вызывать сладкий вкус пищевого или лекарственного продукта или композиции, или его предшественника. Максимальный интервал количества ароматизирующего вещества, вызывающего сладкий вкус, может составлять от около 0,001 частей на миллион до 100 частей на миллион, или узкий интервал может составлять от около 0,1 частей на миллион до около 10 частей на миллион. Альтернативные интервалы количества ароматизирующего вещества, вызывающего сладкий вкус, могут составлять от около 0,01 частей на миллион до около 30 частей на миллион, от около 0,05 частей на миллион до около 15 частей на миллион, от около 0,1 частей на миллион до около 5 частей на миллион, или от около 0,1 частей на миллион до около 3 частей на миллион.
Используемый термин “количество, модулирующее острый вкус” относится к количеству соединения формулы (I), достаточному для того, чтобы изменить (либо усилить, либо ослабить) острый вкус пищевого или лекарственного продукта или композиции, или его предшественника, в достаточной степени для восприятия человеком. Максимальный интервал количества, модулирующего острый вкус, может составлять от около 0,001 частей на миллион до 100 частей на миллион, или узкий интервал может составлять от около 0,1 частей на миллион до около 10 частей на миллион. Альтернативные интервалы количества, модулирующего острый вкус, могут составлять от около 0,01 частей на миллион до около 30 частей на миллион, от около 0,05 частей на миллион до около 15 частей на миллион, от около 0,1 частей на миллион до около 5 частей на миллион или от около 0,1 частей на миллион до около 3 частей на миллион.
Используемый термин “количество, модулирующее сладкий вкус” относится к количеству соединения формулы (I), достаточному для того, чтобы изменить (либо усилить, либо ослабить) сладкий вкус пищевого или лекарственного продукта или композиции, или его предшественника, в достаточной степени для восприятия человеком. Максимальный интервал количества, модулирующего острый вкус, может составлять от около 0,001 частей на миллион до 100 частей на миллион, или узкий интервал может составлять от около 0,1 частей на миллион до около 10 частей на миллион. Альтернативные интервалы количества, модулирующего острый вкус, могут составлять от около 0,01 частей на миллион до около 30 частей на миллион, от около 0,05 частей на миллион до около 15 частей на миллион, от около 0,1 частей на миллион до около 5 частей на миллион или от около 0,1 частей на миллион до около 3 частей на миллион.
Используемый термин «количество, усиливающее острый вкус» относится к количеству соединения, достаточному для усиления вкуса природного или синтетического ароматизирующего вещества, например мононатрий глутамата (MSG), пищевого или лекарственного продукта или композиции. Максимальный интервал количества, усиливающего острый вкус, может составлять от около 0,001 частей на миллион до 100 частей на миллион, или узкий интервал может составлять от около 0,1 частей на миллион до около 10 частей на миллион. Альтернативные интервалы количества, усиливающего острый вкус, могут составлять от около 0,01 частей на миллион до около 30 частей на миллион, от около 0,05 частей на миллион до около 15 частей на миллион, от около 0,1 частей на миллион до около 5 частей на миллион или от около 0,1 частей на миллион до около 3 частей на миллион.
Используемый термин «количество, усиливающее сладкий вкус» относится к количеству соединения, достаточному для усиления вкуса природного или синтетического ароматизирующего вещества, например сахарозы, фруктозы, глюкозы и других природных подсластителей на основе сахаридов, или известных искусственных подсластителей, таких как сахарин, цикламат, аспартам и тому подобное, как подробно обсуждено ниже, пищевого или лекарственного продукта или композиции. Максимальный интервал количества, усиливающего сладкий вкус, может составлять от около 0,001 частей на миллион до 100 частей на миллион, или узкий интервал может составлять от около 0,1 частей на миллион до около 10 частей на миллион. Альтернативные интервалы количества, усиливающего сладкий вкус, могут составлять от около 0,01 частей на миллион до около 30 частей на миллион, от около 0,05 частей на миллион до около 15 частей на миллион, от около 0,1 частей на миллион до около 5 частей на миллион или от около 0,1 частей на миллион до около 3 частей на миллион.
Используемый термин «количество, модулирующее рецептор «умами»» относится к количеству соединения, достаточному для модуляции (активации, стимуляции или блокирования) рецептора «умами». Предпочтительный интервал количества, модулирующего рецептор «умами», составляет от 1 пM до 100 мM и, наиболее предпочтительно, от 1 нM до 100 мкM и, еще более предпочтительно, от 1 нM до 30 мкM. Максимальный интервал количества, модулирующего рецептор «умами», может составлять от около 0,001 частей на миллион до 100 частей на миллион, или узкий интервал может составлять от около 0,1 частей на миллион до около 10 частей на миллион. Альтернативные интервалы количества, модулирующего рецептор «умами», могут составлять от около 0,01 частей на миллион до около 30 частей на миллион, от около 0,05 частей на миллион до около 15 частей на миллион, от около 0,1 частей на миллион до около 5 частей на миллион или от около 0,1 частей на миллион до около 3 частей на миллион.
Используемый термин «количество, модулирующее или активирующее рецептор T1R1/T1R3» относится к количеству соединения, достаточному для модуляции или активации рецептора T1R1/T1R3. Эти количества, предпочтительно, такие же, как количества, модулирующие рецептор «умами».
Используемый термин «рецептор «умами» относится к вкусовому рецептору, который может модулироваться под действием «умами» соединения, предпочтительно, рецептор «умами» представляет собой рецептор, сопряженный с G белками, и, более предпочтительно, «умами» рецептор представляет собой рецептор T1R1/T1R3.
Соединения по изобретению модулируют рецептор «умами» и, предпочтительно, являются агонистами рецептора T1R1/T1R3. Агонист этого рецептора обладает эффектом активации сигнального каскада G белка. Во многих случаях такой агонистический эффект соединения на рецептор также вызывает ощущение острого вкуса во вкусовых тестах. Желательно, таким образом, чтобы такие соединения по изобретению могли использоваться в качестве заместителей MSG, который не может использоваться в некоторых, например пищевых продуктах.
Кроме того, такой агонистический эффект также отвечает за синергетический эффект острого вкуса, который возникает, когда соединение по изобретению комбинировано с другим ароматизатором острого вкуса, таким как MSG. Для усиления острого вкуса MSG и для того, чтобы требовалось относительно меньшее количество MSG для получения острого вкуса по сравнению с добавлением одного только MSG, обычно добавляют нуклеотиды, IMP или GMP. Следовательно желательно, чтобы комбинация соединения по изобретению с другим ароматизатором острого вкуса, таким как MSG, успешно снижала необходимость добавления дорогостоящих нуклеотидов, таких как IMP, в качестве усилителя вкуса, и при этом одновременно снижало или уменьшало количество соединения, вызывающего острый вкус, такого как MSG, необходимое для получения такого же острого вкуса, как и при добавлении одного только соединения, вызывающего острый вкус, или MSG.
Используемый термин «количество, модулирующее сладкий рецептор» относится к количеству соединения, достаточному для модулирования (активации, усиления или блокирования) рецептора сладкого вкуса. Предпочтительный интервал количества, модулирующего рецептор сладкого вкуса, составляет от 1 пM до 100 мM и, наиболее предпочтительно, от 1 нM до 100 мкM и, еще более предпочтительно, от 1 нM до 30 мкM.
Используемый термин «количество, модулирующее или активирующее рецептор T1R2/T1R3» относится к количеству соединения, достаточному для модуляции или активации рецептора T1R2/T1R3. Эти количества, предпочтительно, такие же, как количества, модулирующие рецептор сладкого вкуса.
Используемый термин «рецептор сладкого вкуса» относится к вкусовому рецептору, который может быть модулирован под действием соединения, вызывающего сладкий вкус, предпочтительно, рецептор сладкого вкуса представляет собой рецептор, сопряженный с G-белками, и, более предпочтительно, «умами» рецептор представляет собой рецептор T1R2/T1R3.
Большое количество соединений формулы (I) могут модулировать рецептор сладкого вкуса и, предпочтительно, являются агонистами T1R2/T1R3 рецептора. Агонист этого рецептора обладает эффектом активации сигнального каскада G белка. Во многих случаях такой агонистический эффект соединения на рецептор также вызывает ощущение сладкого вкуса во вкусовых тестах. Желательно, таким образом, чтобы такие соединения по изобретению могли использоваться в качестве заместителей сахарозы, фруктозы, глюкозы и других известных природных подсластителей, основанных на сахариде, или известных искусственных подсластителях, таких как сахарин, цикламат, аспартам и тому подобное, или их смесей, как подробно обсуждено ниже.
Используемый термин «синергетический эффект» относится к усилению острого и/или сладкого вкуса, вызываемого сочетанием соединений, вызывающих острый и/или сладкий вкус, или соединений, активирующих рецептор, по сравнению с суммой вкусовых эффектов или эффектов запаха, которые вызывает каждое отдельное соединение. В случае соединений, усиливающих острый вкус, синергетический эффект для соединения формулы (I) на результативность MSG может быть выражен как соотношение EC50 (как определено ниже), равное 2,0 или более, или, предпочтительно, 5,0 или более, или 10,0 или более, или 15,0 или более. Анализ EC50 усиления сладкого вкуса еще не разработан, но в случае соединения, повышающего как острый, так и сладкий вкус, синергетический эффект может быть подтвержден на вкусовых тестах у человека, как подробно обсуждено ниже.
Если описываемые соединения содержат один или несколько хиральных центров, стереохимия таких хиральных центров может независимо иметь R или S конфигурацию или смесь этих двух конфигураций. Хиральные центы могут также быть обозначены как R или S, или R,S, или d,D, l,L, или d,l, D,L. Соответственно, амидные соединения по изобретению, если они могут иметь оптически активную форму, могут фактически находится в виде рацемической смеси энантиомеров или в виде отдельных энантиомеров, в по существу выделенной и очищенной форме, или в виде смеси, содержащей любые соотношения энантиомеров.
Что касается соединения, описанного в данном описании, суффикс «ен», добавленный к любому описываемому химическому термину, означает, что заместитель присоединен к двум другим частям в соединении. Например, «алкилен» представляет собой (CH2)n, “алкенилен” представляет собой такую группу, которая содержит двойную связь, и “алкинилен” представляет собой такую группу, которая содержит тройную связь.
Используемый термин “углеводородный остаток” относится к химической подгруппе, охватывающей большое число химических соединений, которая содержит только углерод и атомы водорода. Углеводородный остаток может быть алифатическим или ароматическим, с прямой, циклической, разветвленный цепью, насыщенным или ненасыщенным. Углеводородный остаток, определенный таким образом, однако, может содержать или быть замещен гетероатомами, такими как O, S или N, или галогенами (фтор, хлор, бром и йод), или группами заместителей, также содержащими гетероатомы (OH, NH2, NO2, SO3H и тому подобное), и указанные выше атомы углерода и водорода остатка заместителей. Таким образом, когда конкретно указывается на содержание таких гетероатомов или дано определение “замещенный”, углеводородный остаток также может содержать карбонильные группы, аминогруппы, гидроксильные группы и тому подобное, или содержать гетероатомы, включенные в “скелет” углеводородного остатка.
Используемый термин “неорганический остаток” относится к остатку, который не содержит углерод, но содержит по меньшей мере некоторые гетероатомы, включающие O, N, S, один или несколько галогенов или ионы щелочного металла или щелочноземельного металла. Примеры включают, но этим не ограничиваются, H, Na+, Ca++ и K+, галоген, гидрокси, NO2 или NH2.
Используемый термин “алкил”, “алкенил” и “алкинил” включает одновалентные заместители с прямой и разветвленной цепью и циклические, которые, соответственно, являются насыщенными, ненасыщенными с по меньшей мере двойной связью, и ненасыщенными с по меньшей мере тройной связью.
Термин “алкил” относится к углеводородной группе, которая может по существу быть образована из алкана путем удаления водорода из структуры углеводородного соединения с прямой или разветвленной углеродной цепью и замены атома водорода другим атомом или группой заместителей. В некоторых вариантах осуществления изобретения алкильные группы представляют собой “C1-C6алкил”, например метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, амил, трет-амил, гексил и тому подобное. В некоторых вариантах осуществления изобретения “C1-C4алкильные” группы, альтернативно называемые “низшими алкильными” группами, представляют собой метил, этил, пропил, изобутил, втор-бутил, трет-бутил и изопропил. Некоторые из предпочтительных алкильных групп по изобретению содержат три или более атомов углерода, предпочтительно 3-16 атомов углерода, 4-14 атомов углерода или 6-12 атомов углерода.
Предпочтительные алкенильные группы представляют собой “C2-C7алкенил”, например винил, аллил, 2-бутенил, 3-бутенил, 2-пентенил, 3-пентенил, 4-пентенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил, 2-гептенил, 3-гептенил, 4-гептенил, 5-гептенил, 6-гептенил, а также диены и триены с прямыми и разветвленными цепями.
Предпочтительные алкинильные группы представляют собой “C2-C7алкинил”, например этинил, пропинил, 2-бутинил, 2-пентинил, 3-пентинил, 2-гексинил, 3-гексинил, 4-гексинил, 2-гептинил, 3-гептинил, 4-гептинил, 5-гептинил, а также ди- и триины с прямыми и разветвленными цепями, включающими «ен»-«ин»ы.
Углеводородные остатки могут необязательно быть замещены. Два из указанных необязательных заместителя в смежных положениях могут быть связаны с образованием конденсированного, необязательно замещенного ароматического или неароматического, насыщенного или ненасыщенного кольца, содержащего 3-8 члена. Необязательные заместители обычно представляют собой углеводородные остатки, которые могут содержать один или несколько гетероатомов или неорганический остаток, например H, Na+, Ca2+ или K+.
Термины “замещенный алкил,” “замещенный алкенил,” “замещенный алкинил” и “замещенный алкилен” означают, что алкильные, алкенильные, алкинильные и алкиленовые группы замещены одним или несколькими и, предпочтительно, одним или двумя заместителями, предпочтительно, галогеном, гидрокси, C1-C7алкокси, алкоксиалкильными, оксо, C3-C7циклоалкилом, нафтилом, амино, (монозамещенный)амино, (дизамещенный)амино, гуанидино, гетероциклом, замещенным гетероциклом, имидазолилом, индолилом, пирролидинилом, C1-C7ацилом, C1-C7ацилокси, нитро, карбокси, карбамоилом, карбоксамидом, N-(C1-C6алкил)карбоксамидом, N,N-ди(C1-C6алкил)карбоксамидом, циано, метилсульфониламино, тиолом, C1-C4алкилтио или C1-C4алкилсульфонильными группами. Замещенные алкильные группы могут быть замещены один или несколько раз и, предпочтительно, один раз или два, одинаковыми или различными заместителями. В многочисленных вариантах осуществления изобретения предпочтительная группа заместителей включает гидрокси, фтор, хлор, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метил, этил, изопропил, винил, трифторметил, метокси, этокси, изопропокси и трифторметоксигруппы. Большое количество вариантов осуществления изобретения включает вышеуказанные перечни групп заместителей, еще более предпочтительная группа заместителей включает гидрокси, SEt, SCH3, метил, этил, изопропил, метокси и этоксигруппы.
Примеры вышеуказанных замещенных алкильных групп включают 2-оксопроп-1-ил, 3-оксобут-1-ил, цианометил, нитрометил, хлорметил, гидроксиметил, тетрагидропиранилоксиметил, тритилоксиметил, пропионилоксиметил, аминометил, карбоксиметил, аллилоксикарбонилметил, аллилоксикарбониламинометил, метоксиметил, этоксиметил, трет-бутоксиметил, ацетоксиметил, хлорметил, трифторметил, 6-гидроксигексил, 2,4-дихлор(н-бутил), 2-аминопропил, 1-хлорэтил, 2-хлорэтил, 1-бромэтил, 2-хлорэтил, 1-фторэтил, 2-фторэтил, 1-йодэтил, 2-йодэтил, 1-хлорпропил, 2-хлорпропил, 3-хлорпропил, 1-бромпропил, 2-бромпропил, 3-бромпропил, 1-фторпропил, 2-фторпропил, 3-фторпропил, 2-аминоэтил, 1-аминоэтил, N-бензоил-2-аминоэтил, N-ацетил-2-аминоэтил, N-бензоил-1-аминоэтил, N-ацетил-1-аминоэтил и тому подобное.
Примеры вышеуказанных замещенных алкенильных групп включают стиренил, 3-хлорпропен-1-ил, 3-хлорбутен-1-ил, 3-метоксипропен-2-ил, 3-фенилбутен-2-ил, 1-цианобутен-3-ил и тому подобное. Геометрическая изомерия не является определяющей, и могут быть использованы все геометрические изомеры для данного замещенного алкенила.
Примеры вышеуказанных замещенных алкенильных групп включают фенилацетилен-1-ил, 1-фенил-2-пропин-1-ил и тому подобное.
Термин “оксо” означает атом углерода, связанный с двумя дополнительными атомами углерода, замещенными атомом кислорода, связанными двойной связью с атомом углерода, образуя таким образом группу кетона.
Выражение “алкокси” относится к группе OR, где R представляет собой алкил или замещенный алкил. “Алкоксиалкил” относится к алкильной группе, включающей алкокси.
Предпочтительные алкоксигруппы представляют собой “C1-C7алкокси”, например метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси и подобные группы. Термин “замещенный C1-C7алкокси” означает, что алкильная часть алкокси может быть замещена аналогичным образом, как и в случае замещенного C1-C6алкила. Аналогично, используемый термин “C1-C7фенилалкокси” означает “C1-C7алкокси”, связанный с фенильным радикалом.
Термин “ацилокси” относится к OR группе, где R представляет собой ацильную группу. Предпочтительные ацилоксигруппы представляют собой “C1-C7ацилокси”, такие как формилокси, ацетокси, пропионилокси, бутирилокси, пивалоилокси, пентаноилокси, гексаноилокси, гептаноилокси и тому подобное.
Используемый термин “ацил” включает определения алкила, алкенила, алкинила и близких гетероформ, которые образуют пару с дополнительным остатком через карбонильную группу. Предпочтительные ацильные группы представляют собой “C1-C7ацил”, например формил, ацетил, пропионил, бутирил, пентаноил, пивалоил, гексаноил, гептаноил, бензоил и тому подобное. Более предпочтительные ацильные группы представляют собой ацетил и бензоил.
Термин “замещенный ацил” означает ацильную группу, замещенную одним или несколькими и, предпочтительно, одним или двумя, галогенами, гидрокси, оксо, алкилом, циклоалкилом, нафтилом, амино, (монозамещенным)амино, (дизамещенным)амино, гуанидино, гетероциклическим кольцом, замещенным гетероциклическим кольцом, имидазолилом, индолилом, пирролидинилом, C1-C7алкокси, алкоксиалкилом, C1-C7ацилом, C1-C7ацилокси, нитро, сложным C1-C6алкиловым эфиром, карбокси, алкоксикарбонилом, карбамоилом, карбоксамидом, N-(C1-C6алкил)карбоксамидом, N,N-ди(C1-C6алкил)карбоксамидом, циано, метилсульфониламино, тиолом, C1-C4алкилтио или C1-C4алкилсульфонильной группами. Замещенные ацильные группы могут быть замещены один или более раз, и, предпочтительно, один или два раза одинаковыми или различными заместителями.
Примеры замещенных C1-C7ацильных групп включают 4-фенилбутироил, 3-фенилбутироил, 3-фенилпропаноил, 2-циклогексанилацетил, циклогексанкарбонил, 2-фураноил и 3-диметиламинобензоил.
Циклоалкильные остатки представляют собой углеводородные группы в молекуле, содержащие по меньшей мере одно кольцо, состоящее из 3-8 атомов углерода, связанных в кольцо. Примеры таких циклоалкильных остатков включают циклопропильные, циклобутильные, циклопентильные, циклогексильные, циклогептильные, циклооктильные кольца и насыщенные бициклические или конденсированные полициклические циклоалканы, такие как декалиновые группы, норборнильные группы и тому подобное.
Предпочтительные циклоалкильные группы включают “C3-C7циклоалкил”, например циклопропильные, циклобутильные, циклопентильные, циклогексильные или циклогептильные кольца. Аналогично, термин “C5-C7циклоалкил” включает циклопентильные, циклогексильные или циклогептильные кольца.
Термин “замещенный циклоалкил” означает, что вышеуказанные циклоалкильные кольца замещены, предпочтительно, одним или двумя галогенами, гидрокси, C1-C4алкилтио, C1-C4алкилсульфоксидом, C1-C4алкилсульфонилом, замещенным C1-C4алкилтио, замещенным C1-C4алкилсульфоксидом, замещенным C1-C4алкилсульфонилом, C1-C6алкилом, C1-C7алкокси, замещенным C1-C6алкилом, C1-C7алкоксиалкилом, оксо(монозамещенным)амино, (дизамещенным)амино, трифторметилом, карбокси, фенилом, замещенным фенилом, фенилтио, фенилсульфоксидом, фенилсульфонилом, амино. Во многих вариантах воплощения замещенных циклоалкильных групп замещенная циклоалкильная группа будет содержать 1, 2, 3 или 4 группы заместителей, независимо выбранных из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигрупп.
Термин “циклоалкилен” означает циклоалкил, такой как определено выше, где циклоалкильный радикал присоединен в двух положениях, соединяя вместе две отдельные дополнительные группы. Аналогично, термин “замещенный циклоалкилен” означает циклоалкилен, где циклоалкильный радикал связан в двух положениях, соединяя вместе две отдельные дополнительные группы и, кроме того, образуя по меньшей мере дополнительный заместитель.
Термин “циклоалкенил” означает, предпочтительно, 1, 2 или 3-циклопентильное кольцо, 1, 2, 3 или 4-циклогексильное кольцо или 1, 2, 3, 4 или 5-циклогептенильное кольцо, тогда как термин “замещенный циклоалкенил” означает вышеуказанные циклоалкенильные кольца, замещенные заместителем, предпочтительно, C1-C6алкилом, галогеном, гидрокси, C1-C7алкокси, алкоксиалкилом, трифторметилом, карбокси, алкоксикарбонилоксо, (монозамещенным)амино, (дизамещенным)амино, фенилом, замещенным фенилом, амино или защищенным амино.
Термин “циклоалкенилен” означает циклоалкенильное кольцо, как указано выше, где циклоалкенильный радикал присоединен в двух положениях, связывая вместе две отдельные дополнительные группы. Аналогично, термин “замещенный циклоалкенилен” означает циклоалкенилен, дополнительно замещенный, предпочтительно, галогеном, гидрокси, C1-C4алкилтио, C1-C4алкилсульфоксидом, C1-C4алкилсульфонилом, замещенным C1-C4алкилтио, замещенным C1-C4алкилсульфоксидом, замещенным C1-C4алкилсульфонилом, C1-C6алкилом, C1-C7алкокси, замещенным C1-C6алкилом, C1-C7алкоксиалкилом, оксо, (монозамещенным)амино, (дизамещенным)амино, трифторметилом, карбокси, алкоксикарбонилом, фенилом, замещенным фенилом, фенилтио, фенилсульфоксидом, фенилсульфонилом, амино или замещенной аминогруппой.
Термин “гетероцикл” или “гетероциклическое кольцо” означает необязательно замещенные 3-8-членные кольца, содержащие один или несколько атомов углерода, соединенных в кольцо, которое также содержит 1-5 гетероатомов, таких как кислород, сера и/или азот, встроенные в кольцо. Эти 3-8-членные кольца могут быть насыщенными, ненасыщенным или частично ненасыщенными, но являются, предпочтительно, насыщенными. Термин “аминозамещенное гетероциклическое кольцо” означает любое одно из вышеописанных гетероциклических колец, замещенных по меньшей мере аминогруппой. Предпочтительные гетероциклические кольца включают фуранил, тиофуранил, пиперидил, пиридил, морфолино, азиридинил, пиперидинил, пиперазинил, тетрагидрофуранo, пирролo и тетрагидротиофенил.
Термин “замещенный гетероцикл” или “замещенное гетероциклическое кольцо” означает вышеуказанное гетероциклическое кольцо, замещенное, например, одним или несколькими и, предпочтительно, одним или двумя заместителями, которые являются одинаковыми или различными, где заместителями, предпочтительно, могут быть галоген, гидрокси, тио, алкилтио, циано, нитро, C1-C6алкил, C1-C7алкокси, замещенный C1-C7алкокси, алкоксиалкил, C1-C7ацил, C1-C7ацилокси, карбокси, алкоксикарбонил, карбоксиметил, гидроксиметил, алкоксиалкил амино, (монозамещенный)амино, (дизамещенный)амино, карбоксамид, N-(C1-C6алкил)карбоксамид, N,N-ди(C1-C6алкил)карбоксамид, трифторметил, N-((C1-C6алкил)сульфонил)амино, N-(фенилсульфонил)аминогруппы, или замещенные конденсированным кольцом, например бензокольцом. Во многих вариантах осуществления замещенной гетероциклической группы замещенная циклоалкильная группа будет содержать 1, 2, 3 или 4 группы заместителей, независимо выбранные из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы.
Термин “арильные” группы относится к моноциклической ароматической, связанной бициклической ароматической или конденсированной бициклической ароматической группе, содержащей по меньшей мере шести-членное ароматическое “бензольное” кольцо, предпочтительно, содержащее от 6 до 12 кольцевых атомов углерода, например, фенильные, бифенильные или нафтильные группы, которые могут быть необязательно замещены различными органическими и/или неорганическими группами заместителей, где замещенная арильная группа и ее заместители содержат от 6 до 18 или, предпочтительно, 6-16 атомов углерода. Предпочтительные необязательные группы заместителей включают 1, 2, 3 или 4 группы заместителей, независимо выбранные из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы.
Термин “гетероарил” означает гетероциклическое арильное производное, которое, предпочтительно, содержит пятичленную или шестичленную сопряженную и ароматическую кольцевую систему, содержащую от 1 до 4 гетероатомов, таких как кислород, сера и/или азот, встроенных в ненасыщенное и сопряженное гетероциклическое кольцо. Гетероарильные группы включают моноциклические гетероароматические, связанные бициклические гетероароматические или конденсированные бициклические гетероароматические группы. Примеры гетероарилов включают пиридинил, пиримидинил и пиразинил, пиридазинил, пирролил, фуранил, тиофуранил, оксазолоил, изоксазолил, фталимидо, тиазолил, хинолинил, изохинолинил, индолил или фуран, или тиофуран, непосредственно присоединенный к фенильному, пиридильному или пирролильному кольцу и подобному ненасыщенному и конъюгированному гетероароматическому кольцу. Любая моноциклическая, связанная бициклическая или конденсированная бициклическая гетероарильная кольцевая система, которая имеет характеристики ароматичности с точки зрения распределения электронов по всей кольцевой системе, включена в это определение. Обычно гетероароматические кольцевые системы содержат 3-12 кольцевых атома углерода и 1-5 кольцевых гетероатомов, независимо выбранных из атомов кислорода, азота и серы.
Термин “замещенный гетероарил” означает вышеуказанный гетероарил, замещенный, например, одним или несколькими и, предпочтительно, одним или двумя заместителями, которые являются одинаковыми или различными, и, предпочтительно, могут представлять собой галоген, гидрокси, защищенный гидрокси, тио, алкилтио, циано, нитро, C1-C6алкил, замещенный C1-C7алкил, C1-C7алкокси, замещенный C1-C7алкокси, алкоксиалкил, C1-C7ацил, замещенный C1-C7ацил, C1-C7ацилокси, карбокси, алкоксикарбонил, карбоксиметил, гидроксиметил, амино, (монозамещенный)амино, (дизамещенный)амино, карбоксамид, N-(C1-C6алкил)карбоксамид, N,N-ди(C1-C6алкил)карбоксамид, трифторметил, N-((C1-C6алкил)сульфонил)амино или N-(фенилсульфонил)аминогруппы. Во многих вариантах осуществления замещенной гетероарильной группы замещенная циклоалкильная группа содержит 1, 2, 3 или 4 группы заместителей, независимо выбранные из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы.
Аналогично, “арилалкил” и “гетероарилалкил” относятся к ароматическим и гетероароматическим системам, которые соединены с другим остатком через углеродную цепь, включая замещенные или незамещенные, насыщенные или ненасыщенные углеродные цепи, обычно 1-6C. Эти углеродные цепи могут также содержать карбонильную группу, таким образом делая их способными обеспечивать заместителями в качестве ацильной группы. Предпочтительно, арилалкил или гетероарилалкил представляет собой алкильную группу, замещенную в любом положении арильной группой, замещенным арилом, гетероарилом или замещенным гетероарилом. Предпочтительные группы также включают бензил, 2-фенилэтил, 3-фенилпропил, 4-фенил-н-бутил, 3-фенил-н-амил, 3-фенил-2-бутил, 2-пиридинилметил, 2-(2-пиридинил)этил и тому подобное.
Термин “замещенный арилалкил” означает арилалкильную группу, замещенную на алкильном участке одной или несколькими и, предпочтительно, одной или двумя группами, предпочтительно, выбранными из галогена, гидрокси, оксо, амино, (монозамещенного)амино, (дизамещенного)амино, гуанидино, гетероциклического кольца, замещенного гетероциклического кольца, C1-C6алкила, замещенного C1-C6алкила, C1-C7алкокси, замещенного C1-C7алкокси, алкоксиалкила, C1-C7ацила, замещенного C1-C7ацила, C1-C7ацилокси, нитро, карбокси, алкоксикарбонила, карбамоила, карбоксамида, N-(C1-C6алкил)карбоксамида, N,N-(C1-C6диалкил)карбоксамида, циано, N-(C1-C6алкилсульфонил)амино, тиола, C1-C4алкилтио, C1-C4алкилсульфонильной группы; и/или фенильная группа может быть замещена одним или несколькими, и, предпочтительно, одним или двумя заместителями, предпочтительно, выбранными из галогена, гидрокси, защищенного гидрокси, тио, алкилтио, циано, нитро, C1-C6алкила, замещенного C1-C6алкила, C1-C7алкокси, замещенного C1-C7алкокси, алкоксиалкила, C1-C7ацила, замещенного C1-C7ацила, C1-C7ацилокси, карбокси, алкоксикарбонила, карбоксиметила, гидроксиметила, амино, (монозамещенного)амино, (дизамещенного)амино, карбоксамида, N-(C1-C6алкил)карбоксамида, N,N-ди(C1-C6алкил)карбоксамида, трифторметила, N-((C1-C6алкил)сульфонил)амино, N-(фенилсульфонил)амино, циклического C2-C7алкилена или фенильной группы, замещенной или незамещенной, с образованием бифенильной группы. Замещенные алкильная или фенильная группы могут быть замещены одним или несколькими и, предпочтительно, одним или двумя заместителями, которые могут быть одинаковыми или различными.
Примеры термина “замещенный арилалкил” включают группы, такие как 2-фенил-1-хлорэтил, 2-(4-метоксифенил)этил, 4-(2,6-дигидроксифенил)-н-гексил, 2-(5-циано-3-метоксифенил)-н-пентил, 3-(2,6-диметилфенил)пропил, 4-хлор-3-аминобензил, 6-(4-метоксифенил)-3-карбокси-н-гексил, 5-(4-аминометилфенил)-3-(аминометил)-н-пентил, 5-фенил-3-оксо-н-пент-1-ил и тому подобное.
Термин “арилалкилен” означает арилалкил, как указано выше, где арилалкильный радикал присоединен в двух положениях, соединяя вместе две отдельные дополнительные группы. Определение включает группы формулы: -фенилалкил- и алкилфенилалкил-. Заместители на фенильном кольце могут быть в положениях 1,2, 1,3 или 1,4. Термин “замещенный арилалкилен” представляет собой арилалкилен, как определено выше, который дополнительно замещен, предпочтительно, галогеном, гидрокси, защищенным гидрокси, C1-C4алкилтио, C1-C4алкилсульфоксидом, C1-C4алкилсульфонилом, замещенным C1-C4алкилтио, замещенным C1-C4алкилсульфоксидом, замещенным C1-C4алкилсульфонилом, C1-C6алкилом, C1-C7алкокси, замещенным C1-C6алкилом, C1-C7алкоксиалкилом, оксо, (монозамещенным)амино, (дизамещенным)амино, трифторметилом, карбокси, алкоксикарбонилом, фенилом, замещенным фенилом, фенилтио, фенилсульфоксидом, фенилсульфонилом, амино или защищенной аминогруппой на фенильном кольце или на алкильной группе.
Термин “замещенный фенил” означает фенильную группу, замещенную одной или несколькими и, предпочтительно, одной или двумя группами, предпочтительно, выбранными из группы, включающей галоген, гидрокси, защищенный гидрокси, тио, алкилтио, циано, нитро, C1-C6алкил, замещенный C1-C6алкил, C1-C7алкокси, замещенный C1-C7алкокси, алкоксиалкил, C1-C7ацил, замещенный C1-C7ацил, C1-C7ацилокси, карбокси, алкоксикарбонил, карбоксиметил, гидроксиметил, амино, (монозамещенный)амино, (дизамещенный)амино, карбоксамид, N-(C1-C6алкил)карбоксамид, N,N-ди(C1-C6алкил)карбоксамид, трифторметил, N-((C1-C6алкил)сульфонил)амино, N-(фенилсульфонил)амино или фенил, где фенил является замещенным или незамещенным, что дает, таким образом, например, бифенил. Во многих вариантах осуществления замещенной фенильной группы замещенная циклоалкильная группа содержит 1, 2, 3 или 4 группы заместителей, независимо выбранные из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы.
Термин “фенокси” означает фенил, связанный с атомом кислорода. Термин “замещенный фенокси” означает феноксигруппу, замещенную одной или несколькими и, предпочтительно, одной или двумя группами, предпочтительно, выбранными из группы, включающей галоген, гидрокси, защищенный гидрокси, тио, алкилтио, циано, нитро, C1-C6алкил, C1-C7алкокси, замещенный C1-C7алкокси, алкоксиалкил, C1-C7ацил, C1-C7ацилокси, карбокси, алкоксикарбонил, карбоксиметил, гидроксиметил, амино, (монозамещенный)амино, (дизамещенный)амино, карбоксамид, N-(C1-C6алкил)карбоксамид, N,N-ди(C1-C6алкил)карбоксамид, трифторметил, N-((C1-C6алкил)сульфонил)амино и N-(фенилсульфонил)амино.
Термин “замещенный фенилалкокси” означает группу фенилалкокси, где алкильная часть замещена одной или несколькими и, предпочтительно, одной или двумя группами, предпочтительно, выбранными из галогена, гидрокси, защищенного гидрокси, оксо, амино, (монозамещенного)амино, (дизамещенного)амино, гуанидино, гетероциклического кольца, замещенного гетероциклического кольца, C1-C7алкокси, алкоксиалкила, C1-C7ацила, C1-C7ацилокси, нитро, карбокси, алкоксикарбонила, карбамоила, карбоксамида, N-(C1-C6алкил)карбоксамида, N,N-(C1-C6диалкил)карбоксамида, циано, N-(C1-C6алкилсульфонил)амино, тиола, C1-C4алкилтио, C1-C4алкилсульфонильной группы; и/или фенильная группа может быть замещена одним или несколькими и, предпочтительно, одним или двумя заместителями, предпочтительно, выбранными из галогена, гидрокси, защищенного гидрокси, тио, алкилтио, циано, нитро, C1-C6алкила, C1-C7алкокси, алкоксиалкила, C1-C7ацила, C1-C7ацилокси, карбокси, алкоксикарбонила, карбоксиметила, гидроксиметила, амино, (монозамещенного)амино, (дизамещенного)амино, карбоксамида, N-(C1-C6алкил) карбоксамида, N,N-ди(C1-C6алкил)карбоксамида, трифторметила, N-((C1-C6алкил)сульфонил)амино, N-(фенилсульфонил)амино или фенильной группы, замещенной или незамещенной, с получением бифенильной группы. Замещенная алкильная или фенильная группа может быть замещена одним или несколькими и, предпочтительно, одним или двумя заместителями, которые могут быть одинаковыми или различными.
Термин “замещенный нафтил” означает нафтильную группу, замещенную одной или несколькими и, предпочтительно, одной или двумя группами или в одном кольце или в разных кольцах, выбранными из группы, включающей галоген, гидрокси, защищенный гидрокси, тио, алкилтио, циано, нитро, C1-C6алкил, C1-C7алкокси, алкоксиалкил, C1-C7ацил, C1-C7ацилокси, карбокси, алкоксикарбонил, карбоксиметил, гидроксиметил, амино, (монозамещенный)амино, (дизамещенный)амино, карбоксамид, N-(C1-C6алкил)карбоксамид, N,N-ди(C1-C6алкил)карбоксамид, трифторметил, N-((C1-C6алкил)сульфонил)амино или N-(фенилсульфонил)амино.
Термины “гало” и “галоген” относятся к атомам фтора, хлора, брома или йода. Может быть один или несколько галогенов, которые являются одинаковыми или различными. Предпочтительные галогены представляют собой хлор и фтор. Несмотря на то, что большое количество соединений по изобретению содержат атомы галогена в качестве высокоэффективных при связывании соответствующих рецепторов вкуса заместителей, такие галогенированные органические соединения могут часто проявлять нежелательные токсикологические свойства при введении животному in vivo. Поэтому во многих вариантах осуществления соединений формулы (I), если атом галогена (включая атом фтора или хлора) указан как возможный атом заместителя, альтернативная предпочтительная замещающая группа может не включать группы галогена, фтора или хлора.
Термин “(монозамещенный)амино” относится к аминогруппе с одним заместителем, предпочтительно, выбранным из группы, включающей фенил, замещенный фенил, C1-C6алкил, замещенный C1-C6алкил, C1-C7ацил, замещенный C1-C7ацил, C2-C7алкенил, замещенный C2-C7алкенил, C2-C7алкинил, замещенный C2-C7алкинил, C7-C12фенилалкил, замещенный C7-C12фенилалкил и гетероциклическое кольцо. (Монозамещенный)амино может дополнительно содержать аминозащитную группу, которая охватывается термином “защищенный (монозамещенный)амино.”
Термин “(дизамещенный)амино” относится к аминогруппе, замещенной, предпочтительно, двумя заместителями, выбранными из группы, содержащей фенил, замещенный фенил, C1-C6алкил, замещенный C1-C6алкил, C1-C7ацил, C2-C7алкенил, C2-C7алкинил, C7-C12фенилалкил и замещенный C7-C12фенилалкил. Два заместителя могут быть одинаковыми или различными.
Используемый термин “аминозащитная группа” относится к заместителям аминогруппы, обычно используемым для блокирования или защиты функциональной аминогруппы в ходе реакций других функциональных групп молекулы. Термин “защищенный (монозамещенный)амино” означает присутствие аминозащитной группы в монозамещенном амино на атоме азота. Далее, термин “защищенный карбоксамид” означает присутствие аминозащитной группы на азоте карбоксамида. Аналогично, термин “защищенный N-(C1-C6алкил)карбоксамид” означает присутствие аминозащитной группы на азоте карбоксамида.
Термин “алкилтио” относится к сульфидным группам, таким как метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, трет-бутилтио и подобным группам.
Термин “алкилсульфоксид” означает сульфоксидные группы, такие как метилсульфоксид, этилсульфоксид, н-пропилсульфоксид, изопропилсульфоксид, н-бутилсульфоксид, втор-бутилсульфоксид и тому подобное.
Термин «алкилсульфонил» включает группы, такие как метилсульфонил, этилсульфонил, н-пропилсульфонил, изопропилсульфонил, н-бутилсульфонил, трет-бутилсульфонил и тому подобное.
Термины «замещенный алкилтио», «замещенный алкилсульфоксид» и «замещенный алкилсульфонил» означает, что алкильная часть этих групп может быть замещена, как описано выше в отношении «замещенного алкила».
Термины “фенилтио,” “фенилсульфоксид» и “фенилсульфонил” означают тиол, сульфоксид или сульфон, соответственно, содержащие фенильную группу. Термины «замещенный фенилтио», «замещенный фенилсульфоксид» и «замещенный фенилсульфонил» означает, что фенил этих групп может быть замещен, как описано выше в отношении “замещенного фенила.”
Термин “алкоксикарбонил” означает алкоксигруппу, присоединенную к карбонильной группе. Термин “замещенный алкоксикарбонил” означает замещенный алкокси, присоединенный к карбонильной группе, где алкокси может быть замещен, как описано выше в отношении замещенного алкила.
Термин “фенилен” означает фенильную группу, где фенильный радикал присоединен в двух положениях, соединяя вместе две отдельные дополнительные группы. Примеры “фенилена” включают 1,2-фенилен, 1,3-фенилен и 1,4-фенилен.
Термин “замещенный алкилен” означает алкильную группу, где алкильный радикал присоединен в двух положениях, соединяя вместе две отдельные дополнительные группы и далее образуя дополнительный заместитель. Примеры “замещенного алкилена” включают аминометилен, 1-(амино)-1,2-этил, 2-(амино)-1,2-этил, 1-(ацетамидо)-1,2-этил, 2-(ацетамидо)-1,2-этил, 2-гидрокси-1,1-этил, 1-(амино)-1,3-пропил.
Термин “замещенный фенилен” означает фенильную группу, где фенильный радикал присоединен в двух положениях, соединяя вместе две отдельные дополнительные группы, где фенил замещен, как описано выше в отношении “замещенного фенила.”
Термины “циклический алкилен”, “замещенный циклический алкилен”, “циклический гетероалкилен” и “замещенный циклический гетероалкилен” обозначают циклическую группу, присоединенную (“конденсированную”) к фенильному радикалу с получением бициклической кольцевой системы. Циклическая группа может быть насыщенной или содержать одну или две двойные связи. Кроме того, циклическая группа может содержать одну или две метиленовые или метиновые группы, замещенные одним или двумя атомами кислорода, азота или серы, которые представляют собой циклический гетероалкилен.
Группа циклического алкилена или гетероалкилена может быть замещена один раз или дважды одинаковыми или различными заместителями, предпочтительно, выбранными из группы, состоящей из следующей группы: гидрокси, защищенный гидрокси, карбокси, защищенный карбокси, оксо, замещенный оксо, C1-C4ацилокси, формил, C1-C7ацил, C1-C6алкил, C1-C7алкокси, C1-C4алкилтио, C1-C4алкилсульфоксид, C1-C4алкилсульфонил, галоген, амино, замещенный амино, (монозамещенный)амино, замещенный (монозамещенный)амино, (дизамещенный)амино, гидроксиметил или замещенный гидроксиметил.
Группа циклического алкилена или гетероалкилена, конденсированная с бензольным радикалом, может содержать от двух до десяти кольцевых членов, но, предпочтительно, содержит три-шесть членов. Примеры таких насыщенных циклических групп встречаются, когда полученная бициклическая кольцевая система представляет собой кольцо 2,3-дигидроинданила и тетралина. Примеры циклических групп, которые являются ненасыщенными, встречаются, когда полученная бициклическая кольцевая система представляет собой нафтильное кольцо или индолил. Примеры конденсированных циклических групп, каждая из которых содержит один атом азота и одну или несколько двойных связей, предпочтительно одну или две двойные связи, встречаются, когда бензольный радикал конденсирован с пиридинoвым, пирановым, пирролoвым, пиридинильным, дигидропирролoвым или дигидропиридинильным кольцом. Примеры конденсированных циклических групп, каждая из которых содержит один атом кислорода и одну или две двойные связи, встречаются, когда кольцо бензольного радикала конденсировано с фурановым, пирановым, дигидрофуранoвым или дигидропирановым кольцом. Примерами конденсированных циклических групп, каждая из которых содержит атом серы и одну или две двойные связи, являются такие, когда бензольный радикал конденсирован с тиеновым, тиопирановым, дигидротиеновым или дигидротиопирановым кольцом. Примерами циклических групп, которые содержат два гетероатома, выбранных из серы и азота, и одну или две двойные связи, являются такие, когда кольцо бензольного радикала конденсировано с тиазолoвым, изотиазолoвым, дигидротиазолoвым или дигидроизотиазолoвым кольцом. Примерами циклических групп, которые содержат два гетероатома, выбранных из кислорода и азота, и одну или две двойные связи, являются такие, когда бензольное кольцо конденсировано с оксазолoвым, изоксазолoвым, дигидрооксазолoвым или дигидроизоксазолoвым кольцом. Примеры циклических групп, которые содержат два гетероатома азота и одну или две двойные связи, встречаются, когда бензольное кольцо конденсировано с пиразоловым, имидазоловым, дигидропиразоловым или дигидроимидазоловым кольцом или пиразинилом.
Термин “карбамоил” означает группу -NCO-, где радикал присоединен в двух положениях, соединяя вместе две отдельные дополнительные группы.
Одно или несколько соединений изобретения могут быть представлены в виде соли. Термин “соль” охватывает те соли, которые образуются с помощью анионов карбоксилата и амина азота и включают соли, образованные с органическими и неорганическими анионами и катионами, описанными ниже. Кроме того, термин включает соли, которые получают путем стандартных кислотно-основных взаимодействий основных групп (например аминогруппы) и органических или неорганических кислот. Такие кислоты включают хлористоводородную, фтористоводородную, трифторуксусную, серную, фосфорную, уксусную, янтарную, лимонную, молочную, малеиновую, фумаровую, пальмитиновую, холевую, памовую, муциновую, D-глутаминовую, D-камфорную, глутаровую, фталевую, винную, лауриновую, стеариновую, салициловую, метансульфоновую, бензолсульфоновую, сорбиновую, пикриновую, бензойную, коричную и подобные кислоты.
Термин “органический или неорганический катион” относится к противоионам аниона карбоксилата соли карбоксилата. Противоионы выбраны из щелочных и щелочноземельных металлов (например литий, натрий, калий, бор, алюминий и кальций); аммоний и моно-, ди- и триалкил аминов, таких как триметиламин, циклогексиламин; и органических катионов, таких как дибензиламмоний, бензиламмоний, 2-гидроксиэтиламмоний, бис(2-гидроксиэтил)аммоний, фенилэтилбензиламмоний, дибензилэтилендиаммоний и подобные катионы. См., например, “Pharmaceutical Salts,” Berge, et al., J. Pharm. Sci. (1977) 66:1-19, включенную в данное описание в качестве ссылки. Другие катионы, охваченные вышеуказанным термином, включают протонированную форму прокаина, хинина и N-метилглюкозамина и протонированные формы основных аминокислот, таких как глицин, орнитин, гистидин, фенилглицин, лизин и аргинин. Кроме того, любая цвиттер-ионная форма быстрорастворимых соединений, образуемая карбоновой кислотой и аминогруппой, относится к данному термину. Например, катион для аниона карбоксилата будет присутствовать, когда R2 или R3 замещен (четвертичный аммоний)метильной группой. Предпочтительный катион для иона карбоксилата представляет собой катион натрия.
Соединения по изобретению также могут быть представлены в виде сольватов и гидратов. Таким образом, эти соединения могут быть кристаллизованы с гидратированной водой или c одной, несколькими или с какой-либо из фракций молекул маточного растворителя. Cольваты и гидраты таких соединений включены в объем данного изобретения.
Термин “аминокислота” включает любую из двадцати встречающихся в природе аминокислот или D-форму любой из встречающихся в природе аминокислот. Более того, термин “аминокислота” также включает другие не встречающиеся в природе аминокислоты, помимо D-аминокислот, которые являются функциональными эквивалентами встречающихся в природе аминокислот. Такие не встречающиеся в природе аминокислоты включают, например, норлейцин (“Nle”), норвалин (“Nva”), L- или D-нафталанин, орнитин (“Orn”), гомоаргинин (homoArg) и другие аминокислоты, хорошо известные в области пептидов, например, описанные в M.Bodanzsky, в “Principles of Peptide Synthesis,” 1st и 2nd revised ed., Springer-Verlag, New York, NY, 1984 и 1993, и Stewart and Young, “Solid Phase Peptide Synthesis,” 2nd ed., Pierce Chemical Co., Rockford, IL, 1984, обе включенные в данное описание в качестве ссылки. Аминокислоты и аналоги аминокислот можно приобрести коммерчески (Sigma Chemical Co.; Advanced Chemtech) или синтезировать, используя способы, известные в данной области.
Термин “боковая цепь аминокислоты” относится к любой боковой цепи вышеуказанных “аминокислот.”
Термин “замещенный” относится к замещенной группе, такой как углеводород, например замещенный алкил или бензил, где по меньшей мере элемент или радикал, например водород, заменен другим, например водород заменен галогеном, как в хлорбензиле. Остаток химических групп, как использовано в данном описании и заключительных пунктах формулы изобретения, относится к структурному участку или группе, которая является конечным продуктом преобразования химических групп в конкретной реакционной схеме, или в последующем составе, или в химическом продукте, независимо от того, структурный участок или группу фактически получали из химических групп. Таким образом, остаток этиленгликоля в полиэфире относится к одному или нескольким -OCH2CH2O- повторяющимся звеньям в полиэфире, независимо от того, используют этиленгликоль для получения полиэфира или нет. Аналогично, остаток 2,4-тиазолидиндиона в химическом соединении относится к одной или нескольким группам производного -2,4-тиазолидиндиона, независимо от того, получали ли остаток путем взаимодействия 2,4-тиазолидиндиона для получения соединения.
Термин “органический остаток” означает углерод, содержащий остаток, то есть остаток, содержащий по меньшей мере один атом углерода, и включает, но этим не ограничивается, углеродсодержащие группы, остатки или радикалы, определенные выше. Органические остатки могут содержать различные гетероатомы или могут быть присоединены к другой молекуле через гетероатом, включающий кислород, азот, серу, фосфор или тому подобное. Примеры органических остатков включают, но этим не ограничиваются, алкил или замещенные алкилы, алкокси или замещенный алкокси, моно- или дизамещенный амино, амидные группы и т.д. Органические остатки могут, предпочтительно, содержать 1-18 атомов углерода, 1-15 атомов углерода, 1-12 атомов углерода, 1-8 атомов углерода или 1-4 атомов углерода.
Термин «эффективное количество» соединения, предусмотренный в данном описании, означает достаточное количество соединения для обеспечения желаемого регулирования необходимой функции, например генной экспрессии, белковой функции или условий заболевания. Как будет отмечено ниже, необходимое точное количество будет изменяться от индивидуума к индивидууму в зависимости от вида, возраста, общего состояния индивидуума, конкретной идентичности и композиции препарата и т.д. Таким образом, невозможно дать точное определение «эффективного количества». Тем не менее, соответствующее эффективное количество может быть определено любым специалистом в данной области, используя только обычное экспериментирование.
Необходимо отметить, что, как использовано в данном описании и прилагаемых пунктах формулы изобретения, форма единственного числа включает многочисленные ссылки, если в контексте не указано иное. Таким образом, например, отсылка к «ароматическому соединению» охватывает и смеси ароматических соединений.
Часто интервалы выражаются в данном описании как от «около» одного определенного значения и/или до «около» другого определенного значения. Когда такой интервал выражен, другое воплощение включает от одного определенного значения и/или до другого определенного значения. Аналогично, когда значения выражены приблизительно, путем использования предшествующего “около,” станет понятно, что определенное значение образует другое воплощение. Далее становится понятно, что предельное значение каждого интервала является существенным и относительно другого предельного значения, и независимо от другого предельного значения.
Термин “необязательный” или “необязательно” означает, что далее описанное действие или обстоятельство может иметь или может не иметь место, и что описание включает примеры, в которых происходит указанное действие или обстоятельство, и примеры, в которых это не происходит. Например, фраза “необязательно замещенный низший алкил” означает, что низшая алкильная группа может быть или может не быть замещенной и что описание включает как незамещенный низший алкил, так и незамещенные низшие алкилы.
Амидные соединения по изобретению
Соединения по изобретению представляют собой все органические (углеродсодержащие) соединения, которые содержат по меньшей мере “амидную” группу, со следующей общей структурой, которые далее будут указываться как амидные соединения формулы (I), показанной ниже:

Амидные соединения формулы (I) не включают какие-либо амидные соединения, которые, как известно, встречаются в природе в биологических системах или продуктах питания, такие как пептиды, белки, нуклеиновые кислоты, гликопептиды или гликопротеины или тому подобное. Амидные соединения формулы (I) по изобретению представляют собой созданные человеком и искусственные синтетические амидные соединения, хотя авторы не исключают возможности того, что соединения формулы (I) могут, вероятно, быть специально получены или в их конкретной форме, или в форме пептида, или в форме протеин-модифицированного “пролекарства”, полученного человеком, используя один или несколько способов современной биотехнологии.
В различных вариантах осуществления соединения формулы (I), группы R1, R2 и R3 могут быть и являются независимо дополнительно определенными различными способами, как далее будет подробно описано, для образования и/или включения основного количества подродов и/или видов соединения формулы (I). Таким образом, конкретно имеется в виду, что любой подрод и/или вид соединения формулы (I), описанный ниже, может быть или в своей определенной форме, или в виде пригодной в пищу приемлемой соли объединен в эффективном количестве с пищевым или лекарственным продуктом или их предшественником способами и/или методами, описанными где-либо в данном описании, или любым способом, очевидным для специалиста в области получения пищевых или лекарственных продуктов или их предшественников, для получения модифицированного пищевого или лекарственного продукта с острым или сладким вкусом, или его предшественника.
В некоторых вариантах осуществления соединения формулы (I) R1 представляет собой углеводородный остаток, который может содержать один или несколько гетероатомов, или неорганический остаток, и R2 и R3, каждый, независимо, представляет собой H или углеводородный остаток, который может содержать один или несколько гетероатомов; более предпочтительно, R1, R2 и R3 независимо выбраны из группы, включающей арилалкенил, гетероарилалкенил, арилалкил, гетероарилалкил, алкил, алкоксиалкил, алкенил, циклоалкил, циклоалкенил, арил, гетероарил, -R4OH, -R4CN, -R4CO2H, -R4CO2R5, -R4COR5, -R4CONR5R6, -R4NR5R6, -R4N(R5)COR6, -R4SR5, -R4SOR5, -R4SO2R5, -R4SO2NR5R6 и -R4N(R5)SO2R6, или необязательно замещенную их группу и, предпочтительно, один из R2 или R3 представляет собой H; где каждый R4 независимо представляет собой углеводородный остаток, который может содержать один или несколько гетероатомов, предпочтительно, независимо выбранных из низшего (C1-C6)алкилена или (C1-C6)алкоксиалкилена; и где каждый R5 и R6независимо представляет собой H или углеводородный остаток, который может содержать один или несколько гетероатомов, предпочтительно, независимо выбранных из низшего (C1-C6)алкила или (C1-C6)алкоксиалкила.
Во многих вариантах осуществления соединения формулы (I) R1 содержит органический остаток или остаток на углеводородной основе, содержащий по меньшей мере три атома углерода и необязательно от одного до 20, 15, 10, 8, 7, 6 или 5 гетероатомов, независимо выбранных из кислорода, азота, серы, галогенов или фосфора.
Во многих вариантах осуществления соединения формулы (I) один из R2 и R3 представляет собой необязательно H, и один или оба R2 и R3 содержат органический остаток или остаток на углеводородной основе, содержащий по меньшей мере три атома углерода и необязательно от одного до десяти гетероатомов, независимо выбранных из кислорода, азота, серы, галогенов или фосфора.
Соединения формулы (I) представляют собой относительно “малые молекулы” по сравнению с большинством биологических молекул и могут часто обладать разнообразными ограничениями своих предельных абсолютных физических размеров, молекулярной массы и физических характеристик с тем, чтобы они могли быть по меньшей мере отчасти растворимы в водный среде и соответствовать размеру для эффективной связи с подходящими гетеродимерными рецепторами вкуса T1R1/T1R3 или T1R2/T1R3, которые представляют собой часть обычной белковой субъединицы T1R3.
Несмотря на то, что нет какого-либо теоретического подтверждения, полагают, что MSG связывается с субъединицей T1R1 рецепторов “острого” вкуса T1R1/T1R3, и некоторые известные подсластители связываются с субъединицей T1R2 рецепторов сладкого вкуса T1R2/T1R3. Следовательно, неожиданное и внезапное открытие того, что амидные соединения формулы (I) могут характеризоваться многими частично совпадающими физическими и химическими характеристиками и могут иногда связываться или с одним, или с двумя рецепторами острого и сладкого вкуса, является вероятно в ретроспективе разумным и/или рациональным с химической/биохимической/биологической точки зрения.
В качестве примера частично совпадающих физических и химических свойств и/или физических/химических ограничений в отношении острых и/или сладких амидов формулы (I), в большинстве вариантов осуществления соединения формулы (I), молекулярная масса соединения формулы (I) может быть меньше чем около 800 грамм на моль, или в дополнительных связанных вариантах осуществления меньше чем или равна около 700 грамм на моль, 600 грамм на моль, 500 грамм на моль, 450 грамм на моль, 400 грамм на моль, 350 грамм на моль или 300 грамм на моль.
Аналогично, соединения формулы (I) могут иметь предпочтительные интервалы молекулярной массы, такие как, например, от около 175 до около 500 грамм на моль, от около 200 до около 450 грамм на моль, от около 225 до около 400 грамм на моль, от около 250 до около 350 грамм на моль.
В соответствующих сериях вариантов осуществления R1 содержит от 3 до 16 атомов углерода, или от 4 до 14 атомов углерода, или от 5 до 12 атомов углерода и 0, 1, 2, 3, 4 или 5 гетероатомов, выбранных из кислорода, азота, серы, фтора или хлора, и/или по меньшей мере один из R2 или R3 содержит от 3 до 16 атомов углерода и 0, 1, 2, 3, 4 или 5 гетероатомов, независимо выбранных из кислорода, азота, серы, фтора или хлора; или, предпочтительно, по меньшей мере один из R2 или R3 содержит от 4 до 14 атомов углерода и 0, 1, 2, 3, 4 или 5 гетероатомов, независимо выбранных из кислорода, азота, серы, фтора; или еще более предпочтительно, по меньшей мере один из R2 или R3 содержит от 5 до 12 атомов углерода и 0, 1, 2 или 3 гетероатома, независимо выбранных из кислорода, азота и серы.
В дополнение к вышеописанным общим физическим и химическим характеристикам и/или ограничениям, которыми могут характеризоваться различные подгруппы соединений формулы (I), придающих сладкий и острый вкус, соединения формулы (I) могут также характеризоваться более конкретно определяемыми химическими структурными свойствами или химическими группами или остатками, как описано далее ниже.
Например, в некоторых вариантах осуществления R1, R2 и R3 могут быть независимо выбраны из группы, включающей арилалкенил, гетероарилалкенил, арилалкил, гетероарилалкил, алкил, алкоксиалкил, алкенил, циклоалкил, циклоалкенил, арил, гетероарил, -R4OH, -R4OR5, -R4CN, -R4CO2H, -R4CO2R5, -R4COR5, -R4SR5 и -R4SO2R5 и необязательно их замещенное производное, содержащее 1, 2, 3 или 4 карбонила, аминогруппы, гидроксила или группы галогена, и где R4 и R5 представляют собой C1-C6 углеводородные остатки.
В дальнейших соответствующих воплощениях амидных соединений формулы (I) R1, R2 и R3 могут быть независимо выбраны из группы, включающей арилалкенил, гетероарилалкенил, арилалкил, гетероарилалкил, алкил, алкоксиалкил, алкенил, циклоалкил, циклоалкенил, гетероцикл, арил и гетероарильные группы, и необязательно их замещенные производные, содержащие 1, 2, 3 или 4 карбонила, аминогруппы, гидроксила или группы хлора или фтора. В обоих вариантах осуществления приводится только альтернативный и предпочтительный ряд необязательных предполагаемых групп заместителей, независимо выбранных из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигрупп заместителей.
Во многих вариантах осуществления соединения формулы (I) один из R2 и R3 представляет собой водород, а другой R2 или R3 представляет собой органический остаток или группу. Например, во многих вариантах осуществления соединения формулы (I) по меньшей мере или R2 и R3 представляют собой разветвленный или циклический органический остаток, содержащий атом углерода, непосредственно присоединенный как к (a) амидному атому азота, так и к (b) двум дополнительным атомам углерода из других органических остатков, которые являются разветвленными или циклическими органическими остатками, включающими дополнительные атомы водорода и до 10 необязательных дополнительных атомов углерода, и необязательно от нуля до пяти гетероатомов, независимо выбранных из кислорода, азота, серы, фтора и хлора. Такие разветвленные R2 и R3 группы включают органические радикалы формулы:
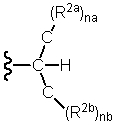
где na и nb независимо выбраны из 1, 2 и 3, и каждый R2a или R2b заместитель независимо выбран из водорода, галогена, гидрокси или углеродсодержащего остатка, необязательно содержащего от нуля до пяти гетероатомов, независимо выбранных из кислорода, азота, серы и галогена. В некоторых таких вариантах осуществления R2a или R2b представляют собой независимые группы заместителей, но в других вариантах осуществления один или несколько радикалов R2a или R2b могут быть соединены вместе с образованием кольцевых структур.
В некоторых таких вариантах осуществления соединения формулы (I) по меньшей мере один из R2 и R3 представляет собой разветвленный алкильный радикал, содержащий 5-12 атомов углерода, или по меньшей мере один из R2 и R3 представляет собой циклоалкильное или циклоалкенильное кольцо, содержащее 5-12 кольцевых атомов углерода. В таких вариантах осуществления R2 и R3 разветвленный алкильный радикал или циклоалкил, или циклоалкенильное кольцо могут быть необязательно замещены 1, 2, 3 или 4 заместителями, независимо выбранными из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метила, этила, изопропила, винила, трифторметила метокси, этокси, изопропокси и трифторметокси.
В других вариантах осуществления амидных соединений формулы (I) по меньшей мере один из R2 и R3 представляет собой “бензильный” радикал, имеющий структуру


где Ar представляет собой ароматическое или гетерароматическое кольцо, например фенил, пиридил, фуранил, тиофуранил, пирролил или аналогичные ароматические кольцевые системы, m равно 0, 1, 2 или 3, и каждый R2′ независимо выбран из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметокси, и каждая замещающая группа R2a может быть независимо выбрана из группы, включающей алкил, алкоксиалкил, алкенил, циклоалкенил, циклоалкил, -R4OH, -R4OR5, -R4CN, -R4CO2H, -R4CO2R5, -R4COR5, -R4SR5 и -R4SO2R5 группы.
Во многих вариантах осуществления соединения формулы (I) по меньшей мере один из R2 и R3 представляет собой разветвленный C3-C10алкил. Было обнаружено, что указанные разветвленные C3-C10алкилы являются высокоэффективными группами R2 как для придающих острый вкус, так и для придающих сладкий вкус амидных соединений. В дальнейших вариантах осуществления разветвленный C3-C10алкил может быть необязательно замещен одним или двумя заместителями, независимо выбранными из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SCH3, SEt, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы.
В дальнейших вариантах осуществления соединения формулы (I) по меньшей мере один из R2 или R3 представляет собой α-замещенную карбоновую кислоту или низший алкиловый эфир α-замещенной карбоновой кислоты. Предпочтительно, по меньшей мере один из R2 и R3 представляет собой низший алкиловый (в частности метиловый) эфир α-замещенной карбоновой кислоты. В некоторых таких предпочтительных вариантах осуществления остаток α-замещенной карбоновой кислоты или остаток эфира α-замещенной карбоновой кислоты соответствует такой встречающейся в природе и оптически активной α-аминокислоте, или ее эфиру, или ее противоположному энантиомеру.
Во многих вариантах осуществления соединения формулы (I) по меньшей мере один из R2 и R3 представляет собой 5- или 6-членное арильное или гетероарильное кольцо, необязательно замещенное 1, 2, 3 или 4 группами заместителей, выбранными из группы, включающей алкил, алкоксил, алкоксиалкил, OH, CN, CO2H, CHO, COR6, CO2R6, SR6, галоген, алкенил, циклоалкил, циклоалкенил, арил и гетероарил: и R6 представляет собой C1-C6алкил. Предпочтительно, арильное или гетероарильное кольцо замещено 1, 2, 3 или 4 группами заместителей, выбранными из группы, включающей гидрокси, фтор, хлор, NH2, NHCH3, N(CH3)2, CO2CH3, SCH3, SEt, метил, этил, изопропил, винил, трифторметил, метокси, этокси, изопропокси и трифторметоксигруппы.
В некоторых вариантах осуществления соединения формулы (I) по меньшей мере один из R2 и R3 представляет собой фенильное, пиридильное, фуранильное, тиофуранильное или пирролильное кольцо, необязательно замещенное одним или двумя заместителями, независимо выбранными из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SCH3, SEt, метила, этила, изопропила, винила, трифторметила, метоксиа, этокси, изопропокси и трифторметокси.
Во многих вариантах осуществления соединения формулы (I) по меньшей мере один из R2 и R3 представляет собой циклоалкильное, циклоалкенильное или насыщенное гетероциклическое кольцо, содержащее 3-10 кольцевых атома углерода, необязательно замещенное 1, 2 или 3 заместителями, независимо выбранными из группы, включающей NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3,C1-C4алкил, C1-C4галогеналкил, C1-C4алкокси, C1-C4галогеналкил, гидрокси и галоген. В некоторых дополнительных вариантах осуществления по меньшей мере один из R2 и R3 представляет собой циклопентильное, циклогексильное, циклогептильное, циклооктильное кольцо или пиперидильное кольцо, необязательно замещенное 1, 2 или 3 заместителями, независимо выбранными из группы, включающей гидрокси, фтор, хлор, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метил, этил, изопропил, винил, трифторметил, метокси, этокси, изопропокси и трифторметокси. В некоторых предпочтительных вариантах осуществления по меньшей мере один из R2 или R3 представляет собой циклогексил, необязательно замещенный 1, 2 или 3 метильными группами. Примеры таких метилзамещенных циклогексильных колец имеют формулу

Во многих вариантах осуществления соединения формулы (I), особенно соединения, обладающие активностью в отношении рецепторов сладкого вкуса, по меньшей мере один из R2 или R3 представляет собой 1-(1,2,3,4)-тетрагидронафталиновое кольцо или 2,3-дигидро-1H-инденовое кольцо, имеющее формулу:


где m равно 0, 1, 2 или 3, и каждый R2′ может быть присоединен к либо ароматическому, либо неароматическому кольцу, и независимо выбран из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SCH3, SEt, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметокси. Ясно, что оптическая и/или диастереоизомерная изомерия может встречаться на циклогексильном или циклопентильном кольце указанного заместителя, и другие оптические изомеры и/или диастереомеры могут часто обладать по меньшей мере несколько отличающейся биологической активностью.
В некоторых вариантах осуществления по меньшей мере один из R2 и R3 представляет собой 1-(1,2,3,4)-тетрагидронафталиновое кольцо с определенными предпочтительными типами заместителей. В частности, по меньшей мере один из R2 и R3 может иметь формулу:


где каждый R2′ независимо выбран из группы, включающей водород, гидрокси, фтор, хлор, NH2, NHCH3, N(CH3)2, COOCH3, SCH3, SEt, метил, этил, изопропил, винил, трифторметил, метокси, этокси, изопропокси и трифторметоксигруппы. Аналогично, в некоторых предпочтительных вариантах осуществления по меньшей мере один из R2 и R3 может иметь формулу:


В некоторых вариантах осуществления по меньшей мере один из R2 и R3 представляет собой незамещенное кольцо 1-(1,2,3,4)-тетрагидронафталина в рацемической или оптически активной форме, как показано ниже:

Ароматические или гетероароматические соединения
Во многих предпочтительных вариантах осуществления амидных соединений формулы (I), проявляющих агонистическую активность к одному или к обоим рецепторам острого или сладкого вкуса, присутствует предпочтительная подгруппа амидных соединений со следующей формулой (II):

где A содержит 5- или 6-членное арильное или гетероарильное кольцо; m равно 0, 1, 2, 3 или 4; каждый R1′ независимо выбран из алкила, алкокси, алкоксиалкила, гидроксиалкила, OH, CN, CO2H, CO2R6, CHO, COR6, SR6, галогена, алкенила, циклоалкила, циклоалкенила, гетероцикла, арила и гетероарила; и R6 представляет собой C1-C6алкил, и R2 может быть любым из вариантов осуществления, рассмотренных выше, или аналогичный.
В некоторых вариантах осуществления группа A формулы (II) содержит арильное кольцо, то есть содержит по меньшей мере шестичленное ароматическое бензольное кольцо. Арилы включают по меньшей мере кольца бензола и нафталина, которые могут не быть, но во многих вариантах осуществления могут быть дополнительно замещены по меньшей мере 1, 2 или 3 замещающими R1′ группами, независимо выбранными из группы, включающей гидрокси, фтор, хлор, NH2, NHCH3, N(CH3)2, COOCH3, SCH3, SEt, метил, этил, изопропил, винил, трифторметил, метокси, этокси, изопропокси и трифторметоксигруппы.
В некоторых предпочтительных вариантах осуществления одна или две из замещающих групп R1′ соединены вместе с образованием насыщенного алкилендиокси кольца на фенильном кольце, например, следующих предпочтительных структур (IIa) и (IIb);

где R1a и R1b независимо представляют собой водород или низший алкил, или, альтернативно, R1a и R1b независимо представляют собой водород или метил, или альтернативно, оба R1a и R1b представляют собой водород.
Во многих вариантах осуществления амидных соединений формулы (II) A представляет собой гетероарильное кольцо и обычно моноциклическое или конденсированное бициклическое гетероарильное кольцо. Конденсированные бициклические гетерарилы показаны на примере следующих бензофуранов (формула IIc) и бензотиофуранов (формула IId):


где m равно 0, 1, 2 или 3 и каждый R1′ может быть присоединен как к фенильному, так и гетероарильному кольцу, и каждый R1′ независимо выбран из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SCH3, SEt, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметокси.
Дополнительные примеры конденсированных бициклических гетероарилов в качестве A группы показаны на примере следующих бензоксазольных соединений (формула IIe и формула IIf):

где R1a или R1b независимо представляют собой водород или низший алкил.
Во многих вариантах осуществления амидных соединений формулы (II) A представляет собой моноциклическое гетероарильное кольцо. Моноциклические гетероарилы, которые могут использоваться в качестве группы A в формуле (II), показаны на примере следующих структур:


где m равно 0, 1, 2 или 3, и каждый R1′ независимо выбран из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SCH3, SEt, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметокси.
В некоторых предпочтительных вариантах осуществления соединения формулы (II) A представляет собой замещенное фурановое, тиофурановое или оксазольное кольцо с тем, чтобы образовать соединения, имеющие формулы (IIg), (IIh) и (IIi):



где m равно 0, 1, 2 или 3, и каждый R1′ независимо выбран из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SCH3, SEt, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметокси. В некоторых из указанных вариантов осуществления m равно 1 или 2.
Во многих вариантах осуществления соединения различных подгрупп формулы (II), описанных непосредственно выше, по меньшей мере один из R2 или R3 может представлять собой разветвленный C3-C10алкил; α-замещенную карбоновую кислоту или низший алкиловый эфир α-замещенной карбоновой кислоты; 5- или 6-членное арильное или гетероарильное кольцо, необязательно замещенное 1, 2, 3 или 4 группами заместителей, выбранными из группы, включающей гидрокси, фтор, хлор, NH2, NHCH3, N(CH3)2, CO2CH3, SCH3, SEt, метил, этил, изопропил, винил, трифторметил, метокси, этокси, изопропокси и трифторметокси; циклогексил, необязательно замещенный 1, 2 или 3 метильными группами; или 1-(1,2,3,4)-тетрагидронафталиновое кольцо или 2,3-дигидро-1H-инденовое кольцо, имеющие формулу:


где m равно 0, 1, 2 или 3, и каждый R2′ может быть присоединен к ароматическому или неароматическому кольцу и независимо выбран из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SCH3, SEt, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметокси; как описано выше в отношении общих амидных соединений формулы (I).
Подгруппы ароматических или гетероароматических амидных соединений формулы(II), описанные непосредственно выше, содержат большое количество высокоэффективных агонистов T1R1/T1R3 рецепторов острого («умами») вкуса и/или T1R2/T1R3 рецепторов сладкого вкуса в очень низких концентрациях амидного соединения, концентрациях порядка микромолей или меньше, и могут вызывать ощутимое чувство острого «умами» вкуса у человека, и/или могут служить в качестве усилителей острого «умами» вкуса MSG, или значительно повышать эффективность различных известных подсластителей, в частности подсластителей на основе сахарида.
Таким образом, большое количество ароматических или гетероароматических амидных соединений формулы (II) могут быть использованы в качестве ароматизирующих веществ, вызывающих острый или сладкий вкус, или в качестве усилителей острого или сладкого вкуса при контакте с обширным рядом пищевых продуктов и/или композиций, или их предшественников, как описано где-либо в данном описании.
В другой подгруппе соединений формулы (I), амидное соединение имеет формулу (III):

где A содержит 5- или 6-членное арильное или гетероарильное кольцо; m равно 0, 1, 2, 3 или 4; каждый R1′ независимо выбран из алкила, алкоксила, алкоксиалкила, гидроксиалкила, OH, CN, CO2H, CHO, COR6, CO2R6, SH, SR6, галогена, алкенила, циклоалкила, циклоалкенила, арила и гетероарила, и R6 представляет собой C1-C6алкил; B представляет собой 5- или 6-членное арильное или гетероарильное кольцо; m′ равно 0, 1, 2, 3 или 4; R2′ выбран из группы, включающей алкил, алкоксил, алкоксиалкил, OH, CN, CO2H, CHO, COR6, CO2R6, SR6, галоген, алкенил, циклоалкил, циклоалкенил, арил и гетероарил; и R6 представляет собой C1-C6алкил.
В соединениях формулы (III) необязательные R1′ и R2′ группы заместителей могут также быть независимо выбраны из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SCH3, SEt, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы.
В соединениях формулы (III) оба кольца A и B содержат пяти- или шестичленное арильное или гетероарильное кольцо. Для кольца A любой из различных вариантов осуществления кольца A, описанный выше для соединения формулы (II), включая фенил и моноциклические и бициклические гетероарилы, может быть подходящим. В некоторых бициклических вариантах осуществления кольцо A соединения формулы (III) имеет следующие структуры:
где R1a и R1b независимо представляют собой водород или низший алкил.
В соединениях формулы (III) кольца B обычно необязательно замещены моноциклическим пяти- или шестичленным арильным или гетероарильным кольцом, таким как фенил, пиридил, фуранил, тиофуранил, пирролил и подобные моноциклы. В некоторых вариантах осуществления соединение формулы (III), где B представляет собой фенил, то есть, где амидное соединение легко получается из замещенного анилинового предшественника, оно может в большом количестве случаев быть ранее известным химическим соединением, но имеется в виду, что ранее было неизвестно, что такие соединения могут использоваться в качестве очень эффективного соединения, вызывающего вкус «умами» в меньших, чем микромолярные концентрациях или менее, см., например, соединение A1 в таблице 1 ниже.
Соединения мочевины
В другой подгруппе амидных соединений формулы (I) амидное соединение представляет собой соединение мочевины, имеющее формулу (IV):

где R7, R8 и R9, каждый, представляют собой углеводородный остаток, который может содержать один или несколько гетероатомов, или неорганический остаток, и, предпочтительно, независимо выбраны из арилалкенила, гетероарилалкенила, арилалкила, гетероарилалкила, алкила, алкоксиалкила, алкенила, циклоалкила, циклоалкенила, арила и гетероарильной группы, каждый из которых может необязательно быть замещен, или один из R7 или R8 может быть и часто представляет собой H.
В некоторых вариантах осуществления соединения мочевины формулы (IV) R7 и R8 вместе образуют гетероциклическое или гетероарильное кольцо, содержащее 5, 6 или 7 кольцевых атомов, которые могут быть необязательно замещены 1, 2 или 3 заместителями, независимо выбранными из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, COOCH3, SCH3, SEt, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы. Примеры такого соединения мочевины могут иметь формулы (IVa) и (IVb):

где m и n независимо равны 0, 1, 2 или 3, и каждый R1′ и R2′ независимо выбраны из фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметокси. В таких вариантах осуществления n равно, предпочтительно, 0.
В дополнительных вариантах осуществления соединения мочевины формулы (IV) R9 и один из R7 и R8 независимо выбраны из арилалкенилов, гетероарилалкенилов, арилалкилов, гетероарилалкилов, алкилов, алкоксиалкилов, алкенилов, циклоалкилов, циклоалкенилов, арилов и гетероарилов, в которых каждые углеродсодержащие группы могут быть необязательно замещены 1, 2 или 3 заместителями, независимо выбранными из водорода, гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, COOCH3, SCH3, SEt, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы.
В дополнительных вариантах осуществления соединений мочевины формулы (IV) R9 и один из R7 и R8 независимо выбраны из арилалкила, гетероарилалкила, алкила, циклоалкила, арила, гетероцикла и гетероарила, каждый из которых может необязательно содержать от одного до пяти гетероатомов, независимо выбранных из кислорода, азота, серы, хлора и фтора.
В дополнительных вариантах осуществления соединения мочевины формулы (IV) R9 и один из R7 и R8 независимо выбраны из алкила, фенила, циклогексила или пиридила, каждый из которых может необязательно содержать от одного до четырех заместителей, независимо выбранных из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметокси.
В дополнительных вариантах осуществления соединения мочевины формулы (IV) по меньшей мере один из R7 и R8 имеет одну из гетероароматических формул:

где m равно 0, 1, 2 или 3, и каждый R1′ независимо выбран из водорода, гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, COOCH3, SCH3, SEt, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы. В таких вариантах осуществления R9 представляет собой, предпочтительно, разветвленный C3-C10алкил, арилалкил или циклоалкил, который необязательно может быть замещен 1, 2 или 3 заместителями, независимо выбранными из водорода, гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, COOCH3, SCH3, SEt, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы.
В дополнительных вариантах осуществления соединения мочевины формулы (IV) по меньшей мере один из R7 и R8 представляет собой фенильное кольцо, необязательно замещенное 1, 2 или 3 заместителями, независимо выбранными из водорода, гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, COOCH3, SCH3, SEt, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы. В таких вариантах осуществления, R9 представляет собой, предпочтительно, разветвленный C3-C10алкил, арилалкил или циклоалкил, который может быть необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из водорода, гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, COOCH3, SCH3, SEt, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы.
В дополнительных вариантах осуществления соединения мочевины формулы (IV) R9 представляет собой разветвленный C3-C10алкил. В дополнительных вариантах осуществления соединения мочевины формулы (IV) R9 имеет структуру


где B представляет собой фенильное, пиридильное, фуранильное, тиофуранильное, пиррольное, циклопентильное, циклогексильное или пиперидильное кольцо, m равно 0, 1, 2 или 3, и каждый R2′ независимо выбран из водорода, гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, COOCH3, SCH3, SEt, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы, и R9a выбран из группы, включающей алкил, алкоксиалкил, алкенил, циклоалкенил, циклоалкил, -R4OH, -R4OR5 -R4CN, -R4CO2H, -R4CO2R5, -R4COR5, -R4SR5 и -R4SO2R5, содержащий 1-12 атомов углерода, или, предпочтительно,
Оксаламидные соединения
В другой подгруппе амидных соединений формулы (I) амидное соединение представляет собой оксаламидное соединение, имеющее формулу (V):

где R10 и R30, каждый, независимо представляет собой выбранный углеводородный остаток, который может содержать один или несколько гетероатомов, или, предпочтительно, R10 и R30 независимо выбраны из группы, включающей арилалкил, гетероарилалкил, гетероциклоалкил или необязательно их замещенные группы, и
R20 и R40, каждый, независимо представляют собой H или углеводородный остаток, который может содержать один или несколько гетероатомов; предпочтительно, R20 и R40 представляют собой H или C1-C3алкил или необязательно их замещенные группы. Более предпочтительно, R20 и R40 представляют собой H. Более того, там могут присутствовать 0, 1, 2, 3 или 4 необязательные группы заместителей для R10 и R30, независимо выбранные из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SCH3, SEt, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы.
В предпочтительном варианте осуществления оксаламидного соединения формулы (V) R10 и R30 представляют собой независимо выбранные углеводородные остатки, содержащие по меньшей мере три атома углерода и необязательно от одного до десяти гетероатомов, независимо выбранных из кислорода, азота, серы, галогенов или фосфора, и где R20 и R40 независимо выбраны из водорода и углеводородного остатка, содержащего по меньшей мере три атома углерода и необязательно от одного до десяти гетероатомов, независимо выбранных из кислорода, азота, серы, галогенов или фосфора.
Во многих предпочтительных вариантах осуществления оксаламидных соединений формулы (V) R20 и R40 представляют собой водород. В таких вариантах осуществления R10 и R30 могут быть независимо выбраны из группы, включающей арилалкилы, гетероарилалкилы, циклоалкилалкилы и гетероциклоалкилы, содержащие 5-15 атомов углерода, где каждый R10 и R30 необязательно может содержать от одного до четырех заместителей, независимо выбранных из водорода, гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы.
Во многих вариантах осуществления оксаламидных соединений формулы (V) оксаламидное соединение имеет формулу (Va):

где A и B независимо представляют собой арил, гетероарил, циклоалкил или гетероцикл, содержащий 5-12 кольцевых атомов; m и n независимо равны 0, 1, 2, 3 или 4-8; R20 и R40 представляют собой водород, R50 представляет собой водород, или алкил, или замещенный алкильный остаток, содержащий один-четыре атома углерода; R60 отсутствует или представляет собой C1-C5алкилен или замещенный C1-C5алкилен; R70 и R80 независимо выбраны из группы, включающей водород, алкил, алкоксил, алкоксиалкил, OH, SR9, галоген, CN, NO2, CO2R9, COR9, CONR9R10, NR9R10, NR9COR10, SOR9, SO2R9, SO2NR9R10, NR9SO2R10, алкенил, циклоалкил, циклоалкенил, арил, гетероарил и гетероцикл; R9 и R10 независимо выбраны из H, C1-C6алкила, C3-C6циклоалкила и C1-C6алкенила.
В предпочтительных вариантах осуществления оксаламидного соединения формулы (Va) R60 представляет собой группу -CH2CH2-, A и B независимо выбраны из фенильного, пиридильного, фуранильного, тиофуранильного и пирролильного кольца, и R70 и R80 независимо выбраны из гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы.
В некоторых вариантах осуществления оксаламидных соединений формулы (Va) A и B независимо представляют собой фенильное, пиридильное, фуранильное, бензофуранильное, пиррольное, бензотиофеновое, пиперидильное, циклопентильное, циклогексильное или циклогептильное кольцо; m и n независимо равны 0, 1, 2 или 3; R20 и R40 представляют собой водород; R50 представляет собой водород или метил; R60 представляет собой C1-C5 или, предпочтительно, C2алкилен; R70 и R80 независимо выбраны из водорода, гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы.
Во многих вариантах осуществления оксаламидных соединений формулы (V) оксаламидное соединение имеет формулу (Vb):

где A представляет собой фенильное, пиридильное, фуранильное, пиррольное, пиперидильное, циклопентильное, циклогексильное или циклогептильное кольцо; m и n независимо равны 0, 1, 2 или 3; R50 представляет собой водород или метил; P равно 1 или 2; и R70 и R80 независимо выбраны из группы, включающей водород, гидрокси, фтор, хлор, NH2, NHCH3, N(CH3)2, COOCH3, SCH3, SEt, метил, этил, изопропил, винил, трифторметил, метокси, этокси, изопропокси и трифторметокси, или два из R70 вместе образуют метилендиокси кольцо. В некоторых вариантах осуществления оксаламидных соединений формулы (Vb), радикал пиридил-R80 имеет структуру:


В некоторых предпочтительных вариантах осуществления амидных соединений формулы (V), оксаламидное соединение имеет формулу (Vc):
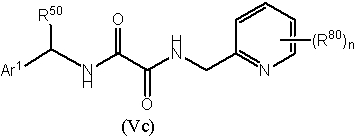
где Ar1 представляет собой замещенное арильное или гетероарильное кольцо, содержащее 5-12 атомов углерода; R50 представляет собой водород или метил; n равно 0, 1, 2 или 3; каждый R80 независимо выбран из группы, включающей гидрокси, фтор, хлор, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метил, этил, изопропил, винил, трифторметил, метокси, этокси, изопропокси и трифторметоксигруппы. В некоторых вариантах осуществления оксаламидных соединений формулы (Vc) Ar1 представляет собой 2-, 3- или 4-монозамещенный фенил, 2,4-, 2,3-, 2,5-, 2,6-, 3,5- или 3,6-дизамещенный фенил, 3-алкил-4-замещенный фенил, тризамещенный фенил, где группы заместителей независимо выбраны из группы, включающей водород, гидрокси, фтор, хлор, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метил, этил, изопропил, винил, трифторметил, метокси, этокси, изопропокси и трифторметокси, или два соседних заместителя вместе образуют метилендиокси кольцо на фенильном кольце. В некоторых вариантах осуществления оксаламидных соединений формулы (Vc) Ar1 представляет собой замещенное гетероарильное кольцо, содержащее 5-12 атомов углерода, и где группы заместителей независимо выбраны из группы, включающей водород, гидрокси, фтор, хлор, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метил, этил, изопропил, винил, трифторметил, метокси, этокси, изопропокси и трифторметокси.
В некоторых предпочтительных вариантах осуществления амидных соединений формулы (V) оксаламидное соединение имеет формулу (Vd):

где A представляет собой замещенное арильное или гетероарильное кольцо, содержащее 5-12 атомов углерода; R50 представляет собой водород или метил; n равно 0, 1, 2 или 3; каждый R80 независимо выбран из группы, включающей водород, гидрокси, фтор, хлор, NH2, NHCH3, N(CH3)2, COOCH3, SCH3, SEt, метил, этил, изопропил, винил, трифторметил, метокси, этокси, изопропокси и трифторметокси. Предпочтительно, A представляет собой фенильное, пиридильное, фуранильное, пиррольное, пиперидильное, циклопентильное, циклогексильное или циклогептильное кольцо, необязательно замещенное 1, 2 или 3 группами заместителей, независимо выбранными из группы, включающей водород, гидрокси, фтор, хлор, NH2, NHCH3, N(CH3)2, COOCH3, SCH3, SEt, метил, этил, изопропил, винил, трифторметил, метокси, этокси, изопропокси и трифторметокси.
В некоторых предпочтительных вариантах осуществления амидных соединений формулы (V) оксаламидное соединение имеет формулу (Ve):

где m и n равны независимо 0, 1, 2 или 3; R70 и R80 независимо выбраны из группы, включающей водород, алкил, алкоксил, алкоксиалкил, OH, SR9, галоген, CN, NO2, CO2R9, COR9, CONR9R10, NR9R10, NR9COR10, SOR9, SO2R9, SO2NR9R10, NR9SO2R10, алкенил, циклоалкил, циклоалкенил, арил, гетероарил и гетероцикл; и R9 и R10 независимо выбраны из H, C1-C6алкила, C3-C6циклоалкила и C1-C6алкенила. Предпочтительно, R70 и R80 независимо выбраны из группы, включающей водород, гидрокси, фтор, хлор, NH2, NHCH3, N(CH3)2, COOCH3, SCH3, SEt, метил, этил, изопропил, винил, трифторметил, метокси, этокси, изопропокси и трифторметокси. Предпочтительно, радикал пиридил-R80 оксаламидного соединения формулы (Ve) имеет структуру:


Как можно заметить при рассмотрении примеров, представленных ниже, оксаламидные соединения формул (Va)-(Ve) представляют собой высокоэффективные агонисты T1R1/T1R3 рецепторов острого («умами») вкуса при очень низких концентрациях, порядка микромолей или меньше, и могут вызывать ощутимое чувство острого «умами» вкуса у человека и/или могут служить в качестве усилителей острого «умами» вкуса MSG. Следовательно, оксаламидные соединения формул (Vc), (Vd) и (Ve) могут использоваться в качестве ароматизирующих веществ, вызывающих острый или сладкий вкус, или усилителей острого или сладкого вкуса при контакте с обширным рядом пищевых продуктов и/или композиций, или их предшественниками, как описано где-либо в данном описании.
Акриламидные соединения
В другой подгруппе амидных соединений формулы (I), амидное соединение представляет собой акриламидное соединение, имеющее формулу (VI):

где A представляет собой 5- или 6-членное арильное или гетероарильное кольцо; m равно 0, 1, 2, 3 или 4; каждый R1′ независимо выбран из алкила, алкоксила, алкоксиалкила, OH, CN, CO2H, CO2R6, CHO, COR6, SR6, галогена, алкенила, циклоалкила, циклоалкенила, арила и гетероарила, и R2 может быть любым из различных вариантов осуществления R2, описанного выше в отношении амидов формулы (I).
В некоторых акриламидных соединениях формулы (VI) A представляет собой фенильное кольцо, и m равно 1, 2, 3 или 4, или, предпочтительно, m равно 1 или 2, и R1′ может быть независимо выбран из водорода, гидрокси, фтора, хлора, NH2, NHCH3, N(CH3)2, CO2CH3, SEt, SCH3, метила, этила, изопропила, винила, трифторметила, метокси, этокси, изопропокси и трифторметоксигруппы. В некоторых акриламидных соединениях формулы (VI) R2 представляет собой C3-C10алкил или низший алкиловый эфир α-замещенной карбоновой кислоты.
Пригодные в пищу или фармацевтически приемлемые соединения
Большинство амидных соединений формулы (I) или их различные перечисленные подгруппы содержат кислотные или основные группы, с тем чтобы в зависимости от кислотного или основного характера (“pH”) пищевых или лекарственных композиций, в состав которых они входят, они могли присутствовать в виде солей, которые являются, предпочтительно, пригодными в пищу (то есть обозначаются как «признанные полностью безвредными» или GRAS), или фармацевтически приемлемых солей (большинство из которых были признаны «Федеральным управлением питания и лекарственных препаратов»).
Амидные соединения формулы (I), содержащие кислотные группы, такие как карбоновые кислоты, будут стремиться (при близком к нейтральному физиологическому pH) присутствовать в растворе в форме анионных карбоксилатов, и поэтому будут в предпочтительных вариантах осуществления содержать соответствующие пригодные в пищу и/или фармацевтически приемлемые катионы, большинство которых известны специалистам в данной области. Такие пригодные в пищу и/или фармацевтически приемлемые катионы включают катионы щелочных металлов (катионы лития, натрия и калия), катионы щелочноземельных металлов (магний, кальций и тому подобное) или аммония (NH4)+ или органически замещенные катионы аммония, например катионы (R-NH3)+.
Амидные соединения формулы (I), содержащие основные группы заместителей, такие как амино или азот, включающие гетероциклические группы, будут стремиться (при близком к нейтральному физиологическому pH или при кислотном уровне pH, часто встречающемся в большинстве продуктов питания) присутствовать в растворе в форме катионных групп аммония, и поэтому будут в предпочтительных вариантах осуществления содержать соответствующие пригодные в пищу и/или фармацевтически приемлемые катионы, большинство которых известны специалистам в данной области. Такие пригодные в пищу и/или фармацевтически приемлемые анионные группы включают анионные формы ряда карбоновых кислот (ацетаты, цитраты, тартраты, анионные соли жирных кислот и т.д.), галиды (в частности, фториды или хлориды), нитраты и тому подобное.
Амидные соединения формулы (I) и их различные подгруппы могут, предпочтительно, быть съедобными, то есть считаться пригодными для употребления в пищу или питьё, и могут также быть фармацевтически приемлемыми. Конкретным способом демонстрации того, что ароматизирующее соединение является съедобным, является проведение исследования соединения и/или оценки группой экспертов Flavor and Extract Manufacturers Association и признание в качестве “признанных полностью безвредными” (“GRAS”). Процесс оценки FEMA/GRAS ароматизирующих соединений является сложным, но хорошо известным специалистам в области получения продуктов питания, что обсуждается Smith et al. в статье под названием “GRAS Flavoring Substances 21,” Food Technology, 57(5), стр. 46-59, May 2003, полное содержание которой включено в данное описание в качестве ссылки.
В процессе оценки FEMA/GRAS новое ароматизирующее соединение обычно исследуют на предмет различных побочных токсических эффектов на лабораторных крысах при кормлении этих крыс по меньшей мере в течение около 90 дней с 100-кратной концентрацией, или 1000-кратной, или даже большими концентрациями, чем предложенная максимально допустимая концентрация соединения в конкретной категории продуктов питания, которые подвергаются апробации на качество продукта. Например, такое исследование амидных соединений изобретения может включать объединение амидного соединения с крысиной едой и скармливание ее лабораторным крысам, например крысам Crl:CD(SD)IGS BR, при концентрации, равной около 100 мг/кг массы тела/день в течение 90 дней, и затем умерщвление и оценка крыс различными исследовательскими методами для демонстрации того, что амидное соединение формулы (I) не вызывает побочных токсических эффектов у крыс.
Соединения по изобретению в качестве усилителей острого или сладкого вкуса
Амидные соединения формулы (I) и их различные подгруппы и виды соединений, как описано выше, предназначены для применения в качестве ароматизирующих веществ, придающих острый или сладкий вкус, или модификаторов вкуса для пищевых или лекарственных продуктов. Как ясно из описания и представленных ниже примеров, большинство соединений формулы (I) представляют собой агонисты рецептора “острого” вкуса hT1R1/hT1R3 или рецептора сладкого вкуса hT1R2/hT1R3 по меньшей мере при относительно высоких концентрациях амидного соединения и, следовательно, большинство амидных соединений формулы (I) могут обладать по меньшей мере некоторой ценностью в качестве ароматизаторов, придающих острый или сладкий вкус, или ароматизирующих усилителей по меньшей мере при относительно высоких концентрациях.
Тем не менее, предпочтительно использовать такое небольшое количество таких синтетических ароматизаторов, насколько это возможно, для того чтобы минимизировать стоимость и любые нежелательные для здоровья побочные эффекты от введения соединения формулы (I) при высоких уровнях концентрации. Следовательно, желательно проводить исследование соединений формулы (I) на их эффективность в качестве агонистов рецепторов вкуса при наименьших уровнях концентраций для определения наилучшего и более эффективного амидного соединения из числа соединений формулы (I). Как описано в WO 03/001876 и публикации патента США 2003-0232407 A1 и как описано ниже, для измерения активностей агониста соединения для рецепторов “острого” вкуса hT1R1/hT1R3 и рецепторов сладкого вкуса hT1R2/hT1R3 в настоящее время используются лабораторные методы. С помощью таких методов измерения обычно измеряют “EC50”, то есть концентрацию, при которой соединение вызывает 50% активацию соответствующего рецептора.
Предпочтительно, амидные соединения формулы (I), которые являются ароматизирующими модификаторами острого вкуса, в случае рецептора hT1R1/hT1R3, имеют значение EC50 меньше чем около 10 мкM. Более предпочтительно, в случае рецептора hT1R1/hT1R3 такие амидные соединения имеют значение EC50 меньше чем около 5 мкM, 3 мкM, 2 мкM, 1 мкM или 0,5 мкM.
Предпочтительно, амидные соединения формулы (I), которые представляют собой модификаторы сладкого вкуса или усилители сладкого вкуса, в случае hT1R2/hT1R3 рецептора имеют значение EC50 меньше чем около 10 мкM. Более предпочтительно, в случае hT1R2/hT1R3 рецептора такие амидные соединения имеют значение EC50 меньше чем около 5 мкM, 3 мкM, 2 мкM, 1 мкM или 0,5 мкM.
В некоторых вариантах осуществления амидные соединения формулы (I) представляют собой модуляторы острого вкуса или усилители активности агониста мононатрий глутамата hT1R1/hT1R3 рецептора. Ниже описан метод исследования для так называемых соотношений EC50, то есть растворения соединения формулы (I) в воде, содержащей MSG, и измерения степени, при которой амидное соединение снижает количество MSG, необходимое для 50% активации присутствующих hT1R1/hT1R3 рецепторов. Предпочтительно, амидные соединения формулы (I), когда растворены в водном растворе, содержащем около 1 мкM амидного соединения, будут понижать наблюдаемую EC50 мононатрий глутамата в случае рецептора hT1R1/hT1R3, экспрессированного в HEK293-Gα15 клеточной линии, на по меньшей мере 50%, то есть амидное соединение имеет соотношение EC50, равное по меньшей мере 2,0 или, предпочтительно, 3,0, 5,0 или 7,0.
Хотя конкретные исследования соотношения EC50 для усилителей сладкого вкуса все еще не проводились, полагают, что амидные соединения формулы (I) и, более конкретно, большинство амидов формулы (II) могут модулировать связывание известных подсластителей, таких как, например, сахароза, фруктоза, глюкоза, эритрит, изомалт, лактитол, маннит, сорбит, ксилит, известный природный терпеноид, флавоноид или белковый подсластитель, аспартам, сахарин, ацесульфам-K, цикламат, сукралоза, алитам или эритрит с рецептором hT1R2/hT1R3. Соответствующие исследования таких свойств усиления сладкого вкуса могут быть легко проведены любым специалистом в данной области, используя подходящие клеточные линии, экспрессирующие рецепторы hT1R2/hT1R3.
Вышеуказанные исследования используются для определения наиболее эффективных амидных соединений формулы (I) в качестве модификатора острого и/или сладкого вкуса или усилителя свойств, и результаты таких исследований, как полагают, хорошо соотносятся с фактическим восприятием острого или сладкого вкуса у животных и человека, но в конечном счете результаты исследований могут быть подтверждены по меньшей мере для наиболее эффективных соединений формулы (I) путем проведения вкусового опробования человеком. Такие вкусовые эксперименты опробованием человеком могут являться удовлетворительными для количественного анализа и контроля путем определения вкуса испытуемого соединения в водных растворах по сравнению с контрольным водным раствором или, альтернативно, путем определения вкуса амидов по изобретению в существующих пищевых композициях.
Следовательно, для идентификации наиболее эффективных модификаторов или веществ, придающих острый вкус, водный раствор, содержащий количество амидного соединения, модифицирующего острый вкус, может иметь острый вкус, как было подтверждено большой частью группы, по меньшей мере восемью людьми, испытывающими вкус.
Соответственно, для идентификации наиболее эффективных усилителей острого вкуса, водный раствор, содержащий количество амидного соединения формулы (I), модифицирующего острый вкус, и 12 мM мононатрий глутамата, может иметь усиленный острый вкус по сравнению контрольным водным раствором, содержащим 12 мM мононатрий глутамата, что подтвердила большая часть группы, по меньшей мере восемь человек, испытывающих вкус. Предпочтительно, для идентификации наиболее эффективных усилителей острого вкуса, водный раствор, содержащий количество амидного соединения формулы (I), модифицирующего острый вкус (предпочтительно около 30, 10, 5 или 2 частей на миллион), и 12 мM мононатрий глутамата, может иметь усиленный острый вкус по сравнению с контрольным водным раствором, содержащим 12 мM мононатрий глутамата и 100 мкM инозинмонофосфата, что подтвердила большая часть группы, по меньшей мере восемь человек, испытывающих вкус.
Простые способы вкусового тестирования человеком могут проводиться для идентификации тех соединений формулы (I), которые являются более эффективными веществами, придающими сладкий вкус, или веществами, усиливающими сладкий вкус. Предпочтительные модификаторы сладкого вкуса формулы (I) могут быть идентифицированы, когда модифицированный пищевой или лекарственный продукт имеет более сладкий вкус, чем контрольный пищевой или лекарственный продукт, не содержащий амидное соединение, что подтвердила большая часть группы экспертов, по меньшей мере восемь человек, испытывающих вкус. Предпочтительные усилители сладкого вкуса формулы (I) могут быть идентифицированы, когда водный раствор, включающий количество известного подсластителя, придающего сладкий вкус, выбранного из группы, включающей сахарозу, фруктозу, глюкозу, эритрит, изомальт, лактитол, маннит, сорбит, ксилит, известный природный терпеноид, флавоноид или белковый подсластитель, аспартам, сахарин, ацесульфам-K, цикламат, сукралозу и алитам, и количество модифицирующего сладкий вкус амидного соединения (предпочтительно около 30, 10, 5 или 2 частей на миллион) имеет более сладкий вкус, чем контрольный водный раствор, включающий количество известного подсластителя, придающего сладкий вкус, что подтвердила большая часть группы, по меньшей мере восемь человек, испытывающих вкус. В таких экспериментах по определению вкуса сахароза может, предпочтительно, присутствовать в концентрации около 6 г/100 мл, 50:50 смесь глюкозы и фруктозы может, предпочтительно, присутствовать в концентрации около 6 г/100 мл, аспартам может, предпочтительно, присутствовать в концентрации около 1,6 мM, ацесульфам-K может, предпочтительно, присутствовать в концентрации около 1,5 мМ, цикламат может, предпочтительно, присутствовать в концентрации около 10 мМ, сукралоза может, предпочтительно, присутствовать в концентрации около 0,4 мМ, или алитам может, предпочтительно, присутствовать в концентрации около 0,2 мМ.
Применение соединения формулы (I) для получения пищевых композиций
Ароматизаторы, модификаторы вкуса, ароматизирующие вещества, усилители вкуса, ароматизирующие вещества, придающие острый («умами») вкус, и/или усилители вкуса по изобретению применяются в продуктах питания, напитках и лекарственных композициях, где обычно используют соединения, придающие острый или сладкий вкус. Указанные композиции включают композиции для употребления человеком и животными. Они включают пищевые продукты для употребления животными, используемыми в сельском хозяйстве, домашними животными и животными в зоопарке.
Специалистам в области получения и продажи пищевых композиций (то есть пищевые продукты или напитки, или их предшественники или модификаторы вкуса) хорошо известен широкий ряд классов, подклассов и видов пищевых композиций и используемые общеизвестные и общепризнанные термины в области, относящейся к указанным пищевым композициям, при получении и продаже различных из указанных композиций. Такой перечень терминов в данной области приведен ниже и конкретно рассматривает различные подгруппы и виды соединений формулы (I), которые могут использоваться для модификации или усиления острого и/или сладкого вкусов перечисленных ниже пищевых композиций, или отдельно, или во всех приемлемых их комбинациях или смесях.
Одно или несколько кондитерских изделий, шоколадное кондитерское изделие, таблетки, батончики, упакованные в пакеты конфеты, упакованные в коробки наборы, стандартные упакованные в коробки наборы, завернутые в обертку миниатюры, сезонный шоколад, шоколад с игрушками, медовые пряники, другие шоколадные кондитерские изделия, мятная леденцовая карамель, стандартная мятная леденцовая карамель, мятная леденцовая карамель, леденцовые карамели, пастилки, жевательные резинки, желе и жвачки, ириски, карамели и нуга, лечебное кондитерское изделие, леденцы на палочках, лакричные конфеты, другие кондитерские изделия из сахара, жевательная конфета, жевательная резинка, жевательная резинка с сахаром, жевательная резинка без сахара, жевательная резинка для профилактики кариеса, надувная жевательная резинка, хлеб, упакованный/промышленной выпечки хлеб, неупакованный/ручной выпечки хлеб, печенье, покрытое шоколадом сухое печенье, многослойное печенье, печенье с начинкой, печенье с приправами и крекеры, заменители хлеба, блюда из зернового продукта для завтрака, готовые блюда из зернового продукта, блюда из зернового продукта для завтрака для всей семьи, хлопья, мюсли, другие готовые блюда из зернового продукта, детские блюда из зернового продукта для завтрака, горячие каши, мороженое, мороженое в упаковке для немедленного употребления, порция молочного мороженого, порция мороженого на воде, несколько порций молочного мороженого в одной упаковке, несколько порций мороженого на воде в одной упаковке, десерты с мороженным, мороженое в упаковке, молочное мороженое в упаковке, десерты мороженое, развесное мороженое, мороженое на воде в упаковке, замороженный йогурт, мороженое домашнего приготовления, молочные продукты, молоко, свежее/пастеризованное молоко, цельное свежее/пастеризованное молоко, обезжиренное свежее/пастеризованное молоко, молоко с длительным сроком хранения, цельное молоко с длительным сроком хранения, обезжиренное молоко с длительным сроком хранения, полностью обезжиренное молоко с длительным сроком хранения, козье молоко, конденсированное/сгущенное молоко, конденсированное/сгущенное молоко с вкусовыми добавками, ароматизированное, специальное сгущенное молоко, ароматизированные молочные напитки, ароматизированные молочные напитки со вкусом только молока, ароматизированные молочные напитки с фруктовым соком, соевое молоко, кислые молочные напитки, ферментированные молочные напитки, забеливатели для кофе, порошковое молоко, ароматизированные порошковые молочные напитки, сливки, сыр, плавленый сыр, пастообразный плавленый сыр, трудно намазывающийся плавленый сыр, необработанный сыр, легко намазывающийся необработанный сыр, твердый сыр, упакованный твердый сыр, неупакованный твердый сыр, йогурт, обычный/естественный йогурт, ароматизированный йогурт, йогурт с фруктами, пробиотический йогурт, питьевой йогурт, регулярный питьевой йогурт, пробиотический питьевой йогурт, охлажденные пригодные для длительного хранения десерты, основанные на молоке десерты, основанные на сое десерты, охлажденный сухой завтрак, творог и сыворотка, обычный творог и сыворотка, ароматизированный творог и сыворотка, острый творог и сыворотка, острые и сладкие закуски, фруктовые закуски, чипсы/хрустящий картофель, закуски, полученные методом экструзии, маисовая лепешка/кукурузные чипсы, попкорн, претцели, орехи, другие острые и сладкие закуски, батончик, используемый в качестве закуски, гранола батончики, батончики для завтрака, энергетические батончики, фруктовые батончики, другие батончики, используемые в качестве закуски, заменители продуктов питания, продукты для похудения, оздоровительные напитки, готовые к употреблению продукты питания, требующее обработки продукты питания, замороженные готовые продукты питания, высушенные готовые продукты питания, охлажденные готовые продукты питания, столовые смеси, замороженная пицца, охлажденная пицца, суп, консервированный суп, дегидратированный суп, сухой суповой концентрат, охлажденный суп, суп длительного срока хранения, замороженный суп, макаронные изделия, консервированные макаронные изделия, высушенные макаронные изделия, охлажденные/свежие макаронные изделия, лапша, простая лапша, быстрорастворимая лапша, лапша быстрого приготовления в чашках/мисках, лапша быстрого приготовления в пакетах, охлажденная лапша, закуски из лапши, консервированный пищевой продукт, мясные консервы и мясные продукты, консервированная рыба/морские продукты, консервированные овощи, консервированные помидоры, консервированные бобы, консервированные фрукты, консервированные готовые к употреблению продукты питания, консервированный суп, консервированные макаронные изделия, другие баночные консервы, замороженный пищевой продукт, замороженное обработанное сырое мясо, замороженная обработанная домашняя птица, замороженная обработанная рыба/морские продукты, замороженные обработанные овощи, заменители мороженого мяса, замороженный картофель, приготовленные в печи чипсы, другие приготовленные в печи картофельные продукты, приготовленный не в печи замороженный картофель, замороженные хлебобулочные изделия, замороженные десерты, замороженные готовые к употреблению продукты питания, замороженная пицца, замороженный суп, замороженная лапша, другой замороженный пищевой продукт, высушенный пищевой продукт, десертные смеси, высушенные готовые пищевые продукты, дегидратированный суп, сухой суповой концентрат, высушенные макаронные изделия, простая лапша, быстрорастворимая лапша, чашка/миска лапша быстрого приготовления в чашке/миске, лапша быстрого приготовления в пакете, охлажденный пищевой продукт, охлажденные обработанные мясные продукты, охлажденная рыба/морские продукты питания, охлажденная обработанная рыба, охлажденная неочищенная рыба, охлажденная копченая рыба, охлажденный обеденный набор, охлажденные готовые к употреблению продукты питания, охлажденная пицца, охлажденный суп, охлажденные/свежие макаронные изделия, охлажденная лапша, масла и жиры, оливковое масло, растительное масло и масло из семян растений, кулинарные жиры, масло, маргарин, легко намазывающиеся масла и жиры, функциональные легко намазывающиеся масла и жиры, соусы, заправки и приправы, томатные пасты и пюре, бульонные кубики, кубики, соусные гранулы, жидкие растворы и основы, зелень и специи, ферментированные соусы, соусы на основе сои, соусы для макаронных изделий, жидкие соусы, сухие смеси соусов/порошков, кетчуп, майонез, обычный майонез, горчица, приправы к салату, обычные приправы к салату, приправы к салату с низким содержанием жиров, заправки с уксусом, соусы, маринованные продукты, другие соусы, заправки и приправы, продукты детского питания, молочные смеси, стандартные молочные смеси, доработанные молочные смеси, молочные смеси для детей ясельного возраста, гипоаллергенные молочные смеси, готовые продукты детского питания, сухие продукты детского питания, другие продукты детского питания, пастообразные продукты, джемы и варенье, мед, шоколадные пастообразные продукты, пастообразные продукты на основе ореха, пастообразные продукты на основе дрожжей.
Предпочтительно, соединения формулы (I) могут использоваться для модификации или повышения острого или сладкого вкуса одной или нескольких следующих подгрупп пищевых композиций: кондитерские изделия, выпечка, мороженое, молочные продукты, сладкие и острые закуски, батончики, используемые в качестве закуски, заменители продуктов питания, готовые к употреблению продукты питания, супы, макаронные изделия, лапша, консервированные продукты питания, замороженные продукты питания, сухие продукты питания, охлажденные продукты питания, масла и жиры, детские продукты питания или пастообразные продукты питания или их смесь.
Пищевые композиции обычно производят с содержанием достаточного количества по меньшей мере одного соединения, входящего в объем формулы (I) или ее различных подгрупп, описанных выше для получения композиции, обладающей желаемыми вкусовыми или ароматическими свойствами, например свойствами “острого” или “сладкого” вкуса.
Обычно, по меньшей мере, модулирующее острый вкус количество, модулирующее сладкий вкус количество, придающее острый вкус количество ароматизирующего вещества или придающее сладкий вкус количество ароматизирующего вещества одного или нескольких соединений формулы (I) добавляют к пищевому или лекарственному продукту для того, чтобы пищевой или лекарственный продукт с модифицированным острым или сладким вкусом усиливал острый и/или сладкий вкус по сравнению с пищевым или лекарственным продуктом, полученным без амидного соединения, как подтверждалось людьми или животными в общем случае, или в случае исследования композиций, что подтвердила большая часть группы экспертов, по меньшей мере восемь человек, испытывающих вкус, с помощью методов, описанных где-либо в данном описании.
Концентрация ароматизирующего вещества, придающего острый или сладкий вкус, необходимая для модуляции или улучшения вкуса пищевого или лекарственного продукта или композиции, будет несомненно меняться в зависимости от большого количества показателей, включая конкретный тип пищевой композиции, вид присутствующих соединений, придающих острый вкус, и их концентрации, и действия конкретного соединения на такие придающие острый вкус соединения. Как известно, важным применением соединения формулы (I) является модулирование (стимулирование, усиление или блокирование) острого или сладкого вкусов или других вкусовых свойств других природных или синтетических соединений, придающих острый вкус. Может обычно требоваться широкий, а также низкий диапазон концентраций амидных соединений формулы (I), то есть от около 0,001 частей на миллион до 100 частей на миллион, или более узкие альтернативные диапазоны от около 0,1 частей на миллион до около 10 частей на миллион, от около 0,01 частей на миллион до около 30 частей на миллион, от около 0,05 частей на миллион до около 15 частей на миллион, от около 0,1 частей на миллион до около 5 частей на миллион или от около 0,1 частей на миллион до около 3 частей на миллион.
Примеры продуктов питания и напитков, где могут содержаться соединения по изобретению, включают, например, группу консервированных супов, группу обезвоженных и кулинарных продуктов, группу напитков, группу замороженных продуктов питания, группу закусочных продуктов питания и приправы или смеси приправ.
Термин “группа консервированных супов” означает консервированные/жидкие супы независимо от концентрации или емкости, включая замороженные супы. В целях данного определения суп(ы) означает продукт питания, полученный из мяса, домашней птицы, рыбы, овощей, хлебных злаков, фруктов и других ингредиентов, приготовленных в жидкости, которая может включать видимые частицы некоторых или всех указанных ингредиентов. Он может быть прозрачным (как бульон) или вязким (как густой суп из рыбы или моллюсков), однородным, чистым или содержащим кусочки, готовым к употреблению, полугустым или густым, и он может употребляться в горячем или холодном виде, в виде первого блюда или основного блюда, или в промежутке между закусками (выпиваться как напиток). Суп может использоваться в качестве ингредиента для получения других компонентов питания и иметь область применения от бульона (консоме) до соусов (супы на основе крема или сыра).
Термин “группа обезвоженных и кулинарных продуктов” означает: (i) вспомогательные продукты для приготовления пищи, такие как: порошки, гранулы, пасты, концентрированные жидкие продукты, включая концентрированные бульоны, бульон и бульонподобные продукты в прессованных кубиках, таблетки или порошок или гранулированная форма, которые продаются отдельно в виде конечного продукта или в виде ингредиента в продукте, соусы и рецептурные смеси (вне зависимости от технологии); (ii) пищевые растворы продуктов, такие как: обезвоженные и замороженные сухие супы, включая обезвоженные суповые смеси, обезвоженные супы быстрого приготовления, обезвоженные суповые полуфабрикаты, обезвоженные или не обезвоженные составы готовых блюд, закуски в ассортименте и отдельно подаваемые закуски, закуски подаваемые до основного блюда, включая макароны, картофельные и рисовые блюда; и (iii) продукты для украшения блюд, такие как: специи, маринады, приправы для салатов, салатные заправки, соусы, панировочные сухари, смеси взбитого теста, пригодные для длительного хранения пастообразные продукты, соусы для барбекю, жидкие рецептурные смеси, концентраты, соусы или смеси соусов, включая рецептурные смеси для салата, продаваемые в качестве готового продукта или в качестве ингредиента в продукте, или в обезвоженном, жидком или замороженном виде.
Термин “группа напитков” означает напитки, смеси напитков и концентраты, включая, но не ограничиваясь ими, спиртные и не спиртные готовые к употреблению и сухие порошкообразные напитки.
Другие примеры продуктов питания и напитков, куда соединения по изобретению могут быть включены, включают, например, насыщенные углекислым газом и ненасыщенные углекислым газом напитки, например газированная вода, фруктовые или овощные соки, спиртные и не спиртные напитки, кондитерские продукты, например торты, печенье, пирожки, леденцы, жевательные резинки, желе, мороженое, фруктовое мороженое, пудинги, джемы, кисель, заправки к салату и другие кондитерские, злаковые и другие пищевые продукты для завтрака, консервированные фрукты и фруктовые соусы и тому подобное.
Дополнительно, исследуемые соединения могут быть использованы в придающих вкус композициях в качестве добавки к продуктам питания и напиткам. В предпочтительных примерах композиция будет содержать другой модификатор аромата или вкуса, например соединение, придающее острый вкус.
Следовательно, в некоторых вариантах осуществления изобретение относится к способам модулирования острого или сладкого вкуса пищевых или лекарственных продуктов, включающим:
получение по меньшей мере пищевого или лекарственного продукта или его предшественника, и
комбинирование пищевого или лекарственного продукта или их предшественника с по меньшей мере количеством модулирующего острый вкус или количеством модулирующего сладкий вкус по меньшей мере одного неприродного амидного соединения или его пригодной в пищу приемлемой соли для получения пищевого или лекарственного продукта с модифицированным вкусом,
где амидное соединение имеет формулу:

где амидное соединение представляет собой амид формулы (I) или любые различные подгруппы или виды описываемого в данном описании соединения, где R1, R2 и R3 могут быть определены различными способами, как описано выше.
Изобретение также относится к пищевым или лекарственным продуктам с модифицированным вкусом, полученным такими способами и аналогичными способами получения пищевых или лекарственных продуктов, известными специалистам в данной области.
Амидные соединения формулы (I) и их различные подгруппы могут быть объединены или использоваться с пищевыми или лекарственными продуктами или их предшественником любым из многочисленных известных в мире способов приготовления пищи или изготовителями пищевых или лекарственных продуктов. Например, амидные соединения формулы (I) могут быть растворены или диспергированы в одной из большого числа пригодных в пищу приемлемых жидкостей, твердых веществ или других носителей, таких как вода с нейтральным, кислым или основным pH, фруктовые или овощные соки, уксус, маринады, пиво, вино, натуральные вода/жировые эмульсии, такие как молоко или сгущенное молоко, пищевые масла и шортенинги, жирные кислоты, олигомеры пропиленгликоля с определенной низкой молекулярной массой, глицериновые эфиры жирных кислот и дисперсии или эмульсии таких гидрофобных веществ в водной среде, соли, такие как хлорид натрия, овощная мука, растворители, такие как этанол, твердые пищевые разбавители, такие как овощные порошки или мука, и тому подобное, и затем объединены с предшественниками пищевых или лекарственных продуктов, или применяться непосредственно к пищевым или лекарственным продуктам.
Получение амидных соединений формулы (I)
Исходные продукты, используемые при получении соединений по изобретению, то есть различных структурных подклассов и видов амидных соединений формулы (I) и их синтетических предшественников, в частности органические карбоновые кислоты и бензойные кислоты, изоцианаты и различные амины, анилины, аминокислоты и т.д., являются обычно хорошо известными соединениями, или их получают известными из литературных источников способами, или они являются коммерчески доступными из различных источников, хорошо известных специалистам в данной области, например Sigma-Aldrich Corporation из Санкт-Луизианы, штат Миссури США, и ее дочерняя компания Fluka and Riedel-de Haen, ее другие различные отделения, разбросанные по всему миру, и другие хорошо известные поставщики, такие как Fisher Scientific, TCI America из Филадельфии, штат Пенсильвания, ChemDiv из Сан-Диего, штат Калифорния, Chembridge из Сан-Диего, штат Калифорния, Asinex из Москвы, Россия, SPECS/BIOSPECS из Нидерландов, Maybridge из Корнуэлла, Англия, Acros, TimTec из России, Comgenex из Южного Сан-Франциско, штат Калифорния, и ASDI Biosciences из Ньюарка, штат Делавэр.
Специалистам в данной области будет понятно, что способы получения предшественников и функционально относящихся к заявленным соединений обычно описаны в литературных источниках. При наличии литературы и данного описания специалист в данной области будет хорошо подготовлен для получения любых необходимых исходных продуктов и/или заявленных соединений. В некоторых следующих примерах, приведенных ниже, исходные продукты не присутствуют в готовом виде, и поэтому они были синтезированы, и поэтому синтез исходных материалов поясняется примером.
Понятно, что специалист в области органической химии может без труда выполнить операции без дополнительных указаний, то есть успешно выполнить эти операции в объеме и практике своей квалификации в данной области. Указанные операции включают восстановление карбонильных соединений до их соответствующих спиртов, окисление, ацилирование, замещение в ароматическом кольце, как электрофильное, так и нуклеофильное, этерификацию до простых эфиров, этерификацию до сложных эфиров, омыление, нитрование, гидрирование, восстановительное аминирование и тому подобное. Эти приемы описаны в стандартных текстах, например March's Advanced Organic Chemistry (3d Edition, 1985, Wiley-Interscience, New York), Feiser and Feiser's Reagents for Organic Synthesis, Carey and Sundberg, Advanced Organic Chemistry и тому подобное, полное описание которых включено в данное описание в качестве ссылок для их изучения в отношении способов синтеза органических соединений.
Специалистам в данной области будет очевидно, что определенные реакции лучше проводить, когда другая функциональная группа блокирована или защищена в молекуле, таким образом удаляя любые нежелательные побочные эффекты и/или повышая выход реакции. Часто специалисты в данной области используют защитные группы для совершенствования таких повышенных выходов или устранения нежелательных взаимодействий. Описание указанных реакций можно найти в литературных источниках, и они хорошо известны специалисту в данной области. Примеры большого числа указанных операций можно найти, например, у T. Greene и P. Wuts, Protecting Groups in Organic Synthesis, 3rd Ed., John Wiley & Sons (1999).
Следующие сокращения имеют указанные значения:
CH3CN = ацетонитрил
CHCl3 = хлороформ
DIC = N,N'-диизопропилкарбодиимид
DIPEA = диизопропилэтиламин
DMAP = 4-(диметиламино)пиридин
ДМФА = N,N-диметилформамид
EDCI = гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида
DCM = дихлорметан
ESIMS = масс-спектрометрия с ионизацией распылением
Et3N = триэтиламин
EtOAc = этилацетат
EtOH = этиловый спирт
Fmoc = N-(9-флуоренилметоксикарбонил)
HCl = хлористоводородная кислота
H2SO4 = серная кислота
HOBt = 1-гидроксибензотриазол
MeOH = метиловый спирт
MgSO4= сульфат магния
NaHCO3 = бикарбонат натрия
NaOH = гидроксид натрия
Na2SO4 = сульфат натрия
Ph = фенил
к.т. = комнатная температура
SPOS = твердофазный органический синтез
ТГФ = тетрагидрофуран
ТСХ = тонкослойная хроматография
Сокращения алкильной группы
Me = метил
Et = этил
н-Pr = нормальный пропил
изо-Pr = изопропил
н-Bu = нормальный бутил
изо-Bu = изобутил
трет-Bu = третичный бутил
втор-Bu = вторичный бутил
н-Pen = нормальный пентил
изо-Pen = изопентил
н-Hex = нормальный гексил
изо-Hex = изогексил
Аббревиатуры реагентов на полимерной основе:
PS-Трисамин = трис-(2-аминоэтил)амин полистирол
PS-Хлорацетил = хлорацетил полистирол
PS-NCO = метилизоцианат полистирол
PS-бензальдегид = бензальдегид полистирол
PS-TsNHNH2 = толуолсульфонилгидразон полистирол
Нижеприведенные примеры схем даны в качестве руководства читателю, и они представляют предпочтительные способы получения соединений, приведенных в качестве примера. Эти способы не являются ограничивающими, и должно быть ясно, что для получения этих соединений могут быть использованы другие способы. К таким способам, в частности, относят твердофазную химию, в том числе комбинаторную химию. У специалиста в данной области есть все необходимое оборудование для получения нужных и/или заявленных соединений способами, описанными в литературе и в описании настоящего изобретения.
Схема 1a

Как представлено на схеме 1a, амидные производные (I) получают при сочетании кислотных производных (II) с аминами (III) в присутствии агента сочетания, такого как гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, и основания. В способе A используется полимеросновный (PS) карбодиимид. Способ B использует неполимеросновный карбодиимид.
Схема 1b - альтернативный способ получения амидов
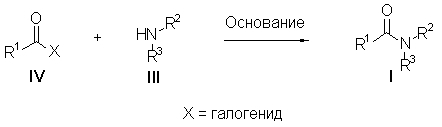
Как показано на схеме 1b, амидные производные (I) альтернативно получают путем сочетания галоидангидридов, сложных эфиров или ангидридов (IV) с аминами (III) в присутствии основания.
Схема 1c - Синтез амидов посредством комбинаторных рядов
Следующий способ использовался и может быть использован для синтеза амидов в комбинаторном ряду.
Использование ацетонитрила в качестве системного растворителя.
Взвешивание аминов в 8 мл сосудах.
Используя Tecan, растворение аминов до 100 мкМ в DCM/CH3CN (1:2, из воронки).
Взвешивание кислоты в 8 мл сосудах.
Используя Tecan, растворение кислот до 110 мкМ в DCM/CH3CN (1:2, из воронки).
Предварительная загрузка в 1,2 мл Greiner ячейки 30 мг PS-карбодиимидного полимера, используя Peli 1400 Case Titer планшет II. Использование ацетонитрила в качестве системного растворителя синтеза.
Добавление 200 мл (20 ммоль, 1 экв.) амина в каждую ячейку планшета для синтеза.
Добавление 200 мл (22 ммоль, 1,1 экв.) кислоты в каждую ячейку планшета для синтеза.
Добавление 110 мл (22 ммоль, 1,1 экв.) HOBt (0,20М в ДМФА) в каждую ячейку планшета для синтеза с помощью 8-канальной пипетки.
Герметичное закрывание планшета матовой крышкой и встряхивание (нормальная скорость) при комнатной температуре в течение ночи.
Загрузка в 20 мг/ячейка PS-трисамин смолы в планшет для синтеза, используя устройство для загрузки титровальных планшетов thin-I. Установка количества полимера исходя из его загрузки.
Добавление в планшет 200 мл DCM/CH3CN.
Герметичное закрывание фольгой планшета и встряхивание (высокая скорость) при комнатной температуре в течение ночи.
Использование метанола в качестве системного растворителя для перемещения в планшет для хранения.
Перемещение 150 мл в планшет для хранения, затем промывка 2 раза 150 мл метанола (медленное встряхивание в течение 5 минут.). Из Top перемещение в каждую ячейку (верхушка иглы -2)
Сушка планшета в Genevac.
Подготовка аналитических плашек (2,5 мкМ теоретический) и их исследование.
Подготовка планшетов для разведений на основе аналитических результатов.
Схема 1c. Получение оксаламидов

В качестве общего способа первичный амин подвергали взаимодействию с этилоксалилхлоридом в присутствии третичного амина в органическом растворителе, таком как диоксан, ацетонитрил, тетрагидрофуран, тетрагидропиран и диметилформамид, при комнатной температуре в течение 0,5-2 часов. Затем добавляли второй амин и суспензию нагревали при 80°C, используя масляную баню в течение ночи, или при 160°C в микроволновой печи в течение 5 минут. Реакционная смесь может быть подвергнута препаративной ВЭЖХ или обработке водой и обычно неочищенный продукт может быть легко очищен перекристаллизацией, колоночной флэш-хроматографией или другими хорошо известными специалистам в данной области методами с получением чистого оксаламида. Указанные ниже выходы продукта не были оптимизированы.
Схема 1d. Получение мочевины

Схема 2

X1, X2 и X3, каждый, независимо, представляют собой алкил или алкокси
Схема 2 описывает способ получения производных пиразина (VIII). Например, взаимодействие замещенных или незамещенных 2,3-диаминопропионовых кислот (V) с 2,3-дионами (VI) при нагревании в присутствии основания давало, после подкисления, замещенную пиразин-2-карбоновую кислоту (VII). Кислоту конденсировали с различными аминами (III) с получением желаемого амида (XIII), используя показанные на схеме 1а условия.
Схема 3

X4 представляет собой алкил, галогенид, алкокси или тиоалкил
Схема 3 описывает способ получения производных бензофурана (XII). Например, взаимодействие 2-гидроксибензальдегидов (IX) с диэтиловым эфиром 2-броммалоновой кислоты (X) при нагревании в присутствии основания давало замещенную бензофуран-2-карбоновую кислоту (XI). Кислоту конденсировали с различными аминами (III) с получением желаемого амида (XII), используя условия, показанные на схеме 1a.
Схема 4

X5 представляет собой Н, алкил, арил, арилалкил, гетероарилалкил
X6 представляет собой алкил, алкоксиалкил, арилалкил, гетероарилалкил
X представляет собой галоген
Схема 4 описывает способы получения алкоксиалкиламида (XX). В способе фталевый ангидрид (XIII) нагревали с аминоспиртом (XIV) с получением спирта (XV), который затем подвергали взаимодействию с алкилгалогенидом (XVI) в присутствии основания с получением алкоксисоединения (XVII). Обработка фталимида (XVII) гидразином давала желаемый амин (XVIII), который далее конденсировали с кислотой (II), как показано на схеме 1a, с получением алкоксиалкиламида (XX). Альтернативно, кислоту (II) конденсировали с аминоспиртом (XIV), применяя способ, показанный на схеме 1a, с получением спирта (XIX), который далее алкилировали с получением соединения (XX).
Схема 5

X представляет собой галоген
X7 представляет собой Н, алкил, алкоксиалкил, арил, арилалкил, гетероарилалкил
X8 и X9 независимо представляют собой Н, алкил, алкоксиалкил, арилалкил и гетероарилалкил.
На схеме 5 показаны способы получения амидоамида (XXIV). Алкилгалогенид (IV) обрабатывали аминокислотой (XXI), как показано на схеме 1b, с получением соответствующей кислоты (XXII), которую далее конденсировали с амином (XXIII), как показано на схеме 1a, с получением амидоамид производного (XXIV).
Схема 6

На схеме 6 показаны способы получения бензоксазола (XXVIII). Аминофенол (XXV) может быть конденсирован с рядом реагентов с получением бензоксазола (XXVI), содержащего широкий ряд заместителя X9, используя способ, описанный в литературе (см., например, J. Med. Chem. 28 (1985) 1255), и/или способ, описанный в примерах 39-47. Затем промежуточный продукт бензоксазола (XXVI) конденсировали с амином (V), используя способ, описанный на схеме 1a, с получением амида (XXVII). Альтернативно, амид (XXVII) получали путем первичной конденсации аминофенола (XXV) с амином (V) с получением аминофенольного промежуточного продукта (XXVIII), который далее преобразовывали в бензоксазол (XXVII), используя различные способы, описанные выше.
Измерение биологической активности соединений по настоящему изобретению
Для первоначального скрининга большого разнообразия соединений на агонистическую или антагонистическую активности в отношении рецепторов острого вкуса T1R1/T1R3 или рецепторов сладкого вкуса T1R2/T1R3, которые были экспрессированы в соответствующих клеточных линиях, использовали клеточные способы и анализы, описанные в WO 02/064631 и WO 03/001876, а также в патентной публикации США 2003-0232407 A1. После получения первоначальных «хит» амидных соединения в таких клеточных линиях, аналогичные анализы и клеточные способы и/или анализы рецепторов использовали в качестве аналитических средств для измерения способности соединений формулы (I) усиливать острый вкус MSG или сладкий вкус известных подсластителей, таких как сахароза, фруктоза, и использовали для получения эмпирических данных в качестве ориентира в циклическом процессе синтеза и тестирования структурных вариантов амидных соединений, в сочетании с чередующимся вкусовым тестированием человеком представляющих наибольший интерес соединений, и, таким образом, разрабатывали, тестировали и идентифицировали группы и представителей соединений с повышенными и оптимальными уровнями желаемой биологической активности.
Большое количество вариантов осуществления изобретения относится к идентификации специфических соединений и классов амидных соединений формулы (I), которые модулируют (усиливают или понижают) активность рецепторов острого вкуса T1R1/T1R3 (предпочтительно, hT1R1/hT1R3) («умами» рецептора), самостоятельно или в сочетании с другим соединением, которое активирует hT1R1/hT1R3, например, MSG. В частности, в некоторых вариантах осуществления изобретение относится к амидам формулы (I), которые модулируют активность hT1R1/hT1R3 (рецептор «умами» человека) in vitro и/или in vivo. В еще одном аспекте изобретение относится к соединениям, которые модулируют восприятие острого вкуса («умами») человеком, самостоятельно или в сочетании с еще одним соединением или ароматизатором, при добавлении к пищевому или лекарственному продукту или композиции.
Большое количество вариантов осуществления изобретений относится к идентификации классов и/или представителей амидных соединений формулы (I), которые модулируют (усиливают или понижают) активность рецепторов сладкого вкуса T1R2/T1R3 (предпочтительно, hT1R2/hT1R3) самостоятельно или в сочетании с другим соединением, которое активирует hT1R2/hT1R3, или в сочетании с соединением, которое активирует вкус сладкого другим образом, например сахаром, глюкозой, фруктозой и тому подобное. В частности, изобретение относится к амидам формулы (I), которые модулируют активность hT1R2/hT1R3 (рецептор сладкого вкуса человека) in vitro и/или in vivo. В еще одном аспекте изобретение относится к соединениям, которые модулируют восприятие сладкого вкуса человеком, самостоятельно или в сочетании с еще одним соединением или ароматизирующей композицией, при добавлении к пищевому или лекарственному продукту или композиции.
В некоторых вариантах осуществления изобретения было неожиданно обнаружено, что по меньшей мере некоторые амидные соединения формулы (I) могут модулировать вкусовое восприятие «умами» и сладкого вкуса человеком, самостоятельно или в сочетании с еще одним соединением или ароматизирующей композицией, при добавлении к пищевому или лекарственному продукту или композиции.
In vitro анализ активации рецептора «умами» вкуса hT1R1/hT1R3
Для идентификации новых ароматизирующих веществ острого вкуса и усилителей вкуса, включая соединения с агонистической и усиливающей активностью острого вкуса (двойная активность), соединения формулы (I) скринировали в первичном анализе и вторичном анализе, включая анализ соединения «доза-ответ» и анализ усиления. В первичном анализе на возможную способность модулировать «умами» вкус идентифицировали амидные соединения формулы (I), которые могут быть либо ароматизаторами острого вкуса сами по себе, либо усилителями вкуса MSG, и их активность оценивали как процент максимального усиления MSG (%). В анализе «доза соединения-ответ» EC50 рассчитывали как отражение эффективности соединения как агониста или усилителя острого вкуса.
Для идентификации соединений со свойствами острого вкуса использовали производные линии клеток HEK-293 (см., например, Chandrashekar et al., Cell (2000) 100:703-711), которые стабильно экспрессируют Gα15 и hT1R1/hT1R3 под индуцибельным промотором (см. WO 03/001876 A2).
Соединения, представленные в данном описании, сначала были отобраны на основании их активности в клеточной линии hT1R1/hT1R3-HEK293-Gα15. Активность определяли, используя автоматический флуорометический анализ визуализации на аппарате FLIPR (счетчик флуорометрической интенсивности в планшетах, Molecular Devices, Sunnyvale, CA) (обозначен как анализ FLIPR). Клетки одного клона (клон обозначен как I-17) собирали в 384-луночные планшеты (приблизительно 48000 клеток на ячейку) в среде Игла, модифицированной по способу Дульбекко (DMEM), с добавлением GlutaMAX (Invitrogen, Carlsbad, CA), 10% диализированной эмбриональной сыворотки теленка (Invitrogen, Carlsbad, CA), 100 Ед/мл пенициллина G, 100 мкг/мл стрептомицина (Invitrogen, Carlsbad, CA) и 60 пM мифепристона (для индукции экспрессии hT1R1/hT1R3, см. WO 03/001876 A2). Клетки клона I-17 выращивали в течение 48 часов при 37°C. Затем клетки I-17 насыщали красителем кальция Fluo-3AM (Molecular Probes, Eugene, OR), 4 мкМ в забуференном фосфатом физиологическом растворе (D-PBS) (Invitrogen, Carlsbad, CA), в течение 1,5 часов при комнатной температуре. После замены на 25 мкл D-PBS, стимулирование выполняли на аппарате FLIPR и при комнатной температуре путем добавления 25 мкл D-PBS, дополнительно содержащего различные стимуляторы в концентрациях, соответствующих двойному желаемому окончательному уровню. Активность рецептора количественно определяли по максимальному усилению флуоресценции (используя 480 нм возбуждение и 535 нм испускание) после нормализации с фоновой интенсивностью флуоресценции, измеренной перед стимулированием.
Для анализа «доза-ответ», раздражитель представляли в дубликатах в 10 различных концентрациях, изменяющихся в пределах от 1,5 мкМ до 30 нм. Активности нормализовали с ответом, полученным с 60 мМ мононатрий глутамата, концентрация которого вызывала максимальный рецепторный ответ. Определяли EC50 (концентрация соединения, которая вызывает 50% активацию рецептора), используя нелинейный алгоритм регрессии, где допускали изменения падения Hill, асимптоты нижней части и асимптоты верхней части. Идентичные результаты были получены при анализе «доза-ответ», используя коммерчески доступное программное обеспечение для нелинейного анализа регрессии, такое как GraphPad PRISM (San Diego, California).
Для определения зависимости hT1R1/hT1R3 для клеточного ответа в отношении различных раздражителей, выбранные соединения подвергали аналогичному анализу на I-17 клетках, в которых не была индуцирована мифепристоном экспрессия рецептора (обозначены как неиндуцированные I-17 клетки). В анализе FLIPR было показано, что в неиндуцированных I-17 клетках не вызывается функциональный ответ в отношении мононатрий глутамата или других острых на вкус веществ. Неиндуцированные «умами» клетки подвергали воздействию соединений при 10 мкM или трехкратной максимальной стимуляции, использованной в анализе «доза-ответ». Было показано, что описываемые соединения не вызывают какого-либо функционального ответа при использовании неиндуцированных «умами» клеток в анализе FLIPR.
В некоторых аспектах настоящего изобретения значение EC50, меньше чем около 10 мМ, является показательным для соединений, которые индуцируют активность T1R1/T1R3 и являются агонистами острого вкуса. Предпочтительно, значение EC50 агониста острого вкуса составляет менее чем приблизительно 1 мМ; и, более предпочтительно, значение EC50 составляет менее чем приблизительно 20 мкM, 15 мкM, 10 мкM, 5 мкM, 3 мкM, 2 мкM, 1 мкM, 0,8 мкM или 0,5 мкM.
В экспериментах по исследованию активности усиления вкуса «умами» измеряют «соотношение EC50» эффективность амидных соединений по изобретению усиления действия ароматизатора (обычно MSG) уже в исследуемом растворе. Серию измерений «доза-ответ» проводили в растворах, содержащих только MSG, затем второй «доза-ответ» проводили с MSG в комбинации с заранее определенными количествами исследуемого соединения формулы (I) одновременно.
В этом исследовании повышение концентрации мононатрий глутамата (изменяется в пределах от 12 мM до 81 мМ) было представлено, в дубликатах, в присутствии или отсутствие исследуемого соединения с установленной концентрацией. Концентрации исследуемого типичного соединения равнялись 30 мкM, 10 мкM, 3 мкM, 1 мкM, 0,3 мкM, 0,1 мкM и 0,03 мкM. Относительную эффективность соединения формулы (I) при усилении рецептора определяли путем вычисления величины отклонения в EC50 для мононатрий глутамата. Усиление определяли как соотношение (EC50R), соответствующее EC50 мононатрий глутамата, определенного в отсутствие исследуемого соединения, разделенное на EC50 мононатрий глутамата, определенного в присутствии исследуемого соединения. Соединения, показывающие EC50R>2,0, рассматривались как усилители.
Альтернативно установлено, “соотношение EC50 ”, по сравнению с MSG, вычисляли на основании следующий формулы:
EC50 соотношение vs. MSG=EC50 (MSG)/EC50 (MSG+[Соединение]),
где “[соединение]” означает концентрацию соединения формулы (I), используемого для выявления (или повышение, или усиление действия) MSG эффекта доза-ответ.
Следует отметить, что измеренное соотношение EC50 может иногда зависеть от концентрации самого соединения. Предпочтительные усилители острого вкуса могут иметь высокое EC50 соотношение vs. MSG при низкой концентрации используемого соединения. Предпочтительно, исследования EC50 соотношения для измерения усиления вкуса «умами» проводят при концентрации соединения формулы (I), составляющей от около 10 мкM до около 0,1 мкM или, предпочтительно, при 1,0 мкM или 3,0 мкM.
Соотношение EC50 большее чем 1, показывает, что соединение модулирует (усиливает действие) hT1R1/hT1R3 активность и представляет собой усилитель острого вкуса. Более предпочтительно, соединения формулы (I), усиливающие острый вкус, имеют значения соотношения EC50, равные по меньшей мере 1,2, 1,5, 2,0, 3,0, 4,0, 5,0, 8,0 или 10,0 или даже выше.
В одном аспекте величину модуляции острого вкуса определенного соединения вычисляли на основе его воздействия на MSG активацию T1R1/T1R3 in vitro. Предположительно, аналогичные исследования могут разрабатываться, используя другие соединения, известные для активации T1R1/T1R3 рецептора.
Конкретные соединения и родовые классы соединений, показанные для модуляции hT1R1/hT1R3 на основе своих соотношений EC50, вычисленных по вышеуказанной формуле, определены в подробном описании изобретения, примерах и пунктах формулы изобретения.
Методы, используемые для тестирования человеком вкуса соединений формулы (I), придающих «умами»/острый вкус, изложены здесь ниже. Сравнимые EC50 исследования активности соединений формулы (I) для агониста рецептора сладкого вкуса и/или восприятия сладкого вкуса у человека также изложены ниже.
In Vitro исследование активации hT1R2/hT1R3 рецептора сладкого вкуса
Производную клеточной линии HEK293 (Chandrashekar, J., Mueller, K.L., Hoon, M.A., Adler, E., Feng, L., Guo, W., Zuker, C.S., Ryba, N.J.,. Cell 2000, 100, 703-711.), которая стабильно экспрессирует Gα15 и hT1R2/hT1R3 (Li, X., Staszewski, L., Xu, H., Durick, K., Zoller, M., Adler, E. Proc Natl Acad Sci USA 2002, 99, 4692-4696.) см. также World Patent # WO 03/001876 A2), использовали для определения соединения, обладающего свойствами, усиливающими сладкий вкус.
Соединения, включенные в данное описание, были изначально выбраны на основе своей активности в клеточной линии hT1R2/hT1R3-HEK293-Gα15 (Li, et al. См. выше). Активность определяли, используя автоматический флуорометический анализ визуализации на аппарате FLIPR (счетчик флуорометрической интенсивности в планшетах, Molecular Devices, Sunnyvale, CA) (обозначен как анализ FLIPR). Клетки одного семейства (определенные S-9 клетки) высевали в 384-луночные планшеты (приблизительно 50000 клеток на ячейку) в среду, содержащую DMEM с пониженным содержанием глюкозы (Invitrogen, Carlsbad, CA), 10% диализированной эмбриональной бычьей сыворотки (Invitrogen, Carlsbad, CA), 100 единиц/мл пенициллина G и 100 мкг/мл стрептомицина (Invitrogen, Carlsbad, CA) (Li, et al. см. выше) см. также World Patent #WO 03/001876 A2). Клетки S-9 выращивали в течение 24 часов при 37°C. Затем клетки S-9 обрабатывали красителем кальция Fluo-3AM (Molecular Probes, Eugene, OR), 4 мкM в забуференном фосфатом физиологическом растворе (D-PBS) (Invitrogen, Carlsbad, CA), в течение 1 часа при комнатной температуре. После замены 25 мкл D-PBS выполняли стимуляцию в аппарате FLIPR и при комнатной температуре путем добавления 25 мкл D-PBS, содержащего различные раздражители при концентрациях, соответствующих двойному желаемому конечному уровню. Рецепторную активность определяли путем установления максимального повышения флуоресценции (используя 480 нм возбуждение и 535 нм испускание) после нормализации до основной интенсивности флуоресценции, измеренной перед стимулированием.
Для анализа «доза-ответ», стимулятор был представлен в дубликатах в 10 различных концентрациях, изменяющихся в пределах от 60 нМ до 30 мкМ. Активности нормализовали с ответом, полученным с 400 мМ D-фруктозы, концентрация которой вызывала максимальный рецепторный ответ. EC50 определяли, используя нелинейный регрессивный алгоритм (используя программное обеспечение Senomyx, Inc.), где допускали изменение падения Hill, асимптоты нижней части и асимптоты верхней части. Тождественные результаты получали при анализе данных доза-ответ, используя коммерчески доступное программное обеспечение для нелинейных регрессивных анализов, такие как GraphPad PRISM (San Diego, California).
Для определения зависимости hT1R1/hT1R3 для клеточного ответа к различной стимуляции, выбранные соединения подвергали аналогичному анализу на клетках HEK293-Gα15 (не экспрессирующие рецептор сладкого вкуса у человека). Клетки HEK293-Gα15 не показывали какого-либо функционального ответа в FLIPR исследовании в отношении В-фруктозы или любого другого известного подсластителя. Аналогично, соединения, представленные в данном описании, не индуцируют какой-либо функциональный ответ при использовании HEK293-Gα15 клетки в FLIPR исследовании.
ПРИМЕРЫ
Следующие примеры даны для иллюстрации разнообразия подтвержденных примерами воплощений изобретения и не предназначены для ограничения изобретения каким-либо образом.
Для решения задач данного описания, соединения, индивидуально описанные в следующих примерах 1-174 и соответствующих таблицах A-E, могут быть указаны в сокращенном виде посредством номера примера. Например, как показано непосредственно ниже, пример 1 описывает синтез конкретного соединения (N-(гептан-4-ил)бензо[d][1,3]диоксол-5-карбоксамида) и результаты экспериментальных исследований его биологической эффективности, указанное соединение указано и может быть указано в данном описании в сокращенном виде как соединение 1. Аналогично, первое соединение, проиллюстрированное в таблице A, может быть указано в каком-либо другом месте описания как соединение A1.
Пример 1
N-(Гептан-4-ил)бензо[d][1,3]диоксол-5-карбоксамид

К раствору гептан-4-амина (8,06 мл, 54 ммоль) в триэтиламине (15,3 мл, 108 ммоль) и дихлорметане (135 мл) по каплям при 0°C добавляли раствор бензо[1,3]диоксол-5-карбонилхлорида (10 г, 54 ммоль), растворенного в дихлорметане (135 мл). Реакционную смесь перемешивали в течение 1 часа. Растворитель удаляли при пониженном давлении и остаток растворяли в EtOAc. Органический слой промывали последовательно 1н водным HCl, 1н водным NaOH, водой, насыщенным раствором соли, сушили (MgSO4) и концентрировали. Остаток вновь перекристаллизовывали из EtOAc и гексана с получением 6,9 г N-(гептан-4-ил)бензо[d][1,3]диоксол-5-карбоксамида (48,3%) в виде белого твердого вещества.1H ЯМР (500 МГц, CDCl3): δ 0,92 (т, 6H), 1,38 (м, 6H), 1,53 (м, 2H), 4,11 (м, 1H), 5,63 (м, 1H), 6,01 (с, 2H), 7,98 (д, 1H), 7,27 (с, д, 2H). MS (M+H, 264).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессированного в клеточной линии HEK293, равное 0,2 мкM, и когда присутствовало в концентрации 0,03 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 6,92.
Пример 2
N-(2-Метилгептан-4-ил)бензо[d][1,3]диоксол-5-карбоксамид

Получали способом, аналогично описанному в примере 1, используя бензо[d][1,3]диоксол-5-карбонилхлорид и 2-метилгептан-4-амин (пример 2a).1H ЯМР (500 МГц, CDCl3): δ 0,93 (м, 9H); 1,38 (м, 5H); 1,53 (м, 1H); 1,66 (м, 1H); 4,21 (м, 1H); 5,61 (д, 1H); 6,01 (с, 2H); 6,82 (д, 1H); 7,26 (м, 2H). MS (278, M+H)
a. Получение 2-метилгептан-4-амина
К раствору 2-метилгептан-4-она (4,24 г, 33,07 ммоль) в метаноле (60 мл) добавляли ацетат аммония (25,50 г, 330,71 ммоль) и цианоборгидрид натрия (2,08 г, 33,07 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение около 24 часов. Растворитель удаляли при пониженном давлении, остаток разбавляли водой, преобразовывали в основание с помощью водного 15%-ного NaOH и экстрагировали эфиром. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния, фильтровали и упаривали с получением 3,3 г 2-метилгептан-4-амина (77%). MS (M+H, 130).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,22 мкM.
Пример 3
N-(2-Метилгексан-3-ил)бензо[d][1,3]диоксол-5-карбоксамид

Получали способом, аналогично описанному в примере 1, используя бензо[d][1,3]диоксол-5-карбонилхлорид и 2-метилгексан-3-амин (пример 3a).1H ЯМР (500 МГц, CDCl3): δ 0,93 (м, 9H); 1,37 (м, 3H); 1,56 (м, 1H); 1,83 (м, 1H); 4,01 (м, 1H); 5,67 (д, 1H); 6,02 (с, 2H); 6,82 (д, 1H); 7,28 (м, 2H). MS (M+H, 264).
a. 2-Метилгексан-3-амин получали, используя аналогичную методику примера 2a, исходя из 2-метилгексан-3-она. Выход: 40%.1H ЯМР (500 МГц, CDCl3): δ 0,86 (д, 3H); 0,91 (м, 6H); 1,20-1,29 (м, 2H); 1,38-1,47 (м, 2H); 1,47 (с, 2H); 1,58 (м, 1H); 2,51 (м, 1H). MS (M+H, 116).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,61 мкM.
Пример 4
N-(2,3-Диметилциклогексил)бензо[d][1,3]диоксол-5-карбоксамид

2,3-Диметилциклогексанамин (20 мкмоль) и бензо[d][1,3]диоксол-5-карбоновую кислоту (1,1 экв.), отдельно, растворяли в смеси ацетонитрил/дихлорметан (200 мкл, 2:1). В 1,2 мл 96 луночный планшет Greiner помещали PS-карбодиимидную смолу (2 экв.), затем добавляли растворы амина и кислоты. В ДМФА (100 мл) растворяли гидроксибензотриазол (1,1 экв.) и добавляли в реакционную ячейку. Реакционную смесь встряхивали в течение ночи при комнатной температуре. После завершения взаимодействия в реакционную смесь добавляли смолу PS-трисамин (1,5 экв.) и раствор встряхивали в течение ночи при комнатной температуре. В реакционную ячейку добавляли ацетонитрил (200 мл) и верхний чистый раствор переносили в новый планшет. Раствор упаривали с получением N-(2,3-диметилциклогексил)бензо[d][1,3]диоксол-5-карбоксамида. MS (M+H, 276,20).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,45 мкM, и, когда присутствовало в концентрации 1 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 8,4.
Пример 5
N-(5-Метилгексан-3-ил)бензо[d][1,3]диоксол-5-карбоксамид

Получали способом, аналогично описанному в примере 1, используя бензо[d][1,3]диоксол-5-карбонилхлорид и 5-метилгексан-3-амин (пример 5a). Выход: 48%.1H ЯМР (500 МГц, CDCl3): δ 0,94 (м, 9H); 1,37 (т, 3H); 1,45 (м, 1H); 1,64 (м, 2H); 4,13 (м, 1H); 5,61 (д, 1H); 6,01 (с, 2H); 6,82 (д, 1H); 7,27 (м, 2H). MS (M+H, 264).
a. 2-Метилгексан-3-амин получали, используя аналогичную методику примера 2а, используя в качестве исходного продукта 5-метилгексан-3-он. Выход: 54%. MS (M+H,116).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,57 мкM.
Пример 6
(R)-Метил 2-(бензо[d][1,3]диоксол-6-карбоксамидо)-4-метилпентаноат

Получали способом, аналогично описанному в примере 1, используя бензо[d][1,3]диоксол-5-карбонилхлорид и гидрохлорид метилового эфира D-лейцина. Выход: 83%.1H ЯМР (500 МГц, CDCl3): δ 0,98 (м, 6H); 1,63-1,67 (м, 1H); 1,71-1,76 (м, 2H); 3,76 (с, 3H); 4,83 (м, 1H); 6,03 (с, 2H); 6,38 (д, 1H); 6,83 (д, 1H); 7,32 (с, 1H); 7,33 (д, 1H). MS (M+H, 294). т.пл.: 89-90°C.
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,34 мкM, и, когда присутствовало в концентрации 0,1 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 4,9.
Пример 7
N-(1,2,3,4-Тетрагидронафталин-1-ил)бензо[d][1,3]диоксол-5-карбоксамид

Получали способом, аналогично описанному в примере 4, используя бензо[d][1,3]диоксол-5-карбоновую кислоту и 1,2,3,4-тетрагидронафталин-1-амин. MS (M+H, 296,6).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,71 мкM, и, когда присутствовало в концентрации 0,3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 7,8.
Пример 8
(R)-N-(1-Гидрокси-4-метилпентан-2-ил)бензо[d][1,3]диоксол-5-карбоксамид

Получали способом, аналогично описанному в примере 4, используя бензо[d][1,3]диоксол-5-карбоновую кислоту и (R)-аминолейцинол. MS (M+H, 266,1)
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 9 мкM, и, когда присутствовало в концентрации 3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 2.
Пример 9
(R)-N-(1-Метокси-4-метилпентан-2-ил)бензо[d][1,3]диоксол-5-бензо[d][1,3]диоксол-5-карбоновая кислота

Получали способом, аналогично описанному в примере 4, используя (R)-1-метокси-4-метил и пентан-2-амин (пример 9a). Выход: 55%.1H ЯМР (500 МГц, CDCl3): δ 0,95 (м, 6H); 1,43 (м, 1H); 1,55 (м, 1H); 1,65 (м, 1H); 3,36 (с, 3H); 3,46 (м, 2H); 4,33 (м, 1H); 6,01 (с, 2H); 6,13 (д, 1H); 6,82 (д, 1H); 7,28 (м, 2H). MS (M+H, 280).
a. (R)-1-Метокси-4-метилпентан-2-амин
К раствору (R)-2-(1-метокси-4-метилпентан-2-ил)изоиндолин-1,3-диона (пример 9b) (3,87 г, 14,84 ммоль) в метаноле (30 мл) добавляли гидразингидрат (0,866 мл, 17,81 ммоль) и реакционную смесь нагревали до 45°С в течение около 3 часов. Смесь подкисляли 2н HCl и перемешивали при 45°С в течение 30 минут. Раствор охлаждали до комнатной температуры, фильтровали и упаривали. Остаток обрабатывали 2н NaOH и экстрагировали эфиром, сушили над MgSO4, фильтровали и упаривали с получением 1,51 г (R)-1-метокси-4-метилпентан-2-амина. Выход 77%.1H ЯМР (500 МГц, CDCl3): δ 0,91 (м, 6H); 1,17 (м, 2H); 1,58 (с, 2H); 1,71 (м, 1H); 3,02 (м, 1H); 3,10 (м, 1H); 3,32 (м, 1H); 3,35 (с, 3H).
b. (R)-2-(1-Метокси-4-метилпентан-2-ил)изоиндолин-1,3-дион
(R)-2-(1-Гидрокси-4-метилпентан-2-ил)изоиндолин-1,3-дион (пример 9c) (5,88 г, 23,87 ммоль) растворяли в сухом ТГФ (25 мл) и гексаметилфосфорамиде (30 мл) и раствор охлаждали до 0°C. Добавляли гидрид натрия (60% в минеральном масле, 1,15 г, 28,65 ммоль), через 10 минут по каплям добавляли йодметан (7,43 мл, 119,35 ммоль), раствор медленно нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь выливали в смесь лед/вода, экстрагировали EtOAC, промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и упаривали. Остаток очищали хроматографией на силикагеле (20% EtOAC в гексане) с получением 3,92 г (R)-2-(1-метокси-4-метилпентан-2-ил)изоиндолин-1,3-диона (63%).
c. (R)-2-(1-Гидрокси-4-метилпентан-2-ил)изоиндолин-1,3-дион
Фталевый ангидрид (10,30 г, 69,55 моль) и D-лейцинол (8,15 г, 69,55 моль) перемешивали в ТГФ (100 мл), реакционную смесь нагревали при 85°C и кипятили с обратным холодильником в течение 18 часов. После охлаждения до комнатной температуры добавляли воду, раствор экстрагировали EtOAC, экстракты промывали 1н HCl, водой, водным NaHCO3, водой и насыщенным раствором соли, сушили над MgSO4, фильтровали и упаривали с получением 8,1 г (R)-2-(1-гидрокси-4-метилпентан-2-ил)изоиндолин-1,3-диона (47%).1H ЯМР (500 МГц, CDCl3): δ 0,94 (м, 6H); 1,54 (м, 2H); 1,99 (м, 1H); 3,86 (м, 1H); 4,04 (м, 1H); 4,47 (м, 1H); 7,72 (м, 2H); 7,83 (м, 2H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 3,5 мкM.
Пример 10
(R)-Метил 2-(бензо[d][1,3]диоксол-6-карбоксамидо)-3-метилбутаноат

Получали способом, аналогично описанному в примере 4, используя бензо[d][1,3]диоксол-5-карбоновую кислоту и (R)-метил 2-амино-3-метилбутаноат. Выход: 50%. MS (M+H; 280,1).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,16 мкM.
Пример 11
Дигидрофосфат 2-(бензо[d][1,3]диоксол-6-карбоксамидо)-4-метилпентила

N-(1-Гидрокси-4-метилпентан-2-ил)бензо[d][1,3]диоксол-5-карбоксамид (пример 11a) (0,57 ммоль, 151 мг) растворяли в безводном ацетонитриле (2 мл), добавляли 1 мл 0,45М раствора тетразола в ацетонитриле в атмосфере азота и перемешивали в течение 5 минут. Затем в атмосфере азота по каплям добавляли 0,627 (1,1 экв., 207 мкл) дибензилдиизопропилфосфорамидит. Смесь перемешивали в течение 1 часа. Растворитель упаривали, неочищенный промежуточный продукт растворяли в DCM, промывали дважды 2% карбонатом калия и насыщенным раствором соли и сушили сульфатом натрия. Продукт сушили и окисляли с помощью 5 мл трет-бутилгидропероксида (4М раствор в нонане) в течение 30 минут. Растворитель упаривали и промежуточный дибензиловый сложный эфир очищали (препаративная ТСХ). Бензильные группы гидролизоровали, используя трифторуксусную кислоту (3 мл смесь 95% ТФУ и 5% воды, 1,5 часа, комнатная температура). Готовый продукт сушили с получением 69 мг (35%) чистого вещества.1H ЯМР (500 МГц, CDCl3): δ 0,88-0,90 (т, 6H), 1,23-1,27 (м, 2H), 1,36-1,37 (м, 1H), 1,53-1,62 (м, 2H), 3,93 (с, 1H), 3,98 (с, 1H), 4,32 (с, 1H), 5,90 (с, 2H), 6,66-6,67 (д, 1H), 6,98-6,99 (ушир., 2H), 7,14 (с, 2H);31P: δ 0,51 (с). MS (M+H, 346,0).
a. N-(1-Гидрокси-4-метилпентан-2-ил)бензо[d][1,3]диоксол-5-карбоксамид получали, используя аналогичную методику примера 4, из пиперониловой кислоты и 2-амино-4-метилпентан-1-ола.
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 10,9 мкM.
Пример 12
N-(Гексан-3-ил)-4-метокси-3-метилбензамид

Получали способом, аналогично описанному в примере 4, используя 4-метокси-3-метилбензойную кислоту и гексан-3-амин (пример 28a).1H ЯМР (500 МГц, CDCl3): δ 0,94 (м, 6H); 1,41 (м, 4H); 1,46 (м, 1H); 1,64 (м, 1H); 2,24 (с, 3H); 3,87 (с, 3H); 4,08 (м, 1H); 5,69 (д, 1H); 6,83 (д, 1H); 7,54 (с, 1H); 7,62 (д, 1H). MS (M+H, 250).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,12 мкM.
Пример 13
(R)-N-(1-(Диметиламино)-4-метил-1-оксопентан-2-ил)бензо[d][1,3]диоксол-5-карбоксамид

(R)-2-(Бензо[d][1,3]диоксол-6-карбоксамидо)-4-метилпентановую кислоту (пример 13a) (52 мг, 0,19 ммоль) в ДМФА (4 мл) и диметиламин (2M в метаноле, 36 мкл, 2 экв.) конденсировали в присутствии HOBt (26 мг, 1 экв.) и гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (44 мг, 1,2 экв.) при комнатной температуре в течение ночи. Реакционную смесь упаривали, остаток растворяли в этилацетате и промывали последовательно насыщенным NaHCO3 и водой, сушили над MgSO4, фильтровали и упаривали с получением 48,6 мг продукта (84%). Продукт дополнительно очищали, используя ОФ-ВЭЖХ.1H ЯМР (500 МГц, CDCl3): δ 0,93-0,94 (д, 3H), 1,03-1,05 (д, 3H), 1,48-1,52 (м, 1H), 1,59-1,63 (м, 1H), 2,98 (с, 3H), 3,14 (с, 3H), 5,17-5,21 (м, 1H), 6,01 (с, 2H), 6,80-6,82 (д, 1H), 6,89-6,91(д, 1H), 7,29-3,30 (д, 1H), 7,33-7,35 (дд, 1H). MS (M+H; 307,2).
a. R)-2-(Бензо[d][1,3]диоксол-6-карбоксамидо)-4-метилпентановая кислота
Получали способом, аналогично описанному в примере 1, используя бензо[d][1,3]диоксол-5-карбонилхлорид и D-лейцин. Выход: 55%. MS (M+H, 280,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,06 мкM.
Пример 14
2-(Бензо[d][1,3]диоксол-6-карбоксамидо)пентилацетат

К раствору N-(1-гидроксипентан-2-ил)бензо[d][1,3]диоксол-5-карбоксамида (пример 14a) (59,8 мг, 0,238 ммоль) в дихлорметане (5 мл) добавляли триэтиламин (166 мл, 1,19 ммоль). Медленно добавляли ацетилангидрид (112,5 мл, 1,19 ммоль) и смесь перемешивали в атмосфере аргона при комнатной температуре в течение ночи. Раствор промывали последовательно насыщенным раствором бикарбоната натрия, водой и насыщенным раствором соли. Органический слой сушили над безводным сульфатом натрия. Фильтровали, затем растворитель удаляли при пониженном давлении с получением 50,8 мг 2-(бензо[d][1,3]диоксол-6-карбоксамидо)пентилацетата (73%).1H ЯМР (CDCl3): δ 0,95 (т, 3H, J=7,2 Гц), 1,43 (м, 2H), 1,57 (м, 2H), 2,1 (с, 3H), 4,11 (дд, 1H, J=3,5 Гц, J=11,5 Гц), 4,27 (дд, 1H, J=3,5 Гц, J=11,4 Гц), 4,29 (м, 1H), 6,02 (с, 2H), 6,1 (м, 1H), 6,82 (д, 1H, J=8,4 Гц), 7,27 (м, 2H). MS (M+H, 294).
a. N-(1-Гидроксипентан-2-ил)бензо[d][1,3]диоксол-5-карбоксамид получали способом, аналогично описанному в примере 4, используя бензо[d][1,3]диоксол-5-карбоновую кислоту и 2-аминопентан-1-ол. Выход: 76%. MS (M+H, 252).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 11,9 мкM, и, когда присутствовало в концентрации 3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 4,1.
Пример 15
(R)-N-(4-Метил-1-оксо-1-(2-(пиридин-3-ил)этиламино)пентан-2-ил)бензо[d][1,3]диоксол-5-карбоксамид
Получали способом, аналогично описанному в примере 13, используя 2-(3-пиридил)этиламин и (R)-2-(бензо[d][1,3]диоксол-6-карбоксамидо)-4-метилпентановую кислоту (пример 13a). (MS M+, 384,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,7 мкM.
Пример 16
N-((R)-1-(2-(Гидроксиметил)пирролидин-1-ил)-4-метил-1-оксопентан-2-ил)бензо[d][1,3]диоксол-5-карбоксамид

Получали способом, аналогично описанному в примере 13, используя R/S пропинол и (R)-2-(бензо[d][1,3]диоксол-6-карбоксамидо)-4-метилпентановую кислоту (пример 13a). (MS M+, 363,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 3 мкM.
Пример 17
N-(Гептан-4-ил)-6-метилбензо[d][1,3]диоксол-5-карбоксамид

Получали способом, аналогично описанному в примере 4, используя 6-метилбензо[d][1,3]диоксол-5-карбоновую кислоту и гептан-4-амин. MS (M+H, 278,67).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,11 мкM.
Пример 18
N-(Гептан-4-ил)-2-метилбензо[d][1,3]диоксол-5-карбоксамид

N-(Гептан-4-ил)-3,4-дигидроксибензамид (пример 18a) (0,5 ммоль) растворяли в толуоле (1,6 мл). К реакционной смеси добавляли моногидрат п-толуолсульфоновой кислоты (0,3 экв.), затем добавляли ацетальдегид (2 экв.). Взаимодействие осуществляли, используя микроволновую печь (180°C, 300 Вт) и нагревая в течение 10 минут. Растворитель упаривали. Остаток растворяли в метаноле (1 мл) и очищали ВЭЖХ. Выход 20%, MS (M+H 278,10).
a. N-(Гептан-4-ил)-3,4-дигидроксибензамид получали способом, аналогично описанному в примере 4, используя 3,4-дигидроксибензойную кислоту и гептан-4-амин. Выход: 25%. MS (M+H, 252,1).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,1 мкM, и, когда присутствовало в концентрации 0,03 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 3,68.
Пример 19
Этил 2-(5-(гептан-4-илкарбамоил)бензо[d][1,3]диоксол-2-ил)ацетат

N-(Гептан-4-ил)-3,4-дигидроксибензамид (пример 18a) (0,29 ммоль, 75 мг) растворяли в сухом ацетоне с 6 экв. избыточным количеством (242 мг) карбоната калия, затем добавляли 1,2 экв. избыточного количества (36 мкл) этилового эфира пропиновой кислоты, и смесь кипятили с обратным холодильником в течение 24 часов. Растворитель упаривали, твердый продукт растворяли в дихлорметане и экстрагировали 10% NaHCO3 и водой. Неочищенный продукт очищали хроматографией на силикагеле с получением 72 мг желаемого продукта (71%).1H ЯМР (500 МГц, CDCl3): δ 0,91-0,94 (т, 6H), 1,23-1,30 (м, 4H), 1,37-1,41 (4H), 2,97-2,98 (д, 2H), 3,70-3,74 (дд, 2H), 4,12-4,17 (м, 1H), 4,2-4,24 (м, 3H), 5,61-5,64 (д, 1H), 6,58-6,60 (т, 1H), 6,79-6,81 (д, 1H), 7,23 (с, 1H), 7,60-7,85 (ушир., 1H). MS (M+H, 350,1).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 14 мкM, и, когда присутствовало в концентрации 3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 2,5.
Пример 20
N-(Гептан-4-ил)-2,2-диметилбензо[d][1,3]диоксол-5-карбоксамид

Получали способом, аналогично описанному в примере 4, используя 2,2-диметилбензо[d][1,3]диоксол-5-карбоксилат натрия и 4-гептиламин (пример 20a). Выход 30%.1H ЯМР: δ 0,92 (т, 6H, J=7,2 Гц), 1,42 (м, 6H), 1,53 (м, 2H), 1,68 (с, 6H), 4,12 (м, 1H), 5,61(д, 1H, J=8,9 Гц), 6,72 (д, 1H, J=8 Гц), 7,16 (д, 1H, J=1,5 Гц), 7,22 (дд, 1H, J=1,5 Гц, J=17 Гц). MS (M+H, 292).
a. 2,2-Диметилбензо[d][1,3]диоксол-5-карбоксилат натрия и 4-гептиламин
Этил 2,2-диметилбензо[d][1,3]диоксол-5-карбоксилат (пример 20b) (461 мг, 2,08 ммоль) перемешивали в диоксане (16 мл) и 1,0н водном NaOH (4,16 мл) в течение 20 часов при комнатной температуре. Растворитель удаляли при пониженном давлении с получением желаемого продукта (449 мг). (M-H, 193).
b. Этил 2,2-диметилбензо[d][1,3]диоксол-5-карбоксилат
Этил 3,4-дигидроксибензоат (910,9 мг, 5 ммоль) объединяли с 2,2-диметоксипропаном (1,23 мл, 10 ммоль) и каталитическим количеством п-толуолсульфоновой кислоты в толуоле. Смесь кипятили с обратным холодильником, используя насадку Дина-Старка в течение 20 часов. Затем растворитель удаляли при пониженном давлении, неочищенный продукт растворяли в этилацетате и промывали последовательно насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором соли. Органический слой сушили над безводным сульфатом натрия. Очистка хроматографией на силикагеле, используя градиент гексан:этилацетат, 90:10-75:25, давала белый порошок (539,1 мг, 49%).1H ЯМР (CDCl3): δ 1,36 (т, 3H, J=7,2 Гц), 1,69 (с, 6H), 4,32 (кв, 2H, J=7,1 Гц, J=14,2 Гц), 6,74 (д, 1H, д, J=8,2 Гц), 7,38 (д, 1H, J=1,7 Гц), 7,61 (дд, 1H, J=1,8 Гц, J=8,3 Гц).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 2,7 мкM.
Пример 21
N-(Гептан-4-ил)-2-изопропилбензо[d][1,3]диоксол-5-карбоксамид

Получали способом, аналогично описанному в примере 4, используя 2-изопропилбензо[d][1,3]диоксол-5-карбоновой кислоты (пример 21a) и 4-гептиламин. Выход: 34%.1H ЯМР (CDCl3): δ 0,92 (т, 6H, J=7,2 Гц), 1,04 (д, 6H, J=6,9 Гц), 1,40 (м, 6H), 1,43 (м, 2H), 2,15 (м, 1H), 4,11 (м, 1H), 5,62 (д, 1H, J=8,9 Гц), 5,96 (д, 1H, J=4,4 Гц), 6,75 (д, 1H, J=8,0 Гц), 7,19 (д, 1H, J=1,8 Гц), 7,22 (д, 1H, J=1,9 Гц), 7,23 (д, 1H, J=1,6 Гц). MS (M+H, 291).
a. 2-Изопропилбензо[d][1,3]диоксол-5-карбоновая кислота
3,4-Дигидробензойную кислоту (154,12 мг, 1 ммоль) и изобутиральдегид (182 мкл, 2 ммоль) объединяли в толуоле (3 мл) и добавляли каталитическое количество п-толуолсульфоновой кислоты. Смесь обрабатывали в микроволновой печи в течение 10 минут при 180°C с показателем мощности 275. Раствор фильтровали и упаривали с получением 100 мг желаемого продукта (48%). MS (M-H, 207).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 11,5 мкM, и, когда присутствовало в концентрации 3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 2,2.
Пример 22
2,2-Дифтор-N-(гептан-4-ил)бензо[d][1,3]диоксол-5-карбоксамид

Получали способом, аналогично описанному в примере 4, используя 2,2-дифторбензо[d][1,3]диоксол-5-карбоновую кислоту и 4-гептиламин. (M+H, 300,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,51 мкM, и, когда присутствовало в концентрации 1 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 2,87.
Пример 23
(1-Пропилбутил)амид 2,3-дигидробензо[1,4]диоксин-6-карбоновой кислоты

Получали способом, аналогично описанному в примере 4, используя 2,3-дигидробензо[1,4]диоксин-6-карбоновую кислоту и гептан-4-амин. MS (M+H, 278,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,49 мкM.
Пример 24
N-(гептан-4-ил)-3,4-дигидро-2H-бензо[b][1,4]диоксепин-7-карбоксамид

Получали способом, аналогично описанному в примере 4, используя 2,3-дигидробензо[1,4]диоксин-6-карбоновую кислоту и гептан-4-амин. MS (M+H, 292,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 6,4 мкM.
Пример 25
(1-Пропилбутил)амид бензофуран-2-карбоновой кислоты

Получали способом, аналогично описанному в примере 1, используя бензофуран-2-карбонилхлорид и гептан-4-амин. Выход: 73%.1H ЯМР (500 МГц, CDCl3): δ 0,93 (т, 6H, J=7,2 Гц), 1,41 (м, 8H), 3,01 (с, 3H), 4,18 (м, 1H), 6,29 (д, 1H, J=9,94 Гц), 7,20 (д, 1H, J=8,62 Гц), 7,37 (м, 2H), 7,44 (с, 1H). MS (M+H, 260).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,88 мкM, и, когда присутствовало в концентрации 0,03 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 2,6.
Пример 26
N-(Гептан-4-ил)-5-метилбензофуран-2-карбоксамид

Получали способом, аналогично описанному в примере 4, используя 5-метилбензофуран-2-карбоновую кислоту (пример 26a) и гептан-4-амин. Выход: 46%.1H ЯМР (500 МГц, CDCl3): δ 0,94 (т, 6H, J=7,2 Гц), 1,41 (м, 10H), 2,44 (с, 1H), 4,18 (м, 1H), 6,29 (д, 1H, J=8,6 Гц), 7,21 (д, 1H, J=8,4 Гц), 7,37(м, 2H), 7,44 (с, 1H). MS (M+H, 274).
a. 5-Метилбензофуран-2-карбоновая кислота
2-Гидрокси-5-метилбензальдегид (544,2 мг, 4 ммоль) объединяли с диэтилброммалонатом (1 мл, 6 ммоль) и карбонатом калия (1,1 г, 8 ммоль) в метилэтилкетоне (5 мл) и смесь кипятили с обратным холодильником в течение ночи. Растворитель упаривали на роторном испарителе с получением неочищенного масла. Затем масло помещали в 10%-ный раствор гидроксида калия в этаноле (10 мл) и кипятили с обратным холодильником в течение 45 минут. Растворитель удаляли при пониженном давлении и затем остаток обрабатывали 2,0н раствором H2SO4. Затем свободную кислоту экстрагировали большим количеством этилацетата. Органический слой сушили над безводным сульфатом натрия. Этилацетат удаляли с получением 566 мг 5-метил-2-карбоксибензофурана (80%) в виде желтоватого порошка.1H ЯМР (500 МГц, CD3OD): δ 2,44 (с, 3H), 7,30 (д, 1H, J=8,7 Гц), 7,45 (д, 1H, J=8,5 Гц), 7,51 (д, 2H, J=7,5 Гц).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,94 мкM.
Пример 27
(R)-Метил 4-метил-2-(5-метилбензофуран-2-карбоксамидо)пентаноат

Получали способом, аналогично описанному в примере 4, используя 5-метилбензофуран-2-карбоновую кислоту (пример 26a) и метиловый эфир D-лейцина.1H ЯМР (500 МГц, CDCl3): δ 0,98 (д, 3H, J=6,26 Гц), 1,00 (д, 3H, J=6,17 Гц), 1,56 (с, 3H), 1,76 (м, 3H), 2,48 (с, 3H), 3,78 (с, 3H), 4,86 (м, 1H), 6,95 (м, 1H), 7,23 (дд, 1H, J=8,54 Гц, J=1,55 Гц), 7,40 (м, 2H). 7,44 (дд, 1H, J=1,72, J=0,9 Гц). MS 304 (M+H, 304).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,11 мкM.
Пример 28
N-(Гексан-3-ил)-5-метилбензофуран-2-карбоксамид

Получали способом, аналогично описанному в примере 4, используя 5-метилбензофуран-2-карбоновую кислоту (пример 26a) и гексан-3-амин (пример 28a). Выход: 49%.1H ЯМР (500 МГц, CDCl3): δ 0,94 (м, 6H), 1,40-1,68 (м, 6H), 2,36 (с, 3H), 4,07 (м, 1H), 5,74 (д, 1H, J=8,97 Гц), 7,16 (д, 1H, J=7,80 Гц), 7,31 (дд, 1H, J=1,73 Гц, J=1,73 Гц), 7,66 (д, 1H, J=1,72 Гц). MS (M+H, 260).
a. Гексан-3-амин получали, используя аналогичную методику примера 2a, используя в качестве исходного продукта гексан-3-он. Выход: 58%.1H ЯМР (500 МГц, CDCl3): δ 0,94 (м, 6H); 1,36-1,58 (м, 6H); 2,83 (м, 1H); 3,12 (с, 2H). MS: (102, M+H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,74 мкM.
Пример 29
N-(Гексан-3-ил)-5-метоксибензофуран-2-карбоксамид

Получали способом, аналогично описанному в примере 4, используя 5-метоксибензофуран-2-карбоновую кислоту и гексан-3-амин (пример 28a). Выход: 32%.1H ЯМР (500 МГц, CDCl3): δ 0,96 (м, 6H); 1,40-1,67 (м, 6H); 3,85 (с, 3H); 4,09 (м, 1H); 6,28 (д, 1H); 7,01 (дд, 1H); 7,08 (д, 1H); 7,38 (м, 2H). MS (276, M+H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,4 мкM.
Пример 30
(R)-Метил 3-циклогексил-2-(5-метоксибензофуран-2-карбоксамидо)пропаноат

Получали способом, аналогично описанному в примере 4, используя 5-метоксибензофуран-2-карбоновую кислоту и (R)-метил 2-амино-3-циклогексилпропаноат. Выход: 45%. MS (M+H, 260,3).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,14 мкM.
Пример 31
5-Метокси-N-(5-метилгексан-3-ил)бензофуран-2-карбоксамид
Получали способом, аналогично описанному в примере 4, используя 5-метоксибензофуран-2-карбоновую кислоту и 5-метилгексан-3-амин (пример 5a). Выход: 67%.1H ЯМР (500 МГц, CDCl3): δ 0,96 (м, 9H); 1,39-1,52 (м, 3H); 1,66 (м, 2H); 3,85 (с, 3H); 4,17 (м, 1H); 6,24 (д, 1H); 7,01 (дд, 1H); 7,08 (д, 1H); 7,38 (м, 2H). MS (290, M+H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,04 мкM.
Пример 32
Получение (R)-метил 4-хлор-2-(5-метилбензофуран-2-карбоксамидо)пентаноата

Получали способом, аналогично описанному в примере 4, используя 5-хлорбензофуран-2-карбоновую кислоту и метиловый эфир D-лейцина. MS (M+H, 324).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,82 мкM.
Пример 33
(R)-Метил 4-метил-2-(3-метилбензофуран-2-карбоксамидо)пентаноат

Получали способом, аналогично описанному в примере 4, используя 3-метилбензофуран-2-карбоновую кислоту и метиловый эфир D-лейцина. MS (M+H, 304).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,18 мкM.
Пример 34
N-(Гептан-4-ил)бензо[b]тиофен-2-карбоксамид

Получали способом, аналогично описанному в примере 4, используя бензо[b]тиофен-2-карбоновую кислоту и 4-гептиламин. MS (M+H, 276).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,21 мкM.
Пример 35
N-(Гептан-4-ил)-1H-индол-2-карбоксамид

Получали способом, аналогично описанному в примере 4, используя 1H-индол-2-карбоновую кислоту и 4-гептиламин. MS (M+H, 259).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 6,8 мкM.
Пример 36
(R)-Метил 4-метил-2-(5-метил-1H-индол-2-карбоксамидо)пентаноат

Получали способом, аналогично описанному в примере 4, используя 5-метил-1H-индол-2-карбоновую кислоту и метиловый эфир D-лейцина. Выход: 50%.1H ЯМР (500 МГц, CDCl3): δ 0,98 (д, 3H, J=6,3 Гц), 1,00 (д, 3H, J=6,1 Гц), 2,44 (с, 3H), 3,784 (с, 3H), 4,87 (м, 1H), 6,56 (д, 1H, J=8,39 Гц), 6,85 (дд, 1H, J=1,94 Гц, J=0,68 Гц), 7,12 (дд, 1H, J=8,46 Гц, J=1,55 Гц), 7,31 (д, 1H, J=8,45 Гц), 7,42 (с, 1H). MS (MH+, 303).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 6,6 мкM.
Пример 37
N-(Гептан-4-ил)-1-метил-1H-индол-2-карбоксамид

Получали способом, аналогично описанному в примере 4, используя 1-метил-1H-индол-2-карбоновую кислоту и 4-гептиламин. Выход 45%.1H ЯМР (500 МГц, CDCl3): δ 0,95 (т, 6H, J=7,2 Гц), 1,46 (м, 4H), 1,57 (м, 4H), 4,05 (с, 3H), 4,15 (м, 1H), 5,85 (д, 1H), 6,80 (с, 1H), 7,14 (т, 1H, J=7,4 Гц), 7,31 (т, 1H, J=7,5 Гц), 7,38 (д, 1H, J=8,4 Гц), 7,62 (д, 1H, J=8 Гц). MS (M+H, 273).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,79 мкM.
Пример 38
N-(Гептан-4-ил)-1H-бензо[d]имидазол-5-карбоксамид
Получали способом, аналогично описанному в примере 4, используя 1H-бензо[d]имидазол-5-карбоновую кислоту и 4-гептиламин. Выход: 80%.1H ЯМР (500 МГц, CDCl3): δ 0,94 (т, 6H, J=7,2 Гц), 1,42 (м, 6H), 1,57 (м, 2H), 4,21 (м, 1H), 6,18 (м, 1H), 7,64 (м, 2H), 8,16 (м, 1H), 8,28 (с, 1H). MS (M+H, 260).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 18,6 мкM.
Пример 39
(1-Пропилбутил)амид бензоксазол-5-карбоновой кислоты

Получали способом, аналогично описанному в примере 4, используя бензоксазол-5-карбоновую кислоту (пример 39a) и 4-гептиламин.1H ЯМР (500 МГц, CDCl3): δ 8,16 (д, J=5,4 Гц, 1H), 7,89 (д, J=8,6 Гц, 1H), 7,64 (д, J=8,6 Гц, 1H), 5,82 (д, J=8,6 Гц, 1H) 4,10-4,22 (м, 1H), 1,58-1,62 (м, 4H), 1,40-1,49 (м, 4H), 0,95 (т, J=7,2 Гц, 6H); ESI MS: 261 (M+H).
a. Бензоксазол-5-карбоновая кислота
Смесь 3-амино-4-гидроксибензойной кислоты (500 мг, 3,26 ммоль) и триметилортоформиата (5 мл) нагревали при 65oС в течение 2 часов в атмосфере аргона. Реакционную смесь охлаждали до комнатной температуры, фильтровали и промывали гексаном. Фильтрат концентрировали в вакууме с получением продукта в виде белого твердого вещества (78 мг, 15%).1H ЯМР (500 МГц, CDCl3): δ 8,57 (д, J=1,5 Гц, 1H), 8,20 (дд, J=8,4, 1,8 Гц, 1H), 8,20 (с, 1H), 7,67 (д, J=9,0 Гц, 1H). MS (M+H, 164).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,91 мкM.
Пример 40
(1-Пропилбутил)амид 2-метилбензоксазол-5-карбоновой кислоты

Получали способом, аналогично описанному в примере 4, используя в качестве исходного продукта 2-метилбензоксазол-5-карбоновую кислоту (пример 40) и 4-гептиламин.1H ЯМР (500 МГц, CDCl3): δ 8,00 (д, J=1,6 Гц, 1H), 7,77 (д, J=8,5, 1,6 Гц, 1H), 7,50 (д, J=8,5 Гц, 1H), 5,79 (д, J=8,9 Гц, 1H для NH), 4,10-4,22 (м, 1H), 2,66 (с, 3H), 1,58-1,65 (м, 4H), 1,38-1,55 (м, 4H), 0,94 (т, J=7,2 Гц, 6H); MS (APCI, M+1): 275,2.
a. 2-Метилбензоксазол-5-карбоновая кислота
Смесь 3-амино-4-гидроксибензойной кислоты (1,5 г, 9,79 ммоль) и триметилортоацетат (15 мл, большой избыток) нагревали при 65°С в течение 5 часов в атмосфере аргона. Реакционную смесь охлаждали до комнатной температуры, фильтровали, промывали гексаном. Фильтрат концентрировали в вакууме с получением продукта в виде желтого твердого вещества (1,4 г, 80%):1H ЯМР (500 МГц, CD3OD): δ 8,26 (д, J=1,7 Гц, 1H), 8,07 (дд, J=8,5, 1,6 Гц, 1H), 7,67 (д, J=8,2 Гц, 1H), 2,67 (с, 1H); MS (APCI, M+1): 178,10.
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,33 мкM.
Пример 41
(1-Пропилбутил)амид 2-этилбензоксазол-5-карбоновой кислоты

Смесь 3-амино-4-гидрокси-N-(1-пропилбутил)бензамида (пример 41a) и триметилортопропирата нагревали при 65°С в течение 5 часов в атмосфере N2. Реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме. Полученный остаток очищали на силикагеле препаративной ТСХ (3% MeOH в CH2Cl2) с получением продукта в виде белого твердого вещества (42 мг, 73%): т.пл. 107-108°C; MS (APCI, M+1): 289,10.
a. 3-Амино-4-гидрокси-N-(1-пропилбутил)бензамид получали способом, аналогично описанному в примере 4, используя 3-амино-4-гидроксибензоовую кислоту и 4-гептиламин. Выход 57%.1H ЯМР (500 МГц, CDCl3): δ 0,93 (т, 6H); 1,26-1,51 (м, 8H); 4,09 (м, 1H); 6,74 (м, 1H); 7,05 (с, 1H); 7,43 (м, 2H); 7,77 (м, 2H). MS: (251, M+H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,68 мкM.
Пример 42
(1-Пропилбутил)амид 2-метоксибензоксазол-5-карбоновой кислоты

Получали способом, аналогично описанному в примере 41, используя 3-амино-4-гидрокси-N-(1-пропилбутил)бензамид (пример 41a) и тетраметилортокарбонат. Выход: 60%. Т.пл. 137-138°C; MS (M+H, 291,10).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,69 мкM.
Пример 43
(1-Пропилбутил)амид 2-этоксибензоксазол-5-карбоновой кислоты
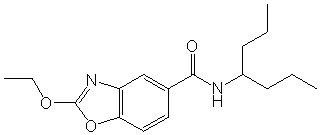
Получали способом, аналогично описанному в примере 41, используя 3-амино-4-гидрокси-N-(1-пропилбутил)бензамид (пример 41a) и тетраэтоксиметан: т.пл. 128-129°C; MS (M+H, 305,1).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 5 мкM.
Пример 44
N-(Гептан-4-ил)-2-(метилтио)бензо[d]оксазол-5-карбоксамид

К раствору N-(гептан-4-ил)-2-(меркапто)бензо[d]оксазол-5-карбоксамида (пример 44a) (50 мг, 0,17 ммоль) в ДМФА (3 мл) при 0°C добавляли K2CO3 (29 мг, 0,17 ммоль) и MeI (29 мг, 0,20). Полученную реакционную смесь нагревали при 80°C в течение ночи. Растворитель удаляли при пониженном давлении. Остаток разбавляли дихлорметаном и промывали водой, сушили (Na2SO4), фильтровали, концентрировали в вакууме, очищали препаративной ТСХ (15% EtOAc в гексане) с получением продукта в виде белого твердого вещества (50 мг, 96%): т.пл. 113-114°C;1H ЯМР (500 МГц, CDCl3): δ 7,94 (д, J=1,8 Гц, 1H), 7,73 (дд, J=8,5, 1,6 Гц, 1H), 7,46 (д, J=8,4 Гц, 1H), 5,76 (д, J=8,4 Гц, 1H), 4,15-4,25 (м, 1H), 2,77 (с, 3H), 1,58-1,65 (м, 2H), 1,38-1,55 (м, 6H), 0,94 (т, J=7,2 Гц, 6H); MS (APCI, M+): 307,2.
a. N-(Гептан-4-ил)-2-(меркапто)бензо[d]оксазол-5-карбоксамид
К раствору 3-амино-4-гидрокси-N-(1-пропилбутил)бензамида (пример 41a) (250 мг, 1,0 ммоль) в EtOH добавляли KSCSOEt (160 мг, 1,0 ммоль). Полученную реакционную смесь нагревали при 80°C в течение ночи. Растворитель удаляли при пониженном давлении. И остаток обрабатывали водой. Полученную смесь подкисляли HOAc до pH~5 и затем фильтровали. Остаток промывали водой с получением продукта в виде белого твердого вещества (160 мг, 55%). MS (M+H, 293,1).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 3,1 мкM.
Пример 45
(1-Пропилбутил)амид 2-хлорметилбензоксазол-5-карбоновой кислоты

Получали способом, аналогично описанному в примере 41, используя 3-амино-4-гидрокси-N-(1-пропилбутил)бензамид (пример 41a) и триметилхлорортоацетат. Выход: 65%. Т.пл. 108,5-109°C. MS (M+H, 309,05).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,23 мкM.
Пример 46
(1-Пропилбутил)амид 2-метилбензоксазол-6-карбоновой кислоты

Получали способом, аналогично описанному в примере 4, используя 2-метилбензоксазол-6-карбоновую кислоту (пример 46a) и 4-гептиламин. Выход 50%:1H ЯМР (500 МГц, CD3OD): δ 8,19 (д, J=1,4 Гц, 1H), 8,05 (дд, J=8,3, 1,5 Гц, 1H), 7,63 (д, J=8,2 Гц, 1H), 2,68 (с, 1H); MS (M+1, 178,10).
a. 2-Метилбензоксазол-6-карбоновую кислоту получали способом, аналогично описанному в примере 40a, исходя из 4-амино-3-гидроксибензойной кислоты (50%):1H ЯМР (500 МГц, CD3OD): δ 8,19 (д, J=1,4 Гц, 1H), 8,05 (дд, J=8,3, 1,5 Гц, 1H), 7,63 (д, J=8,2 Гц, 1H), 2,68 (с, 1H); MS (M+H, 178,10).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 2,1 мкM.
Пример 47
(1-Пропилбутил)амид 2-хлорметилбензоксазол-6-карбоновой кислоты

Получали способом, аналогично описанному в примере 41, используя 3-амино-4-гидрокси-N-(1-пропилбутил)бензамид (пример 47a) и триметилхлорортоацетат. Продукт получали в виде белого твердого вещества (45 мг, 73%): т. пл. 137,0-137,5°C; MS (M+H, 309,05).
a. 3-Амино-4-гидрокси-N-(1-пропилбутил)бензамид получали способом, аналогично описанному в примере 41a, исходя из 4-амино-3-гидроксибензойной кислоты. Выход: 50%.1H ЯМР (500 МГц, CDCl3): δ 0,91 (т, 6H); 1,41 (м, 6H); 1,54 (м, 2H); 4,13 (м, 1H); 5,81 (д, 1H); 6,63 (д, 1H), 6,95 (д, 1H); 7,82 (с, 1H). MS: (251, M+H)
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,45 мкM.
Пример 48
4-Метил-3-метилсульфанил-N-(1-пропилбутил)бензамид

Получали способом, аналогично описанному в примере 4, используя 4-метил-3-(метилтио)бензойную кислоту (пример 48a) и 4-гептиламин. Выход: 50%.1H ЯМР (500 МГц, CDCl3): δ 0,93 (т, 6H, J=7,2 Гц), 1,40-1,41 (м, 8H), 2,35 (с, 3H), 2,51 (с, 1H), 4,15 (м, 1H), 5,75 (д, 1H, J=8,5 Гц), 7,15 (д, 1H, J=7,8 Гц), 7,31 (д, 1H, J=7,8 Гц), 7,65 (д, 1H, J=1,5 Гц). MS (M+H, 280).
a. 4-Метил-3-(метилтио)бензойная кислота
3-Амино-4-метилбензойную кислоту суспендировали в ледяной воде (55 мл) и медленно добавляли концентрированную HCl (8,56 мл). К суспензии в течение 15 минут добавляли водный раствор нитрита натрия (2,4 г в 5,5 мл) и смесь перемешивали в течение еще 15 минут. Далее по каплям добавляли водный раствор ацетата натрия (9,31 г в 18 мл). Реакцию продолжали в течение 45 минут. Получали густой оранжевый осадок. Осадок отфильтровывали и промывали небольшими порциями ледяной воды. Твердый продукт объединяли с раствором ксантагената калия (11,93 г) и карбоната калия (8,22 г) в 250 мл воды. Реакционный сосуд помещали на предварительно нагретую масляную баню с температурой 70°C и смесь перемешивали в течение 25 минут. Рыжеватый раствор извлекали из бани и перемешивали в течение 15 минут или до тех пор, пока температура не достигала 30°C. Добавляли гидроксид натрия (0,782 г) и перемешивали до растворения. Добавляли диметилсульфат (5,70 мл). Смесь перемешивали в течение 1 часа при комнатной температуре, затем быстро кипятили с обратным холодильником. Растворитель удаляли при пониженном давлении с получением оранжевого твердого вещества. Твердый продукт обрабатывали 2,0н раствором H2SO4 и экстрагировали EtOAc. Экстракты промывали водой, затем сушили над безводным MgSO4. Растворитель удаляли при пониженном давлении с получением неочищенного рыжеватого твердого продукта. Твердый продукт адсорбировали на силикагеле и очищали колоночной хроматографией (градиент 5-50% этилацетат в гексане) с получением 4-метил-3-(метилтио)бензойной кислоты в виде светло-желтого порошка (2 г).1H ЯМР (500 МГц, CDCl3): δ 2,39 (с, 3H), 2,54 (с, 3H), 7,24 (д, 1H, J=7,8 Гц), 7,79 (д, 1H, J=7,8 Гц), 7,86 (д, 1H, J=1,5 Гц).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,21 мкM.
Пример 49
(R)-Метил 4-метил-2-(4-метил-3-(метилтио)бензамидо)пентаноат

Получали способом, аналогично описанному в примере 4, используя 3-метил-4-(метилтио)бензойную кислоту (пример 48a) и метиловый эфир D-лейцина. Выход: 45%.1H ЯМР (500 МГц, CDCl3): δ 0,97 (д, 3H, J=6,36 Гц), 0,99 (д, 3H, J=6,1 Гц), 1,64-1,77 (м, 2H), 2,36 (с, 3H), 2,51(с, 3H), 3,77 (с, 3H), 4,85 (м, 1H), 6,50 (д, 1H, J=8,10 Гц), 7,18 (д, 1H, J=7,83 Гц), 7,38 (дд, 1H, J=7,77 Гц, J=1,78 Гц), 7,65 (д, 1H, J=1,65 Гц). MS (M+H, 310).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,1 мкM.
Пример 50
(R)-Метил 4-метил-2-(4-(метилтио)бензамидо)пентаноат
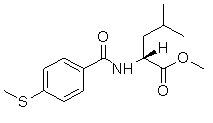
Получали способом, аналогично описанному в примере 4, используя 4-(метилтио)бензойную кислоту и метиловый эфир D-лейцина. MS (M+H, 296).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,16 мкM.
Пример 51
N-(Гептан-4-ил)-3-метил-4-(метилтио)бензамид

Получали способом, аналогично описанному в примере 4, используя 3-метил-4-(метилтио)бензойную кислоту (пример 51a) и 4-гептиламин.1H ЯМР (500 МГц, CDCl3): δ 0,93 (т, 6H); 1,37-1,46 (м, 6H); 1,54-1,56 (м, 2H); 2,35 (с, 3H); 2,49 (с, 3H); 4,17 (м, 1H); 5,73 (д, 1H); 7,14 (д, 1H); 7,52 (с, 1H); 7,58 (д, 1H). MS (280, M+H). Т.пл.: 129-131°C.
a. 3-Метил-4-(метилтио)бензойную кислоту получали, используя аналогичную методику примера 48a, используя в качестве исходного продукта 3-амино-4-метилбензойную кислоту. Выход 30%.1H ЯМР (500 МГц, CDCl3): δ 2,36 (с, 3H); 2,53 (с, 3H); 7,17 (д, 1H); 7,85 (с, 1H); 7,93 (д, 1H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,12 мкM.
Пример 52
4-Метокси-3-метил-N-(2-метилгептан-4-ил)бензамид

Получали способом, аналогично описанному в примере 4, используя 4-метокси-3-метилбензойную кислоту и 2-метил-4-гептанамин (пример 2a). Выход: 45%.1H ЯМР (500 МГц, CDCl3): δ 0,93 (м, 9H); 1,39 (м, 5H); 1,53 (м, 1H); 1,67 (м, 1H); 2,24 (с, 3H); 3,86 (с, 3H); 4,23 (м, 1H); 5,64 (д, 1H); 6,82 (д, 1H); 7,54 (с, 1H); 7,61 (д, 1H). MS (278, M+H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,1 мкM.
Пример 53
4-Метокси-3-метил-N-(5-метилгексан-3-ил)бензамид

Получали способом, аналогично описанному в примере 4, используя 4-метокси-3-метилбензойную кислоту и 5-метилгексан-3-амин (пример 5a).1H ЯМР (500 МГц, CDCl3): δ 0,94 (м, 9H); 1,38 (м, 2H); 1,47 (м, 1H); 1,65 (м, 2H); 2,24 (с, 3H); 3,86 (с, 3H); 4,16 (м, 1H); 5,65 (д, 1H); 6,83 (д, 1H); 7,54 (с, 1H); 7,61 (д, 1H). MS (264, M+H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,09 мкM.
Пример 54
4-Метокси-N-(1-(4-метоксифенил)бутил)-3-метилбензамид
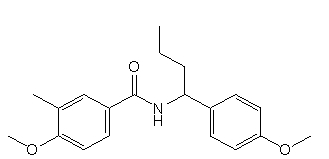
Получали способом, аналогично описанному в примере 4, используя 3-метил-4-метоксибензойную кислоту и 1-(4-метоксифенил)бутан-1-амин (пример 54a). Выход 52%.1H ЯМР (500 МГц, CDCl3): δ 0,94 (т, 3H); 1,31-1,41 (м, 2H); 1,82-1,92 (м, 2H); 2,22 (с, 3H); 3,79 (с, 3H); 3,86 (с, 3H); 5,11 (м, 1H); 6,14 (д, 1H); 6,81 (д, 1H); 6,88 (д, 2H). 7,28 (д, 2H); 7,53 (с, 1H); 7,61 (д, 1H). MS (328, M+H).
a. 1-(4-Метоксифенил)бутан-1-амин получали способом, описанным в примере 2a из 1-(4-метоксифенил)бутан-1-она. Выход 90%. MS (M+H, 180).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 3,14 мкM.
Пример 55
(R)-4-Метокси-3-метил-N-(3-метил-1-(3-метил-1,2,4-оксадиазол-5-ил)бутил)бензамид

Получали способом, аналогично описанному в примере 4, используя 4-метокси-3-метилбензойную кислоту и 3-метил-1-(3-метил[1,2,4]оксадиазол-5-ил)бутиламин (пример 55a). MS (M+H, 318).
a. (R)-3-Метил-1-(3-метил-1,2,4-оксадиазол-5-ил)бутан-1-амин
Boc-D-Leu-OH (0,23 г, 1 ммоль) обрабатывали N-гидроксиацетамидином (74 мг, 1 экв.) и DIC (155 мкл, 1 экв.) в диоксане (2 мл) при комнатной температуре в течение ночи. Добавляли еще одну порцию DIC (1 экв.) и реакционную смесь нагревали при 110°С в течение 4 часов. После удаления растворителя остаток обрабатывали 50% TFA/DCM (2 мл) в течение 1 часа и затем растворитель упаривали. Неочищенную смесь очищали препаративной ВЭЖХ (C-18 колонка, MeOH-H2O подвижная фаза и муравьиная кислота в качестве модификатора) с получением 75 мг амина (45% выход).1H ЯМР (500 МГц, CDCl3): δ 0,95 (д, 3H), 0,99 (д, 3H), 1,70-1,78 (м, 1H), 1,92-1,98 (м, 2H), 2,39 (с, 3H), 3,50 (ушир., 2H, NH2), 4,65 (т, 1H). MS (M+H, 170).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 5,4 мкM.
Пример 56
4-Этокси-N-(гептан-4-ил)-3-метилбензамид

Получали способом, аналогично описанному в примере 4, используя 4-этокси-3-метилбензойную кислоту (пример 56a) и 4-гептиламин. Выход: 75%.1H ЯМР (500 МГц, CDCl3): δ 0,93 (т, 6H); 1,37-1,45 (м, 6H); 1,53-1,59 (м, 2H); 2,24 (с, 3H); 4,07 (кв, 2H); 4,15 (м, 1H); 5,67 (д, 1H); 6,80 (д, 1H); 7,54 (с, 1H); 7,58 (д, 1H). MS (278, M+H)
a. 4-Этокси-3-метилбензойная кислота
4-Гидрокси-3-метилбензойную кислоту (10 г) растворяли в ДМФА (400 мл), затем добавляли карбонат натрия (3 экв.). Этилйодид (3 экв.) растворяли в ДМФА (50 мл), добавляли по каплям к реакционной смеси, и раствор перемешивали в течение ночи. После завершения реакции растворитель упаривали. Остаток растворяли в этилацетате и промывали водой. Органический слой отделяли и упаривали. Остаток растворяли в 200 мл смеси метанол/вода (3:1). Добавляли гидроксид лития (3 экв.) и оставляли перемешиваться в течение ночи. После завершения гидролиза растворитель удаляли и продукт перекристаллизовывали, используя смесь этилацетат/гексан, с получением 8,2 г 4-этокси-3-метилбензойной кислоты. Выход: 70%, MS (M-H, 179,20).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,17 мкM.
Пример 57
4-Этокси-N-(1-метоксипентан-2-ил)-3-метилбензамид

Получали способом, аналогично описанному в примере 4, используя 4-этокси-3-метилбензойную кислоту (пример 56a) и 1-метоксипентан-2-амин (пример 57a). Выход: 33%. MS (M+H, 280,1).
a. 1-Метоксипентан-2-амин получали способом, аналогично описанному в примере 9a, исходя из 2-(1-метоксипентан-2-ил)изоиндолин-1,3-диона (пример 57b). Выход 67%.1H ЯМР (500 МГц, CDCl3): δ 0,91 (т, 3H); 1,24 -1,45 (м, 4H); 1,52 (с, 2H); 2,94 (м, 1H); 3,12 (т, 1H); 3,33 (м, 1H); 3,35 (с, 3H).
b. 2-(1-Метоксипентан-2-ил)изоиндолин-1,3-дион получали способом, аналогично описанному в примере 9b, исходя из 2-(1-гидроксипентан-2-ил)изоиндолин-1,3-диона (пример 57c). Выход: 82%.1H ЯМР (500 МГц, CDCl3): δ 0,91 (т, 3H); 1,32 (м, 2H); 1,64 (м, 1H); 2,03 (м, 1H); 3,31 (с, 3H); 3,54 (м, 1H); 3,98 (т, 1H); 4,50 (м, 1H); 7,70 (м, 2H); 7,82 (м, 2H).
c. 2-(1-Гидроксипентан-2-ил)изоиндолин-1,3-дион получали способом, аналогично описанному в примере 9c, используя изобензофуран-1,3-дион и 2-аминопентан-1-ол. Выход 62%.1H ЯМР (500 МГц, CDCl3): δ 0,92 (т, 3H); 1,33 (м, 2H); 1,76 (м, 1H); 1,95 (м, 1H); 3,88 (м, 1H); 4,06 (м, 1H); 4,39 (м, 1H); 7,72 (м, 2H); 7,83 (м, 2H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,69 мкM.
Пример 58
4-Гидрокси-3-метил-N-(1-пропилбутил)бензамид

Получали способом, аналогично описанному в примере 4, используя 4-гидрокси-3-метилбензойную кислоту и 4-гептиламин. MS (M+H, 250,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,92 мкM.
Пример 59
N-(Гептан-4-ил)-4-(2-метоксиэтокси)-3-метилбензамид

Гидроксид калия (4 ммоль) растворяли в этаноле (5 мл) и нагревали при 80°C. К раствору добавляли 4-гидрокси-3-метил-N-(1-пропилбутил)бензамид (пример 58) (1 ммоль), затем хлорэтанол (3 ммоль). Реакционную смесь перемешивали в течение ночи при 80°C. Реакционную смесь концентрировали и растворяли в 5% лимонной кислоте. Смесь перемешивали в течение 1 часа. Водную смесь экстрагировали три раза этилацетатом. Объединенные этилацетатные слои промывали водой и сушили над сульфатом натрия. Органический слой концентрировали и очищали ВЭЖХ с выходом 39% N-(гептан-4-ил)-4-(2-метоксиэтокси)-3-метилбензамида. MS (M+H, 308,25).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,21 мкM.
Пример 60
(R)-Метил 2-(3-фтор-4-метоксибензамидо)-4-метилпентаноат

Получали способом, аналогично описанному в примере 4, используя 3-фтор-4-метоксибензойную кислоту и метиловый эфир D-лейцина. MS (M+H, 298).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,3 мкM.
Пример 61
3-Хлор-4-метокси-N-(пентан-3-ил)бензамид

Получали способом, аналогично описанному в примере 4, используя 3-пентиламин и 3-хлор-4-метоксибензойную кислоту. Выход 40%. MS (M+H, 256,20).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,56 мкM, и, когда присутствовало в концентрации 0,3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 6,28.
Пример 62
(R)-Метил 2-(3-хлор-4-метоксибензамидо)-4-метилпентаноат

Получали способом, аналогично описанному в примере 4, используя 3-хлор-4-метоксибензойную кислоту и гидрохлорид метилового эфира D-лейцина. MS (M+H, 314,10).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,08 мкM, и, когда присутствовало в концентрации 0,01 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 13,18.
Пример 63
(R)-3-Хлор-4-метокси-N-(1-фенилэтил)бензамид

Получали способом, аналогично описанному в примере 4, используя (R)-1-фенилэтанамин и 3-хлор-4-метоксибензойную кислоту. MS (M+H, 290,0).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 2,5 мкM, и, когда присутствовало в концентрации 0,3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 2,7.
Пример 64
4-Хлор-3-метил-N-(1-пропилбутил)бензамид

Получали способом, аналогично описанному в примере 4, используя 4-хлор-3-метилбензойную кислоту и гептан-4-амин. MS (M+H, 268).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,8 мкM.
Пример 65
3,4-Диметокси-N-(1-пропилбутил)бензамид
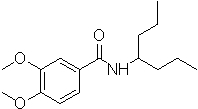
Получали способом, аналогично описанному в примере 4, используя 3,4-диметоксибензойную кислоту и гептан-4-амин. MS (M+H, 279,37).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,36 мкM.
Пример 66
(R)-Метил 2-(4-фтор-3-метилбензамидо)-4-метилпентаноат
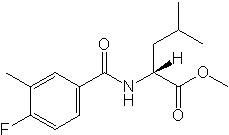
Получали способом, аналогично описанному в примере 4, используя 4-фтор-3-метилбензойную кислоту и метиловый эфир D-лейцина. MS (M+H, 282).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,32 мкM.
Пример 67
4-Метокси-3,5-диметил-N-(2-метилгептан-4-ил)бензамид

Получали способом, аналогично описанному в примере 4, используя 4-метокси-3,5-диметилбензойную кислоту и 2-метилгептан-4-амин (пример 2a). MS (M+H, 292,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,85 мкM.
Пример 68
3,4-Диметил-N-(2-метилгексан-3-ил)бензамид

Получали способом, аналогично описанному в примере 4, используя 3,4-диметилбензойную кислоту и гексан-3-амин (пример 3a).1H ЯМР (500 МГц, CDCl3): δ 0,94 (м, 9H); 1,39 (м, 3H); 1,56 (м, 1H); 1,84 (м, 1H); 2,30 (с, 3H); 2,31 (с, 3H); 4,04 (м, 1H); 5,76 (д, 1H); 7,18 (д, 1H); 7,46 (д, 1H); 7,55 (с, 1H); MS (248, M+H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,11 мкM.
Пример 69
3,4-Диметил-N-(2-метилгептан-4-ил)бензамид

Получали способом, аналогично описанному в примере 4, используя 3,4-диметилбензойную кислоту и 2-метилгептан-4-амин (пример 2a).1H ЯМР (500 МГц, CDCl3): δ 0,94 (м, 9H); 1,40 (м, 5H); 1,53 (м, 1H); 1,68 (м, 1H); 2,29 (с, 3H); 2,30 (с, 3H); 4,24 (м, 1H); 5,69 (д, 1H); 7,17 (д, 1H); 7,46 (д, 1H); 7,54 (с, 1H). MS (262, M+H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,13 мкM.
Пример 70
3,4-Диметил-N-(5-метилгексан-3-ил)бензамид

Получали способом, аналогично описанному в примере 4, используя 3,4-диметилбензойную кислоту и 5-метилгексан-3-амин (пример 5a).1H ЯМР (500 МГц, CDCl3): δ 0,94 (м, 9H); 1,38 (м, 2H); 1,46 (м, 1H); 1,65 (м, 2H); 2,29 (с, 3H); 2,30 (с, 3H); 4,18 (м, 1H); 5,70 (д, 1H); 7,17 (д, 1H); 7,46 (д, 1H); 7,55 (с, 1H). MS (248, M+H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,17 мкM.
Пример 71
(R)-N-(1-Метокси-4-метилпентан-2-ил)-3,4-диметилбензамид

К раствору (R)-N-(1-гидрокси-4-метилпентан-2-ил)-3,4-диметилбензамида (1,59 г, 6,39 ммоль) (пример 71a) в сухом ДМФА (20 мл) добавляли порошкообразный NaOH (281 мг, 7 ммоль), раствор перемешивали при 0°С в течение 2 часов. В ДМФА (10 мл) по каплям в течение 1 часа добавляли йодметан (1 экв., 6,39 ммоль). Температуру поддерживали равной 0°C и смесь перемешивали в течение 1 часа. Реакцию гасили добавлением 300 мл воды. Водный слой экстрагировали дихлорметаном, сушили над MgSO4 и упаривали. Остаток очищали флэш-хроматографией на силикагеле (толуол-этилацетат; 5-20% градиент) с получением 1,23 г (R)-N-(1-метокси-4-метилпентан-2-ил)-3,4-диметилбензамида (73%).1H ЯМР (500 МГц, CDCl3): δ 0,94-0,97 (т, 6H), 1,41-1,47 (м, 1H), 1,54-1,60 (м, 1H), 1,64-1,68 (м, 1H), 2,29 (д, 6H), 3,36 (с, 3H), 3,45-3,50 (м, 2H), 4,34-4,39 (м, 1H), 6,23-6,25 (д, 1H), 7,16-7,17 (д, 1H), 7,47-7,49 (дд, 1H), 7,56 (с, 1H). MS (M+H, 264,3)
a. (R)-N-(1-Гидрокси-4-метилпентан-2-ил)-3,4-диметилбензамид получали способом, аналогично описанному в примере 4, используя 3,4-диметилбензойную кислоту и (R)-аминолейцинол. Выход: 75%. MS (M+H, 250,3).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,2 мкM.
Пример 72
(R)-N-(1-(Метоксиметокси)-4-метилпентан-2-ил)-3,4-диметилбензамид

К раствору (R)-N-(1-гидрокси-4-метилпентан-2-ил)-3,4-диметилбензамида (пример 71a) (0,24 ммоль), растворенного в сухом ДМФА (2 мл), добавляли при 0°C порошкообразный NaOH (0,36 ммоль, 14,5 мг, 1,5 экв.) и смесь перемешивали в течение 1 часа при 0°C. Затем добавляли хлорметоксиметан (19,3 мкл, 1 экв.) и реакционную смесь перемешивали при 0°С в течение 1 часа. Реакцию гасили водой (30 мл) и смесь экстрагировали дихлорметаном. Органическую фазу сушили над MgSO4 и упаривали. Неочищенный продукт очищали препаративной ТСХ (20% этилацетат/гексан) с получением 37,7 мг (R)-N-(1-(метоксиметокси)-4-метилпентан-2-ил)-3,4-диметилбензамида (53%).1H ЯМР (500 МГц, CDCl3): δ 0,98-1,00 (т, 6H), 1,49-1,53 (м, 1H), 1,58-1,64 (м, 1H), 1,69-1,73 (м, 2H), 2,32-2,33 (д, 6H), 3,38-3,39 (т, 3H), 3,64-3,72 (ддд, 2H), 4,41-4,44 (м, 1H), 4,65-4,69 (дд, 2H), 6,37-6,39 (д, 1H), 7,19-7,21 (д, 1H), 7,50-7,52 (дд, 1H), 7,60 (ушир., 1H). MS (M+H, 294,3).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,06 мкM.
Пример 73
N-(1-Метоксиметил-2-метилпропил)-3,4-диметилбензамид

Получали способом, аналогично описанному в примере 71, используя N-(1-гидрокси-3-метилбутан-2-ил)-3,4-диметилбензамид (пример 73a) и метилйодид. Выход 87%.1H ЯМР (500 МГц, CDCl3): δ 0,97-1,00 (дт, 6H), 1,96-2,00 (м, 1H), 2,29 (с, 3H), 2,30 (с, 3H), 3,35 (с, 3H), 3,42-3,45 (дд, 1H), 3,60-3,62 (дд, 1H), 4,01-4,05 (м, 1H), 6,31-6,33 (д, 1H), 7,16-7,18 (д, 1H), 7,48-7,50 (дд, 1H), 7,56-7,57 (д, 1H). MS (M+H, 250).
a. N-(1-Гидрокси-3-метилбутан-2-ил)-3,4-диметилбензамид получали способом, аналогично описанному в примере 71a, используя 3,4-диметоксибензойную кислоту и 2-амино-3-метилбутан-1-ол. Выход 75%. MS (M+H, 236,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,87 мкM.
Пример 74
(R)-Метил 2-(2-метокси-4-(метилтио)бензамидо)-4-метилпентаноат

Получали способом, аналогично описанному в примере 4, используя 2-метокси-4-(метилтио)бензойную кислоту и метиловый эфир D-лейцина. MS (M+H, 326).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 15,8 мкM.
Пример 75
N-(2-Метилгептан-4-ил)бензо[d][1,3]диоксол-5-карбоксамид

Получали способом, аналогично описанному в примере 4, используя 3-(4-метоксифенил)акриловую кислоту и 5-метилгексан-3-амин (пример 5a). Выход: 59%.1H ЯМР (500 МГц, CDCl3): δ 0,93 (м, 9H); 1,33 (т, 2H); 1,43 (м, 1H); 1,58-1,67 (м, 2H); 3,83 (с, 3H); 4,11 (м, 1H); 5,19 (д, 1H); 6,25 (д, 1H); 6,88 (д, 2H); 7,44 (д, 2H); 7,58 (д, 1H). MS (276, M+H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,24 мкM.
Пример 76
N-(1-Этилпропил)-3-[4-(2-гидроксиэтокси)фенил]акриламид

N-(1-Этилпропил)-3-(4-гидроксифенил)акриламид (пример 76a) (0,44 ммоль, 103 мг) растворяли в абсолютном этаноле с KOH (0,7 ммоль, 37 мг). Смесь перемешивали при 80°С в течение 1 часа. Затем по каплям добавляли 2-хлорэтанол (1,76 ммоль, 118 мкл) и смесь кипятили с обратным холодильником в течение ночи. После упаривания неочищенный продукт растворяли в дихлорметане и промывали водой и 5% лимонной кислотой. Органическую фазу упаривали и остаток очищали хроматографией на силикагеле с получением 73 мг желаемого продукта (60%).1H ЯМР (500 МГц, CDCl3): δ 0,92-0,95 (т, 6H), 1,25 (с, 1H),1,40-1,46 (м, 2H), 1,59-1,64 (м, 2H), 3,93-3,94 (м, 1H), 3,95-3,98 (м, 2H), 4,09-4,11 (м, 2H), 5,28-5,30 (д, 1H), 6,26-6,29 (д, 1H), 6,88-6,90 (д, 2H), 7,43-7,45 (д, 2H), 7,56-7,59 (д, 1H). MS (M+H, 278,1).
a. N-(1-Этилпропил)-3-(4-гидроксифенил)акриламид получали способом, аналогично описанному в примере 4, исходя из 4-гидрокси-коричной кислоты и 3-пентиламина. MS (M+H, 234,10).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 5,8 мкM.
Пример 77
(E)-N-(Гептан-4-ил)-3-(тиофен-2-ил)акриламид

Получали способом, аналогично описанному в примере 4, исходя из (E)-3-(тиофен-2-ил)акриловой кислоты и 4-гептиламина. MS (M+H, 252).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,44 мкM.
Пример 78
(R,E)-Метил 4-метил-2-окт-2-енамидопентаноат

Получали способом, аналогично описанному в примере 4, исходя из (E)-окт-2-еновой кислоты и метилового эфира D-лейцина. MS (M+H, 270).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,92 мкM.
Пример 79
3-(4-Метоксифенил)-N-(3-метил-1-пропилбутил)акриламид

Получали способом, аналогично описанному в примере 4, используя 3-(4-метоксифенил)акриловую кислоту и 3-метил-1-пропилбутиламин (пример 2a). Выход: 65%.1H ЯМР (500 МГц, CDCl3): δ 0,90-0,95 (м, 9H), 1,30-1,39 (м, 5H), 1,49-1,50 (м, 1H), 1,64-1,67 (м, 1H), 3,82 (с, 3H), 4,17-4,18 (м, 1H), 5,18-5,20 (д, 1H), 6,22-6,26 (д, 1H), 6,86-6,89 (д, 2H), 7,42-7,45 (д, 2H), 7,56-7,59 (д, 1H). MS (M+H, 290,1).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,84 мкM.
Пример 80
N-(1-Метоксиметил-3-метилбутил)-3-(4-метоксифенил)акриламид

Получали способом, аналогично описанному в примере 71, исходя из 3-(4-метоксифенил)акриловой кислоты и D-лейцинола. Выход: 41%.1H ЯМР (500 МГц, CDCl3): δ 0,93-0,96 (т, 6H), 1,38-1,42 (м, 1H), 1,48-1,54 (м, 1H), 1,63-1,66 (м, 1H), 3,36 (с, 3H), 3,41-3,46 (м, 2H), 3,82-3,83 (с, 3H), 4,29-4,31 (м, 1H), 5,69-5,71 (д, 1H), 6,24-6,27 (д, 1H), 6,87-6,89 (д, 2H), 7,43 (с, 1H), 7,44 (с, 1H), 7,56-7,59 (д, 1H). MS (M+H, 292,1).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,90 мкM.
Пример 81
N-(1-Бензил-2-гидроксиэтил)-3-(4-метоксифенил)акриламид

Получали способом, аналогично описанному в примере 4, исходя из 3-(4-метоксифенил)акриловой кислоты и D-фенилаланинола. MS (M+H, 312,3).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,1 мкM.
Пример 82
3-(4-Этоксифенил)-N-(1-этилпропил)акриламид

Получали способом, аналогично описанному в примере 4, используя 3-(4-этоксифенил)акриловую кислоту и 3-пентиламин. MS (M+H, 262,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,35 мкM.
Пример 83
Метиловый эфир 4-метил-2-(3-тиофен-2-ил-акрилоиламино)пентановой кислоты
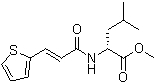
Получали способом, аналогично описанному в примере 4, исходя из 3-тиофен-2-илакриловой кислоты и метилового эфира D-лейцина. MS (M+H, 282,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,59 мкM.
Пример 84
(1,2,3,4-Тетрагидронафталин-1-ил)амид 4-метилпент-2-еновой кислоты

Получали способом, аналогично описанному в примере 4 из 4-метилпент-2-еновой кислоты и 1,2,3,4-тетрагидронафталин-1-иламина. MS (M+H, 244,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,5 мкM.
Пример 85
3-(2-Фторфенил)-N-(1-пропилбутил)акриламид

Получали способом, аналогично описанному в примере 4, исходя из 3-(2-фторфенил)акриловой кислоты и 4-гептиламина. MS (M+H, 264,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,16 мкM.
Пример 86
3-(2-Метоксифенил)-N-(1-пропилбутил)акриламид

Получали способом, аналогично описанному в примере 4, исходя из 3-(2-метоксифенил)акриловой кислоты и 4-гептиламина. MS (M+H, 276,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,90 мкM.
Пример 87
3-(3,4-Диметоксифенил)-N-(1-пропилбутил)акриламид
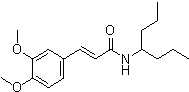
Получали способом, аналогично описанному в примере 4, исходя из 3-(3,4-диметоксифенил)акриловой кислоты и 4-гептиламина. MS (M+H, 306,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,97 мкM, и, когда присутствовало в концентрации 0,3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 2,4.
Пример 89
3-(2-Метоксифенил)-N-(2-метилциклогексил)акриламид

Получали способом, аналогично описанному в примере 4, исходя из 3-(2-метоксифенил)акриловую кислоту и 2-метилциклогексиламин. MS (M+H, 274,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 3,4 мкM
Пример 90
N-(гептан-4-ил)бензофуран-5-карбоксамид

Получали способом, аналогично описанному в примере 4, используя бензофуран-5-карбоновую кислоту и гептан-4-амин. Выход 41%. MS (M+H, 260,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,19 мкM.
Пример 91
N-(Гептан-4-ил)-5,6-диметилпиколинамид

Получали способом, аналогично описанному в примере 4, используя 5,6-диметилпиколиновую кислоту (пример 91a) и 4-гептиламин. Выход: 49%.1H ЯМР (500 МГц, CDCl3): δ 0,91-0,94 (т, 6H), 1,38-1,48 (м, 4H), 1,49-1,61 (м, 4H), 2,32 (с, 3H), 2,52 (с, 3H), 4,11-4,13 (м, 1H), 7,52-7,53 (д, 1H), 7,93-7,94 (д, 1H). MS (M+H, 249,1).
a. 5,6-Диметилпиколиновая кислота
5,6-Диметилпиколинoнитрил (пример 91b) кипятили с обратным холодильником в концентрированной HCl (15 мл) в течение ночи. Растворитель упаривали и твердый остаток упаривали несколько раз вместе с EtOH. Сушка давала 453 мг 5,6-диметилпиколиновой кислоты (80%) в виде белого твердого вещества. MS (M+H, 152,1).
b. 5,6-Диметилпиколинoнитрил:
2,3-Лютидин (13,25 ммоль) кипятили с обратным холодильником в течение ночи с 18 мл ледяной AcOH и 6 мл пероксида водорода. Растворитель упаривали, остаток упаривали с водой два раза, подщелачивали Na2CO3 и экстрагировали хлороформом. Органический слой сушили над Na2SO4 и упаривали с получением 1,45 г кристаллического продукта. Продукт (615 мг, 5 ммоль) подвергали взаимодействию с триметилсиланкарбонитрилом (5,5 ммоль) в дихлорметане (10 мл) при комнатной температуре в течение 5 мин, затем добавляли диметилкарбамоилхлорид (5 ммоль) и раствор перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь обрабатывали 10%-ным карбонатом калия (10 мл), органический слой отделяли и водный слой экстрагировали 2 раза дихлорметаном. Органическую фазу сушили над Na2SO4 и упаривали с получением 495 мг 5,6-диметилпиколинoнитрила (75%).1H ЯМР (500 МГц, CDCl3): δ 2,35 (с, 3H), 2,53 (с, 3H), 7,43-7,45 (д, 1H), 7,51-7,52 (д, 1H);13C: δ 19,71, 22,80, 117,87, 126,36, 130,60, 136,58, 137,66, 159,84. MS (M+H, 133,1).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 2,8 мкM.
Пример 92
4-(Диэтиламино)-N-(гептан-4-ил)бензамид
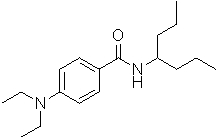
Получали способом, аналогично описанному в примере 4, используя 4-диэтиламинобензойную кислоту и 4-гептиламин. (31%).1H ЯМР (500 МГц, CDCl3): δ 0,92(т, 6H, J=7,17 Гц), 1,18 (т, 6H, J=7,04 Гц), 1,41(м, 4H), 1,55(м, 4H), 3,39 (м, 4H), 4,15 (м, 1H), 5,62 (м, 1H), 6,64 (д, 2H, J=10,26 Гц), 7,64 (д, 2H, J=10,26 Гц). MS (M+H, 291).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 7,6 мкM.
Пример 93
(R)-Метил 2-(2,6-диметоксиизоникотинамидо)-4-метилпентаноат

Получали способом, аналогично описанному в примере 4, используя 2,6-диметокси-изоникотиновую кислоту и метиловый эфир D-лейцина.1H ЯМР (500 МГц, CDCl3): δ 0,92 (д, 3H, J=7,27 Гц), 0,93 (д, 3H, J=7,26 Гц), 1,41-1,58 (м, 8H), 3,95 (с, 3H), 4,08 (с, 3H), 4,15 (м, 1H), 6,43 (д, 1H, J=8,32 Гц), 7,47 (м, ушир., 1H), 8,41 (д, 1H, J=8,34 Гц). MS (M+H; 311).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,91 мкM.
Пример 94
N-(Гептан-4-ил)-6-метоксиникотинамид

Получали способом, аналогично описанному в примере 4, используя натрий 6-метоксиникотинат (пример 94a) и 4-гептиламин. Выход: 44%. MS (M+H, 251).
a. Метил 6-метоксиникотинат (2,097 г, 12,56 ммоль) растворяли в диоксане (30 мл). К раствору добавляли водный раствор NaOH (1,0н, 25 мл) и смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении с получением 2,2 г 6-метоксиникотинат натрия.
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 2,66 мкM.
Пример 95
(1-Пропилбутил)амид 5,6-диметилпиразин-2-карбоновой кислоты

Получали способом, аналогично описанному в примере 4, используя 5,6-диметилпиразин-2-карбоновую кислоту (пример 95a) и 4-гептиламин.1H ЯМР (500 МГц, CDCl3): δ 0,91-0,94 (т, 6H), 1,35-1,42 (м, 4H), 1,48-1,51 (м, 2H), 1,55-1,60 (м, 2H), 2,57-2,60 (д, 6H), 4,13-4,16 (м, 1H), 7,52-7,53 (д, 1H), 9,09 (с, 1H); MS (M+H, 250).
a. 5,6-Диметилпиразин-2-карбоновая кислота
К раствору 2,3-диаминопропионовой кислоты (1,0 г, 9,6 ммоль) в метаноле (20 мл) добавляли бутан-2,3-дион (728 мкл; 11,5 ммоль) и NaOH (1,4 г; 56,6 ммоль). Смесь кипятили с обратным холодильником в течение 2 часов и затем охлаждали до комнатной температуры, барботируя воздух в течение 1 часа. Белый остаток фильтровали и желатиновый продукт концентрировали в вакууме. Неочищенный продукт обрабатывали в дихлорметане, промывали 10% лимонной кислотой, сушили над MgSO4 и фильтровали. Растворитель удаляли при пониженном давлении с получением 5,6-диметилпиразин-2-карбоновой кислоты в виде летучего твердого вещества. Соединение использовали без дополнительной обработки на следующей стадии.
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,01 мкM.
Пример 96
2-Хлор-N-(гептан-4-ил)-6-метилникотинамид

Получали способом, аналогично описанному в примере 4, используя 2-хлор-6-метилникотиновую кислоту и 4-гептиламин. MS (M+H, 269).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 3,9 мкM.
Пример 97
2-Циано-N-(гептан-4-ил)-4-метоксибензамид

Получали способом, аналогично описанному в примере 4, используя 2-циано-4-метоксибензойную кислоту и 4-гептиламин. Выход: 73%.1H ЯМР (CD3OD): δ 0,94 (т, 6H, J=7,3 Гц), 1,38 (м, 4H), 1,53 (м, 4H), 4,02 (с, 3H), 4,12 (м, 1H), 7,27 (д, 1H, J=9,40 Гц), 8,11 (д, 2H, J=2,21 Гц). MS (M+H, 275).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,39 мкM, и, когда присутствовало в концентрации 1 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 4,52.
Пример 98
(R)-метил 2-(2,3-диметилфуран-5-карбоксамидо)-4-метилпентаноат

Получали способом, аналогично описанному в примере 4, используя 4,5-диметилфуран-2-карбоновую кислоту и метиловый эфир D-лейцина. Выход: 27%.1H ЯМР (500 МГц, CDCl3): δ 0,96 (т, 6H), 1,66 (м, 3H), 1,96 (с, 3H), 2,26 (с, 3H), 3,75 (с, 3H), 4,78 (м, 1H), 6,51 (д, 1H), 6,89 (с, 1H). MS (M+H, 268).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,59 мкM.
Пример 99
N-(Гептан-4-ил)-1,3-диметил-1H-пиразол-5-карбоксамид

Получали способом, аналогично описанному в примере 4, используя 1,3-диметил-1H-пиразол-5-карбоновую кислоту и 4-гептиламин.1H ЯМР (500 МГц, CDCl3): δ 0,90 (т, 6H, J=7,2 Гц), 1,41 (м, 4H), 1,50 (м, 4H), 2,27 (с, 3H), 3,77 (с, 3H), 4,09 (м, 1H), 6,49 (д, 1H), 6,53 (с, 1H). MS (M+H, 238).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 7,8 мкM.
Пример 100
N-(гептан-4-ил)-2-метилтиазол-4-карбоксамид

Получали способом, аналогично описанному в примере 4, используя 1,3-диметил-1H-пиразол-5-карбоновую кислоту и 4-гептиламин. MS (M+H, 241).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 7,2 мкM.
Пример 101
N-(Гептан-4-ил)хинолин-6-карбоксамид

Получали способом, аналогично описанному в примере 4, используя хинолин-6-карбоновую кислоту и 4-гептиламин.1H ЯМР (500 МГц, CDCl3): δ 0,96 (т, J=7,2 Гц, 6H), 1,42-1,58 (м, 6H), 1,62-1,70 (м, 2H), 4,18-4,20 (м, 1H), 5,95 (д, J=9,0 Гц, 1H), 7,49 (ушир.с, 1H), 8,04 (дд, J=8,5, 1,5 Гц, 1H), 8,17 (д, J=8,5 Гц, 1H), 8,27 (д, J=8,2 Гц, 1H), 8,30 (с, 1H), 8,99 (ушир.с, 1H); MS (M+H, 271,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 3,2 мкM.
Пример 102
N-(Гептан-4-ил)хинолин-3-карбоксамид

Получали способом, аналогично описанному в примере 4, используя хинолин-3-карбоновую кислоту и гептиламин:1H ЯМР (500 МГц, CDCl3): δ 0,96 (т, J=7,3 Гц, 6H), 1,40-1,58 (м, 6H), 1,60-1,67 (м, 2H), 4,20-4,30 (м, 1H), 6,01 (д, J=8,8 Гц, 1H), 7,61 (т, J=7,5, 1H), 7,80 (т, J=7,6 Гц, 1H), 7,90 (д, J=8,1 Гц, 1H), 8,15 (д, J=8,5 Гц, 1H), 8,57 (д, J=1,2 Гц, 1H), 9,26 (ушир.с, 1H); MS (M+H, 271,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 15,8 мкM.
Пример 103
N-(Гептан-4-ил)изохинолин-1-карбоксамид

Получали способом, аналогично описанному в примере 4, используя изохинолин-1-карбоновую кислоту и гептамин:1H ЯМР (500 МГц, CDCl3): δ 0,98 (т, J=7,05 Гц, 6H), 1,42-1,56 (м, 6H), 1,58-1,66 (м, 2H), 4,20-4,32 (м, 1H), 5,83 (д, J=9,1 Гц, 1H), 7,36 (д, J=4,2, 1H), 7,60 (т, J=7,7 Гц, 1H), 7,75 (т, J=7,7 Гц, 1H), 8,11 (д, J=8,5 Гц, 1H), 8,18 (д, J=8,4 Гц, 1H), 8,88 (д, J=4,9, 1H); MS (APCI, M+): 271,2.
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 14,2 мкM.
Пример 104
4-Метокси-N-(1-метоксиметил-3-метилбутил)-3-метилбензамид

Получали способом, аналогично описанному в примере 71 из 4-метокси-3-метилбензойной кислоты и D-лейцинола. Выход: 86%.1H ЯМР (500 МГц, CDCl3): δ 0,94-0,97 (т, 6H), 1,42-1,47 (м, 1H), 1,54-1,60 (м, 1H), 1,64-1,68 (м, 2H), 2,24 (с, 3H), 3,37 (с, 3H), 3,46-3,48 (м, 2H), 3,87 (с, 3H), 4,35-4,38 (м, 1H), 6,14-6,16 (д, 1H), 6,82-6,84 (д, 1H), 7,56 (д, 1H), 7,61-7,63 (дд, 1H). MS (M+H, 280,3).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,24 мкM.
Пример 105
N-(4-(Трифторметокси)бензил)тиофен-2-карбоксамид

Получали способом, аналогично описанному в примере 4 из тиофен-2-карбоновой кислоты и (4-(трифторметокси)фенил)метанамина. MS (M+H, 303).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 2,4 мкM.
Пример 106
N-(2-(Фуран-2-илметилтио)этил)-4-метокси-3-метилбензамид

Получали способом, аналогично описанному в примере 4, исходя из 4-метокси-3-метилбензойной кислоты и 2-(фуран-2-илметилтио)этанамина. Выход 58%.1H ЯМР (500 МГц, CDCl3): δ 2,23 (с, 3H), 2,76 (т, 2H, J=6,37 Гц), 3,59 (кв, 2H, J=12,2 Гц), 3,76 (с, 2H), 3,86 (с, 3H), 6,22 (дд, 1H, J=3,49 Гц, J=2,67 Гц), 6,30 (дд, 1H, J=3,04 Гц, J=1,78 Гц), 6,46 (м, 1H, широкий), 6,83 (д, 1H, J=8,51 Гц), 7,34 (дд, 1H, J=1,97 Гц, J=1 Гц), 7,56 (д, 1H, J=1,72 Гц), 7,61 (дд, 1H, J=8,53 Гц, J=2,25 Гц). MS (M+H, 306).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 5,6 мкM.
Пример 107
4-Трифторметоксибензиламид тиофен-3-карбоновой кислоты

Получали способом, аналогично описанному в примере 4, используя тиофен-3-карбоновую кислоту и 4-трифторметоксибензиламин. MS (M+H, 302,0).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 2,2 мкM, и, когда присутствовало в концентрации 3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 8,5.
Пример 108
2,4-Диметоксибензиламид 3-метилтиофен-2-карбоновой кислоты

Получали способом, аналогично описанному в примере 4, используя 3-метилтиофен-2-карбоновую кислоту и 2,4-диметоксибензиламин. MS (M+H, 292,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 5,6 мкM, и, когда присутствовало в концентрации 3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 5,8.
Пример 109
2,4-Диметоксибензиламид 5-пиридин-2-илтиофен-2-карбоновой кислоты

Получали способом, аналогично описанному в примере 4, используя 5-пиридин-2-илтиофен-2-карбоновую кислоту и 2,4-диметоксибензиламин. MS (M+H, 355,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 2,86 мкM, и, когда присутствовало в концентрации 3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 8.
Пример 110
2,4-Диметоксибензиламид 2-метил-2H-пиразол-3-карбоновой кислоты

Получали способом, аналогично описанному в примере 4, используя 2-метил-2H-пиразол-3-карбоновую кислоту и 2,4-диметоксибензиламин. MS (M+H, 276,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 6 мкM, и, когда присутствовало в концентрации 3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 7,9.
Пример 111
4-Гидрокси-3-метил-N-(1-метил-3-фенилпропил)бензамид

Получали способом, аналогично описанному в примере 4, используя 4-гидрокси-3-метилбензойную кислоту и 1-метил-3-фенилпропиламин. MS (M+H, 284,2)
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 2,7 мкM, и, когда присутствовало в концентрации 0,3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50, равным 7.
Пример 112
[2-(4-Этилфенил)этил]амид бензо[1,3]диоксол-5-карбоновой кислоты

Получали способом, аналогично описанному в примере 4, используя бензо[1,3]диоксол-5-карбоновую кислоту и 2-(4-этил-фенил)этиламин. MS (M+H, 298,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 3,86 мкM.
Пример 113
4-Метокси-3-метил-N-(1-фенилбутил)бензамид

Получали способом, аналогично описанному в примере 4, используя 4-метокси-3-метилбензойную кислоту и 1-фенилбутиламин. MS (M+H, 298,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 2,5 мкM.
Пример 114
4-Метокси-3-метил-N-(1-пиридин-2-илбутил)бензамид

Получали способом, аналогично описанному в примере 4, используя 4-метокси-3-метилбензойную кислоту и 1-пиридин-2-илбутиламин.1H ЯМР (500 МГц, CDCl3): δ 0,91-0,92 (т, 3H), 1,25-1,3 (м, 2H, 1,85-1,9 (м, 2H), 3,86 (с, 3H), 5,25-5,3 (м, 1H), 6,80-6,82 (д, 1H), 7,2-7,3 (м, 2H), 7,42-7,44 (д, 1H), 7,6-7,7 (м, 3H), 8,6 (д, 1H). MS (M+H, 299,1).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,54 мкM.
Пример 115
[1-(4-Метоксифенил)бутил]амид бензо[1,3]диоксол-5-карбоновой кислоты
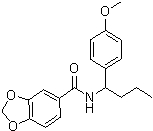
Получали способом, аналогично описанному в примере 4, используя бензо[1,3]диоксол-5-карбоновую кислоту и 1-(4-метоксифенил)бутиламин1H ЯМР (500 МГц, CDCl3): δ 0,93-0,95 (т, 3H), 1,30-1,39 (м, 2H), 1,80-1,90 (м, 2H), 3,79 (с, 3H), 5,08-5,09 (дд, 1H), 6,00 (с, 2H), 6,10-6,12 (д, 1H), 6,79-6,80 (д, 1H), 6,87(с, 1H), 6,88 (с, 1H), 7,25-7,28 (м, 4H). MS (M+H, 328,1).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 4,12 мкM.
Пример 116
4-Этокси-N-[1-(4-метоксифенил)бутил]-3-метилбензамид
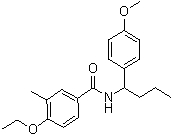
Получали способом, аналогично описанному в примере 4, используя 4-этокси-3-метилбензойную кислоту и 1-(4-метоксифенил)бутиламин.1H ЯМР (500 МГц, CDCl3): δ 0,93-0,96 (т, 3H), 1,31-1,41 (м, 2H), 1,41-1,45 (т, 3H), 1,82-1,92 (м, 2H), 2,28 (с, 3H), 3,79 (с, 3H), 4,04-4,08 (кв, 2H), 5,10-5,12 (д, 1H), 6,12-6,14 (д, 1H), 6,78-6,80 (д, 1H), 6,87 (с, 1H), 6,88 (с, 1H), 7,26-7,29 (м, 2H), 7,52-7,53 (д, 1H), 7,57-7,59 (д, 1H). MS (M+H, 342,1).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 3,9 мкM.
Пример 117
4-Метокси-N-[1-(R)-(4-метоксифенил)этил]-3-метилбензамид

Получали способом, аналогично описанному в примере 4, используя 4-метокси-3-метилбензойную кислоту и 1-(R)-(4-метоксифенил)этиламин. MS (M+H, 300,1).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 2,8 мкM.
Пример 118
Индан-1-иламид бензо[1,3]диоксол-5-карбоновой кислоты

Получали способом, аналогично описанному в примере 4, используя бензо[1,3]диоксол-5-карбоновую кислоту и индан-1-иламина. MS (M+H, 282,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,2 мкM, и, когда присутствовало в концентрации 0,3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 5,33.
Пример 119
4-Метокси-3-метил-N-(пентан-3-ил)бензамид

Получали способом, аналогично описанному в примере 4 из 4-метокси-3-метилбензойной кислоты и пентан-3-амина. MS (M+H, 236)
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,4 мкM.
Пример 120
3-Метил-N-(п-толилэтил)фуран-2-карбоксамид
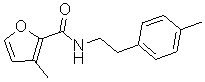
Получали способом, аналогично описанному в примере 4, исходя из 3-метилфуран-2-карбоновой кислоты и 2-п-толилэтанамина. MS (M+H, 244).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 6 мкM, и, когда присутствовало в концентрации 1 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 3,3.
Пример 121
N-(2,4-диметоксибензил)-2-(1H-пиррол-1-ил)бензамид

Получали способом, аналогично описанному в примере 4, используя 1-(2-(1H-пиррол-1-ил)фенил)этанон и 2,4-диметоксибензиламин. MS (M+H, 337,2).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,66 мкM, и, когда присутствовало в концентрации 1 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 11.
Дополнительные «амидные» соединения, синтезированные и экспериментально исследованные, обладают относительно высоким уровнем эффективности в качестве активатора «умами» рецептора hT1R1/hT1R3, экспрессированного в клеточной линии HEK293. Результаты этих исследований представлены ниже в таблице A.
Большое количество амидных соединений формулы (I), которые входят в подгруппы «оксаламидных» соединений, описанных в данном описании, также были синтезированы и экспериментально исследованы на эффективность в качестве активатора рецептора «умами» hT1R1/hT1R3, экспрессированного в клеточной линии HEK293.
Пример 122
Общий способ A получения оксаламида
Синтез N-(2-метоксибензил)-N'-(2-пиридин-2-илэтил)оксаламида

2-Метоксибензиламин (5 ммоль) перемешивали с триэтиламином (2 экв.) в безводном диоксане. Добавляли этилоксалилхлорид (1 экв.) и смесь встряхивали при комнатной температуре в течение 0,5-2 часов. Затем добавляли 2-(2-пиридинил)этиламин (1 экв.) и суспензию нагревали при 80°C в течение ночи. Раствор концентрировали, остаток растворяли в этилацетате и промывали водой. Органический слой сушили сульфатом натрия и растворитель упаривали с получением неочищенного продукта, который очищали колоночной флэш-хроматографией с получением указанного в заголовке соединения: выход 70%, т.пл. 118-119°C; m/e=314 [M+1];1H ЯМР (CDCl3): δ 3,02 (т, 2H), 3,76 (дт, 2H), 3,86 (с, 3H), 4,47 (д, 2H), 6,80-6,90 (м, 2H), 7,14-7,18 (м, 2H), 7,20-7,30 (м, 2H), 7,55-7,62 (м, 1H), 7,75-7,83 (м, 1H), 8,05-8,12 (м, 1H), 8,55-8,63 (м, 1H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,34 мкM, и, когда присутствовало в концентрации 0,3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 18,85.
Пример 123
N-(2,4-Диметоксибензил)-N'-(2-пиридин-2-илэтил)оксаламид

Получали способом, аналогично описанному в примере 122, используя 2,4-диметоксибензиламин, этилоксалилхлорид и 2-(2-пиридинил)этиламин. Выход 72%, т.пл. 123-124°C; m/e=344 [M+1];1H ЯМР (CDCl3): δ 3,02 (т, 2H); 3,73 (дд, 2H); 3,78 (с, 3H); 3,82 (с, 3H); 4,38 (д, 2H) 6,40 (дд, 1H); 6,44 (д, 1H); 7,14 (м, 3H); 7,59 (м, 1H); 7,82 (т, 1H); 8,11 (т, 1H); 8,56 (д, 1H);13C ЯМР: δ 36,9, 38,9, 39,4, 55,6, 55,6, 98,8, 104,1, 117,8, 121,9, 123,5, 130,7, 136,8, 149,6, 158,8, 158,8, 159,6, 160,1, 161,0.
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,09 мкM, и, когда присутствовало в концентрации 0,3 мкM, повышало эффективность мононатрий глутамата с соотношением 6,51.
Пример 124
N-(3-Метилтиофен-2-илметил)-N'-(2-пиридин-2-илэтил)оксаламид

Получали способом, аналогично описанному в примере 122, используя (3-метилтиофен-2-ил)метиламин, этилоксалилхлорид и 2-(2-пиридинил)этиламин. Выход 40%; т.пл. 122-124°C; m/e=304 [M+1];1H ЯМР (ДМСО-d6): δ 2,19 (с, 3H), 2,92-2,95 (т, 2H), 3,48-3,52 (дд, 2H), 4,37-4,38 (д, 2H), 6,79-6,80 (д, 1H), 7,20-7,27 (м, 3H), 7,67-7,71 (дт, 1H), 8,48-8,49 (д, 1H), 8,87-8,89 (т, 1H), 9,25-9,28 (т, 1H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,37 мкM.
Пример 125
Общий способ B синтеза оксаламида
N-(4-Метилбензил)-N'-(2-пиридин-2-илэтил)оксаламид

4-Метилбензиламин (1 ммоль) подвергали взаимодействию с этилоксалилхлоридом (1 экв.) в присутствии триэтиламина (2 экв.) в ацетонитриле при комнатной температуре в течение 0,5-1 часа. Затем добавляли 2-(2-пиридинил)этиламин (1 экв.) и суспензию нагревали при 160°C в микроволновом реакторе в течение 5 минут. Реакционную смесь подвергали препаративной ВЭЖХ с получением чистого указанного в заголовке оксаламида: выход 60%; т.пл. 152-154°C; m/e=298 [M+1];1H ЯМР (CDCl3): δ 2,33 (с, 3H), 3,10 (т, 2H), 3,75 (дт, 2H), 4,43 (д, 2H), 7,10-7015 (м, 4H), 7,18-7,22 (м, 2H), 7,65-7,73 (м, 2H), 8,12 (ушир., 1H), 8,60 (д, 1H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,41 мкM.
Пример 126
N-(2-Метил-4-метоксибензил)-N'-(2-пиридин-2-илэтил)оксаламид

Получали способом, аналогично описанному в примере 122, используя 2-метил-4-метоксибензиламин, этилоксалилхлорид и 2-(2-пиридинил)этиламин. Выход 51%; т.пл. 133-134°C; m/e=328 [M+1];1H ЯМР (CDCl3): δ 2,29 (с, 3H); 3,04 (т, 2H); 3,74-3,77 (м, 2H); 3,78 (с, 3H); 4,40 (д, 2H); 6,69-6,73 (м, 2H); 7,13-7,18 (м, 3H); 7,51 (т, 1H); 7,60-7,63 (м, 1H); 8,17 (т, 1H); 8,58 (д, 1H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,11 мкM.
Пример 127
N-(2,4-Диметоксибензил)-N'-(3-пиридин-2-илпропил)оксаламид

Получали способом, аналогично описанному в примере 125, используя 2,4-диметоксибензиламин, этилоксалилхлорид и 3-(2-пиридинил)пропиламин. Выход 60%; m/e=358 [M+1];1H ЯМР (CDCl3): δ 1,99-2,04 (м, 2H); 2,84 (т, 2H); 3,36 (дд, 2H); 3,79 (с, 3H); 3,82 (с, 3H) 4,60 (д, 2H); 6,41-6,45 (м, 2H); 7,10-7,17 (м, 3H); 7,57-7,60 (м, 1H); 7,81 (т, 1H); 7,89 (т, 1H); 8,54 (д, 1H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,84 мкM.
Пример 128
N-(4-Метоксибензил)-N'-(2-пиридин-2-илэтил)оксаламид

Получали способом, аналогично описанному в примере 125, используя 4-метоксибензиламин, этилоксалилхлорид и 2-(2-пиридинил)этиламин. Выход 50%; т.пл. 156-158°C;1H ЯМР: 3,05 (т, 3H), 3,72-3,77 (м, 2H), 3,79 (с, 3H), 4,40 (д, 2H), 6,86 (д, 2H), 7,16-7,22 (м, 4H), 7,65-7,69 (м, 3H), 8,15 (ушир., 1H), 8,62 (д, 1H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,75 мкM.
Пример 129
N-(2,4-Диметоксибензил)-N'-(2-(3-метилпиридин-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 125, используя 2,4-диметоксибензиламин, этилоксалилхлорид и 2-(3-метилпиридин-2-ил)этиламин (пример 129a). Выход 10%; m/e=358 [M+1];1H ЯМР (CDCl3): δ 2,28 (с, 3H), 3,01 (т, 2H), 3,75-3,82 (м, 2H), 3,79 (с, 3H), 3,82 (с, 3H), 4,39 (д, 2H), 6,41 (дд, 1H), 6,44 (д, 1H), 7,10 (т, 1H), 7,15 (д, 1H), 7,45 (д, 1H), 7,81 (ушир.с, 1H), 8,28 (ушир.с, 1H), 8,40 (д, 1H).
a. 2-(3-Метилпиридин-2-ил)этиламин
К раствору 2-(3-метилпиридин-2-ил)ацетонитрила (пример 129b) (95 мг, 0,72 ммоль) в ТГФ (0,5 мл) добавляли по каплям при комнатной температуре 1М BH3·ТГФ (2,2 мл, 2,2 ммоль). Полученную смесь нагревали в микроволновой печи при 130°С в течение 7 минут. Затем добавляли по каплям при комнатной температуре 6н водным HCl (1 мл). Полученную смесь нагревали в микроволновой печи при 120°С в течение 4 минут. Реакционную смесь промывали Et2O (3×3 мл), затем охлаждали до 0°C и добавляли 10н водный NaOH (0,8 мл). Водный раствор насыщали K2CO3. Продукт экстрагировали CHCl3 (6×5 мл). Органические экстракты сушили (1:1 K2CO3/Na2SO4), фильтровали, концентрировали в вакууме с получением масла (85 мг, 86%), которое непосредственно использовали в примере 8. m/e=137 [M+1].
b. 2-(3-Метилпиридин-2-ил)ацетонитрил
К раствору н-BuLi (2,5н в гексане, 7,92 мл, 19,8 ммоль) при -78°C в атмосфере N2добавляли сухой ТГФ (75 мл), с последующим медленным добавлением раствора сухого MeCN (1,15 мл, 21,78 ммоль) в безводном ТГФ (30 мл) в течение 5 минут. Полученную реакционную смесь перемешивали непрерывно при -78°С в течение 1 часа. Затем добавляли 2-бром-3-метилпиридин (516 мг, 3 ммоль). Полученную реакционную смесь перемешивали при -78°С в течение 1 часа, затем нагревали до комнатной температуры и гасили водой. Органический растворитель упаривали в вакууме, растворяли в CH2Cl2. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), концентрировали, очищали колоночной хроматографией (20% EtOAc в гексане) с получением продукта с количественным выходом: m/e=133 [M+1].
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,64 мкM.
Пример 130
N-(2,5-Диметилфуран-3-илметил)-N'-(2-пиридин-2-илэтил)оксаламид

Получали способом, аналогично описанному в примере 122, используя 2,5-диметилфуран-3-илметиламин, этилоксалилхлорид и 2-(2-пиридинил)этиламин. Выход 51%; т.пл. 112-115°C; m/e=302 [M+1];1H ЯМР (ДМСО-d6): δ 2,14 (с, 3H), 2,18 (с, 3H), 2,91-2,94 (т, 2H), 3,47-3,51 (дд, 2H), 3,98-3,99 (д, 2H), 5,89 (с, 1H), 7,20-7,25 (м, 2H), 7,68-7,71 (дт, 1H), 8,48-8,49 (д, 1H), 8,81-8,84 (т, 1H), 8,97-9,00 (т, 1H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,01 мкM.
Пример 131
N-(1,5-Диметил-1H-пиррол-2-илметил)-N'-(2-пиридин-2-илэтил)оксаламид

Получали способом, аналогично описанному в примере 122, используя 1,5-диметил-1H-пиррол-2-илметиламин, этилоксалилхлорид и 2-(2-пиридинил)этиламин. Выход 25%; т.пл. 147-149°C; m/e=301 [M+1];1H ЯМР (ДМСО-d6): δ 2,11 (с, 3H), 2,92-2,95 (т, 2H), 3,38 (с, 3H), 3,48-3,52 (кв, 2H), 4,24-4,25 (д, 2H), 5,64-5,65 (д, 1H), 5,79-5,65 (д, 1H), 7,20-7,25 (м, 2H), 7,68-7,71 (дт, 1H), 8,48-8,49 (д, 1H), 8,82-8,86 (м, 2H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 2,3 мкM.
Пример 132
N-(2-метокси-4-метилбензил)-N'-(2-(пиридин-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 125, используя (2-метокси-4-метилфенил)метанамин (пример 132a), этилоксалилхлорид и 2-(2-пиридинил)этиламин, выход 20%. т.пл.: 128-131°C; m/e=328 [M+1];1H ЯМР (CDCl3): δ 2,33 (с, 3H); 3,02 (т, 2H); 3,73 (м, 2H); 3,84 (с, 3H); 4,42 (д, 2H); 6,70 (м, 2H); 7,14 (м, 3H); 7,60 (м, 1H); 7,86 (с, 1H); 8,09 (с, 1H); 8,56 (д, 1H).
a. (2-Метокси-4-метилфенил)метанамин
К раствору 2-метокси-4-метилбензамида (пример 132b) (200 мг, 1,21 моль) в ТГФ (0,5 мл) медленно добавляли 1М BH3·ТГФ (2,4 мл, 2,42 ммоль) при комнатной температуре. Полученную смесь нагревали в микроволновой печи при 130°С в течение 7 минут. Затем по каплям при комнатной температуре добавляли 6н водный HCl (1 мл). Полученную смесь нагревали в микроволновой печи при 120°С в течение 4 минут. Реакционную смесь промывали Et2O (3×3 мл), затем охлаждали до 0°С и добавляли 10н водный NaOH (0,8 мл). Водный раствор насыщали K2CO3. Продукт экстрагировали CHCl3 (6×5 мл). Органические экстракты сушили (1:1 K2CO3/Na2SO4), фильтровали, концентрировали в вакууме с получением 180 мг (2-метокси-4-метилфенил)метанамина, который непосредственно использовали в примере 11.
b. 2-Метокси-4-метилбензамид
2-Метокси-4-метилбензойную кислоту (500 мг, 3,01 ммоль) перемешивали с гидрохлоридом 1-этил-3-(3-диметиламинопропил)карбодиимида (577 мг, 3,01 моль) и 1-гидроксибензотриазолом (407 мг, 3,01 моль) в 25 мл дихлорметана при комнатной температуре и перемешивали в течение 5 минут. Добавляли 2M раствор аммиака в метаноле (4,5 мл, 9,03 моль), реакционную смесь перемешивали при комнатной температуре в течение около 5 часов, затем разбавляли дихлорметаном, промывали 1н HCl, насыщенным NaHCO3, водой и насыщенным раствором соли, сушили над MgSO4, фильтровали и упаривали с получением 440 мг 2-метокси-4-метилбензамида с выходом 88%.
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,04 мкМ.
Пример 133
N-(2,4-Диметилбензил)-N'-(2-(пиридин-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 125, используя (2,4-диметилфенил)метанамин (пример 133a), этилоксалилхлорид и 2-(2-пиридинил)этиламин с выходом 60%; т.пл. 148-149°C; m/e=312 [M+1];1H ЯМР (CDCl3): 2,28 (с, 3H); 2,30 (с, 3H); 3,05 (т, 2H); 3,76 (дд, 2H); 4,43 (д, 2H); 6,99 (м, 2H); 7,11 (д, 1H); 7,17 (м, 2H); 7,54 (с, 1H); 7,62 (м, 1H); 8,17 (с, 1H); 8,58 (д, 1H).
a. (2,4-Диметилфенил)метанамин
1M раствор литийалюминийгидрида в ТГФ (15,2 мл, 15,2 моль) помещали в заранее высушенную колбу в атмосфере аргона при 0 °C; по каплям добавляли раствор 2,4-диметилбензонитрила (1,0 г, 7,6 моль) в 15 мл безводного эфира. После добавления реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 3 часов, затем охлаждали до 0°C, добавляли безводный сульфат натрия и добавляли по каплям 1 мл воды. Смесь разбавляли этилацетатом, нерастворимое вещество отфильтровывали, фильтрат промывали водой и насыщенным раствором соли, сушили над MgSO4, фильтровали и упаривали с получением 1,03 г чистого (2,4-диметилфенил)метанамина с количественным выходом без очистки.
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,07 мкM.
Пример 134
N-(4-Этокси-2-метоксибензил)-N'-(2-(пиридин-2-ил)этил)оксаламид
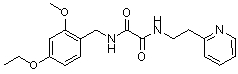
Получали способом, аналогично описанному в примере 125, используя (4-этокси-2-метоксифенил)метанамин (пример 134a), этилоксалилхлорид и 2-(2-пиридинил)этиламин; выход 10%; т.пл. 117-118°C; m/e=358 [M+1];1H ЯМР (CDCl3): δ 1,40 (т, 3H); 3,03 (т, 2H); 3,74 (дд, 2H); 3,82 (с, 3H); 4,01 (дд, 2H); 4,39 (д, 2H); 6,39 (д, 1H); 6,44 (с, 1H); 7,15 (м, 3H), 7,61 (м, 1H); 7,81 (с, 1H); 8,10 (с, 1H); 8,56 (д, 1H).
a. (4-Этокси-2-метоксифенил)метанамин
К раствору 4-этокси-2-метоксибензальдегида (пример 134b) (880 мг, 4,88 ммоль) в 50 мл безводного метанола добавляли ацетат аммония (7,5 г, 97,60 ммоль) и цианоборгидрид натрия (613 мг, 9,76 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение около 4 часов, затем концентрировали на роторном испарителе, остаток разбавляли водой и преобразовывали в основание с помощью 15% водного NaOH, экстрагировали этилацетатом, промывали водой и насыщенным раствором соли, сушили над MgSO4, фильтровали и растворитель упаривали, остаток очищали колоночной хроматографией на силикагеле (DCM/MeOH 9:1) с получением 150 мг продукта; выход 17% (способ не был оптимизирован).
b. 4-Этокси-2-метоксибензальдегид:
К раствору 4-гидрокси-2-метоксибензальдегида (1,0 г, 6,57 моль) в 10 мл ацетона добавляли карбонат калия (0,91 г, 6,57 моль) и йодэтан (1,6 мл, 19,71 моль), реакционную смесь перемешивали при комнатной температуре в течение ночи. Ацетон удаляли на роторном испарителе; остаток разбавляли водой и этилацетатом; экстрагировали этилацетатом, промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и упаривали с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле (этилацетат/гексан=1:4) с получением 943 мг продукта; выход 80%.
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,1 мкМ.
Пример 135
N-(4-Метокси-3-метилбензил)-N'-(2-(пиридин-2-ил)этил)оксаламид
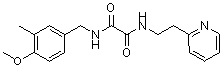
Получали способом, аналогично описанному в примере 125, используя (4-метокси-3-метилфенил)метанамин (пример 135a), этилоксалилхлорид и 2-(2-пиридинил)этиламин, выход 12%; т.пл. 145-147°C; m/e=328 [M+1];1H ЯМР (CDCl3): δ 2,19 (с, 3H); 3,04 (т, 2H); 3,76 (дд, 2H); 3,81 (с, 3H); 4,37 (д, 2H); 6,76 (д, 1H); 7,06 (м, 2H); 7,16 (м, 2H); 7,61 (м, 1H); 7,66 (с, 1H); 8,18 (с, 1H); 8,58 (д, 1H).
a. (4-Метокси-3-метилфенил)метанамин
Получали способом, аналогично описанному в примере 134a, используя 4-метокси-3-метилбензальдегид, ацетат аммония и цианоборгидрид натрия в MeOH; выход 22% (110 мг).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,04 мкМ.
Пример 136
N-(2-хлорбензил)-N'-(2-(пиридин-2-ил)этил)оксаламид:

Получали способом, аналогично описанному в примере 125, используя (2-хлорфенил)метанамин, этилоксалилхлорид и 2-(2-пиридинил)этиламин; выход 45%; m/e=318 [M+1].
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,01 мкМ.
Пример 137
N-((2,3-Дигидробензо[b][1,4]диоксин-5-ил)метил)-N'-(2-(пиридин-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 122, используя (2,3-дигидробензо[b][1,4]диоксин-5-ил)метанамин, этилоксалилхлорид и 2-(2-пиридинил)этиламин; выход 50%; m/e=342 [M+1].
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,3 мкМ.
Пример 138
N-(Бензо[d][1,3]диоксол-5-илметил)-N'-(2-(пиридин-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 125, используя бензо[d][1,3]диоксол-5-илметанамин, этилоксалилхлорид и 2-(2-пиридинил)этиламин; выход 35%; m/e=328 [M+1].
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,5 мкМ.
Пример 139
N-(4-Этилбензил)-N'-(2-(пиридин-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 125, используя 4-этилбензиламин, этилоксалилхлорид и 2-(2-пиридинил)этиламин; выход 38%; m/e=312 [M+1].
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,79 мкМ.
Пример 140
N-(Бензофуран-5-илметил)-N'-(2-(пиридин-2-ил)этил)оксаламид
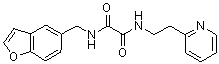
Получали способом, аналогично описанному в примере 125, используя бензофуран-5-илметиламин, этилоксалилхлорид и 2-(2-пиридинил)этиламин; выход 64%; m/e=324 [M+1].
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,78 мкМ.
Пример 141
N-((4-Метоксикарбонилфенил)метил)-N'-(2-(пиридин-2-ил)этил)оксаламид
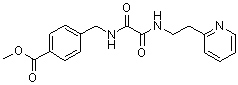
Получали способом, аналогично описанному в примере 122, используя 4-метоксикарбонилфенилметиламин, этилоксалилхлорид и 2-(2-пиридинил)этиламин; выход 52%; m/e=342 [M+1].
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 3,63 мкМ.
Пример 142
N-((2-Карбамоилфенил)метил)-N'-(2-(пиридин-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 122, используя 2-карбамоилфенилметиламин, этилоксалилхлорид и 2-(2-пиридинил)этиламин; выход 48%; m/e=342 [M+1].
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 8,5 мкМ.
Пример 143
N-(2,4-Диметоксибензил)-N'-(1-(пиридин-2-ил)пропан-2-ил)оксаламид

Получали способом, аналогично описанному в примере 125, используя 2,4-диметоксибензиламин, этилоксалилхлорид и 1-(пиридин-2-ил)пропан-2-иламин (пример 143a); выход 34%; m/e=357 [M+1].
a. 1-(Пиридин-2-ил)пропан-2-иламин
Получали способом, аналогично описанному в примере 129a, используя 2-(пиридин-2-ил)пропаннитрил (пример 143b); неочищенный продукт непосредственно использовали в примере 143; выход 53%; m/e=137 [M+1].
b. 2-(Пиридин-2-ил)пропаннитрил
5 ммоль 2-(Пиридин-2-ил)ацетонитрила растворяли в 8 мл безводного ТГФ и помещали на баню со льдом. Добавляли трет-бутоксид калия (1 экв.) и реакционную смесь перемешивали в течение 30 минут. Метилйодид (1 экв.) растворяли в 5 мл безводного ТГФ и медленно добавляли в течение 30 минут. Реакционную смесь перемешивали в течение ночи при комнатной температуре. Растворитель упаривали, неочищенную смесь растворяли в этилацетате и промывали водой. Этилацетатный слой упаривали и продукт очищали препаративной ТСХ (30% этилацетат/гексан); выход 71%; m/e=133 [M+1].
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,4 мкМ.
Пример 144
N-(2,4-Диметоксибензил)-N'-(2-(пиридин-2-ил)пропил)оксаламид

Получали способом, аналогично описанному в примере 125, используя 2,4-диметоксибензиламин, этилоксалилхлорид и 2-(пиридин-2-ил)пропиламин (пример 144a); выход 35%; m/e=357 [M+1].
a. 2-(Пиридин-2-ил)пропиламин
10 ммоль 2-Метилпиридина растворяли в безводном ТГФ и выдерживали в атмосфере инертного газа при 0°C. По каплям добавляли бутиллитий (1,2 экв.) и перемешивали в течение дополнительных 15 минут при 0°C до тех пор, пока температура не поднималась до комнатной. После перемешивания при комнатной температуре в течение 1 часа, реакционную смесь охлаждали вновь до 0°C и добавляли по каплям ацетонитрил (2 экв.). Реакционную смесь перемешивали в течение ночи при комнатной температуре. После охлаждения реакционной смеси до 0°C в реакционную смесь добавляли 30 мл метанола. Порциями медленно при 0°C добавляли боргидрид натрия (3 экв.). Реакционную смесь перемешивали в течение еще одного часа, давая температуре повыситься до комнатной. Реакционную смесь разбавляли водой и тщательно экстрагировали этилацетатом. Объединенные экстракты промывали водой, насыщенным раствором соли и сушили над сульфатом натрия. Раствор концентрировали и растворяли в эфире. Продукт экстрагировали 3н водным HCl, подкисленный экстракт промывали эфиром и подщелачивали с помощью NaOH. Продукт тщательно экстрагировали эфиром. Объединенные эфирные экстракты промывали водой и сушили над сульфатом натрия. Растворитель упаривали с выходом достаточно чистого продукта; выход 47%; m/e=137 [M+1].
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,07 мкМ.
Пример 145
N-(2-Метоксибензил)-N'-(2-(пиридин-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 125, используя 2-метилбензиламин, этилоксалилхлорид и 2-(пиридин-2-ил)этиламин; m/e=298 [M+1];1H ЯМР (CDCl3): δ 2,32 (с, 3H), 3,11 (т, 2H), 3,78 (дт, 2H), 4,46 (д, 2H), 7,15-7,26 (м, 6H), 7,50-7,55 (м, 1H), 7,62-7,67 (м, 1H), 8,12-8,15 (м, 1H), 8,60 (д, 1H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,59 мкМ.
Пример 146
N-(2,3-Диметоксибензил)-N'-(2-(пиридин-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 125, используя 2,3-диметоксибензиламин, этилоксалилхлорид и 2-(пиридин-2-ил)этиламин; m/e=343 [M+1].
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,69 мкМ.
Пример 147
N-(2-(Метилтио)бензил)-N'-(2-(пиридин-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 125, используя 2-метилтиобензиламин, этилоксалилхлорид и 2-(пиридин-2-ил)этиламин; m/e=330 [M+1];1H ЯМР (CDCl3): δ 2,49 (с, 3H), 3,08 (т, 2H), 3,77 (дт, 2H), 4,55 (д, 2H), 7,11-7,14 (м, 1H), 7,15-7,20 (м, 2H), 7,22-7,27 (м, 3H), 7,62 (т, 1H), 7,78-7,83 (м, 1H), 8,08-8,11 (м, 1H), 8,56 (д, 1H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,96 мкМ.
Пример 148
N-(2-Гидроксибензил)-N'-(2-(пиридин-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 125, используя 2-гидроксибензиламин, этилоксалилхлорид и 2-(пиридин-2-ил)этиламин; m/e=300 [M+1].
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 3,11 мкМ.
Пример 149
N-(Бензо[d][1,3]диоксол-4-илметил)-N'-(2-(пиридин-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 125, используя бензо[d][1,3]диоксол-4-илметил амин (пример 149a), этилоксалилхлорид и 2-(пиридин-2-ил)этиламин; выход 12%; m/e=328 [M+1];1H ЯМР (CDCl3): δ 3,12 (м, 2H), 3,77-3,80 (м, 2H), 4,46-4,47 (д, 2H), 5,98 (с, 2H), 6,74-6,79 (м, 3H), 7,24 (м, 1H), 7,7-7,8 (м, 3H), 8,10-8,15 (м, 1H), 8,58-8,59 (м, 1H).
a. Бензо[d][1,3]диоксол-4-илметил амин
Получали способом, аналогично описанному в примере 134a, из бензо[d][1,3]диоксол-4-карбальдегида и ацетата аммония. Неочищенное вещество содержало около 20% продукта (m/e=152,2 [M+1]) и его непосредственно использовали в примере 149.
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,17 мкМ.
Пример 150
N-(Бензо[b]тиофен-2-илметил)-N'-(2-(пиридин-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 125, используя бензо[b]тиофен-2-илметанамин, этилоксалилхлорид и 2-(пиридин-2-ил)этиламин; выход 32%; m/e=240 [M+1];1H ЯМР (ДМСО-d6): δ 2,92-2,95 (т, 2H), 3,48-3,53 (м, 2H), 4,55-4,56 (д, 2H), 7,20-7,25 (м, 2H), 7,38-7,41 (м, 2H), 7,50 (с, 1H), 7,66-7,70 (м, 1H), 7,95-7,99 (м, 2H), 8,47-8,49 (д, 1H), 8,88-8,90 (т, 1H), 9,29-9,31 (т, 1H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,74 мкМ.
Пример 151
N-(Бензо[d]тиазол-2-илметил)-N'-(2-(пиридин-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 125, используя бензо[d]тиазол-2-илметанамин, этилоксалилхлорид и 2-(пиридин-2-ил)этиламин; выход 33%; m/e=341 [M+1];1H ЯМР (ДМСО-d6): δ 2,95-2,98 (т, 2H), 3,52-3,57 (м, 2H), 4,72-4,73 (д, 2H), 7,22-7,24 (м, 1H), 7,25-7,27 (д, 1H), 7,40-7,44 (т, 1H), 7,48-7,51 (т, 1H), 7,69-7,72 (дт, 1H), 7,95-7,96 (д, 1H), 8,05-8,07 (д, 1H), 8,49-8,50 (д, 1H), 8,96-8,98 (т, 1H), 9,67-9,70 (т, 1H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 4,4 мкМ.
Пример 152
N-((5-Метилфуран-2-ил)метил)-N2-(2-(пиридин-2-ил)этил)оксаламид
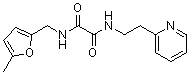
Получали способом, аналогично описанному в примере 125, используя (5-метилфуран-2-ил)метанамин, этилоксалилхлорид и 2-(пиридин-2-ил)этиламин; выход 38%; m/e=288 [M+1];1H ЯМР (ДМСО-d6): δ 2,20 (с, 3H), 2,92-2,95 (т, 2H), 3,48-3,52 (м, 2H), 4,23-4,24 (д, 2H), 5,96-5,97 (д, 1H), 6,06-6,07 (д, 1H), 7,20-7,25 (м, 2H), 7,68-7,71 (т, 1H), 8,48-8,49 (д, 1H), 8,85-8,87 (т, 1H), 9,04-9,07 (т, 1H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 4,9 мкМ.
Пример 153
N-((2-Метилфуран-3-ил)метил)-N'-(2-(пиридин-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 125, используя (2-метилфуран-3-ил)метанамин (пример 153a), этилоксалилхлорид и 2-(пиридин-2-ил)этиламин; выход 50%; m/e=288 [M+1];1H ЯМР (ДМСО-d6): δ 2,23 (с, 3H), 2,91-2,94 (т, 2H), 3,48-3,52 (кв, 2H), 4,05-4,06 (д, 2H), 6,30-6,31 (д, 1H), 7,20-7,25 (м, 2H), 7,38-7,39 (д, 1H), 7,67-7,71 (дт, 1H), 8,48-8,49 (д, 1H), 8,83-8,86 (т, 1H), 9,04-9,07 (т, 1H).
a. (2-Метилфуран-3-ил)метанамин
Раствор 10 ммоль (1,256 мл) метил 2-метилфуран-3-карбоксилата и 38,9 ммоль (2,1 г) NaOMe в 20 мл формамида перемешивали при 100°С в течение 30 минут. Реакционную смесь выливали в воду со льдом (20 мл) и экстрагировали этилацетатом (3×). Экстракт сушили над MgSO4 и концентрировали с получением 1,05 г (83%) 2-метилфуран-3-карбоксамида в виде масла (m/e=126,2 [M+1]). Амид растворяли в сухом ТГФ (10 мл) и по каплям добавляли к 15 мл 1M LiAlH4 с 15 мл ТГФ при 0°C в атмосфере аргона. Затем смесь перемешивали в течение 5 часов при 60°C. После охлаждения к смеси при 5-10°C добавляли 50% водный ТГФ (30 мл). Полученный остаток удаляли фильтрованием, отфильтрованный раствор сушили и концентрировали с получением маслянистого продукта (0,93 г, 84%).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,82 мкМ.
Пример 154
N-(2,4-Диметоксибензил)-N'-(2-(4-метилпиридин-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 122, используя 2,4-диметоксибензиламин, этилоксалилхлорид и 2-(4-метилпиридин-2-ил)этиламин (пример 154a); выход 11%; m/e=358 [M+1]; т.пл. 144-145°C;1H ЯМР (CDCl3): δ 2,31 (с, 3H), 2,97 (т, 2H), 3,71 (кв, 2H), 3,79 (с, 3H), 3,83 (с, 3H), 4,39 (д, 2H), 6,40 (дд, 1H), 6,44 (д, 1H), 6,97 (с, 1H), 6,98 (д, 1H), 7,15 (д, 1H), 7,81 (ушир.с, 1H), 8,08 (ушир.с, 1H), 8,41 (д, 1H).
a. 2-(4-Метилпиридин-2-ил)этиламин
Получали способом, аналогично описанному в примере 129, используя 2-(4-метилпиридин-2-ил)ацетонитрил (пример 154b); выход 83%; m/e=137 [M+1].
b. 2-(4-Метилпиридин-2-ил)ацетонитрил
Получали способом, аналогично описанному в примере 129b, используя 2-бром-4-метилпиридин, ацетонитрил и н-BuLi; выход 88%; m/e=133 [M+1].
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 1,64 мкМ.
Пример 155
N-(2,4-Диметоксибензил)-N'-(2-(5-метилпиридин-2-ил)этил)оксаламид
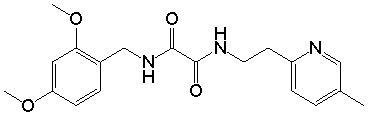
Получали способом, аналогично описанному в примере 122, используя 2,4-диметоксибензиламин, этилоксалилхлорид и 2-(5-метилпиридин-2-ил)этиламин (пример 155a); выход 9%; m/e=358 [M+1]; т.пл. 124-125°C;1H ЯМР (CDCl3): δ 2,30 (с, 3H), 2,97 (т, 2H), 3,70 (кв, 2H), 3,79 (с, 3H), 3,82 (с, 3H), 4,38 (д, 2H), 6,40 (дд, 1H), 6,44 (д, 1H), 7,03 (д, 1H), 7,14 (д, 1H), 7,40 (дд, 1H), 7,81 (ушир.с, 1H), 8,08 (ушир.с, 1H), 8,38 (д, 1H).
a. 2-(5-Метилпиридин-2-ил)этиламин
Получали способом, аналогично описанному в примере 129a, используя 2-(5-метилпиридин-2-ил)ацетонитрил (155b); выход 40%; m/e=137 [M+1].
b. 2-(5-Метилпиридин-2-ил)ацетонитрил:
Получали способом, аналогично описанному в примере 129b, используя 2-бром-5-метилпиридин, ацетонитрил и н-BuLi; выход 68%; m/e=133 [M+1].
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,07 мкМ.
Пример 156
N-(2,4-Диметоксибензил)-N'-(2-(тиофен-2-ил)этил)оксаламид

Получали способом, аналогично описанному в примере 122, используя 2,4-диметоксибензиламин, этилоксалилхлорид и 2-(тиофен-2-ил)этиламин; выход 72%; m/e=349 [M+1]; т.пл. 146-147°C;1H ЯМР (CDCl3): δ 3,06 (т, 2H), 3,58 (кв, 2H), 3,80 (с, 3H), 3,83 (с, 3H), 4,40 (д, 2H), 6,41 (дд, 1H), 6,45 (д, 1H), 6,84 (дд, 1H), 6,93 (дд, 1H), 7,15 (д, 1H), 7,16 (д, 1H), 7,61 (ушир.с, 1H), 7,81 (ушир.с, 1H).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 4,87 мкМ.
Пример 157
N1-(2-Метокси-4-метилбензил)-N2-(2-(5-метилпиридин-2-ил)этил)оксаламид
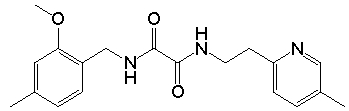
Получали способом, аналогично описанному в примере 125, используя 2-метокси-4-метилбензиламин (пример 132a), этилоксалилхлорид и 2-(4-метилпиридин-2-ил)этиламин (пример 155a). Выход 20%; т.пл. 116-117°C;1H ЯМР (CDCl3): δ 2,31 (с, 3H), 2,34 (с, 3H), 3,00 (т, 2H), 3,71 (кв, 2H), 3,84 (с, 3H), 4,42 (д, 2H), 6,69 (с, 1H), 6,71 (д, 1H), 7,05 (д, 1H), 7,11 (д, 1H), 7,43 (д, 1H), 7,84 (ушир.с, 1H), 8,04 (ушир.с, 1H), 8,39 (с, 1H); MS (M+H, 342).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,03 мкМ
Дополнительные «оксаламидные» соединения, синтезированные и экспериментально исследованные, обладают относительно высоким уровнем эффективности в качестве активатора рецептора «умами» hT1R1/hT1R3, экспрессированного в клеточной линии HEK293. Результаты этих исследований представлены ниже в таблице B.
Большое количество амидных соединений формулы (I), которые входят в подгруппу производных «мочевины», описанных в данном описании, также были синтезированы и экспериментально исследованы на эффективность в качестве активатора рецептора «умами» hT1R1/hT1R3, экспрессированного в клеточной линии HEK293.
Пример 158
1-(4-Хлорфенил)-3-(гептан-4-ил)мочевина

К раствору гептан-4-амина (0,18 мл, 1 ммоль) в CH2Cl2 (5 мл) добавляли 1-хлор-2-изоцианатобензол (0,12 мл, 1 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 2 часов. Белый твердый продукт отделяли осаждением. Реакционную смесь фильтровали. Твердый продукт промывали CH2Cl2 с получением 1-(4-хлорфенил)-3-(гептан-4-ил)мочевины (180 мг, 67%) в виде белого твердого вещества. Т.пл.: 135-136°C.1H ЯМР (500 МГц, CDCl3): δ 0,93 (т, 6H), 1,45 (м, 6H), 1,53 (м, 2H), 3,80 (ушир.с, 1H), 4,33 (д, 1H), 6,00 (с, 1H), 6,95 (тд, 1H), 7,23 (дт, 1H), 7,33 (дд, 1H), 8,13 (дд, 1H). MS (M+H, 269).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,37 мкM, и, когда присутствовало в концентрации 0,3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 4,95.
Пример 159
1-(2,4-Диметоксифенил)-3-(гептан-4-ил)мочевина
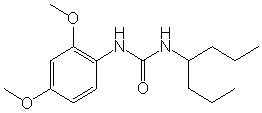
Получали способом, аналогично описанному в примере 158, используя гептан-4-амин и 1-изоцианато-2,4-диметоксибензол. Выход: 88%. т.пл.: 172-173єC.1H ЯМР (500 МГц, CDCl3): δ 0,93 (т, 6H), 1,45 (м, 8H), 3,82 (с, 3H), 3,83 (м, 1H), 3,84 (с, 1H), 4,32 (ушир.с, 1H), 6,34 (ушир.с, 1H), 6,49 (д, 1H), 6,50 (с, 1H), 7,71 (д, 1H). MS (M+H, 295).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,98 мкM, и, когда присутствовало в концентрации 0,3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 7,61.
Пример 160
1-(4-Этоксифенил)-3-(2-(пиридин-2-ил)этил)мочевина

Получали способом, аналогично описанному в примере 158, используя 2-(пиридин-2-ил)этанамин и 1-этокси-4-изоцианатобензол. Выход: 95%. т.пл.: 163-164°C.1H ЯМР (500 МГц, CDCl3): δ 1,43 (т, 3H), 3,03 (т, 2H), 3,68 (т, 2H), 4,03 (кв, 2H), 5,69 (ушир.с, 1H), 6,45 (ушир.с, 1H), 6,84 (м, 2H), 7,14 (м, 3H), 7,20 (д, 1H), 7,64 (дт, 1H), 8,43 (дд, 1H). MS (M+H, 286).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 4,1 мкM, и, когда присутствовало в концентрации 0,3 мкM, повышало эффективность мононатрий глутамата с соотношением EC50 4,2.
Пример 161
1-(4-Изопропилфенил)-3-(2-(пиридин-2-ил)этил)мочевина

Получали способом, аналогично описанному в примере 158, используя 2-(пиридин-2-ил)этанамин и 1-изоцианато-4-изопропилбензол. Очищали колоночной хроматографией (1% MeOH в CH2Cl2 - 3% MeOH в CH2Cl2) с получением 1-(4-изопропилфенил)-3-(2-(пиридин-2-ил)этил)мочевины (130 мг, 50%) в виде белого твердого вещества. Т.пл.: 72-73°C.1H ЯМР (500 МГц, CDCl3): δ 1,25 (д, 6H), 2,89 (м, 1H), 3,06 (т, 2H), 3,70 (т, 2H), 5,80 (ушир.с, 1H), 6,55 (ушир.с, 1H), 7,19 (м, 5H), 7,24 (д, 1H), 7,68 (дт, 1H), 8,46 (д, 1H). MS (M+H, 284).
Соединение имело значение EC50 для активации «умами» рецептора hT1R1/hT1R3, экспрессируемого в клеточной линии HEK293, равное 0,98 мкM.
Дополнительные производные «мочевины», синтезированные и экспериментально исследованные, обладают относительно высоким уровнем эффективности в качестве активатора рецептора «умами» hT1R1/hT1R3, экспрессированного в клеточной линии HEK293. Результаты этих исследований представлены ниже в таблице C.
Большое количество амидных соединений формулы (I), которые входят в подгруппу «акриламидных» соединений, описанных в данном описании, также были синтезированы и экспериментально исследованы на эффективность в качестве активатора рецептора «умами» hT1R1/hT1R3, экспрессированного в клеточной линии HEK293.
Результаты этих исследований представлены ниже в таблице D.
Измерение «умами»/острого вкуса у группы людей
Выбор основной группы людей
Основой скрининг ощущения вкуса: Потенциальную группу людей исследовали на способность различать и оценивать интенсивность растворов, представляющих пять основных вкусов. Группа различала и оценивала интенсивность пяти различных концентраций каждого из пяти следующих соединений: сахарозы (сладкий вкус), хлорида натрия (соленый вкус), лимонную кислоту (кислый вкус), кофеин (горький вкус) и мононатрий глутамат (острый вкус). Для того чтобы быть выбранным в исследуемую группу, необходимо правильно различить и оценить интенсивность образцов с приемлемым числом ошибок.
Предварительные вкусовые тесты: Группа, выбранная, как описано выше, считалась подходящей для осуществления предварительных вкусовых тестов. Предварительные вкусовые тесты использовали для оценки новых соединений на интенсивность основных вкусов и привкуса. Небольшая группа испытуемых (n=5) тестировала приблизительно 5 концентраций соединения (обычно в пределах 1-100 мкМ, полулогарифмический период, например 1, 3, 10, 30 и 100 мкМ) в воде и в растворе 12 мМ MSG для оценки усиления вкуса. Группа оценивала пять основных вкусов (сладкий, соленый, кислый, горький и острый), а также привкусы (химический, металлический, серный) по шкале величин. Образцы использовали 10 мл порциями при комнатной температуре. Целью теста является оценка максимальной концентрации, при которой не определяется неприятный привкус и определение наличия острого вкуса или усиления острого вкуса при любой тестированной концентрации.
Если соединение обладает соответствующим эффектом и не имеет неприятного привкуса, его тестирует подготовленная (экспертная) группа в большем исследовании.
Выбор подготовленной группы экспертов: Подготовленная экспертная группа дополнительно оценивала соединения, которые были тестированы в предварительном тесте.
Группу для экспертной группы выбирали из большой группы квалифицированных экспертов. Группа дополнительно проходила подготовку на способность различать и оценивать интенсивность острого вкуса, используя сочетания MSG и IMP. В завершении группа оценивала серию образцов на различие, интенсивность и отличие от ссылочных тестов растворов с соединениями, вызывающими острый вкус. В тестах на оценку различия и интенсивности группа экспертом оценивала легкие концентрации MSG (0, 6, 18, 36 мМ) и более сложные концентрации MSG (3, 6, 12, 18 мМ) в воде.
Соединение, тестируемое с помощью подготовленной группы экспертов Соединения, которые тестировала подготовленная группа, оценивали на различие от ссылочных экспериментов. Группе давали ссылочный образец (12 мМ MSG+100 мкМ IMP) и просили проанализировать образцы по шкале от -5 до +5 в единицах различия острого вкуса по сравнению со ссылочным (значения: -5 = гораздо менее острый вкус по сравнению со ссылочным; 0 = такой же острый вкус по сравнению со ссылочным; +5 = гораздо более острый вкус по сравнению со ссылочным). Исследуемые образцы представляли собой растворы различных количеств MSG, IMP и данных соединений. Обычно в каждом тесте сравнивали ссылочный образец с несколькими тестируемыми образцами. Тесты обычно содержали различные образцы с различными концентрациями MSG и IMP, а также слепой образец ссылочного образца для оценки точности экспертов. Результаты тестов вкуса представлены в таблице 3, из которой видно, что соединения по изобретению обладают острым вкусом или повышают острый вкус при 3 мкМ+MSG по сравнению с 100 мкМ IMP+MSG. Соединения исследовали против ссылочного образца в образцах, не содержащих и содержащих 12 мМ MSG. Все образцы находились в 10 мл объеме при комнатной температуре. Осуществляли два воспроизводимых теста для каждого соединения, тестируемого для оценки группой экспертов.
Исследование вкуса в прототипе продукта может быть осуществлено аналогично описанному выше.
Примеры «сладкого» амида
Большое количество амидных соединений формулы (I) были также синтезированы и экспериментально исследованы на эффективность в качестве активатора рецептора сладкого вкуса hT1R1/hT1R3, экспрессированного в клеточной линии HEK293.
Примеры получения и биологическая эффективность, исследованная в показателях измерений EC50 сладкого для такого сладкого соединения представлены далее. Однако многие из “сладких” амидов формулы (I) были также подвергнуты скрининговым исследованиям на активность в анализах «умами» EC50 и EC50 соотношения, и как показано далее, некоторые амидные соединения формулы (I) обладают значительной активностью и могут одновременно служить в качестве усилителей острого и сладкого вкуса для использования в пищевых и лекарственных продуктах и композициях.
Пример 162
2,3,5,6-Тетрафтор-4-метил-N-(2-метилциклогексил)бензамид

2,3,5,6-Тетрафтор-п-толуоловую кислоту (4,00 г, 19,22 ммоль), HOBt (5,19 г, 38,44 ммоль) и EDCI (4,42 г 23,06 ммоль) перемешивали в 200 мл безводном DCM и 30 мл безводном ДМФА. Смесь охлаждали до 0°C и оставляли перемешиваться в атмосфере Ar в течение 15 минут. К смеси добавляли 2-метилциклогексан (3,05 мл, 23,06 ммоль), реакционную смесь оставляли медленно нагреваться до комнатной температуры и перемешивали в течение ночи. Реакционную смесь разбавляли DCM, промывали 1н HCl, водой, водным NaHCO3, водой и насыщенным раствором соли, сушили над MgSO4, фильтровали и удаляли растворитель в вакууме, с получением неочищенного продукта в виде светло-желтого твердого вещества. Перекристаллизация (EtOH/H2O) и сушка в вакууме давали 5,23 г указанного в заголовке соединения в виде белого твердого вещества (смесь 2-х диастереомеров, 90%).1H ЯМР (CDCl3): δ 0,95, 1,01 (д, J=7,0, 6,6 Гц, 3H) 1,1-2,1 (м, 9H), 2,29 (м, 3H), 3,70, 4,29 (м, 1H), 5,65, 5,92 (м, 1H). MS (304,1, M+H). Т.пл. 202-204°C.
Значение EC50 соединения для активации hT1R2/hT1R3 рецептора сладкого вкуса, экспрессируемого в клеточной линии HEK293, составляет 0,39 мкM.
Пример 163
(S)-2,3,5,6-Тетрафтор-4-метил-N-(3-метилбутан-2-ил)бензамид
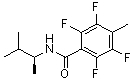
Получали способом, аналогично описанному в примере 162, используя (S)-3-метилбутан-2-амин и 2,3,5,6-тетрафтор-п-толуоловую кислоту (93%).1H ЯМР (CDCl3): δ 0,98 (д, J=6,9 Гц, 6H) 1,18 (д, J=6,8 Гц, 3H), 2,29 (м, 3H), 4,09 (м, 1H), 5,72 (ушир.с, 1H). MS (304,1, M+H). Т.пл. 146-147°C.
Значение EC50 соединения для активации hT1R2/hT1R3 рецептора сладкого вкуса, экспрессируемого в клеточной линии HEK293, составляет 0,6 мкM.
Пример 164
N-Циклогептил-2,3,5,6-тетрафтор-4-метилбензамид
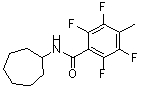
Получали способом, аналогично описанному в примере 162, используя циклогептиламин и 2,3,5,6-тетрафтор-п-толуоловую кислоту (94%).1H ЯМР (CDCl3) δ 1,53 (м, 6H), 1,57 (м, 4H), 2,03 (м, 2H) 2,28 (м, 3H), 4,17 (м, 1H), 5,85 (ушир.с, 1H). MS (304,1, M+H). Т.пл. 164-165°C.
Значение EC50 соединения для активации hT1R2/hT1R3 рецептора сладкого вкуса, экспрессируемого в клеточной линии HEK293, составляет 1,85 мкM.
Пример 165
N-(2,4-Диметилпентан-3-ил)-2,3,5,6-тетрафтор-4-метилбензамид
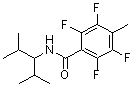
Получали способом, аналогично описанному в примере 162, используя 2,4-диметилпентан-3-амин и 2,3,5,6-тетрафтор-п-толуоловую кислоту (90%).1H ЯМР (CDCl3): δ 0,91 (д, J=6,7 Гц, 6H), 1,00 (д, J=6,8 Гц, 6H), 1,85 (м, 2H), 2,29 (м, 3H), 3,82 (м, 1H), 5,52 (ушир.д, 1H). MS (306,1, M+H). Т.пл. 184-187°C.
Значение EC50 соединения для активации hT1R2/hT1R3 рецептора сладкого вкуса, экспрессируемого в клеточной линии HEK293, составляет 0,81 мкM.
Пример 166
N-(5,7-Диметил-1,2,3,4-тетрагидронафталин-1-ил)-3-метилизоксазол-4-карбоксамид

К раствору 3-метилизоксазол-4-карбоновой кислоты (83 мг, 0,0,67 ммоль), HOBt (100 мг, 0,74 ммоль) и EDCI·HCl (142 мг, 0,74 ммоль) в ДМФА (4 мл) добавляли 5,7-диметил-1,2,3,4-тетрагидронафтил-1-амин (пример 166a) (130 мг, 0,74 ммоль). Реакционную смесь перемешивали в течение 24 часов при комнатной температуре, одновременно растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией на колонке (10:1 Hex:EtOAc) с получением 134 мг N-(5,7-диметил-1,2,3,4-тетрагидронафталин-1-ил)-3-метилизоксазол-4-карбоксамида (70%) в виде белого пенообразного твердого вещества.1H ЯМР (500 МГц, ДМСО-d6): δ 1,74 (м, 2H), 1,86 (м, 2H), 2,16 (с, 3H), 2,19 (с, 3H), 2,43 (с, 3H), 2,55 (м, 2H), 5,10 (м, 1H), 6,86 (с, 1H), 6,89 (с, 1H), 8,60 (д, 1H, J=8,40 Гц), 9,27 (с, 1H).13C ЯМР (125 МГц, ДМСО-d6): δ 10,6, 19,1, 19,6, 20,6, 25,8, 29,4, 46,9, 115,4, 126,4, 129,1, 132,6, 134,1, 135,8, 136,6, 158,5, 159,6, 159,9. MS (M+H, 285). Т.пл. 57-58°C.
a. 5,7-диметил-1,2,3,4-тетрагидронафталин-1-амин
Каталитическое количество никеля Ренея (взвесь в воде) промывали сухим MeOH в атмосфере аргона в круглодонной колбе. К раствору промытого Ni Ренея в растворе аммиака в метаноле (25 мл, 7н) добавляли оксим 5,7-диметил-3,4-дигидронафталин-1(2H)-она (пример 166b) (420 мг, 2,22 ммоль), и смесь перемешивали в атмосфере H2, подаваемого из баллона, в течение 20 часов. После завершения реакции реакционную смесь фильтровали через целит, фильтрат концентрировали в вакууме, разбавляли EtOAC, промывали водой и насыщенным раствором соли, сушили над MgSO4, фильтровали и растворитель удаляли при пониженном давлении с получением 360 мг 5,7-диметил-1,2,3,4-тетрагидронафталин-1-амина (93%).1H ЯМР (500 МГц, CDCl3): δ 1,66-1,83 (м, 4H), 1,96 (м, 2H), 2,19 (с, 3H), 2,28 (с, 3H), 2,55 (м, 1H), 2,66 (м, 1H), 3,97 (м, 1H), 6,88 (с, 1H), 7,09 (с, 1H).
b. Получение оксима 5,7-диметил-3,4-дигидронафталин-1(2H)-она
К смеси 5,7-диметил-3,4-дигидронафталин-1(2H)-она (2,0 г, 11,48 ммоль) и гидрохлорида гидроксиламина (1,6 г, 19,73 моль) в 10 мл воды при 70°C, добавляли MeOH (14 мл), ТГФ (3 мл) и раствор ацетата натрия (2,53 г, 30,83 ммоль, в 7 мл H2O). Перемешивание продолжали в течение 85 мин при 70°C, одновременно образовывался осадок, и добавляли 10 мл воды. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. После завершения реакции продукт собирали фильтрованием с получением 2,12 г оксима 5,7-диметил-3,4-дигидронафталин-1(2H)-она (98%). MS (M+H, 190).
Значение EC50 соединения для активации hT1R2/hT1R3 рецептора сладкого вкуса, экспрессируемого в клеточной линии HEK293, составляет 0,76 мкM.
Пример 167
3-Хлор-2-гидрокси-N-(5-метокси-1,2,3,4-тетрагидронафталин-1-ил)бензамид

Получали способом, подобным описанному в примере 166, используя 5-метокси-1,2,3,4-тетрагидронафталин-1-амин (пример 167a). Выход 40%.1H ЯМР (500 МГц, ДМСО-d6): δ 1,73 (м, 1H), 1,83 (м, 1H), 1,96 (м, 2H), 2,61 (м, 2H), 3,78 (с, 3H), 5,27 (м, 1H), 6,78 (д, 1H, J=7,82 Гц), 6,86 (м, 2H), 7,14 (т, 1H, J=7,98 Гц), 7,60 (дд, 1H, J=7,88, 1,30 Гц), 7,94 (дд, 1H, J=8,03, 1,39 Гц), 9,30 (д, 1H, J=8,06 Гц), 13,80 (с, 1H).13C ЯМР (125 МГц, ДМСО-d6): δ 19,5, 22,7, 28,9, 47,4, 55,3, 108,6, 115,8, 118,7, 119,8, 121,1, 125,9, 126,2, 126,4, 133,8, 137,3, 156,7, 156,8, 168,7. MS (M+H, 332). Т.пл. 175-176°C.
a. 5-Метокси-1,2,3,4-тетрагидронафталин-1-амин:
Получали способом, аналогично описанному в примере 166a, используя 5-метокси-3,4-дигидронафталин-1(2H)-он. Выход 94%.1H ЯМР (500 МГц, CDCl3): δ 1,63-1,79 (м, 4H), 1,94 (м, 2H), 2,60 (м, 1H), 2,71 (м, 1H), 3,82 (с, 3H), 3,97 (м, 1H), 6,71 (д, 1H), 7,02 (д, 1H), 7,17 (т, 1H).
Значение EC50 соединения для активации hT1R2/hT1R3 рецептора сладкого вкуса, экспрессируемого в клеточной линии HEK293, составляет 0,21 мкM.
Пример 168
2,6-Диметил-N-(2-метилциклогексил)бензамид

Получали способом, аналогично описанному в примере 162, используя 2,6-диметилбензойную кислоту и 2-метилциклогексиламин. Выход: 59%.1H ЯМР (500 МГц, CDCl3): δ 0,88-0,94 (3H, дд), 1,14-1,89 (9H, м), 2,21-2,22 (6H, д), 3,39-3,45 (1H, м), 7,02-7,03 (2H, д), 7,12-7,15 (1H, т), 8,11-8,13 (1H, д). MS (M+H, 246,2).
Значение EC50 соединения для активации hT1R2/hT1R3 рецептора сладкого вкуса, экспрессируемого в клеточной линии HEK293, составляет 1,88 мкM.
Пример 169
4-Метокси-2,6-диметил-N-(2-метилциклогексил)бензамид

Получали способом, аналогично описанному в примере 166, используя 4-метокси-2,6-диметилбензойную кислоту (пример 169a) и 2-метилциклогексиламин.1H ЯМР (500 МГц, CDCl3): δ 0,86-0,92 (3H, дд), 1,00-1,85 (м, 9H), 2,18-2,19 (6H, д), 3,33-3,45 (1H, м), 3,71-3,72 (3H, д), 6,59 (2H, с), 7,98-8,05 (1H, м). MS (276,2, M+H).
a. 4-Метокси-2,6-диметилбензойная кислота
2-Бром-5-метокси-1,3-диметилбензол (пример 169b) (3,38 г, 15,79 ммоль) без дополнительной очистки растворяли в 100 мл сухого ТГФ. Смесь охлаждали до -78°C в атмосфере аргона, по каплям добавляли н-бутиллитий (1,6М раствор в гексане, 9,9 мл, 15,8 ммоль) в течение 15 мин и смесь перемешивали еще 15 минут при -78°C. Затем добавляли небольшие порции сухого льда и смесь перемешивали 20 мин при -78°C. Затем охлаждение прекращали и смесь перемешивали в ходе выделения диоксида углерода. Затем смесь выливали на лед (100 мл) и подкисляли, используя 6н HCl. Органический слой отделяли и водную фазу экстрагировали EtOAc. Органические экстракты объединяли, промывали насыщенным раствором соли, водой, сушили над MgSO4 и концентрировали в вакууме. Получали продукт, 4-метокси-2,6-диметилбензойную кислоту, в виде белого твердого вещества (2,7 г, 95%). MS (M+H, 181).
b. 2-Бром-5-метокси-1,3-диметилбензол
20 ммоль 1-Метокси-3,5-диметилбензола (2,82 мл) растворяли в 100 мл сухого ацетонитрила, затем добавляли (22 ммоль, 3,56 г) N-бромсукцинимида. Смесь перемешивали при комнатной температуре в течение ночи. Затем растворитель упаривали при пониженном давлении, твердый продукт отфильтровывали и промывали гексаном с получением 2-бром-5-метокси-1,3-диметилбензола (3,9 г, 92%) в виде белого твердого вещества.1H ЯМР (500 МГц, CDCl3): δ 2,41 (6H, с), 3,78 (3H, с), 6,67 (2H, с).
Значение EC50 соединения для активации hT1R2/hT1R3 рецептора сладкого вкуса, экспрессируемого в клеточной линии HEK293, составляет 2,1 мкM.
Пример 170
(R)-N-(1,2,3,4-Тетрагидронафталин-1-ил)фуран-3-карбоксамид

К раствору фуран-3-карбоновой кислоты (100 мг, 0,68 ммоль), HOBt (240 мг, 1,78 ммоль) и EDCI·HCl (196 мг, 1,03 ммоль) в CH2Cl2 (8 мл) и ДМФА (1,5 мл) при 0°C добавляли (R)-1,2,3,4-тетрагидронафталин-1-амин (160 мкл, 1,06 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 часов, затем добавляли CH2Cl2. Полученный раствор промывали насыщенным NaHCO3, H2O, насыщенным раствором соли, сушили над MgSO4 и концентрировали в вакууме. Перекристаллизация из EtOH/H2O давала (R)-N-(1,2,3,4-тетрагидронафталин-1-ил)-2,5-дигидрофуран-3-карбоксамид.1H ЯМР (500 МГц, CDCl3): δ 1,89 (м, 3H), 2,12 (м, 1H), 2,84 (м, 2H), 5,35 (м, 1H), 5,96 (ушир.д, 1H, J=7,75 Гц), 6,59 (дд, 1H, J=1,90, 0,86 Гц), 7,13 (м, 1H), 7,19 (м, 2H), 7,32 (м, 1H), 7,43 (т, 1H, J=1,73 Гц), 7,93 (м, 1H). MS (M+H, 242).
Значение EC50 соединения для активации hT1R2/hT1R3 рецептора сладкого вкуса, экспрессируемого в клеточной линии HEK293, составляет 6,6 мкM.
Пример 171
(R)-5-Метил-N-(1,2,3,4-тетрагидронафталин-1-ил)изоксазол-4-карбоксамид

Получали способом, аналогично описанному в примере 170, используя 5-метилизоксазол-4-карбоновую кислоту. Очищали препаративной ТСХ (5:1 Hex:EtOAc).1H ЯМР (500 МГц, CDCl3): δ 1,80 (м, 3H), 2,12 (м, 1H), 2,74 (с, 3H), 2,85 (м, 2H), 5,35 (м, 1H), 5,89 (ушир.д, 1H, J=7,75 Гц), 7,10 (м, 1H), 7,18 (м, 2H), 7,32 (м, 1H), 8,26 (с, 1H). MS (M+H, 257).
Значение EC50 соединения для активации hT1R2/hT1R3 рецептора сладкого вкуса, экспрессируемого в клеточной линии HEK293, составляет 8,1 мкM.
Пример 172
N-(4-Хлор-2-метилфенил)изоиндолин-2-карбоксамид

К раствору изоиндолина (238 мг, 2,0 ммоль) в сухом 1,4-диоксане (10 мл) добавляли 4-хлор-2-метилфенилизоцианат (335 мг, 2,0 ммоль) в атмосфере аргона при комнатной температуре. Затем реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель упаривали при пониженном давлении, и остаток очищали перекристаллизацией из этанола с получением указанного в заголовке соединения (540 мг, 94%) в виде белого твердого вещества.1H ЯМР (500 МГц, ДМСО-d6): δ 2,24 (с, 2H), 4,76 (с, 4H), 7,20 (дд, J=2,5, 8,5 Гц, 1H), 7,27 (д, J=2,5 Гц, 1H), 7,30-7,32 (м, 2H), 7,34-7,37 (м, 2H), 7,42 (д, J=8,5 Гц, 1H), 7,84 (с, 1H);13C ЯМР (ДМСО-d6): δ 17,7, 51,9, 122,8, 125,6, 126,8, 127,3, 128,1, 129,5, 134,7, 136,8, 154,2; MS (MH+, 287); ЭЛЕМЕНТНЫЙ АНАЛИЗ вычислено для C16H15ClN2O: C, 67,02; H, 5,27; N, 9,77; найдено C, 66,82; H, 5,41; N, 9,92.
Значение EC50 соединения для активации hT1R2/hT1R3 рецептора сладкого вкуса, экспрессируемого в клеточной линии HEK293, составляет 0,89 мкM.
Пример 173
N-(4-Метокси-2-метилфенил)изоиндолин-2-карбоксамид

К раствору изоиндолина (576 мг, 4,0 ммоль) в сухом 1,4-диоксане (20 мл) добавляли 4-метокси-2-метилфенилизоцианат (815 мг, 5,0 ммоль) в атмосфере аргона при комнатной температуре. Затем реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель упаривали при пониженном давлении и остаток очищали хроматографией на силикагеле (EtOAc/гексан: 1:1) с получением указанного в заголовке соединения (1,18 г, 84%) в виде белого твердого вещества.1H ЯМР (500 МГц, ДМСО-d6): δ 2,19 (с, 3H), 3,72 (с, 3H), 4,73 (с, 4H), 6,72 (дд, J=2,5 Гц, 8,5 Гц, 1H), 6,78 (д, J=2,5 Гц, 1H), 7,17 (д, J=8,5 Гц, 1H), 7,30-7,32 (м, 2H), 7,34-7,36 (м, 2H), 7,74 (с, 1H);13C ЯМР (ДМСО-d6): δ 18,2, 51,9, 55,1, 110,9, 115,1, 122,8, 127,2, 127,8, 130,6, 135,1, 137,0, 154,9, 156,5; MS (MH+, 283); ЭЛЕМЕНТНЫЙ АНАЛИЗ вычислено для C17H18N2O2: C, 72,32; H, 6,43; N, 9,92; найдено C, 72,16; H, 6,82; N, 9,98.
Значение EC50 соединения для активации hT1R2/hT1R3 рецептора сладкого вкуса, экспрессируемого в клеточной линии HEK293, составляет 4,5 мкM.
Пример 174
N-(3,4-Метилендиоксифенил)изоиндолин-2-карбоксамид

К раствору 3,4-(метилендиокси)анилина (150 мг, 1,09 ммоль) в сухом DCM (4 мл) добавляли по каплям фенилхлорформиат (0,138 мл, 1,09 ммоль) и триэтиламин (0,153 мл, 1,09 ммоль). Затем реакционную смесь перемешивали при комнатной температуре в течение 8 часов, добавляли изоиндолин (0,123 мл, 1,09 ммоль) и триэтиламин (0,153 мл, 1,09 ммоль) и реакционную смесь перемешивали в течение ночи. Затем растворитель удаляли при пониженном давлении и остаток очищали хроматографией на силикагеле (EtOAC/Гексан: 1:3) с получением указанного в заголовке соединения (185 мг, 60%) в виде белого твердого вещества: т.пл.: 165-166°C.1H ЯМР (CDCl3, 500 МГц): 4,82 (с, 4H); 5,93 (с, 2H); 6,20 (с, 1H); 6,73 (с, 2H); 7,17 (с, 1H); 7,30 (м, 4H). MS (MH+, 283).
Значение EC50 соединения для активации hT1R2/hT1R3 рецептора сладкого вкуса, экспрессируемого в клеточной линии HEK293, составляет 1,05 мкM.
Пример 175
(1,2,3,4-Тетрагидронафталин-1-ил)амид 3-метилизоксазол-4-карбоновой кислоты

К раствору 3-метилизоксазол-4-карбоновой кислоты (0,52 г, 4,06 ммоль) в DCM (15 мл) и ДМФА (2 мл), добавляли HOBt (1,1 г, 8,14 ммоль) и EDCI (0,896 г 4,67 ммоль). Чистый желтый раствор охлаждали до 0°C и оставляли перемешиваться в атмосфере Ar в течение 15 минут. К раствору добавляли (R)-1-амино-1,2,3,4-тетрагидронафталин (0,73 мл, 5,04 ммоль), реакционную смесь оставляли медленно нагреваться до комнатной температуры и перемешивали в течение ночи. Разбавляли DCM (50 мл), затем экстрагировали водным NaHCO3, водой, промывали насыщенным раствором соли (50 мл), сушили над MgSO4, фильтровали и удаляли растворитель в вакууме. Хроматография на силикагеле (0-25% гексан:EtOAc) давала указанное в заголовке соединение (650 мг; 62,5%) в виде вязкого твердого вещества.1H ЯМР (CDCl3): δ 1,88 (м, 3H), 2,12 (м, 1H), 2,51 (с, 3H), 2,81 (м, 2H), 5,32 (м, 1H), 5,99 (ушир.д, 1H), 7,13 (м, 1H), 7,20 (м, 2H) 7,20 (м, 2H);13C ЯМР (CDCl3) δ 11,22, 20,15, 29,41, 30,35, 47,93, 116,73, 126,72, 127,88, 128,88, 129,65, 136,25, 138,00, 158,45, 160,28. ESIMS: 257 (M+H) ЭЛЕМЕНТНЫЙ АНАЛИЗ вычислено для C15H16N2O2: C, 70,29; H, 6,29; N, 10,93; найдено C, 70,61; H, 6,11; N, 11,09.
Значение EC50 соединения для активации hT1R2/hT1R3 рецептора сладкого вкуса, экспрессируемого в клеточной линии HEK293, составляет 5,8 мкM.
Большое количество амидных соединений формулы (I) также было синтезировано и экспериментально исследовано на эффективность в качестве активатора hT1R2/hT1R3 «сладкого» рецептора, экспрессированного в клеточной линии HEK293.
Результаты этих исследований показаны ниже в таблице E.
Измерение сладкого вкуса и усиления сладкого вкуса у группы людей
Задача: Изучить интенсивность различных вкусов и привкусов исследуемого соединения. Определить максимальную концентрацию исследуемого соединения, которая не вызывает нежелательные свойства или привкус.
Обзор: Различные концентрации исследуемого соединения (обычно водные растворы, содержащие 1, 3, 10 и 30 мкM концентрации исследуемого соединения; и необязательно 50 мкМ и/или 100 мкM концентрации) индивидуально были опробованы группой подготовленных людей, и была оценена интенсивность некоторых вкусовых показателей. Исследуемое соединение может также быть опробовано при растворении в растворе “ключевого соединения, придающего вкус”.
Методика: Соответствующее количество исследуемого соединения растворяли в воде, обычно также содержащей 0,1% этанол, который использовали для облегчения первоначальной дисперсии соединения в исходном водном растворе. Когда это целесообразно, исследуемое соединение также может быть растворено в водных растворах “ключевого соединения, придающего вкус” (например, 4% сахароза, 6% сахароза, 6% фруктоза/глюкоза или 7% фруктоза/глюкоза при pH, равном 7,1 или 2,8).
Для предварительных вкусовых тестов использовали пять индивидуумов. Индивидуумы демонстрировали способность определять по вкусу желаемые вкусовые свойства и были подготовлены к использованию размеченной шкалы магнитуд (LMS) от 0 (едва определяемый сладкий вкус) до 100 (максимально воспринимаемый сладкий вкус). Индивидуумы воздерживались от еды или питья (за исключением воды) в течение по меньшей мере 1 часа до проведения тестов. Индивидуумы ели сухое печенье и полоскали рот водой четыре раза для очистки полости рта перед тестами.
Водные растворы разливали по 10 мл в чашки для образцов объемом, равным 1 унции, и выдавались для дегустации индивидуумами при комнатной температуре. Пробы исследуемого соединения, растворенного в соответствующем ключевом веществе, придающем сладкий вкус (например, 4% сахароза, 6% фруктоза или 6% фруктоза/глюкоза, обычно при pH, равном 7,1) при различных концентрациях исследуемого соединения, также могут быть дегустированы индивидуумами. Индивидуумы также получали контрольные образцы ключевого вещества, придающего сладкий вкус (например, сахароза, фруктоза или фруктоза/глюкоза, обычно при pH, равном 7,1) для сравнения при различных концентрациях.
Индивидуумы пробовали на вкус растворы, начиная с самой низкой концентрации, и сравнивали интенсивность следующих свойств по размеченной шкале магнитуд (LMS) для сладкого вкуса, соленого вкуса, кислого вкуса, горького вкуса, острого («умами») вкуса и других (привкус). Индивидуумы полоскали рот три раза водой в промежутках между дегустациями. Если определенная концентрация выявляла нежелательные признаки или привкус, следующие дегустации с более высокой концентрацией не проводились. После перерыва индивидуумы дегустировали раствор ключевого вещества, придающего вкус (например, 4% сахароза, 6% фруктоза или 6% фруктоза/глюкоза, обычно при pH, равном 7,1) без исследуемого соединения. Затем растворы ключевого вещества, придающего вкус, включая исследуемое соединение, дегустировали в порядке возрастания концентрации. Раствор ключевого вещества, придающего вкус, может быть вновь опробован на вкус для сравнения с ключевым веществом, придающим вкус+растворы исследуемого соединения, если необходимо. Переговоры между участниками группы исследования допускались.
Максимальной концентрацией исследуемого соединения, которая не выявляла нежелательные свойства или привкус, является наивысшая концентрация, при которой конкретное соединение исследовалось при последующих экспериментах с использованием чувствительного восприятия. Для подтверждения предварительных результатов исследования исследование может быть повторено с другой небольшой группой участников исследования.
Предварительное профилирующее исследование является всегда первым исследованием, выполненным на новом исследуемом соединении. В зависимости от результатов предварительного профилирующего исследования, дополнительные количественные исследования могут проводиться для дополнительной характеристики исследуемого соединения.
Методики исследования вкусового восприятия человека “отличие от контрольного образца”
Задача: Определить, как интенсивность испытуемого образца исследуемого соединения отличается от интенсивности контрольного образца в зависимости от сладкого вкуса. Этот тип изучения требует большой группы экспертов (обычно 15-20 субъектов) для получения статистически достоверных данных.
Обзор: Группа из 10 или более участников исследования испытывали пары растворов, где один образец является “контрольным” (который обычно не включает исследуемое соединение и представляет собой испытанное вещество или признанное полностью безвредным (GRAS) вещество, то есть подсластитель) и один образец представляет собой “исследуемый” (который может содержать или не содержит исследуемое соединение). Индивидуумы определяли разницу интенсивности исследуемого образца в сравнении с контрольным для ключевого свойства по шкале от -5 (значительно менее сладкий, чем контрольный) до +5 (более сладкий, чем контрольный). Оценка равная 0 показывает, что исследуемый образец такой же сладкий, как и контрольный.
Методика
Десять или более индивидуумов задействованы в исследованиях “отличие от контрольного образца”. Индивидуумы были предварительно ознакомлены с исследованием ключевых свойств и подготовлены для пользования шкалой с диапазоном от -5 до +5. Индивидуумы воздерживались от пищи или питья (за исключением воды) в течение по меньшей мере 1 часа до проведения исследования. Индивидуумы съедали сухое печенье и полоскали полость рта четыре раза для её очистки.
Исследуемые растворы могут содержать исследуемое соединение в воде, исследуемое соединение плюс ключевое вещество, придающее вкус (например, 4% сахароза, 6% сахароза, 6% фруктоза, 6% фруктоза/глюкоза или 7% фруктоза/глюкоза при pH, равном 7,1 или 2,8), и ряд ключевых веществ, придающих вкус, только растворы в качестве контрольных.
Образцы ключевого вещества, придающие вкус, без исследуемого соединения использовались для определения точности оценки группой экспертов; то есть контрольный образец исследовали сам по себе (вслепую) для определения, как точно группа экспертов оценивала на данный день исследования. Растворы разливали по 10 мл в чашки для образцов объемом, равным 1 унции, и давали для дегустации индивидуумам при комнатной температуре.
Сначала индивидуумы дегустировали контрольный образец, затем непосредственно дегустировали исследуемый образец и оценивали различие в интенсивности ключевого свойства по шкале отличия от контрольного образца (от -5 до +5). Все образцы выплевывались. Индивидуумы могли вновь дегустировать образцы, но только используя объем данных образцов. Индивидуумы должны полоскать по меньшей мере дважды водой полость рта между дегустацией пар образцов. Съедание сухого печенья между дегустацией пар образцов может потребоваться в зависимости от дегустируемых образцов.
Оценка каждого теста усреднялись для всех индивидуумов и вычислялась стандартная ошибка. Точность группы экспертов может быть установлена, используя оценку контрольного исследования вслепую. ANOVA (вариационный анализ) и критерии множественного сравнения (такой как Tukey's Honestly Significant Difference test) может быть использован для определения различий между парами, при условии, что контрольный образец является одним и тем же во всех тестах. Если аналогично исследуемые пары исследовали в другой сессии, тест Стьюдента (парный, двухконцевой; альфа=0,05) может быть использован для определения, если существуют различия в оценках между сессиями.
Ряд различных контрольных подсластителей использовали для измерения усиления сладкого вкуса. Например, для исследования (R)-3-метил-N-(1,2,3,4-тетрагидронафталин-1-ил)изоксазол-4-карбоксамида использовали контрольный образец, включающей 4% сахарозу, который имеет большую, чем предельная, величину уровня сладкого вкуса (то есть, 2% сахароза), и сладкий вкус в области рецептора сладкого вкуса, где человеческие индивидуумы наиболее чувствительны к небольшим изменениям восприятия сладкого вкуса. Для исследования 2,3,5,6-тетрафтор-4-метил-N-(2-метилциклогексил)бензамида использовали смесь 50:50 фруктоза:глюкоза для улучшения образца растворов кукурузного сиропа с высоким содержанием фруктозы, обычно используемых в производстве напитков. Смесь 6% фруктоза/глюкоза демонстрировала приблизительно одинаковое восприятие сладкого вкуса, как 6% сахароза, которая находится в ряду, где группа экспертов чувствительна к небольшим изменениям в восприятии сладкого вкуса. После первоначальных исследований в 6% фруктоза/глюкоза при pH, равном 7,1, исследования сместились к оценке получения соединения в прототипе продукта, более близкого к напиткам типа кока-кола, то есть с более высокими концентрациями подсластителя и низким уровнем pH.
Результаты некоторых исследований определения вкуса человеком сладких амидных соединений по изобретению в водных композициях, предназначенных для моделирования композиции газированного напитка, показаны в таблице F ниже.
Пример 176
Получение супа, используя этанольный исходный раствор
Соединение по изобретению разбавляли, используя 200 градусный этанол до 1000× желаемой концентрации в супе. Соединение может быть диспергировано ультразвуком и нагрето (если стабильно) для полного растворения в этаноле. Суп на бульонной основе получали путем добавления 6 г основы овощного бульона в 500 мл горячей воды в стакан или керамическую посуду. Воду нагревали до 80°C. Концентрация MSG в растворенном бульоне равна 2,2 г/л и IMP не добавляли. После растворения бульонной основы к ней добавляли этанольный исходный раствор. Для 500 мл супа добавляли 0,5 мл 1000× этанольного исходного раствора до конечной концентрации этанола 0,1%. Если этанол изменяет вкус супа, может быть приготовлена более высокая концентрация исходного этанольного раствора, содержащего растворенное соединение.
Пример 177
Приготовление чипсов
Солевую смесь соединения по изобретению приготавливали смешиванием соли, таким образом, чтобы 1,4% солевой смеси, добавленной по объему к чипсам, давала в результате желаемую концентрацию соединения. Для достижения концентрации в 1 часть на миллион конечного соединения на чипсах, 7 мг соединения смешивали с 10 г соли. Соединение измельчали с солью, используя ступку и пестик, и соединение и соль хорошо смешивали. Чипсы нарезали одинаковыми небольшими кусочками, используя блендер. Для каждых 98,6 г чипсов отвешивали 1,4 г солевой смеси. Кусочки чипсов сначала нагревали в микроволновой печи в течение 50 секунд или до тех пор, пока они не становились теплыми. Кусочки раскладывали на большом куске алюминиевой фольги. Солевую смесь равномерно распыляли над чипсами. Чипсы затем помещали в пластиковый пакет таким образом, чтобы вся соль также находилась в пакете. Солевую смесь и чипсы затем встряхивали для того, чтобы добиться равномерного нанесения соли на чипсы.
Пример 178
Приготовление печенья
Соединение по изобретению разбавляли, используя 200-градусный этанол до 1000× желаемой концентрации в конечном продукте. Соединение может быть диспергировано ультразвуком и нагрето (если стабильно) для полного растворения в этаноле. Раствор, содержащий соединение по изобретению, затем смешивали с другими жидкими компонентами (например, водой, жидкими яйцами и ароматизаторами) до тщательного смешения. Смесь смешивали с сухим эмульгатором, таким как лецитин, и затем перемешивали с добавлением жира. Жир смешивали с сухими компонентами (например, мукой, сахаром, солью, какао), которые хорошо смешиваются. Тесто разделяли на порции на противне и выпекали при желаемой температуре до готовности.
Пример 179
Приготовление сока
Соединение по изобретению разбавляли, используя 200-градусный этанол до 1000× желаемой концентрации в соке. Соединение затем смешивали со спиртовым компонентом природного и/или искусственного ароматизаторов для получения “ключа”. Ароматический ключ смешивали с частью концентрата сока до достижения гомогенности. Оставшийся концентрат сока разбавляли водой и смешивали. Подмешивали подсластители, такие как HFCS (кукурузный сироп с высоким содержанием фруктозы), аспартам или сахароза, и перемешивали. Часть ароматизатор/соединение добавляли на конечной стадии и перемешивали.
Пример 180
Пряный томатный сок или смесь «Кровавая Мэри»
Соединение по изобретению добавляли в виде сухого компонента смеси пряностей и тщательно смешивали. Смесь пряностей диспергировали в части томатной пасты, перемешивали, и эту смешанную пасту затем подмешивали к остальной пасте. Пасту затем разбавляли водой. Этот процесс можно проводить при высокой температуре в течение короткого промежутка времени.
Специалистам в данной области будет очевидно, что различные модификации и варианты могут быть осуществлены в настоящем изобретение, не отходя от существа и объема изобретения. Другие варианты осуществления изобретения будут очевидны специалистам в данной области из рассмотрения представленных здесь описания и практического воплощения изобретения. Это означает, что описание и примеры рассматриваются только в качестве примеров, а объем и сущность изобретения представлены в следующей формуле изобретения.
Реферат
Настоящее изобретение относится к ароматизирующим агентам, придающим острый или сладкий вкус, представляющий неприродное амидное соединение или его пригодную в пищу соль в количестве от около 0,001 частей на миллион до около 100 частей на миллион. Амидное соединение имеет формулу (I), где А представляет собой фенил или 5- или 6-членное гетероарильное кольцо, выбранное из группы, состоящей из пиридина, пиразина, пиразола, тиазола, фурана, тиофена бензофурана и бензотиофена; m равно 1, 2 или 3; каждый R1' независимо выбран из гидрокси, фтора, хлора, SEt, SCH3, метила, этила, изопропила, винила, трифторметила, метокси, этокси и изопропокси или, альтернативно, два R1' связаны вместе с образованием насыщенного С1-С3алкилендиокси кольца на фениле; и R2 представляет собой С3-С10разветвленный алкил. Также амидное соединение имеет формулу (II), в которой заместители А, В, R50, R60, R70, R80, n и m имеют значения, указанные в формуле изобретения. Также амидное соединение представляет собой конкретное химическое соединение. Технический результат - модификаторы и усилители острого и сладкого вкуса пищевых и лекарственных продуктов. 5 н. и 34 з.п. ф-лы, 7 табл.
Формула

где А представляет собой фенил или 5- или 6-членное гетероарильное кольцо, выбранное из группы, состоящей из пиридина, пиразина, пиразола, тиазола, фурана, тиофена бензофурана и бензотиофена; m равно 1, 2 или 3;
каждый R1' независимо выбран из гидрокси, фтора, хлора, SEt, SCH3, метила, этила, изопропила, винила, трифторметила, метокси, этокси и изопропокси или, альтернативно, два R1' связаны вместе с образованием насыщенного C1-С3алкилендиокси кольца на фениле; и
R2 представляет собой С3-С10разветвленный алкил,
в количестве от около 0,001 частей на миллион до около 100 частей на миллион.


где R1a и R1b независимо представляют собой водород или метил.


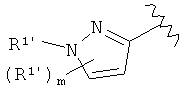





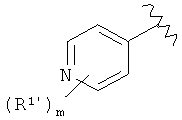

где m равно 1, 2 или 3, и каждый R1' независимо выбран из водорода, гидрокси, фтора, хлора, SEt, SCH3, метила, этила, изопропила, винила, трифторметила, метокси, этокси и изопропокси.

где А представляет собой фенил, тиофен, фуран, пиррол, бензофуран, бензотиофен или безотиазол;
В представляет собой пиридин, тиофен или фуран;
m и n независимо равны 0, 1 или 2,
R50 представляет собой водород или метил;
R60 представляет собой С1-С5алкилен;
каждый R70 независимо выбран из группы, состоящей из водорода, гидрокси, фтора, хлора, СО2СН3, SEt, SCH3, метила, этила, изопропила, метокси, этокси и изопропокси, или два R70 вместе образуют метилендиокси кольцо; и
R80 представляет собой водород, метил, этил или изопропил,
в количестве от около 0,001 частей на миллион до около 100 частей на миллион.
где m равно 1 или 2;
n равно 0 или 1;
R50 представляет собой водород;
R60 представляет собой -СН2- или -СН2СН2-.



где А представляет собой фенил, тиофен, фуран, пиррол, бензофуран, бензотиофен или бензотиазол;
m равно 1 или 2;
n равно 0 или 1;
каждый R70 независимо выбран из группы, состоящей из водорода, гидрокси, фтора, хлора, СО2СН3, SEt, SCH3, метила, этила, изопропила, метокси, этокси и изопропокси, или два R70 вместе образуют метилендиокси кольцо; и
и R80 представляет собой метил.







где m равно 1 или 2, и каждый R70 независимо выбран из гидрокси, фтора, хлора, CO2CH3, SEt, SCH3, метила, этила, изопропила, метокси, этокси и изопропокси.

где А представляет собой фенил, тиофен, фуран, пиррол, бензофуран, бензотиофен или бензотиазол;
В представляет собой пиридин, тиофен или фуран;
m и n независимо равны 0, 1 или 2;
каждый R70 независимо выбран из группы, состоящей из гидрокси, фтора, хлора, CO2CH3, SEt, SCH3, метила, этила, изопропила, метокси, этокси и изопропокси, или два R70 вместе образуют метилендиокси кольцо;
и R80 представляет собой водород, метил, этил или изопропил;
или его пригодная в пищу соль.











где m равно 1 или 2, и каждый R70 независимо выбран из гидрокси, фтора, хлора, CO2CH3, SEt, SCH3, метила, этила, изопропила, метокси, этокси и изопропокси.


N1-(2-метокси-4-метилбензил)-N2-(2-(5-метилпиридин-2-ил)этил)оксаламид,
N1-(2-метокси-4-метилбензил)-N2-(2-(пиридин-2-ил)этил)оксаламид,
N1-(2,4-диметоксибензил)-N2-(2-(5-метилпиридин-2-ил)этил)оксаламид,
N1-(2,4-диметилбензил)-N2-(2-(пиридин-2-ил)этил)оксаламид,
N1-(2,4-диметоксибензил)-N2-(2-(пиридин-2-ил)этил)оксаламид;
или его пригодная в пищу соль.
N-(гептан-4-ил)бензо[d][1,3]диоксол-5-карбоксамид;
N-(2,4-диметоксибензил)-N'-(2-пиридин-2-илэтил)оксаламид;
N1-(2-метокси-4-метилбензил)-N2-(2-(5-метилпиридин-2-ил)-этил)оксаламид;
N1-(2-метокси-4-метилбензил)-N2-(2-(пиридин-2-ил)этил)-оксаламид;
(R)-N-(1-метокси-4-метилпентан-2-ил)-3,4-диметилбензамид;
N-(2,3-диметоксибензил)-N'-(2-(пиридин-2-ил)этил)оксаламид;
или его пригодная в пищу соль.
Документы, цитированные в отчёте о поиске
Способ получения производных 4-замещенных бензамидов



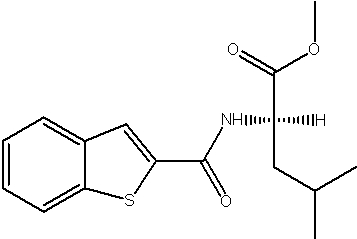












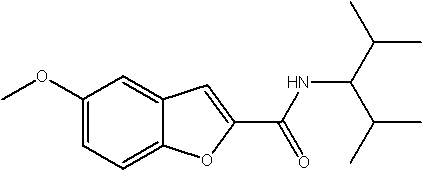







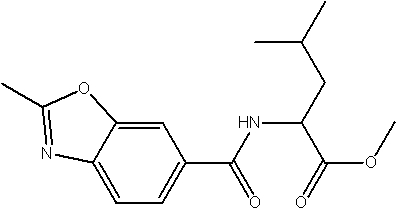


























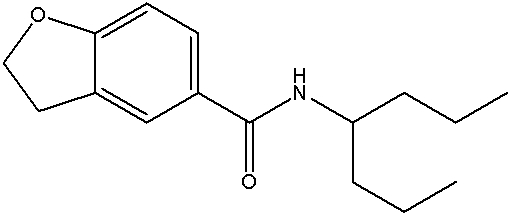





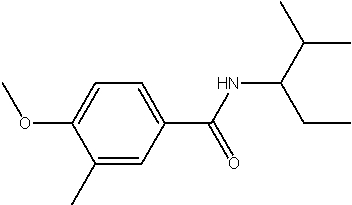



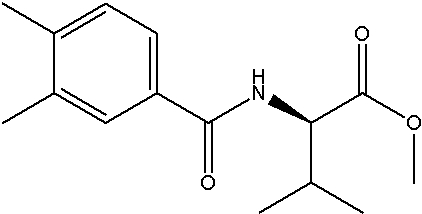



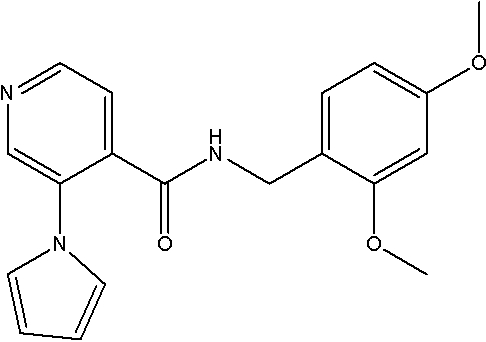
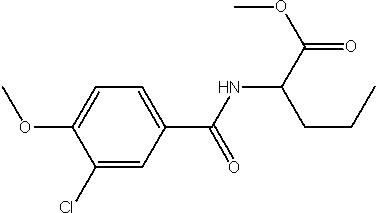



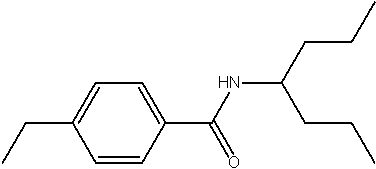



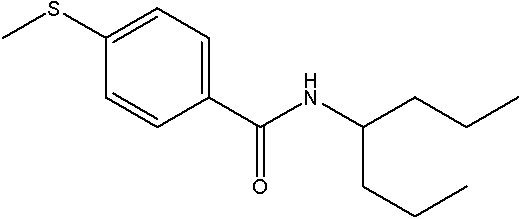


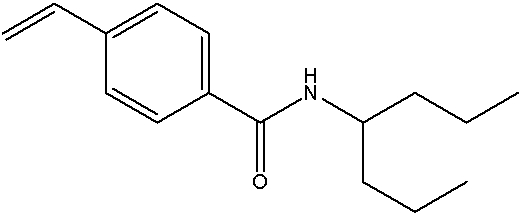















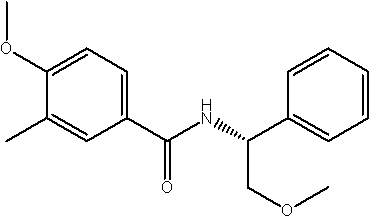














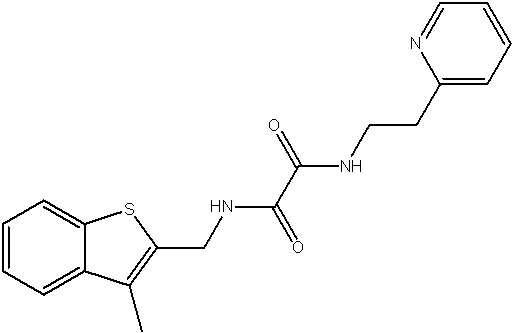









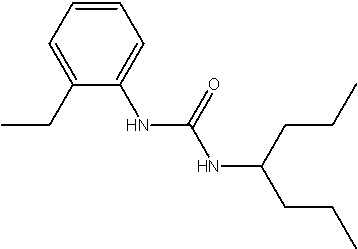
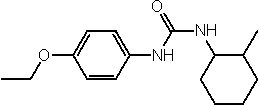





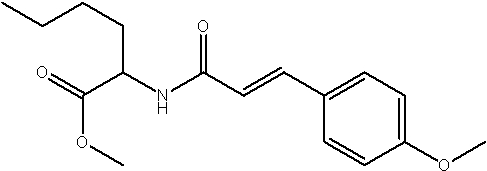

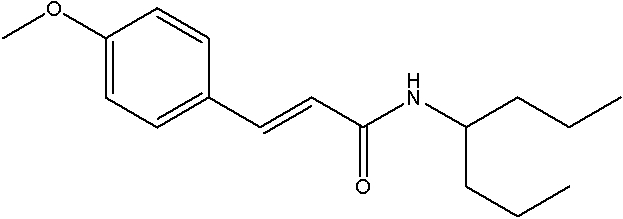
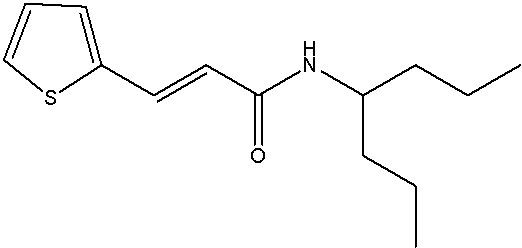

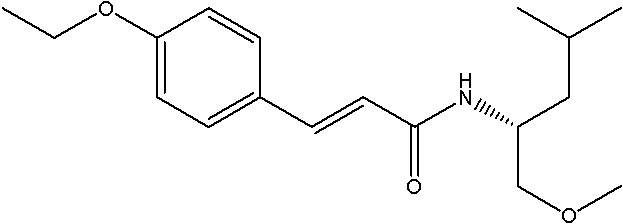















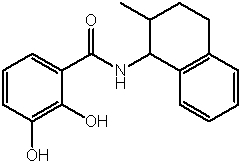


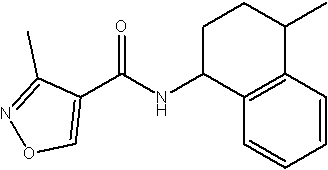










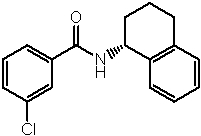

















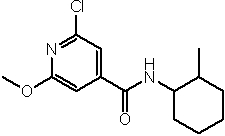

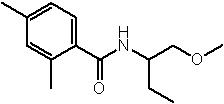
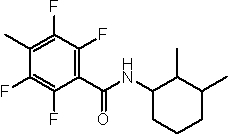

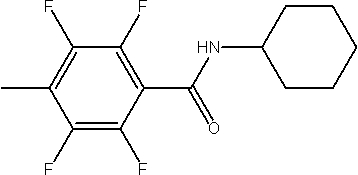

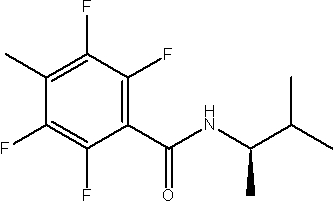
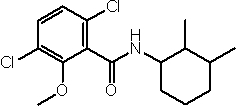














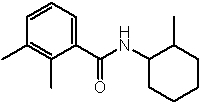
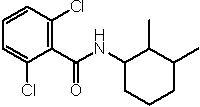



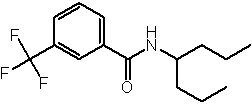



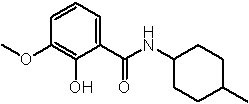

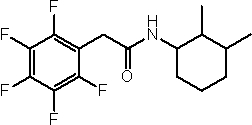


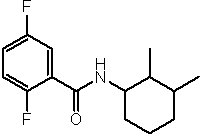



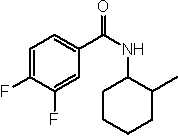



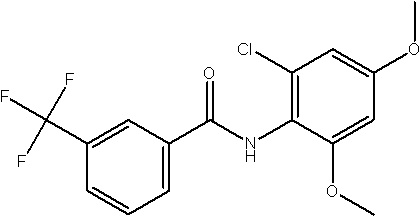
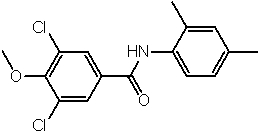


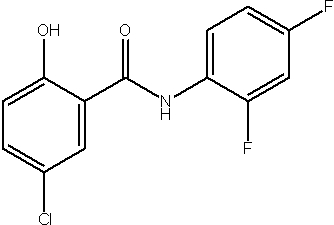









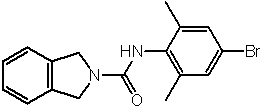
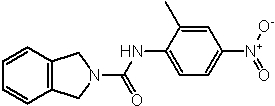

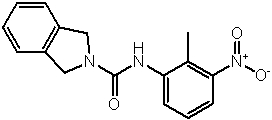



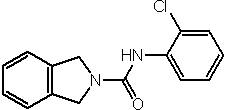
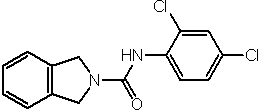

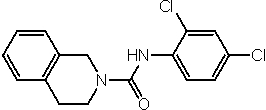





Комментарии